Область техники, к которой относится изобретение
Данное изобретение относится к композициям для подавления раковых заболеваний крови или метастазирования рака, содержащим в качестве активного ингредиента моноацетилдиглицеридное соединение, и к их применению.
Уровень техники
Рак, или злокачественная опухоль, или злокачественное новообразование - это группа клеток, образовавшаяся путем неограниченного размножения клеток делением и пролиферации, обусловленных возникшим по тем или иным причинам нарушением регуляции клеточного роста и, соответственно, расстройством равновесия между делением клеток и апоптозом. Раковые заболевания проявляются в различных частях организма - более чем в 100 частях, включая органы, лейкоциты, кости, лимфатические узлы и др., и развиваются в тяжелые поражения из-за проникновения опухоли в окружающие ткани и перехода в другие органы. Причины рака включают внешние факторы и факторы окружающей среды, например воздействие химических веществ, вирусов, бактерий, ионизирующего излучения и др., и внутренних, организменных факторов, например врожденных генных мутаций и др. В последнее время оживился интерес к связи между хроническим воспалением и раком; сообщалось множество данных, свидетельствующих об этой связи. В 25% всех случаев рака имеют место инфекция и хроническое воспаление; известно, что при хронических воспалительных процессах и заболеваниях, связанных с реакционноспособными формами кислорода (ROS), риск развития рака значительно повышен. Предполагается, что различные вещества-посредники, участвующие в регуляции воспалительной реакции, а именно цитокины, свободные радикалы, факторы роста и др., вызывают генетические и эпигенетические изменения, например мутации в генах - супрессорах опухолей, метилирование ДНК, посттранскрипционные модификации и др., что влияет на поддержание клеточного гомеостаза и в дальнейшем приводит к возникновению и развитию рака.
Если раковое заболевание обнаружено на ранней стадии, могут быть эффективны такие лечебные мероприятия, как химио- или лучевая терапия. Однако это лечение сопровождается побочными эффектами, создающими большие проблемы. Если раковое заболевание обнаружено на такой поздней стадии, что состояние больного приближается к терминальному, или имеет место метастазирование рака, то приходится смириться со значительным ухудшением качества жизни и отсутствием специфического лечения. Поэтому в лечении рака возник новый подход: ведутся исследования с целью разработки препаратов, подавляющих развитие рака или его метастазирование, не обладающие тяжелыми побочными эффектами и в то же время терапевтически эффективные, на основе малотоксичных природных материалов. Было обнаружено, что при лечении, основанном на природных продуктах, слабее такие побочные эффекты, как подавление гемопоэза и иммунной защиты, которые часто наблюдаются при химио- и лучевой терапии.
Из оленьих рогов были выделены вещества, обозначаемые ЕС-18, которые представляют собой моноацетилдиглицеридные соединения. Известно, что ЕС-18 повышает выживаемость подопытных животных с экспериментальным сепсисом при перевязке и проколе слепой кишки и не обладает токсичностью при проверке по стандарту надлежащей лабораторной практики (GLP). Однако действие моноацетилдиацилглицеринов, включая ЕС-18, при раковых заболеваниях крови или метастазировании рака не известно и не описано. Поэтому авторы изобретения поставили своей целью найти вещество на основе природных продуктов или новое соединение, которое подавляло бы раковые заболевания крови или метастазирование рака, и обнаружили, что моноацетилдиацилглицерины подавляют секрецию интерлейкина-4 (IL-4) и активацию белка STAT-6 - одного из факторов транскрипции, участвующих в передаче клеточных сигналов, тем самым разрушая микроокружение, необходимое для роста раковой ткани, и что их можно использовать для предотвращения или лечения раковых заболеваний крови или подавления метастазирования рака.
Раскрытие изобретения
Задачи изобретения
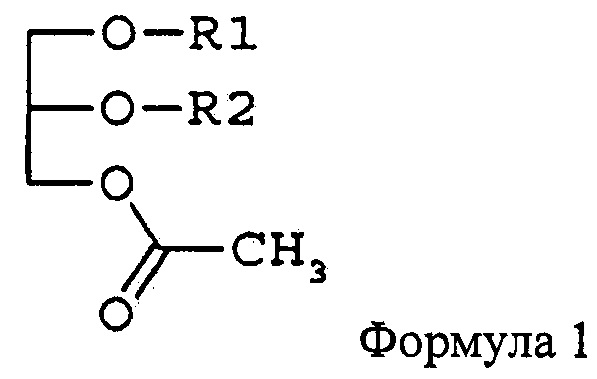
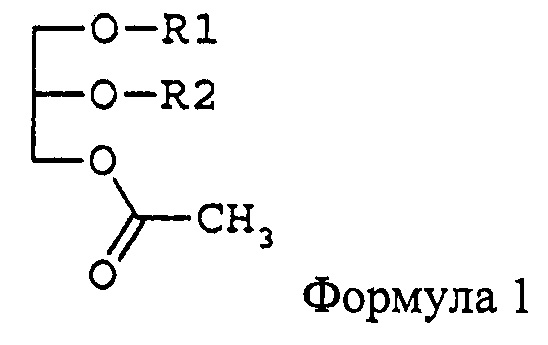
Цель изобретения - предложить фармацевтическую композицию и функциональный продукт лечебного питания для подавления раковых заболеваний крови или метастазирования рака, содержащие в качестве активного ингредиента моноацетилдиацилглицерин, представленный формулой 1,
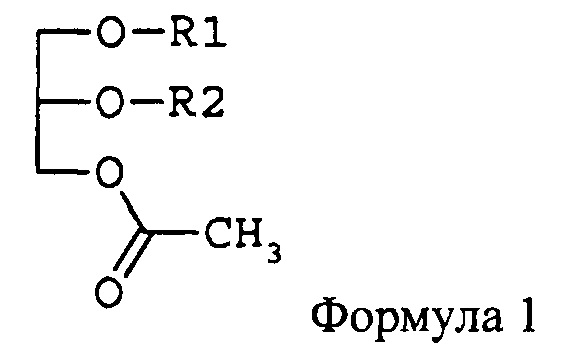
где R1 и R2 независимо друг от друга представляют остаток жирной кислоты из 14-22 атомов углерода.
Другая цель изобретения - предложить способ предотвращения или лечения раковых заболеваний крови или подавления метастазирования рака, включающий этап введения указанной выше фармацевтической композиции по данному изобретению индивиду, у которого имеется или подозревается рак крови или происходит метастазирование рака.
Техническое решение поставленных задач
Для достижения указанных выше целей в этом изобретении предлагаются фармацевтическая композиция и функциональный продукт лечебного питания для подавления раковых заболеваний крови или метастазирования рака, содержащие в качестве активного ингредиента моноацетилдиацилглицерин, представленный формулой 1,
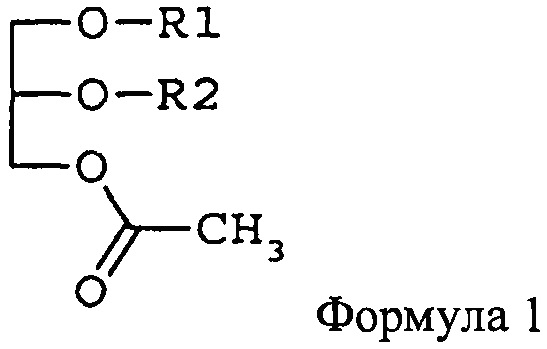
где R1 и R2 независимо друг от друга представляют жирнокислотную группу из 14-22 атомов углерода. В настоящем документе термин «жирнокислотная группа» означает карбоксильную группу жирной кислоты без ОН-группы.
Говоря конкретно, фармацевтическая композиция для подавления раковых заболеваний крови или метастазирования рака по изобретению включает моноацетилдиацилглицерин, представленный формулой 1. По изобретению термин «моноацетилдиацилглицерин» означает производное глицерина, в котором имеются одна ацетильная группа и две ацильных группы и которое можно назвать моноацетилдиацилглицерином (MADG).
В моноацетилдиацилглицерине, представленном формулой 1, R1 и R2 независимо друг от друга представляют остаток жирной кислоты из 14-22 атомов углерода. Предпочтительно примеры R1 и R2, не имеющие ограничительного характера, включают пальмитоил, олеоил, линолеоил, линоленоил, стеароил, миристоил, арахидоноил и др. Предпочтительные комбинации R1 и R2 (R1/R2) включают олеоил/пальмитоил, пальмитоил/олеоил, пальмитоил/линолеоил, пальмитоил/линоленоил, пальмитоил/арахидоноил, пальмитоил/стеароил, пальмитоил/пальмитоил, олеоил/стеароил, линолеоил/пальмитоил, линолеоил/стеароил, стеароил/линолеоил, стеароил/олеоил, миристоил/линолеоил, миристоил/олеоил и др. В отношении оптической активности моноацетилдиацилглицерин, представленный формулой 1, может быть (R)-формой, (S)-формой или рацемической смесью.
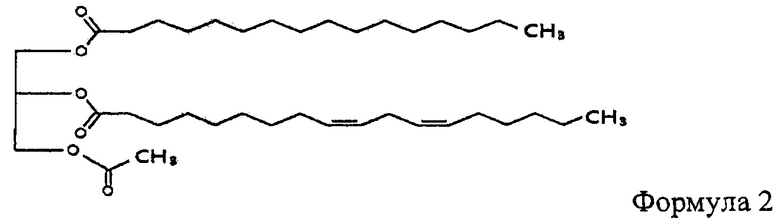
В одном из воплощений изобретения моноацетилдиацилглицерин является соединением, представленным формулой 2.
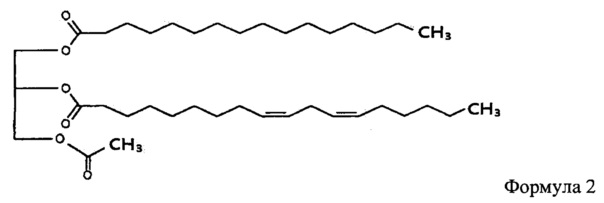
Соединение, представленное формулой 2, это 1-пальмитоил-2-линолеоил-3-ацетилглицерин, который в настоящем документе иногда называется "ЕС-18". В соединении, представленном формулой 2, R1 и R2 представляют пальмитоил и линолеоил соответственно.
Моноацетилдиацилглицерины можно выделить из природного источника - рогов оленей или же их можно получить синтетическими методами, известными в органической химии (см. зарегистрированные патенты Кореи №10-0789323). Конкретно, проделывается следующее. Материал оленьих рогов экстрагируют гексаном, затем остаток экстрагируют хлороформом и хлороформ удаляют, получая экстракт. Объем растворителей для экстракции берется таким, чтобы экстрагируемый материал был полностью погружен в растворитель, но не более. Как правило, на 1 кг оленьих рогов берут около 4-5 литров гексана и/или хлороформа (сказанное здесь не имеет ограничительного характера). Полученные этим способом экстракты далее фракционируют и очищают путем хроматографии на колонках с силикагелем и тонкослойной хроматографии, в результате чего выделяют моноацетилдиацилглицерин по данному изобретению. Растворитель для экстракции выбирают (не ограничиваясь перечисленным здесь) из хлороформа/метилового спирта, гексана/этилацетата/уксусной кислоты.
Способ химического синтеза для получения моноацетилдиацилглицеринов описан в зарегистрированных патентах Кореи №10-0789323. В частности, этот способ включает (а) этап получения соединения вида 1-R1-3-защитная группа-глицерин путем присоединения защитной группы в положении 3 1-R1-глицерина; (b) этап получения соединения вида 1-R1-2-R2-3-защитная группа-глицерин путем введения R2 в положение 2 соединения l-R1-3-защитная группа-глицерин; и (с) этап получения желаемого соединения - моноацетилдиацилглицерина - путем проведения реакции депротекции и одновременно реакции ацетилирования соединения 1-R1-3-защитная группа-глицерин. При необходимости полученный моноацетилдиацилглицерин можно далее очистить. Или же моноацетилдиацилглицерины можно получить путем кислотного разложения (ацетолиза) фосфатидилхолина; сказанное здесь не имеет ограничительного характера. В объем данного изобретения входят также стереоизомеры соединений, представленных формулой (I).
В изобретении показано, что моноацетилдиацилглицерины могут сокращать секрецию IL-4 и, следовательно, их можно эффективного использовать для подавления раковых заболеваний крови или метастазирования рака.
В контексте изобретения термин «рак/раковое заболевание» означает состояние, при котором аномальные клетки, которые в норме должны уничтожаться, из-за расстройства клеточной регуляции остаются жизнеспособными, избыточно размножаются и проникают в окружающие ткани и органы, формируя объемные образования и разрушая или нарушая существовавшую структуру ткани и/или органа. Термин «рак/раковое заболевание» в настоящем документе употребляется взаимозаменяемо с терминами «злокачественная опухоль», «злокачественное новообразование», «злокачественный процесс». Термин «противораковый» означает обладание любой активностью, подавляющей пролиферацию раковых клеток или убивающей их. По изобретению раковое заболевание крови выбирают (не ограничиваясь перечисленным здесь) из группы, состоящей из лимфом, острых лейкозов, хронических лейкозов и множественной миеломы. Термин «метастазирование» означает (не ограничиваясь сказанным здесь) распространение раковых клеток, в частности злокачественных клеток, ассоциированных с раковым заболеванием крови, из одного органа или части тела в окружающие ткани/органы или в другие органы. Большинство злокачественных/опухолевых/раковых клеток обладают способностью распространяться и давать начало новым злокачественным образованиям - метастазам. Раковые клетки выходят из первичного ракового очага в лимфатическую или кровеносную систему, перемещаются по сосудам и дают начало клеточному росту в до того нормальной ткани в другой части тела. Образование метастазов, являющееся характерной чертой злокачественных опухолей, отмечается в 90% случаев смерти от рака. Подавление метастазирования рака по изобретению является средством подавления распространения раковых клеток в другие органы или в окружающие ткани. В настоящем документе термин «предотвращение/профилактика» подразумевает любые мероприятия, подавляющие или задерживающие возникновение или метастазирование рака путем введения фармацевтической композиции по данному изобретению, а термин «лечение» подразумевает любые мероприятия, которые ослабляют или положительным образом изменяют симптомы, обусловленные раковым заболеванием и/или метастазированием рака.
Макрофаги, ассоциированные с опухолями (ТАМ), которые связаны с прогрессированием и метастазированием рака, обнаруживаются преимущественно по периферии опухолевой массы. Новым методом противораковой терапии является метод изменения микроокружения опухоли путем воздействия на макрофаги, ассоциированные с опухолями, веществами, играющими роль в иммунологических реакциях, уровень экспрессии которых в этих клетках повышен. Известно, что клетки ТАМ, будучи фенотипически макрофагами второго типа активации (М2), индуцируются главным образом цитокинами, производимыми клетками Th2, например интерлейкинами (IL-4, IL-13) и др. Клетки ТАМ выделяют фактор, стимулирующий ангиогенез, и металлопротеиназы, а также участвуют в сигнальных путях, которые регулируют функционирование фибробластов, служащих стромальными элементами опухоли, и таким образом способствуют пролиферации и метастазированию опухолевых клеток.
В контексте изобретения термин «интерлейкин-4 (IL-4)» означает выделяемые лимфоцитами Th2 (а также эозинофилами, тучными и некоторыми другими клетками) цитокины, обладающие различными иммуномодулирующими функциями. Сообщалось, что во многих раковых клетках IL-4 присутствует в более высокой концентрации, чем в нормальных тканях, и что он в большом количестве производится лимфоцитами, инфильтрующими опухоли (клетки TIL). В частности, известно, что IL-4 принадлежит к числу цитокинов, активирующих клетки ТАМ: IL-4 вызывает активацию макрофагов с фенотипом М2, тем самым индуцируя опухолевые рост, ангиогенез и метастазирование.
Также показано, что моноацетилдиацилглицерины способны подавлять активацию белка STAT-6; таким образом, эти соединения могут быть эффективно использованы для подавления раковых заболеваний крови и метастазирования рака. В контексте изобретения термином «белок STAT-6" обозначается фактор транскрипции, играющий важную роль в осуществлении биологического ответа, опосредуемого IL-4. А именно, активация STAT-6, состоящая в его фосфорилировании, которое индуцируется при участии IL-4, приводит к активации пути передачи клеточных сигналов IL-4/STAT-6. Известно, что этот сигнальный путь играет важную роль в противодействии пролиферации клеток/клеточному росту и в апоптозе: ингибирование STAT-6 вызывает апоптоз и подавление метастазирования, а также разрушение микроокружения, необходимого для роста злокачественной ткани. Таким образом, композиция по изобретению может быть использована в качестве средства, эффективного в отношении опухолей, и в сочетании таких средств.
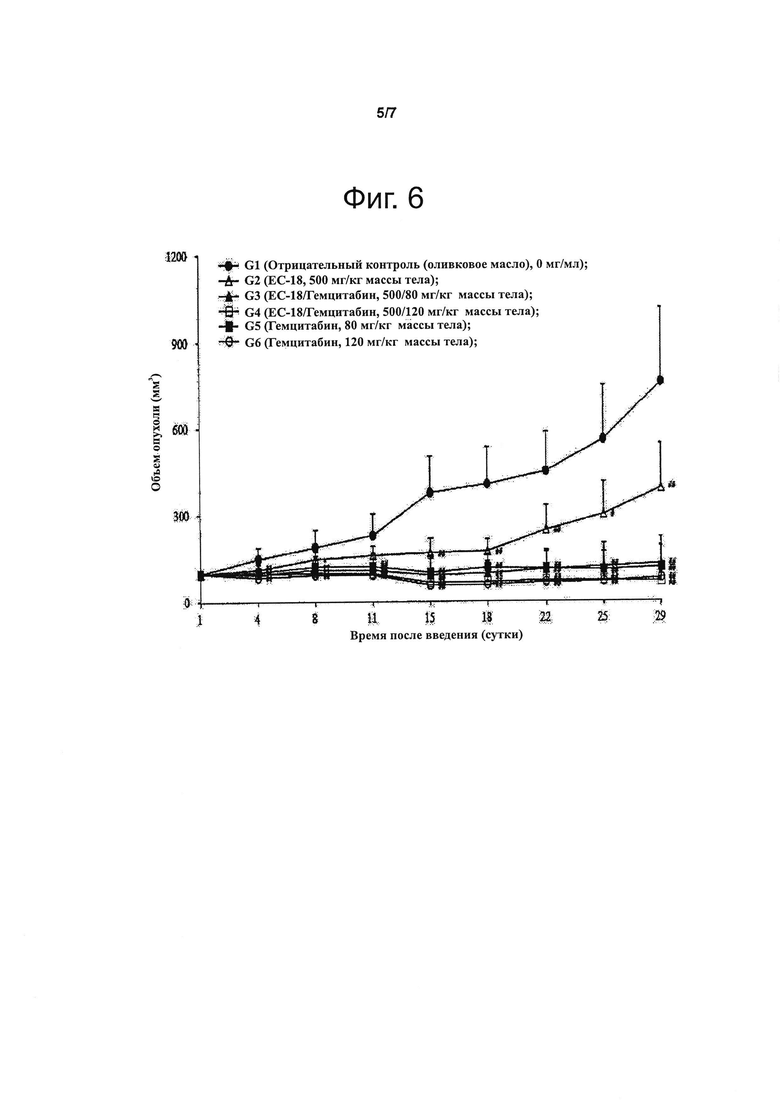
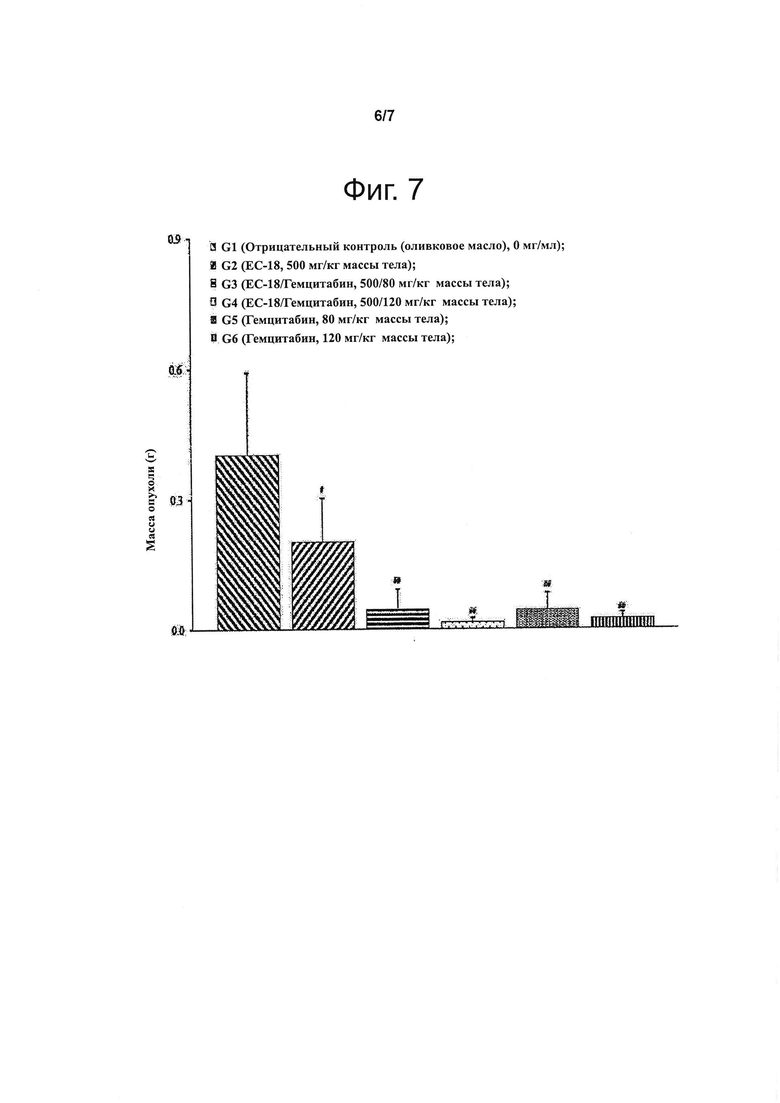
В примерах изобретения показано, что i) когда клетки линий U937, А549 и Jurkat подвергают обработке интерлейкином-4 и ЕС-18, фосфорилирование белка STAT6 подавляется зависимым от концентрации ЕС-18 образом (см. Экспериментальный пример 1; фиг. 1 и 2) и ii) когда белок STAT-6 испытывает воздействие ЕС-18 после того, как STAT-6 активировался в результате обработки клеток НЕК293 и А549 интерлейкином-4, то активность STAT-6 снижена (см. Экспериментальный пример 2; фиг. 3). В другом примере изобретения показано, что количество секретируемого IL-4 снижается в зависимости от концентрации ЕС-18, как следует из проведенного методом твердофазного иммуноферментного анализа (ELISA) определения количества выделяемого IL-4 в зависимости от концентрации ЕС-18 в клетках базофильного лейкоза крыс RBL-2H3 (см. Экспериментальный пример 3; фиг. 4 и 5); это позволяет полагать, что моноацетилдиацилглицерины эффективны для лечения раковых заболеваний крови или метастазирования рака. В частности, клетки множественной миеломы (поражающей костную ткань) человека RPMI 8226 трансплантировали самцам голых мышей и вводили им перорально испытываемое соединение по данному изобретению (ЕС-18), после чего оценивали эффект подавления опухолевого роста. В группе особей, которые получали ЕС-18 в дозе 500 мг/кг массы тела, объем опухолей статистически значимо уменьшался, также статистически значимо уменьшалась масса опухолей по сравнению с группой особей, служившей отрицательным контролем. Соответственно показано, что ЕС-18 подавляет опухолевый рост (см. Экспериментальный пример 4; фиг. 6 и 7), что свидетельствует об эффективности моноацетилдиацилглицеринов для предотвращения или лечения раковых заболеваний крови или подавления метастазирования рака.
В состав фармацевтической композиции по изобретению, содержащей моноацетилдиацилглицерины, могут также входить обычно используемые фармацевтически приемлемые носители, разбавители или иные эксципиенты. Количество моноацетилдиацилглицеринов в фармацевтической композиции по данному изобретению может варьировать в широких пределах без каких-либо специфических ограничений; конкретно содержание моноацетилдиацилглицеринов в фармацевтической композиции по данному изобретению составляет от 0,0001% до 100,0% (масса/масса), предпочтительно от 0,001% до 50% (масса/масса), более предпочтительно от 0,01% до 20% (масса/масса) относительно общего количества композиции.
Фармацевтическая композиция по изобретению может быть представлена различными лекарственными формами для перорального и неперорального введения, например лекарственными формами, выбираемыми из группы, состоящей из таблеток, болюсов, порошков, гранул, капсул (например, мягких или жестких желатиновых капсул), эмульсий, суспензий, сиропов, эмульгируемых концентратов, стерилизованных водных растворов, неводных растворов, лиофилизованных препаратов, суппозиториев и др. При составлении композиции по изобретению могут использоваться обычно применяемые разбавители или иные эксципиенты, например наполнители, объмообразующие агенты, связующие вещества, увлажняющие агенты, дезинтегрирующие агенты и поверхностно-активные вещества. Твердые препараты для перорального применения по изобретению включают таблетки, болюсы, порошки, гранулы, капсулы и проч.; эти твердые препараты могут быть получены путем смешивания одного или более активных компонентов и по меньшей мере одного из таких эксципиентов, как крахмал, карбонат кальция, сахароза, лактоза, желатин и др. Помимо указанных эксципиентов, можно использовать агенты, улучшающие скольжение, например стеарат магния и тальк. Жидкие препараты по изобретению для перорального применения включают эмульсии, суспензии, сиропы и проч.; они могут также содержать обычно используемые разбавители, например воду или жидкий парафин или различные агенты - увлажняющие, подслащивающие, ароматизирующие и консервирующие. Препараты для неперорального применения включают стерилизованные водные растворы, неводные растворы, лиофилизованные препараты, суппозитории и проч.; растворители для таких растворов включают пропиленгликоль, полиэтиленгликоль, растительные масла (например, оливковое масло) и эфиры для инъекций с помощью шприца, например этилолеат. Материалы для основы суппозиториев включают витепсол, макрогол, твин (Tween-61), масло какао, лаурин и глицериножелатин.
Композиция по изобретению вводится в организм в фармацевтически эффективном количестве. Термин «фармацевтически эффективное количество» в настоящем документе употребляется применительно к такому количеству композиции, которое достаточно для достижения желаемого результата при лечебных мероприятиях. Фармацевтически эффективное количество определяется соответственно типу, возрасту и полу индивида, характеру заболевания и степени его тяжести, активности взятого препарата, чувствительности к нему данного индивида, времени, продолжительности и пути введения, скорости выведения из организма и другим критериям, известным в области медицины. Композиция по изобретению может вводиться в организм в отдельности или же одновременно либо последовательно с другими лекарственными средствами; введение может быть однократным или многократным. В свете всех указанных выше факторов важно дозировать количество композиции так, чтобы достигался максимально возможный лечебный эффект при минимальных побочных явлениях или их отсутствии; дозировку композиции по изобретению вполне может определить специалист в данной области техники. Предпочтительное количество композиции по изобретению может варьировать соответственно состоянию индивида, его массе тела, степени тяжести заболевания, характеру препарата, пути и продолжительности введения. Нужное суммарное количество композиции, вводимое за сутки, определяет врач, специализирующийся в соответствующей области медицины; обычно оно составляет от 0,001 мг/кг массы тела до 1000 мг/кг, предпочтительно от 0,05 мг/кг до 200 мг/кг, более предпочтительно от 0,1 мг/кг до 100 мг/кг и вводится в один прием или в несколько приемов на протяжении суток. Композицию по изобретению можно вводить любому индивиду, которому требуется подавление ракового заболевания крови или метастазирования рака. Например, композицию по изобретению моно вводить не только людям, но и животным (в частности, млекопитающим), например обезьянам, собакам, кошкам, кроликам, морским свинкам, крысам, мышам, коровам, овцам, свиньям, козам и др. Композицию по изобретению можно вводить в организм различными обычно применяемыми для введения лекарственных средств способами, например перорально или ректально, внутривенно, внутримышечно, подкожно или интрацеребрально.
В другом аспекте изобретения предлагается функциональный продукт лечебного питания для подавления ракового заболевания крови или метастазирования рака, включающий в качестве активного компонента моноацетилдиацилглицерины, описываемые формулой 1,
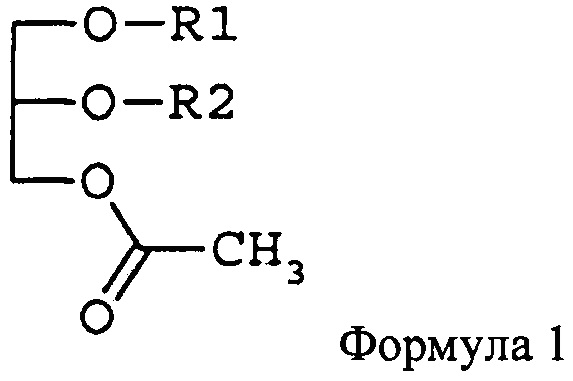
где R1 и R2 независимо друг от друга представляют (не ограничиваясь указанным здесь) жирнокислотную группу из 14-22 атомов углерода.
Подробнее, моноацетилдиацилглицерины по изобретению или их фармацевтически приемлемые соли можно включать в состав функционального продукта лечебного питания для подавления ракового заболевания крови или метастазирования рака. Эти соединения и подавление раковых заболеваний крови или метастазирования рака подробно описаны ранее. Термин «улучшение» означает любое изменение, ослабляющее симптомы или положительным образом влияющее на проявления заболевания у индивида, у которого имеется либо подозревается раковое заболевание крови или метастазирование рака.
В состав функционального продукта лечебного питания композиция по изобретению включается в отдельности или вместе с другим активным компонентом. Количество соединений по изобретению в функциональном продукте лечебного питания определяют соответственно предполагаемому применению этого продукта. Как правило, при изготовлении функционального продукта (в том числе напитка) лечебного питания композиция по изобретению включается в его состав в количестве менее чем 15 массовых долей, предпочтительно менее 10 массовых долей. В случае продолжительного использования функционального продукта лечебного питания с целью поддержания здоровья индивида количество композиции в нем может быть уменьшено. Однако, поскольку активный компонент продукта не вызывает никаких негативных эффектов, количество композиции в продукте может быть больше указанного выше. Функциональный продукт лечебного питания, включающий композицию по изобретению, может представлять собой любой обычный пищевой продукт или напиток. Конкретные примеры включают мясные продукты, колбасные изделия, хлеб, шоколад, конфеты, чипсы и подобные продукты, печенье, пиццу, лапшу быстрого приготовления, макаронные изделия, жевательную резинку, мороженое, молочные продукты, супы, прохладительные безалкогольные напитки, чай, алкогольные напитки, витаминные комплексные препараты и др. При необходимости пищевой продукт по изобретению включает также корм для животных.
В том случае, когда функциональный продукт лечебного питания является напитком, он может включать обычно используемые в напитках подсластители, ароматизирующие агенты, природные углеводы и др. Примеры природных углеводов включают моносахариды, например глюкозу и фруктозу; дисахариды, например мальтозу и сахарозу; полисахариды, например декстрин и циклодекстрин; сахарные спирты, например ксилит, сорбит и эритрит. Предпочтительное количество природных углеводов в напитке по данному изобретению составляет от 0,01 г до 0, 04 г, более предпочтительно от 0,02 до 0,03 г на 100 мл. Примеры подсластителей включают природные агенты, например тауматин и экстракт стевии, и искусственные вещества, например сахарин и аспартам. Функциональный продукт лечебного питания по изобретению может также включать различные питательные добавки, витамины, электролиты, ароматизирующие агенты, красители, пектиновые кислоты и их соли, альгиновую кислоту и ее соли, органические кислоты, защитные коллоиды, загустители, агенты для подведения рН, стабилизирующие агенты, консерванты, глицерин, спирт, соки и др.
В другом аспекте изобретения предлагается способ для предотвращения или лечения ракового заболевания крови или для подавления метастазирования рака, включающий этап введения фармацевтической композиции по данному изобретению индивиду, у которого имеется либо подозревается раковое заболевание крови или метастазирование рака. Понятие «индивид, у которого имеется либо подозревается раковое заболевание крови или метастазирование рака» включает не только животных и людей, у которых имеется раковое заболевание крови или происходит метастазирование рака, но и тех, у которых возможно их возникновение. Индивидов, у которых имеется либо подозревается раковое заболевание крови или метастазирование рака, можно эффективно лечить путем введения фармацевтической композиции по данному изобретению. Термин «введение» означает, что фармацевтическая композиция по данному изобретению каким-либо образом попадает в организм индивида, у которого имеется либо подозревается раковое заболевание крови или метастазирование рака. Путь введения может быть любым - пероральным или непероральным.
Способ лечения раковых заболеваний крови по изобретению включает этап введения нуждающемуся в том индивиду эффективного количества фармацевтической композиции, содержащей моноацетилдиацилглицерины, описываемые формулой I, или их фармацевтически приемлемые соли. Сколько нужно вводить препарата суммарно за сутки, определяет врач; обычно суточная доза составляет от около 0,001 мг/кг массы тела пациента до около 1000 мг/кг, предпочтительно от около 0,05 мг/кг до около 200 мг/кг, более предпочтительно от около 0,1 мг/кг до около 100 мг/кг. Суточная доза может быть введена в один прием (раз в день) или в несколько приемов на протяжении суток. Впрочем, конкретное терапевтически эффективное количество моноацетилдиацилглицеринов для индивида варьирует в зависимости от характера и выраженности желаемой реакции организма в ходе лечения, состава композиции, в том числе от присутствия в ней другого активного агента, возраста, массы тела, общего состояния здоровья, пола и питания индивида, времени и пути введения препарата, соотношения компонентов в композиции, продолжительности курса лечения, других препаратов, используемых параллельно с данным в ходе лечения, и различных других факторов, известных в области медицины.
Полезный эффект изобретения
Моноацетилдиацилглицерины по изобретению эффективно подавляют экспрессию интерлейкина-4 и активность белка STAT-6, не обладая побочными эффектами, свойственными существующими на сегодняшний день агентами для подавления раковых заболеваний крови или метастазирования рака, не токсичны и оказывают выраженное терапевтическое действие. Таким образом, эти соединения можно с успехом использовать для предотвращения и лечения раковых заболеваний крови или метастазирования рака и улучшения состояния больных с такой патологией.
Краткое описание иллюстраций
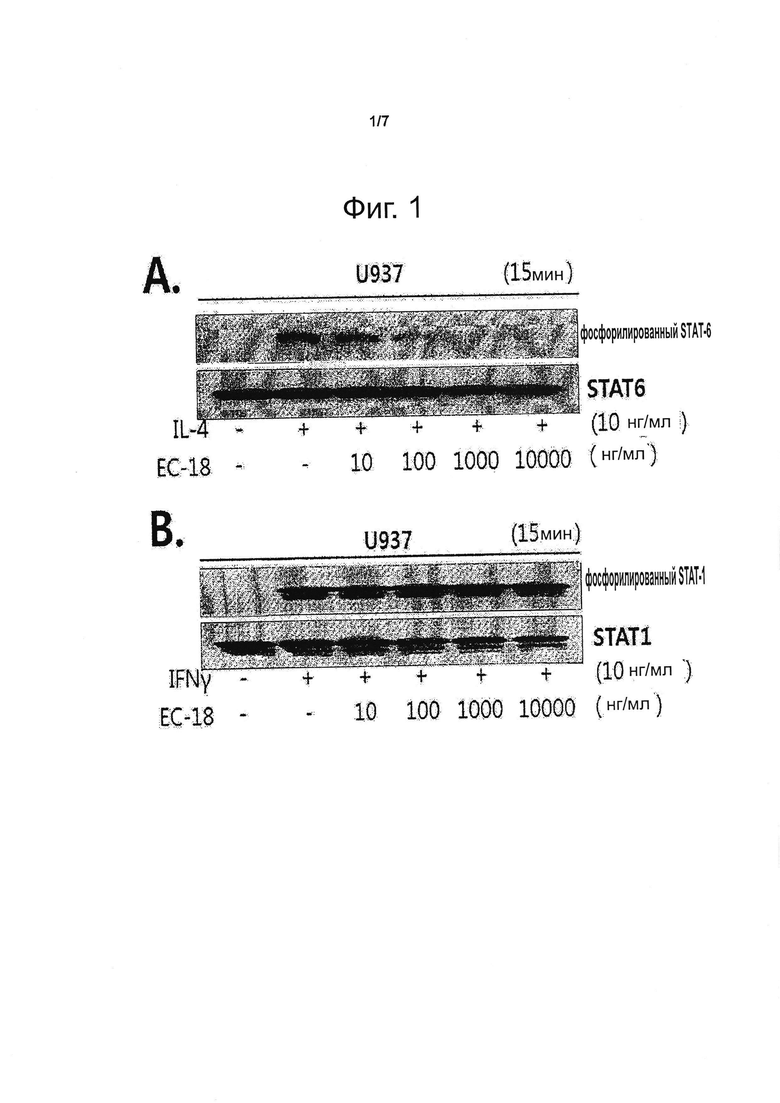
Фигура 1 представляет данные анализа лизата клеток U937 методом вестерн-блоттинга, демонстрирующие подавление вызываемого интерлейкином-4 фосфорилирования STAT-6 в результате воздействия на клетки ЕС-18: (А) фосфорилирование STAT-6, индуцируемое IL-4, в зависимости от концентрации ЕС-18; (B) фосфорилирование STAT-6, индуцируемое IFN-γ, в зависимости от концентрации ЕС-18.
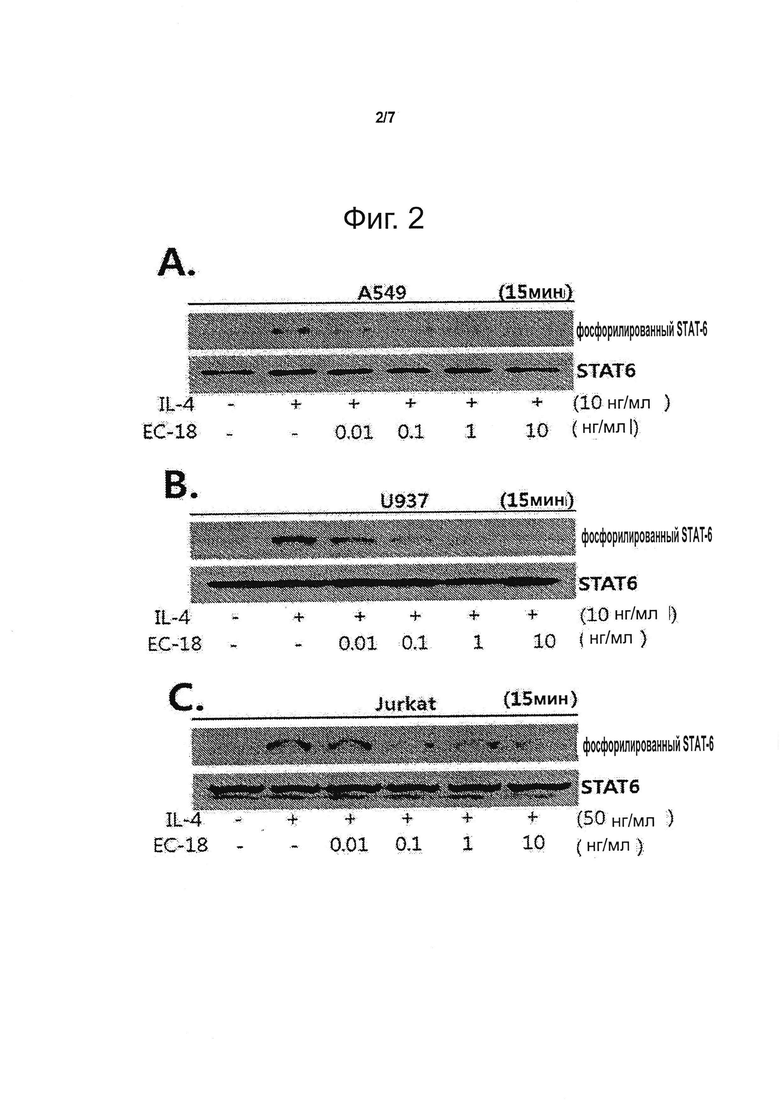
Фигура 2 представляет данные анализа лизата клеток А549 (A), U937 (В) и Jurkat (C) методом вестерн-блоттинга, демонстрирующие подавление индуцируемого IL-4 фосфорилирования STAT-6 в зависимости от концентрации ЕС-18.
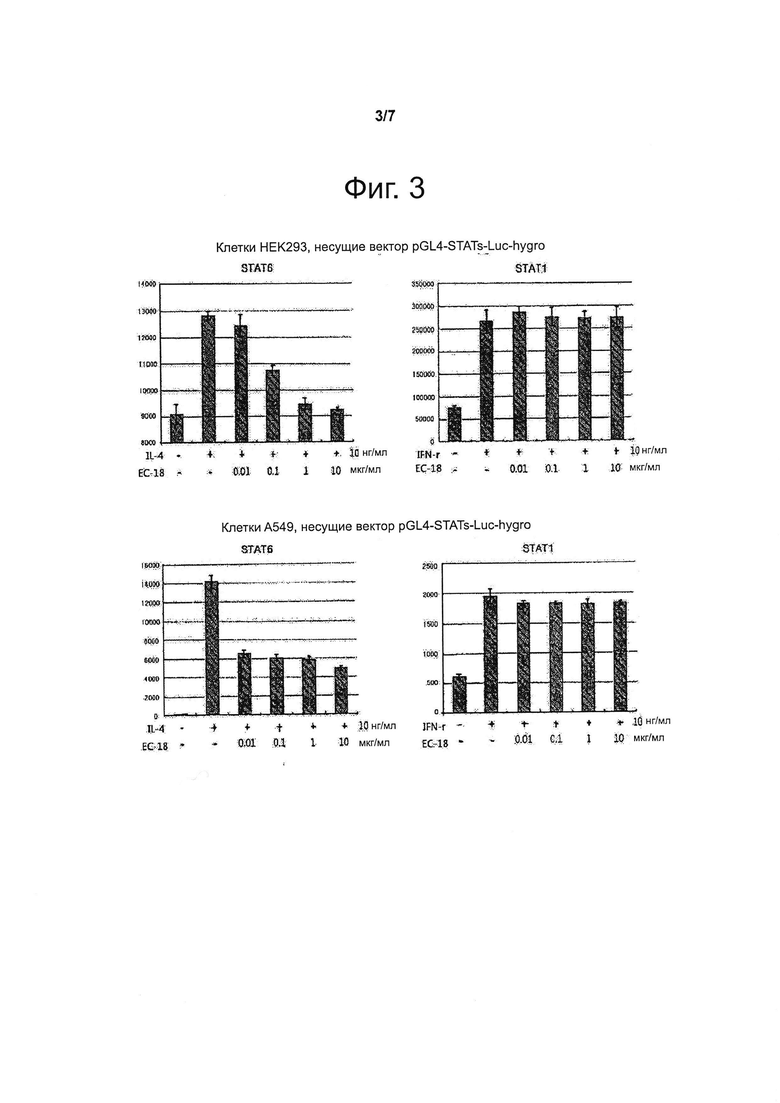
Фигура 3 представляет данные об интенсивности люциферазной флуоресценции, обусловленной индуцируемой IL активацией STAT-6, и STAT-1, активируемым при участии IFN-γ, в зависимости от концентрации ЕС-18, в клетках НЕК293 и А54.
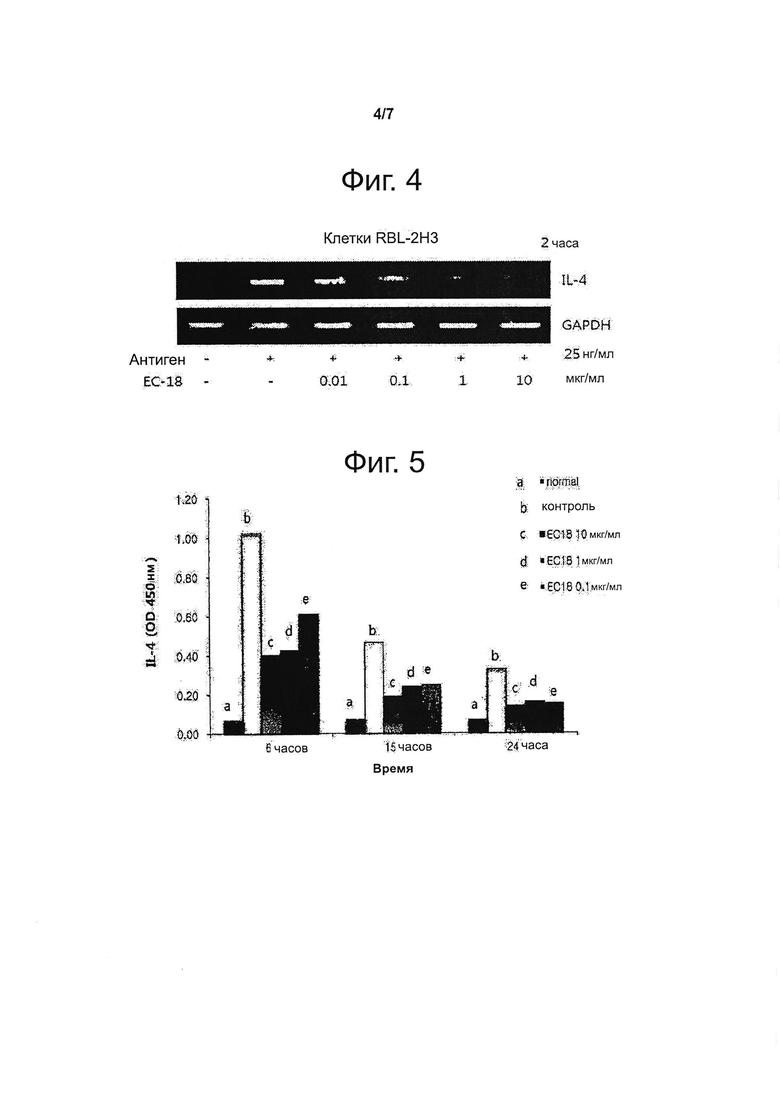
Фигура 4 представляет данные, полученные методом твердофазного иммуноферментного анализа (ELISA), о подавлении секреции IL-4 в клетках RBL-2H3 в зависимости от концентрации ЕС-18.
Фигура 5 демонстрирует изменение секреции IL-4 в клетках RBL-2H3 во времени (6 часов, 15 часов и 24 часа) в зависимости от концентрации ЕС-18.
Фигура 6 демонстрирует уменьшение объема опухолей в результате воздействия ЕС-18 у голых мышей, которым трансплантировали раковые клетки крови человека.
Фигура 7 демонстрирует уменьшение массы опухолей в результате воздействия ЕС-18 у голых мышей, которым трансплантировали раковые клетки крови человека.
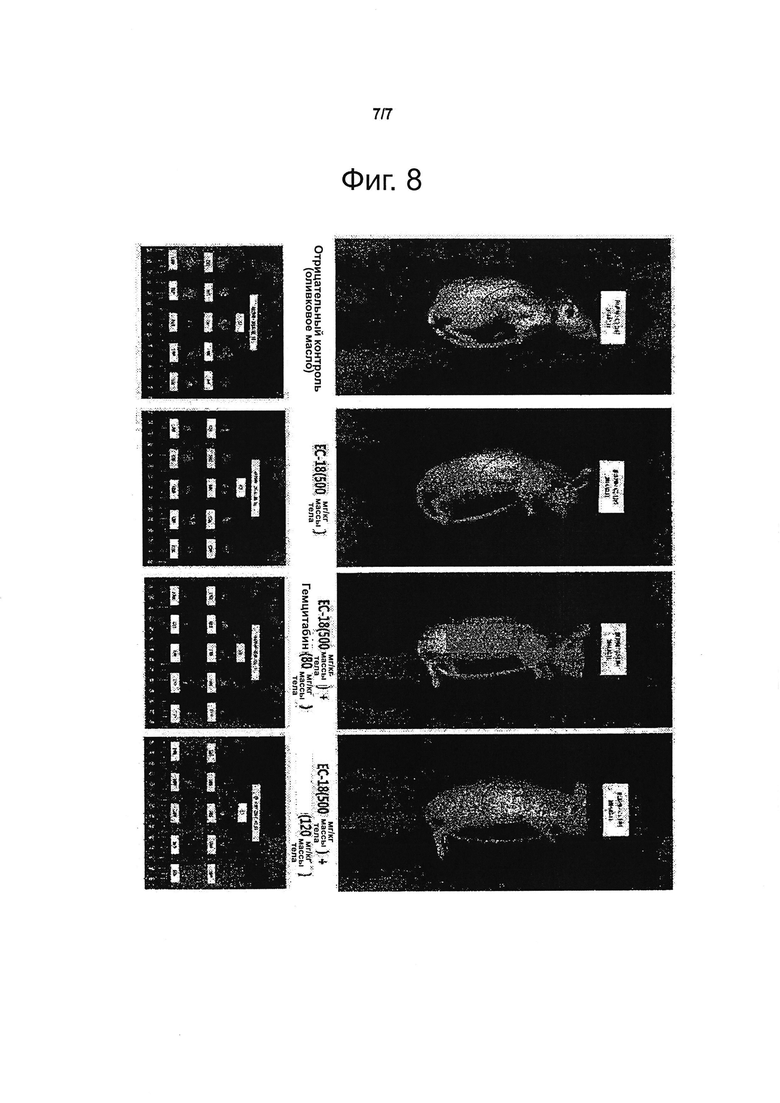
Фигура 8_представляет фотографии, демонстрирующие изменение размеров опухолей у мышей с экспериментально вызванным раковым заболеванием крови в результате введения ЕС-18 по сравнению с положительным и отрицательным контролями.
Осуществление изобретения
Более подробно изобретение будет описано с помощью прилагаемых иллюстраций, которые предназначены для лучшего понимания данного изобретения и не имеют ограничительного характера.
Пример
Культуры клеток
Человеческие клетки линий U937, А549, Jurkat, НЕК293 и крысиные клетки линии RBL-2H3 из Американской коллекции клеточных культур (АТСС, Роквилл, шт. Мэриленд, США) культивировали при температуре 37°C во влажной атмосфере, содержавшей 5% CO2. Клетки линий U937, Jurkat, К562 и А549 культивировали в среде RPMI1640 (Life Technologies, Карлсруэ, Германия), содержавшей 10% фетальной телячьей сыворотки (FCS, HyClone, Логан, шт. Юта, США), 2 мМ L-глутамина, 100 мкг/мл пенициллина и 100 мкг/мл стрептомицина (Life Technologies). Клетки линии НЕК293 культивировали в среде DMEM; клетки линии RBL-2H3 культивировали в среде MEM.
Экспериментальный пример 1
Подавление фосфорилирования белка STAT-6 под действием ЕС-18
Клетки, обработанные ЕС-18, IL-4 и гамма-интерфероном (IFN-γ) подвергали лизису холодным лизирующим буферным раствором, содержавшим SDS [(50 мМ HEPES; 150 мМ NaCl; 0,2 мМ EDTA; 0,5% NP-40; 0,1% SDS; 1 мМ Na3VO4; 10 мМ NaF и полный протеазный ингибирующий коктейль (Roche)] в течение 30 минут на льду. После разрушения клеток выделяли РНК, отделяли водный раствор от нерастворимого осадка путем центрифугирования лизата клеток в течение 30 минут при 13000 об/мин на высокоскоростной центрифуге. Определяли количество полученного водного раствора клеточного содержимого и проводили его разделение путем электрофореза в полиакриламидном геле с додецилсульфатом натрия (10-12% SDS-PAGE). Клеточные белки, разделившиеся в геле, переносили на поливинилиденфторидную (PVDF) мембрану (Millipore, Биллерика, шт. Массачусетс, США) в течение 2 часов при напряжении 100 В.
Для определения количества фосфорилированных белков STAT1, STAT6 в клетках нагруженную мембрану инкубировали с поликлональными кроличьими антителами против STAT1, STAT6 и против фосфорилированных STAT1, STAT6 (Cell signaling Technology, США) (1:1000), служившими первичными антителами, при комнатной температуре в течение 60 минут. Затем мембрану инкубировали с козьими антителами против кроличьего IgG, конъюгированными с пероксидазой хрена (Santa Cruz Biotechnology, США) (1:3000) служившими вторичными антителами, при комнатной температуре в течение 60 минут. Такое же количество клеточных белков подтверждалось результатами, получаемыми с поликлональными кроличьими антителами против STAT1, STAT6. После инкубации с антителами мембрану инкубировали с раствором для усиления хемилюминесценции (ECL, Millipore, Биллерика, шт. Массачусетс, США) и экспонировали на рентгеновскую пленку. По полосе на пленке определяли количество фосфорилированного STAT.
Полученные результаты показывают, что STAT-6 фосфорилируется в эпителиальных клетках А549 и в клетках иммунной системы U937 и Jurkat, причем количество фосфорилированного STAT-6 снижается в случае предварительной обработки ЕС-18 зависимым от его концентрации образом (см. фиг. 1-А и 2-А, В, С). Фиг. 1В демонстрирует, что снижения фосфорилирования STAT-1 под действием ЕС-18 не происходит.
Экспериментальный пример 2
Определение подавления активации STAT-6 под действием ЕС-18 с помощью люциферазного репортера
Вектор p4xSTAT6-Luc2P (Addgene), содержащий элемент STAT-6 (SIE), с которым связывается STAT-6, ввели в клетки линий НЕК293 и А549. Для определения подавления активации STAT-6 под действием ЕС-18 клетки предварительно обрабатывали ЕС-18 и затем IL-4. Также определяли активацию STAT-1, используя вектор pGL4.45[luc2P/ISRE/Hygro] (Promega), содержащий стимулируемый интерфероном элемент ответа (ISRE), с которым связывается STAT-1.
Клетки НЕК293 и А549 диссоциировали путем обработки трипсином-EDTA, после чего наносили на культуральный планшет. С помощью реагента для трансфекции Attractene (Qiagen) клетки трансфицировали p4xSTAT6-Luc2P и pGL4.45[luc2P/ISRE/Hygro] и инкубировали при температуре 37°C в атмосфере, содержавшей 5% СО2, в течение суток. На следующий день клетки собирали с планшета и в количестве 0,1 мл наносили на 96-луночный планшет по 5×104 клеток на лунку; инкубировали при температуре 37°C в атмосфере, содержавшей 5% CO2, в течение суток. На следующий день клетки обрабатывали ЕС-18 в различных концентрациях в течение 1 часа, после чего обрабатывали IL-4 и IFN-γ (10 нг/мл). Инкубировали при температуре 37°C в атмосфере, содержавшей 5% CO2, в течение 6 часов, после чего определяли активность люциферазы, используя реагент ONE-Glo Luciferase Assay System (Promega). A именно, в каждую лунку вносили 0,1 мл смеси (1:1) реагента ONE-Glo Luciferase Assay System и субстрата. Через 3 минуты измеряли интенсивность флуоресценции, обусловленной IL-4 и IFN-γ, используя ONE-Glo Luciferase Assay System (Promega) следующим образом: в каждую лунку 96-луночного планшета вносили 0,1 мл смеси (1:1) буферного раствора ONEONE-Glo™ Luciferase Assay Buffer и субстрата и через 3 минуты измеряли интенсивность флуоресценции с помощью многофункционального планшетного анализатора VICTOR X Multilabel Plate Reader (PerkinElmer) в течение 0,5 секунды.
В клетках, подвергавшихся предварительной обработке ЕС-18 в различных концентрациях, по сравнению с клетками, на которые воздействовали только IL-4, люциферазная флуоресценция была слабее, что указывало на пониженную активность STAT-6 в клетках, обработанных ЕС-18. В то же время люциферазная флуоресценция, обусловленная STAT-1, под действием ЕС-18 в клетках, обработанных IFN-γ, не изменялась (см. фиг. 3). Полученные результаты свидетельствуют, что в клетках НЕК293 и А549 активация STAT-6, индуцированная IL-4, под действием ЕС-18 подавляется.
Экспериментальный пример 3
Подавление экспрессии гена IL-4 под действием ЕС-18
Экспериментальный пример 3-1
Полимеразная цепная реакция с обратной транскриптазой
Клетки RBL-2H3 предварительно обрабатывали ЕС-18, после чего индуцировали клеточную активность антигеном для IgE, и произошедшие в результате изменения в уровнях мРНК экспрессируемого цитокина IL-4 определяли при помощи полимеразной цепной реакции с обратной транскриптазой (RT-PCR). Выделяли суммарную РНК по стандартным протоколам; синтезировали кДНК, используя набор AccuScript High Fidelity 1st Strand cDNA Synthesis Kit (Stratagene) согласно инструкциям производителя. На этапе 2 реакций RT-PCR использовали праймер олиго-dT и обратную транскриптазу, пару специфичных праймеров и полимеразу Taq (Takara Co., Ltd.; Сига, Япония). При реакции PCR (1 мкл кДНК) брали 20 мкл, содержавшие 0,5 Ед ДНК-полимеразы Taq, 1 буферного раствора, 1 мМ смеси нуклеотидов dNTP mix (Takara) и пары специфичных праймеров.
Амплификацию осуществляли, используя амплификатор с активным регулированием GeneAmp PCR system 2700 (Applied Biosystems, Фостер Сити, шт. Калифорния, США) при следующих условиях: 5 минут при температуре 94°C, затем 45 секунд при температуре 94°C, 45 секунд при температуре 56°C и 1 минута при температуре 72°C; 25-40 циклов). Конечное удлинение проводили при температуре 72°C в течение 7 минут. В таблице 1 представлены последовательности праймеров, которые использовались для амплификации кДНК путем PCR. Праймеры подбирали с помощью программы Primer3 и приобретали в компании Bioneer, Inc. (Тэджон, Корея).

Продукт полимеразной цепной реакции выделяли, используя 1,5%-ный агарозный гель, окрашивали бромистым этидием (EtBr), визуализировали в проходящем УФ свете, используя автоматизированную систему Gel Doc 2000 (Bio-Rad Laboratories, Геркулес, шт. Калифорния, США) и анализировали с помощью программы Quantity One (Bio-Rad Laboratories). Каждый образец исследовали по меньшей мере три раза; брали репрезентативные данные. Предварительную обработку клеток ЕС-18 в концентрациях 0,01; 0,1; 1,0 и 10 мкг/мл проводили в течение 1 часа, представляли антиген и затем инкубировали в течение 3 часов. После этого клетки подвергали лизису и выделяли РНК. Получали кДНК, используя обратную транскриптазу с праймерами поли-А + РНК. При амплификации использовали праймеры для IL-4 (см. таблицу 1). В качестве внутреннего стандарта использовали GAPDH.
Экспериментальный пример 3-2
Подтверждение эффекта подавления секреции IL-4 путем твердофазного иммуноферментного анализа (ELISA")
Клетки обрабатывали ЕС-18 в концентрациях от 0,1 пг/мл до 10 мкг/мл в течение 1 часа и представляли антиген. Инкубировали при температуре 37°C в течение 18 часов, после чего клетки отделяли, чтобы получить супернатант. Определение крысиного IL-4, присутствовавшего в среде, где культивировались клетки RBL-2H3, проводили методом твердофазного иммуноферментного анализа (ELISA) согласно протоколу, данному производителем, используя готовые имеющиеся в продаже моноклональные антитела (mAb) (BD Biosciences).
Полученные результаты подтвердили, что в клетках RBL-2H3, обработанных ЕС-18, экспрессия транскрипта IL-4 понижена пропорционально концентрации ЕС-18 (см. фиг. 4) и секреция IL-4, индуцированная антигеном, понижена соответственно обработке клеток RBL-2H3 ЕС-18 (см. фиг. 5). Кроме того, подтвердилось, что в каждый момент времени секреция IL-4 понижена в зависимости от концентрации ЕС-18: при концентрации ЕС-18 10 мкг/мл секреция IL-4 подавлена на 60% или более.
Экспериментальный пример 4
Определение противоопухолевого эффекта ЕС-18 с использованием животных моделей рака.
Самцам голых мышей трансплантировали клетки RPMI 8226, происходящие из множественной миеломы (поражающей костную ткань) человека, и вводили перорально ЕС-18; затем оценивали подавление опухолевого роста. В эксперименте было шесть групп животных по 10 особей в каждой: группа «отрицательный контроль»; особи, получавшие испытываемое вещество (ЕС-18) в дозе 500 мг/кг массы тела; группа «комбинированная терапия», в которой мыши получали 500 мг/кг массы тела испытываемого вещества (ЕС-18) и 80 мг/кг массы тела препарата, служившего положительным контролем (гемцитабина); группа «комбинированная терапия», в которой мыши получали 500 мг/кг массы тела испытываемого вещества (ЕС-18) и 120 мг/кг массы тела гемцитабина; группа «положительный контроль», в которой животные получали 80 мг/кг массы тела гемцитабина; группа «положительный контроль», в которой животные получали 120 мг/кг массы тела гемцитабина. В группе «отрицательный контроль» животным вводили оливковое масло. Испытываемое вещество (ЕС-18) вводили мышам в желудок один раз в сутки на протяжении четырех недель (всего 28 раз). Препарат, служивший положительным контролем (гемцитабин), вводили мышам в брюшную полость два раза в неделю на протяжении четырех недель (всего 8 раз). В период наблюдения животных осматривали раз в сутки, отмечая симптомы, и два раза в неделю измеряли массу тела и объем опухолей (в кубических миллиметрах). По окончании периода наблюдения опухоли иссекали и взвешивали (массу опухолей выражали в граммах). Полученные результаты представлены на фиг. 6 и 7. Как видно из этих иллюстраций, у мышей, получавших испытываемое вещество (ЕС-18) в дозе 500 мг/кг массы тела, объем и масса опухолей были существенно (статистически значимо) меньше, чем в группе «отрицательный контроль», то есть опухолевый рост был подавлен. Также у мышей с экспериментально вызванным раковым заболеванием крови в результате введения ЕС-18 и гемцитабина, служившего положительным контролем, изменялись размеры опухолей, что демонстрируют фотографии, приведенные на фиг. 8. Эта иллюстрация подтверждает, что введение ЕС-18 приводило к уменьшению размеров опухолей, сходному с таковым в случае положительного контроля.
Из приведенного выше описания специалистам в данной области техники понятно, что изобретение может быть воплощено и в других конкретных вариантах без отклонения от технической сущности или существенных признаков изобретения. Поэтому описанные выше примеры следует рассматривать как во всех отношениях иллюстративные и не имеющие ограничительного характера. Имеется в виду, что объем данного изобретения включает все варианты в диапазоне, определяемым приведенным выше описанием и прилагаемой формулой изобретения, а не набор конкретных примеров; также в объем данного изобретения входят все модификации, проистекающие из эквивалентных вариантов.
Изобретение относится к фармацевтической промышленности и представляет собой фармацевтическую композицию для подавления раковых заболеваний крови, содержащую в качестве активного ингредиента моноацетилдиацилглицерин, представленный формулой 1, где R1 и R2 независимо друг от друга представляют жирнокислотную группу из 14-20 атомов углерода, и фармацевтически приемлемый носитель, эксципиент или разбавитель, причем раковое заболевание крови выбирают из группы, состоящей из лимфом, острых лейкозов, хронических лейкозов и множественной миеломы. Изобретение обеспечивает расширение арсенала средств для лечения лимфом, острых лейкозов, хронических лейкозов и множественной миеломы. 3 н. и 8 з.п. ф-лы, 8 ил.
1. Фармацевтическая композиция для подавления раковых заболеваний крови, содержащая в качестве активного ингредиента моноацетилдиацилглицерин, описываемый формулой 1,
где R1 и R2 независимо друг от друга представляют жирнокислотную группу из 14-20 атомов углерода, и фармацевтически приемлемый носитель, эксципиент или разбавитель, причем раковое заболевание крови выбирают из группы, состоящей из лимфом, острых лейкозов, хронических лейкозов и множественной миеломы.
2. Композиция по п. 1, в которой R1 и R2 независимо друг от друга выбирают из группы, состоящей из пальмитоила, олеоила, линолеоила, линоленоила, стеароила, миристоила и арахидоноила.
3. Композиция по п. 1, в которой R1 и R2 (R1/R2) выбирают из группы, состоящей из олеоила/пальмитоила, пальмитоила/олеоила, пальмитоила/линолеоила, пальмитоила/линоленоила, пальмитоила/арахидоноила, пальмитоила/стеароила, пальмитоила/пальмитоила, олеоила/стеароила, линолеоила/пальмитоила, линолеоила/стеароила, стеароила/линолеоила, стеароила/олеоила, миристоила/линолеоила, миристоила/олеоила.
4. Композиция по п. 1, в которой моноацетилдиацилглицерин является соединением, описываемым формулой 2:
5. Композиция по п. 1, в которой моноацетилдиацилглицерин, описываемый формулой 1, является природным веществом, выделенным из оленьих рогов.
6. Композиция по п. 1, в которой моноацетилдиацилглицерин подавляет секрецию IL-4.
7. Композиция по п. 1, в которой моноацетилдиацилглицерин подавляет активацию STAT-6.
8. Функциональный продукт лечебного питания для профилактики раковых заболеваний крови, содержащий в качестве активного ингредиента моноацетилдиацилглицерин, описываемый формулой 1,
где R1 и R2 независимо друг от друга представляют жирнокислотную группу из 14-20 атомов углерода, причем раковое заболевание крови выбирают из группы, состоящей из лимфом, острых лейкозов, хронических лейкозов и множественной миеломы.
9. Продукт по п. 8, в котором R1 и R2 независимо друг от друга выбирают из группы, состоящей из пальмитоила, олеоила, линолеоила, линоленоила, стеароила, миристоила и арахидоноила.
10. Продукт по п. 8, в котором R1 и R2 (R1/R2) выбирают из группы, состоящей из олеоила/пальмитоила, пальмитоила/олеоила, пальмитоила/линолеоила, пальмитоила/линоленоила, пальмитоила/арахидоноила, пальмитоила/стеароила, пальмитоила/пальмитоила, олеоила/стеароила, линолеоила/пальмитоила, линолеоила/стеароила, стеароила/линолеоила, стеароила/олеоила, миристоила/линолеоила, миристоила/олеоила.
11. Способ предотвращения или лечения ракового заболевания крови, включающий введение пациенту, не являющемуся человеком, композиции по любому из пп. 1-7 и причем в котором раковое заболевание крови выбирают из группы, состоящей из лимфом, острых лейкозов, хронических лейкозов и множественной миеломы.
| ИММУНОМОДУЛИРУЮЩЕЕ СРЕДСТВО, ПРОТИВОРАКОВОЕ СРЕДСТВО И ЗДОРОВАЯ ПИЩА, СОДЕРЖАЩАЯ ПРОИЗВОДНЫЕ МОНОАЦЕТИЛДИАЦИЛГЛИЦЕРИНА | 2005 |
|
RU2341257C2 |
| Myung-Hwan Kim et | |||
| al | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Волномер | 1922 |
|
SU474A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Солесос | 1922 |
|
SU29A1 |
Авторы
Даты
2017-10-02—Публикация
2014-08-18—Подача