Изобретение относится к области медицины, конкретно к способам проведения пункционной биопсии.
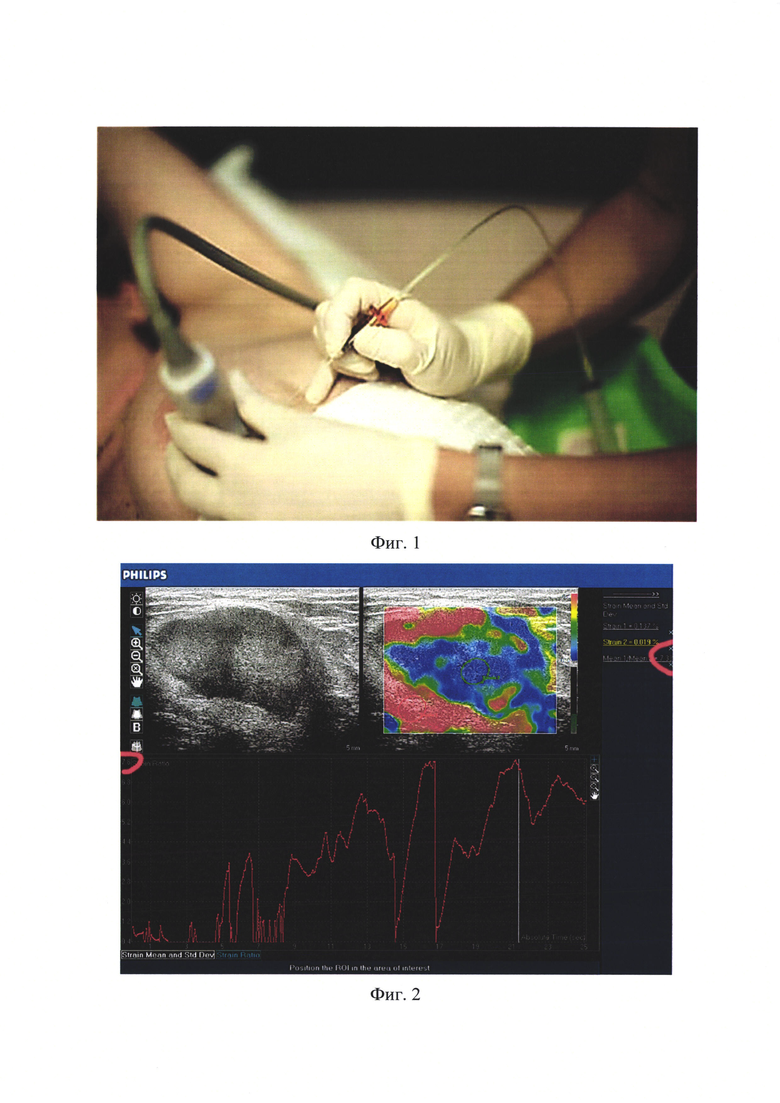
Наиболее близким к предлагаемому является способ тонкоигольной пункционной аспирационной биопсии под ультразвуковым контролем [1, 2]. Проводится стандартное ультразвуковое исследование обозначенного для обследования паренхиматозного органа, либо участка мягких тканей с визуальной оценкой структуры исследуемого органа, либо зоны интереса. Цель проводимого УЗ исследования - выявление дополнительных объемных образований в паренхиматозных органах, либо мягких тканях, требующее морфологической верификации. По результатам ультразвукового исследования врач онколог, хирург, маммолог, либо эндокринолог по показаниям назначает процедуру тонкоигольной пункционной аспирационной биопсии (ПАБ). В ходе проведения биопсии применяют технику fineneedles aspiration biopsy, где для фиксации иглы используют специальные пункционные датчики или съемные адаптеры, либо используют вариант - методика free hand method (метод «свободной руки»), где иглу фиксируют руки врача-оператора, а У3-датчик руки ассистента (Фиг. 1). В настоящее время в практическом здравоохранении предпочтительна вторая методика, следует учитывать, что далеко не в каждом медицинском учреждении есть пункционные датчики, либо съемные адаптеры, да и само исполнение первого варианта пункции с использованием специального датчика, либо съемного адаптера неудобно по размерам иглы и доступности места пункции. Способ ПАБ осуществляется по стандартной схеме под контролем УЗИ. Пациента укладывают в горизонтальном положении, кожу обрабатывают антисептиком (70%-ный раствор спирта и спиртовой раствор йода). Ультразвуковой датчик устанавливают над патологическим очагом, получают отчетливое изображение очага в ультразвуковом В-режиме. Путем прокола кожи и окружающих опухоль тканей с использованием метода «свободной руки» вводят тонкую иглу G 20, 22 в структуру образования, при этом ориентируются на изображение на экране монитора, регистрируют движущийся конец пункционной иглы в виде яркой белой точки. При достижении концом иглы требуемой зоны для пункции к канюле иглы присоединяют шприц и производят аспирацию содержимого очага в просвет иглы. Аспирацию прекращают, основываясь на появлении содержимого (кровь, детрит и др.) в шприце или прозрачной канюле иглы. Содержимое иглы и шприца «выдувают» и наносят на предметное стекло. Полученный таким образом мазок поступает на цитологическое исследование в лабораторию, где производят морфологический анализ полученного цитологического материала с главной целью - исключение злокачественного процесса [2].
Однако известный способ проведения пункционной биопсии является относительно сложной по исполнению процедурой. В практическом применении сложным является именно момент «регистрации движущегося конца пункционной иглы в виде яркой белой точки» в ультразвуковом изображении при сканировании в ультразвуковом В-режиме. Пункционная аспирационная биопсия в этом виде не обладает достаточной точностью и информативностью, так как возможна только субъективная визуальная оценка направления хода пункционной иглы к месту забора морфологического материала при выполнении процедуры. Все это приводит к повторам при проведении пункции и дополнительной травматизации органов и тканей пациента, росту риска осложнений, бо'льшей протяженности по времени процедуры тонкоигольной пункционной аспирационной биопсии. Второй важный момент в правильном проведении пункционной биопсии любого органа или образования - это определение нужного для пункции места (сектора, точки), где возможен достаточный гистологический результат. При пункции требуется выполнить установку - нашли образование, выбрали место, которое, на Ваш взгляд, по определенным признакам (уровню кровотока при цветном допплеровском сканировании, выраженности изменений на различных участках опухоли или органа), даст положительный результат в оценке состояния органа, либо опухоли и при пункции мы должны иглой пунктировать именно эту зону. Третий важный момент при проведении пункционной биопсии - получение достаточного для исследования материала в количественном отношении. При проведении пункции хочется этот момент регистрировать не «в слепую» по количеству аспирационных движений поршня шприца и не по попытке визуализировать изображение в ультразвуковом В-режиме перемещаемых частиц по ходу иглы на серошкальном изображении монитора, этот момент является достаточно сложным в практическом исполнении. Хочется иметь четкий, яркий визуальный контроль за набором тканевого материала в количестве, достаточном для цитологического исследования.
Новый технический результат - повышение информативности, точности диагностической процедуры пункционной биопсии, за счет снижения доли субъективизма при определении хода пункционной иглы до мест забора биопсийного материала, снижение травматизации тканей органов и сосудов, сокращение повторов при пункции и времени проведения диагностической процедуры.
При ложных направлениях пункционной иглы возможно повреждение сосудов и паренхимы соседних органов.
Для достижения нового технического результата в способе проведения пункционной биопсии, включающем визуальную оценку в ультразвуковом В-режиме топографии, формы, контуров, размеров, подвижности, структуры и эхогенности обследуемого органа и выявленного дополнительного объемного образования, его расположения в мягких тканях по отношению к другим структурам, оценку реакции лимфатической системы в регионарных зонах, последующее проведение пункционной иглы к патологическому очагу под ультразвуковым контролем и забор цитологического материала, способ осуществляют под дополнительным допплеровским сканированием и с применением компрессионной соноэластографии, для чего, при цветном допплеровском сканировании, выбирают участок образования, удаленный от центральных сосудистых стволов и без явного локального усиления кровотока, визуально выделяют контур пунктируемого образования из окружающих тканей и определяют достоверный размер найденного опухолевого образования по его прокрашиванию в синий цвет при компрессионной соноэластографии, в ходе пункции иглу проводят с помощью коротких возвратно-поступательных движений, используя небольшие толчки, легкие шевеления иглой, перемещения относительно ее продольной оси, также, контроль за перемещением иглы и аспирационного материала в иглу и шприц осуществляют при цветном допплеровском сканировании по эхо-сигналам в виде четкой тонкой полосы, окрашенной в синий или красный цвета, ритмично движущимся при перемещении иглы в мягких тканях в направлении к патологическому очагу, далее, для забора пункционного материала выбирают участок без визуальных признаков деструкции, забор материала производят из краевой зоны пунктируемого образования, которая четко обозначена при компрессионной соноэластографии в виде области дополнительного прокрашивания синего цвета, расположенной вокруг опухолевой структуры, очерченной в ультразвуковом В-режиме, далее, при попадании конца пункционной иглы в выбранные секторы образования, осуществляют аспирационный забор биопсийного материала, в течение 3-6 сек в случае визуальной регистрации ярко прокрашенной полосы при допплеровском сканировании и 7-10 сек в случае регистрации только единичных прокрашенных эхо-сигналов по ходу иглы от начала их появления.
Способ осуществляют следующим образом.
Пациенту по стандартной методике проводят первичное ультразвуковое исследование паренхиматозного органа, либо участка мягких тканей с определением опухолевой структуры, далее проводят тонкоигольную пункционную аспирационную биопсию под УЗ контролем выявленного дополнительного образования [1, 2, 3]. Для успешного проведения эхографии и пункции соблюдения дополнительных правил и подготовки не требуется. В ходе УЗ исследования определяют локализацию, глубину залегания патологического очага в органе. Устанавливают У3-датчик на теле пациента так, чтобы расстояние между датчиком и патологическим очагом было минимальным.
В работе принимают участие два врача: врач-оператор и ассистент. Используют иглы G 20, 22, надетые на шприц, в котором поршень задвинут до упора. Игла этого шприца тонкая (0,9 мм и 0,8 мм) и достаточная по длине (40 мм и 30 мм) для забора пункционного материала из поверхностно расположенных органов и тканей.
Процедуру проведения пункционной иглы до места забора материала осуществляют в ультразвуковом В-режиме, по стандартной методике.
В случае пункции методом «свободной руки» направление движения пункционной иглы определяют руки врача-оператора (Фиг. 1), визуальную регистрацию движущегося конца пункционной иглы определяют в виде яркой белой точки в ультразвуковом изображении. Здесь и проявляется минус известного способа диагностики - способ «операторзависимый», одному врачу, проводящему процедуру, кажется, что кончик иглы ушел «вправо» от обозначенной для исследования зоны, его ассистент, при этом, совершенно убежден в обратном - игла ушла «влево». Все это вполне объяснимо для ультразвукового изображения в серой шкале, кончик пункционной иглы не настолько ярко белый и сильно отличается от множественных гиперэхогенных включений (в УЗ изображении таких же «белых» по цветовой шкале), обозначающих стенки кровеносных и лимфатических сосудов, сухожилия, множественные линии и участки фиброза и т.д. В этом и заключается относительная сложность точного обнаружения хода пункционной иглы в тканях и ее концевой части. Таким образом, при выполнении процедуры известным способом сохраняется достаточно высокая вероятность не достичь иглой нужного для обследования сектора образования.
В центральном руководстве по ультразвуковой диагностике от 2014 г. [3] доктор Ма О. Дж утверждает, что при проведении контролируемых ультразвуком процедур визуализация иглы имеет первостепенное значение. Несмотря на кажущееся попадание инструмента в зону распространения ультразвукового пучка, визуализация иногда может быть на удивление трудной. Состав мягких тканей, тип иглы, ее диаметр, степень наклона, движение инструмента и угол, под которым распространяются ультразвуковые лучи, - все это влияет на визуализацию [3]. К сожалению, у врача не всегда есть возможность ориентировать пункционную иглу перпендикулярно ультразвуковому лучу. В таком случае для улучшения визуализации, рядом специалистов, рекомендуется между иглой и лучом датчика соблюдать угол, близкий к 60°.
Обозначенный первый недостаток при проведении пункционной биопсии в настоящее время компенсируется только опытом врача, проводящего манипуляцию, и качеством ультразвукового оборудования, использующегося для контроля. В связи с этим, помимо указанной методики эхолокации в В-режиме, для определения направления хода иглы при пункции целесообразно также использовать цветное допплеровское сканирование с целью реального контроля за ходом (перемещением) пункционной иглы, по предлагаемому нами способу обнаружения расположения и хода пункционной иглы в мягких тканях с регистрацией полученного при смещении иглы и тканей по ее ходу цветного прокрашивания, получаемого при цветном допплеровском сканировании (Фиг. 4, 5, 11). Пункционную иглу вводят в исследуемое образование, ориентируясь на линию прокрашивания смещаемых при пункционных движениях мягких тканей по ходу иглы при цветном допплеровском сканировании.
Второй минус при стандартной пункционной аспирационной биопсии - отсутствие возможности обозначить обоснованное определенными критериями место для пункции, которое позволит дать положительный гистологический результат. Онкологами рекомендуются определенные участки для забора материала для гистологического исследования, к примеру, кожные образования - на границе здоровой ткани и опухолевой структуры, лимфатические узлы - в зонах нарушения лимфооттока, которые определяются по характеру изменений структуры, образования в мягких тканях - в ростковых периферических зонах по наружной границе объемной тканевой структуры. Как четко обозначить эту «ростковую» зону для опухоли, остается вопросом, насколько далеко отступать при пункции от края опухоли, на какое количество миллиметров, либо сантиметров? Определенности в этом вопросе нет. Забор материала именно из «ростковой» зоны опухоли даст достоверную гистологическую картину [5].
Предлагаемый способ с использованием компрессионной соноэластограммы делает возможным более точно проводить разметку выявленного при УЗИ образования с определением места забора биопсийного материала.
Соноэластограммы оценивали по компьютеризованной цветовой шкале, где степень жесткости соответствовала определенному цвету (мягкие ткани - красный и зеленый цвета, жесткие - синий).
Для солидных образований Зубаревым А.В., 2009 и Труфановым Г.Е., 2013 принято выделять 5 основных соноэластографических типов цветовых карт [4].
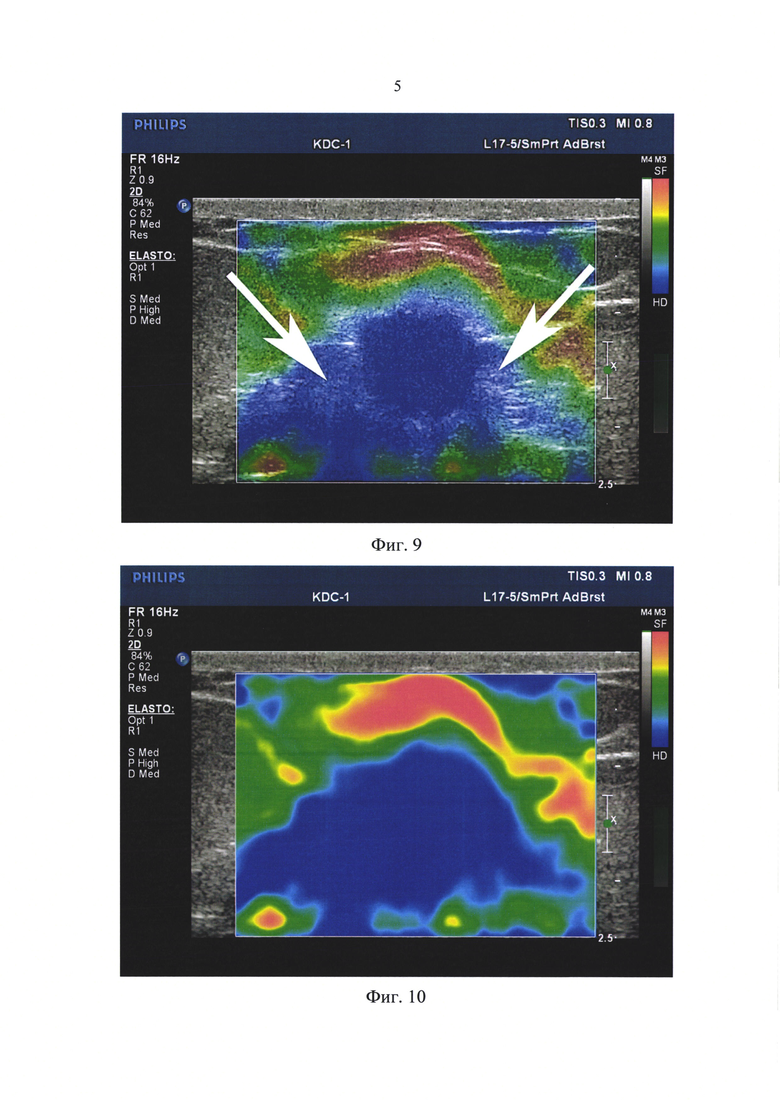
Для скиррозных форм рака характерно преобладание участков фиброзной или гиалинизированной стромы в центре таких опухолей (соединительная ткань здесь представлена до 75%). По периферии таких образований располагаются комплексы опухолевых клеток эпителиальной природы [5]. Если пункционную аспирационную биопсию проводят под контролем УЗИ с соноэластографией, то это позволяет взять биологический материал не просто из середины выявленного узла, а из его краевой зоны, особенно при инфильтративном типе роста опухоли - именно здесь чаще всего встречаются атипичные клетки (Фиг. 7, 9, 10).
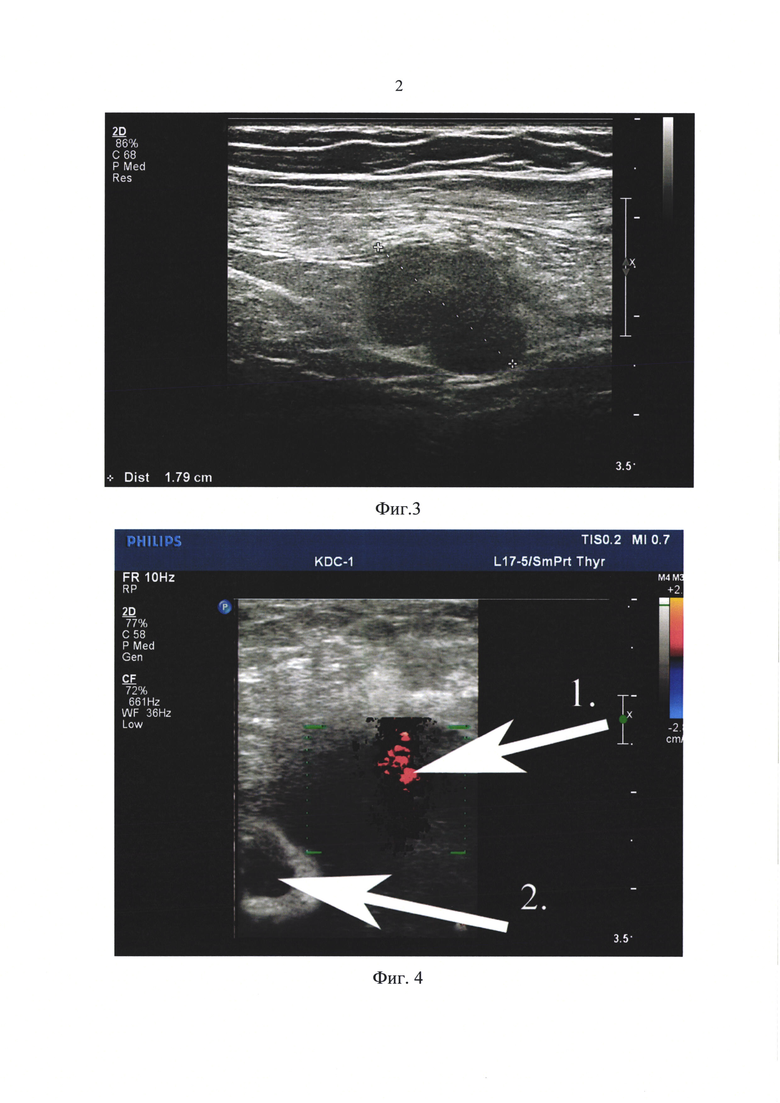
В случаях нераспространения прокрашивания опухолевого образования в синий цвет на компрессионной соноэластограмме за ее наружную визуальную границу в ультразвуковом В-режиме (Фиг. 2), в предлагаемом способе рекомендуют ориентироваться на забор пункционного материала из участков собственно опухоли, прокрашенной в синий цвет по соноэластограмме.
Следующий недостаток при стандартной пункционной аспирационной биопсии - отсутствие возможности контроля за количеством материала, забранного в пункционную иглу, это регистрируется в случае визуального поступления содержимого в канюлю шприца для пункции, либо по количеству аспирационных движений шприцем в количестве 5-8, есть способ предложенный А.В. Борсуковым и З.А. Лемешко [1], при использовании серой шкалы ультразвукового изображения в В-режиме, недостатки которой мы уже обозначили. Вероятность получения недостаточного количества материала, которое попадает в полость иглы, велика, что существенно снижает достоверность исследования. Это может также привести к необходимости проведения повторных пункций и повышает травматичность процедуры для пациента, увеличивает время, снижает точность гистологических заключений.
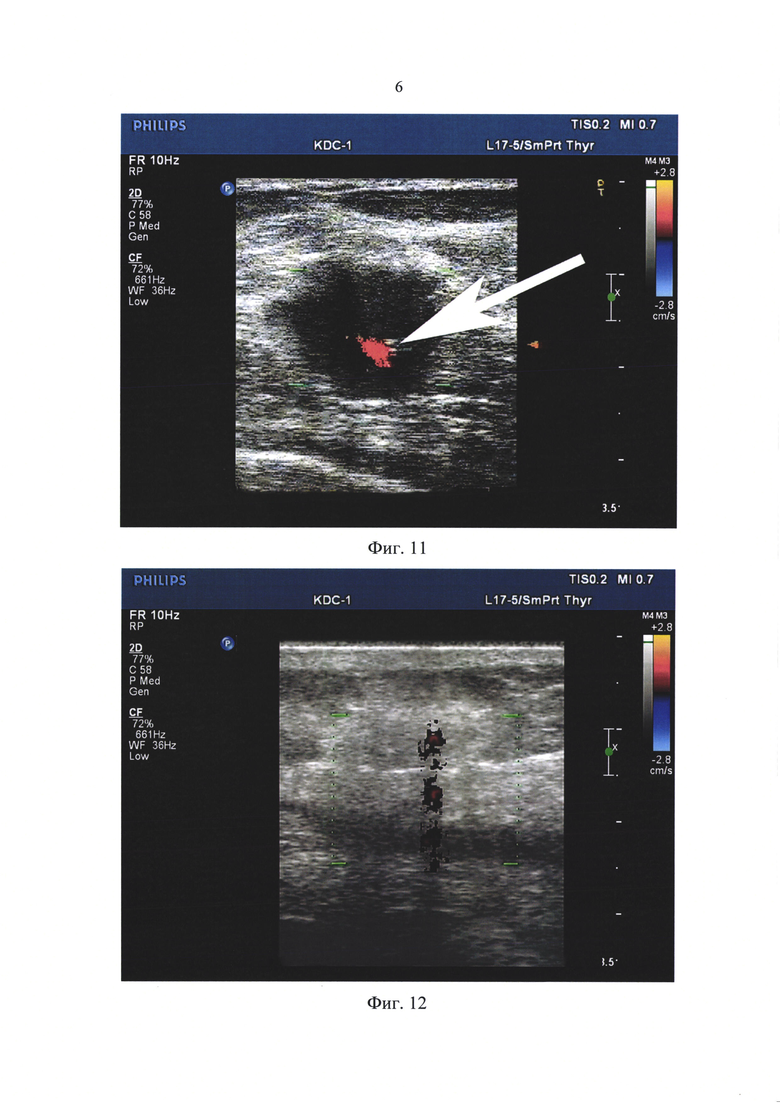
Для забора пункционного материала выбирают участок без визуальных признаков деструкции в ультразвуковом В-режиме. Также, обязательным в ходе процедуры является забор материала из краевой зоны пунктируемого образования, которая четко обозначена нами при компрессионной соноэластографии в виде области дополнительного прокрашивания синего цвета, выявленной лишь при соноэластографии вокруг опухолевой структуры, которая в ультразвуковом В-режиме не визуализируется. Далее, при попадании конца пункционной иглы в выбранный сектор образования, осуществляют аспирационный забор биопсийного материала. Факт начала аспирации и поступления содержимого в пункционную иглу фиксировали появлением тонкой прокрашенной цветной линии по ходу иглы и окружающих ее тканей (Фиг. 8, 12), а количество забранного материала по интенсивности и времени появления прокрашенного потока по контуру иглы при цветном допплеровском сканировании. Регистрация цветовых прокрашенных эхо-сигналов свидетельствует о прохождении содержимого в просвет иглы. В ходе клинических наблюдений установлено, что полноценность аспирационной биопсии по объему забираемого материала определяется периодом времени длительностью от 3 до 10 секунд от начала цветового прокрашивания допплером при заборе цитологического материала в зависимости от визуальной оценки интенсивности прокрашивания при цветном допплеровском сканировании потока:
- 3-6 сек в случае визуальной регистрации ярко прокрашенной полосы при допплеровском сканировании (Фиг. 8);
- 7-10 сек в случае регистрации только единичных прокрашенных эхо-сигналов по ходу иглы (Фиг. 12).
После этого времени процедура считается количественно достаточной для клеточного анализа биопсийного материала. Затем иглу удаляют из тела пациента. Содержимое пункционной иглы переносят на предметное стекло, и готовят мазки для цитологического исследования.
Вероятность получения ответа, не содержащего окончательного суждения о доброкачественности или злокачественности пунктируемого объемного образования, составляет в различных клиниках от 4% до 20-30% и это связано именно с обозначенными нами недостатками стандартной процедуры пункционной аспирационной биопсии в В-режиме. При получении неинформативного ответа пациенту рекомендуется повторно провести биопсию исследуемого образования, чтобы получить дополнительное количество клеток, необходимое для установления точного диагноза. В связи с этим, с целью объективизации факта забора материала, нами и предложено использовать допплеровское сканирование и компрессионную соноэластографию при аспирационном заборе материала из объекта пункции.
Согласно предлагаемому способу нами была проведена пункционная аспирационная биопсия у 19 больных с очаговыми поражениями мягких тканей (3), молочных желез (10), щитовидной железы (6). Общее время проведения процедуры пункционной биопсии уменьшилось на 20%. Во всех случаях было получено достаточное количество цитологического материала для анализа.
Далее приведены клинические примеры осуществления способа.
Пример 1. Больная Д., 56 лет. Пациентка амбулаторная. При осмотре жалоб не предъявляла.
16.11.2015 г. Пациентке в порядке реализации программы диспансеризации взрослого населения (Приказ Министерства здравоохранения Российской Федерации от 3 февраля 2015 г. №36ан "Об утверждении порядка проведения диспансеризации определенных групп взрослого населения") проведена маммография. Заключение маммографии: Фиброаденома верхне-наружного квадранта правой молочной железы?
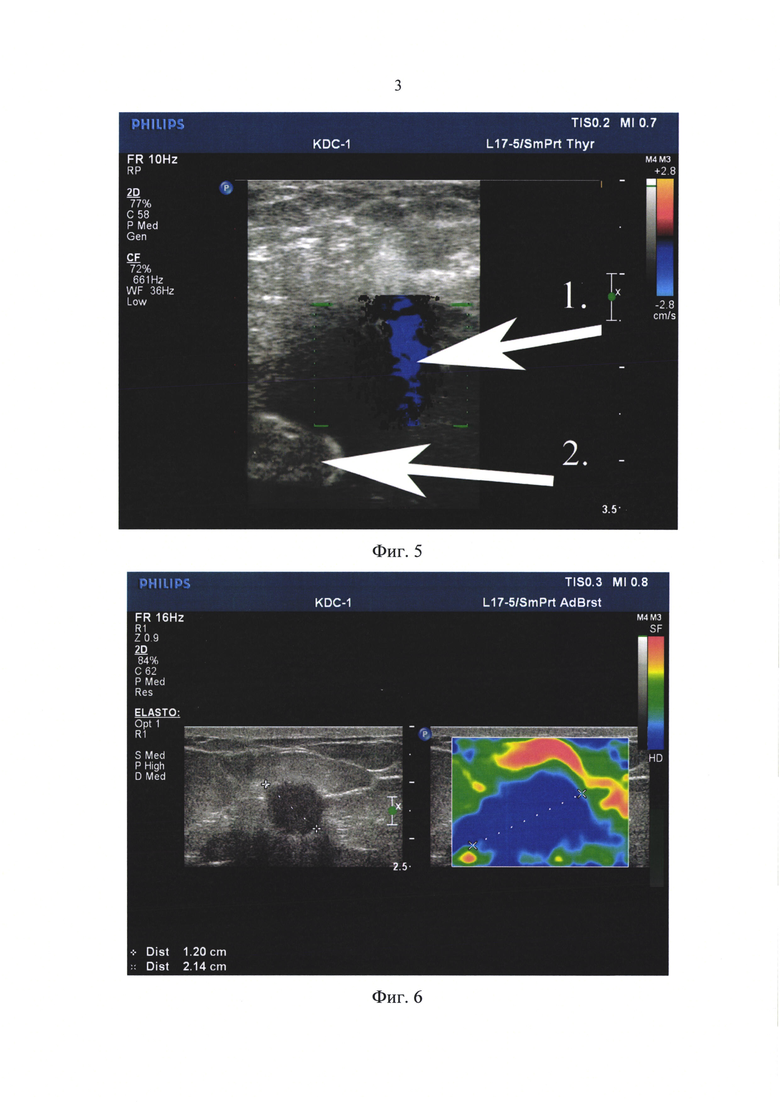
23.11.2015 г. Ультразвуковое исследование молочных желез. Осмотрены обе молочные железы. Кожа не изменена. Толщина слоя железистой ткани с обеих сторон в виде гиперэхогенной прослойки 5 мм. Ячеистость железистого слоя по структуре не прослеживается. Соотношение жировой и железистой ткани 4:1. Структура молочных желез с обеих сторон с линейным фиброзом и разнокалиберными жировыми дольками. В верхне-наружном квадранте правой молочной железы на глубине до 18 мм от поверхности кожи определяется дополнительное объемное тканевое образование овоидной формы с небольшим участком втяжения в среднем сегменте, размер образования 17,9 мм, структура достаточно однородная с небольшим снижением общей эхогенности (Фиг. 3). При ЦДК локального усиления кровотока объемного образования нет. Млечные протоки с обеих сторон не расширены - 1,8 мм в дистальных отделах. Регионарные лимфатические узлы определяются только единичные в подмышечных областях, вытянутой формы, без нарушения соотношения длинника к поперечнику, структура узлов средней эхогенности с гиперэхогенными воротами.
Заключение: Фиброаденома верхне-наружного квадранта правой молочной железы?
26.11.2015 г. Пациентка осмотрена врачом маммологом. Визуально, пальпаторно дополнительных образований в молочных железах выявить не удалось, регионарные лимфатические узлы по результатам обследования были без изменений. Врачом высказано предположение о фиброаденоме правой молочной железы.
По результатам общего обследования, маммографии и ультрасонографии молочных желез врачом маммологом решено провести тонкоигольную пункционную аспирационную биопсию выявленного дополнительного объемного образования под ультразвуковым контролем. Учитывая объем выявленной дополнительной структуры в молочной железе и отсутствие пальпаторных данных по образованию, назначена процедура пункции под ультразвуковым контролем согласно предлагаемому нами способу.
26.11.2015 г. Процедура: Тонкоигольная аспирационная пункционная биопсия образования правой молочной железы под ультразвуковым контролем (Фиг. 1).
Больную взяли в перевязочную-операционную, уложили в удобное для пункции положение пациентки - «на спине» с поднятой вверх и отведенной правой верхней конечностью. Кожу правой молочной железы широко обработали 70%-ным раствором спирта и спиртовым раствором йода. Использовали тонкую иглу G 20, надетую на шприц, в котором поршень задвинут до упора. Местную анестезию не применяли. Обработанный стерильный У3-датчик установили на теле пациентки так, чтобы расстояние между датчиком и патологическим очагом было минимальным и составило 18 мм, получили отчетливое изображение очага размер 17,9 мм в верхне-наружном квадранте правой молочной железы овоидной формы с небольшим участком втяжения в среднем сегменте, структура достаточно однородная с небольшим снижением общей эхогенности (Фиг. 3). При цветном допплеровском картировании локального усиления кровотока не найдено. Регионарные лимфатические узлы увеличены не были.
Пункцию образования проводили методом «свободной руки» (Фиг. 1). Направление движения пункционной иглы определяли руки врача-оператора.
При поисковой скопии выявленного образования молочной железы и окружающих тканей в ходе проведения пункции на первом этапе эхоскопически лоцировать острие пункционной иглы и направление ее движения не удалось.
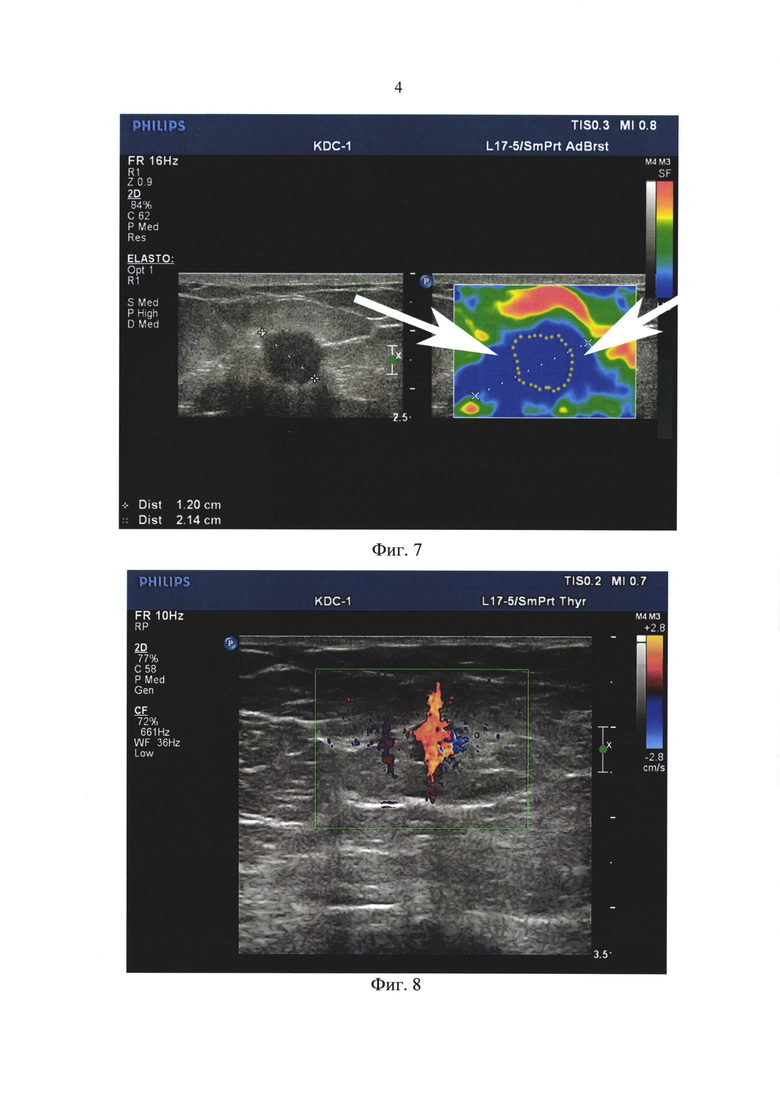
Для обнаружения положения иглы в мягких тканях применен предлагаемый нами способ диагностики. Применено цветное допплеровское сканирование с обозначением зоны пункции на фоне коротких возвратно-поступательных движений, небольших толчков, легких шевелений иглой, перемещения, покачивания вперед-назад, из стороны в сторону. Осуществляемое мелкое смещение и пошевелы иглы в мягких тканях хорошо регистрировались цветной прокрашенной линией красного (Фиг. 4) и синего цвета (Фиг. 5) в зависимости от направления движения пункционной иглы от датчика, либо к датчику.
Визуализируемая цветная линия обозначала глубину проникновения пункционной иглы, направление ее движения, топографию иглы относительно расположения объемного образования молочной железы. Полученный результат четко обозначил, что прокрашенное с помощью цветного допплера изображение положения пункционной иглы (№1 в Фиг. 4 и Фиг. 5) «отстои'т» от пунктируемого объемного образования (№2 в Фиг. 4 и Фиг. 5) на 8 мм, по глубине хода иглы нехватка порядка 5 мм.
Для выбора места забора пункционного материала использовали компрессионную соноэластографию (Фиг. 6, 7). Компрессионная соноэластограмма дополнительного объемного тканевого образования молочной железы обозначила размер найденной опухоли в ультразвуковом В-режиме - 12 мм (Фиг. 6, 7 - левая половина фото). По цветовой карте при компрессионной эластограмме опухоль прокрасилась в синий цвет, что обозначает повышенную жесткость образования. На эластограмме размер выявленной опухоли по цветному прокрашиванию обозначен цифрой 21,4 мм (Фиг. 6, 7 - правая половина фото).
Стрелками на Фиг. 7 отмечены периферические зоны опухоли, обозначенные только при компрессионной соноэластограмме (в ультразвуковом В-режиме они не проявлялись). Именно из этих участков необходимо проводить забор пункционного материала с определением положения пункционной иглы по предложенному нами способу с использованием цветного допплеровского сканирования.
Полученный результат расположения пункционной иглы в мягких тканях при цветном допплеровском сканировании и определение места забора пункционного материала потребовал изменения направления траектории хода иглы на 20° в сторону патологического очага и дальнейшего продвижения иглы вперед на расстояние 5 мм, на этом фоне пункция образования была проведена в обозначенном месте.
Затем была проведена аспирация тканевого содержимого патологического очага. Маркером начала и далее, поступления тканевого содержимого в просвет иглы служило появление цветного прокрашивания при цветном допплеровском сканировании в канале пункционной иглы и по ее наружному контуру в виде ритмично движущихся, направленных от патологического очага эхо-сигналов в виде яркой, четкой, интенсивно прокрашенной полосы, это позволило ограничить время забора материала 4-мя секундами (Фиг. 8). Объем забранного материала оказался достаточным для цитологического анализа.
После этого иглу удалили из тела пациента. Содержимое пункционной иглы перенесли на предметное стекло, и изготовили мазки для цитологического исследования.
Пример 2. Больная В., 64 г. Пациентка амбулаторная.
Направлена по результатам маммографии от 12.12.2015 г. Аппарат МАММО-МТ. Номер кадра: 93. Доза: 0,4. Протокол BIRADS. Молочные железы симметричные. Соски втянуты. Кожа не утолщена. Премаммарные пространства не изменены. Структура молочных желез I типа по Wolfe (фиброгландулярной ткани менее 25% маммограмм). На просветленном за счет жировой ткани фоне остаточная фиброгландулярная ткань и тяжистый фиброз по ходу протоков. На этом фоне на границе верхних квадрантов левой молочной железы определяется округлое образование, средней интенсивности, с нечеткими лучистыми контурами, размерами 24×24 мм, с включением единичных микрокальцинатов. В аксилярных областях дополнительных теней не определяется.
Заключение: Структура молочных желез I типа по Wolfe (фиброгландулярной ткани менее 25% маммограмм). Фиброзно-жировая инволюция молочных желез. Рентген признаки рака левой молочной железы. BIRADS категория 5 (все выявленные признаки указывают на наличие рака молочной железы). Рекомендована консультация онколога, дообследование.
15.12.2015 г. Осмотрена врачом маммологом. При осмотре жалоб не предъявляла. При пальпации на границе верхних квадрантов левой молочной железы определяется дополнительное объемное образование размером до 25 мм, бугристое, плотное, безболезненное. Регионарные лимфатические узлы увеличены не были.
17.12.2015 г. Проведено ультразвуковое исследование молочных желез.
Осмотрены обе молочные железы. Кожа не изменена. Толщина слоя железистой ткани 8 мм. Ячеистость по структуре - редкими, мелкими. Ткань железистого слоя с повышением эхоплотности за счет линейного фиброза, в ткани разнокалиберные жировые дольки.
На границе верхних квадрантов левой молочной железы определяется очаг неправильной формы, размер образования 26×24 мм, структура разнородная, неравномерно пониженной эхогенности. Образование расположено на глубине до 9 мм от поверхности кожи. При цветном допплеровском сканировании усиление местного кровотока по наружной границе и в толще объемного образования за счет развитых сосудистых веток. Регионарные лимфатические узлы - единичные в подмышечных областях, размером до 10 мм, правильной формы, без изменения структуры.
18.12.2015 г. Процедура: Тонкоигольная пункционная аспирационная биопсия образования левой молочной железы.
Больную взяли в перевязочную-операционную, в положение пациентки - «на спине» с поднятой вверх и отведенной левой верхней конечностью. Кожу левой молочной железы широко обработали 70%-ным раствором спирта и спиртовым раствором йода. Использовали тонкую иглу G 20, надетую на шприц, в котором поршень задвинут до упора. Местную анестезию не применяли. Обработанный стерильный У3-датчик установили на теле пациентки так, чтобы расстояние между датчиком и патологическим очагом было минимальным и составило 9 мм, получили ультразвуковое изображение очага на границе верхних квадрантов левой молочной железы неправильной формы, размер образования 26×24 мм, структура пониженной эхогенности. При цветном допплеровском картировании усиление местного кровотока по наружной границе и в толще объемного образования за счет развитых сосудистых веток. Регионарные лимфатические узлы увеличены не были.
Пункцию образования проводили методом «свободной руки» (Фиг. 1). Направление движения пункционной иглы определяли руки врача-оператора.
При проведении процедуры применена компрессионная соноэластография выявленного при ультразвуковом сканировании дополнительного объемного образования левой молочной железы (Фиг. 9, 10). На компрессионной соноэластограмме при цветном прокрашивании в «полупрозрачном» режиме была хорошо обозначена область дополнительного прокрашивания синего цвета, расположенная вокруг опухолевой структуры очерченной в ультразвуковом В-режиме. Режим полупрозрачного прокрашивания при компрессионной соноэластографии позволяет видеть изображение на экране монитора и в ультразвуковом В-режиме, и в то же время, хорошо определяется синее прокрашивание, обозначающее по цветовой карте эластограммы повышенную жесткость лоцируемой структуры. Эта область дополнительного прокрашивания и была выбрана местом для забора материала при пункционной аспирационной биопсии.
Учитывая незначительное расстояние до опухолевого образования и его размеры в 26 мм, пункционную иглу удалось ввести одномоментно на выбранную глубину 12 мм (очаг - 9 мм от поверхности кожи).
Для обнаружения положения кончика иглы непосредственно в опухолевой структуре был применен предлагаемый нами способ пункционной биопсии. Использовали цветное допплеровское сканирование на фоне коротких возвратно-поступательных движений пункционной иглой, это позволило четко обозначить цветным маркером кончик иглы в виде мелкого прокрашенного в красный цвет участка (Фиг. 11).
Проведенные действия позволили оперативно обнаружить расположение кончика пункционной иглы в опухолевой структуре - положение было обозначено цветовым маркером в центре опухолевого образования.
Полученная УЗ картина оказалась достаточной для выполнения следующего этапа - аспирации тканевого содержимого патологического очага. Забор материала на цитологическое исследование далее был выполнен согласно предлагаемому способу - схеме аспирации содержимого при биопсии на протяжении 10 секунд с момента появления цветного прокрашивания при цветном допплеровском картировании в канале пункционной иглы и по ее наружному контуру в виде ритмично движущихся, единичных эхо-сигналов, направленных от патологического очага в виде тонкой цветной прокрашенной полосы по направлению расположения иглы (Фиг. 12).
Иглу удалили из тела пациента. Содержимое пункционной иглы перенесли на предметное стекло, и изготовили мазки для цитологического исследования.
Использование предложенного нами способа в данном случае имело следующие задачи:
- Ориентируясь на визуализацию конца пункционной иглы, обозначить наилучшую точку для забора материала из опухолевой структуры размером 26 мм. Остерегаться насыщенных сосудами участков пунктируемого образования, избегать деструктивных зон относительно неблагоприятных для пункции, выбирать точки, находящиеся в приоритете для проведения забора цитологического материала - «ростковая» зона ближе к периферии очага.
- Регистрация факта начала поступления содержимого в пункционную иглу по началу цветного прокрашивания при цветном допплеровском сканировании в виде тонкой прокрашенной полоски с единичными точечными эхо-сигналами слабой интенсивности. Это является ультразвуковым признаком состоявшегося начала забора пункционного материала. Количеством, достаточным для цитологического исследования, обозначено нами время в 10 секунд с момента начала цветного прокрашивания вдоль пункционной иглы при цветном допплеровском сканировании.
Данные клинические примеры иллюстрируют возможности предлагаемого способа проведения пункционной биопсии. Предложено необходимым объективизировать визуальную оценку хода и топографии пункционной иглы при пункционной аспирационной биопсии в ходе ультразвукового исследования с применением цветного допплеровского сканирования. Это сокращает время на поиск пункционной иглы в мягких тканях пациента при проведении процедуры. Врачу проще, комфортнее выполнять пункционную биопсию, пациентом она легче переносится.
Важным моментом был выбор правильного места забора пункционного материала, возможности простого в исполнительском плане контроля за ходом пункционной иглы при выполнении процедуры биопсии, факта забора цитологического материала в ходе аспирации пункционного материала, а также определение достаточности объема забираемого при аспирационной биопсии материала, что призвано снять определенные сложности при проведении цитологического исследования.
Предлагаемый способ обеспечивает следующие преимущества:
- упрощает визуальный контроль за ходом пункционной иглы во время процедуры (упрощение процедуры, которая становится доступной даже для малоквалифицированного молодого врача);
- уточняет и упрощает определение места забора материала при пункционной биопсии из опухоли по периферической «ростковой» зоне для получения достоверных гистологических результатов;
- дает возможность определить объем забранного в иглу пункционного материала;
- сокращает время выполнения процедуры аспирационной биопсии на 20%;
- уменьшает количество неэффективных аспирационных биопсий;
- снижает травматизацию исследуемых органов и тканей пациента;
- уменьшает риск возникновения осложнений;
- повышает производительность труда врача, выполняющего данную манипуляцию.
В последующем, необходимым является сопоставление данных эхографии с результатами клинических, лабораторных и прочих инструментальных методов исследования.
Полученные результаты определяют вопросы тактики ведения конкретного больного.
Источники информации
1. Способ проведения пункционно-аспирационной биопсии под ультразвуковым контролем. Патент Российской Федерации. №2085121. Авторы: Борсуков А.В., Лемешко З.А. Дата публикации: 27.07.1997.
2. Пранаб Дей; Н.А. Шапиро. Аспирационная пункция тонкой иглой. Трактовка результатов и диагностические проблемы. Руководство. Практическая медицина. - 2014. - С.224.
3. Ма О.Дж. Ультразвуковое исследование в неотложной медицине / О. Дж. Ма, Дж. Р. Матиэр, М. Блэйвес; пер. 2-ого англ. Изд. - М.: БИНОМ. Лаборатория знаний, 2014 г. - 558 с.: ил. - (Неотложная медицина).
4. Зубарев А.В. Эластография - инновационный метод поиска рака различных локализаций / Лучевая диагностика. 2009. - С. 32-37.
5. Заболоцкая Н.В., Заболотский B.C. Новые технологии ультразвуковой маммографии. - М.: ООО «Фирма СТРОМ», 2010. 256 с. (С. 220).
Фиг. 1. Пример проведения пункционной биопсии дополнительного объемного образования поверхностно расположенных органов методом «свободной руки» под ультразвуковым контролем.
Фиг. 2. Компрессионная соноэластография пораженного опухолевым процессом лимфатического узла в паховой области справа (MTS рака матки). По цветовому прокрашиванию пораженный узел разнородный, в центральном сегменте синего цвета, по краевой зоне - красное прокрашивание. Рекомендована пункция областей пораженного узла, прокрашенных в синий цвет (повышенная жесткость).
Фиг. 3. Пациентка Д., 56 лет. Ультрасонограмма молочных желез. В верхне-наружном квадранте правой молочной железы на глубине до 18 мм от поверхности кожи определяется дополнительное объемное тканевое образование овоидной формы с небольшим участком втяжения в среднем сегменте, размер образования 17,9 мм, структура достаточно однородная с небольшим снижением общей эхогенности. Заключение: Фиброаденома верхне-наружного квадранта правой молочной железы?
Фиг. 4. Пациентка Д., 56 лет. Пункционная биопсия правой молочной железы под ультразвуковым контролем с использованием предложенного нами цветного допплеровского картирования. На фоне коротких возвратно-поступательных движений, небольших толчков, легких шевелений иглой, перемещения, покачивания вперед-назад или из стороны в сторону четко обозначено направление движения и положение пункционной иглы в виде цветной прокрашенной линии красного цвета (стрелка №1). Стрелка №2 в Фиг. 4 обозначает, что прокрашенное при цветном допплеровском картировании положение пункционной иглы «отстоит» от пунктируемого объемного образования на 8 мм, по глубине хода иглы нехватка порядка 5 мм.
Фиг. 5. Пациентка Д., 56 лет. Пункционная биопсия правой молочной железы под ультразвуковым контролем с использованием предложенного нами цветного допплеровского картирования. На фоне коротких возвратно-поступательных движений, небольших толчков, легких шевелений иглой, перемещения, покачивания вперед-назад или из стороны в сторону четко обозначено направление движения и положение пункционной иглы в виде цветной прокрашенной линии синего цвета (стрелка №1). Стрелка №2 в Фиг. 5 обозначает, что прокрашенное при цветном допплеровском картировании положение пункционной иглы «отстои'т» от пунктируемого объемного образования на 8 мм, по глубине хода иглы нехватка порядка 5 мм. Полученный результат (Фиг. 4 и Фиг. 5) потребовал изменения направления траектории хода иглы на 20° в сторону патологического очага и дальнейшего продвижения иглы вперед на расстояние 5 мм, на этом фоне пункция образования была успешно проведена.
Фиг. 6. Пациентка Д., 56 лет. Компрессионная соноэластограмма дополнительного объемного тканевого образования молочной железы. Размер найденной опухоли в ультразвуковом В-режиме равен 12 мм (левая половина фото). По цветовой компрессионной эластограмме опухоль прокрасилась в синий цвет, что обозначает повышенную жесткость образования. На эластограмме размер выявленной опухоли по цветному прокрашиванию обозначен 21,4 мм (правая половина фото).
Фиг. 7. Пациентка Д., 56 лет. Компрессионная соноэластограмма дополнительного объемного тканевого образования молочной железы. Стрелками отмечены периферические зоны опухоли, обозначенные только при компрессионной соноэластограмме (в ультразвуковом В-режиме они не проявлялись). Именно из этих участков необходимо проводить забор пункционного материала с определением положения пункционной иглы по предложенному нами способу с использованием цветного допплеровского сканирования.
Фиг. 8. Пациентка Д., 56 лет. Пункционная аспирационная биопсия. Регистрация аспирационного забора материала в виде яркой, четкой, интенсивно прокрашенной полосы, это позволило ограничить время забора материала 4-мя секундами. Объем забранного материала оказался достаточным для цитологического анализа. Фиг. 9. Пациентка В., 64 г. Компрессионная соноэластография выявленного при ультразвуковом сканировании дополнительного объемного образования на границе верхних квадрантов левой молочной железы. На компрессионной соноэластограмме при цветном прокрашивании в «полупрозрачном» режиме (полупрозрачное прокрашивание позволяет видеть изображение и в В-режиме, и в то же время, хорошо определяется синее прокрашивание), обозначена область дополнительного прокрашивания синего цвета, расположенная вокруг опухолевой структуры, очерченной в ультразвуковом В-режиме. Эта область дополнительного прокрашивания, обозначенная стрелками, и есть место для пункционной аспирационной биопсии.
Фиг. 10. Пациентка В., 64 г. Компрессионная соноэластография выявленного при ультразвуковом сканировании дополнительного объемного образования на границе верхних квадрантов левой молочной железы. На компрессионной соноэластограмме при цветном прокрашивании выбран не «полупрозрачный», а «полностью прокрашенный» режим. Этот режим более ярко демонстрирует область повышенной жесткости, прокрашенную в синий цвет.
Фиг. 11. Пациентка В., 64 г. Пункционная биопсия левой молочной железы под ультразвуковым контролем с использованием предложенного нами цветного допплеровского картирования. Применено цветное допплеровское картирование на фоне коротких возвратно-поступательных движений, это позволило четко и оперативно обозначить расположение кончика пункционной иглы в опухолевой структуре цветным маркером в виде отграниченного прокрашенного участка в красный цвет (обозначен стрелкой).
Фиг. 12. Пациентка В., 64 г. Пункционная аспирационная биопсия. Регистрация аспирационного забора материала в виде только единичных прокрашенных эхо-сигналов по ходу иглы, это обозначило время забора материала 10 секундами. Объем забранного материала оказался достаточным для цитологического анализа.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ вакуумно-аспирационной биопсии и удаления новообразований молочной железы | 2022 |
|
RU2790769C1 |
| Способ тонкоигольной аспирационной биопсии парастернальных лимфатических узлов у больных раком молочной железы | 2019 |
|
RU2701352C1 |
| Способ пункционной биопсии объемных образований щитовидной железы | 2018 |
|
RU2727742C2 |
| СПОСОБ CORE-БИОПСИИ ОПУХОЛЕВЫХ ИЗМЕНЕНИЙ ДНА ПОЛОСТИ РТА И ЯЗЫКА ПОД КОНТРОЛЕМ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ | 2022 |
|
RU2805795C2 |
| Способ пункционной биопсии поверхностных новообразований | 2017 |
|
RU2652917C1 |
| СПОСОБ ПРОВЕДЕНИЯ ПУНКЦИОННО-АСПИРАЦИОННОЙ БИОПСИИ ПОД УЛЬТРАЗВУКОВЫМ КОНТРОЛЕМ | 1993 |
|
RU2085121C1 |
| СПОСОБ УЛЬТРАЗВУКОВОГО КОНТРОЛЯ ЭФФЕКТИВНОСТИ ЛАЗЕРНОЙ ДЕСТРУКЦИИ ДОБРОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2385747C2 |
| Способ трепан-биопсии опухолей головки поджелудочной железы и дистального отдела холедоха и устройство для его осуществления | 2019 |
|
RU2722655C1 |
| СПОСОБ ДИАГНОСТИКИ МЕТАСТАТИЧЕСКОГО ПОРАЖЕНИЯ СТОРОЖЕВОГО ЛИМФАТИЧЕСКОГО УЗЛА ПРИ РАКЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2012 |
|
RU2499560C1 |
| СПОСОБ АБЛАСТИКИ ПУНКЦИОННОГО КАНАЛА В ПЕЧЕНИ ПОСЛЕ БИОПСИИ | 1998 |
|
RU2158538C2 |
Изобретение относится к медицине, а именно к ультразвуковой диагностике, и может быть использовано для проведения пункционной биопсии. Выявляют в ультразвуковом В-режиме патологическое объемное образование. При цветном допплеровском сканировании выбирают участок патологического образования, удаленный от центральных сосудистых стволов без локального усиления кровотока. Выделяют контур образования по прокрашиванию его в синий цвет при компрессионной соноэластографии. В ходе пункции иглу проводят с помощью возвратно-поступательных движений, используя толчки и шевеления иглой, контролируя ее перемещение по эхо-сигналам в виде полосы, окрашенной в синий или красный цвета при перемещении иглы. Для забора пункционного материала выбирают участок без визуальных признаков деструкции. Забор материала производят из краевой зоны пунктируемого образования, выявленной при компрессионной соноэластографии в виде области дополнительного прокрашивания синего цвета, расположенной вокруг объемного образования, очерченного в ультразвуком В-режиме. При попадании конца пункционной иглы в выбранный участок образования осуществляют аспирационный забор биопсийного материала в течение 3-6 сек в случае регистрации ярко прокрашенной полосы при допплеровском сканировании и в течение 7-10 сек в случае регистрации единичных эхо-сигналов по ходу иглы от начала их появления. Способ обеспечивает повышение информативности, точности пункционной биопсии за счет объективизации хода и топографии пункционной иглы, выбора оптимального места забора биопсийного материала и определения достаточности количества забираемого при биопсии материала. 12 ил., 2 пр.
Способ проведения пункционной биопсии, включающий выявление в ультразвуковом В-режиме патологического объемного образования, соноэластрографию образования, проведение пункционной иглы к объемному образованию под допплерографическим контролем и забор цитологического материала, отличающийся тем, что при цветном допплеровском сканировании, выбирают участок патологического образования, удаленный от центральных сосудистых стволов без локального усиления кровотока, выделяют контур образования по прокрашиванию его в синий цвет при компрессионной соноэластографии, в ходе пункции иглу проводят с помощью возвратно-поступательных движений, используя толчки и шевеления иглой, контролируя ее перемещение по эхо-сигналам в виде полосы, окрашенной в синий или красный цвета, при перемещении иглы, для забора пункционного материала выбирают участок без визуальных признаков деструкции, забор материала производят из краевой зоны пунктируемого образования, выявленной при компрессионной соноэластографии в виде области дополнительного прокрашивания синего цвета, расположенной вокруг объемного образования, очерченного в ультразвуком В-режиме при попадании конца пункционной иглы в выбранный участок образования, осуществляют аспирационный забор биопсийного материала, в течение 3-6 сек в случае регистрации ярко прокрашенной полосы при допплеровском сканировании и в течение 7-10 сек в случае регистрации единичных эхо-сигналов по ходу иглы от начала их появления.
| Способ осуществления работы аэродинамической трубы кратковременного действия | 1950 |
|
SU87563A1 |
| СПОСОБ ПРОВЕДЕНИЯ ПУНКЦИОННО-АСПИРАЦИОННОЙ БИОПСИИ ПОД УЛЬТРАЗВУКОВЫМ КОНТРОЛЕМ | 1993 |
|
RU2085121C1 |
| СПОСОБ ПУНКЦИИ ОБЪЕМНЫХ И ПОЛОСТНЫХ ОБРАЗОВАНИЙ БРЮШНОЙ ПОЛОСТИ И ЗАБРЮШИННОГО ПРОСТРАНСТВА | 2000 |
|
RU2158146C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ДИФФУЗНЫХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ | 2011 |
|
RU2482792C1 |
| Способ электролитического латунирования | 1942 |
|
SU66903A1 |
| WO 2009153723 A1, 23.12.2009 | |||
| WO 2002045588 A1, 13.06.2002 | |||
| ПРАНАБ Д | |||
| Аспирационная пункция тонкой иглой | |||
| Трактовка результатов и диагностические проблемы | |||
| М., 2014, с.20-23. | |||
Авторы
Даты
2017-10-23—Публикация
2016-05-24—Подача