РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке испрашивается приоритет на предварительную заявку на патент США № 62/794,987, поданную 21 января 2019 года, раскрытие которой включено посредством ссылки в полном объеме.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Заявка, рассматриваемая в данный момент, содержит перечень последовательностей, представленный в электронном виде в формате ASCII и включенный посредством ссылки в полном объеме. Копия ASCII, созданная 15 января 2020 года, подписана как ARB002PCT_SL.txt. Ее размер составляет 18337 байт.
ПРАВИТЕЛЬСТВЕННАЯ ПОДДЕРЖКА
Правительство Соединенных Штатов оказало поддержку, как минимум частичную, в отношении изобретения, раскрываемого в настоящем документе, путем выдачи грантов под номером R44AI088937, R44HL128016, R43NS077600 и R44HL106919 от Департамента здравоохранения и социального обеспечения США (HHS), Национального института здоровья. Правительство США обладает определенными правами на изобретения, основой которого является настоящее раскрытие.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится в основном к антителам, а конкретно - гуманизированным моноклональным антителам, способным связываться с фактором XI, а также способам их использования, включая способы использования антитромботических и противовоспалительных веществ, которые не нарушают гемостаз.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Тромбоэмболические нарушения, включающие как венозный, так и артериальный тромбоз, являются основной причиной серьезного числа хронических заболеваний и смертности в развитых странах по всему миру. Причиной этих нарушений является образование ненормальных кровяных сгустков (тромбов), в результате чего происходит накапливание фибрина, тромбоцитов и других эритроцитов внутри кровяного сосуда, что приводит к закупорке кровеносных сосудов, ишемии тканей и, в некоторых случаях, эмболизации из-за перемещения и миграции точечных фрагментов из тромба.
В типовых обстоятельствах свертывание крови обуславливает гемостаз, который является важным механизмом, предотвращающим потерею крови в местах повреждении органов и тканей путем стимуляции активации тромбоцитов и образования фибрина. На механическом уровне гемостаз происходит посредством двух отдельных процессов. При первичном гемостазе кровь, которая контактирует с внепросветной средой, активируется основным гемостатическим белком, тканевым фактором (TF), что приводит к мгновенному выделению фермента свертывания крови, тромбина. В свою очередь тромбин активирует другие факторы свертывания крови (F), такие как фибриноген (FI), FXIII, FV и другие. Кроме того, тромбоциты прирастают к месту травмы и также активируются, в большинстве случаев, тромбином, и в конечном итоге скапливаются путем связывания друг с другом для образования тромбоцитарной пробки. Образование тромбоцитарной пробки усиливается и стабилизируется при вторичном гемостазе в результате серии непрерывной активации тромбоцитов и ферментативных реакций, включая белки свертывания крови FXI, FIX, FX, FVIII, FVII, FV, FXIII, Fll (протромбин) и FI, что приводит к более стабильной гемостатической пробке, которая в итоге закупоривает разрыв в стенках кровеносных сосудов, предотвращая потерю крови и смерть.
С 1964 года, когда Макфарлейн (журнал Nature, 2 мая 1964 г.; 202:498-9) представил каскадную модель процесса свертывания крови, о механизмах и функции свертывания крови в организме стало известно гораздо больше. За последние десять лет теория о том, что два раздельных пути, так называемые внешний и внутренний пути активации свертывания крови, инициируют свертывание крови и совмещаются в общий путь, что в итоге приводит к выделению тромбина и отложению фибрина, подвергалась пересмотру и оспаривалась.
В одной модели, которая в целом была принята многими специалистами в соответствующей области медицины, инициация выделения тромбина при гемостатическом процессе происходит, когда фактор VII (FVIIa), активируемый протеазами циркулирующей плазмы, начинает контактировать с кофактором, TF, и, таким образом, образует с ним комплекс. Этот комплекс TF-FVIIa преобразует зимогены FIX и FX в их активные (a) формы FIXa и FXa. В свою очередь FIXa может активировать дополнительный FX при наличии кофактора, FVIIIa, а FXa затем может активировать протромбин (FII) для образования тромбина (Flla) при наличии кофактора, FVa, соответственно. Тромбин, ключевой элемент в свертывании, в свою очередь может стать катализатором преобразования фибриногена в фибрин и расщеплять рецепторы, активируемые протеазами (PAR) 1 и 4 на тромбоцитах, что приводит к активации тромбоцитов. Активированные тромбоциты в комбинации с фибрином очень важны для образования гемостатической пробки и, следовательно, являются основными элементами нормального гемостаза.
Хорошо известно, что FXI - это зимоген сериновой протеазы плазмы, который играет второстепенную роль в соединении контактной фазы и фазы усиления выделения тромбина в лабораторных условиях и в организме (Дейви Э.У. и соавт., журнал Biochemistry. 29 октября 1991 г.:30(43):10363-70, Гейлани Д. и Дроуз Г.Дж. мл., журнал Science. 23 августа 1991 г.; 253(5022):909-12; Кравцов Д.В. и соавт., журнал Blood. 9 июля 2009 г.;114(2):452-8). Физиологическое гемостатическое и патолочиеское протромботическое выделение тромбина включает активацию FXI и активность FXIa.
Однако данные демонстрируют, что наследственный дефицит FXI у человека или других млекопитающих обычно не приводит к спонтанному кровотечению, что указывает на то, что FXI не является определяющим элементом в гемостатическом выделении тромбина. Дефицит FXI, гемофилия С, связан с увеличением риска кровотечения со специфической нагрузкой на систему гемостаза, например, определенные типы хирургических процедур или травм, хотя интенсивность кровотечения мало зависит от уровня плазмы или активности FXI. При этом сообщается, что острый дефицит FXI у людей имеет определенные защитные эффекты от тромботических заболеваний, включая ишемический инсульт и глубокий венозный тромбоз (DVT) (Саломон О. и соавт., журнал Thromb Haemost. Февраль 2011 г.;105(2):269-73; Саломон О. и соавт., журнал Blood. 15 апреля 2008 г.;lll(8):4113-7); высокий уровень FXI связан с тромботическими осложнениями и, как сообщается, представляет высокий риск DVT, инфаркта миокарды (MI) и инсульта (Мейджерс Дж.К и соавт., журнал N Engl J Med. 9 марта 2000 г.;342(10):696-701, Берлинер Дж.И. и соавт., журнал Thromb Res. 15 июля 2002 г.;107(l-2):55-60, Янг Д.Т. и соавт., журнал Am J Clin Pathol. Сентябрь 2006 г.;126(3):411-5). Ранее предлагалось, что фармакологическое направленное воздействие FXI может быть более безопасным, чем обычное угнетение свертывания, а благодаря исследованиям на приматах было получено доказательства этой гипотезы (Грубер А и Хенсон С.Р., журнал Blood. 1 августа 2003 г.;102(3):953-955, Такер Э.И. и соавт., журнал Blood. 22 января 2009 г.; 113(4): 936-944).
В целом теоретические соображения и предыдущие исследования указывают на то, что FXI играет второстепенную роль в поддержании гемостаза, но является важным элементом в патогенезе тромбоза, чем обеспечивает FXI перспективную цель для безопасной антитромботической терапии. Неклинические и клинические данные подтверждают эту концепцию. Доступные на данный момент антитромботические препараты либо нацелены на строительные блоки тромбина (фибрина и тромбоцитов), либо сдерживают молекулы (факторы свертывания крови) и клетки (тромбоциты) от участия в процессе образования тромба и гемостатической пробки. Антитромботические профибринолитические и противосвертывающие вещества являются базовым элементом для лечения и профилактики тромбоэмболических заболеваний в течение десятков лет и находятся среди наиболее часто выписываемых препаратов в клинической практике. До сих пор большая часть этих веществ может полностью блокировать тромбоз и гемостазу при введении в эффективных дозах, поэтому они обладают дозолимитирующей антигемостатической токсичностью.
В результате врачи вводят современные антитромботические вещества дозами, которые ниже полных эффективных доз, тщательно пытаясь сбалансировать преимущество антитромботического действия с потенциалом серьезного и даже смертельного кровотечения.
На сегодня одним из нескольких примеров анти-FXI антитела, демонстрирующих терапевтический потенциал, является мышиное антитело 1A6 (также именуемое aximab) согласно публикации Такера и соавт. (Профилактика закупорки сосудистых трансплантатов и выделения тромбина в результате образования тромба путем ингибирования фактора XI. Эрик И. Такер, Улла М. Марцек, Тара К. Уайт, Саван Херст, Сандра Ругани, Оуэг Дж.Т. Маккарти, Давид Гайлани, Андрас Грубер и Стивен Р. Хенсон, журнал Blood. 22 января 2009 г.;113(4):936-944). Антитело 1A6 также раскрывается в патенте США 9,125,895, который включен в настоящий документ посредством ссылки в полном объеме.
Однако антитело 1A6 переставляет собой мышиное антитело и не подходит для лечения людей, особенное для применения в хронических случаях, например, в антитромботической терапии. Таким образом, другим примером анти-FXI антитела, демонстрирующим терапевтический потенциал, является мышиное антитело 14E11 (также именуемое xisomab) избирательного действия согласно публикации Ченга и соавт., A role for factor Xlla-mediated factor XI activation in thrombus formation in vivo («Роль активации Xlla-опосредованного фактора XI в образовании тромба в организме»), Ченг К.И., Такер Э.И., Пайн М.С., Сислер И., Матафонов А, Сан М.Ф., Уайт-Адамс Т.К., Смит С.А., Хенсон С.Р., Маккарти О.Дж., Ренне Т., Грубер А., Гайлани Д., журнал Blood. 11 ноября 2010 г.; 116(19):3981 -3989; Луо Д. и соавт., (2012), журнал Infect Immun. 80(1):9109; Такер Э. и соавт., (2012 г.), журнал Blood. 119(20):4762-8). Антитело 14E11 также раскрывается в патентах США 9,637,550, 8,940,883 и 8,388,959 («Патенты 14E11»).
Одним из способов преобразования мышиного антитела в приемлемое терапевтическое антитело является гуманизация. Специалисту в данной области техники известны стандартные методики, например, описанные в публикации авторов: О’брайен С., Джонс Т. (2001 г.) Humanising Antibodies by CDR Grafting («Гуманизация антител CDR-прививкой»), Контерманн Р., Дюбель С. (Ред.) Antibody Engineering («Разработка антител»). С. 567-590. Springer Lab Manuals. Springer, Берлин, Гейдельберг), в публикации авторов: Хван, Алмаго, Бусс, Тан и Фут (2005 г.). Use of human germline genes in a CDR homology- based approach to antibody humanization. Methods («Использование человеческого гена зародышевой линии в подходе к гуманизации антител на основании гомологии CDR. Методика») (36(l):35-42) и приведенных ссылочных документах. Для дополнительного снижения потенциала иммуногенности гуманизированных антител, может потребоваться оптимизация последовательности и приведение антител к зародышевой линии.
Эти стандартные способы применялись для гуманизации и оптимизации мышечного антитела 14E11, полученного рекомбинантного гуманизированного антитела, далее - AB023, продемонстрировавшего связующую активность в биомеханическом анализе в сравнении с мышиным предшественником. Благодаря изменениям последовательностей были сгенерированы гуманизированные варианты мышиного антитела 14E11, например, антитела AB023, которые показывают сопоставимые биохимические профили и антитромботическое действие в организме.
Сердечно-сосудистые заболевания и венозный тромбоэмболизм (VIE) остаются главными причинами смерти. Первичная профилактика, неотложное лечение и вторичные профилактические стратегии, такие как антикоагуляционная и антитромбоцитарная терапия, являются эффективными, но, в общем, увеличивают риск кровотечения. Таким образом, настоящее изобретение удовлетворяет актуальным медицинским потребностям в отношении безопасных и в то же время действенных веществ для антитромботической и противовоспалительной терапии и лечения без ослабления гемостаза.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ:
Изобретение, раскрываемое в настоящем документе, преодолевает существующие недостатки и известные технические решения, представляя связывающие молекулы, составы, способы и наборы для ингибирования тромбоза без вреда для гемостаза. Композиции по настоящему изобретению включают связывающие молекулы яблочного домена 2 рекомбинантного, гуманизированного анти-FXI антитела, его связывающие фрагменты, варианты, производные, линии клеток и молекулы нуклеиновой кислоты, кодирующую кислоты аминокислотную последовательность связывающих молекул. Настоящее изобретение дополнительно включает фармацевтические композиции, включающие терапевтически эффективное количество связывающих молекул, связывающих фрагментов, вариантов и производных на фармацевтически приемлемом носителе и способы их использования. Способы по настоящему изобретению включают введение композиций по настоящему изобретению нуждающемуся в нем пациенту с целью ингибирования тробоза, профилактики тромбоза или лечения воспаления посредством, например, антитромботической и противовоспалительной активности путем блокировки активации Xlla-опосредованного FXI без ингибирования активации FXI с помощью тромбина или прокоагулянтной функции FXIa. Также представлены способы получения связывающих молекул, связывающих фрагментов, вариантов и производных.
В предпочтительном аспекте по настоящему изобретению предлагается связывающая молекула, включающая:
CDR1 легкой цепи, включающей последовательность KASQDVSTAVA (SEQ ID №: 1); CDR2 легкой цепи, включающей последовательность LTSYRNT (SEQ ID №: 2);
CDR3 легкой цепи, включающей последовательность QQHYKTPYS (SEQ ID №: 3);
CDR1 тяжелой цепи, включающей последовательность GYGIY (SEQ ID №: 4);
CDR2 тяжелой цепи, включающей последовательность MIWGDGRTDYNSALKS (SEQ ID №: 5); и
CDR3 тяжелой цепи, включающей последовательность DYYGSKDY (SEQ ID №: 6).
Связывающая молекула может включать область VH, как представлено в SEQ ID №: 8, и/или область VL, как представлено в SEQ ID №: 9.
Связывающая молекула может включать легкую цепь, как представлено в SEQ ID №: 10, или может кодироваться SEQ ID №: 12, и/или тяжелую цепь, как представлено в SEQ ID №: 11, или может кодироваться SEQ ID №: 13.
Связывающая молекула по настоящему изобретению способна связываться с FXI и/или FXla млекопитающего, включая FXI человека или нечеловеческого примата и/или FXla человека или нечеловеческого примата.
В частности, связывающая молекула способна связываться и образовывать терапевтический иммунный комплекс с аминокислотной последовательностью соответствующей домену A2 FXI, включая аминокислоты 91-175 SEQ ID №: 7. В данном случае нумерация аминокислот человеческого FXI включает сигнальную последовательность, начиная с метионина в положении от -18 до -1, а затем с глютамина в положении 1. Предполагается, что связывающая молекула может представлять собой антитело, его антигенсвязывающий фрагмент, вариант или производную, в том числе гуманизированное моноклинальное антитело, его антигенсвязывающий фрагмент, вариант или производную, например, антитело IgG.
В дополнительном аспекте по настоящему изобретению предлагается полинуклеотид, кодирующий связывающую молекулу, как определено в настоящем документе, и вектор, например, эуспрессирующий вектор, включающий полинуклеотид. Настоящее изобретение также относится к клетке-хозяине, включающей вектор или полинуклеотид.
В дополнительном аспекте представлен процесс получения связывающих молекул, как описано в настоящем документе. Процесс включает культивацию клетки-хозяина, как определено в настоящем документе, в условиях, позволяющих экспрессию связывающей молекулы и, в некоторых случаях, восстановление полученной молекулы из культуры.
Кроме того, настоящее изобретение относится к фармацевтической композиции, включающей связывающую молекулу, полинуклеотид, вектор и/или клетку-хозяина, как определено в настоящем документе, и, в некоторых случаях, один или несколько фармацевтически приемлемых эксципиентов. Фармацевтическая композиция может включать один или несколько дополнительных действующих веществ, например, антитромботические и/или противосвертывающие средства, или может вводиться в составе комбинированной терапии с дополнительными действующими веществами.
Согласно настоящему изобретению связывающая молекула, полинуклеотид, вектор, клетка-хозяин или фармацевтическая композиция могут использоваться в способе ингибирования контактной активации, свертывания крови, агрегации тромбоцитов и/или тромбоза у пациента, и поэтому являются полезными для лечения и/или профилактики нарушений, например, сердечно-сосудистых, инфекционных или воспалительных заболеваний, предпочтительно тромбических или тромбоэмболических нарушений и/или тромбических или тромбоэмболических осложнений.
В настоящем документе дополнительно предлагается использование связывающей молекулы в качестве противосвертывающего средства в образцах крови, при консервации крови, в препаратах из плазмы, биологических образцах или лекарственных добавках или в качестве покрытия на медицинских изделиях.
Более того, настоящее изобретение относится к набору, включающему связывающую молекулу, полинуклеотид, вектор, клетку-хозяина или фармацевтическую композицию, как описано в настоящем документе.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Прилагаемые чертежи включены в спецификацию и составляют ее часть для иллюстрации настоящего изобретения. Эти чертежи вместе с описанием служат для объяснения принципов изобретения. Чертежи иллюстрируют предпочтительные и альтернативные примеры, и не должны толковаться как ограничивающие в отношении настоящего изобретения только представленными примерами. Другие признаки и преимущества станут очевидными на основании следующего более подробного описания различных аспектов, вариантов осуществления и конфигураций настоящего изобретения, как представлено на чертежах ниже.
На ФИГ. 1 представлен график, на котором показано воздействие 14E11, зависимое от концентрации (от 10-5 до 100 ммоль), на активированное частичное тромбопластиновое время (aPTT) в плазме мыши (незакрашенные круги) и человека (закрашенные круги).
На ФИГ. 2A-F представлены блоты и графики, на которых продемонстрированы связывающие свойства 14E11. На ФИГ. 2A отображается 10 %-полиакриламид-гель, окрашенный синим красителем кумасси, рекомбинантного FXI человека (H) и мыши (M); на ФИГ. 2B и C показаны вестерн-блоты 10 %-полиакриламид-гелей нормальной плазмы (N) и плазмы с дефицитом FXI (XI-/-) мыши (B) и человека (C) при невосстанавливающих условиях с использованием биотинилированного 14E11 для определения. FXI на панели B является показателем контроля рекомбинантного FXI мыши; на ФИГ. 2D представлено биотинилированное антитело 14E11 для иммобилизации FXI мыши (незакрашенные круги), FXI человека (закрашенные круги) или FXIa человека (незакрашенные квадраты); на ФИГ. 2E представлен вестерн-блот 10 %-полиакриламид-геля FXI человека (hXI), прокалликреина человека (PK) и FXI человека при невосстанавливающих условиях, где домен A1, A2, A3 или A4 заменен на соответствующий домен из PK. Положение для димера FXI указывается справа как «D», а для мономерного PK как «M» (стоит учесть, что FXI с доменом PK A4 является мономерным, так как A4 опосредует образование димера FXI); и на ФИГ. 2F представлен вестерн-блот (левая панель) 10 %-полиакриламид-геля FXI человека (hXI) и отдельных яблочных доменов FXI человека при невосстанавливающих условиях, связанных с тканевым плазменным активатором (tPA); а правая панель - окрашенный гель, показывающий рекомбинантный гибридный белок яблочного домена-tPA (стоит учесть, что гибридные белки A4 образуют димер). Для панелей A-C и E стандарты молекулярной массы в кДа на фигурах расположены слева, а для панели F - справа.
На ФИГ. 3A-B представлены графики, на которых показано воздействие 14E11 (закрашенные круги) и гуманизированной версии, AB023 (незакрашенные круги) на aPTT в лабораторных условиях. На ФИГ. 3A показано воздействие 14E11 и AB023 в смешанной плазме крови человека; а на ФИГ. 3B показано воздействие 14E11 и AB023 в смешанной плазме крови павиана. 14E11 и AB023 аналогично продлевают aPTT как в плазме крови человека, так и павиана.
На ФИГ. 4A-F представлены блоты и графики, на которых продемонстрированы связывающие свойства AB023. На ФИГ. 4A представлен вестерн-блот 10 %-полиакриламид-геля FXI человека (трек 1) и FXI человека при невосстанавливающих условиях, где домен A1, A2, A3 или A4 заменен на соответствующий домен из прокалликреина человека (PK) с использованием биотинилированного AB023 для определения; на ФИГ. 4B представлен вестерн-блот 10 %-полиакриламид-геля отдельных яблочных доменов FXI человека (A1-A4) при невосстанавливающих условиях, связанных с tPA, где AB023 распознает домен A2 FXI человека; на ФИГ. 4C показано связывание AB023 с FXI человека (закрашенные круги), FXIa человека (незакрашенный квадрат) и FXI мыши (закрашенные треугольники); на ФИГ. 4D показано как AB023 ингибирует активацию FXlIa-активацию FXI в зависимости от концентрации; на ФИГ. 4E показано, что AB023 не предотвращает активацию FXI тромбином; и на ФИГ. 4F показано, что AB023 продлевает aPTT в зависимости от концентрации в плазме крови человека (закрашенные круги), павиана (незакрашенные квадраты), яванского макака (незакрашенные круги) и крыс (незакрашенные ромбы). *Гибридный белок (A4*) FXI/PKA4 представляет собой димерную молекулу, созданную путем замены Cys326 аланином в домене PK A4.
На ФИГ. 5 показано воздействие образования комплекса AB023-FXI на aPTT в лабораторных условиях. Данные опыты выполнялись в последовательном порядке с помощью FIX-дефицитной плазмы (George King, продукт № 1100, партия 6538). Исходное aPTT в FIX-дефицитной плазме определялось как 118,5 с (круги). Рекомбинантный FXI человека (Enzyme Research Labs, кат. № HFXI1111) добавлялся в FIX-дефицитную плазму для окончательной концентрации 10 мг/мл; делалось измерение aPTT. Добавление FXI в FIX-дефицитную плазму укорачивает aPTT до 32,3 с (квадраты). Впоследствии антитело AB023 было добавлено в FIX-дефицитную плазму + 10 мг/мл смеси FXI при окончательной концентрации антител 100 мг/мл, aPTT было продлено до 66,6 с (треугольники). Во втором опыте антитело AB023 было добавлено в FIX-дефицитную плазму для окончательной концентрации антител 100 мг/мл; делалось измерение aPTT. Добавление AB023 в FIX-дефицитную плазму не изменило aPTT в сравнении с исходным значением (117,7 с, перевернутые треугольники). Добавление рекомбинантного FXI человека (окончательная концентрация 10 мг/мл) к этой смеси укорачивает aPTT до 59,1 с (ромбы) аналогично результатам предыдущего опыта. Эти данные демонстрирую, что антикоагулянтное действие AB023 только при образовании комплекса между FXI и AB023.
На ФИГ. 6 показано воздействие 14E11 и AB023 на мышиной модели артериального тромбоза, вызванного в целях опыта. Мыши C57B1/6 (с введением 14E11 (1,0 мг/кг, внутривенно) или AB023 (1,0 мг/кг, внутривенно) или без) или мыши FXI-/- проверялись на модели тромбоза сонной артерии, индуцированного FeCl3. У сонной артерии применялся FeCl3 с концентрацией от 2,5 % до 10 %№; измерялось время до закупоривания. Высота столбиков указывает процент мышей в каждой группе с незакупоренными венами через 30 минут после применения FeCl3. Внутривенное вливание 1,0 мг/кг AB023 диким мышам (столбики с кругами), обеспечило защиту мышей от закупорки сонной артерии, индуцируемой 3,5 %, 5,0 % и 7,5 % FeCl3, в сравнении с дикими мышами без обработки (столбики с точками). Данные результаты сопоставимы с результатами от мышей FXI-/- (незакрашенный столбик) и мышей, получивших 14E11 (столбики в клетку), (n = 10/группа).
На ФИГ. 7 показано отношение концентрации AB023 в плазме и aPTT у четырех павианов. Каждая графа представляет период действия концентрации AB023 в плазме (левые оси y, закрашенные круги) и aPTT (правые оси y, незакрашенные круги) у одного павиана, которому внутривенно было введено AB023, 1,0 мг/кг. У каждого павиана aPTT продлевалось до тех пор, пока концентрация AB023 в плазме не падала ниже определяемых уровней (1000 нг/мл). Для определения свободного AB023 в плазме павиана использовался частично утвержденный анализ ELISA. aPTT показано как кратное изменение в сравнении с исходным значением.
На ФИГ. 8A-D представлено воздействие AB023 на модель тромбоза в организме павиана (трансплантат + расширительная камера). AB023 снижает рост богатого тромбоцитами тромба в модель тромбоза примата. Воздействие AB023 (0,2 мг/кг, внутривенно) на депонирование тромбоцитов (как показано на ФИГ. 8A и 8C) в покрытых коллагеном (диаметр 4 мм, длина 2 см) сосудистых трансплантатах (ФИГ. 8A) и венозной расширительной камере (диаметр 9 мм, длина 2 см) (ФИГ. 8C). На ФИГ. 8B и 8D отображается отложение фибрина в пределах коллагенового трансплантата (ФИГ. 8B), венозной расширительной камеры (ФИГ. 8D) в контрольной группе (заштрихованный столбик) и после введения AB023 (незакрашенный столбик). Значения - среднее значение ± СО, n = 7 опытов/группа с 4 животными для контрольной группы (включая группы исторического контроля из одного опыта, выполненного с помощью 14E11), n= 2 опыта с 2 животными для введения AB023. Значения - среднее значение ± СО.
На ФИГ. 9A-F показано воздействие AB023 на рост богатого тромбоцитами тромба в модели тромбоза в организме павиана (покрытый коллагеном трансплантат). На ФИГ. 9A-9C показано воздействие AB023
(1,0 мг/кг, внутривенно) на депонирование тромбоцитов (ФИГ. 9A-C) в покрытых коллагеном (диаметр 4 мм, длина 2 см) сосудистых трансплантатах (ФИГ. 9A) и 10 см вниз по потоку сосудистого трансплантата («хвост») (ФИГ. 9B); на ФИГ. 9C приводится депонирование тромбоцитов в комбинации трансплантата и хвоста; на ФИГ. 9D-F отображается отложение фибрина в пределах коллагенового трансплантата (ФИГ. 9D), хвоста (ФИГ. 9E) и комбинации трансплантата и хвоста (ФИГ. 9F) в контрольной группе (заштрихованный столбик) и после введения AB023. Значения - среднее значение ± СО, n = 4 опыта/группа с 4 животными. *p <0,05, **p <0,01, *** p <0,001 в сравнении с контрольной группой. Каждое животное подвергалось контрольному опыту, после чего опыту с введением AB023.
На ФИГ. 10A-D представлено сравнение действия AB023 с действием при введении мышиного антитела 14E11. На ФИГ. 10A-B показано воздействие 14E11 и ABQ23 на самоактивацию FXI при наличии сульфата декстрана (ФИГ. 10A) и ДНК (ФИГ. 10B) в качестве функции концентрации антител 14E11 (столбики с точками) и AB023 (заштрихованные столбики). Гуманизированное антитело AB023 ингибирует самоактивацию очищенного человеческого FXI, индуцированную ДНК, в зависимости от концентрации в лабораторных условиях; на ФИГ. 10C представлено воздействие 14E11 (незакрашенные круги) и AB023 (закрашенные квадраты) на ингибирование FXIIa-активации FXI в сравнении с контрольной группой (закрашенные круги); и на ФИГ. 10D показано воздействие 14E11 и AB023 на активацию FXII с помощью FXIa в лабораторных условиях. На графике отображается активность FXIIa, показанная в качестве функции концентрации антител. Смесь очищенного человеческого FXII и FXIa подверглась инкубации с различными концентрациями 14E11 (столбики с точками) или AB023 (заштрихованные столбики). Измерялась амидолитическая активность FXIIa. AB023 ингибирует активацию очиненного человеческого FXII с помощью FXIa в зависимости от концентрации в лабораторных условиях, в то время как 14E11 - нет.
ПОДРОБНОЕ ОПИСАНИЕ
Далее будут приводиться ссылки на основные варианты осуществления настоящего изобретения более подробно. Хотя раскрываемые антитела, их фрагменты, варианты и производные будут описываться в привязке к перечисленным вариантам осуществления, будет понятно, что они не рассчитаны на ограничение настоящего изобретения. Наоборот, раскрываемые антитела, их фрагменты, варианты и производные рассчитаны на охват модификаций, альтернативных и эквивалентных вариантов, которые могут быть включены в объем настоящего изобретения, как определено формулой изобретения. Специалисту в данной области технике станут понятны многие способы и материалы, аналогичные или эквивалентные описанным в настоящем документе, которые могут быть использованы на практике в объеме настоящего изобретения и которые входят в этот объем. Настоящее изобретение никоим образом не ограничивается описанными способами и материалами.
Все публикации и патенты, упомянутые в настоящем документе, включены посредством ссылок в соответствующем полном объеме для целей описания и раскрытия, например, конструкций и методик, которые представлены в публикациях, которые могут использоваться в отношении настоящего изобретения. Публикации, обсуждаемые по всему тексту, представлены для раскрытия предыдущего уровня техники к дате подачи настоящей заявки. Ничто в настоящем документе не должно рассматриваться как признание.
Если не определено иное, все технические и научные термины, используемые в настоящем документе, имеют общеупотребительное значение среди специалистов в данной области техники, к которым относится настоящее изобретение. Термин «какой-нибудь» относится к одному или нескольким соответствующим объектам, таким образом, он должен пониматься как, например, «один или несколько» и «как минимум один», что можно использовать синонимически.
В практической части настоящего изобретения применяются, если не указано иное, вспомогательные методы клеточной биологии, клеточной культуры, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантной ДНК и иммунологии в пределах компетентности в данной области техники. Полное изложение таких методов можно найти в публикациях, например, в следующих работах: Сэмбрук и соавт., под ред., (1989 г.), Molecular Cloning A Laboratory Manual («Молекулярное клонирование: лабораторное руководство») (2-е издание; Cold Spring Harbor Laboratory Press); Сэмбрук и соавт., под ред.,(1992 г.), Molecular Cloning: A laboratory Manual («Молекулярное клонирование: лабораторное руководство»), (Лаборатория в Колд-Спринг-Харбор, Нью-Йорк); Д.Н. Гловер, под ред., (1985 г.), DNA Cloning («Клонирование ДНК»), тома I и II; Гайт, под ред., (1984 г.), Oligonucleotide Synthesis («Синтез олигонуклеотидов»); Мулис и соавт., Патент США № 4,683,195; Хамес и Хиггинс, под ред., (1984 г.), Nudeic Acid Hybridization («Гибридизация нуклеиновых кислот»); Хамес и Хиггинс, под ред., (1984 г.), Transcription and Translation («Транскрипция и интерпретация»); Фрешни, (1987 г.), Culture of Animal Cells («Культура клеток животных») (Alan R. Liss, Inc.); Immobilized Cells and Enzymes («Иммобилизованные клетки и ферменты») (IRL Press, 1986 г.); Пербал, (1984 г.), A Practical Guide to Molecular Cloning («Практическое руководство по молекулярному клонированию»); научный трактат, Methods in Enzymology («Способы ферметологии») (Academic Press, Inc., Нью-Йорк); Миллер и Калос, под ред., (1987 г.), Gene Transfer Vectors for Mammalian Cells («Вектор переноса генов для клеток млекопитающих»), (Лаборатория в Колд-Спринг-Харбор); Ву и соавт., под ред., Methods in Enzymology («Способы в ферментологии»), тома. 154 и 155; Майер и Уокер, под ред., (1987 г.), Immunochemical Methods in Cell and Molecular Biology («Иммунохимические способы в клеточной и молекулярной биологии») (Academic Press, Лондон); Вайр и Блеквел, под ред., (1986 г.), Handbook of Experimental Immunology («Справочник по экспериментальной иммунологии»), тома I-IV; Manipulating the Mouse Embryo («Работа с эмбрионом мыши»), (Cold Spring Harbor Laboratory Press, Колд-Спринг-Харбор, Нью-Йорк, 1986 г.); и Осубель и соавт., (1989 г.), Current Protocols in Molecular Biology («Современные протоколы в молекулярной биологии») (John Wiley and Sons, Балтимор, Мэриленд). Хотя любые способы, устройства и материалы, аналогичные или эквивалентные описанным в настоящем документе, могут быть использованы на практике или при испытании раскрываемых антител, их фрагментов, вариантов и производных, предпочтительные способы, устройства и материалы будут описаны далее.
Ингибирование фактора свертывания крови XI (также называемого FXI), что приписывается в качестве роли при развитии образования патологического тромба с ограниченным воздействие на физиологический гемостаз, представляет собой инновационный перспективный подход к разработке новых антитромботических веществ для получения улучшенного соотношения эффекта и риска. В настоящем изобретении, среди прочего, предусматривается новая связывающая молекула, AB023, которая способна определенным образом связываться с FXI, образуя иммунный комплекс FXI-AB023, и, таким образом, ингибируя надлежащую молекулярную сборку нормально функционирующего комплекса активации контакта, включающего FX11, FXI, прокалликреина человека (PK) и высокомолекулярный кининоген (HMWK). В результате этого ограничивается молекулярное взаимодействие между FXI-AB023, FXII, PK и HMWK и, следовательно, преобразование FXI-AB023 в актированную форму FXIa-AB023 с помощью FXIIa и преобразование FXII в свою активированную форму от FXIIa с помощью FXIa-AB023 также будут ограниченными. Связывающая молекула AB023 - новое антикоагулирующее рекомбинатное моноклональное антитело, направленное на FXI. Более того, также продемонстрирована способность связывающей молекулы связываться с FXIa. Таким образом, связывающая молекула, представленная в настоящем документе, блокирует взаимную активацию элементов, вовлеченных в патологическое образование тромбина и тромбоза, включая образование калликреина и брадикинина, играющих активную роль в регуляции кровяного давления и воспаления (рассмотрел Вайдманн, Г. и соавт., (2017 г.), журнал Biochim Biophys Acta Mol Cell Res.1864 г., (11 ч. B):2118-2127, Бьерквист и соавт., (2014 г.), журнал Thrombosis and Hemostasis. 112(5): 868-75; журнал Blood Advances, 2019 г., 3:658-669). В частности, предусматривается гуманизированная версия мышиного монолконального антитела 14E11, которое преимущественно связывается с FXI с высокой связывающей аффинностью в сравнении с 14E11. Кроме того, образование иммунного комплекса между связывающей молекулой и FXI значительно снижает свертывание крови в лабораторных условиях, на что указывает продление активированного частичного тромбопластинового времени (aPTT) при наличии комплексов, которые образуются при низкой концентрации связывающей молекулы. Таким образом, связывающая молекула по настоящему изобретению представляет собой новое вещество для эффективного лечения и/или профилактики нарушений, когда активация контактной системы играет патогеническую роль, в особенности воспалительных, тромбических или тромбоэмболических нарушений и/или осложнений, и, кроме того, считается эффективной без значительного нарушения гемостаза, что минимизирует риск кровотечения.
Благодаря антителу по настоящему изобретению была получена молекула с терапевтических эффектом, которая снижает риск иммуногенности и замедляет развитие тромба в организме после образования комплекса с циркулирующим FXI. Образование этого иммунного комплекса между антителом и свободным антигеном FXI в организме эффективно блокирует распространение тромба, но без вреда для гемостаза. Более того, образование иммунного комплекса между гуманизированным антителом 14E11, AB023 и FXI не препятствует активации гемостатической обратной связи иммунного комплекса FX1-AB023 за счет тромбина. Более того, иммунный комплекс FXIa-AB023 сохраняет ферментативную активность, что способствует гемостатическому выделению тромбина посредством активации FIX и другого фактора свертывания крови FXIa, таким образом, делая антитромботическую терапию за счет антител, связывающих фрагментов, их вариантов и производных по настоящему изобретению более гемостатически безопасной в сравнении с прямым ингибированием ферментативной активности или гемостатической активации FXI, и, следовательно, расширяя диапазон клинических показаний и сценариев, в которых может применяться этот тип антитромботической терапии. Важно отметить, что при отсутствии циркулирующего иммунного комплекса антитело само по себе не имеет антикоагулирующей или антитромботической активности. Кроме того, при отсутствии свободного, доступного и циркулирующего FXI в циркуляции само по себе не имеет антикоагулирующей или антитромботической или другой активности. Поэтому при отсутствии циркулирующих иммунных комплексов FXI-AB023 антитело по настоящему изобретению может не иметь антикоагулирующей активности и может не иметь антитромботической активности в FXI-дефицитных объектах.
Связывающая молекула
Связывающая молекула по настоящему изобретению представляет собой новое антикоагулирующее рекомбинатное моноклональное антитело к фактору свертывания крови XI (FXI). Оно было получено путем гуманизации с применением прививки гипервариабельного участка (CDR) мышиного моноклонального антитела 14E11, раскрываемое в патентах США 8,388,959, 8,940,883 и 9,637,550 под названием: «Анти-FXI антитела и способы использования». На удивление связывающая молекула по настоящему изобретению не включает ряд аминокислотных замен в участках CDR в сравнении с CDR 14E11, но все равно демонстрирует преимущественные свойства. Мышиное моноклональное антитело. Определялись характеристики 14E11 и гуманизированного антитела, AB023. Оценивались их антикоагулирующие свойства в лабораторных условиях и в организме с целью сравнения. Связывающая молекула по настоящему изобретению обладает способностью связываться с FXI со связывающей аффиностью в сравнении с 14E11, а FXI в иммунном комплексе не подвергается эффективному преобразованию в FXIa за счет FXIIa, однако эффективно преобразуется в FXIa за счет тромбина (ФИГ. 4). Любопытно отметить, что AB023 является более действенным в ингибировании этой активации, чем
14E11 (ФИГ. 10C). Комплекс FXIa-AB023 снизил каталитическую активность для преобразования FXII в его активную форму, FXIIa, в отличие от 14E11 (ФИГ. 10D). Если FXI-AB023 преобразуется за счет тромбина в FXIa-AB023, он сохраняет ферментативную активность в отношении FIX (данные отсутствуют) и других макромолекулярных субстратов и субстратов малых молекул. В результате этого состояния, опосредованные активацией контакта, сокращаются, а активация FXI-AB023, опосредованная гемостатическим тромбином, сохраняет гемостатическую активность циркулирующего FXI.
Связывающая молекула по настоящему изобретению представляет собой гуманизированное моноклональное антитело, антигенсвязывающий фрагмент, вариант или производную, и, предпочтительно, AB023, моноклональное терапевтическое антитело к FXI. Это может быть IgG4 с возможной модификацией в шарнирной области S241P для предотвращения обмена плеч антитела. Аминокислотная последовательность легкой цепи (LC) показана в SEQ ID №: 10, а кодирующая последовательность ДНК для LC показана в SEQ ID №: 12. Аминокислотная последовательность тяжелой цепи (HC) показана в SEQ ID №: 11, а кодирующая последовательность ДНК для HC показана в SEQ ID №: 13. AB023 было получено посредством прививки CDR и содержит легкую цепь каппа (k) и тяжелую цепь изотипа IgG4. Вариабельные последовательности (VH и VL) от мышиного моноклонального антитела-предшественника, 14E11, были клонированы в ген тяжелой цепи IgG4 человека (модифицированная шарнирная область SP241 по номенклатуре Кэбота) и ген легкой цепи каппа. Четыре цепи выдерживались вместе посредством сочетания ковалентных (дисульфидных) и нековалентных связей. Существует 16 цистеиновых остатков и, соответственно, [16/2] потенциальных дисульфидных связей на молекулу. Субъединица тяжелой цепи включает одну консенсусную последовательность (N-X-S/T) для потенциального N-сцепленного гликозилирования в тяжелой цепи.
Антитромботические эффекты, наблюдаемые при применении 14E11 сохранялись после гуманизации, а за счет AB023 обеспечивалось предотвращение венозного и артериального тромбоза. Согласно первому аспекту настоящее изобретение относится к связывающей молекуле, которая способна определенным образом связываться с фактором XI, в котором связывающая молекула включает следующие гипервариабельные участки (CDR): CDR1 легкой цепи, включающей последовательность KASQDVSTAVA (SEQ ID №: 1); CDR2 легкой цепи, включающей последовательность LTSYRNT (SEQ ID №: 2); CDR3 легкой цепи, включающей последовательность QQHYKTPYS (SEQ ID №: 3); CDR1 тяжелой цепи, включающей последовательность GYGIY (SEQ ID №: 4); CDR2 тяжелой цепи, включающей последовательность MIW GDGRTDYN SALKS (SEQ ID №: 5); CDR3 тяжелой цепи, включающей последовательность DYYGSKDY (SEQ ID №: 6). Связывающая молекула может дополнительно включать модификацию S241P.
В процессе гуманизации определялись участки CDR 14E1, а вариабельные области VH и VL были добавлены в программу моделирования для определения того, какие аминокислотные остатки в каркасе были полезными для связывающих свойств антитела. Участки CDR прививались в человеческий каркас с наибольшей степенью гомологии с каркасом 14E11. В случае необходимости для связывания применяется обратная мутация в специфический мышиный каркас. Благодаря этому процессу были получены 3VH и 3VL. В некоторых вариантах осуществления антитело AB023 представляет собой сочетание VH3 (SEQ. ID № 8) и VL3 (SEQ. ID № 9).
Термин «аминокислота» или «аминокислотный остаток» относится к аминокислоте, имеющей определение, принятое в данной области техники, например, аминокислота, отобранная из группы, включающей: аланин (Ala или A); агринин (Arg или R); аспарагин (Asn или N); аспарагиновую кислоту (Asp или D); цистеин (Cys или C); глутамин (Gin или Q); глутаминовой кислоты (GIu или E); глицин (Gly или G); гистидин (His или H); изолейцин (Ile или I); лейцин (Leu или L); лизин (Lys или K); метионин (Met или M); фенилаланин (Phe или F); пролин (Pro или P); серин (Ser или S); треонин (Thr или T); триптофан (Trp или W); тирозин (Tyr или Y) и валин (Val или V), хотя могут использоваться и модифицированные, синтетические или уникальные аминокислоты. В целом, аминокислоты могут классифицироваться на обладающие неполярной боковой цепью (например, Ala, Cys, He, Leu, Met, Phe, Pro, Val); отрицательно заряженной боковой цепью (например, Asp, Glu); положительно заряженной боковой цепью (например, Arg, His, Lys) или незаряженной боковой цепью (например, Asn, Cys, Gin, Gly, His, Met, Phe, Ser, Thr, Trp и Tyr).
Количество аминокислотных замен и их распределение
Аминокислотные замены, как правило, могут распределяться по CDR любым способом, т.е. один CDR может, например, включать один или несколько обменов, а второй CDR - одну или несколько замен. Или два CDR могут включать одну или несколько аминокислотных замен или шесть CDR могут включать одну или несколько аминокислотных замен, например, одну или несколько замен на CDR и, предпочтительно, связывающую молекулу, включающую одну или несколько замен в CDR1, CDR2 и/или CDR3 легкой цепи, или одну или несколько аминокислотных замен в CDR1, CDR2 и/или CDR3 тяжелой цепи, что сохраняет CDR негуманизированной молекулы в максимально возможной степени без вреда для функциональности. В целом, аминокислотные замены могут распределяться фактически любым способом, если только количество общих аминокислотных замен в сравнении с аминокислотой CDR 14E11 не нарушает способность связывающей молекулы связываться с FXI.
Тип замен
В целом, возможно любое сочетание аминокислотных замен в CDR в сравнении с 14E11, пока не нарушается преимущественные свойства связывающих молекул по настоящему изобретению.
Аминокислотные обмены могут быть консервативными (т.е. обмен аминокислоты одного класса или группы с аминокислотой аналогичного класса или группы, как указано выше) или неконсервативным (т.е. обмен аминокислоты одного класса/группы с аминокислотой другого класса/группы).
Предпочтительные замены приводят к выработке связывающих молекул по настоящему изобретению, что приводит к продлению aPTT, как описано в настоящем документе.
Связывающая молекула по настоящему изобретению может включать один или несколько упомянутых ранее CDR, в определенных случаях в комбинации. Предпочтительные замены приводят к выработке связывающих молекул по настоящему изобретению, что приводит к продлению aPTT в 1,5-2 раза, как описано в настоящем документе.
Предпочтительный вариант связывающей молекулы по настоящему изобретению, которая может представлять собой моноклональное антитело, его антигенсвязывающий фрагмент, вариант или производную, включает следующие CDR: CDR1 легкой цепи, включающий последовательность KASQDVSTAVA (SEQ ID №: 1); CDR2 легкой цепи, включающей последовательность LTSYRNT (SEQ ID №: 2); CDR3 легкой цепи, включающей последовательность QQHYKTPYS (SEQ ID №: 3); CDR1 тяжелой цепи, включающей последовательность GYGIY (SEQ ID №: 4); CDR2 тяжелой цепи, включающей последовательность M1W GDGRTDYNS ALKS (SEQ ID №: 5); и CDR3 тяжелой цепи, включающей последовательность DYYGSKDY (SEQ ID №: 6). Предпочтительный вариант связывающей молекулы может дополнительно и в некоторых случаях включать модификацию в шарнирной области S241P.
Более того, предусматривается, что связывающие молекулы по настоящему изобретению включают вариабельную область легкой цепи (VH или VH), как представлено в SEQ ID №: 8, и/или вариабельную область тяжелой цепи (VL или VL), как представлено в SEQ ID №: 9. Однако возможны и другие комбинации областей VL и VH . Соответственно, предпочтительным вариантом осуществления является моноклональное антитело AB023 с последовательностями согласно описанию в настоящем документе и SEQ ID №: 1, 2, 3, 4, 5, 6, 8 и 9.
Фактор XI
Как указано в настоящем документе, связывающая молекула по настоящему изобретению, предпочтительно, способна связываться с двумя идентичными экзозитами на гомодимере FXI, которые участвуют в реакциях распознавания выбранных макромолекулярных субстратов. Человеческий «фактор XI», который также в настоящем документе может именоваться «предшественником плазменного тромбопластина», «PTA», «фактором Розенталя», «фактором свертывания крови XI», «FXI», «Fll» или «fXI», циркулирует в крови в виде гомодимера двухцепочечного гликопротеина с общей молекулярной массой приблизительно 160 килодальтон (кД). Два мономера, которые образуют гомодимер, представляют собой идентичные полипептиды с дисульфидной связью с молекулярной массой приблизительно 80 000 дальтон каждый. Каждый мономер FXI содержит 4 «яблочных домена» (A1 - A4 от N-конца, тяжелой цепи мономера) и C-концевой каталитический домен (легкая цепь мономера). Не желая связывать себя какой-либо конкретной теорией, некоторые специалисты в данной области считают, что 4 яблочных домена содержат участки связывания FXI для других белков, например, A1 для тромбина: A2 для высокомолекулярного кининогена (HK, HMWK), A3 для FIX, гликопротеина lb (GPIb), а также гепарина и A4 для димеризации и, возможно, для FXIIa. FXI можно преобразовать в активную форму, FXIa свертывания крови с помощью FXIIa, тромбина, FXIa и, возможно, других протеаз. Сериновая протеаза FXIa может расщеплять ряд макромолекулярных субстратов, включая FXII, FX, FV, TFPI, FIX и, возможно, другие. Одной из реакций, описанных наилучшим образом, является обычный анализ aPTT, который чувствителен к преобразованию FIX в FIXa, величину можно легко измерить в плазме или крови в обычных клинических лабораториях. FXIa впоследствии активирует фактор свертывания крови IX (IXa), который может активировать фактор свертывания крови X (FXa), который затем может опосредовать активацию свертывания крови FII (протромбин) в тромбин. Затем тромбин может активировать дополнительные молекулы FXI, тем самым, усиливая ферментативный процесс за счет реакции положительной обратной связи, что затем приводит к выработке большего количества тромбина и последующему свертыванию рекальцифицированной цитратной крови или плазмы при анализе aPTT обычно менее чем за 40 секунд с начала реакции с отрицательно заряженными поверхностями и фосфолипидами.
Термин «фактор XI» относится к человеческому фактору свертывания крови XI (FI 1, FXI) с аккр. № Uniprot P03951, начальная версия 194 от 14 октября 2015 г. (SEQ ID №: 7). Как указано в другом месте данного документа, предполагается, что связывающая молекула по настоящему изобретению связывается с доменом в аминокислотной последовательности, соответствующей аминокислотам 91-175 SEQ ID №: 7. Нумерация аминокислот человеческого FXI включает сигнальную последовательность, начиная с метионина в положении от -18 до -1, а затем с глютамина в положении 1.
Термин «положение» при использовании по настоящему изобретению означает положение аминокислоты в аминокислотной последовательности, представленной в данном документе, или положение нуклеотида в нуклеотидной последовательности, представленной в данном документе. Термин «соответствующий» в контексте настоящего документа также включает в себя то, что положение не только определяется количеством предшествующих нуклеотидов/аминокислот, а скорее должно рассматриваться в контексте прилегающей части последовательности. Соответственно, положение конкретной аминокислоты или нуклеотида по настоящему изобретению может изменяться вследствие удаления или добавления аминокислот или нуклеотидов в другом месте последовательности. Таким образом, когда положение упоминается как «соответствующее положение» по настоящему изобретению, очевидно, что нуклеотиды/аминокислоты могут отличаться с точки зрения указанного числа, но все же могут иметься аналогичные прилегающие нуклеотиды/аминокислоты. Чтобы определить, соответствует ли остаток аминокислот (или нуклеотидов) в данной последовательности определенному положению в аминокислотной последовательности (или полинуклеотидной последовательности) «исходной» аминокислотной (или полинуклеотидной последовательности) (например, человеческого FXI, как представлено в SEQ ID №: 7), специалист может использовать средства и методы, хорошо известные в данной области техники, например, выравнивание последовательностей вручную или с использованием компьютерных программ в соответствии с примерами, приведенными в этом документе.
Термин «эпитоп» в целом относится к участку антигена, т.е. (поли-) пептиду, который распознает связывающий домен и может также упоминаться как «антигенная структура» или «антигенная детерминанта». Термин «связывающий домен» относится к «участку связывания антигена», т.е. характеризует домен связывающей молекулы, который связывается/взаимодействует с данным эпитопом-мишенью на антигене или группе антигенов, например, идентичный антиген у разных видов. Антиген-мишень может содержать один эпитоп и предпочтительно содержит как минимум два эпитопа и может включать любое количество эпитопов, в зависимости от размера, конформации и типа антигена. Кроме того, следует отметить, что «эпитоп» антигена-мишени может быть (поли-) пептидом-мишенью, но также может быть или может включать неполипептидные элементы, например, эпитоп может включать углеводную боковую цепь. Термин «эпитоп» в целом охватывает линейные и конформационные эпитопы. Линейные эпитопы представляют собой смежные эпитопы, включенные в аминокислотную первичную последовательность, и могут, например, включать как минимум 2 аминокислоты или больше. Конформационные эпитопы образованы несмежными аминокислотами, наложенными друг на друга путем укладки антигена-мишени и предпочтительно (поли-) пептида-мишени.
Предполагается, что связывающие молекулы по настоящему изобретению распознают структурно консервативный эпитоп, расположенный на тяжелой цепи фактора XI, который включает последовательность как минимум из 2, как минимум из 3, как минимум из 4, как минимум из 5, как минимум из 6, как минимум из 7, как минимум из 8, как минимум из 9, как минимум из 10 смежных или несмежных аминокислот фактора XI (SEQ ID №: 7).
Предлагаемые в настоящем документе связывающие молекулы связываются и образуют иммунный комплекс с доменом A2 человеческого фактора XI, который включает аминокислоты 91-175 SEQ ID №: 7. Однако также предполагается, что связывающая молекула способна связываться с вариантами человеческого FXI, как указано в данном документе, поскольку исходная молекула AB023, 14E11 образует иммунный комплекс или комплексы с FXI в плазме нескольких, но не всех видов млекопитающих. В случае если связывающая молекула находится в нативной (IgG4) форме, она может связывать один или два гомодимера FXI, а также могут образовываться мультимеры или агрегаты. Термин «вариант» при использовании в отношении FXI относится к полипептиду с заменами, удалениями и/или добавлениями одной или нескольких аминокислотных последовательностей в сравнении с «исходной» последовательностью FXI и выполняет ту же биологическую функцию, т.е. может быть преобразован в активную форму FXIa с протеазной активностью и катализирует активацию FIX и/или активацию/инактивацию других макромолекулярных субстратов, таких как TFPI, SERPIN, белок S, FV, FX и FXII. Аминокислотные замены могут быть консервативными, как определено в настоящем документе, или неконсервативными или любым их сочетанием. Варианты FXI могут включать добавления аминокислотных остатков на карбоксильном конце или амино-конце (при этом амино-конец может включать или не включать лидерную последовательность). Термин «вариант» при использовании в отношении FXI включает изоформы, аллельные варианты, сплайс-варианты или посттрансляционно модифицированные варианты (например, варианты гликозилирования) известных полипептидов FXI, например, полипептида FXI с последовательностью, как представлено в SEQ ID №: 7. Легко понять, что связывающие молекулы по настоящему изобретению могут демонстрировать аффинность связывания в отношении вариантов FXI с аминокислотной последовательностью, соответствующей аминокислотам 91-175 SEQ ID №: 7. В соответствии с вышеизложенным, предполагается, что связывающая молекула также способна связываться и формировать различные комплексы с молекулами FXIa и их вариантами при условии, что они включают вышеуказанный участок аминокислот или соответствующие ему положения аминокислот.
Связывающие молекулы по настоящему изобретению также могут связываться с FXI из множества других видов млекопитающих с предпочтением или без предпочтения по отношению к любому виду. Эти нечеловеческие полипептиды FXI предпочтительно кодируются геном FXI или его ортологом или паралогом и демонстрируют ту же биологическую функцию, что и человеческий FXI, даже если они не представлены в виде гомодимеров. Потенциальные белки-мишени нечеловеческих приматов для связывающих молекул по настоящему изобретению включают полипептиды с аккр. № Uniprot H2QQJ4 (Pan troglodytes, начальная версия 26 от 11 ноября 2015 г.), аккр. № Uniprot H2PEX7 (Pongoabelii, начальная версия 27 от 11 ноября 2015 г.), аккр. № Uniprot A0A0D9S2M6 (Chlorocebussabaeus, начальная версия 6 от 11 ноября 2015 г.), аккр. № UniProt G3R2X1 (Gorilla gorilla gorilla, начальная версия 27 от 14 октября 2015 г.), аккр. № Uniprot 20 A0A096NC95 (Papio anubis, начальная версия 11 от 11 ноября 2015 г.), аккр. № Uniprot G1RLE8 (Nomascusleucogenys, начальная версия 28 от 11 ноября 2015 г.), аккр. № Uniprot G7PKF5 (Macaca fascicularis, начальная версия 13 от 14 октября 2015 г.), аккр. № UniProt G7MSF8 (Macaca mulatto, начальная версия 12 от 14 октября 2015 г.). Другие виды включают ряд вариантов FXI млекопитающих, которые имеют такие же консервативные антигенные участки в домене A2, как у людей. Варианты вышеуказанных полипептидов также рассматриваются в качестве мишеней для связывающей молекулы по настоящему изобретению. Предполагается, что рассмотренные полипептиды-мишени нечеловеческих приматов, распознаваемые связывающей молекулой по настоящему изобретению, включают последовательность, соответствующую аминокислотам 91-175 SEQ ID №: 7 или последовательность с идентичностью как минимум 95%, 96%, 97%, 98% или 99%. Таким образом, в настоящем документе также представлены связывающие молекулы с межвидовой специфичностью, направленные на FXI, например, у нечеловеческих приматов. Термин «межвидовое распознавание» или «межвидовая специфичность» в контексте применения в настоящем документе означает связывание описанной в данном документе связывающей молекулы с одним и тем же полипептидом-мишенью у людей и нечеловеческих видов, например, у нечеловеческих приматов. 14E11 является универсальным антителом, что означает, что оно, по-видимому, образует комплексы с большим разнообразием и рядом неродственных видов млекопитающих. Данный аспект предполагает связывание с высококонсервативной или идентичной последовательностью в домене A2 FXI. Поскольку была показана эквивалентность AB023 в отношении 14E11, универсальность AB023 позволяет разрабатывать терапевтические антитела с небольшими видовыми ограничениями.
Как указано в настоящем документе, предполагается, что связывающие молекулы, описанные в настоящем документе, также способны связываться с FXIa человека или млекопитающего, не являющегося человеком. Таким образом, то, что раскрыто в контексте характеристик связывания связывающей молекулы в отношении FXI, предпочтительно, в равной степени применимо к ее характеристикам связывания в отношении FXIa, с учетом соответствующих изменений.
Антитело
Предполагается, что связывающая молекула по настоящему изобретению представляет собой антитело. Как хорошо известно в данной области техники, антитело представляет собой иммуноглобулиновую молекулу, способную к специфическому связыванию с эпитопом-мишенью как минимум через один участок распознавания эпитопа, расположенный в вариабельной области иммуноглобулиновой молекулы. Термины «антитело», «молекула антитела» и «иммуноглобулин» используются в настоящем документе как взаимозаменяемые и в самом широком смысле и могут включать нативные антитела, моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела), (естественные или синтетические) производные, фрагменты или варианты антител, слитные белки, содержащие антигенсвязывающий фрагмент требуемой специфичности, а также любую другую модифицированную конфигурацию антитела, которая включает участок связывания антигена требуемой специфичности. Предполагается, что антитела по настоящему изобретению способны связываться с FXI млекопитающего, как описано в настоящем документе, и предпочтительно демонстрируют преимущественные характеристики антитела AB023, как указано в настоящем документе.
Нативное антитело
«Нативное антитело» представляет собой тетрамерный гликопротеин. В естественном нативном антителе каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара имеет одну «легкую» цепь (примерно 25 кДа) и одну «тяжелую» цепь (примерно 50-70 кДа). Аминоконцевая часть каждой цепи включает «(гипер)вариабельную» область примерно из 100-110 аминокислот или более, которые в первую очередь отвечают за распознавание антигена. Гипервариабельная область включает аминокислотные остатки из «гипервариабельного участка» или CDR или «участков CDR». «Каркасные» или FR-остатки представляют собой остатки вариабельных доменов, отличные от остатков гипервариабельной области.
И легкая, и тяжелая цепи разделены на области структурной и функциональной гомологии, называемые «константной областью» и «вариабельной областью». Термины «константная» и «вариабельная область» используются функционально. В связи с этим, следует понимать, что вариабельные области как легких (VL), так и тяжелых (VH) цепей определяют распознавание и специфичность антигена. Термины «VL», «область VL» и «домен VL» используются как взаимозаменяемые в настоящем описании для обозначения вариабельной области легкой цепи. Аналогичным образом термины «VH», «область VH» и «домен VH» используются в настоящем документе как взаимозаменяемые для обозначения вариабельной области тяжелой цепи.
Термины «CL», «область CL» и «домен CL» используются в настоящем документе как взаимозаменяемые для обозначения константной области легкой цепи. Термины «CH», «область CH» и «домен CH» используются в настоящем документе как взаимозаменяемые для обозначения константной области тяжелой цепи и включают области или домены «CH1», «CH2» и «CH3». В то же время, константные домены легкой цепи (CL) и тяжелой цепи (CH1, CH2 или CH3) обеспечивают биологические свойства, такие как секреция, трансплацентарная подвижность, связывание с рецептором Fc, связывание комплемента и т.п. Условно нумерация доменов константной области увеличивается по мере того, как они становятся более отдаленными от участка связывания антигена или амино-конца антитела. N-концевой участок представляет собой вариабельную область, а C-концевой участок является константной областью; области CH3 и CL фактически содержат карбоксильный конец тяжелой и легкой цепи, соответственно.
Вариабельная область позволяет антителу выборочно распознавать и специфически связывать эпитопы по антигенам. То есть, области VL и VH или подмножество гипервариабельных участков (CDR) в этих вариабельных доменах антитела объединяются с образованием вариабельной области, которая определяет трехмерный участок связывания антигена. Эта четвертичная структура антитела образует участок связывания антигена, который присутствует на конце каждого плеча Y. Еще конкретнее, участок связывания антигена определяется тремя CDR (CDR1, CDR2, CDR3, определяемыми в соответствии с номенклатурой Кэбота) по каждой из областей VH и VL . Три CDR легкой цепи также обозначаются в настоящем документе CDR1 LC или CDRLI, CDR2 LC или CDRL2 и CDR3 LC или CDRL3 . Три CDR тяжелой цепи обозначаются CDR1 HC или CDRHI, CDR2 HC или CDRh и CDRS HC или CDRL3. В нативных антителах шесть «гипервариабельных участков» или «CDR» или «участков CDR», присутствующих в каждом антигенсвязывающем домене, обычно представляют собой короткие, несмежные последовательности аминокислот, которые специфически расположены для образования антигенсвязывающего домена, когда антитело принимает свою трехмерную конфигурацию в водной среде.
Предполагается, что связывающие молекулы и, например, антитела по настоящему изобретению содержат CDR1 легкой цепи, включающей последовательность KASQDVSTAVA (SEQ ID №: 1); CDR2 легкой цепи, включающей последовательность LTSYRNT (SEQ ID №: 2); CDR3 легкой цепи, включающей последовательность QQHYKTPYS (SEQ ID №: 3); CDR1 тяжелой цепи, включающей последовательность GYGIY (SEQ ID №: 4); CDR2 тяжелой цепи, включающей последовательность MIWGDGRTDYNSALKS (SEQ ID №: 5); CDR3 тяжелой цепи, включающей последовательность DYYGSKDY (SEQ ID №: 6); и, в некоторых случаях, модификацию S241P. Специалист легко поймет, что CDR расположены в вариабельной области легкой и тяжелой цепи, соответственно. Моноклональное антитело, которое содержит вышеуказанные CDR, оценивалось как раскрытое и обозначенное в настоящем документе как «AB023».
Предполагается, что связывающие молекулы и предпочтительные моноклональные антитела, их антигенсвязывающие фрагменты, варианты и производные по настоящему изобретению содержат область VL, как представлено в SEQ ID №: 8, и/или область VH, как представлено в SEQ ID №: 9. Однако возможны и другие комбинации областей VL и VH . Предполагается, что связывающие молекулы и предпочтительные моноклональные антитела, их антигенсвязывающие фрагменты, варианты и производные по настоящему изобретению содержат легкую цепь, как представлено в SEQ ID №: 10 или SEQ ID №: 12, и/или тяжелую цепь, как представлено в SEQ ID №: 11 или SEQ ID №: 13. Однако возможны и другие комбинации легких и тяжелых цепей.
Карбоксиконцевая часть каждой легкой и тяжелой цепи определяет константную область, которая в первую очередь отвечает за эффекторную функцию. Иммуноглобулины можно отнести к разным классам в зависимости от аминокислотной последовательности константного домена их тяжелых цепей. Тяжелые цепи подразделяются на мю (m), дельта (D), гамма (g), альфа (a) и эпсилон (e) и определяют изотип антитела как IgM, IgD, IgG, IgA и IgE, соответственно. Некоторые из них могут быть дополнительно разделены на подклассы или изотипы, например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Различные изотипы имеют разные эффекторные функции; например, изотипы IgG1 и IgG3 часто обладают активностью в виде антителозависимой клеточноопосредованной цитотоксичности (ADCC). Легкие цепи классифицируются как каппа или лямбда (k, l). Каждый класс тяжелой цепи может быть связан с легкой цепью каппа или лямбда. В целом, легкие и тяжелые цепи ковалентно связаны друг с другом, а «хвостовые» части двух тяжелых цепей связаны друг с другом ковалентными дисульфидными связями или нековалентными связями. Все типы, классы и подклассы иммуноглобулинов входят в объем настоящего изобретения. Антитела по настоящему изобретению могут быть антителами IgG и, в частности, моноклональными антителами IgG1.
Моноклональные антитела
Согласно настоящему изобретению предусмотрены моноклональные антитела и их антигенсвязывающие фрагменты, варианты и производные. В контексте настоящего документа термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, являются идентичными за исключением возможных естественных мутаций, которые могут присутствовать в небольших количествах. В отличие от обычных типов получения (поликлональных) антител, которые могут включать разные антитела, направленные на разные эпитопы, моноклональные антитела содержат по существу аналогичные участки связывания эпитопа и, следовательно, могут быть направлены на тот же эпитоп на антигене. Термин «моноклональное антитело», таким образом, включает рекомбинантные, химерные, гуманизированные, человеческие или моноклональные антитела Human Engineered™.
Различные способы получения моноклональных антител известны в данной области техники и описаны, например, Годингом, журнал Monoclonal Antibodies: Principles and Practice, сс. 116-227 (Academic Press, 1996). Подходящие методы включают гибридомный метод, впервые описанный Колером и соавт., журнал Nature, 256: 495 (1975), методы рекомбинантных ДНК, которые включают изоляцию и секвенирование ДНК, кодирующей моноклональные антитела, и последующее введение и экспрессию в подходящих клетках-хозяевах, а также изоляцию антител из фаговых библиотек антител, полученных с использованием методов, впервые описанных МакКафферти и соавт., журнал Nature, 348: 552-554 (1990).
Химерное антитело
Как изложено в настоящем документе, термин «антитело» также включает химерные антитела. В контексте настоящего документа словосочетание «химерное антитело» относится к антителу, содержащему последовательность, полученную из двух разных антител, которые могут быть получены из разных видов. В частности, термин относится к антителу, в котором часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из видов или принадлежащих к классу или подклассу антител, в то время как оставшаяся часть цепи (-ей) идентична или гомологична соответствующим последовательностям в антителах, полученных из других видов или принадлежащих к другому классу или подклассу антител, а также фрагментам таких антител.
Другими словами, термин «химерное антитело» будет означать любое антитело, у которого участок связывания антигена получен из первого вида, а константную область (которая может быть интактной, частичной или модифицированной в соответствии с настоящим изобретением) получают из второго вида. Например, участок связывания антигена может быть получен из источника, который не относится к человеку (например, мышь или примат), а константная область - из человека. Например, химерные антитела могут содержать фрагменты человеческих и мышиных антител, например, человеческие константные и мышиные вариабельные области.
Гуманизированное антитело
Как указано в настоящем документе, настоящее изобретение относится к (моноклональному) гуманизированному антителу и его антигенсвязывающим фрагментам, вариантам и производным, полученным из мышиного анти-FXI антитела 14E11 (в исполнении Abzena (ранее известной как Antitope Limited, Кембридж, Великобритания) с использованием обоих методов, хорошо известных и используемых в данной области техники, а также авторской методики).
«Гуманизированное антитело» обычно определяется как антитело, которое (I) получено из источника, который не относится к человеку (например, трансгенная мышь с гетерологичной иммунной системой), причем антитело основано на человеческой последовательности зародышевого типа; или (II) представляет собой антитело с привитыми CDR, причем CDR вариабельной области имеют нечеловеческое происхождение, в то время как одна или несколько каркасных областей и/или часть последовательности CDR вариабельной области имеют человеческое происхождение и, например, константная область (при наличии таковой) имеет человеческое происхождение.
Термин «гуманизированное антитело», таким образом, включает антитела, в которых вариабельная область в тяжелой цепи, легкой цепи или в обеих цепях человеческого антитела изменена как минимум путем частичной замены одного или нескольких CDR из антитела нечеловеческого происхождения с известной специфичностью и, в некоторых случаях, путем частичной замены каркасной области и изменения последовательности. Другими словами, антитело, в котором один или несколько «донорских» CDR из антитела нечеловеческого происхождения (например, мышиное, крысиное, кроличье антитело или антитело нечеловеческого примата) с известной специфичностью прививают в каркасную область тяжелой или легкой цепи человека, в настоящем документе упоминается как «гуманизированное антитело». Замена всех CDR полными CDR из донорского вариабельного домена для передачи антигенсвязывающей способности одного вариабельного домена другому может быть нецелесообразной. Точнее, могут быть переданы только те остатки, которые полезны для поддержания активности участка целевого связывания.
В настоящем изобретении мышиное антитело-предшественник 14E11 гуманизировали путем определения остатков CDR 14E11 и выбора из базы данных человеческой последовательности зародышевого типа с наилучшей общей гомологией с последовательностями VH и VL мыши в качестве акцепторного каркаса зародышевой линии человека для прививки VH и VL CDR3, соответственно, как подробно описано в настоящем документе. Вкратце, структурные модели V-областей химерного анти-FXI антитела были получены с использованием Swiss PDB и проанализированы для идентификации аминокислот в каркасах V-области, которые могут поддерживать связывающие свойства антитела. Эти аминокислоты были отмечены для включения в одно или несколько вариантных антител с привитыми CDR. Обе последовательности VH и Vk связывающей молекулы содержат типичные каркасные остатки, а мотивы CDR 1, 2 и 3 сопоставимы со многими мышиными антителами.
Аминокислотные последовательности V-области тяжелой и легкой цепи сравнивали с базой данных человеческих последовательностей зародышевого типа V-области для идентификации человеческих последовательностей тяжелой и легкой цепи с наибольшей степенью гомологии для использования в качестве каркасов V-области человека. Затем были спроектированы серии гуманизированных V-областей тяжелой и легкой цепи путем прививки CDR на каркасах и, при необходимости, путем обратной мутации в специфическую мышиную последовательность остатков, идентифицированных ранее, что может восстановить эффективность связывания антитела. Затем были выбраны вариантные последовательности с наименьшей частотой встречаемости потенциальных эпитопов T-клеток, как определено путем применения запатентованных Abzena технологий ex vivo, EpiScreen™ (Джонс Т.Д., Хэнлон М., Смит Б.Дж., Хейзе К.Т., Найи П.Д., Сандерс Д.А., Хэмилтон А., Свит К., Юнитт Э., Александер Г., Ло К.М., Гиллис С.Д., Карр Ф.Дж. и Бейкер М.П. The development of a modified human IFN-alpha2b linked to the Fc portion of human IgG1 as a novel potential therapeutic for the treatment of hepatitis C virus infection («Разработка модифицированного человеческого IFN-alpha2b, связанного с Fc-частью человеческого IgG1, в качестве нового потенциального терапевтического средства для лечения вирусной инфекции гепатита С») Журнал J Interferon Cytokine Res. 2004 24(9):560-72; Джонс Т.Д., Филлипс В.Дж., Смит Б.Дж., Бэмфорд К.А., Найи П.Д., Баглин Т.П., Гастон Дж.С. и Бейкер М.П. Identification and removal of a promiscuous CD4+ T cell epitope from the Cl domain of factor VIII («Идентификация и удаление универсального эпитопа CD4+ T-клеток из домена Cl фактора VIII») Журнал J Thromb Haemost. 2005 3(5):991-1000). В контексте настоящего изобретения гуманизированные антитела, которые были оптимизированы по CDR («модифицированы на уровне генов зародышевой линии»), включены в термин «гуманизированные» антитела.
Каркасные области (FR) в вариабельной области в тяжелой цепи, легкой цепи или в обеих цепях гуманизированного антитела могут состоять практически из всех или всех остатков человеческого происхождения, в этом случае эти каркасные области гуманизированного антитела обозначаются как «полностью человеческие каркасные области». Человеческая каркасная область, которая включает смесь человеческих и донорских каркасных остатков, в настоящем документе упоминается как «частично человеческая каркасная область». Кроме того, гуманизированные антитела могут содержать остатки, которых нет ни в реципиентном антителе, ни в донорском антителе. Эти модификации предусмотрены для дальнейшего улучшения характеристик антител (например, для получения требуемой аффинности).
В целом, гуманизированное антитело, таким образом, будет включать практически все или как минимум одну, а в некоторых случаях две вариабельные области, в которых все или часть CDR соответствует таковым для иммуноглобулина, не относящегося к человеку, и все или практически все FR представляют собой FR последовательности иммуноглобулина человека. Гуманизированное антитело, в некоторых случаях, также будет включать как минимум часть константной области иммуноглобулина (Fc), например, иммуноглобулина человека.
Человеческое антитело
Настоящим «человеческое» антитело определяется как антитело, которое не является химерным или «гуманизированным» и не получено (полностью или частично) из нечеловеческого вида. Человеческое антитело или фрагмент функционального антитела может быть получен от человека или может быть синтетическим человеческим антителом. «Синтетическое человеческое антитело» определяется в настоящем документе как антитело, имеющее последовательность, полностью или частично полученную in silico из синтетических последовательностей, которые основаны на анализе известных последовательностей человеческого антитела. Проектирование in silico последовательности человеческого антитела или его фрагмента может быть достигнуто, например, путем анализа базы данных последовательностей человеческого антитела или фрагментов антител и разработки аминокислотной последовательности с использованием данных, полученных посредством этого. Другим примером человеческого антитела или фрагмента функционального антитела является кодируемый нуклеиновой кислотой, выделенной из библиотеки последовательностей антител человеческого происхождения (т.е. такая библиотека основана на антителах, взятых из естественного источника человеческого происхождения).
Фрагменты, варианты и производные
Как указано в настоящем документе, в настоящем изобретении раскрываются полноразмерные антитела, а также их антигенсвязывающие фрагменты, варианты и производные.
Фрагменты
Термин «фрагмент антитела» относится к полипептиду, полученному из «исходного» антитела и сохраняющему свою основную структуру и функцию. Таким образом, фрагмент антитела предпочтительно способен связываться со своим специфическим антигеном, т.е., FXI. Кроме того, фрагмент антитела по настоящему изобретению включает минимальные структурные требования к антителу, которые позволяют связываться с антигеном. Данное минимальное требование, например, может определяться наличием как минимум трех CDR легкой цепи (т.е., CDR1, CDR2 и CDR3 области VL, т.е., CDRL1, CDRL2 и CDRL3) и/или трех CDR тяжелой цепи (т.е., CDR1, CDR2 и CDR3 области VH , т.е., CDRH1, CDRH2 и CDRH3). Таким образом, термин «фрагмент антитела» относится к «функциональному» или «антигенсвязывающему» полипептиду, который сохраняет участок связывания антигена (т.е., CDR и, в некоторых случаях, (часть) FR) «исходного» антитела. Фрагменты антител по настоящему изобретению могут быть получены, например, из моноклональных, рекомбинантных, химерных, гуманизированных и человеческих «исходных» антител.
Предпочтительные антигенсвязывающие фрагменты антитела включают как минимум один из предпочтительно всех CDR1 легкой цепи, включающей последовательность KASQDVSTAVA (SEQ ID №: 1); CDR2 легкой цепи, включающей последовательность LTSYRNT (SEQ ID №: 2); CDR3 легкой цепи, включающей последовательность QQHYKTPYS (SEQ ID №: 3); CDR1 тяжелой цепи, включающей последовательность GYGIY (SEQ ID №: 4); CDR2 тяжелой цепи, включающей последовательность MIWGDGRTDYNSALKS (SEQ ID №: 5); CDR3 тяжелой цепи, включающей последовательность DYYGSKDY (SEQ ID №: 6).
В соответствии с вышеизложенным, термин «антигенсвязывающие фрагменты антитела» может относиться, например, к фрагментам полноразмерных антител, таких как (s)dAb, Fv, Fd, Fab, Fab', F(ab')2 или «rIgG» («полуантитело»). Фрагменты антител по настоящему изобретению также могут быть модифицированными фрагментами антител, таких как scFv, di-scFv или bi(s)-scFv, scFv-Fc, scFv-zipper, scFab, Fab2, Fab3, диатела, одноцепочечные диатела, тандемные диатела (Tandab), тандемные di-scFv, тандемные tri-scFv, «миниантитела», представленные структурой, которая выглядит следующим образом: (VH-VL- CH3)2, (SCFV-CH3)2 или (scFv-CH3-scFv)2, мультитела, например, триатела или тетратела. Кроме того, определение термина «фрагменты антитела» включает конструкции, содержащие фрагменты, т.е., моновалентные, бивалентные и поливалентные/мультивалентные конструкции и, таким образом, моноспецифические конструкции, которые определенным образом связываются только с одним антигеном-мишенью, а также биспецифические и полиспецифические/мультиспецифические конструкции, которые определенным образом связываются с несколькими антигенами-мишенями, например, двумя, тремя или более, через раздельные участки связывания антигена. Более того, определение термина «фрагменты антитела» включает молекулы, состоящие только из одной полипептидной цепи, а также молекулы, состоящие из нескольких полипептидных цепей, которые могут быть идентичными (гомодимеры, гомотримеры или гомоолигомеры) или разными (гетеродимер, гетеротример или гетероолигомер).
Фрагменты антитела могут быть получены методами рекомбинантной ДНК, ферментным или химическим расщеплением интактных антител. Методы получения таких фрагментов хорошо известны в этой области техники.
Варианты
Термин «вариант» относится к полипептидам, включающим аминокислотную последовательность «исходной» связывающей молекулы, например, антитело или фрагмент антитела, но содержащим как минимум одну модификацию аминокислоты (например, замена, удаление или включение) по сравнению с «исходной» аминокислотной последовательностью, при условии, что варианты все еще способны (определенным образом) связываться с FXI, предпочтительно, с доменом A2 человеческого FXI, как представлено в SEQ ID №: 7, и предпочтительно демонстрирует аналогичные или даже улучшенные характеристики по сравнению с антителом AB023. Варианты связывающих молекул по настоящему изобретению, например, антитела и фрагменты антитела, могут быть получены путем введения соответствующих нуклеотидных изменений в нуклеиновые кислоты, кодирующие антитело или фрагмент антитела, или путем пептидного синтеза. В целом, вышеуказанные модификации аминокислот могут быть введены или могут присутствовать в вариабельной или константной области, при условии, что два или несколько CDR вариантов в совокупности содержат 10, 11, 12, 13 или 14 аминокислотных замен по сравнению с CDR AB023, как представлено в SEQ ID №: 1, 2, 3, 4, 5 и 6. Например, модификации аминокислот могут быть введены для модулирования свойств антитела, таких как термодинамическая стабильность, растворимость или вязкость, которые влияют на фармацевтическую разработку («оптимизация последовательности»).
Как указано в настоящем документе, модификации аминокислот включают, например, удаления и/или включения и/или замены остатков в аминокислотных последовательностях связывающих молекул, описанных в настоящем документе, предпочтительно, антител или антигенсвязывающих фрагментов антитела. Любое сочетание удаления, включения и замены может быть введено в «исходную» аминокислотную последовательность для получения конечного продукта, при условии, что он обладает требуемыми характеристиками, как указано в настоящем документе. Модификации аминокислот также могут изменять посттрансляционные процессы связывающих молекул, такие как изменение количества или положения участков гликозилирования.
Например, варианты могут содержать 1, 2, 3, 4, 5 или 6 аминокислот, которые могут быть включены или удалены в каждом из CDR (конечно, в зависимости от их длины), в то время как 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 25 аминокислот могут быть включены или удалены в каждой из FR. Предусмотренные в настоящем документе включения аминокислотной последовательности содержат, например, амино- и/или карбоксиконцевые слияния с диапазоном длины от 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 остатков с полипептидами, содержащими сотню остатков или более, а также включения внутри последовательности одного или нескольких аминокислотных остатков. Инсерционный вариант связывающей молекулы, например, антитело или фрагмент антитела по настоящему изобретению может включать продукт слияния антитела или фрагмента антитела и фермент или другой функциональный полипептид (например, который может увеличивать время полужизни в сыворотке крови для связывающей молекулы, например, антитело или фрагмент антитела).
Аминокислотные замены могут быть введены в CDR тяжелой и/или легкой цепи, например, гипервариабельные области или области FR в тяжелой и/или легкой цепи. В настоящем документе предусмотрены консервативные аминокислотные замены, которые могут быть выполнены, например, на основании сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы вовлеченных остатков.
Альтернативные варианты могут содержать 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот, замещенных в CDR, по сравнению с CDR, как представлено в SEQ ID №: 1-6, в то время как 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 25 аминокислот могут заменяться в каркасных областях (FR) в зависимости от длины CDR или FR.
В целом, если аминокислоты заменяются в одном или нескольких или всех CDR тяжелой и/или легкой цепи, предпочтительно, чтобы полученная таким образом «вариантная» последовательность составляла как минимум 80%, в более предпочтительном варианте как минимум 90% и в наиболее предпочтительном варианте как минимум 95%, 96%, 97%, 98% или 99% идентичности в отношении «исходной» последовательности CDR. Таким образом, длина CDR влияет на количество возможных аминокислотных замен, так что вариантная последовательность все еще включена в настоящее изобретение. Например, CDR, имеющий 5 аминокислот, предпочтительно на 80% идентичен его замещенной последовательности для обеспечения замены как минимум одной аминокислотой. Соответственно, CDR конструкции на основе антитела могут иметь разные степени идентичности с их замещенными последовательностями, например, CDRL1 может иметь идентичность 80%, в то время как CDRL3 может иметь идентичность 90%.
Предпочтительные замены являются консервативными. Однако любая замена (включая неконсервативную замену или одну или несколько типичных замен) предусмотрена до тех пор, пока конструкция на основе антитела сохраняет свою способность связывать FXI и/или CDR идентичны замещенной таким образом последовательности как минимум на 80%, в более предпочтительном варианте как минимум на 90% и в наиболее предпочтительном варианте как минимум на 95%, 96%, 97%, 98% или 99%.
В контексте настоящего документа термин «идентичность последовательностей» указывает степень, при которой две (нуклеотидные или аминокислотные) последовательности имеют идентичные остатки в одних и тех же положениях при выравнивании и часто выражается в процентах. Предпочтительно, идентичность определяется по всей длине сравниваемых последовательностей. Таким образом, две копии одной и той же последовательности имеют идентичность 100%, но последовательности, которые менее высококонсервативны и включают удаления, добавления или замены, могут иметь более низкую степень идентичности. Специалистам в данной области техники будет ясно, что для определения идентичности последовательностей с использованием стандартных параметров доступны несколько алгоритмов, Blast (Алтшул и соавт. (1997), журнал Nucleic Acids Res. 25:3389-3402), Blast2 (Алтшул и соавт. (1990), журнал Journal of Molecular Biology 215:403410), Смит-Ватерман (Смит и соавт. (1981), журнал Journal of Molecular Biology 147:195-197) и Кластал У.
Термин «гомология последовательностей» указывает на сходство двух (нуклеотидных или аминокислотных) последовательностей, приписываемое происхождению от общего предшественника. Гомологичные биологические компоненты (гены, белки, структуры) называются гомологами и включают ортологи и паралоги.
Предпочтительные варианты связывающей молекулы по настоящему изобретению имеют идентичность последовательностей или гомологию на участках CDR как минимум 80%, в более предпочтительном варианте как минимум 90% и в наиболее предпочтительном варианте как минимум 95%, 96%, 97%, 98%, 99% или почти 100% и демонстрируют сравнимую или улучшенную аффинность связывания с FXI и/или сравнимую или улучшенную биологическую активность по сравнению со связывающими молекулами, включающими «исходные» CDR, предпочтительно, SEQ ID №: 1, 2, 3, 4, 5 и 6.
Более того, гомология или сходство последовательностей нуклеиновой кислоты между нуклеотидными последовательностями, кодирующими отдельные вариантные CDR, и нуклеотидными последовательностями, представленными в настоящем документе, составляет как минимум 80% и предпочтительно с увеличивающейся гомологией или идентичностью как минимум 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% и почти 100%.
Помимо CDR и FR, модификации аминокислот также могут быть введены в Fc-часть связывающей молекулы, которая предпочтительно представляет собой моноклональное антитело или его антигенсвязывающий фрагмент. Такие модификации можно использовать для модулирования функциональных свойств антитела, например, взаимодействия с белками комплемента, такими как рецепторы Clq и/или Fc на других иммунных клетках или для модулирования времени полужизни в сыворотке крови или антигензависимой клеточноопосредованной цитотоксичности (ADCC). Таким образом, мутации для модификации эффекторных функций могут быть введены в домены Fc с использованием обычных методов, известных в данной области техники. Среди примеров модификаций выделяются Asn297®Ala297 и Asn297®Gln297, приводящие к гликозилированию IgG1, или Lys322®Ala322 и, в некоторых случаях, Leu234®Ala234 и Leu235®Ala234, которые, как сообщалось, снижают или прекращают клеточноопосредованную цитотоксичность, полученную антителами (ADCC), и/или цитотоксичность, полученную комплементами (CDC).
Производные
Термин «связывающая молекула» также охватывает производные. В настоящем документе предусмотрены производные антител или фрагментов антитела, как указано в другом месте данного документа. Термин «производная», в основном, относится к связывающей молекуле, которая была ковалентно модифицирована для введения дополнительной функциональности. Ковалентные модификации связывающих молекул обычно, но не всегда, выполняются посттрансляционно и могут быть введены в связывающую молекулу путем взаимодействия определенных аминокислотных остатков молекулы с органическим дериватизирующим веществом, способным вступать в реакцию с выбранными боковыми цепями или N- или C-концевыми остатками. Дериватизация связывающих молекул может использоваться для присоединения терапевтических или диагностических веществ, меток, групп, которые увеличивают время полужизни в сыворотке крови для молекулы или включения неприродных аминокислот. Возможные химические модификации связывающих молекул по настоящему изобретению включают, например, ацилирование или ацетилирование N-концевой области или амидирование или этерифицирование C-концевой области или, в качестве альтернативного варианта, в обеих областях. Также предусмотрены химические модификации, такие как алкилирование (например, метилирование, пропилирование, бутилирование), арилирование и этерификация.
Увеличение времени полужизни в сыворотке крови
Примеры средств для увеличения времени полужизни в сыворотке крови для связывающих молекул и предпочтительно антител и их антигенсвязывающих фрагментов по настоящему изобретению включают присоединение пептидов или белковых доменов, которые связываются с другими белками в организме человека (например, сывороточный альбумин, Fc-область иммуноглобулина или неонатальный Fc-рецептор (FcRn). Дополнительные возможные модификации для увеличения времени полужизни в сыворотке крови включают увеличение аминогруппы с использованием полипептидных цепей различной длины (например, технология CTEN или PASylation®), конъюгацию небелковых полимеров, включая, помимо прочего, различные полиолы, например, полиэтиленгликоль (PEGylation), полипропиленгликоль, полиоксиалкилены или сополимеры полиэтиленгликоля и полипропиленгликоля или углеводов, например, гидроксиэтиловый крахмал (например, HESylation®) или полисиаловая кислота (например, технология PolyXen®). Кроме того, как известно из предыдущего уровня техники, аминокислотные замены могут быть выполнены в различных положениях в связывающей молекуле для упрощения добавления полимеров.
Гликозилирование
Другой тип ковалентной модификации связывающих молекул, а также, в предпочтительном варианте, антител и их антигенсвязывающих фрагментов по настоящему изобретению, включает изменение профиля гликозилирования. Как известно в данной области техники, профили гликозилирования могут зависеть как от аминокислотной последовательности молекулы (например, присутствие или отсутствие аминокислотных остатков гликозилирования), или клетки-хозяина или организма, где образуется белок. Гликозилирование полипептидов может быть N-сцепленным или O-сцепленным. N-сцепленное гликозилирование предполагает присоединение углеводного фрагмента к боковой цепи аспарагинового остатка. Добавление участков N-сцепленного гликозилирования к связывающей молекуле удобнее всего производить путем изменения аминокислотной последовательности таким образом, чтобы она содержала одну или несколько трипептидных последовательностей, которые выбираются из аспарагин-X-серина и аспарагин-X-треонина (где X - это любая аминокислота, кроме пролина). Участки O-сцепленного гликозилирования могут быть введены путем добавления сериновых или треониновых остатков в начальную последовательность, или замены на них.
Другой способ гликолизации связывающей молекулы заключается в химическом или ферментном сочетании гликозидов с белком. Преимущества данных процедур заключаются в том, что для них не требуется образование белка в клетке-хозяине, обладающей соответствующими способностями для N- и 0-сцепленного гликозилирования. В зависимости от предусматриваемых условий сочетания, сахара могут быть присоединены к (a) аргинину и гистидину, (b) свободным карбоксильным группам, (c) свободным сульфгидрильным группам, таким как группы цистеина, (d) свободным гидроксильным группам, таким как группы серина, треонина или гидроксипролина, (e) ароматическим остаткам, таким как остатки фенилаланина, тирозина или триптофана, или (f) амидной группе глутамина.
Аналогичным образом дегликозилирование (т.е. удаление углеводных фрагментов, присутствующих в связывающей молекуле) может быть выполнено химическим путем, например, воздействием на связывающую молекулу трифторметансульфоновой кислотой, или ферментативным путем, с использованием эндо- и экзогликозидаз.
Введение меток
Дополнительные потенциальные ковалентные модификации связывающих молекул по настоящему изобретению включают добавление одной или нескольких меток. Группа меток может быть введена в сочетание со связывающей молекулой посредством спейсеров различной длины для ограничения потенциальной стерической изоляции. В данной области техники известны различные способы введения меток в белки, которые могут использоваться в реализации настоящего изобретения. Термин «метка» или «группа меток» означает любую детектируемую метку. В целом, метки подразделяются на множество классов, в зависимости от анализа, в ходе которого предполагается их обнаружение. Выделяются следующие примеры меток, помимо прочего: изотопные метки, которые могут представлять собой радиоактивные или тяжелые изотопы, например, радиоизотопы или радионуклиды (например, 3H, 14C, 15N, 35S, 89Zr, 90Y, 99Tc, ll lln, 1251, 1311); магнитные метки (например, магнитные частицы); редокс-активные фрагменты; оптические красители (в том числе, помимо прочего, хромофоры, люминофоры и флуорофоры), такие как флуоресцентные группы (например, FUC, родамин, люминофоры на основе комплексов лантанидов), хемилюминисцентные группы и флуорофоры, которые могут представлять собой «низкомолекулярные» флуорофоры или белковые флуорофоры; ферментные группы (например, пироксидаза хрена, b-галактозидаза, люцифераза, щелочная фосфатаза); биотинилированные группы; или заранее заданные полипептидные эпитопы, которые распознаются вторичными репортерами (например, парными последовательностями лейциновой «молнии», связывающими участками для вторичных антител, металлсвязывающими доменами, эпитопными маркерами, и т.д.).
ADC
Помимо прочего, предусматривается возможность добавления препарата, например, композиции, имеющей малую молекулу, к связывающим молекулам, и, в предпочтительном варианте, антителам или их антигенсвязывающим фрагментам по настоящему изобретению. Конъюгаты антитело-лекарственное средство (ADC) представляют собой антитела или их антигенсвязывающие фрагменты, соединенные с препаратом или веществом. Соединение может быть установлено посредством ковалентных связей или нековалентных взаимодействий, например, электростатических сил. Для образования ADC, согласно стандартной практике, могут быть использованы различные линкеры, известные в данной области техники.
Аффинные маркеры
Связывающая молекула, и, в предпочтительном варианте, антитело или его антигенсвязывающие фрагменты по настоящему изобретению могут включать дополнительные домены, которые могут поспособствовать очистке и изоляции молекулы (аффинные маркеры). Среди неограничивающих примеров таких дополнительных доменов выделяются пептидные мотивы, известные как Myc-маркер, HAT-маркер, HA-маркер, TAP-маркер, GST-маркер, хитин-связывающий домен (CBD-маркер), мальтозо-связывающий белок (MBP-маркер), Flag-маркер, Strep-маркер и их варианты (например, StrepII-маркер), и His-маркер.
Вышеуказанные фрагменты, варианты и производные могут быть в дальнейшем приспособлены таким образом, чтобы улучшить, например, их антигенсвязывающие свойства. Например, F(ab')2или Fab может предназначаться для максимального ограничения или полного удаления межмолекулярных дисульфидных взаимодействий, которые образовываются между доменами CHI и CL. Полипептиды Fv могут в дальнейшем включать полипептидный линкер между доменами VH и VL, позволяющий для Fv формировать требуемую структуру для связывания антигена. Фрагмент Fab также содержит константный домен легкой цепи и первую константную область (CH1) тяжелой цепи. Отличие фрагментов Fab от фрагментов Fab' определяется путем добавления некоторого количества остатков на карбоксильном конце области CH1 тяжелой цепи, куда входит одна или несколько цистеин от шарнирной области антитела. Fab'-SH представляет собой обозначение в настоящем документе для Fab', где остаток(-ки) цистеина константной области несет свободную теольную группу.
Фрагменты антител F(ab')2 были изначально образованы в виде пар фрагментов Fab', содержащих цистеиновые остатки между собой.
Связывающие молекулы по настоящему изобретению могут быть получены в «изолированной» или «главным образом чистой» форме. «Изолированная» или «главным образом чистая» форма в контексте настоящего документа означает, что связывающая молекула была идентифицирована, отделена и/или извлечена из компонента своей рабочей среды, таким образом, что «изолированная» связывающая молекула оказалась свободна или главным образом свободна от других посторонних компонентов рабочей среды, которые могут помешать удовлетворению терапевтических или диагностических целей. Посторонние компоненты могут включать в себя ферменты, гормоны, и другие белковые или небелковые растворенные вещества. Таким образом, «изолированные» связующие молекулы получаются путем выполнения как минимум одного этапа очистки с удалением или существенным удалением этих посторонних компонентов. Вышеприведенное определение в равной степени применимо к «изолированным» полинуклеотидам, с учетом соответствующим изменений.
Специфическое связывание
Связывающие молекулы по настоящему изобретению, например, антитела и их антигенсвязывающие фрагменты, преимущественно способны связываться с различными FXI млекопитающего, в предпочтительном варианте - FXI человека, которые включают аминокислотную последовательность или состоят из нее, как представлено в SEQ ID №: 7. Термины «связывание с» и «распознавание» во всех грамматических формах используются в настоящем документе как взаимозаменяемые. В предпочтительном варианте, связывающие молекулы специфически связываются с FXI. Термин «специфическая связь» обычно означает, что связывающая молекула, например, антитело или его антигенсвязывающий фрагмент, как описано в настоящем документе, связывается через свой участок связывания антигена с большей легкостью с предполагаемым эпитопом-мишенью, чем со случайным эпитопом-ложной мишенью. Термин «специфическая связь» означает, что аффинность связывающей молекулы будет как минимум в 5 раз, в предпочтительном варианте - в 10 раз, в более предпочтительном варианте - в 25 раз, в еще более предпочтительном варианте - в 50 раз, в наиболее предпочтительном варианте - в 100 раз или более, больше для ее предполагаемого эпитопа-мишени, чем аффинность для эпитопа-ложной мишени.
Таким образом, можно считать, что связывающая молекула, т.е. антитело или его антигенсвязывающий фрагмент, вариант или производное, имеет специфическую связь с эпитопом-мишенью, если она связывает эпитоп с константой распада (KD), которая меньше, чем KD антитела для эпитопа-ложной мишени. Связывающие молекулы по настоящему изобретению также могут быть описаны по их связывающей аффинности относительно FXI млекопитающих, в предпочтительном варианте - FXI человека. Термин «аффинность» или «связывающая аффинность» означает способность связывания отдельного эпитопа с антигенсвязывающим доменом (т.е. CDR связывающей молекулы). Аффинность связывания данной связывающей молекулы относительно конкретного эпитопа, как правило, определяется измерением константы ассоциации равновесия (ka) и константы диссоциации равновесия (kd), а также вычислением отношения kd к ka (KD = kd/ka). Связывающие аффинности можно легко определить, используя общепринятые методики, такие как равновесный диализ; используя прибор BIAcore 2000; посредством радиоиммуноанализа с использованием радиомеченого антигена-мишени; или используя другой способ, известный специалистам в этой области техники. Данные по аффинности могут быть проанализированы, например, методом, описанным Р.Дж. Кауфманом и Ф.А. Шарпом (1982 год, журнал Journal of Molecular Biology 159:601-621). Среди предпочтительных связывающих аффинностей инновационных связывающих молекул выделяются те, чья константа распада или KD составляет менее 5 x 10-6 М, 10-6 М, 5 x 10-7 М, 10-7 М, 5 x 10-8 М, 10-8 10 М, 5 x 10-9 М, 10-9 М, 5 x 10-10 М, 10-10 М, 5 x 10-11 М, 10-11 М, 5 x 10-12 М, 10-12 М, 5 x 10-13 М, 10-13 М, 5 x 10-14 М, 10-14 М, 5 x 10-15 М, или 10-15М.
Перекрестная реактивность
Термин «специфическая связь», тем не менее, не исключает, что связывающие молекулы, имеющие (специфическую) связь с FXI человека, дают перекрестную реакцию с белком FXI другого вида. Соответственно, связывающие молекулы по настоящему изобретению также способны связываться с FXI других видов млекопитающих.
«Межвидовая» связь или распознавание означает связь связывающего домена, как описано в настоящем документе, с аналогичным антигеном-мишенью у людей и нечеловеческих видов. Таким образом, «межвидовую специфичность» следует понимать как межвидовую реактивность на FXI у различных видов, но не на антиген, отличный от FXI. Например, связывающий домен, который связывается с FXI человека, в предпочтительном варианте - с доменом A2, который включает аминокислоты 91 - 175 аминокислотной последовательности, представленной в SEQ ID №:7, также связывается с другим нечеловеческими FXI, и в предпочтительном варианте - с тем, который имеет характеристику области, соответствующую или аналогичную аминокислотам 91 - 175 аминокислотной последовательности, представленной в SEQ ID №: 7.
Биологическая активность
Предполагается, что связывающие молекулы, предлагаемые в настоящем документе, являются биологически активными, т.е. связываются с FXIa и/или FXI млекопитающего и блокируют некоторые из соответствующих биологических функций. В частности, «биологически активные» связующие молекулы по настоящему изобретению образуют иммунный комплекс с FXI, и иммунный комплекс FXI-AB023 не может быть быстро активирован FXIIa или активирован автоматически. Однако иммунный комплекс все еще может быть активирован тромбином. Как только комплекс FXI-AB023 активируется относительно FXla-AB023, его способность к преобразованию зимогена FXII в FXIIa снижается, но активированный комплекс может без потери функции выполнить преобразование FIX в фактор IXa, в результате чего, в предпочтительном варианте, происходит полное или частичное ингибирование контактной активации, при этом сохраняется опосредованная тромбином активация гемостатической обратной связи крови. Таким образом, предполагается, что связывание биологически активных связывающих молекул с их FXIa и/или FXI-мишенью вызовет антикоагулянтную активность, например, в ходе анализа, подразумевающего инициацию коагуляции через комплекс контактной активации. Другими словами, предполагается, что связывающие молекулы по настоящему изобретению выполняют свою полезную функцию посредством а) связывания с FXI, тем самым блокируя преобразование в активную форму FXIa посредством FXIIa или автоматической активации, и/или b) связывания с FXIa, тем самым ограничивая связывание и активацию FXII. Таким образом, в предпочтительном варианте, связывающие молекулы по настоящему изобретению вмешиваются в комплекс контактной активации, и тем самым ограничивают патологические процессы, связанные с контактной активацией, в том числе, например, воспаление и тромбоз, преимущественно без нарушения гемостатических процессов, которые не зависят от комплекса контактной активации.
Антикоагулянтная активность связывающей молекулы может быть определена в лабораторных условиях, как описано в настоящем документе. Вкратце, активированное частичное тромбопластиновое время (aPTT) нормальной плазмы человека или других млекопитающих, которое измеряет образование тромбина в зависимости от активации контактной системы, определяется в присутствии различных концентраций связывающей молекулы или соответствующего растворителя с использованием коммерческого набора для испытаний (реагент SynthASil от Instrumentation Laboratories, Бедфорд, Массачусетс). Испытательные композиции подвергаются инкубации, где также участвует плазма, которая, как правило, содержит эндогенный FXI в диапазоне концентрации от 20 до 45 нМ, а также реагент SynthASil (активатор в виде коллоидного диоксида кремния) при 37° C в течение 3 минут. Затем начинается коагуляция, что выполняется путем добавления 25 нМ хлорида кальция, и определяется время, когда происходит коагуляция, а также определяется концентрация испытательного вещества, вызывающая продление aPTT в 2,0 раза. Предполагается, что связывающие молекулы по настоящему изобретению вызывают продление aPTT в 1,5 раза, в 2,0 раза или более.
Преимущественно, связывающие молекулы, а также, в предпочтительном варианте - моноклональные антитела и их антигенсвязывающие фрагменты, по настоящему изобретению, демонстрируют вышеприведенные биологические свойства, и, следовательно, представляют собой многообещающие агенты для ингибирования тромбоза и воспаления. Так как связывающие молекулы специфически связываются с FXI, предполагается, что они не нарушают или нарушают в незначительной степени гемостаз, и, таким образом, в предпочтительном варианте - не увеличивают риск кровотечения.
Полинуклеотид
Согласно настоящему изобретению дополнительно раскрывается молекула полинуклеиновой/нуклеиновой кислоты, кодирующая связывающую молекулу, или VH или V-домен по настоящему изобретению.
В контексте настоящего документа термин «полинуклеотид» подразумевает под собой полирибонуклеотиды и полидезоксирибонуклеотиды, например, модифицированную или немодифицированную РНК или ДНК, каждую в однонитевой и/или многонитевой (например, двунитевой) форме, линейную или кольцевую, или их комбинации, в том числе гибридные молекулы. Полинуклеотид может включать традиционную фосфодиэфирную связь или нетрадиционную связь (например, амидную связь, как у пептидной нуклеиновой кислоты (ПНК)). Полинуклеотиды по настоящему изобретению могут также содержать одну или несколько модифицированных основ, таких как, например, тритилированные основы, и необычные основы, такие как инозин. Возможны и другие модификации, в том числе химические, ферментные или метаболические модификации, если соединяющая молекула по настоящему изобретению может быть получена из полинуклеотида. Полинуклеотид может быть представлен в изолированной форме, как определено в настоящем документе. Полинуклеотид может включать в себя регуляторные последовательности, например, элементы контроля транскрипции (в том числе ускорители, усилители, операторов, репрессоры и сигналы терминации транскрипции), участок связывания рибосомы, интроны, и т.п.
По настоящему изобретению предлагается полинуклеотид, включающий, или состоящий из нуклеионовой кислоты, кодирующей домен тяжелой цепи иммуноглобулина (область VH), где как минимум одна CDR области VH имеет аминокислотную последовательность, как минимум на 80 %, 85 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % или 100 % идентичную SEQ ID №: 8. Предполагается, что связывающая молекула, включающая кодированные CDR или домены VH, способна связываться с FXI и, за счет образования комплекса между FXI и связывающей молекулой, в предпочтительном варианте - демонстрировать требуемую биологическую активность, как описано в настоящем документе.
По настоящему изобретению предлагается полинуклеотид, включающий, или состоящий из нуклеионовой кислоты, кодирующей домен легкой цепи иммуноглобулина (область VL), где как минимум одна CDR области VL имеет аминокислотную последовательность, как минимум на 80 %, 85 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % или 100 % идентичную SEQ ID №: 9. Предполагается, что связывающая молекула, включающая кодированные CDR или области VL, способна связываться с FXI и, за счет образования комплекса между FXI и связывающей молекулой, в предпочтительном варианте - демонстрировать требуемую биологическую активность, как описано в настоящем документе.
Полинуклеотиды, которые описаны в настоящем документе, могут включать или не включать дополнительные нуклеотидные последовательности, с кодированием, например, сигнального пептида на направление секреции кодируемого полипептида, константных областей антитела, как описано в настоящем документе, или других гетерологичных полипептидов, как описано в настоящем документе. Таким образом, такие полинуклеотиды могут кодировать слитые полипептиды, фрагменты, варианты и другие производные связывающих молекул, которые описаны в настоящем документе.
Кроме того, настоящее изобретение включает в себя композиции, состоящие из одного или нескольких полинуклеотидов, которые описаны выше. Кроме того, в настоящем документе предлагаются композиции, включающие первый полинуклеотид и второй полинуклеотид, при этом первый полинуклеотид кодирует область VH, как описано в настоящем документе, а второй полинуклеотид кодирует область VL, как описано в настоящем документе, в частности, композиция, которая включает или состоит из области VH, представленной в SEQ ID №: 8, и/или области VL, как представлено в SEQ ID №: 9.
Образование полинуклеотидов
Полинуклеотиды по настоящему изобретению могут быть получены с использованием наиболее распространенных методов, известных в данной области техники. Например, если нуклеотидная последовательность связывающей молекулы известна, то полинуклеотид, кодирующий связывающую молекулу, может быть собран из химически синтезированных олигонуклеотидов, посредством отжига и лигирования этих олигонуклеотидов, а затем амплификации лигированных олигонуклеотидов с помощью PCR. Полинуклеотид, кодирующий связывающую молекулу, может быть получен из подходящего источника (например, библиотеки кДНК или нуклеиновой добавки, такой как поли(А)+ мРНК из любой ткани или клеток, из которых можно получить связывающую молекулу, таких как клетки гибридомы) посредством амплификации PCR с использованием синтетических праймеров, поддающихся гибридизации (3'- и 5'-концов последовательности), или путем клонирования с использованием олигонуклеотидного зонда, специфичного для нуклеотидной последовательности гена, для идентификации, например, кДНК, полученной из библиотеки кДНК, кодирующей связывающую молекулу.
После определения нуклеотидной последовательности и соответствующей аминокислотной последовательности связывающей молекулы, ее нудеотидная последовательность может быть модифицирована с использованием методов, хорошо известных в данной области техники для манипуляции с нудеотидными последовательностями, например, методов рекомбинантной ДНК, мутагенеза, характерного для конкретного участка, PCR, и т.д., тем самым вводя одну или несколько нуклеотидных замен, добавлений или удалений в полинуклеотидную последовательность (см., например, методы, описанные Дж. Сэмбруком и соавт., Molecular Cloning: A Laboratory Manual («Молекулярное клонирование: лабораторное руководство») (4-е издание), Лаборатория в Колд-Спринг-Харбор, Cold Spring Harbor Laboratory Press, Нью-Йорк (2012 г.)) для создания неприродных фрагментов, вариантов или производных связывающей молекулы, то есть моноклональное анти-FXI антитело, описанное в настоящем документе (например, область тяжелой цепи иммуноглобулина или область легкой цепи).
Векторы
Далее в настоящем документе представлен вектор, включающий полинуклеотид, как описано в настоящем документе. Полинуклеотид кодирует связывающую молекулу по настоящему изобретению, в предпочтительном варианте - моноклональное антитело или его антигенсвязывающий фрагмент. «Вектор» представляет собой молекулу нуклеиновой кислоты, используемую в качестве несущей среды для переноса (инородного) генетического материала на клетку-хозяина, где он, например, может реплицироваться и/или экспрессироваться.
Термин «вектор» охватывает, помимо прочего, плазмиды, вирусные векторы (в том числе ретровирусные векторы, лентивирусные векторы, аденовирусные векторы, векторы на основе вируса осповакцины, векторы на основе вируса полиомы и аденовирус-ассоциированные векторы (ААВ)), фаги, фагмиды, космиды и искусственные хромосомы (в том числе искусственные бактериальные хромосомы и искусственные дрожжевые хромосомы). Сам вектор, в общем, является нуклеотидной последовательностью, обычно - последовательностью ДНК, включающей вставку (трансген) и более крупную последовательность, которая служит «основой» вектора. Сконструированные векторы могут включать точку начала для автономной репликации в клетках-хозяевах (если требуется стабильная экспрессия полинуклеотида), селективные маркеры, а также участки расщепления рестриктивного фермента (например, участок множественного клонирования, MCS). Векторы могут дополнительно включать ускорители, генетические маркеры, репортерные гены, целенаправленно воздействующие последовательности и/или метки очистки белка. Векторы, называемые векторами экспрессии (экспрессирующие конструкции) специально предназначены для экспрессии трансгена в клетке-мишени, и обычно имеют управляющие последовательности. Специалистам в данной области техники известно большое количество подходящих векторов, доступных на рынке. Примеры подходящих векторов приводятся Дж. Сэмбруком и соавт., Molecular Cloning: A Laboratory Manual («Молекулярное кодирование: лабораторное руководство») (4-е издание), Лаборатория в Колд-Спринг-Харбор, Cold Spring Harbor Laboratory Press, Нью-Йорк (2012 г.).
Целенаправленные векторы
Целенаправленные векторы могут использоваться для интеграции полинуклеотида в хромосому клетки-хозяина (Сэмбрук и соавт., 2012 г.). Вкратце, под подходящими средствами подразумевается, помимо прочего, гомологичная рекомбинация или использование гибридной рекомбиназы, которая нацеливает последовательности на участки интеграции. Целенаправленные векторы могут получить кольцевой или линейный вид, прежде чем быть использованными для гомологичной рекомбинации. В альтернативном варианте, инородные полинуклеотиды могут представлять собой фрагменты ДНК, объединенные посредством PCR слияния, или синтетически сконструированные фрагменты ДНК, которые затем подвергаются рекомебинации в клетку-хозяина. Кроме того, предусматривается возможность использования гетерологичной рекомбинации, которая вызывает случайную или нецеленаправленную интеграцию.
Получение
Векторы экспрессии
«Векторы экспрессии» или «экспрессирующие конструкции» могут использоваться для транскрипции гетерологичных полинуклеотидных последовательностей, например, тех, которые кодируют связывающие молекулы по настоящему изобретению, а также для трансляции их мРНК в подходящей клетке-хозяине. Этот процесс также именуется в настоящем документе как «экспрессия» связывающих молекул согласно настоящему изобретению. Помимо точки начала репликации, селективных маркеров и участков расщепления рестриктивного фермента, векторы экспрессии могут включать в себя одну или несколько регуляторных последовательностей, функционально связанных с гетерологичным полинуклеотидом, подлежащим экспрессии.
Термин «регуляторная последовательность» относится к последовательности нуклеиновой кислоты, необходимой для экспрессии функционально связанной кодирующей последовательности (гетерологичного) полинуклеотида в организме-хозяине, и, таким образом, включает в себя транскрипционные и трансляционные регуляторные последовательности. Регуляторные последовательности, требуемые для экспрессии гетерологичных полинуклеотидных последовательностей у прокариотов, включают, например, ускоритель(-и), в некоторых случаях - последовательность(-и) оператора, а также участок(-ки) связывания рибосомы. У эукариотов могут потребоваться ускорители, сигналы полиаденилирования, усилители и, в некоторых случаях - сигналы сплайсирования. Кроме того, в вектор также могут быть введены специфические сигналы инициации и секреторные сигналы, чтобы обеспечить возможность для секреции интересующего полипептида в среду для культивирования.
Нуклеиновая кислота является «функционально связанной», когда она находится в функциональном отношении с другой последовательностью нуклеиновой кислоты, например, в той же полинуклеотидной молекуле. Например, ускоритель функционально связывается с кодирующей последовательностью гетерологичного гена, когда он может повлиять на экспрессию этой кодирующей последовательности. Ускоритель может быть расположен против хода транскрипции в рамках гена, кодирующего интересующий полипептид, и регулировать экспрессию гена.
Среди примеров регуляторных последовательностей для экспрессии клетки-хозяина млекопитающего выделяются вирусные элементы, которые контролируют высокие уровни экспрессии в клетках млекопитающих, такие как ускорители и/или усилители, полученные из цитомегаловируса (CMV) (например, ускоритель/усилитель CMV), вируса обезьяны 40 (SV40) (например, ускоритель/усилитель SV40), аденовируса (например, главный поздний ускоритель аденовируса (AdMLP)) и полиомы. Для получения дополнительного описания вирусных регуляторных элементов, и их последовательностей, см., например: патент США № 5,168,062, выданный Стинскому; патент США № 4,510,245, выданный Кузенсу и соавт.; и патент США № 4,968,615, выданный Кошиновскому и соавт. Векторы экспрессии также могут включать точки начала репликации и селективные маркеры.
Векторы по настоящему изобретению могут дополнительно включать один или несколько селективных маркеров. Среди селективных маркеров, пригодных к использованию с эукариотическими клетками-хозяевами, выделяются, помимо прочих, гены тимидина киназа вируса простого герпеса (tk), гипоксантингуанин-фосфорибозилтрансферазы (hgprt), а также аденин-фосфорибозилтрансферазы (aprt). Среди других генов выделяются dhfr (устойчивость к метотриксату), gpt (устойчивость к микофеноловой кислоте), neo (устойчивость к G-418) и hygro (устойчивость к гигромицину). Амплификация вектора может быть использована для увеличения уровней экспрессии. В общем, ген-селективный маркер может быть непосредственно связан с полинуклеотидными последовательностями, подлежащими экспрессии, или введен в аналогичную клетку-хозяина посредством котрансформации.
Ввиду вышеизложенного, в настоящем изобретении дополнительно предлагается одна или несколько полинуклеотидных последовательностей, описанных в настоящем документе, которые могут быть введены в вектор. В настоящем изобретении предлагаются реплицируемые векторы, включающие нуклеотидную последовательность, кодирующую связывающую молекулу по настоящему изобретению, или ее тяжелую или легкую цепь, или вариабельный домен тяжелой или легкой цепи, с функциональным соединением с ускорителем. Такие векторы могут включать в себя нудеотидную последовательность, кодирующую константную область связывающей молекулы, и вариабельный домен связывающей молекулы может быть клонирован в такой вектор для экспрессии всей тяжелой или легкой цепи.
Клетка-хозяин
В общем, для экспрессии связывающей молекулы по настоящему изобретению из вектора экспрессии может быть использовано множество клеток-хозяев. В контексте настоящего документа термин «клетка-хозяин» относится к клетке, которая может быть или была реципиентом полинуклеотидов или векторов, или к клетке, кодирующей связывающую молекулу по настоящему изобретению. В частности, клетка-хозяин может в дальнейшем быть способной на экспрессию или, в некоторых случаях - секрецию связывающей молекулы. В описаниях процессов получения связывающих молекул из клеток-хозяев, термины «клетка» и «клеточная культура» используются как взаимозаменяемые для определения источника связывающей молекулы, если ясно не указано иное. Термин «клетка-хозяин» также включает в себя «линии клетки-хозяина».
В общем, термин подразумевает под собой прокариотические и эукариотические клетки, а также включает в себя, помимо прочего, бактерии, дрожжевые клетки, клетки гриба, клетки растения и клетки животного, такие как клетки насекомого и клетки млекопитающего, например, клетки млекопитающих, например, мыши, крысы, макаки, или клетки человека. Полинуклеотиды и/или векторы по настоящему изобретению могут быть введены в клетки-хозяев с использованием наиболее распространенных методов, известных в данной области техники, например, путем трансфекции, трансформации, и т.п.
«Трансфекция» представляет собой процесс преднамеренного введения молекул нуклеиновой кислоты или полиноклеотидов (включая векторы) в клетки-мишени. Термин, в основном, используется для невирусных методов, в отношении эукариотических клеток. Трансдукция, как правило, используется для описания перенесения молекул нуклеиновой кислоты или полинуклеотидов, опосредованного вирусом. Трансфекция клеток животного может предполагать открытие переходных пор или «отверстий» в клеточной мембране, чтобы обеспечить возможность для захвата материала. Трансфекция может быть выполнена с использованием фосфата кальция, посредством электроимпульсного открытия клеточных пор, сжатия клеток или смешивания катионного липида с материалом для получения липосом, которые сливаются с клеточной мембраной и откладывают свои карго-молекулы внутри. Среди примеров методов трансфекции эукариотических клеток-хозяев выделяются захват, опосредованный липидным пузырьком; захват, опосредованный тепловым шоком; трансфекция, опосредованная фосфатом кальция (совместное осаждение фосфата кальция/ДНК); микроинъекция; а также электроимпульсное открытие клеточных пор.
Термин «трансформация» используется для описания невирусного перенесения молекул нуклеиновой кислоты или полинуклеотидов (в том числе векторов) на бактерии, а также на неживотные эукариотические клетки, в том числе на клетки растения. Таким образом, трансформация представляет собой генетическое изменение бактериальной или неживотной эукариотической клетки в результате прямого захвата через клеточную мембрану(-ы) из окружающей среды и последующего включения экзогенного генетического материала (молекул нуклеиновой кислоты). На трансформацию можно повлиять искусственно. Для того чтобы трансформация произошла, клетки или бактерии должны находиться в состоянии компетенции, которое может появиться в виде ограниченной по времени реакции на условия окружающей среды, такие как выращивание на минимальной среде и плотность клеток. Для прокариотической трансформации, среди методов могут быть выделены захват, опосредованный тепловым шоком; слияние бактериальных протопластов с интактными клетками; микроинъекция; а также электроимпульсное открытие клеточных пор. Среди методов для трансформации растения могут быть выделены перенесение, опосредованное агробактерией, такой как A. tumefaciens, быстро перемещаемыми микрочастицами вольфрама или золота; электроимпульсное открытие клеточных пор; микроинъекция; а также захват, опосредованный полиэтиленгликолем.
Ввиду вышеизложенного, в настоящем изобретении дополнительно предлагаются клетки-хозяева, включающие как минимум одну полинуклеотидную последовательность и/или вектор, как описано в настоящем документе.
Для экспрессии связывающей молекулы по настоящему изобретению, может быть выбрана клетка-хозяин, которая модулирует экспрессию введенных полинуклеотидных последовательностей, и/или модифицирует и обрабатывает продукт гена (т.е. РНК и/или белок), если требуется. Такие модификации (например, гликозилирование) и обработка (например, расщепление) продуктов генов могут способствовать выполнению функции связывающей молекулы. Различные клетки-хозяева обладают характерными и специфическими механизмами посттрансляционной обработки и модификации продуктов генов. Подходящие линии клеток или системы-хозяева могут быть выбраны для обеспечения правильной модификации и обработки продукта. С этой целью могут использоваться эукариотические клетки-хозяева, которые обладают клеточным механизмом для надлежащей обработки первичного транскрипта, гликозилирования и фосфорилирования продукта гена.
Среди примеров клеток-хозяев млекопитающих, которые можно использовать для экспрессии связывающих молекул, представленных в настоящем документе, выделяются яичник китайского хомяка (клетки CHO), включая DHFR минус клетки CHO, например, DG44 и DUXB1 1, и, как описано в патенте США № 4634665 (например, используемые с селективным маркером DHFR, например, как описано в патенте США № 5179017), NSO, COS (производное CVI с Т-антигеном SV40), HEK293 (почка человека) и SP2 (миелома мыши). Среди других примеров клеток-хозяев выделяются, помимо прочего, HELA (карцинома шейки матки человека), CVI (линия почек обезьяны), VERY, BHK (почка детеныша хомяка), MDCK, 293, WI38, R1610 (фибробласт китайского хомяка) BALBC/3T3 (фибробласт мыши), HAK (линия почек хомяка), P3x63-Ag3.653 (миелома мыши), BFA-IcIBPT (эндотелиальные клетки крупного рогатого скота) и RAJI (лимфоцит человека). Линии клеток-хозяев могут быть получены у коммерческих служб, Американской коллекции культур тканей или из опубликованной литературы.
Клетки не млекопитающих, такие как клетки бактерий, дрожжей, насекомых или растений, также могут быть легко получены и, в принципе, могут использоваться для экспрессии связывающих молекул по настоящему изобретению. Среди примеров бактериальных клеток-хозяев выделяются энтеробактерии, такие как Escherichia coli, Salmonella; бациллы, такие как, Bacillus subtilis; Pneumococcus; Streptococcus; а также Haemophilus influenzae.
Среди других клеток-хозяев выделяются дрожжевые клетки, такие как Saccharomyces cerevisiae и pichia pastoris. Среди клеток насекомых выделяются, помимо прочего, клетки Spodoptera frugiperda.
В соответствии с вышеизложенным, возможные системы экспрессии (т.е. клетки-хозяева, включающие вектор экспрессии) включают в себя микроорганизмы, такие как бактерии (например, E. coli, B. subtilis), трансформированные рекомбинантной ДНК бактериофага, плазмидной ДНК или векторами экспрессии космидной ДНК; дрожжи (например, Saccharomyces, Pichia), трансформированные рекомбинантными векторами экспрессии дрожжей; системы клеток насекомых, инфицированные рекомбинантными векторами экспрессии вируса (например, бакуловируса); системы клеток растений, инфицированные рекомбинантными векторами экспрессии вируса (например, вирус мозаики цветной капусты, CaMV; вирус табачной мозаики, TMV) или трансформированные рекомбинантными векторами экспрессии плазмиды (например, Ti-плазмиды); или системы клеток млекопитающих (например, клетки COS, CHO, BLK, 293, 3T3), несущие рекомбинантные экспрессирующие конструкции, содержащие ускорители, полученные из генома клеток млекопитающих (например, ускоритель металлотионеина) или вирусов млекопитающих (например, поздний ускоритель аденовируса; ускоритель вируса осповакцины 7.5K).
Для экспрессии связывающих молекул по настоящему изобретению, в предпочтительном варианте предусматриваются эукариотические клетки. Соответственно, клетки СНО, включающие эукариотический вектор с полинуклеотидной последовательностью, кодирующей связывающую молекулу по настоящему изобретению (которая может, например, быть функционально связана с основным усилителем гена немедленного ответа (MIEP) цитомегаловируса человека (CMV)), представляют собой полезные экспрессирующие системы для получения связывающих молекул по настоящему изобретению.
Культивация
Клетки-хозяева, несущие вектор экспрессии, выращиваются в условиях, подходящих для получения связывающих молекул, описанных в настоящем документе, например, легких цепей и тяжелых цепей, как описано в настоящем документе, и анализируются на синтез белка тяжелой и/или легкой цепи. Таким образом, настоящее изобретение включает в себя клетки-хозяев, включающие полинуклеотид, кодирующий связывающую молекулу по настоящему изобретению, или ее тяжелую или легкую цепь, функционально связанную с усилителем. Для экспрессии двухцепочечных антител, векторы, кодирующие как тяжелые, так и легкие цепи, могут совместно экспрессироваться в клетке-хозяине для экспрессии всей молекулы.
Очистка
После рекомбинантной экспрессии связывающей молекулы по настоящему изобретению, ее можно очистить любым способом, известным в данной области техники, например, посредством хроматографии (например, ионообменной хроматографии (например, хроматографии с гидроксилапатитом), аффинной хроматографии, с использованием белка A, белка G, или посредством лектиновой аффинной хроматографии, колоночной хроматографии с распределением по размеру), центрифугирования, дифференциального растворения, хроматографии с гидрофобным взаимодействием или любым другим стандартным способом очистки белков. Специалист легко сможет выбрать подходящий способ очистки, исходя из индивидуальных характеристик связывающей молекулы, подлежащей извлечению.
Ввиду вышеизложенного, в настоящем изобретении дополнительно предлагается процесс получения связывающей молекулы по настоящему изобретению, включающий культивирование культивацию клетки-хозяина, как определено в настоящем документе, в условиях, позволяющих экспрессию связывающей молекулы и, в некоторых случаях, восстановление полученной молекулы из культуры.
Фармацевтическая композиция
В настоящем изобретении дополнительно предлагается фармацевтическая композиция, включающая терапевтически эффективное количество связывающей молекулы, нуклеиновой кислоты, вектора и/или клетки-хозяина по настоящему изобретению, а также, в некоторых случаях, один или несколько фармацевтически приемлемых эксципиентов или носителей. Предпочтительная фармацевтическая композиция включает антитело по настоящему изобретению и, в некоторых случаях, один или несколько фармацевтически приемлемых вспомогательных веществ.
Таким образом, согласно одному аспекту, настоящее изобретение относится к фармацевтической композиции, включающей в качестве действующего вещества связывающую молекулу, как описано в настоящем документе, в предпочтительном варианте - анти-FXI антитело или его антигенсвязывающий фрагмент. Соответственно, в настоящем изобретении также предусматривается возможность использования связывающей молекулы для изготовления фармацевтической композиции. Термин «фармацевтическая композиция», в предпочтительном варианте, относится к композиции, подходящей для введения субъекту, конкретно - человеку. Однако композиции, подходящие для введения нечеловекоподобным животным, также охватываются этим термином.
Фармацевтическая композиция и ее компоненты (т.е. действующие вещества и, в некоторых случаях, эксципиенты), в предпочтительном варианте, являются фармацевтически приемлемыми, т.е. способны вызывать требуемый терапевтический эффект, не вызывая нежелательных локальных или системных эффектов у реципиента. Фармацевтически приемлемые композиции по настоящему изобретению могут быть, например, стерильными и/или фармацевтически инертными. В частности, термин «фармацевтическая приемлемость» может означать одобрение регулирующим органом или другой общепризнанной фармакопеей для использования у животных, и, в предпочтительном варианте, у людей.
Связывающая молекула, описанная в настоящем документе, в предпочтительном варианте, присутствует в фармацевтической композиции в терапевтически эффективном количестве. Под «терапевтически эффективным количеством» подразумевается количество или доза связывающей молекулы, которая вызывает требуемый терапевтический эффект. Терапевтическая эффективность и токсичность могут быть определены стандартными фармацевтическими процедурами на клеточных культурах, подопытных животных, или клиническими испытаниями, например, ED50 (доза, терапевтически эффективная для 50 % населения) и LD50 (доза, летальная для 50 % населения). Соотношение доз между терапевтическими и токсическими эффектами представляет собой терапевтический индекс, и его можно выразить как соотношение ED50/LD50. Предпочтительны фармацевтические композиции, демонстрирующие высокие терапевтические индексы.
Как указано в настоящем документе, фармацевтическая композиция может, в некоторых случаях, включать один или несколько эксципиентов и/или дополнительных действующих веществ.
Антитела и их фрагменты обычно вводятся парентерально, в предпочтительном варианте - внутривенно (инъекция или инфузия) или подкожно. Композиции для парентерального введения включают в себя стерильные водные или неводные растворы, суспензии и эмульсии. Неводные растворители включают в себя, помимо прочего, пропиленгликоль, полиэтиленгликоль, растительное масло, например, оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Водные растворители могут быть подобраны из группы, состоящей из воды, спиртовых/водных растворов, эмульсий или суспензий, в том числе физиологического раствора и буферных сред, таких как, помимо прочего, натрий-фосфатный буферный раствор. Среди парентеральных несущих сред дополнительно выделяются раствор хлористого натрия, декстроза Рингера, декстроза и хлорид натрия, лактат Рингера, или нелетучие масла. Другие подходящие фармацевтические носители, разбавители и/или эксципиенты хорошо известны в этой области техники. Связывающая молекула, такая как антитело или его фрагмент, согласно настоящему изобретению, может быть объединена с фармацевтически приемлемым носителем, разбавителем и/или эксципиентом, такими как те, которые рассматриваются выше, для образования фармацевтической композиции. Фармацевтические композиции могут включать связывающую молекулу по настоящему изобретению в водном носителе, который включает буферное вещество, подобранное из группы, состоящей из буфера гистидина, буфера уксусной кислоты, буфера лимонной кислоты и буфера гидрохлорида гистидина. Специалист в этой области техники может ознакомиться с дополнительными сведениями о буферах и составе, например, в публикации Ван В. и соавт., журнал J. Pharmaceutical Sci., январь 2007 г. (1): 1-26. Кроме того, могут присутствовать консерванты, такие как, например, противомикробные вещества, антиоксиданты, хелатирующие агенты, инертные газы и т.д.
Фармацевтическая композиция может дополнительно включать белковые носители, такие как, например, сывороточный альбумин или иммуноглобулин, в предпочтительном варианте - человеческого происхождения. Согласно одному варианту осуществления, фармацевтическая композиция включает связывающую молекулу в лиофилизированной форме, и, в предпочтительном варианте, восстанавливается в растворе или суспензии перед введением. Согласно другим вариантам осуществления, фармацевтическая композиция включает связывающую молекулу и находится в жидкой форме.
После приготовления фармацевтических композиций по настоящему изобретению и, в некоторых случаях, подходящего эксципиента, они могут быть помещены в соответствующую упаковку и маркированы для лечения указанного состояния. Такая маркировка, например, может включать в себя количество, частоту и способ введения.
Дополнительные действующие вещества
Согласно настоящему изобретению дополнительно предлагаются медицинские препараты или фармацевтические композиции, включающие инновационное соединение и один или несколько действующих ингредиентов, в том числе предназначенные для лечения и/или профилактики нарушений, указанных в настоящем документе. Предпочтительные примеры действующих ингредиентов, пригодных для сочетания, включают в себя, помимо прочего:
- гиполипидемические вещества, в особенности ингибиторы гидроксиметилглутарил-кофермента А (3-гидрокси-3-метилглутарил-кофермента А) редуктазы, включающие, помимо прочего, ловастатин (Mevacor (Мевакор)), симвастатин (Zocor (Зокор)), правастатин (Lescol (Лескол)) и аторвастатин (Lipitor (Липитор));
- коронарные терапевтические средства/сосудорасширяющие факторы, в особенности ингибиторы ACE (ангиотензинпревращающего фермента), включающие в себя, помимо прочего, каптоприл, лизинопил, эналаприл, рамиприл, длазаприл, беназеприл, фосиноприл, квинаприл и периндоприл; или блокаторы рецепторов AII (ангиотензина II), включающие в себя, помимо прочего, эмбусартан, лосартан, валсартан, ирбесартан, кандесартан, эпросартан и темисартан; или блокаторы адренорецепторов, включающие в себя, помимо прочего, карведилол, алпренолол, бисопролол, ацебутолол, атенолол, бетаксолол, картеолол, метопролол, надолол, пенбутолол, пиндолол, пропанолол и тимолол; или блокаторы альфа-1-адренорецепторов, включающие в себя, помимо прочего, празосин, буназосин, доксзосин и теразосин; или диуретики, включающие в себя, помимо прочего, гидрохлоротиазид, фуросемид, амилорид и дигидразалин; или блокаторы кальциевых каналов, включающие в себя, помимо прочего, верапамил и дилтиазем; или производные дигидропиридина, включающие в себя, помимо прочего, нифедипин (Adalat (Адалат)) и нетрендипин (Bayotensin (Байотенсин)); или нитропрепараты, включающие в себя, помимо прочего, изосорбид 5-мононитрат, изосорбиддинитрат и глицерин тринитрат; или вещества, провоцирующие увеличение количества циклогуанозинмонофосфата (cGMP), включающие в себя, помимо прочего, риоцигуат;
- активаторы плазминогена (тромболитики/фибринолитики) и соединения, содействующие тромболизу/фибринолизу, включающие в себя, помимо прочего, ингибиторы ингибитора активатора плазминогена (ингибиторы PAI) или ингибиторы активированного тромбином ингибитора фибринолиза (ингибиторы TAFI), включающие в себя, помимо прочего, тканевой активатор плазминогена (t-PA), стрептокиназу, ретеплазу и урокиназу;
- антикоагулирующие вещества (антикоагулянты), включающие в себя, помимо прочего, гепарин (НГ), низкомолекулярные гепарины (НМГ), которые включают в себя, помимо прочего, тинзапарин, цертопарин, памапарин, надропарин, ардепарин, эноксапарин, ревипарин, далтепарин, данапароид, семулопарин (AVE 5026), адомипарин (Ml 18) и EP-42675/ORG42675;
- прямые ингибиторы тромбина (DTI), включающие в себя, помимо прочего, Pradaxa (Прадакса) (дабигатран), атецегатран AZD-0837), DP-4088, SSR-182289A, аргатробан, бивалиродин и таногитран (BIBT-986 и пропрепарат BIBT-1011), гирудин;
- прямые ингибиторы фактора Ха, включающие в себя, помимо прочего, ривароксабан, апиксабан, эдоксабан (DU-176b), бетриксабан (PRT-54021), R-1663, дарексабан (YM-150), отамиксабан (FXV- 673/RPR-130673), летаксабан (TAK-442), разаксабан (DPC-906), DX-9065a, LY-517717, таногитран (BIBT-986, пропрепарат: BIBT-1011), идрапаринукс и фондапаринукс;
- вещества, ингибирующие агрегацию тромбоцитов (ингибиторы агрегации кровяных телец, ингибиторы агрегации тромбоцитов), включающие в себя, помимо прочего, ацетилсалициловую кислоту (например, Aspirin (Аспирин)), тиклопидин (Ticlid (Тиклид)), клопидогрел (Plavix (Плавикс)), прасугрел, тикагрелор, кангрелор, элиногрел, ворапаксар;
- блокаторы рецепторов фибриногена (гликопротеина-IIb/IIIa), включающие в себя, помимо прочего, абциксимаб, эптифибатид, тирофибан, ламифибан, лефрадафибан и фрадафибан;
- антиаритмические препараты;
- различные антибиотики или противогрибковые медицинские препараты либо в качестве расчетной терапии (до наличия диагноза на основе микроорганизмов), либо терапии специфической;
- сосудосуживающие факторы, включающие в себя, помимо прочего, норэпинэфрин, дофамин и вазопрессин;
- инотропная терапия, включающая, помимо прочего, добутамин;
- человеческий рекомбинантный активированный белок С, например, Зигрис;
- препараты крови, включающие в себя, помимо прочего, эритроцитарную массу, тромбоцитарную массу, эритропоэтин и свежезамороженную плазму;
- ингибиторы адгезии тромбоцитов, такие как блокаторы GPVI и /или GPIb, включающие в себя, помимо прочего, Revacept (Ревацепт) или Caplacizumab (Каплацизумаб).
- ингибиторы путей трансдукции сигналов, зависимых от VEGF и/или PDGF, включающие в себя, помимо прочего, Aflibercept (Афлиберцепт), Ranibizumab (Ранибизумаб), Bevacizumab (Бевацизумаб), KH-902, Pegaptanib (Пегаптаниб), Ramucirumab (Рамицирумаб), Squalaminoder (Скваламинодер), Bevasiranib (Бевасинариб), Apatinib (Апатиниб), Axitinib (Акситиниб), Brivanib (Бриваниб), Cediranib (Цедираниб), Dovitinib (Довитиниб), Lenvatinib (Ленватиниб), Linifanib (Линифаниб), Motesanib (Мотесаниб), Pazopanib (Пазопаниб), Regorafenib (Регорафениб), Sorafenib (Сорафениб), Sunitinib (Сунитиниб), Tivozanib (Тивозаниб), Vandetanib (Вандетаниб), Vatalanib (Ваталаниб), Vargatef (Варгатеф) или E-10030;
- ингибиторы пути трансдукции сигналов (ангиопоэтин-TIe), включающие, помимо прочего, AMG386;
- ингибиторы активности рецептора TIe2 тирозинкиназы;
- ингибиторы интегрин-зависимого пути трансдукции сигналов, включающие в себя, помимо прочего, Volociximab (Волоциксимаб), Cilengitid (Циленгитид) или ALG1001;
- ингибиторы трансдукции сигналов, зависимых от сигнального пути PI3K/AKT/mTOR, включающие, помимо прочего, XL-147, Perifosin (Перифозин), MK2206, Sirolimus (Сиролимус), Temsirolimus (Темсиролимус) или Everolimus (Эверолимус);
- кортикостероиды, включающие в себя, помимо прочего, гидрокортизон, флудрокортизон, Anecortave (Анекортав), Betamethason (Бетаметазон), Dexamethason (Дексаметазон), Triamcinolon (Триамцинолон), Fluocinolon (Флуоцинолон) или Fluocinolonacetonid (Флуоцинолонацетонид);
- ингибиторы пути трансдукции сигналов, зависимых от ALK.l-Smadl/5, включающие в себя, помимо прочего, ACE041;
- ингибиторы циклооксигеназы, включающие в себя, помимо прочего, Bromfenac (Бромфенак) или Nepafenac (Непафенак);
- ингибиторы калликреин-кининовой системы, включающие в себя, помимо прочего, Safotibant (Сафотибант) или Ecallantid (Экаллантид);
- ингибиторы сфингозин-I-фосфат-зависимых путей трансдукции сигналов, включающие в себя, помимо прочего, Sonepcizumab (Сонепцизумаб);
- ингибиторы рецептора комплемента C5a, включающие в себя, помимо прочего, Eculizumab (Экулизумаб); - ингибиторы рецептора 5HTla, включающие в себя, помимо прочего, Tandospiron (Тандоспирон);
- ингибиторы Raf-Mek-Erk-зависимого пути трансдукции сигналов, ингибиторы пути трансдукции сигналов митоген-активиуемой протеинкиназы; ингибиторы пути трансдукции сигналов фактора роста фибропластов, ингибиторы пролиферации эндотелиальных клеток и соединения, способные индуцировать апоптоз; или
- фотодинамические виды терапии, предполагающие использование действующего вещества и воздействие света, причем действующее вещество может быть представлено, например, Verteporfin (Вертепорфин).
«Комбинации» в целях настоящего изобретения подразумевают не только лекарственные формы, содержащие все компоненты (так называемые фиксированные комбинации) и блоки комбинаций, которые содержат компоненты, отделенные друг от друга, но также и компоненты, вводимые одновременно или последовательно, при условии, что они используются для профилактики и/или лечения одного и того же заболевания. Также имеется возможность комбинирования двух или нескольких действующих ингредиентов друг с другом, что означает, что каждый из них, таким образом, будет входить в двух- или многокомпонентные комбинации.
Введение
Для введения фармацевтической композиции по настоящему изобретению существуют различные пути. Введение может быть осуществлено парентерально. Способы парентеральной доставки включают в себя, например, топическое введение, внутриартериальное, внутримышечное, подкожное, костномозговое, интратекальное, интравентрикулярное, внутривенное, интраперитонеальное, внутриматочное, интравагинальное, подъязычное или интраназальное введение.
Фармацевтические композиции для парентерального введения включают в себя водные растворы активных соединений. Для инъекции фармацевтические композиции по настоящему изобретению могут быть выполнены в виде водных растворов, предпочтительно, в виде физиологически совместимых буферов, таких как раствор Ханка, раствор Рингера или забуференный физиологический раствор. Водные суспензии для инъекций могут содержать вещества, повышающие вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбитол или декстран. Дополнительно суспензии активных соединений могут быть приготовлены в виде соответствующих масляных суспензий для инъекций. Примеры липофильных растворителей или несущих сред включают в себя жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или же липосомы. В дополнение к этому, суспензия также может содержать соответствующие стабилизаторы или вещества, которые могут повышать растворимость соединений для обеспечения возможности приготовления выскоконцентрированных растворов. Для топического или назального введения в композиции используют вещества, обеспечивающие проникновение, соответствующие барьеру, который необходимо преодолеть. Такие вещества, обеспечивающие проникновение, общеизвестны в этой области техники. С дополнительной информацией относительно методик приготовления и введения можно ознакомиться в 22-м издании монографии Remington's Pharmaceutical Sciences (ред. Maack Publishing Co, Истон, Пенсильвания, 2012 г.).
Лечение
В контексте настоящего документа термины «лечить» или «лечение» (во всех грамматических формах) подразумевают терапевтическое или профилактическое воздействие на заболевания, приводимые в настоящем документе. «Терапевтическое или профилактическое воздействие» включает виды профилактического воздействия, направленные на замедление или полное предотвращение клинических и/или патологических проявлений, или же терапевтическое воздействие, направленное на уменьшение интенсивности или ремиссию клинических и/или патологических проявлений. Таким образом, термин «лечение» также подразумевает уменьшение интенсивности или предотвращение описанных заболеваний. Лечение также может означать увеличение выживаемости по сравнению с ожидаемым показателем без лечения. К лицам, нуждающимся в лечении, относятся те, у кого уже имеется расстройство или нарушение, кто склонен к такому расстройству или нарушению, или те, в отношении которых надлежит предотвратить развитие расстройства или нарушения.
Термины «больной» или «индивидуум», «животное» или «пациент», либо же «млекопитающее» в настоящем документе взаимозаменяемы и относятся к больному, предпочтительно, субъекту-млекопитающему, в отношении которого необходимо провести диагностику, прогнозирование или лечение (терапию). Субъекты-млекопитающие включают в себя человека, нечеловеческих приматов, домашних животных, сельскохозяйственных животных, животных-компаньонов, животных из зоопарков, для спорта или домашних питомцев, таких как собаки, кошки, морские свинки, кролики, крысы, мыши, лошади, крупный рогатый скот, коровы и т.п.
В контексте настоящего документа выражения, включающие такие обороты как «будут обеспечены положительные эффекты» и «нуждающийся в лечении», подразумевают больных, в отношении которых будут обеспечены положительные эффекты после введения гуманизированного моноклонального антитела, его связывающего фрагмента, варианта или производного.
Дозировка
За счет применения известных методик специалист в этой области техники сможет установить точную дозировку (терапевтически эффективное количество) связывающих молекул, полинуклеотидов, векторов или клеток-хозяев. В соответствующих дозировках обеспечивается наличие достаточного количества связывающих молекул, предпочтительно являющееся терапевтически эффективным, т.е., обеспечивающим требуемый терапевтический или профилактический эффект.
Как известно из предыдущего уровня техники, можно выполнить определение лечения и поправку согласно его цели (например, профилактику, поддержание ремиссии, лечение внезапного острого обострения болезни) на путь, время и частоту введения, время и частоту приготовления препарата для введения, возраст, массу тела, общее состояние здоровья, пол, режим питания, тяжесть заболевания, сочетание (-я) препаратов, аллергические реакции и толерантность/ответ на лечение. Диапазоны соответствующих терапевтически эффективных доз могут быть определены с помощью данных, получаемых при анализе клеточных культур, и за счет исследований на животных, и они могут включать ЭД50. Количество в дозе может варьироваться от 0,1 до 100000 микрограмм, доходя до суммарной дозы около 2 г в зависимости от пути введения. Примеры доз связывающей молекулы могут колебаться в диапазоне от 0,01 до 10 мг/кг, от 0,1 до 10 мг/кг, от 1 до 10 мг/кг, от 1 до 5 мг/кг, от 0,01 до 1 мг/кг или от 0,1 до 1 мг/кг. Руководство по дозировкам и способам доставки приведено в литературных источниках. Известно, что для лечения может потребоваться однократное введение терапевтически эффективной дозы или несколько введений такой дозы, содержащей связывающую молекулу, полинуклеотид, вектор или клетку-хозяина по настоящему изобретению. Например, в зависимости от формы, времени полувыведения и скорости выведения композиции некоторые фармацевтические композиции могут вводиться однократно, периодически в течение определенного периода, измеряющегося в часах, каждые 3-4 дня, еженедельно или один раз в две недели, ежемесячно, один раз в два месяца. Специалистам в этой области техники хорошо известны способы определения каждой из применимых переменных.
Набор
Согласно настоящему изобретению дополнительно раскрываются фармацевтические комплекты и наборы, включающие одну или несколько упаковок или флаконов, заполненных одним или несколькими действующими веществами, входящими в состав вышеприведенных фармацевтических композиций по настоящему изобретению, к которым прилагается инструкция по их введению. Таким образом, в настоящем документе предлагается набор, включающий связывающую молекулу, полинуклеотид, вектор, клетку-хозяина и/или фармацевтическую композицию, как описано в настоящем документе. Вышеприведенные наборы, описанные в настоящем документе, могут использоваться для лечения заболеваний, описанных в нем, или для иных целей.
К вышеприведенным упаковкам могут относиться уведомления в форме, предписанной государственным ведомством, регулирующим изготовление, применение или продажу фармацевтической или биологической продукции, в котором будет указано одобрение со стороны этого ведомства изготовления, применения или продажи этой продукции в целях приема человеком.
Набор может включать одно или несколько действующих веществ (дополнительно выполненных в виде фармацевтической композиции с одним или несколькими эксципиентами). Соответствующие действующие вещества были ранее приведены в контексте фармацевтической композиции и потенциально могут являться частями инновационного набора. Дополнительное действующее вещество может вводиться пациенту одновременно или последовательно в соответствии со связывающей молекулой, нуклеотидной последовательностью, вектором, клеткой-хозяином и/или фармацевтической композицией. В настоящем изобретении также раскрывается введение действующих веществ по разным путям, например, перорально и внутривенно.
В настоящем документе дополнительно предусматриваются наборы, включающие полинуклеотидные последовательности, кодирующие связывающие молекулы согласно настоящему изобретению. Полинуклеотиды могут быть представлены вектором, таким как плазмида, пригодным для трансфекции и экспрессии клеткой-хозяином. В настоящем документе приводится описание таких векторов и клеток-хозяев.
Терапевтическое применение
Согласно настоящему изобретению дополнительно раскрываются связывающие молекулы, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, для применения в качестве медицинских препаратов с целью лечения и/или профилактики заболеваний людей и/или животных.
Согласно настоящему изобретению дополнительно раскрываются связывающие молекулы, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, для применения с целью лечения и/или профилактики нарушений, например, сердечно-сосудистых нарушений, предпочтительно тромбических или тромбоэмболических нарушений и/или осложнений, а также воспалительных процессов, предпочтительно аутоиммунных воспалений или воспалительных реакций, связанных с инфекциями.
FXIa - это фермент, который в контексте коагуляции может быть активирован как посредством тромбина, так и FXIIa, и, следовательно, может быть вовлечен в процесс коагуляции. FXI - это центральный компонент перехода от инициации к усилению и распространению коагуляции. Более того, FXIa - это компонент для инициации и поддержания патологической коагуляции крови в кровеносных сосудах. Кровяная система активации контакта может активизироваться на внутрисосудистых поверхностях с отрицательным зарядом, что включает в себя воздействие субэндотелиального и внесосудистого содержимого (включая коллаген и ламинин) не только на кровоток, на поверхностные структуры инородных клеток (например, бактерии), но также и на такие искусственные поверхности, как сосудистые протезы, катетеры, стенты, устройства поддержки желудочков, клапаны и системы экстракорпорального жизнеобеспечения, такие как оксигенаторы, насосы, трубки, установки для диализа и т.п. На поверхности фактор XII (FXII) активируется по фактору Xlla (FXIIa), который впоследствии активирует FXI, прикрепляющийся к поверхностям FXIa. FXI также может самоактивироваться на отрицательно заряженных поверхностях. Такая активация FXI приводит к выделению тромбина вниз по потоку, а также к ответному усилению всех ферментов комплекса активации контакта, которые включают FXI, FXII и прекалликреин.
Напротив, на гемостатическое выделение тромбина в крови вне кровеносных сосудов, которая выходит из сосуда через рану, не воздействует ингибирование активации контакта, поскольку гемостатическое выделение тромбина возникает под действием комплекса TF/FVIIa и ответной активации FXI за счет тромбина, ни на один из которых не оказывается значительное воздействие при фармакологическом вмешательстве в функции комплекса активации контакта. Отсутствие видимой тенденции к кровотечению и предрасположенности к острому воспалению у млекопитающих, подвергшихся нарушению системы вследствие контакта, которая характеризует эффект образования комплекса между FXI и связывающей молекулой в организме, представляет собой большое преимущество по сравнению с прочими типами ингибиторов FXI/FXla или ингибиторами протеазы для применения в отношении человека, например, в отношении пациентов с повышенным риском кровотечения или воспалительных реакций. Соответственно, связывающие молекулы по настоящему изобретению, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, предназначены для применения при лечении и/или профилактике нарушений или осложнений, которые могут развиться вследствие ферментной и неферментной активности комплекса активации контакта, включая, помимо прочего, тромбин, инициируемый при патологическом контакте в крови, и выделение брадикинина, приводящие к тромбообразованию и воспалению соответственно.
В контексте настоящего изобретения «тромбические или тромбоэмболические нарушения» включают в себя, например, нарушения, возникающие как в артериальной, так и в венозной сосудистой системе, на которые могут воздействовать связывающие молекулы по настоящему изобретению, предпочтительно представленные антителами и их антигенсвязывающими фрагментами; а также предпочтительно, чтобы нарушения были представлены нарушениями коронарных артерий сердца, такими как острый коронарный синдром (ОКС), инфаркт миокарда с подъемом сегмента ST
(ИМпST) и без него (ИМбпST), стабильная стенокардия грудного отдела, нестабильная стенокардия грудного отдела, реокклюзии и рестенозы после вмешательств в коронарные артерии, такие как ангиопластика, стентирование или аортокоронарное шунтирование, а также тромбическими или тромбоэмболическими нарушениями в сосудах, расположенных далее, что приводит к окклюзионным нарушениям артериальной периферии, легочной эмболии, венозной тромбоэмболии, венозным тромбозам, т.е., тромбозам в глубоких венах ног и почек, транзиторным ишемическим атакам, а также тромботическим и тромбоэмболическим инсультам.
В контексте настоящего изобретения «воспалительные нарушения» включают в себя патологические состояния, основанные на активации суммарного комплекса системы контакта (FXFI/FXJ/PK/HK) или запускаемые при ее активации, в том числе избыточное расщепление кининогена (HMWK) и выделение наиболее сильного известного провоспалительного пептида, брадикинина, с последующим или связанным патологическим расширением сосудов и повышенной проницаемостью кровеносных сосудов, дерегуляцией артериального давления, повышенным иммунным ответом на чужеродные вещества, а также повышенными эндогенными аутоиммунными реакциями, включая те, которые предполагают реакции «антиген-антитело» и, следовательно, вносят свой вклад и в активацию плазминогена, и в другие вытекающие из этого состояния, воздействующие либо локально (клетки, органы), либо на всю систему организма.
Активация контактной системы может возникать по различным причинам или вследствие связанных с ними нарушений. В контексте оперативного вмешательства и прочих травм тканей, ограничения мобильности, постельного режима, инфекций, воспаления, рака, повреждения и некроза тканей, аутоиммунитета, временного или постоянного наличия имплантированных посторонних тел, а также ишемической болезни, среди прочего, контактная система может быть активирована и спровоцировать тромбические и воспалительные осложнения. Таким образом, связывающие молекулы по настоящему изобретению, предпочтительно представленные антителами и их антиген-связывающими фрагментами, полезны для профилактики тромбоза и воспаления в контексте оперативного вмешательства, например, в отношении пациентов, подвергшихся операциям на желудочно-кишечном тракте, легких, нервной системе, мочевых путях, ортопедическим и другим серьезным операциям, в отношении которых известно, что они могут быть связаны с тромбообразованием и/или воспалением. Следовательно, связывающие молекулы по настоящему изобретению, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, также подлежат применению для профилактики тромбоза у пациентов с активированной контактной системой.
Таким образом, связывающие молекулы по настоящему изобретению, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, также подлежат применению при лечении и/или профилактике венозных и кардиогенных тромбоэмболий, например, ишемической болезни мозга, инсульта и системных тромбоэмболий и ишемических болезней у пациентов с острой, прерывистой или постоянной сердечной аритмией, например, предсердной фибрилляцией, у пациентов, проходящих электроимпульсную терапию, а также у пациентов с нарушениями работы сердечных клапанов или искусственными клапанами сердца. Дополнительно связывающие молекулы по настоящему изобретению, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, подлежат применению при лечении и/или профилактике генерализованного тромбогеморрагического синдрома (ДВС-синдрома), который может возникнуть, среди прочего, из-за сепсиса, но также и вследствие оперативного вмешательства, нарушений по причине новообразований, ожогов или иных травм и привести к тяжелому поражению органов из-за микротромбозов.
Кроме того, тромбоэмболические и воспалительные осложнения возникают при гемолитической микроангиопатической анемии и при контакте крови с чужеродными поверхностями при экстракорпоральном кровообращении (например, при экстрапульмонарном кроовобращении), при использовании других систем жизнеобеспечения, таких как установки для гемодиализа, экстракорпоральной мембранной оксигенации (ЭКМО), устройство поддержки левого желудочка (УПЛЖ) и аналогичные способы, артериовенозные фистулы, протезы сосудов и сердечных клапанов.
Более того, связывающие молекулы по настоящему изобретению, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, подлежат применению при лечении и/или профилактике нарушений, включающих образование микросгустков или фибриновые отложения в церебральных кровяных сосудах, которые могут приводить к нарушениям, связанным с деменцией, таким как сосудистая деменция или болезнь Альцгеймера. При этом сгусток может провоцировать нарушение как через окклюзии, так и посредством привнесения дополнительных факторов, связанных с заболеванием.
Более того, связывающие молекулы по настоящему изобретению, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, могут быть использованы для профилактики и/или лечения тромбических и/или тромбоэмболических осложнений, например, венозной тромбоэмболии у пациентов, больных раком, включая тех, которые подверглись серьезному оперативному вмешательству или химио- или лучевой терапии. В контексте настоящего изобретения термин «легочная гипертензия» включает в себя легочную артериальную гипертензию, легочную гипертензию, связанную с нарушениями левого отдела сердца, легочную гипертензию, связанную с нарушениями в легких и/или гипоксией, и легочную гипертензию по причине хронической тромбоэмболии (ХТЛГ).
В дополнение к этому, связывающие молекулы по настоящему изобретению, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, также подлежат применению при лечении и/или профилактике системного воспаления и генерализованного тромбогеморрагического синдрома (ДВС-синдрома) на фоне инфекционного заболевания и/или синдрома системной воспалительной реакции (ССВР), органной и полиорганной недостаточности вследствие сепсиса, острого респираторного дистресс-синдрома (ОРДС), острого повреждения легких (ОПЛ), септического шока и/или органной недостаточности вследствие сепсиса. В ходе развития инфекции может возникнуть обобщенная активация контактной и коагулирующей систем,
что спровоцирует симптоматический ДВС-синдром (с истощающей коагулопатией или без нее) с (микро)тромбозом в различных органах, а также вторичными геморрагическими осложнениями. Более того, могут возникнуть повреждения эндотелия с повышенной проницаемостью сосудов и растеканием жидкости и белков в экстравазальном пространстве. По мере развития инфекции может произойти отказ какого-либо одного органа (например, почечная, печеночная недостаточность, отказ дыхательной системы, нарушения центральной нервной системы и недостаточность в сердечно-сосудистой системе и т.д.) или может наступить полиорганная недостаточность. В случае ДВС-синдрома происходит обширная активация коагулирующей системы на поверхности поврежденных эндотелиальных клеток, поверхностях чужеродных тел или перекрестной внесосудистой ткани. Вследствие этого возникает коагуляция в малых сосудах различных органов с развитием гипоксии и последующей функциональной недостаточности органов. Вторичным эффектом является истощение факторов свертывания крови (истощающая коагулопатия), например, белков С, S, Z, FII, FV, FVII, FVIII, FIX, FX, FXI, FXII, FXIII, а также фибриногена (FI) и тромбоцитов, что приводит к снижению контроля над гомеостатическим равновесием крови и может спровоцировать сильное и даже смертельное кровотечение.
Связывающие молекулы по настоящему изобретению, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, также подлежат применению при первичной профилактике тромбических или тромбоэмболических нарушений и/или воспалительных нарушений, и/или нарушений, связанных с повышенной проницаемостью сосудов, у пациентов, мутации генов которых приводят к повышенной активности ферментов или повышению уровня зимогенов, факт которых устанавливают посредством соответствующих тестов/измерений активности ферментов или концентрации зимогенов.
В дополнение к этому, связывающие молекулы по настоящему изобретению, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, также могут быть использованы для предотвращения свертывания крови в лаборатории, например, для защиты органов для трансплантации от повреждений, вызванных образованием сгустков, а также для защиты реципиента органа от тромбоэмболии, вызванной этим органом, для сохранения препаратов крови и плазмы, для чистки/предварительной обработки катетеров и прочих вспомогательных медицинских приспособлений и инструментов, для покрытия синтетических поверхностей вспомогательных медицинских приспособлений и инструментов, используемых внутри или в лаборатории, или для обеспечения биологических проб, которые могут включать FXI/FXIa.
Согласно настоящему изобретению дополнительно раскрывается применение связывающих молекул, предпочтительно представленных антителами и их антигенсвязывающими фрагментами, для лечения и/или профилактики нарушений, приведенных выше.
Согласно настоящему изобретению дополнительно раскрывается применение связывающих молекул, предпочтительно представленных антителами и их антигенсвязывающими фрагментами, для получения медицинского препарата с целью лечения и/или профилактики нарушений, в особенности тех, которые приведены в настоящем документе, предпочтительно для получения медицинского препарата для лечения и/или профилактики тромбических или тромбоэмболических нарушений.
Согласно настоящему изобретению дополнительно раскрывается способ лечения и/или профилактики нарушений, в особенности тех, которые приведены в настоящем документе, с помощью терапевтически эффективного количества связывающих молекул по настоящему изобретению, предпочтительно представленных антителами и их антигенсвязывающими фрагментами.
Согласно настоящему изобретению дополнительно раскрываются связывающие молекулы, предпочтительно представленные антителами и их антигенсвязывающими фрагментами, для применения согласно способу лечения и/или профилактики нарушений, в особенности тех, которые приведены в настоящем документе, с помощью терапевтически эффективного количества связывающих молекул по настоящему изобретению, предпочтительно представленных антителами и их антигенсвязывающими фрагментами.
Согласно настоящему изобретению дополнительно раскрываются способы лечения тромбических или тромбоэмболических нарушений у людей и/или животных за счет введения терапевтически эффективного количества как минимум одной связывающей молекулы по настоящему изобретению, предпочтительно представленной антителом и его антигенсвязывающим фрагментом, или фармацевтической композиции по настоящему изобретению. Согласно настоящему изобретению дополнительно раскрывается способ ингибирования свертывания крови, агрегации тромбоцитов и/или тромбоза у больных за счет введения терапевтически эффективного количества как минимум одной связывающей молекулы по настоящему изобретению, предпочтительно представленной антителом и его антигенсвязывающим фрагментом, или фармацевтической композиции по настоящему изобретению.
Генная терапия
Далее в настоящем документе представлен вектор переноса для применения в целях генной терапии для млекопитающих, включающий полинуклеотид, приведенный в настоящем документе, и способы лечения или профилактики заболеваний, включающие встраивание чужеродной нуклеиновой кислоты согласно описанию, приведенному в настоящем документе, с тем чтобы обеспечивались экспрессия этой чужеродной нуклеиновой кислоты, а также профилактика или лечение заболевания. Согласно одному варианту осуществления молекулы нуклеиновой кислоты, кодирующие как тяжелую, так и легкую цепи, вводятся пациенту. В предпочтительном варианте осуществления молекулы нуклеиновой кислоты вводят так, чтобы они стабильно интегрировались в хромосомы В-лимфоцитов, поскольку эти клетки специализируются на выработке антител. Согласно одному варианту осуществления В-лимфоциты трансфектируются или инфицируются в лаборатории, а затем повторно трансплантируются нуждающемуся в них пациенту. Согласно другому варианту осуществления В-лимфоциты инфицируются внутри организма с помощью рекомбинантного вируса, о котором известно, что он инфицирует рассматриваемый тип клеток.
Согласно предпочтительному варианту осуществления способ генной терапии включает введение изолированной молекулы нуклеиновой кислоты, кодирующей тяжелую цепь, или ее антигенсвязывающей части антитела анти-FXI, как представлено в настоящем документе, и обеспечение экспрессии этой молекулы нуклеиновой кислоты. Согласно другому предпочтительному варианту осуществления способ генной терапии включает введение изолированной молекулы нуклеиновой кислоты, кодирующей легкую цепь, или ее антигенсвязывающей части антитела анти-FXI, как представлено в настоящем документе, и обеспечение экспрессии этой молекулы нуклеиновой кислоты. В другом варианте осуществления способ генной терапии включает введение изолированной молекулы нуклеиновой кислоты, кодирующей тяжелую цепь, или ее антигенсвязывающей части, а также изолированной молекулы нуклеиновой кислоты, кодирующей легкую цепь, или ее антигенсвязывающей части антитела анти-FXI, как представлено в настоящем документе, и обеспечение экспрессии этой молекулы нуклеиновой кислоты.
Конкретные условия поглощения чужеродной нуклеиновой кислоты хорошо известны в этой области техники. Они включают в себя, помимо прочего, инфицирование ретровирусом, аденовирусом, трансформацию плазмидами, трансформацию липосомами, содержащими чужеродную нуклеиновую кислоту, биолистическую доставку нуклеиновой кислоты (т.е., загрузку нуклеиновой кислоты на частицы золота или другого металла и запуск или инъекцию в клетки), инфицирование аденоассоциированным вирусом и вирусом Эпштейна-Барра. В совокупности в целях настоящего изобретения это может быть названо «векторами экспрессии». Векторы экспрессии могут быть представлены или внехромосомными векторами, или векторами, интегрирующимися в геном хозяина. В целом, эти векторы экспрессии включают в себя транскрипционную и трансляционную регуляторную нуклеиновую кислоту, функционально связанную с чужеродной нуклеиновой кислотой. В целом, транскрипционные и трансляционные регуляторные последовательности могут включать в себя, помимо прочего, промоторные последовательности, сайты связывания рибосом, последовательности старта и остановки транскрипции, последовательности старта и остановки трансляции, а также энхансерные и активаторные последовательности. В предпочтительном варианте осуществления регуляторные последовательности включают в себя промоторную последовательность, а также последовательности старта и остановки транскрипции. Помимо этого, вектор экспрессии может включать дополнительные элементы. Например, в отношении интегрирующихся векторов экспрессии последние содержат как минимум одну последовательность, гомологичную геному клетки-хозяина, а предпочтительно - две гомологичные последовательности, фланкирующие экспрессирующую конструкцию. Интегрирующийся вектор может быть направлен на конкретный локус в клетке-хозяине за счет подбора надлежащей гомологичной последовательности для включения в этот вектор. Конструкции для интеграции векторов хорошо известны в этой области техники.
Опыты
Начиная с мышиного анти-FXI антитела 14E11, были получены новые гуманизированные антитела. Потенциальные антитела были испытаны на предмет их активности при связывании FXI, которая определялась конкурентным способом при анализе ELISA, а также по их способности ингибировать преобразование FXI в его активную форму.
Были установлены характеристики примера антитела, представленного АВ023. Были проведены исследования с использованием АВ023 для подтверждения факта того, что обеспечивалось сохранение связывающих и антикоагулирующих свойств и их сопоставимость после гуманизации 14Е11 посредством CDR-прививки. Исследования связывания внутри организма показали, что АВ023 обеспечивает связывание с высокой аффинностью как в отношении мышиных, так и человеческих FXI (0,16 и 3,2 нм соответственно), однако с меньшей аффинностью, чем мышиное моноклональное антитело 14Е11. При проведении анализов aPTT в организме было подтверждено, что антикоагулирующий эффект после гуманизации сохранялся, поскольку АВ023 продлевало aPTT в плазме человека, павиана, яванского макака и крысы в зависимости от концентрации.
Примечательно, при проведении нескольких анализов внутри организма были выявлены некоторые отличия между 14Е11 и АВ023. Во-первых, AB023 смог ингибировать самоактивацию FXI при наличии как сульфата декстрана, так и ДНК, в зависимости от концентрации, в то время как 14Е11 не смог сделать этого при всех испытанных концентрациях. Во-вторых, АВ023 ингибировал активацию FXII за счет FXIa в зависимости от концентрации, в отличие от 14Е11. И наконец, АВ023 был эффективнее при ингибировании активации человеческого FXIIa, относящегося к человеческому FXI, в присутствии HK и сульфата декстрана.
После гуманизации (АВ023) сохранялись антитромботические эффекты, наблюдавшиеся у 14Е11 (Ченг К., Такер Э.И., Пайн М.С., Сислер И., Матафонов А., Сан М.Ф., Уайт-Адамс Т.К., Смит С.А., Хенсон С.Р., Маккарти О.Дж., Ренне Т., Грубер А., Гаилани Д. Журнал Blood. 11 ноября 2010 г.; 116(19):3981-3989; Такер Э.И., Вербаут Н.Г., Люн П.И., Херст С., Маккарти О.Дж., Гаилани Д., Грубер А. Blood. 17 мая 2012 г.; 119(20):4762-8), что было продемонстрировано как на мышиной модели артериального тромбоза, так и на павианьей модели артериального и венозного тромбозов. В мышиной модели артериального тромбоза AB023 предотвратил окклюзию сонной артерии при воздействии FeCl3, сравнимую с общим дефицитом FXI, однако этот эффект не был силен так же, как эффект, полученный при использовании той же дозы мышиного моноклонального антитела (14E11). Относительно устоявшейся павианьей модели тромбоза с помощью тромбообразующей прививки и расширительной камеры для имитации артериального или венозного кровотока соответственно введение низкой дозы АВ023 (0,2 мг/кг внутривенно) немного понизило скорость накопления тромбоцитов в пределах сосудистых трансплантатов по сравнению с контрольными группами, в то время как в расширительной камере было достигнуто практически полное ингибирование накопления тромбоцитов. Отложение фибрина как при артериальном, так и при венозном тромбозе также было ниже. Примечательно, что при использовании тромбообразующей прививки без расширительной камеры введение 1,0 мг/кг АВ023 внутривенно привело как к снижению количества отложений тромбоцитов, так и фибрина в самом сегменте сосудистого трансплантата, а также к предотвращению образования «хвоста» тромба вниз по потоку, что доказало, что АВ023, как и его мышиный прекурсор, 14Е11, предотвратил венозный тромбоз при всех испытуемых дозах. В дополнение к этому, согласно исследованию предполагается, что, очевидно, АВ023 в более высоких дозах также привел к ослаблению артериального тромбоза, что подтверждается сокращением количества тромбоцитов и фибрина в тромбообразующем покрытом коллагеном трансплантате.
Противовоспалительные эффекты AB023 испытывались на павианьей модели сепсиса и, как и при предыдущем испытании на мышиной инфекционной модели с 14Е11 (Силаси Р. и соавт., статья Inhibition of contact-mediated activation of factor XI protects baboons against S aureus-induced organ damage and death («Ингибирование активации фактора XI, медиированной контактом, защищает павианов от повреждений органов и гибели под действием золотистого стафилококка»). Журнал Blood Advances, 2019 г.; 3:658-669, данные не представлены; Такер Э.И. и соавт., статья Inhibition of factor XI activation attenuates inflammation and coagulopathy while improving the survival of mouse polymicrobial sepsis («Ингибирование активации фактора XI аттенюирует воспаление и коагулопатию с одновременным улучшением выживаемости при мышином полимикробном сепсисе»). Журнал Blood. 17 мая 2012 г.; 1(20):4762-8). Все испытания, проведенные для сравнения активности АВ023 и 14Е11, показали одинаковость эффектов. Антикоагулирующий эффект АВ023 также оценивался у здоровых субъектов-людей (Лоренц К.У. и соавт., статья Contact Activation Inhibitor and Factor XI Antibody, AB023, Produces Safe, Dose-Dependent Anticoagulation in a Phase 1 First-In-Human Trial (Ингибитор активации контакта и антитело фактора XI, АВ023, обеспечивают безопасную антикоагуляцию в зависимости от дозы на этапе 1 первого применения на людях».) Журнал Arterioscler Thromb Vase Biol. Апрель 2019 г. 39(4):799-809), и данные (не представлены) показали, что АВ023 оказался безопасным, а также обеспечивал антикоагулирующий эффект в зависимости от дозы.
Возможную перекрестную реактивность АВ023 оценивали с помощью замороженных срезов человеческих тканей, и она обнаружена не была.
В совокупности результаты проведенных исследований АВ023 демонстрируют антикоагулирующие и противотромбообразующие свойства АВ023. Дополнительные исследования показали низкий риск нарушения гемостаза, низкую вероятность перекрестной реактивности и побочных действий, низкую вероятность иммунной активации и иммуногенности, а также низкую вероятность нейро- и кардиотоксических эффектов (данные не представлены).
Определение характеристик мышиного антитела 14Е11
Как приводится в патентах на 14Е11 и других публикациях, цитируемых в настоящем документе, при проведенных исследованиях были определены связывающие и антикоагулирующие свойства моноклонального мышиного анти-FXI антитела 14Е11. Вкратце, связывающие и антикоагулирующие свойства исследовались в лаборатории. Результаты анализа aPTT показали, что 14Е11 продлевает aPTT мышиной (О) или человеческой (∙) плазмы (ФИГ. 1), причем максимальное ингибирование достигается при 25-50 нМ, что укладывается в диапазон концентраций FXI в человеческой плазме (2 045 нМ). Продление времени свертывания составляло приблизительно половину относительно человеческой и мышиной FXI-дефицитной плазмы. 14Е11 не оказал отрицательного воздействия на время свертывания человеческой плазмы (данные не представлены).
Было установлено, что 14Е11 связывает и распознает одну окрашенную полосу прогнозированного размера гомодимера FXI (-160 кДа) в нормальной мышиной и человеческой плазме, а также рекомбинантной мышиной FXI-плазме (ФИГ. 2-А-С), однако связывание в FXI-дефицитной плазме не наблюдалось. При проведении твердофазного анализа связывания была установлена аффинность связывания 14Е11 относительно мышиных и человеческих FXI, а также FXIa (наблюдаемое значение Kd ~ 2-3 пМ, ФИГ. 2D). В отношении большинства млекопитающих FXI представлен гомодимером двух субъединиц по 80 кДа, в каждой из которых расположены по четыре яблочных домена (А1-А4) и протеазный домен. Прекалликреин (PK), мономерный гомолог FXI, имеет строение, практически идентичное мономеру FXI. Для демонстрации необходимости домена А2 для привязки 14Е11 к FXI были использованы человеческие гибридные белки FXI/PK (ФИГ. 2E). Вестерн-блоты, в которых использовались отдельные яблочные домены FXI, связанные с tPA, показывают, что участок связывания 14E11, вероятнее всего, полностью располагается в домене А2 (ФИГ. 2F).
Как представлено на изображении, мышиное моноклональное антитело 14E11 связывается с яблочным доменом 2 (А2) FXI человека и мыши и ингибирует активацию FXI за счет FXIIa и образование тромбина вниз по потоку, а также самоактивацию FXI. 14Е11 связывается с FXI у многих разных видов и может продлевать aPTT в отношении плазмы мыши, человека, павиана, кролика, крысы, свиньи и макака-резуса (данные не представлены).
Гуманизация мышиного антитела 14Е11
Гуманизация мышиного моноклонального антитела 14Е11 была проведена в Abzena (ранее известной как Antitope Limited, Кембридж, Великобритания) с применением технологии прививки гипервариабельного участка (CDR) (О’Брайен С. и Джонс Т., 2001 г. Humanising Antibodies by CDR Grafting («Гуманизация антител путем прививки CDR»). Упоминания: Контерманн Р., Дибель С. (под ред.). Antibody Engineering («Разработка антител»). С. 567-590. Springer Lab Manuals. Springer, Берлин, Гейдельберг). Подробнее, для подбора разновидностей акцепторных семейств зародышевых линий остатки CDR мышиного антитела были определены и прокомментированы в соответствии с номенклатурой Кэбота (подробные сведения см. по адресу http://www.bioinf.org.Uk/abs/#kabatnum). Канонические структуры CDR тяжелой и легкой цепей были определены с помощью человеческих генов зародышевой линии согласно подходу к гуманизации антител, основанному на гомологии CDR, и были подобраны акцепторные каркасы зародышевой линии человека с аналогичными каноническими структурами (О’Брайен и Джонс, 2001 г.; Хван, 2005 г.). Были подобраны акцепторные каркасы зародышевой линии человека с аналогичными каноничными структурами.
Гены вариабельной области (V) 14-Е11 были секвенированы из РНК, изолированной от линии гибридомы 14Е11, и эти последовательности были использованы для получения химерного антитела и разработки ряда вариантов гуманизированного антитела зародышевой линии. Аминокислоты в каркасах вариабельной области 14Е11, которые могут поддерживать связывающие свойства антитела, были определены in silico посредством генерирования структурных моделей химерного антитела, состоящих из вариабельных доменов 14Е11 и человеческого иммуноглобулина подкласса IgG4, а также легких цепей каппа, с помощью Swiss PDB, и они были отмечены для включения в одно или несколько вариантных антител с привитыми CDR. Гены гуманизированной области V были спроектированы на основании человеческих последовательностей зародышевого типа с гомологией, наиболее приближенной к мышиным последовательностям, а также были сконструированы посредством синтеза генов. Затем гуманизированные вариантные антитела в вариабельной области тяжелой цепи (VH) были клонированы в первый вектор, содержащий гены (CH) 1-3 общих областей тяжелой цепи человеческого иммуноглобулина подкласса IgG4 с модифицированной шарнирной областью S241P, с помощью рестрикционных ферментов Hind PI и MluI. Гуманизированные вариантные антитела (Vk) вариабельной области легкой цепи были клонированы во второй вектор, содержащий человеческий ген (Ck) общей области каппа, с помощью рестрикционных ферментов BssH I and BamHI. Также посредством клонирования мышиных вариабельных областей в аналогичные векторы было получено химерное антитело. Была обеспечена стабильная экспрессия гуманизированных и химерных антител в клетках NSO, и было проверено их связывание с антигеном-мишенью (рекомбинантным человеческим FXI) при анализе ELISA конкурентным способом при сопоставлении с 14Е11 (данные не представлены). В дополнение к этому, антикоагулирующие свойства гуманизированных антител были проверены с помощью анализа aPTT (ФИГ. 3). Результаты этих анализов показали, что предпочтительным потенциальным антителом АВ023 является вариант VH3/Vk3 (клон 3G3), а также в Abzena была получена стабильная производственная линия клеток с применением технологии CHO™.
Клетки из стабильной линии клеток могут быть использованы для внесения в производственный биореактор. Например, клетки могут быть культивированы за счет применения периодического процесса с подпиткой и собраны, например, через 14 дней. Затем клетки могут быть очищены за один или несколько этапов применения колонки для хроматографии, удаления вируса, а также пройти концентрацию и диафильтрацию. После получения конечного состава в буфере антитело, т.е., АВ023 может быть подвергнуто фильтрации и хранению в заморозке как лиофилизированный продукт (например, 15 мг/мл после реконструкции), однако это необязательно.
Определение характеристик АВ023
Характеристики АВ023 были определены с помощью ряда аналитических методов. Эти методы были использованы для понимания первичной, частичной конформационной структур, связывания и посттрансляционных изменений белка. К примененным способам анализа относятся пептидное картирование, масс-спектрометрия (MS), капиллярный электрофорез на чипе, капиллярное изоэлектрическое фокусирование (cIEF), эксклюзионная хроматография по размеру (SEC), картирование олигосахаридов, флуоресцирование, циркулярный дихроизм (CD) и дифференциальная сканирующая калориметрия (DSC), каждый из которых хорошо известен в этой области техники.
Молекулярная масса АВ023, равная 146,560 Да, была определена посредством MS для установления структуры и посттрансляционных изменений, а также для определения целостности молекулы. Молекулярная масса тяжелых и легких цепей (49,890 и 23,401 Да соответственно) была определена после восстановления дисульфидных связей в молекуле. Различия по сравнению с теоретической молекулярной массой (144,020 Да) возникли вследствие посттрансляционных изменений, в особенности вследствие гликолизирования.
Аффинность связывания
Аффинность связывания гуманизированного моноклонального антитела АВ023 относительно человеческого и мышиного фактора свертывания крови XI (FXI) была установлена с помощью твердофазного анализа связывания. В дополнение к этому, была проведена оценка аффинности связывания АВ023 относительно активированного человеческого FXI (FXIa) как для АВ023, так и для 14Е11. Вкратце, для данного твердофазного анализа связывания и 14Е11, и АВ023 были биотинилированы с помощью набора для биотинилирования Sulfo-NHS EZ-Link™ (ThermoFisher Scientific, Уолтэм, Массачусетс) согласно инструкциям. На микротитрационные планшеты наносили FXI или FXIa (2 мг/мл, 100 мл/лунка) в 50 ммоль/л Na2CO3, pH 9.6 и инкубировали в течение ночи при температуре 4°C на микротитрационных планшетах Immulon 2HB (Thermo Scientific). Лунки были заблокированы с помощью 150 пл натрий-фосфатного буферного раствора (PBS) с бычьим сывороточным альбумином (BSA) 2 % в течение 1 часа при комнатной температуре Далее добавляли сто миллилитров биотинилированного 14Е11 или АВ023 (0,7-6,7 пмоль/л) в HEPES 90 ммоль/л (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) с рН 7.2, NaCl 100 ммоль/л, BSA 0,1 % с твин 20 (HBS [раствор, забуференный HEPES]) и выполняли инкубацию в течение 90 минут при комнатной температуре. После промывки PBS 0,1 % с твином 20 (PBS-T) добавляли 100 пл стрептавидин-пероксидазы хрена ThermoFisher Scientific, разбавление 1:8000 в HBS) и выполняли инкубацию при комнатной температуре в течение 90 минут. После промывки PBS-T добавляли 100 пл субстратного раствора (12 мл лимонной кислоты 30 ммоль/л; Na2HPO4100 ммоль/л, pH 5.0; и 1 таблетку о-фенилендиамин дигидрохлорида, 12 пл H2O2 30 %). Реакции прекращали по истечении 10 мин с помощью 50 пл H2SO4 2,5 М. Оптическая плотность при длине волны 495 нм измерялась с помощью микропланшетного ридера SpectroMax 340 (Molecular Devices, Сан-Хосе, Калифорния). Анализ данных производился способом линейной регрессии, и наблюдаемое значение Kd (константа диссоциации равновесия) вычислялось при концентрации АВ023, необходимой для достижения полумаксимального связывания при равновесии с помощью GraphPad Prism (вер. 5.0).
С помощью твердофазного анализа связывания была установлена аффинность связывания 14Е11 и АВ023 в отношении мышиных и человеческих FXI. Связывание 14E11 с мышиным FXI имело меньшую аффинность (как было установлено ранее) (наблюдаемое значение Kd ~ 0,07 нМ в сравнении с ~2-3 пМ). 14E11 также продемонстрировал меньшую аффинность связывания в отношении человеческих FXI и FXla, чем мышиных FXI (наблюдаемое значение Kd ~ 0,39 нМ и 0,20 нМ соответственно) (таблица 1). AB023 также продемонстрировал наномолярную аффинность связывания в отношении мышиного и человеческого FXI (наблюдаемое значение для mFXI ~ 0,16 нМ, наблюдаемое значение Kd для hFXI ~ 3,2 нМ и наблюдаемое значение Kd для hFXIa ~ 1,3 нМ), хотя аффинность связывания как для человеческого, так и для мышиного FXI была ниже, чем у 14E11 (ФИГ. 4C, таблица 1). В совокупности эти результаты подтверждают, что после гуманизации антитела 14Е11 сохранялась высокая аффинность связывания с одним и тем же доменом.
Таблица 1: наблюдаемые значения Kd в отношении 14E11 и AB023
Подтверждение связывания домена А2
Для подтверждения связывания AB023 с яблочным доменом 2 (А2) FXI были выполнены иммуноблоты с применением стандартных методик (Ченг и соавт., 2010 г.). На ФИГ. 4А представлены иммуноблоты человеческого рекомбинантного FXI (трек 1) и человеческого FXI, в котором домен A1, A2, A3 или A4 был замещен соответствующим доменом прекалликреина (PK), отделен с помощью электрофореза и иммуноблотирован с AB023, и на ней также подтверждается, что АВ023, как и 14Е11, связывает яблочный домен 2 (А2) FXI. Также были получены слитные белки, в которых каждый отдельный яблочный домен из FXI был слит с тканевым плазменным активатором (tPA). После этого слитные белки были разделены с помощью электрофореза и иммуноблотированы с АВ023. На ФИГ. 4В приведено связывание АВ023 с доменом А2 FXI.
Ингибирование активации FXIIa в составе FXI
Для определения факта сохранения способности AB023 ингибировать активацию FXIIa в составе FXI после гуманизации 14Е11 был проведен анализ в лаборатории. Вкратце, FXI (30 нмоль/л) подвергли инкубации с использованием 0,5 нмоль/л a-FXIIa и сульфата декстрана (0,1 мг/мл) при 37°С в 25 ммоль/л HEPES, pH 7.4, 150 ммоль/л NaCl и BSA 0,1 % при наличии или отсутствии АВ023 (0-300 нмоль/л). После инкубации в течение 30 мин образцы были извлечены и экранированы полибреном (6 мг/мл) для нейтрализации сульфата декстрана и CTI (50 мг/мл) с целью
инактивации FXIIa, после чего генерирование FXIa было подсчитано согласно измерениям скорости гидролиза S-2366 при длине волны 405 нм, и скорость гидролиза S-2366 была преобразована в концентрацию FXIa с помощью калибровочной кривой. На ФИГ. 4D показано, что AB023 ингибирует активацию FXlIa в составе FXI в зависимости от концентрации. Как и 14Е11, АВ023 не ингибирует опосредованную тромбином активацию FXI (ФИГ. 4E). Для определения этого факта был проведен анализ в организме, во время которого FXI (30 нМ) подвергли инкубации с 2,5 нм а-тромбина и сульфата декстрана (0,1 мг/мл) при 37°С в 25 мМ HEPES, рН 7.4, 150 мМ NaCl и BSA 0,1 % при наличии или отсутствии AB023 (30 нМ). По истечении 0, 5, 15, 30 или 60 минут инкубации образцы были изъяты и экранированы полибреном (6 мг/мл) для нейтрализации сульфата декстрана и гирудина (10 ед./мл) с целью инактивации тромбина, после чего генерирование FXIa было подсчитано согласно измерениям скорости гидролиза S-2366 при длине волны 405 нм. Скорость гидролиза S-2366 была преобразована в концентрацию FXIa с помощью калибровочной кривой.
Продление активированного частичного тромбопластинового времени (aPTT)
Была проверена способность AB023 продлевать aPTT в плазме некоторых млекопитающих. Смешанная плазма человека, павиана, крысы и яванского макака (90 пл, взятые у трех отдельных субъектов), антикоагулированная с помощью цитрата натрия 0,38 %, была смешана с 10 пл AB023 (0,183-1 500 мг/л) или контрольной группой (PBS) и оставлена для инкубации при комнатной температуре на 5 минут. Затем сорок микролитров смеси плазмы/антитела были инкубированы с 40 пл реагента aPTT (SynthASil, № 0020006800, Instrumentation Laboratory, Бедфорд, Массачусетс) в течение 3 минут при температуре 37°C. После инкубации были добавлены 40 мл CaCl2, а время свертывания было установлено с помощью анализатора KC4™ (TCoag, Бри, Ирландия). Каждый образец подвергся двум отдельным анализам. В отношении каждого из видов, задействованного в испытании, AB023 продлевал aPTT в зависимости от концентрации у всех из них (ФИГ. 4F). Данные aPTT выражались в виде кратного изменения исходного значения, изображенного в виде зависимости от логической концентрации AB023.
В совокупности эти данные подтверждают факт сохранения свойств 14Е11 после гуманизации.
Образование антикоагулирующего комплекса
В данных опытах исследовалось наличие комплекса, образующегося между моноклональным антителом или каким-либо связывающим фрагментом, вариантом или их производным и FXI, представленного антикоагулянтом, с помощью активированного частичного тромбопластинового времени (aPTT). В других примерах (ФИГ. 4) точно установлено, что FXI мгновенно образует стабильный иммунный комплекс с анти-FXI антителом домена А2 с высокой аффинностью - AB023. В данном случае были проведены два отдельных опыта с использованием FXI-дефицитной плазмы, взятой у FXI-дефицитных субъектов-людей (George King Bio-medical Inc., Оверленд-Парк, Канзас), результаты которых представлены на ФИГ. 5.
В первом опыте исходное значение aPTT измерялось в FXI-дефицитной плазме. Сорок микролитров плазмы были инкубированы с 40 пл реагента aPTT (SynthASil, № 0020006800, Instrumentation Laboratory, Бедфорд, Массачусетс) в течение 3 минут при температуре 37°C. После инкубации были добавлены 40 пл CaCl2, а время свертывания было установлено с помощью анализатора KC4™ (TCoag, Бри, Ирландия). Каждый образец подвергся восьмикратному анализу. Среднее исходное значение aPTT в отношении FXI-дефицитной плазмы составило 118,5 секунды. После начальных измерений FXI (Enzyme Research Laboratories, № HCFXI-1111) был добавлен в 400 пл FXI-дефицитной плазмы для получения конечной концентрации 10 мг/мл. Плазма с FXI/FXI-дефицитная плазма была подвергнута инкубированию при комнатной температуре в течение 5 минут, а значение aPTT было измерено на 200 пл смеси, как представлено выше. На ФИГ. 5 показано, что добавление очищенного FXI (молекул. масса 160 кДа) в FXI-дефицитную плазму прогнозируемо снижает время свертывания до 32,3 секунды, поскольку FXI - это зимоген фермента-прокоагулянта, FXIa. В завершение в оставшиеся 200 пл FXI-дефицитной плазмы + 10 мг/мл FXI был добавлен AB023 для получения конечной концентрации 100 мг/мл (10-кратный избыток антител). Эту смесь инкубировали при комнатной температуре в течение 5 мин, и значение aPTT было измерено, как представлено выше. Добавление антитела AB023 (молекул. масса 146 кДа) с 10-кратным избытком по молекулярной массе добавленного FXI относительно FXI-дефицитной плазмы привело к приблизительно 2-кратному продлению aPTT до среднего значения 66,6 секунды, что согласуется с опытами в лаборатории (ФИГ. 4) и про коагулянта в организме (таблица 2), при проведении которых концентрация AB023 была избыточна по сравнению с FXI. Добавление АВ023 в нормальную плазму, содержащую FXI, не привело к продлению aPTT в той же степени, которая наблюдалась в отношении FXI-дефицитной плазмы. Вероятнее всего, это вызвано тем, что прокоагулирующая активность FXIa, получаемого при анализе aPTT, не ингибируется AB023 (ФИГ. 4Е).
Во втором опыте АВ023 был добавлен в 400 пл FXI-дефицитной плазмы для получения конечной концентрации 100 мг/мл, было выполнено инкубирование при комнатной температуре в течение 5 мин, а значение aPTT было измерено на 200 пл смеси, как представлено выше. Добавление AB023 не привело к изменению времени свертывания (среднее aPTT = 117,7 секунды в сравнении со средним aPTT FXI-дефицитной плазмы, равным 118,5 секунды), что показывает, что сам по себе AB023 не является антикоагулянтом без образования комплекса с FXI. Наконец, FXI был добавлен в смесь FXI-дефицитной плазмы/АВ023 (100 мг/мл) с конечной концентрацией FXI, равной 10 мг/мл (10-кратный избыток антитела относительно FXI для обеспечения перехода FXI в иммунный комплекс). Смесь была инкубирована при комнатной температуре в течение 5 минут, а значение aPTT было измерено, как представлено выше. Добавление FXI сократило aPTT со 117,7 секунды до среднего значения 59,1 секунды (ФИГ. 5).
Данные опыты указывают на то, что 1) добавление FXI в FXI-дефицитную плазму обеспечивает прокоагулирующий эффект, 2) АВ023 сам по себе не обеспечивает антикоагулирующий эффект и 3) иммунный комплекс, образующийся между FXI и АВ023, является антикоагулянтом, но не обеспечивает эквивалентный антикоагулирующий эффект, как при FXI-дефиците.
Определение характеристик антикоагулирующего эффекта
Мышиная модель артериального тромбоза
С помощью устоявшейся мышиной модели артериального тромбоза, вызванного в целях опыта, противотромбообразующие свойства AB023 были определены, как это было сделано ранее для 14E11 (Ченг и соавт., 2010 г.). Вкратце, мыши подвергались действию наркоза посредством ИП инъекции 50 мг/кг пентобарбитала. Была обнажена правая общая сонная артерия и установлен доплеровский датчик потока. AB023 (1,0 мг/кг, внутривенно) вводили во внутреннюю яремную вену за 15 мин. до поражения и индуцировали образование тромба путем наложения двух листов фильтровальной бумаги размером 1 x 1,5 мм, насыщенных FeCl3 (раствор от 2,5% до 10%), на противоположные стороны артерии на 3 мин. После удаления накладок область промывали натрий-фосфатным буферным раствором и контролировали поток в течение 30 мин.
Внутривенное вливание 1,0 мг/кг AB023 диким мышам обеспечило защиту мышей от закупорки сонной артерии, индуцируемой 3,5 %, 5,0 % и 7,5 % FeCl3 (ФИГ. 6). Данные результаты сопоставимы с результатами от мышей FXI-/-. Результаты согласуются с предположением, что FXI активируется FXIIa в данной модели тромбоза, и демонстрируют, что антитромботический эффект сохранялся даже у мышей после гуманизации антитела 14E11.
PK/PD в павианьей модели
В этом опыте оценивали концентрацию AB023 в плазме с течением времени и коррелировали воздействие AB023 на aPTT. Шести самцам павианов вводили 1,0 мг/кг AB023 в 1-й день путем однократной внутривенной болюсной инъекции или однократной подкожной инъекции. Пробу крови отбирали в нескольких временных точках после введения и подвергали антикоагуляции с помощью цитрата натрия 0,32% (1/10 объема). Одну аликвоту использовали для определения концентрации AB023 в плазме, а другую аликвоту использовали для измерения aPTT. Для измерения aPTT плазма (40 пл) была инкубирована с 40 пл реагента aPTT в течение 3 минут при температуре 37°C. После 3-минутной инкубации при температуре 37°C были добавлены 40 пл CaCl2, а время свертывания было установлено с помощью анализатора KC4 Delta™ (Tcoag Ireland Ltd, Уиклоу, Ирландия). Концентрации AB023 в плазме были определены с помощью частично утвержденного ферментного иммуносорбентного анализа (ELISA) для определения свободного AB023 в плазме.
Результаты показали быстрое и немедленное продление aPTT и приблизительно в 2 раза превышающее исходное продление aPTT как минимум в течение 1 недели (168 ч) у всех животных. На ФИГ. 7 представлено отношение между концентрациями AB023 в плазме и aPTT. Аналогичным образом введение 1,0 мг/кг AB023 подкожно также привело к быстрому и немедленному продлению aPTT. Однако после подкожного введения aPTT оставалось продленным, приблизительно в 2 раза выше исходного уровня как минимум в течение 2 недель (336 ч) (не показано). Эти исследования показывают, что продление aPTT тесно связано с воздействием AB023.
Профилактическое лечение в павианьих моделях артериального и венозного тромбоза
Эти исследования определили антитромботический эффект ингибирования активации FXI с помощью FXIIa с использованием гуманизированного моноклонального антитела AB023 в устоявшейся модели артериального и венозного тромбоза примата, вызванного в целях опыта.
Нетерминальные исследования были выполнены на молодых самцах павианов (Papio anubis) весом 9-13 кг. Все исследования были утверждены Институциональным комитетом по содержанию и использованию животных. У каждого павиана был закрытый, установленный хирургическим путем, постоянный экстериоризованный артериовенозный (AV) шунт, соединяющий бедренную артерию и вену, как описано в другом месте (Хенсон С.Р., Гриффин Дж.Х., Харкер Л.А. и соавт. Antithrombotic effects of thrombin-induced activation of endogenous protein C in primates («Антитромботические эффекты тромбин-индуцированной активации эндогенного белка C у приматов») Журнал J Clin Invest, октябрь 1993 г.:92(4):2003-12). Опыты проводились на бодрствующих животных без антикоагуляции, которых удерживали в сидячем положении. Тревога купировалась низкой дозой кетамина, не превышающей 2 мг/кг внутримышечно, до одного раза в час. Экспериментальное лечение проводилось и образцы крови брали через удлинительную трубку из силиконового каучука, включенную в AV-шунт во время опытов. Количество эритроцитов и гематокритное число измеряли ежедневно у каждого животного, в том числе до и после опытов, и расчетная потеря крови не превышала 4% от общего объема крови в любой день опытов. Множественные опыты проводились на одних и тех же животных в разные дни с лечением и без лечения. В повторных опытах были задействованы только животные с шунтами, у которых был хороший неограниченный исходный поток (> 250 мл/мин).
В этой модели тромбоза, вызванного в целях опыта, острый местный тромбоз был инициирован коротким вставленным протезным модифицированным сегментом тромбообразующего трансплантата внутри AV-шунта, как описано ранее (Хенсон С.Р., Гриффин Дж.Х., Харкер Л.А. и соавт. Antithrombotic effects of thrombin-induced activation of endogenous protein C in primates («Антитромботические эффекты тромбин-индуцированной активации эндогенного белка C у приматов») Журнал J Clin Invest, октябрь 1993 г.:92(4):2003-12; Келли А.Б., Марцек У.М., Крупский В. и соавт. Hirudin interruption of heparin-resistant arterial thrombus formation in baboons («Предотвращение образования артериального тромба, устойчивого к гепарину, с помощью гирудина у павианов») Журнал Blood, 1 марта 1991 г.:77(5):1006-12). Поскольку при повреждении сосудов кровоток подвергается воздействию внеклеточного матрикса, который содержит структурные белки, например, коллаген, которые запускают активацию тромбоцитов и FXI1, мы сделали сегменты трансплантата тромбообразующими с иммобилизованным коллагеновым покрытием. Просветы клинических сосудистых трансплантатов длиной 20 мм (расширенный политетрафторэтилен, ePTFE, Gore-Tex; W. L. Gore and Associates, Флагстафф, Аризона) с внутренним диаметром (в.д.) 4 мм были покрыты конским коллагеном I типа (CHRONO-LOG Corporation, Хавертаун, Пенсильвания) в течение 15 мин. и сушили в течение ночи в стерильном воздушном потоке. Данный метод обеспечивает равномерное коллагеновое покрытие в просвете трансплантата, как определено с помощью растровой электронной микроскопии (данные не показаны). Сегменты покрытых коллагеном (тромбообразующих) трансплантатов были включены в трубку из силиконового каучука и помещены в AV-шунты у павианов в течение всех 60-минутных опытов по острому тромбозу.
Кровоток через шунт у павианов без антикоагуляции постоянно вызывает острый тромбоз в сегментах покрытых коллагеном трансплантатов ePTFE. Во время каждого опыта максимальная скорость кровотока через трансплантаты (около 250 мл/мин) ограничивалась дистальным зажимом до 100 мл/мин, обеспечивая среднюю начальную скорость сдвига стенки 265с-1 в 4-миллиметровых трансплантатах. Скорость потока непрерывно контролировали с помощью ультразвукового измерителя потока для трансплантата (Transonics Systems, Итака, Нью-Йорк). Эти трансплантаты диаметром 4 мм не закупоривались, а скорость пульсирующего потока оставалась на уровне 100 мл/мин во время образования тромба. Сегмент трансплантата (и тромб) удаляли из шунта через 60 или 90 мин., а постоянный шунт восстанавливался после каждого опыта. Поскольку было обнаружено, что образование тромба с течением времени распространяется вниз по потоку от коллагеновой поверхности, накопление тромбоцитов также измерялось в пределах области артериовенозного шунта длиной 10 см непосредственно дистальнее трансплантата. Данная модель роста тромба на проксимальной коллагеновой поверхности (на «головке» тромба) с тромбом, который распространяется дистальнее коллагенового сегмента (образуя «хвост» тромба).
Образование тромба оценивали во время опытов продолжительностью 60-90 минут с помощью гамма-камеры для количественной оценки, визуализирующей радиоизотопно-меченые тромбоциты в сегменте трансплантата, и далее оценивали путем определения отложений радиоизотопно-меченого фибрина в конечной точке после завершения каждого опыта, как описано (1). Для количественной оценки депонирования тромбоцитов, аутологичные тромбоциты павиана метили 1 мКи111In, затем повторно вводили животным и обеспечивали циркулирование как минимум в течение 1 часа и до 4 дней перед проведением исследований. Накопление радиоактивности, связанной с тромбоцитами, на трансплантатах определяли с интервалами 5 мин. с использованием сцинтилляционной гамма-камеры GE-400A-61, сопряженной с компьютерной системой NuQuest InteCam, как описано для других устройств в модели постоянного AV-шунта (Грубер и Хенсон, журнал Blood 2003 г.; 102: 953-955; Грубер и соавт., журнал Thromb Res. 2007 г.; 119: 121-127; Хенсон и соавт., журнал J Clin Invest 1993 г.; 92: 2003-2012; Такер и соавт., журнал Blood 2009 г.; 113: 936-944). Через 60-90 минут трансплантат удаляли, промывали, сушили и хранили охлажденным для последующей оценки содержания 125I-фибрина, как описано ранее (Грубер и Хенсон, журнал Blood 2003 г.; 102:953-955; Хенсон и соавт., журнал J Clin Invest 1993 г.; 92:2003-2012). Вкратце, гомологичный 125I-меченый фибриноген павиана (5-25 мг, 4 мКи, свертываемость > 90%) вводили внутривенно за 10 мин. до каждого исследования. Включение меченого фибриногена/фибрина в тромб оценивали с помощью гамма-счетчика (Wizard-3, PerkinElmer, Shelton, CT) как минимум через 30 дней после удаления трансплантата из AV-шунта для обеспечения распада111In, присоединенного к тромбоцитам. 125I-радиоактивность, депонированную в трансплантате, измеряли и сравнивали с радиоактивностью свертывающегося фибрина (фибриногена) в образцах плазмы, взятых во время первичного исследования.
В первом опыте (ФИГ. 8), сегмент покрытого коллагеном сосудистого трансплантата диаметром 4 мм с кремниевой камерой диаметром 9 мм для имитации венозного кровотока был расположен на 20 мм вниз по потоку и использовался для проверки антитромботического эффекта AB023 (0,2 мг/кг, внутривенно вводили за 1 час до опыта). Всего было проведено 4 нетерминальных исследования, в которых были задействованы 2 молодых самца павианов, а данные сравнивались с данными контрольных групп, использованными в идентичном опыте 14E11 (n = 7 опытов/группа с 4 животными для контрольной группы).
Результаты данного исследования приведены на ФИГ. 8A-D. На панелях слева от фигур представлено депонирование тромбоцитов, а на панелях справа представлено терминальное отложение фибрина. Результаты данного исследования показали, что скорость накопления тромбоцитов в сосудистых трансплантатах оказалась немного ниже у животных, которым был введен АВ023, чем у контрольных групп, для которых не был введен АВ023 (ФИГ. 8A), в то время как практически полное ингибирование накопления тромбоцитов было достигнуто в расширительной камере у павианов, которым был введен АВ023 (ФИГ. 8C). Эти данные аналогичны тем, которые наблюдались после введения 14E11, и демонстрируют, что антитромботический эффект AB023 сравним с мышиным прекурсором 14E11. Отложение фибрина как при артериальном, так и при венозном тромбозе также было ниже (ФИГ. 8B и D).
Во втором наборе опытов острый местный тромбоз был инициирован протезными сегментами покрытых коллагеном сосудистых трансплантатов, помещенными в постоянные AV-шунты на 60 минут, при проведении 8 нетерминальных опытов на 4 молодых самцах павианов. Павианам вводили либо АВ023 (внутривенная инъекция 1,0 мг/кг), либо физиологический раствор (контрольная группа, внутривенно). Оценка антитромботических эффектов АВ023 была проведена через 24 ч после внутривенного введения.
Накопление тромбоцитов в покрытых коллагеном сосудистых трансплантатах было ниже у животных, которым был введен АВ023 (ФИГ. 9A), а в области на 10 см ниже по потоку от трансплантата («хвосте») за счет АВ023 было достигнуто практически полное ингибирование накопления тромбоцитов (ФИГ. 9B). В целом, после предварительного введения АВ023 (1,0 мг/кг внутривенно) общее накопление тромбоцитов (накопление тромбоцитов в тромбообразующем трансплантате с хвостом) было снижено (ФИГ. 9C). Данные исследования показали, что АВ023, как и его мышиный прекурсор, обеспечивает антитромботический эффект на моделях тромбоза приматов. Кроме того, при повышенной дозе 1,0 мг/кг АВ023 был эффективен при аттенюации скорости образования артериальных тромбов в тромбообразующем трансплантате, равно как и в «хвосте». Отложение фибрина как в трансплантате, так и в «хвосте» после введения АВ023 снизилось.
В ходе исследования проводился мониторинг aPTT, которое было продлено после введения АВ023 путем инфузии и сохраняло повышенное значение спустя 24 часа после введения в группе лечения АВ023 (30 и 60 мин опыта, таблица 2), в то время как в контрольной группе какие-либо изменения aPTT не наблюдались. В ходе всего исследования также проводились измерения PT. В сравнении с контрольными группами АВ023 не привел к изменению PT (таблица 2).
Таблица 2: aPTT и PT из павианьей модели тромбоза сосудов
Данные выражены в виде среднего значения ± стандартное отклонение
Настоящие данные указывают на то, что гуманизированное антитело АВ023 сохранило свои антикоагулирующие свойства и привело к сокращению явления тромбоза, вызванного в целях опыта, как на мышиных моделях тромбоза, так и на моделях нечеловеческих приматов.
Сопоставление 14Е11 и АВ023
После гуманизации антикоагулирующий эффект АВ023 был сопоставлен с 14Е11 с помощью анализа aPTT, как представлено выше, который показал, что в сравнении с 14Е11 антитело АВ023 привело к продлению aPTT в человеческой и павианьей плазме в аналогичной степени (ФИГ. 3).
Также было исследовано воздействие 14Е11 или АВ023 на активацию пути контакта, самоактивацию FXI и взаимную активацию FXII посредством FXIa. Вкратце, для сравнения воздействия 14Е11 и АВ023 на активацию пути контакта была выполнена инкубация FXI (80 нМ) в HEPES (20 мМ HEPES, pH 7.4), 100 мМ NaCl, PEG-8000 0,1 % при температуре 37°С в течение 15 мин с 1 280 нМ 14Е11 или 800 нМ АВ023 или без них. В нулевой момент времени были добавлены FXIIa, HK и сульфат декстрана (все из них в HEPES) для получения конечных значений концентрации FXI (30 нМ), FXIIa (5 нМ), HK (30 нМ), сульфата декстрана (0,1 мг/мл), а также 14E11 в концентрации 480 нМ или АВ023 в концентрации 300 нМ. В различные моменты времени в 5 пл аликвот добавляли кукурузный ингибитор трипсина (CTI) (конечная концентрация 500 нМ) и полибрен 20 мг/мл (конечная), а оптическую плотность ΔOD405 нм отслеживали на микропланшетном ридере при наличии S-2366 250 мМ.
Для сравнения эффектов 14Е11 и АВ023 на самоактивацию FXIa очищенный человеческий FXI смешивали с DXS (0,1 пМ) при наличии 25 и 100 нМ 14Е11 или АВ023; или очищенный человеческий FXI смешивали с очищенной ДНК, полученной из лейкоцитов, при наличии различных концентраций 14Е11 (0-100 нМ) или АВ023 (0-100 нМ) в 20 мМ HEPES, рН 7.4, 100 мМ NaCl, PEG-8000 0,1 %, ZnCl2 (10 пМ) при 37°C в течение 60 мин. Активацию FXI останавливали посредством смешивания аликвот с полибреном (0,2 мг/мл), а амидолитическую активность FXIa измеряли с помощью хромогенного субстрата S-2366 (1 мМ), а также значение V макс. измеряли как ΔOD 405 нм/мин.
В завершение для сравнения эффектов 14Е11 и АВ023 на взаимную активацию FXII посредством FXIa очищенные человеческие FXII (200 нМ) и FXIa (10 нМ) инкубировали с 14Е11 или АВ023 (0-200 нМ) в 20 мМ HEPES, рН 7.4, 100 мМ NaCl, PEG-8000 0,1 %, ZnCl2 (10 пМ) при 37°C в течение 60 мин. Активацию FXII останавливали апротинином (10 мМ), а амидолитическую активность FXIIa измеряли с помощью хромогенного субстрата S-2302 (1 мМ), а также значение V макс. измеряли как ΔOD 405 нм/мин.
Несмотря на более низкую наблюдаемую аффинность в отношении FXI, АВ023 оказался эффективнее при ингибировании активации FXIIa в составе FXI (ФИГ. 10C). Дополнительно аттенюация самоактивации FXI при наличии отрицательно заряженной поверхности (сульфат декстрана или ДНК) посредством АВ023 была выше по сравнению с 14Е11 (ФИГ. 10A-B).
Гуманизация 14Е11 в AB023 привела к получению инновационной связывающей молекулы, получившей, например, непрогнозированную функцию, т.е., двунаправленную ингибирующую активность при взаимодействии FXIl и FXI (ФИГ. 10C, D). На ФИГ. 10С представлена активация FXI посредством FXIIa. На ФИГ. 10D представлены соответствующие ингибирующие эффекты анти-FXl lgG на активацию FXII посредством FXIa, когда человеческий FXII (200 нМ) был активирован посредством 10 нМ человеческого FXIa при наличии 14Е11 или АВ023. АВ023 не только эффективнее, чем его мышиный прекурсор, при ингибировании активации FXIIa в составе FXI (ФИГ. 10С), но также ингибирует процесс взаимной активации между FXII и FXI, в то время как 14Е11 не обеспечивает такой эффект. Непрогнозированное получение способности к ингибированию может быть связано со сходством последовательностей между молекулами. Выравнивание с помощью средства поиска основного локального выравнивания показало, что сходство последовательностей между 14Е11 и АВ023 составляет около 60-70 % (данные не представлены).
ПОСЛЕДОВАТЕЛЬНОСТИ, ВНЕСЕННЫЕ В ПЕРЕЧЕНЬ
Нуклеотидные последовательности и последовательности аминокислот, включенные в прилагаемый перечень последовательностей, представлены с помощью стандартных буквенных аббревиатур для нуклеиновых оснований, а также трехбуквенного кода для аминокислот согласно определению в пункте 37 раздела 1.822 СФП. Представлена только одна нить каждой последовательности нуклеиновой кислоты, однако комплементарная нить рассматривается как часть представленной нити, включенная посредством любой ссылки.
RWFTCVLKDSVTETLPRVNRTAAISGYSFKQCSHQISACNKDIYVDLDMKGINYNSSVAKSAQECQERCTD
DVHCHFFTYATRQFPSLEHRNICLLKHTQTGTPTRITKLDKVVSGFSLKSCALSNLACIRDIFENTVFADS
NIDSVMAPDAFVCGRICTHHPGCLFFTFFSQEWPKESQRNLCLLKTSESGLPSTRIKKSKALSGFSLQSCR
HSIPVFCHSSFYHDTDFLGEELDIVAAKSHEACQKLCTNAVRCQFFTYTPAQASCNEGKCYLKLSSNGS
PTKILHGRGGISGYTLRLCKMDNECTTKIKPRIVGGTASVRGEWPWQVTLHTTSPTQRHLCGGSIIGNQWI
LTAAHCFYGVESPKILRVYSGILNQSEIKEDTSFFGVQEIIIHDQYKMAESGYDIALLKLETTVNYJDSQR
PICLPSKGDRNVIYTDCWVTGWGYRKLRDKIQNTLQKAKIPLVTNEECQKRYRGHKITHKMICAGYREGGK
DACKGDSGGPLSCKHNEVWHLVGITSWGEGCAQRERPGVYTNVVEYVDWILEKTCAV
TFTISSLQPEDIAVYYCQQHYKTPYSFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPR
EAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLAATLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DNSKSQVSLKLSSVTAADTARYYCARDYYGSKDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALG
CLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYICNVDHKPSNTKVDKR
VESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAK
TKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMT
KNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHE
ALHNHYTQKSLSLSLGK
GACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCAAGGCCAGTCAGG
ATGTGAGTACTGCTGTTGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTACTTGACA
TCCTACCGGAACACTGGGGTCCCAGATAGGTTCAGTGGAAGTGGATCTGGGACAGATTTTACTTTCACCAT
CAGCAGCCTGCAGCCTGAAGATATTGCAGTTTATTACTGTCAGCAACATTATAAAACTCCGTATTCGTTCG
GCGGAGGGACCAAGGTGGAAATCAAACGAACTGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGAT
GAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGT
ACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGG
ACAGCACCTACAGCCTCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCC
TGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCAAAGAGCTTCAACAGGGGAGAGTGTTAG
GGAGTCGGGCCCAGGACTGGTGAAGCCTTCGGAGACCCTGTCCATCACCTGCACTGTCTCIGGGTTCTCAT
TAACOGGCTATGGTATATACTGGGTGCGGCAGCCCCCAGGGAAGGGACTGGAGTGGCTGGGGATGATATGG
GGTGATGGAAGAACAGACTATAATTCAGCTCTCAAATCCCGAGTCACCATATCAAAGGACAACTCCAAGAG
CCAGGTGTCCCTGAAGCTGAGCTCTGTGACCGCGCGGACACGGCCAGGTATTACTGTGCGAGAGATTACT
ACGGTAGTAAGGACTCTGGGGCCAGGGCACCACGGTCACCGTCTCCTCAGCTTCCACCAAGGGCCCATCC
GTCTTCCCCCTGGCGCCCTGCTCCAGGAGCACCTCCGAGAGCACAGCCGCCCTGGGCTGCCTGGTCAAGGA
CTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGG
CTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACG
AAGACCTACACCTGCAATGTAGATCACAAGCCCAGCAAGGTGGACAAGAGAGTTGAGTCCAAATA
TGGTOCCCCATGCCCACCATGCCCAGCACCTGAGTTCCTGGGGGGACCATCAGTCTTCCTGTTCCCCCCAA
GACCCCGAGGTCCAGTTCAACTGGTACGTGGATGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGA
GGAGCAGTTCAACAGCACGTACCGTGTGGTCCTCACCGTCCTGCACCAGGACTGGCTGAACGGCA
AGGAGTACAAGTGCAAGGTCTCCAACAAAGGCCTCCCGTCCTCCATCGAGAAAACCATCTCCAAAGCCAAA
GGGCAGCCCCGAGAGCCACAGGTGTACACCCTGCCCCCATCCCAGGAGGAGATGACCAAGAACCAGGTCAG
CCTGACCTGCCTGGTCAAAGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGG
AGAACAACTACAAGACCACGCCTCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAGGCTAACC
GTGGACAAGAGCAGGTGGCAGGAGGGGATGTCTTCTCATGCTCCGTGATGCATGAGGCTCGCACAACCA
CTACACACAGAAGAGCCTCTCCCTGTCTCTGGGTAAATGA
Описание изобретения выше было представлено в целях иллюстрации и объяснения. Оно не ограничивает объем изобретения формами или формы, которые описаны в настоящем документе. Например, различные признаки изобретения сгруппированы в один или несколько аспектов, вариантов осуществления или конфигураций, чтобы упорядочить описание и способствовать пониманию. Признаки аспектов, вариантов осуществления и конфигурации изобретения могут быть объединены в альтернативные аспекты, варианты осуществления и конфигурации, отличающиеся от тех, которые описаны. Таким образом, настоящее изобретение не следует толковать так, что для него требуется больше признаков, чем те, которые ясно указываются в каждом пункте формулы изобретения. Скорее, как отражено в следующей формуле изобретения, аспекты изобретения заключаются не во всех признаках одного вышеупомянутого описанного аспекта, варианта осуществления и конфигурации. Таким образом, формула изобретения включена в настоящее подробное описание, при этом каждый пункт формулы изобретения представляет собой отдельный предпочтительный вариант осуществления изобретения. Кроме того, несмотря на то, что в описание изобретения было включено описание одного или нескольких аспектов, вариантов осуществления или конфигураций, а также определенных вариаций и модификаций, другие вариации, комбинации и модификации входят в объем изобретения, например, в пределах возможностей и знаний специалистов в данной области техники после ознакомления с настоящим изобретением. Настоящий документ предназначен для получения прав, которые охватывают альтернативные аспекты, варианты осуществления и конфигурацию в той степени, в которой это разрешено, включая конструкции, функции, диапазоны или этапы, являющиеся альтернативными, взаимозаменяемыми и/или аналогичными тем, которые приводятся в формуле изобретения, независимо от того, описываются ли такие альтернативные, взаимозаменяемые и/или аналогичные конструкции, функции, диапазоны или этапы в настоящем документе, при этом намерение открыть общественности какой-либо патентоспособный объект не предусматривается.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> АРОНОРА ИНК.
ОРЕГОН ХЕЛФ ЭНД САЙЕНС ЮНИВЕРСИТИ
<120> НОВЫЕ ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К ФАКТОРУ XI С АНТИТРОМБОТИЧЕСКИМ И
ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ И ИХ ПРИМЕНЕНИЕ
<130> ARB002PCT
<140>
<141>
<150> 62/794,987
<151> 2019-01-21
<160> 13
<170> PatentIn version 3.5
<210> 1
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 1
Lys Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 2
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 2
Leu Thr Ser Tyr Arg Asn Thr
1 5
<210> 3
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 3
Gln Gln His Tyr Lys Thr Pro Tyr Ser
1 5
<210> 4
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 4
Gly Tyr Gly Ile Tyr
1 5
<210> 5
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 5
Met Ile Trp Gly Asp Gly Arg Thr Asp Tyr Asn Ser Ala Leu Lys Ser
1 5 10 15
<210> 6
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 6
Asp Tyr Tyr Gly Ser Lys Asp Tyr
1 5
<210> 7
<211> 625
<212> PRT
<213> Homo sapiens
<400> 7
Met Ile Phe Leu Tyr Gln Val Val His Phe Ile Leu Phe Thr Ser Val
1 5 10 15
Ser Gly Glu Cys Val Thr Gln Leu Leu Lys Asp Thr Cys Phe Glu Gly
20 25 30
Gly Asp Ile Thr Thr Val Phe Thr Pro Ser Ala Lys Tyr Cys Gln Val
35 40 45
Val Cys Thr Tyr His Pro Arg Cys Leu Leu Phe Thr Phe Thr Ala Glu
50 55 60
Ser Pro Ser Glu Asp Pro Thr Arg Trp Phe Thr Cys Val Leu Lys Asp
65 70 75 80
Ser Val Thr Glu Thr Leu Pro Arg Val Asn Arg Thr Ala Ala Ile Ser
85 90 95
Gly Tyr Ser Phe Lys Gln Cys Ser His Gln Ile Ser Ala Cys Asn Lys
100 105 110
Asp Ile Tyr Val Asp Leu Asp Met Lys Gly Ile Asn Tyr Asn Ser Ser
115 120 125
Val Ala Lys Ser Ala Gln Glu Cys Gln Glu Arg Cys Thr Asp Asp Val
130 135 140
His Cys His Phe Phe Thr Tyr Ala Thr Arg Gln Phe Pro Ser Leu Glu
145 150 155 160
His Arg Asn Ile Cys Leu Leu Lys His Thr Gln Thr Gly Thr Pro Thr
165 170 175
Arg Ile Thr Lys Leu Asp Lys Val Val Ser Gly Phe Ser Leu Lys Ser
180 185 190
Cys Ala Leu Ser Asn Leu Ala Cys Ile Arg Asp Ile Phe Pro Asn Thr
195 200 205
Val Phe Ala Asp Ser Asn Ile Asp Ser Val Met Ala Pro Asp Ala Phe
210 215 220
Val Cys Gly Arg Ile Cys Thr His His Pro Gly Cys Leu Phe Phe Thr
225 230 235 240
Phe Phe Ser Gln Glu Trp Pro Lys Glu Ser Gln Arg Asn Leu Cys Leu
245 250 255
Leu Lys Thr Ser Glu Ser Gly Leu Pro Ser Thr Arg Ile Lys Lys Ser
260 265 270
Lys Ala Leu Ser Gly Phe Ser Leu Gln Ser Cys Arg His Ser Ile Pro
275 280 285
Val Phe Cys His Ser Ser Phe Tyr His Asp Thr Asp Phe Leu Gly Glu
290 295 300
Glu Leu Asp Ile Val Ala Ala Lys Ser His Glu Ala Cys Gln Lys Leu
305 310 315 320
Cys Thr Asn Ala Val Arg Cys Gln Phe Phe Thr Tyr Thr Pro Ala Gln
325 330 335
Ala Ser Cys Asn Glu Gly Lys Gly Lys Cys Tyr Leu Lys Leu Ser Ser
340 345 350
Asn Gly Ser Pro Thr Lys Ile Leu His Gly Arg Gly Gly Ile Ser Gly
355 360 365
Tyr Thr Leu Arg Leu Cys Lys Met Asp Asn Glu Cys Thr Thr Lys Ile
370 375 380
Lys Pro Arg Ile Val Gly Gly Thr Ala Ser Val Arg Gly Glu Trp Pro
385 390 395 400
Trp Gln Val Thr Leu His Thr Thr Ser Pro Thr Gln Arg His Leu Cys
405 410 415
Gly Gly Ser Ile Ile Gly Asn Gln Trp Ile Leu Thr Ala Ala His Cys
420 425 430
Phe Tyr Gly Val Glu Ser Pro Lys Ile Leu Arg Val Tyr Ser Gly Ile
435 440 445
Leu Asn Gln Ser Glu Ile Lys Glu Asp Thr Ser Phe Phe Gly Val Gln
450 455 460
Glu Ile Ile Ile His Asp Gln Tyr Lys Met Ala Glu Ser Gly Tyr Asp
465 470 475 480
Ile Ala Leu Leu Lys Leu Glu Thr Thr Val Asn Tyr Thr Asp Ser Gln
485 490 495
Arg Pro Ile Cys Leu Pro Ser Lys Gly Asp Arg Asn Val Ile Tyr Thr
500 505 510
Asp Cys Trp Val Thr Gly Trp Gly Tyr Arg Lys Leu Arg Asp Lys Ile
515 520 525
Gln Asn Thr Leu Gln Lys Ala Lys Ile Pro Leu Val Thr Asn Glu Glu
530 535 540
Cys Gln Lys Arg Tyr Arg Gly His Lys Ile Thr His Lys Met Ile Cys
545 550 555 560
Ala Gly Tyr Arg Glu Gly Gly Lys Asp Ala Cys Lys Gly Asp Ser Gly
565 570 575
Gly Pro Leu Ser Cys Lys His Asn Glu Val Trp His Leu Val Gly Ile
580 585 590
Thr Ser Trp Gly Glu Gly Cys Ala Gln Arg Glu Arg Pro Gly Val Tyr
595 600 605
Thr Asn Val Val Glu Tyr Val Asp Trp Ile Leu Glu Lys Thr Gln Ala
610 615 620
Val
625
<210> 8
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 8
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Gly Tyr
20 25 30
Gly Ile Tyr Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Arg Thr Asp Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Arg Tyr Tyr Cys Ala
85 90 95
Arg Asp Tyr Tyr Gly Ser Lys Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 9
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 9
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Leu Thr Ser Tyr Arg Asn Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Val Tyr Tyr Cys Gln Gln His Tyr Lys Thr Pro Tyr
85 90 95
Ser Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 10
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Leu Thr Ser Tyr Arg Asn Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Val Tyr Tyr Cys Gln Gln His Tyr Lys Thr Pro Tyr
85 90 95
Ser Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 11
<211> 443
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полипептид
<400> 11
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Gly Tyr
20 25 30
Gly Ile Tyr Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Arg Thr Asp Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Arg Tyr Tyr Cys Ala
85 90 95
Arg Asp Tyr Tyr Gly Ser Lys Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 12
<211> 705
<212> DNA
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 12
atgagggtcc ccgctcagct cctggggctc ctgctgctct ggctcccagg cgcgcgatgt 60
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 120
atcacttgca aggccagtca ggatgtgagt actgctgttg cctggtatca gcagaaacca 180
gggaaagccc ctaagctcct gatctacttg acatcctacc ggaacactgg ggtcccagat 240
aggttcagtg gaagtggatc tgggacagat tttactttca ccatcagcag cctgcagcct 300
gaagatattg cagtttatta ctgtcagcaa cattataaaa ctccgtattc gttcggcgga 360
gggaccaagg tggaaatcaa acgaactgtg gctgcaccat ctgtcttcat cttcccgcca 420
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 480
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 540
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 600
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 660
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gttag 705
<210> 13
<211> 1389
<212> DNA
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 13
atgggttgga gcctcatctt gctcttcctt gtcgctgttg ctacgcgtgt ccactcccag 60
gtgcagctgc aggagtcggg cccaggactg gtgaagcctt cggagaccct gtccatcacc 120
tgcactgtct ctgggttctc attaaccggc tatggtatat actgggtgcg gcagccccca 180
gggaagggac tggagtggct ggggatgata tggggtgatg gaagaacaga ctataattca 240
gctctcaaat cccgagtcac catatcaaag gacaactcca agagccaggt gtccctgaag 300
ctgagctctg tgaccgctgc ggacacggcc aggtattact gtgcgagaga ttactacggt 360
agtaaggact actggggcca gggcaccacg gtcaccgtct cctcagcttc caccaagggc 420
ccatccgtct tccccctggc gccctgctcc aggagcacct ccgagagcac agccgccctg 480
ggctgcctgg tcaaggacta cttccccgaa ccggtgacgg tgtcgtggaa ctcaggcgcc 540
ctgaccagcg gcgtgcacac cttcccggct gtcctacagt cctcaggact ctactccctc 600
agcagcgtgg tgaccgtgcc ctccagcagc ttgggcacga agacctacac ctgcaatgta 660
gatcacaagc ccagcaacac caaggtggac aagagagttg agtccaaata tggtccccca 720
tgcccaccat gcccagcacc tgagttcctg gggggaccat cagtcttcct gttcccccca 780
aaacccaagg acactctcat gatctcccgg acccctgagg tcacgtgcgt ggtggtggac 840
gtgagccagg aagaccccga ggtccagttc aactggtacg tggatggcgt ggaggtgcat 900
aatgccaaga caaagccgcg ggaggagcag ttcaacagca cgtaccgtgt ggtcagcgtc 960
ctcaccgtcc tgcaccagga ctggctgaac ggcaaggagt acaagtgcaa ggtctccaac 1020
aaaggcctcc cgtcctccat cgagaaaacc atctccaaag ccaaagggca gccccgagag 1080
ccacaggtgt acaccctgcc cccatcccag gaggagatga ccaagaacca ggtcagcctg 1140
acctgcctgg tcaaaggctt ctaccccagc gacatcgccg tggagtggga gagcaatggg 1200
cagccggaga acaactacaa gaccacgcct cccgtgctgg actccgacgg ctccttcttc 1260
ctctacagca ggctaaccgt ggacaagagc aggtggcagg aggggaatgt cttctcatgc 1320
tccgtgatgc atgaggctct gcacaaccac tacacacaga agagcctctc cctgtctctg 1380
ggtaaatga 1389
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ ФАКТОРА СВЕРТЫВАНИЯ XI | 2017 |
|
RU2757314C2 |
| Антитело против FXI/FXIA, его антигенсвязывающий фрагмент и фармацевтическое применение | 2021 |
|
RU2838408C1 |
| НОВЫЕ АНТИТЕЛА ПРОТИВ ФАКТОРА XI И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2758160C2 |
| АНТИТЕЛА К ФАКТОРУ XI И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2739946C2 |
| АНТИТЕЛА К ФАКТОРУ XI | 2017 |
|
RU2800719C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К АКТИВИРОВАННОМУ БЕЛКУ С ЧЕЛОВЕКА И ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2021 |
|
RU2824515C1 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| УЛУЧШЕННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ РЕЦЕПТОРЫ | 2018 |
|
RU2825816C2 |
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ ЛЕЙКОТОКСИНОВ STAPHYLOCOCCUS AUREUS | 2019 |
|
RU2805969C2 |
| АКТИВИРУЕМЫЕ ПРОТЕАЗОЙ СВЯЗЫВАЮЩИЕ Т-КЛЕТКИ БИСПЕЦИФИЧЕСКИЕ МОЛЕКУЛЫ | 2017 |
|
RU2830288C2 |


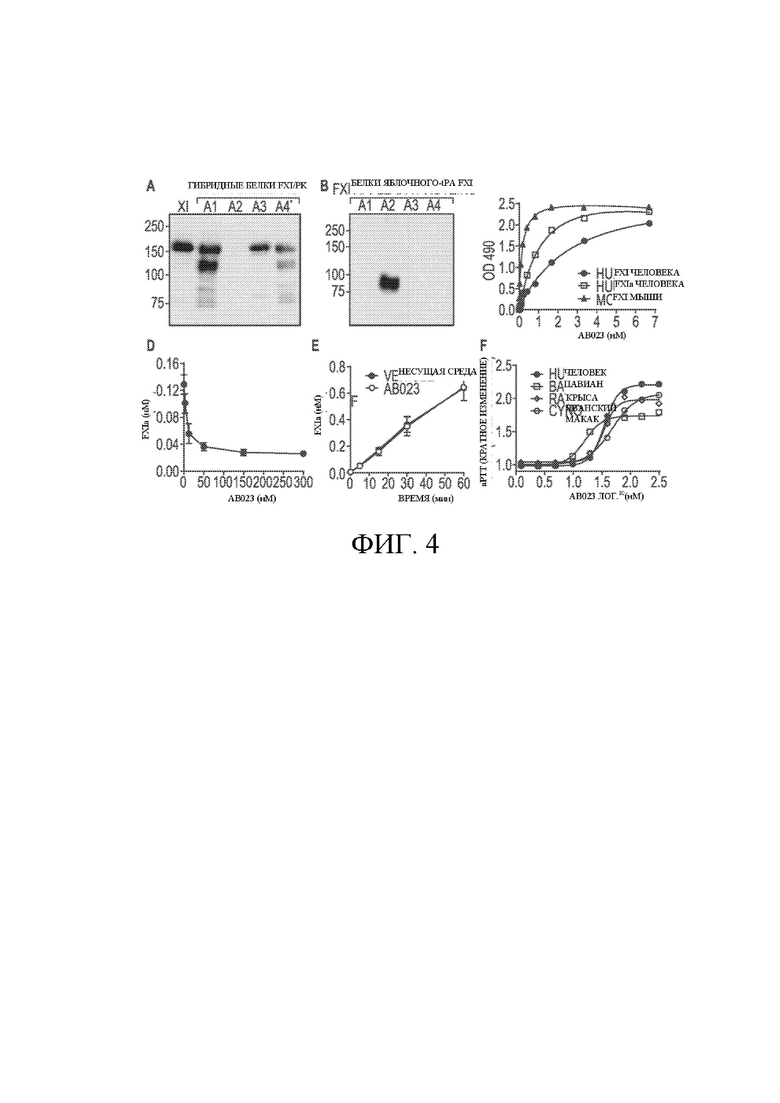




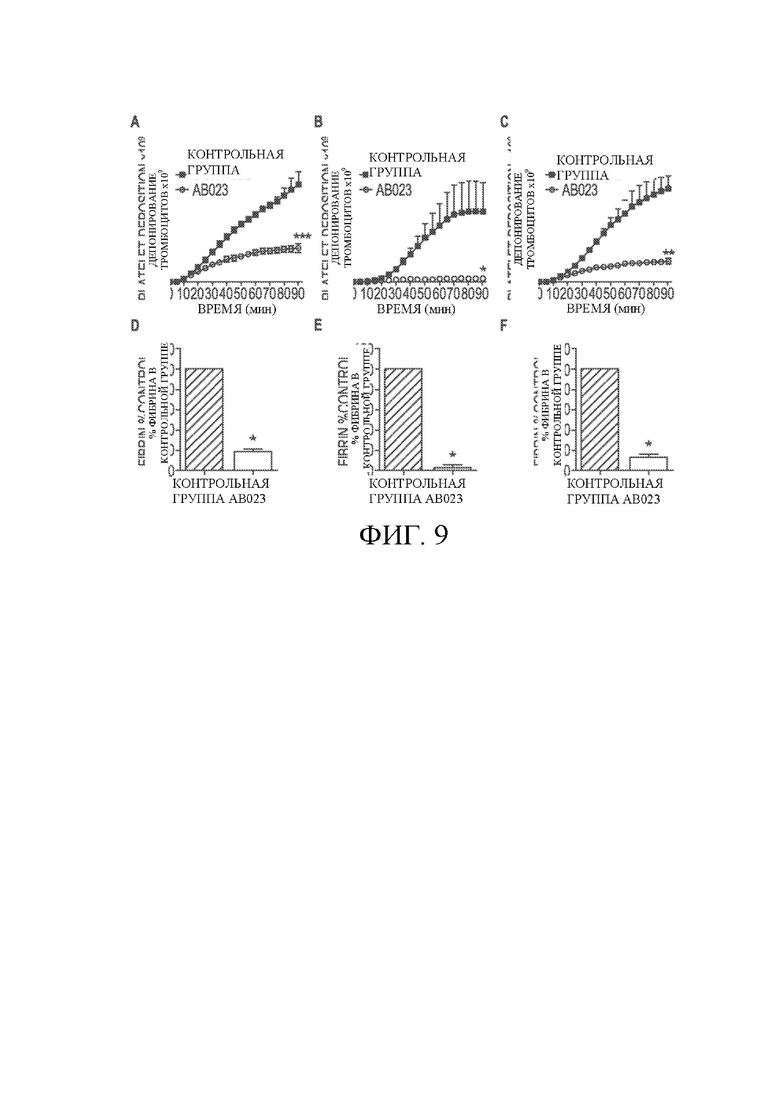

Группа изобретений относится к иммунологии. Предложены моноклональное антитело или его антигенсвязывающий фрагмент, специфически связывающие фактор XI человека или фактор XIa человека. Также предложены полинуклеотид, кодирующий моноклональное антитело или антигенсвязывающий фрагмент, вектор, клетка-хозяин, способ получения моноклонального антитела или антигенсвязывающего фрагмента, композиции, способы и набор с использованием моноклонального антитела или его антигенсвязывающего фрагмента. Антитело или его антигенсвязывающий фрагмент способны связываться с доменом А2 фактора XI и образовывать с ним иммунный комплекс, тем самым нарушая молекулярный комплекс активации контакта, не влияя на активность или активацию гемостатического фактора XI. Изобретения могут быть применены для безопасного ингибирования тромбоза и воспаления без нарушения гемостаза. 10 н. и 15 з.п. ф-лы, 10 ил., 2 табл.
1. Моноклональное антитело или его антигенсвязывающий фрагмент, специфически связывающее фактор XI человека или фактор XIa человека, а также включающее:
CDR1 легкой цепи, включающий последовательность KASQDVSTAVA (SEQ ID №: 1); CDR2 легкой цепи, включающей последовательность LTSYRNT (SEQ ID №: 2); CDR3 легкой цепи, включающей последовательность QQHYKTPYS (SEQ ID №: 3);
CDR1 тяжелой цепи, включающей последовательность GYGIY (SEQ ID №: 4); CDR2 тяжелой цепи, включающей последовательность MIWGDGRTDYNSALKS (SEQ ID №: 5); CDR3 тяжелой цепи, включающей последовательность DYYGSKDY (SEQ ID №: 6).
2. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, включающее область VH, как представлено в SEQ ID №: 8.
3. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, отличающееся тем, что включает область VL, как представлено в SEQ ID №: 9.
4. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, отличающееся тем, что включает область VH, как представлено в SEQ ID №: 8, и область VL, как представлено в SEQ ID №: 9.
5. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, отличающееся тем, что включает легкую цепь, как представлено в SEQ ID №: 10, или может кодироваться SEQ ID №: 12.
6. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, отличающееся тем, что включает тяжелую цепь, как представлено в SEQ ID №: 11, или может кодироваться SEQ ID №: 13.
7. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, отличающееся тем, что включает легкую цепь, как представлено в SEQ ID №: 10, или может кодироваться SEQ ID №: 12 и тяжелую цепь, как представлено в SEQ ID №: 11, или может кодироваться SEQ ID №: 13.
8. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, отличающееся тем, что представляет собой гуманизированное моноклональное антитело или химерное моноклональное антитело.
9. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, отличающееся тем, что является IgG.
10. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, отличающееся тем, что является IgG4.
11. Полинуклеотид, кодирующий моноклональное антитело или антигенсвязывающий фрагмент по п. 1.
12. Клетка-хозяин, используемая для ингибирования контактной активации свертывания крови, агрегации тромбоцитов и/или тромбоза у пациента, которая является рецепиентом полинуклеотида по п. 11 или векторов, включающих полинуклеотид по п. 11, причем клетка-хозяин представляет собой прокариотическую или эукариотическую клетки, или линию указанных клеток.
13. Вектор для переноса генетического материала на клетку-хозяина, включающий полинуклеотид по п. 11.
14. Вектор по п. 13, отличающийся тем, что представляет собой вектор экспрессии.
15. Способ получения моноклонального антитела или его антигенсвязывающего фрагмента по п. 1, включающий культивацию клетки-хозяина по п. 12 в условиях, обеспечивающих возможность для экспрессии моноклонального антитела, его антигенсвязывающего фрагмента.
16. Способ по п. 15, дополнительно включающий извлечение полученного антитела, его антигенсвязывающего фрагмента, из культуры.
17. Фармацевтическая композиция для применения в лечении или профилактике тромбических или тромбоэмболических нарушений, включающая моноклональное антитело, или его антигенсвязывающий фрагмент, полученное в соответствии со способом по п. 15, а также фармацевтически приемлемый эксципиент.
18. Фармацевтическая композиция для применения в лечении или профилактике тромбических или тромбоэмболических нарушений, включающая терапевтически эффективное количество моноклонального антитела или его антигенсвязывающего фрагмента по п. 1, а также фармацевтически приемлемый эксципиент.
19. Фармацевтическая композиция по п. 18, дополнительно включающая одно или несколько действующих веществ, которое подбирается из группы, включающей активаторы плазминогена тромболитики/фибринолитики; ингибиторы активаторов плазминогена; ингибиторы активированных тромбином ингибиторов фибринолиза (TAFI), включающие в себя тканевой активатор плазминогена (t-PA), стрептокиназу, ретеплазу и урокиназу; нефракционированные гепарины; низкомолекулярные гепарины; гепариноид; гирудин; бивалирудин; а также аргатробан.
20. Способ использования моноклонального антитела или его антигенсвязывающего фрагмента по п. 1 в качестве медицинского препарата, включающий введение терапевтически эффективного количества моноклонального антитела или его антигенсвязывающего фрагмента субъекту, нуждающемуся в медицинском препарате для применения в лечении или профилактике тромбических или тромбоэмболических нарушений у человека.
21. Способ по п. 20, отличающийся тем, что субъекту требуется лечение и/или профилактика тромбических или тромбоэмболических нарушений и/или осложнений.
22. Способ по п. 20, отличающийся тем, что субъекту требуется лечение и/или профилактика для ингибирования свертывания крови, агрегации тромбоцитов и/или тромбоза.
23. Способ использования моноклонального антитела или его антигенсвязывающего фрагмента по п. 1 в качестве противосвертывающего средства в образцах крови, при консервации крови, в препаратах из плазмы, биологических образцах, лекарственных добавках или в составе медицинских изделий, включающий добавление моноклонального антитела или его антигенсвязывающего фрагмента в образец, для которого требуется противосвертывающее средство.
24. Набор для использования при лечении или профилактике тромбических или тромбоэмболических нарушений у человека, включающий моноклональное антитело или его антигенсвязывающий фрагмент по п. 1 и инструкцию по его использованию.
25. Набор по п. 24, отличающийся тем, что моноклональное антитело или его антигенсвязывающий фрагмент находится в лиофилизированной форме, и дополнительно включающий фармацевтически приемлемый носитель для ресуспендирования моноклонального антитела или его антигенсвязывающего фрагмента.
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Al-HORANI R.A., DESAI U.R | |||
| Factor XIa inhibitors: A review of the patent literature | |||
| Expert Opin Ther Pat | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
Авторы
Даты
2024-04-11—Публикация
2020-01-20—Подача