Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к лекарственному средству для терапевтического лечения и/или улучшения состояния при сепсисе, сопровождающемся коагулопатией.
Предпосылки создания изобретения
[0002]
Сепсис представляет собой синдром системного воспалительного ответа (SIRS), индуцированный инфекцией. В частности, сепсис определяется как патологическое состояние, которое характеризуется, помимо присутствия инфекции, двумя или более из следующих признаков SIRS ((1) температура тела > 38°C или < 36°C, (2) частота сердечных сокращений > 90/мин, (3) частота дыхания > 20/мин, или PaCO2<32 торр, и (4) число лейкоцитов > 12000/мкл или < 4000/мкл, или незрелые лейкоциты > 10%). Хотя до настоящего времени существенное внимание уделялось присутствию бактерий в крови (бактериемия), бактерии-положительный результат посева крови не был обязательным в соответствии с представленным выше определением. Что касается сепсиса, состояние, при котором наблюдается дисфункция органов, гипоперфузия органов или гипотензия, называется тяжелым сепсисом. Гипоперфузия органов или аномальная перфузия включает лактатацидоз, олигурию, помрачнение сознания и т.п. Из состояний тяжелого сепсиса состояние непрерывной гипотензии, не смотря на достаточную нагрузку инфузионной терапии, называется септическим шоком (непатентный документ 1). Считается, что сильное расстройство кровообращения, наблюдаемое при этих патологических состояниях, вызывается нарушением функции симпатической нервной системы или медиатора, высвобождаемого из нейтрофилов, и т.п., а дисфункция органов вызывается тканевой гипоксией (дизоксия).
[0003]
Тромбомодулин известен как вещество, которое специфически связывается с тромбином, ингибируя свертывающую кровь активность тромбина, и в то же время проявляет антикоагулянтную активность, значительно повышая способность тромбина активировать протеин C. Также известно, что тромбомодулин увеличивает протромбиновое время или подавляет агрегацию тромбоцитов, вызываемую тромбином. Протеин C представляет собой витамин K-зависимый белок, который играет важную роль в системе свертывания крови и фибринолиза и активируется действием тромбина, превращаясь в активированный протеин C. Известно, что активированный протеин C инактивирует активированный фактор свертывания крови V и активированный фактор свертывания крови VIII in vivo и участвует в образовании активатора плазминогена, обладающего тромболитическим действием (непатентный документ 2). Соответственно, считается, что тромбомодулин способствует активации протеина C тромбином и, следовательно, полезен в качестве антикоагулянта или тромболитического средства. Также сообщалось, что в эксперименте на животных тромбомодулин эффективен для лечения или профилактики заболеваний, связанных с состоянием гиперкоагуляции (непатентный документ 3).
[0004]
Тромбомодулин был впервые обнаружен и получен как гликопротеин, экспрессируемый на эндотелиальных клетках сосудов различных видов животных, включая человека, а затем успешно клонирован. В частности, ген предшественника тромбомодулина человека, который включает сигнальный пептид, был клонирован из библиотеки кДНК легких человека методами генной инженерии, и вся последовательность гена тромбомодулина была проанализирована, и в результате была получена аминокислотная последовательность, состоящая из 575 остатков, содержащих сигнальный пептид (как правило, в качестве примера приводят 18 аминокислотных остатков) (патентный документ 1). Известно, что зрелый тромбомодулин, который образуется в результате отщепления сигнального пептида, состоит из 5 областей, а именно, N-концевой области (аминокислотные остатки с 1 по 226, эти положения определены на основании предположения, что сигнальный пептид состоит из 18 аминокислотных остатков, и то же самое применимо к нижеследующим описаниям), области, имеющей шесть EGF-подобных структур (аминокислотные остатки с 227 по 462), области O-связанного гликозилирования (аминокислотные остатки с 463 по 498), трансмембранной области (аминокислотные остатки с 499 по 521) и цитоплазматической области (аминокислотные остатки с 522 по 557) с N-концевой стороны зрелого пептида. Также известно, что частичный белок, имеющий ту же активность, что и активность полноразмерного тромбомодулина (т.е. минимальная активная единица), в основном состоит из 4-й, 5-й и 6-й EGF-подобных структур с N-концевой стороны в области, имеющей шесть EGF-подобных структур (непатентный документ 4).
[0005]
Полноразмерный тромбомодулин практически не растворяется в отсутствие поверхностно-активного вещества, и добавление поверхностно-активного вещества необходимо для получения препарата целого тромбомодулина. При этом известен растворимый тромбомодулин, который может полностью растворяться даже в отсутствие поверхностно-активного вещества. Растворимый тромбомодулин может быть получен путем удаления по меньшей мере части трансмембранной области или всей трансмембранной области. Например, было подтверждено, что растворимый тромбомодулин, состоящий только из 3 областей, а именно из N-концевой области, области, имеющей шесть EGF-подобных структур, и области O-связанного гликозилирования (т.е. растворимый тромбомодулин, имеющий аминокислотную последовательность, состоящую из аминокислотных остатков 19-516 SEQ ID NO: 9), может быть получен с применением рекомбинационных методов, и что полученный рекомбинантный растворимый тромбомодулин имеет такую же активность, как и активность тромбомодулина природного происхождения (патентный документ 1). Также имеются некоторые другие сообщения, касающиеся растворимых тромбомодулинов (патентные документы 2-9). Растворимый тромбомодулин, полученный из мочи человека, и т.п. также описаны в качестве нативных тромбомодулинов (патентные документы 10 и 11).
[0006]
Как признано во многих случаях, в результате спонтанных мутаций или мутаций, происходящих во время получения, в генах человека были обнаружены полиморфные мутации. В настоящее время идентифицированы белки тромбомодулинов, в которых аминокислота в положении 473 предшественника человеческого тромбомодулина, имеющего аминокислотную последовательность, состоящую из 575 аминокислотных остатков, преобразована в Val или Ala. В нуклеотидной последовательности, кодирующей аминокислотную последовательность, это изменение аминокислотного остатка соответствует мутации в Т или С в положении 1418 (непатентный документ 5). Однако эти два типа тромбомодулинов полностью идентичны с точки зрения их активности и физико-химических свойств, и можно считать, что они практически идентичны.
[0007]
Сообщалось, что тромбомодулин эффективен для терапевтического лечения диссеминированного внутрисосудистого свертывания (далее также указано как DIC) (непатентный документ 6). Что касается использования тромбомодулина, в дополнение к вышеуказанному применению тромбомодулин, как ожидается, можно будет использовать для терапевтического и профилактического лечения различных заболеваний, таких как острый коронарный синдром (ACS), тромбоз, обструкция периферических сосудов, обструктивный артериосклероз, васкулит, функциональное расстройство, возникающее после операции на сердце, осложнение, вызванное трансплантацией органов, стенокардия, транзиторная ишемическая атака, токсикоз беременных, диабет, VOD печени (веноокклюзионное заболевание печени, например, молниеносный гепатит, веноокклюзионное заболевание печени, возникающее после трансплантации костного мозга), тромбоз глубоких вен (DVT), сепсис и респираторный дистресс-синдром взрослых (ARDS) (патентные документы 12-14).
[0008]
Как известно, международное нормализованное отношение (далее также сокращенно "INR") в образце плазмы пациента с сепсисом означает коагулопатию. Например, на Конгрессе по реаниматологии (CCM), состоявшемся в 2003 г., в качестве критериев коагулопатии указаны INR > 1,5, а также PPT > 60 секунд (Crit. Care Med., 31, стр. 1250-1256 (2003)). Однако значение INR еще не утверждено в качестве четкого критерия, поскольку значение не было подтверждено клиническими испытаниями и т.п. Фактически, в ходе клинических испытаний фазы III лечения пациентов с тяжелым сепсисом Тифакогин в качестве ингибитора пути тканевого фактора в классе антикоагулянтов показал более благоприятный результат в группе пациентов с INR ≤ 1,2, чем в группе пациентов с INR > 1,2 как результат клинического испытания, основной целью которого были пациенты с INR > 1,2 (JAMA, July 9, Vo. 290, No. 2, pp.238-247 (2003)). Кроме того, в качестве еще одного результата клинического испытания лечения сепсиса с использованием тромбомодулина, среди пациентов с INR > 1,2 это лекарственное средство показало более высокий эффект у пациентов с INR > 1,5, чем у пациентов с INR > 1,2 (патентный документ 13).
[0009]
Как объяснялось выше, в свете некоторых результатов клинических исследований при терапевтическом лечении пациентов с сепсисом с использованием антикоагулянта высокую эффективность ожидают при выборе класса пациентов с сопутствующей коагулопатией. Однако считается, что определение коагулопатии еще не утверждено, поскольку, например, были получены противоположные клинические результаты. Другими словами, как можно получить отличный результат путем выбора целевых пациентов на основании значения INR, не было разъяснено, и нет общих технических знаний о том, какой уровень значения INR у пациента с сепсисом обеспечивает особую эффективность этого лекарственного средства. Что касается корреляции значения INR с клинической эффективностью, считается, что только ограниченная часть корреляции известна как основа для каждого отдельного случая, что касается некоторых отдельных препаратов.
[0010]
В этих обстоятельствах из числа антикоагулянтов внимание авторов настоящего изобретения привлек тромбомодулин, и ими были осуществлены различные исследования терапевтического и/или улучшающего эффекта против сепсиса. В результате неожиданно было обнаружено, что сепсис можно терапевтически лечить и/или облегчить более эффективно у пациентов с тяжелым сепсисом с одной или более органными дисфункциями (за исключением пациентов с тяжелым сепсисом, имеющих органную дисфункцию, ограниченную печенью или почками), чем у пациентов с тяжелым сепсисом без органной дисфункции, когда значение INR у пациентов превышает 1,4, другими словами, что касается терапевтического лечения и/или улучшения состояния при сепсисе с использованием тромбомодулина, авторы изобретения обнаружили, что существует особая корреляция между пациентами, страдающими тяжелым сепсисом с одной или более органными дисфункциями, в классе пациентов с сепсисом, и значением INR больше чем 1,4, что является неожиданным для обычных специалистов в данной области. Кроме того, авторы изобретения к удивлению обнаружили, что для пациентов с тяжелым сепсисом со значением INR более 1,4 и равным или меньше 1,6 был достигнут особенно заметный эффект в том смысле, что разница в уровне смертности между группой тромбомодулина и группой плацебо была выше 15% (патентный документ 13). Однако какой-либо способ введения для достижения такого желаемого клинического эффекта еще полностью не выяснен.
Ссылочные документы предшествующего уровня техники
Патентные документы
[0011]
Патентный документ 1: Публикация не прошедшей экспертизу японской патентной заявки (Kokai) № 64-6219
Патентный документ 2: Публикация не прошедшей экспертизу японской патентной заявки № 5-213998
Патентный документ 3: Публикация не прошедшей экспертизу японской патентной заявки № 2-255699
Патентный документ 4: Публикация не прошедшей экспертизу японской патентной заявки № 3-133380
Патентный документ 5: Публикация не прошедшей экспертизу японской патентной заявки № 3-259084
Патентный документ 6: Публикация не прошедшей экспертизу японской патентной заявки № 4-210700
Патентный документ 7: WO92/00325
Патентный документ 8: WO92/03149
Патентный документ 9: WO93/15755
Патентный документ 10: Публикация не прошедшей экспертизу японской патентной заявки № 3-86900
Патентный документ 11: Публикация не прошедшей экспертизу японской патентной заявки № 3-218399
Патентный документ 12: WO03/061687
Патентный документ 13: WO2013/073545
Непатентные документы
[0012]
Непатентный документ 1: American College of Chest Physicians, CHEST/101/6-/JUNE, 1992:1481-1483
Непатентный документ 2: Koji Suzuki, Igaku no Ayumi (Progress of Medicine), Vol. 125, 901 (1983)
Непатентный документ 3: K. Gomi et al., Blood, 75, 1396-1399 (1990)
Непатентный документ 4: M. Zushi et al., J. Biol. Chem., 246, 10351-10353 (1989)
Непатентный документ 5: D.Z. Wen et al., Biochemistry, 26, 4350-4357 (1987)
Непатентный документ 6: S.M. Bates et al., Br. J. Pharmacol., 144, 1017-1028 (2005)
Непатентный документ 7: Crit. Care Med., 31, 1250-1256 (2003)
Непатентный документ 8: JAMA, 290, 238-247 (2003)
Непатентный документ 9: "Results of Third Phase Clinical Trials for ART-123 in Overseas (preliminary report)", https://www.asahi-kasei.co.jp/asahi/jp/news/2018/me180802.html (August 2, 2018, Asahi Kasei Pharma Corporation)
Сущность изобретения
Цель, достигаемая настоящим изобретением
[0013]
Целью настоящего изобретения является обеспечение лекарственного средства для эффективного терапевтического лечения и/или улучшения состояния при сепсисе и т.п., сопровождающемся коагулопатией, и способа для эффективного терапевтического лечения и/или улучшения состояния при сепсисе и т.п., сопровождающемся коагулопатией.
Средства для достижения цели
[0014]
Для достижения вышеуказанной цели авторы настоящего изобретения сосредоточили внимание на тромбомодулине из числа антикоагулянтов и осуществили различные исследования его терапевтического и/или улучшающего эффекта при сепсисе. В результате они обнаружили, что сепсис у пациентов, у которых он сопровождается коагулопатией, как подтверждено непосредственно перед введением тромбомодулина, можно чрезвычайно эффективно лечить и/или обеспечить положительную динамику при помощи тромбомодулина. Авторы настоящего изобретения также обнаружили, что путем внутривенного введения от 0,005 до 1 мг/кг тромбомодулина пациентам с сепсисом, сопровождающимся коагулопатией, с частотой один раз в день в течение по меньшей мере четырех последовательных дней, сепсис можно чрезвычайно эффективно лечить и/или обеспечить положительную динамику.
[0015]
Авторы настоящего изобретения также обнаружили, что сепсис у пациентов, у которых непосредственно перед введением тромбомодулина подтверждено определенное количество типов органных дисфункций, можно чрезвычайно эффективно лечить и/или блегчить при помощи тромбомодулина.
[0016]
В частности, настоящее изобретение включает следующее:
[1] Лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением значение международного нормализованного отношения (INR) больше чем 1,4.
[0017]
[2] Лекарственное средство в соответствии с пунктом [1], приведенным выше, которое предназначено для введения пациенту, у которого непосредственно перед введением количество тромбоцитов больше чем 30000/мм3.
[3] Лекарственное средство в соответствии с пунктом [1] или [2], приведенным выше, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень комплекса тромбин-антитромбин (TAT) составляет 10 нг/мл или более.
[4] Лекарственное средство в соответствии с любым из пунктов [1]-[3], приведенным выше, которое предназначено для введения пациенту, у которого непосредственно перед введением количество тромбоцитов больше чем 30000/мм3 и оценка по шкале Sofa не больше чем 11.
[0018]
[5] Лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень комплекса тромбин-антитромбин (TAT) не меньше чем 10 нг/мл.
[6] Лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) больше чем 229 пмоль/л.
[7] Лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) не меньше чем 250 пмоль/л.
[0019]
[8] Лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень активности протеина C не больше чем 40%.
[9] Лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень активности антитромбина III (AT III) меньше чем 70%.
[10] Лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого размер микрочастиц (MP) непосредственно перед введением больше чем 10 нм.
[11] Лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением оценка по шкале APACHE II меньше чем 35.
[0020]
[12] Лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением имеется один-три типа органных дисфункций.
[13] Лекарственное средство в соответствии с пунктом [12], которое предназначено для введения пациенту, который не является пациентом с сепсисом, имеющим органную дисфункцию, ограниченную печенью или почками.
[14] Лекарственное средство в соответствии с пунктом [1] или [2], которое предназначено для введения пациенту, у которого непосредственно перед введением имеется один-три типа органных дисфункций.
[15] Лекарственное средство в соответствии с пунктом [14], которое предназначено для введения пациенту, который не является пациентом с сепсисом, имеющим органную дисфункцию, ограниченную печенью или почками.
[16] Лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень D-димера не меньше чем 3500 нг/мл.
[17] Лекарственное средство в соответствии с пунктом [1] или [2], которое предназначено для введения пациенту, у которого непосредственно перед введением уровень D-димера не меньше чем 3500 нг/мл.
[0021]
[18] Лекарственное средство в соответствии с пунктом [1] или [2], которое предназначено для введения пациенту, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) больше чем 229 пмоль/л.
[19] Лекарственное средство в соответствии с пунктом [1] или [2], которое предназначено для введения пациенту, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) не меньше чем 250 пмоль/л.
[20] Лекарственное средство в соответствии с пунктом [1] или [2], которое предназначено для введения пациенту, у которого непосредственно перед введением уровень активности протеина C не больше чем 40%.
[21] Лекарственное средство в соответствии с пунктом [1] или [2], которое предназначено для введения пациенту, у которого непосредственно перед введением уровень активности антитромбина III (AT III) меньше чем 70%.
[22] Лекарственное средство в соответствии с пунктом [1] или [2], которое предназначено для введения пациенту, у которого размер микрочастиц (MP) непосредственно перед введением больше чем 10 нм.
[23] Лекарственное средство в соответствии с пунктом [1] или [2], которое предназначено для введения пациенту, у которого непосредственно перед введением оценка по шкале APACHE II меньше чем 35.
[24] Лекарственное средство в соответствии с любым из пунктов [1]-[23], приведенным выше, которое предназначено для введения пациенту с тяжелым сепсисом, имеющему нарушение сердечно-сосудистой функции и/или нарушение дыхательной функции.
[0022]
[25] Лекарственное средство в соответствии с любым из пунктов [1]-[24], приведенным выше, где тромбомодулин представляет собой растворимый тромбомодулин.
[26] Лекарственное средство в соответствии с любым из пунктов [1]-[25], приведенным выше, где тромбомодулин представляет собой тромбомодулин, имеющий следующие свойства (1)-(4):
(1) действие селективного связывания с тромбином,
(2) действие, промотирующее активацию протеина C тромбином,
(3) действие, продлевающее тромбиновое время, и
(4) действие, подавляющее агрегацию тромбоцитов, вызываемую тромбином.
[0023]
[27] Лекарственное средство в соответствии с любым из пунктов [1]-[26], приведенным выше, где тромбомодулин представляет собой тромбомодулин, имеющий следующие свойства (1)-(5):
(1) действие селективного связывания с тромбином,
(2) действие, промотирующее активацию протеина C тромбином,
(3) действие, продлевающее тромбиновое время,
(4) действие, подавляющее агрегацию тромбоцитов, вызываемую тромбином, и
(5) противовоспалительное действие.
[28] Лекарственное средство в соответствии с любым из пунктов [1]-[27], приведенным выше, где тромбомодулин представляет собой пептид, получаемый из трансформированной клетки, полученной путем трансфекции клетки-хозяина посредством ДНК, кодирующей аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 11.
[29] Лекарственное средство в соответствии с любым из пунктов [1]-[28], приведенным выше, где тромбомодулин представляет собой пептид, содержащий аминокислотную последовательность (i-1) или (i-2), представленную ниже, и указанный пептид представляет собой пептид, имеющий активности тромбомодулина:
(i-1) аминокислотную последовательность от положения 19 до 516 в аминокислотной последовательности SEQ ID NO: 9 или 11, или
(i-2) аминокислотную последовательность (i-1), указанную выше, дополнительно включающую замену, делецию или добавление одного или нескольких аминокислотных остатков.
[0024]
[30] Лекарственное средство в соответствии с любым из пунктов [1]-[29], приведенным выше, где растворимый тромбомодулин представляет собой пептид, содержащий:
(i) аминокислотную последовательность от положения 367 до 480 в аминокислотной последовательности SEQ ID NO: 9 или 11 и аминокислотную последовательность (ii-1) или (ii-2), представленную ниже, и указанный пептид представляет собой пептид, имеющий активности тромбомодулина:
(ii-1) аминокислотную последовательность от положения 19 до 244 в аминокислотной последовательности SEQ ID NO: 9 или 11, или
(ii-2) аминокислотную последовательность (ii-1), указанную выше, дополнительно включающую замену, делецию или добавление одного или нескольких аминокислотных остатков.
[31] Лекарственное средство в соответствии с пунктом [1] или [2], приведенным выше, которое предназначено для внутривенного введения 0,005-1 мг/кг тромбомодулина пациенту с сепсисом, у которого он сопровождается коагулопатией, с частотой один раз в день в течение по меньшей мере четырех последовательных дней.
[32] Лекарственное средство в соответствии с любым из пунктов [1]-[31], приведенным выше, где термин “непосредственно перед введением” означает период 24 часа, рассчитанный ретроспективно от начала введения тромбомодулина.
[33] Лекарственное средство для терапевтического лечения и/или улучшения состояния при сепсисе, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для внутривенного введения 0,005-1 мг/кг тромбомодулина пациенту с сепсисом, сопровождающимся коагулопатией, с частотой один раз в день в течение по меньшей мере четырех последовательных дней.
[34] Способ для терапевтического лечения и/или улучшения состояния при сепсисе, который включает стадию введения тромбомодулина пациенту с сепсисом, у которого значение международного нормализованного отношения (INR) больше чем 1,4.
[0025]
[35] Способ в соответствии с пунктом [34], приведенным выше, который включает стадию введения тромбомодулина пациенту, у которого непосредственно перед введением количество тромбоцитов больше чем 30000/мм3.
[36] Способ в соответствии с пунктом [34] или [35], приведенным выше, который включает стадию введения тромбомодулина пациенту, у которого непосредственно перед введением уровень комплекса тромбин-антитромбин (TAT) 10 нг/мл или больше.
[37] Способ в соответствии с любым из пунктов [34]-[36], приведенным выше, который включает стадию введения тромбомодулина пациенту, у которого непосредственно перед введением количество тромбоцитов больше чем 30000/мм3 и оценка по шкале Sofa не больше чем 11.
[0026]
[38] Способ для терапевтического лечения и/или улучшения состояния при сепсисе, который включает стадию введения тромбомодулина пациенту с сепсисом, у которого непосредственно перед введением уровень комплекса тромбин-антитромбин (TAT) не меньше чем 10 нг/мл.
[39] Способ для терапевтического лечения и/или улучшения состояния при сепсисе, который включает стадию введения тромбомодулина пациенту с сепсисом, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) больше чем 229 пмоль/л.
[40] Способ для терапевтического лечения и/или улучшения состояния при сепсисе, который включает стадию введения тромбомодулина пациенту с сепсисом, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) не меньше чем 250 пмоль/л.
[41] Способ для терапевтического лечения и/или улучшения состояния при сепсисе, который включает стадию введения тромбомодулина пациенту с сепсисом, у которого непосредственно перед введением уровень активности протеина C не больше чем 40%.
[42] Способ для терапевтического лечения и/или улучшения состояния при сепсисе, который включает стадию введения тромбомодулина пациенту с сепсисом, у которого непосредственно перед введением уровень активности антитромбина III (AT III) меньше чем 70%.
[0027]
[43] Способ для терапевтического лечения и/или улучшения состояния при сепсисе, который включает стадию введения тромбомодулина пациенту с сепсисом, у которого размер микрочастиц (MP) непосредственно перед введением больше чем 10 нм.
[44] Способ для терапевтического лечения и/или улучшения состояния при сепсисе, который включает стадию введения тромбомодулина пациенту с сепсисом, у которого непосредственно перед введением оценка по шкале APACHE II меньше чем 35.
[45] Способ для терапевтического лечения и/или улучшения состояния при сепсисе, который включает стадию введения тромбомодулина пациенту с сепсисом, имеющему непосредственно перед введением один-три типа органных дисфункций.
[46] Способ в соответствии с пунктом [45], который включает стадию введения тромбомодулина пациенту, который не является пациентом с сепсисом, имеющим органную дисфункцию, ограниченную печенью или почками.
[47] Способ в соответствии с пунктом [34] или [35], который включает стадию введения тромбомодулина пациенту, у которого непосредственно перед введением имеется один-три типа органных дисфункций.
[48] Способ в соответствии с пунктом [47], который включает стадию введения тромбомодулина пациенту, который не является пациентом с сепсисом, имеющим органную дисфункцию, ограниченную печенью или почками.
[0028]
[49] Способ для терапевтического лечения и/или улучшения состояния при сепсисе, который включает стадию введения тромбомодулина пациенту с сепсисом, у которого непосредственно перед введением уровень D-димера не меньше чем 3500 нг/мл.
[50] Способ в соответствии с пунктом [34] или [35], который включает стадию введения тромбомодулина пациенту, у которого непосредственно перед введением уровень D-димера не меньше чем 3500 нг/мл.
[51] Способ в соответствии с пунктом [34] или [35], который включает стадию введения тромбомодулина пациенту, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) больше чем 229 пмоль/л.
[52] Способ в соответствии с пунктом [34] или [35], который включает стадию введения тромбомодулина пациенту, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) не меньше чем 250 пмоль/л.
[53] Способ в соответствии с пунктом [34] или [35], который включает стадию введения тромбомодулина пациенту, у которого непосредственно перед введением уровень активности протеина C не больше чем 40%.
[0029]
[54] Способ в соответствии с пунктом [34] или [35], который включает стадию введения тромбомодулина пациенту, у которого непосредственно перед введением уровень активности антитромбина III (AT III) меньше чем 70%.
[55] Способ в соответствии с пунктом [34] или [35], который включает стадию введения тромбомодулина пациенту, у которого размер микрочастиц (MP) непосредственно перед введением больше чем 10 нм.
[56] Способ в соответствии с пунктом [34] или [35], который включает стадию введения тромбомодулина пациенту, у которого непосредственно перед введением оценка по шкале APACHE II меньше чем 35.
[57] Способ в соответствии с пунктом [34] или [35], который включает стадию внутривенного введения 0,005-1 мг/кг тромбомодулина пациенту с сепсисом, у которого он сопровождается коагулопатией, с частотой один раз в день в течение по меньшей мере четырех последовательных дней.
[58] Способ в соответствии с любым из пунктов [34]-[57], приведенным выше, где термин “непосредственно перед введением” означает период 24 часа, рассчитанный ретроспективно от начала введения тромбомодулина.
[59] Способ для терапевтического лечения и/или улучшения состояния при сепсисе, который включает стадию внутривенного введения 0,005-1 мг/кг тромбомодулина пациенту с сепсисом, сопровождающимся коагулопатией, с частотой один раз в день в течение по меньшей мере четырех последовательных дней.
[0030]
[60] Применение тромбомодулина в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для введения пациенту с сепсисом, у которого непосредственно перед введением значение международного нормализованного отношения (INR) в образце плазмы пациента больше чем 1,4.
[61] Применение в соответствии с пунктом [60], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением количество тромбоцитов больше чем 30000/мм3.
[62] Применение в соответствии с пунктом [60] или [61], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением уровень комплекса тромбин-антитромбин (TAT) 10 нг/мл или более.
[63] Применение в соответствии с любым из пунктов [60]-[62], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением количество тромбоцитов больше чем 30000/мм3 и оценка по шкале Sofa не больше чем 11.
[0031]
[64] Применение в соответствии с пунктом [60] или [61], приведенным выше, где лекарственное средство представляет собой лекарственное средство для внутривенного введения 0,005-1 мг/кг тромбомодулина пациенту с сопутствующей коагулопатией с частотой один раз в день в течение по меньшей мере четырех последовательных дней.
[65] Применение в соответствии с любым из пунктов [60]-[64], приведенным выше, где термин “непосредственно перед введением” означает период 24 часа, рассчитанный ретроспективно от начала введения тромбомодулина.
[66] Применение тромбомодулина в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для внутривенного введения 0,005-1 мг/кг тромбомодулина пациенту с сепсисом, сопровождающимся коагулопатией, с частотой один раз в день в течение по меньшей мере четырех последовательных дней.
[67] Применение тромбомодулина для получения лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для введения пациенту с сепсисом, у которого непосредственно перед введением значение международного нормализованного отношения (INR) в образце плазмы пациента больше чем 1,4.
[68] Применение в соответствии с пунктом [67], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением количество тромбоцитов больше чем 30000/мм3.
[0032]
[69] Применение в соответствии с пунктом [67] или [68], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением уровень комплекса тромбин-антитромбин (TAT) 10 нг/мл или больше.
[70] Применение в соответствии с любым из пунктов [67]-[69], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением количество тромбоцитов больше чем 30000/мм3 и оценка по шкале Sofa не больше чем 11.
[71] Применение в соответствии с пунктом [67] или [68], приведенным выше, где лекарственное средство представляет собой лекарственное средство для внутривенного введения 0,005-1 мг/кг тромбомодулина пациенту с сепсисом, у которого он сопровождается коагулопатией, с частотой один раз в день в течение по меньшей мере четырех последовательных дней.
[72] Способ в соответствии с любым из пунктов [67]-[71], приведенным выше, где термин “непосредственно перед введением” означает период 24 часа, рассчитанный ретроспективно от начала введения тромбомодулина.
[73] Применение тромбомодулина для получения лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для внутривенного введения 0,005-1 мг/кг тромбомодулина пациенту с сепсисом, сопровождающимся коагулопатией, с частотой один раз в день в течение по меньшей мере четырех последовательных дней.
[0033]
[74] Применение тромбомодулина в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для введения пациенту с сепсисом, у которого непосредственно перед введением уровень комплекса тромбин-антитромбин (TAT) не меньше чем 10 нг/мл.
[75] Применение тромбомодулина в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для введения пациенту с сепсисом, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) больше чем 229 пмоль/л.
[76] Применение тромбомодулина в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для введения пациенту с сепсисом, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) не меньше чем 250 пмоль/л.
[77] Применение тромбомодулина в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для введения пациенту с сепсисом, у которого непосредственно перед введением уровень активности протеина C не больше чем 40%.
[0034]
[78] Применение тромбомодулина в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для введения пациенту с сепсисом, у которого непосредственно перед введением уровень активности антитромбина III (AT III) меньше чем 70%.
[79] Применение тромбомодулина в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для введения пациенту с сепсисом, у которого размер микрочастиц (MP) непосредственно перед введением больше чем 10 нм.
[80] Применение тромбомодулина в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для введения пациенту с сепсисом, у которого непосредственно перед введением оценка по шкале APACHE II меньше чем 35.
[0035]
[81] Применение тромбомодулина в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для введения пациенту с сепсисом, имеющему непосредственно перед введением один-три типа органных дисфункций.
[82] Применение в соответствии с пунктом [81], где лекарственное средство представляет собой лекарственное средство для введения пациенту, который не является пациентом с сепсисом, имеющим органную дисфункцию, ограниченную печенью или почками.
[83] Применение в соответствии с пунктом [60] или [61], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением имеется один-три типа органных дисфункций.
[84] Применение в соответствии с пунктом [83], где лекарственное средство представляет собой лекарственное средство для введения пациенту, который не является пациентом с сепсисом, имеющим органную дисфункцию, ограниченную печенью или почками.
[0036]
[85] Применение тромбомодулина в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния при сепсисе, где лекарственное средство представляет собой лекарственное средство для введения пациенту с сепсисом, у которого непосредственно перед введением уровень D-димера не меньше чем 3500 нг/мл.
[86] Применение в соответствии с пунктом [60] или [61], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением уровень D-димера не меньше чем 3500 нг/мл.
[87] Применение в соответствии с пунктом [60] или [61], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) больше чем 229 пмоль/л.
[88] Применение в соответствии с пунктом [60] или [61], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) не меньше чем 250 пмоль/л.
[89] Применение в соответствии с пунктом [60] или [61], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением уровень активности протеина C не больше чем 40%.
[90] Применение в соответствии с пунктом [60] или [61], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением уровень активности антитромбина III (AT III) меньше чем 70%.
[91] Применение в соответствии с пунктом [60] или [61], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого размер микрочастиц (MP) непосредственно перед введением больше чем 10 нм.
[92] Применение в соответствии с пунктом [60] или [61], приведенным выше, где лекарственное средство представляет собой лекарственное средство для введения пациенту, у которого непосредственно перед введением оценка по шкале APACHE II меньше чем 35.
[93] Применение в соответствии с любым из пунктов [60]-[92], приведенным выше, где термин “непосредственно перед введением” означает период 24 часа, рассчитанный ретроспективно от начала введения тромбомодулина.
Эффект изобретения
[0037]
В соответствии с настоящим изобретением, сепсис, сопровождающийся коагулопатией, можно эффективно лечить и/или улучшить состояние.
Краткое описание чертежей
[0038]
Фиг. 1 показывает протокол испытания, используемый в примерах, где в общей сложности 816 случаев, подтвержденных не далее как за 24 часа до испытания как соответствующие критериям коагулопатии и органной дисфункции, указанным в Примере 1, рандомизировали в срок не более чем 12 часов, первое введение осуществляли не позднее, чем через 4 часа от времени рандомизации в принципе, и количество тромбоцитов, значение INR в плазме и т.п. снова измеряли во время первого введения в качестве момента времени непосредственно перед введением (исходный уровень). На чертеже R указывает момент времени завершения рандомизации.
Способы осуществления изобретения
[0039]
Далее конкретно объясняются некоторые предпочтительные варианты осуществления настоящего изобретения (предпочтительные способы осуществления изобретения, далее в описании также указаны как "варианты осуществления"). Однако объем настоящего изобретения не ограничивается конкретными вариантами осуществления, объясняемыми ниже.
[0040]
Тромбомодулин этого варианта осуществления предпочтительно известен как обладающий действием (1) селективного связывания с тромбином (2) для промотирования тромбином активации протеина C. Кроме того, предпочтительно, когда имеется подтверждение, что тромбомодулин, как правило, обладает (3) действием, продлевающим тромбиновое время, (4) действием, подавляющим агрегацию тромбоцитов, вызываемую тромбином, и/или (5) противовоспалительным действием. Такие действия, которыми обладает тромбомодулин, могут быть указаны как активности тромбомодулина.
[0041]
В качестве активностей тромбомодулина, тромбомодулин предпочтительно обладает действиями (1) и (2), указанными выше, и более предпочтительно обладает действиями (1)-(4), указанными выше. В качестве активностей тромбомодулина, тромбомодулин более предпочтительно обладает всеми из действий (1)-(5), которые указаны выше.
[0042]
Такое действие тромбомодулина, как связывание с тромбином, можно подтвердить методами исследований, описанными в различных известных публикациях, таких как Thrombosis and Haemostasis, 70(3):418-422 (1993) и The Journal of Biological Chemistry, 264, 9, pp,4872-4876 (1989). Что касается действия, промотирующего активацию тромбином протеина C, степень активности, промотирующей активацию протеина C, или присутствие или отсутствие такого действия легко можно подтвердить методами исследований, которые подробно описаны в различных известных публикациях, включая, например, публикацию не прошедшей экспертизу японской патентной заявки № 64-6219. Кроме того действие, продлевающее тромбиновое время, и/или действие, подавляющее агрегацию тромбоцитов, вызываемую тромбином, также можно легко подтвердить. Кроме того, противовоспалительное действие также можно подтвердить методами исследований, описанными в различных известных публикациях, включая, например, Blood, 112:3361-3670 (2008) и The Journal of Clinical Investigation, 115, 5:1267-1274 (2005).
[0043]
Тромбомодулин, используемый для настоящего изобретения, конкретно не ограничивается при условии, что он обладает активностью тромбомодулина. Тромбомодулин предпочтительно представляет собой растворимый тромбомодулин в условиях без поверхностно-активных веществ. Растворимость растворимого тромбомодулина в воде, такой как дистиллированная вода, используемая для инъекций (в отсутствие поверхностно-активного вещества, такого как Triton X-100 или полидоканол, и как правило, около нейтрального диапазона pH) предпочтительно составляет, например, 1 мг/мл или более, или 10 мг/мл или более; предпочтительно 15 мг/мл или более, или 17 мг/мл или более; более предпочтительно 20 мг/мл или более, 25 мг/мл или более, или 30 мг/мл или более; особенно предпочтительно 60 мг/мл или более. В некоторых случаях растворимость составляет, например, 80 мг/мл или более, или 100 мг/мл или более. Должно быть понятно, что для определения успешного растворения растворимого тромбомодулина простыми критериями служат прозрачный внешний вид раствора и отсутствие явно наблюдаемых нерастворимых веществ после растворения растворимого тромбомодулина и визуального осмотра раствора, например, прямо под белым светом в положении, соответствующем освещенности приблизительно 1000 люкс. Также можно наблюдать наличие или отсутствие какого-либо остатка после фильтрации.
[0044]
Молекулярная масса тромбомодулина не ограничивается при условии, что он обладает активностями тромбомодулина, как описано выше. Молекулярная масса предпочтительно составляет 100000 или меньше, более предпочтительно 90000 или меньше, еще более предпочтительно 80000 или меньше, наиболее предпочтительно 70000 или меньше, и молекулярная масса предпочтительно составляет 50000 или больше, наиболее предпочтительно 60000 или больше. Молекулярную массу растворимого тромбомодулина легко можно измерить обычными способами измерения молекулярной массы белка. Измерение методом масс-спектрометрии является предпочтительным, и более предпочтителен метод MALDI-TOF-MS. Для получения растворимого тромбомодулина, имеющего молекулярную массу в желаемом диапазоне, растворимый тромбомодулин, который получен путем культивирования трансформированной клетки, полученной путем трансфекции клетки-хозяина посредством ДНК, кодирующей растворимый тромбомодулин, с использованием вектора, можно подвергнуть фракционированию с использованием колоночной хроматографией или т.п., как описано ниже.
[0045]
Тромбомодулин, используемый для настоящего изобретения, предпочтительно включает аминокислотную последовательность, состоящую из аминокислотных остатков в положениях 19-132 SEQ ID NO: 1, которая известна как центральная часть тромбомодулиновых активностей человеческого тромбомодулина, и тромбомодулин конкретно не ограничивается при условии, что тромбомодулин включает аминокислотную последовательность, состоящую из аминокислотных остатков в положениях 19-132 of SEQ ID NO: 1. Аминокислотная последовательность, состоящая из аминокислотных остатков в положениях 19-132 SEQ ID NO: 1, может быть естественно или искусственно мутированной, при условии, что последовательность обладает действием промотировать активацию тромбином протеина C, т.е. одной из активностей тромбомодулина. В частности, последовательность может включать замену, делецию, или добавление одного или нескольких аминокислотных остатков в аминокислотной последовательности, состоящей из аминокислотных остатков в положениях 19-132 SEQ ID NO: 1. Приемлемый уровень мутации конкретно не ограничивается при условии, что аминокислотная последовательность обладает активностями тромбомодулина. Пример включает гомологию 50% или более, что касается аминокислотных последовательностей, и гомология предпочтительно составляет 70% или более, более предпочтительно 80% или более, еще более предпочтительно 90% или более, особенно предпочтительно 95% или более, и наиболее предпочтительно 98% или более. Такая мутированная аминокислотная последовательность, включающая замену, делецию или добавление одного или нескольких аминокислотных остатков, называется гомологичной мутированной последовательностью. Как описано ниже, эти мутированные аминокислотные последовательности можно легко получить обычными методами манипуляции с генами. Тромбомодулин конкретно не ограничивается при условии, что он имеет вышеуказанную последовательность и действие селективного связывания с тромбином, чтобы способствовать активации тромбином протеина C, по меньшей мере как тромбомодулин в целом, но тромбомодулин предпочтительно также обладает противовоспалительным действием.
[0046]
Аминокислотная последовательность SEQ ID NO: 3 включает мутацию Val, в качестве аминокислоты в положении 125 последовательности SEQ ID NO: 1, в Ala. Тромбомодулин, используемый для настоящего изобретения, также предпочтительно включает аминокислотную последовательность от положения 19 до 132 SEQ ID NO: 3.
[0047]
Как описано выше, хотя тромбомодулин, используемый для настоящего изобретения, конкретно не ограничивается при условии, что тромбомодулин имеет по меньшей мере аминокислотную последовательность от положения 19 до 132 SEQ ID NO: 1 или 3, или гомологичную ей мутированную последовательность, и включает по меньшей мере пептидную последовательность, обладающую активностями тромбомодулина, предпочтительные примеры тромбомодулина включают пептид, состоящий из последовательности от положения 19 до 132 или от 17 до 132 в любой из SEQ ID NO: 1 или SEQ ID NO: 3, и пептид, состоящий из мутированной последовательности, гомологичной вышеуказанной последовательности и имеющей по меньшей мере активности тромбомодулина. Пептид, состоящий из последовательности от положения 19 до 132 в любой из SEQ ID NO: 1 или SEQ ID NO: 3, является более предпочтительным. В другом варианте осуществления пептид, состоящий из мутированной последовательности, гомологичной последовательности от положения 19 до 132 или от 17 до 132 в любой из SEQ ID NO: 1 или SEQ ID NO: 3 и имеющей по меньшей мере активности тромбомодулина, является более предпочтительным.
[0048]
В другом варианте осуществления тромбомодулина в соответствии с настоящим изобретением тромбомодулин предпочтительно включает аминокислотную последовательность из положений 19-480 SEQ ID NO: 5, который конкретно не ограничивается при условии, что тромбомодулин включает аминокислотную последовательность от положения 19 до 480 SEQ ID NO: 5. Аминокислотная последовательность из положений 19-480 SEQ ID NO: 5 может представлять собой гомологичную ей мутированную последовательность, при условии, что последовательность обладает действием промотировать активацию тромбином протеина C, т.е. одной из активностей тромбомодулина.
[0049]
Последовательность SEQ ID NO: 7 включает мутацию Val, в качестве аминокислоты в положении 473 последовательности SEQ ID NO: 5, в Ala. Тромбомодулин, используемый для настоящего изобретения, также предпочтительно включает аминокислотную последовательность от положения 19 до 480 SEQ ID NO: 7.
[0050]
Как описано выше, хотя тромбомодулин, используемый для настоящего изобретения, конкретно не ограничивается при условии, что тромбомодулин имеет по меньшей мере последовательность от положения 19 до 480 в любой из SEQ ID NO: 5 или SEQ ID NO: 7, или гомологичную ей мутированную последовательность, и включает по меньшей мере пептидную последовательность, имеющую активности тромбомодулина, предпочтительные примеры тромбомодулина включают пептид, состоящий из последовательности от положения 19 до 480 или от 17 до 480 в любой из SEQ ID NO: 5 или SEQ ID NO: 7, и пептид, состоящий из мутированной последовательности, гомологичной вышеуказанной последовательности и имеющей по меньшей мере активности тромбомодулина. Пептид, состоящий из последовательности от положения 19 до 480 SEQ ID NO: 5 или 7 является более предпочтительным. В другом варианте осуществления пептид, состоящий из мутированной последовательности, гомологичной последовательности от положения 19 до 480 или от 17 до 480 в любой из SEQ ID NO: 5 или SEQ ID NO: 7 и имеющей по меньшей мере активности тромбомодулина, является более предпочтительным.
[0051]
В другом варианте осуществления тромбомодулина в соответствии с настоящим изобретением тромбомодулин предпочтительно включает аминокислотную последовательность от положения 19 до 515 SEQ ID NO: 9, который конкретно не ограничивается при условии, что тромбомодулин включает аминокислотную последовательность от положения 19 до 515 SEQ ID NO: 9. Аминокислотная последовательность от положения 19 до 515 SEQ ID NO: 9 может представлять собой гомологичную ей мутированную последовательность, при условии, что последовательность обладает действием промотировать активацию тромбином протеина C, т.е. активностью тромбомодулина.
[0052]
Аминокислотная последовательность SEQ ID NO: 11 включает мутацию Val, в качестве аминокислоты в положении 473 SEQ ID NO: 9, в Ala. Тромбомодулин, используемый для настоящего изобретения, также предпочтительно включает аминокислотную последовательность от положения 19 до 515 SEQ ID NO: 11.
[0053]
Как описано выше, хотя тромбомодулин, используемый для настоящего изобретения, конкретно не ограничивается при условии, что тромбомодулин имеет по меньшей мере последовательность от положения 19 до 515 в любой из SEQ ID NO: 9 или SEQ ID NO: 11, или гомологичную ей мутированную последовательность, и включает пептидную последовательность, имеющую по меньшей мере активности тромбомодулина, более предпочтительные примеры включают пептид, имеющий последовательность от положения 19 до 516, от 19 до 515, от 17 до 516 или от 17 до 515 в любой из SEQ ID NO: 9 или SEQ ID NO: 11, и пептид, состоящий из мутированной последовательности, гомологичной вышеуказанной последовательности и имеющей по меньшей мере активности тромбомодулина. Пептид, имеющий последовательность от положения 19 до 516, от 19 до 515, от 17 до 516 или от 17 до 515 SEQ ID NO: 9, является особенно предпочтительным. Их смесь также является предпочтительным примером. В другом варианте осуществления пептид, имеющий последовательность от положения 19 до 516, от 19 до 515, от 17 до 516 или от 17 до 515 SEQ ID NO: 11, является особенно предпочтительным. Их смесь также является предпочтительным примером. Кроме того пептид, состоящий из гомологичной им мутированной последовательности и имеющей по меньшей мере активности тромбомодулина, также является предпочтительным примером. Предпочтительно, когда тромбомодулин также обладает противовоспалительным действием.
[0054]
Пептид, имеющий гомологичную мутированную последовательность является таким, как описано выше, и означает пептид, который может включать замену, делецию или добавление по меньшей мере одного, т.е. одного или нескольких, предпочтительно нескольких (например, 1-20, предпочтительно 1-10, более предпочтительно 1-5, особенно предпочтительно 1-3) аминокислотных остатков в аминокислотной последовательности рассматриваемого пептида. Хотя приемлемый уровень мутации конкретно не ограничивается при условии, что пептид обладает активностями тромбомодулина, пример приемлемого уровня гомологии включает 50% или более, что касается аминокислотных последовательностей, и гомология может составлять предпочтительно 70% или более, более предпочтительно 80% или более, еще более предпочтительно 90% или более, особенно предпочтительно 95% или более, и наиболее предпочтительно 98% или более.
[0055]
Предпочтительные примеры тромбомодулина, используемого для настоящего изобретения, также включают пептид, состоящий из последовательности SEQ ID NO: 14 (462 аминокислотных остатка), пептид, состоящий из последовательности SEQ ID NO: 8 (272 аминокислотных остатка), и пептид, состоящий из последовательности SEQ ID NO: 6 (236 аминокислотных остатков), которые описаны в публикации не прошедшей экспертизу японской патентной заявки № 64-6219.
[0056]
Тромбомодулин, используемый для настоящего изобретения, конкретно не ограничивается при условии, что тромбомодулин имеет по меньшей мере аминокислотную последовательность от положения 19 до 132 в любой из SEQ ID NO: 1 или SEQ ID NO: 3. В качестве такого тромбомодулина предпочтительным является пептид, имеющий по меньшей мере аминокислотную последовательность от положения 19 до 480 в любой из SEQ ID NO: 5 или SEQ ID NO: 7, и более предпочтительным является пептид, имеющий по меньшей мере аминокислотную последовательность от положения 19 до 515 в любой из SEQ ID NO: 9 или SEQ ID NO: 11. Более предпочтительным примером пептида, имеющего по меньшей мере аминокислотную последовательность от положения 19 до 515 в любой из SEQ ID NO: 9 или SEQ ID NO: 11, является пептид, состоящий из последовательности от положения 19 до 516, от 19 до 515, от 19 до 514, от 17 до 516, от 17 до 515 или от 19 до 514 в любой из SEQ ID NO: 9 или SEQ ID NO: 11. Кроме того, смесь пептидов, каждый из которых состоит из последовательности от положения 19 до 516, от 19 до 515, от 19 до 514, от 17 до 516, от 17 до 515 или от 17 до 514 в любой из SEQ ID NO: 9 или SEQ ID NO: 11, также является предпочтительным примером.
[0057]
Для одного варианта осуществления, хотя тромбомодулин конкретно не ограничивается при условии, что он представляет собой тромбомодулин, описанный выше, пример включает растворимый тромбомодулин. Для другого варианта осуществления пример включает человеческий тромбомодулин. Для еще одного варианта осуществления в качестве примера можно привести растворимый тромбомодулин человека. Еще для одного варианта осуществления в качестве примера можно привести тромбомодулин альфа (продукт генной рекомбинации). Тромбомодулин альфа (продукт генной рекомбинации) является активным ингредиентом Рекомодулина (зарегистрированная торговая марка), который одобрен в качестве фармацевтического препарата в Японии. Тромбомодулин альфа (продукт рекомбинации генов) также имеет название АРТ-123.
[0058]
В случае вышеуказанной смеси соотношение в смеси пептида, который начинается с положения 17, и пептида, который начинается с положения 19, для каждой из SEQ ID NO: 9 и 11 составляет, например, от 30:70 до 50:50, предпочтительно от 35:65 до 45:55.
[0059]
Кроме того, соотношение в смеси пептида, который заканчивается в положении 514, пептида, который заканчивается в положении 515, и пептида, который заканчивается в положении 516, для каждой из SEQ ID NO: 9 и 11 составляет, например, от 0:0:100 до 0:90:10, или от 0:70:30 до 10:90:0, или от 10:0:90 до 20:10:70, если необходимо.
Соотношение пептидов в смеси можно определить обычным методом.
[0060]
Последовательность из положений 19-132 в SEQ ID NO: 1 соответствует последовательности из положений 367-480 в SEQ ID NO: 9, а последовательность из положений 19-480 в SEQ ID NO: 5 соответствует последовательности из положений 19-480 в SEQ ID NO: 9. Кроме того последовательность из положений 19-132 в SEQ ID NO: 3 соответствует последовательности из положений 367-480 в SEQ ID NO: 11, а последовательность из положений 19-480 в SEQ ID NO: 7 соответствует последовательности из положений 19-480 в SEQ ID NO: 11. Кроме того, все последовательности из положений 1-18 в SEQ ID NO: 1, 3, 5, 7, 9 и 11 являются идентичными последовательностями.
[0061]
Как описано ниже, эти тромбомодулины в соответствии с настоящим изобретением можно получить из трансформированных клеток, полученных путем трансфекции клеток-хозяев при помощи ДНК, кодирующей каждый пептид (в частности, нуклеотидных последовательностей SEQ ID NO: 2, 4, 6, 8, 10, 12 и т.п.), с использованием вектора.
[0062]
Достаточно, чтобы эти пептиды имели только указанные выше аминокислотные последовательности, и сахарная цепь может быть присоединена или не присоединена, что конкретно не ограничивается. В методах генной манипуляции тип сахарной цепи, положение, в которое добавляется сахарная цепь, и уровень ее добавления различаются в зависимости от типа используемых клеток-хозяев, и могут использоваться любые методы. Что касается положения связывания сахарной цепи и ее типа, факты, описанные в не прошедшей экспертизу японской патентной публикации № 11-341990, известны, и к тромбомодулинам в соответствии с настоящим изобретением могут быть добавлены одинаковые сахарные цепи в одном и том же положении. Два типа N-связанных сахарных цепей, фукозильного биантеннарного типа и фукозильного триантеннарного типа, могут связываться с тромбомодулином этого варианта осуществления, и их соотношение составляет, например, от 100:0 до 60:40, предпочтительно от 95:5 до 60:40, более предпочтительно от 90:10 до 70:30. Соотношение этих сахарных цепей можно измерить на двумерной карте сахарных цепей, описанной в Biochemical Experimental Methods, Vol. 23, Methods of Researches on Glycoprotein Sugar Chains, Japan Scientific Societies Press (1990) и т.п. Кроме того, при исследовании сахарной композиции тромбомодулина этого варианта осуществления, обнаружены нейтральные сахариды, аминосахариды и сиаловая кислота, содержание которых может составлять, каждого независимо, например, от 1 до 30%, предпочтительно от 2 до 20%, более предпочтительно от 5 до 10% по массе в расчете на содержании белка. Содержание сахара можно измерить методами, описанными в Lecture of New Biochemical Experiments, Vol. 3, Sugar I, Glycoprotein (Book 1), Tokyo Kagaku Dojin (1990) (нейтральные сахариды: метод фенол-серной кислоты, аминосахариды: метод Элсона-Моргана, сиаловая кислота: метод периодной кислоты-резорцина).
[0063]
Хотя способ для получения тромбомодулина не ограничивается его получением путем генетической манипуляции, как описано ниже, в качестве сигнальной последовательности, которая может использоваться для экспрессии, когда тромбомодулин получают путем манипуляции с генами, можно использовать нуклеотидную последовательность, кодирующую аминокислотную последовательность из положений 1-18 в SEQ ID NO: 9, и нуклеотидную последовательность, кодирующую аминокислотную последовательность из положений 1-16 в SEQ ID NO: 9, а также можно использовать другие известные сигнальные последовательности, такие как сигнальная последовательность человеческого тканевого активатора плазминогена (Международная публикация WO88/9811).
[0064]
Когда последовательность ДНК, кодирующую тромбомодулин, вводят в клетку-хозяин, примеры предпочтительных способов включают способ включения последовательности ДНК, кодирующей тромбомодулин, предпочтительно в вектор, более предпочтительно в вектор экспрессии, способный экспрессироваться в клетках животных, а затем введение ДНК с вектором. Вектор экспрессии представляет собой молекулу ДНК, которая состоит из промоторной последовательности, последовательности для добавления сайта связывания рибосомы к мРНК, последовательности ДНК, кодирующей белок, который должен быть экспрессирован, сигнала сплайсинга, последовательности терминатора для терминации транскрипции, последовательности точки начала репликации и т.п. Примеры предпочтительного вектора для экспрессии в клетках животных включают pSV2-X, описанный Mulligan R.C. et al. (Proc. Natl. Acad. Sci. USA, 78, 2072 (1981)); pBP69T (69-6), описанный Howley P.M. et al. (Methods in Emzymology, 101, 387 (1983), Academic Press) и т.п. Кроме того, существует также другой предпочтительный вариант осуществления, в котором ДНК вводят в вектор экспрессии, экспрессируемый в микроорганизме.
[0065]
Примеры клетки-хозяина, которую можно использовать для получения таких пептидов, как указано выше, включают клетки животных. Примеры клеток животных включают клетки яичника китайского хомячка (CHO), клетки COS-1, клетки COS-7, клетки VERO (ATCC CCL-81), клетки BHK, клетки MDCK, полученные из почек собак, клетки AV-12-664 хомяка и т.п. Кроме того, примеры клеток-хозяев, полученных от человека, включают клетки HeLa, клетки WI38, клетки 293 человека и клетки PER.C6. Из этих клеток очень распространены и предпочтительны клетки СНО, а среди клеток СНО более предпочтительны клетки СНО с дефицитом дигидрофолатредуктазы (DHFR).
[0066]
В процессе манипуляции с генами или в процессе получения пептидов также часто используются такие микроорганизмы, как Escherichia coli. Предпочтительно используют систему вектор-хозяин, подходящую для каждого способа, и подходящую векторную систему также можно выбрать для вышеуказанных клеток-хозяев. Ген тромбомодулина, используемый в генно-рекомбинантном методе, был клонирован. Были раскрыты примеры получения тромбомодулина таким генно-рекомбинантным методом, и, кроме того, известны способы очистки тромбомодулина для получения его очищенного продукта (публикации не прошедших экспертизу японских патентных заявок №№ 64-6219, 2-255699, 5-213998, 5-310787, 7-155176 и J. Biol. Chem., 264: 10351-10353 (1989)). Поэтому тромбомодулин, используемый в настоящем изобретении, можно получить с использованием способов, описанных в вышеуказанных отчетах, или аналогичными способами. Например, японская патентная публикация № 64-6219 раскрывает штамм DH5 Escherichia coli K-12 (номер доступа АТСС 67283), содержащий плазмиду pSV2TMJ2, которая содержит ДНК, кодирующую полноразмерный тромбомодулин. Этот штамм, повторно депонированный в бывшем National Institute of Bioscience and Human-Technology (в настоящее время Independent Administrative Institution, National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary) (Escherichia coli DH5/pSV2TMJ2) (FERM BP-5570), также можно использовать. Тромбомодулин по настоящему изобретению может быть получен известным методом манипуляции с генами с использованием ДНК, кодирующей полноразмерный тромбомодулин, в качестве исходного вещества.
[0067]
Тромбомодулин этого варианта осуществления можно получить обычным известным способом или подобным способом. Например, можно сослаться на вышеуказанный способ Yamamoto et al. (публикация не прошедшей экспертизу японской патентной заявки № 64-6219) или способ, описанный в публикации не прошедшей экспертизу японской патентной заявки № 5-213998. В частности, например, ДНК, кодирующую аминокислотную последовательность SEQ ID NO: 9, получают из человеческого гена тромбомодулина генно-инженерным методом, и ее можно далее модифицировать при необходимости. Для такой модификации, чтобы получить ДНК, кодирующую аминокислотную последовательность SEQ ID NO: 11 (которая, в частности, состоит из нуклеотидной последовательности SEQ ID NO: 12), кодоны, кодирующие аминокислоту в положении 473 в аминокислотной последовательности SEQ ID NO: 9 (в частности, нуклеотид в положении 1418 в SEQ ID NO: 10), подвергают мутации с использованием сайт-направленного мутагенеза в соответствии со способом, описанным Zoller M.J. et al. (Method in Enzymology, 100:468-500 (1983), Academic Press). Например, с использованием синтетической ДНК для мутации, имеющей нуклеотидную последовательность SEQ ID NO: 13, нуклеотид T в положении 1418 в SEQ ID NO: 10 можно преобразовать в нуклеотид C для получения мутированной ДНК.
[0068]
ДНК, полученную, как описано выше, включают, например, в клетки яичника китайского хомячка (СНО) для получения трансформированных клеток. Такие клетки подвергают соответствующему отбору, и очищенный известным способом тромбомодулин может быть получен из культурального раствора, полученного путем культивирования выбранной клетки. Как описано выше, ДНК (SEQ ID NO: 10), кодирующая аминокислотную последовательность SEQ ID NO: 9, предпочтительно трансфицируют в вышеуказанную клетку-хозяин.
[0069]
Способ получения тромбомодулина этого варианта осуществления не ограничивается вышеуказанным способом. Например, также возможно экстрагировать и очищать тромбомодулин из мочи, крови, других жидкостей организма и т.п. или экстрагировать и очищать тромбомодулин из ткани, продуцирующей тромбомодулин, или культуры вышеуказанной ткани и т.п. Кроме того, тромбомодулин, при необходимости, может быть дополнительно подвергнут обработке расщеплением с использованием протеазы.
[0070]
Для культивирования вышеуказанной трансформированной клетки можно использовать среду, используемую для обычной клеточной культуры, и предпочтительно культивировать трансформированную клетку в различных средах заранее, чтобы выбрать оптимальную среду. Например, известную среду, такую как среда MEM, среда DMEM и среда 199, можно использовать в качестве базовой среды, а также можно использовать еще более улучшенную среду или среду с добавками для различных сред. Примеры метода культивирования включают культивирование в сывороточной среде, где осуществляют культивирование в среде, содержащей сыворотку крови, и культивирование без сыворотки, где культивирование осуществляют в среде, не содержащей сыворотки крови. Хотя метод культивирования конкретно не ограничивается, культивирование в бессывороточной среде является предпочтительным.
[0071]
Когда сыворотку добавляют к среде в случае культивирования в сывороточной среде, предпочтительна бычья сыворотка. Примеры бычьей сыворотки включают фетальную бычью сыворотку, бычью сыворотку новорожденных, телячью сыворотку, бычью сыворотку взрослого животного и т.п., и любой из этих примеров можно использовать, при условии, что сыворотка подходит для клеточной культуры. В качестве бессывороточной среды, используемой в бессывороточной культуре, можно использовать коммерчески доступные среды. На рынке имеются бессывороточные среды, подходящие для различных клеток, и, например, для CHO клеток CD-CHO, CHO-S-SFMII и CHO-III-PFM продаются компанией Invitrogen, а среды IS CHO, IS CHO-CD и т.п. продаются компанией Irvine Scientific. Эти среды можно использовать без какой-либо обработки, или их можно улучшить или дополнить добавками и использовать. Примеры бессывороточной среды также включают среду DMEM, содержащую по 5 мг/л каждого из инсулина, трансферрина и селенистой кислоты. Как описано выше, среда конкретно не ограничивается, при условии, что ее можно использовать для получения тромбомодулина этого варианта осуществления. Способ культивирования конкретно не ограничивается, и можно использовать любое из периодического культивирования, повторяющегося периодического культивирования, периодического культивирования с подпиткой, перфузионного культивирования и т.п.
[0072]
Когда тромбомодулин, используемый для настоящего изобретения, получают вышеуказанным способом культивирования клеток, можно наблюдать отличие в N-концевой аминокислоте из-за посттрансляционной модификации белка. Например, аминокислота в положении 17, 18, 19 или 22 в SEQ ID NO: 9 может служить в качестве N-концевой аминокислоты. Кроме того, например, N-концевую аминокислоту можно модифицировать таким образом, чтобы заменить глутаминовую кислоту в положении 22 на пироглутаминовую кислоту. Предпочтительно, когда аминокислота в положении 17 или 19 служит в качестве N-концевой аминокислоты, и более предпочтительно, когда аминокислота в положении 19 служит в качестве N-концевой аминокислоты. Кроме того, также существует еще один вариант осуществления, в котором аминокислота в положении 17 служит в качестве N-концевой аминокислоты, что является предпочтительным вариантом осуществления. Что касается модификации, отличия и т.п., указанных выше, аналогичные примеры можно указать для последовательности SEQ ID NO: 11.
[0073]
Кроме того, когда растворимый тромбомодулин получают с использованием ДНК, имеющей нуклеотидную последовательность SEQ ID NO: 10, можно наблюдать отличие C-концевой аминокислоты, и может быть получен пептид короче на один аминокислотный остаток. В частности, C-концевую аминокислоту можно модифицировать таким образом, чтобы аминокислота в положении 515 служила в качестве C-концевой аминокислоты, и, кроме того, положение 515 амидируют. Кроме того, может быть получен пептид короче на два аминокислотных остатка. В частности, аминокислота в положении 514 может служить в качестве C-концевой аминокислоты. Поэтому можно получить любой из пептидов, имеющих существенное отличие N-концевой аминокислоты и C-концевой аминокислоты или их смесь. Предпочтительно, когда аминокислота в положении 515 или аминокислота в положении 516 служит в качестве C-концевой аминокислоты, и более предпочтительно, когда аминокислота в положении 516 служит в качестве C-концевой аминокислоты. Кроме того также существует еще один вариант осуществления, в котором аминокислота в положении 514 служит в качестве C-концевой аминокислоты, что является предпочтительным вариантом осуществления. Что касается модификации, отличия и т.п., описанных выше, то же применимо к ДНК, имеющей нуклеотидную последовательность SEQ ID NO: 12.
[0074]
Тромбомодулин, полученный способом, описанным выше, может представлять собой смесь пептидов, которые различаются по N-концевым и C-концевым аминокислотам. Конкретные примеры включают смесь пептидов, имеющих последовательности, включающие положения от 19 до 516, положения от 19 до 515, положения от 19 до 514, положения от 17 до 516, положения от 17 до 515 и положения от 17 до 514 в SEQ ID NO: 9.
[0075]
Затем можно осуществить выделение и очистку тромбомодулина из культурального супернатанта или культуры, полученной, как описано выше, известными методами [edited by Takeichi Horio, Tanpakushitsu/Koso no Kiso Jikken Ho (Fundamental Experimental Methods for Proteins and Enzymes) (1981)]. Например, предпочтительно использовать ионообменную хроматографию или адсорбционную хроматографию, в которой используется взаимодействие между тромбомодулином и хроматографическим носителем, на котором иммобилизованы функциональные группы, имеющие заряд, противоположный заряду тромбомодулина. Другим предпочтительным примером является аффинная хроматография с использованием специфического сродства к тромбомодулину. Предпочтительные примеры адсорбента включают тромбин, который является лигандом тромбомодулина, и антитело против тромбомодулина. В качестве антитела можно использовать антитела против тромбомодулина, обладающие соответствующими свойствами или распознающие соответствующие эпитопы. Примеры включают, например, антитела, описанные в японской патентной публикации (Kokoku) № 5-42920, публикациях не прошедших экспертизу японских патентных заявок №№ 64-45398 и 6-205692 и т.п. Другие примеры включают гель-фильтрационную хроматографию и ультрафильтрацию, в которых используется молекулярный размер тромбомодулина. Другие примеры дополнительно включают гидрофобную хроматографию, в которой используется гидрофобная связь между хроматографическим носителем, на котором иммобилизованы гидрофобные группы, и гидрофобной частью тромбомодулина. Кроме того, гидроксиапатит может использоваться в качестве носителя в адсорбционной хроматографии, примеры которой включают, например, описанные в публикации не прошедшей экспертизу японской патентной заявке № 9-110900. При необходимости эти средства можно использовать в комбинации. Хотя степень очистки может быть выбрана в зависимости от цели использования и т.п., желательно очищать тромбомодулин до тех пор, пока не будет получена одна полоса в результате электрофореза, предпочтительно SDS-PAGE, или пока не будет получен единственный пик выделенного и очищенного продукта в результате гель-фильтрационной ВЭЖХ или обращенно-фазовой ВЭЖХ. Должно быть понятно, что при использовании двух или более типов тромбомодулинов предпочтительно получение по существу только полос тромбомодулинов, и не требуется получение одной единственной полосы.
[0076]
Конкретные примеры способа очистки, используемого в настоящем изобретении, включают способ очистки с использованием в качестве критерия активностей тромбомодулина, например, способ очистки, включающий грубую очистку культурального супернатанта или продукта культивирования с использованием ионообменной колонки Q-Sepharose Fast Flow для сбора фракции, обладающей активностями тромбомодулина; затем очистку фракции на аффинной колонке, колонке с DIP-тромбин-агарозой (диизопропилфосфорилтромбин агароза) в качестве основной стадии очистки для выделения фракции, обладающей сильными активностями тромбомодулина; затем концентрирование выделенной фракции с последующей гель-фильтрацией для получения тромбомодулиновой активной фракции в виде очищенного продукта (Gomi K. et al., Blood, 75: 1396-1399 (1990)). Примером активностей тромбомодулина, используемых в качестве критерия, является промотирование активации тромбином протеина C. Другие предпочтительные примеры способа очистки будут проиллюстрированы ниже.
[0077]
Выбирают подходящую ионообменную смолу, имеющую хорошие условия для адсорбции тромбомодулина, и осуществляют очистку методом ионообменной хроматографии. Особенно предпочтительным примером является способ, включающий использование Q-Sepharose Fast Flow, уравновешенной Tris-HCl буфером 0,02 моль/л (pH 7,4), содержащим 0,18 моль/л NaCl. После промывки, если требуется, можно осуществить элюирование, например, с использованием 0,02 моль/л Tris-HCl буфера (pH 7,4), содержащего 0,3 моль/л NaCl, для получения тромбомодулина в виде грубо очищенного продукта.
[0078]
Затем, например, вещество, обладающее специфическим сродством к тромбомодулину, может быть иммобилизовано на смоле для осуществления очистки методом аффинной хроматографии. Предпочтительные примеры включают колонку с DIP-тромбин-агарозой и колонку с моноклональными антителами против тромбомодулина. В случае колонки с DIP-тромбин-агарозой, колонку предварительно уравновешивают 20 ммоль/л Tris-HCl буфера (pH 7,4), содержащего 100 ммоль/л NaCl и 0,5 ммоль/л хлорида кальция, и вышеуказанный предварительно очищенный продукт затем загружают в колонку, промывают при необходимости и затем элюируют с использованием, например, 20 ммоль/л Tris-HCl буфера (pH 7,4), содержащего 1,0 моль/л NaCl и 0,5 ммоль/л хлорида кальция, с получением тромбомодулина в виде очищенного продукта. В случае колонки с моноклональными антителами против тромбомодулина, пример способа включает: контактирование раствора моноклональных антител против тромбомодулина в 0,1 моль/л буфере NaHCO3 (pH 8,3), содержащем 0,5 моль/л NaCl, с сефарозой 4FF (GE Health Care Biosciences), предварительно CNBr-активированной, с получением смолы Sepharose 4FF, связанной с моноклональными антителами против тромбомодулина, предварительное уравновешивание смолы, которой заполняют колонку, например, фосфатным буфером 20 ммоль/л (pH 7,3), содержащим 0,3 моль/л NaCl, промывку при необходимости, а затем осуществление элюирования глицин-HCl буфером 100 ммоль/л (pH 3,0), содержащим 0,3 моль/л NaCl. Элюат можно нейтрализовать подходящим буфером с получением продукта в виде очищенного продукта.
[0079]
Затем полученный очищенный продукт доводят до pH 3,5 и затем загружают в катионообменник, предпочтительно SP-Sepharose FF (GE Health Care Biosciences) в качестве сильного катионообменника, уравновешенный 100 ммоль/л буфера глицин-HCl (pH 3,5), содержащего 0,3 моль/л NaCl, и промывку осуществляют тем же буфером с получением неадсорбированной фракции. Полученную фракцию нейтрализуют подходящим буфером с получением высокоочищенного продукта. Эти продукты предпочтительно концентрируют ультрафильтрацией.
[0080]
Кроме того, также предпочтителен обмен буфера гель-фильтрацией. Например, высокоочищенный продукт, концентрированный ультрафильтрацией, можно загрузить в колонку Sephacryl S-300 или колонку S-200, уравновешенную фосфатным буфером 20 ммоль/л (pH 7,3), содержащим 50 ммоль/л NaCl, и затем осуществить фракционирование с использованием 20 ммоль/л фосфатного буфера (pH 7,3), содержащего 50 ммоль/л NaCl. Активность, направленная на промотирование активации тромбином протеина C, может быть подтверждена для сбора активной фракции и, таким образом, получения высокоочищенного продукта путем буферного обмена. Для повышения безопасности высокоочищенный продукт, полученный, как описано выше, предпочтительно фильтруют через соответствующий фильтр для удаления вирусов, такой как Planova 15N (Asahi Kasei Medical Co., Ltd.), а затем полученный продукт можно концентрировать ультрафильтрацией до желаемой концентрации. Наконец, продукт предпочтительно фильтруют через фильтр для асептической фильтрации.
[0081]
В качестве одного варианта осуществления настоящего изобретения обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением значение международного нормализованного отношения (INR) в образце плазмы пациента больше чем 1,4.
[0082]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением значение международного нормализованного отношения (INR) в образце плазмы пациента больше чем 1,4, и количество тромбоцитов в образце, полученном от пациента непосредственно перед введением, больше чем 30000/мм3.
[0083]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния при сепсисе, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для внутривенного введения 0,005-1 мг/кг тромбомодулина пациенту с сепсисом с частотой один раз в день в течение по меньшей мере четырех последовательных дней.
[0084]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением значение международного нормализованного отношения (INR) в образце плазмы пациента больше чем 1,4, и уровень комплекса тромбин-антитромбин (TAT) в образце, полученном от пациента непосредственно перед введением, 10 нг/мл или более.
[0085]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, который не является пациентом, очаг инфекции у которого не контролируется надлежащим образом.
[0086]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением значение международного нормализованного отношения (INR) в образце плазмы пациента больше чем 1,4, количество тромбоцитов в образце, полученном от пациента непосредственно перед введением, больше чем 30000/мм3, и оценка по шкале Sofa непосредственно перед введением не больше чем 11.
[0087]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень комплекса тромбин-антитромбин (TAT) в образце плазмы пациента не меньше чем 10 нг/мл.
[0088]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) в образце плазмы пациента больше чем 229 пмоль/л.
[0089]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) в образце плазмы пациента не меньше чем 250 пмоль/л.
[0090]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень активности протеина C в образце плазмы пациента не больше чем 40%.
[0091]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением уровень активности антитромбина III (AT III) в образце плазмы пациента меньше чем 70%.
[0092]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением размер микрочастиц (MP) в образце плазмы пациента больше чем 10 нм.
[0093]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением оценка по шкале APACHE II меньше чем 35.
[0094]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением имеется один-три типа органных дисфункций.
[0095]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, который не является пациентом с сепсисом, имеющим органную дисфункцию, ограниченную печенью или почками, и который имеет непосредственно перед введением один-три типа органных дисфункций.
[0096]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением значение международного нормализованного отношения (INR) больше чем 1,4 и количество тромбоцитов непосредственно перед введением больше чем 30000/мм3, и у которого непосредственно перед введением имеется один-три типа органных дисфункций.
[0097]
В другом варианте осуществления настоящего изобретения также обеспечивается лекарственное средство для терапевтического лечения и/или улучшения состояния пациента с сепсисом, включающее тромбомодулин в качестве активного ингредиента, которое предназначено для введения пациенту, у которого непосредственно перед введением значение международного нормализованного отношения (INR) больше чем 1,4 и количество тромбоцитов непосредственно перед введением больше чем 30000/мм3, и который не является пациентом с сепсисом, имеющим органную дисфункцию, ограниченную печенью или почками, и имеет непосредственно перед введением один-три типа органных дисфункций.
[0098]
Термин непосредственно перед введением, используемый в определениях вариантов осуществления настоящего изобретения, означает период 24 часа, предпочтительно 12 часов, более предпочтительно 8 часов, еще более предпочтительно 4 часа, особенно предпочтительно 2 часа, рассчитанный ретроспективно от момента времени начала введения тромбомодулина. Однако, когда подтверждается, что пациент удовлетворяет вышеуказанным условиям, при этом образец плазмы пациента получен в период 24-48 часов, рассчитанный ретроспективно от момента начала введения, также может достигаться высокая эффективность у пациента.
[0099]
Что касается терапевтического лечения и/или улучшения состояния при сепсисе, примеры предпочтительных эффектов включают, например, "предотвращение смерти пациента от сепсиса". Примеры также включают "предотвращение ухудшения общего состояния пациента, связанного с сепсисом".
Что касается терапевтического лечения и/или улучшения состояния при сепсисе, примеры предпочтительных эффектов также включают, например, "снижение уровня смертности пациентов с сепсисом".
[0100]
Повышение уровня D-димера в крови, который является маркером свертывания крови, может указывать на развивающийся фибринолиз (вторичный фибринолиз или фибринолиз) и т.п., а также указывать на образование фибриновых тромбов, что является признаком других состояний, сопровождающих тромбоэмболию и гиперкоагуляцию. Предпочтительно, чтобы наблюдалось снижение концентрации D-димера в крови или подавление ее повышения, когда лекарственное средство по настоящему изобретению вводят пациенту, по сравнению с тем, когда лекарственное средство не вводят.
[0101]
Комплекс тромбин-антитромбин (ТАТ), который является маркером свертывания крови, представляет собой комплекс, состоящий из тромбина и его типичного ингибитора, антитромбина, связывающихся вместе в соотношении 1:1. Обычно при активации коагуляции часть тромбина быстро связывается с антитромбином с образованием ТАТ. Концентрация ТАТ в крови обычно составляет меньше чем около 3-4 нг/мл. Измеряя концентрацию ТАТ в крови, можно узнать степень активации свертывания во время сбора крови. Предпочтительно, чтобы наблюдалось снижение концентрации ТАТ в крови или подавление ее повышения, когда лекарственное средство по настоящему изобретению вводят пациенту, по сравнению с тем, когда лекарственное средство не вводят.
[0102]
Фрагмент протромбина 1+2 (F1+2) также известен как маркер активации свертывания, как и ТАТ, и представляет собой пептид, высвобождающийся из протромбина во время превращения протромбина в тромбин. Предпочтительно, чтобы наблюдалось снижение концентрации фрагмента протромбина 1+2 в крови или подавление ее увеличения, когда лекарственное средство по настоящему изобретению вводят пациенту, по сравнению с тем, когда лекарственное средство не вводят.
[0103]
Предпочтительно, чтобы при введении лекарственного средства по настоящему изобретению пациенту наблюдалось увеличение количества тромбоцитов или подавление его снижения, по сравнению с тем, когда лекарственное средство не вводят.
[0104]
Антитромбин III (AT III) является одним из физиологических антикоагулянтов, и он связывается с фактором свертывания крови, таким как фактор активации X и фактор активации II (тромбин), в соотношении 1:1, чтобы ингибировать его действие и, таким образом, проявлять антикоагулянтное действие.
[0105]
Микрочастицы (MP) представляют собой мембранные везикулы, образованные из различных клеток, таких как тромбоциты, моноциты и эндотелиальные клетки сосудов, и, как известно, обладают действием, способствующим свертыванию крови, и промотирующим воспалительную реакцию действием.
[0106]
Сепсис, на который ссылаются в этом варианте осуществления, известен как тяжелое системное инфекционное заболевание, при котором микроорганизмы непрерывно или периодически проникают в кровь из очага инфекции, и это заболевание вызывается таким заболеванием, как инфекционные заболевания, злокачественные опухоли, цирроз печени, почечная недостаточность, диабет и дистоция, или терапевтическим лечением травмы или заболевания, таким как использование постоянного катетера, инфузионного устройства, диализа и т.п. и трахеостомии. Если симптомы усиливаются, системный шок индуцируется септическим шоком, т.е. быстрым снижением артериального давления и недостаточностью периферического кровообращения, а к летальности приводит дисфункция жизненно важных органов, таких как легкие, почки, печень, сердце, пищеварительный тракт и центральная нервная система. В качестве осложнения, сопровождающего сепсис, можно указать индуцированный респираторный дистресс-синдром взрослых (ARDS), характеризующийся отеком стромы легкого, кровоизлиянием и острой дыхательной недостаточностью из-за обструкции легочных капилляров, связанной с DIC или активацией нейтрофилов и их миграцией и аккумуляцией в паренхиме легких, что приводит к очень плохому прогнозу.
[0107]
Сепсис, на который ссылаются в этом варианте осуществления, представляет собой синдром системного воспалительного ответа (SIRS), индуцированный инфекцией. Более конкретно, он включает патологическое состояние, которое соответствует, помимо наличия инфекции, двум или более признакам SIRS ((1) температура тела >38°C или <36°C, (2) частота сердечных сокращений > 90/мин, (3) частота дыхания > 20/мин, или PaCO2 <32 торр, и (4) количество лейкоцитов >12000/мкл или <4000/мкл, или бандемия > 10%), и сепсис можно в основном диагностировать на основании такого патологического состояния.
[0108]
Существует несколько методов диагностики сепсиса, и они кратко изложены в Levy M. et al., Crit. Care Med., 31:1250-1256. Например, существуют способы, основанные на диагнозе, поставленном практикующим врачом, и способы с использованием тестовых значений и т.п. Примеры последних включают метод, при котором наблюдается соответствие двум признаком из четырех: (1) температура тела >38°C или <36°C, (2) частота сердечных сокращений >90/мин, (3) частота дыхания >20/мин, или необходимо искусственное дыхание, и (4) количество лейкоцитов >12000/мкл или <4000/мкл, или бандемия >10%, диагноз SIRS установлен, и SIRS, для которого подтвержден или подозревается микроорганизм в качестве его причины, диагностируют как сепсис [LaRosa S., the homepage of The Cleveland Clinic]. Другой метод, аналогичный описанному выше, описан в Members of the American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: Crit. Care Med., 20, 864-874 (1992).
[0109]
Примеры симптомов сепсиса включают, например, бактериемию, септицемию, синдром системного воспалительного ответа (SIRS), сепсис (SIRS, для которого подтвержден или подозревается микроорганизм в качестве его причины), тяжелый сепсис, септический шок, неустранимый септический шок и синдром полиорганной дисфункции (далее также указан как MODS) (Harrison's Principles of Internal Medicine, 15th edition of original work, Section 124, pp,828-833, Medical Science International, Ltd.). Вышеуказанные состояния являются примерами симптомов, на которые эффективно действует лекарственное средство по настоящему изобретению для терапевтического лечения и/или улучшения состояния.
[0110]
Хотя сепсис конкретно не ограничивается при условии, что заболевание диагностировано как сепсис на основании указанных выше диагностических критериев, объектом применения лекарственного средства по настоящему изобретению является сепсис, сопровождающийся аномальной коагуляцией (сепсис с коагулопатией). Примеры показателя коагулопатии включают, например, INR. Хотя коагулопатия конкретно не ограничивается при условии, что INR в образце плазмы, полученном от пациента, больше чем 1,2, предпочтительно он больше чем 1,3, более предпочтительно больше чем 1,4.
[0111]
Кроме того в качестве показателя коагулопатии при сепсисе, сопровождающемся коагулопатией, можно также указать аномальное снижение числа тромбоцитов (например, тромбоцитопения) вместо или помимо INR. Минимальное стандартное значение составляет, например, 20000/мм3, 25000/мм3 или 30000/мм3, а максимальное стандартное значение составляет, например, 200000/мм3, 180000/мм3 или 150000/мм3. Предпочтительный диапазон, указывающий на аномальное снижение числа тромбоцитов, может представлять собой диапазон числа тромбоцитов не меньше чем 30000/мм3 и меньше чем 150000/мм3. Стандартом, указывающим на аномальное снижение числа тромбоцитов, может быть также снижение числа тромбоцитов больше чем на 30% за 24 часа.
[0112]
В качестве показателя коагулопатии при сепсисе, сопровождающемся коагулопатией, аномальное повышение уровня комплекса тромбин-антитромбин (TAT) также можно указать вместо или помимо INR. Минимальное стандартное значение составляет, например, 4 нг/мл, 8 нг/мл, 10 нг/мл, или 12 нг/мл, а максимальное стандартное значение составляет, например, 2000 нг/мл, 5000 нг/мл или 10000 нг/мл.
[0113]
В качестве показателя коагулопатии при сепсисе, сопровождающемся коагулопатией, аномальное повышение уровня фрагмента протромбина 1+2 (F1+2) также можно указать вместо или помимо INR. Минимальное стандартное значение составляет, например, 200 пмоль/л, 229 пмоль/л, 230 пмоль/л или 250 пмоль/л, а максимальное стандартное значение составляет, например, 10000 пмоль/л, 20000 пмоль/л или 40000 пмоль/л.
[0114]
В качестве показателя коагулопатии при сепсисе, сопровождающемся коагулопатией, аномальное снижение уровня протеина C также можно указать вместо или помимо INR. Максимальное стандартное значение составляет, например, 40%, 50% или 60%, а минимальное стандартное значение составляет, например, 5%, 8% или 10%.
[0115]
В качестве показателя коагулопатии при сепсисе, сопровождающемся коагулопатией, аномальное повышение размера микрочастиц (MP) также можно указать вместо или помимо INR. Минимальное стандартное значение составляет, например, 5 нм, 8 нм или 10 нм, а максимальное стандартное значение составляет, например, 350 нм, 370 нм или 400 нм.
[0116]
В качестве показателя коагулопатии при сепсисе, сопровождающемся коагулопатией, аномальное снижение уровня антитромбина III (AT III) также можно указать вместо или помимо INR. Максимальное стандартное значение составляет, например, 45%, 60% или 70%, а минимальное стандартное значение составляет, например, 5%, 8% или 10%.
[0117]
В качестве показателя коагулопатии при сепсисе, сопровождающемся коагулопатией, аномальное повышение уровня D-димера также можно указать вместо или помимо INR. Минимальное стандартное значение составляет, например, 2000 нг/мл, 3000 нг/мл или 3500 нг/мл, а максимальное стандартное значение составляет, например, 50000 нг/мл, 60000 нг/мл или 70000 нг/мл.
[0118]
Хотя время с 1) момента постановки диагноза, определения или подтверждения, является ли пациент с сепсисом пациентом, у которого сепсис сопровождается коагулопатией (момент времени 1), до 2) момента начала терапевтического лечения и/или улучшения состояния пациента с использованием лекарственного средства по настоящему изобретению (момент времени 2) конкретно не ограничивается, если только оно не отклоняется от времени, определенного для объекта настоящего изобретения, время с момента времени 1 до момента времени 2 может составлять, например, 24 часа.
[0119]
Примеры бактериемии включают состояние, при котором присутствие бактерий в крови подтверждено положительным результатом посева крови.
Примеры септицемии включают состояние, при котором подтверждено присутствие микроорганизмов или других токсинов в крови, но оно может представлять собой патологическое состояние, которое соответствует, помимо присутствия инфекции, двум или более из признаков SIRS ((1) температура тела > 38°C или < 36°C, (2) частота сердечных сокращений > 90/мин, (3) частота дыхания > 20/мин, или PaCO2<32 торр, и (4) число лейкоцитов > 12000/мкл или < 4000/мкл, или незрелые лейкоциты > 10%), и положительный результат посева крови необязателен.
Примеры синдрома системного воспалительного ответа (SIRS) включают состояние предварительной стадии DIC, как описано выше.
[0120]
Примеры тяжелого сепсиса включают сепсис, сопровождающийся одним или несколькими симптомами, включая органную дисфункцию, например метаболический ацидоз, гипоперфузию органов, острую энцефалопатию, олигурию, гипоксемию или диссеминированную внутрисосудистую коагуляцию, и гипотензию. Сепсис с органной дисфункцией, гипоперфузией органов или гипотензией называется тяжелым сепсисом. Гипоперфузия органов или аномальная перфузия включает лактатацидоз, олигурию, помрачнение сознания и т.п. Состояние тяжелого сепсиса с постоянно присутствующей гипотензией, несмотря на достаточную нагрузку инфузионной терапии, называется септическим шоком.
[0121]
Более конкретно, тяжелый сепсис, на который ссылаются в этом варианте осуществления, описан ниже.
Примеры септического шока включают состояние с гипотензией (кровяное давление 90 мм рт.ст. или ниже, или ниже, чем обычное кровяное давление на 40 мм рт.ст. или более), не отвечающее на ресусцитацию путем замещения жидкости, и сопровождающееся органной недостаточностью.
Примеры неустранимого септического шока включают состояние с септическим шоком, продолжающееся в течение 1 часа или дольше и не отвечающее на средство, повышающее давление, с инфузионной терапией.
Примеры синдрома полиорганной дисфункции (MODS) включают состояние с нарушением функции одного или нескольких органов, и требующее медицинского вмешательства для поддержания гомеостаза.
[0122]
Оценка по шкале Sofa (Sequential organ failure assessment) представляет собой показатель степени дисфункции жизненно важных органов, представленный цифровым значением, и степень органной дисфункции оценивается в пять ступеней от нуля до четырех баллов по шести пунктам: органы дыхания, система свертывания крови, функция печени, сердечно-сосудистая система, центральная нервная система и функция почек. Считается, что, когда оценка больше 5, смертность достигает уровня около 20%. Эта оценка полезна для определения тяжести сепсиса. Помимо оценки по шкале Sofa, также известна оценка Apache (Acute physiology and chronic health evaluation) II, и она представляет собой оценку, которая позволяет предсказать смертность и т.п., с использованием 12 показателей, касающихся дыхания, кровообращения и т.п.
[0123]
Хотя инфекционное заболевание, приводящее к сепсису, конкретно не ограничивается, примеры включают пневмонию (острую инфекцию легких), инфекцию мочевых путей, кишечную инфекцию, инфекцию кровотока и т.п. Инфекционное заболевание, приводящее к сепсису, для лечения которого используют лекарственное средство по настоящему изобретению, предпочтительно представляет собой инфекционное заболевание, отличное от инфекции мочевых путей (острая легочная инфекция, кишечная инфекция, инфекция кровотока и т.п.).
[0124]
INR, на который ссылаются в этом варианте осуществления, является одним из диагностических критериев, которые определяют нарушение свертываемости крови. INR означает протромбиновое время (далее сокращенно указано как PT), нормализованное для различий между производственными партиями препаратов тромбопластина. INR обычно определяется следующим образом:
INR значение = (Время коагуляции (сек) испытываемого образца/Время коагуляции (сек) контрольного образца)(ISI значение)
В уравнении время коагуляции (сек) испытываемого образца представляет собой PT испытываемого образца плазмы субъекта, подлежащего исследованию, и ISI означает Международный индекс чувствительности.
[0125]
Примеры тяжелого сепсиса, на который ссылаются в этом варианте осуществления, включают сепсис, сопровождающийся одним или несколькими симптомами, включая органную дисфункцию, например метаболический ацидоз, гипоперфузию органов, острую энцефалопатию, олигурию, гипоксемию или диссеминированную внутрисосудистую коагуляцию, и гипотензию, как описано выше. Термин “тяжелый” означает, что заболевание находится в критическом состоянии для поддержания жизни. Примеры тяжелого сепсиса включают, в частности сепсис, сопровождающийся дисфункциями одного или нескольких органов. Хотя органная дисфункция конкретно не ограничивается при условии, что органная дисфункция индуцирована сепсисом, органная дисфункция предпочтительно включает отказ работы органа, который является существенно важным для поддержания жизни. Примеры одной или нескольких органных дисфункций включают одну или несколько органных дисфункций, выбранных из группы, состоящей из дисфункции органа кровообращения, дисфункции органа дыхания, дисфункции почки и дисфункции печени, предпочтительные примеры включают одну или несколько органных дисфункций, выбранных из группы, состоящей из дисфункции органа дыхания, дисфункции органа кровообращения и дисфункции почки, и более предпочтительные примеры включают одну или несколько органных дисфункций, выбранных из группы, состоящей из дисфункции органа дыхания и дисфункции органа кровообращения. Хотя количество органных дисфункций конкретно не ограничивается при условии, что количество составляет одну или более, количество предпочтительно может составлять две или более. Особенно предпочтительно, когда присутствуют два типа органных дисфункций, такие как дисфункция органа дыхания и дисфункция органа кровообращения. Дисфункция органа дыхания и дисфункция органа кровообращения также могут быть указаны как нарушение дыхательной функции и нарушение сердечно-сосудистой функции, соответственно.
[0126]
В этом варианте осуществления предпочтительно, чтобы у пациента была одна органная дисфункция или больше и три или меньше. Также может быть предпочтительно, когда пациент имеет по меньшей мере дисфункцию органа кровообращения или дисфункцию органа дыхания в качестве органной дисфункции.
[0127]
Дисфункция органа кровообращения конкретно не ограничивается при условии, что она представляет собой хорошо известную дисфункцию органа кровообращения, и примеры включают, например, снижение кровяного давления и шок. Конкретные примеры включают состояния, наблюдаемые после приема вазопрессорных препаратов. В качестве еще одного примера можно указать состояние с уровнем лактата в артериальной крови > 2 ммоль/л.
Дисфункция органа дыхания конкретно не ограничивается при условии, что она представляет собой хорошо известную дисфункцию органа дыхания, и примеры включают, например, гипоксемию, острое легочное повреждение и одышку. Конкретные примеры включают состояния, при которых желательно или необходимо использовать аппарат искусственного дыхания.
Почечная дисфункция конкретно не ограничивается при условии, что она представляет собой хорошо известную почечную дисфункцию, и примеры включают, например, нарушение функции почек, олигурию и почечную недостаточность. Конкретные примеры включают состояние с уровнем креатинина ≥ 2,0 мг/дл.
Дисфункция печени конкретно не ограничивается при условии, что она представляет собой хорошо известную дисфункцию печени, и примеры включают, например, нарушение функции печени, желтуху, печеночную недостаточность и т.п. Конкретные примеры включают состояние с уровнем билирубина ≥ 2,0 мг/дл.
[0128]
Эти органные дисфункции широко известны как описанные в публикациях, опубликованных до даты подачи настоящей заявки, например, Funada H., "Elucidation and Treatment Strategy for Sepsis", Iyaku Journal Co., Ltd., p.38- (2006)), "Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock 2008" (Crit. Care Med., 2008 Jan; 36(1): 296-327), и т.п.
[0129]
Предполагается, что органная дисфункция может быть индуцирована фактором, отличным от сепсиса, например как в случае лекарственно-индуцированной органной дисфункции, и, соответственно, желательно, чтобы из числа пациентов с тяжелым сепсисом исключались пациенты, имеющие органную дисфункцию, ограниченную печенью и почками. Также известно, что тромбоцитопения может развиваться как результат органной дисфункции. Хотя количество тромбоцитов у пациентов, которым нужно вводить лекарственное средство этого варианта осуществления, конкретно не ограничивается при условии, что количество тромбоцитов находится на уровне меньше чем 300000/мкл, предпочтительно оно составляет меньше чем 200000/мкл, более предпочтительно меньше чем 150000/мкл.
[0130]
В этом варианте осуществления предпочтительно, когда оценка Apache (Acute physiology and chronic health evaluation) II у пациента меньше чем 35. Она также может быть, например 25 или более.
[0131]
В этом варианте осуществления, значение INR в образце плазмы пациента с сепсисом конкретно не ограничивается при условии, что значение больше чем 1,4, и когда INR больше чем 1,4, тромбомодулин более эффективен для пациентов с сепсисом, имеющих одну или более органных дисфункций. Максимальное значение INR, например, может быть 2,0 или ниже, предпочтительно 1,9 или ниже, более предпочтительно 1,8 или ниже, еще более предпочтительно 1,7 или ниже, наиболее предпочтительно 1,6 или ниже. Оно также может быть предпочтительно 1,5 или ниже. Также предпочтительно исключение пациента с INR значением 1,7.
Выражение "INR больше чем 1,4" также можно указать как "INR > 1,4".
[0132]
В этом варианте осуществления DIC представляет собой заболевание или синдром, при котором образуются большие количества веществ, ускоряющих свертывание крови, в результате повреждения ткани, вызванного различными заболеваниями, таким образом, функция системы коагуляции чрезмерно ускоряется, в сосудистой системе образуются мелкие тромбы (образование микротромбов) и закупоривают мелкие сосуды, и в то же время расходуются тромбоциты или факторы свертывания, необходимые для контроля кровотечения, что вызывает нарушение свертывания крови. В частности, в результате образования фибрина в кровеносных сосудах возникает кровотечение из-за истощения системы свертывания крови или органной недостаточности в результате образования микротромбов. DIC также называют синдромом диссеминированного внутрисосудистого свертывания крови или синдромом диффузного внутрисосудистого свертывания крови.
[0133]
DIC имеет различные типы клинических симптомов в зависимости от типа лежащего в основе патогенного состояния. Помимо наблюдения кровотечения или симптомов со стороны органов, предпочтительный метод диагностики заболевания как DIC-синдрома включает продолжение оценки DIC на основании нескольких оцениваемых показателей, как описано ниже, а затем диагностирование заболевания как DIC, когда оценка DIC достигает определенного уровня. Примеры таких оцениваемых показателей включают количество тромбоцитов в крови, концентрацию продуктов разложения фибрина/фибриногена (далее сокращенно FDP, в некоторых случаях), образованных путем разложения плазмином, концентрацию D-димера, концентрацию фибриногена, протромбиновое время и т.п. Кроме того, также возможно диагностировать определенное состояние как пред-DIC на основании снижения тромбоцитов, повышения концентрации D-димера или FDP и т.п. без необходимости продолжения оценки DIC (Masao Nakagawa, “Search report regarding use of criteria of disseminated intravascular coagulation (DIC),” Research Study Team of Intractable Disease (Blood Coagulation Abnormality), the Ministry of Health and Welfare, Study report 1999, 1999: 65-72; Katsumi Deguchi, “Tentative plan regarding standards for initiation of early treatment of DIC,” Research Study Team of Intractable Disease (Blood Coagulation Abnormality), the Ministry of Health and Welfare, Study report 1999, 1999: 73-77; and Katsumi Nakagawa & Hajime Tsuji, “Current diagnosis of DIC - Reports on results of inquiry survey” Clinical Blood. 1999, 40: 362-364).
[0134]
В этом варианте осуществления пациента с сепсисом с INR значением в образце плазмы пациента больше чем 1,2, предпочтительно больше чем 1,3, более предпочтительно больше чем 1,4, можно назвать пациентом DIC в широком смысле, и лекарственное средство для терапевтического лечения и/или улучшения состояния при сепсисе в соответствии с этим вариантом осуществления можно использовать в качестве лекарственного средства для терапевтического лечения и/или улучшения состояния DIC с INR значением больше чем 1,4.
[0135]
Лекарственное средство этого варианта осуществления также можно использовать для лечения DIC. Сепсис также рассматривается как SIRS, вызванный критической клинической инвазией в результате инфекции, и тесно связан с DIC, причиной которого является инфекционное заболевание. DIC часто развивается одновременно с сепсисом, и лекарственное средство этого варианта осуществления также можно использовать для такого пациента с сепсисом, у которого одновременно развивается DIC. Другими словами, лекарственное средство этого варианта осуществления можно использовать для пациента, у которого диагностирован или подозревается DIC или сепсис, либо и то и другое.
[0136]
В этом варианте осуществления INR можно измерить, например, следующим образом. В частности, тканевый тромбопластин и Ca2+ добавляют к плазме (исследуемому образцу), полученной путем добавления цитрата натрия, измеряют время (PT), необходимое для коагуляции (осаждение фибрина), и определяют оценку на основе относительного показателя времени в секундах относительно контрольного образца (показатель активности). Показатель активности можно получить как “время коагуляции (секунды) исследуемого образца/время коагуляции (секунды) контрольного образца”, но отношение может варьироваться в разных лабораториях, в которых осуществляют испытание, из-за разницы в чувствительности используемого тканевого тромбопластина. Значение INR было разработано для того, чтобы исключить такое отклонение, и путем оценки PT с использованием значения INR, скорректированного с использованием международного индекса чувствительности (далее также сокращенно ISI), отклонения, вызванные различиями в лабораториях, могут быть устранены для получения стандартного результата. ISI представляет собой отличие от международного стандартного образца. ISI определяется для каждого реагента тканевого тромбопластина и прилагается к реагенту. Примеры тромбопластинового реагента включают Thromborel S (зарегистрированная торговая марка, Sysmex Corp.), Thromboplastin C+ (зарегистрированная торговая марка, Sysmex Corp.) и т.п., но не ограничиваются этими примерами. Для Thromborel S (зарегистрированная торговая марка) используют тромбопластин плаценты человека (ISI значение составляет около 1,0), а для Thromboplastin C+ (зарегистрированная торговая марка) используют тромбопластин головного мозга кролика (ISI значение составляет около 1,8)
[0137]
ISI прилагается к каждому реагенту тканевого тромбопластина, и INR значение рассчитывается в соответствии с уравнением, указанным выше.
Хотя контрольный образец конкретно не ограничивается при условии, что образец представляет собой коммерчески доступную объединенную нормальную плазму человека, можно использовать коммерчески доступную объединенную цитратную (Na цитрат) нормальную плазму человека и т.п., доступную, например, от Kojin- Bio Co., Ltd. или International Bioscience Inc.
[0138]
Что касается терапевтического лечения сепсиса, обычно используют такие базовые методы лечения, которые указаны ниже, со ссылкой на известные публикации (Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septic shock: Crit. Care Med., 2008, 36:296-327; Crit. Care Med., 32(3), 1250-56 (2003)), и тромбомодулин и другое лекарственное средство можно использовать в комбинации. Однако другое лекарственное средство, используемое в комбинации, не ограничивается указанными ниже.
[0139]
Когда гипотензия продолжается у пациента с септическим шоком даже после того, как центральное венозное давление (CVP) повышается до желаемого значения, можно вводить дофамин, чтобы поднять среднее кровяное давление по меньшей мере до 60 мм рт.ст. Когда доза дофамина превышает 20 мкг/кг/мин, можно дополнительно вводить другой вазопрессор (обычно норадреналин).
[0140]
Для терапевтического лечения против бактерий, вызывающих сепсис, обычно используют антибиотики. Для выбора антибиотика требуется хорошо взвешенная оценка, основанная на предполагаемой причине, клинических признаках, знаниях, касающихся микроорганизмов, и знаниях, касающихся паттерна чувствительности, общих для конкретного отделения больницы для стационарных пациентов, результатах предварительного анализа на микрофлору и т.д. Интенсивная нормализация уровня сахара в крови у больных сепсисом улучшает клинический исход больных в критических состояниях.
Когда используется антибиотик, можно исследовать образец, такой как кровь, жидкость тела или часть раны, и выбрать лекарственное средство, эффективное в отношении бактериального возбудителя болезни. Например, в случае септического шока неизвестной причины гентамицин или тобрамицин и цефалоспорин третьего поколения можно вводить в комбинации. Кроме того, при подозрении на инфицирование резистентными бактериями Staphylococcus или Enterococcus дополнительно вводят ванкомицин.
[0141]
Обычно дозу корректируют для поддержания уровня сахара в крови на уровне от 80 до 110 мг/дл (от 4,4 до 6,1 ммоль/л) путем непрерывной внутривенной инъекции инсулина.
Поскольку терапия кортикостероидами эффективна для терапевтического лечения сепсиса, ее можно применять в виде дополнительной дозы.
[0142]
Пациенту с высоким риском смерти (оценка APACHE II ≥ 25, полиорганная недостаточность из-за сепсиса, ARDS из-за септического шока или сепсиса) рекомбинантный активированный протеин С (rhAPC, дротрекогин α) может быть назначен при отсутствии противопоказаний (кровоизлияние и т.п.).
Хотя количество целевых пациентов ограничено, можно осуществлять переливание эритроцитов с целью достижения Hb от 7,0 до 9,0 г/дл.
[0143]
В случае нарушения эритропоэза у пациента с сепсисом из-за почечной недостаточности можно вводить эритропоэтин (ЭПО).
В случае тяжелого сепсиса можно вводить гепарин в низких дозах нефракционированного гепарина или низкомолекулярный гепарин для предотвращения DVT.
[0144]
Лекарственное средство по настоящему изобретению может содержать носитель. В качестве носителя, используемого в настоящем изобретении, предпочтителен водорастворимый носитель, и обычно предпочтительны регулятор тоничности, буферный агент, усилитель вязкости, поверхностно-активное вещество, консервант, антисептик, успокаивающее средство, модификатор pH или т.п., приемлемые в качестве фармацевтических добавок. Например, лекарственное средство по настоящему изобретению можно получить путем добавления сахарозы, глицерина, модификатора pH, состоящего из неорганической соли, или т.п. в качестве добавок. Кроме того, если необходимо, можно добавить аминокислоты, соли, углеводы, поверхностно-активные вещества, альбумин, желатин и т.п., как раскрыто в публикациях не прошедших экспертизу патентных заявок Японии №№ 64-6219 и 6-321805. Способ добавления таких добавок конкретно не ограничивается. Однако в случае получения лиофилизированного продукта примеры включают, например, способ смешивания раствора, содержащего по меньшей мере одно терапевтическое средство, выбранное из иммунодепрессанта и средства для лечения гематологических злокачественных заболеваний, и раствора, содержащего тромбомодулин, с последующим добавлением к смеси добавок, и смешивание полученной смеси, а также способ смешивания добавок по меньшей мере с одним терапевтическим средством, выбранным из иммунодепрессанта и средства для лечения гематологических злокачественных заболеваний, предварительно растворенных в воде, воде для инъекций или соответствующем буфере, добавления раствора, содержащего тромбомодулин, к смеси, смешивания полученной смеси с получением раствора и лиофилизации раствора обычно используемым способом. Когда лекарственное средство по настоящему изобретению представляет собой лекарственное средство, включающее комбинацию компонентов лекарственного средства, каждый компонент предпочтительно получают путем добавления носителя в соответствии с подходящим способом получения. Лекарственное средство по настоящему изобретению может быть представлено в форме инъекции или в форме лиофилизированного препарата для растворения при использовании.
[0145]
Что касается получения лекарственного средства по настоящему изобретению, водный раствор для инъекций можно получить путем заполнения ампулы или флакона, например, раствором, содержащим от 0,1 до 10 мг тромбомодулина, воду для инъекций и добавки, в объеме от 0,5 до 10 мл. Примеры способа получения также включают способ замораживания такого раствора и сушки замороженного раствора при пониженном давлении с получением лиофилизированного препарата.
[0146]
Лекарственное средство по настоящему изобретению желательно вводить парентерально, например внутривенно, внутримышечно и подкожно. Лекарственное средство также можно вводить пероральным, интраректальным, интраназальным, сублингвальным способом введения и т.п. Когда лекарственное средство по настоящему изобретению представляет собой лекарственное средство, включающее комбинацию нескольких активных ингредиентов, каждый активный ингредиент лекарственного средства предпочтительно вводят способом введения, подходящим для этого ингредиента.
Примеры способа внутривенного введения включают способ введения желаемой дозы лекарственного средства за один раз (внутривенное болюсное введение) и внутривенное введение путем капельной инфузии.
[0147]
Способ введения желаемой дозы лекарственного средства за один раз (внутривенное болюсное введение) является предпочтительным с той точки зрения, что способ требует короткого промежутка времени для введения. Особенно в случае пациентов с сепсисом, которым часто требуется срочное лечение, может быть предпочтительным введение за короткое время. Когда лекарственное средство вводят за один раз, период, необходимый для введения с использованием шприца для инъекций, обычно может варьироваться. Обычно период времени, необходимый для введения, составляет, например, 5 минут или меньше, предпочтительно 3 минуты или меньше, более предпочтительно 2 минуты или меньше, еще более предпочтительно 1 минуту или меньше, особенно предпочтительно 30 секунд или меньше, хотя это зависит от вводимого объема. Хотя минимальное время введения конкретно не ограничивается, период предпочтительно составляет 1 секунду или дольше, более предпочтительно 5 секунд или дольше, еще более предпочтительно 10 секунд или дольше. Доза конкретно не ограничивается при условии, что доза находится в пределах вышеуказанной предпочтительной дозы. Внутривенное введение путем капельной инфузии также является предпочтительным с той точки зрения, что уровень тромбомодулина в крови можно легко поддерживать постоянным.
[0148]
Суточная доза лекарственного средства по настоящему изобретению может варьироваться в зависимости от возраста, массы тела пациента, тяжести заболевания, пути введения и т.п. Как правило, максимальная доза предпочтительно составляет 20 мг/кг или меньше, более предпочтительно 10 мг/кг или меньше, еще более предпочтительно 5 мг/кг или меньше, особенно предпочтительно 2 мг/кг или меньше, и наиболее предпочтительно 1 мг/кг или меньше, и минимальная доза предпочтительно составляет 0,001 мг/кг или более, более предпочтительно 0,005 мг/кг или более, еще более предпочтительно 0,01 мг/кг или более, особенно предпочтительно 0,02 мг/кг или более, и наиболее предпочтительно 0,05 мг/кг или более, в расчете на количество тромбомодулина.
[0149]
В случае внутривенного болюсного введения, хотя доза конкретно не ограничивается при условии, что доза находится в пределах вышеуказанной предпочтительной дозы, максимальная суточная доза предпочтительно составляет 1 мг/кг или меньше, более предпочтительно 0,5 мг/кг или меньше, еще более предпочтительно 0,1 мг/кг или меньше, особенно предпочтительно 0,08 мг/кг или меньше, и наиболее предпочтительно 0,06 мг/кг или меньше, и минимальная доза предпочтительно составляет 0,005 мг/кг или более, более предпочтительно 0,01 мг/кг или более, еще более предпочтительно 0,02 мг/кг или более, и особенно предпочтительно 0,04 мг/кг или более.
[0150]
Когда лекарственное средство по настоящему изобретению вводят пациенту, имеющему массу тела больше 100 кг, его предпочтительно можно вводить при фиксированной дозе 6 мг, поскольку объем крови не пропорционален массе тела, и объем крови относительно снижен по отношению к массе тела у такого пациента.
[0151]
В случае непрерывной внутривенной инфузии, хотя доза конкретно не ограничивается при условии, что доза находится в пределах вышеуказанной предпочтительной дозы, максимальная суточная доза предпочтительно составляет 1 мг/кг или меньше, более предпочтительно 0,5 мг/кг или меньше, еще более предпочтительно 0,1 мг/кг или меньше, особенно предпочтительно 0,08 мг/кг или меньше, и наиболее предпочтительно 0,06 мг/кг или меньше, и минимальная доза предпочтительно составляет 0,005 мг/кг или более, более предпочтительно 0,01 мг/кг или более, еще более предпочтительно 0,02 мг/кг или более и особенно предпочтительно 0,04 мг/кг или более.
[0152]
Когда лекарственное средство по настоящему изобретению вводят пациенту, имеющему массу тела больше 100 кг, ее предпочтительно можно вводить при фиксированной дозе 6 мг, поскольку объем крови не пропорционален массе тела, и объем крови относительно снижен по отношению к массе тела у такого пациента.
Лекарственное средство вводят один или несколько раз в день, как потребуется. Что касается интервала введения, лекарственное средство можно вводить один раз в 2-14 дней, предпочтительно один раз в 2-7 дней, более предпочтительно один раз в 3-5 дней.
[0153]
[Объяснение перечня последовательностей]
SEQ ID NO: 1: Аминокислотная последовательность, кодируемая геном, используемым для продукции TME456
SEQ ID NO: 2: Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 1
SEQ ID NO: 3: Аминокислотная последовательность, кодируемая геном, используемым для продукции TME456M
SEQ ID NO: 4: Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 3
SEQ ID NO: 5: Аминокислотная последовательность, кодируемая геном, используемым для продукции TMD12
SEQ ID NO: 6: Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 5
SEQ ID NO: 7: Аминокислотная последовательность, кодируемая геном, используемым для продукции TMD12M
SEQ ID NO: 8: Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 7
SEQ ID NO: 9: Аминокислотная последовательность, кодируемая геном, используемым для продукции TMD123
SEQ ID NO: 10: Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 9
SEQ ID NO: 11: Аминокислотная последовательность, кодируемая геном, используемым для продукции TMD123M
SEQ ID NO: 12: Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 11
SEQ ID NO: 13: Синтетическая ДНК для мутации, используемой для осуществления сайт-направленного мутагенеза
Примеры
[0154]
Настоящее изобретение далее подробно объясняется со ссылкой на примеры и примеры испытаний. Однако настоящее изобретение не ограничивается этими примерами.
[0155]
Тромбомодулин по настоящему изобретению, используемый в примерах испытаний, был получен в соответствии с указанным выше способом Yamamoto et al. (способ, описанный в публикации не прошедшей экспертизу японской патентной заявке № 64-6219). Примеры его получения описаны ниже. Безопасность тромбомодулинов, полученных в этих примерах получения, была подтверждена в испытаниях с однократным и повторным внутривенным введением с использованием крыс и обезьян, в испытании на возможное нарушение репродуктивной функции у мышей, в испытании на местное раздражение, в испытании фармакологической безопасности, в испытании на вирусную инактивацию и т.п.
[0156]
[Пример получения 1]
<Получение тромбомодулина>
Высокоочищенный продукт был получен указанным выше способом. В частности, клетки яичника китайского хомячка (СНО) трансфицировали ДНК, кодирующей аминокислотную последовательность SEQ ID NO: 9 (которая, в частности, состояла из нуклеотидной последовательности SEQ ID NO: 10). Из культуры вышеуказанных трансформированных клеток получали высокоочищенный продукт путем сбора активной фракции с использованием фосфатного буфера 20 ммоль/л (pH 7,3), содержащего 50 ммоль/л NaCl, в соответствии с указанным традиционным методом очистки. Продукт затем концентрировали с использованием ультрафильтрационной мембраны с получением раствора тромбомодулина с концентрацией 11,0 мг/мл (далее в описании также сокращенно указан как TMD123)
[0156]
[0157]
<Получение раствора полисорбата>
Полисорбат 80 отвешивали (0,39 г) в стеклянный химический стакан, добавляли воду для инъекций (30 мл) и растворяли.
[0158]
<Получение и расфасовка раствора лекарственного средства>
Раствор TMD123, полученный как описано выше (2239 мл, что соответствует 24,63 г растворимого белка тромбомодулина, добавленного в 5% избыточном количестве), помещали в 5-л сосуд из нержавеющей стали. Затем добавляли полученный ранее раствор полисорбата и добавляли хлорид натрия (27,9 г). Добавляли воду для инъекций (600 мл) и смесь перемешивали. Смесь доводили до pH 6,0 путем добавления раствора 1 моль/л хлористоводородной кислоты. Снова к смеси добавляли воду для инъекций до общего количества 3940 г и смесь однородно смешивали и перемешивали. Этот раствор лекарственного средства подвергали стерилизации фильтрованием с использованием фильтра, имеющего диаметр пор 0,22 мкм (MCGL10S, изготовитель Millipore). Фильтрат загружали в ампулы по 1,1 г в каждую с получением препарата TMD123.
[0159]
[Пример получения 2]
Клетки яичника китайского хомячка (CHO) трансфицировали ДНК, кодирующей аминокислотную последовательность SEQ ID NO: 11 (которая, в частности, состоит из нуклеотидной последовательности SEQ ID NO: 12), получали раствор тромбомодулина, очищенного из культуры указанных выше трансформированных клеток (далее в описании сокращенно указан как TMD123M) вышеуказанным традиционным способом очистки, и TMD123M препарат получали таким же образом, как описано выше.
[0160]
[Пример получения 3]
Клетки яичника китайского хомячка (CHO) трансфицировали ДНК, кодирующей аминокислотную последовательность SEQ ID NO: 1 (которая, в частности, состоит из нуклеотидной последовательности SEQ ID NO: 2), получали тромбомодулин, очищенный из культуры указанных выше трансформированных клеток (далее в описании сокращенно указан как TME456) вышеуказанным традиционным способом очистки, и TME456 препарат получали таким же образом, как описано выше.
[0161]
[Пример получения 4]
Клетки яичника китайского хомячка (CHO) трансфицировали ДНК, кодирующей аминокислотную последовательность SEQ ID NO: 3 (которая, в частности, состоит из нуклеотидной последовательности SEQ ID NO: 4), получали тромбомодулин, очищенный из культуры указанных выше трансформированных клеток (далее в описании сокращенно указан как TME456M) вышеуказанным традиционным способом очистки, и TME456M препарат получали таким же образом, как описано выше.
[0162]
[Пример получения 5]
Клетки яичника китайского хомячка (CHO) трансфицировали ДНК, кодирующей аминокислотную последовательность SEQ ID NO: 5 (которая, в частности, состоит из нуклеотидной последовательности SEQ ID NO: 6), получали тромбомодулин, очищенный из культуры указанных выше трансформированных клеток (далее в описании сокращенно указан как TMD12) вышеуказанным традиционным способом очистки, и TMD12 препарат получали таким же образом, как описано выше.
[0163]
[Пример получения 6]
Клетки яичника китайского хомячка (CHO) трансфицировали ДНК, кодирующей аминокислотную последовательность SEQ ID NO: 7 (которая, в частности, состоит из нуклеотидной последовательности SEQ ID NO: 8), получали тромбомодулин, очищенный из культуры указанных выше трансформированных клеток (далее в описании сокращенно указан как TMD12M) вышеуказанным традиционным способом очистки, и TMD12M препарат получали таким же образом, как описано выше.
[0164]
[Пример получения 7]
Получение препарата плацебо
<Получение раствора полисорбата>
Полисорбат 80 отвешивали (0,4 г) в стеклянный химический стакан, добавляли воду для инъекций (30 мл) и растворяли.
[0165]
<Получение и расфасовка раствора лекарственного средства>
Воду для инъекций (2000 мл) помещали в 5-л сосуд из нержавеющей стали. Затем добавляли полученный ранее раствор полисорбата. Снова к смеси добавляли воду для инъекций до общего количества 4000 г и смесь однородно смешивали и перемешивали. Этот раствор лекарственного средства подвергали стерилизации фильтрованием с использованием фильтра, имеющего диаметр пор 0,22 мкм (MCGL10S, изготовитель Millipore). Фильтрат загружали в ампулы по 1,1 г в каждую с получением препарата плацебо.
[0166]
[Пример 1]
<Метод для эксперимента>
Используя TMD-123, полученный в соответствии с Примером получения 1, в качестве тромбомодулина, осуществляли рандомизированное двойное слепое плацебо-контролируемое исследование для пациентов с тяжелым сепсисом, сопровождающимся коагулопатией. Всего было запланировано 816 пациентов. Из них 402 пациента были распределены в группу введения TMD-123, а 414 пациентов в группу введения плацебо. В эксперименте участвовали 800 пациентов, которым осуществляли следующее введение (TMD-123 получали 395 пациентов, а плацебо получали 405 пациентов). TMD-123 вводили один раз в день в дозе 0,06 мг/кг в течение не более 6 последовательных дней путем внутривенного болюсного введения. В качестве плацебо использовали препарат, полученный в соответствии с Примером получения 7. Пациентам с массой тела более 100 кг равномерно вводили фиксированную дозу 6 мг один раз в день в течение 6 дней подряд путем внутривенного болюсного введения, чтобы подавить побочные эффекты, вызванные передозировкой.
[0167]
В этом эксперименте выражение “сопровождающийся коагулопатией” означало 1) INR > 1,4, и 2) количество тромбоцитов больше чем 30000/мм3 и меньше чем 150000/мм3, или снижение тромбоцитов больше чем на 30% за 24 часа.
[0168]
Значения INR в плазме пациентов перед введением испытываемого лекарственного средства измеряли способом, описанным выше с использованием уравнения. Количество тромбоцитов у пациентов измеряли способом, который традиционно используется как таковой.
[0169]
В этом эксперименте целевыми пациентами были пациенты, имеющие следующую органную дисфункцию a и/или органную дисфункцию b, связанную с сепсисом.
1) Органная дисфункция a: нарушение сердечно-сосудистой функции, требующее как инфузионной терапии, так и вазопрессорного лекарственного средства, достаточных для поддержания среднего артериального давления 65 мм рт.ст. или выше.
2) Органная дисфункция b: нарушение дыхательной функции с острой необходимостью искусственного дыхания и с PaO2/FiO2 отношением меньше чем 250 (или меньше чем 200, когда очаг инфекции находится в легком).
Нарушение дыхательной функции
Вышеуказанное нарушение сердечно-сосудистой функции можно назвать дисфункцией органов кровообращения. Вышеуказанное нарушение дыхательной функции можно назвать дисфункцией органов дыхания.
[0170]
В этом эксперименте в общей сложности 816 пациентов, которые подтвердили соответствие вышеуказанным критериям коагулопатии и вышеуказанным критериям органной дисфункции в пределах не более 24 часов, были рандомизированы в течение не более 12 часов и получили первое введение в течение 4 часов в принципе с момента рандомизации. Во время первого введения количество тромбоцитов, значение INR в плазме и т.п. в момент времени непосредственно перед введением повторно измеряли (исходный уровень) (Фиг. 1).
[0171]
Вышеуказанное выражение "пациенты, которые подтвердили соответствие вышеуказанным критериям коагулопатии и вышеуказанным критериям органной дисфункции в пределах не более 24 часов" означает, что период с момента времени, когда пациенты впервые удовлетворяли любому из критериев значения INR, количества тромбоцитов и органной дисфункции, до момента времени, когда было подтверждено, что пациенты удовлетворяют всем остальным критериям, составляет 24 часа или меньше. Вышеуказанное выражение "рандомизированы в течение не более 12 часов" означает, что период с момента времени, когда было подтверждено, что пациенты соответствуют вышеуказанным критериям коагулопатии и вышеуказанным критериям дисфункции органов, до момента завершения получения согласия пациента на участие в клиническом испытании (информированное согласие, IC), подтверждения соответствия пациента для участия в клиническом испытании в клиническом координационном центре (CCC), регистрации клинического испытания и рандомизации составляет 12 часов или меньше (Фиг. 1).
Общие результаты подтверждали на 28-й день от начала введения, и уровни смертности (смертность) в группах пациентов рассчитывали как основной показатель при оценке эффективности. Различия между показателями смертности в группах введения TMD-123 и плацебо рассчитывали как Разницу.
[0173]
В качестве основных показателей для оценки безопасности наблюдались серьезные побочные эффекты (SAE), серьезные значимые кровотечения (MBE) и антитела против лекарственных препаратов (ADA).
[0174]
<Экспериментальные результаты>
Вышеуказанные 800 случаев были определены как максимальная группа объектов анализа (полная выборка для анализа, FAS), были проанализированы эффективность для полной выборки для анализа и эффективности для ее подгрупп, определенных с различных точек зрения (Таблица 1).
PLT >30000 (мм3)
PLT ≤30000 (мм3)
введение 4 раза или более
введение 4 раза или более, и
PLT >30000 (мм3)
TAT ≥10(нг/мл) и
PLT >30000 (мм3)
PLT >30000 (мм3),
и
оценка по шкале Sofa ≤11
PLT >30000 (мм3),
и
BL оценка по шкале Apache ≤30
PLT >30000 (мм3)
и
1 ≤ BL количество органных дисфункций ≤ 3
PLT >30000 (мм3)
и
BL F1.2 ≥250 (пмоль/л)
PLT >30000 (мм3)
И
BL протеин C ≤40%
PLT >30000 (мм3)
и
BL AT III <70%
PLT >30000 (мм3)
и
BL MP >10 (нм)
PLT >30000 (мм3)
и
BL уровень D-димера ≥3500 (нг/мл)
PLT >30000 (мм3)
и
BL оценка по шкале Apache <35
PLT >30000 (мм3)
и
BL F1+2 >229 (пмоль/л)
[0175]
В приведенной выше таблице "BL INR >1,4" означает группу пациентов, которые показали INR значение больше чем 1,4 на момент времени непосредственно перед введением (исходный уровень(BL)), из полной выборки для анализа.
В приведенной выше таблице "BL INR ≤1,4" означает группу пациентов, которые показали INR значение не больше чем 1,4 на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "BL INR >1,4 и PLT >30000 (мм3)" означает группу пациентов, которые показали INR значение больше чем 1,4 на момент времени непосредственно перед введением (исходный уровень) и количество тромбоцитов больше чем 30000 (мм3) на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0176]
В приведенной выше таблице "BL INR ≤1,4 и/или PLT ≤30000 (мм3)" означает группу пациентов, которые показали INR значение не больше чем 1,4 на момент времени непосредственно перед введением (исходный уровень) и/или количество тромбоцитов не больше чем 30000 (мм3) на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "TAT ≥10 (нг/мл)" означает группу пациентов, которые показали уровень комплекса тромбин-антитромбин (TAT) не меньше чем 10 нг/мл, из полной выборки для анализа.
[0177]
Совершенно очевидно, что "TAT", указанный в приведенной выше таблице, означает измеренный уровень комплекса тромбин-антитромбин (TAT) на момент времени непосредственно перед введением (исходный уровень).
[0178]
В приведенной выше таблице "BL F1+2 ≥250 (пмоль/л)" означает группу пациентов, которые показали уровень фрагмента протромбина 1+2 (F1+2) не меньше чем 250 пмоль/л непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "BL F1+2 >229 (пмоль/л)" означает группу пациентов, которые показали уровень фрагмента протромбина 1+2 (F1+2) больше чем 229 пмоль/л непосредственно перед введением (исходный уровень), из полной выборки для анализа.
"BL AT III <70%" означает группу пациентов, которые показали уровень антитромбина III (ATIII) меньше чем 70% непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0179]
В приведенной выше таблице "BL MP >10 (нм)" означает группу пациентов, которые показали размер микрочастиц больше чем 10 нм непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "BL протеин C ≤40%" означает группу пациентов, которые показали уровень протеина C не больше чем 40% на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0180]
В приведенной выше таблице "BL протеин C >40%" означает группу пациентов, которые показали уровень протеина C больше чем 40% на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "BL оценка по шкале APACHE II ≥25" означает группу пациентов, которые показали оценку по шкале APACHE II не меньше чем 25 на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0181]
В приведенной выше таблице "BL оценка по шкале APACHE II <25" означает группу пациентов, которые показали оценку по шкале APACHE II меньше чем 25 на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "BL оценка по шкале APACHE II ≥35" означает группу пациентов, которые показали оценку по шкале APACHE II не меньше чем 35 на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0182]
В приведенной выше таблице "BL оценка по шкале APACHE II <35" означает группу пациентов, которые показали оценку по шкале APACHE II меньше чем 35 на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "BL количество органных дисфункций" означает количество органных дисфункций у пациента из полной выборки для анализа на момент времени непосредственно перед введением (исходный уровень).
[0183]
В приведенной выше таблице "1 ≤ BL количество органных дисфункций ≤3" означает группу пациентов, которые показали количество органных дисфункций не меньше чем 1 и не больше чем 3 на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "BL INR >1,4, PLT >30000 (мм3), и 1 ≤ BL количество органных дисфункций ≤ 3" означает группу пациентов, которые показали INR значение больше чем 1,4 на момент времени непосредственно перед введением (исходный уровень), количество тромбоцитов больше чем 30000 (мм3) на момент времени непосредственно перед введением (исходный уровень) и количество органных дисфункций не меньше чем 1 и не больше чем 3 на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0184]
В приведенной выше таблице "BL уровень лактата в артериальной крови ≤6 (ммоль/л)" означает группу пациентов, которые показали уровень лактата в артериальной крови не больше чем 6 ммоль/л непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "BL уровень лактата в артериальной крови >6 (ммоль/л)" означает группу пациентов, которые показали уровень лактата в артериальной крови больше чем 6 ммоль/л непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0185]
В приведенной выше таблице "BL сывороточный креатинин <2 (мг/дл)" означает группу пациентов, которые показали уровень сывороточного креатинина меньше чем 2 мг/дл непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "BL сывороточный креатинин ≥2 (мг/дл)" означает группу пациентов, которые показали уровень сывороточного креатинина не меньше чем 2 мг/дл непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0186]
В приведенной выше таблице "диабетические пациенты" означает группу пациентов, у которых было осложнение диабетом непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "недиабетические пациенты" означает группу пациентов, у которых не было осложнения диабетом непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0187]
В приведенной выше таблице "пациенты, использующие гепарин" означает группу пациентов, которые использовали гепарин при низкой дозе непосредственно перед введением (исходный уровень), из полной выборки для анализа.
В приведенной выше таблице "пациенты, не использующие гепарин" означает группу пациентов, которые не использовали гепарин при низкой дозе непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0188]
В приведенной выше таблице "введение четыре раза или более" означает группу пациентов, которые получали 4 или более раз (т.е. от 4 до 6 раз) введение исследуемого лекарственного средства (TMD-123 или плацебо), из полной выборки для анализа.
Нет необходимости объяснять, что "введение 4 раза или более", как указано в приведенной выше таблице, означает "введение в течение по меньшей мере 4 последовательных дней".
[0189]
В приведенной выше таблице "BL INR >1,4 и введение 4 раза или более" означает группу пациентов, которые показали INR значение больше чем 1,4 на момент времени непосредственно перед введением (исходный уровень) и получали введение исследуемого лекарственного средства (TMD-123 или плацебо) 4 или более раз (т.е. от 4 до 6 раз), из полной выборки для анализа.
[0190]
В приведенной выше таблице "BL INR >1,4, введение 4 раза или более и PLT >30000 (мм3)" означает группу пациентов, которые показали INR значение больше чем 1,4 на момент времени непосредственно перед введением (исходный уровень), получали введение исследуемого лекарственного средства (TMD-123 или плацебо) 4 или более раз (т.е. от 4 до 6 раз) и показали количество тромбоцитов больше чем 30000 (мм3) на момент времени непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0191]
В приведенной выше таблице "BL уровень D-димера ≥3500 (нг/мл)" означает группу пациентов, которые показали уровень D-димера не меньше чем 3500 нг/мл непосредственно перед введением (исходный уровень), из полной выборки для анализа.
[0192]
Что касается "BL INR >1,4, и PLT >30000 (мм3)", указанных выше (634 случая), в следующей таблице (Таблица 2) показаны время с момента времени непосредственно перед введением (исходный уровень) до первого введения (крайняя левая колонка Таблицы 2), эффективность, наблюдаемая для групп пациентов, которым вводили исследуемое лекарственное средство в этот период времени (крайняя правая колонка Таблицы 2), и т.п.
[0193]
[0194]
Что касается полной выборки для анализа (800 случаев), влияние периода времени, прошедшего с момента времени, когда можно было подтвердить соответствие критериям коагулопатии и критериям органной дисфункции (во время первого измерения), до момента времени непосредственно перед введением (исходный уровень) (во время повторного измерения) в пределах 24 часов на значение INR в плазме пациентов, представлено в следующей таблице (Таблица 3).
[0195]
(только первое измерение)
[0196]
Что касается полной выборки для анализа (800 случаев), влияние периода времени, прошедшего с момента времени, когда можно было подтвердить соответствие критериям коагулопатии и критериям органной дисфункции (во время первого измерения), до момента времени непосредственно перед введением (исходный уровень) (во время повторного измерения) в пределах 24 часов на количество тромбоцитов у пациентов представлено в следующей таблице (Таблица 4).
[0197]
(только первое измерение)
[0198]
Никакого существенного изменения количества тромбоцитов не наблюдалось в течение 24 часов с момента измерения, что касается коагулопатии. Также было выявлено, что у 70% или более пациентов, которые показали INR >1,4, сохранялось значение INR >1,4 (поддержание коагулопатии) в течение 24 часов после измерения.
[0199]
Как описано выше, считается, что начало введения не позднее, чем через 24 часа после подтверждения того, что измеренные значения количества тромбоцитов и значение INR в плазме у пациентов удовлетворяют вышеуказанным условиям (INR >1,4 и количество тромбоцитов >30000 (мм3)), является предпочтительным для получения высокой эффективности, и результаты, показанные в двух приведенных выше таблицах, предполагают, что в качестве одной из причин для вышеизложенного коагулопатия обычно должна сохраняться в течение 24 часов.
[0200]
Кроме того, не было какой-либо значимой разницы в частоте случаев тяжелого критического кровотечения между всеми 800 пациентами, которым вводили исследуемое лекарственное средство, и пациентами, которые показали "BL INR >1,4 и PLT >30000 (мм3)", как отмечаловь выше (634 случая), а также не наблюдалось каких-либо существенных различий по сравнению с группой плацебо.
Оценка по шкале Sofa, определенная в настоящем изобретении, не является такой, которую рассчитывают в соответствии с обычным методом расчета оценки Sofa, а представляет собой оценку, рассчитываемую на основе оценок пяти внутренних органов (орган дыхания, орган кровообращения, печень, почки и коагуляция), за исключением оценки по шкале Glasgow Coma Scale, и диапазон включает оценки от 0 до 20. Кроме того, в качестве оценок органа дыхания и кровообращения по шкале Sofa использовали предварительные значения, полученные в соответствии со следующими критериями.
Орган дыхания: для пациентов, у которых отношение P/F не измерялось, у находившегося на искусственном дыхании пациента оценка составляла 3 балла, а у не находившегося на искусственном дыхании пациента оценка составлял 0 баллов.
Орган кровообращения: оценка <1> пациента, который удовлетворяет критериям отбора для органа кровообращения, установленным в клиническом испытании, составляла 3 балла, а оценка <2> пациента, которому вводили "добутамин" или "дофамин, не указанный как >5 мкг/кг/мин", составляла 2 балла. Оценка <3> пациента, который не удовлетворял условиям <1> и <2>, но показывал среднее кровяное давление менее 70 мм рт.ст. во время проверки на соответствие, составляла 1 балл, а оценка пациента который не соответствовал ни одному из пациентов от <1> до <3>, составляла 0 баллов.
[0202]
Оценка APACHE (Acute Physiology and Chronic Health Evaluation) II, определенная в настоящем изобретении, соответствует системе оценки тяжести патологии пациента, госпитализированного в отделение интенсивной терапии, и ее получают как сумму баллов, которые присваиваются в соответствии с 12 физиологическими показателями, возрастом и результатами оценки осложненных хронических заболеваний. Считается, что более высокий балл указывает на более высокую степень тяжести, и диапазон составляет от 0 до 71 балла.
[0202]
Промышленная применимость
[0203]
Лекарственное средство по настоящему изобретению, содержащее тромбомодулин, является полезным в качестве лекарственного средства, которое обеспечивает возможность эффективного терапевтического лечения и/или уменьшения тяжести сепсиса, сопровождающегося коагулопатией.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Asahi Kasei Pharma Corporation
<120> Лекарственное средство для терапевтического лечения и/или
улучшения состояния при сепсисе
<130> 181522WO01
<150> US 62/748706
<151> 2018-10-22
<150> US 62/771628
<151> 2018-11-27
<150> US 62/813352
<151> 2019-03-04
<160> 13
<210> 1
<211> 132
<212> Белок
<213> человек
<400> 1
Met Leu Gly Val Leu Val Leu Gly Ala Leu Ala Leu Ala Gly Leu Gly
1 5 10 15
Phe Pro Asp Pro Cys Phe Arg Ala Asn Cys Glu Tyr Gln Cys Gln Pro
20 25 30
Leu Asn Gln Thr Ser Tyr Leu Cys Val Cys Ala Glu Gly Phe Ala Pro
35 40 45
Ile Pro His Glu Pro His Arg Cys Gln Met Phe Cys Asn Gln Thr Ala
50 55 60
Cys Pro Ala Asp Cys Asp Pro Asn Thr Gln Ala Ser Cys Glu Cys Pro
65 70 75 80
Glu Gly Tyr Ile Leu Asp Asp Gly Phe Ile Cys Thr Asp Ile Asp Glu
85 90 95
Cys Glu Asn Gly Gly Phe Cys Ser Gly Val Cys His Asn Leu Pro Gly
100 105 110
Thr Phe Glu Cys Ile Cys Gly Pro Asp Ser Ala Leu Val Arg His Ile
115 120 125
Gly Thr Asp Cys
130
<210> 2
<211> 396
<212> ДНК
<213> человек
<400> 2
atgcttgggg tcctggtcct tggcgcgctg gccctggccg gcctggggtt ccccgacccg 60
tgcttcagag ccaactgcga gtaccagtgc cagcccctga accaaactag ctacctctgc 120
gtctgcgccg agggcttcgc gcccattccc cacgagccgc acaggtgcca gatgttttgc 180
aaccagactg cctgtccagc cgactgcgac cccaacaccc aggctagctg tgagtgccct 240
gaaggctaca tcctggacga cggtttcatc tgcacggaca tcgacgagtg cgaaaacggc 300
ggcttctgct ccggggtgtg ccacaacctc cccggtacct tcgagtgcat ctgcgggccc 360
gactcggccc ttgtccgcca cattggcacc gactgt 396
<210> 3
<211> 132
<212> Белок
<213> человек
<400> 3
Met Leu Gly Val Leu Val Leu Gly Ala Leu Ala Leu Ala Gly Leu Gly
1 5 10 15
Phe Pro Asp Pro Cys Phe Arg Ala Asn Cys Glu Tyr Gln Cys Gln Pro
20 25 30
Leu Asn Gln Thr Ser Tyr Leu Cys Val Cys Ala Glu Gly Phe Ala Pro
35 40 45
Ile Pro His Glu Pro His Arg Cys Gln Met Phe Cys Asn Gln Thr Ala
50 55 60
Cys Pro Ala Asp Cys Asp Pro Asn Thr Gln Ala Ser Cys Glu Cys Pro
65 70 75 80
Glu Gly Tyr Ile Leu Asp Asp Gly Phe Ile Cys Thr Asp Ile Asp Glu
85 90 95
Cys Glu Asn Gly Gly Phe Cys Ser Gly Val Cys His Asn Leu Pro Gly
100 105 110
Thr Phe Glu Cys Ile Cys Gly Pro Asp Ser Ala Leu Ala Arg His Ile
115 120 125
Gly Thr Asp Cys
130
<210> 4
<211> 396
<212> ДНК
<213> человек
<400> 4
atgcttgggg tcctggtcct tggcgcgctg gccctggccg gcctggggtt ccccgacccg 60
tgcttcagag ccaactgcga gtaccagtgc cagcccctga accaaactag ctacctctgc 120
gtctgcgccg agggcttcgc gcccattccc cacgagccgc acaggtgcca gatgttttgc 180
aaccagactg cctgtccagc cgactgcgac cccaacaccc aggctagctg tgagtgccct 240
gaaggctaca tcctggacga cggtttcatc tgcacggaca tcgacgagtg cgaaaacggc 300
ggcttctgct ccggggtgtg ccacaacctc cccggtacct tcgagtgcat ctgcgggccc 360
gactcggccc ttgcccgcca cattggcacc gactgt 396
<210> 5
<211> 480
<212> Белок
<213> человек
<400> 5
Met Leu Gly Val Leu Val Leu Gly Ala Leu Ala Leu Ala Gly Leu Gly
1 5 10 15
Phe Pro Ala Pro Ala Glu Pro Gln Pro Gly Gly Ser Gln Cys Val Glu
20 25 30
His Asp Cys Phe Ala Leu Tyr Pro Gly Pro Ala Thr Phe Leu Asn Ala
35 40 45
Ser Gln Ile Cys Asp Gly Leu Arg Gly His Leu Met Thr Val Arg Ser
50 55 60
Ser Val Ala Ala Asp Val Ile Ser Leu Leu Leu Asn Gly Asp Gly Gly
65 70 75 80
Val Gly Arg Arg Arg Leu Trp Ile Gly Leu Gln Leu Pro Pro Gly Cys
85 90 95
Gly Asp Pro Lys Arg Leu Gly Pro Leu Arg Gly Phe Gln Trp Val Thr
100 105 110
Gly Asp Asn Asn Thr Ser Tyr Ser Arg Trp Ala Arg Leu Asp Leu Asn
115 120 125
Gly Ala Pro Leu Cys Gly Pro Leu Cys Val Ala Val Ser Ala Ala Glu
130 135 140
Ala Thr Val Pro Ser Glu Pro Ile Trp Glu Glu Gln Gln Cys Glu Val
145 150 155 160
Lys Ala Asp Gly Phe Leu Cys Glu Phe His Phe Pro Ala Thr Cys Arg
165 170 175
Pro Leu Ala Val Glu Pro Gly Ala Ala Ala Ala Ala Val Ser Ile Thr
180 185 190
Tyr Gly Thr Pro Phe Ala Ala Arg Gly Ala Asp Phe Gln Ala Leu Pro
195 200 205
Val Gly Ser Ser Ala Ala Val Ala Pro Leu Gly Leu Gln Leu Met Cys
210 215 220
Thr Ala Pro Pro Gly Ala Val Gln Gly His Trp Ala Arg Glu Ala Pro
225 230 235 240
Gly Ala Trp Asp Cys Ser Val Glu Asn Gly Gly Cys Glu His Ala Cys
245 250 255
Asn Ala Ile Pro Gly Ala Pro Arg Cys Gln Cys Pro Ala Gly Ala Ala
260 265 270
Leu Gln Ala Asp Gly Arg Ser Cys Thr Ala Ser Ala Thr Gln Ser Cys
275 280 285
Asn Asp Leu Cys Glu His Phe Cys Val Pro Asn Pro Asp Gln Pro Gly
290 295 300
Ser Tyr Ser Cys Met Cys Glu Thr Gly Tyr Arg Leu Ala Ala Asp Gln
305 310 315 320
His Arg Cys Glu Asp Val Asp Asp Cys Ile Leu Glu Pro Ser Pro Cys
325 330 335
Pro Gln Arg Cys Val Asn Thr Gln Gly Gly Phe Glu Cys His Cys Tyr
340 345 350
Pro Asn Tyr Asp Leu Val Asp Gly Glu Cys Val Glu Pro Val Asp Pro
355 360 365
Cys Phe Arg Ala Asn Cys Glu Tyr Gln Cys Gln Pro Leu Asn Gln Thr
370 375 380
Ser Tyr Leu Cys Val Cys Ala Glu Gly Phe Ala Pro Ile Pro His Glu
385 390 395 400
Pro His Arg Cys Gln Met Phe Cys Asn Gln Thr Ala Cys Pro Ala Asp
405 410 415
Cys Asp Pro Asn Thr Gln Ala Ser Cys Glu Cys Pro Glu Gly Tyr Ile
420 425 430
Leu Asp Asp Gly Phe Ile Cys Thr Asp Ile Asp Glu Cys Glu Asn Gly
435 440 445
Gly Phe Cys Ser Gly Val Cys His Asn Leu Pro Gly Thr Phe Glu Cys
450 455 460
Ile Cys Gly Pro Asp Ser Ala Leu Val Arg His Ile Gly Thr Asp Cys
465 470 475 480
<210> 6
<211> 1440
<212> ДНК
<213> человек
<400> 6
atgcttgggg tcctggtcct tggcgcgctg gccctggccg gcctggggtt ccccgcaccc 60
gcagagccgc agccgggtgg cagccagtgc gtcgagcacg actgcttcgc gctctacccg 120
ggccccgcga ccttcctcaa tgccagtcag atctgcgacg gactgcgggg ccacctaatg 180
acagtgcgct cctcggtggc tgccgatgtc atttccttgc tactgaacgg cgacggcggc 240
gttggccgcc ggcgcctctg gatcggcctg cagctgccac ccggctgcgg cgaccccaag 300
cgcctcgggc ccctgcgcgg cttccagtgg gttacgggag acaacaacac cagctatagc 360
aggtgggcac ggctcgacct caatggggct cccctctgcg gcccgttgtg cgtcgctgtc 420
tccgctgctg aggccactgt gcccagcgag ccgatctggg aggagcagca gtgcgaagtg 480
aaggccgatg gcttcctctg cgagttccac ttcccagcca cctgcaggcc actggctgtg 540
gagcccggcg ccgcggctgc cgccgtctcg atcacctacg gcaccccgtt cgcggcccgc 600
ggagcggact tccaggcgct gccggtgggc agctccgccg cggtggctcc cctcggctta 660
cagctaatgt gcaccgcgcc gcccggagcg gtccaggggc actgggccag ggaggcgccg 720
ggcgcttggg actgcagcgt ggagaacggc ggctgcgagc acgcgtgcaa tgcgatccct 780
ggggctcccc gctgccagtg cccagccggc gccgccctgc aggcagacgg gcgctcctgc 840
accgcatccg cgacgcagtc ctgcaacgac ctctgcgagc acttctgcgt tcccaacccc 900
gaccagccgg gctcctactc gtgcatgtgc gagaccggct accggctggc ggccgaccaa 960
caccggtgcg aggacgtgga tgactgcata ctggagccca gtccgtgtcc gcagcgctgt
1020
gtcaacacac agggtggctt cgagtgccac tgctacccta actacgacct ggtggacggc
1080
gagtgtgtgg agcccgtgga cccgtgcttc agagccaact gcgagtacca gtgccagccc
1140
ctgaaccaaa ctagctacct ctgcgtctgc gccgagggct tcgcgcccat tccccacgag
1200
ccgcacaggt gccagatgtt ttgcaaccag actgcctgtc cagccgactg cgaccccaac
1260
acccaggcta gctgtgagtg ccctgaaggc tacatcctgg acgacggttt catctgcacg
1320
gacatcgacg agtgcgaaaa cggcggcttc tgctccgggg tgtgccacaa cctccccggt
1380
accttcgagt gcatctgcgg gcccgactcg gcccttgtcc gccacattgg caccgactgt
1440
<210> 7
<211> 480
<212> Белок
<213> человек
<400> 7
Met Leu Gly Val Leu Val Leu Gly Ala Leu Ala Leu Ala Gly Leu Gly
1 5 10 15
Phe Pro Ala Pro Ala Glu Pro Gln Pro Gly Gly Ser Gln Cys Val Glu
20 25 30
His Asp Cys Phe Ala Leu Tyr Pro Gly Pro Ala Thr Phe Leu Asn Ala
35 40 45
Ser Gln Ile Cys Asp Gly Leu Arg Gly His Leu Met Thr Val Arg Ser
50 55 60
Ser Val Ala Ala Asp Val Ile Ser Leu Leu Leu Asn Gly Asp Gly Gly
65 70 75 80
Val Gly Arg Arg Arg Leu Trp Ile Gly Leu Gln Leu Pro Pro Gly Cys
85 90 95
Gly Asp Pro Lys Arg Leu Gly Pro Leu Arg Gly Phe Gln Trp Val Thr
100 105 110
Gly Asp Asn Asn Thr Ser Tyr Ser Arg Trp Ala Arg Leu Asp Leu Asn
115 120 125
Gly Ala Pro Leu Cys Gly Pro Leu Cys Val Ala Val Ser Ala Ala Glu
130 135 140
Ala Thr Val Pro Ser Glu Pro Ile Trp Glu Glu Gln Gln Cys Glu Val
145 150 155 160
Lys Ala Asp Gly Phe Leu Cys Glu Phe His Phe Pro Ala Thr Cys Arg
165 170 175
Pro Leu Ala Val Glu Pro Gly Ala Ala Ala Ala Ala Val Ser Ile Thr
180 185 190
Tyr Gly Thr Pro Phe Ala Ala Arg Gly Ala Asp Phe Gln Ala Leu Pro
195 200 205
Val Gly Ser Ser Ala Ala Val Ala Pro Leu Gly Leu Gln Leu Met Cys
210 215 220
Thr Ala Pro Pro Gly Ala Val Gln Gly His Trp Ala Arg Glu Ala Pro
225 230 235 240
Gly Ala Trp Asp Cys Ser Val Glu Asn Gly Gly Cys Glu His Ala Cys
245 250 255
Asn Ala Ile Pro Gly Ala Pro Arg Cys Gln Cys Pro Ala Gly Ala Ala
260 265 270
Leu Gln Ala Asp Gly Arg Ser Cys Thr Ala Ser Ala Thr Gln Ser Cys
275 280 285
Asn Asp Leu Cys Glu His Phe Cys Val Pro Asn Pro Asp Gln Pro Gly
290 295 300
Ser Tyr Ser Cys Met Cys Glu Thr Gly Tyr Arg Leu Ala Ala Asp Gln
305 310 315 320
His Arg Cys Glu Asp Val Asp Asp Cys Ile Leu Glu Pro Ser Pro Cys
325 330 335
Pro Gln Arg Cys Val Asn Thr Gln Gly Gly Phe Glu Cys His Cys Tyr
340 345 350
Pro Asn Tyr Asp Leu Val Asp Gly Glu Cys Val Glu Pro Val Asp Pro
355 360 365
Cys Phe Arg Ala Asn Cys Glu Tyr Gln Cys Gln Pro Leu Asn Gln Thr
370 375 380
Ser Tyr Leu Cys Val Cys Ala Glu Gly Phe Ala Pro Ile Pro His Glu
385 390 395 400
Pro His Arg Cys Gln Met Phe Cys Asn Gln Thr Ala Cys Pro Ala Asp
405 410 415
Cys Asp Pro Asn Thr Gln Ala Ser Cys Glu Cys Pro Glu Gly Tyr Ile
420 425 430
Leu Asp Asp Gly Phe Ile Cys Thr Asp Ile Asp Glu Cys Glu Asn Gly
435 440 445
Gly Phe Cys Ser Gly Val Cys His Asn Leu Pro Gly Thr Phe Glu Cys
450 455 460
Ile Cys Gly Pro Asp Ser Ala Leu Ala Arg His Ile Gly Thr Asp Cys
465 470 475 480
<210> 8
<211> 1440
<212> ДНК
<213> человек
<400> 8
atgcttgggg tcctggtcct tggcgcgctg gccctggccg gcctggggtt ccccgcaccc 60
gcagagccgc agccgggtgg cagccagtgc gtcgagcacg actgcttcgc gctctacccg 120
ggccccgcga ccttcctcaa tgccagtcag atctgcgacg gactgcgggg ccacctaatg 180
acagtgcgct cctcggtggc tgccgatgtc atttccttgc tactgaacgg cgacggcggc 240
gttggccgcc ggcgcctctg gatcggcctg cagctgccac ccggctgcgg cgaccccaag 300
cgcctcgggc ccctgcgcgg cttccagtgg gttacgggag acaacaacac cagctatagc 360
aggtgggcac ggctcgacct caatggggct cccctctgcg gcccgttgtg cgtcgctgtc 420
tccgctgctg aggccactgt gcccagcgag ccgatctggg aggagcagca gtgcgaagtg 480
aaggccgatg gcttcctctg cgagttccac ttcccagcca cctgcaggcc actggctgtg 540
gagcccggcg ccgcggctgc cgccgtctcg atcacctacg gcaccccgtt cgcggcccgc 600
ggagcggact tccaggcgct gccggtgggc agctccgccg cggtggctcc cctcggctta 660
cagctaatgt gcaccgcgcc gcccggagcg gtccaggggc actgggccag ggaggcgccg 720
ggcgcttggg actgcagcgt ggagaacggc ggctgcgagc acgcgtgcaa tgcgatccct 780
ggggctcccc gctgccagtg cccagccggc gccgccctgc aggcagacgg gcgctcctgc 840
accgcatccg cgacgcagtc ctgcaacgac ctctgcgagc acttctgcgt tcccaacccc 900
gaccagccgg gctcctactc gtgcatgtgc gagaccggct accggctggc ggccgaccaa 960
caccggtgcg aggacgtgga tgactgcata ctggagccca gtccgtgtcc gcagcgctgt
1020
gtcaacacac agggtggctt cgagtgccac tgctacccta actacgacct ggtggacggc
1080
gagtgtgtgg agcccgtgga cccgtgcttc agagccaact gcgagtacca gtgccagccc
1140
ctgaaccaaa ctagctacct ctgcgtctgc gccgagggct tcgcgcccat tccccacgag
1200
ccgcacaggt gccagatgtt ttgcaaccag actgcctgtc cagccgactg cgaccccaac
1260
acccaggcta gctgtgagtg ccctgaaggc tacatcctgg acgacggttt catctgcacg
1320
gacatcgacg agtgcgaaaa cggcggcttc tgctccgggg tgtgccacaa cctccccggt
1380
accttcgagt gcatctgcgg gcccgactcg gcccttgccc gccacattgg caccgactgt
1440
<210> 9
<211> 516
<212> Белок
<213> человек
<400> 9
Met Leu Gly Val Leu Val Leu Gly Ala Leu Ala Leu Ala Gly Leu Gly
1 5 10 15
Phe Pro Ala Pro Ala Glu Pro Gln Pro Gly Gly Ser Gln Cys Val Glu
20 25 30
His Asp Cys Phe Ala Leu Tyr Pro Gly Pro Ala Thr Phe Leu Asn Ala
35 40 45
Ser Gln Ile Cys Asp Gly Leu Arg Gly His Leu Met Thr Val Arg Ser
50 55 60
Ser Val Ala Ala Asp Val Ile Ser Leu Leu Leu Asn Gly Asp Gly Gly
65 70 75 80
Val Gly Arg Arg Arg Leu Trp Ile Gly Leu Gln Leu Pro Pro Gly Cys
85 90 95
Gly Asp Pro Lys Arg Leu Gly Pro Leu Arg Gly Phe Gln Trp Val Thr
100 105 110
Gly Asp Asn Asn Thr Ser Tyr Ser Arg Trp Ala Arg Leu Asp Leu Asn
115 120 125
Gly Ala Pro Leu Cys Gly Pro Leu Cys Val Ala Val Ser Ala Ala Glu
130 135 140
Ala Thr Val Pro Ser Glu Pro Ile Trp Glu Glu Gln Gln Cys Glu Val
145 150 155 160
Lys Ala Asp Gly Phe Leu Cys Glu Phe His Phe Pro Ala Thr Cys Arg
165 170 175
Pro Leu Ala Val Glu Pro Gly Ala Ala Ala Ala Ala Val Ser Ile Thr
180 185 190
Tyr Gly Thr Pro Phe Ala Ala Arg Gly Ala Asp Phe Gln Ala Leu Pro
195 200 205
Val Gly Ser Ser Ala Ala Val Ala Pro Leu Gly Leu Gln Leu Met Cys
210 215 220
Thr Ala Pro Pro Gly Ala Val Gln Gly His Trp Ala Arg Glu Ala Pro
225 230 235 240
Gly Ala Trp Asp Cys Ser Val Glu Asn Gly Gly Cys Glu His Ala Cys
245 250 255
Asn Ala Ile Pro Gly Ala Pro Arg Cys Gln Cys Pro Ala Gly Ala Ala
260 265 270
Leu Gln Ala Asp Gly Arg Ser Cys Thr Ala Ser Ala Thr Gln Ser Cys
275 280 285
Asn Asp Leu Cys Glu His Phe Cys Val Pro Asn Pro Asp Gln Pro Gly
290 295 300
Ser Tyr Ser Cys Met Cys Glu Thr Gly Tyr Arg Leu Ala Ala Asp Gln
305 310 315 320
His Arg Cys Glu Asp Val Asp Asp Cys Ile Leu Glu Pro Ser Pro Cys
325 330 335
Pro Gln Arg Cys Val Asn Thr Gln Gly Gly Phe Glu Cys His Cys Tyr
340 345 350
Pro Asn Tyr Asp Leu Val Asp Gly Glu Cys Val Glu Pro Val Asp Pro
355 360 365
Cys Phe Arg Ala Asn Cys Glu Tyr Gln Cys Gln Pro Leu Asn Gln Thr
370 375 380
Ser Tyr Leu Cys Val Cys Ala Glu Gly Phe Ala Pro Ile Pro His Glu
385 390 395 400
Pro His Arg Cys Gln Met Phe Cys Asn Gln Thr Ala Cys Pro Ala Asp
405 410 415
Cys Asp Pro Asn Thr Gln Ala Ser Cys Glu Cys Pro Glu Gly Tyr Ile
420 425 430
Leu Asp Asp Gly Phe Ile Cys Thr Asp Ile Asp Glu Cys Glu Asn Gly
435 440 445
Gly Phe Cys Ser Gly Val Cys His Asn Leu Pro Gly Thr Phe Glu Cys
450 455 460
Ile Cys Gly Pro Asp Ser Ala Leu Val Arg His Ile Gly Thr Asp Cys
465 470 475 480
Asp Ser Gly Lys Val Asp Gly Gly Asp Ser Gly Ser Gly Glu Pro Pro
485 490 495
Pro Ser Pro Thr Pro Gly Ser Thr Leu Thr Pro Pro Ala Val Gly Leu
500 505 510
Val His Ser Gly
515
<210> 10
<211> 1548
<212> ДНК
<213> человек
<400> 10
atgcttgggg tcctggtcct tggcgcgctg gccctggccg gcctggggtt ccccgcaccc 60
gcagagccgc agccgggtgg cagccagtgc gtcgagcacg actgcttcgc gctctacccg 120
ggccccgcga ccttcctcaa tgccagtcag atctgcgacg gactgcgggg ccacctaatg 180
acagtgcgct cctcggtggc tgccgatgtc atttccttgc tactgaacgg cgacggcggc 240
gttggccgcc ggcgcctctg gatcggcctg cagctgccac ccggctgcgg cgaccccaag 300
cgcctcgggc ccctgcgcgg cttccagtgg gttacgggag acaacaacac cagctatagc 360
aggtgggcac ggctcgacct caatggggct cccctctgcg gcccgttgtg cgtcgctgtc 420
tccgctgctg aggccactgt gcccagcgag ccgatctggg aggagcagca gtgcgaagtg 480
aaggccgatg gcttcctctg cgagttccac ttcccagcca cctgcaggcc actggctgtg 540
gagcccggcg ccgcggctgc cgccgtctcg atcacctacg gcaccccgtt cgcggcccgc 600
ggagcggact tccaggcgct gccggtgggc agctccgccg cggtggctcc cctcggctta 660
cagctaatgt gcaccgcgcc gcccggagcg gtccaggggc actgggccag ggaggcgccg 720
ggcgcttggg actgcagcgt ggagaacggc ggctgcgagc acgcgtgcaa tgcgatccct 780
ggggctcccc gctgccagtg cccagccggc gccgccctgc aggcagacgg gcgctcctgc 840
accgcatccg cgacgcagtc ctgcaacgac ctctgcgagc acttctgcgt tcccaacccc 900
gaccagccgg gctcctactc gtgcatgtgc gagaccggct accggctggc ggccgaccaa 960
caccggtgcg aggacgtgga tgactgcata ctggagccca gtccgtgtcc gcagcgctgt
1020
gtcaacacac agggtggctt cgagtgccac tgctacccta actacgacct ggtggacggc
1080
gagtgtgtgg agcccgtgga cccgtgcttc agagccaact gcgagtacca gtgccagccc
1140
ctgaaccaaa ctagctacct ctgcgtctgc gccgagggct tcgcgcccat tccccacgag
1200
ccgcacaggt gccagatgtt ttgcaaccag actgcctgtc cagccgactg cgaccccaac
1260
acccaggcta gctgtgagtg ccctgaaggc tacatcctgg acgacggttt catctgcacg
1320
gacatcgacg agtgcgaaaa cggcggcttc tgctccgggg tgtgccacaa cctccccggt
1380
accttcgagt gcatctgcgg gcccgactcg gcccttgtcc gccacattgg caccgactgt
1440
gactccggca aggtggacgg tggcgacagc ggctctggcg agcccccgcc cagcccgacg
1500
cccggctcca ccttgactcc tccggccgtg gggctcgtgc attcgggc
1548
<210> 11
<211> 516
<212> Белок
<213> человек
<400> 11
Met Leu Gly Val Leu Val Leu Gly Ala Leu Ala Leu Ala Gly Leu Gly
1 5 10 15
Phe Pro Ala Pro Ala Glu Pro Gln Pro Gly Gly Ser Gln Cys Val Glu
20 25 30
His Asp Cys Phe Ala Leu Tyr Pro Gly Pro Ala Thr Phe Leu Asn Ala
35 40 45
Ser Gln Ile Cys Asp Gly Leu Arg Gly His Leu Met Thr Val Arg Ser
50 55 60
Ser Val Ala Ala Asp Val Ile Ser Leu Leu Leu Asn Gly Asp Gly Gly
65 70 75 80
Val Gly Arg Arg Arg Leu Trp Ile Gly Leu Gln Leu Pro Pro Gly Cys
85 90 95
Gly Asp Pro Lys Arg Leu Gly Pro Leu Arg Gly Phe Gln Trp Val Thr
100 105 110
Gly Asp Asn Asn Thr Ser Tyr Ser Arg Trp Ala Arg Leu Asp Leu Asn
115 120 125
Gly Ala Pro Leu Cys Gly Pro Leu Cys Val Ala Val Ser Ala Ala Glu
130 135 140
Ala Thr Val Pro Ser Glu Pro Ile Trp Glu Glu Gln Gln Cys Glu Val
145 150 155 160
Lys Ala Asp Gly Phe Leu Cys Glu Phe His Phe Pro Ala Thr Cys Arg
165 170 175
Pro Leu Ala Val Glu Pro Gly Ala Ala Ala Ala Ala Val Ser Ile Thr
180 185 190
Tyr Gly Thr Pro Phe Ala Ala Arg Gly Ala Asp Phe Gln Ala Leu Pro
195 200 205
Val Gly Ser Ser Ala Ala Val Ala Pro Leu Gly Leu Gln Leu Met Cys
210 215 220
Thr Ala Pro Pro Gly Ala Val Gln Gly His Trp Ala Arg Glu Ala Pro
225 230 235 240
Gly Ala Trp Asp Cys Ser Val Glu Asn Gly Gly Cys Glu His Ala Cys
245 250 255
Asn Ala Ile Pro Gly Ala Pro Arg Cys Gln Cys Pro Ala Gly Ala Ala
260 265 270
Leu Gln Ala Asp Gly Arg Ser Cys Thr Ala Ser Ala Thr Gln Ser Cys
275 280 285
Asn Asp Leu Cys Glu His Phe Cys Val Pro Asn Pro Asp Gln Pro Gly
290 295 300
Ser Tyr Ser Cys Met Cys Glu Thr Gly Tyr Arg Leu Ala Ala Asp Gln
305 310 315 320
His Arg Cys Glu Asp Val Asp Asp Cys Ile Leu Glu Pro Ser Pro Cys
325 330 335
Pro Gln Arg Cys Val Asn Thr Gln Gly Gly Phe Glu Cys His Cys Tyr
340 345 350
Pro Asn Tyr Asp Leu Val Asp Gly Glu Cys Val Glu Pro Val Asp Pro
355 360 365
Cys Phe Arg Ala Asn Cys Glu Tyr Gln Cys Gln Pro Leu Asn Gln Thr
370 375 380
Ser Tyr Leu Cys Val Cys Ala Glu Gly Phe Ala Pro Ile Pro His Glu
385 390 395 400
Pro His Arg Cys Gln Met Phe Cys Asn Gln Thr Ala Cys Pro Ala Asp
405 410 415
Cys Asp Pro Asn Thr Gln Ala Ser Cys Glu Cys Pro Glu Gly Tyr Ile
420 425 430
Leu Asp Asp Gly Phe Ile Cys Thr Asp Ile Asp Glu Cys Glu Asn Gly
435 440 445
Gly Phe Cys Ser Gly Val Cys His Asn Leu Pro Gly Thr Phe Glu Cys
450 455 460
Ile Cys Gly Pro Asp Ser Ala Leu Ala Arg His Ile Gly Thr Asp Cys
465 470 475 480
Asp Ser Gly Lys Val Asp Gly Gly Asp Ser Gly Ser Gly Glu Pro Pro
485 490 495
Pro Ser Pro Thr Pro Gly Ser Thr Leu Thr Pro Pro Ala Val Gly Leu
500 505 510
Val His Ser Gly
515
<210> 12
<211> 1548
<212> ДНК
<213> человек
<400> 12
atgcttgggg tcctggtcct tggcgcgctg gccctggccg gcctggggtt ccccgcaccc 60
gcagagccgc agccgggtgg cagccagtgc gtcgagcacg actgcttcgc gctctacccg 120
ggccccgcga ccttcctcaa tgccagtcag atctgcgacg gactgcgggg ccacctaatg 180
acagtgcgct cctcggtggc tgccgatgtc atttccttgc tactgaacgg cgacggcggc 240
gttggccgcc ggcgcctctg gatcggcctg cagctgccac ccggctgcgg cgaccccaag 300
cgcctcgggc ccctgcgcgg cttccagtgg gttacgggag acaacaacac cagctatagc 360
aggtgggcac ggctcgacct caatggggct cccctctgcg gcccgttgtg cgtcgctgtc 420
tccgctgctg aggccactgt gcccagcgag ccgatctggg aggagcagca gtgcgaagtg 480
aaggccgatg gcttcctctg cgagttccac ttcccagcca cctgcaggcc actggctgtg 540
gagcccggcg ccgcggctgc cgccgtctcg atcacctacg gcaccccgtt cgcggcccgc 600
ggagcggact tccaggcgct gccggtgggc agctccgccg cggtggctcc cctcggctta 660
cagctaatgt gcaccgcgcc gcccggagcg gtccaggggc actgggccag ggaggcgccg 720
ggcgcttggg actgcagcgt ggagaacggc ggctgcgagc acgcgtgcaa tgcgatccct 780
ggggctcccc gctgccagtg cccagccggc gccgccctgc aggcagacgg gcgctcctgc 840
accgcatccg cgacgcagtc ctgcaacgac ctctgcgagc acttctgcgt tcccaacccc 900
gaccagccgg gctcctactc gtgcatgtgc gagaccggct accggctggc ggccgaccaa 960
caccggtgcg aggacgtgga tgactgcata ctggagccca gtccgtgtcc gcagcgctgt
1020
gtcaacacac agggtggctt cgagtgccac tgctacccta actacgacct ggtggacggc
1080
gagtgtgtgg agcccgtgga cccgtgcttc agagccaact gcgagtacca gtgccagccc
1140
ctgaaccaaa ctagctacct ctgcgtctgc gccgagggct tcgcgcccat tccccacgag
1200
ccgcacaggt gccagatgtt ttgcaaccag actgcctgtc cagccgactg cgaccccaac
1260
acccaggcta gctgtgagtg ccctgaaggc tacatcctgg acgacggttt catctgcacg
1320
gacatcgacg agtgcgaaaa cggcggcttc tgctccgggg tgtgccacaa cctccccggt
1380
accttcgagt gcatctgcgg gcccgactcg gcccttgccc gccacattgg caccgactgt
1440
gactccggca aggtggacgg tggcgacagc ggctctggcg agcccccgcc cagcccgacg
1500
cccggctcca ccttgactcc tccggccgtg gggctcgtgc attcgggc
1548
<210> 13
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетическая ДНК
<400> 13
aatgtggcgg gcaagggccg a 21
<---
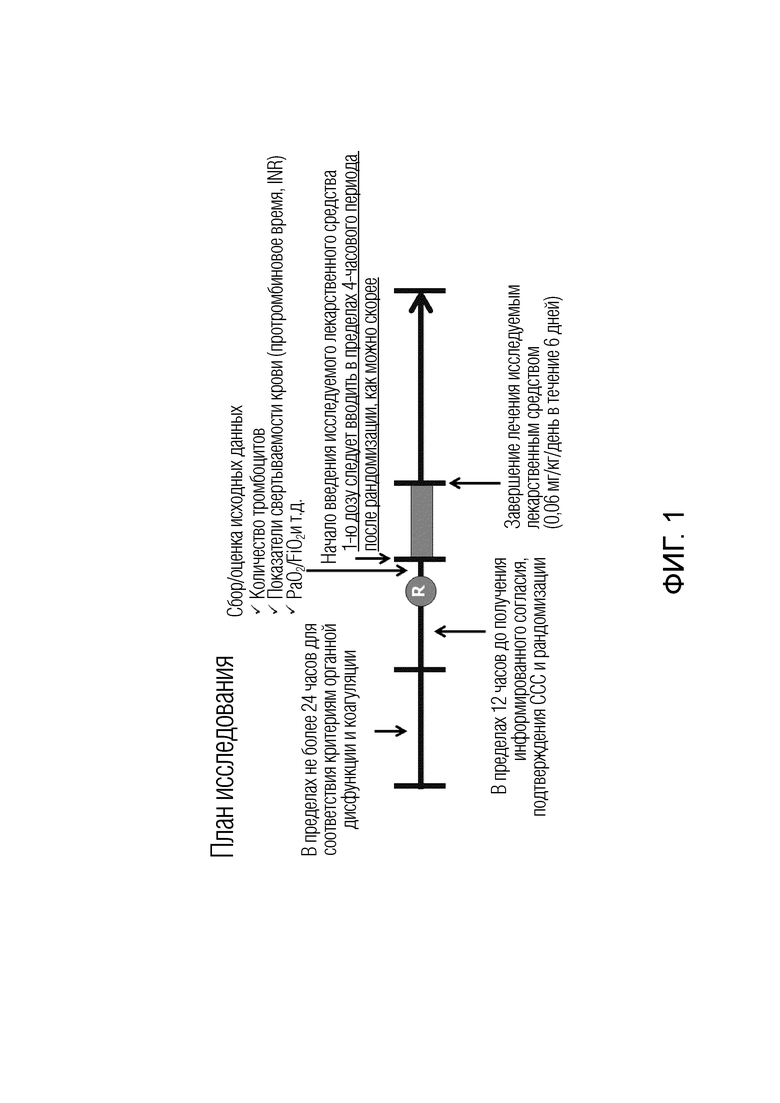
Изобретение относится к области медицины, а именно к способу терапевтического лечения и/или улучшения состояния пациента с сепсисом. Способ терапевтического лечения и/или улучшения состояния пациента с сепсисом включает введение лекарственного средства, содержащего тромбомодулин в качестве активного ингредиента, где указанное лекарственное средство вводится пациенту, у которого непосредственно перед введением значение международного нормализованного отношения (INR) больше чем 1,4, где термин “непосредственно перед введением” означает период 1 час, рассчитанный ретроспективно от начала введения лекарственного средства, содержащего тромбомодулин, где лекарственное средство вводится пациенту, у которого непосредственно перед введением количество тромбоцитов больше чем 30000/мм3. Вышеописанное изобретение позволяет обеспечить способ для эффективного терапевтического лечения и/или улучшения состояния при сепсисе, сопровождающемся коагулопатией. 10 з.п. ф-лы, 1 ил., 4 табл., 8 пр.
1. Способ терапевтического лечения и/или улучшения состояния пациента с сепсисом, где способ включает введение лекарственного средства, содержащего тромбомодулин в качестве активного ингредиента, где указанное лекарственное средство вводится пациенту, у которого непосредственно перед введением значение международного нормализованного отношения (INR) больше чем 1,4,
где термин “непосредственно перед введением” означает период 1 час, рассчитанный ретроспективно от начала введения лекарственного средства, содержащего тромбомодулин, где лекарственное средство вводится пациенту, у которого непосредственно перед введением количество тромбоцитов больше чем 30000/мм3.
2. Способ по п. 1, где лекарственное средство вводится пациенту, у которого непосредственно перед введением уровень комплекса тромбин-антитромбин (TAT) составляет 10 нг/мл или более.
3. Способ по п. 1 или 2, где лекарственное средство вводится пациенту, у которого непосредственно перед введением количество тромбоцитов больше чем 30000/мм3 и оценка по шкале Sofa не больше чем 11.
4. Способ по любому из пп. 1-3, где указанное лекарственное средство вводится пациенту, у которого непосредственно перед введением имеется один-три типа органных дисфункций.
5. Способ по п. 1 или 2, где указанное лекарственное средство вводится пациенту, у которого непосредственно перед введением уровень D-димера не меньше чем 3500 нг/мл.
6. Способ по п. 1 или 2, где указанное лекарственное средство вводится пациенту, у которого непосредственно перед введением уровень фрагмента протромбина 1+2 (F1+2) больше чем 229 пмоль/л.
7. Способ по п. 1 или 2, где указанное лекарственное средство вводится пациенту, у которого непосредственно перед введением уровень активности протеина C не больше чем 40%.
8. Способ по п. 1 или 2, где указанное лекарственное средство вводится пациенту, у которого непосредственно перед введением уровень активности антитромбина III (AT III) меньше чем 70%.
9. Способ по п. 1 или 2, где указанное лекарственное средство вводится пациенту, у которого непосредственно перед введением размер микрочастиц (MP) больше чем 10 нм.
10. Способ по п. 1 или 2, где указанное лекарственное средство вводится пациенту, у которого непосредственно перед введением оценка по шкале APACHE II меньше чем 35.
11. Способ по п. 1 или 2, где лекарственное средство, содержащее 0,005-1 мг/кг тромбомодулина, внутривенно вводится пациенту с сепсисом, у которого он сопровождается коагулопатией, с частотой один раз в день в течение по меньшей мере четырех последовательных дней.
| EP 2781221 A1, 24.09.2014 | |||
| US 2015118699 A1, 30.04.2015 | |||
| US 2013225477 A1, 29.08.2013 | |||
| US 2005148029 A1, 07.07.2005 | |||
| US 2016106806 A1, 21.04.2016 | |||
| БЕЛОУСОВ Ю.Б | |||
| и соавт | |||
| Клиническая фармакокинетика | |||
| Практика дозирования лекарств: Спец | |||
| выпуск серии "Рациональная фармакотерапия" - М.: Литтерра, 2005 | |||
| ДВОЙНОЙ ГАЕЧНЫЙ КЛЮЧ | 1920 |
|
SU288A1 |
| WATANABE E | |||
| et al | |||
| Pharmacokinetics of | |||
Авторы
Даты
2023-07-11—Публикация
2019-08-01—Подача