Область, к которой относится изобретение
Настоящее изобретение относится к ингибирующим антителам против MASP-2 и к композициям, содержащим такие антитела и используемым в целях ингибирования MASP-2-зависимой активации комплемента.
Перекрестная ссылка на родственную заявку
В настоящей заявке испрашивается приоритет предварительной заявки на патент США № 61/482567, поданной 4 мая 2011 года, которая во всей своей полноте вводится в настоящее описание посредством ссылки.
Указание относительно списка последовательностей
Список последовательностей, прилагаемый к настоящей заявке, представлен не в бумажной копии, а в виде текстового файла, а поэтому он вводится в настоящее описание посредством ссылки. Текстовый файл, содержащий список последовательностей, представлен под именем «MP_1_0115_PCT_SequenceListingasFiled_20120504_ST25». Этот текстовой файл, имеющий размер 158 кб, был создан 4 мая 2012 года и подан через EFS-Web вместе с подачей настоящей заявки.
Предшествующий уровень техники
Система комплемента действует на ранней стадии как механизм инициации, амплификации и распределения иммунного ответа на микробную инфекцию и на другие острые инфекции (M.K. Liszewski and J.P. Atkinson, 1993, in Fundamental Immunology, Third Edition, edited by W.E. Paul, Raven Press, Ltd., New York) у человека и других позвоночных. Хотя активация комплемента обеспечивает эффективную защиту первого ряда от потенциальных патогенов, однако активация комплемента, которая стимулирует вырабатывание протективного иммунного ответа, может также представлять потенциальную угрозу для хозяина (K.R. Kalli, et al., Springer Semin. Immunopathol. 15:417-431, 1994; B.P. Morgan, Eur. J. Clinical Investig. 24:219-228, 1994). Так, например, продукты протеолиза C3 и C5 стимулируют рекрутинг и активацию нейтрофилов. Хотя нейтрофилы необходимы для защиты хозяина, однако активированные нейтрофилы не могут быть идентифицированы по высвобождению ими деструктивных ферментов и могут вызывать поражение органов. Кроме того, активация комплемента может вызывать отложение литических компонентов комплемента на участках, расположенных поблизости от клеток-хозяев, а также на микробных мишенях, что приводит к лизису клеток-хозяев.
Система комплемента также участвует в патогенезе различных острых и хронических патологических состояний, включая инфаркт миокарда, инсульт, острый респираторный дистресс-синдром (ОРДС), реперфузионное поражение, септический шок, проницаемость капилляров после тепловых ожогов, воспаление после операции по кардиопульмонарному шунтированию, отторжение трансплантата, ревматоидный артрит, рассеянный склероз, тяжелая миастения и болезнь Альцгеймера. Почти при всех этих состояниях сам комплемент не вызывает эти состояния, но является одним из нескольких факторов, участвующих в патогенезе. Тем не менее, активация комплемента может представлять собой основной патологический механизм и служить эффективной точкой клинического контроля при многих из указанных патологических состояниях.
Все возрастающее признание важного значения в понимании механизмов комплемент-опосредованного поражения тканей при различных патологических состояниях еще раз указывает на необходимость разработки эффективных комплемент-ингибирующих лекарственных средств. В настоящее время экулизумаб (Soliris®), то есть антитело против C5, является единственным лекарственным средством, мишенью которого является комплемент, и которое было разрешено для применения в медицине. Кроме того, C5 является одним из нескольких эффекторных молекул, действующих на поздних этапах реакции системы комплемента, и блокада C5 не приводит к ингибированию активации системы комплемента. Поэтому ингибитор стадий инициации активации комплемента имел бы существенное преимущество по сравнению с ингибитором одного компонента, действующего на поздних этапах в каскаде реакций системы комплемента.
В настоящее время хорошо известно, что система комплемента может активироваться тремя различными путями: по классическому пути, по лектиновому пути и по альтернативному пути. Классический путь обычно запускается комплексом, состоящим из антител хозяина, связанных с чужеродной частицей (то есть с антигеном), и для вырабатывания специфического гуморального ответа требуется предварительная стимуляция антигеном. Поскольку активация классического пути зависит от предварительного адаптивного иммунного ответа у хозяина, то такой классический путь является частью приобретенной иммунной системы. В противоположность этому, лектиновый и альтернативный пути не зависят от адаптивного иммунного ответа и являются частью природной иммунной системы.
Активация системы комплемента приводит к последующей активации серин-протеазных зимогенов. Первой стадией активации классического пути является связывание молекулы специфического распознавания, C1q, с антиген-связанными комплексами IgG и IgM. C1q ассоциируется с серин-протеазными проферментами C1r и C1s в виде комплекса, обозначаемого C1. После связывания C1q с иммунными комплексами, аутопротеолитическое расщепление Arg-Ile-сайта C1r сопровождается C1r-опосредуемым расщеплением и активацией C1s, что сообщает ему способность расщеплять C4 и C2. C4 расщепляется на два фрагмента, обозначаемых C4a и C4b, и аналогогичным образом, C2 расщепляется на компоненты C2a и C2b. Фрагменты C4b могут образовывать ковалентные связи с расположенными рядом гидроксильными группами или аминогруппами и продуцировать C3-конвертазу (C4b2a) посредством нековалентного взаимодействия с фрагментом C2a активированного C2. C3-конвертаза (C4b2a) активирует C3 путем протеолитического расщепления на субкомпоненты C3a и C3b, что приводит к продуцированию C5-конвертазы (C4b2a3b), которая, посредством расщепления C5, способствует образованию комплекса, атакующего мембрану (C5b вместе с C6, C7, C8 и C9 также обозначаются «MAC»), и этот комплекс может разрушать клеточные мембраны и вызывать клеточный лизис. Активированные формы C3 и C4 (C3b и C4b) ковалентно осаждаются на поверхностях чужеродных мишеней, которые распознаются рецепторами комплемента на множестве фагоцитов.
Независимо от этого, первой стадией активации системы комплемента по лектиновому пути также является связывание молекул специфического распознавания, после которой происходит активация связанных серин-протеазных проферментов. Однако, в отличие от C1q, связывающегося с иммунным комплексом, молекулы распознавания в лектиновом пути составляют группу углевод-связывающих белков (маннан-связывающий лектин (MBL), H-фиколин, M-фиколин, L-фиколин и лектин C-типа CL-11), имеющие общее название «лектины». См. J. Lu et al., Biochim. Biophys. Acta 1572:387-400, 2002; Holmskov et al., Annu. Rev. Immunol. 21:547-578 (2003); Teh et al., Immunology 101:225-232 (2000)). См. также J. Luet et al., Biochim Biophys Acta 1572:387-400 (2002); Holmskov et al., Annu Rev Immunol 21:547-578 (2003); Teh et al., Immunology 101:225-232 (2000); Hansen S. et al., J. Immunol 185(10):6096-6104 (2010).
Ikeda с сотрудниками было впервые продемонстрировано, что MBL, подобно C1q, может активировать систему комплемента после связывания с эритроцитами, покрытыми дрожжевым маннаном, по C4-зависимому механизму (Ikeda et al., J. Biol. Chem. 262:7451-7454, 1987). MBL, член семейства белков коллектинов, представляет собой кальций-зависимый лектин, который связывается с углеводами по 3- и 4-гидроксигруппам, ориентированным в экваториальной плоскости пиранозного кольца. Таким образом, наиболее часто встречающимися лигандами для MBL являются D-манноза и N-ацетил-D-глюкозамин, а углеводы, не удовлетворяющие стерическим требованиям, имеют недетектируемую аффинность по отношению к MBL (Weis, W.I., et al., Nature 360:127-134, 1992). Взаимодействие между MBL и одновалентными сахарами является очень слабым, а их константы диссоциации обычно находятся в одноразрядном миллимолярном интервале. MBL достигает тесного специфического связывания с гликановыми лигандами посредством авидности, то есть посредством одновременного взаимодействия с множеством моносахаридных остатков, расположенных в непосредственно близости друг от друга (Lee, R.T., et al., Archiv. Biochem. Biophys. 299: 129-136, 1992). MBL распознает углеводные паттерны, которые обычно окаймляют микроорганизмы, такие как бактерии, дрожжи, паразиты и некоторые вирусы. В отличие от этого, MBL не распознает D-галактозу и сиаловую кислоту, предпоследние и последние сахара, которые обычно окаймляют «зрелый» комплекс гликоконъюгатов, присутствующих на гликопротеинах плазмы и клеточной поверхности у млекопитающих. Считается, что такая специфичность связывания стимулирует распознавание «чужеродных» поверхностей и способствует защите от «аутоактивации». Однако MBL не связывается с высокой аффинностью с кластерами гликанов-«предшественников» с высоким содержанием маннозы на N-связанных гликопротеинах и гликолипидах, секвестрированных в эндоплазматической ретикулуме и в аппарате Гольджи клеток млекопитающих (Maynard, Y., et al., J. Biol. Chem. 257:3788-3794, 1982). Поэтому поврежденные клетки являются потенциальными мишенями для активации по лектиновому пути посредством связывания с MBL.
Фиколины имеют лектиновый домен, отличающийся от лектинового домена MBL и называемый фибриноген-подобным доменом. Фиколины связываются с сахарными остатками по Ca++-независимому механизму. У человека были идентифицированы фиколины трех видов (L-фиколин, M-фиколин и H-фиколин). Два сывороточных фиколина, L-фиколин и H-фиколин, имеют общую специфичность к N-ацетил-D-глюкозамину, однако H-фиколин также связывается и с N-ацетил-D-галактозамином. Различия в специфичности L-фиколина, H-фиколина, CL-11 и MBL к сахарам означают, что различные лектины могут быть комплементарны различным гликоконъюгатам и нацелены на различные, хотя и перекрывающиеся, гликоконъюгаты. Эта концепция подтверждается последними сообщениями в литературе, указывающими на то, что из всех известных лектинов, участвующих в лектиновом пути, только L-фиколин специфически связывается с липотейхоевой кислотой, то есть гликоконъюгатом клеточной стенки, присутствующим на всех грамположительных бактериях. (Lynch, N.J., et al., J. Immunol. 172: 1198-1202, 2004). Коллектины (то есть MBL) и фиколины не обнаруживают какого-либо значимого сходства по своим аминокислотным последовательностям. Однако эти две группы белков имеют одинаковую организацию доменов и, подобно C1q, участвуют в сборке олигомерных структур, что максимизирует вероятность их связывания во многих сайтах.
Концентрации MBL в сыворотке у здоровых индивидуумов в высокой степени варьируются и генетически регулируются полиморфизмом/мутациями в промоторных и в кодирующих областях гена MBL. Уровень экспрессии MBL как белка острой фазы еще более повышается в процессе воспаления. L-фиколин присутствует в сыворотке в концентрациях, аналогичных концентрациям MBL. Поэтому L-фиколиновая ветвь лектинового пути по своей структуре является, возможно, сравнимой с MBL-ветвью. MBL и фиколины могут также действовать как опсонины, что позволяет фагоцитам нацеливаться на MBL- и фиколин-окаймляющие поверхности (см. Jack et al., J. Leukoc Biol., 77(3):328-36 (2004); Matsushita and Fujita, Immunobiology, 205(4-5):490-7 (2002); Aoyagi et al., J. Immunol. 174(1):418-25 (2005)). Такая опсонизация требует взаимодействия этих белков с рецепторами фагоцитов (Kuhlman, M, et al., J. Exp. Med. 169:1733, 1989; Matsushita, M., et al., J. Biol. Chem. 271:2448-54, 1996), идентичность которых пока еще не установлена.
Человеческий MBL стимулирует специфическое и высокоаффинное взаимодействие посредством его коллаген-подобного домена с уникальными C1r/C1s-подобными сериновыми протеазами, называемыми MBL-ассоциированными сериновыми протеазами (MASP). В настоящее время описано три MASP. Сначала был идентифицирован один фермент «MASP», и этот фермент был охарактеризован как фермент, ответственный за инициацию каскада реакций комплемента (то есть реакций расщепления C2 и C4) (Matsushita M & Fujita T., J. Exp Med 176(6):1497-1502 (1992), Ji, Y.H., et al., J. Immunol. 150:571-578, 1993). Затем было определено, что MASP-активность фактически представляет собой смесь двух протеаз: MASP-1 и MASP-2 (Thiel, S., et al., Nature 386:506-510, 1997). Однако было продемонстрировано, что для активации комплемента достаточно и одного комплекса MBL-MASP-2 (Vorup-Jensen, T., et al., J. Immunol. 165:2093-2100, 2000). Кроме того, только MASP-2 в высокой степени расщепляет C2 и C4 (Ambrus, G., et al., J. Immunol. 170: 1374-1382, 2003). Следовательно, MASP-2 представляет собой протеазу, ответственную за активацию C4 и C2 и генерирование C3-конвертазы, C4b2a. Этот механизм значительно отличается от механизма комплекса C1 классического пути, где координированное действие двух специфических сериновых протеаз (C1r и C1s) приводит к активации системы комплемента. Кроме того, была выделена третья новая протеаза, MASP-3 (Dahl, M.R., et al., Immunity 15: 127-35, 2001). MASP-1 и MASP-3 представляют собой продукты альтернативного сплайсинга одного и того же гена.
MASP имеют организацию доменов, идентичную организациям доменов C1r C1s, то есть ферментных компонентом комплекса C1 (Sim, R.B., et al., Biochem. Soc. Trans. 25:545, 2000). Эти домены включают N-концевой домен C1r/C1s/домен VEGF морского ежа/домен белка морфогенеза кости (CUB); домен, подобный эпидермальному фактору роста; второй домен CUB; тандем доменов белка регуляции комплемента и домен сериновой протеазы. Как и в протеазах C1, активация MASP-2 осуществляется посредством расщепления Arg-Ile-связи, непосредственно у домена сериновой протеазы, что приводит к расщеплению фермента на цепи А и В, связанные дисульфидными связями, где указанные цепи состоят из доменов сериновой протеазы. Недавно был описан генетически детерминированный дефицит MASP-2 (Stengaard-Pedersen, K., et al., New Eng. J. Med. 349:554-560, 2003). Мутация одного нуклеотида приводит к замене Asp-Gly в домене CUB1 и сообщает MASP-2 неспособность связываться с MBL.
MBL может также ассоциироваться с альтернативно сплайсированной формой MASP-2, известной как MBL-ассоциированный белок размером 19 кДа (MAp19) (Stover, CM., J. Immunol. 162:3481-90, 1999) или небольшой MBL-ассоциированный белок (sMAP) (Takahashi, M., et al., Int. Immunol. 11:859-863, 1999), который не обладает каталитической активностью MASP-2. MAp19 содержит первые два домена MASP-2, за которыми следует дополнительная последовательность из четырех уникальных аминокислот. Гены MASP 1 и MASP 2 расположены на человеческих хромосомах 3 и 1, соответственно (Schwaeble, W., et al., Immunobiology 205:455-466, 2002).
Существует ряд данных, позволяющих предположить, что различные комплексы MBL-MASP и большая фракция MASP в сыворотке не образуют комплексы с MBL (Thiel, S., et al., J. Immunol. 165:878-887, 2000). H- и L-фиколин связываются со всеми MASP и, как и MBL, активируют лектиновый путь комплемента (Dahl, M.R., et al., Immunity 15: 127-35, 2001; Matsushita, M., et al., J. Immunol. 165:3502-3506, 2002). Лектиновый и классические пути образуют общую C3-конвертазу (C4b2a), и на этой стадии эти два пути сходятся.
Существует широко распространенное мнение, что лектиновый путь играет важную роль в защите неинфицированного хозяина от инфекции. Убедительные доказательства участия MBL в защите хозяина были получены в анализах, проводимых у пациентов со сниженными уровнями функционального MBL в сыворотке (Kilpatrick, D.C., Biochim. Biophys. Acta 1572:401-413, 2002). У этих пациентов наблюдается восприимчивость к рецидивирующим бактериальным и грибковым инфекциям. Такие симптомы обычно появляются в раннем возрасте, в четком временном «окне» восприимчивости к инфекциям по мере убывания титров материнских антител, но еще до развития гуморального ответа с образованием полного репертуара антител. Этот синдром часто является следствием мутаций в нескольких сайтах коллагенозной части MBL, которые препятствуют соответствующему образованию олигомеров MBL. Однако, поскольку MBL может функционировать как опсонин независимо от комплемента, то неизвестно, в какой степени повышение чувствительности к инфекции обусловлено снижением активации комплемента.
В отличие от классических и лектиновых путей, не было обнаружено каких-либо инициаторов альтернативного пути, которые обеспечивали бы функции распознавания, присущие C1q и лектинам в двух других путях. В настоящее время хорошо известно, что альтернативный путь спонтанно подвергается циклической активации на низком уровне, которая может легко усиливаться на чужеродных или других аномальных поверхностях (бактерий, дрожжей, инфицированных вирусом клеток или поврежденной ткани), не имеющих собственных молекулярных элементов, которые поддерживают уже имеющуюся спонтанную активацию комплемента. Существует четыре белка плазмы, непосредственно участвующих в активации альтернативного пути, а именно, C3, факторы B и D, и пропердин. Несмотря на наличие множества данных, указывающих на участие классических и альтернативных путей комплемента в патогенезе неинфекционных заболеваний у человека, роль лектинового пути в таком патогенезе еще только начали исследовать. Последние исследования показали, что активация лектинового пути может быть ответственна за активацию комплемента и ассоциированное с нейтрализует воспаление при ишемии/реперфузионном повреждении. Collard и сотрудники (2000) сообщали, что культивированные эндотелиальные клетки, подвергаемые окислительному стрессу, связываются с MBL и обнаруживают осаждение C3 после воздействия на них человеческой сыворотки (Collard, CD., et al., Am. J. Pathol. 156:1549-1556, 2000). Кроме того, обработка человеческой сыворотки блокирующими моноклональными анти-MBL антителами приводит к ингибированию связывания с MBL и активации комплемента. Эти данные распространяются на крысиную модель ишемии миокарда-реперфузии, при которой у крыс, обработанных блокирующим антителом против крысиного MBL, наблюдалось более явное снижение повреждения миокарда после закупорки коронарной артерии, чем у крыс, обработанных контрольным антителом (Jordan, J.E., et al., Circulation 104:1413-1418, 2001). Молекулярный механизм связывания MBL с васкулярным эндотелием после окислительного стресса остается пока неясным, однако последние исследования позволяют предположить, что активация лектинового пути после окислительного стресса может быть опосредована связыванием MBL с васкулярными эндотелиальными цитокератинами, а не с гликоконъюгатами (Collard, CD., et al., Am. J. Pathol. 159:1045-1054, 2001). Другие исследования указывали на роль классических и альтернативных путей в патогенезе ишемии/реперфузионном повреждении, а роль лектиновго пути в патогенезе такого заболевания, пока остается предметом дискуссии (Riedermann, N.C, et al., Am. J. Pathol. 162:363-367, 2003).
Последние исследования показали, что MASP-1 (и, возможно, также MASP-3) необходим для превращения фактора D, то есть фермента активации альтернативного пути, из его зимогенной формы в ферментативно активную форму (см. Takahashi M. et al., J. Exp. Med. 207(1):29-37 (2010)). На физиологическую важность такого процесса указывает отсутствие функциональной активности альтернативного пути в плазме MASP-1/3-дефицитных мышей. Для функционирования альтернативного пути необходимо протеолитическое продуцирование C3b из нативного C3. Поскольку C3-конвертаза альтернативного пути (C3bBb) содержит C3b как основную субъединицу, то вопрос о рассмотрении происхождения первого C3b в альтернативном пути представляет серьезную проблему и дает стимул к проведению фундаментальных исследований.
C3 принадлежит к семейству белков (наряду с C4 и с макроглобулином α-2), которые содержат редкую посттрансляционную модификацию, известную как тиоэфирная связь. Тиоэфирная группа состоит из глутамина, у которого концевая карбонильная группа образует ковалентную тиоэфирную связь с сульфгидрильной группой цистеина без трех аминокислот. Эта связь является нестабильной, и электрофильный глутамил-тиоэфир может взаимодействовать с нуклеофильными группами, такими как гидроксильные группы или аминогруппы, и тем самым образовывать ковалентную связь с другими молекулами. Тиоэфирная связь является достаточно стабильной, если она секвестрирована в гидрофобном «кармане» интактного C3. Однако протеолитическое расщепление C3 на C3a и C3b приводит к «обнажению» в высокой степени реакционноспособной тиоэфирной связи на C3b, и, после нуклеофильной атаки смежными молекулами, содержащими гидроксильные группы или аминогруппы, C3b становится ковалентно связанной с мишенью. Считается, что помимо хорошо подтвержденной роли C3-тиоэфира в ковалентном связывании C3b с мишенями комплемента, C3-тиоэфир также играет главную роль в запуске альтернативного пути. В соответствии с широко распространенной «теории холостого хода», альтернативный путь инициируется продуцированием конвертазы в жидкой фазе, iC3Bb, которая образуется из C3 под действием гидролизованного тиоэфира (iC3; C3(H2O)) и фактора B (Lachmann, P.J., et al., Springer Semin. Immunopathol. 7:143-162, 1984). C3b-подобный C3(H2O) продуцируется из нативного C3 посредством медленного спонтанного гидролиза внутреннего тиоэфира, присутствующего в белке (Pangburn, M.K., et al., J. Exp. Med. 154:856-867, 1981). Благодаря активности C3(H2O)Bb-конвертазы, молекулы C3b осаждаются на поверхности мишени, и тем самым инициируют альтернативный путь.
Об инициаторах активации альтернативного пути известно очень мало. Считается, что активаторами могут быть стенки дрожжевых клеток (зимосан), многие чистые полисахариды, кроличьи эритроциты, некоторые иммуноглобулины, вирусы, грибы, бактерии, опухолевые клетки животных, паразиты и поврежденные клетки. Единственным общим признаком этих активаторов является присутствие углевода, однако, из-за сложности и разнообразия углеводных структур, трудно определить общие молекулярные детерминанты для распознавания. Широко распространено мнение, что активация альтернативного пути регулируется посредством тонкого баланса между ингибирующими регуляторными компонентами этого пути, такими как фактор Н, фактор I, DAF, CR1 и пропердин, который является единственным позитивным регулятором альтернативного пути. См. Schwaeble W.J. and Reid K.B., Immunol Today 20(1):17-21 (1999)).
Помимо явно нерегулируемого механизма активации, описанного выше, альтернативный путь может также давать петлю усиленной амплификации для C3-конвертазы (C4b2a) лектинового/классического пути, поскольку любой продуцируемый C3b может участвовать, вместе с фактором В, в образовании дополнительной C3-конвертазы (C3bBb) альтернативного пути. C3-конвертаза альтернативного пути стабилизируется посредством связывания пропердина. Пропердин способствует 6-10-кратному увеличению времени полужизни C3-конвертазы альтернативного пути. Добавление C3b к C3-конвертазе альтернативного пути способствует образованию C5-конвертазы альтернативного пути.
Считается, что все три пути (то есть классический, лектиновый и альтернативный) сходятся в C5, который, при его расщеплении, образует продукты, обладающие множеством провоспалительных эффектов. Путь, в котором сходятся все три пути, был определен как концевой путь комплемента. C5a представляет собой исключительно сильный анафилотоксин, индуцирующий изменение тонуса гладких мышц и сосудов, а также сосудистой проницаемости. Он также является сильным хемотаксином и активатором нейтрофилов и моноцитов. C5a-опосредуемая клеточная активация может значительно усиливать воспалительные ответы посредством индуцирования высвобождения множества дополнительных медиаторов воспаления, включая цитокины, гидролитические ферменты, метаболиты арахидоновой кислоты и молекулы активного кислорода. Расщепление C5 приводит к образованию C5b-9, также известного как мембраноатакующий комплекс (MAC). В настоящее время существуют убедительные доказательства того, что осаждение сублитического MAC, помимо его роли как литического порообразующего комплекса, может играть важную роль в воспалительном процессе.
Система комплемента, помимо ее важной роли в иммунной защите, также вносит свой вклад в поражение ткани, наблюдаемое при многих клинических состояниях. Поэтому крайне необходимо разработать терапевтически эффективные ингибиторы комплемента, которые могли бы предупреждать указанные побочные эффекты.
Сущность изобретения
Сущность изобретения заключается в выборе концепций в упрощенной форме, описанных ниже в разделе «Подробное описание изобретения». Такая сущность изобретения не рассматривается ни как способ идентификации ключевых признаков заявленного предмета изобретения, ни как средство, используемое для облегчения определения объема заявленного предмета изобретения.
В одном из аспектов настоящее изобретение относится к выделенному человеческому моноклональному антителу или к его антигенсвязывающему фрагменту, которые связываются с человеческим MASP-2, и включают: (i) вариабельную область тяжелой цепи, содержащую последовательности CDR-H1, CDR-H2 и CDR-H3; и (ii) вариабельную область легкой цепи, содержащую CDR-L1, CDR-L2 и CDR-L3, где последовательность CDR-H3 вариабельной области тяжелой цепи содержит аминокислотную последовательность, представленную как SEQ ID NO:38 или SEQ ID NO:90, и консервативные модификации в их последовательности, где последовательность CDR-L3 вариабельной области легкой цепи содержит аминокислотную последовательность, представленную как SEQ ID NO:51 или SEQ ID NO:94, и консервативные модификации в их последовательности, и где выделенное антитело ингибирует MASP-2-зависимую активацию комплемента.
В другом аспекте настоящее изобретение относится к человеческому антителу, которое связывается с человеческим MASP-2, где указанное антитело включает: I) a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, включающую аминокислотную последовательность 31-35 SEQ ID NO:21; и ii) CDR-H2 тяжелой цепи, включающую аминокислотную последовательность 50-65 SEQ ID NO:21; и iii) CDR-H3 тяжелой цепи, включающую аминокислотную последовательность 95-102 SEQ ID NO:21; и b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, включающую аминокислотную последовательность 24-34 SEQ ID NO:25 или SEQ ID NO:27; и ii) CDR-L2 легкой цепи, включающую аминокислотную последовательность 50-56 SEQ ID NO:25 или SEQ ID NO:27; и iii) CDR-L3 легкой цепи, включающую аминокислотную последовательность 89-97 SEQ ID NO:25 или SEQ ID NO:27; или II) их вариант, который идентичен указанным вариабельным доменам, за исключением тех вариантов, которые содержат все 10 аминокислотных замен в указанных CDR-областях указанной вариабельной области тяжелой цепи и все 10 аминокислотных замен в указанных CDR-областях указанной вариабельной области легкой цепи, где указанное антитело или его вариант ингибируют MASP-2-зависимую активацию комплемента.
В другом аспекте настоящее изобретение относится к выделенному человеческому моноклональному антителу или к его антигенсвязывающему фрагменту, которые связываются с человеческим MASP-2, где указанное антитело включает: I) a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, включающую аминокислотную последовательность 31-35 SEQ ID NO:20; и ii) CDR-H2 тяжелой цепи, включающую аминокислотную последовательность 50-65 SEQ ID NO:20; и iii) CDR-H3 тяжелой цепи, включающую аминокислотную последовательность 95-102 SEQ ID NO:18 или SEQ ID NO:20; и b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, включающую аминокислотную последовательность 24-34 SEQ ID NO:22 или SEQ ID NO:24; и ii) CDR-L2 легкой цепи, включающую аминокислотную последовательность 50-56 SEQ ID NO:22 или SEQ ID NO:24; и iii) CDR-L3 легкой цепи, включающую аминокислотную последовательность 89-97 SEQ ID NO:22 или SEQ ID NO:24; или II) их вариант, который идентичен указанным вариабельным доменам, за исключением тех вариантов, которые содержат все 10 аминокислотных замен в указанных CDR-областях указанной вариабельной области тяжелой цепи и все 10 аминокислотных замен в указанных CDR-областях указанной вариабельной области легкой цепи, где указанное антитело или его вариант ингибируют MASP-2-зависимую активацию комплемента.
В другом аспекте настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающему фрагменту, которые связываются с человеческим MASP-2 и включают вариабельную область тяжелой цепи, содержащую любую из аминокислотных последовательностей, представленных в SEQ ID NO:18, SEQ ID NO:20 или SEQ ID NO:21.
В другом аспекте настоящее изобретение относится к выделенному моноклональному антителу или к его антигенсвязывающему фрагменту, которые связываются с человеческим MASP-2 и включают вариабельную область легкой цепи, содержащую одну из аминокислотных последовательностей, представленных в SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:25 или SEQ ID NO:27.
В другом аспекте настоящее изобретение относится к молекулам нуклеиновой кислоты, кодирующим аминокислотные последовательности анти-MASP-2 антител или их фрагментов согласно изобретению, представленные в таблице 2.
В другом аспекте настоящее изобретение относится к клетке, содержащей по меньшей мере одну молекулу нуклеиновой кислоты, кодирующую аминокислотные последовательности анти-MASP-2 антител или их фрагментов согласно изобретению, представленные в таблице 2.
В другом аспекте настоящее изобретение относится к способу получения выделенного анти-MASP-2 антитела, где указанный способ включает культивирование клеток, содержащих по меньшей мере одну молекулу нуклеиновой кислоты, кодирующую аминокислотные последовательности анти-MASP-2 антител согласно изобретению, в условиях, благоприятствующих экспрессии молекул нуклеиновой кислоты, кодирующих анти-MASP-2 антитело, и выделение указанного анти-MASP-2 антитела.
В другом аспекте настоящее изобретение относится к выделенному полностью человеческому моноклональному антителу или к его антигенсвязывающему фрагменту, которые диссоциируют из человеческого MASP-2 с KD=10 нМ или менее, как было определено методом поверхностного плазмонного резонанса, и ингибируют активацию C4 на покрытом маннаном субстрате с IC50=10 нМ или менее в 1% сыворотке. В некоторых вариантах изобретения указанное антитело или его антигенсвязывающий фрагмент специфически распознает по меньшей мере часть эпитопа, распознаваемого эталонным антителом, где указанное эталонное антитело содержит вариабельную область тяжелой цепи, представленную в SEQ ID NO:20, и вариабельную область легкой цепи, представленную в SEQ ID NO:24.
В другом аспекте настоящее изобретение относится к композициям, содержащим полностью человеческие моноклональные анти-MASP-2 антитела согласно изобретению и фармацевтически приемлемый наполнитель.
В другом аспекте настоящее изобретение относится к способам ингибирования MASP-2-зависимой активации комплемента у индивидуума, где указанные способы включают введение индивидууму человеческого моноклонального антитела согласно изобретению в количестве, достаточном для ингибирования MASP-2-зависимой активации комплемента у указанного индивидуума.
В другом аспекте настоящее изобретение относится к промышленному изделию, содержащему унифицированную дозу человеческого моноклонального анти-MASP-2 антитела согласно изобретению, подходящую для терапевтического введения индивидууму, где указанная унифицированная доза составляет в пределах от 1 мг до 1000 мг.
Описание графического материала
Вышеупомянутые аспекты изобретения и многие из описанных здесь преимуществ изобретения будут более очевидными и более понятными для специалиста из нижеследующего подробного описания, которое сопровождается прилагаемым графическим материалом, где:
на фиг.1A представлена диаграмма, иллюстрирующая геномную структуру человеческого MASP-2;
на фиг.1B представлена диаграмма, иллюстрирующая доменную структуру человеческого белка MASP-2;
на фиг.2 графически проиллюстрированы результаты ELISA-анализа, осуществляемого на популяциях поликлональных антител, выбранных из scFcv-фаговых библиотек, подвергнутых пэннингу на различные антигены MASP-2, как описано в примере 2;
на фиг.3A и 3B представлены результаты тестирования 45 scFv-клонов-кандидатов на функциональную активность в анализе комплемента, как описано в примере 3;
на фиг.4 графически проиллюстрированы результаты эксперимента, который был осуществлен в целях сравнения уровней C3c в трех сыворотках (в человеческой сыворотке, крысиной сыворотке и в сыворотке примата, не являющегося человеком (NHP)), как описано в примере 4;
на фиг.5A проиллюстрировано выравнивание аминокислотных последовательностей области тяжелой цепи (остатки 1-120) наиболее активных клонов, которое выявило две отдельные группы, принадлежащие к семейству генов VH2 и VH6, соответственно, как описано в примере 4;
на фиг.5B проиллюстрировано выравнивание аминокислотных последовательностей scFv-клонов 17D20, 17N16, 18L16 и 4D9, как описано в примере 4;
на фиг.6 графически проиллюстрированы ингибирующие активности препаратов конвертированных материнских клонов IgG4 в анализе на осаждение C3b с использованием 90% человеческой плазмы, как описано в примере 5;
на фиг.7A графически проиллюстрированы результаты ELISA-анализа на материнском клоне 17N16 и на дочерних клонах, оттитрованных на huMASP2A, как описано в примере 6;
на фиг.7B графически проиллюстрированы результаты ELISA-анализа на материнском клоне 17D20 и на дочерних клонах, оттитрованных на huMASP2A, как описано в примере 6;
на фиг.8 проиллюстрировано выравнивание последовательностей белка материнского клона 17N16 и дочернего клона 17N9, указывающее на то, что легкие цепи (начиная с SYE) имеют 17 аминокислотных остатков, которые отличались у этих двух клонов, как описано в примере 6;
на фиг.9 проиллюстрировано выравнивание области CDR-H3 последовательностей белка клонов #35, #59 и #90, полученных в результате мутагенеза, и последовательностей материнского клона 17D20, как описано в примере 7;
на фиг.10A проиллюстрировано выравнивание области CDR3 последовательностей белка материнского клона 17D20 с последовательностью клона 17D20md21N11, полученных путем перестановки цепей, и с последовательностью CDR-H3 мутированного клона #35, представленной на фиг.9, в комбинации с последовательностью VL клона 17D20md21N11 (VH35-VL21N11), как описано в примере 7;
на фиг.10B проиллюстрировано выравнивание последовательностей областей VL и областей VH материнского клона 17D20 и дочернего клона 17D20md21N11, как описано в примере 7;
на фиг.11A графически проиллюстрированы результаты анализа на осаждение C3b, осуществляемого на вариантах изотипа дочернего клона (MoAb#1-3), полученных из материнского клона 17N16 человеческого моноклонального анти-MASP-2 антитела, как описано в примере 8;
на фиг.11B графически проиллюстрированы результаты анализа на осаждение C3b, осуществляемого на вариантах изотипа дочернего клона (MoAb#4-6), полученных из материнского клона 17D20 человеческого моноклонального анти-MASP-2 антитела, как описано в примере 8;
на фиг.12A и 12B графически проиллюстрировано тестирование материнских клонов и MoAb#1-6 в анализе на осаждение C3b в 95% сыворотке, как описано в примере 8;
на фиг.13 графически проиллюстрировано ингибирование осаждения C4b в 95% нормальной человеческой сыворотке, как описано в примере 8;
на фиг.14 графически проиллюстрировано ингибирование осаждения C3b в 95% сыворотке африканской зеленой мартышки, как описано в примере 8;
на фиг.15 графически проиллюстрировано ингибирование активности предварительно собранного комплекса MBL-MASP2 в расщеплении C4 под действием MoAb#2-6, как описано в примере 8;
на фиг.16 графически проиллюстрировано преимущественное связывание MoAb#6 с человеческим MASP2 по сравнению с C1s, как описано в примере 8;
на фиг.17 графически продемонстрировано, что лектиновый путь полностью ингибировался после внутривенного введения античеловеческого антитела MoAb#OMS646 африканским зеленым мартышкам, как описано в примере 10;
на фиг.18A представлен график выживаемости по Каплану-Мейеру, который представляет собой кривую зависимости процента выживаемости от времени после облучения контрольных мышей и мышей, обработанных антителом против мышиных MASP-2 (mAbM11) или антителом против человеческих MASP-2 (mAbOMS646), дозой радиоактивного излучения 7,0 Грей, как описано в примере 11;
на фиг.18В представлен график выживаемости по Каплану-Мейеру, который представляет собой кривую зависимости процента выживаемости от времени после облучения контрольных мышей и мышей, обработанных антителом против мышиных MASP-2 (mAbM11) или антителом против человеческих MASP-2 (mAbOMS646), дозой радиоактивного излучения 6,5 Грей, как описано в примере 11;
на фиг.18С представлен график выживаемости по Каплану-Мейеру, который представляет собой кривую зависимости процента выживаемости от времени после облучения контрольных мышей и мышей, обработанных антителом против человеческих MASP-2 (mAbOMS646), дозой радиоактивного излучения 8,0 Грей, как описано в примере 11;
на фиг.19 графически проиллюстрированы результаты анализа, проводимого методом поверхностного плазмонного резонанса (Biacore), на анти-MASP-2 антителе OMS646 (единицы отклика (связывания) в зависимости от времени в секундах), где указанные результаты показали, что иммобилизованное антитело OMS646 связывается с рекомбинантным MASP-2 с константой Koff приблизительно 1-3×10-4 с-1 и с константой Kon приблизительно 1,6-3×106 М-1·с-1, как описано в примере 12;
на фиг.20 графически проиллюстрированы результаты ELISA-анализа, проводимого для определения аффинности связывания анти-MASP-2 антитела OMS646 с иммобилизованным человеческим MASP-2, где указанные результаты показали, что OMS646 связывается с иммобилизованным рекомбинантным человеческим MASP-2 с KD приблизительно 100 пМ, как описано в примере 12;
на фиг.21А графически проиллюстрирован уровень активации C4 на покрытой маннаном поверхности в присутствии или в отсутствие анти-MASP-2 антитела (OMS646), который подтверждает, что OMS646 ингибирует активацию C4 на покрытой маннаном поверхности с IC50 приблизительно 0,5 нМ в 1% человеческой сыворотке, как описано в примере 12;
на фиг.21B графически проиллюстрирован уровень активации C4 на IgG-покрытой поверхности в присутствии или в отсутствие анти-MASP-2 антитела (OMS646), который подтверждает, что OMS646 не ингибирует зависимую от классического пути активацию компонента комплемента C4, как описано в примере 12;
на фиг.22A графически проиллюстрирован уровень осаждения MAC в присутствии или в отсутствие анти-MASP-2 антитела (OMS646) в условиях проведения анализа, специфичного к лектиновому пути, где указанный уровень подтверждает, что OMS646 ингибирует опосредованное лектином осаждение МАС с IC50 приблизительно 1 нМ, как описано в примере 12;
на фиг.22B графически проиллюстрирован уровень осаждения MAC в присутствии или в отсутствие анти-MASP-2 антитела (OMS646) в условиях проведения анализа, специфичного к классическому пути, где указанный уровень подтверждает, что OMS646 не ингибирует опосредуемое классическим путем осаждение МАС, как описано в примере 12;
на фиг.22C графически проиллюстрирован уровень осаждения MAC в присутствии или в отсутствие анти-MASP-2 антитела (OMS646) в условиях проведения анализа, специфичного к альтернативному пути, где указанный уровень подтверждает, что OMS646 не ингибирует опосредуемое альтернативным путем осаждение МАС, как описано в примере 12;
на фиг.23A графически проиллюстрирован уровень осаждения C3 в присутствии или в отсутствие анти-MASP-2 антитела (OMS646) в соответствующем интервале концентраций в 90% человеческой сыворотке в условиях проведения анализа, специфичного к лектиновому пути, где указанный уровень подтверждает, что OMS646 блокирует осаждение С3 в физиологических условиях, как описано в примере 12;
на фиг.23B графически проиллюстрирован уровень осаждения C4 в присутствии или в отсутствие анти-MASP-2 антитела (OMS646) в соответствующем интервале концентраций в 90% человеческой сыворотке в условиях проведения анализа, специфичного к лектиновому пути, где указанный уровень подтверждает, что OMS646 блокирует осаждение С4 в физиологических условиях, как описано в примере 12;
на фиг.24A графически проиллюстрирован уровень осаждения C4 в отсутствие или в присутствии анти-MASP-2 антитела (OMS646) в 90% сыворотке собакоподобных обезьян в условиях проведения анализа, специфичного к лектиновому пути, где указанный уровень подтверждает, что OMS646 ингибирует осаждение С4 по лектиновому пути в сыворотке собакоподобных обезьян в зависимости от дозы с величинами IC50 в пределах от 30 до 50 нМ, как описано в примере 12; и
на фиг.24B графически проиллюстрирован уровень осаждения C4 в отсутствие или в присутствии анти-MASP-2 антитела (OMS646) в 90% сыворотке африканской зеленой мартышки в условиях проведения анализа, специфичного к лектиновому пути, где указанный уровень подтверждает, что OMS646 ингибирует осаждение С4 по лектиновому пути в сыворотке африканской зеленой мартышки в зависимости от дозы с величинами IC50 в пределах от 15 до 30 нМ, как описано в примере 12.
Описание списка последовательностей
SEQ ID NO:1 - кДНК человеческого MASP-2
SEQ ID NO:2 - белок человеческого MASP-2 (с лидерной последовательностью)
SEQ ID NO:3 - белок человеческого MASP-2 (зрелый)
SEQ ID NO:4 - кДНК крысиного MASP-2
SEQ ID NO:5 - белок крысиного MASP-2 (с лидерной последовательностью)
SEQ ID NO:6 - белок крысиного MASP-2 (зрелый)
Антигены (относящиеся к зрелому белку человеческого MASP-2)
SEQ ID NO:7 - домен CUBI человеческого MASP-2 (аминокислоты 1-121)
SEQ ID NO:8 - домены CUBI/EGF человеческого MASP-2 (аминокислоты 1-166)
SEQ ID NO:9 - домены CUBI/EGF/CUBII человеческого MASP-2 (аминокислоты 1-277)
SEQ ID NO:10 - домен EGF человеческого MASP-2 (аминокислоты 122-166)
SEQ ID NO:l1 - домены CCPI/CCPII/SP человеческого MASP-2 (аминокислоты 278-671)
SEQ ID NO:12 - домены CCPI/CCPII человеческого MASP-2 (аминокислоты 278-429)
SEQ ID NO:13 - домен CCPI человеческого MASP-2 (аминокислоты 278-347)
SEQ ID NO:14 - домен CCPII/SP человеческого MASP-2 (аминокислоты 348-671)
SEQ ID NO:15 - домен CCPII человеческого MASP-2 (аминокислоты 348-429)
SEQ ID NO:16 - домен SP человеческого MASP-2 (аминокислоты 429-671)
SEQ ID NO:17 - мутант, инактивированный сериновой протеазой (аминокислоты 610-625 с мутацией в положении Ser 618)
VH-цепи моноклональных анти-MASP-2 антител
SEQ ID NO:18 - полипептид вариабельной области (VH) тяжелой цепи 17D20mc
SEQ ID NO:19 - ДНК, кодирующая вариабельную область (VH) тяжелой цепи 17D20_dc35VH21N11VL (OMS646) (без сигнального пептида)
SEQ ID NO:20 - полипептид вариабельной области (VH) тяжелой цепи 17D20_dc35VH21N11VL (OMS646)
SEQ ID NO:21 - полипептид вариабельной области (VH) тяжелой цепи 17N16mc
VL-цепи моноклональных анти-MASP-2 антител
SEQ ID NO:22 - полипептид вариабельной области (VL) легкой цепи 17D20mc
SEQ ID NO:23 - ДНК, кодирующая вариабельную область (VL) легкой цепи 17D20_dc21N11VL (OMS644) (без сигнального пептида)
SEQ ID NO:24 - полипептид вариабельной области (VL) легкой цепи 17D20_dc21N11VL (OMS644)
SEQ ID NO:25 - полипептид вариабельной области (VL) легкой цепи 17N16mc
SEQ ID NO:26 - ДНК, кодирующая вариабельную область (VL) легкой цепи 17N16_dc17N9 (OMS641) (без сигнального пептида)
SEQ ID NO:27 - полипептид вариабельной области (VL) легкой цепи 17N16_dc17N9 (OMS641)
CDR тяжелой цепи моноклональных анти-MASP-2 антител
SEQ ID NOS:28-31 - CDR-H1
SEQ ID NOS:32-35 - CDR-H2
SEQ ID NOS:36-40 - CDR-H3
CDR легкой цепи моноклональных анти-MASP-2 антител
SEQ ID NOS:41-45 - CDR-L1
SEQ ID NOS:46-50 - CDR-L2
SEQ ID NOS:51-54 - CDR-L3
Последовательности анти-MASP-2 антител
SEQ ID NO:55: полноразмерный полипептид материнского scFv-клона 17D20
SEQ ID NO:56: полноразмерный полипептид материнского scFv-клона 18L16
SEQ ID NO:57: полноразмерный полипептид материнского scFv-клона 4D9
SEQ ID NO:58: полноразмерный полипептид материнского scFv-клона 17L20
SEQ ID NO:59: полноразмерный полипептид материнского scFv-клона 17N16
SEQ ID NO:60: полноразмерный полипептид материнского scFv-клона 3F22
SEQ ID NO:61: полноразмерный полипептид материнского scFv-клона 9P13
SEQ ID NO:62: ДНК, кодирующая константную область тяжелой цепи IgG4 дикого типа
SEQ ID NO:63: полипептид константной области тяжелой цепи IgG4 дикого типа
SEQ ID NO:64: ДНК, кодирующая константную область тяжелой цепи IgG4 с мутацией S228P
SEQ ID NO:65: полипептид константной области тяжелой цепи IgG4 с мутацией S228P
SEQ ID NO:66: полноразмерный полипептид дочернего scFv-клона 17N16m_d17N9
SEQ ID NO:67: полноразмерный полипептид дочернего scFv-клона 17D20m_d21N11
SEQ ID NO:68: полноразмерный полипептид дочернего scFv-клона 17D20m_d3521N11
SEQ ID NO:69: ДНК, кодирующая константную область тяжелой цепи IgG2 дикого типа
SEQ ID NO:70: полипептид константной области тяжелой цепи IgG2 дикого типа
SEQ ID NO:71: генная последовательность легкой цепи 17N16m_d17N9 (с сигнальным пептидом, кодируемым нуклеотидами 1-57)
SEQ ID NO:72: белковая последовательность легкой цепи 17N16m_d17N9 (с сигнальным пептидом, аминокислоты 1-19)
SEQ ID NO:73: генная последовательность тяжелой цепи IgG2 17N16m_d17N9 (с сигнальным пептидом, кодируемым нуклеотидами 1-57)
SEQ ID NO:74: белковая последовательность тяжелой цепи IgG2 17N16m_d17N9 (с сигнальным пептидом, аминокислоты 1-19)
SEQ ID NO:75: генная последовательность тяжелой цепи IgG4 17N16m_d17N9 (с сигнальным пептидом, кодируемым нуклеотидами 1-57)
SEQ ID NO:76: белковая последовательность тяжелой цепи IgG4 17N16m_d17N9 (с сигнальным пептидом, аминокислоты 1-19)
SEQ ID NO:77: генная последовательность мутированной тяжелой цепи IgG4 17N16m_d17N9 (с сигнальным пептидом, кодируемым нуклеотидами 1-57)
SEQ ID NO:78: белковая последовательность мутированной тяжелой цепи IgG4 17N16m_d17N9 (с сигнальным пептидом, аминокислоты 1-19)
SEQ ID NO:79: генная последовательность легкой цепи IgG4 17D20_3521N11 (с сигнальным пептидом, кодируемым нуклеотидами 1-57)
SEQ ID NO:80: белковая последовательность легкой цепи IgG4 17D20_3521N11 (с сигнальным пептидом, аминокислоты 1-19)
SEQ ID NO:81: генная последовательность тяжелой цепи IgG2 17D20_3521N11 (с сигнальным пептидом, кодируемым нуклеотидами 1-57)
SEQ ID NO:82: белковая последовательность тяжелой цепи IgG2 17D20_3521N11 (с сигнальным пептидом, аминокислоты 1-19)
SEQ ID NO:83: генная последовательность тяжелой цепи IgG4 17D20_3521N11 (с сигнальным пептидом, кодируемым нуклеотидами 1-57)
SEQ ID NO:84: белковая последовательность тяжелой цепи IgG4 17D20_3521N11 (с сигнальным пептидом, аминокислоты 1-19)
SEQ ID NO:85: генная последовательность мутированной тяжелой цепи IgG4 17D20_3521N11 (с сигнальным пептидом, кодируемым нуклеотидами 1-57)
SEQ ID NO:86: белковая последовательность мутированной тяжелой цепи IgG4 17D20_3521N11 (с сигнальным пептидом, аминокислоты 1-19)
SEQ ID NO:87: ДНК, кодирующая полноразмерный полипептид дочернего scFv-клона 17N16m_d17N9 (без сигнального пептида)
SEQ ID NO:88: ДНК, кодирующая полноразмерный полипептид дочернего scFv-клона 17D20m_d21N11 (без сигнального пептида)
SEQ ID NO:89: ДНК, кодирующая полноразмерный полипептид дочернего scFv-клона 17D20m_d3521N11 (без сигнального пептида)
SEQ ID NO:90: консенсусная последовательность CDR-H3 тяжелой цепи 17D20m и d3521N11
SEQ ID NO:91: консенсусная последовательность CDR-L1 легкой цепи 17D20m и d3521N11
SEQ ID NO:92: консенсусная последовательность CDR-L1 легкой цепи 17N16m и d17N9
SEQ ID NO:93: консенсусная последовательность CDR-L2 легкой цепи 17D20m, d3521N11, 17N16m и d17N9
SEQ ID NO:94: консенсусная последовательность CDR-L3 легкой цепи 17N16m и d17N9.
Подробное описание изобретения
Настоящее изобретение относится к полностью человеческим антителам, которые связываются с человеческим MASP-2 и ингибируют опосредуемую лектином активацию комплемента, но при этом сохраняют компонент классического (C1q-зависимого) пути иммунной системы в интактной форме. Человеческие анти-MASP-2 антитела были идентифицированы путем скрининга библиотеки фагового представления, как описано в примерах 2-9. Как описано в примерах 10-12, высокоаффинные анти-MASP-2 антитела были идентифицированы по их способности ингибировать опосредуемую лектином активацию комплемента, как было определено с помощью анализов in vitro и in vivo. Фрагменты вариабельной легкой и тяжелой цепей антител были выделены в форме scFv и в форме полноразмерного IgG. Человеческие анти-MASP-2 антитела могут быть использованы для ингибирования повреждения клеток, ассоциированного с опосредуемой лектином активацией пути комплемента с сохранением компонента классического (C1q-зависимого) пути иммунной системы в интактной форме.
I. Определения
Если это не оговорено особо, то все используемые здесь термины имеют свое общепринятое значения, понятное среднему специалисту в данной области. Нижеследующие определения представлены для лучшего понимания терминов, используемых в описании и в формуле изобретения.
Используемый здесь термин «MASP-2-зависимая активация комплемента» включает MASP-2-зависимую активацию лектинового пути, которая происходит в физиологических условиях (то есть в присутствии Ca++) и приводит к образованию С3-конвертазы C4b2a лектинового пути, которая, после аккумуляции продукта расщепления C3 с образованием C3b, способствует продуцированию С5-конвертазы C4b2a(C3b)n.
Используемый здесь термин «альтернативный путь» означает активацию комплемента, которая запускается, например, зимосаном, происходящим от клеточных стенок грибов и дрожжей; липополисахаридом (ЛПС), происходящим от внешних мембран грам-отрицательных бактерий; и кроличьими эритроцитами, а также многими чистыми полисахаридами, кроличьими эритроцитами, вирусами, бактериями, опухолевыми клетками животных, паразитами и поврежденными клетками, и которая, как принято считать, является следствием спонтанного протеолитического продуцирования C3b из фактора комплемента C3.
Используемый здесь термин «лектиновый путь» означает активацию комплемента, которая происходит посредством специфического связывания сывороточных и несывороточных углевод-связывающих белков, включая маннан-связывающий лектин (MBL), CL-11 и фиколины (H-фиколин, M-фиколин или L-фиколин).
Используемый здесь термин «классический путь» означает активацию комплемента, которая запускается антителом, связанным с чужеродной частицей, и для осуществления которой необходимо связывание с молекулой распознавания C1q.
Используемый здесь термин «MASP-2-ингибирующее антитело» означает любое анти-MASP-2 антитело или его MASP-2-связывающий фрагмент, которые связываются или непосредственно взаимодействуют с MASP-2 и эффективно ингибируют MASP-2-зависимую активацию комплемента. MASP-2-ингибирующие антитела, используемые в способе согласно изобретению, могут снижать уровень MASP-2-зависимой активации комплемента более чем на 20%, например более чем на 30% или более чем на 40%, или более чем на 50%, или более чем на 60%, или более чем на 70%, или более чем на 80%, или более чем на 90%, или более чем на 95%.
Используемый здесь термин «MASP-2-блокирующее антитело» означает MASP-2-ингибирующие антитела, которые снижают уровень MASP-2-зависимой активации комплемента более чем на 90%, более чем на 95% или более чем на 98% (то есть в результате уровень MASP-2-зависимой активации комплемента составляет только 10%, например только 9% или только 8%, или только 7%, или только 6%, например только 5% или менее, или только 4%, или только 3%, или только 2% или только 1%).
Используемые здесь термины «антитело» и «иммуноглобулин» являются синонимами. Эти термины хорошо известны специалистам в данной области и означают белок, состоящий из одного или более полипептидов, специфически связывающихся с антигеном. Одна из форм антител составляет основную структурную единицу антитела. Такая форма представляет собой тетрамер и состоит из двух идентичных пар цепей антител, каждая из которых имеет одну легкую и одну тяжелую цепь. В каждой паре вариабельные области легкой и тяжелой цепей, взятые вместе, ответственны за связывание с антигеном, а константные области ответственны за эффекторные функции антител.
Используемый здесь термин «антитело» охватывает антитела и их фрагменты, полученные от любого антитело-продуцирующего млекопитающего (например мыши, крысы, кролика и приматов, включая человека) или методом гибридомной технологии, фагового отбора, рекомбинантной экспрессии или продуцирования с использованием трансгенных животных (или с применением других методов продуцирования антител или их фрагментов), где указанные антитела и их фрагменты специфически связываются с полипептидами MASP-2 или с их частями. Это не означает, что термин «антитело» ограничен указанными здесь источниками происхождения антител или способами их получения (например, методами гибридомного продуцирования, фагового отбора, рекомбинантной экспрессии, продуцирования с использованием трансгенных животных, пептидного синтеза и т.п.). Репрезентативными антителами являются поликлональные, моноклональные и рекомбинантные антитела; мультиспецифические антитела (например, биспецифические антитела); гуманизованные антитела; мышиные антитела; химерные антитела; антитело «мышь-человек», антитело «мышь-примат», моноклональные антитела «примат-человек» и антиидиотипические антитела, и такими антителами могут быть любые интактные молекулы или их фрагменты. Используемый здесь термин «антитело» охватывает не только интактные поликлональные или моноклональные антитела, но также их фрагменты (такие как dAb, Fab, Fab', F(ab')2, Fv), одноцепочечные фрагменты (ScFv), их синтетические варианты, природные варианты, гибридные белки, включающие часть антитела вместе с антигенсвязывающим фрагментом с нужной специфичностью, гуманизованные антитела, химерные антитела и любые модифицированные конфигурации молекул иммуноглобулина, содержащих антигенсвязывающий сайт или фрагмент (эпитоп-распознающий сайт) с нужной специфичностью.
Используемый здесь термин «антигенсвязывающий фрагмент» означает полипептидный фрагмент, содержащий по меньшей мере одну CDR тяжелой и/или легкой цепей иммуноглобулина, которые связываются с человеческим MASP-2. В соответствии с этим, антигенсвязывающий фрагмент описанных здесь антител может содержать 1, 2, 3, 4, 5 или все 6 представленных здесь CDR последовательностей VH и VL, происходящих от антител, связывающихся с MASP-2. Антигенсвязывающий фрагмент описанных здесь MASP-2-специфических антител обладает способностью связываться с MASP-2. В некоторых вариантах изобретения антигенсвязывающий фрагмент или антитело, содержащее антигенсвязывающий фрагмент, опосредует ингибирование MASP-2-зависимой активации комплемента.
Используемый здесь термин «моноклональные анти-MASP-2 антитела» означает популяцию гомогенных антител, где указанное моноклональное антитело состоит из аминокислот, участвующих в селективном связывании эпитопа на MASP-2. Моноклональные анти-MASP-2 антитела являются в высокой степени специфичными по отношению к антигену-мишени MASP-2. Термин «моноклональное антитело» охватывает не только интактные моноклональные антитела и полноразмерные моноклональные антитела, но также и их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные фрагменты (ScFv), их варианты, гибридные белки, включающие антигенсвязывающую часть, гуманизованные моноклональные антитела, химерные моноклональные антитела и любые другие модифицированные конфигурации молекул иммуноглобулина, содержащих антигенсвязывающий фрагмент (эпитоп-распознающий сайт) с нужной специфичностью и способностью связываться с эпитопом.
Используемый здесь термин «моноклональный» указывает на тип антитела, полученного по существу от гомогенной популяции антител, но этот термин не означает, что данное антитело должно происходить от какого-либо конкретного источника или может быть продуцировано каким-либо конкретным методом (например, методом гибридомного продуцирования, фагового отбора, рекомбинантной экспрессии, продуцирования с использованием трансгенных животных и т.п.). Этот термин включает интактные иммуноглобулины, а также их фрагменты и т.п., описанные выше в определении термина «антитело». Моноклональные антитела могут быть получены любым методом продуцирования молекул антител с использованием стабильных клеточных линий в культуре, например, гибридомным методом, описанным Kohler, G., et al., Nature 256:495, 1975, или методами рекомбинантных ДНК (см., например, патент США № 4816567, Cabilly). Моноклональные антитела могут быть также выделены из фаговых библиотек антител методами, описанными Clackson, T., et al., Nature 352:624-628, 1991, и Marks, J.D., et al., J. Mol. Biol. 222:581-597, 1991. Такими антителами могут быть иммуноглобулины любого класса, включая IgG, IgM, IgE, IgA, IgD, и любого подкласса.
Распознаваемыми полипептидами иммуноглобулинов являются легкие цепи каппа и лямбда, и тяжелые цепи альфа, гамма (IgG1, IgG2, IgG3, IgG4), дельта, ипсилон и мю, или их эквиваленты других видов. «Легкие цепи» полноразмерного иммуноглобулина (имеющие размер приблизительно 25 кДа или длину приблизительно 214 аминокислот) включают вариабельную область длиной приблизительно 110 аминокислот у NH2-конца и константную область каппа или лямбда у COOH-конца. Аналогичным образом, «тяжелые цепи» полноразмерного иммуноглобулина (имеющие размер приблизительно 50 кДа или длину приблизительно 446 аминокислот) включают вариабельную область (длиной приблизительно 116 аминокислот) и одну из вышеупомянутых константных областей тяжелой цепи, например, гамма-цепь (длиной приблизительно 330 аминокислот).
Основной единицей четырехцепочечного антитела является гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Антитело IgM состоит из 5 основных гетеротетрамерных единиц вместе с дополнительным полипептидом, называемым J-цепью, а поэтому оно содержит 10 антигенсвязывающих сайтов. Секретированные антитела IgA могут полимеризоваться с образованием поливалентных комплексов, включающих 2-5 основных 4-цепочечных единиц вместе с J-цепью. Каждая L-цепь связана с Н-цепью одной ковалентной дисульфидной связью, а две Н-цепи связаны друг с другом одной или более дисульфидными связями, в зависимости от изотипа Н-цепи. Каждая Н- и L-цепь также имеет обычную пространственную конфигурацию цепей, между которыми расположены дисульфидные мостики. В результате спаривания VH и VL образуется один антигенсвязывающий сайт.
Каждая Н-цепь имеет у N-конца вариабельный домен (VH), за которым следуют три константных домена (CH) для каждой из α- и γ-цепей, и четыре CH-домена (CH) для изотипов μ и ε.
Каждая L-цепь имеет у N-конца вариабельный домен (VL), за которым следует константный домен (CL) у другого конца. VL расположен на одной линии с VH, а CL расположен на одной линии с первым константным доменом тяжелой цепи (CH1). L-цепь у любого позвоночного может принадлежать к одному из двух явно отличающихся типов, называемых каппа (κ) и лямбда (λ), исходя из аминокислотных последовательностей их константных доменов (CL).
Иммуноглобулины, в зависимости от аминокислотной последовательности константного домена их тяжелых цепей (CH), могут принадлежать к различным классам или изотипам. Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, имеющих тяжелые цепи, обозначаемые альфа (α), дельта (δ), ипсилон (ε), гамма (γ) и мю (μ), соответственно. Классы γ и α также подразделяются на подклассы исходя из небольших различий в последовательностях и функциях CH, например, у человека экспрессируются иммуноглобулины следующих подклассов: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Описание структуры и свойств антител различных классов можно найти, например, в публикации Basic and Clinical Immunology, 8th Edition, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds); Appleton and Lange, Norwalk, Conn., 1994, page 71 and Chapter 6.
Термин «вариабельный» относится к некоторым сегментам V-доменов, которые, как известно, значительно отличаются по последовательностям антител. V-домен опосредует связывание с антигеном и определяет специфичность конкретного антитела к конкретному антигену. Однако вариабельность неравномерно распределяется по всем 110 аминокислотам вариабельных доменов. Точнее, V-области состоят из относительно инвариантных фрагментов, называемых каркасными областями (FR), состоящими из 15-30 аминокислот, разделенных более короткими областями с очень высокой вариабельностью, называемыми «гипервариабельными областями», каждая из которых имеет длину 9-12 аминокислот. Вариабельные домены каждой нативной тяжелой и легкой цепей содержат четыре FR, принимающих, главным образом, бета-складчатые конфигурации, соединенные тремя гипервариабельными областями, которые образуют петли, соединяющие n-складчатую структуру, а в некоторых случаях образующие часть такой структуры. Гипервариабельные области в каждой цепи находятся в непосредственной близости друг к другу за счет FR и, вместе с гипервариабельными областями другой цепи, участвуют в образовании антигенсвязывающего сайта антител (см. Kabat, et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md (1991)). Константные домены не принимают непосредственного участия в связывании антитела с антигеном, но обладают различными эффекторными функциями, такими как участие антитела в развитии антитело-зависимой клеточной цитотоксичности (ADCC).
Используемый здесь термин «гипервариабельная область» означает аминокислотные остатки антитела, ответственные за связывание с антигеном. Гипервариабельная область обычно содержит аминокислотные остатки, происходящие от «комплементарность-определяющей области» или «CDR» (то есть приблизительно остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и приблизительно остатки 31-35 (Н1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи, пронумерованные в соответствии с системой нумерации Кэбата, и описанные Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)), и/или остатки, происходящие от «гипервариабельной петли» (то есть остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и остатки 26-32 (Н1), 52-56 (Н2) и 95-101 (Н3) в вариабельном домене тяжелой цепи, пронумерованные в соответствии с системой нумерации Чотия, как описано в публикации Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987)); и/или остатки, происходящие от «гипервариабельной петли»/CDR (например остатки 27-38 (L1), 56-65 (L2) и 105-120 (L3) в VL, и 27-38 (H1), 56-65 (H2) и 105-120 (H3) в VH в соответствии с системой нумерации IMGT, как описано в публикации Lefranc, J.P., et al., Nucleic Acids Res 27:209-212; Ruiz, M., et al., Nucleic Acids Res 28:219-221 (2000)).
Используемый здесь термин «фрагмент антитела» означает часть полноразмерного анти-MASP-2 антитела или родственную ей часть и обычно включает его антигенсвязывающую или вариабельную область. Иллюстративными примерами фрагментов антител являются Fab-, Fab'-, F(ab')2- и Fv-фрагменты; scFv-фрагменты; диантитела; линейные антитела; одноцепочечные молекулы антител, биспецифические и мультиспецифические антитела, происходящие от фрагментов антител.
Если используются биспецифические антитела, то такими антителами могут быть стандартные биспецифические антитела, которые могут быть получены различными методами (Holliger, P. and Winter G. Current Opinion Biotechnol. 4, 446-449 (1993)), например, они могут быть получены методами химического синтеза или гибридомными методами, либо они могут представлять собой любые вышеупомянутые фрагменты биспецифических антител.
Используемый здесь термин «одноцепочечный Fv-фрагмент» или «scFv» антитела включает домены VH и VL антитела, где указанные домены присутствуют в одной полипептидной цепи. Вообще говоря, полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который обеспечивает образование scFv со структурой, необходимой для связывания с антигеном. См. публикацию Pluckthun в The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994). «Fv» представляет собой минимальный фрагмент антитела, содержащий полноразмерный антиген-распознающий и связывающий сайт. Этот фрагмент состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, связанных друг с другом тесной нековалентной связью. В результате укладки этих двух доменов образуются шесть гипервариабельных петель (по три петли для каждой Н- и L-цепи), которые участвуют в связывании аминокислотных остатков с антигеном и сообщают антителу специфичность связывания с антигеном. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к антигену) обладает способностью распознавать антиген и связываться с антигеном, хотя и с меньшей аффинностью, чем весь сайт связывания.
Используемый здесь термин «специфическое связывание» означает способность антитела преимущественно связываться с конкретным аналитом, который присутствует в гомогенной смеси различных аналитов. В некоторых вариантах изобретения взаимодействие типа специфического связывания позволяет выявлять различия между желательными и нежелательными аналитами в образце, а в некоторых случаях эти аналиты могут отличаться приблизительно в 10-100 раз или более (например приблизительно более чем в 1000 или в 10000 раз). В некоторых вариантах изобретения аффинность агента для захвата по отношению к аналиту, если они специфически связаны в комплексе «агент для захвата/аналит», характеризуется KD (константой диссоциации), которая составляет приблизительно менее 100 нМ или приблизительно менее 50 нМ, или приблизительно менее 25 нМ, или приблизительно менее 10 нМ, приблизительно менее 5 нМ или приблизительно менее 1 нМ.
Используемый здесь термин «вариант» анти-MASP-2 антитела означает молекулу, аминокислотная последовательность которой отличается от аминокислотной последовательности «родительского» или исходного антитела, что обусловлено добавлением, делецией и/или заменой одного или более аминокислотных остатков в последовательности родительского антитела. В одном из вариантов изобретения термин «вариант» анти-MASP-2 антитела означает молекулу, содержащую вариабельные области, которые являются идентичными родительским вариабельным доменам, за исключением комбинации из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен в CDR-областях вариабельной области тяжелой цепи и/или комбинации из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен в указанных CDR-областях вариабельной области легкой цепи. В некоторых вариантах изобретения аминокислотными заменами являются консервативные модификации последовательности.
Используемый здесь термин «родительское антитело» означает антитело, имеющее аминокислотную последовательность, используемую для получения варианта. Предпочтительно родительское антитело имеет человеческую каркасную область, и если она присутствует, то это антитело имеет константную(-ые) область(-и) человеческого антитела. Так, например, родительским антителом может быть гуманизованное или полностью человеческое антитело.
Используемый здесь термин «выделенное антитело» означает антитело, которое было идентифицировано, отделено и/или выделено из компонентов его природного окружения. Контаминирующими компонентами его природного окружения являются вещества, негативно влияющие на диагностическую или терапевтическую эффективность антитела, и такими компонентами могут быть ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах изобретения указанное антитело может быть очищено (1) до степени более чем 95% по массе антитела, как может быть определено методом Лаури, а более предпочтительно, более чем на 99% по массе антитела, или (2) до степени, достаточной для введения по меньшей мере 15 остатков у N-концевой или внутренней части аминокислотной последовательности с использованием секвенатора, снабженного центрифужным сосудом, или (3) до гомогенности с помощью электрофореза в ДСН-ПААГ в восстанавливающих или невосстанавливающих условиях с окрашиванием кумасси синим или, предпочтительно, серебром. Термин «выделенное антитело» включает антитело in situ в рекомбинантных клетках, если отсутствует по меньшей мере один природный компонент этого антитела. Однако, обычно, выделенное антитело может быть получено по меньшей мере в одной стадии очистки.
Используемый здесь термин «эпитоп» означает часть антигена, с которым специфически связывается моноклональное антитело. Эпитопные детерминанты обычно состоят из химически активных групп, присутствующих на поверхности молекул, таких как аминокислоты или сахарные боковые цепи, и обычно имеют три специфические пространственные структурные характеристики, а также специфические зарядные характеристики. Более конкретно, используемый здесь термин «эпитоп MASP-2» означает часть соответствующего полипептида, с которым иммуноспецифически связывается антитело, как может быть определено любым хорошо известным методом, например, с помощью иммуноанализов. Антигенные эпитопы необязательно должны быть иммуногенными. По своей природе такие эпитопы могут быть линейными или могут иметь дискретную структуру. Таким образом, используемый здесь термин «конформационный эпитоп» означает дискретный эпитоп, образованный пространственными взаимодействиями между аминокислотами антигена, которые не являются аминокислотами, составляющими непрерывный ряд.
Используемый здесь термин «маннан-связывающий лектин» («MBL») эквивалентен термину «маннан-связывающий белок»I («MBP»).
Используемый здесь термин «мембрано-атакующий комплекс» («MAC») означает комплекс из пяти концевых компонентов комплемента (C5-C9), которые встраиваются в мембраны и разрушают их. Такой комплекс также обозначается C5b-9.
Используемый здесь термин «индивидуум» включает всех млекопитающих, которыми являются, но не ограничиваются ими, человек; приматы, не относящиеся к человеку; собаки; кошки; лошади; овцы; козы; коровы; кролики; свиньи и грызуны.
Используемые здесь аминокислотные остатки имеют нижеследующие сокращения, а именно: аланин (Ala; A), аспарагин (Asn; N), аспарагиновая кислота (Asp; D), аргинин (Arg; R), цистеин (Cys; C), глутаминовая кислота (Glu; E), глутамин (Gln; Q), глицин (Gly; G), гистидин (His; H), изолейцин (Ile; I), лейцин (Leu; L), лизин (Lys; K), метионин (Met; M), фенилаланин (Phe; F), пролин (Pro; P), серин (Ser; S), треонин (Thr; T), триптофан (Trp; W), тирозин (Tyr; Y) и валин (Val; V).
В более широком смысле, природные аминокислоты могут подразделяться на группы исходя из химических свойств боковых цепей соответствующих аминокислот. «Гидрофобными» аминокислотами являются Ile, Leu, Met, Phe, Trp, Tyr, Val, Ala, Cys или Pro. «Гидрофильными» аминокислотами являются Gly, Asn, Gln, Ser, Thr, Asp, Glu, Lys, Arg или His. Эта группа аминокислот может быть также подразделена на подклассы. «Незаряженными гидрофильными» аминокислотами являются Ser, Thr, Asn или Gln. «Кислотными» аминокислотами являются Glu или Asp. «Основными» аминокислотами являются Lys, Arg или His.
Используемый здесь термин «консервативная аминокислотная замена» означает замену одной аминокислоты другой аминокислотой, где эти аминокислоты входят в одну из нижеследующих групп: (1) глицин, аланин, валин, лейцин и изолейцин, (2) фенилаланин, тирозин и триптофан, (3) серин и треонин, (4) аспартат и глутамат, (5) глутамин и аспарагин, и (6) лизин, аргинин и гистидин.
Используемая здесь «выделенная молекула нуклеиновой кислоты» представляет собой молекулу нуклеиновой кислоты (например полинуклеотид), которая не интегрирована в геномную ДНК данного организма. Так, например, молекула ДНК, которая кодирует фактор роста и которая была отделена от геномной ДНК клетки, представляет собой выделенную молекулу ДНК. Другим примером выделенной молекулы нуклеиновой кислоты является химически синтезированная молекула нуклеиновой кислоты, которая не была интегрирована в геном организма. Молекула нуклеиновой кислоты, выделенная из организма конкретного вида, имеет меньший размер, чем полноразмерная молекула ДНК хромосомы этого вида.
Используемая здесь «конструкция молекулы нуклеиновой кислоты» представляет собой молекулу нуклеиновой кислоты, либо одноцепочечную, либо двухцепочечную, которая была модифицирована человеком так, чтобы она содержала смежные сегменты нуклеиновой кислоты, объединенные в соответствующую структуру, не существующую в природе.
Используемый здесь «экспрессионный вектор» представляет собой молекулу нуклеиновой кислоты, включающую ген, который экспрессируется в клетке-хозяине. Обычно экспрессионный вектор содержит промотор транскрипции, ген и терминатор транскрипции. Экспрессия гена обычно осуществляется под контролем промотора, и говорят, что такой ген «функционально присоединен» к промотору. Аналогичным образом, регуляторный элемент и коровый промотор считаются функционально присоединенными друг к другу, если регуляторный элемент модулирует активность корового промотора.
В настоящем описании при использовании слов «приблизительно» или «около», если они употребляются с числами, обычно подразумевается, что эти числа входят в интервал значений, варьирующихся в пределах 5% (в сторону их увеличения или снижения) от указанного значения, если это не оговорено особо или если это не следует из контекста описания (за исключением случая, когда число будет на 100% превышать возможное значение). Если указаны интервалы величин, то подразумевается, что в этот интервал входят и конечные значения, если это не оговорено особо или если это не следует из контекста описания.
Существительные, употребляемые в единственном числе, могут относиться к существительным во множественном числе, если из контекста описания не следует обратное. Так, например, под словом «клетка» может подразумеваться одна клетка, а также две или более клеток; под словом «агент» может подразумеваться один агент, а также два или более агентов; под словом «антитело» может подразумеваться множество таких антител, а под словом «каркасная область» может подразумеваться одна или более каркасных областей и их эквивалентов, известных специалистам, и т.п.
Каждый вариант в этом описании представляет собой вариант с соответствующими необходимыми изменениями (mutatis mutandis) по сравнению с каждым другим вариантом, если это точно не указано в настоящем описании.
Для получения рекомбинантной ДНК, синтеза олигонуклеотидов и культивирования и трансформации ткани могут быть применены стандартные методы (например электропорация, липофекция). Ферментативные реакции и методы очистки могут быть осуществлены в соответствии с инструкциями производителей или по существу как описано в литературе или в настоящей заявке. Указанные и родственные методы и процедуры могут быть в основном проведены стандартными способами, хорошо известными специалистам и описанными в различных общих и специальных руководствах, цитируемых и обсуждаемых в настоящей заявке. См., например, Sambrook et al., 2001, MOLECULAR CLONING: A LABORATORY MANUAL, 3d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Current Protocols in Molecular Biology (Greene Publ. Assoc. Inc. & John Wiley & Sons, Inc., NY, NY); Current Protocols in Immunology (Edited by: John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober 2001 John Wiley & Sons, NY, NY); или другие соответствующие публикации современных протоколов технологий и другие подобные руководства. Если не приводится конкретных указаний, то это означает, что номенклатура, используемая в связи с этими технологиями, и лабораторные процедуры и методы, применяемые в молекулярной биологии, аналитической химии, химии органического синтеза и в медицинской и фармацевтической химии, и описанные в настоящей заявке, хорошо известны и широко применяются специалистами в данных областях. Стандартные методы могут быть применены в технике рекомбинантных ДНК, в молекулярной биологии, в микробиологии, в области химического синтеза, для химических анализов, для получения фармацевтических препаратов, для составления рецептуры этих препаратов и для доставки этих препаратов, а также для лечения пациентов.
При этом считается, что любой вариант, обсуждаемый в описании настоящей заявки, может относиться к любому способу, набору, реагенту или к любой композиции согласно изобретению и vice versa. Кроме того, композиции согласно изобретению могут быть использованы для осуществления способов согласно изобретению.
II. Краткий обзор
Лектины (MBL, M-фиколин, H-фиколин, L-фиколин и CL-11) представляют собой специфические молекулы распознавания, которые запускают природную систему комплемента, и такая система включает лектиновый путь инициации и ассоциированную с ним петлю амплификации конечного пути, которая амплифицирует инициированную лектином активацию концевых эффекторных молекул комплемента. C1q представляет собой специфическую молекулу распознавания, которая запускает приобретенную систему комплемента, и такая система включает классический путь инициации и ассоциированную с ним петлю амплификации конечного пути, которая амплифицирует C1q-инициированную активацию концевых эффекторных молекул комплемента. Авторы ссылаются на эти две основные системы активации комплемента, такие как лектин-зависимая система комплемента и C1q-зависимая система комплемента, соответственно.
Система комплемента, помимо ее главной роли в иммунной защите, вносит свой вклад в поражение ткани при многих клинических состояниях. Поэтому крайне необходимо разработать терапевтически эффективные ингибиторы комплемента для предупреждения этих побочных эффектов.
Как описано в патенте США № 7919094, в совместно рассматриваемой заявке на патент США регистрационный № 12/905972 (опубликованной как US 2011/0091450), и в совместно рассматриваемой заявке на патент США регистрационный № 13/083441 (опубликованной как US2011/0311549), которые были переуступлены корпорации Omeros Corporation, то есть правопреемнику настоящей заявки, и которые вводятся в настоящее описание посредством ссылки, было установлено, с использованием MASP-2-/--мышиной модели, что опосредуемый лектином MASP-2-путь может ингибироваться, но при этом классический путь остается неизменным. Установление того факта, что опосредуемый лектином MASP-2-путь может ингибироваться, а классический путь остается неизменным, дает возможность осуществления в высокой степени желательного специфического ингибирования активации только системы комплемента, вызывающей конкретную патологию, не подавляя полностью способность комплемента к иммунной защите. Так, например, при патологических состояниях, при которых активация комплемента опосредуется преимущественно лектин-зависимой системой комплемента, предпочтительным является специфическое ингибирование только этой системы. Для регуляции процессинга иммунного комплекса и для обеспечения защиты хозяина от инфекции, система C1q-зависимой активации комплемент должна оставаться неизменной.
Предпочтительным белковым компонентом-мишенью при разработке терапевтических агентов в целях специфического ингибирования лектин-зависимой системы комплемента является MASP-2. Из всех известных белковых компонентов лектин-зависимой системы комплемента (MBL, H-фиколина, M-фиколина, L-фиколина, MASP-2, C2-C9, фактора B, фактора D и пропердина), только MASP-2 является уникальным и необходимым для функционирования этой лектин-зависимой системы комплемента. Лектины (MBL, H-фиколин, M-фиколин, L-фиколин и CL-11) также являются уникальными компонентами лектин-зависимой системы комплемента. Однако отсутствие любого одного из этих лектиновых компонентов необязательно будет ингибировать активацию данной системы, что обусловлено избыточным количеством лектина. Для гарантии ингибирования активации лектин-зависимой системы комплемента необходимо ингибировать все пять лектинов. Кроме того, поскольку также известно, что MBL и фиколины также обладают опсониновой активностью, не зависящей от комплемента, то ингибирование функции лектина будет приводить к потере этого ценного механизма защиты хозяина от инфекции. В противоположность этому, такая не зависимая от комплемента опсониновая активность лектина будет сохраняться, даже если MASP-2 является мишенью для ингибирования активации лектинового пути. Другое преимущество MASP-2 как терапевтической мишени для ингибирования активации лектин-зависимой системы комплемента заключается в том, что концентрация MASP-2 в плазме, по сравнению с любыми другими белками комплемента, является самой низкой (~500 нг/мл), а поэтому, в соответствии с этим, для полного ингибирования будут достаточными низкие концентрации высокоаффинных ингибиторов MASP-2, как описано ниже в примерах.
В соответствии с вышесказанным, описанное здесь настоящее изобретение относится к моноклональным полностью человеческим анти-MASP-2 антителам, которые связываются с человеческим MASP-2 с высокой аффинностью и обладают способностью ингибировать опосредуемую лектином активацию пути комплемента.
III. Антитела, ингибирующие MASP-2
В одном из аспектов настоящее изобретение относится к моноклональному полностью человеческому анти-MASP-2 антителу или к его антигенсвязывающему фрагменту, которые специфически связываются с человеческим MASP-2 и ингибируют или блокируют MASP-2-зависимую активацию комплемента. MASP-2-ингибирующие антитела могут эффективно ингибировать или блокировать MASP-2-зависимую систему активации комплемента посредством ингибирования или блокирования биологической функции MASP-2. Так, например, ингибирующее антитело может эффективно ингибировать или блокировать взаимодействия MASP-2 по типу «белок-белок», препятствовать димеризации или сборке MASP-2, блокировать связывание с Ca2+ или ингибировать активный центр сериновой протеазы MASP-2.
Эпитопы MASP-2
Настоящее изобретение относится к полностью человеческим антителам, которые специфически связываются с человеческим MASP-2. Полипептид MASP-2 имеет молекулярную структуру, аналогичную MASP-1, MASP-3, C1r и C1s, то есть протеазам системы комплемента C1. Молекула кДНК, представленная в SEQ ID NO:1, кодирует репрезентативный MASP-2 (состоящий из аминокислотной последовательности, представленной в SEQ ID NO:2) с образованием человеческого полипептида MASP-2, имеющего лидерную последовательность (аминокислоты 1-15), которая отщепляется после секреции, в результате чего образуется зрелая форма человеческого MASP-2 (SEQ ID NO:3). Как показано на фиг.1A, ген человеческого MASP 2 включает двенадцать экзонов. кДНК человеческого MASP-2 кодируется экзонами B, C, D, F, G, H, I, J, K и L. Молекула кДНК, представленная в SEQ ID NO:4, кодирует крысиный MASP-2 (состоящий из аминокислотной последовательности, представленной в SEQ ID NO:5) с образованием крысиного полипептида MASP-2, имеющего лидерную последовательность, которая отщепляется после секреции, в результате чего образуется зрелая форма крысиного MASP-2 (SEQ ID NO:6).
Специалисту в данной области известно, что последовательности, описанные в SEQ ID NO:1 и SEQ ID NO:4, представляют собой одиночные аллели человеческого и крысиного MASP-2, соответственно, и что в них присутствует, как и ожидалось, аллельное разнознообразие и происходит альтернативный сплайсинг. Аллельные варианты нуклеотидных последовательностей, представленных в SEQ ID NO:l и SEQ ID NO:4, включая варианты, содержащие молчащие мутации, и варианты, в которые были введены мутации, приводящие к заменам в аминокислотной последовательности, входят в объем настоящего изобретения. Аллельные варианты последовательности MASP-2 могут быть клонированы путем зондирования кДНК или геномных библиотек, полученных от различных индивидуумов, стандартными методами.
Домены человеческого белка MASP-2 (SEQ ID NO:3) представлены ниже на фиг.1B и в таблице 1 и включают N-концевой C1r/C1s/VEGF морского ежа/домен белка морфогенеза кости (CUBI), домен, подобный эпидермальному фактору роста, второй домен CUB (CUBII), а также тандем доменов белков регуляции комплемента CCP1 и CCP2 и домен сериновой протеазы. Альтернативный сплайсинг гена MASP-2 приводит к образованию MAp19. MAp19 представляет собой неферментный белок, содержащий N-концевую CUB1-EGF-область MASP-2 с четырьмя дополнительными остатками (EQSL).
Было показано, что несколько белков связываются или взаимодействуют с MASP-2 посредством белок-белковых взаимодействий. Так, например, известно, что MASP-2 связывается с лектиновыми белками MBL, H-фиколином и L-фиколином и образует Ca2+-зависимые комплексы. Было показано, что комплекс MASP-2/лектин активирует комплемент посредством MASP-2-зависимого расщепления белков C4 и C2 (Ikeda, K., et al., J. Biol. Chem. 262:7451-7454, 1987; Matsushita, M., et al., J. Exp. Med. 176: 1497-2284, 2000; Matsushita, M., et al., J. Immunol. 168:3502-3506, 2002). Исследования показали, что CUBI-EGF-домены MASP-2 играют основную роль в связывании MASP-2 с MBL (Thielens, N.M., et al., J. Immunol. 166:5068, 2001). Было также показано, что домены CUB1EGFCUBII опосредуют димеризацию MASP-2, необходимую для образования активного комплекса MBL (Wallis, R., et al., J. Biol. Chem. 275:30962-30969, 2000). Поэтому могут быть идентифицированы MASP-2-ингибирующие антитела, которые связываются с областями-мишенями MASP-2 или ингибируют эти области, которые, как известно, играют важную роль в MASP-2-зависимой активации комплемента.
Домены полипептида MASP-2
(без лидерной последовательности)
(без лидерной последовательности)
(аминокислоты 1-121 SEQ ID NO:3)
(аминокислоты 1-166 SEQ ID NO:3)
(аминокислоты 1-277 SEQ ID NO:3)
(аминокислоты 122-166 SEQ ID NO:3)
(аминокислоты 278-671 SEQ ID NO:3)
(аминокислоты 278-429 SEQ ID NO:3)
(аминокислоты 278-347 SEQ ID NO:3)
(аминокислоты 348-671 SEQ ID NO:3)
(аминокислоты 348-429 SEQ ID NO:3)
(аминокислоты 429-671 SEQ ID NO:3)
(GKDSCRGDAGGALVFL)
(аминокислоты 610-625 SEQ ID NO:3 с мутацией в положении Ser618)
В одном из вариантов изобретения ингибирующие анти-MASP-2 антитела согласно изобретению связываются с частью полноразмерного человеческого белка MASP-2 (SEQ ID NO:3), такой как домены CUBI, EGF, CUBII, CCPI, CCPII или SP MASP-2. В некоторых вариантах изобретения ингибирующие анти-MASP-2 антитела согласно изобретению связываются с эпитопом в домене CCP1 (SEQ ID NO:13 (аминокислоты 278-347 SEQ ID NO:3)). Так, например, были идентифицированы анти-MASP-2 антитела (например, OMS646), которые связываются только с фрагментами MASP-2, содержащими домен CCP1, и ингибируют MASP-2-зависимую активацию комплемента, как описано в примере 9.
Аффинность связывания MASP-2-ингибирующих антител
Ингибирующие анти-MASP-2 антитела специфически связываются с человеческим MASP-2 (представленным как последовательность SEQ ID NO:3, кодируемая последовательностью SEQ ID NO:1) с аффинностью, которая по меньшей мере в десять раз превышает аффинность связывания с другими антигенами в системе комплемента. В некоторых вариантах изобретения MASP-2- ингибирующие антитела специфически связываются с человеческим MASP-2 с аффинностью, которая по меньшей мере в 100 раз превышает аффинность связывания с другими антигенами в системе комплемента.
В некоторых вариантах изобретения MASP-2-ингибирующие антитела специфически связываются с человеческим MASP-2 с KD (константой диссоциации), которая составляет приблизительно менее 100 нМ или приблизительно менее 50 нМ, или приблизительно менее 25 нМ, или приблизительно менее 10 нМ, приблизительно менее 5 нМ или приблизительно менее 1 нМ или равна 1 нМ, или менее 0,1 нМ или равна 0,1 нМ. Аффинность связывания MASP-2-ингибирующих антител может быть определена с помощью подходящего анализа на связывание, известного специалистам, такого как ELISA-анализ, описанный здесь в примерах 3-5.
Активность MASP-2-ингибирующих антител
В одном из вариантов изобретения MASP-2-ингибирующее антитело обладает активностью, достаточной для ингибирования MASP-2-зависимой активации комплемента при IC50≤30 нМ, предпочтительно менее или приблизительно 20 нМ, или менее приблизительно 10 нМ, или менее приблизительно 5 нМ, или менее или приблизительно 3 нМ, или менее или приблизительно 1 нМ, как было измерено в 1% сыворотке.
В одном из вариантов изобретения MASP-2-ингибирующее антитело обладает активностью, достаточной для ингибирования MASP-2-зависимой активации комплемента при IC50≤30 нМ, предпочтительно менее или приблизительно 20 нМ, или менее приблизительно 10 нМ, или менее приблизительно 5 нМ, или менее или приблизительно 3 нМ, или менее или приблизительно 1 нМ, как было измерено в 90% сыворотке.
Ингибирование MASP-2-зависимой активации комплемента характеризуется по меньшей мере одной из нижеследующих замен в компоненте системы комплемента, которые происходят в результате введения MASP-2-ингибирующего антитела: ингибирования генерирования или продуцирования продуктов MASP-2-зависимой системы активации комплемента C4a, C3a, C5a и/или C5b-9 (MAC) (определенного, например, как описано в примере 2 патента США № 7919094), а также продуктов их катаболического расщепления (например, C3desArg), снижения уровня расщепления C4 и осаждения C4b (определенного, например, как описано в примере 5) и продуктов его последующего катаболического расщепления (например, C4bc или C4d), или снижения уровня расщепления C3 и осаждения C3b (определенного, например, как описано в примере 5) или продуктов его последующего катаболического расщепления (например, C3bc, C3d и т.п.).
В некоторых вариантах изобретения MASP-2-ингибирующие антитела согласно изобретению способны ингибировать осаждение C3 в полной сыворотке до уровня менее 80%, например менее 70%, например менее 60%, например менее 50%, например менее 40%, например менее 30%, например менее 20%, например менее 15%, например менее 10% от осаждения контрольного C3.
В некоторых вариантах изобретения MASP-2-ингибирующие антитела согласно изобретению способны ингибировать осаждение C4 в полной сыворотке до уровня менее 80%, например менее 70%, например менее 60%, например менее 50%, например менее 40%, например менее 30%, например менее 20%, например менее 15%, например менее 10% от осаждения контрольного C4.
В некоторых вариантах изобретения ингибирующие анти-MASP-2-антитела селективно ингибируют MASP-2-зависимую активацию комплемента (то есть связываются с MASP-2 с аффинностью, которая по меньшей мере в 100 или более раз превышает аффинность связывания с C1r или C1s), с сохранением функций C1q-зависимой системы активации комплемента (то есть с сохранением по меньшей мере 80% или по меньшей мере 90%, или по меньшей мере 95%, или по меньшей мере 98%, или 100% активности классического пути).
В некоторых вариантах изобретения рассматриваемые ингибирующие анти-MASP-2-антитела обладают следующими свойствами: (a) высокой аффинностью по отношению к человеческому MASP-2 (например, KD=10 нМ или менее, а предпочтительно KD=1 нМ или менее), и (b) способностью ингибировать MASP-2-зависимую активацию комплемента в 90% человеческой сыворотке с IC50=30 нМ или менее, а предпочтительно IC50=10 нМ или менее).
Как описано в примерах 2-12, были идентифицированы полностью человеческие антитела, которые связываются с высокой аффинностью с MASP-2 и ингибируют опосредуемую лектином активацию комплемента с сохранением компонента классического (C1q-зависимого) пути иммунной системы. Фрагменты вариабельной области легкой и тяжелой цепей антител были секвенированы, выделены и проанализированы в scFv-формате и в формате полноразмерного IgG. На фиг.5A проиллюстрировано выравнивание аминокислотных последовательностей семи клонов scFv анти-MASP-2 антител, которые были идентифицированы как антитела, обладающие высокой аффинностью связывания с MASP-2 и способностью ингибировать MASP-2-зависимую активность. На фиг.5В проиллюстрировано выравнивание аминокислотных последовательностей четырех материнских клонов scFv, 17D20, 17N16, 18L16 и 4D9, где указаны каркасные области и CDR-области. Материнские scFv-клоны 17D20 и 17N16 были подвергнуты созреванию аффинности, что приводило к продуцированию дочерних клонов с более высокой аффинностью и с более высокой активностью по сравнению с материнскими клонами, как описано в примерах 6 и 7. Аминокислотные последовательности вариабельных областей тяжелой цепи (VH) (аминокислоты 1-120) и вариабельных областей легкой цепи (VL) (аминокислоты 148-250) scFv-клонов представлены на фиг.5A и 5B, а полученные дочерние клоны представлены ниже в таблице 2.
Положения для замен в человеческом ингибирующем анти-MASP-2 антителе, а также выбор аминокислот, которые могут быть заменены в этих положениях, определяли путем выравнивания аминокислотных последовательностей тяжелых и легких цепей ингибирующих анти-MASP-2 антител, обсуждаемых выше, и идентификации конкретных аминокислот в конкретных положениях. В одном из репрезентативных вариантов изобретения аминокислотные последовательности тяжелых и легких цепей, представленные на фиг.5A и 5B, выравнивают, и определяют идентичность аминокислот в каждом положении репрезентативных антител. Как показано на фиг.5A и 5B (где указаны аминокислоты в каждом положении тяжелых и легких цепей репрезентативных MASP-2-ингибирующих антител), были легко идентифицированы несколько положений для замен, а также аминокислотные остатки, которые могут быть заменены в этих положениях. В другом репрезентативном варианте изобретения аминокислотные последовательности легкой цепи материнских и дочерних клонов выравнивают, а затем определяют идентичность аминокислот в каждом положении репрезентативных антител в целях выявления положений для замен, а также для определения аминокислотных остатков, которые могут быть заменены в этих положениях.
Последовательности репрезентативных анти-MASP-2 антител
В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен тяжелой цепи, который по существу идентичен (например по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95% или по меньшей мере приблизительно на 96%, или по меньшей мере приблизительно на 97%, или по меньшей мере приблизительно на 98%, или по меньшей мере на 99%) домену любой из последовательностей вариабельного домена тяжелой цепи, представленных в таблице 2.
В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен тяжелой цепи, который по существу идентичен (например по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95% или по меньшей мере приблизительно на 96%, или по меньшей мере приблизительно на 97%, или по меньшей мере приблизительно на 98%, или по меньшей мере на 99%) домену 17D20 (VH), представленному как SEQ ID NO:18. В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен тяжелой цепи, который содержит SEQ ID NO:18 или состоит из SEQ ID NO:18.
В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен тяжелой цепи, который по существу идентичен (например по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 96%, по меньшей мере приблизительно на 97% или по меньшей мере приблизительно на 98%, или по меньшей мере на 99%) домену 17D20_cd35VH21N11 (VH), представленному как SEQ ID NO:20. В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен тяжелой цепи, который содержит SEQ ID NO:20 или состоит из SEQ ID NO:20.
В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен тяжелой цепи, который по существу идентичен (например по меньшей мере приблизительно на 70%, по меньшей мере на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95% или по меньшей мере приблизительно на 96%, или по меньшей мере приблизительно на 97%, или по меньшей мере приблизительно на 98%, или по меньшей мере на 99%) домену 17N16 (VH), представленному как SEQ ID NO:21. В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен тяжелой цепи, который содержит SEQ ID NO:21 или состоит из SEQ ID NO:21.
В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен легкой цепи, который по существу идентичен (например по меньшей мере приблизительно на 70%, по меньшей мере на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95% или по меньшей мере приблизительно на 96%, или по меньшей мере приблизительно на 97%, или по меньшей мере приблизительно на 98%, или по меньшей мере на 99%) домену любой из последовательностей вариабельного домена легкой цепи, представленных в таблице 2.
В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен легкой цепи, который по существу идентичен (например по меньшей мере приблизительно на 70%, по меньшей мере на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95% или по меньшей мере приблизительно на 96%, или по меньшей мере приблизительно на 97%, или по меньшей мере приблизительно на 98%, или по меньшей мере на 99%) домену 17D20 (VL), представленному как SEQ ID NO:22. В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет легкую цепь, которая содержит SEQ ID NO:22 или состоит из SEQ ID NO:22.
В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен легкой цепи, который по существу идентичен (например по меньшей мере приблизительно на 70%, по меньшей мере на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95% или по меньшей мере приблизительно на 96%, или по меньшей мере приблизительно на 97%, или по меньшей мере приблизительно на 98%, или по меньшей мере на 99%) домену 17D20_35VH-21N11VL (VL), представленному как SEQ ID NO:24. В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет легкую цепь, которая содержит SEQ ID NO:24 или состоит из SEQ ID NO:24.
В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен легкой цепи, который по существу идентичен (например по меньшей мере приблизительно на 70%, по меньшей мере на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95% или по меньшей мере приблизительно на 96%, или по меньшей мере приблизительно на 97%, или по меньшей мере приблизительно на 98%, или по меньшей мере на 99%) домену 17N16 (VL), представленному как SEQ ID NO:25. В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет легкую цепь, которая содержит SEQ ID NO:25 или состоит из SEQ ID NO:25.
В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет вариабельный домен легкой цепи, который по существу идентичен (например по меньшей мере приблизительно на 70%, по меньшей мере на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95% или по меньшей мере приблизительно на 96%, или по меньшей мере приблизительно на 97%, или по меньшей мере приблизительно на 98%, или по меньшей мере на 99%) домену 17N16_17N9 (VL), представленному как SEQ ID NO:27. В некоторых вариантах изобретения рассматриваемое человеческое моноклональное ингибирующее анти-MASP-2 антитело имеет легкую цепь, которая содержит SEQ ID NO:27 или состоит из SEQ ID NO:27.
В некоторых вариантах изобретения анти-MASP-2 антитела согласно изобретению содержат тяжелую или легкую цепь, кодируемую нуклеотидной последовательностью, которая гибридизуется в условиях высокой жесткости с нуклеотидной последовательностью, кодирующей тяжелую или легкую цепь, представленные в таблице 2. Условия высокой жесткости включают инкубирование при 50°C или выше в 0,1×SSC (15 мМ физиологический раствор/0,15 мМ цитрат натрия).
В некоторых вариантах изобретения ингибирующие анти-MASP-2 антитела согласно изобретению имеют вариабельную область тяжелой цепи, содержащую одну или более CDR (CDR1, CDR2 и/или CDR3), которые по существу идентичны (например по меньшей мере приблизительно на 70%, по меньшей мере на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95% или по меньшей мере приблизительно на 96%, или по меньшей мере приблизительно на 97%, или по меньшей мере приблизительно на 98%, или по меньшей мере приблизительно на 99%) аминокислотной последовательности CDR любой из последовательностей вариабельной области тяжелой цепи или содержат последовательность, идентичную указанной последовательности, или состоят из указанной последовательности, как показано на фиг.5A или 5B или как описано ниже в таблицах 3A-F и в таблице 4.
В некоторых вариантах изобретения ингибирующие анти-MASP-2 антитела согласно изобретению имеют вариабельную область легкой цепи, содержащую одну или более CDR (CDR1, CDR2 и/или CDR3), которые по существу идентичны (например по меньшей мере приблизительно на 70%, по меньшей мере на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95% или по меньшей мере приблизительно на 96%, или по меньшей мере приблизительно на 97%, или по меньшей мере приблизительно на 98%, или по меньшей мере приблизительно на 99%) аминокислотной последовательности CDR любой из последовательностей вариабельной области легкой цепи или содержат последовательность, идентичную указанной последовательности или состоят из указанной последовательности, как показано на фиг.5A или 5B или как описано ниже в таблицах 4A-F и в таблице 5.
Вариабельная область тяжелой цепи
Тяжелая цепь (аминокислоты 1-20)
(SEQ:18)
(SEQ:20)
(SEQ:21)
(SEQ:21)
Тяжелая цепь (аминокислоты 21-40)
(SEQ:18)
(SEQ:20)
(SEQ:21)
(SEQ:21)
Тяжелая цепь (аминокислоты 41-60)
(SEQ:18)
(SEQ:20)
(SEQ:21)
(SEQ:21)
Тяжелая цепь (аминокислоты 61-80)
(SEQ:18)
(SEQ:20)
(SEQ:21)
(SEQ:21)
Тяжелая цепь (аминокислоты 81-100)
(SEQ:18)
(SEQ:20)
(SEQ:21)
(SEQ:21)
Тяжелая цепь (аминокислоты 101-118)
(SEQ:19)
(SEQ:20)
(SEQ:21)
(SEQ:21)
Ниже представлены последовательности вариабельной области тяжелой цепи (VH) для материнских клонов и дочерних клонов, перечисленных выше в таблице 2 и в таблицах 3A-F.
CDR по Кэбату (31-35 (H1), 50-65 (H2) и 95-102 (H3)) выделены жирным шрифтом, а CDR по Чотию (26-32 (H1), 52-56 (H2) и 95-101 (H3)) подчеркнуты.
Вариабельная область тяжелой цепи (VH) 17D20_(SEQ ID NO:18):
QVTLKESGPVLVKPTETLTLTCTVSGFSLSRGKMGVSWIRQPPGKALEWLAHIFSSDEKSYRTSLKSRLTISKDTSKNQVVLTMTNMDPVDTATYYCARIRAGGIDYWGQGTLVTVSS
Вариабельная область тяжелой цепи (VH) 17D20 35VH-21N11VL (VH) (SEQ ID NO:20):
QVTLKESGPVLVKPTETLTLTCTVSGFSLSRGKMGVSWIRQPPGKALEWLAHIFSSDEKSYRTSLKSRLTISKDTSKNQVVLTMTNMDPVDTATYYCARIRRGGIDYWGQGTLVTVSS
Вариабельная область тяжелой цепи (VH) 17N16 (SEQ ID NO:21):
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSTSAAWNWIRQSPSRGLEWLGRTYYRSKWYNDYAVSVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARDPFGVPFDIWGQGTMVTVSS
CDR тяжелой цепи
(где Х в положении 8 представляет собой A (Ala) или R (Arg))
Вариабельные области легкой цепи
Легкая цепь (аминокислоты 1-20)
(SEQ:22)
(SEQ:24)
(SEQ:25)
(SEQ:27)
Легкая цепь (аминокислоты 21-40)
(SEQ:22)
(SEQ:24)
(SEQ:25)
(SEQ:27)
Легкая цепь (аминокислоты 41-60)
(SEQ:22)
(SEQ:24)
(SEQ:25)
(SEQ:27)
Легкая цепь (аминокислоты 61-80)
(SEQ:22)
(SEQ:24)
(SEQ:25)
(SEQ:27)
Легкая цепь (аминокислоты 81-100)
(SEQ:22)
(SEQ:24)
(SEQ:25)
(SEQ:27)
Легкая цепь (аминокислоты 101-120)
(SEQ:22)
(SEQ:24)
(SEQ:25)
(SEQ:27)
Ниже представлены последовательности вариабельной области легкой цепи (VL) для материнских клонов и дочерних клонов, перечисленных выше в таблице 2 и в таблицах 5A-F.
CDR по Кэбату (24-34 (L1), 50-56 (L2) и 89-97 (L3)) выделены жирным шрифтом, а CDR по Чотию (24-34 (L1), 50-56 (L2) и 89-97 (L3)) подчеркнуты. Эти области, пронумерованные по Кэбату и по Чотию, являются идентичными.
Вариабельная область легкой цепи (VL) 17D20m (SEQ ID NO:22)
QPVLTQPPSVSVSPGQTASITCSGDKLGDKFAYWYQQKPGHSPVLVIYQDNKRPSGIPGRFSGSNSGNTATLTISGTQAMDEADYYCQAWDSSTAVFGTGTKVTVLA
Вариабельная область легкой цепи (VL) 17D20m_d3521N11 (SEQ ID NO:24)
QPVLTQPPSLSVSPGQTASITCSGEKLGDKYAYWYQQKPGQSPVLVMYQDKQRPSGIPERFSGSNSGNTATLTISGTQAMDEADYYCQAWDSSTAVFGGGTKLTVL
Вариабельная область легкой цепи (VL) 17N16m_ (SEQ ID NO:25)
SYVLTQPPSVSVAPGQTARITCGGNNIGSKNVHWYQQKPGQAPVLVVYDDSDRPSGIPERFSGSNSGNTATLTVSRVEAGDEADYYCQVWDTTTDHVVFGGGTKLTVLAAAGSEQKLISE
Вариабельная область легкой цепи (VL) 17N16m_d17N9 (SEQ ID NO:27)
SYELIQPPSVSVAPGQTATITCAGDNLGKKRVHWYQQRPGQAPVLVIYDDSDRPSGIPDRFSASNSGNTATLTITRGEAGDEADYYCQVWDIATDHVVFGGGTKLTVLAAAGSEQKLISE
CDR легкой цепи (Кэбат/Чотия)
(где Х в положении 2 представляет собой D (Asp) или E (Glu); и где Х в положении 8 представляет собой F (Phe) или Y (Tyr))
(где X в положении 2 представляет собой N (Asn) или D (Asp); где X в положении 4 представляет собой I (Ile) или L (Leu); где X в положении 6 представляет собой S (Ser) или K (Lys); и где X в положении 8 представляет собой N (Asn) или R (Arg))
(где X в положении 2 представляет собой N (Asn), K (Lys) или S (Ser); и где X в положении 3 представляет собой K (Lys), Q (Gln) или D (Asp))
(где X в положении 4 представляет собой T (Thr) или I (Ile); и где X в положении 5 представляет собой T (Thr) или A (Ala))
В одном из аспектов настоящее изобретение относится к выделенному человеческому моноклональному антителу или к его антигенсвязывающему фрагменту, которые связываются с MASP-2 и включают:
(i) вариабельную область тяжелой цепи, содержащую последовательности CDR-H1, CDR-H2 и CDR-H3; и (ii) вариабельную область легкой цепи, содержащую последовательности CDR-L1, CDR-L2 и CDR-L3, где последовательность CDR-H3 вариабельной области тяжелой цепи содержит аминокислотную последовательность, представленную как SEQ ID NO:38 или SEQ ID NO:90, и их консервативно модифицированные последовательности, а последовательность CDR-L3 вариабельной области легкой цепи содержит аминокислотную последовательность, представленную как SEQ ID NO:51 или SEQ ID NO:94, и их консервативно модифицированные последовательности, и где указанное выделенное антитело ингибирует MASP-2-зависимую активацию комплемента.
В одном из вариантов изобретения последовательность CDR-H2 вариабельной области тяжелой цепи включает аминокислотную последовательность, представленную как SEQ ID NO:32 или SEQ ID NO:33, и их консервативно модифицированную последовательность. В одном из вариантов изобретения последовательность CDR-H1 вариабельной области тяжелой цепи включает аминокислотную последовательность, представленную как SEQ ID NO:28 или SEQ ID NO:29, и их консервативно модифицированную последовательность. В одном из вариантов изобретения последовательность CDR-L2 вариабельной области легкой цепи включает аминокислотную последовательность, представленную как SEQ ID NO:93, и ее консервативно модифицированную последовательность. В одном из вариантов изобретения последовательность CDR-L1 вариабельной области легкой цепи включает аминокислотную последовательность, представленную как SEQ ID NO:91 или SEQ ID NO:92, и их консервативно модифицированную последовательность. В одном из вариантов изобретения последовательность CDR-H1 вариабельной области тяжелой цепи включает последовательность SEQ ID NO:28.
В одном из вариантов изобретения CDR-H2 вариабельной области тяжелой цепи включает SEQ ID NO:32. В одном из вариантов изобретения CDR-H3 вариабельной области тяжелой цепи включает SEQ ID NO:90 (как показано в таблице 4). В одном из вариантов изобретения аминокислотная последовательность, представленная в SEQ ID NO:90, содержит R (Arg) в положении 8.
В одном из вариантов изобретения CDR-L1 вариабельной области легкой цепи включает SEQ ID NO:91 (как показано в таблице 6). В одном из вариантов изобретения аминокислотная последовательность, представленная в SEQ ID NO:91, содержит E (Glu) в положении 2. В одном из вариантов изобретения аминокислотная последовательность, представленная в SEQ ID NO:91, содержит Y (Tyr) в положении 8.
В одном из вариантов изобретения CDR-L2 вариабельной области легкой цепи включает SEQ ID NO:91 (как показано в таблице 6), где аминокислотная последовательность, представленная в SEQ ID NO:93, содержит K (Lys) в положении 2. В одном из вариантов изобретения аминокислотная последовательность, представленная в SEQ ID NO:93, содержит Q (Gln) в положении 3.
В одном из вариантов изобретения CDR-L3 вариабельной области легкой цепи включает SEQ ID NO:51.
В одном из вариантов изобретения указанное антитело или его антигенсвязывающий фрагмент связываются с человеческим MASP-2 с KD=10 нМ или менее. В одном из вариантов изобретения указанное антитело или его антигенсвязывающий фрагмент ингибируют активацию C4 в анализе in vitro в 1% человеческой сыворотке при IC50=10 нМ или менее. В одном из вариантов изобретения указанное антитело или его антигенсвязывающий фрагмент ингибируют активацию C4 в 90% человеческой сыворотке при IC50=30 нМ или менее. В одном из вариантов изобретения их последовательность с консервативными модификациями включает молекулу или состоит из молекулы, содержащей вариабельные области, идентичные указанному(-ым) вариабельному(-ым) домену(-ам), за исключением комбинации из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен в CDR-областях вариабельной области тяжелой цепи и/или комбинации из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен в CDR-областях вариабельной области легкой цепи.
В другом аспекте настоящее изобретение относится к выделенному человеческому антителу или к его антигенсвязывающему фрагменту, которые связываются с человеческим MASP-2, где указанное антитело включает: I) a) вариабельную область тяжелой цепи, содержащую: (i) CDR-H1 тяжелой цепи, включающую аминокислотную последовательность 31-35 SEQ ID NO:21; и (ii) CDR-H2 тяжелой цепи, включающую аминокислотную последовательность 50-65 SEQ ID NO:21; и (iii) CDR-H3 тяжелой цепи, включающую аминокислотную последовательность 95-102 SEQ ID NO:21; и b) вариабельную область легкой цепи, содержащую: (i) CDR-L1 легкой цепи, включающую аминокислотную последовательность 24-34 SEQ ID NO:25 или SEQ ID NO:27; и (ii) CDR-L2 легкой цепи, включающую аминокислотную последовательность 50-56 SEQ ID NO:25 или SEQ ID NO:27; и (iii) CDR-L3 легкой цепи, включающую аминокислотную последовательность 89-97 SEQ ID NO:25 или SEQ ID NO:27; или II) их вариант, который идентичен указанным вариабельным доменам, за исключением комбинаций из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен в указанных CDR-областях указанной вариабельной области тяжелой цепи и комбинаций из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен в указанных CDR-областях указанной вариабельной области легкой цепи, где указанной антитело или его вариант ингибируют MASP-2-зависимую активацию комплемента. В одном из вариантов изобретения указанный вариант содержит аминокислотную замену в одном или более положениях, выбранных из группы, состоящей из положений 31, 32, 33, 34, 35, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 95, 96, 97, 98, 99, 100 или 102 указанной вариабельной области тяжелой цепи. В одном из вариантов изобретения указанный вариант содержит аминокислотную замену в одном или более положениях, выбранных из группы, состоящей из положений 25, 26, 27, 29, 31, 32, 33, 51, 52, 89, 92, 93, 95, 96 или 97 указанной вариабельной области легкой цепи. В одном из вариантов изобретения тяжелая цепь указанного антитела содержит SEQ ID NO:21. В одном из вариантов изобретения легкая цепь указанного антитела содержит SEQ ID NO:25. В одном из вариантов изобретения легкая цепь указанного антитела содержит SEQ ID NO:27.
В другом аспекте настоящее изобретение относится к выделенному человеческому моноклональному антителу, которое связывается с человеческим MASP-2, где указанное антитело включает: I) a) вариабельную область тяжелой цепи, содержащую: (i) CDR-H1 тяжелой цепи, включающую аминокислотную последовательность 31-35 SEQ ID NO:20; и (ii) CDR-H2 тяжелой цепи, включающую аминокислотную последовательность 50-65 SEQ ID NO:20; и (iii) CDR-H3 тяжелой цепи, включающую аминокислотную последовательность 95-102 SEQ ID NO:18 или SEQ ID NO:20; и b) вариабельную область легкой цепи, содержащую: (i) CDR-L1 легкой цепи, включающую аминокислотную последовательность 24-34 SEQ ID NO:22 или SEQ ID NO:24; и (ii) CDR-L2 легкой цепи, включающую аминокислотную последовательность 50-56 SEQ ID NO:22 или SEQ ID NO:24; и (iii) CDR-L3 легкой цепи, включающую аминокислотную последовательность 89-97 SEQ ID NO:22 или SEQ ID NO:24; или II) их вариант, который идентичен указанным вариабельным доменам, за исключением комбинаций из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен в указанных CDR-областях указанной вариабельной области тяжелой цепи и комбинаций из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных замен в указанных CDR-областях указанной вариабельной области легкой цепи, где указанное антитело или его вариант ингибируют MASP-2-зависимую активацию комплемента. В одном из вариантов изобретения указанный вариант содержит аминокислотную замену в одном или более положениях, выбранных из группы, состоящей из положений 31, 32, 33, 34, 35, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 95, 96, 97, 98, 99, 100 или 102 указанной вариабельной области тяжелой цепи. В одном из вариантов изобретения указанный вариант содержит аминокислотную замену в одном или более положениях, выбранных из группы, состоящей из положений 25, 26, 27, 29, 31, 32, 33, 51, 52, 89, 92, 93, 95, 96 или 97 указанной вариабельной области легкой цепи. В одном из вариантов изобретения тяжелая цепь указанного антитела содержит SEQ ID NO:20 или ее вариант, включающий последовательность, которая по меньшей мере на 80% идентична SEQ ID NO:20 (например по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична SEQ ID NO:20). В одном из вариантов изобретения тяжелая цепь указанного антитела содержит SEQ ID NO:18 или ее вариант, включающий последовательность, которая по меньшей мере на 80% идентична SEQ ID NO:18 (например по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична SEQ ID NO:18). В одном из вариантов изобретения легкая цепь указанного антитела содержит SEQ ID NO:22 или ее вариант, включающий последовательность, которая по меньшей мере на 80% идентична SEQ ID NO:22 (например по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична SEQ ID NO:22). В одном из вариантов изобретения легкая цепь указанного антитела содержит SEQ ID NO:24 или ее вариант, включающий последовательность, которая по меньшей мере на 80% идентична SEQ ID NO:24 (например по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% идентична SEQ ID NO:24).
В одном из вариантов изобретения указанное антитело связывается с эпитопом в домене CCP1 MASP-2.
В одном из вариантов изобретения указанное антитело связывается с человеческим MASP-2 с KD=10 нМ или менее. В одном из вариантов изобретения указанное антитело ингибирует осаждение C3b в анализе in vitro в 1% человеческой сыворотке при IC50=10 нМ или менее. В одном из вариантов изобретения указанное антитело ингибирует осаждение C3b в 90% человеческой сыворотке при IC50=30 нМ или менее.
В одном из вариантов изобретения указанным антителом является фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2. В одном из вариантов изобретения указанным антителом является одноцепочечное антитело. В одном из вариантов изобретения указанным антителом является молекула IgG2. В одном из вариантов изобретения указанным антителом является молекула IgG1. В одном из вариантов изобретения указанным антителом является молекула IgG4. В одном из вариантов изобретения указанная молекула IgG4 содержит мутацию S228P.
В одном из вариантов изобретения указанное антитело по существу не ингибирует классический путь (то есть активность классического пути сохраняется по меньшей мере на 80% или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 95%).
В другом аспекте настоящее изобретение относится к выделенному полностью человеческому моноклональному антителу или к его антигенсвязывающему фрагменту, которые диссоциируют из человеческого MASP-2 с KD=10 нΜ или менее, как было определено методом поверхностного плазмонного резонанса, и ингибируют активацию C4 на покрытом маннаном субстрате с IC50=10 нМ или менее в 1% сыворотке. В некоторых вариантах изобретения указанное антитело или его антигенсвязывающий фрагмент специфически распознают по меньшей мере часть эпитопа, распознаваемого исходным антителом, содержащим вариабельную область тяжелой цепи, представленную в SEQ ID NO:20, и вариабельную область легкой цепи, представленную в SEQ ID NO:24, таким как исходное антитело OMS646 (см. таблицу 22). В соответствии с вышесказанным, антитело или его антигенсвязывающий фрагмент согласно некоторым предпочтительным вариантам настоящего изобретения могут представлять собой антитело или его антигенсвязывающий фрагмент, которые конкурируют с любым описанным здесь антителом за связывание с человеческим MASP-2, где указанные антитела (i) специфически связываются с антигеном и (ii) содержат описанные здесь домены VH и/или VL или описанную здесь CDR-H3, или любой их вариант. Конкуренция между партнерами по связыванию может быть легко проанализирована in vitro, например, с помощью ELISA и/или путем мечения специфической молекулой-репортером для ее связывания с агентом, который может быть детектирован в присутствии другого(-их) немеченного(-ых) связывающего(-их) агента(-ов), что позволит идентифицировать специфически связывающиеся агенты, которые связываются с тем же самым эпитопом или с перекрывающимся эпитопом. Таким образом, настоящее изобретение относится к специфическому антителу или к его антигенсвязывающему фрагменту, содержащим антигенсвязывающий сайт человеческого антитела, конкурирующий с описанным здесь антителом, которое связывается с человеческим MASP-2, таким как любое из OMS641-OMS646, представленных в таблице 24, за связывание с человеческим MASP-2.
Вариант MASP-2-ингибирующих антител
Вышеописанные человеческие моноклональные антитела могут быть модифицированы с получением вариантов антител, которые ингибируют MASP-2-зависимую активацию комплемента. Варианты антител могут быть получены путем замены, добавления или делеции по меньшей мере одной аминокислоты вышеописанного человеческого моноклонального антитела. В основном эти варианты антител имеют общие свойства вышеупомянутых человеческих антител и содержат по меньшей мере CDR вышеописанного человеческого антитела или, в некоторых вариантах изобретения, CDR, которые являются наиболее сходными с CDR вышеописанного человеческого антитела.
В предпочтительном варианте изобретения указанный вариант содержит одну или более аминокислотных замен в одной или более гипервариабельных областях родительского антитела. Так, например, указанный вариант может содержать по меньшей мере одну, например, приблизительно от 1 до 10 замен, а именно, по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 замен, а предпочтительно приблизительно от двух до шести замен в одной или более CDR-областях родительского антитела. В одном из вариантов изобретения указанный вариант содержит аминокислотную замену в одном или более положениях, выбранных из группы, состоящей из положений 31, 32, 33, 34, 35, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 95, 96, 97, 98, 99, 100 или 102 указанной вариабельной области тяжелой цепи. В одном из вариантов изобретения указанный вариант содержит аминокислотную замену в одном или более положениях, выбранных из группы, состоящей из положений 25, 26, 27, 29, 31, 32, 33, 51, 52, 89, 92, 93, 95, 96 или 97 указанной вариабельной области легкой цепи.
В некоторых вариантах изобретения варианты антител имеют аминокислотную последовательность, которая идентична последовательности вариабельного домена рассматриваемого антитела, представленного в таблице 2, за исключением комбинации из 1, 2, 3, 4, 5 или 6 аминокислотных замен в указанных CDR-областях указанной вариабельной области тяжелой цепи и/или комбинации из 1, 2, 3, 4, 5 или 6 аминокислотных замен в указанных CDR-областях указанной вариабельной области легкой цепи, где указанное антитело или его вариант ингибируют MASP-2-зависимую активацию комплемента.
Обычно указанный вариант имеет аминокислотную последовательность, которая по меньшей мере на 75% идентична последовательностям вариабельного домена тяжелой или легкой цепи родительского антитела, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90%, а наиболее предпочтительно по меньшей мере на 95% или по меньшей мере на 96%, или по меньшей мере на 97%, или по меньшей мере на 98%, или по меньшей мере на 99%. Идентичность или гомологию по отношению к этой последовательности определяют здесь как процент аминокислотных остатков в последовательности-кандидате, которые идентичны остаткам родительского антитела после выравнивания последовательностей и введения пробелов, если это необходимо для достижения максимального процента идентичности последовательностей. N-концевые, C-концевые или внутренние удлинения, делеции или инсерции в последовательностях антитела (таких как, например, последовательности сигнального пептида, линкерные последовательности или метки, такие как HIS-метки) не должны рассматриваться как последовательности, влияющие на идентичность или гомологию последовательностей. Указанный вариант сохраняет способность связываться с человеческим MASP-2 и предпочтительно обладает лучшими свойствами, чем родительское антитело. Так, например, такой вариант может обладать более высокой аффинностью связывания и/или повышенной способностью ингибировать или блокировать MASP-2-зависимую активацию комплемента.
Для анализа таких свойств Fab-форму указанного варианта сравнивают с Fab-формой родительского антитела, либо полноразмерную форму варианта сравнивают с полноразмерной формой родительского антитела, поскольку, например, в описанных здесь анализах на биологическую активность было обнаружено, что форма анти-MASP-2 антитела влияет на его активность. Конкретным представляющим интерес вариантом описанного здесь антитела является вариант, биологическая активность которого по меньшей мере приблизительно в 10 раз, предпочтительно по меньшей мере приблизительно в 20 раз, а наиболее предпочтительно по меньшей мере приблизительно в 50 раз превышает биологическую активность родительского антитела.
Для улучшения желательных свойств антител согласно изобретению, эти антитела могут быть модифицированы так, чтобы можно было регулировать время их полужизни в сыворотке. Вообще говоря, полноразмерные молекулы антител имеют достаточно продолжительное время полужизни в сыворотке, тогда как их фрагменты (<60-80 кДа) очень быстро выводятся почками. Следовательно, если желательно длительное действие анти-MASP-2 антитела, то предпочтительным анти-MASP-2 антителом является полноразмерное антитело IgG (такое как IgG2 или IgG4), а если желательно более кратковременное действие анти-MASP-2 антитела, то предпочтительным может оказаться фрагмент антитела. Как описано в примере 5, было установлено, что замена S228P в шарнирной области IgG4 приводит к повышению стабильности антитела в сыворотке. В соответствии с этим, в некоторых вариантах изобретения рассматриваемым анти-MASP-2 антителом является полноразмерное антитело IgG4 с заменой S228P.
Одноцепочечные антитела
В одном из вариантов изобретения MASP-2-ингибирующим антителом является одноцепочечное антитело, определяемое как генетически сконструированная молекула, содержащая вариабельную область легкой цепи и вариабельную область тяжелой цепи, связанные подходящим полипептидным линкером и составляющие генетически гибридную одноцепочечную молекулу. Такие одноцепочечные антитела также называются «одноцепочечными Fv»-фрагментами или «scFv»-фрагментами антитела. Обычно полипептид Fv также содержит полипептидный линкер, расположенный между доменами VH и VL и сообщающий scFv-фрагменту способность образовывать структуру, подходящую для связывания с антигеном. ScFv-антитела, связывающиеся с MASP-2, могут иметь такую ориентацию, при которой вариабельная область легкой цепи будет присутствовать у аминоконца по отношению к вариабельной области тяжелой цепи или у карбоксиконца по отношению к этой области. Репрезентативные scFv-антитела согласно изобретению представлены как SEQ ID NO:55-61 и SEQ ID NO:66-68.
Методы получения антител
Во многих вариантах изобретения нуклеиновые кислоты, кодирующие рассматриваемое моноклональное антитело, непосредственно вводят в клетку-хозяина, а затем эту клетку инкубируют в условиях, благоприятствующих индуцированию экспрессии кодируемого антитела.
В некоторых вариантах настоящее изобретение относится к молекуле нуклеиновой кислоты, кодирующей анти-MASP-2 антитело или его фрагмент согласно изобретению, такое как антитело или его фрагмент, представленные в таблице 2. В некоторых вариантах настоящее изобретение относится к молекуле нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:19, SEQ ID NO:23, SEQ ID NO:26, SEQ ID NO:71, SEQ ID NO:73, SEQ ID NO:75, SEQ ID NO:77, SEQ ID NO:79, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:85, SEQ ID NO:97, SEQ ID NO:88 и SEQ ID NO:89.
В некоторых вариантах настоящее изобретение относится к клетке, содержащей молекулу нуклеиновой кислоты, кодирующую анти-MASP-2 антитело согласно изобретению.
В некоторых вариантах настоящее изобретение относится к экспрессионному кластеру, содержащему молекулу нуклеиновой кислоты, кодирующую анти-MASP-2 антитело согласно изобретению.
В некоторых вариантах настоящее изобретение относится к способу получения анти-MASP-2 антител, включающему культивирование клетки, содержащей молекулу нуклеиновой кислоты, кодирующую анти-MASP-2 антитело согласно изобретению.
В соответствии с некоторыми родственными вариантами, настоящее изобретение относится к рекомбинантной клетке-хозяину, которая включает одну или более из описанных здесь конструкций; к нуклеиновой кислоте, кодирующей любое антитело, CDR, VH- или VL-домен или их антигенсвязывающие фрагменты, и к способу получения кодируемого продукта, где указанный способ включает экспрессию указанного продукта из кодирующей его нуклеиновой кислоты. Такая экспрессия может быть соответствующим образом достигнута путем культивирования рекомбинантных клеток-хозяев, содержащих указанную нуклеиновую кислоту, в подходящих условиях. После осуществления экспрессии антитело или его антигенсвязывающий фрагмент могут быть выделены и/или очищены любым подходящим методом, а затем использованы в нужных целях.
Так, например, в качестве клетки-хозяина может быть использована любая клетка, подходящая для экспрессии экспрессионных кластеров, например, дрожжевая клетка, клетка насекомого, клетка растения и т.п. Во многих вариантах изобретения используется клеточная линия млекопитающего-хозяина, которая обычно не продуцирует антитела, и примерами таких клеток являются клетки почек обезьяны (клетки COS), клеточная линия CV1 почек обезьяны, трансформированная SV40 (COS-7, ATCC CRL 1651); клеточная линия почек человеческого эмбриона (HEK-293, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почек детеныша хомячка (ВНК, АТСС CCL 10); клетки яичника китайского хомячка (CHO, Urlaub & Chasin, Proc. Natl. Acad. Sci. USA 77:4216 (1980)); мышиные клетки Сертоли (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почек обезьяны (CV1 ATCC CCL 70); клетки почек африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почек собак (MDCK, ATCC CCL 34); клетки печени лабораторной крысы Buffalo (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки печени человека (HepG2, HB 8065); опухолевые клетки мышиной молочной железы (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки NIH/3T3 (ATCC CRL-1658) и мышиные L-клетки (ATCC CCL-1). Среднему специалисту в данной области известны и другие клеточные линии. Клеточные линии широкого ряда могут быть взяты из Американской коллекции типовых культур, 10801 University Boulevard, Manassas, Va. 20110-2209.
Методы введения нуклеиновых кислот в клетки хорошо известны специалистам. Подходящими методами являются элекропорация, метод «выстреливания» частиц (метод «дробового ружья»), преципитация фосфатом кальция, прямая микроинжекция и т.п. Выбор метода по существу зависит от типа трансформируемой клетки и от условий проведения трансформации (то есть in vitro, ex vivo или in vivo). Общее обсуждение этих методов можно найти в руководстве Ausubel, et al., Short Protocols in Molecular Biology, 3d ed., Wiley & Sons, 1995. В некоторых вариантах изобретения применяются методы переноса генов, опосредуемых липофектамином и кальцием.
После введения рассматриваемых нуклеиновых кислот в клетку, эту клетку обычно инкубируют при 37°C, иногда в селективной среде, в течение периода времени, достаточного для экспрессии антитела. В большинстве вариантов изобретения антитело обычно секретируют в супернатант среды, в которой растет эта клетка.
В клеток-хозяевах млекопитающих, для экспрессии рассматриваемого антитела может быть использован ряд вирусных экспрессионных систем. В тех случаях, когда в качестве экспрессионного вектора используется аденовирус, представляющая интерес антитело-кодирующая последовательность может быть лигирована с аденовирусным комплексом регуляции транскрипции/трансляции, например, с поздним промотором и с трехкомпонентной лидерной последовательностью. Затем этот химерный ген может быть встроен в аденовирусный геном посредством рекомбинации in vitro или in vivo. Инсерция во второстепенной области вирусного генома (например в области E1 или E3) будет приводить к образованию жизнеспособного рекомбинантного вируса, который способен экспрессировать молекулу антитела у инфицированных хозяев (см., например, Logan & Shenk, Proc. Natl. Acad. Sci. USA 81:355-359 (1984)). Эффективность экспрессии может быть повышена путем включения соответствующих энхансерных элементов транскрипции, терминаторов транскрипции и т.п. (см. Bittner et al., Methods in Enzymol. 153:51-544 (1987)).
Для длительного продуцирования рекомбинантных антител с высоким выходом может быть использована стабильная экспрессия. Так, например, могут быть сконструированы клеточные линии, стабильно экспрессирующие молекулу антитела. Вместо использования экспрессионных векторов, содержащих вирусные ориджины репликации, клетки-хозяева могут быть трансформированы экспрессионными кластерами иммуноглобулинов и селективным маркером. После введения чужеродной ДНК сконструированные клетки могут быть культивированы в течение 1-2 дней в обогащенной среде, которую затем заменяют селективной средой. Селективный маркер в рекомбинантной плазмиде сообщает резистентность к отбору и позволяет плазмиде стабильно интегрироваться в хромосому клеток, которые затем могут расти с образованием очагов, которые, в свою очередь, могут быть клонированы и размножены в клеточных линиях. Такие сконструированные клеточные линии могут быть особенно подходящими для скрининга и оценки соединений, которые прямо или опосредованно взаимодействуют с молекулой антитела.
После продуцирования молекулы антитела согласно изобретению, она может быть очищена любым методом, известным специалистам в области очистки молекул иммуноглобулина, например, с помощью хроматографии (например ионообменной хроматографии, аффинной хроматографии, а в частности, хроматографии на основе аффинности к специфическому антигену на белке А, и эксклюзионной колоночной хроматографии), методом центрифугирования, методом дифференциальной растворимости или любым другим стандартным методом очистки белков. Во многих вариантах изобретения, антитела секретируются из клеток в культуральную среду, а затем их собирают из этой культуральной среды. Так, например, последовательность нуклеиновой кислоты, кодирующая сигнальный пептид, может быть включена в область, смежную с областью, кодирующей антитело или его фрагмент, например, область из нуклеотидов 1-57 SEQ ID NO:71, кодирующая сигнальный пептид из аминокислот 1-19 SEQ ID NO:72. Такой сигнальный пептид может быть включен в область, смежную с 5'-концом аминокислотных последовательностей, представленных здесь для рассматриваемых антител, в целях облегчения продуцирования рассматриваемых антител.
Фармацевтические носители и носители для доставки
В другом аспекте настоящее изобретение относится к композициям для ингибирования побочных эффектов MASP-2-зависимой активации комплемента, где указанные композиции содержат терапевтически эффективное количество человеческого ингибирующего анти-MASP-2 антитела и фармацевтически приемлемый носитель.
Вообще говоря, композиции человеческого MASP-2-ингибирующего антитела согласно изобретению, объединенные с любыми другими выбранными терапевтическими средствами, обычно содержатся в фармацевтически приемлемом носителе. Такой носитель является нетоксичным и биологически совместимым, и его выбирают так, чтобы он не оказывал негативного влияния на биологическую активность MASP-2-ингибирующего антитела (и любых других терапевтических средств, присутствующих в комбинации с этим антителом). Репрезентативные фармацевтически приемлемые носители для полипептидов описаны Yamada в патенте США № 5211657. Анти-MASP-2 антитела могут быть приготовлены в виде препаратов в твердой, полутвердой, гелеобразной, жидкой или газообразной формах, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, ингаляторы и инъекции, подходящие для перорального введения, парентерального введения или хирургического вмешательства. В настоящем изобретении также рассматривается местное введение композиций с использованием медицинских устройств с нанесенном на них покрытием и т.п.
Подходящими носителями для парентеральной доставки, осуществляемой путем инъекции, вливания или промывки, и для местной доставки, являются дистиллированная вода, забуференный фосфатом физиологический раствор, нормальные или обработанные лактатом растворы Рингера, раствор декстрозы, раствор Хэнкса или пропандиол. Кроме того, в качестве растворителя или суспендирующей среды могут быть использованы стерильные жирные масла. Для этой цели может быть использовано любое биологически совместимое масло, включая синтетические моно- или диглицериды. Кроме того, для приготовления инъекций могут быть использованы жирные кислоты, такие как олеиновая кислота. Носитель и агент могут быть приготовлены в виде жидкости, суспензии, полимеризуемого или неполимеризуемого геля, пасты или мази.
Носитель может также содержать вещество для доставки, используемый для замедления (то есть для продления, отсрочки или регуляции) доставки агента(-ов) или для улучшения доставки и всасывания, для повышения стабильности или для улучшения фармакокинетических свойств терапевтического(-их) агента(-ов). Такими носителями для доставки могут быть, но не ограничиваются ими, например, микрочастицы, микросферы, наносферы или наночастицы, состоящие из белков, липосом, углеводов, синтетических органических соединений, неорганических соединений, полимерных и сополимерных гидрогелей и полимерных мицелл. Подходящими системами доставки на основе гидрогелей и мицелл являются сополимеры PEO:PHB:PEO и комплексы «сополимер/циклодекстрин», описанные в WO 2004/009664 A2, а также PEO и комплексы «РЕО/циклодекстрин», описанные в публикации заявки на патент США № 2002/0019369 A1. Такие гидрогели могут быть введены местно в область, предназначенную для их действия, или подкожно или внутримышечно для формирования депо пролонгированного высвобождения.
Для внутрисуставного введения MASP-2-ингибирующее антитело может быть введено в вышеуказанную жидкость или в инъецируемые гелевые носители, в вышеуказанные инъецируемые носители для пролонгированной доставки, или в гиалуроновую кислоту или в производное гиалуроновой кислоты.
В соответствии с настоящим изобретением, для интратекальной (IT) или интрацеребровентрикулярной (ICV) доставки могут быть использованы соответствующие стерильные системы доставки (например жидкости, гели, суспензии и т.п.).
Композиции согласно изобретению могут также включать биосовместимые наполнители, такие как диспергирующие или смачивающие агенты, суспендирующие агенты, разбавители, буферы усилители пенетрации, эмульгаторы, связывающие агенты, загустители, отдушки (например, для перорального введения).
Для достижения высокой концентрации анти-MASP-2 антител, используемых для местной доставки, антитела могут быть приготовлены в виде суспензии частиц или кристаллов в растворе для последующей инъекции, такой как внутримышечная инъекция депо-препарата.
Что касается конкретных анти-MASP-2 антител, то репрезентативные препараты могут быть парентерально введены в виде инъецируемых доз раствора или суспензии соединения в физиологически приемлемом разбавителе вместе с фармацевтическим носителем, который может представлять собой стерильную жидкость, такую как вода, масло, физиологический раствор, глицерин или этанол. В концентрациях, содержащих анти-MASP-2 антитела, могут также присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, поверхностно-активные вещества, рН-забуферивающие вещества и т.п. Дополнительными компонентами фармацевтических композиций являются масла (такие как животный жир, растительное масло или синтетическое масло), например, соевое масло и минеральное масло. В общих чертах, предпочтительными жидкими носителями для инъецируемых растворов являются гликоли, такие как пропитенгликоль или полиэтиленгликоль.
Анти-MASP-2 антитела могут быть также введены в виде депо-инъекции или имплантата, которые могут быть приготовлены так, чтобы они позволяли осуществлять пролонгированное или периодическое высвобождение активных агентов.
Фармацевтические композиции, содержащие MASP-2-ингибирующие антитела, могут быть введены различными способами в зависимости от того, какой из способов введения, а именно, местный или системный, является наиболее подходящим для лечения данного состояния. Кроме того, как было описано выше для операций по экстракорпоральной реперфузии, MASP-2-ингибирующие антитела могут быть доставлены посредством введения композиции согласно изобретению в кровоток или плазму. Кроме того, композиции согласно изобретению могут быть доставлены путем покрытия имплантируемого медицинского устройства указанными композициями или включения этих концентраций в данное устройство.
Системная доставка
Используемые здесь термины «системная доставка» и «системное введение» означают, но не ограничиваются ими, пероральное и парентеральное введение, включая внутримышечное введение (i.m.), подкожное введение, внутривенное введение (i.v.), внутриартериальное введение, введение путем ингаляции, подъязычное введение, трансбуккальное введение, местное введение, чрезкожное введение, интраназальное введение, ректальное введение, вагинальное введение и другие способы введения, которые обеспечивают эффективную доставку нужного антитела в один или множество участков предполагаемого терапевтического действия. Предпочтительными способами системной доставки композиций согласно изобретению являются внутривенное введение, внутримышечное введение, подкожное введение и введение путем ингаляции. Следует отметить, что конкретный способ системной доставки выбранных агентов, используемых в конкретных композициях согласно изобретению, определяют частично с учетом восприимчивости данных агентов к метаболическим путям трансформации, ассоциированным с данным способом введения.
MASP-2-ингибирующие антитела и полипептиды могут быть введены индивидууму, нуждающемуся в этом, любым подходящим способом. Методы доставки анти-MASP-2 антител и полипептидов включают пероральное введение, пульмональное введение, парентеральное введение (например, внутримышечную, внутрибрюшинную, внутривенную (i.v.) или подкожную инъекцию), введение путем ингаляции (препарата в виде тонкодисперсного порошка), чрезкожное введение, интраназальное введение, вагинальное введение, ректальное введение или подъязычное введение, и эти антитела и полипептиды могут быть приготовлены в виде лекарственных форм, подходящих для каждого способа введения.
В качестве репрезентативных примеров можно отметить, что MASP-2-ингибирующие антитела и пептиды могут быть введены в живой организм путем их введения в биологические оболочки, способные абсорбировать данные полипептиды, например, в носовую слизистую оболочку, в слизистую желудочно-кишечного тракта и в слизистую прямой кишки. Полипептиды обычно вводят в абсорбирующую оболочку вместе с усилителем проницаемости оболочки. (См., например, Lee, V.H.L., Crit. Rev. Ther. Drug Carrier Sys. 5:69, 1988; Lee, V.H.L., J. Controlled Release 13:213, 1990; Lee, V.H.L., Ed., Peptide and Protein Drug Delivery, Marcel Dekker, New York (1991); DeBoer, A.G., et al., J. Controlled Release 13:241, 1990). Так, например, в качестве усилителя проницаемости для интраназальной доставки может быть использован STDHF, то есть синтетическое производное фузидиновой кислоты, стероидное поверхностно-активное вещество, которое по своей структуре аналогично солям желчных кислот (Lee, W.A., Biopharm. 22, Nov./Dec. 1990.)
MASP-2-ингибирующие антитела и полипептиды могут быть введены в комбинации с другой молекулой, такой как липид, для защиты полипептидов от ферментативного расщепления. Так, например, ковалентное связывание полимеров, а в частности, полиэтиленгликоля (ПЭГ), было применено для защиты некоторых белков от ферментативного гидролиза в организме, и тем самым для увеличения времени их полужизни (Fuertges, F., et al., J. Controlled Release 11:139, 1990). Многие полимерные системы для доставки белков были описаны в литературе (Bae, Y.H., et al., J. Controlled Release 9:271, 1989; Hori, R., et al., Pharm. Res. 6:813, 1989; Yamakawa, I., et al., J. Pharm. Sci. 79:505, 1990; Yoshihiro, I., et al., J. Controlled Release 10:195, 1989; Asano, M., et al., J. Controlled Release 9:111, 1989; Rosenblatt, J., et al., J. Controlled Release 9:195, 1989; Makino, K., J. Controlled Release 12:235, 1990; Takakura, Y., et al., J. Pharm. Sci. 78:117, 1989; Takakura, Y., et al., J. Pharm. Sci. 78:219, 1989).
Недавно были разработаны липосомы с повышенной стабильностью в сыворотке и с увеличенным временем полужизни в кровотоке (см., например, патент США № 5741516, Webb). Кроме того, были описаны различные методы получения липосом и липосомо-подобных препаратов в виде потенциальных носителей для лекарственных средств (см., например, патент США № 5567434, Szoka; патент США № 5552157, Yagi; патент США № 5565213, Nakamori; патент США № 5738868, Shinkarenko; и патент США № 5795587, Gao).
Для чрезкожного введения MASP-2-ингибирующие антитела и полипептиды могут быть объединены с другими подходящими ингредиентами, такими как носители и/или адъюванты. При этом могут быть использованы любые другие ингредиенты без каких-либо ограничений, за исключением того, что они должны быть фармацевтически приемлемыми для предполагаемого способа введения и не должны оказывать негативного воздействия на активность активных ингредиентов данной композиции. Примерами подходящих носителей являются мази, кремы, гели или суспензии, содержащие или не содержащие очищенный коллаген. MASP-2-ингибирующие антитела и полипептиды могут быть также введены путем пропитки чрезкожных пластырей, гипсовых повязок и бинтов, предпочтительно, жидкими или полутвердыми препаратами.
Системное введение композиций согласно изобретению может быть осуществлено периодически через определенные интервалы времени для поддержания терапевтического эффекта на нужном уровне. Так, например, композиции могут быть введены путем подкожной инъекции через каждые 2-4 недели или через меньшие интервалы времени. Схема введения доз может быть определена лечащим врачом с учетом различных факторов, которые могут влиять на действие данной комбинации агентов. Такими факторами являются степень прогрессирования состояния, подвергаемого лечению, возраст, пол и масса пациента и другие клинические факторы. Дозы каждого отдельного агента могут варьироваться в зависимости от функции MASP-2-ингибирующего антитела, включенного в данную композицию, а также от присутствия и природы любого носителя для доставки лекарственного средства (например носителя для доставки с пролонгированным высвобождением). Кроме того, количество дозы может быть скорректировано с учетом изменения частоты введения и фармакокинетических свойств доставляемого(-ых) агента(-ов).
Местное введение
Используемый здесь термин «местное» введение охватывает введение лекарственного средства в область предполагаемого локализованного участка действия и в область, находящуюся поблизости от этого участка, и может включать, например, местное нанесение на кожу или на другие пораженные ткани, офтальмическое введение, интратекальное введение (IT), интрацеребровентрикулярное введение (ICV), внутрисуставное введение, внутриполостное введение, внутричерепное введение или интравезикулярное введение, введение стента или лаваж. Местное введение может оказаться предпочтительным для введения более низкой дозы, для предотвращения системных побочных эффектов и для более точной регуляции времени доставки и концентрации активных агентов в области местного введения. Местное введение предусматривает введение известной концентрации в нужный участок, независимо от различий путей метаболизма, системы кровообращения и т.п. у разных пациентов. Прямой способ доставки также позволяет лучше регулировать введение доз.
Местная доставка MASP-2-ингибирующего антитела может быть достигнута хирургическими методами лечения заболевания или состояния, например, во время операций по артериальному шунтированию, атероктомии, лазерной хирургии, ультразвуковой хирургии, баллонной ангиопластики и операции по установлению стента. Так, например, ингибитор MASP-2 может быть введен индивидууму в комбинации с баллонной ангиопластикой. Баллонная ангиопластика включает введение катетера, содержащего баллон с выкаченным воздухом, в артерию. Баллон с выкаченным воздухом помещают поблизости от атеросклеротической бляшки и накачивают так, чтобы бляшка впрессовывалась в стенку сосуда. В результате этого поверхность баллона контактирует со слоем сосудистых эндотелиальных клеток на поверхности кровеносных сосудов. MASP-2-ингибирующее антитело может быть присоединено к катетеру для баллонной ангиопластики так, чтобы это приводило к высвобождению данного агента в область локализации атеросклеротической бляшки. Этот агент может быть присоединен к баллонному катетеру стандартными методами, известными специалистам. Так, например, такой агент может храниться в отделении баллонного катетера вплоть до накачки данного баллона воздухом, и после этого начинает высвобождаться в окружающую среду. Альтернативно, поверхность баллона может быть пропитана данным агентом так, чтобы она контактировала с клетками стенки артерий по мере накачивания баллона воздухом. Такой агент может также доставляться в перфорированный баллонный катетер, как описано Flugelman, M.Y., et al., Circulation 85:1110-1117, 1992. См. также опубликованную заявку РСТ WO 95/23161, где описана репрезентативная процедура присоединения терапевтического белка к катетеру для баллонной ангиопластики. Аналогичным образом, MASP-2-ингибирующее антитело может быть включено в гель или в полимерное покрытие, наносимые на стент, либо оно может быть включено в материал, из которого изготовлен данный стент, так, чтобы этот стент мог высвобождать MASP-2-ингибирующее антитело после его помещения в кровеносные сосуды.
Схемы лечения
Композиции, содержащие MASP-2-ингибирующее антитело и используемые для лечения артритов и других скелетно-мышечных расстройств, могут быть местно введены путем внутрисуставной инъекции. Такие композиции могут включать подходящий носитель для доставки с пролонгированным высвобождением. Как и в случае местной доставки, которая может оказаться желательной, композиции, содержащие MASP-2-ингибирующее антитело и используемые для лечения заболеваний мочеполовых путей, могут быть соответствующим образом введены интравезикулярно или в другую урогенитальную структуру.
В профилактических целях фармацевтические композиции вводят индивидууму, восприимчивому к заболеванию, ассоциированному с MASP-2-зависимой активацией комплемента, или индивидууму с риском развития такого заболевания, в количестве, достаточном для устранения или снижения риска развития симптомов указанного заболевания. В терапевтических целях фармацевтические композиции вводят индивидууму с подозрением на заболевание, ассоциированное с MASP-2-зависимой активацией комплемента, или индивидууму, уже страдающему таким заболеванием, в терапевтически эффективном количестве, достаточном для ослабления или по меньшей мере частичного ослабления симптомов указанного заболевания. В профилактических и терапевтических схемах введения композиции, содержащие MASP-2-ингибирующие антитела, могут быть введены в нескольких дозах до тех пор, пока у данного индивидуума не будет достигнут нужный терапевтический эффект. Введение композиций, содержащих MASP-2-ингибирующее антитело согласно изобретению, может быть осуществлено путем разового введения данной композиции или ограниченного числа нескольких введений для лечения острого заболевания, например, реперфузионного поражения или другого травматического повреждения. Альтернативно, указанная композиция может быть введена периодически в течение длительного периода времени в целях лечения хронических заболеваний, например, артритов или псориаза.
MASP-2-ингибирующие композиции согласно изобретению могут быть введены сразу или вскоре после приступа острого заболевания, приводящего к активации лектинового пути, например, после ишемического инсульта и реперфузии ишемической ткани. В качестве примеров могут служить реперфузия после приступа ишемии миокарда, реперфузия после приступа ишемии почек, реперфузия после приступа церебральной ишемии, трансплантация органов и реплантация пальцев/конечностей. Другим примером острого заболевания является сепсис. MASP-2-ингибирующая композиция согласно изобретению может быть введена вскоре после приступа острого заболевания, активирующего лектиновый путь, а предпочтительно через 12 часов, а более предпочтительно через 2-3 часа после запуска указанного события, например, путем системной доставки MASP-2-ингибирующей композиции.
Способы и композиции согласно изобретению могут быть применены для ингибирования воспаления и родственных процессов, которые обычно возникают после диагностического и терапевтического вмешательства и после хирургических операций. Для ингибирования таких процессов MASP-2-ингибирующая композиция согласно изобретению может быть введена перипроцедурно. Используемый здесь термин «перипроцедурно» относится к введению ингибирующей композиции перед проведением операции и/или во время проведения операции и/или после проведения операции, то есть до проведения операции; до и во время проведения операции; до и после проведения операции; до, во время и после проведения операции; во время проведения операции; во время и после проведения операции, или после проведения операции. Перипроцедурное введение может быть осуществлено путем местной доставки композиции на участок хирургического или терапевтического вмешательства, например, путем инъекции в данный участок или путем непрерывной или периодической промывки данного участка, или путем системной доставки. Подходящие методы локальной периоперативной доставки MASP-2-ингибирующей композиции описаны в патентах США №№ 6420432, Demopulos, и 6645168, Demopulos. Подходящие методы доставки хондропротективных композиций, включающих MASP-2-ингибирующие антитела, описаны в Международной патентной заявке PCT WO 01/07067 A2. Подходящие методы и композиции для нацеленной системной доставки хондропротективных композиций, включающих MASP-2-ингибирующие антитела, описаны в Международной патентной заявке PCT WO 03/063799 A2.
Дозы
MASP-2-ингибирующие антитела могут быть введены индивидууму, нуждающемуся в этом, в терапевтически эффективных дозах для лечения или облегчения состояний, ассоциированных с MASP-2-зависимой активацией комплемента. Терапевтически эффективная доза означает количество MASP-2-ингибирующего антитела, достаточное для ослабления симптомов указанного состояния.
Токсичность и терапевтическая эффективность MASP-2-ингибирующих антител могут быть определены стандартными фармацевтическими методами с использованием экспериментальных животных-моделей, таких как африканская зеленая мартышка, описанных в настоящей заявке. С использованием таких животных-моделей, NOAEL (отсутствие какого-либо наблюдаемого побочного эффекта) и MED (минимальная эффективная доза) могут быть определены стандартными методами. Дозовое соотношение между эффектами NOAEL и MED представляет собой терапевтический индекс, который выражается как отношение NOAEL/MED. Наиболее предпочтительными являются MASP-2-ингибирующие антитела, дающие высокие терапевтические отношения или терапевтические индексы. Данные, полученные в анализах клеточных культур и в исследованиях на животных, могут быть использованы для вычисления интервалов доз, которые могут быть введены человеку. Доза MASP-2-ингибирующего антитела предпочтительно составляет в пределах концентраций в кровотоке, которые включают MED с низкой токсичностью или с отсутствием токсичности. Доза может варьироваться в этих пределах в зависимости от используемой лекарственной формы и от способа введения.
Для приготовления любого соединения терапевтически эффективная доза может быть вычислена с использованием животных-моделей. Так, например, доза может быть составлена для животного-модели в целях достижения определенного интервала концентраций в плазме, включающего MED. Количественные уровни MASP-2-ингибирующего антитела в плазме могут быть также определены, например, с помощью высокоэффективной жидкостной хроматографии.
Помимо исследований на токсичность, эффективная доза может быть также вычислена с учетом количества белка MASP-2, присутствующего в живом организме, и аффинности связывания MASP-2-ингибирующего антитела. Было показано, что уровни MASP-2 в сыворотке у здорового человека являются низкими и составляют в пределах 500 нг/мл, а уровни MASP-2 у конкретного индивидуума могут быть определены с помощью количественного анализа на MASP-2, описанного в публикации Moller-Kristensen M., et al., J. Immunol. Methods 282:159-167, 2003, которая вводится в настоящее описание посредством ссылки.
Вообще говоря, доза вводимых композиций, содержащих MASP-2-ингибирующие антитела, варьируется в зависимости от таких факторов, как возраст, масса, рост, пол, общее состояние здоровья и история болезни пациента. Для иллюстрации, MASP-2-ингибирующие антитела могут быть введены в дозах, составляющих приблизительно от 0,010 до 10,0 мг/кг, предпочтительно от 0,010 до 1,0 мг/кг, а более предпочтительно от 0,010 до 0,1 мг/кг массы тела пациента.
Терапевтическая эффективность MASP-2-ингибирующих композиций и способы согласно изобретению, применяемые для лечения данного индивидуума, а также соответствующие дозы могут быть определены с помощью анализов системы комплемента, хорошо известных специалистам. Система комплемента генерирует различные специфические продукты. За последнее десятилетие были разработаны чувствительные и специфические анализы, которые являются коммерчески доступными для выявления большинства этих продуктов активации, включая небольшие фрагменты активации C3a, C4a и C5a и крупные фрагменты активации iC3b, C4d, Bb и sC5b-9. В большинстве этих анализов используются антитела, которые реагируют с новыми антигенами (неоантигенами), локализованными на фрагменте, но не на нативных белках, от которых они происходят, что делает такие анализы более простыми и специфичными. Большинство из этих анализов основаны на ELISA-технологии, хотя иногда, для оценки C3a и C5a, проводят радиоиммуноанализ. Эти последние два анализа позволяют определять непроцессированные фрагменты и их «desArg»-фрагменты, которые являются основными формами, преимущественно присутствующими в кровотоке. Непроцессированные фрагменты и C5adesArg быстро выводятся при связывании с рецепторами клеточной поверхности, а поэтому они присутствуют в очень низких концентрациях, тогда как C3adesArg не связываются с клетками и накапливаются в плазме. Измерение уровней C3a является чувствительным и не зависимым от пути комплемента индикатором активации комплемента. Активация альтернативного путем может быть оценена посредством измерения уровня Bb-фрагмента. Детектирование продукта активации пути мембранной атаки в растворе, sC5b-9, свидетельствует о полной активации комплемента. Поскольку лектиновый и классический пути продуцируют одни и те же продукты активации, C4a и C4d, то оценка этих двух фрагментов не позволяет получить какую-либо информацию о том, какой из этих двух путей продуцирует продукты активации.
Ингибирование MASP-2-зависимой активации комплемента обусловлено по меньшей мере одной из нижеследующих замен в компоненте системы комплемента, которая происходит в результате введения анти-MASP-2 антитела согласно изобретению, а именно ингибирования генерирования или продуцирования продуктов системы MASP-2-зависимой активации комплемента C4b, C3a, C5a и/или C5b-9 (MAC); снижения уровня расщепления C4 и осаждения C4b, или снижения уровня расщепления C3 и осаждения C3b.
Промышленные изделия
В другом аспекте настоящее изобретение относится к промышленному изделию, содержащему человеческое MASP-2-ингибирующее антитело или его антигенсвязывающий фрагмент в виде унифицированной лекарственной формы, подходящей для терапевтического введения человеку, например, лекарственной формы с дозой в пределах от 1 мг до 5000 мг, например, от 1 мг до 2000 мг, например, от 1 мг до 1000 мг, например, 5 мг, 10 мг, 50 мг, 100 мг, 200 мг, 500 мг или 1000 мг. В некоторых вариантах изобретения такое промышленное изделие содержит контейнер и этикетку или вкладыш, вложенный в упаковку или наклеенный на контейнер. Подходящими контейнерами являются, например, бутыли, флаконы, шприцы и т.п. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Такой контейнер содержит композицию, которая является эффективной для лечения указанного состояния, и может иметь стерильное входное отверстие (например таким контейнером может быть пакет для внутривенного введения раствора или сосуд, имеющий пробку, протыкаемую иглой для подкожных инъекций). По меньшей мере одним активным агентом в данной композиции является MASP-2-ингибирующее антитело или его антигенсвязывающий фрагмент согласно изобретению. На этикетке или во вкладыше, вложенном в упаковку, должно быть указано, что такая композиция используется для лечения конкретного состояния. На этикетке или во вкладыше, вложенном в упаковку, могут также содержаться инструкции по введению таких антитело-содержащей композиции пациенту. Могут также рассматриваться промышленные изделия и наборы, содержащие описанные здесь средства для комбинированной терапии.
Терапевтическое применение ингибирующих анти-MASP-2 антител
В другом аспекте настоящее изобретение относится к способу ингибирования MASP-2-зависимой активации комплемента у индивидуума, где указанный способ включает введение указанному индивидууму моноклонального ингибирующего анти-MASP-2 антитела согласно изобретению в количестве, достаточном для ингибирования MASP-2-зависимой активации комплемента у указанного индивидуума.
В соответствии с этим аспектом изобретения, описанным в примере 10, MASP-2-ингибирующие антитела согласно изобретению обладают способностью ингибировать лектиновый путь у африканской зеленой мартышки после внутривенного введения. Как показано в таблице 24, в примере 8, было обнаружено, что антитело, используемое в этом исследовании, OMS646, является более активным в человеческой сыворотке. Как известно специалистам, приматы, не являющиеся человеком, часто используются в качестве модели для оценки терапевтического действия антител.
Как описано в патенте США № 7919094, в совместно рассматриваемой заявке на патент США регистрационный № 13/083441 и в совместно рассматриваемой заявке на патент США регистрационный № 12/905972 (переуступленные Корпорации Omeros Corporation, то есть правоприемнику настоящей заявки), которые вводятся в настоящее описание посредством ссылки, MASP-2-зависимая активация комплемента вносит свой вклад в патогенез многих острых и хронических патологических состояний, включая сосудистое заболевание, опосредуемое MASP-2-зависимой активацией комплемента; реперфузионное ишемическое повреждение; атеросклероз; воспалительное заболевание желудочно-кишечного тракта; болезнь легких; экстракорпоральную реперфузию; скелетно-мышечное заболевание; болезнь почек; кожные болезни; заболевание, ассоциированное с трансплантацией органов или тканей; расстройство или поражение нервной системы; болезни крови; заболевание мочеполовых путей; диабет; состояние, ассоциированное с химиотерапией или лучевой терапией; злокачественное заболевание; заболевание эндокринной системы; нарушение свертывания крови или глазные болезни. Поэтому MASP-2-ингибирующие антитела согласно изобретению могут быть использованы для лечения вышеупомянутых заболеваний и состояний.
Как описано ниже в примере 11, MASP-2-ингибирующие антитела согласно изобретению являются эффективными для лечения млекопитающих, подверженных риску возникновения у них побочных эффектов, вызываемых синдромом острой лучевой болезни, или млекопитающих, страдающих такими побочными эффектами, что подтверждает терапевтическую эффективность этих антител in vivo.
Нижеследующие примеры приводятся лишь в целях иллюстрации наилучшего современного способа практического осуществления изобретения, но они не должны рассматриваться как ограничение объема изобретения.
ПРИМЕР 1
В этом примере описаны рекомбинантная экспрессия и продуцирование рекомбинантного полноразмерного человеческого, крысиного и мышиного белка MASP-2, полипептидов, происходящих от MASP-2, и каталитически инактивированных мутантных форм MASP-2.
Экспрессия полноразмерного человеческого и крысиного MASP-2
Последовательность полноразмерной кДНК человеческого MASP-2 (SEQ ID NO:1), кодирующей полипептид человеческого MASP-2 с лидерной последовательностью (SEQ ID NO:2), субклонировали в экспрессионный вектор млекопитающего pCI-Neo (Promega), который запускает эукариотическую экспрессию под контролем области энхансера/промотора CMV (как описано Kaufman R.J. et al., Nucleic Acids Research 19:4485-90, 1991; Kaufman, Methods in Enzymology, 185:537-66 (1991)). Полноразмерную кДНК крысиного MASP-2 (SEQ ID NO:4), кодирующую крысиный полипептид MASP-2 с лидерной последовательностью (SEQ ID NO:5), субклонировали в экспрессионный вектор pED. Затем MASP-2-содержащие экспрессионные векторы переносили в адгезивную клеточную линию яичников китайского хомячка DXBl стандартным методом с использованием фосфата кальция, описанным Maniatis et al., 1989. Трансфецированные клетки, содержащие эти конструкции, росли очень медленно, что указывает на то, что кодируемая протеаза является цитотоксической. Зрелая форма человеческого белка MASP-2 (SEQ ID NO:3) и зрелая форма крысиного белка MASP-2 (SEQ ID NO:6) секретировались в культуральную среду, после чего их выделяли, как описано ниже.
Экспрессия каталитически инактивированного полноразмерного MASP-2
Обоснования
MASP-2 активируется посредством аутокаталитического расщепления после распознавания субкомпонентов MBL, лектина C-типа CL-11 или фиколинов (L-фиколина, H-фиколина или M-фиколина), известных под общим названием «лектины», и связывается с их соответствующими углеводными группами. Аутокаталитическое расщепление, которое приводит к активации MASP-2, часто происходит в процессе выделения MASP-2 из сыворотки или в процессе очистки после рекомбинантной экспрессии. Для продуцирования более стабильного белкового препарата, используемого в качестве антигена, получали каталитически неактивную форму MASP-2, обозначаемую MASP-2A, путем замены серинового остатка, присутствующего в каталитической триаде протеазного домена, аланиновым остатком зрелого крысиного белка MASP-2 (Ser617 на Ala617, SEQ ID NO:6) или зрелого человеческого белка MASP-2 (Ser618 на Ala618, SEQ ID NO:3).
Для продуцирования каталитически неактивных человеческого и крысиного белков MASP-2A осуществляли сайт-направленный мутагенез, описанный в заявке US2007/0172483, которая вводится в настоящее описание посредством ссылки. После электрофореза в агарозном геле и идентификации полос, ПЦР-продукты очищали, и получали последовательности с перекрыванием в один аденозиновый остаток стандартным методом сшивания. Затем связанный с аденозином MASP-2A клонировали в вектор pGEM-T Easy, перенесенный в E. coli. Затем каждый человеческий и крысиный MASP-2A субклонировали в экспрессионные векторы млекопитающих, pED или pCI-Neo, и переносили в клеточную линию яичника китайского хомячка DXB1, как описано ниже.
Конструирование экспрессионных плазмид, содержащих полипептидные области, происходящие от человеческого Masp-2
Нижеследующие конструкции получали с использованием сигнального пептида MASP-2 (остатки 1-15 SEQ ID NO:2) для секретирования различных доменов MASP-2. Конструкцию, экспрессирующую домен CUBI человеческого MASP-2 (SEQ ID NO:7), получали с помощью ПЦР для амплификации области, кодирующей остатки 1-121 MASP-2 (SEQ ID NO:3) (соответствующие N-концевому домену CUBI). Конструкцию, экспрессирующую домен CUBI/EGF человеческого MASP-2 (SEQ ID NO:8), получали с помощью ПЦР для амплификации области, кодирующей остатки 1-166 MASP-2 (SEQ ID NO:3) (соответствующие N-концевому домену CUBI/EGF). Конструкцию, экспрессирующую домен CUBI/EGF/CUBII человеческого MASP-2 (SEQ ID NO:9), получали с помощью ПЦР для амплификации области, кодирующей аминокислотные остатки 1-277 MASP-2 (SEQ ID NO:3) (соответствующие N-концевому домену CUBIEGFCUBII). Конструкцию, экспрессирующую домен EGF человеческого MASP-2 (SEQ ID NO:10), получали с помощью ПЦР для амплификации области, кодирующей аминокислотные остатки 122-166 MASP-2 (SEQ ID NO:3) (соответствующие домену EGF). Конструкцию, экспрессирующую домены CCPI/CCPII/SP человеческого MASP-2 (SEQ ID NO:11), получали с помощью ПЦР для амплификации области, кодирующей аминокислотные остатки 278-671 MASP-2 (SEQ ID NO:3) (соответствующие доменам CCPI/CCPII/SP). Конструкцию, экспрессирующую домены CCPI/CCPII человеческого MASP-2 (SEQ ID NO:12), получали с помощью ПЦР для амплификации области, кодирующей аминокислотные остатки 278-429 MASP-2 (SEQ ID NO:3) (соответствующие доменам CCPI/CCPII). Конструкцию, экспрессирующую домен CCPI MASP-2 (SEQ ID NO:13), получали с помощью ПЦР для амплификации области, кодирующей аминокислотные остатки 278-347 MASP-2 (SEQ ID NO:3) (соответствующие домену CCPI). Конструкцию, экспрессирующую домены CCPII/SP MASP-2 (SEQ ID NO:14), получали с помощью ПЦР для амплификации области, кодирующей аминокислотные остатки 348-671 MASP-2 (SEQ ID NO:3) (соответствующие доменам CCPII/SP). Конструкцию, экспрессирующую домен CCPII MASP-2 (SEQ ID NO:15), получали с помощью ПЦР для амплификации области, кодирующей аминокислотные остатки 348-429 MASP-2 (SEQ ID NO:3) (соответствующие домену CCPII). Конструкцию, экспрессирующую домен SP MASP-2 (SEQ ID NO:16), получали с помощью ПЦР для амплификации области, кодирующей аминокислотные остатки 429-671 MASP-2 (SEQ ID NO:3) (соответствующие домену SP).
Вышеупомянутые домены MASP-2 амплифицировали с помощью ПЦР с использованием полимеразы VentR и pBS-MASP-2 в качестве матрицы в соответствии с хорошо известными ПЦР-методами. 5'-праймерная последовательность смыслового праймера вводила рестрикционный BamHI-сайт (подчеркнут) у 5'-конца ПЦР-продуктов. Антисмысловые праймеры для каждого из доменов MASP-2 были сконструированы для введения стоп-кодона, за которым в конце каждого из ПЦР-продуктов расположен EcoRI-сайт. После амплификации ДНК-фрагменты гидролизовали ферментами BamHI и EcoRI, а затем клонировали в соответствующие сайты вектора pFastBac1. Полученные конструкции охарактеризовывали путем рестрикционного картирования и подтверждали путем секвенирования дцДНК.
Рекомбинантная экспрессия MASP-2 в эукариотах и продуцирование ферментативно неактивного крысиного и человеческого белка MASP-2A
MASP-2- и MASP-2A-экспрессирующие конструкции, описанные выше, переносили в клетки DXB1 стандартным методом трансфекции с использованием фосфата кальция (Maniatis et al., 1989). MASP-2A продуцировали в бессывороточной среде для гарантии того, что эти препараты не будут содержать другие сывороточные белки в качестве примесей. Среду собирали с конфлюэнтных клеток через день (всего четыре раза). Уровень рекомбинантного MASP-2A в среднем составлял приблизительно 1,5 мг/литр культуральной среды для каждого из двух видов.
Очистка белка MASP-2A: MASP-2A (Ser-Ala-мутант, описанный выше) очищали с помощью аффинной хроматографии на колонках с MBP-A-агарозой. Такая стратегия позволяла проводить быструю очистку без использования дополнительных меток. MASP-2A (100-200 мл среды, разведенной равным объемом загрузочного буфера (50 мМ триса-Cl, pH 7,5, содержащего 150 мМ NaCl и 25 мМ CaCl2)), загружали на аффинную колонку с MBP-агарозой (4 мл), предварительно уравновешенную 10 мл загрузочного буфера. После промывки еще 10 мл загрузочного буфера, белок элюировали в 1-мл фракциях 50 мМ триса-Cl, pH 7,5, содержащего 1,25 M NaCl и 10 мМ ЭДТА. Фракции, содержащие MASP-2A, идентифицировали с помощью электрофореза в полиакриламидном геле с ДСН. При необходимости MASP-2A дополнительно очищали с помощью ионообменной хроматографии на колонке MonoQ (HR 5/5). Белок диализовали 50 мМ триса-Cl pH 7,5, содержащего 50 мМ NaCl, и загружали на колонку, уравновешенную в том же самом буфере. После промывки связанный MASP-2A элюировали 10 мл градиента 0,05-1 M NaCl.
Результаты: Из 200 мл среды был получен белок MASP-2А с выходом 0,25-0,5 мг. Молекулярная масса 77,5 кДа, определенная методом MALDI-MS, превышала величину, вычисленную для немодифицированного полипептида (73,5 кДа), что было обусловлено гликозилированием. Наблюдаемую массу можно объяснить присоединением гликанов у каждого из сайтов N-гликозилирования. MASP-2A мигрирует как единственная полоса на полиакриламидных гелях с ДСН, что указывает на то, что этот белок не подвергался протеолитическому процессингу в процессе биосинтеза. Средневесовая молекулярная масса, определенная с помощью равновесного ультрацентрифугирования, соответствовала величине, вычисленной для гомодимеров гликозилированного полипептида.
ПРИМЕР 2
В этом примере описан метод скрининга на прогрессирование созревания аффинности, применяемый для идентификации высокоаффинных полностью человеческих scFv-фрагментов анти-MASP-2 антител-кандидатов, которые блокируют функциональную активность MASP-2.
Общие сведения/обоснования
MASP-2 представляет собой комплексный белок, содержащий множество отдельных функциональных доменов, включая: сайт(-ы) связывания для MBL и фиколинов, каталитический сайт сериновой протеазы, сайт связывания для протеолитического субстрата C2, сайт связывания для протеолитического субстрата C4, сайт расщепления MASP-2 для аутоактивации зимогена MASP-2 и два Ca++-связывающих сайта. Были идентифицированы scFv-фрагменты антител, которые связываются с MASP-2 с высокой аффинностью, а затем идентифицированные Fab2-фрагменты тестировали в функциональном анализе для того, чтобы определить, могут ли эти фрагменты блокировать функциональную активность MASP-2.
Для блокирования функциональной активности MASP-2, антитело или scFv- или Fab2-фрагменты антитела должны связываться со структурным эпитопом на MASP-2, необходимом для функциональной активности MASP-2, и ингибировать такую активность. Поэтому многие или все анти-MASP-2 scFv- или Fab2-фрагментов, связывающихся с высокой аффинностью, могут не ингибировать функциональную активность MASP-2, если только они не связываются со структурными эпитопами на MASP-2, которые непосредственно участвуют в функциональной активности MASP-2.
Функциональный анализ, в котором определяли степень ингибирования образования C3-конвертазы лектинового пути, применяли для оценки «блокирующей активности» анти-MASP-2 scFv. Известно, что главная физиологическая роль MASP-2 в лектиновом пути заключается в продуцировании следующего функционального компонента опосредуемого лектином пути комплемента, а именно, C3-конвертазы лектинового пути. C3-конвертаза лектинового пути представляет собой важный ферментативный комплекс (C4b2a), который протеолитически расщепляет C3 на C3a и C3b. MASP-2 не является структурным компонентом C3-конвертазы лектинового пути (C4b2a), однако функциональная активность MASP-2 необходима для продуцирования двух белковых компонентов (C4b, C2a), которые составляют C3-конвертазу лектинового пути. Кроме того, очевидно, что все отдельные функциональные активности MASP-2, перечисленные выше, необходимы для сообщения MASP-2 способности продуцировать C3-конвертазу лектинового пути. По этой причине, предпочтительным анализом, применяемым для оценки «блокирующей активности» Fab2- и scFv-фрагментов анти-MASP-2 антитела, очевидно является функциональный анализ, позволяющий определить степень ингибирования образования C3-конвертазы лектинового пути.
Профиль ингибирования мишени для терапевтических анти-MASP-2 антител, которые, как было предсказано, давали >90% подавление лектинового пути in vivo после их введения человеку в количестве 1 мг/кг, составлял IC50<5 нМ в 90% плазме. Взаимосвязь между фармакологической активностью in vitro в этом формате анализа и фармакодинамикой in vivo была подтверждена экспериментально с использованием антител против MASP-2 грызунов.
Критериями для отбора MASP-2-блокирующих антител первой генерации, используемых в терапии, являются: высокая аффинность по отношению к MASP-2 и величины IC50, полученные в функциональном анализе, до ~25 нМ. Кроме того, кандидаты были скринированы на перекрестную реактивность с сывороткой приматов, не являющихся человеком, и с крысиной сывороткой.
Методы
Скрининг фагмидной библиотеки scFv против антигена MASP-2
Антигены
Человеческий MASP-2A с N-концевой 5×His-меткой и крысиный MASP-2A с N-концевыми 6×His-метками получали с использованием реагентов, описанных в примере 1, и очищали из супернатантов культуры с помощью хроматографии с аффинностью к никелю, как описано в литературе (Chen et al., J. Biol. Chem. 276: 25894-02 (2001)).
OMS100, человеческое анти-MASP-2 антитело в форме Fab2-фрагмента, использовали в качестве позитивного контроля для связывания с MASP-2.
Описание фагмидной библиотеки
Библиотеку фагового представления последовательностей вариабельной области легкой и тяжелой цепей человеческого иммуноглобулина подвергали пэннингу антигенов, а затем проводили автоматизированный скрининг антител и отбор для идентификации высокоаффинных scFv-фрагментов антител против крысиного белка MASP-2 и человеческого белка MASP-2.
Методы пэннинга
Обзор: Для выделения из фагмидной библиотеки фагов, которые связываются с MASP-2, были применены две стратегии пэннинга, каждая из которых включала всего три раунда пэннинга. Обе стратегии включали пэннинг в растворе и отбор фага, связанного с MASP-2. MASP-2 иммобилизовали на магнитных сферах либо посредством His-метки (с использованием NiNTA-сфер), либо посредством биотина (с использованием стрептавидиновых сфер) на мишени.
Первые два раунда пэннинга включали элюирование щелочью (TEA), а третий раунд пэннинга включал сначала стадию конкурентного элюирования с MBL, а затем стандартную стадию элюирования щелочью (TEA). Негативный отбор осуществляли перед проведением раундов 2 и 3, и такой отбор проводили против функциональных аналогов, C1s и C1r классического пути комплемента. После пэннинга проводили мониторинг специфического обогащения фагов scFv-фрагментами против MASP-2A, и было определено, что такая стратегия пэннинга прошла успешно (данные не приводятся).
После 3-го раунда пэннинга гены scFv клонировали в экспрессионный вектор pHOG и проводили лабораторный скрининг на фильтре для поиска специфичных клонов против MASP-2A, как подробно описано ниже.
Методы пэннинга фагов (биотин/стрептавидин)
(мкг)
(10 мкг)
(10 мкг)
(1 мкг)
Методы пэннинга фагов (His/NiNTA)
(мкг)
(10 мкг)
(10 мкг)
(1 мкг)
Реагенты для пэннинга
Человеческий MASP-2A
Антитело OMS100 (позитивный контроль)
Козье антитело против человеческих IgG (H+L) (Pierce #31412)
NiNTA-сферы (Qiagen #LB 13267)
Сферы Dynabeads® M-280 со стрептавидином, 10 мг/мл (LB 12321)
Нормальная человеческая сыворотка (LB 13294)
Поликлональное кроличье антитело против человеческих C3c (LB13137)
ПХ-конъюгированное антитело против человеческих IgG (American Qualex #A102PU)
Для тестирования меченого антигена MASP-2A проводили эксперимент по захвату антитела OMS100 (200 нг/мл), используемого в качестве позитивного контроля и предварительно инкубированного с биотин-меченным антигеном MASP-2A или HIS-меченным антигеном MASP-2A (10 мкг), с 50 мкл NiNTA-сфер в 4% молоке в PBS или с 200 мкл стрептавидиновых сфер, соответственно. Связанное анти-MASP-2A антитело OMS100 детектировали с использованием ПХ-конъюгированного козьего антитела против человеческих IgG (H+L) (1:5000) и TMB-субстрата (3,3',5,5'-тетраметилбензидина).
ELISA-анализ на NiNTA-сферах
50 мкл NiNTA-сфер блокировали 1 мл 4% молока в забуференном фосфатом физиологическом растворе (PBS) и инкубировали на роторном устройстве в течение 1 часа при комнатной температуре. Параллельно, 10 мкг MASP-2A и антитело OMS100 (разведенные до 200 нг/мл в 4% молоке-PBS) предварительно инкубировали в течение одного часа. Затем, в промежутке между стадиями, сферы три раза промывали 1 мл PBS-T с использованием магнита. MASP-2A, предварительно инкубированный с антителом OMS100, добавляли к промытым сферам. Смесь инкубировали на роторном устройстве в течение 1 часа при комнатной температуре, а затем три раза промывали 1 мл PBS-T с использованием магнита, как описано выше. Пробирки инкубировали в течение 1 часа при комнатной температуре с ПХ-конъюгированным козьим антителом против человеческих IgG (H+L), разведенным 1:5000 в 4% молоке в PBS. Для негативного контроля ПХ-конъюгированное козье антитело против человеческих IgG (H+L) (1:5000) добавляли к промытым и блокированным Ni-NTA-сферам в отдельной пробирке.
Образцы инкубировали на роторном устройстве в течение 1 часа при комнатной температуре, а затем три раза промывали 1 мл PBS-T и один раз 1×PBS с использованием магнита, как описано выше. Затем добавляли 100 мкл TMB-субстрата, и смесь инкубировали в течение 3 минут при комнатной температуре. Пробирки помещали на магнитный стенд на 2 минуты для концентрирования сфер, а затем раствор TMB переносили в микротитрационный планшет и реакцию прекращали добавлением 100 мкл 2 M H2SO4. Оптическую плотность на 450 нм считывали на ELISA-ридере.
ELISA-анализ на стрептавидиновых сферах
Этот анализ осуществляли как описано выше для ELISA-анализа на NiNTA-сферах, за исключением того, что вместо указанных сфер использовали 200 мкл стрептавидиновых сфер на образец и небиотинилированные антигены.
Результаты: His-меченный и меченный биотином антиген MASP-2A, предварительно инкубированные с антителом OMS100, используемым в качестве позитивного контроля, были успешно иммобилизованы на NiNTA-сферах или на стрептавидиновых сферах, соответственно.
Пэннинг
Три раунда пэннинга фаговой библиотеки scFv против HIS- меченного или меченного биотином MASP-2A осуществляли как показано в таблице 7 или в таблице 8, соответственно. Третий раунд пэннинга включал сначала стадию элюирования MBL, а затем TEA (щелочью). Для мониторинга специфического обогащения фагов, представляющих scFv-фрагменты, против MASP-2A-мишени, проводили ELISA поликлонального фага с иммобилизованным MASP-2А, как описано ниже.
ELISA-анализ MASP-2A на поликлональном фаге, обогащенном после пэннинга
После трех раундов пэннинга фаговой библиотеки scFv против человеческого MASP-2А, проводимых как описано выше, осуществляли мониторинг специфического обогащения фагов scFv-фрагментами против MASP-2A-мишени с помощью ELISA на обогащенных популяциях поликлональных фагов, полученных путем пэннинга иммобилизованного MASP-2А, как описано ниже.
Методы
5 нг/мл MASP-2A иммобилизовали на ELISA-планшетах Maxisorp в PBS в течение ночи при 4°C. Упакованные фаги от всех трех раундов пэннинга разводили 1:3 в 4% молоке-PBS и титровали с 3-кратными разведениями. В качестве негативного контроля использовали хелперный фаг M13.
Блокирование осуществляли в 4% молоке в PBS. В промежутке между каждой стадией, планшеты 3 раза промывали в 200 мкл PBS-0,05% твина (об/об). «Первым» антителом является кроличье анти-fd антитело (белок M13 с покрытием), разведенное 1:5000 в 4% молоке-PBS (масс/об). Конъюгат представляет собой ПХ-конъюгированное кроличье антикозье антитело, разведенное 1:10000 в 4% молоке-PBS (масс/об). Субстрат представляет собой ABTS. Все объемы, за исключением промывок и блокирующих растворов, составляли 100 мкл/лунку. Все стадии инкубирования проводили в течение 1 часа со встряхиванием при комнатной температуре.
Результаты
Результаты ELISA фага указывали на специфическое обогащение scFv против MASP-2A для обеих стратегий пэннинга. См. фиг.2. Как показано на фиг.2, стратегия, включающая захват на магнитных NiNTA-сферах, давала обогащение scFv на фагах против MASP-2A после проведения двух раундов пэннинга, а обе стратегии давали хорошее обогащение при конкурентном элюировании и TEA-элюировании после третьего раунда пэннинга. Хелперный фаг M13, используемый в качестве негативного контроля, не обнаруживал какой-либо перекрестной реакции с MASP-2A при его наименьшем разведении. Полученные результаты показали, что наблюдаемый сигнал обусловлен специфическим связыванием scFv с MASP-2A.
Скрининг на фильтре
Бактериальные колонии, содержащие плазмиды, кодирующие scFv-фрагменты, полученные в третьем раунде пэннинга, собирали, измельчали на нитроцеллюлозных мембранах и культивировали в течение ночи на неиндуцируемой среде для приготовления препаративных планшетов. После третьего раунда пэннинга было собрано и проанализировано всего 18000 колоний, половина из которых была получена после конкурентного элюирования, а половина была получена после TEA-элюирования.
Нитроцеллюлозные мембраны с бактериальными колониями индуцировали IPTG для экспрессии и секреции растворимого белка scFv, а затем подвергали контактированию с другой нитроцеллюлозной мембраной, покрытой антигеном MASP-2A, и параллельно, с мембраной, покрытой 4% молоком в PBS (блокирующем растворе).
ScFv, связанные с MASP-2A, детектировали с использованием c-Myc-метки, присоединенной к мышиному анти-cMyc mAb и к ПХ-конъюгированному кроличьему антимышиному антителу. Наилучшие образцы, соответствующие scFv-клонам, которые были позитивными на MASP-2A и негативными на молоке-PBS, отбирали для последующей экспрессии, а затем для ELISA-анализа.
Результаты: Пэннинг фагмидной библиотеки scFv против MASP-2A с последующим превращением scFv и скринингом на фильтре давал 137 позитивных клонов. Большинство позитивных клонов были получены в результате конкурентного элюирования MBL методами с использованием NiNTA и стрептавидина. Все позитивные клоны были подвергнуты микроэкспрессии (в масштабе 200 мкл) и последующей экстракции. ScFv выделяли из периплазмы бактерий путем инкубирования суспензии бактерий с сахарозным буфером для лизиса и с лизоцимом в течение одного часа, а затем выделяли супернатант путем проведения стадии центрифугирования. Супернатант, содержащий scFv, секретированный в среде вместе с содержимым периплазмы, анализировали в двух анализах: в ELISA-анализе с использованием физически адсорбированного MASP-2A, и в анализе на связывание с использованием связанного с амином MASP-2A, нанесенного на чип CM5 на устройстве Biocore, как более подробно описано ниже.
ELISA-анализ MASP-2A на scFv-клонах-кандидатах, идентифицированных посредством пэннинга/превращения scFv и скрининга на фильтре
Методы
4 мкг/мл MASP-2A иммобилизовали на ELISA-планшетах Maxisorp (Nunc) в PBS в течение ночи при 4°C. На следующий день планшеты блокировали путем 3-кратного промывания PBS-твином (0,05%). В планшет добавляли неочищенный scFv-материал (100 мкл экстракта среды-периплазмы) от каждого из 137 scFv-кандидатов (полученных как описано выше). Затем добавляли анти-cMyc антитело, и в конечной стадии добавляли ПХ-конъюгированное кроличье антимышиное антитело для детектирования связанного scFv. Реакцию проявляли в 1 стадию в пероксидазном субстрате ABTS (Calbiochem). В качестве позитивного контроля использовали OMS100 (анти-MASP-2 антитело в Fab2-форме), разведенное до 10 мкг/мл в 0,05% PBS-твине. В качестве негативного контроля использовали среду-периплазму от XL1-Blue без плазмиды.
В промежутках между стадиями осуществляли промывку 3×200 мкл PBS-0,05% твина (об/об).
«Первым» антителом является мышиное анти-cMyc антитело, 1:5000 в PBS-0,05% твине (масс/об).
Конъюгат представляет собой ПХ-конъюгированное кроличье антикозье антитело, разведенное 1:5000 в PBS-0,05% твине (масс/об) или козье антитело против человеческих IgG (H+L, Pierce 31412). В качестве субстрата использовали ABTS, а инкубирование проводили в течение 15 минут при комнатной температуре. Все объемы, за исключением промывок и блокирующих растворов, составляли 100 мкл/лунку. Все процедуры инкубирования проводили в течение 1 часа со встряхиванием при комнатной температуре.
Результаты: В этом ELISA-анализе все 108/137 клонов были позитивными (данные не приводятся), и 45 из этих клонов были снова проанализированы как описано ниже. В качестве позитивного контроля использовали Fab2-фрагмент OMS100, разведенный до 10 мкг/мл в PBS-твине, и этот клон был положительным. В качестве негативного контроля использовали среду-периплазму от XL1-Blue без плазмиды, которая была отрицательной.
ПРИМЕР 3
В этом примере описан функциональный метод скрининга MASP-2, применяемый для анализа высокоаффинных полностью человеческих scFv-фрагментов анти-MASP-2 антител-кандидатов на их способность блокировать активность MASP-2 в нормальной человеческой сыворотке.
Обоснования/общие сведения
Анализ для оценки степени ингибирования образования C3-конвертазы лектинового пути
Функциональный анализ, в котором оценивают степень ингибирования образования C3-конвертазы лектинового пути, осуществляли для оценки «блокирующей активности» scFv-клонов-кандидатов анти-MASP-2 антител. C3-конвертаза лектинового пути представляет собой ферментный комплекс (C4b2a), который протеолитически расщепляет C3 на два активных провоспалительных фрагмента, анафилотоксин C3a и опсонин C3b. Образование C3-конвертазы, очевидно, является ключевой стадией лектинового пути, ответственной за опосредование воспаления. MASP-2 не является структурным компонентом C3-конвертазы лектинового пути (C4b2a), а поэтому анти-MASP-2 антитела (или Fab2) непосредственно не ингибируют активности уже существующей C3-конвертазы. Однако активность сериновой протеазы MASP-2 необходима для продуцирования двух белковых компонентов (C4b, C2a), которые включают C3-конвертазу лектинового пути. Поэтому анти-MASP-2 scFv, который ингибирует функциональную активность MASP-2 (то есть блокирующий анти-MASP-2 scFv), будет ингибировать образование de novo C3-конвертазы лектинового пути. C3 содержит необычную и в высокой степени реакционноспособную тиоэфирную группу, которая является частью ее структуры. После расщепления C3 ферментом C3-конвертазой в этом анализе, тиоэфирная группа на C3b может образовывать ковалентную связь с гидроксильными или аминогруппами на макромолекулах, иммобилизованных на дне пластиковых лунок, посредством сложноэфирных или амидных связей, что позволяет облегчать детектирование C3b в ELISA-анализе.
Дрожжевой маннан представляет собой известный активатор лектинового пути. В описанном ниже методе оценки образования С3-конвертазы, пластиковые лунки, покрытые маннаном, инкубировали с разведенной человеческой сывороткой для активации лектинового пути. Затем лунки промывали и анализировали на C3b, иммобилизованном на лунках, с применением стандартных ELISA-методов. Количество C3b, продуцируемого в этом анализе, служит прямым доказательством образования de novo C3-конвертазы лектинового пути. Анти-MASP-2 scFv в выбранных концентрациях тестировали в этом анализе на их способность ингибировать образование C3-конвертазы и последующее продуцирование C3b.
Методы
45 клонов-кандидатов, идентифицированных как описано в примере 2, экспрессировали, очищали и разводили до той же самой исходной концентрации, а затем снова разводили в Ca++- и Mg++-содержащем буфере GVB (4,0 мМ барбитал, 141 мМ NaCl, 1,0 мМ MgCl2, 2,0 мМ CaCl2, 0,1% желатин, pH 7,4) для гарантии того, что все клоны будут иметь одинаковое количество буфера. Каждый из scFv-клонов тестировали с тремя повторностями при концентрации 2 мкг/мл. В качестве позитивного контроля использовали Fab2 OMS100, который тестировали при 0,4 мкг/мл. Мониторинг образования C3c осуществляли в присутствии и в отсутствие клонов scFv/IgG.
Маннан разводили до концентрации 20 мкг/мл (1 мкг/лунку) в 50 мМ карбонатном буфере (15 мМ Na2CO3 + 35 мМ NaHCO3 + 1,5 мМ NaN3), pH 9,5 и наносили на ELISA-планшет, а затем оставляли на ночь при 4°C. На следующий день, покрытые маннаном планшеты три раза промывали 200 мкл PBS. В лунки добавляли 100 мкл 1% блокирующего раствора HAS, и инкубировали в течение 1 часа при комнатной температуре. Планшеты три раза промывали 200 мкл PBS, и перед добавлением образцов хранили на льду с 200 мкл PBS.
Нормальную человеческую сыворотку разводили до 0,5% в буфере CaMgGVB, и клоны scFv или Fab2 OMS100, используемый в качестве позитивного контроля, добавляли к этому буферу с тремя повторностями при концентрации 0,01 мкг/мл; 1 мкг/мл (только OMS100-контроль) и 10 мкг/мл, и перед добавлением в блокированный ELISA-планшет, предварительно инкубировали в течение 45 минут на льду. Реакцию инициировали путем инкубирования в течение одного часа при 37°C и прекращали путем переноса планшетов на ледяную баню. Осаждение C3b детектировали с использованием кроличьего антитела против мышиного C3c, а затем с использованием ПХ-конъюгированного козьего антикроличьего антитела. В качестве негативного контроля использовали буфер без антитела (без OMS100 = максимальное осаждение C3b), а в качестве позитивного контроля использовали буфер с ЭДТА (без осаждения C3b). Фоновый уровень определяли путем проведения того же самого анализа, но в маннан-негативных лунках. Фоновый сигнал в лунках без маннана вычитали из маннан-позитивных сигналов. Критерий отсечки определяли как половину активности нерелевантного scFv-клона (VZV) и активность с одним буфером.
Результаты: Исходя из критерия отсечки было обнаружено, что все 13 клонов блокируют активность MASP-2 как показано на фиг.3A и 3B. Были отобраны все 13 клонов, обнаруживающие >50% ингибирование пути, и эти клоны были секвенированы, в результате чего было получено 10 уникальных клонов, представленных ниже в таблице 9. Было установлено, что десять различных клонов, указанных в таблице 9, обнаруживали приемлемую функциональную активность в анализе комплемента. Было установлено, что все десять клонов имели легкие цепи одного и того же подкласса, λ3, и тяжелые цепи трех различных подклассов, VH2, VH3 и VH6. Идентичность последовательностей клонов и последовательностей зародышевой линии также указана в таблице 9.
10 уникальных клонов с функциональной анти-MASP-2 активностью
Как показано выше в таблице 9, десять различных клонов с приемлемой функциональной активностью и уникальные последовательности были отобраны для последующего анализа. Как показано в таблице 9, некоторые клоны были детектированы два или три раза, исходя из идентичности последовательностей (см. первый столбец таблицы 9, озаглавленный «Название клона»).
Экспрессия и очистка десяти svFc-клонов-кандидатов
Десять клонов-кандидатов, указанных в таблице 9, экспрессировали в объеме один литр и очищали с помощью ионообменной хроматографии на никеле. После этого образец каждого клона подвергали эксклюзионной колоночной хроматографии для оценки содержания мономеров и димеров. Как показано ниже в таблице 10, почти все scFv-клоны присутствовали в мономерной форме, и эта мономерная фракция была выделена для последующего тестирования и ранжирования.
Анализ содержания мономеров
Тестирование мономерной фракции на связывание и функциональную активность
Клоны, указанные в таблице 10, экспрессировали в объеме 1 литр, очищали с помощью хроматографии на металлах и ионообменной хроматографии, разделяли на мономерные фракции с помощью эксклюзионной хроматографии (ЭХ), и повторно проводили функциональные анализы для определения величин IC50 и перекрестной реактивности.
Функциональный анализ мономерных фракций
Мономерные фракции десяти наилучших клонов, указанных в таблице 10, очищали и тестировали на функциональную IC50 нМ в сериях разведений, где каждая из них имела одну и ту же концентрацию буфера GVB с кальцием и магнием и человеческую сыворотку. scFv-клоны тестировали в 12 разведениях с тремя повторностями. В качестве позитивного контроля служил Fab2 OMS100. Мониторинг осаждения C3b осуществляли в присутствии и в отсутствие антитела. Результаты представлены ниже в таблице 11.
Анализ на связывание
KD аффинности связывания определяли двумя различными способами для очищенных мономерных фракций десяти scFv-клонов-кандидатов. При этом либо MASP-2A иммобилизовали путем связывания амина с чипом CM5, либо scFv в фиксированной концентрации (50 нМ) сначала захватывали с использованием анти-cMyc антитела, которое связывалось с амином с высокой аффинностью, а затем серии концентраций MASP-2A в растворе пропускали поверх чипа. Результаты представлены ниже в таблице 11.
Результаты
Систематизированные данные функциональной ингибирующей активности (IC50) и аффинности связывания с MASP-2 (KD) для десяти scFv-клонов-кандидатов, проанализированных в мономерной форме
IC50 (нМ)
KD (нМ)
KD (нМ)
(13C24/6l18)
(18L16)
(17P10)
(16L13/4F2)
(18C15)
Обсуждение результатов
Как показано в таблице 11, в функциональном анализе, проводимом с использованием 0,5% человеческой сыворотки, пять из десяти scFv-клонов-кандидатов давали величины IC50 менее 25 нМ по критерию мишени. Как описано ниже, эти клоны дополнительно тестировали в присутствии сыворотки примата, не являющегося человеком, и крысиной сыворотки для определения функциональной активности у других видов. Что касается аффинности связывания в растворе, то следует отметить, что все аффинности связывания составляли в пределах низких нМ или выше, тогда как в стандартном анализе, проводимом с использованием иммобилизованного MASP-2, только два клона (4D9 и 17D20) имели аффинности в низком нМ-интервале. Более высокая аффинность, наблюдаемая в анализе, проводимом в растворе, вероятно, является следствием мультимеризации антигена в растворе. Кроме того, если мишень была иммобилизована на чипе (посредством присоединения в соответствующей ориентации), то эпитоп может быть замаскирован, что тем самым будет приводить к снижению наблюдаемых аффинностей в анализе с иммобилизованной мишенью.
ПРИМЕР 4
В этом примере описаны результаты тестирования десяти человеческих scFv-клонов-кандидатов анти-MASP-2 антител на перекрестную реактивность с крысиным MASP-2 и определения величин IC50 этих scFv-клонов в функциональном анализе для оценки их способности ингибировать MASP-2-зависимую активацию комплемента в человеческой сыворотке, в сыворотке примата, не являющегося человеком, и в крысиной сыворотке.
Методы
Перекрестная реактивность с крысиным MASP-2
Десять scFv-клонов-кандидатов, указанных в таблице 9 примера 3, тестировали на перекрестную реактивность с крысиным MASP-2A в стандартном ELISA-анализе, проводимом с использованием адсорбированного крысиного MASP-2A. Крысиный MASP-2A разводили до 4 мкг/мл в PBS и наносили на ELISA-планшет Maxisorp (Nunc), а затем оставляли на ночь при 4°C. На следующий день планшет блокировали путем трехкратной промывки в PBS-твине (0,05%). ScFv-клоны (100 мкл), разведенные в 20 мкг/мл в PBS-твине, добавляли в планшет, а затем титровали три раза с 4-кратными разведениями. MASP-2A-специфические svFc-клоны (лунки, содержащие связанный scFv) детектировали с анти-cMyc антителом и со «вторым» ПХ-конъюгированным кроличьим антимышиным антителом. Реакцию проявляли в пероксидазном субстрате TMB (Pierce). В качестве позитивного контроля использовали Fab2 OMS100, разведенный до 10 мкг/мл в PBS-твине. Все тестируемые клоны, как и ожидалось, обнаруживали перекрестную реактивность с крысиным MASP-2A, поскольку второй раунд пэннинга был проведен с использованием крысиного MASP-2 (данные не приводятся).
Функциональная характеризация десяти scFv-клонов-кандидатов в человеческой сыворотке, в сыворотке примата, не являющегося человеком (NHP), и в крысиной сыворотке
Определение базовых уровней C3c в различных сыворотках
Сначала проводили описанный ниже эксперимент для сравнения базовых уровней C3b в трех сыворотках (человека, крысы и NHP).
Маннан разводили до 20 мкг/мл, а затем наносили на ELISA-планшет и оставляли на ночь при 4°C. На следующий день лунки блокировали 1% HSA. Нормальную человеческую сыворотку, крысиную сыворотку и сыворотку африканской зеленой мартышки (примата, не являющегося человеком, «NHP») разводили, начиная с 2%, двукратными разведениями в буфере CaMgGVB. Реакцию инициировали путем инкубирования в течение одного часа при 37°C, а затем ее завершали путем переноса планшета на ледяную баню. Осаждение C3b детектировали с использованием кроличьего антитела против мышиного C3c, а затем с использованием ПХ-конъюгированного козьего антикроличьего антитела. В качестве негативного контроля использовали буфер без антитела (в отсутствие OMS100 наблюдалось максимальное осаждение C3b), а в качестве позитивного контроля использовали буфер с ЭДТА (без осаждения C3b).
На фиг.4 графически проиллюстрированы базовые уровни C3c в трех сыворотках (человека, крысы и NHP). Как показано на фиг.4, уровни C3c в различных тестируемых сыворотках значительно варьировались. При сравнении уровней C3c было обнаружено, что 1% человеческая сыворотка давала уровни, эквивалентные уровням, наблюдаемым в присутствии 0,2% сыворотки NHP и 0,375% крысиной сыворотки. Исходя из этих результатов, эти концентрации в сыворотках были нормализованы так, чтобы результаты для scFv можно было непосредственно сравнивать в сыворотках трех различных типов.
Функциональный анализ scFv-клонов в различных сыворотках
Очищенные мономерные фракции десяти scFv-клонов-кандидатов тестировали на функциональную IC50 (нМ) в человеческой сыворотке, в крысиной сыворотке и в сыворотке африканской зеленой мартышки (примата, не являющегося человеком, «NHP»). Анализ осуществляли как описано в примере 3 с использованием 1000 нМ очищенного белка scFv и нормальной человеческой сыворотки, разведенной до 0,9% в буфере CaMgGVB; сыворотки африканской зеленой мартышки, разведенной до 0,2% в буфере CaMgGVB; или крысиной сыворотки, разведенной до 0,375% в буфере CaMgGVB. Все десять scFv-клонов тестировали в сериях разведений с одной и той же концентрацией буфера GVB, содержащего кальций и магний, и сыворотки. scFv-клоны тестировали в двенадцати разведениях с тремя повторностями. В качестве позитивного контроля использовали Fab2 OMS100 при 100 нг/мл или с добавлением ЭДТА к реакционной смеси. В качестве негативного контроля использовали нерелевантный scFv-контроль или PBS без scFv. Мониторинг осаждения C3b проводили в присутствии или в отсутствие scFv- или Fab2-фрагмента антитела. Фоновый сигнал OMS100 при 100 нг/мл вычитали из всех сигналов. В таблице 12 систематизированы результаты функциональных анализов во всех трех сыворотках.
Функциональная активность IC50 (нМ) scFv-клонов в сыворотках трех различных типов
(13C24/6l18)
(18L16)
(17P10)
(16L13/4F2)
(18C15)
Систематизированные результаты для функциональной активности в scFv-клонах-кандидатах в различных сыворотках
Все десять scFv-клонов обнаруживали функциональную активность в человеческой сыворотке и в сыворотке примата, не являющегося человеком (NHP), после того как эти сыворотки были нормализованы по уровням осаждения C3b. Наиболее активными клонами в человеческой сыворотке были шесть клонов: 9P13>17N16>17D20>4D9>3F22>18L16, которые перечислены в порядке убывания активности. В сыворотке NHP наиболее активными клонами были (в порядке убывания активности): 17L20>17N16>17D20>9P13>18L16>3F22. Клоны 17N16 и 17D20 находятся в ряду первых лучших трех клонов для человеческой сыворотки и для сыворотки NHP. 17D20 обнаруживал некоторую активность в крысиной сыворотке.
Исходя из этих результатов, были определены три наилучших scFv-клона: 18L16, 17D20 и 17N16. Эти три клона были дополнительно проанализированы в разведенной человеческой сыворотке (1% сыворотке) как показано ниже в таблице 13.
Анализ C3 для клонов-кандидатов: (IC50, нМ) в разведенной сыворотке (1%)
На фиг.5A проиллюстрировано выравнивание аминокислотных последовательностей полноразмерных scFv-клонов 17D20, 18L16, 4D9, 17L20, 17N16, 3F22 и 9P13. Эти scFv-клоны содержат вариабельную область тяжелой цепи (аминокислоты l-120), линкерную область (аминокислоты l21-145) и вариабельную область легкой цепи (аминокислоты 146-250). Как показано на фиг.5A, выравнивание областей тяжелой цепи (остатки 1-120) наиболее активных клонов выявило две отдельные группы, принадлежащие к семейству генов VH2 и VH6, соответственно. Как показано на фиг.5A, область VH соответствует клонам класса VH2: 17D20, 18L16 и 4D9, которые имеют вариабельность в положениях 20 аминокислотных остатков в области из 120 аминокислот (то есть 83%-ная идентичность).
Как показано на фиг.5A, область VH соответствует клонам класса VH6: 17L20, 17N16, 3F22 и 9P13, которые имеют вариабельность в положениях 18 аминокислотных остатков в области из 120 аминокислот (то есть 85%-ная идентичность).
На фиг.5B проиллюстрировано выравнивание последовательностей scFv-клонов 17D20, 17N16, 18L16 и 4D9.
Последовательности scFv-клонов-кандидатов, представленных на фиг.5A и 5B
Приоритетами по ранжированию были: (1) функциональная активность человеческой сыворотки и полное блокирование; (2) перекрестная реактивность в сыворотке NHP и (3) разнообразие последовательностей. Клоны 17D20 и 17N16 были отобраны как наилучшие репрезентативные клоны от каждого семейства генов. 18L16 был отобран как третий кандидат с заметным отличием последовательности CDR3.
Клоны 17N16 и 17D20 были выбраны как два наилучших клона по полному функциональному блокированию, по наилучшей функциональной активности против человеческих антигенов; по значительной перекрестной реактивности с сывороткой обезьян и по отличию семейств генов VH. 3F22 и 9P13 были исключены по той причине, что их последовательности VH были почти идентичны последовательностям 17N16. 18P15, 4J9 и 21B17 были исключены из-за низкой активности. Клон 17L20 больше не использовали, поскольку он обнаруживал лишь частичное блокирование.
Клоны 18L16 и 4D9 имели аналогичные активности и значительно отличались от 17D20. Клон 18L16 был выбран благодаря его более высокой перекрестной реактивности с сывороткой приматов по сравнению с 4D9.
Поэтому, исходя из этих критериев было установлено, что нижеследующие три материнских клона: 17D20, 17N16 и 18L16 обнаруживали прогрессирующее созревание аффинности, как подробно описано ниже.
ПРИМЕР 5
В этом примере описано клонирование трех материнских клонов 17D20, 17N16 и 18L16 (идентифицированных как описано в примерах 2-4) в формате IgG4 дикого типа и анализ функциональных свойств трех материнских клонов в формате полноразмерных IgG.
Обоснования
Полностью человеческие scFv-фрагменты анти-MASP-2 антител с невысокой функциональной активностью идентифицировали методом фагового представления, описанным в примерах 2-4. Эти три материнских клона, 17D20, 17N16 и 18L16, были отобраны по созреванию аффинности. Для анализа функциональных свойств этих материнских клонов в формате полноразмерных IgG были получены IgG4 дикого типа и мутантные формы IgG4 с мутацией S228P в шарнирной области этих антител. S228P-мутант по шарнирной области был включен для повышения стабильности в сыворотке (см. Labrijn A.F. et al., Nature Biotechnology 27:767 (2009)).
Аминокислотная последовательность IgG4 дикого типа представлена как SEQ ID NO:63, кодируемая последовательностью SEQ ID NO:62.
Аминокислотная последовательность IgG4 с мутацией S228P представлена как SEQ ID NO:65, кодируемая последовательностью SEQ ID NO:64.
Молекулы IgG4 были также расщеплены на F(ab')2-фрагменты посредством гидролиза пепсином, а затем они были фракционированы с помощью эксклюзионной хроматографии для сравнения материнских клонов непосредственно с контрольным антителом OMS100, которое представляет собой молекулу F(ab)2.
Методы
Генерирование клонов в полноразмерной форме
Три материнских клона превращали в IgG4 дикого типа и в мутантный IgG4 с мутацией S228P. Это было осуществлено путем ПЦР-выделения соответствующих областей VH и VL из вышеупомянутых материнских клонов и их клонирования в экспрессионные векторы pcDNA3, содержащие соответствующие константные области тяжелой цепи, в результате чего получали гибриды с сохранением рамки считывания и продуцировали нужное антитело. Затем три материнских клона в виде мутантного IgG4 расщепляли пепсином и получали F(ab')2-фрагменты, которые были затем очищены путем фракционирования с помощью эксклюзионной колоночной хроматографии.
Анализ на связывание
Материнские клоны-кандидаты, превращенные в IgG4-форму, временно переносили в клетки HEK 293, и супернатанты от временной трансфекции титровали в ELISA-анализе. Эти клоны обнаруживали превосходную реактивность с физически адсорбированным человеческим MASP-2A, и были ранжированы в следующем порядке: 17N16>17D20>18L16 (данные не приводятся).
Затем эти клоны очищали и повторно тестировали в ELISA-анализе и в анализе на активность как описано ниже. Человеческий MASP-2A наносили в концентрации 3 мкг/мл в PBS на планшет Maxisorp, и IgG (45 мкг/мл) и Fab'2 (30 мкг/мл) разводили в PBS-твине до исходной концентрации 300 нМ, а затем делали 3-кратные разведения. IgG детектировали с использованием ПХ-конъюгированного козьего антитела против человеческих IgG (Southern Biotech), а F(ab')2 детектировали с использованием ПХ-конъюгированного козьего антитела против человеческих IgG H+L (Pierce 31412). Реакцию проявляли субстратом TMB и прекращали добавлением 2 M H2SO4. Результаты представлены ниже в таблице 15.
Аффинность связывания с человеческим MASP-2
Функциональный анализ
Анализ на уровень C3-конвертазы, проводимый с использованием 1% нормальной человеческой сыворотки (NHS) как описано в примере 4, осуществляли для сравнения функциональной активности материнских scFv-клонов и полноразмерных аналогов IgG4 в 1% NHS. Маннан разводили до концентрации 20 мкг/мл, а затем наносили на ELISA-планшет и оставляли на ночь при 4°C. На следующий день лунки блокировали 1% человеческой сывороткой. Человеческую сыворотку разводили до 1% в буфере CaMgGVB, и очищенные антитела, scFv (900 нМ), F(ab')2 (300 нМ), IgG (300 нМ) добавляли в дубликатах в виде серий различных разведений к тому же самому количеству буфера, и перед добавлением в блокированный ELISA-планшет, предварительно инкубировали в течение 45 минут на льду. Реакцию инициировали путем инкубирования при 37°C в течение одного часа, а затем прекращали путем помещения планшета на лед. Осаждение C3b оценивали с использованием кроличьего антитела против мышиных C3c, а затем с использованием ПХ-конъюгированного козьего антикроличьего антитела. Фоновый уровень OMS100 при 50 нМ на маннан-позитивных планшетах вычитали исходя из данных на кривых. Результаты этого анализа систематизированы ниже в таблице 16.
Анализ на уровень C3-конвертазы, проводимый с использованием 1% человеческой сыворотки (IC50, нМ)
Функциональную активность материнских IgG4-клонов также сравнивали с активностью IgG4, имеющими мутацию в шарнирной области (S228P), для каждого клона. Количественные величины IC50 для осаждения C3b, определенного в анализе с использованием 1% NHS, представлены ниже в таблице 17.
Данные по осаждению С3, определенные в анализе с использованием 1% человеческой сыворотки (IC50, нМ) для клонов дикого типа (IgG4) и для клонов IgG4, имеющих мутацию в шарнирной области (S228P)
Как показано выше в таблице 17, в некоторых случаях, агонистические фармакологические свойства IgG4, происходящих от антагонистических scFv, были неожиданными. Механистическая основа для таких наблюдений не ясна.
Активности конвертированных материнских клонов IgG4 с ингибирующей функцией в 1% NHS были дополнительно исследованы в более строгих условиях анализа, которые более точно имитируют физиологические условия. Для оценки активности антитела в физиологических условиях было проведено тестирование препаратов материнского клона IgG4 на их способность ингибировать зависимое от лектинового пути (ЛП) осаждение C3b на покрытых маннаном планшетах в строгих условиях проведения анализа с использованием минимального разведения (90%) человеческой плазмы.
Результаты анализа на осаждение C3b в 90% человеческой плазме представлены на фиг.6. Поскольку MASP-2 и его субстраты присутствуют в аналитической смеси, которая имеет концентрацию, приблизительно в 100 раз превышающую концентрацию в анализе с разведенной сывороткой, а именно 1% нормальной человеческой сывороткой, то обычно предполагается, что на кривой «доза антагониста - ответ» будет наблюдаться сдвиг вправо. На фиг.6, как и ожидалось, сдвиг вправо в сторону более низких явных активностей наблюдался для OMS100 и для всех тестируемых анти-MASP-2 антител. Однако неожиданно было обнаружено, что явного снижения активности не наблюдалось для клона 17D20 с мутацией в шарнирной области (S228P), и активность клона в этой форме была сравнима с активностью, измеренной в 1% плазме (см. таблицу 17). При этом было обнаружено, что в анализе с использованием 90% NHS, функциональная активность IgG4 17D20 (S228) была несколько ниже, чем активность Fab2 OMS100, что отличалось от результатов анализа в 1% NHS, где активность OMS100 в 50-100 раз превышала активность S228P-IgG4 17D20 (данные не приводятся). Клон 17N16 в форме IgG4 дикого типа также обнаруживал полное ингибирование в 90% NHS, но имел несколько меньшую активность в этом формате анализа (IC50~15 нМ), а клон 18L16 в форме IgG4 дикого типа имел еще меньшую активность и обладал лишь частичными ингибирующими свойствами, как показано на фиг.6.
Исходя из этих результатов анализа, активность конвертированных материнских клонов IgG4 была также протестирована путем оценки уровня осаждения C4b в строгих условиях анализа (90% NHS). Анализ, проводимый в таком формате, позволяет непосредственно определить активность антитела с помощью ферментативной реакции, катализируемой MASP-2.
Анализ для оценки ингибирования MASP-2-зависимого расщепления C4
Общие сведения: Активность сериновой протеазы MASP-2 является в высокой степени специфичной, а поэтому были идентифицированы только два белковых субстрата для MASP-2, C2 и C4. Расщепление C4 приводит к образованию C4a и C4b. Анти-MASP-2 Fab2 может связываться со структурными эпитопами на MASP-2, которые непосредственно участвуют в расщеплении C4 (например, MASP-2-связывающий сайт для C4; каталитический центр сериновой протеазы MASP-2), и тем самым ингибируют функциональную активность MASP-2 в расщеплении C4.
Дрожжевой маннан является известным активатором лектинового пути. В описанном ниже методе измерения активности MASP-2 в расщеплении C4, пластиковые лунки, покрытые маннаном, инкубировали в течение 90 минут при 4°C с 90% человеческой сывороткой для активации лектинового пути. Затем лунки промывали и анализировали на человеческий C4b, иммобилизованный на этих лунках, с применением стандартных ELISA-методов. Количество C4b, продуцируемого в этом анализе, является показателем активности MASP-2-зависимого расщепления C4. Анти-MASP-2 антитела в выбранных концентрациях тестировали в этом анализе на способность ингибировать расщепление C4.
Методы: 96-луночные планшеты со средой Costar для оценки связывания инкубировали в течение ночи при 5°C с маннаном, разведенным в 50 мМ карбонатного буфера, pH 9,5, при 1,0 мкг/50 мкл/лунку. Каждую лунку три раза промывали 200 мкл PBS. Затем лунки блокировали 100 мкл/лунку 1% альбумина бычьей сыворотки в PBS и инкубировали, слегка помешивая, в течение одного часа при комнатной температуре. Каждую лунку три раза промывали 200 мкл PBS. Образцы анти-MASP-2 антител разводили выбранными концентрациями в Ca++- и Mg++-содержащем буфере GVB (4,0 мМ барбитал, 141 мМ NaCl, 1,0 мМ MgCl2, 2,0 мМ CaCl2, 0,1% желатин, pH 7,4) при 5°C. К полученным образцам добавляли 90% человеческую сыворотку при 5°C, и 100 мкл переносили в каждую лунку. Планшеты сенсибилизировали и инкубировали в течение 90 минут на бане из ледяной воды для активации комплемента. Реакцию прекращали добавлением ЭДТА к реакционной смеси. Каждую лунку промывали 5×200 мкл PBS-твином 20 (0,05% твина 20 в PBS), а затем каждую лунку два раза промывали 200 мкл PBS. Затем добавляли 100 мкл/лунку 1:700-разведения конъюгированного с биотином куриного антитела против человеческих C4c (Immunsystem AB, Uppsala, Sweden) в PBS, содержащем 2,0 мг/мл альбумина бычьей сыворотки (BSA), и инкубировали в течение одного часа при комнатной температуре, слегка помешивая. Каждую лунку промывали 5×200 мкл PBS. Затем добавляли 100 мкл/лунку 0,1 мкг/мл конъюгированного с пероксидазой стрептавидина (Pierce Chemical #21126) в PBS, содержащем 2,0 мг/мл BSA и инкубировали в течение одного часа при комнатной температуре на шейкере, слегка помешивая. Каждую лунку промывали 5×200 мкл PBS. Затем добавляли 100 мкл/лунку пероксидазного субстрата TMB (Kirkegaard & Perry Laboratories) и инкубировали при комнатной температуре в течение 16 минут. Пероксидазную реакцию прекращали добавлением 100 мкл/лунку 1,0 M H3PO4 и измеряли OD450.
Результаты
В анализе этого формата обе IgG4-формы 17D20 ингибировали инициируемое лектиновым путем осаждение C4b, хотя величины IC50 приблизительно в 3 раза превышали величины, полученные в анализе на осаждение C3b. Интересно отметить, что IgG4 17N16 дикого типа обнаруживал хорошую активность в этом анализе, где величина IC50 и профиль «доза - ответ» были сравнимы с величиной и профилем, полученными в анализе на осаждение C3b. 18L16 оказался значительно менее активным и не давал полного ингибирования в анализе этого формата (данные не приводятся).
Обсуждение
Как описано в примерах 2-5, полностью человеческие scFv-фрагменты анти-MASP-2 антител, обладающие функциональной блокирующей активностью, были идентифицированы методом фагового представления. Три таких клона, 17N16, 17D20 и 18L16, были отобраны по созреванию аффинности, а затем протестированы. Для оценки функциональных свойств этих материнских клонов в форме полноразмерных IgG были продуцированы IgG4 дикого типа и мутантные формы IgG4 с мутацией S228P в шарнирной области этих антител. Как описано в этом примере, большинство полноразмерных IgG обнаруживали улучшенную функциональную активность по сравнению с активностью аналогов scFv, на что указывал стандартный функциональный анализ, проводимый с использованием 1% человеческой плазмы. Для оценки активности антитела в физиологических условиях проводили тестирование препаратов материнского клона IgG4 в строгих условиях с использованием 90% человеческой плазмы. В этих условиях несколько антител обнаруживали функциональные активности, которые значительно превышали активности, ожидаемые при проведении стандартных функциональных анализов в 1% плазме.
ПРИМЕР 6
В этом примере описаны перестановка цепей и созревание аффинности материнских клонов 17D20, 17N16 и 18L16, и анализ полученных дочерних клонов.
Методы
Для идентификации антител с повышенной активностью, три материнских scFv-клона, 17D20, 17N16 и 18L16, идентифицированных как описано в примерах 2-5, подвергали процедуре перестановки легких цепей. Эта процедура включала получение комбинаторной библиотеки, состоящей из VH каждого материнского клона в паре с библиотекой легких цепей лямбда (VL) здорового человека, где указанные библиотеки были получены от шести здоровых доноров. Затем эти библиотеки скринировали на scFv-клоны с улучшенной аффинностью связывания и/или с улучшенными функциональными свойствами.
9000 дочерних клонов, подвергнутых процедуре перестановки легких цепей, анализировали для каждого материнского клона, а всего было проанализировано 27000 клонов. Каждый дочерний клон индуцировали для экспрессии и секреции растворимого scFv, и скринировали на их способность связываться с человеческим MASP-2А. scFv, которые связывались с человеческим MASP-2A, детектировали по их с-Myc-метке. Путем этого предварительного скрининга было отобрано всего 119 клонов, которые включали 107 дочерних клонов от библиотеки 17N16, 8 дочерних клонов от библиотеки 17D20 и 4 дочерних клона от библиотеки 18L16.
119 клонов экспрессировали в лабораторном масштабе, очищали на колонках с NiNTA и тестировали на аффинность связывания в ELISA-анализе, проводимом с использованием физически адсорбированного человеческого MASP-2A.
Результаты
Результаты ELISA-анализа репрезентативной субсерии 119 дочерних клонов представлены на фиг.7A и B. На фиг.7A графически проиллюстрированы результаты ELISA-анализа материнских и дочерних клонов 17N16, оттитрованных на huMASP-2A. На фиг.7B графически проиллюстрированы результаты ELISA-анализа материнских и дочерних клонов 17D20, оттитрованных на huMASP-2A.
Как показано на фиг.7A, дочерние клоны 17N16m_d16E12 и 17N16m_d17N9, происходящие от материнского клона 17N16, имели аффинности, превышающие аффинности материнского клона. Кроме того, как показано на фиг.7B, один клон, происходящий от материнского клона 17D20, а именно 17D20m_d18M24, обладал более высокой аффинностью, чем материнский клон. Эти три клона, а также дополнительные три клона: 17N16m_d13L12, 17N16m_d16K5, 17N16m_d1G5 и 17D20m_d1824, которые имели низкий уровень экспрессии, экспрессировали в объеме 0,5 л, очищали на мономерных фракциях с помощью эксклюзионной хроматографии и снова тестировали в ELISA-анализе и в функциональном анализе. Библиотека 18L16 не продуцировала каких-либо дочерних клонов с нужной аффинностью связывания.
После очистки шесть дочерних клонов были протестированы в анализе комплемента на ингибирующую активность. Результаты представлены в таблице 18.
Анализ комплемента на ингибирующую активность материнских и дочерних клонов
Как показано выше в таблице 18, только один клон, а именно 17N16m_d17N9, имел аффинность и активность в таком же интервале значений, как и материнский клон.
На фиг.8 проиллюстрировано выравнивание аминокислотных последовательностей полноразмерного материнского scFv-клона 17N16 (SEQ ID NO:59) и дочернего клона 17N16m_d17N9 (SEQ ID NO:66), которое показало, что легкие цепи (начиная с SYE) имели 17 аминокислотных остатков, которые отличались у этих двух клонов.
Повторный скрининг библиотеки 17N16 лямбда выявил несколько дополнительных дочерних клонов-кандидатов, из которых клон 17N16m_d27E13 был идентифицирован в ELISA-анализе и в анализе комплемента, а поэтому он был включен в серию дочерних клонов-кандидатов для последующего анализа.
Анализ дочерних клонов в различных сыворотках
Дочерние клоны-кандидаты анализировали в различных сыворотках как описано ниже. Маннан разводили до 20 мкг/мл, а затем наносили на ELISA-планшет и оставляли на ночь при 4°C. На следующий день лунки блокировали 1% HSA. Сыворотку африканской зеленой мартышки разводили до 0,2%, крысиную сыворотку разводили до 0,375%, а человеческую сыворотку разводили до 1% в буфере CaMgGVB. Очищенный scFv от каждого из дочерних клонов-кандидатов добавляли в дубликатах в виде серий с различными концентрациями к тому же самому количеству буфера, и перед добавлением в блокированный ELISA-планшет, предварительно инкубировали в течение 45 минут на льду. Реакцию инициировали путем инкубирования при 37°C в течение одного часа, а затем прекращали путем помещения планшета на ледяную баню. Высвобождение C3c детектировали с использованием кроличьего антитела против мышиных C3c, а затем с использованием ПХ-конъюгированного козьего антикроличьего антитела. Фоновый уровень OMS100 при 0,1 мкг/мл на маннан-негативных планшетах вычитали исходя из данных на кривых. Результаты этого анализа систематизированы ниже в таблице 19.
Величины IC50 для материнского клона 17N16 и дочерних клонов 17N16m_d17N9 и 17N16m_d27E13 в различных сыворотках
Обсуждение результатов
Как показано в таблице 19, дочерний клон 17N16m_d17N9 обладал более высокой функциональной активностью, чем материнский клон. Этот дочерний клон, по сравнению с материнским клоном, помимо отличия в семнадцати аминокислотных остатков в аминокислотной последовательности, обладает улучшенной функцией в крысиной сыворотке, а поэтому он является позитивным кандидатом. Исходя из этих данных, дочерний клон 17N16m_d17N9 был отобран для последующего анализа.
ПРИМЕР 7
В этом примере описаны получение и анализ дочернего клона 17D20m_d3521N11, происходящего от материнского клона 17D20.
Общие сведения/обоснования
Для повышения аффинности материнского клона-кандидата 17D20mc проводили дополнительный «сканирующий мутагенез» на первые три аминокислоты в CDR3 тяжелой цепи (CDR-H3). Этот метод представляет собой технологию мутагенеза, проводимого одновременно с перестановкой в нормальной легкой цепи 17D20mc. Для этого конструировали три различных библиотеки scFv с помощью ПЦР, где положения 1, 2 и 3 аминокислот были рандомизированы для получения серии всех возможных 20 аминокислот с использованием вырожденных кодонов. После клонирования библиотек осуществляли микромасштабную экспрессию, а затем проводили мониторинг связывания scFv на чипе CM5, покрытом MASP-2A (данные не приводятся). BIAcore-анализ микромасштабной экспрессии осуществляли на трех различных библиотеках на чипах CM5, покрытых MASP-2A, методом рандомизации в положениях 1, 2 или 3, и идентифицировали представляющие потенциальный интерес дочерние клоны.
По наблюдениям было установлено, что для положений аминокислот 1 и 2 CDR-H3, не было обнаружено клона, который имел бы повышенную скорость диссоциации по сравнению с материнским клоном-кандидатом 17D20m. Однако некоторые кандидаты с мутациями в аминокислотном положении 3 в CDR-H3 продемонстрировали повышенную скорость диссоциации по сравнению с материнским клоном-кандидатом 17D20m. Эти клоны (#35, #59 и #90) секвенировали для идентификации мутации. Последовательности двух клонов, прошедших «сканирующий мутагенез», сравнивали с последовательностью 17D20mc (исходной последовательностью). Интересно отметить, что все секвенированные клоны, за исключением одного клона (#90), имели замену Ala-Arg в отличие от материнского кандидата.
На фиг.9 проиллюстрировано сравнение аминокислотной последовательности области тяжелой цепи материнского scFv-клона 17D20m (аминокислоты 61-119 SEQ ID NO:18) и аминокислотной последовательности области CDR-H3 scFv-клонов с мутациями в CDR-H3, а именно клона #35 (аминокислоты 61-119 SEQ ID NO:20 с заменой А на R в положении 102 SEQ ID NO:18), клона #59 (с последовательностью, аналогичной последовательности клона #35) и клона #90 (с заменой А на Р в положении 102 SEQ ID NO:18).
Анализ мутантных клонов #35 и #59
Мутантные клоны #35 и #59 были экспрессированы в лабораторном масштабе, а затем протестированы по сравнению с материнским клоном-кандидатом 17D20 в ELISA-анализе с титрованием на иммобилизованном MASP-2A (10 мкг/мл). scFv 5-кратно серийно разводили, начиная с 20 мкг/мл, и связывание детектировали с использованием анти-Myc антитела (мышиного)/ПХ-конъюгированного антимышиного антитела. В этом ELISA-анализе клонов-кандидатов #35 и #59 наблюдался слегка повышенный уровень связывания по сравнению с уровнем связывания материнского клона-кандидата 17D20 (данные не приводятся).
Клон #35 с улучшенными свойствами объединяли с наилучшим клоном, который был подвергнут перестановке легких цепей, 17D20m_d21N11. Мутацию в VH кандидата 17D20md35 (Ala-Arg) объединяли с легкой цепью кандидата 17D20m_d21N11, в результате чего получали клон, обозначаемый VH35-VL21N11, а иногда 3521N11.
На фиг.10А проиллюстрировано выравнивание аминокислотной последовательности области CDR3 материнского клона 17D20 (аминокислоты 61-119 SEQ ID NO:18), той же самой области дочернего клона 17D20m_d21N11, имеющего ту же самую последовательность, и той же самой области клона #35, подвергнутой мутагенезу и объединенной с VL клона 17D20m_d21N11, обозначенного «3521Ν11» (аминокислоты 61-119 SEQ ID NO:20). Выделенные последовательности областей VH содержат CDRH3, а область-мишень с мутированным остатком подчеркнута.
На фиг.10В проиллюстрировано выравнивание белковой последовательности полноразмерного scFv, включая области VL и VH материнского клона 17D20 (SEQ ID NO:55) и дочернего клона 17D20m_d21N11 (SEQ ID NO:67). Дочерний scFv-клон 17D20m_d3521N11 представлен как SEQ ID NO:68. Примечание: было определено, что остаток X на фиг.10B в положении 220 представляет собой «E», как показано в SEQ ID NO:68.
ELISA-анализ с титрованием серии scFv-фрагментов, показанных на фиг.10, проводили на MASP-2 (10 мкг/мл). Результаты представлены в таблице 20.
ELISA-анализ на человеческом MASP-2
Дочерний клон 17D20m_d3521N11 был дополнительно проанализирован на функциональную активность, как описано ниже в примере 8.
ПРИМЕР 8
В этом примере описаны превращение и анализ дочерних клонов-кандидатов 17N16m_d17N9 и 17D20m_d3521N11 в форме IgG4, IgG4/S228P и IgG2.
Общие сведения/обоснования
Методы скрининга антител, описанные в примерах 2-7, позволили идентифицировать два материнских клона, 17N16 и 17D20, обладающих подходящими функциональными свойствами. После созревания аффинности этих материнских клонов были получены дочерние клоны, активность которых в 2 раза превышала активность материнских клонов, проанализированных в суррогатных функциональных анализах на уровне scFv. Дочерними клонами с наибольшей активностью являются 17N16m_d17N9 и 17D20m_d3521N11. Как описано в примере 6, при сравнении функциональной активности материнского клона 17N16 с дочерними клонами с перестановкой легких цепей (анализ в scFv-формате с использованием 1% NHS) было определено, что клон 17N16m_d17N9 является несколько более активным, чем материнский клон, и обладает наибольшей функциональной активностью из всех дочерних клонов, протестированных в этом анализе.
Методы
Сравнение функциональных активностей scFv-клонов-кандидатов осуществляли в анализе на превращение C3 (с использованием 1% человеческой сыворотки и 90% человеческой сыворотки) и в анализе на превращение C4 (с использованием 90% человеческой сыворотки), как описано в примере 5.
Результаты представлены ниже в таблице 21.
Сравнение функциональной активности основных дочерних клонов и их соответствующих материнских клонов при IC50 (нМ) (все анализы проводили в формате scFv)
Как показано выше в таблице TABLE 21, клон 17N16m_d17N9, при его анализе на С3 с использованием 90% нормальной человеческой сыворотки (NHS), обнаруживал хорошую активность и был более активным, чем другие дочерние клоны в данном формате.
Превращение клонов-кандидатов в формат IgG4, IgG4/S228P и IgG2
Все указанные клоны-кандидаты были преобразованы в формат IgG4, IgG4/S228P и IgG2 для последующего анализа.
SEQ ID NO:62: кДНК, кодирующая IgG4 дикого типа
SEQ ID NO:63: полипептид IgG4 дикого типа
SEQ ID NO:64: кДНК, кодирующая мутантный полипептид IgG4 с мутацией S228P
SEQ ID NO:65: мутантный полипептид IgG4 с мутацией S228P
SEQ ID NO:69: кДНК, кодирующая IgG2 дикого типа
SEQ ID NO:70: полипептид IgG2 дикого типа
Систематизированное описание клонов-кандидатов
Моноклональные антитела #1-6 тестировали на способность перекрестно реагировать с не-человеческим белком MASP-2 (белком африканской зеленой мартышки (AG)) в анализе на C3 для того, чтобы определить, можно ли эти антитела использовать для анализа на токсичность у животного-модели, в целях предсказания токсичности у человека. Моноклональные антитела #1-6 были также протестированы в анализе на осаждение C3b и в анализе на C4 в 90% человеческой сыворотке. Результаты представлены ниже в таблице 23.
Человеческие анти-MASP-2 MoAb (IC50, нМ) в 90% человеческой сыворотке
На фиг.11A графически проиллюстрированы результаты анализа на осаждение C3b, осуществляемого с использованием вариантов изотипа дочернего клона (MoAb#1-3), происходящего от материнского клона 17N16 человеческого моноклонального анти-MASP-2 антитела.
На фиг.11В графически проиллюстрированы результаты анализа на осаждение C3b, осуществляемого с использованием вариантов изотипа дочернего клона (MoAb#4-6), происходящего от материнского клона 17D20 человеческого моноклонального анти-MASP-2 антитела.
Как показано в таблице 23 и на фиг.11A и 11B, человеческие моноклональные анти-MASP-2 антитела (MoAb#1-6) связываются с MASP-2 с высокой аффинностью и ингибируют функциональную активность C3 и C4 в 90% человеческой сыворотке. Было также отмечено, что человеческие анти-MASP-2 MoAb перекрестно реагируют с не-человеческим белком MASP-2 (белком африканской зеленой мартышки), что указывает на то, что такое животное-модель может быть использовано в исследованиях на токсичность в целях предсказания токсичности у человека.
MoAb#1-6 также анализировали в 95% человеческой сыворотке и в 95% сыворотке африканской зеленой мартышки. Результаты систематизированы ниже в таблице 24.
На фиг.12A и 12B графически проиллюстрировано тестирование материнских клонов и MoAb#1-6 в анализе на осаждение C3b в 95% нормальной человеческой сыворотке.
На фиг.13 графически проиллюстрировано ингибирование осаждения C4b в 95% нормальной человеческой сыворотке.
На фиг.14 графически проиллюстрировано ингибирование осаждения C3b в 95% сыворотке африканской зеленой мартышки.
MoAb#1-6 были дополнительно протестированы на способность селективно ингибировать лектиновый путь путем проведения анализа на ингибирование крысиного C3b, ингибирование предварительно собранных комплексов MBL-MASP-2; ингибирование классического пути и селективность по отношению к C1s. Результаты систематизированы в таблице 25.
Систематизированные результаты функционального анализа
(IC50, нМ)
На фиг.15 графически проиллюстрировано ингибирование активности расщепления C4 предварительно собранным комплексом MBL-MASP-2 под действием MoAb#2, 3, 5 и 6.
На фиг.16 графически проиллюстрировано преимущественное связывание MoAb#6 с человеческим MASP-2 по сравнению с C1s.
Систематизированные данные о последовательностях дочерних клонов в различных форматах
ПРИМЕР 9
В этом примере описано картирование эпитопов, которое было осуществлено для нескольких блокирующих человеческих анти-MASP-2 MoAb.
Методы
Нижеследующие рекомбинантные белки получали как описано в примере 1:
Человеческий MAp19
Человеческий MASP2A
Человеческий MASP-2 SP
Человеческий MASP-2 CCP2-SP
Человеческий MASP-2 CCP1-CCP2-SP
Человеческий MASP-1/3 CUB1-EGF-CUB2
Человеческий MASP-1 CCP1-CCP2-SP
Анти-MASP-2 антитела OMS100 и MoAb#6 (35VH-21N11VL), которые, как было продемонстрировано, связываются с человеческим MASP-2 с высокой аффинностью и обладают способностью блокировать функциональную активность комплемента (см. примеры 6-8), анализировали на связывание с эпитопом с помощью дот-блот-анализа.
Дот-блот-анализ
Серийные разведения рекомбинантных полипептидов MASP-2, описанных выше, наносили пятнами на нитроцеллюлозную мембрану. Количество нанесенного пятнами белка составляло в пределах от 50 нг до 5 пг за десять стадий. В последующих экспериментах количество нанесенного пятнами белка составляло в пределах от 50 нг до 16 пг за пять стадий. Мембраны блокировали 5% сепарированным сухим молоком в TBS (блокирующем буфере), а затем инкубировали с 1,0 мкг/мл анти-MASP-2 Fab2 в блокирующем буфере (содержащем 5,0 мМ Ca2+). Связанные Fab2 детектировали с использованием ПХ-конъюгированного антитела против человеческого Fab (AbD/Serotec; разведенного 1/10000) и набора для ЭХЛ-детектирования (Amersham). Одну мембрану инкубировали с поликлональным кроличьим Ab против человеческого MASP-2 (описанного Stover et al., J. Immunol 163:6848-59 (1999)), используемым в качестве позитивного контроля. В данном случае связанное Ab детектировали с использованием ПХ-конъюгированного козьего антитела против кроличьих IgG (Dako; разведенного 1/2000).
Результаты
Результаты систематизированы в таблице 27.
Картирование эпитопов
Эти результаты показали, что антитела MoAb#6 и OMS100 являются в высокой степени специфичными по отношению к MASP-2 и не связываются с MASP-1 или MASP-3. Ни одно из этих антител не связывалось с Map 19 и фрагментами MASP-2, не содержащими домен CCP1 MASP-2, что позволяет сделать вывод, что сайты связывания включают домен CCP1.
ПРИМЕР 10
В этом примере было продемонстрировано, что человеческое анти-MASP-2 MoAb#6 ингибирует лектиновый путь у африканских зеленых мартышек после внутривенного введения.
Методы
MoAb#6 вводили внутривенно первой группе, состоящей из трех африканских зеленых мартышек, в дозе 1 мг/кг, и второй группе, состоящей из трех африканских зеленых мартышек, в дозе 3 мг/кг. Пробы крови брали через 2, 4, 8, 10, 24, 48, 72 и 98 часов после введения и тестировали на активность лектинового пути.
Как показано на фиг.17, лектиновый путь полностью ингибировался после внутривенного введения античеловеческого MoAb#6.
ПРИМЕР 11
В этом примере было продемонстрировано, что ингибитор MASP-2, такой как анти-MASP-2 антитело, является эффективным для лечения состояний после радиоактивного облучения и/или лечения, ослабления или предупреждения синдрома острой лучевой болезни.
Обоснования
Облучение высокими дозами ионизирующего излучения приводит к летальному исходу по двум основным механизмам: токсического действия на костный мозг и развития желудочно-кишечного синдрома. Токсическое действие на костный мозг приводит к снижению количества всех клеток крови, что вызывает предрасположенность организма к летальному исходу под действием инфекции и кровоизлияния. Желудочно-кишечный синдром является особенно тяжелым и вызывается потерей функции кишечного барьера, что обусловлено дезинтеграцией эпителиального слоя кишечника и потерей эндокринных функций кишечника. Это приводит к сепсису и ассоциированному с ним синдрому системного воспалительного ответа, который может приводить к смерти.
Лектиновый путь комплемента представляет собой природный иммунный механизм, который инициирует воспаление в ответ на поражение ткани и воздействие чужеродных поверхностей (то есть бактерий). Блокада этого пути приводит к улучшению результатов лечения у мышей с моделью ишемического повреждения ткани кишечника или септического шока. Было высказано предположение, что лектиновый путь может запускать сильный и опасный воспалительный процесс в ответ на поражение ткани, индуцированное радиоактивным излучением. Таким образом, блокада лектинового пути может ослаблять вторичное повреждение и повышать выживаемость при острой лучевой болезни.
Целью исследования, проводимого как описано в этом примере, является оценка влияния блокады лектинового пути на выживаемость мышей с моделью лучевого поражения путем введения этим мышам антител против мышиных MASP-2.
Исследование #1
Методы и материалы
Материалы. В этом исследовании были использованы следующие материалы для тестов: (i) высокоаффинное антитело против мышиных MASP-2 (mAbM11) и (ii) высокоаффинное антитело против человеческих MASP-2 (mAbOMS646), которые блокируют компонент белка MASP-2 лектинового пути комплемента, продуцируемого в трансфецированных клетках млекопитающих. Дозовые концентрации составляли: 1 мг/кг антитела против мышиных MASP-2 (mAbM11), 5 мг/кг антитела против человеческих MASP-2 (mAbOMS646) или соответствующего стерильного раствора. Для каждой схемы введения доз приготавливали адекватный объем свежего раствора в нужной дозе.
Животные. Молодых взрослых самцов мышей Swiss-Webster получали из лаборатории Harlan Laboratories (Houston, TX). Животных помещали в клетки с твердым дном с подстилкой Alpha-Dri, и этим животным давали сертифицированный корм для грызунов PMI 5002 (Animal Specialties, Inc., Hubbard OR) и воду ad libitum. В клетках для содержания животных поддерживали соответствующую температуру и соответствующее освещение с циклом: «12 часов - свет/12 часов - темнота».
Облучение. После 2-недельной акклиматизации в специальном помещении, группу мышей из 10 животных облучали по всей поверхности тела дозами 6,5, 7,0 и 8,0 Грей со скоростью подачи импульсов 0,78 Грей/минуту с использованием системы Therapax X-RAD 320, снабженной в высокой степени стабильным генератором рентгеновского излучения, работающим при 320 кВ, металлокерамической рентгеновской трубкой, коллиматором с варьирующейся подачей рентгеновского излучения и фильтром (Precision X-ray Incorporated, East Haven, CT).
Приготовление и введение лекарственных средств. Соответствующий объем концентрированных маточных растворов разводили охлажденным на льду физиологическим раствором с получением растворов с дозами 0,2 мг/мл антитела против мышиных MASP-2 (mAbM11) или 0,5 мг/мл антитела против человеческих MASP-2 (mAbOMS646) в соответствии с протоколом. Введение анти-MASP-2 антитела mAbM11 и mAbOMS646 осуществляли посредством i.p. инъекции иглой 25-го калибра исходя из массы животного, в целях доставки 1 мг/кг mAbM11, 5 мг/кг mAbOMS646 или физиологического раствора, используемого в качестве носителя.
Протокол исследования. Мышей произвольно распределяли на группы как указано в таблице 28. Массу тела и температуру измеряли и регистрировали ежедневно. Мышей в группах 7, 11 и 13 умерщвляли на 7-й день после облучения, а кровь брали путем сердечной пункции под глубокой анестезией. Животных, выживших на 30-й день после облучения, умерщвляли тем же способом и брали кровь. Плазму получали из взятых проб крови в соответствии с протоколом, и возвращали спонсорам для анализа.
Экспериментальные группы
(Грей)
Статистический анализ. Были построены кривые выживаемости Каплана-Мейера, и эти кривые использовали для сравнения среднего времени выживаемости для лечебных групп с применением логрангового критерия и критерия Уилкоксона. Были получены средние величины со стандартными отклонениями среднего или со стандартной величиной ошибки. Для статистических сравнений облученных животных контрольной группы и отдельных лечебных групп применяли непарный двусторонний т-критерий.
Результаты исследования #1
Кривые выживаемости Каплана-Мейера для групп, облученных дозами 6,5, 7,0 и 8,0 Грей, представлены на фиг.18A, 18B и 18C, соответственно, а систематизированные данные представлены ниже в таблице 29. В целом, введение ab против мышиных MASP-2 (mAbM11) перед облучением приводило к повышению выживаемости облученных мышей по сравнению с выживаемостью облученных контрольных животных, обработанных носителем при дозах облучения 6,5 (20%-ное повышение) и 7,0 Грей (30%-ное повышение). При дозе облучения 6,5 Грей, введение ab против мышиных MASP-2 после облучения приводило к умеренному повышению выживаемости (на 15%) по сравнению с выживаемостью контрольных облученных животных, обработанных носителем.
В противоположность этому, у всех обработанных животных при дозе облучения 7,0 Грей и 8,0 Грей наблюдалось повышение выживаемости по сравнению с выживаемостью облученных контрольных животных, обработанных носителем. Наибольшее изменение выживаемости наблюдалось у животных, которым вводили mAbOMS646, где 45%-ное повышение выживаемости наблюдалось при дозе облучения 7,0 Грей, по сравнению с контрольными животными, а 12%-ное повышение выживаемости наблюдалось при дозе облучения 8,0 Грей. Кроме того, при дозе облучения 7,0 Грей, смертность в группах, которым вводили mAbOMS646, впервые наблюдалась на 15-й день после облучения и на 8-й день после облучения у облученных контрольных животных, которым вводили носитель, где указанная выживаемость на 7 дней превышала выживаемость контрольных животных. Среднее время до гибели мышей, которым вводили mAbOMS646 (27,3±1,3 дня), значительно возрастало (p=0,0087) по сравнению с контрольными животными (20,7±2,0 дней) при дозе облучения 7,0 Грей.
Процент изменения массы тела по сравнению с массой тела за день до облучения (день -1) регистрировали во время всего исследования. Временное снижение массы наблюдалось у всех облученных животных, при этом какого-либо различия в изменениях у групп, которым вводили mAbM11 или mAbOMS646, по сравнению с контролем, не наблюдалось (данные не приводятся). По окончании исследования, у всех выживших животных наблюдалось увеличение массы тела по сравнению с массой тела до проведения исследования (день -1).
Выживаемость исследуемых животных, подвергнутых облучению
(%)
Обсуждение
Синдром острой лучевой болезни состоит из трех определенных субсиндромов: гематопоэтического, желудочно-кишечного и цереброваскулярного. Наблюдаемый синдром зависит от дозы облучения, при этом гематопоэтические эффекты наблюдаются у человека при значительном частичном или полном облучении всей поверхности тела в дозе, превышающей 1 Грей. Гематопоэтический синдром характеризуется сильным подавлением функции костного мозга, приводящим к панцитопении с изменениями формулы крови, количества эритроцитов, лейкоцитов, и тромбоцитов, сопровождающимся поражением иммунной системы. В данном случае, как минимум наблюдаются низкие количества нейтрофилов и тромбоцитов в периферической крови, нейтропения, высокая температура, и, как осложнение, сепсис и неконтролируемое кровотечение, приводящее к летальному исходу.
В настоящем исследовании было обнаружено, что введение mAbH6 приводило к повышению выживаемости самцов мышей Swiss-Webster, облученных по всей поверхности тела рентгеновским излучением в дозе 7,0 Грей. Следует отметить, что при дозе облучения 7,0 Грей, у 80% животных, которым вводили mAbOMS646, продолжительность жизни составляла до 30 дней, тогда как такая продолжительность жизни наблюдалась лишь у 35% контрольных облученных животных, которым вводили носитель. Важно отметить, что первый день гибели животных в этой лечебной группе наступал только на 15-й день после облучения, то есть на 7 дней позже, чем это наблюдалось у контрольных облученных животных, которым вводили носитель. Любопытно, что при более низкой дозе рентгеновского облучения (6,5 Грей), введение mAbOMS646 не оказывало какого-либо влияния на выживаемость или не давало какой-либо отсрочки летального исхода по сравнению с контрольными облученными животными, которым вводили носитель. Такое различие в ответах на различные дозы облучения может иметь много причин, хотя для подтверждения любой гипотезы может потребоваться проведение дополнительных исследований, включая промежуточный сбор проб для анализа микробиологических культур и для оценки гематологических параметров. Одним из простых объяснений может быть то, что число животных, принадлежащих к указанным группам, не позволяет обнаружить какие-либо незначительные различия, связанные с лечением. Так, например, у группы размером n=20, различия в выживаемости в пределах от 65% (mAbOMS646, при дозе облучения 6,5 Грей) до 80% (mAbH6, при дозе облучения 7,0 Грей) наблюдались у 3 животных. С другой стороны, различия от 35% (с контролем-носителем при дозе облучения 7,0 Грей) до 80% (mAbOMS646, при дозе облучения 7,0 Грей) наблюдались у 9 животных, что явно свидетельствовало о различии результатов, связанных с лечением.
Полученные результаты показали, что анти-MASP-2 антитела являются эффективными для лечения млекопитающего с риском развития побочных эффектов синдрома острой лучевой болезни или млекопитающего, у которого уже наблюдаются такие эффекты.
Исследование #2
Мышей Swiss Webster (n=50) облучали ионизирующим излучением (8,0 Грей). Затем терапию анти-MASP-2 антителом (OMS646, 5 мг/кг), вводимым за 18 часов до и через 2 часа после облучения, а затем еженедельно, оценивали с точки зрения ее влияния на показатели смертности.
Результаты исследования #2
Было установлено, что введение анти-MASP-2 антитела OMS646 повышало выживаемость у мышей, облученных дозой 8,0 Грей, при этом, скорректированная средняя выживаемость у этих мышей увеличивалась на 4-6 дней по сравнению с мышами, которым вводили контроль-носитель, а смертность снижалась на 12% по сравнению с контрольными мышами (логранговый критерий, p=0,040).
Исследование #3
Мышей Swiss Webster (n=50) облучали ионизирующим излучением (8,0 Грей), где указанные мыши были распределены по следующим группам: (I: контроль) носитель - физиологический раствор; (II: низкая концентрация) анти-MASP-2 антитело OMS646 (5 мг/кг), вводимое за 18 часов до и через 2 часа после облучения, (III: высокая концентрация) антитело OMS646 (10 мг/кг), вводимое за 18 часов до и через 2 часа после облучения; и (IV: высокая концентрация, вводимая после облучения) антитело OMS646 (10 мг/кг), вводимое только через 2 часа после облучения.
Результаты исследования #3
Было установлено, что введение анти-MASP-2 антитела до и после облучения, в среднем, повышало выживаемость на 4-5 дней по сравнению с животными, которым вводили контроль-носитель. Смертность мышей, которым вводили анти-MASP-2 антитело, снижалась на 6-12% по сравнению с контрольными мышами, которым вводили носитель. Было также отмечено, что каких-либо серьезных побочных эффектов от такого лечения не наблюдалось.
В целом, результаты, описанные в этом примере, показали, что анти-MASP-2 антитела согласно изобретению являются эффективными для лечения млекопитающего с риском развития побочных эффектов синдрома острой лучевой болезни или млекопитающего, у которого уже наблюдаются такие эффекты.
ПРИМЕР 12
В этом примере также описана характеризация антитела OMS646 (17D20m_d3521N11), полностью человеческого антитела IgG4 против человеческих MASP-2 с мутацией в шарнирной области.
Методы
Антитело OMS646 (17D20m_d3521N11), полностью человеческое антитело IgG4 против человеческих MASP-2 с мутацией в шарнирной области, получали как описано выше в примерах 2-8. Антитело OMS646 выделяли из супернатантов культуры экспрессионных клеточных линий CHO, стабильно трансфецированных экспрессионными конструкциями, кодирующими тяжелые и легкие цепи OMS646. Клетки культивировали в среде PF-CHO в течение 16-20 дней, и бесклеточный супернатант собирали, когда жизнеспособность клеток снижалась до уровня ниже 50%. Антитело OMS646 очищали с помощью аффинной хроматографии на белке А, а затем подвергали ионному обмену, концентрировали и буфер заменяли на PBS.
1. Антитело OMS646 связывается с человеческим MASP-2 с высокой аффинностью
Анализ иммобилизованного антитела OMS646, связывающегося с рекомбинантным человеческим MASP-2, проводимый методом поверхностного плазмонного резонанса (Biocore)
Методы
Антитело OMS646 иммобилизовали при различных плотностях посредством присоединения амина к чипу CM5, и ассоциацию и диссоциацию рекомбинантного человеческого MASP-2, растворенного в концентрациях 9 нМ, 3 нМ, 1 нМ или 0,3 нМ, регистрировали в течение всего эксперимента для определения констант скорости ассоциации (Kon) и диссоциации (Koff). Константу равновесного связывания (KD) вычисляли исходя из экспериментальных величин Kon и Koff.
Результаты
На фиг.19 графически проиллюстрированы результаты анализа антитела OMS646 методом поверхностного плазмонного резонанса (Biocore), где указанные результаты показали, что иммобилизованное OMS646 связывается с рекомбинантным MASP-2 с константой диссоциации Koff приблизительно 1-3×10-4 с-1 и с константой ассоциации Kon приблизительно 1,6-3×106 М-1·с-1, и с соответствующей аффинностью (KD приблизительно 92 пМ) в этих экспериментальных условиях. В зависимости от плотности иммобилизованного антитела OMS646 и от концентрации MASP-2 в растворе, экспериментальные величины KD варьировались в пределах 50-250 пМ.
ELISA-анализ антитела OMS646, связывающегося с иммобилизованным рекомбинантным человеческим MASP-2
Методы
ELISA-анализ проводили для оценки зависимости «доза-ответ» для антитела OMS646, связывающегося с иммобилизованным рекомбинантным MASP-2. Рекомбинантный человеческий MASP-2 (50 нг/лунку) иммобилизовали на ELISA-планшетах Maxisorp (Nunc) в PBS в течение ночи при 4°C. На следующий день планшеты блокировали путем трехкратной промывки PBS-твином (0,05%). Затем в MASP-2-покрытые лунки добавляли серии серийных разведений OMS646 в блокирующем буфере (в концентрациях в пределах от 0,001 до 10 нМ). После 1-часового инкубирования для связывания OMS646 с иммобилизованным антигеном, лунки промывали для удаления несвязанного OMS646. Связанное антитело OMS646 детектировали с использованием ПХ-меченного козьего антитела против человеческих IgG (Qualex; разведенного 1:5000 в блокирующем буфере), а затем проявляли с использованием пероксидазного субстрата TMB (Kirkegaard & Perry Laboratories). Пероксидазную реакцию прекращали путем добавления 100 мкл/лунку 1,0 M H3PO4, и превращение субстрата оценивали фотометрически на 450 нм с использованием 96-луночного планшет-ридера (Spectramax). Для вычисления величин KD использовали алгоритм построения кривой для одного сайта связывания (Graphpad).
Результаты
На фиг.20 графически проиллюстрированы результаты ELISA-анализа для определения аффинности связывания OMS646 с иммобилизованным человеческим MASP-2. Как показано на фиг.20, было установлено, что OMS646 связывается с иммобилизованным рекомбинантным человеческим MASP-2 с константой KD=85±5 пМ, которая соответствует результатам, полученным в анализе Biocore, как показано на фиг.19. Эти результаты продемонстрировали, что антитело OMS646 имеет высокую аффинность связывания с человеческим MASP-2 с KD приблизительно 100 пМ.
2. Антитело OMS646 ингибирует активацию C4 на поверхности, покрытой маннаном, но не на поверхности, покрытой иммунным комплексом
Методы
Активацию C4 оценивали на поверхности, покрытой маннаном, или на поверхности, покрытой иммунным комплексом, в присутствии или в отсутствие OMS646 в пределах концентраций, указанных на фиг.21A и 21B, соответственно.
В описанном ниже методе оценки активности расщепления C4 под действием MASP-2, пластиковые лунки, покрытые маннаном, инкубировали в течение 60 минут при 37°C с 1% человеческой сывороткой для активации лектинового пути. Затем лунки промывали и анализировали на человеческий C4b, иммобилизованный на лунках, стандартными ELISA-методами. Количество C4b, продуцируемого в этом анализе, является показателем MASP-2-зависимой активности расщепления C4. Анти-MASP-2 антитела в выбранных концентрациях тестировали в этом анализе на их способность ингибировать расщепление C4.
Методы
Активация C4 на поверхностях, покрытых маннаном
Для определения влияния OMS646 на лектиновый путь, 96-луночные планшеты со средой Costar для оценки связывания покрывали маннаном путем инкубирования в течение ночи при 5°C вместе с 50 мкл 40 мкг/мл раствора маннана, разведенного в 50 мМ карбонатного буфера, pH 9,5. Каждую лунку три раза промывали 200 мкл PBS. Затем лунки блокировали 100 мкл/лунку 1% альбумина бычьей сыворотки в PBS и инкубировали, слегка помешивая, в течение одного часа при комнатной температуре. Каждую лунку три раза промывали 200 мкл PBS. В отдельном 96-луночном планшете, серийные разведения анти-MASP-2 антитела (OMS646) предварительно инкубировали с 1% человеческой сывороткой в Ca++- и Mg++-содержащем буфере GVB (4,0 мМ барбитал, 141 мМ NaCl, 1,0 мМ MgCl2, 2,0 мМ CaCl2, 0,1% желатин, pH 7,4) в течение 1 часа при 5°C. Затем эти смеси «антитело - сыворотка», полученные путем предварительного инкубирования, переносили в соответствующие лунки аналитического планшета, покрытого маннаном. Активацию комплемента инициировали путем переноса аналитического планшета на водяную баню при 37°С. После 60-минутного инкубирования, реакцию прекращали добавлением ЭДТА к реакционной смеси. Каждую лунку промывали 5×200 мкл PBS-твином 20 (0,05% твина 20 в PBS), а затем каждую лунку два раза промывали 200 мкл PBS. Затем добавляли 100 мкл/лунку 1:100-разведения конъюгированного с биотином куриного антитела против человеческих C4c (Immunsystem AB, Uppsala, Sweden) в PBS, содержащем 2,0 мг/мл альбумина бычьей сыворотки (BSA), и инкубировали в течение одного часа при комнатной температуре, слегка помешивая. Каждую лунку промывали 5×200 мкл PBS. Затем добавляли 100 мкл/лунку 0,1 мкг/мл конъюгированного с пероксидазой стрептавидина (Pierce Chemical #21126) в PBS, содержащем 2,0 мг/мл BSA, и инкубировали в течение одного часа при комнатной температуре на шейкере, слегка помешивая. Каждую лунку промывали 5×200 мкл PBS. Затем добавляли 100 мкл/лунку пероксидазного субстрата TMB (Kirkegaard & Perry Laboratories) и инкубировали при комнатной температуре в течение 10 минут. Пероксидазную реакцию прекращали добавлением 100 мкл/лунку 1,0 M H3PO4 и измеряли OD450.
Активация C4 на поверхностях, покрытых иммунным комплексом
Для оценки влияния OMS646 на классический путь, анализ, описанный выше, модифицировали так, чтобы его можно было проводить на планшетах, покрытых иммунным комплексом. Данный анализ осуществляли так, как это подробно описано выше для лектинового пути, за исключением того, что лунки покрывали очищенным овечьим IgG, используемым для стимуляции активации C4 по классическому пути.
Результаты
На фиг.21A графически проиллюстрирован уровень активации C4 на покрытой маннаном поверхности в присутствии или в отсутствие OMS646. На фиг.21B графически проиллюстрирован уровень активации C4 на IgG-покрытой поверхности в присутствии или в отсутствие OMS646. Как показано на фиг.21A, OMS646 ингибирует активацию C4 на покрытой маннаном поверхности с IC50 приблизительно 0,5 нМ в 1% человеческой сыворотке. Величина IC50, полученная в 10 независимых экспериментах, составляла 0,52±0,28 нМ (среднее±ср.кв.откл.). В противоположность этому, как показано на фиг.21B, OMS646 не ингибирует активацию C4 на IgG-покрытой поверхности. Полученные результаты продемонстрировали, что антитело OMS646 блокирует лектин-зависимую активацию компонента комплемента С4, но не блокирует указанную активацию, зависящую от классического пути.
3. Антитело OMS646 специфически блокирует лектин-зависимую активацию концевых компонентов комплемента
Методы
Влияние OMS646 на осаждение мембрано-атакующего комплекса (MAC) анализировали в условиях, специфичных к лектиновому пути, к классическому пути и к альтернативному пути. Для этой цели использовали набор для скрининга комплемента Wieslab Comp300 (Wieslab, Lund, Sweden) в соответствии с инструкциями производителей.
Результаты
На фиг.22A графически проиллюстрирован уровень осаждения MAC в присутствии или в отсутствие анти-MASP-2 антитела (OMS646) в условиях проведения анализа, специфичного к лектиновому пути. На фиг.22В графически проиллюстрирован уровень осаждения MAC в присутствии или в отсутствие анти-MASP-2 антитела (OMS646) в условиях проведения анализа, специфичного к классическому пути. На фиг.22С графически проиллюстрирован уровень осаждения MAC в присутствии или в отсутствие анти-MASP-2 антитела (OMS646) в условиях проведения анализа, специфичного к альтернативному пути.
Как показано на фиг.22A, антитело OMS646 блокирует осаждение МАС, индуцируемое активацией, опосредуемой лектиновым путем с величиной IC50 приблизительно 1 нМ. Однако OMS646 не влияет на осаждение MAC, индуцируемое активацией, опосредуемой классическим путем (фиг.22B) или альтернативным путем (фиг.22С).
4. OMS646 эффективно ингибирует активацию лектинового пути в физиологических условиях
Методы
Лектин-зависимую активацию C3 и C4 анализировали в 90% человеческой сыворотке в отсутствие и в присутствии различных концентраций OMS646 как описано ниже:
Анализ на активацию C4
Для определения влияния OMS646 на лектин-зависимую активацию С4, 96-луночные планшеты со средой Costar для оценки связывания покрывали 2 мкг маннана (50 мкл 40 мкг/мл раствора в 50 мМ карбонатного буфера, pH 9,5) в течение ночи при 5°C. Затем планшеты три раза промывали 200 мкл PBS и блокировали 100 мкл/лунку 1% альбумина бычьей сыворотки в PBS в течение одного часа при комнатной температуре, слегка помешивая. В отдельном планшете для предварительного инкубирования, выбранные концентрации антитела OMS646 смешивали с 90% человеческой сывороткой и инкубировали в течение 1 часа на льду. Затем эти смеси «антитело - сыворотка», полученные путем предварительного инкубирования, переносили в покрытые маннаном лунки аналитических планшетов, находящихся на льду. После этого аналитические планшеты инкубировали в течение 90 минут на бане с ледяной водой для инициации активации комплемента. Реакцию прекращали добавлением ЭДТА к реакционной смеси. Каждую лунку 5 раз промывали 200 мкл PBS-твина 20 (0,05% твина 20 в PBS), а затем каждую лунку два раза промывали 200 мкл PBS. Затем добавляли 100 мкл/лунку 1:1000-разведения конъюгированного с биотином куриного антитела против человеческих C4c (Immunsystem AB, Uppsala, Sweden) в PBS, содержащем 2,0 мг/мл альбумина бычьей сыворотки (BSA), и инкубировали в течение 1 часа при комнатной температуре, слегка помешивая. Каждую лунку 5 раз промывали 200 мкл PBS. Затем добавляли 100 мкл/лунку 0,1 мкг/мл конъюгированного с пероксидазой стрептавидина (Pierce Chemical #21126) в PBS, содержащем 2,0 мг/мл BSA, и инкубировали в течение 1 часа при комнатной температуре на шейкере, слегка помешивая. Каждую лунку 5 раз промывали 200 мкл PBS. Затем добавляли 100 мкл/лунку пероксидазного субстрата TMB (Kirkegaard & Perry Laboratories) и инкубировали при комнатной температуре в течение 16 минут. Пероксидазную реакцию прекращали добавлением 100 мкл/лунку 1,0 M H3PO4 и измеряли OD450.
Анализ на активацию C3
Для оценки влияния OMS646 на лектин-зависимую активацию С3 проводили анализы, аналогичные анализам на активацию С4, описанным выше, за исключением того, что в качестве конечной точки оценивали осаждение С3. Осаждение C3 количественно оценивали следующим образом. По окончании реакции осаждения комплемента, планшеты промывали как описано выше, а затем инкубировали в течение 1 часа со 100 мкл/лунку 1:5000-разведения кроличьего антитела против человеческих C3c (Dako) в PBS, содержащем 2,0 мг/мл альбумина бычьей сыворотки (BSA). Каждый планшет пять раз промывали 200 мкл PBS, а затем инкубировали в течение 1 часа при комнатной температуре со 100 мкл/лунку ПХ-конъюгированного козьего антитела против кроличьих IgG (American Qualex Antibodies) в PBS, содержащем 2,0 мг/мл BSA. Планшеты пять раз промывали 200 мкл PBS, а затем добавляли 100 мкл/лунку пероксидазного субстрата TMB (Kirkegaard & Perry Laboratories) и инкубировали при комнатной температуре в течение 10 минут. Пероксидазную реакцию прекращали добавлением 100 мкл/лунку 1,0 M H3PO4 и измеряли OD450. Величины IC50 вычисляли с помощью алгоритма построения сигмоидальной кривой зависимости «доза-ответ» (GraphPad) и получали серии экспериментальных данных.
Результаты
На фиг.23A графически проиллюстрирован уровень осаждения С3 в присутствии или в отсутствие анти-MASP-2 антитела (OMS646) при концентрациях в определенном интервале в 90% человеческой сыворотке в условиях проведения анализа, специфичного к лектиновому пути. На фиг.23В графически проиллюстрирован уровень осаждения С4 в присутствии или в отсутствие анти-MASP-2 антитела (OMS646) при концентрациях в определенном интервале в 90% человеческой сыворотке в условиях проведения анализа, специфичного к лектиновому пути. Как показано на фиг.23A, OMS646 блокировало осаждение C3 в 90% человеческой сыворотке с IC50=3±1,5 нМ (n=6). Как показано на фиг.23B, OMS646 блокировало осаждение C4 с IC50=2,8±1,3 нМ (n=6).
Эти результаты продемонстрировали, что OMS646 оказывает сильное эффективное блокирующее действие на активацию лектинового пути в физиологических условиях, что подтверждает эффективность использования низких терапевтических доз OMS646. Исходя из этих данных можно предположить, что антитело OMS646 будет блокировать лектиновый путь на >90% в кровотоке пациента при концентрации в плазме 20 нМ (3 мкг/мл) или менее. Исходя из объема плазмы приблизительно 3 литра, типичного для человека, и исходя из известных данных, что объем вводимого материала, содержащего антитело, сохраняется в плазме (Lin Y.S. et al., JPET 288:371 (1999)), можно предположить, что доза OMS646 по меньшей мере 10 мг, вводимая внутривенно, будет эффективно блокировать лектиновый путь в период острой фазы заболевания (то есть в кратковременный период, такой как период от 1 до 3 дней). В случае хронического заболевания может оказаться предпочтительным блокирование лектинового пути в течение более продолжительного периода времени до достижения максимального эффекта лечения. Таким образом, при указанных хронических состояниях, предпочтительной может оказаться доза OMS646, равная 100 мг, которая, как и предполагалось, будет эффективно блокировать лектиновый путь у взрослого человека по меньшей мере за одну неделю или более. При медленном клиренсе и при продолжительном времени полужизни антител, как это обычно наблюдается у человека, возможно, что доза OMS646, равная 100 мг, будет эффективной в течение более, чем одной недели, например, в течение 2 недель или даже 4 недель. Предполагается, что более высокая доза антитела (то есть более 100 мг, например 200 мг, 500 мг или более, например 700 мг или 1000 мг) будет действовать в течение более длительного периода времени (например более 2 недель).
5. OMS646 блокирует активацию лектинового пути у обезьян
Как описано выше в примере 10 и как показано на фиг.17, было установлено, что антитело OMS646 подавляет системную активность лектинового пути в течение периода времени приблизительно 72 часа после внутривенного введения OMS646 (3 мг/кг) у африканских зеленых мартышек, с последующим восстановлением активности лектинового пути.
В этом примере описано пост-экспериментальное исследование результатов, в котором оценивали лектин-зависимую активацию C4 в 90% сыворотке африканской зеленой мартышки или в 90% сыворотке собакоподобных обезьян в определенных интервалах концентраций антитела OMS646 и в отсутствие антитела OMS646, как описано ниже.
Для определения влияния OMS646 на лектин-зависимую активацию С4 у приматов различных видов, не являющихся человеком, 96-луночные планшеты со средой Costar для оценки связывания покрывали 2 мкг маннана (50 мкл 40 мкг/мл раствора в 50 мМ карбонатного буфера, pH 9,5) в течение ночи при 5°C. Затем планшеты три раза промывали 200 мкл PBS и блокировали 100 мкл/лунку 1% альбумина бычьей сыворотки в PBS в течение 1 часа при комнатной температуре, слегка помешивая. В отдельном планшете для предварительного инкубирования, антитело OMS646 в выбранных концентрациях смешивали с 90% сывороткой, взятой у африканских зеленых мартышек или собакоподобных обезьян, и инкубировали в течение 1 часа на льду. Затем эти смеси «антитело - сыворотка», полученные путем предварительного инкубирования, переносили в покрытые маннаном лунки аналитических планшетов, находящихся на льду. После этого аналитические планшеты инкубировали в течение 90 минут на бане с ледяной водой для инициации активации комплемента. Реакцию прекращали добавлением ЭДТА к реакционной смеси. Каждую лунку пять раз промывали 200 мкл PBS-твина 20 (0,05% твина 20 в PBS), а затем каждую лунку два раза промывали 200 мкл PBS. Затем добавляли 100 мкл/лунку 1:1000-разведения конъюгированного с биотином куриного антитела против человеческих C4c (Immunsystem AB, Uppsala, Sweden) в PBS, содержащем 2,0 мг/мл BSA, и инкубировали в течение одного часа при комнатной температуре, слегка помешивая. Каждую лунку пять раз промывали 200 мкл PBS. Затем добавляли 100 мкл/лунку 0,1 мкг/мл конъюгированного с пероксидазой стрептавидина (Pierce Chemical #21126) в PBS, содержащем 2,0 мг/мл BSA, и инкубировали в течение одного часа при комнатной температуре на шейкере, слегка помешивая. Каждую лунку пять раз промывали 200 мкл PBS. Затем добавляли 100 мкл/лунку пероксидазного субстрата TMB (Kirkegaard & Perry Laboratories) и инкубировали при комнатной температуре в течение 10 минут. Пероксидазную реакцию прекращали добавлением 100 мкл/лунку 1,0 M H3PO4 и измеряли OD450. Величины IC50 вычисляли с помощью алгоритма построения сигмоидальной кривой зависимости «доза-ответ» (GraphPad) и получали серии экспериментальных данных.
Результаты
Дозозависимое ингибирование лектинового пути в 90% сыворотке собакоподобных обезьян (фиг.24A) и в 90% сыворотке африканской зеленой мартышки (фиг.24B) наблюдалось при величинах IC50 в пределах от 30 нМ до 50 нМ, и от 15 нМ до 30 нМ, соответственно.
В целом, OMS646, то есть полностью человеческое антитело IgG4 против человеческих MASP-2 (с мутацией в шарнирной области) обладало, как было установлено, нижеследующими преимущественными свойствами: высокой аффинностью связывания с человеческим MASP-2 (KD в пределах 50-250 пМ, Koff в пределах 1-3×10-4 с-1 и Kon в пределах 1,6-3×l06 М-1·с-1); функциональной активностью, направленной на ингибирование осаждения C4 в человеческой сыворотке, с IC50=0,52±0,28 нМ (n=10) в 1% человеческой сыворотке; и IC50=3±1,5 нМ в 90% сыворотке); и перекрестной реактивностью у обезьян, указывающей на ингибирование осаждения C4 с IC50 в пределах 15-50 нМ (в 90% сыворотке обезьян).
Как описано выше, доза OMS646, составляющая по меньшей мере 10 мг (соответствующая 0,15 мг/кг для человека в среднем), как и ожидалось, является эффективной для блокирования лектинового пути в кровотоке человека при остром заболевании (например, в течение по меньшей мере 1-3 дней), а доза OMS646, составляющая по меньшей мере 100 мг (соответствующая 1,5 мг/кг для человека в среднем), как и ожидалось, блокирует лектиновый путь в кровотоке пациента в течение по меньшей мере одной недели или более. Более высокие дозы OMS646 (например более 100 мг, например по меньшей мере 200 мг, по меньшей мере 300 мг, по меньшей мере 400 мг, по меньшей мере 500 мг или более), предпочтительно вводимые подкожно (s.c.) или внутримышечно (i.m.), могут быть использованы для дальнейшего увеличения «временного «окна» эффективного блокирования лектинового пути до двух недель, а предпочтительно, четырех недель.
Так, например, в соответствии с полученными здесь экспериментальными данными, у приматов, доза OMS646 в 1 мг/кг давала ингибирование лектинового пути через 1 день, а доза OMS646 3 мг/кг давала ингибирование лектинового пути приблизительно через 3 дня (72 часа). Поэтому, согласно предварительной оценке, более высокая доза от 7 до 10 мг/кг будет эффективно ингибировать лектиновый путь за период приблизительно 7 дней. Как показано в настоящей заявке, антитело OMS646 обладает в 5-10 раз большей активностью против человеческого MASP-2, чем активностью против обезьяньего MASP-2. Ниже в таблице 30 представлены интервалы доз, которые, как предполагается, принимая во внимания сравнимые фармакокинетические свойства описанных антител, могут оказаться эффективными для блокирования лектинового пути у человека.
Дозы антитела OMS646 для ингибирования лектинового пути in vivo
В настоящем изобретении проиллюстрированы и описаны предпочтительные варианты его осуществления, однако следует отметить, что в эти варианты могут быть внесены различные изменения, не выходящие за рамки существа и объема настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ MASP-2-ЗАВИСИМОЙ АКТИВАЦИИ КОМПЛЕМЕНТА | 2017 |
|
RU2725958C2 |
| СПОСОБЫ ЛЕЧЕНИЯ СОСТОЯНИЙ, АССОЦИИРОВАННЫХ С MASP-2-ЗАВИСИМОЙ АКТИВАЦИЕЙ КОМПЛЕМЕНТА | 2014 |
|
RU2718850C2 |
| СПОСОБЫ ЛЕЧЕНИЯ СОСТОЯНИЙ, АССОЦИИРОВАННЫХ С MASP-2-ЗАВИСИМОЙ АКТИВАЦИЕЙ КОМПЛЕМЕНТА | 2014 |
|
RU2830289C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ MASP-1, И/ИЛИ MASP-2, И/ИЛИ MASP-3 ДЛЯ ЛЕЧЕНИЯ ПАРОКСИЗМАЛЬНОЙ НОЧНОЙ ГЕМОГЛОБИНУРИИ | 2013 |
|
RU2655299C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ MASP-1, И/ИЛИ MASP-2, И/ИЛИ MASP-3 ДЛЯ ЛЕЧЕНИЯ РАЗЛИЧНЫХ ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ | 2013 |
|
RU2709351C2 |
| Способы лечения состояний, связанных с masp-2 зависимой активацией комплемента | 2012 |
|
RU2662563C2 |
| СПОСОБ ЛЕЧЕНИЯ ДИССЕМИНИРОВАННОГО ВНУТРИСОСУДИСТОГО СВЕРТЫВАНИЯ КРОВИ ПУТЕМ ИНГИБИРОВАНИЯ MASP-2 ЗАВИСИМОЙ АКТИВАЦИИ КОМПЛЕМЕНТА | 2010 |
|
RU2600876C2 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА D И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2799044C2 |
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |
| СПОСОБЫ ЛЕЧЕНИЯ СОСТОЯНИЙ, СВЯЗАННЫХ С MASP-2 ЗАВИСИМОЙ АКТИВАЦИЕЙ КОМПЛЕМЕНТА | 2012 |
|
RU2743409C2 |




























































































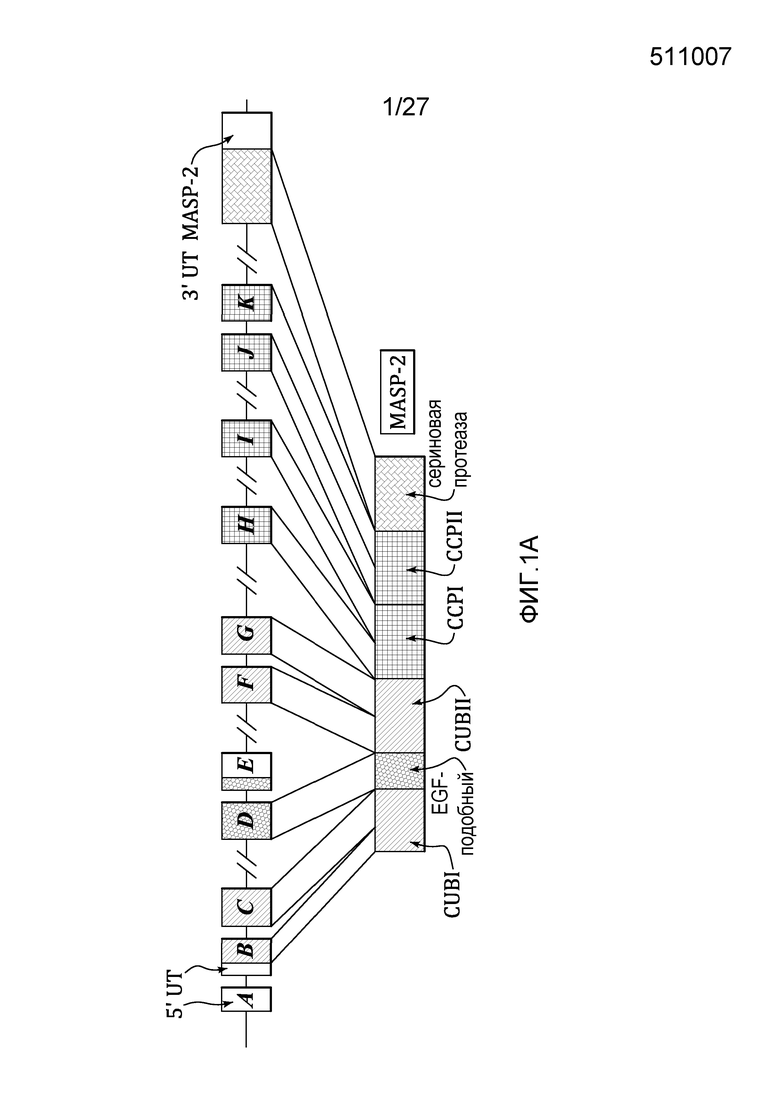
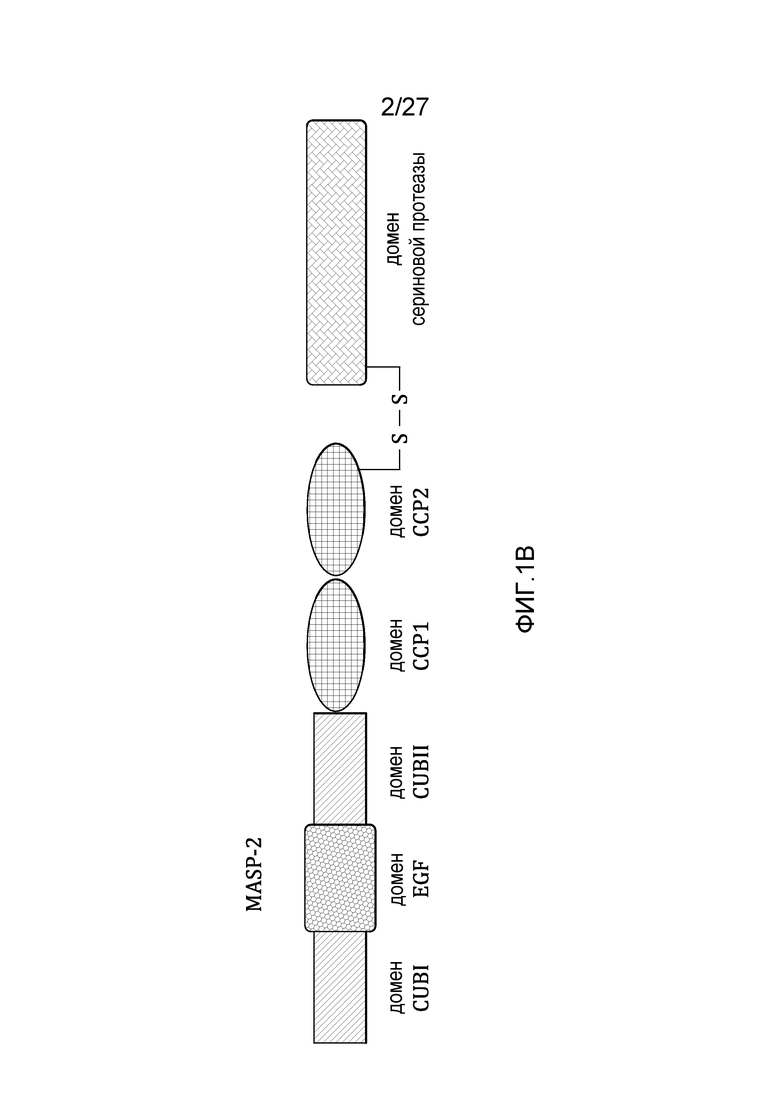
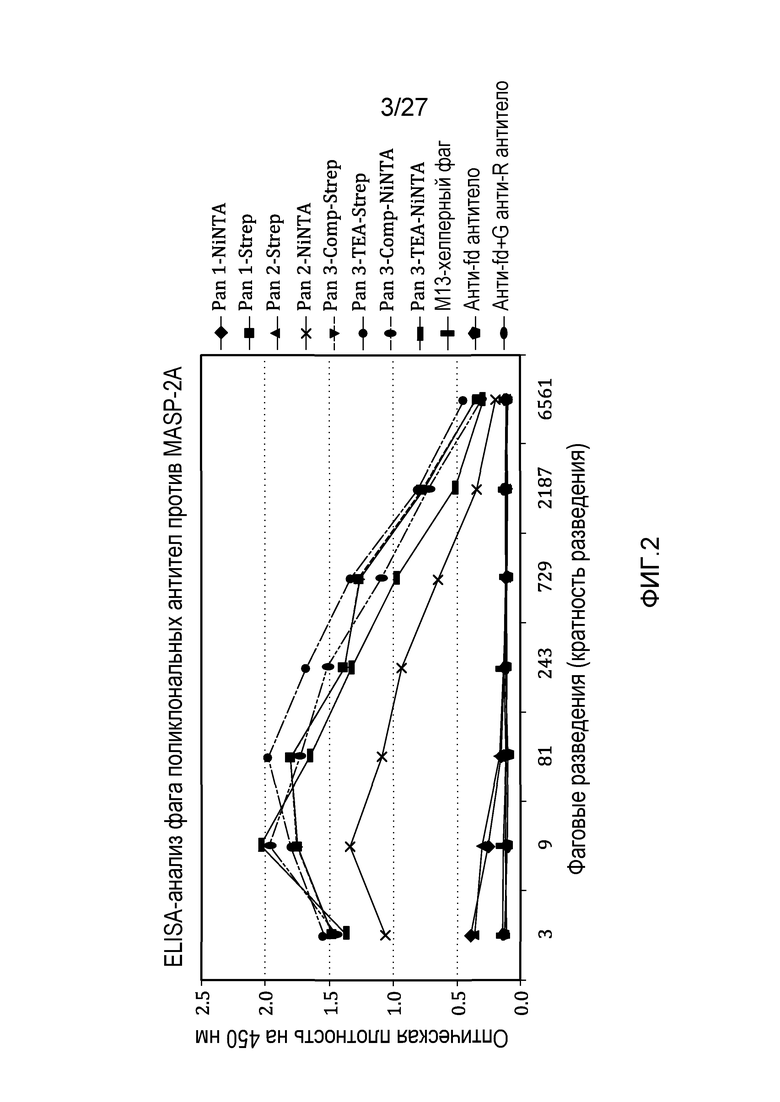
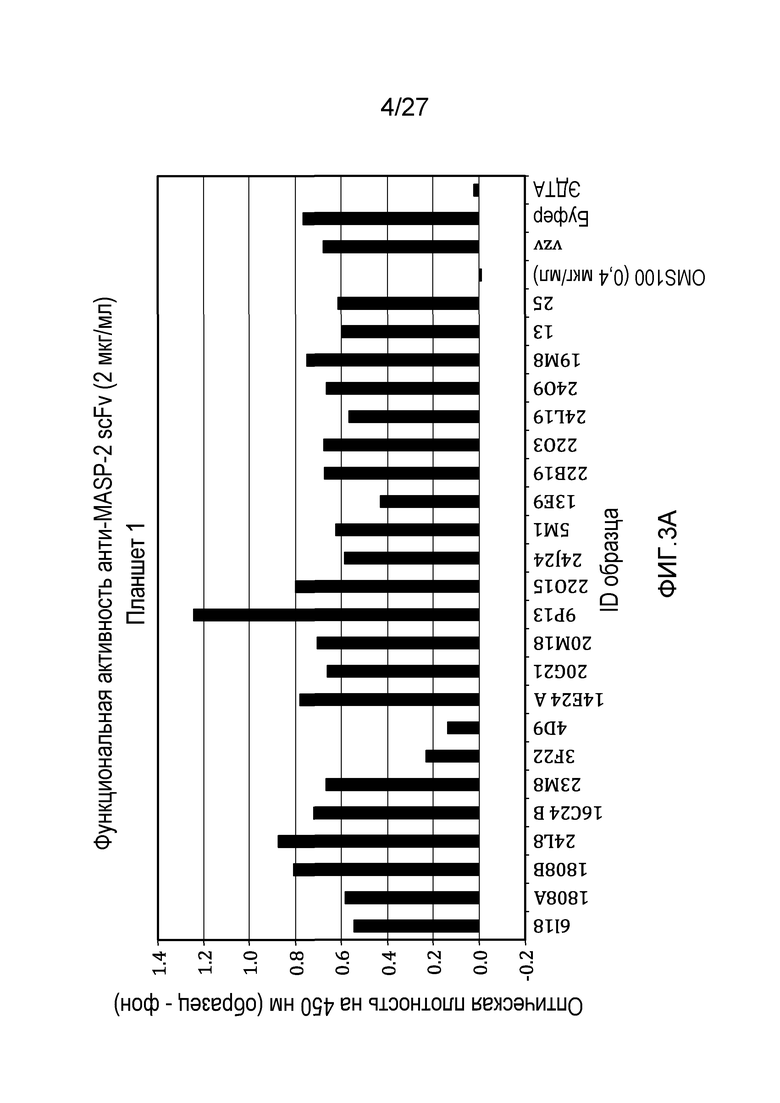
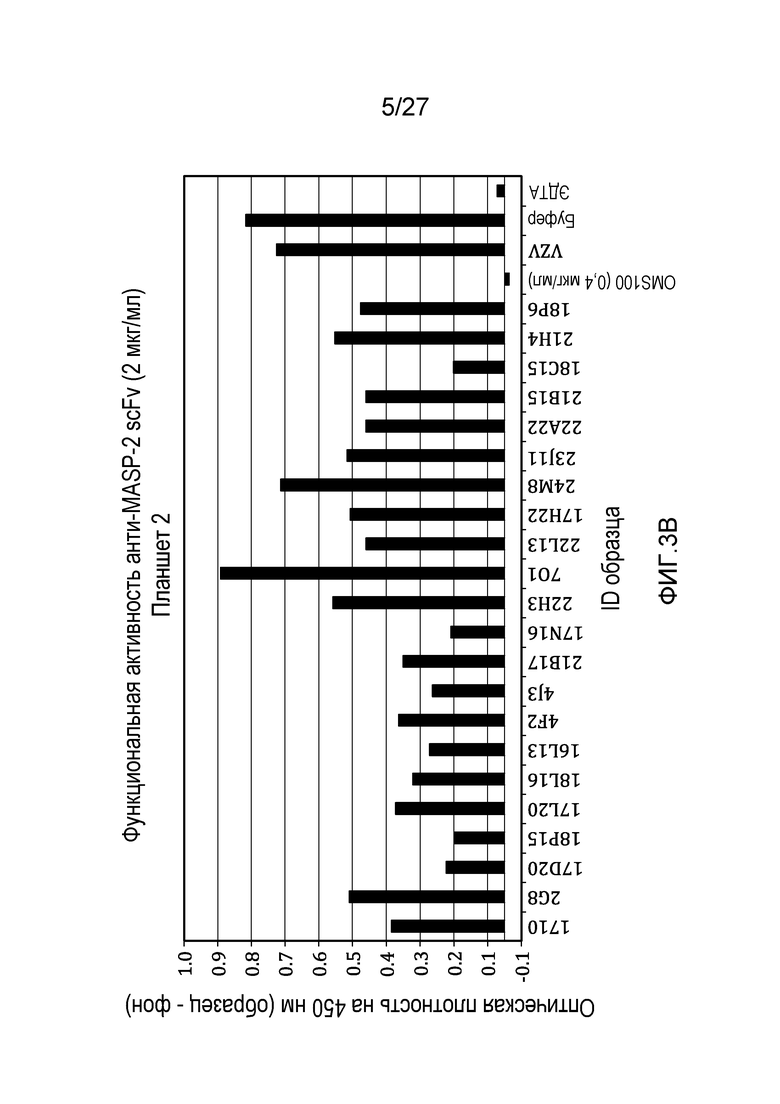
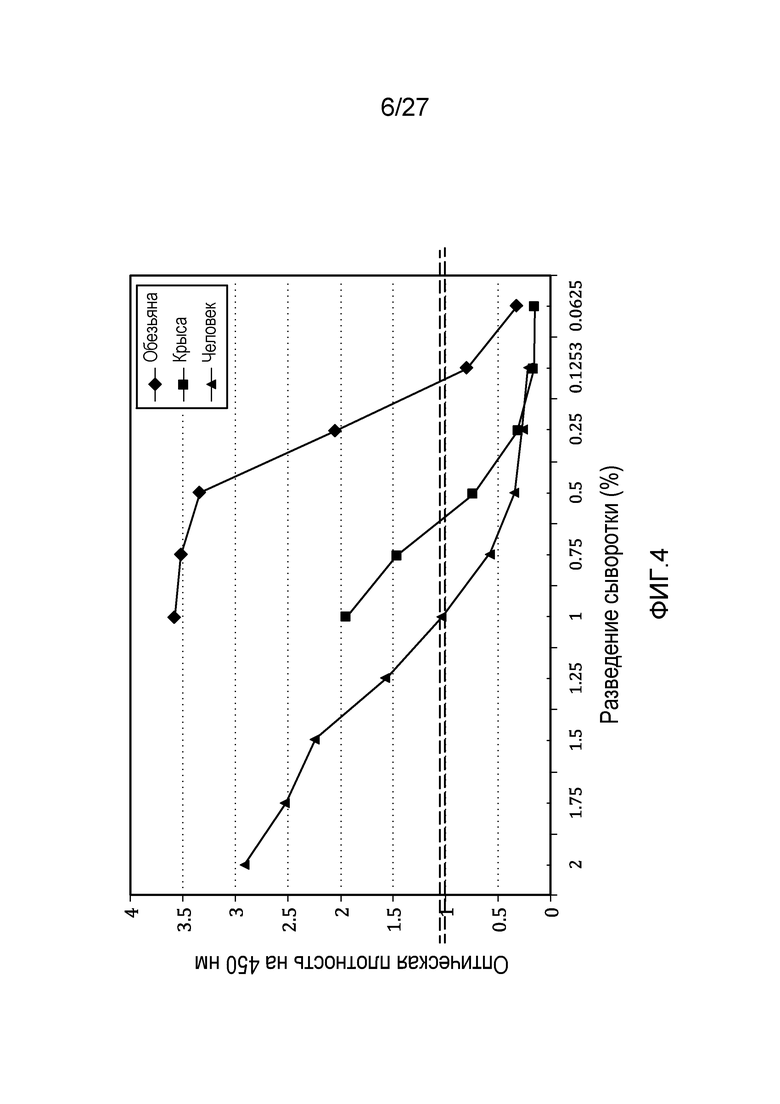


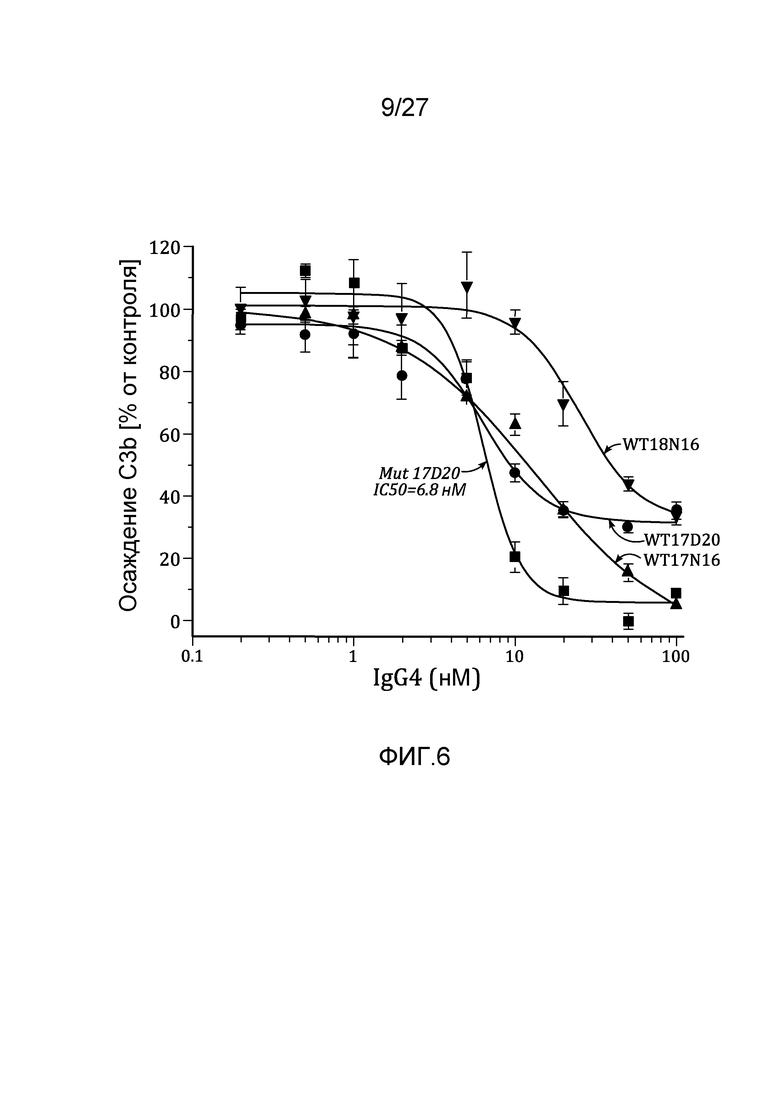
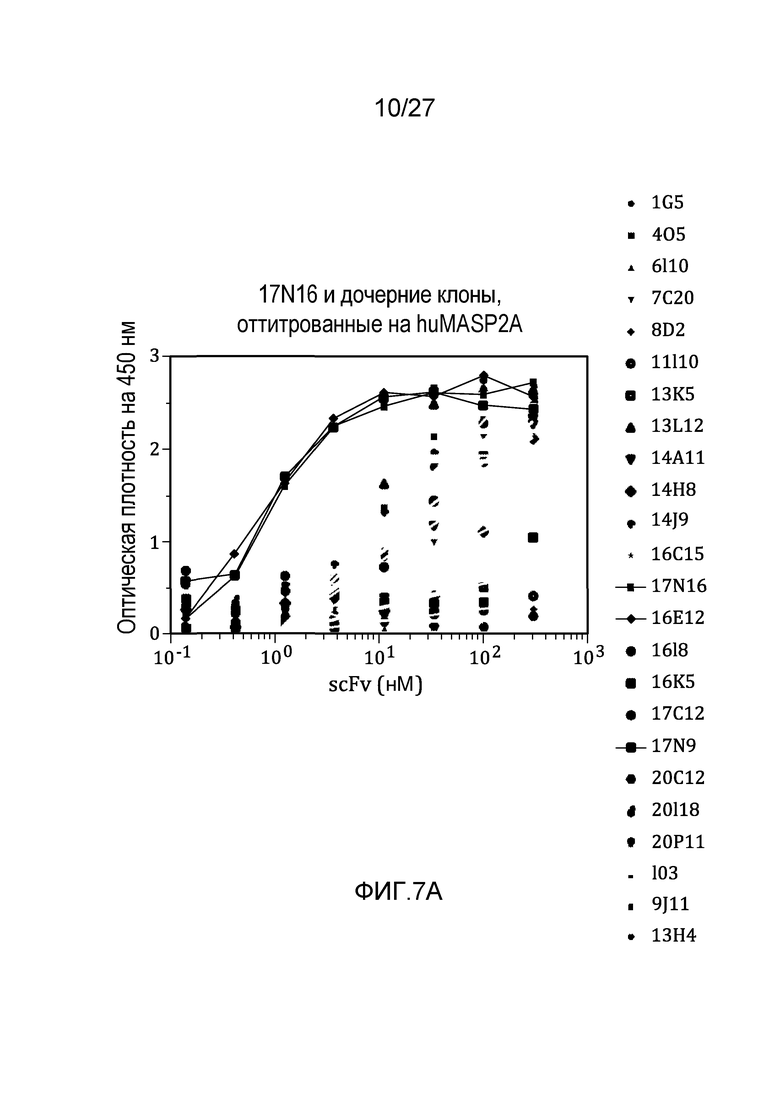
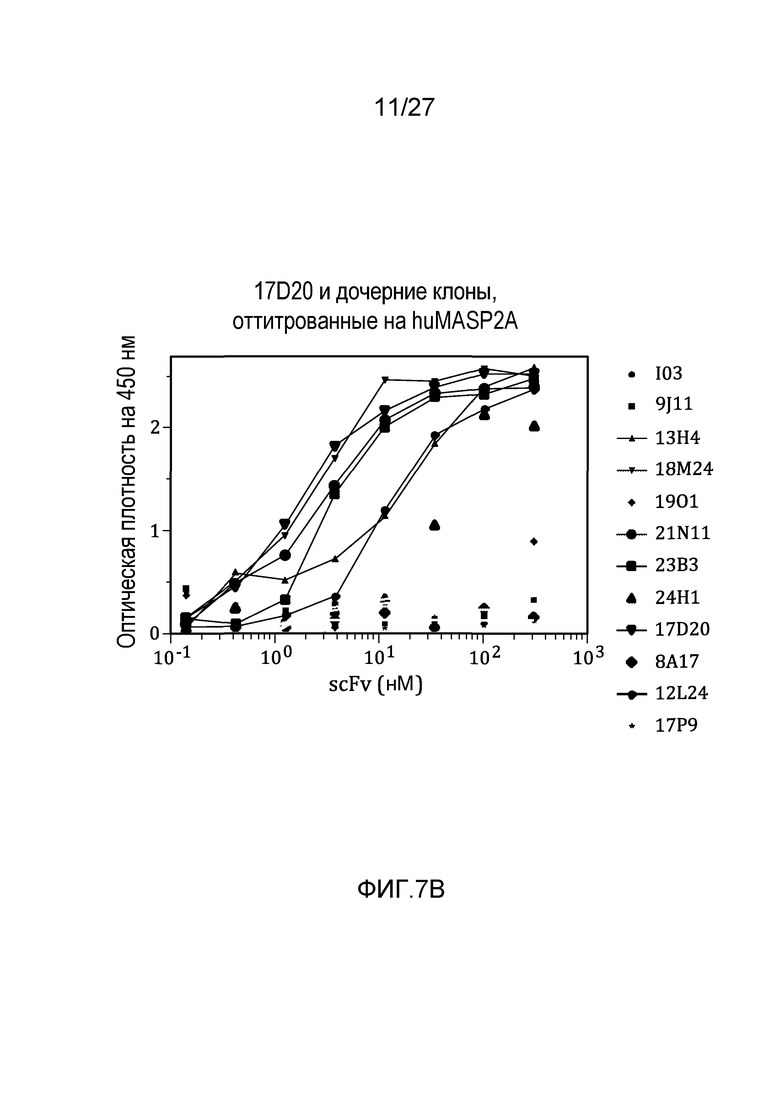

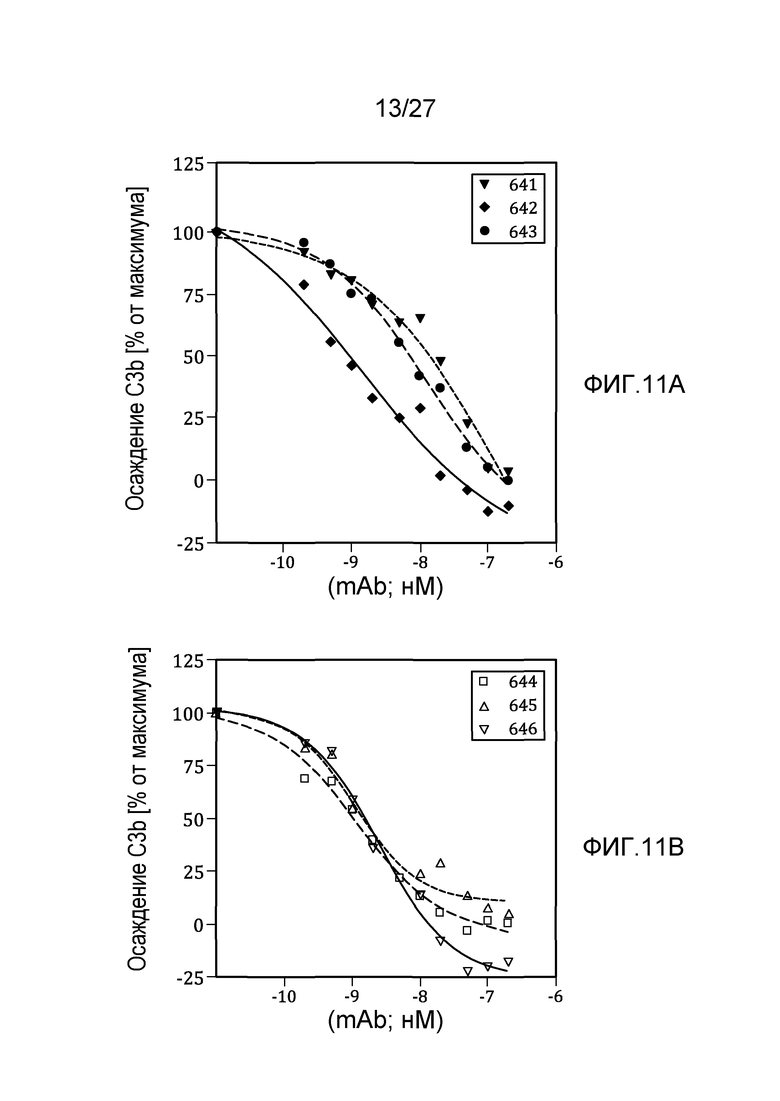
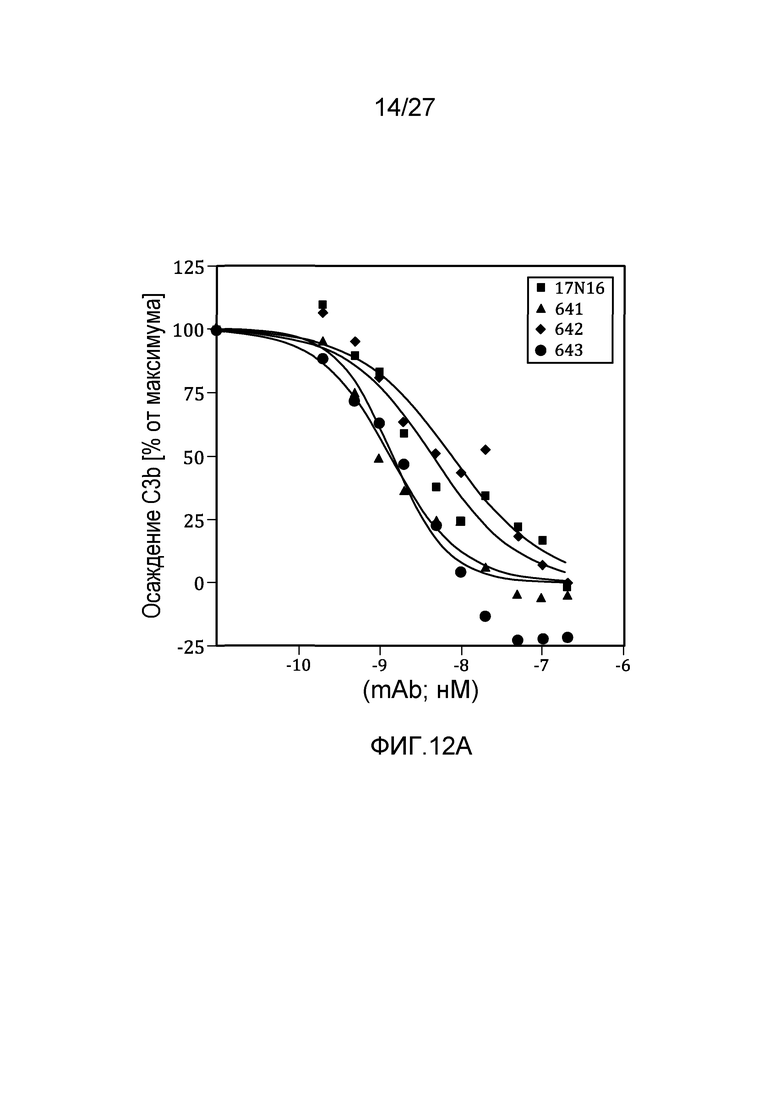
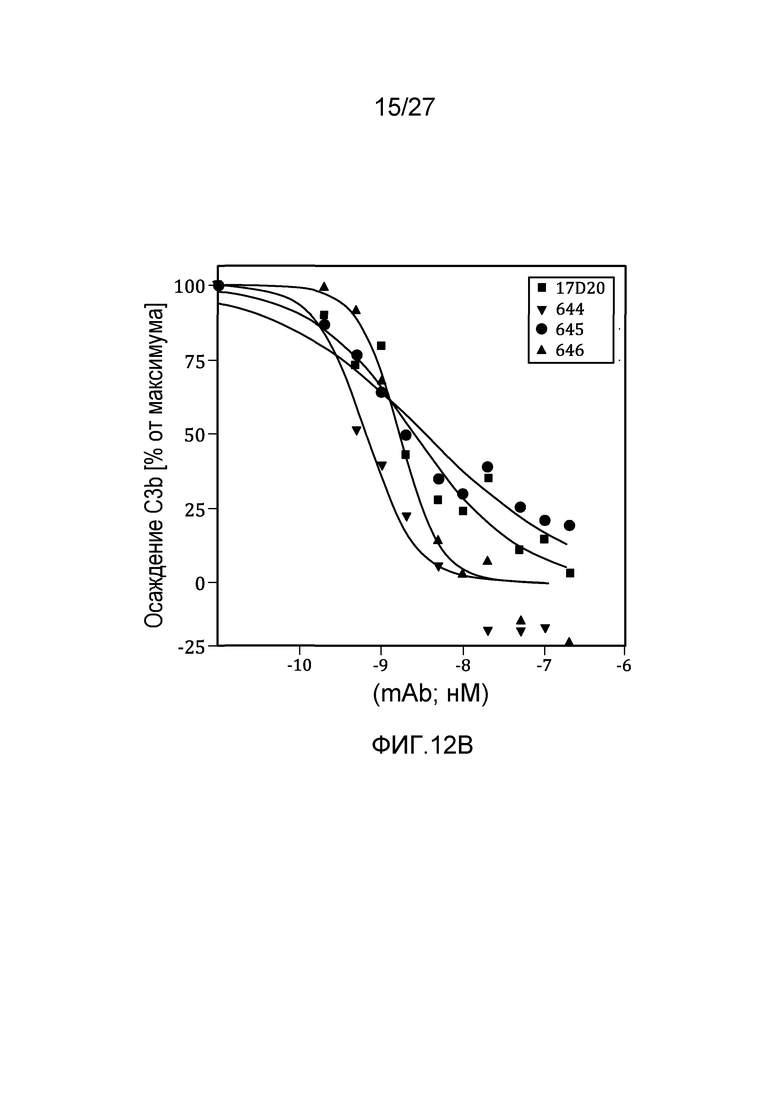
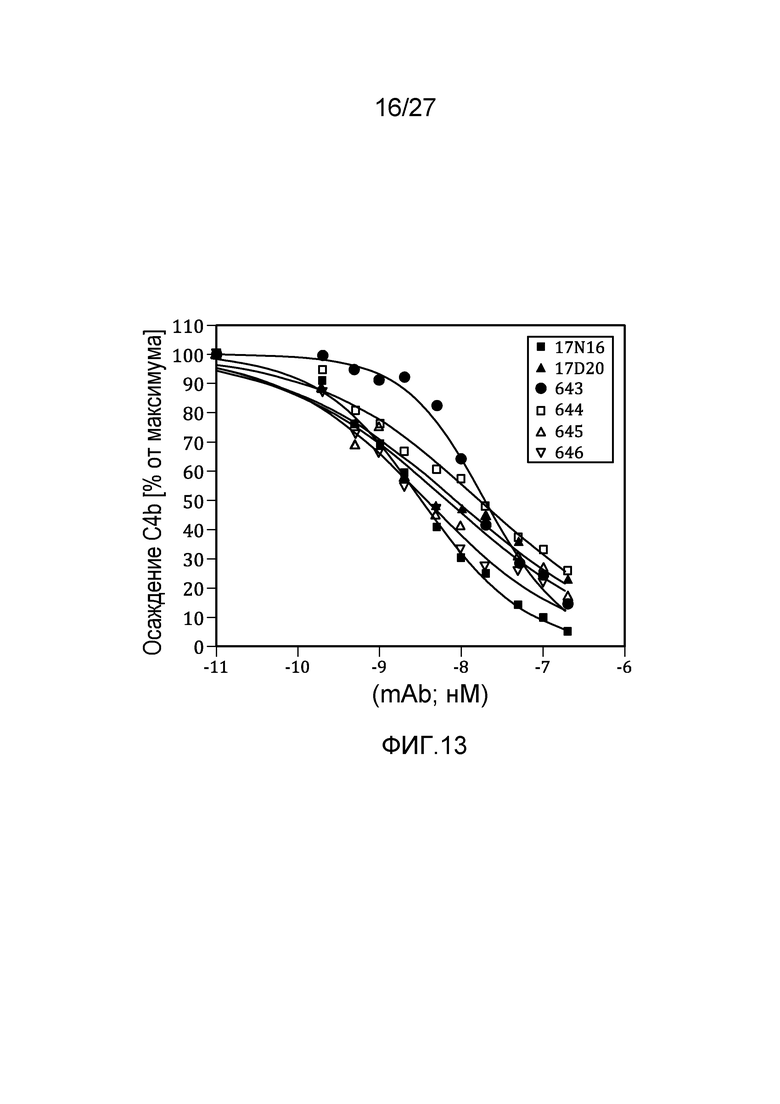
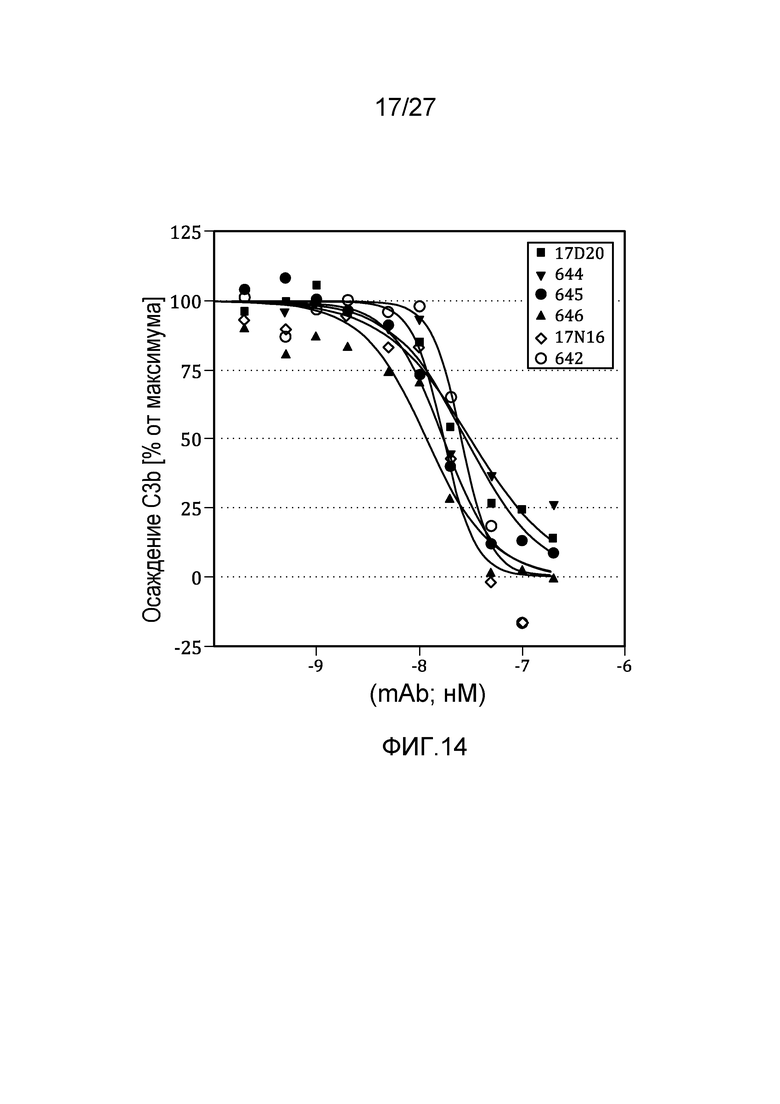
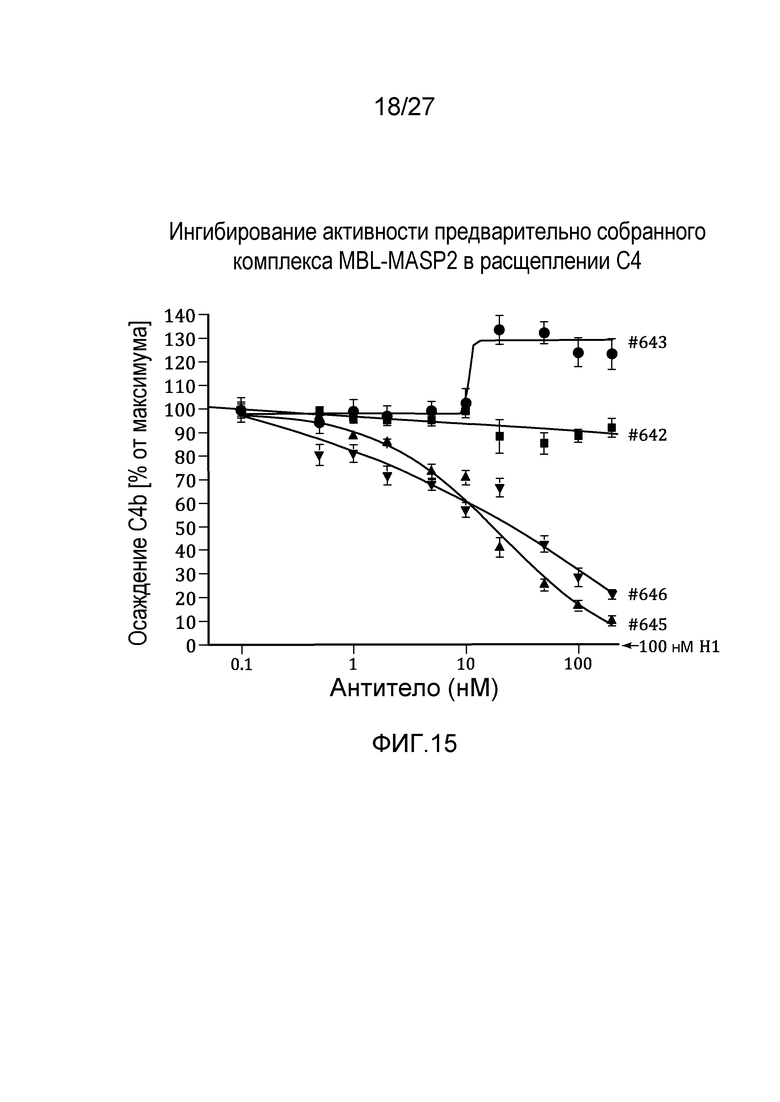
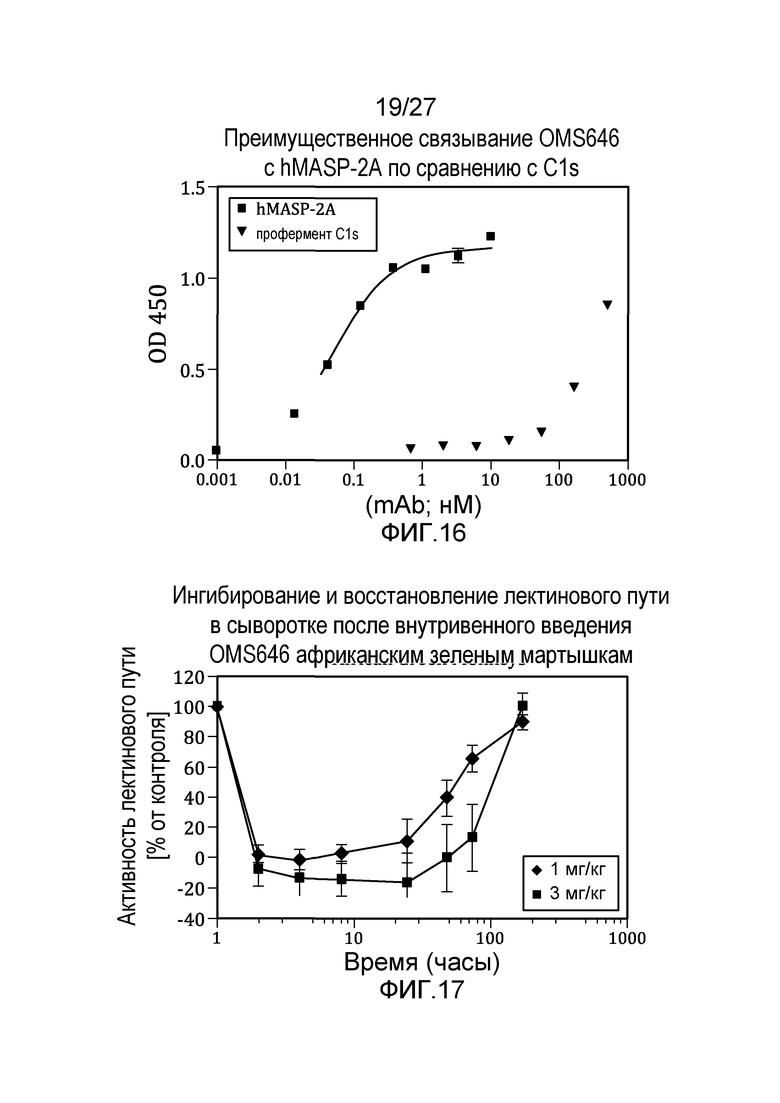
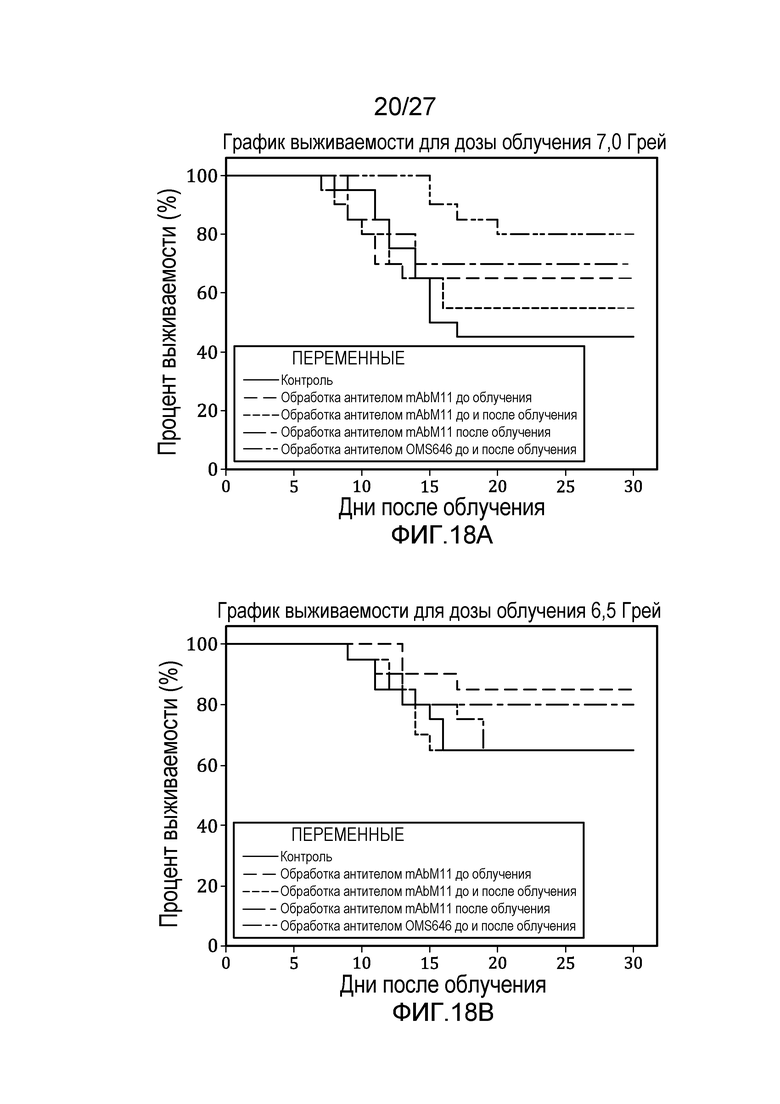
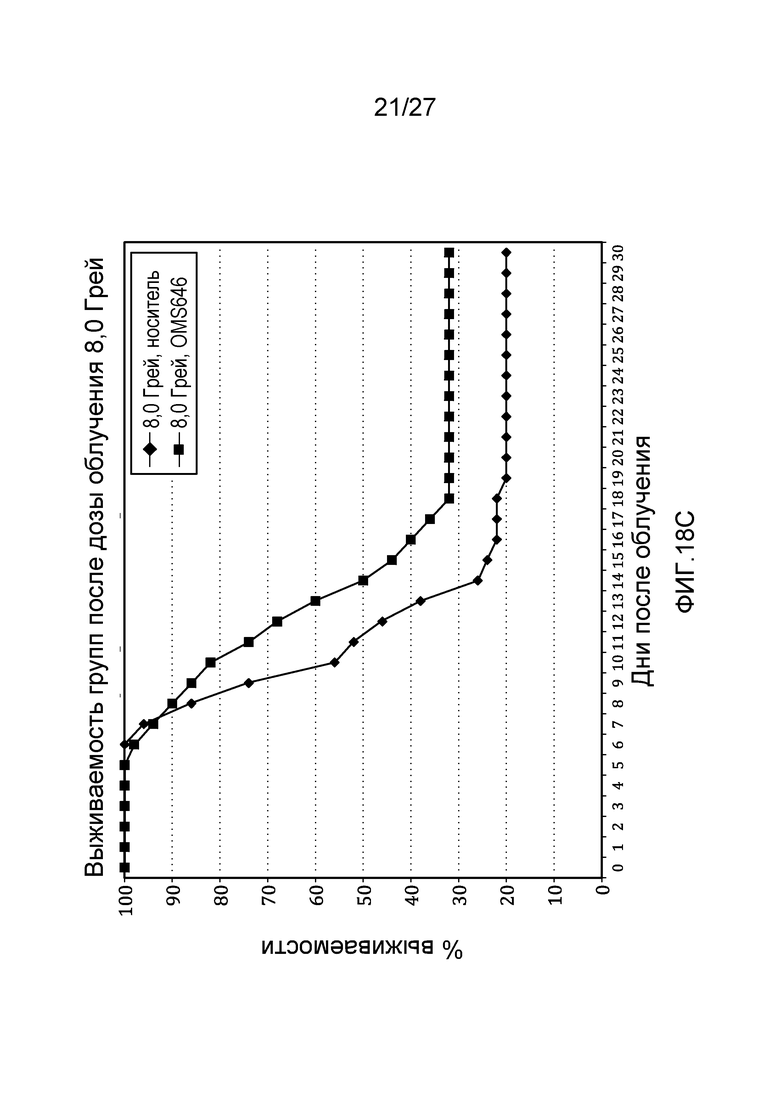
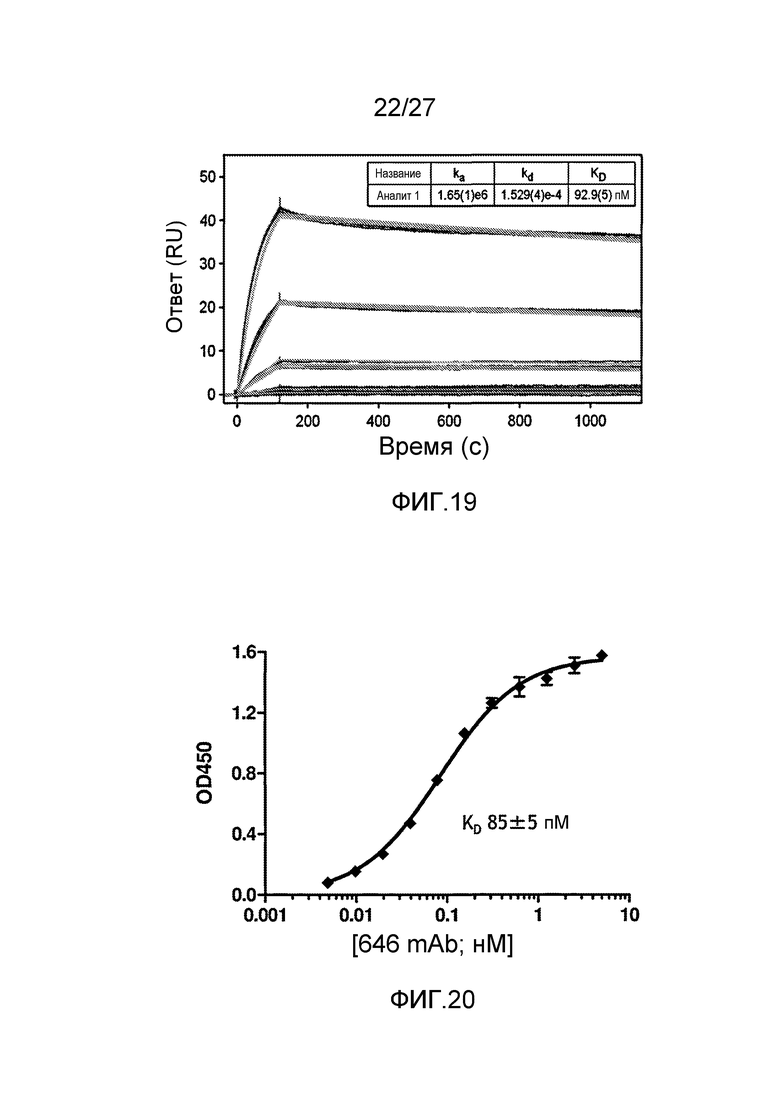
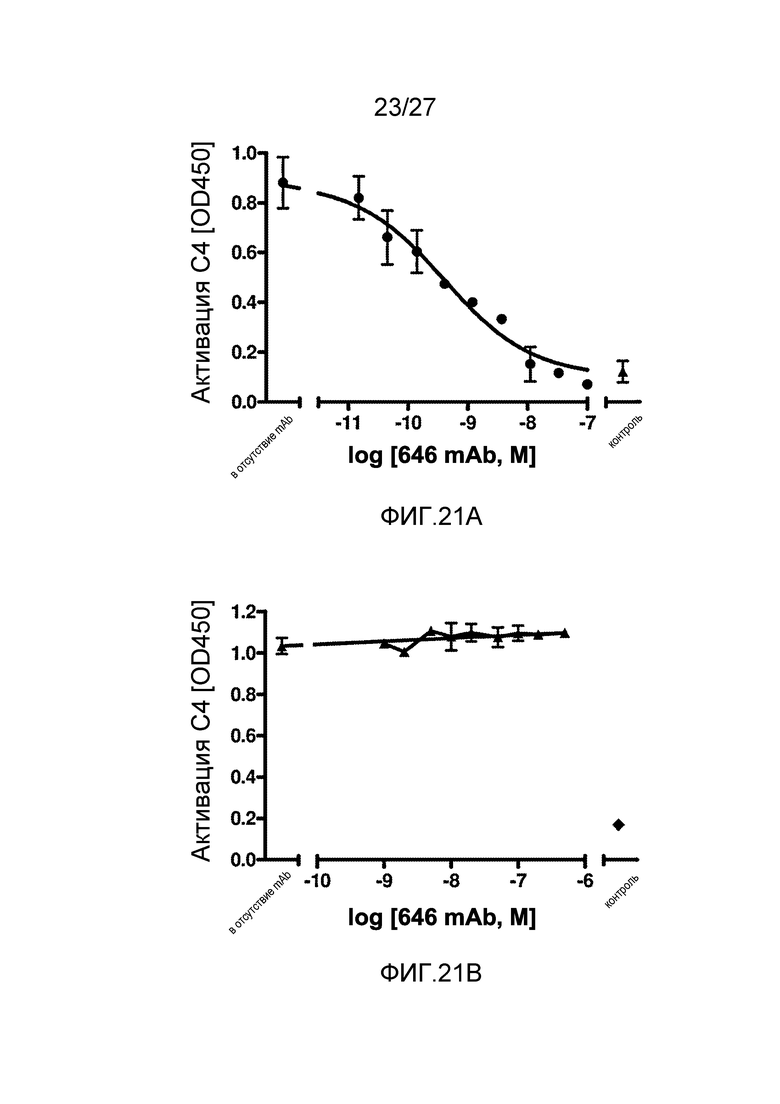
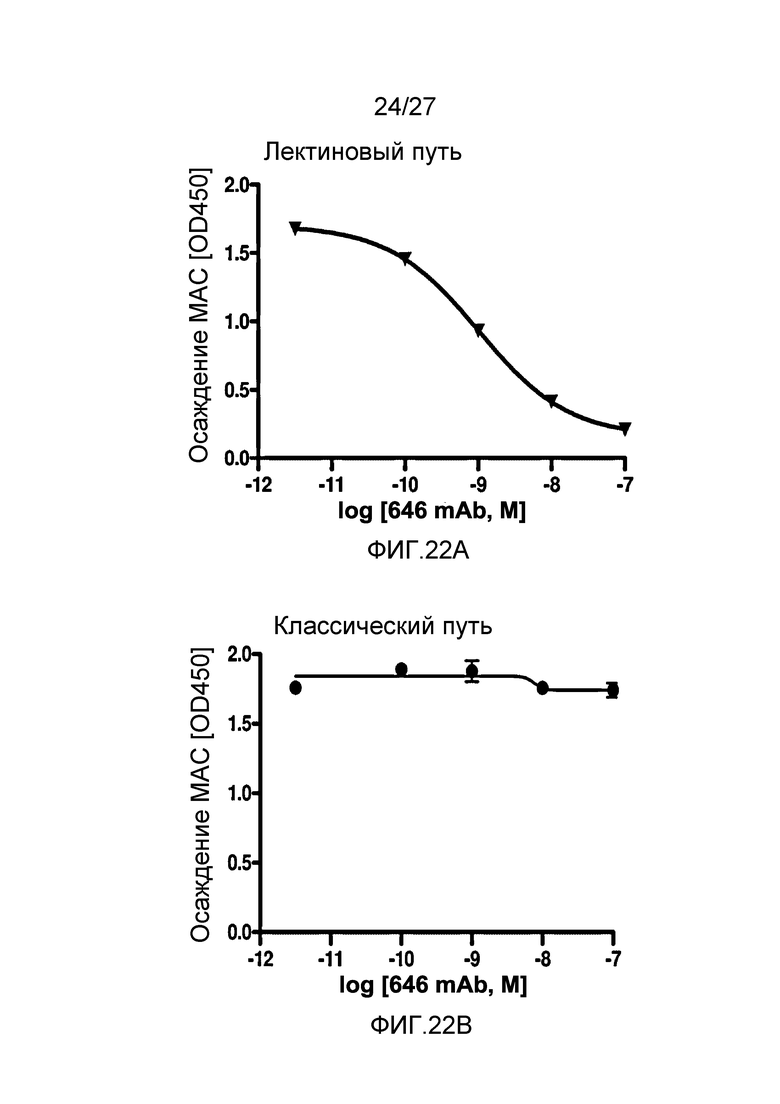
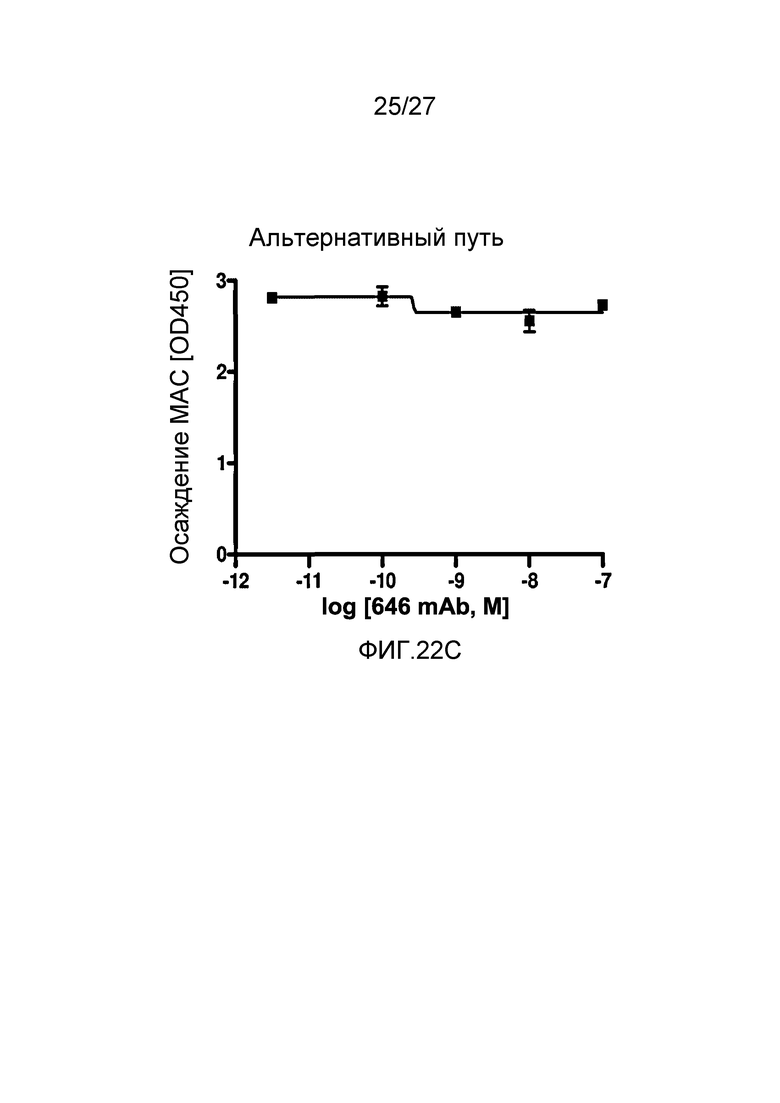
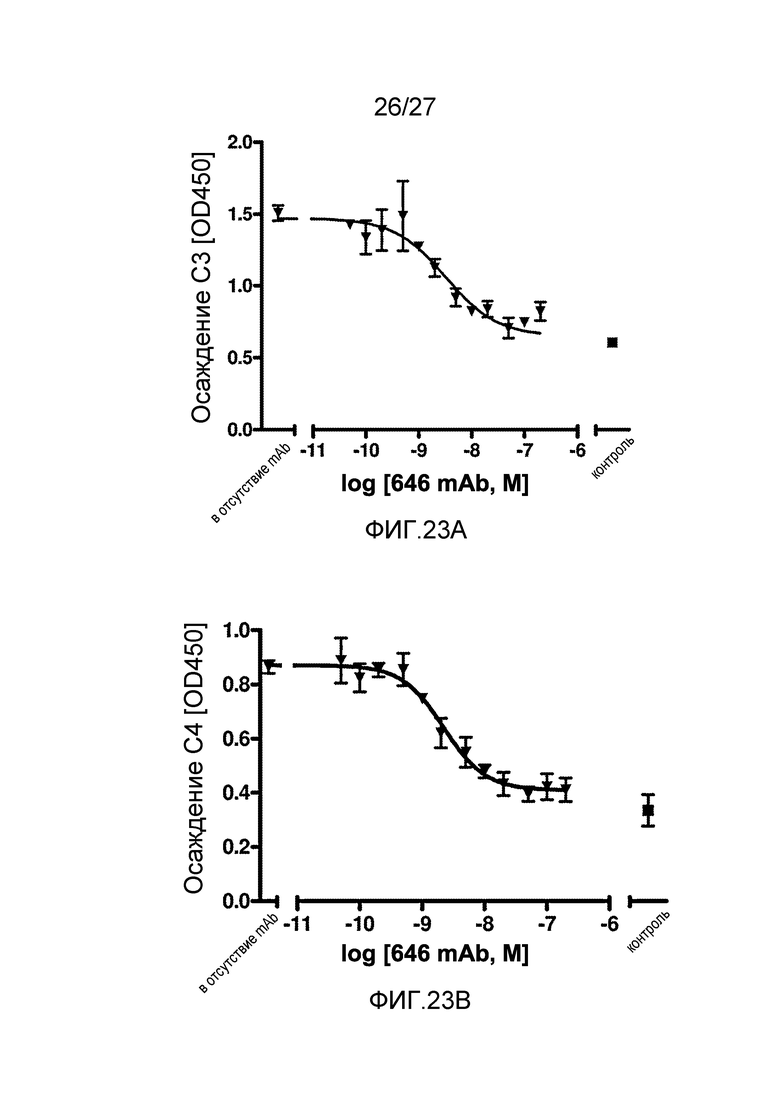
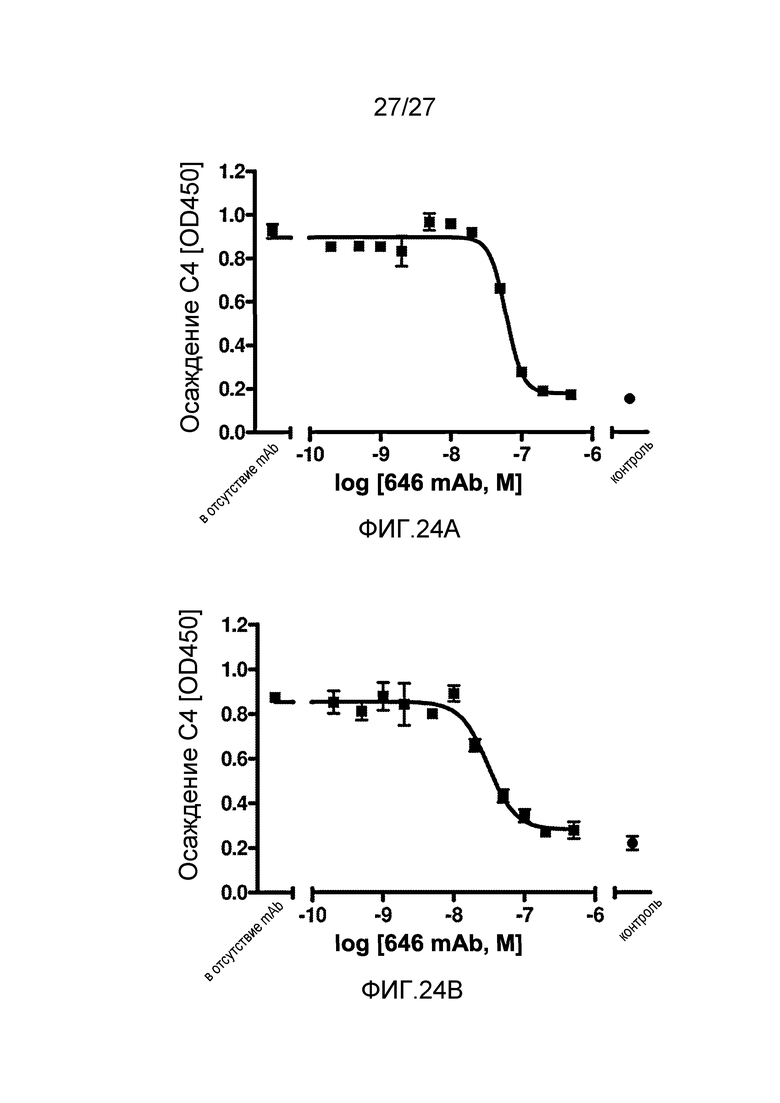
Настоящее изобретение относится к иммунологии. Предложено выделенное человеческое моноклональное антитело и его антигенсвязывающий фрагмент, которые связываются с MASP-2 человека. Кроме того, рассмотрена молекула нуклеиновой кислоты, кодирующая аминокислотные последовательности вариабельных областей антитела и антигенсвязывающего фрагмента; экспрессионная кассета; клетка и способ продуцирования выделенного анти-MASP-2 антитела или его антигенсвязывающего фрагмента. Также описана композиция для лечения состояния, ассоциированного с MASP-2-зависимой активацией комплемента; применение анти-MASP-2-антитела для получения лекарственного средства и промышленное изделие для лечения состояния, ассоциированного с MASP-2-зависимой активацией комплемента. Данное изобретение может найти дальнейшее применение в терапии комплемент-опосредованных заболеваний. 9 н. и 10 з.п. ф-лы, 24 ил., 30 табл., 12 пр.
1. Выделенное человеческое моноклональное антитело или его антигенсвязывающий фрагмент, которые связываются с MASP-2 человека, где указанное антитело включает:
а) вариабельную область тяжелой цепи, содержащую последовательность SEQ ID NO: 20 или ее вариант, содержащий аминокислотную последовательность, которая по меньшей мере на 95% идентична последовательности SEQ ID NO: 20, где
остаток 31 представляет собой R,
остаток 32 представляет собой G,
остаток 33 представляет собой K,
остаток 34 представляет собой М,
остаток 35 представляет собой G,
остаток 36 представляет собой V,
остаток 37 представляет собой S,
остаток 50 представляет собой L,
остаток 51 представляет собой А,
остаток 52 представляет собой Н,
остаток 53 представляет собой I,
остаток 54 представляет собой F,
остаток 55 представляет собой S,
остаток 56 представляет собой S,
остаток 57 представляет собой D,
остаток 58 представляет собой Е,
остаток 59 представляет собой K,
остаток 60 представляет собой S,
остаток 61 представляет собой Y,
остаток 62 представляет собой R,
остаток 63 представляет собой Т,
остаток 64 представляет собой S,
остаток 65 представляет собой L,
остаток 66 представляет собой K,
остаток 67 представляет собой S,
остаток 95 представляет собой Y,
остаток 96 представляет собой Y,
остаток 97 представляет собой С,
остаток 98 представляет собой А,
остаток 99 представляет собой R,
остаток 100 представляет собой I,
остаток 101 представляет собой R,
остаток 102 представляет собой R или А,
остаток 103 представляет собой G,
остаток 104 представляет собой G,
остаток 105 представляет собой I,
остаток 106 представляет собой D и
остаток 107 представляет собой Y; и
b) вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 24 или ее вариант, содержащий аминокислотную последовательность, которая по меньшей мере на 95% идентична последовательности SEQ ID NO: 24, где
остаток 23 представляет собой S,
остаток 24 представляет собой G,
остаток 25 представляет собой Е или D,
остаток 26 представляет собой K,
остаток 27 представляет собой L,
остаток 28 представляет собой G,
остаток 29 представляет собой D,
остаток 30 представляет собой K,
остаток 31 представляет собой Y или F,
остаток 32 представляет собой А,
остаток 33 представляет собой Y,
остаток 49 представляет собой Q,
остаток 50 представляет собой D,
остаток 51 представляет собой K или N,
остаток 52 представляет собой Q или K,
остаток 53 представляет собой R,
остаток 54 представляет собой Р,
остаток 55 представляет собой S,
остаток 56 представляет собой G,
остаток 88 представляет собой Q,
остаток 89 представляет собой А,
остаток 90 представляет собой W,
остаток 91 представляет собой D,
остаток 92 представляет собой S,
остаток 93 представляет собой S,
остаток 94 представляет собой Т,
остаток 95 представляет собой А,
остаток 96 представляет собой V и
остаток 97 представляет собой F;
где указанное антитело или его вариант ингибируют MASP-2-зависимую активацию комплемента.
2. Антитело по п.1, где антитело имеет по меньшей мере одну из нижеследующих функций, а именно:
(i) где указанное антитело связывается с MASP-2 человека с KD=10 нМ или менее;
(ii) где указанное антитело связывается с доменом ССР1 эпитопа MASP-2;
(iii) где указанное антитело ингибирует осаждение C3b в in vitro анализе в 1% сыворотке человека при IC50=10 нМ или менее;
(iv) где указанное антитело ингибирует осаждение C3b в 90% сыворотке человека при IC50=30 нМ или менее;
(v) где указанное антитело по существу не ингибирует классический путь.
3. Антитело по п.1, где антитело или его антигенсвязывающий фрагмент выбраны из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2, одноцепочечного антитела, scFv, одновалентного антитела, не содержащего шарнирной области, и полноразмерного антитела.
4. Антитело по п.1, где указанное антитело выбрано из группы, состоящей из молекулы IgG2, молекулы IgG1 и молекулы IgG4.
5. Антитело по п.4, где молекула IgG4 имеет мутацию S228P.
6. Антитело по п.1, где указанный вариант включает вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, в которой остаток 102 представляет собой R.
7. Антитело по п.1, где указанный вариант содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, в которой остаток 25 представляет собой Е, остаток 31 представляет собой Y, остаток 51 представляет собой K и остаток 52 представляет собой Q.
8. Антитело по п.1, где указанная тяжелая цепь содержит последовательность SEQ ID NO: 20.
9. Выделенное моноклональное антитело или его антигенсвязывающий фрагмент, которые связываются с MASP-2 человека и содержат
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 18, и
вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 22; или
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 20, и
вариабельную область легкой цепи, содержащую последовательность SEQ ID NO: 24.
10. Молекула нуклеиновой кислоты, кодирующая аминокислотную последовательность вариабельной области тяжелой цепи и вариабельной области легкой цепи анти-MASP-2 антитела или его антигенсвязывающего фрагмента по п.1 или 9.
11. Экспрессионная кассета, содержащая молекулу нуклеиновой кислоты, кодирующую вариабельную область тяжелой цепи и вариабельную область легкой цепи анти-MASP-2 антитела или его антигенсвязывающего фрагмента, по п.10.
12. Клетка для продукции анти-MASP-2 антитела или его антигенсвязывающего фрагмента по п.1 или 9, содержащая молекулу нуклеиновой кислоты по п.10 или экспрессионную кассету по п.11.
13. Способ продуцирования выделенного анти-MASP-2 антитела или его антигенсвязывающего фрагмента, включающий культивирование клетки по п.12 в условиях, благоприятствующих экспрессии молекулы нуклеиновой кислоты, кодирующей анти-MASP-2 антитело или его антигенсвязывающий фрагмент, и выделение указанного анти-MASP-2 антитела или его антигенсвязывающего фрагмента.
14. Выделенное полностью человеческое моноклональное антитело или его антигенсвязывающий фрагмент по п.1 или 9, которые диссоциируют из человеческого MASP-2 с KD=10 нМ или менее, как было определено методом поверхностного плазмонного резонанса, и ингибируют активацию С4 на покрытом маннаном субстрате при IC50=10 нМ или менее в 1% сыворотке.
15. Выделенное человеческое антитело по п.14, где указанное антитело или его антигенсвязывающий фрагмент специфически распознают по меньшей мере часть эпитопа, распознаваемого исходным антителом, включающим вариабельную область тяжелой цепи, представленную в SEQ ID NO: 20, и вариабельную область легкой цепи, представленную в SEQ ID NO: 24.
16. Композиция для лечения состояния, ассоциированного с MASP-2-зависимой активацией комплемента, содержащая от 1 мг до 1000 мг полностью человеческого моноклонального анти-MASP-2 антитела или его фрагмента по п.1, 9 или 14 и фармацевтически приемлемый носитель.
17. Композиция по п.16, где указанную композицию составляют для внутриартериального введения, внутривенного введения, внутричерепного введения, внутримышечного введения, введения путем ингаляции, интраназального введения или подкожного введения.
18. Применение анти-MASP-2-антитела по любому из пп.1, 9 или 14 для получения лекарственного средства для ингибирования MASP-2-зависимой активации комплемента у индивидуума, нуждающегося в этом.
19. Промышленное изделие для лечения состояния, ассоциированного с MASP-2-зависимой активацией комплемента, содержащее разовую дозу человеческого моноклонального анти-MASP-2 антитела по любому из пп.1, 9 или 14, подходящую для терапевтического введения человеку, где указанная разовая доза составляет в пределах от 1 мг до 1000 мг.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| SCHWAEBLE W.J | |||
| et al., "Targeting of mannan-binding lectin-associated serine protease-2 confers protection from myocardial and gastrointestinal ischemia/reperfusion injury." Proceedings of the National Academy of Sciences, 3 May 2011; 108(18): 7523-7528 | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2017-11-17—Публикация
2012-05-04—Подача