Область изобретения
Настоящая заявка относится к инновационным соединениям и композициями для профилактики и/или лечения вновь выявленного повреждающего механизма, блокирующего способность восстановления эндогенного миелина в зрелой нервной системе (НС) при заболеваниях, связанных с экспрессией белка оболочки (ENV, envelope protein) HERV-W (human endogenous retrovirus, эндогенный ретровирус типа W человека), в частности, его подтипа MSRV (multiple sclerosis-associated retrovirus, ретровирус, ассоциированный с рассеянным склерозом).
Этот новый терапевтический подход сочетает в себе ингибирование вышележащих патогенных воздействий Env на клетки предшественники олигодендроцитов (OPCs, oligodendrocyte precursor cells) вместе с ингибированием нижележащих эффекторов патогенности Env на дифференциацию ОРС (N0 радикалы), которые, как в настоящее время показано, блокируют ремиелинизацию при HERV-W ассоциированных заболеваниях, влияющих на нервную систему.
Настоящее изобретение относится к терапевтическим композициям, содержащим (i) по меньшей мере один лиганд анти-HERV-W Env, и/или (ii) по меньшей мере одно лекарственное средство, ингибирующее свободные радикалы окиси азота (NO, Nitric Oxyde), применяемым для профилактики и/или лечения блокады ремиелинизации при заболеваниях, связанных с экспрессией белка оболочки (ENV) HERV-W, в частности его подтипа MSRV.
Композиция, при которой объединены как лиганд, так и лекарственное средство, ингибирующее NO, воздействует на вышележащий индуктор Env, так же как и на нижележащие NO эффекторы, в вышеописанном процессе, вызывающем блокаду ремиелинизации при поражениях НС.
Кроме того, синергическое действие двух типов соединений (нацеленных на Env и NO, соответственно) повышает быстроту и эффективность терапии у пациентов с не-ремиелинизирующими поражениями, вызванными активацией HERV-W (в частности, ассоциированных с MSRV подтипом, выделенным в качестве частиц вирионов из клеток MS1) и экспрессией его Env белка в нервной системе.
Подробное описание изобретения
В соответствии с первым аспектом, настоящее изобретение относится к лиганду анти-HERV-W Env, применяемому для профилактики и/или лечения блокады ремиелинизации при болезнях, связанных с экспрессией белка оболочки (ENV) HERV-W, в частности его подтипа MSRV.
В настоящем изобретении, термины "блокада дифференцировки" или "блокада ремиелинизации" применяют для обобщения недавно обнаруженного явления, состоящего в (i) ингибировании дифференциации клеток предшественников олигодендроцитов (OPCs, oligodendrocyte precursor cells), вызванном белком оболочки HERV-W (в частности MSRV подтипом), (ii) в конечной продукции NO из OPCs, и (iii) конечном ингибировании продукции миелина OPCs, как описано в Примере 1.
Болезни, связанные с экспрессией белка оболочки (ENV) HERV-W, в частности его подтипа MSRV, определяют как HERV-W ассоциированные заболевания, поражающие нервную систему, которые предпочтительно представляют собой, но не ограничиваются ими, рассеянный склероз (MS, multiple sclerosis), предпочтительно рецидивирующий ремитирующий рассеянный склероз (RRMS, remitting-relapsing multiple sclerosis), прогрессирующий рассеянный склероз, такой как вторичный прогрессирующий рассеянный склероз (SPMS, secondary progressive multiple sclerosis) или первичный прогрессирующий рассеянный склероз (PPMS, primary progressive multiple sclerosis), хроническая воспалительная демиелинизирующая полинейропатия (CIDP2, chronic inflammatory demyelinating polyneuropathy), психические расстройства, такие как шизофрения или биполярное расстройство6, для которых также описано повреждение миелина3-5.
Обычно, поражения при рассеянном склерозе (MS) связаны с иммуно-опосредованной потерей олигодендроцитов и миелиновых оболочек при повреждении аксонов. Так же описано влияние на иммунные клетки, опосредованное белком оболочки (ENV) ретровируса, ассоциированного с рассеянным склерозом (MSRV, Multiple Sclerosis associated retrovirus) из HERV-W семейства эндогенных ретровирусов, в ассоциации с воспалительными поражениями нервной системы (НС)7. Однако, непосредственная патогенность MSRV-Env на глиальные клетки, включающая блокаду ремиелинизации бляшек MS клетками предшественников олигодендроцитов (ОРС), ранее не была известна и никогда не была показана.
Согласно одному аспекту настоящего изобретения, ингибирование вышележащих патогенных воздействий Env на клетки предшественники олигодендроцитов (OPCs) осуществляется за счет лиганда анти-HERV-W Env. Лиганд анти-HERV-W Env по настоящему изобретению определяется его способностью связываться с белком Env.
Термин "связывание" или "присоединение" лиганда означает, по меньшей мере, временное взаимодействие или объединение с антигеном-мишенью, например ENV, включающим фрагменты, содержащие эпитоп.
Согласно настоящему изобретению, HERV-W ENV означает белок, кодируемый геном env любого члена семейства HERV-W, в том числе подтипа MSRV, как определено из последовательностей, определенных в РНК ретровирусных частиц из MS14,27.
Лиганд по настоящему изобретению также может быть определен, как содержащийся внутри рекомбинантного белка scFv (single-chain fragment of variable region, одноцепочечный фрагмент вариабельной области), Fab-фрагмента (fragment antigen binding, участок связывания антигена), антитела, при этом указанное антитело может быть поликлональным, моноклональным, олигоклональным, химеризованным, синтетическим, или гуманизированным, или человеческим антителом. В конкретном аспекте изобретения, антитело, содержащее лиганд, представляет собой гуманизированный или человеческий lg (иммуноглобулин) G, и, более предпочтительно lgG1 или lgG4.
Более конкретно, лиганд по настоящему изобретению содержит, по меньшей мере один, а более предпочтительно каждый из участков, определяющих комплементарность (CDRs, complementary-determining regions), имеющих аминокислотные последовательности SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5 и SEQ ID No. 6.
Вышеупомянутый лиганд содержит по меньшей мере один и, более предпочтительно, каждый из участков, определяющих комплементарность (CDRs), кодируемых SEQ ID No. 25, SEQ ID No. 26, SEQ ID No. 27, SEQ ID No. 28, SEQ ID No. 29, SEQ ID No. 30.
Как указано выше, блокада ремиелинизации также приводит к продукции NO клетками ОРС.Согласно дальнейшему аспекту настоящее изобретение также относится к лекарственному средству, ингибирующему радикал окиси азота, применяемому для профилактики и/или лечения блокады ремиелинизации при заболеваниях, связанных с экспрессией белка оболочки (ENV) HERV-W, в частности его подтипа MSRV.
Болезни, связанные с экспрессией HERV-W ENV определены выше.
В более конкретном аспекте изобретения, лекарственное средство, ингибирующее свободные радикалы окиси азота, или лекарственное средство, ингибирующее NO представляет собой любое лекарственное средство, которое может ингибировать биологическое воздействие NO молекул, также называемых NO радикалами. Лекарственное средство, ингибирующее NO выбирают из Ng-нитро-L-аргинин метилового эфира (L-NAME), S-метил-изотиомочевины (SMT), фумаровой кислоты и диметилфумарата (DMF).
В другом аспекте, настоящее изобретение относится к фармацевтической композиции, объединяющей, по меньшей мере, лиганд анти-MSRV/HERV-W Env, как определено выше, и, по меньшей мере, одно лекарственное средство, ингибирующее радикал окиси азота, как определено выше. Указанную композицию применяют для профилактики и/или лечения блокады ремиелинизации при заболеваниях, связанных с экспрессией белка оболочки (ENV) HERV-W, в частности его подтипа MSRV, заболеваний определенных выше.
Фармацевтический продукт, содержащий лиганд анти-HERV-W Env, как определено выше, и лекарственное средство, ингибирующее окиси азота, как это определено выше, рассматривается как комбинированный продукт для одновременного, раздельного или разнесенного во времени введения для профилактики и/или лечения блокады ремиелинизации при заболеваниях, связанных с экспрессией белка оболочки (ENV) HERV-W, в частности его подтипа MSRV.
Согласно результатам, описанным ниже на мышиных моделях экспериментального аллергического энцефаломиелита (ЕАЕ, experimental autoimmune encephalomyelitis), индуцированного Env, был показан синергетический эффект комбинации лиганда анти-MSRV/HERV-W Env с по меньшей мере одной из NO-ингибирующих молекул, по сравнению с любым из этих терапевтических агентов применяемых по отдельности. Даже при назначении по отдельности, лекарственные средства, ингибирующие радикалы окиси азота, или лиганды анти-MSRV/HERV-W Env демонстрируют терапевтическую эффективность при восстановлении клинического дефицита, как известно, связанного с поражением миелина в ЕАЕ8. Тем не менее, сравнение между (i) лекарственным средством, ингибирующим радикал окиси азота или лигандом анти-MSRV/HERV-W Env и (ii) комбинацией по меньшей мере одного лекарственного средства, ингибирующего радикалы окиси азота, и, по меньшей мере, одного анти-MSRV/HERV-W Env лиганда, демонстрирует большое преимущество в применении этой комбинации в процессе лечения.
Таким образом, отсутствие воспалительных инфильтратов и/или повреждений с воспалительной активностью (например, неактивные бляшки MS) не исключает лечения блокады ремиелинизации, индуцированной Env у больных. Это особенно актуально у пациентов с прогрессирующим MS (первичной или вторичной прогрессирующей формы), которое, как известно, приводит к многочисленным повреждениям без воспалительной активности, которые долго не обнаруживаются при магнитно-резонансной визуализации сигнала с контрастированием гадолинием при большинстве повреждений головного и спинного мозга.
Настоящее изобретение также относится к способу профилактики и/или лечения блокады ремиелинизации при заболеваниях, связанных с экспрессией белка оболочки (ENV) HERV-W, в частности его MSRV подтипа, включающему введение, по меньшей мере, одного лиганда анти-MSRV / HERV-W Env человеку.
В конкретном аспекте, способ дополнительно включает в себя введение, по меньшей мере, одного лекарственного средства, ингибирующего радикалы окиси азота.
В другом аспекте, изобретение относится к способу профилактики и/или лечению блокады ремиелинизации при заболеваниях, связанных с экспрессией HERV-W белка оболочки (ENV), в частности его MSRV подтипа, включающему введение по меньшей мере одного лекарственного средства, ингибирующего радикал окиси азота, человеку.
Краткое описание графических материалов
Фигура 1. Обнаружение белка Env и экспрессия рецептора TLR4 в тканях MS. (А, Б) Анти-Env иммуногистохимия показала наличие Env белка (стрелки) в NAWM близкое к активным хроническим поражениям (Б), но не в белом веществе здорового мозга (А). (В) Olig2-положительные OPCs в непосредственной близости от Env-положительных клеток микроглии в области хронического активного поражения. (Г-Г''') Контрольная здоровая мозговая ткань с PDGFRα (рецептор к фактору роста тромбоцитов α) - положительными OPCs, демонстрирующими ко-экспрессию TLR4 (толл-подобный рецептор 4) (стрелки). (Д-Д''') OPCs в NAWM близкие к активному поражению MS больных, экспрессирующие как TLR4, так и PDGFRα (стрелки). Масштабная полоска: 50 мкм.
Фигура 2. Регуляция экспрессии TLR4 во время ОРС дифференцировки. (А) Количественная ОТ-ПЦР, показывающая прогрессивное понижающую регуляцию экспрессии TLR4 в процессе спонтанной дифференцировки ОРС крысы в культуре в течение периода девяти дней. В качестве гена для контроля экспрессии применяли GAPDH. Данные показаны как среднее значение +/- стандартное отклонение, полученное из 3 независимых экспериментов, t-тест (*** Ρ<0,001). Б, Б') Анти-TLR4 иммуно-окрашивание показало, что при подавлении TLR4, опосредованного малыми шпилечными РНК (shRNA, small-hairpin RNA), трансфецированные OPCs были лишены экспрессии TLR4 (стрелка), что говорит о специфичности антител. Показанные ОРС были зафиксированы через три дня после трансфекции, и трансфецированные клетки проявляли экспрессию eGFP (зеленый флуоресцентный белок). Примечательно, что соседние нетрансфецированные клетки были TLR4 положительным. (В-Г') Репрезентативные примеры галактоцереброзидаза (GalC) / TLR4 -положительных ОРС после трех дней (В, В') и основной белок миелина (МВР) / TLR4 - положительные OPCs после шести дней (Г, Г') спонтанной дифференцировки в культуре. Стрелки в (Г) указывают на более высоко дифференцированные ОРС только с пониженным уровнем экспрессии TLR4, таким образом, отражая данные об экспрессии генов, показанных в (А). Стрелками указана сильная экспрессия менее зрелых клеток.
Фигура 3. Воспалительные эффекты рекомбинантного Env на культуре ОРС крысы. (А, Б, В) Стимулирование ОРС рекомбинантным Env в растворе (А, растворимый Env), рекомбинантным Env, связанным с поверхностью (Б; Env твердый) и Env, связанным с мембраной, (В) экспрессированных в pVI4Env трансфецированных U343 клетках глиобластомы, (Г-Г') приводит к сильной индукции экспрессии iNOS после восьми часов стимуляции в сравнении с соответствующими буферными контролями или ОРС, выращенными в присутствии pVWctrl трансфецируемых U343 клеток глиобластомы (Д-Д'). В пробе рекомбинантного Env уровень эндотоксина составлял <5 EU/мл (Endotoxin Units в мл) как измерено с помощью теста LAL. (Г-Д') анти-Env иммуно-окрашивание трансфецированных pVI4Env и pVWctrl U343 клеток, демонстрирующих поверхностную экспрессию Env. (Е-Ж1) Олигодендроглиальная морфология, как было оценено путем 04 иммуно-окрашивания остается неизменной при стимуляции связанным с поверхностью рекомбинантным Env, как было показано после одного дня (Ε, Е'), также как после пяти дней (Ж, Ж') в культуре. (3) Непрямой спектрометрический анализ супернатантов клеточной культуры для измерения продукта распада NO - нитрита показал значительное увеличение дозозависимых уровней NO в пробах ОРС, стимулируемых растворимым рекомбинантным Env в течение 24 ч. (И-Л) Провоспалительные цитокины, такие как TNF (фактор некроза опухоли)-α, IL(интерлейкин)-1β и IL-6 подвергаются регуляции при стимуляции поверхностно-связанным рекомбинантным Env. GAPDH применяли в качестве контрольного гена. Данные показаны как средние значения +/- стандартное отклонение, и представляют 1 из 6 (А), 8 (Б), 3 (В), 3 (3) и 8 (И-К) независимых экспериментов, соответственно, t-тест (*** Ρ<0,001). Масштабная полоска: 50 мкм.
Фигура 4. Сравнение чувствительности к HERV-W Env у незрелых (в возрате одного дня - ОРС) и зрелых OPCs крысы (в возрасте семи дней; "зрелые OPCs" или олигодендроциты - OL). Оба типа клеток стимулировали 100 нг/мл растворимого рекомбинантного Env. Несмотря на значительную, по сравнению с буферными контролями, активация iNOS и цитокинов в ответ на Env стимуляцию в OLs является менее выраженной по сравнению с ОРС. Для контроля экспрессии применяли ген GAPDH. Данные представлены в виде среднего значения +/- стандартное отклонение, полученного из одного из 3 независимых экспериментов, t-тест (*** Ρ<0,001, ** Ρ<0,01, * Ρ<0,05).
Фигура 5. Env зависимые реакции ОРС человека. (А) Стимулирование культивируемых человеческих ОРС, связанным с поверхностью (твердым) и растворимым рекомбинантным (растворимым) Env, приводит к сильной индукции экспрессии iNOS через 24 ч стимуляции по сравнению с клетками, обработанными буфером. Для контроля экспрессии применяли ген GAPDH. Данные представлены в виде средних значений +/- стандартное отклонение, полученного из одного из 3 независимых экспериментов, t-тест (*** Ρ<0,001). (Б, Б') Иммунофлуоресцентное окрашивание культивируемых GalC положительных ОРС человека выявило сильный сигнал для TLR4 (показано после трех дней в культуре). Масштабная полоска: 50 мкм.
Фигура 6. Эксперименты по нейтрализации Env пути. (А) Тепловая инактивация рекомбинантного Env приводит к устранению индукции гена iNOS по сравнению с нативным рекомбинантным Env после 8 ч стимуляции ОРС. Два образца, нативный Env и денатурированный Env (Env, обработанный температурой), наносили в концентрации 1000 нг/мл. (Б, В) Снижение экспрессии iNOS в ОРС при фармакологическом ингибировании IRAK1/4 и TRIF, соответственно. После этапа 2 ч предварительной инкубации с 3200 нМ ингибитора I IRAK 1/4 (киназа, ассоциированная с рецептором IL-1) или 50 мкМ TRI F ингибирующего пептида ОРС стимулировали связанным с поверхностью (твердым) рекомбинантным Env в течение 8 ч и впоследствии лизировали. (Г) Снижение экспрессии iNOS в ОРС после опосредованной антителом блокады рецепторов TLR4. После этапа 2 ч пре-инкубации с антителом к TLR4 в концентрации 15 мг/мл при 37°С, ОРС стимулировали твердым Env в течение 8 ч и затем лизировали. Для контроля экспрессии применяли ген GAPDH. Данные представлены в виде средних значений +/- стандартное отклонение, и получены из одного из 3 независимых эксперименты каждый, t-тест (***Р<0,001, **Р<0,01). (Д) Увеличение ядерной локализации NFkB после стимуляции ОРС связанным с поверхностью (твердым) рекомбинантным Env в течение 8 часов. Данные представлены в виде средних значений +/- стандартное отклонение, и получены из одного из 3 независимых экспериментов каждый, t-тест (***Р<0,001). (Е-Ж') Репрезентативное NFkB имуноокрашивание буфера (контроль) и стимулированные Env OPCs. Масштабная полоска: 50 мкм.
Фигура 7. Генерация 3-нитротирозин (3-NT) положительных OPCs. (А) Иммунофлуоресцентное окрашивание показало, что после 24 ч Env стимуляции (связанный с поверхностью рекомбинантный Env) значительно больше ОРС экспрессировали NO-зависимый маркер нитрозильного стресса 3-NT по сравнению с обработанными буфером клетками. В качестве положительного контроля был использован S-нитрозо-N-ацетилпенициламин (SNAP), сильный NO донор. Однако, когда ОРС инкубировали с L-NAME, iNOS ингибирующими молекулами, в концентрации 100 мкМ в течение 30 мин при 37°С до Env стимуляции, 3-NT положительность была снижена до контрольного уровня. Неактивный энантиомер D-NAME не может устранить Env зависимую индукцию 3-NT. Данные представлены в виде средних значений +/- стандартное отклонение, и вытекают из одного из 3 независимых экспериментов, t-тест (*** Ρ<0,001). (Б-Е'') Реперезентативное анти-3-NT имунноокрашивание контрольных клеток (Б, Б'), Env стимулированные OPCs (В, В'), OPCs пре-инкубированные с L-NAME (Г, Г'), D-NAME (Д, Д') и OPCs подвергающиеся SNAP (Ε, Ε'). Масштабная полоска: 50 мкм. (Ж-Ж''). Иммуногистофлуоресцентное окрашивание срезов ткани NAWM MS-пациентов показало, что резидентные ОРС (отмеченные экспрессией ими маркера предшественника PDGFRα, стрелки) могут подвергаться нитрозивному стрессу, как показала их 3-NT позитивность.
Фигура 8. Env зависимое ингибирование ОРС дифференцировки. (А, Б) Иммунофлюоресцентный анализ, демонстрирующий, что после одного - трех дней стимуляции связанным с поверхностью рекомбинантным Env, значительно сниженное число ОРС экспрессировало ранний миелиновый маркер CNPase, также как поздний миелиновый маркер MBPas по сравнению с контрольными клетками. Данные показаны в виде средних значений +/- стандартное отклонение, и получены из одного из 4 независимых экспериментов, t-тест (*** Ρ<0,001). (В-В''') и (Γ-Γ') демонстрируют репрезентативное анти-CNPase и анти-МВР иммуноокрашивание контроля и Env стимулированных OPCs. (Д) Инкубация OPCs с 100 мкМ L-NAME в сочетании со связанным с поверхностью рекомбинантным Env в течение трех дней, приводит к упразднению Env-опосредованной блокады ОРС дифференцировки, как показано анти-МВР иммуноокрашиванием. Применение D-NAME оказалось не в состоянии спасти экспрессию миелина. Данные представлены в виде средних значений +/-стандартное отклонение, и получены из одного из 4 независимых экспериментов, t-тест (*** Ρ<0,001, n.s. не существенно). (Ε-3') Репрезентативное МВР иммуноокрашивание ОРС, стимулированных только Env, сочетанием Env и L-NAME и сочетанием Env и D-NAME, соответственно. Масштабная полоска: 50 мкм.
Фигура 9. Экспрессия ОРС маркеров созревания через 24 и 72 часов стимуляции в камерах (labteks) предварительно покрытых MSRV-Env. Нанесенный MSRV-Env (+Env-T), индуцировал снижение доли CNPase положительных ОРС после 24 ч стимуляции (А), а также снижение в процентах МВР положительных ОРС после 72 ч стимуляции (Б), по сравнению с его разбавленным буфером (буфер). Данные представлены в виде среднего значение +/- стандартная ошибка одного эксперимента оцененная в 10 повторах (от 410 до 563 подсчитанных клеток в группе; * p<0,05 t-тест (А) и с 364 по 491 подсчитанных клеток в группе; * Ρ<0,001 ранговый критерий Манна-Уитни (Б)).
Фигура 10. Экспрессия CNPase в ОРС человека после 24 часов стимуляции MSRV-Env и GNbAC1 (гуманизированное моноклональное антитело против MSRV). (А) Нанесенный MSRV-Env вызывает снижение процента CNPase положительных ОРС после 24 ч стимуляции. GNbAC1 при 50 нМ или 200 нМ полностью подавляет эффект MSRV-Env, при обоих тестированных протоколах GNbAC1 обработки (GNbAC1-А или GNbAC1-В). Данные представлены в виде среднего значения +/- стандартная ошибка от 2 до 8 независимых экспериментов (от 705 до 3878 посчитанных клеток в группе). (Б) GNbAC1 (50 nM или 200 nM), нанесенных поодиночке или вместе с BSA (бычий сывороточный альбумин) (1 мкг/мл), при обоих тестированиях протоколах обработки GNbAC1 (GNbAC1-А или GNbAC1-В) не имеет никакого влияния на процент CNPase положительных ОРС. Данные представлены в виде среднего значения +/- стандартная ошибка одного эксперимента оцененная в 10 повторностях (399 до 512 посчитанных клеток в группе; р>0,05; однофакторный дисперсионный анализ (ANOVA)).
Фигура 11. Экспрессия CNPase в культуре ОРС человека после 24 часов стимуляции MSRV-Env и GNbAC1, добавленных в культуральную среду.
MSRV-Env (3 нМ), разведенных в клеточной культуральной среде, значительно снижает CNPase экспрессию после 24 ч обработки. GNbAC1 (200 нМ) полностью ингибирует этот эффект, в то время как он не показывает никакого эффекта в одиночку. Данные представлены в виде среднего +/-стандартная ошибка от 2 до 4 независимых экспериментов (от 927 по 1913 сосчитанных клеток в группе); *р<0,001 против буфера; однофакторный дисперсионный анализ (ANOVA) с последующим апостериорным методом LSD (less significance distance, наименьшая значимая разность) Фишера.
Фигура 12. Экспрессия МВР в культурах ОРС человека после 72 часов стимуляция MSRV-Env и GNbAC1. (А) Нанесенный MSRV-Env (Env-T) индуцирует снижение в процентах МВР положительных ОРС после 72 ч стимуляции. GNbAC1 при 50 нМ частично ингибирует действие MSRV-Env, и это ингибирование является полным при 200 нМ, в обоих тестированных протоколах обработки GNbAC1 (GNbAC1-А или GNbAC1-В). (Б) MSRV-Env (3 нМ), добавленный в среду клеточной культуры, значительно снижает экспрессию МВР после 72 ч обработки. GNbAC1 (200 нМ) полностью ингибирует этот эффект (Б).
Данные представлены в виде среднего значения +/- стандартная ошибка (А) от 2 до 8 независимых экспериментов (от 924 до 4156 подсчитанных клеток в группе) * p<0,05; ** p<0,001 по сравнению с буфером; ψp<0001 по сравнению с Env-T; однофакторный дисперсионный анализ (ANOVA) с последующим апостериорным методом LSD Фишера, и (Б) от 2 до 4 независимых экспериментов (1013 по 1834 посчитанных клеток в группе; *р<0,001 против буфера; ψp<0,001 против Env-T; однофакторный дисперсионный анализ (ANOVA) с последующим последующим апостериорным методом LSD Фишера).
Фигура 13. Экспрессия маркеров созревания ОРС через 24 и 72 часа стимуляции посредством нанесения MSRV-Env и GNbAC1. Нанесенный MSRV-Env индуцирует (А) уменьшение процента CNPase положительных ОРС человека после 24 ч стимуляции, а также как (Б) уменьшение в процентах МБР положительных ОРС человека после 72 ч стимуляции. (A) GNbAC1 (200 нМ) полностью ингибирует действие MSRV-Env, при обоих тестированных протоколах обработки GNbAC1 (GNbAC1-A или GNbAC1-B). Данные представлены в виде среднего значения +/- стандартная ошибка 6 независимых экспериментов (от 2805 по 3039 сосчитанных клеток в группе; * p<0,05 против буфера; ψp<0,05 против MSRV-Env; ранговый критерий Краскела - Уоллиса ANOVA-1 с последующим апостериорным анализом Стьюдент-Ньюман-Кейля и (Б) от 5 до 6 независимых экспериментов (1671 по 2066 сосчитанных клеток на группу; * p<0,05 по сравнению с буфера; ψp<0,05 по сравнению с MSRV-Env; ранговый критерий Краскела - Уоллиса ANOVA-1 с последующим апостериорным анализом критерием Данна).
Фигура 14. Ингибирование созревания ОРС человека, вызванное MSRV-Env, полностью устраняется GNbAC1. Нанесенный MSRV-Env (ENV) индуцирует (А) снижение процента CNPase положительных ОРС человека после 24 ч стимуляции, а также (Б) уменьшение в процентах МБР положительных ОРС человека после 72 ч стимуляции. GNbAC1 (200 нМ) полностью ингибирует MSRV-Env эффект, в обоих тестированных протоколах обработок GNbAC1 (+ GNbAC1 А или + GNbAC1 В). Результаты выражены как процент CNPase (А) или МВР (Б) положительных клеток, и представляют собой среднее значение +/- стандартная ошибка 8-14 независимых экспериментов (3600 по 6800 сосчитанных клеток в группе (А) и 2700 до 5800 сосчитанных клеток в группе (Б)) * p<0,05 по сравнению с CTRL; ψp<0,05 по сравнению с MSRV-Env; ранговый критерий Краскела - Уоллиса ANOVA-1 с последующим апостериорным анализом критерием Данна.
Фигура 15. Ингибирование созревания ОРС человека, вызванное MSRV-Env, полностью устраняется GNbAC1 (нормализованные данные). MSRV-Env наносили на стекла культуральных камер перед посевом ОРС.GNbAC1 (200 нМ), смешивали с MSRV-Env перед нанесением (GNbAC1-А) или инкубировали на культуральных камерах покрытых MSRV-Env (GNbAC1-В). Данные посчитаны как процент (A) CNPase или (В) МВР-положительных клеток и выражены в виде процента изменений условиям CTRL (MSRV-Env буфер). Результаты представляют собой среднее значение +/- стандартная ошибка 8-14 независимых экспериментов (от 3600 до 6800 сосчитанных клеток в группе (А) и от 2700 до 5800 сосчитанных клеток в группе (Б)). *р<0,05 по сравнению с CTRL, ψp<0,05 по сравнению с MSRV-ENV; ранговый критерий Краскела - Уоллиса ANOVA-1 с последующим апостериорным анализом критерием Данна.
Фигура 16. Кинетика клинического показателя ЕАЕ Группы А, Б, В и Ε (А - необработанные ЕАЕ положительные контроли, Б - ЕАЕ, обработанный GNbAd 200 мкг, В - ЕАЕ, обработанный L-NAME, Г - ЕАЕ, обработанный GNbAc 200 мкг + L-NAME).
Фигура 17. Кинетика клинического показателя ЕАЕ Групп А, Б, Г и Ж (А - необработанные ЕАЕ положительные контроли, Б - ЕАЕ, обработанные GNbAd 200 мкг, Г - ЕАЕ, обработанные SMT, Ж - ЕАЕ, обработанные GNbAc 200 мг + SMT).
Фигура 18. Кинетика ЕАЕ клинического показателя ЕАЕ Групп А, Б, Д и 3 (А - необработанные ЕАЕ положительные контроли, Б - ЕАЕ, обработанный GNbAd 200 мкг, Д - ЕАЕ, обработанный DMF, 3 - ЕАЕ, обработанный 200 мкг GNbAc + DMF).
Фигура 19. Кинетика времени на Rotarod при 23 об/мин
Ось X: Дни измеренных значений, в соответствии с протоколом.
Ось Y: Увеличение или уменьшение времени на Rotarod, относительно 7 дня.
А: Группы А, Б, "1 инъекция" и "2 инъекции" Env; Б: Группы А, Б, В и Е;
В: Группы А, Б, Г и Ж; Г: Группы А, Б, Д и 3.
Фигура 20. Кинетика времени на Rotarod при 26 об/мин
Ось X: Дни измеренных значений, в соответствии с протоколом.
Ось Y: Увеличение или уменьшение времени на Rotarod, относительно 7 дня.
А: Группы А, Б, "1 инъекция" и "2 инъекции" Env; Б: Группы А, Б, В и Е;
В: Группы А, Б, Г и Ж; Г: Группы А, Б, Д и 3.
Фигура 21. Кинетика времени на Rotarod при 29 об/мин
Ось X: Дни измеренных значений, в соответствии с протоколом.
Ось Y: Увеличение или уменьшение времени на Rotarod, относительно 7 дня.
А: Группы А, Б, "1 инъекция" и "2 инъекции" Env; Б: Группы А, Б, В и Е;
В: Группы А, Б, Г и Ж; Г: Группы А, Б, Д и 3.
Фигура 22. Кинетика клинического показателя ЕАЕ Групп А, Б, В и Г
(А - ЕАЕ ложно-отрицательные контроли, Б - необработанные ЕАЕ положительные контроли, В - ЕАЕ, обработанный GNbAc 200 мкг, Г-ЕАЕ, обработанный GNbAc 500 мкг).
Фигура 23. Кинетика клинического показателя ЕАЕ Групп А, Б, Д и Ε
(А - ложно-отрицательные контроли ЕАЕ, Б - необработанные ЕАЕ положительные контроли, Г - ЕАЕ, обработанный SMT, Ж - ЕАЕ, обработанный GNbAc 200 мкг + SMT)
Фигура 24. Кинетика клинического показателя ЕАЕ Групп А, Б, Ж и 3
(А - ложно-отрицательные контроли ЕАЕ, Б - необработанные ЕАЕ положительные контроли, Д - ЕАЕ, обработанный DMF, 3 - ЕАЕ, обработанный GNbAc 200 мкг + DMF).
Фигура 25. Кинетика увеличения массы за период исследования
(Относительное увеличение массы по сравнению с днем до первой инъекции иммуногенов): Группы А, Б, В и Г (А - ложно-отрицательные контроли ЕАЕ, Б - необработанные ЕАЕ положительные контроли, В - ЕАЕ, обработанный GNbAc 200 мкг, Г - ЕАЕ, обработанный GNbAc 500 мкг).
Фигура 26. Кинетика увеличения массы за период исследования
(Относительное увеличение массы по сравнению с днем до первой инъекции иммуногенов): Группы А, Б, Д и Ε (А - ложно-отрицательные контроли ЕАЕ, Б - необработанные ЕАЕ положительные контроли, Г - ЕАЕ, обработанные SMT, Ж - ЕАЕ, обработанные GNbAc 200 мкг + SMT).
Фигура 27. Кинетика увеличения массы за период исследования
(Относительное увеличение массы по сравнению с днем до первой инъекции иммуногенов): А, Б, Ж и 3 (А - ложно-отрицательные контроли ЕАЕ, Б - необработанные ЕАЕ положительные контроли, Д - ЕАЕ, обработанные DMF, 3 - ЕАЕ, обработанные GNbAc 200 мкг + DMF).
Фигура 28. Кинетика времени на Rotarod при 16 об/мин
Ось X: Дни измеренных значений, в соответствии с протоколом.
Ось Y: Увеличение или уменьшение времени на Rotarod, относительно Дня 7.
А: Группы А, Б, В и Г; Б: Группы А, Б, Д и Е; В: Группы А, Б, Ж и 3.
Фигура 29. Кинетика времени на Rotarod при 26 об/мин
Ось X: Дни измеренных значений, в соответствии с протоколом.
Ось Y: Увеличение или уменьшение времени на Rotarod, относительно Дня 7.
А: Группы А, Б, В и Г; В: Группы А, Б, Д и Е; С: Группы А, Б, Ж и 3.
Фигура 30. Кинетика времени на Rotarod при 29 об/мин
Ось X: Дни измеренных значений, в соответствии с протоколом.
Ось Y: Увеличение или уменьшение времени на Rotarod, относительно Дня 7.
А: Группы А, Б, В и Г; В: Группы А, Б, Д и Е; С: Группы А, Б, Ж и 3.
Фигура 31. Кинетика клинического показателя ЕАЕ всех групп в течение периода исследования (А - ложно-отрицательные контроли ЕАЕ, Б -положительные контроли ложно-обработанные изотипом антитела, В - ЕАЕ обработанный GNbAc 500 мкг, Г - ЕАЕ, обработанный фумаратом натрия и Д - ЕАЕ, обработанные GNbAc 500 мкг + фумарат натрия).
Список примененных сокращений

Следующие примеры являются иллюстративными и не ограничивают изобретение.
Пример 1: Блокада ремиелинизации, индуцированная белком оболочки HERV-W семейства (ингибирует дифференцировку олигодендроглиальных клеток предшественников при демиелинизированных поражениях нервной системы).
1.1 Материалы и методы
1.1.1. Культура клеток-предшественников олигодендроцитов
Клетки-предшественники олигодендроцитов крысы (OPCS) очищали, как описано ранее22. ОРС хранили в среде для пролиферации (среда Sato, дополненная 10 нг/мл рекомбинантного основного фактора роста - фибробластов человека и 10 нг /мл рекомбинантного тромбоцитарного фактора роста человека -АА; R&D Systems, Wiesbaden-Nordenstadt, Германия), в то время как дифференциацию инициировали средой Sato, дополненной 0,5% фетальной телячьей сыворотки. Фетальные клетки предшественники олигодендроцитов человека (hOPC) и соответствующая среда были получены от 3Н Biomedical, Uppsala, Швеция. Рекомбинантный Env был получен и очищен с помощью РХ PX-Therapeutics (Grenoble, Франция) в соответствии с требованиями QC GeNeuro (Geneva, Швейцария) поставлявших белковые партии. Уровни эндотоксина составляли <5 ЕЭ/мл, как измерено с помощью теста лизата амебоцитов Limulus (LAL). Env стимуляцию проводили при помощи трех различных подходов с применением i) рекомбинантного полноразмерного Env белка, разбавленного в среде для дифференциации при 10 нг/мл, 100 нг/мл и 1000 нг/л, ii) рекомбинантного белка Env, нанесенного на культуральные чашки для клеток при поверхностной концентрации 17,53 нг/см2 и iii) путем посева ОРС на трансфецированные U343 клетки глиобластомы с гиперэкспрессией Env соответственно. Контрольные эксперименты по стимуляции проводили при помощи получения буфера рекомбинантного Env (20 мМ гистидин, 5 масс/об. %) сахароза, 0,01 масс/об. % полисорбат 20, рН 6,0) при равных разведениях. Измерения NO концентрации в супернатанте ОРС проводили с применением колориметрического кита для анализа окиси азота (Merck-Millipore/Calbiochem, Darmstadt, Германия), а поглощение определяли при 540 нм с использованием планшетного ридера Anthos 2001 (Anthos labtec instruments, Salzburg, Австрия). Оценку морфологии ОРС проводили при помощи анти-04 Merck-Millipore/Chemicon, Darmstadt, Германии) с учетом диаметра клеток и степени ветвления процесса. IRAK-1/4 ингибитор I (1-(2-(4-морфолинил)этил)-2-(3-нитробензоиламидо)бензимидазол, N-(2-морфолинилэтил)-2-(3-нитробензоиламидо)бензимидазол; SigmaAldrich, Hamburg, Германия), эксперименты проводились при концентрации 2400 нМ, TRIF ингибирующего пептида (Invivogen, Сан-Диего, США) Эксперименты проводили при концентрации 50 мкМ в соответствии с протоколами производителей. Env инактивацию проводили посредством воздействия на рекомбинантный Env температуры 123°С в течении 1 часа. Эксперименты по блокированию рецептора TLR4-антителом проводили при концентрации антитела 15 мкг/мл. Эксперименты по блокированию L-NAME / D-NAME проводили при концентрации 100 мкМ каждого; S-нитрозо-N-ацетил-DL-пеницилламин (SNAP) применяли в концентрации 100 нг/мл.
1.1.2 Предшественники олигодендроцитов и трансфекция U343 клеток глиобластомы
ОРС выращивали в течение 24 ч в среде для пролиферации, а трансфекцию проводили при помощи реагента NanoJuice (Merck-Millipore, Дармштадт, Германия) с применением кодирующего shRNA TLR4 супрессирующего вектора на основе HuSH 29 pGFP-V-RS вектора (OriGene, Роквилл, штат Мэриленд, США) для доказательства специфичности aHTH-TLR4 антител. Для экспрессии связанного с мембраной Env в U343 клетках глиобластомы вектор9 экспрессирующий цитрин для визуализации трансфецированных клеток комбинировали с повышенной экспрессией Env (pV14 вектор с 1 по 1629 п. н. HERV-W MSRV типа кодирующей последовательности env гена-GenBank AF331500.1- поставленных Geneuro SA, Швейцария) в соотношении 1:5. Соответствующий пустой вектор применяли в качестве контроля. Трансфекцию U343 клеток глиобластомы проводили при помощи Lipofectamine (Life Technologies, Дармштадт, Германия).
1.1.3 Окрашивание тканей рассеянного склероза
Для Olig2/Env двойного окрашивания фиксированные формалином обработанные парафином MS ткани человека нарезали и 5 мкм срезы депарафинировали ксилолом и регидратировали проводкой через различные концентрации спирта и дистиллированной воды. Эндогенную пероксидазную активность подавляли посредством инкубирования предметных стекол в 0,3% -ной перекиси водорода в метаноле. Затем стекла промывали дистиллированной водой и переносили в 10 мМ Трис, раствор 1 мМ ЭДТА (рН 9) для достижения индуцированной теплом демаскировки антигена. Далее, срезы охлаждали до комнатной температуры, промывали в фосфатно-солевом растворе (PBS) и инкубировали с анти- Olig2 (1: 300; Merck-Millipore) и анти-Env антителами 3B2H4 (1: 500, GeNeuro, Женева, Швейцария) в течение ночи при 4°С. Затем срезы инкубировали с Alexa 488-мечеными антителами осла против кролика (1:400; Life Technologies/Molecular Probes, Дармштадт, Германия) с целью выявления Olig2 и Alexa 555-меченого антитела осла против мыши для визуализации Env. Для TLR4 / PGRFRa двойного окрашивания быстро были готовили срезы из замороженной ткани, и 5 мкм срезы инкубировались с анти-TLR4 (1: 100; Merck-Millipore) и анти-PDGFa антителом (1:50; eBiosciences, Сан-Диего, Калифорния, США) в течение ночи при 4°С. TLR4 детектировали с помощью Alexa 488-меченого антитела осла против мыши (1:400; Life Technologies/Molecular Probes) и PDGFRa биотинилированным антителом кролика против крысы (1: 500; Vector Laboratories, Burlingame, СА, США) и Alexa 647-меченым стрептавидином (1: 400; Life Technologies/Molecular Probes), соответственно. Для окрашивания ядер срезы инкубировали с раствором красителя Hoechst (1: 100; Sigma-Aldrich, Гамбург, Германия) в течение 1 минуты и покрывыли Vectashield (Vector Laboratories). Микроскопический анализ проводили на Leica TCS SP 2 AOBS конфокальном лазерном сканирующем микроскопе (Leica Microsystems, Heidelberg, Германия).
1.1.4 Окрашивание культивируемых клеток
Окрашивание фиксированных в формальдегиде культивируемых клеток проводили, как описано ранее22. Первичные антитела были разбавлены следующим образом: am4i-TLR4 антитела (1/1000; Merck-Millipore, Дармштадт, Германия), антитело к Env 3В2Н4 (1/500; GeNeuro, Женева, Швейцария), антитело к 2',3'-циклический нуклеотид 3'-фосфодиэстеразе (CNPase) (1/1000; Covance, Принстон, Нью-Джерси, США), моноклональные антитела против основного миелинового белка (МВР; 1/1000; Convance, Принстон, Нью-Джерси, США), поликлональные антитела против основного миелинового белка (1: 1000; Millipore, Швальбах, Германия), антитела против галактоцереброзида (Gale), анти-04 антитела (оба 1/1000; Merck-Millipore, Дармштадт, Германия); анти-3-NT антитела (1/1000; Abeam, Кембридж, Массачусетс, США) и анти-NFkB антитела (1/1000; Abeam, Кембридж, Массачусетс, США). Alexa Fluor 488- и Alexa Fluor 594-конъюгированные антитела (оба 1: 500,) применяли для визуализации сигнала. Ядра окрашивали 4, 6-диамино-2-фенилиндолом (DAPI; Roche, Базель, Швейцария).
1.1.5 Получение РНК, синтез кДНК и количественная полимеразная цепная реакция с обратной транскрипцией
Очистку РНК из культивируемых клеток проводили при помощи способа RNeasy (Qiagen, Hilden, Германия). Выделенную РНК подвергали обратной транскрипции при помощи высоко-эффективного кита для обратной транскрипции кДНК (Life Technologies/Applied Biosystems). Количественное определение уровня экспрессии генов выполняли на системе 7900 HT обнаружения последовательности (Life Technologies/Applied Biosystems) при помощи Power SybrGreen universal master mix (Life Technologies/Applied Biosystems). Последовательности праймеров определяли при помощи программного обеспечения PrimerExpress 2.0 (Life Technologies/Applied Biosystems) и проверяли специфичность ампликонов:

 и
и  были использованы в качестве референсных генов, а относительные уровни экспрессии генов были определены в соответствии с AACt (Life Technologies / Applied Biosystems). Каждый образец измеряли в четырех повторностях; Данные представлены в виде средних значений +/-стандартное отклонение, и t-тест применяли для определения статистической значимости.
были использованы в качестве референсных генов, а относительные уровни экспрессии генов были определены в соответствии с AACt (Life Technologies / Applied Biosystems). Каждый образец измеряли в четырех повторностях; Данные представлены в виде средних значений +/-стандартное отклонение, и t-тест применяли для определения статистической значимости.
1.2 Результаты
1. 2. 1 Локализация Env белка близка к хроническим активным MS повреждениям и в окрестностях резидентных ОРС
Применяя иммуногистологический анализ мы изучали локализацию белка Env в образце тканей человеческого мозга. Это показало довольно обильное наличие Env белка в NAWM близко к хроническим активным MS повреждениям (CAL, Фиг. 1Б), а также в окрестностях CAL в непосредственной близости от Olig2-положительных ОРС (Фиг. 1Г). NAWM на более дальнем расстоянии до поражений не показывает заметной Env иммунореактивности (Фиг. 1А.). В целях дальнейшего доказательства, потенциального воздействия белка Env на резидентные ОРС и, таким образом, на соответствующую починку миелина, мы, кроме того, искали TLR4 и тромбоцитарный альфа фактор роста рецепторов (PDGFRα) - дважды положительных OPCs. Мы могли обнаружить их в здоровом мозге (Фиг. 1Г-Г''') и в NAWM MS (фиг. 1Д-Д'''). Наглядно было продемонстрировано, что в MS мозге, TLR4-положительные OPCs могут быть обнаружены в непосредственной близости от HERV -W Env экспрессирующих клеток или соответствующего секретируемого белка, что делает их приемлемыми мишенями этих TLR-4 патогенных агонистов, как было описано 10. Тем не менее, это является неожиданный выводом и открывает еще невиданные перспективы для применения, потому что ранее было не известно, что TLR4 экспрессируется при таких условиях в ОРС и, более того, как продемонстрировали позже, потому что HERV-W белок оболочки, такой как MSRV-Env, не может, следовательно, рассматриваться для непосредственного взаимодействия с ОРС на этом конкретном этапе дифференцировки с окончательными драматическим влиянием на их потенциал миелинизации.
1.2.2 TLR4 экспрессия культивируемыми ОРС крысы и человека
Предыдущие исследования, по существу, свидетельствовали о TLR4-зависимом провоспалительном действии на моноциты и клетки дендритов 10. Anti-TLR4 иммунномечение подтвердило экспрессию этого рецептора на поверхности олигодендроглиальных клеток предшественников крысы и человека (Фиг. 2В, В' и 5Б). Кроме того, специфичный shRNA-опосредованный нокдаун TLR4 в ОРС крыс обосновал специфичность предыдущего имуномечения (Фиг. 2Б, Б'). Для того чтобы оценить кинетику экспрессии рецептора TLR4, от молодых до зрелых ОРС, мы провели ко-окрашивания с использованием антител к галактоцереброзиду (GalC), а также антител к основному белку миелина (МВР), маркера для более зрелых ОРС, после трех и шести дней дифференцировки в культуре (Фиг. 2 В-Г'). Неожиданно было обнаружено, что экспрессия гена рецептора TLR4 через некоторое время подавлялась в процессе клеточной дифференцировки (Фиг. 2А), в то время как специфическая детекция белка TLR4 дала только слабый сигнал на поздних временных точках в морфологически зрелых ОРС крысы (Фиг. 2Г), по сравнению с более молодыми клетками.
1.2.3 Стимуляция ОРС Env индуцируемой экспрессией провоспалительных цитокинов и индуцируемой NO-синтазы
Стимуляция ОРС крысы рекомбинантным Env белком, растворенным в среде (растворимый Env; 100 нг/мл; Фиг. 3А), нанесенным на культуральные чашки для клеток (твердый Env;. Рис 3Б) или сверхэкспрессирующимся на поверхности трансфецированных клеток глиобластомы U343 (PV14Env; Фиг. 3В-Д') привела к сильному увеличению транскрипции индуцибельной синтазы окиси азота (iNOS), также как к индукции провоспалительных цитокинов, таких как TNFα; ΙL-1β и IL-6 (Фиг. 3И-Л) по сравнению с контрольными (буфер или пустой вектор для обработки) условиями. В свою очередь, повышенная экспрессия iNOS приводит к зависящему от концентрации Env повышению ее нитрозивного стресса, образуя продукт оксида азота (NO) в клеточных супернатантах (Фиг. 33). Интересно, что морфология ОРС крысы оставалась неизменной в течение Env стимуляции, как было показано O4 окрашиванием олигодендроглии, осуществленным через один и пять дней воздействия Env (Фиг. 3Е-Ж'). GalC-положительные ОРС человека также были найдены, экспрессирующими TRL4 (Фиг 5Б, Б') и стимуляция рекомбинантным Env (как в растворе, так и как нанесенным на поверхность тарелки) аналогично индуцировала iNOS транскрипцию (Фиг. 5А). Кроме того, мы обнаружили, что Env стимуляция не влияет ни на выживание ОРС (как показано с помощью TUNEL и количественной оценки общего числа клеток; данные не представлены), ни на индуцированное старение фенотипа ОРС (исследуемого путем окрашивания на β-галактозидазу; данные не показаны). Env стимуляция созревших ОРС крыс (matOPCs; хранили в среде для дифференцировки в течение шести дней) приводят к существенно более слабой, провоспалительной реакции, что было определено уровнем транскрипции iNOS, TNFα, IL-1b и IL-6, по сравнению с воздействием на незрелые ОРС (Фиг. 4). Это наблюдение в соответствии с данными о более низком уровне экспрессии TLR4, обнаруженном в зрелых ОРС (Фиг. 2), и подтверждает превосходную чувствительность незрелых клеток в отношении Env, соответствующего TLR-4 уровню экспрессии.
1.2.4 Env опосредует свое воздействие через TLR4 и провоспалительный ответ включает в себя IRAK 1/4, TRIF и NFkB
Для того, чтобы доказать специфичность Env к TLR4 и пролить дополнительный свет на нижележащий сигналинг мы провели ряд контрольных опытов (Фиг. 6). Термоинактивация рекомбинантного Env перед ОРС стимуляцией приводит к весьма значительному снижению индукции iNOS по сравнению с контрольной группой (Фиг. 6А). Аналогичное значительное сокращение iNOS транскрипции может наблюдаться при использовании опосредованной антителом блокады TLR4 тем самым подтверждая специфичность Env к этому рецептору и его актуальность в отношении наблюдаемых нижележащих провоспалительных эффектов (Фиг. 6Г). Для того, чтобы пролить свет на внутриклеточные пути TLR4 активации с помощью Env, мы исследовали роль двух известных нижележащих путей следующих за TLR4 активацией, MyD88-зависимый путь с участием IRAK-1/4 (интерлейкиновый рецептор 1-ассоциированная киназа-1/4) и Му088-независимый путь с участием TRIF (TIR-домен содержащий адаптер, индуцирующий интерферон-β). Применение IRAK-1/4 ингибитора I или TRIF ингибиторного пептида привело к значительному снижению уровня экспрессии iNOS в присутствии Env (Фиг. 6Б, В) демонстрируя, что Env-опосредованная активация TLR4 приводит к активации обоих MyD88-зависимого, так же как MyD88-независимого пути передачи сигнала. Оба пути могут сходится на NFkB (ядерный фактор энхансер легкой цепи типа к активированных В-клеток) ядерной транслокации. При помощи энти-NFkB антитела, мы подтвердили, что Env стимуляция приводит к сильному увеличению ОРС с ядерной локализацией NFkB (Фиг. 6Д-Ж"), предоставляя объяснение наблюдаемой активации транскрипции провоспалительных цитокинов.
1.2.5 Env-опосредованная индукция маркера нитрозивного стресса нитротирозина
NO, уровень которого был повышен после Env стимуляции (см. Фиг 33), является активной формой азота (RNS). NO может реагировать со множеством внутриклеточных молекул, включая белки, нуклеиновые кислоты и липиды, что приводит к формированию 3-нитротирозиновых остатков (3-NT). Мы обнаружили, что воздействие рекомбинантных белков Env на ОРС крысы приводит к сильному увеличению 3-NT-положительных клеток по сравнению с буферными контролями (Фиг. 7Б, Б' и В, В'), указывающее на NO-опосредованную индукцию нитрозивного стресса. Однако, после предварительной инкубации с ингибирующими iNOS молекулами L-NAME (метиловый эфир L-NG-нитроаргинина) продукция NO, как было установлено, была значительно снижена (данные не показаны), как и формирование 3-NT положительных ОРС (Фиг. 7Г, Г'). При применении D-NAME, неактивного энантиомера L-NAME, в качестве отрицательного контроля, ENV-опосредованное 3-NT формирование не было затронуто (Фиг. 7Д, Д'). С другой стороны, применение SNAP (S-нитрозо-N-ацетилпеницилламин), сильного NO донора, служило в качестве положительного контроля, и привело к нитротирозинилированию почти всех ОРС (Фиг. 7Е, Ε'). Важно отметить, что 3-нитротирозин положительные ОРС, выявленные за счет экспрессии их маркера предшественника PDGFRα, также могут быть обнаружены в NAWM мозге больных (Фиг. 7 Ж-Ж''), что указывает на патологически схожий стрессорный механизм в MS.
1.2.6 Env влияет на экспрессию миелина в ОРС
После этих находок мы исследовали, может ли Env белок влиять на процессы олигодендроглиальной дифференцировки, которые, как показано, являются необходимыми для способности восстановления миелина. Для этой цели, Env стимулированные ОРС крыс оценивали в отношении уровня экспрессии миелиновых белков CNPase (2',3'-циклический нуклеотид 3-фосфодиэстераза) после трех дней Env стимуляции и МВР (основной белок миелина) после шести дней стимуляции, соответственно. Результаты показали, что Env сильно сокращал количество CNPase и МВР-положительных клеток (Фиг. 8А-Г''') в отличие от неизмененной экспрессии маркера предшественника 04 (Фиг. 3Е-Ж'). Это свидетельствует о значительно нарушенной реакции клеточной дифференцировки при наличии белка Env. Тем не менее, добавление L-NAME, но не D-NAME параллельно с Env стимуляцией может восстановить экспрессию МВР (Фиг. 8Д-3'), что свидетельствует о прямой связи между образованием 3-NT через нитрозивный стресс и уменьшенной способности к дифференциации ОРС.
1.3 Анализ результатов
Неэффективная ремиелинизация НС в нейровоспалительных демиелинизирующих заболеваниях, таких как MS, как полагают, в первую очередь вызывается снижением способности резидентных ОРС к правильной дифференцировки и ремиелинизации демиелинизированных аксонов II-13, но не не было известно ни одной основной и вышележащей патогенной молекулы, вызывающей блокаду такой ремиелинизации. Предыдущие исследования уже показали, что белок оболочки Env из HERV-W, также названный "Ассоциированным с рассеянным склерозом ретровирусным элементом" (MSRV), при получении из соответствующих ретровирусных частиц 14, оказывает провоспалительное влияние на одноядерные клетки, активирующие врожденную иммунную систему, которые, в свою очередь, производят основные провоспалительные цитокины 10. Однако, прямая связь между Env и снижением способности к дифференцировки ОРС до сих пор не была показана, и не могла быть предположена. Здесь мы показали, что этот белок Env может быть обнаружен в MS-пораженной ткани НС, и что Env может мешать дифференцировки ОРС через ранее неизвестное наличие Env рецептора, TLR4, на ОРС на определенной стадии дифференцировки. Этот вредный эффект обусловлен iNOS. Этот стрессорный ответ приводит к формированию нитротирозина и непосредственно влияет на экспрессию миелинового белка. Интересно, что Env стимуляция не влияет на степень выживаемости ОРС клеток, а клеточная морфология оставалась неизменной на основе чего можно предположить, что Env-опосредованные сигналы не нацелены на элементы цитоскелета. Следует отметить и подтвердить новизну неожиданных результатов, предыдущие исследования утверждают отсутствие TLR4 в олигодендроглиальных клетках в человеческом мозге 15. Однако, в отличие от этого мнения мы могли бы четко показать, что TLR4 экспрессируется не только на культивируемых первичных ОРС (как крысиного, так и человеческого происхождения), но также на PDGFRα-положительных резидентных ОРС в MS ткани человека. Такие различия могут происходить из того, что Ленхардт и его коллеги использовали более общий маркер 04 для детекции олигодендроглиальных клеток, а мы опирались вместо этого на недавно принятый маркер предшественника PDGFR-α. Тем не менее, мы впервые показали этот своеобразный паттерн экспрессии TLR4 в ОРС, в то время как в его существование не верили. Кроме того, мы обнаружили, сильное подавление TLR4 при созревании ОРС, что позволяет предположить, что экспрессия рецептора и, следовательно, склонность к Env, ограничены незрелыми клетками. Тем не менее, это открытие является патологически значимым, поскольку делает эти клетки способными взаимодействовать непосредственно с белком Env, который, как показано, экспрессируется и высвобождается при MS поражениях. В свете этих выводов мы заключили, что MSRV/HERV-W Env является не только иммунопатологическим компонентом MS, но также может оказывать существенное негативное влияние на эндогенную способность восстановления миелина. Поэтому было заключено, что утрата способности починки, как это наблюдается у многих пациентов с MS во время болезни, связана с активацией MSRV/HERV - W элементов2. Следует отметить, что предыдущее исследование, описывающие экспериментальное воздействие белка HERV-W Env кодируемого дефектной копией (не проявляющей RT-активности, ни образующей частицы, по причине отсутствия последовательностей кодирования в генах gag и pol) со стабильной вставкой на хромосоме 716. Этот белок Env может быть экспрессирован единственным кодирующим геном HERV-W 7q элемента (env, или ERVW-E1 локус), имеет четырех аминокислотную делецию в С-концевой части своего поверхностного домена, видимо, вызывая свойственную клеточную маршрутизацию и, как известно, обладает in vivo экспрессией на уровне белка ограниченном плацентой 7,18 Этот белок действительно является примером "одомашненного" HERV белка 17, теперь играющего физиологическую роль в формировании синцитиотрофобластической ткани и потому названный "Синцитин"19. Соответствующий домен слияния в HERV-W Env, а также как и TLR4-связывающий домен, могут быть более или менее консервативными между HERV-W подтипами (например, MSRV-Env или Синтицин). Их доступность в качестве поверхностного белка или внеклеточного белка с конформационной экспозицией активного домена строго регулируется, и физиологическая роль синцитина остается в пределах синцитиотрофобласта и ограничивается присутствием в плаценте. Таким образом, связанная патогенность, по-видимому, является отличительным признаком не физиологичной активации, например, за счет определенных инфекционные агентов окружающей среды 20, 21 у людей, или в экспериментальных трансгенных условиях in vivo или in vitro. Как сообщается, синцитин находится в астроглии НС у пациентов с рассеянным склерозом (MS), но использование антител в другом сообщении позволило обнаружить HERV-W MSRV-Env подтип, а не синцитин22. Последовательность синцитина может, тем не менее, быть экспрессирована путем трансгенеза в астроцитах мыши, вызывая высвобождение цитокинов, вредных для олигодендроцитов16, но трансгенные мыши показали нежизнеспособность (личное общение С. Power к Н. Perron, Neurovirology symposium, Сан-Диего, 2007). Тем не менее, в то время как Antony и коллеги обнаружили, что палочка аденоматозного полипоза (АРС) - положительные миелинизирующиеся олигодендроциты уязвимыми к синцитин-опосредованной цитотоксичности в таких мозгах трансгенных мышей, мы смогли продемонстрировать, что только незрелые OPCs значительно подвержены Env-опосредованным провоспалительным сигналам, тогда как зрелые клетки нет. Таким образом, результаты этого исследования, по всей видимости, являются результатами артефактных экспериментальных условий, связанных с их условиями экспрессии, вызванной трансгенезом плацентарного белка в клетках головного мозга. В отличие от этих результатов, выведенных из искусственных условий, авторами показан повреждающий механизм, который направлен на способность эндогенного ремонта нервной системы (НС) взрослого, а не патологию MS, такую, которая заметно показывает иммуноопосредованную потерю олигодендроцитов и миелиновой оболочки при повреждении аксонов. Действительно, ENV-опосредованные эффекты на клетки иммунной системы в ассоциации с воспалительными поражениями NS являются теперь хорошо документированными7,10,23-25, но никакие предыдущие исследования не свидетельствуют о такой прямой патогенности HERV-W Env на глиальных клетках с участием в блокаде ремеилинизации MS бляшек за счет OPCs. Настоящие результаты, связывающие иммуногистологию мозга при MS, показывают сильную экспрессию белка Env в активных MS бляшках или на краю менее активных поражений, теперь поддерживают такую роль в известном дефекте ремиелинизации за счет ОРС при MS поражениях.
Пример 2: Блокада ремелиенизации, индуцированная белком оболочки семейства HERV-W, эффективно обработанным специфичным антителом против Env
Белок оболочки семейства HERV-W (Env, в частности, из ассоциированного с рассеянным склерозом ретровирусного подтипа, MSRV-Env) является мощным ингибитором способности не миелинизирующих ОРС дифференцироваться в миелин производящие зрелые олигодендроциты, которые являются важным этапом в процессе ремиелинизации. Авторы исследовали влияние MSRV-Env белка на экспрессию двух различных маркеров дифференцировки олигодендроцитов:
- CNPase (2',3'-циклический нуклеотид-3'-фосфогидролаза) представляет 4% общего белка миелина и присутствует в цитоплазме не компактизованной олигодендроглиальной оболочки аксонов. CNPase является самым ранним известным миелин-специфическим белком, который синтезируется путем развития олигодендроцитов.
- МВР (основной белок миелина) представляет собой 30% белков миелина и играет важную роль при уплотнении миелина в центральной и периферической нервной системе. Он появляется последовательно после CNPase как in vitro, так и in vivo, и является специфическим маркером зрелых олигодендроцитов. Целью настоящего исследования являлось определение того, могут ли специфические антитела к Env, такие как GNbAC1, рекомбинантное гуманизированное lgG4 моноклональное антитело к Env, блокировать ингибирование созревания ОРС, индуцированное MSRV-Env. В самом деле, такой эффект GNbAC1 будет свидетельствовать о том, что антитела осуществляют "анти-блокаду ремиелинизирующихся клеток". Для того чтобы проверить эту гипотезу, первичную культуру OPCs человека инкубировали с MSRV-Env, с или без GNbAC1, либо путем нанесения рекомбинантного белка на поверхность культуры или путем добавления белка в культуральную среду. Экспрессию CNPase (как раннего маркера созревания) и МВР (как позднего маркера созревания) оценивали путем иммуноцитохимии после одного или трех дней стимуляции, соответственно.
В настоящем примере, MSRV-ENV относится к полноразмерному рекомбинантному MSRV-Env белку, который содержит внутриклеточный, трансмембранный и внеклеточный домены белка оболочки HERV-W.
Представленные здесь результаты показывают, что ОРС человека специфично экспрессируют TLR4 на своей плазматической мембране, и демонстрируют, что рекомбинантный белок MSRV-Env специфически и существенно уменьшает количество CNPase и МВР-поожительных клеток. Эти наблюдения находятся в соответствии с приведенным Примером 1 на ОРС человека и крысы. Кроме того, наши эксперименты показывают, для начального времени, что ингибирование (блокада) созревания ОРС человека, индуцированное за счет MSRV-Env, является полностью устраняемым путем обработки GNbAC1, демонстрируя эти новые и ранее неожиданные лечебные качества. Это в свою очередь обеспечивает дополнительный признак в лечении прогрессирующих форм рассеянного склероза.
2.1 Материалы и методы
2.1.1.Материалы
Материалы, используемые для первичной культуры ОРС человека
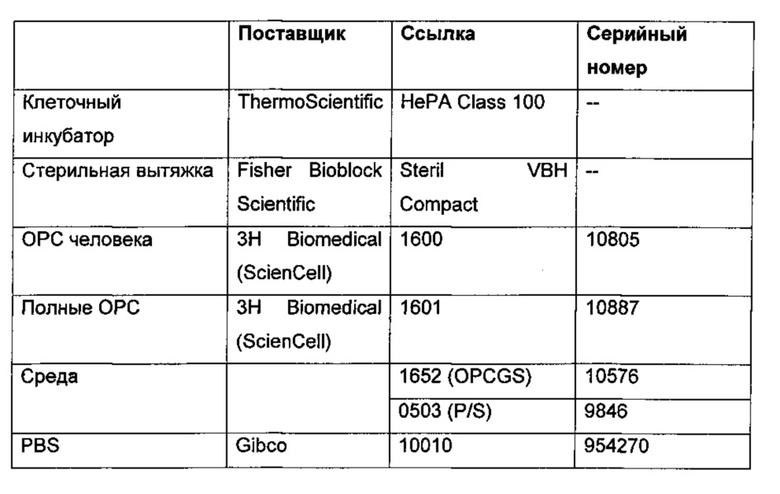

Материалы, применяемые для оценки экспрессии маркеров созревания в ОРС человека
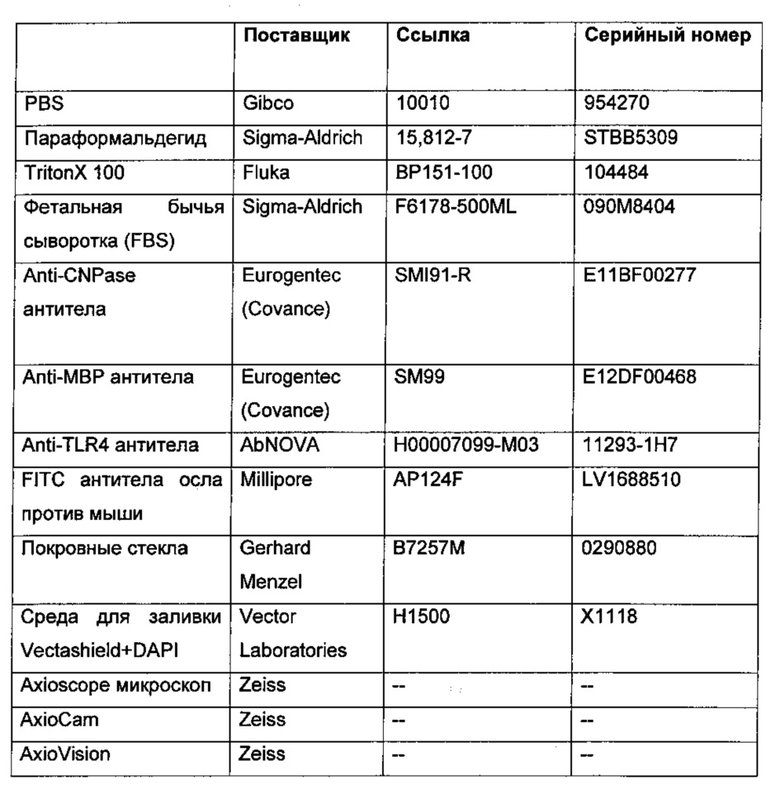
Материалы, используемые для стимуляции ОРС MSRV-Env, GNbAC1 и MSRV-Env буфером
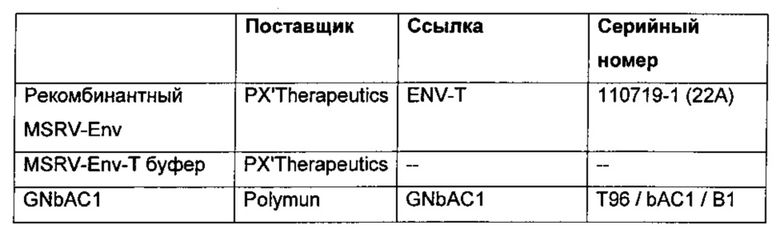
2.1.2 Протоколы
Инкубация ОРС человека с MSRV-Env, MSRV-Env буфером и GNbAC1
Полно-размерный рекомбинантный MSRV-Env был получен и очищен с помощью PX'Therapeutics (548 ак.(аминокислот), 61, 44 кДа) (серия 110719-1). Начальная концентрация составляла 0,6 мг/мл (9,76 мкМ). MSRV-ENV буфер (20 мМ Trizma-HCl, рН 7,5, 150 мМ NaCl, 1,5% SDS, 10 мМ DTT) был предоставлен PX'Therapeutics. Этот раствор использовали в качестве отрицательного контроля. GNbAC1 (Batch Т96/bAC1/В1, производство GMP) был получен и очищен с помощью Polymun Scientific, Вена, Австрия. Начальная концентрация составляла 10 мг/мл (68,03 мкМ).
ОРС человека стимулировали различными способами, либо путем нанесения растворов на поверхность тарелки для культивирования клеток до высева клеток, или путем добавления их в клеточную культуральную среду после посева клеток. В любом случае 8-луночную слайд-камеру labtek (Nunc) предварительно покрывали поли-Ь-лизином (Sigma-Aldrich) в течение ночи при 37°С.
Покрытие стекол 8-луночной камеры Labtek
Различные вещества разводили в PBS в стерильном ламинарном боксе (Fischer Bioblock, Франция), 8 луночные слайд-камеры Labtek (Nunc; 250 мкл на лунку) покрывали следующим образом:
- MSRV-Env (1 мкг/мл) с покрытием в течение 2 ч при 37°С.
- MSRV-Env буфер (такое же разведение, чем MSRV-Env) с покрытием в течение 2 ч при 37°С.
- MSRV-Env + GNbAC1 А1: MSRV-Env (1 мкг/мл) и GNbAC1 (7,35 мкг/мл = 50 нМ) смесь с покрытием течение 2 ч при 37°С.
- MSRV-Env + GNbAC1 А2: MSRV-Env (1 мкг/мл) и GNbAC1 (29,4 мкг/мл = 200 нм) смесь с покрытием в течение 2 ч при 37°С.
- MSRV-Env + GNbAC1 В1: MSRV-Env (1 мкг/мл) с покрытием в течение 2 ч при 37°С, промытые PBS и затем покрытые GNbAC1 (7,35 мкг/мл = 50 нМ) в течение 1 ч при 37°С.
- MSRV-Env + GNbAC1 В2: MSRV-Env (1 мкг/мл) с покрытием в течение 2 ч при 37°С, промытые PBS и затем покрытые GNbAC1 (29,4 мкг/мл = 200 нМ) в течение 1 часа при 37°С.
- GNbAC1 А1 только: GNbAC1 (7,35 мкг/мл = 50 нМ) с покрытием в течение 2 ч при 37°С
- GNbAC1 А2 только: GNbAC1 (29,4 мкг/мл = 200 нМ), с покрытием в течение 2 ч при 37°С.
- GNbAC1 В1 только: PBS в течение 2 ч при 37°С, затем покрытые GNbAC1 (7,35 мкг/мл = 50 нМ) в течение 1 ч при 37°С.
- GNbAC1 В2 только: PBS в течение 2 ч при 37°С, затем покрытые GNbAC1 (29,4 мкг/мл = 200 нМ) в течение 1 ч при 37°С.
- BSA (1 мкг/мл) с покрытием в течение 2 ч при 37°С.
- BSA + GNbAC1 А1: смесь BSA (1 мкг/мл) и GNbAC1 (7,35 мкг/мл = 50 нМ) с покрытием в течение 2 часов при 37°С.
- BSA + GNbAC1 А2: BSA (1 мкг/мл) и GNbAC1 (29,4 мкг/мл = 200 нм) смесь с покрытием в течение 2 ч при 37°С.
- BSA + GNbAC1 В1: BSA (1 мкг/мл) с покрытием в течение 2 ч при 37°С, промытые PBS, а затем покрытые GNbAC1 (7,35 мкг/мл = 50 нМ) в течение 1 ч при 37°С.
- BSA + GNbAC1 В2: BSA (1 мкг/мл) с покрытием в течение 2 ч при 37°С, промытые PBS, а затем покрытые GNbAC1 (29,4 мкг/мл = 200 нМ) в течение 1 ч при 37°С.
Клетки-предшественники культуры олигодендроцитов человека
ОРС, выделенные из головного мозга человека, были приобретены у ScienCell Research Laboratories (через 3 H Biomedical, Швеция). Каждый флакон содержит более 1×106 клеток в 1 мл. Полная ОРС культуральная среда (ОРСМ) была восстановлена путем добавления раствора для роста ОРС (OPCGS) и пенициллина/стрептомицина (P/S) в ОРСМ, в соответствии с рекомендацией производителя (Sciencell).
Флакон, содержащий ОРС человека, помещали на водяную баню при 37°С и осторожно перемешивали путем вращения до полного размораживания содержимого. Клетки осторожно ресуспендировали с помощью пипетки Gilson 1 мл. Затем их разбавляли в полной ОРСМ и засевали в 8-луночные камеры для культивирования labtek (7000 клеток/см2 = 10000 клеток на лунку) предварительно покрытые поли-L-лизином (0,01%, Sigma) и с (или без) обработок, описанных выше (см 3.2.1.1) в стерильном ламинарном боксе (Fisher Bioblock, Франция). Культуры инкубировали при 37°С; 5% СО2 до последующих иммуноцитохимических экспериментов. Питательную среду меняли на следующий день для удаления остаточного DMSO и неприкрепленных клеток в культурах, обрабатываемых в течение 72 ч.
Инкубация в культуральной среде с MSRV-Env
После 3 часов предварительного культивирования (см 3.2.1.2) ОРС человека в 8-луночных камерах для культивирования labtek, клетки инкубировали при 37°С в течение 24 ч или 72 ч в 8-луночных камерах labtek (250 мкл/лунка) с добавлением следующих растворов:
- MSRV-Env буфер, применяемый в качестве отрицательного контроля, добавляли в полную среду для культивирования клеток.
- MSRV-Env, добавленный при 3 нМ (0184 мкг/мл) в полную среду для культивирования клеток.
- MSRV-Env (3 нМ) + GNbAC1 (200 нм; 29,4 мкг/мл) смесь, добавленная в полную среду для культивирования клеток.
- GNbAC1 (200 нМ), добавленный в одиночку в полную среду для культивирования клеток.
Экспрессия TLR4 и маркеры миелинизации в ОРС in vitro
После 24 или 72 ч инкубации, среду для культивирования клеток удаляли и ОРС человека, стимулированные путем обработок, описанных выше (см 3.2.1) фиксировали в растворе параформальдегида (4% PFA в PBS, 250 мкл на камеру) при комнатной температуре в течение 1 часа. Затем их промывали три раза PBS (3×250 мкл на камеру), неспецифические сайты связывания насыщали путем инкубации с 10% фетальной бычьей сывороткой (FBS) в растворе PBS, содержащем 0,1% Тритон ×100 (250 мкл на камеру) в течение 1 ч при 37°С. В случае TLR4 окрашивания, клетки инкубировали с 10% FBS в PBS только (250 мкл на камеру). После насыщения, культуры ОРС инкубировали с раствором первичного антитела в течение ночи при 4°С, разведенного в 10% FBS в растворе PBS (200 мкл на камеру), следующим образом:
- Мышиные антитела к TLR4 1/1000 (после 24 и 72 ч культивирования)
- Мышиные антитела к CNPase 1/200 (после 24 ч стимуляции)
- Мышиные антитела к МВР 1/100 (после 72 ч стимуляции)
Клетки промывали 3 раза в PBS (3×250 мкл на камеру), и инкубировали с раствором вторичного антитела в течение 1 ч при 37°С (250 мкл на камеру), следующим образом:
- FITC-коньюгированные антитела осла против мыши 1/200.
После 3 промывок в PBS (3×300 мкл на камеру) при комнатной температуре, пластиковые камеры отделяли от предметных стекол. Затем предметные стекла помещали в среду для заливки Vectastain®, содержащую DAPI (Vectashield). Окрашивания визуализировали методом флуоресцентной микроскопии с использованием Axioscope микроскопа (Zeiss).
Анализ данных
После 24 часов стимуляции MSRV-Env-T (или контролем), CNPase иммунореактивные клетки подсчитывали в 10 кадров случайно выбранных в камере. Процент CNPase - положительных клеток рассчитывали как:

После 72 часов стимуляции MSRV-Env-T (или контролем), МВР иммунореактивные клетки подсчитывали в 10 случайно выбранных кадрах в камере. Процент МВР-положительных клеток был рассчитан как:

Данные представлены как среднее +/- стандартная ошибка процента CNPase или МВР положительных клеток. Графики получали при помощи GraphPad Software, 5.00 версии для Windows (Сан-Диего Калифорния, США). Непараметрические статистические тесты проводили с помощью Sigma Stat (Чикаго, Иллинойс, США).
Следующие результаты были получены в течение трех независимых серий экспериментов, каждый из которых выполнен с новой ампулой замороженных коммерческих ОРС: ОРС ICC 01, ОРС ICC 02 и ОРС ICC 03.
2.2 Результаты
2.2.1 Экспрессия TLR4 рецепторов в ОРС человека in vitro
Экспрессию TLR4 оценивали при помощи иммунофлуоресцентной микроскопии. Этап насыщения, сделанный без каких-либо детергентов, позволял обнаружить TLR4 только на поверхности клеток. Этот эксперимент подтвердил присутствие рецептора мишени MSRV-Env на клеточной поверхности ОРС человека через 24 и 72 ч первичной культуры (не показано).
2.2.2 Экспрессия CNPase и МВР в ОРС человека in vitro
Морфологию ОРС человека in vitro визуализировали с помощью микроскопии в светлом поле. ОРС представляло тело клетки и в целом два клеточных расширения. CNPase и МВР экспрессии были подтверждены с помощью иммунофлуоресцентной микроскопии после 24 ч и 72 ч в культуре, соответственно (не показаны).
2.2.3 Влияние MSRV-Env с или без GNbAC1 на дифференцировку ОРС человека
Влияние нанесенного MSRV-Env на экспрессию маркеров созревания ОРС человека в первичной культуре (ОРС ICC 01)
Целью этой первой серии экспериментов (ОРС ICC 01) являлось установление условий для первичной культуры ОРС человека, а также протоколов иммуноокрашивания слайд-камер labteks, предварительного покрытых MSRV-Env и CNPase и МВР.
Labtek камеры для культивирования покрывали 1 мкг/мл MSRV-Env перед посевом ОРС человека. В качестве отрицательного контроля (буфера), культуральные камеры инкубировали при тех же условиях, только с буфером MSRV-Env.
Процент CNPase положительных клеток был значительно снижен с 85 +/- 4% в контрольных условиях (буфер) до 69 +/- 6% в ОРС человека, стимулированных в течение 24 ч в камерах labtek предварительно покрытых MSRV-Env (* p<0,05; t-тест) (Фиг. 9А).
После 72 ч культивирования, процент МВР-положительных клеток значительно снизился с 74+1-1% при контрольных условиях (буфер) до 25 +/-3% в labteks предварительно покрытых MSRV-Env (+Εnv-Τ) (* p<0001 ранговый критерий Манна-Уитни) (Фиг. 9Б). Эти результаты показывают, что MSRV-Env ингибирует созревание ОРС человека в миелинезирующих клетках in vitro.
Влияние GNbAC1 на ингибирование созревания ОРС, индуцированного MSRV-Env (ОРС ICC 02)
Целями этой второй серии экспериментов (ОРС ICC 02) являлось подтверждение эффекта MSRV-ENV на дифференцировку ОРС человека и определение того, могут ли MSRV-Env ингибировать дифференцировку ОРС человека при добавлении белка непосредственно в среду для культивирования клеток. Кроме того, мы также протестировали, может ли GNbAC1 ингибировать воздействия MSRV-Env в этой модели.
В случае стимуляции ОРС человека в камерах labtek предварительно покрытых MSRV-Env, GNbAC1 обработки оценивали при двух различных протоколах. Во-первых, labtek культуральные предметные стекла предварительно инкубировали со смесью MSRV-Env (1 мкг/мл) и GNbAC1 (50 нМ или 200 нМ) до посева ОРС (условие GNbAC1-А).
Второй протокол включал в себя последовательное покрытие с MSRV-Env (1 мкг/мл) с последующим покрытием GNbAC1 (50 нМ или 200 нМ) перед посевом ОРС (условие GNbAC1-В).
Влияние MSRV-ENV и GNbAC1 на экспрессию CNPase ОРС человека
После 24 ч стимуляции, значительное снижение процента CNPase положительных клеток с 75 +/- 2% в контрольных условиях (буфер) до 55 +/- 2% наблюдали в labteks, предварительно покрытых 1 мкг/мл MSRV-Env (*р<0,001 по сравнению с буфером; однофакторный дисперсионный анализ с последующим анализом с помощи апостериорного критерия Фишера). Кроме того, стимуляция в камерах labtek, предварительно покрытых 1 мкг/мл BSA, не оказывает влияния на CNPase экспрессию (71 +/- 2%), демонстрируя, что эффект, наблюдаемый с MSRV-Env, является специфичным, так как он не был замечен с контрольным белком (Фиг. 10A).
GNbAC1 значительно ингибирует снижение CNPase положительных клеток, индуцированных в labteks, предварительно покрытых MSRV-Env (Фиг. 10А). Эффект GNbAC1 виден при 50 нМ и 200 нМ, а в двух тестированных протоколах обработки: (I) условие GNbAC1-А, 50 нМ (69 +/- 4%), 200 нМ (80 +/- 2%); (II) условие GNbAC1-В 50нМ (96 +/- 3%) и 200 нМ (76 +/- 4%) (ψp<0,001, однофакторный дисперсионный анализ с последующим анализом с помощи апостериорного критерия Фишера). Кроме того, эффект GNbAC1, по-видимому, зависит от концентрации (Фиг. 10 А).
Дополнительные контрольные эксперименты показали, что ОРС человека, стимулированные в течение 24 ч в камерах labtek, предварительно покрытых одним GNbAC1 (50 нМ или 200 нМ), либо смесью GNbAC1 (50 нМ или 200 нМ)+BSA (1 мкг/мл), не оказывает никакого влияния на экспрессию CNPase по сравнению с контрольным условием (буфер) (р>0,05; однофакторный дисперсионный анализ ANOVA) (Фиг. 10Б). Эти наблюдения были сделаны по двум протоколам обработки GNbAC1, описанных ранее (GNbAC1-A 50 нМ, GNbAC1 200 нМ и GNbAC1-В 50 Нм).
Этот эксперимент также показывает, что даже низкие концентрации MSRV-Env в растворе вызывают значительное снижение процента CNPase положительных клеток после 24 ч, с 78 +/- 2% в контрольных условиях (буфер) до 57 +/- 2% в группе MSRV-Env (*р<0,001 против буфера; однофакторный дисперсионный анализ с последующим анализом с помощи апостериорного критерия Фишера) (Фиг. 11). Кроме того, обработка GNbAC1 (200 нм) полностью противодействует снижению экспрессии CNPase, вызванному MSRV-ENV (76 J_r 2%; Wp<0001 против ENV-T; однофакторный дисперсионный анализ с последующим анализом при помощи апостериорного критерия Фишера). Интересно отметить, что 200 нМ GNbAC1 в одиночку (74 +/- 2%) не оказывает никакого влияния на экспрессию CNPase по сравнению с контрольным условием (буфер) (Фиг. 11).
Влияние MSRV-Env и GNbAC1 на экспрессию МВР в ОРС человека После 72 часов стимуляции, значительное снижение процента МВР положительных клеток с 76 +/- 2% в контролях (буфер) до 57 +/- 1% наблюдается в labteks, предварительно покрытых 1 мкг/мл MSRV-Env (** p<0,001 против буфера; однофакторный дисперсионный анализ с последующим анализом с помощи апостериорного критерия Фишера) (Фиг. 12А). В этом эксперименте было показано, что процент МВР-положительных клеток в ОРС-культура в labteks, предварительно покрытых BSA (1 мкг/ мл), несколько отличался от контроля (буфер) (69 +/- 2%). Однако, BSA также показывал существенно иное влияние по сравнению с MSRV-Env (p<0,001 по сравнению Env-T; однофакторный дисперсионный анализ с последующим анализом с помощи апостериорного критерия Фишера), и, таким образом, показывал, что должны быть изолированы и не оказывать влияния только в этой серии экспериментов, так как не наблюдаются в других экспериментах или с CNPase в этой же серии.
GNbAC1 значительно ингибирует уменьшение МВР-положительных клеток, индуцированных в labteks, предварительно покрытых MSRV-Env (Фиг. 12А). Частичный эффект GNbAC1 появляется при 50 нМ, а полное ингибирование достигается при 200 нм, и в обоих тестированных протоколах обработки: (i) GNbAC1-А 50 нМ (69 +/- 2%) и 200 нМ (73 +/- 2%) и (ii) GNbAC1-В 50 нМ (68 +/- 2%) и 200 нМ (74 +/- 2%) (ψp<0001 против Env-T; однофакторный дисперсионный анализ с последующим анализом с помощи апостериорного критерия Фишера). Кроме того, эффект GNbAC1 по-видимому, зависит от концентрации (Фиг. 12А).
Этот эксперимент также демонстрирует значительное уменьшение процента МВР-положительных клеток от 76+/- 2% в контрольных условиях (буфер) до 55 +/- 2% в клетках, стимулированных добавлением MSRV-Env в культуральную среду (3 нМ) в течение 72 ч (*р<0,001 против буфера; однофакторный дисперсионный анализ с последующим анализом с помощи апостериорного критерия Фишера) (Фиг. 12Б). Кроме того, обработка GNbAC1 (GNbAC1 200 нМ) полностью ингибирует уменьшение МВР экспрессии индуцированной MSRV-Env (76 +/- 2%; ψp<0001 против Env-T; однофакторный дисперсионный анализ с последующим анализом с помощи апостериорного критерия Фишера) (Фиг. 12Б).
Подтверждение GNbAC1 эффектов на ингибирование дифференцировки ОРС индуцируемых MSRV-Env (ОРС ICC 03)
Хотя описанные выше результаты были получены из значительного количества собранных данных, целью этой третьей серии экспериментов (ОРС ICC 03) являлась полное воспроизведение эффекта GNbAC1 при совершенно самостоятельной серии экспериментов.
Влияние MSRV-ENV и GNbAC1 на CNPase и МВР экспрессию в культуре ОРС человека
После 24 ч стимуляции, значительное снижение процента CNPase положительных клеток с 90 +/-1% в контрольных условиях (буфер) до 71 +/-1% наблюдается в labteks, предварительно покрытых MSRV-Env (1 мкг/мл) (* p<0,05; ранговый дисперсионный анализ Крускала-Уоллиса с последующим апостериорным анализом Стьюдента-Ньюмана-Кейлса) (Фиг. 13А). Как описано выше, GNbAC1 (200 нМ) полностью обращает ингибирование экспрессии CNPase, вызванное MSRV-Env при двух GNbAC1 тестируемых протоколах обработок (GNbAC1-90 +/- 2%, GNbAC1-B: 91 +/- 4%) (ψ<0,05 против Env-T; ранговый дисперсионный анализ Крускала-Уоллиса с последующим апостериорным анализом Данна) (Фиг. 13А).
После 72 ч стимуляции, значительное снижение процента МВР положительных клеток с 78 +/- 2% при контрольных условиях (буфер) до 55 +/- 3% наблюдается в labteks, предварительно покрытых MSRV-ENV (1 мкг/мл) в течение 72 ч (* p<0,05 против буфера; ранговый дисперсионный анализ Крускала-Уоллиса с последующим апостериорным анализом Данна) (Фиг. 13Б). Как описано выше, GNbAC1 (200 нМ) полностью меняет ингибирование МВР экспрессии, вызванного MSRV-ENV в двух GNbAC1 тестированных протоколах обработок (GNbAC1-А: 80 +/- 2%, GNbAC1-B: 75 +/- 2%) (WP<0,05 против Env-T; ранговый дисперсионный анализ Крускала-Уоллиса с последующим апостериорным анализом Данна) (Фиг. 13Б).
Объединенные данные экспериментов ОРС ICC 02 и ОРС ICC 03
Результаты, полученные в двух разных сериях экспериментов (OPCICC02 и OPCICCO3), представленные выше, были объединены в одном анализе. Таким образом, данные нанесенные на Фиг. 14 представляют от 8 до 14 независимых экспериментов для CNPase (Фиг. 14А) и МВР (Фиг. 14Б). Этот анализ показывает, что MSRV-Env и GNbAd воздействие на дифференцировку ОРС человека являются высоко воспроизводимыми и последовательными.
Для того, чтобы нормализовать экспрессию данных, контрольное условие (буфер) был использован в качестве референса, и считается 100%. Таким образом, эти результаты показывают, что концентрации MSRV-Env, используемые в настоящей серии, ингибируют 24% количества CNPase положительных клеток (CTRL: 100 +/- 1%; ENV: 76 +/- 1%) и 27% количества МВР-положительных клеток (Ctrl: 100 +/- 2%; ENV: 73 +/- 2%). GNbAC1 (200 нМ) полностью изменяет эффект MSRV-ENV на экспрессию CNPase (GNbAC1-A: 102 +/- 1%; GNbAC1-В 101 +/- 1%) (Фиг. 15А), но также и эффект на экспрессию МВР (GNbAC1-А: 101 +/- 2%; GNbAC1-В 97: +/- 2%) (Фиг. 15Б).
2.3 Анализ результатов
Следовательно, данные из настоящего примера показывают, что MSRV Env индуцирует прочное и высоко воспроизводимое снижение экспрессии двух различных специфических маркеров созревания олигодендроцитов. Таким образом, MSRV Env ингибирует дифференцировку предшественников олигодендроцитов человека в миелинизирующие клетки. Кроме того, наглядно продемонстрировано, что GNbAC1 полностью устраняет вредное воздействие MSRV Env и восстанавливает нормальный уровень CNPase и МВР в этой модели. Эти результаты показывают, что GNbAC1 лечит блокаду дифференцировки ОРС, индуцируемой HERV-W/MSRV-Env. Таким образом, эти результаты подкрепляют инновационное показание GNbAC1 для лечения демиелинизированных поражений, вызванных HERV-W -Env. Они, в частности относятся к прогрессивным формам рассеянного склероза, для которых ремиелинизация является критической, но не происходит от окружающих ОРС MS поражений, в связи с сохраняющимися Env-положительными клетками и секрецией, как показано в Примере 1.
Пример 3: Исследование терапевтических эффектов GNbAC1 антитела, L-NAME, SMT, DMF или фумарата натрия при Экспериментальном Аллергическом Энцефаломиелите (ЕАЕ) на мышиной модели индуцированного гликопротеином олгодендроцитов миелина (MOG, Myelin oligodendrocyte glycoprotrine) и MSRV/HERV-W белком оболочки (Env).
3.А Сравнение между отдельными молекулами (монотерапия) и ассоциации антитела анти-Env с малыми молекулами, ингибирующими Env-индуцированные эффекторы при ОРС блокаде (комбинированная терапия).
3.А.1. Материалы
C57BL/6 мыши из Charles River.
MOG 35-55 EspiKem, Sri (Polypeptide company); ссылка: SC1272.
GNbAd; партия Т950111-8 (Анти MSRV/ HERV-W гуманизированные lgG4 антитела, включающие каждый из участков определяющих комлементарность (CDR), приведенных в SEQ ID No: 1, SEQ ID No: 2, SEQ ID No.3 SEQ ID No: 4, SEQ ID No 5 и SEQ ID No 6.
L-NAME (NG-нитро-L-аргинин метиловый эфир) Sigma; ссылка: N5751-5G партия BCBF4375V
SMT (S) Метилизотио мочевина (Sigma); ссылка: M84445-100G партия STBC1003V
Диметилфумарат (DMF) Sigma; ссылка: 242926-100G партия 2507VBCBH Метоцел МС Sigma; ссылка: 64605-100G партия BCBD9989V
IFA (Sigma) Sigma; ссылка: F5506-10ML партия: 061М8728
РТХ (Коклюшный токсин; Calbiochem); Ссылка: 516561 партия D00128881
PBS (фосфатно-солевой буфер; Lonza); Ссылка 516561; Партия; D00128881
Env (Р'Х Therapeutics); Производственные партии очищенного белка, проверенные на отсутствие эндотоксина (тест LDL<5UL / мл) и биоактивные (Geneuro внутренние тесты QC).
Прибор Rotarod (LE8200; Bioseb Франция)
3.А.2. Методы
Свободные от патогенов мыши женского пола C57BL/6 (6-8 недель) были приобретены у Charles River Laboratories и поддерживались на аппаратуре для животных в течение одной недели до иммунизации. За один день до иммунизации, все мыши были взвешены, а затем оценивались на тесте вращающегося барабана.
Вращающийся барабан
Дни тестирования: 9 и 8 дней до иммунизации. Мышей транспортировали в их домашних клетках, из комнаты, в которой животные содержались, в экспериментальную комнату. Мыши привыкали к экспериментальной комнате в течение 15 мин. В период обучения, каждую мышь помещали на барабан, вращающийся с постоянной скоростью (4 оборотов в минуту), если одна мышь падала, то ее возвращали на вращающийся барабан, до тех пор, пока мыши не становилось комфортно на вращающемся барабане, мыши бегали в течение 120 сек. Всех мышей возвращали в их клетки, скорость увеличивали до 13 об/мин, и мышей снова помещали на вращающийся барабан на 120 сек. Всех мышей возвращали в их клетки, скорость увеличивали до 19 об/мин, и мышей снова помещали на вращающийся барабан на 120 сек. Среда помещения для опытов оставалась постоянной между тестовыми сессиями в отношении температуры, и интенсивности света.
Тестовые дни:
1 день до каждой иммунизации мышей транспортировали в их клетках из комнаты, в которых их держали, в экспериментальную комнату. Мышей приучали к экспериментальной комнате в течение 15 мин. Затем мышей подвергали двум испытаниям при 10 увеличивающихся уровнях скорости, начиная с 7 до 40 об/мин. Отдельные задержки перед падением с вращающегося барабана (для двух испытаний на каждом уровне скорости) регистрировали до 60 сек. Таким образом, для каждого животного определяли подготовку и производительность в системе вращающегося барабана.
Результаты испытаний на вращающемся барабане выражаются в виде кинетики среднего индивидуальной оценки для каждой группы со стандартной ошибкой, указанные в барах, для каждого дня испытания и для каждой тестируемой скорости в требуемом диапазоне для нейромоторного ухудшения в настоящих условиях (от 16 до 29 об/мин).
Они рассчитываются для каждой отдельной мыши, для каждого дня тестирования и для каждого значения скорости, как относительное увеличение или уменьшение времени на вращающемся барабане (до падения), по сравнению с первым тестовым днем при одной и той же скорости (Д-7, перед началом индукции болезни в соответствующих группах). Значение рассчитывается как "Время на вращающемся барабане на день X" - "Время на 7 день для той же мыши с той же скоростью".Цифры показывают кинетику для различных групп на весь период обучения, для характерных дискриминационных значений скорости, при достоверной дифференциации больных от здоровых животных в наших условиях (например, слишком высокие или слишком низкие значениях скорости, либо здоровые падают немедленно или больные способны поддерживать медленное движение).
Данные о начальном весе и производительности своим собственным контролем, прежде чем среднее значение и стандартное отклонение были рассчитаны в группе. Различные группы животных были размещены однородно в каждой клетке, в соответствии с соответствующей информацией, предоставленной, перед каждой экспериментальной серией.
Клиническая оценка
Животных взвешивали и клинически оценивали 5 дней в неделю в соответствии со следующими критериями: 0 = без признаков; 1 = паралич хвоста или гипер-рефлексия задней конечности (ей) или односторонняя слабость задних конечностей; 2 = двусторонняя слабость задних или передних конечностей; 3 = Плюс односторонний паралич или крупный дефицит; 4 = полный паралич задних конечностей или передних; 5 = плюс частичный паралич или крупный дефицит противоположных конечностей; 6 = агония или смерть. Они были взяты из стандартных критериев с тем, чтобы отразить более быструю индукцию повреждений головного мозга и шейного мозга этой моделью.
Мышей взвешивали 3 раза в неделю по понедельникам, средам и пятницам в течение все экспериментов.
Для серии экспериментов Примера З.А, группы определяли следующим образом.
Все группы 6 (шесть) мышей впервые прививали подкожно в области шеи на день 0, затем сбоку спины на 7 и 14 день; 200 мкг MOG / мышь+60 мкг MSRV-ENV+IFA.
Группа А являлась положительной контрольной группой MSRV-Env, индуцирующей ЕАЕ без какого-либо лечения.
Для групп Ж-3, обработку GNbAc1, L-NAME, SMT и DMF отдельно или совместно с GNbAd при дозах, указанных ниже, проводили на 12 день после иммунизации, когда уже наблюдалось прогрессирование клинических симптомов ЕАЕ. GNbAd гуманизированное антитело вводили один раз, a L-NAME или SMT вводили каждые 4 дня до прекращения исследования на 29 день. Что касается групп Д и З, относимых к лечению DMF, мы определили объем ежедневно расходующейся воды для каждой мыши, и установили, что (в наших условиях), каждая мышь потребляет около 3,5 мл питьевой воды в день. Таким образом, на основе этих измерений, дозу в 1 мг DMF + 0,08% Methocel добавляли в 3,5 мл питьевой воды на мышь ежедневно.
350 нг коклюшного токсина (РТХ) на животное, вводили (i.p.) во всех группах на тот же день после каждой инъекции иммуногена, и воспроизводили через 2 дня, как обычно в протоколах ЕАЕ, чтобы облегчить миграцию лимфоцитов через кровь - гематоэнцефалический барьер.
Обобщенная презентация экспериментальных групп в Примере 3.А
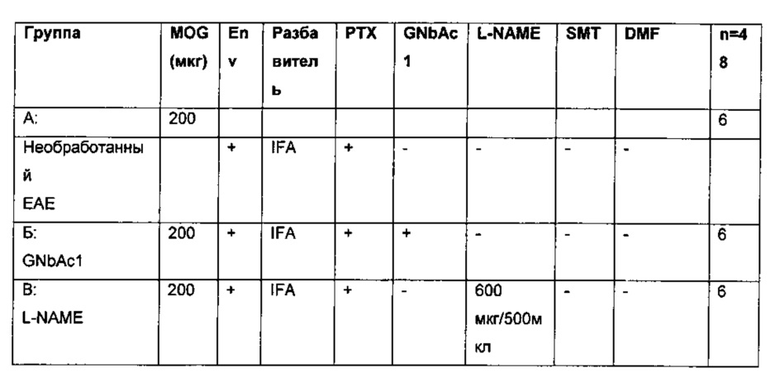
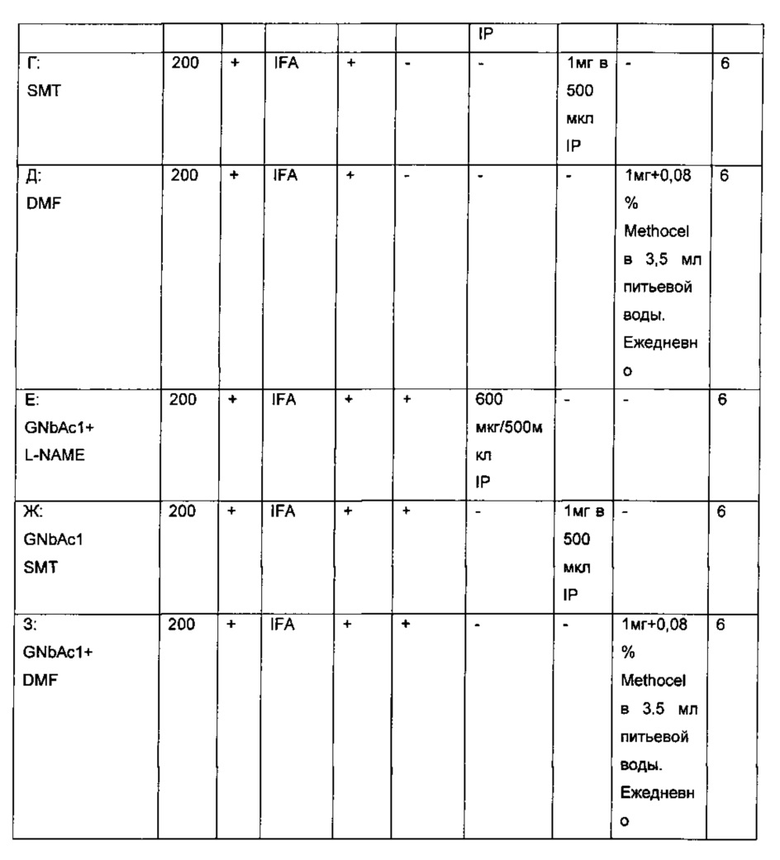
3.А.3 Результаты Клинические наблюдения
Оценку клинических признаков и массы регулярно проводили, как описано выше. Счет кинетики ЕАЕ за исследуемый период представлен на Фиг. 16, 17 и 18.
Регулярное и постоянное развитие ЕАЕ клинических показателей, таких как гипер-рефлексия, паралич хвоста, слабость задних конечностей, передних конечностей и частичный паралич, мог быть зафиксирован у всех мышей до конца опытов в группе А (ЕАЕ положительный контроль) и до 12 дня в других группах, которые были обработаны на 12-й день GNbAd гуманизированными антителами (группа Б) или анти-свободных радикалов (группа В, Г, Д) по отдельности или группами, которые были обработаны одновременно GNbAd и анти-свободными радикалами (группы Е, Ж, 3).
Наблюдения после обработки: клинические признаки в группе Б, обработанной только 1 раз с GNbAd, слегка уменьшались до дня 29. В группах, обработанных только L-NAME, SMT, нерегулярное восстановление можно было наблюдать, но с уменьшением прогрессирования ЕАЕ. Следует отметить, что на + 16 день, введение SMT было прервано.
Что касается групп Д, Ж и 3, обработанных одновременно GNbAd и L-NAME, SMT и DMF соответственно, восстановление было гораздо более значительным и, в частности, в группах Ж и 3. Эти результаты показывают, что синергические эффекты значительно ускоряют и увеличивают симптомы ЕАЕ. Стоит также отметить, что лечение этими веществами не вызывает каких-либо отклонений в любой группе мышей (в том числе контрольных мышей, испытуемых отдельно).
По результатам, представленным на Фиг. 16, 17 и 18, можно резюмировать, что:
- наиболее повышенный клинический показатель (при худшем развитии заболевания) засвидетельствован у необработанных животных (группа А). Животным, обработанным только GNbAC1 (группа Б), становится лучше после его введения (начиная с 12-го дня).
- группы, обработанные L-NAME или SMT только, имели более низкие показатели восстановления и кинетику, чем группа Б.
- группа Д, обработанная DMF, и группа Е, обработанная GNbAd (200 мкг разовая доза) в сочетании с L-NAME имели эквивалентное восстановление к концу исследования.
- Группа Ж, обработанная антителами GNbAC1 в сочетании с SMT, и группа Н, обработанная GNbAC1 антителами в сочетании с DMF, имела значительно лучшее восстановление в конце исследования и более раннюю кинетику клинического улучшения, чем все другие группы. Это демонстрирует синергическое усиление объединения GNbAC1 и SMT или GNbAC1 и DMF, для значительного улучшения терапевтического результата.
Испытание на вращающемся барабане
Прежде всего, должно быть четко указано, что группы с надписью "1 инъекция" и "2 инъекции" на Фиг. 19 соответствуют контрольным животным, которым вводили только один раз (1) или два раза (2) Env белок и MOG антиген, по сравнению с тремя инъекциями Env белка и MOG антигена, требуемых, чтобы вызвать клиническое проявление ЕАЕ, как у всех других группах. Они представляют контрольных мышей, подверженных Env ниже патогенного порога и без индукции клинической картины заболевания. Они подтверждают, что для того, чтобы все животные были протестированы при различных обработках, индуцированных в развитии острой и серьезной ЕАЕ симптоматики и постепенного изменения, требуется подобная картина трех инъекций. Таким образом, терапевтические эффекты, наблюдаемые у обработанных животных, актуальны для эффективности лечения в текущих и прогрессирующих заболеваниях.
В соответствии с результатами, представленными на Фиг. 19, с показателями испытания на вращающемся барабане при 23 об/мин, мы можем увидеть, что:
- Физические усилия при 23 об/мин достигают достаточного порога для того, чтобы раскрыть основные сенсорные и моторные дисфункции у животных: не обработанная группа А имеет худший результат и кинетику, в то время как животные с однократной или двукратной инъекцией ("1 инъекция или 2 инъекции"), имеют значительно более слабые симптомы и более заметные изменения. Уничижительный и прогрессивный клинический дефицит в контрольной группе Б подтверждает, что болезни и соответствующие повреждения NS были очень активными при 3 инъекции Env. Поэтому все другие группы с различными обработками подвергались подобной сильной индукции заболевания Env.
- Группа Б с ЕАЕ, обработанная одной инъекцией 200 мкг GNbAC1, имеет восстановленные показатели, сходные с таковыми контрольных мышей без индукции болезни с низким воздействием на Env, в конце периода исследования.
- Самый примечательный эффект, в этих условиях, обнаружен для группы Ж, обработанной GNbAC1 антителом в сочетании с SMT, которая, кажется, имеет яркую кривую кинетики восстановления заканчивающуюся при лучших показателях всех групп в конце исследования. Это демонстрирует синергическое усиление объединения GNbAC1 и SMT для значительного улучшения терапевтического результата.
- Группа Г обработанная SMT также имеет только улучшенные кинетику и результаты (последняя точка периода исследования), хотя и в меньшей степени.
По результатам, представленным на Фиг. 20, полученным при помощи барабана, вращающегося с 26 об/мин мы видим, что:
- Физическое усилие при 26 об/мин подтверждает, что эти условия являются выше порога требуемого в данном эксперименте для обнаружения важной чувствительной и моторную дисфункции у животных: контрольная группа А имеет худшие результаты и кинетику, в то время как животные, которым вводили только один раз или дважды ("+1 инъекция или 2 инъекции"), имеют значительно более слабые симптомы и более заметные изменения (очень хорошие параметры на конец исследуемого периода для группы "1 инъекция").
- Группа Б с ЕАЕ, обработанная одной инъекцией 200 мкг GNbAC1, имеет восстановленные параметры, похожие на Г, Ж, В, Д и 3 групп и "2 инъекции" контроль, в конце периода исследования.
- Самый примечательный эффект, в этих условиях, свидетельствовал о том, что группа Е, обработанная GNbAC1 антителами в сочетании с L-NAME, по всей видимости, имеет хорошую кривую кинетики восстановления, заканчивающуюся лучшим результатом всех групп в конце исследования. Группа В, обработанная L-NAME только также имеет улучшенную кинетику и результат, хотя и в меньшей степени. Это демонстрирует синергическое усиление объединения GNbAC1 и L-NAME для значительно улучшенного терапевтического результата.
По результатам, представленным на Фиг. 21 при испытании на барабане, вращающемся с 29 об/мин мы видим, что:
- Физические усилия при 29 об/мин до сих пор подтверждают, что эти условия выше порога, необходимого для инициации главных сенсорных и моторных нарушений у животных: контрольная группа А имеет наихудший результат и кинетику, в то время как животные, инъецированные только один или два раза ("1 инъекция или 2 инъекции"), имеют значительно более слабые симптомы и более заметные изменения с аналогичными хорошими результатами в конце исследования.
- Группа Б с ЕАЕ обработанной за счет одной инъекции 200 мкг GNbAC1 имеет восстановленные показатели, похожие на контрольных мышей без индукции болезни индукции с низким воздействием на Env, в конце периода исследования.
- Самый примечательный эффект, в этих условиях, свидетельствует, что группа Е, обработанная GNbAC1 антителами в сочетании с L-NAME, что до сих пор, кажется, имеет хорошую кривую кинетики восстановления заканчивающуюся лучшим результатом всех групп (конец исследования). Группа В обработанная L-NAME имела улучшенную кинетику и результаты, хотя и в меньшей степени.
Еще одним общим примечательным результатом является систематическое улучшение мышей из группы Б, обработанных только GNbAC1, который всегда показывает в значительной степени стабилизированные и/или улучшенные показатели по сравнению с необработанными животными (группа А) во всех условиях (от 16 до 29 об/мин тестов).
Тем не менее, это очевидная эффективность выявляется значительно усиленной, путем сочетания GNbAd с L-NAME или SMT. Она была также улучшена путем сочетания с DMF, но с более медленной кинетикой. В любом случае, это не исключает улучшение с оптимизированными дозами и на более длительный срок лечения.
Таким образом, во всех условиях тестирования (в том числе клинические показатели) сочетание SMT, L-NAME или DMF с GNbAC1 обеспечило значительное преимущество для клинико-функционального восстановления по сравнению с использованием любой терапевтической молекулы, испытанной в одиночку. Сами по себе малые молекулы, по всей видимости, имеют более низкие и довольно переходные эффекты, в то время как GNbAC1 имеет долгосрочные последствия, обеспечивающие лучшее восстановление в конце исследования по сравнению с этими небольшими лекарственными средствами, таким образом, показывая длительную эффективность.
Кинетика и амплитуда окончательного восстановления, будучи значительно улучшенной за счет комбинаций, теперь показано преимущество использования комбинации данных терапевтических средств для их синергических и целевых эффектов на функциональное восстановление в условиях in vitro. Это демонстрирует указание на раннюю и более мощную клиническую эффективность при заболевании человека.
3.Б. Сравнение терапевтической эффективности двух доз анти-Env антитела, данных по отдельности в качестве монотерапии или в комбинации с анти-NO лекарственными средствами.
3.Б.1 Материалы и методы:
Если не указано конкретно, все материалы и методы, являются такими, как описано в Примере ЗА.
Экспериментальные группы
Обобщенная презентация экспериментальных групп Примера 3.Б
DMF
DMF
Все мыши получали три инъекции подкожно на шее в L0, на дорсальной стороне Д7 и Д14. Здесь, мышам из группы А вводили только MOG 200 мкг/ мышь и IFA без Env, что представляет собой группу отрицательного контроля без ЕАЕ в данной серии (ctrl -). Группа положительного контроля с не леченным ЕАЕ в данной серии представлена группой Б (Ctrl +). Другой группе вводили 200 мкг MOG/мышь + MSRV-ENV (60 мкг) + IFA, с процедурами, как указано в вышеизложенной презентации. Лечение было начато на 12-й день после иммунизации в соответствующих группах.
Группы В, Д, Ж получили 200 мкг GnbAd при J12; Группы Г, Е, 3 получили 500 мкг GnbAd при J12; Группа Б получила только GNbAd раствор буфера.
Группы Д и Ε получили IP инъекцию SMT (200 мг/мышь) два раза в неделю при J12, J14, J19, J21, J26 и J28.
Для групп Ж и З, получающих DMF, мы предварительно определили объем ежедневного потребления воды каждой мышью, и определили, что (в наших условиях), каждая мышь потребляет около 3,5 мл питьевой воды в день. Таким образом, на основе этих измерений, дозу в 2 мг DMF + 0,08% Метоцел на мышь добавляли к 3,5 мл питьевой воды ежедневно.
Для каждой тестовой скорости вращающегося барабана, результаты были подтверждены при кривых соответствующих необработанным мышам с ENV-индуцированной ЕАЕ (группа Б, представляющая собой контроль с необработанной ЕАЕ) показали значительный дефицит по сравнению с ложными контролями (группа А, иммунизированная MOG разведенным в IFA без Env белка). Результаты считались "не интерпретируемыми" всякий раз, когда такие критерии не были подобраны, как соответствующие технические и экспериментальные условия, следовательно, не проходящими контролю качества на основе этого значительного расхождения кривых "Положительных против отрицательных ЕАЕ" групп.
После 20-ого дня, была сделана внутривенная (IV) инъекция 20 мкг MSRV-Env в физиологическом растворе, для создания системной острой проблемы с помощью MSRV-Env белка у всех мышей, когда значительное клиническое улучшение (ремиссия-подобное) было получено при большинстве обработок у мышей ЕАЕ. Это было сделано на день Д21 для мышей групп Б, Г, Ε и 3, или на день Д22, для мышей групп А, В, Д и Ж, это было выполнено с целью изучения реакции различных групп с острой Env антигенемии, и оценки возможных различий в защитной эффективности различных методов лечения.
3.Б.2 Результаты
Клинические наблюдения
Показатели клинических показателей и вес регулярно оценивались, как описано выше. Кинетика клинических показателей ЕАЕ в течение периода исследования представлены в Фиг. 22, 23 и 24. Кривые массы, указывающие на относительную массу по сравнению с днем до первой инъекции иммуногенов, представлены на Фиг. 25, 26 и 27.
Испытание на вращающемся барабане
Результаты исследований на вращающемся барабане представлены при разных скоростях (16; 26; 29 об/мин) на фигурах 28, 29 и 30.
Эта серия экспериментов касается влияния среды (200 мкг) по сравнению с высокой концентрацией (500 мкг) терапевтического GNbAC1 антитела в качестве монотерапии, также были проведены аналогичные сравнения при сочетании с SMT и DMF.
Глобальное сравнение кривых клинического показателя за период исследования было обосновано, так как (I) необработанная Env-индуцированный ЕАЕ (группа Б) имеет наиболее неблагоприятные изменения и (II) ложные иммунизированные контроли без ЕАЕ (группа А) не имеют обнаруживаемые клинические признаки сверх периода, предшествующего внутривенной инъекции (I.V.) Env на 20-й день.
До внутривенной инъекции на 20-й день, все обработанные группы значительно отличались от необработанного Env-индуцированного ЕАЕ. На 20-й день обработанные группы с различной кинетикой заболевания за период исследования имели сопоставимые показатели со средним значением ниже 0,5, что указывает на период ремиссии во всех обработанных группах. Это подтверждает эффективность всех доз антител и всех протестированных комбинаций как с DMF так и SMT.
В дальнейшем задача с внутривенной (IV) инъекцией Env белка на 20 день, мимикрировала пик экспрессии Env и его освобождение в кровь, как ожидалось, во время инициации нового и тяжелого рецидива, естественно, возникшего заболевания. На Фигурах 22, 23 и 24, пояснены значительные различия в терапевтической активности различных продуктов и доз:
1) GNbAC1 показал высокую эффективность в придании устойчивости данному пику Env антигенемии при дозировке 500 мкг (группа Г), но временные клинические нарушения были обнаружены при дозе 200 мкг (группа В).
2) В случае комбинации с SMT, не было замечено существенных вариаций клинических параметров при двух дозах GNbAC1 (группы Д & Е). Таким образом, SMT присвоена повышенная устойчивость к IV MSRV-Env, для мышей, получивших низкую дозу GNbAC1 (200 мкг) по сравнению с мышами, которых лечили только антителом при этой более низкой дозе (группа В).
3) Мыши, обработанные DMF, показали клиническую резистентность к данному пику антигенемии, когда также обработаны более высокой дозировкой GNbAC1 (группа 3), но не смогли предотвратить клинические нарушения при низкой дозировке (группа Ж). DMF, таким образом, не обеспечивает повышенную устойчивость к IV MSRV-Env у мышей, обработанных наименьшей дозировкой GNbAC1 (200 мкг). Мыши, обработанные DMF и более высокими дозами GNbAC1 (500 мкг, в группе 3) демонстрировали сопоставимую устойчивость, по сравнению с мышами, обработанными только GNbAC1 в той же дозе (группа Г).
4) Кривые, показывающие увеличение массы в течение периода исследования во всех группах неожиданно показали, что группа Г, обработанная GNbAC1 при 500 мкг, имела лучшую конечную точку.
5) GNbAC1 при 200 мкг (группа В) или DMF с GNbAC1 но при более высокой дозе (Группа 3), дали конечные точки, эквивалентные ложным контролям.
Это указывает на то, что, помимо относительной эффективности различных способов лечения, показанных с показателем клинической кинетики:
- GNbAC1 антитела сами по себе в высоких дозах (500 мкг) демонстрируют лучшую клиническую эффективность. Они также оказали положительное влияние на общее здоровье животных, как показано посредством динамики роста массы.
- В сочетании с GNbAC1 при более низкой дозе (200 мкг), SMT показал значительно большую эффективность для лечения, с полной устойчивостью к окончательной проблеме MSRV-Env IV.
Это указывает на то, что GNbAC1 демонстрирует самое сильное лечение, поскольку обеспечивает лучшие результаты при более высокой дозе (500 мкг), но, и при своей низкой дозе (200 мкг), оно усилено в сочетании с SMT, которое эффективно предотвращает клиническое обострение после пика Env антигенемии созданной IV инъекцией в конце исследования.
Кроме того, эти результаты также показывают, что более высокие дозы GNbAC1, сами по себе или в комбинации с настоящими дозами DMF, обеспечивают существенное усиление в терапевтической эффективности в отношении общего состояния здоровья (в соответствии с кривыми роста массы).
Тем не менее, возможная синергия SMT или DMF с GNbAC1 при более высоких дозах, если имеются, не возможна, поскольку антитело само по себе уже обеспечивает максимальную терапевтическую эффективность при настоящих условиях индукции заболевания и активности в ЕАЕ у мышей.
Параллельно испытание на вращающемся барабане объективно подтверждает, при всех соответствующих скоростях (Фиг. 28А, 29А и ЗОА), что более высокая дозировка GNbAC1 (500 мкг/мышь) является наиболее эффективным продуктом (назначаемым отдельно) в улучшении неврологического дефицита обработанных Env индуцированных ЕАЕ мышей.
Испытание на вращающемся барабане также подтверждает синергетические эффекты SMT с GNbAC1, в тоже время, показывающий неврологическое улучшение животных, обработанных низкими дозами GNbAC1 в сочетании с SMT, демонстрирующими значительное нейромоторное улучшение при 26 и 29 об/мин (Фиг 29Б и 30Б). При 16 об/мин (Рис 28Б), низкая скорость, казалось, не обеспечивает достаточно дискриминирующей способности для подтверждения этого клинического улучшения за исследуемый период.
Наконец, результаты на вращающемся барабане показывают улучшение Env-индуцированных ЕАЕ у мышей с DMF при обеих дозах GNbAC1, но это становится ясно значимым при 29 об/мин только (Фиг. 30В).
Следовательно, принимая во внимание результаты этой цели и автоматизированные тесты, оценивающие неврологическую производительность животных, GNbAC1 является, по-видимому, надежным лечением, когда дается в качестве монотерапии, как показано в примере 3.Б. Синергетические эффекты с молекулами анти-NO, как видно с GNbAC1 при более низкой дозе с SMT, также четко свидетельствуют и указывают на мощное терапевтическое усиление. Это должно быть при различных дозировках GNbAC1, но не может быть обнаружено в нынешних условиях с уже максимальными эффектами 500 мкг из GNbAC1.
3.В. Сравнение между анти-Env антителом или фумаратом натрия поодиночке (монотерапия) и анти-Env антитела с фумаратом натрия (в сочетанной терапии).
3.В1 Материалы и методы
Материал
Экспериментальные группы
3.В.2 Результаты Клинические наблюдения
Оценку клинических признаков и массы регулярно проводили, как описано выше. Показатель кинетики ЕАЕ за исследуемый период представлен на Фиг. 31 31.
Группа А, представляющая отрицательные контроли инъецированные IFA, MOG без Env белка и инъекции плацебо антител, содержащих его буфер разбавитель, не демонстрировала значительные клинические симптомы в течение периода исследования.
Постепенное изменение ЕАЕ клинических показателей может быть зафиксировано до 12-ого дня в группах, которые были обработаны на 12-й день с GNbAd гуманизированными антителами (группа В) или с фумаратом натрия, DMF-связанными анти свободных радикалов окиси азота (анти-NO), по одиночке в группе Г или одновременно с GNbAd в группе Е.
Интересно здесь только группы, получившие высокие дозы GNbAC1 антитела (В и Д) показали значительное возвращение своих показателей клинических кривых и значительно улучшенную конечную точку в конце исследования. Группа Г, обработанная только фумаратом натрия не показала какого-либо значительного клинического улучшения по сравнению с группой Б, обработанной неэффективным изотипом контрольного антитела (Перекрывающиеся величины погрешностей на кривых). Регулярное и постоянное развитие ЕАЕ клинических показателей могут быть записаны во всех мышах вплоть до конца опыта в группе Б (Env-индуцированной ЕАЕ), обработанной изотипом контрольного антитела без специфичности к белку Env. Это указывает на то, что терапевтические эффекты, наблюдаемые с GNbAC1, являются специфическими для этого, в частности, антитела и не имеют отношения к инъекции любого гуманизированного антитела с тем же изотипом который, например, не будет нацелен на тот же эпитоп.
Таким образом, этот последний пример показывает, что:
- Контрольная группа А без введения Env белка ведет себя как здоровые контроли без клинических признаков, несмотря на инъекции всех других компонентов требуемых, чтобы сводить на нет Env-индукцию ЕАЕ (IFA и MOG), а также сводить на нет инъекции антитела (Разбавители антитела); ложной доставки водорастворимого фумарата натрия, являющимся неявно предоставленным за счет нормальной питьевой воды.
- Самый повышенный клинический показатель (при худшем развитии заболевания) зарегистрирован у животных, обработанных нерелевантным изотипом контрольного антитела (Группа Б). Эта инъекция ложного изотипа антител в присутствии Env белка, таким образом, демонстрирует положительный контроль ЕАЕ с типичным постепенным изменением ЕАЕ.
- Группа Г, обработанная только фумаратом натрия, имела неблагоприятный исход в конце исследования, схожий с группой Б, обработанной неэффективными контрольными антителами.
- Группы В и Д, обработанные высокими дозами GNbAC1 антител по-отдельности или в сочетании с фумаратом натрия, имели эквивалентное и значительно лучшее восстановление в конце исследования. Клиническое улучшение появилось на 15-й день, после начала лечения.
Здесь, поскольку фумарат натрия в одиночку не оказывал никакого эффекта и, поскольку кривые динамики групп В и Д эквивалентны, терапевтический эффект, наблюдаемый в этих двух группах должен быть полностью и исключительно вызван GNbAC1, в то время как фумарат натрия показал неэффективность.
3.Г Анализ общих результатов Примера 3
В заключение, по отдельности или в комбинации, лечение при помощи анти-Env специфичных антител, таких как GNbAd и антител против свободных радикалов окиси азота (анти-NO) соединений, таких как DMF, SMT или L-NAME, являются предпочтительными, благодаря лечению и предотвращению блокады потенциальной активности ремиелинизации, вызванной HERV-W белком оболочки, в частности, MSRV-Env, in vitro и in vivo.
GNbAc1 при высокой дозировке (500 мкг/мыши около 20-25 г) также показал эффективность по сравнению с низкой дозой (200 мкг), данной в качестве монотерапии в настоящих примерах.
Ссылки:
1. Perron H, Garson JA, Bedin F, et al. Molecular identification of a novel retrovirus repeatedly isolated from patients with multiple sclerosis. The Collaborative Research Group on Multiple Sclerosis. Proc Natl Acad Sci US A. 1997; 94: 7583-8.
2. Perron H, Germi R, Bernard C, et al. Human endogenous retrovirus type W envelope expression in blood and brain cells provides new insights into multiple sclerosis disease. MaltScler. 2012; 18: 1721-36.
3. Bruno S, Cercignani M and Ron MA. White matter abnormalities in bipolar disorder: a voxel-based diffusion tensor imaging study. Bipolar Disord. 2008; 10:460-8.
4. Goghari VM, Rehm K, Carter CS and MacDonald AW. Sulcal thickness as a vulnerability indicator for schizophrenia. Br J Psychiatry. 2007; 191: 229-33.
5. Stevens JR. Neuropathology of schizophrenia. Arch Gen Psychiatry. 1982; 39:1 131-9.
6. Perron H, Hamdani N, Faucard R, et al. Molecular characteristics of Human Endogenous Retrovirus type-W in schizophrenia and bipolar disorder. Τ ransl Psychiatry. 2012; 2: e201.
7. Perron H, Jouvin-Marche E, Michel M, et al. Multiple sclerosis retrovirus particles and recombinant envelope trigger an abnormal immune response in vitro, by inducing polyclonal Vbeta16 T-lymphocyte activation. Virology. 2001; 287: 321-32.
8. Delarasse C, Smith P, Baker D and Amor S. Novel pathogenic epitopes of myelin oligodendrocyte glycoprotein induce experimental autoimmune encephalomyelitis in C57BL/6 mice. Immunology. 2013.
9. Heinen A, Kremer D, Gottle P, et al. The cyclin-dependent kinase inhibitor p5 7kip2 is a negative regulator of Schwann cell differentiation and in vitro myelination. Proc Natl Acad Sci USA. 2008; 105: 8748-53.
10. Rolland A, Jouvin-Marche E, Viret C, Faure M, Perron H and Marche PN. The envelope protein of a human endogenous retrovirus-W family activates innate immunity through CD14/TLR4 and promotes Th1-like responses. J Immunol. 2006; 176: 7636-44.
11. Chang A, Tourtellotte WW, Rudick R and Trapp BD. Premyelinating oligodendrocytes in chronic lesions of multiple sclerosis. N Engl J Med. 2002; 346: 165-73.
12. Kuhlmann T, Mirón V, Cui Q, Wegner C, Antel J and Bruck W. Differentiation block of oligodendroglial progenitor cells as a cause for remyelination failure in chronic multiple sclerosis. Brain. 2008; 131: 1749-58.
13. Kremer D, Aktas O, Hartung HP and Kury P. The complex world of oligodendroglial differentiation inhibitors. Ann Neurol. 2011; 69: 602-18.
14. Komurian-Pradel F, Paranhos-Baccala G, Bedin F, et al. Molecular cloning and characterization of MSRV-related sequences associated with retrovirus-like particles. Virology. 1999; 260:1-9.
15. Lehnardt S, Massillon L, Follett P, et al. Activation of innate immunity in the CNS triggers neurodegeneration through a Toll-like receptor 4-dependent pathway. Proc Natl Acad Sci USA. 2003; 100: 8514-9.
16. Antony JM, van Marie G, Opii W, et al. Human endogenous retrovirus glycoprotein-mediated induction of redox reactants causes oligodendrocyte death and demyelination. Nat Neurosci. 2004; 7: 1088-95.
17. Bork P, Brown NP, Hegyi H and Schultz J. The protein phosphatase 2C (PP2C) superfamily: detection of bacterial homologues. Protein Sci. 1996; 5: 1421-5.
18. Blond JL, Béseme F, Duret L, et al. Molecular characterization and placental expression of HERV-W, a new human endogenous retrovirus family. J Wrol. 1999; 73: 1 175-85.
19. Mi S, Lee X, Li X, et al. Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis. Nature. 2000; 403: 785-9.
20. Ruprecht K, Obojes K, Wengel V, et al. Regulation of human endogenous retrovirus W protein expression by herpes simplex virus type 1: implications for multiple sclerosis. J Neurovirol. 2006; 12: 65-71.
21. Ruprecht К and Perron H. Exposure to infant siblings during early life and risk of multiple sclerosis. JAMA. 2005; 293: 2089; author reply -90.
22. Roebke C, Wahl S, Laufer G, et al. An N-terrninally truncated envelope protein encoded by a human endogenous retrovirus W locus on chromosome Xq22.3. Retrovirology. 2010; 7: 69.
23. Perron H, Germi R, Bernard C, Garcia-Montojo M, Deluen С and Farinelli L. Human Endogenous Retrovirus type W Envelope expression in blood and brain cells provides new insights into Multiple Sclerosis disease. Multiple Sclerosis journal. 2012; DOI: 10.1177/1352458512441381.
24. Perron H and Lang A. The human endogenous retrovirus link between genes and environment in multiple sclerosis and in multifactorial diseases associating neuroinflammation. Clin Rev Allergy Immunol. 2010; 39: 51-61.
25. Firouzi R, Rolland A, Michel M, et al. Multiple sclerosis-associated retrovirus particles cause Τ lymphocyte-dependent death with brain hemorrhage in humanized SCID mice model. J Neurovirol. 2003; 9: 79-93.
| название | год | авторы | номер документа |
|---|---|---|---|
| Применение трис-(2-гидроксиэтил)аммониевой соли 1-бензилиндолил-3-тиоуксусной кислоты в качестве ингибитора активности эндогенного ретровируса человека HERV-E λ 4-1 env | 2022 |
|
RU2801797C1 |
| АНТИРЕТРОВИРУСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО, НАЦЕЛЕННОЕ НА ЭНДОГЕННЫЙ РЕТРОВИРУС ЧЕЛОВЕКА | 2015 |
|
RU2689326C1 |
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛИРОВАНИЯ СОЗРЕВАНИЯ ДЕНДРИТНЫХ КЛЕТОК, СОДЕРЖАЩАЯ ГИБРИДНЫЙ БЕЛОК Rv2299c/ESAT-6 | 2017 |
|
RU2733886C2 |
| АГЕНТЫ И СПОСОБЫ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ДОМЕНА EDA ФИБРОНЕКТИНА | 2006 |
|
RU2430738C2 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА | 2008 |
|
RU2492234C2 |
| ЖИВОТНАЯ МОДЕЛЬ, ЭКСПРЕССИРУЮЩАЯ ЛЮЦИФЕРАЗУ ПОД КОНТРОЛЕМ ПРОМОТОРА ОСНОВНОГО БЕЛКА МИЕЛИНА (MBP-LUCI), И ПРИМЕНЕНИЕ МОДЕЛИ ДЛЯ ВИЗУАЛИЗАЦИИ БИОЛЮМИНЕСЦЕНЦИИ IN VIVO | 2010 |
|
RU2601128C2 |
| ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА С ПОМОЩЬЮ ВНУТРИОПУХОЛЕВОГО И/ИЛИ ВНУТРИВЕННОГО ВВЕДЕНИЯ РЕКОМБИНАНТНОГО MVA, КОДИРУЮЩЕГО 4-1BBL (CD137L) И/ИЛИ CD40L | 2019 |
|
RU2830601C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИММУНОМОДУЛЯЦИИ | 1997 |
|
RU2192281C2 |
| РЕКОМБИНАНТНАЯ ВАКЦИНА ПРОТИВ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА 1 ТИПА | 2006 |
|
RU2317107C2 |
| СПОСОБ ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ | 2010 |
|
RU2579659C2 |









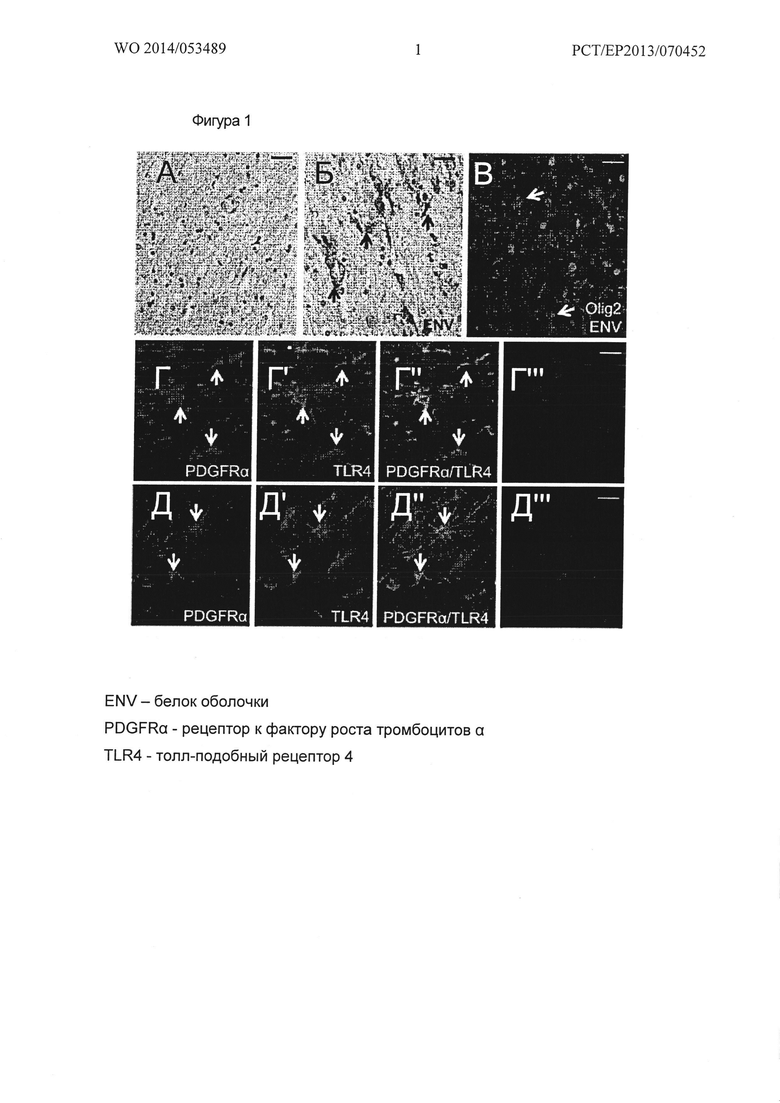
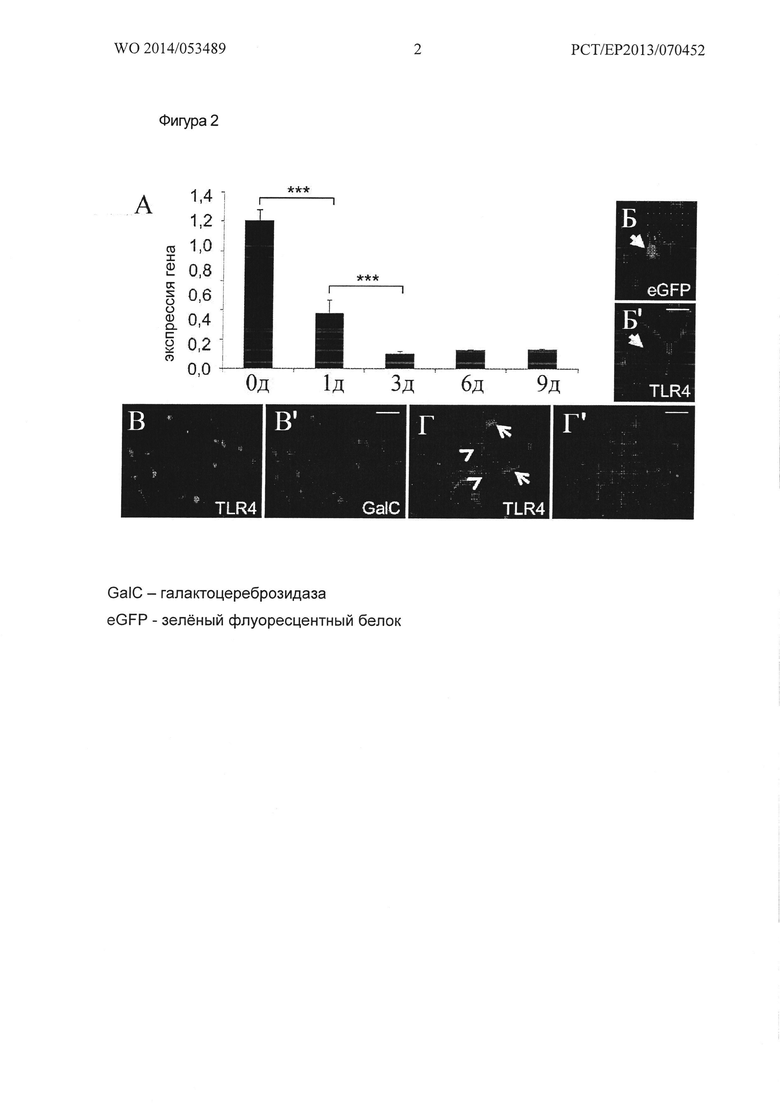
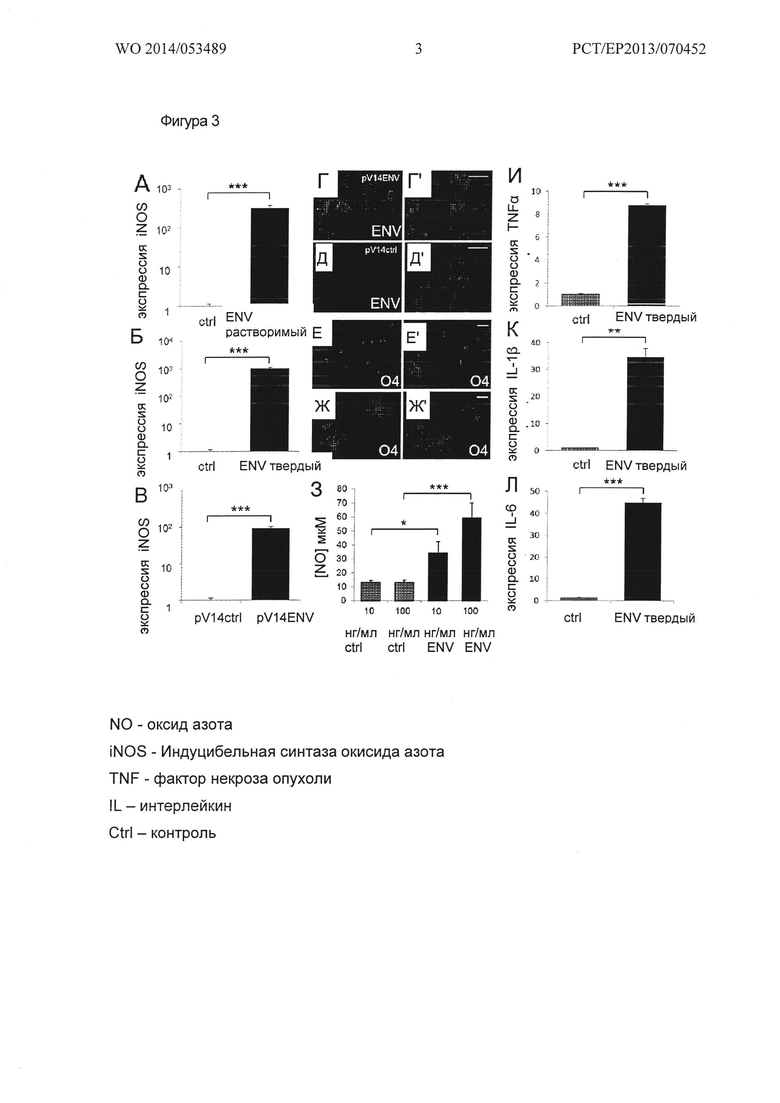
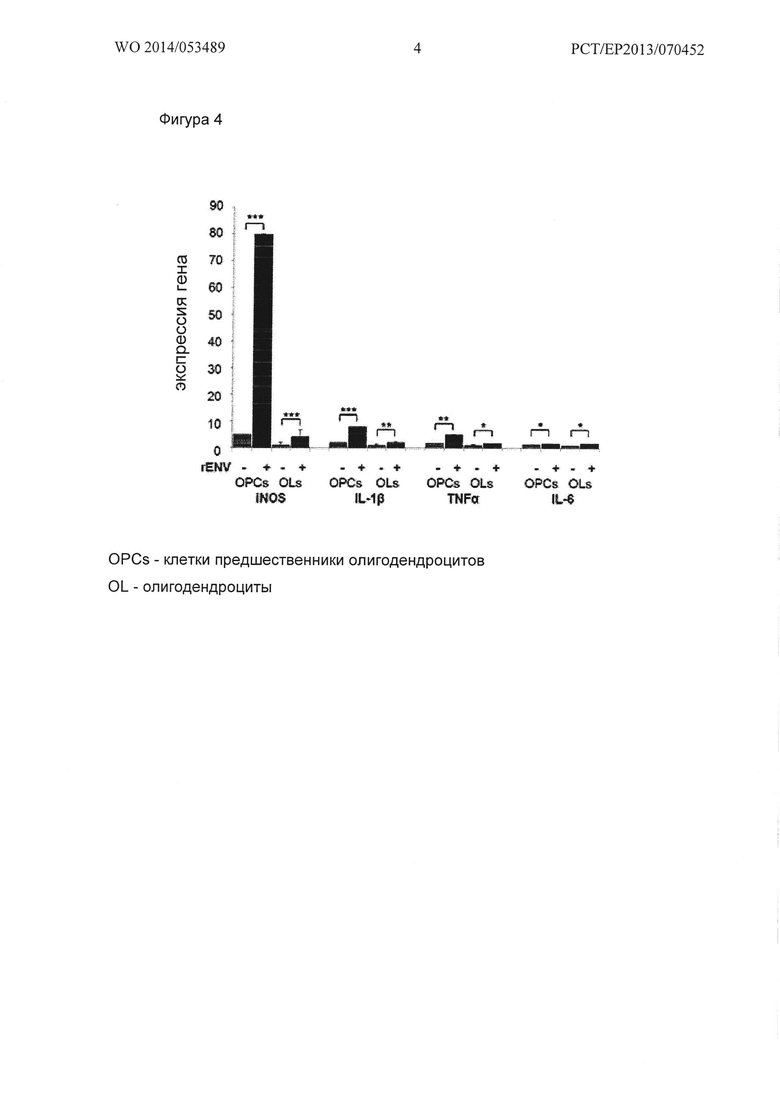
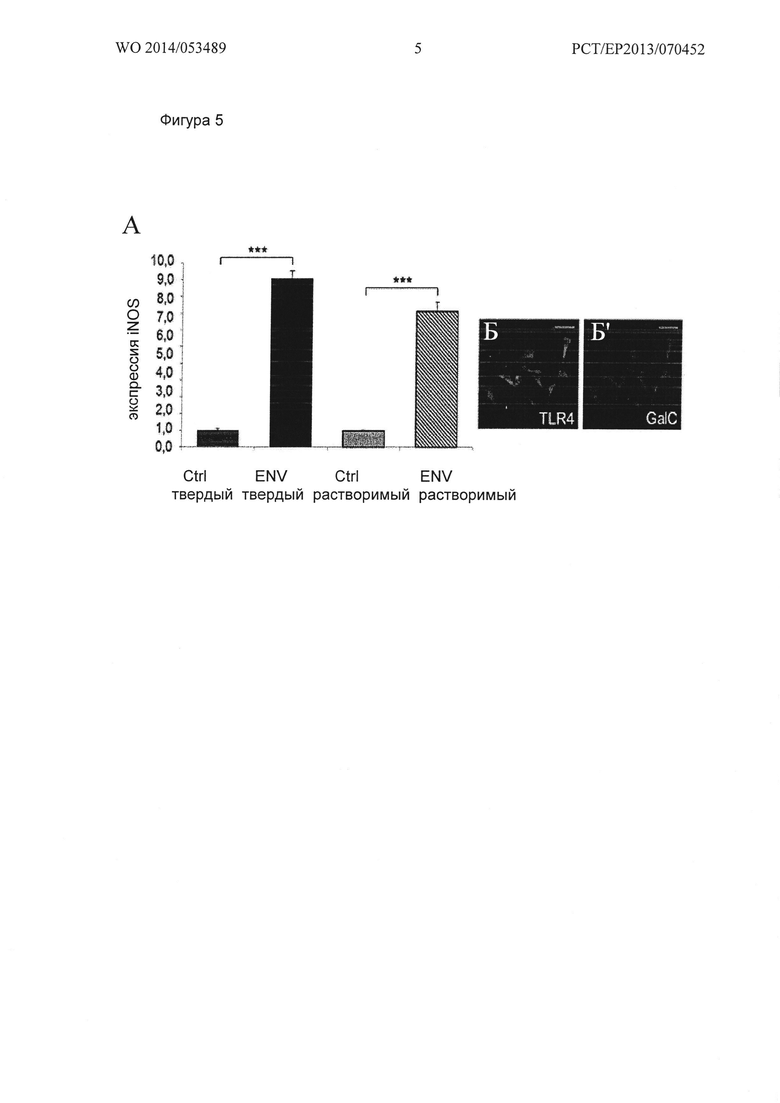
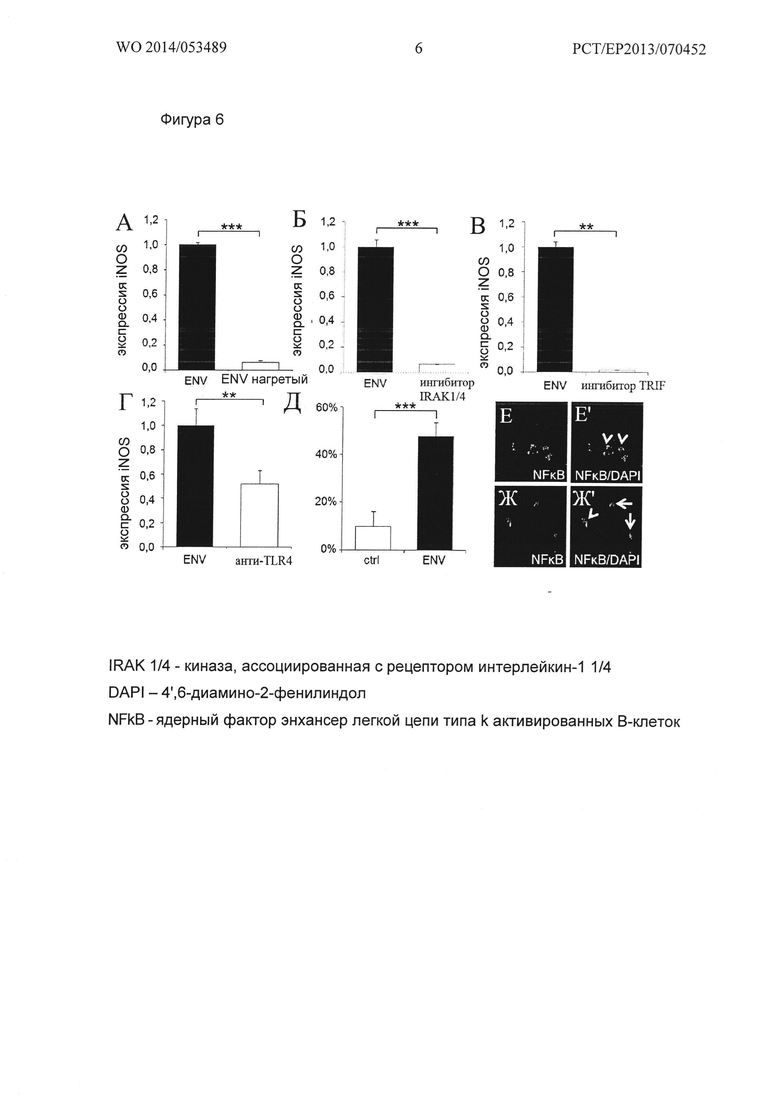
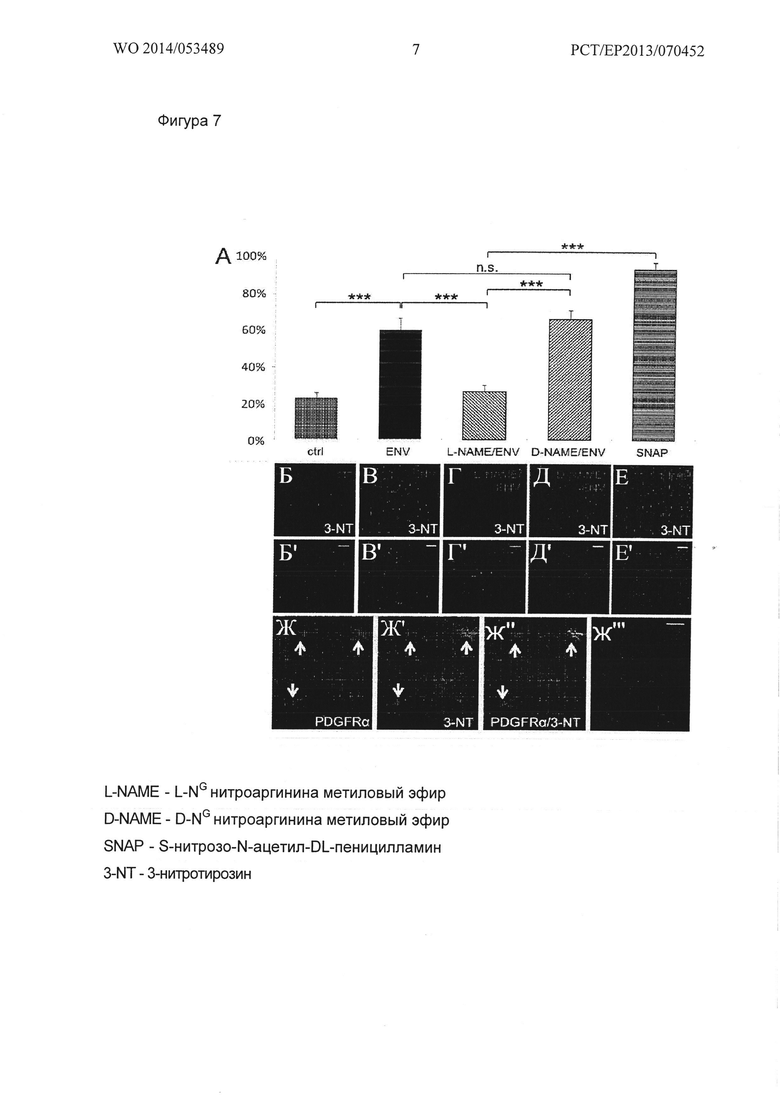
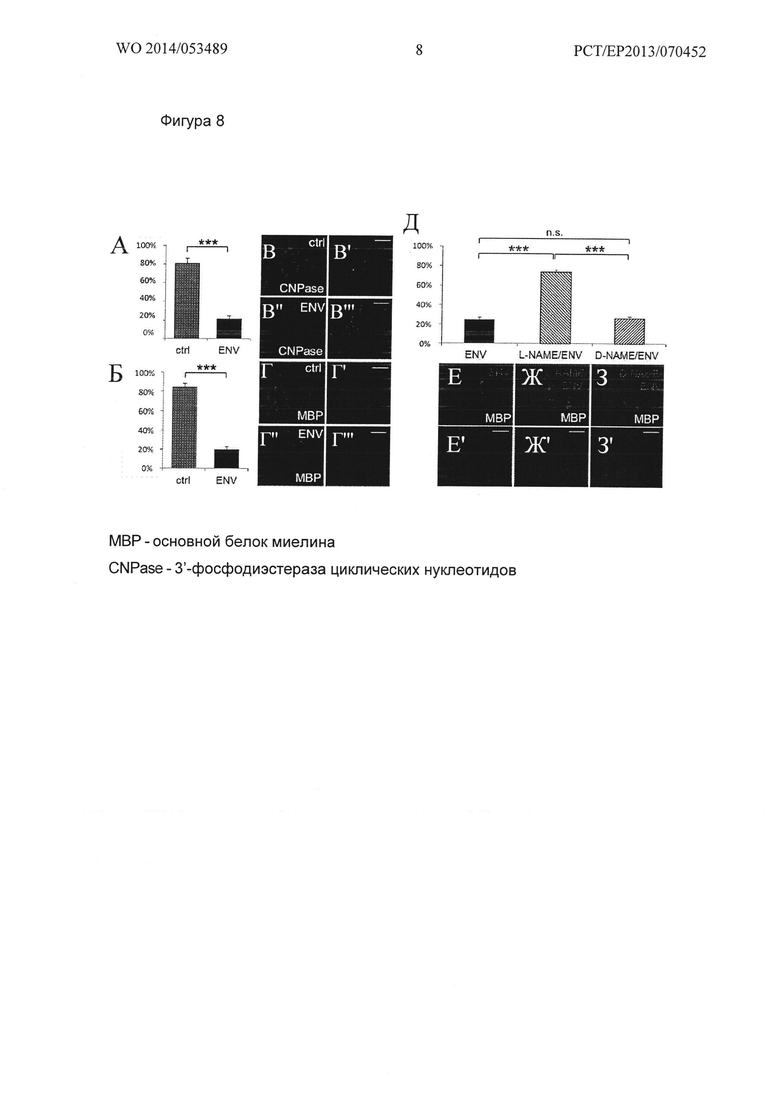
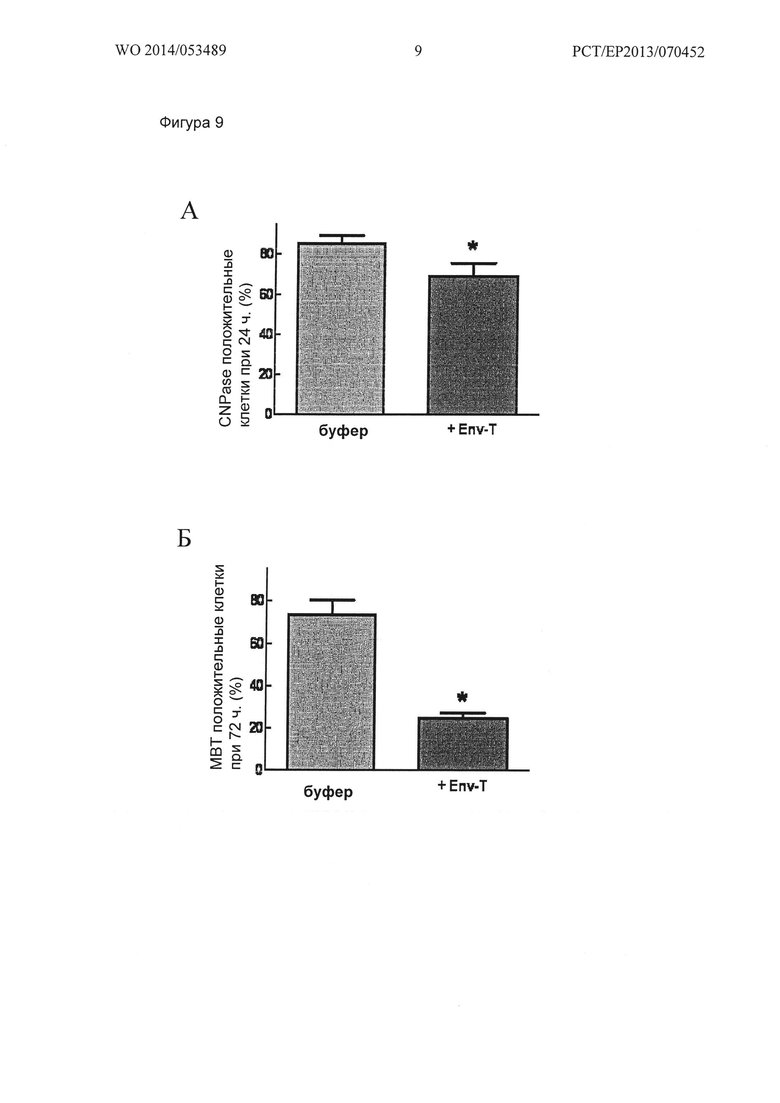
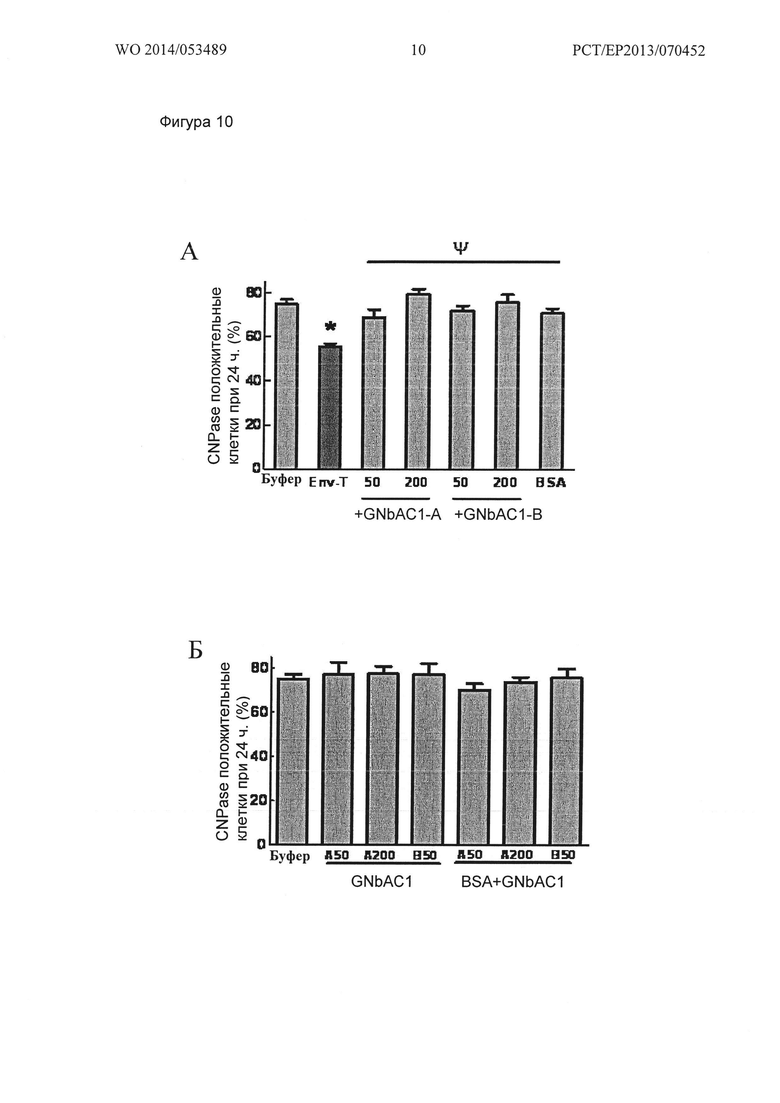
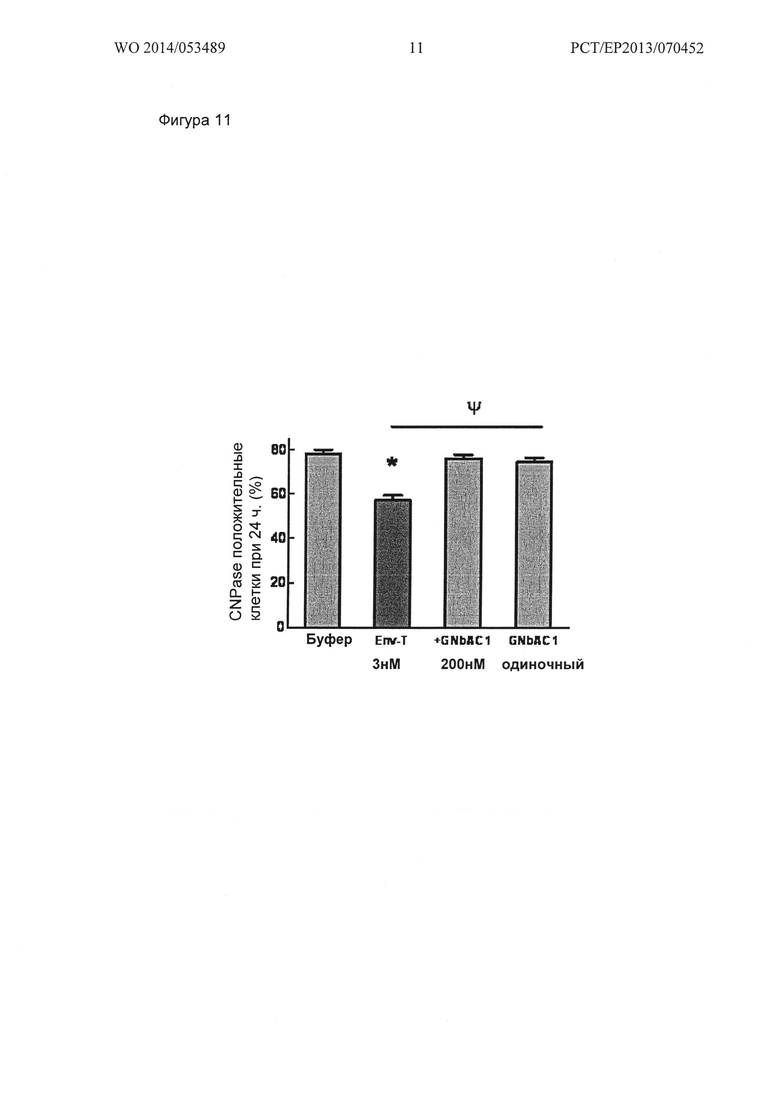
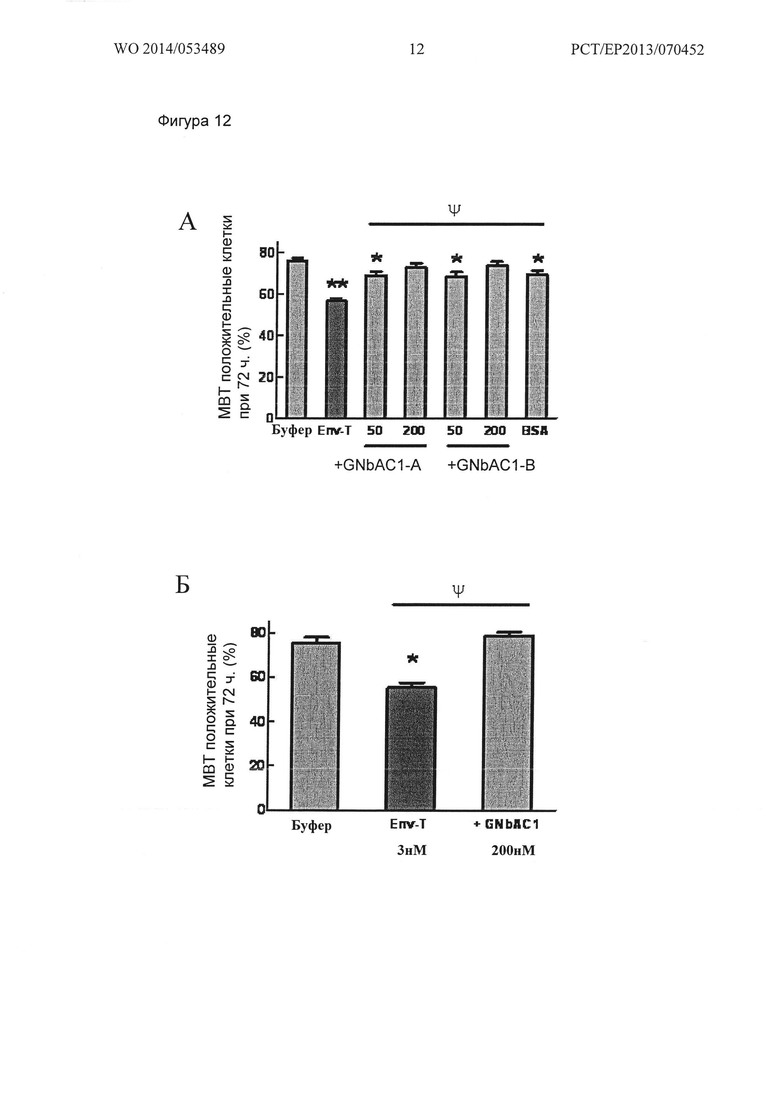
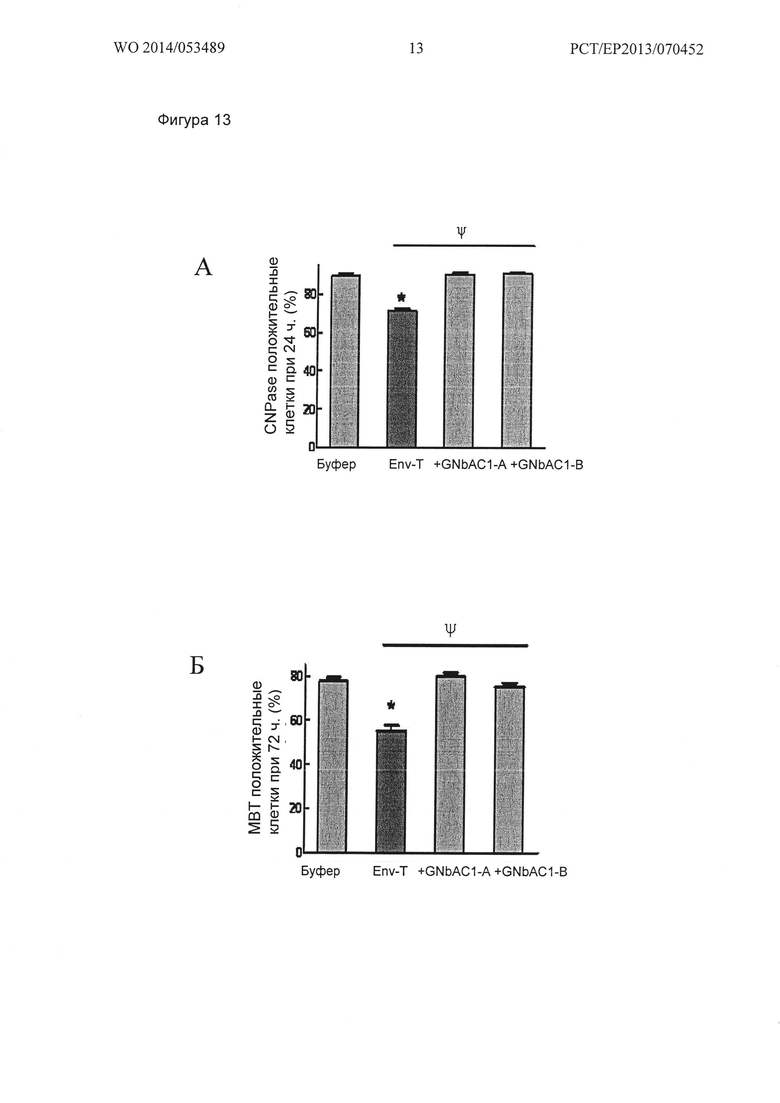
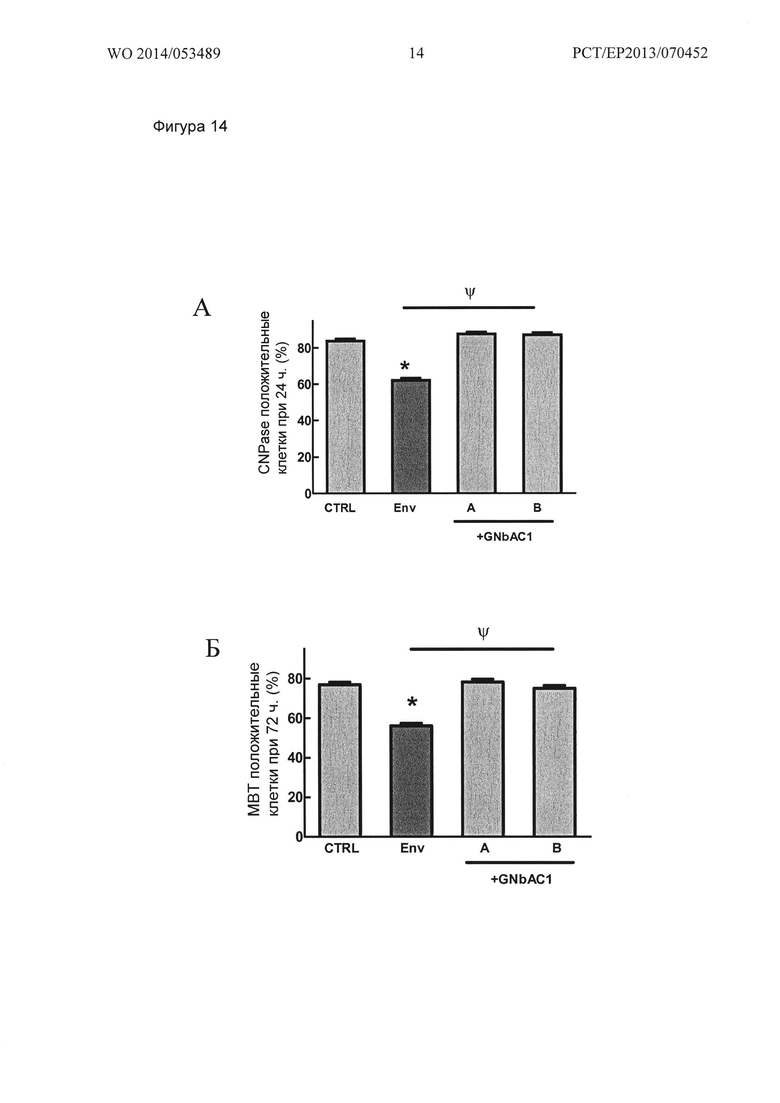
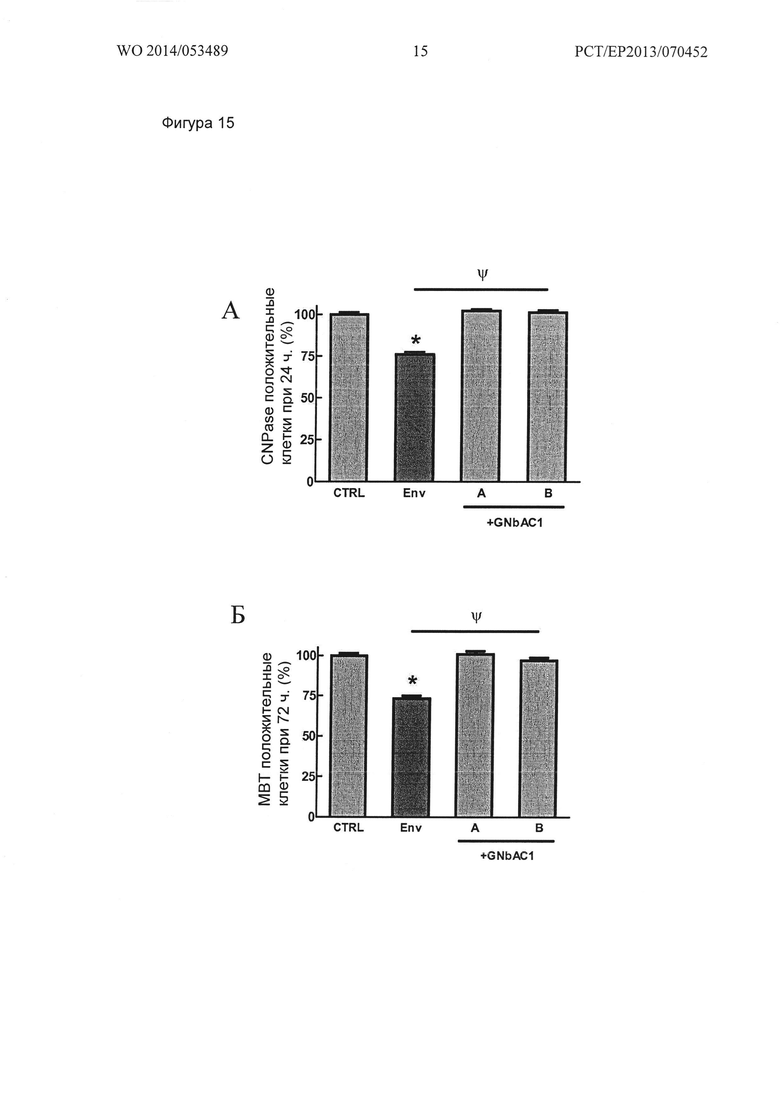
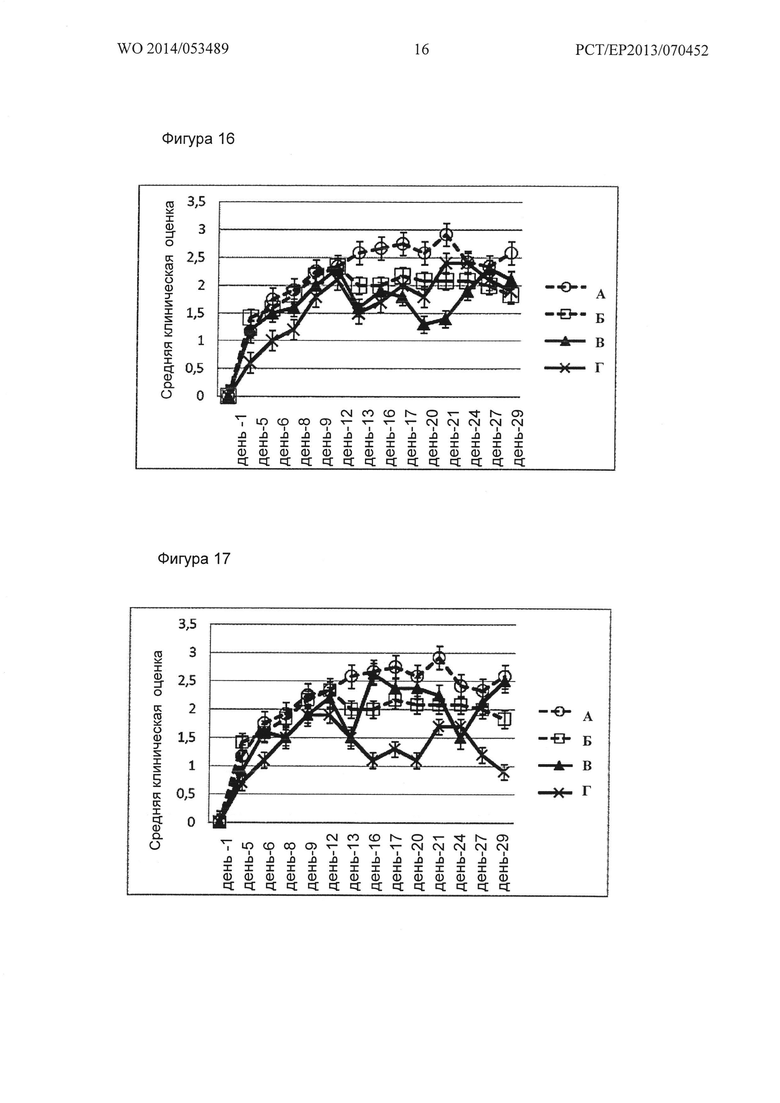

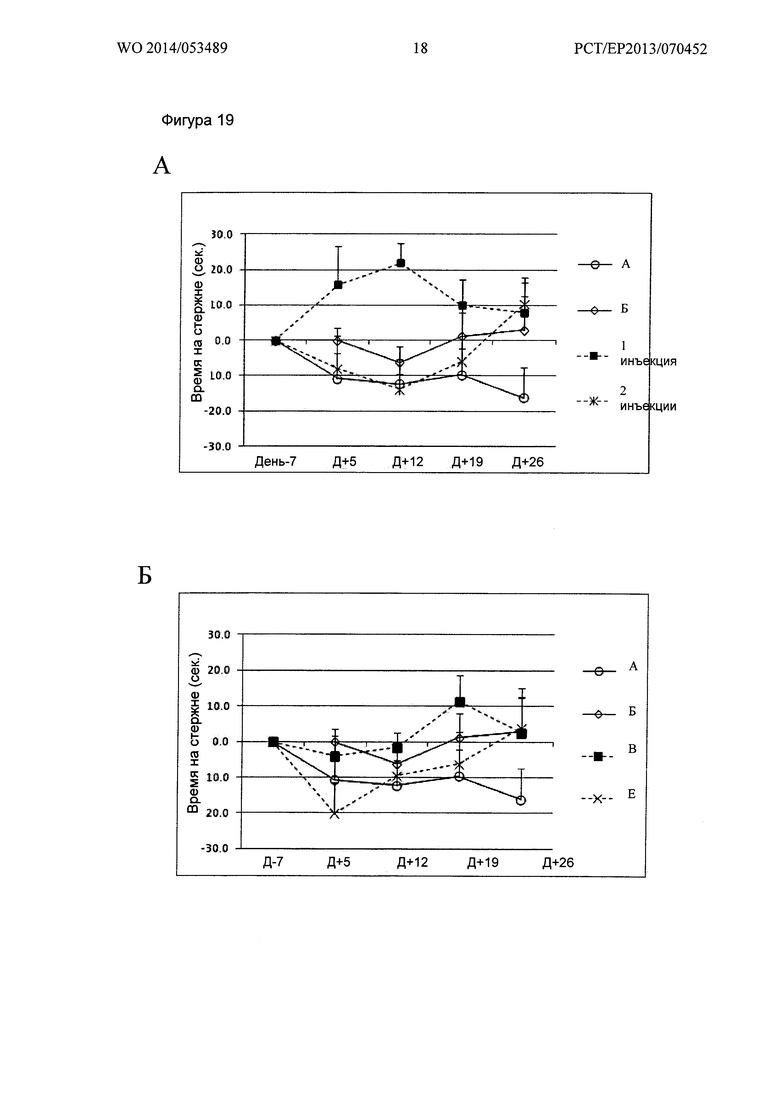
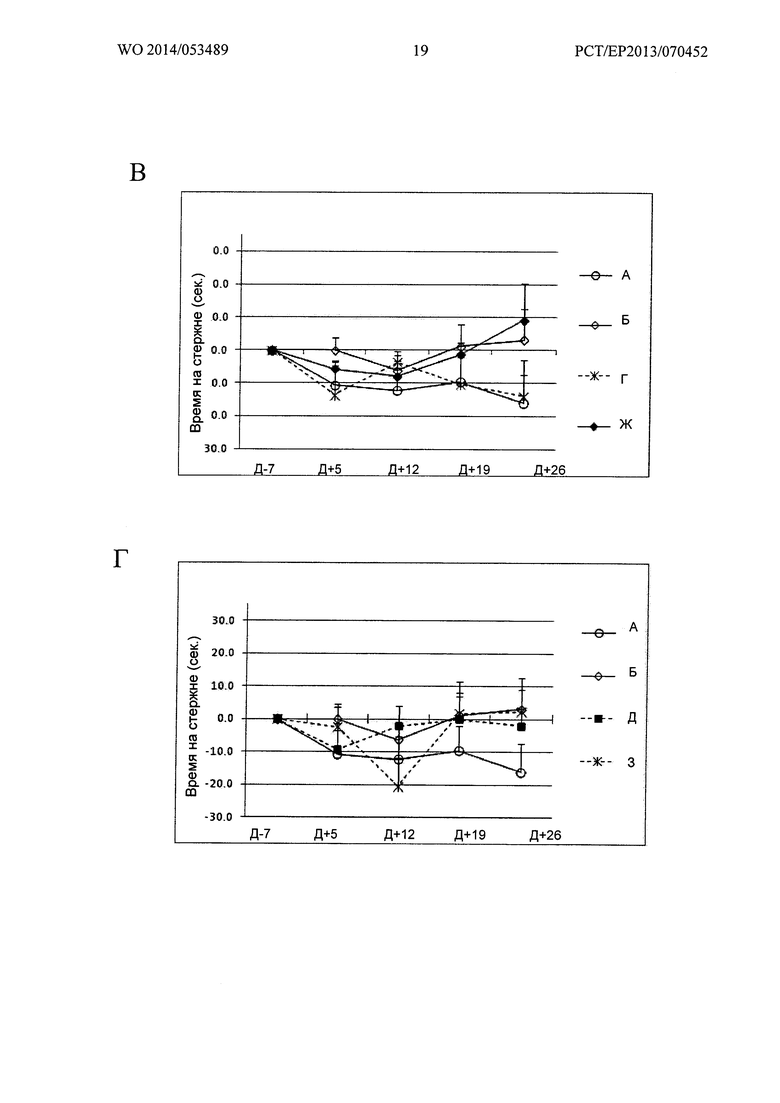
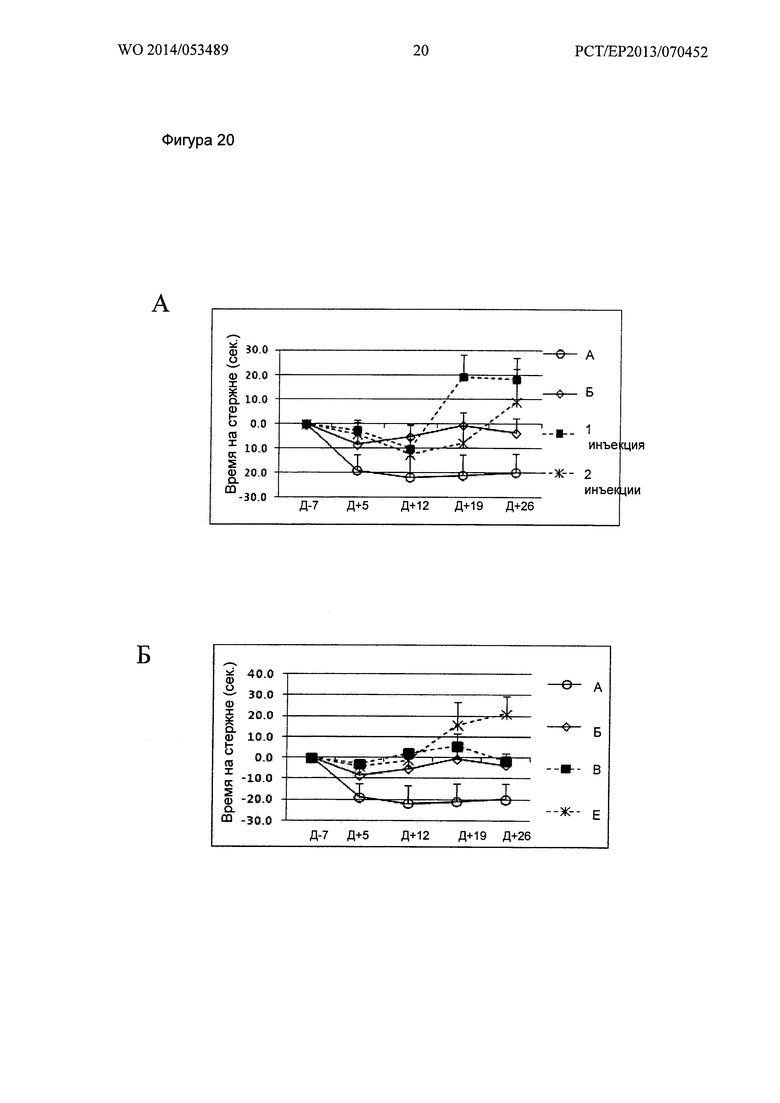
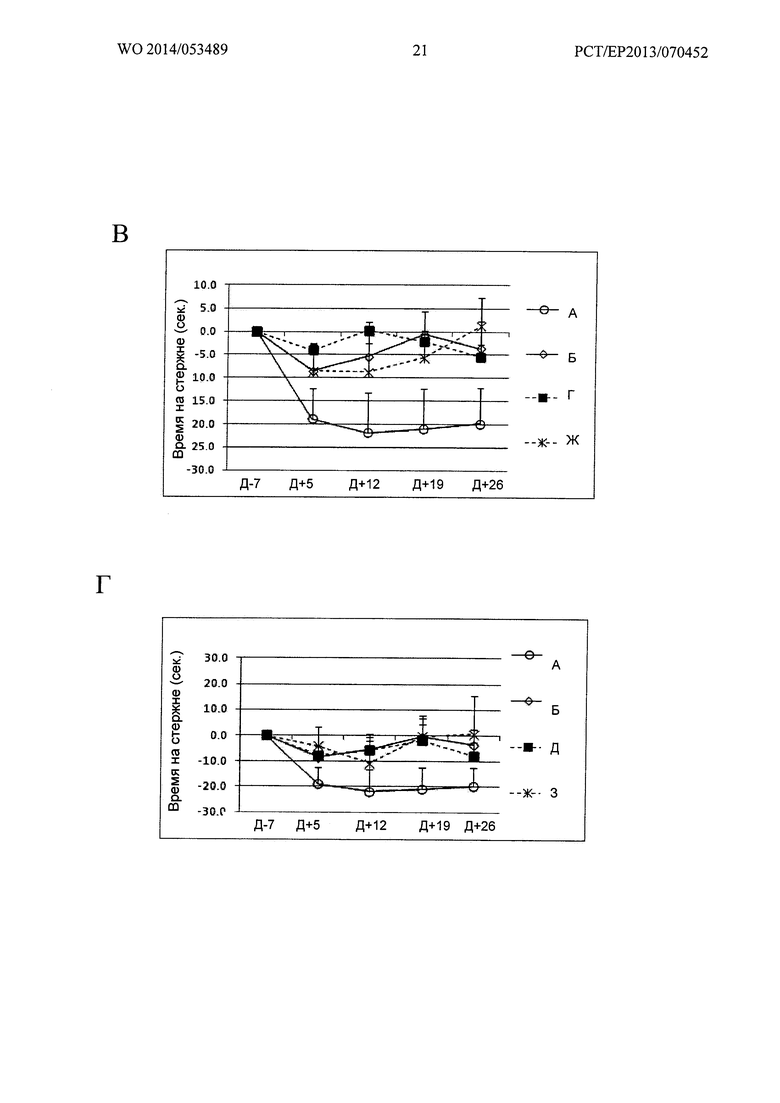
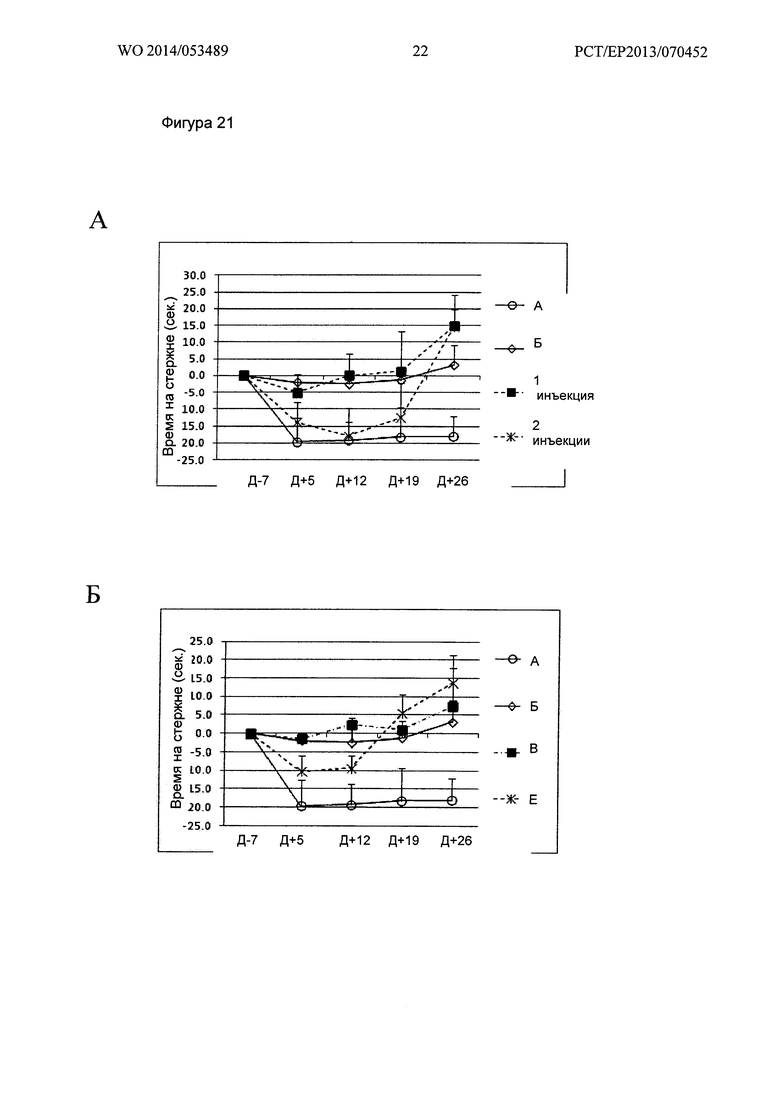
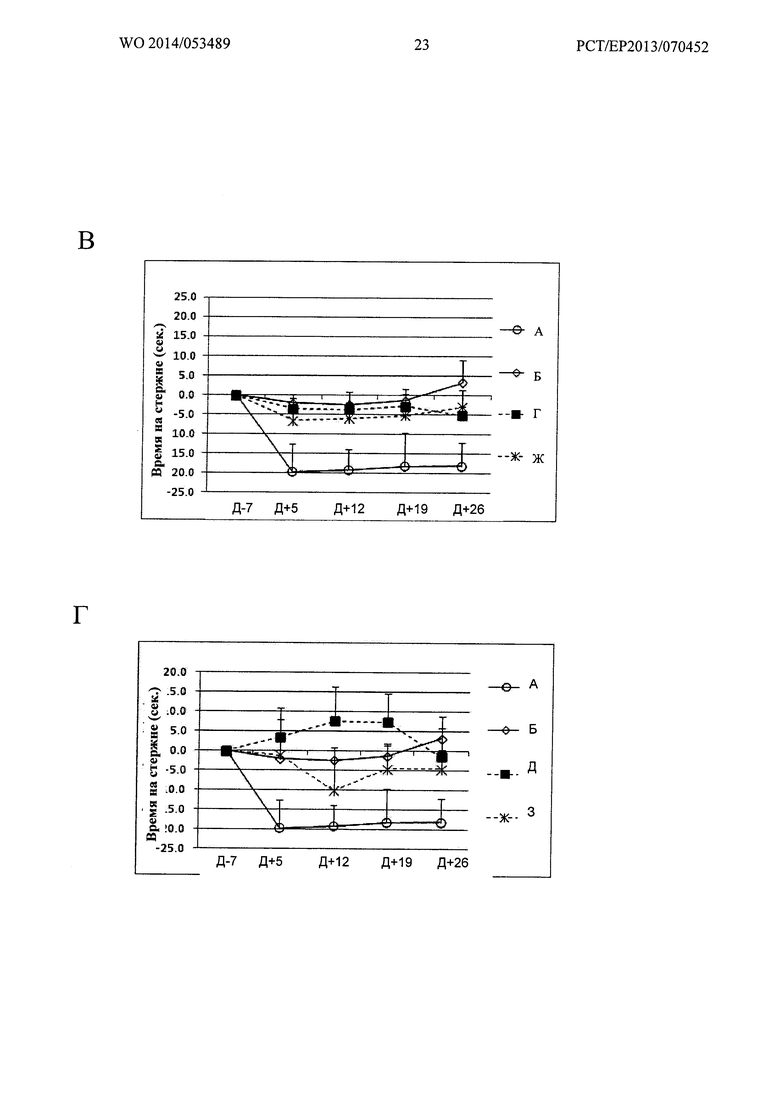

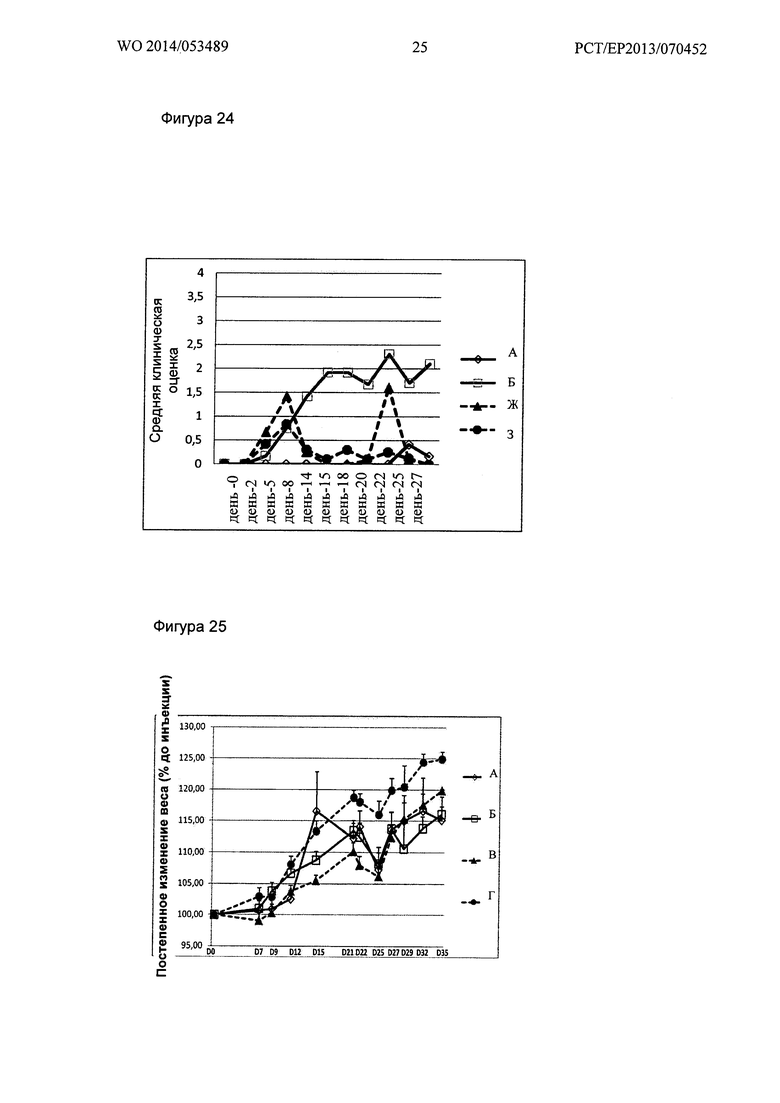
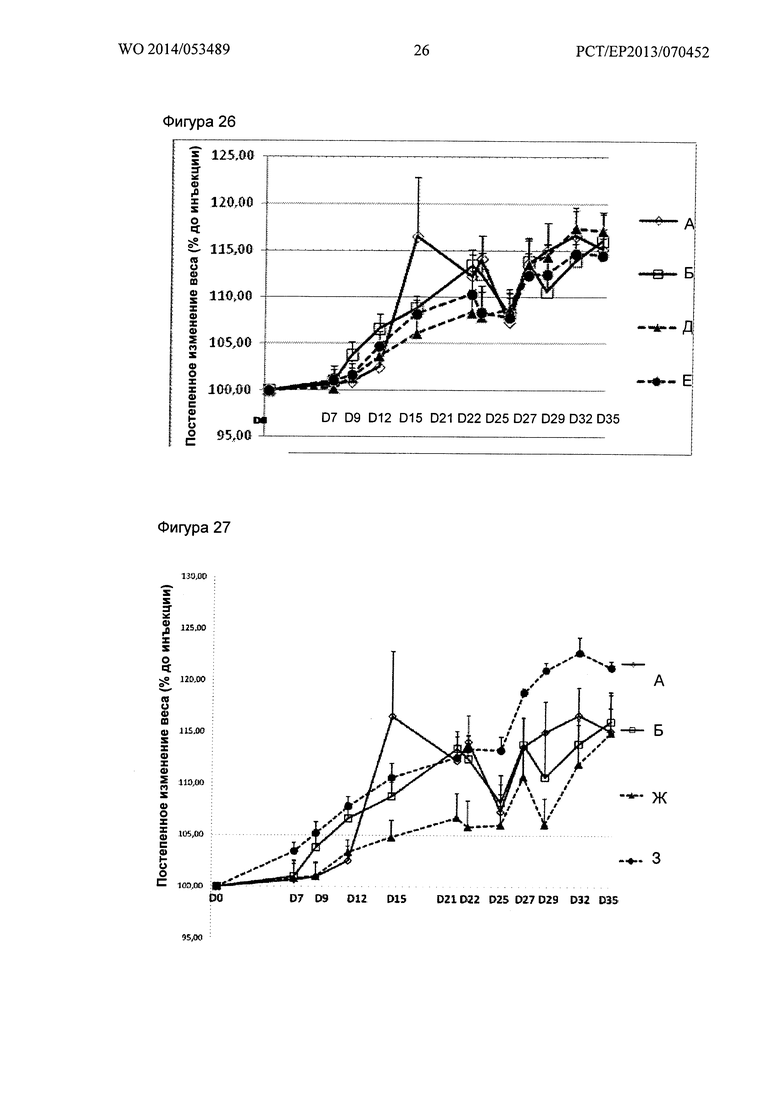
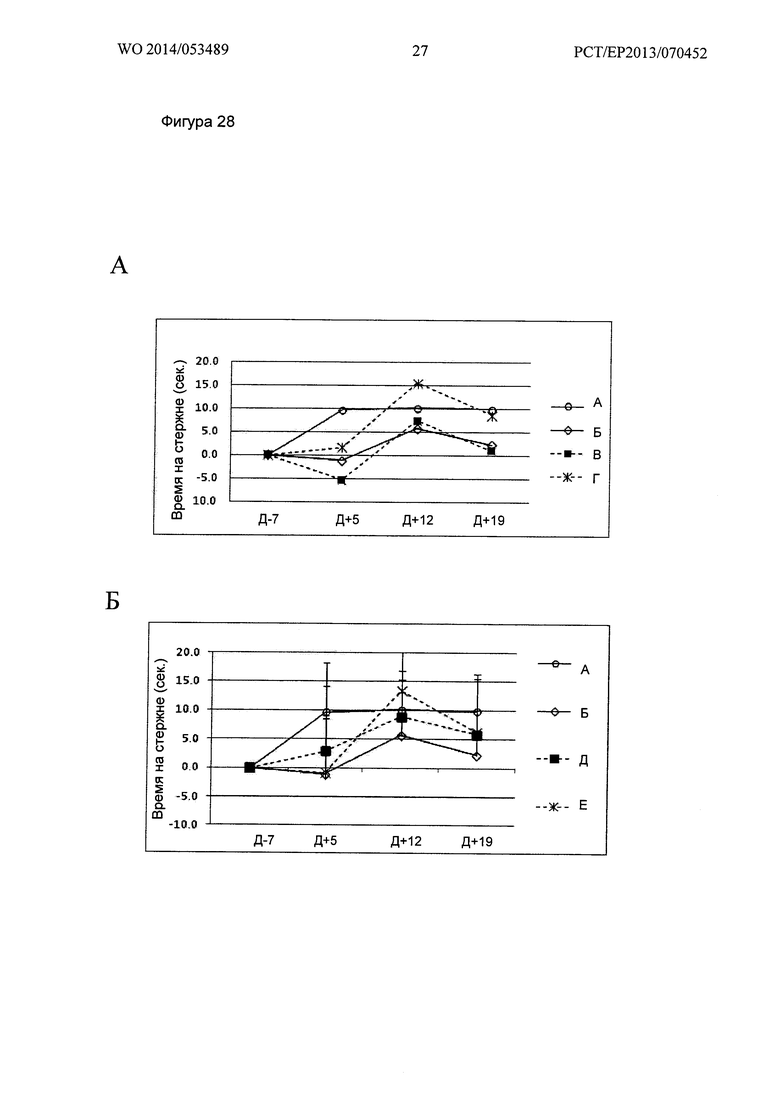
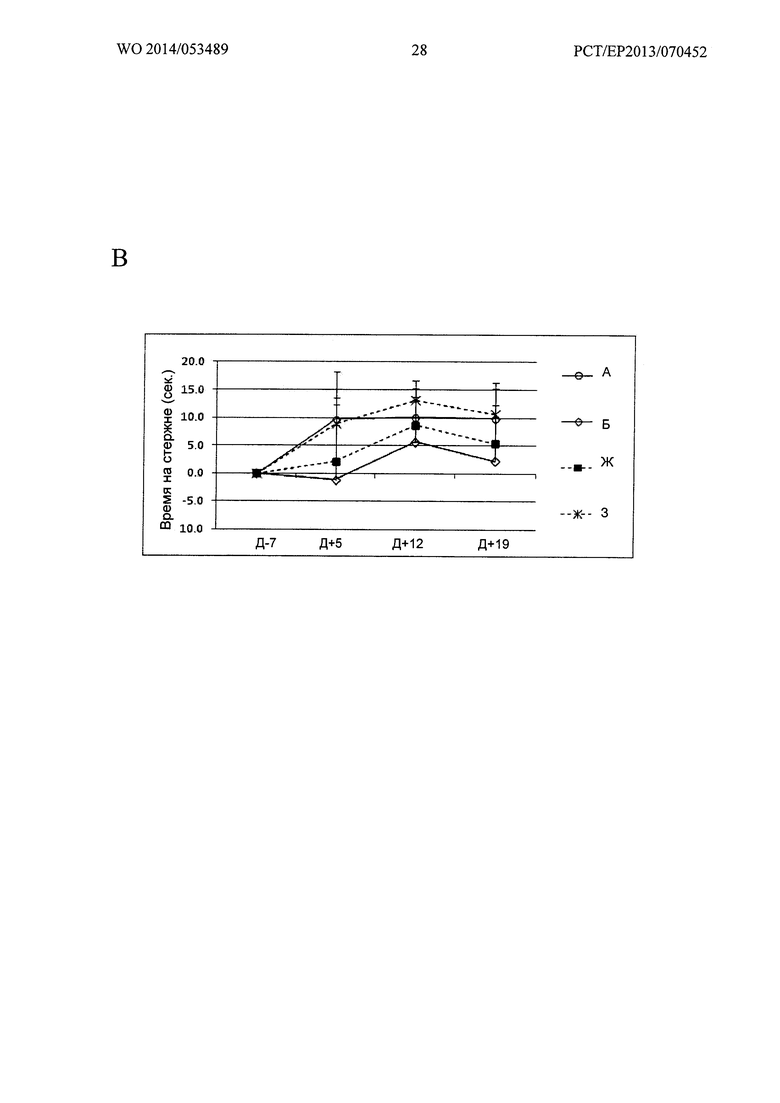
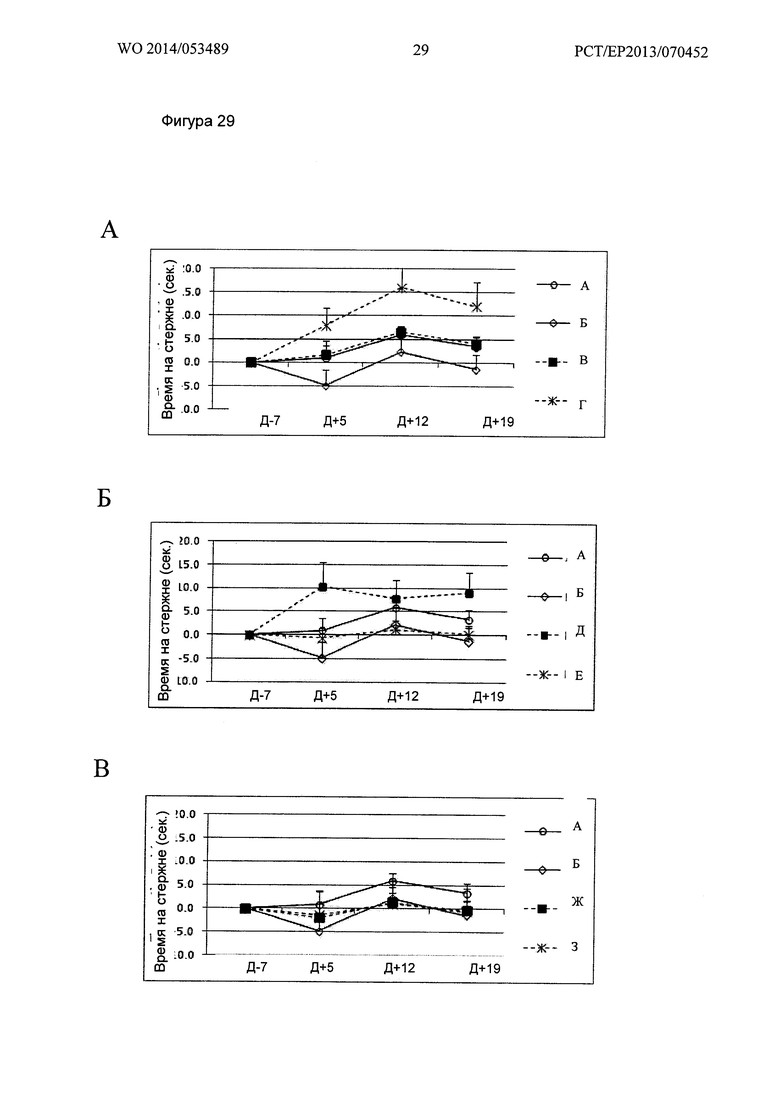
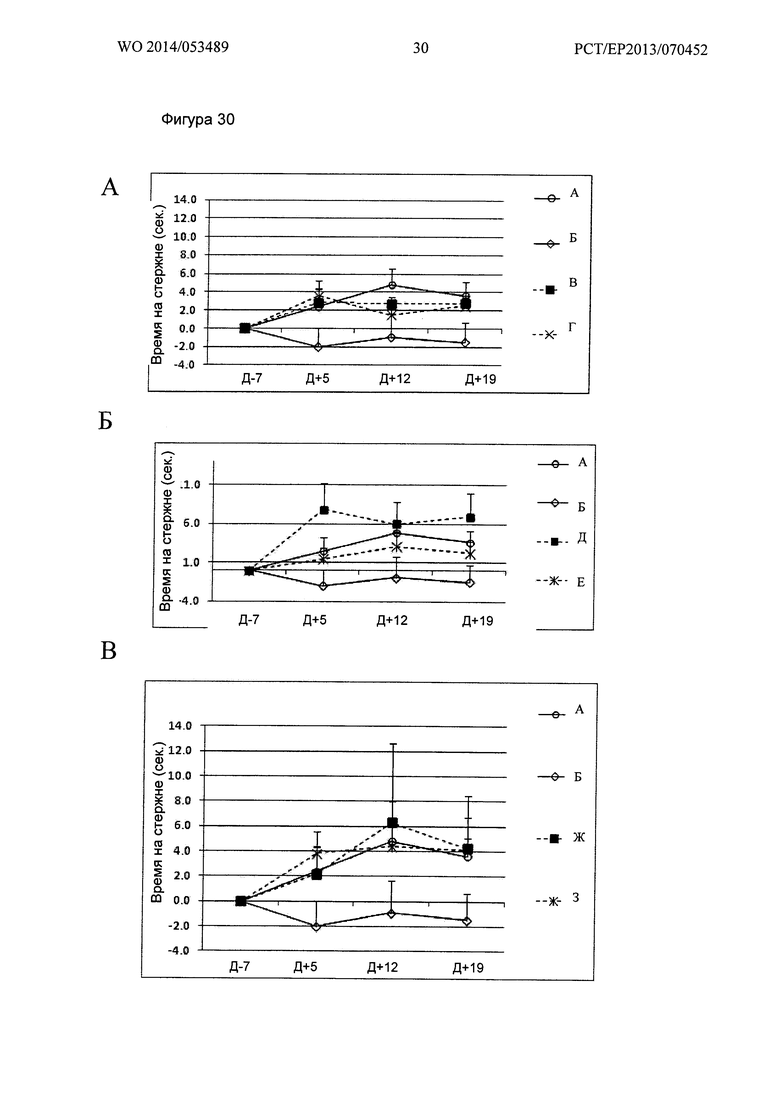
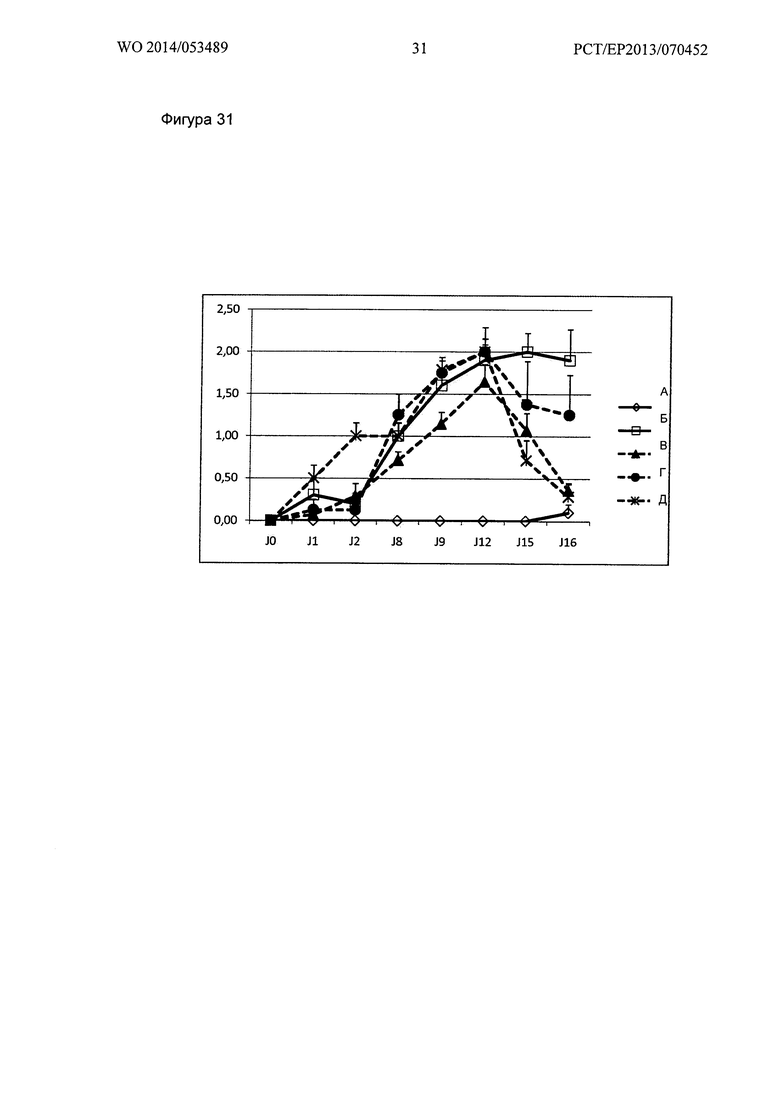
Изобретение касается фармацевтической композиции и способа лечения. Представленная композиция содержит лиганд анти-MSRV/HERV-W Env и по меньшей мере одно лекарственное средство, ингибирующее радикал окиси азота, причем указанный лиганд содержит каждый из участков, определяющих комплементарность (CDR), указанных в SEQ ID NО: 1, SEQ ID NО: 2, SEQ ID NО: 3, SEQ ID NО: 4, SEQ ID NО: 5 и SEQ ID NО: 6, а указанное лекарственное средство, ингибирующее радикал окиси азота, выбрано из группы, состоящей из Ng-нитро-L-аргинин метилового эфира (L-NAME), S-метил-изотиомочевины (SMT), фумаровой кислоты и диметилфумарата (DMF). Представленные изобретения могут быть использованы для лечения блокады ремиелинизации при заболеваниях, связанных с экспрессией белка оболочки (ENV) HERV-W. 2 н. и 4 з.п. ф-лы, 31 ил., 3 пр.
1. Фармацевтическая композиция, содержащая по меньшей мере лиганд анти-MSRV/HERV-W Env и по меньшей мере одно лекарственное средство, ингибирующее радикал окиси азота, применяемая для лечения блокады ремиелинизации при заболеваниях, связанных с экспрессией белка оболочки (ENV) HERV-W, причем
указанный лиганд анти-HERV-W Env содержит каждый из участков, определяющих комплементарность (CDR), указанных в SEQ ID NО: 1, SEQ ID NО: 2, SEQ ID NО: 3, SEQ ID NО: 4, SEQ ID NО: 5 и SEQ ID NО: 6,
указанное лекарственное средство, ингибирующее радикал окиси азота, выбрано из группы, состоящей из Ng-нитро-L-аргинин метилового эфира (L-NAME), S-метил-изотиомочевины (SMT), фумаровой кислоты и диметилфумарата (DMF).
2. Фармацевтическая композиция по п. 1, где лиганд анти-HERV-W Env представляет собой scFv (одноцепочечный фрагмент вариабельной области), Fab-фрагмент (участок связывания антигена) или антитело, предпочтительно химерное, синтетическое или гуманизированное антитело, и более предпочтительно IgG, такой как IgG1 или IgG4.
3. Фармацевтическая композиция по п. 1 или 2, применяемая для лечения блокады ремиелинизации при рассеянном склерозе (MS), предпочтительно рецидивирующем ремитирующем рассеянном склерозе (RRMS), прогрессирующем рассеянном склерозе, таком как вторичный прогрессирующий рассеянный склероз (SPMS) или первичный прогрессирующий рассеянный склероз (PPMS), хронической воспалительной демиелинизирующей полинейропатии (CIDP), психических расстройствах, таких как шизофрения или биполярное расстройство, и других демиелинизирующих заболеваниях, связанных с экспрессией белка оболочки (Env) HERV-W.
4. Способ лечения блокады ремиелинизации при заболеваниях, связанных с экспрессией белка оболочки (ENV) HERV-W, включающий введение человеку по меньшей мере одного лиганда анти-HERV-W Env и по меньшей мере одного лекарственного средства, ингибирующего радикал окиси азота, причем указанный лиганд анти-HERV-W Env содержит каждый из участков, определяющих комплементарность (CDR), указанных в SEQ ID NО: 1, SEQ ID NО: 2, SEQ ID NО: 3, SEQ ID NО: 4, SEQ ID NО: 5 и SEQ ID NО: 6,
указанное лекарственное средство, ингибирующее радикал окиси азота, выбрано из группы, состоящей из Ng-нитро-L-аргинин метилового эфира (L-NAME), S-метил-изотиомочевины (SMT), фумаровой кислоты и диметилфумарата (DMF).
5. Способ по п. 4, где лиганд анти-HERV-W Env представляет собой scFv, Fab-фрагмент или антитело, предпочтительно химерное, синтетическое или гуманизированное антитело, и более предпочтительно IgG, такой как IgG1 или IgG4.
6. Способ лечения блокады ремиелинизации по п. 4 или 5 при рассеянном склерозе (MS), предпочтительно рецидивирующем ремитирующем рассеянном склерозе (RRMS), прогрессирующем рассеянном склерозе, таком как вторичный прогрессирующий рассеянный склероз (SPMS) или первичный прогрессирующий рассеянный склероз (PPMS), хронической воспалительной демиелинизирующей полинейропатии (CIDP), психических расстройствах, таких как шизофрения или биполярное расстройство, и других демиелинизирующих заболеваниях, связанных с экспрессией белка оболочки (ENV) HERV-W.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| KEMER D et al., Endogenous retrovirus type W envelope protein inhibits oligodendroglial precursor cell differentiation, Ann Neurol | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| RU 2420537 C2, 10.06.2011. | |||
Авторы
Даты
2017-11-22—Публикация
2013-10-01—Подача