Область техники, к которой относится изобретение
Настоящее изобретение относится к области молекулярной биологии, органической химии, биотехнологии, микробиологии и медицины и обеспечивает способ определения субстратной совместимости производных нуклеозидтрифосфатов и матричнозависимых ДНК-полимераз, заключающийся в сочетании методов: количественной ПЦР в режиме реального времени на матрице "условно двухцепочечной" ДНК, составленной из двух синтетических олигонуклеотидов с вырожденной центральной частью с взаимно комплементарными фланкирующими частями при полной замене природного нуклеотида на модифицированный аналог; количественной ПЦР в режиме реального времени на бактериальной ДНК-матрице представляющей собой ПЦР-продукт фрагмента гена rpoB длиной 215 п. н. с амплификацией "вложенного" короткого внутреннего фрагмента длиной 126 п. н. при полной замене природного нуклеотида на модифицированный аналог, а также электрофоретического контроля продуктов ПЦР с количественной оценкой полноразмерного продукта. Предлагаемое изобретение может быть использовано при получении модифицированных фрагментов ДНК и модифицированных ДНК-аптамеров методом SELEX, функциональных аналогов моноклональных антител.
Уровень техники, к которой относится изобретение
Модифицированные нуклеиновые кислоты находят разнообразное применение в методах молекулярной диагностики и терапии. Введение метки в ДНК-зонд позволяет детектировать взаимодействие этого зонда с субстратом, что открывает широкие возможности для создания диагностических систем, основанных на применении ДНК-биосенсоров или ДНК-биочипов, которые позволяют проводить массовый скрининг биологических образцов с одновременным анализом сотен и даже тысяч исследуемых параметров (мутации, точечные нуклеотидные замены (SNPs), выявление болезнетворных агентов и т.п.). Такой меткой может служить радиоактивный изотоп (Detection of specific sequences in nucleic acids, US patent, 4883750, - 1989, Applied biosystems, США), биотин {hanger P.R. Enzymatic synthesis of biotin-labeled polynucleotides: novel nucleic acid affinity probes / P.R. Langer, A.A. Waldrop, D.C. Ward // Proc Nati Acad Sci USA. - 1981. - V. 78. - №11. - P. 6633-6637), флуоресцентный краситель (Биочип для определения мутаций в гене галактоза-1-фосфат-уридил трансферазы, вызывающих поражение печени у новорожденных детей, RU патент, - 2009139324, - 2009, Учреждение Российской академии наук Институт молекулярной биологии им. В.А. Энгелъгардта РАН, Федеральное агентство по науке и инновациям, Россия) и др.
Нуклеиновые кислоты могут взаимодействовать с молекулярными мишенями белковой природы (Patel D.J. Structure, recognition and discrimination in RNA aptamer complexes with cofactors, amino acids, drugs and aminoglycoside antibiotics. / D.J. Patel, A.K. Suri // J. Biotechnol. - 2000. - V. 74. №1. - P. 39-60). Одноцепочечные фрагменты нуклеиновых кислот, имеющие аффинное сродство к молекулярной мишени, получили название аптамеры. Аптамеры на основе нуклеиновых кислот, по сути, являются функциональными синтетическиими аналогами белковых антител. Аптамеры получают путем отбора фрагментов нуклеиновых кислот по признаку их аффинного сродства к мишени. Методология заключается в повторяющихся циклах взаимодействия вырожденной комбинаторной библиотеки олигонуклеотидов (библиотека олигонуклеотидов со случайными нуклеотидными последовательностями) с молекулярной мишенью и стадиях ферментативной амплификации методом ПЦР той части ДНК-библиотеки, которая связалась с мишенью. Циклы селекции многократно повторяют.
В ходе процесса, который получил название SELEX, происходит обогащение библиотеки высокоаффинными последовательностями и экспоненциальное увеличение их количества. Связывание происходит путем образования водородных связей, электростатических и ван-дер-ваальсовых взаимодействий нуклеиновых оснований и определенных пространственных форм белковой глобулы.
Недостатком аптамеров на основе природных нуклеотидов является ограниченное разнообразие функциональных групп, входящих в состав ДНК. В белках имееется 21 функциональная группа, в ДНК 4 функциональные группы. Аптамеры на основе природных нуклеотидов часто имеют высокие константы диссоциации со своими мишенями, что является недостатком. Для увеличения липофильного (гидрофобного) взаимодействия аптамеров с мишенью в их структуру вводят липофильные заместители, чаще всего в 5-положение пиримидинового основания нуклеотидов.
Авторами публикации (Aptamer-based multiplexed proteomic technology for biomarker discovery / L. Gold, D. Ayers, J. Bertino et al. // PLoS One. - 2010. - V. 5. - №12:e15004; Expanding the chemistry of DNA for in vitro selection / Vaught J.D., Bock C., Carter J. et al. // J Am. Chem. Soc. - 2010. - V. 132. - P. 4141-4151) для получения модифицированных аптамеров предложены карбоксамидные производные дезоксиуридинтрифосфата. Для получения аптамеров на основе карбоксамидных производных дезоксиуридина разработана специальная модифицированная процедура SELEX. С природной ДНК-библиотеки методом реакции удлинения праймера (primer extension, РЕХ) получали комплементарные копии одноцепочечных модифицированных ДНК, которые затем использовали для взаимодействия с мишенью. Реакция удлинения праймера (primer extension, РЕХ) менее чувствительна к изменениям в структуре нуклеотидов чем ПЦР. С той части одноцепочечных модифицированных ДНК, которые связались с мишенью, получают комплементарные копии природных ДНК. Копии природных ДНК затем амплифицируют в ПЦР и получают частично обогащенную природную ДНК-библиотеку, которую используют на последующем цикле селекции. Циклы селекции многократно повторяют. Такая процедура связана с тем, что карбоксамидные производные дезоксиуридинтрифосфатов в ходе ПЦР не встраиваются ДНК-полимеразами в продукт амплификации.
При амплификации ДНК методом РЕХ происходит увеличение количества синтезируемых молекул ДНК в геометрической прогрессии (n*2), что недостаточно для эффективного выполнения SELEX. В случае амплификации ДНК методом ПЦР происходит увеличение количества синтезируемых молекул ДНК в экспоненциальной прогрессии, что позволяет эффективно выполнять SELEX, отбирать аптамеры из библиотеки случайных последовательностей ДНК. Дополнительные процедуры, связанные с несовместимостью карбоксамидных производных нуклеотидов с ДНК-полимеразами в ПЦР, сильно усложняют процесс получения модифицированных ДНК-аптамеров.
В ведущих научных лабораториях промышленно-развитых стран ведутся интенсивные исследования по поиску структур модифицированных нуклеотидов, которые бы воспринимались ДНК-полимеразами и поиск ДНК-полимераз, которые совместимы с модифицированными нуклеотидами. Поиску способов определения субстратной совместимости модифицированных нуклеотидов и ДНК-полимераз уделяется значительное внимание.
Авторами патентной заявки (Cytidine-5-carboxamide modified nucleotide compositions and methods related thereto, WO патентная заявка, - 077292, - 2015, Somalogic Inc, США) для получения аптамеров предложен ряд модифицированных дезоксицитидинтрифосфатов с не встречающимися в природных биомолекулах функциональными группами, присоединенными через карбоксамидный линкер. Совместимость предложенных производных дезоксицитидина с ДНК-полимеразами в ПЦР авторами не указывается.
В патентной завявке (Compositions and methods for detecting microorganisms, WO патентная заявка, - 126769, - 2015, Somalogic Inc, США) ряд модифицированных нуклеотидов, предназначенных для получения аптамеров, существенно расширен. Наряду с производными дезоксицитидина предложено использовать производные дезоксиуридина. Кроме того, помимо карбоксамидного линкера, предложено использовать линкеры, включающие комбинацию нескольких гетероатомов. Совместимость предложенных производных дезоксиуридина и дезоксицитидина с ДНК-полимеразами в ПЦР авторами не указывается.
Автором публикации (The joys of in vitro selection: chemically dressing oligonucleotides to satiate protein targets /B.E. Eaton // Curr. Opin. Chem. Biol. - 1997. - V. 1. - P. 10-16; New uridine derivatives for systematic evolution of RNA ligands by exponential enrichment / T. Dewey, A. Mundt, G. Crouch et al. // J. Am. Chem. Soc. - 1995. - V. 117. - P. 8474-8475) предложен ряд модифицированных дезоксиуридинтрифосфатов, содержащих в положении 5 нуклеозида различные функциональные группы. Совместимость предложенных производных дезоксиуридинтрифосфатов с ДНК-полимеразами в ПЦР автором не указывается.
В патенте (Functionalized pyrimidine nucleosides and nucleotides and DNA's incorporating same, US patent, - 1998, - 6175001, The Scripps Research Institute, США) для получения аптамеров предложен ряд модифицированных пиримидиновых нуклеотидов, содержащих в положении 5 функциональные группы, характерные для природных аминокислот.
Авторами публикации (Systematic characterization of 2'-deoxynucleoside-5'-triphosphate analogs as substrates for DNA polymerases by polymerase chain reaction and kinetic studies on enzymatic production of modified DNA / Kuwahara M., J. Nagashima, M. Hasegawa et al // Nucleic Acids Res. - 2006. - V. 34. - P. 5383-5394) исследована субстратная совместимость модифицированных по 5-положению трифосфатов 2'-дезоксиуридина и 2'-дезоксицитидина с ДНК-полимеразами Taq, Tth, Vent(exo-), KOD Dash and KOD(exo-) в ПЦР при полной замене природного dTTP на модифицированный аналог. В качестве матрицы использовали коммерческую плазмиду pUC18 и по паре комплементарных праймеров к регионам длиной 110 и 108 пар нуклеотидов. Полноразмерные продукты регистрировали методом электрофореза. Эффективность получения полноразмерных продуктов в ПЦР с модифицированными нуклеотидами сильно различается для ДНК-полимераз. Различия наблюдали и для исследованных регионов, что связано с различиями в последовательности нуклеотидов.
Авторами публикации (Direct PCR amplification of various modified DNAs having amino acids: Convenient preparation of DNA libraries with high-potential activities for in vitro selection. /Kuwahara M., Hanawa K., Ohsawa K. et al // Bioorganic & Medicinal Chemistry. - 2006. - V. 14. - P. 2518-2526) ряд модифицированных по С5-положению трифосфатов 2'-дезоксиуридина расширен. В структуру заместителей дополнительно ввели остатки природных аминокислот. Модифицированные нуклеотиды исследовали в качестве субстратов с ДНК-полимеразами Taq, Tth, Vent(exo-), KOD Dash and KOD(exo-) в ПЦР при полной замене природного dTTP на модифицированный аналог.
В публикации (The application of a modified nucleotide in aptamer selection: novel thrombin aptamers containing 5-(1-pentynyl)-2'-deoxyuridine. / Latham J.A., Johnson R., Toole J.J. // Nucleic Acids Research. - 1994. - V. 22. - P. 2817-2822) предложен модифицированный 2'-дезоксиуридин-5'-трифосфат, несущий в 5-положении функциональную пентинильную группу. Соединение оказалось совместимо с доступной Vent (ехо-) ДНК-полимеразой в ПЦР. На основе этого модифицированного нуклеотида получен модифицированный ДНК-аптамер к белку тромбину.
Заявляемое изобретение отличается от вышеописанных аналогов тем, что для определения субстратной совместимости модифицированных 2'-дезоксиуридин-5'-трифосфатов с модифицирующими группами по 5-положению пиримидинового основания и ДНК-полимераз использовали сочетание методов: количественной ПЦР на специальной ДНК матрице из природных нуклеотидов, включающей вырожденную (комбинаторную) область, длиной 40 нуклеотидов с фланкирующими (праймерными) участками постоянной последовательности при полной замене одного из природных нуклеотидов на модифицированный аналог, метода количественной ПЦР в режиме реального времени на бактериальной ДНК-матрице представляющей собой ПЦР-продукт фрагмента гена rpoB длиной 215 п. н. с амплификацией "вложенного" короткого внутреннего фрагмента длиной 126 п. н. при полной замене природного нуклеотида на модифицированный аналог, а также метода электрофоретического разделения продуктов ПЦР с количественной оценкой полноразмерного продукта.
Заявляемое изобретение позволяет определить степень совместимости ДНК-полимераз и модифицированных трифосфатов дезоксиуридина в зависимости от химической природы модифицирующего заместителя и длины линкера, соединяющего его с пиримидиновым основанием. Заявляемое изобретение позволяет определить ингибирующее влияние модифицированых трифосфатов дезоксиуридина в различных концентрациях на получение продуктов ПЦР.
Наиболее перспективными областями применения изобретения является использование совместимых производных трифосфатов дезоксиуридина и ДНК-полимераз при получении модифицированых аптамеров, которые по назначению могут применяться для анализа белковых, пептидных и низкомолекулярных биологически-активных молекулярных мишеней, в том числе в датчиках и сенсорных устройствах, а также в качестве терапевтических средств. Модифицированные аптамеры, в отличие от антител, устойчивы к протеазам, что открывает новые возможности их применения, недостижимые для антител.
Раскрытие изобретения
В заявляемом изобретении для определения субстратной совместимости модифицированных трифосфатов дезоксиуридина и ДНК-полимераз использовали сочетание методов:
- количественной ПЦР в режиме реального времени на матрице "условно двухцепочечной" ДНК, составленной из двух синтетических олигонуклеотидов с вырожденной центральной частью длиной 40 нуклеотидов с взаимно комплементарными фланкирующими частями при полной замене природного нуклеотида на модифицированный аналог;
- количественной ПЦР в режиме реального времени на бактериальной ДНК-матрице представляющей собой ПЦР-продукт фрагмента гена rpoB М. tuberculosis длиной 215 п. н. с амплификацией "вложенного" короткого внутреннего фрагмента длиной 126 п. н. при полной замене природного нуклеотида на модифицированный аналог;
- электрофоретического контроля продуктов ПЦР с количественной оценкой полноразмерного продукта.
В заявляемом изобретении использовали синтетические олигонуклеотиды с вырожденной центральной частью Matrix_1f-06 и Matrix_1r-06 и прайцмеры Forw_1-06 и Rev_1-06.
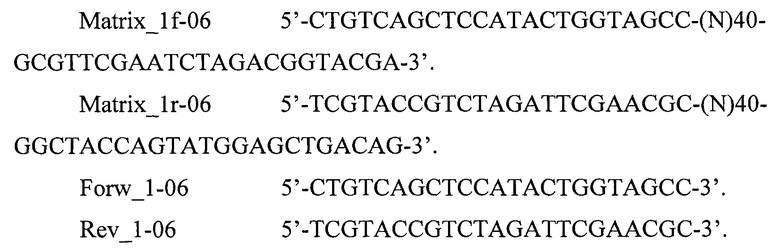
В заявляемом изобретении в качестве бактериальной ДНК-матрицы использовали фрагмент бактериальной ДНК гена rpoB (М. tuberculosis) Matrix_215 длиной 215 п. н., праймеры Forw_215, Rev_215 для амплификации фрагмента длиной 215 п. н. и праймеры Forw_126, Rev_126 для амплификации «вложенного» короткого внутреннего фрагмента длиной 126 п. н.
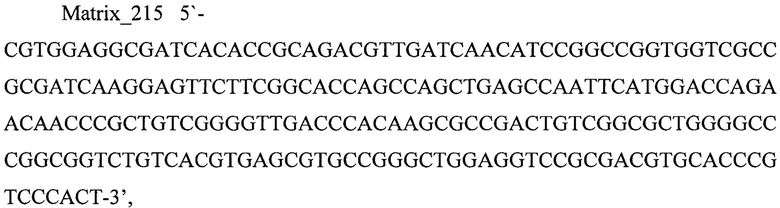
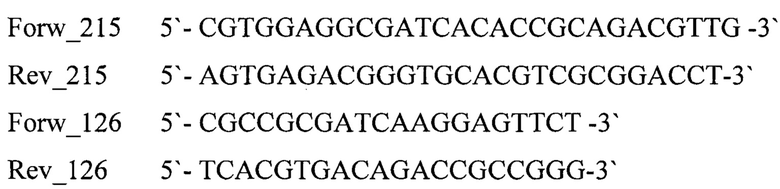
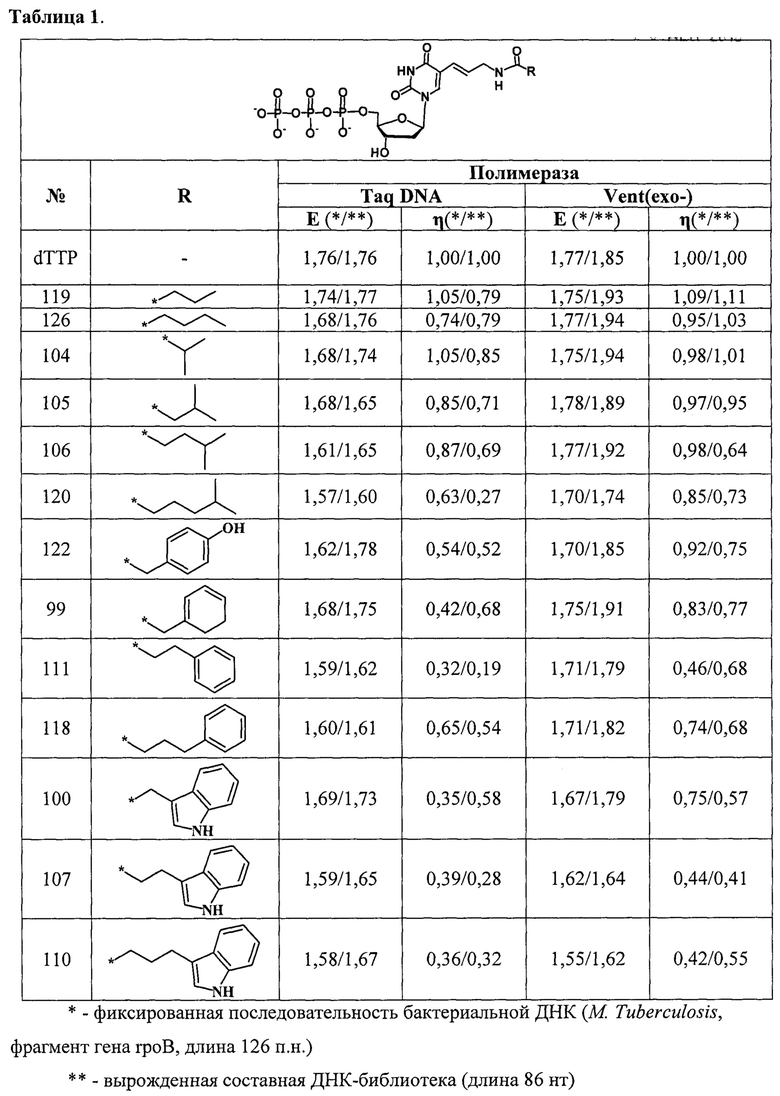
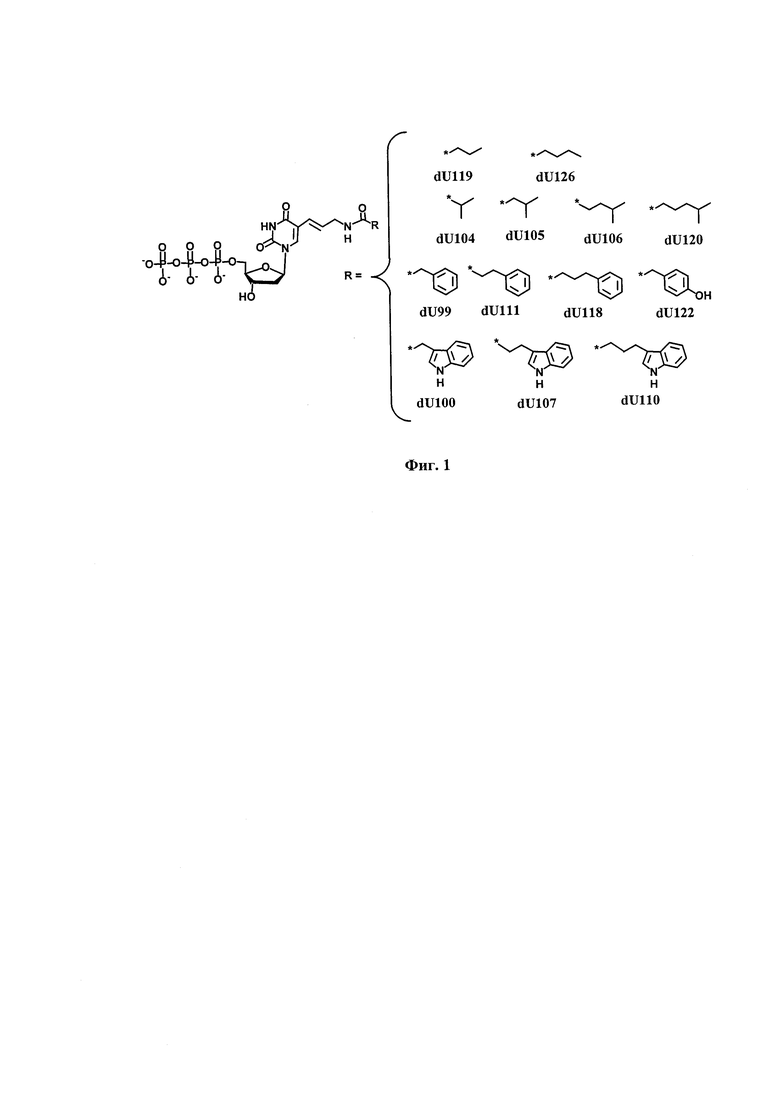
В заявляемом изобретении использовали модифицированные 2'-дезоксиуридин-5'-трифосфатов (mod-dUTP), несущие по С5-положению функциональные группы, присоединенные через карбониламиноаллильный линкер, аллильная часть линкера связана с 5-положением пиримидинового основания транс-алкеновой связью (Фиг. 1). Функциональные группы представлены линейными алифатическими: пропильной (dU121), бутильной (dU126); разветвленными алифатическими: изо-пропильной (dU104), 2-метилпропильной (dU105), 3-метилбутильной (dU106), 4-метилпентильной (dU120); фенилалкильными: фенилметильной (dU99), 2-фенилэтильной (dU111), 3-фенилпропильной (dU118), (4-оксифенил)метильной (dU122); алкилиндольными: (3-индолил)метильной (dU100), (3-индолил)этильной (dU107), (3-индолил)пропильной (dU110). Модифицированные производные 2'-дезоксиуридин-5'-трифосфатов получены реакцией 5-аминоаллил-2'-дезоксиуридин-5'-трифосфатов с N-оксисукцинимидными производными соответствующих кислот.
В заявляемом изобретении использовали ДНК-полимеразы с отсутствующей корректирующей 3'-5'-экзонуклеазной активностью, относящиеся к разным семействам - Taq (семейство А) и Vent(exo-) (семейство В).
В заявляемом изобретении использовали ПЦР с регистрацией в реальном времени, (Real time PCR) по накоплению флуоресцентного сигнала от интеркалирующего красителя Eva Green (Biotium, США) с возбуждением флуоресценции на длине волны около 500 нм и регистрацией около 530 нм.
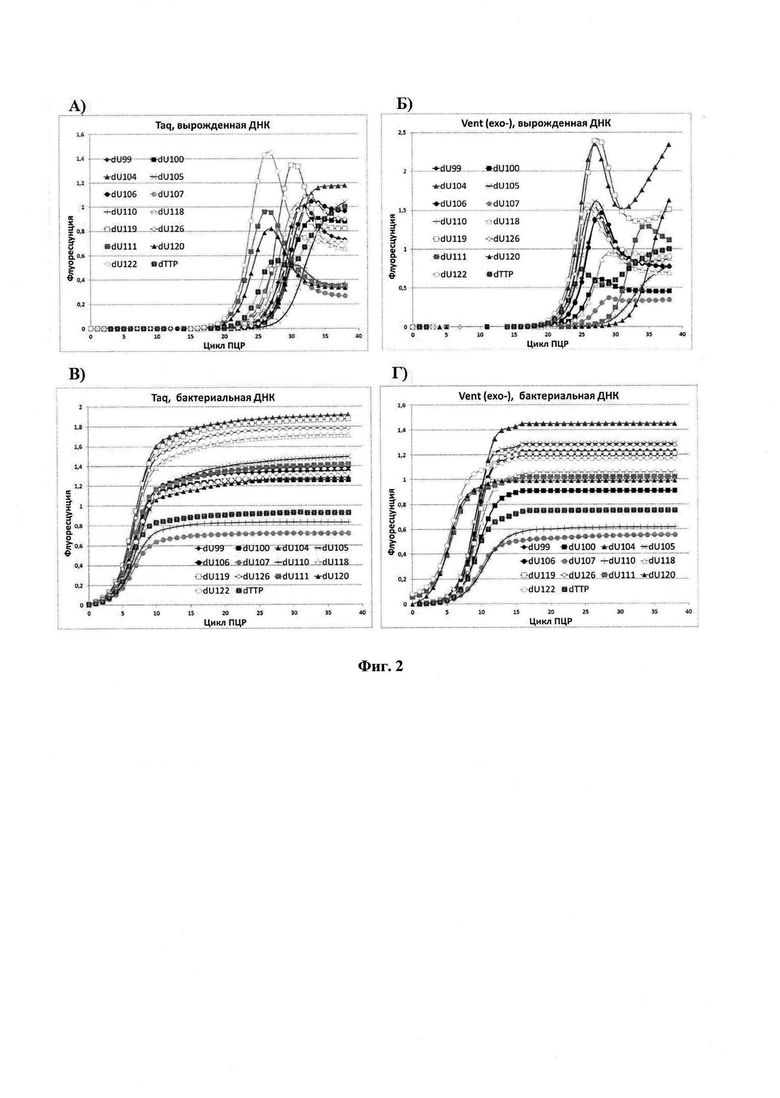
Полученные кривые использовали для расчета эффективности амплификации по тангенсу угла наклона прямого участка S-образной кривой накопления сигнала, представленной в логарифмическом масштабе (Фиг. 2). В случае вырожденной ДНК-библиотеки, при амплификации которой характер накопления сигнала носил волнообразный характер, вычисления осуществляли по первичному увеличению интенсивности сигнала (Фиг. 2а, Фиг. 2б). Значения эффективности амплификации ДНК для mod-dUTP, вычисленные на основании количественной ПЦР с регистрацией в реальном времени, приведены в табл. 1.
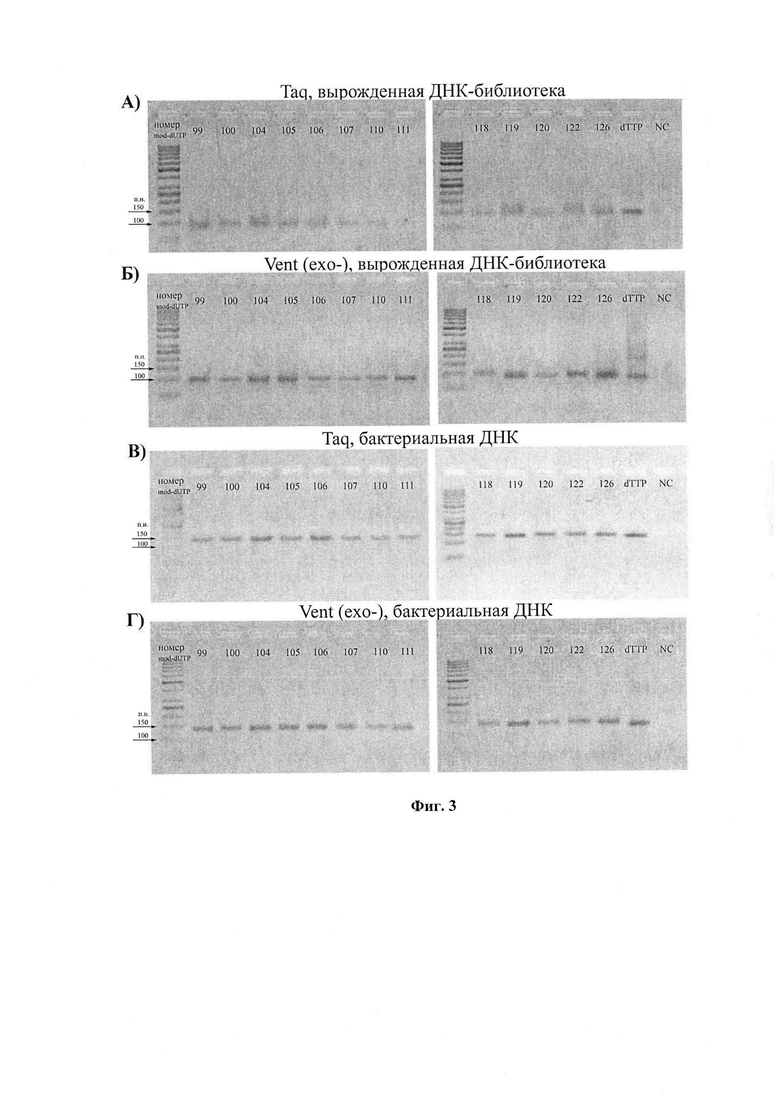
В заявляемом изобретении выход полноразмерных продуктов ПЦР проводили методом электрофореза в 4% агарозном геле. Визуализацию продуктов реакции осуществляли окрашиванием агарозного геля, в котором разделяли продукты ПРЦ, бромистым этидием. Количественную оценку полноразмерного продукта проводили по оптической плотности соответствующих полос в дорожках геля (Фиг. 3).
Выходы целевых продуктов ПЦР для mod-dUTP, определенные на основании результатов электрофореза, приведены в табл. 1. Из таблицы 1 видно, что эффективность амплификации постепенно уменьшается и для Taq-, и для Vent (ехо-)-полимеразы в ряду трифосфатов дезоксиуридина, модифицированных по С5положению азотистого основания фрагментами насыщенных алифатических углеводородов с увеличением длины (и гидрофобности) последних. В ряду ароматических и гетероциклических углеводородов эффективность амплификации уменьшается еще более, причем тенденция зависимости от длины гидрофобного линкера сохраняется.
По эффективности амплификации и по выходу целевого проукта Vent (ехо-)-полимераза демонстрирует преимущество перед Taq-полимеразой. Для Vent (ехо-)-полимеразы пригодны все mod-dUTP (Фиг. 1) с разной степенью эффективности. Для Taq-полимеры относительно хорошими субстратами являются лишь производные с короткими фрагментами насыщенных алифатических углеводородов.
Краткое описание фигур
Фиг. 1. Химическое строение производных 2'-дезоксиуридин-5'-трифосфатов, несущих по С5-положению функциональные группы, присоединенные через карбониламиноаллильный линкер.
Фиг. 2. Кривые накопления продукта для производных 5'-трифосфатов-2'-дезоксиуридина с полимеразами Taq и Vent (ехо-) и с двумя типами ДНК-матриц -бактериальной ДНК с фиксированной последовательностью и вырожденной синтетической ДНК. ПЦР в режиме реального времени. Визуализация с помощью красителя EvaGreen (Biotium, США).
Фиг. 3. Электрофореграммы продуктов ПЦР с производными 2'-дезоксиуридин-5'-трифосфатов при полном замещении природного dTTP. 4% агарозный гель, окрашивание бромистым этидием. NC - отрицательный контроль.
Таблица 1. Эффективность амплификации ДНК и выход целевого продукта при использовании в качестве субстрата mod-dUTP при полной замене природного dTTP. Е - эффективность амплификации (Е=10tgα, где Е - эффективность амплификации, tgα - тангенс угла наклона прямого участка S-образной кривой накопления флуоресцентного сигнала, представленной в логарифмическом масштабе), η - выход продукта, нормированный на выход немодифицированной ДНК (ПЦР с использованием природного dTTP).
Осуществление изобретения
Для осуществления изобретения кинетику амплификации изучали методом ПЦР в реальном времени по накоплению флуоресцентного сигнала от интеркалирующего красителя Eva Green (Biotium, США) для каждого модифицированного трифосфата дезоксиуридина на приборе BioRad IQ5. Использовали Taq- и Vent (ехо-)-ДНК-полимеразы, количество которых в реакционную смесь брали согласно рекомендациям производителя (1.5 ед. акт. для Taq-, и 0.5 ед. акт. для Vent (ехо-) полимераз). Реакционная смесь содержала 200 мкМ каждого из немодифицированных дезоксинуклеозидтрифосфатов dATP, dCTP, dGTP, dTTP или один из mod-dUTPs при полной замене природного dTTP на mod-dUTP. В качестве матрицы использовали синтетические олигонуклеотиды "условно двухцепочечной" ДНК, составленной из двух синтетических олигонуклеотидов длиной 86 нуклеотидов каждая с вырожденной центральной частью длиной 40 нуклеотидов с взаимно комплементарными фланкирующими частями и бактериальную ДНК-матрицу представляющей собой ПЦР-продукт фрагмента гена rpoB М. tuberculosis длиной 215 п. н. по 106 копий. Температурно-временной профиль ПЦР состоял из предварительной денатурации при 95°С в течение 3 мин, за которой следовали 40 циклов: 95°С (денатурация ДНК) в течение 30 с, 64°С (отжиг праймеров) в течение 30 с, 72°С (достройка праймеров) в течение 40 с и далее завершающая инкубация при 72°С в течение 5 мин.
Эффективность реакции определяли по углу наклона прямого участка S-образной кривой накопления ДНК, представленной в логарифмическом масштабе. Использовали следующую формулу для расчета эффективности: E=10tgα, где Е - эффективность амплификации (динамический показатель накопления флуоресцентного сигнала), tgα - тангенс угла наклона линейного участка кривой накопления флуоресцентного сигнала.
При определении выхода продуктов амплификации в ходе ПЦР в реакционную смесь не добавляли интеркалирующий краситель Eva Green. Температурно-временной режим был аналогичен, примененному для ПЦР в реальном времени, за исключением количества циклов амплификации, которое составляло 32 цикла. Продукты ПЦР разделяли в 4% агарозном геле и затем окрашивали бромистым этидием. Выход целевых продуктов ПЦР оценивали по оптической плотности полос в дорожках геля, соответствующих полноразмерному продукту, с использованием программы ImageJ (NIH, США).
Примеры и их применение
Для осуществления изобретения использовали модифицированные трифосфаты дезоксиуридина которые синтезировали по описанному методу [Чудинов А.В., Киселева Я.Ю., Кузнецова В.Е., Шершов В.Е., Спицын М.А., Гусейнов Т.О., Лапа С.А., Тимофеев Э.Н., Арчаков А.И., Лисица А.В., Радько С.П., Заседателев А.С. 2017. Ферментативный синтез ДНК с высокой степенью модификации. Молекуляр. биология. 51, 534-544].
Использовали синтетические олигонуклеотиды с вырожденной центральной частью Matrix_1f-06 и Matrix_1r-06 и прайцмеры Forw_1-06 и Rev_1-06.
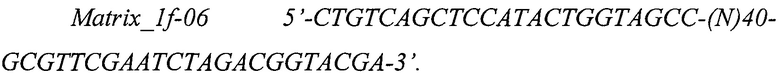
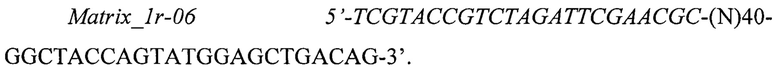
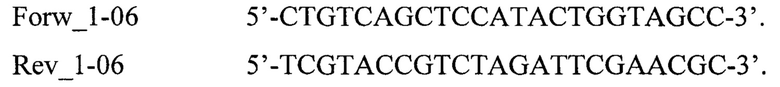
Использовали в качестве бактериальной ДНК-матрицы фрагмент бактериальной ДНК гена rpoB (М. tuberculosis) Matrix_215 длиной 215 п. н., праймеры Forw_215, Rev_215 для амплификации фрагмента длиной 215 п. н. и праймеры Forw_126, Rev_126 для амплификации «вложенного» короткого внутреннего фрагмента длиной 126 п. н.
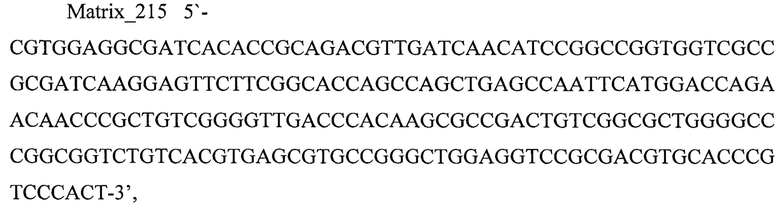
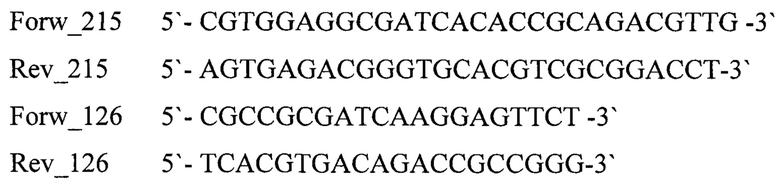
Использовали немодифицированные dNTPs (Thermo Scientific, США), полимеразы Taq (Thermo Scientific) и Vent (exo-) (New England Biolabs, США). ПЦР в режиме реального времени проводили в амплификаторе iCycleriQ5 (Bio-Rad Laboratories, США). В качестве флуоресцентного красителя для ПЦР в режиме реального времени использовали Eva Green (Biotium, США). Для разделения фрагментов ДНК использовали электрофорез в 4% агарозном геле. Для окрашивания электрофорезных гелей использовали бромид этидия ("Хеликон", Россия). В качестве маркера длин ДНК использовали 50 bpDNA Ladder (Thermo Scientific, США).
Использовали полуавтоматические пипетки (Gilson, Франция), амплификатор РТС-220 (Bio-Rad, США), амплификатор для ПЦР в режиме реального времени IQ5 (BioRad, США), центрифуга-вортекс "Микроспин" FV-2400 (Biosan, Латвия), высокоскоростную центрифугу для микропробирок Frontier5515 (Ohaus, США), система для горизонтального электрофореза (ООО "Хеликон", Россия), транс-иллюминатор ТСР-20.МС 254/312 нм (Vilber Lourmat, Франция), цифровой фотоаппарат EOS 500D (Canon, Япония) с оптическим фильтром SYBR photographic filter S7569 (Molecular Probes, США). Олигонуклеотиды синтезировали с помощью автоматического синтезатора ABI 394 DNA/RNA (Applied Biosystems, США). Измерение концентрации олигонуклеотидов и ДНК проводили с помощью спектрофотометра для микрообъемов Nano Drop 1000 (Thermo Scientific, США).
Пример 1.
Количественную ПЦР-РВ проводили в 25 мкл реакционной смеси содержащей смесь матриц Matrix_1f-06 и Matrix_1r-06 каждой по 106 копий, праймеров Forw_1-06 и Rev_1-06 каждого по 5 мкМ, dU119, dATP, dCTP, dGTP каждого по 200 мкМ, Taq ДНК-полимеразу 1.5 ед.акт., краситель Eva Green (Biotium, США), реакционный буфер, оставляемый производителем полимеразы. ПЦР-РВ проводили в амплификаторе iCycler iQ5 ("Bio-Rad Laboratories", США) с возбуждением флуоресценции на длине волны около 500 нм и регистрацией около 530 нм. при следующих условиях: 95°С в течение 3 мин (начальная денатурация); 40 циклов: 95°С (денатурация ДНК) в течение 30 с, 64°С (отжиг праймеров) в течение 30 с, 72°С (достройка праймеров) в течение 40 с и далее завершающая инкубация при 72°С в течение 5 мин. Результаты представлены на Фиг. 2а.
Полученные кривые использовали для расчета эффективности амплификации по тангенсу угла наклона прямого участка S-образной кривой накопления сигнала, представленной в логарифмическо масштабе. Вычисления осуществляли по первичному увеличению интенсивности сигнала (Фиг. 2а). Значения эффективности амплификации ДНК, вычисленные на основании количественной ПЦР с регистрацией в реальном времени, приведены в табл.1. (Где Е - эффективность амплификации (Е=10tgα, где Е - эффективность амплификации, tgα - тангенс угла наклона прямого участка S-образной кривой накопления флуоресцентного сигнала, представленной в логарифмическом масштабе).
Пример 2. Аналогично примеру 1 с заменой dU119 на dU126. Результаты представлены на Фиг. 2а. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 3. Аналогично примеру 1 с заменой dU119 на dU104. Результаты представлены на Фиг. 2а. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 4. Аналогично примеру 1 с заменой dU119 на dU105. Результаты представлены на Фиг. 2а. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 5. Аналогично примеру 1 с заменой dU119 на dU106. Результаты представлены на Фиг. 2а. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 6. Аналогично примеру 1 с заменой dU119 на dU120. Результаты представлены на Фиг. 2а. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 7. Аналогично примеру 1 с заменой dU119 на dU122. Результаты представлены на Фиг. 2а. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 8. Аналогично примеру 1 с заменой dU119 на dU99. Результаты представлены на Фиг. 2а. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 9. Аналогично примеру 1 с заменой dU119 на dU111. Результаты представлены на Фиг. 2а. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 10. Аналогично примеру 1 с заменой dU119 на dU111. Результаты представлены на Фиг. 2а. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 11. Аналогично примеру 1 с заменой dU119 на dU100. Результаты представлены на Фиг. 2а. Значения эффективности амплификации ДНК, в табл. 1.
Пример 12. Аналогично примеру 1 с заменой dU119 на dU107. Результаты представлены на Фиг, 2а. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 13. Аналогично примеру 1 с заменой dU119 на dU110. Результаты представлены на Фиг. 2а. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 14. Аналогично примеру 1 с заменой Taq ДНК-полимеразы на Vent (ехо-) полимеразу (0.5 ед. акт.). Результаты представлены на Фиг. 10 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 15. Аналогично примеру 14 с заменой dU119 на dU126. Результаты представлены на Фиг. 2б. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 16. Аналогично примеру 14 с заменой dU119 на dU104. Результаты представлены на Фиг. 2б. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 17. Аналогично примеру 14 с заменой dU119 на dU105. Результаты представлены на Фиг. 2б. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 18. Аналогично примеру 14 с заменой dU119 на dU106. Результаты представлены на Фиг. 2б. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 19. Аналогично примеру 14 с заменой dU119 на dU120. Результаты представлены на Фиг. 10 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 20. Аналогично примеру 14 с заменой dU119 на dU122. Результаты представлены на Фиг. 2б. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 21. Аналогично примеру 14 с заменой dU119 на dU99. Результаты представлены на Фиг. 2б. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 22. Аналогично примеру 14 с заменой dU119 на dU111. Результаты представлены на Фиг. 2б. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 23. Аналогично примеру 14 с заменой dU119 на dU118. Результаты представлены на Фиг. 2б. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 24. Аналогично примеру 14 с заменой dU119 на dU100. Результаты представлены на Фиг. 2б. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 25. Аналогично примеру 14 с заменой dU119 на dU107. Результаты представлены на Фиг. 2б. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 26. Аналогично примеру 1 с заменой dU119 на dU110. Результаты представлены на Фиг. 2б. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 27. Аналогично примеру 1 с заменой матриц Matrix_1f-06 и Matrix_1r-06 и праймеров Forw_1-06 и Rev_1-06, на матрицу Matrix_215 106 копий, праймеры Forw_126, Rev_126 каждого по 5 мкМ. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 28. Аналогично примеру 27 с заменой dU119 на dU126. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 29. Аналогично примеру 27 с заменой dU119 на dU104. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 30. Аналогично примеру 27 с заменой dU119 на dU105. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 31. Аналогично примеру 27 с заменой dU119 на dU106. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 32. Аналогично примеру 27 с заменой dU119 на dU120. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 33. Аналогично примеру 27 с заменой dU119 на dU122. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 34. Аналогично примеру 27 с заменой dU119 на dU99. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 35. Аналогично примеру 27 с заменой dU119 на dU111. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 36. Аналогично примеру 27 с заменой dU119 на dU118. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 37. Аналогично примеру 27 с заменой dU119 на dU100. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 38. Аналогично примеру 27 с заменой dU119 на dU107. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 39. Аналогично примеру 27 с заменой dU119 на dU100. Результаты представлены на Фиг. 2в. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 40. Аналогично примеру 27 с заменой Taq ДНК-полимеразы на Vent (ехо-) полимеразу (0.5 ед. акт.). Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 41. Аналогично примеру 40 с заменой dU119 на dU126. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 42. Аналогично примеру 40 с заменой dU119 на dU104. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 43. Аналогично примеру 40 с заменой dU119 на dU105. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 44. Аналогично примеру 40 с заменой dU119 на dU106. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 45. Аналогично примеру 40 с заменой dU119 на dU120. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 46. Аналогично примеру 40 с заменой dU119 на dU122. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 47. Аналогично примеру 40 с заменой dU119 на dU99. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 48. Аналогично примеру 40 с заменой dU119 на dU111. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 49. Аналогично примеру 40 с заменой dU119 на dU118. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 50. Аналогично примеру 40 с заменой dU119 на dU100. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 51. Аналогично примеру 40 с заменой dU119 на dU107. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 52. Аналогично примеру 40 с заменой dU119 на dU107. Результаты представлены на Фиг. 2 г. Значения эффективности амплификации ДНК, представлены в табл. 1.
Пример 53. Аналогично примеру 1, с заменой 40 циклов на 32 цикла и без добавления красителя Eva Green в реакционную смесь. Полученные ПЦР-продукты разделяли в 4% агарозном геле и затем окрашивали бромистым этидием. Выход целевых продуктов ПЦР оценивали по оптической плотности полос в дорожках геля, соответствующих полноразмерному продукту, с использованием программы ImageJ (NIH, США). Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 54. Аналогично примеру 53 с заменой dU119 на dU126. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 55. Аналогично примеру 53 с заменой dU119 на dU104. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 56. Аналогично примеру 53 с заменой dU119 на dU105. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 57. Аналогично примеру 53 с заменой dU119 на dU106. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 58. Аналогично примеру 53 с заменой dU119 на dU120. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 59. Аналогично примеру 53 с заменой dU119 на dU122. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 60. Аналогично примеру 53 с заменой dU119 на dU99. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 61. Аналогично примеру 53 с заменой dU119 на dU111. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 62. Аналогично примеру 53 с заменой dU119 на dU118. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 63. Аналогично примеру 53 с заменой dU119 на dU100. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 64. Аналогично примеру 53 с заменой dU119 на dU107. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 65. Аналогично примеру 53 с заменой dU119 на dU110. Результаты представлены на Фиг. 3а. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 66. Аналогично примеру 53, с заменой Taq ДНК-полимеразы на Vent (ехо-) полимеразу (0.5 ед.акт.). Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 67. Аналогично примеру 66 с заменой dU119 на dU126. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 68. Аналогично примеру 66 с заменой dU119 на dU104. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 69. Аналогично примеру 66 с заменой dU119 на dU105. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 70. Аналогично примеру 66 с заменой dU119 на dU106. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 71. Аналогично примеру 66 с заменой dU119 на dU120. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 72. Аналогично примеру 66 с заменой dU119 на dU122. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 73. Аналогично примеру 66 с заменой dU119 на dU99. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 74. Аналогично примеру 66 с заменой dU119 на dU111. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 75. Аналогично примеру 66 с заменой dU119 на dU118. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 76. Аналогично примеру 66 с заменой dU119 на dU100. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 77. Аналогично примеру 66 с заменой dU119 на dU107. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 78. Аналогично примеру 66 с заменой dU119 на dU110. Результаты представлены на Фиг. 3б. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 79. Аналогично примеру 53, с заменой с заменой матриц Matrix_1f-06 и Matrix_1r-06 и праймеров Forw_1-06 и Rev_1-06, на матрицу Matrix_215 106 копий, праймеры Forw_126, Rev_126 каждого по 5 мкМ. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 80. Аналогично примеру 79 с заменой dU119 на dU126. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 81. Аналогично примеру 79 с заменой dU119 на dU104. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 82. Аналогично примеру 79 с заменой dU119 на dU105. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 83. Аналогично примеру 79 с заменой dU119 на dU106. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 84. Аналогично примеру 79 с заменой dU119 на dU120. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 85. Аналогично примеру 79 с заменой dU119 на dU122. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 86. Аналогично примеру 79 с заменой dU119 на dU99. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 87. Аналогично примеру 79 с заменой dU119 на dU111. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 88. Аналогично примеру 79 с заменой dU119 на dU118. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 89. Аналогично примеру 79 с заменой dU119 на dU100. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 90. Аналогично примеру 79 с заменой dU119 на dU107. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 91. Аналогично примеру 79 с заменой dU119 на dU110. Результаты представлены на Фиг. 3в. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 92. Аналогично примеру 79 с заменой Taq ДНК-полимеразы на Vent (ехо-) полимеразу (0.5 ед. акт.). Результаты представлены на Фиг. 3 г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 93. Аналогично примеру 92 с заменой dU119 на dU126. Результаты представлены на Фиг. 3г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 94. Аналогично примеру 92 с заменой dU119 на dU104. Результаты представлены на Фиг. 3г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 95. Аналогично примеру 92 с заменой dU119 на dU105. Результаты представлены на Фиг. 3г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 96. Аналогично примеру 92 с заменой dU119 на dU106. Результаты представлены на Фиг. 3г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 97. Аналогично примеру 92 с заменой dU119 на dU120. Результаты представлены на Фиг. 3г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 98. Аналогично примеру 92 с заменой dU119 на dU122. Результаты представлены на Фиг. 3г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 99. Аналогично примеру 92 с заменой dU119 на dU122. Результаты представлены на Фиг. 3г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 100. Аналогично примеру 92 с заменой dU119 на dU111. Результаты представлены на Фиг. 3 г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 101. Аналогично примеру 92 с заменой dU119 на dU118. Результаты представлены на Фиг. 3г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 102. Аналогично примеру 92 с заменой dU119 на dU100. Результаты представлены на Фиг. 3г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 103. Аналогично примеру 92 с заменой dU119 на dU107. Результаты представлены на Фиг. 3г. Выход целевых продуктов ПЦР, представлен в табл. 1.
Пример 104. Аналогично примеру 92 с заменой dU119 на dU110. Результаты представлены на Фиг. 3г. Выход целевых продуктов ПЦР, представлен в табл. 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения субстратной эффективности производных трифосфатов дезоксиуридина для ДНК-полимераз методом реакции достраивания праймера | 2019 |
|
RU2731739C1 |
| Способ ферментативного получения модифицированных ДНК для создания реагентов, специфично связывающихся с гидрофобными участками высокомолекулярных органических соединений | 2017 |
|
RU2699522C2 |
| Способ термической диссоциации для проведения селекции ДНК-аптамеров | 2019 |
|
RU2723373C1 |
| Способ оценки влияния модифицированных трифосфатов дезоксинуклеозидов на олигонуклеотидный состав комбинаторных ДНК-библиотек для проведения селекции модифицированных аптамеров | 2021 |
|
RU2779058C1 |
| Способ получения модифицированных комбинаторных ДНК библиотек методом твердофазной реакции удлинения праймера на ПЭТ-микрочастицах | 2018 |
|
RU2734941C2 |
| Флуоресцентно-меченые дезоксиуридинтрифосфаты | 2016 |
|
RU2637310C1 |
| Дезоксиуридинтрифосфаты, связанные с цианиновыми красителями сульфамидоалкильными линкерами, для использования в ПЦР | 2017 |
|
RU2667070C1 |
| СПОСОБ АМПЛИФИКАЦИИ НУКЛЕИНОВЫХ КИСЛОТ С ИСПОЛЬЗОВАНИЕМ ФОСФОРИЛГУАНИДИНОВЫХ ОЛИГОНУКЛЕОТИДОВ | 2017 |
|
RU2698134C2 |
| Способ защиты от контаминации реакционных смесей для ПЦР | 2022 |
|
RU2796504C1 |
| КОМПОЗИЦИИ ДЛЯ РЕАКЦИИ ОБРАТНОЙ ТРАНСКРИПЦИИ С ГОРЯЧИМ СТАРТОМ ИЛИ ДЛЯ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ С ОБРАТНОЙ ТРАНСКРИПЦИЕЙ С ГОРЯЧИМ СТАРТОМ | 2013 |
|
RU2630999C2 |
Изобретение относится к области молекулярной биологии, органической химии, биотехнологии, микробиологии и медицины. Заявлен способ определения субстратной совместимости модифицированных трифосфатов дезоксиуридина и ДНК-полимераз сочетанием методом количественной ПЦР и электрофореза. Сущность изобретения заключается в том, что совместимость модифицированных нуклеозидтрифосфатов и ДНК-полимераз определяется сочетанием методов: количественной ПЦР в режиме реального времени на матрице "условно двухцепочечной" ДНК, составленной из двух синтетических олигонуклеотидов с вырожденной центральной частью с взаимно комплементарными фланкирующими частями при полной замене природного нуклеотида на модифицированный аналог; количественной ПЦР в режиме реального времени на бактериальной ДНК-матрице, представляющей собой ПЦР-продукт фрагмента гена rpoB длиной 215 п.н. с амплификацией "вложенного" короткого внутреннего фрагмента длиной 126 п.н. при полной замене природного нуклеотида на модифицированный аналог; электрофоретического контроля продуктов ПЦР с количественной оценкой полноразмерного продукта. Модифицированные 2'-дезоксиуридин-5'-трифосфаты содержат в своей структуре функциональные группы, которые присоединены к 5-положению пиримидинового основания карбониламиноаллильным линкером, аллильная часть линкера связана с 5-положением пиримидинового основания транс-алкеновой связью. Функциональные группы представлены линейными алифатическими, разветвленными алифатическими, фенилалкильными, алкилиндольными группами. Использовали ДНК-полимеразы с отсутствующей корректирующей 3'-5'-экзонуклеазной активностью, относящиеся к разным семействам - Taq (семейство А) и Vent(exo-) (семейство Б). Использовали ПЦР с регистрацией в реальном времени, (Real time PCR) по накоплению флуоресцентного сигнала от интеркалирующего красителя Eva Green (Biotium, США) с возбуждением флуоресценции на длине волны около 500 нм и регистрацией около 530 нм. Продукты ПЦР разделяли методом электрофореза в 4% агарозном геле. Визуализацию продуктов реакции осуществляли окрашиванием агарозного геля, в котором разделяли продукты ПРЦ, бромистым этидием. Количественную оценку полноразмерного продукта проводили по оптической плотности соответствующих полос в дорожках геля. Предлагаемое изобретение может быть использовано при получении модифицированных фрагментов ДНК и модифицированных аптамеров, функциональных аналогов моноклональных антител. Изобретение обеспечивает определение субстратной совместимости производных нуклеозидтрифосфатов и матричнозависимых ДНК-полимераз, предназначенных для получения высокоэффективных модифицированных ДНК-аптамеров методом SELEX. 7 з.п. ф-лы, 1 табл., 104 пр., 3 ил.
1. Способ определения субстратной совместимости модифицированных 2'-дезоксиуридин-5'-трифосфатов и ДНК-полимераз, отличающийся тем, что используют сочетание методов:
- количественной ПЦР в режиме реального времени на матрице "условно двухцепочечной" ДНК, составленной из двух синтетических олигонуклеотидов длиной 86 нуклеотидов каждая с вырожденной центральной частью длиной 40 нуклеотидов с взаимно комплементарными фланкирующими частями при полной замене природного нуклеотида на модифицированный аналог; с последующим определением эффективности амплификации по тангенсу угла наклона прямого участка S-образной кривой накопления сигнала, представленной в логарифмическом масштабе и математическим определением субстратной совместимости модифицированных 2'-дезоксиуридин-5'-трифосфатов и ДНК-полимераз: значение показателя Е меньше 1.2 трактуется как несовместимость, значение Е больше или равно 1.2 трактуется как совместимость; степень совместимости определяется в диапазоне от 1.2 до 2.0 и соответствует градации от «плохо совместим» до «абсолютно совместим»;
- количественной ПЦР в режиме реального времени на бактериальной ДНК-матрице, представляющей собой ПЦР-продукт фрагмента гена rpoB М. tuberculosis длиной 215 п.н. с амплификацией "вложенного" короткого внутреннего фрагмента длиной 126 п.н. при полной замене природного нуклеотида на модифицированный аналог; с последующим определением эффективности амплификации по тангенсу угла наклона прямого участка S-образной кривой накопления сигнала, представленной в логарифмическом масштабе, и математическим определением субстратной совместимости модифицированных 2'-дезоксиуридин-5'-трифосфатов и ДНК-полимераз: значение показателя Е меньше 1.2 трактуется как несовместимость, значение Е больше или равно 1.2 трактуется как совместимость; степень совместимости определяется в диапазоне от 1.2 до 2.0 и соответствует градации от «плохо совместим» до «абсолютно совместим»;
- количественным определением целевых продуктов ПЦР: разделение продуктов ПЦР методом электрофореза в 4% агарозном геле, окрашивание бромистым этидием, количественная оценка целевых продуктов ПЦР по оптической плотности полос в дорожках геля с применением специализированного программного обеспечения путем сравнения (вычисления математического отношения) оптической плотности полосы, соответствующей исследуемому модифицированному трифосфату дезоксинуклеозида с оптической плотностью полосы, соответствующей природному трифосфату дезоксинуклеозида; значение отношения меньше 0.2 трактуется как несовместимость, значение отношения больше или равно 0.2 трактуется как совместимость; степень совместимости определяется в диапазоне от 0.2 до 2.0 и соответствует градации от «плохо совместим» до «абсолютно совместим».
2. Способ по п. 1, отличающийся тем, что модифицированные 2'-дезоксиуридин-5'-трифосфатов содержат в своей структуре функциональные группы, которые присоединены к 5-положению пиримидинового основания карбониламиноаллильным линкером, аллильная часть линкера связана с 5-положением пиримидинового основания транс-алкеновой связью, функциональные группы представлены линейными алифатическими (пропильной, бутильной), разветвленными алифатическими (изо-пропильной, 2-метилпропильной, 3-метилбутильной, 4-метилпентильной), фенилалкильными (метилфенильной, 2-фенилэтильной, 3-фенилпропильной, (4-оксифенил)метильной), алкилиндольными группами (3-индолил)метильной, (3-индолил)этильной, (3-индолил)пропильной).
3. Способ по п. 2, отличающийся тем, что использованы ДНК-полимеразы с отсутствующей корректирующей 3'-5'-экзонуклеазной активностью, относящиеся к разным семействам - Taq (семейство А) и Vent(exo-) (семейство Б).
4. Способ по п. 3, отличающийся тем, что количественную ПЦР в режиме реального времени проводят на матрице "условно двухцепочечной" ДНК, составленной из двух синтетических олигонуклеотидов с вырожденной центральной частью длиной 40 нуклеотидов с взаимно комплементарными фланкирующими частями при полной замене природного нуклеотида на модифицированный аналог, эффективность амплификации определяют по тангенсу угла наклона прямого участка S-образной кривой накопления сигнала, представленной в логарифмическом масштабе.
5. Способ по п. 4, отличающийся тем, что количественную ПЦР в режиме реального времени проводят на бактериальной матрице, фрагменте бактериальной ДНК гена rpoB (М. tuberculosis) длиной 215 п.н., и амплификации «вложенного» короткого внутреннего фрагмента длиной 126 п.н., эффективность амплификации определяют по тангенсу угла наклона прямого участка S-образной кривой накопления сигнала, представленной в логарифмическом масштабе.
6. Способ по п. 5, отличающийся тем, что используют синтетические олигонуклеотиды с вырожденной центральной частью Matrix_1f-06 и Matrix_1r-06 и прайцмеры Forw_1-06 и Rev_1-06:
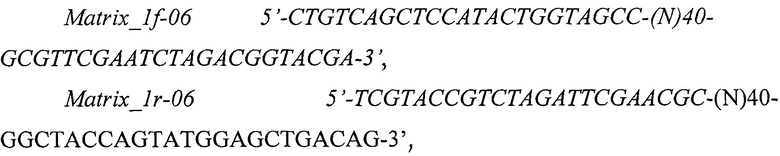
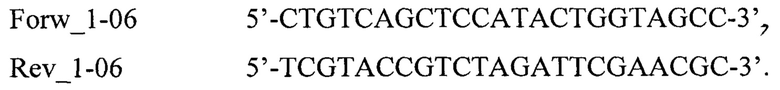
7. Способ по п. 6, отличающийся тем, что в качестве бактериальной ДНК-матрицы используют фрагмент бактериальной ДНК гена rpoB (М. tuberculosis) Matrix_215 длиной 215 п.н., праймеры Forw_215, Rev_215 для амплификации фрагмента длиной 215 п.н. и праймеры Forw_126, Rev_126 для амплификации «вложенного» короткого внутреннего фрагмента длиной 126 п.н.
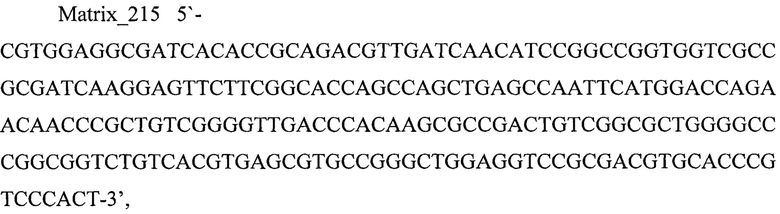
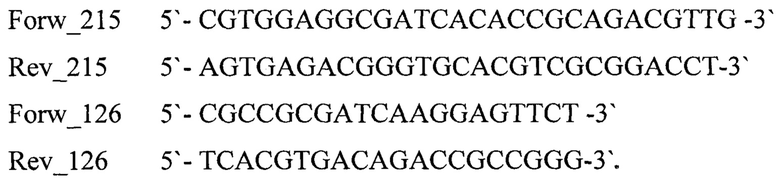
8. Способ по п. 7, отличающийся тем, что продукты ПЦР разделяют методом электрофореза в 4% агарозном геле и затем окрашивают бромистым этидием, выход целевых продуктов ПЦР определяют по оптической плотности полос в дорожках геля.
| Shou Goji и др., Direct Detection of Thrombin Binding to 8-Bromodeoxyguanosine-Modified Aptamer: Effects of Modification on Affinity and Kinetics, J | |||
| of nucleic acids, 15.09.2011, Volume 2011, Article ID 316079, 5 pages | |||
| ПРОСТОЙ, ЭФФЕКТИВНЫЙ И БЫСТРЫЙ СПОСОБ ФЕРМЕНТАТИВНОЙ МОДИФИКАЦИИ И СИНТЕЗА НУКЛЕИНОВОЙ КИСЛОТЫ IN VITRO С ИСПОЛЬЗОВАНИЕМ МИКРОВОЛНОВОГО ИЗЛУЧЕНИЯ | 2002 |
|
RU2295568C2 |
Авторы
Даты
2020-11-23—Публикация
2019-11-18—Подача