Область техники, к которой относится изобретение
Изобретение относится к области молекулярной биологии, органической химии, энзимологии, биотехнологии и медицины, и обеспечивает способ ферментативного получения модифицированных ДНК для создания реагентов, способных специфично связываться с гидрофобными участками высокомолекулярных органических соединений. Метод основан на использовании тонкого органического синтеза индивидуальных модифицированных трифосфатов дезоксиуридина, которые используются в качестве субстрата для специальных ДНК-полимераз в ферментативных реакциях: ПЦР, транскрипции, обратной транскрипции, а также реакции удлинения праймера. Полученные в результате ферментативной амплификации в ПЦР либо в других ферментативных реакциях модификации ДНК с применением специальных ДНК-полимераз, модифицированные цепи ДНК отделяются от немодифицированных цепей ДНК благодаря применению праймера, содержащего биотин, который способен взаимодействовать со стрептавидином, иммобилизованным на специальном носителе - магнитных частицах. Результирующие одноцепочечные ДНК с модификациями способны взаимодействовать с гидрофобными участками высокомолекулярных соединений-мишеней и предназначены для разработки ДНК-зондов, ДНК-сенсоров, аптамеров, модифицированных аптамеров и сомамеров, применяющихся в молекулярно-биологических исследованиях и в медицинской диагностике.
Уровень техники
В последнее время увеличивающееся распространение модифицированных нуклеиновых кислот обусловлено рядом причин. Эти причины связаны с развитием и коммерческим применением методов молекулярной диагностики и терапии. Введение метки в ДНК-зонд позволяет детектировать взаимодействие этого зонда с субстратом, что открывает широкие возможности для создания диагностических систем, основанных на применении ДНК-биосенсоров или ДНК-биочипов, которые позволяют проводить массовый скрининг биологических образцов с одновременным анализом сотен и даже тысяч исследуемых параметров (мутации, точечные нуклеотидные замены (SNPs), выявление болезнетворных агентов и т.п.). Такой меткой может служить радиоактивный изотоп (патент на изобретение США №4883750), биотин (Longer P.R., Waldrop A.A., Ward D.С. Enzymatic synthesis of biotin-labeled polynucleotides: novel nucleic acid affinity probes. Proc Nati Acad Sci USA. 1981. V. 78. №11. P. 6633-6637), флуоресцентный краситель (патент на изобретение РФ №2423521) и другие.
Другим примером биодетекторных систем является применение способности фрагментов нуклеиновых кислот взаимодействовать с субстратом за счет образования трехмерных структур, проявляющих сродство к определенным пространственным формам различных белков или других макромолекул (а также низкомолекулярных лигандов) путем образования водородных связей, электростатических и ван-дер-ваальсовых взаимодействий (Patel D.J., Suri A.K. Structure, recognition and discrimination in RNA aptamer complexes with cofactors, amino acids, drugs and aminoglycoside antibiotics. J. Biotechnol. 2000. V. 74. №1. P. 39-60). Таким образом, аптамеры на основе нуклеиновых кислот являются функциональными аналогами белковых антител, но характеризуются рядом преимуществ, такими как:
а) возможность применения рутинных методов получения НК-аптамеров без использования лабораторных животных;
б) возможность автоматизации процесса получения НК-аптамеров;
в) сравнительная дешевизна;
г) уникальные физико-химические характеристики, такие как возможность многократной денатурации-ренатурации (Радько С.П., Рахметова С.Ю., Бодоев Н.В., Арчаков А.Н. Аптамеры как перспективные аффинные реагенты для клинической протеомики. Биомедицинская химия. 2007. Т. 53. №1. С. 5-24).
Метод селекции из библиотеки олигонуклеотидов различных последовательностей аптамеров (Tuerk С., Gold L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymer ase. Science. 1990. V. 249. №4968. P. 505-510; Ellington A.D., Szostak J.W. In vitro selection of RNA molecules that bind specific ligands. Nature. 1990. V. 346. №6287. P. 818-822), имеющих сродство к определенному субстрату, получил название SELEX (Systematic Evolution of Ligands by EXponential Enrichment) и в упрощенном виде представляет собой ряд циклов связывания олигонуклеотидов с мишенью, выделение связавшейся фракции и амплификацию связавшейся фракции.
В ряде случаев возникают сложности селекции аптамеров с необходимыми для создания надежных аналитических систем константами связывания. Для таких случаев, а также для придания аптамерам дополнительных желаемых свойств проводят модицификацию путем включения в азотистые основания различных функциональных групп, в том числе и флуоресцентных красителей (Власова И.Е., Власов В.В. Молекулярная эволюция: Создание нуклеиновых кислот, способных к специфическому комплексообразованию и обладающих каталитическими функциями Мол. Биология. 1993. Т. 27. №1. С. 5-13; Копылов A.M., Спиридонова В.А. Комбинаторная химия нуклеиновых кислот: SELEX. Мол. Биол. 2000. Т. 34. С. 1097-1113).
Фирма "SomaLogic" и коллектив авторов из Колорадского университета в Боулдере, где ранее была разработана техника отбора аптамеров SELEX (термин впервые введен Ellington A.D., Szostak J.W. In vitro selection of RNA molecules that bind specific ligands. 1990. Nature. V. 346, P. 818-822), предложили методику получения нового поколения синтетически-модифицированных аптамеров (Gold L. Aptamer-based multiplexed proteomic technology for biomarker discovery. PLoS One. 2010. V. 5. №12. e15004) для эффективного применения в протеомике. Полученные аптамеры были названы их создателями как "сомамеры" (SOMAmers от Slow Off-rate Modified Aptamers). Отличительной особенностью сомамеров явилось наличие различных функциональных групп, в том числе, характерных для протеинов. Авторами показана возможность многопараметрического анализа молекул-мишеней с использованием сконструированных ими модифицированных аптамеров (патент на изобретение США №7855054). Результатом работы стало создание биологического микрочипа для исследований в области протеомики, в качестве зондов которого использовались модифицированные сомамеры (патент на изобретение США №7709192). Недостатком описанного подхода является крайне низкая субстратная совместимость предложенных авторами модифицированных трифосфатов дезоксиуридина с используемыми полимеразами, что привело к необходимости применения реакции удлинения праймера вместо высокоэффективной ПЦР.
Годом позже фирма "SomaLogic" предлагает улучшенные методики SELEX с использованием модифицированных по С-5-положению пиримидиновых оснований, и позволяет получать аптамеры с гораздо более низкими константами диссоциации (патент на изобретение США №7947447). К сожалению, в данном исследовании авторам не удалось решить описанную ранее проблему субстратной совместимости.
Упомянутая выше пробема субстратной совместимости модифицированных трифосфатов дезоксинуклеозидов с ДНК-полимеразами стала одной из основных проблем, возникающих при создании модифицированных аптамеров, поскольку требование к их "амплифицируемости", то есть пригодности модифицированных аптамеров к участию в полимеразной цепной реакции, является основополагающим для осуществления процедуры SELEX и ее различных модификаций. Требование совместимости привело к необходимости тщательного отбора модифицированных трифосфатов по признаку их амплифицируемости, а не сродству к мишени.
Авторами патентов (патенты на изобретение США №№7855054, 7947447 и 7964356) представлен расширенный спектр функциональных групп (алифатические, ароматические, гетероциклические заместители и др.), которые удалось использовать для получения модифицированных аптамеров. Такой спектр функциональных групп позволил не только добиться высоких констант связывания аптамер-лиганд, но и расширить спектр белков-мишеней, способных выступать в качестве лигандов. Описанные соединения непригодны для использования в ПЦР.
Изобретение (патент на изобретение США №8846898, - 2014, Lievre Cornu LLC, США) предлагает модифицированные фосфорамидиты нуклеозидов, содержащие различные функциональные группы, расширяющие спектр химико-биологических свойств аптамеров, получаемых с использованием таких модифицированных производных нуклеозидов. По мнению авторов, разработанные ими модифицированные олигонуклеотиды должны найти широкое применение в качестве терапевтических средств (в том числе в технологии аптамеров), для задач медицинской диагностики, для исследований механизмов стереохимии биохимических реакций, а также для изучения различных НК-белковых взаимодействий. Однако, описанные соединения непригодны для применения в качестве субстратов для ДНК-полимераз в ПЦР.
В изобретении (патент на изобретение США №8772464) описаны основанные на аптамерах высокоспецифические сенсоры, представляющие из себя специальный класс олигонуклеотидов (по сути своей - модифицированных аптамеров), которые могут быть сконструированы в лабораторных условиях и способны реагировать с широким спектром лигандов или аналитов и, таким образом, могут быть применены для множества исследовательских или медицинских задач, таких как различные диагностические процедуры. Как пример, авторы приводят применение таких аптамеров-сенсоров в качестве лиганд-связывающего компонента, что демонстрирует способность таких аптамеров к применению в качестве сенсоров для детекции и количественного анализа различных биомолекул. Применение метода ограничено малыми молекулами-мишенями, описанные соединения несовместимы с ПЦР.
Метод детекции малых органических молекул с использованием пары специальным образом сконструированных аптамеров предложен авторами изобретения (патент на изобретение США №8735367). Аптамеры могут взаимодействовать между собой лишь при наличии посредника - детектируемой молекулы. Каждый из пары аптамеров имеет свой сайт узнавания структуры искомой молекулы, а при взаимодействии с молекулами обоих аптамеров образуется шпилька. И лишь в этом случае можно провести лигазную реакцию, и детекция наличия искомой молекулы осуществляется путем образования продукта лигирования. Применение метода ограничено малыми молекулами-мишенями, описанные соединения несовместимы с ПЦР.
Изобретение (патент на изобретение США №8314223) описывает разработку аптамеров, высокоспецифичных к активным центрам хемокинов, играющих важную роль в развитии иммунного ответа. Авторам удалось получить несколько групп аптамеров, высокоспецифичных к одному из классов хемокинов. Получение таких хемокин-специфичных аптамеров позволило использовать их в качестве антагонистов хемокинов для целей терапии некоторых связанных с иммунитетом патологических состояний, а также для целей диагностики заболеваний, связанных с нарушениями работы иммунной системы. Разработка не связана с получением модифицированных ДНК.
Еще одним примером использования аптамеров в реальной медицинской практике служит итальянская разработка - аптамер, высокоспецифичный к Axl-рецептору тирозинкиназы (патент на изобретение США №8741870). Найденный аптамер выступает в роли ингибитора Axl-рецептора (внеклеточный домен тирозин-специфичной протеинкиназы) и, таким образом, может быть использован в терапии и диагностике патологических состояний, связанных с нарушением работы этого фермента - одного из важнейших элементов системы передачи сигнала в клетке. Разработка не связана с получением модифицированных ДНК.
Авторы (Rohloff J.C., Gelinas A.D., Jarvis Т.С., Ochsner U.A., Schneider D.J., Gold L, Janjic N. Nucleic acid ligands with protein-like side chains: modified aptamers and their use as diagnostic and therapeutic agents. Mol. Ther. Nucleic Acids. 2014. V. 3. e201) своей задачей ставили получение аптамерных зондов, специфичных к различных функциональным сайтам белков, путем введения в аптамеры различных синтетических функциональных групп (различного рода ароматические, алифатические и гетероциклические заместители), не встречающихся в природных биомолекулах. В результате получен целый спектр радикалов, подходящих для модификации фосфоамидитов пиримидинов, используемых при синтезе исходных аптамерных библиотек, способных изменять свойства аптамеров и существенно увеличивать спектр белковых мишеней для них. Модифицированные таким образом нуклеотиды способны к образованию уникальных межмолекулярных мотивов и способны непосредственно контактировать с белками. Благодаря совместимости с ферментативным подходом селекции аптамеров, такие модифицированные производные нуклеотидов сделали возможным создание обширной коллекции аптамеров, специфичных к более чем трем тысячам человеческих белков, представляющих такие важные классы как факторы роста, цитокины, ферменты, гормоны и рецепторы. Эта все время пополняющаяся коллекция делает возможным применение таких модифицированных аптамеров для применения в диагностике и терапии. Авторам не удалось решить проблему субстратной совместимости, полученные соединения непригодны для применения в ПЦР.
Авторы изобретения (патент на изобретение РФ №2410432) представили расширенный спектр функциональных групп для олигонуклеотида с целью его модификации. Доказана биологическая активность таких модифицированных аптамеров. Так, в качестве заместителей авторы использовали аминогексанол (NH2 группа), который этерифицирует фосфатную группу на 5'- или 3'-конце и PEG, который присоединяют по 5'- и/или 3'-концу. При этом как минимум один из присоединенных по 5'- или 3'-концу заместителей представляет собой полиэтиленгликоль. Изобретение связано с пост-селекционной модификацией заранее отобранных аптамеров с описанными последовательностями, полученные соединения непригодны в качестве субстратов для ПЦР.
Авторами изобретения (патент на изобретение РФ №2406507) вещества и способы лечения, профилактики и улучшения состояния при заболевании, связанном с комплементом. Предложены различные терапевтически эффективные конъюгаты аптамер/ПЭГ. При этом аптамеры содержат модифицированные нуклеотиды, что повышает их стабильность к ферментативному и химическому разрушению, а также к термическому и физическому разрушению. Данные конъюгаты аптамер/ПЭГ применимы в качестве средств для терапии связанных с комплементом сердечных, воспалительных и аутоиммунных расстройств, ишемического реперфузионного повреждения и/или других заболеваний или расстройств, в которые вовлечена опосредованная С5 активация комплемента. Описанные модификации не затрагивают азотистые основания с целью получения реагентов для высокоспецифичного взаимодействия с гидрофобными участками макромолекул.
К настоящему времени модифицированные трифосфаты нашли широкое применение для создания различного рода диагностических систем, а также в качестве компонентов лекарственных веществ, использующихся в современной медицинской практике. В ряде случаев модифицированные трифосфаты используются для получения модифицированных аптамеров с различными функциональными группами, что позволяет получить новые свойства и резко увеличить сродство аптамера к молекуле-мишени. Методы, основанные на применении аптамеров, рассматриваются многими исследователями как перспективный современный инструмент для создания надежных диагностических систем.
К настоящему времени известен широкий спектр функциональных групп, подходящих для модифицирования аптамеров и ДНК-сенсоров, но исследователи постоянно сталкиваются с проблемами, связанными с недостаточным аффинным сродством используемых функциональных групп к исследуемым субстратам, сложностями амплификации модифицированных трифосфатов, а также так называемой «проблемой смещения селекции» в рамках процедуры SELEX от высокой аффинности к высокой репликативности, что усложняет селекцию необходимых производных сложно контролируемыми процессами избирательной амплификации (Eaton В.Е., Gold L., Zichi D.A. Let's get specific: the relationship between specificity and affinity. Chem Biol. 1995. V. 2. №10. P. 633-638; Osborne S.E., Ellington A.D. Nucleic acid selection and the challenge of combinatorial chemistry. Chem. Rev. 1997. V. 97. №2. P. 349-370).
Ферментативный способ получения модифицированных ДНК лежит в основе методологии отбора аптамеров SELEX, что делает весьма важной задачу совместимости модифицированных аналогов нуклеотидов, позволяющих получать высокоспецифичные аптамеры, с используемыми в процедуре селекции полимеразами. Необходимым становится условие применимости модифицированных трифосфатов как субстратов в ферментативных реакциях, использующихся для проведения отбора аптамеров (ПЦР, обратная транскрипция, реакция удлинения праймера). Однако, к настоящему времени надежное получение аптамеров возможно лишь при условии низкопроизводительной реакции удлинения праймера.
Заявляемое изобретение отличается от вышеописанных аналогов тем, что разработанный способ ферментативного получения модифицированных ДНК для создания реагентов, специфично связывающихся с гидрофобными участками высокомолекулярных органических соединений, а также модифицированные дезоксинуклеозидтрифосфаты и лабораторные методики их синтеза по многим показателям не уступают, а по некоторым показателям обладают преимуществами перед возможными зарубежными аналогами. Разработанные модифицированные дезоксинуклеозидтрифосфаты пригодны для получения аптамеров методом SELEX и различными модификациями этого метода, способны участвовать в качестве субстратов для нескольких ДНК-полимераз не только в реакции удлинения праймера, но и в ПЦР, сконструированы таким образом, чтобы обеспечивать не только совместимость с полимеразами, но и обеспечивать гидрофобные взаимодействия с соответствующими участками макромолекул-мишеней. Способ, включающий в себя несколько последовательных стадий, отличается применением высокопроизводительной ПЦР вместо реакции удлинения праймера для получения модифицированных ДНК, а также включает надежную процедуру отделения модифицированной биотинилированной цепи для проведения селекции модифицированных аптамеров либо сомамеров или ДНК-сенсоров и ДНК-зондов, в совокупности представляя собой новый способ получения модифицированных ДНК для получения высокоспециализированных реагентов, обладающих повышенной специфичностью к гидрофобным участкам органических макромолекул.
Раскрытие сущности изобретения
Разработка методов получения фрагментов модифицированных ДНК, способных нарабатываться в ходе ПЦР, является сложной задачей, требующей комплексного подхода для успешного решения. Конструирование модифицированных дезоксинуклеозидтрифосфатов для создания реагентов на основе модифицированных ДНК, потенциально способных проявлять высокую специфичность к гидрофобным участкам высокомолекулярных органических соединений, требует комплексного подхода и анализа структур трифосфатво, их совместимости с полимеразами и возможность образовывать гидрофобные взаимодействия с потенциальными мишенями. Сложность задачи обусловлена рядом факторов, включая необходимость многостадийного органического синтеза и учета влияния структурных ограничений, влияющих на субстратные свойства трифосфатов дезоксинуклеозидов.
Проблема совместимости модифицированных трифосфатов нуклеозидов и полимеразы определяет необходимость коррекции классической методологии SELEX: применение реакции удлинения праймера вместо ПЦР, использование мутантных полимераз, способных встраивать модифицированный субстрат, проведение амплификации модифицированной матрицы с применением природных трифосфатов нуклеозидов после каждого раунда селекции с последующим получением модифицированной обогащенной библиотеки для следующего раунда.
В известных к настоящему времени аффинных реагентах на основе модифицированной ДНК лишь часть нуклеотидов заменена на модифицированные, что позволяет ограничить выбор модификации только пиримидиновыми нуклеотидами. Наиболее предпочтительным типом модификации является трансформация С5-положения пиримидиновых оснований, поскольку вводимые заместители ориентированы в широкую бороздку двуспиральной ДНК и в наименьшей степени мешают комплементарному взаимодействию оснований и ПНР амплификации.
Целью настоящего изобретения явилась разработка способа ферментативного получения одноцепочечной ДНК с высокой степенью модификации в реакции удлинения праймера и ПЦР, включающий инкубацию матричной одноцепочечной нуклеиновой кислоты, олигонуклеотидных праймеров и набора мононуклеозидтрифосфатов, из которых один мононуклеозидтрифосфат содержит химически-модифицированное азотистое основание, в присутствии полимеразы дезоксинуклеиновой кислоты. В качестве нуклеотида для введения модификаций и последующей проверки совместимости соответствующих производных трифосфатов в ферментативной реакции удлинения праймера, нами предложен дезоксиуридин и такие функциональные группы как индольная и фенильная, характерные для гиброфобных аминокислот (триптофана и фенилаланина, соответственно). Применение вышеуказанных функциональных групп определяет способность получаемых реагентов специфично взаимодействовать с гидрофобными участками высокомолекулярных органических соединений.
Поставленная цель достигается структурами модифицированных нуклеозидтрифосфатов общих формул (А) и (В).
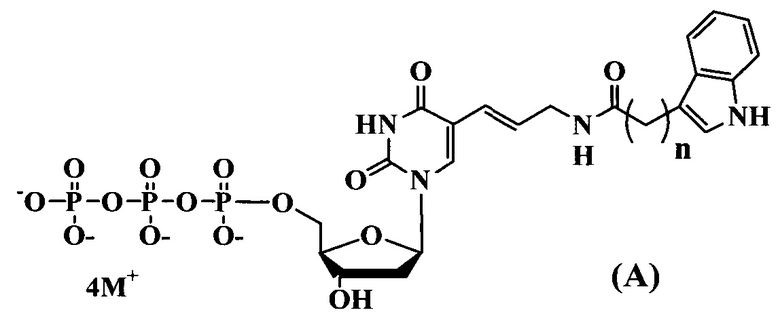
где:
n=1-3
M+ представляет собой H+, Na+, Li+, K+, [CH3(CH2)x](4-y)NHy+ (где x=0-5, y=0-4).
Предлагаемые модифицированные трифосфаты общей формулы (А) характеризуются тем, что содержат в С5 положении пиримидинового основания индольный заместитель, присоединенный через аллильный (этиленовый) линкер различной длины.
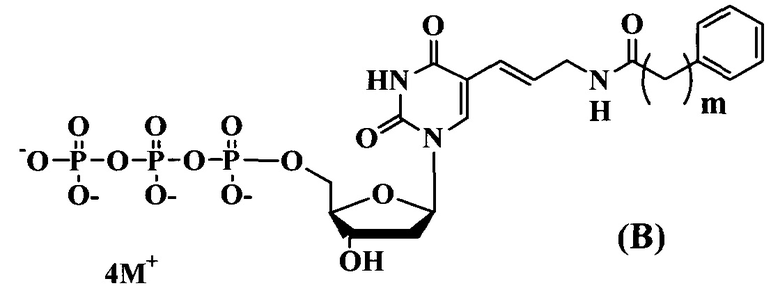
где:
m-1-3
M+ представляет собой Н+, Na+, Li+, K+, [CH3(CH2)x](4-y)NHy+ (где х=0-5, y=0-4).
Предлагаемые модифицированные трифосфаты общей формулы (В) характеризуются тем, что содержат в С5 положении пиримидинового основания фенильный заместитель, присоединенный через аллильный (этиленовый) линкер различной длины.
Нами созданы методики получения шести производных дезоксиуридинтрифосфатов с индольной и фенольной функциональными группами, присоединенными по С5-положению алкеновыми линкерами различной длины. Предложена схема их очистки, позволяющая получать производные с чистотой, обеспечивающей возможность их использования в реакциях ферментативного синтеза ДНК. Показано, что полимеразы Deep Vent, KOD XL и Taq способны встраивать полученные производные дезоксиуридинтрифосфатов в синтезируемую цепь ДНК, при этом цепь может включать участки, содержащие до четырех модифицированных dUTP подряд. Это дает возможность использовать синтезированные производные дезоксиуридинтрифосфатов для получения ДНК с высокой степенью модификации путем ферментативного синтеза для получения реагентов, способных специфично взаимодействовать с гидрофобными участками высокомолекулярных органических соединений. Вышеуказанные реагенты могут применяться для получения ДНК-сенсоров, а также для отбора (селекции) модифицированных аптамеров (сомамеров) к белкам и другим биологически-активным соединениям.
Важной составляющей изобретения является возможность ферментативного получения модифицированных ДНК не только с применением реакции удлинения праймера, но и с применением ПЦР. Это достигается путем обеспечения субстратной совместимости используемых полимераз с созданными модифицированными трифосфатами дезоксинуклеозидов, а также дополнительной оптимизацией ферментативных реакций для обеспечения воспроизводимого ферментативного получения модифицированных реагентов на основе ДНК.
Для использования ПЦР при получении препаративного количества реагента на основе модифицированной ДНК крайне важным является возможность получения продукта с немодифицированной матрицы ДНК с применением модифицированных трифосфатов дезоксинуклеозидов, а также получения модифицированной цепи ДНК (данные представлены в Таблице 1 и Таблице 2).
Применение способа очистки и избирательного разделения цепей с использованием биотинилированного праймера в ПЦР с модифицированными трифосфатами дезоксинуклеозидов является крайне важным, поскольку в результате реализации данного способа амплификации модифицированными оказываются обе цепи. Использование в способе биотинилированного праймера позволяет четко локализовать т.н. «смысловую» цепь, которая может быть использована в раундах селекции аптамеров либо в других способах получения высокоспецифичных реагентов, способных связываться с гидрофобными участками высокомолекулярных органических соединений.
Краткое описание фигур и таблиц
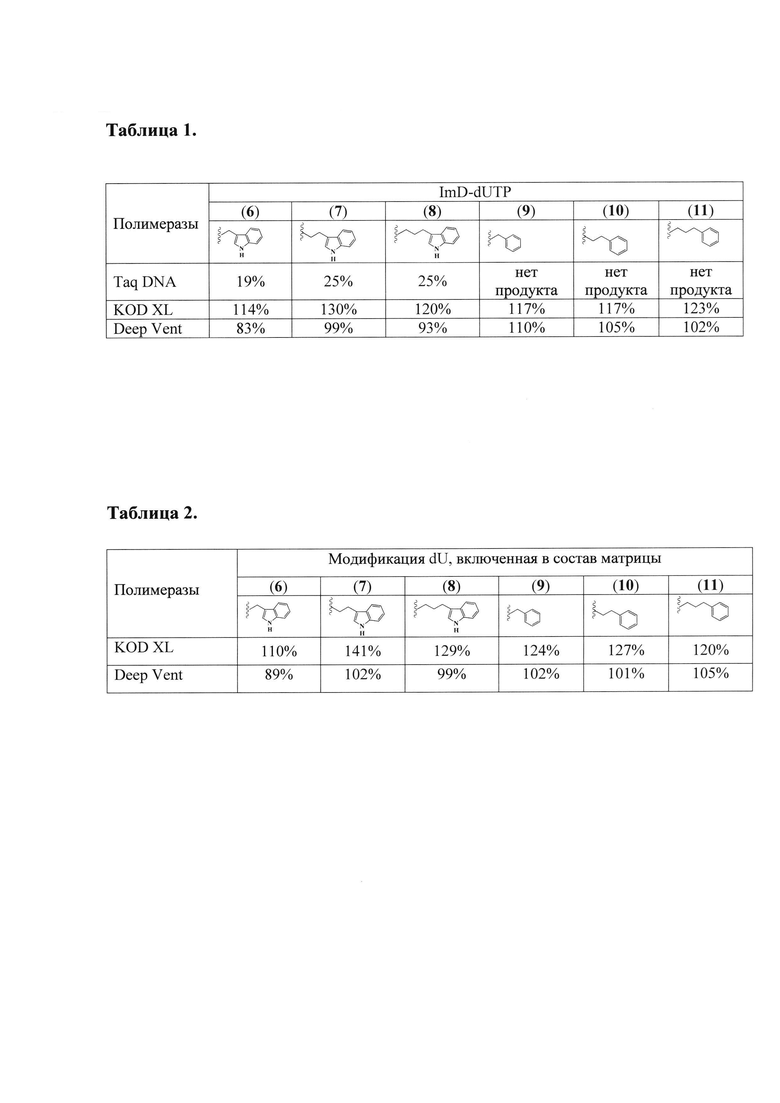
Фиг. 1. Денатурирующий ПААГ-электрофорез. Панель A: L - маркеры (цифры слева указывают длину в нт); 1 - mod-dUTP (B1); 2 - mod-dUTP (A1); 3 - mod-dUTP (A2); 4 - mod-dUTP (B2); 5 - исходная немодифицированная матрица Т40. Deep Vent полимераза. Панель Б: Электрофореграмма (распределение интенсивности флуоресценции в условных единицах по длине электрофоретической дорожки) для mod-dUTP (B2) (дорожка 4). Показаны пики, соответствующие верхней (1) и нижней (2) полосам на геле, границы пиков и базовая линия. Границы пиков и базовая линия устанавливаются программой ImageQuant автоматически. Программа вычисляет площади пиков в условных единицах.
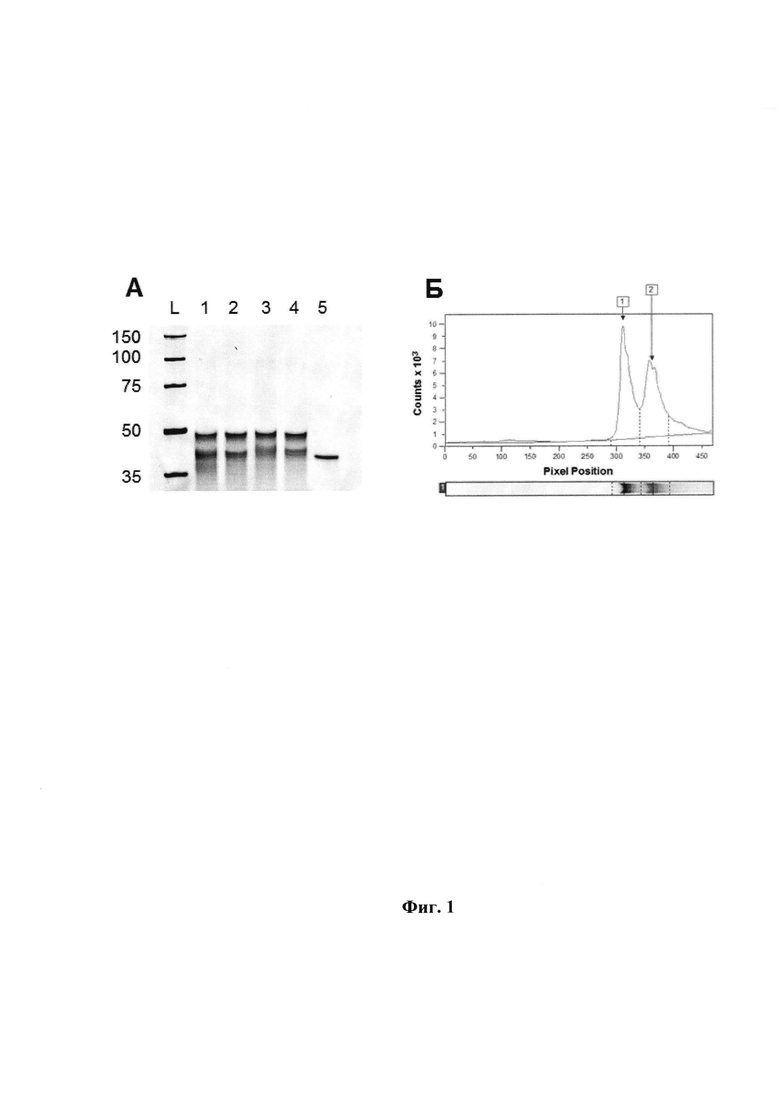
Фиг. 2. Нативный ПААГ-электрофорез. KOD XL полимераза, mod-dUTP (9). Панель A: L - маркеры (цифры слева указывают длину в п.о.); 1 - продукт реакции удлинения праймера по модифицированной матрице; 2 - модифицированная матрица (элюат); 3 - матрица Т40; 4 - эквимолярная смесь Т40 и олигонуклеотида, комплементарного Т40. Панель Б: Электрофореграмма (распределение интенсивности флуоресценции в условных единицах по длине электрофоретической дорожки) для продукта реакции удлинения праймера (дорожка 1). Показаны пик, его границы и базовая линия. Границы пика и базовая линия устанавливаются программой ImageQuant автоматически. Программа вычисляет площадь пика в условных единицах.
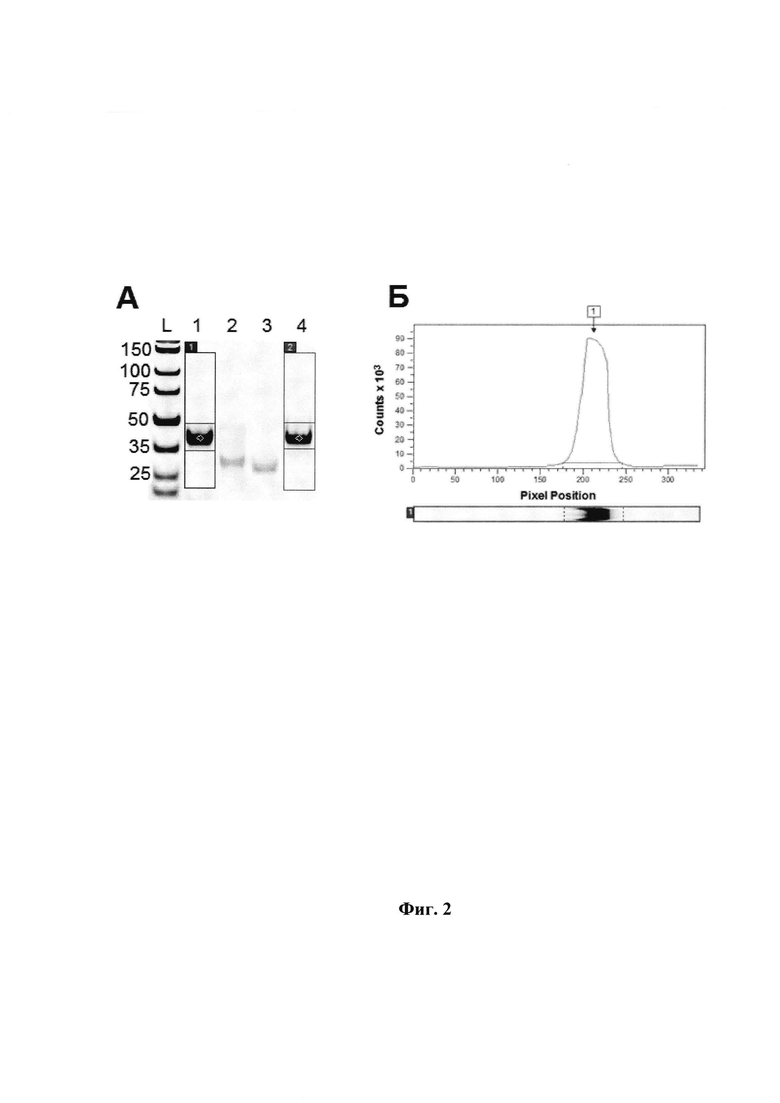
Фиг. 3. Получение модифицированной ДНК с помощью ПЦР и соединений ряда (А) и (В) в качестве субстрата. 1 - mod-dUTP (B1); 2 - mod-dUTP (A1); 3 - mod-dUTP (A2); 4 - mod-dUTP (B2), 5 - mod-dUTP (A3); 6 - mod-dUTP (В3), 7 - немодифицированный продукт ПЦР, 8 - маркер длин ДНК «GeneRuler 50 bp». Deep Vent полимераза.
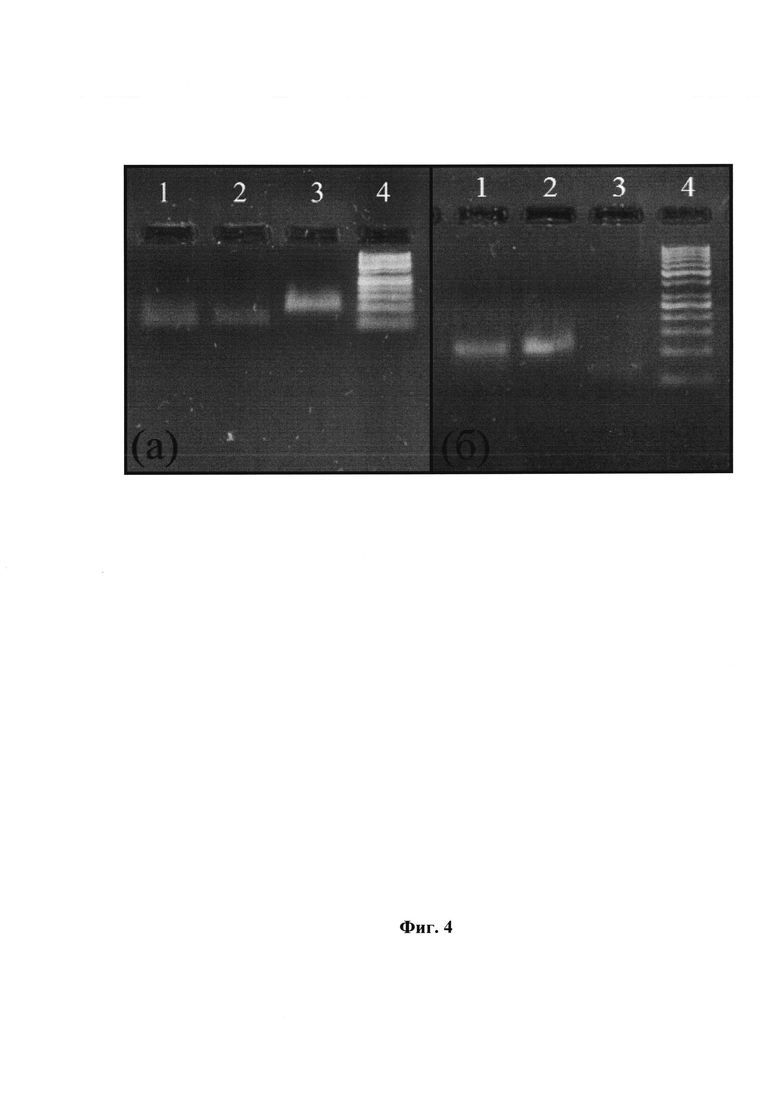
Фиг. 4 Разделение цепей модифицированной ДНК. Электрофоретический анализ в 5%-агарозном геле. а) Использование магнитных частиц. 1 и 2 - небиотинилированная и биотинилированная цепи соответственно, видна 1 цепь, для переосаждения использовался спиртовой раствор ацетата аммония, 3 - исходная ДНК, 4 - маркер длин ДНК «GeneRuler 50 bp». б) Использование λ-экзонуклеазы. 1 - исходная ДНК, 2 - ДНК после фосфорилирования, 3 - одноцепочечный продукт после λ-экзонуклеазы, 4 - маркер длин ДНК «GeneRuler 50 bp».
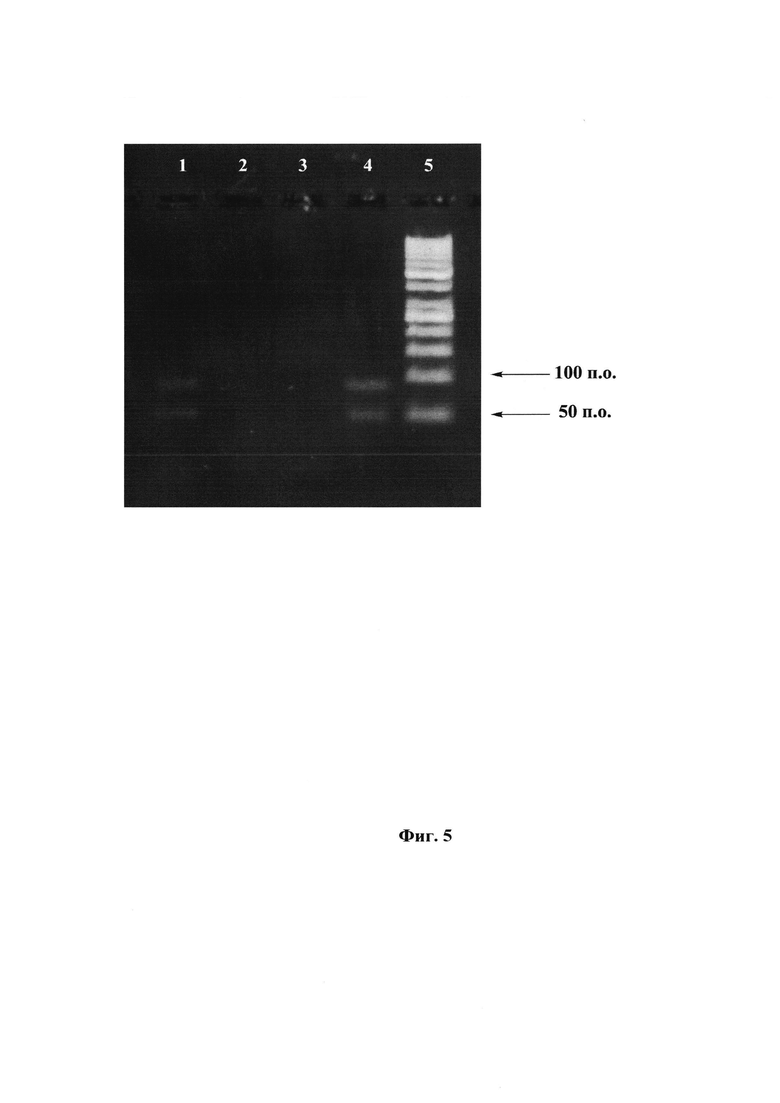
Фиг. 5. Проверка разделения цепей с помощью реакции удлинения праймера. Электрофорез в 5% агарозном геле.
1 - биотинилированная цепь с 5'-праймером по п. 15,
2 - биотинилированная цепь с 3'-праймером по п. 15,
3 - небиотинилированная цепь с 5'-праймером по п. 15,
4 - небиотинилированная цепь с 3'-праймером по п. 15
5 - маркер длин ДНК «GeneRuler 50 bp».
Таблица 1. Эффективность реакции удлинения праймера для различных модифицированных dUTP общих формул (А) и (В) с использованием немодифицированной матрицы.
Таблица 2. Эффективность реакции удлинения праймера для модифицированной матрицы, полученной с использованием различных mod-dUTP общих формул (А) и (В). В качестве субстрата использованы немодифицированные трифосфаты.
Осуществление изобретения
В работе использованы полимеразы Taq ДНК ("Евроген", Россия), Deep Vent ("BioLabs", Великобритания) и KOD XL ("Novagen", США) с буферными растворами соответствующих производителей; трифосфаты дезоксинуклеозидов производства "Fermentas" (США); флуоресцентный краситель SYBR Green ("Thermo Scientific", США); магнитные частицы MagnaBind Streptavidin Beads ("Thermo Scientific", США). Остальные реактивы и растворители марок "ОСЧ", "ХЧ" или "ЧДА" приобретены в фирмах Aldrich, Alfa Aesar, Fluka, Химмед. Воду для приготовления растворов получали на установке Milli-Q (EMD Millipore, США).
DMF очищали перегонкой в вакууме в токе азота над фталевым ангидридом [т. кип. 46°С (10 Торр)]. Диизопропилэтиламин перегоняли над нингидрином, затем над КОН (т. кип. 126-127°С). Уксусный ангидрид кипятили с безводным ацетатом калия, а затем перегоняли (т. кип. 139-140°С).
Индивидуальность полученных производных трифосфатов и ход реакции контролировали методом ТСХ на пластинках TLC Silica gel 60 RP-18 F254 ("Merck", Германия) и TLC Silica gel 60 F254 ("Merck", Германия). Колоночную хроматографию осуществляли на сорбенте Lichroprep RP-18 с размером частиц 0.040-0.063 нм ("Merck", Германия). Обнаружение веществ на хроматограммах осуществляли при длинах волн 254, 302 и 365 нм ("Upland", модель UVLMS-38, США). 1H ЯМР спектры регистрировали на спектрометре Bruker AMX-400 (400 MHz) в растворе DMSO-d6. Химические сдвиги δ выражены в м.д. Олигонуклеотиды для реакции РЕХ синтезировали на ДНК/РНК-синтезаторе ASM-800 ("Биоссет", Россия). Количество ДНК определяли на спектрофотометре NanoDrop 1000 ("Thermo Scientific", США). РЕХ проводили на амплификаторе DNA Engine Tetrad 2 ("Bio-Rad", США). Разделение магнитных частиц выполняли, используя магнитосепаратор DynaMag-2 Magnet ("Thermo Scientific", США). Полиакриламидные гели сканировали на системе визуализации гелей Typhoon 9400 ("GE Healthcare", США). Полученные изображения анализировали с помощью программы ImageQuant (GE Healthcare, США).
1 М Триэтиламмоний-ацетатный буферный раствор (ТЕАА) получали следующим образом. К смеси деионизованной воды (700 мл) и триэтиламина (139 мл, 1 моль) при охлаждении на льду и интенсивном перемешивании добавляли по каплям под слой жидкости уксусную кислоту (57 мл, 1 моль) (до рН 7.0) и объем раствора доводили до 1 л.
1 М Триэтиламмоний-гидрокарбонатный буферный раствор (ТЕАНС) получали следующим образом. В смесь деионизованной воды (700 мл) и триэтиламина (139 мл, 1 моль) при охлаждении на льду, интенсивном перемешивании и контроле рН пропускали газообразный СО2 (до рН 7.5) и объем раствора доводили до 1 л.
0.1М Фосфатно-солевой буферный раствор (PBS), 0.15 М NaCl, рН 7.2 готовили следующим образом. Смесь калия фосфата двузамещенного (0.87 г, 0.005 моль), калия фосфата однозамещенного (0.68 г, 0.005 моль) и хлорида натрия (9.0 г, 0.15 моль) растворяли в деионизованной воде (700 мл). Подщелачивали 1М раствором калия фосфата однозамещенного до рН 7.4 и доводили объем полученного раствора до 1 л.
Буферный раствор Трис/ЭДТА («ТЕ-буфер», 10 мМ Трис (рН 8.0), 1 мМ ЭДТА) приобретали в фирме Aldrich.
Буферный раствор трис-боратный/ЭДТА («ТВЕ-буфер», 10Х, 1.3М TRIS, 450 мМ борная кислота, 25 мМ ЭДТА) приобретали в фирме Aldrich.
Соединения по изобретению общих формул (А) и (В) синтезировали, согласно схеме 1.
Схема 1
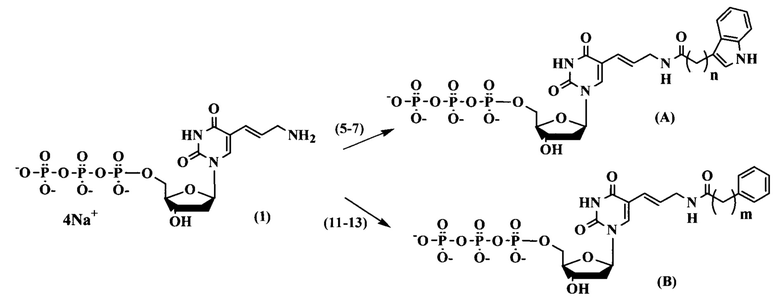
Схема 2
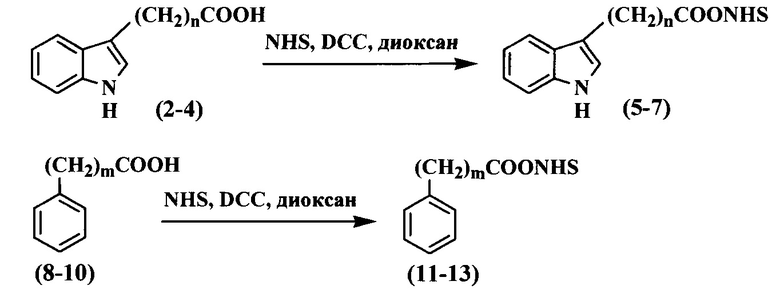
Чтобы синтезировать трифосфаты дезоксинуклеозидов с функциональными группами на гетероциклических основаниях, в качестве исходного соединения использовали 5-аминоаллил-2'-дезоксиуридин-5'-трифосфат (1), синтез которого осуществили согласно предложенному в литературе методу (Longer P.R., Waldrop А.А., Ward D.C. (1981) Enzymatic synthesis of biotin-labeled polynucleotides: Novel nucleic acid affinity probes. Proc. Natl. Acad. Sci. USA. 78, 6633-6637). Для проведения реакции конденсации трифосфата дезоксиуридина (1) с индолуксусной (2), индолпропионовой (3), индолбутановой (4), фенилуксусной (8), фенилпропионовой (9) и фенилбутановой (10) кислотами необходима активация карбоксильной группы (схема 2).
Активацию соединений (2-4), (8-10) проводили в диоксане при комнатной температуре в течение 15 ч при помощи эквимолярного количества NHS и DCC (схема 2). Образующееся в ходе реакции производное мочевины удаляли фильтрацией, а активированный эфир очищали перекристаллизацией из изопропилового спирта. Структура полученных активированных эфиров (5-7), (11-13) подтверждена при помощи 1Н-ЯМР спектрометрии: в спектре присутствовали сигналы протонов, характерные для этиленовой группы сукцинимидного фрагмента.
Реакцию конденсации активированного эфира (5-7), (11-13) и 5-аминоаллил-2'-дезоксиуридин-5'-трифосфата (1) (схема 1) проводили в смеси растворителей DMF и 0.1 М карбонат-бикарбонатного буферного раствора при +5°С. Проведение реакции при пониженной температуре привело к уменьшению образования побочных продуктов и, соответственно, к увеличению выхода целевого продукта, хотя потребовало увеличения времени ее протекания (время полного протекания реакции - 15 ч).
Продукты реакции общих формул (А) и (В) выделяли и очищали от примесей в несколько этапов. Предварительную очистку осуществляли при помощи осаждения конъюгата из реакционной массы раствором перхлората лития в ацетоне. Далее дополнительно очищали обращенно-фазовой хроматографией на сорбенте C18-RP в линейном градиенте концентраций ацетонитрила в 0.1 М триэтиламмоний-гидрокарбонатном буферном растворе. Фракции, содержащие целевое соединение, объединяли и вновь наносили на колонку C18-RP. Следует отметить, что удаление буферного раствора в вакууме даже при комнатной температуре приводило к дефосфорилированию продукта реакции.
Использование на последней стадии выделения и очистки перхлората натрия позволило получить нуклеотиды формул (А) и (В) в виде их натриевых солей. Так же нуклеотиды формулы (А) и (В) можно получить в фосфорнокислой форме, в виде солей щелочных металлов и в виде различных аммониевых солей, используя на последнем этапе очистки вместо перхлората натрия соответствующие реагенты:
- 0.1М KCl - для получения калиевой соли нуклеотида;
- 0.1М LiCl - для получения литиевой соли нуклеотида;
- 0.1М ТЕАА - для получения триэтиламмониевой соли нуклеотида;
- 0.1М NH4HCO3 - для получения аммониевой соли нуклеотида.
Полученные производные трифосфатов дезоксиуридина (А) и (В) характеризовали методами 1H-ЯМР и 31Р-ЯМР спектрометрии и УФ-спектроскопии. Экспериментальные образцы трифосфатов дезоксиуридина хранили в лиофилизованном виде при -20°С до тестирования их субстратной совместимости с полимеразами.
Модифицированные dUTP (mod-dUTP) общих формул (А) и (В) (Таблица 1), различающиеся функциональными группами и/или длиной линкера между основанием и функциональной группой, добавляли в качестве субстрата в реакции удлинения праймера (РЕХ) с использованием полимераз Taq DNA, Deep Vent и KOD XL. Проверяли как включение mod-dUTP полимеразами в растущую цепь, так и возможность синтеза полимеразами немодифицированной нити по модифицированной матрице, что крайне важно при применении ПЦР для получения модифицированных ДНК для создания реагентов, специфично связывающихся с гидрофобными участками высокомолекулярных органических соединений.
Типичные результаты денатурирующего и нативного ПААГ-электрофореза представлены на Фиг. 1 и 2, соответственно. В случае денатурирующего ПААГ-электрофореза, эффективность реакции РЕХ оценивали как отношение (в %) молярного количества модифицированной нити ДНК к молярному количеству матрицы. Для оценки количества ДНК принимали, что площадь пика электрофоретической полосы, соответствующей ДНК-матрице или модифицированной нити ДНК (Фиг. 1б), прямо пропорциональна их весовому количеству. Молярное отношение вычисляли с учетом разницы длин модифицированной нити и матрицы (40 и 45 нт, соответственно, по п.п. 11 и 14 Формулы изобретения). В случае нативного ПААГ-электрофореза, эффективность реакции РЕХ оценивали как отношение (в %) количества материала в электрофоретической полосе, соответствующей дуплексной синтезированной ДНК, к количеству материала в полосе, соответствующей дуплексу, полученному добавлением к модифицированной матрице эквимолярного количества олигонуклеотида по п. 11 Формулы изобретения (обозначен как Т40). При этом предполагали, что количество материала прямо пропорционально площади пика флуоресценции (Фиг. 2б). Олигонуклеотид Т40 также использовали для определения количества модифицированной нити, для чего его наносили в известном количестве на денатурирующий гель, а на соседнюю дорожку наносили модифицированную нить ДНК. Количество материала в полосе, соответствующей модифицированной нити, определяли как отношение площади ее пика к площади пика Т40, умноженное на количество Т40.
В Таблице 1 приведены эффективности реакции РЕХ для немодифицированной матрицы с использованием модифицированных dUTP общих формул (А) и (В), в Таблице 2 - эффективности реакции РЕХ для модифицированной матрицы mod-dU-оцДНК с использованием dNTP. Как можно видеть, полимеразы KOD XL и Deep Vent способны использовать все тестированные mod-dUTP общих формул (А) и (В) как субстрат при синтезе нити по немодифицированной матрице, а также синтезировать немодифицированную нить (с использованием dNTP) по модифицированной матрице для всех типов тестированных mod-dUTP. Полимераза Taq DNA может использовать mod-dUTP общей формулы (А) с индольной группой как субстрат, однако с низкой эффективностью, и не способна использовать mod-dUTP общей формулы (В) с фенольной группой как субстрат (Таблица 1). В связи с этим тестирование способности Taq-полимеразы использовать mod-dU-оцДНК как матрицу не проводилось.
Данные Таблицы 1 свидетельствуют об отсутствии корреляции между эффективностью включения mod-dUTP общих формул (А) и (В) полимеразами Deep Vent и KOD XL в растущую цепь и длиной линкера. Это указывает на то, что все использованные линкеры обеспечивают хорошую стерическую совместимость между модифицированным основанием и активными центрами полимераз Deep Vent и KOD XL. Одной из наиболее вероятных причин, почему Taq-полимераза не способна эффективно использовать mod-dUTP общих формул (А) и (В) как субстрат, может быть именно стерическая несовместимость между модифицированным основанием и активным центром полимеразы. Однако хотя mod-dUTP общей формулы (В) с фенольной группой менее «объемны», чем с индольной (формула (A)), Taq-полимераза совершенно не способна использовать их как субстрат (Таблица 1). Это указывает на то, что эффективность включения mod-dUTP общих формул (А) и (В) полимеразой в растущую цепь может определять не только стерическая совместимость модифицированных оснований с активным центром полимеразы, но и дополнительные факторы, такие, например, как взаимодействия между фенольными (индольными) группами при последовательном включении mod-dUTP в синтезируемую цепь. Различия в гидрофобности могут также влиять на эффективность включения mod-dUTP, особенно в случае их последовательного включения. Хотя в настоящее время отсутствуют оценки гидрофобности производных дезоксиуридинов с индольной и фенольной группами, существуют данные о степени гидрофобности аминокислот - триптофана и фенилаланина - у которых различны именно этими боковыми группами. С одной стороны, степень их гидрофобности, понимаемая как свободная энергия переноса аминокислоты из неполярной среды (спирта) в полярное окружение (воду), практически одинакова (Frommel С. (1984) The apolar surface area of ammo acids and its empirical correlation with hydrophobic free energy. J. Theor. Biol. 111, 247-260). Однако с другой стороны, эти функциональные группы обладают значительными различиями, когда соответствующие аминокислотные остатки находятся в полипептидной цепи - индекс гидрофобности (ОМН, optimal matching hydrophobicity) отличается почти в четыре раза (Sweet R.M., Eisenberg D. (1983) Correlation of sequence hydrophobicities measures similarity in three-dimensional protein structure. J. Mol. Biol. 171, 479-488).
Методику количественного сравнения с помощью красителя SYBR Green характеризуют определенные ограничения, особенно для коротких модифицированных одноцепочечных продуктов. Однако с учетом идентичности первичных структур анализируемых последовательностей использование данного метода позволяет проводить сравнительный оценочный анализ.
Флуоресценция модифицированной нити при окрашивании красителем SYBR Green выше, чем немодифицированной матрицы. Наиболее вероятная причина этого в том, что краситель связывается более прочно с mod-dU-оцДНК из-за присутствия гидрофобных групп. Это приводит к тому, что выход продукта в реакции РЕХ оказывается в ряде случаев выше 100% (Таблица 1). Таким образом, использованный нами подход не позволяет оценить абсолютные значения эффективности включения mod-dUTP общих формул (А) и (В) в синтезируемую цепь полимеразами KOD XL и Deep Vent, однако делает возможным сравнение их относительной эффективности. Видно, что эффективность полимеразы KOD XL несколько выше, чем полимеразы Deep Vent как в случае синтеза модифицированной цепи по немодифицированной матрице, так и наоборот (Таблица 1 и 2).
Конструирование соединения по п. 11 Формулы изобретения. На основании анализа литературных данных выбирали длину вырожденной «рандомной» части комбинаторной библиотеки равной 40 нт. (N=40). Такой выбор представляет собой среднее и наиболее распространенное значение при конструировании ДНК-библиотек для отбора аптамеров к белковым и пептидным мишеням. Вырожденную часть ДНК-библиотеки фланкировали областями, комплементарными ПЦР-праймерам для последующей ПЦР-амплификации набора клонов модифицированных ДНК в каждом из циклов селекции при выборе аптамеров либо сомамеров. Последовательности праймеров приведены в п. 15 формулы изобретения.
Праймеры конструировали с учетом следующих требований:
- температура плавления дуплексов при гибридизации праймеров на матрицу для удобства амплификации должна находиться в пределах 60±2°С;
- праймеры не должны образовывать энергетически выгодные структуры типа «шпилек», димеров и «селф-димеров»;
- праймеры должны соответствовать требованию специфичности, т.е. пройти blast-анализ. Учитывая специфику применения праймеров в процедуре SELEX, это требование носит рекомендательный характер.
При конструировании библиотеки учитывали такую особенность твердофазного синтеза как уменьшение выхода целевого продукта с каждым последующим циклом наращивания цепи олигонуклеотида на твердой фазе CPG (это влияние особенно критично при синтезе длинных олигонуклеотидов - 50 нт и длиннее). С целью избежать влияние большого количества неполноразмерных продуктов синтеза, конструировали библиотеку таким образом, чтобы исходная матрица представляла собой два олигонуклеотида длиной 86 нт. (40 вырожденных нуклеозидов плюс длина обоих фланкирующих праймеров), комплементарных друг другу. Т.е. получали двухцепочечную матрицу для последующей амплификации и ферментативного получения комбинаторной ДНК-библиотеки олигонуклеотидов.
Выбор подходящего модифицированного трифосфата дезоксинуклеозида для каждой из примененнных полимераз был осуществлен с помощью оценки эффективности ПНР с применением электрофоретического метода визуальной оценки. Типичный пример электрофоретической картины приведен на Фиг. 3.
При выборе учитывали следующие требования: введение различных функциональных групп не должно оказывать сильного влияния на способность дезоксинуклеозида служить субстратом для полимеразы (для каждой из используемых полимераз - индивидуально), также необходимая модифицированная ДНК-библиотека должна быть получена с удовлетворительным выходом целевого продукта (не менее 30% при сравнении с немодифицироанным аналогом, см. Фиг. 3).
Реакционная смесь для проведения ПЦР содержала 1,5 мМ MgCl2, 10 мМ KCl, 10 mM Tris-HCl (pH 8,3) и 2,5 единицы TaqDNA полимеразы (Fermentas). Смесь содержала трифосфаты (dATP, dCTP, dGTP и dTTP) в концентрации 0,2 mM каждого. Рабочая концентрация праймеров составляла 100 nM каждого, концентрация каждого из «матричных» олигонуклеотидов составляла 10 nM. Реакцию проводили на ДНК-амплификаторе Rotor-Gene Q5 plex HRM по следующей программе: 5 мин при 95°С; 30 циклов по 30 сек при 95°С, 30 сек при 60°С и 40 сек при 72°С; завершали реакцию инкубированием в течение 5 мин при 72°С. Полученные ПЦР-продукты очищали от полимеразы и трифосфатов нуклеозидов фенол-хлороформной экстракцией с последующим осаждением 2%-ным раствором LiClO4 в ацетоне и оставляли на хранение при -20°С для дальнейшего использования.
С целью выбора эффективного способа разделения цепей ДНК, являющегося одной из последовательных стадий осуществления Способа по п. 1 формулы изобретения, было проведено сравнение двух способов разделения цепей: с помощью магнитных частиц и с использованием λ-экзонуклеазы (Фиг. 4, (а) и (б), соответственно).
В результате был выбран способ, основанный на разделении цепей с помощью магнитных стрептавидиновых частиц. Для этого была проведена ПЦР, с использованием биотинилированного праймера, а также модифицированных трифосфатов дезоксинуклеозидов общих формул (А) и (В). После проведения ПЦР продукты реакции были переосаждены перхлоратом лития в ацетоне.
Далее полученная двухцепочечная ДНК (дцДНК) была использована для разделения на магнитных стрептавидиновых частицах. ПЦР-продукт смешивали с эквивалентным объемом 10х ПЦР-буфера, инкубировали при 95°С в течение 3 мин. Полученную смесь добавляли к магнитным частицам, инкубировали при комнатной температуре 30 мин. За это время биотинилированная цепь ДНК ковалентно связывается со стрептавидином. Магнитные частицы трижды промывали буфером, а затем инкубировали 2 мин с 30% раствором гидроксида аммония. Далее супернатант сливали в чистую пробирку и переосаждали 5-ю объемами спиртового раствора ацетата аммония. Осадок промывали 96% этиловым спиртом, высушивали и растворяли в деионизованной воде (MQ-Н2О).
Магнитные частицы промывали гидроксидом аммония, а затем инкубировали с ним в течение 8 мин. Полученный раствор сливали в пробирку и переосаждали биотинилированную цепь спиртовым раствором ацетата аммония. Осадок промывали 96% этиловым спиртом, высушивали от спирта и растворяли в MQ-Н2О.
Для проверки разделения цепей была использована реакция удлинения праймера (primer extension). Для этого использовали температурный режим по типу ПЦР (15 циклов реакции удлинения праймера) с использованием в качестве матрицы небиотинилированной и биотинилированной цепей. В каждую из пробирок вместо двух праймеров был добавлен только один: либо прямой праймер, либо обратный праймер. Электрофоретический анализ в 5%-агарозном геле изображен на Фиг. 5, на которой видно, что в случае использования биотинилированной цепи в роли матрицы и при добавлении прямого праймера присутствует двухцепочечная ДНК (дцДНК) и одноцепочечная ДНК (оцДНК) (дорожка 1). Такая же ситуация наблюдается и в случае небиотинилированной цепи, но с обратным праймером (дорожка 4). Одноцепочечная ДНК присутствует из-за избытка оцДНК. В случае биотинилированной цепи и обратного праймера, а также в случае небиотинилированной цепи и прямого праймера на электрофорезе видно только непрореагировавшие праймеры (дорожки 2 и 3). Это доказывает то, что разделение цепей прошло успешно.
Таким образом, была ферментативно синтезирована оцДНК, которая может служить в качестве комбинаторной библиотеки при селекции модифицированных аптамеров (сомамеров) к белковой мишеням, для получения ДНК-сенсоров, для создания реагентов на основе модифицированных ДНК, специфично связывающихся с гидрофобными участками высокомолекулярных органических соединений
Примеры
Пример 1. Получение N-гидроксисукцинимидных эфиров ароматических кислот общих формул (5-7) и (11-13).
Смесь ароматической кислоты (2-4) или (8-10) (1 ммоль), N-гидроксисукцинимида (115 мг, 1 ммоль), DCC (206 мг, 1 ммоль) и диоксана (3 мл) перемешивали 15 ч при +5°С. По окончанию перемешивания реакционную массу отфильтровали, осадок промыли диоксаном (2×5 мл). Фильтрат объединили, растворитель удалили в вакууме, а остаток перекристаллизовали из изопропилового спирта (2 мл).
Пример 2. Получение N-гидроксисукцинимидного эфира индолуксусной кислоты (соединение 5).
Получают 0.76 ммоль (76%) соединения 5. 1Н-ЯМР (DMSO-d6), δ (м.д.): 11.06 (с, 1Н, NH), 7.52, 7.36, 7.11, 7.01 (4м, 5Н, ArH), 4.16 (с, 2Н, CH2), 2.81 (м, 4Н, COCH2CH2CO).
Пример 3. Получение N-гидроксисукцинимидного эфира индол-3-пропионовой кислоты (соединение 6).
Получают 0.68 ммоль (68%) соединения 6. 1H-ЯМР (DMSO-d6), δ (м.д.): 10.87 (с, 1Н, NH), 7.54, 7.33, 7.21, 7.08, 6.99 (5м, 5Н, ArH), 3.04 (м, 4Н, COCH2CH2CO), 2.81 (м, 4Н, С(1)H2, С(2)H2).
Пример 4. Получение N-гидроксисукцинимидного эфира индол-4-бутановой кислоты (соединение 7).
Получают 0.73 ммоль (73%) соединения 7. 1H-ЯМР (DMSO-d6), δ (м.д.): 10.78 (с, 1Н, NH), 7.52, 7.33, 7.14, 7.06, 6.95 (5м, 5Н, ArH), 2.82 (м, 6Н, COCH2CH2CO, С(1)H2), 2.69 (м, 2Н, С(3)H2), 2.81 (м, 2Н, С(2)H2).
Пример 5. Получение N-гидроксисукцинимидного эфира фенилуксусной кислоты (соединение 11).
Получают 0.71 ммоль (71%) соединения 11. 1Н-ЯМР (DMSO-d6), δ (м.д.): 7.36 (м, 5Н, ArH), 4.10 (с, 2Н, CH2), 2.81 (м, 4Н, COCH2CH2CO).
Пример 6. Получение N-гидроксисукцинимидного эфира фенил-3-пропионовой кислоты (соединение 12).
Получают 0.63 ммоль (63%) соединения 12. 1Н-ЯМР (DMSO-d6), δ (м.д.): 7.30, 7.22 (2 м, 5Н, ArH), 2.98 (м, 4Н, COCH2CH2CO), 2.81 (м, 4Н, С(1)H2, С(2)H2).
Пример 7. Получение N-гидроксисукцинимидного эфира фенил-4-бутановой кислоты (соединение 13).
Получают 0.79 ммоль (79%) соединения 13. 1H-ЯМР (DMSO-d6), δ (м.д.): 7.25 (м, 5Н, ArH), 2.83 (м, 4Н, СОСН2СН2СО), 2.67 (м, 4Н, С(1)H2, С(3)H2), 1.93 (м, 2Н, С(2)H2).
Пример 8. Получение модифицированных 2'-деоксиуридин-5'-трифосфатов общих формул (А) и (В).
Смесь тетранатриевой соли 5-аминоаллил-2'-деоксиуридин-5'-трифосфата (AAdUTP) (соединение 1) (5.6 мг, 10 мкмоль) и N-гидроксисукцинимидного эфира (соединение 5-7) или (соединение (11-13) (45 мкмоль) в смеси DMF (600 мкл) и NaHCO3/Na2CO3 буферного раствора (0.6 мл, 0.1 М, рН 8.5) энергично перемешивали 15 ч при +5°С. По окончанию перемешивания в реакционную массу добавляли 2%-ный раствор LiClO4 в ацетоне (3 мл). Осадок собирали центрифугированием при 13000 rpm в течение 1 мин, промывали ацетоном (1 мл) и растворяли в 1 мл смеси 30% ацетонитрила в воде.
Раствор модифицированного нуклеотида общих формул (А) и (В) в ТЕАНС (0.1М, 1 мл) наносили на хроматографическую колонку (1.5×23 см), заполненную C18-RP (40-63 мкм) и затем элюировали в линейном градиенте концентраций ацетонитрила в 0.1М ТЕАНС со скоростью 45 мл/час.
Далее получали натриевую соль нуклеотида общих формул (А) и (В). Для этого фракцию, содержащую модифицированный нуклеотид общих формул (А) и (В) собирали, разбавляли до объема 20 мл 0.1М ТЕАНС (рН 8.5) и наносили на хроматографическую колонку (1.5×7 cm) (Analtech, Newark, DE), заполненную C18-RP (40-63 мкм), промывали 0.1М NaClO4, 0.1М EDTA (рН 8.0) и деионизованной водой, и элюировали смесью ацетонитрил - вода.
Модифицированные нуклеотиды общих формул (А) и (В) получали в разных солевых формах. Для этого выполняли процедуру, представленную выше, но на этапе использования 0.1М NaClO4 применяли следующие реагенты:
- 0.1М KCl - для получения калиевой соли нуклеотида;
- 0.1М LiCl - для получения литиевой соли нуклеотида;
- 0.1М ТЕАА - для получения триэтиламмониевой соли нуклеотида;
- 0.1М NH4HCO3 - для получения аммониевой соли нуклеотида.
Растворители удаляли в вакууме, полученный осадок растворяли в «ТЕ-буфере» (рН 8.0), получая раствор модифицированного нуклеотида общих формул (А) и (В) с концентрацией 1 мкмоль/мл. Полученный раствор хранили при температуре -20°С.
Пример 9. Получение тетранатриевой соли 5-[4-аза-5-оксо-6-(1Н-индол-3-ил)гекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение А1).
Получают 4.1 мкмоль (41%) соединения А1. 1Н ЯМР (D2O) δ: 7.56, 7.48, 7.37, 7.23, 7.11, 7.01 [6м, 6Н, С(6)H, ArH], 6.24 [м, 1Н, С(1')H], 6.13 (м, 1Н, С(1)H), 6.00 [m, 1H, С(2)H), 4.50 [m, 1Н, С(4')H], 4.08 [м, 3Н, С(3')H, С(5')H2), 3.76, 3.66 [2м, 2Н, С(3)H2], 2.24 (м, 2Н, С(2')H2), 2.09 (м, 2Н, С(6)H2),. 31P ЯМР (D2O) δ: -20.27 (t, βР), -10.62 (d, αР), 5.25 (d, γP).
Пример 10. Получение тетранатриевой соли 5-[4-аза-5-оксо-7-(1Н-индол-3-ил)гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение А2).
Получают 4.9 мкмоль (49%) соединения А2. 1Н ЯМР (D2O) δ: 7.57, 7.31, 7.19, 7.05 [4 м, 6Н, С(6)H, ArH], 6.29 [м, 1Н, С(1')H], 5.85 (м, 1Н, С(1)H), 5.73 [m, 1Н, С(2)H), 4.59 [m, 1Н, С(4')H], 4.20 [м, 3Н, С(3')H, С(5')H2), 3.64 [м, 2Н, С(3)H2], 3.06 (м, 2Н, С(7)H2), 2.62 (м, 2Н, С(6)H2), 2.36 (м, 2Н, С(2')H2). 31P ЯМР (D2O) δ: -20.71 (t, βP), -10.66 (d, αP), 6.29 (d, γP).
Пример 11. Получение тетранатриевой соли 5-[4-аза-5-оксо-8-(1Н-индол-3-ил)окт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение A3).
Получают 3.2 мкмоль (32%) соединения A3. 1H ЯМР (D2O) δ: 7.55, 7.39, 7.15, 7.05 [4 м, 6Н, С(6)H, ArH], 6.22 [м, 2Н, С(1')H, С(1)H), 6.11 [m, 1Н, С(2)H), 4.39 [m, 1Н, С(4')H], 4.07 [м, 3Н, С(3')H, С(5')H2), 3.75 [м, 2Н, С(3)H2], 2.74 (м, 2Н, С(8)H2), 2.29 (м, 2Н, С(2')H2), 2.16 (м, 2Н, С(6)H2), 1.97 (м, 2Н, С(7)H2). 31Р ЯМР (D2O) δ: -19.47 (t, βP), -10.25 (d, αP), 4.19 (d, γP).
Пример 12. Получение тетранатриевой соли 5-[4-аза-5-оксо-6-фенилгекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение В1).
Получают 3.8 мкмоль (38%) соединения В1. 1Н ЯМР (D2O) δ: 7.82, 7.30 [2 м, 6Н, С(6)H, ArH], 6.24 [уш.м., 3Н, С(1')H, С(1)H), С(2)H), 4.59 [m, 1Н, С(4')H], 4.15 [м, 3Н, С(3')H, С(5')H2), 3.84, 3,59 [2м, 2Н, С(3)H2], 2.33 (м, 2Н, С(2')Н2), 2.15 (м, 2Н, С(6)H2). 31Р ЯМР (D2O) δ: -20.56 (t, βP), -10.34 (d, αP), 7.08 (d, γP).
Пример 13. Получение тетранатриевой соли 5-[4-аза-5-оксо-7-фенилгепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение В2).
Получают 3.1 мкмоль (31%) соединения В2. 1Н ЯМР (D2O) δ: 7.78, 7.23 [2м, 6Н, С(6)H, ArH], 6.28 [м, 1Н, С(1')H], 6.16 (м, 1Н, С(1)H), 6.03 [m, 1Н, С(2)H), 4.62 [m, 1Н, С(4')H], 4.18 [м, 3Н, С(3')H, С(5')Н2), 3.74 [м, 2Н, С(3)H2], 2.90 (м, 2Н, С(7)H2), 2.56 (м, 2Н, С(6)H2), 2.36 (м, 2Н, С(2')H2). 31P ЯМР (D2O) δ: -20.98 (t, βP), -10.62 (d, αP), 7.25 (d, γP).
Пример 14. Получение тетранатриевой соли 5-[4-аза-5-оксо-8-фенилокт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата (соединение В3).
Получают 4.6 мкмоль (46%) соединения В3. 1Н ЯМР (D2O) δ: 7.85 [м, 1Н, С(6)H], 7.26 [м, 5Н, ArH, 6.37 [м, 1Н, С(1')H], 6.29 (м, 2Н, С(1)H, С(2)H), 4.61 [m, 1H, С(4')H], 4.18 [м, 3Н, С(3')H, С(5')H2), 3.84 [м, 2Н, С(3)H2], 2.63 (м, 2Н, С(8)H2), 2.28 (м, 4Н, С(6)H2, С(2')H2), 1.91 (м, 2Н, С(7)Н2). 31P ЯМР (D2O) δ: -20.78 (t, βP), -10.57 (d, αP), 7.04 (d, γP).
Пример 15. Получение биотинилированного праймера
Для последующего разделения цепей комбинаторной ДНК-библиотеки в одну из образующихся в ходе ПНР цепей вводили биотин путем применения биотинилированного праймера. Праймер синтезировали со свободной NH2-группой по 5'-концу с последующим введением биотиновой метки. К раствору биотина (2,0 мг) в ДМФА (590 мкл) добавляли праймер в соотношении 1/10 соответственно. Реакция проходила в течение 30 минут при комнатной температуре. Далее проводили хроматографическую очистку полученного продукта в градиенте ацетонитрила.
Пример 16. Реакция удлинения праймера с использованием немодифицированной и модифицированной матриц.
Чтобы провести реакцию удлинения праймера (РЕХ), использовали: матрицу 5'-GGGTGGTCTGTGTGCAAAACTAAAGAGACGACGAGCGGGAAAAAA-3'-биотин (Т45В, биотинилирована на 3'-конце), праймеры 5'-TCCCGCTCGTCGTCT-3'- (3'-праймер) и 5'-GGGTGGTCTGTGTGC-3' (5'-праймер). Место посадки 3'-праймера на матрицу показано подчеркиванием.
Реакцию проводили следующим образом. Матрицу Т45В (конечная концентрация 1.5 мкМ) и 3'-праймер (конечная концентрация 7.5 мкМ) в реакционном буфере инкубировали при 95°С в течение 1 мин и охлаждали до температуры 50°С. После отжига добавляли равный объем реакционной смеси (в соответствующем реакционном буфере), нагретой до 50°С и содержащей ДНК-полимеразу, 0.2 мМ dATP, dCTP, dGTP, а также dTTP или производное дезоксиуридинтрифосфата общих формул (А) или (В). Конечная концентрация полимераз составляла 0.1 ед./мкл для Taq DNA и KOD XL, и 0.02 ед./мкл для Deep Vent. Концентрации полимераз соответствовали рекомендациям производителей. Реакцию РЕХ проводили при 70°С в течение 30 мин. Реакцию останавливали добавлением Na-EDTA (pH 8) в конечной концентрации 20 мМ.
При использовании в качестве матрицы нити ДНК, содержащей модифицированные основания (модифицированная матрица), отжиг и реакцию удлинения праймера проводили с 5'-праймером и обычными dNTP. Концентрации всех компонентов реакционной смеси и условия отжига и реакции удлинения праймера были такие же, как указано выше, за исключением реакционного буфера для полимеразы Deep Vent, в который дополнительно вносили MgCl2 в конечной концентрации 2 мМ.
Пример 17. Электрофоретический анализ эффективности реакции удлинения праймера с использованием денатурирующего и нативного ПААГ-электрофореза.
Продукты реакции удлинения праймера анализировали методом ПААГ-электрофореза в денатурирующем или нативном полиакриламидном геле. Перед проведением анализа ДНК очищали от компонентов реакционной смеси методом фенольной экстракции с последующим осаждением этанолом. Осадок растворяли в 10 мМ фосфатном буфере (PBS), pH 7.2. При проведении электрофореза в денатурирующих условиях, пробу для электрофореза прогревали 1 мин при 90°С в присутствии 75% формамида. Пробы наносили на полиакриламидный гель (Т=15%, С=7%), содержащий 20 М формамида. При проведении нативного электрофореза, к раствору ДНК добавляли глицерин до конечной концентрации 6% и пробы наносили на полиакриламидный гель (Т=8%, С=5%). Электрофорез в обоих случаях проводили в ТВЕ-буфере. Гели окрашивали красителем SYBR Green.
Пример 18. Разделение цепей дуплексной ДНК после проведения реакции удлинения праймера.
Чтобы получить модифицированную нить ДНК, реакцию удлинения праймера проводили в 500 мкл реакционной смеси. ДНК, содержащую цепь с модифицированными основаниями (mod-дцДНК), очищали от компонентов реакционной смеси методом фенольной экстракции с последующим осаждением этанолом. Осадок растворяли в 10 мМ PBS (pH 7.2) и количество ДНК определяли спектрофотометрически.
Для получения модифицированной ДНК (mod-dU-оцДНК), содержащей 2'-деоксиуридин-5'-трифосфат общих формул (А) и (В), использовали магнитные частицы с ковалентно пришитыми к их поверхности молекулами стрептавидина. Магнитные частицы промывали раствором 0.1 М PBS (pH 7.2)/0.15 M NaCl и ресуспендировали в растворе 1 М NaCl/0.05% Tween-20. mod-дцДНК смешивали с равным объемом раствора 2 М NaCl/0.1% Tween-20, после чего смешивали с подготовленными магнитными частицами. Иммобилизацию проводили при комнатной температуре в течение 40 мин при постоянном перемешивании (1000 об/мин) на вортексе. С помощью магнитосепаратора магнитные частицы с иммобилизованной на них mod-dU-дцДНК отделяли от реакционной смеси и промывали трижды 0.1 М PBS (pH 7.2)/0.15М NaCl. mod-dU-оцДНК элюировали добавлением к магнитным частицам 20 мМ раствора NaOH. Магнитные частицы собирали магнитосепаратором, элюат переносили в чистую пробирку, нейтрализовали щелочь раствором 0.1N HCl и добавляли раствор Tris-HCl (pH 7.5) до конечной концентрации 0.1 М.
Количество ДНК в элюате оценивали электрофоретическим методом с окраской геля флуоресцентным красителем SYBR Green, для чего известный объем элюата наносили на полиакриламидный гель и проводили электрофорез, как описано выше (Фиг. 2). На гель наносили олигонуклеотид Т40 (5'-GGGTGGTCTGTGTGCAAAACTAAAGAGACGACGAGCGGGA-3') в двух известных весовых количествах. Количество материла в электрофоретических полосах, соответствующих Т40, использовали в качестве референсных точек. Количество материала в электрофоретической полосе, соответствующей mod-оцДНК, определяли по соотношению площади пика ее флуоресценции и площади пика флуоресценции олигонуклеотида Т40.
Эффективность элюции mod-dU-оцДНК контролировали, добавляя к магнитным частицам 40 мкл раствора, содержащего 8 М мочевины и 2 М тиомочевины, что приводило к разрушению комплексов стрептавидин-биотин и элюции всей ДНК, иммобилизованной на магнитных частицах. Элюат анализировали методом ПААГ-электрофореза, как описано выше.
Пример 19. Полимеразная цепная реакция для амплификации немодифицированных и модифицированных комбинаторных (вырожденных) ДНК-библиотек.
Реакционная смесь для проведения ПЦР содержала 25 mM MgCl2, БСА (SigmaAldrich, USA), буфер для проведения ПЦР (100 mM Трис-HCl, 500 mM KCl, рН 8,8 при 20°С), 0.1 ед./мкл для Taq DNA и KOD XL, и 0.02 ед./мкл для Deep Vent, трифосфаты (dATP, dCTP, dGTP, а также dTTP или производное дезоксиуридинтрифосфата общих формул (А) или (В)) в концентрации 2 mM каждого. Использовали праймеры прямой (5') и обратный биотинилированный (3'), рабочая концентрация каждого праймера составляла 10 mM. В качестве матрицы использовали синтетическую вырожденную комбинаторную ДНК-библиотеку с последовательностью
CTGTCAGCTCCATACTGGTAGCC-(N)40-GCGTTCGAATCTAGACGGTACGA
, где N - комбинация нуклеотидов А, Т, G, С.
Реакцию проводили на ДНК-амплификаторе MiniCycler (MJResearch, Waltham, Mass.) no следующей программе:
1) 4 мин при 95°С,
2) 30 сек при 95°С,
3) 30 сек при 66°С,
4) 30 сек при 72°С,
5) повтор с 2 пункта по 4 пункт 19 раз,
6) завершали реакцию инкубированием в течение 3 мин при 72°С.
При использовании в качестве субстратов производных дезоксиуридинтрифосфата общих формул (А) или (В) при необходимости температурно-временной профиль ПЦР, а также состав реакционной смеси модифицировали (оптимизировали) с целью увеличения целевого продукта реакции.
Результат прохождения ПЦР оценивали визуально, электрофоретически.
Пример 20. Разделение биотинилированной и небиотинилированной цепей модифицированной ДНК после проведения ПЦР с использованием магнитных частиц.
Для получения модифицированной однонитевой ДНК проводили разделение цепей на магнитных частицах Dynabeads™ M-270 Streptavidin (InvitrogenDynalAS, Norway) с ковалентно пришитыми к их поверхности молекулами стрептавидина. Магнитные частицы промывали три раза буфером 10x (рН 8.8 при 25°С), содержащим 100 mM Трис-HCl и 500 mM KCl, и ресуспендировали в растворе, содержащем 100 мкл 5х ПЦР-буфер для ПЦР. Биотинилированную по 5'-концу двухцепочечную модифицированную с помощью соединений общих формул (А) и (В) ДНК (ПЦР-продукт) добавляли к равному объему раствора, содержащего 10х ПЦР-буфер, нагревали до 95°С, инкубировали 3 мин и охлаждали до комнатной температуры, после чего смешивали с подготовленными магнитными частицами. Иммобилизацию проводили при комнатной температуре в течение 30 мин при постоянном перемешивании. С помощью магнитосепаратора магнитные частицы с иммобилизованной на них двухцепочечной модифицированой ДНК отделяли от реакционной смеси и промывали трижды 5Х буфером, содержащим Трис-HCl и KCl.
Небиотинилированную цепь элюировали добавлением к магнитным частицам 20% раствора гидроксида аммония, инкубировали 2 мин, затем частицы отделяли на магнитном сепараторе, а элюат переносили в чистую пробирку, где к нему добавляли 5 объемов спиртового раствора ацетата аммония, содержащего 0,125 М ацетата аммония и 70% этанола. Одноцепочечную Небиотинилированную ДНК осаждали цетрифугированием (16000 g, 2 мин). Осадок промывали раствором ацетата аммония и высушивали на воздухе. К высушенному осадку добавляли 20 мкл деионизованной воды (MQ-H2O) и определяли концентрацию ДНК на спектрофотометре NanoDrop 1000.
Магнитные частицы с биотинилированной цепью промывали 20% гидроксидом аммония 1 мин при комнатной температуре, затем супернатант удаляли, а частицы инкубировались с 50 мкл 30% гидроксида аммония при 60°С при эпизодическом ручном перемешивании в течение 8 мин. Элюат переносили в чистую пробирку, где переосаждали биотинилированную цепь добавлением 5 объемов спиртового раствора ацетата аммония, содержащего 0,125 М ацетата аммония и 70% этанола. Осадок промывали ацетатом аммония и высушивали на воздухе. К высушенному осадку добавляли 20 мкл деионизованной (MQ) Н2О и определяли концентрацию ДНК на спектрофотометре NanoDrop 1000.
Эффективность реакции элонгации определяли электрофоретическим методом (Фиг. 4а).
Пример 21. Разделение цепей с использованием λ-экзонуклеазы.
Для определения эффективности метода разделения цепей ДНК, содержащей 2'-деоксиуридин-5'-трифосфат общих формул (А) и (В), с помощью магнитных частиц со стрептавидином, в качестве референс-метода использовали получение одноцепочечной ДНК с помощью экзонуклеазы фага λ (лямбда), или λ-экзонуклеазы (лямбда-экзонуклеазы).
Высокопроцессивная 5'→3'-экзодезоксирибонуклеаза фага λ селективно гидролизует 5'-фосфорилированную цепь ДНК. Фосфорилирование проводили с помощью Т4-полинуклеотидкиназы, которая катализирует перенос гамма-фосфата с АТР на 5'-концевую гидроксильную группу ДНК (перенос фосфата из АТФ на ОН- с образованием АДФ).
Реакционная смесь содержала ДНК, 10Х реакционный буфер для Т4-полинуклеотидкиназы АТФ 10 mM (ATP SIGMA disodium salt FW 551, 1) и деионизированную воду. Инкубацию проводили в течение 20 мин. при температуре 37°С, используя РТС-100 Programmable Thermal Controller, дезактивация фермента - 75°С, 10 мин.
Используя пробирку после реакции фосфорилирования ДНК с помощью Т4-полинуклеотидкиназы была приготовлена еще одну пробирка, содержащая фосфорилированную, λ-экзонуклеазу (Lambda Exonuclease 10 U/ μL, «ThermoScientific», USA) и 10Х буфер для фермента (10х Reaction Buffer Lambda Exonuclease «Thermo Scientific», USA). Инкубация проводились в течение 30 мин. при температуре 37°С, используя РТС-100 Programmable Thermal Controller, дезактивация фермента -80°С, 10 мин. Эффективность разделения цепей определяли электрофоретическим методом (Фиг. 4б).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения субстратной эффективности производных трифосфатов дезоксиуридина для ДНК-полимераз методом реакции достраивания праймера | 2019 |
|
RU2731739C1 |
| Дезоксиуридинтрифосфаты, связанные с цианиновыми красителями сульфамидоалкильными линкерами, для использования в ПЦР | 2017 |
|
RU2667070C1 |
| Флуоресцентно-меченые дезоксиуридинтрифосфаты | 2016 |
|
RU2637310C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СУБСТРАТНОЙ СОВМЕСТИМОСТИ МОДИФИЦИРОВАННЫХ ТРИФОСФАТОВ ДЕЗОКСИУРИДИНА И ДНК-ПОЛИМЕРАЗ СОЧЕТАНИЕМ МЕТОДОВ КОЛИЧЕСТВЕННОЙ ПЦР И ЭЛЕКТРОФОРЕЗА | 2019 |
|
RU2736969C1 |
| Дезоксиуридинтрифосфаты, маркированные цвитерионными индоцианиновыми красителями | 2017 |
|
RU2725884C2 |
| Способ оценки влияния модифицированных трифосфатов дезоксинуклеозидов на олигонуклеотидный состав комбинаторных ДНК-библиотек для проведения селекции модифицированных аптамеров | 2021 |
|
RU2779058C1 |
| Способ термической диссоциации для проведения селекции ДНК-аптамеров | 2019 |
|
RU2723373C1 |
| Способ получения модифицированных комбинаторных ДНК библиотек методом твердофазной реакции удлинения праймера на ПЭТ-микрочастицах | 2018 |
|
RU2734941C2 |
| СПОСОБ СОЗДАНИЯ И СЕЛЕКЦИИ БИБЛИОТЕКИ МОДИФИЦИРОВАННЫХ АПТАМЕРОВ | 2016 |
|
RU2652952C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ХАРАКТЕРИСТИК ПОСЛЕДОВАТЕЛЬНОСТИ МОЛЕКУЛЫ НУКЛЕИНОВОЙ КИСЛОТЫ ПУТЕМ ОБНАРУЖЕНИЯ И ХАРАКТЕРИСТИКИ ВАРИАЦИЙ ЭТОЙ ПОСЛЕДОВАТЕЛЬНОСТИ | 1998 |
|
RU2264468C2 |
Группа изобретений относится к молекулярной биологии, органическому синтезу, энзимологии, биотехнологии и медицине. Предложен способ ферментативного получения модифицированных одноцепочечных ДНК для создания реагентов, способных специфично связываться с гидрофобными участками высокомолекулярных органических соединений. Метод основан на проведении полимеразной цепной реакции, либо транскрипции, либо обратной транскрипции, либо реакции удлинения праймера с использованием модифицированных трифосфатов дезоксиуридина, немодифицированных цепей ДНК с заданной последовательностью, высокоспецифичных фланкирующих праймеров, где 3’-праймер биотинилирован по 5’-концу, полимеразы KOD XL или Deep Vent. Модифицированные цепи ДНК отделяются от немодифицированных цепей ДНК с помощью магнитных частиц с ковалентно пришитыми к их поверхности молекулами стрептавидина, либо методом с применением λ-экзонуклеазы. Полученные одноцепочечные ДНК с модификациями способны взаимодействовать с гидрофобными участками высокомолекулярных соединений-мишеней и предназначены для разработки ДНК-зондов, аптамеров и сомамеров, применяющихся в молекулярно-биологических исследованиях и в медицинской диагностике. 9 н. и 3 з.п. ф-лы, 5 ил., 2 табл., 21 пр.
1. Способ ферментативного получения модифицированных одноцепочечных ДНК для создания реагентов, специфично связывающихся с гидрофобными участками высокомолекулярных органических соединений, включающий последовательные стадии:
(а) - органический синтез мономеров – модифицированных трифосфатов дезоксиуридина, содержащих на гетероциклическом основании функциональные группы, способные специфично связываться с гидрофобными участками высокомолекулярных органических соединений, а именно тетранатриевой, тетракалиевой, тетралитиевой, тетрааммониевой или тетракис(триэтиламмониевой) соли 5-[4-аза-5-оксо-6-(1Н-индол-3-ил)гекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата, 5-[4-аза-5-оксо-7-(1Н-индол-3-ил)гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата, 5-[4-аза-5-оксо-8-(1Н-индол-3-ил)окт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата, 5-[4-аза-5-оксо-6-фенилгекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата, 5-[4-аза-5-оксо-7-фенилгепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата или 5-[4-аза-5-оксо-8-фенилокт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата;
(б) - органический синтез немодифицированной одноцепочечной ДНК с заданной последовательностью:
(i) 5'-GGGTGGTCTGTGTGCAAAACTAAAGAGACGACGAGCGGGAAAAAA-3' или
(ii) 5'-CTGTCAGCTCCATACTGGTAGCC-(N)40-GCGTTCGAATCTAGACGGTACGA, а именно вырожденной комбинаторной ДНК-библиотеки, где N - комбинация нуклеотидов А, Т, G, С;
(в) - органический синтез высокоспецифичных фланкирующих праймеров для ферментативной амплификации немодифицированной одноцепочечной ДНК, а именно
5'-TCCCGCTCGTCGTCT-3' (3'-праймер),
5'-GGGTGGTCTGTGTGC-3' (5'-праймер) для последовательности (i) или
5'-CTGTCAGCTCCATACTGGTAGCC-3' (3'-праймер),
5'-TCGTACCGTCTAGATTCGAACGC-3' (5'-праймер) для последовательности (ii);
(г) - ферментативную амплификацию синтетической немодифицированной ДНК с целью наработки необходимого ее количества для последующего введения модифицированных нуклеотидов с применением полимеразной цепной реакции;
(д) - присоединение биотиновой метки к высокоспецифичному 3'-праймеру, полученному на стадии (в), по 5'-концу;
(е) - проведение полимеразной цепной реакции, либо транскрипции, либо обратной транскрипции, либо реакции удлинения праймера с применением амплифицированной ДНК со стадии (г), фланкирующих праймеров со стадии (в), где 3'-праймер биотинилирован, модифицированного трифосфата дезоксиуридина со стадии (а) и полимеразы KOD XL или Deep Vent;
(ж) - получение одноцепочечных модифицированных ДНК методом разделения биотинилированной и небиотинилированной цепей модифицированной ДНК с использованием магнитных частиц с ковалентно пришитыми к их поверхности молекулами стрептавидина, либо методом с применением λ-экзонуклеазы, пригодных для применения в качестве реагентов, способных специфично связываться с гидрофобными участками высокомолекулярных органических соединений.
2. Способ по п. 1, в котором реагенты способны связываться с гидрофобными участками белков, полипептидов, пептидогликанов, гликопротеинов, углеводородов, липосом, липидных мембран, двусторонних липидных мембран;
3. Производное дезоксиуридин-5-трифосфата общей формулы
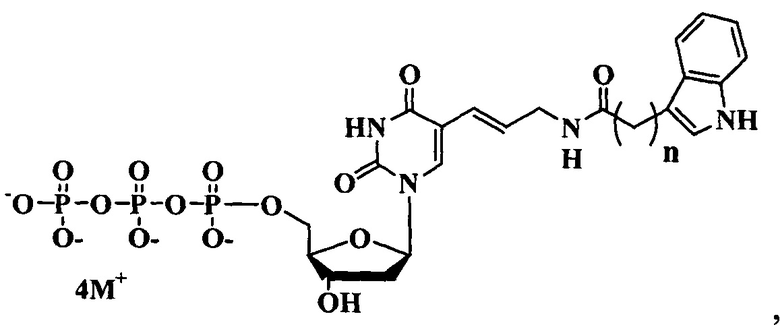 где
где
n=1 – 3, М+ представляет собой Н+, Na+, Li+, K+, [CH3(CH2)x](4-y)NHy+ (х=0 – 5, у=0 – 4), для получения одноцепочечной модифицированной ДНК в способе по пп. 1 и 2.
4. Соединения по п. 3, представляющие собой:
тетранатриевую соль 5-[4-аза-5-оксо-6-(1Н-индол-3-ил)гекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракалиевую соль 5-[4-аза-5-оксо-6-(1Н-индол-3-ил)гекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетралитиевую соль 5-[4-аза-5-оксо-6-(1Н-индол-3-ил)гекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетрааммониевую соль 5-[4-аза-5-оксо-6-(1Н-индол-3-ил)гекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракис(триэтиламмониевую) соль 5-[4-аза-5-оксо-6-(1Н-индол-3-ил)гекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетранатриевую соль 5-[4-аза-5-оксо-7-(1Н-индол-3-ил)гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракалиевую соль 5-[4-аза-5-оксо-7-(1Н-индол-3-ил)гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетралитиевую соль 5-[4-аза-5-оксо-7-(1Н-индол-3-ил)гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетрааммониевую соль 5-[4-аза-5-оксо-7-(1Н-индол-3-ил)гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракис(триэтиламмониевую) соль 5-[4-аза-5-оксо-7-(1Н-индол-3-ил)гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетранатриевую соль 5-[4-аза-5-оксо-8-(1Н-индол-3-ил)окт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракалиевую соль 5-[4-аза-5-оксо-8-(1Н-индол-3-ил)окт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетралитиевую соль 5-[4-аза-5-оксо-8-(1Н-индол-3-ил)окт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетрааммониевую соль 5-[4-аза-5-оксо-8-(1Н-индол-3-ил)окт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракис(триэтиламмониевую) соль 5-[4-аза-5-оксо-8-(1Н-индол-3-ил)окт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата.
5. Производное дезоксиуридин-5-трифосфата общей формулы
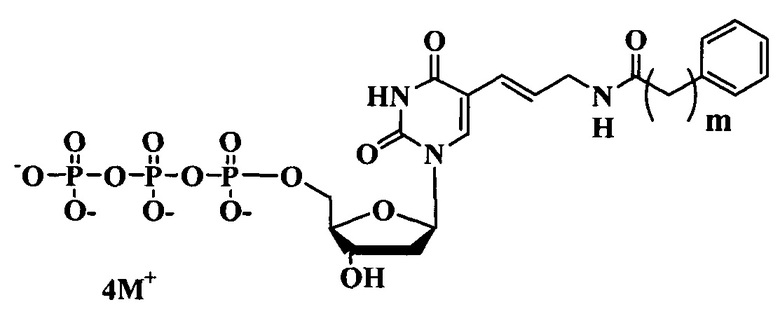
где m=1 – 3, М+ представляет собой Н+, Na+, Li+, K+, [CH3(CH2)x](4-y)NHy+ (х=0 – 5, у=0 – 4), для получения одноцепочечной модифицированной ДНК в способе по пп. 1 и 2.
6. Соединения по п. 5, представляющие собой:
тетранатриевую соль 5-[4-аза-5-оксо-6-фенилгекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракалиевую соль 5-[4-аза-5-оксо-6-фенилгекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетралитиевую соль 5-[4-аза-5-оксо-6-фенилгекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетрааммониевую соль 5-[4-аза-5-оксо-6-фенилгекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракис(триэтиламмониевую) соль 5-[4-аза-5-оксо-6-фенилгекс-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетранатриевую соль 5-[4-аза-5-оксо-7-фенилгепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракалиевую соль 5-[4-аза-5-оксо-7-фенилгепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетралитиевую соль 5-[4-аза-5-оксо-7-фенилгепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетрааммониевую соль 5-[4-аза-5-оксо-7-фенилгепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракис(триэтиламмониевую) соль 5-[4-аза-5-оксо-7-фенилгепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетранатриевую соль 5-[4-аза-5-оксо-8-фенилокт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракалиевую соль 5-[4-аза-5-оксо-8-фенилокт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетралитиевую соль 5-[4-аза-5-оксо-8-фенилокт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетрааммониевую соль 5-[4-аза-5-оксо-8-фенилокт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата,
тетракис(триэтиламмониевую) соль 5-[4-аза-5-оксо-8-фенилокт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфата.
7. Фрагмент ДНК с заданной фиксированной последовательностью (i) 5'-GGGTGGTCTGTGTGCAAAACTAAAGAGACGACGAGCGGGAAAAAA-3' для применения в способе по пп. 1 и 2.
8. Фрагмент ДНК, представляющий собой вырожденную комбинаторную ДНК-библиотеку (ii) 5'-CTGTCAGCTCCATACTGGTAGCC-(N)40-GCGTTCGAATCTAGACGGTACGA для применения в способе по пп. 1 и 2, где N - комбинация нуклеотидов А, Т, G, С.
9. Пара фланкирующих праймеров для ферментативной амплификации немодифицированной ДНК в способе по пп. 1 и 2, характеризующихся последовательностями
5'-TCCCGCTCGTCGTCT-3' (3'-праймер) и
5'-GGGTGGTCTGTGTGC-3' (5'-праймер).
10. Пара фланкирующих праймеров для ферментативной амплификации немодифицированной ДНК в способе по пп. 1 и 2, характеризующихся последовательностями:
5'-CTGTCAGCTCCATACTGGTAGCC-3' (3'-праймер) и
5'-TCGTACCGTCTAGATTCGAACGC-3' (5'-праймер).
11. Высокоспецифичный праймер, содержащий по 5'-концу биотин, для применения в способе по пп. 1 и 2, характеризующийся последовательностью
5'-биотин-TCCCGCTCGTCGTCT-3' (3'-праймер).
12. Высокоспецифичный праймер, содержащий по 5'-концу биотин, для применения в способе по пп. 1 и 2, характеризующийся последовательностью
5'-биотин-CTGTCAGCTCCATACTGGTAGCC-3' (3'-праймер).
| Печь для пирогенетического разложения нефти | 1926 |
|
SU5739A1 |
| US 7947447 B2, 24.05.2011 | |||
| US 6458539 B1, 01.10.2002 | |||
| US 5998142 A, 07.12.1999 | |||
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО НАБОРА ОДНОЦЕПОЧЕЧНЫХ ФРАГМЕНТОВ ДНК ДЛЯ МУЛЬТИПЛЕКСНОГО ГЕНЕТИЧЕСКОГО АНАЛИЗА | 2015 |
|
RU2604198C1 |
| МОДИФИЦИРОВАННЫЕ ДНК АПТАМЕРЫ, ИНГИБИРУЮЩИЕ АКТИВНОСТЬ ТРОМБИНА | 2009 |
|
RU2410432C1 |
Авторы
Даты
2019-09-05—Публикация
2017-11-30—Подача