Область изобретения
Настоящее изобретение относится к диагностике анэуплоидии у плода по выявлению дисбаланса между различными нуклеотидными последовательностями и, в частности, к диагностике анэуплоидии по хромосоме 13, 18, 21, X и/или Y путем исследования материала, взятого от матери, например образца крови.
Предпосылка изобретения
Анеуплоидией называется изменение нормального числа хромосом (или части хромосом), которое часто бывает причиной врожденных пороков развития. При анеуплоидии ген может присутствовать в трех копиях (трисомия) или лишь в одной (моносомия). Такое изменение количества хромосом, обусловленное нарушением расхождения их во время мейоза, влечет за собой значительные изменения у плода, проявляясь известными синдромами. В большинстве случае трисомии и моносомии детальны для плода и либо беременность прерывается, либо ребенок погибает вскоре после рождения. Однако в некоторых случаях анеуплоидии плод выживает, и ребенок рождается с тем или иным синдромом. Наиболее часто анеуплоидия проявляется трисомией по 21, 18, 13 хромосоме или изменением нормального числа половых хромосом. Наиболее частой формой анеуплоидии, при которой ребенок может выжить, является трисомия по хромосоме 21 (синдром Дауна), встречающаяся с частотой 1 случай на 800 новорожденных. Трисомия по хромосоме 18 (синдром Эдвардса) встречается с частотой 1 случай на 6000 новорожденных, а трисомия по хромосоме 13 (синдром Патау) - с частотой 1 случай на 10000 новорожденных. Анеуплоидия по половым хромосомам отмечается в 1 случае на 400 новорожденных и, следовательно, в целом является более распространенной, чем синдром Дауна. Анеуплоидия по половым хромосомам включает целый ряд аномалий половых хромосом, их которых в настоящее время наиболее частой является делеция Х-хромосомы (45Х, синдром Тернера) или добавочная Х- или Y-хромосома (47,XXY - синдром Клайнфельтера, 47,XYY, 47,ХХХ). Из перечисленных хромосомных аномалий только синдром Тернера проявляется легко идентифицируемым физическим фенотипом. Однако для всех форм анеуплоидии по половым хромосомам характерны задержка развития речи и трудности обучения. Наиболее значимым фактором риска анеуплоидии является немолодой возраст матери в период беременности, так как в большинстве случаев дети с анеуплоидией рождаются от матерей, возраст которых превышает 35 лет, поэтому распространенность этих хромосомных аномалий растет, таккак все больше женщин предпочитает откладывать рождение ребенка на более поздний период жизни. Современные программы пренатального скрининга в типичных случаях включают часто встречающиеся хромосомные анеуплоидии по 21-й, 18-й и 13-й хромосомам. Риск анеуплоидии для беременной женщины можно оценить с помощью целого ряда способов. Для диагностики хромосомной анеуплоидии в первые три месяца беременности (на сроке 11-14 нед) применяются неинвазивные скрининговые тесты, основанные на ультразвуковом исследовании (УЗИ) и определении уровня маркеров в сыворотке крови матери. С помощью УЗИ определяют количество жидкости под кожей на задней стороне шеи ребенка, также называемое как толщина воротниковой зоны, а также определить наличие или отсутствие носовых костей. При исследовании образца крови матери определяют уровень двух сывороточных маркеров: свободного β-хорионического гонадотропина человека (β-ХГЧ) и ассоциированного с беременностью протеина А (РАРР-А - pregnancy associated plasma protein-A), которые присутствуют в крови всех беременных женщин. При анеуплоидии плода под кожей заднего отдела шеи скапливается избыточное количество жидкости и/или уровни РАРР-А и β-ХГЧ превышают средний показатель или ниже его. Кроме того, в некоторых случаях у плода с хромосомной анеуплоидией могут отсутствовать носовые кости. Совокупность позднего возраста, увеличения толщины воротниковой зоны, отсутствие носовых костей, и изменение уровня упомянутых сывороточных маркеров указывает на риск наличия синдрома Дауна и риска наличия трисомии по хромосоме 13 или трисомии 18. Скрининг на анеуплоидию в первом триместре беременности, если у плода имеется синдром Дауна, дает положительный результат в 90% случаев, а в 5% случаев результаты оказываются ложноположительными. При трисомии 13 или трисомии 18 чувствительность скрининга несколько выше. УЗИ для измерения толщины воротниковой зоны можно выполнить без определения уровня β-ХГЧ и РАРР-А, но в этом случае диагностировать анеуплоидию удается лишь в около 70% случаев.
Пренатальная диагностика является составной частью акушерского обследования. Для проведения генетической пренатальной диагностики необходим генетический материл, полученный от плода в процессе внутриутробного развития. ДНК плода для анализа обычно получают инвазивным способом, например путем амниоцентеза или биопсии ворсин хориона. Эти процедуры рискованны и соответственно в 0,5 и 1-2% случаев приводят к прерыванию беременности. В связи с этим к инвазивной диагностике анеуплоидии прибегают лишь в тех случаях, когда высока вероятность ее наличия у плода. Женщины с высоким риском анеуплоидии у плода составляют 5-10% всех беременных, подвергающихся скринингу для выявления анеуплоидии. Поскольку традиционная пренатальная диагностика ассоциирована с риском, то было бы идеально при проведении генетической диагностики плода использовать неинвазивные способы исследования. Для этого необходимо получить материал от плода для генетического анализа, не причиняя вреда плоду. Серьезным прорывом в этой области послужили сообщение Lo et al. (1997)1 и заявка WO 98/39474, согласно которым в плазме матери имеется свободно плавающая фетальная ДНК. Авторы затем показали, что ДНК плодного происхождения составляет 10% свободной плавающей ДНК в плазме крови матери. ДНК плода можно выявить в плазме крови матери уже через несколько недель после зачатия, после родов она быстро исчезает из плазмы крови матери в течение нескольких часов. Это означает, что использование свободно плавающей ДНК плодного происхождения в плазме крови матери в качестве источника генетического материала для разработки неинвазивного теста пренатальной диагностики является перспективным. Однако на долю ДНК плодного происхождения приходится лишь незначительная часть общего количества свободноплавающей ДНК в плазме крови, остальная часть которой принадлежит ДНК матери и имеет главным образом лейкоцитарное происхождение.
Учитывая огромное значение этого факта, в течение последнего десятилетия было описано несколько способов неинвазивной диагностики анеуплоидии. Один способ заключается в анализе специфических для плода молекул нуклеиновой кислоты в плазме крови матери, что позволяет избежать помех, создаваемых присутствием в плазме крови ДНК матери. Другой способ направлен на выявление экспрессируемой плацентой мРНК или плацентарных эпигенетических маркеров исследуемой хромосомы. В ряде разработок начиная с 2000 г. была доказана возможность проведения пренатальной диагностики, основанной на исследовании РНК плода в плазме крови матери. Poon et al. (2000)2 показали, что в плазме крови женщины, беременной плодом мужского пола, можно выявить мРНК, транскрибированную с Y-хромосомы. Позднее на основании результатов определения уровня мРНК плацентарного лактогена человека и мРНК, кодирующей β-субъединицу хорионического гонадотропина человека, было показано, что плацента является основным источником РНК плодного происхождения в плазме крови матери3.
В 2007 г. способом, основанным на применении микрочипов, была идентифицирована плацентарная мРНК, транскрибированная с гена PLAC4, локализованного на хромосоме 21, и было показано что эта мРНК присутствует в плазме крови матери и исчезает из нее после рождения плода4. Для определения дозы хромосомы 21 по уровню мРНК, транскрибированной с гена PLAC4, в плазме крови матери был использован подход, состоящий в анализе аллельных отношений. Он основывается на наличии полиморфизма одиночной нуклеотидной замены в кодирующей области гена PLAC4. Если плод гетерозиготен по такому полиморфизму, то он имеет два аллеля, которые отличаются нуклеотидной последовательностью ДНК. Если плод эуплоидный отношение этих двух аллелей составляет 1:1, в случае трисомии 21 аллельное отношение становится равным 1:2 или 2:1. Lo et al. (2007)4 показали, что такую стратегию можно применить к неинвазивной диагностике трисомии 21 у плода. Аналогично проводилась также неинвазивная диагностика трисомии 18 с помощью анализа аллельных отношений мРНК, транскрибированной с гена SERPINB25.
Основное ограничение анализа аллельных отношений состоит в том, что он позволяет проводить успешную диагностику только в случае, когда плод гетерозиготен по анализируемому SNP. Например, при использовании SNP в гене PLACA4 ожидается, что около 45% плодов будут гетерозиготны. Следовательно, нужно несколько маркеров для выполнения полноценной диагностики. Для этого рядом исследователей были описаны новые полиморфные маркеры SNP, которые можно проанализировать с помощью данного подхода. В одном предварительном сообщении описывается десять маркеров с комбинированной частотой гетерозиготности, которая отмечается у 95% популяции Америки (6). Ожидается, что в предстоящие несколько лет будет дана оценка этих маркеров в крупномасштабных клинических испытаниях.
Были исследованы также плацентарные эпигенетические маркеры (такие, как метилирование ДНК), характерные для целевой хромосомы плода. Поскольку ткани в организме имеют разный профиль экспрессии генов, метилированию некоторых генов также присущи тканеспецифические особенности. Исследования показывают, что ДНК в плазме крови матери имеет плацентарное происхождение и что фоновая ДНК, содержащаяся в крови матери, имеет лейкоцитарное происхождение. Поэтому одним из путей для получения эпигенетических маркеров ДНК плода является идентификация генов, чей статус метилирования отличается между тканями плаценты и клетками крови матери. Chim et al. (2005)7 исследовали профиль метилирования промотора гена SERPINB5 (maspin) и показали, что в ткани плаценты он гипометилирован, а в клетках крови матери - гиперметилирован. Применяя метил-чувствительную ПЦР можно было бы детектировать плацентарный гипометилированный ген SERPINB5 и отличить его от материнских гиперметилированных молекул, находящихся в плазме крови матери. Это делает ген SERPINB5, локализованный на хромосоме 18, первым универсальным циркулирующим в крови маркером фетальной ДНК, который можно было бы использовать для обследования всех беременных независимо от пола плода и его генотипа. Поскольку ген SERPINB5 локализован на хромосоме 18, то оказалось возможным разработать подход, аналогичный анализу аллельного отношения PHK-SNP, так называемый анализ эпигенетического аллельного отношения. Таким образом, если плод гетерозиготен по SNP, локализованному в области промотора гена SERPINB5, определение аллельного отношения SNP для гипометилированной версии гена, позволяет диагностировать трисомию плода по хромосоме 18.
Однако метил-чувствительная ПЦР требует применения бисульфитной конверсии, в результате которой неметилированный цитозин превращается в урацил. При этом бисульфитная конверсия разрушает до 95% молекул ДНК в исследуемом образце и, следовательно, снижает количество фетальной ДНК в образце плазмы крови матери, что может стать причиной ложноотрицательных результатов. Поэтому исследователи разработали фетальные эпигенетические маркеры, которые можно было бы детектировать в плазме крови матери, не прибегая к бисульфитной конверсии. С этой целью Chan et al. (2006)8 использовали промотор гена RASSF1, локализованного на хромосоме 3, который в ткани плаценты гиперметилирован, а в клетках крови матери гипометилирован. Следовательно гипометилированные нуклеотидные последовательности гена RASSF1, происходящего из клеток крови матери, можно удалить из плазмы крови матери путем гидролиза с помощью метил-чувствительных рестриктаз. В самом деле, после обработки рестриктазами фетальные нуклеотидные последовательности гена RASSF1 можно было детектировать в образце плазмы крови матери до наступления родов, а через 24 часа после родов они уже не обнаруживались. Chan et al. (2006)9 использовали неодинаковый паттерн метилирования промотора гена RASSF1 в качестве критерия положительного контроли при неинвазивной пренатальной детекции фетального резус-фактора (RhD) у 54 резус-отрицательных женщин на ранних сроках беременности.
Анализ аллельных отношений PHK-SNP и определение профиля метилирования ДНК затрагивают часть молекул нуклеиновой кислоты, присутствующей в плазме крови матери, и проводятся методами молекулярной биологии. Альтернативой этому является применение физических способов, позволяющих добиться относительного обогащения плазмы крови матери фетальной ДНК.
Недавно9 было показано, что длина свободной фетальной ДНК в плазме крови матери примерно на 20 пар нуклеотидов короче, чем ДНК материнского происхождения. Поэтому способы фракционирования ДНК по размеру молекулы, такие, как гель-электрофорез, позволяют фракционировать ДНК, содержащуюся в плазме крови, обогатить ее короткими молекулами ДНК плодного происхождения. Такой подход был успешно применен для обогащения свободной фетальной ДНК. Хотя с его помощью эмпирически была показана возможность качественной диагностики заболевания, вызывающего мутации, например мутации, приводящие к развитию β-талассемии, пока не ясно, будет ли достаточной степень обогащения для диагностики анеуплоидии плода, для которой необходимо количественное определение дозы хромосомы. Dhallan et al. (2006)10 сообщили о другом подходе к обогащению фетальной ДНК, содержащейся в плазме крови матери. Они предположили, что значительная доля свободной ДНК материнского происхождения, содержащейся в плазме крови матери, попадает в нее из лейкоцитов матери после выполнения флеботомии. Поэтому было высказано предположение, что если ядерные клетки крови матери можно было бы фиксировать с помощью формальдегида, то растворения фетальной ДНК в плазме крови матери можно было бы избежать. Dhallan10 продемонстрировал преимущество такого подхода к неинвазивной пренатальной диагностике трисомии 21, показав в эксперименте, охватившем 60 беременных женщин, что долю фетальной ДНК удается довести до 34%. Однако преимущества обработки формальдегидом ряду других исследователей воспроизвести не удалось.
Описанные выше подходы основаны на допущении, что низкая концентрация фетальной ДНК в плазме крови матери затрудняет прямую диагностику хромосомной анеуплоидии у плода. Это связано с недостаточной точностью традиционных способов детекции циркулирующей фетальной ДНК, например способа ПЦР в реальном времени.
Появление недавно способа детекции единичных молекул позволяет диагностировать анеуплоидию у плода, не прибегая к ограничению анализа специфичными для плода молекулами нуклеиновой кислоты в плазме крови матери. Как цифровая ПЦР, так и массивное параллельное секвенирование являются способами подсчета единичных молекул, позволяющими количественно определить содержание нуклеиновых кислот путем подсчета молекул и являются более точными аналитическими способами по сравнению с обычными методами детекции на основе ПЦР. Цифровая ПЦР представляет собой параллельное проведение многих ПЦР, при которых в каждой ПЦР имеется либо единичные молекулы-мишени, либо таковые отсутствуют. Подсчитывая количество положительных реакций по завершении амплификации, можно определить количество входящих молекул-мишеней. Таким образом удается точно подсчитать незначительное увеличение общего количества молекул ДНК, принадлежащих к анеуплоидной хромосоме и сравнить количество материнской и фетальной ДНК. В самом деле, Lo et al. (2007)11 показали, что выявление анеуплоидии возможно даже при небольшой доле трисомической ДНК (10%). Чем меньше концентрация фетальной ДНК, тем меньше ожидаемое увеличение количества ДНК анеуплодной хромосомы. При цифровой ПЦР точность количественного определения повышается при увеличении количества анализов с помощью ПЦР. Lo et al. (2007)11 показали, что для точной диагностики трисомии 21 с помощью анализа плазмы крови матери, содержащей 25% фетальной ДНК, необходимо около 8000 цифровых ПЦР, требующих в клинических условиях использования автоматизированных платформ. Такие автоматизированные платформы, в которых используется микроструйная техника, имеются в продаже, но стоят дорого (например, Fluidigm). Рядом авторов было показано, что неинвазивная диагностика трисомии 21 у плода возможна с помощью массивного параллельного секвенирования или способов секвенирования следующего поколения (см., например, WO 2009/013496). Секвенаторы для массивного параллельного секвенирования позволяют проанализировать нуклеотидные последовательности миллионов и миллиардов молекул ДНК при каждом раунде. Поэтому, помимо идентификации, можно добиться частотного распределения молекул ДНК в анализируемом образце. Поскольку свободно плавающая ДНК в плазме крови матери по своей природе фрагментирована, ее можно использовать для прямой идентификации хромосомного происхождения каждой молекулы ДНК и определения доли молекул, принадлежащих потенциально анеуплоидной хромосоме. Ряд исследователей показали, что доля молекул ДНК, принадлежащих хромосоме 21, в плазме крови женщины, беременной плодом с трисомией 21, повышена по сравнению с плазмой крови беременных эуплоидным плодом. Анализ плазмы крови матери давал возможность точной диагностики трисомии 21 при исследовании небольших когорт беременных.
В последнее время было проведено два клинических валидационных исследования с применением описанного выше способа. В одном исследовании было проанализировано 449 образцов крови, из которых в 39 были трисомии по хромосоме 2112. В другом исследовании было проанализировано 1014 образцов крови беременных женщин, относящихся к группе риска; образцы были получены в 13 клиниках США перед выполнением пренатального инвазивного диагностического исследования13. Из этого количество образцов 119 были подвергнуты анализу путем массивного параллельного секвенирования ДНК. Пятьдесят три секвенированных образца были правильно отнесены к образцам с патологическим кариотипом плода. Оба клинических валидационных исследования показали очень высокую чувствительность и специфичность способа исследования. Эти данные показали, что секвенирование ДНК, содержащейся в крови, является действенным способом неинвазивной диагностики трисомии 21 у плода и гарантирует валидацию при проведении более масштабных многоцентровых исследований.
С другой стороны, было показано, что определение доли нуклеотидных последовательностей, происходящих от хромосом с большем или меньшем содержанием GC по сравнению с хромосомой 21, является не столь надежным, поэтому измерение количества ДНК, принадлежащей хромосомам 18 и 13, является менее точным и имеет погрешность при использовании протоколов для трисомии по хромосоме 21. Поэтому для надежной неинвазивной детекции трисомии 18 и трисомии 13 необходима разработка способа секвенирования и обработки результатов анализов, который меньше зависит от содержания GC хромосом, и дальнейшая валидация этого способа. Недавно проведенное исследование позволило отчасти решить эту проблему, используя референсный геном с незамаскированными повторами и биоинформационный подход для внесения поправки на погрешность, связанную с содержанием GC, в результатах секвенирования14. С помощью такого подхода удалось диагностировать все случаи (25 из 25) трисомии 13 у плода при специфичности способа 98,9% и 34 случая из 37 (92%) трисомии 18 при специфичности 98,0%. Эти данные говорят о том, что при надлежащем биоинформационном анализе неинвазивная пренатальная диагностика трисомии 13 и трисомии 18 путем секвенирования ДНК, содержащейся в плазме крови матери, не столь надежна, как диагностика трисомии 21.
Кроме того, стоимость массивного параллельного секвенирования высока, а производительность низкая. За один раунд можно исследовать лишь несколько случаев, что занимает несколько дней. Поэтому необходимо продолжить исследования, чтобы разработать более дешевый и более производительный способ.
Недавно стали использовать таргетное обогащение для снижения стоимости и повышения эффективности массивного параллельного секвенирования15. Цитируемое исследование было посвящено выяснению применимости обогащения селективных областей генома по ДНК, содержащейся в плазме крови, и оценке количественной производительности такого подхода. Эксперимент показал, что степень покрытия нуклеотидных последовательностей обогащенного образца в среднем в 200 раз выше, чем необогащенного образца, и, что более важно, молекулы ДНК матери и плода были обогащены равномерно. Кроме того, используя данные по однонуклеотидному полиморфизму (SNP), авторам удалось показать, что степень покрытия аллелей плода в пределах таргетной области повысилась с 3,5% до 95,9%. В целом, таргетное секвенирование ДНК, содержащейся в образце плазмы крови матери, дает возможность эффективно и без погрешностей детектировать фетальные аллели и является эффективным способом определения доли фетальной ДНК в образце плазмы крови матери. На основании этой единственной научной статьи видно, что целевое обогащение перспективно, так как оно может существенно снизить стоимость секвенирования. В то же время оно требует дополнительных мер по обогащению, которые могут повысить итоговую стоимость анализа и задержать получение результата, так как типичная процедура обогащения длится около 24-36 ч.
Сущность изобретения
В настоящем изобретении предлагается способ неинвазивной диагностики анеуплоидии по хромосоме 21 и/или 18 и/или 13 и/или Х и/или Y путем комбинирования секвенирующих технологий с мультиплексной ПЦР, основанной на амплификации специфической ДНК-последовательности (то есть мишени), которая содержит по меньшей мере один SNP.
В другом объекте изобретения предлагается неинвазивный способ ДНК-диагностики анеуплоидии по хромосоме 21 и 18 и 13 и Х и Y путем комбинирования мультиплексной ПЦР, основанной на амплификации специфических нуклеотидных последовательностей ДНК (то есть мишеней), которые содержат по меньшей мере один SNP, в сочетании с технологиями секвенирования.
Коротко выражаясь, настоящее изобретение относится к способу дифференциальной детекции предварительно намеченного набора таргетных последовательностей в смешанном материале, полученном от матери и от плода. Таким образом, способы и материалы, описываемые здесь, подразумевают использование методики анализа многочисленных нуклеиновых кислот в биологическом образце (предпочтительно сыворотке или плазме крови), содержащем свободно плавающую ДНК, которая представляет собой смесь ДНК матери и ДНК плода, и позволяют выявить статистически достоверную разницу между эуплоидным и триплоидным плодом. В отличие от указанных способов массивного параллельного секвенирования, основанных на исследовании всего генома или обогащенных образцов, которые не достигают достаточного уровня чувствительности и специфичности, в частности, для хромосомы 13, в настоящем изобретении предлагается неинвазивный способ диагностики, имеющий специфичность и чувствительность, близкую к 100% (специфичность 99,99%, чувствительность 99,5%), позволяющий одновременно выявить анеуплоидию по хромосомам 13, 18, 21, X и Y. Не ограничивая изобретение рамками какой-либо конкретной теории или пояснения, отметим, что одной из причин, по которой мультиплексная ПЦР не применялась в разработке неинвазивной диагностики анеуплоидии, является наличие в хромосоме 13 области с высоким содержанием GC. Другой причиной было скептическое отношение к применению мультиплексной ПЦР одним из ведущих изобретателей (то есть Dennis Lo) в US 2010/0112590. Действительно, в последнем приложении параграфов 116-117 рекомендуется применять не локус-зависимые, а локус-независимые методы исследования, такие, как целевая амплификация, выполненная с помощью способов по изобретению.
Таким образом, один объект изобретения касается способа выявления или исключения анеуплоидии плода в биологическом образце, полученном у матери, путем исследования упомянутого биологического образца, содержащего фетальные и материнские нуклеиновые кислоты, присутствующие во фракции свободно плавающей ДНК, амплификации селективного набора таргетных нуклеотидных последовательностей ДНК в количественной (то есть амплификации матричной ДНК, такой, что амплифицированная ДНК воспроизводит исходное соотношение матричных ДНК) мультиплексной ПЦР, секвенирования упомянутого амплифицированного селективного набора таргетных последовательностей ДНК для определения последовательности нуклеотидов в упомянутых нуклеотидных последовательностях ДНК, использования полученных данных о нуклеотидных последовательностях для сравнения количества амплифицированных последовательностей, принадлежащих по меньшей мере одной первой хромосоме в упомянутой смеси материнской и фетальной ДНК к количеству амплифицированных последовательностей ДНК, принадлежащих по меньшей мере одной второй хромосоме в упомянутой смеси материнской и фетальной ДНК, в которой упомянутая по меньшей мере одна первая хромосома у плода предположительно является эуплоидной, в которой упомянутая по меньшей мере одна вторая хромосома у плода подозрительна на анеуплоидию, что позволяет определить, имеется ли анеуплоидия у плода.
Другой объект изобретения касается способа выявления или исключения анеуплоидии у плода в биологическом образце, полученном у матери, путем исследования упомянутого материнского биологического образца, содержащего фетальные и материнские нуклеиновые кислоты (такие, как свободно плавающая ДНК), амплификации селективного набора таргетных нуклеотидных последовательностей ДНК в количественной мультиплексной ПЦР, в которой каждая амплифицированная последовательность ДНК содержит по меньшей мере один однонуклеотидный полиморфизм (SNP), который считается информативным в случае если беременная женщина гетерозиготна по этому SNP, секвенирования упомянутого амплифицированного селективного набора таргетных нуклеотидных последовательностей ДНК для определения последовательности нуклеотидов в упомянутых нуклеотидных последовательностях ДНК, использования полученных данных о последовательностях для сравнения количества амплифицированных последовательностей, которые несут информативный SNP, принадлежащий по меньшей мере одной первой хромосоме в упомянутой смеси материнской и фетальной ДНК, к количеству амплифицированных нуклеотидных последовательностей ДНК, которые несут информативный SNP, принадлежащий по меньшей мере одной второй хромосоме в упомянутой смеси материнской и фетальной ДНК, в которой упомянутая по меньшей мере одна первая хромосома у плода является предположительно эуплоидной, в которой упомянутая по меньшей мере одна вторая хромосома у плода подозрительна на анеуплоидию, что позволяет определить, имеется ли анеуплоидии у плода и/или определить в упомянутой нуклеотидной последовательности ДНК аллельные отношения информативных SNP, причем измененное аллельное отношение свидетельствует о том, что плод у беременной является анеуплоидным.
Подписи к чертежам
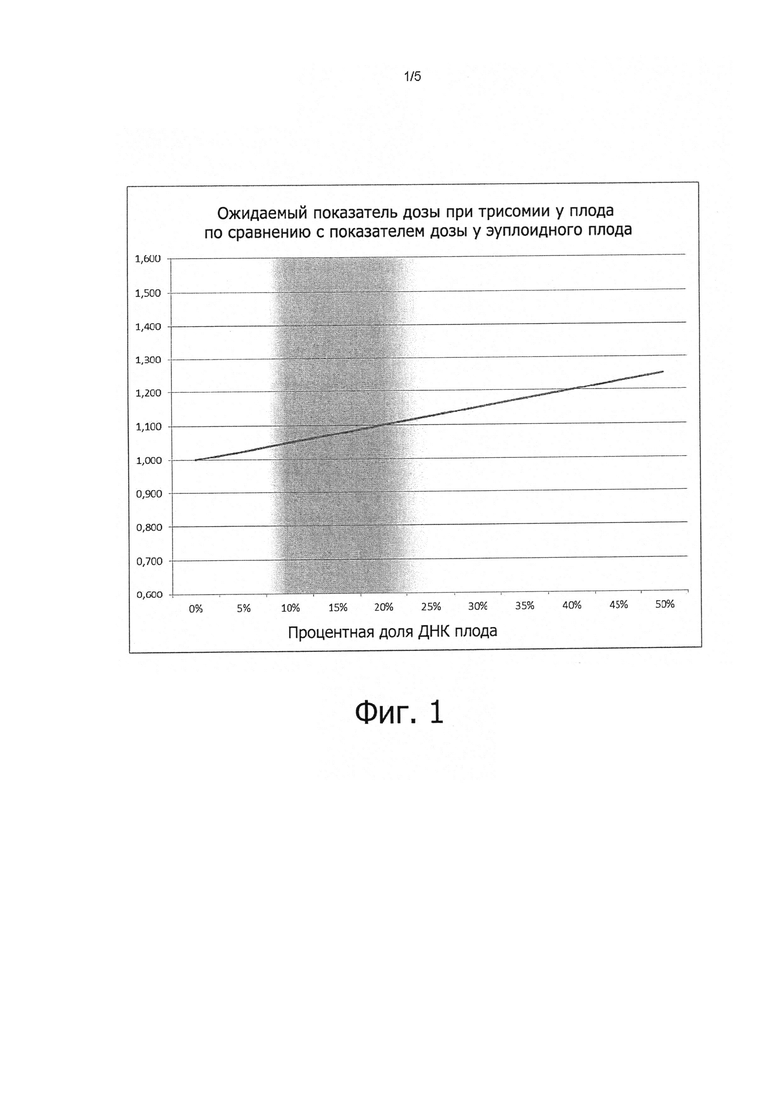
Фиг. 1:
Показатели доз трисомического плода по сравнению с эуплоидпым плодом. Затушеванные участки показывают ожидаемую долю фетальной ДНК, выраженную в процентах.
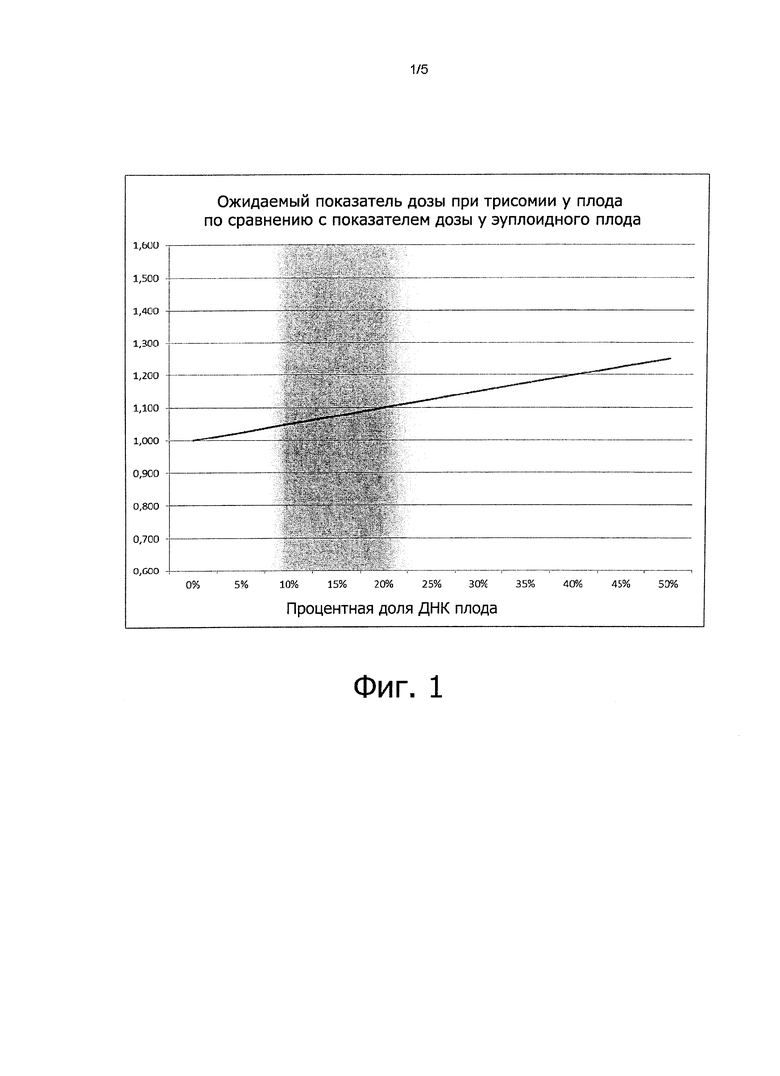
Фиг. 2:
Количество SNP, необходимое для получения как минимум необходимого количества информативных SNP, отраженных на графике относительно частоты минорного аллеля. Расчеты выполнены для минимального уровня вероятности 99%.
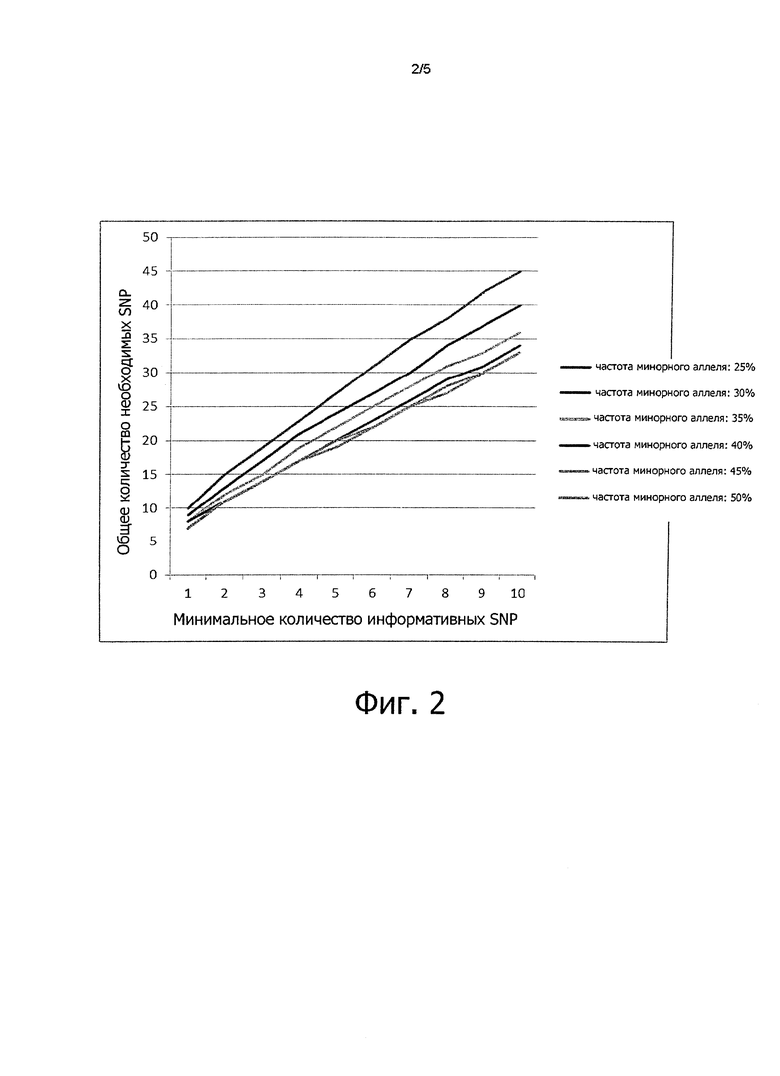
Фиг. 3:
График ожидаемого против наблюдаемого нормированного количества прочтений для образцов ДНК (квадраты) хромосомы 21 при синдроме Дауна (трисомия 21) и четырех образцов ДНК при эуплоидии (кружочки).
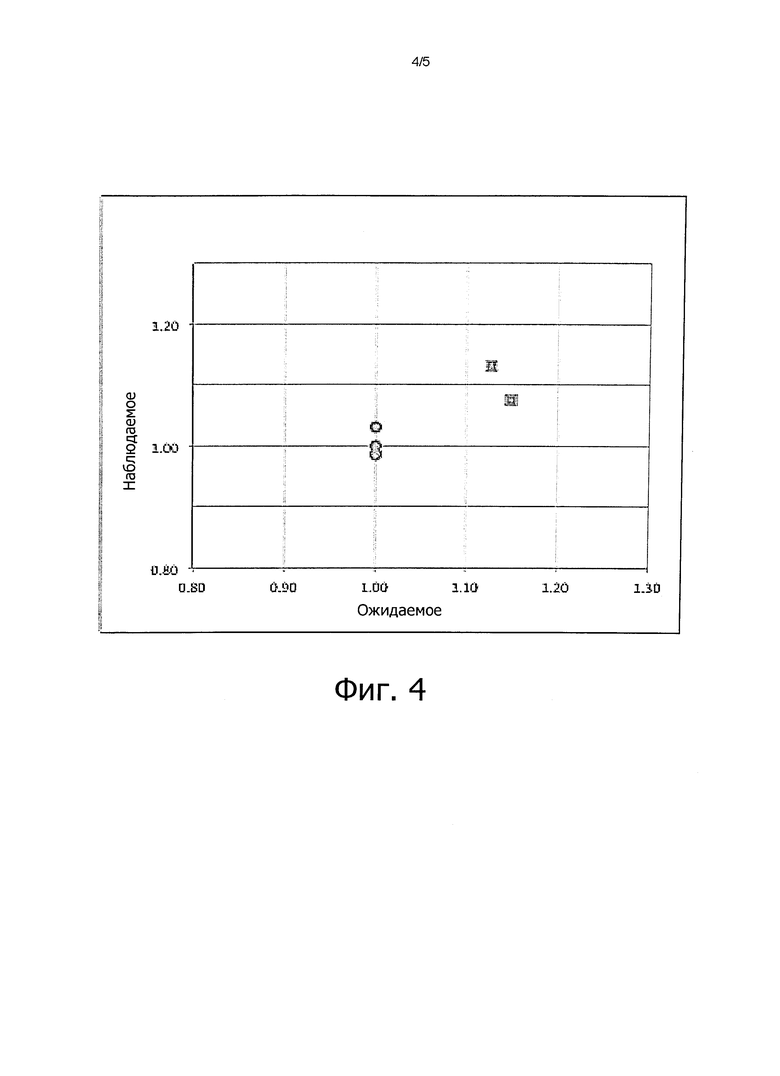
Фиг. 4:
График ожидаемого против наблюдаемого нормированного количества прочтений для двух образцов ДНК (квадраты) искусственных трисомических образцов (в которых на долю трисомии 21 приходится 20%) и 4 образцов ДНК при эуплоидии (кружочки).
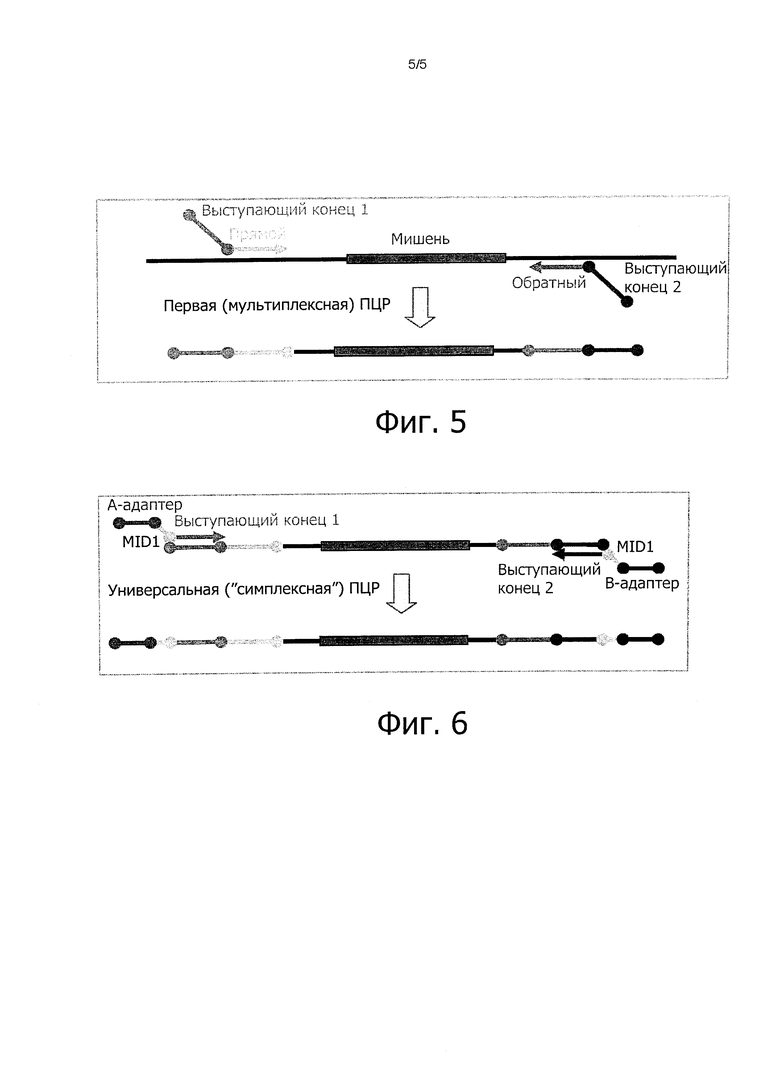
Фиг. 5:
Схематическое представление первой мультиплексной ПЦР при исследовании способом MASTR. Обратный и прямой праймеры являются специфическими к ампликону праймерами. Выступающий конец 1 и Выступающий конец 2 обозначают универсальные последовательности, которые используются во второй ПЦР при исследовании способом MASTR.
Фиг. 6:
Схематическое представление второй ПЦР при исследовании способом MASTR. На этом этапе последовательности MID (шрихкоды) и адаптеры А и В (для эмульсионной ПЦР на платформе 454) встраивают в ампликопы, полученные в первой ПЦР.
Подробное описание изобретения
Из предшествующего уровня техники известна возможность использования массивного параллельного секвепирования как аналитической платформы для диагностики анеуплоидии при анализе свободно плавающей ДНК. Однако производительность этого исследования при использовании его в молекулярной диагностике низкая и стоит оно дорого. Причина этого в основном состоит в том, что выполняемые в настоящее время анализы основываются на полногеномном секвенировании свободно плавающей ДНК, приводящем к получению огромного набора секвенируемых молекул, из которых лишь небольшая доля (~5%) используется для определения плоидности плода. При таком полногеномном подходе приходится задействовать значительную часть мощности массивного параллельного секвенатора и в результате секвенировать материал небольшого числа пациентов за один раунд, на что необходимо несколько дней. Кроме того, от каждого пациента получают огромный набор секвенируемых молекул, что снижает эффективность хранения и анализа.
В настоящем изобретении предлагается решение этой проблемы с помощью подхода, основанного на применении мультиплексной ПЦР для амплификации большого количества отобранных областей хромосом. Отобранные области хромосом амплифицируют в реакции мультиплексной ПЦР от одной или более хромосом, которые предположительно являются анеуплоидными и отобранный набор областей хромосом амплифицируют предпочтительно в той же реакции ПЦР, от одной или более хромосомы, которые предположительно являются эуплоидными. Хромосомы, которые предположительно являются эуплоидными, далее называются референсными.
В первом варианте осуществления изобретения предлагается способ детекции хромосомной анеуплоидии плода у беременных, включающий i) получение биологического образца от беременной женщины. И) получение нуклеиновых кислот из указанного биологического образца, iii) амплификацию выбранного набора таргетных нуклеотидных последовательностей ДНК в количественной мультиплексной ПЦР, при которой по меньшей мере одна амплифицированная нуклеотидная последовательность ДНК содержит по меньшей мере один SNP, который считается информативным, если беременная гетерозиготна по данному SNP, iv) секвенирование амплифицированных таргетных нуклеотидных последовательностей ДНК и v) подсчет суммы числа прочтений для всех амплифицированных нуклеотидных последовательностей ДНК предположительно анеуплоидной хромосомы и последующего нормирования по числу прочтений для всех амплифицированных нуклеотидных последовательностей ДНК референтной хромосомы для определения с помощью статистического анализа количественного показателя, указывающего на хромосомную анеуплоидию плода, и/или определения аллельных отношений информативных SNP, так что отклонение аллельного отношения указывает на фетальную хромосомную анеуплоидию у беременной женщины.
Термин «биологический образец», используемый в тексте, означает любой образец, полученный от субъекта (например, беременной женщины или беременной самки животного) и содержащий одну или более целевую молекулу нуклеиновой кислоты.
В соответствии с этим определением биологический образец включает, например, кровь, слюну, мочу, спинно-мозговую жидкость (СМЖ), слезную жидкость, плазму крови, сыворотку крови, слюну или смыв из канала шейки матки.
Термины «нуклеиновая кислота» или «полинуклеотид» означают дезоксирибонуклеиновую кислоту (ДНК) или рибонуклеиновую кислоту (РНК) и их полимер в виде одинарной или двойной цепочки. Если особо не оговорено, то этот термин включает нуклеиновые кислоты, содержащие известные аналоги натуральных нуклеотидов, которые обладают таким же свойством связываться, как референсная нуклеиновая кислота, и метаболизируется подобно естественным нуклеотидам. Если не указано иначе, конкретная нуклеотидная последовательность неявно включает также консервативные модифицированные варианты (например, замены кодонов на соответствующие вырожденные кодоны), аллели, ортологи, SNP и комплементарные последовательности, а также последовательность, указанную экплицитно. В частности, замены кодонов на соответствующие вырожденные кодоны могут быть достигнуты путем генерирования нуклеотидных последовательностей, в которых третье положение одного или более выбранных (или всех) кодона замещены смешанным основанием или остатками дезоксиинозина. Термин «нуклеиновая кислота» используется взаимозаменяемо с терминами ген, кДНК, мРНК короткие некодирующие РНК, микроРНК (miRNA), РНК, взаимодействующие по piwi типу, и короткие шпилечные РНК (shRNA), кодируемые геном или локусом.
Термин «ген» означает сегмент ДНК, участвующий в синтезе полипептидной цепочки. Он может иметь области, расположенные до или после кодирующей области (лидеры и трейлеры), а также промежуточные последовательности (интроны) между отдельными кодирующими последовательностями (экзоны). Термин «реакция», используемый в тексте, означает любой процесс химического, ферментативного или физического действия, который указывает на наличие или отсутствие конкретной целевой нуклеотидной последовательности. Примером реакции является амплификация, такая, как полимеразная цепная реакция (ПЦР), предпочтительно мультиплексная ПЦР. Другим примером реакции является секвенирующая реакция путем синтеза или лигирования. Под термином «клинически релевантная нуклеотидная последовательность» понимается полинуклеотидная последовательность, соответствующая сегменту более крупной геномной последовательности, потенциальный дисбаланс которой является предметом исследования, или сама более крупная геномная последовательность. Примеры клинически релевантной нуклеотидной последовательности включают хромосомы 18, 13, 21, X и Y, а также мутированные генетические последовательности или генетические полиморфизмы или изменение числа копий, которые плод может унаследовать от одного или обоих родителей. Термин «фоновая нуклеотидная последовательность» означает нуклеотидные последовательности, имеющие материнское происхождение или происходящие от хромосомы, которая не исследуется на анеуплоидию в конкретном анализе.
Термин «свободно плавающие ДНК» означает ДНК, которая происходит от геномной ДНК. Свободно плавающие ДНК фактически представляют собой распавшуюся геномную ДНК и находятся во внеклеточном пространстве. Свободно плавающие ДНК можно изолировать из биологических жидкостей организма (например, из сыворотки или плазмы крови, из слюны). Термин «количественные данные» означает данные, которые получены в одной или более реакции и имеют одно или более численное значение. Термин «параметр» означает численное значение, которое характеризует ряд качественных признаков и/или численное соотношение между количественные данными. Например, отношение (или функция отношения) между первым количеством первой нуклеотидной последовательности и вторым количеством второй нуклеотидной последовательности является параметром.
Термин «точка отсечения» означает численное значение, которое используют для разграничения между двумя или более состояниями (например, нормальным и патологическим) биологического образца. Например, если параметр превышает точку отсечения, состояние относят к одному классу (например, к болезни), а если параметр меньше точки отсечения, - то к другому классу (например, к нормальному состоянию).
Термин «дисбаланс» означает любое существенное отклонение, определяемое по меньшей мере по одной точке отсечения, количества клинически релевантной нуклеотидной последовательности от референсного количества.
Термин «хромосомная анеуплоидия», использованный в тексте, означает изменение количества хромосом относительно диплоидного генома. Изменение может проявиться как в увеличении числа хромосом, так и в уменьшении. Оно может затрагивать одну целую хромосому или область хромосомы. Примерами хромосомных анеуплоидий являются анеуплоидии 13-й, 18-й, 21-й, Х- и Y-хромосомы.
Термин «секвенирование случайным подходом», используемый в тексте, означает секвенирование, при котором фрагменты секвенированной нуклеиновой кислоты конкретно не идентифицированы или на них на нацеливались перед процедурой секвенирования. Специфические праймеры для нацеливания на конкретные генные локусы при секвенировании случайным подходом не требуются. Пул секвенированных нуклеиновых кислот варьируется от образца к образцу и даже от анализа к анализу для одного и того же образца. При секвенировании случайным подходом секвенированные нуклеиновые кислоты удается идентифицировать только после выхода продукта, в отличие от секвенирования нуклеотидных последовательностей, амплифицированных с помощью мультиплексной ПЦР.
В вариантах осуществления изобретения предлагаются способы, системы и аппараты, необходимые для того, чтобы установить, имеется ли, по сравнению с нормальным состоянием, увеличение или уменьшение (патология) клинически релевантной хромосомной области. Установить это можно, используя параметр количества клинически значимой хромосомной области по сравнению с другими хромосомными областями, не имеющими клинического значения (фоновые области), для данного биологического образца. Нуклеиновые кислоты, содержащиеся в биологическом образце, секвенируют, так что часть генома оказывается секвенированной, и по результатам секвенирования можно дать количественную оценку. Чтобы определить, имеются ли изменения по сравнению с референсным количеством (то есть дисбаланс), например, соотношения между количеством двух хромосомных областей (или набора хромосомных областей), выбирают одну или несколько точек отсечения.
Отклонение, выявленное в референсном количестве, может быть любым отклонением (в сторону увеличения или уменьшения) в соотношении между клинически релевантными нуклеотидными последовательностями и нуклеотидными последовательностями, не имеющими клинического значения. Таким образом, референсным состоянием может быть любое отношение или численное значение (например, иное, чем соответствие один в один), а отклонение, выявленное при количественном исследовании, может быть отношением или другим численным значением, которое отличается от референсного количества, если судить по одной или более точке отсечения.
Клинически релевантная хромосомная область (называемая также клинически релевантной нуклеотидной последовательностью или хромосомой или областью хромосомы, которая потенциально анеуплоидная) и фоновая нуклеотидная последовательность могут происходить от клеток первого типа и от одной или более клеток второго типа. Например, фетальные нуклеотидные последовательности, происходящие от клеток плода/плаценты, присутствуют в биологическом образце, например в плазме крови матери, в которой содержится фоновые нуклеотидные последовательности матери, происходящие от материнских клеток. Предпочтительно, чтобы фетальные нуклеотидные последовательности были производными свободноплавающей ДНК. В одном варианте осуществления изобретения точку отсечения определяют на основе по меньшей мере отчасти по процентной доле клеток первого типа в биологическом образце. Процентную долю фетальных нуклеотидных последовательностей в образце можно определить по любым фетальным локусам, не ограничиваясь измерением количества клинически значимых нуклеотидных последовательностей.
В другом варианте осуществления изобретения используются химические вещества, стабилизирующие клетки (например, клетки крови), при подготовке нуклеиновых кислот, содержащихся в биологическом образце, полученном от беременной женщины. В самом деле, одной из наиболее значительных технических трудностей при использовании свободно плавающих ДНК, содержащихся в материнской крови, является низкая доля фетальной ДНК в образце. Эта доля обычно составляет 10-20% в первом триместре беременности (в сроки 11-14 недель) и соответствует стадии, наиболее подходящей для выполнения анализа на анеуплоидию ДНК. Низкая доля фетальной ДНК затрудняет исследование даже в том случае, когда используются молекулярные методы количественной оценки, снижая их чувствительность и специфичность. Поэтому необходимо стремиться по возможности повысить отношение фетальной ДНК к свободной ДНК матери. В настоящем исследовании эта задача решается иначе.
В одном варианте осуществления изобретения разрыв ядер клеток крови предупреждают при получении биологического материала, его хранении и транспортировке, в частности крови матери до отделения от нее плазмы. Это важно для предупреждения разбавления фетальной ДНК, которое приводит к уменьшению отношения фетальной ДНК к свободно плавающей ДНК матери. В продаже имеются несколько типов пробирок для взятия крови, позволяющих стабилизировать клетки крови и хранить их в течение по меньшей мере 14 дней при комнатной температуре, что делает удобным взятие образца крови, его транспортировку и хранение (информация о них имеется, например, на сайте www.streck.com).
В другом варианте осуществления изобретения для подготовки нуклеиновых кислот матери и плода способом по изобретению применяют фракционирование по размеру молекул.
Действительно, из предшествующего уровня техники известно, что фетальная и материнская свободно плавающая ДНК имеют неодинаковое распределение по размеру. Остальная свободно плавающая ДНК обычно на 20 п.о. короче, чем материнская свободно плавающая ДНК, и этот факт можно использовать для дальнейшего обогащения фракции фетальной свободно плавающей ДНК, если эту небольшую фракцию специально отделить от материнской фракции. Сделать это можно, например, с помощью гель-электрофореза. В одном варианте осуществления изобретения для фракционирования по размеру молекул с помощью гель-электрофореза используется аппарат SageScience (www.sagescience.com). Он представляет собой полностью автоматизированную систему с возможностью выбора плотного распределения по размеру и высокой скоростью восстановления. Кроме того, он полностью устраняет риск перекрестного загрязнения, так как все образцы в течение всего процесса фракционирования по размеру отделены друг от друга.
В одном варианте осуществления изобретения амплифицированные нуклеотидные последовательности ДНК, полученные в количественной мультиплексной ПЦР по способам, предлагаемым в изобретении, имеют размеры от 80 до 140 пар оснований. В контексте распределения по размеру фетальной и материнской свободно плавающей ДНК важно, чтобы длина амплифицированных нуклеотидных последовательностей ДНК была меньше 140 п.о для обеспечения эффективной амплификации фракции более короткой фетальной свободно плавающей ДНК.
Предпочтительно, чтобы длина амплифицированных нуклеотидных последовательностей ДНК была в пределах 80-140 п.о.
В другом варианте осуществления изобретения длина амплифицированных нуклеотидных последовательностей ДНК, полученных в одиночной мультиплексной ПЦР соответствует диапазону 30-60 п.о.
В другом варианте осуществления изобретения длина амплифицированных нуклеотидных последовательностей ДНК, полученных в одиночной мультиплексной ПЦР, соответствует диапазону 60-80 п.о.
В другом варианте осуществления изобретения длина амплифицированных нуклеотидных последовательностей ДНК, полученных в одиночной мультиплексной ПЦР, соответствует диапазону 70-80 п.о.
Для работы способами по изобретению предпочтительно применять только количественную мультиплексную ПЦР.
В другом варианте осуществления изобретения содержание GC в таргетных нуклеотидных последовательностях ДНК (то есть последовательностях ДНК, которые амплифицированы с помощью количественной мультиплексной ПЦР) находится в диапазоне 30-70%. Наши данные, полученные в эксперименте, показывают, что для того, чтобы чувствительность и специфичность способов по изобретению была близка к 100%, содержание GC должно быть в пределах 40-60%.
Важным шагом при применении способов по изобретению является секвенирование амплифицированных целевых последовательностей ДНК. Поскольку каждым образцом в каждом цикле теоретически может быть получено большое количество прочтений последовательностей, которое составляет порядка сотен тысяч-миллионов или, возможно, сотен миллионов или даже миллиардов, фактическое количество прочтений последовательностей образует репрезентативный профиль смеси различных видов нуклеотидных последовательностей в исходном биологическом образце. Однако специалистам известно, сколько циклов необходимо выполнить с учетом стадии беременности (которая коррелирует с количеством свободно плавающей фетальной ДНК в биологическом образце) и типа биологического образца, полученного от беременной женщины. Особенно важно получить высокую степень статистической достоверности. Чтобы повысить степень статистической достоверности, предпочтительно выполнить большое число прочтений, предпочтительно от 10000 до 100000 или более в зависимости от процентной доли фетальной ДНК, содержащейся в смеси. В качестве меры статистической достоверности обычно используют 99% доверительный интервал, то есть значение р<0,01, при использовании в расчетах критерия χ2 или t.
В одном предпочтительном варианте осуществления изобретения использован способ массивного параллельного секвенирования. Массивное параллельное секвенирование, осуществляемое, например, по технологии компании Roche (платформа 454) (Margulies, M. et al. 2005 Nature 437, 376-380), Illumina Genome Analyzer (платформа Solexa), SOLiD System (Applied Biosystems) или технологии Helicos True Single Molecule DNA (Harris T D et al. 2008 Science, 320, 106-109), технологии одномолекулярного секвенирования в реальном времени SMRT™ (Pacific Biosciencies), нанопорового секвенирования (Soni G.V. and Meller A. 2007 Clin Chem 53: 1996-2001), позволяет секвенировать много молекул нуклеиновых кислот, изолированных из образца при мультиплексировании высоких порядков параллельных потоков. Каждая из упомянутых технологических платформ секвенирует клонально амплифицированные или даже не амплифицированные одиночные молекулы фрагментов нуклеиновых кислот.
Важным преимуществом ограниченного набора амплифицированных нуклеотидных последовательностей, которые генерируются способами по изобретению, является возможность использования появляющихся в настоящее время дешевых менее производительных массивных параллельных секвенаторов, таких, как платформа 454 Junior (Roche), PGM (Life Technologies) или MiSeq (Illumina). Комбинируя способы по изобретению и используя низкопроизводительные секвенаторы, можно уменьшить время производственного цикла одного анализа, так как цикл секвенирования в этих платформах длится лишь несколько часов. Кроме того, снижение стоимости исследования также является преимуществом способов по изобретению по сравнению с уже известными способами.
В одном варианте осуществления изобретения проанализированы результаты массивного параллельного секвенирования и подсчитана сумма числа прочтений для всех амплифицированных нуклеотидных последовательностей ДНК потенциально анеуплоидной хромосомы, (например, всех амплифицированных нуклеотидных последовательностей, происходящих от хромосомы 21 и/или хромосомы 13 и/или хромосомы 18 и/или Х- или Y-хромосомы), например, подсчитано сколько раз конкретная амплифицированная хромосомная последовательность присутствует в биологическом образце. Сумма числа прочтений для амплифицированных нуклеотидных последовательностей ДНК, принадлежащих к потенциально анеуплоидной хромосоме (например, хромосомы 13 или 18 или 21 или Х или Y) затем нормируют по сумме числа прочтений для амплифицированных нуклеотидных последовательностей ДНК референсной хромосомы (то есть, которая не является анэуплоидной). Таким образом, мультиплексная ПЦР позволяет рассчитать показатель дозы путем сравнения отношения (число прочтений целевой области, то есть потенциально анеуплоидной хромосомы или хромосомной области)/(число прочтений контрольной области, то есть референсной хромосомы или хромосомной области), определенного для матери и для плода. Зависимость показателя дозы от процентной доли фетальной ДНК приведена на фиг. 1.
Существенным элементом способов по изобретению является то, что амплифицированные таргетные (целевые) нуклеотидные последовательности ДНК отражают идентичные отношения количества материнских и фетальных свободно плавающих нуклеиновых кислот в биологическом образце и, следовательно, эти способы требуют количественной амплификации. Основываясь мультиплексной РЦР и условиях ПЦР, используемых для амплификации образцов (ограниченное количество циклов), мы ранее показали, что матричная ДНК амплифицирована количественно16. Если распределение между числом прочтений в этих случаях нормальное, то определяют количественную оценку (например, Z-показатель или показатель дозы). Z-показатель, равный 1 означает, что подозреваемая хромосома не анеуплоидпа. Значение показателя Z выше 1, предпочтительно выше 2, еще предпочтительнее выше 3 свидетельствует об анеуплоидии хромосомы. Понятно, что показатель Z определяют для всех потенциально анеуплоидных хромосом, для которых способом по изобретению получен таргетный набор нуклеотидных последовательностей ДНК. Нормирование показателя Z и расчет его осуществляются с помощью статистических методов. Подходящие статистические методы, которые можно использовать в контексте настоящего изобретения, включают методы байесовского типа оценки вероятности, последовательный критерий отношения вероятностей (SPRT), определение доли ложных отклонений гипотез, доверительный интервал и ROC-анализ.
В другом варианте осуществления изобретения результаты массивного параллельного секвенирования амплифицированных таргетных нуклеотидных последовательностей ДНК проанализированы путем определения аллельных отношений информативных SNP, причем отклонение отношения указывает на фетальную хромосомную анеуплоидию. Аллельное отношение для информативных SNP на анеуплоидной хромосоме отклоняется от нормального. Это отклонение можно измерить, если мать гетерозиготна по данному SNP (который в тексте называется информативным SNP). Таким образом, анализ полинуклеотидных последовательностей при исследовании способом MASTR (мультиплексная амплификация специфических мишеней для ресеквенирования) позволяет получить ряд информативных SNP, которые можно использовать для определения плоидности плода наряду с определением плоидности путем подсчета молекул, как описано выше. На фиг. 2 показан результат подсчета количества информативных SNP с вероятностью 99% при частоте минорного аллеля (MAF) соответствующей диапазону 0,25-0,50. На основании такого подсчета, который приведен на фиг. 2, видно, что при минимальной частоте минорного аллеля 0,25 имеется по меньшей мере 7 информативных SNP в наборе из 35 амплифицированных таргетных нуклеотидных последовательностей ДНК, а при частоте минорного аллеля, равной 0,50, таких информативных SNP-10.
В другом варианте осуществления изобретения результаты массивного параллельного секвенирования амплифицированных таргетных нуклеотидных последовательностей ДНК проанализированы путем определения аллельных отношений информативных SNP, при этом рассчитано отклонение этого отношения, указывающее на хромосомную анеуплоидию у плода, в сочетании с суммой числа прочтений для всех амплифицированных нуклеотидных последовательностей потенциально анеуплоидной хромосомы, например, всех амплифицированных нуклеотидных последовательностей ДНК, относящихся к хромосоме 21 и/или хромосоме 13 и/или хромосоме 18 и/или X- и/или Y-хромосоме (то есть сколько раз конкретная амплифицированная хромосомная нуклеотидная последовательность присутствует в биологическом образце).
В другом варианте осуществления изобретения с помощью способов по изобретению определяли, имеется ли у плода хромосомная анеуплоидия по одной или более анеуплоидным хромосомам. В еще одном варианте осуществления изобретения оценка результата теста является дихотомической «положительный-отрицательный». В другом варианте осуществления изобретения она может быть неопределенной, а в еще одном варианте осуществления интерпретация результата теста осуществляется в более поздние сроки, например врачом.
В предпочтительных вариантах осуществления изобретения биоинформационный, вычислительный и статистический подходы использованные для того, чтобы выяснить, является ли плод у женщины анеуплоидным по хромосоме или хромосомной области или он эуплоидный, были реализованы в компьютерной программе, использованной для определения параметров по выходу продукта секвенирования. Компьютерная программа помогает определить численное значение по хромосоме, подозрительной на анеуплоидию, а также количество по одной или более других хромосом. Параметр определяют и сравнивают с подходящим значением точки отсечения, чтобы выяснить имеется ли у плода анеуплоидия по хромосоме, с подозрением на анеуплоидию.
В еще одном варианте осуществления изобретения предлагается диагностический набор для анализа способом по изобретению. Такой диагностический набор включает по меньшей мере набор праймеров для амплификации таргетных материнских и таргетных фетальных нуклеотидных последовательностей, отличающихся тем, что эти таргетные нуклеотидные последовательности принадлежат хромосоме 13 и/или хромосоме 18 и/или хромосоме 21 и/или Х- и/или Y-хромосоме. Предпочтительно, чтобы диагностический набор включал праймеры для амплификации таргетных нуклеиновых кислот, принадлежащих хромосоме 13, 18, 21, X и Y. Кроме того, диагностический набор содержит набор праймеров, с помощью которых можно идентифицировать таргетные нуклеотидные последовательности ДНК референсной хромосомы или части референсной хромосомы. Понятно, что такая референсная хромосома или ее часть является эуплоидной хромосомой. Эуплоидный означает, что количество хромосом нормальное. Из других реагентов, которые могут быть при необходимости включены в диагностический набор, можно отметить инструкции, полимеразы и буферные растворы для выполнения количественной мультиплексной ПЦР.
Примеры
Примеры, приведенные далее, поясняют изобретение, но ими не ограничиваются положения, вынесенные в формулу изобретения. 1. Пренатальная диагностика трисомии 21 у плода Образцы ДНК, использованные в этих примерах представляют собой образцы, приготовленные путем смешивания образца диплоидной ДНК, полученного от женщины (использован в качестве материнской ДНК), с образцом ДНК, полученным от мужчины с эуплоидной 21-й хромосомой (он назван здесь как образец при искусственной эуплоидной беременности - ИЭП) или образцом ДНК мужчины, триплоидного по 21-й хромосоме (далее ИТС - искусственная трисомическая беременность). Каждый искусственный образец содержал смесь из 80% материнской ДНК и 20% мужской ДНК. Кроме того, в анализ был включен образец ДНК, полученный от больного с синдромом Дауна, у которого кариотип содержит три копии хромосомы 21.
Измерение выполнено в 4 образцах ИЭП, 2 образцах ИТС и 1 образце, полученном от больного с синдромом Дауна. Для каждого измерения использовали примерно 50 нг ДНК в стандартном двухэтапном исследовании способом MASTR (см. Материал и методы). Исследование фетальной хромосомы 21 по способу MASTR включает 20 пар праймеров, полученных для хромосомы 21 и 10 пар праймеров, полученных для хромосомы 18. Полученные ампликоны от каждого образца ДНК, исследованного по способу MASTR, содержали специальный «штрихкод». Полученные ампликоны каждого образца ДНК, снабженные штрихкодом, смешивали в эквимолярном соотношении и подвергали эмульсионной ПЦР на платформе 454 Junior по методике, описанной в инструкции производителя. После выполнения эмульсионной ПЦР бусинки изолировали и загружали в платформу 454 Junior в соответствии с протоколом производителя. Всего проведено 2 раунда исследования на платформе 454 Junior, чтобы получить достаточное число прочтений для достижения 300-500 на один ампликон.
Поскольку при синдроме Дауна в кариотипе содержится 3 копии хромосомы 21, то она даст на 50% больше прочтений хромосомы 21, чем образцы ИЭП. Для того чтобы подсчитать это, выполнены следующие действия с образцом от больного с синдромом Дауна и образцом ИЭП:
(i) Количество прочтений для каждого ампликона хромосомы 18 и 21 делили на общее количество прочтений по хромосоме 18
(ii) Для каждого ампликона хромосомы 18 и 21 подсчитывали среднее число прочтений различных образцов ИЭП
(iii) Для каждого ампликона хромосомы 18 и 21 (i) делили на (ii)
(iv) Для каждой хромосомы и каждого образца подсчитывали среднее значение (iii)
(v) Рассчитывали нормированное отношение хромосома 21/хромосома 18 путем деления среднего значения подсчитанного в (iv) на ИЭП и ИТС
На фиг. 3 показан график фактического (рассчитанного, как показано выше) и ожидаемого (то есть теоретические значения) числа прочтений по ампликонам хромосомы 21 образца больного с синдромом Дауна.
Приведенные данные говорят о том, что имеются четкие различия между нормальным эуплоидным образом ДНК и образцом ДНК с трисомией (то есть при синдроме Дауна) по хромосоме 21.
Для оценки возможности различить эуплоидный образец (представленный образцами ИЭП) от образца искусственной анеуплоидии по хромосоме 21, содержащем 20% ДНК, принадлежащей трисомической хромосоме 21, выполнены приведенные выше расчеты с ИТС образцом относительно ИЭП образцов.
Наличие 20% трисомической ДНК в образце ИТС обусловливает повышение числа прочтений ампликона хромосомы 21 на 10% по сравнению с образцами ИЭП. Действительно, на фиг. 4, на основании приведенных выше расчетов, отчетливо видна разница между образцами ИЭП и ИТС, отражающая примерно 10% повышение хромосомы 21 в двух образцах ИТС.
Материал и методы
1. Последовательности праймеров, использованные в примерах

2. Принцип исследования способом MASTR
Пары праймеров были сначала проверены с помощью простой ПЦР, для которой брали 20 нг геномной ДНК, используя 10 пмоль на один праймер; другие параметры были равны параметрам мультиплексной ПЦР. Мультиплексные ПЦР выполняли с 50 нг геномной ДНК в 25 мл реакционной смеси, содержащей буфер для ПЦР Titanium™Taq (Clontech, Palo Alto, CA), с конечной концентрацией в 25 мкмоль для каждого dNTP (Invitrogen, Carlsbad CA) и в общей сложности 02125 мл Titanium™Taq ДНК-полимеразы (Clontech). Концентрации праймера оптимизировали и варьировали от 0,05 пмоль/мл до 0,2 пмоль/мл окончательной концентрации.
Финальную мультиплексную ПЦР (по способу MASTR) выполняли для амплификации всех образцов ДНК. Первую ПЦР выполняли с 50 нг ДНК при следующих условиях: начальная денатурация образца 10 мин при 95°С за которой следовали 20 циклов, каждый из которых включал: 45 с при 95°С, 45 с при 60° и 2 мин при 68°С, которые завершались финальным этапом амплификации 10 мин при 72°С (см. фиг. 5).
Полученные в ПЦР фрагменты разводили в 1000 раз, после чего выполняли второй этап ПЦР, чтобы встроить индивидуальный штриховой код. Условия проведения ПЦР на этом этапе такие же, как на первом этапе ПЦР (см. фиг. 6).
Полученные ампликоны со штриховым кодом в эквимолярном отношении смешивали и использовали в эмульсионной ПЦР, как описано производителем (Roche diagnostics).
Литература
1 Lo Y, Corbetta N, Chamberlain P, Rai V, Sargent I, Redman C, and Wainscoat J (1997) Presence of fetal DNA in maternal plasma and serum. The Lancet 350: 485-487
2 Poon L, Leung T, Lau T, Lo Y (2000) Presence of fetal RNA in maternal plasma. Clin Chem 46: 1832-1834
3 Ng E, Tsui N, Lau T, Leung T, Chiu R, Panesar N, et al. (2003) mRNA of placental origin is readily detectable in maternal plasma. PNAS 100: 4748-4753
4 Lo Y, Tsui N, Chiu R, Lau T, Leung T, Heung M, et al. (2007) Plasma placental RNA allelic ratio permits noninvasive prenatal chromosomal aneuploidy detection. Nat Med 13: 218-23
5 Tsui N,2, Wong В, Leung T, Lau T, Chiu R and Lo Y (2009) Non-invasive prenatal detection of fetal trisomy 18 by RNA-SNP allelic ratio analysis using maternal plasma SERPINB2 mRNA: a feasibility study. Prenat Diagn 29: 1031-1037
6 Yang Y, Ding J, Lee M, Loria O, Mohsenian F, Tang M, et al. (2008) Identification of mRNA-SNP markers for a noninvasive prenatal trisomy 21 (T21) test. Prenat Diagn 2008: 28-S12
7 Chim S, Tong Y, Chiu R, Lau T, Leung T, Chan L, et al. (2005) Detection of the placental epigenetic signature of the maspingene in maternal plasma. PNAS 102: 14753-14758
8 Chan К, Ding С, Gerovassili A, Yeung S, Chiu R, Leung T et al. (2006) HypermethylatedRASSF1A in Maternal Plasma: A Universal Fetal DNA Marker that Improves the Reliability of Noninvasive Prenatal Diagnosis. Clin Chem 52: 2211-2218
9 Lo D, Chan A, Sun H, Chen E, Jiang P, Lun F et al. (2010) Maternal Plasma DNA Sequencing Reveals the Genome-Wide Genetic and Mutational Profile of the Fetus. SciTransI Med 2: 6
10 Dhallan R, Guo X, Emche S, Damewood M, BaylissP, Cronin M et al. (2007) A noninvasive test for prenatal diagnosis based on fetal DNA present in maternal blood: a preliminary study. Lancet 369: 474-481
11 Lo D, Lun F, Chan A, Tsui Y, Chong C, Lau T, et al. (2007) Digital PCR for the molecular detection of fetal chromosomal aneuploidy. PNAS 104: 13116-131121
12 Ehrich M, Deciu C, Zwiefelhofer T; Tynan J, Cagasan L, Tim R et al. (2011) Noninvasive detection of fetal trisomy 21 by sequencing of DNA in maternal blood: a study in a clinical setting. Am J ObstetGynecol 204: 205.el-11
13 Sehnert A, Rhees B, Comstock D, de Feo E, Heiiek G,1 Burke J and Raval P (2011) Optimal Detection of Fetal Chromosomal Abnormalities by Massively Parallel DNA Sequencing of Cell-Free Fetal DNA from Maternal Blood. ClinChem 57: 1042-1047
14 Chen E, Chiu R, Sun H, Akolekar R, Chan A, Leung Т et al. (2011) Noninvasive Prenatal Diagnosis of Fetal Trisomy 18 and Trisomy 13 by Maternal Plasma DNA Sequencing. PLoS ONE 6: e21791
15 Liao G, Lun F, Zheng Y, Chan A, Leung T, Lau Т et al. (2011) Targeted Massively Parallel Sequencing of Maternal Plasma DNA Permits Efficient and Unbiased Detection of Fetal Alleles. Clin Chem 57: 92-101.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения кариотипа плода беременной женщины на основании секвенирования гибридных прочтений, состоящих из коротких фрагментов внеклеточной ДНК | 2019 |
|
RU2717023C1 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ВЫСОКОМУЛЬТИПЛЕКСНОЙ ПЦР | 2012 |
|
RU2650790C2 |
| СПОСОБЫ НЕИНВАЗИВНОГО ПРЕНАТАЛЬНОГО УСТАНОВЛЕНИЯ ПЛОИДНОСТИ | 2011 |
|
RU2671980C2 |
| НЕИНВАЗИВНОЕ ОБНАРУЖЕНИЕ ГЕНЕТИЧЕСКОЙ АНОМАЛИИ ПЛОДА | 2011 |
|
RU2589681C2 |
| ОБНАРУЖЕНИЕ МУТАЦИЙ И ПЛОИДНОСТИ В ХРОМОСОМНЫХ СЕГМЕНТАХ | 2015 |
|
RU2717641C2 |
| СПОСОБ НЕИНВАЗИВНОЙ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ АНЕУПЛОИДИЙ ПЛОДА | 2014 |
|
RU2583830C2 |
| СПОСОБ НЕИНВАЗИВНОЙ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ АНЕУПЛОИДИЙ ПЛОДА | 2015 |
|
RU2627673C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ИСТОЧНИКА АНЕУПЛОИДНЫХ КЛЕТОК ПО КРОВИ БЕРЕМЕННОЙ ЖЕНЩИНЫ | 2016 |
|
RU2674700C2 |
| Способ неинвазивного пренатального скрининга анеуплоидий плода | 2019 |
|
RU2712175C1 |
| Способ неинвазивного пренатального выявления эмбриональной хромосомной анеуплоидии по материнской крови | 2016 |
|
RU2744604C2 |
Изобретение относится к области пренатальной диагностики. Предложен способ выявления фетальной хромосомной анеуплоидии у беременной женщины. Способ включает получение свободно плавающей ДНК из биологического образца, амплификацию выбранного набора таргетных последовательностей ДНК в количественной мультиплексной ПЦР, где амплифицированная нуклеотидная последовательность ДНК содержит SNP, по которому женщина гетерозиготна, секвенирование амплифицированных таргетных последовательностей ДНК, и подсчет суммарного количества прочтений для всех амплифицированных последовательностей принадлежащей потенциально анеуплоидной хромосоме ДНК, нормирование количества по сумме числа прочтений для всех амплифицированных последовательностей ДНК референсной эуплоидной хромосомы для определения с помощью статистического анализа Z-показателя и/или определения соотношения аллелей информативных SNP. Причем Z-показатель и нарушенное соотношение аллелей позволяют судить о наличии хромосомной анеуплоидии у плода. Изобретение обеспечивает сокращение времени получения результата, возможность обнаружения присутствия анеуплоидии на более ранних стадиях беременности, а также в содержащих более низкий процент фетальной ДНК образцах. 9 з.п. ф-лы, 6 ил., 1 табл., 2 пр.
1. Способ выявления фетальной хромосомной анеуплоидии у беременной женщины, включающий
(i) получение свободно плавающей ДНК из биологического образца, взятого у беременной женщины,
(ii) амплификацию выбранного набора таргетных последовательностей ДНК из одной или нескольких хромосом, которые предположительно могут быть анеуплоидными, и амплификацию выбранного набора таргетных последовательностей ДНК из одной или нескольких хромосом, которые предположительно являются эуплоидными в по меньшей мере одной количественной мультиплексной ПЦР, где по меньшей мере одна амплифицированная нуклеотидная последовательность ДНК содержит по меньшей мере один SNP, по которому женщина гетерозиготна, где амплифицированные последовательности ДНК имеют длину менее 140 пар оснований,
(iii) секвенирование амплифицированных таргетных последовательностей ДНК и
(iv) подсчет суммарного количества прочтений для всех амплифицированных последовательностей ДНК, принадлежащей потенциально анеуплоидной хромосоме, и нормирование этого количества по сумме числа прочтений для всех амплифицированных последовательностей ДНК референсной эуплоидной хромосомы для определения с помощью статистического анализа Z-показателя, позволяющего судить о наличии хромосомной анеуплоидии у плода, и/или определения соотношения аллелей информативных SNP, где нарушенное соотношение аллелей указывает на наличие хромосомной анеуплоидии у плода исследуемой женщины,
где указанная фетальная хромосомная анеуплоидия исследуется у хромосомы 13, и/или хромосомы 18, и/или хромосомы 21, и/или хромосомы X, и/или хромосомы Y.
2. Способ по п. 1, отличающийся тем, что упомянутый биологический образец является взятой у матери кровью, плазмой, мочой, цереброспинальной жидкостью, сывороткой, слюной или смывом из канала шейки матки.
3. Способ по п. 1, отличающийся тем, что при получении указанной свободно плавающей ДНК используют химические вещества для стабилизации клеток.
4. Способ по п. 1, отличающийся тем, что содержание GC в таргетных нуклеотидных последовательностях ДНК соответствует 20-70%.
5. Способ по п. 1, отличающийся тем, что для получения свободно плавающей ДНК матери и плода прибегают к фракционированию по размеру.
6. Способ по любому из пп. 1-5, отличающийся тем, что амплифицированные нуклеотидные последовательности ДНК получены в одной реакции ПЦР.
7. Способ по п. 6, отличающийся тем, что при упомянутой одной мультиплексной ПЦР получают более 40 амплифицированных нуклеотидных последовательностей ДНК.
8. Способ по п. 6, отличающийся тем, что при упомянутой одной мультиплексной ПЦР получают более 60 амплифицированных нуклеотидных последовательностей ДНК.
9. Способ по любому из пп. 1-5, 7, 8, где статистические анализы используют, чтобы рассчитать количественный показатель, выбранный из байесовского типа оценки вероятности, последовательный критерий отношения вероятностей (SPRT), определение доли ложных отклонений гипотез, доверительный интервал и ROC-анализ.
10. Способ по п. 6, где статистические анализы используют, чтобы рассчитать количественный показатель, выбранный из байесовского типа оценки вероятности, последовательный критерий отношения вероятностей (SPRT), определение доли ложных отклонений гипотез, доверительный интервал и ROC-анализ.
| WO 2007147074 A2, 21.12.2007 | |||
| Y M DENNIS LO et al., Plasma placental RNA allelic ratio permits noninvasive prenatal chromosomal aneuploidy detection, Nature Medcine, vol.13, no.2, 07.01.2007, стр | |||
| Прибор для измерения силы звука | 1920 |
|
SU218A1 |
| WO 2007147079 A2, 21.12.2007 | |||
| ОПРЕДЕЛЕНИЕ ХРОМОСОМНЫХ АНОМАЛИЙ В КЛЕТКАХ, ПОЛУЧЕННЫХ ИЗ ФОЛЛИКУЛЯРНОЙ ЖИДКОСТИ | 2005 |
|
RU2395584C2 |
Авторы
Даты
2017-12-13—Публикация
2012-10-18—Подача