Изобретение относится к области органической и медицинской химии, а именно: к способу получения соединений класса гетероциклических систем - производных 1H-пиразоло[3,4-d]пиримидина общей формулы I, которые могут быть использованы для синтеза новых гетероциклических соединений и в медицине в качестве потенциального противомикробного средства.
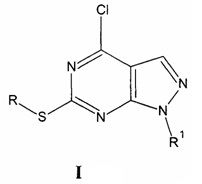 , где:
, где:
R= СН3, R1=C(O)NH2 (Ia - 4-хлоро-6-(метилтио)-1H-пиразоло[3,4-d]пиримидин-1-карбоксамид);
R= СН3, R1=C(NH)NH2 (Iб - 4-хлоро-6-(метилтио)-1H-пиразоло[3,4-d]пиримидин-1-карбоксимидамид);
R= нафтилметил, R1=C(O)NH2 (Iв - 4-хлоро-6-[(1-нафтилметил)тио]-1H-пиразоло[3,4-d]пиримидин-1-карбоксамид);
R= нафтилметил, R1=C(NH)NH2 (Iг - 4-хлоро-6-[(1-нафтилметил)тио]-1H-пиразоло[3,4-d]пиримидин-1-карбоксимидамид).
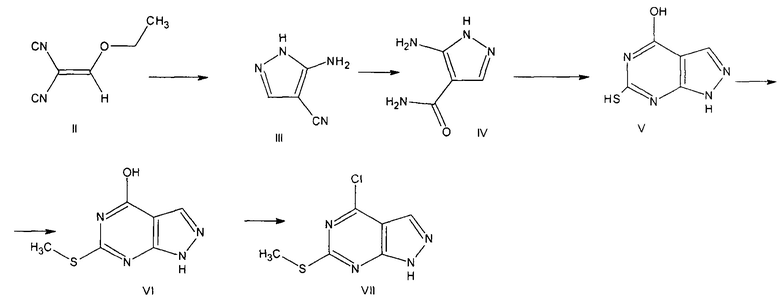
Описан 4-хлор-6-метилмеркаптопиразоло[3,4-d] пиримидина VII, который получают путем последовательных превращений, исходным соединением для синтеза которого является этоксиметиленмалононитрил II [Eur. Journal of Med. Chem., 38(2003), 525-532]. Этоксиметиленмалононитрил II циклизуется при обработке гидразингидратом, при этом полученный 3-амино-4-цианопиразол III превращают в 3-амино-4-пиразолокарбоксамид гидросульфат в результате гидролиза нитрильной группы в присутствии 95% серной кислоты. Продукт гидролиза (5-аминопиразоло-4-карбоксамид IV) взаимодействует с тиомочевиной с 70% выходом, при этом был получен пиразолопиримидин V. Далее проводят S-алкилирование йодистым метилом с количественным выходом. Имеющуюся в молекуле приведенного соединения VI гидроксигруппу хлорируют в присутствии хлорокисифосфора.
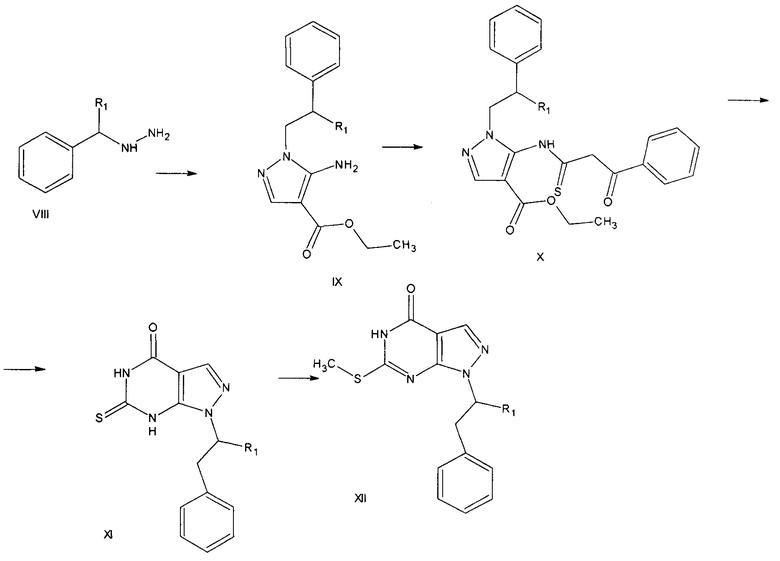
В соответствии с данными литературных источников (Bioorganic & Medicinal Chemistry Letters 21, 2011, 5928-5933) соответствующий пиразолопиримидин XII получают из замещенного пиразола, который в свою очередь получают из 2-(фенилэтил)гидразина VIII (R1 =Н) или 2-(фенилпропил) гидразина (R1 =СН3) путем взаимодействия с этил(этоксиметилен)цианоацетатом. Далее пиразол X обрабатывают бензоилизоцианатом и кипятят в безводном тетрагидрофуране в течение 12 ч. Конденсированный пиразоло[3.4-d]пиримидин XI алкилируют по атому серы.
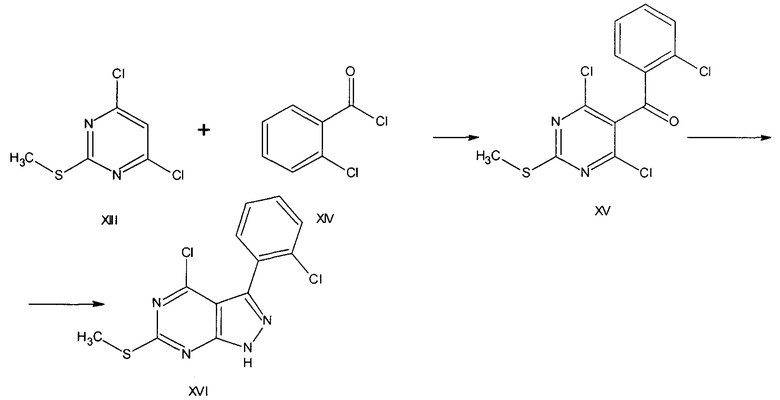
Пиразоло[3.4-d]пиримидины XVI могут быть получены из замещенных тиопиримидинов XII с последующим взаимодействием полученного кетона XV гидразингидратом в присутствии тетрагидрофурана [Organic Letters, 2008, V.10, №12, 2497-2500].
Из патентной и научно-технической литературы не выявлены ни способы получения новых, заявляемых авторами соединений, ни сама структура.
Задачей, предлагаемой группы изобретений является создание новых неописанных в литературе соединений - производных 1H-пиразоло[3,4-d]пиримидина (I).
Техническими результатами, на решение которых направлена группа изобретений, являются получение новых гетероциклических соединений формулы I, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в медицине, например, в качестве антимикробного средства; разработка простого способа их получения с высоким выходом продукта.
Поставленная задача осуществляется путем взаимодействия 4,6-дихлор-2-S-(замещенного)пиримидина-5-карбальдегида (XVII, XVIII), растворенного в тетрагидрофуране (THF) с добавлением расчетного количества производного гидразина (XIX, XX) и триэтиламина (TEA) в мольном соотношении 1:1:2, смесь перемешивают на магнитной мешалке в течение 12 часов при комнатной температуре. Полученный осадок заливают водой и перемешивают при комнатной температуре в течение 3 часов. Перерожденный осадок фильтруют по схеме:
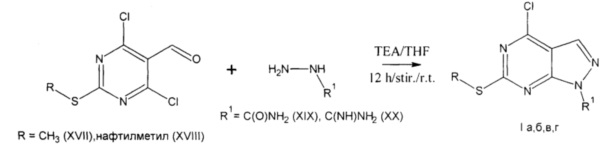
Способ получения производных 1H-пиразоло[3,4-d]пиримидина (I а-г) изучен и проведен в лабораторных условиях на стандартном товарном сырье.
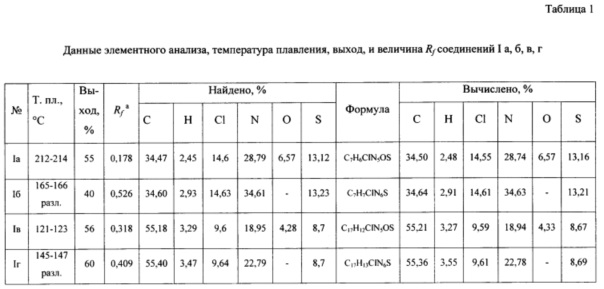
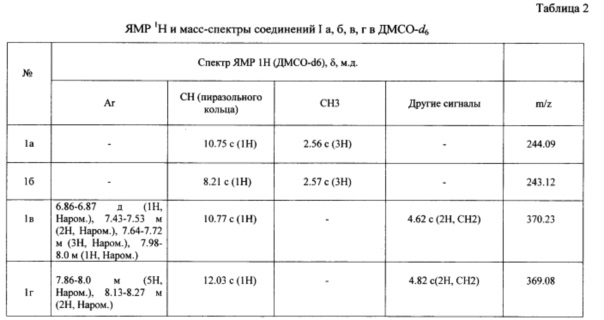
Данные элементного анализа, выход продукта реакции, температура плавления и величина Rf приведены в табл. 1, спектральные характеристики полученного соединения приведены в табл. 2.
Пример 1. Получение 4-хлоро-6-(метилтио)-1H-пиразоло[3,4-d]пиримидин-1-карбоксамида (Iа).
В плоскодонную колбу емкостью 50 мл загружают 5,0 г (0,0224 моль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 30 мл тетрагидрофурана, а затем добавляют 2,5 г (0,0224 моль) гидразинкарбоксамида гидрохлорида и 6,2 мл триэтиламина (0,0448 ммоль).
Реакционную смесь перемешивают в течение 12 часов при комнатной температуре, выпадает осадок белого цвета. Реакционную массу заливают 30 мл воды и перемешивают в течение 3 часов. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок светло-желтого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт серого цвета составляет 3,0 г, 55% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 212-214°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10), Rf = 0,178. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C7H6ClN5OS. Найдено %: С - 34,47, Н - 2,45, Cl - 14,6, N - 28,79, О - 6,57, S - 13,12. Вычислено %: С - 34,50, Н - 2,48, Cl - 14,55, N - 28,74, О - 6,57, S - 13,16.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов метальной группы (δ 2.56 с) и сигналы протона пиразольного кольца δ 10.75 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=244.09).
Пример 2. Получение 4-хлоро-6-(метилтио)-1H-пиразоло[3,4-d]пиримидин-1-карбоксимидамида (Iб).
В плоскодонную колбу емкостью 50 мл загружают 5,0 г (0,0224 моль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 30 мл тетрагидрофурана, а затем добавляют 3,86 г (0,0224 моль) гидразинкарбоксимидамида сернокислого и 6,2 мл триэтиламина (0,0448 ммоль).
Реакционную смесь перемешивают в течение 12 часов при комнатной температуре, выпадает осадок белого цвета. Реакционную массу заливают 30 мл воды и перемешивают в течение 3 часов. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок бежевого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт серого цвета составляет 2,18 г, 40% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура разложения 165-166°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10). Rf = 0,526. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C7H7ClN6S. Найдено %: С - 34,60, Н - 2,93, Cl - 14,63, N - 34,61, S - 13,23. Вычислено %: С - 34,64, Н - 2,91, Cl - 14,61, N - 34,63, S - 13,21.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов метальной группы (δ 2.57 с) и сигналы протона пиразольного кольца δ 8.21 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=243.12).
Пример 3. Получение 4-хлоро-6-[(1-нафтилметил)тио]-1H-пиразоло[3,4-d]пиримидин-1-карбоксамида (1в).
В плоскодонную колбу емкостью 50 мл загружают 5,0 г (0,0143 моль) 4,6-дихлор-2-[(1-нафтилметил)тио]пиримидин-5-карбальдегида и 30 мл тетрагидрофурана, а затем добавляют 1,60 г (0,0143 моль) гидразинкарбоксамида гидрохлорида и 3,98 мл триэтиламина (0,0286 ммоль).
Реакционную смесь перемешивают в течение 12 часов при комнатной температуре, выпадает осадок белого цвета. Реакционную массу заливают 30 мл воды и перемешивают в течение 3 часов. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок серого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт серого цвета составляет 2,97 г, 56% от теоретического из расчета на 4,6-дихлор-2-[(1-нафтилметил)тио]пиримидин-5-карбальдегида. Температура плавления 121-123°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10). Rf = 0,318. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C17H12ClN5OS. Найдено %: С - 55,18, Н - 3,29, Cl - 9,6, N - 18,95, О - 4,28, S - 8,7. Вычислено %: С - 55,21, Н - 3,27, Cl - 9,59, N - 18,94, О - 4,33, S - 8,67.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов метиленовой группы (δ 4.62 с), сигналы протонов нафталинового кольца: δ 6.86-6.87 д (1Н, Наром.), 7.43-7.53 м (2Н, Наром.), 7.64-7.72 м (3Н, Наром.), 7.98-8.0 м (1Н, Наром.) и сигнал протона пиразольного кольца (δ 10.77 с). Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=370.23).
Пример 4. Получение 4-хлоро-6-[(1-нафтилметил)тио]-1H-пиразоло[3,4-d]пиримидин-1-карбоксимидамида (Iг).
В плоскодонную колбу емкостью 50 мл загружают 5,0 г (0,0143 моль) 4,6-дихлор-2-[(1-нафтилметил)тио]пиримидин-5-карбальдегида и 30 мл тетрагидрофурана, а затем добавляют 2,46 г (0,0143 моль) гидразинкарбоксимидамида сернокислого и 3,98 мл триэтиламина (0,0286 ммоль).
Реакционную смесь перемешивают в течение 12 часов при комнатной температуре, выпадает осадок белого цвета. Реакционную массу заливают 30 мл воды и перемешивают в течение 3 часов. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок серого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт серого цвета составляет 3,16 г, 60% от теоретического из расчета на 4,6-дихлор-2-[(1-нафтилметил)тио]пиримидин-5-карбальдегида. Температура разложения 145-147°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10). Rf = 0,409. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C17H13ClN6S. Найдено %: С - 55,40, Н - 3,47, Cl - 9,64 N - 22,79, S - 8,7. Вычислено %: С - 55,36, Н - 3,55, Cl - 9,61 N - 22,78, S - 8,69.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов метиленовой группы (δ 4.82 с), сигналы протонов нафталинового кольца: δ 7.86-8.0 м (5Н, Наром.), 8.13-8.27 м (2Н, Наром.) и сигнал протона пиразольного кольца (δ 12.03 с). Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=369.08).
Пример 5. Соединение I а, б, в, г обладают противомикробной активностью. Определение минимально ингибирующих концентраций (МИК) проводили методом серийных разведений в мясопептонном бульоне в отношении тест-культур микроорганизмов Escherichia coli (штамм 1257), Candida albicans (штамм АТСС 885-635), рекомендованных Государственной Фармакопеей [Государственная Фармакопея СССР. Вып. 2. Общие методы анализа. Лекарственное растительное сырье / МЗ СССР - 11 изд. доп. - М: Медицина, 1989. 400 с.]. Исследуемые соединения ограниченно растворяются в воде, поэтому в качестве растворителя использовали 20% раствор ДМСО, не подавляющий роста ни одной из использованных тест-культур в условиях эксперимента. Минимальная ингибирующая концентрация соединения Iа на Е.coli и С. albicans составляет 64 и 16 мкг/мл соответственно, соединения Iб на Е.coli и С. albicans составляет 500 и 32 мкг/мл соответственно, соединения Iв на Е.coli и С. albicans составляет 125 и 16 мкг/мл соответственно, соединения Iг на Е.coli и С. albicans составляет 64 и 12,5 мкг/мл соответственно, соединения, что находится немного ниже уровня широко используемого на практике антибиотика (офлоксацин - 16 мкг/мл и стрептомицина 12,5 мкг/мл).
Полученные новые соединения - 1H-пиразоло[3,4-d]пиримидины (I а, б, в, г) могут быть использованы для синтеза новых гетероциклических соединений и в медицине в качестве потенциального антимикробного средства; разработан простой способ их синтеза.
| название | год | авторы | номер документа |
|---|---|---|---|
| 1-Бензоилзамещенные-6-(метилтио)-4-хлор-1Н-пиразоло[3,4-d]пиримидины и способ их получения | 2019 |
|
RU2709018C1 |
| 2-Арил-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидины и способ их получения | 2019 |
|
RU2708892C1 |
| ПИРАЗОЛОПИРИМИДИНЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1993 |
|
RU2124016C1 |
| Способ получения производных 2-арил(гетарил)-7-метил-1,2,3,4-тетрагидропиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-она | 2016 |
|
RU2634351C1 |
| ПРОИЗВОДНЫЕ АРИЛСУЛЬФОНАМИДА ИЛИ ИХ СОЛИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ АНГИОПРОТЕКТОРНОЕ, АНТИГИПЕРТЕНЗИВНОЕ И ВАЗОСПАЗМОЛИТИЧЕСКОЕ, В ЧАСТНОСТИ ПРОТИВОИШЕМИЧЕСКОЕ, ДЕЙСТВИЕ | 1992 |
|
RU2083567C1 |
| ЛИГАНДЫ РЕЦЕПТОРОВ ЭСТРОГЕНА | 2012 |
|
RU2620375C9 |
| ИНГИБИТОРЫ СЕРИН/ТРЕОНИНОВЫХ КИНАЗ | 2013 |
|
RU2650501C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617988C2 |
| ТРИАЗИНОВЫЕ, ПИРИМИДИНОВЫЕ И ПИРИДИНОВЫЕ АНАЛОГИ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ И ДИАГНОСТИЧЕСКИХ ПРОБ | 2009 |
|
RU2537945C2 |
| БИЦИКЛИЧЕСКИЕ АГОНИСТЫ СТИМУЛЯТОРА ГЕНОВ ИНТЕРФЕРОНА STING | 2020 |
|
RU2800072C1 |
Изобретение относится к области органической и медицинской химии, а именно, к новым производным 1H-пиразоло[3,4-d]пиримидина общей формулы I, где: R=СН3, R1=C(O)NH2 (Ia); R=СН3, R1=C(NH)NH2 (Iб); R= нафтилметил, Rl=C(O)NH2 (Iв); R= нафтилметил, R1=C(NH)NH2 (Iг). Производные 1H-пиразоло[3,4-d]пиримидина, представленные формулой I, получают путем взаимодействия 4,6-дихлор-2-S-(замещенного)пиримидина-5-карбальдегида, растворенного в тетрагидрофуране, с добавлением расчетного количества производного гидразина и триэтиламина в мольном соотношении 1:1:2, смесь перемешивают на магнитной мешалке в течение 12 часов при комнатной температуре. Полученный осадок заливают водой и перемешивают при комнатной температуре в течение 3 часов. Перерожденный осадок фильтруют. Технический результат - получение новых соединений, которые могут быть использованы для синтеза гетероциклических соединений и в медицине в качестве противомикробных средств. 2 н.п. ф-лы, 2 табл., 5 пр.
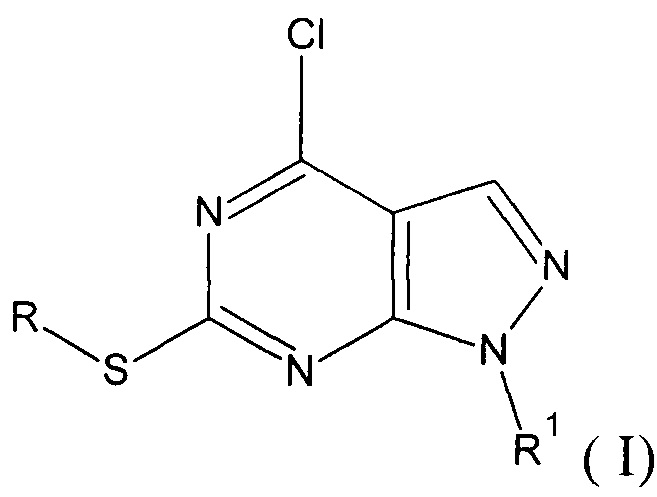
1. Производные 1H-пиразоло[3,4-d]пиримидина общей формулы I
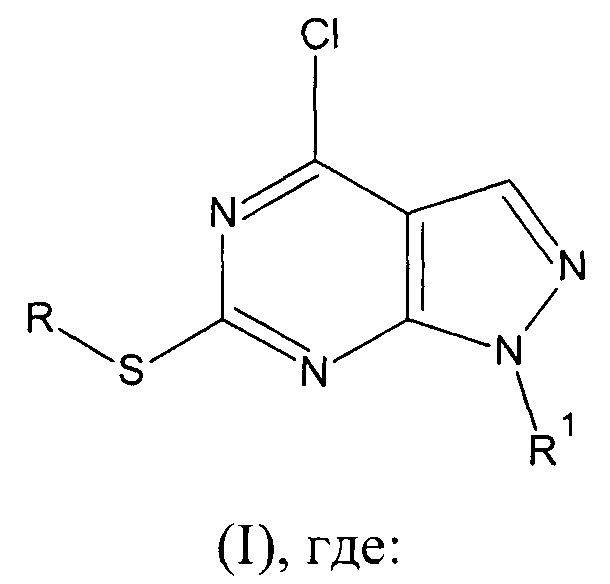
R=СН3, R1=C(O)NH2 (Ia - 4-хлоро-6-(метилтио)-1H-пиразоло[3,4-d]пиримидин-1-карбоксамид);
R=СН3, R1=C(NH)NH2 (Iб - 4-хлоро-6-(метилтио)-1H-пиразоло[3,4-d]пиримидин-1-карбоксимидамид);
R = нафтилметил, R1=C(O)NH2 (Iв - 4-хлоро-6-[(1-нафтилметил)тио]-1H-пиразоло[3,4-d]пиримидин-1-карбоксамид);
R = нафтилметил, R1=C(NH)NH2 (Iг - 4-хлоро-6-[(1-нафтилметил)тио]-1H-пиразоло[3,4-d]пиримидин-1-карбоксимидамид).
2. Способ получения производных 1H-пиразоло[3,4-d]пиримидина общей формулы I
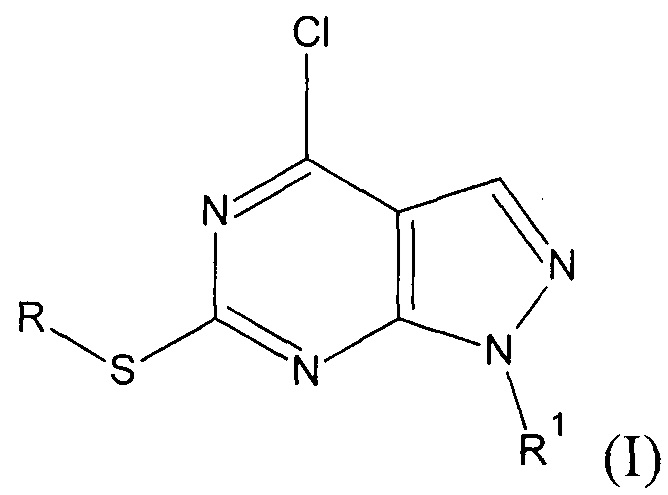 , где:
, где:
R=СН3, R1=C(O)NH2 (Ia - 4-хлоро-6-(метилтио)-1H-пиразоло[3,4-d]пиримидин-1-карбоксамид);
R=СН3, R1=C(NH)NH2 (Iб - 4-хлоро-6-(метилтио)-1H-пиразоло[3,4-d]пиримидин-1-карбоксимидамид);
R = нафтилметил, R1=C(O)NH2 (Iв - 4-хлоро-6-[(1-нафтилметил)тио]-1H-пиразоло[3,4-d]пиримидин-1-карбоксамид);
R = нафтилметил, R1=C(NH)NH2 (Iг - 4-хлоро-6-[(1-нафтилметил)тио]-1H-пиразоло[3,4-d]пиримидин-1-карбоксимидамид), путем взаимодействия 4,6-дихлор-2-(S-замещенного)пиримидин-5-карбальдегида с производным гидразина в присутствии триэтиламина при мольном соотношении 1:1:2 соответственно, для чего 4,6-дихлор-2-(S-замещенный)пиримидин-5-карбальдегид, выбранный из группы, содержащей 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегид и 4,6-дихлор-2-[(1-нафтилметил)тио]пиримидин-5-карбальдегид, растворяют в тетрагидрофуране, добавляют соль производного гидразина, выбранную из группы, содержащей гидразинкарбоксамида гидрохлорид и гидразинкарбоксимидамида сульфат, и триэтиламин, реакционную массу перемешивают при комнатной температуре в течение 12 часов, полученный осадок заливают водой и перемешивают еще 3 часа, а целевой продукт отделяют в виде перерожденного осадка.
| ZEINAB H | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Механизм для изменения угла атаки крыльев самолета | 1925 |
|
SU1795A1 |
| MARC MOSRIN AND PAUL KNOCHEL "Regio- and Chemoselective Multiple Functionalization of Pyrimidines Derivatives by Selective Magnesiations using TMPMgCl-LiCl", Organic Letters, vol | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| КОШЕЛЕВА Е.А | |||
| И ДР | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2017-12-19—Публикация
2017-04-03—Подача