Изобретение относится к области медицины, а именно к иммунологии и онкогематологии, и может быть использовано для контроля качества исследуемого образца костного мозга (КМ) при мониторинге минимальной резидуальной болезни (МРБ) при множественной миеломе (ММ) методом проточной цитофлуориметрии аспирата КМ.
Для оценки ответа на проводимую противоопухолевую терапию в ряде онкогематологических заболеваний выполняется исследование на наличие минимальной резидуальной болезни. МРБ - это состояние, связанное с наличием остаточных опухолевых клеток, не выявляющихся морфологическим методом, но обнаруживающихся более чувствительными методами: многоцветной проточной цитофлуориметрией (МПЦ), полимеразной цепной реакцией, секвенированием. Данные методы позволяют установить наличие остаточных опухолевых клеток с чувствительностью до 10-5-10-6. Актуальным является мониторинг МРБ при множественной миеломе - заболевании, связанном с клональной пролиферацией плазматических клеток (ПК) в костном мозге (реже в экстрамедуллярных очагах) и секрецией моноклональных иммуноглобулинов.
На сегодняшний день известны иммунологические методы лабораторной диагностики - иммунофиксация и иммунофенотипирование, позволяющие получать данные, необходимые для верификации диагноза ММ и оценки клинико-иммунологической ремиссии. Согласно рекомендациям Международной группы по мониторингу ММ иммунофиксация принята в качестве обязательного метода для верификации ремиссии и отсутствия МРБ (Зуева Е.Е., Русанова Е.Б. и др. Множественная миелома: современные направления иммунологического мониторинга. «Эффективная фармакотерапия. Онкология, Гематология и Радиология», 2011, №4; Менделеева Л.П., Вотякова О.М и др. Национальные клинические рекомендации по диагностике и лечению множественной миеломы. «Гематология и трансфузиология». 2016. Т. 61. №1S (2). С. 1-24).
В мировых рекомендациях также представлены панели моноклональных антител (мАТ), необходимые для мониторинга МРБ при ММ с помощью МПЦ. При этом используют 6 и более цветов. А в качестве панели используют моноклональные антитела для мониторинга МРБ при ММ методом проточной цитофлуориметрии: CD38, CD138, CD19, CD45, CD20, CD27, CD28, CD56, CD81, CD117, CD200 [Stetler-Stevenson М. et al. Consensus guidelines for myeloma minimal residual disease sample staining and data acquisition // Cytometry Part B: Clinical Cytometry. - 2016. - T. 90. - №.1. - C. 26-30].
Антитела к антигенам дифференцировки CD38 и CD138 используются для четкой идентификации популяции плазматических клеток, а остальные антигены применяются для дифференциации аномальных и нормальных ПК по аберрантной экспрессии.
Материалом для проведения мониторинга МРБ при ММ является образец аспирата КМ. При осуществлении забора образца в связи со спецификой процедуры возможно значительное разведение КМ периферической кровью. ПК при ММ персистируют в КМ, и при значительном разведении образца кровью возможно получение ложноотрицательных результатов.
Известен способ оценки качества аспирата костного мозга в процессе проведения мониторинга МРБ при множественной миеломе, для предотвращения получения ложноотрицательных результатов с целью констатации наличия значительной примеси периферической крови в КМ. Для решения данной задачи определяют количество зрелых (CD13+/CD16+) гранулоцитов, которые характерны для периферической крови. При этом для определения количества зрелых гранулоцитов необходимо дополнительно осуществлять окрашивание клеток моноклональными антителами к CD13 и CD16 и антителами, позволяющими дифференцировать гранулоциты от остальных клеток, например, комбинация CD45 и CD33. При обнаружении в исследуемом образце более 30% зрелых гранулоцитов делают вывод о том, что образец КМ имеет значительную примесь периферической крови и количественные данные о наличии МРБ не могут быть получены [Loken М.R. et al. Normalization of bone marrow aspirates for hemodilution in flow cytometric analyses // Cytometry Part B: Clinical Cytometry. - 2009. - T. 76. - №.1. - C. 27-36]. Использование данного метода оценки качества образца сказывается на общей стоимости анализа, так как увеличивается количество используемых мАТ к антигенам, которые нужно исследовать, что, в свою очередь, приводит к значительному увеличению и времени исследования. Данный источник информации рассмотрен нами в качестве ближайшего аналога.
Технический результат заявленного технического решения заключается в упрощении способа за счет исключения использования в процессе анализа дополнительных моноклональных антител, что ведет к экономии материальных средств и уменьшению времени проводимого исследования при высокой точности оценки.
Технический результат достигается тем, что оценку качества аспирата костного мозга в процессе проведения мониторинга минимальной резидуальной болезни при множественной миеломе проводят путем его исследования на наличие популяции клеток многоцветной проточной цитофлуориметрией, причем вначале проводят лизис аспирата костного мозга и после центрифугирования оценивают клеточность полученной суспензии на наличие ядросодержащих клеток и до 3×106 ядросодержащих клеток образца из полученного осадка окрашивают моноклональными антителами, инкубируют и анализируют образец, при этом полученный осадок окрашивают с использованием шестицветной панели моноклональных антител: CD38, меченого флуоресцеин изотиоцианатом, CD138, меченого фикоэритрином, CD45, меченого аллофикоцианином-Су7, CD19, меченого перидинин-хлорофиллом-Су5.5, CD56, меченого фикоэретрином-Су7, CD27, меченого аллофикоцианином, а после инкубации производят цитометрический анализ, выделяют всю популяцию плазматических клеток на основе экспрессии маркеров CD38, CD138 и CD45 и оценивают уровни экспрессии на плазматических клетках маркеров CD19, CD56, CD45 и CD27 и при наличии на плазматических клетках двух или более признаков их аномальности, в частности отсутствие экспрессии CD19, отсутствие экспрессии CD45, отсутствие экспрессии CD27 или наличие экспрессии CD56, плазматическую клетку считают резидуальной и при выявлении таких клеток в исследуемом образце его анализируют на наличие В-клеточных предшественников по маркерам CD45 и CD38, и при их количестве менее 0,33% от всей популяции ядросодержащих клеток суспензии костного мозга оценивают качество аспирата костного мозга как неудовлетворительное, то есть образец чрезмерно разведен периферической кровью, и во избежание ложноотрицательного результата на наличие минимальной резидуальной болезни при множественной миеломе рекомендуют повторное проведение пункции костного мозга, а при наличии 0,33% и более В-клеточных предшественников оценивают качество образца костного мозга как удовлетворительное и указывают долю найденных резидуальных плазматических клеток от всех ядросодержащих клеток.
Способ осуществляется следующим образом.
Плазматические клетки при ММ характеризуются аберрантным иммунофенотипом, что и легло в основу поиска данных клеток с помощью МПЦ. Задача заявляемого изобретения состоит в создании нового и точного способа оценки качества исследуемого образца КМ при осуществлении мониторинга МРБ при ММ. Для этого аспират костного мозга больного ММ в количестве 0,5 мл помещают в пробирку и вносят 4,5 мл разведенного лизирующего раствора PharmLyse (Becton Dickinson, США), после чего проводят инкубацию в течение 15 минут при комнатной температуре. Далее осуществляют центрифугирование в течение 3 мин 30 секунд, при ускорении 400 g, из пробирки удаляют супернатант и вносят 2 мл раствора CellWash (Becton Dickinson, США). Далее вновь проводят центрифугирование в течение 3 мин 30 секунд, при ускорении 400 g, из пробирки удаляют супернатант и оценивают клеточность полученной суспензии на наличие ядросодержащих клеток. Количество ядросодержащих клеток оценивалось по параметрам прямого и бокового светорассеяния. Около 3×106 ядросодержащих клеток образца из полученного осадка окрашивают моноклональными антителами. При этом используют шестицветную панель моноклональных антител: 1 мкл CD38, меченого флуоресцеин изотиоцианатом (FITC), 1 мкл CD138, меченого фикоэритрином (РЕ), 1 мкл CD45, меченого аллофикоцианином-Cy7 (АРС-Cy7), 1 мкл CD19, меченого перидинин-хлорофиллом-Cy5.5 (PerCP-Cy5.5), 1 мкл CD56, меченого фикоэретрином-Cy7 (PE-Cy7), 1 мкл CD27, меченого аллофикоцианином (АРС). Инкубируют 15 минут в темноте при комнатной температуре, добавляют 2 мл буферного раствора CellWash, далее центрифугируют в течение 3 мин 30 секунд, при ускорении 400 g, удаляют супернатант, добавляют 500 мкл буферного раствора CellWash и анализируют на проточном цитофлуориметре BD FACSCanto II (Becton Dickinson, США). Цитометрический анализ на проточном цитофлуориметре проводят незамедлительно. При этом выделяют всю популяцию плазматических клеток на основе экспрессии маркеров CD38, CD138 и CD45. Выявление одновременной экспрессии CD38, CD138 и CD45 позволяет уверенно отделить ПК от других лейкоцитов. Для последующего анализа создают логическое ограничение (гейт), объединяющее CD138+-клетки с определенными характеристиками светорассеяния. Позитивная экспрессия CD38 служит подтверждением принадлежности исследуемой популяции к ПК.
Затем оценивают уровни экспрессии на плазматических клетках маркеров CD19, CD56, CD45 и CD27 и при наличии на плазматических клетках двух или более признаков их аномальности, в частности отсутствие экспрессии CD19, отсутствие экспрессии CD45, отсутствие экспрессии CD27 или наличие экспрессии CD56, плазматическую клетку считают резидуальной и при выявлении таких клеток проводят анализ на наличие В-клеточных предшественников по маркерам CD45 и CD38. Анализ на наличие В-клеточных предшественников также проводят на проточном цитофлуориметре по параметрам прямого и бокового светорассеяния и распределения интенсивности флуоресценции по каналу APC-Cy7 (CD45), в зависимости от интенсивности флуоресценции по каналу FITC (CD38). При наличии В-клеточных предшественников, имеющих среднюю экспрессию CD38 и низкую экспрессию CD45, менее 0,33% от всей популяции ядросодержащих клеток суспензии костного мозга, оценивают качество аспирата костного мозга как неудовлетворительное, то есть образец чрезмерно разведен периферической кровью и во избежание ложноотрицательного результата анализа МРБ при ММ рекомендуют повторное проведение пункции КМ, а при наличии 0,33% и более В-клеточных предшественников определяют качество аспирата костного мозга как удовлетворительное и указывают долю найденных резидуальных ПК от всех ядросодержащих клеток.
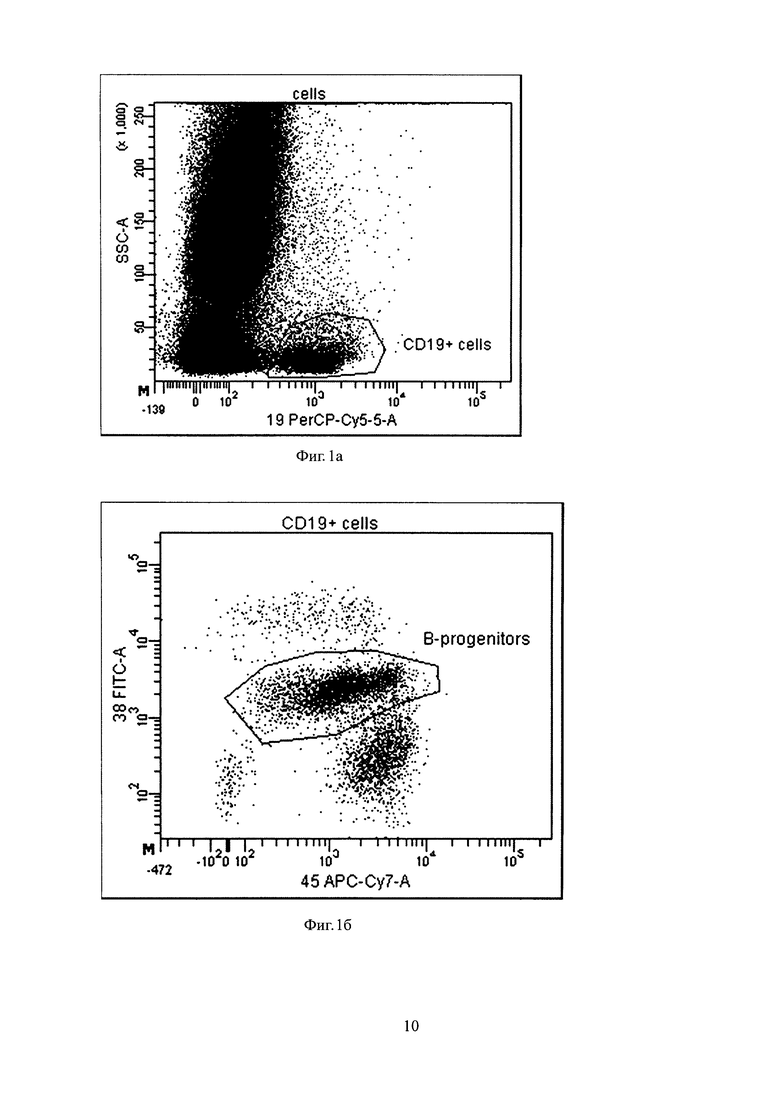
Было проведено исследование, как описано выше, аспиратов КМ 24-х здоровых доноров с выделением у них всей популяции ядросодержащих клеток, которые были окрашены моноклональными антителами. Было получено не менее 2×106 ядросодержащих клеток. Затем после выявления всей популяции плазматических клеток на основе экспрессии маркеров CD38, CD138 и CD45 оценивали уровни экспрессии на плазматических клетках маркеров CD19, CD56, CD45 и CD27. При этом ни в одном образце не было обнаружено резидуальных клеток (ПК с аномальным иммунофенотипом). После чего осуществляли определение количества В-клеточных предшественников. На фигуре 1а представлен точечный график распределения интенсивности флуоресценции по каналу PerCP-Cy5.5 (CD19), в зависимости от бокового светорассеяния (SSC-A). На фигуре 1б представлен точечный график распределения интенсивности флуоресценции по каналу АРС-Cy7 (CD45), в зависимости от интенсивности флуоресценции по каналу FITC (CD38). Из гейта "CD19+ cells" выбираются только клетки со средней экспрессией CD38 и имеющие более низкую интенсивность флуоресценции по каналу APC-Cy7 (CD45), нежели зрелые лимфоциты, что соответствует гейту "B-progenitors". На фигуре 1в представлен точечный график распределения интенсивности флуоресценции (ИФ) по каналу РЕ (CD10), в зависимости от бокового светорассеяния (SSC-A). На графике показаны клетки из гейта "В-progenitors", и проиллюстрировано, что они являются положительными по каналу РЕ (CD10).
Из всех ядросодержащих клеток выбираются клетки, имеющие высокую ИФ по каналу PerCP-Cy5.5 (CD 19) и низкий показатель бокового светорассеяния (SSC-A), что соответствует гейту "CD19+ cells". В данном исследовании показано, что в КМ CD19+ клетки (фиг. 1а) со средней ИФ по каналу FITC (CD38) и более низким значением ИФ по каналу APC-Cy7 (CD45) (фиг. 1б), чем зрелые лимфоциты, имеют иммунофенотип CD19+/CD10+ (фиг. 1в), то есть являются В-клеточными предшественниками. Было определено среднее значение доли В-клеточных предшественников от всех ядросодержащих и плазматических клеток 1,13±0,60% (минимум 0,33%, максимум 2,63%, медиана 1,08%). Таким образом, если при исследовании образца КМ при мониторинге МРБ при ММ обнаруживается менее чем 0,33% клеток со средней ИФ по каналу FITC (CD38) и более низким значением ИФ по каналу APC-Cy7 (CD45) от всех ядросодержащих клеток, то образец считается разведенным периферической кровью, и количественное заключение о наличии МРБ не может быть дано, так как возможно получение ложноотрицательного результата.
Было также проведено исследование 314 образцов аспиратов костного мозга больных множественной миеломой, как описано выше. При этом количество В-предшественников менее 0,33% было выявлено в 12 образцах аспиратов костного мозга, что составило 3,8%. В этих случаях были даны заключения о неудовлетворительном качестве образца, то есть разведенном периферической кровью, и было рекомендовано проведение повторной пункции с последующим повторным анализом. В остальных случаях количество В-предшественников было более 0,33%, что указывало на удовлетворительное качество образца костного мозга. В заключение была указана доля найденных резидуальных плазматических клеток от всех ядросодержащих клеток. При проведении исследования каждого образца время, затраченное на его анализ составляло на 30 минут меньше по сравнению со временем исследования в ближайшем аналоге.
Примеры осуществления способа.
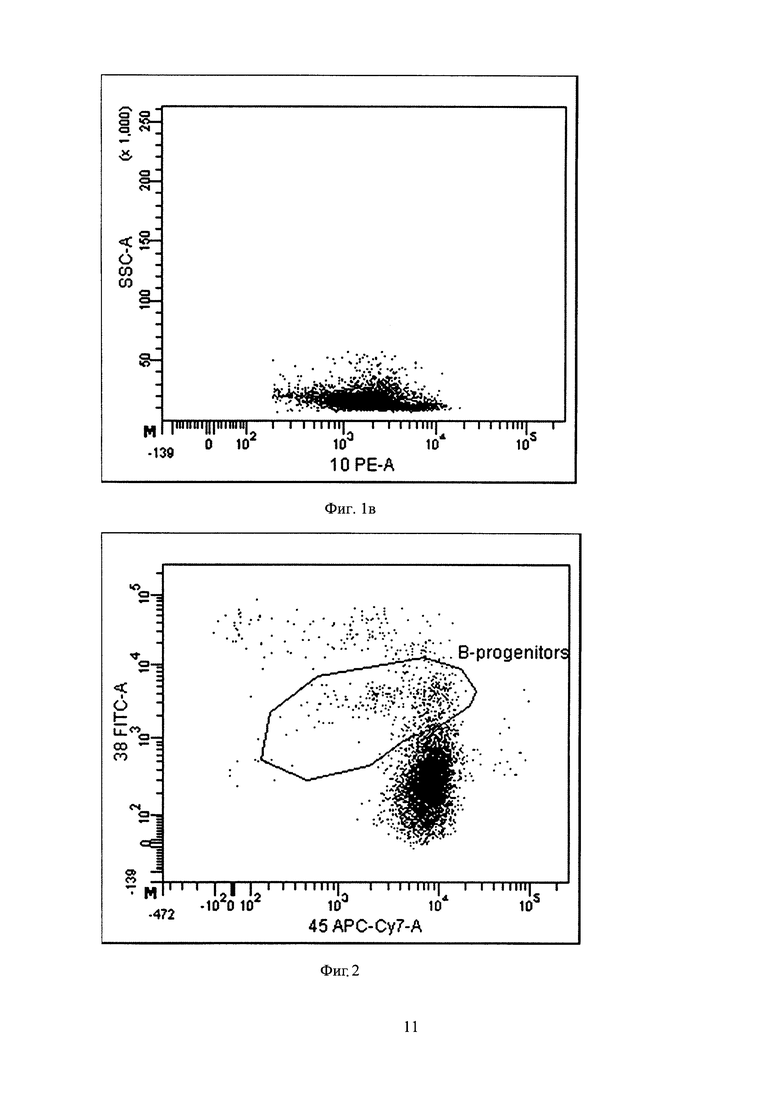
Пример 1. Больной Б., 56 лет. Диагноз: множественная миелома. Через 3 месяца после проведенной трансплантации аутологичных стволовых клеток крови было проведено исследование образца КМ больного. Вначале проводят лизис аспирата костного мозга и после центрифугирования оценивают клеточность полученной суспензии на наличие ядросодержащих клеток. Было выявлено 2,5×105 ядросодержащих клеток образца из полученного осадка, который окрашивали моноклональными антителами с использованием шестицветной панели: CD38, меченого флуоресцеин изотиоцианатом, CD138, меченого фикоэритрином, CD45, меченого аллофикоцианином-Cy7, CD19, меченого перидинин-хлорофиллом-Cy5.5, CD56, меченого фикоэретрином-Cy7, CD27, меченого аллофикоцианином. После инкубации производили цитометрический анализ и выделяли всю популяцию плазматических клеток на основе экспрессии маркеров CD38, CD138 и CD45. Оценили уровни экспрессии на плазматических клетках маркеров CD19, CD56, CD45 и CD27. Было выявлено два признака аномальности: отсутствие экспрессии CD19 и наличие экспрессии CD56. Обнаружено 20 резидульных клеток. Далее был проведен анализ исследуемого образца на наличие В-клеточных предшественников по маркерам В-клеточных предшественников, имеющих среднюю экспрессию CD38 и низкую экспрессию CD45. Их количество составило 0,20% от всей популяции ядросодержащих клеток суспензии костного мозга. На фигуре 2 приведен точечный график распределения интенсивности флуоресценции по каналу APC-Cy7 (CD45), в зависимости от интенсивности флуоресценции по каналу FITC (CD38). Из гейта "CD19+ cells" выбирали только клетки со средней экспрессией CD38 и имеющие более низкую интенсивность флуоресценции по каналу APC-Cy7 (CD45), нежели зрелые лимфоциты, что соответствует гейту "B-progenitors". Так как рассчитанное количество В-клеточных предшественников менее 0,33% (0,20%), то отмечено неудовлетворительное качество образца, то есть что он разведен периферической кровью, и в заключении не могут быть представлены количественные данные о наличии МРБ. Было рекомендовано провести повторно пункцию костного мозга у данного больного с последующим исследованием пунктата.
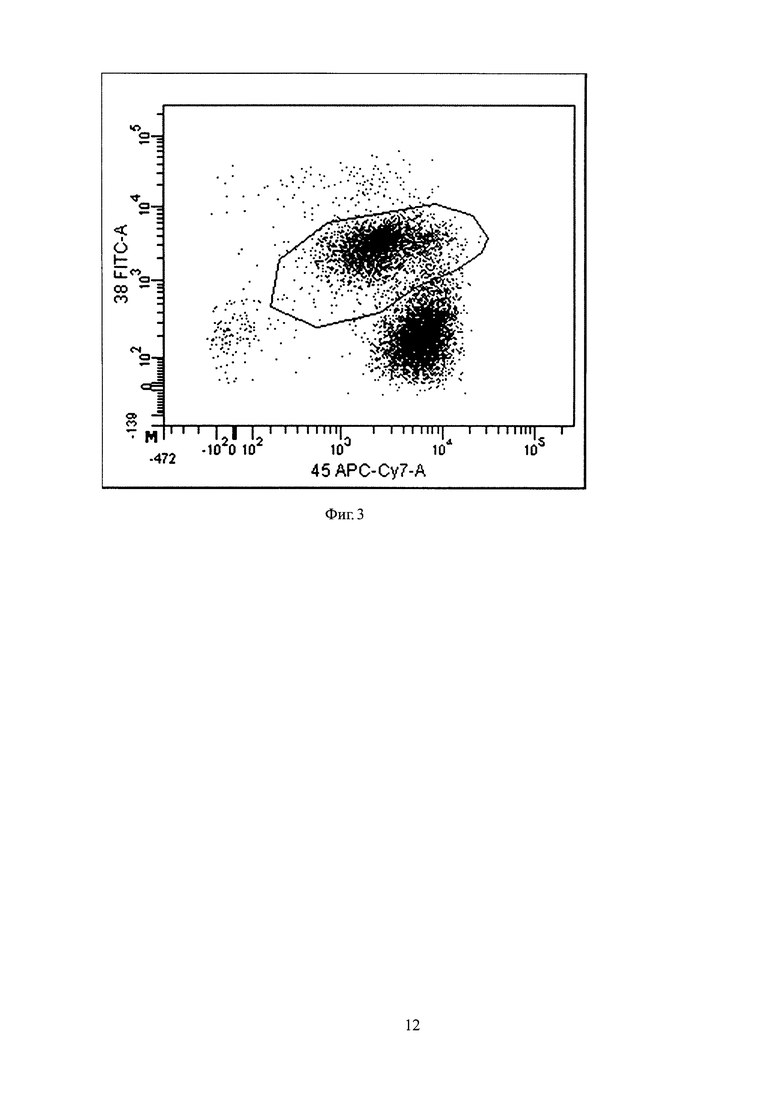
Пример 2. Больной К., 60 лет. Диагноз: множественная миелома. Через 6 месяцев после проведенной трансплантации аутологичных стволовых клеток крови было проведено исследование образца КМ больного. Вначале проводят лизис аспирата костного мозга и после центрифугирования оценивают клеточность полученной суспензии на наличие ядросодержащих клеток. Было выявлено 1,5×105 ядросодержащих клеток образца из полученного осадка, который затем окрашивали моноклональными антителами с использованием шестицветной панели: CD38, меченого флуоресцеин изотиоцианатом, CD138, меченого фикоэритрином, CD45, меченого аллофикоцианином-Cy7, CD19, меченого перидинин-хлорофиллом-Cy5.5, CD56, меченого фикоэретрином-Cy7, CD27, меченого аллофикоцианином. После инкубации производили цитометрический анализ и выделяли всю популяцию плазматических клеток на основе экспрессии маркеров CD38, CD138 и CD45. Оценивали уровни экспрессии на плазматических клетках маркеров CD19, CD56, CD45 и CD27. Было выявлено два признака аномальности: отсутствие экспрессии CD19, отсутствие экспрессии CD45. Обнаружена 31 резидульная клетка. Далее был проведен анализ исследуемого образца на наличие В-клеточных предшественников по маркерам В-клеточных предшественников, имеющих среднюю экспрессию CD38 и низкую экспрессию CD45. При анализе В-клеточных предшественников обнаружено, что их количество составило 0,41% от всех ядросодержащих клеток. На фигуре 3 приведен точечный график распределения интенсивности флуоресценции по каналу APC-Cy7 (CD45), в зависимости от интенсивности флуоресценции по каналу FITC (CD38). Из гейта "CD19+ cells" выбираются только клетки со средней экспрессией CD38 и имеющие более низкую интенсивность флуоресценции по каналу APC-Cy7 (CD45), нежели зрелые лимфоциты, что соответствует гейту "B-progenitors". Количество этих клеток составило 0,41% от всех ядросодержащих клеток.
Так как рассчитанное количество В-клеточных предшественников более 0,33% (0,41%), то определяют качество аспирата костного мозга как удовлетворительное, и в заключении было указано на наличие резидуальной болезни в количестве 0,021% ПК от всех ядросодержащих клеток.
Таким образом, заявленный способ оценки качества аспирата костного мозга в процессе проведения мониторинга минимальной резидуальной болезни при множественной миеломе позволяет оценивать качество образца без применения дополнительных моноклональных антител для определения В-клеточных предшественников, что ведет к экономии материальных средств и уменьшению времени проводимого исследования, которое сокращается на 30 минут. При этом точность оценки сохраняется на прежнем уровне.
Изобретение относится к области медицины, а именно к иммунологии и онкогематологии, и может быть использовано для контроля качества исследуемого образца при мониторинге минимальной резидуальной болезни при множественной миеломе методом проточной цитофлуориметрии аспирата костного мозга. Для этого вначале проводят лизис аспирата костного мозга и после центрифугирования оценивают клеточность полученной суспензии на наличие ядросодержащих клеток и до 3×106 ядросодержащих клеток образца из полученного осадка окрашивают моноклональными антителами, инкубируют и анализируют образец. При этом полученный осадок окрашивают с использованием шестицветной панели моноклональных антител: CD38, меченого флуоресцеин изотиоцианатом, CD138, меченого фикоэритрином, CD45, меченого аллофикоцианином-Су7, CD19, меченого перидинин-хлорофиллом-Су5.5, CD56, меченого фикоэретрином-Су7, CD27, меченого аллофикоцианином. После инкубации производят цитометрический анализ и выделяют всю популяцию плазматических клеток на основе экспрессии маркеров CD38, CD138 и CD45. Оценивают уровни экспрессии на плазматических клетках маркеров CD19, CD56, CD45 и CD27 и при наличии на плазматических клетках двух или более признаков их аномальности, в частности отсутствие экспрессии CD19, отсутствие экспрессии CD45, отсутствие экспрессии CD27 или наличие экспрессии CD56, плазматическую клетку считают резидуальной. И при выявлении таких клеток в исследуемом образце его анализируют на наличие В-клеточных предшественников по маркерам CD45 и CD38, и при их количестве менее 0,33% от всей популяции ядросодержащих клеток суспензии костного мозга оценивают качество аспирата костного мозга как неудовлетворительное, то есть образец чрезмерно разведен периферической кровью, и во избежание ложноотрицательного результата на наличие минимальной резидуальной болезни при множественной миеломе рекомендуют повторное проведение пункции костного мозга, а при наличии 0,33% и более В-клеточных предшественников оценивают качество образца костного мозга как удовлетворительное и указывают долю найденных резидуальных плазматических клеток от всех ядросодержащих клеток. Использование данного способа позволяет проводить оценку качества аспирата костного мозга в процессе проведения мониторинга минимальной резидуальной болезни при множественной миеломе, включающего его исследование на наличие популяции клеток многоцветной проточной цитофлуориметрией. 2 пр., 3 ил.
Способ оценки качества аспирата костного мозга в процессе проведения мониторинга минимальной резидуальной болезни при множественной миеломе, включающий его исследование на наличие популяции клеток многоцветной проточной цитофлуориметрией, причем вначале проводят лизис аспирата костного мозга и после центрифугирования оценивают клеточность полученной суспензии на наличие ядросодержащих клеток и до 3×106 ядросодержащих клеток образца из полученного осадка окрашивают моноклональными антителами, инкубируют и анализируют образец, отличающийся тем, что полученный осадок окрашивают с использованием шестицветной панели моноклональных антител: CD38, меченого флуоресцеин изотиоцианатом, CD138, меченого фикоэритрином, CD45, меченого аллофикоцианином-Cy7, CD19, меченого перидинин-хлорофиллом-Cy5.5, CD56, меченого фикоэретрином-Cy7, CD27, меченого аллофикоцианином, а после инкубации производят цитометрический анализ, выделяют всю популяцию плазматических клеток на основе экспрессии маркеров CD38, CD138 и CD45 и оценивают уровни экспрессии на плазматических клетках маркеров CD19, CD56, CD45 и CD27, и при наличии на плазматических клетках двух или более признаков их аномальности, в частности отсутствие экспрессии CD19, отсутствие экспрессии CD45, отсутствие экспрессии CD27 или наличие экспрессии CD56, плазматическую клетку считают резидуальной и при выявлении таких клеток в исследуемом образце его анализируют на наличие В-клеточных предшественников по маркерам CD45 и CD38, и при их количестве менее 0,33% от всей популяции ядросодержащих клеток суспензии костного мозга оценивают качество аспирата костного мозга как неудовлетворительное, то есть образец чрезмерно разведен периферической кровью, и во избежание ложноотрицательного результата на наличие минимальной резидуальной болезни при множественной миеломе рекомендуют повторное проведение пункции костного мозга, а при наличии 0,33% и более В-клеточных предшественников оценивают качество образца костного мозга как удовлетворительное и указывают долю найденных резидуальных плазматических клеток от всех ядросодержащих клеток.
| LOKEN М.R | |||
| et al | |||
| Normalization of bone marrow aspirates for hemodilution in flow cytometric analyses // Cytometry Part B: Clinical Cytometry, 2009, 76:1б, рр.27-36 | |||
| СПОСОБ ПРОГНОЗИРОВАНИЯ БЕЗРЕЦИДИВНОЙ ВЫЖИВАЕМОСТИ У БОЛЬНЫХ МНОЖЕСТВЕННОЙ МИЕЛОМОЙ ПОСЛЕ ПРОВЕДЕНИЯ АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК | 2015 |
|
RU2580648C1 |
| US2011207627 A1, 25.08.2011 | |||
| ПОПОВ А.М | |||
| и др | |||
| Острые лейкозы: различия иммунофенотипа бластных клеток и их неопухолевых аналогов в костном мозге // Клиническая онкогематология, 2016; 9(3), стр.302-313. | |||
Авторы
Даты
2017-12-21—Публикация
2016-12-26—Подача