Область техники.
Изобретение относится к медицине, а именно к онкологии и может быть использовано в качестве диагностического способа выявления опухолевых клеток Березовского-Рида-Штернберга при классической лимфоме Ходжкина в материале биоптатов, пунктатов лимфатических узлов и для выявления минимального поражения костного мозга.
Уровень техники.
В значительном большинстве случаев, диагностика лимфопролиферативных заболеваний (ЛПЗ), выявление нарушений миелоидных стволовых клеток и установление иммунофенотипического варианта острых лейкозов (ОЛ) основывается на мультимодальном анализе, в котором значительную роль играет проточная цитометрия. Иммунофенотипирование (ИФТ) с помощью проточной цитометрии (ПЦ) основано на обнаружении отдельных клеток в клеточной суспензии (кровь, костный мозг, биопсийная ткань, ликвор и т.д.) в реакции иммунофлуоресценции, отражающей экспрессию конкретного специфического антигена и характеристик светорассеяния. Окрашенные прямыми или непрямыми флуорохромными коньюгатами моноклональных антител конкретные клетки легко могут быть выявлены на основании детекции сигнала от данных фдуорохромных коньюгатов, активируемых лазерным лучом. Используя комбинации связанных с антителами меток с различными спектрами возбуждения и/или излучения, можно охарактеризовать отдельную клетку на наличие и интенсивность экспрессии множества антигенов. Современные мультилазерные проточные цитометры позволяют быстро обнаруживать и характеризовать миллионы клеток. Самым серьезным преимуществом данного метода иммунофенотипирования является быстрота анализа, которая при отработанной методике составляет не более 4-х- 5ти часов. Поэтому исследование методом проточной цитометрии может быть векторным для дальнейшей дифференциальной диагностики патологического процесса, обеспечивая экономию затрат и времени на постановку окончательного диагноза. Благодаря возможности анализа большого количества клеток, проточная цитометрия идеально подходит для выявления относительно редких, антигенно отличающихся популяций в гетерогенных клеточных системах. Это свойство сделало многоцветную проточную цитометрию идеальным методом оценки количества и биологических особенностей клеток минимальной остаточной болезни (МОБ) при острых лейкозах, хроническом лимфолейкозе, множественной миеломе (Гривцова Л.Ю., Мушкарина Т.Ю., Лунин В.В., Зейналова П.А. Проточная цитометрия при диагностике плазмоклеточных опухолей и оценке минимальной остаточной болезни. Онкогематология. 2021. Т16.№3. с.16-25; Чернышева О.А., Гривцова Л.Ю., Серебрякова И.Н., Купрышина Н.А., Шолохова Е.Н., Шервашидзе М.А., Палладина А.Д., Курдюков Б.В., Попа А.В., Тупицын Н.Н. Диагностика острых лимфобластных лейкозов из Т-линейных предшественников и подходы к мониторингу минимальной остаточной болезни. Клиническая онкогематология. Фундаментальные исследования и клиническая практика.2019.Т.12. №1. С. 79-85; Безнос О.А., Гривцова Л.Ю., Тупицын Н.Н. Оптимизация проточно-цитометрических протоколов детекции минимальной остаточной болезни при острых лимфобластных лейкозах. Медицинский алфавит. 2018. Т.1. №5 (342). С. 36-39; Гривцова Л.Ю., Купрышина Н.А., Френкель М.А., Безнос О.А., Тупицын Н.Н., Баранова О.Ю., Зейналова П.А. Диагностика и иммунофенотипические особенности бластных клеток при острых миелоидных лейкозах: экспрессия пан-миелоидных и линейно-нгерестриктированных антигенов. Медицинский алфавит. 2017. Т.4. №28 (325). С.17-21; Гальцева И.В., Смирнова С.Ю., Паровичникова Е.Н. Методические аспекты детекции минимальной остаточной болезни у больных острыми лейкозами. Гематология и трансфузиология. 2022. Т. 67. № 1. С. 108-120; Гальцева И.В., Давыдова Ю.О., Паровичникова Е.Н., Гаврилина О.А., Троицкая В.В., Капранов Н.М., Никифорова К.А., Исинова Г.А., Зарубина К.И., Соколов А.Н., Савченко В.Г. Мониторинг минимальной остаточной болезни и B-клеточных субпопуляций у больных острым B-лимфобластным лейкозом, леченных по протоколу «ОЛЛ-2016». Гематология и трансфузиология. 2021. Т. 66. № 2. С. 192-205.).
Учитывая это можно предполагать, что ПЦ может быть хорошим методом подтверждения диагноза лимфомы, когда злокачественная популяция относительно немногочисленна, а большинство клеток относятся к доброкачественному воспалительному фону. Примерами таких лимфом могут быть классическая Лимфома Ходжкина (кЛХ) и богатая Т-клетками крупноклеточная В- клеточная лимфома.
Классическая лимфома Ходжкина - это В-клеточное новообразование, при котором опухолевая популяция составляет менее 1%, а то и менее 0,01% от общего числа клеток. Опухолевый субстрат клетки Березовского-Рида-Штернберга (БРШ) имеют достаточно характерную морфологию и в целом могут быть распознаны морфологически на основании крупного размера, иногда многолопастных ядер и характерно выступающим ядрышкам. До недавнего времени диагноз кЛХ основывался исключительно на морфологических данных при оценке препаратов, приготовленных из фиксированной парафином ткани (Chan WC. The Reed-Sternberg cell in classical Hodgkin’s disease. Hematol Oncol. 2001;19:1-17).
Наличие специфического иммунофенотипа клеток БРШ и их крупных размеров дает основания использовать для их выявления такой метод диагностики как проточная цитометрия. Ранее этот метод не использовался как диагностический инструмент при ЛХ, в силу трудности выделения единичных клеток БРШ среди большого количества клеток микроокружения. Возможности метода все время совершенствуются и с приходом в клиническую практику проточной цитометрии нового поколения (многоцветная проточная цитометрия высокого разрешения) идентификация клеток БРШ этим методом стала возможной.
Существуют несколько способов идентификации БРШ клеток с помощью проточной цитометрии в аспирационном или биопсийном материале лимфатического узла с целью подтверждения или дополнения иммуногистохимического окрашивания при диагностике ЛХ (Fromm JR, Kussick SJ, Wood BL. Identification and purification of classical Hodgkin cells from lymph nodes by flow cytometry and flow cytometric cell sorting. Am J Clin Pathol. 2006;126(5):764-780; Fromm JR, Thomas A, Wood BL. Flow cytometry can diagnose classical Hodgkin lymphoma in lymph nodes with high sensitivity and specificity. Am J Clin Pathol. 2009;131(3):322-332; Fromm JR, Wood BL. A six-color flow cytometry assay for immunophenotyping classical Hodgkin lymphoma in lymph nodes. Am J Clin Pathol. 2014;141(3):388-396). Исследования в этой области сосредоточены на определении отличий иммунофенотипа клеток БРШ от воспалительного фона и для характеристики клеток опухолевого микроокружения, что может оказаться значимым для прогноза болезни. На первом этапе отработки метода был использован прием с применением блокирующих антител к молекулам клеточной адгезии опухолевого микроокружения (Fromm JR, Kussick SJ, Wood BL. Identification and purification of classical Hodgkin cells from lymph nodes by flow cytometry and flow cytometric cell sorting. Am J Clin Pathol. 2006;126(5):764-780). Но по мере роста технических возможностей ПЦ было продемонстрировано, что нет необходимости блокировать розеткообразование Т-клеток в случае применения проточной цитометрии высокого разрешения с одновременной оценкой на клетках образца 9 специфических параметров (оценка экспрессии на мембране антигенов CD5, CD15, CD20, CD30, CD40, CD45, CD64, CD71 и CD95) (Fromm JR, Thomas A, Wood BL. Flow cytometry can diagnose classical Hodgkin lymphoma in lymph nodes with high sensitivity and specificity. Am J Clin Pathol. 2009;131(3):322-332). Такой подход позволил установить важные для выявления клеток БРШ антигены и несколько упростить протокол (Fromm JR, Wood BL. A six-color flow cytometry assay for immunophenotyping classical Hodgkin lymphoma in lymph nodes. Am J Clin Pathol. 2014;141(3):388-396; Wu D, Wood BL, Fromm JR. Flow cytometry for non-Hodgkin and classical Hodgkin lymphoma. Methods Mol Biol. 2013;971: 27-47; Fromm, J. R., & Wood, B. L. (2012). Strategies for immunophenotyping and purifying classical Hodgkin lymphoma cells from lymph nodes by flow cytometry and flow cytometric cell sorting. Methods, 57(3), 368-375). Принципиальными оказались комбинации антигенов CD30 и CD64, CD95 и CD40, экспрессия антигена Т-клеток CD3 в соотнесении с параметром бокового светорассеяния SSC (неспецифическая характеристика в проточной цитометрии, отражающая степень гранулированности клетки, тип ее ядра), а также CD20 и CD15. Авторам исследования удалось установить, что БРШ клетки без использования антител для блокировки розеткообразования Т-клеток имеют следующие характеристики: повышенное боковое (SSC) и прямое рассеяние (второй неспецифический параметр проточной цитометрии -FSC , отражающий размер клеток), то есть являются более гранулированными и имеют больший размер по сравнению с нормальными лимфоцитами, гетерогенны по экспрессии общелейкоцитарного антигена CD45 (частично из-за связанных Т-клеток), в основном отрицательны в отношении антигена В-клеток CD20, также отрицательны в отношении моноцитарного антигена CD64, могут быть положительными для антигена Т-клеток CD3 (из-за связанных Т-клеток) и всегда позитивны по экспрессии маркеров CD30, CD40 и CD95 (Fromm JR, Thomas A, Wood BL. Flow cytometry can diagnose classical Hodgkin lymphoma in lymph nodes with high sensitivity and specificity. Am J Clin Pathol. 2009;131(3):322-332; Fromm JR, Wood BL. A six-color flow cytometry assay for immunophenotyping classical Hodgkin lymphoma in lymph nodes. Am J Clin Pathol. 2014;141(3):388-396; Wu D, Wood BL, Fromm JR. Flow cytometry for non-Hodgkin and classical Hodgkin lymphoma. Methods Mol Biol. 2013;971: 27-47; Fromm, J. R., & Wood, B. L. (2012). Strategies for immunophenotyping and purifying classical Hodgkin lymphoma cells from lymph nodes by flow cytometry and flow cytometric cell sorting. Methods, 57(3), 368-375).
Известен способ идентификации и очистки классических клеток Ходжкина из лимфатических узлов методом проточной цитометрии и проточно-цитометрической сортировки клеток (Fromm JR, Kussick SJ, Wood BL. Identification and purification of classical Hodgkin cells from lymph nodes by flow cytometry and flow cytometric cell sorting. Am J Clin Pathol. 2006;126(5):764-780). Способ заключается в идентификации клеток БРШ в лимфатических узлах с помощью проточной цитометрии с использованием 10-цветного анализа, в котором использовалась комбинация антител, реагирующих с антигенами на клетках БРШ (CD15, CD30, CD40, CD71 и CD95), B-клетках (CD19 и CD20), Т-клетках (CD3 или CD5), макрофагах (CD64) и лейкоцитах (CD45).
К недостаткам данного способа можно отнести сложность идентификации БРШ в лимфатических узлах или новообразованиях, отличных от кХЛ, но с подозрением на кХЛ в виду присутствия атипичных клеток в суспензиях лимфатических узлов или характерного воспалительного фона. Вследствие данное исследование было подвержено предвзятому отбору.
Известен шестицветный способ проточной цитометрии для иммунофенотипирования классической лимфомы Ходжкина в лимфатических узлах, заключающийся в использовании 6-цветной проточной цитометрии (Fromm JR, Wood BL. A six-color flow cytometry assay for immunophenotyping classical Hodgkin lymphoma in lymph nodes. Am J Clin Pathol. 2014;141(3):388-396). Исследование выполняли на модифицированном четырехлазерном десятицветном проточном цитометре Becton-Dickinson (BD; Сан-Хосе, Калифорния) с использованием следующих комбинаций лазер-флуорохром: (1) синий лазер с длиной волны 488 нм (четыре цвета), включая изотиоцианат флуоресцеина (FITC), фикоэритрин (PE), PE-цианин 5,5 (PE-Cy5.5) и PE-цианин 7 (PE-Cy7); и (2) красный лазер с длиной волны 633 нм (два цвета), включающий аллофикоцианин (APC) и APC-Cy7/APC-H7. Желтый и фиолетовый лазеры на цитометре в исследовании не использовались. Антитела, использованные в одной шестицветной пробирке для всех использованных образцов включали: CD64-FITC (22; BC), CD30-PE (Ber-H83; BD), CD40-PE-Cy5.5 ( MAB89; BC), CD20-PE-Cy7 (B9E9; BC), CD95-APC (DX2; BD) и CD3-APC-Cy7 (SK7; BD) или CD3-APC-H7 (SK7; BD).
Недостатком данного способа является то, что образец должен содержать 50 000 и более жизнеспособных клеток, что не всегда достаточно для выявления редких клеток, какими являются клетки БРШ, и быть не старше 4 дней, а также отсутствие в панели антител антигена CD15, одного из важных маркеров клеток БРШ.
Самым близким (прототипом) является способ диагностики кЛХ в лимфатических узлах с использованием 9-цветной проточной цитометрии (CD95-Pacific blue/CD64-fluorescein isothiocyanate/CD30-phycoerythrin [PE]/CD45-PE-Texas red/CD40-PE cyanine [Cy]5.5/CD20-PECy7/CD15-allophycocyanin [APC]/CD71-APC-AlexaFluor A700/CD5-APC-Cy7) (Fromm JR, Thomas A, Wood BL. Flow cytometry can diagnose classical Hodgkin lymphoma in lymph nodes with high sensitivity and specificity. Am J Clin Pathol. 2009;131(3):322-332). Исследования выполнялись на модифицированном 4-лазерном 10-цветном проточном цитометре Becton Dickinson LSRII (Becton Dickinson [BD], Сан-Хосе, Калифорния) с использованием следующих комбинаций лазер-флюорохром: (1) фиолетовый лазер с длиной волны 405 нм (1 цвет): тихоокеанский синий (pacific blue, PB); (2) синий лазер с длиной волны 488 нм (5 цветов): флуоресцеинизотиоцианат (fluorescein isothiocyanate, FITC), фикоэритрин (phycoerythrin, PE), PE-техасский красный (PE-Texas red, ECD/PE-TR), PE-цианин (PE-cyanine (Cy)-5,5 и PE-Cy7); и (3) красный лазер с длиной волны 633 нм (3 цвета): аллофикоцианин (allophycocyanin, APC), APC-AlexaFluor 700 (APC-A700) и APC-Cy7. Желтый лазер на цитометре (и, следовательно, флуорохром AlexaFluor 594) в исследовании не использовался. Антитела, используемые в одной пробирке для всех используемых образцов, были следующими: CD95-PB (DX2, Caltag), CD64-FITC (22, BC), CD30-PE (Ber-H83, BD), CD45-ECD (J33, BC), CD40-PE-Cy5.5 (MAB89, BC), CD20-PE-Cy7 (B939, BC), CD15-APC (H198, BD), CD71-APC-A700 (YDJ.1.2.2, BC) и CD5-APC-Cy7 (BL1a, BC). Суспензии лимфатических узлов готовили стандартным способом: ткань мелко измельчали в 3-5 мл среды RPMI с помощью скальпеля. Затем гомогенат фильтровали (через фильтр 40 мкм), центрифугировали (550 g в течение 10 минут), промывали PBS и ресуспензировали в 0,5 мл RPMI-1640. Процедуру проводили при комнатной температуре в темноте. Клетки инкубировали с меченными антителами в течение 15 минут в 100 мкл RPMI-1640. Затем клеточные суспензии лизировали и фиксировали 0,15 моль/л хлорида аммония, pH 4,8, содержащего 0,25% формальдегида (Polysciences, Warrington, PA) в течение 15 минут, промывали 3 мл PBS, содержащий бычий сывороточный альбумин и инкубировали с 0,1 мл PBS перед анализом.
Недостатком данного способа является, что для одного из антител (мка к антигену CD45) применены тандемные флуорохромные красители ECD (PE-TexRed), которые в силу значительного перекрёстного спектра излучения сложно скомпенсировать в пробах объединяющих более 5 различных флуорохромов, что может дать ложноположительные результаты по другим каналам флуоресценции. К тому же данные красители, очень быстро разлагаются на свету, что может привести к получению ложноотрицательных результатов. Кроме того, поскольку экспрессия на клетках БРШ антигена CD20 , то применение МКА к данному антигену с тандемным красителем (PE-cy7) также может исказить результаты.
Данный способ наиболее близок по технической сущности с предлагаемым изобретением и предусматривает анализ биопсийного материала лимфатических узлов пациентов с подозрением на кЛХ, приготовлением клеточной суспензии путем механического растирания ткани в буферном растворе, а также проведение последующей прямой реакции иммунофлуоресценции (Таблица 1).
Задачей изобретения является создание нового способа с применением одной пробы, где оптимально будут скомбинированы антигены и подобраны моноклональные антитела с оптимальными флуорохромами, выявление которых принципиально для идентификации клеток БРШ.
Задача решается тем, что также как и в известном способе (прототипе) проводят анализ биопсийного материала лимфатических узлов пациентов с подозрением на кЛХ и приготовление клеточной суспензии путем механического растирания ткани в буферном растворе, после чего проводят прямую реакцию иммунофлуоресценции.
Особенностью заявляемого способа является то, что маркеры, согласно таблице 1, объединяют в одну пробу и после окрашивания моноклональными антителами пробу анализируют на 14-параметровом проточном цитометре высокого разрешения и проводят одновременный анализ 10000000 клеток пробы с применением программного обеспечения Kaluza Analysis 2.2, в соответствии с последовательным алгоритмом гейтирования и согласно иммунофенотипическим характеристикам БРШ клеток определяют CD-45-негативные клетки образца, далее в пределах этих клеток оценивают все CD30+ клетки образца, после чего проводят этап исключения из анализа примеси миело-моноцитарных клеток, для этого берут антиген CD64 и в анализ включают клетки CD30++CD64-, попавшие в область С, затем в пределах популяции CD30++CD64- исключают возможную примесь В-клеток по экспрессии пан-В-клеточных антигенов CD19 и CD20, далее, среди CD30++CD64-CD19- клеток на основании характеристик светорассеяния FSC/SSC в анализ включают только крупные клетки со средними и высокими показателями бокового светорассеяния SSC, проводят учет CD95+CD40+ клеток, определяют искомую популяцию БРШ клеток с иммунофенотипом CD45-CD30++CD64-CD19-CD95+CD40+ и в пределах полученной популяции учитывают CD15+ клетки, составляющие подавляющее большинство среди CD45-CD30++CD64-CD19-CD95+CD40+ клеток.
Изобретение поясняется подробным описанием, примером и иллюстрацией, на которой изображено:
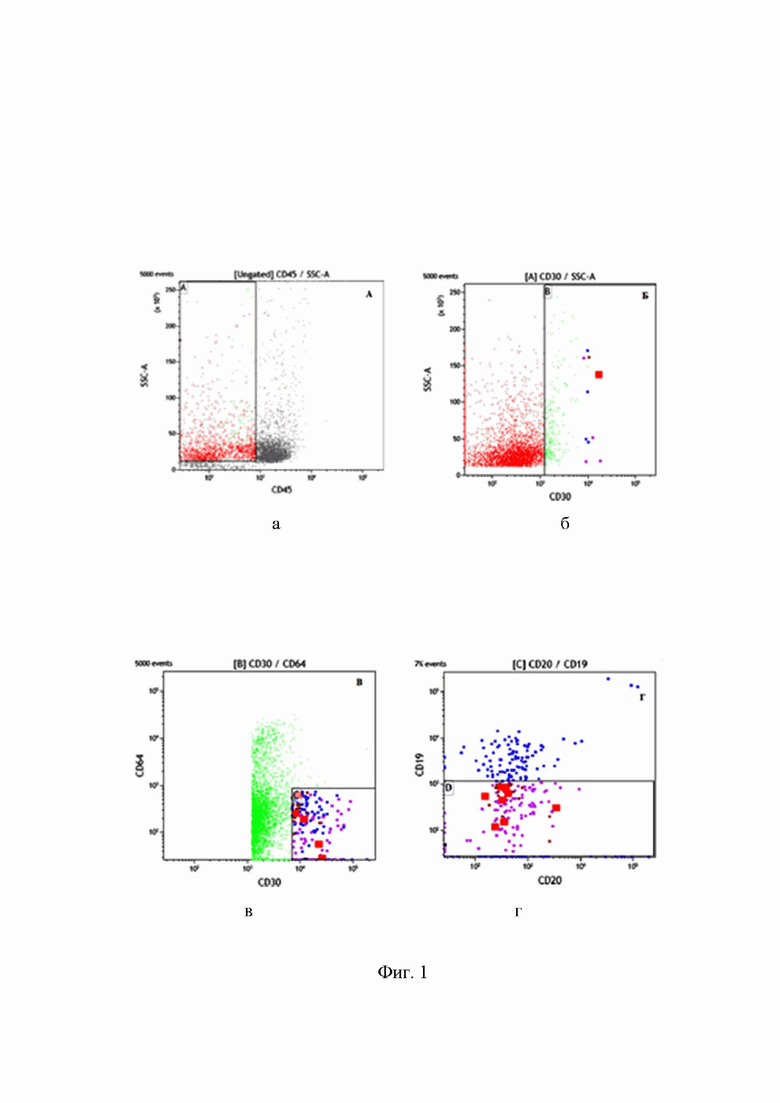
Фиг. 1 - Демонстрация алгоритма проточно-цитометрического выявления клеток БРШ в клеточной суспензии биоптата лимфатического узла: а) выделение CD45-негативных клеток среди всех клеток анализируемого образца; б) в пределах только CD45-негативных клеток выявление CD30+ клеток; в) выделение клеток с яркой экспрессией антигена CD30 и исключение из анализа других миело-моноцитарных клеток по экспрессии миеломоноцитарного антигена CD64; г) исключение из популяции CD30++CD64- примеси В-клеток (CD19+Cd20+) на основании экспрессии соответствующих антигенов.
Способ осуществляют следующим образом.
Аналогично прототипу (Fromm JR, Thomas A, Wood BL. Flow cytometry can diagnose classical Hodgkin lymphoma in lymph nodes with high sensitivity and specificity. Am J Clin Pathol. 2009;131(3):322-332) анализируют биопсийный материал лимфатических узлов пациентов с подозрением на кЛХ. На преаналитическом этапе из ткани лимфатического узла приготавливают клеточную суспензию посредством аккуратного механического растирания ткани в буферном растворе. С полученными клетками проводят прямую реакцию иммунофлуоресценции согласно стандартной методике (Coons, A. H., Kaplan, M. H. (1950). Localization of antigen in tissue cells; improvements in a method for the detection of antigen by means of fluorescent antibody. The Journal of experimental medicine, 91(1), 1-13). При этом клетки окрашивались одномоментно моноклональными антителами к 9 антигенам.
Принципиальные маркеры (Табл.1) объединяют в одну пробу, где оптимально скомбинированы антигены, подобраны моноклональные антитела с оптимальными флуорохромами, выявление которых принципиально для идентификации клеток БРШ. После окрашивания моноклональными антителами пробу анализируют на 14-параметровом проточном цитометре высокого разрешения (например, FACS Aria III).
для выявления клеток БРШ.
флуорохром
Проводят одновременный анализ 10000000 клеток пробы с применением программного обеспечения Kaluza Analysis 2.2, в соответствии с последовательным алгоритмом гейтирования. Согласно иммунофенотипическим характеристикам БРШ клеток определяют CD-45-негативные клетки образца, далее в пределах этих клеток оценивают все CD30+ клетки образца. После чего проводят этап исключения из анализа примеси миело-моноцитарных клеток, для этого берут антиген CD64 и в анализ включают клетки CD30++CD64-, попавшие в область С. Затем в пределах популяции CD30++CD64- исключают возможную примесь В-клеток по экспрессии пан-В-клеточных антигенов CD19 и CD20, далее, среди CD30++CD64-CD19- клеток на основании характеристик светорассеяния FSC/SSC в анализ включают только крупные клетки со средними и высокими показателями бокового светорассеяния SSC. Проводят учет CD95+CD40+ клеток, определяют искомую популяцию БРШ клеток с иммунофенотипом CD45-CD30++CD64-CD19-CD95+CD40+ и в пределах полученной популяции учитывают CD15+ клетки, составляющие подавляющее большинство среди CD45-CD30++CD64-CD19-CD95+CD40+ клеток.
Пример 1.
Был изучен биопсийный материал лимфатических узлов у пациента Х. с диагнозом классическая Лимфома Ходжкина, нодулярный склероз II, IIb стадия.
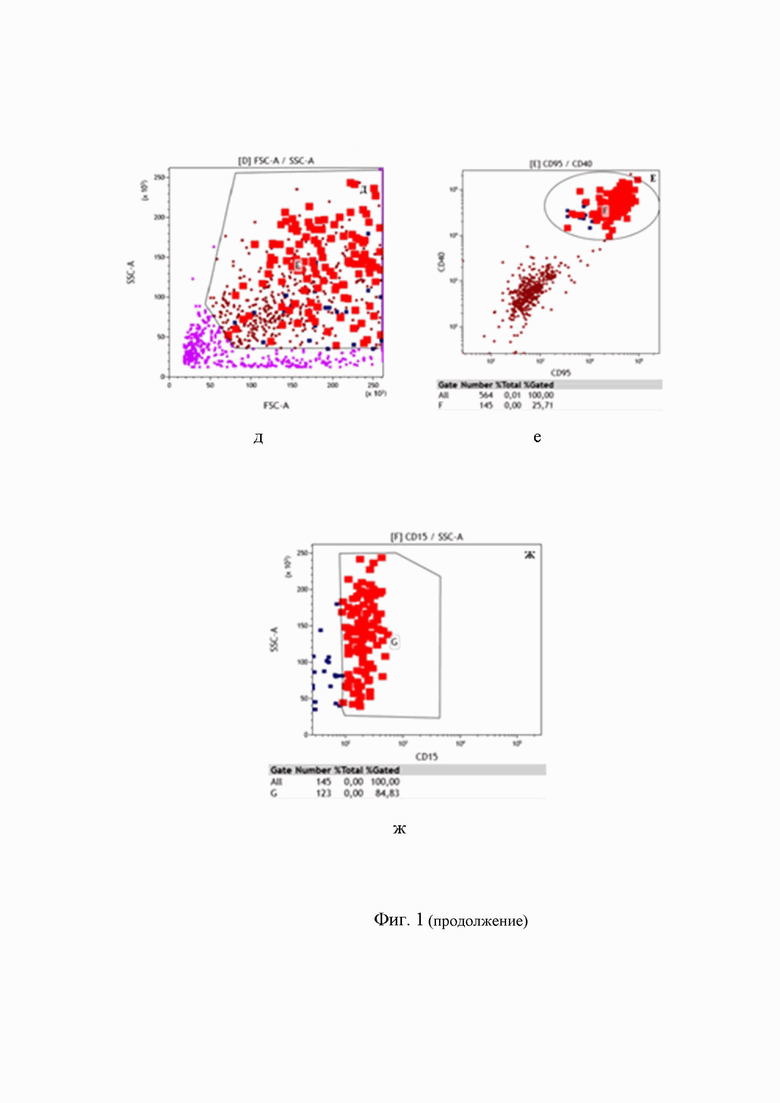
Клеточную суспензию готовили стандартным методом, путем механического растирания ткани в буферном растворе, с полученными клетками провели прямую реакцию иммунофлуоресценции с прямыми флуорохромными коньюгатами моноклональных антител, указанных ранее (Табл. 1) по стандартной методике простановки прямой реакции иммунофлуоресценции Далее пробу анализировали на 14-параметровом проточном цитометре высокого разрешения FACS Aria III и для анализа через прибор пропускали не менее 10 000 000 клеток пробы. Анализ данных проводили с применением программного обеспечения Kaluza Analysis 2.2. В соответствии с последовательным алгоритмом гейтирования и согласно иммунофенотипическим характеристикам БРШ клеток определяли CD45-негативные клетки образца (рис.1А), далее в пределах этих клеток оценивали все CD30+ клетки образца (рис.1Б). На следующем этапе исключали из анализа примесь миело-моноцитарных клеток, на основании экспрессии антигена CD64 и в дальнейший анализ включали только клетки CD30++CD64-, попавшие в область С (рис.1В), затем в пределах популяции CD30++CD64- исключили возможную примесь В-клеток по экспрессии пан-В-клеточных антигенов CD19 и CD20 (рис.1Г). Далее, среди CD30++CD64-CD19- клеток на основании характеристик светорассеяния FSC/SSC в анализ включали только крупные клетки со средними и высокими показателями бокового светорассеяния SSC (рис.1Д). В пределах крупных клеток проводили учет CD95+CD40+ клеток и определяли искомую популяцию БРШ клеток с иммунофенотипом CD45-CD30++CD64-CD19-CD95+CD40+, которая в данном случае составила 145 клеток на 10 000 000 проанализированных клеток полученной нами суспензии клеток лимфатического узла. Дополнительно, в пределах полученной популяции учитывали CD15+ клетки, составляющие подавляющее большинство среди CD45-CD30++CD64-CD19-CD95+CD40+ клеток (рис.1Ж).
Таким образом, суммарное количество клеток БРШ с иммунофенотипом CD45-CD30++CD64-CD19-CD95+CD40+CD15+ составила 123 клетки на 10 000 000 проанализированных клеток полученной нами суспензии клеток лимфатического узла.
Данный случай продемонстрировал наибольшее количество клеток БРШ, выявленное нами в анализируемом образце ЛХ.
Применение данного способа позволило нам во всех анализируемых образцах с диагнозом классическая Лимфома Ходжкина, нодулярный склероз выявить популяцию клеток БРШ в разном количестве, а также установить вариабельность клеток БРШ в отношении экспрессии антигенов CD15 и CD20.
Предложенный способ позволяет очень четко выявлять и характеризовать малые клеточные популяции на основании особенностей их иммунофенотипа, даже если эти клетки являются единичными среди клеток микроокружения.
Изобретение может быть использовано для выявления клеток БРШ в биоптатах и пунктатах лимфатических узлов для подтверждения диагноза кЛХ.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫЯВЛЕНИЯ ЦИРКУЛИРУЮЩИХ В КРОВИ ОПУХОЛЕВЫХ КЛЕТОК МЕТОДОМ МНОГОПАРАМЕТРОВОЙ ПРОТОЧНОЙ ЦИТОМЕТРИИ | 2024 |
|
RU2825188C2 |
| Способ прогноза развития раннего рецидива у больных классической лимфомой Ходжкина | 2019 |
|
RU2702360C1 |
| СПОСОБ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ПАРОКСИЗМАЛЬНОЙ НОЧНОЙ ГЕМОГЛОБИНУРИИ | 2015 |
|
RU2574968C1 |
| Метод определения минимальной остаточной болезни методом мультипараметрической проточной цитометрии у детей и взрослых с В-линейным острым лимфобластным лейкозом в условиях применения CD19-направленной иммунотерапии | 2022 |
|
RU2818950C1 |
| СПОСОБЫ ПОЛУЧЕНИЯ КЛЕТОК, ПРОЯВЛЯЮЩИХ ФЕНОТИПИЧЕСКУЮ ПЛАСТИЧНОСТЬ | 2010 |
|
RU2536941C2 |
| СПОСОБ ДИАГНОСТИКИ СТОРОЖЕВЫХ ЛИМФОУЗЛОВ ПРИ РАКЕ ЖЕЛУДКА | 2020 |
|
RU2727251C2 |
| Способ оценки качества аспирата костного мозга в процессе проведения мониторинга минимальной резидуальной болезни при множественной миеломе | 2016 |
|
RU2639382C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ОСТРЫХ ЛЕЙКОЗОВ С ПОМОЩЬЮ КЛЕТОЧНОГО БИОЧИПА | 2017 |
|
RU2681651C1 |
| СПОСОБ ДЕТЕКЦИИ ВНЕКЛЕТОЧНОЙ ДНК В ЦЕЛЬНОЙ ПЕРИФЕРИЧЕСКОЙ КРОВИ С ИСПОЛЬЗОВАНИЕМ ПРОТОЧНОЙ ЦИТОМЕТРИИ | 2022 |
|
RU2815709C1 |
| Способ оценки минимальной остаточной болезни (МОБ) методом многоцветной проточной цитофлуориметрии у больных острым миелоидным лейкозом (ОМЛ) в постиндукционной фазе лечения | 2022 |
|
RU2802131C1 |
Изобретение относится к области биотехнологии. Описан способ выявления клеток Березовского-Рида Штернберга (БРШ) в лимфатических узлах пациентов с классической лимфомой Ходжкина. Способ включает анализ биопсийного материала лимфатических узлов пациентов с подозрением на кЛХ и приготовление клеточной суспензии путем механического растирания ткани в буферном растворе, после чего проводят прямую реакцию иммунофлуоресценции. Согласно способу изобретения, маркеры CD40, CD95, CD45, CD15, CD64, CD19, CD30, CD20, CD3 объединяют в одну пробу и после окрашивания моноклональными антителами пробу анализируют на 14-параметровом проточном цитометре высокого разрешения. Изобретение расширяет арсенал способов выявления клеток БРШ в лимфатических узлах пациентов с классической лимфомой Ходжкина. 1 ил., 1 табл., 1 пр.
Способ выявления клеток Березовского-Рида Штернберга (БРШ) в лимфатических узлах пациентов с классической лимфомой Ходжкина, включающий анализ биопсийного материала лимфатических узлов пациентов с подозрением на кЛХ и приготовление клеточной суспензии путем механического растирания ткани в буферном растворе, после чего проводят прямую реакцию иммунофлуоресценции, отличающийся тем, что маркеры CD40, CD95, CD45, CD15, CD64, CD19, CD30, CD20, CD3 объединяют в одну пробу и после окрашивания моноклональными антителами пробу анализируют на 14-параметровом проточном цитометре высокого разрешения и проводят одновременный анализ 10 000 000 клеток пробы с применением программного обеспечения Kaluza Analysis 2.2, в соответствии с последовательным алгоритмом гейтирования и согласно иммунофенотипическим характеристикам БРШ клеток определяют CD-45-негативные клетки образца, далее в пределах этих клеток оценивают все CD30+ клетки образца, после чего проводят этап исключения из анализа примеси миело-моноцитарных клеток, для этого берут антиген CD64 и в анализ включают клетки CD30++CD64-, попавшие в область С, затем в пределах популяции CD30++CD64- исключают возможную примесь В-клеток по экспрессии пан-В-клеточных антигенов CD19 и CD20, далее, среди CD30++CD64-CD19- клеток на основании характеристик светорассеяния FSC/SSC в анализ включают только крупные клетки со средними и высокими показателями бокового светорассеяния SSC, проводят учет CD95+CD40+ клеток, определяют искомую популяцию БРШ клеток с иммунофенотипом CD45-CD30++CD64-CD19-CD95+CD40+ и в пределах полученной популяции учитывают CD15+ клетки, составляющие подавляющее большинство среди CD45-CD30++CD64-CD19-CD95+CD40+ клеток.
| Flores M.B.A | |||
| et al | |||
| A new approach to the study of Hodgkin lymphoma by flow cytometry // Pathology, February 2023, 55(1), p | |||
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| Fromm J.R., Thomas A., Wood B.L | |||
| Flow cytometry can diagnose classical Hodgkin lymphoma in lymph nodes with high sensitivity and specificity // American journal of clinical pathology, 2009, 131(3), p | |||
| Ледорезный аппарат | 1921 |
|
SU322A1 |
Авторы
Даты
2024-04-24—Публикация
2023-08-25—Подача