ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к связывающим элементам с измененными диверсифицированными доменами остова, получению библиотек из таких связывающих элементов и селекции и скринингу связывающих элементов из таких библиотек.
УРОВЕНЬ ТЕХНИКИ
Гуманизация антител включает объединение участков, определяющих комплементарность (CDR), животного с каркасами человека. Пересадка CDR представляет собой хорошо отработанный метод, применяемый для гуманизации антител. Антитела, полученные путем иммунизации животного, секвенируют, идентифицируют петли CDR и получают гибридную молекулу, состоящую из человеческого каркаса с одним или более CDR, полученными из антитела животного1. При пересадке CDR вероятно необходимо, чтобы образующийся пептид принял конкретную структуру для сохранения исходной специфичности связывания, и часто необходимо "точно отрегулировать" процесс гуманизации путем изменения дополнительных остатков, включая поддерживающие остатки в каркасном участке.
Не происходящие из антител пептиды из других источников также пересаживали на каркасы антител. Barbas и др. (1993) встраивали природную связывающую интегрин последовательность в участок CDR3 VH антитела человека2, a Frederickson и др. (2006)3 клонировали 14-мерный пептид, который, как известно, связывает рецептор тромбопоэтина (ТРО), в несколько участков CDR антител против столбнячного анатоксина. По 2 аминокислоты на каждом конце указанного пептида рандомизировали и проводили селекцию из полученной библиотеки методом фагового дисплея. Такая же работа описана в документе US 20100041012 А1, наряду со вставкой пептида из 18 аминокислот, о котором известно, что он связывается с рецептором эритропоэтина4. Исходная последовательность связывающего рецептор эритропоэтина пептида содержала два цистеина, которые удаляли из-за предполагаемых проблем с образованием дисульфидной связи в антителе. В этих случаях 2-3 кодона рандомизировали в месте соединения между кодирующей областью встроенного пептида и реципиентным каркасом для выбора оптимальных соединяющих последовательностей из полученных библиотек фагового дисплея. Liu и др. встраивали пептид из 14-16 аминокислот с активностью связывания с CXCR4 в 2 различных CDR (CDR3 VH и VH CDR25). Kogelberg встраивал 17-мерный пептид αVβ6, образующий мотив шпилька : альфа-спираль, в CDR3 VH антитела мыши6. Этот пептид содержит коровый элемент RGDLxxL, который, как известно, направляет связывание с αVβ6. Данная работа дала начало подходу на основе библиотек, сфокусированному на CDR3 VH, в котором старались сымитировать структуру шпилька : альфа спираль7 исходной вставки. Во всех этих случаях антитело действовало в качестве носителя для образующегося пептида, не внося вклад в связывание мишени.
Gallo и др. встраивали пептиды в CDR3 VH, применяя альтернативный подход диверсификации (к введению разнообразия). Диверсификация в антитела в природе происходит внутри В-клеток, и в US 8012714 описан способ воспроизведения такого процесса диверсификации внутри гетерологичных клеток млекопитающих. В созревающих В-клетках гены антитела собираются путем рекомбинации отдельных сегментов V, D и J посредством активностей "генов активации рекомбинации" (RAG1 и RAG2), приводящей к делеции больших фрагментов промежуточных последовательностей. В US 8012714 RAG1 и RAG2 внедряли в эмбриональные клетки почки человека (HEK293) наряду с плазмидами, содержащими субстраты рекомбинации, чтобы воспроизвести рекомбинантное соединение V-D-J в клетках, не относящихся к В-клеткам. В данном основанном на рекомбинации с помощью RAG1/2 подходе используются механизмы клеток млекопитающих, осуществляющие репарацию и эксцизию ДНК, и он не был продемонстрирован в прокариотических клетках.
Такую же in vitro систему на основе клеток млекопитающих использовали в WO 2013134881 A1, где сегмент был эффективно заменен на ДНК, которая кодирует фрагменты пептида, полученные из двух других связывающих молекул. Поскольку обусловленная RAG1/RAG2 диверсификация происходит только в клетках млекопитающих, данную систему нельзя применять напрямую в прокариотических подходах, таких как фаговый дисплей. В WO 2013134881 A1 приведен пример внедрения в CDR3 тяжелой цепи таких же 14-мерных пептидных фрагментов, которые использовали Frederickson3 и Bowdish (US 20100041012 А1). Конструкцию, связывающую рецептор ТРО, внедряли в середину CDR3 и, таким образом, сохраняли последовательности CDR, а также прививали дополнительные аминокислоты с получением в целом 12 или более аминокислот между каркасом антитела и образующимся пептидом. В WO 2013134881 A1 также приведен пример антител, слитых с экстендином-4, которые получали с применением комбинированного линкера длиной в диапазоне 9-14 аминокислот между каркасом антитела и образующимся пептидом.
Saini и др.8,9 сообщили о существовании сверхдлинных богатых цистеином CDR3 внутри домена VH бычьих антител. Данные сверхдлинные CDR VH длиной 40-67 аминокислот, которые составляют 9% ответа бычьих антител, обычно образовывали пары исключительно с определенными легкими цепями Vλ1. Недавно структуру двух таких бычьих антител определили с помощью рентгеноструктурного анализа10 и выявили необычную структуру "стебля", образованную поднимающимися и опускающимися β-цепями, на вершине которых находится "выступ", содержащий пептид с множеством дисульфидных связей, образованных парами остатков цистеина. Эта структура стебель : выступ образована участком CDR3 домена VH, но стебель поддерживается взаимодействиями с CDR1 VH, CDR2 VH, а также всеми CDR спаренной цепи Vλ1. Таким образом, все диверсифицированные CDR данных антител направлены на презентацию "выступа", который сам по себе находится на расстоянии приблизительно 38 ангстрем от поддерживающего каркаса до первого остатка цистеина "выступа"11. Способность других CDR взаимодействовать с тем же эпитопом, который узнает выступ, следовательно, отсутствует или сильно ограничена.
В последующей работе "выступ" заменили на цитокины, такие как колониестимулирующий фактор гранулоцитов12 и эритропоэтин13, которые были связаны со стеблем посредством гибкой последовательности Gly-Gly-Gly-Gly-Ser (SEQ ID NO: 1) (Gly4Ser) на N- и С-концевых местах соединения. Впоследствии показали, что жесткую β-складчатую структуру стебля можно заменить на жесткую структуру антипараллельной суперспирали11. Гибкие линкеры Gly4Ser и Gly-Gly-Ser-Gly (SEQ ID NO: 2) снова помещали на каждом конце суперспиральной последовательности, чтобы "оптимизировать укладку и стабильность полученного в результате этого антитела". Данная конструкция также позволяла представление колониестимулирующего фактора гранулоцитов. Liu и др. использовали такой же подход применения жестких структур стебля, связанных с гибкими пептидами в обоих местах соединения, чтобы соединить лептин и гормон роста в CDR3 VH, CDR2 VH и VL CDR314. В данном примере сохранившееся связывание антитела сочли потенциальным недостатком, и было выдвинуто предложение использовать "нулевое" антитело-партнер, например, антитело к респираторному синцитиальному вирусу (РСВ), чтобы избежать его участия в связывании антитела хозяина.
Peng и др. (2015) сообщали о включении двух природных агонистов (лептина и фолликулостимулирующего гормона) в качестве "гостей" в CDR3 VH антитела с сохранением агонистической активности15. Создали библиотеку слитых белков, в которых гибкие пептиды из 5-15 аминокислот встраивали между доменами на каждом из N- и С-концов, наряду с 3 произвольными аминокислотами на каждом конце (т.е. суммарные длины линкеров составляли 16-36 аминокислот). Библиотеку из 107 слитых вариантов экспрессировали в клетках HEK293, и слитые белки, которые сохраняли активность агониста-"гостя", идентифицировали по активации репортерного гена в аутокринном подходе к скринингу. Полезные свойства увеличенного времени полужизни антитела распространяются на встраиваемого гостя.
Подход Peng и др. (2015) реализовывали в клетках млекопитающих, применяя систему аутокринного репортера, в которой клетки выращивают в полутвердой среде, и секретированные слитые антитела удерживаются вблизи продуцирующей клетки. Таким образом, относительно высокие концентрации секретированного продукта накапливаются в непосредственной близости от клетки16, что затрудняет различение внутри библиотеки клонов с измененной экспрессией/стабильностью или свойствами связывания. Таким образом, существует ограничение на строгость в системе, описанной Peng и др. (2015). Более того, подход функционального скрининга также ограничен скринингами, для которых доступна соответствующая система рецептор/репортер. Доля клонов, которые работали, была низкой (несмотря на преимущество укладки с участием эндогенных шаперонов в клетках млекопитающих).
Антитела широко применяются в качестве связывающего остова (скаффолдв). В качестве альтернативы было продемонстрировано получение связывающих элементов, основанных на не-антительных остовах38,39. Эти сконструированные белки получали из библиотек вариантов, которые диверсифицировали в экспонированных на поверхности остатках коревого остова38,40.
Betton и др. (1997)17 сообщили о встраивании β-лактамазы в несколько принимающих пермиссивных сайтов в связывающих мальтозу белках с применением линкеры длиной 9-10 аминокислот (DPGG-вставка-YPGDP (последовательности SEQ ID NO: 3, 4) и PDPGG-вставка-YPGGP (последовательности SEQ ID NO: 5, 6)). Collinet18 сообщили о встраивании β-лактамазы или дигидрофолатредуктазы в пермиссивные сайты фосфоглицераткиназы с применением аминокислотных остатков SGG или GG на N-концевой точке вставки и GAG на С-концевой точке вставки. Исследования фермента β-лактамазы, который придает бактериям устойчивость к ампициллину, также выявили потенциальные сайты, в которых можно разместить встроенные пептиды19. Vandevenne и др. сообщили о встраивании в один из данных сайтов белка с хитин-связывающим доменом хитотриозидазы макрофагов человека20, применяя конструкцию, которая внедряет 6-7 аминокислот в каждый из N- и С-концов вставки. Crasson и др.21 продемонстрировали функционализацию нанотела путем его встраивания в пермиссивный сайт β-лактамазы, соединяющий две спирали.
КРАТКОЕ ОПИСАНИЕ
Авторы настоящего изобретения обнаружили, что внедрение целого связывающего домена ("донорного диверсифицированного домена остова") внутрь второго связывающего домена ("реципиентного домена остова") повышает разнообразие популяций связывающих элементов и позволяет селекцию и выделение связывающих элементов с полезными свойствами из данных популяций. Это может быть полезно, например, при выборе связывающих элементов, которые связываются с целевыми молекулами, такими как ионные каналы, на которые сложно нацелиться с помощью обычных антител.
В некотором аспекте настоящего изобретения предложен способ скрининга, включающий:
(i) обеспечение исходной библиотеки связывающих элементов,
каждый связывающий элемент в указанной исходной библиотеке содержит слитый белок и необязательно домен-партнер, связанный со слитым белком,
при этом слитый белок содержит донорный диверсифицированный домен остова, встроенный внутрь реципиентного диверсифицированного домена остова, необязательно при этом каждый из N- и С-концов донорного диверсифицированного домена остова связан с реципиентным диверсифицированным доменом остова с помощью линкеров длиной по 4 аминокислоты или менее,
при этом указанный донорный диверсифицированный домен остова содержит донорный остов и донорную последовательность взаимодействия и реципиентный диверсифицированный домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия, и одна или более из донорных последовательностей взаимодействия, реципиентных последовательностей взаимодействия и линкеров в указанной исходной библиотеке различаются,
(ii) скрининг исходной библиотеки для выявления исходных связывающих элементов, которые проявляют активность связывания, и
(iii) идентификацию одного или более исходных связывающих элементов в указанной исходной библиотеке, которые проявляют активность связывания.
В некоторых вариантах реализации линкеры в указанной исходной библиотеке различаются.
Указанный способ может дополнительно включать:
(iv) внедрение диверсифицированных аминокислотных остатков в одно или более положений в последовательности аминокислот одного или более идентифицированных исходных связывающих элементов с получением модифицированной библиотеки связывающих элементов,
(v) скрининг модифицированной библиотеки для выявления модифицированных связывающих элементов, которые проявляют активность связывания, и
(vi) идентификацию одного или более модифицированных связывающих элементов в модифицированной библиотеке, которые проявляют активность связывания.
В некоторых вариантах реализации диверсифицированные аминокислотные остатки можно ввести в донорную последовательность взаимодействия, реципиентную последовательность взаимодействия и/или домен-партнер одного или более идентифицированных исходных связывающих элементов.
Указанный способ может дополнительно включать:
(vii) соединение слитого белка из одного или более идентифицированных связывающих элементов или модифицированных связывающих элементов с диверсифицированной популяцией связывающих доменов-партнеров (цепей-партнеров) с получением перетасованной библиотеки связывающих элементов,
(viii) скрининг перетасованной библиотеки для выявления перетасованных связывающих элементов, которые проявляют активность связывания,
(ix) идентификацию одного или более перетасованных связывающих элементов, которые проявляют активность связывания.
В другом аспекте настоящего изобретения предложен способ получения библиотеки связывающих элементов, включающий:
обеспечение популяции нуклеиновых кислот, кодирующих диверсифицированную популяцию слитых белков, содержащих донорный диверсифицированный домен остова, встроенный в реципиентный диверсифицированный домен остова, необязательно при этом N- и С-концы донорного диверсифицированного домена остова связаны с реципиентным диверсифицированным доменом остова с помощью линкеров из 4 аминокислот или менее на каждом конце,
при этом указанный донорный диверсифицированный домен остова содержит донорный остов и донорную последовательность взаимодействия и реципиентный диверсифицированный домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия, и
одна или более из донорной последовательности взаимодействия, реципиентной последовательности взаимодействия и линкеров в указанной популяции различаются,
экспрессию указанной популяции нуклеиновых кислот с получением диверсифицированной популяции, и
необязательно соединение слитых белков с популяцией доменов-партнеров, таким образом получая библиотеку связывающих элементов.
В другом аспекте настоящего изобретения предложена библиотека связывающих элементов, содержащая:
диверсифицированную популяцию слитых белков, содержащих донорный диверсифицированный домен остова, встроенный в реципиентный диверсифицированный домен остова,
при этом указанный донорный диверсифицированный домен остова содержит донорный остов и донорную последовательность взаимодействия, и реципиентный диверсифицированный домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия, необязательно при этом каждый из N- и С-концов донорного диверсифицированного домена остова связан с реципиентным диверсифицированным доменом остова с помощью линкеров из 4 аминокислот или менее,
при этом указанный донорный диверсифицированный домен остова содержит донорный остов и донорную последовательность взаимодействия, и реципиентный диверсифицированный домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия, и
одна или более из донорной последовательности взаимодействия, реципиентной последовательности взаимодействия и линкеров введено в указанной популяции различаются, и
необязательно при этом указанные слитые белки связаны с партнерами по связыванию с образованием гетеродимеров.
В другом аспекте настоящего изобретения предложен слитый белок, содержащий донорный диверсифицированный домен остова, встроенный в реципиентный диверсифицированный домен остова,
при этом указанный донорный диверсифицированный домен остова содержит донорный остов и донорную последовательность взаимодействия, и реципиентный диверсифицированный домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия, необязательно при этом N- и С-концы донорного диверсифицированного домена остова связаны с реципиентным диверсифицированным доменом остова с помощью линкеров из 4 аминокислот или менее.
В другом аспекте настоящего изобретения предложен связывающий элемент, содержащий слитый белок, описанный в данной заявке, и домен-партнер, связанный с указанным слитым белком.
В других аспектах настоящего изобретения предложены изолированные донорные диверсифицированные домены остова, реципиентные диверсифицированные домены остова или домены-партнеры из связывающих элементов, выявленных и/или выделенных, как описано в данной заявке, например, предложены изолированные донорные диверсифицированные домены остова, сконструированные, как описано в данной заявке, или изолированные реципиентные диверсифицированные домены остова или домены-партнеры, которые могут быть полезны в гетерологичных связывающих элементах, например, связывающих элементах, которые не содержат исходный донорный диверсифицированный домен остова.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1А представлено изображение pIONTAS1, демонстрирующее кассету, содержащую промотор lacl, лидерную последовательность М13, ген антитела scFv - ген 3 (без соблюдения масштаба). Данная кассета присутствует внутри сайтов клонирования Hind3/EcoR1 плазмиды pUC119, которая содержит ген устойчивости к ампициллину, точку начала репликации coleE1 и точку начала репликации бактериофага f1. Ген VH фланкирован сайгами рестрикции Nco1 и Xho1 и the ген VL фланкирован сайтами рестрикции Nhe1 и Not1, что позволяет простое клонирование в совместимые векторы. На фигуре 1В представлено изображение домена VL, демонстрирующее положения каркасных областей (FW) и гипервариабельных участков (CDR). Донор ноттин (knottin) встраивали в положение CDR1 реципиентной VL. Сайты PmI1 и Mfe1 позволяют клонирование библиотеки доноров ноттинов. Область от FR2 до конца FR4 получали из репертуара легких цепей28. Описание фигуры 1C соответствует описанию фигуры 1В, но донором ноттином замещают CDR2 гена VL, используя сайты рестрикции Pst1 и BspE1.
На фигуре 2 показана последовательность синтетических генов одноцепочечного Fv, используемая в конструкции KnotBody. В конструкциях KnotBody использовали VH существующего антитела D12. На фигуре 2А показаны сайты рестрикции Nco1 и Xho1, которые фланкируют последовательность VH, а также гибкий линкер, соединяющий VH с VL. Далее расположена последовательность, кодирующая V лямбда 1а (IGLV1-36) зародышевого типа. Показан CDR1 VL, и ему предшествует сайт клонирования PmI1. Ввели мутацию путем замены Ser на Thr, чтобы позволить включение сайта PmI1 на конце каркаса 1. Данный сайт позволяет клонирование ноттина в положение CDR1 VL. На конце каркаса 2 VL синтетического гена находится пермиссивный сайт Pst1 для клонирование ноттина в положение CDR2. Описание фигуры 2В соответствует описанию фигуры 2А, но на ней показана последовательность зародышевого типа V каппа (IGKV1D-39).
На фигуре 3 показано встраивание донора ноттина EETI-II в реципиентной VL. На фигуре 3А показана последовательность донора ноттина EETI-II с остатками цистеина, выделенными полужирным шрифтом, и коровая последовательность, участвующая в связывании трипсина ("PRIL"), подчеркнута. На фигуре 3В представлено изображение встраивания донора EETI-II в CDR1 или CDR2 гена лямбда зародышевого типа IGLV1-36. Границы определены в соответствии с международной информационной системой ImMunoGenetics (IMGT)29. Аминокислоты указаны в соответствии с однобуквенным кодом аминокислот, принятым Международным союзом чистой и прикладной химии (IUPAC). На фигуре 3В i показана последовательность реципиентного домена V лямбда около CDR1 перед встраиванием ноттина. На фигурах 3В ii и 3В iii показана последовательность после встраивания донора EETI-II. (Последовательность, представленная на фигуре 3В iii, получена с помощью праймера, который позволил ввести дополнительный остаток Gly между остатками донора и каркаса, по сравнению с 3В ii). На фигуре 3В iv показана последовательность реципиентного домена V лямбда около CDR2 перед встраиванием донора, и на фигуре 3В v показана последовательность после встраивания донора EETI-II. Остатки каркаса антитела подчеркнуты и остатки из антитела-реципиента, которые утрачиваются, показаны строчными буквами. В местах соединения, рандомизированные остатки обозначены х, при этом остатки, которые заменяют остатки каркаса или донора, обозначены строчным х. Любые "дополнительные" остатки внутри линкера между указанными доменами выделены полужирным шрифтом и обозначены прописными буквами (A, Z или X). Z означает любую аминокислоту из Val, Ala, Asp или Gly. X представляет собой аминокислоты, кодируемые кодоном VNC (кодирующим 12 аминокислот) или VNS, кодирующим всего 16 аминокислот (V=А, С или G и S=С или G). На фигурах 3C-F показана последовательность ДНК и аминокислот конструкции, полученной путем встраивания донора ноттина EETI-II соответственно в: С. CDR1 IGLV1-36, D. CDR1 IGKV1D-39, Е. CDR2 IGLV1-36 и F. CDR2 IGKV1D-39. (IGLV1-36 представляет собой ген V лямбда зародышевого типа и IGKV1D-39 представляет собой ген V каппа зародышевого типа). Сайты рестрикции, используемые при клонировании, выделены, и каркасные области и CDR подписаны.
На фигуре 4 показан анализ поликлонального фага по результатам 2 раунда селекции. Исследовали связывание поликлонального фага (ось х) из 2 раунда пэннинга библиотеки CDR1 EETI-II (В) и библиотеки CDR2 EETI-II (С) с трипсином. Связывание трипсина не происходило, когда EETI-II непосредственно соединяли с N-концом гена-III (А). На оси y показано связывание трипсина в единицах флуоресценции (Е.Ф.).
На фигуре 5 показан анализ моноклонального связывания клонов KnotBody по результатам 2 раунда селекции. 94 отдельных клона по результатам селекции из библиотеки (раунд 2) EETI-II CDR1 (А) и EETI-II CDR2 (В) переносили в 96-луночные культуральные планшеты, и получали фаг из каждого клона. Для каждого клона исследовали связывание кондиционированного фагом супернатанта с биотинилированным трипсином, иммобилизованным на покрытых нейтравидином планшетах Maxisorp™. Связывание фага с трипсином детектировали, применяя антитело мыши к М13, а затем конъюгированное с европием антитело против антитела мыши. На оси x показан номер клона и на оси y показано связывание трипсина в единицах флуоресценции (Е.Ф.).
На фигуре 6 показан анализ методом вестерн-блот клонов KnotBody и их мутантов GlyAla. Фаги, полученные из 11 (выбранных произвольно) KnotBody (обозначили W1 - W11) и их мутантов GlyAla (обозначили М1 - М11), анализировали с помощью вестерн-блоттинга, применяя антитело мыши к pIII. Слияние гена III дикого типа (ДТ) и гена III KnotBody (KB) визуализировали с помощью вторичного антитела против антител мыши IRDye® 680 (LI-COR, номер в каталоге 926-32220).
На фигуре 7 показана кассета экспрессии Fab KnotBody в векторной системе pIMT12. В данной плазмиде транскрипция кассеты легкой цепи, кодирующей слитый VL EETI-II и домен CL, находится под контролем промотора EF1-альфа. Транскрипция кассеты тяжелой цепи, кодирующей VH D1A12, слитый с константным доменом 1 (СН1) IgG1, находится под контролем промотора CMV.
На фигуре 8А показан анализ методом электрофореза (ЭФ) в ПААГ/ДСН KnotBody IgG1, экспрессированных в клетках HEK-293F (типичный пример). Fab KnotBody очищали, применяя аффинную матрицу CaptureSelect, визуализировали на геле ПААГ/ДСН с помощью окрашивания кумасси. Наиболее интенсивную полосу на уровне приблизительно 50 кДа наблюдали для образцов, полученных при невосстанавливающих условиях, соответствующую полноразмерной молекуле Fab KnotBody (дорожка 2 и 4). Верхнюю полосу (приблизительно 27 кДа) и нижнюю полосу (приблизительно 23 кДа) наблюдали для образцов, полученных при восстанавливающих условиях (дорожка 3 и 5), соответствующую слитым VH-CH1 и слитым ноттин-VL-CL, соответственно. На дорожку 1 загружали маркер молекулярной массы белков Biorad (Biorad, 161-0373). На фигуре 8В показан хроматографический профиль KnotBody, анализированный с помощью эксклюзионной хроматографии с применением колонки Superdex200 PC3.2/30 (GE Healthcare).
На фигуре 9 показана структура слитого EETI-CDR2 VL антитела. Кристаллическая структура KB_А05 (А) при 1,9 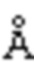 и кристаллическая структура KB_А12 (В) при 2,5
и кристаллическая структура KB_А12 (В) при 2,5 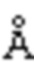 .
.
На фигуре 10А (i) показана ранее опубликованная структура EETI-II, представленная в режиме лент (код PDB 1H9I). Фигура 10А (ii). EETI-II в виде слияния с CDR2 VL. Фигура 10А (iii). Наложение ранее опубликованной структуры EETI-II и EETI-II в виде слияния с CDR2 VL. На фигуре 10В показаны VH и VL (слитые с EETI-II) Fab KB_A05. Остатки CDR VH выделены черным шрифтом и CDR3 VH подписан.
На фигуре 11 показан анализ выхода поликлонального фага в результате селекции фагового дисплея из перетасованных библиотек VH KnotBody. Библиотеки (комбинированные) KB_А07 и KB_А12 с перетасованными тяжелыми цепями подвергали селекции на 5 различных антигенах: cMET-Fc (A), GAS6-CD4 (В), FGFR4-CD4 (С), uPA (D) и B-gal (Е). Исследовали связывание каждого поликлонального фага после 5 указанных селекций с трипсином, всеми указанными антигенами, используемыми для селекции, нейтравидином и стрептавидином, чтобы определить фоновое связывание. На оси х показаны антигены, иммобилизованные на планшетах Maxisorp™, и на оси y показано связывание поликлонального фага с антигеном в единицах флуоресценции (Е.Ф.).
На фигуре 12 показаны типичные примеры связывания моноклональных биспецифических антител KnotBody (после селекции на cMET-Fc и GAS6-CD4) с трипсином и cMET-Fc или с трипсином и GAS6-CD4. Связывание моноклонального фага с указанными антигенами, иммобилизованными на планшетах Maxisorp™, детектировали, применяя антитело мыши к М13, а затем конъюгированное с европием антитело против антитела мыши. На оси х показан номер клона и на оси y показано связывание антигена в единицах флуоресценции (Е.Ф.).
На фигуре 13 показан каскад селекции фагов из библиотеки KnotBody "с перетасованными тяжелыми цепями", подвергнутой селекции на биотинилированном трипсине. Оптимальные концентрации антигена для раунда 2 и раунда 3 определили опытным путем с помощью селекции фаговых антител KnotBody против диапазона концентраций трипсина и сравнения полученных значений с "контролем без антигена".
На фигуре 14 показан формат анализа захвата KnotBody. KnotBody-scFv-Fcs (В) захватывали на планшетах Maxisorp™, покрытых антителом к Fc (А), и связывание биотинилированного трипсина (С) с антителами KnotBody детектировали, применяя конъюгированный со стрептавидином европий (D).
На фигуре 15 показан типичный пример эффективности клонов с улучшенной аффинностью в анализе захвата Fc KnotBody. KnotBody-scFv-Fcs захватывали на планшеты Maxisorp™, покрытые антителом к Fc, и связывание биотинилированного трипсина с антителами KnotBody детектировали, применяя конъюгированный со стрептавидином европий. Сигналы связывания, наблюдаемые для клонов, выделенных в результате селекции по созреванию аффинности, сравнивали с таковыми для исходных клонов KB_А12 и KB_А07. На оси х показан номер клона антитела KnotBody и на оси y показано связывание KnotBody с трипсином в единицах флуоресценции.
На фигуре 16 показано улучшение связывания трипсина после перетасовки тяжелых цепей. Скорость диссоциации клона KB_Tr_F03, выбранного из библиотеки с перетасованными тяжелыми цепями, сравнивали с таковой для двух исходных антител KnotBody KB_A07 и KB_А12. На оси х показан анализ скорости диссоциации в секундах и на оси y показаны резонансные единицы (RU).
На фигуре 17 показана кассета экспрессии KnotBody в векторной системе pINT3-hg1. В данной плазмиде транскрипция кассеты легкой цепи, кодирующей слитые ноттин/токсин VL и домен CL, находится под контролем промотора EF1-альфа. Транскрипция кассеты тяжелой цепи, кодирующей VH D1A12 и константные домены IgG1 (СН1-СН2-СН3), находится под контролем промотора CMV. Сайты PstI и BspEI в гене легкой цепи (реципиента) позволяют встраивание ноттинов (доноров) в положение CDR2.
На фигуре 18 показан анализ методом ЭФ в ПААГ/ДСН KnotBody IgG1, экспрессированных в клетках HEK-293F. Антитела KnotBody очищали, применяя аффинную хроматографию на основе связывания с белком А, визуализировали на восстанавливающем геле ПААГ/ДСН с помощью окрашивания кумасси. Верхние полосы соответствуют тяжелым цепям (ТЦ) антитела и нижние полосы соответствуют легкой цепи антитела, отображающей ноттины/токсины в качестве слитых с CDR2 белков. Образцы 1-4 представляют собой слитые с антителом-реципиентом KB_А12 блокаторы NaV1.7 (Huwentoxin-IV, ProTx-II, Ssm6a и Ssm6a_GGS). Образцы 5-10 представляют собой блокаторы Kv1.3 (калиотоксин, Moka-1 и Shk), слитые с антителом KB_А07 (5, 6 и 7) или антителом KB_А12 (8, 9 и 10). Образцы 11 и 12 представляют собой исходные клоны KnotBody (слитые EETI-II) - KB_А07 и KB_А12, соответственно.
На фигуре 19 показано специфичное связывание двух слитых белков адгирон (adhiron)-антитело с белком LOX-1. В данном анализе связывание фага, на котором отображены слитые с адгироном антитела, с LOX1 детектировали, применяя антитело мыши к М13, а затем конъюгированное с европием антитело против антитела мыши. Исходные антитела KnotBody KB_A07 и KB_А12 (слитые EETI-II) включили в качестве контролей. Белки cMET-FC, GAS6-CD4, FGFR4-CD4, UPA и B-gal использовали для исследования неспецифического связывания. Все антигены были напрямую иммобилизованы на планшетах Maxisorp™.
На фигуре 20 показано представление вторичной структуры, наложенное на первичную последовательность. На фигуре 20А показана последовательность 10ого домена адгезии клеток III типа фибронектина. Элементы вторичной структуры (бета-слои) подчеркнуты. Остатки, которые соединяют бета-слои на верхней поверхности домена, обозначены строчными буквами. На фигуре 20В показана последовательность белка gp2 с обозначенными бета-слоями и альфа-спиральными областями. Потенциальные сайты для встраивания донора или диверсификации показаны строчными буквами. N- и С-концевые остатки, удаленные без нарушения структуры, обозначены курсивным шрифтом меньшего размера.
На фигуре 21 представлены кривые зависимости от концентрации, демонстрирующие зависимое от концентрации ингибирование потоков через канал huKv1.3 антителами KnotBody. Log [M] концентрации (ось х) слитых с токсинами антител KnotBody: KB_A12_Shk (токсин Shk, квадраты), KB_A07_Shk (токсин Shk, треугольники) и KB_А07_KTX (калиотоксин, круги), - нанесен на график в зависимости от % оставшегося потока (ось y). По данным кривым зависимости от концентрации определили концентрацию, при которой ингибируется 50% потока (IC50; краткое описание см. в таблице 11).
На фигуре 22 показано сравнение связывания вариантов KnotBody с разными линкерами с трипсином. Связывание Fab KnotBody (ось х) с биотинилированным трипсином, иммобилизованным на покрытых стрептавидином планшетах Maxisorp™, детектировали, применяя антитело мыши к СН1, а затем конъюгированное с европием антитело против антитела мыши. На оси y показан нормированный сигнал связывания (%), при этом связывание контролей Gly4Ser нормировали на таковое для соответствующего исходного клона (т.е. 100% связывание).
На фигуре 23 показано связывание клонов моноклонального фага, выбранных из библиотеки петель KnotBody, с β-галактозидазой (А) и сМЕТ (В). Связывание моноклонального фага с антигеном, напрямую иммобилизованным на планшетах Maxisorp™, детектировали, применяя антитело мыши к М13, а затем конъюгированное с европием антитело против антитела мыши. На оси х показан номер клона и на оси y показано связывание антигена в единицах флуоресценции (Е.Ф.).
На фигуре 24 показан типичный пример скрининга для выявления KnotBody, связывающихся с TFR крысы. Связывание моноклонального фага с TFR крысы, иммобилизованным на планшетах Maxisorp™, детектировали, применяя антитело мыши к М13, а затем конъюгированное с европием антитело против антитела мыши. На оси х показан номер клона и на оси y показан сигнал фага, связавшегося с TFR, в единицах флуоресценции (Е.Ф.).
На фигуре 25 показано сравнение связывания KnotBody KB_A12 и формата, состоящего из бычьего антитела с природным "сверхдлинным CDR3 VH" ("ULVC-AT коровы"). Богатый цистеином выступ ULVC-AT коровы был замещен на ноттин EETI-II ("EETI-II ULVC-AT коровы"). Гены, кодирующие данные конструкции, клонировали в pSANG4, и фаг высвобождали либо из KB_А12, либо из слитых конструкций EETI-II ULVC-AT коровы (ось х) и преципитировали с помощью ПЭГ. Исследовали связывание 12,5х (А) и 0,5х (В) фага (относительно исходного объема культуры) с биотинилированным трипсином, иммобилизованным на покрытых стрептавидином планшетах Maxisorp™. Связывание фага с трипсином детектировали, применяя антитело к М13, а затем конъюгированное с европием антитело против антитела мыши. На оси y показан сигнал связывания фага в единицах флуоресценции (Е.Ф.).
На фигуре 26 показано схематичное изображение вектора дисплея в млекопитающем pD6. Гены антитела нацелены на локус человека AAVS, который расположен внутри интрона длиной 4428 п.о. между первым и вторым экзонами гена, кодирующего регуляторную субъединицу 12С протеинфосфатазы 1 (PPP1R12C). Пару нуклеаз Tale, направленных на данный участок, используют для расщепления генома в данном сайте. По 700-800 п.о. указанных последовательностей с 5'- и 3'-стороны от сайта расщепления встраивают в донорные векторы в качестве левого и правого плечей гомологии (ПГ), соответственно. Донорный вектор pD6 используют для встраивания генов антитела в формате одноцепочечных Fv (scFv), слитых с Fc-областью IgG1 человека. Указанный вектор также содержит промотор CMV, запускающий экспрессию гена scFv-Fc, и экзон, кодирующий трансмембранный домен из "рецептора фактора роста тромбоцитов" (PDGFR-TM). Участок трансгена, кодирующий слитое антитело scFv-Fc, фланкирован левым и правым плечами гомологии (левое ПГ, правое ПГ), представляющими последовательности, которые фланкируют сайт расщепления в локусе AAVS. Указанный вектор также кодирует ген бластицидина без промотора, который активируется при сплайсинге с сохранением рамки считывания с экзоном 1 внутри локуса AAVS.
На фигуре 27 показана функциональная экспрессия антител KnotBody на поверхности клетки. Все клетки окрашивали меченым РЕ антителом к Fc (канал FL2) и меченым АРС комплексом стрептавидин/биотинилированный трипсин (канал FL4). После трансфекции клетки подвергали селекции в бластицидине и анализировали с помощью проточной цитометрии через 15 дней после трансфекции. На панелях показаны результаты для (А) KB_А07, (В) KB_А12 или (С) нетрансфицированных клеток HEK293.
На фигуре 28 представлено встраивание донора ноттина EETI-II в CDR1 VH (А), CDR2 VH (В), CDR3 VH (С), CDR1 VL (D), CDR2 VL (Е) и CDR3 VL (F) антитела к ТАСЕ - scFv D1A12 (таблица 23, Таре, C.J., PNAS USA 108, 5578-5583 (2011)). Кроме того, создали библиотеку линкеров для KB_А07, в которой донор ноттин ЕЕТ1-II встраивали в CDR2 VL (G). Границы в данном примере определяли в соответствии с базой данных V BASE (MRC, Кембридж, Великобритания) согласно критериям, определенным Чотиа (Chothia и др., J. Mol. Biol. 264, 220-232 (1996)). Аминокислоты обозначены однобуквенным кодом аминокислот согласно IUPAC. На фигуре 28Ai показана последовательность реципиентного домена VH около CDR1 перед встраиванием ноттина. На фигуре 28Aii показана последовательность после встраивания донора EETI-II. На фигуре 28Bi показана последовательность реципиентного домена VH около CDR2 перед встраиванием ноттина. На фигуре 28Bii показана последовательность после встраивания донора EETI-II. На фигуре 28Ci показана последовательность реципиентного домена VH около CDR3 перед встраиванием ноттина. На фигуре 28Cii показана последовательность после встраивания донора EETI-II. На фигуре 28Di показана последовательность реципиентного домена VL около CDR1 перед встраиванием ноттина. На фигуре 28Dii показана последовательность после встраивания донора EETI-II. На фигуре 28Ei показана последовательность реципиентного домена VL около CDR2 перед встраиванием ноттина. На фигуре 28Eii показана последовательность после встраивания донора EETI-II. На фигуре 28Fi показана последовательность реципиентного домена VL около CDR3 перед встраиванием ноттина. На фигуре 28Fii показана последовательность после встраивания донора EETI-II. На фигуре 28Gi показана последовательность реципиентного домена VL KB_А07 "дикого типа" около CDR2 перед рандомизированием линкера. На фигуре 28Gii показана последовательность после рандомизирования остатков линкера. В местах соединения рандомизированные остатки обозначены X.
На фигуре 29 показано встраивание донора ноттина EETI-II 5-3 с другой рамкой считывания в реципиентной VL. Ноттины с другой рамкой считывания встраивали в CDR1 или CDR2 V каппа (IGKV1D-39) или V лямбда (IGLV1-36) легкой цепи. На фигуре 29А показана последовательность нуклеиновых кислот и аминокислот конструкции ноттина ЕЕТ 5-3 с другой рамкой считывания, которую использовали в качестве донора, которую встраивали в CDR1 и CDR2 реципиентной VL. Остатки цистеина выделены полужирным шрифтом, и коровая последовательность, участвующая в связывании трипсина ("PRIL"), подчеркнута. На фигуре 29В показано встраивание донора EETI-II 5-3 в CDR1 или CDR2 гена лямбда зародышевого типа IGLV1-36. Границы определены в соответствии с международной информационной системой ImMunoGenetics (IMGT)29. Аминокислоты обозначены однобуквенным кодом аминокислот согласно IUPAC. На фигуре 29Bi показана последовательность реципиентного домена V лямбда около CDR1 перед встраиванием ноттина. На фигурах 29Bii и 29Biii показана последовательность после встраивания донора EETI-II 5-3. (Последовательность на фигуре 29Biii получали с помощью праймера, который вводил дополнительный остаток Gly между остатками донора и каркаса по сравнению с 29В ii). На фигуре 29В iv показана последовательность реципиентного домена V лямбда около CDR2 перед встраиванием донора и на фигуре 29В v показана последовательность после встраивания донора EETI-II. Остатки каркаса антитела подчеркнуты и остатки из антитела-реципиента, которые утрачиваются, показаны строчными буквами. В местах соединения рандомизированные остатки обозначены х, при этом остатки, которые заменяют остатки каркаса или донора, обозначены строчным х. Любые "дополнительные" остатки внутри линкера между указанными доменами выделены полужирным шрифтом и обозначены прописными буквами (A, Z или X). Z означает любую аминокислоту из Val, Ala, Asp, Gly или Glu (кодируется кодоном GNS). X представляет собой аминокислоты, кодируемые кодоном VNC (кодирующим 12 аминокислот), или VNS, кодирующим всего 16 аминокислот (V=А, С или G и S=С или G). На фигурах 29 C-D показана последовательность ДНК и аминокислот конструкции, полученной путем встраивания донора ноттина EETI-II 5-3 либо в CDR1 (С), либо в CDR2 IGLV1-36 (D). Такой же формат 5-3 ЕЕТ также встраивали в CDR1 и CDR2 IGKV1D-39, который представляет собой ген V каппа зародышевого типа, и его изображение показано на фигуре 3, с использованием нативной (1-5) ориентации EETI-II, но применяя такой же подход, который описан в примере 16 и изображен на фигуре 29 для встраивания формата EETI-II 5-3. Сайты рестрикции, используемые при клонировании, выделены, и каркасные области и CDR подписаны.
На фигуре 30 показано, что KnotBody, содержащее блокирующий Kv1.3 донорный домен (Shk), снижает секрецию цитокинов в Т-клетках. МКПК активировали с помощью антитела к CD3 и инкубировали совместно с KnotBody, в котором диверсифицированный домен донора представляет собой либо Shk (KB_A12_Shk), либо ЕЕТ (KB_А12). Свободный Shk также использовали в качестве положительного контроля. На диаграммах показаны уровни интерферона гамма (IFNγ) (фиг. 30А); гранзима (фиг. 30В), интерлейкина 7А (IL17A) (фиг. 30С) и TNF-альфа (фигура 30D) после активации Т-клеток в МКПК.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены диверсифицированные популяции и библиотеки связывающих элементов, которые содержат донорный диверсифицированный домен остова, встроенный внутрь реципиентного диверсифицированного домена остова, и связывающие элементы, выделенные из таких популяций и библиотек.
Авторы настоящего изобретения показали, что полноразмерный донорный диверсифицированный домен остова способен правильно укладываться с получением стабильной функциональной конформации после встраивания в реципиентный связывающий домен, при этом оба домена остаются биологически активными. Обнаружили, что реципиентный связывающий домен размещает поступивший донорный домен без нарушения его структуры. Более того, донорный и реципиентный домены, каждый из которых содержит множество остатков цистеина, образуют правильные паттерны дисульфидных связей внутри слитого белка.
Комбинации донорных и реципиентных диверсифицированных доменов остова, описанных в данной заявке, полезны для повышения диверсификации (разнообразия) популяций и библиотек связывающих элементов. Например, антитела представляют собой эволюционировавшие в природе диверсифицированные остовы, но большая часть диверсификации сфокусирована участке CDR3 и, в частности, участке CDR3 тяжелой цепи антитела. Внедрение донорного диверсифицированного домена остова в домен VH и/или VL реципиентного антитела значительно повышает доступное разнообразие химерного связывающего элемента донор/антитело.
Более того, если донорный диверсифицированный домен остова склонен связываться с конкретным классом целевых молекул, таких как ионный канал, такая склонность может передаться связывающему элементу, содержащему донорный диверсифицированный домен остова. Таким образом, связывающий элемент может сохранять активность связывания донорного диверсифицированного домена остова (например, связывания ноттина с ионным каналом), при этом также время полужизни соответствует таковому у реципиентного диверсифицированного домена остова in vivo (например, антитела).
Предпочтительно, донорные и реципиентные диверсифицированные домены остова химерного связывающего элемента согласно настоящему изобретению непосредственно соединены или связаны короткими линкерами, чтобы ограничить или сдержать гибкость и относительные движения между доменами, чтобы связывающий элемент был относительно жестким. Более длинные не структурированные линкеры в большей степени подвержены протеолитической деградации, а также могут способствовать образованию неправильных дисульфидных связей посредством повышенной конформационной гибкости. Кроме того, конформационная гибкость более длинных, относительно не структурированных пептидов компрометирует аффинность взаимодействия. При взаимодействии между 2 молекулами, такими как антитело и антиген, конформационная энтропия утрачивается при образовании комплекса. При использовании более длинных линкеров между донорными и реципиентными диверсифицированными доменами остова потенциально доступно гораздо больше конформаций, в результате чего образование комплекса становится энергетически невыгодным. Напротив, образование комплекса, содержащего более структурированный слитый белок с короткими линкерами или без линкеров будет энтропически более выгодным, потенциально приводя к взаимодействию с более высокой аффинностью30,31,32,33.
Поскольку конформационная гибкость приводит к термодинамическим "энтропическим потерям" для взаимодействий со связыванием, ограничение конформационных взаимоотношений между донорными и реципиентными диверсифицированными доменами остова, описанными в данной заявке, минимизирует энтропические потери от взаимодействий и приводит к выигрышу в аффинности полученного в результате этого взаимодействия связывающего элемента.
Учитывая непосредственную близость донорных и реципиентных диверсифицированных доменов остова, аминокислоты на поверхности как донорных, так и реципиентных диверсифицированных доменов остова могут вносить вклад в паратоп, который связывается с молекулой-мишенью или различными целевыми молекулами внутри комплекса. Это может повышать аффинность или специфичность связывающего элемента по сравнению с любым диверсифицированным доменом остова отдельно. Домен-партнер любого из донорного или реципиентного диверсифицированного домена остова также может вносить вклад в связывание с молекулой-мишенью. Любой из донорного, реципиентного домена или домена-партнера может контактировать с близко расположенными сайтами на целевой молекуле или комплексе.
Связывающий элемент, описанный в данной заявке, может включать слитый белок. Указанный слитый белок представляет собой химерную молекулу, содержащую два диверсифицированного домена остова: донорный диверсифицированный домен остова и реципиентный диверсифицированный домен остова.
Донорный диверсифицированный домен остова расположен внутри реципиентного диверсифицированного домена остова, т.е. донорный диверсифицированный домен остова фланкирован с обоих N- и С-концов реципиентным диверсифицированным доменом остова.
Предпочтительно, как донорные, так и реципиентные диверсифицированные домены остова слитого белка вносят вклад в активность связывания указанного слитого белка, например, связывания с одинаковыми или различными целевыми молекулами.
В других вариантах реализации один из донорных и реципиентных диверсифицированных доменов остова указанного слитого белка, предпочтительно донорный диверсифицированный домен остова, отвечает за активность связывания указанного слитого белка, например, связывания целевой молекулы.
В некоторых предпочтительных вариантах реализации слитый белок подходит для представления на поверхности бактериофага, например, для селекции с помощью фагового дисплея. Слитый белок для дисплея может дополнительно содержать белок оболочки фага, такой как pIII, pVI, pVIII, pVII и pIX из фага Ff, или капсидный белок, кодируемый геном 10 фага Т7. Белок оболочки фага может быть расположен на N- или С-конце указанного слитого белка, предпочтительно на С-конце указанного слитого белка.
Диверсифицированный домен остова представляет собой структурный домен с независимой укладкой со стабильной третичной структурой, которая способна представлять диверсифицированные последовательности взаимодействия, способные опосредовать связывание с молекулой-мишенью. Диверсифицированные домены остова включают домены, присутствующие в паралогичных или ортологичных группах, которые использовались в процессе эволюции, чтобы осуществлять взаимодействия указанного каркаса с другими молекулами. Диверсифицированные домены остова также включают природные домены, которые были сконструированы, чтобы обеспечить разнообразие, а также полностью синтетические белки, эволюционировавшие или разработанные таким образом, чтобы они образовывали стабильную самостоятельно упаковывающуюся структуру.
Примеры диверсифицированных доменов остова, известные в данной области, включают домены иммуноглобулинов41, богатые цистеином пептиды, такие как ноттины и пептидные токсины из яда, аффитела (сконструированный домен Z домена белка А)42,43, монотела (т.е. сконструированные фибронектины)44, разработанные белки с анкириновыми повторами (DARPin)45, адгироны46, антикалины47, тиоредоксин48, однодоменные антитела49,50 и белок гена 2 фага Т7 (Gp2)51.
В некоторых предпочтительных вариантах реализации диверсифицированный домен остова может содержать множество дисульфидных мостиков, образованных остатками цистеина внутри домена остова.
Предпочтительные диверсифицированные домены остова для применения, описанного в данной заявке, включают домены VH и VL антитела. Связывание Т-клеточных рецепторов с мишенями также направляют петли CDR, присутствующие внутри вариабельных доменов Ig (α и β), при этом наибольшая диверсификация присутствует в CDR3 β-цепи. Их использовали in vitro для представления диверсифицированных последовательностей34,35. Другие домены Ig, такие как константные домены Ig в тяжелых цепях (например, СН1, СН2 и СН3) и легких цепях (С-каппа, С-лямбда) антитела, также можно применять в качестве диверсифицированных остовов 36,37. Помимо антител и Т-клеточных рецепторов, домен Ig присутствовал в рамках диверсификации остова, распространяясь и эволюционируя в ходе эволюции, и домены Ig обнаружены во множестве сотен различных белков, участвующих в молекулярном распознавании. Домены Ig из таких белков можно применять в качестве диверсифицированных доменов остова, описанных в данной заявке,
Остов диверсифицированного домена остова представляет собой каркас, который поддерживает элементы вторичной структуры, которые объединяются с образованием стабильной коровой структуры домена. Остов содержит множество смежных или несмежных остатков остова, которые образуют ковалентные и нековалентные взаимодействия с боковыми цепями или основной пептидной цепью других остатков остова в указанном домене. Взаимодействия могут включать водородные связи, дисульфидные связи, ионные взаимодействия и гидрофобные взаимодействия. Указанные остатки остова могут образовывать элементы вторичной структуры домена, такие как α-спирали, β-слои, β-листы и другие структурные мотивы. Так как они вносят вклад в коровую структуру диверсифицированного домена остова, остатки остова консервативны, и замена остатков остова внутри диверсифицированного домена остова ограничена.
Примеры остовов включают каркасные области вариабельного домена антитела или каркас цистеинового узла ноттинов (например, шесть или более остатков цистеина, которые образуют характерную узловую структуру), вместе с бета-слоями и мотивом 310-спираль ноттина.
Последовательность взаимодействия диверсифицированного домена остова представляет собой последовательность смежных или несмежных аминокислот, которая представлена стабильной коровой структурой каркаса. Последовательность взаимодействия может взаимодействовать с другими молекулами и опосредовать активность связывания указанного домена, например, связывания с молекулой-мишенью. В некоторых вариантах реализации последовательность взаимодействия домена может содержать один или более диверсифицированных остатков, позволяя селекцию связывающих элементов с определенной активностью связывания и их выделение из библиотеки.
Остатки последовательности взаимодействия могут быть полностью неструктурными и могут не поддерживать и не вносить вклад в третичную структуру домена. Например, указанные остатки взаимодействия могут располагаться в петлях или изгибах между элементами вторичной структуры или мотивами. Так как они не вносят вклад в коровую структуру диверсифицированного домена остова, указанные остатки последовательности взаимодействия менее консервативны, и замена остатков взаимодействия в диверсифицированном домене остова менее ограничена. В некоторых вариантах реализации последовательность взаимодействия диверсифицированного домена остова может содержать остатки в поверхностях белка, не относящихся к петлям43,44,52.
Примеры последовательностей взаимодействия включают участки CDR вариабельного домена антитела и петли, соединяющие элементы вторичной структуры стабильных, самоупаковывающихся доменов белка, например, соединяющие петли ноттина, такие как мотив PRIL петли 1 EETI-II. Другие примеры последовательностей взаимодействия внутри каркасных доменов известны в данной области 34-38, 41-48,51, 53.
В некоторых вариантах реализации домен может содержать остатки, которые вносят вклад как в связывание, так и во вторичную структуру. Данные остатки могут составлять как последовательности остова, так и последовательности взаимодействия. Это можно проиллюстрировать с помощью аффител (сконструированного домена Z домена белка А) 43, 52 и монотел (сконструированных каркасов на основе домена фибронектина)44. В связывающих элементах, описанных в данной заявке, можно диверсифицировать остатки, которые вносят вклад как во вторичную структуру, так и в связывание. Связывающие элементы, которые сохраняют вторичную структуру, например, можно выявить в библиотеках, применяя стандартные методики селекции. В некоторых вариантах реализации остатки, которые вносят вклад как во вторичную структуру, так и в связывание, нельзя диверсифицировать.
В слитых белках и связывающих элементах, описанных в данной заявке, диверсифицированные домены остова можно использовать либо в качестве донорных, либо в качестве реципиентных диверсифицированных доменов остова.
Донорный диверсифицированный домен остова содержит донорный остов и донорную последовательность взаимодействия.
Предпочтительно донорные диверсифицированные домены остова содержат N- и С-концы, которые расположены проксимально друг к другу в нативной структуре домена. Расстояние между указанными концами донора, например, может находиться в пределах 20% от расстояния между концами участка вставки в реципиентном диверсифицированном домене остова, более предпочтительно расстояние одинаково. Примеры донорных доменов с проксимальными концами включают ноттины54, адгироны46 и каркасы Gp251.
В других вариантах реализации донорные диверсифицированные домены остова могут содержать N- и С-концы, которые не проксимальны в нативной структуре домена. Донорные диверсифицированные домены остова с непроксимальными N- и С-концами можно встроить в реципиентный диверсифицированный домен остова, описанный в данной заявке, применяя линкеры, длина которых достаточна для того, чтобы позволить слияние концов донорного домена с петлями реципиентного диверсифицированного домена остова, таким образом, что указанные линкеры служат перемычкой между концами донорного и реципиентного доменов. В качестве альтернативы, донорный диверсифицированный домен остова можно укоротить, чтобы создать донорный домен, в котором N- и С-концы находятся поблизости, или реципиентный диверсифицированный домен остова можно укоротить, чтобы создать реципиентный домен, в котором концы участка встраивания находятся вблизи концов донорного домена. Конечным результатом будет утрата остатков, происходящих из слитых структурных доменов донора и реципиента. Линкеры или укорочения могут уменьшить расстояние между указанными концами донорного домена до 20% от расстояния между концами участка встраивания в реципиентном остове, или более предпочтительно расстояние одинаково.
Донорный диверсифицированный домен остова может состоять из по меньшей мере 15, по меньшей мере 20, по меньшей мере 25, по меньшей мере 30 или по меньшей мере 40 аминокислот. Донорный диверсифицированный домен остова может состоять из 400 или менее, 300 или менее, 200 или менее или 100 или менее аминокислот. Например, донорный диверсифицированный домен остова может состоять из от 20 до 400 аминокислот.
Донорный диверсифицированный домен остова может содержать 2, 4, 6, 8, 10 или более остатков цистеина, которые образуют дисульфидные связи в каркасном домене (т.е. указанный домен может содержать 1, 2, 3, 4, 5 или более дисульфидных связей).
В некоторых вариантах реализации донорные диверсифицированные остовы могут состоять из по меньшей мере 15 аминокислот и содержат 4 или более остатков цистеина.
Примеры подходящих донорных диверсифицированных доменов остова включают иммуноглобулин, домен иммуноглобулина, домен VH, домен VL, аффитело, богатый цистеином пептид, такой как пептид токсина из яда или ноттин, "разработанный белок с анкириновыми повторами" (DARPin), адгирон, домен фибронектина, антикалин, белок гена 2 (Gp2) фага Т7, монотело, однодоменное антитело49, 50 или аффитело.
Предпочтительные донорные диверсифицированные домены остова включают богатые цистеином пептиды, такие как модулирующие ионные каналы пептиды, пептидные токсины из яда и ноттины.
Богатые цистеином пептиды содержат сеть дисульфидных связей в качестве корового структурного элемента. Структурные конформации богатых цистеином пептидов хорошо известны в данной области55, 6.
Модулирующие ионные каналы пептиды (как агонистические, так и антагонистические), содержащие множество дисульфидных связей, хорошо известны в данной области. Примеры включают пептидные токсины из яда из ядовитых видов, таких как пауки, змеи, скорпионы и ядовитые улитки26, 55.
Структурные конформации и паттерны дисульфидных связей пептидов токсина яда также хорошо известны в данной области. Например, анализ ядов пауков и других животных выявил большое разнообразие конформаций и паттернов дисульфидных связей55, 65, 66, 67. Например, паттерн дисульфидных связей токсина паука Huwentoxin-II следующий: I-III, II-V, IV-V168, и паттерн дисульфидных связей "двойственных атракотоксинов" (J-ACTX) следующий: I-IV, II-VII, III-IV и V-VIII (включая необычную "вицинальную" дисульфидную связь между 2 соседними остатками цистеина)56, где пары римских цифр относятся к порядку, в котором каждый цистеин появляется в последовательности, и положению партнера цистеина, с которым он образует дисульфидную связь.
Богатые цистеином пептиды могут содержать структуру "дисульфид-направленной бета-шпильки" (DDH), содержащей антипараллельную бета-шпильку, стабилизированную 2 дисульфидными связями56. Коровая структура DDH обнаружена в широко изученной структуре "ингибиторного цистеинового узла" (далее называемой минибелками с цистеиновым узлом или ноттинами).
Ноттины представляют собой малые богатые цистеином белки, которые содержат переплетенный связанный дисульфидными связями каркас, трехнитевую укладку β-листа и одну или более выставленных в растворитель петель. Ноттины обычно содержат по меньшей мере 3 дисульфидных мостика, и для них характерен дисульфидный узел, который образуется, когда дисульфидный мостик между остатками цистеина III и VI пересекает макроцикл, образованный двумя другими дисульфидами (дисульфидами I-IV и II-V) и связанным остовом. Данные мостики стабилизируют обычную третичную укладку, образованную антипараллельными β-слоями и, в некоторых случаях, короткой спиралью 310. (Пары римских цифр относятся к порядку, в котором каждый цистеин появляется в последовательности, и к положению партнера цистеина, с которым он образует дисульфидную связь). Длина ноттинов составляет 20-60 остатков, обычно 26-48 остатков, и их обнаружили в разнообразных организмах от членистоногих, моллюсков и паукообразных до растений57. Ноттины, происходящие от улиток конусов (конотоксины), в частности, были широко изучены54,58-60. Было обнаружено множество тысяч других ноттинов, и их последовательности и структуры находятся в открытом доступе57,61,62, например, в размещенной в Интернете базе данных (такой как размещенная в интернете база данных ноттинов57 Centre de Biochimie Structural, CNRS, Франция).
В некоторых вариантах реализации в целом правильную вторичную структуру ноттина можно придать с помощью правильного распределения и расстояний между остатками цистеина. В других вариантах реализации может потребоваться один или более дополнительных остатков остова для придания правильной вторичной структуры. Например, остатки 11-15 и 22-25 EETI-II направляют склонность к укладке 11-15 в виде участка 310-спирали, а 22-25 - в виде участка β-изгиба, соответственно, в отсутствие любых дисульфидов63.
Ноттины проявляют высокую степень гибкости последовательности и могут размещать большие количества ненативных последовательностей. Например, EETI-II может разместить более 50% ненативных последовательностей (при рандомизации 2 из петель)24.
Подходящий богатый цистеином пептид для применения для диверсификации остова, описанной в данной заявке, может, например, включать последовательность аминокислот Huwentoxin-IV, ProTx-II, Ssm6a, калиотоксина, мокатоксина-1, конотоксина-ω, MCoTI-II, Shk, РсТХ1 или мамбалгина (mambalgin) (как показано в таблице 8А; последовательности SEQ ID NO: 7-25), или другую последовательность, представленную в базе данных ноттинов, или может представлять собой фрагмент или вариант данной последовательности, у которых сохранилась правильная укладка структуры.
Ноттин, который представляет собой вариант эталонной последовательности ноттина, такой как последовательность, показанная в таблице 8А (SEQ ID NO: 7-25) или представленная в базе данных ноттинов, может включать последовательность аминокислот, идентичную по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95%, или по меньшей мере на 98% эталонной последовательности. Конкретные варианты последовательности аминокислот могут отличаться от последовательности ноттина из таблицы 8А (SEQ ID NO: 7-25) по вставке, добавлению, замене или делеции 1 аминокислоты, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более 10 аминокислот.
Подобие и идентичность последовательностей обычно определяют, руководствуясь алгоритмом GAP (Wisconsin Package, Accelerys, Сан-Диего, США). В GAP для выравнивания двух полноразмерных последовательностей используется алгоритм Нидлмана-Вунша, который максимизирует количество совпадений и минимизирует количество гэпов. Как правило, используют следующие параметры по умолчанию: штраф за открытие гэпа = 12 и штраф за продление гэпа = 4. Применение GAP может быть предпочтительным, но можно применять другие алгоритмы, например, BLAST (в котором применяют способ, описанный в Altschul и др. (1990) J. Mol. Biol. 215: 405-410), FASTA (в котором применяют способ, описанный в Pearson и Lipman (1988) PNAS USA 85: 2444-2448), или алгоритм Смита-Уотермана (Smith и Waterman (1981) J. Mol Biol. 147: 195-197), или программу TBLASTN, описанную выше в Altschul и др. (1990), как правило, используя параметры по умолчанию. В частности, можно применять алгоритм позиционно-специфичного итерационного BLAST (psi-Blast) (Nucl. Acids Res. (1997) 25 3389-3402).
Сравнение последовательностей можно осуществлять по всей длине соответствующей последовательности, описанной в данной заявке.
В один или более остатков внутри петли ноттина, например, один или более остатков внутри петли 1, 2, 3, 4 или 5 ноттина можно диверсифицировать или рандомизировать. В некоторых вариантах реализации в один или более остатков внутри мотива связывания мишени, такого как мотив связывания трипсина PRIL в петле 1 EETI-II, или соответствующие остатки в отличном ноттине, можно диверсифицировать. Например, можно диверсифицировать 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более остатков.
Образование нативных паттернов дисульфидных связей в донорных и реципиентных диверсифицированных доменах вместе и принятие правильных вторичных структур в доменах остова слитого белка пояснено примером ниже.
В других предпочтительных вариантах реализации донорный диверсифицированный остов представляет собой адгирон. Адгироны представляют собой пептиды, состоящие из приблизительно 80-100 аминокислот, на основе полученных из растения фитоцистатинов46. Подходящие последовательности адгиронов хорошо известны в данной области и описаны в других местах в данной заявке. Подходящий адгирон для применения для диверсификации остова, описанного в данной заявке, например, может содержать последовательность аминокислот, показанную в таблице 12 (последовательности SEQ ID NO: 26, 27), или может представлять собой фрагмент или вариант данной последовательности.
Адгирон, который представляет собой вариант эталонной последовательности адгирона, такой как последовательность, показанная в таблице 12 (последовательности SEQ ID NO: 26 и 27), может включать последовательность аминокислот, идентичную по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% эталонной последовательности. Конкретные варианты последовательности аминокислот могут отличаться от последовательности, представленной в таблице 12 (последовательностей SEQ ID NO: 26 и 27), по вставке, добавлению, замене или делеции 1 аминокислоты, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более 10 аминокислот.
Для способов, описанных в данной заявке, не требуется знание структуры донорного диверсифицированного домена остова. Селекция связывающих элементов может быть основана на связывании с молекулой-мишенью (если известна) или правильной укладке реципиентного домена. Донорный диверсифицированный домен остова может быть предоставлен внутри библиотеки, из которой можно выбрать клоны с правильной укладкой реципиентного остова, или может быть встроен в существующий реципиентный диверсифицированный остов, в котором размещен поступивший донорный диверсифицированный остов.
Неспособность одного каркасного домена к укладке будет влиять на общую экспрессию и стабильность полученного слитого белка, и, следовательно, также будет возможность диверсификации при отсутствии знания о структуре и провести скрининг для выявления остаточной экспрессии упакованного каркасного домена. Тем не менее, если структура донорного диверсифицированного домена остова известна, то сайты для диверсификации при конструировании библиотек можно выбрать, руководствуясь данной структурой.
Реципиентный диверсифицированный домен остова и донорный диверсифицированный домен остова предпочтительно являются гетерологичными, т.е. их соединяют искусственно с помощью рекомбинантных средств, и они не соединены в природе. В некоторых предпочтительных вариантах реализации указанные донорные и реципиентные диверсифицированные домены остова принадлежат к различным классам остова, например, они не являются вместе иммуноглобулинами, не являются вместе богатыми цистеином белками, не являются вместе ноттинами или не являются вместе адгиронами.
Реципиентный диверсифицированный домен остова включает реципиентный остов и реципиентную последовательность взаимодействия.
В некоторых вариантах реализации в реципиентном диверсифицированном домене остова могут отсутствовать остатки цистеина, которые образуют дисульфидные связи. Например, каркасный домен может содержать 0 или 1 остаток цистеина. В других вариантах реализации реципиентный диверсифицированный домен остова может содержать 2, 4, 6, 8, 10 или более остатков цистеина, которые образуют дисульфидные связи в домене остова (т.е. указанный домен может содержать 1, 2, 3, 4, 5 или более дисульфидных связей).
Примеры подходящих реципиентных диверсифицированных доменов остова включают домен иммуноглобулина, домен VH, домен VL, ноттин, белок А, богатый цистеином пептид, токсин из яда, разработанный белок с анкириновыми повторами (DARPin), адгирон, домен фибронектина, антикалин и белок гена 2 фага Т7 (Gp2).
Выбор места встраивания донорного диверсифицированного домена остова и линкерных последовательностей может определяться структурой реципиентного домена, если указанная структура известна64,53,23,75,39,43. Например, подходящее место встраивания можно расположить на участке, соединяющем элементы вторичной структуры реципиентного диверсифицированного домена остова, такие как бета-цепи или альфа-спирали. Подходящие участки для места встраивания внутри 10ого домена клеточной адгезии фибронектина III типа показаны на фиг. 20А (SEQ ID NO: 28) и участки для места встраивания внутри белка gp2 Т7 показаны на фиг. 20В (SEQ ID NO: 29). Определение подходящих мест встраивания более подробно описано в примере 10, ниже. Знания о структуре также можно использовать для прямой диверсификации при конструировании библиотек.
Предпочтительно реципиентный диверсифицированный домен остова представляет собой полноразмерный иммуноглобулин или его часть, наиболее предпочтительно, полноразмерный вариабельный домен антитела или его часть. Например, реципиентный диверсифицированный домен остова может представлять собой вариабельный домен легкой цепи (VL) антитела или вариабельный домен тяжелой цепи (VH) антитела.
Поступивший донорный диверсифицированный домен остова разделяет реципиентный диверсифицированный домен остова на N-концевую и С-концевую части в точке встраивания в реципиента. Донорный диверсифицированный домен остова встроен внутрь реципиентного диверсифицированного домена остова таким образом, что N-конец и С-конец донорного диверсифицированного домена остова соединены либо непосредственно, либо через линкер с N- и С-концевыми частями, соответственно, реципиентного диверсифицированного домена остова. В некоторых вариантах реализации один или более остатков на N- и/или С-концах донорного диверсифицированного домена остова или реципиентного диверсифицированного домена остова можно удалить и/или рандомизировать. В реципиентном диверсифицированном домене остова сохраняются исходные N- и С-концы, которые не затрагиваются вставкой донорного диверсифицированного домена остова во внутреннее место встраивания.
В некоторых вариантах реализации ориентацию поступившего донорного диверсифицированного домена остова по сравнению с реципиентным диверсифицированным доменом остова можно изменить путем соединения реципиентного диверсифицированного домена остова с различными положениями внутри донорного диверсифицированного домена остова. Например, поворачиваемый донорный диверсифицированный домен остова можно разработать путем циклизации донорного диверсифицированного домена остова посредством соединения нативных N- и С-концов и линеаризации в отличном положении в последовательности аминокислот, чтобы создать искусственные N- и С-концы. Данные искусственные концы можно соединить с реципиентным диверсифицированным доменом остова внутри слитого белка. Другими словами, нативные N- и С-концы донорного диверсифицированного домена остова, такие как в богатом цистеином пептиде, можно соединить напрямую или посредством пептидной последовательности, и создать искусственные N- и С-концы в отличном положении в последовательности донорного диверсифицированного домена остова. В слитом белке, полученном с применением данных искусственных N- и С-концов, донорный диверсифицированный домен остова поворачивается относительно реципиентного диверсифицированного домена остова, по сравнению со слитым белком, содержащим донорный диверсифицированный домен остова с нативными N- и С-концами. Например, можно изменить порядок петель внутри донорного диверсифицированного домена остова. Примеры донорных диверсифицированных доменов остова ЕЕТI-II с измененной ориентацией показаны в таблице 28 (последовательности SEQ ID NO: 302-307).
Предпочтительно, донорный диверсифицированный домен остова полностью заменяет часть или всю последовательность петли реципиентного диверсифицированного домена остова, таким образом, что донорный диверсифицированный домен остова непосредственно связан с остатками остова реципиентного диверсифицированного домена остова. Например, последовательности петель, соединяющие элементы вторичной структуры в реципиентном домене (например, CDR, соединяющий 2 β-цепи β-слоя каркасных элементов в вариабельном домене антитела), можно полностью удалить. В некоторых вариантах реализации один или более остатков остова можно удалить или заменить в донорном диверсифицированном домене остова или реципиентном диверсифицированном домене остова, чтобы уменьшить расстояние между ними, при этом позволяя укладку составных частей указанного слитого белка.
Предпочтительно донорный диверсифицированный домен остова расположен в слитом белке рядом с последовательностью взаимодействия реципиентного диверсифицированного домена остова. Например, донорный диверсифицированный остов может быть расположен менее чем в 20 ангстремах от реципиентного донорного остова, например, в 8-13 ангстремах в случае вставки ноттина, приведенного в качестве примера в данной заявке; рассчитывали от конца предыдущего каркаса до первого цистеина донорного/узлового мотива. Такая близость позволяет обеим взаимодействующим последовательностям взаимодействовать с одним и тем же или близко расположенным сайтом на целевой молекуле или комплексе, таким образом, что как донорный, так и реципиентный домены могут одновременно способствовать связыванию. Например, в слитом белке могут отсутствовать жесткие стебли и гибкие линкеры для соединения донорного диверсифицированного домена остова с реципиентным диверсифицированным доменом остова.
В некоторых предпочтительных вариантах реализации реципиентный диверсифицированный остов представляет собой вариабельный домен антитела, например, домен VH или VL антитела.
Остов реципиентного домена VH, VL каппа или VL лямбда может содержать остатки 1-26, 39-55 и 66-104 (нумерация IMGT) домена. Указанный остов также может содержать остатки каркаса 4, которые кодируются последними 11 остатками, кодируемыми сегментами J тяжелой цепи и последними 10 остатками, кодируемыми сегментами J легких цепей каппа и лямбда. Последовательность взаимодействия домена VH, VL каппа или VL лямбда может содержать остатки с 27 по 38 (CDR1), с 56 по 65 (CDR2) и с 105 по 117 (CDR3) (нумерация IMGT).
Примеры предпочтительных реципиентных диверсифицированных доменов остова показаны в таблице 1 со встроенными донорными диверсифицированными доменами остова.
Другие предпочтительные реципиентные остовы включают константные домены антитела, например, домен СН1, СН2 или СН3 тяжелой или легкой цепи.
Донорный диверсифицированный домен остова может заменить часть или, более предпочтительно, все CDR (т.е. CDR1, CDR2 или CDR3) в реципиентном вариабельном домене антитела.
Предпочтительно донорный диверсифицированный домен остова заменяет весь или часть CDR1 или CDR2 вариабельного домена антитела. Это позволяет более диверсифицированным и центральным CDR3 вносить вклад в активность связывания, а также вариабельному домену антитела-партнера. Встраивание донорного диверсифицированного домена остова в CDR1 и CDR2 пояснено примером ниже.
Последовательность взаимодействия донорного диверсифицированного домена остова и одного или более CDR вариабельного домена реципиентного антитела или домена-партнера могут взаимодействовать с одним и тем же эпитопом на целевой молекуле. Например, последовательность взаимодействия донорного диверсифицированного домена остова и CDR3 вариабельного домена антитела и/или домена-партнера могут взаимодействовать с одним и тем же эпитопом на целевой молекуле.
В некоторых предпочтительных вариантах реализации реципиентный диверсифицированный домен остова представляет собой вариабельный домен антитела, например, домен VH или VL, и донорный диверсифицированный домен остова представляет собой ноттин или адгирон. Примеры связывающих элементов, содержащих диверсифицированный домен остова донора ноттина и реципиентный диверсифицированный домен остова VL, показаны в таблице 1. Связывающий элемент, содержащий реципиентный вариабельный домен антитела и богатый цистеином донорный домен в данной заявке называют "Knotbody".
В одной серии предпочтительных вариантов реализации реципиентный диверсифицированный домен остова представляет собой домен VL антитела, и донорный диверсифицированный домен остова представляет собой ноттин, который заменяет CDR2 домена VL. Подходящие ноттины могут связываться с ионным каналом, таким как Kv1.3, и могут содержать ShK и калиотоксин. Домен VL реципиентного антитела может проявлять отсутствие связывания мишени или может связываться с той же целевой молекулой, что и ноттин, с ассоциированным белком в комплексе с молекулой-мишенью ноттина или с молекулой-мишенью, отличной от таковой у ноттина.
Подходящий связывающий элемент, например, может включать слитый белок, содержащий последовательность аминокислот согласно любой из последовательностей SEQ ID NO: 31-35 (как показано в таблице 8В) или может представлять собой фрагмент или вариант такой последовательности. Связывающий элемент может дополнительно содержать домен-партнер, который связывается со слитым белком. Подходящие домены-партнеры включают любой домен VH, например, домен VH D12 А12, показанный в таблице 8В (SEQ ID NO: 30).
Подходящие домены VH могут не участвовать в связывании, могут связываться с молекулой-мишенью, отличной от таковой для слитого белка, или могут связываться с той же целевой молекулой, что и слитый белок, например, чтобы повысить аффинность связывания указанного слитого белка.
Слитый белок, который представляет собой вариант эталонной последовательности, такой как последовательность, показанная в таблице 1 (последовательности SEQ ID NO: 84-139), таблице 8В (последовательности SEQ ID NO: 31-35), таблице 29 (последовательности SEQ ID NO: 308-317) или на фигуре 29 (последовательности SEQ ID NO 349 и 351), может включать последовательность аминокислот, идентичную по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 98% эталонной последовательности. Конкретные варианты последовательности аминокислот могут отличаться от последовательности слитого белка, указанной в таблице 1 (последовательностей SEQ ID NO: 84-139), таблице 8В (последовательностей SEQ ID NO: 31-35), таблице 29 (последовательностей SEQ ID NO: 308-317) или на фигуре 29 (последовательностей SEQ ID NO 349 и 351) вставкой, добавлением, заменой или делецией 1 аминокислоты, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более 10 аминокислот.
В других предпочтительных вариантах реализации реципиентный диверсифицированный домен остова может представлять собой константный домен иммуноглобулина, например, константный домен иммуноглобулина из тяжелой или легкой цепи антитела, и донорный диверсифицированный домен остова может представлять собой ноттин или адгирон.
Предпочтительно, расстояние между каркасными остатками реципиентного диверсифицированного домена остова и донорного диверсифицированного домена остова минимизировано, чтобы снизить протеолитическую неустойчивость и/или относительную гибкость между доменами. Это может быть полезно для улучшения аффинности связывания. Например, каждый из N- и С-концов донорного диверсифицированного домена остова может быть непосредственно связан с реципиентным диверсифицированным доменом остова без линкера или посредством линкеров из 1, 2, 3 или 4 аминокислот, реципиентным диверсифицированным доменом остова без линкера или посредством линкеров из 1, 2, 3 или 4 аминокислот. Можно использовать одинаковые или различные линкерные последовательности для соединения N- и С-концов донорного диверсифицированного домена остова с реципиентным диверсифицированным доменом остова.
Примеры подходящих линкерных последовательностей показаны в таблицах 2, 26 и 27.
В некоторых вариантах реализации может быть предпочтительным, чтобы донорные и реципиентные диверсифицированные домены остова были соединены посредством линкера, отличного от GGSG (SEQ ID NO: 2), линкера, отличного от GGGS (SEQ ID NO: 32), или линкера, который не содержит GG, например, как SGG или GG.
Длина линкера относится к количеству аминокислотных остатков, которые приобретаются или утрачиваются в элементах остова донорного и реципиентного доменов, когда их соединяют. Например, удаление остатков остова и применение равного количества рандомизированных остатков для соединения донорных и реципиентных диверсифицированных доменов остова в данной заявке считают рандомизированием удаленных остатков остова, а не включением дополнительных линкерных остатков.
В некоторых вариантах реализации 1, 2, 3 или 4 аминокислоты на N- и/или С-конце донорного диверсифицированного домена остова и/или 1, 2, 3 или 4 аминокислоты с каждой стороны от места встраивания в реципиентный остов можно заменить посредством мутагенеза и/или рандомизирования.
Слитый белок может быть связан с доменом-партнером посредством ковалентной или нековалентной связи.
Домен-партнер может быть связан с реципиентным диверсифицированным доменом остова и/или донорным диверсифицированным доменом остова указанного слитого белка. Предпочтительно, домен-партнер связан с реципиентным диверсифицированным доменом остова.
В некоторых предпочтительных вариантах реализации реципиентный диверсифицированный домен остова представляет собой вариабельный домен легкой цепи (VL) антитела и домен-партнер представляет собой вариабельный домен тяжелой цепи (VH) антитела. В других предпочтительных вариантах реализации реципиентный диверсифицированный домен остова представляет собой вариабельный домен тяжелой цепи (VH) антитела и домен-партнер представляет собой вариабельный домен легкой цепи (VL) антитела.
В некоторых вариантах реализации вариабельные домены тяжелой и легкой цепи антитела связывающего элемента, описанного в данной заявке, можно соединить с помощью гибкого линкера, например, в формате scFv.
Связывающий элемент, описанный в данной заявке, включает слитый белок. Связывающий элемент может дополнительно содержать домен-партнер, который связан со слитым белком. Например, связывающий элемент может представлять собой гетеродимер.
В некоторых вариантах реализации связывающий элемент может содержать два или более слитых белков или доменов-партнеров. Например, связывающий элемент может быть мультимерным. В некоторых вариантах реализации реципиент или донорный диверсифицированный домен остова связывающего элемента могут образовывать гомомультимер, такой как гомодимер. Реципиентный или донорный диверсифицированный домен остова связывающего элемента может вступать во взаимодействия с отличной формой того же домена, такой как домен дикого типа или мутагенизированная форма домена.
Вдобавок к слитому белку и необязательному домену-партнеру, связывающий элемент может дополнительно содержать терапевтическую молекулу, молекулу, продлевающую время полужизни, или детектируемую метку. Указанная молекула или метка может быть связана ковалентной или нековалентной связью со слитым белком или доменом-партнером.
В некоторых вариантах реализации связывающий элемент может быть отображен на частице или молекулярном комплексе, таком как клетка, рибосома или фаг, например, для скрининга и селекции. Связывающий элемент может дополнительно содержать выставляющую молекулу, такую как белок оболочки фага, чтобы облегчить отображение на частице или молекулярном комплексе. Белок оболочки фага может быть соединен или связан ковалентной связью со слитым белком или доменом-партнером.
В некоторых вариантах реализации связывающий элемент, описанный в данной заявке, может проявлять благоприятные свойства, такие как повышенная аффинность, стабильность, растворимость, экспрессия, специфичность или время полужизни in vivo по сравнению с изолированным донорным и/или реципиентным диверсифицированным доменом остова.
В других аспектах настоящего изобретения предложено получение библиотек связывающих элементов, описанных в данной заявке.
Способ получения библиотеки связывающих элементов может включать:
обеспечение популяции нуклеиновых кислот, кодирующих диверсифицированную популяцию или репертуар слитых белков, содержащих донорный диверсифицированный домен остова, встроенный в реципиентный диверсифицированный домен остова, при этом необязательно N- и С-концы донорного диверсифицированного домена остова связаны с реципиентным диверсифицированным доменом остова с помощью линкеров длиной до 4 аминокислот,
при этом указанный донорный диверсифицированный домен остова содержит донорный остов и донорную последовательность взаимодействия, и реципиентный диверсифицированный домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия, и
одна, две или все три из донорной последовательности взаимодействия, реципиентной последовательности взаимодействия и линкеров в указанной популяции различаются, и
экспрессию указанной популяции нуклеиновых кислот с получением диверсифицированной популяции или репертуара, и
необязательно соединение слитых белков с доменом-партнером или популяцией доменов-партнеров, таким образом получая библиотеку связывающих элементов.
Популяцию нуклеиновых кислот можно получить с помощью способа, включающего встраивание первой популяции нуклеиновых кислот, кодирующих донорный диверсифицированный домен остова, во вторую популяцию нуклеиновых кислот, кодирующих реципиентный диверсифицированный домен остова, при этом необязательно первая и вторая нуклеиновые кислоты связаны с третьей популяцией нуклеиновых кислот, кодирующих линкеры длиной до 4 аминокислот, при этом указанные одна, две или все три из указанной первой, второй и третьей популяции нуклеиновых кислот различаются.
Указанные нуклеиновые кислоты могут содержаться в векторах, например, в векторах экспрессии. Подходящие векторы включают векторы фагового дисплея на основе фага76 или на основе фагмиды77.
Указанные нуклеиновые кислоты можно экспрессировать рекомбинантным способом в клетке или в растворе, применяя бесклеточную систему трансляции in vitro, такую как рибосома, чтобы получить библиотеку. В некоторых предпочтительных вариантах реализации библиотека экспрессируется в системе, в которой функция связывающего элемента позволяет выделение кодирующей его нуклеиновой кислоты. Например, связывающий элемент может быть отображен на частице или в молекулярном комплексе, чтобы позволить селекцию и/или скрининг. В некоторых вариантах реализации библиотеку связывающих элементов можно отобразить на гранулах, бесклеточных рибосомах, бактериофаге, прокариотических клетках или эукариотических клетках. В качестве альтернативы кодируемый связывающий элемент может присутствовать внутри эмульсий, в которых активность связывающего элемента вызывает идентифицируемое изменение. В качестве альтернативы, кодируемый связывающий элемент может экспрессироваться внутри или вблизи клетки, где активность связывающего элемента вызывает фенотипические изменения или изменения в экспрессии репортерного гена16, 78, 79.
Эукариотические клетки обладают преимуществом наличия системы шаперонов, способствующих укладке секретированных доменов белка80, и они отсутствуют в бактериальных системах экспрессии. Результаты, представленные ниже, показывают, что системы шаперонов млекопитающих необязательны для правильной укладки связывающих элементов, описанных в данной заявке. Кроме того, связывающие элементы, обнаруженные с применением прокариотических систем фагового дисплея, по определению подходят для дополнительного конструирования внутри системы фагового дисплея для получения улучшенных связывающих молекул. Прокариотические системы, такие как фаговый дисплей, также облегчают конструирование больших библиотек и облегчают селекцию, скрининг и идентификацию связывающих элементов из таких библиотек. Напротив, связывающие элементы, обнаруженные в эукариотических системах, могут не подходить для дополнительного конструирования внутри прокариотический системы.
Предпочтительно нуклеиновые кислоты экспрессируются в прокариотической клетке, такой как E coli. Например, указанные нуклеиновые кислоты можно экспрессировать в прокариотической клетке, чтобы получить библиотеку связывающих элементов, которая отображена на поверхности бактериофага. Подходящие прокариотические системы фагового дисплея хорошо известны в данной области и описаны, например, в Kontermann, R и Dubel, S, Antibody Engineering, Springer-Verlag Нью-Йорк, LLC; 2001, ISBN: 3540413545, WO 92/01047, US 5969108, US 5565332, US 5733743, US 5858657, US 5871907, US 5872215, US 5885793, US 5962255, US 6140471, US 6172197, US 6225447, US 6291650, US 6492160 и US 6521404. Системы фагового дисплея позволяют получение большой библиотеки, например, библиотеки с 108 или более, 109 или более, или 1010 или более представителями.
В других вариантах реализации указанная клетка может представлять собой эукариотическую клетку, такую как клетка дрожжей, насекомого, растения или млекопитающего.
Библиотека связывающих элементов, например, библиотека, полученная с помощью описанного выше способа, может включать:
диверсифицированную популяцию слитых белков, содержащих донорный диверсифицированный домен остова, встроенный в реципиентный диверсифицированный домен остова, при этом необязательно каждый из N- и С-концов донорного диверсифицированного домена остова связан с реципиентным диверсифицированным доменом остова линкерами, состоящими из до 4 аминокислот,
при этом указанный донорный диверсифицированный домен остова содержит донорный остов и донорную последовательность взаимодействия, и реципиентный диверсифицированный домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия, и
одна, две или все три из донорной последовательности взаимодействия, реципиентной последовательности взаимодействия и линкеров в указанной популяции различаются, и
при этом необязательно каждый слитый белок в указанной популяции связан с доменом-партнером.
Указанные последовательности одной, двух или всех трех из донорной последовательности взаимодействия, реципиентной последовательности взаимодействия и линкеров могут быть диверсифицированными. Например, связывающие элементы в указанной библиотеке могут содержать диверсифицированные донорные последовательности взаимодействия и одну и ту же реципиентную последовательность взаимодействия; диверсифицированные реципиентные последовательности взаимодействия и одну и ту же донорную последовательность взаимодействия; диверсифицированные линкерные последовательности и одинаковые реципиентные и донорные последовательности взаимодействия или; диверсифицированные реципиентные и донорные последовательности взаимодействия.
Диверсифицированная последовательность, описанная в данной заявке, представляет собой последовательность, которая изменяется между представителями популяции, т.е. указанная последовательность различна у различных представителей популяции. Диверсифицированная последовательность может быть произвольной, т.е. конкретную аминокислоту или нуклеотид в каждом положении в диверсифицированной последовательности можно произвольно выбрать из полного набора встречающихся в природе аминокислот или нуклеотидов или их поднабора.
Разнообразие (диверсификацию) можно ориентировать на донорную последовательность взаимодействия, реципиентную последовательность взаимодействия, линкеры или последовательности внутри домена-партнера, применяя подходы, известные специалистам в данной области, такие как олигонуклеотид-направленный мутагенез22,23., Molecular Cloning: a Laboratory Manual: 3е издание, Russell и др., 2001, Cold Spring Harbor Laboratory Press, и приведенные в ней ссылки). Например, если реципиентный диверсифицированный домен остова представляет собой вариабельный домен антитела и донорным диверсифицированным доменом остова заместили один участок CDR, то замены аминокислот, такие как диверсифицированные последовательности, можно внедрить в другие CDR реципиентного домена или цепи партнера. Если донорный домен представляет собой ноттин, диверсифицированные последовательности можно ввести в области, соединяющие элементы корового остова, такие как цистеиновый узел. Было показано, что структура ноттина способна разместить более 50% ненативной структуры24. Диверсификация остовов ноттина, таких как EETI-II24, калиотоксин25, ProTx-126 и TRPA126 для получения библиотек известна в данной области.
Диверсифицированные последовательности могут быть смежными или могут быть распределены внутри домена. Подходящие способы внедрения диверсифицированных последовательностей в домены хорошо описаны в данной области. Например, диверсификацию можно осуществить, используя смеси олигонуклеотидов, полученные с помощью частичного или полного рандомизирования нуклеотидов, или используя смеси кодонов, например, используя тринуклеотиды. В качестве альтернативы, популяцию диверсифицированных олигонуклеотидов можно синтезировать, применяя способы высокопроизводительного синтеза генов, и объединить с получением точно установленной и контролируемой популяции вариантов доменов. В качестве альтернативы можно применять методики "допинга", в которых исходный нуклеотид преобладает, а альтернативный нуклеотид(ы) присутствует(-ют) с более низкой частотой. В качестве альтернативы, в примере 2 ниже описаны способы диверсификации домена на основе диверсификации природного источника (в данном примере, репертуара антител).
Любой из донорного или реципиентного доменов может быть частью мультимерного белка, и потенциальное дополнительную диверсификацию можно осуществить за счет цепи партнера. Цепь партнера можно полностью заменить, например, с помощью перетасовки цепей27. В качестве альтернативы, диверсификацию можно осуществить в области существующей цепи партнера реципиента или донора, например, в VH-партнера VL-реципиента донора. В целом, гетеродимерная природа антител и возможность выбирать варианты цепи партнера независимо от цепи реципиента, содержащей цепь донора, приумножает эффективность данного подхода.
Предпочтительно указанная библиотека представляет собой библиотеку дисплея. Связывающие элементы в указанной библиотеке могут быть представлены на поверхности частиц или молекулярных комплексов, таких как гранулы, рибосомы, клетки или вирусы, включая реплицируемые генетические упаковщики, такие как дрожжи, бактерии или частицы бактериофагов (например, Fd, M13 или Т7), вирусы, клетки, включая клетки млекопитающих, или ковалентные, рибосомные или другие системы дисплея in vitro. Каждая частица или молекулярный комплекс может содержать нуклеиновую кислоту, которая кодирует связывающий элемент, который отображается указанной частицей, и необязательно также отображенный домен-партнер, если он присутствует.
В некоторых предпочтительных вариантах реализации связывающие элементы в указанной библиотеке представлены на поверхности бактериофага. Подходящие способы получения и скрининга библиотек фагового дисплея хорошо известны в данной области. Фаговый дисплей описан, например, в WO 92/01047 и патентах США US 5969108, US 5565332, US 5733743, US 5858657, US 5871907, US 5872215, US 5885793, US 5962255, US 6140471, US 6172197, US 6225447, US 6291650, US 6492160 и US 6521404.
Можно осуществить скрининг библиотек, описанных в данной заявке, для выявления связывающих элементов, которые проявляют активность связывания, например, связывания с молекулой-мишенью.
Связывание можно измерить напрямую или можно измерить опосредованно по агонистическим или антагонистическим эффектам, возникшим в результате связывания.
Связывание с молекулой-мишенью может быть опосредовано одним или более донорными диверсифицированными доменами остова, реципиентными диверсифицированными доменами остова и доменами-партнерами связывающего элемента.
Последовательности взаимодействия донорных и реципиентных диверсифицированных доменов остова слитого белка могут связываться с молекулой-мишенью, и более предпочтительно с одним и тем же эпитопом молекулы-мишени. Слитый белок и домен-партнер связывающего элемента может связываться с одной и той же молекулой-мишенью или с различными молекулами-мишенями. Например, слитый белок может связываться с первой молекулой-мишенью, а домен-партнер может связываться со второй молекулой-мишенью.
Связывающий элемент может связываться с молекулой-мишенью с такой же аффинностью, как и у исходного донорного или реципиентного диверсифицированного домена остова, или с более низкой или более высокой аффинностью. В некоторых вариантах реализации связывающий элемент может нейтрализовать биологическую активность целевой молекулы. В других вариантах реализации связывающий элемент может активировать биологическую активность целевой молекулы.
Подходящие молекулы-мишени включают биологические макромолекулы, такие как белки. Молекула-мишень может представлять собой рецептор, фермент, антиген или олигосахарид. В некоторых предпочтительных вариантах реализации мишень может представлять собой интегральный мембранный белок. В некоторых вариантах реализации мишень может представлять собой рецептор, сопряженный с G-белком (GPCR). Молекулы-мишени, на которые трудно нацелиться с помощью антител, такие как транспортеры ионов, могут быть особенно подходящими.
В некоторых предпочтительных вариантах реализации молекула-мишень может представлять собой транспортер ионов, такой как ионный насос или ионный канал.
Подходящие ионные каналы хорошо известны в данной области и включают Kir1.1, Kir2.1, Kir6.2, SUR2, Kv1.1, KCNQ1, KCNQ, KCNQ4, TRPP2, TRPA1, TRPC6, CNGA1, BK, Nav1.1, Nav1.5, Nav1.6, Nav2.1, Cav1.2, Cav2.1, рецепторы глицина, GABA-A, CHRNA482. Другие подходящие ионные каналы включают потенциалзависимые калиевые каналы, такие как Kv1.3, потенциалзависимые кальциевые каналы L-типа, Cav2.2, hERG, ASICs и Eag1.
Связывающий элемент, описанный в данной заявке, может связываться с двумя или более различными целевыми эпитопами (т.е. связывающий элемент может быть мультиспецифическим). Целевые эпитопы, которые связывает связывающий элемент, могут находиться на одной или на различных молекулах-мишенях. Например, один или более из донорного диверсифицированного домена остова, реципиентного диверсифицированного домена остова и/или домена-партнера мультиспецифического связывающего элемента может связываться с целевым эпитопом, отличным от такового для других доменов.
В некоторых вариантах реализации связывающий элемент может быть биспецифическим, т.е. может связываться с двумя различными эпитопами.
Биспецифический связывающий элемент может связываться с двумя различными целевыми эпитопами одновременно. Это может быть полезно для сближения первого и второго эпитопа, например, чтобы соединить друг с другом молекулы или клетки. Если целевые эпитопы расположены на различных молекулах-мишенях, то молекулы-мишени можно привести в непосредственную близость путем одновременного связывания со связывающим элементом. Если молекулы-мишени расположены на различных клетках, то одновременное связывание молекул-мишеней со связывающим элементом может привести клетки в непосредственную близость, например, чтобы вызвать или усилить взаимодействие указанных клеток. Например, связывающий элемент, который связывается с опухолеспецифическим антигеном и антигеном Т-клетки, таким как CD3, может быть полезен для приведения в непосредственную близость Т-клеток с клетками опухоли.
Одновременное связывание различных целевых эпитопов связывающим элементом, описанным в данной заявке, также может быть полезно для стабилизации определенной конформации молекулы-мишени или комплекса молекул-мишеней.
Связывающий элемент может связываться с двумя различными целевыми эпитопами последовательно, т.е. связывающий элемент может связываться с одним целевым эпитопом, а затем с другим. Это может быть полезно, например, для пересечения гематоэнцефалического барьера (ГЭБ120) или барьера «кровь-нерв» (БКН121). Например, связывающий элемент может связываться с эпитопом на рецепторе ГЭБ или БКН. Подходящие рецепторы хорошо известны в данной области и включают рецепторы трансферрина (TFR), инсулина (IR), лептина (LEP-R), глюкозы (GLUT1), CD98 (LAT1) и липопротеина (LRP-1). После связывания с рецептором ГЭБ или БКН связывающий элемент может перейти путем трансцитоза через ГЭБ или БКН, после чего он может независимо связаться с эпитопом на второй молекуле-мишени в головном мозге или периферической нервной системе, например, с ионным каналом или протеазой.
В некотором предпочтительном варианте реализации связывающий элемент может связываться с TFR. Например, связывающий элемент может содержать домен-партнер, который связывается с TFR, и слитый белок, который связывается со второй молекулой-мишенью в головном мозге или периферической нервной системе. Реципиентный остов в слитом белке может представлять собой домен VL и домен-партнер может представлять собой домен VH. Подходящие домены-партнеры VH для нацеливания на TFR могут включать последовательность, представленную в таблице 20 (последовательности SEQ ID NO: 237-245), или вариант указанной последовательности.
Подходящие системы in vitro для скрининга библиотек для выявления биспецифических связывающих элементов, способных пересекать ГЭБ или БКН, хорошо известны в данной области (Nakagawa, S. и др. Neurochem. Int. 54, 253-263 (2009); Yosef, N. и др. J. Neuropathol. Exp. Neurol. 69, 82-97 (2010)) и более подробно описаны ниже.
В некоторых предпочтительных вариантах реализации первый домен на связывающем элементе (например, один из донорного диверсифицированного домена остова, реципиентного диверсифицированного домена остова и домена-партнера) может быть направлен на первую молекулу-мишень на поверхности клетки. Связывание с данной первой молекулой-мишенью может соединить связывающий элемент с поверхностью клетки, тем самым способствуя взаимодействию второго связывающего домена (например, другого из донорного диверсифицированного домена остова, реципиентного диверсифицированного домена остова и домена-партнера) со второй молекулой-мишенью путем повышения локальной концентрации связывающего элемента на поверхности клетки. Например, биспецифический связывающий элемент может состоять из домена-партнера VH, который связывается с высокой аффинностью с находящейся в изобилии первой молекулой-мишенью на Т-клетках, связанного со слитым белком VL-ноттин, который связывает и блокирует вторую молекулу-мишень, такую как ионный канал, например, Kv1.3. Домен специфического связывания с определенной клеткой (в данном примере - VH) можно получить, например, путем селекции по рекомбинантному белку, который представляет собой кандидатную молекулу-мишень (как описано в примере 6), или путем селекции библиотеки на поверхности целевой клетки для поиска домена-партнера (в данном примере - VH), что повышает связывание второго домена. Связывание первого домена с первой молекулой-мишенью соединяет связывающий элемент с поверхностью клетки и может преодолеть проблему низкой аффинности, низкой плотности или относительной недоступности второго связывающего домена для второй молекулы-мишени. Это может повышать эффективность второго связывающего домена на клетках, которые экспрессируют мишень, узнаваемую первым связывающим доменом. Данный подход также может повышать специфичность связывающего элемента, поскольку для оптимального связывания/блокирования необходимо, чтобы обе молекулы-мишени были на одной и той же клетке. Было показано, что присутствие первой связывающей молекулы влияет на усиление связывания второй связывающей молекулы на несколько порядков величины, на основе аффинности и плотности антигенов (Rhoden и др. (2016) J Biol. Chem. 291 p11337-11347).
Молекулы-мишени для применения для селекции и скрининга можно получить, применяя любую удобную методику. Например, интегральные мембранные белки можно получить, применяя бактериальные, бакуловирусные системы экспрессии или системы экспрессии в млекопитающих86,87, протеолипосомы88, "нанодиски"89 или лизаты клеток90.
В некоторых вариантах реализации, описанных в данной заявке, первичную «исходную» библиотеку связывающих элементов можно применять, чтобы определить один или более исходных связывающих элементов, которые позволяют одновременную укладку как донорных, так и реципиентных диверсифицированных доменов остова. Данные исходные связывающие элементы можно выбрать по сохранившимся донорным и реципиентным доменам, которые проявляют желательную активность связывания, например, связывания с молекулой-мишенью. На следующих этапах исходные связывающие элементы можно подвергнуть дополнительной модификации и скринингу, чтобы оптимизировать активность связывания и другие свойства. В качестве альтернативы, первичная «исходная» библиотека связывающих элементов может включать любую библиотеку, в которой объединены реципиентный диверсифицированный домен остова, донорный диверсифицированный домен остова и необязательно линкер, описанный в данной заявке, когда обеспечено разнообразие любого из указанного реципиентного диверсифицированного домена остова, донорного диверсифицированного домена остова или последовательности линкера.
Способ скрининга, описанный в данной заявке, может включать:
(i) обеспечение исходной библиотеки связывающих элементов, описанной в данной заявке;
при этом одна, две или все три из донорной последовательности взаимодействия, реципиентной последовательности взаимодействия и линкеров в указанной исходной библиотеке различаются,
(ii) скрининг указанной библиотеки для выявления связывающих элементов, которые проявляют активность связывания, и
(iii) идентификацию одного или более связывающих элементов в указанной исходной библиотеке, которые проявляют активность связывания.
Указанный один или более идентифицированных связывающих элементов можно выделить из исходной библиотеки.
В некоторых предпочтительных вариантах реализации линкерные последовательности в указанной библиотеке могут быть различающимися. Это может быть полезно для идентификации функциональных слитых белков донорных и реципиентных диверсифицированных доменов остова. Примеры диверсифицированных линкерных последовательностей приведены в данной заявке. В некоторых вариантах реализации диверсифицированные линкеры из 1, 2, 3 или 4 аминокислот можно встроить в места соединения между донорным диверсифицированным доменом остова и реципиентным диверсифицированным доменом остова, чтобы позволить селекцию оптимальных соединяющих последовательностей из полученных библиотек.
Необязательно последовательности внутри реципиентного диверсифицированного домена остова также можно диверсифицировать, чтобы упростить идентификацию реципиентного диверсифицированного домена остова, который поддерживает функциональное слияние с донорным диверсифицированным доменом остова. В некоторых вариантах реализации один или более аминокислотных остатков донорного диверсифицированного домена остова и/или реципиентного диверсифицированного домена остова в одном или обоих соединениях между двумя доменами могут быть диверсифицированы (т.е. можно диверсифицировать один или более остатков домена, непосредственно примыкающих к одному или обоим местам соединения с другим доменом). Примеры, в которых каркасные остатки донорного и реципиентного остовов диверсифицированы, приведены ниже. Например, могут быть диверсифицированы 1, 2, 3 или 4 остатка на N- и С-концевых соединениях донорного диверсифицированного домена остова и/или 1,2,3 или 4 остатка внутри реципиентного диверсифицированного домена остова в местах соединения с донорным доменом.
Активность связывания может представлять собой связывание с молекулой-мишенью. Способ скрининга библиотеки может включать:
обеспечение исходной библиотеки связывающих элементов, описанной в данной заявке,
осуществление контакта указанной исходной библиотеки с молекулой-мишенью, и
селекцию одного или более представителей исходной библиотеки, которые связываются с молекулой-мишенью.
Можно выделить указанный один или более идентифицированных или прошедших селекцию связывающих элементов и подвергнуть дополнительной селекции и/или скринингу.
Можно осуществить множество раундов пэннинга, чтобы определить связывающие элементы, которые проявляют активность связывания. Например, популяцию связывающих элементов, обогащенных по активности связывания, можно выделить или изолировать из исходной библиотеки и подвергнуть одному или более дополнительным раундам скрининга активности связывания для получения одной или более дополнительно обогащенных популяций. Исходные связывающие элементы, которые проявляют активность связывания, можно обнаружить в указанной одной или более дополнительно обогащенных популяциях и выделить, изолировать и/или дополнительно исследовать.
Исходные связывающие элементы, которые проявляют активность связывания, могут пройти дополнительное конструирование для улучшения активности или свойства или введения новой активности или свойств, например, свойств связывания, таких как аффинность и/или специфичность, повышенная нейтрализация молекулы-мишени и/или модуляция определенной активности молекулы-мишени. Связывающие элементы также можно сконструировать, чтобы улучшить стабильность, растворимость или уровень экспрессии.
Например, идентифицированную последовательность линкера идентифицированного исходного связывающего элемента можно сохранить в модифицированной библиотеке, при этом диверсифицированные последовательности вводят в один или более из реципиентного, донорного домена или домена-партнера в зависимости от применения и желательного результата. В некоторых случаях дополнительная диверсификация линкера может быть полезна для оптимизации функции связывающего элемента.
Способ скрининга, описанный в данной заявке, может дополнительно включать:
(iv) внедрение диверсифицированных аминокислотных остатков в одно или более положений в последовательности аминокислот одного или более связывающих элементов, описанных в данной заявке, например, одного или более связывающих элементов, идентифицированных в исходной библиотеке, с получением модифицированной библиотеки связывающих элементов,
(v) скрининг модифицированной библиотеки для выявления модифицированных связывающих элементов, которые проявляют активность связывания, и
(vi) идентификацию одного или более модифицированных связывающих элементов в модифицированной библиотеке, которые проявляют активность связывания.
Активность связывания может представлять собой связывание с молекулой-мишенью. Способ скрининга библиотеки может включать:
обеспечение модифицированной библиотеки связывающих элементов, описанных выше,
осуществление контакта указанной модифицированной библиотеки с молекулой-мишенью и
селекцию одного или более представителей модифицированной библиотеки, которые связываются с молекулой-мишенью.
Указанный один или более идентифицированных или прошедших селекцию связывающих элементов можно выделить и подвергнуть дополнительным раундам скрининга.
Разнообразные аминокислоты можно внедрить с помощью любой подходящей методики, описанной в других местах в данной заявке, включая Неспецифический мутагенез или сайт-направленный мутагенез.
Можно идентифицировать один или более модифицированных связывающих элементов, которые проявляют повышенную или улучшенную активность связывания, например, повышенную аффинность и/или специфичность связывания по сравнению с одним или более исходными связывающими элементами, идентифицированными на этапе (iii).
Можно осуществить множество раундов пэннинга, чтобы определить модифицированные связывающие элементы, которые проявляют улучшенную активность связывания. Например, популяцию связывающих элементов, обогащенных улучшенной активностью связывания, можно выделить или изолировать из библиотеки и подвергнуть одному или более дополнительным раундам скрининга активности связывания с получением одной или более дополнительно обогащенных популяций. Модифицированные связывающие элементы, которые проявляют улучшенную активность связывания, можно обнаружить в одной или более дополнительно обогащенных популяциях и выделить и/или дополнительно исследовать.
Исходные связывающие элементы или модифицированные связывающие элементы можно дополнительно подвергнуть дополнительному мутагенезу, например, чтобы получить дополнительно модифицированные библиотеки и осуществить селекцию связывающих элементов с улучшенной или новой активностью или свойствами. Аминокислотные остатки можно мутировать в одном или более положениях в последовательности аминокислот одного или более идентифицированных связывающих элементов из библиотеки и/или модифицированной библиотеки. Например, аминокислотные остатки внутри донорного остова, донорной последовательности взаимодействия, реципиентного остова, реципиентной последовательности взаимодействия, линкера или домена-партнера указанного одного или более идентифицированных связывающих элементов можно мутировать.
Указанная мутация может ввести диверсифицированные аминокислотные остатки в одно или более положений с получением библиотеки дополнительно модифицированных связывающих элементов. Примеры делеции или замены взаимодействующих остатков и остатков остова реципиента и донора и их замены на рандомизированные остатки представлены ниже.
Для того чтобы получить связывающие элементы, в которых домен-партнер, такой как VH- или VL-домен-партнер, вносит вклад в дополнительные контакты взаимодействия с молекулой-мишенью, можно получить библиотеку, в которой исходный домен-партнер заменен на целый репертуар альтернативных доменов-партнеров, с получением библиотеки "с перетасованными цепями". Связывающие элементы с улучшенной активностью вследствие полезного вклада вновь прошедшего селекцию домена-партнера можно идентифицировать, выделить и изолировать.
Способ скрининга, описанный в данной заявке, может дополнительно включать:
(vii) соединение слитого белка из одного или более идентифицированных связывающих элементов или модифицированных связывающих элементов, описанных выше, с диверсифицированной популяцией доменов-партнеров с получением перетасованной библиотеки связывающих элементов,
(viii) скрининг перетасованной библиотеки для выявления перетасованных связывающих элементов, которые проявляют активность связывания,
(ix) идентификацию одного или более перетасованных связывающих элементов, которые проявляют активность связывания.
Можно идентифицировать один или более перетасованных связывающих элементов, которые проявляют повышенную активность связывания по сравнению с одним или более исходными связывающими элементами, идентифицированными на этапе (iii), и/или модифицированными связывающими элементами, идентифицированными на этапе (vi).
Можно провести множество раундов пэннинга или функционального скрининга, чтобы идентифицировать перетасованные связывающие элементы, которые проявляют повышенную или улучшенную активность связывания. Например, из перетасованной библиотеки можно изолировать популяцию перетасованных связывающих элементов, обогащенную улучшенной активностью связывания, и подвергнуть одному или более дополнительным раундам скрининга активности связывания для получения одной или более дополнительно обогащенных перетасованных популяций. Перетасованные связывающие элементы, которые проявляют улучшенную активность связывания, можно идентифицировать в одной или более дополнительно обогащенных популяциях и изолировать и/или дополнительно исследовать.
Можно осуществить скрининг исходной библиотеки, модифицированной библиотеки или перетасованной библиотеки путем определения связывания указанных связывающих элементов в указанной библиотеке с молекулой-мишенью.
Связывание можно определить с помощью любой подходящей методики. Например, исходную библиотеку, модифицированную библиотеку или перетасованную библиотеку можно привести в контакт с молекулой-мишенью при условиях связывания на период времени, достаточный для взаимодействия молекулы-мишени с библиотекой и образования комплекса реакции связывания с по меньшей мере одним ее представителем.
Условия связывания представляют собой такие условия, которые совместимы с известной природной функцией связывания молекулы-мишени. Такие совместимые условия представляют собой буфер, рН и температурные условия, которые сохраняют биологическую активность молекулы-мишени, тем самым сохраняя способность указанной молекулы участвовать в заранее выбранном связывающем взаимодействии. Как правило, такие условия включают водный физиологический раствор с рН и ионной силой, обычно сопоставимой с интересующей молекулой-мишенью.
Исходную библиотеку, модифицированную библиотеку или перетасованную библиотеку можно привести в контакт с молекулой-мишенью в виде гетерогенной или гомогенной смеси. Таким образом, указанные представители библиотеки могут находиться в твердой фазе, а молекула-мишень - присутствовать в жидкой фазе. В качестве альтернативы, молекула-мишень может находиться в твердой фазе, а указанные представители библиотеки - присутствовать в жидкой фазе. Кроме того, как представители библиотеки, так и молекула-мишень могут присутствовать в жидкой фазе.
Подходящие способы установления связывания связывающего элемента с молекулой-мишенью хорошо известны в данной области и включают твердофазный иммуноферментный анализ (ELISA), анализы связывания на основе гранул (например, с применением покрытых стрептавидином гранул в сочетании с биотинилированными молекулами-мишенями), поверхностный плазменный резонанс, проточную цитометрию, вестерн-блоттинг, иммуноцитохимию, иммунопреципитацию и аффинную хроматографию. В качестве альтернативы можно применять биохимические или основанные на клеточной системе анализы, такие как анализ миграции клеток НТ-1080 или репортерные анализы на основе флуоресценции или на основе люминесценции.
В некоторых вариантах реализации связывание можно определить по обнаружению агонизма или антагонизма (включая блокирующую активность в случае ионных каналов и ферментов), возникших в результате связывания связывающего элемента с молекулой-мишенью, такой как лиганд, рецептор или ионный канал. Например, можно осуществить скрининг исходной библиотеки, модифицированной библиотеки или перетасованной библиотеки путем экспрессии указанной библиотеки в репортерных клетках и идентификации одной или более репортерных клеток с измененной экспрессией генов или фенотипом. Подходящие методики функционального скрининга для скрининга рекомбинантных популяций связывающих элементов хорошо известны в данной области16,78,79,91.
Системы, подходящие для конструирования библиотек путем клонирования репертуаров генов в репортерные клетки были описаны ранее16, 78. В данных системах экспрессия и репортерные функции объединены внутри одной клетки, и обычно вводят популяцию антител, подвергнутых селекции против заранее известной мишени (например, применяя фаговый дисплей или дисплей в млекопитающем).
Популяцию нуклеиновых кислот, кодирующих связывающие элементы, описанные в данной заявке, можно ввести в репортерные клетки для получения библиотеки с применением стандартных методик. Можно идентифицировать клонов внутри популяции с изменением фенотипа (например, измененной экспрессией генов или выживаемостью), обусловленным связывающим элементом. Для того чтобы данная обусловленная фенотипом селекция сработала, требуется сохранить связь между геном связывающего элемента, присутствующего внутри экспрессирующей клетки (генотипом), и следствием экспрессии связывающего элемента (фенотипом). Этого можно добиться, например, путем прикрепления связывающего элемента к поверхности клетки, как описано для дисплея антител, или путем применения полутвердой среды для того чтобы секретированные антитела остались вблизи продуцирующей клетки105. В качестве альтернативы, связывающие элементы можно сохранить внутри клетки. Связывающие элементы, сохранившиеся на поверхности клетки или в окружающей среде, могут взаимодействовать с эндогенным или экзогенным рецептором на поверхности клетки, вызывая активацию указанного рецептора. Это, в свою очередь, может вызвать изменение экспрессии репортерного гена или изменение фенотипа указанной клетки. В качестве альтернативы, связывающий элемент может блокировать рецептор или лиганд, чтобы снизить активацию рецептора. Нуклеиновую кислоту, кодирующую связывающий элемент, который вызывает модифицированное поведение клетки, затем можно выделить для продукции или дополнительного конструирования.
В качестве альтернативы данному "направленному на мишень" подходу, можно ввести в клетку "непримированную" популяцию связывающих элементов, которые не были подвергнуты предварительной селекции на определенной молекуле-мишени. Репортерную систему клетки используют, чтобы определить представителей популяции с измененным поведением. Поскольку нет предварительных сведений о молекуле-мишени, для данного ненаправленного на мишень подхода предъявляется особое требование большого репертуара, поскольку предварительное обогащение популяции связывающих элементов, направленных на молекулу-мишень, невозможно.
Подход "функциональной селекции" можно использовать для других применений с использованием библиотек в эукариотических клетках, особенно в клетках высших эукариотов, таких как клетки млекопитающих. Например, связывающий элемент можно соединить с сигнальным доменом таким образом, что связывание молекулы-мишени вызывает активацию рецептора. Подходящие сигнальные домены включают домены рецептора цитокинов, такого как рецептор тромбопоэтина (ТРО), рецептор эритропоэтина (ЕРО), gp130, рецептор IL-2 и рецептор EGF. Химеры связывающий элемент-рецептор можно применять для запуска зависимой от молекулы-мишени экспрессии генов или фенотипических изменений в первичных или стабильных репортерных клетках. Данную способность можно использовать, чтобы идентифицировать слитые связывающие элементы в указанной библиотеке, которые запускают сигнальный ответ, или связывающие вещества, которые ингибируют ответ123-125.
Комбинации реципиентов и линкерных последовательностей, выявленных с применением способов, описанных в данной заявке, можно применять для представления различных донорных диверсифицированных доменов остова одного класса, например, богатых цистеином белков с одинаковым количеством остатков цистеина, или различных классов.
Донорный диверсифицированный домен остова можно заменить в указанном одном или более идентифицированных связывающих элементах из указанной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки на заменяющий его донорный диверсифицированный домен остова.
Донорный диверсифицированный домен остова и заменяющий донорный диверсифицированный домен остова могут содержать остовы из одного класса. Например, донорный диверсифицированный домен остова и заменяющий донорный диверсифицированный домен остова могут содержать одинаковый каркас и различные последовательности взаимодействия. В некоторых вариантах реализации донорный диверсифицированный домен остова может представлять собой ноттин, который связывается с первой молекулой-мишенью, и заменяющий донорный диверсифицированный домен остова может представлять собой ноттин, который связывается со второй молекулой-мишенью. Реципиентный диверсифицированный домен остова, который оптимизировали для одного донорного диверсифицированного домена остова ноттина, описанного в данной заявке, может быть полезен для всех донорных диверсифицированных доменов остова ноттинов. Например, донорный домен ноттина внутри реципиентного вариабельного домена антитела исходного связывающего элемента можно заменить на отличный донорный домен ноттина, что описано в примере ниже.
Донорный диверсифицированный домен остова и заменяющий донорный диверсифицированный домен остова могут содержать остовы из различных классов. Например, донорный диверсифицированный остов и заменяющий донорный диверсифицированный остов может содержать различные донорные остовы и различные донорные последовательности взаимодействия. Например, донорный домен ноттина внутри реципиентного вариабельного домена антитела исходного связывающего элемента можно заменить на донорный диверсифицированный домен остова адгирона, что описано в примере ниже.
В слитые белки или домены-партнеры указанного одного или более идентифицированных связывающих элементов из библиотеки и/или модифицированной библиотеки можно ввести дополнительную последовательность аминокислот. Например, донорный диверсифицированный домен остова, например, донорный домен ноттина, можно подвергнуть конструированию, чтобы ввести новые специфичности связывания, например, путем рационального дизайна, прививки петель и подходов на основе комбинаторных библиотек, применяя технологии дисплея in vitro.
Указанная дополнительная последовательность аминокислот может представлять собой последовательность, связывающую мишень, такую как связывающая VEGF-A последовательность92 или связывающая тромбопоэтин (ТРО) последовательность54.
В некоторых вариантах реализации диверсифицированную последовательность можно внедрить в связывающий элемент, описанный в данной заявке, с получением дополнительной библиотеки для селекции улучшенных вариантов. Например, можно диверсифицировать донорный или реципиентный диверсифицированный домен остова или домен-партнер. Подходящие диверсифицированные последовательности можно внедрить с помощью олигонуклеотид-направленного мутагенеза или неспецифического мутагенеза22.
В некоторых вариантах реализации опосредующий связывание первый домен, выбранный из донорного диверсифицированного домена остова, реципиентного диверсифицированного домена остова и домена-партнера, внутри связывающего элемента можно использовать в качестве ведущего домена, чтобы направить селекцию из библиотеки с применением способа, описанного в данной заявке, чтобы определить модифицированные или перетасованные связывающие элементы, в которых второй домен также вносит вклад в связывание.
Указанный второй домен может взаимодействовать с той же целевой молекулой, что и первый ведущий домен, или может взаимодействовать со второй целевой молекулой, которая тесно связана с ней. Например, связывание с альфа-субъединицей ионного канала, такого как потенциалзависимый натриевый или калиевый канал (например, канал Nav или Kv), донорного диверсифицированного домена остова ноттина можно увеличить или расширить на дополнительные контакты от связывания домена-партнера VH или реципиентного домена VL либо с той же альфа-субъединицей, либо с ассоциированной с ней субъединицей, такой как бета-субъединица ионного канала.
Во втором раунде исходный ведущий домен также можно модифицировать или заменить. Например, один из донорного диверсифицированного домена остова, реципиентного диверсифицированного домена остова или домена-партнера связывающего элемента может действовать как первый ведущий домен, который связывается с молекулой-мишенью. После идентификации второго домена, который вносит вклад в связывание указанной молекулы-мишени, способ может включать модифицирование или замену указанного первого ведущего домена для получения библиотеки связывающих элементов, содержащих второй домен и первый диверсифицированный домен. Это позволяет получить конечный слитый белок, которому принесла пользу доступность исходного ведущего домена во время его разработки, описанной в данной заявке, но не содержит исходный ведущий домен. Это может быть полезно, например, если требуется конечный связывающий элемент, который не содержит слитый донорный диверсифицированный домен остова внутри реципиентного диверсифицированного домена остова.
Например, если донорный диверсифицированный домен остова ноттина внутри связывающего элемента использовали для изолирования вариабельного домена антитела-партнера (например, домена VH) в первом раунде селекции, то данный вариабельный домен антитела-партнера может, в свою очередь, действовать как ведущий домен во втором раунде для селекции альтернативного комплементарного вариабельного домена (например, домена VL). Данный комплементарный домен может представлять собой реципиентный диверсифицированный домен остова с присоединенным к нему донорным диверсифицированным доменом остова или может представлять собой нормальный (т.е. неслитый) вариабельный домен антитела. В некоторых вариантах реализации указанный вариабельный домен антитела (например, домен VH), идентифицированный в первом цикле путем применения связывающего ионный канал донорного диверсифицированного домена остова, может связываться с ассоциированной субъединицей ионного канала, такой как бета-цепь, которая взаимодействует с различными альфа-цепями. Данный вариабельный домен антитела затем может направлять селекцию вариабельных доменов комплементарного антитела или слитых белков донорного диверсифицированного VL- домена остова относительно различных альфа-цепей, которые ассоциируются с одной и той же β-цепью.
В некоторых вариантах реализации первый домен может связываться с молекулой-мишенью с низкой - умеренной аффинностью. Например, аффинность может быть меньше, чем KD 100 нМ. Это позволяет улучшить связывание благодаря вкладу второго домена, который может связываться с тем же белком или тесно ассоциированной субъединицей. В качестве альтернативы, второй домен может связываться с невзаимодействующей или слабо взаимодействующей молекулой на той же клетке, которая соединяет второй домен с клеткой-мишенью, способствуя его взаимодействию с мишенью.
В некоторых вариантах реализации молекула-мишень может быть представлена на поверхности клетки в меченой или немеченой форме для определения связывания93. Например, интегральный мембранный белок, такой как транспортер ионов или GPCR, можно экспрессировать с меткой. Библиотеку связывающих элементов, содержащих домен-партнер, который связывается с меткой (например, домен VH или VL антитела) и диверсифицированную популяцию донорных диверсифицированных доменов остова, представленных на реципиентном домене VL или VH, можно подвергнуть селекции по улучшенному связыванию с меченым экспрессированным на поверхности клетки целевым белком. Это может позволить идентификацию слитых белков и донорных диверсифицированных доменов остова, которые связывают целевой белок снаружи метки. Данные слитые белки и донорные диверсифицированные домены остова можно использовать в дополнительных раундах скрининга, например, с диверсифицированными доменами-партнерами, чтобы определить связывающие элементы, которые связываются с немеченым целевым белком.
Различные подходящие метки известны в данной области, включая, например, MRGS(H)6 (SEQ ID NO: 36), DYKDDDDK (SEQ ID NO: 37) (FLAG™), T7-, S-(KETAAAKFERQHMDS; SEQ ID NO: 38), поли-Arg (R5-6), поли-His (Н2-10), поли-Cys (С4) поли-Phe(F11) поли-Asp(D5-16), Strept-tag II (WSHPQFEK; SEQ ID NO: 39), c-myc (EQKLISEEDL; SEQ ID NO: 40), гемагглютинин вируса гриппа (НА-метка) (Murray, P.J. и др. (1995) Anal Biochem 229, 170-9), метка Glu-Glu-Phe (Stammers, D.K. и др. (1991) FEBS Lett 283, 298-302), Tag. 100 (Qiagen; метка длиной 12 АК, полученная из МАР-киназы 2 млекопитающего), Cruz tag 09™ (MKAEFRRQESDR; (SEQ ID NO: 41), Santa Cruz Biotechnology Inc.) и Cruz tag 22™ (MRDALDRLDRLA; (SEQ ID NO: 42), Santa Cruz Biotechnology Inc.). Известные последовательности меток приведены в обзоре у Terpe (2003) Appl. Microbiol. Biotechnol. 60 523-533.
В некоторых вариантах реализации библиотеку, модифицированную библиотеку и/или перетасованную библиотеку, описанную в данной заявке, можно подвергнуть селекции для выявления связывающих элементов, в которых донорный диверсифицированный домен остова и/или реципиентный диверсифицированный домен остова принимают нативную структуру, т.е. они правильно уложены в активную конформацию.
Например, если донорный диверсифицированный домен остова связывается с известной молекулой-мишенью, то исходную библиотеку, модифицированную библиотеку и/или перетасованную библиотеку, описанную в данной заявке, можно подвергнуть селекции для выявления связывающих элементов, связанных с молекулой-мишенью.
Связывающие элементы, которые связываются с молекулой-мишенью, содержат донорный диверсифицированный домен остова, который активен и правильно уложен в нативную структуру. Это может быть полезно, например, когда фактическая структура донорного диверсифицированного домена остова неизвестна.
Также, как и основанная на аффинности селекция правильной укладки донорного диверсифицированного остова, такие системы селекции как фаговый дисплей могут обеспечить дополнительную селективность в отношении правильной укладки реципиента, поскольку было показано, что фаговый дисплей приводит к обогащению слитыми белками с лучшей структурной целостностью94. Если реципиентный диверсифицированный домен остова представляет собой иммуноглобулин или его фрагмент или домен, то библиотеку, модифицированную библиотеку и/или перетасованную библиотеку, описанную в данной заявке, можно подвергнуть селекции для выявления связывающих элементов, которые связываются со связывающей иммуноглобулин молекулой55. Связывающие элементы, которые связываются со связывающей иммуноглобулин молекулой, содержат реципиентный диверсифицированный домен остова, который активен и правильно уложен в нативную структуру, несмотря на слияние с донорным доменом. Жесткость указанной системы можно дополнительно улучшить, подвергнув популяцию отображенных элементов (например, популяцию фагового дисплея) более разрушительным условиям, например, повышенной температуре, что было сделано ранее94,96.
Подходящие связывающие иммуноглобулин молекулы хорошо известны в данной области и включают формы дикого типа и сконструированные формы белка L, белка G и белка А, а также антитела к Ig и фрагменты антител к Ig. В некоторых вариантах реализации связывающая иммуноглобулин молекула может содержаться в среде для аффинной хроматографии. Подходящие среды для аффинной хроматографии хорошо известны в данной области и включают KappaSelect™, LambdaSelect™, IgSelect™ и GammaBind™ (GE Healthcare).
Один или более связывающих элементов, идентифицированных как описано выше, можно дополнительно исследовать, например, определить функциональное влияние связывания с молекулой-мишенью. Способ может включать определение влияния одного или более связывающих элементов, идентифицированных в указанной библиотеке, модифицированной библиотеке и/или перетасованной библиотеке, на активность молекулы-мишени.
В некоторых вариантах реализации молекула-мишень может представлять собой ионный канал, и можно определить влияние указанного одного или более идентифицированных связывающих элементов на поток ионов через указанный канал.
Поток ионов через канал можно определить, применяя стандартные электрофизиологические методики, такие как фиксация потенциала. Например, поток ионов можно измерить, применяя двухэлектродный режим фиксации потенциала, после эндогенной или гетерологичной экспрессии ионного канала. В некоторых вариантах реализации функцию ионного канала можно определить, применяя анализы на основе флуоресценции. Например, клетки, экспрессирующие эндогенный или гетерологичный ионный канал, например, потенциалзависимый кальциевый канал (Cav), можно нагрузить флуорофором, таким как Fura3 или Calcium Green. Активация ионного канала путем вызванной K+ деполяризации приводит к временному повышению концентрации внутриклеточных ионов, которую можно легко измерить. Подходящие системы деполяризации клеточных мембран и регистрации отклика доступны в данной области (например, FlexStation™; Molecular Devices Inc, США).
Поток ионов через канал также можно определить, применяя датчик ионов на основе флуоресцентных белков. Подходящие датчики ионов на основе флуоресцентных белков доступны в данной области97.
В некоторых вариантах реализации можно определить влияние указанного одного или более идентифицированных связывающих элементов на панель молекул-мишеней. Например, можно определить влияние указанного одного или более идентифицированных связывающих элементов на поток ионов через панель ионных каналов. Это может быть полезно, например, для определения или выявления характеристик специфичности связывающего элемента. В качестве альтернативы, можно определить влияние указанного одного или более идентифицированных связывающих элементов на активность протеазы, если мишень представляет собой протеазу. В качестве альтернативы, можно определить влияние указанного одного или более идентифицированных связывающих элементов на передачу сигналов в клетке, если мишень представляет собой рецептор.
После идентификации, описанной выше, один или более идентифицированных связывающих элементов можно выделить, изолировать и/или очистить из библиотеки, модифицированной библиотеки и/или перетасованной библиотеки.
В предпочтительных вариантах реализации каждый связывающий элемент в указанной библиотеке можно представить на поверхности частицы, такой как гранула, рибосома, клетка или вирус, которая содержит нуклеиновую кислоту, кодирующую связывающий элемент.
После селекции связывающих элементов, которые проявляют активность связывания (например, связывания молекулы-мишени) и отображены на бактериофаге или других частицах или молекулярных комплексах библиотеки, нуклеиновую кислоту можно снять с бактериофага или другой частицы или молекулярного комплекса, на котором отображен прошедший селекцию связывающий элемент.
Частицы, на которых представлен указанный один или более идентифицированных связывающих элементов, можно изолировать и/или очистить из указанной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки. Нуклеиновую кислоту, кодирующую указанный один или более идентифицированных связывающих элементов, можно изолировать и/или очистить от частиц.
Изолированную нуклеиновую кислоту, кодирующую указанный один или более идентифицированных связывающих элементов, можно амплифицировать, клонировать и/или секвенировать.
Подходящие способы амплификации, клонирования и/или секвенирования нуклеиновых кислот хорошо известны в данной области (см. например, Protocols in Molecular Biology, второе издание, Ausubel и др. ред. John Wiley & Sons).
Последовательность изолированной нуклеиновой кислоты можно использовать для последующего получения связывающего элемента или слитого белка.
Указанный один или более идентифицированных связывающих элементов или кодирующие их нуклеиновые кислоты можно синтезировать. Например, указанный один или более связывающих элементов можно получить полностью или частично путем химического синтеза. Например, связывающие элементы, или отдельные донорные или реципиентные диверсифицированные домены остова, или их слитые белки и домены-партнеры можно синтезировать, применяя способы жидкофазного или твердофазного синтеза, в растворе или с помощью любой комбинации твердофазной, жидкофазной химии и химии растворов, например, путем сначала получения всей соответствующей пептидной части, а затем, при необходимости и желании, после удаления любых присутствующих защитных групп, путем включения остатка X посредством реакции соответствующей карбоновой или сульфоновой кислоты или ее способного вступать в реакции производного.
Химический синтез полипептидов хорошо известен в данной области (J.M. Stewart и J.D. Молодой, Solid Phase Peptide Synthesis, 2oe издание, Pierce Chemical Company, Рокфорд, Иллинойс (1984); M. Bodanzsky и A. Bodanzsky, The Practice of Peptide Synthesis, Springer Verlag, Нью-Йорк (1984); J. H. Jones, The Chemical Synthesis Of Peptides. Oxford University Press, Оксфорд, 1991; в Applied Biosystems 430A User's Manual, ABI Inc., Фостер Сити, Калифорния; G. A. Grant, (ред.) Synthetic Peptides, A User's Guide. W. H. Freeman & Co., Нью-Йорк 1992, E. Atherton и R.C. Sheppard, Solid Phase Peptide Synthesis, A Practical Approach. IRL Press 1989 и в G.B. Fields, (ред.) Solid Phase Peptide Synthesis (Methods in Enzymology, том 289). Academic Press, Нью-Йорк и Лондон 1997).
Указанный один или более идентифицированных связывающих элементов можно рекомбинантно экспрессировать с кодирующей нуклеиновой кислоты. Например, нуклеиновую кислоту, кодирующую связывающий элемент, можно экспрессировать в клетке-хозяине, и экспрессированный полипептид изолировать и/или очистить из культуры клеток.
Последовательности и конструкции нуклеиновых кислот, описанные выше, могут содержаться внутри вектора экспрессии. Подходящие векторы можно выбрать или сконструировать таким образом, чтобы они содержали подходящие регуляторные последовательности, включая последовательности промотора, фрагменты терминатора, последовательности полиаденилирования, последовательности энхансера, маркерные гены и другие последовательности, при необходимости. Предпочтительно вектор содержит подходящие регуляторные последовательности для запуска экспрессии нуклеиновой кислоты в клетке-хозяине. Подходящие регуляторные последовательности для запуска экспрессии последовательностей, кодирующих гетерологичную нуклеиновую кислоту, в системах экспрессии хорошо известны в данной области и включают конститутивные промоторы, например, промоторы вирусов, таких как CMV или SV40, и индуцируемые промоторы, такие как контролируемые Tet-on промоторы. Вектор также может содержать такие последовательности, как точки начала репликации и селектируемые маркеры, которые позволяют селекцию, репликацию и экспрессию в бактериальных хозяевах, таких как Е. coli, и/или в эукариотических клетках.
Множество методик и протоколов экспрессии рекомбинантных полипептидов в культуре клеток и последующего их выделения и очистки известны в данной области (см. например, Protocols in molecular Biology, второе издание, Ausubel и др. ред. John Wiley & Sons, 1992; Recombinant Gene Expression Protocols Ed RS Tuan (Mar 1997) Human Press Inc).
Подходящие клетки-хозяева включают бактерии, клетки млекопитающих, клетки растений, мицелиальные грибы, дрожжевые и бакуловирусные системы и трансгенные растения и животные. Экспрессия антител и фрагментов антител в прокариотических клетках хорошо отработана в данной области. Как правило, бактериальный хозяин представляет собой Е. coli.
Экспрессия в эукариотических клетках в культуре также доступна для специалистов в данной области как возможный вариант получения связывающего элемента. Линии клеток млекопитающих, доступные в данной области для экспрессии гетерологичного полипептида, включают клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почки новорожденного хомяка, клетки меланомы мыши NS0, клетки миеломы крысы YB2/0, эмбриональные клетки почки человека (например, клетки HEK293), эмбриональные клетки сетчатки человека (например, клетки PerC6) и многие другие.
Можно изменить формат одного или более из идентифицированных связывающих элементов. Например, можно изменить формат связывающего элемента, содержащего реципиентный связывающий домен иммуноглобулина или домен-партнер иммуноглобулина, на scFv, Fab, scFv-Fc, Fc, IgA, IgD, IgM, IgG или полуантитело. Способ может включать выделение нуклеиновой кислоты, кодирующей домен иммуноглобулина (например, домен VH или VL), из клеток клона, амплификацию нуклеиновой кислоты, кодирующей указанный домен, и встраивание амплифицированной нуклеиновой кислоты в вектор с получением вектора, кодирующего указанную молекулу антитела. Изменение формата с scFv на формат Fab и формат IgG пояснено в примере ниже.
В некоторых вариантах реализации донорный диверсифицированный домен остова из одного или более идентифицированных связывающих элементов можно изолировать. Способ, описанный в данной заявке, может дополнительно включать синтез или рекомбинантную экспрессию изолированного донорного диверсифицированного домена остова из одного или более идентифицированных связывающих элементов из исходной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки.
Можно изменить формат изолированного донорного диверсифицированного домена остова. Например, донорный диверсифицированный домен остова можно встроить в отличный реципиентный диверсифицированный домен остова в связывающем элементе, описанном в данной заявке, или можно встроить в отличный формат связывающего элемента, такой как слитый с N- или С-концом белок.
В некоторых вариантах реализации изолированный донорный диверсифицированный домен остова можно использовать в качестве независимой связывающей молекулы, свободной от любого реципиентного домена или партнера по слиянию.
К указанному одному или более идентифицированным связывающим элементам можно присоединить детектируемую или функциональную метку или молекулу, продлевающую время полужизни.
Метка может представлять собой любую молекулу, которая вырабатывает или может быть стимулирована для выработки сигнала, включая, но не ограничиваясь перечисленными метками: флуоресцирующие вещества, радиоактивные метки, ферменты, хемилюминесцентные вещества или фотосенсибилизаторы. Таким образом, связывание можно обнаружить и/или измерить путем обнаружения флуоресценции или люминесценции, радиоактивности, ферментнативной активности или поглощения света.
Подходящие метки включают ферменты, такие как щелочная фосфатаза, глюкоза-6-фосфат-дегидрогеназа ("G6PDH"), альфа-D-галактозидаза, глюкозоксидаза, глюкозамилаза, карбонангидраза, ацетилхолинэстераза, лизоцим, малатдегидрогеназа и пероксидаза, например, пероксидаза хрена; красители; флуоресцентные метки или флуоресцирующие вещества, такие как флуоресцеин и его производные, флуорохром, соединения и производные родамина, GFP (зеленый флуоресцентный белок), данзил, умбеллиферон, фикоэритрин, фикоцианин, аллофикоцианин, орто-фталевый альдегид и флуорескамин; флуорофоры, такие как криптаты и хелаты лантаноидов, например, европия и т.д. (Perkin Elmer и Cis Biointernational); хемилюминесцентные метки или хемилюминесцентные вещества, такие как изолюминол, люминол и диоксетаны; биолюминесцентные метки, такие как люцифераза и люциферин; сенсибилизаторы;
коферменты; субстраты ферментов; радиоактивные метки, включая бром-77, углерод-14, кобальт-57, фтор-8, галлий-67, галлий-68, водород-3 (тритий), индий-111, индий-113m, йод-123m, йод-125, йод-126, йод-131, йод-133, ртуть-107, ртуть-203, фосфор-32, рений-99m, рений-101, рений-105, рутений-95, рутений-97, рутений-103, рутений-105, скандий-47, селен-75, сера-35, технеций-99, технеций-99m, теллур-121m, теллур-122m, теллур-125m, туллий-165, туллий-167, туллий-168 и иттрий-199; частицы, такие как частицы латекса или углерода; золь металла; кристаллит; липосомы; клетки и т.д., которые можно дополнительно пометить красителем, катализатором или другой детектируемой группой; и молекулы, такие как биотин, дигоксигенин или 5-бромдезоксиуридин; молекулы токсинов, такие как, например, молекула токсина, выбранного из группы, состоящей из экзотоксина псевдомонад (РЕ или его цитотоксического фрагмента или мутанта), дифтерийного токсина или его цитотоксического фрагмента или мутанта, ботулинического токсина А, В, С, D, Е или F, рицина или его цитотоксического фрагмента, например, рицина А, абрина или его цитотоксического фрагмента, сапонина или его цитотоксического фрагмента, противовирусного токсина лаконоса или его цитотоксического фрагмента и бриодина 1 или его цитотоксического фрагмента.
Подходящие ферменты и коферменты описаны в Litman и др., US 4275149, и Boguslaski и др., US 4318980. Подходящие флуоресцентные вещества и хемилюминесцентные вещества описаны в Litman и др., US 4275149. Метки дополнительно содержат химические молекулы, такие как биотин, которые можно детектировать посредством связывания с определенной узнаваемой детектируемой молекулой, например, меченым авидином или стрептавидином. Детектируемые метки можно присоединить к антителам согласно настоящему изобретению, применяя обычные химические способы, известные в данной области.
Подходящие продлевающие время полужизни молекулы включают белки, слитые с Fc доменами или сывороточным альбумином, не структурированные пептиды, такие как XTEN98 или PAS99 полиэтиленгликоль (ПЭГ),
Способ, описанный в данной заявке, может дополнительно включать получение композиции указанного одного или более идентифицированных связывающих элементов из указанной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки или изолированного донорного диверсифицированного домена остова с фармацевтически приемлемым вспомогательным веществом.
Термин "фармацевтически приемлемый" в данной заявке относится к соединениям, материалам, композициям и/или лекарственным формам, которые, в рамках здравого медицинского суждения, подходят для применения в контакте с тканями субъекта (например, человека) без избыточной токсичности, раздражения, аллергического ответа или другой проблемы или осложнения, в соответствии с приемлемым отношением польза/риск. Каждый носитель, вспомогательное вещество и т.д. также должны быть "приемлемыми" в том смысле, что они совместимы с другими ингредиентами состава. Подходящие носители, вспомогательные вещества и т.д. можно найти в стандартных фармацевтических документах, например, Remington's Pharmaceutical Sciences, 18ое издание, Mack Publishing Company, Истон, Пенсильвания, 1990.
В другом аспекте настоящего изобретения предложена нуклеиновая кислота, кодирующая слитый белок или связывающий элемент, описанный в данной заявке.
Нуклеиновая кислота может включать ДНК или РНК и может быть полностью или частично синтетической. Упоминание последовательности нуклеотидов в данной заявке включает молекулу ДНК с определенной последовательностью и включает молекулу РНК с определенной последовательностью, в которой U замещает Т, если контекстом не требуется иное.
В другом аспекте настоящего изобретения предложен вектор, содержащий нуклеиновую кислоту, описанную в данной заявке, а также кассеты транскрипции или экспрессии, содержащие указанную нуклеиновую кислоту. Векторы могут представлять собой плазмиды, вирусные, например, фаг или фагмида, в соответствующих случаях. Дополнительные подробности см., например, в Molecular Cloning: a Laboratory Manual; 3ее издание, Russell и др., 2001, Cold Spring Harbor Laboratory Press.
В другом аспекте настоящего изобретения предложена популяция нуклеиновых кислот, кодирующих библиотеку связывающих элементов, описанных в данной заявке.
Указанные нуклеиновые кислоты, кодирующие указанную библиотеку, могут содержаться в векторах экспрессии, таких как фаговые или фагмидные векторы.
В другом аспекте настоящего изобретения предложена популяция частиц, содержащих библиотеку, описанную в данной заявке, и/или популяцию нуклеиновых кислот, кодирующих библиотеку, описанную в данной заявке.
Библиотека может быть отображена на поверхности вирусных частиц. Каждый связывающий элемент в указанной библиотеке может дополнительно содержать белок оболочки фага, чтобы способствовать отображению на его поверхности. Каждая вирусная частица может содержать нуклеиновую кислоту, кодирующую связывающий элемент, отображенный на частице. Подходящие вирусные частицы включают бактериофаг, например, нитевидный бактериофаг, такой как М13 и Fd. Методики получения библиотек фагового дисплея хорошо известны в данной области.
В других аспектах настоящего изобретения предложена клетка-хозяин, содержащая связывающий элемент, нуклеиновую кислоту или вектор, описанные в данной заявке, и популяция клеток-хозяев, содержащая библиотеку, популяцию нуклеиновых кислот и/или популяцию вирусных частиц, описанных в данной заявке.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая слитый белок или связывающий элемент, описанный в данной заявке, и фармацевтически приемлемое вспомогательное вещество.
Указанная фармацевтическая композиция для удобства может присутствовать в стандартной лекарственной форме, и ее можно получить с помощью любых способов, хорошо известных в области фармацевтики. Такие способы включают этап приведения связывающего элемента в ассоциацию с носителем, который может содержать один или более вспомогательных ингредиентов. Как правило, фармацевтические композиции получают путем приведения в однородную и тесную ассоциацию активного соединения с жидкими носителями или тонкодисперсными твердыми носителями или обоими, а затем, при необходимости, формовки продукта.
Фармацевтические композиции могут находиться в форме жидкостей, растворов, суспензий, эмульсий, эликсиров, сиропов, таблеток, пастилок, гранул, порошков, капсул, облаток, пилюль, ампул, суппозиториев, пессариев, мазей, гелей, паст, кремов, спреев, дымок, пен, лосьонов, масел, болюсов, электуариев или аэрозолей.
Связывающий элемент или фармацевтическую композицию, содержащую связывающий элемент, можно вводить субъекту с помощью любого удобного пути введения, либо системного/периферического, либо в место желательного действия, включая, но не ограничиваясь перечисленными путями: пероральный (например, путем приема внутрь); топический (включая например, трансдермальный, внутриназальный, глазной, буккальный и сублингвальный); легочный (например, посредством ингаляционной или инсуффляционной терапии с применением, например, аэрозоля, например, через рот или нос); ректальный; вагинальный; парентеральный, например, путем инъекции, включая подкожную, внутрикожную, внутримышечную, внутривенную, интраартериальную, внутрисердечную, интратекальную, интраспинальную, внутрисуставную, подкапсулярную, внутриглазничную, интраперитонеальную, внутритрахеальную, субкутикулярную, внутрисуставную, субарахноидальную и внутристернальную инъекцию; путем имплантации депо, например, подкожно или внутримышечно.
Фармацевтические композиции, подходящие для перорального введения (например, путем приема внутрь), могут быть представлены в виде отдельных единиц, таких как капсулы, облатки или таблетки, каждая из которых содержит заранее определенное количество активного соединения; в виде порошка или гранул; в виде раствора или суспензии в водной или безводной жидкости; или в виде жидкой эмульсии «масло в воде» или жидкой эмульсии «вода в масле»; в виде болюса; в виде электуария или в виде пасты.
Фармацевтические композиции, подходящие для парентерального введения (например, путем инъекции, включая кожную, подкожную, внутримышечную, внутривенную и внутрикожную инъекцию), включают водные и безводные изотонические апирогенные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, консерванты, стабилизаторы, бактериостатические средства и растворенные вещества, которые делают состав изотоничным для крови предполагаемого реципиента; и водные и безводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители, и липосомы или другие системы микрочастиц, которые разработаны для нацеливания указанного соединения на компоненты крови или один или более органов. Примеры подходящих изотонических сред для применения в таких составах включают хлорид натрия для инъекций, раствор Рингера или раствор Рингера с лактатом для инъекций. Как правило, концентрация активного соединения в растворе составляет от приблизительно 1 нг/мл до приблизительно 10 мкг/мл, например, от приблизительно 10 нг/мл до приблизительно 1 мкг/мл. Указанные составы могут быть представлены в однодозовых или многодозовых запечатанных контейнерах, например, ампулах и пробирках, и их можно хранить в высушенном сублимацией (лиофилизированном) состоянии, требующем лишь добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением.
Должно быть очевидно, что подходящие дозировки связывающего элемента могут изменяться от пациента к пациенту. Определение оптимальной дозировки, как правило, включает сопоставление уровня диагностической пользы и какого-либо риска или вредных побочных эффектов от введения. Выбранный уровень дозировки будет зависеть от различных факторов, включая, но не ограничиваясь перечисленными: путь введения, время введения, скорость выведения визуализационного агента, требуемое количество контраста, другие лекарственные средства, соединения и/или материалы, используемые в комбинации, и возраст, пол, массу тела, состояние, общее состояние здоровья и анамнез пациента. Количество визуализационного агента и путь введения в конечном счете будет определять лечащий врач, хотя, как правило, дозировка будет такой, чтобы добиться концентраций визуализационного агента в месте, таком как опухоль, интересующая ткань или все тело, которые позволяют визуализацию, не вызывая значительных опасных или вредных побочных эффектов.
Введение in vivo можно осуществить одной дозой, непрерывно или с перерывами (например, дробными дозами с подходящими интервалами). Способы определения наиболее эффективных средств и дозировок для введения хорошо известны специалистам в данной области и будут изменяться в зависимости от состава, используемого для терапии, цели терапии, клетки-мишени, которую лечат, и субъекта, которого лечат. Можно осуществить однократное введение или множество введений, при этом уровень дозы и схему введения выбирает лечащий врач.
Связывающие элементы, описанные в данной заявке, можно применять в способах диагностики или лечения людей или животных, например, человека. Связывающие элементы для молекулы-мишени, такой как ионный канал, можно применять для лечения расстройств, связанных с молекулой-мишенью.
В других аспектах настоящего изобретения предложены слитый белок, связывающий элемент или композиция, описанные в данной заявке, для применения в качестве лекарственного средства; слитый белок, связывающий элемент или композиция, описанные в данной заявке, для применения для лечения боли или аутоиммунного заболевания; и применение слитого белка, связывающего элемента или композиции, описанных в данной заявке, для производства лекарственного средства для лечения состояния, связанного с активностью или нарушением функционирования ионного канала.
В другом аспекте настоящего изобретения предложен способ лечения, включающий введение связывающего элемента или композиции, описанных в данной заявке, нуждающемуся в этом индивиду, необязательно для лечения состояния, связанного с активностью или нарушением функционирования ионного канала.
Эффективное количество связывающего элемента или композиции, описанной в данной заявке, отдельно или в комбинированной схеме приема с другим подходящим лекарственным средством, известным в данной области или описанным в данной заявке, можно применять для лечения или уменьшения тяжести по меньшей мере одного симптома любого из заболеваний или расстройств, связанных с молекулой-мишенью, у нуждающегося в этом пациента, так что тяжесть по меньшей мере одного симптома любого из описанных выше расстройств уменьшается.
В других аспектах и вариантах реализации настоящего изобретения предложены аспекты и варианты реализации, описанные выше, в которых термин "включающий" заменен на термин "состоящий из", и аспекты и варианты реализации, описанные выше, в которых термин "включающий" заменен на термин "по существу состоящий из".
Должно быть очевидно, что в настоящей заявке раскрыты все комбинации друг с другом любого из описанных выше аспектов и вариантов реализации, описанных выше, если только в контексте не требуется иное. Аналогично, в настоящей заявке раскрыты все комбинации предпочтительных и/или необязательных свойств либо отдельно, либо вместе с любым из других аспектов, если только в контексте не требуется иное.
Модификации описанных выше вариантов реализации, дополнительных вариантов реализации и их модификаций должны быть очевидны для квалифицированного специалиста при прочтении настоящего описания, и, следовательно, они входят в объем настоящего изобретения.
Содержания всех документов, веб-сайтов, записей баз данных и баз данных последовательностей, упомянутых в настоящей заявке, включая последовательности аминокислот и нуклеотидов, описанные в них, полностью включены в данную заявку посредством ссылки во всех отношениях.
"И/или", когда их используют в данной заявке, следует понимать как конкретное описание каждого из двух упомянутых свойств или компонентов вместе с другим или без него. Например, "А и/или В" следует понимать как конкретное описание каждого из (i) А, (ii) В и (iii) А и В, точно так же, как если бы каждый из них был указан отдельно в данной заявке.
Некоторые аспекты и варианты реализации настоящего изобретения далее будут проиллюстрированы с помощью примеров и со ссылкой на описанные выше фигуры.
Эксперименты
1. Краткое описание.
Встраивание донорного диверсифицированного остова (например, ноттина) в реципиентный диверсифицированный домен остова (например, домен VL антитела) было впервые показано в данной заявке с применением ингибитора трипсина: ингибитора трипсина-II Ecballium elaterium (EETI-II). В данном каркасе ноттина высокая аффинность связывания с трипсином зависит от правильной укладки ноттина. Ген ноттина клонировали либо в CDR1, либо в CDR2 реципиентной легкой цепи антитела (продемонстрировали для обеих легких цепей каппа и лямбда). Создали библиотеку вариантов реципиента, чтобы позволить селекцию таких вариантов реципиента, которые могут разместить поступившего донора. Указанные донорные и реципиентные домены находились в близком контакте. В примере ниже поступивший донор замещал петлю CDR, и концы поступившего донорного домена присоединялись к фланкирующим остаткам каркаса антитела, т.е. последовательностям β-цепи коровой структуры. В некоторых примерах ниже остатки остова были заменены на произвольные последовательности. Связывающий элемент, следовательно, сконструировали таким способом, который ограничивал длину последовательности, соединяющей донора и реципиентный остов, таким образом, что не добавлялось или добавлялось несколько дополнительных остатков. В некоторых случаях внутри соединения между остатками остова и донорным доменом было меньшее остатков по сравнению с их количеством, полученным при слиянии напрямую элементов вторичной структуры донора и реципиента. Создали библиотеку вариантов, в которой последовательность аминокислотных остатков на N- и С-концевой границе поступившего домена варьировали, при этом сохраняя короткую длину линкера, чтобы ограничить конформационную гибкость. Данная библиотека была разработана для того, чтобы определить правильные слитые комбинации, содержащие фиксированную последовательность каппа или лямбда, предшествующую ноттину, при этом диверсификацию осуществляли на основе природного репертуара легких цепей в участок, который следовал за встроенным ноттином. Таким образом, при встраивании ноттина в CDR1, последовательность от каркаса 2 (FW2) до конца домена VL была из природного репертуара. Аналогичным образом, за вставкой в CDR2 от каркаса 3 до конца домена VL следовали последовательности из природного репертуара.
Популяция генов, кодирующих слитые донорные и реципиентные диверсифицированные остовы, клонировали в вектор фагового дисплея, выделяли частицы фагов, отображающие слитый белок, и проводили селекцию популяции на иммобилизованном трипсине, применяя технологию фагового дисплея28,100. Таким образом, осуществляли селекцию по сохранившемуся связыванию с трипсином и, следовательно, правильной укладке донора ноттина. Помимо селекции на основе аффинности по правильной укладке донора, фаговый дисплей также обеспечивает дополнительную селективность по правильной укладке реципиента, поскольку было показано, что фаговый дисплей обогащает слитыми белками с лучшей структурной целостностью94. Таким образом, если у донора была правильная укладка (и, следовательно, способность связывать трипсин), но укладка реципиента была нарушена, то отображение донора все же будет нарушено (возможно посредством деградации неправильно уложенного слитого белка). Селективность по укладке реципиентного антитела, следовательно, можно дополнительно повысить путем предварительной селекции на белке L или белке А, оба из которых, как было показано, связываются с определенными доменами VL и VH, соответственно95, при обязательном условии правильной укладки. Строгость данной системы можно дополнительно улучшить, подвергнув популяцию фагов более разрушительным условиям94,96.
Проводили селекцию с получением панели вариантов легкой цепи, которые поддерживают укладку EETI-II и его связывание с трипсином. Как только каркас прошел селекцию с использованием одного представителя семейства донорных диверсифицированных остовов (в данном случае, ноттинов), его можно применять для дополнительных представителей того же семейства донорных диверсифицированных остовов, учитывая общие структурные ограничения внутри семейства доноров. Используя два из прошедших селекцию реципиентных остовов легких цепей антитела, диапазон других ноттинов, которые блокируют натриевые каналы 71 72 70, калиевые каналы 25,73,74 и кислото-чувствительные ионные каналы118,122, использовали в качестве доноров для прошедших предварительную селекцию реципиентных доменов антитела. Для некоторых из них показали сохранение блокирующей активности по отношению к целевому ионному каналу в случае потенциалзависимого калиевого канала Kv1.3 и кислото-чувствительного ионного канала 1а. Таким образом было показано, что выбранный реципиентный домен представляет собой общий каркас, который можно применять для множества различных доноров из того же класса диверсифицированных остовов.
Два указанных связывающих остова были соединены короткими негибкими линкерами, чтобы ограничить гибкость и относительное движение между доменами. Учитывая непосредственную близость слитых связывающих остовов, у аминокислот на поверхности обоих донорного и диверсифицированных остовов есть возможность вносить вклад в паратоп, вовлеченный во взаимодействие с тем же эпитопом на одном белке. Аналогичным образом, поверхность доменов-партнеров любого из донорного или диверсифицированных остовов может вносить вклад в связывание мишени. В качестве альтернативы, оба каркаса могут контактировать с близко расположенными сайтами на комплексе целевого белка. Конформационная гибкость приводит к термодинамическому "энтропийному штрафу" для взаимодействий со связыванием. По той же причине, фиксирование конформационных взаимосвязей между двумя указанными слитыми доменами дает преимущества, и, следовательно, предпочтительно избежать соединения двух указанных доменов гибкими линкерными последовательностями.
Связывающий элемент, содержащий донорный ноттин, встроенный в вариабельный домен реципиентного антитела, кристаллизовали и определяли белковую структуру. Этим подтвердили правильную укладку ноттина и показали, что у ноттина, присутствующего внутри реципиентного вариабельного домена антитела, была такая же структура, как и показанная ранее для свободного ноттина. Данная структура также подтвердила правильную укладку антитела и близкий контакт двух указанных доменов. Для обоих доменов выявили ожидаемую структуру, и ожидаемую относительно жесткую конформацию между доменами подтвердили по кристаллической структуре. Слияние богатого цистеином донорного домена с реципиентным доменом антитела далее обозначают KnotBody™
Пример 1. Конструирование библиотек фагового дисплея слитого белка ноттин-CDR VL.
Вектор фагового дисплея pSANG428 представляет собой вектор фагового дисплея на основе фагмиды, который позволяет легко клонировать антитела в формате одноцепочечного Fv (scFv). В формате scFv ген VH и ген VL соединены с помощью ДНК, кодирующей гибкий линкерный пептид. С помощью pSANG4 гены scFv клонировали в сайты Nco1 и Not1 с сохранением рамки считывания с получением слитого белка с лидерной последовательностью М13, которая предшествует сайту Nco1, и минорным белком оболочки, кодируемым геном 3, который следует за сайтом Not1 (фигура 1А).
Синтезировали синтетический ген scFv, содержащий фиксированный ген VH (D12), который не взаимодействует с трипсином (фигура 2) (от Genscript). Данный ген D12 VH101 связывается с "TNF-альфа-превращающим ферментом" (ТАСЕ) и происходит из гена зародышевой линии IGHV3-23 (также известного как DP47), который часто используется при гуморальных иммунных ответах102.
Ген VH соединяют с синтетическим геном, кодирующим N-концевую часть либо гена зародышевого типа IGKV1D-39 (представителя семейства 1 V каппа), либо гена зародышевого типа IGLV1-36 (представителя семейства 1 V лямбда) до конца фрагмента FR2, за которым следует участок рестрикции Not 1.
Данный синтетический ген, содержащий часть гена VL, позволит вставку гена ноттина либо в положение CDR1, либо в положение CDR2 (фигура 1В, С). Указанный ген вводит сайт рестрикции Pml1 в конце FR1, который используют для клонирования репертуара ноттинов, фланкированных с 5'- и 3'-концов сайтом Pml1 и Mfe1, соответственно (фигура 1В). Сайт Pml был введен рядом с концом FW1 в результате молчащей мутации в гене каппа. Мутацию с заменой Ser на Thr вводили в участок FW1 гена лямбда, чтобы разместить сайт для того же самого фермента рестрикции. Указанные синтетические гены также вводили сайт Pst1 на конце FW2, который использовали для внедрения гена ноттина в положение CDR2, применяя сайты рестрикции Pst1 и BspE1 на 5'- и 3'-концах гена ноттина (фигура 1С). При сборке функционального гена VL остальную часть домена VL (начиная от FR2 в случае вставки ноттина в положение CDR1 и от FW3 в случае вставки в положение CDR2) получали с помощью ПЦР из репертуара легких цепей28, чтобы слитые белки были полноразмерными (см. пример 2).
Данные 2 синтетических гена, кодирующих фрагмент гена зародышевого типа либо каппа, либо лямбда легкой цепи, амплифицировали, применяя праймеры 2561 (GGTACCTCGCGAATGCATCTAG; SEQ ID NO: 43) и 2562 (CATGCAGGCCTCTGCAGTCG; SEQ ID NO: 44). Очищенные продукты ПЦР расщепляли с помощью Nco1 и Not1 перед лигированием в вектор pSANG428, расщепленный с помощью тех же ферментов рестрикции. Продуктами лигирования трансформировали клетки DH5-альфа E. coli (Life Technologies), следуя инструкциям производителя. Плазмидную ДНК получали из трансформантов с подтвержденной последовательностью, применяя набор Macherey Nagel Midi prep (следуя инструкциям производителя). Данные векторы назвали "plONTAS1_KB_Kappa" и "plONTAS1_KB_lambda", и указанные последовательности от сайта Nco1 до сайта Not1 показаны на фигурах 2А и 2В, соответственно.
Для того чтобы продемонстрировать возможность слияния уложенного донора ноттина с реципиентным антителом, использовали ингибитор трипсина-II Ecballium elaterium (EETI-II) - полученный из растения ноттин с активностью ингибитора трипсина. EETI-II содержит свободные N- и С-концы, и связывание трипсина запускается ограниченной последовательностью "PRIL", присутствующей в петле 1 (фигура 3А)103. Высокая аффинность к трипсину в правильно уложенном состоянии104 дает возможность определить донорные ноттины, которые сохраняют связывание трипсина, несмотря на их клонирование в реципиентный домен VL. Конструирование библиотеки фагового дисплея, в которой между донором и реципиентом ввели вариабельную слитую последовательность, позволит селекцию функциональных комбинаций ноттин-CDR-VL из указанных библиотек на основе связывания трипсина.
Данный донорный диверсифицированный остов ноттина присоединяли в положение CDR1, либо в положение CDR2 либо каппа, либо лямбда доменов VL. Это осуществляли путем замены остатков внутри поступившего донорного ноттина и реципиентного VL на произвольные аминокислоты таким способом, который ограничивал количество добавленных аминокислот между указанными 2 доменами или даже уменьшал его (фигура 3В). Мы также внедрили репертуар фрагментов легкой цепи, содержащих фрагмент гена VL, после точки вставки (пример 2).
Встраивание ноттинов в CDR1.
Создали синтетический ген донора ноттина EETI-II и использовали его для замены положений CDR1 в реципиентной легкой цепи путем получения фрагмента ПЦР с сайтами Pml1 и Mfe (которые были введены с помощью ПЦР) и клонирования в plONTAS1_KB_Kappa и plONTAS1_KB_lambda. Обозначения каркаса и CDR соответствуют описанным в Международной информационной системе ImMunoGenetics (IMGT)29. Указанные праймеры для ПЦР также встраивали вариабельные последовательности аминокислот между сайтами рестрикции и геном ноттина. Каждый из праймеров для ПЦР Pml1-5EETa и Pml1-5EETb встраивал 3 вариабельных кодона, кодируемых последовательностью VNS (V=АС или G, N=ACG или Т, S=С или G) сразу после сайта рестрикции Pml. Указанные вырожденные кодоны "VNS" кодируют 16 аминокислот (за исключением цистеина, тирозина, триптофана, фенилаланина и стоп-кодонов) в каждом рандомизированном положении из 24 комбинаций кодонов.
5'-конец данных последовательностей представляет собой сайт, созданный Pml1 - ферментом рестрикции, распознающим последовательность "CACGTG" (SEQ NO: 47), с получением тупого конца. Для того чтобы облегчить клонирование продукта ПЦР с тупыми концами, синтезировали праймеры с 5'-фосфорилированными концами.
Встраивание продуктов ПЦР в этом месте приводит к замене последних 3 остатков FW1 и первого остатка EETI-II (который образует часть β-слоя внутри ноттина) на 3 рандомизированных остатка. Результирующий эффект состоит в утрате аминокислоты в месте соединения каркаса и донора. Праймер Pml1-5EETb кодирует дополнительный остаток Gly, который восстанавливает количество остатков между ними (фигура 3В).
На 3'-конце гена ноттина применяли антисмысловые праймеры 1-5EETMfe (кодирующие сайт Mfe1), чтобы амплифицировать EETI-II. Сайт Mfe1, используемый для клонирования, кодирует 2ю и 3ю аминокислоты FW2 (Asn-Trp). Данный праймер также сохранил концевой глицин, обнаруженный в EETI-II, и ввел 2 произвольные аминокислоты, кодируемые кодонами VNS или VNC, за которыми следовал сайт Mfe1. Результатом данной стратегии по внедрению гена донорного ноттина является удаление первой аминокислоты FW2 и соединение 2 указанных доменов с применением 2 рандомизированных аминокислот (фигура 3В) с суммарным добавлением 1 аминокислоты между донором и каркасом.

Последовательности, кодирующие сайт Mfe1, подчеркнуты. В качестве примера, конструкции, полученные в результате амплификации с Pml1-5EETa и 1-5EETMfe, а затем клонирования либо в plONTAS1_KB_lambda, либо в plONTAS1_KB_Kappa, показаны на фигуре 3С и 3D, соответственно.
Встраивание ноттинов в CDR2.
Донорный ноттин внедряли в положения CDR2 plONTAS1_KB_lambda и plONTAS1_KB_Kappa путем получения фрагмента ПЦР с сайтами рестрикции Pst1 и BspE1, которые вводили с помощью ПЦР. Оказалось возможным ввести сайт Pst1 в первые два остатка участка CDR2 гена V каппа IGKV1D-39 (в последовательности Ala-Ala). Для удобства клонирования такой же сайт рестрикции и кодируемые остатки встраивали на конце каркаса 2 гена V лямбда зародышевого типа IGLV1-36. В лямбда зародышевого типа также можно было встроить сайт BspE1 в 4й и 5й остатки участка FW3, кодирующего Ser-Gly (фигура 3Е). Снова данный сайт рестрикции и кодируемые аминокислоты также встраивали в ген V каппа (фигура 3F).
Праймеры для ПЦР PST1-5EETa применяли для амплификации EETI-II и встраивания 2 кодонов Ala, содержащих сайт Pst1 для клонирования (подчеркнут), за которыми следовали 2 вариабельных кодона, кодируемых последовательностью GNS (кодирующей Val, Ala, Asp или Gly) и VNS (кодирующей 16 аминокислот в пределах 24 кодонов), сразу после сайта рестрикции Pst1 и перед последовательностью ноттина. Кодон VNS заменяет первую аминокислоту EETI-II с суммарным эффектом добавления 3 аминокислот (2 остатков Ala и одного из Val, Asp, Ala или Gly) между донорным и реципиентным остовами (фигура 3В).
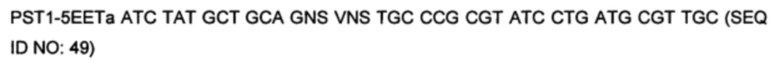
На 3'-конце поступившего донорного ноттина использовали праймеры для ПЦР 5EETBse, чтобы амплифицировать EETI-II. Они встраивали сайт BspE1 для клонирования. Продукт ПЦР встраивал донорный ноттин, за ним следовал глицин, который в природе следует за последним цистеином EETI-II (фигура 3А). Затем следовали 2 рандомизированные аминокислоты, которые примыкают к 4ой и 5ой аминокислотам FW3 после клонирования. В результате получали замену первых трех остатков FW3 на две рандомизированные аминокислоты, при этом сохранялся концевой глицин ноттина (фигура 3В). Суммарный эффект состоял в утрате аминокислоты между донором и каркасом 3.

В качестве примера, конструкции, полученные в результате амплификации с PST1-5ЕЕТа и 1-5EETBse, а затем клонирования либо в plONTAS1_KB_Kappa, либо в plONTAS1_KB_lambda показаны на фигуре 3Е и 3F, соответственно.
Пример 2. Дополнительная диверсификация реципиентного домена VL.
У людей существует 2 различных класса легкой цепи антитела (каппа или лямбда), которые кодируются приблизительно 50 и 40 генами зародышевого типа, соответственно. Каждый из них можно распределить по семействам на основании гомологии последовательностей с 7 различными семействами каппа (V каппа 1 - V каппа 7) и 11 различными семействами лямбда (V лямбда 1 - V лямбда 11). Изучение последовательностей зародышевого типа29 позволяет разработать праймеры смысловой цепи ("прямые праймеры"), специфичные к различным семействам генов зародышевого типа VL.
В ходе созревания антитела отдельные гены зародышевого типа VL рекомбинируют приблизительно с 5 различными специфичными к каппа или лямбда сегментами J на 3'-конце. Следовательно, можно разработать небольшое количество прямых и обратных праймеров, чтобы позволить амплификацию перегруппированных генов VL из доноров-людей для конструирования библиотек фагового дисплея антител, описанного, например, у Schofield и др. (2007)28. В данном примере мы продемонстрировали, как аналогичный подход можно применять для амплификации фрагментов генов VL, начиная либо с FW2, либо с FW3, до конца гена VL. Это позволяет диверсифицировать реципиентные домены VL, которые содержат донорные вставки либо в CDR1, либо в CDR2. Данный подход, следовательно, позволяет дополнительно диверсифицировать реципиентный домен по ходу транскрипции от встроенного донора.
Амплификация репертуаров VL, начиная с каркаса 2.
Последовательности семейств генов V каппа и V лямбда зародышевого типа выровняли (данные из IMGT29) и разработали праймеры для ПЦР таким образом, чтобы позволить амплификацию репертуаров VL от начала каркаса 2. Были разработаны лямбда-специфичные праймеры ("Mfelam"), обеспечивающие возможность амплификации от участка FW2 V лямбда 1, 2 и 3. Данные праймеры также были разработаны таким образом, чтобы ввести сайт Mfe1 (подчеркнут), который совместим и находится в одной рамке считывания с сайтом Mfe1, введенным на конце гена ноттина, как описано выше. Аналогичным способом были разработаны каппа-специфичные праймеры ("Mfekap"), обеспечивающие возможность амплификации от участка FW2 V каппа 1, 2 и 3.

Данные прямые праймеры смысловой цепи использовали для амплификации репертуара генов VL из библиотеки, которую предварительно клонировали в сайт Nhe1/Not1 вектора фагового дисплея (как показано на фигуре 1). Введенный сайт Mfe1 подчеркнут и последовательность Mfelam1 и Mfekap1 представлена в начале FW2 на фигурах 3Е и 3F, соответственно. Для легких цепей каппа был разработан один обратный праймер (JKFOR_Thr2), который расширял исходную границу клонирования, охватывая Not1, включая гомологию с фагмидным вектором, а также начало клонированного сегмента J каппа. Для легких цепей лямбда был разработан один праймер (JLFORQP2), который гибридизовался в последовательности фагмидной плазмиды, через сайт клонирования Not1 и в начало сегмента J лямбда.
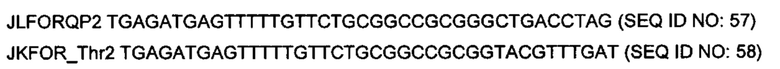
Амплификация со спаренными прямыми и обратными праймерами каппа или лямбда позволяла получить продукт ПЦР, кодирующий:
Указанные праймеры вводят сайт Mfe1 на 5'-конце и сайт Not 1 на 3'-конце, совместимые и находящиеся в одной рамке считывания с продуктами ПЦР ноттина, описанными выше, и вектором фагмидного дисплея, показанным на фигуре 1. Это позволит амплификацию библиотек генов VL, которые можно слить с конструкциями, кодирующими вставки ноттина в CDR1, применяя ферменты рестрикции Mfe1 и Not 1. Это дополнительно диверсифицирует CDR2 и CDR3 в реципиентном домене VL. JLFORQP2 и JKFOR_Thr2 представляют собой антисмысловые обратные праймеры, и обратная комплементарная кодирующая смысловая цепь представлена на фигурах 3С, 3D, 3Е и 3F, соответственно, в виде участка FW4-Not1 в конечной конструкции.
Амплификация репертуаров VL, начиная с каркаса 3.
С помощью аналогичного подхода были разработаны прямые праймеры смысловой цепи, которые гибридизовались с началом FW3 генов VL лямбда (праймеры "Bsplam") или каппа (праймеры "BspKap"), при этом вводя сайт рестрикции BspE1, соответствующий сайту BspE1, введенному в конструкции ноттина, описанные выше. Встроенный сайт BspE1 подчеркнут и последовательность Bsplam1a и BspKap1a представлена в начале FW3 на фигурах 3Е и 3F, соответственно.
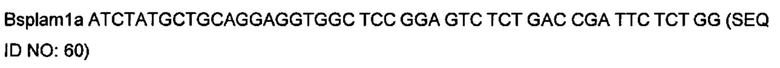

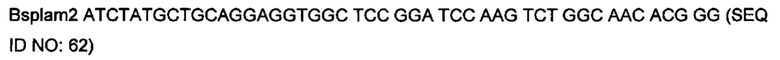

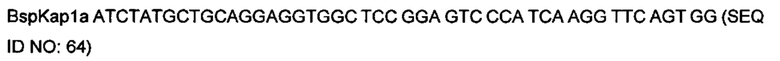

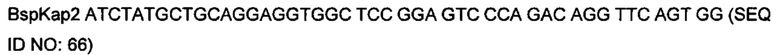
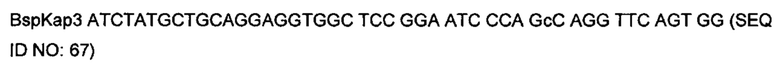
Когда лямбда-специфичные прямые праймеры использовали вместе с лямбда-специфичным обратным праймером (JLFORQP2) или когда каппа-специфичные прямые праймеры использовали вместе с каппа-специфичными обратными праймерами ((JKFOR_Thr2), тогда получали продукт ПЦР, кодирующий последовательность, представленную ниже:
Это позволяло амплификацию библиотек генов VL, которые можно слить с конструкциями со вставками гена ноттина в CDR2 путем применения ферментов рестрикции BspE1 и Not 1. Это приводило к дополнительной диверсификации CDR3 в реципиентном домене VL.
Применяя стандартные методики молекулярной биологии, получили конструкции (изображенные на фигуре 3) с использованием фрагментов гена, созданных, как описано выше. Их клонировали в "plONTAS1_KB_Kappa" и "plONTAS1_KB_lambda" и вводили путем электропорации в клетки TG1 E. coli, и конструировали библиотеку KnotBody размером 3,5-6,6×108, применяя стандартные методики молекулярной биологии, например, см. Schofield и др. 200728.
Пример 3. Выделение и определение характеристик функциональных клонов слитого белка ноттин-антитело из библиотек KnotBody с применением технологии фагового дисплея.
Технология фагового дисплея облегчает выделение веществ, связывающих любую данную мишень, из больших комбинаторных репертуаров на основе белков и пептидов, которые могут быть представлены на поверхности нитевидного фага105. Для того, чтобы выделить функциональные слитые белки ноттин-антитело из библиотек KnotBody, проводили множество раундов селекции фагового дисплея на трипсине (антигене, узнаваемом донором EETI-II). Частицы фагов получали путем освобождения библиотек KnotBody, применяя расщепляемый трипсином фаг-помощник102,106. Проводили два раунда селекции фагового дисплея на 10 мкг/мл биотинилированного трипсина, иммобилизованного на покрытых стрептавидином (для раунда 1) или нейтравидином (для раунда 2) иммунопробирках Maxisorp™ (Thermo Scientific, номер в каталоге 444202). В обоих раундах селекции фаговые библиотеки предварительно инкубировали с покрытыми стрептавидином парамагнитными гранулами (Thermo Fisher Scientific, номер в каталоге 11205D). Данные гранулы удаляли перед добавлением фага в пробирки с антигеном, чтобы ограничить попадание в селекцию связывающих стрептавидин элементов. Анализировали связывание с трипсином поликлональных препаратов фага после 2ого раунда селекции, применяя анализ связывания с помощью флуоресценции с временным разрешением (TRF). В данном анализе связывание поликлонального фага с биотинилированным трипсином, иммобилизованным на покрытых нейтравидином (Thermo Fisher Scientific, номер в каталоге 31000) планшетах Maxisorp™ (Thermo Scientific, номер в каталоге 437111), детектировали, применяя антитело мыши к М13 (GE Healthcare, номер в каталоге 27-9420-01), а затем конъюгированное с европием антитело против антитела мыши (Perkin Elmer, номер в каталоге AD0124).
Поликлональный фаг из обеих библиотек EETI-II проявил хорошее связывание с трипсином в данном анализе, что продемонстрировало успешную селекцию фагового дисплея с обогащением антителами KnotBody, которые связываются с трипсином (фигура 4). Для того чтобы исследовать, будет ли работать подход представления EETI-II с помощью стандартного фагового дисплея, ген EETI-II клонировали в вектор фагмидного дисплея28, где его непосредственно соединяли с N-концом гена III. Неожиданно, не выявили детектируемого связывания с трипсином EETI-II, представленного на фаге в виде слияния напрямую с N-концом гена III, тогда как для прошедшего селекцию поликлонального фага из обеих библиотек слитых EETI-II CDR выявили связывание трипсина. Важно отметить, что данный результат демонстрирует, что опосредованное представление ноттинов на фаге посредством петель CDR антитела (которое слито с геном III) может быть лучшей альтернативой непосредственному слиянию ноттин-ген III.
Для того чтобы идентифицировать моноклональные антитела KnotBody с желательными свойствами связывания, 94 отдельных клона, полученных после 2 раундов селекции с применением библиотек CDR1 или CDR2 EETI-II, переносили в 96-луночные культуральные планшеты и из каждого клона получали фаг. Способы скрининга с помощью ELISA моноклонального фага известны в данной области107. Исследовали связывание кондиционированного фагом супернатанта из каждого клона с биотинилированным трипсином, иммобилизованным на покрытых нейтравидином планшетах Maxisorp™, применяя анализ TRF (описанный выше). Типичный пример анализа моноклонального связывания показан на фигуре 5. Клоны с сигналом связывания, превышающим фоновый уровень более чем в 3 раза, выбирали как положительных клонов и секвенировали, чтобы идентифицировать уникальные клоны. Идентифицировали 14 и 42 уникальных связывающих представителя в библиотеках EETI-II-CDR1 и EETI-II-CDR2, соответственно (таблица 1). 18 связывающих представителей из библиотеки EETI-II-CDR2 и 3 связывающих представителя из библиотеки EETI-II-CDR1 выбирали для дополнительного определения характеристик диверсификации VL и последовательности линкера. Данным связывающим представителям присваивали новые идентификационные номера клонов (таблица 2).
Способность EETI-II связывать трипсин обусловлена остатками пролина (Pro3) и аргинина (Arg4), присутствующими в его петле 1 (GCPRILMRC; SEQ ID NO: 68). Для того чтобы показать, что прошедшие селекцию антитела KnotBody связываются с трипсином через полностью уложенный EETI-II, отображенный в виде слияния с CDR VL (т.е. не через другие петли CDR или С- или N-концевые соединяющие последовательности), связывающие трипсин остатки (Pro3 и Arg4) EETI-II заменили на глицин (Gly) и аланин (Ala), соответственно. Моноклональный фаг получили из 21 прошедшего селекцию клона и их мутантных эквивалентов. Проверяли связывание кондиционированного фагом супернатанта для каждого клона с биотинилированным трипсином (иммобилизованным на покрытых стрептавидином планшетах Maxisorp™), применяя анализ связывания TRF (описанный выше). Замена связывающих трипсин остатков EETI-II нарушала способность всех клонов KnotBody связываться с трипсином (таблица 3). Для того чтобы подтвердить, что утрата связывания трипсина не была следствием пониженной экспрессии или пониженного отображения слитого plll, получили фаг для 11 (выбранных произвольно) антител KnotBody и их вариантов GlyAla и проанализировали с помощью вестерн-блоттинга с применением антитела, которое распознает продукт гена 3 (plll), применяя антитело к plll (MoBiTec GmbH) (фигура 6). Не наблюдали значительного различия в количестве отображенного слитого plll между любым клоном KnotBody и его GlyAla-замещенным вариантом. Полученные результаты подтверждают, что функциональная возможность связывания трипсина данными клонами Knotody является результатом правильного отображения донорного ноттина (EETI-II) в виде слияния с CDR VL и подтверждает, что связывание трипсина направляет донорный ноттин EETI-II.
Пример 4. Кристаллическая структура антител KnotBody. прошедших селекцию из библиотеки CDR2 EETI-II.
Для того чтобы получить кристаллические структуры антител KnotBody, для 18 клонов, выделенных из библиотеки CDR2 EETI-II (таблица 3), изменили формат на Fab. В данном формате ген VH (из D1A12) соединяли с константным доменом 1 тяжелой цепи IgG1 человека (СН1) и реципиентные цепи VL, содержащие EETI-II, соединяли с константным доменом легкой цепи (CL). Способы экспрессии антител путем временной экспрессии в клетках млекопитающих хорошо известны специалистам в данной области108. Для того чтобы позволить экспрессию данных Fab KnotBody в клетках млекопитающих, цепи VL, кодирующие ноттин, амплифицировали с помощью ПЦР, применяя праймеры LLINK2 (CTCTGGCGGTGGCGCTAGC; SEQ ID NO: 69) и NotMycSeq (GGCCCCATTCAGATCCTCTTCTGAGATGAG; SEQ ID NO: 70). Амплифицированные гены VL расщепляли с помощью ферментов рестрикции Nhel и Notl и лигировали в вектор pINT12 (кодирующий тяжелую цепь D1A12), предварительно расщепленный теми же ферментами. Вектор pINT12 (фигура 7) содержит кассету экспрессии с двойным промотором, в которой экспрессия тяжелой цепи находится под контролем промотора цитомегаловируса (CMV), а экспрессия легкой цепи запускается промотором фактора элонгации-1-альфа (EF1-альфа).
Для того чтобы экспрессировать Fab KnotBody в клетках HEK-293F, получали ДНК достаточного для трансфекции качества, применяя набор Plasmid Plus (Qiagen, номер в каталоге 12945). 24 мкг плазмидной ДНК инкубировали с 48 мкг полиэтиленимина (ПЭИ) в 2 мл среды для экспрессии Freestyle 293 (Thermo Fisher Scientific, номер в каталоге 12338-018) в течение 15 минут. После инкубации смесь ДНК : ПЭИ добавляли в 20 мл клеток HEK-293F (Thermo Fisher Scientific, номер в каталоге R790-07), высевали при плотности 1×106 клеток/мл во флаконы для культуры ткани емкостью 125 мл. Флаконы для культуры ткани инкубировали при 37°С в течение 5 дней (при 5% СО2, влажности 75% и взбалтывании при 800 об/мин). Все трансфектанты, за исключением KB_А03, успешно экспрессировали Fab KnotBody. Экспрессированные белки очищали из культуральных супернатантов, применяя аффинную матрицу CaptureSelect lgG-CH1 (Life Technologies, номер в каталоге 194320005), следуя инструкциям производителя. Очищенные белки подвергали диализу против 2х ФБР в течение ночи, и диализованные образцы визуализировали на геле ПААГ/ДСН с помощью окрашивания Quick Coomassie (Generon, ссылка на продукт GEN-QC-STAIN). Типичный пример показан на фигуре 8А. Мономерное состояние очищенных Fab KnotBody подтверждали с помощью аналитической эксклюзионной хроматографии, применяя колонку Superdex200 емкостью 2,4 мл (GE HealthCare, 17-1089-01) и систему Akta Purifier (GE Healthcare). Для всех Fab KnotBody выявили хроматографические профили, соответствующие мономерным видам Fab (фигура 8В).
Для того чтобы подтвердить способность антител KnotBody в формате Fab связывать трипсин, исследовали связывание очищенных белков с трипсином, применяя анализ связывания TRF. В данном анализе детектировали связывание Fab KnotBody (при концентрации 10 мкг/мл, 2,4 мкг/мл и 0,5 мкг/мл) с биотинилированным трипсином (иммобилизованным на покрытых стрептавидином планшетах Maxisorp™), применяя антитело мыши к СН1, а затем конъюгированное с европием антитело против антитела мыши (таблица 4).
7 антител KnotBody (KB_А04, KB_А01, KB_А05, KB_А07, KB_А08, KB_А10, KB_А12) выбирали для кристаллизации. ДНК, полученной для данных клонов, трансфицировали 500 мл клеток HEK-293F, как было описано ранее. Экспрессированные белки очищали, применяя аффинную матрицу CaptureSelect IgG-CH1. Очищенные белки изначально подвергали испытаниям с кристаллизацией, применяя доступные для приобретения средства анализа кристаллизации (Supplier). Отчетливо выраженные кристаллы легко получали для KB_А12 и KB_А05. Условия кристаллизации для данных двух клонов дополнительно оптимизировали и использовали следующие условия, чтобы получить кристаллы дифракционного качества: 0,1 М MES рН=6,5, 25% масса/объем ПЭГ ММЕ 2000 и 0,1 М Трис. Cl, 50% ПЭГ ММЕ, 10 мМ NiCl2. Данные полной дифракции собирали для указанных кристаллов при 100 K в потоке жидкого азота. Собранные данные обрабатывали, применяя программное обеспечение PROTEUM2 (Bruker). Кристаллическую структуру слитых с ноттином антител Fab разрешали, применяя методику молекулярного замещения109, с помощью программного обеспечения Phenix версии 1.8.1-1168110. Полученную структуру дополнительно уточняли, применяя Phenix.Refine111. Модели для молекулярного замещения загружали с сайта в сети Интернет PDB (www.rcsb.org/pdb, коды PDB: 3G04 для легкой цепи и 3QOS для тяжелой цепи). Последовательности KnotBody KB_А12 и KB_А05 приведены ниже. Была встроена дополнительная последовательность AlaSer на N-конце легкой цепи из сайта Nhe1, используемого при клонировании.
Тяжелая цепь KB_А12

Легкая цепь KB_А12

Тяжелая цепь KB_А05

Легкая цепь KB_А05

Для обоих наборов данных решения молекулярного замещения были успешны, свидетельствуя о том, что общая укладка слитых с ноттином Fab не изменялась. После тщательного уточнения (фигура 9) было очевидно, что слитое с ноттином антитело Fab имело правильную укладку, и дисульфидный паттерн компонента ноттина внутри антитела был точно таким же, как и у EETI-II (фигура 10А), о чем сообщали ранее (PDB ID: 1H9I). Дополнительно относительное расположение компонента EETI-II в Fab свидетельствовало о том, что участки CDR тяжелой цепи были доступны для потенциального связывания с другим антигеном. Нехватка электронной плотности у остатков CDR3 VH (фигура 10В) дополнительно усиливает эту вероятность. Координаты PDB.
Пример 5. Демонстрация способности биспецифического связывания формата KnotBody.
Концепция биспецифических антител, которые могут связываться с двумя различными целевыми антигенами, становится все в большей степени популярной в области разработки лекарственных средств112. Стандартные биспецифические антитела обычно состоят из двух пар VH-VL с различными специфичностями (т.е. двух различных пар доменов VH-VL, каждая из которых распознает отличный антиген). В данном примере мы описываем разработку биспецифического формата KnotBody. В данном формате детерминанты связывания, необходимые для распознавания двух различных антигенов, встроены в одну пару VH-VL. Этого добились, применяя VH, чтобы опосредовать одну специфичность связывания, и слитые ноттин-VL, чтобы опосредовать другую специфичность связывания.
Два хорошо охарактеризованных связывающих трипсин KnotBody (KB_А07 и KB_А12, см. пример 3) использовали здесь в качестве модельных каркасов для конструирования биспецифической функциональной группы. Данные антитела KnotBody содержали обычный ген тяжелой цепи из антитела D1A12 (антитела к ТАСЕ)101 и два различных гена легкой цепи, отображающих EETI-II в слитом с CDR2 виде. Способность данных антител KnotBody связывать трипсин полностью обуславливалась доменом VL, отображающим EETI-II. Следовательно, осуществляли рекомбинацию данных слитых генов реципиент VL : донор ноттин с большим репертуаром непримированных генов VH28 с получением библиотеки, из которой можно выделить новые молекулы с дополнительными опосредованными VH специфичностями связывания.
В предшествующей работе Schofield и коллеги описали клонирование репертуаров генов VH и VL в промежуточную библиотеку антител28. Данную промежуточную библиотеку антител использовали для получения функциональной библиотеки антител фагового дисплея ("библиотеки McCafferty" и "библиотеки антител lontas" 28). В данном примере использовали такой же репертуар генов VH для конструирования библиотеки KnotBody с перетасованными тяжелыми цепями. Этого добивались путем амплификации ПЦР генов VH из исходных растворов бактерий с библиотекой антител lontas, применяя праймеры М13 leaderseq (AAATTATTATTCGCAATTCCTTTGGTTGTTCCT; SEQ ID NO: 75) и HLINK3 (CTGAACCGCCTCCACCACTCGA; SEQ ID NO: 76). Амплифицированные гены VH расщепляли с помощью ферментов рестрикции Ncol и Xhol и лигировали в вектор plONTAS1_KB (кодирующий легкую цепь KB_А017 и KB_А12), предварительно расщепленный теми же ферментами. Продукт лигирования очищали, применяя набор для очистки продуктов ПЦР MiniElute (Qiagen, номер в каталоге 28004), и внедряли путем электропорации в клетки TG1 E. coli (Lucigen, номер в каталоге 60502-2). Фаг выделяли из данной библиотеки, как описано в примере 3107
Для того чтобы идентифицировать биспецифические антитела KnotBody с новыми специфичностями связывания, опосредованными доменом VH, проводили два раунда селекции фагового дисплея на 5 различных антигенах (слитый сМЕТ человека-Fc, слитый FGFR4 мыши-CD4, слитый GAS6 человека -CD4, активаторе плазминогена человека урокиназного типа и β-галактозидазе). cMET-Fc, FGFR4-CD4, GAS6-CD4 и активатор плазминогена урокиназного типа (UPA) напрямую иммобилизовали на иммунопробирках Maxisorp™. Биотинилированную β-галактозидазу (био-B-гал) опосредованно иммобилизовали на иммунопробирках Maxisorp™, покрытых стрептавидином (раунд-1) или нейтравидином (раунд 2). Селекцию фагов проводили, как описано в примере 3. Поликлональный фаг, полученный после 2 раунда селекции, исследовали в анализе связывания TRF (как описано в примере 3) со всеми 5 антигенами, трипсином и иммобилизирующими партнерами (стрептавидином и нейтравидином). Для всех популяций поликлонального фага выявили специфичное связывание с трипсином и антигеном, по которому осуществляли их селекцию, но не с другими антигенами (фигура 11). Например, сигналы связывания, обнаруженные для поликлонального фага, полученного в результате селекции на cMET-Fc, были специфичны к трипсину и сМЕТ. Данный результат демонстрирует успешность селекции фагового дисплея в отношении обогащения биспецифическими связывающими элементами. Для того чтобы определить моноклональные связывающие молекулы, 48 отдельных клонов выбирали из каждого выхода селекции и получали моноклональный фаг из каждого клона (как описано в примере 3). Исследовали связывание супернатанта, кондиционированного моноклональным фагом из каждого клона, с трипсином и антигеном, используемым для селекции (типичный пример данного анализа показан на фигуре 12). Любой клон, для которого выявили сигнал связывания выше 15000 единиц флуоресценции как с трипсином, так и с антигеном селекции, рассматривали как проявляющий биспецифическое связывание. В каждом выходе селекции идентифицировали большие панели биспецифических связывающих элементов (таблица 5).
Пример 6. Демонстрация способности формата KnotBody к биэпитопному связыванию.
В предыдущем примере мы продемонстрировали способность остова ноттина связываться с двумя различными антигенами посредством различных паратопов, один из которых расположен на слитых реципиенте-доноре (т.е. VL-ноттин), а другой - на VH. Тот же принцип можно применять для нацеливания на два различных эпитопа внутри одного целевого антигена, где можно использовать направленное VH связывание для повышения аффинности и/или специфичности исходного взаимодействия (опосредованного ноттином). С помощью данного подхода можно использовать дополнительные свойства связывания домена VH, чтобы улучшить эффективность или специфичность лекарственных средств на основе ноттина. В качестве альтернативы, такой дополнительной вклад в связывание также может быть вносить CDR3 VL, при применении подхода, описанного в примере 2. В данном примере мы продемонстрировали способность биэпитопного связывания остовов ноттина путем улучшения аффинности антител к трипсину KnotBody (KB_А07 и KB_А12, см. пример 3) путем введения новых партнеров тяжелый цепи, которые независимо связываются с трипсином.
KB_А07 и KB_А12 содержат общий домен VH (D12), который связывается с доменом dis-cys превращающего фактор некроза опухоли-α фермента101, и домен VL, который связывается с трипсином посредством EETI-II (отображенного в положении CDR2). Для того чтобы определить новых партнеров тяжелой цепи, которые связываются с отличным эпитопом на трипсине (и улучшают общую аффинность), получили библиотеку фагового дисплея путем замены VH D1A12 данных двух антител KnotBody на большой репертуар непримированных тяжелых цепей (см. пример 5). Клоны с улучшенной аффинностью выделяли из данной библиотеки "с перетасованными цепями" путем осуществления трех раундов селекции фагового дисплея на трипсине при строгих условиях, которые способствуют преимущественному обогащению клонами с высокой аффинностью. Строгость селекции контролировали, применяя уменьшающиеся количества трипсина в каждом раунде селекции (фигура 13). Оптимальную концентрацию антигена для каждого раунда определяли опытным путем, осуществляя селекцию антител KnotBody в диапазоне концентраций антигена и сравнивая полученные количества фага с контролем без антигена. 1 раунд селекции проводили путем пэннинга на антигене, иммобилизованном на иммунопробирках Maxisorb, как описано в примере 5. Популяцию после 2 раунда селекции, который проводили при концентрации антигена 20 нМ, выбирали для дополнительно 3его раунда.
Гены KnotBody, полученные после 2 раунда (селекция при концентрации 20 нМ) и 3 раунда (селекция при концентрации 2 нМ и 0,2 нМ) амплифицировали с помощью ПЦР, применяя праймеры М13 leaderseq (см. пример 4) и NotMycSeq  . Продукты ПЦР расщепляли с помощью ферментов рестрикции Ncol и Notl и клонировали в вектор pBIOCAM5-3F посредством Ncol и Notl. pBIOCAM5-3F позволяет экспрессию антител в виде растворимых слитых белков scFv-Fc в клетках млекопитающих113, следовательно, облегчая скрининг связывающих KnotBody с улучшенной аффинностью. 352 клона (полученных в результате клонирования pBIOCAM5-3F) переносили в 4×96-луночных культуральных планшета. Плазмидную ДНК подходящего для трансфекции качества получали из каждого клона, применяя набор Plasmid Plus 96 (номер в каталоге Qiagen 16181). 600 нг каждой плазмидной ДНК инкубировали с 1,44 мкг полиэтиленимина (ПЭИ) в среде для экспрессии Freestyle HEK-293F (Thermo Fisher Scientific, номер в каталоге R790-07) в течение 15 минут перед добавлением в 96-луночные планшеты с глубокими лунками, содержащими 500 мкл/лунку клеток HEK-293F в экспоненциальной фазе роста при плотности, равной 1×106 клеток/мл. Планшеты запечатывали газопроницаемым покрытием и инкубировали при 37°С в течение 5 дней (при 5% CO2, влажности 75% и взбалтывании при 800 об/мин). Культуральный супернатант, содержащий слитые белки KnotBody-Fc, использовали для скрининга, чтобы определить клоны с улучшенной аффинностью.
. Продукты ПЦР расщепляли с помощью ферментов рестрикции Ncol и Notl и клонировали в вектор pBIOCAM5-3F посредством Ncol и Notl. pBIOCAM5-3F позволяет экспрессию антител в виде растворимых слитых белков scFv-Fc в клетках млекопитающих113, следовательно, облегчая скрининг связывающих KnotBody с улучшенной аффинностью. 352 клона (полученных в результате клонирования pBIOCAM5-3F) переносили в 4×96-луночных культуральных планшета. Плазмидную ДНК подходящего для трансфекции качества получали из каждого клона, применяя набор Plasmid Plus 96 (номер в каталоге Qiagen 16181). 600 нг каждой плазмидной ДНК инкубировали с 1,44 мкг полиэтиленимина (ПЭИ) в среде для экспрессии Freestyle HEK-293F (Thermo Fisher Scientific, номер в каталоге R790-07) в течение 15 минут перед добавлением в 96-луночные планшеты с глубокими лунками, содержащими 500 мкл/лунку клеток HEK-293F в экспоненциальной фазе роста при плотности, равной 1×106 клеток/мл. Планшеты запечатывали газопроницаемым покрытием и инкубировали при 37°С в течение 5 дней (при 5% CO2, влажности 75% и взбалтывании при 800 об/мин). Культуральный супернатант, содержащий слитые белки KnotBody-Fc, использовали для скрининга, чтобы определить клоны с улучшенной аффинностью.
Сигнал связывания, наблюдаемый для конкретного клона в первичном анализе связывания (например, анализе связывания TRF с применением супернатанта, кондиционированного моноклональным фагом), представляет собой комбинированную функцию аффинности и экспрессии. Поскольку экспрессия белка может значительно изменяться от клона к клону, ранжирование антител KnotBody по сигналу связывания в первичном анализе не обязательно коррелирует с их аффинностями. Следовательно, применяли два независимых от экспрессии анализа скрининга для ранжирования клонов KnotBody по аффинности и их сравнения с исходными клонами. Это были (i) анализ захвата TRF и (ii) анализ скорости диссоциации Biacore. В "анализе захвата TRF" (фигура 14) KnotBody-scFv-Fcs захватывали планшетами Maxisorp™, покрытыми антителом к Fc (Abcam, номер в каталоге ab113636), и детектировали связывание биотинилированного трипсина с антителами KnotBody, применяя конъюгированный со стрептавидином европий (Perkin Elmer, номер в каталоге 1244-360). Для нормирования на различия в экспрессии KnotBody (scFv-Fc), каждую лунку покрывали ограниченными количествами антитела к Fc. Например, лунка, покрытая 50 мкл антитела к Fc при концентрации 2,5 мкг/мл (32 нМ), обладает максимальной (теоретической) емкостью захвата 1,6 фемтомоль scFv-Fc. Тем не менее, средняя экспрессия scFv-Fc в клетках HEK-293F с применением векторной системы pBIOCAM5-3F составляет 10-20 мг/л (83-166 нМ), и 50 мкл необработанного супернатанта, используемого для данного анализа, в среднем будет содержать 4,1-8,2 фемтомоль scFv-Fc, следовательно, обеспечивая насыщение каждой лунки покрытием иммобилизованного антитела к Fc. Для большинства антител KnotBody, прошедших селекцию из перетасованных библиотек VH, выявили более высокий сигнал связывания с трипсином, чем у исходных клонов (типичный пример показан на фигуре 15). 90 антител KnotBody, для которых получили наиболее высокий сигнал связывания в анализе захвата, тщательно отбирали и исследовали в "анализе скорости диссоциации Biacore". В "анализе скорости диссоциации Biacore" константы диссоциации (скорости диссоциации) клонов KnotBody анализировали с помощью поверхностного плазмонного резонанса (применяя Biacore Т100 от GE healthcare). Константа диссоциации взаимодействия антитело-антиген не зависит от концентрации и, следовательно, нормирование на различную экспрессию не требовалось. В данном анализе с сенсорным чипом СМ5 (GE healthcare, номер в каталоге BR-1005-30) связывали приблизительно 3000 резонансных единиц (RU) антитела к Fc (набор для захвата антитела человека, GE healthcare, номер в каталоге BR-1008-39). Приблизительно 1200-1600 RU KnotBody-scfv-Fc было захвачено на антитело к Fc. Раствор трипсина (400 нМ) впрыскивали на 60 секунд. Фазу диссоциации каждого взаимодействия KnotBody-трипсин отслеживали в течение 300 секунд. После каждого цикла поверхность чипа восстанавливали путем впрыскивания 3 М MgCl2. Определили константу диссоциации (kd) для каждого KnotBody, применяя модель Лэнгмюра для связывания 1:1 (применяя для оценки программное обеспечение Biacore Т100). Считали, что клоны, для которых выявили в 1,5 раза более медленные константы диссоциации, чем у исходных клонов, проявляют улучшенную аффинность (таблица 6). Всего идентифицировали 22 клона с улучшенной аффинностью, применяя анализ захвата и анализ скорости диссоциации. Типичный пример клона, для которого выявили улучшенную скорость диссоциации по сравнению с исходными клонами, показан на фигуре 16. Такое улучшение в аффинности клонов KB_А07 и KB_А12 путем перетасовки тяжелых цепей демонстрирует способность биэпитопного связывания формата KnotBody.
Пример 7. Клонирование, экспрессия и очистка различных богатых цистеином доноров токсинов внутри CDR3 реципиентного остова VL антитела.
Нарушение нормального функционирования ионного канала вовлечено в патогенез ряда заболеваний, включая болевые расстройства и аутоиммунитет. Например, нарушение функции потенциалзависимого натриевого канала 1.7 (NaV1.7) играет основную роль как в гиперчувствительности, так и в отсутствии чувствительности к боли. Потенциалзависимый калиевый канал 1.3 (Kv1.3) вовлечен в аутоиммунитет, опосредованный Т-клетками. Кислото-чувствительный ионный канал 1а (ASIC1a) участвует в восприятии и обработке болевых сигналов. Таким образом, специфичные модуляторы ионных каналов обладают огромным терапевтическим потенциалом для лечения боли и различных аутоиммунных расстройств. Ряд встречающихся в природе ноттинов действуют как блокирующие ионный канал токсины. Как обсуждалось ранее, единственное лекарственное средство на основе ноттина (зиконотид), одобренное для терапии, представляет собой блокатор потенциалзависимого кальциевого канала N-типа, полученный из яда улитки конус.
В данном примере описано слияние альтернативных богатых цистеином доноров токсинов с прошедшими предварительную селекцию реципиентными остовами VL с получением антител KnotBody, направленных на ионные каналы (таблица 7). Этого добивались путем клонирования трех блокаторов NaV1.7, трех блокаторов Kv1.3 и трех блокаторов кислото-чувствительных ионных каналов 1а (ASIC 1а) в положение CDR2 двух антител KnotBody KB_А07 и KB_А12 (т.е. замена гена EETI-II в положении, описаном в примере 3). Гены, кодирующие все токсины (таблица 8), синтезировали в виде фрагментов гена (от Integrated DNA Technologies). Каждый ген токсина амплифицировали с помощью ПЦР, применяя наборы праймеров, которые кодируют соединяющие последовательности, специфичные для KB_А07 и KB_А12 (таблица 9). Дополнительный вариант Ssm6a (Ssm6s_GGS), содержащий линкерные последовательности (GGS на N-конце и SGG на С-конце), также амплифицировали с помощью ПЦР. В данном примере конструкции KnotBody находились в формате молекул IgG, где ген VH был слит с константными доменами тяжелой цепи IgG1 (СН1-СН2-СН3), и реципиентные цепи VL, содержащие новые донорные токсины, слиты с константным доменом легкой цепи (CL). Для того чтобы экспрессировать данные конструкции KnotBody в клетках млекопитающих, фрагменты ПЦР клонировали в сайты Pstl и BspEl цепи VL KB_А12 и KB_А07 (кодируемые вектором pINT3-hg1, фигура 17). Вектор pINT3-hg1 содержит кассету экспрессии с двойным промотором, в которой экспрессия тяжелой цепи находится под контролем промотора цитомегаловируса (CMV), а экспрессия легкой цепи запускается промотором фактора элонгации-1-альфа (EF1-альфа).
Для того чтобы экспрессировать антитела KnotBody в клетках млекопитающих, получали ДНК достаточного для трансфекции качества, применяя набор Plasmid Plus (Qiagen, номер в каталоге 12945). 60 мкг плазмидной ДНК инкубировали с 120 мкг полиэтиленимина (ПЭИ) в 5 мл среды для экспрессии Freestyle 293 (Thermo Fisher Scientific, номер в каталоге 12338-018) в течение 15 минут перед добавлением к 50 мл клеток HEK-293F (Thermo Fisher Scientific, номер в каталоге R790-07), высеяных при плотности 1×106 клеток/мл во флакон для культуры ткани емкостью 250 мл. Флаконы для культуры ткани инкубировали при 37°С в течение 5 дней (при 5% СО2, влажности 75% и взбалтывании при 800 об/мин). Экспрессированные белки очищали из культуральных супернатантов, применяя аффинную хроматографию на основе связывания с белком А (белок-А, конъюгированный с сефарозой, от Generon, номер в каталоге РС-А5). Очищенные белки подвергали диализу против 2х ФБР, и диализованные образцы визуализировали на геле ПААГ/ДСН с помощью окрашивания Quick Coomassie (Generon, ссылка на продукт GEN-QC-STAIN). Типичный пример показан на фигуре 18. Средние уровни экспрессии (7,7 мг/л), полученные для данных слитых молекул в клетках HEK293F, сравнивали с таковыми для обычных антител, полученных с применением той же векторной системы (4 мг/л). Выход белка после очистки приведен в таблице 10. В случае слитых с мамбалгином белков, клетки CHO-Expi трансфицировали указанной ДНК, как описано в примере 11, и привели полученные выходы.
Вкратце, результаты, описанные в данном примере, иллюстрируют, что: (i) блокирующие ионные каналы токсины можно экспрессировать в виде доноров в слиянии с реципиентными доменами VL (например, KnotBody); (ii) остовы ноттина, отличные от EETI-II, можно перевести в формат антител KnotBody или, другими словами, формат KnotBody способен к функциональному представлению множества ноттинов; (ii) данные слитые молекулы можно эффективно экспрессировать и очистить в виде IgG.
Пример 8. Функциональная оценка блокаторов Kv1.3 и ASIC1a, экспрессированных в виде антител KnotBody.
Исследовали способность ноттинов - блокаторов Kv1.3 и ASIC1a, экспрессированных в формате KnotBody (см. примеры 6 и 7), ингибировать функцию целевых ионных каналов. Влияние данных антител KnotBody на клетки, экспрессирующие каналы Kv 1.3 человека (huKv1.3) или ASIC1a человека, оценивали, применяя автоматизированный электрофизиологический метод локальной фиксации потенциала на целой клетке QPatch (Sophion).
Для тестирования Kv1.3 анализировали клетки СНО, стабильно экспрессирующие huKv1.3 (Charles River Lab), применяя электрофизиологический анализ QPatch в присутствии или отсутствие слитых белков KnotBody или антител изотипического (отрицательного) контроля. Внутренний и внешний физиологические растворы получали прямо перед анализом. Внеклеточный раствор содержал 145 мМ NaCl, 4 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, 10 мМ HEPES и 10 мМ глюкозу; рН подводили до 7,4 с помощью NaOH; осмолярность составляла ~ 305 мОсм/л. Внутриклеточный раствор содержал: KF (120 мМ), KCl (20 мМ), HEPES (10 мМ) и EGTA (10 мМ); рН подводили до 7,2 с помощью КОН; осмолярность составляла ~ 320 мОсм/л.
Серию деполяризующих импульсов напряжения (активация канала) использовли для отслеживания потоков через канал после добавления контроля (внеклеточного раствора), чтобы определить фоновый контрольный уровень активности потока. В данные измеренные контрольные потоки добавляли возрастающие концентрации антител KnotBody или изотипов исходных антител (контрольных молекул) во внешний омывающий раствор (2,2 мкМ - 0,5 нМ, разбавленные во внеклеточном растворе). Антитела KnotBody KB_А12 и KB_А07 (слитые белки EETI-II) использовали в качестве изотипических контролей для тестирования. От напряжения в открытом состоянии -80 мВ деполяризующие активирующие импульсы напряжения +30 или +80 мВ прикладывали в течение 300 мс, каждые 5 или 10 секунд. Значения вызванного максимального потока наружу, измеренные во время этапа активации для каждого периода замены раствора, усредняли (n=3-8 для каждой используемой концентрации) и наносили на график в виде кривых зависимости от концентрации. По данным кривым зависимости от концентрации (см. типичные графики на фигуре 21) рассчитывали значения IC50 (кратко описанные в таблице 11А). Все слитые белки KB_A07_Shk, KB_A12_Shk и KB_А07_KTX (калиотоксин) ингибировали потоки huKv1.3 зависимым от концентрации образом со значениями IC50, составляющими приблизительно 20 нМ, 40 нМ и 900 нМ, соответственно. Для сравнения, для исходных антител KnotBody, KB_А12, KB_А07, Moka-1 на обоих реципиентных остовах и калиотоксина на KB_12 не выявили существенного снижения измеренного потока (~ IC50 экстраполировали до >10 мкМ), что было сходно по величине со снижением потока, зарегистрированным для контрольных добавлений внешнего раствора за тот же период времени (четыре добавления каждого продолжительностью четыре минуты, всего 16 минут).
Для того чтобы функционально оценить ASIC1a KnotBody, клетки HEK293, стабильно экспрессирующие huASIC1a (Sophion), анализировали, применяя электрофизиологический анализ QPatch в присутствии или отсутствие слитых белков KnotBody (используя KB_А12 в качестве реципиента и заменяя исходного донора EETI-II, как показано в таблице 8). "Исходный" KB_А12 с донором EETI-II использовали в качестве отрицательного контроля. Внутренний и внешний физиологические растворы получали непосредственно перед проведением анализа. Внеклеточный раствор содержал 145 мМ NaCl, 4 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2, 10 мМ HEPES и 10 мМ глюкозу; рН подводили до 7,4 с помощью NaOH (для контрольного рН в состоянии покоя) или до 6,0 с помощью MES (для кислого рН в состоянии активации); осмолярность составляла ~ 305 мОсм/л. Внутриклеточный раствор содержал: CsF (140 мМ), HEPES (10 мМ), NaCl (10 мМ) и EGTA/CsOH (1 мМ/5 мМ); рН подводили до 7,3 с помощью CsOH; осмолярность составляла ~ 320 мОсм/л.
По всем считываниям ASIC1a, считывание потенциала клеточной мембраны фиксировали на -60 мВ. Контрольные фоновые потоки ASIC1a вызывали путем нанесения внешнего раствора при активирующем рН 6,0 на 3000 мс. Данное применение активирующего рН повторяли три дополнительных раза, получая четыре фоновых контрольных потока ASIC1a. Фиксирующие клетки затем предварительно инкубировали с KnotBody, разбавленными во внешнем растворе, при рН 7,4, в течение 15-20 минут. После данной предварительной инкубации KnotBody на фиксирующую клетку наносили такую же концентрацию KnotBody во внешнем растворе при активирующем рН 6,0.
По окончании каждой инкубации KnotBody и последующей активации потока ASIC1a, полностью блокирующую концентрацию (300 нМ) ингибитора РсТх1 ноттина ASIC1a (положительного контроля) пропускали через фиксирующую клетку, и наносили внешний раствор с конечным активирующим рН 6,0. Определяли процент разницы сигнала между фоновым уровнем для активирующего рН 6,0 (т.е. перед инкубацией с KnotBody) и после инкубации с KnotBody. На данных фигурах (см. таблицу 11В) можно видеть, что антитела KnotBody KB_А12_РсТх1 и KB_А07_РсТх1 были активны, снижая поток ASIC1a до 4,8%, и данный уровень был таким же, как наблюдаемый при нанесении положительного контроля РсТх1 (1,9-3,8%). Для KB_А12_Mba-1 и KB_А12_Mba-2 выявили одинаковый уровень потока, как и для отрицательного контроля KB_А12 или контроля "только буфер".
Описанные выше результаты иллюстрируют возможность соединять ноттины, у которых есть терапевтический потенциал (т.е. блокаторы ионных каналов), с остовом реципиентного антитела, которое изначально подвергли селекции по соединению с отличным ноттином (т.е. EETI-II).
Пример 9. Функциональное слияние не относящегося к ноттину донора с реципиентными доменами VL антител.
В данном примере описано слияние не относящегося к ноттину донорного диверсифицированного домена остова с реципиентным доменом VL. Не относящиеся к ноттину донорные диверсифицированные домены остова, в которых отсутствуют дисульфидные связи, могут быть ценной альтернативой ноттинам. Как уже обсуждалось ранее, было сконструировано большое разнообразие остовов белка для новых специфичностей связывания38,114. В данной заявке мы используем малый остов белка (приблизительно 100 аминокислот), называемый адгироном, который основан на консенсусной последовательности полученных из растений фитостатинов (белковых ингибиторов протеаз цистеина). Адгироны проявляют высокую термическую устойчивость и хорошо экспрессируются в E. coli46. Они отличаются по структуре от ноттинов и не содержат остатков цистеина.
В качестве доноров мы выбрали два сконструированных адгирона, которые связываются с подобным лектину рецептором 1 окисленных липопротеинов низкой плотности (LOX-1), для замены EETI-II в положении CDR2 VL цепей VL (реципиентов) из KB_А07 и KB_А12 (пример 3). Последовательности данных адгиронов (обозначены Ad-LOX1-A и Ad-LOX1-B, таблица 12) получили из патента WO 2014125290 А1 и синтезировали в виде фрагментов гена, чтобы позволить клонирование (таблица 13). Каждый ген адгирона амплифицировали с помощью ПЦР, применяя наборы праймеров, специфичных к KB_А07 и KB_А12 (таблица 14). Продукты ПЦР клонировали в сайты Pstl и BspEl вектора фагового дисплея plONTAS1_KB (фигура 1), кодирующего гены KB_А12 и KB_А07.
Для того чтобы проверить функциональность данных слитых с адгироном антител, оценивали связывание моноклонального фага, полученного из каждого клона, с LOX-1 в анализе связывания TRF. В данном анализе детектировали связывание LOX-1 (иммобилизованного непосредственно на планшетах Maxisorp™) с фагом, на котором отображено слитое с адгироном антитело, применяя антитело мыши к М13 (GE Healthcare), а затем конъюгированное с европием антитело против антитела мыши (Perkin Elmer). Исходные антитела KnotBody KB_А07 и KB_А12 (слитые белки EETI-II) включили в качестве контролей. Белки cMET-FC, GAS6-CD4, FGFR4-CD4, UPA и бета-галактозидазу использовали для исследования неспецифического связывания. Результат данного анализа (фигура 19) показал, что все слитые с адгироном антитела специфично связываются с LOX-1. Для исходных клонов KB_А07 и KB_А12 не выявили связывания с LOX-1, подтверждая, что связывание LOX-1, которое выявили у слитых молекул адгирон-антитело, опосредуется адгиронами (отображенными в петлях CDR2 VL данных антител).
В данном примере мы продемонстрировали, что не относящиеся к ноттину донорные диверсифицированные остовы можно встроить в реципиентные остовы VL с получением альтернативных форматов KnotBody.
Пример 10. Идентификация участков петли для встраивания донорной последовательности или диверсификации в последовательности донора, реципиента или партнера.
Описанный в примере 1 способ встраивания донорной последовательности ноттина в реципиентный домен Ig можно применять для идентификации последовательностей, которые соединяют элементы вторичной структуры других остовов, как потенциальных сайтов для встраивания донора.
Для доменов lg обозначения каркаса и CDR соответствуют описанным в базе данных Международной информационной системы ImMunoGenetics (IMGT). Согласно IMGT v3.1.10, нумерация последовательностей CDR1, CDR2 и CDR3 занимает положения аминокислот 27-38, 56-65 и 105-117, соответственно (для всех последовательностей VH и VL). Остатки FW1, FW2 и FW3 занимают положения 1-26, 39-55 и 66-104. На конце реаранжированного гена V FW4 кодируется 6 J-фрагментами для VH, 5 J-фрагментами для V каппа и 7 J-фрагментами для V лямбда (в каждом случае кодируется 11, 10 и 10 аминокислот, соответственно, для каждого FW4).
В одном подходе отдельный CDR можно полностью удалить и заменить на последовательность поступившего донора, которая фланкирована линкерами из не более чем 4 аминокислотных остатков на каждом из N- и С-концов. В другом подходе некоторые остатки CDR можно сохранить, но суммарное количество остатков, включая остатки CDR, которые соединяют поступивший донорный диверсифицированный остов с реципиентным диверсифицированным остовом Ig, не может превышать 4 аминокислоты на каждом конце (чтобы сохранить непосредственную близость между донором и реципиентом). В еще одном подходе вариантные остатки каркаса на границе соединения можно удалить из донорного или реципиентного остовов и заменить на рандомизированные кодоны, содержащие некоторые или все аминокислоты. Суммарная связь на N- и С-концах (за исключением замененных остатков каркаса) не должна превышать 4 аминокислот.
Ген или популяцию генов, кодирующих слитый белок, разработанный таким образом, можно получить, применяя способы, известные специалистам в данной области (также приведенные в качестве примеров в данной заявке). Указанный ген можно получить как полностью синтетический ген или получить из фрагментов гена, возникших в результате расщепления рестриктазами или ПЦР, и включить в состав конечного слитого гена путем сборки методом ПЦР или лигирования. Фрагменты гена и/или продукты ПЦР можно соединить, применяя независимое от лигирования клонирование, клонирование по Гибсону, NEB Builder (NEB) или другие способы, известные специалистам в данной области. Полученные гены затем можно клонировать в подходящий вектор экспрессии, что обсуждалось выше.
В подходе выше пользуются преимуществом базы данных IMGT как проверенного источника информации о последовательности доменов Ig. Такой же подход, как описанный выше, можно применять, чтобы охватить все домены с известной структурой. Ссылки на файлы pdb, которые описывают отдельные структуры белков, можно найти в ссылках на первоисточники (например, в ссылках, цитированных в данной заявке, или приведенных в них ссылках). Банк данных белков RCSB ("сервер pdb") представляет собой портал структурной информации о биологических макромолекулах, таких как домены белков. Другие источники доступа к данным о структуре, включая PDBSUM, были кратко описаны115. Данные, связанные с такими файлами, также позволяют идентифицировать элементы вторичной структуры путем просмотра 3-мерных структур или путем применения программного обеспечения, такого как DSSB, или сайтов в сети Интернет, на которых запускается такое программное обеспечение116. Применяя данный подход можно получить представление о вторичной структуре по первичной последовательности аминокислот. В качестве альтернативы можно использовать структурную модель или непосредственное выравнивание последовательностей между желательным реципиентным доменом и ортологами или паралогами с известной структурой, чтобы определить элементы вторичной структуры. В качестве альтернативы можно использовать алгоритмы предсказания элементов вторичной структуры.
Структуру 10ого домена клеточной адгезии III типа фибронектина117 можно использовать в качестве примера подхода, чтобы определить потенциальные сайты внутри кандидатного реципиентного домена для встраивания последовательностей донора. Такой же подход можно применять, чтобы определить участки, которые дают возможность диверсификации цепи донора, реципиента и партнеров.
В качестве примера файл pdb, в котором описан 10й домен клеточной адгезии III типа фибронектина (Fnlll-10), называется "1FNA". Используя файл pdb (например, путем просмотра на сервере pdb), можно получить изображение линейной последовательности аминокислот Fnlll-10 с подписанными элементами вторичной структуры (фигура 20А). Участки, которые образуют бета-цепи, подчеркнуты и остатки, которые соединяют их на верхней поверхности домена, показаны строчными буквами. В дополнительном примере структура gp251 представлена в файле pdb 2WMN. Линейное изображение элементов вторичной структуры представлено на фигуре 20В. Остатки, соединяющие бета-цепи, или соединение бета-цепь-альфа-спираль подчеркнуты.
Данная "соединяющая последовательность", которая представлена строчными буквами, представляет участки, которые можно заменить частично или полностью, при этом сохранив короткий линкер между донором и реципиентом. Как обсуждалось выше, остатки остова можно удалить на границе соединения реципиентных остовов и заменить на рандомизированные кодоны, содержащие некоторые или все аминокислоты. Те же самые остатки, которые представлены на фигуре 20, также представляют собой возможные сайты, допускающие диверсификацию, как описано выше.
Gp2 представляет собой малый домен белка из 64 аминокислот со сближенными N-и С-концами, и, следовательно, данная молекула также представляет собой идеального кандидата донорного домена. Дополнительно было показано, что N- и С-концы Gp2 можно укоротить, не влияя на укладку домена, позволяя слияние в непосредственной близости к реципиентному домену.
Пример 11. Прошедшие селекцию линкеры необходимы для функциональной экспрессии донорных доменов ноттина внутри реципиентного домена антитела.
В противоположность подходам слияния пептидов, используемым другими, в которых для соединения доменов используют длинные гибкие линкеры, в формате KnotBody используются короткие негибкие линкерные последовательности, чтобы ограничить относительное движение между донорным и реципиентным доменами. Это важный аспект настоящего изобретения. Для того чтобы определить подходящие линкеры, обеспечивающие возможность правильную укладку 2 слитых структурных доменов, мы использовали подход получения библиотеки с вариацией в линкере. В примере 3 и примере 12 мы описали выделение нескольких функциональных молекул KnotBody с прошедшими селекцию корокими негибкими линкерными последовательностями, соединяющими EETI-II (донорный домен) с каркасными остатками доменов VL или VH (реципиент).
Для того чтобы продемонстрировать важность селекции линкера, прошедшие селекцию короткие линкеры из двух хорошо описанных антител KnotBody KB_А07 и KB_А12 были заменены на длинные гибкие N- и С-концевые линкеры, обычно используемые другими исследователями11,13,15 (см. таблицу 15). Эффективность вариантов с данными линкерами затем сравнивали с таковой у исходных антител KnotBody с короткими негибкими линкерами, выбранными из библиотеки с применением анализа связывания трипсина.
В данном примере варианты KnotBody перевели в формат Fab, в котором ген VH слит с константным доменом-1 тяжелой цепи (СН1), и цепи VL, содержащие KnotBody с разными линкерами, слиты с константным доменом легкой цепи (CL). Гены VL, кодирующие ноттин и линкерные последовательности, синтезировали в виде фрагментов гена (Integrated DNA Technologies, см. таблицу 16). Для того чтобы экспрессировать варианты KnotBody с разными линкерами в клетках млекопитающих, данные фрагменты гена клонировали в вектор pINT12 экспрессии (кодирующий тяжелую цепь D1A12), применяя сайты рестрикции Nhel и Notl.
Вектор pINT12 (фигура 7) содержит кассету экспрессии с двойным промотором, в которой экспрессия тяжелой цепи находится под контролем промотора цитомегаловируса (CMV), а экспрессия легкой цепи запускается промотором фактора элонгации-1-альфа (EF1-альфа).
Для того чтобы экспрессировать антитела KnotBody в клетках млекопитающих, получали ДНК достаточного для трансфекции качества, применяя набор NucleoBond Xtra Midi plus (Macherey Nagel, номер в каталоге 740412.50). 25 мкг плазмидной ДНК инкубировали с 80 мкл реагента для трансфекции СНО ExpiFectamine (Thermo Fisher scientific, номер в каталоге А29129) в 2 мл бессывороточной среды OptiPRO (Thermo Fisher Scientific, номер в каталоге 12309050) в течение 5 минут перед добавлением к 25 мл клеток Expi-CHO (Thermo Fisher Scientific, номер в каталоге А29133), высеянных при плотности 6×106 клеток/мл во флакон для культуры ткани емкостью 125 мл. Флаконы для культуры ткани инкубировали при 37°С в течение 7 дней (при 5% CO2, влажности 75% и взбалтывании при 800 об/мин) с одной подкормкой через 18-22 часа после трансфекции. Подкормка включала 6 мл подкормки ExpiCHO, содержащей 150 мкл раствора энхансера. Экспрессированные белки очищали из культуральных супернатантов, применяя аффинную матрицу CaptureSelect lgG-CH1 (Thermo Fisher Scientific, номер в каталоге 194320005), следуя инструкциям производителя. Очищенные белки подвергали диализу против 2х ФБР в течение ночи. Концентрации белков определяли по поглощению на 280 нм и теоретическому коэффициенту экстинкции.
Для того чтобы сравнить эффективность антител KnotBody с короткими и длинными линкерами, исследовали связывание очищенных Fab с трипсином с помощью ELISA. В данном анализе связывание Fab KnotBody (при концентрации 0,5 мкг/мл) с биотинилированным трипсином (5 мкг/мл, иммобилизованным на покрытых стрептавидином планшетах Maxisorp™) детектировали, применяя антитело мыши к СН1 (Hybridoma Reagent Laboratories), а затем конъюгированное с европием антитело против антитела мыши (Perkin Elmer, номер в каталоге AD0124). Способность антител KnotBody KB_А07 и KB_А12 связывать трипсин сильно уменьшалась, когда короткие прошедшие селекцию линкеры были заменены на длинные и гибкие линкеры (фигура 22). Данный пример явно демонстрирует значимость коротких негибких линкеров для получения оптимальных слитых белков донор-реципиент.
Пример 12. Диверсификация донорного домена путем рандомизации взаимодействующих с донором доменов.
В примерах 5 и 6 показано использование перетасовки VH для диверсификации в последовательности домена-партнера по связыванию KnotBody, для проведения селекции вариантов с дополнительной специфичностью или улучшенной кинетикой связывания. В обоих примерах диверсифицировали домен-партнер (домен VH), и исходная специфичность связывания донорного домена (ноттина) оставалась неизменной. В примерах 2 и 3 мы проиллюстрировали диверсификацию реципиентного домена VL. В данном примере мы продемонстрировали отличный подход для введения диверсифицированные последовательности в донорный домен KnotBody: замену существующих петель в донорном ноттине на произвольные последовательности аминокислот. Способность антител KnotBody связывать трипсин, описанную в данном патенте, обуславливали последовательности петли 1 (PRILMR) ноттина-EETI-II. В данном примере мы заменили последовательности петли 1 KnotBody KB_А12 на рандомизированные последовательности различной длины (6, 8, 9 и 10 остатков), чтобы повысить диверсификацию, а также потенциальную связывающую поверхность. Полученные библиотеки петель затем использовали, чтобы создать специфичности связывания сМЕТ и β-галактозидазы, применяя технологию фагового дисплея.
Для того чтобы создать обширные библиотеки фагового дисплея с высокой долей вариантов с замененной петель, применяли подход олигонуклеотид-направленного мутагенеза с помощью мутагенеза по Кункелю (Kunkel, Т. А., и др. Meth. Enzymol. 154,367-382 (1987)) и селективную амплификацию по типу катящегося кольца, Huovinen, Т. и др. PLoS ONE7, е31817 (2012). Используемые олигонуклеотиды кодировали кодоны VNS (V=A/C/G, N=A/G/C/T и S=G/C), которые кодируют 16 аминокислот (за исключением цистеина, тирозина, триптофана, фенилаланина и стоп-кодонов) в данном положении. Используемые мутагенные олигонуклеотиды, представляющие антисмысловую цепь (где В=TGC), приведены в таблице 18.
Матрицу ДНК, кодирующую KB_А12 (в векторе фагового дисплея, pSANG428), очищали в виде содержащей урацил одноцепочечной ДНК (dU-оц-ДНК) из фага, выделенного из E. coli CJ236 (штамм dut-/ung-). Антисмысловые олигонуклеотиды, описанные выше, гибридизовали с матрицей dU-оц-ДНК и удлиняли, применяя полимеразу Т7 для получения комплементарной цепи. Вновь синтезированную гетеродуплексную ДНК подвергали амплификации по типу катящегося кольца, применяя гексамеры произвольной последовательности (Thermo Fisher Scientific, номер в каталоге S0142) и полимеразу Phi29 (Thermo Fisher Scientific, номер в каталоге ЕР0091), чтобы селективно амплифицировать мутантную цепь. Продукт амплификации по типу катящегося кольца разрезали с получением единиц размера плазмиды, применяя эндонуклеазу рестрикции Notl (New England Bio labs, номер в каталоге R3189S), и снова циркуляризовали путем самолигирования. Продукт лигирования очищали, применяя набор для очистки продуктов ПЦР MiniElute (Qiagen, номер в каталоге 28004), и внедряли путем электропорации в клетки TG1 E.coli (Lucigen, номер в каталоге 60502-2). Способы мутагенеза по Кункелю и селективной амплификации по типу катящегося кольца известны специалистам в данной области. Фаг выделяли из данной библиотеки, как описано в примере 3.
Для того чтобы выделить KnotBody с новыми специфичностями связывающих петель, проводили два раунда селекции фагового дисплея на сМЕТ человека и β-галактозидазе, напрямую иммобилизованных на иммунопробирках Maxisorp™. Селекцию фагов проводили, как описано в примере 3. Гены VL KnotBody после 2 раунда селекции амплифицировали с помощью ПЦР, применяя праймеры LLINK2 (SEQ ID NO: 69) и NotMycSeq (SEQ ID NO: 70). Амплифицированные гены VL KnotBody расщепляли с помощью Nhel и Notl и лигировали в вектор pSANG4 (кодирующий тяжелую цепь D1A12), предварительно расщепленный теми же ферментами. Продуктами лигирования трансформировали клетки TG1 E. coli. Для того чтобы идентифицировать моноклональные связывающие элементы, из каждой трансформации выбирали 47 отдельных клонов и получали моноклональный фаг из каждого клона (как описано в примере 3). Исследовали связывание супернатанта, кондиционированного моноклональным фагом из каждого клона, с используемым для селекции антигеном, применяя анализ связывания TRF. 30 из 47 исследованных клонов связывали c-Met и 37 из 47 клонов связывали β-галактозидазу (фигура 23). Связывающие элементы из данного анализа секвенировали, используя праймер LMB3 (CAGGAAACAGCTATGACC: SEQ ID NO: 77). 23 уникальные последовательности идентифицировали для сМЕТ (таблица 17А) и 11 уникальных последовательностей идентифицировали для β-галактозидазы (таблица 17 В). Хотя природная длина петли 1 EETI-II составляет 6 остатков, все новые связывающие элементы, выделенные из указанной библиотеки петель, содержали петлю размером 8 либо 9 аминокислот.
В данном примере явно продемонстрировано, можно осуществить дополнительную диверсификацию KnotBody путем замены существующих петель ноттина на произвольные последовательности различной длины. Данный подход замены/рандомизирования петель можно применять, чтобы получить новую специфичность (как описано в примере 5) или отрегулировать существующую специфичность или аффинность, опосредованную донорным или реципиентным доменом.
Пример 13. Получение биспецифических антител KnotBody. которые могут пересекать гематоэнцефалический барьер (ГЭБ) путем опосредованного рецептором трансцитоза (ОРТ).
Пересечение гематоэнцефалического барьера (ГЭБ) является главной проблемой при доставке пептидов и антител в головной мозг для лечения неврологических расстройств (например, хронической боли, болезни Альцгеймера, рассеянного склероза, эпилепсии). Например, приблизительно 0,1% антител попадают из кровотока в головной мозг (Zuchero, Y.J.Y. и др. Neuron 89, стр. 70-82 (2015)). В качестве альтернативы, такие лекарства как зиконотид (ноттин из яда улитки конуса) вводят, применяя инвазивные и дорогостоящие процедуры интратекальной инъекции. Следовательно, разработка эффективных стратегий для доставки молекул через ГЭБ уже долгое время является целью для фармацевтической промышленности (Niewoehner, J. и др. Neuron 81, 49-60 (2014). На протяжении последних лет основная цель данного исследования состояла в разработке молекул, способных переносить молекулы лекарственного средства через ГЭБ, пользуясь преимуществами эндогенных систем транспорта питательных веществ, например, опосредованного рецептором трансцитоза (ОРТ). Как правило, этого добиваются, применяя биспецифический формат, который включает "молекулярный челнок" и активную молекулу лекарственного средства. Например, Yu и коллеги сообщили об обычном биспецифическом антителе, которое транспортирует ингибитор бета-секретазы-1 (ВАСЕ) через ГЭБ, используя "молекулярный челнок", который связывает рецептор трансферрина (TFR) (Yu, Y.J. и др. Sci Transl Med 3, 84ra44-84ra44 (2011)). Данный формат биспецифического антитела состоит из 2 различных пар VH: VL (т.е., 2 различных плечей Fab), каждая из которых распознает либо TFR, либо ВАСЕ. В примере 5 мы продемонстрировали получение биспецифических антител KnotBody, в которых детерминанты связывания, необходимые для распознавания двух различных антигенов, входят в состав одной пары VH-VL. В данном примере мы описали получение биспецифических антител KnotBody в таком же формате, в котором домены VH, прошедшие селекцию по связыванию с TFR, переносят своих партнеров - слитых доменов ноттин-VL - через ГЭБ посредством ОРТ.
В примере 5 описаны VH-перетасованные библиотеки, состоящие из легких цепей связывающих трипсин KnotBody (KB_А07 и KB_А12) в паре с репертуаром генов VH, выделенных из неиммунизированных доноров. Осуществляли селекцию биспецифических антител KnotBody к TFR из данных библиотек, применяя 2-3 раунда селекции фагового дисплея на антигене TFR, напрямую иммобилизованном на иммунопробирках Maxisorp™. 1 раунд селекции проводили на TFR мыши, а затем 2 раунд селекции проводили на TFR крысы. В другом случае проводили 3 раунда селекции на TFR мыши-TFR мыши-TFR крысы (которые представляют собой антигены, используемые в раундах 1, 2 и 3, соответственно). В качестве альтернативы, селекцию проводили на TFR мыши - TFR человека - TFR мыши. Затем в конечном раунде селекции выбрали 736 отдельных клонов и получили моноклональный фаг из каждого клона (как описано в примере 3). Исследовали связывание супернатанта, кондиционированного моноклональным фагом из каждого клона, с TFR крысы с помощью ELISA (типичный пример данного анализа показан на фигуре 24). Выбрали 376 клонов, для которых выявили сигнал связывания выше 10000 единиц флуоресценции, и секвенировали, чтобы идентифицировать уникальных клонов. На основании анализа последовательностей CDR VH идентифицировали 65 уникальных связывающих элементов.
Для того чтобы позволить экспрессию данных связывающих TFR антител KnotBody в виде Fab, гены VH амплифицировали с помощью ПЦР, применяя праймеры М13 leaderseq (см. пример 4) и HLINK3 (CTGAACCGCCTCCACCACTCGA: SEQ ID 76). Амплифицированные гены VH расщепляли с помощью ферментов рестрикции Ncol и Xhol и лигировали в вектор pINT12 (кодирующий легкую цепь KB_А07 или KB_А12), предварительно расщепленный теми же ферментами. Вектор pINT12 (фигура 7) содержит кассету экспрессии с двойным промотором, в которой экспрессия тяжелой цепи находится под контролем промотора цитомегаловируса (CMV), а экспрессия легкой цепи запускается промотором фактора элонгации-1-альфа (EF1-альфа). Для того чтобы экспрессировать данные Fab KnotBody в клетках млекопитающих, получали ДНК достаточного для трансфекции качества, применяя набор Plasmid Plus (Qiagen, номер в каталоге 12945). 15 мкг плазмидной ДНК инкубировали с 48 мкл реагента для трансфекции СНО ExpiFectamine (Thermo Fisher scientific, номер в каталоге А29129) в 1 мл бессывороточной среды OptiPRO (Thermo Fisher Scientific, номер в каталоге 12309050) в течение 5 минут перед добавлением к 15 мл клеток Expi-CHO (Thermo Fisher Scientific, номер в каталоге А29133), высеянных при плотности 6×106 клеток/мл во флакон для культуры ткани емкостью 125 мл. Флаконы для культуры ткани инкубировали при 37°С в течение 7 дней (при 5% СО2, влажности 75% и взбалтывании при 800 об/мин) с одной подкормкой через 18-22 часа после трансфекции. Указанная подкормка содержала 3,6 мл ExpiCHO, дополненной 90 мкл раствора энхансера. Экспрессированные белки очищали из культуральных супернатантов, применяя аффинную смолу CaptureSelect IgG-CH1 (Thermo Fisher Scientific, номер в каталоге 194320005), следуя инструкциям производителя. Очищенные белки подвергали диализу против 2х ФБР в течение ночи. Концентрации белков определяли по поглощению на 280 нм и теоретическому коэффициенту экстинкции.
Для того чтобы оценить способность данных антител KnotBody пересекать ГЭБ, использовали готовую к применению модельную систему in vitro ГЭБ крысы (Pharmacocell, номер в каталоге RBT-24H). В данной модельной системе крысы эндотелиальные клетки мозга культивировали совместно с перицитами и астроцитами, чтобы имитировать анатомию ГЭБ in vivo (Nakagawa, S. и др. (2009) Neurochem. Int. 54, 253-263). Набор in vitro ГЭБ крысы культивировали, следуя инструкциям производителя, и измеряли трансэндотелиальную электрическую устойчивость (TEER) перед тестированием антител KnotBody, чтобы убедиться в целостности барьера. Во всех лунках величина TEER составляла >200 Ω/см2. Исследовали способность 21 Fab KnotBody пересекать ГЭБ в модельной системе ГЭБ in vitro. ОХ-26, хорошо охарактеризованное антитело к TFR крысы, которое, как было показано в моделях in vivo, пересекает ГЭБ (хотя и на низких уровнях), использовали в качестве положительного контроля (Jefferies, W.A., Brandon, М.R., Williams, A.F. & Hunt, S.V. Immunology 54, 333-341 (1985), Moos, Т. & Morgan, Е.Н. Journal of Neurochemistry 79,119-129 (2001)). Исходное KnotBody KB_A12 использовали в качестве отрицательного контроля. Как положительный, так и отрицательный контроли экспрессировали и очищали в формате Fab, как описано выше. Для данного анализа тестируемые антитела KnotBody получали в виде 7 олигоклональных смесей, каждая из которых содержала 3 различных антитела Fab в конечной концентрации 2 мкМ в аналитическом буфере (среде DMEM-F12, содержащей 15 мМ HEPES, 0,5% БСА, 500 нМ гидрокортизон и 10 мкг/мл Na-F). Положительный и отрицательный контроли получали при концентрации 1 мкМ в том же аналитическом буфере. Данные олигоклональные смеси Fab и контроли добавляли в верхнюю камеру (называемую стороной крови) набора для совместного культивирования и инкубировали при 37°С в течение 6 часов (при 5% СО2 и влажности 75%). Концентрацию перешедших путем трансцитоза Fab в нижней камере (называемой стороной головного мозга) определяли, применяя сэндвич-ELISA. В данном ELISA Fab захватывали, применяя антитело к СН1 (предоставленное Hybridoma Reagent Laboratories), и детектировали, применяя антитело кролика к легкой цепи каппа IgG человека (Abcam, номер в каталоге ab 195576) или антитело кролика к легкой цепи лямбда IgG человека (Abcam, номер в каталоге ab124719), а затем конъюгированное с европием антитело к антителам кролика (Perkin Elmer, номер в каталоге AD0105). Для олигоклональных смесей Fab KnotBody в лунках С2, С3 и С4 выявили значительные уровни трансцитоза по сравнению с отрицательными контролями (см. таблицу 19). Последовательности VH антител KnotBody, присутствующих в данных лунках, показаны в таблице 20. В данном примере продемонстрировали применение домена VH, специфичного к рецептору (т.е. TFR), участвующему в транспорте макромолекул в головной мозг, для доставки слитого ноттина-VL с отличной специфичностью (в данном примере - связывание трипсина). Такой же подход можно использовать, чтобы получить функциональные слитые белки ноттин-VL, которые могут модулировать активность мишеней, которые экспрессируются в головном мозге (например, ионных каналов в центральной нервной системе, протеаз, таких как ВАСЕ). Наблюдаемый уровень трансцитоза можно дополнительно улучшить путем оптимизирования специфичности и/или аффинности домена VH, применяя способы, известные специалистам в данной области.
Пример 14. Сравнение KnotBody и бычьего антитела с природными "сверхдлинными" CDR3 VH (ULVC-AT коровы), представляющими встроенный ноттин (EETI-II ULVC-AT коровы).
Были описаны бычьи антитела с природными сверхдлинными CDR3 VH, содержащими выставленный в растворитель двухцепочечный антипараллельный слой длиной приблизительно 20 А° (называемый стеблем), представляющий уложенный домен, стабилизированный 3 дисульфидными связями (называемый выступом)10. Zhang и коллеги показали, что домены выступа данных антител коров со сверхдлинными CDR3 VH (ULVC-AT) можно заменить на другие уложенные белки, такие как эритропоэтин13. В данном примере мы оценивали способность ULVC-AT коров представлять функциональные слитые ноттины на фаге по сравнению с KnotBody. Для того чтобы получить слитый ноттин-UCLA коровы, последовательность между первым и последним остатками цистеина участка выступа BLV1H12 ULVC-AT коровы заменяли на последовательность связывающего трипсина ноттина -EETI-II (EETI-II ULVC-AT коровы). Синтезировали фрагмент гена, кодирующий данную конструкцию (Integrated DNA Technologies, таблица 21). Данный синтетический ген клонировали в вектор фагового дисплея pSANG4, используя сайты рестрикции Ncol и Notl, и трансформировали им клетки TG1 E. coli. Эффективность слитого ноттина-ULVC-AT коровы затем сравнивали с таковой у KnotBody KB_А12 (которое представляет ноттин EETI-II в виде слияния с CDR2 VL), применяя анализ связывания трипсина. В данном анализе связывание с трипсином фага, выделенного из EETI-II ULVC-AT коровы и KB_А12, детектировали, применяя антитело к М13, а затем конъюгированное с европием антитело против антитела мыши (как описано в примере 3). Для KnotBody KB_А12 выявили лучшее связывание с трипсином по сравнению со слитым EET-II-ULVC-АТ коровы (фигура 25).
Пример 15. Функциональный дисплей антител KnotBody на поверхности клеток млекопитающих.
В примерах 1, 2, 3, 5, 6, 9, 12 и 13 технологию фагового дисплея применяли, чтобы позволить дисплей антител KnotBody или производных библиотек, и их селекцию. В качестве альтернативы фаговому дисплею, осуществляли дисплей связывающих элементов на бактериальных, дрожжевых клетках и клетках млекопитающих. В данных способах можно применять проточную сортировку для измерения связывания и экспрессии связавшейся молекулы, а также связывания с мишенью. Таким образом, дисплей библиотек антител KnotBody на поверхности клеток, например, клеток млекопитающих, позволит скрининг и селекцию десятков миллионов клонов путем сортировки клеток с возбуждением флуоресценции (FACS) по повышенной аффинности к мишени и уровням экспрессии в конечном их формате scFv-Fc, Fab или IgG. Способы конструирования и применения библиотек дисплея в других системах известны специалистам в данной области.
Библиотеки антител KnotBody (например, в пределах реципиентного, донорного, линкерного домена или домена-партнера) также можно применять для непосредственного функционального скрининга для выявления измененных фенотипов в клетках млекопитающих, как описано выше. Таким образом, библиотеки представленных или секретированных антител KnotBody в клетках млекопитающих могут обеспечить эффективный путь к открытию кандидатных лекарственных средств или молекул-прототипов лекарственных средств. Предложены способы конструирования библиотек в клетках млекопитающих путем направляемого нуклеазой встраивания, например, описанные в WO 2015166272 и цитируемых в нем ссылках, все из которых включены в данную заявку посредством ссылки. В данном примере мы продемонстрировали, что можно отобразить заякоренный в мембрану scFv-Fc KnotBody на поверхности клеток млекопитающих. Этого добивались путем клонирования scFv KnotBody KB_А07 и KB_А12 в нацеливающий вектор pD6 (фигура 26), осуществления опосредованного нуклеазой встраивания гена в клетки НЕК293 с последующим анализом методом проточной цитометрии. Результаты проточной цитометрии показали, что экспрессия была достигнута, когда окрашивали меченым антителом к Fc, и что отображенный ноттин имел правильную укладку, так как произошло окрашивание меченым флуорофором трипсином.
Гены KB_А07 и KB_А12 KnotBody получали для встраивания в вектор дисплея в млекопитающем таким образом, чтобы позволить модификацию с получением библиотек линкеров. Получили 3 фрагмента и соединили их с помощью ПЦР, используя перекрывающиеся концы на границах для запуска соединения. В направлении от N-конца к С-концу фрагмент 1 состоит из продукта ПЦР, кодирующего N-концевую часть гена scFv до точки встраивания донора (кодирующего, в данном случае, сайт Nco1, полноразмерный VH, линкер scFv, FW1, CDR1, FW2, перекрывание). Фрагмент 2 состоит из перекрывания, поступившего донора ноттина, перекрывания. Фрагмент 3 состоит из перекрывания, FW3, CDR3, FW4, сайта Not 1. Описание потенциальных размеров линкеров и сайтов приведено ниже. Положение перекрывания можно выбрать, но, как правило, оно будет гомологично каркасу антитела или кодирующей донор области (позволяя диверсифицировать один или другой фрагмент внутри перекрывания). В примерах ниже указанные фрагменты содержат перекрывания длиной от 18 до 27 гомологичных нуклеотидов, чтобы позволить их сборку и амплификацию с помощью ПЦР. Конечный продукт scFv, содержащий донор, получали путем сборки 3 фрагментов. Данный подход сборки 3 фрагментов подробно описан с применением исходного KnotBody (без диверсификации).
Описанные праймеры перечислены в таблице 22. Фрагмент 1 scFv KB_А07 (569 п.о.) получали с помощью ПЦР, используя прямой праймер 2985 и обратный праймер 2999 и матрицу ДНК plONTAS1, несущую ген KB_А07. Фрагмент 2 scFv KB_А07 получали с помощью ПЦР, используя праймеры 2979 и 2980 в отсутствие матрицы. В данном случае праймеры просто гибридизовали и удлиняли с получением фрагмента 2 KB_А07 длиной 137 п.о. Фрагмент 3 scFv KB_А07 (170 п.о.) получали с помощью ПЦР, используя прямой праймер 3000 и обратный праймер 2995 и матрицу ДНК plONTAS1, несущую КВ_А07. Фрагмент 1 scFv KB_А12 (572 п.о.) получали с помощью ПЦР, используя прямой праймер 2985 и обратный праймер 3003 и матрицу ДНК plONTAS1, несущую KnotBody А12. Фрагмент 2 scFv KB_А12 получали с помощью ПЦР, используя праймеры 2983 и 2984 в отсутствие матрицы. В данном случае праймеры просто гибридизовали и удлиняли с получением фрагмента 2 А12 длиной 137 п.о. Фрагмент 3 scFv KB_А12 (179 п.о.) получали с помощью ПЦР, используя прямой праймер 3004 и обратный праймер 3002) и матрицу ДНК plONTAS1, несущую KB_А12. Фрагменты 2 и 3 очищали в геле и фрагмент 1 очищали с помощью центрифужной колонки. Три указанных фрагмента затем объединяли (100 нМ каждого в 10 мМ Трис-HCl (рН8)) в общем объеме 10 мкл. К ним добавляли 10 мкл смеси KOD Hot Start Master Mix (Merck Millipore, номер в каталоге 71842). Указанные фрагменты затем соединяли путем инкубации при 95°С в течение 2 минут с последующими 20 циклами: 95°С (20 сек), 60°С (1 мин, 40 сек) и 70°С (30 сек). 1 мкл продукта данной реакции сборки затем использовали в качестве матрицы в смеси для реакции ПЦР с внешними праймерами 2985 и 2995 (А07) или 2985 и 3002 (А12). Соединенные продукты ПЦР, кодирующие гены scFv KB_А07 и KB_А12, затем расщепляли эндонуклеазами рестрикции Ncol и Notl, очищали в геле и клонировали в нацеливающий вектор pD6 дисплея в млекопитающем (фигура 26), предварительно расщепленный теми же ферментами. Плазмидную ДНК подходящего для трансфекции качества получали, применяя набор NucleoBond Xtra Midi plus (Macherey Nagel, номер в каталоге 740412.50).
Электропорация представляет собой эффективный способ внедрения ДНК в клетки, и в протоколах, разработанных Maxcyte, объединены высокоэффективная трансфекция клеток млекопитающих с высокой жизнеспособностью клеток. Клетки HEK293 центрифугировали и ресуспендировали при конечной концентрации 108 клеток/мл в буфере для электропорации от производителя (Maxcyte Electropration buffer, Thermo Fisher Scientific, номер в каталоге NC0856428)). Аликвоту 4×107 клеток (0,4 мл) добавляли в кювету для электропорации ОС-400 (Maxcyte, номер в каталоге OC400R10), содержащую 88 мкг ДНК (т.е., 2,2 мкг/106 клеток). Смесь ДНК состояла из 80 мкг плазмидной ДНК, кодирующей AAVS-SBI TALEN (pZT-AAVS1 L1 и pZT-AAVS R1 Systems Bioscience, номер в каталоге GE601A-1), в виде эквимолярной смеси и 8 мкг ДНК "донорной" плазмиды pD6, кодирующей KB_А07 или KB_А12. Также проводили контрольные электропорации, в которых ДНК TALEN или донорную ДНК заменяли на pcDNA3.0. Электропорации проводили, следуя инструкциям производителя (Maxcyte). Через 2 дня после трансфекции (2 дпт) начинали селекцию на бластицидине (5 мкг/мл). Через 13 дней (15 дпт) клетки анализировали с помощью проточной цитометрии для обнаружения экспрессии scFv-Fc, применяя антитело к Fc, меченое фикоэритрином (РЕ). Присутствие правильно уложенного ноттина обнаруживали по окрашиванию клеток биотинилированным трипсином, предварительно конъюгированным с меченым аллофикоцианином (АРС) стрептавидином. Анализ ограничивали жизнеспособными клетками, используя прямое рассеяние и окрашивание 7AAD в канале FL3. Клетки, положительные по окрашиванию в канале FL3 (представляющие собой нежизнеспособные клетки, которые поглощали 7-AAD), исключали.
Очищенный трипсин биотинилировали, применяя набор EZ-Link Sulfo-NHS-LC-Biotin (Pierce, номер в каталоге 21327), следуя инструкциям производителя. Биотинилированный трипсин (1,25 мкл, 0,1 мг/мл, 4,3 мкМ) и стрептавидин-АРС (Molecular Probes, номер в каталоге SA1005, 1 мкл, 0,2 мг/мл, 3,8 мкМ) предварительно инкубировали в ФБР/1% БСА (100 мкл) в течение 30 мин при комнатной температуре. Клетки (106 на образец), предварительно промытые ФБР, ресуспендировали в смеси биотинилированный трипсин/стрептавидин-АРС, полученной, как описано выше, и к ним добавляли антитела к Fc человека, меченые РЕ (BioLegend, номер в каталоге 409304, 200 мкг/мл, 0,5 мкл) и инкубировали в течение 30 минут при 4°С. Клетки промывали дважды в ФБР/0,1% БСА, ресуспендировали в ФБР/0,1% БСА, содержащем раствор для окрашивания на жизнеспособность 7-AAD (eBioscience, номер в каталоге 00-6993-50), и анализировали, применяя проточный цитометр (Intellicyt iQUE screener).
На фигуре 27 показано, что после 13 дней селекции в бластицидине (15 дпт) 34% и 11% трансфицированных KB_А07 и KB_А12 клеток HEK293, соответственно, окрашивались как Fc, так и трипсином. Не наблюдали окрашивания нетрансфицированных клеток HEK293. В данном примере продемонстрировали, что можно отображать связанные с мембраной антитела KnotBody на поверхности клеток млекопитающих при правильной укладке донорного ноттина.
Пример 16. Встраивание ноттинов в CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL антитела с вариабельными линкерными последовательностями, их отображение на фаге и селекция функциональных антител KnotBody.
В примерах 1, 2 и 3 продемонстрировали встраивание ноттина в CDR1 VL и CDR2 VL антитела, отображение полученных KnotBody на поверхности фага и селекцию функциональных антител KnotBody. В примерах 1, 2 и 3 получали библиотеки, в которых между донором и реципиентом встраивали вариабельные соединяющие последовательности, которые затем подвергали селекции с помощью фагового дисплея и скринингу для выявления оптимальных соединяющих последовательностей для отображения функциональных ноттинов. В результате идентифицировали короткие линкерные последовательности, которые проявили себя лучше, чем длинные гибкие линкеры для отображения функциональных ноттинов, как описано в примере 11. Встраивание ноттина в CDR1 VL или CDR2 VL вносит дополнительный вклад в связывание CDR VL и VH. Для некоторых применений могут быть предпочтительны альтернативные конфигурации, в которых ноттин встроен в альтернативные CDR либо на VH, либо на VL. Весьма вероятно, что, как описано в примере 3, лишь часть вариабельных слитых последовательностей, соединяющих донорный ноттин с каждым CDR, позволяет функциональный дисплей ноттинов. Для того чтобы продемонстрировать, что можно отображать функциональный ноттин во всех CDR антитела, были разработаны варианты D1A12 в формате scFv (Таре, С.J. и др. (2011) PNAS USA 108, стр. 5578-5583) с ноттином, встроенным в CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL, в которых рандомизировали два кодона, фланкирующих ноттин, чтобы позволить создание конструкций ноттина с "библиотеками линкеров", показанных на фигуре 28. Последовательность исходного scFv к ТАСЕ101 показана в таблице 23. Кроме того, создали библиотеку линкеров для KB_А07, в которой донорный ноттин EETI-II встраивали в CDR2 VL, как показано на фигуре 28. Вставки, кодирующие ноттины, с рандомизированными линкерными последовательностями, встроенные в каждый из шести CDR D1A12, и библиотеку линкеров KB_А07, в которой ноттин с рандомизированными фланкирующими аминокислотами встраивали в CDR2 VL, получали путем сборки трех фрагментов, как описано в примере 15, применяя стандартные методики молекулярной биологии, известные специалистам в данной области, например, Schofield и др. 200728. Библиотеки фагового дисплея получали путем клонирования в вектор фагового дисплея pSANG4 (Schofield и др., 2007), фаг выделяли, как описано в примере 3, подвергали селекции по связыванию с трипсином и проводили анализ ELISA моноклонального фага с отдельными клонами. Получение положительных клонов демонстрировало, что функциональный дисплей ноттинов возможен во всех петлях CDR в вариабельных областях как тяжелых, так и легких цепей антитела.
Стратегия и методика получения вставок библиотеки линкеров ноттинов в scFv путем сборки трех фрагментов с помощью ПЦР подробно описана в примере 15, и праймеры для получения указанных вставок перечислены в таблицах 22 и 24. Пары праймеров, необходимые для получения трех фрагментов для каждой из библиотек, матрица ДНК (при необходимости) и размеры продуктов перечислены в таблице 25, и способ получения и очистки отдельных вставок описан в примере 15. Указанные три фрагмента для каждой из библиотек A-G, перечисленных в таблице 25, затем объединяли в эквимолярном соотношении (например, фрагменты А1, А2 и A3 объединяли с получением библиотеки А) и соединяли, как описано в примере 15. Можно было получить фрагмент Е (дтиверсификацию осуществляли рядом с концом гена scFv), применяя сборку 2 фрагментов. Продукты амплифицировали с помощью ПЦР, используя прямой праймер 2985 и любой из указанных обратных праймеров D1A12 Notl Rev (библиотеки А-F) или 2995 (библиотека G). Собранные продукты ПЦР, кодирующие библиотеки А-G, затем расщепляли с помощью Ncol и Notl, очищали в геле, лигировали в вектор фагового дисплея pSANG4 (предварительно расщепленный теми же ферментами), и лигированый продукт внедряли путем электропорации в клетки TG1 E. coli (Lucigen, номер в каталоге 60502-2), как описано в примере 2. Добились размеров библиотек от 0,7 до 1,6×108. Фаг высвобождали из библиотек, как описано в примере 3, с получением семи библиотек: библиотеки А (библиотеки линкеров ноттинов, встроенной в CDR1 VH D1A12); библиотеки В (библиотеки линкеров ноттинов, встроенной в CDR2 VH D1A12); библиотеки С (библиотеки линкеров ноттинов, встроенной в CDR3 VH D1A12); библиотеки D (библиотеки линкеров ноттинов, встроенной в CDR1 VL D1A12); библиотеки Е (библиотеки линкеров ноттинов, встроенной в CDR2 VL D1A12); библиотеки F (библиотеки линкеров ноттинов, встроенной в CDR3 VL D1A12); и библиотеки G (библиотеки линкеров ноттинов, встроенной в CDR2 VL KB_А07).
Для того чтобы выделить функциональные слитые белки ноттин-антитело, каждую из библиотек фагового дисплея линкеров ноттина-антитела А-G, описанных выше, подвергали двум раундам селекции фагового дисплея с помощью биотинилированного трипсина, как описано в примере 3. Отдельные клоны (по 46 для каждой селекции) переносили в 96-луночные культуральные планшеты, получали фаг и исследовали связывание кондиционированного фагом супернатанта для каждого клона с биотинилированным трипсином, иммобилизованным на покрытых стрептавидином планшетах Maxisorp™, при этом связывание обнаруживали, применяя анализ TRF, описанный в примере 3 (используя концентрацию покрытия биотинилированным трипсином, равную 2,5 мкг/мл). Из сигналов ELISA на каждом 96-луночном планшете вычитали сигнал фонового уровня, полученного путем усреднения двух считываний отрицательного контроля на том же планшете без добавления фага в лунки. Специфичность к трипсину подтвердили по отсутствию связывания с покрытыми стрептавидином Maxisorp™ в отсутствие добавленного трипсина. Скрининг клонов, выбранных из не подвергнутых селекции библиотек антител линкеров ноттина С, Е и G, привел к 0%, 1% и 32% положительных клонов, соответственно, свидетельствуя о том, что ограниченная доля представителей библиотеки способна отображать функциональный донорный ноттин. Коэффициенты совпадения клонов, полученных после селекции фагового дисплея и ELISA моноклонального фага для библиотек А, В, С, D, Е, F и G, составляла 11%, 17%, 28%, 4%, 74%, 24% и 93% соответственно, демонстрируя обогащение антителами KnotBody, которые отображают функциональный ноттин.
Положительные клоны секвенировали, чтобы определить фланкирующие линкерные последовательности, которые позволяют отображение функциональных ноттинов с CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL Последовательности идентифицированных линкерных последовательностей перечислены в таблицах 26 и 27. Выделили примеры функциональных антител KnotBody с уникальными линкерными последовательностями (таблица 26), таким образом демонстрируя встраивание функциональных ноттинов в CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL антитела.
Пример 17. Альтернативное обрамление ноттинов. встроенных в домены антитела CDR1 VL и CDR2 VL
В приведенных выше примерах нативный N-конец и С-конец богатых цистеином пептидов (далее называемых ноттинами, независимо от структуры и паттерна дисульфидных связей) встраивали в остатки CDR антитела таким способом, который сохраняет природную линейную последовательность ноттина с нативными N- и С-концами, слитого с каркасами антител. Тем не менее, возможны альтернативные стратегии "обрамления" между реципиентным антителом и донорным ноттином, и пример этого приведен в данной заявке. В следующем далее описании последовательности между последовательными остатками цистеина в доноре называют "петлями" и нумеруют 1-5, на основании их природного порядка. Например, петля 1 находится между первым цистеином и вторым цистеином. Петля 5 находится между 5м и 6м цистеинами. Некоторые богатые цистеином пептиды, такие как циклотиды, находятся в циклической форме, в которой N- и С-концы соединены посредством пептидной последовательности. Например, МоСоТ можно обнаружить в "линейной" форме (т.е. со свободными N- и С-концами) или в циклической форме. Дополнительную пептидную последовательность, соединяющую первый (N-концевой) и 6ой (С-концевой) цистеин в циклической форме обозначают "петля 6" (Jagadish и др., (2010) Peptide Science 94, стр. 611-616) и используют в примерах ниже для соединения исходных N- и С-концов.
С одной стороны, N- и С-концы донорного ноттина в KnotBody соединены с помощью антитела, которое можно рассматривать как эквивалент "петли 6", "соединяющий" N- и С-концевые остатки цистеина в циклическом ноттине. С той же стороны, можно рассмотреть альтернативные "обрамления", где антитело заменяет альтернативные петли. В данном расположении нативные N- и С-концы донора могут быть связаны дополнительным пептидом "петли 6", обнаруженном в циклическом MoCoTI-II. Данные стратегии альтернативного обрамления позволят варьировать размещение различных петель по отношению к реципиентному антителу, что приведет к потенциальным преимуществам при создании оптимальных биспецифических ориентации и стратегиях конструирования, например, улучшения аффинности или специфичности посредством контактирования как донора, так и реципиента с целевыми белками или комплексами. Эффективный "поворот" донора относительно реципиента может повысить доступность некоторых важных петель, например, связывающую трипсин петлю в ЕЕТ 5-3 перемещают в более центральное положение внутри донора по отношению к ЕЕТ 1-5 (см. ниже). Добавление альтернативной "петли 6" дополнительно повышает возможность дополнительных контактов с целевыми белками. Наконец, возможность такого альтернативного обрамления в некоторых случаях может обеспечить лучшую экспрессию или укладку по сравнению с нативной конструкцией KnotBody.
Когда ноттин встроен в своей нативной конфигурации, как описано в предыдущих примерах, за N-концевым фрагментом реципиентного антитела следует первый цистеин и петля 1 донорного ноттина. Донор кончается на петле 5, за которой следует концевой цистеин. В используемой в данной заявке номенклатуре данную конфигурацию называют "1-5" конфигурацией, что отражает порядок петель ноттина: 1, 2, 3, 4, 5. В данном случае антитело можно рассматривать как эквивалент петли 6 циклического ноттина. В таблице 28 проиллюстрированы различные потенциальные стратегии изменения обрамления между ноттином и антителом. В таблице 28 природная петля 1 подчеркнута в каждом случае. Исходные N- и С-концы EETI-II соединены с получением "петли 6", и используется пептидная последовательность петли 6 MoCOTI-II (обозначена курсивным шрифтом). Более подробное представление расположения петель в конфигурации EET_5-3 приведено на фигуре 29А. На ней показано, что в альтернативной конфигурации EET_5-3 порядок петель следующий: петля 5, 6, 1, 2 и 3 (при этом антитело "заменяет" петлю 4).
Для того чтобы проиллюстрировать на примере селекцию ноттинов, встроенных в альтернативную рамку, донорный ноттин с расположением рамки в конфигурации EET_5-3, присоединяли либо в положение CDR1, либо в положение CDR2 доменов VL либо каппа, либо лямбда. Это осуществляли путем замены остатков внутри реципиентной VL на произвольные аминокислоты таким способом, который ограничивает количество добавляемых аминокислот между 2 доменами (фигура 29В).
Встраивание ноттинов с модифицированным обрамлением в CDR1.
Получали синтетический ген донора нотгина EETI-II с обрамлением 5-3 и использовали его для замены положений CDR1 в реципиентной легкой цепи путем получения фрагмента ПЦР с сайтами Pml1 и Mfe (которые были введены с помощью ПЦР) и клонирования в plONTAS1_KB_Kappa и plONTAS1_KB_lambda. Обозначения каркаса и CDR соответствуют описанным в Международной информационной системе ImMunoGenetics (IMGT)29. Указанные праймеры для ПЦР также вводили вариабельные последовательности аминокислот между сайтами рестрикции и геном ноттина. Каждый из праймеров для ПЦР Pml5-3EETa и Pml5-3EETb встраивал 3 вариабельных кодона, кодируемых последовательностью VNS (V=А, С или G, N=А, С, G или Т, S=С или G) сразу после сайта рестрикции Pml. Указанные вырожденные кодоны "VNS" кодируют 16 аминокислот (за исключением цистеина, тирозина, триптофана, фенилаланина и стоп-кодонов) в каждом рандомизированном положении из 24 комбинаций кодонов. Pml5-3EETb также встраивал дополнительный остаток глицина между донором и реципиентом, по сравнению с Pml5-3EETa.

5'-конец данных последовательностей представляет собой сайт, созданный Pml1 - ферментом рестрикции, распознающим последовательность "CACGTG", с получением тупого конца. Для того чтобы облегчить клонирование продукта ПЦР с тупыми концами, синтезировали праймеры с 5'-фосфорилированными концами.
На 3'-конце гена ноттина использовали антисмысловые праймеры 5-3EETMfe (кодирующий сайт Mfe1), чтобы амплифицировать рамку 5-3 EETI-II. Сайт Mfe1, используемый для клонирования, кодирует 2ую и 3ю аминокислоты FW2 (Asn-Trp). Данный праймер встраивает 2 произвольные аминокислоты, кодируемые кодонами VNS или VNC, за которыми следует сайт Mfe1 (подчеркнут).
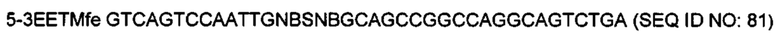
На фигуре 29С изображена последовательность после встраивания EETI-II в формате 5-3 в CDR1 легкой цепи лямбда IGKV1D-39 с применением праймера Pml5-3EETa. Репертуар фрагментов легкой цепи, содержащих каркас 2-каркас 4, также клонировали после донорного ноттина, как описано ранее в примере 2, применяя сайты рестрикции Mfe1 и Not1 (подчеркнуты).
Встраивание ноттинов в CDR2
Донорный ноттин внедряли в положения CDR2 plONTAS1_KB_lambda и plONTAS1_KB_Kappa путем получения фрагмента ПЦР с сайтами рестрикции Pst1 и BspE1, который внедряли с помощью ПЦР. Оказалось возможным ввести сайт Pst1 в первые два остатка участка CDR2 гена V каппа IGKV1D-39 (в последовательности Ala-Ala). Для удобства клонирования такой же сайт рестрикции и кодируемые остатки встраивали на конце каркаса 2 гена V лямбда зародышевого типа IGLV1-36. В лямбда зародышевого типа также можно было встроить сайт BspE1 в 4й и 5й остатки участка FW3, кодирующие Ser-Gly (фигура 3Е). Снова данный сайт рестрикции и кодируемые аминокислоты также встраивали в ген V каппа (фигура 3F).
Праймеры для ПЦР PST5-3EETa применяли для амплификации EETI-II и встраивания 2 кодонов Ala, содержащих сайт Pst1 для клонирования (подчеркнут), за которыми следовали 2 вариабельных кодона, кодируемых последовательностью GNS (кодирующей Val, Ala, Asp или Gly) и VNS (кодирующей 16 аминокислот в пределах 24 кодонов), сразу после сайта рестрикции Pst1 и перед последовательностью ноттина. Кодон VNS заменяет первую аминокислоту EETI-II с суммарным эффектом добавления 3 аминокислот (2 остатков Ala и одного из Val, Asp, Ala или Gly) между донорным и реципиентным остовами (фигура 29В, D).

На 3'-конце поступившего донорного ноттина использовали праймеры для ПЦР 5-3EETBse, чтобы амплифицировать EETI-II в рамке 5-3. Они встраивали сайт BspE1 для клонирования. Продукт ПЦР встраивал донорный ноттин, за ним следовал глицин, который в природе следует за последним цистеином EETI-II (фигура 3а). Затем следуют 2 рандомизированные аминокислоты, которые примыкают к 4ой и 5ой аминокислотам FW3 после клонирования. Следствием этого является замена первых трех остатков FW3 на две рандомизированные аминокислоты, при этом сохраняется концевой глицин ноттина (фигура 3В).
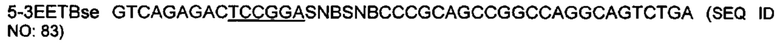
Репертуар фрагментов легкой цепи, содержащий каркас 3-каркас 4, также клонировали после донорного ноттина, как описано ранее в примере 2.
На фигуре 29D изображена последовательность после встраивания EETI-II в формате 5-3 в CDR2 легкой цепи лямбда IGKV1D-39 с применением праймера 5-3EETBse. Репертуар фрагментов легкой цепи, содержащий каркас 3-каркас 4, также клонировали после донорного ноттина, как описано ранее в примере 2, применяя сайты рестрикции BspE1 и Not1.
Применяя стандартные методики молекулярной биологии, известные специалистам в данной области, например, Schofield и др. 200728, создавали конструкции (изображенные на фигуре 29В, С и D)), используя фрагменты гена, полученные как описано выше. Их клонировали в plONTAS1_KB_Kappa" и "plONTAS1_KB_lambda и вводили путем электропорации в клетки TG1 E.coli, и конструировали библиотеки KnotBody величиной 3,5-6,6×108 представителей.
После селекции на трипсине, описанной в примере 3, положительные клоны детектировали с помощью ELISA моноклонального фага и определяли их последовательности. Примеры положительных клонов в CDR1 или CDR 2 легких цепей каппа и лямбда показаны в таблице 29, где линкерные последовательности обозначены строчными буквами, а донорный ноттин в рамке 5-3 обозначен курсивным шрифтом. Также показано значение сигнала ELISA, полученного при анализе ELISA моноклонального фага. Специфичность взаимодействия дополнительно подтверждали путем мутирования пары остатков пролин-аргинин, участвующих во взаимодействии с трипсином, на аланин-аланин, которые ослабляли связывание (как описано в примере 3).
Пример 18. Оценка иммуномодуляторной функции антител KnotBodv против Kv1.3.
Kv1.3 играет ключевую роль в поддержании передачи сигнала кальция после активации Т-клеточных рецепторов, тем самым модулируя активацию, пролиферацию и высвобождение цитокинов Т-клетками в эффекторных Т-клетках памяти (TEM). Клетки TEM играют важную роль в патогенезе опосредованных Т-лимфоцитами аутоиммунных заболеваний, и, следовательно, блокирование активности Kv1.3 представляет собой потенциальную точку терапевтического вмешательства.
В примере 7 описано получение блокаторов Kv1.3 путем замены связывающего трипсин ноттина EETI-II в положении CDR2 антител KnotBody KB_А07 и KB_А12 на богатые цистеином минибелки Shk или калиотоксин (встречающиеся в природе блокаторы Kv1.3 из яда морских актиний и яда скорпиона, соответственно). В примере 8 продемонстрирована блокирующая активность данных антител KnotBody по отношению к Kv1.3, определенная с помощью электрофизиологических способов. В данном примере мы оценили способность KB_А12 Shk модулировать секрецию цитокинов активированными Т-клетками.
Способы измерения высвобождения цитокинов из Т-клеток хорошо известны специалистам в данной области (например, Tarcha и др., (2012) J Pharmacology and Experimental Therapeutics, 342, стр. 642-653). Мононуклеарные клетки периферической крови (МКПК) выделяли из 5 здоровых доноров и стимулировали путем культивирования в 96-луночных планшетах, предварительно покрытых 500 нг/мл антитела к CD3 ОКТ3 (Ebioscience, номер в каталоге 16-0037-85). МКПК суспендировали при концентрации 2×106 клеток/мл, и 100 мкл суспензии клеток смешивали с 100 мкл тестируемого образца (KB_A12_ShK), или положительного контроля (свободного токсина Shk, Alomone labs, STS-400), или отрицательного контроля (исходного KnotBody KB_А12) при конечной концентрации 100 нМ. (Образцы исследовали в трех повторах для KB_A12_Shk или в двух повторах для KB_А12 и свободного Shk). Клетки инкубировали при 37°С в течение 72 часов, центрифугировали при 1500 об/мин в течение 5 мин при комнатной температуре перед удалением 150 мкл супернатанта. После 72 часов инкубации определяли концентрацию цитокинов и гранзима-В, применяя анализ на основе гранул Luminex, следуя инструкциям производителя (Thermo Fisher).
Секреция интерферона гамма, гранзима В, интерлейкина-17А и TNF-альфа снижалась в МКПК из всех 5 различных доноров после инкубации с KB_A12_Shk, по сравнению с контролями, инкубированными с контрольными KnotBody (KB_А12) (фигуры 30А-D). Полученные результаты продемонстрировали, что KB_A12_ShK не только блокирует функцию Kv1.3, что измеряли с помощью способов электрофизиологии (пример 8), но также непосредственно препятствует активации Т-клеток, что определили в функциональном анализе Т-клеток.
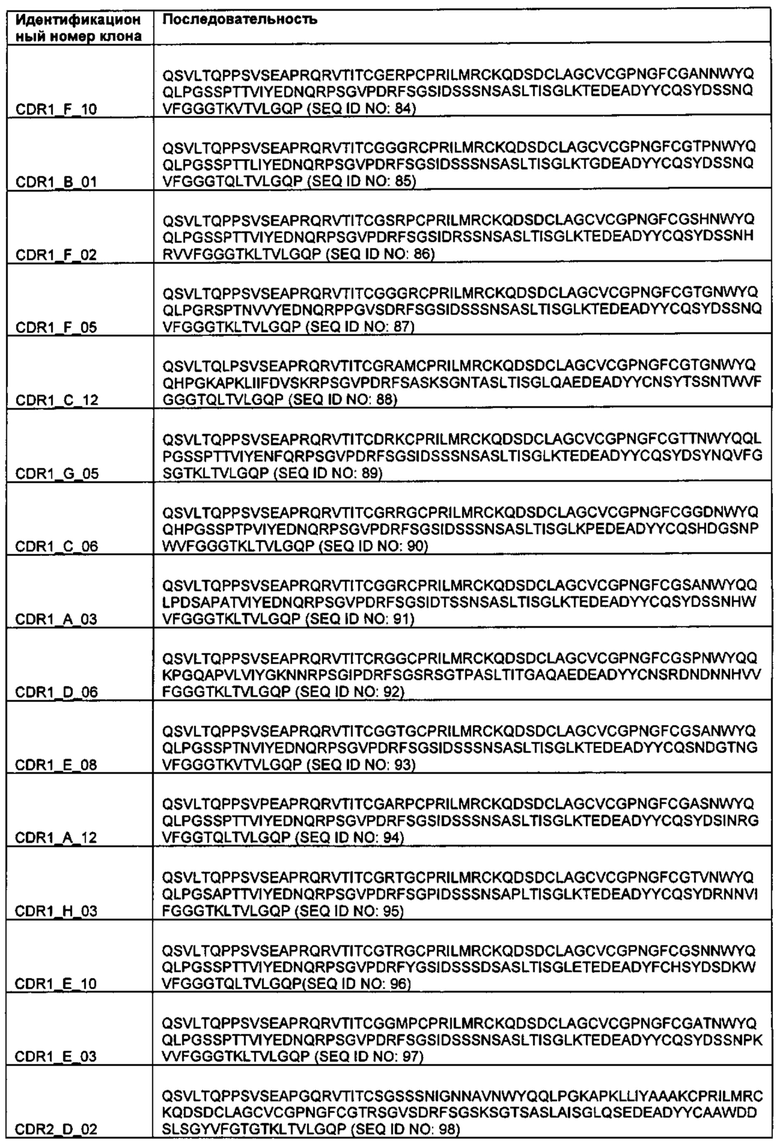
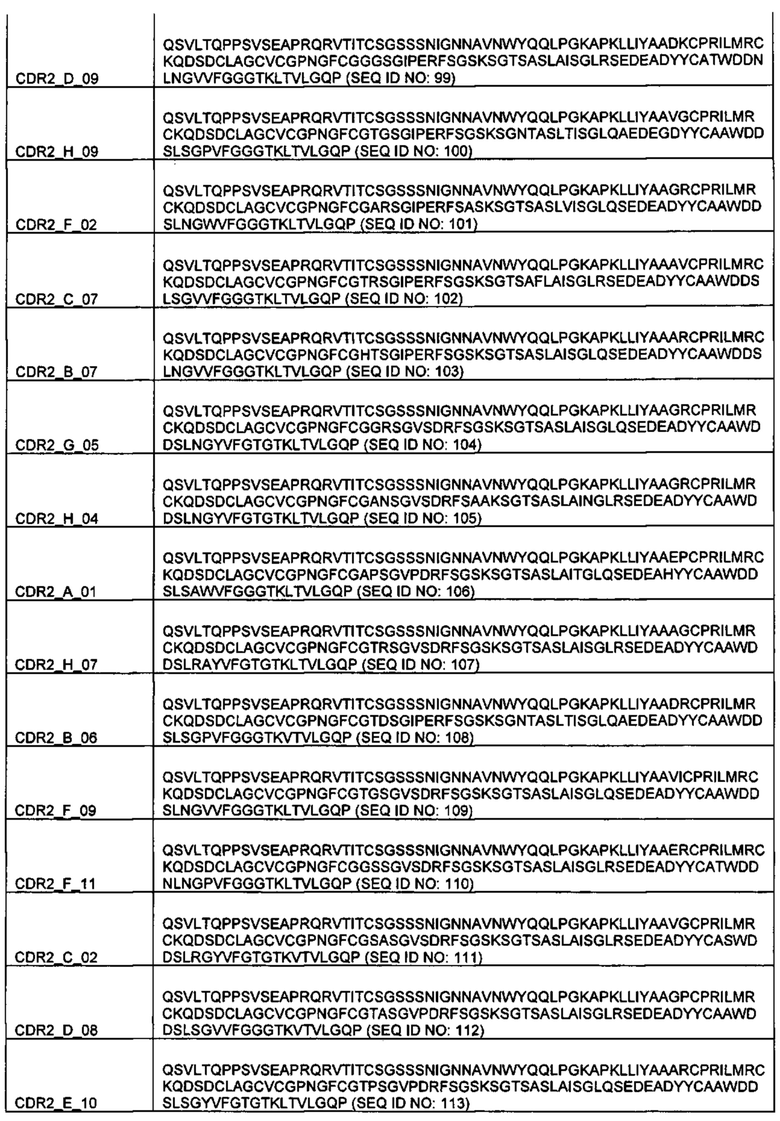

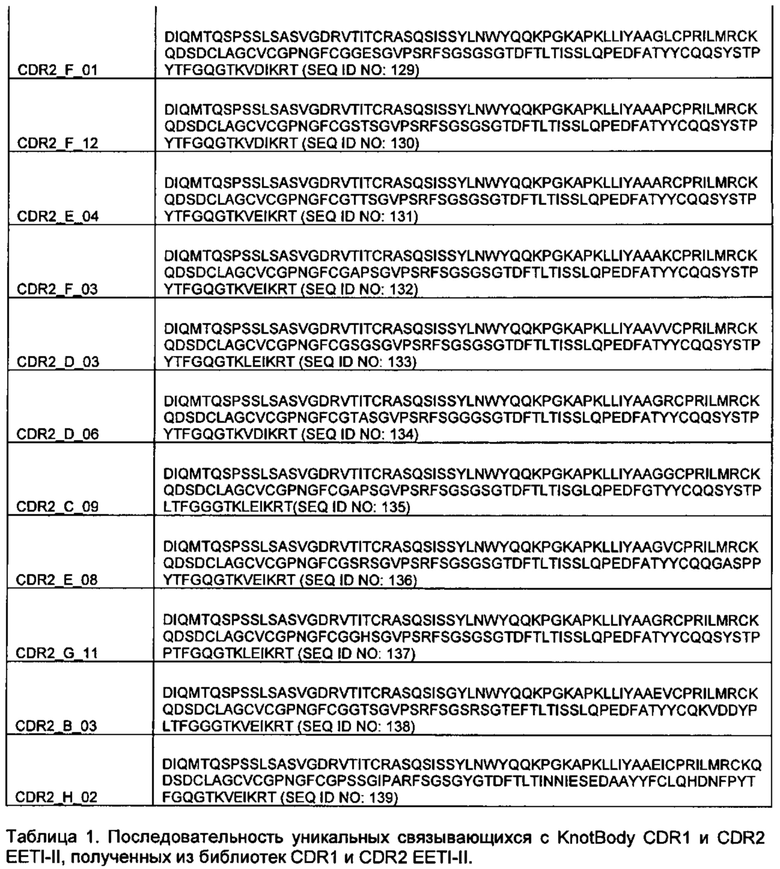

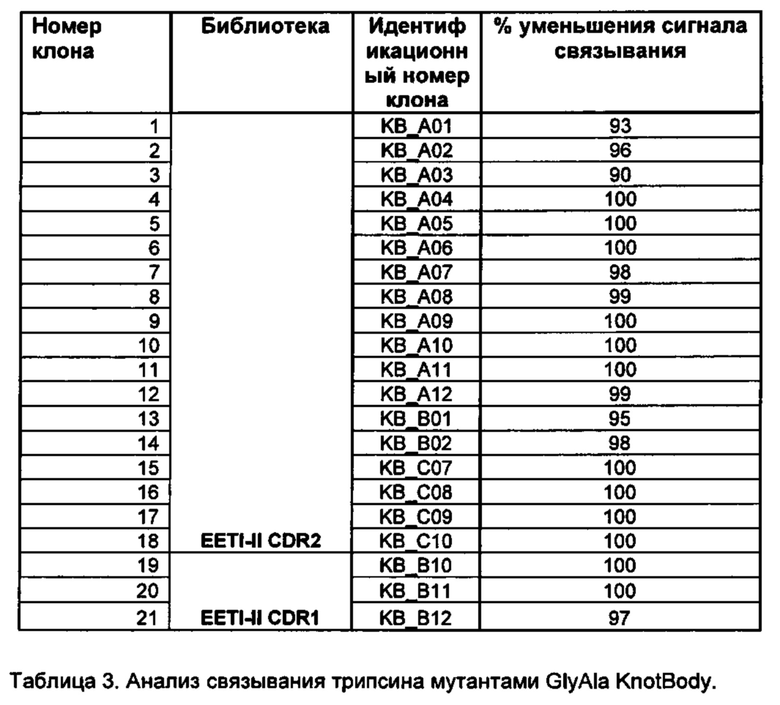
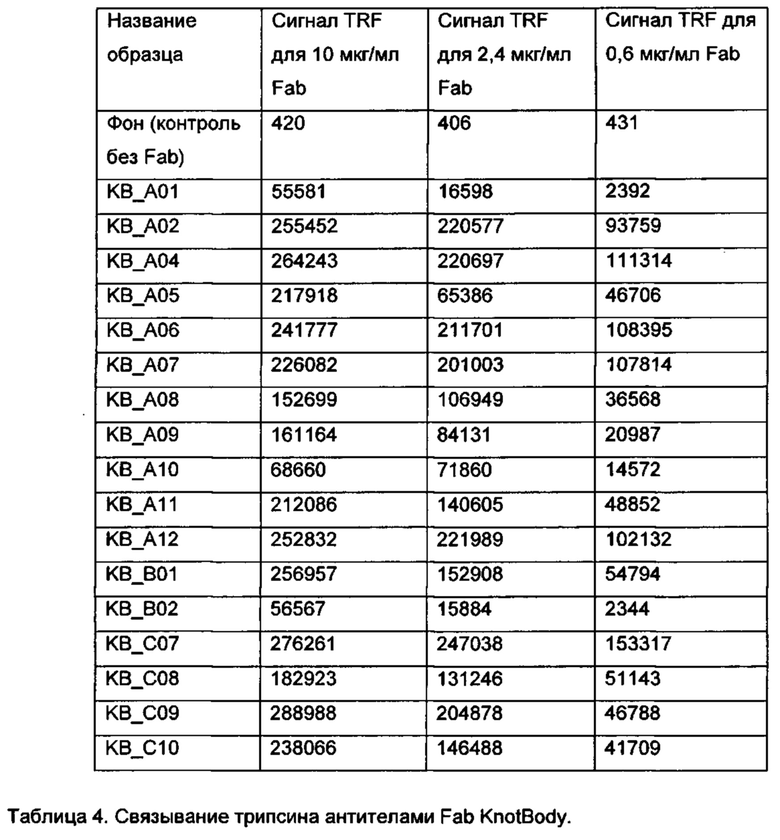
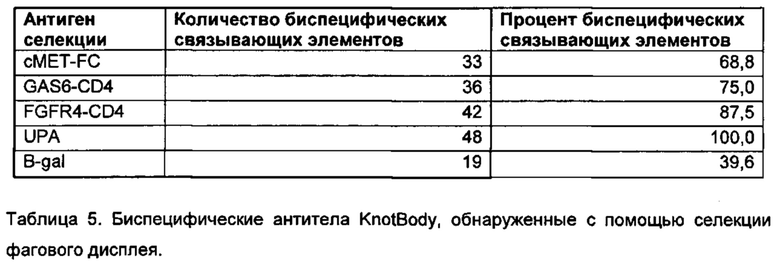

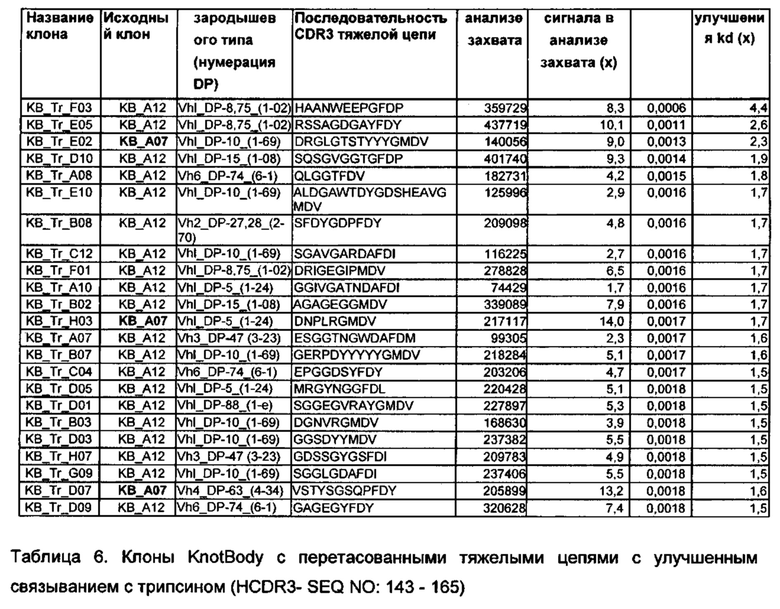
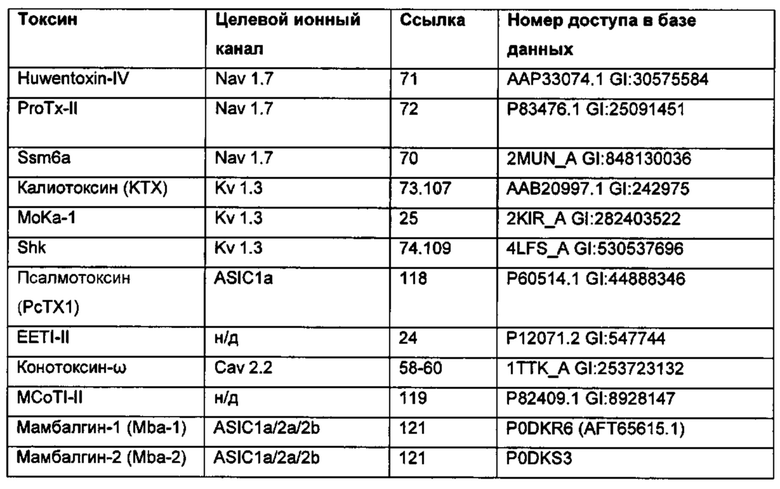

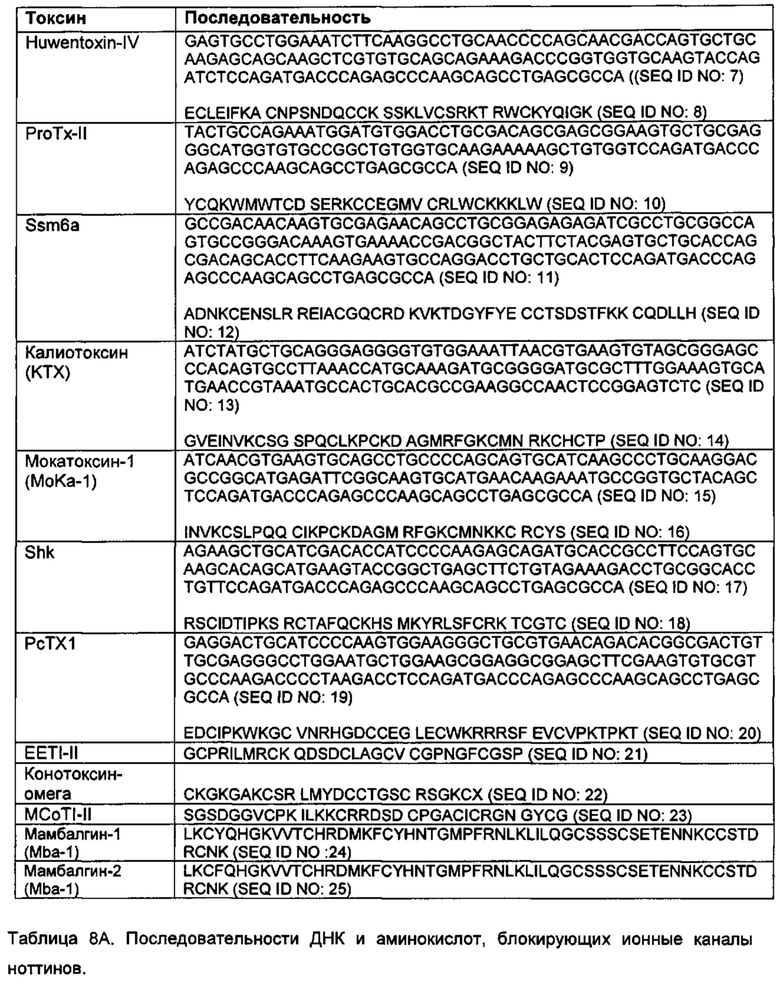
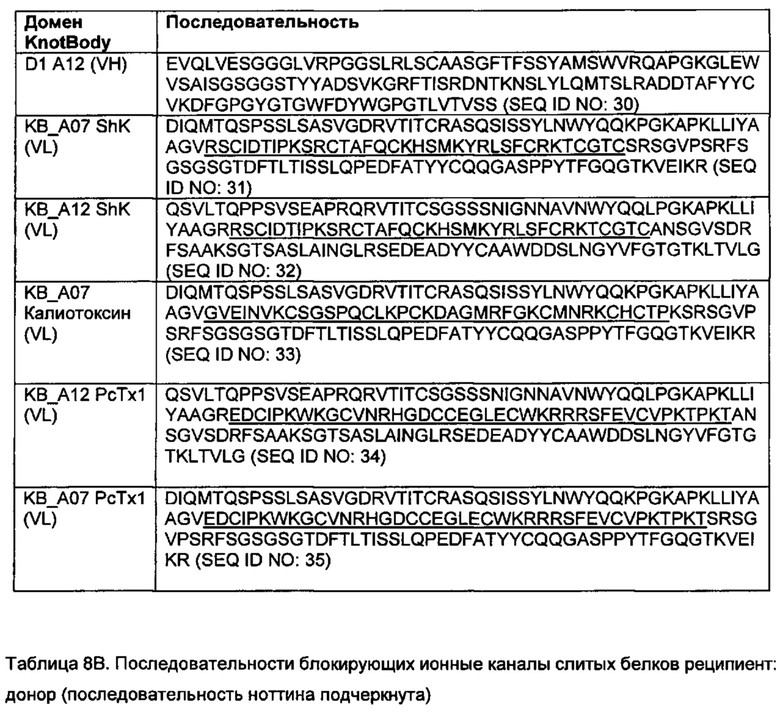

Таблица 9А. Праймеры, используемые для клонирования блокаторов ионных каналов (токсинов) в CDR2 VL KB_А07. В названии праймера указан токсин, используемый для слияния (например, Huwen_ А07 Rev представляет собой обратный праймер, используемый для клонирования Huwentoxin-IV в KB_А07)

Таблица 9В. Праймеры, используемые для клонирования блокаторов ионных каналов (токсинов) в CDR2 VL KB_А12. В названии праймера указан токсин, используемый для слияния (например, Huwen_A12 Fwd представляет собой прямой праймер, используемый для клонирования Huwentoxin-IV в KB_А07).
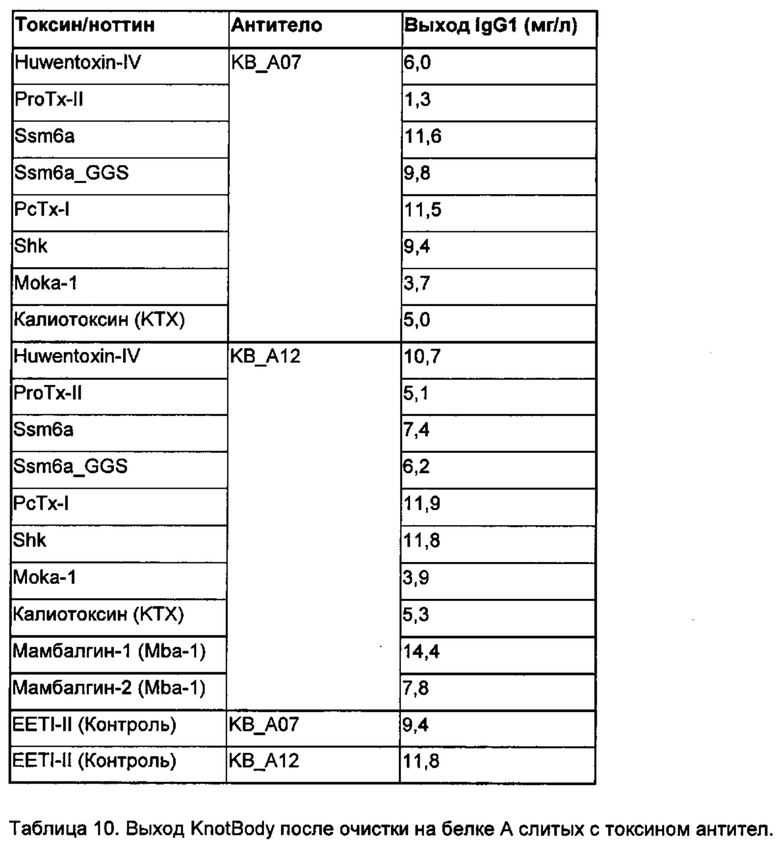
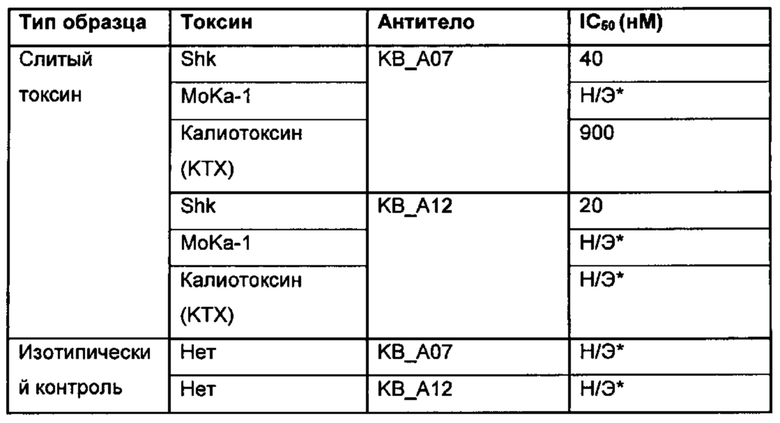
Таблица 11А. Краткое описание результатов IC50 для восьми образцов, исследованных на каналах Kv1.3. Н/Э*=нет детектируемого эффекта.
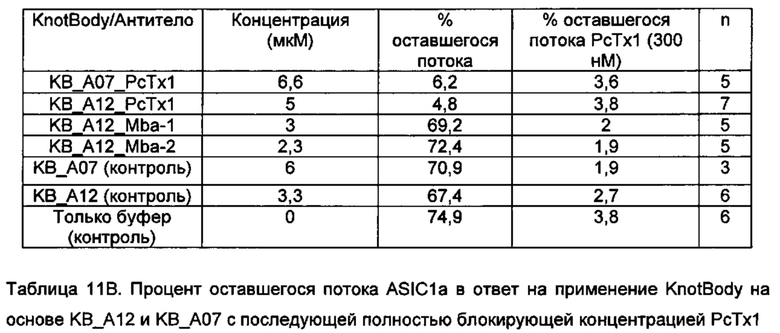



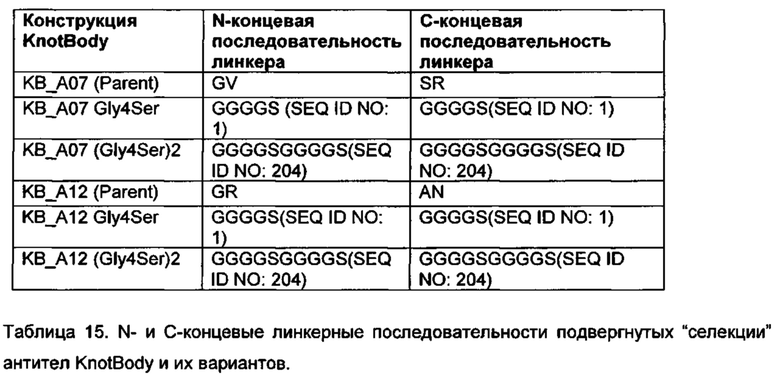

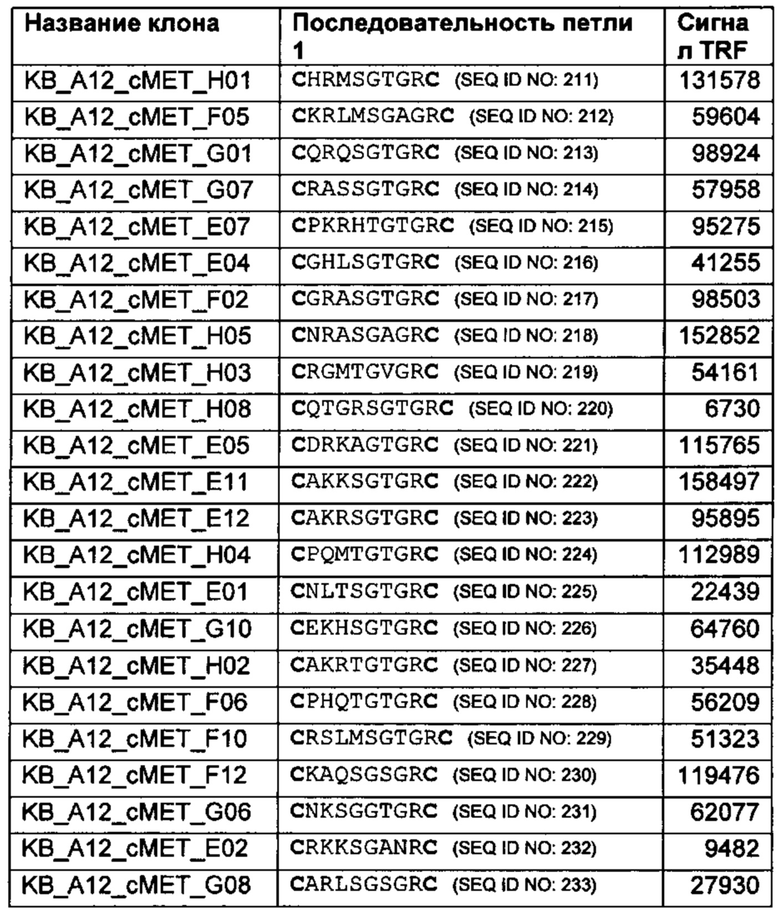
Таблица 17А. Последовательности петли 1 уникальных связывающих сМЕТ элементов, выделенных из библиотеки петель KnotBody. Остатки цистеина, фланкирующие остатки петли 1, выделены жирным шрифтом.

Таблица 17В. Последовательности петли 1 уникальных связывающих β-галактозидазу элементов, выделенных из библиотеки петель KnotBody. Остатки цистеина, фланкирующие остатки петли 1, выделены жирным шрифтом.

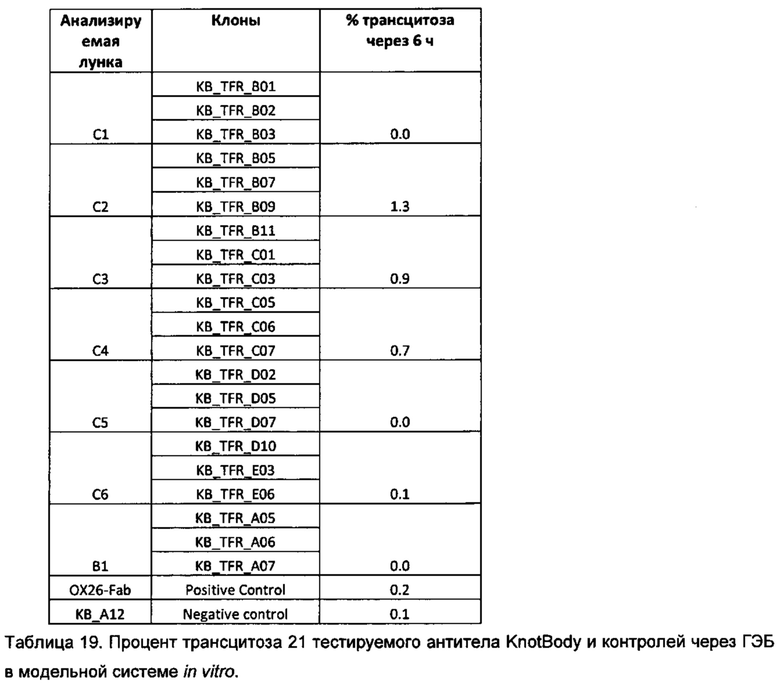






Таблица 25. Пары праймеров, необходимые для получения вставок ДНК, необходимых для сборки трех фрагментов для получения библиотеки линкеров ноттинов. Библиотеку линкеров ноттинов CDR3 VL создавали путем сборки 2 фрагментов со вставками F1 и F2.
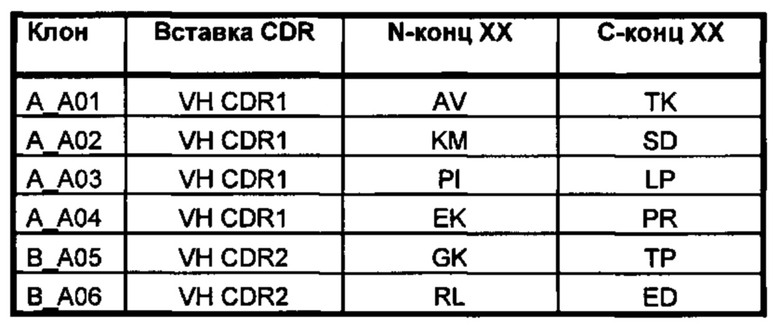

Таблица 26. Последовательности линкеров, подходящих для функционального дисплея ноттинов, включенных в CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL и CDR3 VL D1A12. XX представляет собой рандомизированные остатки, указанные на фигуре 28.
Таблица 27. Последовательности линкеров, подходящих для функционального дисплея ноттинов, включенных в CDR2 VL KB_А07. XX представляет собой рандомизированные остатки, указанные на фигуре 28.


Цитируемые источники
1. Jones, Р.Т., et al. Nature 321, 522-525 (1986).
2. Barbas, C.F., et al. PNAS USA 90, 10003-10007 (1993).
3. Frederickson, S. et al. PNAS USA, 14307-14312 (2006).
4. Wrighton, N.C. et al. Science (New York, N. Y 273, 458-464 (1996).
5. Liu, T. et al. J. Am. Chem. Soc. 136, 10557-10560 (2014).
6. Kogelberg, H. et al. Journal of molecular biology 382, 385-401 (2008).
7. Man, Y.K.S. et al. PLoS ONE 8, e70452 (2013).
8. Saini, S.S. et al Eur. J. Immunol. 29, 2420-2426 (1999).
9. Saini, S.S., et al. Int. Immunol. 15, 845-853 (2003).
10. Wang, F. et al. Cell 153, 1379-1393 (2013).
11. Zhang, Y. et al. Angew. Chem. Int. Ed. Engl. 53,132-135 (2014).
12. Zhang, Y. et al.. Angew. Chem. Int. Ed. Engl. 52, 8295-8298 (2013).
13. Zhang, Y. et al. AACS Chem. Biol. 8, 2117-2121 (2013).
14. Liu, T. et al. PNAS USA 112, 1356-1361 (2015).
15. Peng, Y. et al. Chem. Biol. 22,1134-1143 (2015).
16. Melidoni, A.N. et al. PNAS USA 110, 17802-17807 (2013).
17. Betton, J.M. et al. Nature (1997).
18. Collinet, B. et al. 275, 17428-17433 (2000).
19. Ruth, N. et al. FEBS Journal 275, 5150-5160 (2008).
20. Vandevenne, M. et al. Protein Engineering Design and Selection 21, 443-451 (2008).
21. Crasson, O. et al. Protein Eng. Des. Sel. 28, 451-460 (2015).
22. Neylon, C. Nucleic Acids Res. 32, 1448-1459 (2004).
23. Banta, S. et al. Annu Rev Biomed Eng 15, 93-113 (2013).
24. Kimura, R.H. et al. PLoS ONE 6, e16112 (2011).
25. Takacs, Z. et al. PNAS 106, 22211-22216 (2009).
26. Gui, J. et al. Curr. Biol. (2014). doi:10.1016/j.cub.2014.01.013
27. Dyson, M.R. et al. Anal Biochem 417, 25-35 (2011).
28. Schofield, D.J. et al.. Genome biology 8, R254 (2007).
29. Lefranc, M. - P. et al. Nucleic Acids Res. 43, D413-22 (2015).
30. Katz, B.A. e. Biochemistry 34, 15421-15429 (1995).
31. Katz, B.A. Annu Rev Biophys Biomol Struct 26, 27-45 (1997).
32. Lowman, H.B. Annu Rev Biophys Biomol Struct 26, 401-424 (1997).
33. Giebel, L.B. et al. Biochemistry 34, 15430-15435 (1995).
34. Holler, P.D. et al. PNAS USA 97, 5387-5392 (2000).
35. Li, Y. et al. Nat. Biotechnol. 23, 349-354 (2005).
36. Wozniak-Knopp, G. et al. Protein Eng. Des. Sel. 23, 289-297 (2010).
37. Ying, T. et al. Biochim. Biophys. Acta 1844, 1977-1982 (2014).
38. Binz, H.K. et al. Nature biotechnology 23,1257-1268 (2005).
39. Skerra, A. Curr. Opin. Biotechnol. 18, 295-304 (2007).
40. Gebauer, M. & Skerra, A. Curr Opin Chem Biol 13, 245-255 (2009).
41. Hufton, S.E. et al.. FEBS Lett. 475, 225-231 (2000).
42. Nord, K. et al. Nat. Biotechnol. 15, 772-777 (1997).
43. Nygren, P. - A. & Skerra, A. J Immunol Methods 290, 3-28 (2004).
44. Koide, A. et al. Journal of molecular biology 415, 393-405 (2012).
45. Steiner, D. et al. Journal of Molecular Biology 382, 1211-1227 (2008).
46. Tiede, C. et al. Protein Eng. Des. Sel. 27,145-155 (2014).
47. Gebauer, M. & Skerra, A. Meth. Enzymol. 503,157-188 (2012).
48. Colas, P. et al. Nature 380, 548-550 (1996).
49. De Meyer, T et al. Trends Biotechnol. 32, 263-270 (2014).
50. Shao, C. - Y. et al. Mol. Immunol. 44, 656-665 (2007).
51. Kruziki, M.A., et al. Chem. Biol. 22, 946-956 (2015).
52. Nygren, P. - A. FEBS J. 275, 2668-2676 (2008).
53. Jost, C. &  , A. Curr. Opin. Struct. Biol. 27,102-112 (2014).
, A. Curr. Opin. Struct. Biol. 27,102-112 (2014).
54. Kolmar, H. FEBS J. 275, 2684-2690 (2008).
55. Mouhat, S. et al Cunent Pharmaceutical Design 14, 2503-2518 (2008).
56. Wang, X. et al. Nat. Struct. Biol. 7, 505-513 (2000).
57. Gracy, J. et al. Nucleic Acids Res. 36, D314-9 (2008).
58. England, S. & de Groot, M. J. Br. J. Pharmacol. 158, 1413-1425 (2009).
59. Clare, J.J. Expert Opin Investig Drugs 19, 45-62 (2010).
60. Kolmar, H. Expert Rev Mol Diagn 10, 361-368 (2010).
61. Gelly, J. - C. et al. Nucleic Acids Res. 32, D156-9 (2004).
62. Combelles, ef al. Proteins 73, 87-103 (2008).
63. Heitz, A., et al. Eur. J. Biochem. 233, 837-846 (1995).
64. Cheek, S. et al. Journal of molecular biology 359, 215-237 (2006).
65. Yu, F.H. Pharmacological Reviews 57, 387-395 (2005).
66. Escoubas, P. Mol. Divers. 10, 545-554 (2006).
67. Klint, J.K. et al. Toxicon 60, 478-491 (2012).
68. Shu, Q. et al. Protein Sci. 11, 245-252 (2002).
69. Ueberheide, В. M. et al PNAS USA 106, 6910-S915 (2009).
70. Yang, S. et al. NAS USA (2013). doi:10.1073/pnas.1306285110
71. Peng, K. et al. The Journal of biological chemistry 277, 47564-47571 (2002).
72. Xiao, Y. et al. Mol Pharmacol 78, 1124-1134 (2010).
73. Crest, M. et al. The Journal of biological chemistry 267', 1640-1647 (1992).
74. Tudor, J.E. et al. Nat. Struct. Biol. 3, 317-320 (1996)
75. Galat, A., et al. FEBS J. 275, 3207-3225 (2008).
76. McCafferty, J ef al. Nature 348, 552-554
77. Hoogenboom, H. R. et al. Nucleic Acids Res. 19, 4133-4137 (1991).
78. Zhang, H. et al. PNAS USA 109, 15728-15733 (2012).
79. Xie, J. et al. PNAS USA 110, 8099-8104 (2013).
80. Nishimiya, D. Appl. Microbiol. Biotechnol. 98,1031-1042 (2014).
81. Vendel, M.C. et al. Arch. Biochem. Biophys. 526,188-193 (2012).
82. Bagal, S.K. et al. J. Med. Chem. 56, 593-624 (2013).
83.  , C A. & Jentsch, T.J. Hum. Mol. Genet. 11, 2435-2445 (2002).
, C A. & Jentsch, T.J. Hum. Mol. Genet. 11, 2435-2445 (2002).
84. Jentsch, T.J., et al. Nat. Cell Biol. 6, 1039-1047 (2004).
85.  , Q. & An, W.F. Combinatorial chemistry & high throughput screening 11,185-194 (2008).
, Q. & An, W.F. Combinatorial chemistry & high throughput screening 11,185-194 (2008).
86. Tate, C.G.. FEBS Lett. 504, 94-98 (2001).
87. Shintre, C.A. et al. PNAS USA 110, 9710-9715 (2013).
88. Suharni ef al. Monoclon Antib Immunodiagn lmmunother 33, 378-385 (2014).
89. Pavlidou, M. et al.. PLoS ONE 8, e72272 (2013).
90. Tillotson, B.J. et al.. Protein Eng. Des. Sel. 26, 101-112 (2013).
91. Zhang, H. et al. Chem. Biol. 20, 734-741 (2013).
92. Gunasekera, S. et al. J. Med. Chem. 51, 7697-7704 (2008).
93. Keller, T. et al. PLoS ONE 10, e0127169 (2015).
94. Jung, S. & Pluckthun, A. Protein Eng. 10, 959-966 (1997).
95.  , B. et al. J Immunol Methods 177, 151-163 (1994).
, B. et al. J Immunol Methods 177, 151-163 (1994).
96. Jespers, L et al. Nat. Biotechnol. 22,1161-1165 (2004).
97. Richler, E. et al. Nature methods 5, 87-93 (2007).
98. Podust, V.N. et al. J Control Release (2015). doi:10.1016/j.jconrel.2015.10.038
99. Schlapschy, M. et al. Protein Eng. Des. Sel. 26, 489-501 (2013).
100. Pershad, K. et al. Protein Engineering Design and Selection 23, 279-288 (2010).
101. Tape, C.J. et al. PNAS USA 108, 5578-5583 (2011).
102. Vaughan, T.J. et al. Nature biotechnology 14, 309-314 (1996).
103. Favel, A. et al. Int. J. Pept. Protein Res. 33, 202-208 (1989).
104. Chiche, L. et al. Current Protein & Peptide Science 5, 341-349
105. Azzazy, H.M.E. & Highsmith, W.E.. Clin. Biochem. 35, 425-445 (2002).
106. Goletz, S. et al.. Journal of molecular biology 315,1087-1097 (2002).
107. Lee, С.M. Y., et al. Nature Protocols 2, 3001-3008 (2007).
108. Hacker, D. L. et al. Protein expression and purification 92, 67-76 (2013).
109. Phaser crystallographic software. 40, 658-674 (2007).
110. PHENIX: a comprehensive Python-based system for macromolecular structure solution.
66, 213-221 (2010).
111. Afonine, P. V. et al. Acta Crystallogr. D Biol. Crystallogr. 68, 352-367 (2012).
112. Spiess, C. Mol. Immunol. 67, 95-106 (2015).
113. Falk, R. et al. Methods 58, 69-78 (2012).
114. Hosse, R.J. et al. Protein Sci. 15, 14-27 (2006).
115.  , X.M., et al. Nucleic Acids Res. 42, D1-6 (2014).
, X.M., et al. Nucleic Acids Res. 42, D1-6 (2014).
116. Rocha, L. Journal of Molecular Structure (2014).
117. Dickinson, C.D. et al. Journal of molecular biology 236, 1079-1092 (1994).
118. Dawson, R.J.P. et al. Nat Commun 3, 936 (2012).
119 Hernandez et al Biochemistry 39 (19), 5722-5730 (2000)
120. Obermeier, В et al. Nat Med 19,1584-1596 (2013))
121. Ubogu, E.E. J. Vase. Res. 50, 289-303 (2013)).
122. Diochot S et al, Nature 490, 552-555 (2012).
123. Kawahara, M. et al Biochem Biophys Res Commun, 315, 132-138. (2004)
124. Kawahara, M. et al Journal of Biotechnology, 133, 154-161. (2008).
125. Kawahara, M. et al Cytokine, 55, 402-408. (2011).
| название | год | авторы | номер документа |
|---|---|---|---|
| БИБЛИОТЕКИ СИНТЕТИЧЕСКИХ ПОЛИПЕПТИДОВ И СПОСОБЫ ПОЛУЧЕНИЯ ВАРИАНТОВ ПОЛИПЕПТИДОВ С ЕСТЕСТВЕННЫМ РАЗНООБРАЗИЕМ | 2010 |
|
RU2562163C2 |
| ПАРТНЕРЫ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ С NGF | 2006 |
|
RU2406728C2 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К КАТАЛИТИЧЕСКОМУ ДОМЕНУ FOKI НУКЛЕАЗЫ, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2830090C2 |
| Антигены, ассоциированные с воспалительным заболеванием кишечника | 2012 |
|
RU2612878C2 |
| АНТАГОНИСТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2005 |
|
RU2401842C2 |
| БИБЛИОТЕКА FV НА ОСНОВЕ КОМБИНАЦИЙ БЕЛКОВ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2014 |
|
RU2639505C2 |
| МОЛЕКУЛЫ АНТИТЕЛ ЧЕЛОВЕКА К IL-13 | 2004 |
|
RU2387667C2 |
| ПОЛИПЕПТИД, ВКЛЮЧАЮЩИЙ АНТИГЕНСВЯЗЫВАЮЩИЙ ДОМЕН И ТРАНСПОРТИРУЮЩИЙ СЕГМЕНТ | 2018 |
|
RU2841528C2 |
| АНТИГЕН, АССОЦИИРОВАННЫЙ С РЕВМАТОИДНЫМ АРТРИТОМ | 2013 |
|
RU2649368C2 |
| СПОСОБ ИНГИБИРОВАНИЯ GMCSFRa У ПАЦИЕНТА | 2012 |
|
RU2639546C2 |
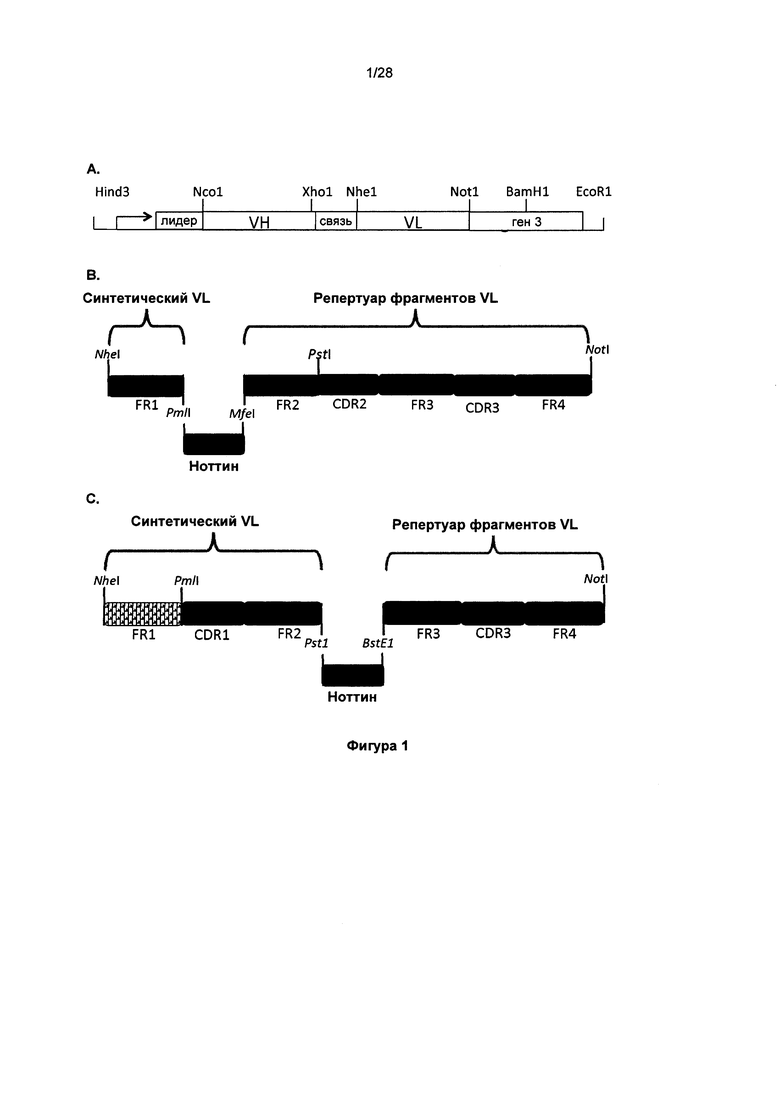




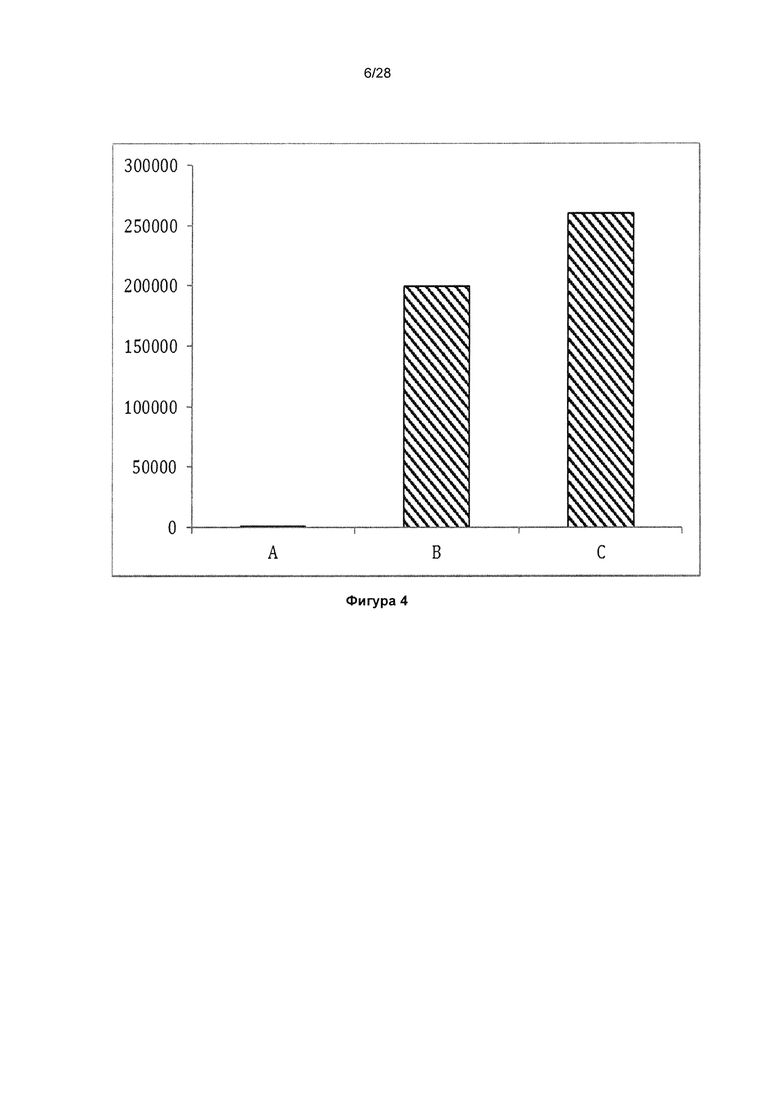

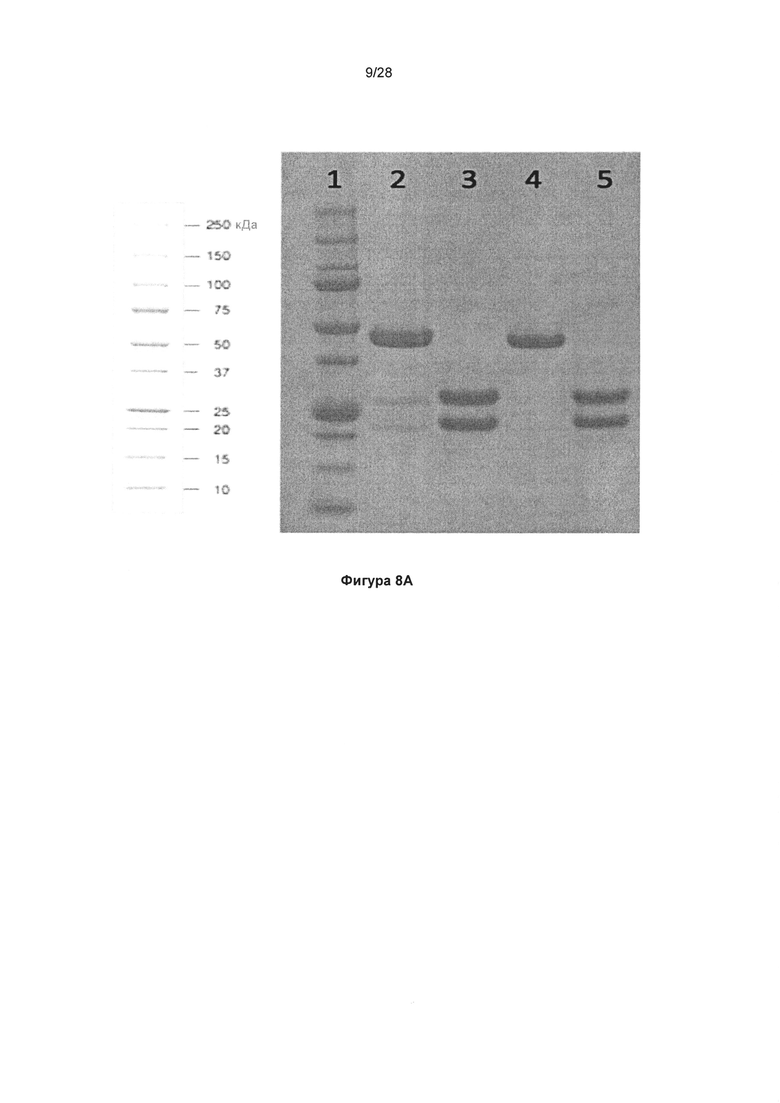
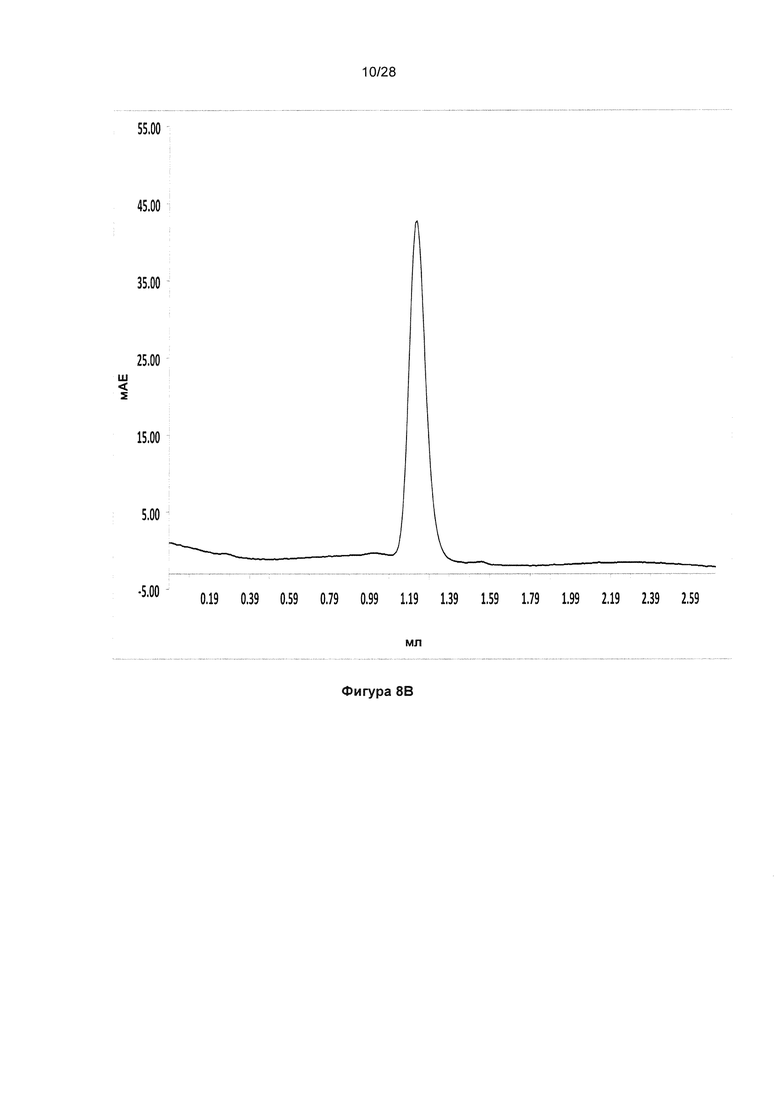
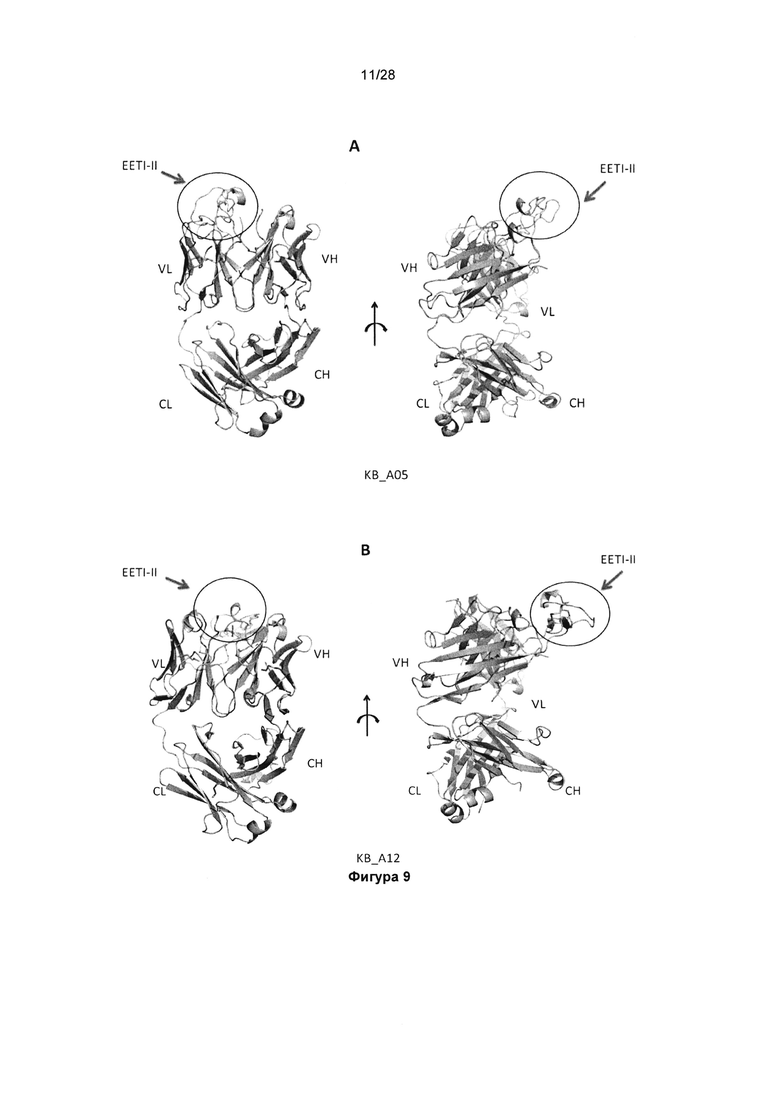
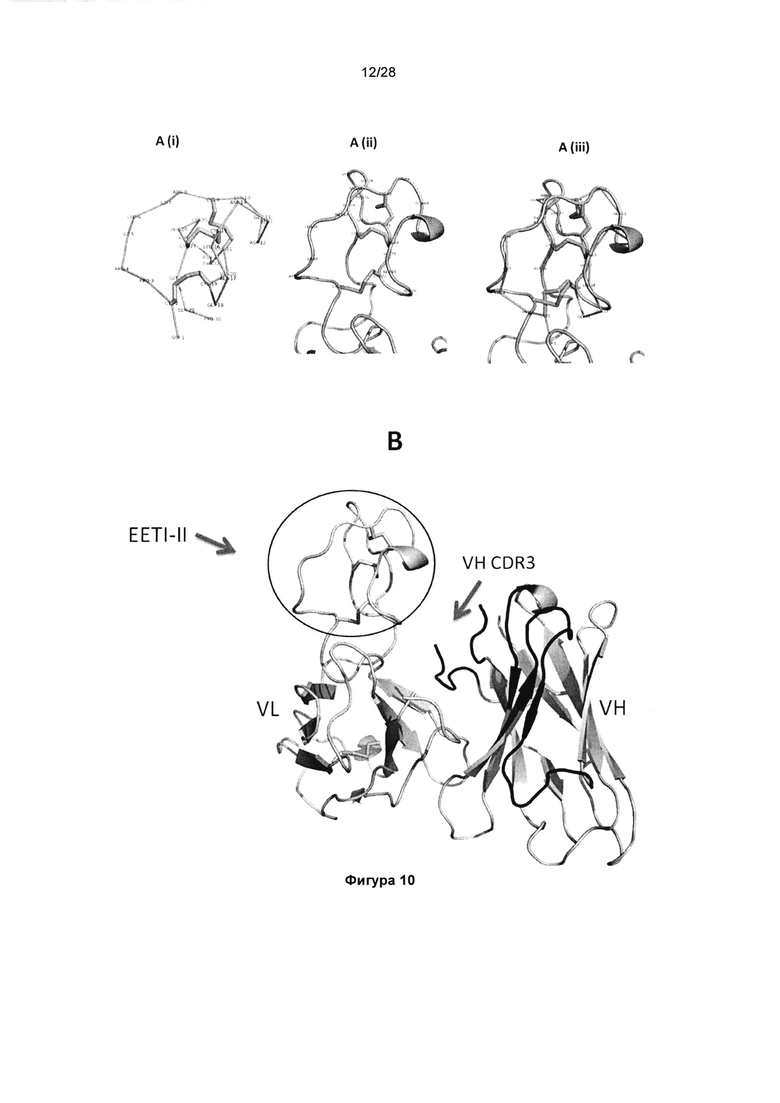
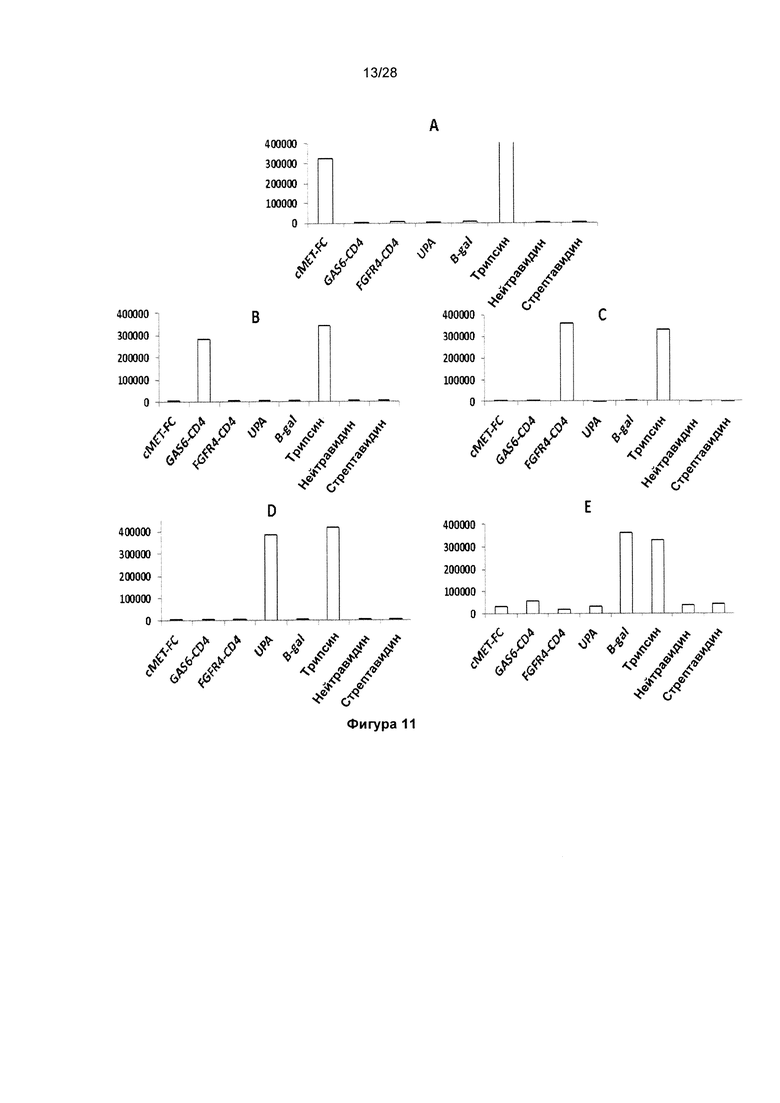
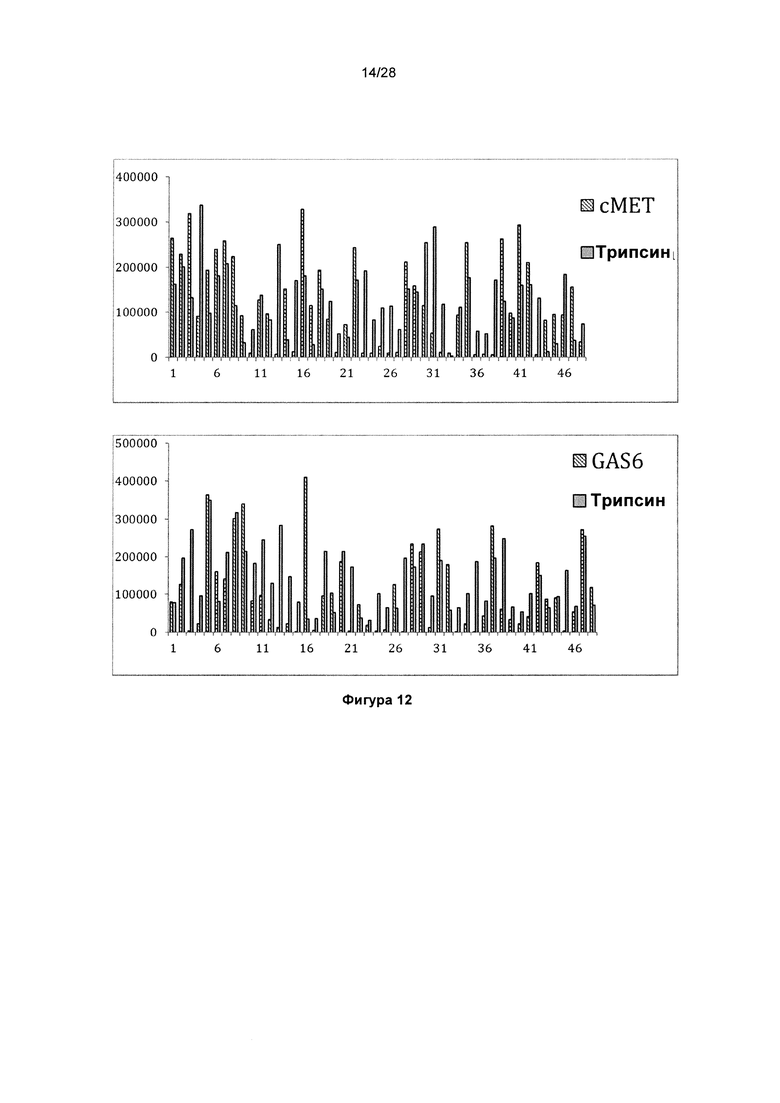
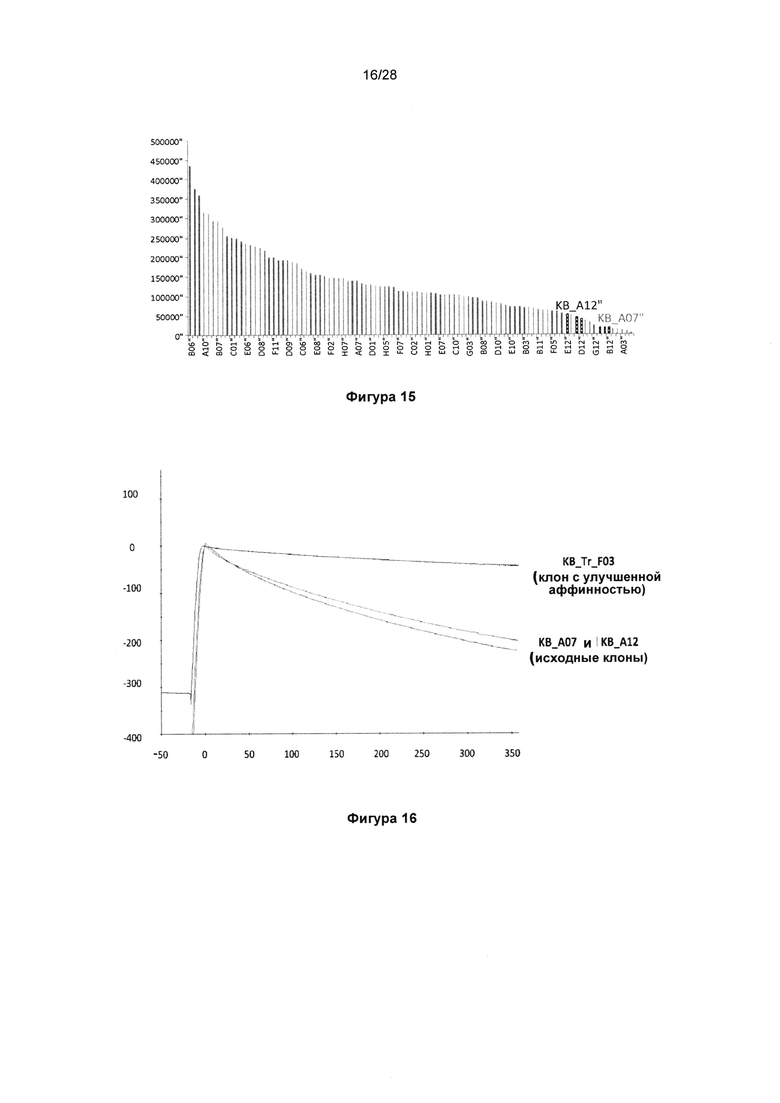
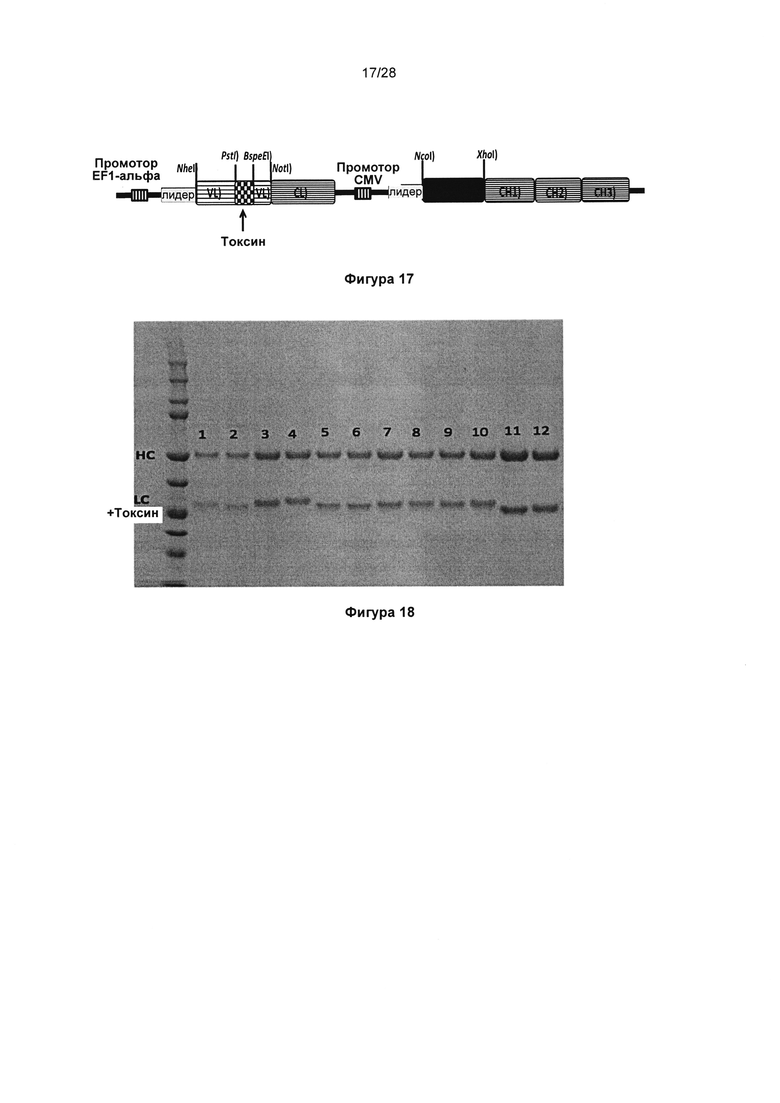
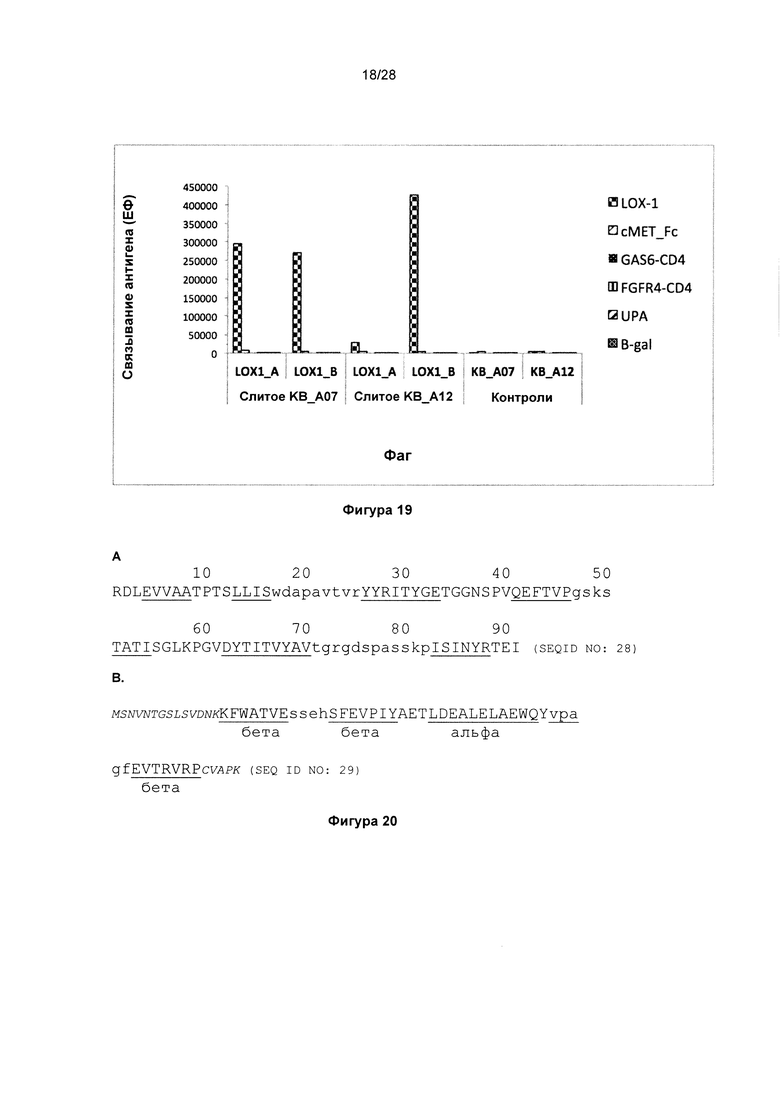
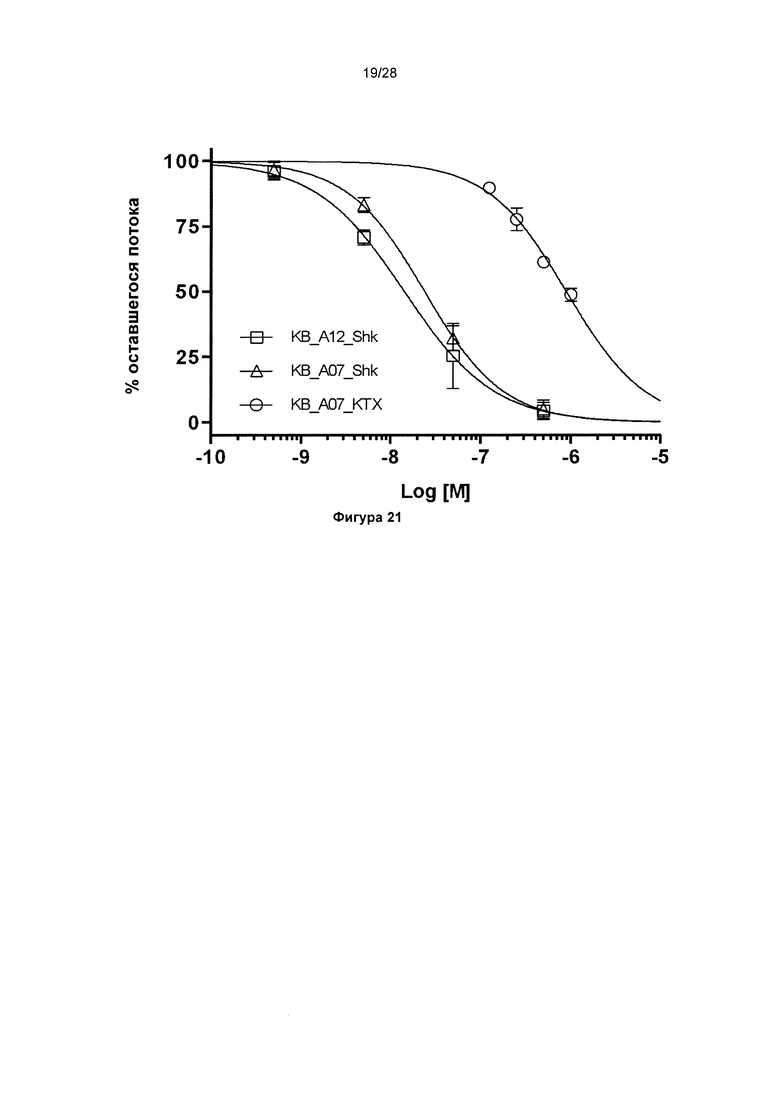
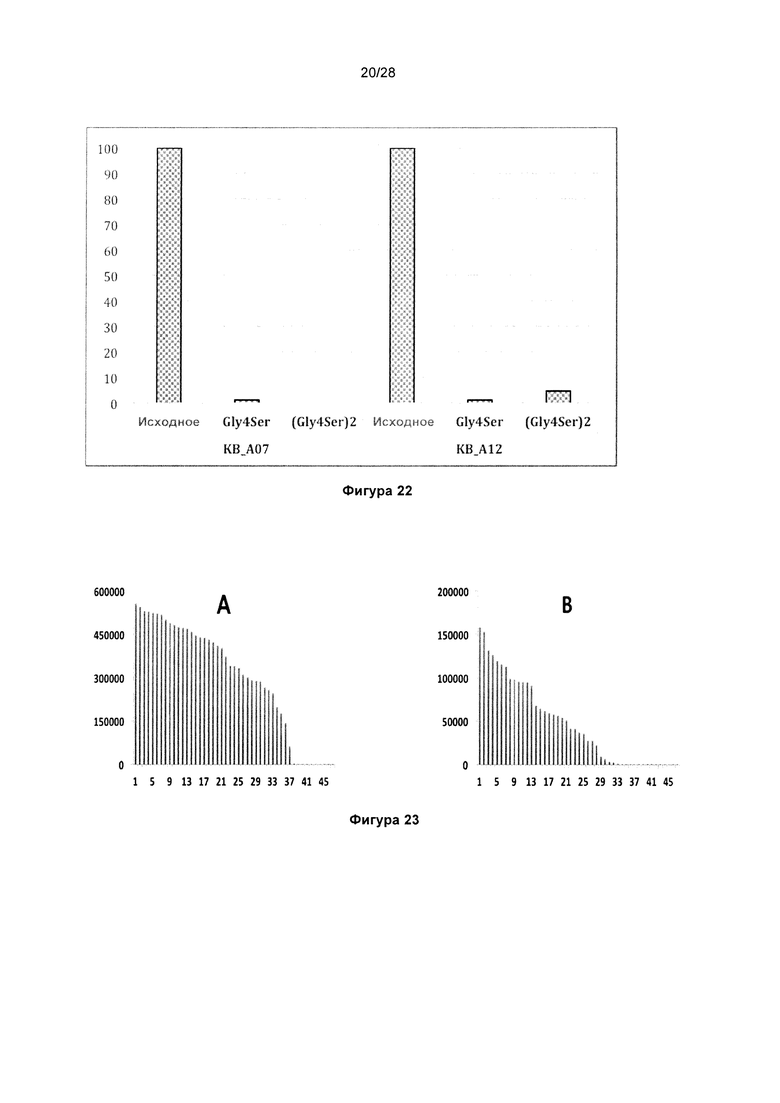
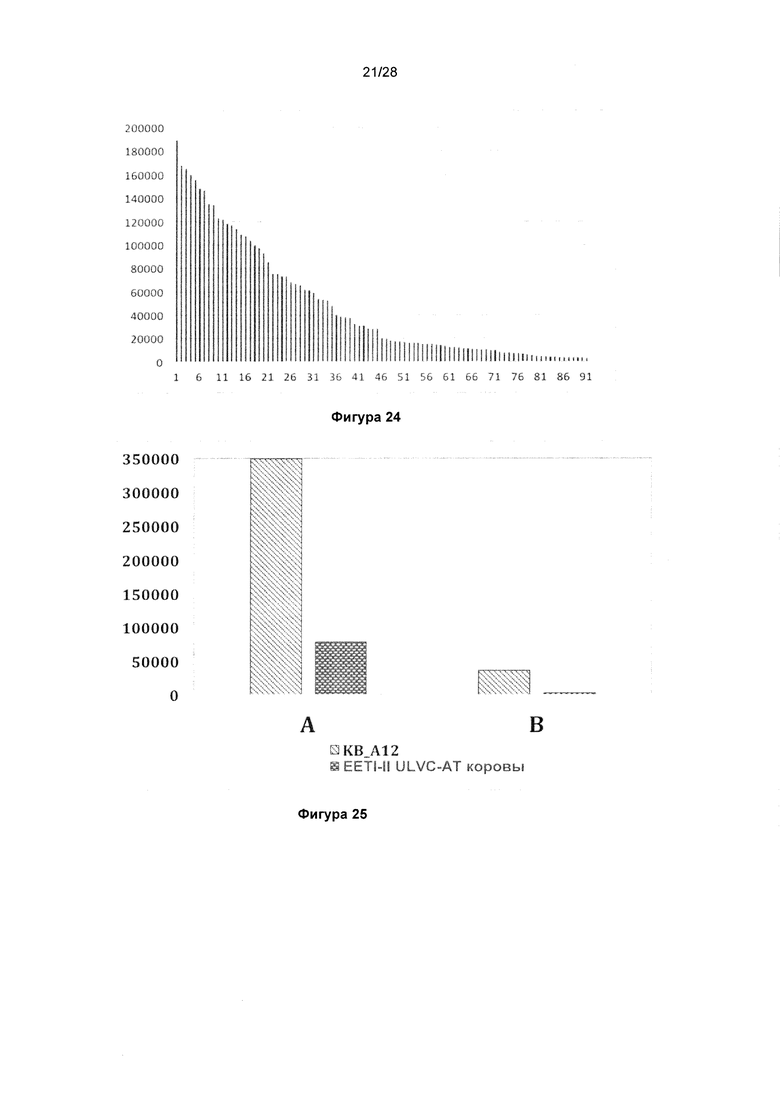
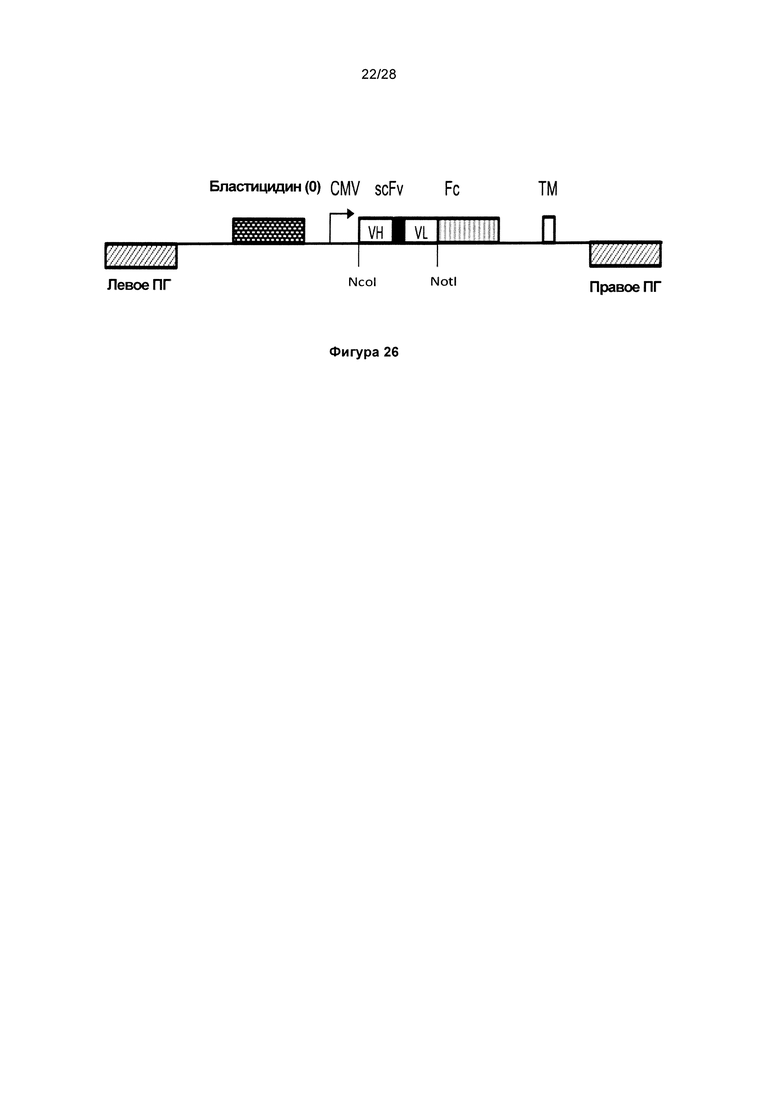
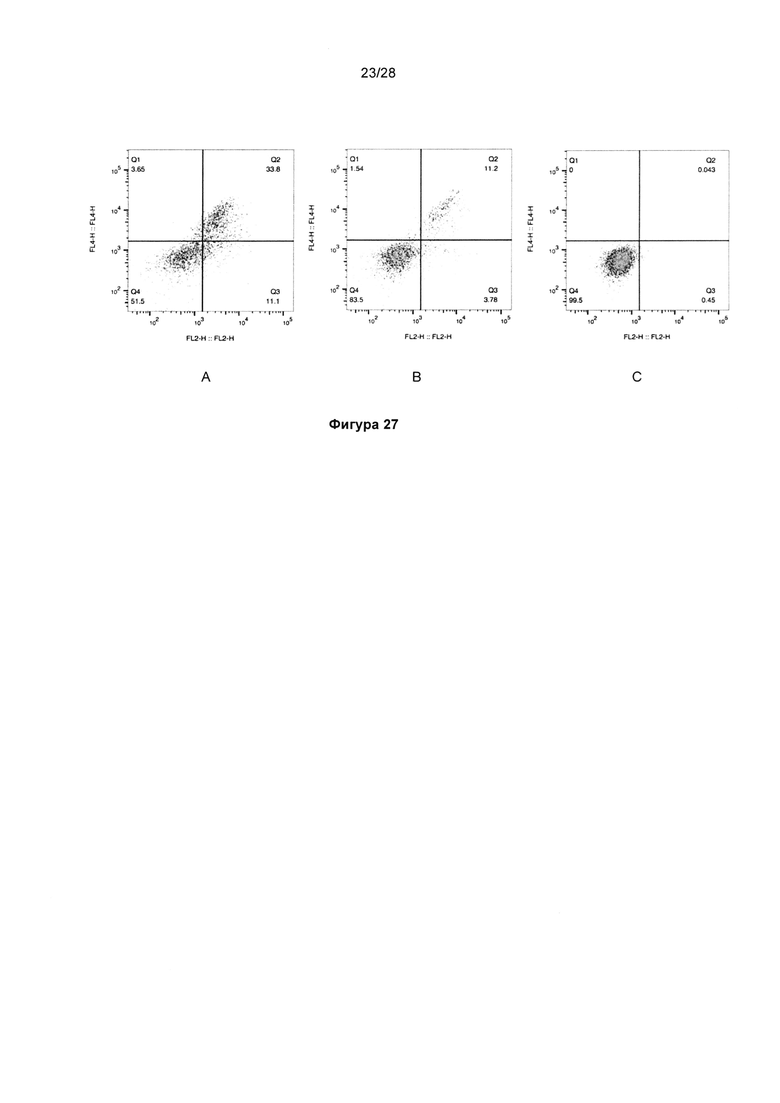



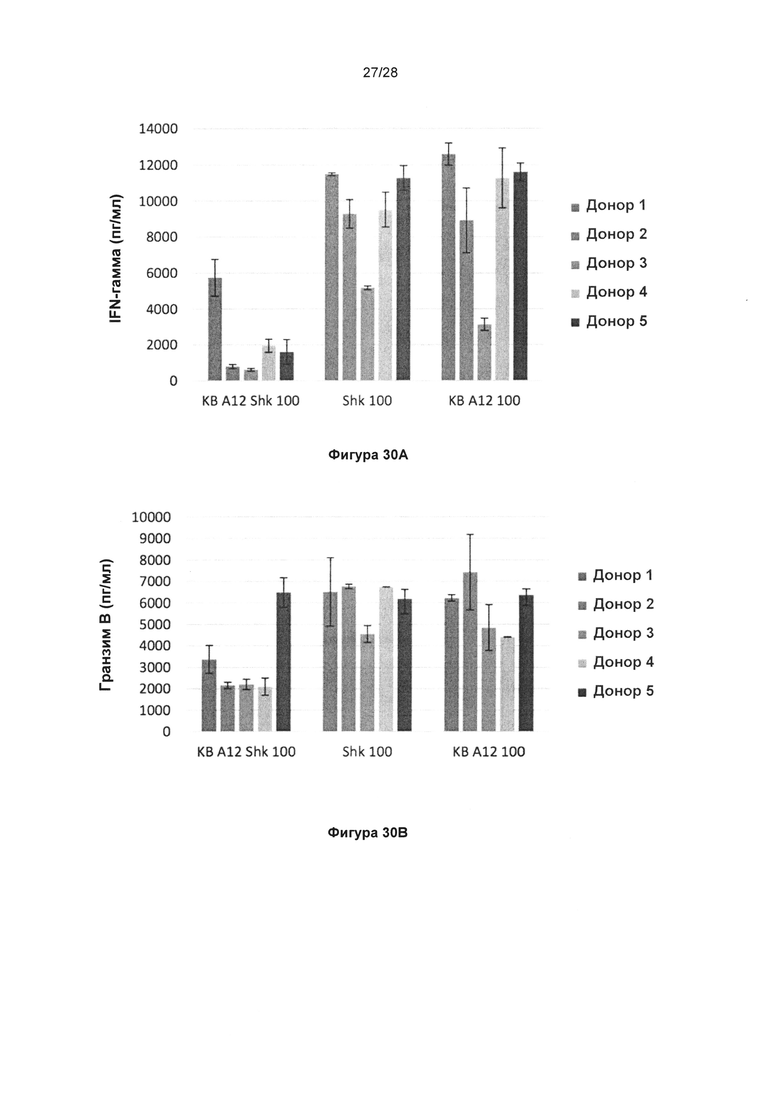
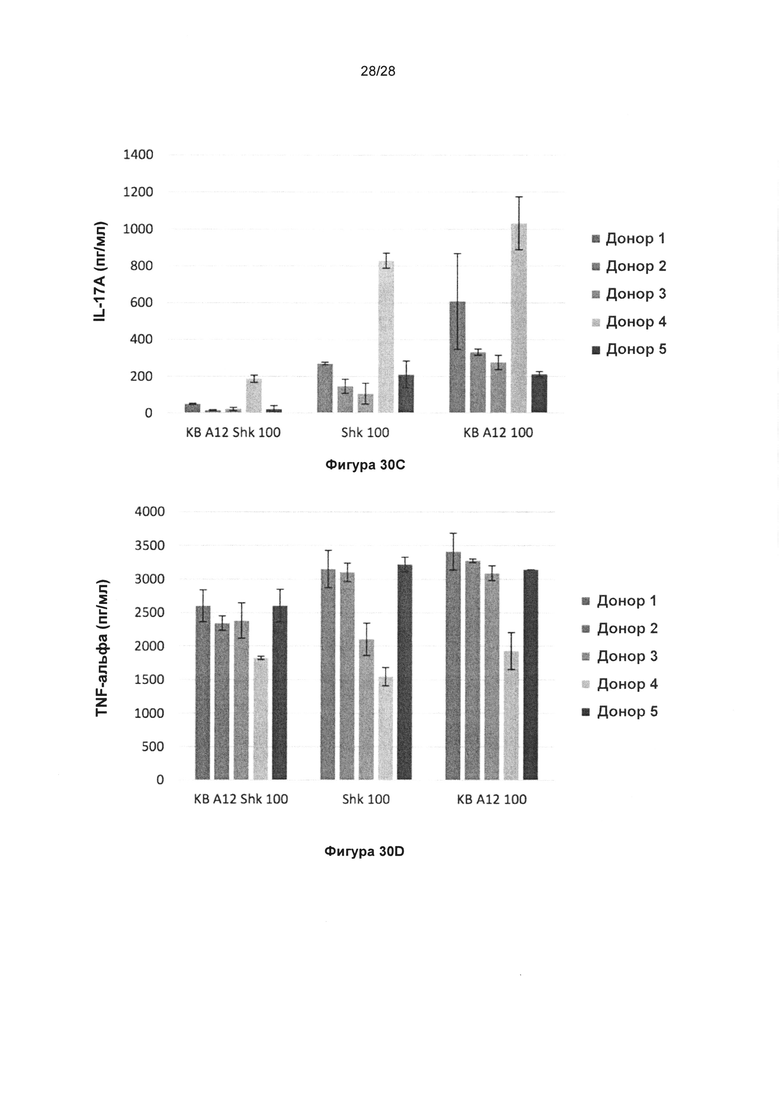
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая способ скрининга, слитый белок для связывания с молекулой-мишенью (варианты), связывающий элемент для связывания с молекулой мишенью, способ получения библиотеки связывающих элементов, библиотеку связывающих элементов и способ получения связывающего элемента. В одном из вариантов реализации способ скрининга включает в себя стадии обеспечения исходной библиотеки связывающих элементов, скрининга исходной библиотеки для выявления связывающих элементов, которые проявляют активность связывания и идентификацию одного или более связывающих элементов в указанной исходной библиотеке, которые проявляют указанную активность связывания. Изобретение расширяет арсенал средств скрининга. 7 н. и 111 з.п. ф-лы, 43 ил., 33 табл., 18 пр.
1. Способ скрининга, включающий:
(i) обеспечение исходной библиотеки связывающих элементов, причем
каждый связывающий элемент в указанной библиотеке представляет собой слитый белок,
при этом указанный слитый белок содержит донорный увеличивающий разнообразие домен остова, встроенный в реципиентный увеличивающий разнообразие домен остова, при этом N- и C-концы донорного увеличивающего разнообразие домена остова связаны с реципиентным увеличивающим разнообразие доменом остова без линкеров или линкерами, состоящими из до 4 аминокислот,
при этом указанный донорный увеличивающий разнообразие домен остова содержит донорный остов и донорную последовательность взаимодействия, и указанный реципиентный увеличивающий разнообразие домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия, и одна, две или все три из донорной последовательности взаимодействия, реципиентной последовательности взаимодействия и линкеров в указанной исходной библиотеке различаются,
при этом указанный донорный увеличивающий разнообразие домен остова представляет собой богатый цистеином пептид, содержащий множественные дисульфидные мостики, образованные остатками цистеина в пределах указанного донорного увеличивающего разнообразие домена остова, причем указанный донорный увеличивающий разнообразие домен остова состоит из 200 или менее аминокислот, и
при этом указанный реципиентный увеличивающий разнообразие домен остова представляет собой домен иммуноглобулина (домен Ig), сконструированный домен Z белка A, сконструированный домен фибронектина, сконструированный белок с анкириновым повтором (DARPin), адгирон, антикалин, домен тиоредоксина или белок гена 2 фага T7 (Gp2),
(ii) скрининг исходной библиотеки для выявления связывающих элементов, которые проявляют активность связывания, при этом указанная активность связывания представляет собой связывание с молекулой-мишенью, и
(iii) идентификацию одного или более связывающих элементов в указанной исходной библиотеке, которые проявляют указанную активность связывания.
2. Способ по п. 1, отличающийся тем, что связывающий элемент в указанной библиотеке представляет собой слитый белок, связанный с доменом-партнером.
3. Способ по п. 1, отличающийся тем, что связывающие элементы в указанной исходной библиотеке содержат разнообразные донорные последовательности взаимодействия и одну и ту же реципиентную последовательность взаимодействия.
4. Способ по п. 1, отличающийся тем, что указанные связывающие элементы в указанной исходной библиотеке содержат разнообразные реципиентные последовательности взаимодействия и одну и ту же донорную последовательность взаимодействия.
5. Способ по п. 1, отличающийся тем, что указанные связывающие элементы в указанной исходной библиотеке содержат разнообразные реципиентные и донорные последовательности взаимодействия.
6. Способ по любому из пп. 1-5, отличающийся тем, что указанные связывающие элементы в указанной исходной библиотеке содержат разнообразные линкерные последовательности.
7. Способ по п. 6, отличающийся тем, что указанные связывающие элементы в указанной исходной библиотеке содержат одинаковые реципиентные и донорные последовательности взаимодействия.
8. Способ по любому из предшествующих пунктов, включающий дополнительно обогащение одного или более связывающих элементов путем:
(a) выделения одного или более связывающих элементов,
(b) проведения селекции выделенных связывающих элементов по активности связывания,
(c) выделения одного или более прошедших селекцию связывающих элементов,
(d) необязательно повторения этапов (b) и (c) один или более раз.
9. Способ по любому из предшествующих пунктов, дополнительно включающий:
(iv) внедрение разнообразных аминокислотных остатков в одно или более положений в последовательности аминокислот одного или более идентифицированных исходных связывающих элементов с получением модифицированной библиотеки связывающих элементов,
(v) скрининг модифицированной библиотеки для выявления модифицированных связывающих элементов, которые проявляют активность связывания, при этом указанная активность связывания представляет собой связывание с молекулой-мишенью, и
(vi) идентификацию одного или более модифицированных связывающих элементов в модифицированной библиотеке, которые проявляют указанную активность связывания.
10. Способ по любому из пп. 1-9, отличающийся тем, что разнообразные аминокислоты внедряют путем неспецифического мутагенеза или сайт-направленного мутагенеза.
11. Способ по п. 9 или 10, отличающийся тем, что указанное одно или более положений находятся в последовательности аминокислот донорного остова, донорной последовательности взаимодействия, реципиентного остова, реципиентной последовательности взаимодействия, линкера или домена-партнера указанных одного или более идентифицированных связывающих элементов.
12. Способ по любому из пп. 9-11, отличающийся тем, что активность связывания одного или более из модифицированных связывающих элементов улучшена по сравнению с одним или более исходными связывающими элементами, идентифицированными на этапе (iii).
13. Способ по любому из пп. 9-12, включающий дополнительно обогащение одного или более связывающих элементов путем:
(e) выделения одного или более модифицированных связывающих элементов,
(f) проведения селекции выделенных модифицированных связывающих элементов по активности связывания,
(g) выделения одного или более прошедших селекцию модифицированных связывающих элементов и
(h) необязательно повторения этапов (f) и (g) один или более раз.
14. Способ по любому из предшествующих пунктов, включающий замену донорного увеличивающего разнообразие домена остова в указанных одном или более идентифицированных связывающих элементах или модифицированных связывающих элементах на замещающий донорный увеличивающий разнообразие домен остова.
15. Способ по п. 14, отличающийся тем, что указанный донорный увеличивающий разнообразие домен остова и заменяющий донорный увеличивающий разнообразие домен остова содержат остовы одинакового класса.
16. Способ по п. 15, отличающийся тем, что указанный донорный увеличивающий разнообразие домен остова и указанный заменяющий донорный увеличивающий разнообразие домен остова содержат одинаковый донорный остов и различные донорные последовательности взаимодействия.
17. Способ по п. 15 или 16, отличающийся тем, что как указанный донорный увеличивающий разнообразие домен остова, так и указанный заменяющий донорный увеличивающий разнообразие домен остова представляют собой ноттины.
18. Способ по п. 15, отличающийся тем, что указанный донорный увеличивающий разнообразие остов и указанный заменяющий донорный увеличивающий разнообразие остов содержат различные донорные остовы и различные донорные последовательности взаимодействия.
19. Способ по любому из пп. 14-18, отличающийся тем, что указанный заменяющий донорный увеличивающий разнообразие остов содержит увеличивающую разнообразие донорную последовательность взаимодействия.
20. Способ по любому из предшествующих пунктов, включающий:
(vii) соединение слитого белка из одного или более идентифицированных связывающих элементов или модифицированных связывающих элементов с разнообразной популяцией партнеров по связыванию с получением перетасованной библиотеки связывающих элементов,
(viii) скрининг указанной перетасованной библиотеки для выявления перетасованных связывающих элементов, которые проявляют активность связывания, при этом указанная активность связывания представляет собой связывание с молекулой-мишенью,
(ix) идентификацию одного или более перетасованных связывающих элементов, которые проявляют указанную активность связывания.
21. Способ по п. 20, включающий дополнительно обогащение указанных одного или более перетасованных связывающих элементов путем:
(i) выделения одного или более перетасованных связывающих элементов,
(j) проведения селекции указанных выделенных перетасованных связывающих элементов по активности связывания,
(k) выделения одного или более прошедших селекцию модифицированных связывающих элементов, и
(l) необязательно повторения этапов (j) и (k) один или более раз.
22. Способ по п. 20 или 21, отличающийся тем, что активность связывания перетасованных связывающих элементов улучшена по сравнению с одним или более связывающими элементами, идентифицированными на этапе (iii) и/или этапе (vi).
23. Способ по любому из предшествующих пунктов, включающий встраивание дополнительной последовательности аминокислот в слитые белки или домены-партнеры указанных одного или более идентифицированных связывающих элементов из исходной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки.
24. Способ по п. 23, отличающийся тем, что указанная дополнительная последовательность аминокислот представляет собой последовательность, связывающую мишень.
25. Способ по любому из предшествующих пунктов, отличающийся тем, что как указанный донорный, так и указанный реципиентный увеличивающие разнообразие остовы слитого белка вносят вклад в активность связывания указанного слитого белка.
26. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный связывающий элемент представляет собой антагонист или ингибитор молекулы-мишени.
27. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный связывающий элемент представляет собой агонист, энхансер или активатор молекулы-мишени.
28. Способ по любому из предшествующих пунктов, отличающийся тем, что один из указанного донорного увеличивающего разнообразие домена остова, реципиентного увеличивающего разнообразие домена остова и домена-партнера связывается с молекулой-мишенью и указанный способ включает модификацию или замену указанного донорного увеличивающего разнообразие домена остова, реципиентного увеличивающего разнообразие домена остова или домена-партнера в указанных одном или более идентифицированных связывающих элементах.
29. Способ по любому из предшествующих пунктов, отличающийся тем, что указанную исходную библиотеку, модифицированную библиотеку или перетасованную библиотеку подвергают скринингу путем определения связывания указанных связывающих элементов в указанной библиотеке с молекулой-мишенью, при этом одна из молекулы-мишени и исходной библиотеки, модифицированной библиотеки или перетасованной библиотеки иммобилизована.
30. Способ по любому из пп. 1-29, отличающийся тем, что указанную исходную библиотеку, модифицированную библиотеку или перетасованную библиотеку подвергают скринингу путем экспрессии указанной библиотеки в репортерных клетках и идентификации одной или более репортерных клеток с измененным фенотипом.
31. Способ по п. 29 или 30, отличающийся тем, что связывание с молекулой-мишенью или измененный фенотип детектируют методом проточной цитометрии, иммуногистохимии или твердофазного иммуноферментного анализа (ELISA).
32. Способ по любому из предшествующих пунктов, дополнительно включающий проведение селекции указанных одного или более идентифицированных связывающих элементов по стабильности.
33. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный способ включает проведение селекции исходной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки для выявления связывающих элементов, в которых донорный увеличивающий разнообразие остов и/или реципиентный увеличивающий разнообразие остов принимают активные конформации.
34. Способ по п. 33, отличающийся тем, что указанный реципиентный увеличивающий разнообразие домен остова представляет собой последовательность иммуноглобулина и указанный способ дополнительно включает скрининг указанной библиотеки с применением связывающей иммуноглобулин молекулы.
35. Способ по п. 34, отличающийся тем, что указанная связывающая иммуноглобулин молекула представляет собой белок L, белок A или антитело к Ig или фрагмент антитела к Ig.
36. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный способ включает выделение и/или очистку указанных одного или более идентифицированных связывающих элементов из указанной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки.
37. Способ по любому из предшествующих пунктов, отличающийся тем, что указанные связывающие элементы в указанной библиотеке представлены на поверхности рибосомы, клетки или вируса, которые содержат нуклеиновую кислоту, кодирующую указанный связывающий элемент.
38. Способ по п. 37, отличающийся тем, что указанный способ включает выделение и/или очистку рибосомы, клетки или вируса, на которых представлены указанные один или более идентифицированные связывающие элементы из указанной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки.
39. Способ по п. 37 или 38, отличающийся тем, что указанный способ включает выделение и/или очистку нуклеиновой кислоты, кодирующей указанные один или более идентифицированные связывающие элементы из указанной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки.
40. Способ по любому из пп. 37-39, отличающийся тем, что указанный способ включает амплификацию и/или клонирование нуклеиновой кислоты, кодирующей указанные один или более идентифицированные связывающие элементы из указанной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки.
41. Способ по любому из пп. 37-40, отличающийся тем, что указанный способ включает секвенирование нуклеиновой кислоты, кодирующей указанные один или более идентифицированные связывающие элементы из указанной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки.
42. Способ по любому из предшествующих пунктов, включающий синтез или рекомбинантную экспрессию одного или более идентифицированных связывающих элементов из указанной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки.
43. Способ по любому из предшествующих пунктов, включающий определение влияния одного или более связывающих элементов, идентифицированных из указанной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки на активность молекулы-мишени.
44. Способ по п. 43, отличающийся тем, что молекула-мишень представляет собой ионный канал и определяют влияние указанных одного или более идентифицированных связывающих элементов на поток ионов через указанный канал.
45. Способ по любому из пп. 1-44, включающий синтез или рекомбинантную экспрессию выделенного донорного увеличивающего разнообразие домена остова из одного или более идентифицированных связывающих элементов из исходной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки.
46. Способ по любому из пп. 1-45, включающий изменение формата одного или более из обнаруженных связывающих элементов на scFv, Fab, scFv-Fc, Fc, IgA, IgD, IgM или IgG.
47. Способ по любому из предшествующих пунктов, включающий присоединение терапевтической молекулы, молекулы, продлевающей время полужизни, или детектируемой метки к указанным одному или более идентифицированным связывающим элементам.
48. Способ по любому из предшествующих пунктов, включающий получение композиции указанных одного или более идентифицированных связывающих элементов из исходной библиотеки, модифицированной библиотеки и/или перетасованной библиотеки или выделенного донорного увеличивающего разнообразие домена остова с фармацевтически приемлемым вспомогательным веществом.
49. Слитый белок для связывания с молекулой-мишенью, при этом указанный слитый белок содержит донорный увеличивающий разнообразие домен остова, встроенный в реципиентный увеличивающий разнообразие домен остова, при этом указанный донорный увеличивающий разнообразие домен остова содержит донорный остов и донорную последовательность взаимодействия, и указанный реципиентный увеличивающий разнообразие домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия,
при этом N- и C-концы донорного увеличивающего разнообразие домена остова связаны с реципиентным увеличивающим разнообразие доменом остова без линкера или линкерами, состоящими из до 4 аминокислот;
при этом указанный донорный увеличивающий разнообразие домен остова представляет собой богатый цистеином пептид, содержащий множественные дисульфидные мостики, образованные остатками цистеина в пределах указанного донорного увеличивающего разнообразие домена остова, причем указанный донорный увеличивающий разнообразие домен остова состоит из 200 или менее аминокислот, и
при этом указанный реципиентный увеличивающий разнообразие домен остова представляет собой домен иммуноглобулина (домен Ig), сконструированный домен Z белка A, сконструированный домен фибронектина, сконструированный белок с анкириновым повтором (DARPin), адгирон, антикалин, домен тиоредоксина или белок гена 2 фага T7 (Gp2).
50. Слитый белок для связывания с молекулой-мишенью, при этом указанный слитый белок содержит донорный увеличивающий разнообразие домен остова, встроенный в реципиентный увеличивающий разнообразие домен остова,
при этом указанный донорный увеличивающий разнообразие домен остова содержит донорный остов и донорную последовательность взаимодействия и указанный реципиентный увеличивающий разнообразие домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия,
при этом указанный донорный увеличивающий разнообразие домен остова представляет собой богатый цистеином пептид, содержащий множественные дисульфидные мостики, образованные остатками цистеина в пределах указанного донорного увеличивающего разнообразие домена остова, причем указанный донорный увеличивающий разнообразие домен остова состоит из 200 или менее аминокислот,
и при этом указанный реципиентный увеличивающий разнообразие домен остова представляет собой:
- вариабельный домен легкой цепи антитела (VL), при этом указанный донорный увеличивающий разнообразие домен остова заменяет все или часть CDR1, CDR2 или CDR3 указанного вариабельного домена легкой цепи антитела (VL);
- вариабельный домен тяжелой цепи антитела (VH), при этом указанный донорный увеличивающий разнообразие домен остова заменяет все или часть CDR1 или CDR2 указанного вариабельного домена тяжелой цепи антитела (VH);
- константный домен антитела; или
- иммуноглобулиновый домен Т-клеточного рецептора.
51. Слитый белок по п. 50, отличающийся тем, что указанный реципиентный увеличивающий разнообразие домен остова представляет собой вариабельный домен легкой цепи антитела (VL), при этом указанный донорный увеличивающий разнообразие домен остова заменяет все или часть CDR1 или CDR2 указанного вариабельного домена легкой цепи антитела (VL).
52. Слитый белок по любому из пп. 49-51, отличающийся тем, что указанные последовательности взаимодействия донорных и реципиентных увеличивающих разнообразие доменов остова взаимодействуют с одним и тем же эпитопом на молекуле-мишени.
53. Слитый белок по любому из пп. 49-52, отличающийся тем, что указанная молекула-мишень представляет собой интегральный мембранный белок.
54. Слитый белок по п. 53, отличающийся тем, что указанный интегральный мембранный белок представляет собой ионный канал, рецептор, сопряженный с G-белком, или рецептор I типа.
55. Слитый белок по любому из пп. 49-54, отличающийся тем, что указанный донорный увеличивающий разнообразие домен остова замещает всю или часть последовательности петли указанного реципиентного увеличивающего разнообразие домена остова.
56. Слитый белок по любому из пп. 49-55, отличающийся тем, что указанный реципиентный увеличивающий разнообразие домен остова представляет собой полноразмерный иммуноглобулин или часть иммуноглобулина.
57. Слитый белок по любому из пп. 49-56, отличающийся тем, что указанный реципиентный увеличивающий разнообразие домен остова представляет собой домен Ig.
58. Слитый белок по п. 57, отличающийся тем, что указанный домен Ig представляет собой вариабельный домен антитела, домен Т-клеточного рецептора (TCR) или константный домен антитела.
59. Слитый белок по п. 56, отличающийся тем, что указанный реципиентный увеличивающий разнообразие домен остова представляет собой полноразмерный вариабельный домен антитела или часть вариабельного домена антитела.
60. Слитый белок по п. 59, отличающийся тем, что указанный реципиентный увеличивающий разнообразие домен остова представляет собой вариабельный домен легкой цепи (VL) антитела.
61. Слитый белок по п. 60, отличающийся тем, что указанный вариабельный домен легкой цепи (VL) антитела содержит последовательность аминокислот SEQ ID NO: 270 или ее вариант.
62. Слитый белок по п. 59, отличающийся тем, что указанный реципиентный увеличивающий разнообразие домен остова представляет собой вариабельный домен тяжелой цепи (VH) антитела.
63. Слитый белок по любому из пп. 57-62, отличающийся тем, что указанный донорный увеличивающий разнообразие домен остова заменяет весь или часть CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL или CDR3 VL вариабельного домена антитела.
64. Слитый белок по любому из пп. 57-63, отличающийся тем, что домен Ig представляет собой однодоменное антитело.
65. Слитый белок по любому из пп. 57-63, отличающийся тем, что последовательность взаимодействия указанного донорного увеличивающего разнообразие домена остова и одного или более CDR вариабельного домена антитела взаимодействуют с одним и тем же эпитопом на молекуле-мишени.
66. Слитый белок по п. 65, отличающийся тем, что последовательность взаимодействия донорного увеличивающего разнообразие домена остова и CDR3 вариабельного домена антитела взаимодействуют с одним и тем же эпитопом на молекуле-мишени.
67. Слитый белок по любому из пп. 49-66, отличающийся тем, что указанный донорный увеличивающий разнообразие домен остова состоит из по меньшей мере 15 аминокислот, предпочтительно из по меньшей мере 20 аминокислот.
68. Слитый белок по любому из пп. 49-67, отличающийся тем, что указанный донорный увеличивающий разнообразие домен остова представляет собой пептид, модулирующий ионные каналы, пептид токсина яда или ноттин.
69. Слитый белок по п. 68, отличающийся тем, что указанный донорный увеличивающий разнообразие домен остова представляет собой пептид яда.
70. Слитый белок по п. 68 или 69, отличающийся тем, что указанный донорный увеличивающий разнообразие домен остова представляет собой ноттин.
71. Слитый белок по п. 70, отличающийся тем, что ноттин представляет собой ингибитор трипсина-II Ecballium elaterium (EETI-II), MCoTI-II, хьювентоксин-IV (Huwentoxin-IV), ProTx-II, SSm6a, калиотоксин, MoKa-1, Shk, PcTx1 и конотоксин-ω или их вариант.
72. Слитый белок по любому из пп. 66-71, отличающийся тем, что нативные N- и C-концы указанного донорного увеличивающего разнообразие домена остова связаны с указанным реципиентным увеличивающим разнообразие доменом остова.
73. Слитый белок по п. 72, отличающийся тем, что ноттин включает последовательность аминокислот с любой из последовательностей SEQ ID NO: 211 - 233, SEQ ID NO: 234 - 244 или SEQ ID NO: 342 или ее вариант.
74. Слитый белок по любому из пп. 66-73, отличающийся тем, что реципиентный увеличивающий разнообразие домен остова содержит последовательность аминокислот реципиентного связывающего домена согласно любой из последовательностей SEQ ID NO: 84 - 139 и необязательно линкер содержит последовательность аминокислот линкера согласно любой из последовательностей SEQ ID NO: 84 - 139.
75. Слитый белок по любому из пп. 72-74, отличающийся тем, что слитый белок содержит последовательность аминокислот с любой из последовательностей SEQ ID NO: 84 – 139 или SEQ ID NO: 31 – 35 или ее вариант.
76. Слитый белок по любому из пп. 66-71, отличающийся тем, что искусственные N- и C-концы, полученные путем циклизации и линеаризации указанного донорного увеличивающего разнообразие домена остова, связаны с указанным реципиентным увеличивающим разнообразие доменом остова.
77. Слитый белок по п. 76, отличающийся тем, что указанный донорный увеличивающий разнообразие домен остова представляет собой ноттин, содержащий последовательность аминокислот с любой из последовательностей SEQ ID NO: 302-307 или ее вариант.
78. Слитый белок по п. 76 или 77, отличающийся тем, что указанный слитый белок содержит последовательность аминокислот с любой из последовательностей SEQ ID NO: 308 – 317, SEQ ID NO: 349 или 351 или ее вариант.
79. Слитый белок по любому из пп. 49-78, который слит или конъюгирован с токсином, терапевтической молекулой, молекулой, продлевающей время полужизни, или детектируемой меткой.
80. Связывающий элемент для связывания с молекулой-мишенью, содержащий
(i) cлитый белок по любому из пп. 49-79 и
(ii) домен-партнер.
81. Связывающий элемент по п. 80, отличающийся тем, что у указанного связывающего элемента или слитого белка увеличено время полужизни in vivo по сравнению с выделенным донорным увеличивающим разнообразие доменом остова.
82. Связывающий элемент по любому из пп. 80, 81, отличающийся тем, что указанный слитый белок связан с доменом-партнером посредством ковалентной или нековалентной связи.
83. Связывающий элемент по п. 82, отличающийся тем, что реципиентный увеличивающий разнообразие домен остова слитого белка связан с доменом-партнером.
84. Связывающий элемент по п. 82, отличающийся тем, что донорный увеличивающий разнообразие домен остова слитого белка связан с доменом-партнером.
85. Связывающий элемент по любому из пп. 80-84, отличающийся тем, что указанный связывающий элемент является гетеродимерным.
86. Связывающий элемент согласно любому из пп. 80-85, отличающийся тем, что указанный связывающий элемент содержит множество доменов-партнеров.
87. Связывающий элемент по п. 86, отличающийся тем, что указанный связывающий элемент является мультимерным.
88. Связывающий элемент по любому из пп. 80-87, отличающийся тем, что указанные слитый белок и домен-партнер связываются с одной и той же молекулой-мишенью.
89. Связывающий элемент по любому из пп. 80-88, отличающийся тем, что указанный связывающий элемент связывается с первой молекулой-мишенью и второй молекулой-мишенью.
90. Связывающий элемент по любому из пп. 80-89, отличающийся тем, что один из слитого белка и домена-партнера связывается с указанной первой молекулой-мишенью и другой из слитого белка и домена-партнера связывается с указанной второй молекулой-мишенью.
91. Связывающий элемент по п. 89 или 90, отличающийся тем, что указанные молекулы-мишени находятся на поверхности одной и той же клетки.
92. Связывающий элемент по п. 91, отличающийся тем, что связывание связывающего элемента с указанной первой молекулой-мишенью повышено за счет связывания связывающего элемента с указанной второй молекулой-мишенью.
93. Связывающий элемент по любому из пп. 89-92, отличающийся тем, что указанная первая молекула-мишень представляет собой рецептор гематоэнцефалического барьера или рецептор барьера кровь-нейрон.
94. Связывающий элемент по любому из пп. 80-93, отличающийся тем, что указанный домен-партнер представляет собой вариабельный домен тяжелой цепи (VH) антитела.
95. Связывающий элемент по п. 94, отличающийся тем, что указанный вариабельный домен тяжелой цепи (VH) антитела имеет последовательность аминокислот SEQ ID NO: 249, SEQ ID NO: 250, SEQ ID NO: 251, SEQ ID NO: 252, SEQ ID NO: 253, SEQ ID NO: 254, SEQ ID NO: 255, SEQ ID NO: 256 или SEQ ID NO: 257 или ее вариант.
96. Связывающий элемент по любому из пп. 80-93, отличающийся тем, что указанный домен-партнер представляет собой вариабельный домен легкой цепи (VL) антитела.
97. Связывающий элемент по п. 94 или 96, отличающийся тем, что указанные домен VL и домен VH соединены с помощью гибкого линкера.
98. Связывающий элемент по п. 96, отличающийся тем, что указанный донорный увеличивающий разнообразие домен остова заменяет весь или часть CDR1 или CDR2 домена VL антитела.
99. Связывающий элемент по п. 80, отличающийся тем, что указанный слитый белок содержит последовательность аминокислот с любой из последовательностей SEQ ID NO: 84 – 139 или SEQ ID NO: 31 – 35 или ее вариант, или тем, что указанный слитый белок содержит последовательность аминокислот с любой из последовательностей SEQ ID NO: 308 – 317, SEQ ID NO: 349 или 351 или ее вариант, при этом указанный связывающий элемент включает домен-партнер, указанный домен-партнер представляет собой домен VH.
100. Связывающий элемент по любому из пп. 80-99, который слит или конъюгирован с токсином, терапевтической молекулой, молекулой, продлевающей время полужизни, или детектируемой меткой.
101. Способ получения библиотеки связывающих элементов, включающий:
(i) обеспечение популяции нуклеиновых кислот, кодирующих разнообразную популяцию слитых белков, содержащих донорный увеличивающий разнообразие домен остова, встроенный в реципиентный увеличивающий разнообразие домен остова,
при этом указанный донорный увеличивающий разнообразие домен остова содержит донорный остов и донорную последовательность взаимодействия и указанный реципиентный увеличивающий разнообразие домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия, при этом N- и C-концы указанного донорного увеличивающего разнообразие домена остова связаны с указанным реципиентным увеличивающим разнообразие доменом остова без линкера или линкерами, состоящими из до 4 аминокислот, и одна, две или все три из указанной донорной последовательности взаимодействия, реципиентной последовательности взаимодействия и линкеров в указанной популяции различаются,
при этом указанный донорный увеличивающий разнообразие домен остова представляет собой богатый цистеином пептид, содержащий множественные дисульфидные мостики, образованные остатками цистеина в пределах указанного донорного увеличивающего разнообразие домена остова, причем указанный донорный увеличивающий разнообразие домен остова состоит из 200 или менее аминокислот, и
при этом указанный реципиентный увеличивающий разнообразие домен остова представляет собой домен иммуноглобулина (домен Ig), сконструированный домен Z белка A, сконструированный домен фибронектина, сконструированный белок с анкириновым повтором (DARPin), адгирон, антикалин, домен тиоредоксина или белок гена 2 фага T7 (Gp2), и
(ii) экспрессию указанной популяции нуклеиновых кислот с получением имеющей разнообразие популяции с получением тем самым библиотеки связывающих элементов.
102. Способ по п. 101, дополнительно включающий соединение указанных слитых белков, полученных на стадии (II), с популяцией доменов-партнеров.
103. Способ по п. 101, отличающийся тем, что указанные нуклеиновые кислоты экспрессируются в клетке или бесклеточной рибосоме.
104. Способ по п. 103, отличающийся тем, что указанная клетка представляет собой прокариотическую клетку.
105. Способ по п. 103, отличающийся тем, что указанная клетка представляет собой эукариотическую клетку.
106. Способ по п. 105, отличающийся тем, что указанная эукариотическая клетка представляет собой клетку растения, дрожжей, насекомого или млекопитающего.
107. Библиотека связывающих элементов, содержащая
имеющую разнообразие популяцию слитых белков, содержащих донорный увеличивающий разнообразие домен остова, встроенный в реципиентный увеличивающий разнообразие домен остова,
при этом указанный донорный увеличивающий разнообразие домен остова содержит донорный остов и донорную последовательность взаимодействия и указанный реципиентный увеличивающий разнообразие домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия, при этом N- и C-концы донорного увеличивающего разнообразие домена остова связаны с реципиентным увеличивающим разнообразие доменом остова без линкера или линкерами, состоящими из до 4 аминокислот,
при этом указанный донорный увеличивающий разнообразие домен остова представляет собой богатый цистеином пептид, содержащий множественные дисульфидные мостики, образованные остатками цистеина в пределах указанного донорного увеличивающего разнообразие домена остова, причем указанный донорный увеличивающий разнообразие домен остова состоит из 200 или менее аминокислот, и
при этом указанный реципиентный увеличивающий разнообразие домен остова представляет собой домен иммуноглобулина (домен Ig), сконструированный домен Z белка A, сконструированный домен фибронектина, сконструированный белок с анкириновым повтором (DARPin), адгирон, антикалин, домен тиоредоксина или белок гена 2 фага T7 (Gp2),
и при этом одна, две или все три из донорной последовательности взаимодействия, реципиентной последовательности взаимодействия и линкеров в указанной популяции различаются.
108. Библиотека связывающих элементов по п. 107, отличающаяся тем, что указанные слитые белки связаны с партнерами по связыванию с образованием гетеродимеров.
109. Библиотека по п. 107 или 108, отличающаяся тем, что указанные связывающие элементы в указанной библиотеке содержат:
(i) разнообразные донорные последовательности взаимодействия и одну и ту же реципиентную последовательность взаимодействия,
(ii) разнообразные реципиентные последовательности взаимодействия и одну и ту же донорную последовательность взаимодействия или
(iii) разнообразные реципиентные и донорные последовательности взаимодействия.
110. Библиотека по п. 109, отличающаяся тем, что указанные связывающие элементы в указанной библиотеке содержат разнообразные линкерные последовательности.
111. Библиотека по п. 110, отличающаяся тем, что указанные связывающие элементы в указанной библиотеке содержат одинаковые реципиентные и донорные последовательности взаимодействия и разнообразные линкерные последовательности.
112. Библиотека по любому из пп. 107-111, отличающаяся тем, что указанные связывающие элементы в указанной библиотеке содержат разнообразные домены-партнеры.
113. Библиотека по любому из пп. 107-112, которую получают с помощью способа по любому из пп. 101-106.
114. Библиотека по любому из пп. 107-113, отличающаяся тем, что каждый связывающий элемент в указанной библиотеке представлен на поверхности рибосомы, клетки или вируса, которые содержат нуклеиновую кислоту, кодирующую связывающий элемент.
115. Библиотека по п. 114, отличающаяся тем, что указанные связывающие элементы представлены на поверхности бактериофага или эукариотической клетки.
116. Библиотека по любому из пп. 107-115, отличающаяся тем, что указанный слитый белок указанных связывающих элементов слит с белком оболочки нитевидного фага.
117. Способ получения связывающего элемента, включающий:
(i) встраивание нуклеиновой кислоты, кодирующей донорный увеличивающий разнообразие домен остова, в нуклеиновую кислоту, кодирующую реципиентный увеличивающий разнообразие домен остова, с получением химерной нуклеиновой кислоты, кодирующей слитый белок;
при этом указанный донорный увеличивающий разнообразие домен остова содержит донорный остов и донорную последовательность взаимодействия и указанный реципиентный увеличивающий разнообразие домен остова содержит реципиентный остов и реципиентную последовательность взаимодействия;
при этом N- и C-концы донорного увеличивающего разнообразие домена остова связаны с реципиентным увеличивающим разнообразие доменом остова без линкера или линкерами, состоящими из до 4 аминокислот;
при этом указанный донорный увеличивающий разнообразие домен остова представляет собой богатый цистеином пептид, содержащий множественные дисульфидные мостики, образованные остатками цистеина в пределах указанного донорного увеличивающего разнообразие домена остова, причем указанный донорный увеличивающий разнообразие домен остова состоит из 200 или менее аминокислот, и
при этом указанный реципиентный увеличивающий разнообразие домен остова представляет собой домен иммуноглобулина (домен Ig), сконструированный домен Z белка A, сконструированный домен фибронектина, сконструированный белок с анкириновым повтором (DARPin), адгирон, антикалин, домен тиоредоксина или белок гена 2 фага T7 (Gp2), и
(ii) экспрессию указанной химерной нуклеиновой кислоты с получением указанного слитого белка.
118. Способ получения связывающего элемента по п. 117, дополнительно включающий соединение указанного слитого белка с доменом-партнером.
| WO 2012064658 A1, 18.05.2012 | |||
| US 7258986 B2, 21.08.2007 | |||
| MOORE S.J., COCHRAN J.R | |||
| "Engineering knottins as novel binding agents." Academic Press, Methods in enzymology, 2012, 503: 223-251 | |||
| WO 2010097589 A1, 02.09.2010 | |||
| HOSSE R.J | |||
| et al., "A new generation of protein display scaffolds for molecular recognition." Protein Science, 2006, 15(1): |
Авторы
Даты
2022-08-23—Публикация
2017-01-09—Подача