Изобретение относится к медицине и фармакологии и представляет собой средство, обладающее корректирующим действием на метаболизм хрящевой ткани, в частности предназначенного для профилактики остеоартрозов, остеохондрозов, спондилеза.
Известно, что хрящевая ткань играет важную роль в организме, помимо множества других функций, она выстилает поверхности суставов.
При этом различные факторы, к которым относят инфекции, особенности функционирования иммунитета, пол, возраст, генетическая предрасположенность, повышенные нагрузки и другие, могут приводить к нарушениям структуры хряща сустава. В свою очередь, такие нарушения обусловливают развитие различных поражений суставов, таких как остеоартроз, остеохондроз, спондилез.
Поэтому поиск новых, более эффективных лекарственных средств, направленных на восстановление структуры и функции суставов, на сегодняшний день является актуальной проблемой фармакологии. Это повлияет на повышение качества жизни и активности пациентов с данной патологией, а также позволит снизить затраты здравоохранения на реабилитацию таких пациентов.
Указанное лечение в составе комплексной терапии, включает, в том числе и использование средств, направленных на коррекцию метаболизма хрящевой ткани.
По существу, данная группа препаратов обладает смешанным хондропротективным и противовоспалительным действием и позволяет провести лечение за более короткий срок.
Эта группа препаратов представляют собой лекарственные средства, которые используются для улучшения восстановления хрящевой ткани суставов, а также для замедления дегенеративных процессов, которые постепенно разрушают суставы и приводят к различным заболеваниям опорно-двигательного аппарата. В их состав могут входить различные натуральные или искусственные компоненты. Наиболее часто они содержат компоненты хрящевой ткани или вещества, которые улучшают в нем обменные процессы, ускоряют восстановление хряща, повышают эластичность, а также нормализуют трофику хрящевой ткани.
Так, известно получение композиции хондропротекторного действия, например, из хрящевой ткани рыб, при котором проводят измельчение, обезжиривание, обработку ферментами протеолитического действия из гепатопанкреаса камчатского краба, инактивацию ферментов, отделение продуктов ферментации с последующей их сушкой, при этом дополнительно в сырье вводят коллагенсодержащие и костные ткани рыб, а обработку ферментами проводят в водном экстракте плодов шиповника, или цветов ромашки аптечной, или листьев шалфея (патент RU 2355240, 09.01.2008).
Также указанные препараты могут содержать в своем составе помимо компонентов хрящевой ткани и другие вещества, обладающие трофическим и анальгетическим действием.
Так, известно получение композиции для парентерального применения, обладающей противовоспалительным, иммунотропным, противоаллергическим и ранозаживляющим действием, содержащей пептиды, ассоциированные с фосфолипидами, полученные из печени тресковых, солюбилизатор, натрия хлорид, консервант и воду для инъекций, (патент RU 2464993, 22.11.2011).
Таким образом, в настоящее время разработка препаратов для терапии заболеваний, связанных с повреждением хрящевой ткани, направлена на создание комплексных средств, содержащих помимо хондропротекторов и иные активные вещества, способствующие восстановлению ткани и уменьшению воспалительного процесса.
Одним из таких препаратов, обладающих комплексным действием, является «Афлутоп», производимый в Румынии.
Препарат характеризуется обезболивающим и противовоспалительным действием. «Алфлутоп» обладает хондропротекторным влиянием, он эффективно регулирует в хрящевой ткани обмен веществ. Хондропротекторное свойство препарата основано на снижении активности специальных ферментов, в том числе гиалуронидазы. Эти ферменты играют главную роль в стабилизации биосинтеза коллагена II типа и гиалуроновой кислоты и участвуют в разрушении межклеточного матрикса.
Препарат снижает разрушение макромолекулярной структуры основного материала соединительной ткани, уменьшает проницаемость капилляров. Кроме того, «Алфлутоп» стимулирует восстановительный процесс в тканях суставного хряща и в интерстициальной ткани. Протеогликаны, являющиеся составным элементом препарата, обуславливают трофическое действие. Обладая замещающим эффектом, они значительно повышают МРТ-показатели гидрофильности хряща, его высоты и однородности костных тканей.
Благодаря этому данное лекарство уменьшает силу болевых ощущений при покое и движении. Существенно уменьшается боль при ходьбе по ровной дороге, иногда даже при ходьбе по лестнице. Заметно снижается выраженность контрактуры и местная припухлость. Таким образом, «Алфлутоп» облегчает общую двигательную активность пораженных суставов, повышает объем его движений.
Препарат выпускают в виде 1% раствора для инъекций. Активным компонентом препарата является биоактивный концентрат из мелкой морской рыбы: кильки (Sprattus sprattus sprattus), мерланга черноморского (Odontogadus merlangus euxinus), пузонка черноморского (Alosa tanaica nordmanni) и анчоуса черноморского (Engraulis encrassicholus ponticus), полученный путем экстракции с последующей депротеинизацией и делипидизацией. В его состав входят глюкозаминогликаны, включая хондроитин, дерматан сульфат, аминокислоты, полипептиды и микроэлементы. Содержание аминокислот составляет 3,7-12% (Rosoiu N. et al. Original bioactive complexes rich in glycosaminoglycans obtained from small fish // Roum. Biotechnol. Lett., 2008, 13 (5), 3944-3954).
Однако состав данной композиции обладает выраженным непостоянством, связанным с сезонным характером получения источника биоактивного концентрата. В частности, можно констатировать наличие непостоянного аминокислотного состава, который напрямую зависит от кормовой базы рыб и загрязненности моря. Также от данных факторов зависит и наличие нежелательных примесей в составе композиции. Все перечисленное часто и определяет не всегда прогнозируемый желательный терапевтический эффект.
Задачей настоящей работы является разработка средства хондропротекторного действия на основе смеси аминокислот, которое было бы лишено указанных недостатков.
В качестве решения поставленной задачи предлагается средство, обладающее корректирующим действием на метаболизм хрящевой ткани, включающее смесь аминокислот, взятых в следующих количествах в мкг/мл, растворенных в жидком фармацевтически приемлемом носителе:
В качестве фармацевтически приемлемого носителя в частном случае осуществления изобретения используется вода для инъекций.
Дополнительно заявляемое средство содержит вспомогательное вещество - стабилизатор, в частности фенол, 0,01 мг/мл 100 мг/мл
Средство используется для внутрисуставного или подкожного или внутримышечного введения.
Способ получения средства включает смешение вышеуказанных компонентов препарата в фармацевтическом приемлемом носителе, их перемешивание, при необходимости добавление вспомогательных веществ.
Техническими результатами изобретения являются:
1. Получение стабильного по составу, с нормированным по количественным и качественным показателям средства, обладающего корректирующим действием на метаболизм хрящевой ткани;
2. Получение стабильного по терапевтическому эффекту средства, обладающего корректирующим действием на метаболизм хрящевой ткани,
3. Получение средства, не зависящего от сезонной добычи источника биологически активных веществ, входящих в состав средства;
4. Получение средства, обладающего длительным хранением, у которого производственные затраты стабильны, унифицированы, методы контроля стандартизированы, понятны и воспроизводимы.
Ниже приведены примеры частного случая осуществления изобретения.
Пример 1
Инъекционные растворы получали общеизвестным способом (Чуешов В.И. и др. Промышленная технология лекарств, Т. 2, МТК - Книга; Изд-во НФАУ, 2002 г., стр. 510-543).
Для приготовления раствора для внутрисуставного и внутримышечного введения смешивают ингредиенты в следующем составе (мкг/мл):
Приготовление раствора включает следующие операции: исходные вещества взвешивают, добавляют в воду для инъекций, полностью растворяют при постоянном перемешивании, после чего добавляют стабилизатор, полученный раствор фильтруют, фасуют, разливая по ампулам. Раствор прозрачный, бесцветный, без запаха.
Пример 2
Для приготовления раствора для внутрисуставного и внутримышечного введения смешивают ингредиенты из расчета состава одной ампулы (2 мл):
Приготовление раствора включает следующие операции: исходные вещества взвешивают, добавляют в воду для инъекций, полностью растворяют при постоянном перемешивании, после чего добавляют стабилизатор, полученный раствор фильтруют, фасуют, разливая по ампулам.
Пример 3
Для приготовления раствора для внутрисуставного и внутримышечного введения смешивают ингредиенты из расчета состава одной ампулы (2 мл):
Приготовление раствора включает следующие операции: исходные вещества взвешивают, добавляют в воду для инъекций, полностью растворяют при постоянном перемешивании, полученный раствор фильтруют, фасуют, разливая по ампулам.
Пример 4
Для приготовления раствора для внутрисуставного и внутримышечного введения смешивают ингредиенты из расчета состава одной ампулы (2 мл):
Приготовление раствора включает следующие операции: исходные вещества взвешивают, добавляют в воду для инъекций, полностью растворяют при постоянном перемешивании, полученный раствор фильтруют, фасуют, разливая по ампулам.
Пример 5
Для приготовления раствора для внутрисуставного и внутримышечного введения смешивают ингредиенты из расчета состава одной ампулы (2 мл):
Приготовление раствора включает следующие операции: исходные вещества взвешивают, добавляют в воду для инъекций, полностью растворяют при постоянном перемешивании, после чего добавляют стабилизатор, полученный раствор фильтруют, фасуют, разливая по ампулам.
Пример 6. Исследование хондропротекторной активности заявленного средства у пациентов с вертеброгенным плечелопаточным периартрозом.
Длительность исследования составила 3 месяца: 2 месяца составили периоды стационарного и амбулаторного лечения, 1 месяц - период наблюдения. Заявленное средство назначалось пациентам основной группы в дозе 1 мл (100 мг) через день (первые три инъекции), четвертая и последующие инъекции - 2 мл (200 мг), всего 30 инъекций на протяжении 2 месяцев на фоне проводимого основного лечения. В контрольной группе терапия проводилась без введения заявленного средства.
Клиническое исследование включало 5 визитов (V) (4 визита в период лечения и 1 визит в период наблюдения): V1 - визит скрининга, V2 - рандомизация и начало терапии, V3 - 1 месяц от начала терапии (телефонный контакт с пациентом), V4 - 2 месяца от начала терапии, V5 - 3 месяца от начала терапии. У половины пациентов визиты V1 и V2 совмещались. Период между визитами V1 и V2 не превышал 1 неделю.
На визите скрининга пациент подписывал информированное согласие, осуществлялась оценка соответствия критериям включения и выявлялись критерии исключения, заполнялась карта пациента. Проводилось клиническое и инструментальное обследование больного. На втором визите пациентам основной группы проводилась первая внутримышечная инъекция заявляемого препарата (100 мг). На визитах V3 осуществлялся телефонный контакт, выявлялись нежелательные явления, оценивалась переносимость препарата, врач-исследователь получал подтверждение о соблюдении протокола исследования пациентом. На визитах V4 и V5 проводился осмотр пациента, оценивалась эффективность и безопасность препарата, заполнялась анкета. На визите V5 оценивались повторные анализы крови: клинический (гемоглобин, лейкоциты, СОЭ) и биохимический (АЛТ, ACT), анализ мочи.
В процессе терапии оценивались все реакции, возникшие в период лечения. Оценивались частота и характер нежелательных явлений, развившихся за период наблюдения, их связь с исследуемым препаратом.
Контролировались показатели анализов крови: клинический (гемоглобин, лейкоциты, СОЭ) и биохимический (ACT, АЛТ), анализ мочи.
Также использовались следующие показатели эффективности:
1) Динамика индекса WOMAC (боль, скованность, функциональная недостаточность), изменение индекса в % относительно начального визита;
2) Тест «Встань и иди» (сек);
3) Потребность в приеме НПВП (снижение суточной дозы, отмена), день наступления эффекта;
4) Оценка эффективности терапии врачом и пациентом.
Результаты оценки эффективности терапии заявляемым средством с помощью теста «Встань и иди».
Каждый пациент выполнял функциональный тест - «Встань и иди».
На фоне проводимого лечения заявляемым средством уменьшалось время, требуемое для выполнения теста, что является показателем улучшения функционального состояния больных. Данные представлены на рисунке.
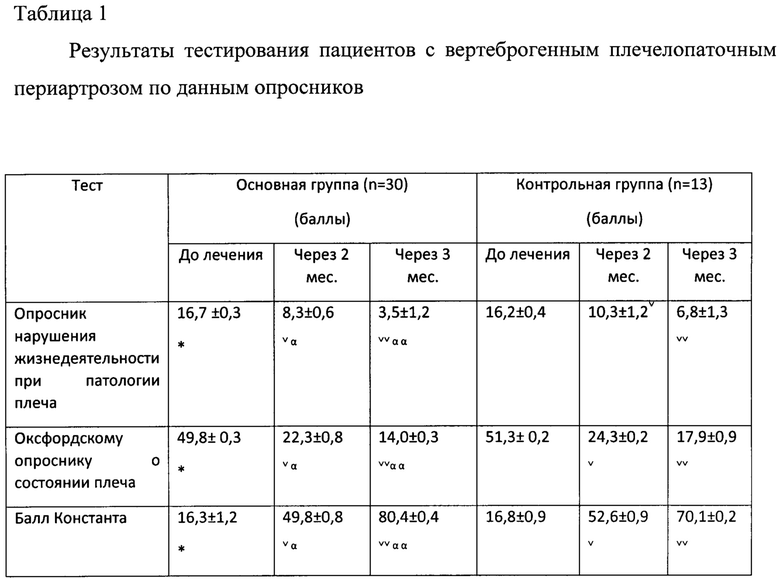
Также для субъективной оценки патологии до и после лечения, а также эффективности терапии проводилось тестирование пациентов. Заполнялся «Опросник нарушения жизнедеятельности при патологии плеча (по P. Croft и соавт., 1994)», норма - 22 балла. Применялся «Оксфордский опросник для плеча (по J. Dawson и соавт., 1996)», оценка состояния колеблется от 12 баллов при небольших проблемах до 60 баллов при серьезных проблемах с плечом. Рассчитывался «Балл Константа (по C.R. Constant, A.H.G. Murley, 1987)» (норма 100 баллов), используемый для оценки эффективности лечения заболеваний плечевого сустава.
С целью исследования структурных изменений в области плечевого сустава проводилась ультрасонография. Данный метод является информативным в диагностике состояния мягкотканых структур, гиалинового хряща, костной ткани. Оценивались грудинно-ключичный сустав (суставная щель, суставные поверхности, межключичная связка, реберно-ключичная связка, передняя грудино-ключичная связка), акромиально-ключичный сустав (суставная щель, суставные поверхности, поверхностная акромиально-ключичная связка, глубокая акромиально-ключичная связка), лопаточно-плечевой сустав (суставные поверхности, связочный аппарат сустава), суставные сумки, ротаторная манжетка, сухожилие длинной головки бицепса.
Вертебральный синдром подтверждался рентгенологическими изменениями шейного и грудного отделов позвоночника.
Всем пациентам проводилась мобилизация пораженных суставов, постизометрическая релаксация мышц плечевого пояса и руки, массаж шейного, грудного отделов, пораженной конечности, физиотерапия синусомоделированными токами цервико-торакального перехода. На фоне проведенного лечения у всех пациентов отмечалась положительная динамика в виде уменьшения болевого синдрома в покое и при движениях, увеличения объема движений в плечевом суставе. Улучшились биомеханические характеристики мышц плечевого пояса, что в целом сказалось на физической активности пациентов, что подтверждается снижением показателей ВАШ до 3±1,5 баллов.
При анализе опросников были получены следующие показатели, отраженные в таблице 1. Согласно «Опроснику нарушения жизнедеятельности при патологии плеча» отмечалась положительная динамика на фоне лечения в обеих группах. Через 2 месяца лечения у пациентов основной группы ограничения жизнедеятельности заключались преимущественно в избегании выполнения тяжелой работы по дому, затруднениях в ношении сумок при покупках, занятиях спортом. Средний балл составил 8,3±0,6, что на 50% ниже, чем до лечения. В контрольной группе дополнительно выявлялись нарушения сна из-за невозможности лежать на больном плече и умеренной болезненности при активных движениях рукой. Средний балл составил 10,3±1,2, то есть симптоматика снизилась на 30%. Через 3 месяца лечения в основной группе пациенты избегали активных занятий спортом, но уверенно выполняли ЛФК. В контрольной по-прежнему не могли выполнять тяжелую работу по дому, хотя боли в плече регрессировали.
Анализ результатов тестирования с использованием «Оксфордского опросника о состоянии плеча» показал, что через 2 месяца разница в показателях была недостоверной. Через 3 месяца меньшая выраженность болевого синдрома и более высокая повседневная активность наблюдались в основной группе (14,0±0,3 балла в основной группе, 17,9±0,9 балла в контрольной).
Оценка «Балла Константа» показала, что у пациентов обеих групп возрос уровень физической активности, увеличилась сила в руке. При объективном исследовании объема движений в пораженном плечевом суставе также имелась положительная динамика. Небольшие ограничения, преимущественно в контрольной группе, выявлялись при отведении руки и заведении ее за спину. Через 3 месяца лечения объем движений в плечевом суставе полностью восстановился у пациентов в основной группе (80,4±0,4 балла). В контрольной группе ограничения движений в плечевом суставе составили 5-10%, но сопровождались умеренной болью (70,1±0,2 балла).
Контрольное ультразвуковое исследование плечевого сустава выявило также положительную тенденцию в виде уменьшения степени или исчезновения отека мышц, признаки частичного восстановления структуры мышц, образующих ротаторную манжетку плеча. Положительная динамика была отмечена в основной группе пациентов (38%), получавших наряду с основным лечением заявленный хондропротектор. В группе сравнения подобную тенденцию зарегистрировать не удалось.
На визите V5 оценивали динамику показателей лабораторных исследований. Все показатели в основной и контрольной группах были в пределах нормы как в начале исследования, так и в конце его. Таким образом, побочных проявлений от приема препаратов не выявлено.
Таким образом, с учетом изложенного, заявляемое средство обладало достоверно выраженным анальгетическим действием; приводило к уменьшению боли при ходьбе «стартовой», ночной боли; улучшению функциональной активности
Пример 7. Исследование хондропротекторной активности заявленного средства в условиях развития экспериментального артроза у животных.
Исследование проводили на белых беспородных крысах-самцах массой 250-300 г, полученных из одного помета (идентичного возраста и массы, с нормальными основными показателями клинических и биохимических анализов). Предварительно животных разделяли на группы, взвешивали, наносили индивидуальные метки.
1 группа - интактный контроль (n=10)
2 группа - контрольная патология (n=20);
3 группа - крысы с артрозом, получающие в/м заявленное средство в дозе 800 мкг/кг с содержанием аминокислот как в примере 1 (n=12);
4 группа - крысы с артрозом, получающие в/м заявленное средство в дозе 800 мкг/кг с содержанием аминокислот как в примере 2 (n=12);
5 группа - крысы с артрозом, получающие в/м заявленное средство в дозе 800 мкг/кг с содержанием аминокислот как в примере 4 (n=12);
6 группа - крысы с артрозом, получающие в/м «Афлутоп» в дозе 800 мкг/кг
Далее проводили моделирование стероидного артроза путем троекратного в/м введения дексаметазона с интервалом в 1 неделю в разовой дозе 7 мг/кг. Первые проявления артропатии возникают уже на 4 неделю эксперимента. Степень активности патологического процесса оценивали в контрольной группе по биохимическим показателям анализа крови, для чего часть животных выводили из эксперимента (10 крыс) и собирали кровь. Начиная с 28 дня эксперимента и на протяжении 4 недель все животные ежедневно получали заявленное средство в соответствующих концентрациях и «Афлутоп» внутримышечно. На протяжении исследования проводилось клиническое наблюдение за животными, контролировали функциональное состояние суставов крыс (степень подвижности, устойчивости к физической нагрузке, отечности, гиперемии). По окончании введения препаратов (на 56-е сутки эксперимента) животных подвергали декапитации под эфирным наркозом с целью получения биоматериала для биохимических и гистоморфологических исследований. Исследуемые показатели учитывали в сравнении с интактным контролем по состоянию на 28 сутки (для группы контрольной патологии) и 56 сутки исследования.
Исследования уровня хондропротекторной активности заявленного средства в условиях развития экспериментального артроза показали выраженное хондропротекторное действие этого средства, сопоставимое с таковым у препарата «Афлутоп».
Пример 8. Хранение при длительных условиях.
Были произведены опытно-промышленные серии заявленного средства с содержанием компонентов, как в примерах 1-5. Розлив растворов был проведен в ампулы из темного стекла объемом 2 мл. Образцы были заложены на изучение стабильности в условиях естественного хранения (+25 град С) 20.12.2010 г. По истечении трех лет. По истечении указанного срока заявленное средство соответствует требованиям нормативной документации.
Пример 9.
Полученную лекарственную форму необходимо использовать следующим образом.
При полиостеоартрозе и остеохондрозе - по 1 мл в день, глубоко в/м. Курс лечения составляет 20 инъекций (по 1 инъекции в день в течение 20 дней).
При преимущественном поражении крупных суставов - по 1-2 мл в каждый сустав с интервалом 3-4 дня, внутрисуставно. Всего на курс - 5-6 инъекций в каждый сустав.
Возможно сочетание внутрисуставного и в/м методов введения.
Курс лечения целесообразно повторить через 6 мес после консультации врача.
Таким образом, разработанное авторами средство характеризуется обезболивающим и противовоспалительным действием, обладает хондропротекторным влиянием, регулирует в хрящевой ткани обмен веществ, стимулирует восстановительный процесс в тканях суставного хряща и в интерстициальной ткани и как следствие уменьшает силу болевых ощущений при покое и движении, облегчает общую двигательную активность пораженных суставов, повышает объем его движений.
* - Р>0,5 сравнение основной группы с контрольной до лечения
** - Р<0,5 сравнение основной группы с контрольной до лечения
v - P<0,01 сравнение внутри группы до лечения и после лечения
vv - Р<0,001 сравнение внутри группы до лечения и после лечения
α - Р>0,5 сравнение основной группы с контрольной после лечения
αα - Р<0,5 сравнение основной группы с контрольной после лечения
Изобретение относится к медицине и фармакологии и представляет собой средство, обладающее корректирующим действием на метаболизм хрящевой ткани, включающее следующую смесь аминокислот: аспарагиновая кислота в количестве 0,01-100 мкг/мл, серин в количестве 0,01 -100 мкг/мл, глутаминовая кислота в количестве 0,01-100 мкг/мл, глицин в количестве 0,01-100 мкг/мл, гистидин в количестве 0,01-100 мкг/мл, аргинин в количестве 0,01-100 мкг/мл, треонин в количестве 0,01-100 мкг/мл, аланин в количестве 0,01-100 мкг/мл, пролин в количестве 0,01-100 мкг/мл, тирозин в количестве 0,01-100 мкг/мл, валин в количестве 0,01-100 мкг/мл, метионин в количестве 0,01-100 мкг/мл, лизин в количестве 0,01-100 мкг/мл, изолейцин в количестве 0,01-100 мкг/мл, лейцин в количестве 0,01-100 мкг/мл и фенилаланин в количестве 0,01-100 мкг/мл, растворенных в жидком фармацевтически приемлемом носителе. Изобретение обеспечивает обезболивающее и противовоспалительное действием, обладает хондропротекторным влиянием, регулирует в хрящевой ткани обмен веществ, стимулирует восстановительный процесс в тканях суставного хряща и в интерстициальной ткани и, как следствие, уменьшает силу болевых ощущений при покое и движении, облегчает общую двигательную активность пораженных суставов, повышает объем их движений. 2 н. и 4 з.п. ф-лы, 1 табл., 9 пр
1. Средство, обладающее корректирующим действием на метаболизм хрящевой ткани, включающее смесь аминокислот, взятых в следующих количествах в мкг/мл, растворенных в жидком фармацевтически приемлемом носителе:
2. Средство по п. 1, отличающееся тем, что дополнительно содержит вспомогательное вещество - стабилизатор, в частности фенол, в концентрации 0,01 мг/мл - 100 мг/мл.
3. Средство по п. 1, отличающееся тем, что в качестве фармацевтически приемлемого носителя используется вода для инъекций.
4. Средство по п. 1, отличающееся тем, что средство используется для внутрисуставного или подкожного или внутримышечного введения.
5. Способ получения средства по пп. 1-3, включающий смешение вышеуказанных компонентов препарата в фармацевтическом приемлемом носителе, их перемешивание, при необходимости добавление вспомогательных веществ.
6. Способ по п. 5, отличающийся тем, что в качестве вспомогательных веществ используют стабилизатор, в частности фенол, в концентрации 0,01 мг/мл - 100 мг/мл.
| СРЕДСТВО, ОБЛАДАЮЩЕЕ РЕГЕНЕРАТИВНОЙ АКТИВНОСТЬЮ | 1994 |
|
RU2080854C1 |
| Автоматическое устройство для наматывания на барабан электрического кабеля, соединяющего повозку и передвигаемый по контактным проводам токоприемник | 1926 |
|
SU14469A1 |
| US 20090324669 A1, 31.12.2009 | |||
| WO 2007130430 A1, 15.11.2007. | |||
Авторы
Даты
2018-02-13—Публикация
2017-04-18—Подача