Изобретения относятся к биотехнологии и могут быть использованы, в частности, для получения биологически активного соединения – природного полисахарида ламинарана.
Ламинараны (или ламинарины) являются эффективными иммуностимуляторами растений, животных и человека, проявляют антилипемический эффект, оказывают радиопротекторное, противоопухолевое, противовирусное и антибактериальное действие, используются как криопротекторы. Ламинараны относятся к запасным полисахаридам бурых водорослей и представляют собой низкомолекулярные 1 → 3; 1 → 6β-D- глюканы, гетерогенные по молекулярным массам, расположению и содержанию β -1--->6-связанных остатков глюкозы.
Известно, что одним из наиболее богатых и легко возобновляемых источников широко известных, интересных по структуре и биологической активности водорастворимых полисахаридов: ламинаранов и фукоиданов являются бурые водоросли.
В связи с этим в настоящее время сырьем для получения этих полисахаридов являются крупноталломные бурые водоросли, собираемые из естественных зарослей или выращиваемые на плантациях в открытом море, в основном виды ламинарий. Это затрудняет получение сырья с заданными свойствами, т.е. известным высоким содержанием ламинарана определенной структуры. Выход ламинарана при известных способах выделения из ламинарий, как правило, не превышает 5-11%, а из фукуса – 3,9% от сухой массы водоросли (п. РФ № 2240816, МПК, A61K 35/80 A61K 31/715, опубл. 27.11.2004; п. РФ № 2135518, МПК C08B 37/00, C08B 37/18, C07H 1/08, опубл. 27.08.1999; п. РФ № 2028153, МПК A61K 35/80, опубл. 1995; п. РФ 1642725, МПК C08B 37/18, опубл. 15.11.1983).
Кроме того, использование культивируемых водорослей для производства ламинарана ограничивается тем, что в основном хозяйства марикультуры водорослей ориентированы на производство пищевого продукта и отчуждение части урожая для производства полисахарида им экономически невыгодно.
Техническая проблема, поставленная перед изобретением, найти новый источник получения ламинарана и разработать технологический процесс, позволяющий получать значительную биомассу водоросли с высоким содержанием этого полисахарида.
Техническая проблема решается тем, что в качестве сырья для получения ламинарана предложено использовать нитчатую бурую микроводоросль Streblonema sp.
Заявителем впервые обнаружено, что в качестве альтернативного источника для получения ламинарана может быть использована нитчатая бурая микроводоросль, Streblonema sp. Эта микроводоросль выделена заявителем из талломов ламинариевых водорослей.
Установлено, что она обладает высокой скоростью роста, а благодаря своим микроскопическим размерам она может выращиваться в контролируемых условиях в фотобиореакторах, что позволяет получать биомассу с воспроизводимым химическим составом, что в конечном результате позволит снизить себестоимость конечного продукта.
Нитчатая бурая микроводоросль Streblonema sp. является эндофитом, поселяющимся внутри водоросли-хозяина, глубоко поникая в его ткани. Репродуктивные органы образуются на поверхности водоросли-хозяина. В этот период изоляция Streblonema sp. и выделение ее в свободную культуру не представляет труда.
Микроводоросль Streblonema sp. была выделена с поверхности спорофилл Alaria fistulosa. Спорофиллы с бурыми пятнами, которые представляли собой ткани водоросли, пораженные эндофитом, осушивали бумажной салфеткой, на пятно помещали каплю стерилизованной кипячением морской воды, выдерживали 20 мин, собирали и помещали в 2 мл пробирку с закручивающейся крышкой, содержащую 1,5 мл стерилизованной кипячением морской воды.
Затем пробирки, содержащие споры водоросли, выдерживали в течение 1.5 мес. при температуре 16°С и освещенности 20-25 мкЕ/м2 с. За это время нити водоросли становились видны невооруженным глазом. Затем водоросли пересевали на свежую среду (морская вода, обогащенная ES) в конические колбы по 1 нитчатому таллому. Водоросли выращивали в течение 1 года при температуре 16°С, освещенности 20-25 мкЕ/м2 с на стерилизованной морской воде, обогащенной ES, при ежемесячной смене среды. Нитчатые талломы водоросли сформировали шарообразные плотные массы до 5 см в диаметре. Идентификацию водоросли до рода производили в свободноживущей культуре и при инфицировании фрагментов спорофитов Undaria pinnatifida и Saccharina japonica.
Морфологические признаки водоросли в свободной культуре.
Нити неправильно разветвленные, клетки нитей бочонкообразные, цилиндрические прямые и изогнутые 5-12 мкм шир., с одним пластинчатым хлоропластом. Многогнездные спорангии цилиндрические, 1-3 рядные, 75-110×10-14 мкм, развиваются терминально на латеральных ветвях. Волоски имеются.
Условия хранения.
Свободноживущую культуру микроводоросли Streblonema sp. хранят в коллекции «Гаметофиты бурых водорослей» ЦКП Биоресурсная коллекция «Морской биобанк» ННЦМБ ДВО РАН №506171 в альгологически чистой культуре на стерилизованной морской воде, обогащенной средой ES (см. Таблица) при 8°С, освещенности около 1 мкЕ/м2 с. Пересев осуществляют ежемесячно.
Заявленная техническая проблема решается также тем, что обогащение микроводоросли Streblonema sp. ламинараном ведут в два этапа, на первом этапе накапливают биомассу микроводоросли Streblonema sp. путем ее культивирования на питательной среде не менее 10 суток, температуре 8-18°С и освещенности - от 35 до 100 мкЕ/м2 с еженедельной заменой питательной среды, на втором этапе непосредственно накапливают ламинаран в микроводоросли Streblonema sp., для чего в накопленной биомассе микроводоросли Streblonema sp. меняют питательную среду на безнитратную питательную среду, и затем на ней в течение не менее 7 суток культивируют микроводоросль Streblonema sp., при температуре 8-18°С и освещенности - от 35 до 100 мкЕ/м2.
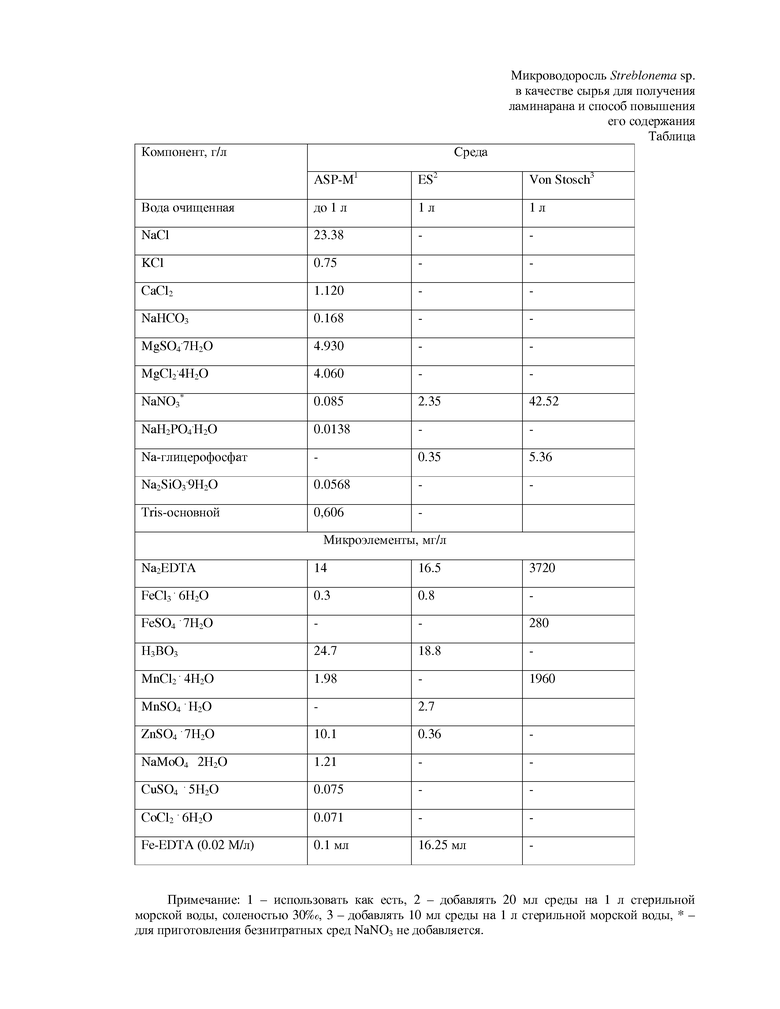
В качестве питательной среды могут использоваться, в частности, искусственная морская вода - ASP-M; морская вода, обогащенная средой ES; морская вода, обогащенная средой von Stosch; стерилизованная морская вода, обогащенная нитратом и глицерофосфатом. Рекомендуемые составы питательных (культуральных) сред представлены в таблице.
Установлено, что для нормального роста микроводоросли Streblonema sp., освещенность должна быть в диапазоне 35-100 мкЕ/м2 с. Освещенность ниже 35 и выше 100 мкЕ/м2 с ингибирует рост водоросли. Снижение освещенности ниже 35 мкЕ/м2с. ведет к 1.5-кратному снижению скорость роста, а увеличение освещенности более 100 мкЕ/м2 ведет к обесцвечиванию микроводорослей и торможению их роста.
Для достижения заявленного технического результата культивирование (выращивание) микроводоросли Streblonema sp. целесообразно вести в диапазоне температур от 8 до 18°С. При температуре ниже 8°С скорость роста крайне низкая, при температуре выше 18°С микроводоросль погибает в течение недели.
Наибольший рост микроводоросли обеспечивает температура 13-16°С.
Для накопления биомассы микроводоросли Streblonema sp. её культивирование необходимо вести не менее 10 суток.
Накопление ламинарана в биомассе микроводоросли Streblonema sp. (второй этап) обеспечивается культивированием на безнитратной питательной среде. В качестве безнитратной среды могут использоваться, в частности, питательные среды, применяемые на этапе накопления биомассы микроводоросли, но не содержащие нитраты (см. Таблица), или стерилизованная морская вода без добавления элементов минерального питания. Использование безнитратной среды приводит к повышению содержания ламинарана в 2.5–4.5 раза.
Культивирование на безнитратной питательной среде целесообразно вести не менее 7 суток, поскольку установлено, что именно, начиная с 7 дня культивирования, наблюдается значительное повышение содержания ламинарана в микроводоросли Streblonema sp.
Содержание ламинарана в биомассе микроводоросли определяют фенол-сернокислым методом (Dubois M, Gilles KA, Hamilton JK (1956) Colorimetric method for determination of sugars and related substances. Anal Chem 1956. Vol. 28. P. 350–356) после экстракции полисахарида в водную среду (рН=1.5, HCl) при 70°С в течение часа.
Способ демонстрируется таблицей, в которой приведены составы питательных сред, использованных в примерах осуществления изобретения, для культивирования микроводоросли Streblonema sp. cоставы сред взяты из следующих работ: среда Von Stosch (Guiry, M., and Cunningham, E. 1984. Photoperiodic and temperature responses in the reproduction of the northeastern Atlantic Gigartina acicularis (Rhodophyta: Gigartinales). Phycologia 23:357–67; среда ASP-M (McLachlan, J. 1964. Some considerations of the growth of marine algae in artificial media. Can. J. Microbiol. 10:769–82); среда ЕС (Provasoli, L. 1968. Media and prospects for the cultivation of marine algae. In: Watanabe, A., and Hattori, A., eds. Cultures and Collections of Algae. Proceedings of the U.S.–Japan Conference, Hakone, Japan, September 1966. Japanese Society of Plant Physiology, pp. 63–75).
Способ осуществляют следующим образом.
Для получения инокулята (суспензия клеток, являющаяся исходной для клеточной культуры и используемая для посева на питательную среду) берут ранее выделенную культуру микроводоросли Streblonema sp. в виде конгломерата, измельчают до получения однородной суспензии с помощью блендера при 3000 об/мин в течение 3 минут в стерильной морской воде, обогащенной ES (см. Таблица). Затем культуру разбавляют той же средой до достижения оптической плотности суспензии, измеренной при 664 нм, равной 1. Полученную культуру разливают в колбы объемом 2 л, заполняя их на 1/3 высоты и выращивают (культивируют) в течение 2 недель при освещении люминесцентными лампами Phillips 18W 4000 K 35 мкЕ/м2 с фотопериодом 12 часов свет : 12 часов темнота) при непрерывном барботаже воздухом и температуре 16°С. Частичную смену среды осуществляют еженедельно. В конце периода выращивания суспензию водоросли концентрируют с помощью отстаивания и используют в качестве инокулята.
Пример 1
В однолитровые конические колбы наливают немодифицированную среду ASP-M (см. Таблица), добавляют в неё инокулят микроводоросли Streblonema sp. и культивируют при освещении люминисцентными лампами Phillips 18W 4000К 50 мкЕ/м2 (с фотопериодом 12 часов свет : 12 часов темнота) при непрерывном барботаже воздухом и температуре 16°С. Объем культуры в колбах составлял 0.6 л, начальная плотность культуры 0.74 г микроводорослей/л (или 0.09 г сухой массы/л). Культивирование ведут в течение 10 суток, через неделю питательную среду обновляют. Биомасса микроводорослей за этот период увеличивается в 2.8 раза.
Биомасса микроводоросли содержит 7.4±0.9% ламинарана от сух. массы.
Полученную биомассу микроводорослей используют для накопления в ней ламинарана. В накопленной биомассе микроводорослей проводят смену культуральной среды на безнитратную питательную среду. Для чего аккуратно с помощью трубочки сливают около 0.5 л среды и добавляют модифицированную среду ASP-М, не содержащую нитратов (см. Таблица), и затем на ней в течение 10 суток культивируют микроводоросль Streblonema sp. при постоянном барботировании воздухом, температуре 16°С и освещенности – 35 мкЕ/м2. Содержание ламинарана в микроводоросли составляет, % от сух. мас. 21.9±3.0 или 43.3±4.5 мг/л.
Пример 2
В двухлитровые конические колбы наливают стерильную морскую воду, обогащенную средой ES (см. Таблица), добавляют в неё инокулят микроводоросли Streblonema sp. и культивируют при освещении люминесцентными лампами Phillips 18W 4000 К 35 мкЕ/м2 (с фотопериодом 12 часов свет : 12 часов темнота), без барботажа воздухом и температуре 18°С. Объем культуры в колбах составлял 1 л, начальная плотность культуры 0.4 г микроводорослей/л (или 0.05 г сухой массы/л). Культивирование ведут в течение 14 суток, через неделю питательную среду обновляют. Биомасса микроводорослей за этот период увеличивается в 2.9 раза.
Содержание ламинарана в биомассе составляет 6.2±1.8 % от сух. массы водорослей.
Полученную биомассу микроводорослей используют для накопления в ней ламинарана. В накопленной биомассе микроводорослей проводят смену культуральной среды на среду с низким содержанием нитрата. Для чего аккуратно с помощью трубочки сливают около 0.8 л среды и добавляют модифицированную среду ASP-М, не содержащую нитратов (см. Таблица), и затем на ней в течение 7 суток культивируют микроводоросль Streblonema sp. при температуре 18°С, без барботажа воздухом и освещенности – 35 мкЕ/м2. Содержание ламинарана в микроводоросли составляет 16.3±2.3% сух. массы или 24.6±3.9 мг/л.
Пример 3
В однолитровые конические колбы наливают стерильную морскую воду, обогащенную средой von Stosch (см. Таблица), добавляют в неё инокулят микроводоросли Streblonema sp. и культивируют при освещении люминесцентными лампами НЛ-HS-105Вт-6500K 100 мкЕ/м2 (с фотопериодом 12 часов свет : 12 часов темнота) и температуре 8°С. Объем культуры в колбах составлял 0.6 л, начальная плотность культуры 0.3 г микроводорослей/л (или 0.036 г сухой массы/л). Культивирование ведут в течение 14 суток, через неделю питательную среду обновляют. Биомасса микроводорослей за этот период увеличивается в 5 раз.
Содержание ламинарана в биомассе составляет 2.1±0.6 % от сух. массы водоросли.
Полученную биомассу микроводорослей используют для накопления в ней ламинарана. В накопленной биомассе микроводорослей проводят смену культуральной среды на среду с низким содержанием нитрата. Для чего аккуратно с помощью трубочки сливают около 0.5 л среды и добавляют стерильную морскую воду, и затем на ней в течение 14 суток культивируют микроводоросль Streblonema sp. при температуре 8°С и освещенности – 100 мкЕ/м2. Содержание ламинарана в микроводоросли составляет, 8.6±1.2% сух. мас. или 18.7±3.6 мг/л.
Дальнейшее выращивание на безнитратной среде (до 21 дня) позволяет увеличить выход ламинарана до 16±2.5% от сух. массы водоросли.
Пример 4
В однолитровые конические колбы наливают стерильную морскую воду, к которой добавлен нитрат натрия (0.4252 г/л) и натрия глицерофосфат (0,0536 г/л), добавляют в неё инокулят микроводоросли Streblonema sp. и культивируют при освещении люминесцентными лампами НЛ-HS-105Вт-6500K 100 мкЕ/м2 (с фотопериодом 12 часов свет : 12 часов темнота) и температуре 8°С. Объем культуры в колбах составляет 0.6 л, начальная плотность культуры 0.4 г микроводорослей/л (или 0.048 г сухой массы/л). Культивирование ведут в течение 14 суток, через неделю питательную среду обновляют. Биомасса микроводорослей за этот период увеличивается в 3.8 раз.
Биомасса микроводоросли содержит 2.2±0.4 % ламинарана от сух. массы водоросли.
Полученную биомассу микроводорослей используют для накопления в ней ламинарана. В накопленной биомассе микроводорослей проводят смену культуральной среды на среду с низким содержанием нитрата. Для чего аккуратно с помощью трубочки сливают около 0.5 л среды и добавляют стерильную морскую воду и затем на ней в течение 14 суток культивируют микроводоросль Streblonema sp. при температуре 8°С и освещенности – 100 мкЕ/м2. Содержание ламинарана в микроводоросли составляет, 5.7±1.9% сух. массы или 16.1±6.4 мг/л.
Пример 5
В двухлитровые конические колбы наливают стерильную морскую воду, обогащенную средой ES (см. Таблица), добавляют в неё инокулят микроводоросли Streblonema sp. и культивируют при освещении люминесцентными лампами Philips 18W 4000K 35 мкЕ/м2 (с фотопериодом 12 часов свет : 12 часов темнота), непрерывном барботировании и температуре 16°С. Объем культуры в колбах составляет 1 л, начальная плотность культуры 0.74 г микроводорослей/л (или 0.09 г сухой массы/л). Культивирование ведут в течение 10 суток, через 7 суток питательную среду обновляют. Биомасса микроводорослей за этот период увеличилась в 2.9 раз.
Биомасса микроводоросли содержит 11.2±1.1% ламинарана от сух. массы водоросли.
Полученную биомассу микроводорослей используют для накопления в ней ламинарана. В накопленной биомассе микроводорослей проводят смену культуральной среды на среду с низким содержанием нитрата. Для чего аккуратно с помощью трубочки сливают около 0.8 л среды и добавляют стерильную морскую воду и затем на ней в течение 7 суток культивируют микроводоросль Streblonema sp. при температуре 16°С, непрерывном барботировании и освещенности – 35 мкЕ/м2.
Содержание ламинарана в микроводоросли составляет, 26±1.8% сух. массы или 67±6.4 мг/л.
Как видно из представленных примеров, нитчатая бурая микроводоросль Streblonema sp. может стать альтернативным источником получения биологически активного соединения – природного полисахарида ламинарана. Разработанный заявителем способ не только позволяет наработать необходимое количество биомассы микроводоросли, но и значительно повысить в ней содержание целевого продукта ламинарана.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ культивирования Cyanobacterium sp. для получения полисахаридов | 2023 |
|
RU2820201C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ ЗЕЛЕНЫХ МИКРОВОДОРОСЛЕЙ, ОБОГАЩЕННОЙ ЖИРНЫМИ КИСЛОТАМИ | 2012 |
|
RU2507251C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ RHODOMONAS SALINA | 2019 |
|
RU2717663C1 |
| ШТАММ МИКРОВОДОРОСЛИ Coelastrella sp. - ПРОДУЦЕНТ СМЕСИ НАТУРАЛЬНОГО БИОАНТИОКСИДАНТА АСТАКСАНТИНА И β-КАРОТИНА | 2018 |
|
RU2703420C1 |
| ШТАММ МИКРОВОДОРОСЛИ Desmodesmus sp. ДЛЯ КОНВЕРСИИ УГЛЕКИСЛОТЫ ИЗ ПРОМЫШЛЕННЫХ СБРОСНЫХ ГАЗОВ В СЫРЬЕ ДЛЯ ПРОИЗВОДСТВА БИОТОПЛИВА И КОРМОВЫХ ДОБАВОК | 2013 |
|
RU2555520C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ COELASTRELLA RUBESCENS ДЛЯ ПОЛУЧЕНИЯ КАРОТИНОИДОВ И ЛИПИДОВ | 2017 |
|
RU2661086C1 |
| Способ интенсивного выращивания коловратки солоноватоводной с применением культур морских микроводорослей | 2024 |
|
RU2824043C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛИ CHROMOCHLORIS ZOFINGIENSIS ДЛЯ ПОЛУЧЕНИЯ ЛИПИДОВ И КАРОТИНОИДОВ | 2019 |
|
RU2715039C1 |
| СПОСОБ ПОЛУПРОМЫШЛЕННОГО КУЛЬТИВИРОВАНИЯ КРАСНОЙ МИКРОВОДОРОСЛИ PORPHYRIDIUM PURPUREUM | 2024 |
|
RU2832916C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МОРСКОЙ МИКРОВОДОРОСЛИ PORPHYRIDIUM PURPUREUM | 2023 |
|
RU2823597C1 |
Изобретение относится к получению биологически активного соединения – природного полисахарида ламинарана. Предложено применение микроводоросли Streblonema sp. в качестве сырья для получения природного полисахарида ламинарана. Также заявлен способ обогащения микроводоросли Streblonema sp. природным полисахаридом ламинараном. Обогащение ведут в два этапа. На первом этапе накапливают биомассу микроводоросли Streblonema sp. путем её культивирования на питательной среде не менее 10 суток, температуре 8 - 18°С и освещенности от 35 до 100 мкЕ/м2 с еженедельной заменой питательной среды. На втором этапе накапливают природный полисахарид ламинаран в микроводоросли Streblonema sp. путем замены питательной среды на безнитратную питательную среду. Затем на ней в течение не менее 7 суток культивируют микроводоросль Streblonema sp. при температуре 8 - 18°С и освещенности от 35 до 100 мкЕ/м2. Изобретение позволяет использовать нитчатую бурую водоросль Streblonema sp. при производстве ламинарана. 2 н. и 2 з.п. ф-лы, 1 табл., 5 пр.
1. Применение микроводоросли Streblonema sp. в качестве сырья для получения природного полисахарида ламинарана.
2. Способ обогащения микроводоросли Streblonema sp. природным полисахаридом ламинараном, заключающийся в том, что обогащение ведут в два этапа, на первом этапе накапливают биомассу микроводоросли Streblonema sp. путем её культивирования на питательной среде не менее 10 суток, температуре 8 - 18°С и освещенности от 35 до 100 мкЕ/м2 с еженедельной заменой питательной среды, на втором этапе накапливают природный полисахарид ламинаран в микроводоросли Streblonema sp., для чего в накопленной биомассе микроводоросли Streblonema sp. меняют питательную среду на безнитратную питательную среду и затем на ней в течение не менее 7 суток культивируют микроводоросль Streblonema sp., при температуре 8 - 18°С и освещенности от 35 до 100 мкЕ/м2.
3. Способ по п. 2, отличающийся тем, что в качестве безнитратной среды используют питательные среды, применяемые на этапе накопления биомассы микроводоросли, но не содержащие нитраты, или стерилизованную морскую воду.
4. Способ по п. 2, отличающийся тем, что культивирование микроводоросли Streblonema sp для накопления биомассы и её обогащения природным полисахаридом ламинараном ведут при температуре 13-16°С.
| EP 2921504 A1, 23.09.2015 | |||
| KR 19810000029 B1, 02.02.1981 | |||
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРАСТВОРИМЫХ ПОЛИСАХАРИДОВ БУРЫХ ВОДОРОСЛЕЙ | 1998 |
|
RU2135518C1 |
| WO 2012071253 A1, 31.05.2012 | |||
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ БУРЫХ ВОДОРОСЛЕЙ С ПОЛУЧЕНИЕМ ПРЕПАРАТОВ ДЛЯ МЕДИЦИНЫ И КОСМЕТОЛОГИИ | 2003 |
|
RU2240816C1 |
Авторы
Даты
2018-02-28—Публикация
2017-05-04—Подача