Область техники
Изобретение относится к биологически активным добавкам для профилактики вирусных заболеваний человека и предназначено для сублингвального применения в период угрозы эпидемий вирусных инфекций и при заболеваниях, приводящих к ослаблению иммунитета.
Уровень техники
Перспективная фармакологическая защита организма человека заключается в применении таких лекарственных средств, когда под их воздействием любая клетка организма выполняет свою, возложенную на нее природой функцию. Индивидуальные особенности любого организма заключаются в том, что экзогеннную рибонуклеиновую кислоту (РНК) иммунная система воспринимает как чужеродную, как посягательство на суверенитет (статус) систем организма. Вследствие этого введение любой формы РНК вызывает стимуляцию его защитных факторов и мобилизацию сил для встречи врага-патогена.
Препараты на основе РНК все шире используются при создании лекарственных средств для профилактики и лечения актуальных инфекционных заболеваний. Наличие в составе фармакологического средства РНК позволяет активировать целый комплекс механизмов защиты клетки и расширяет возможности иммунопрофилактики, особенно в случае высокой изменчивости возбудителей: вирусы гриппа, папилломы человека, ВИЧ. Такими препаратами являются индукторы интерферона на основе двуспиральной РНК микробиологического происхождения - ридостин, ларифан, рифастин [1-4].
Ридостин относится к высокомолекулярным индукторам интерферона природного происхождения, его действующим началом является двуспиральная рибонуклеиновая кислота (дсРНК) киллерных штаммов дрожжей Saccharomyces cerevisiae.
Ларифан - высокомолекулярный индуктор интерферона природного происхождения, представляет собой дс-РНК фага f2 [4].
Рифастин - индуктор интерферона природного происхождения, представляет собой двуспиральную РНК бактериофага ϕ6.
Препараты на основе индуктора интерферона, двуспиральной РНК, обладают эффективностью при лечении не только вирусных, но и других инфекционных заболеваний, как видно из таблицы 1 [5].

Поскольку действующее начало имеет физико-химическую структуру, близкую к структуре генетического материала патогенных вирусов и бактерий, то введение двуспиральной РНК вызывает мощный иммунный ответ в организме, включающий индукцию интерферонов, стимуляцию фагоцитарной активности макрофагов и нейтрофилов периферической крови и другие процессы, противодействующие инфекции.
Задача изобретения состояла в разработке состава композиции биологически активной добавки на основе РНК, стимулятора иммунитета, для сублингвального применения.
Аналоги и их недостатки
Выпускаемый препарат Ридостин [1-3], представляющий собой смесь натриевых солей двуспиральной и одноцепочечной рибонуклеиновой кислоты, производит Российская фармацевтическая компания ООО «Диа-Фарм» на основе лицензионного договора на передачу прав по Патенту РФ №2083221, МПК А61К 38/20, опубл. 10.07.1997 г. с ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора.
Известно, что указанный препарат рекомендован для профилактики гриппа и ОРЗ инъекционно в дозе 8 мг на человека 1 раз: до заболевания или в день обращения больного к врачу, а при терапии гриппа и ОРЗ препарат назначают инъекционно по 8 мг на человека 2 раза: в день обращения больного к врачу и через 2 дня.
Недостатки способа: для профилактики и лечения заболеваний, вызванных штаммами субтипа H5N1 вируса гриппа птиц, такая схема препарата не дает надежного эффекта, особенно при лечении, и требует разработки иной схемы применения данного индуктора интерферона в комбинации с другими противовирусными препаратами.
Известен патент 2398596, в котором описан способ профилактики и лечения заболеваний, вызванных штаммами субтипа H5N1 вируса гриппа птиц, с использованием индуктора интерферона и ингибитора нейраминидазы, включающий введение в организм препарата индуктора интерферона или совместно индуктора интерферона и ингибитора нейраминидазы озельтамивира, согласно изобретению в качестве индуктора интеферона используют препарат Ридостин, который при профилактике заболеваний вводят в организм инъекционно в диапазоне доз от 0,05 до 0,5 мг/кг 1 раз в сутки и далее через 1 и 3 суток после первого введения Ридостина. При лечении заболеваний вводят в организм Ридостин инъекционно в диапазоне доз от 0,05 до 0,5 мг/кг 1 раз в сутки в день инфицирования и далее через 1 и 3 суток после инфицирования и ингибитор нейраминидазы озельтамивир перорально в диапазоне доз от 0,2 до 2 мг/кг 2 раза в сутки в течение 5-7 суток после инфицирования вирусом гриппа H5N1.
Недостатки способа: препарат Ридостин необходимо вводить инъекционно, несколько раз, под контролем медицинского работника, сочетая с употреблением препарата озельтамивир (тамифлу). Этот способ значительно стимулирует иммунную систему и оправдан при заболевании или угрозе заражения особо опасными инфекциями. При вероятности заражения ОРЗ или сезонным гриппом такая стимуляция иммунной системы избыточна.
Известен также патент РФ 2191594. Средство и способ повышения резистентности к инфекции. МПК А61К 38/21, опубл. 27.10.2002 г. Сущность изобретения состоит в том, что разработан препарат интерферона (ИФН), для чего используют сублингвальные гранулы, содержащие низкие дозы препарата реаферон или реальдирон или ингибитор ИФН (ридостин, ларифан, полудан, амиксин и т.д.). Содержание индукторов интерферона в сублингвальных гранулах составляет 0,01-5 мг в грануле без рекомендации четкой дозировки для каждого препарата из заявленной группы: амиксин, циклоферон, неовир, ридостин, полудан, ларифан, кагоцел, а также из группы: дибазол, папаверин, кофеин, курантил. Сублингвальные гранулы весом по 0,05 г готовятся на основе сахарозы или лактозы. Для диабетиков возможно применение капель.
Данное средство имеет следующие недостатки: сублингвальные гранулы содержат индуктор интерферона в малых дозах, по этой причине, как указано в патенте, даже для профилактики заболевания необходимо одномоментно использовать до 5 гранул и для достижения эффекта принимать их 1-3 раза в день. Данные об эффективности сублингвальных гранул, содержащих индуктор интерферона, при использовании для лечения заболевания отсутствуют. При этом препарат проявляет заявляемый эффект при совместном использовании с препаратом альфа-2 интерферона. Кроме того, нет сведений о лечебно-профилактическом действии препарата в отношении заболеваний, вызванных штаммами субтипа H5N1 вируса гриппа птиц.
Недостатки способа: способ предполагает использование рекомбинантного человеческого интерферона α2β, полученного путем микробиологического синтеза и специальной технологии его очистки. Известно, что при длительном применении рекомбинантных цитокинов организм начинает вырабатывать к ним антитела, которые нейтрализуют активность вводимых белков, и дозы последних приходится увеличивать.
Кроме того, указанные препараты относятся к лекарствам и требуют врачебного назначения в соответствующих лечебных дозах, что не позволяет широко использовать их для профилактических и оздоровительных целей в качестве БАД
Перспективным в качестве профилактического средства представляется использование сублингвальной формы РНК.
Раскрытие изобретения
Задача изобретения состояла в разработке состава композиции биологически активной добавки на основе РНК, стимулятора иммунитета, для сублингвального применения, которая, наряду с использованием полезных свойств РНК, обладала бы более широким спектром эффективного действия на организм, что позволило бы пополнить ассортимент пищевых добавок общеукрепляющего назначения.
Поставленная задача решена путем включения РНК в микрокапсулы, образованные из лактата кальция и пектина, на основе которых создана сублингвальная форма биологически активной добавки для стимуляции иммунитета.
Содержание компонентов: двуспиральная РНК 0,5±0,1 мг, одноцепочечная РНК 4,5±0,5 мг, пектин и лактат кальция используются в количествах, необходимых для образования микрокапсул. Для растворения пектина и лактата кальция используется раствор декстрана с молекулярной массой 40000 Да, применяемый в медицине в качестве кровезаменителя (Реополиглюкин).
Примеры конкретного выполнения
1. Выбор соотношения компонентов для формирования микрокапсул
Были подобраны соотношения компонентов: пектина и кальция лактата таким образом, чтобы образовывались однородные капсулы. Ряд соотношений основных компонентов представлены в таблице 2.
Наиболее однородные микрокапсулы наблюдались при соотношении компонентов, мг/г: пектин - 20, кальция лактат - 15, которые и были выбраны для дальнейших исследований. Препарат назвали Рикальцин.
На Рис. 1 приведен вид микрокапсул при микроскопировании (увеличение 100, 10×10).
2. Получение биологически активной добавки на основе РНК
2.1. Получение биологически активной добавки на основе дрожжевой РНК
Средство получают в два этапа: приготовление растворов (А и Б) и образование микрокапсул при их смешивании.
Для приготовления раствора А навеску ридостина (лиофилизированная пористая масса по ФС 42-3862-99 [6, 7], содержащая смесь натриевых солей нуклеиновых кислот: 10% двуспиральной РНК и 90% одноцепочечной РНК) массой 5 мг растворяют в 0,7 мл раствора реополиглюкина (декстран с молекулярной массой 30000-40000 Да в 0,9%-ном растворе NaCl по ФСП 42-0088-7009-05,2006 [8]), затем добавляют и растворяют 20-22 мг пектина.
Раствор Б готовят растворением навески лактата кальция массой 15-17 мг в 0,3 мл раствора реополиглюкина.
Раствор Б быстро вносят в раствор А при интенсивном перемешивании и оставляют на 10-15 мин для формирования трехмерных микрокапсул.
2.2. Получение биологически активной добавки на основе двуспиральной РНК бактериофага и одноцепочечной дрожжевой РНК
Для приготовления раствора А навеску рифастина, содержащую дсРНК бактериофага ϕ6 (производство ИМБТ ГНЦ ВБ Вектор), массой 0,5 мг растворяют в 0,7 мл раствора реополиглюкина (декстран с молекулярной массой 30000-40000 Да в 0,9%-ном растворе NaCl по ФСП 42-0088-7009-05,2006 [8]), добавляют и растворяют навеску полирибоната (препарат высокополимерной РНК из пекарских дрожжей по ТУ 9381-018-00479979-01 [9]) и затем добавляют и растворяют 20-22 мг пектина.
Раствор Б готовят растворением навески лактата кальция массой 15-17 мг в 0,3 мл раствора реополиглюкина.
Раствор Б быстро вносят в раствор А при интенсивном перемешивании и оставляют на 10-15 мин для формирования трехмерных микрокапсул.
3. Изучение кинетики высвобождения РНК из микрокапсул в физиологическом растворе и соляной кислоте при 37°C путем измерения оптической плотности при 260 нм. При исследовании кинетики высвобождения РНК пластинки препарата размерами: 1,5×1×0,25 см помещали в бюксы, добавляли 5 мл физиологического раствора (или 0,5% соляной кислоты). Через определенные промежутки времени замеряли оптическую плотность при длине волны 260 нм раствора (надосадочной фракции). По результатам измерений строили график зависимости оптической плотности в оптических единицах от времени в минутах.
Максимум концентрации РНК при диффузии в физраствор зафиксирован через 1,5-2,5 часа, он равнялся 3,8 -4 мг РНК (75-80% от исходного содержания), оставаясь на данном уровне в течение 12 часов. При этом внешний вид микрокапсул при микроскопировании значительно не изменялся.
При диффузии в раствор 0,5% соляной кислоты максимум концентрации РНК зафиксирован через 2 часа, значение концентрации было равным 1,5-1,8 мг, далее содержание РНК постепенно снижается до 0 в течение следующих 3 часов. Микрокапсулы при этом деформировались.
4. Оценка стабильности препаратов
Стабильность препаратов оценивали методом электрофореза в 1%-ном агарозном геле с окрашиванием бромистым этидием.
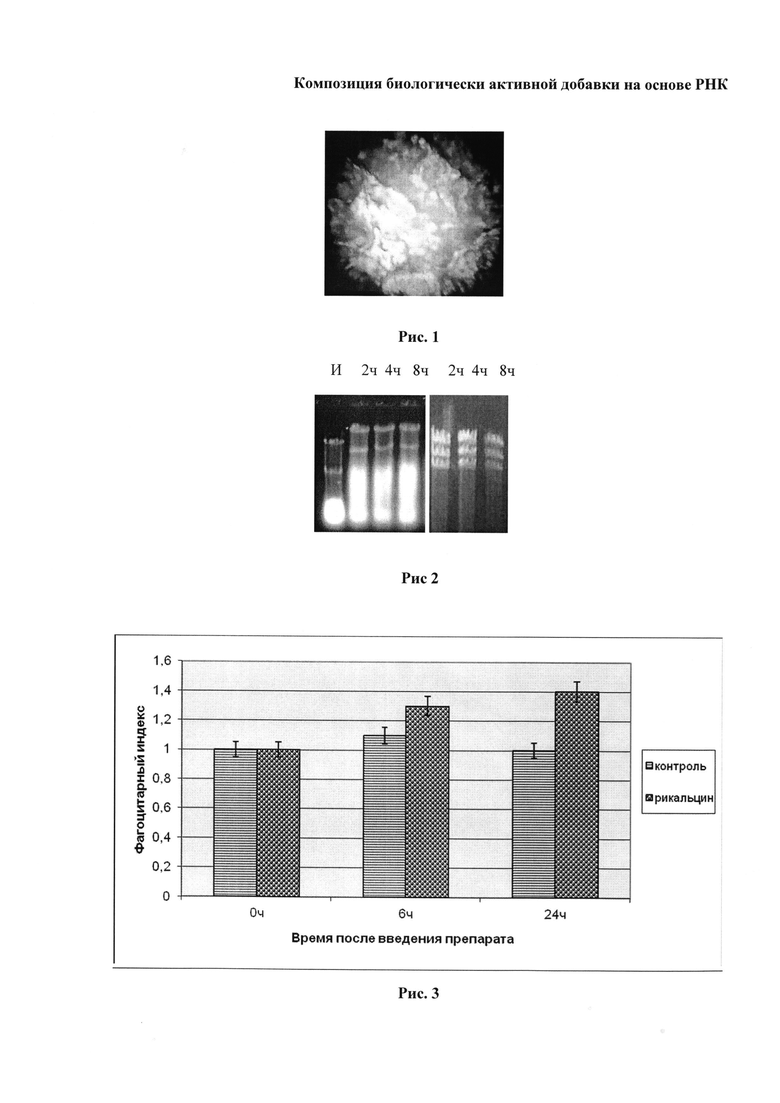
При анализе электрофорезом в 1%-ном геле агарозы было установлено, что подвижность РНК в препарате снижена по сравнению с подвижностью исходной (субстанция РНК), но структура ее сохраняется (Рис. 1). Аналогичное сохранение РНК было установлено после хранения препарата в течение 90 суток в условиях холодильника, при 6°C.
На Рис. 2 приведена Электрофореграмма (1%-ный гель агарозы, окрашивание бромистым этидием) образцов РНК, диффундировавшей в раствор через 2, 4 и 8 ч из микрокапсул. И - исходная (субстанция РНК).
Слева препарат на основе дрожжевой РНК, справа - двуспиральная РНК бактериофага.
5. Определение иммуностимулирующих свойств препаратов
Для определения фагоцитарной активности использовали двухмесячных сирийских (золотистых) хомяков с массой тела 90-110 г, по 5 голов в каждой группе, полученных из питомника. Для этого им скармливали по 0,2 г препарата. Через 6 и 24 ч брали на анализ кровь и выделяли макрофаги. В качестве объекта фагоцитоза использовали частицы туши. Фагоцитарную активность определяли по фагоцитарному индексу (ФИ) общепринятым способом [10].
Биологическую активность образцов Рикальцина оценивали на хомяках по его способности повышать фагоцитарную активность макрофагов, определяя фагоцитарный индекс.
На Рис. 3 приведен фагоцитарный индекс макрофагов после введения препарата Рикальцина.
Различия с контролем (капсулы, не содержащие РНК) достоверны при P<0,05.
Как видно из графика (Рис. 3), повышение активности наблюдалось через 6 ч после введения препарата, эффект стимуляции усиливался через 24 ч. Эти данные согласуются с результатами работы авторов [11], которые использовали введение препарата вирусоподобных частиц из дрожжей, содержащих РНК.
Результат, достигаемый при использовании изобретения, заключается в таком подборе ингредиентов, который позволяет, с одной стороны, поддерживать и стимулировать иммунную систему организма, благодаря наличию РНК в составе. С другой стороны, предлагаемая БАД будет обеспечивать организм микроэлементами, необходимыми для его нормального функционирования и пищевыми волокнами, оказывающими регулирующее воздействие на обмен веществ.
Также следует отнести к достоинствам БАД сублингвальный способ приема: в этом случае компоненты не будут подвергаться деградирующему воздействию желудочного сока и пищеварительных ферментов.
Технологический процесс получение привлекателен отсутствием технически сложных приемов и состоит из следующих несложных стадий: растворение, смешивание, формование.
Полезность БАД и отсутствие технических сложных решений при изготовлении, может способствовать освоению широкого промышленного выпуска препарата.
Препарат, получаемый в форме пластин, применяется сублингвально в качестве БАД. Рекомендуемая профилактическая доза по одной пластинке ежедневно при угрозе возможной инфекции.
Использованные источники информации
1. Интерфероногены: перспективы клинического применения. Руководство для врачей. Под редакцией М.Г. Романцова. НТФФ "Полисан", Москва - Санкт-Петербург, 1998.
2. ФС 42-3862-99 утверждена 20 января 2000 года «РИДОСТИН - противовирусный препарат, иммуностимулятор, индуктор интерферона».
3. ФСП 42-0197-06-16-00 утверждена 6 декабря 2000 года «РИДОСТИН-МАЗЬ - противовирусный препарат, индуктор интерферона».
4. Что такое Ларифан. URL http://www.larifans.lv/
5. Применение ридостина для лечения вирусных и бактериальных инфекций и перспективы его применения при лечении заболеваний неинфекционной природы. Сб. мат-ов "Круглого стола" науч. конф. / Минздрав РФ. Сиб. отд-ние РАМН. ГНЦ ВБ "Вектор". НИКТИ БАВ ГНЦ ВБ "Вектор". Межрегион. ассоциации "Здравоохранение Сибири", - Бердск, 1998. - 81 с.
6. ФС 42-3862-99, утверждена 20 января 2000 года.
7. ФСП 42-0197-5044-04 (лиофилизат) / ЛС-000381 от 03.08.2010.
8. ФСП 42-0088-7009-05,2006, Реополиглюкин.
9. ТУ 9381-018-00479979-01, Полирибонат.
10. Стенко М.И. Справочник по клиническим методам исследования. - М., 1975. - С. 56-57.
11. Shevchenko Z.A., Lebedev L.R., Klimenko V.P. et al. Production methods and properties of virus-like particles of Saccharomyces cerevisiae yeast killer strain/Applied Biochemistry and Microbiology. 2015. T. 51. №8. C. 812-817.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ВИРУСОМ ГРИППА ПТИЦ A/H5N1, С ИСПОЛЬЗОВАНИЕМ ИНДУКТОРА ИНТЕРФЕРОНА И ИНГИБИТОРА НЕЙРАМИНИДАЗЫ | 2008 |
|
RU2398596C2 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО | 1996 |
|
RU2123339C1 |
| ИНДУКТОР ИНТЕРФЕРОНА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ | 1999 |
|
RU2172631C2 |
| СПОСОБ ЛЕЧЕНИЯ ГРИППА ПТИЦ | 2012 |
|
RU2502512C2 |
| ИНДУКТОР ИНТЕРФЕРОНА РИДОСТИН | 1993 |
|
RU2083221C1 |
| Способ профилактики желудочно-кишечных болезней молодняка крупного рогатого скота | 2019 |
|
RU2722161C1 |
| Интраназальное противовирусное средство | 2023 |
|
RU2833350C1 |
| ТАБЛЕТКА ДЛЯ РАССАСЫВАНИЯ, СОДЕРЖАЩАЯ ЧЕЛОВЕЧЕСКИЙ ИНТЕРФЕРОН И/ИЛИ ИНДУКТОР ИНТЕРФЕРОНА, ОБЛАДАЮЩАЯ ПРОТИВОВИРУСНЫМ ДЕЙСТВИЕМ (ВАРИАНТЫ) | 2004 |
|
RU2277932C2 |
| Способ повышения клеточного иммунитета лабораторных животных | 2018 |
|
RU2709809C1 |
| СРЕДСТВО И СПОСОБ ПОВЫШЕНИЯ РЕЗИСТЕНТНОСТИ К ИНФЕКЦИИ | 2001 |
|
RU2191594C1 |
Изобретение относится к фармацевтической промышленности и медицине, в частности иммунологии, и представляет собой композицию, обладающую иммуностимулирующим действием для сублингвального применения, состоящую из двуспиральной РНК бактериофага Ф6 в количестве 0,5±0,1 мг, одноцепочечной дрожжевой РНК в количестве 4,5±0,5 мг, пектина в количестве 21±3 мг, лактата кальция в количестве 15±3 мг, декстрана в количестве 100±10 мг, хлорида натрия в количестве 9±1 мг и воды очищенной до 1 мл. Изобретение обеспечивает иммуностимулирующее действие, а также возможность получения стабильной композиции. 2 табл., 3 ил.
Композиция, обладающая иммуностимулирующим действием для сублингвального применения, состоящая из двуспиральной РНК бактериофага Ф6, одноцепочечной дрожжевой РНК, пектина, лактата кальция, декстрана, хлорида натрия и воды очищенной, при следующем соотношении компонентов:
| ИНДУКТОР ИНТЕРФЕРОНА РИДОСТИН | 1993 |
|
RU2083221C1 |
| СУХАЯ ФОРМА БИОЛОГИЧЕСКИ АКТИВНОЙ ДОБАВКИ К ПИЩЕ НА ОСНОВЕ ЦИСТ РАЧКА РОДА Artemia | 2014 |
|
RU2550025C1 |
| Приспособление к проекционному фонарю для обслуживания его с расстояния | 1928 |
|
SU13468A1 |
| WO 2017077520 A1, 11.05.2017 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Практический комментарий Федерального закона РФ "О рекламе", 2001 г., найдено в Интернет: http://www.law.edu.ru/doc/document.asp?docID=1114972. | |||
Авторы
Даты
2018-03-15—Публикация
2017-05-31—Подача