Настоящее изобретение относится к органическим соединениям, полезным для терапии или профилактики у млекопитающего, и, в частности, к ингибиторам белка, связывающего жирные кислоты (FABP; от англ. "fatty-acid binding protein"), 4 и/или 5, более конкретно к двойным ингибиторам FABP 4/5, для лечения или профилактики, например, диабета типа 2, атеросклероза, хронических заболеваний почек, неалкогольного стеатогепатита и рака.
В настоящем изобретении предложены новые соединения формулы (I)
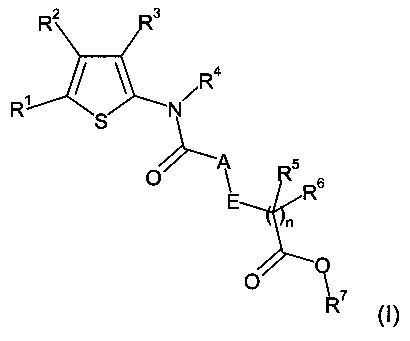
где
R1 и R2 независимо выбраны из H, алкила, галогеналкила, алкоксиалкила, галогеналкоксиалкила, циклоалкила, циклоалкилалкила, галогенциклоалкила, галогенциклоалкилалкила, замещенного арила, замещенного арилалкила, замещенного гетероциклоалкила, замещенного гетероциклоалкилалкила, замещенного гетероарила, замещенного гетероарилалкила, замещенного аминокарбонила, алкоксикарбонила, галогеналкоксикарбонила и карбокси, где замещенный арил, замещенный арилалкил, замещенный гетероциклоалкил, замещенный гетероциклоалкилалкил, замещенный гетероарил и замещенный гетероарилалкил замещены R14, R15 и R16, и где замещенный аминокарбонил замещен на атоме азота заместителями в количестве от одного до двух, независимо выбранными из H, алкила, циклоалкила, галогеналкила, алкилциклоалкила, циклоалкилалкила, алкилциклоалкилалкила, гидроксиалкила и алкоксиалкила;
R3 представляет собой замещенный арил, замещенный арилалкил, замещенный гетероциклоалкил, замещенный гетероциклоалкилалкил, замещенный гетероарил или замещенный гетероарилалкил, где замещенный арил, замещенный арилалкил, замещенный гетероциклоалкил, замещенный гетероциклоалкилалкил, замещенный гетероарил и замещенный гетероарилалкил замещены R17, R18 и R19;
R4 представляет собой H или алкил;
R5 и R6 независимо выбраны из H, алкила и циклоалкила;
R7 представляет собой H, алкил или циклоалкил;
A представляет собой NR8 или CR9R10;
E представляет собой NR11 или CR12R13;
R8 и R11 независимо выбраны из H, алкила, галогеналкила, циклоалкила, галогенциклоалкила, циклоалкилалкила или галогенциклоалкилалкила;
R9, R10, R12 и R13 независимо выбраны из H, атома галогена, алкила, галогеналкила или циклоалкила;
либо R5 и R12 вместе с атомами углерода, к которым они присоединены, образуют замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил или замещенный гетероарил, где замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил и замещенный гетероарил замещены R20 и могут быть дополнительно замещены R21 и/или R22, где в случае, когда R5 и R12 вместе с атомами углерода, к которым они присоединены, образуют замещенный арил или замещенный гетероарил, R6 и R13 отсутствуют;
либо R8 и R12 вместе с атомами азота и углерода, к которым они присоединены, образуют замещенный гетероциклоалкил или замещенный гетероарил, где замещенный гетероциклоалкил и замещенный гетероарил замещены R20 и могут быть дополнительно замещены R21 и/или R22, где в случае, когда R8 и R12 вместе с атомами углерода, к которым они присоединены, образуют замещенный гетероарил, R13 отсутствует;
либо R9 и R11 вместе с атомами азота и углерода, к которым они присоединены, образуют замещенный гетероциклоалкил или замещенный гетероарил, где замещенный гетероциклоалкил и замещенный гетероарил замещены R20 и могут быть дополнительно замещены R21 и/или R22, где в случае, когда R9 и R11 вместе с атомами углерода, к которым они присоединены, образуют замещенный гетероарил, R10 отсутствует;
либо R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил или замещенный гетероарил, где замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил и замещенный гетероарил замещены R20 и могут быть дополнительно замещены R21 и/или R22, где в случае, когда R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют замещенный арил или замещенный гетероарил, R10 и R13 отсутствуют;
либо R10 и R13 вместе с атомами углерода, к которым они присоединены, образуют замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил или замещенный гетероарил, где замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил и замещенный гетероарил замещены R23 и могут быть дополнительно замещены R24 и/или R25, где в случае, когда R10 и R13 вместе с атомами углерода, к которым они присоединены, образуют замещенный арил или замещенный гетероарил, R9 и R12 отсутствуют;
либо R10 и R13 вместе с атомами углерода, к которым они присоединены, образуют двойную связь;
R14, R15, R16, R17, R18, R19, R20, R21, R23, R24 и R25 независимо выбраны из H, гидрокси, оксо, атома галогена, алкила, галогеналкила, циклоалкила, галогенциклоалкила, алкокси, галогеналкокси, алкоксиалкила, галогеналкоксиалкила, алкоксикарбонила, карбокси и амино, замещенного на атоме азота заместителями в количестве от одного до двух, независимо выбранными из H, алкила, циклоалкила, галогеналкила, алкилциклоалкила, циклоалкилалкила, алкилциклоалкилалкила, гидроксиалкила и алкоксиалкила;
n равно нулю или 1;
или их фармацевтически приемлемые соли.
Белки FABP4 (aP2) и FABP5 (mal1) являются членами семейства белков, связывающих жирные кислоты. Белки FABP представляют собой белки, имеющие молекулярную массу 14-15 КДа, действующие в качестве шаперонов для жирных кислот в водной среде цитозоля, и способствующие их перемещению между клеточными компартментами. К настоящему времени идентифицировано по меньшей мере девять членов этого семейства с тканеспецифическим паттерном экспрессии. FABP4 экспрессируется, в основном, в адипозной ткани и в макрофагах, но также в других типах клеток, тогда как FABP5 экспрессируется в широком ряде тканей и органов. Белки FABP ответственны за перенос жирных кислот в различные клеточные компартменты и, следовательно, вовлечены в ключевые клеточные функции, такие как запасание липидов в адипоцитах, окисление жирных кислот в митохондриях, передача сигнала в эндоплазматическом ретикулуме (ЭПР), экспрессия генов, зависимых от жирных кислот, регуляция активности цитозольных ферментов, модулирование воспалительного ответа и синтез лейкотриенов. Плазматический FABP4 секретируется адипозной тканью у мышей, где регуляция секреции нарушается при ожирении, и блокирование плазматического FABP4 антителами in vivo повышает чувствительность к инсулину.
Несколько генетических данных у человека подтверждает роль FABP4 и FABP5 при метаболических заболеваниях. Мутация в промоторе FABP4 (SNP Т-87С), приводящая к 50% снижению экспрессии гена, связана со сниженным риском сердечно-сосудистых заболеваний (ССЗ) и диабета типа 2 (Т2Д) и со сниженными плазматическими триглицеридами (ТГ). Две мутации в гене FABP5, одна в 54JTR (rs454550), одна в промоторе (nSNP), связаны, соответственно, с повышенным (OR 4.24) и сниженным (OR 0.48) риском Т2Д. Кроме того, было показано, что уровни белка и мРНК FABP4 в макрофагах атеросклеротических бляшек связаны с нестабильностью бляшек и смертью от ССЗ. Наконец, в большом числе публикаций описана связь между уровнями FABP4 и FABP5 в плазме и тяжестью метаболических заболеваний. Повышенные уровни FABP4 в плазме связаны с атерогенной дислипидемией, сниженной функцией эндотелия, увеличенной толщиной комплекса интима-медиа (ИМ), метаболическим синдромом, ожирением и инсулинорезистентностью (ИР). Повышенные уровни FABP5 в плазме связаны с метаболическим синдромом.
Генетические и фармакологические исследования на мышах в значительной степени подтверждают данные, полученные для человека. Было продемонстрировано, что утрата функции FABP4 и FABP5 повышает чувствительность к инсулину, снижает глюкозу и защищает против атеросклероза. Нокаут-мыши по FABP4 на рационе с высоким содержанием жиров проявляли улучшение метаболизма, регулируемое компенсаторной повышающей регуляцией FABP5 в адипозной ткани. У мышей с делецией гена FABP5 на рационе с высоким содержанием жиров (HF; от англ. "high fat") показано снижение массы тела и улучшенная толерантность к глюкозе и инсулину. Двойные нокаут-мыши FABP4/FABP5 были в высокой степени защищены от гипергликемии, инсулинорезистентности и стеатоза печени. Кроме того, на фоне дефицита ApoE делеция FABP4 и FABP5 обладала высоким защитным действием против развития атеросклероза и увеличивала продолжительность жизни. В клэмп-тесте у мышей ob/ob показано снижение продуцирования глюкозы в печени, повышенный захват глюкозы в мышцах и адипозной ткани и уменьшение стеатоза печени специфичным ингибитором FABP4 (BMS309403), но не показано изменение массы тела и потребления энергии. Под действием этого ингибитора показано также снижение образования атеросклеротических бляшек у мышей ApoE KO. Двойной ингибитор FABP4/5, представляющий собой Соединение 3, раскрытое в статье Journal of Lipid Research 2011, 52, 646, у мышей на рационе HF показал снижение триглицеридов и свободных жирных кислот в плазме, но не показал повышение толерантности к инсулину и глюкозе.
Объектами настоящего изобретения являются соединения формулы (I) и их упомянутые выше соли и сложные эфиры, а также их применение в качестве терапевтически активных веществ, способ получения данных соединений, промежуточные соединения, фармацевтические композиции, лекарственные средства, содержащие данные соединения, их фармацевтически приемлемые соли или сложные эфиры, применение данных соединений, солей или сложных эфиров для лечения или профилактики заболеваний, в частности, при лечении или профилактике диабета типа 2, метаболического синдрома, атеросклероза, дислипидемии, заболеваний печени, включающих воспаление, стеатоз и/или фиброз, таких как неалкогольная жировая болезнь печени, в частности, неалкогольный стеатогепатит, ожирения, липодистрофии, такой как наследственная и ятрогенная липодистрофия, рака, глазных заболеваний, поддерживаемых за счет пролиферации эндотелия и ангиогенеза, таких как макулярная дегенерация и ретинопатия, заболеваний легких, таких как астма, бронхолегочная дисплазия и хроническая обструктивная болезнь легких, саркоидоза, хронических заболеваний почек, таких как васкулит, фокальный сегментарный гломерулосклероз, диабетическая нефропатия, волчаночный нефрит, поликистоз почек и хронический тубулоинтерстициальный нефрит, индуцированный лекарственным средством или токсином, хронических воспалительных и аутоиммунных воспалительных заболеваний, преэклампсии и синдрома поликистоза яичников, и применение данных соединений, солей или сложных эфиров для получения лекарственных средств для лечения или профилактики диабета типа 2, метаболического синдрома, атеросклероза, дислипидемии, заболеваний печени, включающих воспаление, стеатоз и/или фиброз, таких как неалкогольная жировая болезнь печени, в частности, неалкогольный стеатогепатит, ожирения, липодистрофии, такой как наследственная и ятрогенная липодистрофия, рака, глазных заболеваний, поддерживаемых за счет пролиферации эндотелия и ангиогенеза, таких как макулярная дегенерация и ретинопатия, заболеваний легких, таких как астма, бронхолегочная дисплазия и хроническая обструктивная болезнь легких, саркоидоза, хронических заболеваний почек, таких как васкулит, фокальный сегментарный гломерулосклероз, диабетическая нефропатия, волчаночный нефрит, поликистоз почек и хронический тубулоинтерстициальный нефрит, индуцированный лекарственным средством или токсином, хронических воспалительных и аутоиммунных воспалительных заболеваний, преэклампсии и синдрома поликистоза яичников.
Соединения по настоящему изобретению являются ингибиторами FABP4 и/или 5, более конкретно двойными ингибиторами FABP 4 и 5. Некоторые конкретные соединения формулы (I) по настоящему изобретению также являются селективными ингибиторами FABP 4 и/или 5 по сравнению с FABP3 и/или 1.
Термин "алкокси" обозначает группу формулы -O-R', где R' представляет собой алкильную группу. Примеры алкоксигруппы включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси и трет-бутокси. Конкретная алкоксигруппа включает метокси, этокси и изопропокси. Более конкретная алкоксигруппа представляет собой метокси.
Термин "алкоксиалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен алкоксигруппой. Иллюстративные алкоксиалкильные группы включают метоксиметил, этоксиметил, метоксиэтил, этоксиэтил, метоксипропил и этоксипропил. Конкретная алкоксиалкильная группа включает метоксиметил и метоксиэтил. Более конкретная алкоксиалкильная группа представляет собой метоксиэтил.
Термин "алкоксикарбонил" обозначает группу формулы -C(O)-R', где R' представляет собой алкоксигруппу. Примеры алкоксикарбонильной группы включают группу, где R' представляет собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси и трет-бутокси. Конкретные алкоксикарбонильные группы включают группу, где R' представляет собой метокси, этокси, изопропокси и трет-бутокси. Более конкретная алкоксикарбонильная группа представляет собой группу, где R' представляет собой метокси или этокси.
Термин "алкил" обозначает одновалентную нормальную или разветвленную насыщенную углеводородную группу из атомов углерода в количестве от 1 до 12, в частности, из атомов углерода в количестве от 1 до 7, более конкретно из атомов углерода в количестве от 1 до 4, например, метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Конкретный алкил представляет собой метил.
Термин "алкилциклоалкил" обозначает циклоалкильную группу, где по меньшей мере один из атомов водорода циклоалкильной группы замещен алкильной группой. Примеры алкилциклоалкила включают метил-циклопропил, диметил-циклопропил, метил-циклобутил, диметил-циклобутил, метил-циклопентил, диметил-циклопентил, метил-циклогексил и диметил-циклогексил. Конкретные алкилциклоалкильные группы включают метил-циклопропил и диметил-циклопропил.
Термин "алкилциклоалкилалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен алкилциклоалкильной группой. Примеры алкилциклоалкилалкила включают метил-циклопропилметил, диметил-циклопропилметил, метил-циклопропилэтил, диметил-циклопропилэтил, метил-циклобутилметил, диметил-циклобутилметил, метил-циклобутилэтил, диметил-циклобутилэтил, метил-циклопентилметил, диметил-циклопентилметил, метил-циклопентилэтил, диметил-циклопентилэтил, метил-циклогексилметил, диметил-циклогексилметил, метил-циклогексилэтил, диметил-циклогексилэтил, метил-циклогептилметил, диметил-циклогептилметил, метил-циклогептилэтил, диметил-циклогептилэтил, метил-циклооктилметил, диметил-циклооктилметил, метил-циклооктилэтил и диметил-циклооктилэтил.
Термин "амино" обозначает группу -NH2.
Термин "аминокарбонил" обозначает группу формулы -C(O)-NH2.
Термин "арил" обозначает одновалентную ароматическую карбоциклическую моно- или бициклическую кольцевую систему, содержащую от 6 до 10 кольцевых атомов углерода. Примеры арильных группировок включают фенил и нафтил. Конкретная арильная группа представляет собой фенил.
Термин "арилалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен арильной группой. Примеры арилалкила включают фенилметил и фенилэтил.
Термин "карбонил" обозначает группу -C(О)-.
Термин "карбокси" обозначает группу -C(O)OH.
Термин "циклоалкенил" обозначает одновалентную, ненасыщенную неароматическую моноциклическую или бициклическую углеводородную группу из кольцевых атомов углерода в количестве от 3 до 8. Конкретные циклоалкенильные группы являются моноциклическими. Примеры циклоалкенильных групп включают циклобутенил, циклопентенил и циклогексенил.
Термин "циклоалкил" обозначает одновалентную насыщенную моноциклическую или бициклическую углеводородную группу из кольцевых атомов углерода в количестве от 3 до 10, в частности, одновалентную насыщенную моноциклическую углеводородную группу из кольцевых атомов углерода в количестве от 3 до 8. Бициклическая группа означает группу, состоящую из двух насыщенных или частично ненасыщенных карбоциклов, имеющих два общих атома углерода. Конкретные циклоалкильные группы представляют собой циклопропил, циклобутил, циклопентил, циклогексил, циклогептанил, бицикло[2.2.2]гептанил, бицикло[2.2.2]октанил, замещенный бицикло[2.2.2]гептанил и замещенный бицикло[2.2.2]октанил.
В случае R1, R2, R17, R18 и R19 конкретным примером циклоалкила является циклопропил.
В случае циклоалкила, образованного R9 и R12 вместе с атомами углерода, к которым они присоединены, конкретные примеры циклоалкила представляют собой циклопентил, циклогексил и бицикло[2.2.2]октанил.
Термин "циклоалкилалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен циклоалкильной группой. Примеры циклоалкилалкила включают циклопропилметил, циклопропилэтил, циклобутил пропил и циклопентилбутил.
Термин "галогеналкокси" обозначает алкоксигруппу, где по меньшей мере один из атомов водорода алкоксигруппы замещен одинаковыми или разными атомами галогена. Термин "пергалогеналкокси" обозначает алкоксигруппу, где все атомы водорода алкоксигруппы замещены одинаковыми или разными атомами галогена. Примеры галогеналкокси включают фторметокси, дифторметокси, трифторметокси, трифторэтокси, трифторметилэтокси, трифтордиметилэтокси и пентафторэтокси. Конкретные галогеналкоксигруппы представляют собой трифторметокси, трифторэтокси и трифторметилэтокси.
Термин "галогеналкоксиалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен галогеналкоксигруппой. Примеры галогеналкоксиалкила включают фторметоксиметил, дифторметоксиметил, трифторметоксиметил, фторэтоксиметил, дифторэтоксиметил, трифторэтоксиметил, фторметоксиэтил, дифторметоксиэтил, трифторметоксиэтил, фторэтоксиэтил, дифторэтоксиэтил, трифторэтоксиэтил, фторметоксипропил, дифторметоксипропил, трифторметоксипропил, фторэтоксипропил, дифторэтоксипропил и трифторэтоксипропил. Конкретный галогеналкоксиалкил представляет собой 2,2-дифторэтоксиэтил.
Термин "галогеналкоксикарбонил" обозначает группу формулы -C(O)-R', где R' представляет собой галогеналкоксигруппу. Примеры галогеналкоксикарбонильных групп включают группу формулы -C(O)-R', где R' представляет собой фторметокси, дифторметокси, трифторметокси, трифторэтокси, трифторметилэтокси, трифтордиметилэтокси или пентафторэтокси.
Термин "галогеналкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен одинаковыми или разными атомами галогена. Термин "пергалогеналкил" обозначает алкильную группу, где все атомы водорода алкильной группы замещены одинаковыми или разными атомами галогена. Примеры галогеналкила включают фторметил, дифторметил, трифторметил, трифторэтил, трифторметилэтил и пентафторэтил. Конкретные галогеналкильные группы представляют собой трифторметил и трифторэтил.
Термин "галогенциклоалкил" обозначает циклоалкильную группу, где по меньшей мере один из атомов водорода циклоалкильной группы замещен одинаковыми или разными атомами галогена, в частности, атомами фтора. Примеры галогенциклоалкильных групп включают фторциклопропил, дифторциклопропил, фторциклобутил и дифторциклобутил.
Термин "галогенциклоалкилалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен галогенциклоалкилом. Примеры галогенциклоалкилалкильных групп включают фторциклопропилметил, фторциклопропилэтил, дифторциклопропилметил, дифторциклопропилэтил, фторциклобутилметил, фторциклобутилэтил, дифторциклобутилметил и дифторциклобутилэтил.
Термин "атом галогена" и "галоген" используют в настоящем описании взаимозаменяемо, и они обозначают атом фтора, хлора, брома или йода. Конкретными атомами галогена являются атомы хлора и фтора. Более конкретный атом галогена представляет собой атом фтора.
Термин "гетероарил" обозначает одновалентную ароматическую гетероциклическую моно- или бициклическую кольцевую систему из кольцевых атомов в количестве от 5 до 12, содержащую 1, 2, 3 или 4 гетероатома, выбранных из N, O и S, где остальные кольцевые атомы представляют собой атомы углерода. Примеры гетероарильных группировок включают пирролил, фуранил, тиенил, имидазолил, оксазолил, тиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридинил, пиразинил, пиразолил, пиридазинил, пиримидинил, триазинил, азепинил, диазепинил, изоксазолил, бензофуранил, изотиазолил, бензотиенил, индолил, изоиндолил, изобензофуранил, бензимидазолил, бензоксазолил, бензоизоксазолил, бензотиазолил, бензоизотиазолил, бензоксадиазолил, бензотиадиазолил, бензотриазолил, пуринил, хинолинил, изохинолинил, хиназолинил или хиноксалинил. Конкретные гетероарильные группы представляют собой оксадиазолил, оксазолил, тиазолил, тиадиазолил, пиридинил или пиримидинил. Более конкретные гетероарильные группы представляют собой [1,2,4]-оксадиазолил, тиазолил и тиадиазолил.
В случае R1 и R2 конкретная гетероарильная группа представляет собой тиадиазолил.
В случае R3 конкретные гетероарильные группы представляют собой тиазолил, [1,2,4]-тиадиазолил и [1,2,4]-оксадиазолил.
Термин "гетероарилалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен гетероарильной группой.
Термин "гетероциклоалкил" обозначает одновалентную насыщенную или частично ненасыщенную моно- или бициклическую кольцевую систему из кольцевых атомов в количестве от 4 до 9, содержащую 1, 2 или 3 кольцевых гетероатома, выбранных из N, O и S, где остальные кольцевые атомы представляют собой атомы углерода. Бициклическая группа означает группу, состоящую из двух циклов, имеющих два общих кольцевых атома, то есть мостик, разделяющий два кольца, представляет собой либо простую связь, либо цепь, состоящую из одного или двух кольцевых атомов. Примерами моноциклического насыщенного гетероциклоалкила являются следующие группы: 4,5-дигидро-оксазолил, оксетанил, азетидинил, пирролидинил, 2-оксо-пирролидин-3-ил, тетрагидрофуранил, тетрагидротиенил, пиразолидинил, имидазолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, пиперидинил, тетрагидропиранил, тетрагидротиопиранил, пиперазинил, морфолинил, тиоморфолинил, 1,1-диоксо-тиоморфолин-4-ил, азепанил, диазепанил, гомопиперазинил или оксазепанил. Примерами бициклического насыщенного гетероциклоалкила являются следующие группы: 8-аза-бицикло[3.2.1]октил, хинуклидинил, 8-окса-3-аза-бицикло[3.2.1]октил, 9-аза-бицикло[3.3.1]нонил, 3-окса-9-аза-бицикло[3.3.1]нонил или 3-тиа-9-аза-бицикло[3.3.1]нонил. Примерами частично ненасыщенного гетероциклоалкила являются следующие группы: дигидрофурил, имидазолинил, дигидро-оксазолил, тетрагидро-пиридинил или дигидропиранил. Более конкретным примером гетероциклоалкильной группы является оксетанил.
Термин "гетероциклоалкилалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен гетероциклоалкильной группой.
Термин "гидрокси" обозначает группу -OH.
Термин "гидроксиалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен гидроксигруппой. Примеры гидроксиалкила включают гидроксиметил, гидроксиэтил, гидроксипропил, гидроксиметилпропил и дигидроксипропил. Конкретными примерами являются гидроксиметил и гидроксиэтил.
Термин "оксо" обозначает группу =O.
Термин "фармацевтически приемлемые соли" относится к солям, сохраняющим биологическую эффективность и свойства свободных оснований или свободных кислот, и не являющимся ни биологически, ни иначе нежелательными. Соли образуют с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, в частности, соляная кислота, и с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин и тому подобное. Кроме того, эти соли могут быть получены путем присоединения неорганического основания или органического основания к свободной кислоте. Соли, образованные из неорганического основания, включают, но не ограничены ими, соли натрия, калия, лития, аммония, кальция, магния и тому подобное. Соли, образованные из органических оснований, включают, но не ограничены ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полииминные смолы и тому подобное. Конкретные фармацевтически приемлемые соли соединений формулы (I) представляют собой соли гидрохлориды, соли метансульфоновой кислоты и соли лимонной кислоты. Конкретные фармацевтически приемлемые соли соединений формулы (I) также представляют собой соли натрия и калия.
"Фармацевтически приемлемые сложные эфиры" означают, что соединения общей формулы (I) могут быть дериватизированы при функциональных группах с получением производных, способных к обратному преобразованию в исходные соединения in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные сложноэфирные производные, такие как метоксиметиловые эфиры, метилтиометиловые эфиры и пивалоилоксиметиловые эфиры. Кроме того, любые физиологически приемлемые эквиваленты соединений общей формулы (I), подобные метаболически лабильным сложным эфирам, способные образовывать исходные соединения общей формулы (I) in vivo, находятся в пределах объема данного изобретения.
Термин "защитная группа" (PG; от англ. "protecting group") обозначает группу, селективно блокирующую активный сайт в многофункциональном соединении, таким образом, что химическую реакцию можно проводить селективно при другом незащищенном активном сайте, в значении, традиционно связанном с данным термином в химии синтеза. Защитные группы могут быть удалены в подходящий момент. Иллюстративные защитные группы представляют собой амино-защитные группы, карбокси-защитные группы или гидрокси-защитные группы. Конкретные защитные группы представляют собой трет-бутоксикарбонил (Boc), бензилоксикарбонил (Cbz), флуоренилметоксикарбонил (Fmoc) и бензил (Bn). Более конкретные защитные группы представляют собой трет-бутоксикарбонил (Boc) и флуоренилметоксикарбонил (Fmoc). Более конкретная защитная группа представляет собой трет-бутоксикарбонил (Boc).
Соединения формулы (I) могут содержать несколько асимметрических центров и могут находиться в форме оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы, оптически чистых диастереоизомеров, смесей диастереоизомеров, диастереоизомерных рацематов или смесей диастереоизомерных рацематов.
Согласно правилу Кана-Ингольда-Прелога асимметрический атом углерода может иметь "R" или "S" конфигурацию.
Воплощение настоящего изобретения также представляет собой соединения согласно формуле (I), как раскрыто в данном описании, и их фармацевтически приемлемые соли или сложные эфиры, в частности, соединения согласно формуле (I), как раскрыто в данном описании, и их фармацевтически приемлемые соли, более конкретно соединения согласно формуле (I), как раскрыто в данном описании.
Следующее воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R1 и R2 независимо выбраны из H, алкила, галогеналкила, циклоалкила, замещенного гетероциклоалкила, замещенного гетероарила, замещенного аминокарбонила и алкоксикарбонила, где замещенный гетероциклоалкил и замещенный гетероарил замещены R14, R15 и R16, и где замещенный аминокарбонил замещен на атоме азота заместителями в количестве от одного до двух, независимо выбранными из H, алкила, циклоалкила, галогеналкила, алкилциклоалкила, циклоалкилалкила, алкилциклоалкилалкила, гидроксиалкила и алкоксиалкила.
Конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R1 и R2 независимо выбраны из H, алкила, галогеналкила, циклоалкила, замещенного гетероциклоалкила, замещенного гетероарила, замещенного аминокарбонила и алкоксикарбонила, где замещенный гетероциклоалкил и замещенный гетероарил замещены R14, R15 и R16, и где замещенный аминокарбонил замещен на атоме азота двумя заместителями, независимо выбранными из алкила.
Конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R1 представляет собой H, алкил, галогеналкил, циклоалкил, замещенный гетероциклоалкил, замещенный гетероарил, замещенный аминокарбонил и алкоксикарбонил, где замещенный гетероциклоалкил и замещенный гетероарил замещены R14, R15 и R16, и где замещенный аминокарбонил замещен на атоме азота двумя заместителями, независимо выбранными из H, алкила, циклоалкила, галогеналкила, алкилциклоалкила, циклоалкилалкила, алкилциклоалкилалкила, гидроксиалкила и алкоксиалкила.
В следующем воплощении настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R1 представляет собой алкил или циклоалкил.
Следующее воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R2 представляет собой H, алкил, галогеналкил или циклоалкил.
Другое воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R2 представляет собой алкил или галогеналкил.
Другое конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R1 и R2 независимо выбраны из H, алкила или циклоалкила.
Настоящее изобретение также относится к соединениям согласно формуле (I), как раскрыто в данном описании, где R1 и R2 представляют собой алкил.
Следующее конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R3 представляет собой замещенный арил или замещенный гетероарил, где замещенный арил и замещенный гетероарил замещены R17, R18 и R19.
Более конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R3 представляет собой гетероарил, замещенный R17, R18 и R19.
Воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R3 представляет собой пирролидинил, замещенный [1,2,4]-оксадиазолил, оксазолил, замещенный тиазолил, замещенный [1,2,4]тиадиазол-5-ил или пиримидинил, где замещенный [1,2,4]-оксадиазолил, замещенный [1,2,4]тиадиазол-5-ил и замещенный тиазолил замещены R17.
Воплощение настоящего изобретения также представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R3 представляет собой пирролидинил, замещенный [1,2,4]-оксадиазолил, оксазолил, замещенный тиазолил или пиримидинил, где замещенный[1,2,4]-оксадиазолил и замещенный тиазолил замещены R17.
Настоящее изобретение также относится к соединениям согласно формуле (I), как раскрыто в данном описании, где R3 представляет собой замещенный [1,2,4]-оксадиазолил или замещенный [1,2,4]тиадиазол-5-ил, где замещенный[1,2,4]-оксадиазолил и замещенный [1,2,4]тиадиазол-5-ил замещены R17.
Другое воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R3 представляет собой [1,2,4]-оксадиазолил, замещенный R17.
Следующее конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R4 представляет собой H.
Конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R7 представляет собой H.
Воплощение настоящего изобретения также представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где A представляет собой CR9R10.
Следующее конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где E представляет собой CR12R13.
Следующее конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где в случае, когда A представляет собой NR8, E представляет собой CR12R13.
Следующее конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где в случае, когда E представляет собой NR11, A представляет собой CR9R10.
Настоящее изобретение также относится к соединениям согласно формуле (I), как раскрыто в данном описании, где R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил или замещенный гетероарил, где замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил и замещенный гетероарил замещены R20 и могут быть дополнительно замещены R21 и/или R22, где в случае, когда R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют замещенный арил или замещенный гетероарил, R10 и R13 отсутствуют.
Другое воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют циклоалкил, замещенный R20.
Другое воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют циклопентил, циклогексил или бицикло[2.2.2]октил.
Настоящее изобретение также относится к соединениям согласно формуле (I), как раскрыто в данном описании, где R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют циклопентил или циклогексил.
Воплощение настоящего изобретения также представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R10 и R13 вместе с атомами углерода, к которым они присоединены, образуют двойную связь.
Воплощение настоящего изобретения также представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R14, R15, R16, R17, R18, R19, R20, R21, R23, R24 и R25 независимо выбраны из H, алкила, галогеналкила и циклоалкила.
Другое воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R14 представляет собой циклоалкил.
Конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R17 представляет собой H, алкил, галогеналкил или циклоалкил.
Другое конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R17 представляет собой алкил или циклоалкил.
Следующее конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R17 представляет собой циклоалкил.
Более конкретное воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где R18, R19, R20, R21 и R23 представляют собой H.
Конкретное воплощение настоящего изобретения также представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где n равно нулю или 1.
Следующее конкретном воплощение настоящего изобретения представляет собой соединения согласно формуле (I), как раскрыто в данном описании, где
R1 и R2 независимо выбраны из H, алкила, галогеналкила и циклоалкила;
R3 представляет собой гетероарил, замещенный R17;
R4 представляет собой H;
R7 представляет собой H;
A представляет собой CR9R10;
E представляет собой CR12R13;
R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют циклоалкил, замещенный R20;
R10 и R13 вместе с атомами углерода, к которым они присоединены, образуют двойную связь;
R17 представляет собой H, алкил, галогеналкил или циклоалкил;
R20 представляет собой H;
n равно нулю;
или их фармацевтически приемлемые соли.
Конкретные примеры соединений формулы (I), как раскрыто в данном описании, выбраны из следующих соединений:
2-(3-Фенил-тиофен-2-илкарбамоил)-циклопент-1-енкарбоновая кислота;
5-[(3-Карбокси-бицикло[2.2.2]окт-2-ен-2-карбонил)-амино]-3-метил-4-(4-метил-тиазол-2-ил)-тиофен-2-карбоновой кислоты метиловый эфир;
2-[4-Циклопропил-5-метил-3-(3-метил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
3-[4-Циклопропил-5-метил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
2-[5-Циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
3-[5-Циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-метил-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[4-Циклопропил-5-метил-3-(3-метил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
3-[4-Циклопропил-5-метил-3-(3-метил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[4-Циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
3-[4-Циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-метил-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
3-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[4-Циклопропил-5-метил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-5-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4-метил-5-оксетан-3-ил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4-метил-5-оксетан-3-ил-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-5-метил-4-трифторметил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
5-[(2-Карбокси-циклопент-1-енкарбонил)-амино]-4-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-3-метил-тиофен-2-карбоновой кислоты этиловый эфир;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-5-диметилкарбамоил-4-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[5-Циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[4-Циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-5-(2,2,2-трифтор-этил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4-трифторметил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-5-(5-диметиламино-[1,2,4]тиадиазол-3-ил)-4-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
и их фармацевтически приемлемых солей.
Конкретные примеры соединений формулы (I), как раскрыто в данном описании, также выбраны из следующих соединений:
3-[4,5-Диметил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]тиадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]тиадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
3-[3-(3-Циклопропил-[1,2,4]тиадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[5-Циклопропил-4-метил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[5-Циклопропил-4-метил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
3-[5-Циклопропил-4-метил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[5-Циклопропил-3-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-4-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[4,5-Диметил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
3-[5-Циклопропил-3-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-4-метил-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
(1SR,2SR)-2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-циклогексанкарбоновая кислота;
(1RS,2SR)-2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-циклогексанкарбоновая кислота;
2-[4,5-Диметил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
2-[5-Циклопропил-3-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-4-метил-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
5-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-3,6-дигидро-2H-пиран-4-карбоновая кислота;
4-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-5,6-дигидро-2H-пиран-3-карбоновая кислота;
(R)-1-[4,5-Диметил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-пирролидин-2-карбоновая кислота;
и их фармацевтически приемлемых солей.
Следующие конкретные примеры соединений формулы (I), как раскрыто в данном описании, выбраны из следующих соединений:
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
2-[5-Циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-5-метил-4-трифторметил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[4,5-Диметил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
и их фармацевтически приемлемых солей.
Следующие конкретные примеры соединений формулы (I), как раскрыто в данном описании, также выбраны из следующих соединений:
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
2-[5-Циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-5-метил-4-трифторметил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
и их фармацевтически приемлемых солей.
Способы получения соединений формулы (I), как раскрыто в данном описании, являются объектом изобретения.
Получение соединений формулы (I) по настоящему изобретению может быть выполнено в последовательных или конвергентных путях синтеза. Синтезы по изобретению представлены на приведенных ниже общих схемах. Навыки, необходимые для проведения реакции и очистки полученных в результате продуктов, известны специалистам в данной области техники. В том случае, когда в процессе реакции получают смесь энантиомеров или диастереоизомеров, эти энантиомеры или диастереоизомеры можно разделить способами, раскрытыми в данном описании, или известными специалистам в данной области техники, такими как, например, хиральная хроматография или кристаллизация. В том случае, когда одно из исходных веществ или соединений формулы (I) содержит одну или более функциональных групп, являющихся нестабильными или активными в условиях реакции одной или более стадий реакции, подходящие защитные группы могут быть введены перед критической стадией с применением способов, хорошо известных специалистам в данной области техники. Такие защитные группы можно удалить на более поздней стадии синтеза, используя стандартные способы, описанные в литературе. Заместители и индексы, используемые при последующем описании способов, имеют значение, приведенное в данном описании.
В настоящем тексте использованы следующие сокращения:
AcCl = ацетилхлорид, трет-BuOH = трет-бутиловый спирт, CDI = N,N'-карбонилдиимидазол (от англ. "N,N'-carbonyldiimidazole"), CHCl3 = хлороформ, CH2Cl2 = дихлорметан, CH3CN = ацетонитрил, CsCO3 = карбонат цезия, DBU = 1,8-диазабицикло[5.4.0]ундец-7-ен, DCC = N,N'-дициклогексилкарбодиимид (от англ. "N,N'-dicyclohexylcarbodiimide"), DIPEA = диизопропилэтиламин (основание Хюнига), ДМАП = 4-диметиламинопиридин, ДМА = N,N-диметилацетамид, ДМЭ = 1,2-диметоксиэтан, ДМФ = N,N-диметилформамид, ДМСО = диметилсульфоксид, EDCl = 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид, ИЭР = ионизация электрораспылением, EtOAc = этилацетат, EtOH = этанол, Et2O = диэтиловый эфир, ч = час (часы), HATU = O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат, HCl = соляная кислота, H2O = вода, HOBt = 1-гидрокси-1,2,3-бензотриазол, ВЭЖХ = высокоэффективная жидкостная хроматография, K2CO3 = карбонат калия, KF = фторид калия, KHCO3 = бикарбонат калия, LiHMDS = бис(триметилсилил)амид лития, LiOH = гидроксид лития, MeOH = метанол, MgSO4 = сульфат магния, мин = минута (минуты), СДЖХ = жидкостная хроматография среднего давления, МС = масс-спектр, реагент Мукаямы = 2-хлор- или 2-бром-1-метилпиридиния йодид, Na2SO4 = сульфат натрия, NaClO2 = хлорит натрия; NaCN = цианид натрия, NaH = гидрид натрия, NaHCO3 = бикарбонат натрия, NaH2PO4 = дигидрофосфат натрия, NaOEt = этилат натрия, NaOH = гидроксид натрия, NaOMe = метилат натрия, NEt3 = триэтиламин, NH4Cl = хлорид аммония, NH4OAc = ацетат аммония, Pd(Ph3P)4 = тетракис(трифенилфосфин)палладий(0), КТ = комнатная температура, TBAF = тетрабутиламмония фторид (от англ. "tetrabutylammonium fluoride"), TBTU = О-бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат, ТГФ = тетрагидрофуран, ТБМЭ = трет-бутилметиловый эфир, ТФУ = трифторуксусная кислота, ТСХ = тонкослойная хроматография.
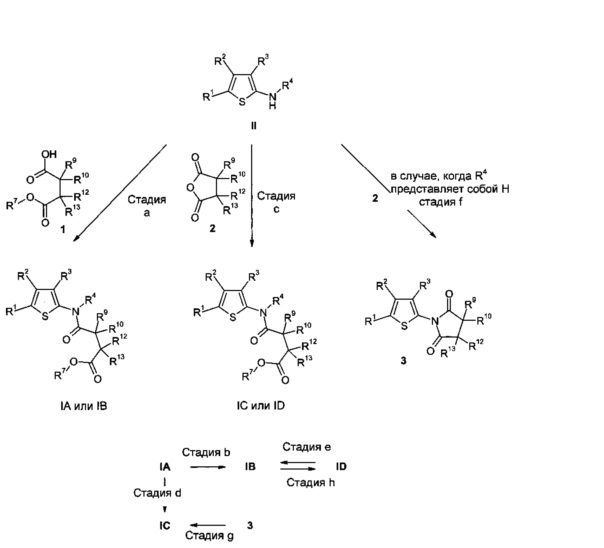
Соединения общей формулы IA, где R4 представляет собой H, R7 представляет собой алкил или циклоалкил, A представляет собой CR9R10, E представляет собой CR12R13 и n равно нулю, IB, где R4 представляет собой алкил, R7 представляет собой алкил или циклоалкил, A представляет собой CR9R10, E представляет собой CR12R13 и n равно нулю, IC, где R4 и R7 представляют собой H, A представляет собой CR9R10, E представляет собой CR12R13 и n равно нулю, и ID, где R4 представляет собой алкил, R7 представляет собой H, A представляет собой CR9R10, E представляет собой CR12R13 и n равно нулю, могут быть получены, например, как изображено на Схеме 1.
В результате ацилирования 2-аминотиофенов II (либо имеющихся в продаже, либо полученных согласно литературным методам или, как описано на Схемах 4-6) сложными моноэфирами дикарбоновой кислоты 1, либо имеющимися в продаже, либо полученными согласно литературным методам, получают соединения IA и IB, соответственно (стадия а). Амидные сочетания данного типа широко описаны в литературе и могут быть выполнены путем использования реагентов сочетания, таких как, например, CDI, DCC, HATU, HOBT, TBTU или реагент Мукаямы, в подходящем растворителе, например, в ДМФ, ДМА, CH2Cl2 или диоксане, необязательно в присутствии основания (например, NEt3, DIPEA (основание Хюнига) или ДМАП). Альтернативно карбоновые кислоты 1 можно преобразовать в их хлорангидриды путем обработки, например, тионилхлоридом, в чистом виде или необязательно в растворителе, таком как CH2Cl2. В результате взаимодействия хлорангидрида с 2-аминотиофенами II в подходящем растворителе, таком как CH2Cl2 или ДМФ, и основания, например, NEt3, основания Хюнига, пиридина, ДМАП или бис(триметилсилил)амида лития, при температурах в диапазоне от 0°C до температуры образования флегмы растворителя или смеси растворителей получают соединения IA и IB, соответственно (стадия а).
Соединения IB могут быть альтернативно получены путем алкилирования соединений IA соединениями типа R4X, в которых X представляет собой подходящую уходящую группу, такую как атом хлора, атом брома, атом йода, -OSO2алкил (например, мезилат (метансульфонат), -OSO2фторалкил (например, трифлат (трифторметансульфонат) или -OSO2арил (например, тозилат (пара-толуолсульфонат), используя подходящее основание в соответствующем растворителе (например, гидрид натрия в ДМФ) при температурах от 0°C до температуры кипения растворителя (стадия b).
В результате ацилирования 2-аминотиофенов II ангидридами карбоновых кислот 2 (либо имеющимися в продаже, либо доступными способами, известными в данной области техники) в соответствующих растворителях (например, Et2O, ТГФ, диоксан, ДМФ или CH3CN) получают соединения IC и ID. Эту реакцию можно проводить в присутствии подходящего основания, такого как NEt3, основание Хюнига, ДМАП, DBU или бис(триметилсилил)амид лития (стадия с).
Соединения IC могут быть также получены из соединений IA (стадия d) для тех случаев, в которых заместитель R7 в соединениях формулы IA представляет собой отщепляемую алкильную группу. В результате отщепления сложноэфирной функциональной группы в соединениях IA в основных (например, метиловые или этиловые эфиры с гидроксидом лития или натрия в полярных растворителях, таких как метанол, H2O или ТГФ или смеси этих растворителей) или в кислых условиях (например, трет-бутиловый эфир, используя концентрированную соляную кислоту в тетрагидрофуране или муравьиной кислоте в подходящем растворителе, таком как спирты, такие как изопропанол) получают соединения IC (стадия d). Дополнительные сложные эфиры включают, но не ограничены ими, например, аллиловые или бензиловые эфиры, которые можно отщеплять способами, известными специалистам в данной области техники.
Соединения IB могут быть также получены из соединений ID путем алкилирования ID соединениями R7X, в которых X представляет собой подходящую уходящую группу, такую как атом хлора, атом брома, атом йода, -OSO2алкил (например, мезилат (метансульфонат), -OSO2фторалкил (например, трифлат (трифторметансульфонат) или -OSO2арил (например, тозилат (пара-толуолсульфонат), используя подходящее основание в соответствующем растворителе (например, гидрид натрия в ДМФ) при температурах от 0°C до температуры кипения растворителя (стадия е).
Соединения IC могут быть также получены из промежуточных соединений 3 путем расщепления имида, применяя методы, описанные в литературе (например, L. Aurelio et al., J. Med. Chem. 2010, 53(18), 6550-6559), например, путем использования подходящего основания и растворителя, такого как NaOH в ТГФ или H2O и EtOH (стадия g).
Соединения ID могут быть также получены из соединений IB для тех случаев, в которых заместитель R7 в соединениях формулы IB представляет собой отщепляемую алкильную группу, используя описанные выше способы (стадия h).
Промежуточные соединения 3, в свою очередь, могут быть получены путем ацилирования 2-аминотиофенов II, в которых R4 представляет собой атом водорода, путем ацилирования ангидридами карбоновых кислот 2 в описанных выше условиях (стадия f).
Схема 1
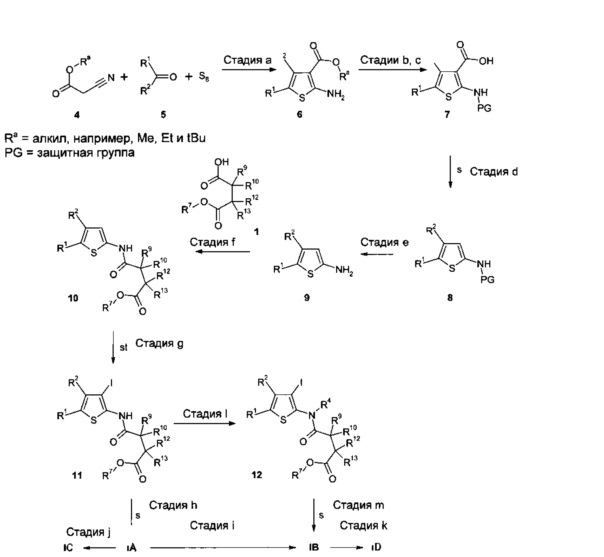
Альтернативный синтез соединений IA-ID представлен на Схеме 2. Специалистам в данной области техники понятно, что эти преобразования применимы только к тем соединениям, которые несут группы и заместители, в частности, сложноэфирные функциональные группы, замещенные R7, которые являются стабильными и неактивными в применяемых условиях реакции.
В результате реакции Гевальда с использованием α-цианоэфиров 4, в которых Ra представляет собой отщепляемую группу, такую как, например, метильная, этильная или трет-бутильная группа, альдегидов (R1 или R2=H) или кетонов 5 и элементной серы в присутствии основания, такого как морфолин, в подходящем растворителе, таком как EtOH, получают тиофеновые промежуточные соединения 6 (стадия а).
В результате защиты аминной функциональной группы подходящей защитной группой, такой как ацетильная группа, и последующего расщепления сложного эфира с применением способов, известных в данной области техники, и, как описано в литературе (например, Y. Huang et al. Chem Biol. Drug Des. 2010, 76, 116-129) получают кислотные промежуточные соединения 7 (стадии b, с).
Промежуточные соединения 7 могут быть декарбоксилированы согласно литературным методам (например, К. Gewald et al., Z. Chem. 1967, 7(5), 186-187; H. Luetjens et al., J. Med. Chem. 2003, 46(10), 1870-1877; S. Takada, J. Med. Chem. 1988, 31(9), 1738-1745; WO 2005044008), например, используя медь и хинолин при повышенных температурах, с получением промежуточных соединений 8 (стадия d).
В результате удаления защитной группы в соединении 8 с применением способов, известных специалистам в данной области техники, и, как описано в литературе, получают 2-аминотиофены 9 (стадия е).
В результате ацилирования промежуточных соединений 9 с использованием условий, изображенных на Схеме 1, моноэфирами дикарбоновых кислот 1, либо имеющимися в продаже, либо полученными согласно литературным методам, получают промежуточные соединения 10 (стадия f).
В результате йодирования промежуточных соединений 10 с использованием литературных методов (например, WO 2005/044008), например, используя йод в ТГФ или монохлорид йода в уксусной кислоте, получают промежуточные соединения 11 (стадия g).
В результате реакций кросс-сочетания соединений 11, например, с борорганическими, оловоорганическими или цинкорганическими реагентами R3M получают соединения IA (стадия h). Реакции данного типа широко описаны в литературе (например, N. Miyaura (ed.), "Cross-coupling reactions: A practical guide", Curr. Topics Chem. 219). Например, в результате взаимодействия соединений 11 с (замещенными) арил- или гетероарил-бороновыми кислотами R3-B(OH)2 или сложными бороновыми эфирами R3-B(OR')2 (например, пинаколовым или триметиленгликолевым эфиром, либо имеющимся в продаже, либо полученными с использованием литературных методов, как описано, например, в кн. "Boronic Acids - Preparation and Applications in Organic Synthesis and Medicine" by Dennis G. Hall (ed.) 1st Ed., 2005, John Wiley & Sons, New York), используя подходящий катализатор (например, аддукт дихлор[1,1-бис(дифенилфосфино)-ферроцен]палладия(II) с CH2Cl2, тетракис(трифенилфосфин)палладия(0) или ацетата палладия(II) с трифенилфосфином) в соответствующем растворителе (например, в диоксане, ДМЭ, H2O, толуоле, ДМФ или их смесях) и подходящее основание (например, Na2CO3, NaHCO3, KF, карбонат калия или NEt3) при температурах от комнатной температуры до температуры кипения растворителя или смеси растворителей, получают соединения IA (стадия h). Реакции Сузуки данного типа широко описаны в литературе (например, A. Suzuki, N. Miyaura, Chem. Rev. 1979, 95, 2457-2483; A. Suzuki, J. Organomet. Chem. 1999, 576, 147-168; V. Polshettiwar et al., Chem. Sus. Chem. 2010, 3, 502-522) и хорошо известны специалистам в данной области техники. Альтернативно арил- или гетероарил-трифторбораты R3BF3K можно использовать в реакции кросс-сочетания с применением палладиевого катализатора, такого как тетракис-(трифенилфосфин)палладий(0), ацетат палладия(II) или аддукт дихлор[1,1`-бис(дифенилфосфино)ферроцен]палладия(II) с CH2Cl2 в присутствии подходящего основания, такого как карбонат цезия или фосфат калия, в растворителях, таких как толуол, ТГФ, диоксан, H2O или их смеси, при температурах от комнатной температуры до температуры кипения растворителя или смеси растворителей.
Соединения IA можно также синтезировать путем взаимодействия 11 с реагентами, представляющими собой (замещенный) арил- или гетероарил-олово R3-SnR3 (R = например, Me или n-Bu; либо имеющимися в продаже, либо полученными согласно литературным методам), в присутствии подходящего катализатора (например, тетракис(трифенилфосфин)-палладия(0), бензилбис(трифенил-фосфин)палладия(II) хлорида, бис(трифенилфосфин)-палладия(II) дихлорида или аддукта дихлор[1,1`-бис(дифенилфосфино)ферроцен]палладия(II) и CH2Cl2) в соответствующем растворителе (например, в ТГФ, диоксане, ДМФ или НМРА или их смесях) при температурах от комнатной температуры до температуры кипения растворителя или смеси растворителей, необязательно в присутствии хлорида лития. Сочетания Стилла данного типа широко описаны в литературе (например, J.К. Stille, Angew. Chem. Int. Ed. Engl. 1986, 25, 508-524) и хорошо известны специалистам в данной области техники (стадия h).
Альтернативно соединения IA можно синтезировать путем взаимодействия 11 с (замещенными) арил- или гетероарилгалогенидами цинка R3-ZnX (X=Cl, Br или I) (либо имеющимися в продаже, либо синтезированными способами, описанными в литературе), используя никелевый (например, тетракис(трифенилфосфин)никель(0)) или палладиевый катализатор (например, тетракис(трифенил-фосфин)палладий(0)), в соответствующем растворителе, таком как ТГФ или ДМА, в диапазоне температуры от комнатной температуры до температуры кипения растворителя. Сочетания Негиши данного типа широко описаны в литературе (например, "Name Reactions for Homologations-Part I: Negishi cross-coupling reaction", Li, J.J., Corey, E.J., Eds.; Wiley & Sons, Hoboken, NJ, 2009, 70-99; G. Organ, Eur. J. Org. Chem. 2010, 4343-4354) и хорошо известны специалистам в данной области техники (стадия h).
Затем соединения IA могут быть далее преобразованы в соединения IB-ID, как описано под Схемой 1 (стадии i, j, k).
Соединения IB могут быть также получены с помощью реакций кросс-сочетания промежуточных соединений 12 с борорганическими, оловоорганическими или цинкорганическими реагентами R3M, используя описанные выше условия сочетания (стадия m).
Промежуточные соединения 12 доступны, например, путем алкилирования промежуточных соединений 11 алкилирующим агентом R4-X, в котором X обозначает подходящую уходящую группу, такую как атом хлора, атом брома, атом йода, -OSO2алкил (например, мезилат (метансульфонат), -OSO2фторалкил (например, трифлат (трифторметансульфонат) или -OSO2арил (например, тозилат (пара-толуолсульфонат), используя подходящее основание, например, гидрид натрия, в подходящем растворителе, таком как ТГФ или ДМФ (стадия I).
Схема 2
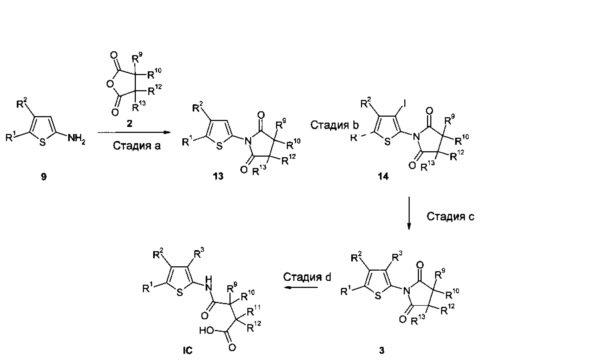
Альтернативный синтез соединений IC из промежуточных соединений 9 представлен на Схеме 3.
В результате ацилирования 2-аминотиофеновых промежуточных соединений 9, полученных, как описано под Схемой 2, ангидридами карбоновых кислот 2 (либо имеющимися в продаже, либо доступными способами, описанными в ссылках, или способами, известными в данной области техники) в соответствующих растворителях (например, в Et2O, ТГФ, диоксане, ДМФ или CH3CN) получают промежуточные соединения 13. Эту реакцию можно проводить в присутствии подходящего основания, такого как NEt3, основание Хюнига, ДМАП, DBU или бис(триметилсилил)амид лития (стадия a).
В результате йодирования промежуточных соединений 13 согласно литературным методам (например, WO 2005/044008), например, используя йод в ТГФ или монохлорид йода в уксусной кислоте, получают промежуточные соединения 14 (стадия b).
Реакции кросс-сочетания промежуточных соединений 14 с борорганическими, оловоорганическими или цинкорганическими реагентами R3M R3M, используя условия сочетания, описанные под Схемой 2, получают промежуточные соединения 3 (стадия с), которые могут быть далее преобразованы в соединения IC, используя условия реакции, описанные под Схемой 1 (стадия d).
Схема 3
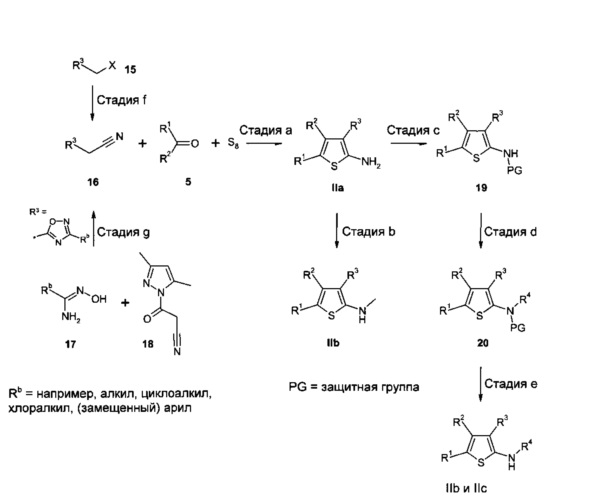
Пример конструирования 2-аминотиофенов IIa, где R4 представляет собой H, IIb, где R4 представляет собой метил, и IIc, где R4 представляет собой алкил или циклоалкил, показан на Схеме 4.
Синтез замещенных 2-аминотиофенов IIa широко описан в литературе. В частности, реакцию Гевальда, однореакторную многокомпонентную конденсацию между соединением α-метиленкарбонила (циклическим или ациклическим кетоном или альдегидом), элементной серой, основанием (например, NEt3, морфолином) и α-активированным нитрилом (например, α-цианоэфирами с получением соединений, где R3 представляет собой сложноэфирную группу, малоннитрилом с получением соединений, в которых R3 представляет собой циано, или арил- или гетероарилацетонитрилами с получением соединений, в которых R3 представляет собой арил или гетероарил) часто применяют для синтеза поли-замещенных 2-амино-тиофенов (например, K. Gewald et al., Angew. Chem. 1961, 73(3), 114-114; K. Gewald et al., Chem. Ber. 1965, 98, 3571-3577; K. Gewald et al., Monatsh. Chem. 1988, 119, 985-992; R.W. Sabnis et al., J. Het. Chem. 1999, 36, 333-345; H. Zhang et al., Synthesis 2004, 18, 3055-3059; M. Sridhar et al., Tetrahedron Lett., 2007, 48(18), 3171-3172; Z. Puterová et al., Arkivoc 2010 (i), 209-246; Т. Wang et al., Synlett 2010, 1351-1354; DE 2627935; WO 2005/044008; WO 2009/033581).
В результате реакции Гевальда, как описано выше, с использованием имеющихся в продаже и соответствующим образом замещенных ацетонитрилов 16, альдегидов (R1 или R2=Н) или кетонов (в которых для настоящего изобретения R1 и R2 вместе не образуют цикл, и либо R1, либо R2 представляет собой необязательно моно-замещенную метильную группу) 5 и элементной серы в присутствии основания, такого как морфолин, получают 2-аминотиофены IIa (стадия а).
В случаях, где производные ацетонитрила 16 не имеются в продаже, они могут быть получены из соединений 15, в которых X представляет собой подходящую уходящую группу, такую как атом хлора, атом брома, -OSO2алкил (например, мезилат (метансульфонат), -OSO2фторалкил (например, трифлат (трифторметансульфонат) или -OSO2арил (например, тозилат (пара-толуолсульфонат), путем нуклеофильного замещения с цианидом натрия или калия в подходящем растворителе, таком как ДМСО или ДМФ, при температурах от 0°C до температуры кипения растворителя (стадия f). Реакции данного типа известны специалистам в данной области техники и описаны в литературе (например, М. Katkevics, Synlett 2011, 17, 2525-2528; R. Gomez et al., Bioorg. Med. Chem. Lett. 2011, 21(24), 7344-7350; F. Fache et al., Eur. J. Org. Chem. 2011, 30, 6039-6055; US 2012/0015999). В случае, когда R3 представляет собой 1,2,4-оксадиазольное кольцо, несущее, например, алкильный, циклоалкильный, хлоралкильный или необязательно замещенный арильный заместитель в 3-положении (Rb), производные ацетонитрила 16 могут быть получены из амидоксимов 17 (либо имеющихся в продаже, либо полученных, например, путем взаимодействия алкил-, циклоалкил-, хлоралкил- или арилнитрилов с гидроксиламином по аналогии с литературными методами, например, WO 2005/082859; WO 2005/0076347; WO 2008/093960) и имеющегося в продаже 1-цианоацетил-3,5-диметилпиразола 18 согласно литературным методам (например, I.О. Zhuravel et al., Synthetic Commun. 2008, 38(21), 3778-3784; A.V. Borisov et al., J. Comb. Chem. 2009, 11(6), 1023-1029) (стадия g).
В результате алкилирования 2-аминотиофенов IIa метилиодидом или диметилсульфатом, используя подходящее основание и растворитель, например, карбонат калия (необязательно в присутствии иодида калия) в CH3CN или CsCO3 в ДМФ, получают соединения IIb, в которых R4 представляет собой метильную группу (стадия b). Для ускорения реакции можно применять микроволновое облучение. Альтернативно соединения IIa могут быть преобразованы в соединения IIb путем взаимодействия IIa с триэтилортоформиатом и последующего восстановления полученного в результате этоксиметиленамино-тиофенового промежуточного соединения с подходящим восстанавливающим агентом, таким как NaBH4, в соответствующем растворителе, таком как EtOH. Реакции обоих типов описаны в литературе (например, WO 2008/154221; WO 2011/100838; I.C. Gonzalez et al., Bioorg. Med. Chem. Lett. 2004, 14(15), 4037-4043) и известны специалистам в данной области техники (стадия b).
2-Аминотиофены IIb и IIc могут быть получены из IIa, например, сначала путем защиты функциональной группы амина в соединениях IIa подходящей защитной группой, такой как ацетил или трет-бутоксикарбонил (Boc), способами, известными в данной области техники, и как описано в литературе, с получением промежуточных соединений 19 (стадия с).
В результате алкилирования промежуточных соединений 19 алкилирующим агентом R4-X, в котором X обозначает подходящую уходящую группу, такую как атом хлора, атом брома, атом йода, -OSO2алкил (например, мезилат (метансульфонат), -OSO2фторалкил (например, трифлат (трифторметансульфонат) или -OSO2арил (например, тозилат (пара-толуолсульфонат), используя подходящее основание, например, гидрид натрия, в соответствующем растворителе, таком как ТГФ или ДМФ, получают промежуточные соединения 20 (стадия d).
В результате удаления защитной группы в промежуточных соединениях 20 с применением способов, известных специалистам в данной области техники, и как описано в литературе, получают 2-аминотиофены IIb и IIc соответственно. Реакции данного типа также опубликованы в литературе (например, WO 2005/044008; P.J. Scammels et al., Org. Biomol. Chem. 2011, 9(13), 4886-4902) (стадия e).
Схема 4
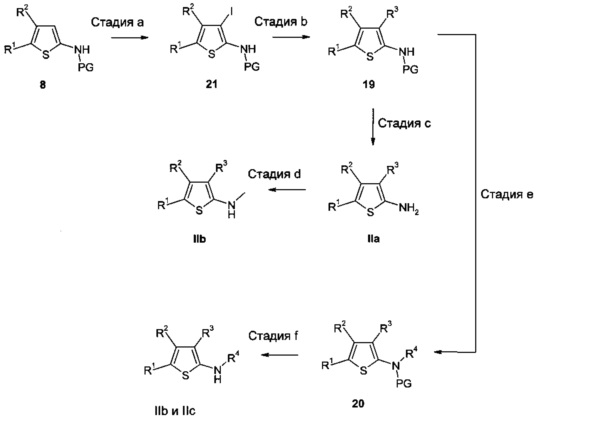
2-Аминотиофены IIa-IIc могут быть также альтернативно получены из промежуточных соединений 8 согласно Схеме 5.
В результате йодирования промежуточных соединений 8 согласно литературным методам (например, WO 2005/044008), например, используя йод в ТГФ или монохлорид йода в уксусной кислоте, получают промежуточные соединения 21 (стадия а).
В результате реакций кросс-сочетания промежуточных соединений 21 с борорганическими, оловоорганическими или цинкорганическими реагентами R3M, используя условия сочетания, описанные под Схемой 2, получают промежуточные соединения 19 (стадия b).
В результате удаления защитной группы в соединениях 19, применяя способы, известные специалистам в данной области техники, получают 2-аминотиофены IIa (стадия с), которые можно далее преобразовать в соединения IIb в соответствии с методами, описанными под Схемой 4 (стадия d).
Промежуточные соединения 19 можно преобразовать в промежуточные соединения 20 путем взаимодействия с алкилирующим агентом R4-X, в котором X означает подходящую уходящую группу, такую как такую как атом хлора, атом брома, атом йода, -OSO2алкил (например, мезилат (метансульфонат), -OSO2фторалкил (например, трифлат (трифторметансульфонат) или -OSO2арил (например, тозилат (пара-толуолсульфонат), используя подходящее основание, например, гидрид натрия, в соответствующем растворителе, таком как ТГФ или ДМФ (стадия е).
В результате удаления защитной группы в промежуточных соединениях 20, применяя способы, известные специалистам в данной области техники, и, как описано в литературе, получают 2-аминотиофены IIb и IIc, соответственно.
Схема 5
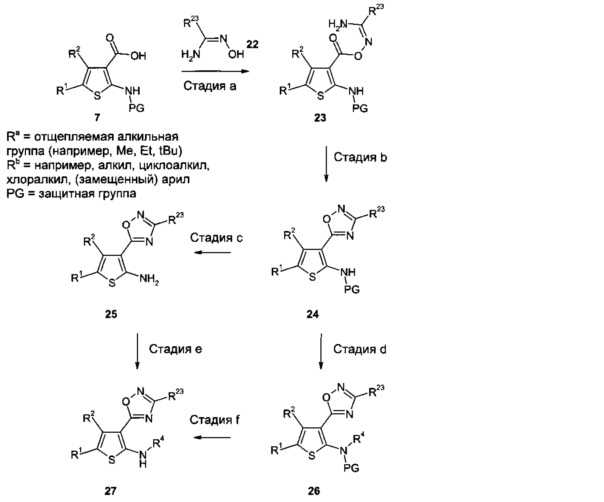
2-Аминотиофены, где R3 представляет собой гетероциклоалкил или гетероарил, которые могут быть получены из арилкарбоново-кислотных предшественников, могут быть также получены из тиофенкарбоново-кислотных промежуточных соединений, таких как 7, которые, в свою очередь, можно синтезировать, например, способами, описанными под Схемой 2. Синтез гетероциклических кольцевых систем из карбоновых кислот широко описан в литературе и хорошо известен специалистам в данной области техники. Один пример, где R3 представляет собой 3-замещенное 1,2,4-оксадиазольное кольцо, показан на Схеме 6.
В результате взаимодействия 7 с замещенными N-гидроксикарбоксимидамидами 22 (либо имеющимися в продаже, либо полученными, например, путем взаимодействия нитрилов типа R23CN с гидроксиламином по аналогии с литературными методами, например, WO 2005/082859; WO 2005/0076347; WO 2008/093960), применяя стандартные условия сочетания, используя, например, EDCI вместе с HOBT или HATU в подходящем растворителе, таком как ДМФ (стадия а), и замыкание цикла полученных в результате промежуточных соединений 23, используя, например, TBAF в ТГФ, получают промежуточные соединения 24 (стадия b).
В результате отщепления защитной группы в промежуточных соединениях 24, используя литературные методы, известные специалистам в данной области техники, получают промежуточные соединения 25 (стадия с).
В результате алкилирования промежуточных соединений 24 путем взаимодействия с алкилирующим агентом R4-X, в котором X означает подходящую уходящую группу, такую как такую как атом хлора, атом брома, атом йода, -OSO2алкил (например, мезилат (метансульфонат), -OSO2фторалкил (например, трифлат (трифторметансульфонат) или -OSO2арил (например, тозилат (пара-толуолсульфонат), используя подходящее основание, например, гидрид натрия, в соответствующем растворителе, таком как ТГФ или ДМФ, получают промежуточные соединения 26 (стадия d).
Промежуточные соединения 27 могут быть получены из промежуточных соединений 26 путем удаления защитной группы, используя литературные методы (стадия f). Альтернативно в результате алкилирования промежуточных соединений 25, используя способы, например, описанные под Схемой 4, получают промежуточные соединения 27 (стадия е).
Схема 6
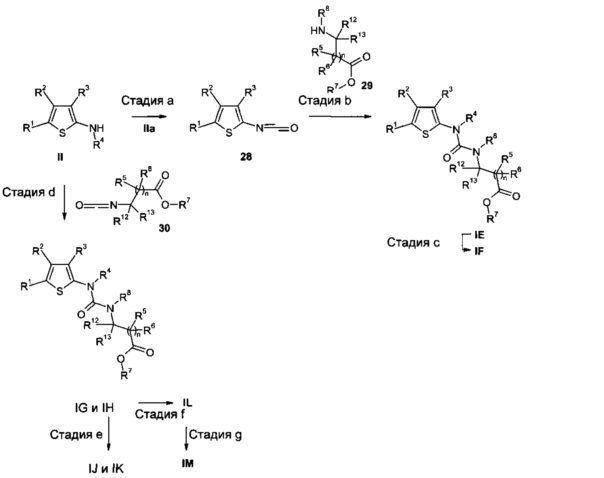
Соединения общей формулы I, где A представляет собой NR8, E представляет собой CR12R13 и n равно нулю или 1, могут быть получены, например, согласно Схеме 7. В частности, соединения формулы IE, где R4 представляет собой H и R7 представляет собой алкил или циклоалкил, IF, где R4 и R7 представляют собой H, IG, где R4 представляет собой H, R7 представляет собой алкил или циклоалкил и R8 представляет собой H, IH, где R4 представляет собой алкил, R7 представляет собой алкил или циклоалкил и R8 представляет собой H, IJ, где R4, R7 и R8 представляют собой H, IK, где R4 представляет собой алкил, а R7 и R8 представляют собой Н, IL, где R4 представляет собой H или алкил, R7 представляет собой алкил или циклоалкил и R8 представляет собой алкил, и IM, где R4 и R7 представляют собой H и R8 представляет собой алкил.
Аминогруппу в 2-аминотиофенах IIa, где R4 представляет собой H, можно преобразовать в изоцианатную функциональную группу, например, путем взаимодействия IIa с фосгеном или его заменителем (например, трихлорметилхлорформиатом ("дифосгеном") или бис(трихлорметил)карбонатом ("трифосгеном")) в подходящем растворителе, таком как ТГФ или CH2Cl2, необязательно в присутствии основания, такого как пиридин или NEt3, с получением промежуточных соединений 28 (стадия а). Преобразование данного типа хорошо известно в данной области техники и широко описано в литературе (например, G.N. Anilkumar et al., Bioorg. Med. Chem. Lett. 2011, 21(18), 5336-5341; DE 3529247; WO 2011/140527; WO 2011/123937).
В результате взаимодействия изоцианатов 28 с соответствующим образом замещенными α- или β-аминокислотами (R7 представляет собой H) или сложными эфирами (R7 представляет собой алкил или циклоалкил) 29 (n равно нулю и 1, имеющимися в продаже или синтезированными способами, известными в данной области техники) в соответствующем растворителе, таком как толуол, ДМФ или CH2Cl2, необязательно в присутствии подходящего основания, такого как NEt3 или основание Хюнига, получают соединения IE и IF соответственно (стадия b). Присоединения первичных или вторичных аминов с изоцианатами описаны в литературе (например, W.J. McClellan et al., Bioorg. Med. Chem. Lett. 2011, 21(18), 5620-5624; J. Regan et al., J. Med. Chem. 2002, 45(14), 2994-3008; US 4314842; WO 2006/067385) и хорошо известны специалистам в данной области техники.
Соединения IF альтернативно можно синтезировать из соединений IE для тех случаев, в которых заместитель R7 в соединениях формулы IE представляет собой отщепляемую алкильную группу, используя способы, описанные под Схемой 1 (стадия с).
2-Аминотиофены II можно подвергать взаимодействию с изоцианатами 30 (либо имеющимися в продаже, либо синтезированными способами, известными в данной области техники) в соответствующем растворителе, таком как толуол, ДМФ или CH2Cl2, необязательно в присутствии подходящего основания, такого как NEt3 или основание Хюнига, с получением соединений IG и IH, соответственно (стадия d).
В случае, когда R7 в соединениях IG и IH представляют собой отщепляемую сложноэфирную группу, ее можно отщепить, применяя методы, известные в данной области техники и, как опубликовано, с получением соединений IJ и IK соответственно (стадия е).
Соединения IL можно синтезировать путем алкилирования соединений IH соединениями типа R8X, в которых X представляет собой подходящую уходящую группу, такую как атом хлора, атом брома, атом йода, -OSO2алкил (например, мезилат (метансульфонат), -OSO2фторалкил (например, трифлат (трифторметансульфонат) или -OSO2арил (например, тозилат (пара-толуолсульфонат), используя подходящее основание, например, гидрид натрия, в соответствующем растворителе, таком как ТГФ или ДМФ) при температурах от 0°C до температуры кипения растворителя (стадия f).
В случае, когда R7 в соединениях IL представляет собой отщепляемую сложноэфирную группу, ее можно отщеплять, применяя методы, известные специалистам в данной области техники, и как описано в литературе, с получением соединений IM (стадия g).
Схема 7
Соединения IN, где A представляет собой CR8R9, E представляет собой NR11, n равно 1 и R7 представляет собой алкил или циклоалкил, и IO, где A представляет собой CR8R9, E представляет собой NR11, n равно 1 и R7 представляет собой H, могут быть получены, например, как показано на Схеме 8.
Соединения IN можно синтезировать, например, путем ацилирования 2-аминотиофенов II соответствующим образом замещенной (алкоксикарбонилметил-амино)-уксусной кислотой или производными (циклоалкоксикарбонилметил-амино)-уксусной кислоты 31 (либо имеющимися в продаже, либо синтезированными способами, известными в данной области техники), используя литературные методы и способы, описанные под Схемой 1.
Если R7 в соединениях IN представляет собой отщепляемую сложноэфирную группу, ее можно отщепить, применяя методы, известные специалистам в данной области техники, и как описано в литературе, с получением соединений IO (стадия b).
Схема 8
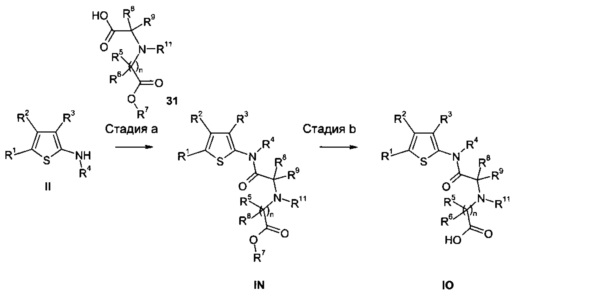
Воплощение настоящего изобретения также представляет собой способ получения соединения формулы (I), как определено выше, включающий взаимодействие:
а) соединения формулы (II) в присутствии соединения формулы (V);
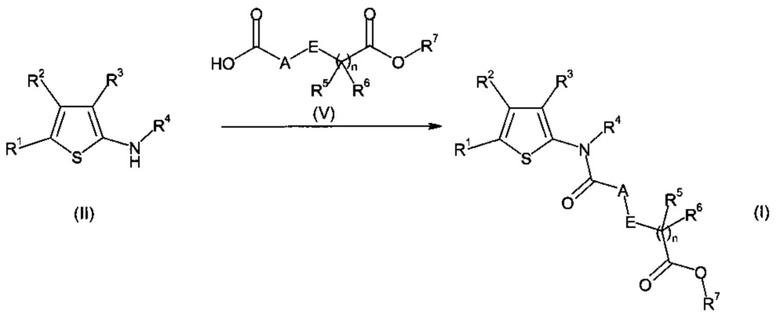
b) соединения формулы (II) в присутствии соединения формулы (VI);
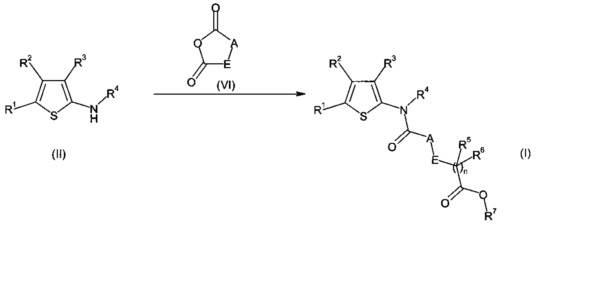
c) соединения формулы (VII) в присутствии соединения формулы (VIII);
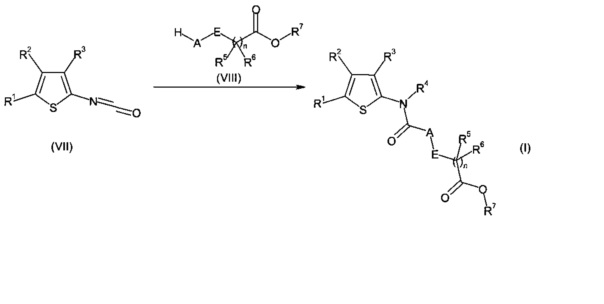
или
d) соединения формулы (II) в присутствии соединения формулы (IX);
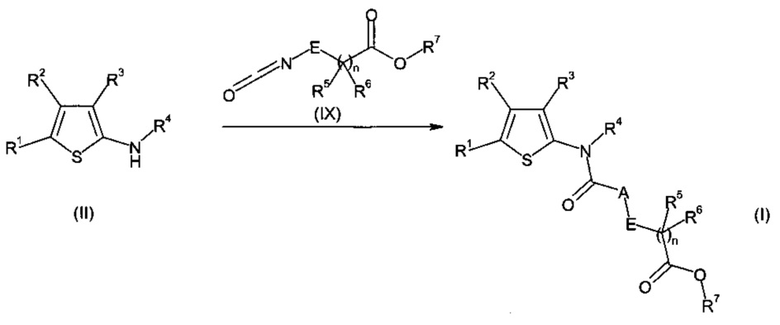
являются такими, как определено выше, и где R7 представляет собой алкил или циклоалкил и A представляет собой CR9R10 на стадии а), A представляет собой CR9R10, E представляет собой CR12R13 и n равно нулю на стадии b), R4 представляет собой H, A представляет собой NR8 на стадии c) и d).
Следующее предпочтительное воплощение настоящего изобретения также представляет собой способ получения соединения формулы (I), как определено выше, включающий взаимодействие соединения формулы (II) в присутствии соединения формулы (VI).
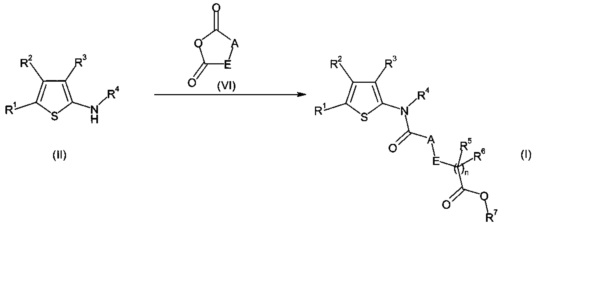
где R1, R2, R3, R4, R5, R6, R7 и n являются такими, как определено выше, и где A представляет собой CR9R10 и E представляет собой CR12R13. В частности, в присутствии растворителя, в частности, CH3CN, ТГФ или Et2O, в присутствии или в отсутствие основания, в частности, в присутствии ДМАП, DIEPA или DBU, при температуре, составляющей от 0°C до температуры образования флегмы, в частности, от КТ до температуры образования флегмы.
Объектом настоящего изобретения также является соединение согласно формуле (I), как раскрыто в данном описании, применяемое в качестве терапевтически активного вещества.
Объектом настоящего изобретения также является фармацевтическая композиция, содержащая соединение согласно формуле (I), как раскрыто в данном описании, и терапевтически инертный носитель.
В соответствии с изобретением соединения формулы (I) или их фармацевтически приемлемые соли или сложные эфиры можно применять для лечения или профилактики диабета типа 2, метаболического синдрома, атеросклероза, дислипидемии, заболеваний печени, ожирения, липодистрофии, рака, глазных заболеваний, заболеваний легких, саркоидоза, хронических заболеваний почек, хронических воспалительных и аутоиммунных воспалительных заболеваний, преэклампсии и синдрома поликистоза яичников.
Конкретные заболевания печени представляют собой заболевания печени, включающие воспаление, стеатоз и/или фиброз, такой как неалкогольная жировая болезнь печени, более конкретно неалкогольный стеатогепатит.
Конкретная липодистрофия представляет собой наследственную и ятрогенную липодистрофию.
Конкретные глазные заболевания представляют собой глазные заболевания, поддерживаемые пролиферацией эндотелия и ангиогенезом, в частности, макулярную дегенерацию и ретинопатию.
Конкретные заболевания легких представляют собой астму, бронхолегочную дисплазию и хроническую обструктивную болезнь легких.
Конкретные хронические заболевания почек представляют собой васкулит, фокальный сегментарный гломерулосклероз, диабетическую нефропатию, волчаночный нефрит, поликистоз почек и хронический тубулоинтерстициальный нефрит, индуцированный лекарственным средством или токсином.
Настоящее изобретение также относится к применению соединения согласно формуле (I), как раскрыто в данном описании, для лечения или профилактики диабета типа 2, метаболического синдрома, атеросклероза, дислипидемии, заболеваний печени, ожирения, липодистрофии, рака, глазных заболеваний, заболеваний легких, саркоидоза, хронических заболеваний почек, хронических воспалительных и аутоиммунных воспалительных заболеваний, преэклампсии и синдрома поликистоза яичников.
Настоящее изобретение, в частности, относится к применению соединения согласно формуле (I), как раскрыто в данном описании, для лечения или профилактики диабета типа 2, атеросклероза, рака, хронического заболевания почек и неалкогольного стеатогепатита.
Настоящее изобретение также относится к применению соединения согласно формуле (I), как раскрыто в данном описании, для лечения или профилактики неалкогольного стеатогепатита.
Конкретное воплощение настоящего изобретения представляет собой соединение согласно формуле (I), как раскрыто в данном описании, для лечения или профилактики диабета типа 2, метаболического синдрома, атеросклероза, дислипидемии, заболеваний печени, ожирения, липодистрофии, рака, глазных заболеваний, заболеваний легких, саркоидоза, хронических заболеваний почек, хронических воспалительных и аутоиммунных воспалительных заболеваний, преэклампсии и синдрома поликистоза яичников.
Другое конкретное воплощение настоящего изобретения представляет собой соединение согласно формуле (I), как раскрыто в данном описании, для лечения или профилактики диабета типа 2, атеросклероза, рака, хронического заболевания почек и неалкогольного стеатогепатита.
Конкретное воплощение настоящего изобретения также представляет собой соединение согласно формуле (I), как раскрыто в данном описании, для лечения или профилактики неалкогольного стеатогепатита.
Настоящее изобретение также относится к применению соединения согласно формуле (I), как раскрыто в данном описании, для получения лекарственного средства для лечения или профилактики диабета типа 2, метаболического синдрома, атеросклероза, дислипидемии, заболеваний печени, ожирения, липодистрофии, рака, глазных заболеваний, заболеваний легких, саркоидоза, хронических заболеваний почек, хронических воспалительных и аутоиммунных воспалительных заболеваний, преэклампсии и синдрома поликистоза яичников.
Настоящее изобретение, в частности, относится к применению соединения согласно формуле (I), как раскрыто в данном описании, для получения лекарственного средства для лечения или профилактики диабета типа 2, атеросклероза, рака, хронического заболевания почек и неалкогольного стеатогепатита.
Воплощение настоящего изобретения также представляет собой применение соединения согласно формуле (I), как раскрыто в данном описании, для получения лекарственного средства для лечения или профилактики неалкогольного стеатогепатита.
Объектом изобретения также является способ лечения или профилактики диабета типа 2, метаболического синдрома, атеросклероза, дислипидемии, заболеваний печени, ожирения, липодистрофии, рака, глазных заболеваний, заболеваний легких, саркоидоза, хронических заболеваний почек, хронических воспалительных и аутоиммунных воспалительных заболеваний, преэклампсии и синдрома поликистоза яичников, где данный способ включает введение эффективного количества соединения согласно формуле (I), как раскрыто в данном описании.
Другим объектом изобретения является способ лечения или профилактики диабета типа 2, атеросклероза, рака, хронического заболевания почек и неалкогольного стеатогепатита, где данный способ включает введение эффективного количества соединения согласно формуле (I), как раскрыто в данном описании.
Воплощение настоящего изобретения также представляет собой способ лечения или профилактики неалкогольного стеатогепатита, где данный способ включает введение эффективного количества соединения согласно формуле (I), как раскрыто в данном описании.
Воплощение настоящего изобретения также представляет собой способ лечения или профилактики липодистрофии, где данный способ включает введение эффективного количества соединения согласно формуле (I), как раскрыто в данном описании.
Конкретное воплощение настоящего изобретения также представляет собой соединение согласно формуле (I), как раскрыто в данном описании, полученное согласно любому из раскрытых способов.
Аналитические методы
Соединения были профилированы по активности против FABP4 человека (huFABP4) и/или FABP5 человека (huFABP5) в анализах резонансного переноса энергии флюоресценции тербия (Tb) с временным разрешением (TR-FRET; от англ. "time resolved-fluorescence energy transfer"), с помощью которых проводили мониторинг прямого связывания жирной кислоты, меченой Bodipy, с белками FABP, несущими метку His6 (huFABP4 экспрессировали в лаборатории в E.coli и очищали, huFABP5 был приобретен у фирмы Cayman Chemical Co., № по каталогу 10010364), связанными с антителом против метки His6, меченым тербием. Считывания данных этого анализа отражали перенос энергии при связывании лиганда с белком FABP с донорной молекулы тербия на акцепторную группировку Bodipy. По конечной концентрации лиганда (125 нМ) аппроксимировали Kd для каждого белка.
Концентрированные растворы соединений (1,8 мМ) в ДМСО серийно разводили 100% ДМСО в 3 раза до десяти концентраций (конечная концентрация соединения составляла от 50 мкМ до 0,003 мкМ). 1 мкл этих разведений соединения и 1 мкл меченой Bodipy жирной кислоты, 4,5 мкМ в 100% ДМСО (Bodipy FL С11, № по каталогу D3862, Invitrogen) последовательно переносили пипеткой в 384-луночные черные полипропиленовые планшеты (Thermo Matrix, № по каталогу 4344). Затем добавляли белок FABP4 или FABP5 (28 мкл 64 нМ раствора белка в буфере 25 мМ Трис pH 7,5, 0,4 мг/мл γ-глобулина, 1 мМ дитиотрейтола (ДТТ), 0,012% NP40, конечная концентрация белка 50 нМ). Чистые контроли анализа содержали лиганд, но не содержали белок. Нейтральные контроли содержали лиганд, но не содержали соединение. После добавления идентифицирующего реагента (Tb антитело против His6, Columbia Biosciences, TB-110, 6 мкл 24 нМ раствора Ab в буфере: 25 мМ Трис pH 7,5, 0,4 мг/мл γ-глобулина, конечная концентрация Tb анти-His6 Ab 4 нМ), планшеты центрифугировали одну минуту при 1000 об/мин. После инкубации при комнатной температуре при встряхивании в течение 30 минут планшеты считывали, используя считывающее устройство Envision (Perkin Elmer, длина волны экстинкции: 340 нм, испускания: 490 нм и 520 нм, задержка времени: 100 мксек; временное окно: 200 мксек, 50 импульсов).
Конечные условия анализа были следующими: 50 нМ белка FABP, 125 нМ меченой Bodipy жирной кислоты, 0,009% (об/об) NP40, 5,5% (об/об) ДМСО в конечном объеме анализа, составляющем 36 мкл. Анализ проводили в трех повторах.
Отношение относительных единиц флуоресценции (ОЕФ) (520 нм*10000/488 нм) использовали для вычисления процента ингибирования: 100-(отношение ОЕФ соединения-чистый контроль)/нейтральный контроль-чистый контроль)*100. Затем эти значения процента ингибирования приводили в соответствие с кривыми доза-ответ, используя 4-параметрическую логистическую модель (сигмоидная модель доза-ответ Хилла). Значения IC50 отражали концентрации соединения, связанные с 50% ингибированием активности белка по сравнению с активностью нейтральных контролей.
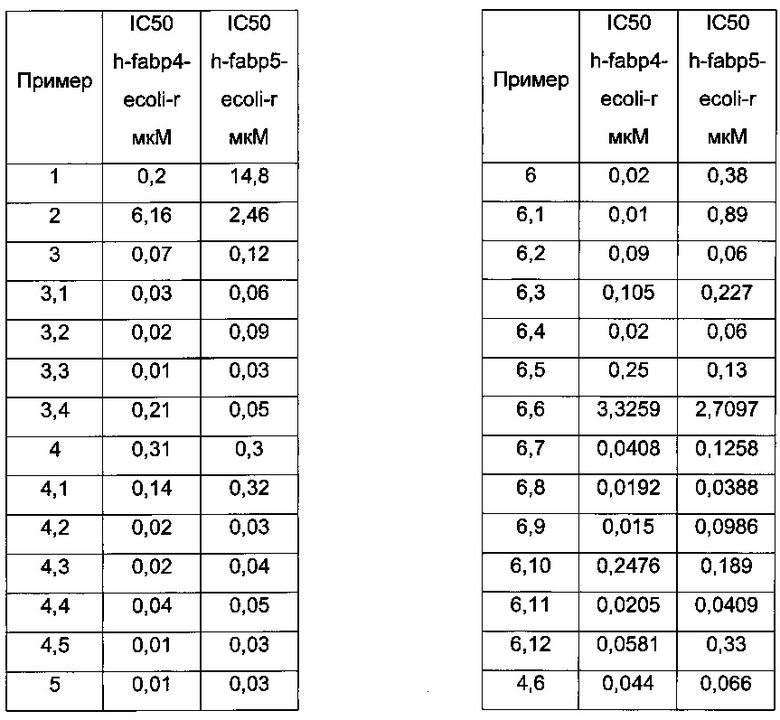
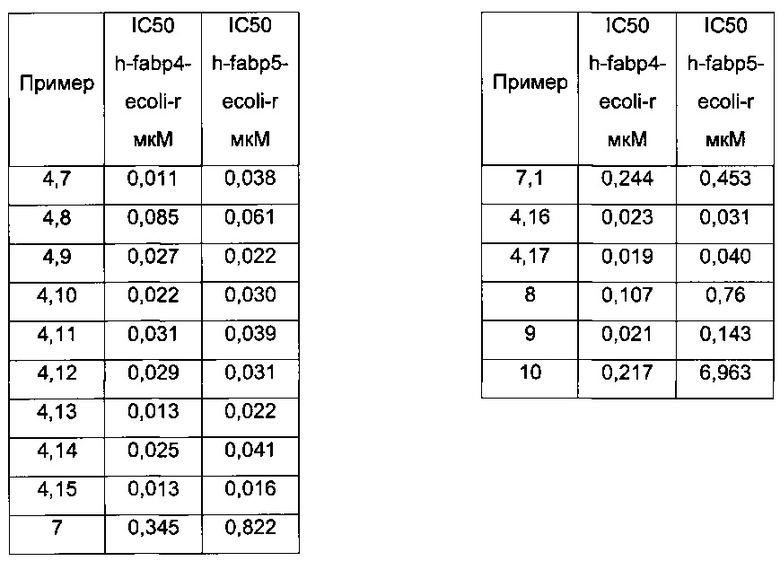
Соединения формулы (I) и их фармацевтически приемлемые соли или сложные эфиры, как раскрыто в данном описании, имеют значения IC50 (ингибирование FABP4) от 0,000001 мкМ до 1000 мкМ, конкретные соединения имеют значения IC50 от 0,000005 мкМ до 500 мкМ, более конкретные соединения имеют значения IC50 от 0,00005 мкМ до 5 мкМ.
Соединения формулы (I) и их фармацевтически приемлемые соли или сложные эфиры, как раскрыто в данном описании, имеют значения IC50 (ингибирование FABP5) от 0,000001 мкМ до 1000 мкМ, конкретные соединения имеют значения IC50 от 0,000005 мкМ до 500 мкМ, более конкретные соединения имеют значения IC50 от 0,00005 мкМ до 50 мкМ.
Соединения формулы (I) и их фармацевтически приемлемые соли могут применяться в качестве лекарственных средств (например, в форме фармацевтических препаратов). Эти фармацевтические препараты можно вводить внутрь, как, например, перорально (например, в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий), назально (например, в форме назальных спреев) или ректально (например, в форме суппозиториев). Тем не менее, введение можно также выполнять парентерально, как, например, внутримышечно или внутривенно (например, в форме инъекционных растворов).
Соединения формулы (I) и их фармацевтически приемлемые соли можно обрабатывать фармацевтически инертными, неорганическими или органическими адъювантами для получения таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.д. можно использовать, например, в качестве таких адъювантов для таблеток, драже и твердых желатиновых капсул.
Подходящими адъювантами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые вещества и жидкие полиолы и т.д.
Подходящими адъювантами для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д.
Подходящими адъювантами для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Подходящими адъювантами для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полутвердые или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, вещества, увеличивающие вязкость, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, корригенты, соли для варьирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать еще другие терапевтически ценные вещества.
Дозировка может варьировать в широких пределах и будет, конечно, подобрана в соответствии с индивидуальными потребностями в каждом конкретном случае. Как правило, в случае перорального введения целесообразной будет суточная дозировка, составляющая приблизительно от 0,1 мг до 20 мг на кг массы тела, предпочтительно приблизительно от 0,5 мг до 4 мг на кг массы тела (например, приблизительно 300 мг на человека), предпочтительно разделенная на 1-3 индивидуальные дозы, которые могут состоять, например, из одинаковых количеств. Тем не менее, понятно, что приведенный выше верхний предел может быть превышен, когда это показано.
Согласно изобретению соединения формулы (I) или их фармацевтически приемлемые соли и сложные эфиры можно применять для лечения или профилактики микрососудистых осложнений, обусловленных диабетом типа 2 (таких как, но не ограниченных ими, диабетическая ретинопатия, диабетическая нейропатия и диабетическая нефропатия), болезни коронарных артерий, ожирения и лежащих в основе воспалительных заболеваний, хронических воспалительных и аутоиммунных/воспалительных заболеваний.
Далее в данном описании изобретение проиллюстрировано Примерами, не имеющими ограничивающего характера.
В случае, когда препаративные примеры получают в виде смеси энантиомеров, чистые энантиомеры можно разделить способами, раскрытыми в данном описании, или способами, известными специалистам в данной области техники, такими как, например, хиральная хроматография или кристаллизация.
ПРИМЕРЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Все примеры и промежуточные соединения были получены в атмосфере аргона, если не указано иное.
Пример 1
2-(3-Фенил-тиофен-2-илкарбамоил)-циклопент-1-енкарбоновая кислота
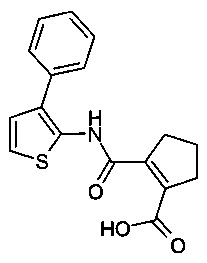
3-Фенил-тиофен-2-иламин (73 мг, 417 мкмоль, Int1.1), NEt3 (84,3 мг, 116 мкл, 833 мкмоль) и 1-циклопентен-1,2-дикарбоновый ангидрид (144 мг, 1,04 ммоль) растворяли в безводном ТГФ (3 мл). Желто-зеленую суспензию перемешивали при КТ в течение выходных дней и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали препаративной ВЭЖХ (MeOH/H2O с 0,1% муравьиной кислотой) с получением соединения, указанного в заголовке, в виде желтого масла (47 мг, 32%, чистоту оценили как 90%). MS (ИЭР): m/z=312,2 [M-H]-.
Пример 2
5-[(3-Карбокси-бицикло[2.2.2]окт-2-ен-2-карбонил)-амино]-3-метил-4-(4-метил-тиазол-2-ил)-тиофен-2-карбоновой кислоты метиловый эфир
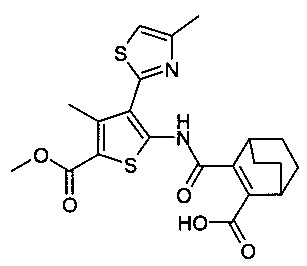
К раствору метил-5-амино-3-метил-4-(4-метилтиазол-2-ил)тиофен-2-карбоксилата (61 мг, 227 мкмоль, Int1.2) в CH3CN (7 мл) добавляли ДМАП (55,5 мг, 455 мкмоль) и бицикло[2.2.2]окт-2-ен-2,3-дикарбоновый ангидрид (40,5 мг, 227 мкмоль, CAS RN 151813-29-5). После перемешивания при КТ в течение 3 ч реакционную смесь перемешивали при 65°C в течение ночи. Реакционную смесь экстрагировали EtOAc и 1 М водным раствором HCl, органический слой высушивали над Na2SO4, фильтровали и выпаривали. Соединение очищали хроматографией на силикагеле, используя смесь CH2Cl2:MeOH (20:1 об/об) в качестве элюента. Коричневое твердое вещество. МС (ИЭР): m/z=447,1 [M+H]+.
Пример 3
2-[4-Циклопропил-5-метил-3-(3-метил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота
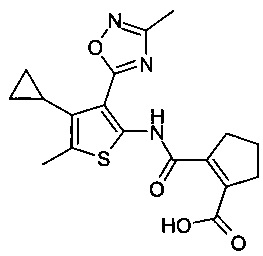
К раствору 4-циклопропил-5-метил-3-(3-метил-[1,2,4]оксадиазол-5-ил)-тиофен-2-иламина (100 мг, 425 мкмоль, Int1.3) в CH3CN (8 мл) добавляли DBU (129 мг, 127 мкл, 850 мкмоль) и 1-циклопентен-1,2-дикарбонового ангидрида (64,6 мг, 467 мкмоль, CAS RN 3205-94-5), и темный раствор перемешивали при 65°C в течение 18 ч. Реакционную смесь концентрировали в вакууме, и остаток очищали препаративной ВЭЖХ (колонка Gemini NX) с градиентом MeOH:H2O (содержащим 0,1% муравьиной кислоты) (80:20-98:2). Желтое твердое вещество (69 мг, 44%). МС (ИЭР): m/z=374,117 [M+H]+.
Примеры в таблице 1 были получены согласно способам, используемым в примере 3, используя реагенты, представляющие собой 2-аминотиофен и ангидрид карбоновой кислоты, перечисленные в таблице 1.
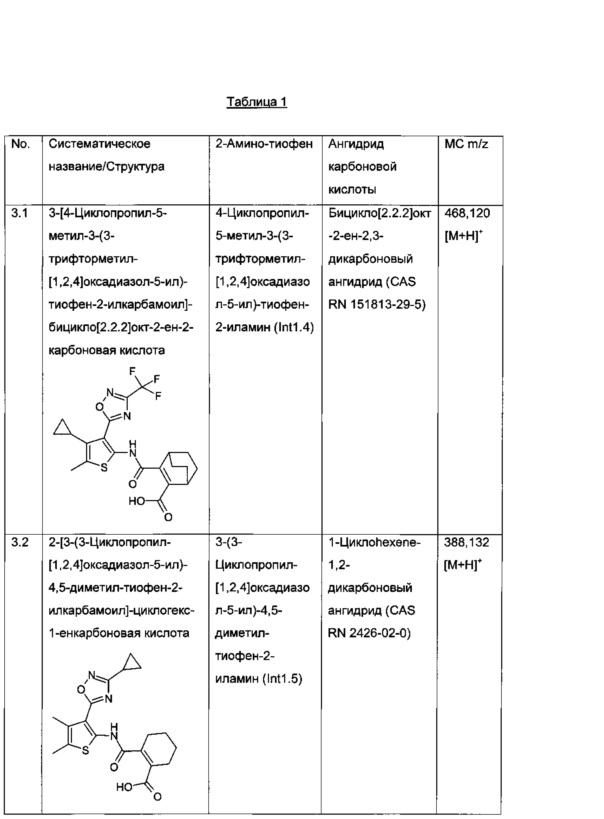
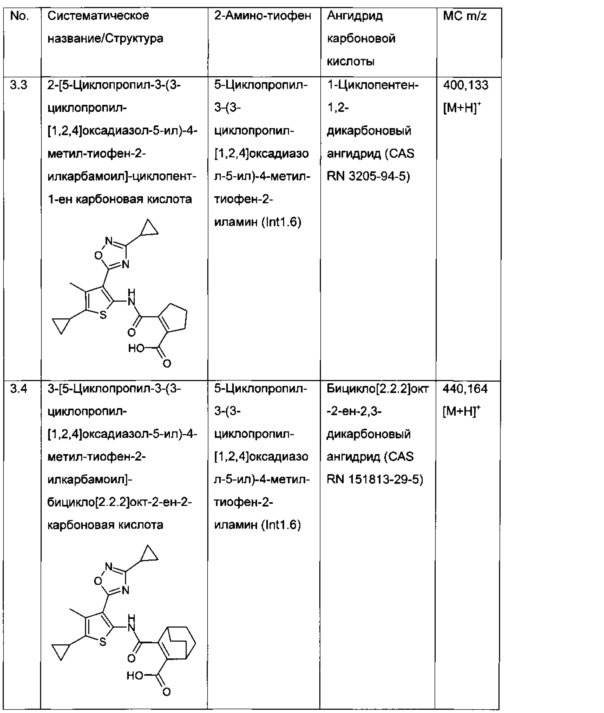
Пример 4
2-[4-Циклопропил-5-метил-3-(3-метил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота
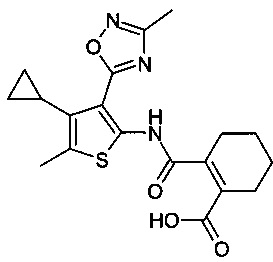
К раствору 4-циклопропил-5-метил-3-(3-метил-[1,2,4]оксадиазол-5-ил)-тиофен-2-иламина (85 мг, 361 мкмоль, Int1.3) в Et2O (3 мл) добавляли 1-циклогексен-1,2-дикарбонового ангидрида (55,0 мг, 361 мкмоль, CAS RN 2426-02-0) и ДМАП (2,21 мг, 18,1 мкмоль). Реакционную смесь перемешивали при КТ в течение 18 ч, а затем концентрировали в вакууме. Остаток очищали препаративной ВЭЖХ (колонка Gemini NX) с градиентом MeOH:H2O (содержащим 0,1% муравьиную кислоту) (80:20-98:2). Светло-желтое твердое вещество (17 мг, 12,1%). МС (ИЭР): m/z=388,133 [M+H]+.
Примеры в таблице 2 были получены согласно способам, используемым в примере 4, используя реагенты, представляющие собой 2-аминотиофен и ангидрид карбоновой кислоты, перечисленные в таблице 2.
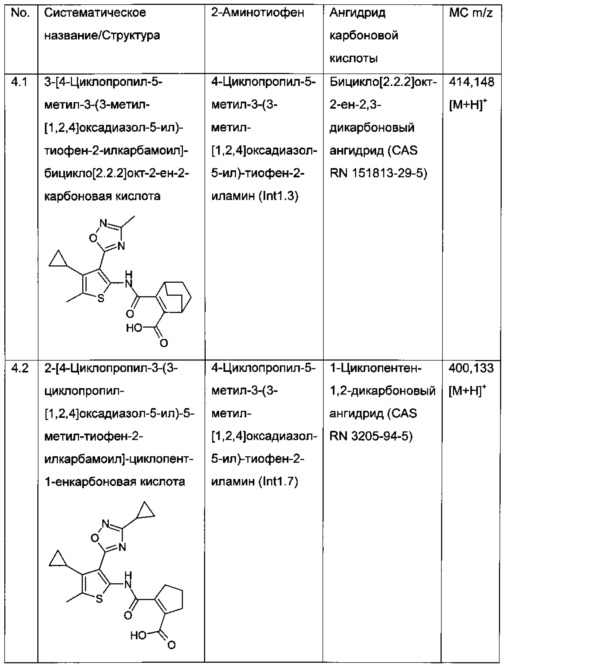
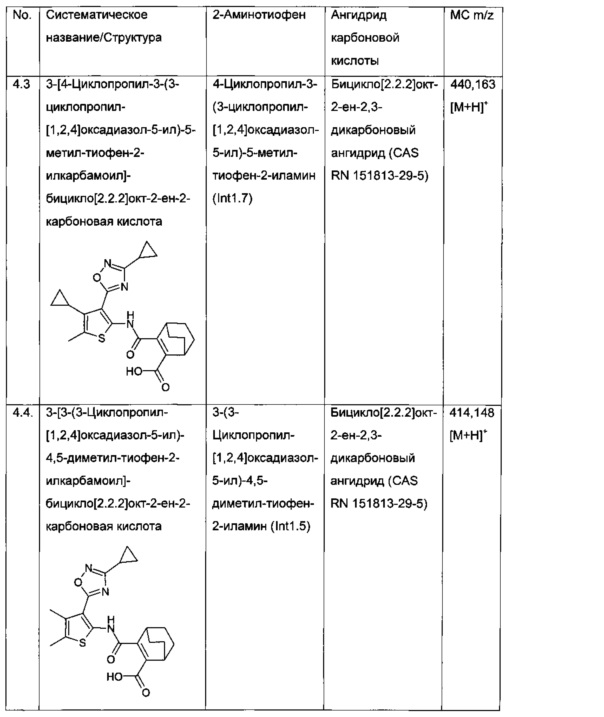
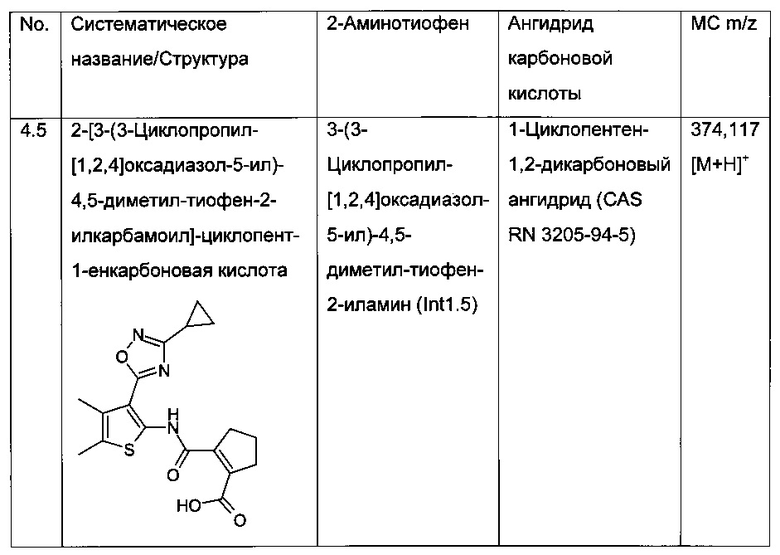
Пример 5
2-[4-Циклопропил-5-метил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота
К раствору 2-[4-циклопропил-5-метил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновой кислоты метилового эфира (80 мг, 181 мкмоль, промежуточное соединение 7) в диоксане (3 мл) добавляли H2O (3 мл) и LiOH моногидрат (9,51 мг, 227 мкмоль), и полученный в результате прозрачный раствор перемешивали при КТ в течение 8 ч. Реакционную наливали на 100 мл 1 М водного раствора HCl и 100 мл EtOAc, и слои разделяли. Водный слой экстрагировали второй раз 100 мл EtOAc. Органические слои промывали 100 мл соляного раствора, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Соединение очищали хроматографией на силикагеле на колонке 20 г, используя систему жидкостной хроматографии среднего давления (ЖХСД) (Flashmaster), элюируя градиентом CH2Cl2:MeOH (100:0-80:20). Желтое твердое вещество (57 мг, 74%). МС (ИЭР): m/z=428,088 [M+H]+.
Пример 6
2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-5-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота
К раствору 3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-метил-тиофен-2-иламина (75 мг, 339 мкмоль, Int1.8) в ТГФ (2,5 мл) добавляли LiHMDS (678 мкл, 678 мкмоль, 1 М раствор в ТГФ) при -78°C, и полученную в результате реакционную смесь перемешивали в течение 30 мин при -78°C. Затем добавляли 1-циклопентен-1,2-дикарбоновый ангидрид (46,8 мг, 339 мкмоль, CAS RN 3205-94-5) при -78°C. Реакционной смеси давали подогреться до 20°C и перемешивали при этой температуре в течение 2 ч. Реакционную смесь наливали на 30 мл 1 М водного раствора HCl и 30 мл EtOAc, и слои разделяли. Водный слой экстрагировали второй раз 30 мл EtOAc. Органические слои промывали 30 мл соляного раствора, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Продукт очищали препаративной ВЭЖХ (колонка Gemini NX) с градиентом MeOH:H2O (содержащим 0,1% муравьиной кислоты) (80:20-98:2). Желтое твердое вещество (52 мг, 42,7%). МС (ИЭР): m/z=360,101 [M+H]+.
Примеры в таблице 3 были получены согласно способам, используемым в примере 6, используя реагенты, представляющие собой 2-аминотиофен и ангидрид карбоновой кислоты, перечисленные в таблице 3, применяя один из следующих способов очистки: Способ Р1: препаративная ВЭЖХ, элюент MeOH:H2O (содержащий 0,1% муравьиной кислоты) (градиент 80:20-98:2); Способ Р2: ЖХСД, элюент CH2Cl2:MeOH (градиент 100:0-95:5); Способ Р3: препаративная ВЭЖХ, элюент CH3CN:H2O (градиент 50:50-95:5); Способ Р4: препаративная ВЭЖХ, элюент CH3CN:H2O (градиент 20:80-98:2); Способ Р5: осаждение после выпаривания органического слоя.
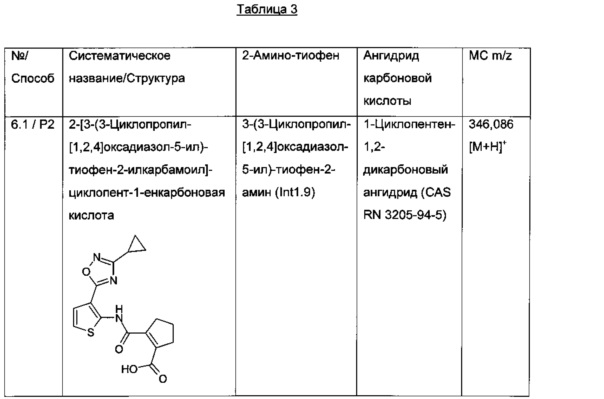
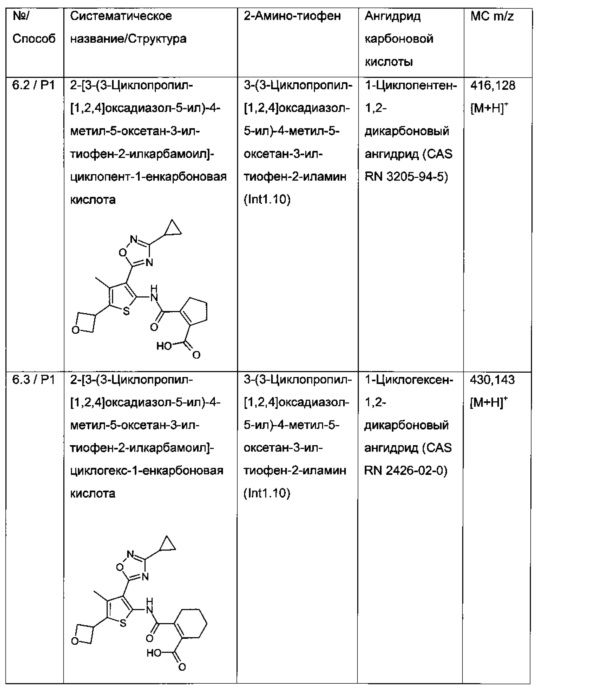
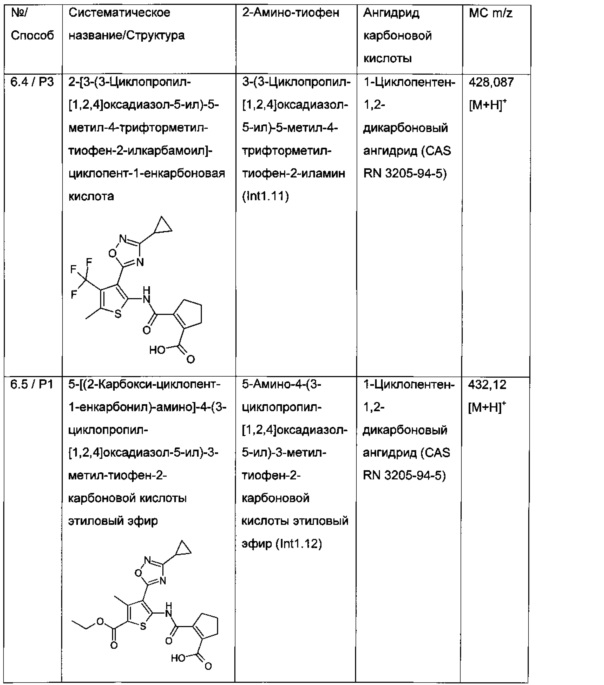
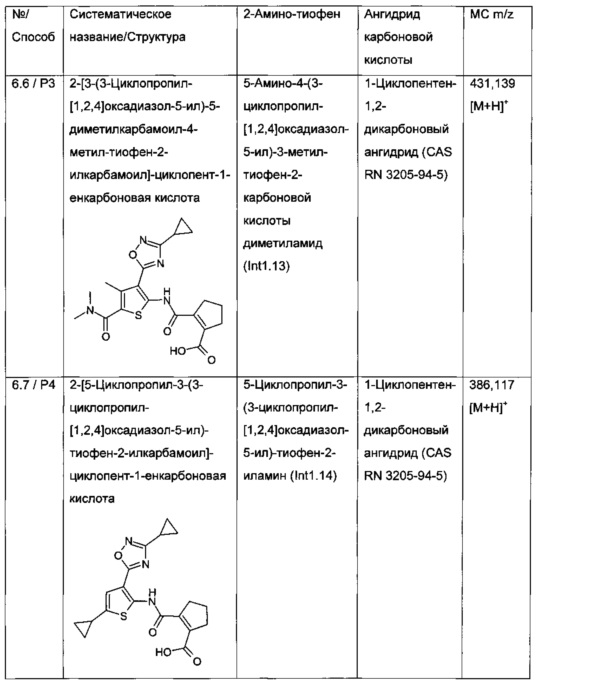
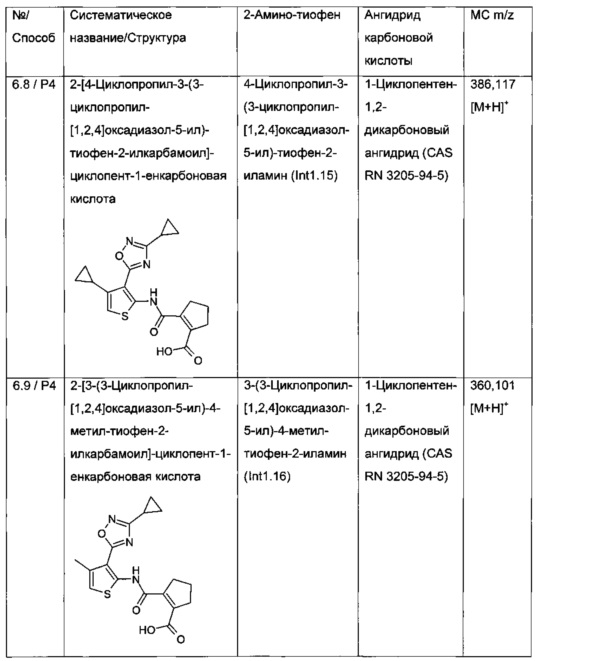
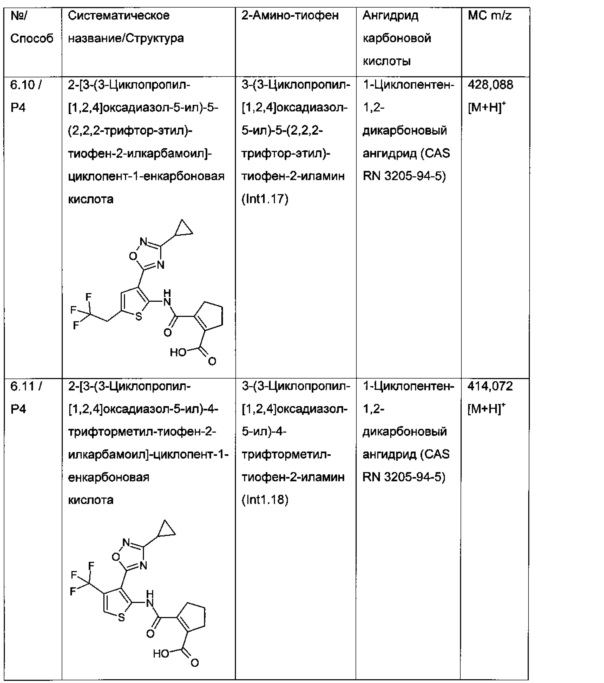
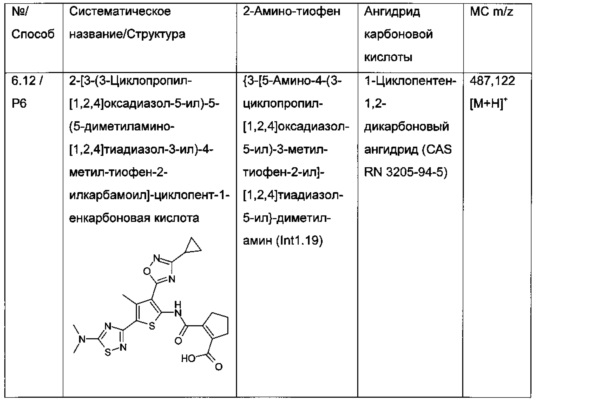
Промежуточные соединения
Общий метод A: Получение 2-аминотиофена
Способ A1: расщепление Boc-защищенного 2-аминотиофена
Boc-защищенный 2-аминотиофен (0,5 ммоль) растворяют в диоксане (5% раствор) и добавляют 4 М HCl в диоксане (10 ммоль). Раствор перемешивают КТ до тех пор, пока TCX не покажет завершение реакции. Неочищенную реакционную смесь концентрируют в вакууме с получением желаемого соединения, которое используют в следующей стадии без дополнительной очистки.
Способ A2: Реакция Гевальда, проводимая в одном сосуде без выделения промежуточного соединения
К раствору альдегида или кетона (5 ммоль) в MeOH (5% раствор) добавляют гетероциклическое производное ацетонитрила (5 ммоль), морфолин (12,5 ммоль) и элементную серу (5,5 ммоль), и реакционную смесь перемешивают при 65°C в течение ночи. После охлаждения до комнатной температуры реакционную смесь экстрагируют EtOAc и полунасыщенным раствором NH4Cl. Органический слой высушивают над Na2SO4 и активированным углем, выпаривают, и соединение очищали хроматографией на силикагеле на колонке 50 г, используя градиент н-гептена:EtOAc в качестве элюента.
Способ A3: замыкание цикла аддукта Кневенагеля
К раствору аддукта Кневенагеля (1,5 ммоль) в EtOH (20 мл) добавляют DBU (3,75 ммоль) и серу (1,5 ммоль). Реакционную смесь перемешивают при 65°C в течение 2 ч, а затем наливали на 10% водный раствор NaHCO3 (30 мл) и EtOAc (30 мл). Слои разделяют, и водный слой экстрагируют второй раз EtOAc (30 мл). Органические слои промывают 30 мл соляного раствора, высушивают над MgSO4, фильтруют и концентрируют в вакууме. Соединение очищают хроматографией на силикагеле на колонке 20 г, используя систему ЖХСД (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан:EtOAc.
Способ A4: Преобразование сложного эфира в оксадиазол на 2-аминотиофене
К раствору 2-аминотиофена, замещенного 3-(метил или этил)эфиром (3,0 ммоль), в EtOH (5 мл) добавляют N'-гидрокси-алкил- или -циклоалкил-карбоксимидамид (3,0 ммоль) и раствор NaOEt (21 масс. % раствор в EtOH, 3,0 ммоль), и реакционную смесь перемешивают при 70°C до завершения реакции, показанного ТСХ или жидкостной хроматографией с масс-спектрометрией (ЖХ-МС). В зависимости от хода реакции можно добавить другую партию N'-гидроксициклопропанкарбоксимидамида и этилата натрия. Реакционную смесь наливают на 30 мл 10% водного раствора NaHCO3 и 30 мл EtOAc, и слои разделяют. Водный слой экстрагируют второй раз 30 мл EtOAc, и органические слои промывают 30 мл соляного раствора, высушивают над MgSO4, фильтруют и концентрируют в вакууме. Продукт очищают препаративной ВЭЖХ (колонка Gemini NX) с градиентом MeOH:H2O (содержащим 0,1% муравьиной кислоты).
Способ A5: Преобразование сложного эфира в оксадиазол на 2-аминотиофене с использованием микроволнового реактора
К раствору 2-аминотиофена, замещенного 3-(метил или этил)эфиром (2 ммоль), в EtOH (4 мл) добавляют N'-гидрокси-алкил- или -циклоалкил-карбоксимидамид (2 ммоль) и NaOEt (21 масс. % раствор в EtOH (2 ммоль). Микроволновое нагревание (120°C) применяют к реакционной смеси, пока ЖХ-МС не покажет завершение преобразования (в характерном случае 30 мин). Реакционную смесь наливают на 30 мл 10% водного раствора NaHCO3 и 30 мл EtOAc, и слои разделяли. Водный слой экстрагируют второй раз 30 мл EtOAc, и органические слои промывают 30 мл соляного раствора, высушивают над MgSO4, фильтруют и концентрируют в вакууме. Соединение очищают хроматографией на силикагеле на колонке 20 г, используя систему ЖХСД (Flashmaster), элюируя градиентом н-гептан:EtOAc (100:0-60:40).
Способ A6: Реакция Гевальда, проводимая в одном сосуде без выделения промежуточного соединения с использованием условий микроволнового реактора
К раствору альдегида или кетона (1 ммоль) в EtOH (1,5 мл) добавляют гетероциклическое производное ацетонитрила (1 ммоль), серу (1 ммоль) и N-метилморфолин (1 ммоль), реакционную смесь нагревают в микроволновой печи при 120-150°C в течение 30 мин, а затем наливают на 30 мл 10% водного раствора NaHCO3 и 30 мл EtOAc, и слои разделяют. Водный слой экстрагируют второй раз 30 мл EtOAc. Органические слои промывают 30 мл соляного раствора, высушивают над MgSO4, фильтруют и выпаривают. Соединение очищают хроматографией на силикагеле на колонке 20 г, используя систему ЖХСД (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан:EtOAc.
Способ A7: Модифицированная реакция Гевальда, проводимая в одном сосуде без выделения промежуточного соединения
К раствору альдегида или кетона (3 ммоль) в EtOH (7 мл) добавляют гетероциклическое производное ацетонитрила (3 ммоль) и элементную серу (3 ммоль), и реакционную смесь перемешивают при 50°C в течение 30 мин. Затем добавляют по каплям морфолин (180 ммоль) в течение 10 мин. Реакционную смесь перемешивают при 50°C в течение 1,5 ч, а затем наливают на 30 мл 10% водного раствора NaHCO3 и 30 мл EtOAc, и слои разделяют. Водный слой экстрагируют второй раз 30 мл EtOAc, и органические слои промывают 30 мл соляного раствора, высушивают над MgSO4, фильтруют и концентрируют в вакууме. Соединение очищают хроматографией на силикагеле на колонке 20 г, используя систему ЖХСД (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан:EtOAc.
Промежуточные соединения в таблице 4 были получены согласно описанным выше способам и с использованием исходного вещества, как перечислено в таблице 4:
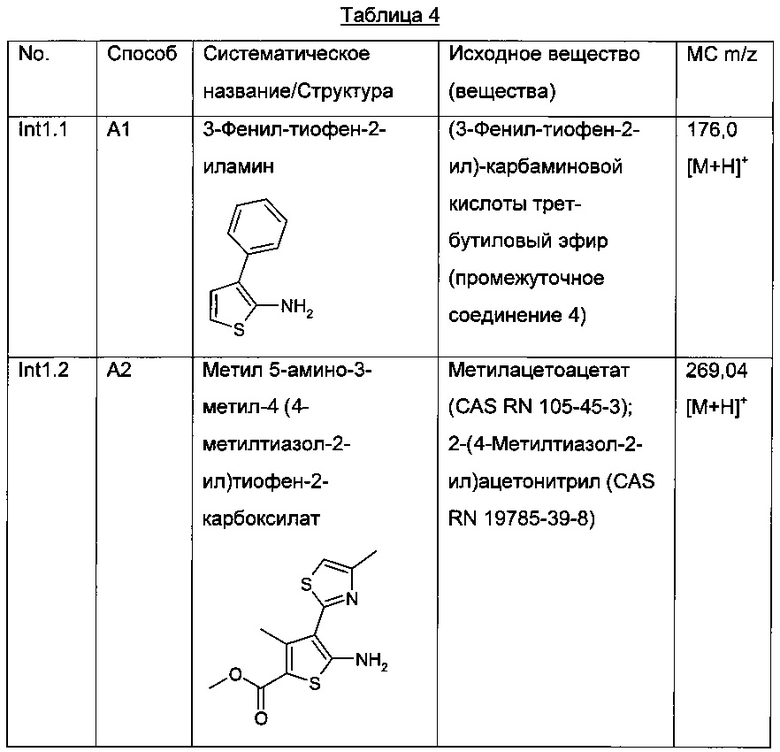
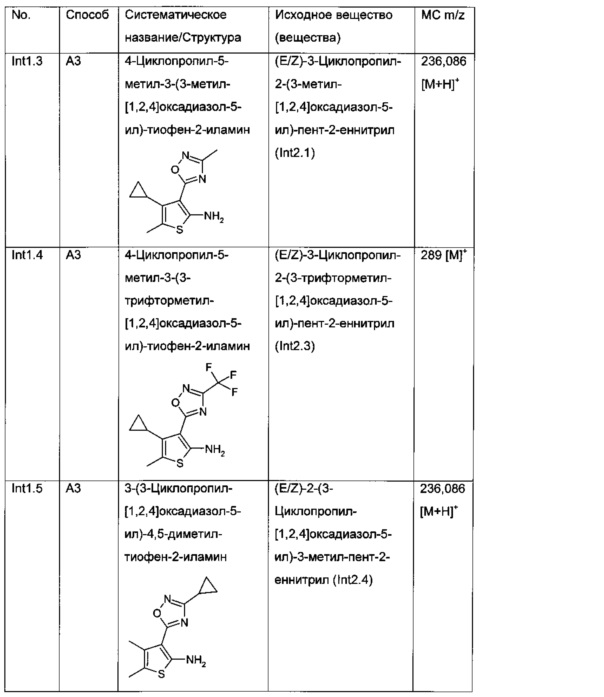
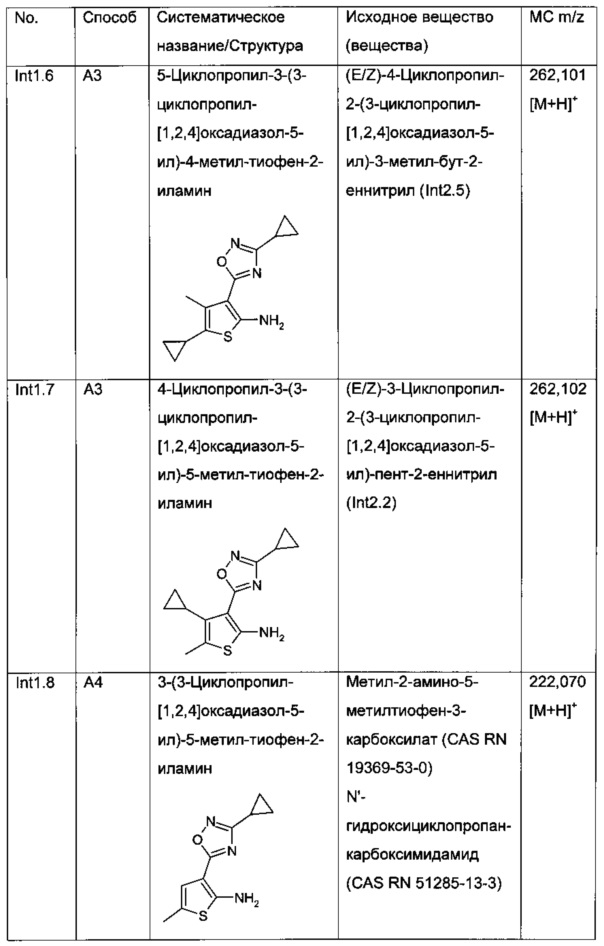
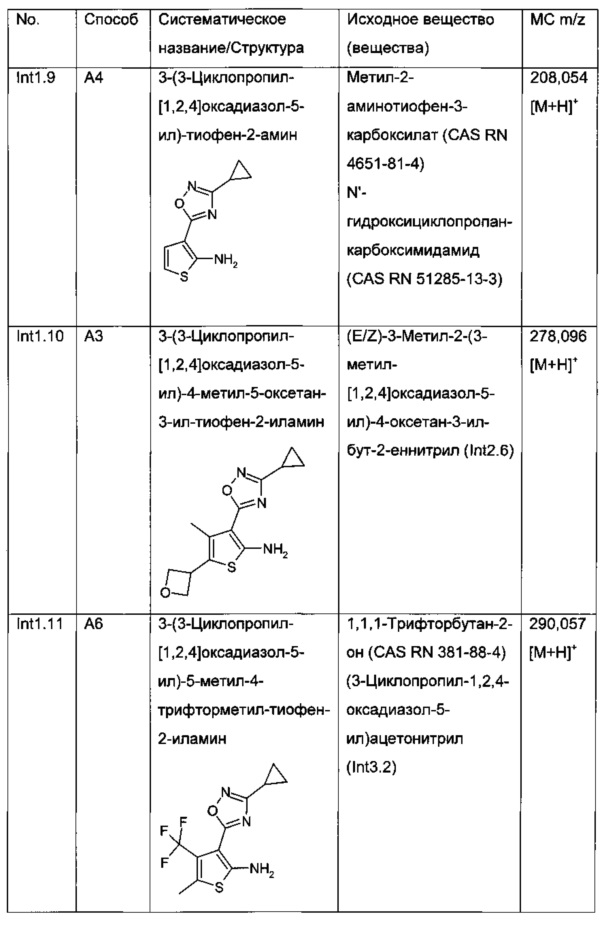
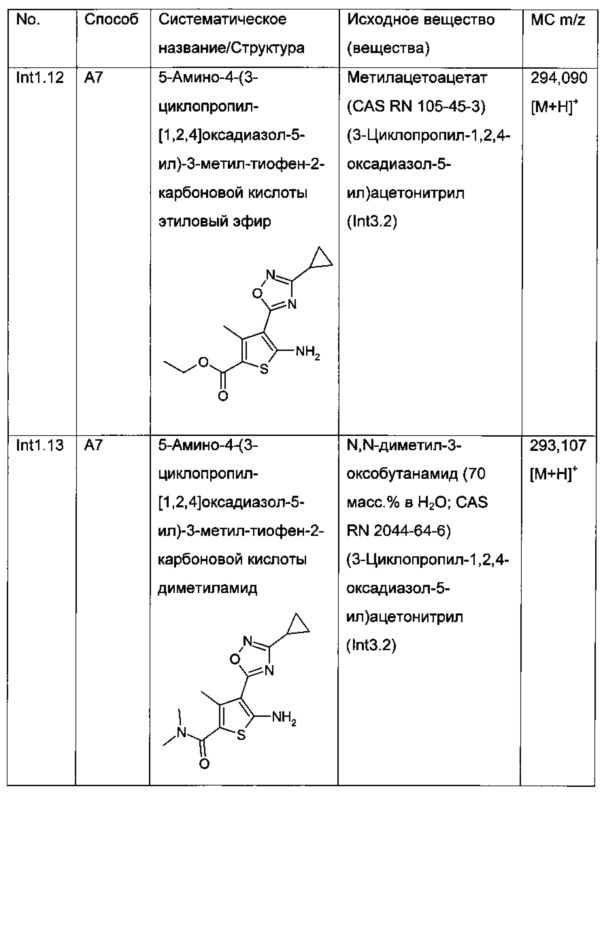
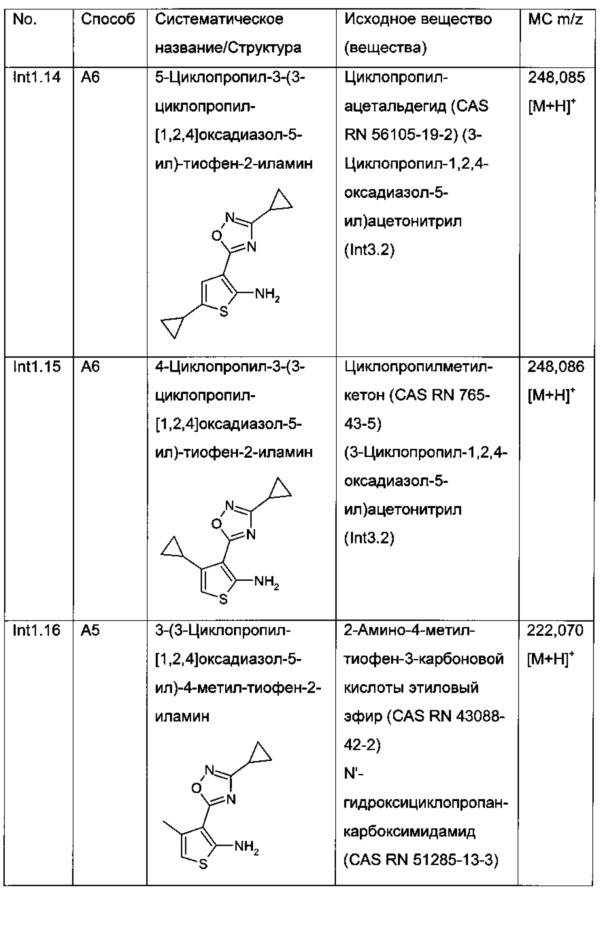
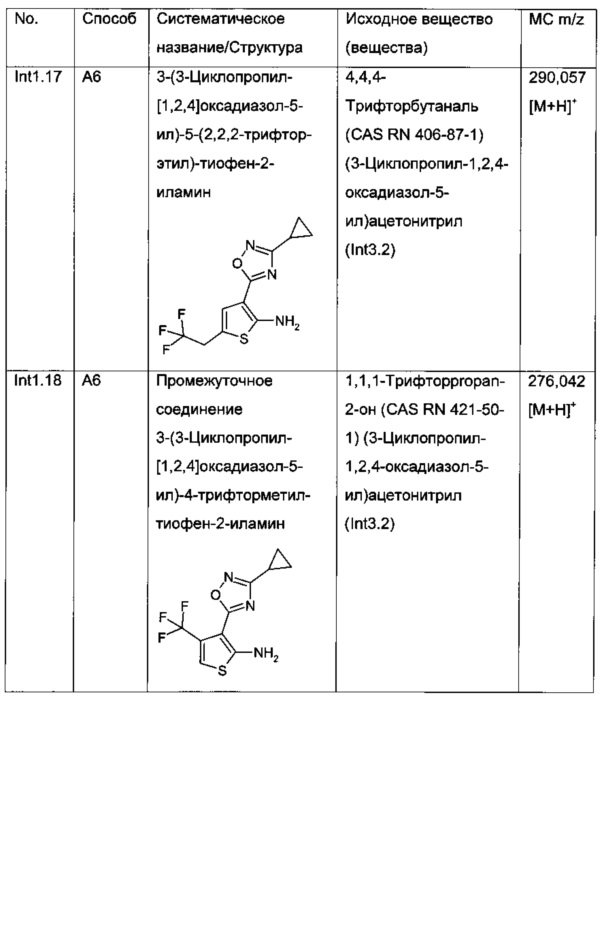
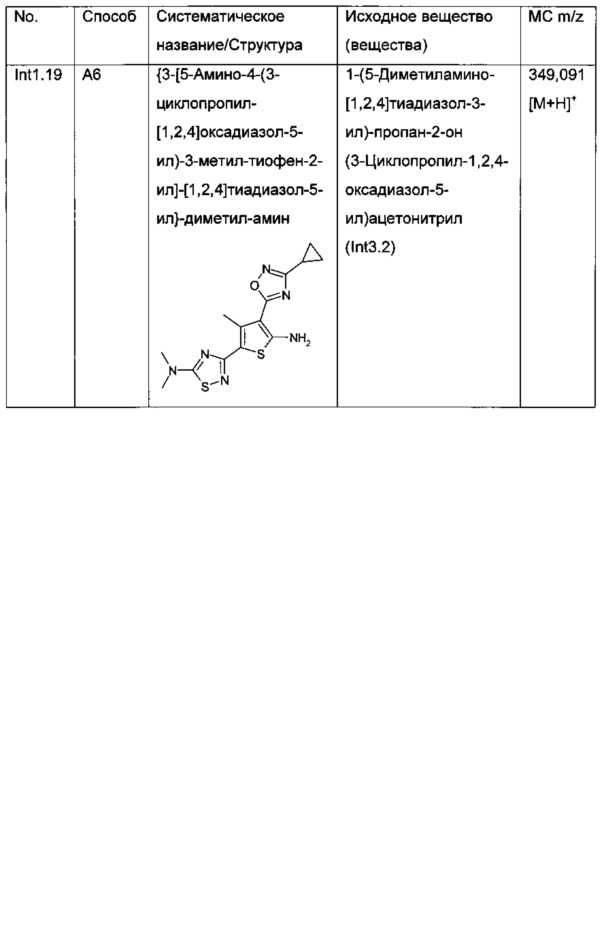
Общий метод B: Получение аддуктов Кневенагеля
Способ B1: К суспензии кетона или альдегида (3 ммоль) в толуоле (9 мл) добавляют гетероциклил-ацетонитрил и NH4OAc (6 ммоль). Реакционную смесь перемешивают при 100°C в течение 18 ч, затем наливают на 10% водный раствор NaHCO3 (30 мл) и EtOAc (30 мл), и слои разделяют. Водный слой экстрагируют второй раз EtOAc (30 мл), и органические слои промывают соляным раствором (30 мл), высушивают над MgSP4, фильтруют и концентрируют в вакууме. Соединение очищают хроматографией на силикагеле на колонке 20 г, используя систему ЖХСД (Flashmaster), элюируя градиентом н-гептан:EtOAc.
Промежуточные соединения в таблице 5 были получены согласно описанным выше способам, и с использованием исходных веществ, перечисленных в таблице 5:
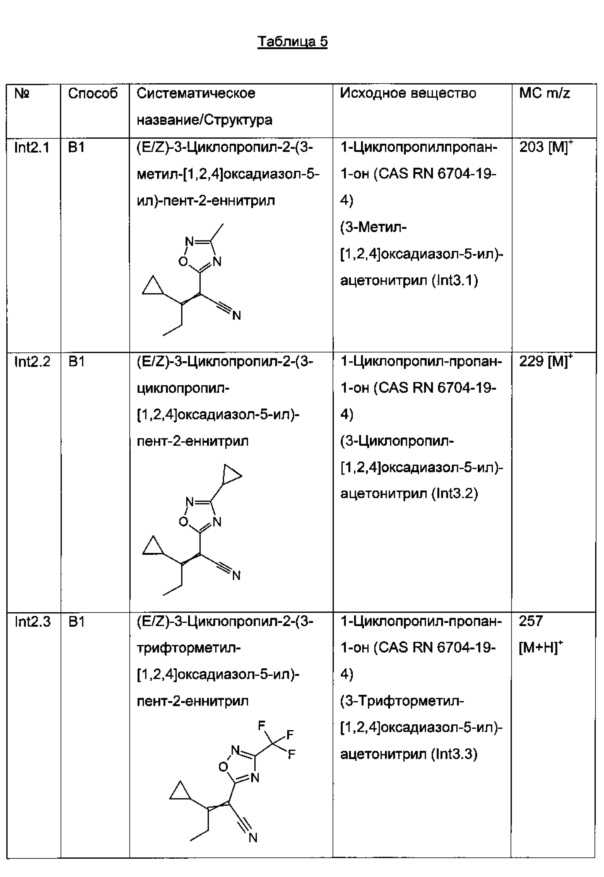
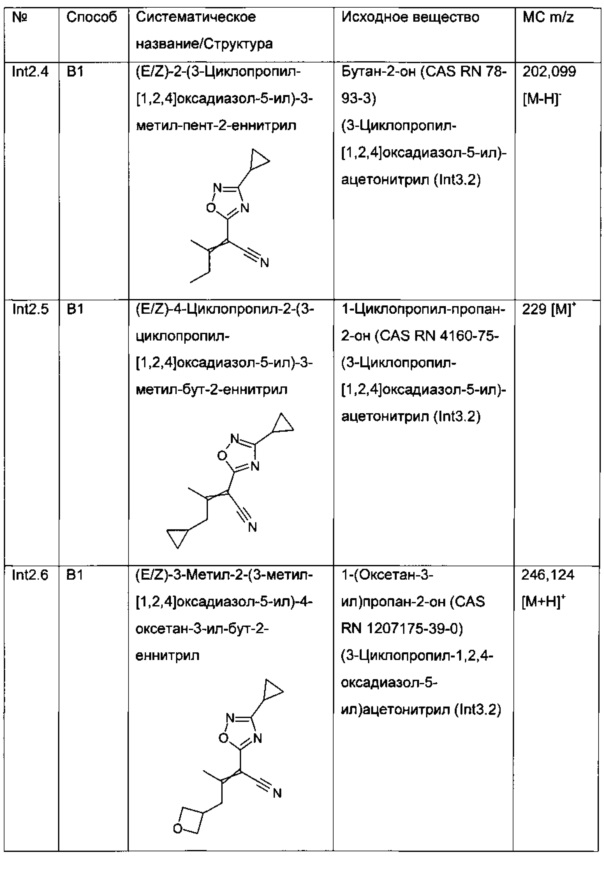
Общий метод C: Получение цианометилоксадиазолов
Способ C1: к раствору N'-гидрокси-алкил- или -циклоалкил-карбоксимидамида (50 ммоль) в диоксане (150 мл) добавляют 3-(3,5-диметил-1H-пиразол-1-ил)-3-оксопропаннитрил (55 ммоль). Реакционную смесь перемешивают при температуре образования флегмы в течение 3 ч, а затем концентрируют в вакууме. Соединение очищают хроматографией на силикагеле на колонке 330 г, используя систему ЖХСД (CombiFlash Companion XL, Isco Inc.), элюируя градиентом н-гептан:EtOAc.
Способ C2: К суспензии NaCN (30 ммоль) в CH3CN (10 мл) добавляют 15-краун-5 (10 ммоль, CAS RN 33100-27-5), и суспензию перемешивают при КТ в течение 45 мин. К этой смеси добавляют по каплям раствор 5-(хлорметил)-3-замещенного 1,2,4-оксадиазола (5 ммоль) в CH3CN (5 мл) в течение 30 мин. Светло-желтую суспензию перемешивают при КТ в течение 3 ч, а затем наливают на 100 мл H2O и 100 мл EtOAc, и слои разделяют. Водный слой экстрагируют второй раз 100 мл EtOAc, и органические слои промывают 100 мл соляного раствора, высушивают над MgSO4, фильтруют и концентрируют в вакууме. Соединение очищают хроматографией на силикагеле на колонке 50 г, используя систему ЖХСД (CombiFlash Companion, Isco Inc.), элюируя градиентом н-гептан:EtOAc.
Промежуточные соединения в таблице 6 были получены согласно описанным выше способам, и с использованием исходных веществ, перечисленных в таблице 6.

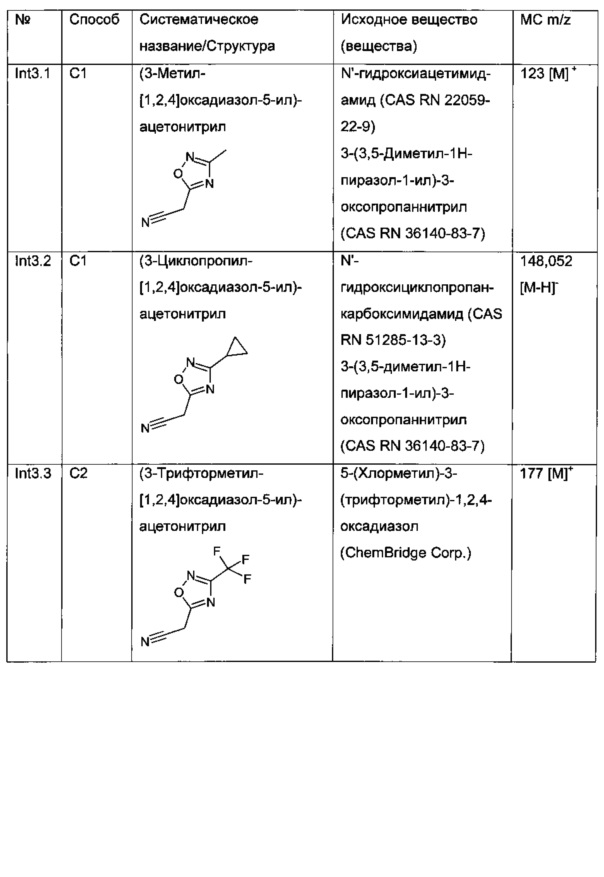
Промежуточное соединение 4
(3-Фенил-тиофен-2-ил)-карбаминовой кислоты трет-бутиловый эфир
3-Фенил-тиофен-2-карбоновую кислоту (200 мг, 979 мкмоль), NEt3 (99,1 мг, 136 мкл, 979 мкмоль) и дифенилфосфорилазид (275 мг, 215 мкл, 999 мкмоль) растворяли в трет-BuOH. Раствор перемешивали при 85°C в течение 5 ч, затем при КТ в течение ночи. Образовавшуюся суспензию фильтровали, и фильтрационный кек промывали небольшим количеством трет-BuOH. Фильтрат разбавляли EtOAc, промывали H2O и соляным раствором. Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (от 0% до 18% EtOAc в н-гептане) с получением соединения, указанного в заголовке, в виде желтого твердого вещества (0,122 г, 45%). МС (ИЭР): m/z=276,2 [M+H]+.
Промежуточное соединение 5
3-Фенил-тиофен-2-карбоновая кислота
3-Фенил-тиофен-2-карбальдегид (0,527 г, 2,8 ммоль) разводили в CH3CN (12,4 мл), и раствор охлаждали до 10°C. Добавляли раствор NaH2PO4 (47 мг, 0,392 ммоль) в H2O (0,54 мл) и пероксид водорода (1,36 г, 1,2 мл, 14,0 ммоль, 35 масс. % раствор в воде) с последующим добавлением раствора NaClO2 (0,166 г, 1,83 ммоль) в H2O (1,89 мл) в течение 5 мин. Полученную в результате двухфазную систему энергично перемешивали при 10°C в течение 2 ч. Перемешивание продолжали при КТ в течение ночи. Реакционную смесь гасили охлаждением до 10°C и добавлением Na2SO3. Затем реакционную смесь наливали на водный раствор Na2SO3. Прозрачную двухфазную систему образовывали путем добавления некоторого количества H2O. После подкисления до pH 1 5 М водным раствором HCl образовалась суспензия, которую фильтровали. Твердое вещество промывали H2O и высушивали в высоком вакууме с получением соединения, указанного в заголовке, в виде белого твердого вещества (0,532 г, 92%). МС (ИЭР): m/z=203,1 [M-H]-.
Промежуточное соединение 6
3-Фенил-тиофен-2-карбальдегид
3-Бромтиофен-2-карбальдегид (3 г, 1,67 мл, 14,8 ммоль, CAS RN 930-96-1) растворяли в ДМЭ (180 мл), и из полученного в результате раствора откачивали воздух и продували аргоном три раза. Добавляли Pd(Ph3P)4 (512 мг, 443 мкмоль), реакционную колбу снова продували аргоном, и перемешивание продолжали при КТ в течение 15 мин. Затем добавляли 2 М водный раствор Na2CO3 (14,8 мл, 29,5 ммоль), а затем фенилбороновую кислоту (1,98 г, 16,2 ммоль). Реакционную колбу снова продували аргоном, и реакционную смесь нагревали до 80°C и перемешивали в течение 6,5 ч. После выпаривания растворителя остаток растворяли в Et2O и H2O, и слои разделяли. Органический слой высушивали над Na2SO4, фильтровали и выпаривали. Неочищенный остаток суспендировали в CH2Cl2 и н-гептане, и твердое вещество отфильтровывали. Фильтрат выпаривали, и неочищенный продукт очищали флэш-хроматографией на силикагеле (градиент EtOAc/н-гептан, 0%-10%). Фракции, содержащие продукт, объединяли и дополнительно очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде желтого масла (0,939 г, 34%). МС (ИЭР): m/z=189,2 [M+H]+.
Промежуточное соединение 7
2-[4-Циклопропил-5-метил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновой кислоты метиловый эфир
К циклопент-1-ен-1,2-дикарбоновой кислоты монометиловому эфиру (50,0 мг, 294 мкмоль, полученному по аналогии с Т. Yoshimutsu, Т. Tanaka et al., Heterocycles 2009, 77(1), 179-186), добавляли ДМФ (2,15 мг, 2,28 мкл, 29,4 мкмоль) и тионилхлорид (699 мг, 429 мкл, 5,88 ммоль), и раствор нагревали до образования флегмы в течение 30 мин. Реакционную смесь концентрировали в вакууме, и остаток разбавляли три раза толуолом с последующим выпариванием, чтобы полностью удалить тионилхлорид. Остаток растворяли в CH2Cl2 (2 мл), и этот раствор добавляли к раствору 4-циклопропил-5-метил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-иламина (85 мг, 294 мкмоль, Int1.4) и DIPEA (76,0 мг, 103 мкл, 588 мкмоль) в CH2Cl2 (3 мл), и светло-коричневый раствор перемешивали при КТ в течение 18 ч. Реакционную смесь наливали на 30 мл 10% водный раствор NaHCO3 и 30 мл EtOAc, и слои разделяли. Водный слой экстрагировали второй раз 30 мл EtOAc. Органические слои промывали 30 мл соляного раствора, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Соединение очищали хроматографией на силикагеле на колонке 20 г, используя систему ЖХСД (Flashmaster), элюируя градиентом н-гептан:EtOAc (100:0-75:25). Светло-желтое твердое вещество (88 мг, 67,8%). МС (ИЭР): m/z=442,104 [M+H]+.
Промежуточные соединения в таблице 7 были получены согласно способу, описанному под промежуточным соединением 7, и используя исходные вещества, перечисленные в таблице 7.
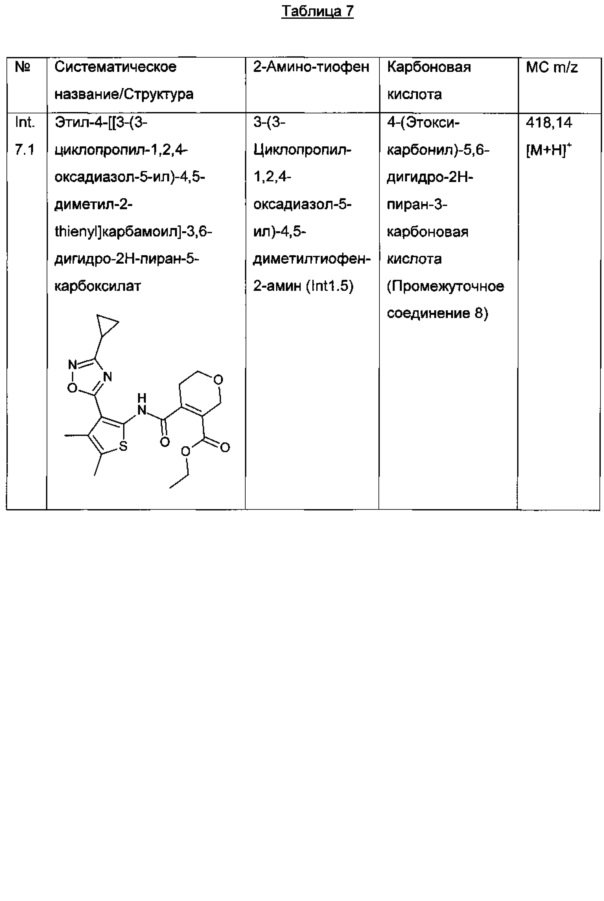
Пример 7
транс-2-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-циклогексанкарбоновая кислота
К раствору 3-(3-циклопропил-1,2,4-оксадиазол-5-ил)-4,5-диметилтиофен-2-амина (0,08 г, 340 мкмоль, Int1.5) в трет-бутилметиловом эфире (2 мл) добавляли транс-1,2-циклогександикарбоновый ангидрид (62,9 мг, 408 мкмоль, CAS RN 14166-21-3), и этот прозрачный раствор нагревали до образования флегмы в течение 19 ч. Реакционную смесь выпаривали, и продукт очищали препаративной ВЭЖХ (колонка Gemini NX), используя градиент MeOH:H2O (содержащий 0,1% муравьиной кислоты) (20:80-98:2). Бесцветное твердое вещество (0,1 г; 75,5%). МС (ИЭР): m/z=390,15 [M+H]+.
Примеры в таблице 8 были получены согласно способам, используемым в примере 7, используя реагенты, представляющие собой 2-аминотиофен и производное карбоновой кислоты, перечисленные в таблице 8.
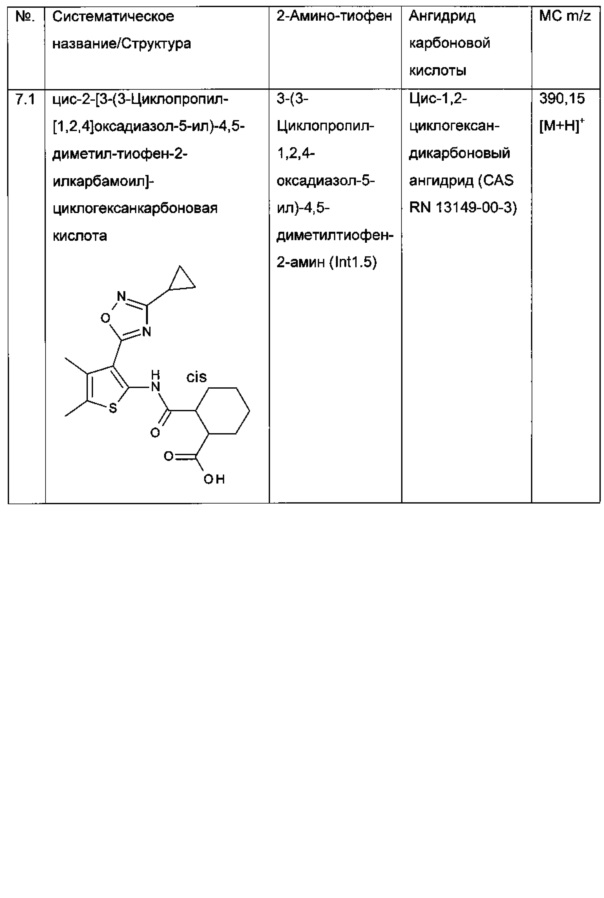
Примеры 8 и 9
5-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-3,6-дигидро-2H-пиран-4-карбоновая кислота
и
4-[3-(3-Циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметил-тиофен-2-илкарбамоил]-5,6-дигидро-2H-пиран-3-карбоновая кислота
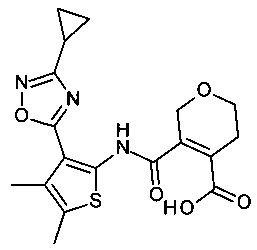 и
и 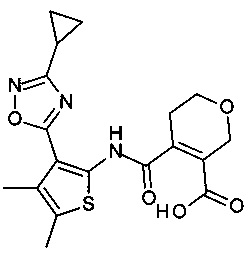
К суспензии этил-5-(3-(3-циклопропил-1,2,4-оксадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил)-3,6-дигидро-2H-пиран-4-карбоксилата (272 мг, 652 мкмоль, Int7.1) в диоксане (3 мл) и H2O (3 мл) добавляли LiOH моногидрат (15,6 мг, 652 мкмоль), и реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Затем добавляли другую партию LiOH моногидрата (7,8 мг, 326 мкмоль). Густую желтую суспензию выпаривали. Остаток суспендировали в H2O (приблизительно 3,5 мл) и обрабатывали 1 М водным раствором HCl (3 мл). Эту смесь дважды экстрагировали EtOAc. Органические слои один раз промывали соляным раствором, высушивали над MgSO4, фильтровали и выпаривали. Остаток очищали двумя хроматографиями на силикагеле на колонке 50 г, используя систему ЖХСД (CombiFlash Companion XL, Isco Inc.), элюируя градиентом CH2Cl2:MeOH (100:0-90:10). В результате препаративной ВЭЖХ (хиральная колонка Chiralpak-AD) с использованием изократической смеси (EtOH+0,5% муравьиная кислота):н-гептан (40:60) получили желаемые изомеры.
Изомер, элюирующий первым (пример 8): Светло-желтое твердое вещество (44 мг, 17,3%). МС (ИЭР): m/z=390,11 [M+H]+.
Изомер, элюирующий вторым (пример 9): Восковое желтое твердое вещество (80 мг, выход 31,5%). МС (ИЭР): m/z=390,11 [M+H]+.
Промежуточное соединение 8
4-(Этоксикарбонил)-5,6-дигидро-2H-пиран-3-карбоновая кислота
Смесь уксусного ангидрида (5,19 г, 4,8 мл, 50,9 ммоль), DIPEA (6,58 г, 8,89 мл, 50,9 ммоль) и формиата натрия (5,19 г, 76,3 ммоль) перемешивали при КТ в течение 1 ч. Добавляли по каплям раствор этил-5-(трифторметилсульфонилокси)-3,6-дигидро-2H-пиран-4-карбоксилата (8,6 г, 25,4 ммоль; получен согласно WO 2010038167) в ДМФ (50 мл) с последующим добавлением ацетата палладия(II) (286 мг, 1,27 ммоль) и LiCl (3,24 г, 76,3 ммоль). После перемешивания при КТ в течение 1,5 ч черную суспензию наливали на 2 М водный раствор HCl (100 мл) и EtOAc (100 мл), и слои разделяли. Водный слой дважды экстрагировали EtOAc (100 мл). Органические слои дважды промывали H2O и один раз соляным раствором, высушивали над MgSO4, фильтровали, обрабатывали силикагелем и выпаривали. Соединение очищали хроматографией на силикагеле на колонке 120 г, используя систему ЖХСД, элюируя градиентом CH2Cl2:MeOH (100:0-80:20). Светло-коричневое масло (4,14 г; 81,3%). МС (ИЭР): m/z=199,06 [M-H]-.
Пример 10
(R)-1-[4,5-Диметил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-пирролидин-2-карбоновая кислота
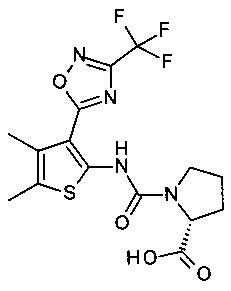
К раствору 5-(2-изоцианато-4,5-диметил-тиофен-3-ил)-3-трифторметил-[1,2,4]оксадиазола (178 мг, 0,615 ммоль) в CH2Cl2 (10 мл) добавляли D-пролин (142 мг, 1,23 ммоль) и триэтиламин (0,128 мл, 0.923 ммоль) при 25°C, и реакционную смесь перемешивали при 25°C в течение 12 ч. Реакционную смесь разбавляли CH2Cl2 (20 мл) и промывали 2 н. водным раствором HCl (15 мл), а затем H2O (20 мл). Органический слой высушивали над Na2SO4, фильтровали и выпаривали. Остаток очищали, используя колоночную хроматографию на силикагеле, используя градиент CH2Cl2:MeOH (100:0-95:5), с получением желаемого соединения в виде беловатого твердого вещества (120 мг, 48%). МС (ИЭР): m/z=403,4 (M-H)-.
Промежуточное соединение 9
5-(2-Изоцианато-4,5-диметил-тиофен-3-ил)-3-трифторметил-[1,2,4]-оксадиазол
к раствору 4,5-диметил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-иламина (165 мг, 0,627 ммоль, Int1.22) в ТГФ (4 мл) добавляли трифосген (149 мг, 0,501 ммоль), и реакционную смесь перемешивали при 25°C в течение 2 ч. Растворитель выпаривали с получением желаемого соединения в виде бесцветного твердого вещества (178 мг, 98%), которое использовали в следующей стадии без очистки.
Примеры в таблице 9 были получены согласно способам, используемым в примере 4, используя реагенты, представляющие собой 2-аминотиофен и ангидрид карбоновой кислоты, перечисленные в таблице 9.
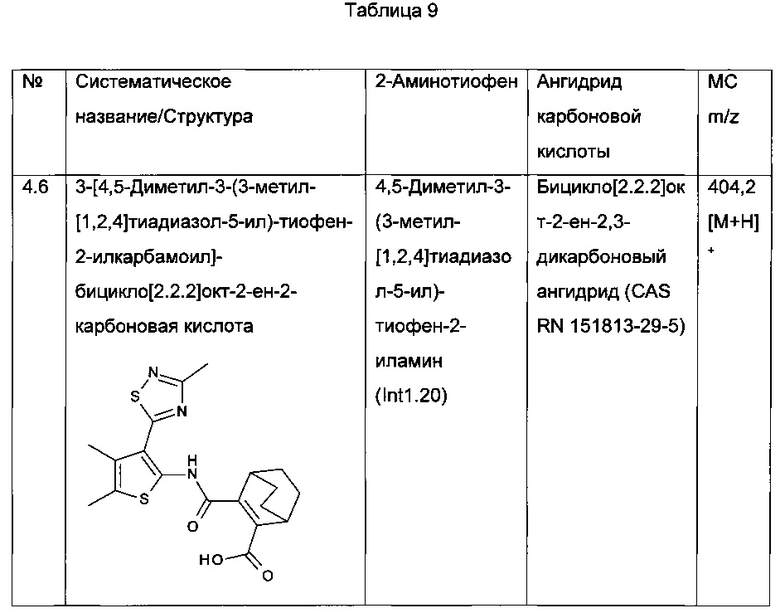
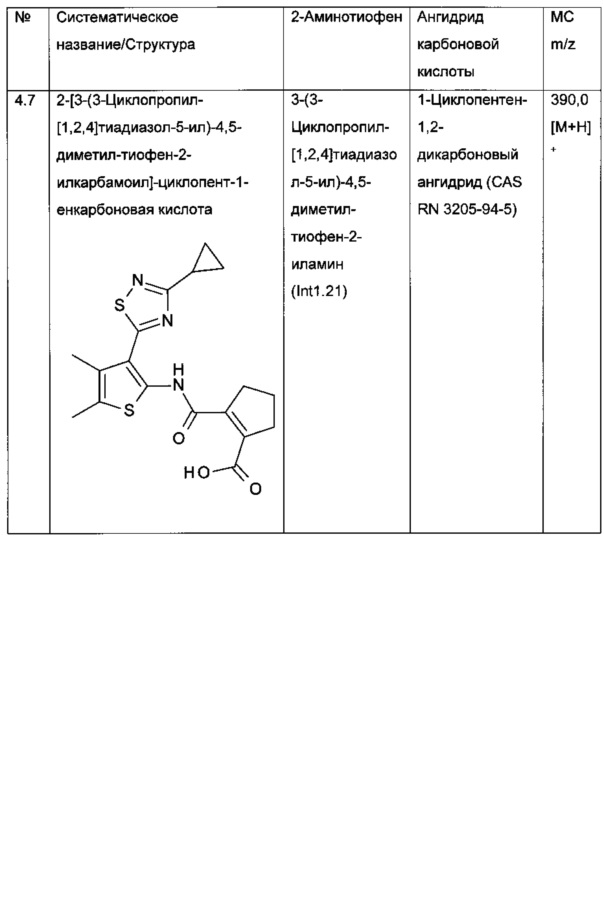
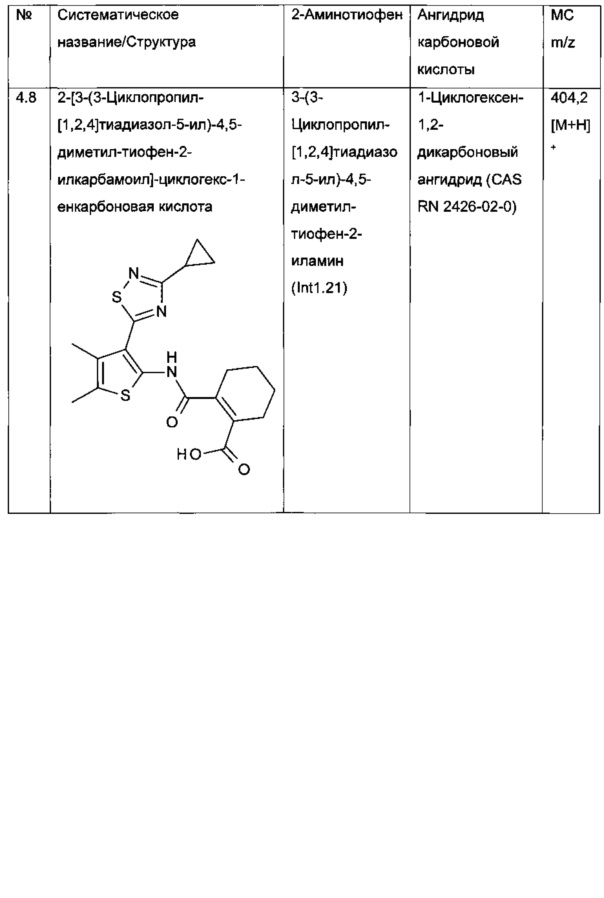
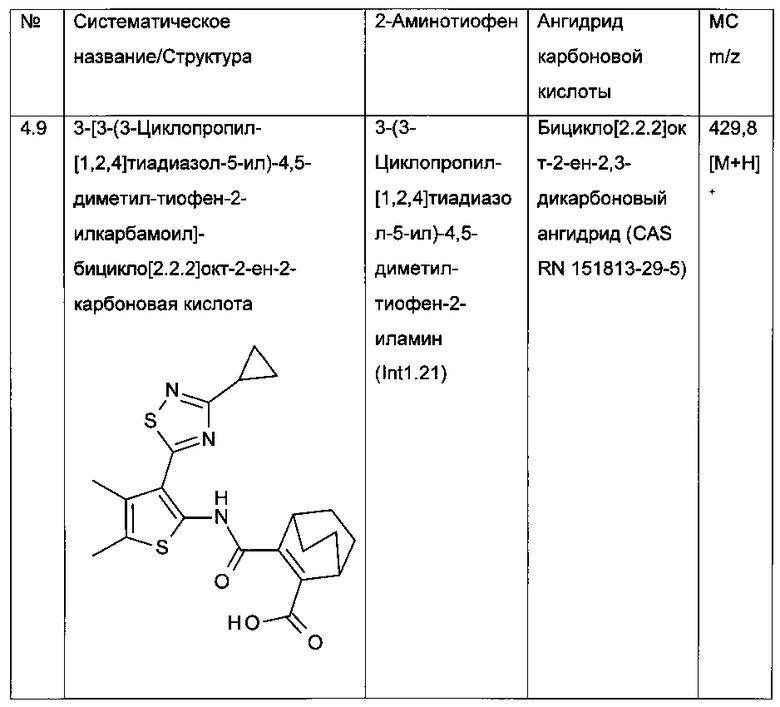
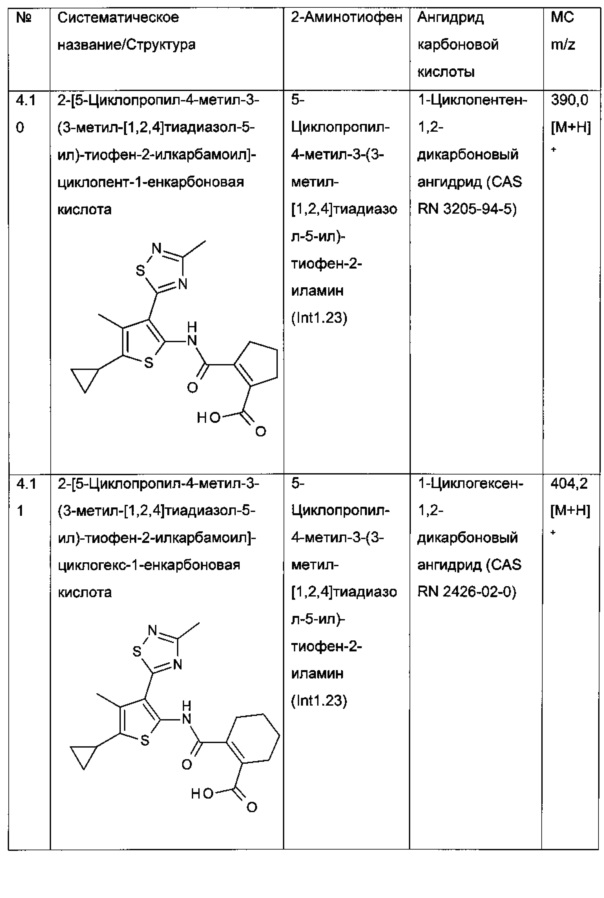
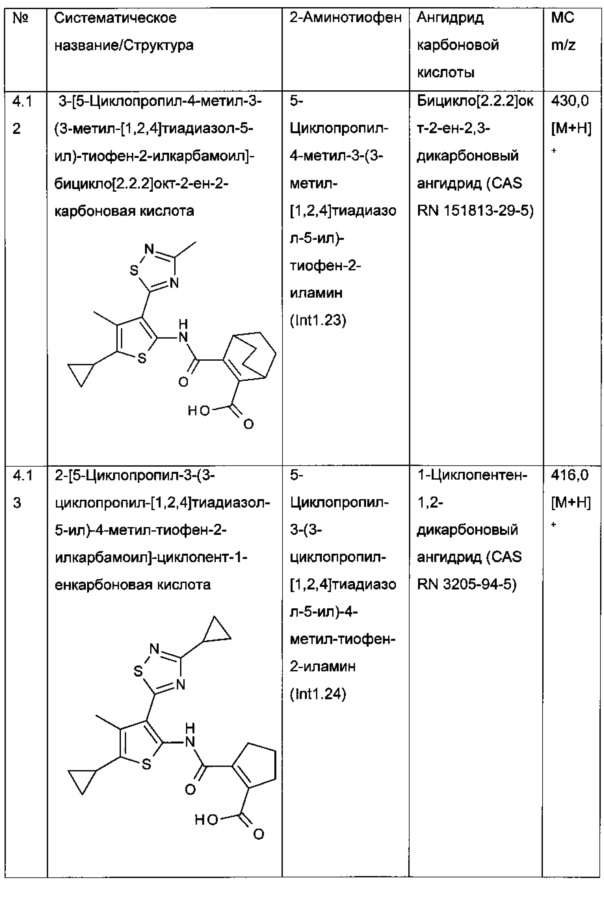
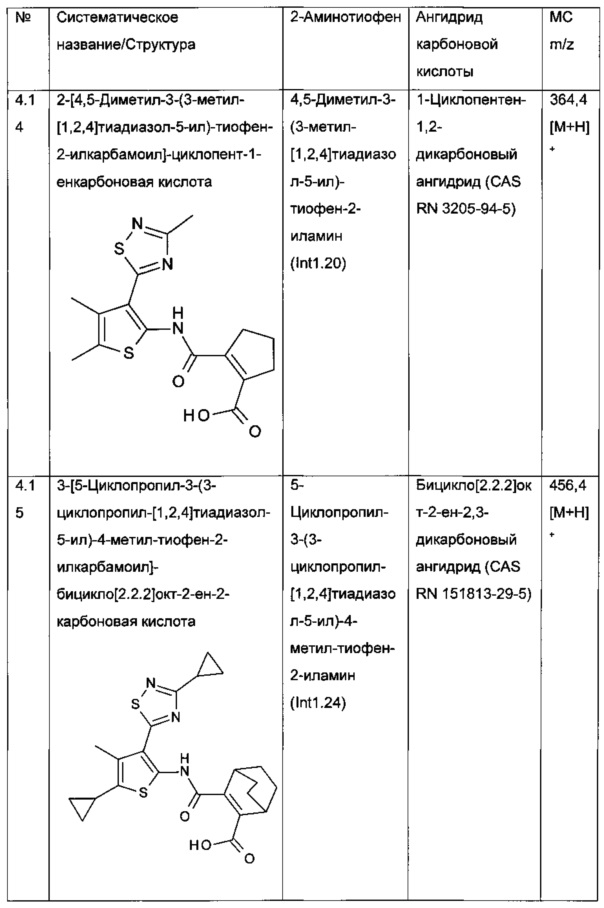
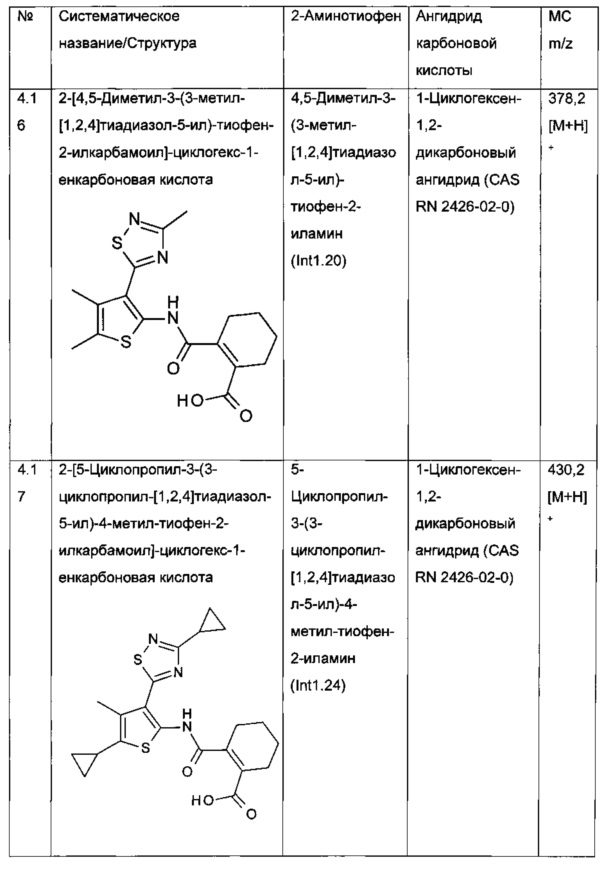
Промежуточные соединения в таблице 10 были получены согласно способам A7 и A3, соответственно, как описано выше, и используя исходные вещества, перечисленные в таблице 10.
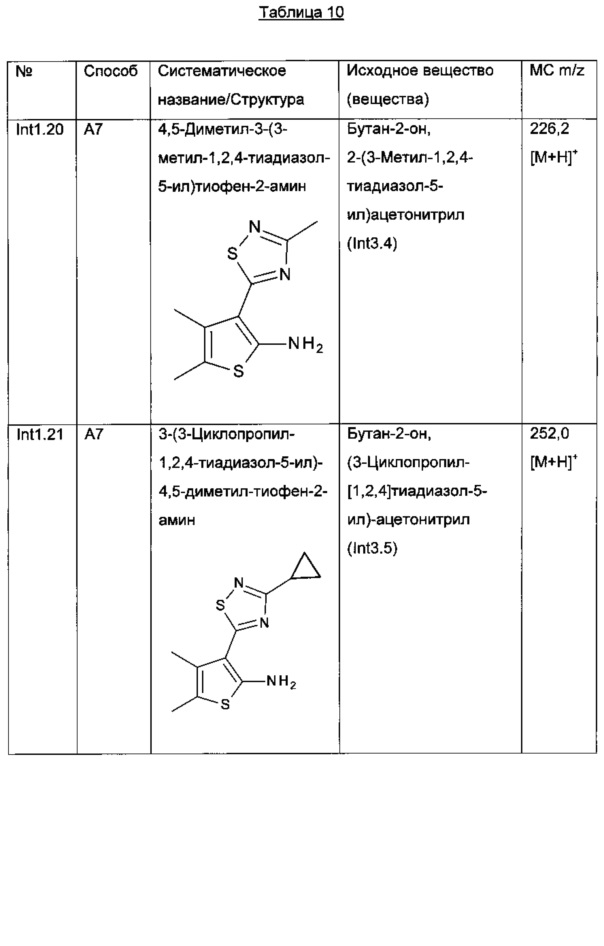
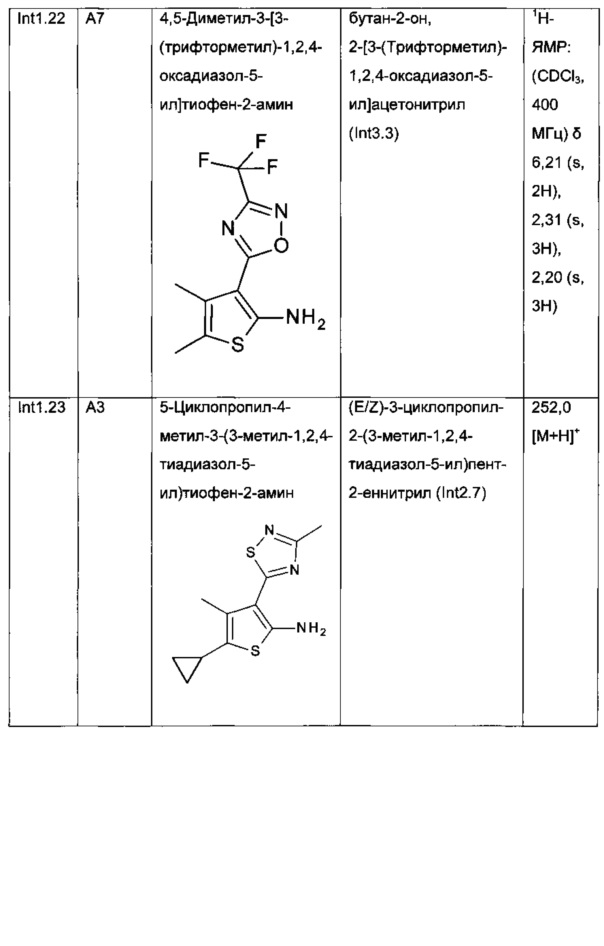
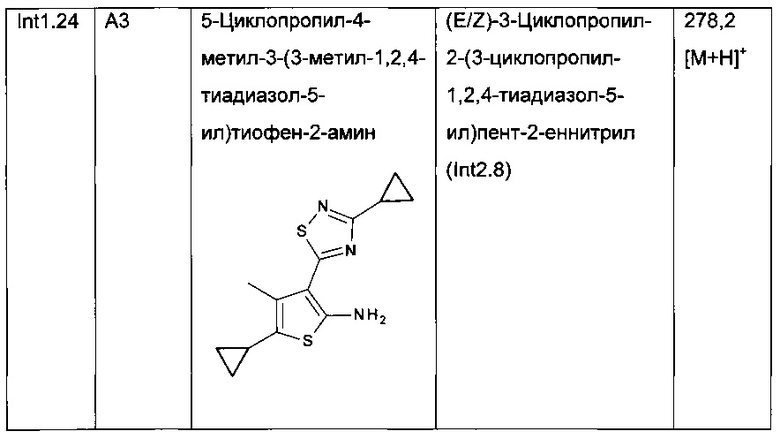
Промежуточные соединения в таблице 11 были получены согласно способу B1, описанному выше, и используя исходные вещества, перечисленные в таблице 11:
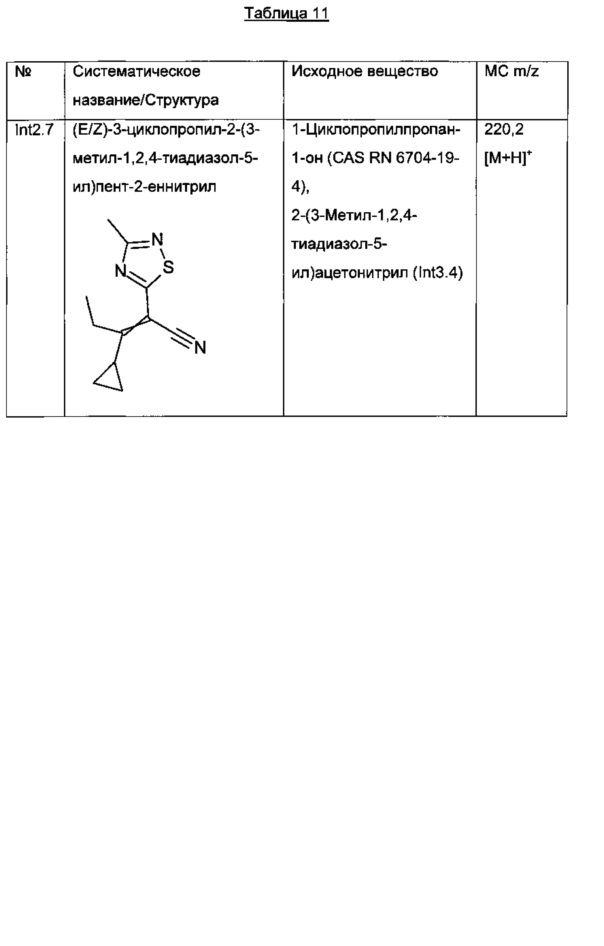
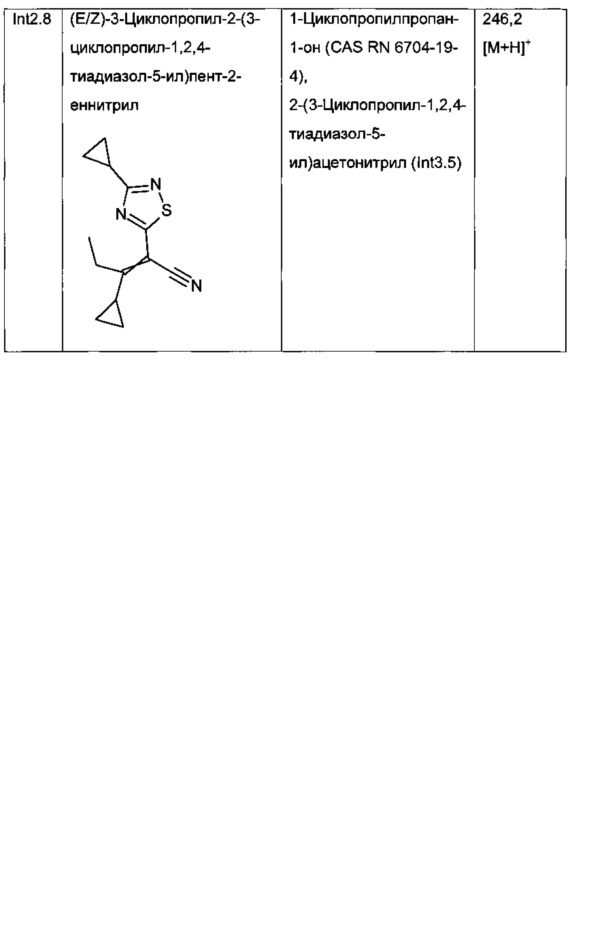
Общий метод D: Получение цианометил-тиадиазолов
К раствору 5-хлор-3-алкил-[1.2.4]тиадиазола (6 ммоль) в безводном ТГФ (15 мл) добавляют безводный CH3CN (12 ммоль), и раствор охлаждают до 0°C. Затем добавляют по каплям LiHMDS (12 ммоль, 1 М раствор в ТГФ) при этой температуре, и реакционную смесь перемешивают при 25°C в течение 5 ч. Реакционную смесь гасят насыщенным водным раствором NH4Cl (20 мл) и экстрагируют три раза EtOAc (каждый раз по 30 мл). Объединенные органические слои промывают соляным раствором, высушивают над Na2SO4, фильтруют и выпаривают. Остаток очищают колоночной хроматографией на силикагеле, элюируя градиентом EtOAc:н-гептан, с получением желаемого продукта, который можно использовать в следующей стадии без дополнительной очистки.
Промежуточные соединения в таблице 12 были получены согласно описанному выше способу, и используя исходные вещества, перечисленные в таблице 12.
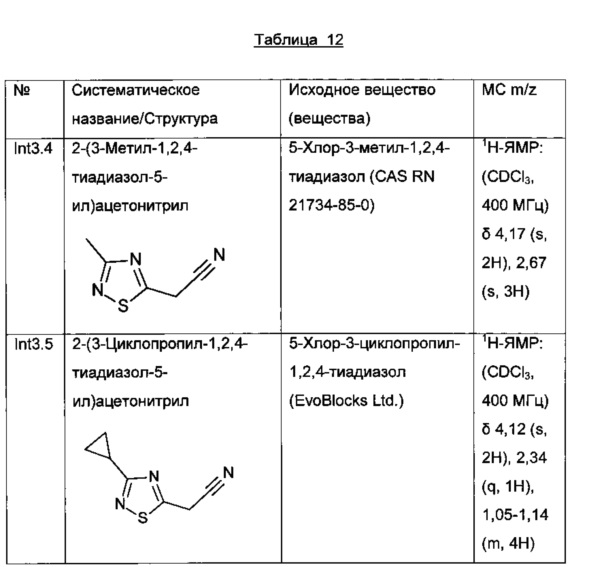
Пример A
Соединение формулы (I) можно применять способом, который сам по себе известен, в качестве активного ингредиента для получения таблеток следующей композиции:
Пример B
Соединение формулы (I) можно применять способом, который сам по себе известен, в качестве активного ингредиента для получения капсул следующей композиции:
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ТИОФЕНИЛАМИДА | 2013 |
|
RU2644565C2 |
| Бициклические производные пиридина, полезные в качестве ингибитора белков, связывающих жирные кислоты (FABP) 4 и/или 5 | 2013 |
|
RU2648247C2 |
| ПРОИЗВОДНЫЕ ДОЛАСТАТИНА 15 | 1998 |
|
RU2195462C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Ха | 2004 |
|
RU2346944C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА | 2020 |
|
RU2839897C2 |
| ПРОИЗВОДНЫЕ ПИРИДИНА И ПИРИМИДИНА В КАЧЕСТВЕ АНТАГОНИСТОВ mGluR2 | 2007 |
|
RU2451673C2 |
| ПРОИЗВОДНЫЕ N-(ИМИДАЗОПИРИМИДИН-7-ИЛ)-ГЕТЕРОАРИЛАМИДОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE10A | 2011 |
|
RU2562066C2 |
| АЗАИНДОЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Xa | 2004 |
|
RU2330853C2 |
| ДИКЕТОН В КАЧЕСТВЕ ПРОМЕЖУТОЧНОГО ПРОДУКТА ПРИ ПОЛУЧЕНИИ 3-ГАЛОГЕН-1Н-ПИРАЗОЛОВ | 1996 |
|
RU2251543C2 |
| АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ КАК ПРОТИВОВОСПАЛИТЕЛЬНЫЕ, ИММУНОМОДУЛИРУЮЩИЕ И АНТИПРОЛИФЕРАТИВНЫЕ СРЕДСТВА | 2003 |
|
RU2386625C2 |
Изобретение относится к соединению формулы (I)
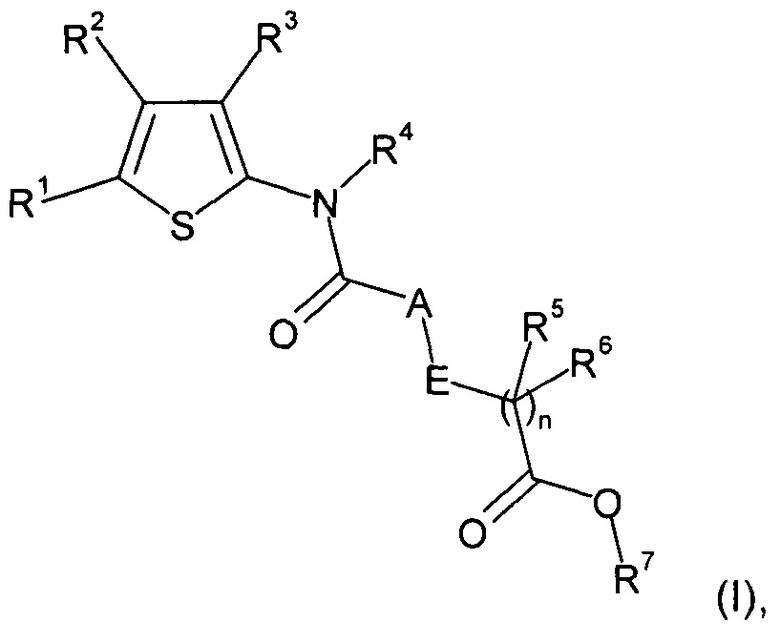
где R1 и R2 независимо выбраны из Н, алкила, галогеналкила, алкоксиалкила, галогеналкоксиалкила, циклоалкила, циклоалкилалкила, галогенциклоалкила, галогенциклоалкилалкила, замещенного арила, замещенного арилалкила, замещенного гетероциклоалкила, замещенного гетероциклоалкилалкила, замещенного гетероарила, замещенного гетероарилалкила, замещенного аминокарбонила, алкоксикарбонила, галогеналкоксикарбонила и карбокси, где замещенный арил, замещенный арилалкил, замещенный гетероциклоалкил, замещенный гетероциклоалкилалкил, замещенный гетероарил и замещенный гетероарилалкил замещены R14, R15 и R16, и где замещенный аминокарбонил замещен на атоме азота заместителями в количестве от одного до двух, независимо выбранными из Н, алкила, циклоалкила, галогеналкила, алкилциклоалкила, циклоалкилалкила, алкилциклоалкилалкила, гидроксиалкила и алкоксиалкила; R3 представляет собой пирролидинил, замещенный [1,2,4]-оксадиазолил, оксазолил, замещенный тиазолил, замещенный [1,2,4]тиадиазол-5-ил или пиримидинил, где замещенный [1,2,4]-оксадиазолил, замещенный [1,2,4]тиадиазол-5-ил и замещенный тиазолил замещены R17; R4 представляет собой Н или алкил; R5 и R6 независимо выбраны из Н, алкила и циклоалкила; R7 представляет собой Н, алкил или циклоалкил; А представляет собой NR8 или CR9R10; Е представляет собой CR12R13; R8 выбран из Н, алкила, галогеналкила, циклоалкила, галогенциклоалкила, циклоалкилалкила или галогенциклоалкилалкила; R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил или замещенный гетероарил, где замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил и замещенный гетероарил замещены R20 и могут быть дополнительно замещены R21, где в случае, когда R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют замещенный арил или замещенный гетероарил, R10 и R13 отсутствуют; R10 и R13 вместе с атомами углерода, к которым они присоединены, образуют двойную связь; R14, R15, R16, R17, R20 и R21 независимо выбраны из Н, гидрокси, оксо, атома галогена, алкила, галогеналкила, циклоалкила, галогенциклоалкила, алкокси, галогеналкокси, алкоксиалкила, галогеналкоксиалкила, алкоксикарбонила, карбокси и аминогруппы, замещенной на атоме азота заместителями в количестве от одного до двух, независимо выбранными из Н, алкила, циклоалкила, галогеналкила, алкилциклоалкила, циклоалкилалкила, алкилциклоалкилалкила, гидроксиалкила и алкоксиалкила; n равно нулю, ингибирующие активность белков, связывающих жирные кислоты, FABP4 и/или FABP5. 3 н. и 9 з.п. ф-лы, 12 табл., 10 пр.
1. Соединение формулы (I)
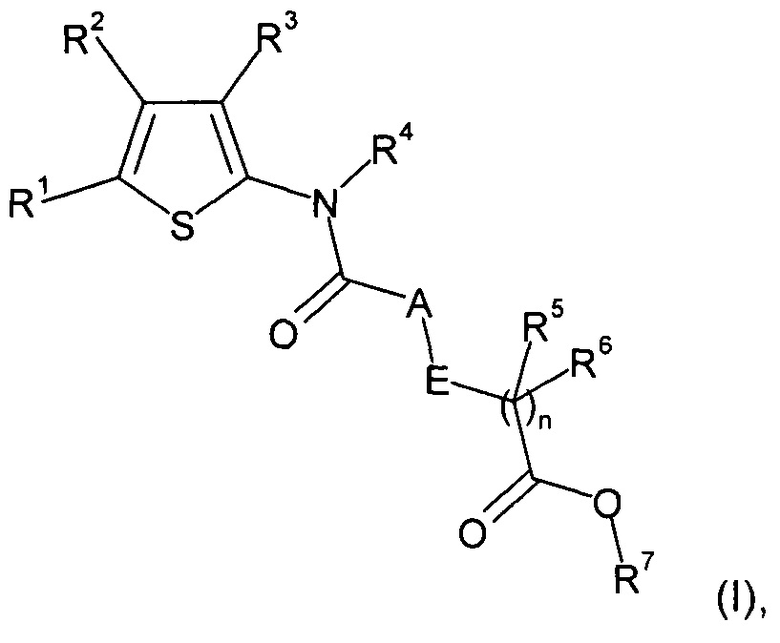
где
R1 и R2 независимо выбраны из Н, алкила, галогеналкила, алкоксиалкила, галогеналкоксиалкила, циклоалкила, циклоалкилалкила, галогенциклоалкила, галогенциклоалкилалкила, замещенного арила, замещенного арилалкила, замещенного гетероциклоалкила, замещенного гетероциклоалкилалкила, замещенного гетероарила, замещенного гетероарилалкила, замещенного аминокарбонила, алкоксикарбонила, галогеналкоксикарбонила и карбокси, где замещенный арил, замещенный арилалкил, замещенный гетероциклоалкил, замещенный гетероциклоалкилалкил, замещенный гетероарил и замещенный гетероарилалкил замещены R14, R15 и R16, и где замещенный аминокарбонил замещен на атоме азота заместителями в количестве от одного до двух, независимо выбранными из Н, алкила, циклоалкила, галогеналкила, алкилциклоалкила, циклоалкилалкила, алкилциклоалкилалкила, гидроксиалкила и алкоксиалкила;
R3 представляет собой пирролидинил, замещенный [1,2,4]-оксадиазолил, оксазолил, замещенный тиазолил, замещенный [1,2,4]тиадиазол-5-ил или пиримидинил, где замещенный [1,2,4]-оксадиазолил, замещенный [1,2,4]тиадиазол-5-ил и замещенный тиазолил замещены R17;
R4 представляет собой Н или алкил;
R5 и R6 независимо выбраны из Н, алкила и циклоалкила;
R7 представляет собой Н, алкил или циклоалкил;
А представляет собой NR8 или CR9R10;
Е представляет собой CR12R13;
R8 выбран из Н, алкила, галогеналкила, циклоалкила, галогенциклоалкила, циклоалкилалкила или галогенциклоалкилалкила;
R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил или замещенный гетероарил, где замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклоалкил и замещенный гетероарил замещены R20 и могут быть дополнительно замещены R21, где в случае, когда R9 и R12 вместе с атомами углерода, к которым они присоединены, образуют замещенный арил или замещенный гетероарил, R10 и R13 отсутствуют;
R10 и R13 вместе с атомами углерода, к которым они присоединены, образуют двойную связь;
R14, R15, R16, R17, R20 и R21 независимо выбраны из Н, гидрокси, оксо, атома галогена, алкила, галогеналкила, циклоалкила, галогенциклоалкила, алкокси, галогеналкокси, алкоксиалкила, галогеналкоксиалкила, алкоксикарбонила, карбокси и аминогруппы, замещенной на атоме азота заместителями в количестве от одного до двух, независимо выбранными из Н, алкила, циклоалкила, галогеналкила, алкилциклоалкила, циклоалкилалкила, алкилциклоалкилалкила, гидроксиалкила и алкоксиалкила;
n равно нулю;
или их фармацевтически приемлемые соли,
где «арил» обозначает одновалентную ароматическую карбоциклическую моно- или бициклическую кольцевую систему, содержащую от 6 до 10 кольцевых атомов углерода; «арилалкил» обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен арильной группой; «гетероарил» обозначает одновалентную ароматическую гетероциклическую моно- или бициклическую кольцевую систему из кольцевых атомов в количестве от 5 до 12, содержащую 1, 2, 3 или 4 гетероатома, выбранных из N, О и S, где остальные кольцевые атомы представляют собой атомы углерода; «гетероарилалкил» обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен гетероарильной группой; «циклоалкил» обозначает одновалентную насыщенную моноциклическую или бициклическую углеводородную группу из кольцевых атомов углерода в количестве от 3 до 10; «циклоалкилалкил» обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен циклоалкильной группой; «циклоалкенил» обозначает одновалентную ненасыщенную неароматическую моноциклическую или бициклическую углеводородную группу из кольцевых атомов углерода в количестве от 3 до 8; «гетероциклоалкил» обозначает одновалентную насыщенную или частично ненасыщенную моно- или бициклическую кольцевую систему из кольцевых атомов в количестве от 4 до 9, содержащую 1, 2 или 3 кольцевых гетероатома, выбранных из N, О и S, где остальные кольцевые атомы представляют собой атомы углерода; "гетероциклоалкилалкил" обозначает алкильную группу, где по меньшей мере один из атомов водорода алкильной группы замещен гетероциклоалкильной группой.
2. Соединение по п. 1, где R1 представляет собой Н, алкил, галогеналкил, циклоалкил, замещенный гетероциклоалкил, замещенный гетероарил, замещенный аминокарбонил и алкоксикарбонил, где замещенный гетероциклоалкил и замещенный гетероарил замещены R14, R15 и R16, и где замещенный аминокарбонил замещен на атоме азота двумя заместителями, независимо выбранными из Н, алкила, циклоалкила, галогеналкила, алкилциклоалкила, циклоалкилалкила, алкилциклоалкилалкила, гидроксиалкила и алкоксиалкила.
3. Соединение по п. 1, где R2 представляет собой Н, алкил, галогеналкил или циклоалкил.
4. Соединение по п. 1, где R3 представляет собой [1,2,4]-оксадиазолил, замещенный R17.
5. Соединение по п. 1, где R14, R15, R16, R17, R20 и R21 независимо выбраны из Н, алкила, галогеналкила и циклоалкила.
6. Соединение по п. 1, выбранное из следующих соединений:
2-(3-фенилтиофен-2-илкарбамоил)-циклопент-1-енкарбоновая кислота;
5-[(3-карбоксибицикло[2.2.2]окт-2-ен-2-карбонил)-амино]-3-метил-4-(4-метилтиазол-2-ил)-тиофен-2-карбоновой кислоты метиловый эфир;
2-[4-циклопропил-5-метил-3-(3-метил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
3-[4-циклопропил-5-метил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
2-[5-циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-метилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
3-[5-циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-метилтиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[4-циклопропил-5-метил-3-(3-метил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
3-[4-циклопропил-5-метил-3-(3-метил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[4-циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-метилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
3-[4-циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-метилтиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
3-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[4-циклопропил-5-метил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-метилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-метил-5-оксетан-3-ил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-метил-5-оксетан-3-ил-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-метил-4-трифторметилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
5-[(2-карбоксициклопент-1-енкарбонил)-амино]-4-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-3-метилтиофен-2-карбоновой кислоты этиловый эфир;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-диметилкарбамоил-4-метилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[5-циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[4-циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-метилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-(2,2,2-трифторэтил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-трифторметилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-(5-диметиламино-[1,2,4]тиадиазол-3-ил)-4-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
и их фармацевтически приемлемых солей.
7. Соединение по п. 1, выбранное из следующих соединений:
3-[4,5-диметил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
3-[3-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[5-циклопропил-4-метил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[5-циклопропил-4-метил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
3-[5-циклопропил-4-метил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
2-[5-циклопропил-3-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-4-метилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[4,5-диметил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
3-[5-циклопропил-3-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-4-метил-тиофен-2-илкарбамоил]-бицикло[2.2.2]окт-2-ен-2-карбоновая кислота;
(1SR,2SR)-2-[3-(3-циклопропил[1,2,4]оксадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-циклогексанкарбоновая кислота;
(1RS,2SR)-2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-циклогексанкарбоновая кислота;
2-[4,5-диметил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
2-[5-циклопропил-3-(3-циклопропил-[1,2,4]тиадиазол-5-ил)-4-метилтиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
5-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-3,6-дигидро-2Н-пиран-4-карбоновая кислота;
4-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-5,6-дигидро-2Н-пиран-3-карбоновая кислота;
(R)-1-[4,5-диметил-3-(3-трифторметил-[1,2,4]оксадиазол-5-ил)-тиофен-2-илкарбамоил]-пирролидин-2-карбоновая кислота;
и их фармацевтически приемлемых солей.
8. Соединение по п. 1, выбранное из следующих соединений:
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
2-[5-циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-метилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-метил-4-трифторметил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[4,5-диметил-3-(3-метил-[1,2,4]тиадиазол-5-ил)-тиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
и их фармацевтически приемлемых солей.
9. Соединение по п. 1, выбранное из следующих соединений:
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4,5-диметилтиофен-2-илкарбамоил]-циклогекс-1-енкарбоновая кислота;
2-[5-циклопропил-3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-4-метил-тиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
2-[3-(3-циклопропил-[1,2,4]оксадиазол-5-ил)-5-метил-4-трифторметилтиофен-2-илкарбамоил]-циклопент-1-енкарбоновая кислота;
и их фармацевтически приемлемых солей.
10. Соединение по любому из пп. 1-9, применяемое в качестве ингибитора белков, связывающих жирные кислоты, FABP4 и/или FABP5.
11. Фармацевтическая композиция, ингибирующая активность белков, связывающих жирные кислоты, FABP4 и/или FABP5, содержащая эффективное количество соединения по любому из пп. 1-9 и терапевтически инертный носитель.
12. Применение соединения по любому из пп. 1-9 для лечения или профилактики диабета типа 2, атеросклероза, рака, хронического заболевания почек и неалкогольного стеатогепатита.
| WO 2008109856 A2, 12.09.2008 | |||
| US 2010168084 A1, 01.07.2010 | |||
| WO 2007036730 A1, 05.04 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Ann V | |||
| Hertzel et al | |||
| "Identification and Characterization of a Small Molecule Inhibitor of Fatty Acid Binding Proteins" J.Med.Chem | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Qinyuan Xu, et al | |||
| "Design, synthesis and biological evaluation of thiazole- and indole-based derivatives for the treatment of type II diabetes", European Journal of Medicinal Chemistry 52 (2012) 70-81 doi.org/10.1016/j.ejmech.2012.03.006 | |||
| Yehya Mahmmoud Elkholy, "STUDIES WITH 2-BENZOTHIAZOLYLACETONITRILE: SYNTHESIS OF NEW 2-THIENYLBENZOTHIAZOLES AND N-THIENYL MALEIMIDE DERIVATIVES" Phosphorus, Sulfur and Silicon, 2002, 177:115-122 | |||
| ISHIKAWA, "Cyclic Guanidines | |||
| XIII | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| КОНДЕНСИРОВАННЫЕ БИЦИКЛИЧЕСКИЕ КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ СХСR2 ДЛЯ ЛЕЧЕНИЯ ВОСПАЛЕНИЙ | 2005 |
|
RU2404962C2 |
Авторы
Даты
2018-03-16—Публикация
2013-09-09—Подача