Область техники, к которой относится изобретение
Изобретение относится к биотехнологии, в частности к способу получения лакказ гриба Rhizoctonia solani F-895, показана способность культуральной жидкости указанного штамма окислять фенилпропаноиды и другие ароматические соединения в нейтрально-щелочных условиях среды.
Возможно применение лакказ, продуцируемых штаммом гриба предлагаемым способом, в технологиях, применяемых в пищевой и текстильной промышленности, косметологии, создании биосенсоров и клеточных платформ биосинтеза ценных биологически активных соединений, осуществляемых в нейтрально-щелочных условиях среды.
Уровень техники
Фенилпропаноиды - класс растительных органических соединений ароматического ряда. Характерным структурным фрагментом является бензольное кольцо с присоединенной к нему неразветвленной трехуглеродной цепью. Производные фенилпропаноидов (лигнаны, стильбены, флавоноиды и др.) востребованы в фармацевтике в связи с рядом оказываемых ими биологических эффектов проявляют канцеролитические, цитостатические, антиоксидантные, антибактериальные, фунгицидные, антипаразитарные, стимулирующие и адаптогенные свойства.
Одними из перспективных на сегодняшний день ферментов, способных осуществлять трансформацию ряда субстратов ароматической природы, являются голубые оксидазы (лакказы). Каталитический механизм лакказы заключается в четырехэлектронном восстановлении молекулы кислорода до молекулы воды, сопряженном с одноэлектронным окислением четырех молекул субстрата (1, 2). В результате образуются четыре активных субстратных радикала, которые в свою очередь способны вызвать ряд неферментных реакций: полимеризации, окислительного расщепления, окисления, декарбоксилирования и пр. (1, 2).
Согласно литературным данным в настоящий момент имеется скудная информация о лакказной активности растений и грибов в отношении фенилпропаноидов (Таблица 1).
Монолигнолы (n-кумаровый спирт, конифериловый спирт, синаповый спирт), а также их предшественники (n-кумаровая, феруловая и синаповая кислоты) малоизучены в качестве субстратов грибных лакказ. Наиболее исследованы такие соединения в качестве субстратов растительных лакказ (Таблица 1). В большинстве случаев активность лакказ с фенилпропаноидами ниже активности с АБТК (3-9) за исключением лакказы из растения Populus euramericana (Таблица 1). Эта лакказа имеет более высокую активность с конифериловым и n-кумаровым спиртом (625 и 250%) по сравнению с активностью с АБТК (5).
Субстратную избирательность лакказ в отношении фенилпропаноидов в большинстве известных работ измеряли при более кислых значениях рН 4.0-6.7 (Таблица 1).
На данный момент отсутствует информация об активности лакказ грибов с фенилпропаноидами при рН>7.0, что важно при использовании лакказ в процессах, протекающих в нейтральных условиях, в частности в биосинтезе ценных биологически активных соединений с помощью клеточных технологий.
На сегодняшний день существует несколько сообщений о грибных лакказах с рН-оптимумом активности, близкой к нейтральной. Так, среди базидиомицетов лакказа из Coprinus cinereus имеет рН-оптимум окисления сирингалдазина в области рН 6.0-7.0 (10).
Также имеются сообщения о нейтральных лакказах из аскомицетов. Так, лакказы из Melanocarpus albomyces (11) и Myceliophthora thermophila (12) имели рН оптимум окисления сирингалдазина при рН 6.0-7.0.
Единичные сообщения имеются о щелочных лакказах грибов. Так, лакказа из аскомицета Acremonium murorum имеет рН-оптимум окисления сирингальдазина при рН 8.0-9.0 (13), у лакказы из дейтеромицета Myrothecium verrucaria 24G-4 реакция полимеризации 4-аминоантипирина с фенолом оптимально протекает при рН 9 (14).
Имеются единичные разрозненные сообщения, касающиеся продукции лакказ гриба Rhizoctonia praticola 93А и Rhizoctonia solani AG4 (15, 16) и выделения и краткой характеристики лакказ из гриба Rhizoctonia praticola 93А (17).
Ранее исследована продукция лакказ грибом Rhizoctonia praticola в зависимости от используемого в ходе погруженного культивирования индуктора (феруловой и вератровой кислот, ксилидина, о-анизидина и n-анизидина), различных концентраций ионов меди и рН среды культивиролвания (15, 18). Максимальный выход лакказ наблюдался при погруженном культивировании гриба в присутствии 0.02 мМ n-анизидина и ксилидина при начальной рН среды культивирования 7.5. К сожалению, выход лакказ наблюдали по окислению сирингальдазина при 525 нм (15) или 2,6-диметоксифенола (18), что не позволяет корректно сравнить полученные данные с данными настоящей работы.
В литературе имеется лишь одно сообщение об активности лакказы представителя рода Rhizoctonia - штамма R. praticola (Vaartija no. 1347) с соединением, относящимся к группе фенилпропаноидов - феруловой кислоте (19). К сожалению, активность лакказы измеряли по скорости поглощения кислорода при окислении субстратов (активность лакказы с феруловой кислотой составляла 91% от активности в отношении 2,6-диметоксифенола, нет данных об активности лакказы с АБТК), что затрудняет проведение сравнительного анализа с активностями других штаммов, в том числе с данными, полученными в настоящей работе. Фермент был наиболее активен с 2,6-диметоксифенолом при рН 6.8, с феруловой кислотой рН-оптимум находился в области рН 7.2.
В другой работе (20) показана наибольшая способность лакказы штамма Rhizoctonia praticola полимеризовать хлор-, метил-, метокси- и бромзамещенные фенолы лакказой в областях рН 3.0-4.0 и рН 9.0-10.0.
Рекомбинантные лакказы, полученные из гриба Rhizoctonia solani RS22 имели рН-оптимум окисления сирингалдазина в районе рН 6.0-7.0 (21, 22), а лакказы Rhizoctonia praticola 93А были наиболее активны с сирингальдазином в районе 7.4 (17, 23). рН-оптимум нативной лакказы из Rhizoctonia praticola (Vaartija no. 1347) в реакции с 2,6-диметоксифенолом находился в районе 6.7-6.9 (24). Лакказа из базидиомицета Rhizoctonia praticola RS22 была наиболее активна с сирингальдазином при рН 7,5 (21).
Известно, что для получения лакказной активности штамм гриба Rhizoctonia solani 93А культивировали, как описано ниже (15). Инокулят готовили следующим образом: мицелий гриба выращивали в конических колбах в Линдеберг-Хелм среде с рН 5.5 (глюкоза - 20 г/л, аспарагин - 1.5 г/л, KH2PO4 - 1 г/л, MgSO4×7H2O - 0,5 г/л, цитраты Fe, Zn, Cu - 1 ppm, Mn - 3 ppm, Ca - 20 ppm, анеурин - 50 мкг/л, дрожжевой экстракт - 100 мг/л) в течение 7 дней при 28°С без перемешивания. Собранный мицелий диспергировали в блендере (15 секунд при 10000 rpm) и использовали в дальнейших экспериментах в концентрации 2,5% (v/v). Культивирование проводили в Линдеберг-Хелм среде с добавлением в качестве источника углерода и энергии глюкозы (0.5, 1.0, 2.0, 5.0, 10.0, 15.0 г/л) и L-аспарагина (0.25, 0.5, 1.0, 1.5, 2.0, 5.0, 10.0 г/л), а также сульфата меди (0-300 мкМ). Индукторы лакказ (феруловая и вератровая кислоты, о- и n-анизидины, 2,5-ксилидин) добавляли в среду на третий день культивирования мицелия до концентрации 0.02, 1.0 или 5.0 мМ. Погруженное культивирование проводили при 28°С в 2.5 л ферментере, содержащем 2 л среды Линдеберг-Хелм. Оптимальная продукция лакказ грибом R. praticola (4000 nkat/l=0,24 мкМ/мин/мл) наблюдалась при погруженном культивировании в среде Линдеберга-Хольма в присутствии 5 мкМ Cu2+ на 3-и сутки культивирования при начальном значении рН среды 7.5. К сожалению, лакказную активность определяли спектрофотометрически не по скорости окисления АБТК, а по скорости образования продукта окисления сирингалдазина при 25°С при рН 7.4, что затрудняет проведение сравнительного анализа лакказной активности штамма с известными штаммами, в том числе с данными, полученными в ходе настоящей работы с грибом Rhizoctonia solani F-895.
Было описано выращивание гриба Rhizoctonia solani AG4 (16) в жидкой среде GAsnM, включающей (г/л) в качестве источника углерода и энергии глюкозу - 9.0, аспарагин - 1.0, тиамин - 1023, а также K2HPO4 - 0.1, КС1 - 0.1, MgSO4×7H2O - 0.1 и 25 мл раствора микроэлементов, содержащего (г/л) FeEDTA - 34.4, ZnSO4×7H2O -6.3, MnSO4×H2O - 15.4, CuSO4×5H2O (2.5) и NH4Mo7O2×4H2O - 0.5. Мицелий гриба (40 мкл инокулята) культивировали в конических колбах объемом 300 мл в 40 мл GAsnM среды в темноте при 25°С без перемешивания. Инокулят готовили следующим образом: мицелий гриба выращивали на картофельно-декстрозном агаре, смывали 10 мл 0,3 М маннитолом. Индукторы лакказ добавляли после 48 часов погруженного культивирования гриба до конечной концентрации: 5 мМ LiCl2, 5 мМ CaCl2, 0,4 мМ CuSO4, 0,4 мМ MnSO4, 0.3 мМ n-анизидина, 0.2 мМ параквата, 2.5% этанола, 2.5% изопрапанола, 8 мкМ вискозинамина, 7.5 мМ ц-АМФ и 5 мМ кофеина. Культивирование осуществляли до 145 часов. Лучшим индуктором внеклеточной лакказной активности в этом случае был изопропанол -340 мкМ/мин/мл. К сожалению, активность лакказ измеряли с АБТК при 405 нм в растворе Бритон-Робинсона, ε405 нм=35 мМ-1 см-1 в отличие от классического способа измерения лакказной активности с АБТК при 436 нм в Na-ацетатном буфере (ε436 нм=23900 М-1 см-1 (34)), что значительно затрудняет проведение сравнительного анализа лакказной активности штамма с известными штаммами, в том числе с данными, полученными в ходе настоящей работы со штаммом гриба Rhizoctonia solani F-895.
Однако описанные способы погруженного культивирования с целью получения лакказной активности гриба требуют дорогостоящих источников углерода и энергии (глюкоза, аспарагин, тиамин), индукторов лакказ (солей меди, марганца, кальция, лития, ароматических соединений) и органических растворителей.
Информации об исследовании продукции лакказ штамма гриба Rhizoctonia solani F-895 и их характеристике на сегодняшний день не найдено.
Сущность изобретения
Технической задачей, на решение которой направлено предлагаемое изобретение, является разработка способа получения лакказ штамма гриба Rhizoctonia solani F-895, активных в нейтрально-щелочных условиях среды, с целью получения лакказного препарата, окисляющего фенилпропаноиды и другие ароматические соединения. Это обеспечивает возможность последующего определения рН-оптимумов и субстратной избирательности доминирующих лакказ культуральной жидкости указанного штамма.
Предложен способ получения лакказ штамма гриба Rhizoctonia solani F-895, активных в нейтрально-щелочных условиях среды, характеризующийся тем, что погруженное культивирование штамма гриба Rhizoctonia solani F-895 проводят в минеральной среде с добавлением в качестве натурального источника углерода и энергии, по крайней мере, одного компонента, выбранного из ряда: белокочанная капуста, картофель, томатная паста, горох, фасоль, до получения максимальной активности лакказ в культуральной жидкости, полученную культуральную жидкость гриба отделяют от мицелия.
Натуральные источника углерода и энергии берут в следующих концентрациях (г/л): капуста - 10-160, картофель - 40-200, томатная паста - 20-40, горох - 40-80, фасоль - 20-80.
Причем преимущественно в качестве натурального источника углерода и энергии применяют горох или фасоль.
При этом культивирование мицелия гриба осуществляют в минеральной среде следующего состава (г/л): NH4NO3 - 0,2; KH2PO4 - 0,2; K2HPO4 - 0,02; MgSO4×7Н2О - 0,12.
Культуральную жидкость гриба отделяют от мицелия центрифугированием.
Используемый в качестве продуцента лакказы штамм гриба Rhizoctonia solani F-895 получен из коллекции ВКМ ИБФМ РАН.
Контроль за ходом культивирования штамма проводят по лакказной активности культуральной жидкости, которую определяют по степени окисления 1 мкМ АБТК (ε436=29300 M-1 см-1) в 20 мМ Na-ацетатном буфере, рН 5.0 (25).
Измерения проводят в кварцевой кювете (1 см) при 25°С на спектрофотометре Shimadzu UV-160 (Япония) при 436 нм. За единицу активности лакказы принимают скорость превращения 1 мкМ субстрата в 1 мл культуральной жидкости за 1 мин.
В частности, культивирование проводят в 100 мл минеральной среды в медицинских колбах объемом 750 мл при 29°С и перемешивании (200 об/мин) в течение 5 суток с конечным выходом лакказной активности в культуральной жидкости гриба 218 ед./мг в среде, содержащей 40 г/л размельченных семян гороха или 227 ед./мл в среде, содержащей 80 г/л размельченных семян фасоли.
Авторами было показано, что полученные лакказы гриба R. solani F-895 проявляют максимальную активность в нейтрально-щелочной среде: с 2,6-диметоксифенолом - при рН 7.0, с сирингалдазином - при рН 8.0, с конифериловым спиртом - при рН 7.0, с n-кумаровым спиртом - рН 7.5, с феруловой кислотой - рН 7.0.
Было установлено, что известные ароматические индукторы лакказной активности грибов (феруловая кислота, 2,6-диметоксифенол и 2,4-диметилфенол в конечной концентрации 1 мМ и таниновая кислота в конечной концентрации 0.2 мМ) приводили к значительному (в случае с феруловой кислотой) или полному (в случае с 2,6-диметоксифенолом, 2,4-диметилфенолом и таниновой кислотой) ингибированию лакказной активности штамма R. solani F-895 при погруженном культивировании в жидкой минеральной среде по сравнению с контрольными вариантами (данные не приводятся).
В настоящей работе ионы Са2+ и ароматические соединения, используемые ранее в качестве индукторв лакказной активности грибов Rhizoctonia praticola 93А и Rhizoctonia solani AG4 (15, 16), значительно не повышали продукцию лакказной активности гриба Rhizoctonia solani F-895 (данные получены авторами настоящей работы при культивировании на агаризованной среде).
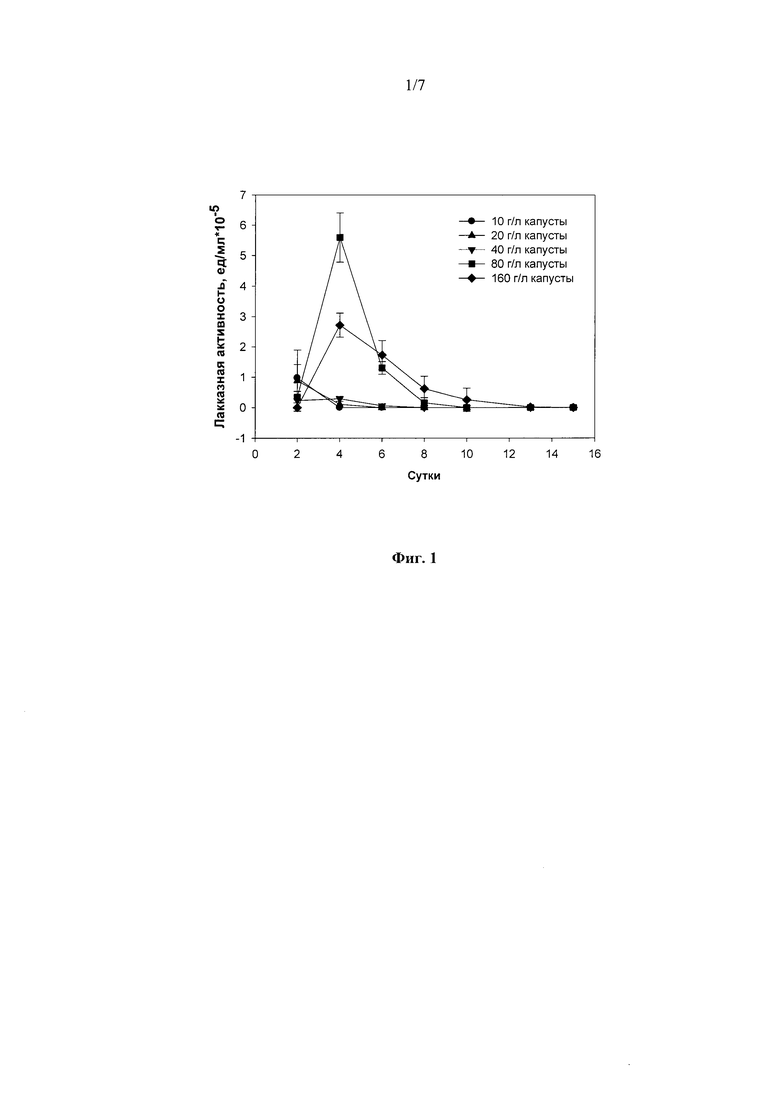
Исходя из среды обитания штамма гриба R. solani F-895 (паразит травянистых растений, штамм выделен с белокочанной капусты) тестирование различных концентраций свежей размельченной капусты (10, 20, 40, 80 и 160 г/л) позволило выявить оптимальную концентрацию субстрата (80 г/л), при которой наблюдалась максимальная лакказная активность (5.5 ед./мл) культуральной жидкости штамма (Фиг. 1).
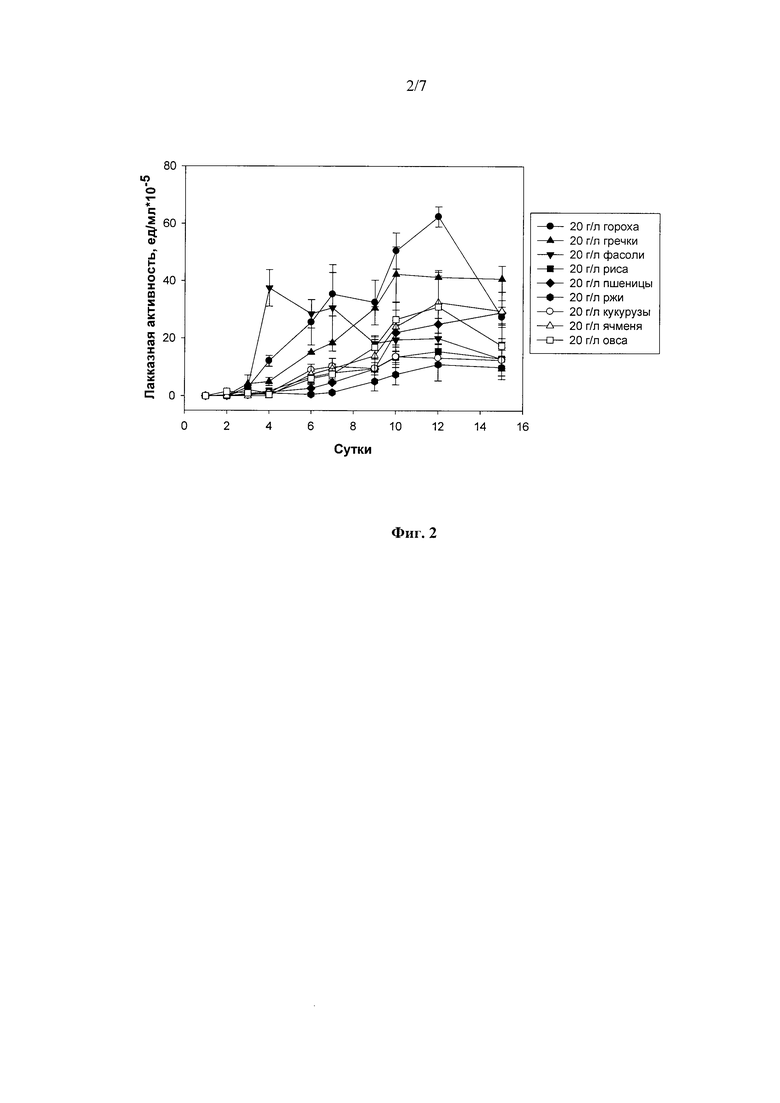
Наиболее оптимальными источниками углерода и энергии из 7 протестированных зерновых (рожь, пшеница, овес, ячмень, гречиха, рис и кукуруза) и 2 бобовых (горох и фасоль) культур в концентрациях 20 г/л для лакказной активности штамма при погруженном культивировании (Фиг.2) были горох (63 ед./мл, 4-7-е сутки) и фасоль (37.5 ед./мл на 10-12-е сутки культивирования).
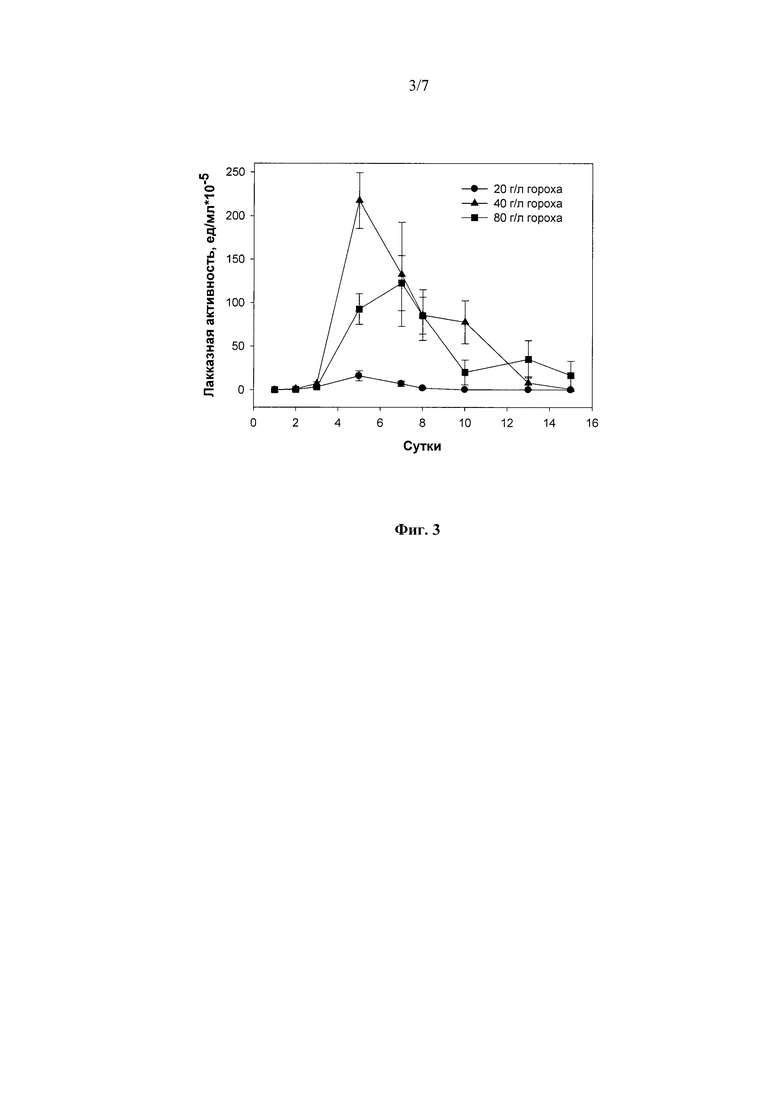
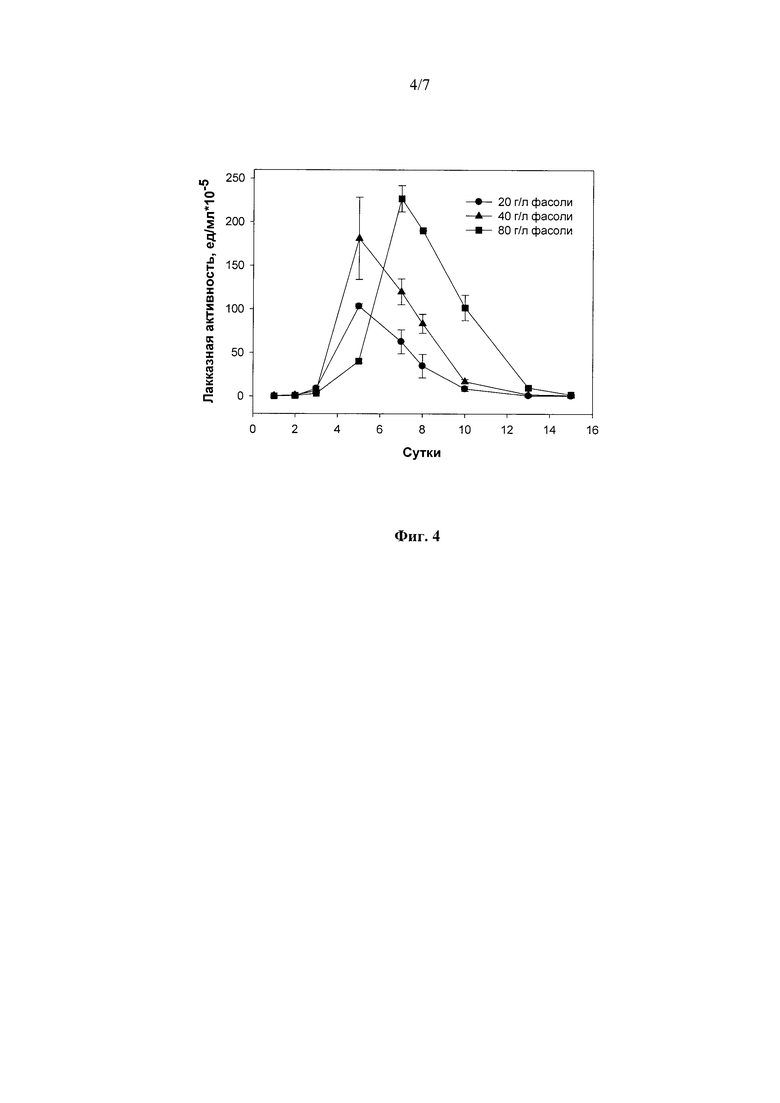
Наилучшими концентрациями гороха и фасоли, при которых в ходе погруженного культивирования штамма гриба R. solani F-895 наблюдался максимальный выход лакказ, были 40 г/л гороха (218±25 ед./мл, на 5-е сутки культивирования (Фиг. 3) и 80 г/л фасоли (227±15 ед./мл, на 7-е сутки культивирования (Фиг. 4)).
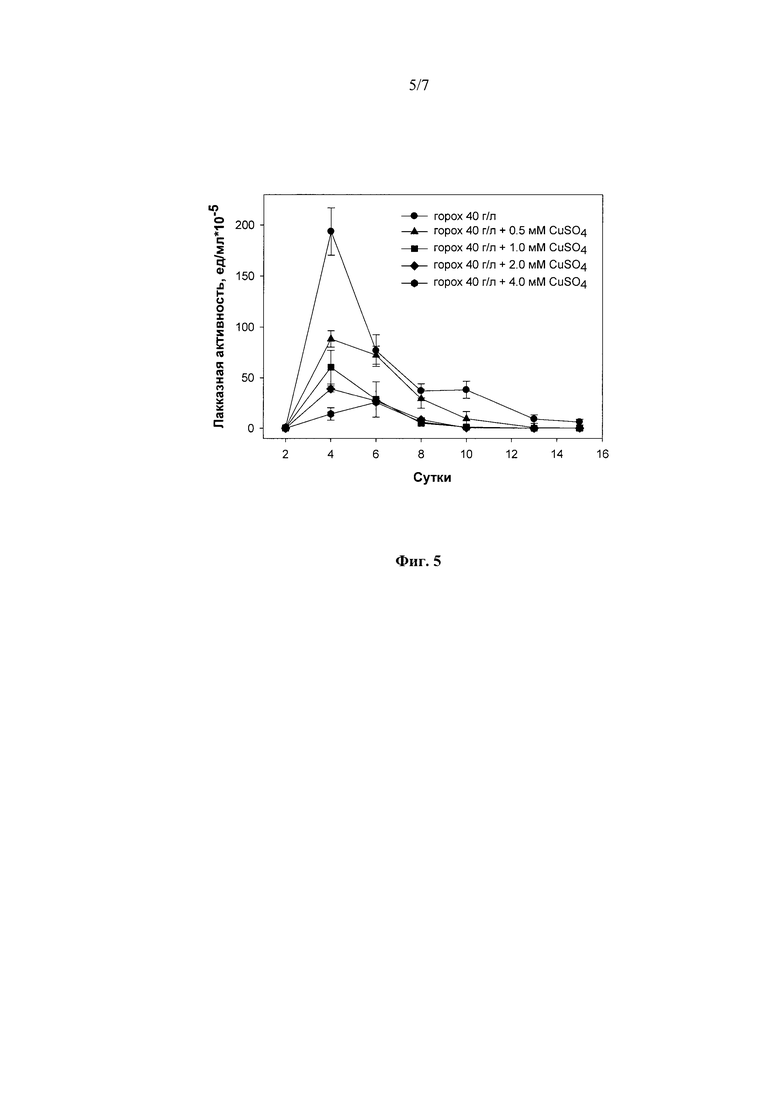
Было показано, что добавление известного индуктора лакказной активности ионов меди (1) в среду культивирования штамма с наиболее оптимальными источниками углерода и энергии (40 г/л гороха или 80 г/л фасоли) во всех протестированных концентрациях оказывают ингибирующее действие на лакказную активность штамма гриба R. solani F-895 (Фиг. 5).
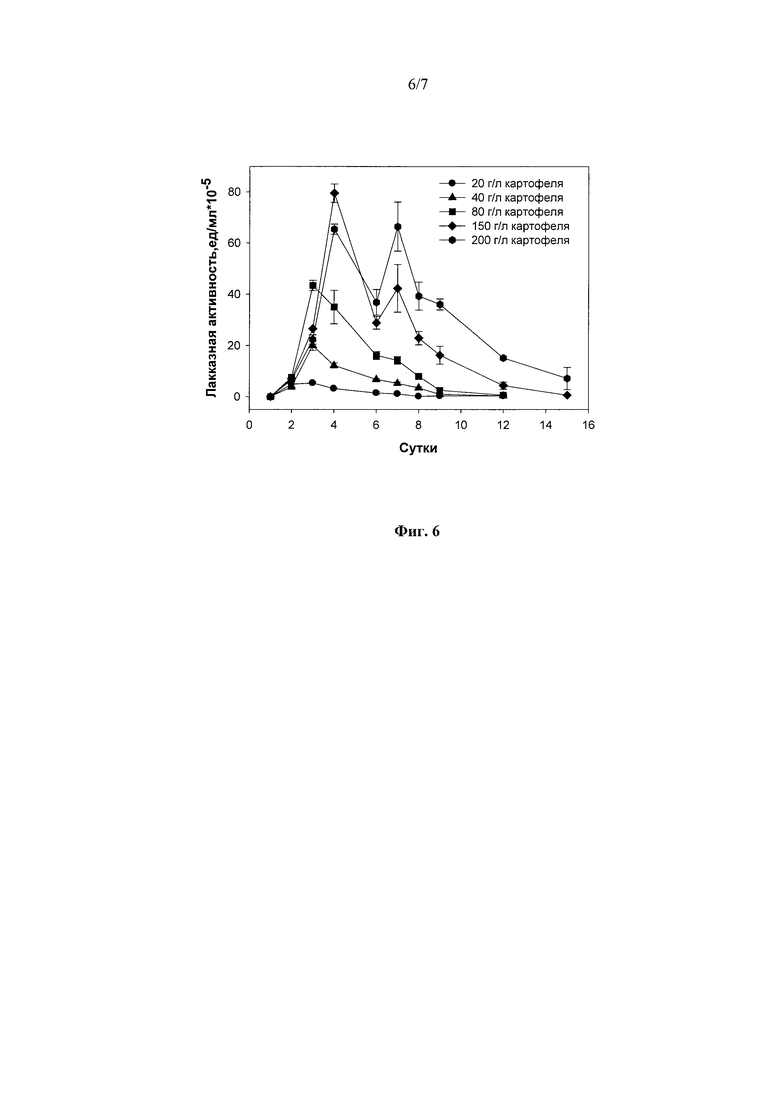
Оптимальной концентрацией картофеля в качестве источника углерода и энергии, повышающего выход лакказ, была 150 г/л (79±4 ед./мл, на 4-е сутки культивирования) (Фиг. 6).
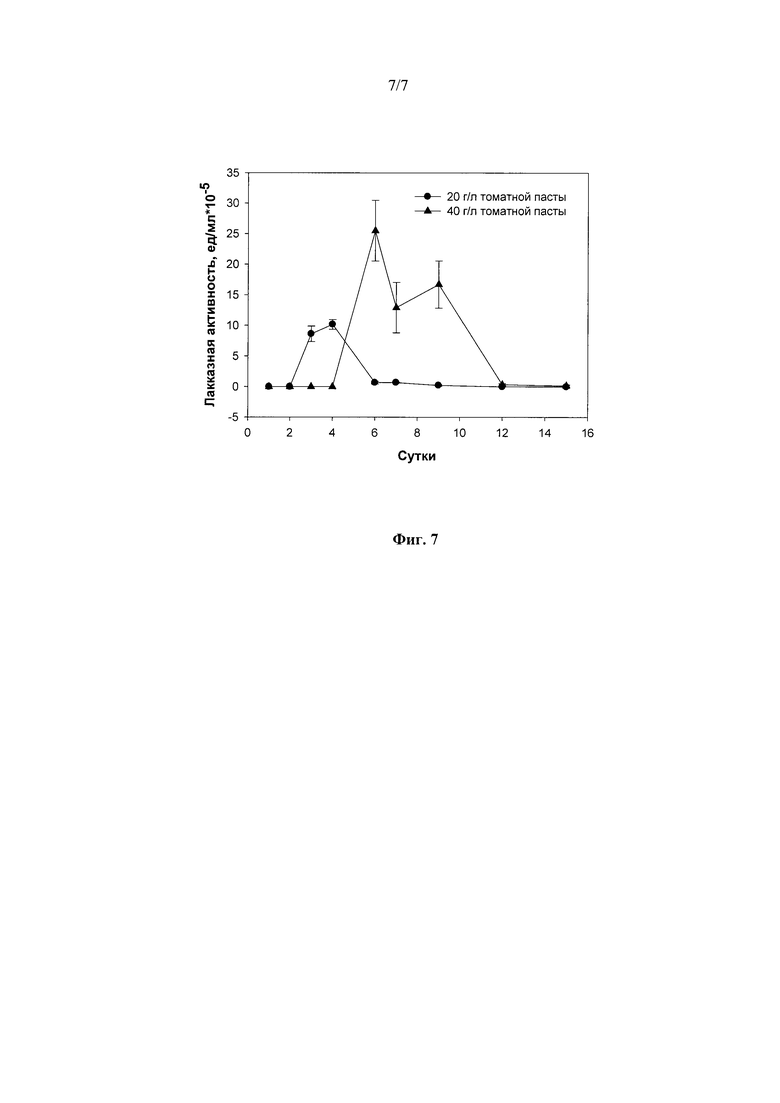
Из всех протестированных концентраций томатной пасты (20, 40, 80, 150 и 200 г/л) в качестве источника углерода и энергии, повышающих выход лакказ гриба R. solani F-895, наиболее оптимальной была концентрация 40 г/л (Фиг. 7).
Проведенная в настоящей работе оптимизация условий погруженного культивирования R. solani F-895 в присутствии натуральных источников углерода и энергии (семян зерновых и бобовых культур, картофеля и томатов) не имеет аналогов для других представителей рода Rhizoctonia и базидиомицетов в целом.
В описании известных способов (15, 16) нет совпадений со способом, предлагаемым авторами изобретения, в том числе используются и иные штаммы грибов.
Культуральная жидкость гриба R. solani F-895, полученная при погруженном культивировании мицелия в присутствии 40 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде, использовалась для исследования рН-оптимума и субстратной избирательности продуцируемых лакказ (Таблица 2), рН-оптимум окисления АБТК культуральной жидкости штамма гриба R. solani F-895 находился в области рН 2.5.
Максимальная активность лакказ гриба с 2,6-диметоксифенолом зарегистрирована при рН 7.0. С сирингалдазином культуральная жидкость гриба была наиболее активна при рН 8.0. Максимальное окисление кониферилового спирта лакказами культуральной жидкости гриба R. solani F-895 осуществлялось при рН 7.0, рН-оптимум окисления n-кумарового спирта лакказами гриба находился в районе 7.5.
Оптимальное окисление феруловой кислоты лакказами культуральной жидкости гриба проходило при рН 7.0.
Показано, что лакказы культуральной жидкости гриба R. solani F-895 проявляли максимальную активность со всеми замещенными фенолами, в том числе фенилпропаноидами (феруловая кислота, конифериловый и n-кумаровый спирты), за исключением АБТК, при рН 7.2 по сравнению с рН 5.0 (Таблица 2).
Наибольшая активность лакказ культуральной жидкости гриба наблюдалась с конифериловым спиртом и феруловой кислотой при рН 7.2 (100.05 и 112.71 ед./мл; 667.0 и 751.4% от активности с АБТК или 46.10 или 52.00% от активности с АБТК при рН 5.0). Меньшая активность (26.36 ед./мл; 175.70% от активности с АБТК при рН 7.2 или 12.1% от активности с АБТК при рН 5.0) наблюдалась в реакции с n-кумаровым спиртом, однако такая активность была соизмерима со скоростью окисления 2,6-диметоксифенола (25.38 ед./мл; 169.22% от активности с АБТК при рН 7.2 или 11.71% от активности с АБТК при рН 5.0).
При рН 7.2 сирингалдазин окислялся лакказами культуральной жидкости со скоростью 44.18 ед./мл (294.50% от активности с АБТК при рН7.2 или 20.38% от активности с АБТК при рН 5.0).
Лакказы культуральной жидкости гриба R. solani F-895 были в 4.4 раза более активны с феруловой кислотой, чем с 2,6-диметоксифенолом, при рН 7.2 и в 10.7 раз - при рН 5.0 (Таблица 2), по сравнению с активностью лакказы штамма R. praticola (Vaartija no. 1347) (19), активность которой с феруловой кислотой была меньше, чем с 2,6-диметоксифенолом, она составляла 91% от активности с 2,6-диметоксифенолом. Нет данных об активности лакказы с АБТК.
Кроме того, данный штамм способен продуцировать более алкалофильные лакказы с рН-оптимумом окисления сирингальдазина в области рН 8.0 по сравнению с ранее описанными лакказами грибов рода Rhizoctonia.
Перечень чертежей
Фиг. 1 Динамика лакказной активности штамма Rhizoctonia solani F-895 при погруженном культивировании в присутствии белокочанной капусты в различных концентрациях.
Фиг. 2 Динамика лакказной активности штамма Rhizoctonia solani F-895 при погруженном культивировании в присутствии злаков или бобовых культур.
Фиг. 3 Динамика лакказной активности штамма Rhizoctonia solani F-895 при погруженном культивировании в присутствии гороха в различных концентрациях.
Фиг. 4 Динамика лакказной активности штамма Rhizoctonia solani F-895 при погруженном культивировании в присутствии фасоли в различных концентрациях.
Фиг. 5 Динамика лакказной активности штамма Rhizoctonia solani F-895 при погруженном культивировании в присутствии 40 г/л гороха и CuSO4 в различных концентрациях.
Фиг. 6 Динамика лакказной активности штамма Rhizoctonia solani F-895 при погруженном культивировании в присутствии картофеля в различных концентрациях.
Фиг. 7 Динамика лакказной активности штамма Rhizoctonia solani F-895 при погруженном культивировании в присутствии томатной пасты в различных концентрациях.
Сведения, подтверждающие возможность осуществления изобретения
Пример 1. Культивирование штамма Rhizoctonia solani F-895 с использованием свежеразмельченной белокочанной капусты в качестве источника углерода и энергии с целью повышения лакказной активности гриба
С целью хранения культуру гриба поддерживали в пробирках со скошенным глюкозо-картофельным агаром (глюкоза - 10 г/л, свежий мелко натертый картофель 200 г/л, агар - 20 г/л) и хранили при 4°С.
Инокулят грибной культуры выращивали в медицинских колбах объемом 750 мл при перемешивании (200 об/мин) в течение 7 суток при 29°С в 100 мл соево-глицериновой среды (26). Среда содержала (г/л): NH4NO3 - 0.2, KH2PO4 - 0.2, K2HPO4 - 0.02, MgSO4×7H2O - 0.1, пептон - 0.5, соевую муку - 0.5 и глицерин - 4.0, рН 5.0. Полученный мицелий гомогенизировали фарфоровыми бусами при перемешивании (200 об/мин) в течение 10 мин и вносили в медицинские колбы объемом 750 мл из расчета 10 мл гомогенизированного мицелия на 100 мл среды.
Погруженное культивирование грибного мицелия R. solani F-895 осуществляли в медицинских колбах объемом 750 мл (перемешивание 200 об/мин, 29°С) в 100 мл жидкой минеральной среды (NH4NO3 - 0,2; KH2PO4 - 0,2; K2HPO4 - 0,02; MgSO4×7H2O - 0,12 г/л), содержащей в качестве источника углерода свежеизмельченную белокочанную капусту в различных концентрациях (Фиг. 1):
1) в присутствии 10 или 20 г/л - 2 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 1 ед./мл;
2) в присутствии 40 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 0,25 ед./мл;
3) в присутствии 80 г/л - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 5,5 ед./мл;
4) в присутствии 160 г/л - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 2,75 ед./мл.
Пример 2. Культивирование штамма Rhizoctonia solani F-895 с использованием семян гречихи в качестве источника углерода и энергии
Культивирование штамма гриба проводили, как описано в примере 1, в присутствии 20 г/л размельченных семян гречихи 10 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 42,0 ед./мл (Фиг. 2).
Примере 3. Культивирование штамма гриба Rhizoctonia solani F-895 с использованием семян риса в качестве источника углерода и энергии
Культивирование гриба проводили, как описано в примере 1, в присутствии 20 г/л размельченных семян риса осуществляли 12 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 15,5 ед./мл (Фиг. 2).
Пример 4. Культивирование штамма гриба Rhizoctonia solani F-895 с использованием семян пшеницы в качестве источника углерода и энергии
Культивирование гриба в присутствии 20 г/л размельченных семян пшеницы осуществляли, как описано в Примере 1, 15 суток по достижении максимальной лакказной активности в культуральной жидкости гриба - 29,0 ед./мл (Фиг. 2).
Пример 5. Культивирование штамма гриба Rhizoctonia solani F-895 с использованием семян ржи в качестве источника углерода и энергии
Культивирование гриба в присутствии 20 г/л размельченных семян ржи осуществляли 12 суток по достижении максимальной лакказной активности в культуральной жидкости гриба - 10,0 ед./мл (Фиг. 2).
Пример 6. Культивирование штамма гриба Rhizoctonia solani F-895 с использованием семян кукурузы в качестве источника углерода и энергии
Культивирование гриба проводили, как описано в примере 1, в присутствии семян кукурузы в течение 10 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 14,0 ед./мл (Фиг. 2).
Пример 7. Культивирование штамма гриба Rhizoctonia solani F-895 с использованием семян ячменя в качестве источника углерода и энергии
Культивирование гриба в присутствии 20 г/л размельченных семян ячменя осуществляли 12 суток по достижении максимальной лакказной активности в культуральной жидкости гриба - 33,0 ед./мл (Фиг. 2).
Пример 8. Культивирование штамма гриба Rhizoctonia solani F-895 с использованием семян овса в качестве источника углерода и энергии
Культивирование гриба в присутствии 20 г/л размельченных семян овса осуществляли 12 суток по достижении максимальной лакказной активности в культуральной жидкости гриба - 31,0 ед./мл (Фиг. 2).
Пример 9. Культивирование штамма гриба Rhizoctonia solani F-895 с использованием различных концентраций размельченных семян гороха в качестве источника углерода и энергии
Погруженное культивирование грибного мицелия осуществляли в минеральной среде, как описано в Примере 1, с добавлением размельченных семян гороха в качестве источника углерода и энергии в различной концентрации:
1) в присутствии 20 г/л - 5 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 15,0 ед./мл (Фиг. 3);
2) в присутствии 40 г/л - 5 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 218,0 ед./мл (Фиг. 3);
3) в присутствии 80 г/л - 7 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 122,5 ед./мл (Фиг. 3).
Пример 10. Культивирование штамма гриба Rhizoctonia solani F-895 с использованием 40 г/л размельченных семян гороха в качестве источника углерода и энергии и добавлением различных концентраций ионов меди в качестве индукторов с целью повышения лакказной активности гриба
Погруженное культивирование грибного мицелия штамма Rhizoctonia solani F-895 осуществляли в минеральной среде, как описано в Примере 1, в присутствии 40 г/л размельченных семян гороха в качестве источника углерода и энергии и с добавлением на 3-е сутки культивирования сульфата меди в качестве индуктора лакказ в различных концентрациях (Фиг. 5):
1) в присутствии 0,5 мМ сульфата меди - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 85,0 ед./мл;
2) в присутствии 1,0 мМ сульфата меди - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 60,0 ед./мл;
3) в присутствии 2,0 мМ сульфата меди - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 38,0 ед./мл;
4) в присутствии 4,0 мМ сульфата меди - 6 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 23,0 ед./мл.
Пример 11. Культивирование штамма гриба Rhizoctonia solani F-895 с использованием размельченных семян фасоли в качестве источника углерода и энергии
Погруженное культивирование грибного мицелия штамма гриба Rhizoctonia solani F-895 осуществляли в минеральной среде, как описано в Примере 1, с добавлением размельченных семян фасоли в различной концентрации:
1) в присутствии 20 г/л размельченных семян фасоли 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 37,5 ед./мл (Фиг. 2);
2) в присутствии 20 и 40 г/л размельченных семян фасоли осуществляли 5 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 102,5 и 180,0 ед./мл, соответственно (Фиг. 4);
3) в присутствии 80 г/л размельченных семян фасоли осуществляли 5 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 227,0 ед./мл (Фиг. 4).
Пример 12. Культивирование штамма гриба Rhizoctonia solani F-895 с использованием свежих мелко натертых клубней картофеля в различных концентрациях в качестве источника углерода и энергии с целью повышения лакказной активности гриба
Погруженное культивирование грибного мицелия штамма R. solani F-895 осуществляли в минеральной среде, как описано в Примере 1, с добавлением свежих мелко натертых клубней картофеля в различных концентрациях:
1) в присутствии 20 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 5,0 ед./мл (Фиг. 6);
2) в присутствии 40 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 20,0 ед./мл (Фиг. 6);
3) в присутствии 80 г/л - 3 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 43,5 ед./мл (Фиг. 6);
4) в присутствии 150 г/л - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 79,0 ед./мл (Фиг. 6);
5) в присутствии 200 г/л - 3 суток и 7 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 65,0 ед./мл и 67 ед./мл, соответственно (Фиг. 6).
Пример 13. Культивирование штамма гриба Rhizoctonia solani F-895 с использованием томатной пасты в различных концентрациях в качестве источника углерода и энергии с целью повышения лакказной активности гриба
Погруженное культивирование грибного мицелия штамма гриба R. solani F-895 осуществляли, как описано в Примере 1, в жидкой минеральной среде, содержащей в качестве источника углерода и энергии томатную пасту в различной концентрации (Фиг. 7):
1) в присутствии 20 г/л - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 10,1 ед./мл;
2) в присутствии 40 г/л - 4 суток до достижения максимальной лакказной активности в культуральной жидкости гриба - 25,5 ед./мл.
Пример 14. Определение рН-оптимума лакказ культуральной жидкости гриба Rhizoctonia solani F-895
Измеряли спектрофотометрически на спектрофотометре UV-160 («Shimadzu», Япония) рН-оптимум культуральной жидкости штамма гриба в кварцевой кювете с длиной оптического пути 10 мм при 25°С в универсальном Бриттон-Робинсон буфере (27) в интервале рН от 2,5 до 9,0. Бриттон-Робинсон буфер был получен смешиванием 0,1 М борной, 0,1 М ортофосфорной и 0,1 М уксусной кислот.
В качестве субстратов использовали АБТК, сирингалдазин, n-кумаровый спирт, конифериловый спирт, феруловую кислоту.
Активность культуральной жидкости гриба с субстратами определяли по скорости образования продуктов с использованием коэффициентов молярной экстинкции (для АБТК - ε436=29300 М-1 см-1 (25), для 2,6-диметоксифенола - ε470=35645 М-1 см-1 (9), сирингалдазина - ε525=65000 М-1 см-1 (28)) или по скорости окисления субстрата (n-кумаровый спирт - ε259=13210 М-1 см-1 (3); конифериловый спирт - ε263=13400 М-1 см-1 (29); феруловая кислота - ε287=12483 М-1 см-1 (3)).
За единицу активности лакказы принимали среднюю скорость превращения 1 мкМ субстрата в минуту 1 мл культуральной жидкости.
Реакцию начинали добавлением в реакционную смесь культуральной жидкости штамма гриба R. solani F-895.
Для исследования рН-оптимума лакказной активности и субстратной избирательности использовалась культуральная жидкость гриба R. solani F-895, полученная при погруженном культивировании мицелия в присутствии 40 г/л гороха в качестве единственного источника углерода и энергии в минеральной среде (Таблица 2).
рН-оптимум окисления АБТК лакказами культуральной жидкости штамма R. solani F-895 находился в области 2.5.
Максимальная активность лакказ штамма с 2,6-диметоксифенолом зарегистрирована при рН 7.0. С сирингалдазином лакказы культуральной жидкости штамма наиболее активны при рН 8.0.
Максимальное окисление кониферилового спирта лакказами культуральной жидкости штамма осуществлялось при рН 7.0.
рН-оптимум окисления n-кумарового спирта лакказами культуральной жидкости штамма находился в районе 7.5.
Оптимальное окисление феруловой кислоты лакказами культуральной жидкости штамма осуществлялось при рН 7.0.
Пример 15. Определение субстратной избирательности культуральной жидкости штамма в зависимости от рН среды
Субстратную избирательность культуральной жидкости измеряли спектрофотометрически на спектрофотометре UV-160 («Shimadzu», Япония) в кварцевой кювете с длиной оптического пути 10 мм при 25°С в двух буферах: 20 мМ Na-ацетатном буфере с рН 5.0 и 50 мМ трис-HCl с рН 7.2. В качестве субстратов использовали АБТК, 2,6-диметоксифенол, сирингалдазин, n-кумаровый спирт, конифериловый спирт и феруловую кислоту в концентрации 0.1 мМ в кювете.
Активность культуральной жидкости гриба с субстратами определяли по скорости образования продуктов или окисления субстратов (Пример 14). Реакцию начинали добавлением в реакционную смесь культуральной жидкости гриба. Измерение проводили как минимум в трех повторностях. За единицу активности лакказы принимали среднюю скорость превращения 1 мкМ субстрата в минуту 1 мл культуральной жидкости.
Субстратную избирательность, выраженную в процентах от скорости окисления АБТК при рН 5.0 и рН 7.2, оценивали по скорости окисления того или иного субстрата лакказами гриба R. solani F-895.
Культуральная жидкость штамма гриба R. solani F-895, полученная по предлагаемому способу, проявляла максимальную активность со всеми замещенными фенолами, в том числе фенилпропаноидами (феруловая кислота, конифериловый и n-кумаровый спирты), за исключением АБТК, при рН 7.2 по сравнению с рН 5.0 (Таблица 2).
Наибольшая активность культуральной жидкости штамма наблюдалась с конифериловым спиртом и феруловой кислотой при рН 7.2 (100.05 и 112.71 ед./мл соответственно; 667.0 и 751.4% от активности с АБТК или 46.10 или 52.00% от активности с АБТК при рН 5.0).
Меньшая активность (26.36 ед./мл; 175.70% от активности с АБТК при рН 7.2 или 12.1% от активности с АБТК при рН5.0) наблюдалась в реакции с n-кумаровым спиртом, однако такая активность была соизмерима со скоростью окисления 2,6-диметоксифенола (25.38 ед./мл; 169.22% от активности с АБТК при рН 7.2 или 11.71% от активности с АБТК при рН 5.0). При рН 7.2 сирингалдазин окислялся культуральной жидкостью со скоростью 44.18 ед./мл (294.50% от активности с АБТК при рН 7.2 или 20.38% от активности с АБТК при рН 5.0).
Культуральная жидкость штамма гриба R. solani F-895 была в 4.4 раза более активна с феруловой кислотой, чем с 2,6-диметоксифенолом, при рН 7.2 и в 10.7 раз - при рН 5.0) (Таблица 2) по сравнению с активностью лакказы штамма гриба R. praticola (Vaartija no. 1347) (19), активность которой с феруловой кислотой была меньше, чем с 2,6-диметоксифенолом; она составляла 91% от активности с 2,6-диметоксифенолом. Нет данных об активности лакказы гриба R. praticola (Vaartija no. 1347) с АБТК.
Таким образом показано, что предлагаемый способ получения лакказ штамма гриба Rhizoctonia solani F-895, основанный на применении натуральных источников углерода и энергии, без использования дорогостоящих компонентов среды (глюкозы, аспарагина, тиамина), индукторов лакказ (солей меди, марганца, кальция, лития, ароматических соединений) и органических растворителей обеспечивает высокую активность лакказ указанного штамма гриба.
Сравнительный анализ полученных в настоящей работе данных с литературными данными свидетельствует о том, что активность лакказ, полученных по предлагаемому способу культивирования гриба Rhizoctonia solani F-895, с фенилпропаноидами при рН 7.2 превышает аналогичные показатели лакказной активности других организмов, измеренные при более низких значениях рН, и приближается к уровню активности лакказ растительного штамма Populus euramericana (5), непосредственно принимающих участие в модификации природных фенилпропаноидов в растительных клетках.
В настоящей работе впервые для представителей рода Rhizoctonia представлены данные о возможности окисления монолигнолов (n-кумарового и кониферилового спиртов) культуральной жидкостью гриба Rhizoctonia solani F-895.
Также в настоящей работе впервые для представителей рода Rhizoctonia была подробно исследована субстратная избирательность полученной по предлагаемому способу культуральной жидкости Rhizoctonia solani F-895 в отношении фенилпропаноидов. Из всех известных в мире лакказ только для лакказной активности штамма Rhizoctonia solani F-895 измерена субстратная избирательность при рН>7.0.
В тексте использованы следующие сокращения:
АБТК - 2,2-Азино-бис(3-этилбензотиазолин 6-сульфоновая кислота)
Fe EDTA - Fe-этилендиаминтетрауксусная кислота.
Использованная литература
1. Baldrian P. Fungal laccases-occurrence and properties. FEMS Microbiol. Rev. 2006, Vol. 30, P. 215-242.
2. Mikolasch A., Schauer F. Fungal laccases as tools for the synthesis of new hybrid molecules and biomaterials. Appl. Microbiol. Biotechnol. 2009, Vol. 82, P. 605-624.
3. Sterjiades R., Dean J.F.D., Eriksson K.-E.L. Laccase from Sycamore maple (Acer pseudoplatanus) polymerizes monolignols. Plant Physiol. 1992, Vol. 99, P. 1162-1168.
4. Sterjiades R., Dean J.F.D., Gamble G., Himmelsbach D.S., Eriksson K.-E.L. Extracellular laccases and peroxidases from sycamore maple (Acer pseudoplatanus) cell-suspension cultures. Planta, 1993, Vol. 190, P. 75-87.
5. Ranocha P., McDougall G., Hawkins S., Sterjiades R., Borderies G., Stewart D., Macheteau M.C., Boudet A.-M., Goffner D. Biochemical characterization, molecular cloning and expression of laccases ± a divergent gene family ± in poplar. Eur. J. Biochem. 1999, Vol. 259, P. 485-495.
6. Robles A., Lucas R., de Cienfuegos G.A., Galvez A. Phenol-oxidase (laccase) activity in strains of the hyphomycete Chalara paradoxa isolated from olive mill wastewater disposal ponds. Enz. Microbial. Technol., 2000, Vol. 26, P. 484-490.
7. Min K.-L., Kim Y.-H., Kim Y.W., Jung H.S., Hah Y.C. Characterization of a novel laccase produced by the wood-rotting Fungus Phellinus ribis. Arch. Biochem. Biophys., 2001, Vol. 392, P. 279-286.
8. Ai M.-Q., Wang F.-F., Huang F. Purification and characterization of a thermostable laccase 1 from Trametes trogii 2 and its ability in modification of kraft lignin. J. Microbiol. Biotechnol., 2015, Apr 15, PMID: 25876603.
9. Eggert C, Temp U., Eriksson K.E. The ligninolytic system of the white rot fungus Pycnoporus cinnabarinus: purification and characterization of the laccase. Appl. Environ. Microbiol., 1996, Vol. 62, P. 1151-1158.
10. Schneider P., Caspersen M.B., Mondorf K., Halkier Т., Skov L.K., Qstergaard P.R., Brown K.M., Brown S.H., Xu F. Characterization of a Coprinus cinereus laccase. Enz. Microbial. Technol., 1999, Vol. 25, P. 502-508.
11. Kiiskinen L.-L., Viikari L., Kruus K. Purification and characterisation of a novel laccase from the ascomycete Melanocarpus albomyces. Appl. Microbiol. Biotechnol., 2002, Vol. 59, P. 198-204.
12. Berka R.M., Schneider P., Golightly E.J., Brown S.H., Madden M., Brown K.M., Halkier Т., Mondorf K., Xu F. Characterization of the gene encoding an extracellular laccase of Myceliophthora thermophila and analysis of the recombinant enzyme expressed in Aspergillus oryzae. Appl. Environ. Microbiol., 1997, Vol. 63, P. 3151-3157.
13. Gouka R.J., van der Heiden M., Swarthoff Т., Verrips C.T. Cloning of a phenol oxidase gene from Acremonium murorum and its expression in Aspergillus awamori. Appl. Environ. Microbiol., 2001, Vol. 67, P. 2610-2616.
14. Sulistyaningdyah W.T., Ogawa J., Tanaka H., Maeda C., Shimizu S. Characterization of alkaliphilic laccase activity in the culture supernatant of Myrothecium verrucaria 24G-4 in comparison with bilirubin oxidase. FEMS Microbiol. Lett., 2004, Vol. 230, P. 209-214.
15. Janusz G., Rogalski J., Barwinska M., Szczodrak J. Effect of culture on production of extracellular laccase by Rhizoctonia praticola. Polish J. Microbiol., 2006, Vol. 55, P. 309-319.
16. Crowe J.D., Olsson S. Induction of laccase activity in Rhizoctonia solani by antagonistic Pseudomonas fluorescens strains and a range of chemical treatments. Appl. Environ. Microbiol., 2001, Vol. 67, P. 2088-2094.
17. Rogalski J., Janusz G., Legiec D., Cho N.-S., Shin S.-J., Ohga S. Purification of extracellular laccase from Rhizoctonia praticola. J. Fac. Agr. Kyushu Univ., 2011, Vol. 56, P. 1-7.
18. Shuttleworth K.L., Postie L., Bolag J.-M. Production of induced laccase by the fungus Rhizoctonia praticola. Can. Microbiol., 1986, Vol. 32, P. 867-870.
19. Bollag J.-M., Leonowicz A. Comparative studies of extracellular fungal laccases. Appl Environ Microbiol., 1984, Vol. 48, No. 4, P. 849-854.
20. Dec J., Bollag J.-M. Detoxification of substituted phenols by oxidoreductive enzymes through polymerization reactions. Arch. Environ. Contamin. Toxicol., 1990, Vol. 19, P. 543-550.
21. Wahleithner J.A., Xu F., Brown K.M., Brown S.H., Golightly E.J., Halkier Т., Kauppinen S., Pederson A., Schneider P. The identification and characterization of four laccases from the plant pathogenic fungus Rhizoctonia solani. Curr. Genet., 1996, Vol. 29, P. 395-403.
22. Christensen B.E., Schneider P., Wahleider J.A. Purified pH neutral Rhizoctonia laccases and nucleic acids encoding same. Patent EP 0719337 (A1). - Date of publication: 07.03.1996.
23. Cho N.-S., Rogalsky J., Jaszek M., Luterek J., Wojtas-Wasilewska M. Malarczyk E., Fink-Boots M., Leonovich A. Effect of coniferyl alcohol addition on removal of chlorophenols from water effluent by fungal laccase. J. Wood Sci., 1999, Vol. 45, P. 174-178.
24. Bollag J.-M., Sjoblad R.D., Liu S.-Y. Characterization of an enzyme from Rhizoctonia praticola which polymerizes phenolic compounds. Can. J. Microbiol., 1979, Vol. 25, P. 229-233.
25. Perez J., Jeffries T.W. Mineralization of C-ring-labeled synthetic lignin correlates with the production of lignin peroxidase, not of manganese peroxidase or laccase. Appl. Environ. Microbiol., 1990, Vol. 56, P. 1806-1812.
26. Мясоедова H.M., Гасанов Н.Б., Черных A.M., Коломыцева М.П., Головлева Л.А. Селективная регуляция продукции изоформ лакказы грибом Lentinus strigosus 1566. Прикладная Биохимия и Микробиология, 2015, Т. 51, С. 1-8.
27. Xu F. Oxidation of phenols, anilines, and benzenethiols by fungal laccases: correlation between activity and redox potentials as well as halide inhibition. Biochemistry, 1996, Vol. 35, P. 7608-7614.
28. Leonowicz A., Grzywnowicz K. Quantitative estimation of laccase forms in some white-rot fungi using syringaldazine as a substrate. Enz. Microb. Technol., 1981, Vol. 3, P. 55-58.
29. Paszczyn ´ ski A., Huynh V.-B., Crawford R. Comparison of ligninase-I and peroxidase-M2 from the white-rot fungus Phanerochaete chrysosporium. Arch. Biochem. Biophys., 1986, Vol. 244, P. 750-765.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения оксидаз Curvularia geniculata ВКМ F-3561, активных с фенольными соединениями в нейтральных условиях среды | 2017 |
|
RU2664483C2 |
| Способ получения лакказ гриба Myrothecium verrucaria ВКМ F-3851, трансформирующие фенольные соединения в нейтрально - щелочных условиях среды | 2016 |
|
RU2663342C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСИДАЗ ГРИБА MICROTHIELAVIA OVISPORA VKM F-1735, ОБЕСЦВЕЧИВАЮЩИХ ПРОМЫШЛЕННЫЕ КРАСИТЕЛИ БЕЗ МЕДИАТОРА | 2021 |
|
RU2773712C1 |
| ТЕРМОСТАБИЛЬНАЯ ЛАККАЗА III ГРИБА Steccherinum ochraceum LE (BIN) 1833 D И СПОСОБ ПОЛУЧЕНИЯ ЛАККАЗ | 2008 |
|
RU2385930C1 |
| Штамм Fomes fomentarius ВКПМ F-1531 - продуцент фенолоксидазных ферментов | 2021 |
|
RU2770690C1 |
| Штамм гриба Beauveria bassiana, используемый для производства биопрепарата против колорадского жука, грибных патогенов и стимуляции роста картофеля в вегитационный период, биопрепарат на его основе и способ стимуляции роста картофеля в вегитационный период, защиты его от колорадского жука и ризоктониоза | 2019 |
|
RU2704859C1 |
| ШТАММ БАЗИДИАЛЬНОГО ГРИБА Trametes hirsuta (Wulfen) Pilát- ПРОДУЦЕНТ ГОЛУБОЙ ЛАККАЗЫ | 2006 |
|
RU2345135C2 |
| РЕКОМБИНАНТНАЯ ДВУХДОМЕННАЯ ЛАККАЗА БАКТЕРИИ Streptomyces griseoflavus Ac-993, ОБЛАДАЮЩАЯ ВЫСОКОЙ ТЕРМОСТАБИЛЬНОСТЬЮ И ЩЕЛОЧНЫМ ОПТИМУМОМ pН ОКИСЛЕНИЯ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ; ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ДВУХДОМЕННУЮ ЛАККАЗУ БАКТЕРИИ Streptomyces griseoflavus Ac-993; СПОСОБ ПОЛУЧЕНИЯ ДВУХДОМЕННОЙ ЛАККАЗЫ БАКТЕРИИ Streptomyces griseoflavus Ac-993 | 2012 |
|
RU2539780C2 |
| БИОФУНГИЦИД ДЛЯ ЗАЩИТЫ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР ОТ БОЛЕЗНЕЙ И ПОВЫШЕНИЯ УРОЖАЙНОСТИ | 2015 |
|
RU2621356C1 |
| ШТАММ БАКТЕРИЙ PSEUDOMONAS CHLORORAPHIS ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ ФИТОПАТОГЕННЫХ ГРИБОВ И БАКТЕРИЙ И СТИМУЛЯЦИИ РОСТА РАСТЕНИЙ | 2015 |
|
RU2588473C1 |
Изобретение относится к биотехнологии. Способ получения лакказ предусматривает погружное культивирование Rhizoctonia solani F-895 в минеральной питательной среде с добавлением в качестве натурального источника углерода и энергии по крайней мере одного компонента, выбранного из ряда: белокочанная капуста, горох, фасоль, картофель, томатная паста, до получения максимальной активности лакказ в культуральной жидкости с последующим отделением культуральной жидкости от мицелия центрифугированием. При этом минеральная среда содержит NH4NO3, KH2PO4, K2HPO4, MgSO4×7H2O в заданном соотношении компонентов, а в качестве натурального источника углерода и энергии преимущественно используют горох или фасоль. Изобретение позволяет повысить лакказную активность и получить препарат, окисляющий фенилпропаноиды и другие ароматические соединения. 4 з.п. ф-лы, 7 ил., 15 пр.
1. Способ получения лакказ штамма гриба Rhizoctonia solani F-895, активных в нейтрально-щелочных условиях среды, характеризующийся тем, что погруженное культивирование гриба Rhizoctonia solani F-895 проводят в минеральной среде с добавлением в качестве натурального источника углерода и энергии по крайней мере одного компонента, выбранного из ряда: белокочанная капуста, горох, фасоль, картофель, томатная паста, до получения максимальной активности лакказ в культуральной жидкости, полученную культуральную жидкость гриба отделяют от мицелия.
2. Способ по п. 1, отличающийся тем, что натуральный источник углерода и энергии применяют в следующих концентрациях (г/л): капуста 10-160, горох 40-80, фасоль 20-80, картофель 40-200, томатная паста 20-40.
3. Способ по п. 2, отличающийся тем, что применяют в качестве натурального источника углерода и энергии преимущественно горох или фасоль.
4. Способ по п. 1, отличающийся тем, что погруженное культивирование мицелия гриба Rhizoctonia solani F-895 проводят в минеральной среде следующего состава (г/л): NH4NO3 - 0,2; KH2PO4 - 0,2; K2HPO4 - 0,02; MgSO4×7H2O - 0,12.
5. Способ по п. 1, отличающийся тем, что культуральную жидкость гриба отделяют от мицелия центрифугированием.
| ТЕРМОСТАБИЛЬНАЯ ЛАККАЗА III ГРИБА Steccherinum ochraceum LE (BIN) 1833 D И СПОСОБ ПОЛУЧЕНИЯ ЛАККАЗ | 2008 |
|
RU2385930C1 |
| ЕР 0719337 A1, 03.07.1996 | |||
| WAHLEITHNER J.A., XU F., BROWN K.M | |||
| et.al | |||
| The identification and characterization of four laccases from the plant pathogenic fungus Rhizoctonia solani, Current genetics,1996 | |||
| V | |||
| Солесос | 1922 |
|
SU29A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| 395-403. | |||
Авторы
Даты
2018-03-19—Публикация
2015-11-03—Подача