Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции в виде частиц и к способу получения композиции в виде частиц.
Уровень техники
Обычно, по отношению к фармацевтической твердой композиции, для контроля характеристик растворения лекарственного средства или чего-либо подобного, порошок фармацевтических исходных материалов гранулируется посредством добавления связующего вещества, наполнителя и тому подобного, или порошок фармацевтических исходных материалов покрывается водонерастворимым веществом покрытия. Например, патентный документ 1 описывает частицы лекарственного средства с покрытием, покрытые водонерастворимым полимером посредством использования устройства для нанесения покрытий на гранулы, и гранулирования и способа получения частиц, в котором используют водонерастворимый полимер в количестве от 0,1 до 2% от массы лекарственного средства и диаметр частиц композиции равен 17 мкм.
Например, патентный документ 2 также описывает, что 1-5% оксида титана добавляют к слою покрытия, покрывающему лекарственное средство, с помощью этилцеллюлозы или HPMC с получением размеров частиц композиции от 200 до 300 мкм.
Например, патентный документ 3 также описывает, что лекарственное средство покрывается HPC или этилцеллюлозой, что используют тальк, диоксид кремния или что-либо подобное, и что диаметр частиц композиции равен 161 мкм.
Например, патентный документ 4 также описывает мелкодисперсную композицию с пролонгированным высвобождением, получаемую посредством плавления и смешивания лекарственного средства, полимерных соединений (этилцеллюлозы и HPMCAS), стеариновой кислоты и этанола. Хотя в патентном документе 4 нет описания диаметра частиц композиции, мелкодисперсные гранулы, получаемые с помощью обычного способа, как правило, имеют размер примерно 90 мкм или больше.
Например, патентный документ 5 также описывает композицию в виде частиц, получаемую посредством покрытия частиц (диаметр частиц от 50 до 250 мкм), содержащих лекарственное средство липидным компонентом и полимерным соединением, а в Примере 4 описываются частицы лекарственного средства с покрытием, полученные посредством нанесения покрытия на частицы, содержащие лекарственное средство, с помощью распыления метанольного раствора, содержащего 2% сополимера метакриловой кислоты (Eudragit L) и 10% стеариновой кислоты.
Однако, как правило, поскольку площадь поверхности лекарственного средства становится больше, когда диаметр его частиц становится меньше, контроль растворения лекарственного средства (в особенности, подавления растворения или маскировка горечи) является очень сложным, когда частицы, содержащие лекарственное средство, становятся очень мелкими.
Способ сушки распылением широко используется в качестве простого и эффективного способа гранулирования и получения порошков. Однако нанесение покрытия в псевдоожиженном слое часто используется для покрытия лекарственного средства с целью контроля растворения лекарственного средства. Одна из причин этого заключается в том, что для способа сушки распылением является сложным получение достаточной толщины пленки покрытия и по этой причине невозможно получить композицию в виде частиц с покрытием с хорошо контролируемым растворением лекарственного средства.
В качестве технологии нанесения покрытия для лекарственного средства с использованием способа сушки распылением, патентный документ 6 описывает, например, получение частиц лекарственного средства, имеющего однослойную структуру покрытия, и его горький вкус подавляется с помощью способа сушки распылением.
Однако патентный документ 6 не описывает способа нанесения многослойного покрытия с использованием способа сушки распылением и, таким образом, этот способ является недостаточным для контроля характеристик растворения лекарственного средства.
Например, патентный документ 7 также описывает способ получения композиции, содержащей лекарственное средство, в виде частиц, покрытых тонкой пленкой агента, предотвращающего агрегирование, посредством распыления и приведения в контакт полимерного раствора, содержащего лекарственное средство, и водного раствора агента, предотвращающего агрегирование, друг с другом в устройстве для сушки распылением с использованием различных сопел.
Однако, способ, описанный в патентном документе 7, имеет тот недостаток, что получение продукта со стабильным качеством является сложным, поскольку растворы с различными композициями распыляются одновременно с помощью двух сопел. Кроме того, из-за специальной конфигурации, имеющей два сопла, оборудование является дорогостоящим, и имеется другая проблема, заключающаяся в том, что требуется длительное время и большие затраты для его очистки и обслуживания после использования.
Патентный документ 7 не описывает способа простого получения композиции в виде частиц, покрытых многослойным покрытием, хорошо контролируемого по растворению лекарственного средства с помощью способа сушки распылением без использования сложного способа одновременного распыления двух видов распыляемых растворов, соответственно, с помощью отдельных сопел.
Например, патентный документ 8 описывает также кишечнорастворимую гранулу, полученную посредством покрытия исходных гранул первым кишечнорастворимым слоем и вторым кишечнорастворимым слоем.
Однако способ получения кишечнорастворимой гранулы, описанный в патентном документе 8, представляет собой не способ сушки распылением, но способ нанесения покрытия методом гранулирования в псевдоожиженном слое, и в качестве полимеров покрытия для первого кишечнорастворимого слоя и второго кишечнорастворимого слоя, используют эмульгированные полимеры, диспергированные в воде, и целлюлозные кишечнорастворимые полимеры (HPMCAS) используют для первого слоя и второго слоя (pH растворения HPMCAS, который должен использоваться во втором слое, ниже, чем pH растворения HPMCAS, который должен использоваться в первом слое).
Список цитирования
Патентный документ
Патентный документ 1: Публикация заявки на патент Японии Kokai 2008-013480
Патентный документ 2: Патент Японии № 3317444
Патентный документ 3: Публикация заявки на патент Японии Kokai 2008-81448
Патентный документ 4: Публикация заявки на патент Японии Kokai Hei-09-020663
Патентный документ 5: Патент Японии № 3247511
Патентный документ 6: Патент Японии № 3415835
Патентный документ 7: Патент Японии № 3205884
Патентный документ 8: Публикация заявки на патент Японии Kokai 2007-332101
Сущность изобретения
Техническая проблема
Принимая во внимание рассмотренный выше современный уровень техники, целью настоящего изобретения является получение композиции в виде частиц с эффективно контролируемой характеристикой растворения лекарственного средства, даже если средний диаметр частиц является малым, и способа получения композиции в виде частиц с хорошо контролируемым растворением лекарственного средства: и этот способ может обеспечить простое получение композиции в виде частиц посредством нанесения на частицы лекарственного средства многослойного покрытия с помощью способа сушки распылением без использования сложного способа одновременного распыления двух видов распыляемых растворов с помощью различных сопел.
Решение проблемы
Для решения рассмотренной выше проблемы, авторы настоящего изобретения, осуществив различные исследования, обнаружили, что растворение лекарственного средства может предпочтительно контролироваться посредством использования водонерастворимого полимера, неорганических частиц и/или липидного компонента при заданном массовом отношении для нанесения слоя покрытия на частицы лекарственного средства, и это открытие привело теперь к завершению настоящего изобретения.
То есть, настоящее изобретение предусматривает композицию в виде частиц, содержащую частицы лекарственного средства и первый слой покрытия, покрывающий частицы лекарственного средства, отличающийся тем, что первый слой покрытия содержит водонерастворимый полимер, неорганические частицы и/или липидный компонент и липидный компонент содержит C15 или более высокомолекулярную жирную кислоту.
В композиции в виде частиц по настоящему изобретению, водонерастворимый полимер предпочтительно содержит кишечнорастворимый полимер.
Кроме того, средний диаметр частиц неорганических частиц предпочтительно составляет от 1 до 1000 нм.
Кроме того, неорганические частицы предпочтительно состоят из диоксида кремния и/или диоксида титана.
Кроме того, неорганические частицы предпочтительно подвергаются гидрофобизации.
Кроме того, неорганические частицы предпочтительно содержатся в количестве от 0,5 до 2,4 массовой доли на 2,4 массовой доли водонерастворимого полимера.
Кроме того, неорганические частицы предпочтительно содержатся в количестве от 0,5 до 2,4 массовой доли на 2,4 массовой доли частиц лекарственного средства.
Кроме того, липидный компонент предпочтительно содержит C15-C21 жирную кислоту и C15-C21 жирная кислота предпочтительно представляет собой стеариновую кислоту.
Кроме того, липидный компонент предпочтительно содержится в количестве от 0,1 до 0,8 массовой доли на 2,4 массовой доли водонерастворимого полимера.
Кроме того, композиция в виде частиц по настоящему изобретению предпочтительно дополнительно содержит второй слой покрытия, покрывающий первый слой покрытия.
Первый слой покрытия предпочтительно содержит кишечнорастворимый полимер целлюлозы, и второй слой покрытия предпочтительно содержит водонерастворимый полимер, отличный от кишечнорастворимого полимера целлюлозы.
Кишечнорастворимый полимер целлюлозы предпочтительно содержит фталат гидроксипропилметилцеллюлозы (HPMCP) и/или ацетат сукцинат гидроксипропилметилцеллюлозы (HPMCAS).
Водонерастворимый полимер, отличный от кишечнорастворимого полимера целлюлозы, содержит, по меньшей мере, один вид, выбранный из группы, состоящей из этилцеллюлозы, сополимера метакриловой кислоты-метилакрилата, сополимера метилметакрилата-бутилметакрилата-диметиламиноэтилметакрилата, поливинилацеталя диэтиламиноацетата, сополимера этилакрилата-метилметакрилата-хлортриметиламмония этилметакрилата и сополимера этилакрилата-метилметакрилата.
Композиция в виде частиц по настоящему изобретению предпочтительно имеет средний диаметр частиц от 0,1 до 200 мкм.
Авторы настоящего изобретения осуществили разнообразные исследования и, как следствие, обнаружили, что композиция в виде частиц с хорошо контролируемым растворением лекарственного средства может быть просто получена с помощью способа сушки распылением посредством формирования первого слоя покрытия на частицах лекарственного средства с помощью способа сушки распылением и дополнительного формирования после этого второго слоя покрытия с помощью способа сушки распылением, и с использованием различных полимеров покрытия для первого слоя покрытия и второго слоя покрытия, и это открытие привело теперь к завершению способа получения композиции в виде частиц по настоящему изобретению.
Таким образом, настоящее изобретение предусматривает способ получения композиции в виде частиц, включающий стадии: формирования первого слоя покрытия на частицах лекарственного средства посредством растворения и/или суспендирования частиц лекарственного средства в первом растворе покрытия, содержащего кишечнорастворимый полимер целлюлозы, и осуществления способа сушки распылением; и формирования второго слоя покрытия посредством суспендирования частиц лекарственного средства, покрытых первым слоем покрытия, во втором растворе покрытия, содержащем водонерастворимый полимер, отличный от кишечнорастворимого полимера целлюлозы, и осуществления способа сушки распылением.
В способе получения композиции в виде частиц по настоящему изобретению, первый раствор покрытия предпочтительно содержит первый полярный растворитель, и первый полярный растворитель предпочтительно представляет собой ацетон.
Второй раствор покрытия предпочтительно содержит второй полярный растворитель, отличный от первого полярного растворителя, и второй полярный растворитель предпочтительно представляет собой этанол.
Далее, настоящее изобретение будет описываться подробно.
Настоящее изобретение предусматривает композицию в виде частиц, содержащую частицы лекарственного средства и первый слой покрытия, покрывающий частицы лекарственного средства.
Композиция в виде частиц по настоящему изобретению с такой конфигурацией отличается тем, что растворение лекарственного средства может эффективно контролироваться даже в случае, когда средний диаметр частиц является малым.
Лекарственное средство в композиции в виде частиц не является как-либо ограниченным постольку, поскольку оно представляет собой активный компонент, который является физиологически активным или фармакологически активным, и их примеры включают полипептиды и нуклеиновые кислоты, имеющие физиологическую активность, жаропонижающие, обезболивающие и противовоспалительные лекарственные средства, лекарственные средства для лечения подагры и лечащие гиперурикемию, гипнотические и седативные лекарственные средства, снотворные лекарственные средства, успокаивающие лекарственные средства, противоэпилептические лекарственные средства, антипсихотические лекарственные средства, антидепрессанты, лекарственные средства против болезни Паркинсона, агонисты для автономной нервной системы, церебральные мелиоранты, лекарственные средства для лечения аллергии, противоаллергические лекарственные средства, антиангинальные лекарственные средства, β-блокаторы, антагонисты кальциевых каналов, кардиотонические лекарственные средства, антиаритмические лекарственные средства, диуретики, депрессанты, вазоконстрикторы, вазодилататоры, агенты против гиперлипидемии, вещества, вызывающее повышение кровяного давления, бронходилаторы - противоастматические лекарственные средства, противокашлевые лекарственные средства, отхаркивающие средства, агенты против язвы желудка и двенадцатиперстной кишки, средства, стимулирующие пищеварение, слабительные средства, интестинальные лекарственные средства, желудочные антациды, антидиабетические лекарственные средства, гормональные композиции, витаминные композиции, антибиотики, лекарственные средства для лечения остеопороза, антибактериальные лекарственные средства, химиотерапевтические лекарственные средства, противовирусные лекарственные средства, противоопухолевые лекарственные средства, лекарственные средства - мышечные релаксанты, антикоагулянты, гемостатические средства, противотуберкулезные агенты, антагонисты наркотиков, ингибиторы резорбции костей, ангиогенные ингибиторы, агенты, воздействующие на центральную нервную систему, локальные анестетики, лекарственные средства против головокружения, сердечнососудистые лекарственные средства, респираторные стимуляторы, противодиарейное средство, желчегонное средство, агенты, воздействующие на органы пищеварения, агенты, воздействующие на мочеполовые органы, агенты против заболевание печени и тому подобное. Рассмотренные выше лекарственные средства могут использоваться сами по себе или в сочетании двух или более видов.
Частицы лекарственного средства могут быть получены с помощью обычной известной технологии измельчения (молотковой мельницы, мельницы для получения образцов, игольчатой мельницы, струйной мельницы, шаровой мельницы и тому подобное).
Кроме того, пригодными в качестве частиц лекарственного средства являются, например, частицы, содержащие лекарственное средство, полученные посредством смешивания композиции физиологически или фармакологически приемлемого агента, и частицы, содержащие лекарственное средство, полученное посредством покрытия поверхности сердцевидных частиц соответствующего материала с помощью лекарственного средства посредством использования устройства для гранулирования с псевдоожиженным слоем, перемешивающего устройства с псевдоожиженным слоем, роторного устройства с псевдоожиженным слоем, центрифугирующего роторного устройства или устройства для сушки распылением.
В композиции в виде частиц по настоящему изобретению, частицы лекарственного средства предпочтительно имеют средний диаметр частиц от 0,08 до 160 мкм. Если средний диаметр частиц меньше чем 0,08 мкм, площадь поверхности композиции в виде частиц по настоящему изобретению становится слишком большой и контроль растворения лекарственного средства иногда становится сложным. С другой стороны, если средний диаметр частиц превышает 160 мкм, композиция может, вероятно, давать чувство шероховатости или ощущение постороннего предмета во рту, когда принимается композиция в виде частиц по настоящему изобретению. Более предпочтительно, средний диаметр частиц лекарственного средства находится в пределах от 0,4 до 80 мкм, а еще более предпочтительно, в пределах от 0,8 до 32 мкм.
Средний диаметр частиц для частиц лекарственного средства означает то же самое, что и средний диаметр частиц композиции в виде частиц, описанной далее.
Композиция в виде частиц по настоящему изобретению имеет конфигурацию, когда частицы лекарственного средства покрываются первым слоем покрытия.
Первый слой покрытия содержит водонерастворимый полимер, неорганические частицы и/или липидный компонент.
В следующем далее описании, компоненты, которые должны использоваться для композиции в виде частиц по настоящему изобретению вместе с частицами лекарственного средства, могут также коллективно называться компонентами композиции.
Различные физиологически или фармакологически приемлемые материалы могут использоваться в качестве водонерастворимого полимера. Конкретные примеры водонерастворимого полимера включают полимеры для пролонгированного высвобождения, желудочные полимеры, кишечнорастворимые полимеры и тому подобное.
Примеры полимеров для пролонгированного высвобождения включают водонерастворимые производные целлюлозы, такие как этилцеллюлоза; водонерастворимые сополимеры акриловой кислоты, такие как сополимер этилакрилата-метилметакрилата-хлортриметиламмония этилметакрилата (например, Eudragit RS и Eudragit RL, оба - от Evonik Industries), сополимер этилакрилата-метилметакрилата (например, Eudragit NE от Evonik Industries) и тому подобное.
Примеры желудочных полимеров включают производные поливинила, такие как поливинилацеталь диэтиламиноацетат; сополимеры (мет)акриловой кислоты, такие как сополимер метилметакрилата-бутилметакрилата-диметиламиноэтилметакрилата (например, Eudragit E от Evonik Industries) и тому подобное.
Примеры кишечнорастворимых полимеров включают производные целлюлозы, такие как ацетат сукцинат гидроксипропилметилцеллюлозы, фталат гидроксипропилметилцеллюлозы, фталат гидроксиметилэтилцеллюлозы, карбоксиметилэтилцеллюлозу, ацетат пропионат целлюлозы, ацетат фталат целлюлозы, ацетат сукцинат целлюлозы, ацетат тримеллитат целлюлозы и фталат метилцеллюлозы; сополимеры (мет)акриловой кислоты, такие как сополимер метакриловой кислоты L (например, Eudragit L от Evonik Industries), сополимер метакриловой кислоты LD (например, Eudragit LD от Evonik Industries), сополимер метакриловой кислоты S (например, Eudragit S от Evonik Industries) и тому подобное.
Эти водонерастворимые полимеры могут использоваться сами по себе или в сочетании двух или более видов. Предпочтительные примеры представляют собой водонерастворимые производные целлюлозы, водонерастворимые сополимеры акриловой кислоты, желудочные полимеры, кишечнорастворимые полимеры и тому подобное, и они могут использоваться сами по себе или в сочетании двух или более видов.
"(Мет)акриловый" означает акриловый или метакриловый.
Более предпочтительно, в композиции в виде частиц по настоящему изобретению, водонерастворимые полимеры содержат кишечнорастворимый полимер. Он дает возможность, чтобы лекарственное средство могло более эффективно растворяться именно в кишечнике посредством приготовления первого слоя покрытия, содержащего кишечнорастворимый полимер и неорганические частицы, описанные далее.
"Кишечнорастворимый полимер" означает полимер, который является нерастворимым в водном растворе при pH меньше чем 5, но является растворимым в водном растворе при значении pH в пределах pH 5-7.
Примеры кишечнорастворимого полимера включают те, которые рассмотрены выше, и все их примеры, рассмотренные выше, фталат гидроксипропилметилцеллюлозы и сополимер (мет)акриловой кислоты используются предпочтительно. Коммерчески доступные примеры этих кишечнорастворимых полимеров представляют собой HP 55 (наименование продукта от Shin-Etsu Chemical Co., Ltd.) и Eudragit S100 (от Evonik Industries).
Различные физиологически или фармакологически приемлемые материалы могут использоваться в качестве неорганических частиц, составляющих первый слой покрытия.
Примеры таких неорганических частиц включают диоксид кремния (гидратированный диоксид кремния, легкий кремниевый ангидрид), диоксид титана, тальк, каолин, стеарат магния, стеарат кальция, натрий стеарилфумарат, карбонат кальция, фосфат кальция, силикат кальция, силикат магния, силикат алюминия, магний силикат алюминат, магний метасиликат алюминат, магний алюминий силикат, легкий оксид алюминия и тому подобное. Эти неорганические частицы могут использоваться сами по себе или в сочетании двух или более видов.
Эти неорганические частицы могут быть получены с помощью широко известной технологии измельчения и диспергирования (молотковой мельницы, мельницы для получения образцов, игольчатой мельницы, струйной мельницы, шаровой мельницы, гомогенизатора высокого давления, ультразвукового измельчения и диспергирования и тому подобное).
Неорганические частицы предпочтительно представляют собой частицы, подвергаемые гидрофобизации. Растворение лекарственного средства делается лучше контролируемым посредством воздействия гидрофобизации на неорганические частицы.
В настоящем документе, "подвергаемый воздействию гидрофобизации" означает химическое алкилирование поверхности.
Конкретные примеры гидрофобизации включают те, которые осуществляются посредством покрытия поверхности легкого кремниевого ангидрида метильными группами, в случае легкой кремниевой кислоты, подвергаемой воздействию гидрофобизации, а также те, которые осуществляются посредством химической обработки оксида титана октилсиланом, в случае оксида титана, подвергаемого воздействию гидрофобизации.
Особенно предпочтительно, неорганические частицы представляют собой диоксид кремния и/или диоксид титана, поскольку являются доступными их коммерческие продукты со средним диаметром частиц, находящимся в пределах, описанных далее. В частности, предпочтительными являются легкий кремниевый ангидрид, подвергаемый воздействию гидрофобизации (например, Aerosil-R972 от Nippon Aerosil Co., Ltd.), и оксид титана, подвергаемый воздействию гидрофобизации (например, Aeroxide-T805 от Nippon Aerosil Co., Ltd.).
Средний диаметр частиц для неорганических частиц предпочтительно составляет от 1 до 1000 нм, а более предпочтительный нижний предел составляет 100 нм, и еще более предпочтительный верхний предел составляет 500 нм. Если размер меньше чем 1 нм, свойства при манипуляциях в течение работы и частицы, которые могут быть куплены как фармацевтическая добавка, возможно, не являются доступными. С другой стороны, если средний диаметр частиц превышает 1000 нм, в случае использования таких частиц для композиции в виде частиц по настоящему изобретению, становится сложным однородное и плотное заполнение первого слоя покрытия частицами и, таким образом, контроль растворения лекарственного средства может, вероятно, стать невозможным.
Здесь, средний диаметр частиц для неорганических частиц означает то же самое, что и средний диаметр частиц композиции в виде частиц, описанный далее.
В композиции в виде частиц по настоящему изобретению, отношение содержания неорганических частиц к содержанию рассмотренного выше водонерастворимого полимера предпочтительно контролируется так, чтобы оно находилось в пределах от 0,5 до 2,4 массовой доли, а более предпочтительно, в пределах от 1,0 до 2,0 массовых долей на 2,4 массовой доли водонерастворимого полимера, в соответствии с типом частиц лекарственного средства, желаемой степенью контроля растворения лекарственного средства и тому подобное. Если отношение содержания неорганических частиц к содержанию водонерастворимого полимера меньше чем 0,5 массовой доли, вероятно, станет невозможным осуществление воздействия контроля растворения лекарственного средства. С другой стороны, если содержание превышает 2,4 массовой доли, это может, вероятно, вызвать хрупкость первого слоя покрытия.
Отношение содержания неорганических частиц к содержанию рассмотренных выше частиц лекарственного средства предпочтительно также контролируется в соответствии с типом частиц лекарственного средства, желаемой степенью контроля растворения и тому подобное, и оно предпочтительно составляет от 0,5 до 2,4 массовой доли, а более предпочтительно, от 1,0 до 2,0 массовых долей на 2,4 массовой доли частиц лекарственного средства. Если отношение содержания неорганических частиц к содержанию частиц лекарственного средства меньше чем 0,5 массовой доли, вероятно, станет невозможным осуществление достаточного воздействия на контроль растворения лекарственного средства. С другой стороны, если содержание превышает 2,4 массовой доли, это может, вероятно, вызвать хрупкость первого слоя покрытия.
В качестве липидного компонента, содержащего первый слой покрытия, могут использоваться различные физиологически или фармакологически приемлемые материалы.
Примеры такого липидного компонента включают жирные кислоты (пальмитиновую кислоту, стеариновую кислоту, арахиновую кислоту, бегеновую кислоту и тому подобное), высшие спирты (цетиловый спирт, пальмитиловый спирт, стеариловый спирт и тому подобное), сложные эфиры жирных кислот (глицерилмоностеарат, глицерилмонопальмитат, глицерилбехенат и тому подобное), гидрированные масла (гидрированное касторовое масло и тому подобное), твердые жиры и масла (масло какао и тому подобное), и воски (пчелиный воск, белый пчелиный воск, карнаубский воск и тому подобное). Эти липидные компоненты могут использоваться сами по себе или в сочетании двух или более видов.
В композиции в виде частиц по настоящему изобретению, липидный компонент включает C15 или более высокомолекулярную жирную кислоту. Если липидный компонент представляет собой жирную кислоту более низкомолекулярную, чем C15, вероятно, может стать невозможным достаточный контроль растворения лекарственного средства.
Особенно предпочтительно, липидный компонент содержит C15-C21 жирную кислоту. Растворение лекарственного средства может эффективно контролироваться с помощью удерживания C15-C21 жирной кислоты в качестве липидного компонента, даже в случае, когда средний диаметр частиц композиции в виде частиц по настоящему изобретению является малым.
C15 или более высокомолекулярная жирная кислота означает жирную кислоту, имеющую 15 или более атомов углерода в молекуле в целом.
C15-C21 жирная кислота означает жирную кислоту, имеющую 15-21 атомов углерода в целом в молекуле, и, например, пальмитиновая кислота, стеариновая кислота и арахиновая кислота являются предпочтительными, а стеариновая кислота является особенно предпочтительной. Растворение лекарственного средства может хорошо контролироваться посредством добавления стеариновой кислоты в качестве липидного компонента.
В композиции в виде частиц по настоящему изобретению, отношение содержания липидного компонента к содержанию рассмотренного выше водонерастворимого полимера контролируется так, чтобы оно находилось в пределах от 0,1 до 0,8 массовой доли на 2,4 массовой доли водонерастворимого полимера в соответствии с типом частиц лекарственного средства, желаемой степенью контроля растворения лекарственного средства и тому подобного. Отношение содержания предпочтительно составляет от 0,15 до 0,75 массовых долей, а более предпочтительно, от 0,2 до 0,55 массовых долей на 2,4 массовой доли водонерастворимого полимера.
Если содержание липидного компонента по отношению к водонерастворимому полимеру меньше, чем 0,1 массовых долей, возможно, станет сложным растворение лекарственного средства в нейтральной области, в случае, когда композиция в виде частиц по настоящему изобретению представляет собой кишечнорастворимую композицию, и таким образом характеристика кишечнорастворимой композиции не сможет быть продемонстрирована в достаточной степени. С другой стороны, если содержание превышает 0,8 массовой доли, становится сложным формирование эффективного первого слоя покрытия, и это приводит к невозможности контроля растворения лекарственного средства.
В дополнение к этому, первый слой покрытия может содержать, по необходимости, широко известные компоненты, которые должны использоваться в фармацевтических композициях, например, водорастворимые полимеры, связующие вещества, разрыхлители, воски, пластификаторы, сахариды, подкислители, искусственные подсластители, ароматизирующие вещества, смазывающие вещества, красители, стабилизаторы и тому подобное, в качестве добавок. Эти добавки могут использоваться сами по себе или в сочетании двух или более видов.
Первый слой покрытия может содержать поверхностно-активные вещества, по необходимости, для улучшения диспергируемости частиц лекарственного средства в растворе покрытия, описанном далее. Эти поверхностно-активные вещества могут использоваться сами по себе или в сочетании двух или более видов. Примеры поверхностно-активного вещества включают глицерилмоноизостеарат и тому подобное.
Первый слой покрытия может формироваться посредством использования в качестве раствора покрытия, например, раствора (раствора в органическом растворителе и тому подобного) или дисперсии (водной дисперсии и тому подобного), содержащей рассмотренный выше водонерастворимый полимер, неорганические частицы и/или липидный компонент, а также другие добавки (компоненты композиции).
Примеры растворителя в растворе покрытия включают воду и органические растворители. Примеры органических растворителей включают спирты (этанол, пропанол, изопропанол и тому подобное), углеводороды (н-гексан, циклогексан и тому подобное), галогенированные алканы (дихлорметан, хлороформ, трихлорэтан, четыреххлористый углерод и тому подобное), кетоны (ацетон, метилэтилкетон и тому подобное), сложные эфиры (этилацетат и тому подобное), простые эфиры, нитрилы (ацетонитрил и тому подобное) и тому подобное.
Эти органические растворители могут использоваться в сочетании двух или более видов, и водосовместимые органические растворители могут использоваться в качестве смешанных растворителей вместе с водой.
Спирты, кетоны и вода являются предпочтительными среди этих растворителей.
Концентрация водонерастворимого полимера в растворе покрытия может выбираться в соответствии со свойствами вязкости и распыления раствора покрытия, и она составляет, например, 0,1-50% мас., предпочтительно, 0,2-40% мас., более предпочтительно, примерно от 0,5 до 25% мас., а еще более предпочтительно, примерно от 1 до 10% мас. Раствор покрытия может содержать рассмотренные выше различные виды добавок.
Первый слой покрытия может формироваться на поверхности частиц лекарственного средства с помощью широко известной технологии нанесения покрытия с использованием, например, устройства с перемешиваемым псевдоожиженным слоем, роторного устройства с псевдоожиженным слоем, устройства Вустера с псевдоожиженным слоем или устройства для сушки распылением. Особенно пригодным для получения композиции в виде частиц по настоящему изобретению, является способ сушки распылением с использованием устройства для сушки распылением.
В способе сушки распылением, сначала получают раствор покрытия посредством смешивания или суспендирования частиц лекарственного средства и соответствующих материалов, составляющий первый слой покрытия, и раствор покрытия распыляется в сушильной камере устройства для сушки распылением с использованием сопла. Вода или органический растворитель в виде мелкодисперсных гранулированных капель, сформированных посредством распыления, выпаривается в течение короткого времени, так что может быть получена композиция в виде частиц, содержащая частицы лекарственного средства, покрытые первым слоем покрытия.
Примеры типа сопла включают тип двухжидкостного сопла, тип многожидкостного сопла, тип сопла высокого давления, тип вращающегося диска и тому подобное.
Тип сопла и условия распыления не являются как-либо ограниченными постольку, поскольку они являются пригодными для распыления раствора покрытия, полученного, как описано выше. Условия могут выбираться соответствующим образом в соответствии с композицией в виде частиц и устройствами для сушки распылением, которые должны использоваться. Например, в случае устройства для сушки распылением с соплом двухжидкостного типа, температура поступающего воздуха регулируется соответствующим образом в соответствии с растворителем, который должен использоваться, и, как правило, она составляет примерно от 30 до 200°C, а предпочтительно, примерно от 40 до 150°C. Количество распыляемого раствора регулируется соответствующим образом в соответствии с масштабом устройства и, как правило, оно составляет примерно от 1 до 30 мл/мин в случае, например, лабораторного масштаба (диаметр камеры 15,5 см). Скорость потока распыляемого газа, как правило, регулируется в пределах примерно от 50 до 900 л/час, хотя она зависит от диаметра частиц композиции в виде частиц, который должен быть получен, и от диаметра сопла.
В композиции в виде частиц, если это необходимо, вода или растворитель в частицах лекарственного средства может полностью удаляться при пониженном давлении.
Средний диаметр частиц композиции в виде частиц по настоящему изобретению не является как-либо ограниченным, постольку, поскольку он находится в пределах, в которых чувство шероховатости во рту может быть уменьшено, и предпочтительно, он составляет от 0,1 до 200 мкм, более предпочтительно, от 0,5 до 100 мкм, еще более предпочтительно, от 1,0 до 40 мкм, а наиболее предпочтительно, от 1,0 до 15 мкм. Если средний диаметр частиц меньше чем 0,1 мкм, площадь поверхности композиции в виде частиц по настоящему изобретению становится слишком большой и контроль растворения лекарственного средства иногда становится сложным. С другой стороны, если средний диаметр частиц превышает 200 мкм, он может, вероятно, давать чувство шероховатости или ощущение постороннего предмета во рту.
В настоящем документе, "средний диаметр частиц" означает диаметр 50% объема всех частиц и может измеряться посредством использования "автоматического анализатора изображений частиц" (анализатор изображений частиц представляет собой устройство для измерения диаметра частиц по изображениям сфотографированных частиц) и "анализатор распределения размеров частиц на основе дифракции лазерного света" (или "анализатор распределения размеров частиц на основе дифракции/рассеяния лазерного света").
Кроме того, композиция в виде частиц по настоящему изобретению, предпочтительно, дополнительно содержит второй слой покрытия, покрывающий первый слой покрытия. Растворение лекарственного средства может быть сделано лучше контролируемым посредством нанесения на частицы лекарственного средства первого слоя покрытия и второго слоя покрытия.
В композиции в виде частиц по настоящему изобретению, имеющей первый слой покрытия и второй слой покрытия, является предпочтительным, чтобы первый слой покрытия содержал кишечнорастворимый полимер на основе целлюлозы, а второй слой покрытия содержал водонерастворимый полимер, отличный от кишечнорастворимого полимера целлюлозы.
Композиция в виде частиц по настоящему изобретению, имеющая первый слой покрытия и второй слой покрытия, может быть получена с помощью способа, включающего стадии формирования первого слоя покрытия на частицах лекарственного средства посредством растворения и/или суспендирования частиц лекарственного средства в первом растворе покрытия, содержащем кишечнорастворимый полимер целлюлозы, и осуществления способа сушки распылением, и формирования второго слоя покрытия посредством суспендирования частиц лекарственного средства, покрытых первым слоем покрытия, во втором растворе покрытия, содержащем водонерастворимый полимер, отличный от кишечнорастворимого полимера целлюлозы, и осуществления способа сушки распылением. Способ получения композиции в виде частиц также представляет собой одно из настоящего изобретения.
На стадии формирования первого слоя покрытия, частицы лекарственного средства растворяются и/или суспендируются в первом растворе покрытия, содержащем кишечнорастворимый полимер целлюлозы.
Способ растворения и/или суспендирования частиц лекарственного средства в первом растворе покрытия не является как-либо ограниченным, и он может осуществляться с помощью широко известного способа.
В качестве кишечнорастворимого полимера целлюлозы могут использоваться различные физиологически или фармакологически приемлемые материалы. Особенно предпочтительно кишечнорастворимый полимер целлюлозы является водонерастворимым, и примеры кишечнорастворимого полимера целлюлозы включают ацетат сукцинат гидроксипропилметилцеллюлозы (HPMCAS), фталат гидроксипропилметилцеллюлозы (HPMCP), фталат гидроксиметилэтилцеллюлозы, карбоксиметилэтилцеллюлозу, ацетат пропионат целлюлозы, ацетат фталат целлюлозы, ацетат сукцинат целлюлозы, ацетат триметллитат целлюлозы, фталат метилцеллюлозы и тому подобное.
Эти кишечнорастворимые полимеры целлюлозы могут использоваться сами по себе или в сочетании двух или более видов.
В частности, ацетат сукцинат гидроксипропилметилцеллюлозы (HPMCAS) и/или фталат гидроксипропилметилцеллюлозы (HPMCP) предпочтительно используется в качестве кишечнорастворимого полимера целлюлозы. В случае использования этих кишечнорастворимых полимеров целлюлозы, становится легким формирование первого слоя покрытия для эффективного контроля растворения.
В дополнение к этому, "кишечнорастворимый полимер" означает полимер, который является нерастворимым в водном растворе при pH ниже, чем 5, но является растворимым в водном растворе при значении pH в пределах pH 5-7.
Первый раствор покрытия может содержать рассмотренные выше неорганические частицы, а также, по потребности, широко известные компоненты, которые должны использоваться для фармацевтических композиций, например, водорастворимые полимеры, связующие вещества, разрыхлители, воски, пластификаторы, сахариды, подкислители, искусственные подсластители, ароматизирующие вещества, смазывающие вещества, красители, стабилизаторы и тому подобное, в качестве добавок. Эти добавки могут использоваться сами по себе или в сочетании двух или более видов.
Раствор (раствор органического растворителя), дисперсия (водная дисперсия) или что-либо подобное, содержащая рассмотренный выше кишечнорастворимый полимер целлюлозы, неорганические частицы и другие добавки (компоненты композиции) могут использоваться в качестве первого раствора покрытия.
Примеры растворителя включают воду и органические растворители.
Примеры органических растворителей включают спирты (этанол, пропанол, изопропанол и тому подобное), углеводороды (н-гексан, циклогексан и тому подобное), галогенированные алканы (дихлорметан, хлороформ, трихлорэтан, тетрахлорметан и тому подобное), кетоны (ацетон, метилэтилкетон и тому подобное), сложные эфиры (этилацетат и тому подобное), простые эфиры, нитрилы (ацетонитрил и тому подобное) и тому подобное. Эти органические растворители могут использоваться в сочетании двух или более видов, и водосовместимые органические растворители могут использоваться как смешанные растворители вместе с водой.
В качестве органического растворителя, предпочтительным является полярный органический растворитель (далее упоминается как первый полярный растворитель), а более конкретно, предпочтительные примеры включают кетоны (например, ацетон), смешанные растворители из кетонов и спиртов (например, этанола, метанола), и смешанные растворители из кетонов и галогенированных алканов (например, дихлорметана). Среди них, в качестве первого полярного растворителя, особенно предпочтительным является ацетон.
Концентрация кишечнорастворимого полимера целлюлозы в первом растворе покрытия выбирается в соответствии со свойствами вязкости и распыления первого раствора покрытия, и она предпочтительно составляет, например, 0,1-50% мас., более предпочтительно, 0,2-40% мас., еще более предпочтительно, примерно 0,5 до 25% мас., и наиболее предпочтительно, примерно от 1 до 10% мас. Если концентрация кишечнорастворимого полимера целлюлозы меньше чем 0,1% мас., вероятно, станет невозможным получение композиции в виде частиц с достаточным контролем растворения лекарственного средства. С другой стороны, если концентрация превышает 50% масс, первый раствор покрытия становится очень вязким, и это иногда может привести к невозможности формирования однородного первого слоя покрытия.
В способе сушки распылением, сначала первый раствор покрытия, полученный посредством растворения или суспендирования частиц лекарственного средства с помощью рассмотренного выше способа, распыляется в сушильной камере устройства для сушки распылением с использованием сопла. Вода или органический растворитель в мелкодисперсных гранулированных каплях выпаривается в пределах исключительно короткого времени, так что может формироваться первый слой покрытия на частицах лекарственного средства.
Примеры сопла включают тип двухжидкостного сопла, тип многожидкостного сопла, тип сопла высокого давления, тип вращающегося диска и тому подобное.
Тип сопла и условия распыления не являются как-либо ограниченными постольку, поскольку они являются пригодными для распыления первого раствора покрытия, полученного посредством растворения и/или суспендирования частиц лекарственного средства, как описано выше. Условия могут выбираться соответствующим образом в соответствии с композицией в виде частиц, которая должна быть получена, и устройства для сушки распылением, которое должно использоваться. Например, в случае устройства для сушки распылением типа с двухжидкостным соплом, температура поступающего воздуха соответствующим образом регулируется в соответствии с растворителем, который должен использоваться, и, как правило, она составляет примерно от 50 до 200°C,а предпочтительно, примерно от 80 до 150°C. Количество распыляемого раствора регулируется соответствующим образом в соответствии с масштабом устройства, и, как правило, оно составляет примерно от 1 до 30 мл/мин в случае, например, лабораторного масштаба (диаметр камеры 15,5 см). Скорость потока распыляемого газа регулируется, как правило, в пределах примерно от 50 до 900 л/час, хотя она зависит от диаметра частиц композиции в виде частиц, который должен быть получен, и от диаметра сопла.
На этой стадии, если это необходимо, вода или растворитель в частицах лекарственного средства может полностью удаляться при пониженном давлении.
Средний диаметр частиц для частиц, покрытых первым слоем покрытия и получаемых на этой стадии, предпочтительно составляет от 0,09 до 180 мкм, более предпочтительно, от 0,45 до 90 мкм, а еще более предпочтительно, от 0,9 до 36 мкм. Если средний диаметр частиц меньше чем 0,09 мкм, иногда становится сложным контроль растворения лекарственного средства в композиции в виде частиц, которая должна быть получена в соответствии с настоящим изобретением. С другой стороны, если средний диаметр частиц превышает 180 мкм, композиция в виде частиц, полученная в соответствии с настоящим изобретением, может, вероятно, давать чувство шероховатости или ощущение постороннего предмета во рту, когда принимается композиция в виде частиц.
Способ получения композиции в виде частиц по настоящему изобретению, кроме того, имеет стадию формирования второго слоя покрытия посредством суспендирования частиц лекарственного средства, покрытых первым слоем покрытия, во втором растворе покрытия, содержащем водонерастворимый полимер, отличный от кишечнорастворимого полимера целлюлозы, и осуществления способа сушки распылением.
Второй слой покрытия может формироваться на частицах лекарственного средства, покрытых первым слоем покрытия, с помощью способа сушки распылением на этой стадии, с получением желаемой композиции в виде частиц.
На этой стадии, сначала, частицы лекарственного средства, покрытые первым слоем покрытия, суспендируются во втором растворе покрытия.
Второй раствор покрытия представляет собой раствор, содержащий водонерастворимый полимер, отличный от кишечнорастворимого полимера целлюлозы. Как описано далее, примеры водонерастворимого полимера, содержащегося во втором растворе покрытия, включают такие же полимеры, как рассмотренные выше кишечнорастворимые полимеры целлюлозы; однако, в настоящем изобретении, полимеры, отличные от рассмотренных выше кишечнорастворимых полимеров целлюлозы, используются в качестве водонерастворимого полимера, который должен использоваться на этой стадии. Во втором растворе покрытия, требуется только, чтобы тип кишечнорастворимого полимера целлюлозы был отличным от типа водонерастворимого полимера.
Применение второго раствора покрытия, содержащего такой водонерастворимый полимер, может придавать композиции в виде частиц, которая должна быть получена с помощью настоящего изобретения, структуру многослойного покрытия на частицах лекарственного средства, и таким образом, они могут хорошо контролировать растворение лекарственного средства.
В качестве водонерастворимого полимера могут использоваться различные физиологически или фармакологически приемлемые материалы. Примеры водонерастворимого полимера включают полимеры для пролонгированного высвобождения, желудочные полимеры, кишечнорастворимые полимеры и тому подобное.
Примеры полимеров для пролонгированного высвобождения включают водонерастворимые производные целлюлозы, такие как этилцеллюлоза; водонерастворимые сополимеры акриловой кислоты, такие как сополимер этилакрилата-метилметакрилата-хлортриметиламмония этилметакрилата (например, Eudragit RS и Eudragit RL, оба - от Evonik Industries), и сополимер этилакрилата-метилметакрилата (например, Eudragit NE от Evonik Industries) и тому подобное.
Примеры желудочных полимеров включают производные поливинила, такие как поливинилацеталь диэтиламиноацетат; сополимеры (мет)акриловой кислоты, такие как сополимер метилметакрилата-бутилметакрилата-диметиламиноэтилметакрилата (например, Eudragit E от Evonik Industries) и тому подобное.
Примеры кишечнорастворимых полимеров включают сополимеры (мет)акриловой кислоты, такие как сополимер метакриловой кислоты L (например, Eudragit L от Evonik Industries), сополимер метакриловой кислоты LD (например, Eudragit LD от Evonik Industries), сополимер метакриловой кислоты S (например, Eudragit S от Evonik Industries) и тому подобное.
Эти водонерастворимые полимеры могут использоваться сами по себе или в сочетании двух или более видов. Предпочтительные примеры представляют собой водонерастворимые производные целлюлозы, желудочные полимеры, кишечнорастворимые полимеры и тому подобное, и они могут использоваться сами по себе или в сочетании двух или более видов.
"(Мет)акриловый" означает акриловый или метакриловый.
Среди них, предпочтительными в качестве водонерастворимого полимера являются этилцеллюлоза, сополимер метакриловой кислоты S, поливинилацеталь диэтиламиноацетат и сополимер метилметакрилата-бутилметакрилата-диметиламиноэтилметакрилата. В особенности предпочтительной является этилцеллюлоза. В случае использования этилцеллюлозы в качестве водонерастворимого полимера, легко может формироваться второй слой покрытия для эффективного контроля растворения.
Второй раствор покрытия может содержать неорганические частицы такие же, как частицы в рассмотренном выше первом растворе покрытия.
Содержание неорганических частиц определяется соответствующим образом в соответствии с типом лекарственного средства рассмотренных выше частиц лекарственного средства, желаемой степенью контроля растворения и тому подобного. Содержание предпочтительно составляет от 0,5 до 2,0 массовых долей, а более предпочтительно, от 1,0 до 2,0 массовых долей, на 2,4 массовой доли водонерастворимого полимера. Если содержание неорганических частиц меньше чем 0,5 массовой доли, вероятно, станет невозможным осуществление воздействия контроля растворения. С другой стороны, если содержание превышает 2,0 массовых долей, это может, вероятно, вызывать хрупкость второго слоя покрытия.
Второй раствор покрытия может содержать в качестве добавок, по потребности, широко известные компоненты, которые должны использоваться в фармацевтических композициях, например, водорастворимые полимеры, связующие вещества, разрыхлители, воски, пластификаторы, сахариды, подкислители, искусственные подсластители, ароматизирующие вещества, смазывающие вещества, красители, стабилизаторы и тому подобное. Эти добавки могут использоваться сами по себе или в сочетании двух или более видов.
Второй раствор покрытия предпочтительно содержит рассмотренные выше водонерастворимые полимеры, неорганические частицы и другие добавки (компоненты композиции), а также второй полярный растворитель, отличный от рассмотренного выше первого полярного растворителя.
Второй полярный растворитель отличается от первого полярного растворителя. В частности, второй полярный растворитель отличается от первого полярного растворителя по свойствам растворения. Более конкретно, второй полярный растворитель отличается от первого полярного растворителя тем, что второй полярный растворитель по существу не растворяет кишечнорастворимый полимер целлюлозы, который должен использоваться в первом слое покрытия. В дополнение к этому, "по существу не растворяет кишечнорастворимый полимер целлюлозы" означает, что масса кишечнорастворимого полимера целлюлозы, растворимого в 100 г второго полярного растворителя, составляет 1 г или меньше (при условиях комнатной температуры, 25°C).
Композиция в виде частиц, покрытых двухслойным покрытием, может быть получена в соответствии с настоящим изобретением, и эта композиция в виде частиц обеспечивается хорошо контролируемым растворением посредством использования второго полярного растворителя, отличного от первого полярного растворителя. В случае, когда используется рассмотренное выше водорастворимое лекарственное средство, поскольку полярный органический растворитель не оказывает никакого воздействия на лекарственное средство, имеющее растворимость в воде, второй полярный растворитель предпочтительно представляет собой полярный органический растворитель.
Примеры второго полярного растворителя включают спирты (например, этанол и метанол) и галогенированные алканы (например, дихлорметан), и, в частности, предпочтительно используется этанол.
Концентрация водонерастворимого полимера во втором растворе покрытия выбирается в соответствии со свойствами вязкости и распыления второго раствора покрытия, и она составляет, например, от 0,1 до 50% мас., предпочтительно, от 0,2 до 40% мас., более предпочтительно, примерно от 0,5 до 25% мас., а наиболее предпочтительно, примерно от 1 до 10% мас. Если концентрация водонерастворимого полимера меньше чем 0,1% мас., вероятно, станет невозможным получение композиции в виде частиц с достаточным контролем растворения лекарственного средства. С другой стороны, если концентрация превышает 50% мас., второй раствор покрытия становится очень вязким, и это может иногда приводить к невозможности формирования однородного второго слоя покрытия.
Способ сушки распылением с использованием второго раствора покрытия может представлять собой такой же способ как рассмотренный выше способ сушки распылением с использованием первого раствора покрытия.
В соответствии со способом получения композиции в виде частиц по настоящему изобретению, включающим рассмотренные выше стадии, могут быть получены композиции в виде частиц с двухслойным покрытием, содержащие частицы лекарственного средства, покрытые рассмотренными выше первым и вторым слоями покрытия, и композиции в виде частиц с такой структурой придается хорошо контролируемое растворение лекарственного средства.
Кроме того, на стадиях формирования первого слоя покрытия и второго слоя покрытия, нет необходимости в использовании сложного способа одновременного распыления двух типов распыляемых растворов из различных сопел, и композиция в виде частиц с рассмотренной выше конфигурацией может быть получена просто с помощью способа сушки распылением.
Средний диаметр частиц композиции в виде частиц, покрытого вторым слоем покрытия, не является как-либо ограниченным постольку, поскольку он находится в пределах, в которых чувство шероховатости во рту может быть уменьшено, и он предпочтительно составляет от 0,1 до 200 мкм, более предпочтительно, от 0,5 до 100 мкм, еще более предпочтительно, от 1,0 до 50 мкм, а наиболее предпочтительно, от 1,0 до 40 мкм.
Если средний диаметр частиц композиции в виде частиц меньше чем 0,1 мкм, площадь поверхности композиции в виде частиц становится слишком большой и контроль растворения иногда становится сложным. С другой стороны, если средний диаметр частиц композиции в виде частиц превышает 200 мкм, композиция может, вероятно, давать чувство шероховатости или ощущение постороннего предмета во рту. Здесь, средний диаметр частиц композиции в виде частиц представляет собой значение, измеренное таким же способом, как и для среднего диаметра частиц композиции в виде частиц по настоящему изобретению, описанного выше.
Композиция в виде частиц по настоящему изобретению может вводиться в организм, как есть, в форме мелкодисперсных гранул, а также может вводиться после формирования в виде различных видов композиций и может, таким образом, использоваться как исходное вещество для получения таких композиций.
Примеры композиций включают композиции для инъекций, композиции для перорального введения (например, порошкообразные лекарственные средства, гранулы, капсулы, таблетки, таблетки, разрыхляющиеся во рту, сухие сиропы, суспензии/эмульсии и агенты в виде пленок), лекарственные средства для трансназального введения, суппозитории (например, ректальные суппозитории и вагинальные суппозитории) и тому подобное.
Количество частиц лекарственного средства в этих композициях может изменяться в соответствии с типом лекарственного средства, формой введения, целевым заболеванием и тому подобное, и, как правило, оно предпочтительно оставляет от 0,001 мг до 5 г, а более предпочтительно, примерно от 0,01 мг до 2 г на одну композицию.
Композиция может быть получена с помощью, повсеместно используемого и широко известного способа.
В частности, композиция в виде частиц по настоящему изобретению может формироваться в виде композиции для инъекций посредством формирования композиции в виде частиц в форме водной суспензии с использованием дисперсанта (например, Tween 80 от Atlas Powder, USA), HCO 60 (от Nikko Chemicals Co., Ltd.), карбоксиметилцеллюлозы, альгината натрия и тому подобного), консерванта (например, метилпарабена, пропилпарабена, бензилового спирта, хлорбутанола и тому подобного), агента для поддержания тоничности (например, хлорида натрия, глицерина, сорбитола, глюкозы, и так далее) и тому подобное, или посредством диспергирования композиции в виде частиц в растительном масле, таком как оливковое масло, кунжутное масло, арахисовое масло, хлопковое масло или кукурузное масло, или в пропиленгликоле, с формированием его в виде масляной суспензии.
Композиции для перорального введения могут быть получены в соответствии с широко известным способом, с использованием композиции в виде частиц по настоящему изобретению и широко используемого агента для приготовления.
Примеры агента для приготовления включают широко используемые компоненты композиций для перорального введения, такие как водорастворимые полимеры или связующие вещества (например, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, метилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, кристаллическая целлюлоза/натрий карбоксиметилцеллюлоза, поливинилпирролидон, поливиниловый спирт, порошок аравийской камеди, желатин, пуллулан и тому подобное), наполнители (кристаллическая целлюлоза, крахмал, такой как кукурузный крахмал, сахариды, такие как сахароза, лактоза, порошкообразный сахар, гранулированный сахар, глюкоза и маннитол, легкий кремниевый ангидрид, тальк, карбонат магния, карбонат кальция и тому подобное), разрыхлители (например, крахмалы, такие как кукурузный крахмал, кальций кармелоза, кроссповидон, гидроксипропилцеллюлоза с низкой степенью замещения и тому подобное), липиды (например, углеводороды, воски, высокомолекулярные жирные кислоты и их соли, высшие спирты, сложные эфиры жирных кислот, гидрированные масла, такие как гидрированное касторовое масло), пластификаторы (триацетин, триэтилцитрат, дибутилсебацат и тому подобное), корригенты (например, подсластители (сахара, такие как сахароза, лактоза, глюкоза и мальтоза, сахарные спирты, такие как маннитол, ксилитол, сорбитол и эритритол, искусственные подсластители, такие как сахарин, сахарин натрия, аспартам и стевия); подкислители, такие как лимонная кислота, винная кислота, и яблочная кислота; ароматизирующие вещества, такие как лимон, лимон-лайм, апельсин и ментол), смазывающие вещества (например, стеарат магния, стеарат кальция, стеариновая кислота, тальк и тому подобное), флюидизирующие агенты (например, легкий кремниевый ангидрид), красители (например, пищевые красители, жжёный сахар, красный оксид железа, оксид титана и тому подобное), поверхностно-активные вещества (например, анионные поверхностно-активные вещества, такие как натрий алкилсульфат, неионные поверхностно-активные вещества, такие как сложные сорбитановые эфиры полиоксиэтилена и жирных кислот, сложные эфиры полиоксиэтилена и жирных кислот и полиоксиэтиленовые производные касторового масла и тому подобное), смачивающие агенты (полиэтиленгликоль (макроголь) и тому подобное) наполнители, агенты для придания объема, адсорбенты, консерванты, такие как антисептики или стабилизаторы, антистатические агенты, агенты для разрыхления - увеличения объема и тому подобное.
Кроме того, композиции для перорального введения могут покрываться, по потребности, с помощью широко известного способа для маскировки вкуса, растворимости, кишечнорастворимой растворимости или пролонгирования высвобождения.
Кроме того, в случае получения, например, лекарственного средства для трансназального введения, композиция в виде частиц по настоящему изобретению может формироваться в виде твердого, полутвердого или жидкого лекарственного средства для трансназального введения с помощью широко известного способа. Например, в качестве твердого лекарственного средства, композиция в виде частиц по настоящему изобретению может использоваться, как есть, или к нему добавляется или подмешивается наполнитель (например, глюкоза, маннитол, крахмал, микрокристаллическая целлюлоза и тому подобное), загуститель (например, природные смолы, производные целлюлозы, полимеры акриловой кислоты и тому подобное) и тому подобное, для получения композиции порошка.
В случае жидкой композиции, почти такой же, как случае композиции для инъекций, композицию в виде частиц получают в виде масляной или водной суспензии. В случае полутвердого типа, предпочтительной является мазь. Эти композиции могут содержать агент для регулировки pH (например, угольную кислоту, фосфорную кислоту, лимонную кислоту, хлористоводородную кислоту, гидроксид натрия и тому подобное), антисептик (например, сложные эфиры п-оксибензойной кислоты, хлорбутанол, бензалконий хлорид, и так далее) и тому подобное.
Кроме того, в случае получения, например, суппозитория, композиция в виде частиц по настоящему изобретению может формироваться в виде твердого, полутвердого или жидкого суппозитория на основе масла или воды посредством добавления масляной основы или водной основы в соответствии с широко известным способом.
Масляная основа может представлять собой основу, которая не растворяет композицию в виде частиц, и их примеры включают глицериды высокомолекулярных жирных кислот (например, масло какао, витепсол и тому подобное), средние жирные кислоты (например, миглитолы и тому подобное), растительные масла (например, кунжутное масло, соевое масло, хлопковое масло, и так далее) и тому подобное. Примеры водной основы включают полиэтиленгликоль, пропиленгликоль и тому подобное. В случае получения суппозитория, в качестве основы для водного геля, могут использоваться природные смолы, производные целлюлозы, виниловые полимеры, полимеры акриловой кислоты и тому подобное.
Композиция для перорального введения может быть получена с помощью широко используемого способа в соответствии с формой дозировки, например, посредством гранулирования или замешивания композиции в виде частиц по настоящему изобретению, по потребности, и приготовления полученного материала.
Гранулирование композиции в виде частиц по настоящему изобретению может осуществляться с помощью широко используемого способа гранулирования, например, с помощью способа роторного гранулирования или способа гранулирования в псевдоожиженном слое, и гранулирование и замешивание, как правило, осуществляются с использованием носителя, такого как наполнитель или связующее вещество. В случае, например, таблетки, композиция в виде частиц по настоящему изобретению может смешиваться или замешиваться вместе с носителем, таким как наполнитель или связующее вещество, и гранулироваться по необходимости, смешиваться с добавкой, такой как смазывающее вещество, и компактироваться в виде таблетки. В случае, например, капсулы, композиция в виде частиц по настоящему изобретению или ее гранула может инкапсулироваться с получением капсулы.
Преимущественные воздействия изобретения
Поскольку композиция в виде частиц по настоящему изобретению имеет слой покрытия, наносимого на частицы лекарственного средства, который содержит водонерастворимый полимер, неорганические частицы и/или липидный компонент при заданном массовом отношении, частицы лекарственного средства могут эффективно покрываться первым слоем покрытия и растворение лекарственного средства может эффективно подавляться даже в случае, когда диаметр частиц лекарственного средства является малым.
В предпочтительном варианте осуществления, в котором водонерастворимый полимер включает кишечнорастворимый полимер, поскольку первый слой покрытия содержит конкретный липидный компонент, лекарственное средство может более эффективно растворяться именно в кишечнике.
Описание вариантов осуществления
Далее, настоящее изобретение будет конкретно описываться со ссылками на примеры; однако настоящее изобретение не должно ограничиваться этими примерами.
Следующие далее лекарственные средства и компоненты композиций используются в следующих далее примерах и сравнительных примерах.
(Лекарственные средства)
Гваяколсульфонат калия
Тамсулозин гидрохлорид
(Компоненты композиции)
Этилцеллюлоза (Ethocel 10 от Dow Chemical)
HPMCP; фталат гидроксипропилметилцеллюлозы (HP 55 от Shin-Etsu Chemical Co., Ltd.)
Eudragit S100 (Eudragit-S100 от Evonik Industries)
Миристиновая кислота (реагент специального качества от Wako Pure Chemical Industries Ltd.)
Пальмитиновая кислота (реагент специального качества от Wako Pure Chemical Industries Ltd.)
Стеариновая кислота (реагент специального качества от Wako Pure Chemical Industries Ltd.)
Арахиновая кислота (реагент специального качества от Wako Pure Chemical Industries Ltd.)
Бегеновая кислота (реагент специального качества от Wako Pure Chemical Industries Ltd.)
Гидрофобный легкий кремниевый ангидрид (Aerosil-R972 от Nippon Aerosil Co., Ltd.)
Оксид титана (Aeroxide-P-25 и Aeroxide-T805 от Nippon Aerosil Co., Ltd.)
Глицерилмоноизостеарат (NIKKOL-MGIS от Nikko Chemicals Co., Ltd.)
Композиции в виде частиц получают и оценивают в следующих примерах и сравнительных примерах в соответствии со следующими способами.
(Получение композиции в виде частиц, содержащей гваяколсульфонат калия)
Раствор получают посредством добавления и растворения 100 г гваяколсульфоната калия в 900 г воды. Раствор подвергают сушке распылением с помощью устройства для сушки распылением (Mini Spray Dryer B-290 от BUCHI Labortechnik AG) при количестве поступающего в единицу времени распыляемого раствора 2 мл/мин, при температуре поступающего воздуха 120°C и при скорости потока распыляемого воздуха 190 л/час с получением сферических частиц гваяколсульфоната калия в качестве частиц лекарственного средства.
(Получение частиц тамсулозина гидрохлорида)
Тамсулозин гидрохлорид физически измельчают с помощью струйной мельницы (Spiral Jet Mill 50 AS от Hosokawa Micron Corporation) с получением частиц тамсулозина гидрохлорида в качестве частиц лекарственного средства.
(Нанесение покрытия)
Компоненты композиции и частицы лекарственного средства добавляют к растворителям и суспендируют. Полученные суспензии подвергают сушке распылением с помощью устройства для сушки распылением (Mini Spray Dryer B-290 от BUCHI Labortechnik AG) с получением композиции в виде частиц. Композиции компонентов композиции, используемые в соответствующих примерах, и сравнительных примерах показаны в таблицах.
(Измерение среднего диаметра частиц)
<Средний диаметр частиц композиции в виде частиц>
Средний диаметр частиц измеряют с использованием 20000 или более частиц с помощью автоматизированного анализатора изображений частиц (Morphologi (зарегистрированное торговое наименование) - G3 от Malvern Instruments).
<Средний диаметр частиц для неорганических частиц>
Сначала, перед получением композиций в виде частиц, предварительно измеряется средний диаметр частиц для неорганических частиц.
То есть этанольная суспензия неорганических частиц приготавливается и подвергается ультразвуковой обработке, и после этого измеряют средний диаметр частиц с помощью системы измерения диаметра частиц ELSZ-1 (от Otsuka Electronics, Co., Ltd., с помощью метода динамического и электрофоретического рассеяния света). Средние диаметры частиц для неорганических частиц, используемых в примерах, показаны ниже.
Aerosil-A200 (средний диаметр частиц 400,5 нм) в качестве неорганических частиц, не подвергающихся воздействию гидрофобизации; Aerosil-R972 (средний диаметр частиц 218,0 нм) в качестве неорганических частиц, подвергающихся воздействию гидрофобизации; Aeroxide-P25 (средний диаметр частиц 128,2 нм) в качестве неорганических частиц, не подвергающихся воздействию гидрофобизации; и Aeroxide-T805 (средний диаметр частиц 111,4 нм) в качестве неорганических частиц, подвергающихся воздействию гидрофобизации.
(Исследование растворения)
В соответствии со способом, в котором используется проточная ячейка, описанным в Японской Фармакопее, осуществляют исследование с использованием среды растворения, которая представляет собой одну среду из 1-ой текучей среды для исследования растворения (pH 1,2), 2-ой текучей среды для исследования растворения (pH 6,8) и буферного раствора динатрий гидрофосфат-лимонная кислота при pH 7,2 (получают посредством растворения 7,1 г дегидратированного динатрия гидрофосфата в воде и доведения общего объема до 1000 мл, и доведения pH до 7,2 посредством добавления к полученному раствору, раствора, полученного посредством растворения 5,3 г моногидрата лимонной кислоты в воде и доведения общего объема до 1000 мл).
Держатель для фильтров Swinnex 25 мм (от Nippon Millipore) используют в качестве ячейки. Для предотвращения вытекания композиции в виде частиц, последовательно устанавливают опорную сетку (25 мм, нержавеющая сталь, от Nippon Millipore), мембранные фильтры Durapore (PVDF, гидрофильные, 0,45 мкм, 25 мм, от Nippon Millipore) и силиконовую манжету, 25 мм (держатель для фильтра Swinnex от Nippon Millipore). Masterflex L/S (Model 7524-50 от Cole Parmer Instrument COMPANY) используют в качестве насоса, и переносят среду растворения при скорости подачи 2,5 мл/мин. В остальном, исследование осуществляют в соответствии с методом проточной ячейки, описанной в Японской Фармакопее. Образцы элюата отбирают через 10, 30, 60 минут после начала исследования, и количество растворенного лекарственного средства в элюате измеряют с помощью высокоэффективной жидкостной хроматографии (HPLC), и вычисляют долю растворения к начальному содержанию лекарственного средства.
(Примеры 1-5)
Этилцеллюлозу в качестве полимера для пролонгированного высвобождения используют в качестве водонерастворимого полимера, частицы лекарственного средства гваяколсульфоната калия используют в качестве частиц лекарственного средства, и типы неорганических частиц изменяют для получения композиции в виде частиц с помощью рассмотренного выше способа. Композиция и результаты различных исследований показаны в Таблице 1.
(Сравнительный пример 1)
Композицию в виде частиц готовят таким же способом, как в Примере 1, за исключением того, что неорганические частицы не добавляют. Композиция и результаты различных исследований показаны в Таблице 1.
Как показано в Таблице 1, было обнаружено, что композиции в виде частиц из примеров, содержащих полимер для пролонгирования высвобождения в качестве водонерастворимого полимера и неорганические частицы при заданном массовом отношении, могли бы эффективно контролировать (подавлять) растворение лекарственного средства, и они показывают характеристики в качестве композиции с пролонгированным высвобождением.
С другой стороны, композиция в виде частиц Сравнительного примера 1, не содержащая неорганических частиц, не может эффективно контролировать (подавлять) растворение лекарственного средства.
(Примеры 6 и 7)
HPMCP в качестве кишечнорастворимого полимера для водонерастворимого полимера, неорганические частицы (Aerosil-R972) и частицы лекарственного средства гваяколсульфоната калия в качестве частиц лекарственного средства используют для приготовления композиции в виде частиц. Композиция и результаты различных исследований, измеренные таким же способом, как в Примере 1, показаны в Таблице 2.
(Сравнительный пример 2)
Композицию в виде частиц готовят таким же способом, как в Примере 6, за исключением того, что неорганических частиц не добавляют. Композиция и результаты различных исследований показаны в Таблице 2.
Как показано в Таблице 2, было обнаружено, что композиции в виде частиц из примеров, содержащих кишечнорастворимый полимер в качестве водонерастворимого полимера и неорганические частицы при заданном массовом отношении, могли бы эффективно контролировать (подавлять) растворение лекарственного средства при условиях pH 1,2 и могли бы ускорять растворение лекарственного средства при условиях pH 6,8, и таким образом, они показывают характеристики в качестве кишечнорастворимого лекарственного средства.
С другой стороны, композиция в виде частиц Сравнительного примера 2, не содержащая неорганических частиц, не может эффективно контролировать (подавлять) растворение лекарственного средства.
(Примеры 8-17)
Этилцеллюлозу в качестве полимера для пролонгирования высвобождения и Eudragit S100 в качестве кишечнорастворимого полимера используют в качестве водонерастворимых полимеров, частицы лекарственного средства гваяколсульфоната калия используют в качестве частиц лекарственного средства и типы неорганических частиц изменяют для получения композиций в виде частиц. Композиция и результаты различных исследований, измеренные таким же способом, как в Примере 1, показаны в Таблице 3.
(Сравнительный пример 3)
Композицию в виде частиц готовят таким же способом, как в Примере 8, за исключением того, что неорганических частиц не добавляют. Композиция и результаты различных исследований показаны в Таблице 3.
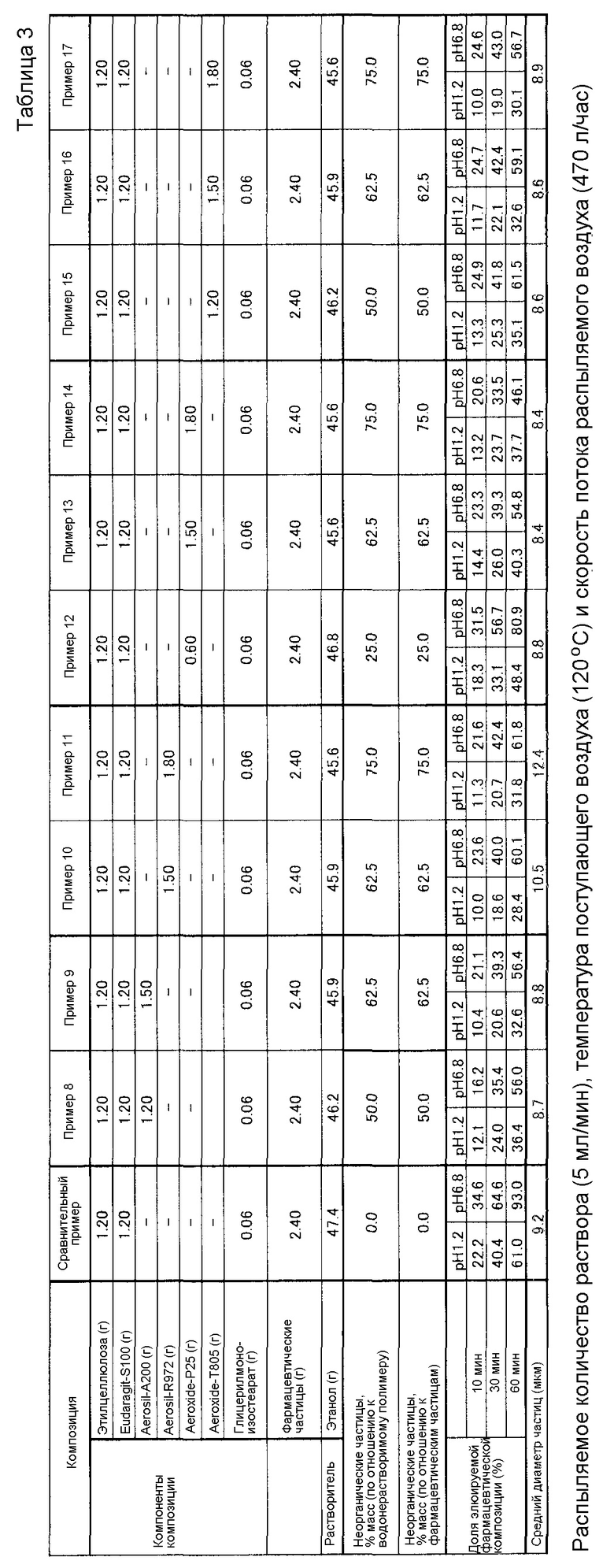
Как показано в Таблице 3, было обнаружено, что композициям в виде частиц из Примеров 10, 11 и 15-17, содержащим водонерастворимый полимер и неорганические частицы, подвергаемые воздействию гидрофобизации, в сочетании, придается усиленное воздействие, в частности, на кишечнорастворимое воздействие, по сравнению с композициями в виде частиц из Примеров 8, 9 и 12-14, содержащими водонерастворимый полимер и неорганические частицы, не подвергаемые воздействию гидрофобизации, в сочетании.
С другой стороны, композиция в виде частиц Сравнительного примера 3, не содержащая неорганических частиц, не может эффективно контролировать (подавлять) растворения лекарственного средства.
В дополнение к этому, пытаются приготовить композицию в виде частиц, имеющую первый слой покрытия и второй слой покрытия, посредством использования композиции в виде частиц из Примера 7 в качестве частиц лекарственного средства и второго раствора покрытия, полученного при таких же условиях, как в Примере 10, за исключением того, что растворитель заменяют на ацетон; однако, поскольку HPMCP в первом слое покрытия растворяется в ацетоне и становится очень вязким, второй раствор покрытия не мог бы распыляться.
(Пример 18)
При композиции, показанной в Таблице 4, фталат гидроксипропилметилцеллюлозы (HPMCP), гидрофобный легкий кремниевый ангидрид (Aerosil-R972), глицерилмоноизостеарат, стеариновую кислоту и частицы лекарственного средства гваяколсульфоната калия суспендируют в ацетоне. Приготовленную суспензию подвергают сушке распылением с помощью устройства для сушки распылением (Mini Spray Dryer B-290 от BUCHI Labortechnik AG) при количестве поступающего в единицу времени распыляемого раствора 5 мл/мин, при температуре поступающего воздуха 120°C и при скорости потока распыляемого воздуха 470 л/час, с получением композиции в виде частиц. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 7,2. Результаты исследования коллективно показаны в Таблице 1.
(Сравнительный пример 4)
Композицию в виде частиц готовят таким же способом, как в Пример 1, за исключением того, что стеариновую кислоту не добавляют. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 7,2. Композиция и результаты исследования коллективно показаны в Таблице 4.
Как показано в Таблице 4, было обнаружено, что композиция в виде частиц из Примера 18, содержащая HPMCP (кишечнорастворимый полимер) в качестве водонерастворимого полимера и липидные компоненты при заданном массовом отношении, имеет средний диаметр частиц равный 9,5 мкм и могла бы эффективно контролировать (подавлять) растворение лекарственного средства при условиях pH 1,2, и могла бы ускорять растворение лекарственного средства при условиях pH 7,2, и таким образом, она показывает высокое отношение долей растворения между pH 7,2 и pH 1,2 и характеристики в качестве кишечнорастворимого лекарственного средства.
С другой стороны, композиция в виде частиц Сравнительного примера 4, не содержащая липидного компонента, не может эффективно ускорять растворение лекарственного средства при условиях pH 7,2 по сравнению с композицией в виде частиц из Примера 18.
(Пример 19)
При композиции, показанной в Таблице 5, этилцеллюлозу, Eudragit S100, пальмитиновую кислоту, гидрофобный легкий кремниевый ангидрид (Aerosil-R972), глицерилмоноизостеарат и частицы лекарственного средства гваяколсульфоната калия суспендируют в этаноле. Приготовленную суспензию подвергают сушке распылением с помощью устройства для сушки распылением (Mini Spray Dryer B-290 от BUCHI Labortechnik AG) при количестве поступающего в единицу времени распыляемого раствора 5 мл/мин, при температуре поступающего воздуха 120°C и при скорости потока распыляемого воздуха 470 л/час, с получением композиции в виде частиц. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 7,2. Результаты исследования коллективно показаны в Таблице 5.
(Пример 20)
Композицию в виде частиц готовят таким же способом, как в Примере 19, за исключением того, что пальмитиновую кислоту заменяют стеариновой кислотой. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 7,2. Композиция и результаты исследования коллективно показаны в Таблице 5.
(Пример 21)
Композицию в виде частиц, имеющую первый слой покрытия и второй слой покрытия, готовят таким же способом, как в Примере 20, за исключением того, что композицию в виде частиц, полученную в Примере 18, используют вместо частиц лекарственного средства гваяколсульфоната калия. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 7,2. Композиция и результаты исследования коллективно показаны в Таблице 5.
(Пример 22)
Композицию в виде частиц готовят таким же способом, как в Пример 20, за исключением того, что смешиваемое количество стеариновой кислоты изменяют от 0,30 г до 0,60 г. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 7,2. Композиция и результаты исследования коллективно показаны в Таблице 5.
(Пример 23)
Композицию в виде частиц готовят таким же способом, как в Примере 19, за исключением того, что пальмитиновую кислоту заменяют арахиновой кислотой. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 7,2. Композиция и результаты исследования коллективно показаны в Таблице 5.
(Пример 24)
Композицию в виде частиц готовят таким же способом, как в Примере 19, за исключением того, что пальмитиновую кислоту заменяют бегеновой кислотой. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 7,2. Композиция и результаты исследования коллективно показаны в Таблице 5.
(Сравнительный пример 5)
Композицию в виде частиц готовят таким же способом, как в Пример 20, за исключением того, что смешиваемое количество стеариновой кислоты изменяют от 0,30 г до 0,90 г. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 7,2. Композиция и результаты исследования показаны в Таблице 5.
(Сравнительный пример 6)
Композицию в виде частиц готовят таким же способом, как в Примере 19, за исключением того, что пальмитиновую кислоту заменяют миристиновой кислотой. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 7,2. Композиция и результаты исследования коллективно показаны в Таблице 5.
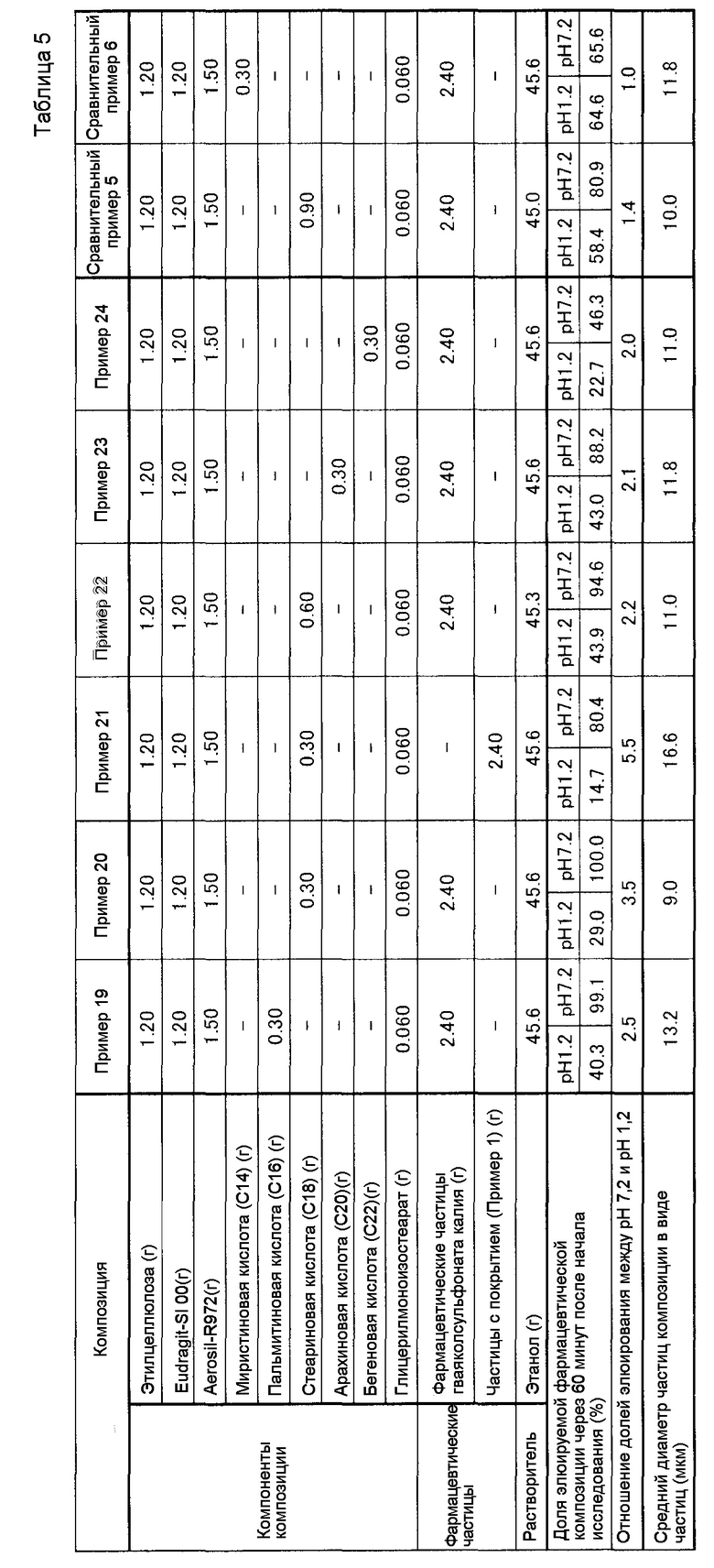
Как показано в Таблице 5, было обнаружено, что композиции в виде частиц Примеров 19-24, содержащие Eudragit S100 (кишечнорастворимый полимер) и этилцеллюлозу (полимер для пролонгирования высвобождения) в качестве водонерастворимых полимеров и C15 или более высокомолекулярную жирную кислоту в качестве липидного компонента, при заданном массовом отношении, имеют средний диаметр частиц от 9,0 до 16,6 мкм и могли бы эффективно контролировать (подавлять) растворение лекарственного средства при условиях pH 1,2, и могли бы ускорять растворение лекарственного средства при условиях pH 7,2, и таким образом, они показывают высокое отношение долей растворения между pH 7,2 и pH 1,2 и характеристику в качестве кишечнорастворимого лекарственного средства. В дополнение к этому, композиция в виде частиц из Примера 24, использующая бегеновую кислоту C22 в качестве липидного компонента, чуть хуже по доле растворения лекарственного средства при условиях pH 7,2, по сравнению с другими примерами. На основе сравнения Примера 20 и Примера 21, обнаружено увеличение среднего диаметра частиц и уменьшение (подавление) доли растворения при формировании первого слоя покрытия и второго слоя покрытия, по сравнению с этими параметрами в случае однослойного покрытия (Пример 20), и получается композиция в виде частиц с эффективно подавляемым растворением.
С другой стороны, композиция в виде частиц Сравнительного примера 5, содержащая 0,90 массовых долей стеариновой кислоты в качестве липидного компонента, и композиция в виде частиц Сравнительного примера 6, содержащая миристиновую кислоту (C14) в качестве липидного компонента, не могут контролировать (подавлять) растворение лекарственного средства при условиях рН 1,2, и отношение долей растворения между pH 7,2 и pH 1,2 сужается.
(Пример 25)
Для композиции, показанной в Таблице 6, этилцеллюлозу, Eudragit S100, глицерилмоноизостеарат, стеариновую кислоту и частицы лекарственного средства тамсулозина гидрохлорида суспендируют в этаноле.
Полученную суспензию подвергают сушке распылением с помощью устройства для сушки распылением (Mini Spray Dryer B-290 от BUCHI Labortechnik AG) при количестве поступающего в единицу времени распыляемого раствора 5 мл/мин, при температуре поступающего воздуха 120°C и при скорости потока поступающего воздуха 470 л/час, с получением композиции в виде частиц. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 6,8. Результаты исследования коллективно показаны в Таблице 6.
(Пример 26)
Композицию в виде частиц готовят таким же способом, как в Пример 25, за исключением того, что дополнительно добавляют гидрофобный легкий кремниевый ангидрид (Aerosil-R972). Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 6,8. Композиция и результаты исследования коллективно показаны в Таблице 6.
(Сравнительный пример 7)
Композицию в виде частиц готовят таким же способом, как в Примере 25, за исключением того, что стеариновую кислоту не добавляют. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 6,8. Композиция и результаты исследования коллективно показаны в Таблице 6.
(Сравнительный пример 8)
Композицию в виде частиц готовят таким же способом, как в Примере 26, за исключением того, что стеариновую кислоту не добавляют. Композицию в виде частиц подвергают воздействию исследования растворения в среде растворения при pH 1,2 и pH 6,8. Композиция и результаты исследования коллективно показаны в Таблице 6.
(Сравнительный пример 9)
Частицы лекарственного средства тамсулозина гидрохлорида, физически измельченные с помощью струйной мельницы подвергают воздействию исследования растворения с помощью среды растворения при pH 1,2 и pH 6,8. Результаты исследования коллективно показаны в Таблице 6.
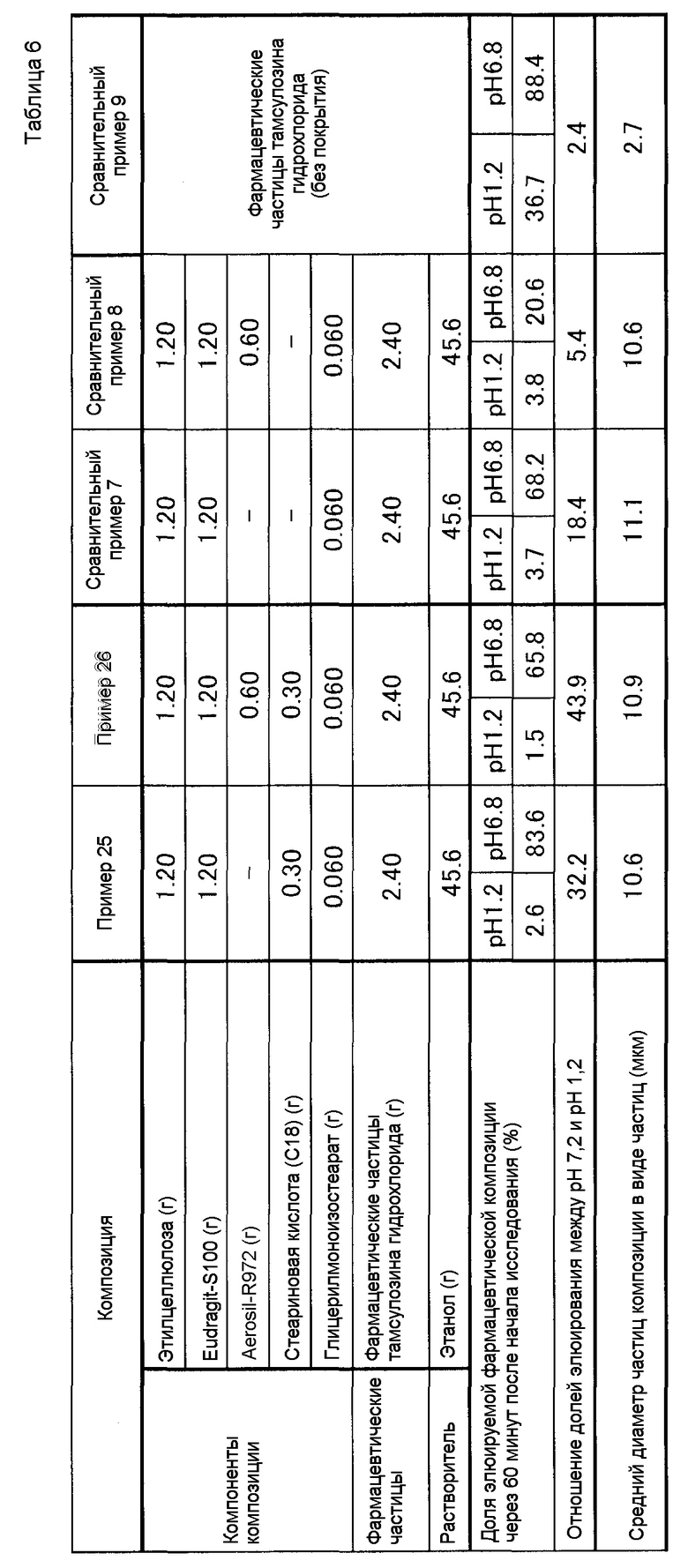
Как показано в Таблице 6, частицы лекарственного средства Сравнительного примера 9, физически измельченные с помощью струйной мельницы, показывают высокую долю растворения лекарственного средства при условиях pH 1,2 и pH 6,8.
Было обнаружено, что композиция в виде частиц из Примера 25, содержащая Eudragit S100 (кишечнорастворимый полимер) и этилцеллюлозу (полимер для пролонгирования высвобождения) в качестве водонерастворимых полимеров и C18 стеариновую кислоту в качестве липидного компонента, при заданном массовом отношении, имеет средний диаметр частиц 10,6 мкм и могла бы эффективно контролировать (подавлять) растворение лекарственного средства при условиях рН 1,2, и могла бы ускорять растворение лекарственного средства при условиях рН 6,8, и таким образом, она показывает высокое отношение долей растворения между pH 6,8 и pH 1,2 и характеристики в качестве кишечнорастворимого лекарственного средства. С другой стороны, композиция в виде частиц Сравнительного примера 7, не содержащая липидного компонента, не может эффективно ускорять растворение лекарственного средства при условиях рН 6,8, по сравнению с композицией в виде частиц из Примера 25, и отношение долей растворения между pH 6,8 и pH 1,2 становится низким.
В случае тамсулозина гидрохлорида, который отличается от случая гваяколсульфоната калия, растворение лекарственного средства могло бы эффективно контролироваться (подавляться) при условиях рН 1,2, в то время как растворение лекарственного средства ускоряется при условиях рН 6,8 без использования гидрофобного легкого кремниевого ангидрида. Кроме того, растворение лекарственного средства могло бы эффективно контролироваться (подавляться) при условиях рН 1,2 с помощью однослойного покрытия без необходимости в формировании двухслойного покрытия, как в случае использования гваяколсульфоната калия.
Было обнаружено, что композиция в виде частиц из Примера 26, содержащая Eudragit S100 (кишечнорастворимый полимер) и этилцеллюлозу (полимер для пролонгирования высвобождения) в качестве водонерастворимых полимеров, C18 стеариновую кислоту в качестве липидного компонента и гидрофобный легкий кремниевый ангидрид, при заданном массовом отношении, имеет средний диаметр частиц 10,9 мкм и могла бы эффективно контролировать (подавлять) растворение лекарственного средства при условиях рН 1,2, и могла бы ускорять растворение лекарственного средства при условиях рН 6,8, и таким образом, она показывает высокое отношение долей растворения между pH 6,8 и pH 1,2 и характеристику в качестве кишечнорастворимого лекарственного средства. С другой стороны, композиция в виде частиц Сравнительного примера 8, не содержащая липидного компонента, не может эффективно ускорять растворение лекарственного средства при условиях рН 6,8, по сравнению с композицией в виде частиц из Примера 26, и отношение долей растворения между pH 6,8 и pH 1,2 становится низким.
Было обнаружено, что, по сравнению с композицией в виде частиц из Примера 26, содержащей 0,60 массовых долей гидрофобного легкого кремниевого ангидрида, композиция в виде частиц из Примера 25, не содержащая гидрофобного легкого кремниевого ангидрида, могла бы контролировать (подавлять) растворение лекарственного средства при условиях рН 6,8, в то время же эффективно контролируя (подавляя) растворение лекарственного средства при условиях рН 1,2. Как описано выше, добавление гидрофобного легкого кремниевого ангидрида делает возможным контроль растворения лекарственного средства при условиях рН 6,8, в то же время эффективно контролируя (подавляя) растворение лекарственного средства при условиях рН 1,2.
Растворение лекарственного средства могло бы свободно контролироваться при кислотных условиях и нейтральных условиях посредством изменения количество заходов нанесения покрытия, типа и добавляемого количества водонерастворимого полимера, добавляемого количества гидрофобного легкого кремниевого ангидрида и добавляемого количества липидного компонента в соответствии с физическими свойствами лекарственного средства, такого как растворимость.
Промышленное применение
В настоящем изобретении, на частицы лекарственного средства могут эффективно наноситься покрытия, и растворение лекарственного средства может эффективно подавляться в случае, когда диаметр частиц лекарственного средства является малым, посредством нанесения на частицы лекарственного средства первого слоя покрытия, содержащего водонерастворимый полимер, неорганические частицы и/или липидный компонент.
Соответственно, композиция в виде частиц по настоящему изобретению может вводиться, как есть в форме мелкодисперсных гранул в живой организм, а также она может вводиться после формирования в виде различных видов композиций.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕССОВАННЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 2016 |
|
RU2744270C2 |
| СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА, СОДЕРЖАЩИЕ СЛАБООСНОВНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА И ОРГАНИЧЕСКИЕ КИСЛОТЫ | 2007 |
|
RU2428176C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ АНТАГОНИСТОВ МЕТАБОТРОПНОГО ГЛУТАМАТНОГО РЕЦЕПТОРА 5 (MGLU5) | 2011 |
|
RU2602955C2 |
| Композиция гидрокортизона с контролируемым высвобождением | 2013 |
|
RU2619869C2 |
| ТВЕРДОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ | 2006 |
|
RU2467740C2 |
| ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА В ТОЛСТУЮ КИШКУ | 2007 |
|
RU2646825C2 |
| КОМПОЗИЦИЯ ПОКРЫТИЯ, ПОДХОДЯЩАЯ ДЛЯ ФАРМАЦЕВТИЧЕСКИХ ИЛИ НУТРИЦЕВТИЧЕСКИХ ДОЗИРОВАННЫХ ФОРМ | 2011 |
|
RU2606588C2 |
| СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ВКЛЮЧАЮЩИЕ В СЕБЯ ТВЕРДЫЕ РАСТВОРЫ СЛАБООСНОВНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2007 |
|
RU2434630C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ИЛИ НУТРИЦЕВТИЧЕСКИЙ СОСТАВ | 2010 |
|
RU2604861C2 |
| ТВЕРДЫЕ ТАБЛЕТКИ И КАПСУЛЫ МОДИФИЦИРОВАННОГО ВЫСВОБОЖДЕНИЯ БЕНЗОНАТАТА | 2014 |
|
RU2673239C2 |
Настоящее изобретение описывает фармацевтическую композицию в виде частиц, полученную способом сушки распылением, для замедленного растворения лекарственного средства. Композиция содержит частицы лекарственного средства, первый слой покрытия, нанесенный на частицы лекарственного средства, и второй слой покрытия, покрывающий первый слой покрытия. Указанный первый слой покрытия содержит водонерастворимый полимер и неорганические частицы или водонерастворимый полимер, неорганические частицы и липидный компонент. Водонерастворимый полимер первого слоя покрытия содержит кишечнорастворимый полимер целлюлозы. Указанный липидный компонент содержит C15 или более высокомолекулярную жирную кислоту. Средний диаметр неорганических частиц составляет от 1,0 до 500 нм. Неорганические частицы состоят из диоксида кремния и/или диоксида титана и неорганические частицы содержатся в количестве от 0,5 до 2,4 массовой доли на 2,4 массовой доли водонерастворимого полимера. Второй слой покрытия содержит водонерастворимый полимер, отличный от указанного кишечнорастворимого полимера целлюлозы. Композиция по изобретению обеспечивает замедленное растворение лекарственного средства. 8 з.п. ф-лы, 6 табл., 24 пр.
1. Фармацевтическая композиция в виде частиц, полученная способом сушки распылением, для замедленного растворения лекарственного средства, содержащая частицы лекарственного средства и первый слой покрытия, нанесенный на указанные частицы лекарственного средства, дополнительно содержащая второй слой покрытия, покрывающий первый слой покрытия, отличающаяся тем, что указанный первый слой покрытия содержит водонерастворимый полимер и неорганические частицы или содержит водонерастворимый полимер, неорганические частицы и липидный компонент, и указанный липидный компонент содержит C15 или более высокомолекулярную жирную кислоту, где средний диаметр неорганических частиц составляет от 1 до 500 нм и средний диаметр частиц композиции в виде частиц составляет от 1,0 до 40 мкм, в которой неорганические частицы состоят из диоксида кремния и/или диоксида титана и неорганические частицы содержатся в количестве от 0,5 до 2,4 массовой доли на 2,4 массовой доли водонерастворимого полимера, где указанный первый слой покрытия содержит кишечнорастворимый полимер целлюлозы, и второй слой покрытия содержит водонерастворимый полимер, отличный от указанного кишечнорастворимого полимера целлюлозы.
2. Композиция в виде частиц по п.1, в которой водонерастворимый полимер содержит кишечнорастворимый полимер.
3. Композиция в виде частиц по п.1, в которой неорганические частицы подвергаются воздействию гидрофобизации.
4. Композиция в виде частиц по п.1, в которой неорганические частицы содержатся в количестве от 0,5 до 2,4 массовой доли на 2,4 массовой доли частиц лекарственного средства.
5. Композиция в виде частиц по п.1, в которой липидный компонент содержит C15-C21 жирную кислоту.
6. Композиция в виде частиц по п.5, в которой C15-C21 жирная кислота представляет собой стеариновую кислоту.
7. Композиция в виде частиц по п.1, в которой липидный компонент содержится в количестве от 0,1 до 0,8 массовой доли на 2,4 массовой доли водонерастворимого полимера.
8. Композиция в виде частиц по п.1, в которой кишечнорастворимый полимер целлюлозы включает фталат гидроксипропилметилцеллюлозы (HPMCP) и/или ацетат сукцинат гидроксипропилметилцеллюлозы (HPMCAS).
9. Композиция в виде частиц по п.1, в которой водонерастворимый полимер, отличный от кишечнорастворимого полимера целлюлозы, содержит по меньшей мере один вид полимера, выбранный из группы, состоящей из этилцеллюлозы, сополимера метакриловой кислоты-метилакрилата, сополимера метилметакрилата-бутилметакрилата-диметиламиноэтилметакрилата, поливинилацеталя диэтиламиноацетата, сополимера этилакрилата-метилметакрилата-хлортриметиламмония этилметакрилата и сополимера этилакрилата-метилметакрилата.
| КОМПОЗИЦИЯ С РЕГУЛИРУЕМЫМ ВЫДЕЛЕНИЕМ ЛЕКАРСТВЕННОГО СРЕДСТВА | 1991 |
|
RU2067859C1 |
| Способ сушки пиломатериалов | 1984 |
|
SU1195160A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| СПОСОБ ПОЛУЧЕНИЯ УЛЬТРАДИСПЕРСНОГО АМОРФНОГО ИЛИ НАНОКРИСТАЛЛИЧЕСКОГО ДИОКСИДА КРЕМНИЯ | 2001 |
|
RU2191159C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОГНЕТУШАЩЕГО ПОРОШКА | 2003 |
|
RU2230586C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОКРЫТАЯ ЭНТЕРОСОЛЮБИЛЬНОЙ ОБОЛОЧКОЙ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1998 |
|
RU2197227C2 |
| US 4835183, 30.05.1989 | |||
| US 4835187, 30.05.1989. | |||
Авторы
Даты
2018-03-23—Публикация
2012-05-30—Подача