Область техники
Настоящее изобретение относится к гетероциклическому соединению бензимидазол-2-пиперазин, способам его получения и включающим данное соединение фармацевтическим композициям, а также к способам его применения в качестве лечебного препарата и ингибитора поли(АДФ-рибоза)-полимеразы (PARP).
Уровень техники
Химиотерапия и ионизирующая радиация - это два самых распространенных способа лечения рака. Оба способа лечения одинаковым образом вызывают одно- и/или двунитевый разрыв ДНК, который приводит к цитотоксическому эффекту и гибели опухолевой клетки-мишени из-за повреждения хромосом. Важнейшей реакцией на повреждение ДНК является активирование позиционных сигналов системы контроля клеточного цикла, цель которого заключается в защите клетки с поврежденной ДНК от деления, что предотвращает повреждение клеток в целом. В большинстве случаев опухолевая клетка одновременно с проявлением нарушения позиционных сигналов системы контроля клеточного цикла обладает очень высокой способностью к росту. Поэтому можно сделать вывод, что в опухолевой клетке существует особый механизм репарации ДНК, который может быстро реагировать и восстанавливать повреждения хромосом, относящихся к функции клеточного размножения. Именно это позволяет им справляться с цитотоксическим эффектом некоторых фармацевтических препаратов и поддерживать свое дальнейшее существование.
При клиническом применении эффективная концентрация химиотерапевтических препаратов или интенсивность излучения могут оказывать сопротивление этим механизмам репарации ДНК, обеспечивая поражающее воздействие на клетки-мишени. Однако опухолевые клетки благодаря усилению механизма репарации своих поврежденных ДНК могут вырабатывать устойчивость к лечению, что позволяет клетке выживать даже в условиях очень серьезного повреждения ДНК. Чтобы справиться с проявлением устойчивости к лечению, обычно требуется увеличить количество вводимого химиотерапевтического препарата или повысить интенсивность излучения, но это неизбежно окажет неблагоприятное воздействие на нормальные структуры рядом с очагом болезни. В таком случае процесс лечения сопровождают серьезные побочные эффекты, увеличивающие терапевтические риски, а непрерывно возрастающая устойчивость к лечению и вовсе снижает его эффективность. Отсюда можно сделать вывод, что, регулируя механизм сигнальной репарации повреждений ДНК, можно достаточно эффективно повышать цитотоксичность препаратов, используя специфический характер существования опухолевых клеток.
PARPs (Poly (ADP-ribose)polymerases), особенностью которых является активность поли(аденозиндифосфат)-рибозилирования, образуют суперсемейство из 18 ядерных и цитоплазматических ферментов. Поли(АДФ)-рибозилирование регулирует каталитическую активность белков-мишеней и белок-белковое взаимодействие, а также присутствует во многих основных биологических процессах, включая репарацию ДНК, гибель клеток, геномную стабильность и др.
Активность фермента PARP-1 занимает примерно 80% всей активности PARP в клетке. PARP-1 вместе с очень близким ему PARP-2 занимаются репарацией повреждений ДНК. Являясь по сути датчиком повреждений ДНК и сигнальным белком, PARP-1 может быстро проверять ДНК и напрямую прицепляться к ней на участках повреждений, после чего происходит агрегация всех необходимых для репарации белков с последующим восстановлением ДНК от повреждения. При недостатке PARP-1 в клетке репарация повреждений ДНК происходит с участием PARP-2. Исследования показывают, что в сравнении с обычными клетками активность белков PARP в солидных опухолях сильнее. Кроме того, что касается опухолей (например, рака молочной железы или рака яичников), где происходит репарация делецированных генов ДНК (например, BRCA-1 или BRCA-2), то тут наблюдается крайняя чувствительность к ингибиторам PARP-1. Это означает, что однократная инъекция ингибитора PARP может потенциально применяться в области лечения трижды негативного рака молочной железы. В то же время, поскольку механизм репарации повреждений ДНК - это важный для опухолевой клетки механизм, способствующий появлению устойчивости клетки к химиотерапевтических препаратам и лечению ионизирующим излучением, то именно PARP-1 является действующей целью исследований новых способов лечения рака.
Разработанный на раннем этапе исследований ингибитор PARP, как и его аналоги, представляет собой структурный аналог никотинамида NAD в роли субстрата PARP-катализации. Эти ингибиторы являются конкурентными ингибиторами NAD, которые соперничают с NAD в местах катализации PARP и приводят к блокированию синтеза поли-(АДФ-рибоза) цепочки. Поли-(АДФ-риболизация) не происходит, и PARP не в состоянии оторваться от места повреждения ДНК, это приводит к невозможности проникновения туда других участвующих в репарации белков и остановке самого процесса репарации. Поэтому под воздействием цитотоксических препаратов или облучении присутствие ингибиторов PARP в конечном итоге убивает опухолевую клетку с поврежденной ДНК.
Кроме того, будучи расходуемым субстратом катализации PARP, NAD является крайне необходимым в процессе синтеза АТФ в клетке. При высокой активности PARP уровень NAD в клетке заметно понижается, что непосредственно влияет на внутриклеточный уровень АТФ. Из-за недостаточного количества АТФ в клетке не происходит зависящий от присутствия АТФ процесс программируемой гибели клетки, начинается некроз, особый процесс отмирания клеточной ткани. В процессе некроза проявляется множество воспалительных факторов, оказывающих токсическое действие на другие органы и структуры. Поэтому ингибиторы PARP можно использовать при лечении большого количества заболеваний, связанных с данным механизмом действия, включая нейродегенеративные заболевания (болезнь Альцгеймера, синдром Хантингтона, болезнь Паркинсона), сахарный диабет, осложнения, вызванные ишемическим или ишемически-реперфузионным повреждением, например, инфаркт миокарда и острая почечная недостаточность, также заболевания системы кровообращения, например, септический шок, также воспалительные заболевания, например, хронический ревматизм.
Сущность изобретения
Одна из целей настоящего изобретения заключается в том, чтобы предложить новое гетероциклическое соединение бензимидазол-2-пиперазин и его дериват, а также их таутомеры, энантиомеры, диастереомеры, рацематы и фармацевтически приемлемые соли, а также метаболиты и метаболические предшественники или пролекарства.
Другая цель настоящего изобретения заключается в том, чтобы предложить фармацевтическую композицию с активным компонентом в виде описанного выше гетероциклического соединения бензимидазол-2-пиперазина.
Третья цель настоящего изобретения заключается в том, чтобы предложить метод получения описанного выше гетероциклического соединения бензимидазол-2-пиперазина.
Четвертая цель настоящего изобретения заключается в том, чтобы предложить применение описанного выше гетероциклического соединения бензимидазол-2-пиперазина в фармацевтических препаратах.
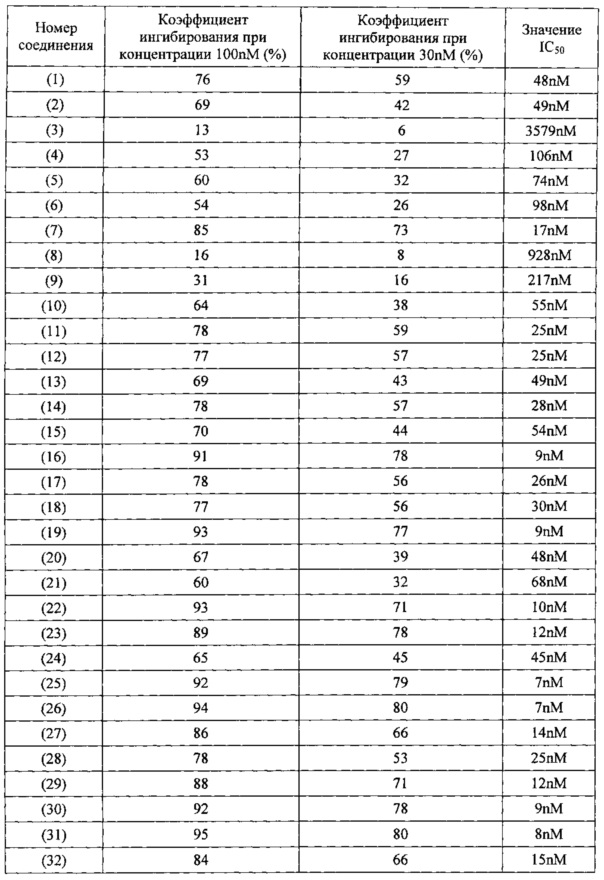
Гетероциклическое соединение бензимидазол-2-пиперазин, являясь первой составной частью настоящего изобретения, представляет собой соединение, описанное общей формулой (I):

где
R - водород или галоген;
один из X, Y, Z - азот, а два других - углеводороды, либо же X, Y, Z - углеводороды;
R1 - водород, C1-С6-алкил, метоксил, трифторметил, галоген, нитрил, циан, CONR2R3 и NR2R3;
R2 - водород, С1-С6-алкил;
R3 - водород, C1-С6-алкил, С3-С6-циклоалкил или NR2R3 вместе образуют цикл морфолина, пирролидина и пиперидина.
Настоящее изобретение также предлагает более оптимальную структуру соединения общей формулы (I), где
R - водород или фтор;
один из X, Y, Z - азот, а два других - углеводороды, либо же X, Y, Z - углеводороды;
R1 - водород, С1-С4-алкил, метоксил, трифторметил, фтор, нитрил, циан, CONR2R3 и NR2R3;
R2 - водород, С1-С4-алкил;
R3 - водород, С1-С4-алкил, С3-С6-циклоалкил или NR2R3 вместе образуют цикл морфолина, пирролидина.
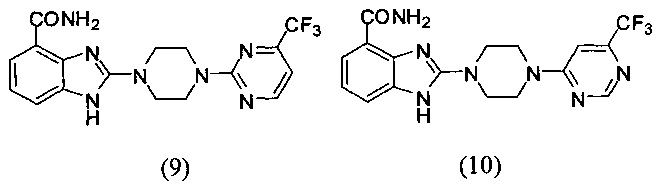
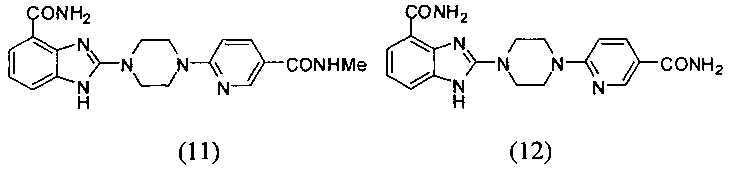
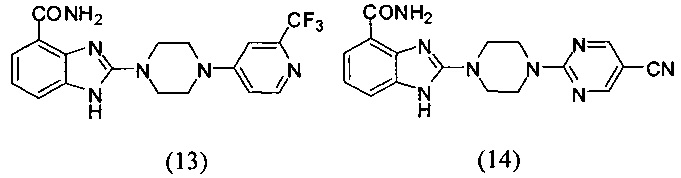
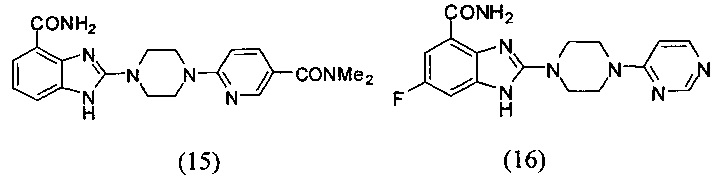
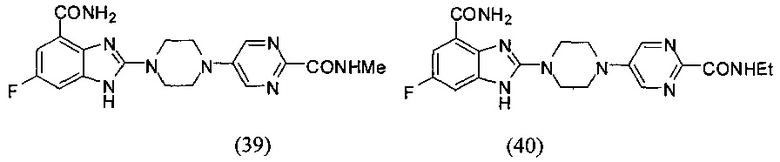
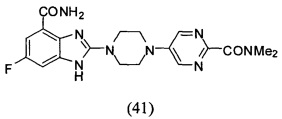
В наиболее оптимальном виде соединение, представленное общей формулой (I) настоящего изобретения, представляет собой соединение (1)-(37):
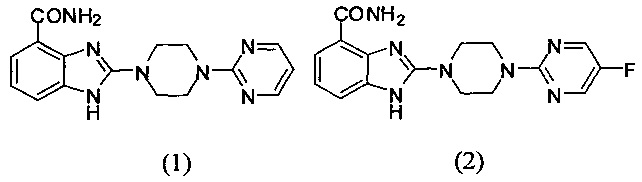
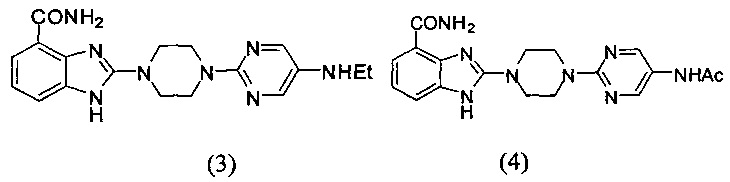
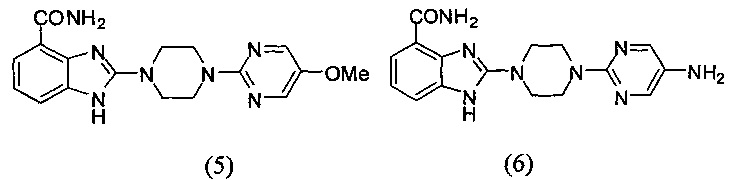
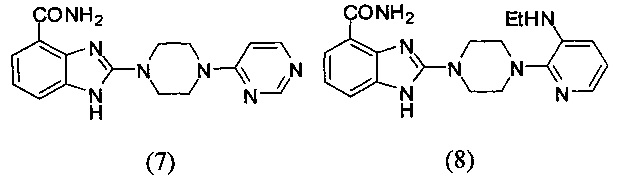


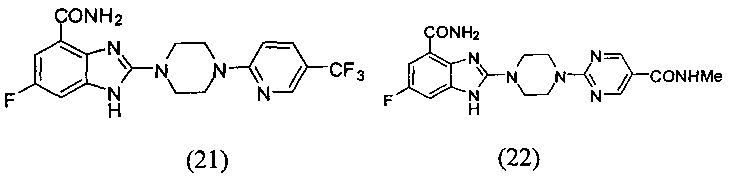
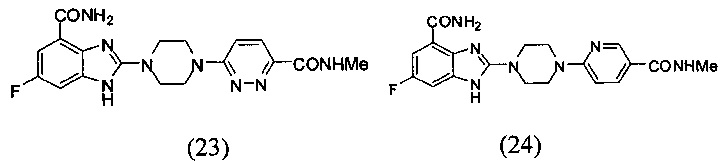
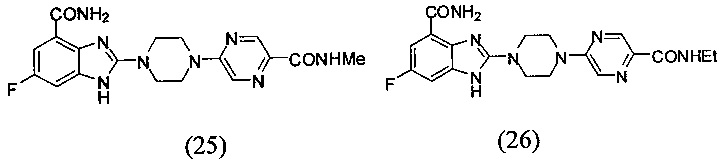
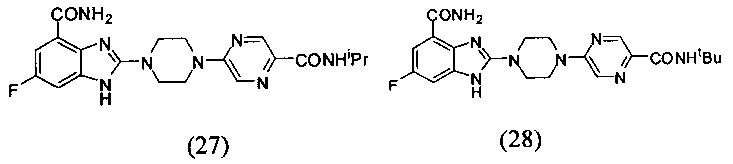
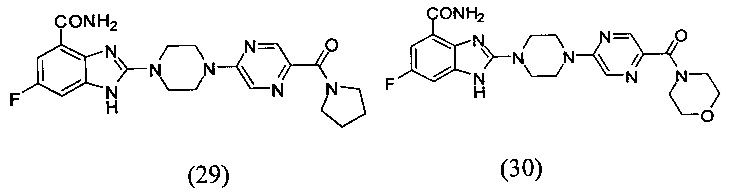
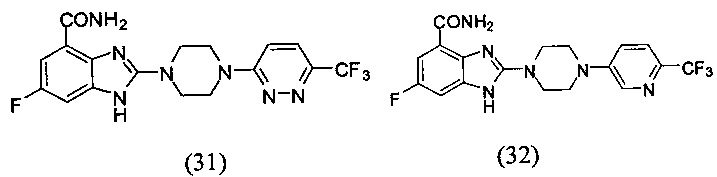
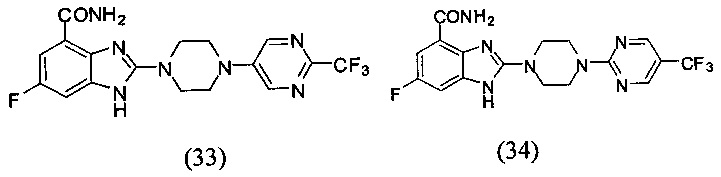
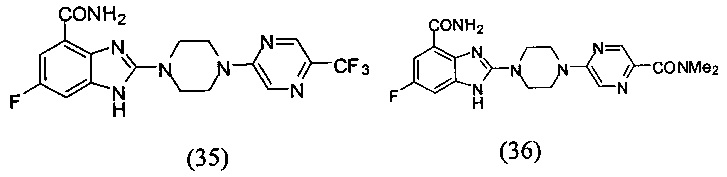

Соединение, описанное общей формулой (I), является смесью энантиомеров, или диастереомеров, или конформеров, или смесью любых двух или всех трех этих изомеров.
Соединение, описанное общей формулой (I), является фармацевтически приемлемым дериватом.
Соединение, описанное общей формулой (I) настоящего изобретения, может существовать в форме фармацевтически приемлемой соли.
Фармацевтически приемлемой солью, описанной в настоящем изобретении, являются гидрохлорид, сульфат, фосфат, ацетат, трифторацетат, мезилат, трифтормезилат, толуолсульфонат, тартат, малеат, фумарат, сукцинат или малат соединения, описанные общей формулой (I).
Оптимальным примером использования гетероциклического соединения бензимидазол-2-пиперазин, описанного общей формулой (I) настоящего изобретения, является соединение 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамид, а также его фармацевтически приемлемые соли.
Способ получения соединения общей формулы (I), являясь второй частью настоящего изобретения, имеет следующую схему реакций:
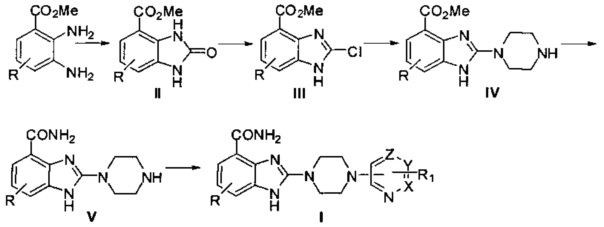
где значения R и R1 описаны выше, а сам процесс выглядит так:
этап 1: из циклической реакции 2,3-диаминометилбензоата с карбонилдиимидазолом получают 2-оксо-2,3-дигидро-1Н-бензимидазол-4-метилформиат (II);
этап 2: осуществляют хлорирование полученного на предыдущем этапе 2-оксо-2,3-дигидро-1Н-бензимидазол-4-метилформиата (II) хлорокисью фосфора, в результате чего получают 2-хлор-1Н-бензимидазол-4-метилформиат (III);
этап 3: в присутствии щелочи проводят нуклеофильное замещение полученного на предыдущем этапе 2-хлор-1Н-бензимидазол-4-метилформиата (III) путем реакции с пиперазином, в результате чего получают 2-(пиперазин-1-ил)-1Н-бензимидазол-4-метилформиат (IV);
этап 4: проводят реакцию аминолиза эфирной группы полученного на предыдущем этапе 2-(пиперазин-1-ил)-1Н-бензимидазол-4-метилформиата (IV) в аммиачно-метанольном растворе, в результате чего получают 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамид (V);
этап 5: проводят связывание при реакции полученного на предыдущем этапе 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида (V) с кислотой или восстановительное аминирование при реакции с альдегидом, в результате чего получают соединение, описанное общей формулой (I).
Фармацевтическая композиция, являясь третьей частью настоящего изобретения, включает в себя соединение общей формулы (I) в качестве активного компонента терапевтически эффективного количества и один или несколько фармацевтических веществ-носителей и/или разжижающий агент. Или данная фармацевтическая композиция включает в себя соединение общей формулы (I) в качестве активного компонента терапевтически эффективного количества и фармацевтически приемлемый носитель, эксципиент или разжижающий агент.
Фармацевтическая композиция, являясь третьей частью настоящего изобретения, включает в себя фармацевтически приемлемый дериват соединения общей формулы (I) в качестве активного компонента терапевтически эффективного количества и один или несколько фармацевтических веществ-носителей и/или разжижающий агент. Или данная фармацевтическая композиция включает в себя фармацевтически приемлемый дериват соединения общей формулы (I) в качестве активного компонента терапевтически эффективного количества и фармацевтически приемлемый носитель, эксципиент или разжижающий агент.
Фармацевтическая композиция, являясь третьей частью настоящего изобретения, включает в себя фармацевтически приемлемую соль соединения общей формулы (I) в качестве активного компонента терапевтически эффективного количества и один или несколько фармацевтических веществ-носителей и/или разжижающий агент. Или данная фармацевтическая композиция включает в себя фармацевтически приемлемую соль соединения общей формулы (I) в качестве активного компонента терапевтически эффективного количества и фармацевтически приемлемый носитель, эксципиент или разжижающий агент.
На основе описанной фармацевтической композиции производят таблетки, капсулы, водные суспензии, масляные суспензии, диспергируемые порошки, гранулы, леденцы, эмульсии, сиропы, кремы, мази, суппозитории и инъекции.
Соединение общей формулы (I) в составе описанной фармацевтической композиции существует в свободном виде.
Соединение общей формулы (I) применяется в приготовлении фармацевтических препаратов для лечения состояний, которые улучшаются при ингибировании активности PARP, это является четвертой частью настоящего изобретения.
Фармацевтически приемлемый дериват соединения общей формулы (I) применяется в приготовлении фармацевтических препаратов для лечения состояний, которые улучшаются при ингибировании активности PARP, это является четвертой частью настоящего изобретения.
Фармацевтически приемлемая соль соединения общей формулы (I) применяется в приготовлении фармацевтических препаратов для лечения состояний, которые улучшаются при ингибировании активности PARP, это является четвертой частью настоящего изобретения.
Описанная выше фармацевтическая композиция применяется в приготовлении фармацевтических препаратов для лечения состояний, которые улучшаются при ингибировании активности PARP, это является четвертой частью настоящего изобретения.
К описанным выше состояниям, лечение которых улучшается вследствие ингибирования активности PARP, относятся сосудистые заболевания, септический шок, ишемические повреждения, нейротоксичность, геморрагический шок, воспалительные заболевания или рассеянный склероз.
Соединение общей формулы (I) применяется в приготовлении поддерживающих фармацевтических препаратов для лечения опухолей, это является четвертой частью настоящего изобретения.
Фармацевтически приемлемый дериват соединения общей формулы (I) применяется в приготовлении поддерживающих фармацевтических препаратов для лечения опухолей, это является четвертой частью настоящего изобретения.
Фармацевтически приемлемая соль соединения общей формулы (I) применяется в приготовлении поддерживающих фармацевтических препаратов для лечения опухолей, это является четвертой частью настоящего изобретения.
Описанная выше фармацевтическая композиция применяется в приготовлении поддерживающих фармацевтических препаратов для лечения опухолей, это является четвертой частью настоящего изобретения.
Соединение общей формулы (I) применяется в приготовлении фармацевтических препаратов для химиорадиотерапии злокачественных опухолей, это является четвертой составной частью настоящего изобретения.
Фармацевтически приемлемый дериват соединения общей формулы (I) применяется в приготовлении фармацевтических препаратов для химиорадиотерапии злокачественных опухолей, это является четвертой частью настоящего изобретения.
Фармацевтически приемлемая соль соединения общей формулы (I) применяется в приготовлении фармацевтических препаратов для химиорадиотерапии злокачественных опухолей, это является четвертой частью настоящего изобретения.
Описанная выше фармацевтическая композиция применяется в приготовлении фармацевтических препаратов для химиорадиотерапии злокачественных опухолей, это является четвертой частью настоящего изобретения.
Соединение общей формулы (I) применяется в приготовлении фармацевтических препаратов для химиотерапии опухолей, это является четвертой частью настоящего изобретения.
Фармацевтически приемлемый дериват соединения общей формулы (I) применяется в приготовлении фармацевтических препаратов для химиотерапии опухолей, это является четвертой частью настоящего изобретения.
Фармацевтически приемлемая соль соединения общей формулы (I) применяется в приготовлении фармацевтических препаратов для химиотерапии опухолей, это является четвертой частью настоящего изобретения.
Описанная выше фармацевтическая композиция применяется в приготовлении фармацевтических препаратов для химиотерапии опухолей, это является четвертой частью настоящего изобретения.
Соединение общей формулы (I) применяется в приготовлении фармацевтических препаратов для индивидуализированного лечения рака с дефицитом зависимой от гомологичной рекомбинации (HR) репарации двунитевых разрывов (DSB) ДНК, это является четвертой частью настоящего изобретения.
Фармацевтически приемлемый дериват соединения общей формулы (I) применяется в приготовлении фармацевтических препаратов для индивидуализированного лечения рака с дефицитом зависимой от гомологичной рекомбинации (HR) репарации двунитевых разрывов (DSB) ДНК, это является четвертой частью настоящего изобретения.
Фармацевтически приемлемая соль соединения общей формулы (I) применяется в приготовлении фармацевтических препаратов для индивидуализированного лечения рака с дефицитом зависимой от гомологичной рекомбинации (HR) репарации двунитевых разрывов (DSB) ДНК, это является четвертой частью настоящего изобретения.
Описанная выше фармацевтическая композиция применяется в приготовлении фармацевтических препаратов для индивидуализированного лечения рака с дефицитом зависимой от гомологичной рекомбинации (HR) репарации двунитевых разрывов (DSB) ДНК, это является четвертой частью настоящего изобретения.
Описанный выше рак означает, предпочтительно, рак, при котором одна или нескольких раковых клеток обладают пониженной или аннулированной способностью по отношению к нормальным клеткам восстанавливать DSB ДНК посредством HR.
Описанный выше рак означает, предпочтительно, рак, при котором раковые клетки имеют BRCA1- и/или BRCA2-мутационный дефицитный фенотип. Описанный выше рак означает, предпочтительно, рак молочной железы, рак яичников, рак поджелудочной железы или рак простаты.
Для проверки качества воздействия предложенного соединения на ферменты PARP проводилось тестирование ферментативной активности биохимического уровня, которое убедительно доказало то, что все типы соединений настоящего изобретения активны в отношении ферментов PARP.
PARP - это один из видов посттрансляционной модификации ферментов, которые могут активироваться повреждениями ДНК. Внутри процесса катализации PARP представляет собой NAD-зависимый процесс поли(АДФ-рибозил)ирования, в котором субстраты - это некоторые нуклеопротеины, включая те, что внутри PARP. Один из них - гистоны. Активность PARP измерялась поли(АДФ-рибозил)ированием гистонов под действием NAD в пригодном для ПЦР 96-луночном планшете, затем измерялась активность PARP после воздействия ингибиторов. Таким образом была проведена оценка качества ингибирования активности PARP соединений тестируемого класса.
Варианты применения
Если не указано иное в отношении используемых в описании и формуле изобретения терминов, то ниже приведены их пояснения:
В настоящем изобретении термин «С1-С6-алкил» означает насыщенные
одновалентные углеводородные радикалы линейного или разветвленного расположения с 1-6 атомами углерода. Такие радикалы включают, но не ограничиваются, метил, этил, пропил, изопропил, н-бутил, изобутил и третбутил.
Термин «галоген» и «галогено-» означает F, Cl, Br, I.
«Фармацевтически приемлемые соли» означает соли, сохранившие биологическую эффективность и свойства исходных соединений. Такие соли включают в себя:
(1) Кислотно-аддитивные соли, получаемые при реакциях свободного основания исходного соединения с неорганической или органической кислотой. К неорганическим кислотам относятся соляная кислота, бромистоводородная кислота, азотная кислота, фосфорная кислота, метафосфорная кислота, серная кислота, сернистая кислота, перхлорат и др. К органическим кислотам относится уксусная кислота, пропионовая кислота, акриловая кислота, щавелевая кислота, D- и L-яблочная кислота, фумаровая кислота, малеиновая кислота, оксибензойная кислота, γ-гидроксимасляная кислота, метоксибензойная кислота, ортофталевая кислота, метансульфоновая кислота, этансульфоновая кислота, нафталин-1-сульфоновая кислота, нафталин-2-сульфоновая кислота, р-толуолсульфоновая кислота, салициловая кислота, винная кислота, лимонная кислота, молочная кислота, миндальная кислота, янтарная кислота, малоновая кислота и др.
(2) Соли, образованные в результате замещения протонов кислоты, находящихся в исходном соединении, ионами металлов или в результате координационного соединения с алкалоидом. К ионам металлов относятся, например, ионы щелочных металлов, ионы щелочноземельных металлов или ионы алюминия; к алкалоидам относятся этаноламин, диэтаноламин, триэтаноламин, трометамол, N-метилглюкамин и др.
«Фармацевтическая композиция» означает смесь, которая содержит одно или несколько соединений настоящего изобретения, или их фармацевтически приемлемые соли, сольваты, гидраты, или пролекарства, а также другие химические соединения, например, фармацевтически приемлемые носители. Фармацевтическую композицию применяют с целью ускорения воздействия препарата на организм.
«Фармацевтический носитель» означает неактивный компонент в составе фармацевтической композиции, который не вызывает в организме явной раздражимости и не препятствует биологической активности вводимого в него соединения. К фармацевтическим носителям относятся, но не ограничиваются: карбонат кальция, фосфат кальция, разного рода углеводы (например, лактоза, маннит и др.), крахмал, циклодекстрин, стеарат магния, фибрин, углекислый магний, акрилат сополимер или метакрилат сополимер, гель, вода, полиэтиленгликоль, пропиленгликоль, этиленгликоль, касторовое масло или гидрированное касторовое масло, или полиэтоксилированное касторовое масло, кунжутное масло, кукурузное масло, арахисовое масло и др.
В описанной выше фармацевтической композиции, кроме фармацевтически приемлемого носителя, также могут быть фармацевтически (препаративно) приемлемые вспомогательные средства, например, антибактериальные, противогрибковые, противомикробные средства, консерванты, красители, солюбилизаторы, загустители, поверхностно-активные вещества, комплексообразующие агенты, белки, аминокислоты, жиры, углеводы, витамины, минералы, микроэлементы, подсластители, пигменты, эссенции и их соединения.
Настоящее изобретение открыто предлагает соединение и применение этого соединения в качестве ингибитора поли(АДФ-рибоза)-полимеразы. Специалисты в данной области могут обращаться к содержанию настоящего изобретения и совершенствовать его в технических аспектах. Особо следует отметить, что для специалиста в данной области хорошо понятны все возможные подмены и изменения в соединениях, приведенных в настоящем изобретении, поэтому все подмены и изменения также считаются охваченными настоящим изобретением. Способы получения и аспекты применения уже описаны и представлены на сравнительно хороших конкретных примерах, при практической реализации квалифицированные специалисты могут легко изменять и дорабатывать их, а также комбинировать ими, не отрываясь от главного содержания, сущности и границ настоящего изобретения.
Ниже представлены различные комбинации соединения для более детального описания настоящего изобретения:
Примеры получения соединения
Пример 1
Получение соединения (1) 2-(4-(пиримидин-2-ил)пиперазин-1-ил)-1H-бензимидазол-4-формамида, схема получения представлена ниже:

Этап 1: Получение 2-оксо-2,3-дигидро-1Н-бензимидазол-4-метилформиата.
В сухой раствор тетрагидрофурана (20 мл) с растворенным 2,3-диаминометилбензоатом (0,8 г, 4,8 ммоль) добавляем карбонилдиимидазол (1,56 г, 9,6 ммоль), нагреваем до температуры кипения с обратным холодильником и через 8 часов реакции охлаждаем, удаляем растворитель при пониженном давлении. Остаток быстро очищаем хроматографией на колонке (петролейный эфир : этилацетат = 5:1) и получаем твердое соединение светло-желтого цвета «а» 2-оксо-2,3-дигидро-1Н-бензимидазол-4-метилформиат (0,3 г, выход 33%). MS (ESI) m/z: [М+Н]+=193.
Этап 2: Получение 2-хлор-1Н-бензимидазол-4-метилформиата.
В соединение «а» 2-оксо-2,3-дигидро-1Н-бензимидазол-4-метилформиат (1,1 г, 5,7 ммоль) добавляем хлорокись фосфора (8 мл), нагреваем до температуры кипения с обратным холодильником и через 8 часов реакции охлаждаем, удаляем растворитель при пониженном давлении. Остаток быстро очищаем хроматографией на колонке (петролейный эфир : этилацетат = 5:1) и получаем твердое соединение белого цвета «b» 2-хлор-1Н-бензимидазол-4-метилформиат (1,5 г, выход 100%). MS (ESI) m/z: [М+Н]+=211.
Этап 3: Получение 2-(пиперазин-1-ил)-1Н-бензимидазол-4-метилформиата.
В раствор диметилформамида (5 мл) с соединением «b» 2-хлор-1Н-бензимидазол-4-метилформиатом (59 мг, 0,28 ммоль) добавляем пиперазин (110 мг, 1,12 ммоль), нагреваем до 100°С и через 8 часов реакции охлаждаем, удаляем растворитель при пониженном давлении. Остаток быстро очищаем хроматографией на колонке (дихлорметан : метанол = 10:1) и получаем твердое соединение белого цвета «c» 2-(пиперазин-1-ил)-1Н-бензимидазол-4-метилформиат (100 мг, выход 100%). MS (ESI) m/z: [М+Н]+=261.
Этап 4: Получение 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
В раствор тетрагидрофурана (5 мл) с соединением «c» 2-(пиперазин-1-ил)-1Н-бензимидазол-4-метилформиатом (100 мг, 0,28 ммоль) добавляем аммиачную воду (5 мл), нагреваем до 70°С, через 8 часов реакции в герметично закрытом реакционном сосуде охлаждаем, удаляем растворитель при пониженном давлении. Остаток быстро очищаем хроматографией на колонке (дихлорметан : метанол = 10:1) и получаем твердое соединение белого цвета «d» 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамид (20 мг, выход 28%). MS (ESI) m/z: [М+Н]+=246.
Этап 5: Получение 2-(4-(пиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
В раствор диметилформамида (5 мл) с соединением «d» 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамидом (74 мг, 0,3 ммоль) добавляем 2-хлорпиримидин (34 мг, 0,3 ммоль) и триэтиламин (30 мг, 0,3 ммоль), нагреваем до 100°С, через 8 часов реакции охлаждаем, удаляем растворитель при пониженном давлении. Остаток быстро очищаем хроматографией на колонке (дихлорметан : метанол = 10:1) и получаем соединение (1) 2-(4-(пиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (32 мг, выход 33%). LC-MS (ESI): m/z 324 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.10 (br, 1Н), 9.16 (br, 1H), 8.44-8.38 (m, 2H), 7.62-7.54 (m, 2H), 7.36-7.32 (m, 1H), 7.01-6.95 (m, 1H), 6.70-6.63 (m, 1H), 3.89 (br, 4H), 3.67 (br, 4H).
Пример 2
Получение соединения (2) 2-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
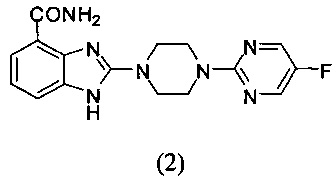
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 2-хлор-5-фторпиримидина получаем соединение (2): 2-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (30 мг, выход 72%). LC-MS (ESI): m/z 342 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 11.92 (br, 1Н), 9.13 (br, 1H), 8.50 (s, 2H), 7.60 (d, 1H, J=7.8 Hz), 7.52 (br, 1H), 7.32 (d, 1H, J=7.8 Hz), 6.98 (t, 1H, J=7.8 Hz), 3.87-3.83 (m, 4H), 3.67-3.64 (m, 4H).
Пример 3
Получение соединения (3) 2-(4-(5-этиламинопиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
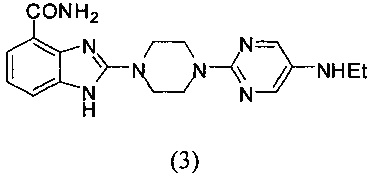
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 2-хлор-5-этиламинопиримидина получаем соединение (3): 2-(4-(5-этиламинопиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (23 мг, выход 42%). LC-MS (ESI): m/z 367 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 9.08 (br, 1H), 7.92 (s, 2H), 7.78-7.72 (m, 2H), 7.66-7.60 (m, 2H), 7.22-7.16 (m, 1H), 4.71-4.67 (m, 2H), 4.19-4.15 (m, 2H), 3.73-3.70 (m, 4H), 2.65-2.60 (m, 2H), 1.37 (t, 3H, J=4.5 Hz).
Пример 4
Получение соединения (4) 2-(4-(5-ацетамидопиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
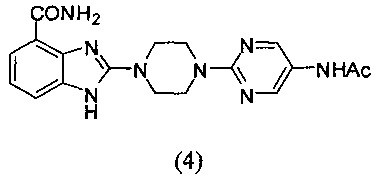
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 2-хлор-5-ацетамидопиримидина получаем соединение (4): 2-(4-(5-ацетамидопиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (12 мг, выход 22%). LC-MS (ESI): m/z 381 (М+1)+. 1H NMR (300 MHz, DMSO-d6): δ 11.85 (br, 1Н), 9.89 (br, 1H), 9.14 (s, 1H), 8.54 (s, 2H), 7.60 (d, 1H, J=7.5 Hz), 7.51 (br, 1H), 7.31 (d, 1H, J=7.5 Hz), 6.98 (t, 1H, J=7.5 Hz), 3.84-3.65 (m, 8H), 2.00 (s, 3H).
Пример 5
Получение соединения (5) 2-(4-(5-метоксипиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
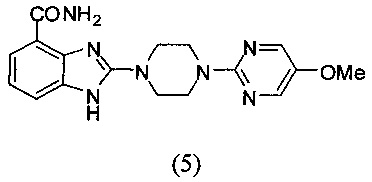
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 2-хлор-5-метоксипиримидина получаем соединение (5): 2-(4-(5-метоксипиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (17 мг, выход 41%). LC-MS (ESI): m/z 354 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 11.86 (br, 1H), 9.15 (br, 1H), 8.25 (s, 2H), 7.60 (d, 1H, J=7.5 Hz), 7.51 (br, 1H), 7.31 (d, 1H, J=7.5 Hz), 6.98 (t, 1H, J=7.5 Hz), 3.77 (br, 7H), 3.64 (br, 4H).
Пример 6
Получение соединения (6) 2-(4-(5-аминопиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
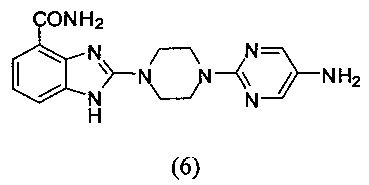
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 2-хлор-5-аминопиримидина получаем соединение (6): 2-(4-(5-аминопиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (190 мг, выход 83%). LC-MS (ESI): m/z 339 (М+1)+. 1H NMR (300 MHz, DMSO-d6): δ 9.12 (br, 1Н), 7.60-7.25 (m, 7H), 7.00-6.95 (m, 1H), 3.67 (br, 8H).
Пример 7
Получение соединения (7) 2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
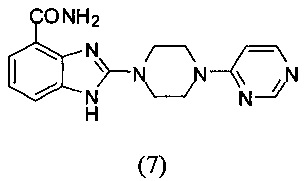
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1.
Из реакции нуклеофильного ароматического замещения соединения «d» 2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 4-хлоропиримидина получаем соединение (7): 2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (25 мг, выход 65%). LC-MS (ESI): m/z 324 (М+1)+. 1H NMR (300 MHz, DMSO-d6): δ 11.85 (br, 1H), 9.09 (br, 1H), 8.53 (s, 1H), 8.22 (d, 1H, J=8.1 Hz), 7.60 (d, 1H, J=7.5 Hz), 7.50 (br, 1H), 7.33 (d, 1H, J=7.5 Hz), 6.99 (t, 1H, J=7.5 Hz), 6.91 (d, 1H, J=8.1 Hz), 3.80-3.79 (m, 4H), 3.68-3.66 (m, 4H).
Пример 8
Получение соединения (8) 2-(4-(3-этиламинопиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
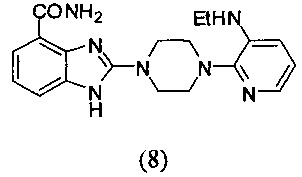
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 2-хлор-3-этиламинопиридина получаем соединение (8): 2-(4-(3-этиламинопиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (13 мг, выход 36%). LC-MS (ESI): m/z 366 (М+1)+. 1H NMR (300 MHz, DMSO-d6): δ 12.02 (br, 1H), 9.18 (br, 1H), 7.62-7.50 (m, 4H), 7.34-7.31 (m, 1H), 7.00-6.89 (m, 3H), 3.77-3.74 (m, 4H), 3.14-3.10 (m, 4H), 2.00-1.93 (m, 2H), 0.85-0.80 (m, 3H).
Пример 9
Получение соединения (9) 2-(4-(4-трифторметилпиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:

Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 2-хлор-4-трифторметилпиримидина получаем соединение (9): 2-(4-(4-трифторметилпиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (36 мг, 55%). LC-MS (ESI): m/z 392 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 11.87 (br, 1H), 9.13 (br, 1Н), 8.72 (d, 1H, J=4.8 Hz), 7.61 (d, 1H, J=7.8 Hz), 7.53 (br, 1H), 7.33 (d, 1H, J=7.8 Hz), 7.07 (d, 1H, J=4.8 Hz), 6.99 (t, 1H, J=7.8 Hz), 3.94 (br, 4H), 3.69 (br, 4H).
Пример 10
Получение соединения (10) 2-(4-(6-трифторметилпиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
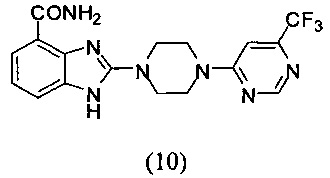
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 6-хлор-4-трифторметилпиримидина получаем соединение (10): 2-(4-(6-трифторметилпиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (40 мг, выход 61%). LC-MS (ESI): m/z 392 (М+1)+. 1H NMR (300 MHz, DMSO-d6): δ 11.88 (br, 1Н), 9.12 (br, 1H), 8.66 (s, 1H), 7.61 (d, 1H, J=7.5 Hz), 7.53 (br, 1H), 7.35 (s, 1H), 7.33 (d, 1H, J=7.5 Hz), 6.99 (t, 1H, J=7.5 Hz), 3.92 (br, 4H), 3.69 (br, 4H).
Пример 11
Получение соединения (11) 2-(4-(5-метилкарбамоилпиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
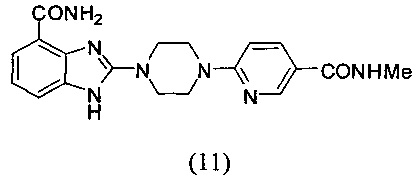
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 6-хлор-3-метилкарбамоилпиридина получаем соединение (11): 2-(4-(5-метилкарбамоилпиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (15 мг, 24%). LC-MS (ESI): m/z 380 (M+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 11.86 (br, 1H), 9.14 (br, 1H), 8.6 (s, 1H), 8.24 (br, 1H), 7.96 (d, 1H, J=9.6 Hz), 7.61 (d, 1H, J=7.8 Hz), 7.52 (br, 1H), 7.32 (d, 1H, J=7.8 Hz), 7.01-6.92 (m, 2H), 3.77 (br, 4H), 3.67 (br, 4H), 2.74 (d, 3H, d=4.2 Hz).
Пример 12
Получение соединения (12) 2-(4-(5-карбамоилпиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
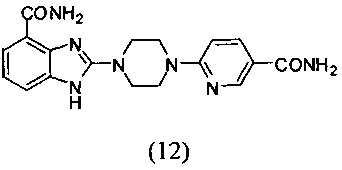
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 6-хлор-3-карбамоилпиридина получаем соединение (12): 2-(4-(5-карбамоилпиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (25 мг, выход 41%). LC-MS (ESI): m/z 366 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 11.86 (br, 1Н), 9.14 (br, 1H), 8.64 (s, 1H), 7.99 (d, 1H, J=7.8 Hz), 7.79 (br, 1H), 7.60 (d, 1H, J=9.0 Hz), 7.51 (br, 1H), 7.32 (d, 1H, J=7.8 Hz), 7.17 (br, 1H), 7.01-6.91 (m, 2H), 3.78 (br, 4H), 3.67 (br, 4H).
Пример 13
Получение соединения (13) 2-(4-(2-трифторметилпиридин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
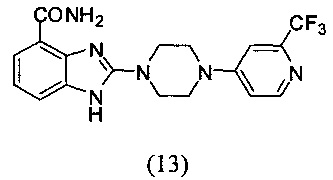
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 4-хлор-2-трифторметилпиридина получаем соединение (13): 2-(4-(2-трифторметилпиридин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (7 мг, выход 13%). LC-MS (ESI): m/z 391 (М+1)+. 1H NMR (300 MHz, DMSO-d6): δ 11.88 (br, 1Н), 9.13 (br, 1H), 8.34-8.29 (m, 1H), 7.63-7.60 (m, 1H), 7.53 (br, 1H), 7.35-7.30 (m, 2H), 7.12-7.09 (m, 1H), 7.03-6.97 (m, 1H), 3.70-3.64 (m, 8H).
Пример 14
Получение соединения (14) 2-(4-(5-цианопиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:

Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1.
Из реакции нуклеофильного ароматического замещения соединения «d» 2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 2-хлор-5-цианопиримидина получаем соединение (14): 2-(4-(5-цианопиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (40 мг, выход 71%). LC-MS (ESI): m/z 349 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 11.88 (br, 1Н), 9.09 (br, 1H), 8.80 (s, 2H), 7.60 (d, 1H, J=7.2 Hz), 7.53 (br, 1H), 7.33 (d, 1H, J=7.2 Hz), 6.99 (t, 1H, J=7.2 Hz), 4.01 (br, 4H), 3.69 (br, 4H).
Пример 15
Получение соединения (15) 2-(4-(5-диметилкарбамоилпиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида:
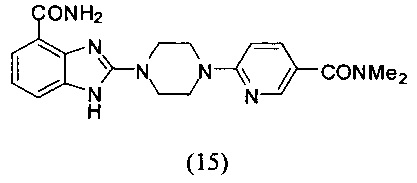
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения соединения «d» 2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 6-хлор-3-диметилкарбамоилпиридина получаем соединение (15): 2-(4-(5-диметилкарбамоилпиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (35 мг, выход 44%). LC-MS (ESI): m/z 394 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.11 (br, 1H), 9.19 (br, 1H), 8.24 (s, 1H), 7.66-7.59 (m, 2H), 7.53 (br, 1H), 7.34-7.31 (m, 1H), 7.00-6.91 (m, 2H), 3.73-3.70 (m, 8H), 2.96 (s, 6H).
Пример 16
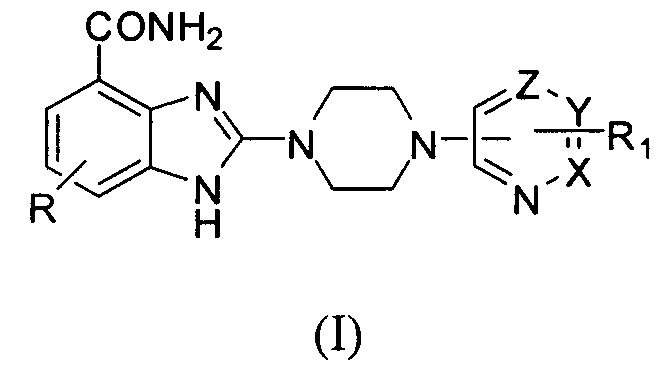
Получение соединения (16) 6-фтор-2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида, схема получения представлена ниже:
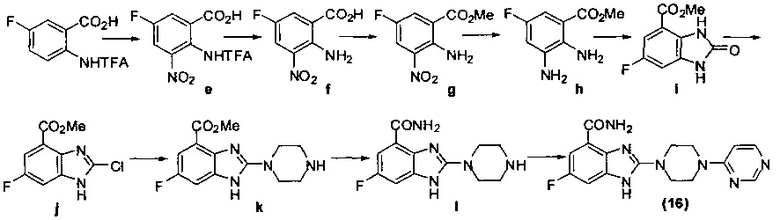
Этап 1: Получение 5-фтор-3-нитро-2-(2,2,2-трифторацетамид)бензойной кислоты.
В ледяной бане 2-трифторацетамид-5-фтор-бензойную кислоту (2,5 г, 10 ммоль) медленно добавляем в дымящуюся азотную кислоту (14 мл), перемешиваем смесь, находящуюся в ледяной бане, в течение 1 часа и затем выливаем в ледяную воду. Осадок отфильтровываем и получаем твердое соединение белого цвета «е» 5-фтор-3-нитро-2-(2,2,2-трифторацетамид)бензойную кислоту (1,9 г, выход 65%). MS (ESI) m/z: [М-Н]-=295.
Этап 2: Получение 2-амино-5-фтор-3-нитробензойной кислоты.
10-процентный водный раствор каустической соды (20 мл) добавляем в раствор этилового спирта (20 мл) с растворенным соединением «е» 5-фтор-3-нитро-2-(2,2,2-трифторацетамид)бензойной кислотой, нагреваем смесь до 80°С и перемешиваем в течение 3 часов, затем удаляем этанол при пониженном давлении. Остаток подкисляем до рН4 и отфильтровываем, в результате получаем твердое соединение желтого цвета «f» 2-амино-5-фтор-3-нитробензойную кислоту (0,72 г, выход 90%) MS (ESI) m/z: [М-Н]-=199.
Этап 3: Получение 2-амино-5-фтор-3-нитрометилбензоата.
В ледяной бане тионилхлорид (2,38 г) медленно каплями добавляем в раствор метанола (20 мл) с растворенным соединением «f» 2-амино-5-фтор-3-нитробензойной кислотой (0,8 г, 4 ммоль), нагреваем до температуры кипения с обратным холодильником и через 8 часов реакции охлаждаем, удаляем растворитель при пониженном давлении. Остаток быстро очищаем хроматографией на колонке (петролейный эфир : этилацетат = 5:1) и получаем твердое соединение желтого цвета «g» 2-амино-5-фтор-3-нитрометилбензоат (0,5 г, выход 58%). MS (ESI) m/z: [М+Н]+=215.
Этап 4: Получение 2,3-диамино-5-фторметилбензоата.
Палладий 10% на угле (0,7 г) добавляем в раствор метанола (50 мл) с растворенным соединением «g» 2-амино-5-фтор-3-нитрометилбензоатом (7 г, 32,7 ммоль), проводим гидрирование в течение 7 часов при комнатной температуре, отфильтровываем. Остаток быстро очищаем хроматографией на колонке (петролейный эфир : этилацетат = 5:1) и получаем твердое соединение желтого цвета «h» 2,3-диамино-5-фторметилбензоат (2,16 г, выход 36%). MS (ESI) m/z: [М+Н]+=185.
Этап 5: Получение 6-фтор-2-оксо-2,3-дигидро-1Н-бензимидазол-4-метилформиата.
Способ получения аналогичен 1-му этапу получения соединения (1) из примера 1.
Из реакции циклизации при смеси соединения «h» 2,3-диамино-5-фторметилбензоата с карбонилдиимидазолом (CDI) получаем соединение «i» 6-фтор-2-оксо-2,3-дигидро-1Н-бензимидазол-4-метилформиат (711 мг, выход 37%). MS (ESI) m/z: [М+Н]+=211.
Этап 6: Получение 2-хлор-6-фтор-1Н-бензимидазол-4-метилформиата.
Способ получения аналогичен 2-му этапу получения соединения (1) из примера 1. В результате реакции хлорирования при смеси соединения «i» 6-фтор-2-оксо-2,3-дигидро-1Н-бензимидазол-4-метилформиата и хлорокиси фосфора получаем соединение «j» 2-хлор-6-фтор-1Н-бензимидазол-4-метилформиат (681 мг, выход 94%). MS (ESI) m/z: [M+H]+=229.
Этап 7: Получение 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-метилформиата.
Способ получения аналогичен 3-му этапу получения соединения (1) из примера 1. В результате реакции нуклеофильного замещения при смеси соединения «j» 2-хлор-6-фтор-1Н-бензимидазол-4-метилформиата с пиперазином получаем соединение «k» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-метилформиат (430 мг, выход 65%). MS (ESI) m/z: [М+Н]+=279.
Этап 8: Получение 6-фтор-2-(пиперазин-1-ил)-1H-бензимидазол-4-формамида.
В раствор тетрагидрофурана (5 мл) с растворенным соединением «k» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-метилформиатом (100 мг, 0,28 ммоль) добавляем аммиачную воду (5 мл), нагреваем до 70°С, через 8 часов реакции в герметично закрытом реакционном сосуде охлаждаем, удаляем растворитель при пониженном давлении. Остаток быстро очищаем хроматографией на колонке (дихлорметан : метанол = 10:1) и получаем твердое соединение белого цвета «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамид (20 мг, выход 28%). MS (ESI) m/z: [М+Н]+=246.
Этап 9: Получение 6-фтор-2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения при смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида с 4-хлорпиримидином получаем соединение (16) 6-фтор-2-(4-(пиримидин-4-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (21 мг, выход 48%). LC-MS (ESI): m/z 342 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.04 (br, 1Н), 9.10 (br, 1H), 8.52 (s, 1H), 8.22 (d, 1H, J=7.2 Hz), 7.71 (br, 1H), 7.33-7.2 (m, 1H), 7.19-7.17 (m, 1H), 6.90 (d, 1H, J=7.2 Hz), 3.80 (br, 4H), 3.66 (br, 4H).
Пример 17
Получение соединения (17) 6-фтор-2-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
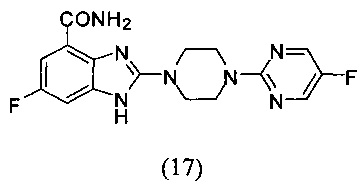
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1.
Из реакции нуклеофильного ароматического замещения при смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида с 2-хлор-5-фторпиримидином получаем соединение (17) 6-фтор-2-(4-(5-фторпиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (27 мг, выход 87%). LC-MS (ESI): m/z 360 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 9.11 (br, 1H), 8.49 (s, 2H), 7.71-7.69 (m, 1H), 7.31-7.28 (m, 1H), 7.18-7.15 (m, 1H), 3.84-3.82 (m, 4H), 3.68-3.65 (m, 4H).
Пример 18
Получение соединения (18) 2-(4-(5-(диметилформамид)пиридин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамида.
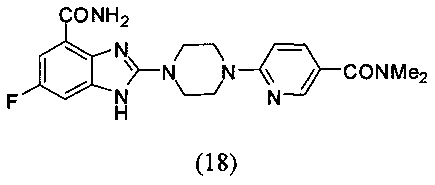
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения при смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида с 6-хлор-3-диметилкарбамоилпиридином получаем соединение (18) 2-(4-(5-(диметилформамид)пиридин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамид (14 мг, выход 18%). LC-MS (ESI): m/z 412 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.57 (br, 1Н), 9.12 (br, 1H), 8.23 (s, 1H), 7.70-7.63 (m, 2H), 7.31-7.27 (m, 1H), 7.18-7.14 (m, 1H), 6.94-6.91 (m, 1H), 3.72 (br, 8H), 2.95 (s, 6H).
Пример 19
Получение соединения (19) 2-(4-(5-цианопиримидин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамида.
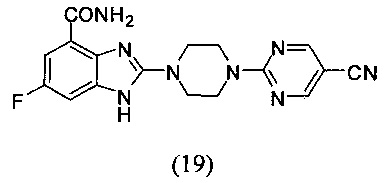
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения при смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида с 2-хлор-5-цианопиримидином получаем соединение (19) 2-(4-(5-цианопиримидин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамид (43 мг, выход 77%). LC-MS (ESI): m/z 367 (М+1)+. 1H NMR (300 MHz, DMSO-d6): δ 12.11 (br, 1H), 9.07 (br, 1H), 8.80 (s, 2H), 7.72 (br, 1H), 7.33-7.29 (m, 1H), 7.20-7.16 (m, 1H), 4.00 (br, 4H), 3.69 (br, 4H).
Пример 20
Получение соединения (20) 6-фтор-2-(4-(3-метилформамидпиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
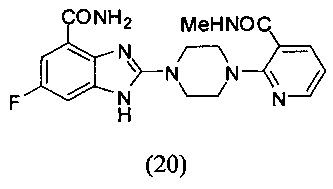
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения при смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида с 2-хлор-N-метилникотинамидом получаем соединение (20) 6-фтор-2-(4-(3-метилформамидпиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (28 мг, выход 52%). LC-MS (ESI): m/z 398 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.21 (br, 1H), 9.10 (br, 1Н), 8.41 (br, 1H), 8.26-8.25 (m, 1H), 7.75-7.72 (m, 1H), 7.68 (br, 1H), 7.32-7.28 (m, 1H), 7.18-7.15 (m, 1H), 6.96-6.92 (m, 1H), 3.69 (br, 8H), 2.79 (s, 3H).
Пример 21
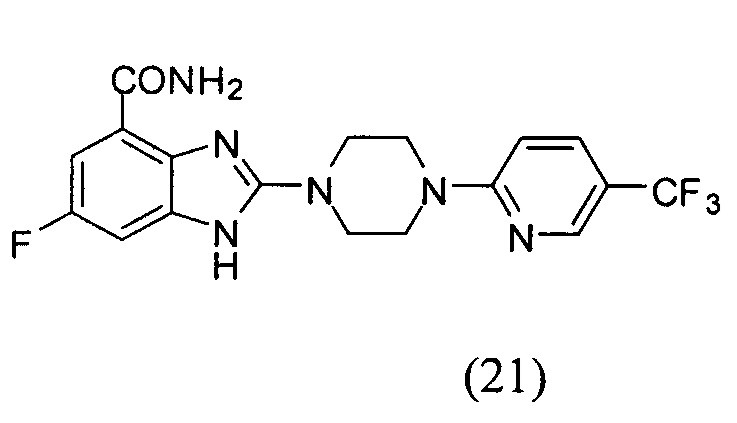
Получение соединения (21) 6-фтор-2-(4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
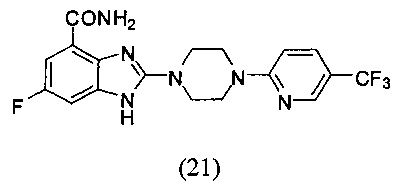
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения при смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида с 2-хлор-5-трифторметилпиридином получаем соединение (21) 6-фтор-2-(4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (23 мг, выход 52%). LC-MS (ESI): m/z 409 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.32 (br, 1H), 9.10 (br, 1H), 8.44 (s, 1H), 7.85-7.81 (m, 1H), 7.70 (br, 1H), 7.32-7.28 (m, 1H), 7.19-7.15 (m, 1H), 7.06-7.02 (m, 1H), 3.81 (br, 4H), 3.70 (br, 4H).
Пример 22
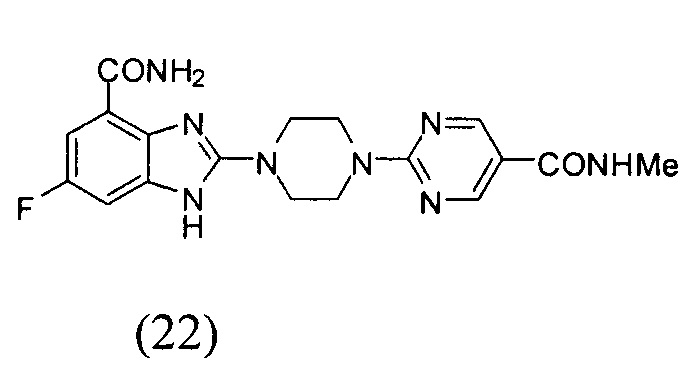
Получение соединения (22) 6-фтор-2-(4-(5-метиламинопиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
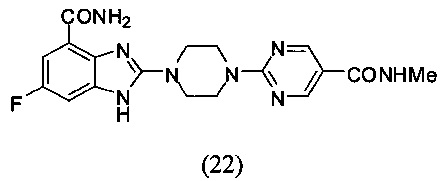
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения при смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида с 2-хлор-N-метилпиримидин-5-формамидом получаем соединение (22) 6-фтор-2-(4-(5-метиламинопиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (17 мг, выход 29%). LC-MS (ESI): m/z 399 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.01 (br, 1Н), 9.08 (br, 1H), 8.78 (s, 2H), 8.37 (br, 1H), 7.73 (br, 1H), 7.34-7.27 (m, 1H), 7.19-7.13 (m, 1H), 3.98 (br, 4H), 3.67 (br, 4H), 2.75 (s, 3H).
Пример 23
Получение соединения (23) 6-фтор-2-(4-(6-метиламинопиридазин-3-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
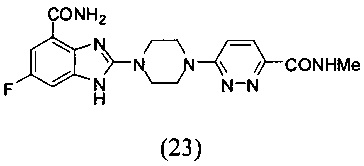
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения при смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида с 6-хлор-N-метилпиридазин-3-формамидом получаем соединение (23) 6-фтор-2-(4-(6-метиламинопиридазин-3-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (20 мг, выход 27%). LC-MS (ESI): m/z 399 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.05 (br, 1Н), 9.11 (br, 1H), 8.84 (br, 1H), 7.87 (d, 1H, J=10.5 Hz), 7.74 (br, 1H), 7.44-7.41 (m, 1H), 7.31 (d, 1H, J=10.5 Hz), 7.20-7.17 (m, 1H), 3.90 (br, 4H), 3.72 (br, 4H), 2.80 (s, 3H).
Пример 24
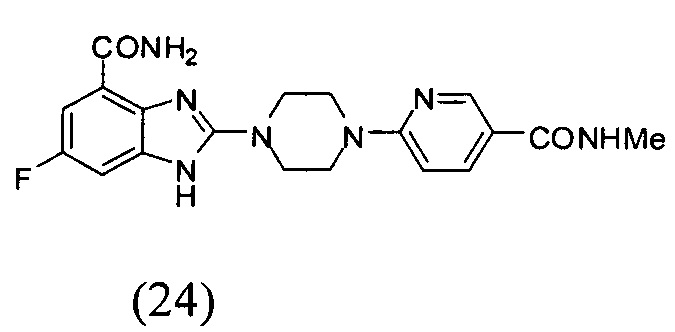
Получение соединения (24) 6-фтор-2-(4-(5-метиламинопиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
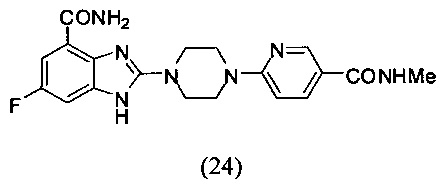
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения при смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида с 6-хлор-N-метилникотинамидом получаем соединение (24) 6-фтор-2-(4-(5-метиламинопиридин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (6 мг, выход 13%). LC-MS (ESI): m/z 398 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.58 (br, 1H), 9.12 (br, 1Н), 8.62 (s, 1H), 8.04-7.98 (m, 1H), 7.72 (s, 1H), 7.32-7.26 (m, 2H), 7.17-7.15 (m, 1H), 6.98-6.92 (m, 1H), 3.75-3.69 (m, 8H), 2.73 (s, 3H).
Пример 25
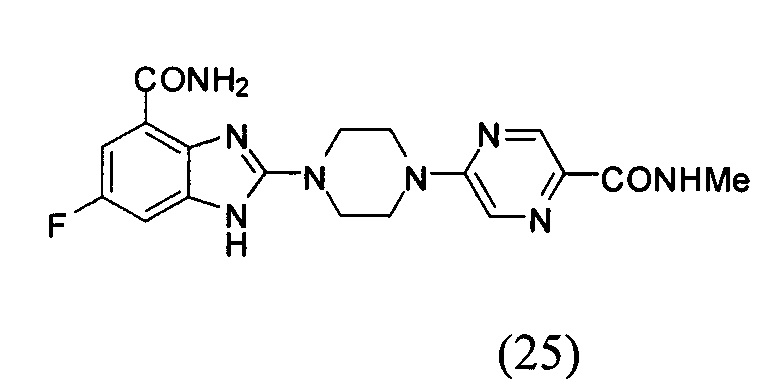
Получение соединения (25) 6-фтор-2-(4-(5-метиламинопиразин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.

Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-хлор-N-метилпиразин-2-формамида получаем соединение (25) 6-фтор-2-(4-(5-метиламинопиразин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (38 мг, выход 64%). LC-MS (ESI): m/z 399 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.05 (br, 1Н), 9.09 (br, 1H), 8.62 (s, 1H), 8.39 (br, 1H), 8.34 (s, 1H), 7.72 (br, 1H), 7.33-7.29 (m, 1H), 7.19-7.17 (m, 1H), 3.88 (br, 4H), 3.70 (br, 4H), 2.77 (s, 3H).
Пример 26
Получение соединения (26) 2-(4-(5-этиламинопиразин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамида.

Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-хлор-N-этилпиразин-2-формамида получаем соединение (26) 2-(4-(5-этиламинопиразин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамид (19 мг, выход 31%). LC-MS (ESI): m/z 413 (М+1)+. 1H NMR (300 MHz, DMSO-d6): δ 12.09 (br, 1Н), 9.11 (br, 1H), 8.63 (s, 1H), 8.44-8.42 (m, 1H), 8.34 (s, 1H), 7.73 (br, 1H), 7.33-7.29 (m, 1H), 7.20-7.17 (m, 1H), 3.87 (br, 4H), 3.71 (br, 4H), 3.28 (q, 2H, J=6.9 Hz), 1.09 (t, 3H, J=6.9 Hz).
Пример 27
Получение соединения (27) 6-фтор-2-(4-(5-изопропиламинопиразин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.

Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «1» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-хлор-N-изопропилпиразин-2-формамида получаем соединение (27) 6-фтор-2-(4-(5-изопропиламинопиразин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (22 мг, выход 28%). LC-MS (ESI): m/z 427 (M+1)+. 1Н NMR (300MHz, DMSO-d6): δ 12.04 (br, 1Н), 9.09 (br, 1H), 8.63 (s, 1H), 8.32 (s, 1H), 8.05-8.00 (m, 1H), 7.70 (br, 1H), 7.34-7.29 (m, 1H), 7.20-7.16 (m, 1H), 4.09 (sep, 1H, J=6.6Hz), 3.88 (br, 4H), 3.71 (br, 4H), 1.15 (d, 6H, J=6.6Hz)
Пример 28
Получение соединения (28) 2-(4-(5-трет-бутиламинопиразин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамида.
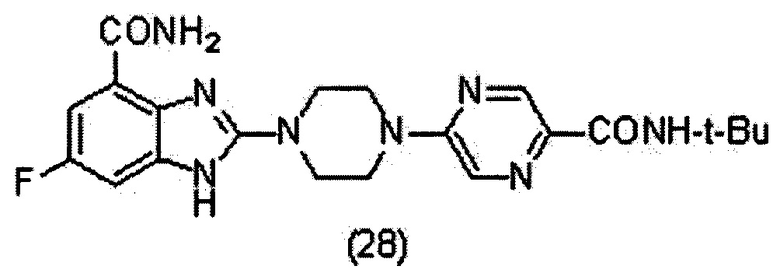
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «1» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-хлор-N-трет-бутилпиразин-2-формамида получаем соединение (28) 2-(4-(5-трет-бутиламинопиразин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамид (29 мг, выход 35%). LC-MS (ESI): m/z 441 (M+1)+. 1Н NMR (300MHz, DMSO-d6): δ 12.04 (br, 1H), 9.09 (br, 1H), 8.62 (s, 1H), 8.31 (s, 1H), 7.71 (br, 1H), 7.53 (br, 1H), 7.33-7.29 (m, 1H), 7.20-7.16 (m, 1H), 3.86 (br, 4H), 3.71 (br, 4H), 1.37 (s, 9H).
Пример 29
Получение соединения (29) 6-фтор-2-(4-(5-(пирролин-1-ацил)пиразин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
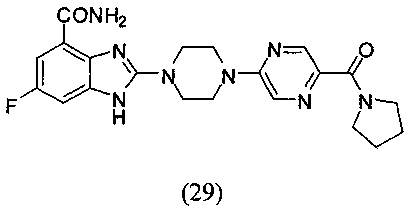
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и (5-хлорперазин-2-ил)(пирролин-1-ил)кетона получаем соединение (29) 6-фтор-2-(4-(5-(пирролин-1-ацил)пиразин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (14 мг, выход 17%). LC-MS (ESI): m/z 441 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.04 (br, 1Н), 9.08 (br, 1H), 8.51 (s, 1H), 8.34 (s, 1H), 7.71 (br, 1H), 7.33-7.29 (m, 1H), 7.19-7.16 (m, 1H), 3.86 (br, 4H), 3.70 (br, 4H), 3.47-3.45 (m, 4H), 1.86-1.83 (m, 4H)
Пример 30
Получение соединения (30) 6-фтор-2-(4-(5-(морфолин-4-ацил)пиразин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
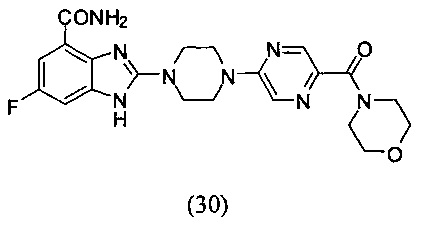
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и (5-хлорпиразин-2-ил)(морфолин-1-ил)кетона получаем соединение (30) 6-фтор-2-(4-(5-(пирролин-1-ацил)пиразин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (32 мг, выход 37%). LC-MS (ESI): m/z 455 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.04 (br, 1Н), 9.09 (br, 1H), 8.41 (s, 1H), 8.35 (s, 1H), 7.71 (br, 1H), 7.34-7.30 (m, 1H), 7.20-7.16 (m, 1H), 3.85 (br, 6H), 3.70 (br, 4H), 3.62 (br, 6H).
Пример 31
Получение соединения (31) 6-фтор-2-(4-(6-трифторметил-пиридазин-3-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.

Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 3-хлор-6-трифторметил-пиридазина получаем соединение (31) 6-фтор-2-(4-(6-трифторметил-пиридазин-3-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (15 мг, выход 20%). LC-MS (ESI): m/z 410 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.05 (br, 1Н), 9.10 (br, 1H), 7.94-7.85 (m, 1H), 7.71 (br, 1H), 7.51-7.47 (m, 1H), 7.34-7.30 (m, 1H), 7.21-7.17 (m, 1H), 3.93 (br, 4H), 3.72 (br, 4H).
Пример 32
Получение соединения (32) 6-фтор-2-(4-(6-трифторметил-пиридин-3-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
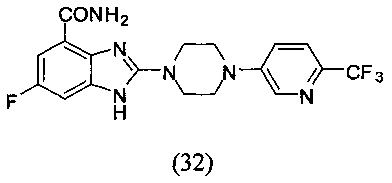
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-бром-2-трифторметил-пиридина получаем соединение (32) 6-фтор-2-(4-(6-трифторметил-пиридин-3-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (23 мг, выход 19%). LC-MS (ESI): m/z 409 (М+1)+. 1H NMR (300 MHz, DMSO-d6): δ 9.09 (br, 1Н), 8.50 (s, 1H), 7.72-7.66 (m, 2H), 7.52-7.48 (m, 1H), 7.33-7.28 (m, 1H), 7.20-7.16 (m, 1H), 3.72 (br, 4H), 3.54 (br, 4H).
Пример 33
Получение соединения (33) 6-фтор-2-(4-(2-трифторметил-пиримидин-5-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
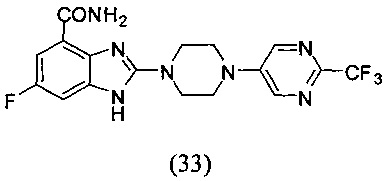
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-бром-2-трифторметил-пиримидина получаем соединение (33) 6-фтор-2-(4-(2-трифторметил-пиримидин-5-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (12 мг, выход 16%). LC-MS (ESI): m/z 410 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.04 (br, 1Н), 9.09 (br, 1H), 8.69 (s, 2H), 7.71 (br, 1H), 7.32-7.29 (m, 1H), 7.20-7.17 (m, 1H), 3.73 (br, 4H), 3.62 (br, 4H).
Пример 34
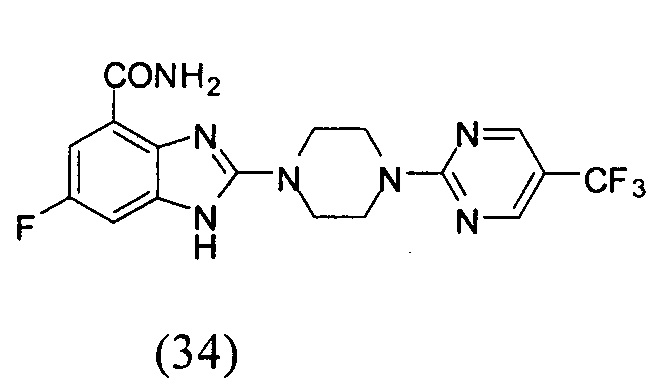
Получение соединения (34) 6-фтор-2-(4-(5-трифторметил-пиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
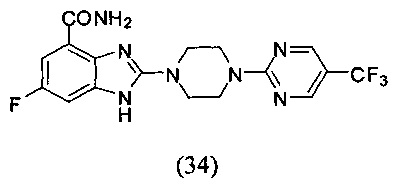
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 2-хлор-5-трифторметил-пиримидина получаем соединение (34) 6-фтор-2-(4-(5-трифторметил-пиримидин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамид (8 мг, выход 14%). LC-MS (ESI): m/z 410 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.02 (br, 1Н), 9.09 (br, 1H), 8.75 (s, 2H), 7.72 (br, 1H), 7.33-7.29 (m, 1H), 7.20-7.17 (m, 1H), 4.00 (br, 4H), 3.69 (br, 4H).
Пример 35
Получение соединения (35) 6-фтор-2-(4-(5-трифторметил-пиразин-2-ил)пиперазин-1-ил)-1Н-бензимидазол-4-формамида.
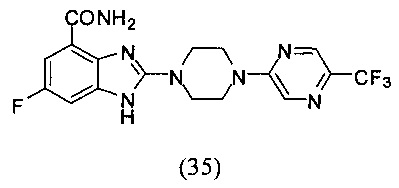
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 2-хлор-5-трифторметил-пиразина получаем соединение (35) 6-фтор-2-(4-(5-трифторметил-пиразин-2-ил)пиперазин-1-ил)-1H-бензимидазол-4-формамид (60 мг, выход 90%). LC-MS (ESI): m/z 410 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.04 (br, 1H), 9.09 (br, 1H), 8.51 (s, 1H), 8.50 (s, 1H), 7.71 (br, 1H), 7.33-7.30 (m, 1H), 7.20-7.17 (m, 1H), 3.89 (br, 4H), 3.71 (br, 4H).
Пример 36
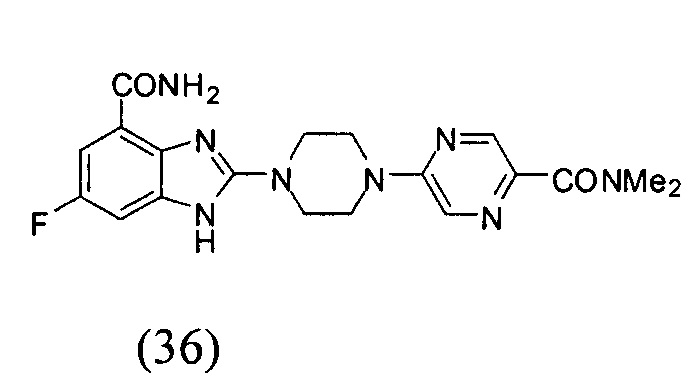
Получение соединения (36) 2-(4-(5-диметиламинопиразин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамида.
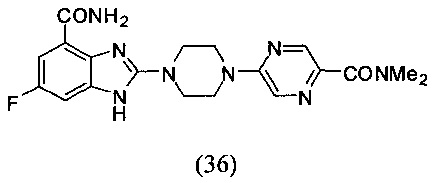
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-хлор-N,N-диметилпиразин-2-формамида получаем соединение (36) 2-(4-(5-диметиламинопиразин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамид (29 мг, выход 37%). LC-MS (ESI): m/z 413 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.02 (br, 1Н), 9.09 (br, 1H), 8.37 (s, 1H), 8.34 (s, 1H), 7.71 (br, 1H), 7.33-7.30 (m, 1H), 7.20-7.16 (m, 1H), 3.83 (br, 4H), 3.73 (br, 1H), 3.07 (s, 3H), 2.98 (s, 3H).
Пример 37
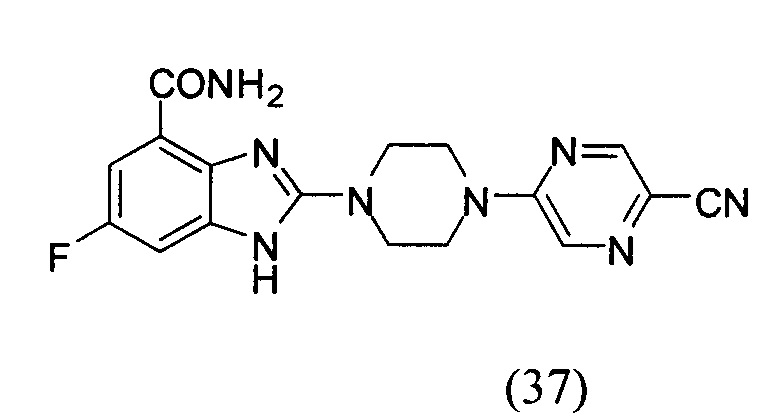
Получение соединения (37) 2-(4-(5-цианопиразин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамида.
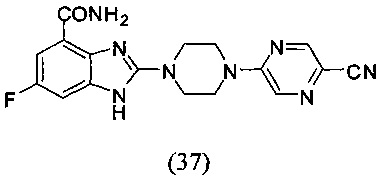
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-хлор-2-цианопиразина получаем соединение (37) 2-(4-(5-цианопиразин-2-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамид (40 мг, выход 58%). LC-MS (ESI): m/z 367 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.05 (br, 1H), 9.07 (br, 1H), 8.59 (s, 1H), 8.49 (s, 1H), 7.69 (s, 1H), 7.33-7.29 (m, 1H), 7.20-7.16 (m, 1H), 3.93 (br, 4H), 3.71 (br, 4H).
Пример 38
Получение соединения (38) 2-(4-(2-цианопиримидин-5-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамида.
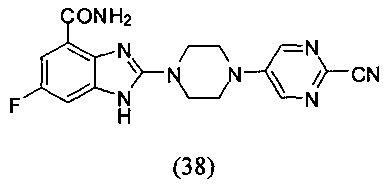
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-бром-2-цианопиримидина получаем соединение (38) 2-(4-(2-цианопиримидин-5-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамид (18 мг, выход 26%). LC-MS (ESI): m/z 367 (М+1)+. 1H NMR (300 MHz, DMSO-d6): δ 12.03 (br, 1H), 9.08 (br, 1H), 8.63 (s, 2H), 7.73-7.65 (m, 1H), 7.33-7.29 (m, 1H), 7.22-7.17 (m, 1H), 3.73-3.69 (m, 8H).
Пример 39
Получение соединения (39) 6-фтор-2-(4-(2-метиламинопиримидин-2-ил)пиперазин-5-ил)-1Н-бензимидазол-4-формамида.
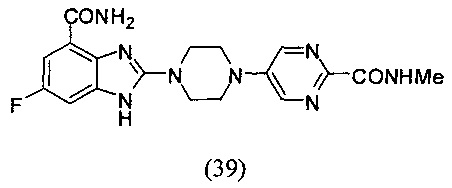
Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-бром-N-метилпиримидин-2-формамида получаем соединение (39) 6-фтор-2-(4-(2-метиламинопиримидин-2-ил)пиперазин-5-ил)-1Н-бензимидазол-4-формамид (16 мг, выход 29%). LC-MS (ESI): m/z 399 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.02 (br, 1H), 9.08 (br, 1Н), 8.67 (s, 2H), 8.34 (br, 1H), 7.71 (br, 1H), 7.33-7.27 (m, 1H), 7.19-7.12 (m, 1H), 3.99 (br, 4H), 3.68 (br, 4H), 2.72 (s, 3H).
Пример 40
Получение соединения (40) 2-(4-(2-этиламинопиримидин-5-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамида.

Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-бром-М-этилпиримидин-2-формамида получаем соединение (40) 2-(4-(2-этиламинопиримидин-5-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамид (17 мг, выход 23%). LC-MS (ESI): m/z 413 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.01 (br, 1H), 9.09 (br, 1H), 8.64 (s, 2H), 8.31 (br, 1H), 7.72 (br, 1H), 7.34-7.27 (m, 1H), 7.19-7.13 (m, 1H), 3.96 (br, 4H), 3.65 (br, 4H), 3.26 (q, 2H, J=6.9 Hz), 1.07 (t, 3H, J=6.9 Hz).
Пример 41
Получение соединения (41) 2-(4-(2-диметиламинопиримидин-5-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамида.

Способ получения аналогичен 5-му этапу получения соединения (1) из примера 1. Из реакции нуклеофильного ароматического замещения в смеси соединения «l» 6-фтор-2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида и 5-бром-N-диметилпиримидин-2-формамида получаем соединение (41) 2-(4-(2-диметиламинопиримидин-5-ил)пиперазин-1-ил)-6-фтор-1Н-бензимидазол-4-формамид (19 мг, выход 26%). LC-MS (ESI): m/z 413 (М+1)+. 1Н NMR (300 MHz, DMSO-d6): δ 12.03 (br, 1H), 9.07 (br, 1H), 8.63 (s, 2H), 8.32 (br, 1H), 7.72 (br, 1H), 7.31-7.26 (m, 1H), 7.18-7.13 (m, 1H), 3.97 (br, 4H), 3.67 (br, 4H), 3.08 (s, 3H), 2.97 (s, 3H).
Биологическая оценка
Принцип проведения испытания
Рибозилирование поли-АДФ нуклеопротеинов - это посттрансляционный механизм, запускающийся в ответ на повреждение ДНК. PARP, а именно поли(АДФ-рибоза)-полимераза, в присутствии NAD катализирует образование цепей поли(АДФ-рибозы) на нуклеопротеинах, тем самым запуская механизм репарации ДНК путем эксцизионного восстановления оснований комплементарных цепей. С помощью НТ Universal Chemiluminescent PARP Assay Kit компании Trevigen можно измерять уровень сцепления маркированной биотином АДФ-рибозы с гистонами.
Реагенты и расходные материалы
1. HT Universal Chemiluminescent PARP Assay Kit with Histone-coated Strip Wells американской компании Trevigen, артикул: 4676-096-K;
2. Планшет-ридер, EnVisionMultilabel Plate Reader американской компании Perkin Elmer.
Растворы и буферные жидкости
1. Промывка. Раствор PBS, содержащий 0.1% Triton Х-100;
2. Буферный раствор 20х PARP. Буферный раствор 20х PARP разбавить в 20 раз деионизированной водой для получения буферного раствора 1х, которым разбавляем рекомбиназы PARP, PARP Cocktail и тестируемое соединение.
3. 10х PARP Cocktail. Способ получения 1x PARP Cocktail: 10x PARP Cocktail 2.5 μl/well, активированная ДНК 10х 2.5 μl/well, буферный раствор 1x PARP 20 μl/well.
4. PARP Enzyme. Непосредственно перед использованием осторожно разбавить рекомбиназы буферным раствором 1x PARP, который необходимо использовать как можно быстрее, неиспользованный раствор утилизируется.
5. Strep-HRP. Непосредственно перед использованием разбавить Strep-HRP в 500 раз разбавителем 1x Strep до получения раствора 1х.
6. Хемилюминесцентные субстраты. Непосредственно перед использованием смешать растворы PeroxyGlow А и В в равных объемах до получения субстратов пероксидазы хрена.
Способ проведения эксперимента
Приготовление соединения
1. Используя DMSO, маточный раствор каждого испытываемого соединения 10 mM разбавили до 10 uM, 1 uM.
2. Непосредственно перед началом эксперимента растворы с разной концентрацией каждого соединения, растворенного в DMSO, разбавили в 20 раз буферным раствором 1x PARP до получения раствора соединения 5х, который использовали для проведении эксперимента. Лунки с положительным контролем (POSITIVE) и отрицательным контролем (NEGATIVE) означают буферный раствор 1х PARP (содержание DMSO 5%).
Этапы проведения эксперимента
1. В каждую лунку добавили 50 мкл буферного раствора 1х PARP для подпитки гистонов. Планшеты инкубировали при комнатной температуре в течение 30 минут. Затем буферный раствор 1x PARP отсосали из лунок и оставшуюся жидкость вытряхнули на бумажную салфетку.
2. Растворы с хорошо разбавленными соединениями 5х (соединения с 1 по 37) добавили в соответствующие лунки, в каждую лунку 10 мкл. Лунки с положительным контролем (POSITIVE) и отрицательным контролем (NEGATIVE) означают буферный раствор 1x PARP (содержание DMSO 5%).
3. Используя буферный раствор 1x PARP, разбавили ферменты PARP так, чтобы в каждых 15 мкл было содержание 0.5Unit. Затем во все лунки, кроме отрицательных, добавили по 15 мкл ферментного раствора. В лунки с отрицательным контролем добавили только буферный раствор 1x PARP. Планшеты инкубировали при комнатной температуре в течение 10 минут.
4. Продолжили добавлять 1x PARP Cocktail по 25 мкл в каждую лунку.
5. Инкубировали при температуре 27°С в течение 60 минут.
6. После окончания инкубирования жидкость из лунок отсосали и оставшуюся жидкость вытряхнули на бумажную салфетку. Затем раствором PBS с 0.1% Triton X-100 промыли планшеты 4 раза, используя по 200 мкл на каждую лунку каждый раз, оставшуюся жидкость вытряхнули на бумажную салфетку.
7. Далее в каждую лунку добавили разведенный раствор 1X Strep-HRP, инкубировали при температуре 27°С в течение 60 минут.
8. После окончания инкубирования жидкость из лунок отсосали и оставшуюся жидкость вытряхнули на бумажную салфетку. Затем раствором PBS с 0.1% Triton X-100 промыли планшеты 4 раза, используя по 200 мкл на каждую лунку каждый раз, оставшуюся жидкость вытряхнули на бумажную салфетку.
9. После промывки планшетов в каждую лунку добавили по 100 мкл раствора из PeroxyGlow А и В, смешанных в равных объемах, и поместили в планшет-ридер для записи хемилюминесцентных сигналов.
Обработка данных
Данные, полученные с каждой лунки, необходимо перевести в коэффициент ингибирования. Коэффициент ингибирования можно вычислить по следующей формуле:
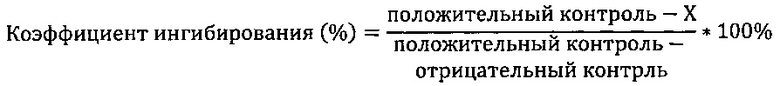
Внимание: данные лунок с положительным контролем означают данные лунок positive, где активность фермента 100%; данные лунок с отрицательным контролем означают данные лунок negative, где активность фермента 0%; активность X означает данные о каждой концентрации каждого образца.
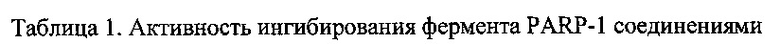

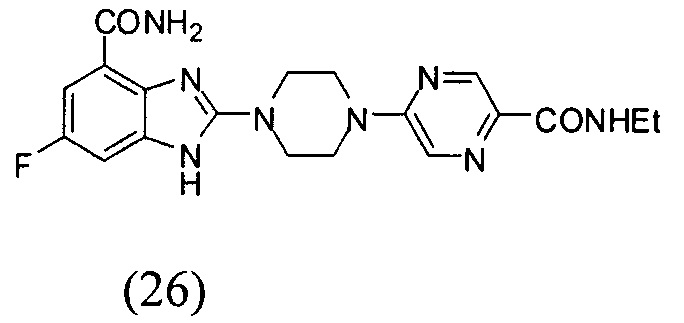
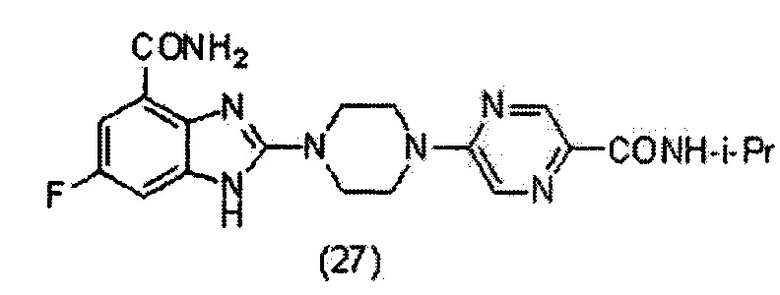
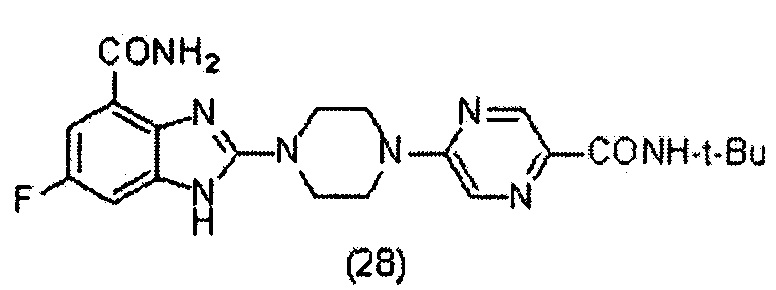
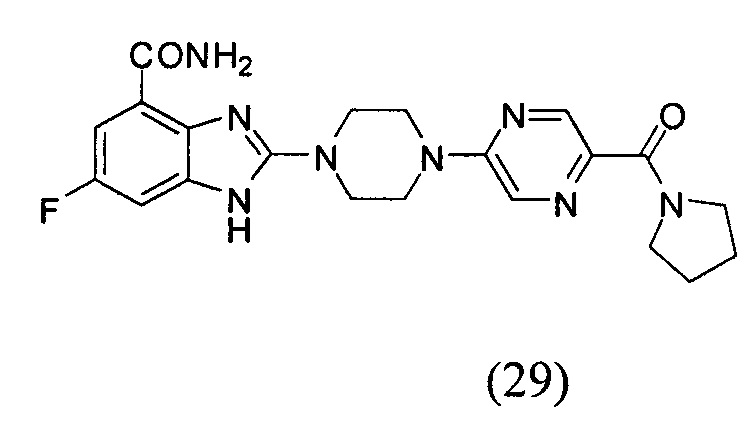
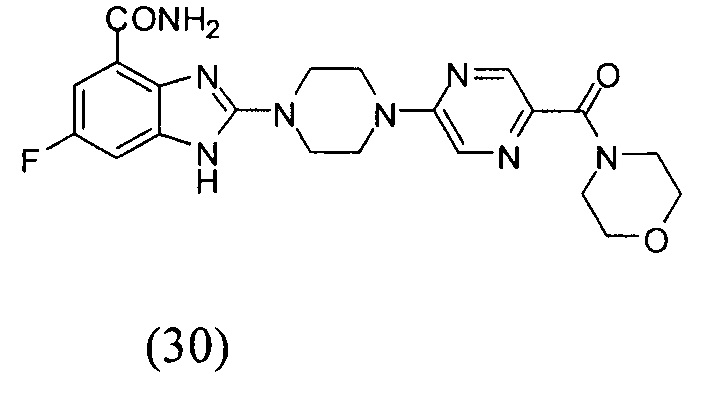
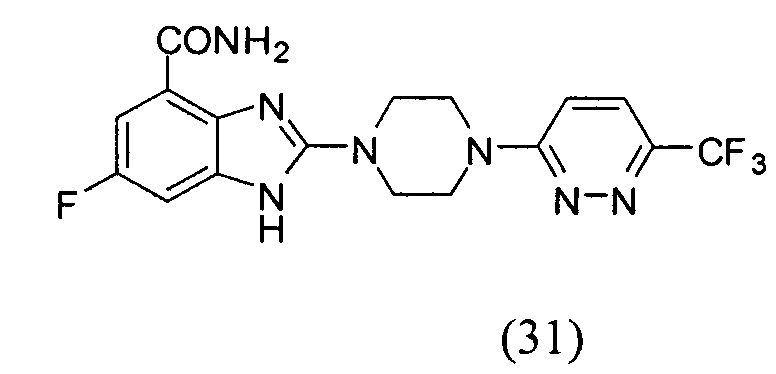
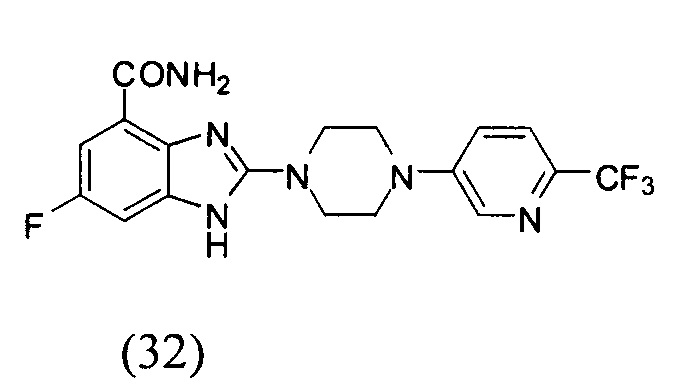
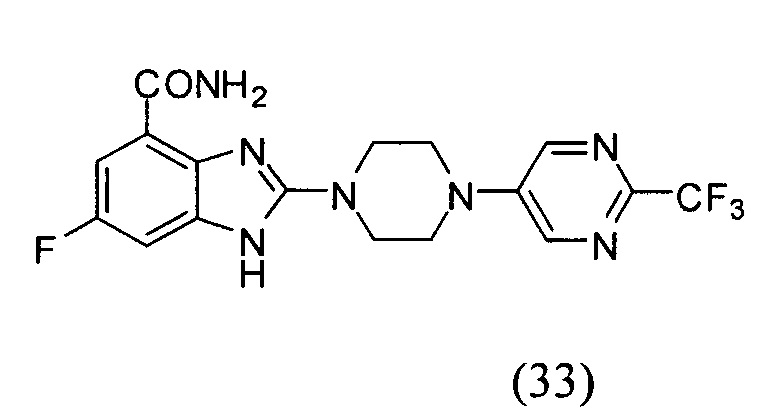
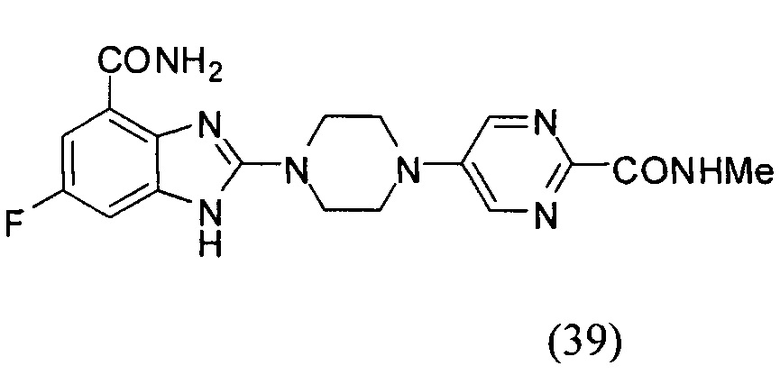
Данные из таблицы 1 показывают, что соединения, предлагаемые в данном изобретении, являются ингибиторами PARP-1. Эксперимент также показал, что соединения (1), (2), (5), (6), (7), (10), (11), (12), (13), (14), (15), (16), (17), (18), (19), (20), (21), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34), (35), (36), (37), (38), (39), (40), (41) имеют значение IC50 не выше 100 nM, а соединения (16), (19), (25), (26), (30), (31), (33), (35), (36), (37), (38), (39), (40), (41) имеют значение IC50 не выше 10 nM.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ ИМИДАЗОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2686314C1 |
| БИ-АРИЛ-МЕТА-ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2006 |
|
RU2589878C2 |
| БИ-АРИЛ-МЕТА-ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2006 |
|
RU2597364C2 |
| Анелированные 9-гидрокси-1,8-диоксо-1,3,4,8-тетрагидро-2Н-пиридо[1,2-a]пиразин-7-карбоксамиды - ингибиторы интегразы ВИЧ, способы их получения и применения | 2019 |
|
RU2717101C1 |
| Соединение-антагонист PD-L1 | 2020 |
|
RU2823231C1 |
| АРИЛСУЛЬФОНИЛМЕТИЛЬНЫЕ ИЛИ АРИЛСУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ РАССТРОЙСТВ, ВОСПРИИМЧИВЫХ К ЛЕЧЕНИЮ ЛИГАНДАМИ ДОФАМИНОВЫХ D РЕЦЕПТОРОВ, С ИХ ПОМОЩЬЮ | 2005 |
|
RU2442781C2 |
| ПРОИЗВОДНЫЕ ИЗОХИНОЛИНОНА, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ РАКА | 2015 |
|
RU2690853C2 |
| Гибридные производные (1Н-1,2,4) триазола и серосодержащих гетероциклов: производных тиазолидин-2,4-диона, тиоморфолин-3-она и 1,4-тиазепан-3-она, обладающих антимикробной активностью | 2020 |
|
RU2771027C1 |
| БЕНЗАМИДНЫЕ ПРОИЗВОДНЫЕ, ОБЛАДАЮЩИЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2565079C2 |
| Способ получения ингибитора ацетилхолинэстеразы (AChE) и ингибитор, полученный способом | 2021 |
|
RU2779555C1 |
Изобретение относится к области органической химии, а именно к производному бензмидазол-2-пиперазин общей формулой (I), где R - фтор; один из X, Y, Z - азот, а два других - углеводороды, либо же X, Y, Z -углеводороды; R1 - водород, метоксил, трифторметил, галоген, циан, CONR2R3 и NR2R3; R2 - водород, C1-С6-алкил; R3 - водород, C1-С6-алкил, или NR2R3 вместе образуют цикл морфолина, пирролидина. Также изобретение относится к способу получения соединения формулы (I). Технический результат: получены новые производные полезные в качестве ингибитора поли(АДФ-рибоза)-полимеразы (PARP). 2 н. и 2 з.п. ф-лы, 1 табл., 41 пр.
1. Гетероциклическое соединение бензимидазол-2-пиперазин, которое является соединением, представленным общей формулой (I):

где
R - фтор;
один из X, Y, Z - азот, а два других - углеводороды, либо же X, Y, Z - углеводороды;
R1 - водород, метоксил, трифторметил, галоген, циан, CONR2R3 и NR2R3;
R2 - водород, C1-С6-алкил;
R3 - водород, C1-С6-алкил, или NR2R3 вместе образуют цикл морфолина, пирролидина.
2. Соединение по п.1, в котором соединение представлено общей формулой (I), где
R - фтор;
один из X, Y, Z - азот, а два других - углеводороды, либо же X, Y, Z - углеводороды;
R1 - водород, метоксил, трифторметил, фтор, циан, CONR2R3 и NR2R3;
R2 - водород, С1-С4-алкил;
R3 - водород, С1-С4-алкил, или NR2R3 вместе образуют цикл морфолина, пирролидина.
3. Соединение по п.1, которое представляет собой соединение (16)-(41):







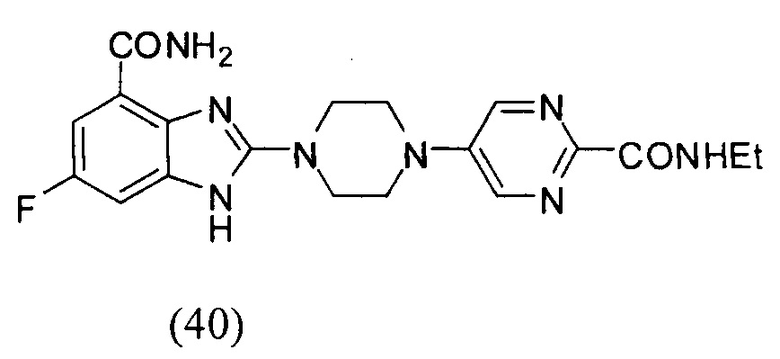

4. Способ получения соединения формулы (I), описанного в пункте 1 формулы изобретения:
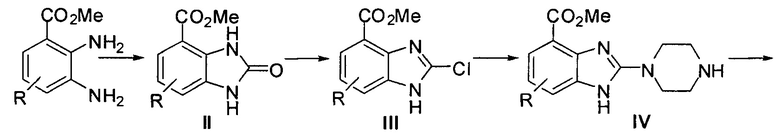
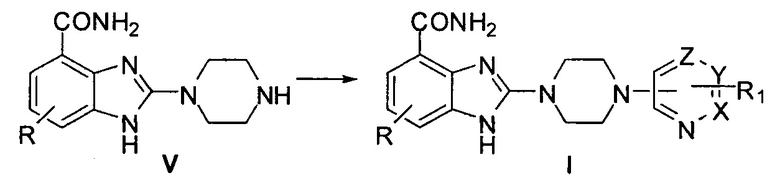
где значение R и R1 описано выше, а сам процесс выглядит так:
этап 1: из циклической реакции 2,3-диаминометилбензоата с карбонилдиимидазолом получают 2-оксо-2,3-дигидро-1Н-бензимидазол-4-метилформиат (II);
этап 2: осуществляют хлорирование полученного на предыдущем этапе 2-оксо-2,3-дигидро-1Н-бензимидазол-4-метилформиата (II) хлорокисью фосфора, в результате чего получают 2-хлор-1H-бензимидазол-4-метилформиат (III);
этап 3: в присутствии диметилформамида проводят нуклеофильное замещение полученного на предыдущем этапе 2-хлор-1Н-бензимидазол-4-метилформиата (III) путем реакции с пиперазином, в результате чего получают 2-(пиперазин-1-ил)-1Н-бензимидазол-4-метилформиат (IV);
этап 4: проводят реакцию аминолиза эфирной группы, полученного на предыдущем этапе 2-(пиперазин-1-ил)-1Н-бензимидазол-4-метилформиата (IV) в тетрагидрофуране и аммиачной воде, в результате чего получают 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамид (V);
этап 5: проводят ароматическое нуклеофильное замещение полученного на предыдущем этапе 2-(пиперазин-1-ил)-1Н-бензимидазол-4-формамида (V) путем реакции с хлор-замещенным гетероарилом или гетероарилформамидом, в результате чего получают соединение, описанное общей формулой (I).
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| НОВЫЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2294326C2 |
Авторы
Даты
2018-03-29—Публикация
2014-06-13—Подача