Область техники, к которой относится изобретение
Настоящее изобретение относится к области белковой инженерии, биотехнологии и медицины и касается способа получения рекомбинантного белка барназы, внеклеточной гуанилспецифичной рибонуклеазы (РНКазы) Bacillus amyloliquefaciens. Изобретение может найти применение при разработке супрамолекулярных белковых комплексов, а также лекарств, подавляющих рост опухолевых клеток.
Уровень техники
Барназа - щелочная внеклеточная РНКаза, продуцируемая бактериями вида Bacillus amyloliquefaciens. Фермент полипептидной природы, состоящий из 110 а.о., принадлежит к классу циклизующих рибонуклеозид-3'-трансфераз и проявляет выраженную специфичность к гуаниловым основаниям (Hartley R.W., Barker E.A. // Nature. 1972. V. 235. P. 15-16). Белок синтезируется в бациллярных клетках в виде белка-предшественника и затем секретируется наружу из клетки. В ходе транспортировки из его состава вычленяется сигнальный пептид. Бациллярные клетки синтезируют специальный белок барстар для защиты от РНКазы в случае ее попадания в цитоплазму. Барстаробразует очень крепкую связь с барназой, полностью блокируя ее активность (Hartley R.W. // TrendsBiochem. Sci. 1989. V. 14. P. 450-454). Барназа не имеет дисульфидных связей и не нуждается ни в посттрансляционных модификациях, ни в ионах двухвалентных металлов, ни в каких-либо других компонентах для проявления своей каталитической функции. Поэтому фермент активен в любой клетке, в которую попадет. Способность барназы расщеплять РНК в любых условиях, и вызывать тем самым гибель клеток, была применена на практике. Ген барназы использовали для индукции мужской стерильности в трансгенных растениях и для получения семян гибридных линий (Mariani C. etal. // Nature. 1990. V. 347. P. 737-741; Singh S.P. etal. // Scientific Reports. 2015. V. 5, 11274).
Барназа изучалась во многих лабораториях. Определена третичная структура фермента высокого разрешения при помощи метода кристаллографии (Martin C. et al. // Acta Crystallogr. D: Biol. Crystallogr. 1999. V. 55. P. 386-398) и ядерного магнитного резонанса (Bycroft M. et al. // Biochemistry. 1991. V. 30. P. 8697-8701).
РНКаза барназа обладает цитотоксическим действием на многие виды опухолевых клеток и в связи с этим представляет интерес для приготовления на ее основе эффективных лекарственных средств для лечения некоторых видов рака. Показано, что барназа способна ингибировать клеточную пролиферацию при ряде лейкозов и солидных опухолей человека (Edelweiss E. et al. // PLoS ONE. 2008. V. 3. с.2434). Из клеточных линий опухолей системы крови к терапии барназой оказались чувствительными U-937, HL-60, K562.
Одним из наиболее перспективных направлений разработки противоопухолевых препаратов на основе барназы является конъюгация ее с другими биологически активными молекулами с целью повысить избирательность действия на опухолевые клетки. Чаще всего используются антитела или их фрагменты. Была показана селективная цитотоксичность и противоопухолевый эффект иммунотоксина на ее основе (Balandin T.G., Edelweiss E., Andronova N.V., Treshalina E.M., Sapozhnikov A.M., Deyev S.M. // Invest New Drugs. 2011. V. 29(1). P. 22-32). Барназа в составе рекомбинантных белков обладает высокой стабильностью и способностью вновь принимать нативную биологически активную конформацию после прекращения действия хаотропных агентов (Martsev S.P., Tsybovsky Y.I., Stremovskiy O.A., Odintsov S.G., Balandin T.G, Arosio P., Kravchuk Z.I., Deyev S.M. // Protein Eng. Des. Sel. 2004. V. 17(1). P. 85-93).
Барназа и барстар при взаимодействии образуют прочный комплекс и характеризуются чрезвычайно быстрой кинетикой (kon ~ 108 М–1⋅с–1) и высокой аффинностью связывания (коэффициент ассоциации Kac ~ 1014 М–1) (Fersht A.R., Schreiber G. // Nat. Struct. Biol. 1996. V. 3. P. 427-431.). У обоих белков N- и C-концевые части локализованы на поверхности белковых глобул вне интерфейса их взаимодействия и доступны для соединения с другими белками в составе рекомбинантных конструкций. Способность барназы формировать высокоаффинный комплекс с барстаром позволяет использовать их в качестве метки (или вектора) для конъюгации с другими белками и пептидами по типу «молекулярного конструктора» для достижения разных целей, например для самосборки гетеромерных надмолекулярных структур [Деев С.М., Лебеденко Е.Н. // Биоорганическая химия. 2015. Т. 41. С. 539-552; Никитин М.П. и др. // Патент RU 2480524 (C2) - 2013-04-27).
Сохраняющаяся популярность барназы диктует необходимость получения этого белка в больших количествах. Наиболее простым способом является экспрессия гена РНКазы в клетках Е. coli.
Известен способ получения барназы в Е. coli, выбранный в качестве аналога,в котором ген барназы, имеющий на 5'-конце последовательность, кодирующую сигнальный пептид phoA, экспрессируется в составе единого оперона с геном барстар под контролем tac-промотора. С помощью пептида phoA РНКаза выводится наружу из клетки, а активность той ее части, которая по той или иной причине остается внутри клетки, блокируется ингибитором барстаром.
(Hartley R.W. // J. Mol. Biol. 1988. V. 202. C. 913-915).
Недостатком указанного способа получения барназы, выбранного в качестве аналога, является низкий выход целевого белкового продукта, примерно 20 мг с литра бактериальной культуры, что объясняется рядом факторов, основным из которых является слабая регуляция tac-промотора, в силу чего клетки рекомбинантного штамма постоянно подвергаются токсическому стрессу, вызванному барназой.
Наиболее близким по технической сущности и достигаемому результату к предлагаемому изобретению является способ получения барназы, принятый за ближайший аналог (прототип),в котором ген РНКазы, имеющий на 5′-конце последовательность, кодирующую сигнальный пептид phoA, экспрессируется в составе единого оперона с геном барстар под контролем pR промотора, регулируемого термочувствительным CI857 репрессором. Экспрессионная система по прототипу обеспечивает более высокие выходы барназы - до 100 мг с литра культуры и решает проблему токсичности РНКазы.
(Okorokov A.L., Hartley R.W., Panov K.I. // Protein Expr. Purif. 1994. V. 5. C. 547-552).
Вместе с тем, недостатками экспрессионной системы по прототипу является относительно невысокий и нестабильный уровень продукции, а также сложность масштабирования методов культивирования полученных штаммов и очистки белка. РНКазу приходится выделять из культуральной жидкости, что диктует необходимость многократного ее разбавления с тем, чтобы обеспечить возможность сорбции РНКазы на хроматографическую смолу. Известна также проблема неправильного процессинга phoA, из-за чего у части молекул РНКазы присутствуют несколько аминокислотных остатков от сигнального пептида. Вычистить препарат от этих молекул бывает очень проблематично. В задачу изобретения положено создание нового способа получения барназы, который лишен перечисленных недостатков.
Задача настоящего изобретения состоит в разработке экономичного и простого способа получения барназы в клетках E.coli с высоким выходом.
Поставленная задача достигается за счет:
1) гена барназы, имеющего на 5'-конце последовательность, кодирующую сигнальный пептид термостабильного токсина STII Е. coli;
2) рекомбинантной плазмиды pET-STII-Ba, содержащей ген барназы и ген барстара в составе вектора экспрессии pET39b;
3) штамма E. coli BL21(DE3)/pET-STII-Ba, получаемого путем трансформации штамма BL21(DE3) плазмидой pET-STII-Ba и отбора клона трансформанта с наиболее высоким уровнем синтеза барназы;
4) способа получения барназы из периплазмы клеток Escherichia coli BL21(DE3)/pET-STII-Ba, выращенных при пониженной температуре (25°С).
В результате решения поставленной задачи получают следующий технический результат:
1) высокий уровень индуцируемого синтеза (45% от суммарного клеточного белка) и стабильную продукцию барназы, которые обеспечиваются штаммом E.coli BL21(DE3)/pET-STII-Ba;
2) существенное упрощение способа получения барназы;
3) улучшение качества получаемой барназы.
Раскрытие изобретения
Решение задачи получения вектора, направляющего эффективный синтез целевого белка в гетерологичной системе, включает следующие необходимые этапы:
а) дизайн конструкции гена целевого белка, предполагающий оптимальную для транскрипции и трансляции его кодирующую последовательность;
б) выбор клеток-хозяев и создание векторных конструкций для экспрессии гена целевого белка в избранной гетерологичной системе;
в) оптимизация условий продукции целевого белка.
Ген барназы, содержащий на 5'-конце последовательность сигнального пептида термостабильного токсина STII Е. coli, получают при помощи метода полимеразной цепной реакции (ПЦР) в два этапа, последовательно наращивая длину последовательности сигнального пептида.
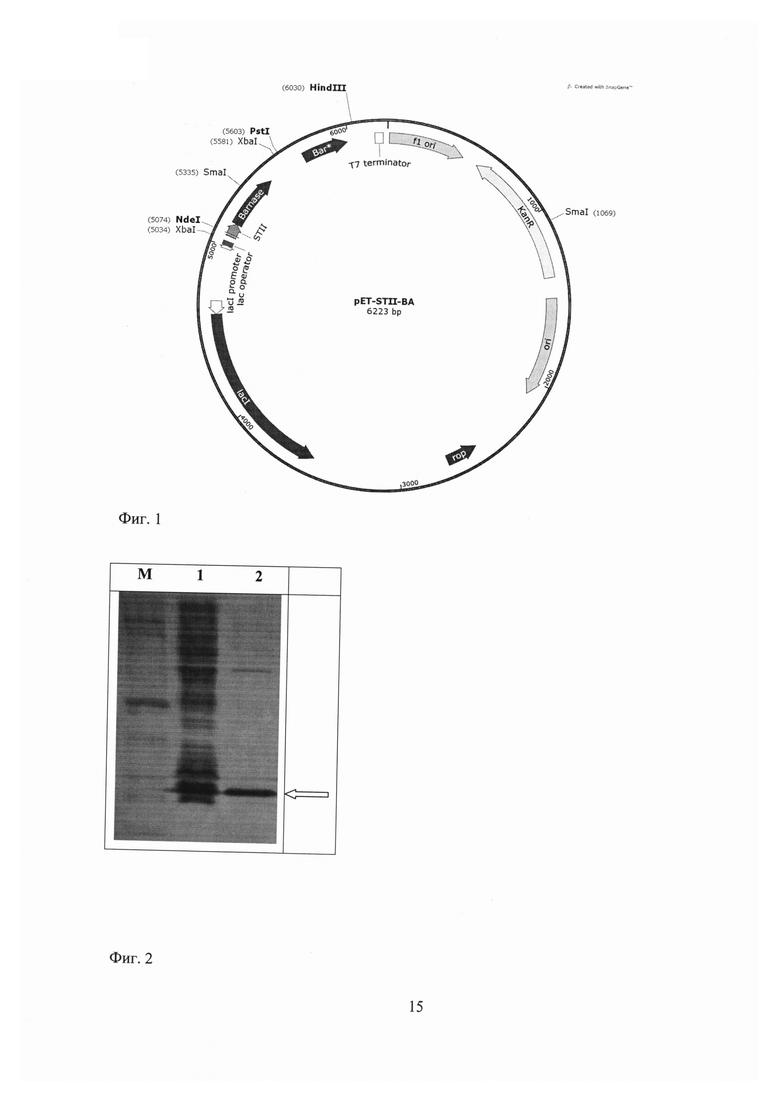
Экспрессирующую рекомбинантную плазмиду pET-STII-Ba получают путем клонирования последовательности, кодирующей барназу и барстар, в вектор pET39b (pET System Manual, 10th Edition Rev.B 0403, Novagen Inc. (2003))по сайтам рестрикции NdeI/HindIII (фиг. 1). Для преодоления чрезвычайной токсичности РНКазы барназы для бактериальной клетки ген целевого белка ставят под контроль индуцируемого промотора фага Т7, кроме того, в конструкцию включаютген ингибитора барназы, барстар, под собственным промотором. С помощью сигнального пептида STII РНКаза выводится наружу из клетки, а активность той ее части, которая оказывается внутри клетки, блокируется ингибитором барстаром.
Путем трансформации клеток штамма Escherichia coli BL21 (DE3) (Studier, F.W. and Moffatt, B.A. // J. Mol. Biol. 1986. V. 189. P. 113-130), сконструированной плазмидой pET-STII-Ba, отбора и культивирования клонов трансформантов с высоким уровнем синтеза барназы получают рекомбинантный штамм Escherichia coli BL21(DE3)/pET-STII-Ba - продуцент барназы. Синтез барназы в полученном рекомбинантном штамме осуществляется при культивировании на обычных селективных средах с добавлением индуктора изопропил-D-тиогалактозида (ИПТГ) или лактозы при пониженной температуре 25°С. Экспериментально было показано, что при таком способе выращивания большая часть РНКазы накапливается в периплазме клеток Е. coli.
В способе получения рекомбинантной барназы белок выделяют из периплазмы клеток, выращенных при пониженной температуре (25°С). Затем барназу дочищают при помощи хроматографии на фосфоцеллюлозе и катионообменнике. Выделение белка из клеточной периплазмы позволяет уменьшить - не менее чем в 5 раз - объем раствора белка, наносимого на хроматографический сорбент, облегчить и ускорить процедуру выделения белка. Кроме того, это позволяет масштабировать любым образом метод очистки белка.
Таким образом, настоящее изобретение включает 3 объекта:
Первый объект - рекомбинантная плазмида pET-STII-Ba, обеспечивающая синтез в клетках Escherichia coli барназы, имеющей аминокислотную последовательность SEQ ID №3, причем указанная плазмида получена путем клонирования рекомбинантного фрагмента ДНК с нуклеотидной последовательностью SEQ ID №1 в плазмидный вектор pET39b по сайтам рестрикции NdeI/HindIII.
Второй объект - рекомбинантный штамм Escherichia coli BL21 (DE3)/pET-STII-Ba, содержащий рекомбинантную плазмиду pET-STII-Ba - продуцент барназы.
Третий объект - способ получения высокоочищенной барназы с использованием штамма Escherichia coli BL21 (DE3)/pET-STII-Ba.
Краткое описание фигур.
Фиг. 1 - Физическая и генетическая карты вектора pET-STII-Ba. Обозначено положение гена барназы, барстар, других элементов вектора, уникальных сайтов рестрикции.
Фиг. 2 - Денатурирующий полиакриламидный гель-электрофорез (1) суммарного клеточного белка и (2) культуральной жидкости рекомбинантного штамма BL21 (DE3)/pET-STII-Ba, выращенного при 25°С; (M) маркеры молекулярных масс. Стрелкой обозначено положение полосы барназы.
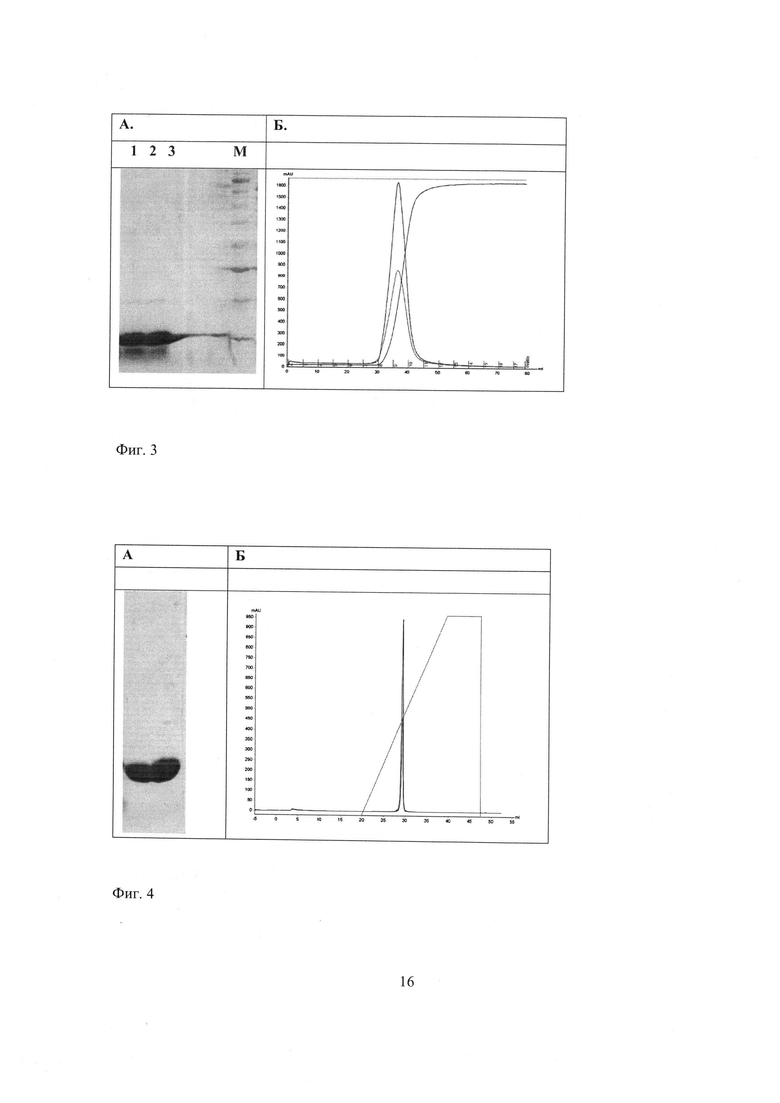
Фиг. 3 - Хроматография на фосфоцеллюлозе.
А. Электрофоретический анализ фракций, содержащих барназу; М - маркеры молекулярных масс;
Б. Профиль элюции.
Фиг. 4 - Хроматография на MonoS 10/100 GL.
А. Электрофоретический анализ очищенной барназы;
Б. Профиль элюции.
Осуществление изобретения.
Пример 1. Получение рекомбинантной ДНК, содержащей ген барназы с N-концевой аминокислотной последовательностью сигнального пептида термостабильного токсина STII Е. coli, а также структурный ген барстар.
Ген барназы с N-концевой последовательностью STII получают при помощи метода полимеразной цепной реакции (ПЦР) в два этапа, последовательно наращивая длину последовательности сигнального пептида.
В качестве матрицы на первом этапе используют плазмидную ДНК pMT416 (Hartley R.W. // J. Mol. Biol. 1988. V. 202. C. 913-915). При помощи двух праймеров
(ST1 5' CTTCTATGTTCGTTTTCTCCATCGCTACCAACGCATACGCGgcccaggttatcaacac 3' HBa 5' GCAAGCTTGCGGGTTTG 3') амплифицируют фрагмент ДНК, содержащий гены барназы и барстар. Праймер HBa содержит рестрикционный сайт HindIII, который необходим для последующего клонирования ПЦР фрагмента в экспрессионный вектор (подчеркнутая последовательность). В последовательности праймера ST1 строчными буквами обозначен участок, который отжигается с 5'-концом последовательности, кодирующей зрелую барназу.
Реакционная смесь содержит:
1 мкл плазмидной ДНК pMT416 с концентрацией 10 нг/мкл;
5 мкл 10-кратного TersusPlus-буфера (Евроген, Россия);
1 мкл 10 мМ смеси dNTPs (NEB);
41 мкл деионизованной воды;
1 мкл термостабильной ДНК полимеразы Tersus (Евроген, Россия).
По 0.5 мкл каждого из праймеров ST1 и HBa с концентрацией 100 мкМ.
Условия проведения ПЦР: температура крышки 105°C; предварительная денатурация 95°C, 1'; денатурация 95°С, 30''; отжиг праймеров 48°С, 30''; элонгация ДНК 72°С, 55''; всего 20 циклов.
ПЦР продукты анализируют при помощи электрофореза в 1.5% агарозном геле и выявляют фрагмент ДНК размером около 950 н.п., который очищают с помощью набора Cleanup Mini («Евроген», Россия), руководствуясь инструкцией производителя.
На втором этапе в качестве матрицы используют продукт ПЦР с первого этапа и пару праймеров: ST25' GCCATATGAAAAAGAACATCGCATTTCTGCTGGCTTCTATGTTCGTTTTCTCC 3' HBa 5' GCAAGCTTGCGGGTTTG 3'. За исключением перечисленных компонентов состав реакционной смеси - такой же, как и на первом этапе. Праймер ST2 содержит рестрикционный сайт NdeI, который необходим для последующего клонирования ПЦР фрагмента в экспрессионный вектор (подчеркнутая последовательность).
Условия проведения ПЦР: температура крышки 105°C; предварительная денатурация 95°C, 1'; денатурация 95°С, 30''; отжиг праймеров 40°С, 30''; элонгация ДНК 72°С, 60''; всего 20 циклов.
ПЦР продукты анализируют при помощи электрофореза в 1.5% агарозном геле. Фрагмент ДНК размером примерно 950 н.п. выделяют из геля с помощью набора Cleanup Mini (Евроген, Россия).
Пример 2. Получение рекомбинантной плазмиды pET-STII-Ba.
Фрагмент ПЦР, полученный как описано в примере 1, встраивают в состав плазмидного вектора pET39b, содержащего промотор фага Т7, обеспечивающий высокий уровень экспрессии гетерологичных генов в штаммах E.coli, синтезирующих T7 полимеразу (pET System Manual, 10thEditionRev.B 0403, Novagen Inc. (2003)). Для этого 100 нг ПЦР фрагмента гидролизуют совместно рестриктазами NdeI/HindIII и объединяют с помощью Т4 ДНК лигазы с плазмидным вектором pET39b, расщепленным теми же рестриктазами.
Полученной лигазной смесью трансформируют компетентные клетки штамма Escherichia coli XL1-Blue:recA1, endA1, gyrA96, thi-1, hsdR17, supE44, relA1, lac [F'proAB, lacIqZΔM15::Tn10(Tetr)] (Stratagene, США); полученные канамицин-устойчивые трансформанты анализируют методом ПЦР-скрининга с праймерами T7dirL и T7rev, имеющих место посадки, соответственно, на Т7 промоторе и Т7 терминаторе, и отбирают «положительные» клоны, образующие ПЦР фрагменты размером примерно 1200 н.п. Несколько «положительных» клонов проверяют секвенированием с использованием этих же праймеров и отбирают клон с геном барназы без неспецифических ПЦР-мутаций, который обозначают как pET-STII-Ba (фиг. 1).
Пример 3. Получение рекомбинантного штамма - продуцента барназы.
Рекомбинантный штамм-продуцент барназы получают путем трансформации штамма E.coli BL21(DE3) [F-, ompT, hsdSB (rB-, mB-), dcm, gal, λ(DE3)] (Studier, F.W. andMoffatt, B.A. // J. Mol. Biol. 1986. V. 189. P. 113-130) плазмидой pET-STII-Ba. Выбор данного штамма в качестве реципиента для продукции барназы обусловлен тем, что он синтезирует РНК-полимеразу фага Т7, а также обладает сниженной протеазной активностью, что способствует повышению выхода целевых белков.
Поскольку первичные трансформанты DE3-реципиентов могут заметно отличаться по уровню экспрессии целевого белка (Vethanayagam J, Flower A. // Microbial Cell Factories. 2005. V. 4. P. 3-7), для селекции наиболее активного продуцента барназы и параметров индукции синтеза барназы отдельные клоны трансформантов выращивают в условиях «автоиндукции» (Studier F.W. // Protein Expr. Purif. 2005. V. 41. №1. P. 207-234) в течение 24-48 часов при 25°С с периодическим отбором аликвот суспензии клеток. Для получения грубого экстракта осадок клеток из 100-200 мкл культуры суспендируют в 100 мкл лизирующего буфера для нанесения на ДСН-ПААГ, прогревают 3 мин при 85°С, клеточный дебрис удаляют центрифугированием (12000 об/мин, 5 мин) и 5 мкл полученного экстракта анализируют путем электрофореза в 15% денатурирующем полиакриламидном геле.
Появление отчетливой полосы размером примерно 16 кДа в образцах анализируемых штаммов при ее отсутствии в контрольном реципиентном штамме BL21(DE3) принимают за доказательство способности штамма синтезировать барназу.
Клон трансформанта, отличающийся наибольшим выходом барназы, обозначают BL21(DE3)/pET-STII-Ba.
Выход барназы в полученном штамме E. coli BL21(DE3)/pET-STII-Ba составляет 45% от суммарного белка клетки.
Клетки полученного рекомбинантного штамма Escherichia coli BL21(DE3)/pET-STII-Ba характеризуются следующими признаками.
Морфологические признаки: Клетки имеют продолговатую палочковидную форму, при делении не почкуются.
Культуральные признаки: Клетки хорошо растут на обычно используемых питательных средах. Время генерации около 30 мин в жидкой LB-среде. На 2-2,5% питательном агаре "Difco" образуются круглые, гладкие, желтоватые колонии с ровными краями. При выращивании на жидких LB- и YT-средах образуется интенсивная ровная мутность.
Физиолого-биохимические признаки: Оптимальная температура культивирования - от 25 до 30°C, оптимум рН - 7,6. Источником азота служат органические соединения (в виде триптона, дрожжевого экстракта).
Уровень синтеза барназы в сконструированном штамме составляет около 200 мг с литра культуры, что следует из данных определения барназы в образцах биомассы штамма-продуцента с помощью электрофореза в 15% ДСН-ПААГ (фиг. 2).
Пример 4. Получение биомассы рекомбинантного штамма-продуцента барназы.
Размороженную аликвоту штамма-продуцента в объеме 100 мкл вносят в колбу на 100 мл, содержащую 10 мл среды YT с глюкозой 1 г/л и канамицином 50 мг/л. Выращивают посевной материал на качалке при 250 об/мин и 37°С в течение нескольких часов до достижения оптической плотности примерно 0.5 о.е. при 260 нм.
Посевной материал переносят в колбу объемом 2 л, содержащую 200 мл жидкой питательной среды ZYM-5052 (Studier F.W. // Protein Expr. Purif. 2005. V. 41. №1. P. 207-234) с 50 мг/л канамицина, и культивируют при температуре 25°С и 250 об/мин в течение суток.
Биомассу осаждают центрифугированием при 6000 g в течение 10 мин. Надосадочную жидкость сливают, а биомассу замораживают при -70°С.
Выход влажной биомассы составляет от 10.0 до 20.0 г/л культуральной среды.
Пример 5. Выделение и очистка барназы.
Суспендируют биомассу, собранную с 100 мл культуры, в 20 мл 200 мМ Трис-HCl, 0.5 М сахароза, 1 мМ ЕДТА (рН 8.0). Добавляют лизоцим до конечной концентрации 60 мкг/мл. Разбавляют суспензию в два раза водой и инкубируют при комнатной температуре в течение 30 мин. Центрифугируют при 6000 g, 4°С, в течение 20 мин. Супернатант разбавляют в 5 раз 20 мМ NaOAc, рН 4.5 и подтитровывают до рН 5.0 ледяной уксусной кислотой. Образующийся преципитат осаждают центрифугированием при 6000 g, 4°С, в течение 20 мин. Супернатант фильтруют через фильтр Millex-GP 0.22 μm (33 мм) (MILLIPORE, США) и наносят на колонку XK16/20, набитую фосфоцеллюлозой (Sigma, США) и уравновешенную 20 мМ NaOAc, рН 4.5. Сорбент последовательно промывают 20 мМ NaOAc, рН 4.5, затем 20 мМ NaPi, рН 7.0 до достижения стабильных значений базовой линии (примерно 10 объемов колонки). Белок элюируют 50 мМ NaPi, 1.7 М (NH4)Cl, рН 7.0; собирают все светопоглощающие фракции (фиг. 3).
Элюат наносят на колонку HiPrep 26/10 Desalting Column (GE Healthcare, США), уравновешенную 20 мМ NaOAc, рН 4.5, и собирают все светопоглощающие фракции вплоть до выхода с колонки соли.
Объединенную фракцию наносят на колонку MonoS 10/100 GL (GE Healthcare, США),уравновешенную 20 мМ NaOAc, рН 5.0. Колонку отмывают тем же буфером. Белок элюируют в линейном градиенте NaCl. Собранные фракции анализируют при помощи денатурирующего гель-электрофореза по Лэмли. Фракции, содержащие барназу, объединяют и концентрируют при помощи Amicon Ultra-15 (c MWCO 5000) (Merck Millipore, США) (фиг. 4).
Пример 6. Определение ферментативной (РНКазной) активности барназы.
Для определения ферментативной активности барназы используют модифицированный метод кислоторастворимого осадка. В качестве субстрата используют дрожжевую РНК.
Исследуемую пробу белка растворяют в концентрации 1,25 мкМ в буферном растворе 0.125 М Трис-HCl, pH 8.5 и затем получают серию последовательных 5-кратных разведений образца в том же буфере. В качестве отрицательного контрольного образца используют буферный раствор 0.125 М Трис-HCl, pH 8.5. В качестве положительного контрольного образца используют стандартный образец рекомбинантной барназы. К 40 мкл каждого образца добавляют 160 мкл раствора дрожжевой РНК (в концентрации 2 г/л) в 0.125 М Трис-HCl, pH 8.5 на льду. Реакционную смесь инкубируют 30 минут при +37°С. Реакцию останавливают добавлением 200 мкл 6% хлорной кислоты и инкубируют смесь 15 мин при 0°С. После чего центрифугируют при 16000 g в течение 10 минут. Супернатанты разбавляют в 10 раз и измеряют оптическую плотность при 260 нм (OD260) относительно контрольного образца. Большим значениям оптической плотности соответствует большая РНКазная активность. 1 ед. акт. РНКазы в исследуемой пробе соответствует приращению OD260 на 0.05 единиц.



Группа изобретений относится к биотехнологии и касается получения рекомбинантной барназы. Предложена рекомбинантная плазмида pET-STII-Ba, обеспечивающая синтез в клетках Escherichia coli барназы, имеющей аминокислотную последовательность SEQ ID №3. Указанная плазмида получена путем клонирования рекомбинантного фрагмента ДНК с нуклеотидной последовательностью SEQ ID №1 в плазмидный вектор pET39b по сайтам рестрикции NdeI/HindIII. Предложен рекомбинантный штамм Escherichia coli BL21(DE3)/pET-STII-Ba, содержащий рекомбинантную плазмиду pET-STII-Ba и продуцирующий барназу. Способ получения барназы, имеющей аминокислотную последовательность SEQ ID №3, из биомассы штамма Escherichia coli BL21(DE3)/pET-STII-Ba включает выделение белка из периплазмы клеток, выращенных при пониженной температуре 25ºС, и последующую его очистку при помощи хроматографии на фосфоцеллюлозе и катионообменнике. Группа изобретений позволяет увеличить и стабилизировать продукцию рекомбинантной барназы при накоплении последней в периплазме клеток, выращенных при пониженной температуре 25°С. 3 н.п. ф-лы, 4 ил., 6 пр.
1. Рекомбинантная плазмида pET-STII-Ba, обеспечивающая синтез в клетках Escherichia coli барназы, имеющей аминокислотную последовательность SEQ ID №3, причем указанная плазмида получена путем клонирования рекомбинантного фрагмента ДНК с нуклеотидной последовательностью SEQ ID №1 в плазмидный вектор pET39b по сайтам рестрикции NdeI/HindIII.
2. Рекомбинантный штамм Escherichia coli BL21(DE3)/pET-STII-Ba, содержащий рекомбинантную плазмиду pET-STII-Ba по п.1 - продуцент барназы.
3. Способ получения барназы, имеющей аминокислотную последовательность SEQ ID №3, из биомассы штамма Escherichia coli BL21(DE3)/pET-STII-Ba по п.2, включающий выделение белка из периплазмы клеток, выращенных при пониженной температуре (25°С), и последующую его очистку при помощи хроматографии на фосфоцеллюлозе и катионообменнике.
| OKOROKOV A.L | |||
| et al | |||
| An Improved System for Ribonuclease Ba Expression // Protein Expression and purification, 1994, 5, p | |||
| Комнатная печь | 1922 |
|
SU547A1 |
| CHEN M | |||
| et al | |||
| The roles of signal peptide and mature protein in RNase (barnase);export from Bacillus subtilis // Mol Gen Genet, 1993, 239: 409-415 | |||
| КОНСТРУКЦИЯ НА ОСНОВЕ БЕЛКОВОЙ ПАРЫ БАРНАЗА-БАРСТАР И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2480524C2 |
| база данных EMBL-EBI, ID: AGM65031, sequence 11 from patent US 8383575, 30.05.2013, найдено он-лайн https://www.ebi.ac.uk/Tools/dbfetch/dbfetch?db=uspto_prt;id=AGM65031. | |||
Авторы
Даты
2018-04-17—Публикация
2017-01-17—Подача