По данной заявке испрашивается приоритет согласно 35 U.S.С. §119 по предварительной патентной заявке США с серийным номером №61/548901, поданной 19 октября 2011 года; и предварительной патентной заявке США с серийным номером №61/663263, поданной 22 июня 2012 года, обе озаглавленные «Сконструированные микробы и способы получения микробного масла», содержание каждой из которых включено в настоящий документ путем отсылки в полном объеме.
Сведения о предшествующем уровне техники
Биотопливо, производимое на устойчивой основе, является альтернативой ископаемым видам топлива и может способствовать уменьшению истощения легкодоступных запасов ископаемых видов топлива, избегая при этом загрязнения и парниковых выбросов, связанных с ископаемыми видами топлива, удовлетворяя, таким образом, растущий спрос на доступную энергию на устойчивой основе. Разработка способов и вырабатывающих масло организмов, пригодных для эффективной конверсии источников углерода в липиды, является необходимым условием широкомасштабного внедрения производства микробного биотоплива.
Краткое описание изобретения
Выработка микробного масла гетеротрофными организмами является наиболее перспективным путем экономически эффективного производства биотоплива из возобновляемых ресурсов при условии достижения высоких степеней конверсии. Ключом к экономически эффективному производству микробного масла из возобновляемого сырья является высокий выход конверсии углеводов в масло. Метаболическая инженерия стала технологией, применяющейся для этой цели, и отмечаются многочисленные примеры успешного конструирования путей обмена веществ, которые значительно улучшили характеристики микробных биокатализаторов при проведении синтеза химических, фармацевтических и топливных продуктов.
Предпринятые ранее усилия по инженерингу микробов для выработки масла были направлены на усиление предполагаемых определяющих скорость стадий в пути синтеза жирных кислот. Одним существенным недостатком таких усилений является то, что увеличение потока углерода на пути синтеза жирных кислот повышает уровень насыщенных жирных кислот в клетке, что активирует петлю сильной отрицательной обратной связи биосинтеза жирных кислот.
Некоторые аспекты данного изобретения обеспечивают стратегию инженеринга микробов, которая объединяет усиление вышерасположенных (upstream), формирующих метаболит путей, также называемое здесь как «push» метаболических путей, с аналогичным увеличением потока нижерасположенных (downstream), секвестирующих продукт путей, также называемым здесь как «pull» путей. Некоторые аспекты данного изобретения предусматривают, что сбалансированное сочетание «push» и «pull» модификаций в микробе приводит к большим усилениям потока углерода на пути синтеза липидов без значительных отклонений концентраций промежуточных метаболитов от их гомеостатических физиологических уровней, что позволяет избежать ингибирования синтеза липидов по типу обратной связи.
Некоторые аспекты данного изобретения относятся к признанию того, что эффекты модификаций по одной линии, например, только «push» модификаций или только «pull» модификаций, на эффективность конверсии, как правило, ограничены по причине компенсаторной регуляции выхода при синтезе в клетке, и что согласованная «push» и «pull» модуляция стадий биосинтеза липидов в микробных клетках приводит к неожиданному синергическому эффекту на выработку липидов.
Например, некоторые аспекты данного изобретения обеспечивают генетически модифицированные жирообразующие микробы (жировые, маслянистые), содержащие комбинацию модификаций в своих путях биосинтеза липидов, также называемых здесь как «push-pull» модификации. В некоторых вариантах осуществления микроб, представленный здесь, содержит модификацию, влияющую на увеличение выработки метаболитов или интермедиатов, необходимых для синтеза липидов, и модификацию, приводящую к секвестрированию продукта синтеза липидов, например триацилглицерина, в форму запасания липида в пределах клетки, ослабляя, таким образом, ингибирование синтеза липидов по типу обратной связи некоторыми его продуктами, например, жирными кислотами или диацилглицеринами. В некоторых вариантах осуществления сочетание модификаций метаболического «push» и метаболического «pull» путей приводит к синергически увеличенной выработке липидов. В некоторых вариантах осуществления модификация «push» приводит к увеличенному уровню строительных блоков синтеза липидов или метаболитов для синтеза липидов в клетке. В некоторых вариантах осуществления модификация «pull» ослабляет ингибирование синтеза липидов по типу обратной связи.
Некоторые аспекты данного изобретения обеспечивают микробы, которые содержат генетические модификации, одновременно влияющие на «push» и «pull» пути биосинтеза липидов. Например, «push» и «pull» модификации вводят в экспериментальный микроб, предназначенный для выработки масла, жирообразущие дрожжи Yarrowia lipolytica. Сверхэкспрессию диацилглицерин-ацилтрансферазы (DGA1), конечный этап на пути синтеза триглицерида (TAG), исследовали как пример «pull» модификации. Сверхэкспрессия DGA1 привела к 4-кратному увеличению выработки липидов по сравнению с контрольными микробами, до содержания липидов, составляющего 33,8% сухого веса клеток (DCW). Сверхэкспрессию ацетил-СоА-карбоксилазы (АСС1), первый осуществляемый этап синтеза жирных кислот, исследовали как пример «push» модификации. Сверхэкспрессия АСС1 увеличила содержание липидов в 2 раза по сравнению с контролем, до содержания липидов, составляющего 17,9%. Одновременную коэкспрессию АСС1 и DGA1 из тандемной экспрессионной генетической конструкции исследовали как пример «push-pull» модификации. Одновременная сверхэкспрессия АСС1 и DGA1 дополнительно увеличила содержание липидов до 41,4%, демонстрируя синергические эффекты коэкспрессии АСС1+DGA1.
Характеристики трансформанта АСС1+DGA1 в отношении выработки липидов использовали для ферментации в биореакторе объемом 2 л, достигая 61,7% содержания липидов через 120 ч. Общий выход и продуктивность составили 0,195 г/г и 0,143 г/л/ч, соответственно, при этом максимальные выход и продуктивность составили 0,270 г/г и 0,253 г/л/ч во время фазы накопления липидов процесса ферментации. Этот результат демонстрирует отличную способность жирообразущих дрожжей Y. Lipolytica вырабатывать липиды, а также эффекты метаболического конструирования двух важных стадий пути синтеза липидов, которые действуют по перенаправлению потока в сторону синтеза липидов и создают движущую силу для синтеза TAG.
Некоторые аспекты данного изобретения обеспечивают новую платформу для сверхэкспрессии для использования в вырабатывающих масло микробах, например, в жирообразущих дрожжах. Некоторые аспекты данного изобретения обеспечивают экспрессионные конструкции, содержащие промотор, управляющий транскрипцией транскрипта, который содержит кодирующую последовательность и интрон, например, промотор фактора элонгации трансляции 1α (TEF), расположенный выше нуклеотидной последовательности, содержащей интрон и кодирующую последовательность. Некоторые аспекты данного изобретения предполагают, что такие интрон-содержащие экспрессионные конструкции способны увеличивать экспрессию по меньшей мере в 17 раз по сравнению с не содержащим интрон промотором TEF.
Некоторые аспекты данного изобретения обеспечивают изолированную жирообразующую клетку, содержащую генетическую модификацию, которая увеличивает экспрессию продукта гена DGA1. В некоторых вариантах осуществления изолированная жирообразующая клетка дополнительно содержит генетическую модификацию, которая увеличивает экспрессию продукта гена АСС1. В некоторых вариантах осуществления изолированная жирообразующая клетка дополнительно содержит генетическую модификацию, которая увеличивает экспрессию продукта гена SCD. В некоторых вариантах осуществления изолированная жирообразующая клетка дополнительно содержит генетическую модификацию, которая увеличивает экспрессию продукта гена ACL. В некоторых вариантах осуществления генетическая модификация содержит конструкцию нуклеиновой кислоты, которая увеличивает экспрессию генного продукта, при этом конструкция нуклеиновой кислоты содержит (а) экспрессионную кассету, содержащую нуклеотидную последовательность, кодирующую продукт гена под контролем пригодного гомологичного или гетерологичного промотора, и/или (b) нуклеотидную последовательность, которая модулирует уровень экспрессии продукта гена при вставке в геном клетки. В некоторых вариантах осуществления промотор представляет собой индуцируемый или конститутивный промотор. В некоторых вариантах осуществления промотор представляет собой промотор TEF. В некоторых вариантах осуществления экспрессионная кассета дополнительно содержит интрон. В некоторых вариантах осуществления интрон расположен ниже сайта инициации транскрипции. В некоторых вариантах осуществления интрон находится в пределах нуклеотидной последовательности, кодирующей продукт гена. В некоторых вариантах осуществления конструкция нуклеиновой кислоты ингибирует или нарушает природную регуляцию нативного гена, кодирующего продукт гена, что приводит к сверхэкспрессии нативного гена. В некоторых вариантах осуществления ингибирование или нарушение природной регуляции нативного гена опосредовано делецией, нарушением, мутацией и/или замещением регуляторного участка, или части регуляторного участка, регулирующего экспрессию гена. В некоторых вариантах осуществления продукт гена представляет собой транскрипт. В некоторых вариантах осуществления продукт гена представляет собой белок. В некоторых вариантах осуществления конструкция нуклеиновой кислоты вставлена в геном клетки. В некоторых вариантах осуществления увеличенная экспрессия продукта гена придает предпочтительный фенотип клетке для превращения источника углерода в липид, например, жирную кислоту, производное жирной кислоты и/или триацилглицерин (TAG). В некоторых вариантах осуществления предпочтительный фенотип содержит модифицированный профиль жирных кислот, модифицированный профиль TAG, увеличенную скорость синтеза жирной кислы и/или триацилглицерина, увеличенный выход конверсии, увеличенное накопление триацилглицерина в клетке и/или увеличенное накопление триацилглицерина в липидном теле клетки. В некоторых вариантах осуществления скорость синтеза жирной кислоты или TAG клетки по меньшей мере в 2 раза увеличена по сравнению с не модифицированными клетками такого же клеточного типа. В некоторых вариантах осуществления скорость синтеза жирной кислоты или TAG клетки по меньшей мере в 5 раз увеличена по сравнению с не модифицированными клетками такого же клеточного типа. В некоторых вариантах осуществления скорость синтеза жирной кислоты или TAG клетки по меньшей мере в 10 раз увеличена по сравнению с не модифицированными клетками такого же клеточного типа. В некоторых вариантах осуществления клетка превращает источник углерода в жирную кислоту или TAG при скорости конверсии в диапазоне от около 0,025 г/г до около 0,32 г/г (например, г выработанного липида/г потребленного источника углерода). В некоторых вариантах осуществления клетка превращает источник углерода в жирную кислоту или TAG при скорости конверсии по меньшей мере около 0,11 г/г. В некоторых вариантах осуществления клетка превращает источник углерода в жирную кислоту или TAG при скорости конверсии по меньшей мере около 0,195 г/г. В некоторых вариантах осуществления клетка превращает источник углерода в жирную кислоту или TAG при скорости конверсии по меньшей мере около 0,24 г/г. В некоторых вариантах осуществления клетка превращает источник углерода в жирную кислоту или TAG при скорости конверсии по меньшей мере около 0,27 г/г. В некоторых вариантах осуществления клетка содержит липидное тело и вакуоль. В некоторых вариантах осуществления клетка представляет собой бактериальную клетку, водорослевую клетку, грибковую клетку или дрожжевую клетку. В некоторых вариантах осуществления клетка представляет собой жирообразующую дрожжевую клетку. В некоторых вариантах осуществления клетка представляет собой клетку Y. Lipolytica.
Некоторые аспекты данного изобретения обеспечивают культуру, содержащую жирообразующую клетку, например, жирообразующую клетку, описанную здесь. В некоторых вариантах осуществления культура дополнительно содержит источник углерода. В некоторых вариантах осуществления источник углерода включает сбраживаемый сахар. В некоторых вариантах осуществления сбраживаемый сахар представляет собой С6 сахар. В некоторых вариантах осуществления источник углерода содержит глюкозу. В некоторых вариантах осуществления источник углерода содержит органическую кислоту. В некоторых вариантах осуществления органическая кислота представляет собой уксусную кислоту. В некоторых вариантах осуществления уксусная кислота содержится при концентрации по меньшей мере 5% об./об., по меньшей мере 10% об./об., по меньшей мере 15% об./об., по меньшей мере 20% об./об., по меньшей мере 25% об./об. или по меньшей мере 30% об./об. В некоторых вариантах осуществления источник углерода содержит ацетат. В некоторых вариантах осуществления ацетат содержится при концентрации по меньшей мере 1% об./об. В некоторых вариантах осуществления ацетат содержится при концентрации по меньшей мере 2% об./об. В некоторых вариантах осуществления ацетат содержится при концентрации по меньшей мере 3% об./об. В некоторых вариантах осуществления ацетат содержится при концентрации по меньшей мере 4% об./об. В некоторых вариантах осуществления ацетат содержится при концентрации по меньшей мере 5% об./об. В некоторых вариантах осуществления культура содержит глицерин. В некоторых вариантах осуществления глицерин содержится при концентрации около 2% об./об. В некоторых вариантах осуществления культура содержит растворенный кислород на уровне по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15% или по меньшей мере 20%. В некоторых вариантах осуществления культура проявляет рН в диапазоне от рН 7,0 до рН 7,5. В некоторых вариантах осуществления культура содержит сульфат аммония. В некоторых вариантах осуществления культура содержит сульфат аммония и уксусную кислоту в соотношении 1:2. В некоторых вариантах осуществления культура проявляет титр липидов в диапазоне от 5 г/л до 60 г/л. В некоторых вариантах осуществления культура проявляет выработку липидов в диапазоне от 0,04 г/л/ч до 0,60 г/л/ч. В некоторых вариантах осуществления культура проявляет максимальную продуктивность липидов в диапазоне от 0,1 г/л/ч до 1 г/л/ч.
Некоторые аспекты данного изобретения обеспечивают способ, включающий приведение в контакт источника углерода с изолированной жирообразующей клеткой, при этом клетка содержит генетическую модификацию, которая увеличивает экспрессию продукта гена DGA1; и инкубацию источника углерода, приведенного в контакт с клеткой, в условиях, пригодных для по меньшей мере частичной конверсии клеткой источника углерода в жирную кислоту или триацилглицерин. В некоторых вариантах осуществления жирообразующая клетка дополнительно содержит генетическую модификацию, которая увеличивает экспрессию продукта гена АСС1. В некоторых вариантах осуществления жирообразующая клетка дополнительно содержит генетическую модификацию, которая увеличивает экспрессию продукта гена SCD. В некоторых вариантах осуществления жирообразующая клетка дополнительно содержит генетическую модификацию, которая увеличивает экспрессию продукта гена ACL. В некоторых вариантах осуществления изолированная жирообразующая клетка представляет собой инженерную изолированную жирообразующую клетку, описанную здесь. В некоторых вариантах осуществления источник углерода содержит сбраживаемый сахар. В некоторых вариантах осуществления источник углерода содержит глюкозу. В некоторых вариантах осуществления источник углерода содержит ацетат. В некоторых вариантах осуществления ацетат содержится при концентрации по меньшей мере 1% об./об., по меньшей мере 2% об./об., по меньшей мере 3% об./об., по меньшей мере 4% об./об. или по меньшей мере 5% об./об. В некоторых вариантах осуществления источник углерода содержит уксусную кислоту. В некоторых вариантах осуществления уксусная кислота содержится при концентрации по меньшей мере 5% об./об., по меньшей мере 10% об./об., по меньшей мере 15% об./об., по меньшей мере 20% об./об., по меньшей мере 25% об./об. или по меньшей мере 30% об./об. В некоторых вариантах осуществления способ включает приведение в контакт клетки с растворенным кислородом при уровне по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15% или по меньшей мере 20%. В некоторых вариантах осуществления приведение в контакт и/или инкубацию выполняют при рН в диапазоне от рН 7,0 до рН 7,5. Способ по любому из пунктов 53-69 включает приведение в контакт клетки с сульфатом аммония. В некоторых вариантах осуществления способ включает приведение в контакт клетки с сульфатом аммония и уксусной кислотой в соотношении 1:2. В некоторых вариантах осуществления способ дополнительно включает приведение в контакт клетки с глицерином. В некоторых вариантах осуществления способ включает приведение в контакт клетки с глицерином при концентрации около 2% об.об. В некоторых вариантах осуществления источник углерода, приведенный в контакт с изолированной жирообразующей клеткой, инкубируют в реакторе. В некоторых вариантах осуществления источник углерода приводят в контакт с изолированной жирообразующей клеткой и инкубируют для конверсии источника углерода в жирную кислоту или триацилглицерин в ходе периодического процесса с подпиткой «fed batch process». В некоторых вариантах осуществления источник углерода приводят в контакт с изолированной жирообразующей клеткой и инкубируют для конверсии источника углерода в жирную кислоту или триацилглицерин в ходе непрерывного процесса. В некоторых вариантах осуществления способ дополнительно включает приведение в контакт дополнительного количества источника углерода или некоторого количества дополнительного источника углерода с источником углерода, приведенным в контакт с изолированной жирообразующей клеткой, один или более раз во время стадии инкубации. В некоторых вариантах осуществления жирная кислота или триацилглицерин экстрагирован из источника углерода, приведенного в контакт с изолированной жирообразующей клеткой, путем экстракции растворителем. В некоторых вариантах осуществления экстракция растворителем включает экстракцию смесью хлороформ-метанол. В некоторых вариантах осуществления экстракция растворителем включает экстракцию гексаном. В некоторых вариантах осуществления жирную кислоту или триацилглицерин отделяют от источника углерода, приведенного в контакт с изолированной жирообразующей клеткой, и затем очищают путем переэтерификации.
Некоторые аспекты данного изобретения обеспечивают способ, включающий модификацию профиля жирной кислоты, профиля триацилглицерина, скорости синтеза жирной кислоты, скорости синтеза триацилглицерина, степени накопления производного жирной кислоты, скорости секреции производного жирной кислоты, скорости конверсии углевода в жирную кислоту или производное жирной кислоты, и/или эффективной степени конверсии углевода в жирную кислоту или производное жирной кислоты в жирообразующей клетке путем увеличения в клетке экспрессии продукта гена DGA1. В некоторых вариантах осуществления способ дополнительно включает увеличение в клетке экспрессии продукта гена АСС1, продукта гена SCD и/или продукта гена ACL. В некоторых вариантах осуществления степень накопления производного жирной кислоты представляет собой степень накопления производного жирной кислоты в липидном теле. В некоторых вариантах осуществления производное жирной кислоты представляет собой триацилглицерин. В некоторых вариантах осуществления модификация профиля жирной кислоты, профиля триацилглицерина, скорости синтеза жирной кислоты, скорости синтеза триацилглицерина, степени накопления производного жирной кислоты, скорости секреции производного жирной кислоты, скорости конверсии углевода в жирную кислоту или производное жирной кислоты, и/или эффективной степени конверсии углевода в жирную кислоту или производное жирной кислоты в жирообразующей клетке включает увеличение скорости синтеза жирной кислоты, скорости синтеза триацилглицерина, степени накопления производного жирной кислоты, скорости секреции производного жирной кислоты, скорости конверсии углевода в жирную кислоту или производное жирной кислоты, и/или эффективной степени превращения углевода в жирную кислоту или производное жирной кислоты в жирообразующей клетке. В некоторых вариантах осуществления модификация эффективности конверсии углевода в жирную кислоту или производное жирной кислоты клетки включает увеличение эффективности конверсии по меньшей мере в 2 раза. В некоторых вариантах осуществления модификация эффективности конверсии углевода в жирную кислоту или производное жирной кислоты клетки включает увеличение эффективности конверсии по меньшей мере в 3 раза. В некоторых вариантах осуществления модификация эффективности конверсии углевода в жирную кислоту или производное жирной кислоты клетки включает увеличение эффективности конверсии по меньшей мере в 4 раза. В некоторых вариантах осуществления модификация эффективности конверсии углевода в жирную кислоту или производное жирной кислоты клетки включает увеличение эффективности конверсии, по меньшей мере, в 5 раз. В некоторых вариантах осуществления клетка представляет собой клетку дрожжей. В некоторых вариантах осуществления клетка дрожжей представляет собой клетку Yarrowia sp. В некоторых вариантах осуществления жирообразующие дрожжи представляют собой Y. Lipolytica.
Некоторые аспекты данного изобретения обеспечивают изолированную молекулу нуклеиновой кислоты, содержащую: а) нуклеотидную последовательность, которая кодирует SEQ ID NO: 2 (Y. lipolytica DGA1), или b) нуклеотидную последовательность, которая по меньшей мере на 85% идентична нуклеотидной последовательности а). В некоторых вариантах осуществления нуклеотидная последовательность, которая кодирует SEQ ID NO: 2, содержит SEQ ID NO: 1. Некоторые аспекты данного изобретения обеспечивают экспрессионную кассету, содержащую изолированную молекулу нуклеиновой кислоты, описанную здесь, и гетерологичный промотор. В некоторых вариантах осуществления промотор представляет собой конститутивный промотор или индуцируемый промотор. В некоторых вариантах осуществления гетерологичный промотор представляет собой промотор фактора элонгации трансляции (TEF). В некоторых вариантах осуществления гетерологичный промотор содержит интрон. В некоторых вариантах осуществления гетерологичный промотор дополнительно содержит инициирующий кодон. В некоторых вариантах осуществления интрон расположен ниже сайта инициации трансляции нуклеотидной последовательности, которая кодирует SEQ ID NO: 2. Некоторые аспекты данного изобретения обеспечивают вектор, содержащий экспрессионную кассету, описанную здесь. Некоторые аспекты данного изобретения обеспечивают клетку, содержащую экспрессионную кассету, описанную здесь, или по меньшей мере часть вектора, описанного здесь.
Объект данной заявки может включать, в некоторых случаях, взаимосвязанные продукты, альтернативные решения определенной проблемы и/или совокупность разных способов использования единой системы или изделия.
Другие преимущества, отличительные признаки и применения изобретения будут очевидны из подробного описания определенных неограничивающих вариантов осуществления, чертежей и формулы изобретения.
Краткое описание чертежей
Фигура 1. Общий вид главных метаболических путей для синтеза липидов в Y. Lipolytica.
Фигура 2. Ферментативная активность β-галактозидазы под действием различных промоторов после 50 часов культивирования.
Фигура 3. Ферментация в биореакторе трансформанта ACC1+DGA1 (MTYL065).
Фигура 4. Профиль жирной кислоты (FAP) трансформанта АСС1+DGA1 в ферментационном биореакторе объемом 2 л.
Фигура 5. Профиль жирной кислоты трансформанта АСС+DGA, выращенного в биореакторе объемом 2 л с ацетатом в качестве источника углерода.
Фигура 6. Выработка жирной кислоты АСС+DGA1 Y. Lipolytica на ацетате.
Фигура 7. Схема конструкции комбинаторной экспрессии. Путь клонирования и стратегия конструирования плазмид, содержащих комбинацию генов-мишеней накопления липидов. Эти плазмиды затем были трансформированы в Y. lipolytica для исследования накопления липидов.
Фигура 8. Транскрипционная экспрессия кассеты TEFin-DGA при интегрировании через рМТ053 в сравнении с рМТ092.
Фигура 9. Относительная продуктивность и выход липидов между штаммами Y. Lipolytica, экспрессирующими комбинаторные конструкции, измеренные по общему содержанию жирной кислоты, нормализованному к контрольному штамму. Присутствие (+) или отсутствие (-) трансформированной сверхэкспрессионной кассеты для соответствующего целевого гена указано под графиком. Продуктивность (светло серые столбцы) рассчитывали как относительное накопление липидов в течение первых 100 часов культивирования. Расчеты выходов производились путем деления накопления липидов на потребленный сахар. Отношение C/N среды составило 20. Результаты представляют собой усредненные значения множества экспериментов.
Фигура 10. Транскрипционная экспрессия целевых генов в штамме MTYL089. Экспрессия внутренне нормализована к экспрессии актина, и произведено сравнение с контрольным штаммом (MTYL038), и измерения проводились после 66 часов выращивания.
Фигура 11. Периодическая ферментация в биореакторе штамма MTYL089, сверхэкспрессия АСС, D9, ACL12 и DGA. Молярное отношение C/N равно 100. Все отборы образцов выполняли в трех параллелях.
Фигура 12. Микроскопия штамма MTYL089 в конце ферментации в объеме 2 л. Нормальная световая микроскопия (изображение слева) показывает, что большинство клеток находится в форме дрожжей и содержит большие вакуоли. Флуоресцентная микроскопия (изображение справа) показывает, что эти вакуоли состоят из нейтральных липидов.
Фигура 13. Сравнение профилей жирных кислот между штаммами MTYL065 и MTYL089. Профили жирных кислот, взятые из конечного момента времени в соответствующих ферментациях, нормализованы к общему содержанию жирных кислот.
Фигура 14. Изменения азота (мМ), титры нелипидов и липидов (г/л).
Фигура 15. Изменения титра липидов (г/л), содержание липидов (%) и отношение C/N. Первичная ось показывает титр липидов и содержание липидов в виде % сухого веса клеток. Вторичная ось показывает отношение C/N. Отношение C/N падает в конце по причине быстрого потребления ацетата.
Фигура 16. Вверху - «Плавающие клетки», наблюдаемые под масляно-иммерсионным микроскопом (100Х) без флуоресценции. Внизу - Такая же рамка в условиях флуоресценции показывает яркое красное липидное тело.
Подробное описание определенных вариантов осуществления изобретения
Жидкое биотопливо является перспективной альтернативой ископаемым видам топлива, что может помочь рассеять опасения по поводу изменения климата и сгладить неопределенности, связанные с поставками (1). Биодизель, авиационное масло и другие виды топлива, получаемые из масла, особенно необходимы для авиации и тяжелых транспортных средств. В настоящее время они производятся исключительно из растительных масел, что является затратным и нерациональным путем (2). Привлекательной возможностью является нефотосинтетическая конверсия возобновляемого углеводного сырья в масло (3). Для биодизеля, переход с растительного масла на производство микробного масла имеет множество дополнительных преимуществ: приспособляемость к различным видам сырья, гибкость в отношении требований к земле, эффективный оборот производственного цикла и легкость расширения производства (4). К тому же, биологические платформы для микробного производства легче поддаются генетической модификации для дальнейшей оптимизации.
Ключом к экономически эффективной микробной технологии для конверсии углеводов в масла является высокий выход конверсии углеводов в масло. Метаболическая инженерия стала новой технологией, применяющейся для этой цели, и отмечаются многочисленные примеры успешного конструирования путей обмена веществ, которые значительно улучшили характеристики микробных биокатализаторов при проведении синтеза химических, фармацевтических и топливных продуктов (5). Предпринятые ранее усилия, направленные на инженеринг микробов с высоким выходом липидов, были сфокусированы на усиление предполагаемых определяющих скорость стадий в пути синтеза жирных кислот (6). Эти усилия, однако, дали неоднозначные результаты, по-видимому, по той причине, что модулирующий поток жирной кислоты вызвал образование насыщенных жирных кислот, которые являются сильными аллостерическими ингибиторами ферментов биосинтеза жирных кислот, обеспечивая петлю отрицательной обратной связи для биосинтеза жирной кислоты (7). В настоящем документе авторы описывают подход, который объединяет усиление вышерасположенных (upstream), формирующих метаболит путей, с аналогичным увеличением потока нижерасположенных (downstream), потребляющих метаболит путей. В сбалансированном состоянии эта стратегия «push-and-pull» может привести к большим усилениям потока без значительных отклонений концентраций промежуточных метаболитов от их гомеостатических физиологических уровней.
Жирообразующие дрожжи Yarrowia lipolytica являются перспективным кандидатом для производства микробного масла, которые также продемонстрировали пригодность во многих других областях промышленности: производстве лимонной кислоты, производстве белков (например, протеаз и липаз) и биоремедиации (8-10). С помощью полностью секвенированного генома и растущего числа инструментов генетической инженерии, инженеринг Y. Lipolytica может быть достигнут относительно легко (11). Было также обнаружено, что Y. lipolytica являются устойчивыми при культивировании, могут расти на различных субстратах, и использовались для производства липидов на агропромышленных остатках, промышленном глицерине и промышленных жирах (12-14). Y. lipolytica обладают великолепной способностью накапливать липиды, как правило, накапливая до 36% их сухого веса клеток (DCW) в виде липидов (15).
Метаболические пути de novo синтеза липидов в Y. Lipolytica начинают полностью определяться и существующая в настоящее время модель синтеза липидов проиллюстрирована на Фигуре 1: Глюкоза, вступающая на путь гликолиза, поступает в митохондрию виде пирувата для использования в цикле ТСА; однако, избыток ацетил-соА переносится из митохондрии в цитозоль посредством челночного механизма с участием цитрата. Цитозольный ацетил-СоА затем превращается в малонил-СоА под действием ацетил-СоА-карбоксилазы (АСС), что является первой стадии синтеза жирной кислоты. После синтеза жирной кислоты синтез триацилглицерина (TAG) следует пути Кеннеди, который возникает в эндоплазматическом ретикулуме (ER) и липидных телах. Ацил-СоА является предшественником, используемым для переноса ацильной группы на глицерол-3-фосфата с образованием лизофосфатидной кислоты (LPA), которая затем ацилируется с образованием фосфатидной кислоты (РА). Фосфатидная кислота (РА) затем подвергается дефосфорилированию с образованием диацилглицерина (DAG), и затем конечное ацилирование происходит с помощью диацилглицерол-ацилтрансферазы (DGA) с получением TAG.
Транспорт ацетил-СоА из митохондрии в цитозоль происходит путем опосредованного АТР-цитрат-лиазой (ACL) расщепления цитрата посредством челночного механизма с участием цитрата с получением ацетил-СоА и оксалоацетата (ОАА). Ацетил-СоА-карбоксилаза (АСС) затем катализирует первую осуществляемую стадию в направлении биосинтеза липидов, превращая цитозольный ацетил-СоА в малонил-СоА, который является исходным предшественником для элонгации жирных кислот. Полные жирные цепи ацил-СоА затем переносятся в эндоплазматический ретикулум (ER) или мембраны липидного тела для конечной сборки триацилглицерина (TAG) посредством пути Кеннеди. Свыше 80% накапливаемых липидов, вырабатываемых в Y. lipolytica, находится в форме TAG (16). Цитозольный ОАА превращается в малат под действием дегидрогеназы яблочной кислоты и переносится обратно в митохондрию для завершения цикла по механизму челночного переноса с участием цитрата. Восстановительные эквиваленты в форме NADPH обеспечены либо с помощью пентозофосфатного пути или с помощью малик-фермента в трансгидрогеназной реакции. В Y. lipolytica интенсивный поток через пентозофосфатный путь (РРР) и слабая сверхэкспрессия малик-фермента дает основание предположить, что первое является первичным источником для NADPH (4, 17).
Внутриклеточное накопление липидов может происходить двумя способами: синтез липидов de novo или внедрения ex novo экзогенных жирных кислот и липидов. Накопление липидов чаще всего происходит, когда поступление питательных веществ исчерпывается в присутствии избытка углерода. В культуре это состояние обычно совпадает с началом стационарной фазы. На практике наиболее часто используемым лимитирующим питательным веществом является азот, так как его легко контролировать в композициях среды (15). Несмотря на эти индуцируемые условия, пути синтеза липидов жестко регулируются организмом для уравновешивания роста клеток с накоплением энергии. Например, АСС, взятый отдельно, регулируется на множестве уровнях и множеством факторов (7).
Это жесткое регулирование в некоторых случаях удалось обойти. Путем устранения путей пероксисомального окисления и инженеринга метаболизма глицерина, Y. Lipolytica способны обеспечить 40%-70% липидов посредством ex novo накопления липидов (18, 19). Коэкспрессия генов Δ6- и Δ12-десатуразы обеспечивает значительную выработку γ-линоленовой кислоты (GLA) (20). Однако инженеринг путей биосинтеза липидов в Y. lipolytica все еще сравнительно мало используются и до сих пор разрабатываются стратегии эффективного инженеринга путей выработки липидов для максимального увеличения выхода.
Некоторые аспекты данного изобретения обеспечивают сконструированные микробы для производства биотоплива или предшественника биотоплива. Термин «биотопливо» относится к топливу, которое получено из биологического источника, такого как живая клетка, микроб, гриб или растение. Термин включает, например, топливо, напрямую полученное из биологического источника, например, с помощью обычных способов экстракции, дистилляции или очистки, и топливо, полученное путем обработки предшественника биотоплива, полученного из биологического источника, например, путем химической модификации, такой как процессы переэтерификации. Примерами биотоплива, которое можно получить напрямую, являются спирты, такие как этанол, пропанол и бутанол, жир и масло. Примерами биотоплива, которое можно получить путем обработки предшественника биотоплива (например, липида), являются биодизельное (например, полученное путем переэтерификации липида) и зеленое дизельное/модифицированное дизельное топливо (например, полученное путем гидрирования масла). На сегодняшний день биодизель, также называемый как сложный метиловый (или этиловый) эфир жирной кислоты, является одним из наиболее важных с экономической точки зрения видов биотоплива и может быть получен в промышленном масштабе путем переэтерификации липидов, когда гидроксид натрия и метанол (или этанол) взаимодействуют с липидом, например, триацилглицерином, с получением биодизеля и глицерина.
Сырье для производства в промышленном масштабе биодизеля включает животные жиры, растительные масла, пальмовое масло, пеньку, сою, семена рапса, лен, подсолнечник и масличные водоросли. В других подходах биомасса превращается с помощью микроба в предшественник биотоплива, например, липид, который затем экстрагируют и в дальнейшем обрабатывают с получением биотоплива. Термин «биомасса» относится к материалу, полученному путем роста и/или распространения живой клетки или организма, например, микроба. Биомасса может содержать клетки, микробы и/или внутриклеточное содержимое, например, клеточные жирные кислоты и TAGS, а также внеклеточный материал. Внеклеточный материал включает, но без ограничения, соединения, секретируемые клеткой, например, секретируемые жирные кислоты или TAG. Важными типами биомассы для производства биотоплива являются биомасса водорослей и биомасса, полученная из растений, например, кукурузная солома и древесное волокно. В некоторых вариантах осуществления биомасса для производства биотоплива или предшественника биотоплива может содержать сахара, полученные из растений, например, сахар, полученный из тростника или кукурузы.
Некоторые аспекты данного изобретения относятся к инженерингу и разработке микробных источников липидов, полезных, например, для производства в промышленном масштабе экономически целесообразного биодизеля. Термин «липид» относится к жирным кислотам и их производным. Соответственно, примеры липидов включают жирные кислоты (FA, насыщенные и ненасыщенные); глицериды или глицеролипиды, также называемые как ацилглицеролы (такие как моноглицериды (моноацилглицеролы), диглицериды (диацилглицеролы), триглицериды (триацилглицеролы, TAG или нейтральные жиры); фосфоглицериды (глицерофосфолипиды); неглицериды (сфинголипиды, стерольные липиды, в том числе холестерин и стероидные гормоны), пренольные липиды, в том числе терпеноиды, жирные спирты, воски и поликетиды); и комплексные производные липидов (связанные с сахаром липиды или гликолипиды, и связанные с белком липиды). Липиды представляют собой основную часть плазматической мембраны живых клеток и микробов. Некоторые клетки и микробы также вырабатывают липиды для накопления энергии, например, в форме триацилглицеридов в липидных телах, липидных каплях или вакуолях.
Некоторые аспекты данного изобретения относятся к сконструированным микробам для производства биотоплива или предшественника биотоплива. В некоторых вариантах осуществления микробы, обеспеченные здесь, сконструированы для оптимизации их метаболизма липидов для выработки липидов. Термин «метаболизм липидов» относится к молекулярным процессам, которые включают образование или деградацию липидов. Синтез жирных кислот, окисление жирных кислот, десатурации жирных кислот, синтез TAG, резервирование TAG и деградация TAG служат примерами процессов, которые являются частью липидного метаболизма клетки. Соответственно, термин «метаболизм жирных кислот» относится ко всем клеточным или организменным процессам, которые включают синтез, образование, трансформацию или деградацию жирных кислот. Синтез жирных кислот, окисление жирных кислот, синтез TAG и деградация TAG служат примерами процессов, которые являются частью метаболизма жирных кислот клетки.
Термин «триацилглицерин» (TAG, иногда также называемый как триглицерид) относится к молекуле, содержащей одну молекулу глицерина, ковалентно связанную с тремя молекулами жирных кислот, алифатических монокарбоновых кислот, посредством сложноэфирных связей, одной на каждую из трех гидроксильных (ОН) групп молекулы глицерина. Триацилглицерины представляют собой высококонцентрированные резервы метаболической энергии благодаря своей восстановленной безводной природе и являются подходящим сырьем для производства биодизеля.
Многие клетки и организмы хранят метаболическую энергию в форме жирных кислот и производных жирных кислот, таких как TAG. Жирные кислоты и их производные, такие как TAG, обеспечивают идеальную форму для хранения метаболической энергии. Энергия, содержащаяся в связях С-С, может эффективно высвобождаться путем β-окисления, реакции, формально эквивалентной процессу, противоположному биосинтезу жирных кислот, но опосредуемой и регулируемой различными ферментами, определяющими различные молекулярные пути. Микробы могут извлекать жирные кислоты из внешних источников, эндогенного оборота и синтеза de novo. Некоторые аспекты данного изобретения относятся к идентификации микроба для производства биотиплива или предшественника биотоплива на основе способности микроба эффективно синтезировать и хранить жирные кислоты или производные жирных кислот, такие как TAG, из внешне поставляемого источника углерода.
Молекулы природных жирных кислот обычно имеют неразветвленную алифатическую цепь или хвост, содержащий от 4 до 28 атомов углерода. Жирные кислоты называются как «насыщенные», если все атомы углерода алифатической цепи соединены посредством простой связи С-С, или как «ненасыщенные», если два или более атомов углерода соединены посредством двойной связи С-С. Ненасыщенные жирные кислоты играют важную роль в регулировании текучести мембраны, клеточной активности, метаболизме и ядерных событиях, управляющих транскрипцией генов.
Спектр жирных кислот в дрожжах состоит в основном из жирных кислот С16 и С18, например, пальмитиновой кислоты (С16), пальмитинолеиновой кислоты (с16), стеариновой кислоты (С18) и олеиновой кислоты (С18). Пальмитиновая кислота представляет собой неразветвленную насыщенную жирную кислоту с алифатической цепью из 16 атомов углерода (атомы углерода/ненасыщенные связи: 16.0). Стеариновая кислота представляет собой неразветвленную насыщенную жирную кислоту с алифатической цепью из 18 атомов углерода (18.0). Пальмитинолеиновая кислота представляет собой мононенасыщенную жирную кислоту с алифатической цепью из 16 атомов углерода (16.1). Олеиновая кислота представляет собой мононенасыщенную жирную кислоту с алифатической цепью из 18 атомов углерода (18.1). Разновидности жирных кислот, присутствующие в незначительных количествах в дрожжах, включают жирные кислоты С14 и С26, которые выполняют важную функцию по модификации белка или в качестве компонентов сфинголипидов и гликозилфосфатидилинозитолов, соответственно.
Синтез de novo жирных кислот использует значительные количества метаболитов, ацетил-СоА, АТР и NADPH, и, таким образом, соревнуется с другими клеточными процессами, которые зависят от этих соединений. NADPH требуется для двух стадий восстановления в цикле элонгации жирной кислоты, связывая синтез жирной кислоты с метаболическим состоянием клетки, и приводит к синтезу жирной кислоты, ограниченному условиями высокой энергетической нагрузки клеток, что подтверждается увеличенным отношением АТР/АМР, повышенными эквивалентами восстановления и повышенным пулом ацетил-СоА. Почти все субклеточные органеллы вовлечены в метаболизм жирных кислот, что указывает на то, что поддержание гомеостаза жирных кислот требует регуляции на многих уровнях. Стадии синтеза липидов, на которых генерируются метаболиты, ацетил-СоА, АТР или NADPH для биосинтеза липидов, иногда называются здесь как «стадии push» синтеза липидов. Усиление процесса, который увеличивает выработку метаболитов, ацетил-СоА, АТР или NADPH для синтеза липидов в клетке, например, путем сверхэкспрессии продукта гена, опосредующего такой процесс выработки метаболитов, иногда называется здесь как «push модификация».
Большинство организмов, включая дрожжи, способны синтезировать de novo жирные кислоты из различных источников углерода. На начальной стадии ацетил-СоА карбоксилируют путем добавления СО2 в малонил-СоА с помощью фермента ацетил-СоА-карбоксилазы (АСС; кодированной АСС1 и HFA1 в дрожжах). Биотин является важным кофактором в этой реакции и ковалентно присоединен к апопротеину АСС посредством фермента биотин:апопротеин лигазы (кодированной BPL1/ACC2 в дрожжах). АСС представляет собой трехфункциональный фермент, содержащий домен белка-носителя биотин карбоксила (ВССР), домен биотинкарбоксилазы (ВС) и домен карбоксилтрансферазы (СТ). У большинства бактерий эти домены экспрессируются в виде индивидуальных полипептидов и собираются в гетеромерный комплекс. Напротив, эукариотическая АСС, включая митохондриальные варианты АСС (Hfa1 в дрожжах), содержит эти функции на одном полипептиде. Малонил-СоА, продуцируемый АСС, служит в качестве донора двухуглеродных фрагментов в циклических сериях реакций, катализируемых синтазой жирных кислот, FAS и элонгазами.
Промежуточным продуктом синтеза de novo жирных кислот являются насыщенные жирные кислоты. Насыщенные жирные кислоты, как известно, являются предшественниками ненасыщенных жирных кислот в эукариотах, включая дрожжи. Ненасыщенные жирные кислоты, как правило, получают путем десатурации простых связей С-С в насыщенных жирных кислотах с помощью специальных ферментов, называемых десатуразами. Контрольные механизмы, которые управляют превращением насыщенных жирных кислот в ненасыщенные жирные кислоты, не совсем понятны. В эукариотах ненасыщенные жирные кислоты выполняют важные функции по регулированию текучести мембран, клеточной активности, метаболизма и ядерных событий, которые управляют транскрипцией генов. Как правило, около 80% жирных кислот дрожжей являются мононенасыщенными, что означает, что они содержат одну ненасыщенную связь в своей алифатической цепи.
Жирные кислоты являются сильными ингибиторами синтеза жирных кислот, и ингибирование по типу обратной связи синтеза жирных кислот жирными кислотами является важной помехой в инженеринге микробов для производства масла. Некоторые аспекты данного изобретения основаны на признании того, что, в то время как «push» модификации синтеза липидов обычно не могут перекрывать опосредованное жирными кислотами ингибирование по типу обратной связи синтеза липидов, сочетание «push» модификации (например, сверхэкспрессия АСС1) с «pull» модификацией (например, сверхэкспрессия DGA1) может эффективно обходить ингибирование по типу обратной связи, таким образом, в полной мере реализуя увеличение потока углерода на путь синтеза липидов, например, в TGA, хранящихся в липидном теле или вакуоли клетки.
Некоторые аспекты данного изобретения обеспечивают стратегии инженеринга микробов для производства масла. В некоторых вариантах осуществления такие стратегии используют генетический инженеринг жирообразующих микробов, например, Y. Lipolytica, для одновременного усиления «push-» и «pull-»стадии синтеза липидов. Как описано здесь, значительные увеличения выработки липидов в клетках-хозяевах жирообразующих дрожжей были достигнуты с использованием этих стратегий.
Некоторые аспекты данного изобретения основаны на признании того, что «push» и «pull» модификации, например, одновременное усиление метаболических стадий, которые продуцируют метаболиты для путей синтеза липидов, и метаболических стадий, которые депонируют продукты синтеза, опосредуя ингибирование синтеза липидов по типу обратной связи, приводят к значительному увеличению потока углерода на пути синтеза липидов по сравнению с инженерингом только «push» или только «pull» модификаций. Некоторые аспекты данного изобретения относятся к неожиданному открытию того, что сверхэкспрессия продукта гена DGA1 в жирообразующем микробе, например, Yarrowia lipolytica, приводит к значительному увеличению потока углерода на путь синтеза липидов, и что одновременная сверхэкспрессия продукта гена АСС1 синергирует со сверхэкспрессией DGA1, что приводит к получению «push» и «pull» модифицированного микроба, который обладает значительно усиленными свойствами в отношении углеродного потока, и является пригодным для производства масла в промышленном масштабе из различных углеродных субстратов.
Открытие того, что сбалансированная модуляция генерирующих метаболит стадий (например, образование малонил-СоА), а также секвестирующих продукт стадий метаболизма (например, ацилирование диацилглицеринов в триацилглицерины) в микробе, приводящая к значительному увеличению чистого потока углерода в сторону синтеза липидов, имеет важное значение для процессов, направленных на превращение возобновляемых источников углерода в биотопливо или предшественники биотоплива с помощью инженерных клеток. На основе некоторых аспектов данного изобретения стало возможным модифицировать метаболизм микробов для синтеза липидов, например жирообразующих дрожжей, таких как Y. Lipolytica, способом, который придает желательные фенотипы для конверсии в промышленном масштабе углевода в биотопливо или предшественник биотоплива, такие как значительные увеличения синтеза жирных кислот, синтеза TAG, а также резервирование жирной кислоты и TAG в липидных телах или вакуолях.
Согласно некоторым аспектам данного изобретения, модификация метаболизма липидов в микробе в соответствии со способами, обеспеченными здесь, например путем одновременной сверхэкспрессии продукта гена, опосредующего генерирующую метаболит («push») стадию, и продукта гена, опосредующего секвестирующую продукт («pull») стадию синтеза липидов, позволяет создать микроб, оптимизированный для использования в процессах производства биотоплива или предшественников биотоплива. Некоторые аспекты данного изобретения обеспечивают стратегии и способы инеженеринга метаболизма жирной кислоты в микробе путем одновременного усиления стадии «push» и стадии «pull» биосинтеза липидов, что приводит к увеличению скорости синтеза и накоплению жирных кислот, и производных жирных кислот в микробе.
Некоторые аспекты данного изобретения обеспечивают способы, которые включают генетические модификации, приводящие к модуляции экспрессии и/или активности продуктов генов, регулирующих липидный метаболизм микробов для производства биотоплива или предшественника биотоплива. Такие генетические модификации в соответствии с некоторыми аспектами данного изобретения нацелены на увеличение превращения углеводов в жирную кислоту и/или TAG для оптимизации модифицированного микроба для производства в промышленном масштабе липидов из источника углерода, например, источника углеводов. Некоторые модификации, обеспеченные в соответствии с некоторыми аспектами данного изобретения, например, сверхэкспрессия, нокаут, нокдаун, активация и/или ингибирование специфических продуктов гена, могут быть достигнуты по отдельности или в сочетании, и/или в сочетании с другими модификациями, известными специалистам в данной области. Термин «модификация» относится как к генетической манипуляции, например, сверхэкспрессии, нокауту, нокдауну, активации и/или ингибированию специфических продуктов гена, так и к негенетической манипуляции, например, манипуляция со средой для выращивания, субстратом, предварительной обработкой субстрата, рН, температурой, процессом превращения и т.д.
Модификация экспрессии генов, также называемая здесь как модуляция экспрессии генов, может представлять собой нарушение или ингибирование природной регуляции экспрессии, сверхэкспрессию, ингибирование экспрессии или полное прекращение экспрессии заданного гена. Вставка гетерологичного промотора в положение выше последовательности нативного гена, например, последовательности нативного гена DGA1 или АСС1, или делеция регуляторных последовательностей в области промотора, например, регуляторных последовательностей, которые опосредуют ингибирование по типу обратной связи гена DGA1 или АСС1 насыщенными жирными кислотами, являются примерами нарушения или ингибирования природной регуляции экспрессии. Стратегии модуляции экспрессии генов могут включать генетические изменения, например, с помощью рекомбинантных технологий, таких как направленное воздействие на гены или вирусные трансдукции, или негенетические изменения, например изменения, вызванные изменениями окружающей среды, которые, как известно, приводят к повышающему или понижающему регулированию экспрессии генов, или транзиентную доставку модуляторов, например, лекарственных средств или малых молекул РНК в целевые клетки. Способы генетических или негенетических изменений микробов хорошо известны специалистам в данной области и описаны, например, в J. Sambrook and D. Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; 3rd edition (January 15, 2001); David C. Amberg, Daniel J. Burke; and Jeffrey N. Strathern, Methods in Yeast Genetics: A Cold Spring Harbor Laboratory Course Manual, Cold Spring Harbor Laboratory Press (April 2005); John N. Abelson, Melvin I. Simon, Christine Guthrie, and Gerald R. Fink, Guide to Yeast Genetics and Molecular Biology, Part A, Volume 194 (Methods in Enzymology Series, 194), Academic Press (March 11, 2004); Christine Guthrie and Gerald R. Fink, Guide to Yeast Genetics and Molecular and Cell Biology, Part B, Volume 350 (Methods in Enzymology, Vol 350), Academic Press; 1st edition (July 2, 2002); Christine Guthrie and Gerald R. Fink, Guide to Yeast Genetics and Molecular and Cell Biology, Part C, Volume 351, Academic Press; 1st edition (July 9, 2002); Gregory N. Stephanopoulos, Aristos A. Aristidou and Jens Nielsen, Metabolic Engineering: Principles and Methodologies, Academic Press; 1 edition (October 16, 1998); и Christina Smolke, The Metabolic Pathway Engineering Handbook: Fundamentals, CRC Press; 1 edition (July 28, 2009), все из которых включены здесь путем отсылки.
Используемый здесь термин «сверхэкспрессия» относится к увеличенному уровню экспрессии заданного продукта гена в заданной клетке, типе клетки или состоянии клетки по сравнению с референсной клеткой, например, клеткой дикого типа такого же клеточного типа или клеткой такого же клеточного типа, но не имеющей специфической модификации, например, генетической модификации. Принудительная непрерывная экспрессия гена DGA1 и/или АСС1 в клетках Y. Lipolytica, проявляющих концентрации насыщенных жирных кислот, которые будут ингибировать экспрессию гена DGA1 или АСС1 в клетках дикого типа, является примером сверхэкспрессии генов.
Некоторые аспекты данного изобретения обеспечивают способ манипуляции активностью продукта гена диацилглицерин-ацилтрансферазы 1 (DGA1) в микробе для производства биотоплива или предшественника биотоплива. Ген DGA1 кодирует ацилтрансферазу, которая катализирует терминальную стадию формирования триацилглицерина (TAG), ацилируя диацилглицерин с использованием ацил-СоА в качестве ацильного донора. Результатом этой реакции ацилтрансферазы являются триацилглицерины, которые не проявляют такого же ингибирующего эффекта по типу обратной связи на синтез жирных кислот, как сами жирные кислоты. TAG обычно резервируются в липидных телах или вакуолях в вырабатывающих липиды клетках. В некоторых вариантах осуществления манипуляция представляет собой сверхэкспрессию. В некоторых вариантах осуществления манипуляция достигается путем приведения в контакт микроба для производства биотоплива или предшественника биотоплива с экспрессионной конструкцией, содержащей нуклеиновую кислоту, кодирующую продукт гена DGA1, например, белок DGAT2, функционально связанную с гетерологичным промотором, например, конститутивным или индуцируемым промотором. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая продукт гена DGA1, содержит кодирующую последовательность SEQ ID NO: 1. В некоторых вариантах осуществления DGA1 представляет собой DGA1 Y. lipolytica, например, DGA1 Y. Lipolytica, содержащий аминокислотную последовательность SEQ ID NO: 2. В некоторых вариантах осуществления микроб представляет собой Y. lipolytica. В некоторых вариантах осуществления манипуляцию активностью продукта гена DGA1 в микробе проводят для придания предпочтительного фенотипа для конверсии в промышленном масштабе углевода в липид, например, увеличенной скорости синтеза липидов, увеличенной эффективности конверсии углеводов в липиды, увеличенного резервирования липидов и увеличенной скорости роста, увеличенной устойчивости к повышенным концентрациям источника углерода или липидного продукта. Последовательности гена DGA1 и продукта гена хорошо известны специалистам в данной области. Иллюстративные репрезентативные последовательности гена и продукта гена можно найти под номером ХМ_504700 в базе данных NCBI (www.ncbi.nlm.nih.gov).
Неограничивающие примеры пригодных нуклеотидных последовательностей DGA1 и последовательностей белков представлены ниже. Дополнительные пригодные последовательности DGA1, в том числе последовательности из других видов, будут очевидны специалистам в данной области, и изобретение не ограничено в этом отношении.

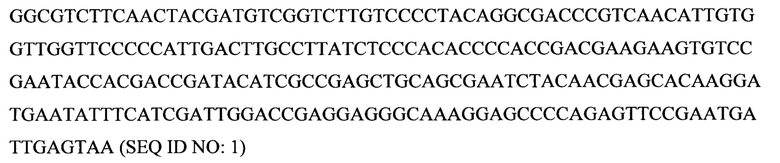

Некоторые аспекты данного изобретения обеспечивают способ манипуляции продуктом гена ацетил-СоА-карбоксилазы (АСС) в микробе для производства биотоплива или предшественника биотоплива, например, в Y. Lipolytica. Продукты гена АСС опосредуют превращение ацетил-СоА, главного С2-предшественника в синтезе жирных кислот, в малонил-СоА, что считается первой осуществляемой стадией в синтезе жирных кислот, а также рассматривается как определяющая скорость стадия в синтезе жирных кислот (смотри Cao Y, Yang J, Xian М, Xu X, Liu W. Increasing unsaturated fatty acid contents in Escherichia coli by coexpression of three different genes. Appl Microbiol Biotechnol. 2010). В некоторых вариантах осуществления манипуляция активностью АСС представляет собой сверхэкспрессию АСС. В некоторых вариантах осуществления манипуляцию проводят путем приведения в контакт микроба, предназначенного для производства биотоплива или предшественника биотоплива, с экспрессионной конструкцией, содержащей нуклеиновую кислоту, кодирующую продукт гена АСС, например белок АСС1, функционально связанную с гетерологичным промотором, например, конститутивным или индуцируемым промотором. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая продукт гена АСС, содержит кодирующую последовательность SEQ ID NO: 3. В некоторых вариантах осуществления продукт гена АСС представляет собой белок АСС1, содержащий аминокислотную последовательность SEQ ID NO: 4. В некоторых вариантах осуществления сверхэкспрессия АСС в микробе увеличивает скорость синтеза жирной кислоты и/или придает предпочтительный фенотип для конверсии в промышленном масштабе углеводов в биотопливо или предшественник биотоплива, например, увеличенную скорость синтеза липидов, увеличенную эффективность конверсии углеводов в липиды, увеличенное резервирование липидов и увеличенную скорость роста, увеличенную устойчивость к концентрациям вещества, например, источника углерода, биотоплива или предшественника биотоплива, или токсического вещества. Последовательности гена АСС и продукта гена хорошо известны специалистам в данной области. Иллюстративные репрезентативные последовательности гена и продукта гена можно найти под номером GeneIDs: 855750 и 2909424, или под номером NC_006069 в базе данных NCBI (www.ncbi.nlm.nih.gov).
Неограничивающие примеры пригодных нуклеотидных последовательностей АСС и последовательностей белков представлены ниже. Дополнительные пригодные последовательности АСС, в том числе последовательности из других видов, будут очевидны специалистам в данной области, и изобретение не ограничено в этом отношении.
Нуклеотидная последовательность, кодирующая АСС:





Некоторые аспекты данного изобретения обеспечивают способ манипуляции активностью стеароил-СоА-десатуразы (SCD) в микробе для производства биотоплива или предшественника биотоплива. SCD представляет собой десатуразу Δ9, которая вводит двойную связь между С9 и С10 стеариновой кислоты, соединенной с СоА, что является главной стадией в генерации ненасыщенных жирных кислот и их производных, как описано более подробно здесь. В некоторых вариантах осуществления манипуляция представляет собой сверхэкспрессию. В некоторых вариантах осуществления манипуляцию проводят путем приведения в контакт микроба, предназначенного для производства биотоплива или предшественника биотоплива, с экспрессионной конструкцией, содержащей нуклеиновую кислоту, кодирующую продукт гена SCD, например, белок SCD, функционально связанную с гетерологичным промотором, например, конститутивным или индуцируемым промотором. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая продукт гена SCD, содержит кодирующую последовательность SEQ ID NO: 5. В некоторых вариантах осуществления SCD представляет собой SCD Y. Lipolytica, например, SCD Y. Lipolytica, содержащий аминокислотную последовательность SEQ ID NO: 6. В некоторых вариантах осуществления микроб представляет собой Y. lipolytica. В некоторых вариантах осуществления манипуляцию активностью SCD в микробе выполняют для придания предпочтительного фенотипа для конверсии в промышленном масштабе углеводов в биотопливо или предшественник биотоплива, например, увеличенной скорости синтеза, увеличенной эффективности конверсии углеводов в липиды, увеличенного резервирования липидов и увеличенной скорости роста, увеличенной устойчивости к повышенным концентрациям источника углерода или липидного продукта. Последовательности гена стеароил-СоА-десатуразы и продукта гена хорошо известны специалистам в данной области. Иллюстративные репрезентативные последовательности гена и продукта гена можно найти под номером GeneID: 852825 в базе данных NCBI (www.ncbi.nlm.nih.gov).
Неограничивающие примеры пригодных нуклеотидных последовательностей SCD и последовательностей белков представлены ниже. Дополнительные пригодные последовательности SCD, в том числе последовательности из других видов, будут очевидны специалистам в данной области, и изобретение не ограничено в этом отношении.
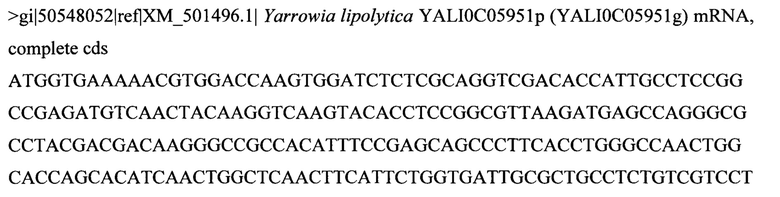


Некоторые аспекты данного изобретения обеспечивают способ манипуляции активностью АТР-цитрат-лиазы (ACL) в микробе для производства биотоплива или предшественника биотоплива. ACL обеспечивает цитозольный ацетил-СоА путем расщепления цитрата, который переносится с помощью челночного механизма из митохондрии в виде продукта цикла ТСА. Путем расщепления цитрата на оксалоацетат и ацетил-СоА, продукты гена ACL обеспечивает субстрат ацетил-СоА для АСС, который затем опосредует превращение ацетил-СоА, главного С2-предшественника в синтезе жирной кислоты, в малонил-СоА, что считается первой осуществляемой стадией в синтезе жирных кислот, как описано более подробно здесь. В некоторых вариантах осуществления продукт гена ACL представляет собой белок, состоящий из двух субъединиц, кодированных отдельными генами. В некоторых вариантах осуществления продукт гена ACL состоит из двух субъединиц, кодированных одним и тем же геном. В некоторых вариантах осуществления манипуляция представляет собой сверхэкспрессию. В некоторых вариантах осуществления манипуляцию проводят путем приведения в контакт микроба, предназначенного для производства биотиплива или предшественника биотоплива, с экспрессионной конструкцией, содержащей нуклеиновую кислоту, кодирующую продукт гена ACL, например, белок ACL, функционально связанную с гетерологичным промотором, например, конститутивным или индуцируемым промотором. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая продукт гена ACL, содержит кодирующие последовательности SEQ ID NO: 7 и SEQ ID NO: 9. В некоторых вариантах осуществления ACL представляет собой ACL Y. lipolytica, например, ACL Y. Lipolytica, содержащий аминокислотные последовательности SEQ ID NO: 8 и SEQ ID NO: 10. В некоторых вариантах осуществления микроб представляет собой Y. lipolytica. В некоторых вариантах осуществления манипуляцию активностью ACL в микробе проводят для придания предпочтительного фенотипа для конверсии в промышленном масштабе углевода в липид, например, увеличенной скорости синтеза липидов, увеличенной эффективности превращения углеводов в липиды, увеличенного резервирования липидов и увеличенной скорости роста, увеличенной устойчивости к повышенным концентрациям источника углеводов или липидного продукта. Последовательности гена АТР-цитрат-лиазы или продукта гена хорошо известны специалистам в данной области. Иллюстративные репрезентативные последовательности гена и продукта гена можно найти под номером GeneID: 2912101 и 2910381 в базе данных NCBI (www.ncbi.nlm.nih.gov).
Неограничивающие примеры пригодных нуклеотидных последовательностей ACL и последовательностей белков представлены ниже. Дополнительные пригодные последовательности ACL, в том числе последовательности из других видов, будут очевидны специалистам в данной области, и изобретение не ограничено в этом отношении.
АТР Цитрат-лиаза (Yarrowia lipolytica) субъединица 1, ACL1 DNA
YALI0E34793g
ХМ_504787

АТР Цитрат-лиаза (Yarrowia lipolytica) субъединица 1, Белок ACL1
YALI0E34793p
ХР_504787


АТР Цитрат-лиаза (Yarrowia lipolytica) субъединица 2, ACL2 DNA
YALI0D24431g
ХМ_503231

АТР Цитрат-лиаза (Yarrowia lipolytica) субъединица 2, Белок ACL2
YALI0D24431p
ХР_503231
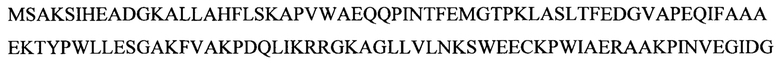

Некоторые аспекты данного изобретения обеспечивают жирообразующие микробы для производства масла, содержащие любую из модификаций, описанных здесь, например, модификацию DGA1, описанную здесь, модификацию АСС1, описанную здесь, и/или модификацию SCD, описанную здесь. В некоторых вариантах осуществления обеспечен модифицированный жирообразующий микроб, который содержит модификацию «push», описанную здесь, и модификацию «pull», описанную здесь. В некоторых вариантах осуществления модификация «push» включает сверхэкспрессию продукта гена АСС1. В некоторых вариантах осуществления модификация «pull» включает сверхэкспрессию продукта гена DGA1 и/или SCD.
Некоторые аспекты данного изобретения обеспечивают нуклеиновые кислоты, кодирующие продукт гена, придающий требуемый и/или желательный фенотип микробу, предназначенному для производства биотоплива или предшественника биотоплива, например, Y. Lipolytica. В некоторых вариантах осуществления нуклеиновая кислота представляет собой нуклеиновую кислоту, полученную из Y. Lipolytica. В некоторых вариантах осуществления нуклеиновая кислота кодирует продукт гена DGA1, например, белок DGA1. В некоторых вариантах осуществления нуклеиновая кислота кодирует продукт гена АСС1, например, белок АСС1. В некоторых вариантах осуществления нуклеиновая кислота кодирует десатуразу, например, Δ9 десатуразу. В некоторых вариантах осуществления нуклеиновая кислота кодирует Δ9 десатуразу (SCD) Y. Lipolytica. В некоторых вариантах осуществления обеспечена нуклеиновая кислота, которая кодирует комбинацию продуктов генов, например, во множестве цистронов, содержащих продукт гена, сверхэкспрессия которого представляет «push» модификацию биосинтеза липидов (например, продукт гена АСС1), и продукт гена, сверхэкспрессия которого представляет «pull» модификацию биосинтеза липидов (например, продукт гена DGA1 и/или SCD).
Термин «нуклеиновая кислота» относится к молекуле, содержащей множество связанных нуклеотидов. «Нуклеиновая кислота» и «молекула нуклеиновой кислоты» используются взаимозаменяемо и относятся к олигорибонуклеотидам, а также олигодеоксирибонуклеотидам. Термины также включают полинуклеозиды (то есть полинуклеотид без фосфата) и любое другое органическое основание, содержащее нуклеиновую кислоту. Органические основания включают аденин, урацил, гуанин, тимин, цитозин и инозин. Нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными. Нуклеиновая кислота может быть природного и неприродного происхождения. Нуклеиновые кислоты могут быть получены из природных источников или могут быть синтезированы с использованием синтезатора нуклеиновой кислоты (то есть синтетические). Изолирование нуклеиновых кислот достигается обычными способами, известными в данной области, которые можно найти в стандартных учебниках по молекулярной биологии. (Смотри, например, Maniatis' Handbook of Molecular Biology). Нуклеиновая кислота может представлять собой DNA или RNA, например, геномную DNA, митохондриальную DNA, mRNA, cDNA, rRNA, miRNA, PNA или LNA, или их комбинацию, описанную здесь. Нуклеиновые кислоты неприродного происхождения, такие как искусственные бактериальные хромосомы (ВАС) и искусственные хромосомы дрожжей (YAC) могут быть также использованы в соответствии с аспектами данного изобретения.
Некоторые аспекты данного изобретения относятся к использованию производных нуклеиновых кислот. Использование определенных производных нуклеиновых кислот может увеличить стабильность нуклеиновых кислот изобретения путем предотвращения их расщепления, в особенности тогда, когда они подвергаются воздействию биологических образцов, которые могут содержать нуклеазы. Используемое здесь производное нуклеиновой кислоты представляет собой нуклеиновую кислоту неприродного происхождения или ее единицу. Производные нуклеиновых кислот могут содержать элементы неприродного происхождения, такие как нуклеотиды неприродного происхождения, и связи в основной цепи неприродного происхождения. Производные нуклеиновых кислот в соответствии в некоторыми аспектами данного изобретения могут содержать модификации в основной цепи, такие как, но без ограничения, тиофосфатные связи, модифицированные фосфодиэфиром нуклеиновые кислоты, комбинации фосфодиэфира и тиофосфатной нуклеиновой кислоты, метилфосфонат, алкилфосфонаты, эфиры фосфорной кислоты, алкилфосфонотиоаты, фосфорамидаты, карбаматы, карбонаты, фосфатные триэфиры, ацетамидаты, карбоксиметиловые эфиры, метилфосфоротиоат, фосфородитиоат, п-этокси и их комбинации. Композиция основной цепи нуклеиновых кислот может быть гомогенной или гетерогенной.
Производные нуклеиновых кислот согласно некоторым аспектам данного изобретения могут содержать заместители или модификации в сахарах и/или основаниях. Например, некоторые производные нуклеиновых кислот могут включать нуклеиновые кислоты, имеющие на своем остове сахара, которые ковалентно связаны с низкомолекулярными органическими группами, не являющимися гидроксильной группой в 3'-положении и не являющимися фосфатной группой в 5'-положении (например, 2'-O-алкилированная рибозная группа). Производные нуклеиновой кислоты могут включать сахара, например арабинозу вместо рибозы. Производные нуклеиновых кислот могут содержать замещенные пурины и пиримидины, такие как модифицированные С-5-пропином основания, 5-метилцитозин, 2-аминопурин, 2-амино-6-хлорпурин, 2,6-диаминопурин, гипоксантин, 2-тиоурацил и псевдоизоцитозин.
В некоторых вариантах осуществления нуклеиновая кислота может содержать пептидную нуклеиновую кислоту (PNA), закрытую нуклеиновую кислоту (LNA), DNA, RNA или сонуклеиновые кислоты указанных выше, такие как DNA-LNA сонуклеиновая кислота.
Используемый здесь термин «изолированная молекула нуклеиновой кислоты» относится к нуклеиновой кислоте, которая не находится в своем естественном окружении, например, нуклеиновой кислоте, которая была (i) экстрагирована и/или очищена из клетки или микроба, например, бактерии или дрожжей способами, известными в данной области, например, путем щелочного лизиса клетки-хозяина и последующей очистки нуклеиновой кислоты, например, с помощью процесса адсорбции на кремнеземе; (ii) усилена in vitro, например, с помощью полимеразной цепной реакции (PCR); (iii) рекомбинантно получена путем клонирования, например, нуклеиновая кислота клонирована в экспрессионный вектор; (iv) фрагментирована и разделена по размеру, например, путем ферментативного разложения in vitro или путем сдвига и последующего гель-разделения; или (v) синтезирована, например, путем химического синтеза. В некоторых вариантах осуществления термин «изолированная молекула нуклеиновой кислоты» относится к (vi) нуклеиновой кислоте, которая химически значительно отличается от любой нуклеиновой кислоты природного происхождения. В некоторых вариантах осуществления изолированная нуклеиновая кислота может быть легко манипулирована методами рекомбинантной ДНК, хорошо известными в данной области. Соответственно, нуклеиновая кислота, клонированная в вектор, или нуклеиновая кислота, доставленная в клетку хозяина и интегрированная в геном хозяина, считается изолированной, а нуклеиновая кислота, находящаяся в своем нативном состоянии в своем природном хозяине, например, в геноме хозяина, изолированной не считается. Изолированная нуклеиновая кислота может быть в основном очищена, но не обязательно. Например, нуклеиновая кислота, которая изолирована в пределах клонирующего или экспрессионного вектора, не является чистой по той причине, что может содержать только незначительный процент материала в клетке, в которой она находится. Такая нуклеиновая кислота, тем не менее, является изолированной, как следует из используемого здесь термина.
Некоторые аспекты данного изобретения относятся к нуклеиновым кислотам, кодирующим продукт гена, придающий требуемый или желательный фенотип микробу для производства биотоплива или предшественника биотоплива, которые связаны с промотором или другим активирующим транскрипцию элементом. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая продукт гена и связанная с промотором, содержится в экспрессионном векторе или экспрессионной конструкции. Используемые здесь термины «экспрессионный вектор» или «экспрессионная конструкция» относятся к конструкции нуклеиновой кислоты, созданной рекомбинантно или синтетически, с сериями элементов указанной нуклеиновой кислоты, которые обеспечивают транскрипцию конкретной нуклеиновой кислоты в микробе-хозяине, например, жирообразующих дрожжах. В некоторых вариантах осуществления экспрессионный вектор может быть частью плазмиды, вируса или фрагмента нуклеиновой кислоты. В некоторых вариантах осуществления экспрессионный вектор включает кодирующую нуклеиновую кислоту, подлежащую транскрибированию, функционально связанную с промотором. Промотор представляет собой элемент нуклеиновой кислоты, который содействует транскрипции нуклеиновой кислоты, подлежащей транскрибированию. Промотор обычно расположен на той же нити и в положении выше (или 5') нуклеотидной последовательности, транскрипцию которой он контролирует. В некоторых вариантах осуществления экспрессионный вектор включает кодирующую нуклеиновую кислоту, подлежащую транскрибированию, функционально связанную с гетерологичным промотором. Гетерологичный промотор представляет собой промотор, неприродным образом функционально связанный с заданной последовательностью нуклеиновой кислоты. Например, ген DGA1 в Y. lipolytica природным образом функционально связан с промотором гена DGA1 Y. Lipolytica. Любой промотор, отличный от промотора гена DGA1 Y. lipolytica дикого типа, функционально связанный с геном DGA1 или его частями, например, в экспрессионной конструкции, будет, таким образом, являться гетерологичным промотором в этом контексте. Например, промотор TEF1, связанный с нуклеиновой кислотой, кодирующей продукт гена DGA1, является гетерологичным промотором в контексте DGA1.
В некоторых вариантах осуществления экспрессионный вектор включает кодирующую нуклеиновую кислоту, например, нуклеиновую кислоту, кодирующую продукт гена DGA1, АСС1 и/или SCD, функционально связанную с конститутивным промотором. Термин «конститутивный промотор» относится к промотору, который обеспечивает непрерывную транскрипцию его ассоциированного гена. В некоторых вариантах осуществления экспрессионный вектор включает кодирующую нуклеиновую кислоту, например, нуклеиновую кислоту, кодирующую продукт гена DGA1, АСС1 и/или SCD, функционально связанную с индуцируемым промотором. Термин «индуцируемый промотор», используемый здесь взаимозаменяемо с термином «условный промотор», относится к промотору, который обеспечивает транскрипцию его ассоциированного гена только в присутствии или отсутствии биотических или абиотических факторов. Индуцируемые лекарственными средствами промоторы, например, индуцируемые тетрациклином/доксициклином промоторы, индуцируемые тамоксифеном промоторы, а также промоторы, которые зависят от явления рекомбинации с тем, чтобы стать активными, например, cre-опосредованной рекомбинации сайтов loxP, являются примерами индуцируемых промоторов, которые хорошо известны в данной области.
Некоторые аспекты данного изобретения относятся к неожиданному открытию того, что сверхэкспрессия заданного продукта гена из гетерологичного промотора в жирообразующих микробах может быть значительно усилена путем включения интрона в соответствующую экспрессионную конструкцию. Некоторые аспекты данного изобретения обеспечивают усиленный интроном конститутивный промотор для сверхэкспрессии генов в жирообразующих микробах, а также экспрессионные конструкции и векторы, содержащие этот усиленный интроном промотор. В некоторых вариантах осуществления обеспечен усиленный интроном промотор TEF, который содержит последовательность промотора TEF, сайт инициации транскрипции, интронную последовательность в положении ниже сайта инициации транскрипции и последовательность кодирующей нуклеиновой кислоты, например, последовательность нуклеиновой кислоты, кодирующей продукт гена DGA1, АСС1 и/или SCD. В некоторых вариантах осуществления интрон расположен в положении ниже сайта инициации трансляции, при этом в пределах открытой рамки считывания последовательности гена, например, после старт-кодона, но перед сайтом терминации последовательности нуклеиновой кислоты, кодирующей продукт гена. В некоторых вариантах осуществления интрон расположен непосредственно ниже сайта инициации трансляции, например, старт-кодона ATG, при этом выше остальной кодирующей последовательности. В целях иллюстрации неограничивающий пример структуры экспрессионной конструкции, усиленной интроном, представлен следующим образом:
5'--промотор TEF - сайт инициации транскрипции - интрон - последовательность, кодирующая DGA1 -- 3'. Другой неограничивающий пример структуры экспрессионной конструкции, усиленной интроном, представлен следующим образом:
5'--промотор TEF - сайт инициации транскрипции - старт-кодон - интрон -- последовательность, кодирующая DGA1 - стоп-кодон -- 3'. Экспрессионные конструкции для продуктов генов АСС1 и SCD будут иметь последовательность, кодирующую АСС или SCD, соответственно, вместо последовательности, кодирующей DGA1.
Пригодные последовательности промотора TEF, а также пригодные последовательности интронов будут очевидны специалистам в данной области. Раскрыты некоторые безинтронные последовательности промотора TEF, например, в патенте США №6265185. Некоторые иллюстративные репрезентативные последовательности представлены ниже. Однако будет понятно, что изобретение не ограничено в этом отношении.
Иллюстративная последовательность промотора TEF:

Иллюстративная последовательность интрона:

Иллюстративная последовательность интрон-промотор TEF, содержащая старт-кодон (ATG) между последовательностями промотора и интрона:

Способы доставки экспрессионных векторов или экспрессионных конструкций в микробы, например, в клетки дрожжей, хорошо известны специалистам в данной области. Нуклеиновые кислоты, включая экспрессионные векторы, могут быть доставлены в прокариотические и эукариотические микробы различными способами, хорошо известными специалистам в соответствующей области биологических наук. Способы доставки нуклеиновых кислот в микроб в соответствии с некоторыми аспектами данного изобретения включают, но без ограничения, различные химические, электрохимические и биологические подходы, например, трансформацию с использованием теплового шока, электропорацию, трансфекцию, например, опосредованную липосомами трансфекцию, DEAE-декстран-опосредованную трансфекцию или кальций-фосфатную трансфекцию. В некоторых вариантах осуществления конструкцию нуклеиновой кислоты, например, экспрессионную конструкцию, содержащую комбинацию последовательностей нуклеиновых кислот, кодирующих DGA1, АСС1 и/или SCD, вводят в микроб-хозяин с использованием носителя или вектора для переноса генетического материала. Векторы для переноса генетического материала в микробы хорошо известны специалистам в данной области и включают, например, плазмиды, искусственные хромосомы и вирусные векторы. Способы создания конструкций нуклеиновых кислот, включая экспрессионные конструкции, содержащие конститутивные или индуцируемые гетерологичные промоторы, конструкции нокаута и нокдауна, а также способы и векторы для доставки нуклеиновой кислоты или конструкции нуклеиновой кислоты в микроб, хорошо известны специалистам в данной области и описаны, например, в J. Sambrook and D. Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; 3rd edition (January 15, 2001); David C. Amberg, Daniel J. Burke; and Jeffrey N. Strathern, Methods in Yeast Genetics: A Cold Spring Harbor Laboratory Course Manual, Cold Spring Harbor Laboratory Press (April 2005); John N. Abelson, Melvin I. Simon, Christine Guthrie, and Gerald R. Fink, Guide to Yeast Genetics and Molecular Biology, Part A, Volume 194 (Methods in Enzymology Series, 194), Academic Press (March 11, 2004); Christine Guthrie and Gerald R. Fink, Guide to Yeast Genetics and Molecular and Cell Biology, Part B, Volume 350 (Methods in Enzymology, Vol 350), Academic Press; 1st edition (July 2, 2002); Christine Guthrie and Gerald R. Fink, Guide to Yeast Genetics and Molecular and Cell Biology, Part C, Volume 351, Academic Press; 1st edition (July 9, 2002); Gregory N. Stephanopoulos, Aristos A. Aristidou and Jens Nielsen, Metabolic Engineering: Principles and Methodologies, Academic Press; 1 edition (October 16, 1998); и Christina Smolke, The Metabolic Pathway Engineering Handbook: Fundamentals, CRC Press; 1 edition (July 28, 2009), все из которых включены здесь путем отсылки.
В некоторых вариантах осуществления нативный промотор гена, кодирующий продукт гена, придающий требуемый или желательный фенотип микробу, например, нативный промотор DGA1, АСС1 или SCD, модифицирован в микробе для изменения регуляции его транскрипционной активности. В некоторых вариантах осуществления модифицированный промотор проявляет увеличенную транскрипционную активность по сравнению с его немодифицированным аналогом. Используемый здесь термин «модифицированный промотор» относится к промотору, нуклеотидная последовательность которого была искусственно изменена. Нуклеотидная делеция(и), вставка(и) или мутация(и), по отдельности или в комбинации, являются примерами таких искусственных изменений. Искусственные изменения промотора могут быть проведены направленным образом, например, с помощью подходов гомологической рекомбинации, таких как направленное воздействие на гены, нокаут, нокин, сайт-направленный мутагенез или опосредованные цинк-пальцевой нуклеазой стратегии. Альтернативно, такие изменения могут быть проведены с помощью случайного или псевдослучайного события, такого как облучение или ненаправленная нуклеотидная интеграция и последующий отбор. Модификации промотора, в целом, разработаны для модуляции свойств транскрипционной активации соответствующего промотора. Например, нарушение или делеция регуляторного элемента, опосредующего репрессию промотора DGA1, АСС1 или SCD в ответ на повышенные внутриклеточные уровни жирных кислот, будет приводить к непрерывной транскрипционной активации соответствующего гена, даже в условиях повышенных внутриклеточных уровней жирных кислот. Аналогичным образом, вставка конституционно активного элемента транскрипционного активатора в область условного промотора может влиять на сверхэкспрессию соответствующего гена в нормальных ингибирующих условиях. Способы направленного разрушения нативного промотора, например, нативного промотора DGA1, АСС1 или SCD, в микробе, например, направленного разрушения, приводящего к увеличенной скорости транскрипции, хорошо известны специалистам в данной области.
Некоторые аспекты данного изобретения относятся к инженерингу микроба, например, Y. lipolytica, для проявления требуемого и/или желательного фенотипа для производства в промышленном масштабе биотоплива или предшественника биотоплива. Некоторые аспекты данного изобретения относятся к метаболическому инженерингу пути синтеза липидов для получения микроба, оптимизированного для производства биотоплива. Некоторые аспекты данного изобретения относятся к метаболическому инженерингу, который включает комбинацию генетических модификаций, модулирующих экспрессию генов, регулирующих поток углерода на путь синтеза липидов, для получения микроба, оптимизированного для производства биотоплива. В некоторых вариантах осуществления комбинация генетических модификаций включает «push» модификацию и «pull» модификацию. В некоторых вариантах осуществления «push» модификация содержит генетическую модификацию, которая увеличивает уровень метаболитов, ацетил-СоА, АТР или NADPH для синтеза липидов в клетке, например, сверхэкспрессия продукта гена АСС1. В некоторых вариантах осуществления «pull» модификация представляет собой генетическую модификацию, которая понижает уровень продукта или интермедиата синтеза липидов, которая проявляет ингибирующую функцию по типу обратной связи, например, жирной кислоты. В некоторых вариантах осуществления «pull» модификация включает сверхэкспрессию продукта гена DGA1 и/или SCD.
Некоторые аспекты данного изобретения обеспечивают способы значительного увеличения эффективности опосредованной Y. Lipolytica конверсии источника углерода в липиды путем модуляции метаболизма нативных липидов Y. Lipolytica. Поразительно и неожиданно было обнаружено, что комбинации «push» и «pull» модификаций метаболизма липидов в соответствии с некоторыми способами, обеспеченными данным изобретением, обеспечивают значительно увеличенный поток углерода на путь синтеза липидов по сравнению с индивидуальными модификациями, модулирующими только процессы «push» или «pull», соответственно.
Некоторые аспекты данного изобретения относятся к микробу, сконструированному и/или оптимизированному для производства биотоплива или предшественника биотоплива в промышленном масштабе. В некоторых вариантах осуществления обеспечен инженерный микроб, который был манипулирован с помощью способа, или с использованием нуклеиновой кислоты или белка, обеспеченного некоторыми аспектами данного изобретения, например, экспрессионной конструкции или комбинации экспрессионных конструкций, обеспеченных здесь, приводящих к сверхэкспрессии комбинации продукта гена, опосредующего процесс «push» синтеза липидов (например, продукта АСС1), и продукта гена, опосредующего процесс «pull» синтеза липидов (например, продукта гена DGA1 и/или SCD). В некоторых вариантах осуществления обеспечен инженерный микроб, который сверхэкспрессирует «push» и «pull» комбинацию продуктов генов, которые согласно некоторым аспектам данного изобретения придают требуемый и/или желательный фенотип микробу для производства биотоплива или предшественника биотоплива. В некоторых вариантах осуществления обеспечен микроб, содержащий увеличенную активность продукта гена DGA1, АСС1 и/или SCD. В некоторых вариантах осуществления микроб проявляет увеличенную скорость синтеза жирных кислот, увеличенное резервирование TAG и/или дополнительные требуемые или желательные признаки.
Термин «увеличенная скорость синтеза» или «увеличенная скорость синтезирования», используемый здесь в контексте микробного синтеза липидов, например, в контексте скорости синтеза жирных кислот вырабатывающего масло микроба, описанного здесь, относится к скорости синтеза в инженерном микробе, которая является увеличенной по сравнению с соответствующей скоростью синтеза в микробах дикого типа таких же видов. Например, увеличенная скорость синтеза TAG в инженерном микробе Y. lipolytica, описанном здесь, относится к скорости синтеза липидов, которая является увеличенной по сравнению со скоростью синтеза TAG в Y. Lipolytica дикого типа. В некоторых вариантах осуществления увеличенная скорость синтеза липида, например синтеза TAG, или синтеза общих липидов, относится к скорости синтеза жирных кислот культуры клеток, например, культуры инженерных микробов. В некоторых вариантах осуществления увеличенная скорость синтеза липидов представляет собой скорость синтеза липида, например, синтеза TAG или синтеза общих липидов, составляющую по меньшей мере 0,01 г/л/ч (грамм липида на литр культуры в час), по меньшей мере 0,004 г/л/ч, по меньшей мере 0,05 г/л/ч, по меньшей мере 0,1 г/л/ч, по меньшей мере 0,14 г/л/ч, по меньшей мере 0,15 г/л/ч, по меньшей мере 0,2 г/л/ч, по меньшей мере 0,3 г/л/ч, по меньшей мере 0,4 г/л/ч, по меньшей мере 0,5 г/л/ч, по меньшей мере 0,6 г/л/ч, по меньшей мере 0,7 г/л/ч, по меньшей мере 0,8 г/л/ч, по меньшей мере 0,9 г/л/ч, по меньшей мере 1 г/л/ч, по меньшей мере 2 г/л/ч, по меньшей мере 3 г/л/ч, по меньшей мере 4 г/л/ч, по меньшей мере 5 г/л/ч, по меньшей мере 6 г/л/ч, по меньшей мере 7 г/л/ч, по меньшей мере 8 г/л/ч, по меньшей мере 9 г/л/ч, по меньшей мере 10 г/л/ч или по меньшей мере 25 г/л/ч.
В некоторых вариантах осуществления скорость синтеза в данном контексте представляет собой скорость синтеза, измеренную за полный цикл работы биореактора, например, расчет скорости синтеза из общего количества липида, например, TAG, синтезированного за общее время работы биореактора или общее измеренное время выработки липида. Этот тип скорости синтеза также называется здесь иногда как «общая продуктивность липидов» или «суммарная продуктивность липидов», и обычно представлена в г/л/ч (грамм выработанного липида на литр культуральной среды на время работы в часах). В некоторых вариантах осуществления обеспечен инженерный микроб, например, инженерный Y. Lipolytica, который сверхэкспрессирует продукт гена АСС1, продукт гена DGA1 и/или продукт гена SCD, который проявляет по меньшей мере 5-кратное увеличение, по меньшей мере 6-кратное увеличение, по меньшей мере 7-кратное увеличение, по меньшей мере 8-кратное увеличение, по меньшей мере 9-кратное увеличение, по меньшей мере 10-кратное увеличение, по меньшей мере 12-кратное увеличение, по меньшей мере 10-кратное увеличение, по меньшей мере 12,5-кратное увеличение, по меньшей мере 15-кратное увеличение, по меньшей мере 20-кратное увеличение, по меньшей мере 30-кратное увеличение, по меньшей мере 40-кратное увеличение, по меньшей мере 50-кратное увеличение, по меньшей мере 60-кратное увеличение, по меньшей мере 70-кратное увеличение, по меньшей мере 80-кратное увеличение, по меньшей мере 90-кратное увеличение, по меньшей мере 100-кратное увеличение, по меньшей мере 500-кратное увеличение или по меньшей мере 1000-кратное увеличение общей продуктивности липидов по сравнению с микробом дикого типа, например, Y. Lipolytica дикого типа.
В некоторых вариантах осуществления увеличенная скорость общего синтеза липидов или увеличенная общая продуктивность липидов составляет по меньшей мере 0,01 г/л/ч, по меньшей мере 0,004 г/л/ч, по меньшей мере 0,05 г/л/ч, по меньшей мере 0,1 г/л/ч, по меньшей мере 0,14 г/л/ч, по меньшей мере 0,15 г/л/ч, по меньшей мере 0,2 г/л/ч, по меньшей мере 0,3 г/л/ч, по меньшей мере 0,4 г/л/ч, по меньшей мере 0,5 г/л/ч, по меньшей мере 0,6 г/л/ч, по меньшей мере 0,7 г/л/ч, по меньшей мере 0,8 г/л/ч, по меньшей мере 0,9 г/л/ч, по меньшей мере 1 г/л/ч, по меньшей мере 2 г/л/ч, по меньшей мере 3 г/л/ч, по меньшей мере 4 г/л/ч или по меньшей мере 5 г/л/ч,
В некоторых вариантах осуществления скорость синтеза представляет собой максимальную скорость синтеза или пиковую скорость синтеза, измеренную, например, в оптимальных условиях роста и подвергания воздействию питательных веществ. Этот тип скорости синтеза также называется здесь иногда как «максимальная продуктивность липидов». В некоторых вариантах осуществления увеличенная максимальная скорость синтеза липидов представляет собой скорость синтеза липидов, например синтеза TAG, составляющую, по меньшей мере 0,2 г/л/ч, по меньшей мере 0,3 г/л/ч, по меньшей мере 0,4 г/л/ч, по меньшей мере 0,5 г/л/ч, по меньшей мере 0,6 г/л/ч, по меньшей мере 0,7 г/л/ч, по меньшей мере 0,8 г/л/ч, по меньшей мере 0,9 г/л/ч, по меньшей мере 1 г/л/ч, по меньшей мере 2 г/л/ч, по меньшей мере 3 г/л/ч, по меньшей мере 4 г/л/ч, по меньшей мере 5 г/л/ч, по меньшей мере 6 г/л/ч, по меньшей мере 7 г/л/ч, по меньшей мере 8 г/л/ч, по меньшей мере 9 г/л/ч, по меньшей мере 10 г/л/ч или по меньшей мере 25 г/л/ч,
В некоторых вариантах осуществления инженерный микроб представляет собой жирообразующие дрожжи, например, Y. lipolytica. В некоторых вариантах осуществления инженерные дрожжи, обеспеченные данным изобретением, проявляют одну или более в высокой степени желательных и неожиданных фенотипических характеристик, например: увеличенную скорость или эффективность конверсии углерода в масло, увеличенное накопление липидов в липидном теле.
В некоторых вариантах осуществления инженерный микроб, например, инженерные дрожжи, обеспеченные аспектами данного изобретения, проявляет скорость конверсии углерода в масло, также называемую здесь как «выход липидов», в диапазоне от около 0,02 г/г (г выработанного масла, липида или TAG/г потребленного углерода, например, глюкозы, ацетата или уксусной кислоты) до около 0,3 г/г. В некоторых вариантах осуществления инженерный микроб, например, инженерные дрожжи, обеспеченные аспектами данного изобретения, проявляет скорость конверсии углерода в масло около 0,010 г/г, около 0,02 г/г, около 0,025 г/г, около 0,03 г/г, около 0,04 г/г, около 0,05 г/г, около 0,06 г/г, около 0,07 г/г, около 0,075 г/г, около 0,08 г/г, около 0,09 г/г, около 0,1 г/г, около 0,11 г/г, около 0,12 г/г, около 0,13 г/г, около 0,14 г/г, около 0,15 г/г, около 0,16 г/г, около 0,17 г/г, около 0,18 г/г, около 0,19 г/г, около 0,2 г/г, около 0,21 г/г, около 0,22 г/г, около 0,23 г/г, около 0,24 г/г, около 0,25 г/г, около 0,26 г/г, около 0,27 г/г, около 0,28 г/г, около 0,29 г/г, около 0,3 г/г, около 0,31 г/г, около 0,32 г/г или значения, приближающиеся к теоретическим. В некоторых вариантах осуществления инженерный микроб, например, инженерные дрожжи, обеспеченные аспектами данного изобретения, проявляет скорость конверсии углерода в масло по меньшей мере около 0,010 г/г (г выработанного липида/г потребленного углерода, например глюкозы, ацетата или уксусной кислоты), по меньшей мере около 0,02 г/г, по меньшей мере около 0,025 г/г, по меньшей мере около 0,03 г/г, по меньшей мере около 0,04 г/г, по меньшей мере около 0,05 г/г, по меньшей мере около 0,06 г/г, по меньшей мере около 0,07 г/г, по меньшей мере около 0,075 г/г, по меньшей мере около 0,08 г/г, по меньшей мере около 0,09 г/г, по меньшей мере около 0,1 г/г, по меньшей мере около 0,11 г/г, по меньшей мере около 0,12 г/г, по меньшей мере около 0,13 г/г, по меньшей мере около 0,14 г/г, по меньшей мере около 0,15 г/г, по меньшей мере около 0,16 г/г, по меньшей мере около 0,17 г/г, по меньшей мере около 0,18 г/г, по меньшей мере около 0,19 г/г, по меньшей мере около 0,2 г/г, по меньшей мере около 0,21 г/г, по меньшей мере около 0,22 г/г, по меньшей мере около 0,23 г/г, по меньшей мере около 0,24 г/г, по меньшей мере около 0,25 г/г, по меньшей мере около 0,26 г/г, по меньшей мере около 0,27 г/г, по меньшей мере около 0,28 г/г, по меньшей мере около 0,29 г/г, по меньшей мере около 0,3 г/г, по меньшей мере около 0,31 г/г, по меньшей мере около 0,32 г/г, или значения, приближающиеся к теоретическим.
Термин «титр липидов», используемый здесь в контексте микробного синтеза липидов, например, в контексте синтеза жирных кислот вырабатывающим масло микробом, описанным здесь, относится к количеству липидов, синтезированных на объем микробной культуры, содержащей вырабатывающий масло микроб. В некоторых вариантах осуществления инженерный микроб, например, инженерный микроб Y. Lipolytica, описанный здесь, может обеспечить или обеспечивает титр липидов по меньшей мере 1 г/л (грамм липида на литр микробной культуры), по меньшей мере 2 г/л, по меньшей мере 3 г/л, по меньшей мере 4 г/л, по меньшей мере 5 г/л, по меньшей мере 6 г/л, по меньшей мере 7 г/л, по меньшей мере 8 г/л, по меньшей мере 9 г/л, по меньшей мере 10 г/л, по меньшей мере 15 г/л, по меньшей мере 20 г/л, по меньшей мере 25 г/л, по меньшей мере 30 г/л, по меньшей мере 40 г/л, по меньшей мере 50 г/л, по меньшей мере 60 г/л, по меньшей мере 70 г/л, по меньшей мере 80 г/л, по меньшей мере 90 г/л, по меньшей мере 100 г/л, по меньшей мере 200 г/л или по меньшей мере 250 г/л.
В некоторых вариантах осуществления инженерный микроб, обеспеченный здесь, обеспечивает увеличенный титр липидов во время конверсии углерода в масло. Термин «увеличенный титр липидов», используемый здесь в контексте микробного синтеза липидов, например, в контексте синтеза жирных кислот вырабатывающим масло микробом, описанным здесь, относится к количеству синтезированных липидов на объем микробной культуры, содержащей вырабатывающий масло микроб, которое является увеличенным по сравнению с соответствующим титром липидов микроба дикого типа таких же видов и в таких же условиях (например, в такой же среде для выращивания, с таким же отношением C/N, таким же количеством кислорода, таким же рН, такими же питательными веществами и т.д.). Например, увеличенный титр липидов, достигнутый с помощью инженерного микроба Y. Lipolytica, описанного здесь, относится к титру липида, который является увеличенным по сравнению с титром липида, который может быть достигнут с помощью Y. lipolytica дикого типа в идентичных условиях. В некоторых вариантах осуществления увеличенный титр липида относится к титру липида, составляющему по меньшей мере 1 г/л (грамм липида на литр микробной культуры), по меньшей мере 2 г/л, по меньшей мере 3 г/л, по меньшей мере 4 г/л, по меньшей мере 5 г/л, по меньшей мере 6 г/л, по меньшей мере 7 г/л, по меньшей мере 8 г/л, по меньшей мере 9 г/л, по меньшей мере 10 г/л, по меньшей мере 15 г/л, по меньшей мере 20 г/л, по меньшей мере 25 г/л, по меньшей мере 30 г/л, по меньшей мере 40 г/л, по меньшей мере 50 г/л, по меньшей мере 60 г/л, по меньшей мере 70 г/л, по меньшей мере 80 г/л, по меньшей мере 90 г/л, по меньшей мере 100 г/л, по меньшей мере 200 г/л или по меньшей мере 250 г/л.
Некоторые аспекты данного изобретения обеспечивают инженерные микробы для выработки масла, которые могут использовать различные источники углерода, включая, но без ограничения, сбраживаемые сахара, например С6 сахара, такие как глюкоза, и органические кислоты, например, уксусная кислота, и/или их соли, например, ацетат.
Некоторые аспекты данного изобретения относятся к культурам генетически модифицированных микробов, обеспеченных здесь. В некоторых вариантах осуществления культура содержит генетически модифицированный микроб, обеспеченный здесь, и среду, например, жидкую среду. В некоторых вариантах осуществления культура содержит генетически модифицированный микроб, обеспеченный здесь, и источник углерода, например, сбраживаемый углеводный источник, или органическую кислоту или ее соль. В некоторых вариантах осуществления культура содержит генетически модифицированный микроб, обеспеченный здесь, и соль и/или буфер, устанавливающий условия минерализации, осмолярности и рН, которые являются пригодными для выживания, роста и/или конверсии углевода в биотопливао или предшественник биотоплива с помощью микроба. В некоторых вариантах осуществления культура содержит дополнительный компонент, например, добавку. Неограничивающими примерами добавок являются питательные вещества, ферменты, аминокислоты, альбумин, факторы роста, ингибиторы ферментов (например, ингибиторы протеазы), жирные кислоты, липиды, гормоны (например, дексаметазон и гиббереллиновая кислота), следовые количества элементов, неорганические соединения (например, восстанавливающие агенты, такие как марганец), редокс-регуляторы (например, антиоксиданты), стабилизирующие агенты (например, диметилсульфоксид), полиэтиленгликоль, поливинилпирролидон (PVP), желатин, антибиотики (например, брефелдин А), соли (например, NaCl), хелатирующие агенты (например, EDTA, EGTA) и ферменты (например, целлюлаза, диспаза, гиалуронидаза или дезоксирибонуклеаза (ДНКаза)). В некоторых вариантах осуществления культура может содержать лекарственное средство, индуцирующее или ингибирующее транскрипцию с условного или индуцируемого промотора, например, доксициклин, тетрациклин, тамоксифен, изопропилтиогалактозид (IPTG), гормоны или ионы металлов.
Несмотря на то, что специфические условия культивирования, например, концентрация источника углерода, будут зависеть от соответствующего конструируемого микроорганизма, подлежащего культивированию, общие способы и условия культивирования для создания микробных культур хорошо известны специалистам в данной области и описаны, например, в J. Sambrook and D. Russell, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; 3rd edition (January 15, 2001); David C. Amberg, Daniel J. Burke; and Jeffrey N. Strathern, Methods in Yeast Genetics: A Cold Spring Harbor Laboratory Course Manual, Cold Spring Harbor Laboratory Press (April 2005); John N. Abelson, Melvin I. Simon, Christine Guthrie, and Gerald R. Fink, Guide to Yeast Genetics and Molecular Biology, Part A, Volume 194 (Methods in Enzymology Series, 194), Academic Press (March 11, 2004); Christine Guthrie and Gerald R. Fink, Guide to Yeast Genetics and Molecular and Cell Biology, Part B, Volume 350 (Methods in Enzymology, Vol 350), Academic Press; 1st edition (July 2, 2002); и Christine Guthrie and Gerald R. Fink, Guide to Yeast Genetics and Molecular and Cell Biology, Part C, Volume 351, Academic Press; 1st edition (July 9, 2002), все из которых включены здесь путем отсылки. Для выработки масла культуры сконструированных микробов, описанные здесь, культивируют в условиях, пригодных для накопления масла, как известно в данной области.
В некоторых вариантах осуществления генетически модифицированный микроб проявляет преимущество в отношении роста перед микробами дикого типа такого же вида и/или перед другими микробами, например микробами, которые обычно загрязняют микробные культуры, предназначенные для конверсии источника углерода в биотопливо или предшественник биотоплива. В некоторых вариантах осуществления преимущество в отношении роста и/или пролиферации сконструированного микроба, обеспеченное аспектами данного изобретения, позволяет использовать нестерильные условия культивирования и ферментации для производства биотоплива или предшественника биотоплива, так как проблема разрастания культуры под действием загрязняющих микробов является уменьшенной или полностью устраненной. В некоторых вариантах осуществления сконструированный микроб, обеспеченный аспектами данного изобретения, культивирован в нестерильных условиях для производства биотоплива или предшественника биотоплива. Например, в некоторых вариантах осуществления используется нестерильное сырье, нестерильная культуральная среда, нестерильные добавки или нестерильный биореактор (например, открытый реактор в нестерильных условиях) для производства биотоплива или предшественника биотоплива.
Различные микробы могут быть генетически модифицированы в соответствии с некоторыми аспектами данного изобретения и использованы для производства биотоплива или предшественника биотоплива в промышленном масштабе, например, микробы из разнообразных источников дрожжей, таких как жирообразующие дрожжи, бактерии, водоросли и грибы. Неограничивающими примерами пригодных клеток дрожжей являются клетки из Yarrowia lipolytica, Hansenula polymorpha, Pichia pastoris, Saccharomyces cerevisiae, S. bayanus, S.K. lactis, Waltomyces lipofer. Mortierella alpine, Mortierella isabellina, Hansenula polymorpha., Mucor rouxii, Trichosporon cutaneu, Rhodotorula glutinis Saccharomyces diastasicus, Schwanniomyces occidentalis, S. cerevisiae, Pichia stipitis и Schizosaccharomyces pombe. Неограничивающими примерами пригодных бактерий являются Bacillus subtilis, Salmonella, Escherichia coli, Vibrio cholerae, Streptomyces, Pseudomonas fluorescens, Pseudomonas putida, Pseudomonas sp, Rhodococcus sp, Streptomyces sp, и Alcaligenes sp. Неограничивающие примеры пригодных клеток грибов могут быть, например, культивированы из таких разновидностей, как Aspergillus shirousamii, Aspergillus niger и Trichoderma reesei. Неограничивающими примерами клеток водорослей являются клетки из Neochloris oleoabundans, Scenedesmus obliquus, Nannochloropsis sp., Dunaliella tertiolecta, Chlorella vulgaris, Chlorella entersonii, и Spirulina maxima.
Некоторые аспекты данного изобретения обеспечивают способы производства биотоплива или предшественников биотоплива с использованием генетически модифицированных микробов, обеспеченных здесь. В некоторых вариантах осуществления обеспечены способы производства биотоплива или предшественников биотоплива в промышленном масштабе.
Различные источники углерода могут быть превращены в биотопливо или предшественник биотоплива с использованием способа и/или генетически модифицированного микроба, обеспеченного здесь. В некоторых вариантах осуществления источник углерода содержит углевод. Сахара, крахмалы и волокна являются неограничивающими примерами источников углеводов, пригодных для способов конверсии, обеспеченных здесь. В соответствии с некоторыми аспектами данного изобретения, источник углеводов может содержать очищенный и/или неочищенный сахар, крахмал и/или волокно, или их комбинацию. Неограничивающими примерами сахаров являются сбраживаемые сахара, такие как глюкоза, фруктоза, сахароза, ксилоза и лактоза. Неограничивающими примерами крахмалов являются амилаза и амилопектин. Неограничивающими примерами волокон являются растительные волокна, такие как целлюлоза, гемицеллюлоза и древесные волокна. Некоторые аспекты данного изобретения относятся к использованию промышленных побочных продуктов, промежуточных продуктов или отходов, например, экстрактов из растительного сырья, мелассы, соломы или сточных вод в качестве источника углерода. В некоторых вариантах осуществления источник углерода получен из водорослей. В некоторых вариантах осуществления биомасса водорослей получена специально для использования в качестве источника углерода в опосредованном микробами производстве биотоплива или предшественника биотоплива.
В некоторых вариантах осуществления обеспечены способы производства биотоплива или предшественника биотоплива, которые включают использование дешевого, широко распространенного и легкодоступного сырьевого источника углерода в качестве источника углерода. В некоторых вариантах осуществления целлюлоза или гемицеллюлоза используется в качестве источника углерода. В некоторых вариантах осуществления целлюлоза или гемицеллюлоза получена из промышленных побочных продуктов или отходов. В некоторых вариантах осуществления целлюлоза или гемицеллюлоза получена напрямую из биомассы растений или водорослей. Биомасса растений или водорослей является одним из наиболее распространенных сырьевых материалов и содержит значительное количество несбраживаемых сахаров и волокон, например, целлюлозу и гемицеллюлозу. В некоторых вариантах осуществления сырьевую биомассу предварительно обрабатывают для превращения несбраживаемого сахара или волокна в сбраживаемый сахар, делая их, таким образом, пригодными для роста микробов и опосредованного микробами производства биотоплива или предшественника биотоплива. В некоторых вариантах осуществления предварительная обработка сырьевой биомассы включает деполимеризацию компонентов целлюлозы и/или гемицеллюлозы в мономерные сахара с использованием метода предварительной обработки, известного специалистам в данной области, например, метода обработки разбавленной кислотой или разрушения целлюлозы аммиаком (AFEX) (смотри, например, Yang В, Wyman СЕ. Dilute acid and autohydrolysis pretreatment. Methods Mol Biol. 2009; 581:103-14; Balan V, Bals B, Chundawat SP, Marshall D, Dale BE, Lignocellulosic biomass pretreatment using AFEX Methods Mol Biol. 2009; 581:61-77). Другие способы деполимеризации полимеров биомассы в мономерные сахара хорошо известны специалистам в данной области и предполагаются быть использованными в некоторых вариантах осуществления данного изобретения.
В некоторых вариантах осуществления сырьевую биомассу, содержащую несбраживаемые сахара, предварительно обрабатывают с использованием метода обработки разбавленной кислотой для деполимеризации несбраживаемого сахара в мономерный сбраживаемый сахар. В некоторых вариантах осуществления биомассу обрабатывают разбавленной серной кислотой при относительно умеренных температурах в течение определенного периода времени. Например, в некоторых вариантах осуществления биомассу обрабатывают около 0,5%, около 1%, около 2%, около 3%, около 4%, около 5% или около 6% серной кислотой. В некоторых вариантах осуществления биомассу обрабатывают при температуре около 30°С, около 37°С, около 40°С, около 50°С, около 60°С, около 70°С, около 80°С, около 90°С, около 100°С, около 110°С, около 120°С, около 130°С, около 140°С, около 150°С, около 175°С, около 200°С, или при около 200°С или выше.
В некоторых вариантах осуществления полученный гидролизат содержит нерастворимый лигнин и солюбилизированный целлюлозные и гемигеллюлозные полимеры. Указанные продукты могут быть дополнительно обработаны для получения гексозных и пентозных сахаров, таких как мономеры глюкозы и ксилозы с помощью способов, хорошо известных специалистам в данной области, например, путем обработки целлюлазой или другими гидролизующими ферментами. В некоторых вариантах осуществления предварительная обработка несбраживаемых сахаров разбавленной кислотой приводит к образованию побочных продуктов, которые включают токсические соединения, которые ингибируют рост, снижают жизнеспособность и/или ингибируют выработку биотоплива или предшественника биотоплива микробами, не сконструированными согласно аспектам данного изобретения. В некоторых вариантах осуществления предварительно обработанный сырьевой материал промывают, дополняют средой, поддерживающей микробный рост и выработку биотоплива или предшественника биотоплива, и/или обрабатывают избытком извести для детоксификации.
В некоторых вариантах осуществления сырьевую биомассу, содержащую несбраживаемые сахара, предварительно обрабатывают с использованием метода AFEX для деполимеризации несбраживаемого сахара в мономерный сбраживаемый сахар. В некоторых вариантах осуществления биомассу обрабатывают жидким аммиаком при высокой температуре и давлении в течение определенного периода времени. В некоторых вариантах осуществления биомассу обрабатывают в течение около 10 минут, около 20 минут, около 30 минут, около 40 минут, около 50 минут, около 60 минут, около 70 минут, около 80 минут, около 90 минут или дольше. В некоторых вариантах осуществления биомассу обрабатывают при температуре около 30°С, около 37°С, около 40°С, около 50°С, около 60°С, около 70°С, около 80°С, около 90°С, около 100°С, около 110°С, около 120°С, около 130°С, около 140°С, около 150°С, около 175°С, около 200°С, или при около 200°С или выше. В некоторых вариантах осуществления предварительная обработка AFEX приводит к превращению кристаллической целлюлозы, содержащейся в сырьевом материале, в аморфную сбраживаемую форму. В некоторых вариантах осуществления предварительно обработанная методом AFEX сырьевая биомасса не содержит значительных количеств токсических побочных продуктов, которые ингибируют рост микробов и/или выработку биотоплива или предшественника биотоплива, и используется без предварительной детоксификации для микробного производства биотоплива или предшественника биотоплива.
В некоторых вариантах осуществления сырьевую биомассу, с предварительной обработкой или без нее, обрабатывают ферментом, который гидролизует или деполимеризует полимеры сахаров, например, ферментом целлюлазой или гемицеллюлазой. В некоторых вариантах осуществления сырьевой материал приводят в контакт с ферментом в жидкой фазе и инкубируют при температуре, дающей возможность ферменту катализировать реакцию деполимеризации или гидролизации, в течение времени, достаточного для гидролиза или деполимеризации значительного количества несбраживаемого сахара или волокна в сырьевой биомассе. В некоторых вариантах осуществления жидкую фазу сырьевого материала, приведенного в контакт с ферментом, который содержит растворимую сбраживаемую фракцию сахара, отделяют от твердой фазы, включая несбраживаемые сахара и волокна, после инкубации для гидролизации и деполимеризации, например, путем центрифугирования. В некоторых вариантах осуществления жидкую фракцию сырьевого материала затем приводят в контакт с микробом, например, микробом, обеспеченным аспектами данного изобретения, для превращения в биотопливо или предшественник биотоплива. В некоторых вариантах осуществления ферментативное превращение несбраживаемых сахаров или волокна происходит в совместном биопроцессе, например, в одно и то же время и/или в том же реакторе, в котором происходит микробное превращение полученных сбраживаемых сахаров в биотопливо или предшественник биотоплива. В некоторых вариантах осуществления в первую очередь выполняют ферментативное превращение, и затем сырьевой материал, приведенный в контакт с ферментом, приводят в контакт с микробом для выработки биотоплива или предшественника биотоплива. В некоторых вариантах осуществления ферментативное и микробное превращение выполняют в одно и то же время и в одном и том же реакторе.
В некоторых вариантах осуществления сконструированный микроб, обеспеченный здесь, например, Yarrowia lipolytica, сверхэкспрессирующий продукт гена DGA1, АСС1 и/или SCD, выращен на ацетате в качестве основного источника углерода. В некоторых вариантах осуществления микроб выращен в растворе уксусной кислоты с концентрацией около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9%, около 10% об./об., около 20% об./об., около 25% об./об. или около 30% об./об. В некоторых вариантах осуществления концентрация ацетата составляет около 3%-10% масса/объем. В некоторых вариантах осуществления культуры клеток, содержащие генетически модифицированные микробы, обеспеченные здесь, которые культивированы на ацетате или уксусной кислоте как основном источнике углерода, приводят в контакт или «прокалывают (spiked)» глицерином. В некоторых вариантах осуществления генетически модифицированные микробы прерывисто контактируют с глицерином. В некоторых вариантах осуществления микробы контактируют с глицерином непрерывно или полунепрерывно. В некоторых вариантах осуществления микробы контактируют с глицерином при концентрации около 0,5%, около 1%, около 2%, около 3%, около 4% или около 5% об./об. Приведение в контакт сконструированных микробов, обеспеченных здесь, с глицерином обеспечивает метаболиты для выработки TAG, а также восстановительные фрагменты для выработки жирных кислот из углеводов. В некоторых вариантах осуществления прокалывание глицерином выполняют в способах производства биотоплива или предшественника биотоплива с использованием источника углерода, отличного от ацетата, например, любого источника углерода, описанного здесь.
В некоторых вариантах осуществления сконструированный микроб, обеспеченный здесь, например, Yarrowia lipolytica, сверхэкспрессирующий продукт гена DGA1 и/необязательно продукт гена АСС1 и/или SCD, выращивают на источнике углерода, например, на ацетате или уксусной кислоте, который пополняют во время процесса роста или периода культивирования, например, путем приведения в контакт микроба в культуре с дополнительным количеством источника углерода или с количеством дополнительного источника углерода через некоторый период времени, например, через 8 часов, через 24 часа или через 48 часов. В некоторых вариантах осуществления сконструированный микроб, обеспеченный здесь, первоначально выращен, например, в течение первых 6, 12, 18, 24, 30, 36, 42, 48, 54, 60, 66 или 72 часов в культуральной среде, которая содержит низкое отношение углерода к азоту (C/N), например, отношение C/N, равное около 10, около 20, около 25, около 30, менее чем 30, менее чем 25 или менее чем 20. В некоторых вариантах осуществления низкое отношение C/N достигается путем дополнения культуральной среды источником азота, например, аммиаком, для достижения требуемого отношения C/N. В некоторых вариантах осуществления, например в вариантах осуществления, в которых источник углерода, например, ацетат или уксусная кислота, подаются в культуру вырабатывающих масло микробов, как описано здесь, источник углерода дополняют источником азота, например, аммиаком. В некоторых вариантах осуществления дополнение источником азота прекращают после первоначального периода культивирования, например, после первых 6, 12, 18, 24, 30, 36, 42, 48, 54, 60, 66 или 72 часов в культуре, обеспечивая, таким образом, возможность для сконструированных микробов в культуре потреблять источник азота, что, в свою очередь, приводит к увеличению отношения C/N. Этот сдвиг отношения C/N может быть усилен или ускорен путем подачи дополнительного источника углерода в культуру, которая не является дополненной источником азота, например, путем подачи уксусной кислоты или ацетата, который не является дополненным аммиаком или любым другим источником азота. В некоторых вариантах осуществления оптимальное отношение C/N для выработки масла сконструированным микробом, описанным здесь, находится в диапазоне 80-120.
В некоторых вариантах осуществления процессы ферментации для опосредованной микробом конверсии углевода в липиды в промышленном масштабе могут проводиться в биореакторах. Используемые здесь термины «биореактор» и «ферментер», которые используются взаимозаменяемо, относятся к закрытому или частично закрытому реактору, в котором протекает биологическая и/или химическая реакция, по меньшей мере часть которого включает живой организм или часть живого организма. «Крупный биореактор» или «биореактор промышленного масштаба» представляет собой биореактор, который используется для создания продукта, например, биотоплива или предшественника биотоплива, например, жирной кислоты и/или TAG, в коммерческом или псевдокоммерческом масштабе. Крупные биореакторы обычно имеют объемы в диапазоне литров, сотен литров, тысяч литров или больше.
Биореактор в соответствии с аспектами данного изобретения может содержать микроб или микробную культуру. В некоторых вариантах осуществления биореактор может содержать спору и/или любой вид клетки покоящегося типа любого изолированного микроба, обеспеченного аспектами данного изобретения, например, в сухом состоянии. В некоторых вариантах осуществления добавление пригодного источника углеводов в такие биореакторы может привести к активации покоящейся клетки, например, зарождению спор дрожжей и последующему превращению источника углеводов, по меньшей мере частично, в биотопливо или предшественник биотоплива.
Некоторые биореакторы, в соответствии с аспектами данного изобретения, могут включать системы культивирования клеток, в которых микробы находятся в контакте с движущимися жидкостями и/или пузырьками газа. Микробы или культуры микробов в соответствии с аспектами данного изобретения могут быть выращены в суспензии или прикреплены к твердофазным носителям. Неограничивающие примеры систем носителей включают микроносители (например, полимерные сферы, микрошарики и микродиски, которые могут быть пористыми или непористыми), поперечно-сшитые шарики (например, декстран), заряженные специфическими химическими группами (например, третичными аминогруппами), 2D микроносители, включая клетки, захваченные в непористые полимерные волокна, 3D носители (например, несущие волокна, полые волокна, мультикартриджные реакторы и полупроницаемые мембраны, которые могут содержать пористые волокна), микроносители, имеющие пониженную ионообменную способность, инкапсулирующие клетки, капилляры и агрегаты. Носители могут быть изготовлены из материалов, таких как декстран, желатин, стекло и целлюлоза.
Процессы конверсии углевода в липиды в промышленном масштабе в соответствии с аспектами данного изобретения могут протекать в непрерывных, полунепрерывных или прерывистых режимах. Неограничивающими примерами режимов работы в соответствии с данным изобретением являются стационарный (batch), стационарный с подпиткой (fed batch), стационарный продленный (extended batch), стационарный повторяющийся (repetitive batch), периодического наполнения, вращающейся стенки, вращающегося флакона и/или перфузионный режим работы.
В некоторых вариантах осуществления могут быть использованы биореакторы, которые обеспечивают непрерывное или полунепрерывное пополнение запаса субстрата, например, источника углевода, и/или непрерывное или полунепрерывное разделение продукта, например, секретируемого липида, органической фазы, содержащей липид, и/или клеток, проявляющих требуемое содержание липида, из реактора.
Неограничивающими примерами биореакторов в соответствии с данным изобретением являются: вертикальные ферментеры с перемешиванием, биореакторы, перемешиваемые с помощью вращающихся перемешивающих устройств, хемостаты, биореакторы, перемешиваемые с помощью встряхивающих устройств, эрлифтные ферментеры, реакторы с фильтрующим наполнителем, реакторы с фиксированной твердой фазой, биореакторы со взвешенной твердой фазой, биореакторы, использующие волновое перемешивание, центрифужные биореакторы, роллерные флаконы и биореакторы с полыми волокнами, роллерные устройства (например, настольные, передвижные и/или автоматические разновидности), вертикально уложенные пластины, вращающиеся флаконы, перемешивающие или измельчающие флаконы, встряхивающие многолуночные планшеты, MD бутыли, Т-флаконы, Roux бутыли, тканевые культуральные культиваторы со множеством поверхностей, модифицированные ферментеры и покрытые шарики (например, шарики, покрытые сывороточными белками, нитроцеллюлозой или карбоксиметилцеллюлозой для предотвращения прикрепления клеток).
Биореакторы и ферментеры в соответствии с аспектами данного изобретения могут необязательно содержать датчик и/или систему контроля для измерения и/или регулирования параметров реакции. Неограничивающими примерами параметров реакции являются: биологические параметры, например, скорость роста, размер клеток, число клеток, плотность клеток, тип клеток или состояние клеток, химические параметры, например, рН, редокс-потенциал, концентрация субстрата реакции и/или продукта, концентрация растворенных газов, например, концентрация кислорода и концентрация СО2, концентрация питательных веществ, концентрации метаболитов, концентрация глюкозы, концентрация глутамина, концентрация пирувата, концентрация апатита, концентрация олигопептида, концентрация аминокислоты, концентрация витамина, концентрация гормона, концентрация добавки, концентрация сыворотки, ионная сила, концентрация иона, относительная влажность, молярность, осмолярность, концентрация других химических веществ, например, буферных агентов, вспомогательных веществ или побочных продуктов реакции, физические/механические параметры, например плотность, проводимость, степень перемешивания, давление и скорость потока, усилие сдвига, скорость сдвига, вязкость, цвет, мутность, поглощение света, скорость перемешивания, скорость превращения, а также термодинамические параметры, такие как температура, интенсивность/качество освещения и т.д.
Датчики, которые могут измерять описанные здесь параметры, хорошо известны специалистам в соответствующей области механики и электроники. Системы контроля, которые могут регулировать параметры в биореакторе на основе входных сигналов от датчика, описанные здесь, известны специалистам в области конструирования биореакторов.
Тип источника углерода, подлежащий использованию для превращения в биотопливо или предшественник биотоплива в соответствии с аспектами данного изобретения, зависит от конкретного используемого микроба. Некоторые микробы, обеспеченные аспектами данного изобретения, могут эффективно превращать определенный источник углеводов, при этом другой источник углеводов может не обрабатываться этим же микробом с высокой эффективностью или не обрабатываться вообще. В соответствии с аспектами данного изобретения жирообразующие дрожжи Y. Lipolytica, например, могут эффективно превращать сахара, такие как глюкоза, фруктоза, сахароза и/или лактоза, и источники углевода с высоким содержанием сахаров, например, мелассу, и растительные волокна в жирные кислоты и их производные.
В некоторых вариантах осуществления биотопливо или предшественник биотоплива, например, жирная кислота или триацилглицерин, образованные из сырьевого источника углерода, секретируется, по меньшей мере частично, микробом, обеспеченным аспектами данного изобретения, например, жирообразующими дрожжами, такими как клетка Y. Lipolytica. В некоторых вариантах осуществления микроб, обеспеченный аспектами данного изобретения, приводят в контакт с источником углеводов в водном растворе в биореакторе, и секретируемое биотопливо или предшественник биотоплива образует органическую фазу, которая может быть отделена от водной фазы. Используемый здесь термин «органическая фаза» относится к жидкой фазе, содержащей неполярное органическое соединение, например, жирную кислоту, TAG и/или другой неполярный липид. И органическая фаза в соответствии с данным изобретением может дополнительно содержать микроб, углевод или другое соединение, содержащееся в других фазах, содержащихся в соответствующем биореакторе. Способы, пригодные для разделения фаз в промышленном масштабе, хорошо известны специалистам в данной области. В некоторых вариантах осуществления органическую фазу откачивают непрерывно или полунепрерывно. В некоторых вариантах осуществления используется биореактор, содержащий сепаратор, который непрерывно или полунепрерывно экстрагирует органическую фазу.
В некоторых вариантах осуществления биотопливо или предшественник биотоплива накапливается в клетках в соответствии с аспектами данного изобретения. В некоторых вариантах осуществления клетки, которые накопили требуемое количество биотоплива или предшественника биотоплива, отделяют непрерывно или полунепрерывно из биореактора, например, путем центрифугирования, седиментации или фильтрации. Отделение клеток может быть также выполнено, например, на основе изменения физических характеристик клеток, таких как размер клеток или плотность, с помощью способов, хорошо известных специалистам в данной области. Накопленное биотопливо или предшественник биотоплива может быть в дальнейшем экстрагирован из соответствующих клеток с использованием стандартных способов экстракции, хорошо известных специалистам в данной области, например, экстракцией растворителем генсаном. В некоторых вариантах осуществления микробные клетки собирают и экстрагируют гексаном в объеме, составляющем 3 объема собранных клеток. В некоторых вариантах осуществления экстрагированное биотопливо или предшественник биотоплива дополнительно очищают. В некоторых вариантах осуществления предшественник биотоплива, например, триацилглицерин, превращают в биотопливо, например биодизель, с использованием способа, хорошо известного специалистам в данной области, например, процесса переэтерификации.
Функции и преимущества этих и других вариантов осуществления настоящего изобретения будут более понятны из представленных ниже примеров. Следующие примеры предназначены для иллюстрации преимуществ настоящего изобретения, но не иллюстрируют полный объем изобретения. Таким образом, будет понятно, что раздел примеров не направлен на ограничение объема изобретения.
Примеры
Пример 1
Материалы и способы
Штаммы дрожжей, рост и условия культивирования
Штаммы Y. lipolytica, используемые в данном исследовании, были получены из штамма W29 (АТСС20460) Y. lipolytica дикого типа. Ауксотрофный Po1g (Leu-), используемый во всех трансформациях, получали от фирмы Yeastern Biotech Company (Taipei, Taiwan). Все штаммы, используемые в этом исследовании, перечислены в Таблице 1
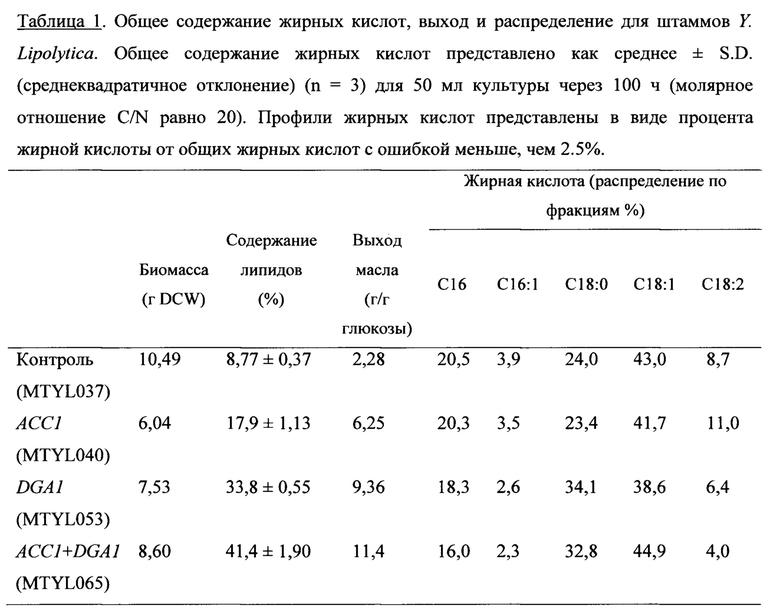
Среда и условия роста для Escherichia coli были описаны ранее Sambrook et al. (21), и для Y. lipolytica были описаны Barth and Gaillardin (11). Обогащенную среду (YPD) готовили с 20 г/л Бактопептона (Difco Laboratories, Detroit, MI), 10 г/л экстракта дрожжей (Difco), 20 г/л глюкозы (Sigma-Aldrich, St. Louis, МО). Среду YNB готовили с 1.7 г/л основы азотного агара для дрожжей (без аминокислот) (Difco), 0,69 г/л CSM-Leu (MP Biomedicals, Solon, ОН) и 20 г/л глюкозы. Планшеты с селективной средой YNB содержали 1.7 г/л основы азотного агара для дрожжей (без аминокислот), 0,69 г/л CSM-Leu, 20 г/л глюкозы и 15 г/л Бактоагара (Difco).
Эксперименты методом встряхивания колбы проводили с использованием следующей среды: 1.7 г/л основы азотного агара для дрожжей (без аминокислот), 1.5 г/л экстракта дрожжей и 50 г/л глюкозы. Из замороженных сырьевых запасов прекультуры инокулировали в среду YNB (в пробирку Falcon объемом 5 мл, 200 об/мин, 28°С, 24 ч). Приготовленные накануне вечером культуры инокулировали в 50 мл среды во встряхиваемую колбу Эрленмейера объемом 250 мл до оптической плотности (А600) 0,05 и инкубировали в течение 100 часов (200 об/мин, 28°С), после чего биомассу, содержание сахара и содержание липида измеряли и анализировали.
Ферментацию в масштабе биореактора проводили в биореакторе объемом 2 литра с механическим перемешиванием, содержащем корпус с перегородками. Используемая среда содержала 1.5 г/л основы азотного агара для дрожжей (без аминокислот и сульфата аммония), 2 г/л сульфата аммония, 1 г/л экстракта дрожжей и 90 г/л глюкозы. Из планшета с селективной средой начальную прекультуру инокулировали в среду YPD (40 мл в колбу Эрленмейера объемом 250 мл, 200 об/мин, 28°С, 24 ч). Экспоненциально растущие клетки из приготовленной накануне прекультуры переносили в биореактор до оптической плотности (А600) 0,1 в реакторе объемом 2 л (аэрация 2.5 vvm, рН 6.8, 28°С, перемешивание 250 об/мин). Образцы, отобранные в определенные моменты времени, хранили при -20°С для последующего анализа липидов. Содержание сахара и органической кислоты определяли с помощью HPLC. Биомассу определяли гравиметрически из образцов, высушенных при 60°С в течение двух ночей.
Конструкция плазмиды
Стандартные молекулярно-генетические методики использовали на протяжении этого исследования (21). Ферменты рестрикции и полимеразу Phusion High-Fidelity DNA polymerase, используемую в клонировании, получали от фирмы New England Biolabs (Ipswich, MA). Геномную ДНК выделяли из трансформантов дрожжей с использованием набора Yeastar Genomic DNA kit (Zymo Research, Irvine, CA). Все сконструированные плазмиды проверяли с помощью секвенирования. Продукты ПЦР (PCR) и фрагменты ДНК очищали с помощью набора PCR Purification Kit или набора QIAEX II kit (Qiagen, Valencia, СА). Используемые плазмиды описаны в Таблице 3. Используемые праймеры описаны в Таблице 4.
Плазмиду рМТ010 конструировали путем амплификации промоторной области фактора элонгации трансляции 1 альфа (TEF) (Accession number: AF054508) из геномной ДНК Y. lipolytica штамма Po1g с использованием праймеров МТ078 и МТ079. Ампликон вставляли между сайтами SalI и KpnI исходного вектора, pINA1269, также известного как pYLEX1, полученного от фирмы Yeastern Biotech Company (Taipei, Taiwan). Также, в обратный праймер МТ079 были включены сайты MluI и NsiI для добавления сайтов рестрикции в сайт множественного клонирования.
Плазмиду рМТ015 конструировали путем амплификации из геномной ДНК Y. lipolytica штамма Po1g промотора TEF и 5' кодирующей области, содержащей старт-кодон ATG и 113 bp (пар оснований) эндогенного интрона (Accession number: CR382129). Праймеры МТ118 и МТ122 использовали для этой амплификации и вставляли между сайтами SalI и MluI рМТ010. В целях клонирования некоторые из интронов были опущены для инкорпорации сайта рестрикции SnaBI. Таким образом, клонирование гена в эту плазмиду требует пропуска старт-кодона ATG гена, добавления TAACCGCAG в начало 5' праймера, и лигирование тупых концов на 5' конце.
Плазмиду рМТ025 конструировали путем амплификации гена LacZ, кодирующего β-галактозидазу, из Е. coli и вставляли в сайты PmlI и BamHI исходного вектора pINA1269 с использованием праймеров МТ170 и МТ171. Плазмиду рМТ038 конструировали путем амплификации гена LacZ и вставки его в сайты MluI и NsiI рМТ010 с использованием праймеров МТ168 и МТ169. Так как LacZ содержит множество сайтов MluI, AscI использовали в качестве 5' сайта рестрикции на МТ168, который имел совпадающие «липкие концы». Плазмиду рМТ037 конструировали путем амплификации гена LacZ и вставки его в сайты SnaBI и NsiI рМТ015. Использовали праймеры МТ172 и МТ169, при этом прямой праймер МТ127 пропускает старт-кодон ATG LacZ и вместо этого начинается с последовательности TAACCGCAG, которая завершает интронную последовательность рМТ015.
Плазмиду рМТ013 конструировали путем амплификации гена АСС1 из геномной ДНК Y. lipolytica штамма Po1g (Accession Number: ХМ_501721) и вставки его в сайты MluI и NsiI рМТ010 с использованием праймеров МТ080 и МТ081. Плазмиду рМТ040 конструировали путем амплификации гена АСС1 и его терминатора из рМТ013 с использованием праймеров МТ222 и МТ137 и вставки этого в исходный вектор pINA1269, расщепленный PmlI и ClaI.
Плазмиду рМТ053 конструировали путем амплификации гена DGA1 из геномной ДНК Y. lipolytica штамма Po1g (Accession Number: ХМ_504700) с использованием праймеров МТ271 и МТ272. Амплифицированный ген был расщеплен NsiI и вставлен в РМТ015 таким же способом, как в случае конструирования рМТ037.
Для получения одной плазмиды, которая может экспрессировать АСС1 и DGA1, кассету промотор-ген-терминатор амплифицировали из рМТ053 с использованием праймеров МТ220 и МТ265. Это затем расщепляли DpnI и AseI, и вставляли в рМТ040, затем расщепляли NruI и AseI с получением тандемной конструкции гена рМТ065. Сайт рестрикции AseI был выбран для содействия селекции, так как он расположен в пределах маркерного гена устойчивости к ампициллину. Так как NruI является сайтом рестрикции с тупыми концами, вставка ампликона не увеличивает общее число сайтов NruI для содействия прогрессивным вставкам.
Плазмиды линеаризовали с помощью либо NotI или SacII, и хромосомно интегрировали в Po1g согласно одностадийному методу трансформации с ацетатом лития, описанным Chen et al. (22). Трансформанты засевали на селективную среду и проверяли с помощью PCR полученной геномной ДНК. Проверенные трансформанты затем хранили в замороженном виде при -80°С и на селективных планшетах YNB при 4°С.
Выделение RNA и количественное определение транскрипта
Штаммы дрожжей выращивали на YNB в течение 24 ч, собирали, замораживали жидким азотом и хранили при 80°С. Образцы затем измельчали в жидком азоте и тотальную РНК выделяли из Y. lipolytica с помощью набора RNeasy Mini Kit (Qiagen) и обрабатывали RNase-free DNase во время стадии выделения в соответствии с инструкциями изготовителя. Выделенную РНК количественно определяли с помощью спектрофотометрии при 260 нм. Анализ с помощью количественной ПЦР с детекцией в реальном времени (qRT-PCR) проводили с использованием набора iScript One-step RT-PCR Kit в присутствии SYBR Green (Bio-Rad, Hercules, CA). Сравнительная количественная оценка была основана на способе 2ΔCT с использованием АСТ1, кодирующего актин, в качестве внутреннего контроля. Образцы анализировали в трех параллелях.
Анализ β-галактозидазы
Ферментативную активность LacZ измеряли с использованием набора для анализа β-галактозидазы (β-gal assay kit) от фирмы Sigma-Aldrich. Клетки ресуспендировали в буфере PBS и лизировали путем перемешивания на вортексе со стеклянными шариками 500 мкм (Sigma-Aldrich) в течение 2 минут. Клеточный лизат в объеме 40 мкл переносили в 340 мкл реакционной смеси, содержащей 47 мг/мл ONPG, 0,6 М Na2HPO4⋅7H2O, 0,4 М NaH2PO4⋅H2O, 0,1 М KCl, 0,01 М MgSO4⋅7H2O. Реакционную смесь инкубировали при 37°С до возникновения изменения цвета и в заключение гасили 500 мкл 1М карбоната натрия. Затем измеряли поглощение на спектрофотометре при 420 нм. Единицы активности фермента рассчитывали на основе ферментативной активности, деленной на время инкубации и сухой вес клеток.
Анализ липидов
Общие липиды экстрагировали с использованием методики Folch et al (23). Отмеренное количество клеточной биомассы (в грубом приближении 1 мг) суспендировали в 1 мл раствора хлороформ : метанол (2:1) и перемешивали на вортексе в течение 1 часа. После центрифугирования 500 мкл переносили в 125 мкл солевого раствора. Верхний водный слой удаляли, и нижний слой выпаривали и ресуспендировали в 100 мкл гексана. Образцы затем хранили при -20°С до переэтерификации.
Переэтерификацию экстрактов общих липидов выполняли путем добавления 1 мл 2% (масса/объем) серной кислоты в метаноле в каждый образец. Образцы затем инкубировали при 60°С в течение 2 часов. После этого образцы частично выпаривали и сложные метиловые эфиры жирных кислот (FAME) экстрагировали путем добавления 1 мл гексана, и перемешивали на вортексе в течение 10 мин. Затем 800 мкл этого гексана переносили в стеклянные колбы для анализов методом газовой хроматографии (GC).
Анализы FAME методом газовой хроматографии (GC) выполняли с использованием прибора Bruker 450-GC, оснащенного пламенно-ионизационным детектором и капиллярной колонкой HP-INNOWAX (30 м × 0,25 мм). Режим работы термостата GC был следующий: 150°С (1 мин), 10 мин подъем до 230°С, выдержка при 230°С в течение 2 мин. Коэффициент деления потока (split ratio) составил 10:1. Жирные кислоты идентифицировали и количественно определяли путем сравнения с коммерческими стандартами FAME, нормализованными к метил тридеканоату (С13:0). Общее содержание липидов рассчитывали как сумму общих содержаний жирных кислот для пяти FAME: метилпальмитат (С16:0), метил пальмитолеат (С16:1), метил стеарат (С18:0), метил олеат (С18:1), метил линолеат (С18:2) (Sigma-Aldrich). Добавление тридеканоевой кислоты в экстрагент хлороформ-метанол использовали в качестве внутреннего стандарта на протяжении всего анализа и переэтерифицировали в его сложный метиловый эфир.
Результаты и обсуждение
Установление платформы для высокой экспрессии, в которой используется усиливающий экспрессию интрон фактора элонгации трансляции-1α
Имеется ряд промоторов, которые вызывают экспрессию генов в Y. Lipolytica, включая индуцируемые и конститутивные промоторы (24). Промотор TEF был изначально идентифицирован как сильный конститутивный промотор; однако последующее клонирование и определение характеристик привело к более низкой экспрессии по сравнению с индуцируемым промотором XPR2 (25). Совсем недавно стал популярным гибридный промотор hp4d благодаря своей сильной квазиконститутивной экспрессии (26), и был использован в ряде применений, в которых требовалась высокая экспрессия белков (20, 27, 28).
Анализ геномной последовательности в отношении TEF выявил присутствие сплайсомного интрона длиной 122-bp (пар оснований) сразу же после старт-кодона в 5' области открытой рамки считывания. Было обнаружено, что проксимальные промоторные сплайсомные интроны часто оказывают сильное влияние на экспрессию их соответствующих генов в различных организмах (29). Авторы изобретения предполагают, что сильная экспрессия TEF зависит от этого интрона и что более сильная экспрессия может быть достигнута путем включения интрона вместе с промотором в экспрессионный вектор. Разумеется, начальный скрининг и выделение промотора TEF вероятно были основаны на опосредованном интроном усилении экспрессии для внесения в библиотеки cDNA, признака, который не был бы замечен, если бы интрон не был сплайсирован.
Конструировали плазмиды рМТ025, рМТ037 и рМТ038, экспрессирующие LacZ, для сравнения относительной экспрессии трех промоторов: синтетического гибридного промотора (php4d), промотора TEF без интрона (pTEF) и промотора TEF с интроном (pTEFin). Примечательно, промотор TEFin проявляет 17-кратное увеличение экспрессии по сравнению с безинтронным промотором TEF, и 5-кратное увеличение экспрессии по сравнению с промотором hp4d через 50 ч культивирования.
Опосредованное интроном усиление экспрессии, наблюдаемое в других системах, сильно изменяется: от только 2-кратного в человеческих клетках и дрожжах до 1000-кратного в кукурузе (30, 31). Полагают, что интроны усиливают экспрессию генов несколькими путями: содержанием регуляторных элементов, способствующих экспорту mRNA, и увеличением скоростей инициации транскрипции (29). Интронные гены, как группа, имеют тенденцию к проявлению более высоких уровней экспрессии по сравнению с безинтронными генами. Например, в S. cerevisiae интронные гены представляют только менее 4% от общего числа генов, обеспечивая при этом 27% тотальной РНК, образованной в клетке (32). Геном Y. lipolytica содержит интроны в 10,6% своих генов по сравнению с только 4,5% в S. cerevisiae (33). Привлечение этого эндогенного процесса для усиления экспрессии разработанных авторами изобретения генов является простым средством максимального увеличения экспрессии, который можно применять для широкого круга эукариотических организмов. Например, имеется высокая степень гомологии сплайс-вариантов последовательностей среди дрожжей Hemiascomycetous (34). Несмотря на то, что исследование продолжается для дальнейшего изучения функции, эволюции и назначения интронов, применение интронов в биотехнологических целях является относительно неиспользованной возможностью.
Сверхэкспрессия АСС1 и DGA1 приводит к значительным увеличениям накопления липидов
Использование промотора TEF вместе с его усиливающим экспрессию интроном обеспечивает отличную платформу для высокой экспрессии генов в Y. Lipolytica. Таким образом, авторы изобретения использовали это для сверхэкспрессии DGA1 (рМТ053), который оказался важным в отношении накопления липидов в обоих видах дрожжей, Y. lipolytica и S. cerevisiae (19, 35). Ген АСС1, уже имеющий два эндогенных промоторных проксимальных интронов, не клонировали вместе с промотором TEFin. Вместо этого указанный ген клонировали вместе с промоторами TEF и hp4d (рМТ013 и рМТ040, соответственно). Скорости роста и выработка липидов были относительно схожими между этими двумя вариантами (данные не показаны), поэтому php4d-ACC1 использовали для экспериментов по выработке липидов и для тандемной конструкции генов ACC1+DGA1 (рМТ065). К тому же, промотор hp4d был отобран для максимального уменьшения возможности гомологичной рекомбинации двух параллельных кассет генов в конструкции ACC1+DGA1. Одновременная коэкспрессия двух генов в Y. lipolytica с использованием тандемной конструкции генов была успешно выполнена где-либо в другом месте (20).
Эффект сверхэкспрессии АСС1 и DGA1 на выработку липидов сначала оценивали в экспериментах методом встряхивания колбы. Контрольный LacZ штамм вырабатывал только 8,77% (г/г DCW) липидов, что является сходным с показателем для дикого типа по методу встряхиваемой колбы с глюкозой в качестве единственного субстрата (36). Оба трансформанта, АСС1 и DGA1, превзошли контроль, накапливая 17,9% и 33,8% содержания липидов, соответственно. В частности, DGA1 показал накопление липидов, почти в два раза превышающее АСС1, почти в 4 раза превышающее контроль. Биомасса, образованная из контроля, была значительно выше, чем другие штаммы, что указывает на то, что экспрессия АСС1 и DGA1 может нарушать потенциальные возможности роста Y. Lipolytica. Суммарные выходы масла были относительно низкими по сравнению с теоретическим максимальным выходом, составляющим 0,32 г/г (37). Имелись также незначительные сдвиги в профиле жирных кислот, при этом АСС1 вырабатывал значительно больше линолевой кислоты, и DGA1 сохранял более высокое относительное содержание стеариновой кислоты. Относительное содержание олеиновой кислоты оставалось относительно ровным на протяжении всех трансформаций.
В результате использования обоих трансформантов одного гена, ACC1+DGA1, содержание липидов достигло 41.4%, то есть 4,7-кратного улучшения по сравнению с контролем. Выработка биомассы была улучшена по сравнению с индивидуальными трансформантами, но все еще была меньше контроля. Выход масла улучшился пропорционально до 0,114 г/г или 35% от теоретического выхода.
В эукариотических организмах сверхэкспрессия АСС обеспечила только ограниченное улучшение выработки липидов. Гетерологичная экспрессия АСС1 из жирообразующих грибов Mucor rouxii в нежирообразующих дрожжах Hansenula polymorpha смогла обеспечить увеличение общего содержания жирных кислот только на 40%, то есть от 3,8% до 5,3% (38). В растениях сверхэкспрессия АСС1 Arabidopsis привела к значительным увеличениям ферментативной активности, но не более чем 30% увеличению конечного содержания липидов (39, 40). Предполагается, что улучшения были ограниченными по причине сильного метаболического и регуляторного контроля, сохраняющегося над этим ферментом в эукариотах. Экспрессия и активность АСС усилены многочисленными факторами транскрипции, протеинкиназами и метаболитами (41). Например, в Candida (Yarrowia) lipolytica накопление ацил-СоА в мутантах ацетил-СоА-синтетазы привело к 8-кратному понижению активности АСС (42). Тем не менее, Y. lipolytica может являться исключением среди эукариотических организмов благодаря своей жировой природе, с 2-кратным увеличением содержания липидов посредством сверхэкспрессии эндогенного АСС1, которое было достигнуто авторами изобретения.
Только недавно было обнаружено, что DGA является важным для синтеза липидов. В Y. lipolytica, DGA1p преимущественно локализуется на поверхности мембран липидных тел и действует совместно с липазой триглицеридов (TGL3) для уравновешивания потока TAG внутрь и наружу из липидных тел (16). Таким образом, можно ожидать, что резервирование TAG в значительной степени основано на относительной активности (и распространенности) DGA1p относительно его партнера TGL3p.Кроме того, было сделано предположение, что DGA перенаправляет поток в сторону от синтеза фосфолипидов и, таким образом, создает движущую силу для синтеза липидов, так как больший поток требуется для выработки все еще необходимых фосфолипидов (6). Таким образом, сверхэкспрессия DGA1 оказывает значительное влияние на накопление липидов. Сверхэкспрессия DGA1 в жирообразующем мутанте Δsnf2 приводит к накоплению до 27% содержания липидов в S. Cerevisiae, то есть 2.3-кратному увеличению (35). В растениях сверхэкспрессия DGAT Arabidopsis приводит к 20-кратному увеличению содержания липидов в листьях, и двукратному в целом (43).
Баланс между путями синтеза жирной кислоты и TAG, так или иначе, связан с интермедиатами ацил-СоА, поскольку они функционируют как в качестве продуктов, так и в качестве ингибиторов по типу обратной связи в вышерасположенном (upstream) пути синтеза жирных кислот и первичных предшественников в нижерасположенном (downstream) пути синтеза TAG. Повышающее регулирование вышерасположенного пути увеличивает производительность синтеза жирных кислот, и в отношении АСС, в частности, перенаправляет поток в сторону от любых путей, которые будут конкурировать за цитозольный ацетил-СоА. Повышающее регулирование нижерасположенного пути создает движущую силу путем деплеции интермедиатов ацил-СоА и увеличения скорости резервирования TAG в липидных телах. Однако при индивидуальном модулировании может произойти нарушение баланса, что может вызвать нежелательные воздействия на метаболизм и рост клеток.
При коэкспрессии АСС1 и DGA1 как вышерасположенный, так и нижерасположенный путь одновременно повышающе регулируются, что приводит к увеличению выработки липидов без нарушения регуляции, опосредованной интермедиатом. Коэкспрессия также объединяет высокий поток в направлении синтеза липидов от АСС с движущей силой, обеспеченной секвестрацией TAG в липидные тела с помощью DGA. Результатом является синергическое увеличение накопления липидов, которое почти в 5 раз превышает контроль. Таким образом, сочетание сверхвыработки и движущих сил с метаболическим стоком стало мощной стратегией в недавних попытках метаболического инженеринга, в частности, для производства биотоплива (44-46).
Выполнение ферментации трансформанта АСС1+DGA1
Для дальнейшей характеристики трансформанта ACC1+DGA1 (MTYL065) и использования его для изучения свойств в отношении накопления липидов, ферментацию в больших объемах выполняли с использованием биореактора с механическим перемешиванием объемом 2 л. Концентрацию глюкозы увеличивали, и концентрацию сульфата аммония уменьшали для достижения молярного отношения C/N, равного 100. Оптимальные молярные отношения C/N для накопления липидов, как правило, изменяются в диапазоне 80-120 (15).
Глюкоза полностью потреблялась в ходе 120 ч ферментации, при этом конечная биомасса достигала 28,49 г/л (Фигура 3). Конечное содержание липидов составило 61.7% DCW, то есть 50% увеличение накопления липидов по сравнению с экспериментом методом встряхивания колбы. Это значительно отличается от других ферментаций сахара (28, 47-49), а также значений, рассматриваемых в схемах ex novo накопления липидов (19, 50). Общий выход и продуктивность составили 0,195 г/г и 0,143 г/л/ч, соответственно; однако, во время максимальной выработки липидов, наблюдаемой между 70-100 часами, были достигнуты выход 0,270 г/г и продуктивность 0,253 г/л/ч (Таблица 2). Почти вся биомасса, выработанная во время этой стадии, может быть обусловлена увеличением содержания липидов. Достигнутые общие и максимальные выходы составили 60,9% и 84,3% от теоретического выхода для синтеза TAG.


Профиль жирной кислоты сильно изменился во время масштабирования (Фигура 4). Наблюдалось относительное истощение стеариновой кислоты и обогащение пальмитиновой кислоты и олеиновой кислотой, при этом только олеиновая кислота составляла 49,3% общих жирных кислот. Соотношение между олеиновой и стеариновой кислотами постоянно увеличивалось в процессе ферментации (данные не показаны), в конечном итоге достигнув отношения, равного 4,6. Это является значительным изменением по сравнению с отношением, равным 1.3, наблюдаемым в экспериментах методом встряхивания колбы. Аналогичный эксперимент выполняли с ацетатом в качестве источника углерода. Профиль жирных кислот анализировали через 134 ч, и результаты показаны на Фигуре 5.
Высокие относительные концентрации олеата (до 58,5%) наблюдались также в других ферментациях 2 л (51), и имеют сходство с профилями других жирообразующих дрожжей, которые накапливают более чем 50% содержания липидов (15). В условиях быстрой выработки липидов олеиновая кислота может быстрее резервироваться и легче накапливаться, так как известно, что DGA1p имеет изменяющиеся специфичности в отношении различных ацил-СоА; в S. cerevisiae, С18:1 является наиболее предпочтительным субстратом с активностью, которая в два раза превышает активность С18:0 (52). Кроме того, высокая концентрация олеиновой кислоты может являться реакцией на более высокую скорость аэрации, достигнутую в биореакторе и не сразу видимую в ферментациях методом встряхивания колбы.
Высокое содержание липидов, выход и продуктивность, наблюдаемые в штамме ACC1+DGA1, демонстрируют врожденную способность Y. Lipolytica направлять высокий поток на путь синтеза липидов. С помощью дополнительных модификаций и оптимизации процесса, дрожжи Y. lipolytica с помощью сконструированных путей синтеза липидов могут обеспечить перспективные открытия в области эффективного de novo синтеза липидов.

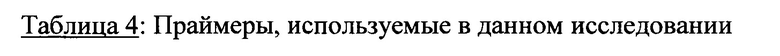
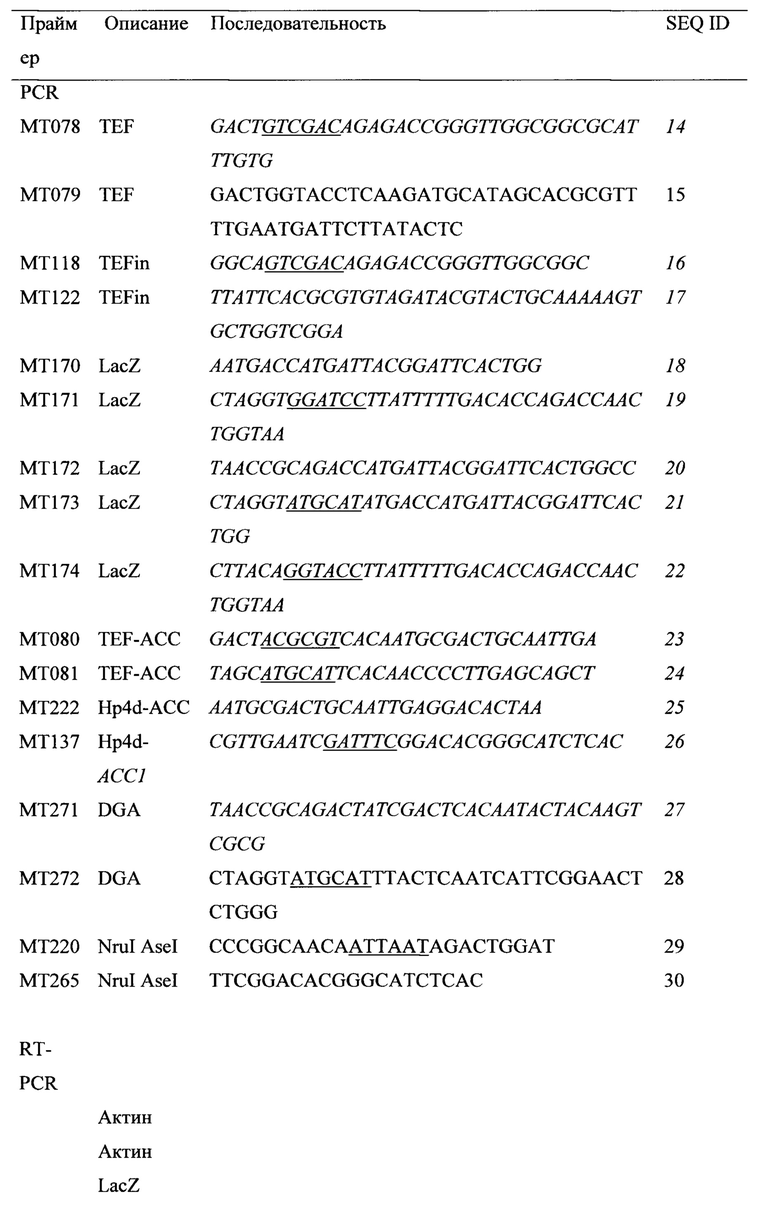

Выработка липидов из ацетата с использованием сконструированного штамма АСС+DGA
Дрожжи Yarrowia lipolytica природным образом растут на органической кислоте, в частности, на ацетате. Ацетат является предпочтительным субстратом, так как он может вырабатываться с высокими выходами гомоацетогенными организмами из диоксида углерода или моноксида углерода посредством нефотосинтетических путей фиксации углерода. Ацетат вступает на пути клеточного метаболизма в форме ацетил-СоА, основного предшественника синтеза липидов посредством ацетил-СоА-карбоксилазы (АСС). Таким образом, штамм АСС+DGA выглядит перспективным кандидатом для выработки липидов на ацетатном субстрате, так как имеется прямая сверхэкспрессия ацетил-СоА с использованием фермента, связанного с мощной движущей силой для накопления липидов.
Ферментацию в биореакторе объемом 2 л выполняли с использованием штамма ACC+DGA с ацетатом в качестве углеродного субстрата (Фигура 6). При высоком содержании кислорода наблюдалось, что ацетат быстро потреблялся с низким образованием биомассы, поэтому ферментацию проводили в условиях лимитирования как азота, так и кислорода для максимального увеличения выработки липидов и выхода.
Конечный титр выработки масла составил 5,5 г/л через 130 часов, что составляет 62% от общих 8,9 г/л биомассы по сухому весу клеток. Общий выход липидов на ацетате составил 0,152 г масла/г ацетата. Во время стадии выработки липидов (между 90-130 ч) максимальная выработка липидов была достигнута при выходе 0,27 г масла/г ацетата, что составляет 96% от теоретического максимального выхода.
Сравнение показателей ферментации с показателями, полученным на глюкозе, показывают, что несмотря на более низкие выходы биомассы и скорости роста, накопление липидов и максимальный выход липидов были соизмеримыми.

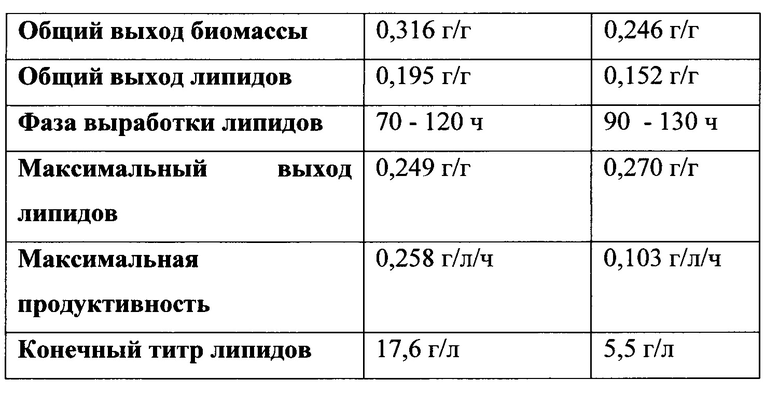
Выводы
Биосинтез липидов представляет собой жестко регулируемый метаболический путь. Для соответствующих применений в промышленности для производства липидов требуется тщательно продуманный метаболический инженеринг для максимального увеличения выходов и продуктивности. Использование жирообразующих дрожжей Y. lipolytica является предпочтительным благодаря наличию высокой способности к накоплению липидов и инструментов для инженеринга метаболического пути липидов. В настоящем документе показано, что усиленная интроном совместная сверхэкспрессия двух важных генов в пути синтеза липидов, АСС1 и DGA1, обеспечивает движущую силу в направлении выработки липидов даже при умеренных отношениях C/N. Так как два фермента осуществляют первую и последнюю стадии синтеза липидов, одновременное «push» и «pull» потока углерода в направлении TAG обеспечивает усиленную выработку с минимальным накоплением интермедиатов, которые могут привести к ингибированию. Полученный штамм ACC1+DGA1 способен накапливать до 62% своей сухой клеточной массы (DCW) в виде липидов посредством синтеза de novo при общей объемной продуктивности 0,143 г/л/ч.
Основные принципы (а) сильной сверхэкспрессии генов пути, (b) баланс вышерасположенных и нижерасположенных путей, (с) перенаправление потока в направлении желательных путей, и (d) движущие силы в направлении конечного продукта, являются главными стратегиями при осуществлении на практике метаболического инженеринга, когда метаболические сети сконструированы и оптимизированы для получения желательных продуктов. Воплощение этих основных принципов в отношении накопления липидов можно легко распространить на ряд биологических платформ, в том числе микроводорослей. Эти стратегии будут главными в обеспечении технологий надежного, эффективного, товарного производства биологических химических веществ и топлива. Их применение для биосинтеза липидов открывает путь для сверхсинтеза микробного масла и экономически эффективного производства биотоплива.
Пример 2.
Комбинаторная экспрессия генов синтеза липидов в Yarrowia lipolytica
Исследование клеточного метаболизма может быть проведено с использованием метаболического инженеринга. Метаболический инженеринг представляет собой использование технологий рекомбинантной ДНК для манипулирования метаболическими путями в организме (Bailey 1991). Посредством манипуляции и инженеринга специфических метаболических сетей могут быть идентифицированы и разработаны контролирующие факторы и определяющие скорость стадии. Опираясь на существующие знания и инструменты для специфического организма или пути можно оценить, каким образом можно использовать новые возмущения для перенаправления и контроля образования желаемых продуктов.
Биосинтез липидов является отличным путем для исследования с использованием метаболического инженеринга, имеющим широкое применение, от здоровья, злокачественных заболеваний и медицины, до производства биохимических веществ и биотоплива (Beopoulos et al. 2011; Courchesne et al. 2009; Kohlwein and Petschnigg 2007). Проводились интенсивные физиологические, ферменталогические и метаболические исследования в отношении биосинтеза липидов в различных организмах, от бактерии до человека, которые дали возможность сформировать мощную базу знаний как для сравнительного, так и для исследовательского анализа (Kurat et al. 2006; Ohlrogge and Jaworski 1997). Метаболизм липидов играет важную роль в ряде аспектов физиологии клеток, от роста клеток и пролиферации до резервирования энергии и метаболизма (Kohlwein and Petschnigg 2007; Tehlivets et al. 2007). Для использования этих путей для медицинских и промышленных целей важно понимать, какие возмущения имеют самое большое воздействие на процесс в целом.
Жирообразующие дрожжи Yarrowia lipolytica рассматриваются как отличная модель организма для исследования метаболизма липидов. Так как Y. lipolytica являются жирообразующими дрожжами, они могут естественным путем накапливать до 36% липидов в обогащенных углеродах средах (Beopoulos et al. 2009). Эти липиды резервируются в форме триацилглицеридов (TAG) в липидных телах. Они являются наиболее изученными «нестандартными» разновидностями дрожжей, с секвенированным геномом и диапазоном доступных генетических инструментов (Barth and Gaillardin 1997). Они использовались в ряде промышленных применений и рассматривались как модель организма для секреции белка, утилизации гидрофобного субстрата, метаболизма липидов и митохондриального дыхания (Beckerich et al. 1998; Beopoulos et al. 2009; Coelho et al. 2010; Kerscher et al. 2002). Несмотря на то, что Y. lipolytica природным образом накапливают большие количества липидов, было сделано ряд успешных попыток по дополнительному увеличению или иному улучшению их характеристик в отношении накопления липидов (Beopoulos et al. 2008; Chuang et al. 2010; Dulermo and Nicaud 2011; Zhang et al. 2011). Однако количество и разнообразие изученных генетических манипуляций остается относительно ограниченным в этом отношении и потенциал Y. Lipolytica в качестве платформы для сверхсинтеза липидов остается относительно неиспользованным.
Некоторые представляющие интерес целевые гены связаны с накоплением липидов посредством различных подходов и стратегий (Courchesne et al. 2009). В целом, ацетил-соА-карбоксилаза (АСС) известна определяющая скорость стадия в биосинтезе жирных кислот, контроле потока, вступающего на данный путь. Ацетил-соА-карбоксилаза (АСС) отвечает за выработку малонил-соА, который может использоваться в элонгации жирных кислот. АСС использует цитозольный ацетил-соА в качестве своего основного метаболического предшественника. Ферментом, который поставляет цитозольный ацетил-соА в большинство эукариот, является АТР цитрат-лиаза (ACL). ACL расщепляет цитрат, который был перенесен по механизму челночного переноса из митохондрии как продукт цикла ТСА, с формированием ацетил-соА и оксалоацетата. После завершения выработки жирной кислоты с помощью комплекса, синтазы жирной кислоты, молекулы ацил-соА могут быть дополнительно манипулированы посредством элонгации и десатурации в эндоплазматическом ретикулуме. Эти процессы помогают модифицировать химические свойства цепей ацил-соА для содействия резервированию или утилизации в других метаболических путях. Ферменты, такие как Δ9-десатураза (D9), превращают молекулы стеароил-соА в молекулы олеоил-соА, что представляется очень важным как в регуляции липидов, так и в метаболизме (Dobrzyn and Ntambi 2005). Конечной стадией в сборке липидов и резервировании является превращение диацилглицерина (DAG) в TAG посредством фермента диацилглицерин ацилтрансферазы (DGA). Реакция этой стадии протекает как в эндоплазматическом ретикулуме, так и на поверхности липидных тел, при этом устанавливается динамическое равновесие между сборкой и деградацией TAG в зависимости от потребностей организма в энергии (Athenstaedt et al. 2006). В Y. lipolytica было идентифицировано ряд генов DGA, которые выполняют эту функцию (Zhang et al. 2011). Эти стадии ферментативных реакций проявляют интересную взаимосвязь с накоплением липидов. АСС контролирует поток, вступающий на путь синтеза липидов, и сверхэкспрессия АСС в бактерии Escherichia coli привела к 6-кратному увеличению синтеза жирных кислот (Davis et al. 2000). Цитратный челнок, который находится под контролем ACL, дифференциально наблюдается в жирообразующих грибах по сравнению с нежирообразующими грибами, и рассматривается как необходимый путь для обеспечения высокого потока на путь биосинтеза липидов (Boulton and Ratledge 1981; Vorapreeda et al. 2012). Также, предполагается, что деактивация ACL приводит к накоплению и секреции цитрата, нежелательному явлению в выработке липидов (Papanikolaou and Aggelis 2002; Papanikolaou et al. 2002). D9 вовлечен в метаболические процессы, происходящие в раковых опухолях, являясь повышающе регулированным в клетках опухоли млекопитающего. D9 является потенциально сильным позитивным регулятором липогенеза и способствует выработке липидов, необходимых для быстрого роста, происходящего в раковых клетках (Dobrzyn and Ntambi 2005; Hulver et al. 2005; Ntambi and Miyazaki 2004). DGA является конечной осуществляемой стадией резервирования липидов, и сверхэкспрессия DGA в мутанте Δsnf2 S. cerevisiae привела к значительным увеличениям накопления липидов (Kamisaka et al. 2007). Несмотря на то, что эти результаты позволили сделать интересные выводы и заключения, анализ их участия в пределах одной модели организма может дать возможность системно оценить их участие и взаимодействие для достижения увеличенной выработки липидов.
В настоящем документе рассмотрено воздействие некоторых важных генов, вовлеченных в биосинтез липидов, и использованы их вклады в направлении увеличения накопления липидов в жирообразующих дрожжах Y. Lipolytica. С помощью сверхэкспрессии целевых генов, отдельно и в комбинации, можно исследовать, каким образом гены могут оказывать положительное воздействие на поток по пути биосинтеза липидов. Кроме того, изучены показатели выработки липидов двух кандидатных штаммов для оценки важности сбалансированного метаболического потока в пределах клетки для достижения высокой продуктивности.
Материалы и способы
Штаммы дрожжей, рост и условия культивирования
Штаммы Y. lipolytica, используемые в этом исследовании, получали из штамма W29 Y. lipolytica дикого типа (АТСС20460). Ауксотрофный Po1g (Leu-), используемый во всех трансформациях, получали от фирмы Yeastern Biotech Company (Taipei, Taiwan). Все штаммы, используемые в этом исследовании, перечислены в Таблице 6. Конструированные плазмиды были линеаризованы с помощью SacII и хромосомно интегрированы в Po1g в соответствии с одностадийным способом трансформации ацетатом лития, описанным Chen et al. (Chen et al. 1997). Названия трансформантам MTYL были присвоены по числовому обозначению их соответствующих интегрированных плазмид, за исключением MTYL088 и MTYL089. Для конструирования штаммов MTYL088 и MTYL089, штаммы MTYL078 и MTYL079 подвергались двум дополнительным циклам трансформации: (1) трансформировали кассетой URA KO на селективной 5-FOA для нокаута эндогенного URA; (2) трансформировали с помощью РМТ092, линеаризованной с помощью SacII. Трансформанты высевали на селективную среду и проверяли с помощью PCR полученной геномной ДНК. Проверенные трансформанты затем хранили в замороженном виде в глицерине при -80°С и на селективных планшетах YNB при 4°С. Краткое описание разработанной сверхэкспрессии генов для каждого штамма представлено в Таблице 7.
Среда и условия выращивания для Escherichia coli были ранее описаны Sambrook et al. (Sambrook and Russell 2001), и для Y. lipolytica были описаны Barth and Gaillardin (Barth and Gaillardin 1997). Обогащенную среду (YPD) готовили с помощью 20 г/л Бактопептона (Difco Laboratories, Detroit, MI), 10 г/л экстракта дрожжей (Difco), 20 г/л глюкозы (Sigma-Aldrich, St. Louis, МО). Среду YNB получали с помощью 1,7 г/л основы азотного агара для дрожжей (без аминокислот) (Difco), 0,69 г/л CSM-Leu (MP Biomedicals, Solon, ОН), и 20 г/л глюкозы. Селективные планшеты YNB содержали 1,7 г/л основы азотного агара для дрожжей (без аминокислот), 0,69 г/л CSM-Leu, 20 г/л глюкозы, и 15 г/л Бактоагара (Difco). Эксперименты методом встряхивания колбы проводили с использованием следующей среды: 1,7 г/л основы азотного агара для дрожжей (без аминокислот), 1,5 г/л экстракта дрожжей, и 50 г/л глюкозы. Из замороженных запасов прекультуры инокулировали в среду YNB (5 мл в пробирке Falcon, 200 об/мин, 28°С, 24 ч). Приготовленные накануне вечером культуры инокулировали в 50 мл среды во встряхиваемые флаконы Эрленмейера объемом 250 мл до оптической плотности (А600) 0,05 и оставляли для инкубации в течение 100 часов (200 об/мин, 28°С), после чего биомассу, содержание сахара и содержание липидов измеряли и анализировали.
Ферментацию в масштабе биореактора проводили в биореакторе объемом 2 л с механическим перемешиванием с корпусом, содержащим перегородки. Используемая среда содержала 1,7 г/л основы азотного агара для дрожжей (без аминокислот и сульфата аммония), 2 г/л сульфата аммония, 1 г/л экстракта дрожжей и 90 г/л глюкозы. Из селективного планшета начальную прекультуру инокулировали в среду YPD (40 мл в колбу Эрленмейера объемом 250 мл, 200 об/мин, 28°С, 24 ч). Экспоненциально растущие клетки из приготовленной накануне вечером прекультуры переносили в биореактор до оптической плотности (А600), равной 0,1 в реакторе объемом 2 л (аэрация 2.5 vvm, рН 6.8, 28°С, перемешивание 250 об/мин). Образцы, отобранные в определенные моменты времени хранили при -20°С для последующего анализа липидов. Содержание сахара органической кислоты определяли с помощью HPLC. Биомассу определяли гравиметрически из образцов, отмытых и высушенных при 60°С в течение двух ночей.
Генетические методы
Стандартные молекулярно-генетические методы использовали на протяжении всего исследования (Sambrook and Russell 2001). Рестрикционные ферменты и ДНК-полимеразу Phusion High-Fidelity DNA polymerase, используемую в клонировании, получали от фирмы New England Biolabs (Ipswich, MA). Геномную ДНК выделяли из трансформантов дрожжей с использованием набора Yeastar Genomic DNA kit (Zymo Research, Irvine, CA). Все сконструированные плазмиды проверяли с помощью секвенирования. Продукты PCR и фрагменты ДНК очищали с помощью набора PCR Purification Kit или набора QIAEX II kit (Qiagen, Valencia, СА). Используемые плазмиды описаны в Таблице 6. Используемые праймеры описаны в Таблице 9.
Делеция URA3
Для увеличения доступности маркеров в штаммах Y. lipolytica, ген, кодирующий на прототрофность по урацилу, оротидин-5'-фосфат декарбоксилазу (URA3, Accession Number: AJ306421) амплифицировали и использовали в качестве основы кассеты нокаута для создания ауксотрофных штаммов URA. Вышерасположенные (upstream) и нижерасположенные (downstream) последовательности открытой рамки считывания URA амплифицировали с использованием пар праймеров МТ310-МТ311 и МТ312-МТ313, соответственно. Праймеры разрабатывали таким образом, что два ампликона несли перекрывающуюся область в 23 bp (пар оснований). После очистки двух ампликонов оба продукта смешивали, и PCR выполняли с использованием праймеров МТ310 и МТ313 с получением ампликона в 456 bp (пар оснований), сливающего вышерасположенные (upstream) и нижерасположенные (downstream) ампликоны. Эту DNA очищали и затем трансформировали в Po1g. Трансформированные клетки затем помещали на планшет с селективной средой, содержащей урацил и 5-фтороротовую кислоту (5-FOA). Колонии, которые выросли, повторно высевали на 5-FOA планшеты для повторной селекции в отношении ауксотрофии URA, и проверяли с помощью PCR полученной геномной ДНК. Полученный штамм ΔLEU2 ΔURA3 был назван MTYL100.
Конструкции плазмид
Конструирование плазмид рМТ010, рМТ015, рМТ038, рМТ040, рМТ013 и рМТ065 описано выше и аналогично способам, описанными здесь. Плазмиду рМТ047, экспрессирующую АТР:цитрат-лиазу субъединицу 1 конструировали путем амплификации гена ACL1 из штамма Po1g Y. lipolytica геномной ДНК (Accession Number: ХМ_504787) и вставляли в сайты MluI и NsiI рМТ010 с использованием праймеров МТ252 и МТ253. Плазмиду рМТ049, экспрессирующую АТР:цитра-лиазу субъединицу 2, аналогично конструировали путем амплификации гена ACL2 из штамма Po1g Y. lipolytica геномной ДНК (Accession Number: ХМ_503231) и вставляли в сайты MluI и NsiI рМТ010 с использованием праймеров МТ254 и МТ255. Плазмиду рМТ061, экспрессирующую десатуразу жирной кислоты Delta-9 (D9) амплифицировали из Po1g геномной ДНК (Accession Number: ХМ_501496) и вставляли в pINA1269 под контролем промотора php4d с использованием сайтов рестрикции PmlI и BamHI с праймерами МТ283 и МТ284.
Для получения плазмид, которые экспрессируют множество генов (рМТ050, рМТ065, рМТ066, рМТ073, рМТ074, рМТ075, рМТ078, рМТ079), кассету промотор-ген-терминатор амплифицировали из одной плазмиды с использованием праймеров МТ220 и МТ265. Это затем расщепляли с помощью DpnI и AseI и вставляли во вторую плазмиду, которую расщепляли с помощью NruI и AseI, что привело к образованию тандемной конструкции генов рМТ065. Сайт рестрикции AseI был отобран для содействия селекции, так как он расположен в пределах устойчивого к пенициллину маркера. Так как NruI является сайтом рестрикции с глухим концом, лигирование вставки не увеличивает общего числа сайтов NruI, обеспечивая, таким образом, повторяющиеся вставки с использованием такого же процесса. Общая последовательность и схема, используемая для комбинаторного конструирования этих плазмид, описана на Фигуре 7. Для конструирования комплементарного вектора pACYCDUET-1 отбирали в качестве комплементарного вектора челночного механизма переноса, так как он использует другую основную цепь, селективный маркер и происхождение репликации. Вышерасположенные (upstream) последовательности LIP2 (Accession Number: ХМ_500282) амплифицировали из штамма Po1g Y. lipolytica геномной ДНК с использованием пар праймеров МТ316-МТ317 и вставляли в pDUET с использованием сайтов рестрикции BamHI и EcoRI. Нижерасположенную (downstream) последовательность LIP2 амплифицировали с использованием пар праймеров МТ318-МТ319 и вставляли в pDUET с использованием сайтов рестрикции KpnI и AvrII. Селективный маркер для прототрофности по урацилу дрожжей амплифицировали из плазмид JMP62-URA с использованием пар праймеров МТ314-МТ315 и интегрировали в pDUET с использованием сайтов рестрикции PvuI и KpnI. Полученная плазмида рМТ091 содержала мультиклонирующий сайт, фланкированный с помощью вышерасположенных (upstream) и нижерасположенных (downstream) последовательностей LIP2, и маркер URA3. Разложение с помощью фермента рестрикции SacII линеаризует плазмиду и отделяет вектор встраивания от основной цепи плазмиды, сводя к минимуму встраивание посторонней и необязательной ДНК. Использование комплементарной плазмиды требует конструирования экспрессионной кассеты на оригинальной основной цепи pINA1269 и затем переноса кассеты на рМТ091 с использованием субклонирования фермента рестрикции. Большой участок мультиклонирования и дифференциальный антибиотический маркер содействуют процессу клонирования и селекции.
Выделение RNA и количественное определение транскрипта
Культуры по методу встряхиваемой колбы, выращиваемые в течение 42 ч, собирали и центрифугировали в течение 5 мин при 10000 г. Каждый клеточный осадок ресуспендировали в 1,0 мл реагента Trizol (Invitrogen) и добавляли 100 мкл промытых кислотой стеклянных шариков (Sigma-Aldrich). Пробирки перемешивали на вортексе в течение 15 мин при 4°С до возникновения лизиса клеток. Пробирки затем центрифугировали в течение 10 мин при 12000 г при 4°С и супернатант собирали в неиспользованные пробирки объемом 2 мл. Затем добавляли 200 мкл хлороформа и пробирки встряхивали вручную в течение 10 секунд. Пробирки снова центрифугировали в течение 10 мин при 12000 г при 4°С. 400 мкл верхней водной фазы переносили в новую пробирку и добавляли равный объем смеси фенол-хлороформ-изоамиловый спирт (рН 4,7) (Ambion, Austin, ТХ). Пробирки снова встряхивали вручную в течение 10 секунд и центрифугировали в течение 10 мин при 12000 г при 4°С. 250 мкл верхней фазы переносили в новую пробирку с равным объемом холодного этанола и 1/10 объема ацетата натрия (рН 5,2). Пробирки охлаждали при -20°С в течение тридцати минут для содействия осаждению. Пробирки затем центрифугировали в течение 5 мин при 12000, отмывали дважды 70% этанолом, сушили в печи при 60°С и в заключение ресуспендировали в не содержащей RNAse воде. Количество RNA анализировали с использованием спектрофотометра NanoDrop ND-1000 (NanoDrop Technologies, Wilmington, DE) и образцы хранили в замороженном виде при -80°С. Анализ методом qRT-PCR проводили с использованием набора iScript One-step RT-PCR Kit с применением SYBR Green (Bio-Rad, Hercules, CA) с использованием системы детекции Bio-Rad iCycler iQ Real-Time PCR Detection System. Результаты флуоресценции анализировали с использованием Real-time PCR Miner, и сравнительное количественное определение и статистический анализ выполняли с помощью REST 2009 (Qiagen) с использованием актина в качестве референсного гена и MTYL038 в качестве референсного штамма (Zhao and Fernald 2005). Образцы анализировали в четырех параллелях.
Экстракция липидов и количественное определение
Общие липиды экстрагировали с использованием методики Folch et al (Folch et al. 1957). Отмеренное количество клеточной биомассы (в грубом приближении 1 мг) суспендировали в 1 мл раствора хлороформ : метанол (2:1) и перемешивали на вортексе в течение 1 часа. После центрифугирования 500 мкл переносили в 125 мкл солевого раствора. Верхний водный слой удаляли, и нижний слой выпаривали и ресуспендировали в 100 мкл гексана. Образцы затем хранили при -20°С до переэтерификации.
Переэтерификацию экстрактов общих липидов выполняли путем добавления 1 мл 2% (масса/объем) серной кислоты в метаноле в каждый образец. Образцы затем инкубировали при 60°С в течение 2 часов. После этого образцы частично выпаривали и метиловые эфиры жирных кислот (FAME) экстрагировали путем добавления 1 мл гексана и перемешивали в течение 10 мин. Затем 800 мкл этого гексана переносили в стеклянную колбу для анализа методом GC.
Анализ FAME методом GC выполняли с помощью прибора Bruker 450-GC, оснащенного пламенно-ионизационным детектором и капиллярной колонкой HP-INNOWAX (30 м × 0,25 мм). Режим работы термостата GC был следующий: 150°С (1 мин), 10 мин подъем до 230°С, выдержка при 230°С в течение 2 мин. Коэффициент деления потока (split ratio) составил 10:1. Жирные кислоты идентифицировали и количественно определяли путем сравнения с коммерческими стандартами FAME, нормализованными к метил тридеканоату (С13:0). Общее содержание липидов рассчитывали как сумму общих содержаний жирных кислот для пяти FAME: метилпальмитат (С16:0), метил пальмитолеат (С16:1), метил стеарат (С18:0), метил олеат (С18:1), метил линолеат (С18:2) (Sigma-Aldrich). Добавление тридеканоевой кислоты в экстрагент хлороформ-метанол использовали в качестве внутреннего стандарта, который использовали на протяжении всего анализа и переэтерифицировали в его метиловый эфир.
Результаты и обсуждение
Конструкция комплементарного вектора обеспечивает альтернативный способ для экспрессии DGA
Для обеспечения альтернативного и комплементарного способа для экспрессии генов в Y. lipolytica, маркер URA был выключен из родительского штамма Po1g. Как часть дизайна комплементарного вектора интеграции, ген внеклеточной липазы LIP2 был выбран в качестве сайта «причаливания», так как этот ген хорошо описан и, по-видимому, имеет отрицательное или нейтральное действие на de novo синтез и накопление липидов. Таким образом, в процессе интеграции комплементарного вектора LIP2 будет выключен. При конструировании комплементарного вектора для экспрессии генов необходимо исследовать, будет ли оказано воздействие на экспрессию гена в зависимости от того, какой трансформационный вектор будет использован. Для тестирования этого, ген, кодирующий диацилглицерин ацилтрансферазу (DGA) клонировали в оба вектора, рМТ015 и рМТ091. Несмотря на то, что экспрессионная кассета была одинаковой в обоих векторах, сайт «причаливания» отличался: сайт «причаливания» pBR322 для рМТ015 (и все векторы на основе pINA1269), и ген LIP2 для рМТ091. После трансформации этих векторов и проверки геномной интеграции выполняли RT-PCR экстрагированной РНК на обоих штаммах, изучая сверхэкспрессию DGA в обоих случаях относительно контрольного штамма (MTYL038). Как показано на Фигуре 8, оба штамма проявляют 32-кратные увеличения экспрессии DGA относительно контрольных штаммов MTYL038. Эти результаты обосновывают использование рМТ091 в качестве комплементарного вектора и LIP2 в качестве альтернативного сайта «причаливания» для экспрессии генов при отсутствии обнаруживаемого вмешательства со стороны возможного эпигенетического феномена.
Полное исследование комбинаторных конструкций идентифицирует улучшенные штаммы с отобранными генами
Для изучения вкладов и взаимодействий целевых генов выполняли исследование различных промежуточных комбинаций экспрессии генов, тестируя способности трансформированных штаммов вырабатывать липиды. В Таблице 7 описаны 13 сконструированных штаммов и повышающая регуляция их соответствующих генов. Все измерения на липиды выполняли через 100 ч культивирования для сравнения скорее продуктивности липидов, чем только накопление липидов. Для промышленных целей общая продуктивность является более важным показателем, чем общее содержание липидов, так как медленно растущий штамм, дающий высокие выходы, все-таки будет менее полезен, чем быстрорастущий штамм, дающий умеренно высокие выходы. Результаты полного исследования продуктивностей липидов и выходов показаны на Фигуре 9.
Исследуемые штаммы, содержащие сверхэкспрессии только одного гена (MTYL040, MTYL053, MTYL050, MTYL061), АСС и DGA имеют явные улучшения как по продуктивности, так и по выходу. ACL и D9 не имеют каких-либо значительных увеличений, ни по продуктивности, ни по выходу. Эти результаты указывают на то, что для Y. lipolytica, АСС и DGA проявляют контроль над биосинтезом липидов и являются определяющими скорость стадиями, в то время как ACL и D9 не проявляют аналогичного явления.
Эффекты АСС и DGA обсуждались более подробно выше, но DGA создает движущую силу путем секвестирования липидов и деплеции интермедиатов ацил-соА, тогда как АСС увеличивает выходы путем перенаправления потока в направлении синтеза липидов и более быстрой мобилизации пула цитозольного ацетил-соА. Когда два гена объединены в штамме MTYL065, они вырабатывают синергическую реакцию путем установления динамики «push-and-pull» в пределах пути синтеза липидов, с ацетил-соА в качестве балансирующего интермедиата.
При объединении с другими генами ген D9 способен обеспечить некоторые преимущества в отношении продуктивности липидов. Например, MTYL069, сверхэкспрессирующий D9 и DGA, имеет более высокие продуктивности липидов, чем MTYL053, который содержит только сверхэкспрессию DGA. Аналогичным образом, MTYL066, сверхэкспрессирующий АСС и D9, имеет более высокие продуктивности липидов, чем MTYL040, сверхэкспрессирующий только АСС. Однако, MTYL073, сверхэкспрессирующий ACC+D9+DGA, показал более низкую продуктивность липидов, чем MTYL065. Не было значительных различий между MTYL089 и ее лишенным D9 вариантом, MTYL088. Несмотря на то, что некоторые преимущества наблюдались в отношении накопления и продуктивности, преимущества в отношении выхода были незначительными. Наблюдение того, что D9 улучшает выработку липидов только в комбинации с другими генами, дает основание предположить, что D9 не обладает сильным регулирующим или определяющим скорость контролем над процессом синтеза липидов, но его ферментативное действие обеспечивает предпочтительные условия, усиливающие действие других генов. В качестве ассоциированного с мембраной фермента на мембране липидного тела и эндоплазматического ретикулума, D9 повышающе регулируется во время фаз накопления липидов (Morin et al. 2011). Было обнаружено, что многие ферменты синтеза липидов обладают самой высокой специфичностью в отношении олеата, который является продуктом десатурации D9 (Oelkers et al. 2002). Это также продемонстрировано наблюдением, что Y. lipolytica растет очень быстро на олеате в качестве источника углерода и интенсивные исследования проводились по выращиванию на этом субстрате (Beopoulos et al. 2008; Fickers et al. 2005). Соответственно, увеличенная концентрация олеата, несмотря на то, что специфически не управляет выработкой или выходом липидов, трансформирует пул жирных кислот для более быстрого секвестирования. В конечном итоге это приводит к более высоким скоростям накопления липидов без увеличения выхода, так как увеличенное секвестрование будет возникать только в ситуациях, когда синтез липидов уже повышающе регулирован с помощью других манипуляций.
В противоположность этому, при объединении сверхэкспрессии ACL с другими генами продуктивность липидов имеет тенденцию к понижению. MTYL078 и MTYL079 не показали значительных увеличений в отношении выработки липидов, несмотря на сверхэкспрессию АСС и/или D9. MTYL088, содержащий ACC+ACL+DGA, увеличил выработку липидов по сравнению с контролем, но не проявил каких-либо улучшений в отношении выработки липидов по сравнению с MTYL065. Эти результаты указывают на то, что несмотря на то, что ACL может влиять на распределение потока углерода по метаболической сети, сверхэкспрессия ACL, независимо или в комбинации с другими липогенными улучшениями, значительно не способствует выработке липидов и в большинстве случаев понижает продуктивность липидов. Это аналогично наблюдению того, что несмотря на то, что АТР цитрат-лиаза является ферментом, дифференциально экспрессируемым в жирообразующих дрожжах по сравнению с нежирообразующими дрожжами, активность гена в различных организмах не коррелирует с измеренной жирностью (Boulton and Ratledge 1981).
Другим наблюдением в исследовании липидов является то, что экспрессия DGA вместе со множеством других мишеней обычно приводила к сходным ответам, как в отношении продуктивности, так и в отношении выхода. Несмотря на то, что возможно имеется некоторое насыщение в экспрессии или активности, возникающее в этих конструкциях, этот вышедший на плато ответ может быть также обусловлен ограничением используемого эксперимента, поскольку измеренным показателем в этом исследовании была начальная общая продуктивность, а не накопление или продуктивность липидов в стационарной фазе. Кроме того, несмотря на то, что штамм MTYL065 явно продемонстрировал самую высокую продуктивность, выход был сравнительно схожим со многими вышедшими на плато штаммами. На основании этого можно предположить, что хотя все из этих штаммов успешно перенаправляют поток в направлении липидов, давая увеличенные выходы, MTYL065 является исключительным по его балансу вышерасположенных (upstream) и нижерасположенных (downstream) путей для достижения высокой продуктивности и выхода. Эти результаты показывают важность балансирования возмущений сети метаболического потока для достижения оптимальных продуктивностей и выходов, что является красной нитью в метаболическом инженеринге для связанных с ростом продуктов (Feist et al. 2010; Tyo et al. 2007).
Анализ RT-PCR полной конструкции показывает сверхэкспрессию в MTYL089
Для изучения области плато из исследования липидов дополнительно изучали штамм MTYL089, сверхэкспрессирующий ACC+D9+ACL12+DGA. Штамм был сконструирован в результате трансформации двух плазмид, рМТ079 и рМТ092, в исходный штамм ΔLEU и ΔURA MTYL100 Y. Lipolytica. Использование двух плазмид было в первую очередь обусловлено размерами плазмид, поскольку рМТ079 уже включала четыре тандемных экспрессионных кассеты и составляла 23 kb в длину. Анализ методом PCR геномной ДНК подтвердил успешную интеграцию обеих плазмид в штамм с подтверждением правильной интеграции каждой индивидуальной экспрессионной кассеты. Анализ методом RT-PCR завершенного и проверенного штамма относительно контрольного штамма подтвердил надлежащую транскрипционную сверхэкспрессию всех пяти генов (Фигура 10). Сильная сверхэкспрессия DGA, который был единственным геном под экспрессией TEFin, показывает характеристики усиления сплайсомного интрона даже при возможной конкуренции со стороны различных кассет, использующих тот же промотор. АСС, который был под контролем безинтронного промотора TEF, показал самую низкую экспрессию. Две субъединицы ACL, также под контролем промотора TEF, проявили более высокую экспрессию, чем D9, который был под контролем промотора hp4d. Так как отбор образцов происходил после фазы экспоненциального роста (где hp4d может проявить экспрессию, зависимую от псевдо-роста (Madzak et al. 2000)), конститутивные экспрессии hp4d и TEF были сравнительно близкими друг другу. Эти результаты показали достаточную сверхэкспрессию целевых генов.
Ферментация 2 л MTYL089 демонстрирует высокую способность к накоплению липидов
После проверки экспрессии генов в штамме MTYL089 липогенную характеристику штамма тестировали в биореакторе для ферментации объемом 2 л. Отношение C/N среды доводили до 100 для содействия накоплению липидов. Отношение C/N определяет количество избыточного углерода, имеющееся в процессе ферментации при истощении азота, и часто требует тонкого уравновешивания для оптимизации выработки липидов по сравнению с выработкой цитрата (Beopoulos et al. 2009). Фигура 11 показывает временную зависимость на протяжении всего времени периодической ферментации. После 185 ч ферментации все 90 г/л глюкозы являются потребленными с получением 26 г/л биомассы (сухой вес клеток) и значительного 76,8% содержания липидов для продуктивности 0,109 г липидов/л/ч. Общий выход липидов на глюкозе составил 0,227 г липидов/г глюкозы, что составляет 70% от теоретического максимального выхода. Во время фазы накопления липидов, от 66 до 185 ч, были достигнуты максимальные значения продуктивности липидов и выхода, при 0,154 г липидов/л/ч и 0,277 г липидов/г глюкозы, соответственно, с увеличением выхода до 85% от максимального теоретического выхода.
Микроскопия клеточной культуры, показанная на Фигуре 12, в конце ферментации показывает, что все клетки содержат большие вакуоли, которые занимают виртуально весь объем клетки. Окрашивание с помощью Nile red и флуоресценция указывают на то, что вакуоли преимущественно состоят из нейтральных липидов. Даже незначительное количество гифальных клеток, которые обычно являются менее продуктивными (Coelho et al. 2010), проявляет значительное накопление липидов, вырабатывая множество липидных тел по длине клетки.
Несмотря на значительное накопление липидов, наблюдаемое в культуре, некоторые характеристики оказались нежелательными, особенно по сравнению с предыдущими экспериментами с использованием MTYL065. Во-первых, имелась значительная выработка цитрата, происходящая параллельно с выработкой липидов, начинающаяся с 75 ч. Цитрат представляет собой интермедиат пути биосинтеза липидов, использующий АТР цитрат-лиазу для ферментативного превращения в оксалоацетат и липогенный предшественник ацетил-соА. Несмотря на сверхэкспрессию обоих ферментов ACL в штамме MTYL089, все еще наблюдалось накопление цитрата. Возможно, что отношение C/N было слишком высоким, что могло привести к выработке цитрата вместо липидов (Beopoulos et al. 2009); однако, результаты, полученные авторами изобретения, показывают, что оба, цитрат и липиды, вырабатываются одновременно. Эта совместная выработка обоих продуктов отличается от дискретной фазы выработки липидов с последующей фазой выработки цитрата, наблюдаемой в экспериментах со штаммом MTYL065. Кроме того, отношение C/N соответствовало периодической ферментации MTYL065, которая не показала этого большого объема выработки цитрата. Это указывает на то, что, скорее всего, неадекватные количества образования АТР в условиях ферментации, в сочетании с высоким вышерасположенным потоком на путь синтеза липидов, привели к накоплению внутриклеточного цитратного пула, в конечном итоге приведя к секреции. К тому же, значительно более низкую продуктивность наблюдали в MTYL089. Поскольку аэрация сохраняется постоянной на протяжении ферментации, лимитированный кислородом рост ожидался на более поздних стадиях ферментации. Однако начало линейного роста возникало гораздо раньше в этой ферментации, чем с MTYL065, возникая только через день, когда концентрация биомассы достигала приблизительно 6 г/л. Раннее начало линейного роста привело к более длительному времени ферментации, и, таким образом, более низкой продуктивности, несмотря на более высокое содержание липидов. Так как аэрация также соответствовала условиям ферментации MTYL065, по-видимому, метаболические изменения MTYL089 накладывают еще большие ограничения на рост. С другой стороны, MTYL089 показал лучший общий выход липидов, 0,227 г/г по сравнению с 0,195 г липидов/г глюкозы в MTYL065. Это также обеспечило ферментацию с более высоким титром, 20,2 г/л липидов по сравнению с 17,6 г/л.
В Таблице 8 приведено сравнение ключевых характеристик между ферментациями в объеме 2 л MTYL065 и MTYL089. Сравнение профилей жирных кислот (Фигура 13) указывает на только незначительные изменения в распределении жирных кислот между штаммами, с более строгим предпочтением по пальмитолеату и олеату мононенасыщенных жирных кислот. Дополнительные эффекты сверхэкспрессии ACL и D9, по-видимому, увеличивают поток в направлении синтеза липидов, но при значительных затратах на скорость роста. К тому же, так как отсутствует сходное увеличение в образовании АТР путем клеточного метаболизма, цитрат секретируется скорее в виде побочного продукта, чем используется в пути синтеза липидов. Так как синтез липидов и резервирование могут сильно конкурировать с ростом за ресурсы, для управления этой активностью обычно необходимо жесткое регулирование (Tehlivets et al. 2007). Сверхэкспрессия этих четырех целевых генов раскрыла большую часть этого регулирования и, как результат, авторы наблюдали сильную конкуренцию между установлением приоритетов клеточного роста и выработки липидов. Общей задачей метаболического инженеринга является максимальное увеличение выработки конкретного продукта, что часто требует уравновешивания потока в направлении желаемого продукта и общего здоровья и роста организма. Различия между MTYL065 и MTYL089 явным образом демонстрируют эту необходимость, при этом MTYL065 иллюстрирует более оптимизированный поток через путь синтеза липидов.
Заключение
Несмотря на то, что компоненты биосинтеза липидов являются хорошо изученными, до сих пор многое неизвестно о том, каким образом возмущения генов, в частности в комбинации, воздействуют на производительность и поток по этому пути. С помощью изучения жирообразующих дрожжей Y. lipolytica авторы смогли использовать организм хозяина с природной способностью вырабатывать липиды для исследования степени, до которой метаболический инженеринг может улучшить продуктивность липидов и выход. Авторы изучили четыре целевых гена - АСС, D9, ACL, DGA - и смогли достичь значительного, составляющего 76,8%, содержания липидов в биореакторе объемом 2 л с помощью штамма, несущего все четыре целевых сверхэкспрессии. С помощью дополнительного исследования этих целевых генов посредством комбинаторной сверхэкспрессии авторы смогли оценить положительное воздействие этих генов на выработку липидов, при этом DGA и АСС вносят значительный положительный вклад, D9 вносит незначительный вклад только при объединении с другими генами, и в заключение, ACL, не вносит значительного положительного вклада. Авторы также смогли использовать возможные взаимодействия между отдельными эффектами, идентифицируя наиболее сильное синергическое взаимодействие между АСС и DGA. Выработка микробных липидов имеет широкий диапазон применений и быстро завоевывает внимание к их использованию в производстве биодизеля. Метаболический инженеринг центральных путей синтеза липидов будет играть важную роль в обеспечении успеха этих будущих технологий и процессов.


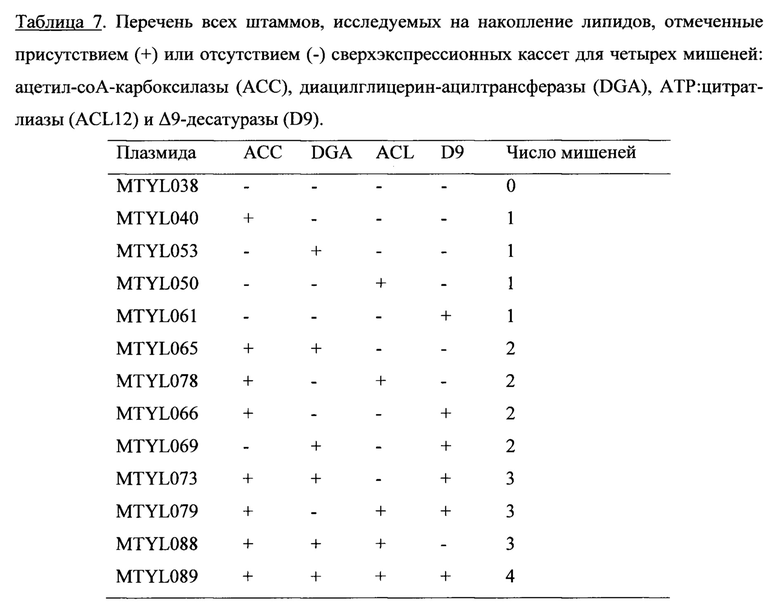
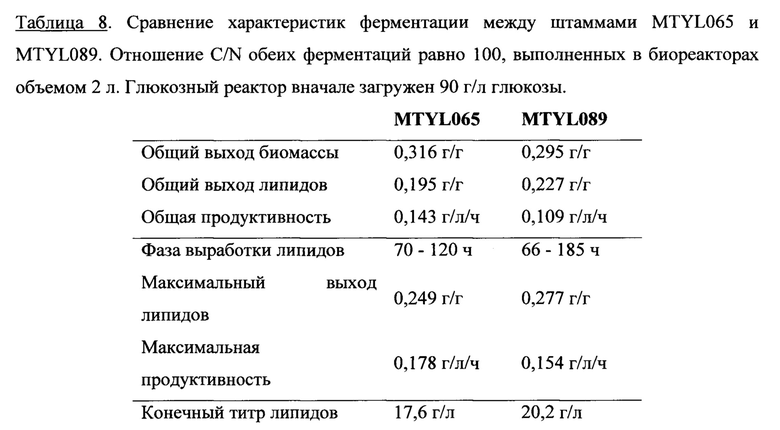
Пример 3.
Материалы и способы
Штаммы дрожжей, рост и условия культивирования
Штамм трансформанта ACC+DGA1 Yarrowia lipolytica (MTLY065), описанного в Примере 1, использовали в экспериментах, приведенных в данном разделе. Среду YPD готовили, как описано в Примере 1. Компонентами среды, используемыми в биореакторе, являлись основа азотного агара для дрожжей (без аминокислот и сульфата аммония) (Amresco), экстракт дрожжей (Difco), сульфат аммония (Macron Chemicals), ацетат натрия (Macron Chemicals) и уксусная кислота (Sigma Aldrich, St. Louis, МО). Испытания в биореакторе проводили в реакторах объемом 2 л с механическим перемешиванием, содержащим корпус с перегородками. Инокулум для биореактора готовили, как описано в Примере 1.
Функционирование биореактора: подача ацетата, уксусной кислоты и сульфата аммония
Исходный состав среды в реакторе представлял собой: 30 г/л ацетата натрия, 2.5 г/л экстракта дрожжей, 4.25 г/л основы азотного агара без дрожжей и 2.4 г/л сульфата аммония. Концентрации экстракта дрожжей и основы азотного агара без дрожжей, используемые в экспериментах, описанных в этом разделе, были выше по сравнению с концентрациями, описанным в Примере 1. Отношение углерода к азоту (C/N), равное 20, было выбрано для обеспечения достаточного количества азота для выработки биомассы. Постоянный уровень растворенного кислорода, составляющий 20%, поддерживали в течение всего времени в реакторе с использованием каскадного контроля. рН устанавливали равным 7,3
Для создания высоких плотностей клеток, которые будут в дальнейшем служить в качестве платформы для накопления липидов, разрабатывали и воплощали стратегию, в которой источник углерода, состоящий из 30 г/л ацетата натрия, был дополнен путем подачи уксусной кислоты. Использование уксусной кислоты имело несколько преимуществ, так как она служила двойной цели обеспечения источника углерода для роста и делений клеток, и в то же время обеспечивала контроль рН. Для поддержания низкого отношения C/N для начального периода роста, источник азота подавали параллельно с уксусной кислотой. Начальный период роста включал подачу 15 г/л сульфата аммония на литр 30% (об.об.) уксусной кислоты. Последующая подача содержала чистую 100% уксусную кислоту (и без сульфата аммония), повышая, таким образом, отношение C/N, так как азот потреблялся клетками и истощался из среды, что вызывало улучшенное накопление липидов.
Рабочий объем в начале эксперимента составил 1,6 л. 1 л кислоты и раствор сульфата аммония добавляли в течение первых 60 ч. Около 200 мл чистой уксусной кислоты добавляли в течение последующих 40 ч. Объем культуры не удаляли, только в момент отбора образцов, который производили каждые 24 ч для проведения измерений. Для компенсации дополнительного объема, поступающего в реактор, жидкость выпаривали. Высокая скорость аэрации (2.5 vvm) обеспечивала достаточное выпаривание, которое способствовало поддержанию объема реактора. Даже с использованием выпаривания объем бульона незначительно увеличивался до около 1,8 л во время эксперимента.
Оптическую плотность (OD) культурального бульона измеряли каждые 24 часа. Образцы хранили при -20°С для анализа липидов. Анализ HPLC показал уровни ацетата в реакторе. Аммиак измеряли с помощью аммониевого электрода YSI 7100 (YSI Life Sciences). Биомассу определяли, как описано в Примере 1.
Анализ липидов
Анализ липидов включал протокол прямой переэтерификации на основании патента США №7932077 и Griffiths et al. LIPIDS (2010) 45:1053-1060, содержание каждого из которых включено здесь путем отсылки в полном объеме. Протокол включал использование 0,5 N метоксида натрия и 18 М серную кислоту (Sigma Aldrich, St. Louis, МО). Метоксид натрия готовили на месте с использованием гидроксида натрия (Macron Chemicals) и метанола (Sigma Aldrich, St. Louis, МО). Вначале 500 мкл 0,5 N метоксида натрия добавляли в 1 мг образца клеточного осадка с последующим перемешиванием на вортексе в течение 1 часа. После этого добавляли 40 мкл серной кислоты и 500 мкл гексана с последующим еще одним перемешиванием на вортексе в течение 30 мин для растворения переэтерифицированных сложных метиловых эфиров в гексан. Реакционную смесь центрифугировали в течение 1 мин при 8000 об/мин, и 800 мкл верхней гексановой фазы переносили во флаконы для анализа методом GC и анализировали методом GC-FID. Колонка GC, режим работы и конечный анализ соответствовали способам, описанным в Примере 1, за исключением того, что тригептадеканоат использовали в качестве контроля вместо тридеканоевой кислоты.
Результаты и обсуждение
Результаты экспериментов в биореакторе обобщены в Таблице 10.


Фигуры 14 и 15 показывают тенденции изменения азота, нелипидных и липидных титров, содержания липидов и отношений C/N во время репрезентативного режима работы биореактора с ацетатом. Нелипидная биомасса росла в течение начального периода роста, когда в реактор подавали азот. Через 48 ч почти все увеличение биомассы было обусловлено накоплением липидов. В этот период клетки синтезировали липиды с выходом 0,24 г/г и при скорости 1 г/л/ч с получением конечного титра липидов 55 г/л, который был по меньшей мере в 10 раз выше, чем титры, достигнутые в экспериментах, описанных в Примере 1. Тем не менее, конечное содержание липидов и общий выход липидов были схожими с содержанием липидов и общим выходом липидов из Примера 1. Эти величины зависят в основном от используемого штамма микробов. Почти 70% липидов оказалось олеатом, что согласуется с данными, представленными в Примере 1.
Эксперимент, описанный здесь, направлен на максимальное увеличение выработки липидов с использованием мутанта ACC+DGA1 посредством применения указанных выше стратегий и оптимальных условий процесса. Сравнение результатов этого эксперимента с результатами, показанными в Примере 1, представлены в таблице 11 ниже. Улучшение титра в 10 раз и улучшение общей продуктивности в 14 раз наблюдается между экспериментами, проведенными с использованием ацетата.
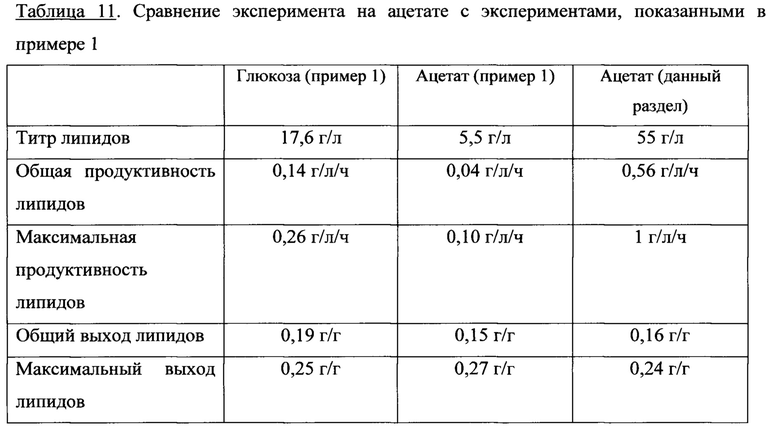
Клетки с высоким содержанием липидов (больше, чем 80%) при центрифугировании флотировали на поверхности вместо осаждения. При наблюдении под микроскопом оказалось, что эти клетки заполнены маслом. На Фигуре 16 показаны эти клетки, наблюдаемые под масляным иммерсионным микроскопом (100×) при окрашивании с помощью Nile Red. Яркие пятна представляют собой липидные вакуоли.
Все публикации, патенты и инвентарные номера последовательностей в базе данных, приведенные в данном описании, включены здесь путем отсылки в той же степени, как если бы являлось указанным, что каждая отдельная публикация или патент конкретно и отдельно включены здесь путем отсылки. В случае конфликта настоящая заявка, включая любые определения внутри, будет осуществлять контроль.
Эквиваленты и область применения
Специалисты в данной области смогут распознать или будут в состоянии установить, используя не более чем рутинные эксперименты, множество эквивалентов конкретных вариантов осуществления изобретения, описанных в данном документе. Объем настоящего изобретения не предполагается быть ограниченным представленным выше описанием, поэтому скорее указан прилагаемой формулой изобретения.
В формуле изобретения артикли, такие как «а», «an» и «the», могут означать один или более чем один, если не указано иное или очевидное иным образом не вытекает из контекста. Пункты формулы изобретения или описания, которые включают «или» между одним или несколькими членами группы, считаются соответственными, если один или несколько, или все члены группы присутствуют, используются или иным образом относятся к данному продукту или процессу, если не указано иное или очевидное иным образом не вытекает из контекста. Изобретение включает варианты осуществления, в которых присутствует, используется или иным образом относится к данному продукту или процессу ровно один член группы. Изобретение также включает варианты осуществления, в которых присутствуют, используются или иным образом относятся к данному продукту или процессу более чем один или все члены группы.
К тому же, следует понимать, что изобретение охватывает все варианты, комбинации и изменения, при которых одно или несколько ограничений, элементов, частей формулы изобретения, описательных терминов и т.д., взятых из одного или нескольких пунктов формулы изобретения или из соответствующих частей описания, вносятся в другой пункт формулы изобретения. Например, любой пункт формулы изобретения, который зависит от другого пункта, может быть модифицирован для учета одного или более ограничений, содержащихся в любом другом пункте, который зависит от такого же базового пункта формулы изобретения. К тому же там, где в формуле изобретения излагается композиция, следует понимать, что способы использования композиции для любой из раскрытых здесь целей учтены, а способы приготовления композиции согласно любому из раскрытых здесь способов ее приготовления или других способов, известных специалистам в данной области, также учтены, если не указано иначе или же специалисту в данной области не становятся очевидными возникновения противоречия или несовместимости.
Там, где элементы представлены в виде перечня, например, в формате группы Маркуша, следует понимать, что при этом также раскрывается каждая подгруппа элементов, и любой элемент(ы) может быть удален из группы. Следует также отметить, что термин «включающий» предполагается открытым для применения и допускает включение дополнительных элементов или стадий. Следует понимать, что в общем случае там, где на раскрытие сущности изобретения или на аспекты по изобретению ссылаются как на аспекты, содержащие конкретные элементы, признаки, стадии, и т.д., определенные варианты осуществления изобретения согласно раскрытию его сущности или аспекты по изобретению состоят или по существу состоят из таких элементов, признаков, стадий и т.д. С целью упрощения такие варианты осуществления изобретения не были изложены конкретно словесно в настоящем описании. Таким образом, для каждого варианта осуществления изобретения, который содержит один или более элементов, признаков, стадий и т.д., изобретение также обеспечивает варианты осуществления, которые состоят или в основном состоят из этих элементов, признаков, стадий и т.д.
Там, где представлены диапазоны, конечные точки являются включенными. К тому же, следует понимать, что если не указано иное или очевидное иным образом не вытекает из контекста и/или понимания специалиста в данной области, то значения, которые выражены как диапазоны, могут принимать любое конкретное значение в пределах установленных диапазонов в различных вариантах осуществления изобретения до десятых единиц нижнего предела диапазона, если контекст явно не указывает на иное. Также следует понимать, что если не указано иное или очевидное иным образом не вытекает из контекста и/или понимания специалиста в данной области, то значения, которые выражены как диапазоны, могут оказаться в поддиапазоне в пределах заданного диапазона, в котором конечные точки поддиапазона выражены с такой же степенью точности, как десятые единицы нижнего предела диапазона.
Помимо этого следует понимать, что любой конкретный вариант осуществления настоящего изобретения может быть исключен из любого одного или нескольких пунктов формулы изобретения. Где указаны диапазоны, любое значение в пределах диапазоне может быть исключено из любого одного или нескольких пунктов формулы изобретения. Любой вариант осуществления изобретения, элемент, признак, применение или аспект композиций и/или способов изобретения, может быть исключен из любого одного или нескольких пунктов формулы изобретения. В целях упрощения все из вариантов осуществления, в которых один или несколько элементов, признаков, целей или аспектов, является исключенным, не представлены здесь в явном виде.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способы получения липидов | 2011 |
|
RU2636344C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПИДОВ | 2012 |
|
RU2656996C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПИДОВ | 2012 |
|
RU2804627C2 |
| ГЕННО-МОДИФИЦИРОВАННЫЕ ОРГАНИЗМЫ ДЛЯ ПОЛУЧЕНИЯ ЛИПИДОВ | 2010 |
|
RU2617963C2 |
| СПОСОБ ХИМИЧЕСКОЙ МОДИФИКАЦИИ ЛИПИДОВ МИКРОВОДОРОСЛЕЙ, СПОСОБ ПОЛУЧЕНИЯ МЫЛА И МЫЛО, ВКЛЮЧАЮЩЕЕ СОЛИ ЖИРНЫХ КИСЛОТ ОМЫЛЕННЫХ ЛИПИДОВ МИКРОВОДОРОСЛЕЙ | 2009 |
|
RU2542374C2 |
| ДЕЛЬТА-5-ДЕСАТУРАЗА И ЕЕ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ | 2007 |
|
RU2469092C2 |
| Трансформант дрожжей Yarrowia lipolytica, продуцирующий кантаксантин | 2023 |
|
RU2827562C1 |
| РЕКОМБИНАНТНЫЕ КЛЕТКИ ДРОЖЖЕЙ, ПРОДУЦИРУЮЩИЕ ПОЛИМОЛОЧНУЮ КИСЛОТУ, И ИХ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2758138C2 |
| ВАРИАНТ ИЗ РОДА YARROWIA И СПОСОБ ПОЛУЧЕНИЯ ЖИРА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2021 |
|
RU2817101C1 |
| ДРОЖЖИ РОДА YARROWIA, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ ВНУТРИКЛЕТОЧНО НАКАПЛИВАТЬ СЛОЖНЫЕ ЭФИРЫ ЖИРНЫХ КИСЛОТ, И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ТАКИХ ЭФИРОВ | 2013 |
|
RU2539744C1 |





































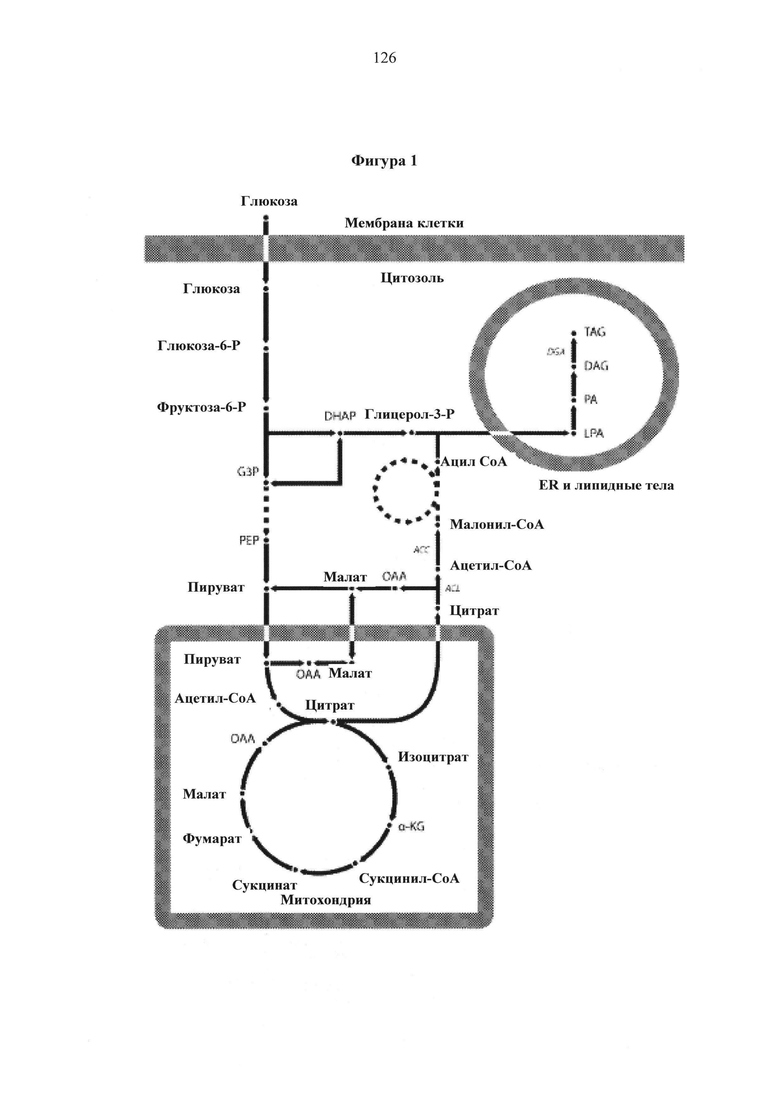
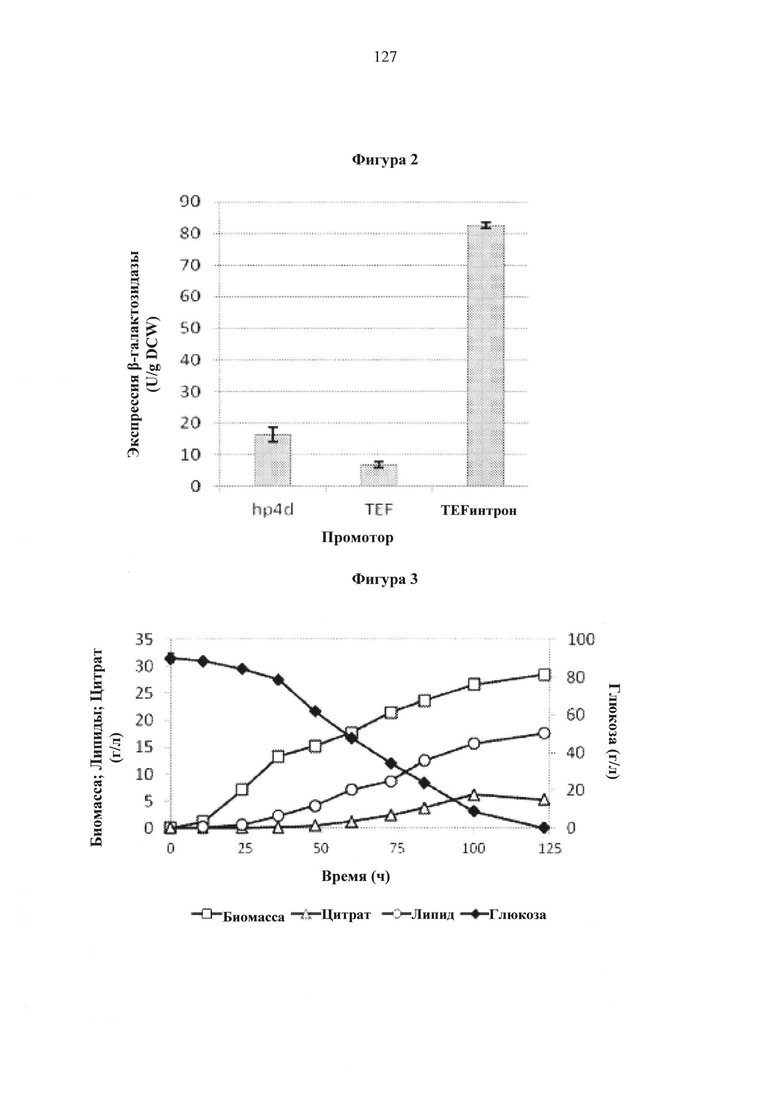
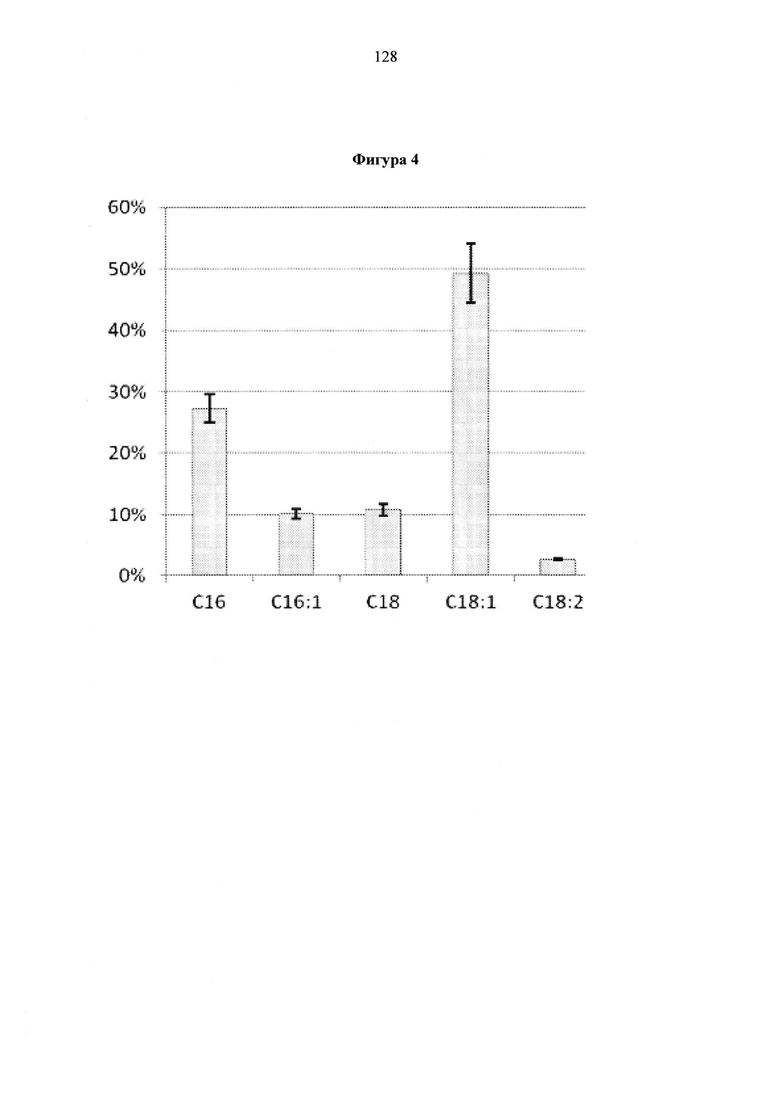

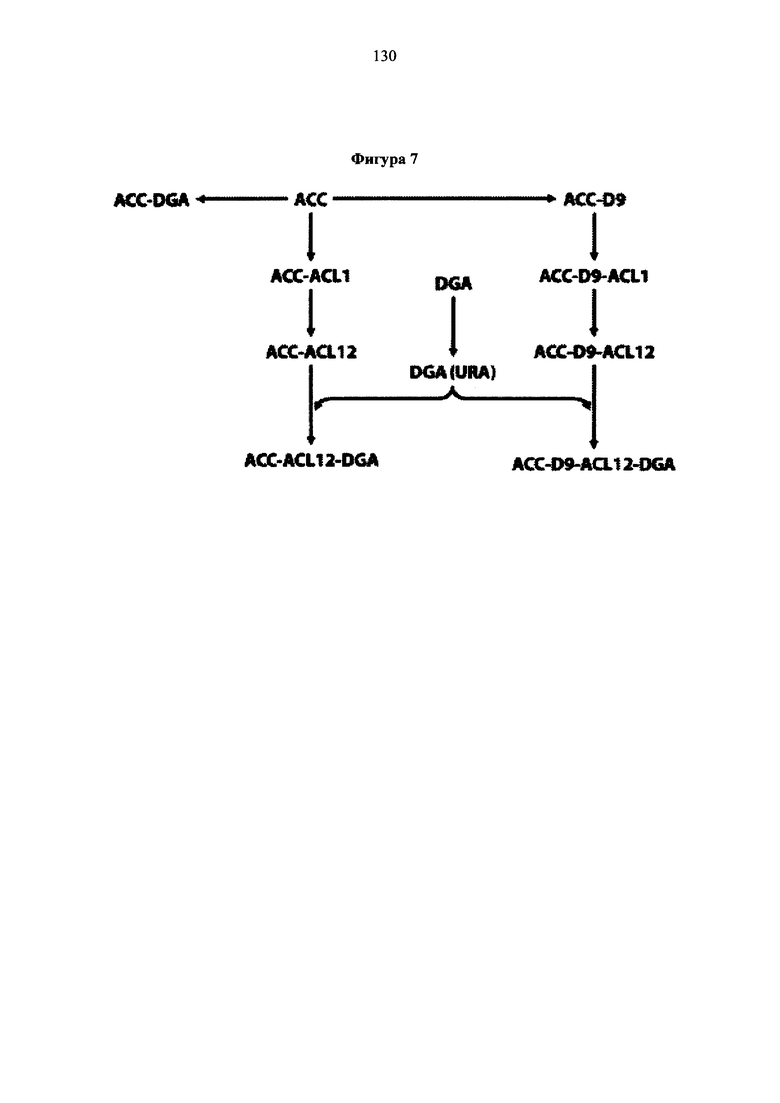
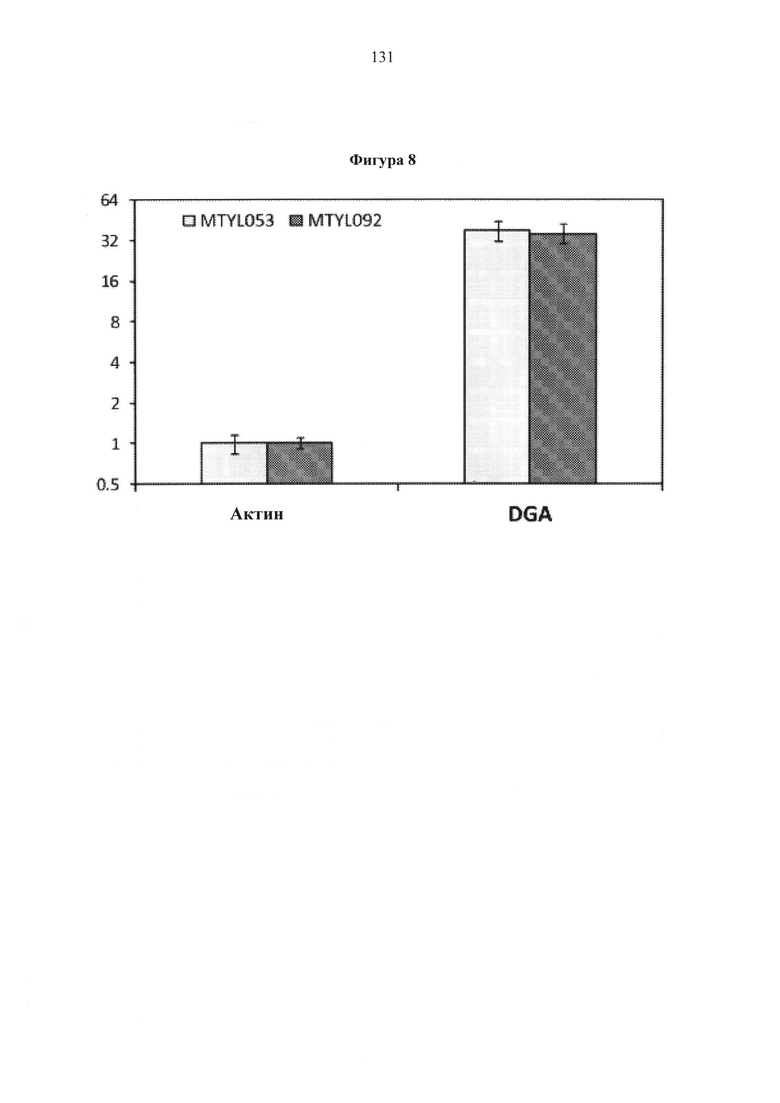
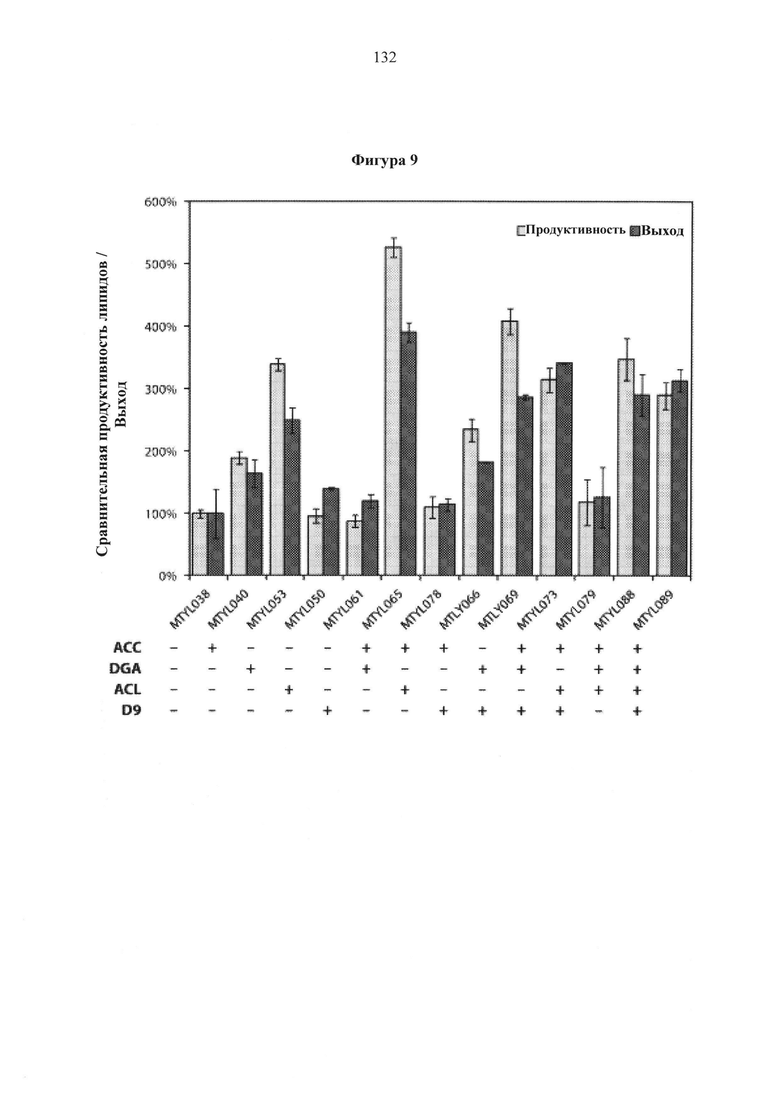
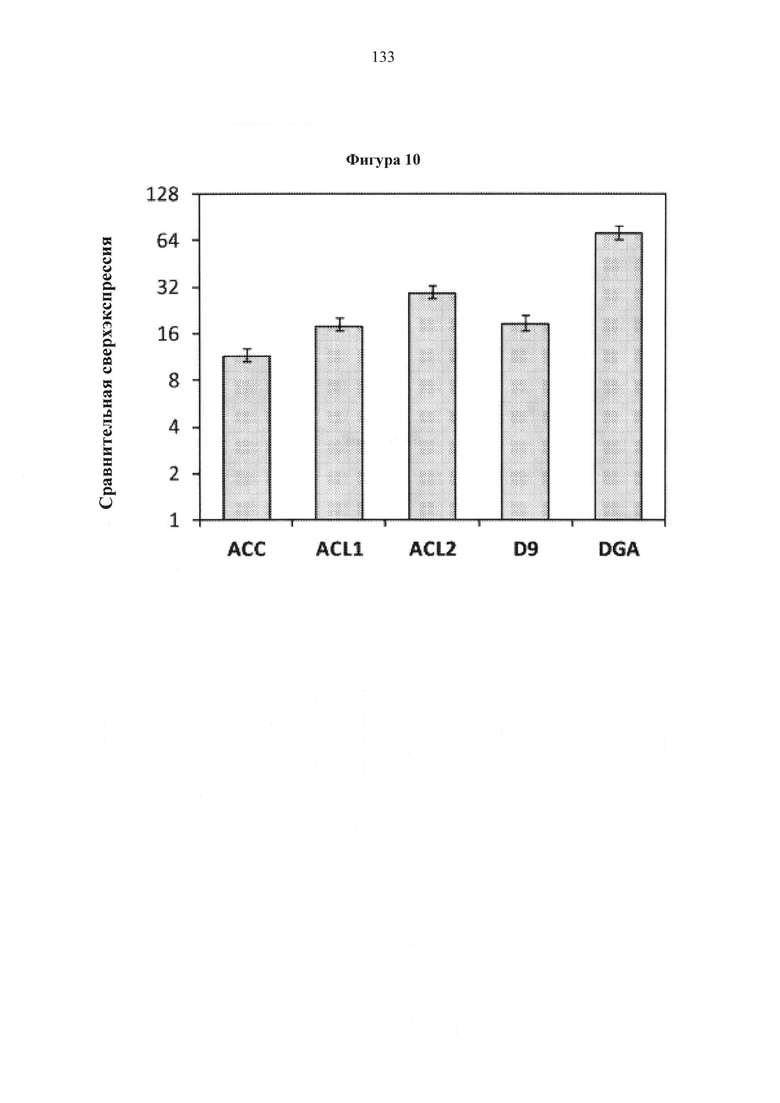
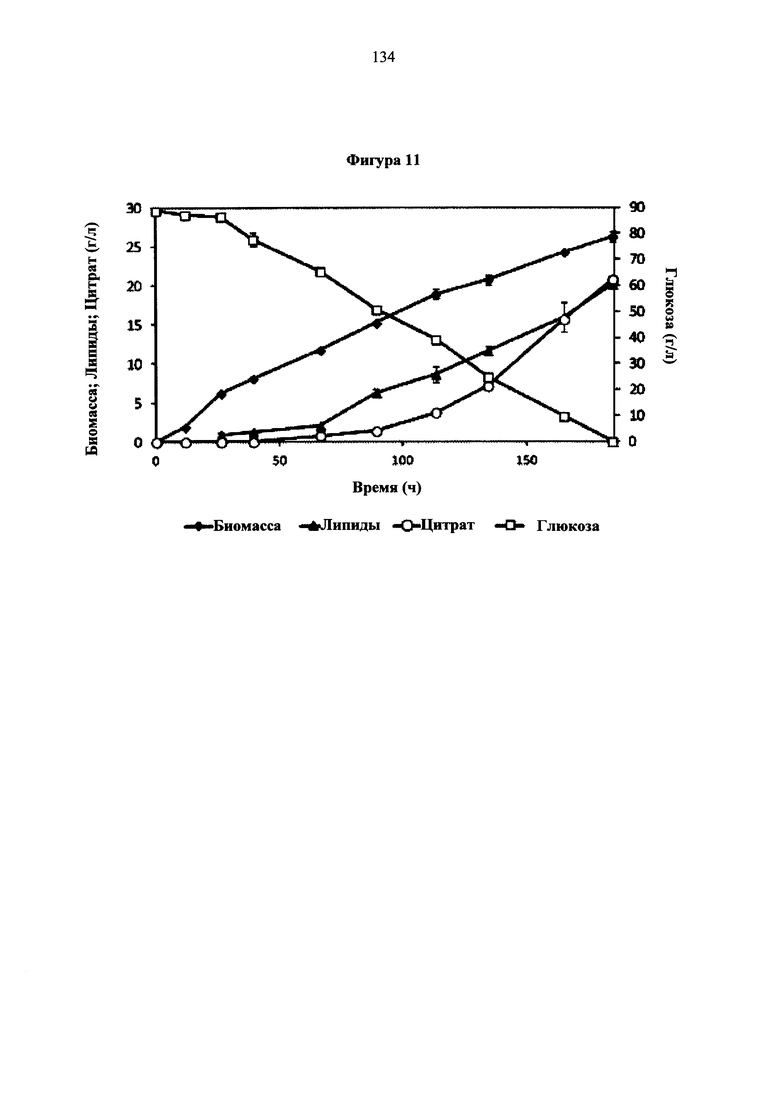
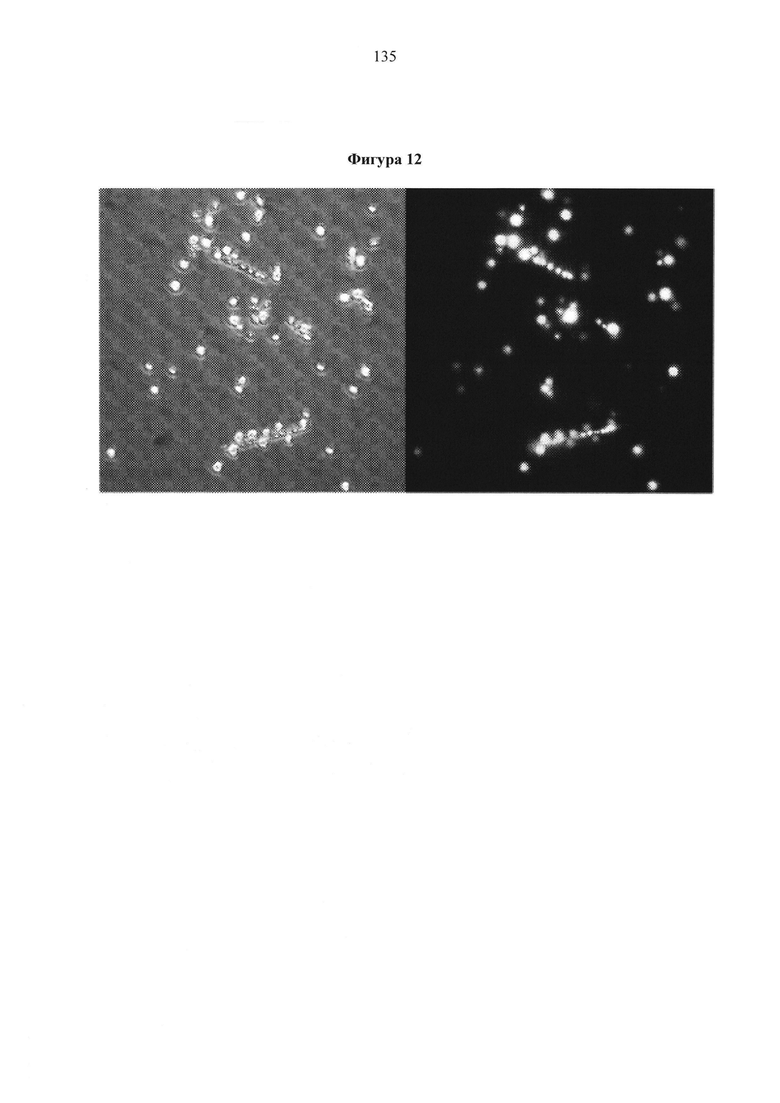
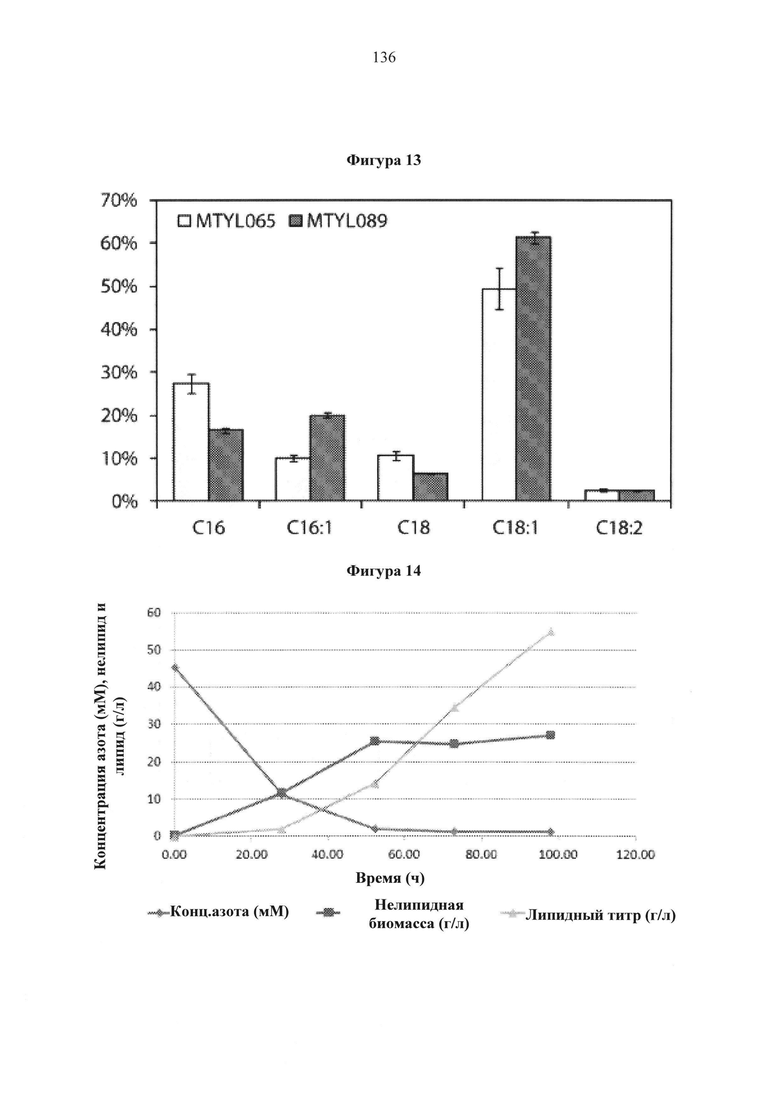
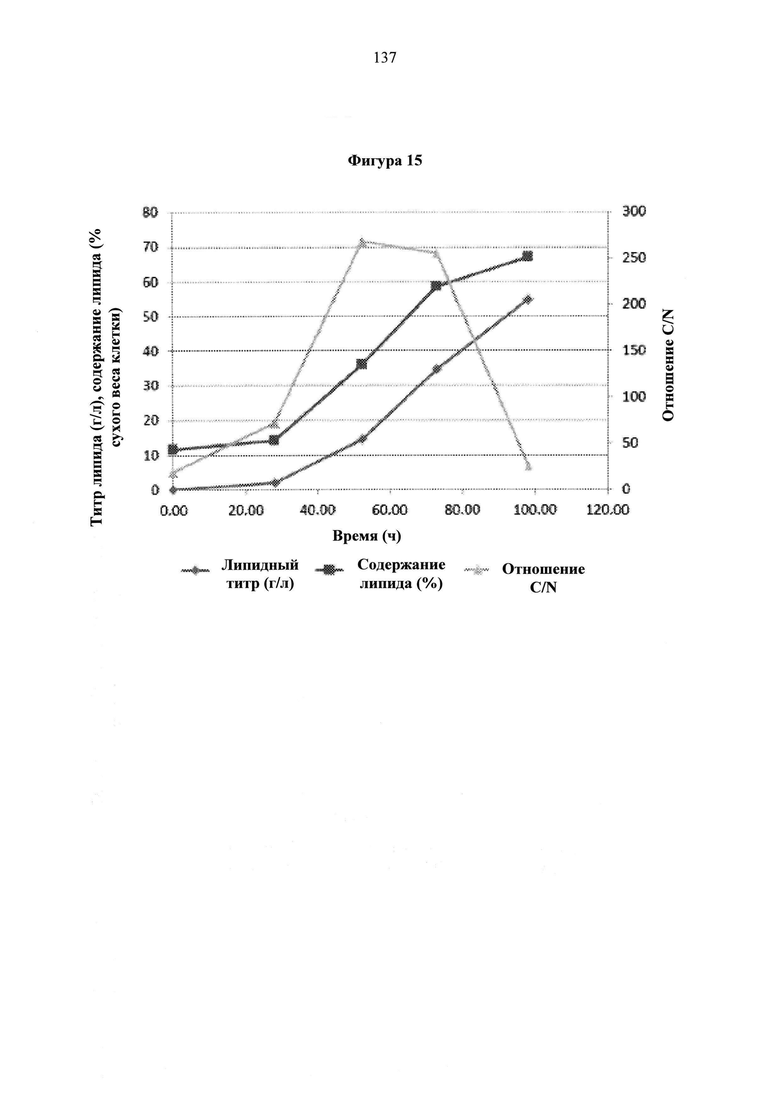
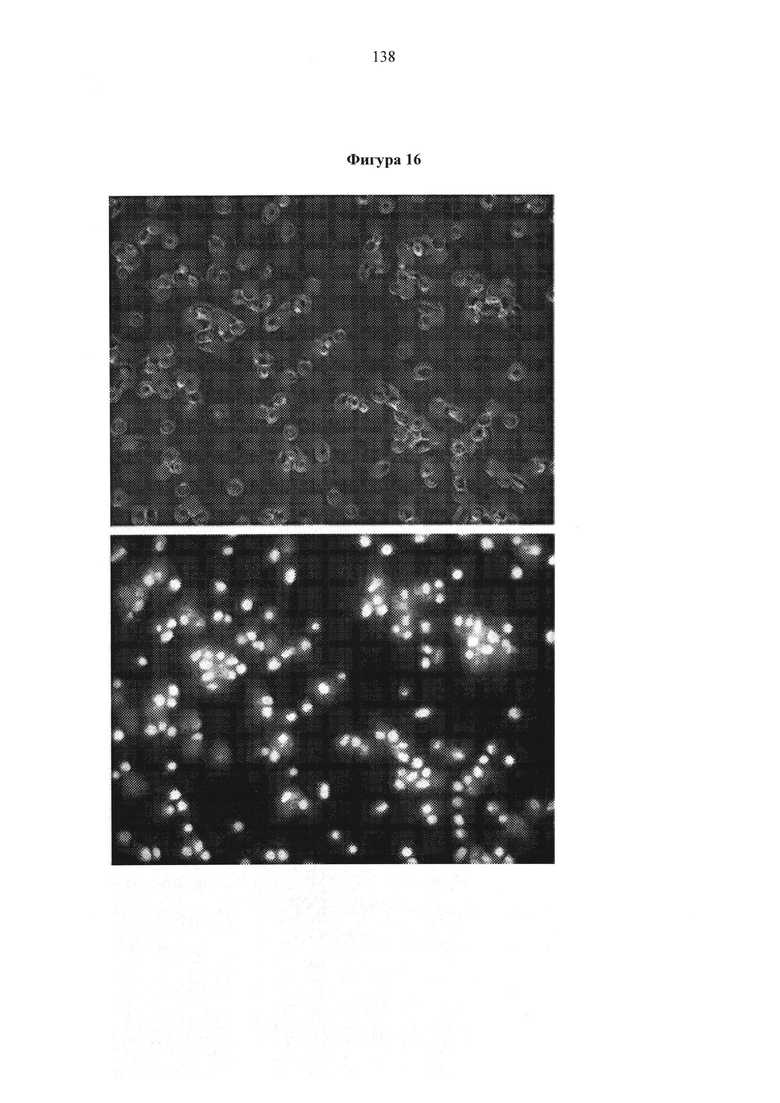
Изобретение относится к области генной инженерии, конкретно к получению микробных продуцентов, и может быть использовано для получения микробного масла. Сконструирована жирообразующая клетка дрожжей, способная к конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин. Полученная клетка характеризуется генетической модификацией, которая увеличивает экспрессию генов диацилглицерин-ацилтрансферазы (DGA1) и ацетил-СоА-карбоксилазы (АСС1) и дополнительно может содержать генетическую модификацию, которая увеличивает экспрессию продукта гена SCD и/или ACL. При этом клетка содержит первую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, кодирующую продукт гена DGA1, и гетерологичный усиленный интроном промотор, который содержит сайт инициации транскрипции и интронную последовательность в положении ниже сайта инициации транскрипции; а также вторую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, кодирующую продукт гена АСС1. Изобретение позволяет получить дрожжевые продуценты, которые проявляют значительно улучшенные степени конверсии, а также свойства в отношении синтеза и резервирования TAG. 10 н. и 91 з.п. ф-лы, 16 ил., 11 табл.
1. Изолированная жирообразующая клетка дрожжей, способная к конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин, причем данная клетка характеризуется генетической модификацией, которая увеличивает экспрессию генов диацилглицерин-ацилтрансферазы (DGA1), и ацетил-СоА-карбоксилазы (АСС1), причем жирообразующая клетка дрожжей содержит:
первую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена DGA1;
причем первая конструкция нуклеиновой кислоты содержит гетерологичный усиленный интроном промотор, который содержит сайт инициации транскрипции и интронную последовательность в положении ниже сайта инициации транскрипции; и
вторую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена АСС1.
2. Изолированная жирообразующая клетка по п. 1, при этом генетическая модификация содержит конструкцию нуклеиновой кислоты, которая увеличивает экспрессию продукта гена, при этом указанная конструкция нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, которая модулирует уровень экспрессии продукта гена при вставке в геном изолированной жирообразующей клетки дрожжей.
3. Изолированная жирообразующая клетка дрожжей по п. 2, при этом гетерологичный промотор представляет собой индуцируемый или конститутивный промотор.
4. Изолированная жирообразующая клетка дрожжей по п. 2, при этом промотор представляет собой промотор TEF.
5. Изолированная жирообразующая клетка дрожжей по п. 1, при этом интрон находится в пределах последовательности нуклеиновой кислоты, кодирующей продукт гена.
6. Изолированная жирообразующая клетка дрожжей по п. 2, при этом конструкция нуклеиновой кислоты ингибирует или нарушает природную регуляцию нативного гена, кодирующего продукт гена, что приводит к сверхэкспрессии нативного гена.
7. Изолированная жирообразующая клетка дрожжей по п. 6, при этом ингибирование или нарушение природной регуляции нативного гена опосредовано делецией, нарушением, мутацией и/или замещением регуляторной области или части регуляторной области, регулирующей экспрессию гена.
8. Изолированная жирообразующая клетка дрожжей по любому из пп. 1 и 3-7, при этом продукт гена представляет собой транскрипт.
9. Изолированная жирообразующая клетка дрожжей по любому из пп. 1 и 3-7, при этом продукт гена представляет собой белок.
10. Изолированная жирообразующая клетка дрожжей по п. 2, при этом конструкция нуклеиновой кислоты вставлена в геном изолированной жирообразующей клетки.
11. Изолированная жирообразующая клетка по любому из пп. 1, 3-7 и 10, при этом увеличенная экспрессия продукта гена придает предпочтительный фенотип изолированной жирообразующей клетке дрожжей для превращения источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин (TAG).
12. Изолированная жирообразующая клетка по п. 11, при этом предпочтительный фенотип включает увеличенное содержание липидов, увеличенный выход липидов, увеличенную продуктивность липидов, увеличенную скорость синтеза жирной кислоты и/или триацилглицерина, увеличенный выход превращения, увеличенное накопление триацилглицерина в изолированной жирообразующей клетке дрожжей и/или увеличенное накопление триацилглицерина в липидном теле изолированной жирообразующей клетки дрожжей.
13. Изолированная жирообразующая клетка дрожжей по п. 11, при этом скорость синтеза жирной кислоты или TAG изолированной жирообразующей клетки дрожжей по меньшей мере в 2 раза увеличена по сравнению с немодифицированными изолированными жирообразующими клетками дрожжей такого же клеточного типа.
14. Изолированная жирообразующая клетка дрожжей по п. 13, при этом скорость синтеза жирной кислоты или TAG изолированной жирообразующей клетки дрожжей по меньшей мере в 5 раз увеличена по сравнению с немодифицированными изолированными жирообразующими клетками дрожжей такого же клеточного типа.
15. Изолированная жирообразующая клетка по п. 13, при этом скорость синтеза жирной кислоты или TAG изолированной жирообразующей клетки дрожжей по меньшей мере,в 10 раз увеличена по сравнению с немодифицированными изолированными жирообразующими клетками дрожжей такого же клеточного типа.
16. Изолированная жирообразующая клетка дрожжей по любому из пп. 12-15, при этом изолированная жирообразующая клетка превращает источник углерода в жирную кислоту или TAG при скорости конверсии в диапазоне от около 0,025 г/г до около 0,32 г/г (г продуцированного TAG/г потребленной глюкозы).
17. Изолированная жирообразующая клетка дрожжей по п. 16, при этом изолированная жирообразующая клетка дрожжей превращает источник углерода в жирную кислоту или TAG при скорости конверсии по меньшей мере около 0,11 г/г.
18. Изолированная жирообразующая клетка дрожжей по п. 17, при этом изолированная жирообразующая клетка дрожжей превращает источник углерода в жирную кислоту или TAG при скорости конверсии по меньшей мере около 0,195 г/г.
19. Изолированная жирообразующая клетка дрожжей по п. 18, при этом изолированная жирообразующая клетка дрожжей превращает источник углерода в жирную кислоту или TAG при скорости конверсии по меньшей мере около 0,24 г/г.
20. Изолированная жирообразующая клетка дрожжей по п. 19, при этом изолированная жирообразующая клетка дрожжей превращает источник углерода в жирную кислоту или TAG при скорости конверсии по меньшей мере около 0,27 г/г.
21. Изолированная жирообразующая клетка дрожжей по любому из пп. 1, 3-4, 10, 12-15 и 17-20, при этом изолированная жирообразующая клетка дрожжей содержит липидное тело или вакуоль.
22. Изолированная жирообразующая клетка дрожжей по любому из пп. 1-7, 10, 12-15 и 17-20, представляющая собой клетку Y. Lipolytica.
23. Культуральная среда для конверсии источников углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин, содержащая изолированную жирообразующую клетку дрожжей по любому из пп. 1-22 и источник углерода, и дополнительно содержащая один или более компонентов, выбранных из группы, состоящей из органической кислоты, ацетата, глицерина, растворенного кислорода и/или сульфата аммония.
24. Культуральная среда по п. 23, при этом источник углерода содержит сбраживаемый сахар.
25. Культуральная среда по п. 24, при этом сбраживаемый сахар представляет собой С6 сахар.
26. Культуральная среда по п. 25, при этом источник углерода содержит глюкозу.
27. Культуральная среда по любому из пп. 24-26, при этом органическая кислота представляет собой уксусную кислоту.
28. Культуральная среда по п. 27, при этом уксусная кислота присутствует в концентрации по меньшей мере 5% об./об., по меньшей мере 10% об./об., по меньшей мере 15% об./об., по меньшей мере 20% об./об., по меньшей мере 25% об./об. или по меньшей мере 30% об./об.
29. Культуральная среда по любому из пп. 24-26, при этом источник углерода содержит ацетат.
30. Культуральная среда по п. 29, при этом ацетат присутствует в концентрации по меньшей мере 1% об./об.
31. Культуральная среда по п. 29, при этом ацетат присутствует в концентрации по меньшей мере 2% об./об.
32. Культуральная среда по п. 29, при этом ацетат присутствует в концентрации по меньшей мере 3% об./об.
33. Культуральная среда по п. 29, при этом ацетат присутствует в концентрации по меньшей мере 4% об./об.
34. Культуральная среда по п. 29, при этом ацетат присутствует в концентрации по меньшей мере 5% об./об.
35. Культуральная среда по п. 23, при этом глицерин присутствует в концентрации около 2% об./об.
36. Культуральная среда по п. 23, при этом культура содержит растворенный кислород на уровне по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15% или по меньшей мере 20%.
37. Культуральная среда по п. 23, при этом культура проявляет рН в диапазоне от рН 7,0 до рН 7,5.
38. Культуральная среда по п. 23, при этом культура содержит сульфат аммония и уксусную кислоту в соотношении 1:2.
39. Культуральная среда по п. 23, при этом культура проявляет титр липидов между 5 г/л и 60 г/л.
40. Культуральная среда по п. 23, при этом культура проявляет выработку липидов между 0,04 г/л/ч и 0,60 г/л/ч.
41. Культуральная среда по п. 23, при этом культура проявляет максимальную продуктивность липидов между 0,1 г/л/ч и 1 г/л/ч.
42. Способ конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин изолированной жирообразующей клеткой дрожжей, включающий:
приведение в контакт источника углерода с изолированной жирообразующей клеткой дрожжей по любому из пп. 1-22, при этом изолированная жирообразующая клетка дрожжей характеризуется генетической модификацией, которая увеличивает экспрессию DGA1 и АСС1; причем жирообразующая клетка дрожжей содержит:
первую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена DGA1;
причем первая конструкция нуклеиновой кислоты содержит гетерологичный усиленный интроном промотор, который содержит сайт инициации транскрипции и интронную последовательность в положении ниже сайта инициации транскрипции; и
вторую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена АСС1; и
инкубацию источника углерода, приведенного в контакт с изолированной жирообразующей клеткой дрожжей, в условиях, пригодных для по меньшей мере частичной конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин изолированной жирообразующей клеткой дрожжей.
43. Способ конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин изолированной жирообразующей клеткой дрожжей, включающий:
приведение в контакт источника углерода с изолированной жирообразующей клеткой дрожжей по любому из пп. 1-22, причем изолированная жирообразующая клетка дрожжей характеризуется генетической модификацией, которая увеличивает экспрессию DGA1 и АСС1, и дополнительно содержит генетическую модификацию, выбранную из группы, состоящей из генетической модификации, которая увеличивает экспрессию продукта гена SCD, или генетической модификации, которая увеличивает экспрессию продукта гена ACL, или их комбинации, причем клетка содержит:
первую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена DGA1;
причем первая конструкция нуклеиновой кислоты содержит гетерологичный усиленный интроном промотор, который содержит сайт инициации транскрипции и интронную последовательность в положении ниже сайта инициации транскрипции;
вторую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена АСС1; и
третью и/или четвертую конструкцию нуклеиновой кислоты, выбранную из экспрессионной кассеты, содержащей кодирующую нуклеиновую кислоту, которая кодирует продукт гена SCD, и/или экспрессионной кассеты, содержащей кодирующую нуклеиновую кислоту, которая кодирует продукт гена ACL; и
инкубирование источника углерода, приведенного в контакт с изолированной жирообразующей клеткой дрожжей, в условиях, пригодных для по меньшей мере частичной конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин изолированной жирообразующей клеткой дрожжей.
44. Способ по любому из пп. 42, 43, в котором источник углерода содержит сбраживаемый сахар.
45. Способ по п. 44, в котором источник углерода содержит глюкозу.
46. Способ по любому из пп. 42, 43, в котором источник углерода содержит ацетат.
47. Способ по п. 46, в котором ацетат присутствует в концентрации, по меньшей мере 1% об./об.
48. Способ по п. 46, в котором ацетат присутствует в концентрации, по меньшей мере, 2% об./об.
49. Способ по п. 46, в котором ацетат присутствует в концентрации по меньшей мере 3% об./об.
50. Способ по п. 46, в котором ацетат присутствует в концентрации по меньшей мере 4% об./об.
51. Способ по п. 46, в котором ацетат присутствует в концентрации по меньшей мере 5% об./об.
52. Способ по любому из пп. 42, 43, в котором источник углерода содержит уксусную кислоту.
53. Способ по п. 52, в котором уксусная кислота присутствует в концентрации по меньшей мере 5% об./об., по меньшей мере 10% об./об., по меньшей мере 15% об./об., по меньшей мере 20% об./об., по меньшей мере 25% об./об. или по меньшей мере 30% об./об.
54. Способ по любому из пп. 42, 43, при этом способ включает приведение в контакт изолированной жирообразующей клетки дрожжей с растворенным кислородом на уровне по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15% или по меньшей мере 20%.
55. Способ по любому из пп. 42, 43, в котором приведение в контакт и/или инкубацию выполняют при рН в диапазоне от рН 7,0 до рН 7,5.
56. Способ по любому из пп. 42, 43, при этом способ включает приведение в контакт изолированной жирообразующей клетки дрожжей с сульфатом аммония.
57. Способ по п. 56, при этом способ включает приведение в контакт изолированной жирообразующей клетки с сульфатом аммония и уксусной кислотой в соотношении 1:2.
58. Способ по любому из пп. 42, 43, при этом способ дополнительно включает приведение в контакт изолированной жирообразующей клетки дрожжей с глицерином.
59. Способ по п. 58, при этом способ включает приведение в контакт изолированной жирообразующей клетки дрожжей с глицерином в концентрации около 2% об./об.
60. Способ по любому из пп. 42, 43, в котором источник углерода, приведенный с контакт с изолированной жирообразующей клеткой дрожжей, инкубируют в реакторе.
61. Способ по любому из пп. 42, 43, в котором источник углерода приводят в контакт с изолированной жирообразующей клеткой дрожжей и инкубируют для конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин в ходе процесса периодического действия с подпиткой.
62. Способ по любому из пп. 42, 43, в котором источник углерода приводят в контакт с изолированной жирообразующей клеткой дрожжей и инкубируют для конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин в ходе непрерывного процесса.
63. Способ по любому из пп. 42, 43, дополнительно включающий приведение в контакт дополнительного количества источника углерода или некоторого количества дополнительного источника углерода с источником углерода, приведенным с контакт с изолированной жирообразующей клеткой дрожжей, один или несколько раз во время стадии инкубации.
64. Способ по любому из пп. 42, 43, в котором жирную кислоту или триацилглицерин экстрагируют из источника углерода, приведенного в контакт с изолированной жирообразующей клеткой дрожжей, путем экстракции растворителем.
65. Способ по п. 64, в котором экстракция растворителем включает экстракцию смесью хлороформ-метанол.
66. Способ по п. 64, в котором экстракция растворителем включает экстракцию гексаном.
67. Способ по любому из пп. 42, 43, в котором жирную кислоту или триацилглицерин отделяют от источника углерода, приведенного в контакт с изолированной жирообразующей клеткой дрожжей, и затем очищают путем переэтерификации.
68. Применение изолированной жирообразующей клетки по любому из пп. 1-22 для увеличения содержания липидов, выхода липидов, продуктивности липидов, профиля триацилглицерина, скорости синтеза жирной кислоты, скорости синтеза триацилглицерина, степени накопления производного жирной кислоты, скорости секреции производного жирной кислоты, скорости конверсии углевода в жирную кислоту или производное жирной кислоты и/или эффективного выхода конверсии углевода в жирную кислоту или производное жирной кислоты в изолированной жирообразующей клетке дрожжей.
69. Применение по п. 68, в котором степень накопления производного жирной кислоты представляет собой степень накопления производного жирной кислоты в липидном теле.
70. Применение по п. 68, в котором производное жирной кислоты представляет собой триацилглицерин.
71. Применение по любому из пп. 68-70, в котором увеличение эффективности конверсии углевода в жирную кислоту или производное жирной кислоты изолированной жирообразующей клетки дрожжей включает увеличение эффективности конверсии по меньшей мере в 2 раза.
72. Применение по любому из пп. 68-70, в котором увеличение эффективности конверсии углевода в жирную кислоту или производное жирной кислоты изолированной жирообразующей клетки дрожжей включает увеличение эффективности конверсии по меньшей мере в 3 раза.
73. Применение по любому из пп. 68-70, в котором увеличение эффективности конверсии углевода в жирную кислоту или производное жирной кислоты изолированной жирообразующей клетки дрожжей включает увеличение эффективности конверсии по меньшей мере в 4 раза.
74. Применение по любому из пп. 68-70, в котором увеличение эффективности конверсии углевода в жирную кислоту или производное жирной кислоты изолированной жирообразующей клетки дрожжей включает увеличение эффективности конверсии по меньшей мере в 5 раз.
75. Применение по п. 68, в котором изолированная жирообразующая клетка дрожжей представляет собой клетку Yarrowia sp..
76. Применение по п. 75, в котором изолированная жирообразующая клетка дрожжей представляет собой Y. Lipolytica.
77. Изолированная жирообразующая клетка дрожжей, способная к конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триглицерин, причем клетка характеризуется генетической модификацией, которая увеличивает экспрессию генов диацилглицерин-ацилтрансферазы (DGA1) и ацетил-СоА-карбоксилазы (АСС1), и дополнительно содержащая генетическую модификацию, выбранную из группы, состоящей из генетической модификации, которая увеличивает экспрессию стеароил-СоА-десатуразы (SCD), и генетической модификации, которая увеличивает экспрессию АТР-цитрат-лиазы (ACL), или их комбинации, причем клетка содержит:
первую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена DGA1;
причем первая конструкция нуклеиновой кислоты содержит гетерологичный усиленный интроном промотор, который содержит сайт инициации транскрипции и интронную последовательность в положении ниже сайта инициации транскрипции;
вторую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена АСС1; и
третью и/или четвертую конструкцию нуклеиновой кислоты, выбранную из экспрессионной кассеты, содержащей кодирующую нуклеиновую кислоту, которая кодирует продукт гена SCD, и/или экспрессионной кассеты, содержащей кодирующую нуклеиновую кислоту, которая кодирует продукт гена ACL.
78. Изолированная жирообразующая клетка дрожжей по пункту 77, в которой генетическая модификация включает конструкцию нуклеиновой кислоты, которая увеличивает экспрессию продукта гена, причем указанная конструкция нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, которая модулирует уровень экспрессии продукта гена при вставке в геном изолированной жирообразующей клетки дрожжей.
79. Изолированная жирообразующая клетка дрожжей по п. 78, в которой гетерологичный промотор представляет собой индуцируемый или конститутивный промотор.
80. Изолированная жирообразующая клетка дрожжей по п. 78, в которой промотор представляет собой TEF промотор.
81. Изолированная жирообразующая клетка дрожжей по п. 77, в которой интрон находится в пределах последовательности нуклеиновой кислоты, кодирующей продукт гена.
82. Изолированная жирообразующая клетка дрожжей по любому из пп. 77 или 78, в которой конструкция нуклеиновой кислоты ингибирует или нарушает природную регуляцию нативного гена, кодирующего продукт гена, что приводит к сверхэкспрессии нативного гена.
83. Изолированная жирообразующая клетка дрожжей по п. 82, в которой ингибирование или нарушение природной регуляции нативного гена опосредовано делецией, нарушением, мутацией и/или замещением регуляторной области или части регуляторной области, регулирующей экспрессию гена.
84. Изолированная жирообразующая клетка дрожжей по любому из пп. 77, 79, 80 и 81-83, в которой продукт гена представляет собой транскрипт.
85. Изолированная жирообразующая клетка дрожжей по любому из пп. 77, 79, 80 и 81-83, в которой продукт гена представляет собой белок.
86. Изолированная жирообразующая клетка дрожжей по п. 78, в которой конструкция нуклеиновой кислоты вставлена в геном изолированной жирообразующей клетки.
87. Изолированная жирообразующая клетка дрожжей по любому из пп. 77, 79-83 и 86, в которой увеличенная экспрессия продукта гена придает предпочтительный фенотип изолированной жирообразующей клетке дрожжей для превращения источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин (TAG).
88. Изолированная жирообразующая клетка дрожжей по п. 87, при этом предпочтительный фенотип включает увеличенное содержание липидов, увеличенный выход липидов, увеличенную продуктивность липидов, увеличенную скорость синтеза жирной кислоты и/или триацилглицерина, увеличенный выход превращения, увеличенное накопление триацилглицерина в изолированной жирообразующей клетке дрожжей и/или увеличенное накопление триацилглицерина в липидном теле изолированной жирообразующей клетки дрожжей.
89. Изолированная жирообразующая клетка дрожжей по п. 87, при этом скорость синтеза жирной кислоты или TAG изолированной жирообразующей клетки дрожжей по меньшей мере в 2 раза увеличена по сравнению с немодифицированными изолированными жирообразующими клетками дрожжей такого же клеточного типа.
90. Изолированная жирообразующая клетка дрожжей по п. 89, при этом при этом скорость синтеза жирной кислоты или TAG изолированной жирообразующей клетки дрожжей по меньшей мере в 5 раз увеличена по сравнению с немодифицированными изолированными жирообразующими клетками дрожжей такого же клеточного типа.
91. Изолированная жирообразующая клетка дрожжей по п. 89, при этом скорость синтеза жирной кислоты или TAG изолированной жирообразующей клетки дрожжей по меньшей мере в 10 раз увеличена по сравнению с немодифицированными изолированными жирообразующими клетками дрожжей такого же клеточного типа.
92. Изолированная жирообразующая клетка дрожжей по любому из пп. 88-91, при этом изолированная жирообразующая клетка дрожжей превращает источник углерода в жирную кислоту или TAG при скорости конверсии в диапазоне от около 0,025 г/г до около 0,32 г/г (г продуцированного TAG/г потребленной глюкозы).
93. Изолированная жирообразующая клетка дрожжей по п. 92, при этом изолированная жирообразующая клетка дрожжей превращает источник углерода в жирную кислоту или TAG при скорости конверсии по меньшей мере около 0,11 г/г.
94. Изолированная жирообразующая клетка дрожжей по п. 93, при этом изолированная жирообразующая клетка дрожжей превращает источник углерода в жирную кислоту или TAG при скорости конверсии, по меньшей мере, около 0,195 г/г.
95. Изолированная жирообразующая клетка дрожжей по п. 94, при этом изолированная жирообразующая клетка дрожжей превращает источник углерода в жирную кислоту или TAG при скорости конверсии по меньшей мере около 0,24 г/г.
96. Изолированная жирообразующая клетка дрожжей по п. 95, при этом изолированная жирообразующая клетка дрожжей превращает источник углерода в жирную кислоту или TAG при скорости конверсии по меньшей мере около 0,27 г/г.
97. Изолированная жирообразующая клетка дрожжей по любому из пп. 77, 79, 80, 86, 88-91 и 93-96, при этом изолированная жирообразующая клетка дрожжей содержит липидное тело или вакуоль.
98. Изолированная жирообразующая клетка дрожжей по любому из пп. 77-81, 83, 86, 88-91 и 93-96, представляющая собой клетку Y. Lipolytica.
99. Способ конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин изолированной жирообразующей клеткой дрожжей, включающий:
приведение в контакт источника углерода с изолированной жирообразующей клеткой дрожжей по любому из пп. 77-97, причем изолированная жирообразующая клетка дрожжей характеризуется генетической модификацией, которая увеличивает экспрессию DGA1 и АСС1, причем жирообразующая клетка дрожжей содержит:
первую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена DGA1;
причем первая конструкция нуклеиновой кислоты содержит гетерологичный усиленный интроном промотор, который содержит сайт инициации транскрипции и интронную последовательность в положении ниже сайта инициации транскрипции; и
вторую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена АСС1; и
инкубирование источника углерода, приведенного в контакт с изолированной жирообразующей клеткой дрожжей, в условиях, пригодных для по меньшей мере частичной конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин изолированной жирообразующей клеткой дрожжей.
100. Способ конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин изолированной жирообразующей клеткой дрожжей, включающий:
приведение в контакт источника углерода с изолированной жирообразующей клеткой дрожжей по любому из пп. 77-97, причем изолированная жирообразующая клетка дрожжей характеризуется генетической модификацией, которая увеличивает экспрессию DGA1 и АСС1, и дополнительно содержит генетическую модификацию, выбранную из группы, состоящей из генетической модификации, которая увеличивает экспрессию продукта гена SCD, или генетической модификации, которая увеличивает экспрессию продукта гена ACL, или их комбинации, причем клетка содержит:
первую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена DGA1;
причем первая конструкция нуклеиновой кислоты содержит гетерологичный усиленный интроном промотор, который содержит сайт инициации транскрипции и интронную последовательность в положении ниже сайта инициации транскрипции;
вторую конструкцию нуклеиновой кислоты, содержащую экспрессионную кассету, содержащую кодирующую нуклеиновую кислоту, которая кодирует продукт гена АСС1; и
третью и/или четвертую конструкцию нуклеиновой кислоты, выбранную из экспрессионной кассеты, содержащей кодирующую нуклеиновую кислоту, которая кодирует продукт гена SCD, и/или экспрессионной кассеты, содержащей кодирующую нуклеиновую кислоту, которая кодирует продукт гена ACL; и
инкубирование источника углерода, приведенного в контакт с изолированной жирообразующей клеткой дрожжей, в условиях, пригодных для по меньшей мере частичной конверсии источника углерода в жирную кислоту, производное жирной кислоты и/или триацилглицерин изолированной жирообразующей клеткой дрожжей.
101. Применение изолированной жирообразующей клетки дрожжей по любому из пп. 77-97 для увеличения содержания липидов, выхода липидов, продуктивности липидов, профиля триацилглицерина, скорости синтеза жирной кислоты, скорости синтеза триацилглицерина, степени накопления производного жирной кислоты, скорости конверсии углевода в жирную кислоту или производное жирной кислоты, и/или эффективного выхода конверсии углевода в жирную кислоту или производное жирной кислоты в изолированной жирообразующей клетке дрожжей.
| US 20090104674 A1, 23.04.2009 | |||
| US 7736884 B2, 15.06.2010 | |||
| US 20060160193 A1, 20.07.2006 | |||
| US 20100081178 A1, 01.04.2010 | |||
| НОВЫЙ КЛАСС ФЕРМЕНТОВ В БИОСИНТЕТИЧЕСКОМ ПУТИ ПОЛУЧЕНИЯ ТРИАЦИЛГЛИЦЕРИНА И РЕКОМБИНАНТНЫЕ МОЛЕКУЛЫ ДНК, КОДИРУЮЩИЕ ЭТИ ФЕРМЕНТЫ | 2000 |
|
RU2272073C2 |
Авторы
Даты
2018-05-03—Публикация
2012-10-19—Подача