ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Технология, представленная в данном документе, относится к новым вариантам микробных глюкозооксидаз с улучшенными свойствами, более специфичным к полипептидам, имеющим глюкозооксидазную активность в качестве их основной ферментативной активности; к молекулам нуклеиновых кислот, кодирующих упомянутые глюкозооксидазы; векторам и клеткам-хозяевам, содержащим нуклеиновые кислоты, и способам продуцирования глюкозооксидазы; композициям, содержащим упомянутую глюкозооксидазу; способам приготовления и получения таких ферментов; и к способам использования таких ферментов для обработки пищи и кормов, для измерения свободной глюкозы в клинических образцах и биореакторах, и разработке миниатюрных биохимических топливных элементов.
УРОВЕНЬ ТЕХНИКИ
Глюкозооксидаза (β-D-глюкоза:кислород 1-оксидоредуктаза; EC 1.1.2.3.4) катализирует окисление β-D-глюкозы до глюконовой кислоты путем использования молекулярного кислорода как акцептора электронов с одновременной продукцией перекиси водорода. Микробной глюкозооксидазе в настоящее время уделяется большое внимание благодаря ее разнообразным применениям в химической, фармацевтической, пищевой промышленности, промышленности безалкогольных напитков, клинической химической, биотехнологической и других отраслях промышленности. В последние годы имеется повышенный запрос на новые применения глюкозооксидазы в биосенсорах. Глюкозооксидазы изолированы из различных микробных источников.
Фермент глюкозооксидаза из Aspergillus niger используется, например, в промышленности пищевой переработки и фармакологической промышленности и как компонент иммуноанализа и биосенсоров в области медицинской диагностике. Фермент также используется в производстве миниатюрных биотопливных элементов, которые могут быть источниками питания биомедицинских имплантов, таких как биосенсоры и дозаторы инсулина. Выход этих устройств ограничен производительностью глюкозооксидазы в анодном отделе.
В частности, три свойства фермента существенны в отношении биотопливных элементов: (1) скорость переноса электронов с электрода на фермент (собственная активность фермента); (2) активность фермента в физиологических условиях (pH 7,4 и 5 мМ глюкозы); и (3) термостабильность фермента.
Патентная заявка W089/126675 описывает продукцию глюкозооксидазы из Aspergillus niger в рекомбинантных системах, а WO 2008/079227 A1 относится к ферменту, полученному из Aspergillus niger и изготовленному в виде композиции, обладающей улучшенной стабильностью при хранении. Также описаны глюкозооксидазы различного происхождения, включая в себя морские водоросли, например, Chondrus crispus (патент США 7544795, патент США 6924366), гифомицеты, например, Cladosporium spp. (патентные заявки WO 95/29996, WO 1998/020136, патент США 5834280) и Talaromyces flavus (патент США 6054318). Патентная заявка WO2012/017008 A1 описывает варианты глюкозооксидазы Aspergillus niger с измененной эффективностью фермента по сравнению с глюкозооксидазой дикого типа.
Однако получение доступа к глюкозооксидазам с улучшенными свойствами для множества применений было бы в высокой степени полезно.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Улучшенные глюкозооксидазы по данному раскрытию могут быть использованы для многочисленных применений, включающих в себя удаление кислорода из пищи и прохладительных напитков, формирование перекиси водорода для консервирования пищи, измерение свободной глюкозы в клинических образцах и биореакторах, и в разработках миниатюрных биотопливных элементов. Многие промышленные процессы могли бы выиграть от использования улучшенных вариантов глюкозооксидаз по данному раскрытию.
В первом аспекте варианты данного раскрытия, предлагают полипептиды, имеющие глюкозооксидазную активность, в которых упомянутый полипептид содержит вариации в положениях, соответствующих аминокислотным остаткам T30, I94 и A162 в глюкозооксидазе дикого типа из Aspergillus niger (SEQ ID NO: 1), и, по меньшей мере, одну или более дополнительных вариаций в положениях, соответствующих аминокислотным остаткам M556, R537, R37, V106, V293 или E310, и в котором аминокислотная последовательность упомянутого полипептида имеет, по меньшей мере, минимальный процент идентичности последовательности и (или) процент гомологии, по меньшей мере, 80% по отношению к аминокислотной последовательности SEQ ID NO: 1.
Еще один объект - варианты осуществления данного раскрытия, относящиеся к молекулам нуклеиновой кислоты, выбранным из группы, состоящей из:
молекулы нуклеиновой кислоты, кодирующей полипептид по любому из пп. 1-15;
молекулы нуклеиновой кислоты, кодирующей полипептид по любому из пп. 1-15, в котором один или более аминокислотных остатков консервативно замещены;
молекула нуклеиновой кислоты, которая представляет собой фракцию, вариант, производное или фрагмент молекулы нуклеиновой кислоты, представленной как SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID N0: 12 или SEQ ID NO: 14;
или комплементарная последовательность каких-либо молекул нуклеиновых кислот по пп. a)-c).
Еще один объект - варианты осуществления данного раскрытия, относящиеся к вектору, содержащему молекулу нуклеиновой кислоты по данному раскрытию, и к клеткам-хозяевам, трансформированным, трансдуцированным или трансфецированным упомянутым вектором.
Еще один объект - варианты осуществления данного раскрытия предоставляющие способы получения полипептида, имеющего глюкозооксидазную активность, содержащие стадии: (a) культивирования клеток-хозяев по данному раскрытию в подходящей культуральной среде при подходящих условиях для продуцирования полипептидов, имеющих глюкозооксидазную активность; (b) получение упомянутой продукции полипептидов, и, если требуется, (c) обработка полипептидов.
Еще один объект - некоторые варианты осуществления данного раскрытия относящиеся к композициям, содержащим полипептид по данному раскрытию, в частности к пищевым композициям, фармацевтическим композициям, диагностическим композициям и косметическим композициям.
Еще один объект - некоторые варианты осуществления, предоставляющие способы для анализа глюкозы в образце, в которых образец приведен в контакт с полипептидом, имеющим глюкозооксидазную активность по данному раскрытию, и измерения количества глюкозы, окисленной глюкозооксидазой.
Далее, несколько вариантов осуществления имеют отношение к устройствам и наборам для анализа глюкозы в образце, содержащем полипептид, имеющий глюкозооксидазную активность по данному раскрытию и медиатор транспорта электронов.
Кроме того, некоторые варианты осуществления относятся к ферментным электродам, имеющим полипептид с глюкозооксидазной активностью по данному раскрытию, который иммобилизован на электроде.
Далее, некоторые другие варианты осуществления имеют отношение к ферментным сенсорам для анализа глюкозы, содержащим ферментный электрод по данному раскрытию в качестве рабочего электрода.
Еще один объект - варианты осуществления, относящиеся к использованию полипептида, имеющего глюкозооксидазную активность по данному раскрытию для переработки пищи.
В частности, еще один объект - варианты осуществления данного описания, имеющие отношение к модифицированным глюкозооксидазам, содержащим замены, по меньшей мере, трех аминокислотных остатков в аминокислотной последовательности, встречающейся в природе глюкозооксидазы Aspergillus niger дикого типа, в положениях, соответствующих 556 и 537 или 37 относительно нумерации аминокислотной последовательности глюкозооксидазы дикого типа из Aspergillus niger (SEQ ID NO: 1), и, по меньшей мере, замещения в положениях, соответствующих аминокислотным остаткам 556 и 537 или 37 и 106, и в которых упомянутая модифицированная глюкозооксидаза имеет более высокую собственную активность, чем фермент дикого типа.
Прежде чем раскрытие изобретения будет описано детально, следует понять, что данное раскрытие не ограничено описанными конкретными частями устройств, или стадиями процесса по описанным способам, поскольку такие устройства и способы могут варьировать. Также следует понимать, что терминология, использованная в данном документе, предназначена только для целей описания конкретных вариантов осуществления и не направлена на то, чтобы быть ограничивающей. Надо отметить, что, так как это используется в спецификации и прилагаемой формуле изобретения, формы единственного числа включают в себя и единичные и (или) множественные определяемые объекты, если только контекст ясно не диктует иного. Также следует понимать, что в случае, если диапазон параметра дан в виде определенных числовых значений, полагают, что диапазоны включают в себя эти граничные значения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
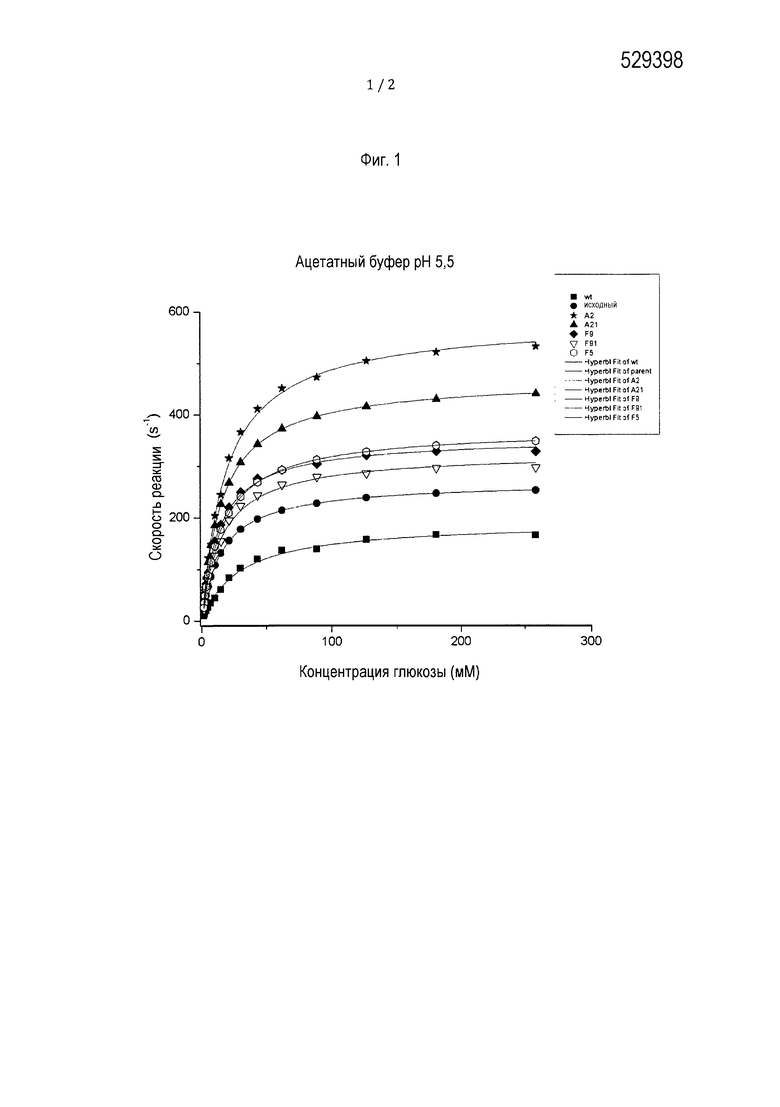
Фиг. 1 представляет собой диаграмму, показывающую кинетику вариантов GOx фермента по данному раскрытию при pH 5,5.
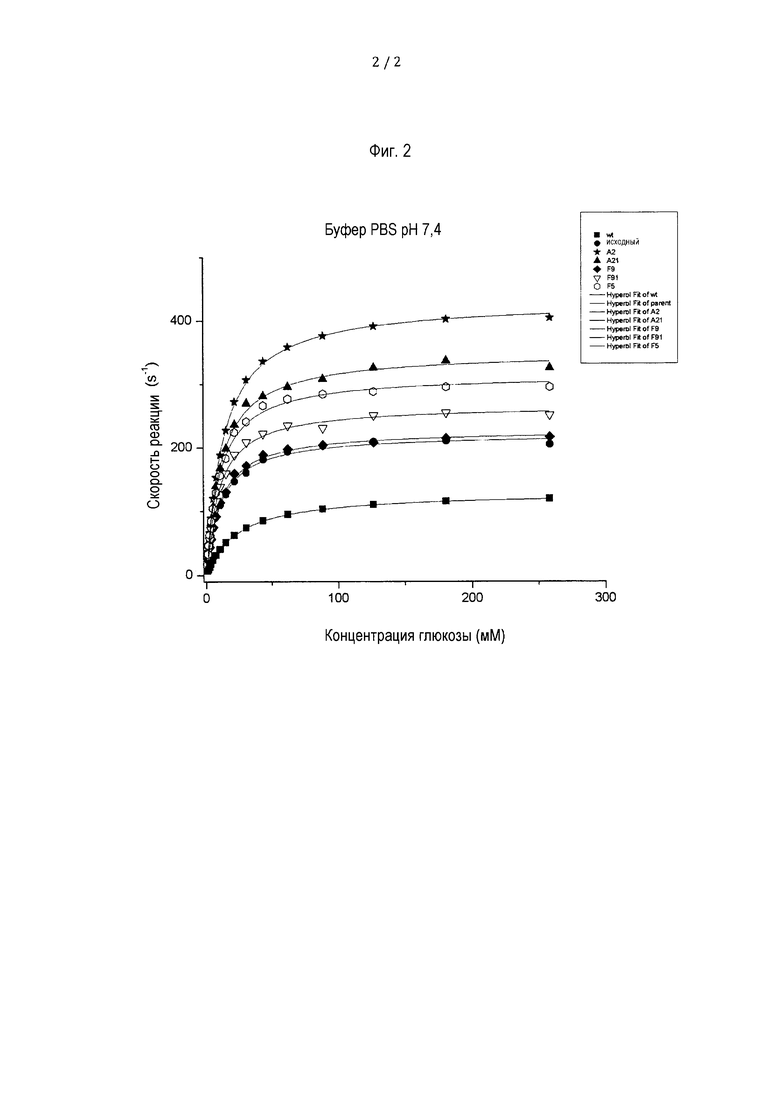
Фиг. 2 представляет собой диаграмму, показывающую кинетику вариантов GOx фермента по данному раскрытию при pH 7,4.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном документе раскрыты варианты фермента глюкозооксидазы (β-d-глюкоза:кислород 1-оксидоредуктаза; EC 1.1.2.3.4), в частности варианты глюкозооксидазы дикого типа Aspergillus niger, содержащие аминокислотную последовательность SEQ ID NO: 1, и молекулы нуклеиновых кислот, кодирующие упомянутые варианты глюкозооксидазы, которые могут быть использованы в промышленных применениях, включающих в себя пищевую промышленность и фармацевтическое производство, также как компонент иммуноанализа и биосенсоры в области медицинской диагностики. Варианты фермента могут быть также использованы в производстве миниатюрных биотопливных элементов, которые могут питать биомедицинские импланты, такие как биосенсоры и дозаторы инсулина.
В частности, варианты глюкозооксидазы по данному раскрытию показывают улучшенную каталитическую эффективность по сравнению с диким типом и исходной глюкозооксидазой и (или) улучшенные свойства стабильности, такие как термостабильность и (или) pH-стабильность. Эти характеристики делают их особенно полезными для промышленного и диагностического применений.
В целом, данное раскрытие относится к полипептидам, имеющим глюкозооксидазную активность, причем упомянутые полипептиды содержат вариации в положениях, соответствующих аминокислотным остаткам T30 и I94 в глюкозооксидазе дикого типа из Aspergillus niger (SEQ ID NO: 1), и, по меньшей мере, одну или более других вариаций в положениях, соответствующих аминокислотным остаткам M556, R537, R37, A162, V106, V293 или E310, и в котором аминокислотная последовательность упомянутых полипептидов имеет, по меньшей мере, минимальный процент идентичности последовательности - по меньшей мере, 80% аминокислотной последовательности SEQ ID NO: 1 или ее вариантов, модифицированных форм, гомологов, химерных белков, функциональных эквивалентов и фрагментов.
Например, гомологичный полипептид по данному раскрытию содержит какую-либо активную глюкозооксидазу с процентом идентичности последовательности, по меньшей мере, 70% или предпочтительно, по меньшей мере, 80%, 85%, 90%, 95%, 97% или 99% к SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11 или SEQ ID NO: 13 и содержащую вариации в положениях, соответствующих аминокислотным остаткам T30 и I94, и, по меньшей мере, одну или более других вариаций в положениях, соответствующих аминокислотным остаткам M556, R537, R37, A162, V106, V293 или E310.
Данное раскрытие выявляет глюкозооксидазные ферменты с аминокислотной последовательностью, происходящей из аминокислотной последовательности, показанной в SEQ ID NO:1, или их варианты, модифицированные формы, гомологи, химерные белки, функциональные эквиваленты или функциональные фрагменты, имеющие вариации в положениях, соответствующих аминокислотным остаткам T30 и I94 и одном или более положений, выбранных из группы положений, которые соответствуют структурно или по гомологии аминокислотной последовательности положениям M556, R537, R37, A162, V106, V293 или E310.
Так, как это используется в данном документа, термины «клетка», «клеточная линия» и «клеточная культура» могут быть использованы взаимозаменяемо, и все такие обозначения включают в себя потомство. Таким образом, слова «трансформанты» или «трансформированные клетки» включают в себя первичный клеточный объект и происходящие от него культуры, независимо от количества пассажей. Также понятно, что все потомство может не быть в точности идентичным по содержащейся в нем ДНК вследствие направленных или случайных мутаций. Мутантное потомство, которое имеет такую же функциональность, как была обнаружена в исходных трансформированных клетках, также включено.
Термин «комплементарный», как это используется в данном документе, относится к связи между двумя последовательностями нуклеиновой кислоты. Одна последовательность нуклеиновой кислоты является комплементарной второй последовательности нуклеиновой кислоты, если она способна сформировать двойную спираль со второй нуклеиновой кислотой, в которой каждый остаток в двойной спирали образует пару оснований гуанозин - цитидин (G-C) или аденозин - тимидин (A-T) или эквивалентную пару оснований. Эквивалентные пары оснований могут включать в себя нуклеозиды или аналоги нуклеотидов, иные, чем гуанозин, цитидин, аденозин или тимидин.
Фраза «положение, соответствующее тому-то», как это используется в данном документе, означает положение аминокислотного остатка в ряду аминокислотной последовательности, которая сравнивается с аминокислотным остатком в референтной аминокислотной последовательности с использованием программного обеспечения AlignX Vector NTI со стандартными параметрами (доступным на фирме Invitrogen; см., Lu, G., и Moriyama, E. N. (2004) Vector NTI, a balanced all-in-one sequence analysis suite. Brief Bioinform 5, 378-88). Таким образом, «аминокислотный (AA) остаток в положении, соответствующем положению Y аминокислотной последовательности, представленной в SEQ ID NO: X» означает аминокислотный остаток в ряду аминокислотной последовательности, которая выровнена с аминокислотой Y в SEQ ID NO: X, когда ряд аминокислотной последовательности сравнивается с SEQ ID NO: X с помощью AlignX Vector NTI со стандартными параметрами. Следует отметить, что сама аминокислота Y в SEQ ID NO: X также охватывается этим термином. Мутантная глюкозооксидаза по данному раскрытию демонстрирует повышенную оксидазную активность при сохранении и (или) увеличении стабильности фермента, в частности, термостабильности.
Так, как это используется в данном документе, термин «активность» или «каталитическая активность» количественно описывает преобразование данного субстрата при определенных условиях реакции. Термин «остаточная активность» определен как соотношение каталитической активности фермента при определенном наборе условий к каталитической активности при другом наборе условий. Термин «специфическая активность» или «собственная активность» количественно описывает каталитическую активность на количество фермента при определенных условиях реакции. В частности, активность оксидазы описывает ферментативную активность глюкозооксидазы по катализу окисления глюкозы с образованием глюконолактона, использующую кислород как акцептор электронов. Например, активность оксидазы может быть исследована анализами, описанными в примерах данного раскрытия (см. пример 7). Как упоминалось, «активность» глюкозооксидазы, как это используется в данном документе, может быть направлена на измерение ее способности катализировать реакцию окисления D-глюкоза + О2 → глюконолактон + H2O2, и может быть выражена как скорость, при которой образуется продукт реакции. Например, глюкозооксидазная активность может быть представлена как количество продукта (глюконолактон и (или) H2О2), образовавшегося за единицу времени, или на единицу глюкозооксидазы (например, концентрации или веса).
Активность, улучшенная вариантами GOx по данному раскрытию, представляет собой, в частности, собственную активность (специфическую активность), но также общую активность. Так, как это используется в данном документе, «Kcat» означает скорость реакции при высоких концентрациях субстрата (условия насыщения), деленную на концентрацию фермента (на единицу фермента). «Km» определена как концентрация субстрата, при которой фермент достигает максимальной скорости, но это относится к скорости реакции при условиях ненасыщенного субстрата, то есть при низкой концентрации глюкозы. «Kcat/km» представляет собой константу специфичности и суммирует 2 свойства. В выгодных вариантах осуществления все улучшенные варианты GOx по данному раскрытию показывают улучшенный kcat и лучший km (и, следовательно, kcat/km) по сравнению с вариантом дикого типа.
Термин «фермент» по данному изобретению означает какое-либо вещество, состоящее целиком или главным образом из белка или полипептидов, которые катализируют или активизируют более или менее специфически одну или более химическую или биохимическую реакцию. Термин «фермент» может также относиться к каталитическому полинуклеотиду (например, РНК или ДНК).
Термин «реакция окисления» означает в общих терминах химическую или биохимическую реакцию, вовлекающую добавление кислорода к субстрату с образованием оксигенированного или окисленного субстрата или продукта. Реакция окисления обычно сопровождается реакцией восстановления (откуда термин «редокс-реакция» для окисления и восстановления). Соединения является «окисленным», когда оно приобретает кислород или теряет электроны. Как упоминалось выше, глюкозооксидаза обычно катализирует окисление группы первичного спирта до альдегида.
Термин «глюкозооксидаза» или «GOx» обозначает белок, который катализирует окисление β-D-глюкозы в D-глюконо-1,5-лактон (D-глюкоза + О2 → глюконолактон + H2О2), который может затем гидролизоваться в глюконовую кислоту. Соответственно, глюкозооксидаза представляет собой фермент. Далее, термин «полипептид, имеющий активность глюкозооксидазы» относится к полипептиду, имеющему упомянутую выше активность. Фермент глюкозооксидаза представляет собой, таким образом, член класса окислительных ферментов, который катализирует реакцию окисления путем добавления, введения, вовлечения или переноса кислорода из источника или от донора к субстрату. Такие ферменты также именуются оксидоредуктазами или редокс-ферментами и охватывают оксигеназы, гидрогеназы или редуктазы, оксидазы и пероксидазы. В этой связи термины «донор кислорода», «окисляющий агент» и «оксидант» означают вещество, молекулу или соединение, которые являются донаторами кислород для субстрата в реакции окисления. Обычно, донатор кислород восстанавливается (акцептирует электроны). Примеры донаторов кислорода, которые не являются ограничивающими, включают в себя молекулярный кислород или дикислород (О2) и перекиси, включая в себя перекиси алкилов, такие как перекись t-бутила, а наиболее предпочтительно - перекись водорода (H2О2). Перекись представляет собой какое-либо соединение, имеющее два атома кислорода, связанные между собой.
Молекула нуклеиновой кислоты по данному раскрытию кодирует полипептид или его фрагмент, который происходит из глюкозооксидазы (GOx) из Aspergillus niger (SEQ ID NO: 1) с улучшенными кинетическими свойствами и (или) стабильностью, в частности, термостабильностью фермента в реакции превращения глюкозы в глюконолактон и H2О2. Глюкозооксидаза из Aspergillus niger представляет собой хорошо охарактеризованный белок, образующий димер величиной в 160 кДа с известной кристаллической структурой (Hecht HJ et al. Crystal structure of glucose oxidase from Aspergillus niger refined at 2.3 Angstrom resolution. Journal of Molecular Biology 1993: 229(1) 153-172).
Термин «варианты глюкозооксидазы», «модифицированная глюкозооксидаза» или «мутантная глюкозооксидаза» означает какую-либо глюкозооксидазу, полученную, например, направленным или случайным мутагенезом, вставкой, делецией, рекомбинацией и (или) каким-либо иным способом белковой инженерии, который дает глюкозооксидазу, которая отличается по аминокислотной последовательности от соответствующей глюкозооксидазы дикого типа. Термины «глюкозооксидаза дикого типа», «фермент дикого типа» или «дикий тип» по данному раскрытию описывает фермент глюкозооксидазу с аминокислотной последовательностью, обнаруженной в природе, или ее фрагмент.
Термин «исходная глюкозооксидаза», «родительская» или «исходные GOx» , как это используется в данном документе, означает глюкозооксидазу, содержащую аминокислотную последовательность SEQ ID NO: 3 с заменами в положениях, соответствующих аминокислотным остаткам T30V, I94V и A162T глюкозооксидазы дикого типа из Aspergillus niger (SEQ ID NO: 1), или глюкозооксидазу, содержащую аминокислотную последовательность SEQ ID NO: 1 с заменами в положениях, соответствующих аминокислотным остаткам T30V и I94V.
Термин «производное», как это используется в данном документе, относится к молекуле нуклеиновой кислоты, которая имеет сходные характеристики связывания с последовательностью нуклеиновая кислоты-мишени, что и молекула нуклеиновой кислоты по одной из заявляемых последовательностей.
Термин «клон экспрессии» относится к последовательностям ДНК, содержащим желаемую кодирующую последовательность и управляющие последовательности, находящиеся в управляемом взаимодействии, так что хозяин, трансформированный этими последовательностями, способен продуцировать кодируемые белки. Термин «система экспрессии» относится к хозяину, трансформированному клоном экспрессии. Чтобы выполнить трансформацию, клон экспрессии может быть включен в вектор; однако, соответствующая ДНК может также быть интегрирована в хромосому хозяина.
Термин «рекомбинантные белки» содержит все белки, происходящие от модифицированной глюкозооксидазы по данному раскрытию путем ковалентной сшивки дополнительных аминокислотных последовательностей на C- и (или) N-конце. Источник и композиция дополнительной аминокислотной последовательности являются либо природными для какого-либо живого организма или вируса, либо не являются природными. В частности, рекомбинантный белок может быть «рекомбинантным» полипептидом, который определяется либо по способу его продукции, либо по его структуре. Что касается способа их получения, рекомбинантные полипептиды производятся путем процесса, вовлекающего использование технологий рекомбинантной нуклеиновой кислоты. Что касается структуры, рекомбинантные полинуклеотиды или полипептиды содержат последовательности из различных источников. В частности, они охватывают полипептиды, полученные путем генерации последовательности, содержащей два или более фрагмента, которые в природе не являются сопряженными или функционально связанными друг с другом. Таким образом, например, охватываются продукты, полученные с помощью трансформированных клеток с каким-либо не встречающимся в природе вектором.
Термин «функциональный фрагмент» или «эффективный фрагмент» означает фрагмент или участок варианта глюкозооксидазы по данному раскрытию, который сохраняет приблизительно ту же самую ферментативную функцию или эффект и (или) ту же самую термостабильность.
Термин «ген» относится к последовательности ДНК, которая содержит управляющую и кодирующую последовательности, необходимые для продукции воспроизводимого биоактивного полипептида или предшественника.
Термин «гомологичный полипептид» или «гомолог» по данному раскрытию содержит какой-либо фермент с последовательностью, идентичной, по меньшей мере, на 70%, или предпочтительно, по меньшей мере, на 80%, 85%, 90%, 95%, 97% или 99% варианту глюкозооксидазы по данному раскрытию, включая в себя их функциональные фрагменты или эффективные фрагменты.
Термин «гомолог молекулы нуклеиновой кислоты» относится к молекуле нуклеиновой кислоты, последовательность которой имеет один или более нуклеотидов, добавленных, делетированных, замененных или химически модифицированных иным образом по сравнению с молекулой нуклеиновой кислоты по одной из заявляемых последовательностей, при том, что всегда гомолог сохраняет практически те же самые ферментативные свойства и (или) свойства стабильности, как у последнего.
Термин «клетка-хозяин» в связи с данным раскрытием включает в себя какую-либо клетку, которая содержит либо молекулу нуклеиновой кислоты или вектор экспрессии, как описано выше, и которая используется в гетерологической продукции фермента, имеющего специфические свойства, как они определены в данном документе или в способах данного раскрытия.
Термин «изолированный» описывает какую-либо молекулу, выделенную из ее природного источника.
Термин «модифицированная форма» или «вариант» означает, что фермент был модифицирован из исходной формы (исходная/дикого типа, wt), но сохраняет, по меньшей мере, те же самые ферментативные характеристики, что и фермент дикого типа.
Термин «модификация» или «вариация», как это используется в данном документе, относится, например, к заменам, вставкам или делециям аминокислотных остатков в специфических положениях в аминокислотной последовательности, также как и фосфорилирование, ацетилирование, пальмитоилирование, метилирование, сульфатирование, гликозилирование, липидизация, изопренилирование, фарнесилирование, присоединение остатка жирной кислоты, гликозилирование добавлением якоря гликозил-фосфатидилинозитола, связывающего белки с липидами посредством гликана, и (или) убиквитинилирование специфических положений в полипептиде или их комбинация. В выгодном варианте осуществления вариация представляет собой замену.
Термин «мутация» относится к замене или замещению одиночного или множественных нуклеотидов, вставкам или делециям одного или более триплетов/кодонов, гомологичных или гетерологичных рекомбинаций между различными генами, присоединение дополнительных кодирующих последовательностей либо на конце кодирующей последовательности, либо вставка дополнительной кодирующих последовательностей или какая-либо комбинация этих способов, которые дают последовательность полинуклеиновой кислоты, кодирующую желаемый белок. Таким образом, термин «мутации» также относится ко всем изменениям полипептидной последовательности, кодируемой последовательностью полинуклеиновой кислоты, модифицированной одной или более вышеописанными изменениями. Аббревиатуры аминокислотных остатков в нижеследующей Табл. 1 представляют собой либо одно-, либо трехбуквенный код.
Термин «молекула нуклеиновой кислоты» или «нуклеиновая кислота» направлен на то, чтобы указать на какую-либо одно- или двухнитевую молекулу нуклеиновой кислоты, происходящую от кДНК, геномной ДНК, синтетической ДНК или РНК, пептид-нуклеиновой кислоты (PNA) или LNA.
Термин «олигонуклеотид», как это используется в данном документе, определяется как молекула, содержащая два или более дезоксирибонуклеотидов или рибонуклеотидов. Конкретный размер зависит от многих факторов, которые, в свою очередь, зависят от основной функции или применения олигонуклеотида. Олигонуклеотиды могут быть изготовлены с помощью какого-либо способа, включающего в себя, например, клонирование и рестрикции соответствующих последовательностей и прямой химический синтез таким способом, как фосфотриэфирный способ, диэтилфосфорамидитный способ и способом твердой подложки. Обзор способов синтеза представлен в Goodchild J, Bioconjug. Chem. (1990) 165-187.
Термин «плазмида», «векторная система», «вектор» или «вектор экспрессии» означает конструкт, способный к экспрессии in vivo или in vitro. В контексте данного раскрытия, эти конструкты могут быть использованы для введения генов, кодирующих ферменты в клетки-хозяева.
«Процент идентичности последовательности» в отношении двух аминокислотных или полинуклеотидных последовательностей означает процент остатков, которые идентичны в двух последовательностях, когда последовательности выровнены оптимально. Таким образом, 80% идентичность аминокислотных последовательностей означает, что 80% аминокислот в двух оптимально выровненных полипептидных последовательностях идентичны. Процент идентичности может быть определен, например, прямым сравнением информации о последовательностях между двумя молекулами выравниванием последовательностей, подсчетом точного количества совпадений между двумя выровненными последовательностями, делением на длину более короткой последовательности и умножением результата на 100. Чтобы облегчить анализ, могут быть использованы легкодоступные компьютерные программы, такие как ALIGN, Dayhoff, M.O. в "Atlas of Protein Sequence and Structure", M.O. Dayhoff et., Suppl. 3:353-358, National Biomedical Research Foundation, Washington, DC, которая использует алгоритм локальной гомологии по Smith and Waterman (1981) Advances in Appl. Math. 2:482-489 для анализа пептидов. Программы для определения идентичности нуклеотидной последовательности доступна в Wisconsin Sequence Analysis Package, Version 8 (доступны на фирме Genetics Computer Group, Madison, WI), например, программы BESTFIT, FASTA и GAP, которые также опираются на алгоритм Smith и Waterman. Эти программы легко использовать с параметрами по умолчанию 5, рекомендованными производителем и описанными в Wisconsin Sequence Analysis Package, упомянутом выше. Пример алгоритма, который пригоден для определения сходства последовательностей - это алгоритм BLAST, который описан у Altschul, et al., J. Mol. Biol. 215:403-410 (1990). Программное обеспечение для проведения анализов BLAST доступно для публики через Национальный Центр биотехнологической информации (National Center for Biotechnology Information) (http://www.ncbi.nlm.nih.gov/).
Термин «полинуклеотид» соответствует какому-либо генетическому материалу какой-либо длины и какой-либо последовательности, содержащим однонитевую или двухнитевую молекулы ДНК и РНК, включающие в себя регуляторные элементы, структурные гены, группы генов, плазмиды, целые геномы и его фрагменты.
Термин «положение» в полинуклеотиде или полипептиде относится к специфическому одиночному основанию или аминокислотному остатку в последовательности полинуклеотида или полипептида, соответственно.
Термин «обязательные условия» относится к условиям, при которых зонд будет гибридизоваться со своей последовательностью-мишенью, но не с другими последовательностями. Обязательные условия являются зависимыми от последовательности и различаются при разных обстоятельствах. Более длинные последовательности специфически гибридизуются при более высоких температурах.
В целом, обязательные условия выбираются так, чтобы они были на около 5°C ниже, чем термическая температура плавления (Tm) для специфической последовательности при определенной ионной силе и pH. Tm представляет собой температуру (при определенной ионной силе, pH и концентрации нуклеиновой кислоты), при которой 50% зонда, кoмплементарного последовательности-мишени, гибридизуется с последовательностью-мишенью при равновесии. (Поскольку последовательности-мишени в целом присутствует в избытке при Tm, 50% зонда при равновесии захватывается). Обычно, обязательные условия таковы, при которых концентрация соли составляет менее чем около 1,0 M иона Na, обычно около 0,01 до 1,0 M иона Na (или других солей) при pH 7,0-8,3 и температуре, по меньшей мере, около 30° C для коротких зондов (например, 10-50 нуклеотидов) и, по меньшей мере, около 60° C для более длинных зондов. Обязательные условия могут также быть достигнуты путем добавления дестабилизирующих агентов, таких как формамид.
Термин «термостабильный фермент», «термостабильная глюкозооксидаза» или «термостабильный полипептид», как это используется в данном документе, относится к ферменту, который стабилен при нагревании и поддерживает высокую активность после воздействия повышенной температуры. «Термическая стабильность» или «термостабильность» мутантной глюкозооксидазы или варианты по данному описанию определялись путем инкубирования фермента в 50 мМ ацетатном буфере (pH 5,5) при 60°C в отсутствии субстрата и измерения остаточной активности повторяющихся аликвот с использованием анализа ABTS (см. пример 8).
Термин «вариант молекулы нуклеиновой кислоты» относится в данном документе к молекуле нуклеиновой кислоты, которая в основном сходна по структуре и биологической активности с молекулой нуклеиновой кислоты по одной из заявляемых последовательностей.
Сокращения для аминокислот
Мутации или вариации описаны путем использования следующей номенклатуры: положение; замененный аминокислотный остаток (остатки). В соответствии с этой номенклатурой замена, например, остатка аланина на остаток глицина в положении 20 обозначается как 20G. Когда остаток аминокислоты в конкретном положении заменен двумя или более альтернативными аминокислотными остатками, эти остатки отделяются запятой или знаком дроби. Например, замена аланина в положении 20 глицином или глютаминовой кислотой показана как 20G/E или 20G, 20E.
Кроме того, может быть также использована следующая номенклатура: аминокислотный остаток в каркасном белке; положение; замененный аминокислотный остаток (остатки). В соответствии с этой номенклатурой замена, например, остатка аланина на остаток глицина в положении 20 обозначается как Ala20Gly или A20G, или 20G. Делеция аланина в том же положении показана как Ala20* или A20*. Вставка дополнительного аминокислотного остаток (например, глицина) показана как Ala20AlaGly или A20AG. Делеция последовательного участка аминокислотных остатков (например, между аланином в положении 20 и глицином в положении 21) обозначается как Δ(Ala20-Gly21) или Δ(A20-G21). Когда последовательность, содержащая делецию по сравнению с исходным белком, используется для нумерации, вставка в таком положении (например, аланин в делетированном положении 20) обозначается как *20Ala или *20A. Множественные мутации разделяются знаком «плюс» или знаком дроби. Например, две мутации в положениях 20 и 21, замещающие аланин и глютаминовую кислоту на глицин и серин, соответственно, обозначены как A20G+E21S или A20G/E21S. Когда предполагается, что положение, пригодное для модификации, идентифицируется в данном документе как не имеющее какой-либо модификации, следует понимать, что какой-либо аминокислотный остаток может быть заменен на другой аминокислотный остаток в этом положении. Таким образом, например, когда модификация аланина в положении 20 упоминается, но не уточняется, следует понимать, что аланин может быть делетирован или заменен на какой-либо другой аминокислотный остаток (т.е., какой-либо из R, N, D, C, Q, E, G, H, I, L, K, M, F, P, S, T, W, Y и V).
Термины «консервативная мутация» или «консервативная замена», соответственно, относится к аминокислотной мутации, которую специалисты в данной области техники сочтут консервативной для первой мутации. «Консервативная» в данном контексте означает сходную аминокислоту в терминах аминокислотных характеристик. Если, например, мутация приводит в конкретном положении к замене неалифатического остатка аминокислоты (например, Ser) на остаток алифатической аминокислоты (например, Leu), тогда замена в том же положении другой алифатической аминокислотой (например, He или Val) считается консервативной мутацией. Другие характеристики аминокислоты включают в себя размер остатка, гидрофобность, полярность, заряд, значение pK и другие характеристики аминокислоты, известные в данной области техники. Соответственно, консервативная мутация может включать в себя замену, как основная на основную, кислотная на кислотную, полярная на полярную и т.д. Набор аминокислот, полученный таким образом, вероятно, консервативен по структурным соображениям. Эти наборы могут быть описаны в форме диаграммы Венна (Livingstone CD. и Barton G.J. (1993) "Protein sequence alignments: a strategy for the hierarchical analysis of residue conservation" Comput.Appl Biosci. 9: 745-756; Taylor W.R. (1986) "The classification of amino acid conservation" J.Theor.Biol. 119; 205-218). Консервативные замены могут быть сделаны, например, в соответствии с таблицей, приведенной ниже, которая описывает общепринятую диаграмму Венна группировки аминокислот.
Диаграмма Венна по группам аминокислот
Также понятно, что данное раскрытие содержит все молекулы, которые происходят из полинуклеотидов по данному раскрытию, и все их варианты, описанные в данной заявке, путем посттрансляционной обработки сравнивали с генетически кодированной аминокислотной последовательностью. Эти посттрансляционные модификации содержат, но не ограничиваются ими, протеолитическое дробление N-концевых последовательностей, таких как лидерная и (или) пропоследовательность, протеолитическое удаление C-концевых расширений, N- и (или) O-гликозилирование, липидизацию, ацилирование, деамидирование, образование пироглютамата, фосфорилирование и (или) иное, или какую-либо их комбинацию, поскольку они происходят при продукции/экспрессии в естественном хозяине или каком-либо подходящем для экспрессии хозяине. Эти посттрансляционные модификации могут или не могут иметь влияние на физические или ферментативные свойства ферментов, как это исследовано в данном документе.
Как упоминалось выше, данное раскрытие имеет отношение к полипептиду, имеющему глюкозооксидазную активность, причем упомянутый полипептид содержит вариации в положениях, соответствующих аминокислотным остаткам T30 и I94 в глюкозооксидазе дикого типа из Aspergillus niger (SEQ ID NO: 1), и, по меньшей мере, одну или более дополнительных вариаций в положениях, соответствующих аминокислотным остаткам M556, R537, R37, A162, V106, V293 или E310, и в котором аминокислотная последовательность упомянутого полипептида имеет, по меньшей мере, минимальный процент идентичности последовательности, по меньшей мере, 80% от аминокислотной последовательности SEQ ID NO: 1.
В выгодных вариантах осуществления упомянутый полипептид содержит, по меньшей мере, вариации в положениях, соответствующих аминокислотным остаткам T30, I94, A162, и, по меньшей мере, одну или более вариаций в положениях, соответствующих аминокислотным остаткам M556, R537, R37, V106, V293 или E310 аминокислотной последовательности, представленной в SEQ ID NO: 1.
В еще одном варианте осуществления упомянутый полипептид содержит, по меньшей мере, вариации в положениях, соответствующих аминокислотным остаткам T30, I94, A162, и, по меньшей мере, вариацию в аминокислотном остатке M556, в частности, в комбинации, по меньшей мере, с вариацией в положении, соответствующем аминокислотному остатку R537 аминокислотной последовательности, представленной в SEQ ID NO: 1.
В выгодных вариантах осуществления упомянутый полипептид содержит, по меньшей мере, вариации в положениях, соответствующих аминокислотным остаткам T30, I94, A162, и, по меньшей мере, вариацию в положении, соответствующем аминокислотному остатку R37, в частности, в комбинации, по меньшей мере, с вариацией в положении, соответствующем аминокислотным остаткам R37 и V106 аминокислотной последовательности, представленной в SEQ ID NO: 1.
В выгодных вариантах осуществления упомянутый полипептид содержит, по меньшей мере, вариации в положениях, соответствующих аминокислотным остаткам T30, I94, A162 и, по меньшей мере, вариацию в положении, соответствующем аминокислотному остатку V106 и (или), по меньшей мере, вариацию в положении, соответствующем аминокислотному остатку V293 аминокислотной последовательности, представленной в SEQ ID NO: 1.
В выгодных вариантах осуществления, упомянутый полипептид содержит, по меньшей мере, вариации в положениях, соответствующих аминокислотным остаткам T30, I94, A162, и, по меньшей мере, вариацию в положении, соответствующем аминокислотному остатку E310 аминокислотной последовательности, представленной в SEQ ID NO: 1.
В упомянутых ранее мутантах по глюкозооксидазе по данному раскрытию, упомянутые вариации представляют собой замены, выбранные из группы T30V, I94V, R37K, V106I, A162T, V293I, E310, R537K и M556V или их комбинаций.
Предпочтительные примеры полипептида, имеющего улучшенную глюкозооксидазную активность по сравнению с ферментом дикого типа, содержат замены, выбранные из группы, состоящей из:
M556V, R537K, T30V, I94V
M556V, R537K, T30V, I94V, A162T
M556V, R537K, R37K, V293I, E310D, T30V, I94V, A162T
M556V, R37K, V106I, T30V, I94V, A162T
R37K, V106I, T30V, I94V, A162T
Таблица 3 показывает список полезных вариантов мутантной глюкозооксидазы по данному раскрытию, содержащих вариации в положениях, соответствующих аминокислотным остаткам аминокислотной последовательности, представленной в SEQ ID NO: 1.
Полезные замены в SEQ ID NO: 1
Полезный вариант осуществления данного раскрытия имеет отношение к полипептиду, имеющему глюкозооксидазную активность, содержащему аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11 или SEQ ID NO: 13, в частности, полипептиду, содержащему аминокислотную последовательность SEQ ID NO: 7 или SEQ ID NO: 11, причем полипептид имеет улучшенную глюкозооксидазную активность (kM, kca и (или) kcat/kM) и (или) улучшенную термостабильность по сравнению с ферментом дикого типа и исходной GOx.
В полезных вариантах осуществления полипептиды, имеющие глюкозооксидазную активность по данному раскрытию, имеют, по меньшей мере, 1,2, по меньшей мере, 1,4, по меньшей мере, 1,5, по меньшей мере, 1,6, или, по меньшей мере, 1,7-кратное повышение активности при pH 5,5 по сравнению с исходной GOx и (или), по меньшей мере, 1,2, по меньшей мере, 1,4, по меньшей мере, 1,5, по меньшей мере 1,6 или, по меньшей мере, 1,7-кратное повышение активности при pH 5,5, чем у исходной GOx.
В других полезных вариантах осуществления полипептиды, имеющие глюкозооксидазную активность по данному раскрытию имеют, по меньшей мере, 3, по меньшей мере, 3,5 и, по меньшей мере, 4 кратное повышение активности при pH 5,5 по сравнению с GOx дикого типа и (или), по меньшей мере, 2,5, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 5,8-кратное повышение активности при pH 7,4 по сравнению с GOx дикого типа.
Данное раскрытие имеет отношение к полипептидам, содержащим вышеупомянутые вариации, в частности, замены в аминокислотной последовательности, по меньшей мере, с минимальным процентом идентичности последовательности 85%, по меньшей мере, 90%, по меньшей мере, 93%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% аминокислотной последовательности SEQ ID NO: 1.
Варианты осуществления по данному раскрытию также включают в себя варианты какой-либо глюкозооксидазы, представленной в SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11 или SEQ ID NO: 13, в частности, полипептид, содержащий аминокислотную последовательность SEQ ID NO: 7, или SEQ ID NO: 11, который имеет глюкозооксидазную активность и аминокислотную последовательность, имеющую процент идентичности последовательности, по меньшей мере, 50%, по меньшей мере, 60%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 93%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, и, по меньшей мере, 99% по сравнению с каждым из вариантов глюкозооксидазы, представленных в последовательностях SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11 или SEQ ID NO: 13.
Другие варианты осуществления данного раскрытия представляют собой молекулы нуклеиновых кислот, выбранные из группы, состоящей из
e) молекулы нуклеиновой кислоты, кодирующей полипептид по данному раскрытию;
f) молекулы нуклеиновой кислоты, кодирующей полипептид по данному раскрытию, в которой один или более аминокислотных остатков консервативно заменены;
g) молекулы нуклеиновой кислоты, которые представляют собой вариант, гомолог, производное или фрагмент молекулы нуклеиновой кислоты, представленной в SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14;
h) молекулы нуклеиновой кислоты, которые способны к гибридизации с какими-либо молекулами нуклеиновых кислот по пп. a)-c) при обязательных условиях;
i) молекулы нуклеиновой кислоты, которая способна к гибридизации с комплементом каких-либо молекул нуклеиновых кислот по пп. a)-d) при обязательных условиях;
j) молекулы нуклеиновой кислоты, имеющей идентичность последовательности, по меньшей мере, 95% с какой-либо из молекул нуклеиновой кислоты по пп. a)-e) и кодирующей полипептид, имеющий улучшенную глюкозооксидазную активность и (или) термостабильность;
k) молекулы нуклеиновой кислоты, имеющей идентичность последовательности, по меньшей мере, 85% с какими-либо молекулами нуклеиновых кислот по пп. a)-e) и кодирующей полипептид, имеющий улучшенную глюкозооксидазную активность и (или) термостабильность;
l) или комплемент к каким-либо молекулам нуклеиновых кислот по пп. a)-g).
В одном из вариантов осуществления по данному раскрытию глюкозооксидазные ферменты демонстрируют особенно улучшенную термостабильность и в то же время улучшенную или нормальную собственную активность по сравнению с GOx дикого типа или исходного фермента GOx. Эти характеристики делают их особенно пригодными для обработки пищевых продуктов и других промышленных и диагностических применений.
Другие варианты осуществления данного раскрытия представляют собой векторы, клоны экспрессии и клетки-хозяева, содержащие молекулы нуклеиновых кислот, кодирующие варианты глюкозооксидазы по данному описанию.
Другие варианты осуществления представляют собой способы изготовления вариантов глюкозооксидазы по данному раскрытию, которые содержат культивирование трансформированных, трансдуцированных или трансфецированных клеток-хозяев и изоляцию модифицированной глюкозооксидазы из культуры.
Таким образом, данное раскрытие также охватывает вектор, содержащий полинуклеотид, кодирующий мутантную глюкозооксидазу, клетку-хозяин, трансформированную таким вектором, и способ изготовления мутантной глюкозооксидазы по данному изобретению путем культивирования трансформанта, сбора и очистки мутантной глюкозооксидазы из культуры.
Раскрытие также охватывает способ анализа глюкозыпутем помещения глюкозооксидазы по данному раскрытию в контакт с образцом и измерения количества глюкозы, окисленной глюкозооксидазой. Еще один объект - данное раскрытие предоставляет устройство для анализа глюкозы в образце, содержащем глюкозооксидазу по данному раскрытию и an медиатор транспорта электронов.
Устройство для анализа может иметь сходную структуру, как у какой-либо общепринятой коммерчески доступной амперометрической биосенсорной тестовой полоски для контроля уровня глюкозы в крови. Один из примеров такого устройства имеет два электрода (рабочий электрод и электрод сравнения или интегрирующий электрод) расположенные на изолирующей подложке, вход для реагента и приемник для образца. Вход для реагента содержит мутантную глюкозооксидазу по раскрытию и медиатор транспорта электронов. Когда образец, такой как образец крови, вводится в приемник образца, глюкоза, содержащаяся в образце, вступает в реакцию с глюкозооксидазой, что генерирует ток, который является индикатором количества глюкозы в образце. Типичные примеры электрохимических сенсоров пригодных для определения субстратов фермента известны, например, из патентной заявки WO 2004/113900 и патента США 5,997,817. В качестве альтернативы электрохимическим сенсорам могут быть использованы технологии оптического детектирования. Обычно такие оптические устройства основываются на изменении цвета, которые происходят в системе реагентов, содержащей фермент, медиатор транспорта электронов и индикатор. Изменения цвета могут быть оценены количественно с использованием измерений флуоресценции, абсорбции или излучения. Типичные примеры оптических устройств, подходящих для определения субстрата фермента известны, например, из патента США 7,008,799, US 6,036,919, и патента 5,334,508.
Еще один объект - данное раскрытие предоставляет набор для анализа глюкозы в образце, содержащем глюкозооксидазу по данному раскрытию и медиатор транспорта электронов.
Набор для измерения глюкозы может быть собран с использованием фермента по данному раскрытию. В дополнение к глюкозооксидазе по данному раскрытию, набор содержит буфер, необходимый для измерения, подходящий медиатор и, если необходимо, ферменты, такие как пероксидаза, стандартный раствор глюкозы для приготовления калибровочной кривой и инструкцию по применению. Глюкозооксидаза по данному изобретению может быть предоставлена в различных формах, например, как замороженный и высушенный реагент или как раствор в подходящем для хранения растворе.
Еще один объект - данное изобретение предоставляет ферментный электрод, имеющий глюкозооксидазу по данному изобретению, которая иммобилизована на электроде.
Еще один объект - данное раскрытие предоставляет ферментный сенсор для анализа глюкозы, содержащий ферментный электрод по данному раскрытию в качестве рабочего электрода. В полезном варианте осуществления сенсор представляет собой одноразовый сенсор.
Концентрация глюкозы в образце может быть определена путем измерения количества электронов, генерируемых ферментативной реакцией. В данной области техники описаны различные сенсорные системы, включающие в себя системы, основанные на угольном электроде, металлическом электроде и платиновом электроде. Мутантная глюкозооксидаза по данному раскрытию иммобилизована на электродах. Примеры средств иммобилизации включают в себя перекрестную сшивку, инкапсулирование в макромолекулярном матриксе, покрытие диализной мембраной, оптический полимер перекрестной сшивки, электропроводный полимер, окислительно-восстановительный полимер и какая-либо их комбинация.
Когда измерение проводится в амперометрической системе с использованием угольного электрода, золотого электрода или платинового электрода, снабженного иммобилизованным ферментом, он используется как рабочий электрод вместе с интегрирующим электродом (таким, как платиновый электрод) и электродом сравнения (таким как Ag/AgCl-электрод). Электроды помещаются в буфер, содержащий медиатор, и содержатся при определенной температуре. Определенное напряжение подается на рабочий электрод, затем добавляют образец, и измеряют увеличивающийся электрический ток. Примеры медиатора, использованного в анализе, включают в себя феррицианид калия, ферроцен, осмиевые производные, рутениевые производные, феназин метосульфат, производные нитрозоанилина и т.д. В целом также возможно использовать так называемые двухэлектродные системы с одним рабочим электродом и интегрирующим или псевдо-электродом сравнения.
Далее, глюкоза может быть проанализирована с помощью иммобилизованного медиатора транспорта электронов в амперометрической системе с помощью угольного электрода, золотого электрода или платинового электрода. Фермент иммобилизован на электроде вместе с медиатором транспорта электронов (таким как феррицианид калия, ферроцен, осмиевое производное или феназин метосульфат) в макромолекулярном матриксе путем адсорбции или ковалентного связывания для изготовления рабочего электрода. Он вводится в буфер вместе с интегрирующим электродом (таким, как платиновый электрод) и электродом сравнения (таким, как Ag/AgCl-электрод), и содержится при определенной температуре. Определенное напряжение подается на рабочий электрод, затем вносят образец и измеряют повышенный электрический ток.
Как упоминалось выше, один из вариантов осуществления по данному раскрытию относится к способам производства полипептида, имеющего глюкозооксидазную активность, содержащим стадии: (a) культивирования клеток-хозяев, содержащих молекулы нуклеиновых кислот, кодирующие варианты глюкозооксидазы по данному описанию в подходящей культуральной среде при подходящих условиях, чтобы получить полипептиды, имеющие глюкозооксидазную активность; (b) получение упомянутых продуцированных полипептидов, и, если требуется (c) обработка полипептидов.
Чтобы получить фермент глюкозооксидазу, ДНК, кодирующая фермент, может быть химически синтезирована из опубликованных последовательностей или получена из клеток-хозяев, содержащих ген (например, путем скрининга библиотеки кДНК или амплификации ПЦР). Ген глюкозооксидазы может быть включен в экспрессионную кассету и (или) клонирован в подходящий вектор экспрессии путем стандартных технологий молекулярного клонирования. Такие экспрессионные кассеты или векторы часто содержат последовательности, которые способствуют инициации и терминированию транскрипции (например, промоторы и терминаторы), и могут содержать селектируемые маркеры. Кассеты могут также содержать плюс- или минус-нить мРНК, и их экспрессия может включать или не включать в себя стадию амплификации перед трансляцией мРНК. Экспрессируемый ген глюкозооксидазы может содержать или не содержать определенные домены белка, такие как полимер-связывающие домены (например, углевод-связывающие домены) различных специфичностей. Экспрессирующие кассеты или вектор могут быть введены в подходящую для экспрессии клетку-хозяин, которая затем экспрессирует соответствующий ген глюкозооксидазы. Особенно подходящие для экспрессии хозяева представляют собой экспрессирующие бактериальные роды, включающие в себя Escherichia (например, E. coli), Pseudomonas (например, P. fluorescens или P. stutzerei), Proteus (например, Proteus mirabilis), Ralstonia (например, R. eutropha), Streptomyces, Staphylococcus (например, S. carnosus), Lactococcus (например, L. lactis), и Bacillus (например, B. subtilis, B. megaterium, B. licheniformis). Также особенно подходящим хозяином для экспрессии являются дрожжи, такие как Saccharomyces cerevisiae, Schizosaccharomyces pombe, Yarrowia lipolytica, Hansenula polymorpha, Kluyveromyces lactis или Pichia pastoris. Особенно подходящими хозяевами для экспрессии являются грибы, такие как Chrysosporium lucknowense, Aspergillus (например, A. oryzae, A. niger, A. nidulans) или Trichoderma reesei. Также подходящими для экспрессии являются хозяева-млекопитающие, такие как клеточные линии мыши (например, NS0), яичники китайского хомячка (CHO) или почка новорожденного хомяка (BHK), трансгенные системы млекопитающих, такие как кролики, козы или коровы, другие эукариотические хозяева, такие как клетки насекомых или растений, или вирусные системы экспрессии, такие как бактериофаги M13, T7 или λ, или вирусы эукариот, такие как Baculovirus.
Гены глюкозооксидазы могут быть введены для экспрессии в клетки-хозяева с помощью множества способов трансформации, включая в себя, но не ограничиваясь этим, электропробой мембраны, трансформацию или трансфекцию с помощью липидов («липофекция»), химически опосредованную трансфекцию (например, , CaCl и (или) CaP), трансформацию, опосредованную ацетатом лития (например, протопластов клетки-хозяина), трансформацию с помощью биолистической «генной пушки», трансформацию, опосредованную полиэтиленгликолем (PEG) (например, протопластов клетки-хозяина), слияние протопластов (например, с использованием бактериальных и эукариотических протопластов), трансформацию, опосредованную липосомами, Agrobacterium tumefaciens, аденовирусом или другой вирусной или фаговой трансформацией или трансдукцией.
Представляющий интерес белок может быть секретирован во внеклеточное пространство или периплазматическое пространство или экспрессируется внутриклеточно. Если требуется, после внутриклеточной экспрессии вариантов фермента или секреции в периплазматическое пространство с помощью сигнальных последовательностей, таких как упомянутые выше, могут быть использованы стадии пермеабилизации или лизиса, чтобы высвободить фермент глюкозооксидазу в супернатант. Разрушение мембранного барьера может быть достигнуто путем использования механических средств, таких как ультразвуковые волны, обработка давлением (плунжером), кавитация или использование ферментов, переваривающих мембрану, таких как лизоцим или смеси ферментов. Как еще одна альтернатива, гены, кодирующие фермент глюкозооксидазу, экспрессируются бесклеточно с помощью подходящей бесклеточной системы экспрессии. Например, для этой цели был использован экстракт S30 из клеток Escherichia coli или коммерчески доступные системы (например, технология CECF фирмы Roche Applied Science, Inc.). В бесклеточных системах гены, представляющие интерес, обычно транскрибируются с помощью промоторов, но возможно и лигирование с образованием кольцевого вектора экспрессии. РНК может также быть добавлена экзогенно или образована без транскрипции и транслируется в бесклеточной системе. Конфигурации конструктов экспрессии для экспрессии in vitro и работа всех приведенных выше систем экспрессии находятся в пределах возможностей опытного специалиста в данной области техники.
Как описано выше, белки глюкозооксидазы могут быть экспрессированы в различных системах экспрессии и в соответствии с подходящим процессингом в прямом направлении и отобраны процедурами очистки. В полезном варианте осуществления данного раскрытия вариант глюкозооксидазы экспрессируется в микробном хозяине, а белок секретируется в периплазматическое или внеклеточное пространство. Клетки, экспрессирующие варианты глюкозооксидазы, сохраняются способами, хорошо известными специалистам в данной области техники, такими как, но не ограничиваясь ими, криоконсервация. Культуры экспрессирующего организма готовятся в каком-либо подходящем объеме стандартными способами ферментации. В предпочтительном варианте осуществления культуры для экспрессии белка инокулировались из криоконсерванта, и объем культуры успешно рос в соответствующих контейнерах. В предпочтительном варианте осуществления клетки растут в ферментере и, если требуется, условия роста, такие как pH, температура, кислород и (или) ресурсы питательных веществ контролируются. Первая стадия очистки содержит отделение клеток от супернатанта с использованием одной или более технологий, таких как седиментация, микрофильтрация, центрифугирование или флоккуляция. В предпочтительном варианте осуществления применяемый способ является микрофильтрацией. В случае внутриклеточной экспрессии клетки подвергаются обработкам, которые приводят к выделению белка из внутриклеточного пространства. Эти обработки могут содержать, например, обработку давлением, ферментативную, осмотическим шоком, замораживанием, ультразвуковую или иную обработку для получения клеточного экстракта, который может быть или может не быть предметом дальнейшей очистки.
В полезном варианте осуществления по данному раскрытию белок секретируется в супернатант и возможная стадия очистки содержит концентрацию супернатанта путем ультрафильтрации. Дальнейшая очистка белка из супернатанта или концентрированного супернатанта может быть выполнена одним или более из нескольких способов, содержащих способы экстракции или фракционирования, такие как преципитация сульфатом аммония или этанолом или кислотой, или хроматографическими способами, включающими в себя, но не ограничивающимися ими, ионообмен, гидрофобное взаимодействие, гидроксилапатит, фракционирование по размеру путем гель-фильтрации, фосфоцеллюлозная или лектиновая хроматография и аффинная хроматография или какая-либо их комбинация. В более предпочтительном способе аффинно-помеченный белок очищается металло-хелатной аффинной хроматографией для получения белка высокой чистоты.
В еще одном полезном варианте осуществления по данному раскрытию супернатант или супернатант, частично очищенный ультрафильтрацией, или сконцентрированный и (или) диафильтрованный супернатант высушивается каким-либо одним из нескольких технических способов, таких как, но, не ограничиваясь ими, сушка распылением, лиофилизация, обращенное выпаривание, тонкослойное выпаривание, сублимационное центрифугирование, конвейерное высушивание или какая-либо их комбинация.
В еще одном полезном варианте осуществления по данному раскрытию ферментированная клеточная суспензия, включающая в себя экспрессированные варианты глюкозооксидазы, высушивается целиком с помощью таких процессов, но, не ограничиваясь ими, как сушка в кипящем слое, конвейерная сушка, сушка распылением или сушка в барабанной сушилке или какая-либо их комбинация.
Представляющий интерес продуцированный полипептид, может быть собран, далее очищен, выделен, обработан и (или) модифицирован способами, известными в данной области техники. Например, полипептид может быть собран из питательной среды общепринятыми процедурами, включая в себя, но, не ограничиваясь ими, центрифугирование, фильтрацию, ультрафильтрацию, экстракцию или преципитацию. Дальнейшие стадии обработки, такие как стадии очистки, могут быть выполнены путем различных процедур, известных в данной области техники, включая в себя, но, не ограничиваясь ими, хроматографии (например, ионообменной, аффинной, гидрофобной, хроматофокусирования и эксклюзионной), электрофоретических процедур (например, препаративного изоэлектрического фокусирования), дифференциальной растворимости (например, преципитации сульфатом аммония) или экстракция. Кроме того, выделенный и очищенный полипептид, представляющий интерес, может быть далее обработан, например, изготовлен в композиции, в частности в пищевой композиции, фармацевтической композиции, диагностической композиции или косметической композиции.
При последующем выравнивании последовательностей аминокислотные последовательности, кодирующие глюкозооксидазу дикого типа из Aspergillus niger (SEQ ID NO: 1) обозначены wt (верхний ряд), исходная глюкозооксидаза (SEQ ID NO: 3), обозначена как имеющая замены T30V-I94V-A162T, вариант глюкозооксидазы по данному раскрытию A21 (SEQ ID NO: 5) обозначен как имеющий замены T30V-I94V-R537K-M556V, вариант глюкозооксидазы по данному раскрытию A2 (SEQ ID NO: 7) обозначен как имеющий замены T30V-I94V-A162T-R537K-M556V, вариант глюкозооксидазы по данному раскрытию F5 (SEQ ID NO: 9) обозначен как имеющий замены T30V-R37K-I94V-A162T-V293I-E310D-R537K-M556V, вариант глюкозооксидазы по данному раскрытию F91 (SEQ ID NO: 11) обозначен как имеющий замены T30V-R37K-I94V-V106I-A162T, и вариант глюкозооксидазы по данному раскрытию F9 (SEQ ID NO: 13) обозначен как имеющий замены T30V-R37K-I94V-V106I-A162T-M556V.


Способы и Примеры
В нижеследующих примерах приведены материалы и способы по данному раскрытию, включающие в себя определение каталитических свойств и свойств стабильности ферментов, полученных данным способом. Следует понимать, что эти примеры предназначены исключительно для иллюстративных целей и не должны истолковываться как ограничивающие данное раскрытие каким-либо образом. Все публикации, патенты и патентные заявки, процитированные в данном документе, таким образом, включены по ссылке во всей их полноте для всех целей.
Пример 1: Направленный мутагенез
Варианты глюкозооксидазы создавали с помощью набора для множественного направленного мутагенеза QuickChange (фирма Agilent Technologies, США) и ультракомпетентных клеток XL10Gold E. coli. Были синтезированы направленные праймеры (фирма Eurofins MWG Operon, Германия) и вшиты в различных положениях в последовательность GOx, которая была помещена в вектор pCTCON2 и включала в себя метку c-myc.
Смесь для ПЦР содержала 400 пг/мкл матричной ДНК, 200 нМ праймеров и остальные компоненты из набора для мутагенеза. Реакцию проводили при нагревании до 95°C в течение 1 мин, за чем следовали 30 циклов по 95°C в течение 1 мин, 55°C в течение 1 мин и 65°C в течение 16,5 мин, за чем следовало заключительное удлинение при 65°C в течение 20 мин. Продукты реакции затем переваривали с помощью Dpnl в течение 3 ч при 37°C и хранили при 4°C до того, когда они требовались.
Однонитевая ДНК, полученная с помощью ПЦР, вводилась в ультракомпетентные бактерии в соответствии с инструкциями набора для мутагенеза, и плазмиду ДНК выделяли с помощью набора Macherey-Nagel Plasmid DNA (фирма Duren, Германия).
Пример 2: Трансформация клеток EBY 100 S. cerevisiae
Плазмиду ДНК вводили в S. cerevisiae EBY 100 (как описано Gietz RD и Schiestl RH, Nature protocols 2007, 2: 31-4) с помощью стадии теплового шока 2,5 ч 42°C. Клетки культивировали в среде с глюкозой YNB-CAA в течение 48 ч при 27°C, 160 оборотов в минуту, а затем индуцировали к экспрессии GOx путем переноса в среду YNB-CAA Gal/Raf при тех же условиях на 16 -18 ч.
Пример 3: Анализ с помощью 2,2'-азинобис(3-этилбензтиазолин-6- сульфоновой кислоты) (ABTS) на агаровых пластинках
Клетки S. cerevisiae выращивали при 27°C в течение 3 дней, реплики высевали в среду YNB-CAA Gal/Raf и культивировали в течение еще 1 дня. Аналитическую среду готовили, смешивая 2% агара с равным объемом раствора ABTS, содержащего 333 мМ глюкозы, 1,75 единиц/мл пероксидазы хрена (HRP) и 7 мМ ABTS. Среду наносили на чашки с агаром. Зеленые кольца наблюдались вокруг колоний с активностью GOx.
Пример 4: ABTS-анализ на микротитровальных планшетах (MTP)
Клетки S. cerevisiae культивировали (как описано в Bulter T et al. In: Directed Enzyme Evolution Screening and Selection Methods, Arnold FH, Georgiou G (eds) Humana Press: Totowa, New Jersey, 2003), и 5 мкл аликвоты переносили в свежие MTPs для ABTS анализа, (как описано Zhu Z et al. Biosensors & Bioelectronics 2006, 21:2046-51; Baron AJ et al. J. Biol. Chem. 1994, 269:25095-25105; Sun L et al. Protein Eng Des Select 2001, 14: 699-704) с нижеследующими модификациями.
Клетки ресуспендировали в 70 мкл фосфатного буфера (PBS) и определяли OD600 (оптическую плотность на длине волны 600 нм), затем добавляли 70 мкл раствора ABTS и измеряли кинетику на длине волны 405 нм каждые 20 с в течение 10 мин. Два измерения брали по каждой культуре: одно - с использованием 4 мМ раствора ABTS, содержащего 250 мМ глюкозы и 1 единицу/мл HRP, и одно - с такими же компонентами, но только с 5 мМ глюкозы. Три клона дикого типа включали в каждый микротитровальный планшет для стандартизации. Для каждого измерения рассчитывали крутизну для линейного участка и нормализовали по OD600 клеток в каждом гнезде планшета.
Пример 5: Выделение и повторное клонирование ДНК Pichia pastoris
ДНК экстрагировали из мутантов S. cerevisiae (как описано в Singh MV and Weil PA, Analytical Biochemistry 2002, 307:13-17), и последовательность GOx переносили в Xhol/Xbal сайты pICZα A (фирма Invitrogen, Германия) с помощью подходящих ферментов рестрикции (фирма New England Biolabs GmbH, Германия). Компетентные клетки P. pastoris KM71H (фирма Invitrogen, Германия) готовили и трансформировали (см. Becker DM and Guarente L, Methods Enzymol 1991, I94: 182-187) и отбирали наиболее эффективные клоны, представляющие каждый мутант.
Пример 6: Очистка белка
После ферментации в течение 4 дней в соответствии с рекомендациями фирмы Invitrogen, клетки осаждали центрифугированием при 11000 x g в течение 10 мин с помощью центрифуги Beckman Coulter Avanti J26 XP (Крефельд, Германия). Собирали супернатант и фильтровали через фильтр 0,22 мкм PTFE (фирма Carl Roth GmbH, Германия), и фильтрат концентрировали до 5-10 мл с помощью системы Viva Flow 50 с мембраной 10 кДа (фирма Sartorius AG, Германия). Концентрат диализировали против 10 мМ фосфатного буфера (pH 6,0) в течение ночи при 4°C и загружали на 20-мл колонку Fast Flow с DEAE-сефарозой (фирма GE Healthcare Europe GmbH, Германия) с помощью ÄKTApurifier (фирма GE Healthcare Europe GmbH, Германия). Белок очищали с помощью более 30 объемов колонки линейного градиента от 10 до 250 мМ фосфатного буфера pH 6. Мы тестировали 50 мл фракции с помощью анализа с ABTS, и те из них, у которых были отдельные пики активности GOx, собирали и концентрировали до 5 мл с помощью 10 кДа ультрафильтрационных колонок (фирма Sartorius AG, Германия).
Пример 7: Кинетический анализ с помощью ABTS-анализа
Кинетические характеристики каждого из вариантов GOx определяли с помощью ABTS-анализа в триплетах MTP с концентрациями глюкозы в диапазоне от 2,5 до 260 мМ при pH 5,5 и 7,4. Крутизну при каждом измерении рассчитывали по линейному участку и использовали в кривых Михаэлиса-Ментен, чтобы позволить определение значений KM и kca. Также строили графики Лайнуивера-Берка, Эди-Хофсти и Хейнса-Вульфа, и резко отклоняющиеся значения идентифицировались и удалялись. Значения kcat определяли измерением поглощения на длине волны 280 нм (поглощение 1,5 мг/мл GOx приравнивали 1 условной единице, основываясь на последовательности, рассчитывая с помощью ProtParam).
В качестве контроля использовали исходную GOx, содержащую аминокислотную последовательность SEQ ID NO: 3 (с заменами в положениях, соответствующих аминокислотным остаткам T30V, I94V и A162T глюкозооксидаза дикого типа из Aspergillus niger (SEQ ID NO: 1)). Нуклеиновая кислота, кодирующая исходную GOx, показана в SEQ ID NO: 4.
Кинетические параметры ферментов исследовали так, чтобы полученные данные можно было использовать в уравнении Михаэлиса-Ментен. Все мутанты GOx имели более высокую собственную активность, чем фермент дикого типа (протестированный при pH 5,5), но разница была более выраженной при pH 7,4. Улучшенные кинетические константы суммированы в Таблице 4. Наиболее эффективным мутантом был A2 с более низкой в 1,5 раз KM и в 2,6 раз более высокой kcat, дающим в сумме четырехкратное повышение активности при pH 5,5 и повышение в 5,8 раз при pH 7,4.
Активность мутантных ферментов по сравнению с диким типом
Как упоминалось выше, все отобранные мутанты имеют более высокую собственную активность, чем фермент дикого типа (протестированную при pH 55), но разница была более выраженной при pH 7,4. Лучший мутант (A2) был в четыре раза более активным при pH 5,5 и в 5,8 раз более активным при pH 7,4, что предполагает, что он был бы идеален для разработки миниатюрных биотопливных элементов, предназначенных для работы в организме человека.
Фиг. 1 показывает кинетические константы, определенные с помощью ABTS-анализа в 150 мкл реакционном объеме при световом пути 0,5 см в буфере PBS при pH 7,4, 1 единица/мл HRP и 4 мМ ABTS. Концентрации глюкозы варьировали от 2,5 до 260 мМ. Кинетику мерили при длине волны 405 нм каждые 20 с в течение 10 мин. Крутизну для каждого измерения рассчитывали по линейному участку. Данные использовали с помощью Origin 8 (фирма OriginLab Corporation, Нортгемптон) в кривых Михаэлиса-Ментен и определяли KM и kcat.
Фиг. 2 показывает кинетические константы, определенные с помощью ABTS-анализа в 150 мкл реакционном объеме при световом пути 0,5 см в 50 мМ натрий-ацетатном буфере при pH 5,5, 1 единица/мл HRP и 4 мМ ABTS. Концентрации глюкозы варьировали от 2,5 до 260 мМ. Кинетику измеряли при длине волны 405 нм каждые 20 с в течение 10 мин. Крутизну для каждого измерения рассчитывали по линейному участку. Данные использовали с помощью Origin 8 (фирма OriginLab Corporation, Нортгемптон) в кривых Михаэлиса-Ментен и определяли KM и kcat.
Пример 8: Анализ кинетики с использованием ферроценметанола
Ферроценметанол (окисленный) готовили, как описано Zhu et al., и pH, установленный до соответствующих значений pH, использовали для измерений активности с использованием 1 M KOH или 1 M HCl. Очищенные варианты глюкозооксидазы были использованы для определения KM и kcat для ферроценметанола в присутствии кислорода. Каждое измерение выполняли в MTP в триплетах с использованием 400 мМ глюкозы и варьирующих концентраций окисла ферроценметанола в диапазоне от 0,22-10 мМ. Измерения выполняли при pH 5,5, 7,4 и 8. Кинетику реакции контролировали при длине волны 625 нм. С использованием этих измерений KM и kcat определяли применением модели Михаэлиса-Ментен к данным, используя нелинейную регрессию способом наименьших квадратов. Чтобы рассчитать kcat, концентрацию фермента измеряли по поглощению на длине волны 280 нм (поглощение 1,5 мг/мл GOx принимали равным 1 условной единице, основываясь на последовательности, рассчитывая с помощью ProtParam). Выскакивающие варианты идентифицировались и удалялись. Кинетические параметры для ферроценметанола суммированы в Таблице 5.
При том, что kcat для протестированных значений pH у отдельных мутантов сравнимы, KM намного ниже при высоких значениях pH, и константа специфичности при высоких значениях pH значительно улучшена. Значения KM мутантов и дикого типа сравнимы для каждого значения pH, таким образом, демонстрируя, что повышенная аффинность мутантов к глюкозе не влияет негативно на аффинность к ферроценметанолу. В присутствии кислорода медиатор все еще способен конкурировать с кислородом.
Активность мутантных ферментов по сравнению диким типом с использованием ферроценметанола (FM) в качестве субстрата
Все мутанты показывают более высокую активность к медиатору по сравнению с вариантом дикого типа. Мутант A2 является лучшим мутантом с повышенной в 10 раз активностью к ферроценметанолу.
Пример 9: Кинетический анализ с использованием N,N-диметил-p-нитрозоанилина (NDMA)
Раствор N,N-диметил-p-нитрозоанилина (NDMA) готовили добавлением этого химического вещества в подходящий буфер (фосфатный буфер pH 7,4 или ацетатный буфер pH 5,5). Такой окисленный N,N-диметил-p-нитрозоанилин использовали для кинетических измерений с предварительно очищенными мутантами GOx. Для этого скорость реакции GOx с медиаторами определяли для варьирующих концентраций медиатора. Восстановление NDMA контролировали при длине волны 528 нм и насыщенной концентрации глюкозы. Определение KM и kcat выполняли с использованием 400 мМ глюкозы и варьирующей концентрации NDMA между 0,46 и 15,33 мМ при pH 5,5 и 7,4. Все измерения выполняли в триплетах в MTPs. Полученные данные по кинетике для NDMA при pH 5,5 и 7,4 использовали в кривых Михаэлиса-Ментен. Как контроль качества и для идентификации и устранения выскакивающих вариант также строили графики Лайнуивер-Бурка, Хейнс-Вульф и Эди-Хофсти. Кинетические данные для NDMA представлены в Таблице 6.
Активность мутантных ферментов по сравнению с диким типом с использованием N,N-диметил-p-нитрозоанилина как субстрата
Как и в случае FM, NDMA может конкурировать с кислородом за фермент дикого типа, как и за мутантные. Аффинность к медиатору также повышена при более высоких pH, что показано более низкими значениями KM. Фермент дикого типа и F91 показывают более низкие значения KM, чем другие варианты при обоих протестированных pH, что показывает, что мутация M556V, которая не присутствует в F91 и в ферменте дикого типа, но есть во всех других вариантах, повышает значение KM. Этого не наблюдается для FM. Константа специфичности для мутантов повышена в диапазоне от 5 раз (F91) до 8 раз (A2) по сравнению с ферментом дикого типа.
Пример 10: Термостабильность
Термостабильность мутантов GOx определяли путем инкубирования фермента в 50 мМ ацетатного буфера (рН 5,5) при 60°С в отсутствие субстрата (см. Bhatti HN, Saleem N, Food Technol. Biotechnol. 47(3) 331-335, 2009, 47: 331-335) и измерения остаточной активности повторяющихся аликвот с помощью ABTS-анализа. Значения A(t), представляющие процент остаточной активности, наносили на график в различные моменты времени относительно 100% активности в момент времени 0 экспоненциальной зависимости, чтобы определить константы скорости инактивации (kd), как показано ниже:
A(t) = e-kd*t
Полувремя термостабильности рассчитывали, принимая A(t) равным 0,5A(0).
По данному раскрытию термостабильность всех мутантов GOx была больше, чем у фермента дикого типа (см. Табл. 5). В этом случае наиболее эффективным мутантом был F91 со временем полужизни при 60°C вдвое более длительным, чем фермент дикого типа.
Термостабильность мутантных ферментов по сравнению с ферментом дикого типа
Литература

| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ ИЗОПРЕНСИНТАЗЫ, ПРИМЕНЯЕМЫЕ ДЛЯ УЛУЧШЕНИЯ ПРОДУЦИРОВАНИЯ ИЗОПРЕНА МИКРООРГАНИЗМАМИ | 2009 |
|
RU2516343C2 |
| СПОСОБЫ И МАТЕРИАЛЫ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПОМПЕ | 2013 |
|
RU2644258C2 |
| ГЕНЕТИЧЕСКИ СКОНСТРУИРОВАННАЯ ЗАВИСИМАЯ ОТ ПИРРОЛОХИНОЛИНХИНОНА ГЛЮКОЗОДЕГИДРОГЕНАЗА, СОДЕРЖАЩАЯ ИНСЕРЦИЮ АМИНОКИСЛОТЫ | 2005 |
|
RU2336306C1 |
| ГЕНЫ GRG23 И GRG51, ПРИДАЮЩИЕ УСТОЙЧИВОСТЬ К ГЕРБИЦИДАМ | 2006 |
|
RU2393225C2 |
| НОВЫЙ ПОЛИПЕПТИД СИСТЕМЫ ЦИТОХРОМА Р450 С ПОВЫШЕННОЙ ФЕРМЕНТНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2677997C2 |
| ПОЛИПЕПТИД | 2005 |
|
RU2415939C2 |
| НОВЫЕ ГЕНЫ, КОДИРУЮЩИЕ НОВЫЕ ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ | 2002 |
|
RU2296160C2 |
| UDP-ЗАВИСИМАЯ ГЛИКОЗИЛТРАНСФЕРАЗА ДЛЯ ВЫСОКОЭФФЕКТИВНОГО ПРОДУЦИРОВАНИЯ РЕБАУДИОЗИДОВ | 2017 |
|
RU2777901C2 |
| Новый мутантный белок орнитиндекарбоксилаза и его применение | 2014 |
|
RU2669996C2 |
| CПОСОБ МЫТЬЯ ПОСУДЫ | 2007 |
|
RU2509152C2 |



















Настоящее изобретение относится к области биотехнологии, в частности к новым вариантам глюкозооксидазы из Aspergillus niger с улучшенными свойствами, а именно термостабильностью и собственной глюкозооксидазной активностью. Настоящее изобретение также раскрывает молекулу нуклеиновой кислоты, вектор экспрессии, клетку-хозяина, способ получения глюкозооксидазы путём культивирования указанной клетки-хозяина, способ анализа количества глюкозы в образце и набор для анализа количества глюкозы в образце. Настоящее изобретение позволяет повысить эффективность при использовании глюкозооксидазы. 7 н. и 6 з.п. ф-лы, 2 ил., 7 табл., 10 пр.
1. Полипептид, имеющий улучшенную термостабильность и в то же время улучшенную собственную глюкозооксидазную активность по сравнению с глюкозооксидазой дикого типа из Aspergillus niger, содержащей аминокислотную последовательность SEQ ID NO: 1, причем упомянутый полипептид содержит вариации в положениях, соответствующих аминокислотным остаткам T30 и I94 в глюкозооксидазе дикого типа из Aspergillus niger, содержащей аминокислотную последовательность SEQ ID NO: 1, и, по меньшей мере, одну или более дополнительных вариаций в положениях, соответствующих аминокислотным остаткам A162, M556, R537, R37, V293, E310 или V106, причем упомянутые вариации представляют собой замены, выбранные из группы T30V, I94V, R37K, V106I, A162T, V293I, E310D, R537K и M556V или их комбинации, и где аминокислотная последовательность упомянутого полипептида имеет, по меньшей мере, процент идентичности последовательности в, по меньшей мере, 80% от аминокислотной последовательности SEQ ID NO: 1.
2. Полипептид по п. 1, в котором упомянутый полипептид содержит, по меньшей мере, одну или более вариаций в положениях, соответствующих аминокислотным остаткам V293 или E310.
3. Полипептид по п. 1, причем упомянутый полипептид содержит замены, выбранные из группы, состоящей из:
a) M556V, R537K, T30V, I94V,
b) M556V, R537K, T30V, I94V, A162T,
c) M556V, R537K, R37K, V293I, E310D, T30V, I94V, A162T,
d) M556V, R37K, V106I, T30V, I94V, A162T,
e) R37K, V106I, T30V, I94V, A162T.
4. Полипептид по любому из пп. 1-3, причем упомянутый полипептид содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11 и SEQ ID NO: 13.
5. Полипептид по любому из пп. 1-3, причем упомянутый полипептид содержит аминокислотную последовательность SEQ ID NO: 7.
6. Полипептид по любому из пп. 1-3, причем упомянутый полипептид содержит аминокислотную последовательность SEQ ID NO: 11.
7. Полипептид по любому из пп. 1-3, причем аминокислотная последовательность имеет, по меньшей мере, процент идентичности последовательности, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 93%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% от аминокислотной последовательности SEQ ID NO: 1.
8. Молекула нуклеиновой кислоты, кодирующая полипептид по любому из пп. 1-7.
9. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по п. 8.
10. Клетка-хозяин для продукции полипептида по пп. 1-7, трансформированная, трансдуцированная или трансфецированная вектором по п. 9.
11. Способ получения полипептида, имеющего глюкозооксидазную активность, содержащий стадии: (a) культивирования клетки-хозяина по п. 10 в подходящей культуральной среде при подходящих условиях, чтобы продуцировать полипептиды, имеющие глюкозооксидазную активность; (b) получение упомянутых продуцированных полипептидов и, если требуется, (c) обработка полипептидов.
12. Способ анализа количества глюкозы в образце, содержащий контакт образца с полипептидом, имеющим глюкозооксидазную активность, по любому из пп. 1-7 и измерение количества глюкозы, окисленной глюкозооксидазой.
13. Набор для анализа количества глюкозы в образце, содержащий полипептид, имеющий глюкозооксидазную активность, по любому из пп. 1-7 и медиатор транспорта электронов.
| WO 2013026575 A2, 28.02.2013 | |||
| ZHU ZIWEI et al | |||
| Directed evolution of glucose oxidase from Aspergillus niger for ferrocenemethanol-mediated electron transfer, Biotechnology journal, 2007, Vol.2, Issue 2, pp.241-248 | |||
| РЕКОМБИНАНТНЫЙ ВЕКТОР, ЭКСПРЕССИРУЮЩИЙ ПОЛИПЕПТИД С АКТИВНОСТЬЮ ГЛЮКОЗООКСИДАЗЫ, ТРАНСФОРМИРОВАННЫЙ ШТАММ SACCHAROMYCES CEREVISIAE, РЕКОМБИНАНТНЫЙ ПОЛИПЕПТИД С АКТИВНОСТЬЮ ГЛЮКОЗООКСИДАЗЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1989 |
|
RU2228357C2 |
| Двухзвенный зубчатый механизм с перекрещивающимися осями | 1957 |
|
SU117011A1 |
Авторы
Даты
2018-05-03—Публикация
2014-04-17—Подача