1. ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает преимущества предварительной заявки США №62/374408, поданной 12 августа 2016 г., содержание которой полностью включено в настоящее описание посредством ссылки.
2. ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение относится к определенным уридиндифосфат-зависимым гликозилтрансферазам (UGT), содержащим их композициям, содержащим их клеткам-хозяевам и способам их применения для получения ребаудиозидов, включая ребаудиозид D и ребаудиозид М.
3. ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
[0003] Желательно, чтобы подсластители с нулевой калорийностью, полученные из натуральных источников, ограничивали вредные последствия потребления большого количества сахара (например, диабет и ожирение). Ребаудиозид М (RebM), является одним из многих соединений со сладким вкусом, производимых растением стевии (Stevia rebaudiana Bertoni). Из всех ребаудиозидов RebM обладает самой высокой эффективностью (примерно в 200-300 раз слаще, чем сахароза) и является самым чистым по вкусу. Тем не менее, RebM производится растением стевия только в незначительных количествах и составляет лишь небольшую долю от общего содержания стевиоловых гликозидов (<1,0%). Ohta и др., 2010, J. Appl. Glycosci., 57, 199-209 (2010). По этой причине желательно производить RebM с использованием биотехнологических путей, позволяющих получать его в больших количествах и с высокой степенью чистоты.
[0004] Предпочтительно, для экономичного производства продукта с использованием биотехнологии каждый этап биоконверсии от сырья к продукту должен иметь высокую эффективность преобразования (в идеале >90%). При разработке дрожжей для получения RebM было выявлено ограничение на предпоследней стадии биосинтеза, а именно преобразование Ребаудиозида A (RebA) в Ребаудиозид D (RebD). См. ФИГ. 1А. Наблюдалось, что нативный фермент (Ono, ЕР 2826861 A1, UGT91D_like3 или близкий гомолог) преобразует около 3% RebA в RebD. Были идентифицированы два других фермента UGT, которые способны преобразовывать RebA в RebD. Одним из них является Os_UGT_91C1 из Oryza sativa (также называемый EUGT11 в патентной заявке Houghton-Larsen и др., WO 2013/022989 А2), а другим является Sl_UGT_101249881 из Solarium lycopersicum (также называемый UGTSL2 в патентной заявке Markosyan и др., WO 2014 / 193888 А1). Однако авторы настоящего изобретения первоначально наблюдали, что и Os_UGT_91C1, и Sl_UGT_101249881 имели более низкие, чем желаемые, коэффициенты преобразования, составляющие примерно 53% и 70% соответственно. Все три этих фермента, UGT91D_like3, Os_UGT_91C1 и SL_UGT_101249881, представляют собой уридиндифосфат-зависимые гликозилтрансферазы (UGT), которые переносят глюкозный фрагмент в положение С-2'остатка 19-О-глюкозы через образование бета(1->2) связи (ФИГ. 1А).
[0005] Для эффективного получения RebM с высокой чистотой необходимы улучшенные ферменты, способные преобразовывать RebA в RebD с высокой эффективностью. Композиции и способы, представленные здесь, удовлетворяют эту потребность и обеспечивают соответствующие преимущества.
4. КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0006] Здесь представлены композиции и способы для улучшенного преобразования RebA в RebD и для улучшенного производства RebD и/или RebM. Эти композиции и способы частично основаны на неожиданном открытии некоторых уридиндифосфат-зависимых гликозилтрансфераз (UGT), способных преобразовывать RebA в RebD с необычно высокой эффективностью. Даже незначительное улучшение характеристик штамма (например, на десять процентов) с новыми UGT может в будущем сэкономить более десяти миллионов долларов на производственных затратах, если предположить, что рыночный спрос на RebM составляет 5000 миллионов тонн в год.
[0007] Определенные UGT, описанные здесь, также способны продуцировать RebM с небольшим содержанием ненатуральных гликозидов, таких как побочный продукт RebM2 (то есть изомер RebM), или без них. См. списка известных в настоящее время стевиоловых гликозидов в работе Ceunen S. et al. Steviol Glycosides: Chemical Diversity, Metabolism, and Function. J. Nat. Prod., 76, 1201-1228 (2013). Как таковые, в определенных вариантах осуществления композиции и способы, описанные здесь, могут снизить стоимость последующей обработки для получения композиции с высокой чистотой RebM.
[0008] Здесь также представлены композиции и способы для альтернативных ферментов, которые способны продуцировать стевиоловые гликозиды с субстратной специфичностью, отличной от субстратной специфичности ранее известных UGT. Новые альтернативные ферменты могут потенциально продуцировать разные смеси или пропорции стевиоловых гликозидов по сравнению с теми, которые вырабатываются другими известными ферментами. Композиции с различными смесями или пропорциями стевиоловых гликозидов могут потенциально придавать альтернативные профили сладкого вкуса, которые могут быть полезны при разработке рецептур различных потребительских или пищевых продуктов.
[0009] Таким образом, здесь представлены генетически модифицированные клетки-хозяева и способы их использования для получения промышленно полезных соединений. В одном аспекте здесь представлена генетически модифицированная клетка-хозяин, содержащая: гетерологичную нуклеиновую кислоту, кодирующую UDP-гликозилтрансферазу (UGT40087, также называемую Si_UGT_40087). В некоторых вариантах осуществления генетически модифицированная клетка-хозяин дополнительно содержит один или несколько ферментативных путей, способных продуцировать стевиол и/или стевиоловые гликозиды.
[0010] В некоторых вариантах осуществления здесь представлены генетически модифицированные клетки-хозяева, содержащие гетерологичную нуклеиновую кислоту, кодирующую UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, имеющую идентичность последовательности с последовательностью UGT40087 по меньшей мере 80%, 85%, 90% или 95% (например, SEQ ID NO: 1 или SEQ ID NO: 11). В некоторых вариантах осуществления генетически модифицированная клетка-хозяин способна преобразовывать RebA в RebD с эффективностью, превышающей 90%, 95%, 96% или 97%. В некоторых вариантах осуществления генетически модифицированная клетка-хозяин содержит UDP-гликозилтрансферазу, содержащую акцепторный домен сахара, где аминокислотная последовательность акцепторного домена сахара по меньшей мере 84%, 85%, 86%, 87%, 88%, 89% 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления генетически модифицированная клетка-хозяин содержит UDP-гликозилтрансферазу, которая содержит аминокислотную последовательность loop1, вариантную аминокислотную последовательность loop1, аминокислотную последовательность loop2, вариантную аминокислотную последовательность loop2, аминокислотную последовательность loop3_1, вариантную аминокислотная последовательность loop3_1, аминокислотную последовательность loop3_2, вариантную аминокислотную последовательность loop3_2, аминокислотную последовательность loop4_1, вариантную аминокислотную последовательность loop4_1, аминокислотную последовательность loop4_2 или любую их комбинацию. В некоторых вариантах осуществления генетически модифицированная клетка-хозяин содержит UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая по меньшей мере на 61%, 65%, 70%, 75%, 80%, 85%, 90% или 95%) идентична последовательности акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11 и дополнительно содержит аминокислотную последовательность loop4_1 SEQ ID NO: 1 или SEQ ID NO: 11.
[0011] В некоторых вариантах осуществления здесь представлены генетически модифицированные клетки-хозяева, содержащие гетерологичную нуклеиновую кислоту, кодирующую UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, имеющую идентичность последовательности по меньшей мере 80%, 85%, 90% или 95% с последовательностью SEQ ID NO: 2, 5 или 6. В некоторых вариантах осуществления генетически модифицированная клетка-хозяин способна преобразовывать RebA в RebD с эффективностью, превышающей 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96% или 97%. В некоторых вариантах осуществления генетически модифицированная клетка-хозяин содержит UDP-гликозилтрансферазу, содержащую акцепторный домен сахара, где аминокислотная последовательность акцепторного домена сахара по меньшей мере на 84%, 85%, 86%о, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности акцепторного домена сахара SEQ ID NO: 2, 5 или 6. В некоторых вариантах осуществления генетически модифицированная клетка-хозяин содержит UDP-гликозилтрансферазу, которая содержит аминокислотную последовательность loop1, вариантную аминокислотную последовательность loop1, аминокислотную последовательность loop2, вариантную аминокислотную последовательность loop2, аминокислотную последовательность loop3_1, вариантную аминокислотную последовательность loop3_1, аминокислотную последовательность loop3_2, вариантную аминокислотную последовательность loop3_2, аминокислотную последовательность loop4_1, вариантную аминокислотную последовательность loop4_1, аминокислотную последовательность loop4_2 или любую их комбинацию. В некоторых вариантах осуществления генетически модифицированная клетка-хозяин содержит UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая по меньшей мере на 61%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична последовательности акцепторного домена сахара SEQ ID NO: 2, 5 или 6 и дополнительно содержит аминокислотную последовательность loop4_1 SEQ ID NO: 2, 5 или 6.
[0012] В другом аспекте здесь предлагаются способы получения гетерологичного стевиолового гликозида, причем способ включает в себя культивирование популяции генетически модифицированных клеток-хозяев, представленных здесь, способных продуцировать стевиоловый гликозид, как описано здесь, в среде с источником углерода в условиях, подходящих для получения указанного соединения стевиолового гликозида; и извлечение указанного стевиолового гликозида из среды. В некоторых вариантах осуществления гетерологичный стевиоловый гликозид выбран из группы, состоящей из RebD и RebM.
[0013] В другом аспекте здесь предлагается способ увеличения продукции стевиол-гликозидного соединения в клетке-хозяине, включающий в себя экспрессию в клетке-хозяине гетерологичной нуклеиновой кислоты, кодирующей UGT40087; и культивирование клетки-хозяина в условиях, подходящих для продуцирования стевиолового гликозида. В некоторых вариантах осуществления клетка-хозяин не содержит фермента UGT91D_like3, фермента Os_UGT_91C1 или фермента Sl_UGT_101249881.
[0014] В другом аспекте здесь представлены способы получения RebD, причем способ включает в себя культивирование популяции генетически модифицированных клеток-хозяев, представленных здесь, способных продуцировать RebD, как описано здесь, в среде с источником углерода в условиях, подходящих для получения указанного RebD; и восстановление указанного RebD из среды.
[0015] В другом аспекте здесь предлагаются способы получения RebM, причем способ включает в себя культивирование популяции генетически модифицированных клеток-хозяев, представленных здесь, способных продуцировать RebM, как описано здесь, в среде с источником углерода в условиях, подходящих для получения указанного RebM; и восстановление указанного RebM из среды.
[0016] В другом аспекте здесь представлены способы получения RebD, причем способ включает в себя контактирование RebA с глюкозой и описанной здесь UDP-гликозилтрансферазой, способной преобразовывать RebA в RebD, в условиях, подходящих для образования RebD.
[0017] В другом аспекте здесь представлены способы получения RebM, причем способ включает в себя контактирование RebA с глюкозой и описанной здесь UDP-гликозилтрансферазой, способной преобразовывать RebA в RebD, в условиях, подходящих для образования RebD, и с описанной здесь UDP-гликозилтрансферазой, способной преобразовывать RebD в RebM.
[0018] В некоторых вариантах осуществления клетка-хозяин представляет собой дрожжевую клетку. В некоторых вариантах осуществления дрожжи представляют собой Saccharomyces cerevisiae. В некоторых вариантах осуществления клетка-хозяин продуцирует RebD или RebM с высокой эффективностью. В некоторых вариантах осуществления клетка-хозяин продуцирует повышенное количество RebD или RebM по сравнению с дрожжевой клеткой, не содержащей фермент UGT40087. В некоторых вариантах осуществления клетка-хозяин продуцирует повышенное количество RebM относительно RebM2 по сравнению с дрожжевой клеткой, не содержащей фермент UGT40087.
[0019] В другом аспекте другие представленные здесь UDG-гликозилтрансферазы могут использоваться в дополнение или в качестве альтернативы UGT40087. К ним относятся, например, sr.UGT_9252778, Bd_UGT10840, Hv_UGT_V1, Bd_UGT10850 и Ob_UGT91B1_like. 5.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАЦИЙ
[0020] ФИГ. 1А - схематическое представление преобразования RebA в RebD в RebM.
[0021] ФИГ. 1В - структура RebM2.
[0022] ФИГ. 1С - принципиальная схема мевалонатного пути.
[0023] ФИГ. 2А - примерный путь фарнезилпирофосфата (FPP) к стевиолу.
[0024] ФИГ. 2В - примерный путь стевиола к RebM.
[0025] ФИГ. 2С - примерный путь ферментативного производства RebM.
[0026] ФИГ. 3 - отношение конверсии RebA к RebD in vivo, измеренное по микромолям Reb (D + М) / микромолям Reb (А + D + М). Родительский контрольный штамм обозначен как 91D_like3 (от Stevia rebaudiana; этот штамм содержит только UGT: 85С2, 74G1, 91D_like3 и 76G1, в дополнение к пустой посадочной площадке. Отмечается, что 91D_like3 имеет очень низкий процент преобразования RebA в RebD (~3% см. Таблицу 5). Одна копия каждого фермента UGT была вставлена в родительский контрольный штамм и проверена на предмет улучшенной конверсии RebA в RebD. Показано, что шесть ферментов UGT имеют конверсию RebA в RebD, которая эквивалентны или лучше, чем у предыдущих известных ферментов Os_UGT_91C1 и Sl_UGT_101249881. Три фермента UGT (Si_UGT_40087, Ob_UGT91B1_like и Hv_UGT_V1 преобразуют RebA в RebD лучше, чем оба ранее идентифицированных фермента UGT. «Усы» отображают стандартную ошибку.
[0027] ФИГ. 4 - принципиальная схема конструкции «посадочной площадки», используемой для введения отдельных ферментов UGT для скрининга на преобразование RebA в RebD у дрожжей.
[0028] ФИГ. 5a-h - иллюстрация хроматограмм RebA, RebD, RebM, RebM2, полученных in vivo для каждого гена UGT, используемого для получения данных, описанных в Таблице 5 и на ФИГ. 3. Пики хроматограммы выбраны таким образом, чтобы показать пики, связанные с RebA, RebD, RebM и RebM2. На каждом рисунке показано время удерживания в зависимости от процента интенсивности для аутентичных стандартов, контрольного исходного штамма Y31062 и Y31062 с дополнительным ферментом UGT. Y31062 является родительским контрольным штаммом и содержит UGT74G1, UGT85C2, UGT91D_like3 и UGT76G1 с пустой посадочной площадкой. ФИГ. 5а: данные для Si_UGT_40087; этот рисунок также включает хроматограмму для аутентичного стандарта RebE. ФИГ. 5b: данные для Ob_UGT91B1_like. ФИГ. 5с: данные для Hv_UGT_V1. ФИГ. 5d: данные для Sl_UGT_101249881. ФИГ. 5е: данные для UGT_g252778. ФИГ. 5f: данные для Os_UGT_91C1. ФИГ. 5g: данные для Bd_UGT10850. ФИГ. 5h: данные для Bd_UGT10840. ФИГ. 5i показывает увеличенное изображение хроматограммы только для пика RebE Si_UGT_40087 по сравнению с аутентичным стандартом, чтобы подтвердить, что этот пик является RebE.
[0029] ФИГ. 6 - иллюстрация модели гомологии структуры UGT40087. Его N- и С-концевые домены показаны светло-серым и темно-серым; четыре петли, использованные в эксперименте по замене петель, также помечены на структуре.
[0030] ФИГ. 7 - иллюстрация схематичного обзора конструкций замены UGT-доменов.
[0031] ФИГ. 8 - иллюстрация выравнивания последовательностей четырех UDP-гликозилтрансфераз (UGT40087 (SEQ ID NO: 1); Os_UGT_91C1 (SEQ ID NO: 8); 91Dlike3 (SEQ ID NO: 7); Si91Dlike (SEQ ID NO: 12)).
[0032] ФИГ. 9a - иллюстрация хроматограмм стевиоловых гликозидов, полученных in vivo для родительской контрольной клетки (включающей UGT74G1, UT85C2, UGT76G1 и UGT91D_like3). ФИГ. 9b - иллюстрация хроматограммы стевиоловых гликозидов, полученных in vivo для родительского контрольного штамма с UGT40087. На ФИГ. 9с представлена хроматограмма стевиоловых гликозидов, полученных in vivo для родительского контрольного штамма с Ob_UGT91B1_like.
6. ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
6.1 Терминология
[0033] Используемый здесь термин «гетерологичный» относится к тому, что обычно не встречается в природе. Термин «гетерологичная нуклеотидная последовательность» относится к нуклеотидной последовательности, обычно не встречающейся в данной клетке в природе. Как таковая, гетерологичная нуклеотидная последовательность может (а) быть чужеродной для ее клетки-хозяина (то есть «экзогенной» для клетки); (b) естественным образом обнаруживаться в клетке-хозяине (то есть «эндогенной»), но присутствовать в неестественном количестве в клетке (то есть в большем или меньшем количестве, чем в естественном состоянии в клетке-хозяине); или (с) обнаруживаться в природе в клетке-хозяине, но распологаться вне ее естественного локуса. Термин «гетерологичный фермент» относится к ферменту, который обычно не обнаруживается в данной клетке в природе. Термин охватывает фермент, который: (а) является экзогенным для данной клетки (то есть кодируется нуклеотидной последовательностью, которая не присутствует в природе в клетке-хозяине или не присутствует в данном контексте в клетке-хозяине); и (b) естественным образом обнаруживается в клетке-хозяине (например, фермент кодируется нуклеотидной последовательностью, которая является эндогенной для клетки), но продуцируется в неестественном количестве (например, больше или меньше, чем в естественном состоянии) в клетке-хозяине.
[0034] С другой стороны, термин «нативный» или «эндогенный», используемый здесь применительно к молекулам и, в частности, к ферментам и нуклеиновым кислотам, обозначает молекулы, которые экспрессируются в организме, в котором они возникли или встречаются в природе, независимо от уровня экспрессии, который может быть ниже, равен или выше уровня экспрессии молекулы в нативном микроорганизме. При этом понимается, что экспрессия нативных ферментов или полинуклеотидов может быть модифицирована в рекомбинантных микроорганизмах.
[0035] Используемый здесь термин «родительская клетка» относится к клетке, которая имеет идентичный генетический фон, как описанная здесь генетически модифицированная клетка-хозяин, за тем исключением, что она не содержит одну или несколько конкретных генетических модификаций, встроенных в модифицированную клетку-хозяина, например, одну или несколько модификаций, выбранных из группы, состоящей из гетерологичной экспрессии фермента пути стевиола, гетерологичной экспрессии фермента пути стевиолового гликозида, гетерологичной экспрессии геранилгеранилдифосфатсинтазы, гетерологичной экспрессии копалилдифосфатсинтазы, гетерологичной экспрессии каурен-синтазы, гетерологичной экспрессии кауреноксидазы, гетерологичной экспрессии стевиол-синтазы (гидроксилаза кауреновой кислоты), гетерологичной экспрессии цитохром-Р450-редуктазы, гетерологичной экспрессии UGT74G1, гетерологичной экспрессии гетерогенного UGT76G1, UGT85C2, гетерологичной экспрессии UGT91D и гетерологичной экспрессии UGT40087.
[0036] Используемый здесь термин «встречающийся в природе» относится к тому, что встречается в природе. Например, UDP-гликозилтрансфераза, которая присутствует в организме, которая может быть выделена из источника в природе и которая не была преднамеренно изменена человеком в лаборатории, является встречающейся в природе UDP-гликозилтрансферазой. И наоборот, используемый здесь термин «не встречающийся в природе» относится к тому, что не встречается в природе, но создается благодаря вмешательству человека.
[0037] Термин «среда» относится к культуральной среде и/или ферментационной среде.
[0038] Термин «ферментационная композиция» относится к композиции, которая содержит генетически модифицированные клетки-хозяева и продукты или метаболиты, продуцируемые генетически модифицированными клетками-хозяевами. Примером ферментационной композиции является цельноклеточный бульон, который может представлять собой все содержимое сосуда (например, колбы, чашки или ферментера), включая клетки, водную фазу и соединения, полученные из генетически модифицированных клеток-хозяев.
[0039] Используемый здесь термин «продукция», как правило, относится к количеству стевиола или стевиолового гликозида, продуцируемых представленной здесь генетически модифицированной клеткой-хозяином. В некоторых вариантах осуществления продукция выражается в виде продуцирования стевиола или стевиоловых гликозидов клеткой-хозяином. В других вариантах осуществления продуцирование выражается как продуктивность клетки-хозяина в продуцировании стевиола или стевиолового гликозида.
[0040] Используемый здесь термин «продуктивность» относится к выработке стевиола или стевиоловых гликозидов клеткой-хозяином, выраженной как количество произведенного стевиола или стевиоловых гликозидов (по массе) на количество ферментативного бульона, в котором культивируется клетка-хозяин (по объему) с течением времени (в час).
[0041] Используемый здесь термин «выход» относится к выработке стевиола или стевиоловых гликозидов клеткой-хозяином, выраженной в количестве произведенного стевиола или стевиоловых гликозидов на количество источника углерода, потребляемого клеткой-хозяином, по массе.
[0042] Используемый здесь термин «неопределяемый уровень» соединения (например, RebM2, стевиолгликозиды или другие соединения) означает уровень соединения, который слишком низок, чтобы его можно было измерить и/или проанализировать с помощью стандартной методики для измерения состава. Например, термин включает уровень соединения, который не обнаруживается аналитическими методами, описанными в Примере 7.
[0043] Используемый здесь термин «стевиоловый гликозид(-ы)» относится к стевиолу, ферментативно измененному добавлением одной или нескольких сахарных групп, таких как стевиоловый гликозид, включая, в том числе, встречающиеся в природе стевиоловые гликозиды например, стевиолмонозид, стевиолбиозид, рубусозид, дуклозид В, дуклозид А, ребаудиозид В, ребаудиозид G, стевиозид, ребаудиозид С, ребаудиозид F, ребаудиозид А, ребаудиозид I, ребаудиозид Е, ребаудиозид Н, ребаудиозид L, ребаудиозид К, ребаудиозид J, ребаудиозид М, ребаудиозид D, ребаудиозид N, ребаудиозид О, синтетические стевиоловые гликозиды, например ферментативно глюкозилированные стевиоловые гликозиды и их комбинации.
[0044] Используемый здесь термин «уридиндифосфат (UDP)-гликозилтрансфераза» или «UDP-зависимая гликозилтрансфераза» относится к ферменту, который обладает активностью переноса моносахаридного фрагмента от гликозильного донора к гликозильному акцептору, в частности, к ферменту, который использует UDP-caxap в качестве донора гликозила. Термин «UDP-гликозилтрансфераза» может использоваться взаимозаменяемо с «UGT».
[0045] Используемый здесь термин «функциональный домен» означает либо «акцепторный домен сахара», либо «донорный домен сахара» UDP-гликозилтрансферазы. Растительная UDP-гликозилтрансфераза (UGT) принадлежит к семейству 1 суперсемейства гликозилтрансфераз. Они принимают структурную складку GT-B. Эта общая структурная особенность UGT состоит из двух доменов, С-концевого и N-концевого домена, с похожими Rossmann-подобными складками, разделенными междоменным линкером. С-концевой домен связывает UDP-глюкозу («донор сахара») и, таким образом, также называется донорным доменом сахара, в то время как N-концевой домен связывает несахарный субстрат («акцептор») и поэтому также называется в качестве домена-акцептора.
[0046] Используемый здесь термин «вариант» относится к полипептиду, отличающемуся от конкретно указанного «эталонного» полипептида (например, последовательности дикого типа) аминокислотными вставками, делециями, мутациями и/или заменами, но сохраняет активность, которая по существу аналогична эталонному полипептиду. Например, вариант UGT40087 сохраняет активность, которая по существу аналогична эталонному UGT40087, имеющему последовательность SEQ ID NO: 11, в том, что вариант UGT40087 также способен катализировать реакцию преобразования RebA в RebD и/или стевиозида в RebE. В некоторых вариантах осуществления этот вариант создается методами рекомбинантной ДНК, такими как мутагенез. В некоторых вариантах вариантный полипептид отличается от своего эталонного полипептида заменой одного основного остатка другим (т.е. заменой Arg на Lys), заменой одного гидрофобного остатка другим (т.е. заменой Leu на Ile) или заменой одного ароматического остатка для другого (то есть заменой Phe на Tyr) и т.д. В некоторых вариантах осуществления варианты включают аналоги, в которых получены консервативные замены, приводящие к существенной структурной аналогии эталонной последовательности. Примеры таких консервативных замен, в том числе, включают глутаминовую кислоту для аспарагиновой кислоты и наоборот; глютамин для аспарагина и наоборот; серии для треонина и наоборот; лизин для аргинина и наоборот; или изолейцин, валин или лейцин друг для друга соответственно.
[0047] Используемый здесь термин «вариантная аминокислотная последовательность loopl» относится к аминокислотной последовательности, которая отличается от эталонной аминокислотной последовательности loop1 SEQ ID NO: 1 или SEQ ID NO: 11 (или модифицированной последовательности loop1 UGT40087, имеющей последовательность SEQ ID NO: 28), включающей одну, две, три, четыре, пять, шесть, семь, восемь, девять или десять аминокислотных вставок, делеций, мутаций и/или замен, но допускает наличие UDP-гликозилтрансферазы, содержащий вариантную аминокислотную последовательност loop1, вставленную в позиции, которая соответствует местоположению аминокислотной последовательности loop1 SEQ ID NO: 1 или SEQ ID NO: 11, соответственно, для катализа преобразования RebA в RebD и/или стевиозида в RebE.
[0048] Используемый здесь термин «вариантная аминокислотная последовательность loop2 относится к аминокислотной последовательности, которая отличается от эталонной аминокислотной последовательности loop2 SEQ ID NO: 1 или SEQ ID NO: 11 на одну, две, три, четыре, пять, шесть, семь, восемь, девять или десять аминокислотных вставок, делеций, мутаций и/или замен, но допускает UDP-гликозилтрансферазу, содержащую вариантную аминокислотную последовательность loop2, вставленную в позиции, которая соответствует местоположению аминокислотной последовательности loop2 SEQ ID NO: 1 или SEQ ID NO: 11, соответственно, для катализа преобразования RebA в RebD и/или стевиозида в RebE.
[0049] Используемый здесь термин «вариантная аминокислотная последовательность loop3_1» относится к аминокислотной последовательности, которая отличается от эталонной аминокислотной последовательности loop3_1 SEQ ID NO: 1 или SEQ ID NO: 11 на одну, две, три, четыре, пять, шесть, семь, восемь, девять или десять аминокислотных вставок, делеций, мутаций и/или замен, но допускает UDP-гликозилтрансферазу, содержащую вариантную аминокислотную последовательность loop3_1, вставленную в позиции, которая соответствует расположению аминокислотной последовательности loop3_1 SEQ ID NO: 1 или SEQ ID NO: 11, для катализа преобразования RebA в RebD и/или стевиозида в RebE. Используемый здесь термин «вариантная аминокислотная последовательность loop3_2» относится к аминокислотной последовательности, которая отличается от эталонной аминокислотной последовательности loop3_2 SEQ ID NO: 1 или SEQ ID NO: 11 на одну, две, три, четыре, пять, шесть, семь, восемь, девять или десять аминокислотных вставок, делеций, мутаций и/или замен, но допускает UDP-гликозилтрансферазу, содержащую вариантную аминокислотную последовательность loop3_2, вставленную в позиции, которая соответствует местоположению аминокислотной последовательности loop3_2 SEQ ID NO: 1 или SEQ ID NO: 11, соответственно, для катализа преобразования RebA в RebD и/или стевиозида в RebE. В некоторых вариантах осуществления вариантная аминокислотная последовательность loop3_2 отличается от эталонной аминокислотной последовательности loop3_2 на одну, две, три, четыре, пять шесть, семь, восемь, девять, десять или до тридцати аминокислотных вставок, делеций, мутаций и/или замен.
[0050] Используемый здесь термин «вариантная аминокислотная последовательность loop4_1» относится к аминокислотной последовательности, которая отличается от эталонной аминокислотной последовательности loop4_1 SEQ ID NO: 1 или SEQ ID NO: 11 на одну, две, три, четыре, пять, шесть, семь, восемь, девять или десять или до 30 аминокислотных вставок, делеций, мутаций и/или замен, но допускает UDP-гликозилтрансферазу, содержащую вариантную последовательность loop4_1, вставленную в позиции, которая соответствует местоположению аминокислотной последовательности loop4_1 SEQ ID NO: 11, для катализа преобразования RebA в RebD и/или стевиозида в RebE. Используемый здесь термин «идентичность последовательности» или «процентная идентичность» в контексте или двух или более последовательностей нуклеиновой кислоты или белка относится к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или имеют определенный процент аминокислотных остатков, или к нуклеотидам, которые являются одинаковыми. Например, последовательность может иметь процент идентичности, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91% по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или более высокую идентичность, чем указанный диапазон, по отношению к последовательности при сравнении и выравнивании для максимального соответствия по диапазону сравнения или заданной области, измеренной с использованием алгоритма сравнения последовательностей или путем ручного выравнивания и визуального контроля. Например, процент идентичности определяется путем расчета отношения количества идентичных нуклеотидов (или аминокислотных остатков) в последовательности, деленного на длину всех нуклеотидов (или аминокислотных остатков), минус длины любых разрывов.
[0051] Для удобства степень идентичности между двумя последовательностями можно установить с использованием компьютерной программы и математических алгоритмов, известных в данной области техники. Такие алгоритмы, которые вычисляют процент идентичности последовательности, как правило, учитывают разрывы последовательности и несовпадения в области сравнения. Для этой цели полезны программы, которые сравнивают и выравнивают последовательности, такие как Clustal W (Thompson и др., (1994) Nucleic Acids Res., 22: 4673-4680), Clustal Omega (Sievers и др., (2011) Molecular Systems Biology., 7:539), ALIGN (Myers и dp, (1988) CABIOS, 4: 11-17), FASTA (Pearson и др., (1988) PNAS, 85:2444-2448; Pearson (1990), Methods Enzymol, 183: 63-98) и BLAST (Altschul и др., (1997) Nucleic Acids Res., 25: 3389-3402). Программа BLAST или BLAST 2.0 (Altschul и др., J. Mol. Biol. 215:403-10, 1990) доступна из нескольких источников, включая Национальный центр биологической информации (NCBI) и в Интернете, и используется вместе с программами анализа последовательностей BLASTP, BLASTN, BLASTX, TBLASTN и TBLASTX. Дополнительную информацию можно найти на вебсайте NCBI.
[0052] В некоторых вариантах осуществления выравнивания последовательностей и вычисления процентной идентичности могут производиться с использованием программы BLAST с использованием ее стандартных параметров по умолчанию. Для выравнивания нуклеотидных последовательностей и вычисления идентичности последовательностей используется программа BLASTN с параметрами по умолчанию (штраф на внесение делеций в выравнивание = 5, штраф на продолжение делеции = 2, совпадение нуклеотидов = 2, несовпадение нуклеотидов = -3, ожидаемая величина = 10.0, размер слова = 11, Максимальное число совпадений в диапазоне запросов = 0). В некоторых вариантах осуществления для выравнивания нуклеотидной последовательности и вычисления идентичности последовательности программа BLASTN используется с этими параметрами (штраф на внесение делеций в выравнивание = 5, штраф на продолжение делеции = 2, совпадение нуклеотидов = 1, несовпадение нуклеотидов = -3, ожидаемая величина = 10,0, размер слова = 11). Для выравнивания полипептидной последовательности и вычисления идентичности последовательностей используется программа BLASTP с параметрами по умолчанию (матрица выравнивания = BLOSUM62; разрывные затраты: существование = 11, расширение = 1; композиционные корректировки = условный композиционный балл, матричная корректировка; ожидаемая величина = 10,0; размер слова = 6; максимальное количество совпадений в диапазоне запросов = 0. В качестве альтернативы используются следующие программы и параметры: программное обеспечение Align Plus из пакета Clone Manager Suite версии 5 (программное обеспечение Sci-Ed), сравнение ДНК: глобальное сравнение, стандартная матрица линейных оценок, штраф на несовпадение = 2, штраф на внесение делеций в выравнивание = 4, штраф на продолжение делеций = 1. В описанных здесь вариантах осуществления, идентичность последовательности вычисляется с использованием программ BLASTN или BLASTP с использованием их параметров по умолчанию. В описанных здесь вариантах осуществления, выравнивание последовательности из двух или более последовательностей выполняется с использованием прогрммного обеспечения Clustal Omega с применением предложенных параметров по умолчанию (снять выравнивание входных последовательностей: нет; Mbed-подобное руководство по кластеризации: да; Mbed-подобная итерация кластеризации: да; количество комбинированных итераций: по умолчанию (0); максимальное количество итераций направляющего дерева: по умолчанию; максимум итераций НММ: по умолчанию; порядок: выровнен).
6.2 Клетки-хозяева
[0053] Здесь представлены клетки-хозяева, способные продуцировать ребаудиозид D (RebD) из ребаудиозида A (RebA) с высокой эффективностью. В определенных вариантах осуществления клетки-хозяева могут продуцировать RebD из RebA в качестве исходного материала. В предпочтительных вариантах осуществления клетки-хозяева могут продуцировать RebA из источника углерода в культуральной среде и могут дополнительно продуцировать RebD из RebA. В конкретных вариантах осуществления клетки-хозяева могут дополнительно продуцировать ребаудиозид М (RebM) из RebD.
[0054] В конкретных вариантах осуществления клетки-хозяева содержат ферментативную активность уридиндифосфатгликозилтрансферазы 87 (UGT40087). Фермент UGT40087 способен с высокой эффективностью преобразовывать RebA в RebD. В некоторых вариантах осуществления фермент UGT40087 способен преобразовывать RebA в RebD с эффективностью более 80%. В некоторых вариантах осуществления фермент UGT40087 способен преобразовывать RebA в RebD с эффективностью более 85%. В некоторых вариантах осуществления фермент UGT40087 способен преобразовывать RebA в RebD с эффективностью, превышающей 90%. В некоторых вариантах осуществления фермент UGT40087 способен преобразовывать RebA в RebD с эффективностью более 95%. В некоторых вариантах осуществления фермент UGT40087 способен преобразовывать RebA в RebD с эффективностью, превышающей 96%. В некоторых вариантах осуществления фермент UGT40087 способен преобразовывать RebA в RebD с эффективностью около 97%. В некоторых вариантах осуществления фермент UGT40087 способен преобразовывать стевиозид в RebE.
[0055] В определенных вариантах осуществления клетка-хозяин способна преобразовывать RebA в RebD с эффективностью, превышающей 80%. В определенных вариантах осуществления клетка-хозяин способна преобразовывать RebA в RebD с эффективностью более 85%. В некоторых вариантах осуществления клетка-хозяин способна преобразовывать RebA в RebD с эффективностью, превышающей 90%. В определенных вариантах осуществления клетка-хозяин способна преобразовывать RebA в RebD с эффективностью, превышающей 95%. В некоторых вариантах осуществления клетка-хозяин способна преобразовывать RebA в RebD с эффективностью более 96%. В определенных вариантах осуществления клетка-хозяин способна преобразовывать RebA в RebD с эффективностью около 97%. В определенных вариантах осуществления клетка-хозяин способна преобразовывать стевиозид в RebE.
[0056] Эффективность преобразования может быть измерена любым методом, очевидным для специалистов в данной области техники. В некоторых вариантах осуществления эффективность преобразования может быть измерена путем контакта RebA с ферментом или клеткой-хозяином в подходящих условиях для образования RebD. Эффективность может быть измерена путем сравнения молярного количества произведенного RebD с общим количеством RebA и RebD в полученной композиции. Эффективность также можно измерить, сравнивая общее количество RebD и продуктов RebD дальнейшего предела с общим количеством RebA, RebD и продуктов RebD дальнейшего предела в полученной композиции. Например, эффективность также может быть измерена путем сравнения общего количества RebD, RebM и RebM2 по сравнению с общим количеством RebA, RebD, RebM и RebM2 в полученной композиции.
[0057] В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие UGT40087, содержащий аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, по существу, идентичную аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая по меньшей мере на 60% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая по меньшей мере на 65% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая по меньшей мере на 70% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая, по меньшей мере на 75% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая не менее чем на 85% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая, по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая, не менее чем на 95% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая по меньшей мере на 96% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая по меньшей мере на 97% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая по меньшей мере на 99% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая, по меньшей мере на 60%, по меньшей мере на 99% или, не менее чем на любой процент от 60% до 99% идентична аминокислотной последовательности SEQ. ID NO: 1 или SEQ ID NO: 11.
[0058] В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, описанную здесь, и способную преобразовывать RebA в RebD. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, описанную здесь, и способную к бета-1,2-гликозилированию положения С2 '19-O глюкозы стевиолового гликозида. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, способную преобразовывать RebA в RebD с эффективностью, превышающей 90%, 95%, 96% или 97%, где UDP-гликозилтрансфераза содержит аминокислотную последовательность, имеющую идентичности последовательности не менее 95% по отношению к аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11.
[0059] В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую UGT40087, содержащую аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, по существу, идентичную аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая, по меньшей мере на 60% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая, по меньшей мере на 65% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая, по меньшей мере на 70% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 85% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 96% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 97% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 99% идентична аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая, по меньшей мере на 60%, по меньшей мере на 99% или любой процент от 60% до 99% идентична аминокислотной последовательности SEQ. ID NO: 1 или SEQ ID NO: 11.
[0060] В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие гетерологичную нуклеиновую кислоту, содержащую нуклеотидную последовательность SEQ ID NO: 13, которая кодирует UGT40087, имеющий последовательность SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие гетерологичную нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% идентична нуклеотидной последовательности SEQ ID NO: 13. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие гетерологичную нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая, по меньшей мере на 90%, по меньшей мере на 99% или любой процент между 60% и 99% идентична нуклеотидной последовательности SEQ ID NO: 11.
[0061] В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие функциональный домен UGT40087, где UGT40087 содержит аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий N-концевой акцепторный домен сахара UGT40087, содержащий аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий С-концевой донорный домен сахара UGT40087, содержащий аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления акцепторный домен сахара в UGT40087 содержит положения аминокислот примерно от 1 до 214 последовательности SEQ ID NO: 11 (которые соответствуют положениям аминокислот от 1 до 215 последовательности SEQ ID NO: 1). В некоторых вариантах осуществления донорный домен сахара UGT40087 содержит положения аминокислот примерно от 215 до 435 последовательности SEQ ID NO: 11 (которые соответствуют положениям аминокислот от 216 до 436 последовательности SEQ ID NO: 1). В некоторых вариантах осуществления акцепторный домен сахара UGT40087 содержит положения аминокислот примерно от 1 до 215 SEQ ID NO: 1. В определенных вариантах осуществления донорный домен сахара содержит положения аминокислот примерно от 216 до 436 последовательности SEQ ID NO: 1. В некоторых вариантах осуществления акцепторный домен сахара и донорный домен сахара UGT40087 содержат более узкий диапазон аминокислотных остатков, чем от 1 до 214 или от 215 до 435, соответственно, по отношению к SEQ ID NO: 11. В некоторых вариантах осуществления акцепторный домен сахара и донорный домен сахара UGT40087 содержат более узкий диапазон аминокислотных остатков, чем от 1 до 215 или от 216 до 436, соответственно, по отношению к SEQ ID NO: 1.
[0062] В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, по существу идентичную аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 60% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 65% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 70% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 75% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 85% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 96% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 97% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 98% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 99% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь предоставлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 60%, не менее чем на 99% или любой процент от 60% до 99% идентична аминокислотной последовательности N-концевого сахара акцепторный домен SEQ ID NO: 1 или SEQ ID NO: 11.
[0063] В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую UGT40087, содержащую аминокислотную последовательность N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, по существу, идентичную аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 60% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 65% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 70% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 75% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 80% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 85% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 90% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 95% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 96% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 97% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 98% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 99% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11.
[0064] В некоторых вариантах осуществления при сравнении и анализе трехмерных смоделированных структур UGT40087 и другой UDP-гликозилтрансферазы выявили четыре петли (то есть, loop1, loop2, loop3 и loop4), которые обладают значительными конформационными различиями N-концевого акцепторного домена сахара. См. ФИГ. 6 и Пример 12. Экспериментальные результаты замен соответствующих последовательностей петель между двумя UGT показали, что loop1, loop2, loop3_1, loop3_2 и loop4_1 UGT40087 могут быть заменены соответствующими им последовательностями петель из других UDP-гликозилтрансфераз, которые способны преобразовывать RebA в RebD. В этих вариантах осуществления две версии loop3 (то есть loop3_1 и loop3_2) и loop_4 (то есть loop4_1 и loop4_2) были разработаны для учета двух возможных длин петли.
[0065] Таким образом, в определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая не менее чем на 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие гетерологичную нуклеиновую кислоту, кодирующую UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая не менее чем на 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%о, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит аминокислотную последовательность loopl UGT40087 (то есть SEQ ID NO: 1 или SEQ ID NO: 11) в местоположении UDP-гликозилтрансферазы, которое соответствует местоположению loop1 SEQ ID. NO: 1 или SEQ ID NO: 11 соответственно. В некоторых вариантах осуществления аминокислотная последовательность loop1 SEQ ID NO: 1 или SEQ ID NO: 11 имеет аминокислотную последовательность SEQ ID NO: 30. В определенных вариантах осуществления аминокислотная последовательность loop1 имеет последовательность SEQ ID NO: 28. В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит вариантную аминокислотную последовательность loop1 в положении UDP-гликозилтрансферазы, которое соответствует местоположению loop1 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно. Вариантная аминокислотная последовательность loop1 относится к аминокислотной последовательности, которая отличается от эталонной аминокислотной последовательности loop1 SEQ ID NO: 1 или SEQ ID NO: 11 или аминокислотной последовательности loop1, имеющей SEQ ID NO: 28, но допускает UDP-гликозилтрансферазу, содержащую вариантную аминокислотную последовательность loop1 для сохранения своей активности по преобразованию RebA в RebD и/или по преобразованию стевиозида в RebE.
[0066] В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит аминокислотную последовательность loop2 UGT40087 (то есть SEQ ID NO: 1 или SEQ ID NO: 11) в позиции UDP-гликозилтрансферазы, которое соответствует местоположению loop2 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно. В некоторых вариантах осуществления аминокислотная последовательность loop2 SEQ ID NO: 1 или SEQ ID NO: 1 имеет аминокислотную последовательность SEQ ID NO: 19. В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит вариантную аминокислотную последовательность loop2 в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop2 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно. Вариантная аминокислотная последовательность loop2 относится к аминокислотной последовательности, которая отличается от эталонной аминокислотной последовательности loop2 SEQ ID NO: 1 или SEQ ID NO: 11, но допускает UDP-гликозилтрансферазу, содержащую вариантную аминокислотную последовательность loop2, для сохранения своей активности по преобразованию RebA в RebD и/или преобразованию стевиозида в RebE.
[0067] В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит аминокислотную последовательность loop3_1 UGT40087 (то есть SEQ ID NO: 1 или SEQ ID NO: 11) в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop3_1 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно. В некоторых вариантах осуществления аминокислотная последовательность loop3_1 SEQ ID NO: 1 или SEQ ID NO: 11 имеет аминокислотную последовательность SEQ ID NO: 20. В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит вариантную аминокислотную последовательность loop3_1 в позиции UDP-гликозилтрансферазы, которая соответствует расположению loop3_1 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно. Вариантная аминокислотная последовательность loop3_1 относится к аминокислотной последовательности, которая отличается от эталонной аминокислотной последовательности loop3_1 SEQ ID NO: 1 или SEQ ID NO: 11, но допускает UDP-гликозилтрансферазу, содержащую вариантную аминокислотную последовательность loop3_1, для сохранения своей активности по преобразованию RebA в RebD и/или преобразованию стевиозида в RebE.
[0068] В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит аминокислотную последовательность loop3_2 UGT40087 (т.е. SEQ ID NO: 1 или SEQ ID NO: 11) в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop3_2 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно. В некоторых вариантах осуществления аминокислотная последовательность loop3_2 SEQ ID NO: 1 или SEQ ID NO: 11 имеет аминокислотную последовательность SEQ ID NO: 21. В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит вариантную аминокислотную последовательность loop3_2 в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop3_2 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно. Вариантная аминокислотная последовательность loop3_2 относится к аминокислотной последовательности, которая отличается от эталонной аминокислотной последовательности loop3_2 SEQ ID NO: 1 или SEQ ID NO: 11, но допускает UDP-гликозилтрансферазу, содержащую вариантную аминокислотную последовательность loop3_2, для сохранения своей активности по преобразованию RebA в RebD и/или преобразованию стевиозида в RebE.
[0069] В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит аминокислотную последовательность loop4_1 UGT40087 (то есть SEQ ID NO: 1 или SEQ ID NO: 11) в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop4_1 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно. В некоторых вариантах осуществления аминокислотная последовательность loop4_1 SEQ ID NO: 1 или SEQ ID NO: 11 имеет аминокислотную последовательность SEQ ID NO: 22. В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит вариантную аминокислотную последовательность loop4_1 в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop4_1 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно. Вариантная аминокислотная последовательность loop4_1 относится к аминокислотной последовательности, которая отличается от эталонной аминокислотной последовательности loop4_1 SEQ ID NO: 1 или SEQ ID NO: 11, но допускает UDP-гликозилтрансферазу, содержащую вариантную аминокислотную последовательность loop4_1, для сохранения своей активности по преобразованию RebA в RebD и/или преобразованию стевиозида в RebE.
[0070] В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит аминокислотную последовательность loop4_2 UGT40087 (то есть SEQ ID NO: 1 или SEQ ID NO: 11) в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop4_2 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно. Аминокислотная последовательность loop4_2 SEQ ID NO: 1 или SEQ ID NO: 11 имеет аминокислотную последовательность SEQ ID NO: 23.
[0071] В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая не менее чем на 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11 или гетерологичную нуклеиновую кислоту, кодирующую ее UDP-гликозилтрансферазу, и дополнительно содержащую любую комбинацию следующего:
(a) Аминокислотная последовательность loop1 в SEQ ID NO: 1 или SEQ ID NO: 11, аминокислотная последовательность SEQ ID NO: 28 или вариантная аминокислотная последовательность loop1 в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop1 в SEQ ID NO: 1 или SEQ ID NO: 11 соответственно;
(b) аминокислотная последовательность loop2 в SEQ ID NO: 1 или SEQ ID NO: 11 или вариантная аминокислотная последовательность loop2 в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop2 в SEQ ID NO: 1, или SEQ ID NO: 11 соответственно;
(c) аминокислотная последовательность loop3_1 SEQ ID NO: 1 или SEQ ID NO: 11, или вариантная аминокислотная последовательность loop3_1, в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop3_1 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно;
(d) аминокислотная последовательность loop3_2 SEQ ID NO: 1 или SEQ ID NO: 11 или вариантная аминокислотная последовательность loop3_2 в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop3_2 SEQ ID NO: 1, или SEQ ID NO: 11 соответственно;
(e) аминокислотная последовательность loop4_1 SEQ ID NO: 1 или SEQ ID NO: 11, или вариантная аминокислотная последовательность loop4_1, в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop4_1 в SEQ ID NO: 1, или SEQ ID NO: 11 соответственно; а также
(f) аминокислотная последовательность loop4_2 SEQ ID NO: 1 или SEQ ID NO: 11 в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop4_2 в SEQ ID NO: 1 или SEQ ID NO: 11, соответственно.
[0072] В некоторых вариантах осуществления при сравнении и анализе трехмерных смоделированных структур UDP-гликозилтрансфераз, способных преобразовывать RebA в RebD, было обнаружено, что loop4_1 UGT40087 при включении в соответствующее местоположение loop4_1 другой UDP-гликозилтрансферазы (и замене ее природной аминокислотной последовательностью loop4_1) привела к превосходной активности вариантной UDP-гликозилтрансферазы с точки зрения ее способности преобразовывать RebA в RebD. См. Пример 12. Эти результаты показывают, что аминокислотная последовательность loop4_1 любой подходящей UDP-гликозилтрансферазы может быть заменена аминокислотной последовательностью loop4_1 SEQ ID NO: 1 или SEQ ID NO: 11 для преобразования RebA в RebD.
[0073] Следовательно, в определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая не менее чем на 61%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11 и дополнительно содержит аминокислотную последовательность loop4_1 (т.е. SEQ ID NO: 22) UGT40087 (т.е., SEQ ID NO: 1 или SEQ ID NO: 11). В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие гетерологичную нуклеиновую кислоту, кодирующую UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая не менее чем на 61%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11 и дополнительно содержит аминокислотную последовательность loop4_1 (например, SEQ ID NO: 22) SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления любая подходящая UDP-гликозилтрансфераза, которая содержит аминокислотную последовательность, которая не менее чем на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% до SEQ ID NO: 1 или SEQ ID NO: 11 может использоваться для интеграции аминокислотной последовательности loop4_1 из SEQ ID NO: 1 или SEQ ID NO: 11 в соответствующем местоположении loop4_1 (заменяя ее нативную аминокислотную последовательность loop4_1). Например, Ob_UGT91B_like, Hv_UGT_V1, Sl_UGT_101249881, Sr.UGT_g252778, Os_UGT_91C1, Bd_UGT10840, Bd_UGT10850 или Si91Dlike могут использоваться в качестве базы для интеграции аминокислотной последовательности loop4_1. В некоторых вариантах осуществления UDP-гликозилтрансфераза содержит аминокислотную последовательность SEQ ID NO: 25.
[0074] В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, по существу идентичную аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 60% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 65% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 70% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 75% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 80% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 85% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 90% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 95% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 96% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 97% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 98% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 99% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11.
[0075] В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую UGT40087, содержащую аминокислотную последовательность С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, по существу идентичную аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 60% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 65% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 70% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 75% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 80% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 85% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 90% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 95% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 96% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 97% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 98% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В некоторых вариантах осуществления здесь представлены клетки-хозяева, содержащие нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, которая не менее чем на 99% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11.
[0076] В некоторых вариантах осуществления N-концевые акцепторные домены сахара и С-концевые донорные домены сахара рекомбинировали для изменения либо специфичности субстрата, либо каталитической активности. Как подробно описано в Примере 11, было определено, что когда донорный домен сахара из другой UDP-гликозилтрансферазы, способной преобразовывать RebA в RebD, рекомбинировали с акцепторным доменом сахара SEQ ID NO: 1 или SEQ ID NO: 11, химерные UDP-гликозилтрансферазы сохранили свою способность преобразовывать RebA в RebD.
[0077] Таким образом, в определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая не менее чем на 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие гетерологичную нуклеиновую кислоту, кодирующую UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая не менее чем на 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична аминокислотной последовательности С-концевого донорного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11. Как показано в Примере 11, С-концевой донорный домен сахара является относительно взаимозаменяемым с другой UDP-гликозилтрансферазой с последовательностью идентичной не менее чем на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95%. В некоторых вариантах осуществления UDP-гликозилтрансфераза дополнительно содержит С-концевой донорный домен сахара из другой UDP-гликозилтрансферазы. Примеры других UDP-гликозилтрансфераз с подходящими С-концевыми донорными доменами сахара включают Ob_UGT91B_like, Hv_UGT_V1, SI_UGT_101249881, Sr.UGT_g252778, Os_UGT_91C1, Bd_UGT10840, Bd_UGT10850 или Si91D.
[0078] В определенных вариантах осуществления было обнаружено, что определенные аминокислотные остатки в N-концевом акцепторном домене сахара могут восстанавливать каталитическую активность нефункциональной, предполагаемой UDP-гликозилтрансферазы в активную UDP-гликозилтрансферазу. Следовательно, здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, которая не менее чем на 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности N-концевого акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11, и дополнительно содержат один или более из следующих аминокислотных остатков:
(a) валин в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 11 SEQ ID NO: 11;
(b) изолейцин в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 12 SEQ ID NO: 11;
(c) пролин в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 55 SEQ ID NO: 11;
(d) глутаминовая кислота в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 90 SEQ ID NO: 11;
(e) серии в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 203 SEQ ID NO: 11;
(f) глутаминовая кислота в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 223 SEQ ID NO: 11; или же
(g) валин в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 413 SEQ ID NO: 11,
где позиции аминокислот UDP-гликозилтрансферазы, которые соответствуют позициям аминокислот SEQ ID NO: 11, определяются выравниванием последовательностей.
[0079] В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие UDP-гликозилтрансферазу, содержащую аминокислотную последовательность SEQ ID NO: 24.
[0080] В определенных вариантах осуществления клетка-хозяин содержит вариант полипептида UGT40087, описанный выше. В некоторых вариантах осуществления вариант может содержать до 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислотных замен относительно полипептида UGT40087. В некоторых вариантах осуществления вариант может содержать до 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 консервативных аминокислотных замен относительно полипептида UGT40087. В определенных вариантах осуществления любая из нуклеиновых кислот, описанных здесь, может быть оптимизирована для клетки-хозяина, например, оптимизирована по ко донам.
[0081] В описанных здесь вариантах осуществления может быть использован любой подходящий способ для определения соответствующих позиций аминокислот или соответствующих позиций петли двух полипептидов. В некоторых вариантах осуществления последовательности UDP-гликозилтрансферазы и эталонной последовательности SEQ ID NO: 11 могут быть выровнены с использованием прогрммного обеспечения Clustal Omega с применением параметров по умолчанию. В другом варианте осуществления последовательности UDP-гликозилтрансферазы и эталонной последовательности SEQ ID NO: 11 могут быть выровнены с использованием структурных выравниваний, таких как SWISS-MODEL, который является сервером моделирования гомологии белковой структуры, доступным через веб-сервер ExPASy, или из программы DeepView (Swiss Pdb-Viewer).
[0082] Хотя SEQ ID NO: 11 упоминается как эталонная последовательность для определения соответствующих позиций аминокислот или позиций петли для UDP-гликозилтрансферазы, в некоторых вариантах осуществления SEQ ID NO: 1 также может использоваться в качестве эталонной последовательности для выравнивания.
[0083] В некоторых вариантах осуществления RebA является таким, как показано на ФИГ. 1А. В некоторых вариантах осуществления UGT40087 или вариант UGT40087 способен катализировать реакцию остатка сахара, образующего β-связь, до позиции С-2' 19-О-глюкозы в RebA с образованием RebD, как показано на ФИГ. 1А. В некоторых вариантах осуществления UGT40087 или вариант UGT40087 способен катализировать реакцию гексозного остатка в Р-образовании до позиции С-2'19-О-глюкозы RebA. В некоторых вариантах осуществления UGT40087 способен катализировать реакцию остатка глюкозы в β-образовании с позицией С-2' 19-О-глюкозы RebA.
[0084] В некоторых вариантах осуществления RebE является таким, как показано на ФИГ. 2В. В некоторых вариантах осуществления UGT40087 или вариант UGT40087 способен катализировать реакцию остатка сахара, образующего β-связь, до позиции С-2'19-О-глюкозы стевиозида с образованием RebE, как показано на ФИГ. 2В. В определенных вариантах осуществления UGT40087 или вариант UGT40087 способен катализировать реакцию остатка гексозы в β-образовании до позиции С-2'19-О-глюкозы стевиозида. В некоторых вариантах осуществления UGT40087 или вариант UGT40087 способен катализировать реакцию остатка глюкозы в β-образовании до позиции С-2'19-О-глюкозы стевиозида.
[0085] В определенных вариантах осуществления UGT40087 или вариант UGT40087 не катализирует реакцию добавления второго сахарного фрагмента к стевиолмонозиду (то есть 13-О-стевиолгликозиду) на определяемом уровне. В некоторых вариантах осуществления UGT40087 или вариант UGT40087 не катализирует реакцию добавления второго сахарного фрагмента к рубусозиду (то есть 19-О-стевиолгликозиду) на определяемом уровне.
[0086] В некоторых вариантах осуществления RebD является таким, как показано на ФИГ. 1А. В определенных вариантах осуществления клетка-хозяин дополнительно содержит один или несколько ферментов, способных преобразовывать RebA в RebD. В определенных вариантах осуществления ячейка-хозяин содержит UGT40087 и/или вариант UGT40087 для преобразования RebA в RebD.
[0087] В определенных вариантах осуществления UGT76G1 способен катализировать реакцию остатка сахара с преобразованием RebD в RebM, как показано на ФИГ. 1А. В определенных вариантах осуществления клетки-хозяева дополнительно содержат один или несколько ферментов, способных преобразовывать RebD в RebM. В некоторых вариантах осуществления клетка-хозяин дополнительно содержит UGT76G1, способный преобразовывать RebD в RebM.
[0088] В некоторых вариантах осуществления RebM2 показан на ФИГ. 1B. RebM2 представляет собой изомер RebM с единственной неправильной глюкозной связью, как показано на ФИГ. 1B. RebM2 имеет Glcβ (1-2) [Glcβ (1-6)] Glcβ1 - в позиции углерода 19 (СООН) вместо желаемого Glcβ (1-2) [Glcβ (1-3)] Glcβ1 - для RebM.
[0089] Специалистам понятно, что в определенных приложениях RebM2 может быть нежелательным побочным продуктом. Преимущественно, в определенных вариантах осуществления UGT40087 (или вариант UGT40087) и представленные здесь клетки-хозяева, способны продуцировать RebM2 в малых количествах или вообще не способны продуцировать RebM2. Количество RebM2 может быть выражено как отношение RebM к RebM2. В определенных вариантах осуществления отношение RebM к RebM2 составляет не менее 2:1. В определенных вариантах осуществления отношение RebM к RebM2 составляет не менее 3:1. В определенных вариантах осуществления отношение RebM к RebM2 составляет не менее 4:1. В определенных вариантах осуществления отношение RebM к RebM2 составляет не менее 5:1. В определенных вариантах осуществления отношение RebM к RebM2 составляет не менее 10:1. В определенных вариантах осуществления отношение RebM к RebM2 составляет, не менее 100:1. В некоторых вариантах осуществления отношение RebM к RebM2 составляет, не менее 1000:1. В некоторых вариантах осуществления отношение RebM к RebM2 составляет, не менее 10000:1. В определенных вариантах осуществления UGT40087 (или вариант UGT40087) и представленные здесь клетки-хозяева, продуцируют необнаружимый уровень RebM2.
[0090] В то время как UGT40087 или любой вариант UGT40087 клеток-хозяев принимает RebA в качестве субстрата, источником RebA может быть любой источник, который считается подходящим для специалистов. В определенных вариантах осуществления UGT40087 или любой вариант UGT40087 могут связываться с RebA. В определенных вариантах осуществления клетка-хозяин может связываться с RebA. В определенных вариантах осуществления UGT40087 или любой вариант UGT40087 можно связать с композицией, содержащей один или несколько стевиоловых гликозидов. В определенных вариантах осуществления композиция содержит RebA. В определенных вариантах осуществления композиция содержит стевиозид. В определенных вариантах осуществления композиция получена из натуральных продуктов, выделенных из листьев Stevia rebaudiana. В определенных вариантах осуществления композиция является производной микробов. В определенных вариантах осуществления клетка-хозяин может контактировать с композицией, содержащей один или несколько стевиоловых гликозидов.
[0091] В определенных вариантах осуществления любой вариант UGT40087, подходящий для катализа желаемой реакции, может быть подвергнут скринингу любыми подходящими способами, известными в данной области. Например, подходящий вариант UGT40087 можно анализировать in vivo путем экспрессии гетерологичной нуклеиновой кислоты, кодирующей вариант UGT40087, и скрининга клеток, которые продуцируют функциональный вариант UGT40087, способный добавлять сахар в желаемом месте субстрата (например, позиция С2' 19-О-глюкозы из стевиоловых гликозидов или других субстратов). Примерные способы скрининга описаны в Примерах 3-7 ниже. В другом примере подходящий вариант UGT40087 может быть подвергнут скринингу in vitro путем контакта варианта UGT40087 с субстратом, таким как RebA. В этом примере анализ на наличие RebD можно использовать в качестве теста, чтобы определить, является ли вариант UGT40087 подходящим ферментом. Реакция может быть проанализирована с помощью LC-MS или других известных в данной области способов. См., например, патентную завку WO 2013/022989.
[0092] В определенных вариантах осуществления вариант UGT40087 считается подходящим для преобразования RebA в RebD (или из любого подходящего субстрата в его продукт путем гликозилирования), если он способен конвертировать RebA в RebD с эффективностью более 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96% или 97% in vivo.
[0093] В некоторых вариантах осуществления другие подходящие UDP-гликозилтрансферазы, обнаруженные в настоящей заявке, могут использоваться в дополнение или в качестве альтернативы UGT40087. К ним относятся, например, UDP-гликозилтрансферазы sr.UGT_9252778, Bd_UGT10840, Hv_UGT_V1, Bd_UGT10850 и Ob_UGT91B1_like. В некоторых вариантах осуществления UDP-гликозилтрансфераза sr.UGT_9252778 содержит SEQ ID NO: 2. В некоторых вариантах осуществления UDP-гликозилтрансфераза Bd_UGT10840 содержит SEQ ID NO: 3. В некоторых вариантах осуществления UDP-гликозилтрансфераза Hv_UGT_V1 содержит SEQ ID NO: 4. В некоторых вариантах осуществления UDP-гликозилтрансфераза Bd_UGT10850 содержит SEQ ID NO: 5. В некоторых вариантах осуществления UDP-гликозилтрансфераза Ob_UGT91B1_like содержит SEQ ID NO: 6. Любые обсуждения, касающиеся композиций и способов, относящихся к описанному здесь UGT40087, могут также применяться к этим другим UDP-гликозилтрансферазам.
[0094] Например, в некоторых вариантах осуществления клетки-хозяева содержат ферментативную активность уридиндифосфат-гликозилтрансферазы sr.UGT_9252778, Bd_UGT10840, Hv_UGT_V1, Bd_UGT10850 и/или Ob_UGT91B1_like. В определенных вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью, превышающей 40%. В определенных вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью более 45%. В определенных вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью, превышающей 50%. В некоторых вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью более 55%. В определенных вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью более 60%. В определенных вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью, превышающей 65%. В определенных вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью, превышающей 70%. В определенных вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью, превышающей 75%. В определенных вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью, превышающей 80%. В определенных вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью, превышающей 85%. В определенных вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью, превышающей 90%. В определенных вариантах осуществления один или несколько из этих ферментов способны преобразовывать RebA в RebD с эффективностью, превышающей 95%.
[0095] В определенных вариантах осуществления здесь предоставлены клетки-хозяева, содержащие любой один или несколько из sr.UGT_9252778, Bd_UGT10840, Hv_UGT_V1, Bd_UGT10850 и/или Ob_UGT91B1_like, содержащих аминокислотную последовательность SEQ ID NO: 2, 3, 4, 5, или 6 соответственно. В определенных вариантах осуществления здесь представлены клетки-хозяева, содержащие полипептид, содержащий аминокислотную последовательность, которая не менее чем на 60%, не менее чем на 70%, не менее чем на 75%, не менее чем на 80%, не менее чем на 85%, не менее чем на 90%, не менее чем на 95%, не менее чем на 96%, не менее чем на 97%, не менее чем на 98%, не менее чем на 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 2, 3, 4, 5 или 6.
[0096] В предпочтительных вариантах осуществления клетка-хозяин может содержать один или несколько ферментативных путей, способных продуцировать RebA, причем указанные пути взяты по отдельности или вместе. В некоторых вариантах осуществления клетки-хозяева содержат один или несколько ферментов, способных преобразовывать геранилгеранилдифосфат в RebA. Пригодные ферменты и нуклеиновые кислоты, кодирующие ферменты, известны специалистам в данной области. Особенно полезные ферменты и нуклеиновые кислоты описаны в разделах ниже и дополнительно описаны, например, в патентных заявках US 2014/0329281 А1, US 2014/0357588 A1, US 2015/0159188, WO 2016/038095 A2 и US 2016/0198748 A1.
[0097] В других вариантах осуществления клетки-хозяева дополнительно содержат один или несколько ферментов, способных производить геранилгеранилдифосфат из источника углерода. К ним относятся ферменты пути DXP и ферменты пути MEV. Пригодные ферменты и нуклеиновые кислоты, кодирующие ферменты, известны специалистам в данной области. Примерные ферменты каждого пути описаны ниже и дополнительно описаны, например, в патентной заявке US 2016/0177341 A1. Путь MEV также показан на ФИГ. 1С.
[0098] В определенных вариантах осуществления дополнительные ферменты являются нативными. В предпочтительных вариантах дополнительные ферменты являются гетерологичными. В определенных вариантах осуществления два фермента могут быть объединены в один полипептид.
6.3 Не встречающиеся в природе полипептиды UDP-гликозилтрансферазы и нуклеиновые кислоты
[0099] В другом аспекте здесь представлены не встречающиеся в природе вариантные UDP-гликозилтрансферазы, которые включают модификацию (и) аминокислотных остатков по сравнению с эталонной последовательностью (например, SEQ ID NO: 1) и при этом сохраняют активность как UDP-гликозилтрансфераза для преобразования RebA в RebD и/или стевиозида в RebE. В некоторых вариантах осуществления не встречающиеся в природе вариантные UDP-гликозилтрансферазы могут включать до 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислотных замен, делеций дополнения и/или вставки в определенных позициях или позициях аминокислот по сравнению с эталонной последовательностью (например, SEQ ID NO: 1 или SEQ ID NO: 11). В некоторых вариантах осуществления не встречающиеся в природе вариантные UDP-гликозилтрансферазы включают любую из описанных здесь вариантных UDP-гликозилтрансфераз, в частности те, которые описаны в разделе 6.2.
[0100] В других аспектах здесь представлены не встречающиеся в природе варианты UDP-гликозилтрансфераз, которые включают модификацию (и) остатков нуклеиновой кислоты по сравнению с эталонной последовательностью (например, SEQ ID NO: 26), и, тем не менее, при трансляции в белок, белок сохраняет активность в качестве UDP-гликозилтрансферазы для преобразования RebA в RebD и/или для преобразования стевиозида в RebE. В некоторых вариантах осуществления не встречающиеся в природе вариантные UDP-гликозилтрансферазы могут кодировать любую описанную здесь вариантную UDP-гликозилтрансферазу, в частности те, которые описаны в разделе 6.2.
6.4 Клеточные штаммы
[0101] Представленные здесь клетки-хозяева, полезные композиции и способы, включают в себя клетки археи, прокариотические или эукариотические клетки.
[0102] Подходящие прокариотические хозяева включают, в том числе, любую из множества грамположительных, грамотрицательных или грамотрицательных бактерий. Примеры включают, в том числе, клетки, принадлежащие к родам: Agrobacterium, Alicyclobacillus, Anabaena, Anacystis, Arthrobacter, Azobacter, Bacillus, Brevibacterium, Chromatium, Clostridium, Corynebacterium, Enterobacter, Erwinia, Escherichia, Lactobacillus, Lactococcus, Mesorhizobium, Methylobacterium, Microbacterium, Phormidium, Pseudomonas, Rhodobacter, Rhodopseudomonas, Rhodospirillum, Rhodococcus, Salmonella, Scenedesmun, Serratia, Shigella, Staphlococcus, Strepromyces, Synnecoccus, и Zymomonas. Примеры прокариотических штаммов включают, в том числе: Bacillus subtilis, Bacillus amyloliquefacines, Brevibacterium ammoniagenes, Brevibacterium immariophilum, Clostridium beigerinckii, Enterobacter sakazakii, Escherichia coli, Lactococcus lactis, Mesorhizobium loti, Pseudomonas aeruginosa, Pseudomonas mevalonii, Pseudomonas pudica, Rhodobacter capsulatus, Rhodobacter sphaeroides, Rhodospirillum rubrum, Salmonella enterica, Salmonella typhi, Salmonella typhimurium, Shigella dysenteriae, Shigella flexneri, Shigella sonnei, and Staphylococcus aureus. В конкретном варианте осуществления клетка-хозяин представляет собой клетку Escherichia coli.
[0103] Подходящие архейные хозяева включают, в том числе, клетки, принадлежащие к родам: Aeropyrum, Archaeglobus, Halobacterium, Methanococcus, Methanobacterium, Pyrococcus, Sulfolobus, и Thermoplasma. Примеры штаммов архей включают, в том числе: Archaeoglobus fulgidus, Halobacterium sp., Methanococcus jannaschii, Methanobacterium thermoautotrophicum, Thermoplasma acidophilum, Thermoplasma volcanium, Pyrococcus horikoshii, Pyrococcus abyssi, и Aeropyrum pernix.
[0104] Подходящие эукариотические хозяева включают, в том числе, клетки грибов, клетки водорослей, клетки насекомых и клетки растений. В некоторых вариантах осуществления дрожжи, используемые в представленных способах, включают дрожжи, которые были депонированы в хранилищах микроорганизмов (например, IFO, АТСС и т.д.) и принадлежат, помимо прочих, к родам, Aciculoconidium, Ambrosiozyma, Arthroascus, Arxiozyma, Ashbya, Babjevia, Bensingtonia, Botryoascus, Botryozyma, Brettanomyces, Bullera, Bulleromyces, Candida, Citeromyces, Clavispora, Cryptococcus, Cystofilobasidium, Debaryomyces, Dekkara, Dipodascopsis, Dipodascus, Eeniella, Endomycopsella, Eremascus, Eremothecium, Erythrobasidium, Fellomyces, Filobasidium, Galactomyces, Geotrichum, Guilliermondella, Hanseniaspora, Hansenula, Hasegawaea, Holtermannia, Hormoascus, Hyphopichia, Issatchenkia, Kloeckera, Kloeckeraspora, Kluyveromyces, Kondoa, Kuraishia, Kurtzmanomyces, Leucosporidium, Lipomyces, Lodderomyces, Malassezia, Metschnikowia, Mrakia, Myxozyma, Nadsonia, Nakazawaea, Nematospora, Ogataea, Oosporidium, Pachysolen, Phachytichospora, Phaffia, Pichia, Rhodosporidium, Rhodotorula, Saccharomyces, Saccharomycodes, Saccharomycopsis, Saitoella, Sakaguchia, Saturnospora, Schizoblastosporion, Schizosaccharomyces, Schwanniomyces, Sporidiobolus, Sporobolomyces, Sporopachydermia, Stephanoascus, Sterigmatomyces, Sterigmatosporidium, Symbiotaphrina, Sympodiomyces, Sympodiomycopsis, Torulaspora, Trichosporiella, Trichosporon, Trigonopsis, Tsuchiyaea, Udeniomyces, Waltomyces, Wickerhamia, Wickerhamiella, Williopsis, Yamadazyma, Yarrowia, Zygoascus, Zygosaccharomyces, Zygowilliopsis, и Zygozyma.
[0105] В некоторых вариантах осуществления микроб хозяина представляет собой Saccharomyces cerevisiae, Pichia pastoris, Schizosaccharomyces pombe, Dekkera bruxellensis, Kluyveromyces lactis (прежнее название Saccharomyces lactis), Kluveromyces marxianus, Arxula adeninivorans, или Hansenula polymorpha (текущее название Pichia angusta). В некоторых вариантах осуществления микроб хозяина представляет собой штамм рода Candida, например, Candida lipolytica, Candida guilliermondii, Candida krusei, Candida pseudotropicalis, или Candida utilis.
[0106] В конкретном варианте осуществления микробом-хозяином является штамм Saccharomyces cerevisiae. В некоторых вариантах осуществления хозяином является штамм Saccharomyces cerevisiae, выбранный из группы, состоящей из пекарских дрожжей, СВ8 7959, CBS 7960, CBS 7961, CBS 7962, CBS 7963, CBS 7964, IZ-1904, ТА, BG-1, CR-1, SA-1, М-26, Y-904, РЕ-2, РЕ-5, VR-1, BR-1, BR-2, МЕ-2, VR-2, МА-3, МА-4, САТ-1, СВ-1, NR-1, ВТ-1, и AL-1. В некоторых вариантах осуществления микробом-хозяином является штамм Saccharomyces cerevisiae, выбранный из группы, состоящей из РЕ-2, САТ-1, VR-1, BG-1, CR-1 и SA-1. В конкретном варианте осуществления штаммом Saccharomyces cerevisiae является РЕ-2. В другом конкретном варианте осуществления штаммом Saccharomyces cerevisiae является САТ-1. В другом конкретном варианте осуществления штаммом Saccharomyces cerevisiae является BG-1.
[0107] В некоторых вариантах осуществления микроб-хозяин представляет собой микроб, который подходит для промышленной ферментации. В конкретных вариантах осуществления микроб кондиционируется для существования при высокой концентрации растворителя, высокой температуре, расширенном использовании субстрата, ограничении питательных веществ, осмотическом стрессе из-за сахара и солей, кислотности, сульфитного и бактериального загрязнения или их комбинациях, которые являются признанными стрессовыми условиями промышленной ферментативной среды.
6.5 Пути биосинтеза стевиола и стевиолового гликозида
[0108] В некоторых вариантах осуществления путь биосинтеза стевиола и/или путь биосинтеза стевиолового гликозида активируется в предоставленных здесь генетически модифицированных клетках-хозяевах путем конструирования клеток для экспрессии полинуклеотидов и/или полипептидов, кодирующих один или несколько ферментов пути. ФИГ. 2А иллюстрирует примерный путь биосинтеза стевиола. На ФИГ. 2В показан пример пути биосинтеза стевиолового гликозида, начиная со стевиола и заканчивая различными стевиолового гликозидами.
[0109] Таким образом, в некоторых вариантах осуществления представленные здесь генетически модифицированные клетки-хозяева содержат гетерологичный полинуклеотид, кодирующий полипептид, обладающий активностью геранилгеранилдифосфатсинтазы (GGPPS). В некоторых вариантах осуществления представленные здесь генетически модифицированные клетки-хозяева содержат гетерологичный полинуклеотид, кодирующий полипептид, обладающий активностью копалилдифосфатсинтазы или энт-копалилпирофосфатсинтазы (CDPS; также называемой энт-копалилпирофосфат-синтазой или CPS). В некоторых вариантах осуществления представленные здесь генетически модифицированные клетки-хозяева содержат гетерологичный полинуклеотид, кодирующий полипептид, обладающий активностью каурен-синтазы (KS; также называемой энт-кауренсинтазой). В некоторых вариантах осуществления представленные здесь генетически модифицированные клетки-хозяева содержат гетерологичный полинуклеотид, кодирующий полипептид, обладающий активностью кауреноксидазы (KO; также называемой энт-каурен-19-оксидазой). В некоторых вариантах осуществления представленные здесь генетически модифицированные клетки-хозяева содержат гетерологичный полинуклеотид, кодирующий полипептид, обладающий активностью стевиолсинтазы (также называемой энт-кауреновой кислотой 13-гидроксилазой или KAH). В некоторых вариантах осуществления представленные здесь генетически модифицированные клетки-хозяева содержат гетерологичный полинуклеотид, кодирующий полипептид, обладающий активностью цитохром-Р450-редуктазы (CPR).
[0110] В некоторых вариантах осуществления представленные здесь генетически модифицированные клетки-хозяева содержат гетерологичный полинуклеотид, кодирующий полипептид, обладающий активностью UGT74G1. В некоторых вариантах осуществления представленные здесь генетически модифицированные клетки-хозяева содержат гетерологичный полинуклеотид, кодирующий полипептид, обладающий активностью UGT76G1. В некоторых вариантах осуществления представленные здесь генетически модифицированные клетки-хозяева содержат гетерологичный полинуклеотид, кодирующий полипептид, обладающий активностью UGT85C2. В некоторых вариантах осуществления представленные здесь генетически модифицированные клетки-хозяева содержат гетерологичный полинуклеотид, кодирующий полипептид, обладающий активностью UGT91D. В некоторых вариантах осуществления представленные здесь генетически модифицированные клетки-хозяева содержат гетерологичный полинуклеотид, кодирующий полипептид, обладающий активностью UGT40087.
[0111] В определенных вариантах осуществления клетка-хозяин содержит вариант. В некоторых вариантах осуществления вариант может содержать до 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислотных замен относительно соответствующего полипептида. В некоторых вариантах осуществления вариант может содержать до 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 консервативных аминокислотных замен относительно эталонного полипептида. В определенных вариантах осуществления любая из описанных здесь нуклеиновых кислот может быть оптимизирована для клетки-хозяина, например, оптимизирована по кодонам.
[0112] Типичные нуклеиновые кислоты и ферменты пути биосинтеза стевиола и/или пути биосинтеза стевиолового гликозида описаны ниже.
6.5.1 Геранилгеранилдифосфатсинтазы (GGPPS)
[0113] Геранилгеранилдифосфатсинтазы (ЕС 2.5.1.29) катализируют преобразование фарнезилпирофосфата в геранилгеранилдифосфат (также известный как геранилгеранилпирофосфат). Иллюстративными примерами ферментов являются ферменты Stevia rebaudiana (учетный номер ABD92926), Gibberella fujikuroi (учетный номер САА75568), Mus musculus (учетный номер ААН69913), Thalassiosira pseudonana (учетный номер ХР_002288339), Streptomyces clavuligerus (учетный номер ZP_05004570), Sulfulobus acidocaldarius (учетный номер ВАА43200), Synechococcus sp. (учетный номер АВС98596), Arabidopsis thaliana (учетный номер NP_195399), Blakeslea trispora (учетный номер AFC92798.1) и US 2014/0329281 A1. Нуклеиновые кислоты, кодирующие эти ферменты, полезны в представленных здесь клетках и способах. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%, 85%, 90% или 95% идентична последовательности одной из этих нуклеиновых кислот GGPPS. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид с последовательностью, идентичной последовательности одного из этих ферментов GGPPS не менее чем на 80%, 85%, 90%, 95%.
6.5.2 Копалилдифосфатсинтазы (CDPS)
[0114] Копалилдифосфатсинтазы (ЕС 5.5.1.13) катализируют преобразование геранилгеранилдифосфата в копалилдифосфат. Иллюстративные примеры ферментов включают ферменты Stevia rebaudiana (учетный номер ААВ87091), Streptomyces clavuligerus (учетный номер EDY51667), Bradyrhizobium japonicum (учетный номер ААС28895.1), Zea mays (учетный номер AY562490). NM_116512), Arabidopsis thaliana (учетный номер NM_116512), Oryza sativa (учетный номер Q5MQ85.1) и US 2014/0329281 A1. Нуклеиновые кислоты, кодирующие эти ферменты, полезны в представленных здесь клетках и способах. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%, 85%, 90% или 95% идентична последовательности одной из этих нуклеиновых кислот CDPS. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид с последовательностью, идентичной последовательности одного из этих ферментов CDPS не менее чем на 80%, 95%, 90% или 95%.
6.5.3 Каурен-синтазы (KS)
[0115] Каурен-синтазы (ЕС 4.2.3.19) катализируют преобразование копалилдифосфата в каурен и дифосфат. Иллюстративные примеры ферментов включают ферменты Bradyrhizobium japonicum (учетный номер ААС28895.1), Phaeosphaeria sp. (учетный номер 013284), Arabidopsis thaliana (учетный номер Q9SAK2), Picea glauca (учетный номер ADB55711.1) и US 2014/0329281 A1. Нуклеиновые кислоты, кодирующие эти ферменты, полезны представленных здесь в клетках и способах. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%, 85%, 90% или 95% идентична последовательности одной из этих нуклеиновых кислот KS. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид, с последовательнстью, идентичной последовательности одного из этих ферментов KS не менее чем на 80%, 85%, 85%, 90%.
6.5.4 Бифункциональная копалидифосфат-синтаза (CDPS) и каурен-синтаза (KS)
[0116] CDPS-KS бифункциональные ферменты (ЕС 5.5.1.13 и ЕС 4.2.3.19) также могут быть использованы. Наглядные примеры ферментов включают ферменты Phomopsis amygdali (учетный номер BAG30962), Physcomitrella patens (учетный номер BAF61135), Gibberella fujikuroi (учетный номер Q9UVY5.1) и US 2014/0329281 A1, US 2014/0357588 A1, US 2015/0159188 и WO 2016/038095 A2. Нуклеиновые кислоты, кодирующие эти ферменты, полезны представленных здесь в клетках и способах. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%о, 85%, 90% или 95% идентична последовательности одной из этих нуклеиновых кислот CDPS-KS. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид, с последовательнстью, идентичной последовательности одного из этих ферментов CDPS-KS не менее чем на 80%, 85%, 90% или 95%.
6.5.5 Энтакауреноксидазы (KO)
[0117] Энтакауреноксидазы (ЕС 1.14.13.78; также именуемые здесь кауреноксидазами) катализируют преобразование каурена в кауреновую кислоту. Иллюстративные примеры энзимов включают ферменты Oryza sativa (учетный номер Q5Z5R4), Gibberella fujikuroi (учетный номер O94142), Arabidopsis thaliana (учетный номер Q93ZB2), Stevia rebaudiana (учетный номер AAQ63464.1), Pisum sativum (Unip notivot (Unip). Q6XAF4) и US 2014/0329281 A1, US 2014/0357588 A1, US 2015/0159188 и WO 2016/038095 A2. Нуклеиновые кислоты, кодирующие эти ферменты, полезны в представленных здесь клетках и способах. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%, 85%, 90% или 95% идентична последовательности одной из этих нуклеиновых кислот КО. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид, с последовательнстью, идентичной последовательности одного из этих ферментов KO не менее чем на 80%, 85%, 90%.
6.5.6 Стевиолсинтазы (KAH)
[0118] Стевиолсинтазы или гидроксилазы кауреновой кислоты (KAH) (ЕС 1.14.13) катализируют преобразование кауреновой кислоты в стевиол. Иллюстративные примеры ферментов включают в себя ферменты Stevia rebaudiana (учетный номер ACD93722), Stevia rebaudiana (учетный номер 10), Arabidopsis thaliana (учетный номер NP_197872), Vitis vinifera (учетный номер ХР_002282091), Medicago trunculata (учетный номер76С90) и US 2014/0329281 A1, US 2014/0357588 A1, US 2015/0159188 и WO 2016/038095 A2. Нуклеиновые кислоты, кодирующие эти ферменты, полезны в клетках и способах, представленных здесь. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%, 85%, 90% или 95% идентична последовательности одной из этих нуклеиновых кислот KAH. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид, с последовательнстью, идентичной последовательности одного из этих ферментов KAH не менее чем на 80%, 85%, 90% или 95%.
6.5.7 Цитохром Р450 редуктазы (CPR)
[0119] Цитохром Р450 редуктазы (ЕС 1.6.2.4) способны содействовать или облегчать описанную выше активность KO и/или KAH. Иллюстративными примерами ферментов являются ферменты Stevia rebaudiana (учетный номер АВВ88839) Arabidopsis thaliana (учетный номер NP_194183), Gibberella fujikuroi (учетный номер САЕ09055), Artemisia annua (учетный номер АВС47946.1) и US 2014/0329281 A1, US 2014/0357588 A1, US 2015/0159188 и WO 2016/038095 A2. Нуклеиновые кислоты, кодирующие эти ферменты, полезны в представленных здесь клетках и способах. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%, 85%, 90% или 95% идентична последовательности одной из этих нуклеиновых кислот CPR. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид, с последовательнстью, идентичной последовательности одного из этих ферментов CPR не менее чем на 80%, 85%, 90%.
6.5.8 UDP гликозилтрансфераза 74G1 (UGT74G1)
[0120] UGT74G1 способен функционировать как уридин-5'-дифосфоглюкозил: стевиол-19-СООН-трансфераза и как уридин-5'-дифосфоглюкозил : стевиол-13-O-глюкозид-19-СООН-трансфераза. Как показано на ФИГ. 2В, UGT74G1 способен преобразовывать стевиол в 19-гликозид. UGT74G1 также способен преобразовывать стевиолмонозид в рубусозид. UGT74G1 также может преобразовывать стевиолбиозид в стевиозид. Иллюстративные примеры ферментов включают ферменты Stevia rebaudiana (например, ферменты Richman и др., 2005, Plant J. 41: 56-67 и US 2014/0329281 и WO 2016/038095 А2 и учетный номер AAR06920.1). Нуклеиновые кислоты, кодирующие эти ферменты, полезны в представленных здесь клетках и способах. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%, 85%, 90% или 95% идентична последовательности одной из этих нуклеиновых кислот UGT74G1. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид, с последовательнстью, идентичной последовательности одного из этих ферментов UGT74G1 не менее чем на 80%, 85%, 90% или 95%.
6.5.9 UDP гликозилтрансфераза 76G1 (UGT76G1)
[0121] UGT76G1 способен переносить глюкозный фрагмент в позицию С-3'С-13-О-глюкозы акцепторной молекулы, стевиоловых гликозидов 1,2. Таким образом, UGT76G1 способен функционировать как 5'-дифосфоглюкозил уридин:стевиол-13-O-1,2-глюкозид-С-3'-глюкозилтрансфераза и 5'-дифосфоглюкозил уридин:стевиол-19-O-глюкоза, 13-O-1,2 биозид С-3' глюкозилтрансфераза. Как показано на ФИГ. 2A, UGT76G1 способен преобразовывать стевиолбиозид в RebB. UGT76G1 также способен преобразовывать стевиозид в RebA. UGT76G1 также способен конвертировать RebD в RebM. Иллюстративные примеры ферментов включают ферменты Stevia rebaudiana (например, ферменты Richman и др., 2005, Plant J. 41: 56-67 и US 2014/0329281 A1 и WO 2016/038095 А2 и учетный номер AAR06912.1). Нуклеиновые кислоты, кодирующие эти ферменты, полезны в представленных здесь клетках и способах. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%, 85%, 90% или 95% идентична последовательности одной из этих нуклеиновых кислот UGT76G1. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид, с последовательнстью, идентичной последовательности одного из этих ферментов UGT76G1 не менее чем на 80%, 85%, 90% или 95%.
6.5.10 UDP гликозилтрансфераза 85С2 (UGT85C2)
[0122] UGT85C2 способен функционировать как уридин-5'-дифосфоглюкозил: стевиол-13-ОН-трансфераза и уридин-5'-дифосфоглюкозил : стевиол-19-O-глюкозид-13-ОН-трансфераза. Таким образом, как показано на ФИГ. 2В, UGT85C2 способен преобразовывать стевиол в стевиолмонозид, а также способен преобразовывать 19-гликозид в рубусозид. Иллюстративные примеры ферментов включают ферменты Stevia rebaudiana (например, ферменты Richman и др., 2005, Plant J. 41: 56-67 и US 2014/0329281 A1 и WO 2016/038095 А2 и учетный номер AAR06916.1). Нуклеиновые кислоты, кодирующие эти ферменты, полезны в представленных здесь клетках и способах. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%, 85%, 90% или 95% идентична последовательности одной из этих нуклеиновых кислот UGT85C2. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид, с последовательнстью, идентичной последовательности одного из этих ферментов UGT85C2 не менее чем на 80%), 85%, 90% или 95%.
6.5.11 UDP- гликозилтрансфераза 91D (UGT91D)
[0123] UGT91D способен функционировать в качестве уридин-5'-дифосфоглюкозил : стевиол-13-O-глюкозидтрансферазы, перенося глюкозный фрагмент в позицию С-2 '13-0-глюкозы акцепторной молекулы, стевиол-13-О-глюкозид (стевиолмонозид) для получения стевиобиозида. UGT91D также способен функционировать в качестве уридин-5'-дифосфоглюкозил:рубусозидтрансферазы, перенося глюкозную составляющую в позицию С-2'13-О-глюкозы акцепторной молекулы рубусозида, для получения стевиозида, как показано на ФИГ. 2В. UGT91D также способен переносить глюкозный фрагмент в позицию С-2'19-О-глюкозы RebA, для получения RebD, как показано на ФИГ. 2В. UGT91D также упоминается как UGT91D2, UGT91D2e или UGT91D-like3. Иллюстративные примеры ферментов UGT91D включают ферменты Stevia rebaudiana (например, ферменты UGT с номером доступа АСЕ87855.1, US 2014/0329281 A1, WO 2016/038095 А2 и SEQ ID NO: 7). Нуклеиновые кислоты, кодирующие эти ферменты, полезны в представленных здесь клетках и способах. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%, 85%, 90% или 95% идентична последовательности одной из этих нуклеиновых кислот UGT91D. В определенных вариантах осуществления здесь представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид, с последовательнстью, идентичной последовательности одного из этих ферментов UGT91D не менее чем на 80%, 85%, 90% или 95%.
6.5.12 UDP-гликозилтрансфераза 40087 (UGT40087)
[0124] UGT40087 способен переносить глюкозный фрагмент в позицию С-2'19-О-глюкозы RebA, для получения RebD, как показано на ФИГ. 2В. UGT40087 также способен переносить глюкозный фрагмент в позицию С-2'19-О-глюкозы стевиозида с образованием RebE. Иллюстративные примеры UGT40087 описаны выше в разделе 5.2. Любой описанный здесь вариант UGT40087 может быть использован в описанных здесь композициях и способах. Нуклеиновые кислоты, кодирующие эти ферменты, полезны в представленных здесь клетках и способах. В определенных вариантах осуществления в настоящем документе представлены клетки и способы, использующие нуклеиновую кислоту, последовательность которой не менее чем на 80%, 85%, 90% или 95% идентична последовательности одного из ферментов UGT40087. В определенных вариантах осуществления в настоящем документе представлены клетки и способы, использующие нуклеиновую кислоту, которая кодирует полипептид, с последовательнстью, идентичной последовательности одного из этих ферментов UGT40087 не менее чем на 80%, 85%, 90% или 95%. В конкретных вариантах осуществления в данном документе представлена нуклеиновая кислота, которая кодирует описанный здесь вариант UGT40087.
6.6 Путь MEV для производства FPP и/или GGPP
[0125] В некоторых вариантах осуществления представленная здесь генетически модифицированная клетка-хозяин содержит один или несколько гетерологичных ферментов пути MEV, полезных для образования фарнезилпирофосфата (FPP) и/или геранилгеранил пирофосфата (GGPP). В некоторых вариантах осуществления один или несколько ферментов пути MEV содержат фермент, который конденсирует ацетил-КоА с малонил-КоА с образованием ацетоацетил-КоА. В некоторых вариантах осуществления один или несколько ферментов пути MEV содержат фермент, который конденсирует две молекулы ацетил-КоА с образованием ацетоацетил-КоА. В некоторых вариантах осуществления один или несколько ферментов пути MEV содержат фермент, который конденсирует ацетоацетил-КоА с ацетил-КоА с образованием HMG-КоА. В некоторых вариантах осуществления один или несколько ферментов пути MEV содержат фермент, который преобразует HMG-КоА в мевалонат. В некоторых вариантах осуществления один или несколько ферментов пути MEV содержат фермент, который фосфорилирует мевалонат до мевалоната 5-фосфата. В некоторых вариантах осуществления один или несколько ферментов пути MEV содержат фермент, который преобразует мевалонат-5-фосфат в мевалонат-5-пирофосфат. В некоторых вариантах осуществления один или несколько ферментов пути MEV содержат фермент, который преобразует мевалонат-5-пирофосфат в изопентенил-пирофосфат.
[0126] В некоторых вариантах осуществления один или несколько ферментов пути MEV выбирают из группы, состоящей из ацетил-КоА-тиолазы, ацетоацетил-КоА-синтетазы, HMG-КоА-синтазы, HMG-КоА-редуктазы, мевалонат-киназы, фосфомавалонат-киназы и мевалонат пирофосфат декарбоксилазы. В некоторых вариантах осуществления в отношении фермента пути MEV, способного катализировать образование ацетоацетил-КоА, генетически модифицированная клетка-хозяин содержит либо фермент, который конденсирует две молекулы ацетил-КоА с образованием ацетоацетил-КоА, например, ацетил-КоА тиолазы; или фермент, который конденсирует ацетил-КоА с малонил-КоА с образованием ацетоацетил-КоА, например ацетоацетил-КоА-синтазы. В некоторых вариантах осуществления генетически модифицированная клетка-хозяин содержит фермент, который конденсирует две молекулы ацетил-КоА с образованием ацетоацетил-КоА, например, ацетил-КоА-тиолазы; и фермент, который конденсирует ацетил-КоА с малонил-КоА с образованием ацетоацетил-КоА, например, ацетоацетил-КоА-синтазы.
[0127] В некоторых вариантах осуществления клетка-хозяин содержит одну или несколько гетерологичных нуклеотидных последовательностей, кодирующих более одного фермента пути MEV. В некоторых вариантах осуществления клетка-хозяин содержит одну или несколько гетерологичных нуклеотидных последовательностей, кодирующих два фермента пути MEV. В некоторых вариантах осуществления клетка-хозяин содержит одну или несколько гетерологичных нуклеотидных последовательностей, кодирующих фермент, который может преобразовывать HMG-КоА в мевалонат, и фермент, который может преобразовывать мевалонат в мевалонат 5-фосфат. В некоторых вариантах осуществления клетка-хозяин содержит одну или несколько гетерологичных нуклеотидных последовательностей, кодирующих три фермента пути MEV. В некоторых вариантах осуществления клетка-хозяин содержит одну или несколько гетерологичных нуклеотидных последовательностей, кодирующих четыре фермента пути MEV. В некоторых вариантах осуществления клетка-хозяин содержит одну или несколько гетерологичных нуклеотидных последовательностей, кодирующих пять ферментов пути MEV. В некоторых вариантах осуществления клетка-хозяин содержит одну или несколько гетерологичных нуклеотидных последовательностей, кодирующих шесть ферментов пути MEV. В некоторых вариантах осуществления клетка-хозяин содержит одну или несколько гетерологичных нуклеотидных последовательностей, кодирующих семь ферментов пути MEV. В некоторых вариантах осуществления клетка-хозяин содержит множество гетерологичных нуклеиновых кислот, кодирующих все ферменты пути MEV.
[0128] В некоторых вариантах генетически модифицированная клетка-хозяин дополнительно содержит гетерологичную нуклеиновую кислоту, кодирующую фермент, который может преобразовывать изопентенилпирофосфат (IPP) в диметилаллилпирофосфат (DMAPP). В некоторых вариантах осуществления генетически модифицированная клетка-хозяин дополнительно содержит гетерологичную нуклеиновую кислоту, кодирующую фермент, который может конденсировать молекулы IPP и/или DMAPP с образованием полипренильного соединения. В некоторых вариантах осуществления генетически модифицированная клетка-хозяин дополнительно содержит гетерологичную нуклеиновую кислоту, кодирующую фермент, который может модифицировать IPP или полипренил, с образованием изопреноидного соединения, такого как фарнезен.
6.6.1 Преобразование ацетил-КоА в ацетоацетил-КоА
[0129] В некоторых вариантах осуществления генетически модифицированная клетка-хозяин содержит гетерологичную нуклеотидную последовательность, кодирующую фермент, который может конденсировать две молекулы ацетил-кофермента А с образованием ацетоацетил-КоА, например, ацетил-КоА-тиолазы. Иллюстративные примеры нуклеотидных последовательностей, кодирующих такой фермент, включают, в том числе: (NC_000913 REGION: 2324131.2325315; Escherichia coli), (D49362; Paracoccus denitrificans) и (L20428; Saccharomyces cerevisiae).
[0130] Ацетил-КоА-тиолаза катализирует обратимую конденсацию двух молекул ацетил-КоА с образованием ацетоацетил-КоА, но эта реакция термодинамически неблагоприятна; тиолиз ацетоацетил-КоА предпочтительнее синтеза ацетоацетил-КоА. Ацетоацетил-КоА-синтаза (AACS) (называемая либо ацетил-КоА, либо малонил-КоА-ацилтрансфераза; ЕС 2.3.1.194) конденсирует ацетил-КоА с малонил-КоА с образованием ацетоацетил-КоА. В отличие от ацетил-КоА-тиолазы, катализируемый AACS синтез ацетоацетил-КоА является по существу благоприятной для энергии реакцией вследствие ассоциированного декарбоксилирования малонил-КоА. Кроме того, AACS не проявляет активности тиолиза против ацетоацетил-КоА, и, таким образом, реакция необратима.
[0131] В клетках-хозяевах, содержащих ацетил-СоА-тиолазу и гетерологичный фермент аденозиндеаминаза (ADA) и/или фосфотрансацетилазу (РТА), обратимая реакция, катализируемая ацетил-СоА-тиолазой, которая способствует тиолизу ацетоацетил-КоА, может привести к большому пулу ацетил-КоА. Ввиду обратимой активности ADA, этот пул ацетил-КоА может, в свою очередь, приводить ADA в направлении обратной реакции преобразования ацетил-КоА в ацетальдегид, тем самым уменьшая преимущества, предоставляемые ADA, по отношению к образованию ацетил-КоА. Точно так же активность РТА обратима, и, таким образом, большой пул ацетил-КоА может стимулировать РТА в направлении обратной реакции преобразования ацетил-КоА в ацетилфосфат. Следовательно, в некоторых вариантах осуществления, чтобы обеспечить сильное притяжение ацетил-КоА для стимулирования прямой реакции ADA и РТА, в пути MEV генетически модифицированной клетки-хозяина, представленной здесь, используется ацетоацетил-КоА-синтаза для образования ацетоацетил-КоА из ацетил-КоА и малонил-КоА.
[0132] В некоторых вариантах осуществления AACS относится к Streptomyces sp. штамм CL190 (Okamura и др., Proc Natl Acad Sci USA 107 (25): 11265-70 (2010). Репрезентативные нуклеотидные последовательности AACS штамма Streptomyces sp. CL190 включают регистрационный номер АВ540131.1. Репрезентативные последовательности белка AACS Streptomyces sp.штамма CL190 включают регистрационные номера D7URV0, BAJ10048. Другие ацетоацетил-СоА-синтазы, полезные представленных здесь для композиций и способов, включают, в том числе, Streptomyces sp.(АВ183750; KO-3988 BAD86806); S. anulatus strain 9663 (FN178498; САХ48662); Streptomyces sp KO-3988 (AB212624; BAE78983); Actinoplanes sp A40644 (AB113568; BAD07381); Streptomyces sp. С (NZ_ACEW010000640; ZP_05511702); Nocardiopsis dassonvillei DSM 43111 (NZ_ABUI01000023; ZP_04335288); Mycobacterium ulcerans Agy99 (NC 008611; YP_907152); Mycobacterium marinum M (NC_010612; YP_001851502); Streptomyces sp. Mg1 (NZ_DS570501; ZP_05002626); Streptomyces sp. AA4 (NZ_ACEV01000037; ZP_05478992); S roseosporus NRRL 15998 (NZ_ABYB01000295; ZP_04696763); Streptomyces sp ACTE (NZ_ADFD01000030; ZP_06275834); S. viridochromogenes DSM 40736 (NZ_ACEZ01000031; ZP_05529691); Frankia sp. CcI3 (NC_007777; YP_480101); Nocardia brasiliensis (NC_018681; YP_006812440.1); и Austwickia chelonae (NZ_BAGZ01000005; ZP_10950493.1). Дополнительные подходящие ацетоацетил-КоА-синтазы включают те, которые описаны в публикациях патентных заявок США №2010/0285549 и №2011/0281315, содержание которых полностью включено в качестве ссылки.
[0133] Ацетоацетил-СоА-синтазы, также полезные в представленных здесь композициях и способах, включают те молекулы, которые называются «производными» любой из описанных здесь ацетоацетил-СоА-синтаз. Такое «производное» имеет следующие характеристики: (1) имеет существенную гомологию с любой из описанных здесь ацетоацетил-СоА-синтаз; и (2) способно катализировать необратимую конденсацию ацетил-КоА с малонил-КоА с образованием ацетоацетил-КоА. Считается, что производное ацетоацетил-СоА-синтазы имеет «существенную гомологию» с ацетоацетил-СоА-синтазой, если аминокислотные последовательности производного составляют не менее чем на 80% и, более предпочтительно, не менее чем на 90% и, наиболее предпочтительно, не менее чем на 95% аналогичны последовательности ацетоацетил-КоА-синтазы.
6.6.2 Преобразование ацетоацетил-КоА в HMG-КоА
[0134] В некоторых вариантах осуществления клетка-хозяин содержит гетерологичную нуклеотидную последовательность, кодирующую фермент, который может конденсировать ацетоацетил-КоА с другой молекулой ацетил-КоА с образованием 3-гидрокси-3-метилглутарил-КоА (HMG-КоА), например, HMG-КоА-синтазы. Иллюстративные примеры нуклеотидных последовательностей, кодирующих такой фермент, включают, в том числе: (NC_001145. Комплемент 19061.20536; Saccharomyces cerevisiae), (Х96617; Saccharomyces cerevisiae), (X83882; Arabidopsis thaliana), (AB037907; Kitasatospora griseola), (BT007302; Homo sapiens), и (NC_002758, Locus tag SAV2546, GeneID 1122571; Staphylococcus aureus).
6.6.3 Преобразование ГМГ-КоА в мевалонат
[0135] В некоторых вариантах осуществления клетка-хозяин содержит гетерологичную нуклеотидную последовательность, кодирующую фермент, который может преобразовывать HMG-КоА в мевалонат, например, HMG-КоА-редуктазу. В некоторых вариантах осуществления HMG-КоА-редуктаза представляет собой NADH-использующую гидроксиметилглутарил-КоА-редуктазу-КоА-редуктазу. Редуктазы HMG-КоА (ЕС 1.1.1.34; ЕС 1.1.1.88) катализируют восстановительное деацилирование (S) -HMG-КоА до (R)-мевалоната и могут быть разделены на два класса, HMGrs класса I и класса II. Класс I включает ферменты эукариотов и большинства архей, а класс II включает редуктазы HMG-КоА некоторых прокариотов и архей. Помимо расхождения в последовательностях, ферменты двух классов также различаются в отношении их специфичности кофактора. В отличие от ферментов класса I, которые используют исключительно NADPH, редуктазы HMG-КоА класса II различаются по способности различать NADPH и NADH. См., например, Hedl и др., Journal of Bacteriology 186 (7): 1927-1932 (2004). Особенности кофакторов для избранных редуктаз HMG-КоА класса II представлены ниже.
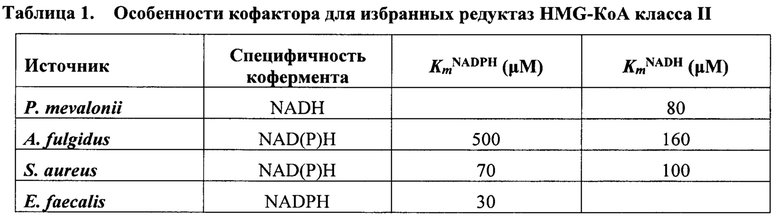
[0136] Используемые HMG-КоА редуктазы для представленных здесь композиций и способов включают HMG-КоА редуктазы, которые способны использовать NADH в качестве кофактора, например, HMG-КоА редуктазу из P. mevalonii, A.fulgidus или S. aureus. В конкретных вариантах осуществления HMG-КоА редуктаза способна использовать в качестве кофактора только NADH, например, HMG-КоА редуктазу из P. mevalonii, S. pomeroyi или D. acidovorans.
[0137] В некоторых вариантах осуществления использующая NADH HMG-КоА редуктаза происходит из Pseudomonas mevalonii. Последовательность гена mvaA дикого типа Pseudomonas mevalonii, который кодирует HMG-КоА редуктазу (ЕС 1.1.1.88), была описана ранее. См. Beach and Rodwell, J. Bacteriol. 171: 2994-3001 (1989). Репрезентативные нуклеотидные последовательности mvaA из Pseudomonas mevalonii включают регистрационный номер М24015. Типичные последовательности белка HMG-КоА редуктазы Pseudomonas mevalonii включают регистрационные номера ААА25837, Р13702, MVAA_PSEMV.
[0138] В некоторых вариантах осуществления использующая NADH HMG-КоА редуктаза происходит от Silicibacter pomeroyi. Репрезентативные нуклеотидные последовательности HMG-КоА-редуктазы Silicibacter pomeroyi включают регистрационный номер NC_006569.1. Типичные последовательности белка HMG-КоА редуктазы в Silicibacter pomeroyi включают регистрационный номер YP_164994.
[0139] В некоторых вариантах осуществления использующая NADH HMG-КоА редуктаза происходит от Delftia acidovorans. Типичные нуклеотидные последовательности HMG-КоА-редуктазы Delftia acidovorans включают NC_010002 REGION: комплемент (319980…321269). Типичные последовательности белка HMG-КоА редуктазы Delftia acidovorans включают регистрационный номер YP_001561318.
[0140] В некоторых вариантах осуществления использующая NADH HMG-КоА редуктаза получена из Solanum tuberosum. (Crane и др., J. Plant Physiol. 159:1301-1307 (2002)).
[0141] Использующие NADH HMG-KoA-редуктазы, также полезные в представленных здесь композициях и способах, включают те молекулы, которые называют «производными» любой из описанных здесь использующих NADH HMG-KoA-редуктаз, например, из P. mevalonii. S. pomeroyi и D. acidovorans. Такое «производное» имеет следующие характеристики: (1) имеет существенную гомологию с любой из описанных здесь NDH-использующих HMG-КоА редуктаз; и (2) способно катализировать восстановительное деацилирование (S)-HMG-КоА до (R)-мевалоната, предпочтительно используя в качестве кофактора NADH. Считается, что производное NADH-использующей HMG-КоА-редуктазы имеет «существенную гомологию» с NADH-использующей HMG-КоА-редуктазой, если аминокислотные последовательности производного не менее чем на 80% и, более предпочтительно, не менее чем на 90% и, наиболее предпочтительно, не менее чем на 95% аналогичны последовательности NADH-использующей HMG-КоА редуктазы.
[0142] Используемое здесь выражение «использование NADH» означает, что HMG-КоА-редуктаза, использующая NADH, является селективной в отношении NADH по сравнению с NADPH в качестве кофактора, например, демонстрируя более высокую специфическую активность для NADH, чем для NADPH. В некоторых вариантах осуществления селективность в отношении NADH в качестве кофактора выражается в виде отношения kcat(NADH)/ kcat(NADPH). В некоторых вариантах осуществления NDH-использующая HMG-KoA редуктаза имеет отношение kcat(NADH)/ kcat(NADPH), не менее 5, 10, 15, 20, 25 или более 25. В некоторых вариантах осуществления NADH-использующая HMG-КоА редуктаза использует исключительно NADH. Например, NADH-использующая HMG-КоА редуктаза, которая использует исключительно NADH, отображает некоторую активность с NADH, поставляемым в качестве единственного кофактора in vitro, и не обнаруживает определяемой активности, когда в качестве единственного кофактора предоставляется NADPH. Любой метод определения специфичности кофактора, известный в данной области, может быть использован для идентификации редуктаз HMG-КоА, предпочитающих в качестве кофактора NADH, включая те, которые описаны Kim и др., Protein Science 9: 1226-1234 (2000); и Wilding и др., J. Bacteriol. 182 (18): 5147-52 (2000), содержание которого полностью включено в настоящий документ.
[0143] В некоторых вариантах осуществления изобретения NADH-использующая HMG-КоА редуктаза сконструирована так, чтобы она была селективной в отношении NADH по сравнению с NAPDH, например, посредством сайт-направленного мутагенеза кофактор-связывающего кармана. Методы конструирования NADH-селективности описаны в Watanabe и др., Microbiology 153: 3044-3054 (2007), а методы определения кофакторной специфичности редуктаз HMG-КоА описаны в Kim и др., Protein Sci. 9: 1226-1234 (2000), содержание которого полностью включено в настоящее описание посредством ссылки.
[0144] В некоторых вариантах осуществления NMH-использующая HMG-КоА редуктаза получена из видов-хозяев, которые нативно включают путь деградации мевалоната, например, из вида-хозяина, который катаболизирует мевалонат в качестве его единственного источника углерода. В этих вариантах осуществления NADH-использующая HMG-КоА-редуктаза, которая обычно катализирует окислительное ацилирование интернализованного (R)-мелоната до (S)-HMG-КоА в его нативной клетке-хозяине, используется для каталитической обратной реакции, то есть восстановительного деацилирования (S)-HMG-КоА до (R)-мевалоната в генетически модифицированной клетке-хозяине, содержащей путь биосинтеза мевалоната. Прокариоты, способные расти на мевалонате как их единственном источнике углерода, были описаны в работах Anderson и др., J. Bacteriol, 171(12):6468-6472 (1989); Beach и др., J. Bacteriol. 171:2994- 3001 (1989); Bensch и др., J. Biol. Chem. 245:3755-3762; Fimongnari и др., Biochemistry 4:2086-2090 (1965); Siddiqi и др., Biochem. Biophys. Res. Commun. 8:110-113 (1962); Siddiqi и др., J. Bacteriol. 93:207-214 (1967); и Takatsuji и др., Biochem. Biophys. Res. Commun 10:187-193 (1983), содержание которых полностью включено в настоящее описание посредством ссылки.
[0145] В некоторых вариантах осуществления представленных здесь композиций и способов, клетка-хозяин содержит как HMGr, использующий NADH, так и HMG-КоА редуктазу, использующую NADPH. Иллюстративные примеры нуклеотидных последовательностей, кодирующих NADPH-использующую HMG-КоА редуктазу, включают, в том числе: (NM_206548; Drosophila melanogaster), (NC_002758, Locus tag SAV2545, GeneID 1122570; Staphylococcus aureus), (AB015627; Streptomyces sp. KO 3988), (AX128213, предоставление последовательности, кодирующей усеченную HMG-КоА-редуктазу; Saccharomyces cerevisiae), и (NC_001145: комплемент (115734.118898; Saccharomyces cerevisiae).
6.6.4 Преобразование мевалоната в мевалонат-5-фосфат
[0146] В некоторых вариантах осуществления клетка-хозяин содержит гетерологичную нуклеотидную последовательность, кодирующую фермент, который может преобразовывать мевалонат в мевалонат-5-фосфат, например мевалонат-киназу. Иллюстративные примеры нуклеотидных последовательностей, кодирующих такой фермент, включают, в том числе: (L77688; Arabidopsis thaliana) и (Х55875; Saccharomyces cerevisiae).
6.6.5 Преобразование мевалонат-5-фосфата в мевалонат-5-пирофосфат
[0147] В некоторых вариантах осуществления клетка-хозяин содержит гетерологичную нуклеотидную последовательность, кодирующую фермент, который может преобразовывать мевалонат-5-фосфат в мевалонат-5-пирофосфат, например, фосфомевалонат-киназу. Иллюстративные примеры нуклеотидных последовательностей, кодирующих такой фермент, включают, в том числе: (AF429385; Hevea brasiliensis), (NM_006556; Homo sapiens), и (NC_001145. комплемент 712315.713670; Saccharomyces cerevisiae).
6.6.6 Преобразование мевалонат-5-пирофосфата в IPP
[0148] В некоторых вариантах осуществления клетка-хозяин содержит гетерологичную нуклеотидную последовательность, кодирующую фермент, который может преобразовывать мевалонат-5-пирофосфат в изопентенилдифосфат (IPP), например, мевалонат-пирофосфатдекарбоксилазу. Иллюстративные примеры нуклеотидных последовательностей, кодирующих такой фермент, включают, в том числе: (Х97557; Saccharomyces cerevisiae), (AF290095; Enterococcus faecium), и (U49260; Homo sapiens).
6.6.7 Преобразование IPP в DMAPP
[0149] В некоторых вариантах осуществления клетка-хозяин дополнительно содержит гетерологичную нуклеотидную последовательность, кодирующую фермент, который может преобразовывать IPP, генерируемый посредством пути MEV, в диметилаллилпирофосфат (DMAPP), например, изомеразу IPP. Иллюстративные примеры нуклеотидных последовательностей, кодирующих такой фермент, включают, в том числе: (NC_000913, 3031087.3031635; Escherichia coli), и (AF082326; Haematococcuspluvialis).
6.6.8 Полипренильные синтазы
[0150] В некоторых вариантах осуществления клетка-хозяин дополнительно содержит гетерологичную нуклеотидную последовательность, кодирующую полипренилсинтазу, которая может конденсировать молекулы IPP и/или DMAPP с образованием полипренильных соединений, содержащих более пяти атомов углерода.
[0151] В некоторых вариантах осуществления изобретения клетка-хозяин содержит гетерологичную нуклеотидную последовательность, кодирующую фермент, который может конденсировать одну молекулу IPP с одной молекулой DMAPP с образованием одной молекулы геранилпирофосфата («GPP»), например, синтазы GPP. Иллюстративные примеры нуклеотидных последовательностей, кодирующих такой фермент, включают, в том числе: (AF513111; Abies grandis), (AF513112; Abies grandis), (AF513113; Abies grandis), (AY534686; Antirrhinum majus), (AY534687; Antirrhinum majus), (Y17376; Arabidopsis thaliana), (AE016877, Locus API 1092; Bacillus cereus; ATCC 14579), (AJ243739; Citrus sinensis), (AY534745; Clarkia breweri), (AY953508; Ips pini), (DQ286930; Lycopersicon esculentum), (AF182828; Mentha x piperita), (AF182827; Mentha x piperita), (MPI249453; Mentha x piperita), (PZE431697, Locus CAD24425; Paracoccus zeaxanthinifaciens), (AY866498; Picrorhiza kurrooa), (AY351862; Vitis vinifera), и (AF203881, Locus AAF12843; Zymomonas mobilis).
[0152] В некоторых вариантах осуществления клетка-хозяин содержит гетерологичную нуклеотидную последовательность, кодирующую фермент, который может конденсировать две молекулы IPP с одной молекулой DMAPP или добавлять молекулу IPP к молекуле GPP, чтобы образовать молекулу фарнезилпирофосфата («FPP»), например, синтаза FPP. Иллюстративные примеры нуклеотидных последовательностей, которые кодируют такой фермент, включают, в том числе: (ATU80605; Arabidopsis thaliana), (ATHFPS2R; Arabidopsis thaliana), (AAU36376; Artemisia annua), (AF461050; Bos taurus), (D00694; Escherichia coli K-12), (AE009951, Locus AAL95523; Fusobacterium nucleatum subsp. nucleatum ATCC 25586), (GFFPPSGEN; Gibberella fujikuroi), (CP000009, Locus AAW60034; Gluconobacter oxydans 621H), (AF019892; Helianthus annuus), (HUMFAPS; Homo sapiens), (KLPFPSQCR; Kluyveromyces lactis), (LAU15777; Lupinus albus), (LAU20771; Lupinus albus), (AF309508; Mus musculus), (NCFPPSGEN; Neurospora crassa), (PAFPS1; Parthenium argentatum), (PAFPS2; Parthenium argentatum), (RATFAPS; Rattus norvegicus), (YSCFPP; Saccharomyces cerevisiae), (D89104; Schizosaccharomyces pombe), (CP000003, Locus AAT87386; Streptococcus pyogenes), (CP000017, Locus AAZ51849; Streptococcus pyogenes), (NC_008022, Locus YP_598856; Streptococcus pyogenes MGAS10270), (NC_008023, Locus YP_600845; Streptococcus pyogenes MGAS2096), (NC_008024, Locus YP_602832; Streptococcus pyogenes MGAS10750), (MZEFPS; Zea mays), (AE000657, Locus AAC06913; Aquifex aeolicus VF5), (NM_202836; Arabidopsis thaliana), (D84432, Locus BAA12575; Bacillus subtilis), (U12678, Locus AAC28894; Bradyrhizobium japonicum USDA 110), (BACFDPS; Geobacillus stearothermophilus), (NC_002940, Locus NP_873754; Haemophilus ducreyi 35000HP), (L42023, Locus AAC23087; Haemophilus influenzae Rd KW20), (J05262; Homo sapiens), (YP_395294; Lactobacillus sakei subsp.sakei 23K), (NC_005823, Locus YP_000273; Leptospira interrogans serovar Copenhageni str. Fiocruz L1-130), (AB003187; Micrococcus luteus), (NC_002946, Locus YP 208768; Neisseria gonorrhoeae FA 1090), (U00090, Locus AAB91752; Rhizobium sp. NGR234), (J05091; Saccharomyces cerevisae), (CP000031, Locus AAV93568; Silicibacter pomeroyi DSS-3), (AE008481, Locus AAK99890; Streptococcus pneumoniae R6), и (NC_004556, Locus NP 779706; Xylella fastidiosa Temeculal).
[0153] В некоторых вариантах осуществления клетка-хозяин дополнительно содержит гетерологичную нуклеотидную последовательность, кодирующую фермент, который может объединять IPP и DMAPP или IPP и FPP с образованием геранилгеранилпирофосфата (GGPP). Иллюстративные примеры нуклеотидных последовательностей, которые кодируют такой фермент, включают, в том числе: (ATHGERPYRS; Arabidopsis thaliana), (ВТ005328; Arabidopsis thaliana), (NM_119845; Arabidopsis thaliana), (NZ_AAJM01000380, Locus ZP_00743052; Bacillus thuringiensis serovar israelensis, ATCC 35646 sq1563), (CRGGPPS; Catharanthus roseus), (NZ_AABF02000074, Locus ZP_00144509; Fusobacterium nucleatum subsp. vincentii, ATCC 49256), (GFGGPPSGN; Gibberella fujikuroi), (AY371321; Ginkgo biloba), (AB055496; Hevea brasiliensis), (AB017971; Homo sapiens), (MCI276129; Mucor circinelloides f. lusitanicus), (AB016044; Mus musculus), (ААВХ01000298, Locus NCU01427; Neurospora crassa), (NCU20940; Neurospora crassa), (NZ_AAKL01000008, Locus ZP_00943566; Ralstonia solanacearum UW551), (AB118238; Rattus norvegicus), (SCU31632; Saccharomyces cerevisiae), (AB016095; Synechococcus elongates), (SAGGPS; Sinapis alba), (SSOGDS; Sulfolobus acidocaldarius), (NC_007759, Locus YP_461832; Syntrophus aciditrophicus SB), (NC_006840,Locus YP 204095; Vibrio fischeri ES114), (NM_112315; Arabidopsis thaliana), (ERWCRTE; Pantoea agglomerans), (D90087, Locus BAA14124; Pantoea ananatis), (X52291, Locus CAA36538; Rhodobacter capsulatus), (AF195122, Locus AAF24294; Rhodobacter sphaeroides), и (NC_004350, Locus NP_721015; Streptococcus mutans UA159).
[0154] Хотя примеры ферментов мевалонатного пути описаны выше, в некоторых вариантах осуществления ферменты пути DXP могут использоваться в качестве альтернативного или дополнительного пути для продуцирования DMAPP и IPP в описанных здесь клетках-хозяевах, композициях и способах. Ферменты и нуклеиновые кислоты, кодирующие ферменты пути DXP, хорошо известны и охарактеризованы в данной области. WO 2012/135591 А2.
6.7 Методы производства стевиоловых гликозидов
[0155] В другом аспекте здесь представлен способ получения стевиолового гликозида путем преобразования одного стевиолового гликозида в другой стевиоловый гликозид с использованием любых описанных здесь UDP-гликозилтрансфераз (например, UGT40087 или любого варианта UGT40087). В определенных вариантах осуществления здесь представлен способ получения RebD, включающий преобразование RebA в RebD с использованием любой из описанных здесь UDP-гликозилтрансфераз, способных преобразовывать RebA в RebD. В определенных вариантах осуществления здесь представлен способ получения RebM, включающий: преобразование RebA в RebD с использованием любой из описанных здесь UDP-гликозилтрансфераз, способных преобразовывать RebA в RebD; и преобразование RebD в RebM с использованием UDP-гликозилтрансферазы, способной преобразовывать RebD в RebM.
[0156] В определенных вариантах осуществления стевиоловый гликозид (например, RebA или RebD) или композиция, содержащая стевиоловый гликозид, может связываться в подходящих условиях с любой описанной здесь UDP-гликозилтрансферазой и UDP-сахаром для получения желаемого стевиолового гликозида (например, RebM). Такие методы могут быть выполнены in vivo или in vitro. Типичные UDP-caxapa включают UDP-гликозу, UDP-ксилозу или UDP-рамнозу.
[0157] В другом аспекте здесь предложен способ получения стевиолового гликозида, включающий стадии: (а) культивирования популяции любой из описанных здесь генетически модифицированных клеток-хозяев, которые способны продуцировать стевиоловый гликозид в среде с источником углерода в условиях, подходящих для получения стевиол-гликозидного соединения; и (b) извлечение указанного стевиол-гликозидного соединения из среды. [0158] В некоторых вариантах осуществления генетически модифицированная клетка-хозяин продуцирует повышенное количество стевиолового гликозида по сравнению с родительской клеткой, не содержащей одну или несколько модификаций, или родительской клеткой, содержащей только поднабор из одной или нескольких модификаций генетически модифицированная клетка-хозяин, но в остальном генетически идентична. В некоторых вариантах осуществления увеличенное количество составляет не менее 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100% или более 100%, как измерено, например, по выходу, производству, продуктивности, в граммах на литр клеточной культуры, миллиграммах на грамм массы сухих клеток, на единицу объема культуры клеток, на единицу массы сухих клеток, на единицу объема культуры клеток в единицу времени или на единицу массы сухих клеток в единицу времени.
[0159] В некоторых вариантах осуществления клетка-хозяин продуцирует повышенный уровень стевиолового гликозида, который превышает примерно 10 г на литр ферментационной среды. В некоторых таких вариантах осуществления стевиоловый гликозид получают в количестве от около 10 до около 50 г на литр клеточной культуры, более 15 г на литр клеточной культуры, более 20 г на литр клеточной культуры, более чем 25 г на литр клеточной культуры, более 30 г на литр клеточной культуры, более 35 г на литр клеточной культуры, более 40 г на литр клеточной культуры, более 45 г на литр клеточная культура, или более чем 50 г на литр клеточной культуры.
[0160] В некоторых вариантах осуществления клетка-хозяин продуцирует повышенный уровень стевиолового гликозида, который превышает примерно 50 миллиграммов на грамм массы сухих клеток. В некоторых таких вариантах осуществления стевиоловый гликозид получают в количестве от около 50 до около 1500 миллиграммов, более чем около 100 миллиграммов, более чем около 150 миллиграммов, более чем около 200 миллиграммов, более чем около 250 миллиграммов, более чем около 500 миллиграммов более чем около 750 миллиграммов или более чем около 1000 миллиграммов на грамм массы сухих клеток.
[0161] В некоторых вариантах осуществления клетка-хозяин продуцирует повышенный уровень стевиолового гликозида, который составляет, не менее чем около 10%, не менее чем около 15%, не менее чем около 20%, не менее чем около 25%, не менее чем около 30%, не менее чем около 35%о, не менее чем около 40%, не менее чем около 45%, не менее чем около 50%, не менее чем около 60%, не менее чем около 70%, не менее чем около 80%, не менее чем около 90%, не менее чем примерно в 2 раза, не менее чем примерно в 2,5 раза, не менее чем примерно в 5 раз, не менее чем примерно в 10 раз, не менее чем примерно в 20 раз, не менее чем примерно в 30 раз, не менее чем примерно в 40 раз, не менее чем примерно в 50 раз, не менее чем примерно в 75 раз, не менее чем примерно в 100 раз, не менее чем примерно в 200 раз, не менее чем примерно в 300 раз, не менее чем примерно в 400 раз, не менее чем примерно в 500 раз, или не менее чем примерно в 1000 раз или более выше, чем уровень стевиолового гликозида, продуцируемого родительской клеткой, на единицу объема культуры клеток.
[0162] В некоторых вариантах осуществления клетка-хозяин продуцирует повышенный уровень стевиолового гликозида, который составляет, не менее чем примерно 10%, не менее чем примерно 15%, не менее чем примерно 20%, не менее чем примерно 25%, не менее чем примерно 30%, не менее чем примерно 35%, не менее чем примерно 40%, не менее чем примерно 45%, не менее чем примерно 50%, не менее чем примерно о 60%, не менее чем примерно 70%, не менее чем примерно 80%, не менее чем примерно 90%, не менее чем примерно в 2 раза, не менее чем примерно в 2,5 раза, не менее чем примерно в 5 раз, не менее чем примерно в 10 раз, не менее чем примерно в 20 раз, не менее чем примерно в 30 раз, не менее чем примерно в 40 раз, при не менее чем примерно в 50 раз, не менее чем примерно в 75 раз, не менее чем примерно в 100 раз, не менее чем примерно в 200 раз, не менее чем примерно в 300 раз, не менее чем примерно о в 400 раз, не менее чем примерно в 500 раз, или при не менее чем примерно в 1000 раз или более выше, чем уровень стевиолового гликозида, продуцируемого родительской клеткой, на единицу массы сухих клеток.
[0163] В некоторых вариантах осуществления клетка-хозяин продуцирует повышенный уровень стевиолового гликозида, который составляет, не менее чем примерно 10%, не менее чем примерно 15%о, не менее чем примерно 20%, не менее чем примерно 25%, не менее чем примерно 30%, не менее чем приблизительно 35%, не менее чем приблизительно 40%, не менее чем приблизительно 45%, не менее чем приблизительно 50%, не менее чем приблизительно 60%, не менее чем приблизительно 70%, не менее чем приблизительно 80%, не менее чем приблизительно 90%, не менее чем примерно в 2 раза, не менее чем примерно в 2,5 раза, не менее чем примерно в 5 раз, не менее чем примерно в 10 раз, не менее чем примерно в 20 раз, не менее чем примерно в 30 раз, не менее чем примерно в 40 раз, при не менее чем примерно в 50 раз, не менее чем примерно в 75 раз, не менее чем примерно в 100 раз, не менее чем примерно в 200 раз, не менее чем примерно в 300 раз, не менее чем примерно в 400 раз, не менее чем примерно в 500 раз, или при не менее чем примерно в 1000 раз или более выше, чем уровень стевиолового гликозида, продуцируемого родительской клеткой, на единицу объема культуры клеток в единицу времени.
[0164] В некоторых вариантах осуществления клетка-хозяин продуцирует повышенный уровень стевиолового гликозида, который составляет, не менее чем примерно 10%, не менее чем примерно 15%, не менее чем примерно 20%, не менее чем примерно 25%, не менее чем примерно 30%, не менее чем приблизительно 35%, не менее чем приблизительно 40%, не менее чем приблизительно 45%, не менее чем приблизительно 50%, не менее чем приблизительно 60%, не менее чем приблизительно 70%, не менее чем приблизительно 80%, не менее чем приблизительно 90%, не менее чем примерно в 2 раза, не менее чем примерно в 2,5 раза, не менее чем примерно в 5 раз, не менее чем примерно в 10 раз, не менее чем примерно в 20 раз, не менее чем примерно в 30 раз, не менее чем примерно в 40 раз, при не менее чем примерно в 50 раз, не менее чем примерно в 75 раз, не менее чем примерно в 100 раз, не менее чем примерно в 200 раз, не менее чем примерно в 300 раз, не менее чем примерно в 400 раз, не менее чем примерно в 500 раз, или при не менее чем примерно в 1000 раз или более выше, чем уровень стевиолового гликозида, продуцируемого родительской клеткой, на единицу массы сухих клеток на единицу времени.
[0165] В большинстве вариантов осуществления производство повышенного уровня стевиоловых гликозидов клеткой-хозяином контролируется репрессирующим соединением. Такой клеткой-хозяином можно легко манипулировать в присутствии репрессирующего соединения. Затем репрессирующее соединение удаляют, чтобы индуцировать продуцирование повышенного уровня стевиоловых гликозидов клеткой-хозяином. В других вариантах воплощения продуцирование повышенного уровня стевиоловых гликозидов клеткой-хозяином индуцируется изменением условий культивирования, таких как, например, температура роста, составляющие среды и тому подобное.
6.8 Культуральные среды и условия
[0166] Материалы и методы для поддержания и роста микробных культур хорошо известны специалистам в области науки о микробиологии или ферментации (см., например, Bailey и др., Biochemical Engineering Fundamentals, second edition, McGraw Hill, New York, 1986). Необходимо учитывать подходящую культуральную среду, рН, температуру и требования к аэробным, микроаэробным или анаэробным условиям в зависимости от конкретных требований клетки-хозяина, ферментации и процесса.
[0167] Представленные здесь способы получения стевиоловых гликозидов, можно осуществлять в подходящей культуральной среде (например, с добавлением пантотената или без него) в подходящем контейнере, включая, в том числе, планшет для культивирования клеток, колбу или ферментер. Кроме того, способы могут быть выполнены в любом масштабе ферментации, известном в данной области техники, для поддержания промышленного производства микробных продуктов. Может быть использован любой подходящий ферментер, включая ферментер с мешалкой, ферментер с воздушным транспортом, пузырьковый ферментер или любую их комбинацию. В конкретных вариантах осуществления с использованием Saccharomyces cerevisiae в качестве клетки-хозяина штаммы можно выращивать в ферментере, как подробно описано у Kosaric, и др., В Ullmann's Encyclopedia of Industrial Chemistry, Sixth Edition, Volume 12, pages 398-473, Wiley-VCH Verlag GmbH & Co. KDaA, Weinheim, Germany.
[0168] В некоторых вариантах осуществления культуральная среда представляет собой любую культуральную среду, в которой может существовать генетически модифицированный микроорганизм, способный продуцировать стевиоловый гликозид, то есть поддерживать рост и жизнеспособность. В некоторых вариантах осуществления культуральная среда представляет собой водную среду, содержащую ассимилируемые источники углерода, азота и фосфата. Такая среда может также включать соответствующие соли, минералы, металлы и другие питательные вещества. В некоторых вариантах осуществления источник углерода и каждое из основных питательных веществ для клеток добавляют постепенно или непрерывно в ферментационную среду, и каждое требуемое питательное вещество поддерживается по существу на минимальном уровне, необходимом для эффективного усвоения растущими клетками, например, в соответствии с заданной кривой роста клеток, основанной на метаболической или дыхательной функции клеток, которые преобразуют источник углерода в биомассу.
[0169] Подходящие условия и подходящие среды для культивирования микроорганизмов хорошо известны в данной области. В некоторых вариантах подходящая среда дополняется одним или несколькими дополнительными агентами, такими как, например, индуктор (например, когда одна или несколько нуклеотидных последовательностей, кодирующих продукт гена, находятся под контролем индуцибельного промотора), репрессор (например, когда одна или несколько нуклеотидных последовательностей, кодирующих продукт гена, находятся под контролем репрессируемого промотора), или селективный агент (например, антибиотик для отбора микроорганизмов, содержащих генетические модификации).
[0170] В некоторых вариантах осуществления источником углерода является моносахарид (простой сахар), дисахарид, полисахарид, неферментируемый источник углерода или одна или несколько их комбинаций. Неограничивающие примеры подходящих моносахаридов включают глюкозу, маннозу, фруктозу, ксилозу, рибозу и их комбинации. Неограничивающие примеры подходящих дисахаридов включают сахарозу, лактозу, мальтозу, галактозу, трегалозу, целлобиозу и их комбинации. Неограничивающие примеры подходящих полисахаридов включают крахмал, гликоген, целлюлозу, хитин и их комбинации. Неограничивающие примеры подходящих неферментируемых источников углерода включают ацетат и глицерин.
[0171] Концентрация источника углерода, такого как глюкоза, в культуральной среде должна способствовать росту клеток, но не должна быть настолько высокой, чтобы подавлять рост используемого микроорганизма. Как правило, ферментационные культуры используют с источником углерода, таким как глюкоза, добавляемым на уровнях для достижения желаемого уровня роста и биомассы, но на неопределяемых уровнях (с пределами обнаружения, составляющими около <0,1 г/л). В других вариантах осуществления концентрация источника углерода, такого как глюкоза, в культуральной среде составляет более чем примерно 1 г/л, предпочтительно, более чем примерно 2 г/л и, более предпочтительно, более чем примерно 5 г/л. Кроме того, концентрация источника углерода, такого как глюкоза, в культуральной среде обычно составляет менее чем примерно 100 г/л, предпочтительно, менее чем примерно 50 г/л и, более предпочтительно, менее чем примерно 20 г/л. Отмечается, что ссылки на концентрации компонентов культуры могут относиться как к начальным, так и/или к текущим концентрациям компонентов. В некоторых случаях может оказаться желательным позволить обеднению питательной среды источником углерода во время культивирования.
[0172] Источники ассимилируемого азота, которые можно использовать в подходящей культуральной среде, включают, в том числе, простые источники азота, источники органического азота и сложные источники азота. Такие источники азота включают безводный аммиак, соли аммония и вещества животного, растительного и/или микробного происхождения. Подходящие источники азота включают, в том числе, гидролизаты белка, гидролизаты микробной биомассы, пептон, дрожжевой экстракт, сульфат аммония, мочевину и аминокислоты. Как правило, концентрация источников азота в культуральной среде составляет более примерно 0,1 г/л, предпочтительно более чем примерно 0,25 г/л и более предпочтительно более чем примерно 1,0 г/л. Однако, помимо определенных концентраций, добавление источника азота в культуральную среду не выгодно для роста микроорганизмов. В результате концентрация источников азота в культуральной среде составляет менее чем примерно 20 г/л, предпочтительно, менее чем примерно 10 г/л и, более предпочтительно, менее чем примерно 5 г/л. Кроме того, в некоторых случаях может быть желательно позволить питательной среде исчерпывват источники во время культивирования.
[0173] Эффективная культуральная среда может содержать другие соединения, такие как неорганические соли, витамины, микроэлементы или стимуляторы роста. Такие другие соединения могут также присутствовать в источниках углерода, азота или минеральных веществ в эффективной среде или могут добавляться конкретно в среду.
[0174] Культуральная среда также может содержать подходящий источник фосфата. Такие источники фосфатов включают как неорганические, так и органические источники фосфатов. Предпочтительные источники фосфатов включают, в том числе, фосфатные соли, такие как одно-или двухосновные фосфаты натрия и калия, фосфат аммония и их смеси. Как правило, концентрация фосфата в культуральной среде превышает примерно 1,0 г/л, предпочтительно превышает примерно 2,0 г/л и, более предпочтительно, превышает примерно 5,0 г/л. Однако, помимо определенных концентраций, добавление фосфата в культуральную среду не выгодно для роста микроорганизмов. Соответственно, концентрация фосфата в культуральной среде обычно составляет менее чем примерно 20 г/л, предпочтительно менее чем примерно 15 г/л и, более предпочтительно, менее чем примерно 10 г/л.
[0175] Подходящая культуральная среда также может включать источник магния, предпочтительно в форме физиологически приемлемой соли, такой как гептагидрат сульфата магния, хотя можно использовать другие источники магния в концентрациях, которые вносят аналогичные количества магния. Как правило, концентрация магния в культуральной среде превышает примерно 0,5 г/л, предпочтительно превышает примерно 1,0 г/л и, более предпочтительно, превышает примерно 2,0 г/л. Однако, помимо определенных концентраций, добавление магния в культуральную среду не способствует росту микроорганизмов. Соответственно, концентрация магния в культуральной среде обычно составляет менее чем примерно 10 г/л, предпочтительно менее чем примерно 5 г/л и, более предпочтительно, менее чем примерно 3 г/л. Кроме того, в некоторых случаях может быть желательно позволить питательной среде исчерпывать источники магния во время культивирования.
[0176] В некоторых вариантах осуществления культуральная среда может также включать биологически приемлемый хелатирующий агент, такой как дигидрат тринатрийцитрата. В таком случае концентрация хелатирующего агента в культуральной среде превышает примерно 0,2 г/л, предпочтительно превышает примерно 0,5 г/л и, более предпочтительно, превышает примерно 1 г/л. Однако, помимо определенных концентраций, добавление хелатирующего агента в культуральную среду не выгодно для роста микроорганизмов. Соответственно, концентрация хелатирующего агента в культуральной среде обычно составляет менее чем примерно 10 г/л, предпочтительно менее чем примерно 5 г/л и, более предпочтительно, менее чем примерно 2 г/л.
[0177] Культуральная среда также может изначально включать биологически приемлемую кислоту или основание для поддержания желаемого рН культуральной среды. Биологически приемлемые кислоты включают, в том числе, соляную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и их смеси. Биологически приемлемые основания включают, в том числе, гидроксид аммония, гидроксид натрия, гидроксид калия и их смеси. В некоторых вариантах осуществления используемым основанием является гидроксид аммония.
[0178] Культуральная среда может также включать биологически приемлемый источник кальция, включая, в том числе, хлорид кальция. Как правило, концентрация источника кальция, такого как хлорид кальция, дигидрат, в культуральной среде находится в диапазоне от около 5 мг/л до около 2000 мг/л, предпочтительно в диапазоне от около 20 мг/л до около 1000 мг/л и, более предпочтительно, в диапазоне от около 50 мг/л до около 500 мг/л.
[0179] Культуральная среда также может включать хлорид натрия. Как правило, концентрация хлорида натрия в культуральной среде находится в диапазоне от около 0,1 г/л до около 5 г/л, предпочтительно в диапазоне от около 1 г/л до около 4 г/л, и более предпочтительно в диапазоне от примерно 2 г/л до примерно 4 г/л.
[0180] В некоторых вариантах осуществления культуральная среда также может включать следовые металлы. Такие микроэлементы можно добавлять в культуральную среду в виде исходного раствора, который для удобства можно приготовить отдельно от остальной культуральной среды. Как правило, количество такого раствора микроэлементов, добавляемого в культуральную среду, превышает примерно 1 мл/л, предпочтительно превышает примерно 5 мл/л и более предпочтительно превышает примерно 10 мл/л. Однако, помимо определенных концентраций, добавление микроэлементов в культуральную среду не выгодно для роста микроорганизмов. Соответственно, количество такого раствора микроэлементов, добавляемого в культуральную среду, обычно составляет менее чем примерно 100 мл/л, предпочтительно менее примерно 50 мл/л и, более предпочтительно, менее чем примерно 30 мл/л. Отмечается, что кроме добавления микроэлементов в исходный раствор некоторые компоненты могут добавляться отдельно, каждый в пределах диапазонов, каждый независимо от количеств компонентов, определяемых вышеуказанными диапазонами раствора микроэлементов.
[0181] Питательная среда может включать другие витамины, такие как пантотенат, биотин, кальций, пантотенат, инозит, пиридоксин-HCl и тиамин-HCl. Такие витамины можно добавлять в культуральную среду в виде исходного раствора, который для удобства можно приготовить отдельно от остальной культуральной среды. Однако, помимо определенных концентраций, добавление витаминов в культуральную среду не способствует росту микроорганизмов.
[0182] Описанные здесь способы ферментации могут быть реализованы в обычных режимах культивирования, которые включают, в том числе, периодический, подпиточный, рециркуляцию клеток, непрерывный и полунепрерывный режимы. В некоторых вариантах осуществления ферментация проводится в периодическом режиме с подпиткой. В таком случае некоторые компоненты среды истощаются во время культивирования, в том числе пантотенат во время производственной стадии ферментации. В некоторых вариантах осуществления культура может быть дополнена относительно высокими концентрациями таких компонентов на начальном этапе, например, на стадии производства, так что рост и/или продуцирование стевиолового гликозида поддерживается в течение периода времени, прежде чем потребуются добавления. Предпочтительные диапазоны этих компонентов поддерживаются во всей культуре путем внесения дополнений по мере истощения уровней культурой. Уровни компонентов в культуральной среде могут контролироваться, например, путем периодического отбора проб культуральной среды и анализа концентраций. Альтернативно, после того как разработана стандартная процедура культивирования, дополнения могут делаться через определенные интервалы времени, соответствующие известным уровням в определенные моменты времени во всей культуре. Как будет понятно специалистам в данной области, скорость потребления питательного вещества увеличивается во время культивирования с увеличением плотности клеток среды. Кроме того, чтобы избежать введения чужеродных микроорганизмов в культуральную среду, добавление выполняют с использованием методов асептического добавления, известных в данной области. Кроме того, во время культивирования может быть добавлено небольшое количество антипенного агента.
[0183] Температура культуральной среды может быть любой температурой, подходящей для роста генетически модифицированных клеток и/или производства стевиолового гликозида. Например, перед инокуляцией культуральной среды инокулятом культуральную среду можно довести до температуры и поддерживать при температуре в диапазоне от около 20°С до около 45°С, предпочтительно до температуры в диапазоне от около 25°С до около 40°С и, более предпочтительно, в диапазоне от около 28°С до около 32°С.
[0184] рН культуральной среды можно контролировать путем добавления в культуральную среду кислоты или основания. В таких случаях, когда аммиак используется для контроля рН, он также удобно служит источником азота в культуральной среде. Предпочтительно рН поддерживают на уровне от около 3,0 до около 8,0, более предпочтительно от около 3,5 до около 7,0 и, наиболее предпочтительно, от около 4,0 до около 6,5.
[0185] В некоторых вариантах осуществления концентрация источника углерода, такая как концентрация глюкозы, в культуральной среде контролируется во время культивирования. Концентрация глюкозы в культуральной среде может контролироваться с использованием известных методов, таких как, например, использование ферментного теста с глюкозооксидазой или жидкостная хроматография высокого давления, которые можно использовать для контроля концентрации глюкозы в супернатанте, например, безклеточный компонент питательной среды. Как указывалось ранее, концентрация источника углерода должна поддерживаться ниже уровня, при котором происходит ингибирование роста клеток. Хотя такая концентрация может варьироваться от организма к организму, для глюкозы в качестве источника углерода ингибирование роста клеток происходит при концентрациях глюкозы, превышающих примерно 60 г/л, и может быть легко определено путем испытания. Соответственно, когда глюкоза используется в качестве источника углерода, глюкоза предпочтительно подается в ферментер и поддерживается в количестве ниже пределов обнаружения. Альтернативно, концентрация глюкозы в культуральной среде поддерживается в диапазоне от около 1 г/л до около 100 г/л, более предпочтительно в диапазоне от около 2 г/л до около 50 г/л и, еще больше предпочтительно, в диапазоне от около 5 г/л до около 20 г/л. Хотя концентрация источника углерода может поддерживаться в желаемых уровнях путем добавления, например, по существу чистого раствора глюкозы, приемлемо и может быть предпочтительным поддерживать концентрацию источника углерода в культуральной среде путем добавления аликвот исходного культуральная среда. Использование аликвот исходной культуральной среды может быть желательным, поскольку концентрации других питательных веществ в среде (например, источников азота и фосфата) могут поддерживаться одновременно. Аналогично, концентрации микроэлементов можно поддерживать в культуральной среде путем добавления аликвот раствора микроэлементов.
[0186] Другие подходящие ферментационные среды и способы описаны, например, в материалах патентной заявки WO 2016/196321.
6.9 Ферментационные композиции
[0187] В другом аспекте здесь представлены ферментационные композиции, содержащие генетически модифицированную клетку-хозяина, описанную здесь, и стевиоловые гликозиды, полученные из генетически модифицированной клетки-хозяина. Ферментационные композиции могут дополнительно содержать среду. В некоторых вариантах осуществления ферментационные композиции содержат генетически модифицированную клетку-хозяина и дополнительно содержат RebA, RebD и RebM. В определенных вариантах осуществления предлагаемые здесь ферментационные композиции содержат RebM в качестве основного компонента стевиоловых гликозидов, полученных из генетически модифицированной клетки-хозяина. В определенных вариантах осуществления ферментационные композиции содержат RebA, RebD и RebM в соотношении не менее 1:7:50. В других вариантах осуществления ферментационные композиции содержат (RebA + RebD) и RebM в соотношении не менее 8:50. В некоторых вариантах осуществления ферментационные композиции содержат RebA, RebD и RebM в соотношении не менее от 1:7:50 до 1:100:1000. В других вариантах осуществления ферментационные композиции содержат (RebA + RebD) и RebM в соотношении не менее от 8:50 до 101:1000. В определенных вариантах осуществления ферментационные композиции содержат соотношение не менее от 1:7:50 до 1:200:2000. В других вариантах осуществления ферментационные композиции содержат (RebA + RebD) и RebM в соотношении не менее от 8:50 до 201:2000. В некоторых вариантах осуществления соотношение RebA, RebD и RebM основано на общем содержании этих трех стевиоловых гликозидов, которые связаны с генетически модифицированной клеткой-хозяином и средой. В некоторых вариантах осуществления соотношение RebA, RebD и RebM основано на общем содержании этих трех стевиоловых гликозидов в среде. В некоторых вариантах осуществления соотношение RebA, RebD и RebM основано на общем содержании этих трех стевиоловых гликозидов, которые связаны с генетически модифицированной клеткой-хозяином.
[0188] В других вариантах осуществления ферментационные композиции содержат генетически модифицированную клетку-хозяина и дополнительно содержат RebA и RebM. В некоторых вариантах осуществления ферментационные композиции содержат RebA и RebM при соотношении RebA: RebM не менее 1:50. В определенных вариантах осуществления ферментационные композиции содержат RebA и RebM при соотношении RebA : RebM, не менее от 1:50 до 1:1000. В определенных вариантах осуществления ферментационные композиции содержат RebA и RebM при соотношении RebA : RebM, не менее от 1:50 до 1:2000. В некоторых вариантах осуществления соотношение RebA и RebM основано на общем содержании этих двух стевиоловых гликозидов, которые связаны с генетически модифицированной клеткой-хозяином и средой. В некоторых вариантах осуществления соотношение RebA и RebM основано на общем содержании этих двух стевиоловых гликозидов в среде. В некоторых вариантах осуществления соотношение RebA и RebM основано на общем содержании этих двух стевиоловых гликозидов, которые связаны с генетически модифицированной клеткой-хозяином.
[0189] В дополнительном варианте осуществления ферментационные композиции содержат генетически модифицированную клетку-хозяина и дополнительно содержат RebD и RebM. В некоторых вариантах осуществления ферментационные композиции содержат RebD и RebM при соотношении RebD : RebM не менее 7:50. В некоторых вариантах осуществления ферментационные композиции содержат RebD и RebM при соотношении RebD : RebM, не менее от 7:50 до 7:100. В некоторых вариантах осуществления ферментационные композиции содержат RebD и RebM при соотношении RebD : RebM, не менее от 7:50 до 7:200. В некоторых вариантах осуществления соотношение RebA, RebD и RebM основано на общем содержании этих двух стевиоловых гликозидов, которые связаны с генетически модифицированной клеткой-хозяином и средой. В некоторых вариантах осуществления соотношение RebD и RebM основано на общем содержании этих двух стевиоловых гликозидов в среде. В некоторых вариантах осуществления соотношение RebD и RebM основано на общем содержании этих двух стевиоловых гликозидов, которые связаны с генетически модифицированной клеткой-хозяином.
[0190] В определенных вариантах осуществления ферментационные композиции, представленные здесь, содержат RebM2 на неопределяемом уровне. В определенных вариантах осуществления ферментационные композиции, представленные здесь, содержат не встречающиеся в природе стевиоловые гликозидына необнаруживаемом уровне. В определенных вариантах осуществления предлагаемые здесь ферментационные композиции, когда они подвергаются ГХ-хроматографии, не дают пика «стевиол + 2 глюкоза» между пиком RebA и RebB на детектируемом уровне.
6.10 Восстановление стевиоловых гликозидов
[0191] Как только стевиоловый гликозид продуцируется клеткой-хозяином, он может быть извлечен или выделен для последующего использования с использованием любых подходящих способов разделения и очистки, включая любые подходящие способы выделения и очистки стевиолового гликозида, известные в данной области техники. Подходящие способы описаны, например, в патентах США №№7,838,044 и 8,981,081; Патентные заявки США №№14/603,941, 14/033,563, 14/362,275, 14/613,615, 14/615,888; Заявки РСТ №PCT/US12/070562 и PCT/US14/031129. Содержание этих документов включено в настоящий документ посредством ссылки во всей их полноте. В некоторых вариантах осуществления водную фазу, содержащую стевиоловый гликозид, отделяют от ферментации центрифугированием. В других вариантах осуществления водная фаза, содержащая гликозид стевиола, самопроизвольно отделяется от ферментации. В других вариантах осуществления водную фазу, содержащую стевиолгликозид, отделяют от ферментации путем добавления деэмульгатора и/или зародышеобразователя в реакцию ферментации. Иллюстративные примеры деэмульгаторов включают флокулянты и коагулянты. Иллюстративные примеры зародышеобразователей включают капли самого стевиоловых гликозидови органические растворители, такие как додекан, изопропилмиристрат и метилолеат.
[0192] Стевиоловый гликозид, продуцируемый в этих клетках, может присутствовать в супернатанте культуры и/или ассоциироваться с клетками-хозяевами. В вариантах осуществления, где стевиоловый гликозид связан с клеткой-хозяином, извлечение стевиолового гликозида может включать способ пермеабилизации или лизиса клеток. Альтернативно или одновременно стевиоловый гликозид в культуральной среде может быть извлечен с использованием процесса восстановления, включающего, в том числе этим, хроматографию, адсорбционную хроматографию, экстракцию, экстракцию растворителем, мембранное разделение, электродиализ, обратный осмос, дистилляцию, химическую дериватизацию и кристаллизацию.
[0193] В некоторых вариантах осуществления стевиоловый гликозид отделяют от других продуктов, которые могут присутствовать в водной фазе. В некоторых вариантах осуществления разделение достигается с использованием адсорбции, дистилляции, газожидкостной экстракции (отгонки), жидкостной экстракции (экстракции растворителем), вакуумной экстракции, выпаривания, ультрафильтрации и стандартных хроматографических методов. Другие подходящие ферментационные среды и способы описаны, например, в публикациях патентных заявок США №2016/0185813, 2017/0190728, WO/2017/093895. Другие подходящие способы описаны, например, в патентах США №№7,838,044 и 8,981,081; Патенты США №№14/603,941, 14/033,563, 14/362,275, 14/613,615 и 14/615,888; Заявки РСТ №PCT/US 12/070562 и PCT/US 14/031129. Содержание этих документов включено в настоящий документ посредством ссылки во всей их полноте.
[0194] В определенных вариантах осуществления извлеченный гликозид (ы) стевиола можно использовать в различных конечных продуктах. Например, очищенное соединение RebM или композицию, содержащую RebM, можно использовать в любых потребляемых продуктах, таких как пищевые продукты, фармацевтические продукты, диетические добавки или пищевые добавки. В конкретных вариантах осуществления расходный материал, содержащий RebM, получают путем культивирования популяции генетически модифицированных клеток-хозяев по любому из предшествующих пунктов в среде с источником углерода в условиях, подходящих для получения RebM; и извлечение указанного соединения RebM из среды.
[0195] Композиции подсластителей, используемые в данном описании, означают композиции, которые содержат, не менее один сладкий компонент в комбинации, не менее с одним другим веществом, таким как, например, другой подсластитель или добавка.
[0196] Используемые здесь подслащивающие композиции означают вещества, которые контактируют с полостью рта человека или животного, включая вещества, которые попадают в рот и впоследствии выбрасываются изо рта, и вещества, которые пьют, едят, проглатывают или проглатывают иным образом, и безопасны для употребления человеком или животными при использовании в общепринятом диапазоне.
[0197] Термин «подслащенные композиции», как он используется здесь, означает вещества, которые содержат как подслащивающую композицию, так и композицию подсластителя или подсластителя. Например, напиток без подсластителя является типом подслащиваемой композиции. Композицию подсластителя, содержащую RebM, полученную способом по настоящему изобретению, и эритрит можно добавлять в подслащенный напиток, тем самым обеспечивая подслащенный напиток. Подслащенный напиток представляет собой разновидность подслащенной композиции. Подходящие подслащивающие композиции, подслащенные композиции и способы их получения описаны, например, в заявке PCT/US 12/070562, содержание которой включено в настоящий документ посредством ссылки во всей своей полноте.
[0198] В одном варианте осуществления подсластитель, содержащий RebM, получают путем культивирования популяции генетически модифицированных клеток-хозяев по любому из предшествующих пунктов в среде с источником углерода в условиях, подходящих для получения RebM; и извлечение указанного соединения RebM из среды. В другом варианте осуществления композицию подсластителя, содержащую, не менее одно другое вещество и RebM, получают путем культивирования популяции генетически модифицированных клеток-хозяев по любому из предшествующих пунктов в среде с источником углерода в условиях, подходящих для получения RebM; и извлечение указанного соединения RebM из среды. В другом варианте осуществления подслащенную композицию, содержащую RebM, получают путем культивирования популяции генетически модифицированных клеток-хозяев по любому из предшествующих пунктов в среде с источником углерода в условиях, подходящих для получения RebM; и извлечение указанного соединения RebM из среды. Один из вариантов осуществления включает способ получения композиции подсластителя, включающий объединение не менее одного другого вещества с RebM, полученным в результате культивирования популяции генетически модифицированных клеток-хозяев по любому из предшествующих пунктов в среде с источником углерода в условиях, подходящих для делая РебМ; и извлечение указанного соединения RebM из среды. Другой вариант осуществления включает способ получения подслащенной композиции, включающий объединение, не менее одной подслащенной композиции с RebM, полученным в процессе культивирования популяции генетически модифицированных клеток-хозяев по любому из предшествующих предшествующих пунктов в среде с источником углерода в условиях, подходящих для делая РебМ; и извлечение указанного соединения RebM из среды.
6.11 Способы изготовления генетически модифицированных клеток
[0199] Также здесь предоставлены способы получения клетки-хозяина, которая была генетически сконструирована таким образом, чтобы включать одну или несколько описанных выше модификаций, например, одну или несколько гетерологичных нуклеиновых кислот, кодирующих UGT40087, и/или ферменты пути биосинтеза, например, для стевиол-гликозидного соединения. Экспрессия гетерологичного фермента в клетке-хозяине может быть достигнута путем введения в клетки-хозяева нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую фермент под контролем регуляторных элементов, которые допускают экспрессию в клетке-хозяине. В некоторых вариантах осуществления нуклеиновая кислота представляет собой внехромосомную плазмиду. В других вариантах осуществления нуклеиновая кислота интегрирована в хромосому клетки-хозяина.
[0200] Нуклеиновые кислоты, кодирующие белки, могут быть введены в клетку-хозяина любым способом, известным специалисту в данной области, без ограничения, (см., например, Hinnen et al. (1978) Proc. Natl. Acad. Sci. USA 75:1292-3; Cregg et al. (1985) Mol. Cell. Biol. 5:3376-3385; Goeddel et al. eds, 1990, Methods in Enzymology, vol. 185, Academic Press, Inc., CA; Krieger, 1990, Gene Transfer and Expression - A Laboratory Manual, Stockton Press, NY; Sambrook et al., 1989, Molecular Cloning -- A Laboratory Manual, Cold Spring Harbor Laboratory, NY; and Ausubel и др., eds., Current Edition, Current Protocols in Molecular Biology, Greene Publishing Associates and Wiley Interscience, NY). Типичные способы включают, в том числе, сферопластирование, электропорацию, опосредованную PEG 1000 трансформацию и опосредованную ацетатом лития или хлоридом лития трансформацию.
[0201] Активность фермента в клетке-хозяине может быть изменена путем модификации транскрипции гена, который кодирует фермент.Это может быть достигнуто, например, путем изменения числа копий нуклеотидной последовательности, кодирующей фермент (например, путем использования вектора экспрессии с большим или меньшим числом копий, содержащего нуклеотидную последовательность, или путем введения дополнительных копий нуклеотидной последовательности в геном клетки-хозяина или путем удаления или разрушения нуклеотидной последовательности в геноме клетки-хозяина), путем изменения порядка кодирования последовательностей на полицистронной мРНК оперона или расщепления оперона на отдельные гены, каждый из которых имеет свои собственные элементы управления, или путем увеличения силы промотора или оператора, с которым функционально связана нуклеотидная последовательность. Альтернативно или в дополнение, активность фермента в клетке-хозяине может быть изменена путем изменения уровня трансляции мРНК, которая кодирует фермент. Это может быть достигнуто, например, путем изменения стабильности мРНК, изменения последовательности сайта связывания рибосомы, изменения расстояния или последовательности между сайтом связывания рибосомы и стартовым кодоном последовательности, кодирующей фермент, модификации всей межцистронной области, расположенной «выше» или ближе к 5'-стороне стартового кодона области, кодирующей фермент, стабилизации 3'-конца транскрипта мРНК с помощью шпилек и специализированных последовательностей, модификации использования фермента кодоном, изменения экспрессии используемых тРНК редких кодонов в биосинтезе фермента и/или повышении стабильности фермента, например, посредством мутации его кодирующей последовательности.
[0202] Активность фермента в клетке-хозяине можно изменять несколькими способами, включая, в том числе, экспрессию модифицированной формы фермента, которая проявляет повышенную или пониженную растворимость в клетке-хозяине, экспрессию модифицированной формы фермента, в котором отсутствует домен, через который ингибируется активность фермента, экспресси экспрессию модифицированной формы фермента, который имеет более высокую или более низкую Kcat или более низкую или более высокую Km для субстрата, или экспрессию модифицированной формы фермента, который более или менее подвержен влиянию обратной связи или регуляции прямой связи другой молекулой в пути.
[0203] В некоторых вариантах осуществления нуклеиновая кислота, используемая для генетической модификации клетки-хозяина, содержит один или несколько селектируемых маркеров, полезных для отбора трансформированных клеток-хозяев и для оказания селективного давления на клетку-хозяина для поддержания чужеродной ДНК.
[0204] В некоторых вариантах осуществления селектируемый маркер представляет собой маркер устойчивости к антибиотику. Иллюстративные примеры маркеров устойчивости к антибиотикам включают, в том числе, BLA, NAT1, PAT, AUR1-C, PDR4, SMR1, CAT, продукт гена dhfr мыши, НРН, DSDA, KANR, и продукты гена SH BLE. Продукт гена BLA из E.coli придает устойчивость к бета-лактамным антибиотикам (например, цефалоспоринам узкого спектра, цефамицинам и карбапенемам (эртапенем), цефамандолу и цефоперазону) и ко всем антиграм-отрицательным бактериальным пенициллинам, кроме темоциллина; продукт гена NAT1 из S. noursei придает устойчивость к нурсеотрицину; продукт гена PAT из S. viridochromogenes Tu94 придает устойчивость к биалофосу; продукт гена AUR1-C из Saccharomyces cerevisiae придает устойчивость к ауэробазидину А (AbA); продукт гена PDR4 придает устойчивость к церуленину; продукт гена SMR1 придает устойчивость к сульфометурон метилу; генный продукт CAT из транспозона Tn9 придает устойчивость к хлорамфениколу; продукт гена dhfr мыши придает устойчивость к метотрексату; генный продукт HPH Klebsiella pneumonia придает устойчивость к гигромицину В; генный продукт DSDA E.coli позволяет клеткам расти на чашках с D-серином в качестве единственного источника азота; ген KANR транспозона Tn903 придает устойчивость к G418; и продукт гена SH BLE из Streptoalloteichus hindustanus придает устойчивость к зеоцину (блеомицину). В некоторых вариантах осуществления маркер устойчивости к антибиотику удаляют после выделения описанной здесь генетически модифицированной клетки-хозяина.
[0205] В некоторых вариантах осуществления селектируемый маркер спасает ауксотрофию (например, ауксотрофию питания) в генетически модифицированном микроорганизме. В таких вариантах осуществления родительский микроорганизм включает функциональное нарушение в одном или нескольких генных продуктах, которые функционируют в пути биосинтеза аминокислоты или нуклеотида, и нефункциональные, которые делают родительскую клетку неспособной к росту в среде без добавления одного или нескольких питательных веществ. Такие генные продукты включают, в том числе, генные продукты HIS3, LEU2, LYS1, LYS2, МЕТ15, TRP1, ADE2 и URA3 в дрожжах. Ауксотрофный фенотип может быть затем спасен путем трансформации родительской клетки с помощью экспрессионного вектора или конструкции хромосомной интеграции, кодирующей функциональную копию разрушенного генного продукта, и генерируемая генетически модифицированная клетка-хозяин может быть выбрана на основе потери ауксотрофного фенотипа родительской клетки. Использование генов URA3, TRP1 и LYS2 в качестве селектируемых маркеров имеет заметное преимущество, поскольку возможны как положительный, так и отрицательный отбор. Положительный отбор осуществляется ауксотрофной комплементацией мутаций URA3, TRP1 и LYS2, тогда как отрицательный отбор основывается на специфических ингибиторах, а именно, на 5-фтор-оротовой кислоте (FOA), 5-фторантраниловой кислоте и аминоадипиновой кислоте (аАА), которые, соответственно, предотвращают рост прототрофных штаммов, но допускают рост мутантов URA3, TRP1 и LYS2 соответственно. В других вариантах осуществления селектируемый маркер устраняет другие нелетальные недостатки или фенотипы, которые могут быть идентифицированы известным способом отбора.
[0206] Здесь описаны конкретные гены и белки, используемые в излагаемых здесь способах, композициях и организмах; однако следует признать, что абсолютная идентичность таким генам не является необходимой. Например, изменения в конкретном гене или полинуклеотиде, содержащем последовательность, кодирующую полипептид или фермент, могут быть выполнены и проверены на активность. Обычно такие изменения включают консервативные мутации и молчащие мутации. Такие модифицированные или мутированные полинуклеотиды и полипептиды могут быть подвергнуты скринингу на экспрессию функционального фермента с использованием способов, известных в данной области.
[0207] Из-за врожденной дегенерации генетического кода другие полинуклеотиды, которые кодируют по существу те же или функционально эквивалентные полипептиды, также могут быть использованы для клонирования и экспрессии полинуклеотидов, кодирующих такие ферменты.
[0208] Как будет понятно специалистам в данной области техники, может быть выгодно модифицировать кодирующую последовательность для усиления ее экспрессии в конкретном хозяине. Генетический код избыточен с 64 возможными кодонами, но большинство организмов обычно используют подмножество этих кодонов. Кодоны, которые чаще всего используются у вида, называются оптимальными кодонами, а те, которые не используются очень часто, классифицируются как редкие или малоиспользуемые кодоны. Кодоны могут быть заменены, чтобы отразить предпочтительное использование кодонов хозяина, в процессе, который иногда называют «оптимизацией кодонов» или «контролем смещения кодонов видов». Оптимизацию кодонов для других клеток-хозяев можно легко определить с помощью таблиц использования кодонов или можно выполнить с использованием коммерчески доступного программного обеспечения, такого как CodonOp (www.idtdna.com/CodonOptfrom) от Integrated DNA Technologies.
[0209] Оптимизированные кодирующие последовательности, содержащие кодоны, предпочтительные для конкретного прокариотического или эукариотического хозяина (Murray и др., 1989, Nucl Acids Res. 17: 477-508), могут быть получены, например, для увеличения скорости трансляции или для получения рекомбинантных РНК-транскриптов, имеющих желательные свойства, такие как более длительный период полураспада, по сравнению с транскриптами, полученными из неоптимизированной последовательности. Стоп-кодоны трансляции также могут быть изменены, с тем чтобы отражать предпочтения хозяина. Например, типичными стоп-кодонами для S. cerevisiae и млекопитающих являются UAA и UGA соответственно. Типичным стоп-кодоном для однодольных растений является UGA, тогда как насекомые и кишечная палочка обычно используют UAA в качестве стоп-кодона. (Dalphin и др., 1996, Nucl Acids Res. 24: 216-8).
[0210] Специалистам в данной области техники должно быть понятно, что из-за вырожденной природы генетического кода множество молекул ДНК, различающихся по своим нуклеотидным последовательностям, могут быть использованы для кодирования данного фермента в раскрытии сущности изобретения. Нативная последовательность ДНК, кодирующая описанные выше биосинтетические ферменты, упоминается здесь просто для иллюстрации варианта осуществления изобретения, и раскрытие включает молекулы ДНК любой последовательности, которые кодируют аминокислотные последовательности полипептидов и белки ферментов, используемых в раскрытии сущности изобретения. Подобным образом, полипептид обычно может переносить одну или несколько аминокислотных замен, делеций и вставок в своей аминокислотной последовательности без потери или значительной потери желаемой активности. Раскрытие сущности изобретения включает такие полипептиды с аминокислотными последовательностями, отличными от описанных здесь специфических белков, при условии, что модифицированные или вариантные полипептиды обладают ферментативной анаболической или катаболической активностью эталонного полипептида. Кроме того, аминокислотные последовательности, кодируемые показанными здесь последовательностями ДНК, просто иллюстрируют варианты осуществления изобретения.
[0211] Кроме того, настоящим раскрытием сущности изобретения охватываются гомологи ферментов, полезных для представленных здесь композиций и способов. В некоторых вариантах осуществления два белка (или область белков) являются по существу гомологичными, когда аминокислотные последовательности имеют идентичность не менее чем приблизительно 30%, 40%, 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%. Чтобы определить процентную идентичность двух аминокислотных последовательностей или двух последовательностей нуклеиновых кислот, последовательности выравнивают под оптимальные цели сравнения (например, могут быть введены пробелы в одной или обеих первой и второй аминокислотной или нуклеиновой кислотной последовательности для оптимального выравнивания, а негомологичные последовательности могут не учитываться для целей сравнения). В одном варианте осуществления длина эталонной последовательности, выровненной для целей сравнения, составляет не менее 30%, обычно не менее 40%, более типично не менее 50%, еще более типично не менее 60% и еще более типично не менее 70%, 80%, 90%, 100% длины эталонной последовательности. Затем сравнивают аминокислотные остатки или нуклеотиды в соответствующих аминокислотных позициях или нуклеотидных позициях. Когда позиция в первой последовательности занята тем же аминокислотным остатком или нуклеотидом, что и соответствующая позиция во второй последовательности, тогда молекулы в этой позиции являются идентичными (в данном контексте, «идентичность» аминокислоты или нуклеиновой кислоты эквивалентна «гомология» аминокислоты или нуклеиновой кислоты). Процент идентичности между двумя последовательностями является функцией количества идентичных позиций, совместно используемых последовательностями, с учетом количества промежутков и длины каждого промежутка, которые необходимо ввести для оптимального выравнивания двух последовательностей.
[0212] Когда термин «гомологичный» используется в отношении белков или пептидов, признается, что позиции остатков, которые не являются идентичными, часто отличаются консервативными аминокислотными заменами. «Консервативная аминокислотная замена» представляет собой такую замену, в которой аминокислотный остаток замещен другим аминокислотным остатком, имеющим боковую цепь (группу R) со сходными химическими свойствами (например, заряд или гидрофобность). В целом, консервативная аминокислотная замена не будет существенно изменять функциональные свойства белка. В случаях, когда две или более аминокислотных последовательностей отличаются друг от друга консервативными заменами, процентная идентичность последовательности или степень гомологии могут быть скорректированы в сторону увеличения, с тем чтобы скорректировать консервативный характер замены. Средства для выполнения этой регулировки хорошо известны специалистам в данной области техники, (см., например, Pearson W.R., 1994, Methods in Mol Biol 25: 365-89).
[0213] Каждая из следующих шести групп содержит аминокислоты, которые являются консервативными заменами друг для друга: 1) серии (S), треонин (Т); 2) аспарагиновая кислота (D), глутаминовая кислота (Е); 3) аспарагин (N), глутамин (Q); 4) аргинин (R), лизин (K); 5) изолейцин (I), лейцин (L), аланин (А), валин (V) и 6) фенилаланин (F), тирозин (Y), триптофан (W).
[0214] Гомология последовательности для полипептидов, которая также упоминается как процент идентичности последовательности, обычно измеряется с использованием программного обеспечения для анализа последовательности. Типичным алгоритмом сравнения последовательности молекул с базой данных, содержащей большое количество последовательностей из разных организмов, является компьютерная программа BLAST. При поиске в базе данных, содержащей последовательности из большого числа различных организмов, обычно сравнивают аминокислотные последовательности.
[0215] Кроме того, любой из генов, кодирующих вышеуказанные ферменты (или любые другие, упомянутые здесь (или любые регуляторные элементы, которые контролируют или модулируют их экспрессию), может быть оптимизирован методами генной / белковой инженерии, такими как направленная эволюция или рациональный мутагенез, которые известны специалистам в данной области. Такое действие позволяет специалистам в данной области техники оптимизировать ферменты для экспрессии и активности в дрожжах.
[0216] Кроме того, гены, кодирующие эти ферменты, могут быть идентифицированы из других видов грибов и бактерий и могут быть экспрессированы для модуляции этого пути. Разнообразные организмы могут служить источниками для этих ферментов, включая, в том числе, Saccharomyces spp., включая S. cerevisiae и S. uvarum, Kluyveromyces spp., включая K. thermotolerans, K. lactis, и K. marxianus, Pichia spp., Hansenula spp., включая H. polymorpha, Candida spp., Trichosporon spp., Yamadazyma spp., включая Y. spp. stipitis, Torulaspora pretoriensis, Issatchenkia orientalis, Schizosaccharomyces spp., включая S. pombe, Cryptococcus spp., Aspergillus spp., Neurospora spp., или Ustilago spp. Источники генов от анаэробных грибов включают, в том числе, Piromyces spp., Orpinomyces spp., или Neocallimastix spp. Источники прокариотических ферментов, которые полезны, включают, в том числе, Escherichia. coli, Zymomonas mobilis, Staphylococcus aureus, Bacillus spp., Clostridium spp., Corynebacterium spp., Pseudomonas spp., Lactococcus spp., Enterobacter spp., и Salmonella spp.
[0217] Способы, известные специалистам в данной области, могут быть пригодны для идентификации дополнительных гомологичных генов и гомологичных ферментов. Как правило, аналогичные гены и/или аналогичные ферменты могут быть идентифицированы с помощью функционального анализа и будут иметь функциональные сходства. Методы, известные специалистам в данной области, могут подходить для идентификации аналогичных генов и аналогичных ферментов. Например, методы для идентификации гомологичных или аналогичных UDP-гликозилтрансфераз, РТА или любых генов, белков или ферментов биосинтетического пути могут включать, в том числе, клонирование гена с помощью ПЦР с использованием праймеров на основе опубликованной последовательности гена / представляющего интерес фермента или путем вырожденной ПЦР с использованием вырожденных праймеров, предназначенных для амплификации консервативной области среди представляющего интерес гена. Кроме того, специалист в данной области может использовать методы для идентификации гомологичных или аналогичных генов, белков или ферментов с функциональной гомологией или сходством. Методы включают исследование клетки или клеточной культуры на предмет каталитической активности фермента с помощью ферментных анализов in vitro в отношении указанной активности (например, как описано здесь или в работе Kiritani, K. Branched-Chain Amino Acids Methods Enzymology, 1970), затем выделение фермента с указанной активностью посредством очистки, определение белковой последовательности фермента с помощью таких методов, как деградация Эдмана, конструирование праймеров ПЦР с вероятной последовательностью нуклеиновой кислоты, амплификация указанной последовательности ДНК посредством ПЦР и клонирование указанной последовательности нуклеиновой кислоты. Методы для идентификации гомологичных или сходных генов и/или гомологичных или сходных ферментов, аналогичных генов и/или аналогичных ферментов или белков также включают сравнение данных, касающихся гена-кандидата или фермента, с базами данных, такими как BRENDA, KEGG или MetaCYC. Ген-кандидат или фермент-кандидат могут быть идентифицированы в вышеупомянутых базах данных в соответствии с приведенными здесь идеями.
7. ПРИМЕРЫ
Пример 1: Получение основного штамма дрожжей, способного к высокому потоку фарнезилпирофосфата (FPP) и изопреноида фарнезена.
[0218] Штамм-продуцент фарнезена был создан из штамма Saccharomyces cerevisiae дикого типа (CEN.PK2) путем экспрессии генов мевалонатного пути (ФИГ. 1С) под контролем промоторов GAL1 или GAL10. Этот штамм включал в себя следующие хромосомно интегрированные гены мевалонатного пути из S. cerevisiae: ацетил-КоА-тиолазу, HMG-КоА-синтазу, HMG-КоА-редуктазу, мевалонат-киназу, фосфомевалонат-киназу, мевалонат-пирофосфат-декарбоксилазу и IP-IP-фосфолазу: IPP. Все описанные здесь гены были оптимизированы по кодонам с использованием общедоступных или других подходящих алгоритмов. Кроме того, штамм содержал шесть копий фарнезен-синтазы из Artemisinin annua, также под контролем промоторов GAL1 или GAL10. Штамм также содержал делецию гена GAL80 и дополнительную копию GAL4 под промотором GAL4oc, где кодирующая последовательность гена GAL4 Saccharomyces cerevisiae находится под регуляторным контролем «оперативно-конститутивной» версии его нативного промотора (PGAL4oc; см. например, Griggs & Johnston (1991) PNAS 88 (19): 8597-8601). Наконец, ген ERG9, кодирующий сквален-синтазу, подавляется путем замены нативного промотора промотором дрожжевого гена МЕТ3 (Westfall et al. PNAS 2012).
Пример 2. Генерация базового штамма дрожжей, способного к высокому потоку RebA.
[0219] На ФИГ. 2А показан типичный путь биосинтеза от FPP до стевиола. На ФИГ. 2В показан типичный путь биосинтеза от стевиола до гликозида RebM. Чтобы преобразовать описанный выше штамм фарнезенового основания с высоким потоком в изопреноидный каурен С-20, в геном интегрировали шесть копий геранилгеранилпирофосфат синтазы (GGPPS), а затем по четыре копии копалилдифосфатсинтазы и кауренсинтазы. На этом этапе шесть копий фарнезен-синтазы удаляли из штамма. Как только было подтверждено, что новый штамм вырабатывает энткаурен, в геном встраивали оставшиеся гены для преобразования энткаурена в RebA. В таблице 4 перечислены все гены и промоторы, используемые для преобразования FPP в RebA. Каждый ген после каурен-синтазы объединяли с одной копией, за исключением фермента Sr.KAH, который имел две копии (таблица 4). Штамм, содержащий все гены, описанные в Таблице 1, в основном продуцировал RebA. Фермент UGT91D_like3 обладает низкой активностью по преобразованию RebA в Ребаудиозид D (RebD). Измерили, что одна копия UGT91D_like3 способна преобразовывать приблизительно (3%) RebA в штамме в RebD in vivo в дрожжевом штамме, описанном выше (ФИГ. 3 и таблица 5). UGT76G1 затем может преобразовывать RebD в конечный продукт RebM.
Пример 3. Получение штамма для скрининга новых ферментов UDP-гликозилтрансферазы (UGT) для преобразования RebA в RebD.
[0220] Для создания штамма скрининга для быстрого скрининга на преобразование RebA в RebD in vivo в описанный выше штамм RebA вставили посадочную площадку. Посадочная площадка состояла из 500 п.н. последовательностей ДНК, нацеленных на локус, на обоих концах конструкции до геномной области ниже открытой рамки считывания ALG1 (ФИГ. 4). Внутри посадочная площадка содержала промотор PGAL1 и дрожжевой терминатор, фланкирующий сайт узнавания эндонуклеазы (F-CphI).
Пример 4. Скрининг генов UGT, которые с высокой эффективностью преобразуют RebA в RebD in vivo
[0221] Более ста ферментов UGT, полученных из банка Genbank, оптимизировали по ко донам для оптимальной экспрессии в S. cerevisiae и синтезировали с последовательностью 60 п.н., гомологичной PGAL1, и дрожжевым терминатором, фланкирующим последовательности F-CphI в описанной выше посадочной площадке. Каждый синтезированный ген UGT тестировали индивидуально, с одной копией, на предмет способности преобразовывать RebA в RebD in vivo в описанном выше штамме дрожжей. Дрожжи трансформировали донорской ДНК UGT и плазмидой, содержащей эндонуклеазу F-CphI, для разрезания ДНК в посадочной площадке. Правильные интеграции проверяли с помощью ПЦР колоний с использованием обратного праймера, внутреннего по отношению к конкретному гену UGT в каждой трансформации, и универсального прямого праймера в конце ORF ALG1.
Пример 5. Методы дрожжевой трансформации
[0222] Каждую ДНК-конструкцию интегрировали в Saccharomyces cerevisiae (CEN.PK2) с помощью стандартных методов молекулярной биологии с оптимизированной трансформацией в ацетат лития (LiAc). Вкратце, клетки выращивали в течение ночи в среде пептондекстрозы (YPD) дрожжевого экстракта при 30°С при встряхивании (200 об./мин), разбавляли до OD600 0,1 в 100 мл YPD и выращивали до OD600 0,6-0,8. Для каждой трансформации 5 мл культуры собирали центрифугированием, промывали в 5 мл стерильной воды, снова центрифугировали, ресуспендировали в 1 мл 100 мМ LiAc и переносили в пробирку для микроцентрифугирования. Клетки центрифугировали (13000 мкг) в течение 30 секунд, супернатант удаляли, и клетки ресуспендировали в трансформирующей смеси, состоящей из 240 мкл 50% ПЭГ, 36 мкл 1 М LiAc, 10 мкл ДНК вареной спермы лосося и 74 мкл. донорской ДНК. Для трансформаций, которые требовали экспрессии эндонуклеазы F-Cph1, донорская ДНК включала плазмиду, несущую ген F-CphI, экспрессированный под промотором дрожжевого TDH3. Таким образом сайт узнавания эндонуклеазы F-CphI в посадочной площадке разрезается, чтобы облегчить интеграцию гена UGT. После теплового шока при 42°С в течение 40 минут клетки извлекали в течение ночи в среде YPD перед посевом на селективные среды. Интеграцию ДНК подтверждали с помощью ПЦР колоний с праймерами, специфичными для интеграции.
Пример 6. Условия культивирования дрожжей
[0223] Колонии дрожжей, которые, как было установлено, содержат ожидаемый ген UGT, отбирали в 96-луночные микротитрационные планшеты, содержащие среду Bird Seed Media (BSM, первоначально описанные van Hoek и др., Biotechnology and Bioengineering 68 (5), 2000, pp. 517-523) с 20 г/л сахарозы и 37,5 г/л сульфата аммония. Клетки культивировали при 30°С в высокотемпературном микропланшетном инкубаторе, встряхивая при 1000 об./мин, при влажности 80% в течение 3 дней, пока культуры не достигли истощения углерода. Насыщенные ростом культуры субкультивировали в свежие чашки, содержащие BSM с 40 г/л сахарозы и 150 г/л сульфата аммония, отбирая 14,4 мкл из насыщенных культур и разбавляя в 360 мкл свежей среды. Клетки в производственной среде культивировали при 30°С в высокопроизводительном микротитровальном шейкере при 1000 об./мин и влажности 80% в течение дополнительных 3 дней перед экстракцией и анализом. По завершении весь клеточный бульон разбавляли 360 мкл 100% этанола, герметично закрывали фольгой и встряхивали при 1250 об./мин в течение 30 минут для экстракции стевиоловых гликозидов. В новую пробирку для анализа объемом 1,1 мл добавляли 490 мкл смеси 50:50 этанол : вода и 10 мкл смеси культа/этанол. Смесь центрифугировали для осаждения любых твердых веществ, 400 мкл раствора переносили на новую пластину объемом 1,1 мл и анализировали с помощью LC-MS.
Пример 7. Аналитические методы
[0224] Образцы анализировали с помощью LC-MS масс-спектрометра (АВ QTrap 4000) с использованием Sigma Ascentis Express Peptide ES-C18 (5 см, 2,1 мм, 2,7 мкм; часть №53301-U) со следующим градиентом (подвижная фаза А: 0,1% муравьиная кислота в Н2О; подвижная фаза В: 0,1%) муравьиная кислота в ацетонитриле):
[0225] Масс-спектрометр работал в режиме мониторинга множественных реакций с отрицательными ионами. Каждый изомер ребаудиозида идентифицировали по времени удерживания, определенному по аутентичному стандарту, и переходу MRM:
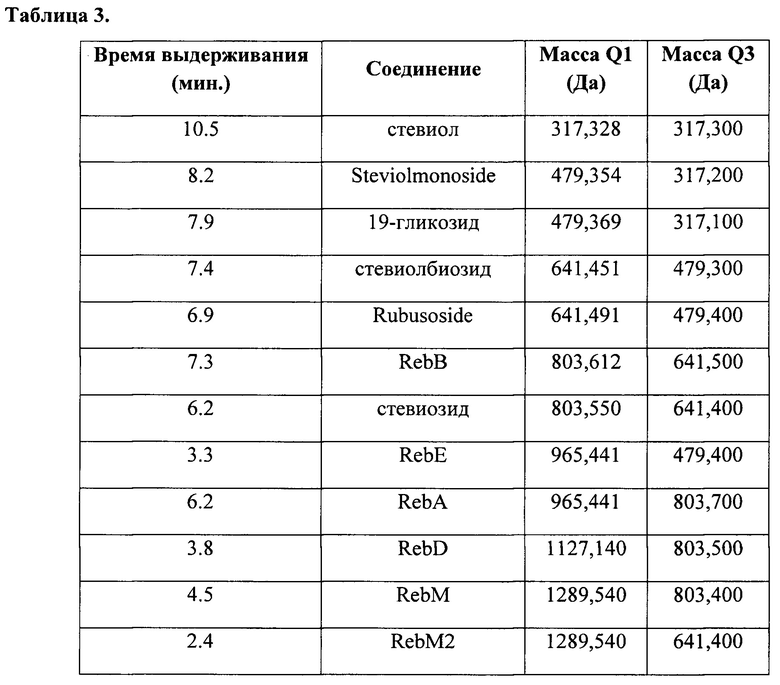
[0226] Площади пиков на хроматограмме от масс-спектрометра использовали для получения калибровочной кривой. Молярное отношение соответствующих соединений (то есть RebA, RebD, RebM) определяли путем количественного определения количества в молях каждого соединения посредством внешней калибровки с использованием аутентичного стандарта и затем с использованием соответствующих соотношений.
[0227] ЯМР-анализ проводили для подтверждения того, что RebM продуцировали из генетически модифицированных штаммов. После ферментации штаммы удаляли из ферментационного бульона. Стевиоловые гликозиды очищали от оставшейся жидкой среды. Могут быть использованы любые подходящие методы для анализа ЯМР, включая те, которые описаны, например, в материалах патентных заявок WO / 2017/093895 и WO / 2016/028899.
Пример 8. Установлено, что ферменты UGT обладают высокой активностью по преобразованию RebA в RebD.
[0228] Было обнаружено, что шесть UGT-ферментов обладают высокой активностью по преобразованию RebA в RebD (ФИГ. 3). Эффективность этих ферментов сравнивали с двумя другими ферментами UGT, описанными в литературе, Os_UGT_91C1 (то есть EUGT11, описанным в материалах патентной заявки WO 2013/022989 А2) и Sl_UGT_101249881 (то есть UGTSL2 в WO2014 / 193888 А1), которые также преобразуют RebA в REBD. В Таблице 5 приведено медианное соотношение [микромоль Reb (D + М) / микромоль (А + D + М)]; RebA, RebD и RebM измеряли in vivo, как описано выше. Это соотношение является мерой эффективности преобразования RebA в RebD. Сумма uM [Reb (А + D + М)] измеряет общее количество RebA, которое когда-либо производилось в клетке. Сумма uM [Reb (D + М)] измеряет общее количество RebD, которое когда-либо производилоь в клетке. На ФИГ. 5a-i показаны хроматограммы RebE, RebA, RebD, RebM и RebM2 для всех генов UGT на ФИГ. 3 и в Таблице 2. RebM2 является изомером RebM с единственной неправильной глюкозной связью. RebM2 имеет Glcβ (1-2) [Glcβ (1-6)] Glcβ1-в позиции углерода 19 (СООН) вместо желаемого Glcβ (1-2) [Glcβ (1-3)] Glcβ1- для RebM.
[0229] Используя методы ЯМР, описанные в Примере 7, образец продукта, полученный из штамма, содержащего UGT40087, сравнивали со стандартным RebM с помощью 1D и 2D ЯМР спектроскопии. Наложение 1D и 2D ЯМР спектров, зарегистрированных в метаноле и пиридине, подтвердило, что оба соединения идентичны. Детальная интерпретация данных 2D ЯМР и сравнение с данными, опубликованными в литературе, подтвердили, что оба образца представляли собой RebM.
[0230] В сосуде для ферментации объемом 0,5 или 2,0 литра UGT40087, экспрессированный на фоне разных штаммов, продуцировал RebA, RebD и RebM в соотношении примерно RebA : RebD : RebM примерно 1:7:50.
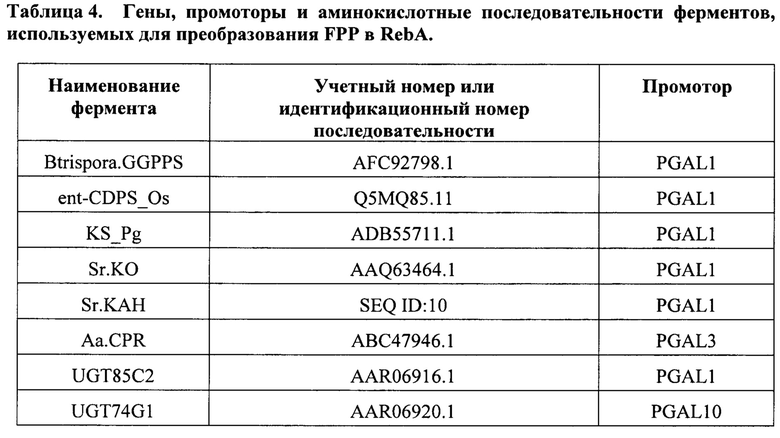

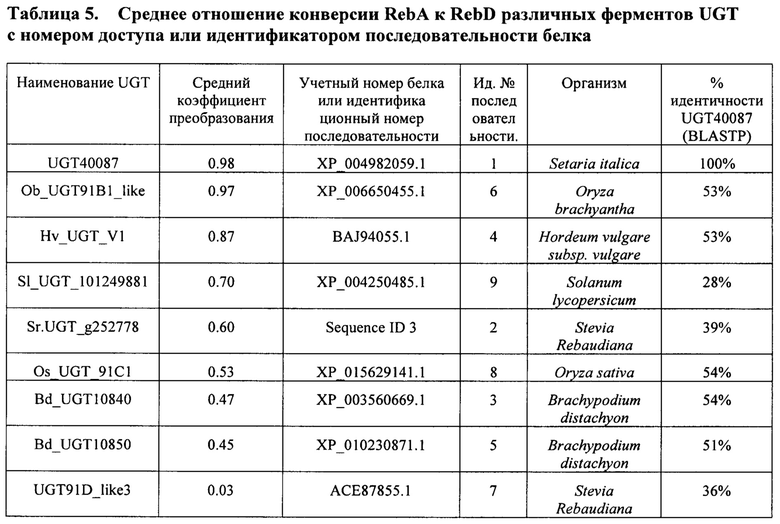
Пример 9: Специфичность ферментов в Таблице 5, которые преобразуют RebA в RebD.
[0231] Ферменты, перечисленные в таблице 5, способны катализировать преобразование RebA в RebD путем добавления глюкозного сахара в позиции С-2'19-О-глюкозы RebA посредством образования бета-1,2-гликозидной связи. В некоторых вариантах осуществления для биотехнологического производства RebM в гетерологичном хозяине желательно продуцировать RebM (1) с высокой чистотой и (2) без получения каких-либо «неприродных» стевиоловых гликозидов. Любой коммерческий продукт, вероятно, потребует чрезвычайно высокой чистоты, чтобы обеспечить наилучший профиль вкуса и соответствовать множеству человеческих пищевых стандартов. Присутствие стевиоловых гликозидов, отличных от RebM, вероятно, увеличит стоимость последующей обработки для получения высокочистого RebM. Если имеются значительные количества не-RebM стевиоловых гликозидов, это может потенциально поставить под угрозу конечную чистоту продукта RebM. В определенных вариантах осуществления может быть выгодным, чтобы гетерологичные ферменты не продуцировали никаких «неприродных» стевиоловых гликозидов. «Неприродный» стевиоловый гликозид определяется здесь как любой стевиоловый гликозид, который, как известно, не встречается в природе в растении Stevia rebaudiana.
[0232] По причинам, описанным выше, все ферменты, перечисленные в Таблице 5, исследовали на предмет их профиля примесей, чтобы определить, производили ли они какие-либо неожиданные или неприродные стевиоловые гликозиды, которые не показаны на РИС 2В. Дополнительно анализировали хроматографические следы для более длительного времени удерживания для всех ферментов, перечисленных в Таблице 2. Из всех ферментов с эффективностью преобразования выше 50% единственными ферментами, которые не давали неожиданных продуктов, были UGT40087 и Os_UGT_91C1 (EUGT11). Как и ожидалось, UGT91D_like3 не давал неожиданных пиков на хроматограмме.
[0233] Среди ферментов с эффективностью преобразования выше 50% хроматографические следы этих ферментов продуцировали один или несколько неожиданных пиков, которые связаны с не встречающимся в природе гликозидом. Например, хроматографический след Ob_UGT91B1_like дает неожиданный пик (стевиол + 2 глюкоза) между пиком RebA и пиком RebB при времени удерживания около 6,61 минуты. Интенсивность неожиданного пика Ob_UGT91B1_like была как минимум в 31 раз выше, чем у пика RebA. См. ФИГ. 9в. Неожиданный пик (стевиол + 2 глюкоза) отсутствует в хроматографическом следе от родительского контрольного штамма (с UGT74G1, UGT85C2, UGT76G1 и UGT91D_like3) или от штамма, содержащего UGT40087. См. ФИГ. 9б и 9в. В другом примере хроматографический след Hv_UGT_V1 дает неожиданный пик (стевиол + 2 глюкоза) между пиком RebA и пиком RebB при времени удерживания около 6,61 минуты. Интенсивность неожиданного пика Hv_UGT_V1 была на 0,6 раза ниже, чем у пика RebA. В другом примере хроматографический след Sl_UGT_101249881 дает неожиданный пик (стевиол + 2 глюкоза) между пиком RebA и пиком RebB при времени удерживания около 6,67 минут. Интенсивность неожиданного пика Sl_UGT_101249881 была примерно в 1,11 раза выше, чем у пика RebA. В другом примере хроматографический след Sr.UGT_g252778 дает неожиданный пик (стевиол + 2 глюкоза) между пиком RebA и пиком RebB при времени удерживания около 6,67 минут. Интенсивность неожиданного пика Sr.UGT_g252778 была примерно на 0,96 раза ниже, чем у пика RebA. Некоторые из этих ферментов также дают дополнительные неожиданные пики. Хроматографические следы для Hv_UGT_V1, Sl_UGT_101249881 и Sr.UGT_g252778 опущены.
[0234] Эти результаты показывают, что по сравнению с двумя ферментами UGT40087 и Os_UGT_91C1 (EUGT11) другие три фермента с более чем 50%-ной эффективностью преобразования А в D (т.е. Hv_UGTV1, SI_UGT_101249881 и Sr.UGT_g252778) могут катализировать дополнительные реакции, потенциально продуцирующие стевиоловые гликозиды, которые обычно не образуются на пути к RebM на растении Stevia Rebaudiana.
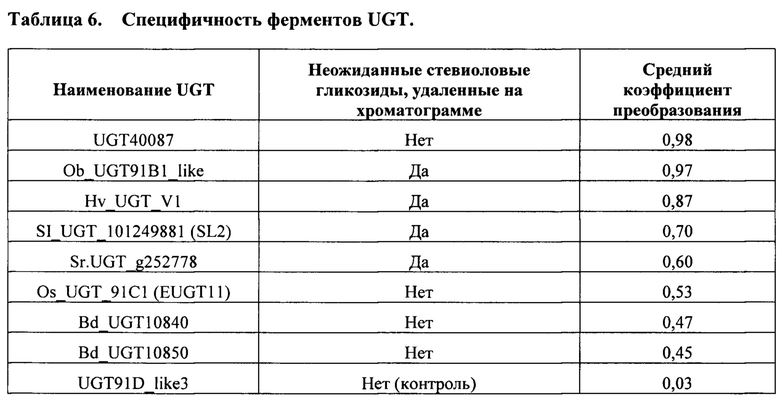
Пример 10. Активность фермента UGT40087 специфична для позиции С-2'стевиоловых гликозидов 19-О-глюкозы.
[0235] UGT40087 катализирует реакцию добавления второго сахарного фрагмента к позиции С-2'19-О-глюкозы либо стевиозида, либо RebA. Как показано на ФИГ. 5а и 5i, родительский контрольный штамм без UGT40087 (как описано в Примере 2) способен вырабатывать RebA, но не выявляет определяемых количеств RebE, RebD или RebM. Добавление UGT40087 в родительскую клетку теперь приводит к обнаруживаемому количеству RebE, что указывает на то, что UGT40087 катализирует добавление второго фрагмента глюкозы к позиции С-2'19-О-глюкозы в связи бета-1,2 стевиозид, для получения RebE. Кроме того, два новых пика для RebD и RebM появляются на хроматограмме для штамма, содержащего UGT40087, в то время как пик для RebA значительно снижается по сравнению с родительским штаммом без UGT40087. Следовательно, UGT40087 способен катализировать добавление второй глюкозной группы к позиции С-2'19-О-глюкозы в бета-1,2-связи ребаудиозида А с ребаудиозидом D. Присутствие UGT76G1 в штамме затем катализирует окончательное добавление глюкозы для преобразования RebD в RebM.
[0236] Чтобы проверить способность добавлять сахар в позиции С-2'13-О-глюкозы в бета-1,2-связи стевиолмонозида или рубусозида, изготовили базовый штамм, который несет высокий поток только к рубусозиду. Базовый штамм рубузозида генетически идентичен базовому штамму RebA, описанному в Примере 2, за исключением того, что базовый штамм рубусозида не содержит фермент UGT91D_like3. Как показано в Таблице 7, штамм на основе рубусозида, который имеет UGT74G1, UGT85C2 и UGT76G1, способен производить только 19-гликозид, стевиолмонозид и рубусозид. Добавление UGT40087 к этому штамму не меняет этот профиль. Если UGT40087 был способен добавлять сахар в позиции С-2' 13-О-глюкозы в бета-1,2-связи стевиолмонозида или рубусозида, то должны быть обнаруживаемые количества либо стивиолбиозида, либо стивиозида, либо обоих. Стевиолбиозид, стевиозид, а также RebA видны, когда штамм трансформируется UGT91D_like3, который способен добавлять сахар в позиции С-2'13-О-глюкозы в бета-1,2-связи как стевиолмонозида, так и рубусозида.
[0237] EUGT 11 (Os_UGT_91C1) ранее был охарактеризован другими исследователями для катализирования добавления второго сахарного фрагмента в позиции С-2' либо гликозида 19-О-стевиола, либо гликозида 13-О-стевиола. См. ФИГ. 5 патентной заявки WO 2013/022989. Как отмечено выше, UGT40087, по-видимому, не катализирует добавление сахара в позиции С-2' 13-О-глюкозы в бета-1,2-связи стевиолмонозида или рубусозида на определяемом уровне. Эти результаты показывают, что UGT40087 является UDP-гликозилтрансферазой, которая функционально различима и дает другие результаты по сравнению с EUGT11.
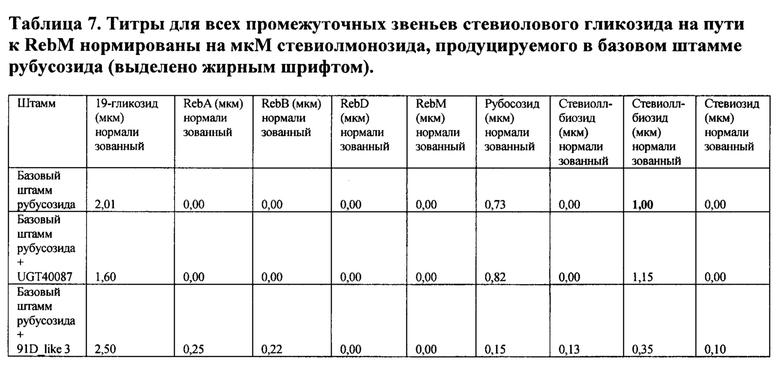
Пример 11. Проектирование UGT-химер путем замены N-концевых доменов.
[0238] Растительные UDP-гликозилтрансферазы (UGT) имеют высоко консервативные белковые структуры, даже если они имеют относительно низкую гомологию аминокислотной последовательности. Эти UGT, которые принимают так называемую структурную складку GT-B, состоят из двух доменов, грубо разрушающихся в средней точке их первичных аминокислотных последовательностей. N-концевой домен представляет собой акцепторный домен сахара, который в основном определяет субстратную специфичность. Как и ожидалось, этот домен является более вариабельным доменом с точки зрения его аминокислотной последовательности, отражая разнообразные субстраты, которые могут быть гликозилированы UGT. Более консервативным С-концевым доменом является донорный домен сахара, с которым связана UDP-глюкоза. Два домена обычно связаны гибким линкером, создавая идеальную область для расщепления белка для схем замены доменов (ФИГ. 6). Учитывая природу высоко консервативной доменной структуры UGT, домены из любых двух UGT могут быть рекомбинированы для изменения специфичности субстрата или усиления желаемой функции, такой как каталитическая активность. В этом примере мы исследовали роль N-концевого домена UGT40087 в придании субстратной специфичности, то есть активности преобразования RebA в RebD путем конструирования нескольких химер UGT путем замены домена.
[0239] Общий подход, который можно было бы использовать для разработки эксперимента по перестановке доменов, включает следующие этапы: 1) выбор пар перестановки кандидатов, 2) выбор сайта перестановки доменов для создания химеры между парой UGT (с возможностью мутировать С-концевой домен для улучшения взаимодействия с целевым субстратом и N-концевым доменом), и 3) создание, развитие и тестирование химерных белков на предмет требуемой активности. Этот подход был использован в этом примере для замены домена, как описано ниже.
[0240] В качестве родителей для конструирования химер выбрали четыре UGT: UGT40087 (SEQ ID №11), UGT Si91Dlike (SEQ ID №12), OS_UGT_91C1 (SEQ ID №8) и 91Dlike3 (SEQ ID №7), N-концевой домен UGT40087 использовался для замены N-концевых доменов Si91Dlike, OS_UGT_91C1 и 91Dlike3, создавая три химеры с общей идентичностью последовательностей 97%, 79% и 71% относительно UGT40087 соответственно.
[0241] SWISS-MODEL использовали для генерации структурных моделей для всех четырех UGT. Точные положения аминокислот («сайты обмена») выбрали на основе структурных выравниваний и выравниваний последовательностей. Чтобы минимизировать возмущение трехмерного сворачивания химерных белков, гибкий участок, расположенный между N- и С-концевыми доменами, которые составляют две отдельные половины фермента (ФИГ. 6), использовали для обмена местами. Gly215 и Leu216 (номера аминокислот относятся к UGT40087) в этом регионе высоко консервативны во всех UGT, включая четыре UGT в этом Примере. Следовательно, два домена разделили между этими двумя остатками для замены домена (ФИГ. 6).
[0242] Чтобы проверить эффекты перестановок доменов, эксперименты проводили на штаммах дрожжей, которые являются генетически идентичными, за тем исключением, что штаммы дрожжей включают разные UGT. Эти штаммы дрожжей, однако, генетически отличаются от тех, которые используются при скрининге разнообразия UGT, описанном в Примере 4. Общие методы, описанные в Примерах 4-7, использовали для трансформации штаммов, культивирования и анализа. Коэффициенты преобразования RebA в RebD для различных схем обмена доменами показаны в Таблице 8 ниже.
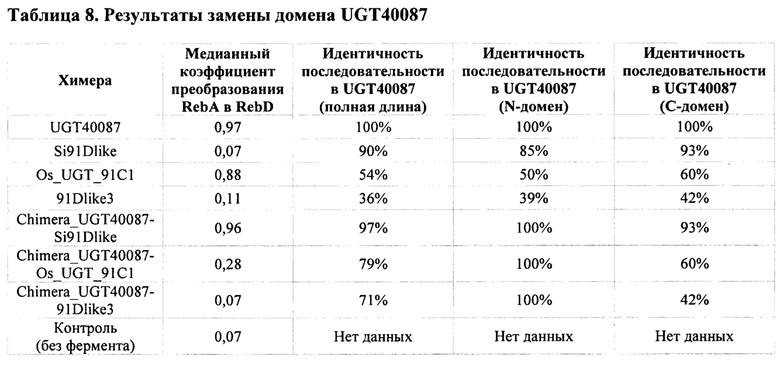
[0243] UGT40087 разделяет 90%, 54% и 36% общей идентичности последовательностей с Si91Dlike, Os_UGT_91C1 и 91Dlike3 соответственно. За исключением 91Dlike3, который имеет приблизительно 40% идентичных последовательностей в N- и С-концевых последовательностях в отношении UGT40087, химеры N-концевого домена UGT40087 и С-концевые домены Si91Dlike и Os_UGT_91C1 активны в преобразовании RebA в RebD (Таблица 8). Несмотря на то, что Si91Dlike не имеет обнаруживаемой активности, замена его N-концевого домена доменом UGT40087 перенесоа всю активность UGT40087, что указывает на то, что N-концевой домен UGT40087 важен для преобразования RebA в RebD.
[0244] Выравнивания четырех родительских UGT также выявляют шесть N-концевых аминокислотных остатков (V11, I12, Р55, Е90, S203, Е223 и V413 в UGT40087; ФИГ. 8 - выравнивание последовательности), которые являются общими для двух активных ферментов (UGT40087 и Os_UGT_91C1) для преобразования RebA в RebD, но отличаются от таковых в двух неактивных ферментах (Si91Dlike и 91Dlike3).
Пример 12. Разработка вариантов UGT путем замены N-концевых петель
[0245] Сравнение смоделированных структур UGT40087 и Os_UGT_91C1 выявило четыре петли, которые обладают значительными конформационными различиями в N-концевом акцепторном домене сахара. Расположение петель показано на ФИГ. 6. Чтобы идентифицировать петли, которые могут способствовать превосходной активности UGT40087 по преобразованию RebA в RebD, каждую из этих петель поменяли местами в двух белках для генерации в общей сложности 12 вариантов UGT. Разработали две версии loop_3 и loop_4 для учета двух возможных длин петли. Подробные проекты приведены в Таблицах 9 и 10.

[0246] В таблице 9 аминокислотная последовательность с идентификационным номером последовательности между двумя аминокислотными остатками с индексами представляет собой область петли, замененную с Os_UGT_91C на основание UGT40087. Два аминокислотных остатка с индексами, смежными с областью замененной петли из Os_UGT_91C, и номера индексов соответствуют аминокислотным остаткам и аминокислотной позиции UGT40087, соответственно, до включения области измененной петли. В новых химерных UGT, перечисленных в Таблице 9, область перестановочной петли из Os_UGT_91C заменила соответствующую область петли основания UGT40087.
[0247] Отмечено, что аминокислотная последовательность SEQ ID NO: 27, область с измененной петлей, интегрированной в UGT40087_loop1, является модифицированной версией первоначальной петли 1 Os_UGT_91C1. Более конкретно, 12-й аминокислотный остаток в последовательности SEQ ID NO: 27 представляет собой пролин (вместо аргинина, который присутствует в соответствующей позиции в исходной петле 1 Os_UGT_91C, имеющей SEQ ID NO: 8). Таким образом, в UGT40087_loop1 имеется одна аминокислотная замена, пролин в положении 51, по сравнению с исходной последовательностью UGT40087, имеющей SEQ ID NO: 11. Положение замещенного пролина в положении 51 в UGT40087_loop1 показано жирным шрифтом в Таблице 9.

[0248] В Таблице 10 аминокислотная последовательность с идентификационным номером последовательности между двумя аминокислотными остатками с индексами представляет собой область петли, замененную UGT40087 на основание Os_UGT_91C1. Два аминокислотных остатка с индексами, смежными с областью подкачки петли из UGT40087, и номера индексов соответствуют аминокислотным остаткам и аминокислотным положениям Os_UGT_91C1, соответственно, до включения области подкачки петли. В новых химерных UGT, перечисленных в таблице 10, область перестановочной петли из UGT40087 заменила соответствующую область петли в базе OSUGT91C1.
[0249] Отмечается, что аминокислотная последовательность SEQ ID NO: 28, области с замененной петлей, интегрированной в Os_UGT_91C1_loop1, представляет собой модифицированную версию оригинальной петли 1 UGT40087. Более конкретно, 12-й аминокислотный остаток в последовательности SEQ ID NO: 28 представляет собой аргинин (вместо пролина, который присутствует в соответствующем положении в исходной петле 1 UGT40087, имеющей SEQ ID NO: 11). Таким образом, в Os_UGT_91C1_loop1 имеется одна аминокислотная замена, аргинин в положении 58, по сравнению с исходной последовательностью Os_UGT_91C1, имеющей SEQ ID NO: 8. Положение замещенного аргинина в положении 58 в Os_UGT_91C1_loop1 выделено жирным шрифтом в Таблице 10.
[0250] Вариантные белки синтезировали с помощью Twist Bioscience с последовательностью в 60 п.н., гомологичной промотору GAL1, и дрожжевым терминатором, фланкирующим последовательности F-CphI в посадочной площадке, описанной в Примере 4. Каждый синтезированный вариант UGT тестировали индивидуально как отдельную хромосомную копию на предмет активности в преобразовании RebA в RebD на том же фоне штаммов, что и в Примере 11 для экспериментов по замене химер доменом UGT. Для создания штаммов ДНК-доноры химеры UGT и плазмиду, содержащую эндонуклеазу F-CphI, трансформировали в клетки-хозяева дрожжей. Правильные интеграции проверяли верены с помощью ПЦР колоний с использованием обратного праймера, внутреннего по отношению к конкретным генам UGT, и универсального прямого праймера в конце локуса интеграции. Подтвержденные штаммы тестировали на преобразование RebA в RebD, как описано выше.
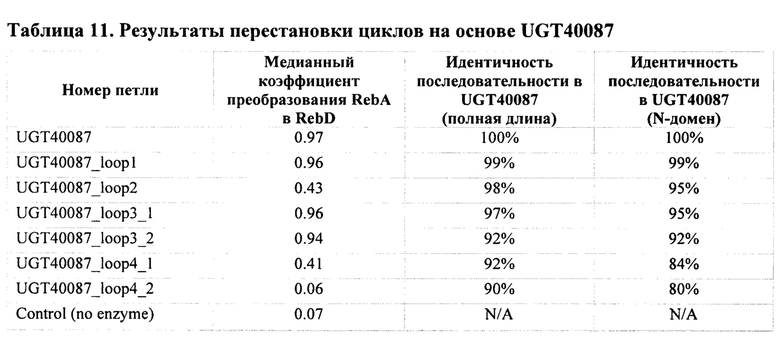
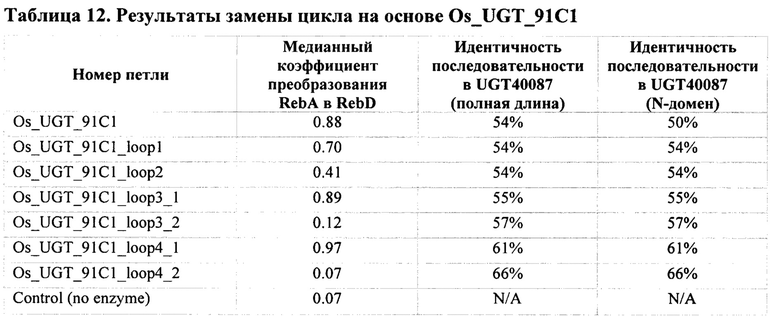
[0251] С UGT40087 в качестве родителя все варианты с циклической заменой были активны при преобразовании RebA в RebD, за исключением UGT40087_loop4_2 (Таблица 11). Loop4_2 - это длинная последовательность, которая расположена близко к интерфейсу домена N- и С-конца, и ее замена может создать существенное возмущение для общей структуры варианта. Среди всех активных вариантов идентичность N-концевой последовательности к UGT40087 варьируется от 84% (Loop4_1) до 99% (Loop1).
[0252] С Os_UGT_91C1 в качестве родителя, большинство вариантов с циклической заменой также показали активность в преобразовании RebA в RebD (таблица 12). Опять же, обмен Loop4_2 отменил действие, поддерживая гипотезу о том, что его замена может повлиять на структурную целостность варианта. Примечательно, что включение Loop4_1 привело к увеличению коэффициента преобразования RebA в RebD (с 88% до 97%), что указывает на то, что Loop4_1 ответственен за обеспечение превосходной активности UGT40087. Кроме того, результаты экспериментов по замене петель с обоими белками в качестве родителей также показали, что эти области петель важны для придания различий в активности и субстратной специфичности UGT, обладающих активностью RebA к RebD, и дополнительную замену вариантов петли гомолога или мутагенеза этих областей петли можно использовать для генерации улучшенных вариантов UGT для преобразования RebA в RebD.
[0253] Все публикации, патенты и патентные заявки, процитированные в этом описании, включены сюда посредством ссылки, как если бы каждая отдельная публикация или заявка на патент были конкретно и индивидуально указаны для включения в качестве ссылки. Хотя вышеизложенное изобретение было описано в некоторых деталях в целях иллюстрации и примера для ясности понимания, специалистам в данной области техники будет легко понять в свете идей этого изобретения, что некоторые изменения и модификации могут быть сделаны без отступления от сущности или объема прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ КАУРЕНОКСИДАЗЫ PISUM SATIVUM ДЛЯ ВЫСОКОЭФФЕКТИВНОГО ПРОИЗВОДСТВА РЕБАУДИОЗИДОВ | 2018 |
|
RU2795550C2 |
| БИОСИНТЕТИЧЕСКОЕ ПОЛУЧЕНИЕ СТЕВИОЛОВОГО ГЛИКОЗИДА РЕБАУДИОЗИДА D4 ИЗ РЕБАУДИОЗИДА E | 2017 |
|
RU2764803C2 |
| РЕКОМБИНАНТНОЕ ПОЛУЧЕНИЕ СТЕВИОЛ-ГЛИКОЗИДОВ | 2014 |
|
RU2706789C2 |
| АBC-ТРАНСПОРТЕРЫ ДЛЯ ВЫСОКОЭФФЕКТИВНОГО ПРОИЗВОДСТВА РЕБАУДИОЗИДОВ | 2020 |
|
RU2795855C2 |
| ГИДРОЛИЗ СТЕВИОЛОВЫХ ГЛИКОЗИДОВ С ПОМОЩЬЮ БЕТА-ГЛЮКОЗИДАЗЫ | 2018 |
|
RU2775697C2 |
| СПОСОБЫ И ВЕЩЕСТВА ДЛЯ ОСНОВАННОГО НА РЕКОМБИНАЦИИ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ШАФРАНА | 2012 |
|
RU2676730C2 |
| Способ получения ребаудиозида D и ребаудиозида M | 2022 |
|
RU2839979C2 |
| РЕКОМБИНАНТНОЕ ПОЛУЧЕНИЕ СТЕВИОЛ-ГЛИКОЗИДОВ | 2014 |
|
RU2741103C2 |
| СПОСОБЫ ФЕРМЕНТАТИВНОГО СИНТЕЗА МОГРОЗИДНЫХ СОЕДИНЕНИЙ | 2012 |
|
RU2633644C2 |
| УЛУЧШЕННЫЕ ВАКЦИНЫ ПРОТИВ Bordetella pertussis НА ОСНОВЕ МУТАНТНЫХ ГЛИКОЗИЛТРАНСФЕРАЗ LPS | 2008 |
|
RU2542667C2 |






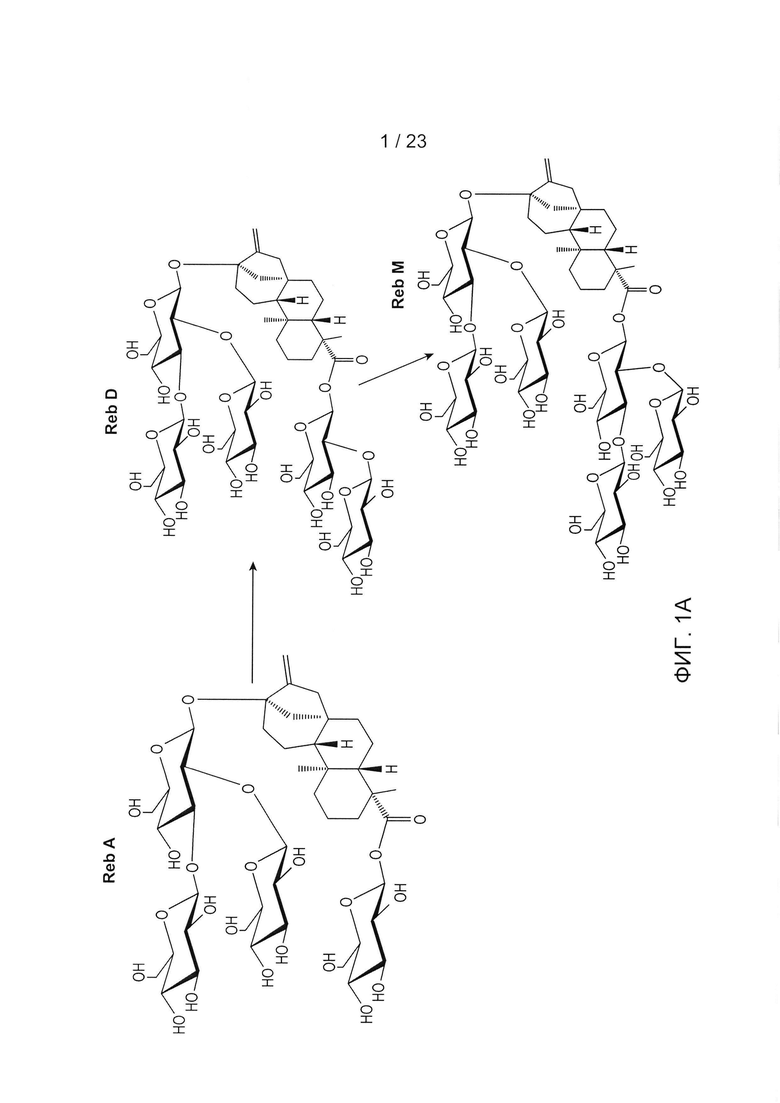
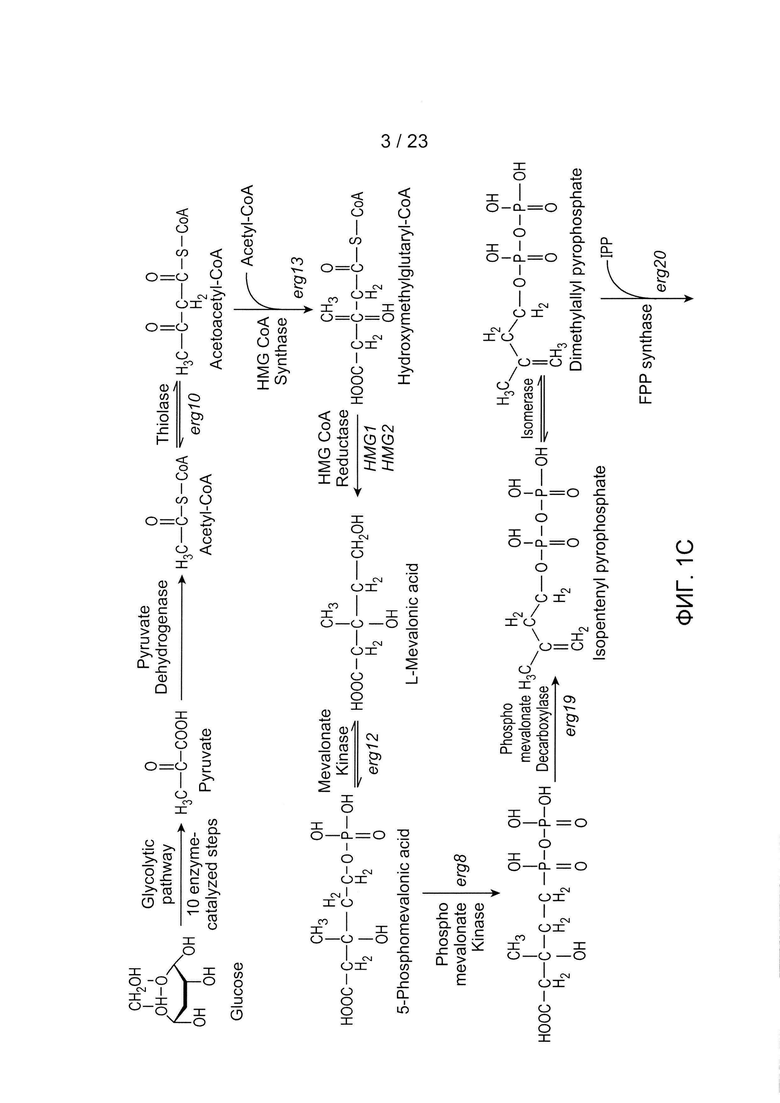
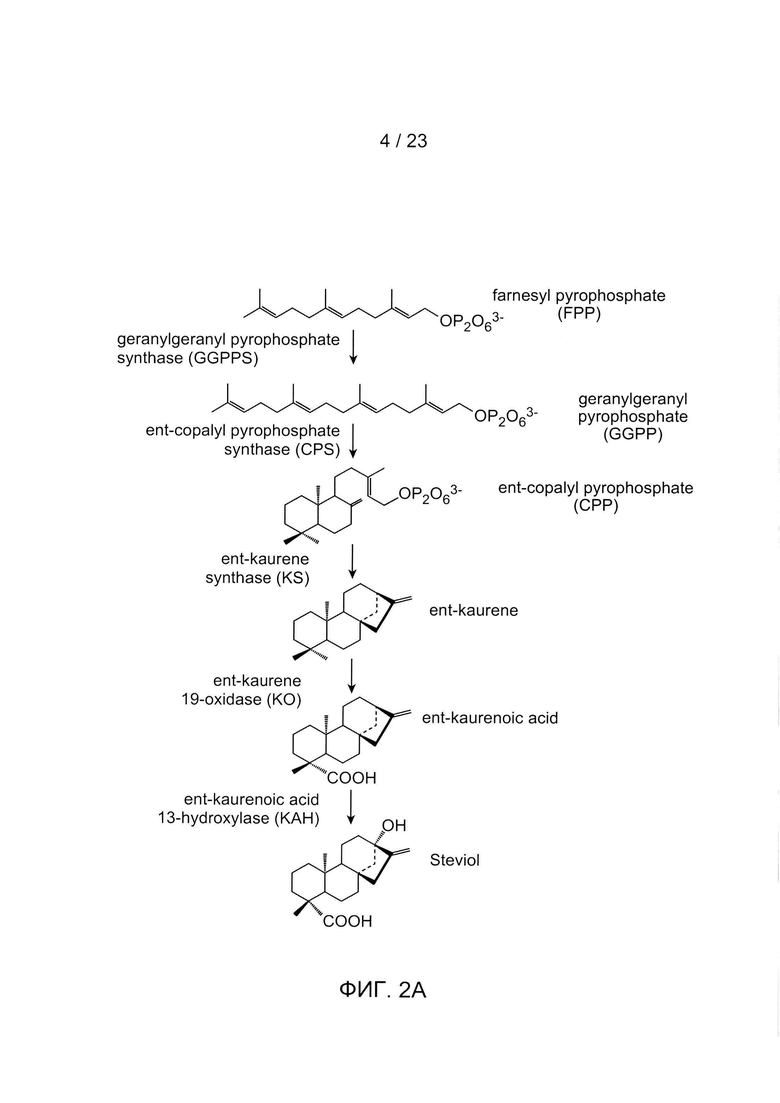
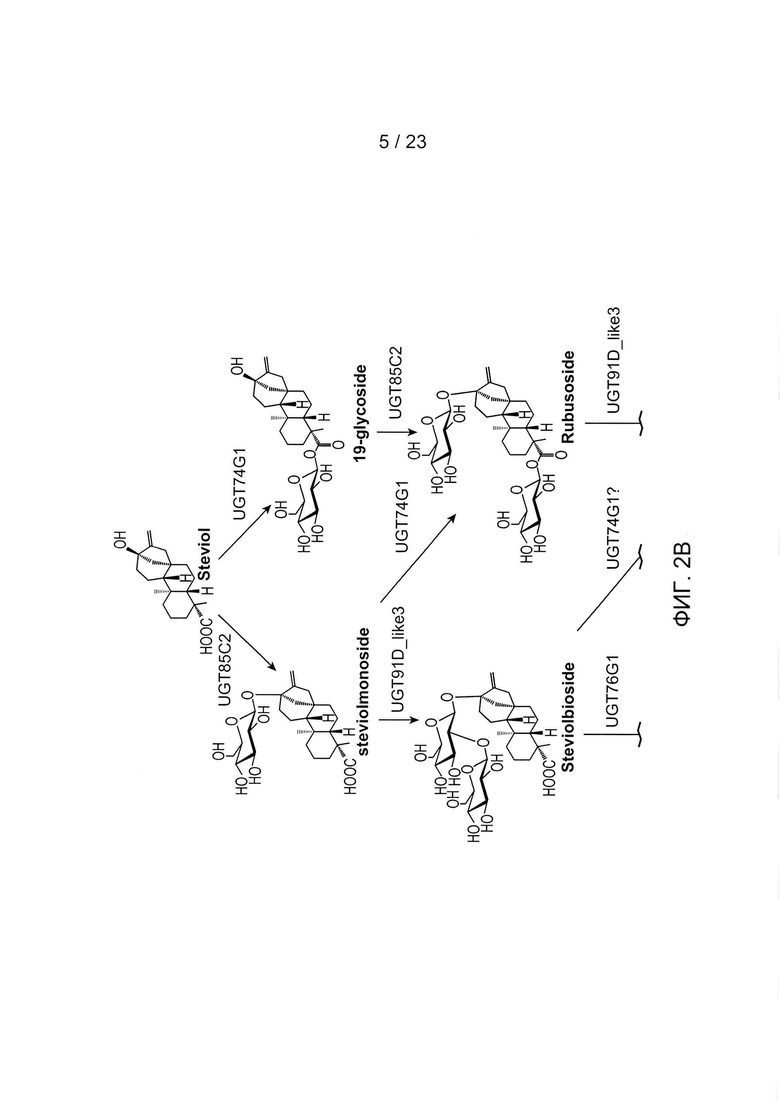
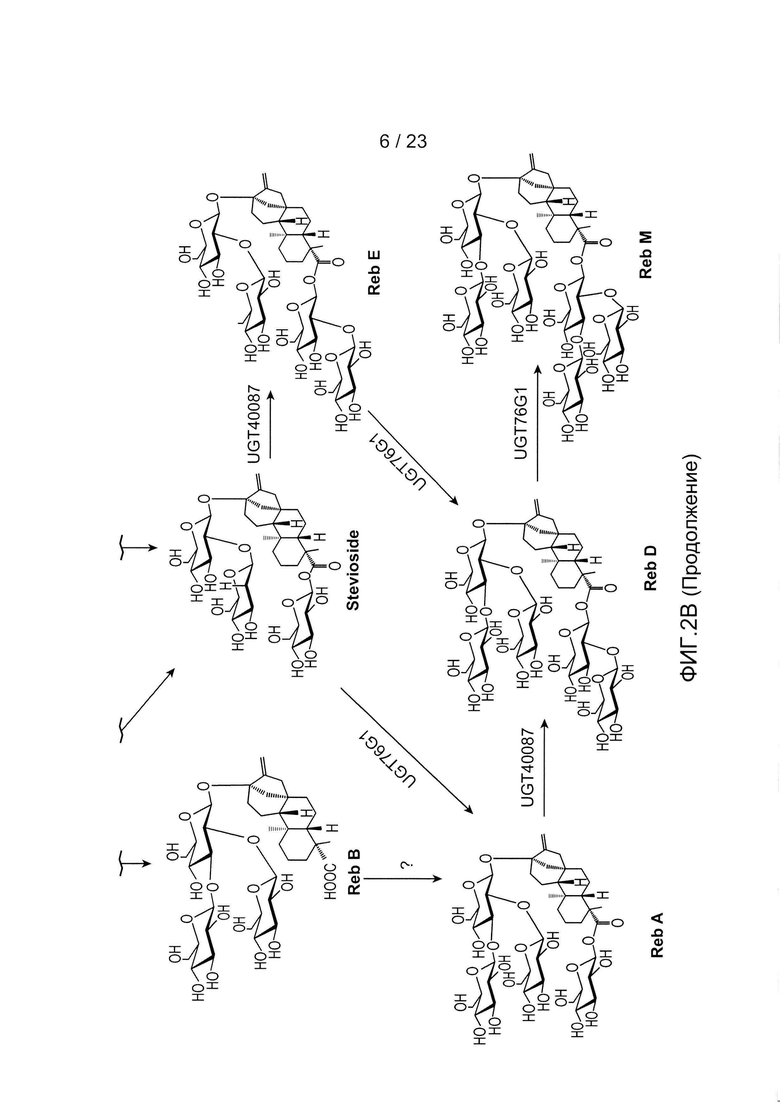
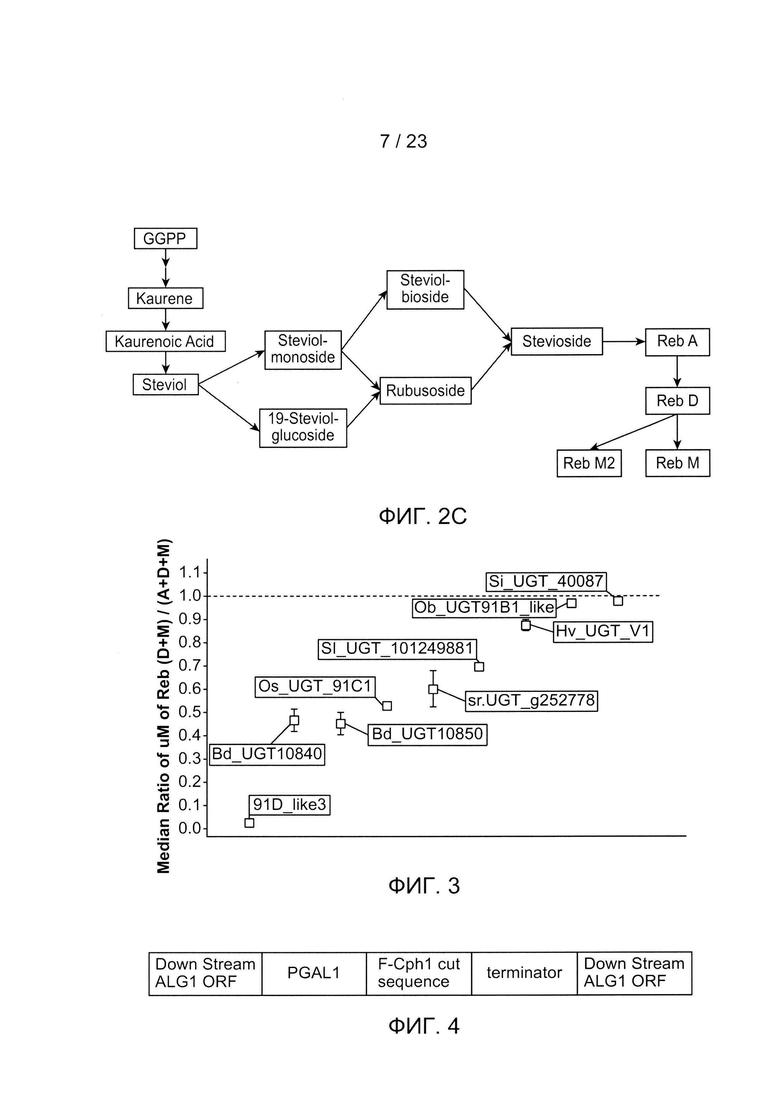
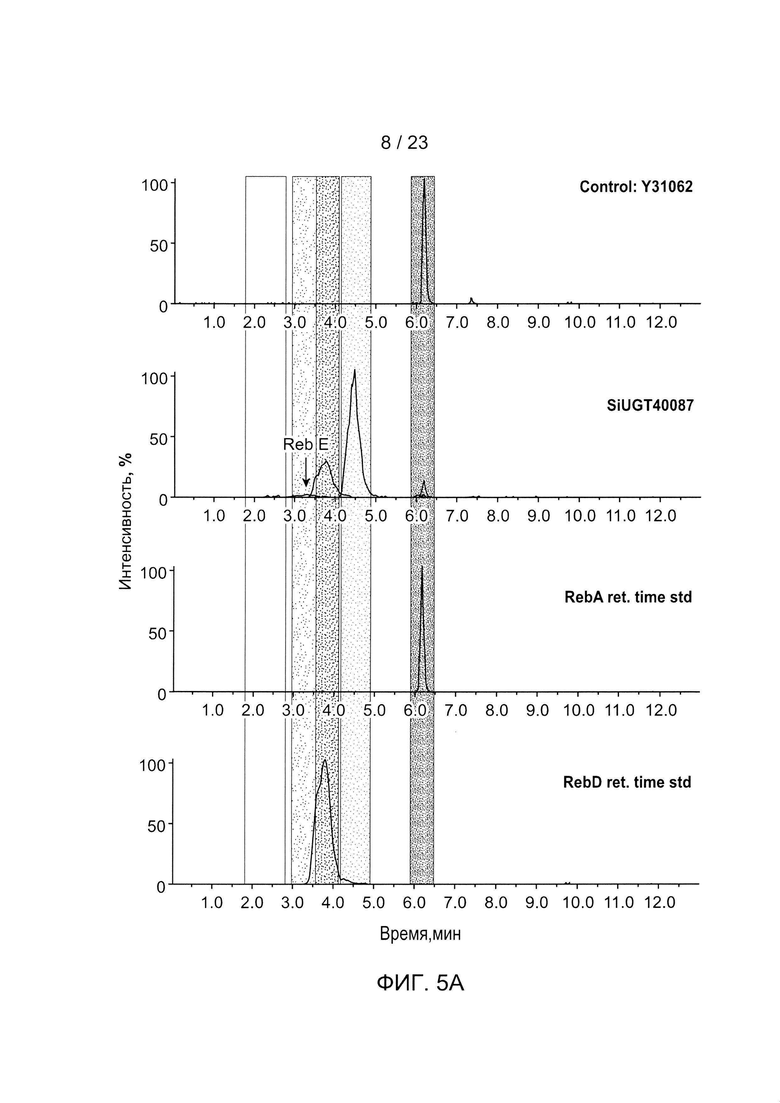
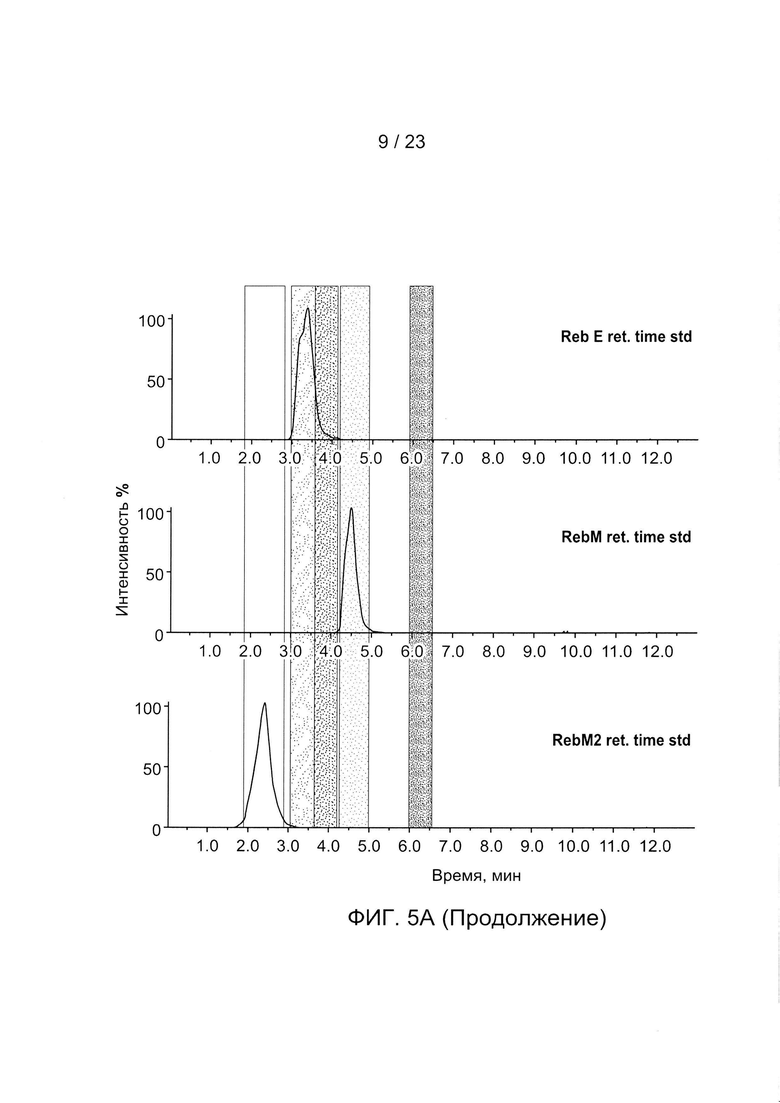
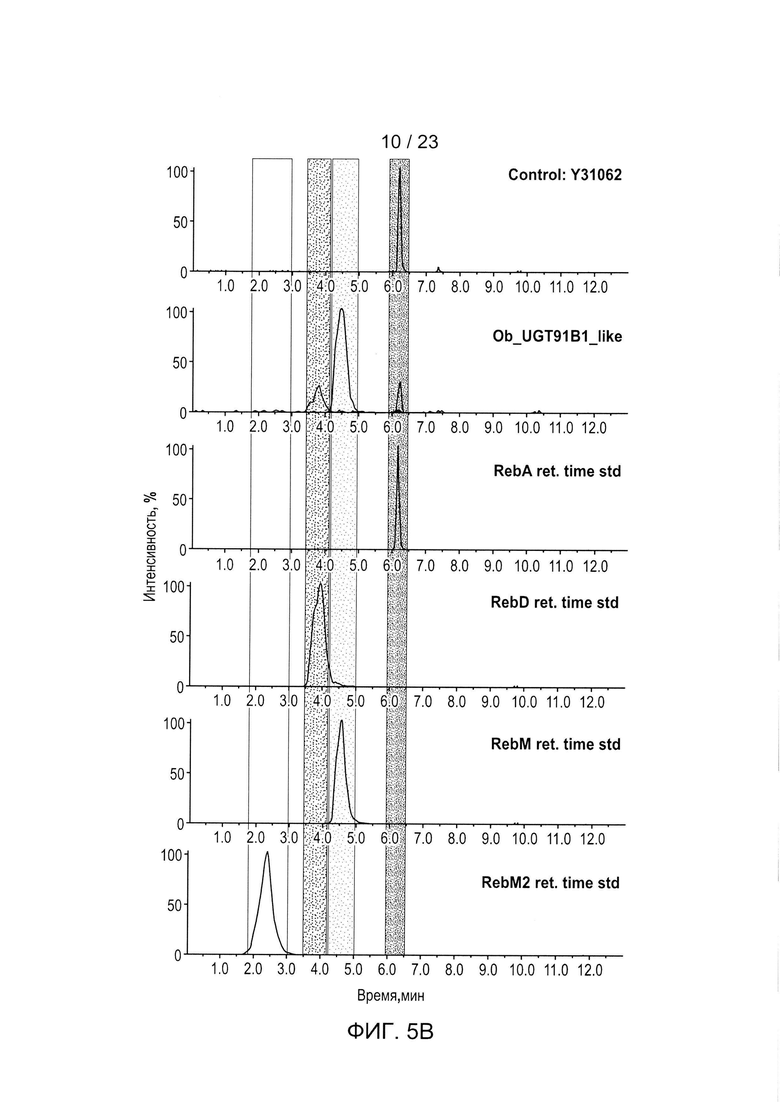
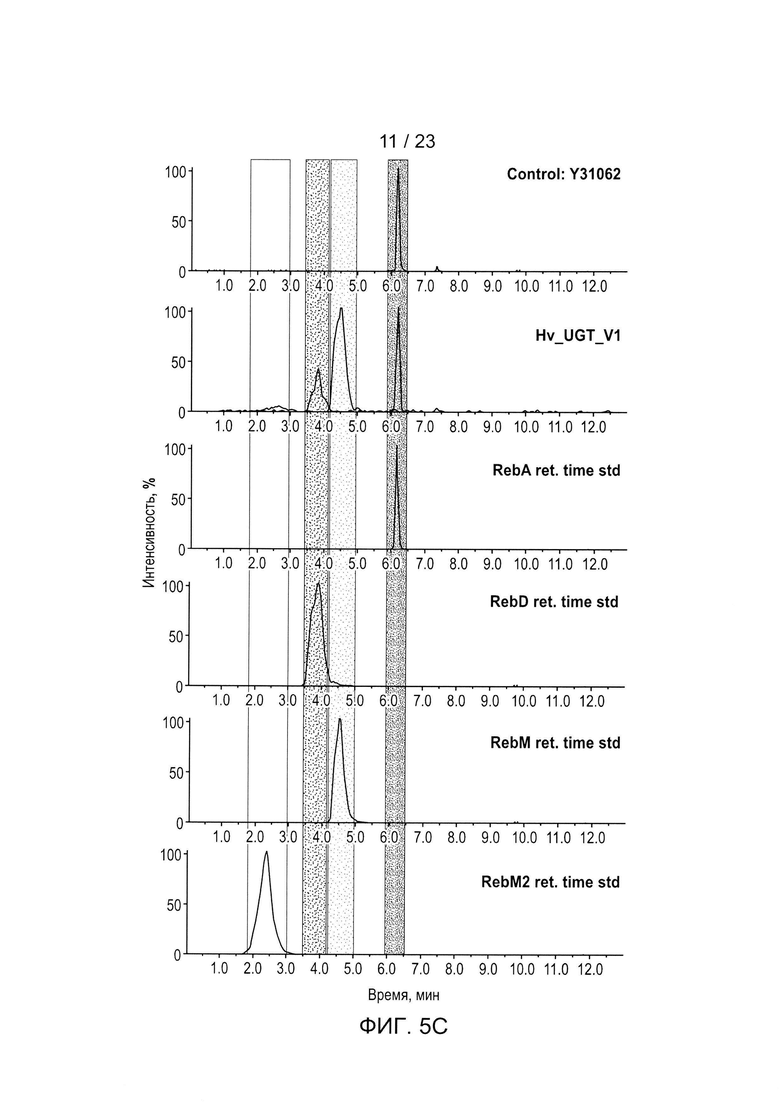
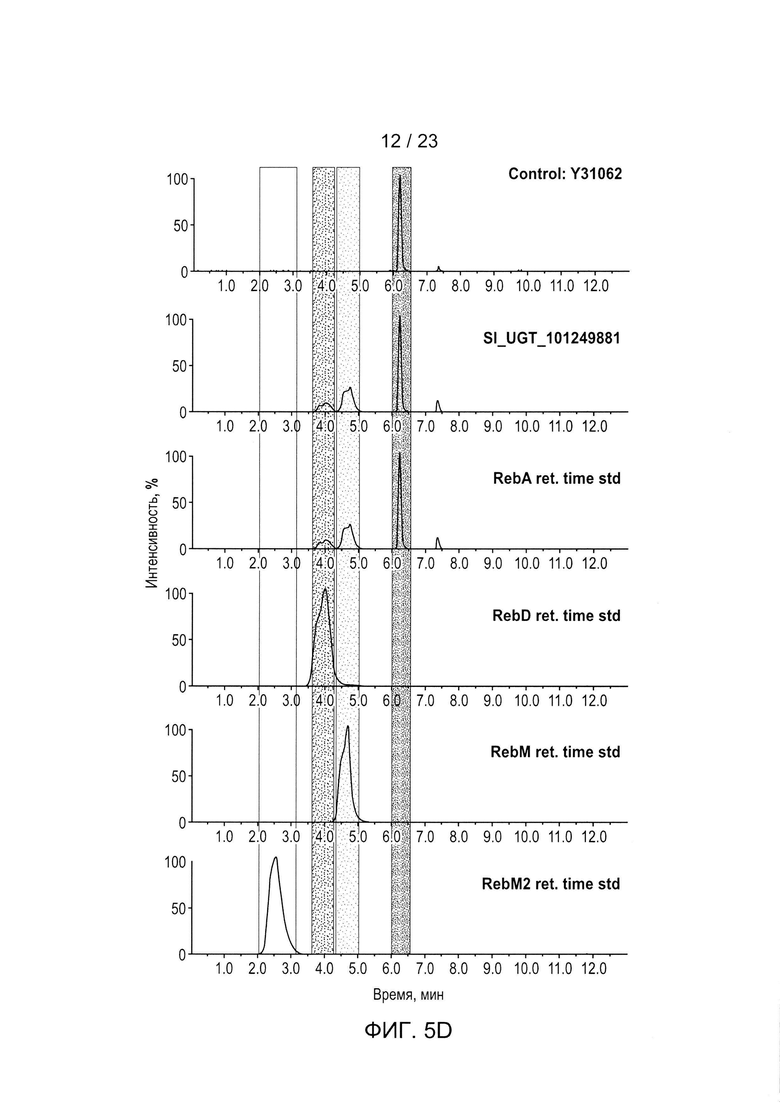
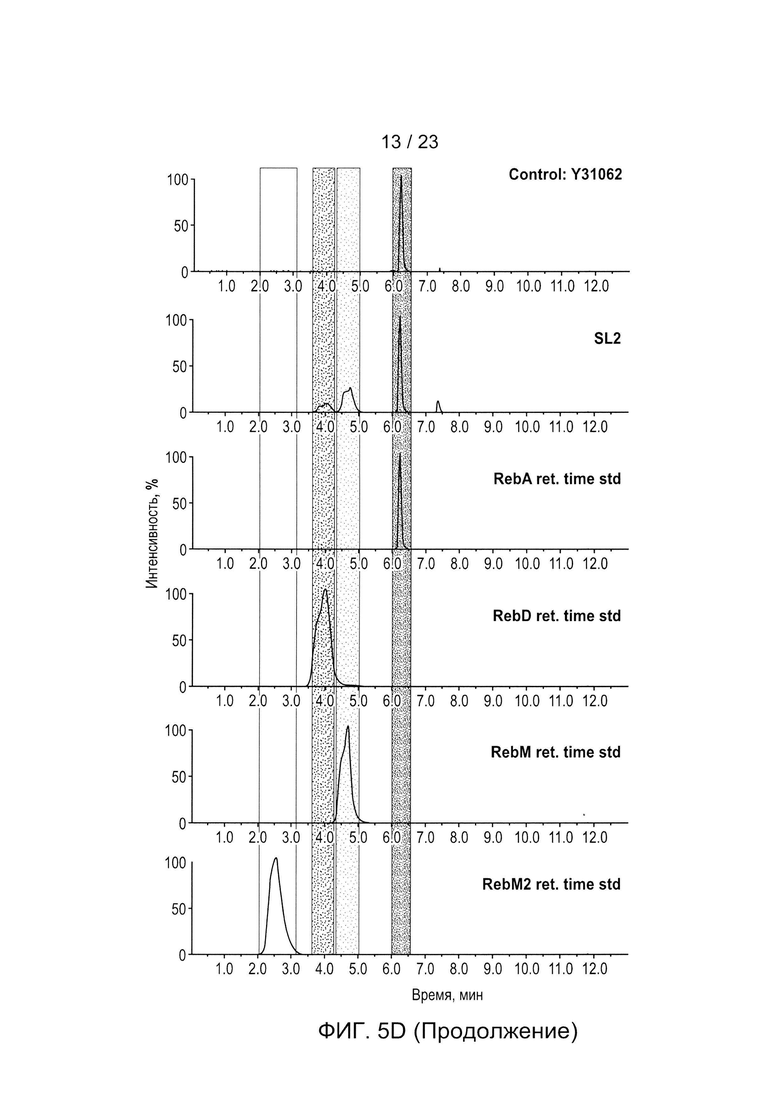
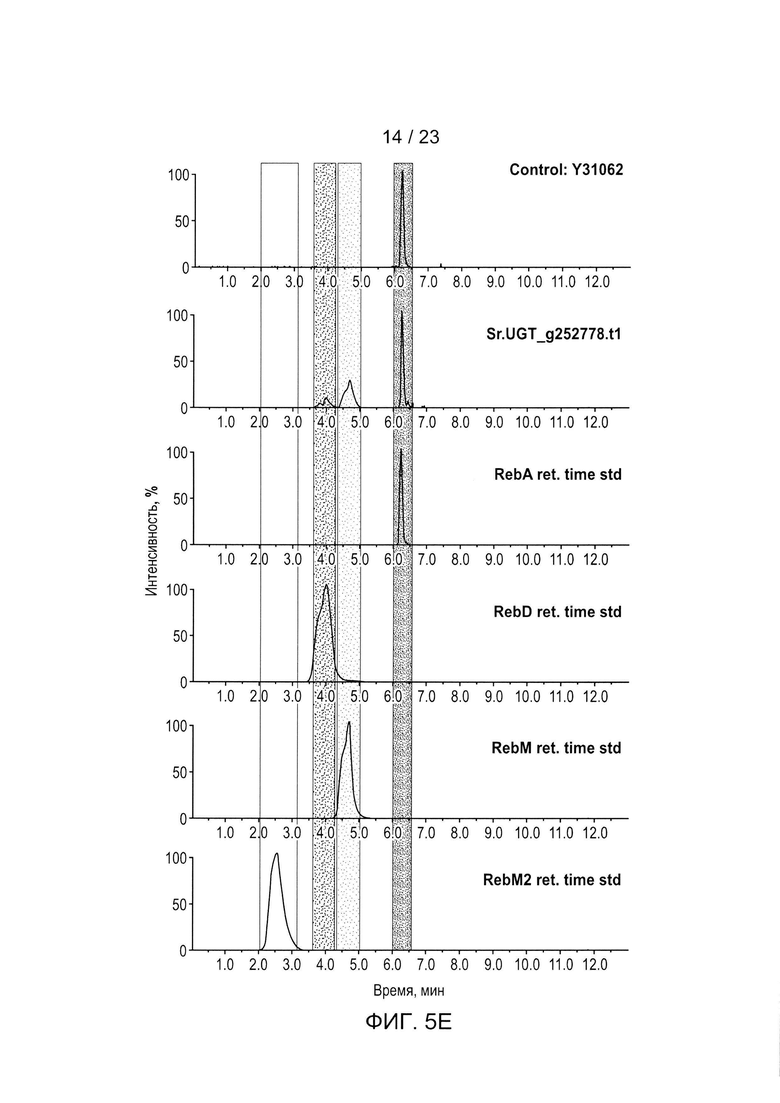
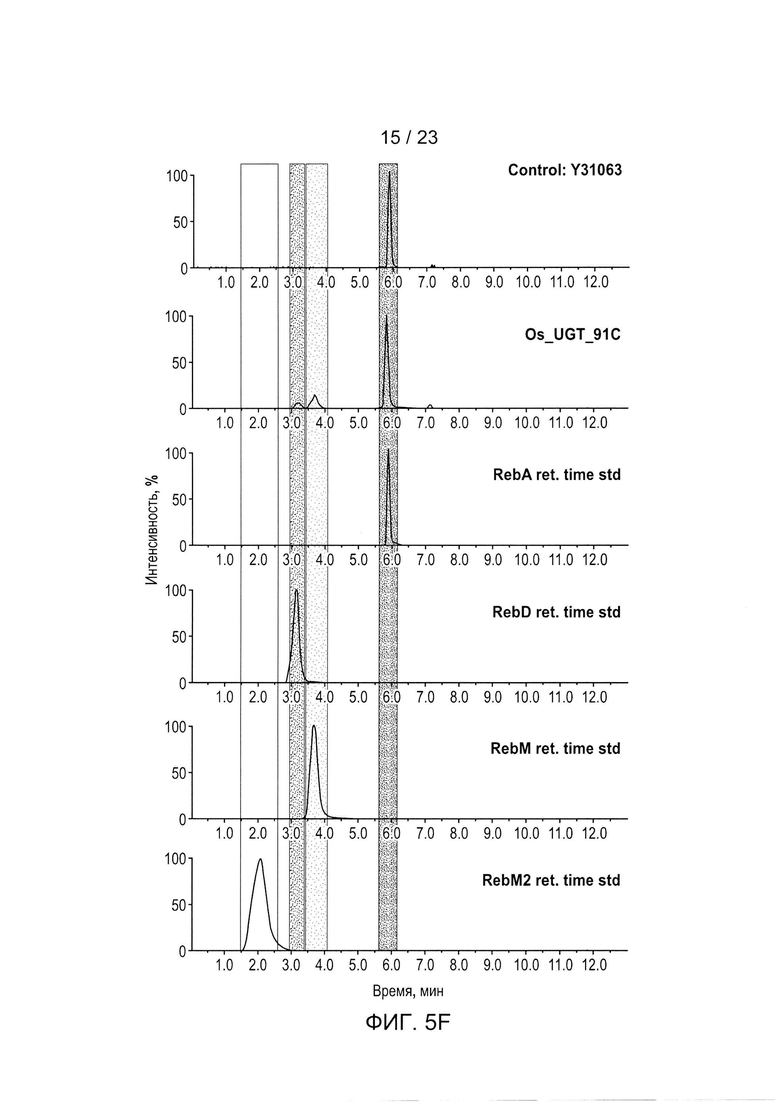
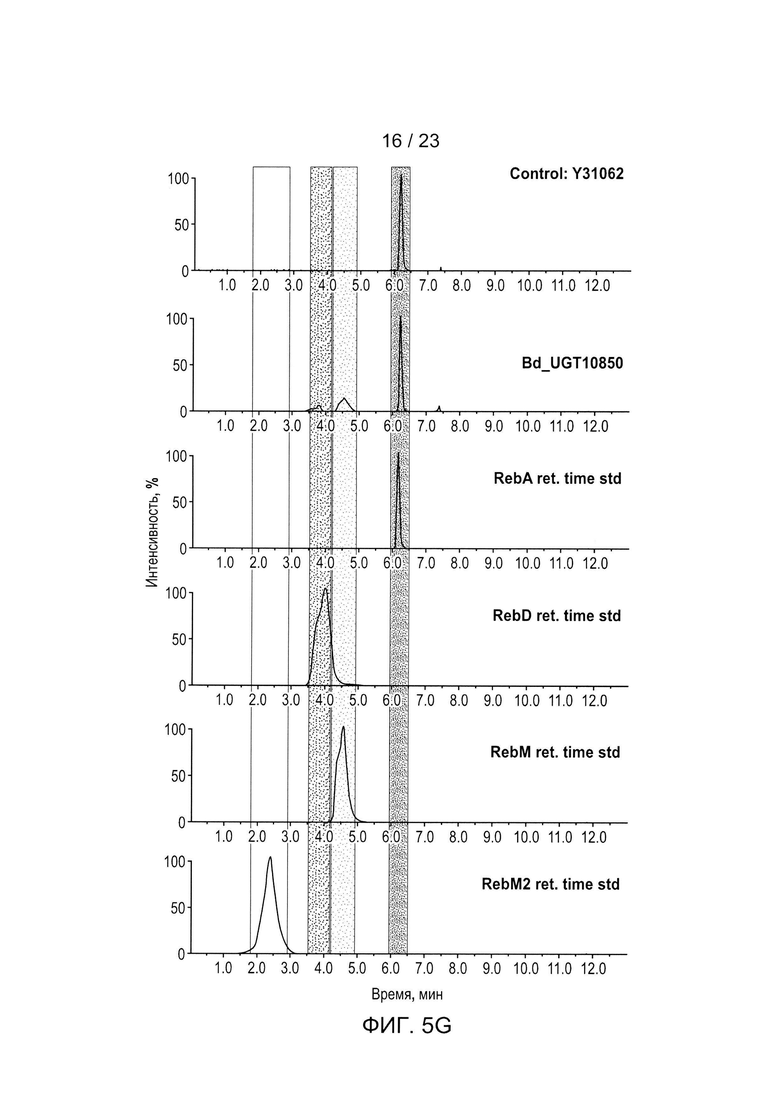
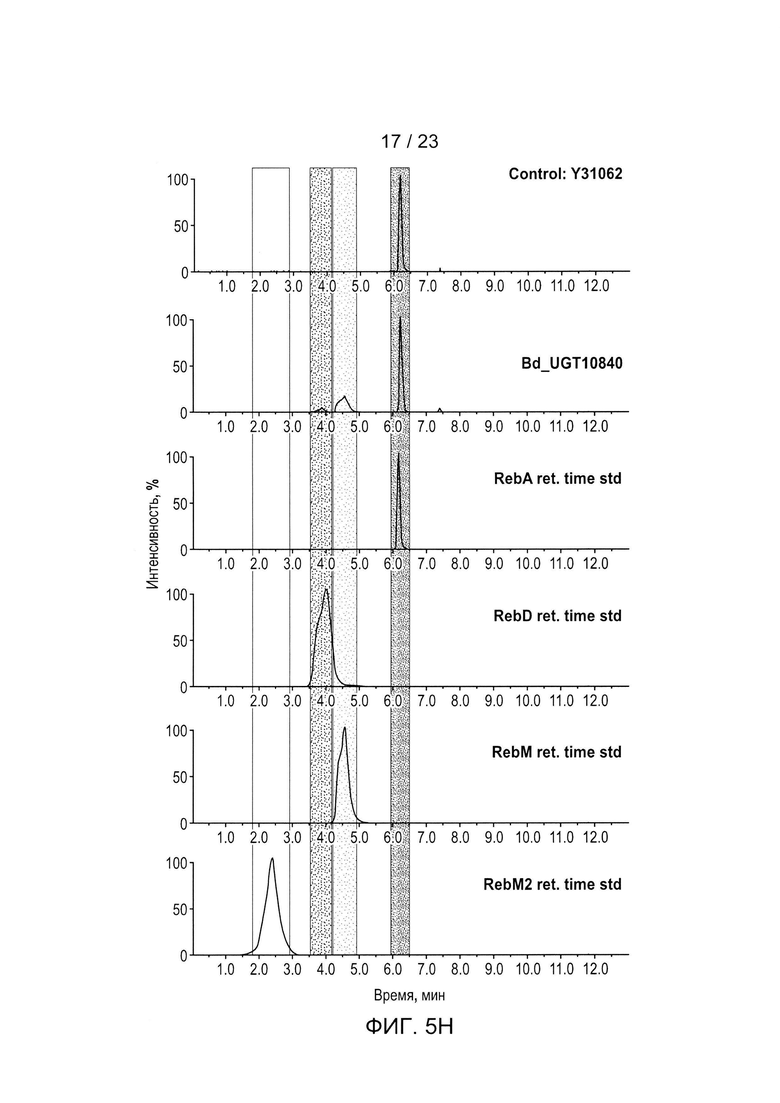
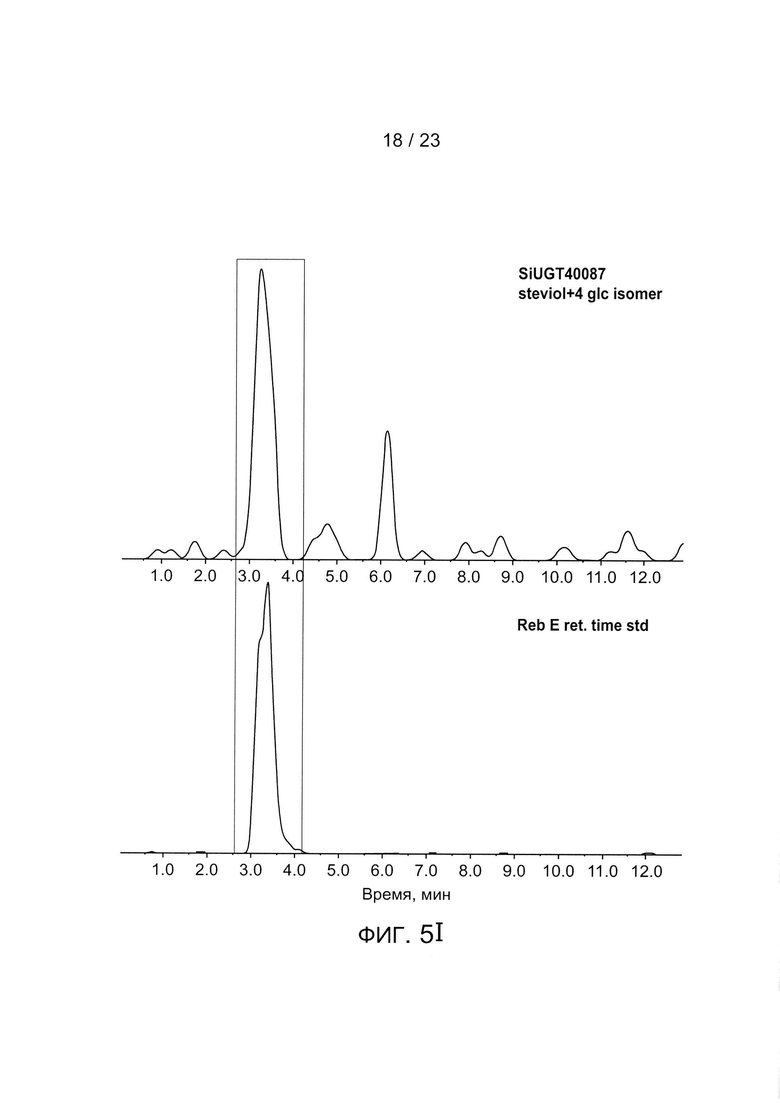
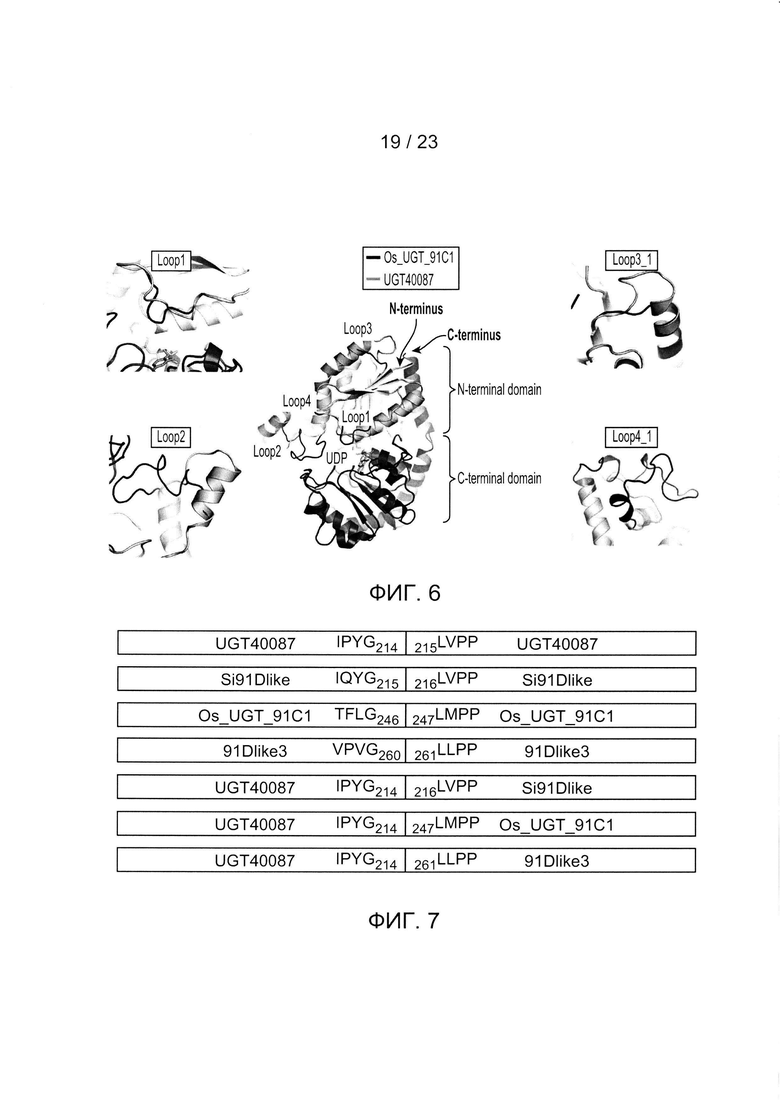
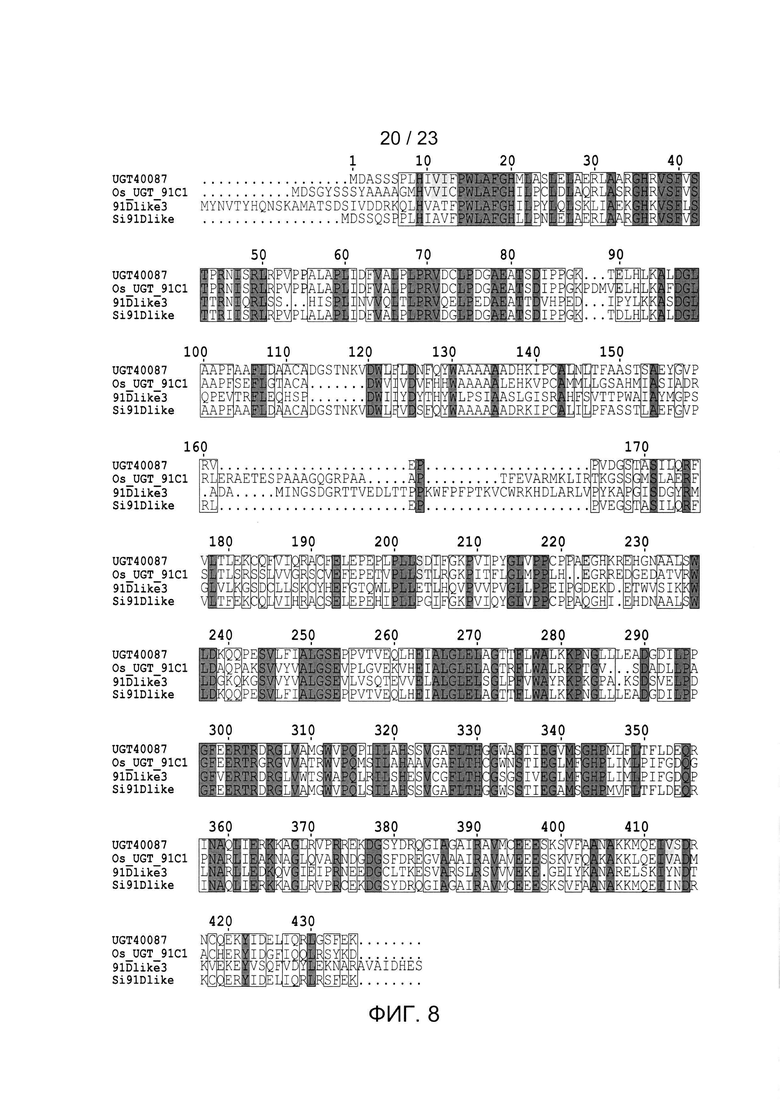
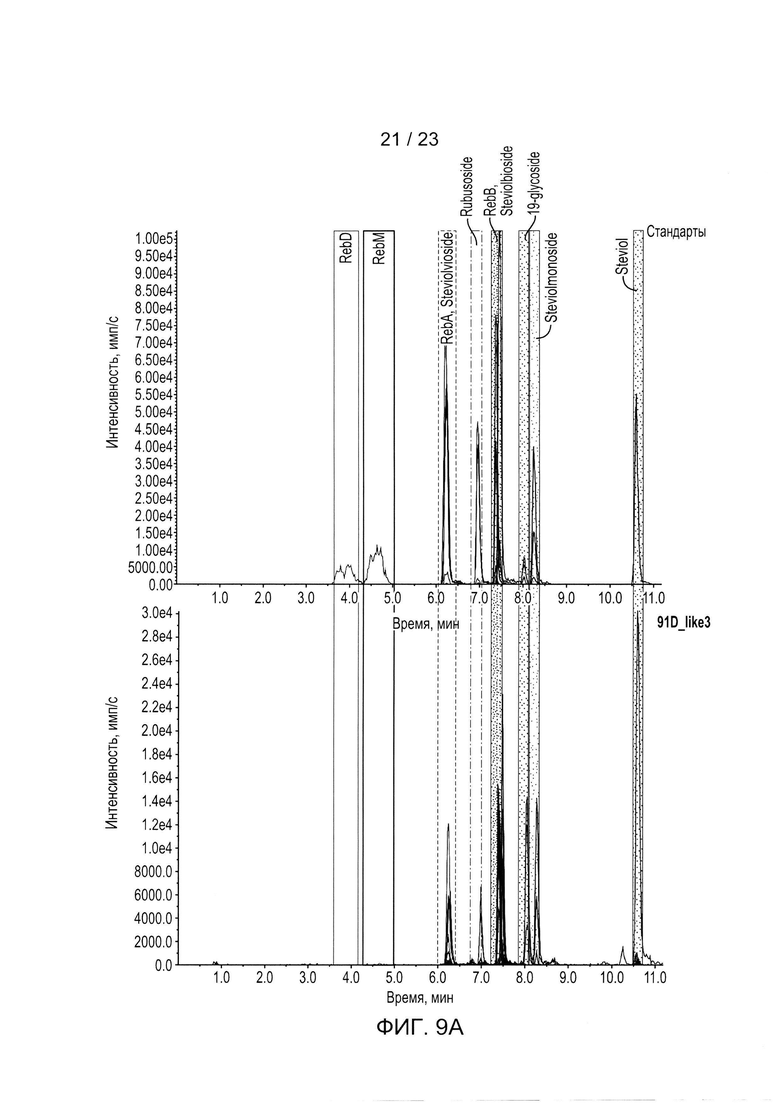
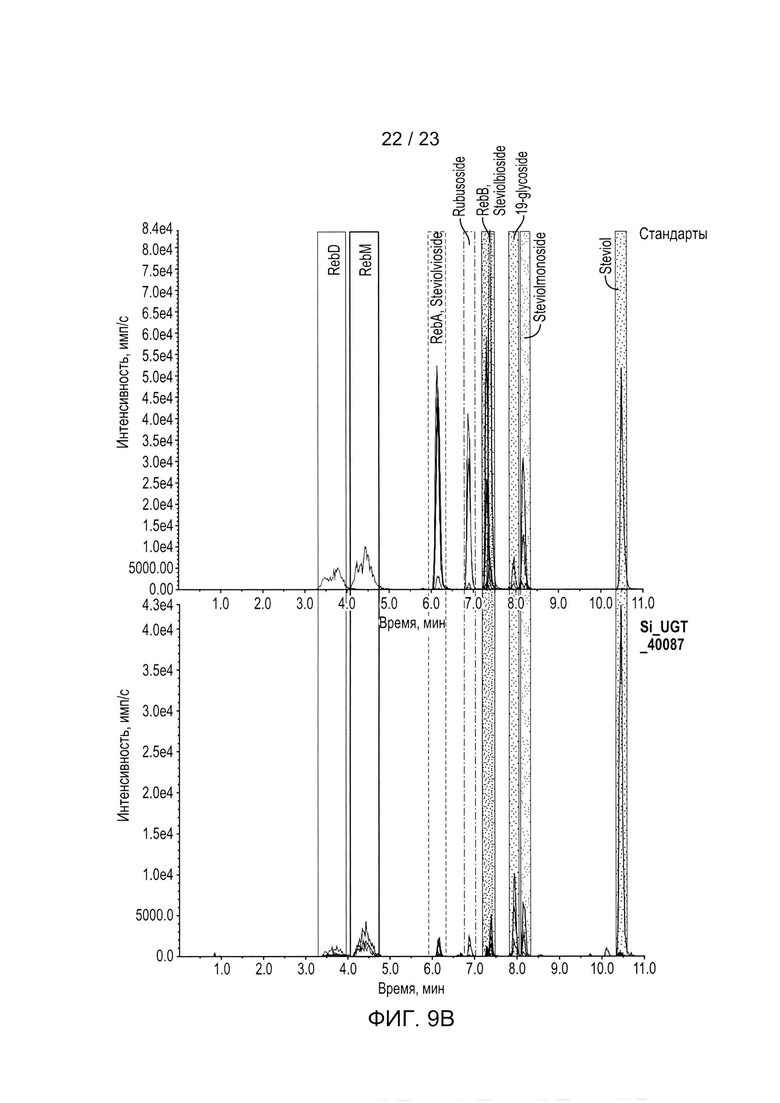
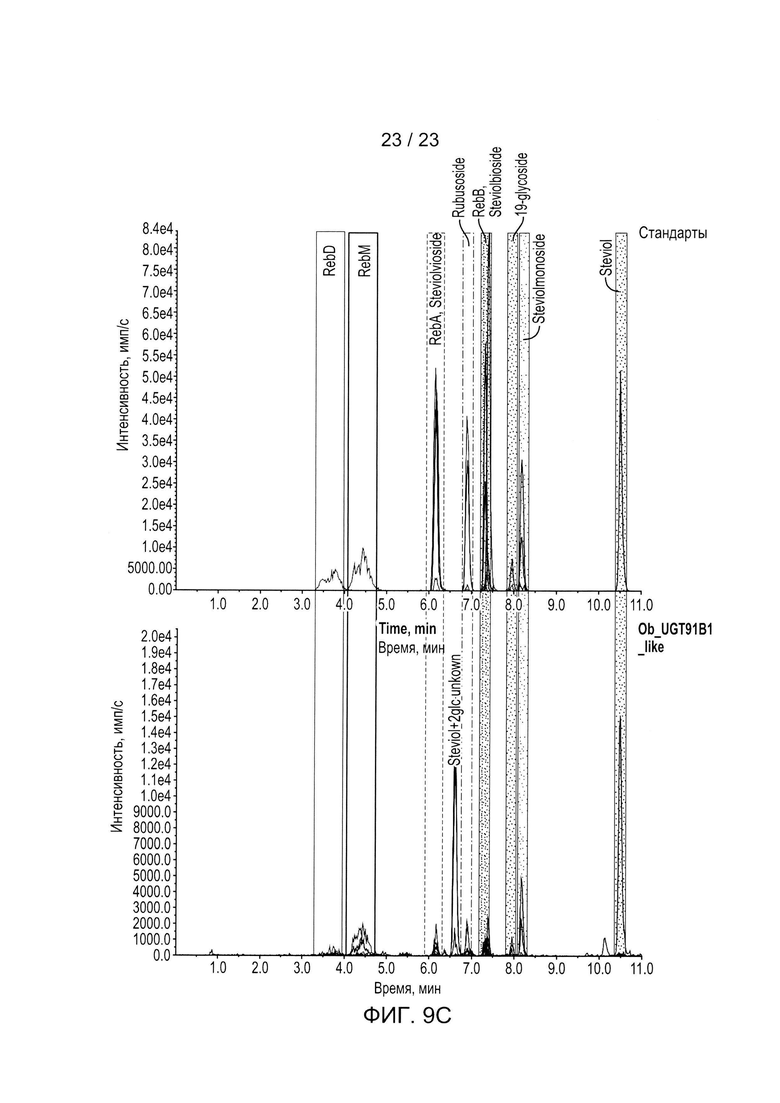
Изобретение относится к биотехнологии и представляет собой генетически модифицированную клетку-хозяин для производства одного или более стевиоловых гликозидов, содержащую гетерологичную нуклеиновую кислоту, кодирующую UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, имеющую идентичность последовательности с SEQ ID NO: 1 или SEQ ID NO: 11 не менее 80%. Способы, описанные здесь, обеспечивают эффективный путь гетерологичного получения стевиоловых гликозидов, включая, но не ограничиваясь, ребаудиозид D и ребаудиозид М. 8 н. и 48 з.п. ф-лы, 9 ил., 12 табл., 12 пр.
1. Генетически модифицированная клетка-хозяин для производства одного или более стевиоловых гликозидов, содержащая гетерологичную нуклеиновую кислоту, кодирующую UDP-гликозилтрансферазу, содержащую аминокислотную последовательность, имеющую идентичность последовательности с SEQ ID NO: 1 или SEQ ID NO: 11 не менее 80%.
2. Генетически модифицированная клетка-хозяин по п. 1, которая способна преобразовывать ребаудиозид A (RebA) в ребаудиозид D (RebD) с эффективностью, превышающей 90%, 95%, 96% или 97%.
3. Генетически модифицированная клетка-хозяин по п. 1, в которой UDP-гликозилтрансфераза содержит аминокислотную последовательность, имеющую последовательность SEQ ID NO: 1 или SEQ ID NO: 11.
4. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, в которой UDP-гликозилтрансфераза способна к бета 1,2-гликозилированию С2' позиции 19-O глюкозы стевиолового гликозида.
5. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где UDP-гликозилтрансфераза кодируется гетерологичной нуклеиновой кислотой, где гетерологичная нуклеиновая кислота содержит нуклеотидную последовательность, имеющую идентичность последовательности с SEQ ID NO: 13, по меньшей мере, 80%.
6. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, в которой UDP-гликозилтрансфераза кодируется гетерологичной нуклеиновой кислотой, имеющей последовательность SEQ ID NO: 13.
7. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где UDP-гликозилтрансфераза представляет собой полипептид, имеющий функциональный домен с идентичностью последовательности функционального домена SEQ ID. NO: 1 или SEQ ID NO: 11 не менее 80%.
8. Генетически модифицированная клетка-хозяин по п. 5, в которой функциональный домен представляет собой акцепторный домен сахара.
9. Генетически модифицированная клетка-хозяин по п. 6, где акцепторный домен сахара расположен на N-конце UDP-гликозилтрансферазы.
10. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где UDP-гликозилтрансфераза содержит акцепторный домен сахара SEQ ID NO: 1 или SEQ ID NO: 11.
11. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где UDP-гликозилтрансфераза содержит акцепторный домен сахара, где аминокислотная последовательность акцепторного домена сахара имеет идентичность последовательности с аминокислотной последовательностью акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11 по меньшей мере 84%.
12. Генетически модифицированная клетка-хозяин по п. 11, где UDP-гликозилтрансфераза содержит:
(a) аминокислотную последовательность loop1 SEQ ID NO: 1 или SEQ ID NO: 11, последовательность SEQ ID NO: 28 или вариантную аминокислотную последовательность loop1, в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loopl в SEQ ID NO: 1 или SEQ ID NO: 11 соответственно;
(b) аминокислотную последовательность 1оор2 SEQ ID NO: 1 или SEQ ID NO: 11 или вариантную аминокислотную последовательность 1оор2, в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop2 в SEQ ID NO: 1 или SEQ ID NO: 11 соответственно;
(c) аминокислотную последовательность loop3_1 SEQ ID NO: 1 или SEQ ID NO: 11 или вариантную аминокислотную последовательность loop3_1, в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop3_1 в SEQ ID NO: 1 или SEQ ID NO: 11 соответственно;
(d) аминокислотную последовательность loop3_2 SEQ ID NO: 1 или SEQ ID NO: 11 или вариантную аминокислотную последовательность loop3_2 в позиции UDP-гликозилтрансферазы, которая соответствует местоположению loop3_2 в SEQ ID NO: I или SEQ ID NO: 11 соответственно;
(e) аминокислотную последовательность 1оор4_1 SEQ ID NO: 1 или SEQ ID NO: 11 или вариантную аминокислотную последовательность 1оор4_1, в позиции UDP-гликозилтрансферазы, которая соответствует местоположению 1оор4_1 в SEQ ID NO: 1 или SEQ ID NO: 11 соответственно;
(f) аминокислотную последовательность 1оор4_2 SEQ ID NO: 1 или SEQ ID NO: 11 в позиции, которая соответствует местоположению 1оор4_2 в SEQ ID NO: 1 или SEQ ID NO: 11, соответственно; или
(g) любую комбинацию от (а) до (f).
13. Генетически модифицированная клетка-хозяин по п. 11, в которой любая из вариантной аминокислотной последовательности loop1, вариантной аминокислотной последовательности 1оор2, вариантной аминокислотной последовательности loop3_1, вариантной аминокислотной последовательности loop 3_2 и вариантной аминокислотной последовательности 1оор4_1 получена из соответствующих им позиций петли другой UDP-гликозилтрансферазы, отличной от SEQ ID NO: 1 или SEQ ID NO: 11, где другая UDP-гликозилтрансфераза содержит аминокислотную последовательность, имеющую идентичность последовательности с SEQ ID NO: 1 или SEQ ID NO: 11 не менее 80%.
14. Генетически модифицированная клетка-хозяин по п. 13, где другая UDP-гликозилтрансфераза способна к бета-1,2-гликозилированию С'2 позиции 19-O-глюкозы стевиолового гликозида.
15. Генетически модифицированная клетка-хозяин по п. 13, в которой другой UDP-гликозилтрансферазой является Os_UGT_91C1.
16. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где UDP-гликозилтрансфераза содержит:
(а) акцепторный домен сахара другой UDP-гликозилтрансферазы, содержащей аминокислотную последовательность, имеющую идентичность последовательности не менее 80% по отношению к последовательности акцепторного домена сахара SEQ ID NO: 1 или SEQ ID NO: 11; и
(b) аминокислотную последовательность 1оор4_1 SEQ ID NO: 1 или SEQ ID NO: 11 в местоположении другой UDP-гликозилтрансферазы, которое соответствует расположению 1оор4_1 в SEQ ID NO: 1 или SEQ ID NO: 11, соответственно.
17. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, в которой UDP-гликозилтрансфераза содержит последовательность SEQ ID NO: 22 в качестве акцепторного домена сахара.
18. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, в которой UDP-гликозилтрансфераза содержит аминокислотную последовательность, имеющую идентичность последовательности с SEQ ID NO: 1 или SEQ ID NO: 11, по меньшей мере, 80%, и имеет аминокислотную последовательность 1оор4_1 последовательности SEQ ID NO: 1 или SEQ ID NO: 11 в позиции, которая соответствует местоположению 1оор4_1 SEQ ID NO: 1 или SEQ ID NO: 11 соответственно.
19. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где UDP-гликозилтрансфераза содержит последовательность SEQ ID NO: 25.
20. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где UDP-гликозилтрансфераза содержит один или несколько из следующих аминокислотных остатков:
(a) валин в аминокислотной позиции UDP-гликозилтрансферазы, который соответствует аминокислотной позиции 11 в SEQ ID NO: 11;
(b) изолейцин в аминокислотной позиции UDP-гликозилтрансферазы, который соответствует аминокислотной позиции 12 в SEQ ID NO: 11;
(c) пролин в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 55 в SEQ ID NO: 11;
(d) глутаминовая кислота в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 90 в SEQ ID NO: 11;
(e) серин в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 203 в SEQ ID NO: 11;
(f) глутаминовая кислота в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 223 в SEQ ID NO: 11; или
(g) валин в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 413 в SEQ ID NO: 11,
где позиции аминокислот UDP-гликозилтрансферазы, которые соответствуют позициям аминокислот SEQ ID NO: 11, определяются выравниванием последовательности.
21. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где UDP-гликозилтрансфераза содержит аминокислотную последовательность, имеющую SEQ ID NO: 24.
22. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где UDP-гликозилтрансфераза содержит донорный домен сахара, где донорный домен сахара содержит аминокислотную последовательность, имеющую идентичность последовательности с аминокислотной последовательностью домена донора сахара SEQ ID NO: 1 или SEQ ID NO: 11, по меньшей мере, 80%.
23. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где донорный домен сахара расположен на С-конце UDP-гликозилтрансферазы.
24. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, способная продуцировать RebD.
25. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, способная продуцировать ребаудиозид М (RebM).
26. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, которая способна продуцировать в RebM и RebM2 в соотношении не менее 10:1, 100:1 или 1000:1.
27. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где генетически модифицированная клетка-хозяин продуцирует необнаружимый уровень RebM2.
28. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где генетически модифицированная клетка-хозяин способна преобразовывать стевиозид в ребаудиозид Е (RebE).
29. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где генетически модифицированная клетка-хозяин дополнительно содержит одну или несколько гетерологичных нуклеиновых кислот, кодирующих один или несколько ферментов пути для получения стевиола.
30. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где генетически модифицированная клетка-хозяин дополнительно содержит одну или несколько гетерологичных нуклеиновых кислот, кодирующих один или несколько ферментов пути для получения стевиолового гликозида.
31. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где генетически модифицированная клетка-хозяин дополнительно содержит одну или несколько гетерологичных нуклеиновых кислот, кодирующих один или несколько ферментов пути для получения RebA.
32. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где генетически модифицированная клетка-хозяин дополнительно содержит одну или несколько гетерологичных нуклеиновых кислот, кодирующих один или несколько ферментов пути для получения RebM.
33. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где генетически модифицированная клетка-хозяин дополнительно содержит одну или несколько гетерологичных нуклеиновых кислот, кодирующих один или несколько ферментов пути для получения RebE.
34. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где один или несколько ферментов пути включают геранилгеранил-дифосфат синтазу.
35. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где один или несколько ферментов пути включают копалил-дифосфат-синтазу.
36. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где один или несколько ферментов пути включают энт-кауренсинтазу.
37. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где один или несколько ферментов пути содержат кауреноксидазу.
38. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где один или несколько ферментов пути включают гидроксилазу кауреновой кислоты.
39. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где один или несколько ферментов пути включают цитохром Р450-редуктазу.
40. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где один или несколько ферментов пути включают уридин-5'-дифосфогликозилтрансферазу.
41. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, в которой один или несколько ферментов пути включают UGT74G1, UGT76G1, UGT85C2 и UGT91D.
42. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где один или несколько ферментов пути включают геранилгеранил-дифосфатсинтазу, копалил-дифосфат-синтазу, энт-каурен-синтазу, кауреноксидазу, гидроксилазу кауреновой кислоты, цитохром Р450 редуктазу, UGT74G1, UGT76G1, UGT85C2 и UGT91D.
43. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где один или несколько ферментов пути включают бифункциональную копалил-дифосфат-синтазу и кауренсинтазу.
44. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где одна или несколько гетерологичных нуклеиновых кислот, кодирующих один или несколько ферментов пути, находятся под контролем одного регулятора транскрипции.
45. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где одна или несколько гетерологичных нуклеиновых кислот, кодирующих один или несколько ферментов пути, находятся под контролем множества гетерологичных регуляторов транскрипции.
46. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, в которой клетка выбрана из группы, состоящей из бактериальной клетки, грибковой клетки, клетки водорослей, клетки насекомого и клетки растения.
47. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где клетка представляет собой дрожжевую клетку.
48. Генетически модифицированная клетка-хозяин по любому из предшествующих пунктов, где дрожжи представляют собой Saccharomyces cerevisiae.
49. Способ производства RebD, включающий:
(a) культивирование популяции генетически модифицированных клеток-хозяев по любому из предшествующих пунктов в среде с источником углерода в условиях, подходящих для получения RebD; и
(b) извлечение указанного соединения RebD из среды.
50. Способ производства RebM, включающий:
(a) культивирование популяции генетически модифицированных клеток-хозяев по любому из предшествующих пунктов в среде с источником углерода в условиях, подходящих для получения RebM; и
(b) извлечение указанного соединения RebM из среды.
51. Способ производства RebD, включающий:
(a) контактирование RebA с глюкозой и UDP-гликозилтрансферазой по любому из предшествующих пунктов, способных преобразовывать RebA в RebD, в условиях, подходящих для образования RebD; и
(b) извлечение указанного соединения RebD из среды.
52. Способ производства RebM, включающий:
(а) контактирование в условиях, подходящих для образования RebM, субстрата с глюкозой или UDP-сахаром, и
(i) UDP-гликозилтрансферазой по любому из предшествующих пунктов, способной преобразовывать RebA в RebD; и
(ii) UDP-гликозилтрансферазой, способной преобразовывать RebD в RebM.
53. Способ получения RebM, включающий:
(a) преобразование RebA в RebD с использованием любой из UDP-гликозилтрансферазы по любому из предшествующих пунктов, способной преобразовывать RebA в RebD; и
(b) преобразование RebD в RebM с использованием UDP-гликозилтрансферазы, способной преобразовывать RebD в RebM.
54. Не встречающаяся в природе UDP-гликозилтрансфераза, имеющая по меньшей мере 80% идентичность последовательности с SEQ ID NO: 1 или SEQ ID NO: 11.
55. He встречающаяся в природе UDP-гликозилтрансфераза по п. 54, где UDP-гликозилтрансфераза содержит один или несколько следующих аминокислотных остатков;
(a) валин в аминокислотной позиции UDP-гликозилтрансферазы, который соответствует аминокислотной позиции 11 SEQ ID NO: 11;
(b) изолейцин в аминокислотной позиции UDP-гликозилтрансферазы, который соответствует аминокислотной позиции 12 SEQ ID NO: 11;
(c) пролин в аминокислотной позиции UDP-гликозилтрансферазы, который соответствует аминокислотной позиции 55 SEQ ID NO: 11;
(d) глутаминовая кислота в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 90 SEQ ID NO: 11;
(e) серин в аминокислотной позиции UDP-гликозилтрансферазы, который соответствует аминокислотной позиции 203 SEQ ID NO: 11;
(f) глутаминовая кислота в аминокислотной позиции UDP-гликозилтрансферазы, которая соответствует аминокислотной позиции 223 SEQ ID NO: 11; или
(g) валин в аминокислотной позиции UDP-гликозилтрансферазы, который соответствует аминокислотной позиции 413 SEQ ID NO: 11,
где положения аминокислот UDP-гликозилтрансферазы, которые соответствуют положениям аминокислот SEQ ID NO: 11, определяются выравниванием последовательности.
56. Не встречающаяся в природе нуклеиновая кислота, кодирующая не встречающуюся в природе UDP-гликозилтрансферазу по п. 54.
| WO 2016023844 A1, 18.02.2016 | |||
| US 20160021918 A1, 28.01.2016 | |||
| WO 2013022989 A3, 14.02.2013 | |||
| WO 2016073740 A1, 12.05.2016 | |||
| ПОДСЛАСТИТЕЛИ НА ОСНОВЕ РЕБАУДИОЗИДА D И ПИЩЕВЫЕ ПРОДУКТЫ, ПОДСЛАЩЕННЫЕ РЕБАУДИОЗИДОМ D | 2012 |
|
RU2575042C2 |
Авторы
Даты
2022-08-11—Публикация
2017-08-11—Подача