Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет предварительной заявки США № 61/125336, поданной 23 апреля 2008, которая во всей своей полноте включена в настоящее описание посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к способам и композициям, содержащим по меньшей мере один фермент изопренсинтазу, обладающую повышенной каталитической активностью и/или растворимостью. В частности, настоящее изобретение относится к вариантам растительных изопренсинтаз, способствующих повышению уровня продуцирования изопрена в клетках микроорганизмов-хозяев. Биосинтетически продуцируемый изопрен согласно изобретению может найти свое применение в изготовлении каучука и эластомеров.
Предшествующий уровень техники
Изопреноиды представляют собой изопреновые полимеры, которые используются для получения фармацевтических средств, натуральных пищевых продуктов, флаворантов, косметики и резиновых изделий. Однако получение природных изопреноидов ограничено требованиями к охране окружающей среды. По этим причинам, в целях получения изопреноидных композиций, имеющих небольшое количество примесей и высокую степень однородности, изопреноиды, такие как каучук, часто синтезируют искусственно.
Изопрен (2-метил-1,3-бутадиен) представляет собой летучий углеводород, который не растворяется в воде и растворяется в спирте. В промышленном объеме, изопрен может быть получен путем прямого выделения из нефтяных крекинг-C5-фракций или путем дегидратации C5-изоалканов или изоалкенов (Weissermel and Arpe, Industrial Organic Chemistry, 4th ed., Wiley-VCH, pp. 117-122, 2003). C5-остов может быть также синтезирован из менее крупных субъединиц. Однако желательно разработать способ крупномасштабного продуцирования изопрена, который не будет зависеть от состояния природных ресурсов.
Биосинтетическое продуцирование изопрена происходит по двум различным путям метаболизма (Julsing et al., Appl Microbiol Biotechnol, 75:1377-1384, 2007). В эукариотах и архебактериях, изопрен образуется по мевалонатному пути (MVA), а некоторые эубактерии и высшие растения продуцируют изопрен по метилэритритолфосфатному (MEP) пути. Выделение изопрена из растений зависит от количества света и температуры, и уровень его выделения повышается по мере развития листьев. Изопрен-продуцирующий фермент, изопренсинтаза, был идентифицирован в деревьях осины (Silver and Fall, Plant Physiol, 97:1588-1591, 1991; и Silver and Fall, J Biol Chem, 270:13010-13016, 1995), и очевидно, что такой фермент ответственен за in vivo продуцирование изопрена в целых листьях. Было также описано продуцирование изопрена бактериями (Kuzma et al, Curr Microbiol, 30:97-103, 1995; и Wilkins, Chemosphere, 32:1427-1434, 1996), и количество продуцируемого изопрена в бактериях варьируется в зависимости от стадии их роста и содержания питательных веществ в культуральной среде (патент США 5849970, Fall et al.; и публикация Wagner et al., J Bacteriol, 181:4700-4703, 1999, которые во всей своей полноте включены в настоящее описание посредством ссылки). Однако уровни изопрена, продуцируемые бактериальными системами, описанными в литературе, являются недостаточными для их применения в промышленных целях.
Таким образом, в настоящее время необходимо разработать эффективный и крупномасштабный способ продуцирования изопрена в бактериях, который будет служить в качестве основы для промышленного производства изопреноидов.
Все приведенные в данном описании патенты, патентные заявки, статьи и публикации во всей своей полноте включены в настоящее описание посредством ссылки.
Описание сущности изобретения
Настоящее изобретение относится к способам и композициям, содержащим по меньшей мере один фермент изопренсинтазу, обладающую повышенной каталитической активностью и/или растворимостью. В частности, настоящее изобретение относится к вариантам растительных изопренсинтаз, способствующих повышению уровня продуцирования изопрена в клетках микроорганизмов-хозяев. Биосинтетически продуцируемый изопрен согласно изобретению может найти применение в производстве каучука и эластомеров.
В частности, настоящее изобретение относится к выделенным вариантам изопренсинтазы, где указанный вариант содержит замену в положении, соответствующем положению одного или нескольких (одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти) остатков изопренсинтазы пуэрарии волосистой, включающей аминокислотную последовательность, представленную в SEQ ID NO:2. В некоторых вариантах осуществления изобретения вариантом изопренсинтазы является вариант изопренсинтазы пуэрарии волосистой (Pueraria sp.) или вариант изопренсинтазы тополя (Populus sp.). В некоторых вариантах осуществления изобретения один или несколько остатков выбраны, но без ограничений, из группы, состоящей из L26, E30, F31, Q33, L35, E36, N37, L39, K40, V41, K43, L44, R61, V62, D63, Q65, K87, E94, N95, L99, D100, N105, K137, E138, G143, E144, N182, L184, K185, G187, N189, T190, P225, H226, K247, T257, E258, M259, D266, N334, D353, S357, 1358I, E361, N389, I392, I393, K398, E401, C421, Q423, Q424, E425, D426, H430, L432, R433, S434, D437, R443, L462, E463, H476, N478, D479, Q485, D508, P513, A515, Q532, Y533, L537, G538, R539, Y542, A543 и P557. В некоторых вариантах осуществления изобретения один или несколько остатков выбраны, но без ограничений, из группы, состоящей из P24, N25, Y309, D310, L377, F381, E384, Y399, N402, A403, S406, S407, G409, A411, L413, F449, A456, T457, S458, A459, A460, E461, L462, E463, R464, G465, E466, T467, T468, N469, M523, S527 и Y531. В некоторых вариантах осуществления изобретения один или несколько остатков выбраны, но без ограничений, из группы, состоящей из A20, N21, Y22, Q23, R271, W278, F299, V302 и S408. Настоящее изобретение также относится к выделенному варианту изопренсинтазы, а именно, изопренсинтазы пуэрарии волосистой, которая содержит замену A20G и имеет аминокислотную последовательность, представленную в SEQ ID NO:2. В субсерии таких вариантов осуществления изобретения указанный вариант содержит по меньшей мере две (две, три, четыре, пять, шесть, семь, восемь, девять или десять) замены, где одной из указанных замен является замена A20G в изопренсинтазе пуэрарии волосистой, имеющей аминокислотную последовательность, представленную в SEQ ID NO:2. Настоящее изобретение также относится к выделенному варианту изопренсинтазы, а именно, изопренсинтазы пуэрарии, содержащей замену S408D и имеющей аминокислотную последовательность, представленную в SEQ ID NO:2. В подсерии таких вариантов осуществления изобретения указанный вариант содержит по меньшей мере две (две, три, четыре, пять, шесть, семь, восемь, девять или десять) замены, где одной из замен является замена S408D в изопренсинтазе пуэрарии волосистой, имеющей аминокислотную последовательность, представленную в SEQ ID NO:2. В некоторых предпочтительных вариантах осуществления изобретения вариант изопренсинтазы обладает по меньшей мере одним улучшенным свойством по сравнению с изопренсинтазой дикого типа. В некоторых особенно предпочтительных вариантах осуществления изобретения по меньшей мере одно улучшенное свойство выбрано, но без ограничений, из группы, состоящей из удельной активности (способности продуцировать изопрен из диметилаллилдифосфата) и растворимости.
Кроме того, настоящее изобретение также относится к полинуклеотидной последовательности, кодирующей вариант изопренсинтазы. Настоящее изобретение также относится к экспрессионному вектору, содержащему полинуклеотидную последовательность, кодирующую вариант изопренсинтазы, функционально присоединенную к промотору. В других своих вариантах осуществления настоящее изобретение относится к клетке-хозяину, содержащей экспрессионный вектор. Настоящее изобретение также относится к лизату клетки-хозяина, где указанный лизат также содержит лизоцим. В некоторых вариантах осуществления изобретения лизат имеет нейтральный pH (6,5-7,5), а в других вариантах осуществления лизат имеет основный pH (выше 7,5 и ниже 9,5). Настоящее изобретение также относится к способам получения изопрена, включающим: (a) получение клеток-хозяев, содержащих экспрессионный вектор, и (b) культивирование клеток-хозяев в условиях, подходящих для продуцирования изопрена. В некоторых вариантах осуществления изобретения указанные способы дополнительно включают (с) выделение изопрена. В других вариантах осуществления указанные способы дополнительно включают (d) полимеризацию изопрена. Настоящее изобретение также относится к способам детектирования изопренсинтазной активности, включающим: (a) культивирование клеток-хозяев, содержащих экспрессионный вектор, в условиях, подходящих для продуцирования варианта изопренсинтазы; (b) лизис клеток-хозяев с использованием буфера для лизиса, содержащего лизоцим, с получением клеточного лизата; и (c) детектирование изопренсинтазной активности в клеточном лизате путем измерения уровня продуцирования изопрена из диметилаллилдифосфата (DMAPP). В некоторых вариантах осуществления изобретения хозяина выбирают, но без ограничений, из группы, состоящей из грамположительных бактериальных клеток, грамотрицательных бактериальных клеток, клеток нитчатых грибов и дрожжевых клеток. В некоторых предпочтительных вариантах осуществления изобретения хозяина выбирают, но без ограничений, из группы, состоящей из Escherichia sp. (E. coli), Panteoa sp. (P. citrea), Bacillus sp. (B. subtilis), Yarrowia sp. (Y. lipolytica) и Trichoderma (T. reesei). В некоторых вариантах осуществления изобретения клетки-хозяева культивируют в среде, включающей источник углерода, выбранный, но без ограничений, из группы, состоящей из глюкозы, глицерола, глицерина, дигидроксиацетона, дрожжевого экстракта, биомассы, мелассы, сахарозы и масла.
Кроме того, настоящее изобретение относится к способам детектирования изопрена во множестве образцов (крупномасштабный скрининг), где указанные способы включают: (a) получение: i) множества образцов, каждый из которых содержит изопренсинтазу; ii) стеклянного планшета, содержащего множество лунок; и iii) герметика для заклеивания стеклянных планшетов; (b) внесение множества образцов во множество лунок указанного стеклянного планшета; (c) заклеивание стеклянного планшета герметиком, с получением герметично закрытого стеклянного планшета, имеющего множество лунок, в верхней части (зоне «хэдспейс») которых присутствует образец; (d) инкубирование указанного стеклянного планшета в условиях, при которых изопренсинтаза является активной, и (e) детектирование изопрена в зоне «хэдспейс» планшета. В некоторых вариантах осуществления изобретения изопрен детектируют с помощью газовой хроматографии-масс-спектрометрии (ГХ-МС). В некоторых вариантах осуществления множество образцов содержат клетки-хозяева, включающие экспрессионный вектор, содержащий полинуклеотидную последовательность, кодирующую вариант изопренсинтазы, функционально присоединенную к промотору. В некоторых вариантах осуществления множество образцов включает лизат клеток-хозяев, лизоцим и диметилаллилдифосфат (DMAPP). В некоторых предпочтительных вариантах осуществления изобретения стеклянным планшетом является стеклянный блок с глубокими лунками. В некоторых предпочтительных вариантах осуществления изобретения планшет с множеством лунок включает по меньшей мере 24 лунки (предпочтительно, по меньшей мере 48 лунок, более предпочтительно, по меньшей мере 96 лунок, еще более предпочтительно, по меньшей мере 192 лунки, и наиболее предпочтительно, по меньшей мере 384 лунки). В особенно предпочтительных вариантах осуществления каждая из множества лунок имеет объем 2 мл или менее (предпочтительно, 2 мл-0,2 мл).
Кроме того, настоящее изобретение относится к клеткам-хозяевам, содержащим гетерологичную полинуклеотидную последовательность, кодирующую вариант изопренсинтазы, функционально присоединенную к промотору, где указанный вариант изопренсинтазы содержит замену в положении, соответствующем положению одного или нескольких (одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти) остатков изопренсинтазы пуэрарии волосистой, включающей аминокислотную последовательность, представленную в SEQ ID NO:2. В некоторых вариантах осуществления изобретения один или несколько остатков выбраны, но без ограничений, из группы, состоящей из L26, E30, F31, Q33, L35, E36, N37, L39, K40, V41, K43, L44, R61, V62, D63, Q65, K87, E94, N95, L99, D100, N105, K137, E138, G143, E144, N182, L184, K185, G187, N189, T190, P225, H226, K247, T257, E258, M259, D266, N334, D353, S357, I358I, E361, N389, I392, I393, K398, E401, C421, Q423, Q424, E425, D426, H430, L432, R433, S434, D437, R443, L462, E463, H476, N478, D479, Q485, D508, P513, A515, Q532, Y533, L537, G538, R539, Y542, A543 и P557. В некоторых вариантах осуществления изобретения один или несколько остатков выбраны, но без ограничений, из группы, состоящей из P24, N25, Y309, D310, L377, F381, E384, Y399, N402, A403, S406, S407, G409, A411, L413, F449, A456, T457, S458, A459, A460, E461, L462, E463, R464, G465, E466, T467, T468, N469, M523, S527 и Y531. В некоторых вариантах осуществления изобретения один или несколько остатков выбраны, но без ограничений, из группы, состоящей из A20, N21, Y22, Q23, R271, W278, F299, V302 и S408. Настоящее изобретение также относится к выделенному варианту изопренсинтазы, а именно, к изопренсинтазе пуэрарии волосистой, которая содержит замену A20G и/или S408D и имеет аминокислотную последовательность, представленную в SEQ ID NO:2. В некоторых предпочтительных вариантах осуществления изобретения вариант изопренсинтазы обладает по меньшей мере одним улучшенным свойством по сравнению с изопренсинтазой дикого типа. В некоторых особенно предпочтительных вариантах осуществления изобретения по меньшей мере одно улучшенное свойство выбрано, но без ограничений, из группы, состоящей из удельной активности (способности продуцировать изопрен из диметилаллилдифосфата) и растворимости. В некоторых предпочтительных вариантах осуществления изобретения полинуклеотидная последовательность содержится в плазмиде. В других предпочтительных вариантах осуществления изобретения полинуклеотидная последовательность интегрирована в хромосому клетки-хозяина. В некоторых вариантах осуществления изобретения хозяина выбирают, но без ограничений, из группы, состоящей из грамположительных бактериальных клеток, грамотрицательных бактериальных клеток, клеток нитчатых грибов и дрожжевых клеток. В некоторых предпочтительных вариантах осуществления изобретения хозяина выбирают, но без ограничений, из группы, состоящей из Escherichia sp. (E. coli), Panteoa sp. (P. citrea), Bacillus sp. (B. subtilis), Yarrowia sp. (Y. lipolytica) и Trichoderma (T. reesei). В некоторых вариантах осуществления изобретения клетки-хозяева культивируют в среде, включающей источник углерода, выбранный, но без ограничений, из группы, состоящей из глюкозы, глицерола, глицерина, дигидроксиацетона, дрожжевого экстракта, биомассы, мелассы, сахарозы и масла. В некоторых вариантах осуществления изобретения клетка-хозяин дополнительно включает гетерологичную или природную нуклеиновую кислоту, кодирующую полипептид IDI и/или гетерологичную или природную нуклеиновую кислоту, кодирующую полипептид DXS, иногда в комбинации с нативным полипептидом пути DXP (например, в результате экспрессии dxs и idi в E. coli в комбинации с нативным полипептидом пути DXP). Альтернативно, весь путь экспрессии DXP (фиг.15) может осуществляться на плазмиде, либо этот полинуклеотид может интегрироваться на хромосоме в качестве оперона под контролем одного промотора, регулирующего экспрессию, или нескольких промоторов различной длины (например, GI 1.20, GI 1.5 или GI 1.6), регулирующими экспрессию одного или нескольких отдельных генов. В некоторых вариантах осуществления изобретения клетка-хозяин дополнительно содержит одну или несколько нуклеиновых кислот, кодирующих полипептид IDI и полипептид DXS, и в некоторых предпочтительных вариантах осуществления изобретения один вектор кодирует вариант изопренсинтазы, полипептид IDI и полипептид DXS. В некоторых вариантах осуществления изобретения клетка-хозяин дополнительно содержит гетерологичную нуклеиновую кислоту, кодирующую полипептид пути MVA (например, полипептид пути MVA в Saccharomyces cerevisia или Enterococcus faecalis). В некоторых вариантах осуществления изобретения клетка-хозяин дополнительно включает одну или несколько нуклеиновых кислот, кодирующих полипептид пути MVA и полипептид DXS, и в некоторых предпочтительных вариантах осуществления изобретения один вектор кодирует вариант изопренсинтазы, полипептид пути MVA и полипептид DXS. В некоторых предпочтительных вариантах осуществления изобретения клетка-хозяин дополнительно включает одну или несколько нуклеиновых кислот, кодирующих полипептид DXS, полипептид IDI или один или несколько остальных полипептидов пути DXP, и полипептид пути MVA. В некоторых вариантах осуществления изобретения вектор дополнительно включает селективный маркер (например, резистентную к антибиотику нуклеиновую кислоту). Настоящее изобретение также относится к способам продуцирования изопрена, включающим: (a) культивирование клеток-хозяев в условиях, подходящих для продуцирования изопрена, и (b) продуцирование изопрена. В некоторых вариантах осуществления изобретения указанные способы дополнительно включают (с) выделение изопрена. В некоторых предпочтительных вариантах осуществления изобретения указанные способы дополнительно включают (d) полимеризацию изопрена. Настоящее изобретение также относится к способам продуцирования изопренсинтазы, включающим: (а) получение: (i) клеток-хозяев и (ii) нуклеиновой кислоты, кодирующей вариант изопренсинтазы, функционально присоединенной к промотору, где указанный вариант изопренсинтазы содержит замену в положении, соответствующем положению одного или нескольких (одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти) остатков изопренсинтазы пуэрарии волосистой, включающей аминокислотную последовательность, представленную в SEQ ID NO:2; (b) контактирование клеток-хозяев с нуклеиновой кислотой с продуцированием трансформированной клетки-хозяина; и (c) культивирование трансформированных клеток-хозяев в условиях, подходящих для продуцирования изопренсинтазы.
В другом аспекте, настоящее изобретение относится к выделенным вариантам изопренсинтазы тополя. В одном из вариантов осуществления изобретения указанный вариант усечен у N-концевой части изопренсинтазы. В другом варианте осуществления изобретения указанный вариант изопренсинтазы, по сравнению с полноразмерной изопренсинтазой, обладает повышенной удельной активностью. В другом варианте осуществления изобретения изопренсинтазой является изопренсинтаза P. alba с последовательностью SEQ ID NO:120. В другом варианте осуществления изобретения указанный вариант выбран из группы, состоящей из: варианта MEA (SEQ ID NO:122), варианта MSV (SEQ ID NO:124), варианта MVS (SEQ ID NO:126), варианта MTE (SEQ ID NO:128), варианта MNV (SEQ ID NO:130). В другом варианте осуществления изобретения указанным вариантом является вариант MEA (SEQ ID NO:122). В другом варианте осуществления изобретения указанный вариант выбран из группы, состоящей из: варианта TRC (-3) (SEQ ID NO:136), варианта TRC (-4) (SEQ ID NO:138), варианта TRC (-5) (SEQ ID NO:140), варианта TRC (-6) (SEQ ID NO:142) и варианта TRC (-7) (SEQ ID NO:144). В другом варианте осуществления изобретения указанным вариантом является вариант MET изопренсинтазы P. tremuloides (SEQ ID NO:146). В другом варианте осуществления изобретения указанным вариантом является вариант MET изопренсинтазы P. trichocharpa (SEQ ID NO:148).
В другом аспекте настоящее изобретение относится к выделенным вариантам изопренсинтазы тополя, где указанный вариант содержит замену одного или нескольких аминокислотных остатков, присутствующих в изопренсинтазе дикого типа, и где указанный вариант изопренсинтазы обладает повышенной изопренсинтазной активностью по сравнению с активностью изопренсинтазы дикого типа. В одном из вариантов осуществления изобретения повышенная изопренсинтазная активность характеризуется более быстрым ростом клеток-хозяев, содержащих изопреновый вариант, в присутствии диметилаллилпирофосфата (DMAPP), по сравнению с ростом клетки-хозяина, содержащей родительскую изопренсинтазу. В другом варианте осуществления изобретения изопренсинтазой является изопренсинтаза P. alba SEQ ID NO:120. В другом варианте осуществления изобретения указанный вариант содержит одну или несколько аминокислотных замен, выбранных из группы, состоящей из V10M, F12S, T15A, E18G, V58I, V58F, L70Q, L70V, L70T, T71P, V79L, E89D, G94A, S119F, F120L, G127R, E175V, T212I, S257A, R262G, A266G, F280L, N297K, F305L, L319M, E323K, A328T, D342E, A359T, K366N, E368D, L374M, S396T, V418S, K438N, H440R, T442I, T442A, I449V, A469S, K500R, K505Q, G507S, S509N, F511Y и N532K. В другом варианте осуществления изобретения по меньшей мере одной аминокислотной заменой является замена L70R. В другом варианте осуществления изобретения указанный вариант содержит одну или несколько аминокислотных замен, выбранных из группы, состоящей из G127R/F511Y, L70Q/G94A/R262G/F305L, F12S/T15A/E18G/N297K, S396T/T442I, V10M/E323K, F120L/A266G, K438N/K500R, V79L/S509N, E175V/S257A/E368D/A469S, T71P/L374M, F280L/H440R, E89D/H440R, V58F/A328T/N532K, S119F/D342E/I449V и K366N/G507S.
В другом аспекте настоящее изобретение относится к кристаллической форме полипептида, содержащего аминокислотные остатки SEQ ID NO:120 (фиг.19).
В другом аспекте настоящее изобретение относится к способам продуцирования изопрена, включающим: (a) получение клеток-хозяев, содержащих экспрессионный вектор, который включает полинуклеотидную последовательность, кодирующую вариант изопренсинтазы, и (b) культивирование клеток-хозяев в условиях, подходящих для продуцирования изопрена. В одном из вариантов осуществления изобретения указанный способ дополнительно включает (с) выделение изопрена. В другом варианте осуществления изобретения указанный способ дополнительно включает (d) полимеризацию изопрена.
В другом аспекте настоящее изобретение относится к способам детектирования изопренсинтазной активности, включающим: (a) культивирование клеток-хозяев, содержащих экспрессионный вектор, в условиях, подходящих для продуцирования варианта изопренсинтазы; (b) лизис клеток-хозяев с использованием буфера для лизиса, содержащего лизоцим, с получением клеточного лизата; и (c) детектирование изопренсинтазной активности в клеточном лизате путем измерения уровня продуцирования изопрена из диметилаллилдифосфата (DMAPP). В одном из вариантов осуществления изобретения клетку-хозяина выбирают из группы, состоящей из грамположительных бактериальных клеток, грамотрицательных бактериальных клеток, клеток нитчатых грибов и дрожжевых клеток. В другом варианте осуществления изобретения клетку-хозяина выбирают из группы, состоящей из Escherichia sp. (E. coli), Panteoa sp. (P. citrea), Bacillus sp. (B. subtilis), Yarrowia sp. (Y. lipolytica) и Trichoderma (T. reesei). В другом варианте осуществления изобретения клетку-хозяина культивируют в среде, включающей источник углерода, выбранный из группы, состоящей из глюкозы, глицерола, глицерина, дигидроксиацетона, дрожжевого экстракта, биомассы, мелассы, сахарозы и масла.
В другом аспекте настоящее изобретение относится к клеткам-хозяевам, содержащим гетерологичную полинуклеотидную последовательность, кодирующую вариант изопренсинтазы, функционально присоединенную к промотору, где указанный вариант изопренсинтазы содержит замену в положении, соответствующем положениям одного или нескольких (одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти) остатков изопренсинтазы тополя. В одном из вариантов осуществления изобретения изопренсинтазой является изопренсинтаза P. alba с последовательностью SEQ ID NO:120. В другом варианте осуществления изобретения указанный вариант выбран из группы, состоящей из: варианта MEA (SEQ ID NO:122), варианта MSV (SEQ ID NO:124), варианта MVS (SEQ ID NO:126), варианта MTE (SEQ ID NO:128), варианта MNV (SEQ ID NO:130). В другом варианте осуществления изобретения указанный вариант выбран из группы, состоящей из: варианта TRC (-3) (SEQ ID NO:136), варианта TRC (-4) (SEQ ID NO:138), варианта TRC (-5) (SEQ ID NO:140), варианта TRC (-6) (SEQ ID NO:142) и варианта TRC (-7) (SEQ ID NO:144). В другом варианте осуществления изобретения указанным вариантом является вариант MET изопренсинтазы P. tremuloides (SEQ ID NO:146). В другом варианте осуществления изобретения указанным вариантом является вариант MET изопренсинтазы P. trichocharpa (SEQ ID NO:148). В другом варианте осуществления изобретения указанный вариант содержит одну или несколько аминокислотных замен, выбранных из группы, состоящей из V10M, F12S, T15A, E18G, V58I, V58F, L70Q, L70V, L70T, T71P, V79L, E89D, G94A, S119F, F120L, G127R, E175V, T212I, S257A, R262G, A266G, F280L, N297K, F305L, L319M, E323K, A328T, D342E, A359T, K366N, E368D, L374M, S396T, V418S, K438N, H440R, T442I, T442A, I449V, A469S, K500R, K505Q, G507S, S509N, F511Y и N532K. В другом варианте осуществления изобретения по меньшей мере одной аминокислотной заменой является замена L70R. В другом варианте осуществления изобретения указанный вариант содержит одну или несколько аминокислотных замен, выбранных из группы, состоящей из G127R/F511Y, L70Q/G94A/R262G/F305L, F12S/T15A/E18G/N297K, S396T/T442I, V10M/E323K, F120L/A266G, K438N/K500R, V79L/S509N, E175V/S257A/E368D/A469S, T71P/L374M, F280L/H440R, E89D/H440R, V58F/A328T/N532K, S119F/D342E/I449V и K366N/G507S. В другом варианте осуществления изобретения полинуклеотидная последовательность содержится в плазмиде. В другом варианте осуществления изобретения полинуклеотидная последовательность интегрирована в хромосому клетки-хозяина. В другом варианте осуществления изобретения клетку-хозяина выбирают из группы, состоящей из грамположительных бактериальных клеток, грамотрицательных бактериальных клеток, клеток нитчатых грибов и дрожжевых клеток. В другом варианте осуществления изобретения хозяина выбирают из группы, состоящей из Escherichia sp. (E. coli), Panteoa sp. (P. citrea), Bacillus sp. (B. subtilis), Yarrowia sp. (Y. lipolytica) и Trichoderma (T. reesei). В другом варианте осуществления изобретения клетки-хозяева культивируют в среде, включающей источник углерода, выбранный из группы, состоящей из глюкозы, глицерола, глицерина, дигидроксиацетона, дрожжевого экстракта, биомассы, мелассы, сахарозы и масла. В другом варианте осуществления изобретения клетка-хозяин дополнительно включает гетерологичную или природную нуклеиновую кислоту, кодирующую полипептид IDI и/или гетерологичную или природную нуклеиновую кислоту, кодирующую полипептид DXS, необязательно в комбинации с природным полипептидом пути DXP. В другом варианте осуществления изобретения клетка-хозяин дополнительно содержит одну или несколько нуклеиновых кислот, кодирующих полипептид IDI и полипептид DXS. В другом варианте осуществления изобретения клетка-хозяин содержит один вектор, кодирующий вариант изопренсинтазы, полипептид IDI и полипептид DXS. В другом варианте осуществления изобретения клетка-хозяин дополнительно содержит гетерологичную нуклеиновую кислоту, кодирующую полипептид пути MVA, выбранный из группы, состоящей из полипептида пути MVA в Saccharomyces cerevisia и Enterococcus faecalis. В другом варианте осуществления изобретения клетка-хозяин дополнительно включает одну или несколько нуклеиновых кислот, кодирующих полипептид пути MVA и полипептид DXS, где один вектор кодирует вариант изопренсинтазы, полипептид пути MVA и полипептид DXS. В другом варианте осуществления изобретения клетка-хозяин дополнительно включает одну или несколько нуклеиновых кислот, кодирующих полипептид DXS, полипептид IDI или один или несколько остальных полипептидов пути DXP, и полипептид пути MVA.
В другом аспекте настоящее изобретение относится к способам продуцирования изопрена, включающим: (a) культивирование клеток-хозяев, содержащих гетерологичную полинуклеотидную последовательность, кодирующую вариант изопренсинтазы, функционально присоединенную к промотору, где указанный вариант изопренсинтазы содержит замену в положении, соответствующем положению одного или нескольких (одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти) остатков изопренсинтазы тополя в условиях, подходящих для продуцирования изопрена, и (b) продуцирование изопрена. В одном из вариантов осуществления изобретения указанный способ дополнительно включает (с) выделение изопрена. В другом варианте осуществления изобретения указанный способ дополнительно включает (d) полимеризацию изопрена.
В другом аспекте настоящее изобретение относится к способам продуцирования изопренсинтазы, включающим: (а) получение: (i) клеток-хозяев и (ii) нуклеиновой кислоты, кодирующей вариант изопренсинтазы, функционально присоединенной к промотору, где указанный вариант изопренсинтазы содержит замену в положении, соответствующем положению одного или нескольких (одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти) остатков изопренсинтазы P. alba SEQ ID NO:120; (b) контактирование клеток-хозяев с нуклеиновой кислотой с продуцированием трансформированной клетки-хозяина; и (c) культивирование трансформированных клеток-хозяев в условиях, подходящих для продуцирования изопренсинтазы.
Краткое описание чертежей
На фиг.1 представлена кодирующая последовательность (SEQ ID NO:1) изопренсинтазы пуэрарии волосистой (Pueraria montana), оптимизированной по кодонам для экспрессии в Escherichia coli.
На фиг.2 представлена аминокислотная последовательность (SEQ ID NO:2) изопренсинтазы пуэрарии.
На фиг.3 представлена кодирующая последовательность (SEQ ID NO:6) изопренсинтазы тополя (Populus alba x tremula), оптимизированной по кодонам для экспрессии в Escherichia coli.
На фиг.4 представлена аминокислотная последовательность (SEQ ID NO:7) изопренсинтазы тополя (Populus alba x tremula).
На фиг.5 представлена модель гомологии изопренсинтазы пуэрарии волосистой, имеющей цистеиновые остатки, отмеченные как заштрихованные молекулы.
На фиг.6 представлена модель гомологии изопренсинтазы тополя, имеющей цистеиновые остатки, отмеченные как заштрихованные (темно-серым) молекулы. Кроме того, цистеиновые остатки модели изопренсинтазы пуэрарии, представленные на фиг.5, накладываются на модели изопренсинтазы тополя и отмечены как молекулы, заштрихованные (светло-серым).
На фиг.7 представлены кривые зависимости роста от времени для цистеиновых мутантов IspS пуэрарии волосистой, описанных в примере 5.
На фиг.8 проиллюстрирован ДСН-ПААГ-анализ цистеиновых мутантов IspS пуэрарии, выделенных из лизированных клеток. Клеточный осадок и фракции супернатанта получали путем центрифугирования.
На фиг.9 представлена карта плазмиды MCM93 (pCR2.1-Kudzu).
На фиг.10 представлена нуклеотидная последовательность плазмиды MCM93 (SEQ ID NO:22).
На фиг.11 представлена карта плазмиды pET24D-Kudzu.
На фиг.12 представлена нуклеотидная последовательность плазмиды pET24D-Kudzu (SEQ ID NO:23).
На фиг.13 проиллюстрирован ДСН-ПААГ-анализ телец включения, содержащих изопренсинтазу пуэрарии. Дорожка M содержит маркеры молекулярной массы, и другие дорожки содержат возрастающие количества очищенного препарата телец включения. Как было оценено, изопренсинтаза пуэрарии волосистой имеет чистоту >90%.
На фиг.14 представлены графики, иллюстрирующие изопренсинтазную активность членов библиотеки оценок сайтов пуэрарии волосистой (SEL) для положений Y22, A20 и S408. Большинство из этих членов обнаруживали в высокой степени низкую активность, тогда как члены с консервативными заменами обнаруживали меньшее снижение активности. На панели A представлены результаты анализа для членов библиотеки Y22 в сравнении с независимыми образцами дикого типа (обозначены WT в кружочках). На панели В представлены результаты анализа, проведенные для членов библиотеки A20 в сравнении с образцами дикого типа (обозначены WT в кружочках). На панели С представлены результаты анализа, проведенные для членов библиотеки S408, указывающие то, что член S408D имеет активность, которая в 1,5-2 раза превышает среднюю активность контрольных образцов дикого типа.
На фиг.15 представлены метаболические пути MVA и DXP для изопрена (на основе публикации F. Bouvier et al., Progress in Lipid Res. 44: 357-429, 2005). Нижеследующее описание включает альтернативные названия для каждого полипептида в путях метаболизма, и работы, в которых описан анализ для измерения активности указанного полипептида (каждая из указанных работ во всей своей полноте введена в настоящее описание посредством ссылки, в частности, такие их разделы, которые относятся к анализам на полипептидную активность полипептидов, участвующих в путях MVA и DXP). Мевалонатный путь: AACT; ацетил-CoA-ацетилтрансфераза, MvaE, EC 2.3.1.9. Анализ: J. Bacteriol., 184: 2116-2122, 2002; HMGS; гидроксиметилглутарил-CoA-синтаза, MvaS, EC 2.3.3.10. Анализ: J. Bacteriol., 184: 4065-4070, 2002; HMGR; 3-гидрокси-3-метилглутарил-CoA-редуктаза, MvaE, EC 1.1.1.34. Анализ: J. Bacteriol., 184: 2116-2122, 2002; MVK; мевалонат-киназа, ERG12, EC 2.7.1.36. Анализ: Curr Genet 19:9-14, 1991. PMK; фосфомевалонат-киназа, ERG8, EC 2.7.4.2, Анализ: MoI. Cell. Biol, 11:620-631, 1991; DPMDC; дифосфомевалонат-декарбоксилаза, MVD1, EC 4.1.1.33. Анализ: Biochemistry, 33:13355-13362, 1994; IDI; изопентилдифосфат-дельта-изомераза, IDI1, EC 5.3.3.2. Анализ: J. Biol. Chem. 264:19169-19175, 1989. Путь DXS: DXS; l-дезоксиксилулозо-5-фосфатсинтаза, dxs, EC 2.2.1.7. Анализ: PNAS, 94:12857-62, 1997; DXR; 1-дезокси-D-ксилулозо-5-фосфатредуктоизомераза, dxr, EC 2.2.1.7. Анализ: Eur. J. Biochem. 269:4446-4457, 2002; MCT; 4-дифосфоцитидил-2C-метил-D-эритритолсинтаза, IspD, EC 2.7.7.60. Анализ: PNAS, 97: 6451-6456, 2000; CMK; 4-дифосфоцитидил-2-C-метил-D-эритритолкиназа, IspE, EC 2.7.1.148. Анализ: PNAS, 97:1062-1067, 2000; MCS; 2C-метил-D-эритритол-2,4-циклодифосфатсинтаза, IspF, EC 4.6.1.12. Анализ: PNAS, 96:11758-11763, 1999; HDS; 1-гидрокси-2-метил-2-(E)-бутенил-4-дифосфатсинтаза, ispG, EC 1.17.4.3. Анализ: J. Org. Chem., 70:9168-9174, 2005; HDR; 1-гидрокси-2-метил-2-(E)-бутенил-4-дифосфатредуктаза, IspH, EC 1.17.1.2. Анализ: JACS, 126:12847-12855, 2004.
На фиг.16 представлена карта pDu27.
На фиг.17 представлена аминокислотная последовательность (SEQ ID NO:118) 6Xhis-меченной по N-концу IspS P. alba в pDu27.
На фиг.18 представлена нуклеотидная последовательность (SEQ ID NO:119) плазмиды pDu27.
На фиг.19 представлена аминокислотная последовательность (SEQ ID NO:120) полноразмерной IspS P. alba в pET24a. Подчеркнутые остатки указывают на положения N-концевых усечений в IspS в плазмидах pDu39-pDu43.
На фиг.20 представлена нуклеотидная последовательность (SEQ ID NO:121) плазмиды pET24a P. alba.
На фиг.21 представлены изображения очищенных IspS, полученных в виде «дублета» с низкой молекулярной массой, как показал анализ, проводимый с помощью электрофореза в ДСН-ПААГ.
На фиг.22 показаны триптические пептиды, идентифицированные с помощью масс-спектрометрии.
На фиг.23 представлены карты pDu40, pDu41, pDu42 и pDu43, имеющих N-концевые усечения IspS P. alba.
На фиг.24 представлена карта Pdu39, которая представляет собой немеченый вариант MEA pET24a-P. alba (в штамме MD09-173).
На фиг.25 представлена аминокислотная последовательность (SEQ ID NO:122) усеченного варианта «MEA» IspS P. alba в pDu39.
На фиг.26 представлена нуклеотидная последовательность (SEQ ID NO:123) плазмиды pDu39.
На фиг.27 представлена аминокислотная последовательность (SEQ ID NO:124) усеченного варианта «MSV» IspS P. alba в pDu41.
На фиг.28 представлена нуклеотидная последовательность (SEQ ID NO:125) плазмиды pDu41 (pET24a-P.alba, немеченый вариант (MSV)).
На фиг.29 представлена аминокислотная последовательность (SEQ ID NO:126) усеченного варианта «MSV» IspS P. alba в pDu43.
На фиг.30 представлена нуклеотидная последовательность (SEQ ID NO:127) плазмиды pDu43 (pET24a-P.alba, немеченый вариант (MVS)).
На фиг.31 представлена аминокислотная последовательность (SEQ ID NO:128) усеченного варианта «MTE» IspS P. alba в pDu42.
На фиг.32 представлена нуклеотидная последовательность (SEQ ID NO:129) плазмиды pDu42 (pET24a-P.alba, немеченый вариант (MTE)).
На фиг.33 представлена аминокислотная последовательность (SEQ ID NO:130) усеченного варианта «MNV» IspS P. alba в pDu40.
На фиг.34 представлена нуклеотидная последовательность (SEQ ID NO:131) плазмиды pDu40 (pET24a-P.alba, немеченый вариант (MNV)).
На фиг.35 представлены карты MD09-161 и MD09-163, C-концевых TEV, 6XHis-меченных вариантов IspS.
На фиг.36 представлена аминокислотная последовательность (SEQ ID NO:132) MEA(+)TEV P. alba в MD09-163.
На фиг.37 представлена нуклеотидная последовательность (SEQ ID NO:133) плазмиды MD09-163 (pET24a-P.alba MEA(+)TEV. Область CDS подчеркнута, сайт протеазы TEV выделен жирным шрифтом.
На фиг.38 представлена аминокислотная последовательность (SEQ ID NO:134) FL(+)TEV P. alba в MD09-161.
На фиг.39 представлена нуклеотидная последовательность (SEQ ID NO:135) плазмиды MD09-161 (pET24a-P.alba FL(+)TEV. Область CDS подчеркнута, сайт протеазы TEV выделен жирным шрифтом.
На фиг.40 представлен график, иллюстрирующий удельные активности MD09-167, полноразмерного варианта (FL), MD09-165 и усеченной изопренсинтазы (MD09-173). Реакции проводили при 30°С в течение 15 минут в растворе, содержащем 100 мМ триса, 100 мМ NaCl, 50 мМ MgCl2, 5 мМ DMAPP и 2,5-4,5 мкг изопренсинтазы в супернатанте лизата целых клеток.
На фиг.41 представлены графики, иллюстрирующие скорость/[E] для [DMAPP]. «×» означают MD09-173, кружки означают MD09-167, ромбы означают MD09-165, и квадраты означают полноразмерную IspS.
На фиг.42 представлен график, иллюстрирующий изопренсинтазную активность для [DMAPP]. «×» означают данные, полученные с использованием усеченной изопренсинтазы MD09-173. Кружки означают данные, полученные с использованием изопренсинтазы MD09-167. Ромбы означают данные, полученные с использованием изопренсинтазы MD09-165. Квадраты означают данные, полученные с использованием полноразмерной изопренсинтазы. Каждый набор данных был получен с тремя повторами от независимо выращенных культур.
На фиг.43 представлены графики, иллюстрирующие влияние изменения kcat и KM и Ki на скорость реакции. На панели А дорожка 1 представляет кривую скорости реакции усеченной изопренсинтазы и скорости реакции полноразмерной изопренсинтазы в зависимости от различных концентраций DMAPP. Дорожка 2 представляет кривую скорости реакции полноразмерной синтазы, где kcat был заменен на kcat усеченной изопренсинтазы, деленный на скорость реакции полноразмерной синтазы. Дорожка 3 представляет кривую скорости реакции полноразмерной изопренсинтазы, где KM был заменен на KM усеченной изопренсинтазы, деленный на скорость реакции полноразмерной синтазы. Дорожка 4 представляет кривую скорости реакции полноразмерной изопренсинтазы, где Ki был заменен на Ki усеченной изопренсинтазы, деленный на скорость реакции полноразмерной изопренсинтазы. На панели B приведен график, представляющий данные, соответствующие отношению скорости реакции усеченной изопренсинтазы к скорости реакции полноразмерной изопренсинтазы для [DMAPP].
На фиг.44 представлен график, иллюстрирующий ингибирование роста MCM531 под действием мевалоновой кислоты (MVA). Клетки культивировали в среде TM3 в микротитрационном планшете с различными концентрациями MVA. Измерения OD600 в лунках с четырьмя повторами проводили в указанные периоды времени.
На фиг.45 представлены графики, иллюстрирующие DMAPP-анализы в планшете L70 SSL. Темные столбцы представляют либо полноразмерный вариант (pET24a P. alba), либо pDU39-контроль (усеченный). Варианты в лунках C3 (27), D3 (39) или E3 (51) были выбраны для последующего анализа.
На фиг.46 представлены графики, иллюстрирующие среднюю удельную активность всех вариантов, отобранных для DMAPP-анализа с определением белка. Величины ошибок указаны как стандартное отклонение. Все 3 варианта L70R обладают большей активностью, чем контроль (дикого типа).
На фиг.47 представлен график, иллюстрирующий среднюю удельную активность всех 3 вариантов L70R в сравнении с удельной активностью усеченного варианта «MEA» фермента IspS P. alba. Величины ошибок указаны как стандартное отклонение.
На фиг.48 представлены карты плазмид pDu47-3, pDu47-4 и pDu47-5.
На фиг.49 представлены карты плазмид pDu47-6, pDu47-7 и pDu48.
На фиг.50 представлены карты плазмид pDu49, pDu50 и pDu50-4.
На фиг.51 представлена аминокислотная последовательность (SEQ ID NO:136) TRC (-3) P. alba в pDu47-3.
На фиг.52 представлена нуклеотидная последовательность (SEQ ID NO:137) плазмиды pDu47-3.
На фиг.53 представлена аминокислотная последовательность (SEQ ID NO:138) TRC (-4) P. alba в pDu47-4.
На фиг.54 представлена нуклеотидная последовательность (SEQ ID NO:139) плазмиды pDu47-4.
На фиг.55 представлена аминокислотная последовательность (SEQ ID NO:140) TRC (-5) P. alba в pDu47-5.
На фиг.56 представлена нуклеотидная последовательность (SEQ ID NO:141) плазмиды pDu47-5.
На фиг.57 представлена аминокислотная последовательность (SEQ ID NO:142) TRC (-6) P. alba в pDu47-6.
На фиг.58 представлена нуклеотидная последовательность (SEQ ID NO:143) плазмиды pDu47-6.
На фиг.59 представлена аминокислотная последовательность (SEQ ID NO:144) TRC (-7) P. alba в pDu47-7.
На фиг.60 представлена нуклеотидная последовательность (SEQ ID NO:145) плазмиды pDu47-7.
На фиг.61 представлена аминокислотная последовательность (SEQ ID NO:146) TRC (MET) P. tremuloides в pDu48.
На фиг.62 представлена нуклеотидная последовательность (SEQ ID NO:147) плазмиды pDu48.
На фиг.63 представлена аминокислотная последовательность (SEQ ID NO:148) (TRC) P. trichocarpa в pDu49.
На фиг.64 представлена нуклеотидная последовательность (SEQ ID NO:149) плазмиды pDu49.
На фиг.65 представлена аминокислотная последовательность (SEQ ID NO:150) TRC (MEA) пуэрарии волосистой в pDu50.
На фиг.66 представлена нуклеотидная последовательность (SEQ ID NO:151) плазмиды pDu50.
На фиг.67 представлена аминокислотная последовательность (SEQ ID NO:152) TRC (-4) пуэрарии волосистой в pDu50-4.
На фиг.68 представлена нуклеотидная последовательность (SEQ ID NO:153) плазмиды pDu50-4.
На фиг.69 представлены графики, иллюстрирующие необработанные и нормализованные по OD данные DMAPP-анализа усеченных вариантов IspS.
На фиг.70 представлен график, иллюстрирующий удельную активность усеченных вариантов IspS. Усеченные варианты P. alba, P. tremuloides и P. trichocharpa сравнивали с «полноразмерным» вариантом P. alba в отношении их удельных активностей.
На фиг.71 представлена карта плазмиды p9795.
На фиг.72 представлена нуклеотидная последовательность плазмиды p9795 (SEQ ID NO:154).
На фиг.73 представлена карта плазмиды pTrcKudzu.
На фиг.74 представлена нуклеотидная последовательность (SEQ ID NO:155) плазмиды pTrcKudzu.
На фиг.75 представлена карта плазмиды pMAL-C4X.
На фиг.76 представлена нуклеотидная последовательность (SEQ ID NO:156) плазмиды pMAL-C4X.
На фиг.77 представлена карта плазмиды pMAL-C4X-Kudzu.
На фиг.78 представлена нуклеотидная последовательность (SEQ ID NO:157) плазмиды pMAL-C4X-Kudzu.
На фиг.79 представлены карты плазмид pET24, pET24a P. tremuloides и pET24a P. trichocharpa.
На фиг.80 представлена аминокислотная последовательность (SEQ ID NO:158) IspS P. tremuloides в pET24a P. trichocharpa.
На фиг.81 представлена нуклеотидная последовательность (SEQ ID NO:159) плазмиды pET24a P. tremuloides.
На фиг.82 представлена аминокислотная последовательность (SEQ ID NO:160) IspS P. trichocharpa в pET24a P. trichocharpa.
На фиг.83 представлена нуклеотидная последовательность (SEQ ID NO:161) плазмиды pET24a P. trichocharpa.
На фиг.84 представлены карты плазмид pDu30, pDu31 и pDu32.
На фиг.85 представлена аминокислотная последовательность (SEQ ID NO:162) варианта IspS P.albaTRC-pET200 в pDu30.
На фиг.86 представлена нуклеотидная последовательность (SEQ ID NO:163) плазмиды pDu30.
На фиг.87 представлена аминокислотная последовательность (SEQ ID NO:164) варианта IspS P.tremTRC-pET200 в pDu31.
На фиг.88 представлена нуклеотидная последовательность (SEQ ID NO:165) плазмиды pDu31.
На фиг.89 представлена аминокислотная последовательность (SEQ ID NO:166) варианта IspS P.trichTRC-pET200 в pDu32.
На фиг.90 представлена нуклеотидная последовательность (SEQ ID NO:167) плазмиды pET24a.
На фиг.91 представлена трехмерная структура IspS P. tremuloides, показанная в виде димера. Цепь А отмечена темно-серым цветом, цепь В отмечена умеренно серым цветом, и один ион магния, присутствующий в каждом активном центре, отмечен светло-серым цветом.
На фиг.92 приведено мономерное представление структуры IspS P. tremuloides. Магний показан в виде светло-серой сферы, и указаны N- и C-концы.
На фиг.93 проиллюстрировано сравнение структур (A) BdpS и LS, (B) BdpS и IspS тополя, (C) LS и IspS тополя и (D) TEAS и IspS тополя. В каждом случае, первая структура отмечена светло-серым цветом и вторая - темно-серым цветом. Двухвалентные катионы показаны в виде сфер.
На фиг.94 представлена трехмерная структура петель в BdpS и LS. На панели A, N-концевая петля Ls показана светло-серым цветом, и N-концевая петля BdpS показана темно-серым цветом. На панели B показано, что петля I и петля II имеют гомологичную структуру.
На фиг.95 показано, что N-концевая петля BdpS (темно-серый цвет) и IspS тополя (светло-серый цвет) имеют различные структуры. На панели A представлена N-концевая петля, и на панели B представлена петля I и петля II.
На фиг.96 показано, что N-концевая петля LS (светло-серый цвет) и IspS тополя (темно-серый цвет) имеют различные структуры. На панели A представлена N-концевая петля, и на панели B представлена петля I и петля II.
На фиг.97 показано, что N-концевая петля TEAS (светло-серый цвет) и IspS тополя (темно-серый цвет) имеют различные структуры. На панели A представлена N-концевая петля, и на панели B представлена петля I и петля II. Петля I имеет неупорядоченную структуру в TEAS.
Общее описание изобретения
Настоящее изобретение относится к способам и композициям, содержащим по меньшей мере один фермент изопренсинтазу, обладающую повышенной каталитической активностью и/или растворимостью. В частности, настоящее изобретение относится к вариантам растительных изопренсинтаз, способствующих повышению уровня продуцирования изопрена в клетках микроорганизмов-хозяев. Биосинтетически продуцируемый изопрен согласно изобретению может найти применение в изготовлении каучука и эластомеров.
Если не указано иное, то для осуществления настоящего изобретения применяются стандартные технологии, обычно используемые в молекулярной биологии, в микробиологии и в методах рекомбинантных ДНК, и известные специалистам в данной области. Такие технологии известны специалистам в данной области и описаны в различных публикациях и справочных руководствах (см., например, Sambrook et al., "Molecular Cloning: A Laboratory Manual," Second Edition, Cold Spring Harbor, 1989; и Ausubel et al., "Current Protocols in Molecular Biology," 1987).
Если конкретно не указано иное в описании настоящего изобретения, то все используемые технические и научные термины имеют значения, в основном, понятные любому среднему специалисту в области, к которой относится настоящее изобретение. Так, например, в публикациях Singleton and Sainsbury, Dictionary of Microbiology and Molecular Biology, 2d Ed., John Wiley and Sons, NY (1994); и Hale and Marham, The Harper Collins Dictionary of Biology, Harper Perennial, NY (1991), а также в общих словарях имеется много терминов, обычно используемых специалистами в данной области и в настоящем изобретении. Хотя для осуществления настоящего изобретения могут быть использованы способы, аналогичные или эквивалентные описанным в указанных публикациях способам, однако предпочтительными являются способы, описанные в настоящем описании. В соответствии с этим, термины, определенные непосредственно ниже, более подробно объяснены со ссылками на описание настоящего изобретения в целом.
Кроме того, представленные в настоящем описании заголовки разделов не ограничивают различных аспектов или вариантов осуществления настоящего изобретения, которые приведены в настоящем описании посредством ссылки на описание в целом. В соответствии с этим, термины, определенные непосредственно ниже, более подробно объяснены со ссылками на описание настоящего изобретения в целом. Тем не менее, для более ясного понимания настоящего изобретения, ниже приводятся определения ряда терминов.
Определения
Если конкретно не указано иное, то все используемые в настоящем описании технические и научные термины имеют значения, в основном, понятные любому среднему специалисту в области, к которой относится настоящее изобретение. Хотя для осуществления настоящего изобретения могут быть использованы способы, аналогичные или эквивалентные описанным в указанных публикациях способам, однако предпочтительными являются способы, описанные в настоящем описании. В соответствии с этим, термины, определенные непосредственно ниже, более подробно объяснены со ссылками на описание настоящего изобретения в целом.
В настоящем описании, при употреблении терминов в единственном числе подразумевается, что термины, используемые в описании настоящего изобретения, могут употребляться как в единственном числе, так и во множественном числе, если это явно не противоречит контексту изобретения. Если не указано иное, то нуклеиновые кислоты записываются слева направо в направлении 5'→3', и аминокислотные последовательности записываются слева направо в направлении от амино-конца к карбокси-концу, соответственно. При этом следует отметить, что настоящее изобретение не ограничивается конкретно описанными в данном описании способами, протоколами и реагентами, которые могут варьироваться в зависимости от цели их применения.
При этом, предусматривается, что каждый максимальный числовой предел, указанный в настоящем описании, может включать каждый нижний числовой предел так, как если бы такой нижний числовой предел был точно определен в настоящем описании. Каждый минимальный числовой предел, указанный в настоящем описании, может включать верхний числовой предел так, как если бы такой верхний числовой предел был точно определен в настоящем описании. Каждый числовой интервал, указанный в описании настоящего изобретения, включает каждый более узкий числовой интервал, который входит в такой более широкий числовой интервал так, как если бы все указанные более узкие числовые интервалы были точно определены в описании настоящего изобретения.
Все документы, цитируемые в соответствующем разделе настоящего описания, включены в настоящее описание посредством ссылки. Однако цитирование какого-либо документа не должно обязательно означать, что этот документ относится к прототипу настоящего изобретения.
Используемый в данном описании термин «2-метил-l,3-бутадиен» (CAS# 78-79-5) («изопрен») означает чистый и конечный летучий C5-углеводородный продукт, образующийся в результате элиминации пирофосфата из 3,3-диметилаллилпирофосфата (DMAPP), и не является продуктом связывания или полимеризации молекул(ы) IPP с молекулой(ами) DMAPP. Используемые в данном описании термины «изопренсинтаза» и «IspS» означают ферменты, которые катализируют элиминацию пирофосфата из диметилаллилдифосфата (DMAPP) с образованием изопрена. В некоторых предпочтительных вариантах осуществления изобретения IspS представляет собой фермент, полученный из растений, таких как пуэрария, тополь или красный дуб. В некоторых вариантах осуществления изобретения термин «IspS» означает природный зрелый фермент или его часть.
Родственные белки (и их производные) включают «варианты белков». В некоторых предпочтительных вариантах осуществления изобретения варианты белков отличаются от родительского белка (например, IspS пуэрарии, представленного как SEQ ID NO:2, или IspS тополя) и отличаются друг от друга небольшим числом аминокислотных остатков. Число отличающихся аминокислотных остатков может составлять один или более, и предпочтительно, 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50 или более аминокислотных остатков. В некоторых предпочтительных вариантах осуществления изобретения число отличающихся вариантов аминокислот составляет от 1 до 10. В некоторых особенно предпочтительных вариантах осуществления изобретения родственные белки, и в частности, варианты белков имеют аминокислотные последовательности, идентичные по меньшей мере на 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99%. Кроме того, используемые в данном описании термины «родственный белок» или «варианты белка» означают белок, который отличается от другого родственного белка или от родительского белка числом выступающих областей. Так, например, в некоторых вариантах осуществления изобретения варианты белков имеют 1, 2, 3, 4, 5 или 10 соответствующих выступающих областей, которые отличаются от областей родительского белка.
Специалистам в данной области известно несколько способов, которые являются подходящими для получения вариантов ферментов согласно изобретению, включая, но, не ограничиваясь ими, сайт-насыщающий мутагенез, сканирующий мутагенез, инсерционный мутагенез, неспецифический мутагенез, сайт-направленный мутагенез и прямая эволюция, а также различные другие рекомбинаторные способы.
Характеризацию белков дикого типа и мутантных белков осуществляют с помощью любых подходящих средств или «тестов», и такую характеризацию предпочтительно осуществляют исходя из оценки представляющих интерес свойств. Так, например, в некоторых вариантах осуществления настоящего изобретения оценивают одно или несколько из нижеследующих свойств, таких как стабильность при различных значениях pH; термостабильность; стабильность к окислению; стабильность к протеолизу; растворимость; Km и/или удельная активность превращения DMAPP в изопрен in vitro; Km и/или удельная активность превращения DMAPP в изопрен in vivo в среде организма-хозяина (например, E. coli) и экспрессия фермента(ов) по пути DXP и/или по пути MVA. Действительно, считается, что в настоящем изобретении могут быть использованы ферменты, имеющие различные степени стабильности, растворимости, активности и/или различные уровни экспрессии в одном или нескольких условиях тестирования.
Используемый в данном описании термин «ген» означает полинуклеотид (например, ДНК-сегмент), который кодирует полипептид и включает области, находящиеся перед и за кодирующими областями, а также промежуточные последовательности (интроны), расположенные между отдельными кодирующими сегментами (экзонами).
Используемый в данном описании термин «гомологичные гены» означает пару генов, которые отличаются друг от друга, но обычно являются родственными молекулами, которые соответствуют друг другу и либо являются идентичными, либо имеют очень высокую степень сходства. Этот термин охватывает гены, которые были разделены в процессе видообразования (то есть, образования новых видов) (например, ортологичные гены), а также гены, которые были разделены в процессе генетической дупликации (например, паралогичные гены).
Используемый в данном описании термин «ортолог» и «ортологичные гены» означает гены, присутствующие у различных видов, которые эволюционировали от общего гена-предка (то есть, гомологичного гена) в процессе видообразования. Обычно, ортологи сохраняют свою функцию в процессе эволюции. Идентификация ортологов применяется для точного предсказания функции гена в только что секвенированных геномах.
Используемый в данном описании термин «паралог» и «паралогичные гены» означает гены, которые стали родственными в результате дупликации в геноме. Хотя ортологи сохраняют свои функции в процессе эволюции, паралоги приобретают новые функции, даже некоторые функции паралогов часто соответствуют их исходным функциям.
Используемый в данном описании термин «гомология» означает сходство или идентичность последовательностей, предпочтительно, идентичность. Гомологию определяют стандартными способами, известными в данной области (см., например, публикации Smith and Waterman, Adv Appl Math, 2:482, 1981; Needleman and Wunsch, J. Mol. Biol., 48:443, 1970; Pearson and Lipman, Proc. Natl. Acad. Sci. USA, 85:2444, 1988; и программы, такие как GAP, BESTFIT, FASTA и TFASTA, входящие в пакет программного обеспечения Wisconsin Genetics Software Package, Genetics Computer Group, Madison, WI; и Devereux et al, Nucl. Acid. Res., 12:387-395, 1984).
Используемый в данном описании термин «аналогичная последовательность» означает последовательность, в которой функция гена по существу аналогична функции гена, сконструированного на основе изопренсинтазы пуэрарии (IspS) или IspS тополя (IspS). Кроме того, аналогичными генами являются гены, последовательности которых по меньшей мере примерно на 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% идентичны последовательности изопренсинтазы пуэрарии. В дополнительных вариантах осуществления изобретения указанная последовательность обладает более чем одним из вышеуказанных свойств. Аналогичные последовательности определяют известными способами выравнивания последовательностей. Наиболее распространенным способом выравнивания является BLAST, хотя, как указывается выше и ниже, для выравнивания последовательностей могут быть также применены и другие способы.
Одним из примеров подходящего алгоритма является алгоритм PILEUP. Алгоритм PILEUP позволяет осуществлять выравнивание множества последовательностей из группы родственных последовательностей путем последовательного попарного выравнивания. Для осуществления выравнивания может быть также построена древовидная схема, иллюстрирующая кластерные взаимосвязи. В программе PILEUP используется упрощенный метод последовательного выравнивания, описанный Feng и Doolittle (Feng and Doolittle, J. Mol. Evol., 35:351-360, 1987). Этот метод аналогичен методу, описанному Higgins и Sharp (Higgins and Sharp, CABIOS 5:151-153, 1989). Подходящими параметрами PILEUP являются: «цена» пробела 3.00 по умолчанию, «цена» длины пробела 0.10 по умолчанию и взвешенные значения концевых пробелов.
Другим примером подходящего алгоритма является алгоритм BLAST, описанный Altschul et al., (Altschul et al, J. Mol. Biol, 215:403-410, 1990; и Karlin et al., Proc. Natl. Acad. Sci. USA, 90:5873-5787, 1993). Особенно подходящей программой BLAST является программа WU-BLAST-2 (см., Altschul et al., Meth. Enzymol., 266:460-480, 1996). В программе WU-BLAST-2 используется несколько параметров поиска, большинство из которых принимаются как величины по умолчанию. Корректируемые параметры установлены со следующими величинами по умолчанию: охват с перекрыванием = 1, перекрывающаяся фракция = 0.125, предельная длина слова (T)=11. Параметрами HSP S и HSP S2 являются динамические величины, и эти параметры устанавливаются самой программой в зависимости от состава конкретной последовательности и состава конкретной базы данных, в которой осуществляется поиск представляющей интерес последовательности. Однако для повышения чувствительности, эти величины могут быть скорректированы. Процент (%) идентичности аминокислотных последовательностей определяют по числу соответствующих идентичных остатков, деленному на общее число остатков «более длинной» последовательности в выравниваемой области. «Более длинной» последовательностью является последовательность, имеющая наиболее ценные остатки в выравниваемой области (пробелы, вводимые с помощью программы WU-Blast-2 для максимизации «веса» выравнивания, не учитываются).
Таким образом, «процент (%) идентичности последовательностей нуклеиновой кислоты» определяют как процент нуклеотидных остатков в последовательности-кандидате, которые идентичны нуклеотидным остаткам исходной последовательности (то есть, представляющей интерес последовательности). В предпочтительном способе используется модуль BLASTN программы WU-BLAST-2, установленный по умолчанию, где перекрывание и перекрывающаяся фракция имеют значения 1 и 0.125, соответственно.
Используемый в данном описании термин «гибридизация» означает процесс, в результате которого цепь нуклеиновой кислоты присоединяется к комплементарной цепи посредством спаривания оснований, как известно в данной области.
Последовательность нуклеиновой кислоты считается «селективно гибридизуемой» с эталонной последовательностью нуклеиновой кислоты, если две последовательности специфически гибридизуются друг с другом в условиях гибридизации и промывки умеренно высокой жесткости. Условия гибридизации создают исходя из температуры плавления (Tm) комплекса или зонда, связывающегося с нуклеиновой кислотой. Так, например, условия «максимальной жесткости» обычно соответствуют примерно Tm=5°C (на 5° ниже Tm зонда); условия «высокой жесткости» соответствуют температуре, которая примерно на 5-10°C ниже Tm зонда; условия «промежуточной жесткости» соответствуют температуре, которая примерно на 10-20°C ниже Tm зонда; и условия «низкой жесткости» соответствуют температуре, которая примерно на 20-25°C ниже Tm зонда. Фактически, условия максимальной жесткости могут быть использованы для идентификации последовательностей, которые являются полностью идентичными или почти идентичными последовательности гибридизационного зонда, и гибридизация в условиях промежуточной или низкой жесткости может быть использована для идентификации или детектирования гомологов полинуклеотидных последовательностей.
Условия гибридизации умеренной и высокой жесткости хорошо известны в данной области. Примером условий высокой жесткости является гибридизация примерно при 42°C в 50% формамиде, 5X SSC, 5X растворе Денхардта, 0,5% ДСН и 100 мкг/мл денатурированной ДНК-носителя, с последующей двукратной промывкой в 2X SSC и 0,5% ДСН при комнатной температуре и двумя дополнительными промывками в 0,1X SSC и 0,5% ДСН при 42°C. Примерами условий умеренной жесткости являются инкубирование в течение ночи при 37°C в растворе, содержащем 20% формамид, 5Х SSC (150 мМ NaCl, 15 мМ тринатрийцитрат), 50 мМ фосфат натрия (pH 7,6), 5Х раствор Денхардта, 10% сульфат декстрана и 20 мг/мл денатурированной фрагментированной ДНК спермы лосося, с последующей промывкой фильтров в 1Х SSC примерно при 37-50°C. Способ коррекции температуры, ионной силы и т.п., необходимой для адаптации таких факторов, как длина зонда и т.п., хорошо известен специалистам в данной области.
Используемый в данном описании термин «рекомбинантный» относится к клетке или вектору, которые были модифицированы путем введения гетерологичной последовательности нуклеиновой кислоты, или к клетке, полученной путем такой модификации. Так, например, рекомбинантные клетки экспрессируют гены, которые отсутствуют в идентичной форме в нативной (нерекомбинантной) клетке, или экспрессируют нативные гены, которые по той или иной причине либо подвергаются аномальной экспрессии, либо вообще не экспрессируются, либо искусственно экспрессируются в результате вмешательства человека. Термины «рекомбинация», «перегруппировка» и генерирование «рекомбинантной» нуклеиновой кислоты обычно означают сборку двух или более фрагментов нуклеиновой кислоты, где такая сборка приводит к образованию химерного гена.
В предпочтительном варианте осуществления изобретения последовательности мутантных ДНК получают путем сайт-насыщающего мутагенеза по меньшей мере в одном кодоне. В другом предпочтительном варианте осуществления сайт-насыщающий мутагенез осуществляют в двух или более кодонах. В другом варианте осуществления изобретения мутантные последовательности ДНК более чем на 50%, более чем на 55%, более чем на 60%, более чем на 65%, более чем на 70%, более чем на 75%, более чем на 80%, более чем на 85%, более чем на 90%, более чем на 95% или более чем на 98% гомологичны последовательности дикого типа. В альтернативных вариантах осуществления изобретения мутантную ДНК получают in vivo с применением любой известной методики мутагенеза, такой как, например, облучение, введение нитрозогуанидина и т.п. Затем выделяют нужную последовательность ДНК, и эту последовательность используют в описанных в данном описании способах.
Используемый в данном описании термин «последовательность-мишень» означает последовательность ДНК в клетке-хозяине, где указанная последовательность кодирует последовательность, необходимую для встраивания последовательности, встраивающейся в геном клетки-хозяина. В некоторых вариантах осуществления изобретения последовательность-мишень кодирует функциональный ген дикого типа или оперон, и в других вариантах осуществления изобретения последовательность-мишень кодирует функциональный мутантный ген или оперон, или нефункциональный ген или оперон.
Используемый в данном описании термин «фланкирующая последовательность» означает любую последовательность, расположенную выше или ниже обсуждаемой последовательности (например, для генов A-B-C, ген B фланкирован последовательностями гена А и С). В предпочтительном варианте осуществления изобретения встраивающаяся последовательность с каждой стороны фланкирована гомологичным боксом. В другом варианте осуществления изобретения встраивающаяся последовательность и гомологичные боксы содержат элемент, который с каждой стороны фланкирован «лишней» последовательностью. В некоторых вариантах осуществления изобретения фланкирующая последовательность присутствует только с одной стороны (либо 3'-, либо 5'-конца), однако в предпочтительных вариантах осуществления изобретения указанная последовательность фланкирована с обеих сторон. В некоторых вариантах осуществления изобретения фланкирующая последовательность присутствует только с одной стороны (либо 3'-, либо 5'-конца), и в предпочтительных вариантах осуществления изобретения такая последовательность фланкирована с обеих сторон.
Используемый в данном описании термин «лишняя последовательность» означает любую дополнительную ДНК, которая фланкирует гомологичные боксы (обычно, векторные последовательности). Однако этот термин охватывает любую негомологичную последовательность ДНК. Не ограничиваясь какой-либо конкретной теорией, следует только отметить, что «лишняя» последовательность представляет собой мишень для клеток, не играющую важной роли для инициации поглощения ДНК.
Используемые в данном описании термины «амплификация» и «амплификация гена» означают процесс, благодаря которому конкретные последовательности ДНК непропорционально реплицируются, в результате чего амплифицированный ген присутствует в геноме с большим числом копий, чем в исходном состоянии. В некоторых вариантах осуществления изобретения отбор клеток путем их культивирования в присутствии лекарственного средства (например, ингибитора ингибируемого фермента) приводит к амплификации любого эндогенного гена, кодирующего генный продукт, необходимый для роста клеток в присутствии лекарственного средства, или к амплификации экзогенных (то есть, встраиваемых) последовательностей, кодирующих этот генный продукт, или к амплификации того и другого.
«Амплификация» представляет собой частный случай репликации нуклеиновой кислоты, специфичной к данной матрице. Данная репликация отличается от неспецифически зависимой матрицы репликации (то есть, репликации, которая зависит от матрицы вообще, но не от конкретной матрицы). В данном контексте, специфичность к матрице отличается от точности репликации (то есть, синтеза соответствующей полинуклеотидной последовательности) и от специфичности к нуклеотиду (рибонуклеотиду или дезоксирибонуклеотиду). Специфичность к матрице часто определяется термином «специфичность к мишени». Последовательности-мишени являются «мишенями» в том смысле, что они должны быть дифференцированы от другой нуклеиновой кислоты. Методики амплификации были разработаны, главным образом, для осуществления такого отбора.
Используемый в данном описании термин «ко-амплификация» означает введение в одиночную клетку амплифицируемого маркера в комбинации с другими генными последовательностями (то есть, последовательностями, содержащими один или несколько неселектируемых генов, таких как гены, содержащиеся в экспрессионном векторе), и создания соответствующего давления отбора таким образом, чтобы клетка амплифицировала амплифицируемый маркер и другие неселектируемые генные последовательности. Амплифицируемый маркер может быть физически присоединен к другим генным последовательностям, или альтернативно, два отдельных фрагмента ДНК, один из которых содержит амплифицируемый маркер, а другой содержит неселектируемый маркер, могут быть введены в одну и ту же клетку.
Используемые в данном описании термины «амплифицируемый маркер», «амплифицируемый ген» и «вектор для амплификации» означают ген или вектор, кодирующий ген, который позволяет этому гену амплифицироваться в соответствующих условиях культивирования.
«Специфичность к матрице» достигается с применением большинства методик амплификации путем выбора фермента. Ферментами для амплификации являются ферменты, которые, при их присутствии в условиях, в которых они используются, будут процессировать только специфические последовательности нуклеиновой кислоты в гетерогенной смеси нуклеиновой кислоты. Так, например, в случае репликазы Qβ, РНК MDV-1 представляет собой матрицу, специфичную для репликазы (см. например, Kacian et al., Proc. Natl. Acad. Sci. USA 69:3038, 1972), а другие нуклеиновые кислоты не реплицируются под действием такого фермента для амплификации. Аналогичным образом, в случае РНК-полимеразы T7, такой фермент для амплификации обладает высокой степенью специфичности к его собственным промоторам (см., Chamberlin et al., Nature 228:227, 1970). В случае ДНК-лигазы T4, фермент не лигирует два олигонуклеотида или полинуклеотида, если имеется несоответствие между олигонуклеотидным или полинуклеотидным субстратом и матрицей в стыке лигирования (см., Wu and Wallace, Genomics 4:560, 1989). И наконец, было обнаружено, что полимеразы Taq и Pfu, благодаря своей способности функционировать при высокой температуре, обладают высокой специфичностью к последовательностям, связанным и, тем самым, ограниченным праймерами, где высокая температура обеспечивает термодинамические условия, которые благоприятствуют гибридизации праймеров с последовательностями-мишенями и не благоприятствуют гибридизации с последовательностями, не являющимися мишенями.
Используемый в данном описании термин «амплифицируемая нуклеиновая кислота» относится к нуклеиновым кислотам, которые могут быть амплифицированы любым способом амплификации. Следует отметить, что термин «амплифицируемая нуклеиновая кислота» обычно включает «образец-матрицу».
Используемый в данном описании термин «образец-матрица» означает нуклеиновую кислоту, происходящую от образца, который анализируют на присутствие «мишени» (определенной ниже). В противоположность этому, термин «фоновая матрица» употребляется по отношению к нуклеиновой кислоте, которая не является образцом-матрицей, и может присутствовать или не присутствовать в образце. Фоновая матрица часто образуется самопроизвольно. Она может образовываться в результате переноса нуклеиновых кислот или она может образовываться благодаря присутствию примесных нуклеиновых кислот, которые должны быть удалены из образца. Так, например, нуклеиновые кислоты, полученные из организмов, которые не были детектированы, могут присутствовать в тест-образце как фоновые.
Используемый в данном описании термин «праймер» означает олигонуклеотид, который, независимо от того, существует ли он в природе как очищенный гидролизат рестриктирующего фермента или он был продуцирован путем синтеза, способен действовать как сайт инициации синтеза, осуществляемого в условиях, при которых индуцируется синтез продукта удлинения праймера, являющегося комплементарным цепи нуклеиновой кислоты (то есть, в присутствии нуклеотидов и индуцирующего агента, такого как ДНК-полимераза, и при подходящей температуре и рН). Для достижения максимально эффективной амплификации, предпочтительно, чтобы данный праймер был одноцепочечным, однако, альтернативно, он может быть двухцепочечным. Если праймер является двухцепочечным, то его сначала обрабатывают для разделения цепей, а затем используют для получения продуктов удлинения. Предпочтительным праймером является олигодезоксирибонуклеотид. Праймер должен иметь длину, достаточную для инициации синтеза продуктов удлинения в присутствии индуцирующего агента. Точная длина праймеров зависит от многих факторов, включая температуру, источник происхождения праймера и способ его применения.
Используемый в данном описании термин «зонд» означает олигонуклеотид (то есть, последовательность нуклеотидов), который независимо от того, существует ли он в природе как очищенный гидролизат рестриктирующего фермента, был ли он продуцирован путем синтеза методами рекомбинантных ДНК или путем ПЦР-амплификации, и обладает ли он способностью гибридизоваться с другим, представляющим интерес олигонуклеотидом. Такой зонд может быть одноцепочечным или двухцепочечным. Зонды могут быть использованы для детектирования, идентификации и выделения конкретных генных последовательностей. Считается, что любой зонд, используемый в настоящем изобретении, может быть помечен любой «репортерной» молекулой, которая является детектируемой в любой детектирующей системе, включая, но, не ограничиваясь ими, ферментную систему (например, ELISA, а также гистохимические анализы на основе ферментов), флуоресцентную, радиоактивную и люминесцентную систему. При этом предусматривается, что настоящее изобретение не ограничивается какой-либо конкретной детектирующей системой или меткой.
Термин «мишень», если он используется в данном описании по отношению к полимеразной цепной реакции, означает область нуклеиновой кислоты, связанную с праймерами, используемыми для полимеразной цепной реакции. Таким образом, «мишень» выбирают из других последовательностей нуклеиновой кислоты. «Сегмент» определяют как область нуклеиновой кислоты в последовательности-мишени.
В одном из вариантов изобретения, используемый в данном описании термин «полимеразная цепная реакция» («ПЦР») относится к способам, описанным в патентах США 4683195, 4683202 и 4965188, которые включены в настоящее описание посредством ссылки, где указанные способы включают увеличение концентрации сегмента последовательности-мишени в смеси геномной ДНК без проведения клонирования или очистки. Такой способ амплификации последовательности-мишени состоит из введения большого избытка двух олигонуклеотидных праймеров в смесь ДНК, содержащую нужную последовательность-мишень, с последующим проведением конкретного ряда термоциклов в присутствии ДНК-полимеразы. Два праймера являются комплементарными их соответствующим цепям двухцепочечной последовательности-мишени. Для осуществления амплификации, смесь денатурируют, и затем праймеры гибридизуют с комплементарными им последовательностями в молекуле-мишени. После отжига, праймеры удлиняют под действием полимеразы, в результате чего образуется новая пара комплементарных цепей. Стадии денатурации, отжига праймеров и удлинения под действием полимеразы могут быть проведены много раз (то есть, стадии денатурации, отжига и удлинения составляют один «цикл», при этом могут составлять и множество циклов), с получением высокой концентрации амплифицированного сегмента нужной последовательности-мишени. Длину амплифицированного сегмента нужной последовательности-мишени определяют по положениям праймеров по отношению друг к другу, и поэтому такая длина является регулируемым параметром. Так как данный процесс носит повторяющийся характер, то такой способ называется «полимеразной цепной реакцией» (далее обозначаемой «ПЦР»). Поскольку нужные амплифицированные сегменты последовательности-мишени становятся преобладающими последовательностями (с точки зрения их концентрации) в данной смеси, то их принято называть «ПЦР-амплифицированными».
Используемый в данном описании термин «реагенты для амплификации» означает реагенты (дезоксирибонуклеотид-трифосфаты, буфер и т.п.), необходимые для амплификации, за исключением праймеров, нуклеиновокислотной матрицы и фермента для амплификации. Обычно, реагенты для амплификации, вместе с другими компонентами реакционной смеси, помещают на хранение в реакционный сосуд (в тест-пробирку, микролунку и т.п.).
С помощью ПЦР можно амплифицировать одну копию специфической последовательности-мишени в геномной ДНК до уровня, который может быть детектирован с применением нескольких различных способов (например, гибридизации с меченым зондом; введения биотинилированных праймеров с последующим детектированием конъюгата «авидин-фермент»; и введения 32P-меченных дезоксинуклеотид-трифосфатов, таких как dCTP или dATP, в амплифицированный сегмент). Помимо геномной ДНК, любая олигонуклеотидная или полинуклеотидная последовательность может быть амплифицирована с использованием соответствующего набора молекул-праймеров. В частности, амплифицированные сегменты, полученные с помощью ПЦР, сами по себе являются матрицами, которые могут быть использованы для последующих ПЦР-амплификаций.
Используемые в данном описании термины «ПЦР-продукт», «ПЦР-фрагмент» и «продукт амплификации» означают смесь соединений, полученную после проведения двух или более циклов ПЦР-стадий денатурации, отжига и удлинения. Эти термины включают случаи, когда происходит амплификация одного или нескольких сегментов одной или нескольких последовательностей-мишеней.
Используемый в данном описании термин «ОТ-ПЦР» означает репликацию и амплификацию последовательностей РНК. В этом способе обратную транскрипцию проводят в комбинации с ПЦР, в основном, с применением одной ферментативной процедуры, в которой используется термостабильная полимераза, как описано в патенте США 5322770, который включен в настоящее описание посредством ссылки. В ОТ-ПЦР РНК-матрицу превращают в кДНК с помощью обратной транскриптазной активности полимеразы и затем амплифицируют с использованием полимеризующей активности полимеразы (то есть, как в других ПЦР-способах).
Используемые в данном описании термины «рестриктирующие эндонуклеазы» и «рестриктирующие ферменты» означают бактериальные ферменты, каждый из которых разрезает двухцепочечную ДНК в конкретной нуклеотидной последовательности или около этой последовательности.
Термин «рестрикционный сайт» означает нуклеотидную последовательность, распознаваемую и расщепляемую данной рестриктирующей эндонуклеазой, и в большинстве случаев, таким сайтом является сайт инсерции ДНК-фрагментов. В некоторых вариантах осуществления изобретения рестрикционные сайты встраивают в селективный маркер и присоединяют к 5'- и 3'-концам ДНК-конструкции.
Используемый в данном описании термин «интеграция в хромосому» означает способ, посредством которого встраивающуюся последовательность вводят в хромосому клетки-хозяина. Гомологичные области трансформирующей ДНК присоединяют к гомологичным областям хромосомы. Затем последовательность, расположенную между гомологичными боксами, заменяют встраивающейся последовательностью при двойном кроссинговере (то есть, посредством гомологичной рекомбинации). В некоторых вариантах осуществления изобретения гомологичные сегменты инактивирующего хромосомного сегмента ДНК-конструкции присоединяют к фланкирующим гомологичным областям природной области хромосомы Bacillus. Затем природную хромосомную область делетируют под действием ДНК-конструкции при двойном кроссинговере (то есть, посредством гомологичной рекомбинации).
Термин «гомологичная рекомбинация» означает обмен ДНК-фрагментами между двумя молекулами ДНК или спаренными хромосомами в сайте идентичных или почти идентичных нуклеотидных последовательностей. В предпочтительном варианте осуществления изобретения интеграция в хромосому представляет собой гомологичную рекомбинацию. Используемый в данном описании термин «гомологичные последовательности» означает последовательность нуклеиновой кислоты или полипептидную последовательность, которые на 100%, 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91%, 90%, 88%, 85%, 80%, 75% или 70% идентичны другой последовательности нуклеиновой кислоты или полипептидной последовательности при их оптимальном выравнивании для сравнения. В некоторых вариантах осуществления изобретения гомологичные последовательности являются идентичными на 85%-100%, в других вариантах осуществления изобретения на 90%-100%, и в более предпочтительных вариантах осуществления изобретения на 95%-100%.
Используемый в данном описании термин «аминокислота» относится к последовательностям пептидов или белков или их фрагментов. Используемые в данном описании термины «белок», «пептид» и «полипептид» являются взаимозаменяемыми.
Используемый в данном описании термин «гетерологичный белок» означает белок или полипептид, который обычно не присутствует в клетке-хозяине. Примерами гетерологичных белков являются ферменты, такие как изопренсинтаза. В некоторых вариантах осуществления изобретения гены, кодирующие белки, являются природными генами, и в других вариантах осуществления изобретения используются мутированные и/или синтезированные гены.
Используемый в данном описании термин «гомологичный белок» означает нативный белок или полипептид, либо белок или полипептид, присутствующий в природной клетке. В предпочтительных вариантах осуществления изобретения указанной клеткой является грамотрицательная клетка, и в особенно предпочтительных вариантах осуществления изобретения указанной клеткой является клетка-хозяин Escherichia.
Фермент «сверхэкспрессируется» в клетке-хозяине, если такой фермент экспрессируется в клетке на уровне, превышающем уровень его экспрессии в соответствующей клетке дикого типа.
Термины «белок» и «полипептид» являются в данном случае взаимозаменяемыми. В описании настоящего изобретения, для обозначения аминокислот используется 3-буквенный код, который был определен в соответствии с соглашением Объединенной комиссии по биохимической номенклатуре IUPAC-IUB (JCBN). Также следует отметить, что полипептид, из-за вырожденности генетического кода, может кодироваться более чем одной нуклеотидной последовательностью.
Термин «зрелая» форма белка или пептида означает конечную функциональную форму белка или пептида. Так, например, зрелая форма изопренсинтазы пуэрарии включает аминокислотную последовательность SEQ ID NO:2.
Термин «форма-предшественник» белка или пептида означает зрелую форму белка, имеющую пропоследовательность, функционально присоединенную к амино-концу или к карбонильному концу белка. Такой предшественник может также иметь «сигнальную последовательность», функционально присоединенную к амино-концу пропоследовательности. Предшественник может также иметь дополнительные полинуклеотиды, которые участвуют в посттрансляционной активности (например, полинуклеотиды, отщепленные от этой последовательности, образуют зрелую форму белка или пептида).
Термин «природный фермент» означает фермент, имеющий немодифицированную аминокислотную последовательность, идентичную последовательности, встречающейся в природе. Природными ферментами являются нативные ферменты, то есть, ферменты, которые обычно экспрессируются или которые были обнаружены в конкретном микроорганизме.
Термин «идентичный», используемый по отношению к двум последовательностям нуклеиновых кислот или полипептидов, относится к остаткам в двух последовательностях, которые являются одинаковыми при их выравнивании на максимальное соответствие, как было определено с помощью одного из указанных ниже алгоритмов сравнения или анализа последовательностей.
Термин «оптимальное выравнивание» означает выравнивание, позволяющее выявить самую высокую величину процента идентичности.
Термины «процент идентичности последовательностей», «процент идентичности аминокислотных последовательностей», «процент идентичности генных последовательностей» и/или «процент идентичности последовательностей нуклеиновых кислот/полинуклеотидов», если они относятся к двум аминокислотным, полинуклеотидным и/или генным последовательностям (если они используются), означают процент остатков, которые являются идентичными в двух последовательностях при их оптимальном выравнивании. Таким образом, 80%-ная идентичность аминокислотных последовательностей означает, что 80% аминокислот в двух оптимально выравниваемых полипептидных последовательностях являются идентичными.
Термин «по существу, идентичный», используемый по отношению к двум нуклеиновым кислотам или полипептидам, относится к полинуклеотидам или полипептидам, имеющим последовательность, которая по меньшей мере на 70%, предпочтительно, по меньшей мере на 75%, предпочтительно, по меньшей мере на 80%, предпочтительно, по меньшей мере на 85%, предпочтительно, по меньшей мере на 90%, предпочтительно, по меньшей мере на 95%, предпочтительно, по меньшей мере на 97%, предпочтительно, по меньшей мере на 98% и предпочтительно, по меньшей мере на 99% идентична эталонной последовательности, как было определено с помощью программ или алгоритмов (например, BLAST, ALIGN, CLUSTAL) с использованием стандартных параметров. Одним из подтверждений, что два полипептида, по существу, идентичны друг другу, является тот факт, что первый полипептид вступает в иммунную перекрестную реакцию со вторым полипептидом. Обычно, полипептиды, которые отличаются по своим консервативным аминокислотным заменам, вступают в перекрестную иммунную реакцию. Таким образом, полипептид является, по существу, идентичным второму полипептиду, например, если два пептида отличаются только консервативными заменами. Другим указанием на то, что две последовательности нуклеиновой кислоты, по существу, идентичны друг другу, является тот факт, что эти две молекулы гибридизуются друг с другом в жестких условиях (например, в условиях умеренно высокой жесткости).
Термин «выделенный» или «очищенный» относится к материалу, который был удален из его природного окружения (например, из его естественного окружения, если он встречается в таком окружении). Так, например, говорят, что данный материал является «очищенным», если он присутствует в конкретной композиции в более высокой или более низкой концентрации, чем в природном организме или в организме дикого типа (например, в пуэрарии), или в комбинации с компонентами, которые обычно не присутствуют после экспрессии из природного организма или организма дикого типа. Так, например, природный полинуклеотид или полипептид, присутствующий у живого животного, не является выделенным, и тот же самый полинуклеотид или полипептид, отделенный от некоторых или всех веществ, присутствующих вместе в природной системе, является выделенным. Такие полинуклеотиды могут быть частью вектора, и/или такие полинуклеотиды или полипептиды могут быть частью композиции, и кроме того, они могут быть изолированными, то есть такой вектор или такая композиция не являются частью своего природного окружения. В предпочтительных вариантах осуществления изобретения нуклеиновая кислота или белок считаются, например, очищенными, если они дают, по существу, одну полосу в электрофоретическом геле или блоте.
Термин «выделенный», если он используется по отношению к последовательности ДНК, относится к последовательности ДНК, которая была удалена из ее природной генетической среды и поэтому не содержит других чужеродных или нежелательных кодирующих последовательностей, и присутствует в форме, подходящей для применения в генетически сконструированных системах продуцирования белка. Аналогичным образом, термин «выделенный», если он используется по отношению к последовательности рекомбинантной ДНК, относится к последовательности ДНК, которая была удалена из генетической среды организма-хозяина, и поэтому она не содержит других побочных или нежелательных кодирующих последовательностей (например, вектора, экспрессирующего IspS пуэрарии и реплицирующегося в E. coli). Такими выделенными молекулами являются молекулы, отделенные от их природного окружения, которые включают кДНК и геномные клоны. Выделенные молекулы ДНК согласно изобретению не содержат других генов, с которыми они обычно ассоциируются в природе, но они могут включать природные 5' и 3' нетранслируемые области, такие как промоторы и терминаторы. Идентификация ассоциированных областей известна специалисту в данной области (см. например, Dynan and Tijan, Nature 316:774-78, 1985). Термин «выделенная последовательность ДНК», альтернативно, называется «клонированной последовательностью ДНК».
Термин «выделенный», если он относится к белку, означает, что белок находится в условиях, отличающихся от условий его природной окружающей среды. В своей предпочтительной форме, выделенный белок, по существу, не содержит других белков и, в частности, других гомологичных белков. Аналогичным образом, термин «выделенный», если он используется по отношению к рекомбинантно продуцируемому белку, относится к белку, который был удален из белковой среды организма-хозяина, и поэтому он не содержит других побочных или нежелательных белков кодирующих (например, рекомбинантного IspS пуэрарии волосистой, продуцируемого в E. coli). Выделенный белок имеет чистоту более чем 10%, предпочтительно, более чем 20%, и еще более предпочтительно, более чем 30%, как определено с помощью электрофореза в ДСН-ПААГ. Другие аспекты изобретения включают белок с высокой степенью чистоты (то есть, более чем 40%, более чем 60%, более чем 80%, более чем 90%, более чем 95%, более чем 97% и даже более чем 99%), как определено с помощью электрофореза в ДСН-ПААГ.
Для облегчения конструирования вариантов фермента согласно изобретению может быть применен описанный ниже метод кластерного мутагенеза, хотя могут быть применены и другие способы. Как описано в настоящем описании, сначала получают природный ген, кодирующий фермент, а затем его секвенируют полностью или частично. Затем последовательность сканируют для определения положения, в которое желательно введение мутации (делеции, инсерции или замены) одной или более аминокислот в кодируемом ферменте. Последовательности, фланкирующие такое положение, оценивают на присутствие рестрикционных сайтов, подходящих для замены короткого сегмента гена олигонуклеотидным пулом, который, при его экспрессии, будет кодировать различные мутанты. Такими рестрикционными сайтами, предпочтительно, являются уникальные сайты в гене белка, которые облегчают замену генного сегмента. Однако может быть использован любой подходящий рестрикционный сайт, который не является чрезмерно избыточным в гене данного фермента, при условии, что генные фрагменты, полученные посредством гидролиза рестриктирующими ферментами, могут быть подвергнуты повторной сборке с получением «правильной» последовательности. Если рестрикционные сайты отсутствуют в положениях, расположенных на подходящем расстоянии от выбранного положения (от 10 до 15 нуклеотидов), то такие сайты получают путем замены нуклеотидов в гене таким способом, при котором в конечной конструкции не изменяются ни рамка считывания, ни кодируемые аминокислоты. Если мутацию гена проводят в целях изменения его последовательности, то подтверждение нужной последовательности осуществляют путем удлинения праймера М13 в соответствии с общеизвестными способами. Задача определения локализации подходящих фланкирующих областей и выявления необходимых модификаций для получения двух подходящих последовательностей рестрикционных сайтов была решена рутинным способом, основанным на избыточности генетического кода, получения рестрикционной карты гена и большого числа различных рестриктирующих ферментов. Следует отметить, что если стандартный фланкирующий рестрикционный сайт является доступным, то вышеописанный способ должен быть применен только к фланкирующей области, не содержащей какого-либо сайта.
После клонирования природной ДНК и/или синтезированной ДНК, рестрикционные сайты, фланкирующие положения, подвергаемые мутации, гидролизуют когнатными рестриктирующими ферментами, и множество комплементарных по концам олигонуклеотидных кластеров лигируют в ген. Благодаря этому способу, мутагенез может быть упрощен, поскольку все олигонуклеотиды могут быть синтезированы таким образом, чтобы они имели одни и те же рестрикционные сайты, и для создания рестрикционных сайтов не требуется присутствия синтетических линкеров.
Используемый в данном описании термин «соответствующий» относится к остатку, присутствующему в пронумерованном положении белка или пептида, или к остатку, который является аналогичным, гомологичным или эквивалентным пронумерованному остатку в белке или пептиде. Используемый в данном описании термин «соответствующая область», в основном, относится к аналогичному положению на всей последовательности родственных белков или родительского белка.
Используемый в данном описании термин «комбинаторный мутагенез» относится к способам получения библиотек вариантов исходной последовательности. В этих библиотеках варианты содержат одну или несколько мутаций, выбранных из предварительно определенной серии мутаций. Кроме того, такие способы позволяют вводить неспецифические мутации, которые не являются членами предварительно определенной серии мутаций. В некоторых вариантах осуществления изобретения указанными способами являются способы, описанные в заявке на патент США 09/699250, поданной 26 октября 2000, которая включена в настоящее описание посредством ссылки. В альтернативных вариантах осуществления изобретения способы комбинаторного мутагенеза осуществляют с помощью коммерчески доступных наборов (например, QUIKCHANGE® Multisite, Stratagene, San Diego, CA).
Используемый в данном описании термин «библиотека мутантов» относится к популяции клеток, которые являются идентичными в большей части своего генома, но включают различные гомологи одного или нескольких генов. Такие библиотеки могут быть использованы, например, для идентификации генов или оперонов с улучшенными свойствами.
Используемые в данном описании термины «исходный ген» и «родительский ген» означают представляющий интерес ген, который кодирует представляющий интерес белок с улучшенными и/или измененными свойствами согласно изобретению.
Используемые в данном описании термины «выравнивание множества последовательностей» и «ВМП» относятся к последовательностям множества гомологов исходного гена, выравнивание которых проводят с помощью алгоритма (например, Clustal W).
Используемые в данном описании термины «консенсусная последовательность» и «каноническая последовательность» означают архетипическую аминокислотную последовательность, с которой сравнивают все варианты конкретного представляющего интерес белка или конкретной представляющей интерес последовательности. Эти термины также означают последовательность, имеющую нуклеотиды, которые наиболее часто встречаются в представляющей интерес последовательности ДНК. Для каждого положения гена, консенсусная последовательность дает аминокислоту, которая наиболее часто встречается в этом положении при ВМП.
Используемый в данном описании термин «консенсусная мутация» относится к различию в последовательности исходного гена и консенсусной последовательности. Консенсусные мутации идентифицируют путем сравнения последовательностей исходного гена и консенсусной последовательности, полученной в результате ВМП. В некоторых вариантах осуществления изобретения консенсусные мутации вводят в исходный ген таким образом, чтобы он был более сходным с консенсусной последовательностью. Консенсусными мутациями также являются аминокислотные замены, которые заменяют аминокислоту в исходном гене на аминокислоту, которая более часто встречается при ВМП в этом положении, чем аминокислота в исходном гене. Таким образом, термин «консенсусная мутация» включает все замены одной аминокислоты, которые позволяют заменить аминокислоту исходного гена аминокислотой, которая встречается более часто, чем аминокислота при ВМП.
Термины «модифицированная последовательность» и «модифицированные гены» являются взаимозаменяемыми и означают последовательность, которая включает делецию, инсерцию или разрыв последовательности природной нуклеиновой кислоты. В некоторых предпочтительных вариантах осуществления изобретения продукт экспрессии модифицированной последовательности представляет собой усеченный белок (например, если указанной модификацией является делеция или разрыв последовательности). В некоторых особенно предпочтительных вариантах осуществления изобретения усеченный белок сохраняет биологическую активность. В альтернативных вариантах осуществления изобретения продуктом экспрессии модифицированной последовательности является удлиненный белок (например, модификации, содержащие вставку в последовательность нуклеиновой кислоты). В некоторых вариантах осуществления изобретения такая инсерция приводит к образованию усеченного белка (например, если инсерция приводит к образованию стоп-кодона). Таким образом, инсерция может приводить к образованию либо усеченного белка, либо удлиненного белка в качестве продукта экспрессии.
Используемые в данном описании термины «мутантная последовательность» и «мутантный ген» являются взаимозаменяемыми и означают последовательность, которая имеет модификацию по меньшей мере в одном кодоне, присутствующую в последовательности дикого типа клетки-хозяина. Продуктом экспрессии мутантной последовательности является белок, имеющий модифицированную аминокислотную последовательность, по сравнению с последовательностью дикого типа. Продукт экспрессии может обладать модифицированной функциональной активностью (например, повышенной ферментативной активностью).
Термины «мутагенный праймер» или «мутагенный олигонуклеотид» (в настоящем описании эти термины являются взаимозаменяемыми) означают олигонуклеотидные композиции, которые соответствуют части последовательности-матрицы и обладают способностью гибридизоваться с этой последовательностью. Что касается мутагенных праймеров, то такие праймеры не имеют точного соответствия с матричной нуклеиновой кислотой, где такое несоответствие или такие несоответствия в праймере используются для введения нужной мутации в библиотеку нуклеиновых кислот. Используемый в данном описании термин «немутагенный праймер» или «немутагенный олигонуклеотид» означает олигонуклеотидные композиции, которые точно соответствуют матричной нуклеиновой кислоте. В одном из вариантов изобретения используются только мутагенные праймеры. В другом предпочтительном варианте осуществления изобретения праймеры конструируют таким образом, чтобы по меньшей мере в одной области, в которую включен мутагенный праймер, также присутствовал немутагенный праймер, включенный в олигонуклеотидную смесь. Путем добавления смеси мутагенных праймеров и немутагенных праймеров, соответствующих по меньшей мере одному из мутагенных праймеров, можно получить библиотеку нуклеиновых кислот, в которой присутствует ряд комбинаторных мутационных паттернов. Так, например, если желательно, чтобы некоторые члены библиотеки мутантных нуклеиновых кислот сохраняли свою родительскую последовательность в некоторых положениях, а другие члены были мутантными в таких сайтах, то могут быть получены немутагенные праймеры, обладающие способностью обеспечивать конкретный уровень немутантных членов в библиотеке нуклеиновых кислот для данного остатка. В способах согласно изобретению используются мутагенные и немутагенные олигонуклеотиды, которые обычно имеют длину 10-50 оснований, и более предпочтительно, примерно 15-45 оснований. Однако для достижения желаемого результата мутагенеза может оказаться необходимым использование праймеров, которые имеют длину менее чем 10 оснований или более чем 50 оснований. Что касается соответствующих мутагенных и немутагенных праймеров, то необязательно, чтобы соответствующие олигонуклеотиды имели одну и ту же длину, при условии, если они перекрываются только в области, соответствующей вводимой мутации.
Праймеры могут быть добавлены в отношении, предварительно определенном в соответствии с настоящим изобретением. Так, например, если желательно, чтобы полученная библиотека имела значительный уровень некоторых специфических мутаций и меньшее количество других мутаций в одном и том же сайте или в различных сайтах, то путем коррекции количества добавляемых праймеров можно получить библиотеку с желаемыми несоответствиями. Альтернативно, путем добавления меньшего или большего количества немутагенных праймеров можно скорректировать частоту, с которой соответствующая(ие) мутация(и) будет(ут) продуцироваться в библиотеке мутантных нуклеиновых кислот.
Используемые в данном описании термины «последовательность дикого типа» или «ген дикого типа» являются взаимозаменяемыми и означают последовательность, которая является нативной или присутствует в природе в клетке-хозяине. В некоторых вариантах осуществления изобретения последовательность дикого типа означает представляющую интерес последовательность, которая является исходной точкой для осуществления проекта конструирования белков. Последовательность дикого типа может кодировать гомологичный или гетерологичный белок. Гомологичным белком является белок, который продуцируется клеткой-хозяином без какого-либо вмешательства. Гетерологичным белком является белок, который не продуцируется клеткой-хозяином, и такое продуцирование может быть достигнуто искусственным путем.
Используемый в данном описании термин «лизат» означает раствор, содержащий компоненты лизированных клеток. В некоторых вариантах осуществления изобретения таким лизатом является лизат бактериальных клеток (например, клеток E. coli, лизированных с использованием раствора лизоцима READYLYSE™ от Epicentre; или клеток E. coli, лизированных в камере Френч-пресса).
Используемый в данном описании термин «лизоцим» означает гликозидазу, которая гидролизует связь между N-ацетилмурамовой кислотой и N-ацетилглюкозамином, что приводит к расщеплению нужного полимера в клеточной стенке многих бактерий. Подходящими лизоцимами, используемыми в настоящем изобретении, являются, но не ограничиваются ими, лизоцим белка куриных яиц (Sigma), лизоцим T4, рекомбинантный лизоцим, не происходящий от млекопитающих и птиц (READYLYSE™), или лизоцим грибов.
Используемый в данном описании термин «хэдспейс» («верхнее пространство») означает смесь пара/воздуха, образующуюся поверх твердого или жидкого образца в герметично закрытом сосуде.
Используемые в данном описании термины «высокоэффективный скрининг» и «ВЭС» означают измерение уровней изопрена по меньшей мере в 96 образцах в течение 4 часов или менее. В предпочтительных вариантах осуществления изобретения объем образца составляет менее чем 2 мл.
Если не указано иное, то все уровни компонентов или композиций относятся к уровням активного компонента или композиции, за исключением примесей, например, остаточных растворителей или побочных продуктов, которые могут присутствовать в коммерчески доступных источниках.
Молекулярные массы ферментных компонентов определяют исходя из массы общего активного белка. Все проценты и отношения приводятся по массе, если не указано иное. Все проценты и отношения были вычислены исходя из общего состава, если не указано иное.
Подробное описание изобретения
Изопреновый мономер используется в производстве полиизопрена и различных сополимеров (изобутилена, бутадиена, стирола или других мономеров). Для создания штамма (прокариотического или эукариотического), способного продуцировать коммерчески доступные уровни изопрена, необходима оптимизация всего пути, либо превращения MVA в изопрен, либо превращения DXP в изопрен. Ключевым ферментом такого пути является изопренсинтаза (IspS), которая превращает предшественника DMAPP в изопрен. В настоящее время идентифицированы только изопренсинтазы (IspS), полученные из таких растений, как тополь, английский дуб и пуэрария лопастная. Хотя некоторые бактерии, такие как Bacillus subtilis, также продуцируют изопрен, однако, прокариотический IspS еще не был идентифицирован, а активность нативного IspS в Bacillus является недостаточной для промышленного применения. Идентифицированные в настоящее время растительные ферменты IspS были частично охарактеризованы отчасти по экспрессии в E. coli, и некоторые кинетические параметры этих ферментов были определены in vitro с использованием очищенного белка. Однако информация о кинетических параметрах (Km, скорость и т.п.) нативных ферментов IspS является недостаточной для промышленного производства изопрена в биологическом хозяине.
Для решения этой задачи, как описано в данном описании, экспрессию растительного IspS осуществляли в бактериальном хозяине. Кроме того, был сконструирован IspS, нужные свойства которого были изменены. Характеризацию IspS дикого типа и мутантного IspS осуществляют различными способами или путем проведения подходящего «теста», предпочтительно, исходя из оценки представляющих интерес свойств. Такими, представляющими интерес свойствами, но, не ограничиваясь ими, являются оптимальный pH, термостабильность (например, величина Tm), внутриклеточная и внеклеточная растворимость, величина Km, величина kcat или удельная активность, а также чувствительность к потенциальным ингибиторам, включая ингибирование субстрата или продукта. Также представляет интерес устойчивость к окислению и протеолизу. Кроме того, представляет интерес активация или ингибирование, обусловленное действием ионов металла и ионной силой. Такие свойства и параметры могут быть оценены путем превращения DMAPP в изопрен in vitro с использованием очищенной или частично очищенной изопренсинтазы или in vivo в среде организма-хозяина, такого как E. coli, экспрессирующие белки пути DXP, пути MVA или того и другого. Считается, что ферменты, имеющие различные степени стабильности, растворимости, активности и/или уровни экспрессии в одном или нескольких условиях проведения теста, могут быть использованы в настоящем изобретении для продуцирования изопрена в широком круге хозяев. Высокоэффективные способы, такие как способы, описанные в примере 10, необходимы для исследования указанных свойств в целях осуществления экономически выгодного производства.
Настоящее изобретение относится к композициям и способам продуцирования изопрена в больших количествах. В частности, указанные композиции и способы позволяют увеличивать скорость производства изопрена и увеличивать общее количество продуцируемого изопрена. Описанные в данном описании способы биосинтетического продуцирования изопрена представляют собой желаемую альтернативу использованию природного каучука. Как подробно обсуждается ниже, количество изопрена, продуцируемого клетками, может быть значительно увеличено путем введения гетерологичной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы (IspS), в клетки. Полипептиды изопренсинтазы превращают диметилаллилдифосфат (DMAPP) в изопрен. Как показано в примерах, гетерологичный полипептид изопренсинтазы Pueraria montana (пуэрарии волосистой) и его варианты были экспрессированы в клетках грамотрицательных бактерий (например, в Escherichia coli). Как показано в примерах, в объем настоящего изобретения также входят полипептид изопренсинтазы тополя и его варианты, которые были экспрессированы в клетках грамотрицательных бактерий (например, в Escherichia coli).
Гетерологичная экспрессия растительного IspS в бактериальных клетках-хозяевах приводит к продуцированию большего количества изопрена, чем это происходит в соответствующих клетках, не содержащих растительного IspS.
Было показано, что мутация аминокислотных остатков на поверхности протеазных ферментов может повышать их активность, экспрессию и стабильность (WO2008/153925, WO2008/153934, WO2008/153935). Авторами настоящего изобретения было неожиданно обнаружено, что мутация аминокислотных остатков на поверхности абсолютно другого фермента, изопренсинтазы, может приводить к повышению ее экспрессии, растворимости и активности. Примером такой эффективной поверхностной мутации является L70R.
Определение трехмерной структуры фермента является важным условием для точной идентификации аминокислотных остатков на его поверхности. Моделирование гомологии с использованием структур, последовательности которых приблизительно на 40% идентичны последовательностям изопренсинтазы (например, борнилсинтазы и лимоненсинтазы, то есть, ферментов, которые, как известно, имеют структуру, наиболее идентичную структуре изопренсинтазы), позволит выявить основные аспекты моделированной структуры фермента, однако, оно является недостаточным для точной идентификации поверхностных остатков и количественной оценки степени их доступности на поверхности. Доступность аминокислотного остатка на поверхности количественно оценивают путем определения процента доступной для растворителя площади поверхности боковой цепи фермента.
Мутации нижеследующих классов, присутствующие в изопренсинтазе, могут улучшать растворимость фермента путем нацеливания на аминокислотные остатки, которые более чем на 50%, предпочтительно >65% и наиболее предпочтительно >85% доступны для растворителя, а именно:
Гидрофобные → положительно заряженные и наоборот
Гидрофобные → отрицательно заряженные и наоборот
Гидрофобные → нейтральные полярные и наоборот
Нейтральные полярные → положительно заряженные и наоборот
Нейтральные полярные → отрицательно заряженные и наоборот
Положительно заряженные → отрицательно заряженные и наоборот.
Кроме того, продуцирование изопрена клетками, содержащими гетерологичную нуклеиновую кислоту изопренсинтазы, может быть усилено путем увеличения количества полипептида 1-дезокси-D-ксилулозо-5-фосфатсинтазы (DXS) и/или полипептида изопентенилдифосфатизомеразы (IDI), экспрессируемого клетками. Так, например, в клетки могут быть введены нуклеиновая кислота, кодирующая DXS, и/или нуклеиновая кислота, кодирующая IDI. Нуклеиновой кислотой, кодирующей DXS, может быть гетерологичная нуклеиновая кислота или дуплицированная копия эндогенной нуклеиновой кислоты. Аналогичным образом, нуклеиновой кислотой, кодирующей IDI, может быть гетерологичная нуклеиновая кислота или дуплицированная копия эндогенной нуклеиновой кислоты. В некоторых вариантах осуществления изобретения количество полипептида DXS и/или IDI повышают путем замены эндогенных промоторов или регуляторных областей DXS и/или IDI другими промоторами и/или регуляторными областями, которые повышают уровень транскрипции нуклеиновых кислот, кодирующих DXS и/или IDI. В некоторых вариантах осуществления изобретения клетки содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы (например, нуклеиновую кислоту растительной изопренсинтазы) и дуплицированную копию эндогенной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы.
Кодируемые полипептиды DXS и IDI представляют собой часть пути DXP для биосинтеза изопрена (фиг.15). Полипептиды DXS превращают пируват и D-глицеральдегид-3-фосфат в 1-дезокси-D-ксилулозо-5-фосфат. Не ограничиваясь какой-либо конкретной теорией, следует отметить, что с увеличением количества полипептида DXS возрастает поток углерода по пути DXP, что приводит к повышению уровня продуцирования изопрена. Полипептиды IDI катализируют взаимное превращение изопентенилдифосфата (IPP) и диметилаллилдифосфата (DMAPP). Не ограничиваясь какой-либо конкретной теорией, следует также отметить, что с увеличением количества полипептида IDI в клетках возрастает количество IPP, который превращается в DMAPP, что, в свою очередь, приводит к превращению в изопрен.
В некоторых вариантах осуществления изобретения продуцирование изопрена клетками, содержащими гетерологичную нуклеиновую кислоту, кодирующую изопренсинтазу, может быть повышено путем увеличения уровня экспрессии полипептида MVA в клетках (фиг.15). Репрезентативными полипептидами путей MVA являются любые из нижеследующих полипептидов, таких как: полипептиды ацетил-CoA ацетилтрансферазы (AA-CoA-тиолазы), полипептиды 3-гидрокси-3-метилглутарил-CoA-синтазы (HMG-CoA-синтазы), полипептиды 3-гидрокси-3-метилглутарил-CoA-редуктазы (HMG-CoA-редуктазы), полипептиды мевалонаткиназы (MVK), полипептиды фосфомевалонаткиназы (PMK), полипептиды дифосфомевалонатдекарбоксилазы (MVD), полипептиды IDI и полипептиды (например, гибридные полипептиды), обладающие активностью двух или более полипептидов пути MVA. Так, например, в клетки может быть введена одна или несколько нуклеиновых кислот, кодирующих полипептиды пути MVA. В некоторых вариантах осуществления изобретения клетки содержат нуклеиновые кислоты, кодирующие полипептиды верхнего пути MVA, которые включают нуклеиновые кислоты, кодирующие AA-CoA-тиолазу, HMG-CoA-синтазу и HMG-CoA-редуктазу. В некоторых вариантах осуществления изобретения клетки содержат нуклеиновые кислоты, кодирующие полипептиды нижнего пути MVA, которые включают нуклеиновые кислоты MVK, PMK, MVD и IDI. В некоторых вариантах осуществления изобретения клетки содержат нуклеиновые кислоты, кодирующие полипептиды полного пути MVA, где указанными нуклеиновыми кислотами являются нуклеиновые кислоты AA-CoA-тиолазы, HMG-CoA-синтазы, HMG-CoA-редуктазы, MVK, PMK, MVD и IDI. Нуклеиновыми кислотами пути MVA могут быть гетерологичные нуклеиновые кислоты или дуплицированные копии эндогенных нуклеиновых кислот. В некоторых вариантах осуществления изобретения количество одного или нескольких полипептидов пути MVA повышают путем замены эндогенных промоторов или регуляторных областей нуклеиновых кислот пути MVA другими промоторами и/или регуляторными областями, которые повышают уровень транскрипции нуклеиновых кислот пути MVA. В некоторых вариантах осуществления изобретения клетки содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы (например, нуклеиновую кислоту растительной изопренсинтазы) и дуплицированную копию эндогенной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы.
В некоторых вариантах осуществления изобретения по меньшей мере часть клеток сохраняет гетерологичную нуклеиновую кислоту изопренсинтазы, DXS, IDI и/или пути MVA по меньшей мере приблизительно за 5, 10, 20, 50, 75, 100, 200, 300 или более делений клеток в непрерывной культуре (такой как непрерывная культура без разведения). В некоторых вариантах любого из аспектов изобретения, нуклеиновая кислота, содержащая гетерологичную или дуплицированную копию эндогенной нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA, также содержит селективный маркер, такой как маркер резистентности нуклеиновой кислоты к антибиотикам, таким как канамицин, ампициллин, карбенициллин, гентамицин, гигромицин, флеомицин, блеомицин, неомицин или хлорамфеникол.
I. Репрезентативные полипептиды и нуклеиновые кислоты
В композициях и способах согласно изобретению могут быть использованы различные полипептиды изопренсинтазы, DXS, IDI и/или пути MVA и нуклеиновые кислоты, кодирующие эти полипептиды.
Используемый в данном описании термин «полипептиды» включает полипептиды, белки, пептиды, фрагменты полипептидов и гибридные полипептиды, которые включают часть первого полипептида или весь первый полипептид (например, полипептид изопренсинтазы, DXS, IDI или пути MVA) и часть второго полипептида или весь второй полипептид (например, пептид, который облегчает очистку или детектирование гибридного полипептида, такой как His-метка). В некоторых вариантах осуществления изобретения гибридный полипептид обладает активностью двух или более полипептидов пути MVA (таких как полипептиды AA-CoA-тиолазы и HMG-CoA-редуктазы). В некоторых вариантах осуществления изобретения указанным полипептидом является природный полипептид (такой как полипептид, кодируемый нуклеиновой кислотой mvaE Enterococcus faecalis), который обладает активностью двух или более полипептидов пути MVA.
В различных вариантах осуществления изобретения полипептид имеет по меньшей мере или примерно 50, 100, 150, 175, 200, 250, 300, 350, 400 или более аминокислот. В некоторых вариантах осуществления изобретения полипептидный фрагмент содержит по меньшей мере или примерно 25, 50, 75, 100, 150, 200, 300 или более смежных аминокислот, полученных из полноразмерного полипептида, и обладает активностью, которая составляет по меньшей мере или примерно 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100% от активности соответствующего полноразмерного полипептида. В конкретных вариантах осуществления изобретения указанный полипептид включает сегмент аминокислотной последовательности или всю аминокислотную последовательность любого природного полипептида изопренсинтазы, DXS, IDI или пути MVA. В некоторых вариантах осуществления изобретения указанный полипептид, по сравнению с последовательностью полипептида изопренсинтазы, DXS, IDI или пути MVA дикого типа (то есть, с природной последовательностью), имеет одну или несколько мутаций.
В некоторых вариантах осуществления изобретения указанным полипептидом является выделенный полипептид. Используемый в данном случае «выделенный полипептид» не является частью библиотеки полипептидов, такой как библиотека из 2, 5, 10, 20, 50 или более различных полипептидов, и отделен по меньшей мере от одного компонента, с которым он встречается в природе. Выделенный полипептид может быть получен, например, путем экспрессии рекомбинантной нуклеиновой кислоты, кодирующей полипептид.
В некоторых вариантах осуществления изобретения указанным полипептидом является гетерологичный полипептид. Термин «гетерологичный полипептид» означает полипептид, аминокислотная последовательность которого не идентична аминокислотной последовательности другого полипептида, обычно экспрессируемого той же самой клеткой-хозяином.
Используемый в данном описании термин «нуклеиновая кислота» означает два или более дезоксирибонуклеотидов и/или рибонуклеотидов, присутствующих в одноцепочечной или двухцепочечной форме. В некоторых вариантах осуществления изобретения нуклеиновой кислотой является рекомбинантная нуклеиновая кислота. Термин «рекомбинантная нуклеиновая кислота» означает представляющую интерес нуклеиновую кислоту, которая не содержит одну или несколько нуклеиновых кислот (например, генов), присутствующих в геноме природного организма, от которого происходит представляющая интерес нуклеиновая кислота, и фланкирующих представляющую интерес нуклеиновую кислоту. Поэтому этот термин включает, например, рекомбинантную ДНК, которая встроена в вектор, в автономно реплицирующуюся плазмиду или вирус, или в геномную ДНК прокариота или эукариота, или которая существует как отдельная молекула (например, кДНК, фрагмент геномной ДНК или фрагмент кДНК, продуцируемые с помощью ПЦР или путем гидролиза рестриктирующей эндонуклеазой), не связанная с другими последовательностями.
В различных вариантах осуществления изобретения указанной нуклеиновой кислотой является рекомбинантная нуклеиновая кислота. Так, например, в некоторых вариантах осуществления изобретения нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA функционально присоединена к другой нуклеиновой кислоте, кодирующей другой полноразмерный полипептид или его часть таким образом, что в результате, указанная рекомбинантная нуклеиновая кислота кодирует гибридный полипептид, который включает полипептид изопренсинтазы, DXS, IDI или пути MVA, и другой полноразмерный полипептид или его часть (например, пептид, облегчающий очистку или детектирование гибридного полипептида, такой как His-метка). В некоторых вариантах осуществления изобретения часть рекомбинантной нуклеиновой кислоты или полноразмерная рекомбинантная нуклеиновая кислота являются химически синтезированными. В некоторых вариантах осуществления изобретения указанной нуклеиновой кислотой является гетерологичная нуклеиновая кислота. Термин «гетерологичная нуклеиновая кислота» означает нуклеиновую кислоту, последовательность которой не идентична последовательности другой нуклеиновой кислоты, обычно присутствующей в той же самой клетке-хозяине.
В конкретных вариантах осуществления изобретения нуклеиновая кислота включает сегмент последовательности или полноразмерную последовательность любой природной нуклеиновой кислоты изопренсинтазы, DXS, IDI или пути MVA. В некоторых вариантах осуществления изобретения нуклеиновая кислота включает по меньшей мере или примерно 50, 100, 150, 200, 300, 400, 500, 600, 700, 800 или более смежных нуклеотидов, полученных из природной нуклеиновой кислоты изопренсинтазы, DXS, IDI или пути MVA. В некоторых вариантах осуществления изобретения нуклеиновая кислота, в отличие от последовательности нуклеиновой кислоты изопренсинтазы, DXS, IDI или пути MVA дикого типа (то есть, природной последовательности), имеет одну или несколько мутаций. В некоторых вариантах осуществления изобретения нуклеиновая кислота имеет одну или несколько мутаций (например, молчащих мутаций), которые способствуют повышению уровня транскрипции или трансляции нуклеиновой кислоты изопренсинтазы, DXS, IDI или пути MVA. В некоторых вариантах осуществления изобретения указанной нуклеиновой кислотой является вырожденный вариант любой нуклеиновой кислоты, кодирующей полипептид изопренсинтазы, DXS, IDI или пути MVA.
Термин «вырожденность кодона» означает расхождение в генетическом коде, приводящее к изменению нуклеотидной последовательности, но не влияющее на аминокислотную последовательность кодируемого полипептида. Специалисту в данной области хорошо известно о «смещении кодонов», наблюдаемом в конкретных клетках-хозяевах, в которых используются нуклеотидные кодоны, специфичные для данной аминокислоты. Поэтому, в некоторых вариантах осуществления изобретения при синтезе нуклеиновой кислоты, осуществляемом в целях улучшения экспрессии в клетке-хозяине, желательно сконструировать такую нуклеиновую кислоту, в которой частота встречаемости кодонов будет приближаться к частоте встречаемости предпочтительных кодонов в клетке-хозяине.
Регистрационные номера репрезентативных полипептидов изопренсинтазы, DXS, IDI, и/или пути MVA и кодирующих их нуклеиновых кислот перечислены в приложении 1 заявки США № 61/013574, которая во всей своей полноте включена в настоящее описание посредством ссылки, и в частности, в разделе, относящемся к аминокислотным последовательностям и нуклеотидным последовательностям полипептидов изопренсинтазы, DXS, IDI, и/или пути MVA. База данных Kegg также содержит аминокислотные и нуклеотидные последовательности различных репрезентативных полипептидов изопренсинтазы, DXS, IDI, и/или MVA (см., например, сайт в Интернете «genome.jp/kegg/pathway/map/map00100.html» и имеющиеся там последовательности, которые во всей своей полноте включены в настоящее описание посредством ссылки, и в частности, аминокислотные последовательности и нуклеотидные последовательности полипептидов изопренсинтазы, DXS, IDI и/или пути MVA). В некоторых вариантах осуществления изобретения один или несколько полипептидов изопренсинтазы, DXS, IDI и/или пути MVA и/или кодирующих их нуклеиновых кислот имеют последовательности, идентичные последовательностям, имеющимся в базе данных, которая стала общедоступной 12 декабря 2007, например, любые последовательности, соответствующие последовательностям, имеющим любой из регистрационных номеров в приложении 1 заявки США No 61/013574, или любые последовательности, представленные в базе данных Kegg на день подачи данной заявки. Другие репрезентативные полипептиды изопренсинтазы, DXS, IDI и/или пути MVA и кодирующие их нуклеиновые кислоты более подробно описаны ниже.
Репрезентативные полипептиды и нуклеиновые кислоты изопренсинтазы
Как указывалось выше, полипептиды изопренсинтазы превращают диметилаллилдифосфат (DMAPP) в изопрен. Репрезентативными полипептидами изопренсинтазы являются полипептиды, фрагменты полипептидов, пептиды и гибридные полипептиды, обладающие по меньшей мере одной активностью полипептида изопренсинтазы. Для того чтобы определить, обладает ли полипептид активностью полипептида изопренсинтазы, могут быть использованы стандартные способы, путем оценки способности полипептида превращать DMAPP в изопрен in vitro, в клеточном экстракте или in vivo. Активность полипептида изопренсинтазы в клеточном экстракте может быть определена, например, как описано в публикации Silver et al., J. Biol. Chem. 270:13010-13016, 1995 и цитируемых там ссылках, каждая из которых во всей своей полноте включена в настоящее описание посредством ссылки, в частности, ее разделы, которые относятся к анализам на активность полипептида изопренсинтазы. DMAPP (Sigma) выпаривают досуха в токе азота и подвергают регидратации до концентрации 100 мМ в 100 мМ фосфатно-калиевого буфера, pH 8,2, и затем помещают на хранение при -20°С. Для проведения этого анализа, раствор 5 мкл 1M MgCl2, 1 мМ (250 мкг/мл) DMAPP, 65 мкл буфера с растительным экстрактом (PEB) (50 мМ трис-HCl, pH 8,0, 20 мМ MgCl2, 5% глицерина и 2 мМ DTT) добавляют к 25 мкл клеточного экстракта в 20-миллилитровом сосуде, имеющем зону «хэдспейс» и снабженном завинчивающейся металлической крышкой и кремниевой перегородкой с тефлоновым покрытием (Agilent Technologies), и культивируют при 37°С в течение 15 минут при встряхивании. Затем реакцию гасят добавлением 200 мкл 250 мМ EDTA или путем термоинактивации, после чего определяют количество изопрена с помощью ГХ/МС.
Репрезентативными нуклеиновыми кислотами изопренсинтазы являются нуклеиновые кислоты, кодирующие полипептид, фрагмент полипептида, пептид и гибридный полипептид, обладающий по меньшей мере одной активностью полипептида изопренсинтазы. Репрезентативными полипептидами и нуклеиновыми кислотами изопренсинтазы являются природные полипептиды и нуклеиновые кислоты, полученные из любого из описанных в данном описании организмов-источников, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любого из описанных в данном описании организмов-источников.
В некоторых вариантах осуществления изобретения полипептид или нуклеиновая кислота изопренсинтазы получена из семейства Fabaceae, семейства Salicaceae или семейства Fagaceae. В некоторых вариантах осуществления изобретения полипептидом или нуклеиновой кислотой изопренсинтазы являются природный полипептид или природная нуклеиновая кислота, полученные из Pueraria montana (пуэрарии волосистой) (Sharkey et al, Plant Physiology 137: 700-712, 2005), тополя (такого как Populus alba x tremula CAC35696) (Miller et al, Planta 213: 483-487, 2001), осины (такой как Populus tremuloides) (Silver et al, JBC 270(22): 13010-1316, 1995) или английского дуба (Quercus robur) (Zimmer et al, WO 98/02550), где указанные публикации во всей своей полноте включены в настоящее описание посредством ссылки, и в частности, их разделы, относящиеся к нуклеиновым кислотам изопренсинтазы и к экспрессии полипептидов изопренсинтазы. Подходящими изопренсинтазами являются, но не ограничиваются ими, изопренсинтазы, идентифицированные в базе данных GenBank под регистрационными номерами AY341431, AY316691, AY279379, AJ457070 и AY182241, которые во всей своей полноте включены в настоящее описание посредством ссылки, в частности их разделы, относящиеся к последовательностям нуклеиновых кислот и полипептидов изопренсинтазы. В некоторых вариантах осуществления изобретения полипептидом или нуклеиновой кислотой изопренсинтазы не является природный полипептид или природная нуклеиновая кислота, полученные из Quercus robur (то есть, указанным полипептидом или указанной нуклеиновой кислотой изопренсинтазы являются полипептид или нуклеиновая кислота изопренсинтазы, отличающиеся от природного полипептида или природной нуклеиновой кислоты, полученных из Quercus robur). В некоторых вариантах осуществления изобретения нуклеиновой кислотой или полипептидом изопренсинтазы не являются природный полипептид или природная нуклеиновая кислота, полученные из тополя (такого как Populus alba x tremula CAC35696).
Репрезентативные полипептиды и нуклеиновые кислоты DXS
Как указывалось выше, полипептиды 1-дезокси-D-ксилулозо-5-фосфатсинтазы (DXS) превращают пируват и D-глицеральдегид-3-фосфат в 1-дезокси-D-ксилулозо-5-фосфат. Репрезентативными полипептидами DXS являются полипептиды, фрагменты полипептидов, пептиды и гибридные полипептиды, обладающие по меньшей мере одной активностью полипептида DXS. Для того чтобы определить, обладает ли полипептид активностью полипептида DXS, могут быть использованы стандартные способы (такие как способы, описанные в настоящем описании), путем оценки способности полипептида превращать пируват и D-глицеральдегид-3-фосфат в 1-дезокси-D-ксилулозо-5-фосфат in vitro в клеточном экстракте или in vivo. Репрезентативными нуклеиновыми кислотами DXS являются нуклеиновые кислоты, кодирующие полипептид, фрагмент полипептида, пептид и гибридный полипептид, обладающий по меньшей мере одной активностью полипептида DXS. Репрезентативными полипептидами и нуклеиновыми кислотами DXS являются природные полипептиды и нуклеиновые кислоты, полученные из любого из описанных в данном описании организмов-источников, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любого из описанных в данном описании организмов-источников.
Репрезентативные полипептиды и нуклеиновые кислоты IDI
Полипептиды изопентенилдифосфат-изомеразы (изопентенил-дифосфат-дельта-изомераза или IDI) катализируют взаимное превращение изопентенилдифосфата (IPP) и диметилаллилдифосфата (DMAPP) (например, превращение IPP в DMAPP и/или превращение DMAPP в IPP). Репрезентативными полипептидами IDI являются полипептиды, фрагменты полипептидов, пептиды и гибридные полипептиды, обладающие по меньшей мере одной активностью полипептида IDI. Для того чтобы определить, обладает ли полипептид активностью полипептида IDI, могут быть использованы стандартные способы (такие как способы, описанные в настоящем описании), путем оценки способности полипептида к превращению IPP и DMAPP друг в друга in vitro, в клеточном экстракте или in vivo. Репрезентативными нуклеиновыми кислотами IDI являются нуклеиновые кислоты, кодирующие полипептид, фрагмент полипептида, пептид или гибридный полипептид, обладающий по меньшей мере одной активностью полипептида IDI. Репрезентативными полипептидами и нуклеиновыми кислотами IDI являются природные полипептиды и нуклеиновые кислоты, полученные из любого из описанных в данном описании организмов-источников, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любого из описанных в данном описании организмов-источников.
Репрезентативные полипептиды и нуклеиновые кислоты пути MVA
Репрезентативными полипептидами пути MVA являются полипептиды ацетил-CoA-ацетилтрансферазы (AA-CoA-тиолазы), полипептиды 3-гидрокси-3-метилглутарил-CoA-синтазы (HMG-CoA-синтазы), полипептиды 3-гидрокси-3-метилглутарил-CoA-редуктазы (HMG-CoA-редуктазы), полипептиды мевалонаткиназы (MVK), полипептиды фосфомевалонаткиназы (PMK), полипептиды дифосфомевалонатдекарбоксилазы (MVD), полипептиды IDI и полипептиды (например, гибридные полипептиды), обладающие активностью двух или более полипептидов пути MVA. В частности, полипептидами пути MVA являются полипептиды, фрагменты полипептидов, пептиды и гибридные полипептиды, обладающие по меньшей мере одной активностью полипептида пути MVA. Репрезентативными нуклеиновыми кислотами пути MVA являются нуклеиновые кислоты, кодирующие полипептид, фрагмент полипептида, пептид и гибридный полипептид, обладающий по меньшей мере одной активностью полипептида пути MVA. Репрезентативными полипептидами и нуклеиновыми кислотами пути MVA являются природные полипептиды и нуклеиновые кислоты, полученные из любого из описанных в данном описании организмов-источников, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любого из описанных в данном описании организмов-источников.
В частности, полипептиды ацетил-CoA-ацетилтрансферазы (AA-CoA-тиолазы или ААСТ) превращают две молекулы ацетил-CoA в ацетоацетил-CoA. Для того чтобы определить, обладает ли полипептид активностью полипептида AA-CoA-тиолазы, могут быть использованы стандартные способы (такие как способы, описанные в настоящем описании), путем оценки способности полипептида превращать две молекулы ацетил-CoA в ацетоацетил-CoA in vitro, в клеточном экстракте или in vivo.
Полипептиды 3-гидрокси-3-метилглутарил-CoA-синтазы (HMG-CoA-синтазы или HMGS) превращают ацетоацетил-CoA в 3-гидрокси-3-метилглутарил-CoA. Для того чтобы определить, обладает ли полипептид активностью полипептида HMG-CoA-синтазы, могут быть использованы стандартные способы (такие как способы, описанные в настоящем описании), путем оценки способности полипептида превращать ацетоацетил-CoA в 3-гидрокси-3-метилглутарил-CoA in vitro, в клеточном экстракте или in vivo.
Полипептиды 3-гидрокси-3-метилглутарил-CoA-редуктазы (HMG-CoA-редуктазы или HMGR) превращают 3-гидрокси-3-метилглутарил-CoA в мевалонат. Для того чтобы определить, обладает ли полипептид активностью полипептида HMG-CoA-редуктазы, могут быть использованы стандартные способы (такие как способы, описанные в настоящем описании), путем оценки способности полипептида превращать 3-гидрокси-3-метилглутарил-CoA в мевалонат in vitro, в клеточном экстракте или in vivo.
Полипептиды мевалонат-киназы (MVK) фосфорилируют мевалонат с образованием мевалонат-5-фосфата. Для того чтобы определить, обладает ли полипептид активностью полипептида MVK, могут быть использованы стандартные способы (такие как способы, описанные в настоящем описании), путем оценки способности полипептида превращать мевалонат в мевалонат-5-фосфат in vitro, в клеточном экстракте или in vivo.
Полипептиды фосфомевалонат-киназы (PMK) фосфорилируют мевалонат-5-фосфат с образованием мевалонат-5-дифосфата. Для того чтобы определить, обладает ли полипептид активностью полипептида PMK, могут быть использованы стандартные способы (такие как способы, описанные в настоящем описании), путем оценки способности полипептида превращать мевалонат-5-фосфат в мевалонат-5-дифосфат in vitro, в клеточном экстракте или in vivo.
Полипептиды дифосфомевалонат-декарбоксилазы (MVD или DPMDC) превращают мевалонат-5-дифосфат в полипептиды изопентенил-дифосфата (IPP). Для того чтобы определить, обладает ли полипептид активностью полипептида MVD, могут быть использованы стандартные способы (такие как способы, описанные в настоящем описании), путем оценки способности полипептида превращать мевалонат-5-дифосфат в IPP in vitro, в клеточном экстракте или in vivo.
Репрезентативные способы выделения нуклеиновых кислот
Нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA могут быть выделены стандартными методами. Способы получения нужных нуклеиновых кислот из представляющего интерес организма-источника (такого как бактериальный геном) широко применяются и хорошо известны специалистам в области молекулярной биологии (см., например, заявку WO 2004/033646 и цитируемые там ссылки, которые во всей своей полноте включены в настоящее описание посредством ссылки, и в частности, разделы, относящиеся к выделению представляющих интерес нуклеиновых кислот). Так, например, если последовательность нуклеиновой кислоты является известной (такой как любая из описанных в данном описании известных нуклеиновых кислот), то подходящие геномные библиотеки могут быть созданы путем расщепления рестриктирующей эндонуклеазой и могут быть скринированы с использованием зондов, комплементарных нужной последовательности нуклеиновой кислоты. После выделения последовательности, ДНК может быть амплифицирована с применением прямых методов амплификации с использованием стандартных праймеров, например, таких как полимеразная цепная реакция (ПЦР) (патент США 4683202, который во всей своей полноте включен в настоящее описание посредством ссылки, и в частности, его раздел, относящийся к ПЦР-методам), с получением ДНК в количестве, подходящем для ее трансформации с использованием соответствующих векторов. Альтернативно, нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA (такие как любые нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA с известными нуклеотидными последовательностями) могут быть химически синтезированы стандартными способами.
Другие полипептиды и нуклеиновые кислоты изопренсинтазы, DXS, IDI или пути MVA, которые могут быть подходящими для их применения в описанных в данном описании композициях и способах, могут быть идентифицированы стандартными способами. Так, например, космидные библиотеки хромосомной ДНК организмов, которые, как известно, продуцируют изопрен, обычно конструируют в таких организмах, как E. coli, и затем скринируют на продуцирование изопрена. Другие способы получения нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA включают скрининг метагеномной библиотеки с помощью анализа (такого, как описанный в данном описании анализ в зоне «хэдспейс») или с помощью ПЦР с использованием праймеров, направленных на нуклеотиды, кодирующие последовательность из консервативных аминокислот (например, по меньшей мере 3 консервативных аминокислот). Консервативные аминокислоты могут быть идентифицированы путем выравнивания аминокислотных последовательностей известных полипептидов изопренсинтазы, DXS, IDI и/или пути MVA. Консервативные аминокислоты полипептидов изопренсинтазы могут быть идентифицированы, исходя из выровненных последовательностей известных полипептидов изопренсинтазы. Природный организм, который, как было обнаружено, продуцирует изопрен, может быть очищен стандартными методами очистки белков (хорошо известными в данной области), и затем полученный очищенный полипептид может быть секвенирован стандартными способами. Другие способы можно найти в литературе (см., например, публикации Julsing et al., Applied. Microbiol. Biotechnol. 75: 1377-84, 2007; и Withers et al., Appl Environ Microbiol. 73:6277-83, 2007, которые во всей своей полноте включены в настоящее описание посредством ссылки, и в частности, те их разделы, которые относятся к идентификации нуклеиновых кислот, участвующих в синтезе изопрена).
Кроме того, для идентификации других полипептидов и нуклеиновых кислот DXS, IDI или пути MVA могут быть использованы стандартные программы выравнивания последовательностей и/или предсказания их структуры, которые осуществляют исходя из сходства их первичных и/или предсказанных вторичных полипептидных структур со структурами известных полипептидов и нуклеиновых кислот DXS, IDI или пути MVA. Для идентификации полипептидов и нуклеиновых кислот изопренсинтазы, DXS, IDI или пути MVA могут быть также использованы стандартные базы данных, такие как база данных swissprot-trembl (сайт в Интернете «expasy.org», Швейцарского института биоинформатики Swiss-Prot group CMU-1 rue Michel Servet CH-1211 Geneva 4, Switzerland). Вторичная и/или третичная структура полипептида изопренсинтазы, DXS, IDI или пути MVA может быть предсказана с использованием параметров по умолчанию, имеющихся в стандартных программах предсказания структуры, таких как PredictProtein (Rost et al., The PredictProtein Server. Nucleic Acids Research 32(Web Server issue):W321-W326, 2004). Альтернативно, фактическая вторичная и/или третичная структура полипептида изопренсинтазы, DXS, IDI или пути MVA может быть определена стандартными способами. Дополнительные нуклеиновые кислоты изопренсинтазы, DXS, IDI или пути MVA могут быть также идентифицированы путем гибридизации с зондами, генерируемыми из известных нуклеиновых кислот изопренсинтазы, DXS, IDI или пути MVA.
Репрезентативные промоторы и векторы
Любые описанные в данном описании нуклеиновые кислоты изопренсинтазы, DXS, IDI или пути MVA могут быть включены в один или несколько векторов. В соответствии с этим, настоящее изобретение также относится к векторам, содержащим одну или несколько нуклеиновых кислот, кодирующих любой из описанных в данном описании полипептидов изопренсинтазы, DXS, IDI или пути MVA. Используемый в данном описании термин «вектор» означает конструкцию, которая способна доставлять, желательно, экспрессировать одну или несколько представляющих интерес нуклеиновых кислот в клетке-хозяине. Примерами таких векторов являются, но не ограничиваются ими, плазмиды, вирусные векторы, ДНК- или РНК-экспрессирующие векторы, космиды и фаговые векторы. В некоторых вариантах осуществления изобретения вектор содержит нуклеиновую кислоту под контролем последовательности регуляции экспрессии.
Используемый в данном описании термин «последовательность регуляции экспрессии» означает последовательность нуклеиновой кислоты, которая направляет транскрипцию представляющей интерес нуклеиновой кислоты. Последовательностью регуляции экспрессии может быть промотор, такой как конститутивный или индуцибельный промотор, или энхансер. «Индуцибельный промотор» представляет собой промотор, который является активным при соответствующей регуляции условий окружающей среды или роста. Такая последовательность регуляции экспрессии функционально присоединена к транскрибируемому сегменту нуклеиновой кислоты.
В некоторых вариантах осуществления изобретения указанный вектор содержит селективный маркер. Термин «селективный маркер» означает нуклеиновую кислоту, способную экспрессироваться в клетке-хозяине, что позволяет легко проводить отбор клеток-хозяев, содержащих введенную нуклеиновую кислоту или введенный вектор. Примерами селективных маркеров являются, но не ограничиваются ими, нуклеиновые кислоты резистентности к антибиотикам (например, к канамицину, ампициллину, карбенициллину, гентамицину, гигромицину, флеомицину, блеомицину, неомицину или хлорамфениколу) и/или нуклеиновые кислоты, сообщающие клеткам-хозяевам метаболические свойства, такие как преимущество в отношении питательных веществ. В некоторых вариантах осуществления изобретения нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA интегрируется в хромосому клеток без селективного маркера.
Подходящими векторами являются векторы, совместимые с используемыми клетками-хозяевами. Подходящие векторы могут быть получены, например, из бактерии, вируса (такого как бактериофаг T7 или фаг, происходящий от M-13), космиды, дрожжей или растения. Протоколы получения и применения таких векторов известны в данной области (см., например, руководство Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989, которое во всей своей полноте включено в настоящее описание посредством ссылки, и в частности, его раздел, относящийся к применению векторов).
Промоторы хорошо известны в данной области. Любой промотор, который функционирует в клетке-хозяине, может быть использован для экспрессии нуклеиновой кислоты изопренсинтазы, DXS, IDI или пути MVA в клетке-хозяине. Существует множество известных специалистам в данной области инициирующих экспрессию регуляторных областей или промоторов, которые могут быть использованы для запуска экспрессии нуклеиновых кислот изопренсинтазы, DXS, IDI или пути MVA в различных клетках-хозяевах (см., например, заявку WO 2004/033646 и цитируемые там ссылки, которые во всей своей полноте включены в настоящее описание посредством ссылки, в частности, работы, относящиеся к векторам, экспрессирующим представляющие интерес нуклеиновые кислоты). Фактически, в настоящем изобретении могут быть использованы любые промоторы, способные запускать экспрессию этих нуклеиновых кислот, включая, но, не ограничиваясь ими, промоторы lac, trp, λPL, λPR, T7, tac и trc (подходящие для экспрессии в E. coli).
В некоторых вариантах осуществления изобретения используется промотор глюкозоизомеразы (см., например, патент США 7132527 и цитируемые там ссылки, которые во всей своей полноте включены в настоящее описание посредством ссылки, и в частности, их разделы, относящиеся к промоторам и плазмидным системам для экспрессии представляющих интерес полипептидов). Описанные мутанты промоторов глюкозоизомеразы могут быть использованы для изменения уровней экспрессии полипептида, кодируемого нуклеиновой кислотой, функционально присоединенной к промотору глюкозоизомеразы (патент США 7132527). В различных вариантах осуществления изобретения промотор глюкозоизомеразы содержится в низкокопийных, среднекопийных или в высококопийных плазмидах (патент США 7132527).
В различных вариантах осуществления изобретения нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA содержится в низкокопийной плазмиде (например, в плазмиде, которая включает по меньшей мере примерно 4 копии на клетку), в среднекопийной плазмиде (например, в плазмиде, которая содержит примерно от 10 до 15 копий на клетку) или в высококопийной плазмиде (например, в плазмиде, которая включает примерно 50 или более копий на клетку). В некоторых вариантах осуществления изобретения гетерологичная или дополнительная эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA функционально присоединена к промотору T7. В некоторых вариантах осуществления изобретения гетерологичная или дополнительная эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA, функционально присоединенная к промотору T7, содержится в среднекопийной или в высококопийной плазмиде. В некоторых вариантах осуществления изобретения гетерологичная или дополнительная эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA функционально присоединена к промотору Trc. В некоторых вариантах осуществления изобретения гетерологичная или дополнительная эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA, функционально присоединенная к промотору Trc, содержится в среднекопийной или в высококопийной плазмиде. В некоторых вариантах осуществления изобретения гетерологичная или дополнительная эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA функционально присоединена к промотору Lac. В некоторых вариантах осуществления изобретения гетерологичная или дополнительная эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA, функционально присоединенная к промотору Lac, содержится в низкокопийной плазмиде. В некоторых вариантах осуществления изобретения гетерологичная или дополнительная эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA функционально присоединена к эндогенному промотору, такому как эндогенный промотор Escherichia, Panteoa, Bacillus, Yarrowia, Streptomyces или Trichoderma, или эндогенный промотор щелочной серинпротеазы, изопренсинтазы, DXS, IDI или пути MVA. В некоторых вариантах осуществления изобретения гетерологичная или дополнительная эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA, функционально присоединенная к эндогенному промотору, содержится в высококопийной плазмиде. В некоторых вариантах осуществления изобретения вектором является реплицирующаяся плазмида, которая не интегрируется в хромосому клеток. В некоторых вариантах осуществления изобретения часть вектора или весь вектор интегрируется в хромосому клеток.
В некоторых вариантах осуществления изобретения экспрессионный вектор дополнительно включает последовательность терминации транскрипции. Последовательности регуляции транскрипции также могут быть получены из различных генов, которые являются нативными для данной клетки-хозяина. В некоторых вариантах осуществления изобретения последовательность терминации и промоторную последовательность получают из одного и того же источника. В другом варианте осуществления изобретения последовательность терминации является эндогенной для данной клетки-хозяина.
В некоторых вариантах осуществления изобретения промотор, кодирующую область и терминатор получают из экспрессируемой нуклеиновой кислоты изопренсинтазы, DXS, IDI или пути MVA. В некоторых вариантах осуществления изобретения кодирующую область нуклеиновой кислоты изопренсинтазы, DXS, IDI или пути MVA встраивают в многоцелевой экспрессионный вектор таким образом, чтобы он находился под транскрипционным контролем последовательности экспрессионной промоторной конструкции и последовательности терминатора. В некоторых вариантах осуществления изобретения гены или их часть встраивают в область, расположенную ниже сильного промотора cbh1.
Нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA может быть встроена в вектор, такой как экспрессионный вектор, с применением стандартных способов (см. руководство Sambrook et al, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, 1982, которое во всей своей полноте включено в настоящее описание посредством ссылки, и в частности, его раздел, относящийся к скринингу соответствующих последовательностей ДНК и конструированию векторов). Способы, используемые для лигирования конструкции ДНК, содержащей представляющую интерес нуклеиновую кислоту (такую как нуклеиновая кислота изопренсинтазы, DXS, IDI или пути MVA), промотор, терминатор и другие последовательности, и для их встраивания в подходящий вектор, хорошо известны специалистам в данной области. Так, например, рестриктирующие ферменты могут быть использованы для расщепления нуклеиновой кислоты изопренсинтазы, DXS, IDI или пути MVA, и вектора. Затем, совместимые концы расщепленной нуклеиновой кислоты изопренсинтазы, DXS, IDI или пути MVA и расщепленный вектор могут быть лигированы. Связывание обычно осуществляют путем лигирования в стандартных рестрикционных сайтах. Если такие сайты отсутствуют, то используют синтетические олигонуклеотидные линкеры в соответствии со стандартной практикой (см. руководства Sambrook et al, Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989, и Bennett and Lasure, More Gene Manipulations in Fungi, Academic Press, San Diego, pp 70-76, 1991, которые во всей своей полноте включены в настоящее описание посредством ссылки, и в частности, их разделы, относящиеся к олигонуклеотидным линкерам). Кроме того, векторы могут быть сконструированы с использованием стандартных рекомбинантных способов (например, Invitrogen Life Technologies, Gateway Technology).
В некоторых вариантах осуществления изобретения может оказаться желательной сверхэкспрессия нуклеиновых кислот изопренсинтазы, DXS, IDI или пути MVA на уровнях, которые значительно превышают уровни, обычно наблюдаемые в природных клетках. Такая сверхэкспрессия может быть осуществлена путем селективного клонирования нуклеиновых кислот, кодирующих указанные полипептиды в многокопийные плазмиды под контролем сильного индуцибельного или конститутивного промотора. Способы сверхэкспрессии желаемых полипептидов широко применяются и хорошо известны специалистам в молекулярной биологии, и их описание можно найти в руководстве Sambrook et al, Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989, которое во всей своей полноте включено в настоящее описание посредством ссылки, и в частности, его раздел, относящийся к способам клонирования.
Нижеследующие материалы включают описание дополнительных общих способов, которые могут быть применены в настоящем изобретении, а именно, руководства Kreigler, Gene Transfer and Expression; A Laboratory Manual, 1990; и Ausubel et al, Eds. Current Protocols in Molecular Biology, 1994, которые во всей своей полноте включены в настоящее описание посредством ссылки, и в частности, их разделы, относящиеся к способам молекулярной биологии и клонирования.
Репрезентативные организмы-источники
Нуклеиновые кислоты изопренсинтазы, DXS, IDI или пути MVA (и кодируемые ими полипептиды) могут быть получены из любого организма, который обычно содержит нуклеиновые кислоты изопренсинтазы, DXS, IDI или пути MVA. Как указывалось выше, изопрен обычно продуцируется различными организмами, такими как бактерии, дрожжи, растения и животные. Такие организмы содержат полипептиды пути MVA, пути DXP или путей MVA и DXP, посредством которых они продуцируют изопрен (фиг.15). Таким образом, нуклеиновые кислоты DXS могут быть получены, например, из любого организма, содержащего нуклеиновые кислоты пути DXP или путей MVA и DXP. Нуклеиновые кислоты IDI и изопренсинтазы могут быть получены, например, из любого организма, содержащего нуклеиновые кислоты пути MVA, пути DXP или тех и других путей. Нуклеиновые кислоты пути MVA могут быть получены, например, из любого организма, содержащего нуклеиновые кислоты пути MVA или путей MVA и DXP.
В некоторых вариантах осуществления изобретения последовательность нуклеиновой кислоты изопренсинтазы, DXS, IDI или пути MVA идентична последовательности нуклеиновой кислоты, которая продуцируется любыми из нижеследующих организмов в природе. В некоторых вариантах осуществления изобретения аминокислотная последовательность изопренсинтазы, DXS, IDI или пути MVA идентична полипептидной последовательности, которая продуцируется любыми из нижеследующих организмов в природе. В некоторых вариантах осуществления изобретения нуклеиновой кислотой или полипептидом изопренсинтазы, DXS, IDI или пути MVA являются мутантная нуклеиновая кислота или мутантный полипептид, полученные из любого из описанных в данном описании организмов. Используемый в данном описании термин «получен из» относится к источнику нуклеиновой кислоты или полипептида, в который были введены одна или несколько мутаций. Так, например, термин «полипептид, полученный из растительного полипептида» означает представляющий интерес полипептид, который образуется в результате введения одной или нескольких мутаций в последовательность растительного полипептида дикого типа (то есть, его природной последовательности).
В некоторых вариантах осуществления изобретения организмом-источником является бактерия, такая как штаммы Escherichia (например, E. coli) или штаммы Bacillus (например, B. subtilis).
Используемый в данном описании термин «бактерии рода Escherichia» включает бактерии всех видов, принадлежащие к роду «Escherichia», и известные специалистам в данной области, включая, но, не ограничиваясь ими, E. coli, E. adecarboxylata, E. albertii, E. blattae, E. fergusonii, E. hermannii, E. senegalensis и E. vulneris. Род «Escherichia» определен как грамотрицательные, неспорообразующие, факультативно анаэробные, палочковидные бактерии, классифицированные как члены семейства Enterobacteriaceae, отряда Enterobacteriales, класса Gamma Proteobacteria.
Используемый в данном описании термин «род Bacillus» включает все виды, принадлежащие к роду «Bacillus», известному специалистам в данной области, включая, но, не ограничиваясь ими, B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. lautus и B. thuringiensis. Следует отметить, что род Bacillus может подвергаться таксономической реорганизации. Таким образом, предполагается, что такой род включает виды, которые были переклассифицированы, включая, но, не ограничиваясь ими, такие микроорганизмы, как B. stearothermophilus, который в настоящее время называется «Geobacillus stearothermophilus». Продуцирование резистентных эндоспор в присутствии кислорода рассматривается как определяющий признак рода Bacillus, хотя такими свойствами также обладают недавно идентифицированные бактерии Alicyclobacillus, Amphibacillus, Aneurinibacillus, Anoxybacillus, Brevibacillus, Filobacillus, Gracilibacillus, Halobacillus, Paenibacillus, Salibacillus, Thermobacillus, Ureibacillus и Virgibacillus.
Репрезентативные клетки-хозяева
Для экспрессии полипептидов изопренсинтазы, DXS, IDI и/или пути MVA и для продуцирования изопрена способами, раскрываемыми в настоящем изобретении, могут быть использованы различные клетки-хозяева. Репрезентативными клетками-хозяевами являются клетки любого из организмов, перечисленных в предыдущем разделе под заголовком «Репрезентативные организмы-источники». Клеткой-хозяином может быть клетка, которая по своей природе продуцирует изопрен, или клетка, которая по своей природе не продуцирует изопрен. В некоторых вариантах осуществления изобретения клетка-хозяин по своей природе продуцирует изопрен по пути DXP, и для повышения уровня продуцирования изопрена по этому пути добавляют нуклеиновую кислоту изопренсинтазы, DXS и/или IDI. В некоторых вариантах осуществления изобретения клетка-хозяин по своей природе продуцирует изопрен по пути MVA, и для повышения уровня продуцирования изопрена по этому пути добавляют нуклеиновые кислоты изопренсинтазы и/или нуклеиновые кислоты одного или нескольких путей MVA. В некоторых вариантах осуществления изобретения клетка-хозяин по своей природе продуцирует изопрен по пути DXP, и для продуцирования изопрена с использованием неполного или полного пути MVA, а также пути DXP добавляют одну или несколько нуклеиновых кислот пути MVA. В некоторых вариантах осуществления изобретения клетка-хозяин по своей природе продуцирует изопрен по путям DXP и MVA, и для повышения уровня продуцирования изопрена по одному или обоим этим путям добавляют одну или несколько нуклеиновых кислот изопренсинтазы, DXS, IDI или пути MVA.
Репрезентативные способы трансформации
Нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA или содержащие их векторы могут быть встроены в клетку-хозяина (например, бактериальную клетку) стандартными способами экспрессии кодируемого полипептида изопренсинтазы, DXS, IDI и/или пути MVA. Введение ДНК-конструкции или ДНК-вектора в клетку-хозяина может быть осуществлено такими способами, как трансформация, электропорация, микроинжекция в ядро, трансдукция, трансфекция (например, трансфекция, опосредуемая липофекцией или DEAE-декстрином, или трансфекция с использованием рекомбинантного фагового вируса), инкубирование с преципитатом ДНК, содержащим фосфат кальция, высокоскоростная бомбардировка микрочастицами, покрытыми ДНК, и слияние протопластов. Общие способы трансформации известны в данной области (см., например, руководства Current Protocols in Molecular Biology (F.M. Ausubel et al. (eds) Chapter 9, 1987; Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989; и Campbell et al, Curr Genet, 16:53-56, 1989, которые во всей своей полноте включены в настоящее описание посредством ссылки, и в частности, их разделы, относящиеся к способам трансформации). Введенные нуклеиновые кислоты могут интегрироваться в хромосомную ДНК или сохраняться в виде внехромосомных реплицирующихся последовательностей.
Репрезентативные среды для культивирования клеток
Настоящее изобретение также включает клетки или популяции клеток в культуре, которые продуцируют изопрен. Термин «клетки в культуре» означает две или более клеток в растворе (например, в клеточной среде), в котором эти клетки могут подвергаться одному или более клеточным делениям. Термин «клетки в культуре» не включают растительные клетки, которые являются частью «живых» многоклеточных растений, содержащих клетки, дифференцирующиеся в растительные ткани. В различных вариантах осуществления изобретения клеточная культура включает по меньшей мере или примерно 10, 20, 50, 100, 200, 500, 1000, 5000, 10000 или более клеток.
Для культивирования клеток-хозяев может быть использован любой источник углерода. Термин «источник углерода» означает одно или несколько углеродсодержащих соединений, способных подвергаться метаболизму в клетке- или организме-хозяине. Так, например, клеточная среда, используемая для культивирования клеток-хозяев, может включать любой источник углерода, подходящий для поддержания жизнеспособности или роста клеток-хозяев.
В некоторых вариантах осуществления изобретения источником углерода является углевод (такой как моносахарид, дисахарид, олигосахарид или полисахариды), инвертированный сахар (например, ферментативно обработанный сахарный сироп), глицерол, глицерин (например, глицериновый побочный продукт, образующийся в результате производства биодизельного топлива или мыла), дигидроксиацетон, одноатомный источник углерода, жирная кислота (например, насыщенная жирная кислота, ненасыщенная жирная кислота или полиненасыщенная жирная кислота), липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, полипептид (например, микробный или растительный белок или пептид), возобновляемый источник углерода (например, источник углерода, представляющий собой биомассу, такую как гидролизованная биомасса; меласса сахарной свеклы или сахарного тростника), дрожжевой экстракт, компонент дрожжевого экстракта, полимер, кислота, спирт, альдегид, кетон, аминокислота, сукцинат, лактат, ацетат, этанол или любая комбинация двух или более вышеперечисленных компонентов. В некоторых вариантах осуществления изобретения источником углерода является продукт фотосинтеза, включая, но, не ограничиваясь им, глюкозу.
Репрезентативными моносахаридами являются глюкоза и фруктоза; репрезентативными олигосахаридами являются лактоза и сахароза, и репрезентативными полисахаридами являются крахмал и целлюлоза. Репрезентативными углеводами являются C6-сахара (например, фруктоза, манноза, галактоза или глюкоза) и C5-сахара (например, ксилоза или арабиноза). В некоторых вариантах осуществления изобретения клеточная среда включает углевод, а также источник углерода, не являющийся углеводом (например, глицерол, глицерин, дигидроксиацетон, одноатомный источник углерода, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода или компонент дрожжевого экстракта). В некоторых вариантах осуществления изобретения клеточная среда включает углевод, а также полипептид (например, микробный или растительный белок или пептид). В некоторых вариантах осуществления изобретения микробным полипептидом является полипептид дрожжей или бактерий. В некоторых вариантах осуществления изобретения растительным полипептидом является полипептид, полученный из сои, кукурузы, канолы, ятрофы, пальмы, арахиса, подсолнечника, кокосового ореха, горчицы, рапса, семян хлопчатника, косточек плодов пальмы, плодов маслины, сафлора, кунжута или льняного масла.
В некоторых вариантах осуществления изобретения концентрация углевода составляет по меньшей мере примерно 5 граммов на литр бульона (г/л, где указанный объем бульона включает объем клеточной среды и объем клеток), например, по меньшей мере примерно 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300, 400 г/л или более. В некоторых вариантах осуществления изобретения концентрация углевода составляет примерно от 50 до 400 г/л, например, примерно от 100 до 360 г/л, примерно от 120 до 360 г/л или примерно от 200 до 300 г/л. В некоторых вариантах осуществления изобретения такая концентрация углевода включает общее количество углевода, добавляемого до и/или во время культивирования клеток-хозяев.
Репрезентативными липидами являются любое вещество, содержащее одну или несколько жирных кислот, которые представляют собой жирные кислоты, имеющие 4 или более атомов углерода, и которые являются насыщенными, ненасыщенными или разветвленными.
Репрезентативными жирными кислотами являются соединения формулы R-COOH, где «R» представляет собой углеводород. Репрезентативными ненасыщенными жирными кислотами являются соединения, где «R» включает по меньшей мере одну углерод-углеродную двойную связь. Репрезентативными ненасыщенными жирными кислотами являются, но не ограничиваются ими, олеиновая кислота, вакценовая кислота, линолевая кислота, пальмитолеиновая кислота и арахидоновая кислота. Репрезентативными полиненасыщенными жирными кислотами являются соединения, где «R» включает множество углерод-углеродных двойных связей. Репрезентативными насыщенными жирными кислотами являются соединения, где «R» представляет собой насыщенную алифатическую группу. В некоторых вариантах осуществления изобретения источник углерода включает одну или несколько С12-С22 жирных кислот, таких как С12 насыщенная жирная кислота, С14 насыщенная жирная кислота, С16 насыщенная жирная кислота, С18 насыщенная жирная кислота, С20 насыщенная жирная кислота или С22 насыщенная жирная кислота. В репрезентативном варианте осуществления изобретения жирной кислотой является пальмитиновая кислота. В некоторых вариантах осуществления изобретения источником углерода является соль жирной кислоты (например, ненасыщенной жирной кислоты), производное жирной кислоты (например, ненасыщенной жирной кислоты) или соль производного жирной кислоты (например, ненасыщенной жирной кислоты). Подходящими солями являются, но не ограничиваются ими, соли лития, соли калия, соли натрия и т.п. Ди- и триглицериды представляют собой сложные эфиры глицерина и жирных кислот.
В некоторых вариантах осуществления изобретения концентрация липида, жирной кислоты, моноглицерида, диглицерида или триглицерида составляет по меньшей мере или примерно 1 грамм на литр бульона (г/л, где указанный объем бульона включает объем клеточной среды и объем клеток), например, по меньшей мере или примерно 5, 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300, 400 г/л или более. В некоторых вариантах осуществления изобретения концентрация липида, жирной кислоты, моноглицерида, диглицерида или триглицерида составляет примерно от 10 до 400 г/л, например, примерно от 25 до 300 г/л, примерно от 60 до 180 г/л или примерно от 75 до 150 г/л. В некоторых вариантах осуществления изобретения указанная концентрация включает общее количество липида, жирной кислоты, моноглицерида, диглицерида или триглицерида, добавляемое до и/или во время культивирования клеток-хозяев. В некоторых вариантах осуществления изобретения источник углерода включает (i) липид, жирную кислоту, моноглицерид, диглицерид или триглицерид и (ii) углевод, такой как глюкоза. В некоторых вариантах осуществления изобретения отношение количества липида, жирной кислоты, моноглицерида, диглицерида или триглицерида к количеству углевода составляет примерно 1:1 в расчете на атом углерода (то есть, один атом углерода в липиде, жирной кислоте, моноглицериде, диглицериде или триглицериде на один атом углерода в углеводе). В конкретных вариантах осуществления изобретения количество липида, жирной кислоты, моноглицерида, диглицерида или триглицерида составляет примерно от 60 до 180 г/л, и количество углевода составляет примерно от 120 до 360 г/л.
Репрезентативными микробными полипептидными источниками углерода являются один или несколько полипептидов дрожжей или бактерий. Репрезентативными растительными полипептидными источниками углерода являются один или несколько полипептидов сои, кукурузы, канолы, ятрофы, пальмы, арахиса, подсолнечника, кокосового ореха, горчицы, рапса, семян хлопчатника, косточек плодов пальмы, плодов маслины, сафлора, кунжута или льняного масла.
Репрезентативными возобновляемыми источниками углерода являются пермеат молочной сыворотки сыра, сироп, получаемый из выжимок кукурузы, меласса сахарной свеклы, солод ячменя и любые их компоненты. Репрезентативными возобновляемыми источниками углерода также являются глюкоза, гексоза, пентоза и ксилоза, присутствующие в биомассе, такой как кукуруза, просо, сахарный тростник, клеточные отходы, образующиеся в процессе ферментации, и белковый побочный продукт, образующийся после помола сои, кукурузы или пшеницы. В некоторых вариантах осуществления изобретения источником углерода типа биомассы является лигноцеллюлозный, гемицеллюлозный или целлюлозный материал, такой как, но не ограничивающийся ими, трава, пшеница, пшеничная солома, багасса, багасса сахарного тростника, мягкая древесная пульпа, кукуруза, кукурузные початки или кукурузная шелуха, кукурузные зерна, волокно, получаемое из кукурузных зерен, кукурузная солома, просо, продукт, получаемый из рисовой шелухи, или побочный продукт сырого или сухого помола зерен (например, зерна кукурузы, сорго, ржи, тритикале, ячменя, пшеницы и/или барда). Репрезентативными целлюлозными материалами являются древесина, отходы целлюлозно-бумажной промышленности, травянистые растения и плодовая пульпа. В некоторых вариантах осуществления изобретения источником углерода является любая часть растения, такая как стебли, зерно, корни или клубни. В некоторых вариантах осуществления изобретения в качестве источника углерода используются все нижеследующие растения или их части, такие как кукуруза, пшеница, рожь, сорго, тритикале, рис, просо, ячмень, кассава, бобовые культуры, такие как фасоль и горох, картофель, сладкий картофель, бананы, сахарный тростник и/или тапиока. В некоторых вариантах осуществления изобретения источником углерода является гидролизат биомассы, такой как гидролизат биомассы, включающий ксилозу и глюкозу или сахарозу и глюкозу.
В некоторых вариантах осуществления изобретения возобновляемый источник углерода (такой как биомасса), перед его добавлением в среду для культивирования клеток, подвергают предварительной обработке. В некоторых вариантах осуществления изобретения предварительная обработка включает предварительную ферментативную обработку, химическую предварительную обработку или комбинацию ферментативной и химической предварительной обработки (см., например, публикацию Farzaneh et al, Bioresource Technology 96 (18): 2014-2018, 2005; патент США 6176176 и патент США 6106888, которые во всей своей полноте включены в настоящее описание посредством ссылки, и в частности, их разделы, относящиеся к предварительной обработке возобновляемых источников углерода). В некоторых вариантах осуществления изобретения возобновляемый источник углерода, перед его добавлением в среду для культивирования клеток, подвергают частичному или полному гидролизу.
В некоторых вариантах осуществления изобретения возобновляемый источник углерода (такой как кукурузная солома), перед его добавлением в среду для культивирования клеток, подвергают предварительной обработке путем вытягивания аммиачных волокон (AFEX) (см., например, Farzaneh et al., Bioresource Technology 96 (18): 2014-2018, 2005). В процессе предварительной обработки AFEX возобновляемый источник углерода обрабатывают жидким безводным аммиаком при умеренной температуре (такой как примерно 60°С-100°С) и при высоком давлении (таком как примерно 250-300 фунт/кв. дюйм=17240-20700 кПа) примерно в течение 5 минут. Затем давление быстро снимают. В данном процессе объединенные химические и физические эффекты солюбилизации лигнина, гидролиза гемицеллюлозы, декристаллизации целлюлозы и увеличения площади поверхности приводят почти к полному ферментативному превращению целлюлозы и гемицеллюлозы в ферментируемые сахара. Предварительная AFEX-обработка имеет то преимущество, что почти весь аммиак может быть выделен и использован повторно, и оставшаяся его часть служит в качестве источника азота для микроорганизмов в последующих процессах. Кроме того, для предварительной AFEX-обработки не требуется промывка струей воды. Таким образом, выход сухого вещества после AFEX-обработки составляет почти 100%. По своей природе, AFEX представляет собой процесс высушивания досуха. Такой обработанный возобновляемый источник углерода остается стабильным в течение длительного периода времени и может подаваться при очень высокой загрузке твердых веществ в процессах ферментативного гидролиза или ферментации. Целлюлоза и гемицеллюлоза хорошо сохраняются в AFEX-процессах, и не подвергаются или почти не подвергаются разложению. Перед ферментативным гидролизом возобновляемого источника углерода, подвергаемого предварительной AFEX-обработке, не требуется нейтрализации. Ферментативный гидролиз AFEX-обработанных источников углерода приводит к продуцированию осветленных потоков сахара, которые используются для последующей ферментации.
В некоторых вариантах осуществления изобретения концентрация источника углерода (например, возобновляемого источника углерода) эквивалентна по меньшей мере или примерно 0,1, 0,5, 1, 1,5, 2, 3, 4, 5, 10, 15, 20, 30, 40 или 50% глюкозы (масс./об.). Эквивалентное количество глюкозы может быть определено стандартными методами ВЭЖХ с использованием глюкозы в качестве стандарта для оценки количества глюкозы, генерируемой из источника углерода. В некоторых вариантах осуществления изобретения концентрация источника углерода (например, возобновляемого источника углерода) эквивалентна примерно 0,1-20% глюкозы, например, примерно 0,1-10% глюкозы, примерно 0,5-10% глюкозы, примерно 1-10% глюкозы, примерно 1-5% глюкозы или примерно 1-2% глюкозы.
В некоторых вариантах осуществления изобретения источник углерода включает дрожжевой экстракт или один или несколько компонентов дрожжевого экстракта. В некоторых вариантах осуществления изобретения концентрация дрожжевого экстракта составляет по меньшей мере 1 грамм дрожжевого экстракта на литр бульона (г/л, где указанный объем бульона включает объем клеточной среды и объем клеток), например, по меньшей мере или примерно 5, 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300 г/л или более. В некоторых вариантах осуществления изобретения концентрация дрожжевого экстракта составляет примерно от 1 до 300 г/л, например, примерно от 1 до 200 г/л, примерно от 5 до 200 г/л, примерно от 5 до 100 г/л или примерно от 5 до 60 г/л. В некоторых вариантах осуществления изобретения концентрация включает общее количество дрожжевого экстракта, добавляемого до и/или во время культивирования клеток-хозяев. В некоторых вариантах осуществления изобретения источник углерода включает дрожжевой экстракт (или один или несколько его компонентов) и другой источник углерода, такой как глюкоза. В некоторых вариантах осуществления изобретения отношение дрожжевого экстракта к другому источнику углерода составляет примерно 1:5, примерно 1:10 или примерно 1:20 (масс./масс.).
Кроме того, источником углерода может быть также субстрат с одним атомом углерода, такой как диоксид углерода или метанол. Продуцирование глицерина из источников, имеющих один атом углерода (например, метанола, формальдегида или формиата), было описано для метилотрофных дрожжей (см. публикацию Yamada et al., Agric. Biol. Chem., 53(2) 541-543, 1989, которая во всей своей полноте включена в настоящее описание посредством ссылки, и в частности, ее раздел, относящийся к источникам углерода) и для бактерий (см. публикацию Hunter et. al, Biochemistry, 24, 4148-4155, 1985, которая во всей своей полноте включена в настоящее описание посредством ссылки, и в частности, ее раздел, относящийся к источникам углерода). Эти микроорганизмы могут усваивать соединения с одним атомом углерода в процессе прохождения окислительного пути от метана до формиата и продуцировать глицерин. Усвоение углерода может осуществляться по пути через монофосфат рибулозы, через серин или через монофосфат ксилулуозы (см. публикацию Gottschalk, Bacterial Metabolism, Second Edition, Springer-Verlag: New York, 1986, которая во всей своей полноте включена в настоящее описание посредством ссылки, и в частности, раздел, относящийся к источникам углерода). Рибулозо-монофосфатный путь включает конденсацию формиата с рибулозо-5-фосфатом с образованием сахара с 6 атомами углерода, который превращается во фруктозу, и, в конечном счете, в продукт с 3 атомами углерода, а именно, глицеральдегид-3-фосфат. Аналогичным образом, сериновый путь способствует усвоению соединения с 1 атомом углерода по гликолитическому пути через метилентетрагидрофолат.
Также известно, что метилотрофные организмы, помимо субстратов с 1 и 2 атомами углерода, утилизируют ряд других углеродсодержащих соединений, таких как метиламин, глюкозамин и ряд аминокислот, обладающих метаболической активностью. Так, например, известно, что метилотрофные дрожжи утилизируют углерод метиламина с образованием трегалозы или глицерина (см. публикацию Bellion et al, Microb. Growth Cl Compd., [Int. Symp.], 7th ed., 415-32. Editors: Murrell et al, Publisher: Intercept, Andover, UK, 1993, которая во всей своей полноте включена в настоящее описание посредством ссылки, и в частности, раздел, относящийся к источникам углерода). Аналогичным образом, в различных видах Candida происходит метаболизм аланина или олеиновой кислоты (см. публикацию Suiter et al., Arch. Microbiol. 153(5), 485-9, 1990, которая во всей своей полноте включена в настоящее описание посредством ссылки, и в частности, раздел, относящийся к источникам углерода).
В некоторых вариантах осуществления изобретения клетки культивируют в стандартной среде, содержащей физиологические соли и питательные вещества (см., например, публикации Pourquie, J. et al., Biochemistry and Genetics of Cellulose Degradation, eds. Aubert et al., Academic Press, pp. 71-86, 1988; и Ilmen et al., Appl. Environ. Microbiol. 63:1298-1306, 1997, которые включены в настоящее описание посредством ссылки, и в частности, их разделы, относящиеся к клеточным средам). Репрезентативными культуральными средами являются стандартные коммерчески доступные среды, такие как бульон Луриа-Бертани (LB), декстрозный бульон Сабуро (SD) или бульон с дрожжевой средой (YM). Могут быть также использованы и другие культуральные среды определенного состава или синтетические среды, и подходящие среды для культивирования конкретных клеток-хозяев, известные специалистам в области микробиологии или ферментации.
Клеточная среда, помимо соответствующего источника углерода, должна содержать, если это необходимо, подходящие микроэлементы, соли, кофакторы, буферы и другие компоненты, известные специалистам в данной области и подходящие для выращивания культур или повышения уровня продуцирования изопрена (см., например, заявку WO 2004/033646 и цитируемые там ссылки, а также заявку WO 96/35796 и цитируемые там ссылки, которые включены в настоящее описание посредством ссылки, и в частности, их разделы, относящиеся к клеточным средам и к условиям культивирования клеток). В некоторых вариантах осуществления изобретения, если нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA находится под контролем индуцибельного промотора, то к данной среде желательно добавлять индуцирующий агент (например, сахар, соль металла или антимикробное средство) в концентрации, эффективной для индуцирования экспрессии полипептида изопренсинтазы, DXS, IDI или пути MVA. В некоторых вариантах осуществления изобретения клеточная среда содержит антибиотик (такой как канамицин), который соответствует нуклеиновой кислоте-маркеру резистентности к антибиотику (такой как нуклеиновая кислота резистентности к канамицину), присутствующей на векторе, содержащем одну или несколько нуклеиновых кислот DXS, IDI или пути MVA.
Репрезентативный способ продуцирования изопрена
В некоторых вариантах осуществления изобретения клетки культивируют в культуральной среде в условиях, способствующих продуцированию изопрена клетками. В некоторых вариантах осуществления изобретения клетки в культуре продуцируют изопрен в концентрации более чем или примерно 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000 или более нмоль изопрена/грамм клеток на влажную массу клеток/час (нмоль/гwcm/час). В некоторых вариантах осуществления изобретения количество изопрена составляет примерно от 2 до 5000 нмоль/гwcm/час, например, примерно от 2 до 100 нмоль/гwcm/час, примерно от 100 до 500 нмоль/гwcm/час, примерно от 150 до 500 нмоль/гwcm/час, примерно от 500 до 1000 нмоль/гwcm/час, примерно от 1000 до 2000 нмоль/гwcm/час или примерно от 2000 до 5000 нмоль/гwcm/час. Количество изопрена, выражаемое в единицах нмоль/гwcm/час, может быть измерено, как описано в патенте США 5849970, который во всей своей полноте включен в настоящее описание посредством ссылки, и в частности, его раздел, относящийся к измерению уровня продуцирования изопрена. Так, например, зону «хэдспейс» 2 мл (например, пространство верхней зоны культуры, такое как 2 мл культуры, выращиваемой в герметично закрытых сосудах при 32°С при встряхивании при 200 об/мин приблизительно в течение 3 часов) анализируют на изопрен с использованием стандартной системы газовой хроматографии, такой как система, работающая в изотермальных условиях (85°С) и снабженная колонкой с н-октаном/porasil C (Alltech Associates, Inc., Deerfield, IL), а также подсоединенная к газовому детектору, работающему в условиях восстановления оксида ртути (Trace Analytical, Menlo Park, CA) (см., например, публикацию Greenberg et al, Atmos. Environ. 21 A: 2689-2692, 1993; Silver et al, Plant Physiol. 97:1588-1591, 1991, которая включена в настоящее описание посредством ссылки, и в частности, ее разделы, относящиеся к измерению уровня продуцирования изопрена). Единицы площади на газовой хроматограмме преобразовывают в нмоль изопрена путем построения стандартной калибровочной кривой концентрации изопрена. В некоторых вариантах осуществления изобретения величину в граммах клеток на влажную массу клеток вычисляют путем получения величины A600 для образца клеточной культуры, с последующим преобразованием величины A600 в граммы клеток путем построения калибровочной кривой для влажных масс клеточных культур с известной величиной A600. В некоторых вариантах осуществления изобретения граммы клеток вычисляют с учетом того, что один литр бульона (включая клеточную среду и клетки) с величиной A600, равной 1, имеет влажную клеточную массу 1 грамм. Затем это значение также делят на количество часов инкубирования культуры, например, три часа.
В некоторых вариантах осуществления изобретения клетки в культуре продуцируют изопрен в концентрации более чем или примерно 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 100000 или более нг изопрена/грамм клеток на влажную массу клеток/час (нг/гwcm/час). В некоторых вариантах осуществления изобретения количество изопрена составляет примерно 2-5000 нг/гwcm/час, например, примерно 2-100 нг/гwcm/час, примерно 100-500 нг/гwcm/час, примерно 150-500 нг/гwcm/час, примерно 500-1000 нг/гwcm/час, примерно 1000-2000 нг/гwcm/час или примерно 2000-5000 нг/гwcm/час. Количество изопрена в нг/гwcm/час может быть вычислено путем умножения величины уровня продуцирования изопрена в единицах «нмоль/гwcm/час», указанных выше, на 68,1 (как описано ниже в уравнении 5).
В некоторых вариантах осуществления изобретения клетки в культуре продуцируют суммарный титр (общее количество) изопрена при более чем или примерно 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 100000 или более мг изопрена/л бульона (мг/лбульона, где объем бульона включает объем клеток и клеточной среды). В некоторых вариантах осуществления изобретения количество изопрена составляет примерно 2-5000 мг/лбульона, например, примерно 2-100 мг/лбульона, примерно 100-500 мг/лбульона, примерно 500-1000 мг/лбульона, примерно 1000-2000 мг/лбульона или примерно 2000-5000 мг/лбульона. Удельная продуктивность изопрена, выраженная в мг изопрена/литр зоны «хэдспейс» от культур в шейкерных колбах или аналогичных культур, может быть измерена путем взятия 1 мл образца из клеточной культуры с величиной OD600 приблизительно 1,0, помещения этого образца в 20 мл-сосуд, инкубирования в течение 30 минут и последующего измерения количества изопрена в зоне «хэдспейс». Если величина OD600 не равна 1,0, то измеренная величина может быть нормализована по величине OD600, равной 1,0, путем деления на величину OD600. Величина мг изопрена/литр зоны «хэдспейс» может быть преобразована в мг/лбульона/час/OD600 культурального бульона путем умножения на 38. Величина, выраженная в единицах мг/лбульона/час/OD600, может быть умножена на количество часов и величину OD600, с получением суммарного титра, выраженного в единицах мг изопрена/литр бульона.
Мгновенная скорость продуцирования изопрена, выраженная в мг/лбульона/час, в ферментере может быть измерена путем взятия образца отходящего газа ферментера, анализа этого образца для определения количества изопрена (в единицах, таких как мг изопрена на лгаза) и умножения полученной величины на скорость, при которой отходящий газ проходит через каждый литр бульона (например, при 1 vvm (объем воздуха/объем бульона/минуту) проходит 60 л газа в час). Таким образом, количество отходящего газа, равное 1 мг/лгаза, соответствует мгновенной скорости продуцирования 60 мг/лгаза/час при потоке воздуха в 1 vvm. Если это необходимо, то величину, выраженную в единицах мг/лгаза/час, можно разделить на величину OD600 с получением константы скорости, выраженной в мг/лбульона/час/OD. Средняя величина, выраженная в мг изопрена/лгаза, может быть преобразована в общую продуктивность продукта (граммы изопрена на литр сбраживающего бульона, мг/лбульона) путем умножения средней концентрации отходящего газа изопрена на общее количество барботируемого отходящего газа на литр сбраживающего бульона в процессе ферментации. Таким образом, средняя концентрация отходящего газа изопрена, составляющая 0,5 мг/лбульона/час за 10 часов при 1 vvm соответствует общей концентрации продукта, составляющей 300 мг изопрена/лбульона.
В некоторых вариантах осуществления изобретения клетки в культуре превращают более чем или примерно 0,0015, 0,002, 0,005, 0,01, 0,02, 0,05, 0,1, 0,12, 0,14, 0,16, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,4 или 1,6% углерода, присутствующего в клеточной культуральной среде, в изопрен. В некоторых вариантах осуществления изобретения процент превращения углерода в изопрен составляет примерно 0,002-1,6%, например, примерно 0,002-0,005%, примерно 0,005-0,01%, примерно 0,01-0,05%, примерно 0,05-0,15%, примерно 0,15-0,2%, примерно 0,2-0,3%, примерно 0,3-0,5%, примерно 0,5-0,8%, примерно 0,8-1,0% или примерно 1,0-1,6%. Процент превращения углерода в изопрен (также называемый в данном описании «% выхода углерода») может быть измерен путем деления молей углерода в продуцируемом изопрене на моли углерода в источнике углерода (такие как моли углерода в экстракте глюкозы и дрожжевом экстракте в периодической культуре и в культуре с подпиткой). Полученную величину умножают на 100% и получают процентную величину (как указано в уравнении 1).
Уравнение 1
% выхода углерода=(моль углерода в продуцируемом изопрене)/(моль углерода в источнике углерода)·100
Для этих вычислений может быть принято, что дрожжевой экстракт содержит 50% масс. углерода.
Уравнение 2
% выхода углерода=(39,1 г изопрена·1/68,1 моль/г*5 C/моль)/[(181221 г глюкозы*1/180 моль/г*6 C/моль)+(17780 г дрожжевого экстракта*0,5*1/12 моль/г)]*100=0,042%
Специалист в данной области может легко преобразовать скорости продуцирования изопрена или количество продуцируемого изопрена в любые другие единицы. Репрезентативные уравнения для преобразования одних единиц измерения в другие представлены ниже.
Единицы скорости продуцирования изопрена (общие и частные значения)
Уравнение 3
1 г изопрена/лбульона/час=14,7 ммоль изопрена/лбульона/час (общий объемный расход)
Уравнение 4
1 нмоль изопрена/гwcm/час=1 нмоль изопрена/лбульона/час/OD600
(при данном преобразовании принимается, что один литр бульона с OD600=1 имеет влажную клеточную массу 1 грамм).
Уравнение 5
1 нмоль изопрена/гwcm/час=68,1 нг изопрена/гwcm/час
(данная молекулярная масса изопрена)
Уравнение 6
1 нмоль изопрена/лгаз О2/час=90 нмоль изопрена/лбульона/час
(при скорости потока О2=90 л/час на литр культурального бульона)
Уравнение 7
1 мкг изопрена/лгаза изопрена в отходящем газе=60 мкг изопрена/лбульона/час при скорости потока 60 лгаз на 1 лбульона (l vvm)
Единицы измерения титров (общих и специфических)
Уравнение 8
1 нмоль изопрена/мг клеточного белка=150 нмоль изопрена/лбульона/OD600
(при этом преобразовании принимается, что один литр бульона с OD600=1 имеет приблизительно 150 мг общего клеточного белка) (удельная продуктивность).
Уравнение 9
1 г изопрена/лбульона=14,7 ммоль изопрена/лбульон (общий титр)
Если это необходимо, то уравнение 10 может быть использовано для преобразования любых единиц в расчете на влажную массу клеток в соответствующие единицы в расчете на сухую массу клеток.
Уравнение 10
Сухая масса клеток=(влажная масса клеток)/3,3
В некоторых вариантах осуществления изобретения клетка, содержащая гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, продуцирует изопрен в количестве, которое по меньшей мере или примерно в 2, 3, 5, 10, 25, 50, 100, 150, 200, 400 раз или более превышает количество изопрена, продуцируемого соответствующими клетками, культивируемыми, в основном, в тех же самых условиях, но в отсутствие гетерологичной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы.
В некоторых вариантах осуществления изобретения клетка, содержащая гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы и одну или несколько гетерологичных нуклеиновых кислот, кодирующих полипептид DXS, IDI и/или полипептид пути MVA, продуцирует изопрен в количестве, которое по меньшей мере или примерно в 2, 3, 5, 10, 25, 50, 100, 150, 200, 400 раз или более превышает количество изопрена, продуцируемого соответствующими клетками, культивируемыми, в основном, в тех же самых условиях, но в отсутствие указанных гетерологичных нуклеиновых кислот.
Репрезентативные способы очистки изопрена
В некоторых вариантах осуществления изобретения любой из описанных в данном описании способов дополнительно включает выделение изопрена. Так, например, изопрен, полученный с применением композиций и способов согласно изобретению, может быть выделен стандартными способами, такими как отгонка газа, фракционирование, абсорбция/десорбция, диффузионное испарение, тепловая или вакуумная десорбция изопрена из твердой фазы или экстракция изопрена, иммобилизованного или абсорбированного на твердой фазе под действием растворителя (см. например, патенты США 4703007 и 4570029, каждый из которых во всей своей полноте включен в настоящее описание посредством ссылки, и в частности, разделы, относящиеся к способам выделения и очистки изопрена). В некоторых вариантах осуществления изобретения выделение изопрена включает выделение изопрена в жидкой форме (такой как чистый раствор изопрена или раствор изопрена в растворителе). Отгонка газа включает удаление паров изопрена из потока отходящего газа, образующегося в процессе сбраживания, в непрерывном режиме. Такое удаление может достигаться несколькими различными путями, включая, но, не ограничиваясь ими, адсорбцию на твердой фазе, распределение в жидкой фазе или прямую конденсацию. В некоторых вариантах осуществления изобретения обогащение перегородки потоком пара с растворенным изопреном при температуре выше точки росы пара приводит к конденсации жидкого изопрена.
Выделение изопрена может включать одну или несколько стадий. В некоторых вариантах осуществления изобретения удаление парообразного изопрена из отходящего газа, образующегося при сбраживании, и превращение изопрена в жидкую фазу может быть осуществлено одновременно. Так, например, изопрен может быть непосредственно конденсирован из потока отходящего газа с образованием жидкости. В некоторых вариантах осуществления изобретения удаление паров изопрена из отходящего газа, образующегося при сбраживании, и превращение изопрена в жидкую фазу осуществляют последовательно. Так, например, изопрен может быть адсорбирован на твердой фазе, а затем экстрагирован из твердой фазы растворителем.
В некоторых вариантах осуществления изобретения любой из описанных в данном описании способов дополнительно включает очистку изопрена. Так, например, изопрен, продуцируемый с применением композиций и способов согласно изобретению, может быть очищен стандартными способами. Термин «очистка» означает процесс, посредством которого изопрен отделяется от одного или нескольких компонентов, присутствующих при продуцировании изопрена. В некоторых вариантах осуществления изобретения изопрен получают, в основном, в виде чистой жидкости. Примерами способов очистки являются: (i) перегонка из раствора в жидком экстрагирующем растворителе и (ii) хроматография. Используемый в данном описании термин «очищенный изопрен» означает изопрен, который был отделен от одного или нескольких компонентов, присутствующих при продуцировании изопрена. В некоторых вариантах осуществления изобретения по меньшей мере примерно 20% масс. изопрена не содержит других компонентов, присутствующих при его продуцировании. В различных вариантах осуществления изобретения изопрен имеет чистоту по меньшей мере или примерно 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90%, 95% или 99% по массе. Чистота может быть оценена любым подходящим способом, например, с помощью колоночной хроматографии, анализа ВЭЖХ или анализа ГС-МС.
Кристаллическая структура изопренсинтазы
В настоящем изобретении также рассматриваются кристаллические формы растительной изопренсинтазы (например, тополя и пуэрарии) и ее варианты, описанные выше и в нижеследующих примерах. В одном из вариантов осуществления настоящее изобретение включает любой полипептид, имеющий кристаллическую структуру изопренсинтазы тополя, представленную в таблице 16-7.
Экспериментальная часть
Нижеследующие примеры приводятся для лучшего понимания и дополнительной иллюстрации некоторых предпочтительных вариантов осуществления и аспектов настоящего изобретения и не должны рассматриваться как ограничение его объема.
В экспериментальной части, описанной ниже, используются следующие сокращения: °С (градусы Цельсия); об/мин (обороты в минуту); H2O (вода); diH2O (деионизованная вода); а.к. (аминокислоты); п.н. (пары оснований); т.п.н. (тысяча пар оснований); кД (килоДальтон); г (граммы); мкг (микрограммы); мг (миллиграммы); нг (нанограммы); мкл (микролитры); мл (миллилитры); мм (миллиметры); дост. кол. (достаточное количество); нм (нанометры); мкм (микрометры); M (молярный); мМ (миллимолярный); мкМ (микромоли); пМ (пикомоли); ед. (U) (единицы); ММ (молекулярная масса); сек (секунды); мин (минута/минуты); ч (час/часы); OD600 (оптическая плотность на 600 нм); BSA (бычий сывороточный альбумин); DMAPP (диметилаллилдифосфат); DTT (дитиотреитол); EtOH (этанол); IPTG (изопропил-бета-D-тиогалактопиранозид); изопрен (2-метил-1,3-бутадиен); IspS (изопренсинтаза); PAGE (электрофорез в полиакриламидном геле); PBS (забуференный фосфатом физиологический раствор [150 мМ NaCl, 10 мМ фосфатно-натриевый буфер, pH 7,2]); и ДСН (додецилсульфат натрия).
Ниже приводятся сокращенные названия компаний-производителей или компаний-поставщиков, продукты которых используются в экспериментальных примерах: Agilent (Agilent Technologies, Santa Clara, CA); Becton Coulter (Becton Coulter, Inc., Fullerton, CA); Bio-Rad (Bio-Rad Laboratories, Hercules, CA); Cayman Chemical (Cayman Chemical Co., Ann Arbor, MI); CTC Analytics (CTC Analytics A. G., Zwingen, Switzerland); EMS (Electron Microscopy Supply, Hatfield, PA); Epicentre (Epicentre Biotechnologies, Madison, WI); Integrated DNA Technologies (Integrated DNA Technologies, Coral ville, IA); Invitrogen (Invitrogen Corp., Carlsbad, CA); Molecular Dynamics (Molecular Dynamics, Sunnyvale, CA); Novagen (Novagen, Inc., Madison, WI); Perkin Elmer (Perkin Elmer, Waltham, MA); Roche (Roche Applied Science, Indianopolis, IN); Sigma (Sigma-Aldrich, St. Louis, MO); Stratagene (Stratagene Cloning Systems, La Jolla, CA); Qiagen (Qiagen, Inc., Valencia, CA); Takara (Takara Bio USA, Madison, WI); Thomson Instrument (Thomson Instrument Co., Oceanside, CA); V&P Scientific (V&P Scientific, Inc., San Diego, CA); и Zinsser (Zinsser North America, Northridge, CA).
Пример 1
Клонирование изопренсинтазы пуэрарии для экспрессии в рекомбинантных бактериях
В данном примере описаны способы продуцирования изопренсинтазы пуэрарии (IspS) в E. coli. Последовательность белка, кодируемого геном изопренсинтазы пуэрарии волосистой (Pueraria montana) (IspS), получали из GenBank (AAQ84170). Ген изопренсинтазы пуэрарии волосистой, оптимизированный по частоте встречаемости кодонов, закупали у DNA2.0 (Menlo Park, CA), и такая последовательность представлена как SEQ ID NO:1 (фиг.1). Ген изопренсинтазы выделяли из закупленной плазмиды путем гидролиза рестриктирующей эндонуклеазой с использованием BspLUIII/Pstl, затем подвергали гель-очистке и лигировали в плазмиду pTrcHis2B (Invitrogen), которую гидролизовали ферментами Ncol/Pstl. Эту конструкцию создавали таким образом, чтобы стоп-кодон в гене изопренсинтазы находился со стороны 5'-конца по отношению к Pstl-сайту. В результате, при экспрессии данной конструкции, His-метка не была присоединена к белку изопренсинтазы. Полученную плазмиду pTrcKudzu подтверждали путем секвенирования.
Ген изопренсинтазы также клонировали в pET16b (Novagen). В этом случае, ген изопренсинтазы встраивали в pET16b таким образом, чтобы рекомбинантный белок изопренсинтазы содержал N-концевую His-метку. Ген изопренсинтазы амплифицировали из pTrcKudzu с помощью ПЦР, с использованием набора праймеров pET-His-Kudzu-2F: 5'-CGTGAGATCA TATGTGTGCG ACCTCTTCTC AATTTAC (SEQ ID NO:3) и pET-His-Kudzu-R: 5'-CGGTCGACGG ATCCCTGCAG TTAGACATAC ATCAGCTG (SEQ ID NO:4). Эти праймеры добавляли NdeI-сайт у 5'-конца и BamHI-сайт у 3'-конца гена, соответственно. Плазмиду pTrcKudzu, описанную выше, использовали в качестве ДНК-матрицы, ДНК-полимеразу HERCULASE (Stratagene) использовали в соответствии с инструкциями производителей, и праймеры добавляли в концентрации 10 пМ. ПЦР осуществляли в общем объеме 25 мкл. ПЦР-продукт гидролизовали ферментами NdeI/BamHI и клонировали в вектор pET16b, гидролизованный такими же ферментами. Смесь для лигирования переносили в клетки E. coli Topl0 (Invitrogen), и «правильный» клон отбирали путем секвенирования. Затем полученную плазмиду, обозначенную pETNHisKudzu, переносили в клетки BL21(λDE3)pLysS (Novagen) для экспрессии с промотора T7.
Ген изопренсинтазы пуэрарии также клонировали в низкокопийную плазмиду pCL1920 (Lerner and Inouye, Nucl Acids Res, 18:4631, 1990). Для амплификации гена изопренсинтазы пуэрарии из pTrcKudzu, описанной выше, использовали праймеры. Прямой праймер добавлял HindIII-сайт и консенсусную последовательность RBS E. coli к 5'-концу. Клонирующий PstI-сайт уже присутствовал в pTrcKudzu непосредственно у 3'-конца стоп-кодона, и поэтому обратный праймер был сконструирован таким образом, чтобы конечный ПЦР-продукт включал PstI-сайт. Указанные праймеры имели следующие последовательности: ΗindIII-rbs-Kudzu F (прямой): 5'-CATATGAAAG CTTGTATCGA TTAAATAAGG AGGAATAAAC C (SEQ ID NO:5) и BamΗl-Kudzu R (обратный): 5'-CGGTCGACGG ATCCCTGCAG TTAGACATAC ATCAGCTG (SEQ ID NO:4). ПЦР-продукт амплифицировали с использованием ДНК-полимеразы ΗERCULASE (Stratagene), а также праймеров в концентрации 10 пМ и 1 нг матричной ДНК (pTrcKudzu). Протокол амплификации включает 30 циклов (95°C, 1 минута, 60°C, 1 минута, 72°C, 2 минуты). Продукт гидролизовали ферментами HindIII и PstI и лигировали в плазмиду pCL1920, которую также гидролизовали ферментами HindIII и PstI. Смесь для лигирования переносили в клетки E. coli Topl0. Несколько трансформантов подтверждали путем анализа последовательности. Полученную плазмиду обозначали pCL-lac-Kudzu.
Для удаления гена бета-лактамазы, pTrcKudzu гидролизовали ферментом BspHI, обрабатывали щелочной фосфатазой креветок (SAP), инкубировали при 65°C в течение 10 минут для термоинактивации SAP, и затем концы достраивали путем инкубирования с 2 единицами фрагмента Кленова (New England BioLabs) и dNTPS. Фрагмент в 5 т.п.н. выделяли из агарозного геля и лигировали с геном Kan(R). Ген Kan(R) получали путем ПЦР-амплификации из pCR-Blunt-II-TOPO (Invitrogen) с использованием праймеров MCM22 и MCM23 и ДНК-полимеразы Taq в соответствии с инструкциями производителей. ПЦР-фрагмент гидролизовали ферментами HindIII и PvuI, и концы достраивали с помощью фрагмента Кленова и dNTP. Смесь для лигирования переносили в химически компетентные клетки E. coli Top 10, и трансформант, несущий плазмиду, сообщающую резистентность к канамицину, pTrcKudzu(kan), отбирали на агаре Луриа, содержащем канамицин (50 мкг/мл). Праймеры имели следующие последовательности: MCM22 5'-gatcaagcttAACCGGAATTGCCAGCTG (SEQ ID NO:15) и MCM23 5'-gatccgatcgTCAGAAGAACTCGTCAAGAAGGC (SEQ ID NO:16).
Пример 2
Клонирование изопренсинтазы тополя для экспрессии в рекомбинантных бактериях
В данном примере описаны способы продуцирования изопренсинтазы тополя (IspS) в E. coli. Последовательность белка, кодируемого геном изопренсинтазы тополя (Populus alba x Populus tremula) (Schnitzler et al., Planta 222:777-786, 2005), получали из GenBank (CAC35696). Ген, оптимизированный по частоте встречаемости кодонов в E. coli, закупали у DNA2.0, и такая последовательность представлена как SEQ ID NO:6 (фиг.3). Ген изопренсинтазы выделяли из закупленной плазмиды (p9796-poplar) путем гидролиза рестриктирующими ферментами BspLUIII/Pstl, подвергали гель-очистке и лигировали в pTrcHis2B, которую гидролизовали ферментами Ncol/Pstl. Эту конструкцию создавали таким образом, чтобы стоп-кодон во вставке находился перед Pstl-сайтом, в результате чего в этой конструкции His-метка не присоединяется к белку изопренсинтазы. Полученную плазмиду pTrcPoplar подтверждали путем секвенирования с использованием коммерчески доступных праймеров (прямого и обратного), гибридизующихся с последовательностью вектора, а также праймера Poplar InSeq 5'-GAGAAAATCG GTAAGGAACT GG (SEQ ID NO:8).
Пример 3
Продуцирование изопрена в рекомбинантных бактериях
В данном примере описаны способы, используемые для продуцирования изопрена и определения его уровня в рекомбинантных E. coli.
I. Определение уровня продуцирования изопрена
Для культур в шейкерных колбах, 1 мл культуры переносили из шейкерных колб в 20-миллилитровые сосуды CTC с зоной «хэдспейс» (сосуд Agilent, номер по каталогу No. 5188 2753, и крышка, номер по каталогу No. 5188 2759). Крышку плотно завинчивали, и сосуды инкубировали при эквивалентной температуре со встряхиванием при 250 об/мин. Через 30 минут, сосуды вынимали из инкубатора и анализировали, как описано ниже. В случаях, когда продуцирование изопрена подтверждалось, из ферментера брали образцы отходящего газа и сразу анализировали.
Данный анализ осуществляли с использованием ГХ/МС-системы Agilent 6890, подсоединенной к автоматическому устройству для взятия образцов CTC Analytics CombiPAL, работающему в режиме «хэдспейс». Для разделения аналитов использовали ГХ/МС-колонку Agilent HP-5MS (30 м×0,25 мм; пленка толщиной 0,25 мкм). Устройство для взятия образцов устанавливали на «впрыск» 500 мкл газа в зону «хэдспейс». В ГХ/МС методе в качестве газа-носителя использовали гелий при скорости потока 1 мл/мин. Входное отверстие для инъекций поддерживали при температуре 250°C с отношением деления потока 50:1. Во время анализа, продолжающегося 2 минуты, температуру печи поддерживали при 37°С. Селективный масс-детектор Agilent 5793N работал в режиме мониторинга одного иона (SIM) при отношении масса/заряд (m/z) 67. Для элюирования перманентного потока газов, детектор отключали на 1,4-1,7 минут. В этих условиях было установлено, что изопрен (2-метил-1,3-бутадиен) элюировался через 1,78 минут. Для количественной оценки абсолютного количества изопрена использовали калибровочную таблицу, которая показывала линейную зависимость на участке от 1 мкг/л до 200 мкг/л. По оценкам, проводимым данным способом, предел детектирования составлял от 50 до 100 нг/л.
II. Продуцирование изопрена в шейкерных колбах
Векторы, описанные выше, вводили в штамм E. coli BL21(λDE3)pLysS (Novagen) для продуцирования штаммов BL21/ptrcKudzu, BL21/pCL-lac-Kudzu и BL21/pETHisKudzu. Штаммы распределяли для выделения на агаре LA (агаре Луриа), содержащем соответствующий антибиотик (50 мкг/мл карбенициллина для BL21/ptrcKudzu и BL21/pETHisKudzu или 50 мкг/мл стрептомицина для BL21/pCL-lac-Kudzu), и инкубировали в течение ночи при 37°C. Моноколонии инокулировали в 250-миллилитровые шейкерные колбы с перегородками, содержащие 20 мл бульона Луриа-Бертани (LB) и соответствующий антибиотик. Культуры выращивали в течение ночи при 20°C со встряхиванием при 200 об/мин. OD600 ночных культур измеряли, и затем культуры разводили в 250-миллилитровой шейкерной колбе с перегородкой, содержащей 30 мл экспрессионной среды MAGICMEDIA (Invitrogen), включающей соответствующий антибиотик, до OD600 ~0,05. Полученную культуру инкубировали при 30°C со встряхиванием при 200 об/мин. Когда OD600 составляла ~0,5-0,8, добавляли 400 мкМ IPTG, и клетки инкубировали еще 6 часов при 30°С со встряхиванием при 200 об/мин. Через 0, 2, 4 и 6 часов после IPTG-индуцирования, 1 мл аликвот культур собирали, определяли OD600, и количество продуцированного изопрена измеряли, как описано выше.
III. Продуцирование изопрена из BL21/ptrcKudzu в 14-литровом ферментере
Крупномасштабное продуцирование изопрена клетками E. coli, содержащими рекомбинантный ген изопренсинтазы пуэрарии, осуществляли путем их культивирования в периодической культуре с подпиткой. Среда для ферментации (TM2) содержала нижеследующие компоненты на литр: 13,6 г K2HPO4, 13,6 г KH2PO4, 2 г MgSO4•7Н2О, 2 г моногидрата лимонной кислоты, 0,3 г цитрата железа(3)-аммония, 3,2 г (NH4)2SO4, 5 г дрожжевого экстракта, 1 мл 1000× модифицированного раствора следовых количеств металла. Все компоненты добавляли одновременно и растворяли в diH2O. pH доводили до 6,8 добавлением гидроксида калия (KOH), и объем доводили до нужной величины. Конечный продукт стерилизовали на 0,22 мкМ-фильтре, но не обрабатывали в автоклаве. 1000× модифицированный раствор следовых количеств металла имел следующий состав: 40 г лимонной кислоты•Н2О; 30 г MnSO4•Н2О; 10 г NaCl, 1 г FeSO4•7Н2О; 1 г CoCl2•6Н2О, 1 г ZnSO•7Н2О, 100 мг CuSO4•5Н2О, 100 мг H3BO3, 100 мг NaMoO4•2Н2О. Каждый компонент сразу растворяли в diH2O, рН доводили до 3,0 добавлением HCl/NaOH, затем объем доводили до нужной величины и стерилизовали на фильтре 0,22 микрон.
Данный эксперимент проводили в 14-литровом биореакторе для мониторинга образования изопрена из глюкозы в нужном режиме ферментации, при pH 6,7 и при температуре 34°C. Инокулят штамма BL21/ptrcKudzu E. coli, взятый из замороженного сосуда, получали в среде, содержащей соевый пептон-дрожжевой экстракт-глюкозу, в двух 600-миллилитровых колбах. После достижения инокулятом OD550=0,6, две 600-миллилитровые колбы центрифугировали, и содержимое ресуспендировали в 70 мл супернатанта для переноса клеточного осадка (70 мл материала с OD 3,1) в биореактор. Через различные периоды времени после инокуляции брали образцы и определяли количество продуцированного изопрена, как описано выше.
Пример 4
Выбор сайтов для улучшения свойств растительных изопренсинтаз
Предполагается, что растительные изопренсинтазы гомологичны терпенсинтазам. Трехмерные структуры двух гомологичных терпенсинтаз определяли для борнилдифосфатсинтазы (код ввода pdb 1N1B) и 5-эпи-аристологенсинтазы (код ввода pdb 5EAU). Эти ферменты были гомологичны только на 32%, но они имели консервативную третичную структуру. Кроме того, было показано, что структуры промежуточных комплексов, содержащих оба фермента, имеющие не только третичную укладку, но и обнаруживающие взаимодействия в своих активных центрах, также были в высокой степени консервативными.
Изопренсинтазы пуэрарии и тополя имели последовательности, которые были более идентичными, чем последовательности борнилдифосфатсинтазы и 5-эпи-аристологенсинтазы, как показано ниже в таблице 4-1.
Модель гомологии изопренсинтазы тополя была создана на основе борнилдифосфатсинтазы (BDP-синтазы) с кодом ввода pdb 1N24 (идентичность последовательности ~40%). Очевидно, что эта модель гомологии может быть создана на основе моделей, полученных из 10 испытаний по оценке близкого сходства, где указанные модели получали с использованием программы MOE, записанной и поставляемой компанией The Chemical Computing Group, Inc. Сходство определяли исходя из консервативности общих аминокислотных остатков в сайтах структуры BDP-синтазы, участвующих в катализе.
Сравнение активного центра структуры BDP-синтазы и модели гомологии IspS тополя показало, что активный центр, участвующий в связывании с ионом металла и в распознавании фосфата, является консервативным. В частности, наблюдалось, что остатки Lys 272, Asp 309, Asp 313, Glu 387, Arg 450 и Asn 453 IspS тополя перекрываются с эквивалентными остатками в BDP-синтазе. В данном примере, положения аминокислотных остатков IspS тополя происходят от SEQ ID NO:7. Положения остатков в промежуточном соединении BDP-синтазы также сравнивали с положениями остатков в модели гомологии для IspS тополя. Исходя из этого, можно идентифицировать аналогичную связывающую область и понять, необходимо ли участие изопентенилдифосфата в связывании и взаимодействии с ферментом IspS тополя.
Модель гомологии для изопренсинтазы пуэрарии была создана на основе борнилдифосфатсинтазы с кодом ввода pdb 1N24, имеющей ~40% идентичность последовательностей. Сравнение активного центра структуры BDP-синтазы и модели гомологии IspS пуэрарии показало, что множество остатков активного центра, участвующих в связывании с ионом металла и в распознавании фосфата, являются консервативными. В частности, наблюдалось, что остатки Arg 269, Asp 306, Asp 310, Glu 384, Arg 450 и Asn 453 IspS пуэрарии перекрываются с эквивалентными остатками в BDP-синтазе.
Сравнение остатков активного центра, идентифицированных в моделях гомологии IspS тополя и пуэрарии, показало, что остатки одной модели гомологии также были абсолютно гомологичными аналогичным остаткам в другой модели гомологии, при этом, наблюдались незначительные сдвиги в ряде относительных положений для некоторых остатков. Исходя из моделей гомологии, сайты в IspS тополя и пуэрарии были идентифицированы в качестве кандидатов на мутагенез с продуцированием вариантов фермента IspS с улучшенными свойствами. Кратко, были отобраны сайты IspS, которые могли изменять характер связывания с металлом, распознавания дифосфата, связывания цепи IPP и/или близости к активному центру.
I. Сайты связывания с дифосфатом/металлом
Были идентифицированы боковые цепи аминокислотных остатков IspS тополя, которые находятся вблизи от боковых цепей, связывающихся с металлом и дифосфатом (DPP). Такими остатками являются остатки Phe 384, Tyr 402, Ala 406, Ser 409, Ala 460 и Asn 469. Авторы настоящего изобретения отмечают, что Lys 272, исходя из оценки гомологии, не соответствует остатку других известных последовательностей IspS тополя, которые имеют Arg в этом положении.
II. Петля доступа к субстрату
Петля, доступная для субстрата в IspS тополя, представляет собой область, отличающуюся от области структуры BDP-синтазы. В структуре BDP-синтазы остатки образуют сегмент, который создает «покрытие». Не ограничиваясь какой-либо конкретной теорией, авторы настоящего изобретения считают, что этот сегмент в фактической трехмерной структуре IspS тополя будет образовывать аналогичную структуру. Остатки в этой петле, включая остатки 455-466, будут находиться в положении, изменяющем активность фермента IspS тополя. В ферменте IspS тополя остатки 454-466 имеют следующую последовательность: LASASAEIARGET (SEQ ID NO:9).
III. Сайт связывания с изопренилом
Комплекс BDP-синтазы и продукта реакции, борнилдифосфата (код ввода pdb 1N24) был использован для идентификации остатков в модели фермента тополя, которая может модулировать специфичность к субстрату и/или скорость реакции (изменять скорость ассоциации и диссоциации субстрата и продукта). Такими остатками являются Arg 274, Trp 281, Phe 302, Val 305, Ser 411, Gln 415, Phe 449, Ser 537 и Glu 540.
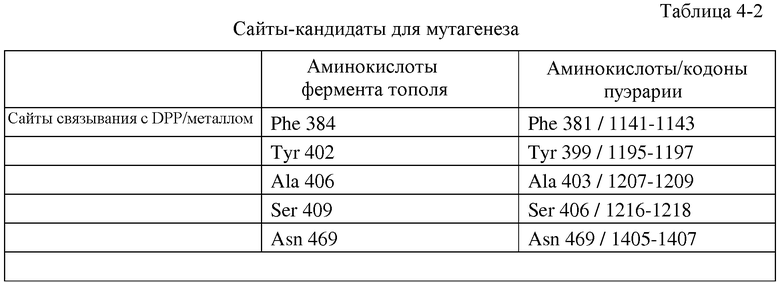
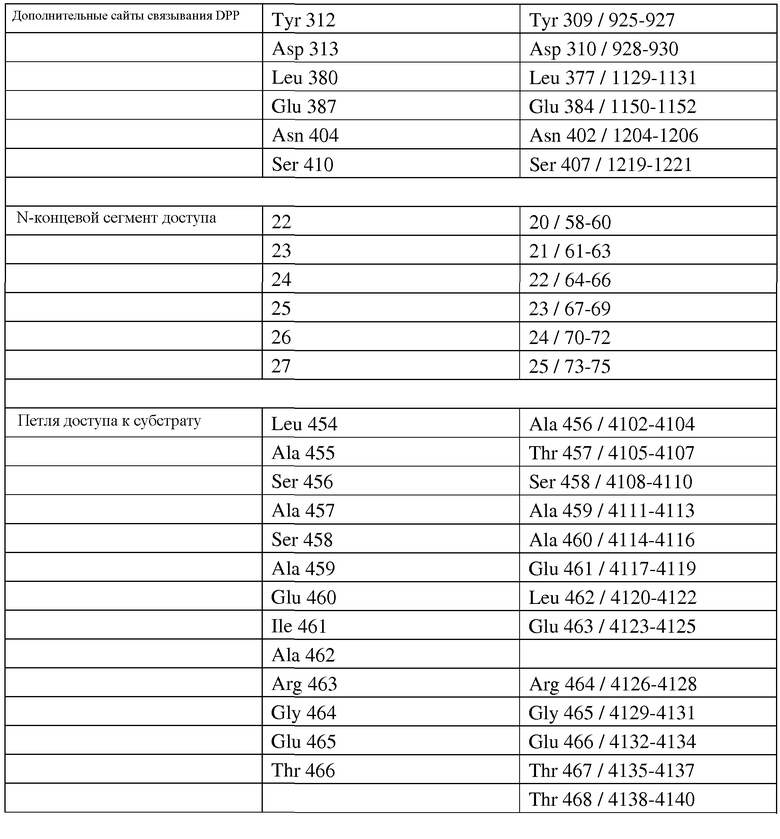
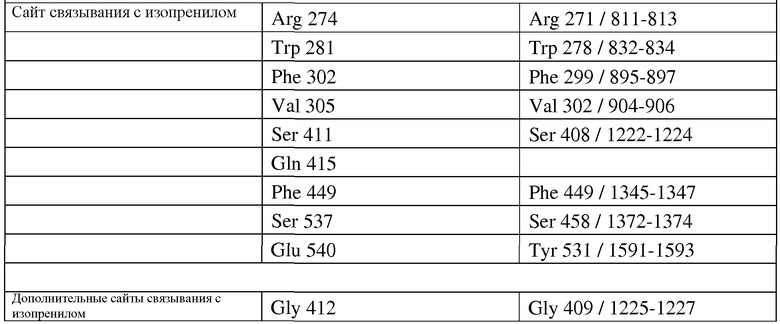

Пример 5
Мутация неконсервативных цистеинов в изопренсинтазе пуэрарии
Модели гомологии изопренсинтазы пуэрарии волосистой и тополя (IspS), созданные на основе кристаллической структуры борнилдифосфатсинтазы, сравнивали с положениями цистеиновых остатков. Цистеины могут образовывать дисульфидные связи и стабилизировать структуры. Неконсервативные цистеины, которые, как считается, могут влиять на растворимость и/или активность, модифицировали с помощью сайт-направленного мутагенеза. Аминокислотная последовательность IspS пуэрарии, используемая для моделирования, представлена на фиг.2 (SEQ ID NO:2). Как видно из модели гомологии на фиг.5, в IspS пуэрарии волосистой присутствуют восемь цистеинов в положениях 57, 291, 343, 378, 421, 446, 451 и 529 (по сравнению со зрелой формой белка). В противоположность этому, как видно из модели гомологии на фиг.6, после наложения цистеинов пуэрарии друг на друга, в аминокислотной последовательности IspS тополя присутствуют пять цистеинов. Несколько таких цистеинов являются явно консервативными для последовательностей IspS тополя и пуэрарии, что указывает на то, что эти положения играют важную роль в стабилизации структуры, активности и/или другой функции белка. Остальные цистеины (неконсервативные остатки 57, 291, 421 и 446) у пуэрарии волосистой были заменены серином, как описано в настоящем описании.
I. Мутагенез
Набор для множественного сайт-направленного мутагенеза QUIKCHANGE® (Stratagene) использовали в соответствии с рекомендациями производителей. Для мутагенеза были использованы следующие праймеры:
C57S-F 5'-CTGGAGGAAGAAGTTCGC TCC
ATGATCAACCGTGTAGAC (SEQ ID NO:10);
C291S-F 5'-CGCCAGACCCGCAGTTTGGTGAA TCT
CGCAAAGCTGTTACTAAAATG (SEQ ID NO:11);
C421S-F 5'-CGCCGTCTTACTTTTCCGTA TCC
CAGCAGCAGGAAGACATC (SEQ ID NO:12);
C446S-F 5'-CATGGTCTGGTGCGTTCTAGC TCC
GTTATCTTCCGCCTGTGC (SEQ ID NO:13) и
C421S-R 5'-GATGTCTTCCTGCTGCTG GGA
TACGGAAAAGTAAGACGGCG (SEQ ID NO:14).
Плазмиду pTrcKudzu(kan), описанную в примере 1, использовали в качестве ДНК-матрицы. Праймеры C57S-F, C291S-F, C421S-F и C446-F объединяли в одной реакции (100 пмоль). Матричную ДНК (~200 нанограммов) и 0,5 мкл раствора Quiksolution добавляли к рекомендованным объемам фермента и буфера. ПЦР-реакцию проводили на ПЦР-оборудовании Эппендорфа при температуре отжига 55°C и времени удлинения 12 минут для 30 циклов. Другие параметры цикла указаны в инструкциях. ПЦР-смесь обрабатывали ферментом DpnI в течение 4 часов при 37°C (2×1 мкл, каждую обработку проводили в течение 2 часов), затем 5 мкл реакционной смеси переносили в химически компетентные клетки E. coli Top 10 (Invitrogen) и эти клетки высевали на агар Луриа, содержащий канамицин (50 мкг/мл). После инкубирования в течение ночи при 37°C несколько колоний собирали и инокулировали в 5 мл бульона Луриа, содержащего канамицин (50 мкг/мл). Плазмиды выделяли с использованием набора QIAprep Spin Miniprep (Qiagen) и все полноразмерные гены IspS секвенировали. Различные одиночные мутации и их комбинации получали, как указано ниже в таблице 5-1.
Все варианты плазмид переносили в химически компетентные клетки BL21(λDE3) (Novagen). Во второй реакции pTrcKudzu(kan) и плазмидную ДНК, выделенную из C6, использовали в качестве матриц в односайтовой реакции, проводимой с праймерами C421S-F и C421S-R, при использовании набора QUIKCHANGE® для сайт-направленного мутагенеза (Stratagene). После подтверждения путем секвенирования получали два дополнительных штамма.
II. Культивирование клеток и продуцирование изопрена
Клетки выращивали в 5-миллилитровых пробирках, содержащих бульон Луриа, в который было добавлено 50 мг/л канамицина, при 30°С в течение ночи при перемешивании. Полученные культуры разводили в бульоне TM3, в который было добавлено 10 г/л глюкозы и 50 мг/л канамицина. Объем культуры в 250 мл-колбе Bellco Delong с перегородкой составлял 25 мл, и в этой колбе клетки культивировали при 30°С при перемешивании (225 об/мин). Образцы брали в асептических условиях, как указано выше, для измерения оптической плотности A600. Результаты приведены на фиг.7. Культуры индуцировали 200 мкМ IPTG через 3,33 часа, затем культуры оставляли для последующего роста и через 7,8 часа собирали. Эти культуры центрифугировали при 10000×g в течение 10 минут, затем супернатанты декантировали и клеточный осадок замораживали при -80°С и хранили в течение ночи.
Замороженный клеточный осадок оттаивали и ресуспендировали в 2 мл PEB (50 мМ трис-HCl, pH 8,0, 20 мМ MgCl, 2 мМ дитиотреитола и 50% [об/об] глицерина). Клетки лизировали, за один пассаж, путем их разрыва на френч-прессе, при давлении 20000 фунт/кв. дюйм (138000 кПа). Лизат центрифугировали в течение 15 минут при 10000×g. Супернатанты декантировали и осадок ресуспендировали в 2 мл PEB. Осадок и супернатанты анализировали с помощью электрофореза в ДСН-ПААГ, в 4-12% гелях NuPage (Invitrogen), в буфере MES в восстанавливающих условиях. В качестве стандарта молекулярной массы использовали SeeBlue2 (Invitrogen). Результаты представлены на фиг.8. Концентрации белка IspS оценивали с помощью BCA-анализа (Pierce) с использованием BSA в качестве стандарта (таблица 5-2).
III. Анализы на активность и растворимость изопренсинтазы
Кратко, активность супернатантов оценивали с помощью реакции с DMAPP, и количество выделяемого изопрена определяли с помощью ГХ/МС.
Анализ в зоне «хэдспейс». Образец 200 мкл нужной культуры инокулировали в 2 мл-сосуды CTC с зоной «хэдспейс» (сосуд Agilent, номер по каталогу No. 5188 2753, и крышка, номер по каталогу No. 5188 2759). Крышку плотно завинчивали и сосуды инкубировали при 37°С со встряхиванием при 250 об/мин. Через 30 минут сосуды удаляли из инкубатора и быстро охлаждали водопроводной водой при комнатной температуре. Сосуды помещали в устройство для автоматического сбора образцов CombiPal с зоной «хэдспейс» для проведения анализа с помощью ГХ/МС. Данный анализ проводили с использованием ГХ/МС-системы Agilent 6890, подсоединенной к автоматическому устройству для взятия образцов CTC Analytics CombiPAL, работающему в режиме «хэдспейс». Для разделения аналитов использовали ГХ/МС-колонку Agilent HP-5MS (30 м×0,25 мм; пленка толщиной 0,25 мкм). Устройство для взятия образцов устанавливали на «впрыск» 500 мкл газа в зону «хэдспейс». В ГХ/МС-методе в качестве газа-носителя использовали гелий при скорости потока 1 мл/мин. Входное отверстие для инъекций поддерживали при температуре 250°C с отношением деления потока 50:1. Во время анализа, продолжающегося 2 минуты, температуру печи поддерживали при 37°С. Селективный масс-детектор Agilent 5793N работал в режиме мониторинга одного иона (SIM) при отношении масса/заряд (m/z) 67. Для элюирования перманентного потока газов детектор отключали на 1,4-1,7 минут. В этих условиях было установлено, что изопрен (2-метил-l,3-бутадиен) элюировался через 1,78 минут. Для количественной оценки абсолютного количества изопрена использовали калибровочную таблицу, которая показывала линейную зависимость на участке от 1 мкг/л до 200 мкг/л. По оценкам, проводимым данным способом, предел детектирования составлял 50-100 нг/л.
DMAPP-анализ. Аликвоту 95 мкл фракции супернатанта, взятой из центрифугированного лизата клеток на Френч-прессе, добавляли в сосуды с зоной «хэдспейс». Затем добавляли 5 мкл-аликвоту 8 мМ DMAPP в 100 мМ фосфатно-калиевого буфера, pH 8,2, сосуды герметично закрывали и оставляли на 30 минут для инкубирования при комнатной температуре. Количество продуцированного изопрена измеряли с помощью ГХ/МС, как описано выше, и полученные данные систематизировали в таблице 5-2.
(мг/мл)
Величины, указанные в таблице 5-2, представляют собой средние значения для реакций с двумя различными концентрациями экстракта. Все белки, содержащие любые из указанных цистеиновых мутантов, способствовали значительному снижению ферментативной активности и явному снижению уровня растворимого белка, на что указывало относительное увеличение количества белка в нерастворимой (осажденной) фракции.
Пример 6
Мутация остатков в изопренсинтазе тополя
Выравнивание аминокислотных последовательностей изопренсинтаз пуэрарии волосистой и тополя с аминокислотными последовательностями других синтаз проводили с использованием устройства Vector Nti (Invitrogen). Выравниваемые последовательности включали: бета-оксименсинтазу Lotus corniculatus (AAT86042); предполагаемую терпенсинтетазу Medficago trunculata (AAV36465); гипотетический белок Vitis vinifera (can65805); гипотетический белок Vitis vinifera (CAN62729); пиненсинтазу Quercus ilex (CAK55186); IspS Pueraria montana (пуэрарии волосистой) Шарки (AAQ84170); монотерпенсинтазу Eucaliptus globulus (BAF02832); IspS Populus nigra Фортунати (CAL69918); IspS Populus tremuloides Шарки (AAQ16588); IspS Populus alba (BAD98243); и IspS Populus alba x tremula Циммера (CAC35696). Последовательность базы данных Populus alba x tremula (CAC35696) имела различные аминокислоты в положениях 272 и 497, которые в той или иной степени являются высококонсервативными. Кроме того, исходя из анализа модели гомологии IspS тополя, было обнаружено, что положение 453 идентифицировано в качестве третьего кандидата для проведения мутагенеза.
I. Мутагенез
Набор для множественного сайт-направленного мутагенеза QUIKCHANGE® (Stratagene) использовали в соответствии с инструкциями производителей для введения нижеследующих мутаций, отдельно и в комбинации, в последовательность IspS Populus alba x tremula (SEQ ID NO:7): K272R; C497W и N453D. Для мутагенеза использовали следующие праймеры:
K272R тополя: 5'-ccaaactgcacttcg ctcgtgaccgcctgattgag (SEQ ID NO:17);
N453D тополя: 5'-atctttcgcctgtgcgacgacctggcaagc (SEQ ID NO:18) и
C497W тополя: 5'-tgaatctgatcgacgaaacctggaagaaaatgaacaaagaaaaac (SEQ ID NO:19).
Для секвенирования использовали следующий праймер, InSeq тополя: 5'-gagaaaatcggtaaggaactgg (SEQ ID NO:8).
Мутагенез осуществляли в соответствии с инструкциями производителей и все три праймера для мутагенеза добавляли в одну реакционную смесь (100 нг каждого) с использованием pTrcPoplar в качестве матричной ДНК (100 нг). Добавление 0,5 мкл раствора Quiksolution ускоряло реакцию мутагенеза. Рассматриваемый ПЦР-цикл проводили при температуре отжига 55°C и времени удлинения 12 минут. Другие параметры цикла указаны в инструкциях. ПЦР-смесь обрабатывали ферментом DpnI в течение 4 часов при 37°C (1 мкл, каждую обработку проводили в течение 2 часов), и затем 5 мкл реакционной смеси переносили в химически компетентные клетки E. coli Top 10 (Invitrogen). Несколько колоний отбирали и высевали в 5 мл бульона Луриа (LB), содержащего карбенициллин (50 мкг/мл). Плазмиды выделяли с использованием набора QIAprep Spin Miniprep (Qiagen) и отдавали для секвенирования, проводимого с использованием прямых и обратных праймеров, которые гибридизовались с вектором, а также с использованием праймера InSeq тополя.
Были получены следующие варианты pTrcPoplar: pTrcPoplar K272R, pTrcPoplar K272R/N453D; pTrcPoplar K272R/N453D/C497W и pTrcPoplar 272R/497W. Данные плазмиды переносили в химически компетентные клетки BL21(λDE3)pLysS (Novagen) для проведения анализа. Варианты анализировали на активность в зоне «хэдспейс» (продуцирование изопрена из цельных клеток), растворимость и удельную активность.
II. Культивирование клеток и продуцирование изопрена
Варианты, родительский штамм тополя и штамм, содержащий pTrcKudzu, культивировали в течение ночи при 37°C в 5 мл среды Луриа-Бертани, содержащей карбенициллин (50 мкг/мл штаммов тополя) или канамицин (50 мкг/мл штамма пуэрарии). Полученные культуры разводили в бульоне TM3 до OD600=0,05, в который было добавлено 10 г/л глюкозы и либо 50 мкг/мл карбенициллина (мутанты тополя и штаммы дикого типа), либо 50 мг/л канамицина (BL21/pTrcKudzu). Бульон ТМ3 имел следующий состав: K2HPO4, (13,6 г/л), KH2PO4 (13,6 г/л), MgSO4•7Н2О (2 г), моногидрат лимонной кислоты (2 г/л), цитрат железа(3)-аммония (0,3 г/л), (NH4)2SO4 (3,2 г/л), дрожжевой экстракт (0,2 г/л), 1 мл 1000× модифицированного раствора следовых количеств микроэлементов, где pH доводили до 6,8 добавлением гидроксида аммония и объем доводили до нужной величины добавлением стерильной diH2O, затем стерилизовали на фильтре 0,22 микрон. 1000× раствор следовых количеств микроэлементов имел следующий состав: лимонная кислота•Н2О (40 г/л); MnSO4•Н2О (30 г/л); NaCl (10 г/л), FeSO4•7Н2О (1 г/л); CoCl2•6Н2О (1 г/л), ZnSO•7Н2О (1 г/л), CuSO4•5Н2О (100 мг/л), H3BO3 (100 мг/л), NaMoO4•2Н2О (100 мг/л). Каждый компонент сразу растворяли в diH2O, рН доводили до 3,0 добавлением HCl/NaOH и затем объем доводили до нужной величины и стерилизовали на фильтре 0,22 микрон.
Объем разведенной культуры в 250 мл-колбе Bellco Delong с перегородкой составлял 25 мл, и в этой колбе клетки культивировали при 30°С при перемешивании (225 об/мин). Образцы брали в асептических условиях, как указано выше, для измерения оптической плотности A600. Были получены две серии культур, одну из которых использовали для индуцирования 0,2 мМ IPTG и одну оставляли неиндуцированной. После 3-часового культивирования при 30°С со встряхиванием при 200 об/мин (OD600 ~0,5) одну серию культур индуцировали 0,2 мМ IPTG и инкубировали еще 3 часа при 30°С со встряхиванием при 200 об/мин и неиндуцированную серию дополнительно инкубировали в течение такого же периода времени. OD600 определяли для всех культур до индуцирования (через 3 часа после инокуляции) и во время измерения уровней изопрена с помощью анализа в зоне «хэдспейс» (через 3 часа после индуцирования, где общее время культивирования составляло 6 часов). Клеточные культуры центрифугировали при 7000×g в течение 15 минут на сверхскоростной центрифуге Sorvall для осаждения клеток. Супернатанты удаляли и замороженный клеточный осадок использовали в анализе in vitro на изопренсинтазную активность. Результаты культивирования и анализов в зоне «хэдспейс» представлены в нижеследующих таблицах.

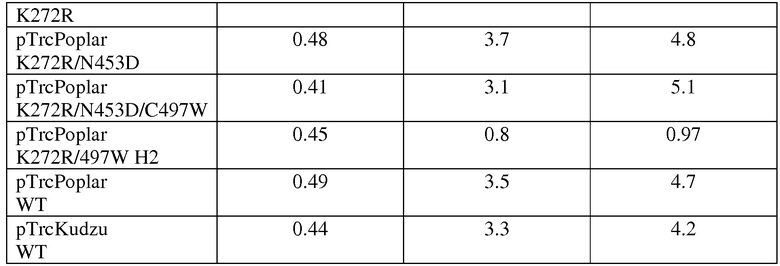
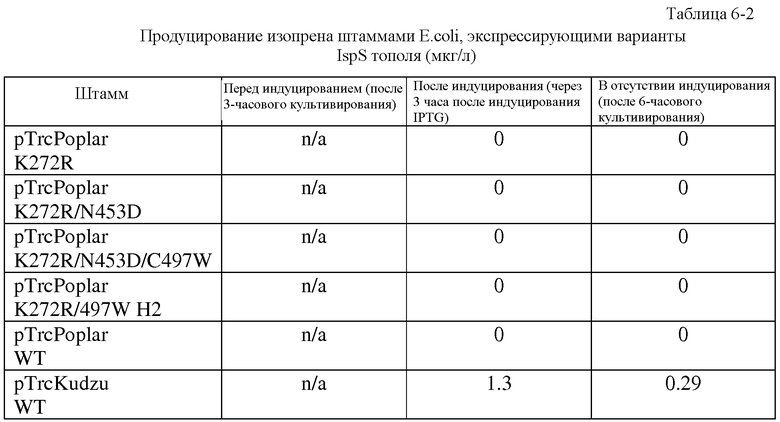
Неожиданно было обнаружено, что штамм, экспрессирующий IspS пуэрарии волосистой, продемонстрировал определенную степень детектируемого продуцирования изопрена. Обнаружение этого факта было неожиданным, если принять во внимание имеющиеся в литературе сообщения о том, что кинетические свойства ферментов тополя значительно превосходят свойства ферментов пуэрарии. В частности, в литературе указывается, что удельная активность (Ед/мг) и Km (мкМ) рекомбинантного IspS пуэрарии волосистой составляют 0,075 и 7700 соответственно, нативного IspS осины - 0,5 и 8000 соответственно, и рекомбинантного IspS тополя - 0,16 и 9000 соответственно (Silver and Fall, J Biol Chem, 270:13010-1316, 1995; Miller et al., Planta, 213:483-487, 2001; и Sharkey et al., Plant Physiology, 137:700-712, 2005). Опубликованные величины Km для этих трех ферментов являются достаточно высокими, и значения каждого фермента варьируются в пределах значений для двух других ферментов, однако удельная активность изопренсинтазы пуэрарии значительно меньше активности двух других изопренсинтаз.
III. Анализы на активность и растворимость изопренсинтазы
С помощью анализа DMAPP активность изопренсинтазы может быть измерена прямым способом, поскольку DMAPP является основным субстратом для фермента. Клеточный осадок родительского и мутантного штаммов тополя, а также пуэрарии дикого типа оттаивали и ресуспендировали в 2 мл PEB (50 мМ трис-HCl, pH 8,0, 20 мМ MgCl, 2 мМ дитиотреитола и 50% [об/об] глицерина). Клетки лизировали, за один пассаж, путем их разрыва на френч-прессе, при давлении 20000 фунт/кв. дюйм (138000 кПа). Лизат (1 мл) центрифугировали на микроцентрифуге в течение 20 минут при 20000 об/мин при 4°C. Супернатант удаляли и осадок ресуспендировали в 1 мл PEB. Образцы супернатанта и осадка анализировали с помощью электрофореза в ДСН-ПААГ и с помощью DMAPP-анализа и содержание общего белка определяли с помощью BCA.
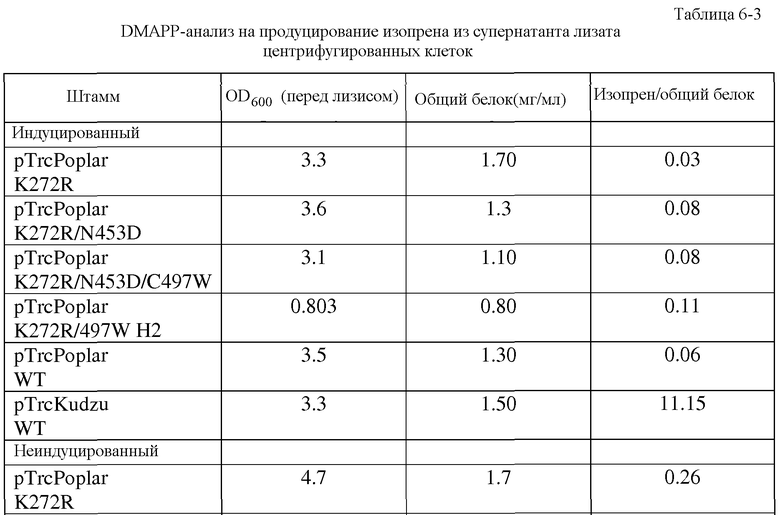
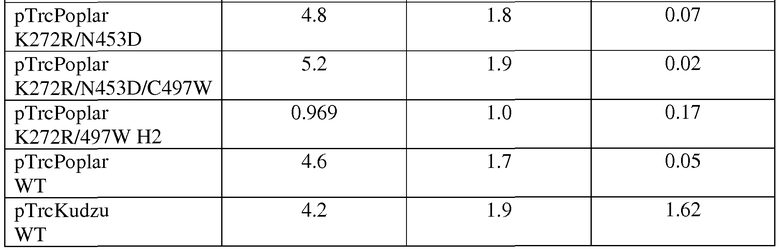
Уровень продуцирования нормализовали по уровню продуцирования общего белка в супернатанте клеточного лизата.
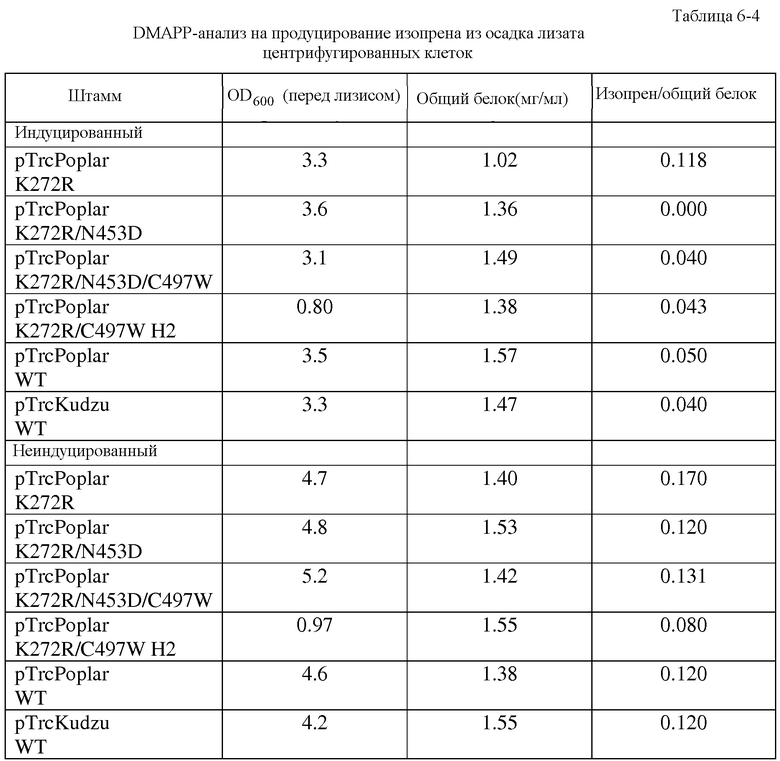
Уровень продуцирования нормализовали по уровню продуцирования общего белка осадка клеточного лизата.
Активность варианта K272R/C497W тополя в 1,8 раз превышала активность штамма дикого типа в супернатантной фракции индуцированных культур. Аналогичным образом, активность вариантов K272R и K272R/C497W тополя в 5,2 и 3,4 раз превышала активность штамма дикого типа в супернатантной фракции неиндуцированных культур. Кроме того, активность варианта K272R тополя в 2 раза превышала активность штамма дикого типа в осадке индуцированных культур. Однако самым неожиданным результатом является то, что IspS пуэрарии волосистой является более активным, чем используемый в данном случае IspS тополя (в 185 раз). В приведенных выше таблицах H2 является названием клона, обозначенного pTrcPoplar K272R/C497W H2.
Пример 7
Субклонирование изопренсинтазы пуэрарии
В данном примере описаны способы конструирования библиотек SEL изопренсинтазы пуэрарии (IspS). В целях создания экспрессионного вектора для конструирования библиотек оценочных сайтов (SEL) ген изопренсинтазы пуэрарии сублонировали в вектор pET24d (Novagen) из вектора pCR2.1 (Invitrogen). Ген IspS пуэрарии амплифицировали из матричной ДНК pTrcKudzu с использованием праймеров MCM50 5'-GATCATGCAT TCGCCCTTAG GAGGTAAAAA AACATGTGTG CGACCTCTTC TCAATTTACT (SEQ ID NO:20) и MCM53 5'-CGGTCGACGG ATCCCTGCAG TTAGACATAC ATCAGCTG (SEQ ID NO:21). ПЦР-реакции осуществляли с использованием ДНК-полимеразы Taq (Invitrogen) и полученный продукт клонировали в клонирующий вектор pCR2.1-TOPO TA (Invitrogen), который затем переносили в химически компетентные клетки E. coli Top 10 (Invitrogen). Трансформанты высевали на L-агар, содержащий карбенициллин (50 мкг/мл), и инкубировали в течение ночи при 37°C. Пять миллилитров культур в бульоне Луриа, содержащего 50 мкг/мл карбенициллина, инокулировали одиночными трансформантами и культивировали в течение ночи при 37°C. Пять колоний скринировали на «правильную» вставку путем секвенирования плазмидной ДНК, выделенной из 1 мл жидкой культуры (бульона Луриа), и очищали с использованием набора QIAprep Spin Mini-prep (Qiagen). Полученная плазмида, обозначенная MCM93, содержала кодирующую последовательность IspS пуэрарии в остове pCR2.1 (фиг.9). Последовательность MCM93 (SEQ ID NO:22) представлена на фиг.10.
Кодирующую последовательность пуэрарии удаляли путем гидролиза рестриктирующей эндонуклеазой с использованием ферментов Pcil и BamHI (Roche) и подвергали гель-очистке с использованием набора для гель-экстракции QIAquick (Qiagen). ДНК-вектор pET24d гидролизовали ферментами NcoI и BamHI (Roche), обрабатывали щелочной фосфатазой креветок (Roche) и очищали с использованием набора QIAprep Spin Mini-prep (Qiagen). Фрагмент IspS пуэрарии лигировали в NcoI/BamHI-гидролизованный pET24d с использованием набора для быстрого лигирования ДНК (Roche) в отношении фрагмент:вектор=5:1 в полном объеме 20 мкл. Часть смеси для лигирования (5 мкл) переносили в химически компетентные клетки E. coli Top 10 и высевали на L-агар, содержащий канамицин (50 мкг/мл). Нужный трансформант подтверждали путем секвенирования и переносили химически компетентные клетки BL21(λDE3)pLysS (Novagen). Моноколонии отбирали после культивирования в течение ночи при 37°C на L-агаре, содержащем канамицин (50 мкг/мл). Карта полученной плазмиды, обозначенной pET24D-Kudzu, представлена на фиг.11. Последовательность pET24D-Kudzu (SEQ ID NO:23) представлена на фиг.12. Активность IspS подтверждали с помощью анализа в зоне «хэдспейс», как описано в примере 5.
Пример 8
Конструирование библиотек оценочных сайтов изопренсинтазы (SEL)
Для улучшения кинетических параметров растительного IspS получали SEL в сайтах, выбранных из моделей гомологии ферментов IspS пуэрарии и тополя. Хотя с использованием моделей гомологии было предсказано, что конструирование в указанных сайтах будет улучшать свойства обоих ферментов, однако в данном примере описаны только SEL пуэрарии. Представляющими интерес поверхностными сайтами IspS пуэрарии являются, но не ограничиваются ими, 26 L, 30 E, 31 F, 33 Q, 35 L, 36 E, 37 N, 39 L, 40 K, 41 V, 43 K, 44 L, 61 R, 62 V, 63 D, 65 Q, 87 K, 94 E, 95 N, 99 L, 100 D, 105 N, 137 K, 138 E, 143 G, 144 E, 182 N, 184 L, 185 K, 187 G, 189 N, 190 T, 225 P, 226 H, 247 K, 257 T, 258 E, 259 M, 266 D, 334 N, 353 D, 357 S, 358 I, 361 E, 389 N, 392 I, 393 I, 398 K, 401 E, 421 C, 423 Q, 424 Q, 425 E, 426 D, 430 H, 432 L, 433 R, 434 S, 437 D, 443 R, 462 L, 463 E, 476 H, 478 N, 479 D, 485 Q, 508 D, 513 P, 515 A, 532 Q, 533 Y, 537 L, 538 G, 539 R, 542 Y, 543 A и 557 P. Представляющими интерес положениями активных центров IspS пуэрарии являются, но не ограничиваются ими: 24 P, 25 N, 309 Y, 310 D, 377 L, 381 F, 384 E, 399 Y, 402 N, 403 A, 406 S, 407 S, 409 G, 411 A, 413 L, 449 F, 456 A, 457 T, 458 S, 458 S, 459 A, 460 A, 461 E, 462 L, 463 E, 464 R, 465 G, 466 E, 467 T, 468 T, 469 N, 523 M, 527 S и 531 Y. Дополнительными представляющими интерес положениями активных центров IspS пуэрарии являются, но не ограничиваются ими: 20 A, 21 N, 22 Y, 23 Q, 271 R, 278 W, 299 F, 302 V и 408 S. Каждая библиотека SEL содержит клоны, которые включают максимум 20 различных вариантов. Так, например, SEL 531 изопренсинтазы пуэрарии содержит варианты, в которых ДНК-триплет, кодирующий тирозин в положении 531 зрелого фермента пуэрарии, заменен другим ДНК-триплетом, кодирующим аланин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, метионин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин или триптофан. Кратко, ДНК-триплеты со специфическими положениями в кодирующей цепи ДНК зрелого IspS являются замененными. Затем мутированные нуклеиновые кислоты IspS лигировали с подходящим экспрессионным вектором и использовали для трансформации подходящих клеток-хозяев.
Библиотеки оценочных сайтов создавали либо путем упорядочения синтетических конструкций (например, DNA2.0), либо путем упорядочения праймеров с последовательностью «nns», встроенной вместо мутированного кодона. Затем праймеры использовали для мутации гена для продуцирования SEL в указанном сайте с помощью описанных коммерчески доступных наборов для мутагенеза (например, Stratagene) (например, WO0507682A2). Мутированные кодоны идентифицировали путем анализа последовательности. Библиотеки сайтов располагали в виде массивов в 96-луночных мастер-планшетах и замораживали для последующего использования. Культуры выращивали в мастер-планшетах и приготавливали для скрининга.
Требуемыми конечными продуктами являются ферменты IspS, которые оптимально функционируют в хозяине, который был метаболически сконструирован для максимизации потока углерода посредством IspS. В этих целях было проведено несколько стадий скрининга для того, чтобы убедиться в правильности параметров. Репрезентативные стадии скрининга включают, но не ограничиваются ими, экспрессию, подачу DMAPP для продуцирования HG, обработку в микрореакторе, определение белков и анализы в зоне «хэдспейс». Скрининг путем экспрессии, проводимый одним из способов анализа на уровни белка, осуществляли следующим образом. Растворимые и нерастворимые фракции клеточных лизатов (полученных из лизированных клеточных культур) приготавливали путем центрифугирования. Полученные супернатанты и осадок анализировали с помощью электрофореза в ДСН-ПААГ. Процент растворимого белка определяли с помощью денситометрического анализа белка, присутствующего в супернатанте и в осадке.
В репрезентативном варианте осуществления изобретения библиотеки оценочных сайтов пуэрарии волосистой конструировали в экспрессионном векторе pET24D. Вектор pET24D-Kudzu, содержащий ген изопренсинтазы пуэрарии, служил в качестве матричной ДНК.
Материалы:
Вектор pET24D-Kudzu (~50 нг/мкл)
Праймеры для сайт-направленного мутагенеза IS пуэрарии (Integrated DNA Technologies)
Набор для множественного сайт-направленного мутагенеза QUIKCHANGE® (Stratagene)
Термоячейка MJ Research PTC-200 Peltier (Bio-Rad Laboratories)
Компетентные клетки One Shot TOP10 (Invitrogen)
Набор QIAprep Spin Miniprep (Qiagen)
Компетентные клетки BL21(λDE3) pLysS (Invitrogen)
Агаровые планшеты с бульоном Луриа (LB)
Способы
Метод мутагенеза основывался на технологии внесения кодон-специфических мутаций, где создание всех возможных мутаций в специфическом ДНК-триплете осуществляли с использованием одного прямого праймера длиной в 25-45 нуклеотидов, включающего специфическую сконструированную последовательность ДНК-триплета NNS (N=A, C, T или G и S=C или G), соответствующую последовательности мутируемого кодона. Данный способ позволяет осуществлять рандомизированное включение нуклеотидов в специфический представляющий интерес кодон pET24D-kudzu. В таблице 8-1 приведен список олигонуклеотидных праймеров, используемых для мутагенеза, где число в названии праймера соответствует положению кодона в последовательности зрелого фермента изопренсинтазы пуэрарии. Все олигонуклеотидные праймеры были синтезированы (Integrated DNA Technologies) в масштабе 100 нмоль и очищены в ПААГ.

ПЦР-реакцию проводили в 0,5-миллилитровой ПЦР-пробирке с тонкими стенками в соответствии с протоколом, рекомендованным производителями набора для множественного сайт-направленного мутагенеза QUIKCHANGE® (Stratagene), который включает: 1 мкл вектора pET24-Kudzu (50 нг/мкл); 1 мкл прямого мутагенного праймера для сайт-направленного мутагенеза IS пуэрарии (10 мкМ); 2,5 мкл 10X буфера для множественных реакций QUIKCHANGE®; 1 мкл dNTP-смеси, 1 мкл смеси множества ферментов QUIKCHANGE® (2,5 Ед/мкл); и 18,5 мкл дистиллированной автоклавированной воды до общего объема реакционной смеси 25 мкл. SEL pET24 пуэрарии волосистой амплифицировали в следующих условиях: 95°C, 1 минута (только 1-й цикл), и затем 95°C, 1 минута, 55°C, 1 минута, 65°C, 12 минут, и этот раунд повторяли 29 раз. Затем реакционную смесь гидролизовали ферментом DpnI (поставляемым в наборе для множественного сайт-направленного мутагенеза QUIKCHANGE®) путем добавления 1,5 мкл рестриктирующего фермента DpnI в каждую пробирку и затем смесь инкубировали при 37°C в течение 2 часов для гидролиза родительского вектора pET24D-kudzu. DpnI-обработанную ПЦР-смесь переносили в компетентные клетки One Shot TOP10 (Invitrogen), эти клетки высевали на планшеты с агаром LB, содержащим 50 мкг/мл канамицина, и затем инкубировали в течение ночи при 37°C. На следующий день 96 рандомизированных колоний собирали и секвенировали для идентификации минимум 15 из 19 возможных вариантов аминокислот. После идентификации вариантов, подвергнутых сайт-направленному мутагенезу, каждый вариант клона инокулировали в 5 мл-пробирку с LB+50 мкг/мл канамицина и культивировали в течение ночи при 37°C при встряхивании (250 об/мин). На следующий день плазмидную ДНК очищали с использованием набора QIAprep Spin Miniprep (Qiagen). Затем варианты переносили в компетентные клетки One Shot BL21(λDE3) pLysS (Invitrogen) для скрининга экспрессии белка, затем эти клетки высевали на планшеты с агаром LB, содержащим 50 мкг/мл канамицина и 30 мкг/мл хлорамфеникола, и инкубировали в течение ночи при 37°C.
Был также с успехом применен альтернативный способ продуцирования SEL pET24D-Kudzu в клетках E. coli BL21(λDE3)pLysS. Трансформанты TOP10-компетентных клеток, полученных из DpnI-обработанной ПЦР-смеси, описанной выше, собирали путем нанесения 3 мл среды LB на верхнюю часть агара и ресуспендирования клеток путем их соскабливания с планшета стерильным плоским скребком. 3 мл собранных ресуспендированных клеток затем использовали для инокуляции 25-миллилитровой шейкерной колбы, содержащей LB+50 мкг/мл канамицина. Затем собранную культуру культивировали в течение ночи при 37°C при встряхивании (250 об/мин). На следующий день плазмидную ДНК выделяли из собранных культур с использованием набора QIAprep Spin Miniprep (Qiagen). Затем собранную плазмидную ДНК переносили в компетентные клетки One Shot BL21(λDE3)pLysS для скрининга экспрессии белка, как описано выше.
Для приготовления мастер-планшета «правильные» конструкции распределяли по 96-луночным планшетам с четырьмя повторами. Одну колонию с нужной последовательностью использовали для инокуляции 4 лунок и культивировали в течение нескольких часов или в течение ночи при 37°С в среде LB, содержащей 50 мкг/мл канамицина, при встряхивании (200 об/мин). В культуры добавляли стерильный глицерин до конечной концентрации 15% (до конечного общего объема 150-200 мкл/лунка). Затем планшеты герметично закрывали с использованием мембран BREATHE-EASIER (EMS No по каталогу 70536-20) и хранили при -80°С.
Пример 9
Продуцирование и очистка телец включения, содержащих изопренсинтазу
Тельца включения, содержащие изопренсинтазу пуэрарии, образовывали при сверхэкспрессии фермента в присутствии шаперона GroELS в штамме BL21(λDE3). Кратко, плазмиду pETNHisKudzu (заявка США 61/013574, которая включена в настоящее описание посредством ссылки) субклонировали в pGro7 (Takara Catalog No. 3340) в соответствии с инструкциями производителей. 500 мл культуры выращивали, в основном, как описано ранее (Whittington et al., Proc. Natl. Acad. Sci. USA, 99:15375-15380, 2002). Несмотря на присутствие шаперона и на низкую температуру культивирования, эта культура продуцировала преимущественно тельца включения и только низкие уровни растворимого активного белка. Тельца включения собирали с использованием системы рефолдинга белка IFOLD (Novagen Catalog No. 71552-3) в соответствии с инструкциями производителей. Эта процедура приводила к образованию рекомбинантной изопренсинтазы пуэрарии с высоким выходом (>50 мг). Чистота телец включения проиллюстрирована на фиг.13. Этот препарат использовали для продуцирования кроличьей поликлональной антисыворотки против изопренсинтазы (Invitrogen).
Пример 10
Высокоэффективный биохимический скриниг вариантов изопренсинтазы
В данном примере описаны высокоэффективные способы определения изопренсинтазной активности. Библиотеки клеток-хозяев E. coli BL21(λDE3)pLysS, способных экспрессировать варианты изопренсинтазы, распределяли по 96-луночным планшетам и хранили в замороженном состоянии при -80°С в виде 15% глицериновых маточных растворов, описанных выше в примере 8. Для анализа планшета, содержащего до 96 вариантов, отпечатывание реплик главного планшета с глицериновым маточным раствором на агар с бульоном Луриа, содержащий соответствующий(ие) антибиотик(и) (например, 30 мкг/мл хлорамфеникола, 50 мкг/мл канамицина), осуществляли с помощью устройства с плавающими 96 иглами MULTI-BLOT (V & P Scientific Catalog No. VP 408AF). Планшет с репликами инкубировали в течение ночи при 30°С для осуществления роста бактериальных «пэтчей». С использованием такого же репликатора с плавающими иглами 96-луночный планшет с квадратными глубокими лунками, содержащий 250 мкл среды TM3, в которую было добавлено 0,08% дрожжевого экстракта Biospringer и 1% глюкозы и антибиотики (30 мкг/мл хлорамфеникола, 50 мкг/мл канамицина), инокулировали агаровой пластиной и инкубировали в течение ночи при 30°С. Бульон ТМ3 имел следующий состав: K2HPO4 (13,6 г/л), KH2PO4 (13,6 г/л), MgSO4•7Н2О (2 г), моногидрат лимонной кислоты (2 г/л), цитрат железа(3)-аммония (0,3 г/л), (NH4)2SO4 (3,2 г/л), дрожжевой экстракт (0,2 г/л), 1 мл 1000× модифицированного раствора следовых количеств микроэлементов, где pH доводили до 6,8 добавлением гидроксида аммония, и объем доводили до нужной величины добавлением стерильной diH2O, затем стерилизовали на фильтре 0,22 микрон. 1000× раствор следовых количеств микроэлементов имел следующий состав: лимонная кислота•Н2О (40 г/л); MnSO4•Н2О (30 г/л); NaCl (10 г/л), FeSO4•7Н2О (1 г/л); CoCl2•6Н2О (1 г/л), ZnSO•7Н2О (1 г/л), CuSO4•5Н2О (100 мг/л), H3BO3 (100 мг/л), NaMoO4•2Н2О (100 мг/л). Каждый компонент сразу растворяли в diH2O, рН доводили до 3,0 добавлением HCl/NaOH, затем объем доводили до нужной величины и стерилизовали на фильтре 0,22 микрон. Ночные культуры разводили в такой же среде до OD600=0,05 и культивировали в другом 96-луночном планшете с квадратными глубокими лунками (Thomson Instrument, Catalog No. 951652C), где каждая лунка содержала разведение 600 мкл. Разведенные культуры выращивали при 30°С при встряхивании до OD600=0,8 и затем индуцировали IPTG, добавленным до концентрации 400 мкМ. Затем планшет культивировали в течение 5 часов и определяли OD600 для оценки контроля качества и нормализации.
Культуры в объеме 400 мкл переносили в новый 96-луночный планшет (Perkin Elmer, Catalog No. 6008290) и клетки собирали путем центрифугирования на центрифуге Beckman Coulter Allegra 6R при 2500×g. Осадок ресуспендировали в 200 мкл гипотонического буфера (5 мМ MgCl2, 5 мМ трис-HCl, 5 мМ DTT, pH 8,0) и планшет замораживали при -80°С не менее 60 минут. Клеточный лизат получали путем оттаивания планшета и добавления 32 мкл буфера для DMAPP-анализа на изопренсинтазу (57 мМ трис-HCl, 19 мМ MgCl2, 74 мкг/мл ДНКазы I (Sigma Catalog No. DN-25), 2,63×105 ед/мл раствора лизоцима READYLYSE (Epicentre Catalog No. R1802M) и 5 мг/мл BSA с чистотой, соответствующей стандартам молекулярной биологии. Планшет инкубировали при встряхивании при 25°С в течение 30 минут и затем помещали на лед. Для продуцирования изопрена 80 мкл аликвоты лизата переносили в 96-луночный стеклянный планшет с глубокими лунками (Zinsser Catalog No. 3600600) и добавляли 20 мкл 10 мМ раствора DMAPP в 100 мМ KHPO4, pH 8,2 (Cayman Chemical Catalog No. 63180). Планшет герметично закрывали герметиком, изготовленным из листового алюминия (Beckman Coultor Catalog No. 538619), и инкубировали при встряхивании при 30°С в течение 60 минут. Ферментативные реакции прекращали путем нагревания стеклянного блока (70°С в течение 5 минут). Зону «хэдспейс» в каждой лунке количественно анализировали, как описано в примере 5.
Для определения концентрации белка 5 мкл или более лизата наносили на предварительно формованные гели (Invitrogen Catalog No. NP030 IBOX) для вестерн-блот-анализа после переноса на нитроцеллюлозную мембрану (Invitrogen Catalog No. LC2000). Используемым «первым» антителом является антитело против изопренсинтазы, описанное в примере 9. После связывания «первого» антитела осуществляли проявление «вторым» антителом, меченным Alexa Fluor 488 (Invitrogen Catalog No. A-11008) для количественного детектирования сигнала. Процедуру вестерн-блот-анализа осуществляли, как описано в инструкции Invitrogen. Флуоресцентный сигнал регистрировали на устройстве Molecular Dynamics STORM с использованием набора фильтров для синего диапазона спектра и количественно оценивали с помощью пакета компьютерных программ для анализа изображений Molecular Dynamics IMAGEQUANT. Удельную активность членов библиотеки вычисляли исходя из отношения количества продуцированного изопрена, деленного либо на A600 индуцированных культур, либо на концентрацию белка изопренсинтазы, определенную с помощью вестерн-блот-анализа. Стандарт белка изопренсинтазы калибровали с помощью стандартного денситометрического анализа в геле с использованием BSA, окрашенного кумасси бриллиантовым голубым R250, служащим в качестве первичного стандарта. Для последующего анализа составляли таблицу увеличения, снижения или отсутствия изменений удельной активности всей библиотеки. На фиг.14 представлены графики, иллюстрирующие изопренсинтазную активность членов библиотеки оценочных сайтов (SEL) пуэрарии волосистой для положений Y22, A20 и S408. Большинство членов обладали значительно более низкой активностью по сравнению с членами дикого типа, тогда как консервативные замены обнаруживали меньшее снижение активности. Активность варианта A20G приближалась к активности фермента пуэрарии дикого типа, что указывает на то, что этот вариант является кандидатом на его использование в качестве партнера для комбинаторного мутанта. Интересно отметить, что вариант S408D библиотеки S408 обнаруживал более высокую активность по сравнению с ферментом дикого типа, и поэтому он является другим кандидатом на его использование в качестве партнера для комбинаторного мутанта.
Пример 11
Усечения изопренсинтазы
В данном примере описана идентификация аминокислотной последовательности белка в нижней полосе дублета, наблюдаемого в очищенных препаратах IspS (см. фиг.21). Также была генерирована серия усеченных по N-концу молекул IspS, исходя из предполагаемых сайтов расщепления, идентифицированных с помощью масс-спектрометрии. Был также создан более короткий усеченный по N-концу IspS (усеченный «MEA» в pDu39, см. ниже) для оценки влияния дополнительного усечения на активность IspS (Williams DC, McGarvey DJ, Katahira EJ, Croteau R (1998) Biochemistry 37:12213-12220).
I. Конструирование усеченного по N-концу и 6XHis-меченного IspS (в pDu27) для очистки белка
Полноразмерный IspS P. alba, из матричного pET24a P. alba (фиг.19 и 20), получали с помощью ПЦР. Последующую ПЦР-реакцию осуществляли с использованием: 1 мкл (матричной) pET24a-P. alba, 5 мл 10× буфера для гибридизации PfuUltraII, 1 мкл dNTP (10 мМ), 1 мкл (50 мкМ) прямого праймера (MCM219), 1 мкл (50 мкМ) обратного праймера (MCM 182), 41 мкл diH2O и 1 мкл гибридизующей ДНК-полимеразы PfuUltra II Fusion (Stratagene). Циклы ПЦР проводили с помощью термоячейки Эппендорфа Mastercycler в следующем режиме: 29 циклов: 95°С, 1 минута, 95°С, 1 минута, 55°С, 20 секунд, 72°С, 27 секунд, и затем при 72°С, 3 минуты, и 4°С для охлаждения. ПЦР-продукт подвергали гель-экстракции и очищали с использованием 0,8% E-геля (Invitrogen) и геля для экстракции Qiagen QIAquick, а также набора QIAprep Spin Miniprep в соответствии с протоколом, рекомендованным производителями. Аликвоту в 3 мкл очищенного продукта лигировали в вектор pET200D/TOPO (Invitrogen) в соответствии с протоколом производителей. Реакционную смесь инкубировали в течение 5 минут при комнатной температуре и затем 6 мкл топоизомеразной смеси добавляли в химически компетентные клетки E. coli Top 10 (Invitrogen), в соответствии с протоколом производителей. Трансформанты отбирали на планшетах LB, содержащих канамицин (50 мкг/мл) (Kan50), и инкубировали при 37°С в течение ночи. Пять колоний собирали и скринировали на ПЦР-сферах PuReTaq Ready-To-Go PCR Beads (Amersham) с использованием прямого праймера T7 и праймера MCM182. Затем клоны, содержащие вставки «правильного» размера, дополнительно подтверждали путем секвенирования с использованием прямого праймера T7 и обратного праймера T7 (Quintara Biosciences). Одну конструкцию, pDu27 (фиг.16-18), отбирали для дальнейшего исследования. 1 мкл аликвоты плазмидного препарата переносили в клетки BL21(λDE3)pLysS (Invitrogen), в соответствии с протоколом производителей. Трансформанты отбирали на планшетах LB, содержащих Kan50+ и хлорамфеникол (35 мкг/мл) (Cm35), и инкубировали при 37°С в течение ночи. Полученный штамм использовали для экспрессии и очистки IspS P. alba, 6XHis-меченного по N-концу.
II. Очистка 6XHis-меченного IspS
Экспрессия 6XHis-меченного IspS
6XHis-меченный по N-концу IspS экспрессировали и выделяли из штамма MD08-99. Процедура культивирования является подходящей для экспрессии меченных гистидином ферментов в клетках BL2l(λDE3)pLysS. 10 мл ночной культуры получали для 1 литра каждой из стандартных культур. Соответствующие антибиотики (50 мг/мл канамиина, 50 мг/мл хлорамфеникола и/или 50 мг/мл карбенициллина) добавляли в 10 мл среды LB в 25 мл-колбе и инокулировали 1 колонией, взятой из свежего планшета с клетками или непосредственно из глицеринсодержащего замороженного клеточного исходного материала. Культуры выращивали при 30°С в течение ночи со встряхиванием при ~220 об/мин. Дневные культуры приготавливали в 1 литре среды LB, содержащей соответствующие антибиотики для каждой культуры. Каждый 1 литр дневной культуры инокулировали 10 мл ночной культуры и выращивали при 30°С со встряхиванием при ~220 об/мин до OD600~0,4-0,6. Затем дневные культуры индуцировали 400 мкМ IPTG и оставляли приблизительно на 5-6 часов при 30°С со встряхиванием при ~220 об/мин для дальнейшего роста. После этого клетки собирали путем центрифугирования при 10000×g в течение 10 минут при 4°С. После сбора клетки либо использовали непосредственно, либо хранили при -80°С до их использования в последующем способе.
Очистка 6XHis-меченного IspS
Для очистки меченных гистидином ферментов, выделенных из клеток BL21(λDE3)pLysS, клетки осторожно ресуспендировали в свежем буфере для лизиса (буфер для лизиса: Ni-содержащий промывочный буфер+0,5 мМ PMSF, 0,01% твин-20, 1 мг/мл лизоцима, 0,2 мг/мл DNasel; Ni-содержащий промывочный буфер: 50 мМ NaH2PO4, 300 мМ NaCl, 20 мМ имидазола, pH 8,0). На 1 литр клеточного осадка использовали приблизительно 40-50 мл буфера для лизиса. Затем клетки инкубировали на льду в течение приблизительно 30 минут. Затем клеточную суспензию полностью лизировали путем 2-3-кратного пропускания клеток через камеру Френч-пресса (крупные клетки пропускали через Френч-пресс при давлении, установленном на отметку 1200 фунтов/кв. дюйм)/высокое) до тех пор, пока лизат не становился прозрачным. Образец лизата сохраняли для анализа на активность и для анализа в геле (~100 мкл). Затем лизат осветляли путем его центрифугирования при 30000×g в течение 30 минут и при 4°С на ультрацентрифуге Sorvall Discovery 90SE. Супернатант удаляли и сохраняли. Образец «осветленного» лизата сохраняли для анализа на активность и для анализа в геле (~100 мкл).
Осветленный лизат пропускали через колонки HisTrap HP (GE Healthcare) с использованием градиента 0-100% Ni-содержащего буфера B. Затем образцы анализировали с помощью электрофореза в ДСН-ПААГ-геле (4-12% гель NUPAGE, Invitrogen), в соответствии с инструкциями производителей. Нужные фракции концентрировали на центрифужных фильтрах (Vivaspin-20, Sartoris) и затем обессоливали на обессоливающей колонке HiPrep 26/10 (GE heathcare), упакованной смолой Sephadex G25. Буфер G-25 состоял из 50 мМ HEPES, 50 мМ NaCl и 1 мМ DTT, pH 7,4. Затем нужный образец очищали на колонке HiTrapQ HP (GE) при элюировании градиентом 0% буфера с сефарозой Q (A)→100% буфера с сефарозой Q (В) (буфер с сефарозой Q (A): 50 мМ трис, 0,05M NaCl, 1 мМ DTT, pH 7,6; и буфер с сефарозой Q (В): 50 мМ трис, 1,0M NaCl, 1 мМ DTT, pH 7,6). Фракции, содержащие нужный белок, анализировали и концентрировали. Буфер для образца заменяли буфером, содержащим 50 мМ HEPES, 50 мМ NaCl, pH 7,4 и 1 мМ DTT, путем пропускания образца поверх обессоливающей колонки Hi Prep 26/10 (GE heathcare), упакованной смолой Sephadex G25. При необходимости проводили конечную стадию гель-фильтрации с глубокой очисткой. Образец пропускали через препаративную колонку с высокой загрузкой (Hi) Superdex 200 с чистотой, соответствующей стандарту 26/60 (GE), в буфере для гель-фильтарции: (50 мМ HEPES, 150 мМ NaCl, 1 мМ DTT, pH 7,4). Затем фракции анализировали и концентрировали. Затем образцы помещали на хранение -80°С. В целях приготовления образца для анализа полосы данный образец подвергали электрофорезу в ДСН-ПААГ (в 4-12% геле NUPAGE, Invitrogen), окрашивали и нужную полосу вырезали и обрабатывали, как описано ниже.
III. Масс-спектрометрия изопренсинтазы
Приготовление образцов
Была проведена процедура гидролиза в геле и масс-спектрометрия LCQ-Deca (модифицированный по Розенфельду протокол гидролиза в геле) (Rosenfeld et al, Anal. Biochem. (1992) 203, 173-179; Hellman et al, Anal Biochem, (1995) 224, 451-455). Очищенный образец изопренсинтазы подвергали электрофорезу в 4-12% ПААГ с ДСН (NUPAGE, Invitrogen) и окрашивали кумасси бриллиантовым голубым R-250 (Thermo Scientific) или безопасным красителем SimplyBlue (Invitrogen). Представляющую(ие) интерес полосу(ы) вырезали из геля и обесцвечивали. Каждый кусочек геля разрезали кубиками на небольшие части размером ~1 мм×1 мм и помещали в 0,65-миллилитровые пробирки с «очень гладкой поверхностью» (силиконовые), поставляемые компанией PGC Scientific. В каждую пробирку добавляли приблизительно 100 мкл 25 мМ NH4HCO3/50% ACN/Н2О и встряхивали в течение 10 минут. Супернатанты экстрагировали и отбрасывали. Эти стадии повторяли два раза. Затем кусочки геля сушили досуха в центрифуге Savant SpeedVac (~20-30 минут).
Затем образцы восстанавливали и алкилировали. Для восстановления на осушенные гели наносили 25 мкл (или количество, достаточное для нанесения покрытия) 10 мМ DTT в 25 мМ NH4HCO3 (свежеприготовленного). Затем пробирки встряхивали и быстро центрифугировали. Реакционные смеси инкубировали при 50°С в течение 1 часа. Для алкилирования супернатанты удаляли и на гель наносили 25 мкл или более 55 мМ йодацетамида (IAA) в 25 мМ NH4HCO3. Пробирки с реакционными смесями встряхивали и снова быстро центрифугировали. Реакционные смеси оставляли на 1 час в темноте при комнатной температуре. Супернатанты удаляли и гели промывали ~100 мкл 25 мМ NH4HCO3/50% ACN/Н2О путем встряхивания в течение 10 минут и быстрого центрифугирования. Супернатант удаляли и стадию промывки проводили еще один раз. Затем кусочки геля сушили на центрифуге SpeedVac (~15-30 минут).
Буфер для гидролиза получали путем добавления 400 мкл 0,1% н-октил-B-D-глюкопиранозидазы-воды к 100 мкл 8M мочевины. 400 мкл полученного буфера для гидролиза добавляли к 20 мкг свежеприготовленного трипсина. Из одного сосуда, содержащего 20 мкг трипсина с чистотой, подходящей для секвенирования, брали 0,05 мкг/мкл трипсина с чистотой, подходящей для секвенирования (Promega), и это количество растворяли в 400 мкл 1,6M раствора мочевины. Раствор фермента трипсина добавляли в количестве, достаточном для покрытия кусочков геля. Пробирки покрывали парафильмом и инкубировали при 37°С в течение ночи (16-20 часов). При этом допускается, что поверх геля будет присутствовать небольшой избыток буфера.
Пептиды экстрагировали из гелей путем быстрого встряхивания и центрифугирования гидролизата. Раствор гидролизата переносили в силиконовую 0,65 мл-пробирку наконечником пипетки для загрузки геля. 50% ACN/0,1% FA/H2O в количестве 50 мкл (достаточного для покрытия) наносили на кусочки геля и образцы встряхивали в течение 10 минут, центрифугировали и затем обрабатывали ультразвуком в течение пяти минут. Экстрагированные пептиды собирали вместе в одну пробирку. Стадии экстракции повторяли еще 2-3 раза до тех пор, пока кусочки геля не приобретали белую окраску и не уменьшались в размере. Экстрагированные гидролизаты встряхивали, центрифугировали и сушили на центрифуге Speed Vac до объема 55 мкл. В случае, когда объем составлял менее чем 55 мкл, для достижения конечного объема 55 мкл достаточно добавить 0,1% FA.
Масс-спектрометрия
Образец впрыскивали в масс-спектрометр с ионной ловушкой, работающий в режиме ионизации электрораспылением (ESI) Thermofinnigan (San Jose, CA) LCQ-Deca. При этом использовали колонку с C18 Vydac (5 микрон, 300A, 0,2×150 мм, Michrom Bioresources, Auburn, CA) и со скоростью потока 200 мкл/мин. Объем впрыска составлял 50 мкл, и образец, перед его загрузкой на колонку, фильтровали через подсоединенный к колоночной системе патрон-ловушку (Peptide CapTrap, Michrom Bioresources, Auburn, CA). Разделение гидролизата в геле осуществляли в нижеследующем градиенте (растворитель A: 0,1% трифторуксусная кислота в Н2О (J.T. Baker, Phillipsburg, NJ), растворитель B: 0,08% трифторуксусная кислота в ацетонитриле (J.T. Baker, Phillipsburg, NJ)):

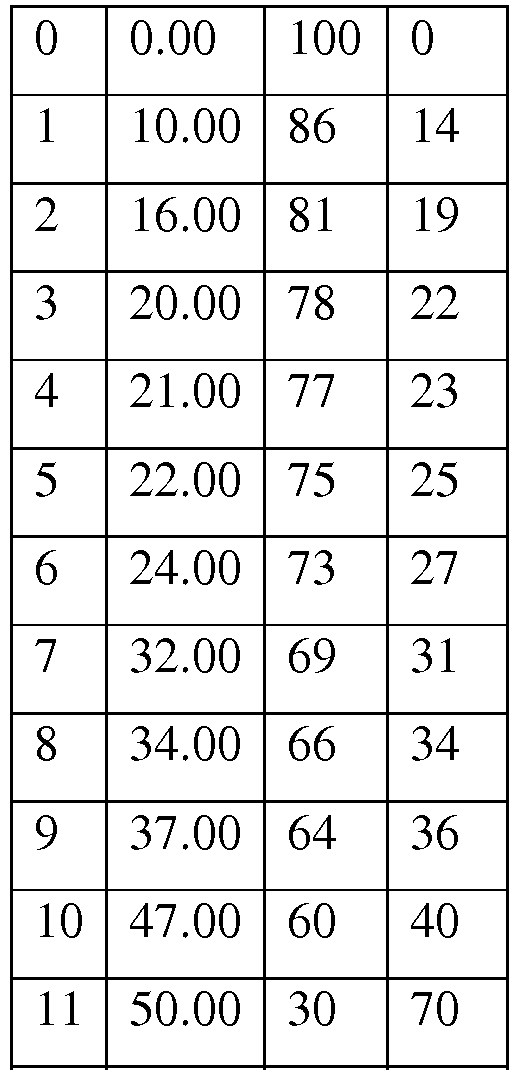
Результаты масс-спектрометрии
6,4 мкг-аликвоты белка загружали на 5 дорожек 4-12% бис-трис-геля NUPAGE (Invitrogen), буфера MOPS и проводили электрофорез в течение 50 минут. Как описано выше, гель окрашивали в течение 2 минут и затем обесцвечивали в течение 15 минут. Полученный гель промывали в Н2О, затем все полосы вырезали, разрезали на мелкие кусочки и обесцвечивали. Кусочки восстанавливали и алкилировали DTT/IAA в течение 1 часа, при 52°С и при комнатной температуре, каждый, соответственно. Для проведения гидролиза в течение ночи добавляли трипсин. Экстрагированные пептиды вводили в масс-спектрометр LCQ-Deca. На фиг.21 и 22 представлены результаты масс-спектрометрического анализа. Нижнюю полосу дублета (на фиг.21) идентифицировали как IspS. На фиг.22 показано, что N-концевые усечения наблюдались за аминокислотами 39, 40, 42 и 44 (соответствующим пептидной последовательности His-меченного по N-концу белка IspS в pDu27). C-конец IspS оставался интактным.
IV. Конструирование усеченных по N-концу вариантов IspS
Все усеченные конструкции без аффинных меток получали с помощью набора для сайт-направленного мутагенеза QuickChange Site-directed Mutagenesis (Stratagene) с использованием матричной pET24a P. alba для ПЦР-амплификации. Приблизительно 50 нг матричной DNA использовали для амплификации (на термоячейке Эппендорфа Mastercycler для проведения градиентной ПЦР) мутагенного ПЦР-продукта с использованием пары прямых (For) и обратных (Rev) праймеров, соответствующих каждому релевантному усечению (прямого QC MSV и обратного QC MSV, см., например, таблицу 11-2). Использованы следующие ПЦР-смеси, содержащие: 1 мкл P. alba pET24a, 5 мкл 10X буфера PfuUltra HF, 1 мкл dNTP, 1 мкл (50 мкМ) прямого праймера (например, прямого праймера QC MSV For), 1 мкл (50 мкМ) обратного праймера (например, QC MSV Rev), 2 мкл ДМСО, 39 мкл diH2O, 1 мкл полимеразы PfuUltra HF (Stratagene). Циклы ПЦР осуществляли в следующем режиме: 95°С, 1 минута, 95°С, 30 секунд, 55°С, 1 минута, 68°С, 7,3 минут для одного цикла, и затем 95°С, 30 секунд, 55°С, 1 минута, 68°С, 7,3 минут для всех 18 циклов, и наконец, при 4°С. ПЦР-продукты обрабатывали 1-2 мкл DpnI (Roche) в течение 1-3 часа при 37°С. 5 мкл-аликвоту DpnI-обработанных продуктов визуализировали на 0,8% Е-геле (Invitrogen). 1 мкл-аликвоту каждого продукта переносили в химически компетентные клетки E. coli Top 10 (Invitrogen) в соответствии с протоколом производителей. Трансформанты отбирали на среде LB, содержащей канамицин в концентрации 50 мкг/мл (Kan50), и инкубировали в течение ночи при 37°С. Пять колоний каждого трансформанта отбирали и культивировали до достижения стационарной фазы роста в 3 мл жидкой среды LB с Kan50. Плазмиды очищали с использованием набора Qiagen miniprep, в соответствии с протоколом, рекомендованным производителями. Очищенные плазмиды секвенировали (Quintara Biosciences) с использованием прямого и обратного праймеров T7 и подтверждали на их соответствующее усечение. Полученные плазмиды (pDU39-pDU43, см. таблицу 11-4, фиг.23-34) переносили в химически компетентные клетки E. coli BL21(λDE3)pLysS (Invitrogen), в соответствии с протоколом, рекомендованным производителями. В таблице X описаны штаммы, используемые для экспрессии усеченных ферментов IspS.
Конструкции с аффинной меткой (6XHis) и с меткой для протеолиза (TEV, вирус табачной гравировки) получали с использованием pET24a P. alba в качестве матрицы для ПЦР-реакций. Была получена ПЦР-смесь, содержащая: 1 мкл (pET24a P. alba), 5 мкл 10× буфера PfuUltraII для гибридизации, 1 мкл dNTP (10 мМ), 1 мкл праймера (50 мкМ) Alba FL-NdeI-For или Alba TRC (MEA)-NdeI-F, 1 мкл праймера (50 мкМ) Alba FLTRC (+) TEV-R, 41 мкл diH2O и 1 мкл PfuUltra II ДНК-полимеразы для гибридизации, полученной от Stratagene. Циклы ПЦР осуществляли в следующем режиме: 95°С, 1 минута, 95°С, 30 секунд, 55°С, 20 секунд, 72°С, 25 секунд, для одного цикла, с последующими дополнительными 28 циклами при 95°С, 30 секунд, 55°С, 20 секунд, 72°С, 25 секунд, и наконец, 72°С, 3 минуты, и затем при 4°С. После амплификации и подтверждения «правильной» молекулярной массы продукта путем визуализации на 0,8% E-геле (Invitrogen), ПЦР-продукты гидролизовали рестриктирующими ферментами NdeI и XhoI (Roche) в течение 2 часов при 37°С и затем подвергали гель-очистке с использованием системы гелей для очистки Qiaquick (Qiagen), в соответствии с протоколом, рекомендованным производителями. 3 мкл очищенного продукта лигировали в pET-24a (Invitrogen), которую гидролизовали ферментами NdeI и XhoI (Roche), и подвергали гель-очистке и дефосфорилированию (с использованием SAP, щелочной фосфатазы креветок) (Promega), в соответствии с протоколами, рекомендованными производителями. Лигазу T4 (NEB) использовали для реакции лигирования, и полученную реакционную смесь инкубировали в течение ночи при 16°С. Реакционную смесь для лигирования диализовали в воде в течение 30 минут, и 2 мкл полученной реакционной смеси использовали для электропорации компетентных клеток MCM331 (см. ниже). Клетки оставляли на 2 часа при 30°С для регенерации и затем отбирали на Kan50 с использованием 5 мМ (R)-(-)-мевалонолактона (MVA) (Sigma), распределенного по планшету. Положительные трансформанты инокулировали в 3 мл жидкого LB с Kan50 и плазмиды выделяли с использованием набора QIAPrep Spin miniprep (Qiagen). Вставки подтверждали путем гидролиза рестриктирующими ферментами NdeI и XhoI (Roche) и положительные клоны секвенировали (Quintara Biosciences) с использованием секвенирующих праймеров для промотора T7 и терминатора T7. 1 мкл каждой плазмиды (см. таблицу 11-4 для описания плазмиды и фиг.35-39) переносили в химически компетентные клетки E. coli BL21(λDE3)pLysS (Invitrogen), в соответствии с протоколом, рекомендованным производителями. Трансформанты отбирали на планшетах с LB Kan50+Cm35 (хлорамфеникол, 35 мкг/мл) и инкубировали при 37°С. Описание всех экспрессионных штаммов приведено в таблице 11-5.
Штамм MCM331 получали следующим образом. Синтетический оперон, содержащий гены мевалонаткиназы, мевалонатфосфаткиназы, мевалонатпирофосфат-декарбоксилазы и IPP-изомеразы, интегрировали в хромосому E. coli. При желании, экспрессия может быть модифицирована путем интеграции различных промоторов, находящихся у 5'-конца по отношению к оперону.
i) Конструирование вектора-мишени
Сайт attTn7 отбирали для интеграции. Области гомологии, находящиеся выше (выше attTn7) (праймеры MCM78 и MCM79) и ниже (ниже attTn7) (праймеры MCM88 и MCM89), амплифицировали с помощью ПЦР из клеток MG1655. 50 мкл реакционной смеси, содержащей 1 мкл 10 мкМ праймеров, 3 мкл ddH2O, 45 мкл суперсмеси для ПЦР Invitrogen Platinum PCR Supermix High Fidelity, и колонию MG1655, полученную путем соскоба, денатурировали 2 минуты при 94°С за 25 циклов (2 мин при 94°С, 30 сек при 50°С и 1 мин при 68°С), удлиняли в течение 7 минут при 72°С и охлаждали до 4°С. Полученную ДНК клонировали в pCR2.1 (Invitrogen) в соответствии с инструкциями производителей и получали плазмиды MCM278 (выше attTn7) и MCM252 (ниже attTn7). 832 п.н. фрагмент ApaI-PvuI, гидролизованный и подвергнутый гель-очистке из MCM252, клонировали в ApaI-PvuI-гидролизованную и очищенную на геле плазмиду pR6K и получали плазмиду MCM276. 825 п.н. PstI-NotI-фрагмент, гидролизованный и подвергнутый гель-очистке из MCM278, клонировали в PstI-NotI-гидролизованную и очищенную на геле плазмиду MCM276, в результате чего получали плазмиду MCM281.
ii) Клонирование компонентов нижнего пути и промотора
Гены MVK-PMK-MVD-IDI амплифицировали из pTrcKKDyIkIS с использованием праймеров MCM104 и MCM105 с применением ПЦР-системы удлинения цепи Roche Expand Long PCR System, в соответствии с инструкциями производителей. Полученный продукт гидролизовали ферментами NotI и ApaI и клонировали в MCM281, который был гидролизован ферментами NotI и ApaI и очищен на геле. Праймеры MCM120 и MCM127 использовали для амплификации кластера CMR из матричной ДНК GeneBridges FRT-gb2-Cm-FRT с использованием Pfu Ultra II Stratagene. ПЦР-программу, а именно: денатурацию при 95°С, 4 мин; 5 циклов при 95°С, 20 сек, 55°С, 20 сек, 72°С, 2 мин; 25 циклов при 95°С, 20 сек, 58°С, 20 сек, 72°С, 2 мин, 72°С, 10 мин; и последующее охлаждение до 4°С проводили с использованием четырех реакционных 50 мкл-смесей для ПЦР, содержащих 1 мкл ~10 нг/мкл матрицы, 1 мкл каждого праймера, 1,25 мкл 10 мМ dNTP, 5 мкл 10× буфера, 1 мкл фермента и 39,75 мкл ddH2O. Реакционные смеси объединяли, очищали на колонке для ПЦР-очистки Qiagen и использовали для электропорации промытых водой клеток Pirl, содержащих плазмиду MCM296. Электропорацию проводили в 2 мМ-кюветах при 2,5 В и 200 Ом. Реакционные смеси после электропорации регенерировали в LB в течение 3 часов при 30°С. Трансформант MCM330 отбирали на LA с использованием CMP5, Kan50.
iii) Интеграция в хромосому E. coli
Мини-препарат ДНК (набор Qiaquick Spin), полученный из MCM330, гидролизовали ферментом SnaBI и использовали для электропорации BL21(DE3) (Novagen) или MG1655, содержащих плазмиду pRedET Carb GeneBridges. Клетки культивировали при 30°С приблизительно до OD1 и затем индуцировали 0,4% L-арабинозы при 37°С в течение 1,5 часа. Полученные клетки три раза промывали в ddH2O при 4°С и затем подвергали электропорации с использованием 2 мкл ДНК. Интегранты отбирали на L-агаре, содержащем хлорамфеникол (5 мкг/мл), и затем подтверждали, могут ли данные интегранты расти на среде с L-агаром+канамицином (50 мкг/мл). BL21-интегранты MCM331 и MG1655 и интегрант MCM333 хранили в замороженном виде.






V. Биохимический анализ IspS с усечениями
Относительную активность различных усеченных по N-концу ферментов IspS определяли с помощью DMAPP-анализа. Штаммы, описанные выше, анализировали с помощью DMAPP-анализа в 96-луночном планшете. Все штаммы анализировали с четырьмя повторами. Термин «полноразмерный» вариант означает фермент IspS, экспрессируемый в клетках BL21(λDE3)pLysS (Invitrogen) из плазмиды pET24a P. alba.
Результаты: В таблице X показано, что при нормализации по OD600 все штаммы MD09-173 (с плазмидой pDu39), MD09-175 (pDu41), MD09-176 (pDu42) и MD09-177 (pDu43) обладали более высокой DMAPP-активностью, чем «полноразмерный» фермент IspS (в штамме BL21(λDE3)pLysS с pET24a) P. alba.
VI. Подробный кинетический анализ "MEA"-усечений в IspS
Была определена относительная удельная активность, и оцененную кинетику изопренсинтаз P. alba с N-концевыми усечениями сравнивали с кинетикой «полноразмерных» изопренсинтаз P. alba. В данном анализе использовали четыре штамма, экспрессирующие четыре различных конструкции: BL21(λDE3)pLysS с pET24a P. alba; MD09-173; MD09-165 и MD09-167 (штаммы, подробно описанные выше). Указанные штаммы экспрессируют «полноразмерную» IspS P. alba, усеченную IspS P. alba (с MEA-усечением), «полноразмерную» IspS P. alba с C-концевой TEV- и His-меткой и «усеченную» IspS P. alba с C-концевой TEV- и His-меткой соответственно. В описанных ниже экспериментах термин «усеченный» относится, в частности, к MEA-варианту IspS P. alba.
Все штаммы инокулировали в среду LB, содержащую 30 мг/л хлорамфеникола (Cm) и 50 мг/л канамицина, и культивировали в течение ночи в 2-миллилитровых пробирках для культивирования при 37°С. На следующее утро ночные культуры разводили 1:100 в 25 мл бульона LB, содержащего 30 мг/л хлорамфеникола (Cm) и 50 мг/л канамицина, и культивировали при 37°С до достижения OD ~0,5. Каждый штамм культивировали с тремя повторами. Затем культуры индуцировали 400 мкМ IPTG и инкубировали при 37°С в течение 4 часов. 20 мл каждой культуры центрифугировали при 3000×g в течение 20 минут и супернатант отбрасывали. Осадок хранили в замороженном виде при -80°С в течение ночи. Осадок ресуспендировали в 2 мл буфера, содержащего 100 мМ триса, 100 мМ NaCl, 0,25 мг/мл лизоцима и 0,25 мг/мл ДНКазы, pH 8. Клеточные суспензии два раза обрабатывали на Френч-прессе при давлении 20000 фунт/кв. дюйм (138000 кПа) и затем лизат центрифугировали при 14000×g в течение 20 минут, с получением бесклеточного экстракта, который использовали для кинетических исследований и определения концентрации белка.
Для измерения удельной активности 5 мкл бесклеточного экстракта от каждого штамма инкубировали с 5 мМ DMAPP, 50 мМ MgCl2 в буфере, содержащем 100 мМ триса и 100 мМ NaCl (pH 8) до конечного объема 100 мкл в течение 15 минут при 30°С в 2-миллилитровых газонепроницаемых сосудах. Реакции прекращали добавлением 100 мкл 500 мкМ EDTA, pH 8. Образцы анализировали с помощью ГХ-МС для определения концентрации изопрена в зоне «хэдспейс» сосудов.
Для определения kcat и KM 5 мкл бесклеточного экстракта от каждого штамма инкубировали с DMAPP в концентрациях от 0,625 до 40 мМ DMAPP в буфере, содержащем 100 мМ триса, 50 мМ MgCl2 и 100 мМ NaCl (pH 8) до конечного объема 100 мкл в течение 15 минут при 30°С в 2-миллилитровых газонепроницаемых сосудах. Реакции прекращали добавлением 100 мкл 500 мкМ EDTA, pH 8. Образцы анализировали с помощью ГХ-МС для определения концентрации изопрена в зоне «хэдспейс» сосудов. Данные анализировали с использованием программы Kaleidagraph и строили кривую в соответствии с нижеследующим уравнением, для неконкурентного ингибирования субстрата: скорость/E=kcat*S/(KM+S*(1+S/Ki)). Все данные получали с тремя повторами за исключением варианта MD09-167 с 2,5 мМ DMAPP, который получали в дубликате.
Бесклеточный экстракт помещали в микрофлюидизатор для электрофореза (Caliper Life Sciences, Hopkinton, MA, USA), для количественной оценки изопренсинтазы в каждом образце. Образцы чипа и белков в микрофлюидизаторе получали в соответствии с инструкциями производителей (LabChip® HT Protein Express, P/N 760301).
Лизаты культур получали в 96-луночных микротитрационных планшетах путем добавления 50 мМ триса pH 8,0, содержащего 0,1% твина 20, 0,1 мг/мл лизоцима, 1,0 мкг/мл ДНКазы при комнатной температуре в течение 30 минут с последующим центрифугированием. Затем супернатанты переносили в другой 96-луночный планшет и хранили при -20°С до использования, то есть когда их оттаивали при комнатной температуре в течение 30 минут. После быстрого встряхивания 2 мкл каждого образца культуры переносили в 96-луночные ПЦР-планшеты (Bio-Rad, Hercules, CA, USA), содержащие 7 мкл буфера для образцов (Caliper), и затем планшеты нагревали до 90°С в течение 5 минут на планшете с подогревом, снабженном термостатом для регуляции температуры. Затем планшеты оставляли для охлаждения и к каждому образцу добавляли 35 мкл воды. После чего планшеты помещали в устройство, содержащее поставляемый стандартный белок, и калибровали в соответствии с инструкциями производителей. Этот прибор осуществлял смешивание образца с флуоресцентным красителем, который нековалентно связывался с белком, и затем проводили электрофорез через гелевую матрицу. По мере продвижения белков за фокальную точку на чипе регистрировали флуоресцентный сигнал и определяли концентрацию белка путем количественной оценки сигнала по отношению к сигналу, генерируемому калиброванной серией белковых стандартов.
ош. (с-1)
ош. (мМ)
ош. (мМ)
Параметры определяли путем составления нижеследующего уравнения неконкурентного ингибирования субстрата по данным, полученным для зависимости скорости/[E] от [DMAPP]:

Удельную активность (S.A.) вычисляли для реакционных смесей, содержащих 5 мМ DMAPP, 50 мМ MgCl2, 100 мМ триса, 100 мМ NaCl и 2,5-4,5 мкг изопренсинтазы, полученной из супернатанта лизата целых клеток. Реакции осуществляли при 30°С в течение 15 минут с тремя повторами с использованием независимо выращенных культур.
Результаты/Обсуждения
Определяли удельную активность каждого белка (фиг.40 и таблица 11-7). Удельная активность усеченной изопренсинтазы приблизительно в 2 раза превышала удельную активность полноразмерной изопренсинтазы. Полноразмерная изопренсинтаза с С-концевой His-меткой обладала приблизительно такой же удельной активностью, как и полноразмерная изопренсинтаза. His-меченная по С-концу и усеченная изопренсинтаза обладала меньшей удельной активностью, чем немеченая усеченная изопренсинтаза, но большей удельной активностью, чем обе полноразмерные изопренсинтазы.
Скорость превращения DMAPP в изопрен оценивали в интервалах концентраций DMAPP для определения параметров kcat и KM ферментов (фиг.41 и 42 и таблица 11-7). Все ферменты имели профили скорости, соответствующие неконкурентному DMAPP-ингибированию субстрата. Ki для полноразмерных конструкций превышал Ki для усеченных конструкций, как было определено по изменению Ki и наблюдению наилучшего соответствия (R-величина) для этих данных (данные не приводятся). На фигурах, представленных в настоящем описании, все данные соответствовали Ki 10 мМ. Величины KM усеченной изопренсинтазы были ниже соответствующих величин KM для полноразмерных изопренсинтаз. Поэтому по мере снижения концентрации субстрата отношение изопренсинтазной активности усеченной изопренсинтазы к активности полноразмерной изопренсинтазы увеличивалось (фиг.43). Величины kcat усеченных изопренсинтаз превышали величины kcat полноразмерных изопренсинтаз. Это приводило к увеличению изопренсинтазной активности для усеченных изопренсинтаз по сравнению с активностью полноразмерных изопренсинтаз при всех концентрациях субстрата (фиг.43). Было определено отношение изопренсинтазной активности усеченной изопренсинтазы к активности полноразмерной изопренсинтазы при различных уровнях DMAPP (фиг.43).
Выводы: «Усеченные» изопренсинтазы имели более высокие значения kcat и более низкие значения KM в отношении катализа превращения DMAPP в изопрен, по сравнению со значениями для «полноразмерных» изопренсинтаз. Удельная активность «усеченных» изопренсинтаз превышала удельную активность «полноразмерных» изопренсинтаз. Наиболее активной изопренсинтазой является вариант «МЕА» немеченой усеченной изопренсинтазы (в штамме MD09-173). Усеченная изопренсинтаза, по сравнению с полноразмерной изопренсинтазой, может обладать более высокой активностью в организмах, используемых для продуцирования изопрена.
Пример 12
Обогащение клеток изопренсинтазой - Снижение токсичности DMAPP
В данном примере идентифицировали замены остатков в IspS, которые сообщают ферменту более высокую активность посредством улучшения кинетических свойств, повышения уровня экспрессии, повышения растворимости или улучшения каких-либо других свойств, благодаря которым DMAPP более эффективно превращается в изопрен под действием изопренсинтазы. Данная процедура позволяет снижать уровни внутриклеточного цитотоксичного DMAPP путем экспрессии улучшенных вариантов IspS. В популяции клеток, экспрессирующих гетерогенную смесь вариантов IspS, такие наиболее эффективные ферменты должны усиливать рост их штамма-хозяина и в такой смешанной популяции, количество этих ферментов должно быть увеличено.
I. Конструирование штаммов
Конструирование штаммов MCM518-521 и 528-531, в которых промоторы лямбда запускают интегрированный mKKDyI, описано ниже. Праймеры MCM120 и MCM224 (таблица 12-1) использовали для амплификации кластера резистентности из матрицы GeneBridges FRT-gb2-Cm-FRT с использованием набора для гибридизации с геркулазой II Stratagene Herculase II Fusion, в соответствии с протоколом производителей. Циклы четырех реакций с 50 мкл-смесью проводили следующим образом: 95°С, 2 мин (95°С, 20 сек, 55°С 20 сек, 72°С, 1 мин) за 30 циклов; затем 72°С, 3 мин; и 4°С для охлаждения. Четыре реакционных смеси объединяли, очищали на ПЦР-колонке Qiagen, в соответствии с протоколом производителей, и элюировали 60 мкл EB при 55°С.
Плазмиду pRedET-carb (GeneBridges) переносили путем электропорации в MCM446. Трансформанты извлекали путем встряхивания в течение одного часа в среде SOC (Invitrogen) при 30°С и затем отбирали на планшетах со средой LB, содержащей карбенициллин (50 мкг/мл) (carb50) при 30°С в течение ночи. Резистентную к карбенициллину колонию замораживали и обозначали MCM508 (таблица 12-2).
Штамм MCM508 культивировали в виде свежего штриха в 5 мл LB/carb50 при 30°С до достижения OD600~0,5. Затем добавляли 40 мМ L-арабинозы и культуру инкубировали при 37°С в течение 1,5 часа. Клетки собирали и подвергали электропорации с использованием 3 мкл очищенных ампликонов, как описано выше, и затем извлекали в 500 мкл SOC при 37°С в течение 1,5-3 часов. Трансформанты отбирали на планшетах со средой LB/kan10 при 37°С.
Рекомбинацию ампликона в локусе-мишени подтверждали с помощью ПЦР-праймеров GB-DW и MCM208. Полученные ампликоны секвенировали для идентификации четырех клонов с нижеследующими последовательностями. Чувствительные к карбенициллину клоны замораживали в виде штаммов MCM518-521.
MCM518-521 снова высевали штрихом на планшеты LB с kan10 и выращивали в течение ночи при 37°С.
Штаммы MCM518-521 культивировали в LB/kan 10 при 37°С и затем подвергали электротрансформации с использованием плазмиды pCP20 (Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA. 2000 Jun 6;97(12):6640-5). Клетки извлекали в 500 мкл SOC при встряхивании при 30°С в течение 1 часа. Трансформанты отбирали на планшетах LB/carb50 при 30°С в течение ночи. На следующее утро колонию от каждого трансформанта культивировали при 30°С в жидкой среде LB/carb50 до тех пор, пока не наблюдалось видимого помутнения колоний. Затем культуру доводили до 37°С и оставляли по меньшей мере на 3 часа. Клетки полученной культуры высевали штрихом на планшеты LB и культивировали в течение ночи при 37°С.
На следующий день колонии переносили в виде «пэтчей» на среду LB, LB/carb50 и LB/kan10. Клоны, которые не росли ни на carb50, ни на kan10, культивировали в жидкой среде LB из пэтчей, содержащихся на LB, и затем замораживали и обозначали MCM528-531.
Последовательности ДНК
Такая сборка включает новые промоторы, встроенные в хромосому в штаммах MCM518-521, а также промоторы, расположенные в самом начале ОРС mMVK. Выше за этой сборкой находится последовательность кластера GeneBridges FRT-gb2-Cm-FRT. Ниже находится остаточная область ОРС mMVK и за ней остальная часть интегрона нижнего пути MVA штамма MCM508.



neo-PL.2-mKKDyI (из MCM521) трансдуцировали в клетки BL21(λDE3) для создания штамма MD09-171. Получали лизат Pl штамма MCM521 и трансдуцировали в клетки BL21(λDE3) стандартными методами молекулярной биологии (Miller, A Short Course in Bacterial Genetics). Трансдуктанты отбирали на планшетах со средой Kan20-LB. Затем положительные колонии подтверждали с помощью ПЦР для идентификации присутствия PL.2-mKKDyI в штамме BL21(λDE3). Затем 1 мкл плазмиды pCP20 переносили в этот штамм, отбирали на LB+Carb50 и инкубировали при 30°С. Затем положительные трансформанты высевали штрихом на планшет LB и инкубировали при 37°С для удаления плазмиды pCP20. Для подтверждения отсутствия маркера резистентности к неомицину (канамицину) колонии, которые росли при 37°С, высевали в виде пэтчей на планшеты с LB+Kan20, с LB+Carb50 и только с LB. Штаммы, которые содержали интегрированный PL.2 mKKDyI и не содержали маркер резистентности к канамицину и в которых отсутствовала плазмида pCP20, должны быть чувствительными к канамицину и к карбенициллину. 4 штамма KanS+CarbS подвергали ПЦР-анализу на присутствие mKKDyI в BL21(λDE3) с использованием родительского штамма BL21(λDE3) в качестве контроля. После ПЦР-подтверждения присутствия mKKDyI полученный штамм трансформировали 1 мкл плазмиды pLysS (Invitrogen). Полученный штамм, MD09-171, использовали в описанных ниже экспериментах по обогащению.

II. Ингибирование роста MCM531 под действием мевалоновой кислоты
Ночную культуру MCM531 (см. описание штамма) подвергали обратному разведению до OD600=0,05 (это значение соответствовало OD600~0,005 в 96-луночном планшет-ридере) (SpectraMax M2, Molecular Devices). Затем разведенную культуру разделяли на аликвоты в отдельные лунки 96-луночного планшета с глубокими лунками, в которые была добавлена стандартная среда TM3 (13,6 г K2PO4, 13,6 г KH2PO4, 2,0 г MgSO4•7Н2О), содержащая 1% глюкозы и 0,8 г/л дрожжевого экстракта Biospringer (1% конечного дрожжевого экстракта)) с 0, 1, 5, 10, 15 или 20 мМ MVA. На фиг.44 показана кривая роста MCM531 в различных концентрациях MVA. Каждую концентрацию MVA анализировали с четырьмя повторами, при этом величина ошибки является ничтожно малой. На фиг.44 показано, что рост MCM531 значительно ингибировался при концентрациях 5 мМ MVA и выше.
III. Мутагенез IspS и анализ методом отбора/обогащения
Для генерирования открытой рамки считывания IspS со случайно введенной мутацией использовали набор для мутагенеза доменов клона GeneMorph II EZ (Stratagene), в соответствии с протоколом, рекомендованным производителями. Специфические праймеры для амплификации матрицы (Pdu39 (pET24a-P. alba (MEA))) описаны ниже (таблица 12-3, прямой и обратный праймеры pET24 Megaprime). Для достижения желаемой частоты мутаций рекомендуется следовать протоколу, описанному в наборе GeneMorph II. Для введения 2-3 замен остатков на молекулу проводили начальную ПЦР-реакцию с использованием приблизительно 150 нг исходной матричной ДНК. Большее или меньшее количество матрицы использовали для продуцирования ферментов IspS с меньшими или большими заменами остатков соответственно. Затем для амплификации остальной части плазмиды использовали полученные мутантные «мегапраймеры», в соответствии с протоколом, рекомендованным производителями.
Конечный ПЦР-продукт из набора GeneMorph II обрабатывали ферментом DpnI, в соответствии с протоколом, рекомендованным производителями. Перед переносом в E. coli реакционную смесь для ПЦР необходимо обессолить путем микродиализа. Обычно приблизительно 20 мкл реакционной ПЦР-смеси подвергали микродиализу и использовали для электропорации в штамм MD09-171 (таблица 12-2) стандартными методами молекулярной биологии. После электропорации клетки извлекали в течение 2 часов при 30°С и затем высевали на среду LB-Kan50 Cm35. Трансформанты в полном объеме высевали для получения всех мутаций, полученных методом мутагенеза.
Для обогащения все трансформанты соскабливали и объединяли. Аликвоты от каждого пула замораживали и хранили при -80°С. Перед обогащением штаммы (контрольные или экспериментальные пулы) инокулировали непосредственно в среду LB с Kan50 и культивировали в течение нескольких часов для минимизации утраты гетерогенности пула. После периода извлечения клетки разводили в жидкой среде TM3 (описанной выше), содержащей Kan50, 5 мМ MVA и 200 мкМ IPTG. (Точное разведение определяли эмпирически для каждого пула/источника среды/контрольной реакции). Затем культуры помещали в шейкерный инкубатор при 34°С до OD600 не более чем 5. На этой стадии плазмиды выделяли из 1 мл «обогащенной» культуры, в соответствии с протоколом Miniprep (Qiagen). Затем полученный плазмидный препарат переносили в электрокомпетентные клетки MD09-171, как описано выше. Затем трансформированные клетки восстанавливали в течение 2 часов в среде LB без антибиотиков и полученные клетки подвергали дополнительному раунду обогащения путем разведения в TM3 с Kan50, 5 мМ MVA и 200 мкМ IPTG, как описано выше. Полученную культуру помещали в шейкерный инкубатор при 34°С до OD600 не более чем 5, как описано выше. Затем плазмиды очищали, снова трансформировали и подвергали дополнительным раундам «обогащения». Процесс обогащения включал 5 или 6 раундов отбора, очистки плазмиды и повторной трансформации. Этот процесс продолжали до тех пор, пока культура не становилась гомогенной, то есть содержала только один вариант IspS, на что указывал секвенирующий анализ.
После проведения последнего раунда обогащения плазмидный пул переносили в химически компетентные клетки E. coli Top 10 (Invitrogen), в соответствии с протоколом, рекомендованным производителями, и затем регенерировали, высевали на среду LB с Kan50 и отправляли в лабораторию для полного секвенирования (Quintara Biosciences) для сравнения данных последовательностей с последовательностью IspS P. alba дикого типа. Праймеры, используемые для секвенирования, описаны ниже.
IV. Замены отдельных остатков, идентифицированные по обогащению/снижению токсичности DMAPP
Плазмиды, выделенные путем отбора/обогащения, полностью секвенировали. Последующие замены остатков подтверждали путем секвенирования (Quintara Biosciences). Нумерация остатков соответствует нумерации остатков «полноразмерной» последовательности P. alba (в pET24a P.alba; SEQ ID NO:120), где исходным метионином является аминокислота номер 1. Идентифицированными заменами остатков являются: V10M, F12S, T15A, E18G, V58I, V58F, L70Q, L70V, L70T, T71P, V79L, E89D, G94A, S119F, F120L, G127R, E175V, T212I, S257A, R262G, A266G, F280L, N297K, F305L, L319M, E323K, A328T, D342E, A359T, K366N, E368D, L374M, S396T, V418S, K438N, H440R, T442I, T442A, I449V, A469S, K500R, K505Q, G507S, S509N, F511Y и N532K.
Ниже представлены комбинации замен остатков (в одном ферменте IspS), идентифицированные путем обогащения/снижения токсичности DMAPP: G127R/F511Y, L70Q/G94A/R262G/F305L, F12S/T15A/E18G/N297K, S396T/T442I, V10M/E323K, F120L/A266G, K438N/K500R, V79L/S509N, E175V/S257A/E368D/A469S, T71P/L374M, F280L/H440R, E89D/H440R, V58F/A328T/N532K, S119F/D342E/I449V и K366N/G507S.
Пример 13
Конструирование библиотек насыщения сайтов (SSL) и биохимический анализ варианта L70R
Данный пример включает анализ возможных аминокислотных замен в сайтах, идентифицированных методом отбора/обогащения, описанным выше, и в других представляющих интерес потенциальных сайтах (в активном центре, консервативном для видов тополя), на их влияние на растворимость, экспрессию и активность IspS.
I. Конструирование штаммов
Остатки, идентифицированные методом отбора/обогащения (L70, G94, R262, F305), описанным выше, отбирали для анализа. Кроме того, остатки, предположительно, участвующие в связывании с субстратом (F303, V3065, F385, S412, Q416, F450), и остатки, отличающиеся от остатков у различных видов тополя (например, V418, T442), были отобраны для дальнейшего анализа (нумерация остатков соответствует нумерации остатков «полноразмерной» аминокислотной последовательности IspS P. alba). Для генерирования рандомизированного пула аминокислотных замен (библиотека насыщения сайтов, SSL), pDu39 (описание см. выше) подвергали мутагенезу QuickChange (Stratagene) с использованием праймеров QC, указанных ниже (таблица 13-1), в соответствии с протоколом, рекомендованным производителями. Была получена реакционная ПЦР-смесь, которая включала: 1 мкл pDu39, 5 мкл 10× буфер PfuUltra HF, 1 мкл dNTP, 1 мкл (50 мкМ) прямого праймера (например, QC L69 F), 1 мкл (50 мкМ) обратного праймера (например, QC L69 R), 2 мкл ДМСО, 39 мкл diH2O и 1 мкл полимеразы PfuUltra HF (Stratagene). Циклы ПЦР для мутагенеза QuickChange проводили в следующем режиме: 1 цикл: 95°С, 1 мин, 95°С, 30 сек, 55°С, 1 мин, 68°С, 7,3 мин, и затем, более 17 циклов: 95°С, 30 сек, 55°С, 1 мин, 68°С, 7,3 мин. Затем температуру снижали до 4°С. Введение оснований NNK в кодон для остатков, описанных выше, позволяет встраивать кодоны, которые представляют все 20 возможных аминокислот в данном сайте. 1 мкл полученных пулов мутагенных ПЦР-продуктов обрабатывали ферментом DpnI (как описано выше) и переносили в химически компетентные клетки E. coli Top 10 (Invitrogen), в соответствии с протоколом, рекомендованным производителями. Все реакционные смеси для трансформации регенерировали в 1 мл среды LB без антибиотиков при 37°С в течение 1 часа и высевали на среду LB с Kan50. На следующий день все трансформанты соскабливали с LB-планшетов, тщательно смешивали и плазмиды очищали с помощью набора miniprep (Qiagen). Затем пулы плазмид переносили в химически компетентные клетки BL21(λDE3)pLysS (Invitrogen), в соответствии с протоколом производителей. Реакционные смеси для трансформации регенерировали в 1 мл среды LB при 37°С в течение 1 часа и затем высевали на среду LB с Kan50+Cm35 при разведениях, достаточных для разделения позитивных колоний. После инкубирования в течение ночи при 37°С отдельные колонии инокулировали в отдельные лунки 96-луночного микротитрационного планшета с глубокими лунками (VWR), содержащими, каждая, 500 мкл жидкой LB с Kan50+Cm35. В восемь лунок (обычно столбец 12, A-H) инокулировали штамм MD09-173 (см. выше) или штамм BL21(λDE3)pLysS с pET24a P. alba (полноразмерная плазмида), используемый в качестве контроля для DMAPP-анализа. Затем микротитрационные планшеты герметично закрывали полупроницаемой мембраной (Breathe-Easier, Diversified Biotech) и инкубировали в течение ночи при 30°С в шейкерном инкубаторе (Vertiga). На следующий день 100 мкл образцов от каждой лунки в 96-луночном планшете смешивали с 50 мкл 50% глицерина в новом 96-луночном 200 мкл-планшете, замораживали и хранили при -80°С до проведения следующего анализа. Затем этот планшет использовали для DMAPP-анализа, описанного ниже.
II. Приготовление «наилучшего» планшета («Winner») для проведения второго анализа и идентификации L70R как варианта с повышенной удельной активностью
Для последующего анализа отбирали варианты, которые обнаруживали повышенное специфическое продуцирование изопрена, по сравнению с ферментом дикого типа. На фиг.45 представлен типичный набор данных, полученных в SSL-планшете, для отдельных остатков, и в данном случае для L70. Из этого специального планшета образцы в лунках C3 (27), D3 (39) и E3 (51) отбирали для последующего анализа. Другие варианты для различных остатков (перечисленных выше), которые обнаруживали повышенный уровень продуцирования изопрена при проведении DMAPP-анализа, выделяли из их исходных SSL-планшетов, которые хранились при -80°С (как описано выше), и перераспределяли в новом «наилучшем» планшете для вторичного скрининга. В качестве контроля использовали две лунки, содержащие MD09-173. Все варианты секвенировали (Quintara Biosciences) и подвергали DMAPP-анализу, описанному выше. См. таблицу 13-2, в которой представлены результаты секвенирования. Для DMAPP-анализа рост каждого варианта анализировали по отдельности, и поэтому генерировали один лизат, но с четырьмя повторами, для получения статистически значимых данных. Данные для образцов, проанализированых при OD600, представлены в таблице 13-2. Анализ белка осуществляли на всех лизатах с использованием набора для вестерн-блот-анализа Western Breeze Western blot (Invitrogen) с последующим детектированием флуоресценции на приборе Storm860 (см. ниже).
III. DMAPP-анализ - Культивирование, лизис и измерение уровня изопрена
«Пэтч»-планшет приготавливали из планшета с ночным маточным раствором глицерина с использованием планшета для создания крупных пэтчей на LB-агаре, содержащим CM35/Kan50 (VP-Scientific Replication Tool). Культуры инкубировали при 30°С в течение ночи (20-24 часов). Планшеты хранили при 4°С в течение периода времени до одной недели.
Ночную культуру для ее культивирования в планшете получали из 500 мл среды LB с CM35/Kan50. 300 мкл/лунка среды LB с CM35/Kan50 пипеткой закапывали в глубокие лунки 96-луночного планшета. С помощью устройства для репликации (V&S Replication Tool) инокулят в виде пэтча переносили в 96-луночный планшет с глубокими лунками. Среду инокулировали путем покачивания устройства, что приводило к вибрации игл в лунках. Планшет для выращивания культуры в течение ночи герметично закрывали мембраной для герметичного закрытия планшетов Breathe-Easier. Планшет инкубировали при 30°С в течение ночи в шейкерном инкубаторе Vertiga при 800 об/мин в течение 16-18 часов.
96-луночный планшет с глубокими лунками для дневных культур приготавливали путем закапывания 588 мкл/лунка среды LB CM35/Kan50. Планшет для ночных культур вынимали из инкубатора и культуры 50-кратно разводили. 12 мкл ночной культуры переносили в планшет для дневных культур, содержащий 588 мкл/лунка добавленной среды LB. Планшет для ночных культур герметично закрывали новой мембраной для герметичного закрытия планшетов Breathe-Easier и инкубировали при 34°С и 800 об/мин в течение 2,25 часа в шейкерном инкубаторе Vertiga.
Для индуцирования экспрессии IspS 12 мМ оттаянного IPTG выливали в стерильный 50 мл- или 100 мл-резервуар и пипеткой закапывали в количестве 20 мкл/лунка в каждые 600 мкл/лунка культуры. Планшет для ночных культур снова герметично закрывали новой мембраной для герметичного закрытия планшетов Breathe-Easier и инкубировали при 34°С и 800 об/мин в течение 4 часов в шейкерном инкубаторе Vertiga.
Для сбора клеток 200 мкл индуцированной культуры переносили в 450 мкл-планшет Nunc для хранения. Этот планшет центрифугировали при 3300 об/мин в течение 20 мин при 4°С на низкоскоростной настольной центрифуге. 180 мкл супернатанта удаляли с помощью пипетки-дозатора и отбрасывали. Планшет герметично закрывали мембраной из алюминиевой фольги, покрывали плоской пластиковой крышкой, замораживали и хранили при -80°С.
Затем регистрировали OD600 планшетов. 150 мкл 1× PBS пипеткой закапывали в 96-луночный планшет Costar Read Plate (#9017). Затем 50 мкл образцов культуры переносили на планшет-ридер. Считывание OD600 проводили на планшет-ридере Spectramax.
Лизис: Планшет для сбора размораживали на водяной бане при комнатной температуре в течение 4 мин и затем инкубировали в термомиксере при 25°С и при 1200 об/мин в течение 1 мин. В 20 мкл/лунка клеток в камере для сбора пипеткой закапывали буфер для лизиса при 80 мкл/лунка. 1,25× буфера с маточным рабочим раствором для лизиса получали из 6,25 мл 1M триса, pH 8, 625 мкл 10% твина 20, 312,5 мкл 0,2M PMSF, 462,5 мкл 10 мг/мл ДНКазы I (Sigma), 1,25 мл 1M MgCl2, 132,5 мкл 25000 ед/мкл лизоцима (Epicentre Technologies) и 40,968 мл diH2O. Планшеты инкубировали на термомиксере при 25°С и 1200 об/мин в течение 30 минут. 1× маточный раствор буфера для лизиса получали путем разведения 19 мл 1,25× рабочего раствора для лизиса 4,75 миллилитра diH2O.
Рабочий маточный раствор DMAPP получали следующим образом:
25 мг диметилаллилпирофосфата (триаммониевой соли) (Cayman Chemicals, Cat No. 63180)
В качестве разбавителя использовали 0,1M фосфат калия. 200 мкл/лунка переносили в лунки с образцами путем закапывания и хранили на льду.
DMAPP-реакция: 1× буфер для лизиса пипеткой закапывали в количестве 65 мкл/лунка. 15 мкл/лунка лизата переносили в соответствующие лунки с образцом в 96-луночном стеклянном блоке с глубокими лунками Zinsser. Реагент DMAPP пипеткой закапывали в количестве 20 мкл/лунка. Стеклянный блок заклеивали мембраной из алюминиевой фольги и инкубировали при 25°С и при 450 об/мин в течение 45 мин. Реакцию прекращали путем переноса стеклянного блока в водяную баню при 70°С и инкубирования в течение 6 минут. ГХ-анализ осуществляли, как описано выше.
IV. Вестерн-блот-анализ изопренсинтазы с использованием флуоресцентно меченного «второго» антитела
Образцы получали и подвергали электрофорезу в бис-трис-гелях NativePAGE™ Novex® (Invitrogen), в соответствии с протоколом производителей. После завершения электрофореза гели сразу переносили на нитроцеллюлозные мембраны с использованием блот-модуля XCeIl II™ (Invitrogen), в соответствии с протоколом, рекомендованным производителями. После переноса мембрану помещали в 15 мл соответствующего блокирующего раствора (вода, подвергнутая ультрафильтрации, 31,5 мл, блокатор/разбавитель (часть A), 9 мл, блокатор/разбавитель (часть В), 4,5 мл) в закрытой пластиковой чашке, поставляемой в наборе, и инкубировали в течение 30 минут на роторном шейкере, установленном на 1 об/сек. Блокирующий раствор декантировали и мембрану 2 раза ополаскивали 20 мл воды в течение 5 минут. Мембрану инкубировали с 15 мл раствора «первого» антитела (Ab) (24 мкл «первого» Ab в 15 мл блокирующего раствора) в течение 1 часа, с последующими 3-кратными промывками в течение 5 минут 20 миллилитрами 1× промывочного раствора антител. Затем мембрану инкубировали в 15 мл раствора «второго» антитела (15 мкл «второго» Ab (козьего антитела против кроличьих IgG, меченного Alexa Fluor 488 (H+L, Invitrogen)) в 15 мл блокирующего раствора) в течение 30 минут. Мембрану 3 раза промывали 20 мл промывочного раствора антитела в течение 5 минут и два раза ополаскивали 20 мл воды в течение 2 минут. Мембрану сушили, помещая ее между бумажными полотенцами, и хранили при комнатной температуре для последующего детектирования. Флуоресцентные полосы детектировали и количественно оценивали с использованием визуализатора Storm 860 Molecular Imager (GMI, Inc).
V. Результаты
В таблице 13-2 представлены все соответствующие данные для каждого проанализированного варианта: результаты секвенирования, замены остатков, средний уровень продуцирования изопрена, концентрации белка и средняя удельная активность (для всех 4 репликатов). На фиг.46 дано графическое представление данных, указанных в таблице 13-2. Удельную активность вычисляли путем умножения уровня продуцированного изопрена (мкл/л) на 0,0414 и затем деления полученного результата на концентрацию белка (мг/мл). Этот коэффициент преобразования (0,0414) вводят для учета общего объема зоны «хэдспейс» в герметично закрытом 2-миллилитровом ГХ-сосуде (1,9 мл), объема лизата (15 мкл), продолжительности DMAPP-анализа (45 мин) и молекулярной массы изопрена. Таким образом, величины удельной активности выражали в нмоль изопрена/мг Isps/мин.
Данные, представленные в таблице 13-2 и на графике на фиг.46, показали, что из всех проанализированных вариантов все три варианта L70R имели большую удельную активность, чем фермент дикого типа. Для дополнительного анализа вариантов L70R величины удельной активности для всех 3 изолятов (4 повторности для каждого) усредняли и сравнивали с контролем (2 изолята в каждом из 4 повторов). Поэтому было проведено 12 измерений для варианта L70R и 8 измерений для фермента дикого типа. Эти данные показаны ниже в таблице 13-3. С учетом поправок на белок, варианты L70R обнаруживали 25%-ное увеличение активности по сравнению с активностью MD09-173 (MEA-усечение). На фиг.47 представлена средняя удельная активность для всех вариантов L70R по сравнению с активностью MEA. Величины ошибок представляют одно стандартное отклонение. Две серии данных для L70R и MEA-контроля оценивали с использованием t-критерия Стьюдента для проведения статистического анализа и получали величину P=6,0011×10-5.

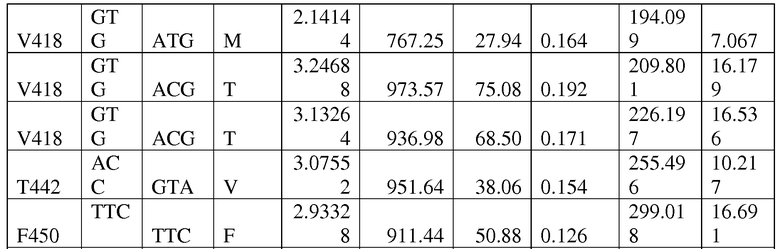
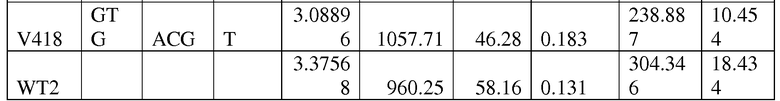
Следует отметить, что последовательности всех плазмид идентичны последовательности Pdu39 (см. выше), за исключением указанного кодона. Варианты L70R выделены серым цветом.
Пример 14
Усеченные изопренсинтазы P. alba, P. tremuloides, P. trichocharpa и пуэрарии
В данном примере описано получение серий усеченных ферментов IspS P. alba, P. tremuloides, P. trichocharpa и пуэрарии и определение влияния таких усечений на активность.
I. Конструирование штаммов
Все гены изопренсинтазы были оптимизированы по кодонам для E. coli, синтезированы и клонированы в pET24a с использованием программы DNA2.0 (Menlo Park, CA). Все усеченные конструкции получали с помощью набора для сайт-направленного мутагенеза QuickChange (Stratagene), с использованием описанных выше матриц pET24a P. alba (для плазмид pDu47-3-7, фиг.48, 49, 51-60), pET24a P. tremuloides (для плазмиды pDu48, фиг.49C, 61 и 62), pET24a P. trichocharpa (для плазмиды pDu49, фиг.50A, 63, 64), или pET24d-Kudzu (для плазмид pDu50 и 50-4, фиг.50B, 50C, 65-68) для ПЦР-амплификации. Приблизительно 50 нг матричной ДНК использовали для амплификации (на устройстве для градиентной ПЦР Эппендорфа Mastercycler) ПЦР-продукта с использованием пар прямых (For) и обратных (Rev) праймеров, соответствующих каждому релевантному усечению (QC Trunc-3 F и QC Trunc-3 R, например, см. таблицу 14-1). Были получены реакционные смеси для ПЦР, включающие: 1 мкл pET24a P.alba (или другой матрицы), 5 мкл 10X буфера PfuUltra HF, 1 мкл dNTP (10 мМ), 1 мкл (50 мкМ) прямого праймера, 1 мкл (50 мкМ) обратного праймера, 1,5 мкл ДМСО, 39,5 мкл diH2O и 1 мкл полимеразы PfuUltra HF. ПЦР-циклы проводили в следующем режиме: 18 циклов (95°С, 1 мин, 95°С, 1 мин, 55°С, 1 мин, 68°С, 7,30 мин), и затем при 4°С для охлаждения, в устройстве для градиентной ПЦР Эппендорфа Mastercycler. ПЦР-продукты обрабатывали 1-2 мкл DpnI (Roche) в течение 1-3 часов при 37°С. 5 мкл DpnI-обработанных продуктов визуализировали на 0,8% E-геле (Invitrogen). 1 мкл каждого продукта переносили в химически компетентные клетки E. coli Top 10 (Invitrogen) (в соответствии с протоколом производителей). Трансформанты отбирали на среде LB, содержащей канамицин в концентрации 50 мкг/мл (Kan50), и инкубировали в течение ночи при 37°С. Пять колоний каждого трансформанта отбирали и культивировали до стационарной фазы роста в 3 мл жидкой среды LB с Kan50. Плазмиды очищали с использованием набора QIAPrep Spin miniprep (Qiagen), в соответствии с протоколом, рекомендованным производителями. Очищенные плазмиды секвенировали (Quintara Biosciences) с использованием прямого и обратного праймеров Т7, сравнивали с родительской последовательностью и подтверждали на соответствующее усечение. Полученные плазмиды (pDu47-3 - pDu50-4, см. таблицу 14-2) переносили в химически компетентные клетки E. coli BL21(DE3)pLysS (Invitrogen), в соответствии с протоколом, рекомендованным производителями. В таблице 14-3 описаны штаммы, используемые для экспрессии усеченных ферментов IspS.
После инкубирования в течение ночи при 37°С отдельные колонии инокулировали в отдельные лунки 96-луночного микротитрационного планшета с глубокими лунками (VWR), содержащими, каждая, 500 мкл жидкой LB с Kan50+Cm35. Затем микротитрационные планшеты герметично закрывали полупроницаемой мембраной (Breathe-Easier, Diversified Biotech) и инкубировали в течение ночи при 30°С в шейкерном инкубаторе (Vertiga). На следующий день 100 мкл образцов от каждой лунки в 96-луночном планшете смешивали с 50 мкл 50% глицерина в новом 96-луночном 200 мкл-планшете, замораживали и хранили при -80°С до проведения следующего анализа. Затем планшет использовали для DMAPP-анализа, описанного в примере 13. В таблице 14-4 представлены данные средней удельной продуцируемости всех образцов, и на фиг.69 дано графическое представление таких же данных.
Количественную оценку DMAPP-активности и белка проводили, как описано в примере 13.
Удельную активность вычисляли путем умножения уровня продуцируемого изопрена (мкг/л) на 0,00776 и деления полученного результата на концентрацию белка (мг/мл). Этот коэффициент преобразования (0,00776) вводят для учета общего объема зоны «хэдспейс» в герметично закрытом 2-миллилитровом ГХ-сосуде (1,9 мл), объема лизата (80 мкл), продолжительности DMAPP-анализа (45 мин) и молекулярной массы изопрена. Таким образом, величины удельной активности выражали в нмоль изопрена/мг IspS/мин.
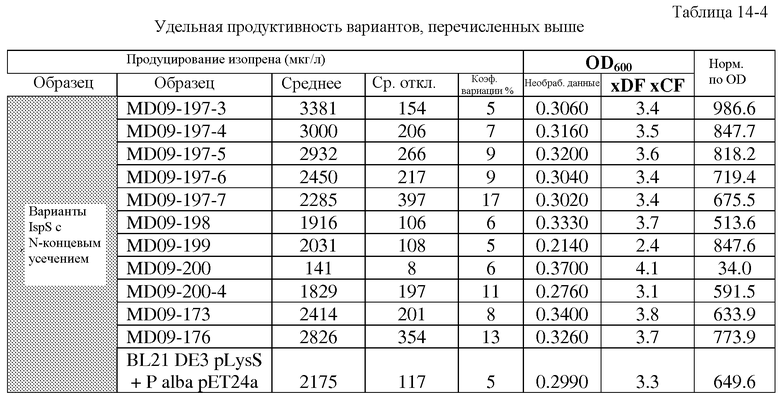
Второй эксперимент проводили на штаммах, указанных в таблице 14-5. В качестве контроля использовали BL21DE3pLysS с pET24a P. alba (полноразмерный IspS P. alba).

Результаты
Для сравнения соответствующих удельных активностей всех усеченных IspS P. alba и двух IspS P. tremuloides и P. trichocharpa параллельно проводили DMAPP-анализ и количественный вестерн-блот-анализ. По меньшей мере два образца на один вариант анализировали на продуцирование изопрена и определяли количество IspS в мг/мл. Вариант MD09-174 продуцировал незначительное количество изопрена и экспрессировали белок на низком уровне, но при этом обнаруживали высокую удельную активность. Высокую удельную активность также обнаруживали варианты MD09-173, MD09-176 и MD09-197-3 (см. таблицу 14-6 и фиг.70). Наиболее высокие уровни белка (мкг), на 3 мкг общего белка, продуцировали варианты MD09-176 и MD09-197-3, что указывало на то, что эти варианты более эффективно экспрессировались в штамме-хозяине BL21DE3 E. coli.
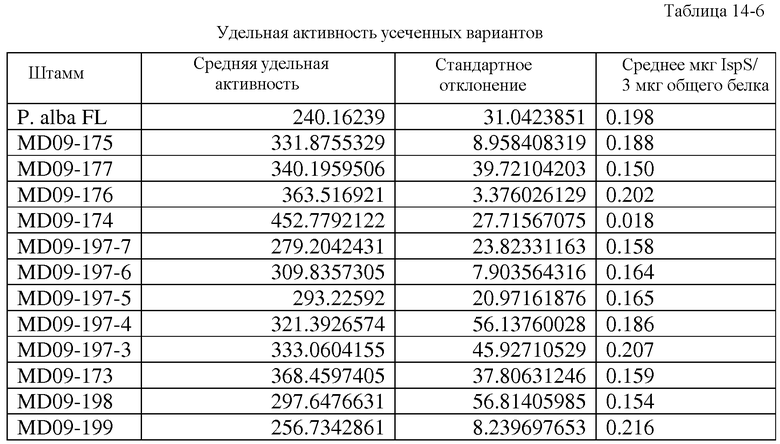
Пример 15
Конструкции для определения трехмерной структуры
I. Конструирование pMAL-C4X пуэрарии
Синтетический ген, кодирующий изопренсинтазу (IspS) пуэрарии лопастной (Pueraria lobata) и оптимизированный по кодонам для E. coli, закупали у DNA2.0 (Menlo Park, CA) и получали в виде плазмиды p9795 (фиг.71 и 72). Вставку удаляли путем гидролиза ферментами BspLUIII/PstI, очищали на геле и снова лигировали с NcoI/PstI-гидролизованной pTrcHis2B (Invitrogen, Carlsbad, California). Полученную плазмиду обозначали pTrcKudzu (фиг.73: карта pTrcKudzu). Во вставке стоп-кодон находится перед PstI-сайтом, что позволяет получить конструкцию, в которой His-метка не присоединена к белку IspS.
ПЦР-реакцию осуществляли для амплификации гена пуэрарии, оптимизированного по кодонам для E. coli, с использованием плазмиды pTrcKudzu в качестве ДНК-матрицы, праймеров EL-959 и EL-960, 10 мМ dNTP (Roche, Indianapolis, IN), и ДНК-полимеразы Pfu Ultra II Fusion (Stratagene, La Jolla, CA), в соответствии с протоколом производителей. ПЦР проводили в следующем режиме: 28 циклов: 95°С, 2 мин (только первый цикл), 95°С, 25 сек, 60°С, 25 сек, 72°С, 30 сек, с последующим конечным удлинением при 72°С, 1 мин. Затем ПЦР-продукт очищали с использованием набора для ПЦР-очистки QIAquick (Qiagen Inc, Valencia, CA).
ПЦР-продукт пуэрарии (1 мкг) гидролизовали рестриктирующими эндонуклеазами EcoRI и HindIII (Roche), в соответствии с протоколом производителей. Гидролизат инкубировали при 37°С в течение 30 минут для минимизации гидролиза внутреннего EcoRI-сайта, который присутствует в гене пуэрарии. Затем гидролизованный ПЦР-фрагмент очищали с использованием набора для ПЦР-очистки QIAquick. Вектор pMAL-C4X (0,5 мкг) (New England Biolabs, Ipswich, MA; фиг.75 и 76) гидролизовали рестриктирующими эндонуклеазами EcoRI и HindIII (Roche) в соответствии с протоколом производителей. Затем гидролизованный вектор подвергали гель-очистке с использованием набора для гель-экстракции QIAquick (Qiagen Inc). Реакцию лигирования ДНК осуществляли с использованием ДНК-лигазы T4 (New England Biolabs) в отношении гидролизованного ПЦР-продукта пуэрарии к гидролизованному вектору pMAL-C4X, составляющем 5:1, в соответствии с протоколом производителей. Затем аликвоту реакционной смеси для лигирования переносили в химически компетентные клетки TOP10 (Invitrogen Corp). Трансформанты отбирали на планшетах со средой LA+50 мкг/мкл карбенициллина.
Скрининг трансформантов, содержащих ген пуэрарии, осуществляли путем сбора колоний и проведения ПЦР с использованием праймеров EL-957 и EL-966 и сфер для ПЦР PuReTaq Ready-To-Go (GE Healthcare, Piscataway, NJ), в соответствии с протоколом производителей. ПЦР проводили в следующем режиме: 28 циклов, 95°С, 2 мин (только в первом цикле), 95°С, 30 сек, 50°С, 30 сек, 72°С, 40 сек, с конечным удлинением при 72°С, 1 мин. ПЦР-продукты анализировали на 2% E-геле (Invitrogen Corp) для идентификации 600 п.н. фрагмента. Колонии, содержащие вставку ПЦР-продукта требуемого размера, подвергали секвенированию ДНК с использованием праймеров EL-950, EL-951, EL-953 и EL-957. Секвенирование ДНК подтвердило конструкцию плазмиды pMAL-C4X Kudzu (фиг.77-79).

Плазмиду pMAL-C4X пуэрарии переносили в химически компетентные клетки OneShot BL21 (λDE3) (Invitrogen Corp). Трансформанты экспрессирующего штамма отбирали на планшетах со средой LA+50 мг/мл карбенициллина.
II. Варианты IspS для определения кристаллической структуры
В данном примере описаны способы получения аффинно меченных ферментов изопренсинтазы (IspS) для экспрессии, очистки и кристаллизации.
Конструирование штаммов
Для получения конструкций в векторе pET200D-TOPO (Invitrogen), ПЦР-продукты ферментов IspS P. alba, P. tremuloides и P. trichocharpa подвергали экстракции и очистке на геле (Qiagen) с использованием 0,8% E-геля (Invitrogen), в соответствии с протоколом, рекомендованным производителями. ПЦР-реакции для конструкций pET200 осуществляли следующим образом: Реакционная смесь содержала l мкл (матрицы)-pET24a-P.alba, 5 мкл 10× буфера для гибридизации PfuUltraII, 1 мкл dNTP (10 мМ), 1 мкл (50 мкМ), прямого праймера (MCM219 или 218), 1 мкл (50 мкМ), обратного праймера (MCM182), 41 мкл diH2O и 1 мкл ДНК-полимеразы PfuUltra II Fusion, Stratagene; циклы проводили в следующем режиме: 29 циклов: 95°С, 1 мин, 95°С, 1 мин, 55°С, 20 сек, 72°С, 27 сек; удлинение при 72°С, 3 мин, и затем при 4°C для охлаждения, с использованием термоячейки Эппендорфа Mastercycler. Аналогичные реакции проводили для P. tremuloides, P. trichocarpa и пуэрарии. Затем 3 мкл очищенного продукта лигировали в вектор pET200D/TOPO (Invitrogen), в соответствии с протоколом производителей. Реакционную смесь инкубировали в течение 5 минут при комнатной температуре, затем 6 мкл топоизомеразной смеси переносили в химически компетентные клетки E. coli Top 10 (Invitrogen), в соответствии с протоколом производителей. Трансформанты отбирали на среде LB с Kan50 и инкубировали при 37°С в течение ночи. Пять колоний на конструкцию отбирали и скринировали на ПЦР-сферах PuReTaq Ready-To-Go (Amersham) с использованием прямого праймера T7 и праймера MCM 182 (таблица 15-2). Клоны, содержащие вставки нужного размера, дополнительно подтверждали с помощью плазмидного мини-препарата с использованием набора QIAPrep Spin Miniprep (Qiagen) и затем секвенировали с использованием прямого и обратного праймеров T7 (Quintara Biosciences). Для последующего исследования отбирали одну полностью секвенированную конструкцию для каждого варианта IspS (см. ниже подробное описание и последовательность/фиг.79-90). 1 мкл каждой плазмиды переносили в BL21(λDE3)pLysS (Invitrogen), в соответствии с протоколом производителей. Трансформанты отбирали на среде LB с Kan50+Cm35 и инкубировали при 37°С в течение ночи. Полученные штаммы использовали в кристаллографических исследований для экспрессии и очистки различных ферментов IspS.
Конструирование 6His-меченных по N-концу плазмид IspS; штаммы и очистка описаны в примере 11.
III. Гидролиз ферментов, меченных TEV (вирусом табачной гравировки) или EK (энтерокиназой)
Расщепление TEV (IspS штаммов MD09-165 и MD09-167)
Штаммы MD09-165 и MD09-167 описаны в примере 11. Для гидролиза, ферменты очищали на заряженной Ni-сефарозе (GE Healthcare) и обессоливали в буфере 50 мМ HEPES, 50 мМ NaCl, pH 7,4, содержащем 1 мМ DTT. Гидролиз осуществляли с использованием протеазы TurboTEV от Eton Bioscience Inc. Была использована одна единица TurboTEV на 10 мкг очищенного белка. Гидролиз осуществляли при 4°С в течение ночи. Образцы пропускали через другую Ni-колонку, уравновешенную в Ni-буфере, для удаления нерасщепленного фермента, метки, протеазы TurboTEV (которая также была помечена) и примесей. Материал, пропущенный через Ni-колонку, и промывки анализировали с помощью электрофореза в ПААГ с ДСН (NUPAGE, Invitrogen) и оценивали DMAPP-активность. Образцы, содержащие чистый фермент, объединяли и обессоливали в буфере 50 мМ NaCl, pH 7,4, содержащем 1 мМ DTT, и хранили при -80°С.
Расщепление энтерокиназой (EK) (IspS штаммов MD08-102 и MD08-104)
Для гидролиза ферменты очищали на заряженной Ni-сефарозе (GE Healthcare) и обессоливали в буфере 50 мМ HEPES, 50 мМ NaCl, pH 7,4, содержащем 1 мМ DTT.
Гидролиз осуществляли с использованием EKMax (E180-02) (Invitrogen), а именно 1 единица EKMax на 20 мкг очищенного белка при 4°С в течение ночи. Образцы пропускали поверх смолы EK Away (Invitrogen) для удаления избытка энтерокиназы. Образцы партиями загружали Ni-сефарозную смолу (уравновешенную в промывочном Ni-буфере) и инкубировали в течение 30 минут при 4°С при периодическом переворачивании. Это позволяло удалять нерасщепленный фермент, метку и примеси. Материал, пропущенный через Ni-колонку, и промывки анализировали с помощью электрофореза в ПААГ с ДСН (4-12% NUPAGE, Invitrogen), и оценивали DMAPP-активность. Образцы, содержащие чистый фермент, объединяли и обессоливали в буфере 50 мМ HEPES, 50 мМ NaCl, pH 7,4, содержащем 1 мМ DTT, и хранили при -80°С.
IV. Очистка MBP-IspS
Конструирование pMAL-C4X пуэрарии для экспрессии изопренсинтазы MBP-Kudzu осуществляли, как описано выше. Продуцирование изопренсинтазы MBP-kudzu осуществляли в клетках E. coli, выращенных в периодической культуре в масштабе 15 литров.
Состав среды (на литр сбраживаемой среды)
Среда имела следующий состав: K2HPO4, 7,5 г, MgSO4•7Н2О, 2 г, моногидрат лимонной кислоты, 2 г, цитрат железа(3)-аммония, 0,3 г, дрожжевой экстракт, 0,5 г, 1000× модифицированный раствор следовых количеств микроэлементов, 1 мл. Все компоненты добавляли одновременно и растворяли в diH2O. Полученный раствор автоклавировали. рН доводили до 7,0 гидроксидом аммония (30%) и объем доводили до нужной величины. После стерилизации и коррекции рН добавляли 10 г глюкозы, 0,1 г тиамина•HCl и антибиотики.
1000× модифицированный раствор следовых количеств микроэлементов
1000× раствор следовых количеств микроэлементов имел следующий состав: лимонная кислота•Н2О, 40 г; MnSO4•Н2О, 30 г; NaCl, 10 г; FeSO4•7Н2О, 1 г; CoCl2•6Н2О, 1 г; ZnSO•7Н2О, 1 г; CuSO4•5Н2О, 100 мг; H3BO3, 100 мг; NaMoO4•2Н2О, 100 мг. Каждый компонент сразу растворяли в diH2O, рН доводили до 3,0 добавлением HCl/NaOH, затем объем доводили до нужной величины и раствор стерилизовали на фильтре 0,22 микрон.
Ферментацию осуществляли в 15-литровом биореакторе с клетками BL21 (DE3) E. coli, содержащими плазмиду pMAL-C4X, экспрессирующую гибридную молекулу «белок, связывающийся с мальтозой (MBP) - изопренсинтаза пуэрарии». Данный эксперимент проводили для продуцирования изопренсинтазы в нужной среде для ферментации при pH 7,0 и при температуре 30°С. Замороженный сосуд со штаммом E. coli оттаивали и инокулировали в среду для экстракции, содержащую триптон-дрожжи. После того как инокулят достигал OD 1,0, как было определено на 550 нм (OD550), 120 мл среды использовали для инокуляции 15-литрового биореактора с доведением исходного объема до 9 литров.
Экспрессии нужной молекулы достигали путем добавления изопропил-бета-D-1-тиогалактопиранозида (IPTG). Концентрацию IPTG доводили до 1 мМ, когда OD550 достигала величины 10. Через 3 часа после добавления IPTG, клетки, содержащие требуемый продукт, собирали.
Очистка MBP-IspS
Бульон центрифугировали в течение 15 минут при 10000×g. Осадок собирали и хранили в замороженном виде при -80°С для дальнейшей очистки. Клетки ресуспендировали в MBP-связывающем буфере (5% глицерин, 20 мМ триса, pH 7,4, 200 мМ NaCl, 2 мМ DTT, l мг/мл лизоцима) и три раза пропускали через френч-пресс, работающий при давлении 20000 фунт/кв.дюйм (137000 кПа). Затем лизат подвергали ультрацентрифугированию при 100000×g в течение 1 часа с получением относительно прозрачного раствора. Супернатант брали пипеткой из верхней части пробирки таким образом, чтобы при этом не повреждался гелеобразный материал, находящийся на дне центрифужной пробирки. Гель-фильтрацию осуществляли на супернатанте на колонке Superdex-200 26/60 (GE healthcare). Колонку проявляли с использованием MBP-связывающего буфера при скорости потока 3 мл/мин при 23°С. Фракции тестировали на DMAPP-активность, как описано ниже. Активные фракции объединяли и загружали на 25 мл амилозной смолы (New England Biolabs). Колонку промывали 10 колоночными объемами MBP-связывающего буфера и затем белок элюировали 2 колоночными объемами MBP-связывающего буфера, содержащего 10 мМ мальтозы, с получением >90% чистого MBP-IspS.
V. DMAPP-анализ
Для DMAPP-анализа использовали следующую реакционную смесь: 25 мкл смеси лизата, 5 мкл MgCl2 (1M), 5 мкл DMAPP (100 мМ) и 65 мкл 100 мМ триса, pH 8, 100 мМ NaCl, полный объем 100 мкл. Реакцию проводили при 30°С в течение 15 минут в газонепроницаемой 1,8-миллилитровой ГХ-пробирке. Реакции прекращали добавлением 100 мкл 500 мМ EDTA (pH 8). Количество продуцированного изопрена измеряли с помощью ГХ/МС, как описано выше.
Пример 16
Трехмерная структура IspS
Для создания кристаллов, подходящих для рентгеноструктурного анализа, получали семь конструкций растительной изопренсинтазы (IspS). Такими конструкциями являются: конструкция, содержащая связывающийся с мальтозой белок, меченный гистидином по N-концу, и IspS пуэрарии (MBP-kudzu), полноразмерный IspS P. alba с N-концевой гистидиновой меткой (MD08-99), IspS P. alba с первыми 19 удаленными N-концевыми остатками (MD08-100), причем эта конструкция также содержала N-концевую his-метку, удаленную после очистки. Был также получен полноразмерный немеченый IspS P. alba (штамм RM11608-2). Была также генерирована усеченная конструкция IspS P. alba, характеризующаяся двумя дополнительными остатками, расположенными перед мотивом из двух аргининов (MD09-167). Была также генерирована IspS P. tricharpa, которая имеет как N-концевую His-метку, так и N-концевое усечение (MD08-104), и другая конструкция, состоящая из IspS P. tremuloides и содержащая N-концевую his-метку и N-концевое усечение (MD08-102). Конструирование штаммов, экспрессирующих различные изопренсинтазы, описано выше.
Каждую конструкцию очищали и затем полученный концентрированный раствор белка оценивали при всех возможных условиях кристаллизации. Каждую конструкцию независимо очищали и оценивали, как описано ниже. Все лабораторные способы скрининга кристаллизации осуществляли посредством испарительной диффузии методом «висячей капли». Каждую конструкцию, как минимум, оценивали с использованием следующих коммерчески доступных программ скрининга: «Crystal Screen» от Hampton Research (Aliso Viejo, CA) и «JCSG+Suite» от Qiagen (Valencia, CA).
Очищенную MBP-kudzu оценивали с использованием следующих коммерчески доступных программ скрининга: «Crystal Screen» от Hampton Research и «JCSG+Suite». Кроме того, очищенный препарат MBP-kudzu был послан в Институт Хоптмана-Вудварда (Hauptman-Woodward (Buffalo, NY) для проведения высокоэффективного скрининга, где оценивали не менее чем 1536 условий кристаллизации. В большинстве условий кристаллизации, очищенный гибрид MBP-kudzu осаждался из раствора, но кристаллов белка не наблюдалось.
Другой конструкцией, используемой для скрининга кристаллизации, является MD08-99 (полноразмерный IspS P. alba с N-концевой гистидиновой меткой). MD08-99 очищали и гистидиновую метку удаляли. Те же самые три начальные процедуры скрининга кристаллизации осуществляли так же, как и для MBP-kudzu. Каждый скрининг кристаллов осуществляли с помощью программ Hampton Research Crystal Screen и Qiagen JCSG+ Suite при множестве концентраций белков. Небольшие игольчатые кристаллы наблюдались при некоторых условиях скрининга Hampton Research Crystal Screen. В дополнительной попытке улучшения кристаллов проводили совместную кристаллизацию с ингибитором IspS, а именно ибандронатом натрия (Sigma-Aldrich, St Louis, MO). В целом, были сделаны попытки оценить кристаллизацию при дополнительных 288 условиях с различными pH, концентрациями и реагентами кристаллизации. Затем брали девять наилучших кристаллов для сбора данных и тестировали в лаборатории на вращающемся анодном генераторе Rigaku RU200 и R-AXIS IV++, и эти кристаллы либо не дифрагировали рентгеновские лучи, либо представляли собой солевые кристаллы.
Первые девятнадцать N-концевых остатков IspS P. alba удаляли для получения конструкции MD08-100. Эта конструкция имела N-концевую гистидиновую метку, удаленную после очистки. Лабораторный скрининг кристаллизации осуществляли с помощью программ Hampton Research Crystal Screen и Qiagen JCSG+ Suite при множестве концентраций белков. Наилучшими исходными кристаллами были гексагональные пластины, которые давали дифракцию с разрешением 16 Å и небольшие стержневидные кристаллы, которые дифрагировали с разрешением 5 Å на лабораторном генераторе рентгеновских лучей. В попытке улучшения кристаллов, MD08-100 совместно кристаллизовали либо с ибандронатом натрия, либо с пирофосфатом натрия (Sigma-Aldrich, St Louis, MO), которые являются ингибиторами активности IspS. Ни один из этих ингибиторов не давал улучшения кристаллов и улучшения дифракции. Были сделаны попытки оценить кристаллизацию при дополнительных 168 условиях кристаллизации с различными pH, концентрациями и реагентами кристаллизации. 21 наиболее перспективный из кристаллов MD08-100 скринировали на дифракцию, при этом наилучшее разрешение, которое было достигнуто, составляло 5 Å.
Полноразмерный немеченый IspS P. alba (штамм RM11608-2) выделяли из сбраживаемой среды. Предварительный скрининг проводили с использованием программы Hampton Research Crystal Screen и кристаллы оценивали при четырех различных условиях. Все четыре кристалла подвергали лабораторному тестированию на дифракцию, при этом три кристалла оказались солевыми и один вообще не дифрагировал.
Была получена усеченная конструкция IspS P. alba, характеризующаяся двумя дополнительными остатками перед мотивом из двух аргининов (MD09-167). Эта конструкция содержала С-концевую гистидиновую метку, и в экспериментах по кристаллизации было установлено, что эта метка либо отщеплялась, либо не отщеплялась при различных концентрациях белка, независимо от того, присутствовал или отсутствовал пирофосфат натрия. Предварительный скрининг кристаллизации осуществляли так же, как для молекулы MBP-kudzu. Кристаллы этой конструкции наблюдали в различных условиях, причем оптимизация включала 528 различных pH, осаждающих агентов, концентраций и ингибиторов. В экспериментах по оптимизации, пятнадцать различных кристаллов MD09-167 скринировали на дифракцию в лаборатории. При попытке улучшить разрешение были протестированы различные условия замораживания кристаллов, при этом наилучший эффект улучшения наблюдался при дифракционных пределах от 10 Å до 6,5 Å.
Была генерирована новая конструкция, содержащая IspS P. tricharpa и включающая как N-концевую гистидиновую метку, так и N-концевое усечение (MD08-104). Очищенный MD08-104 с отщепленной гистидиновой меткой оценивали с помощью программ Hampton Research Crystal Screen и Qiagen JCSG+ suite. Эта конструкция давала больший осадок, чем конструкции IspS P. alba. При этом наблюдались очень мелкие игольчатые кристаллы, и ни один из этих кристаллов не был подходящим для дифракции.
Была получена другая конструкция, состоящая из IspS P. tremuloides и содержащая N-концевую гистидиновую метку и N-концевое усечение (MD08-102). Очищенный MD08-102 с гистидиновой меткой и без отщепленной гистидиновой метки оценивали с использованием программ Hampton Research Crystal Screen и Qiagen JCSG+ suite при различных концентрациях белка. При некоторых условиях наблюдались стержневидные кристаллы и пластинчатые кристаллы, и для улучшения кристаллов было проведено 120 дополнительных экспериментов при различных pH, концентрациях и реагентах кристаллизации. В лабораторных экспериментах по оптимизации было протестировано десять кристаллов, при этом начальная наилучшая дифракция достигалась с разрешением 5 Å. После дополнительной модификации кристаллов в замороженном состоянии был обнаружен кристалл белка с неотщепленной гистидиновой меткой, который дифрагировал с разрешением до 3,3 Å. Этот кристалл был выращен путем смешивания 2 мкл белка (10 мг/мл, с 30 мМ MgCl2) с 2 мкл раствора осаждающего агента [10% (масс./об.) полиэтиленгликоль 8000, 0,1M HEPES, pH 7,5, 8% этиленгликоль] и уравновешивания с 500 мкл осаждающего агента. Через три недели наблюдалось образование кластера из стержневидных кристаллов. Эти кристаллы принадлежали к тетрагональной пространственной группе P43212 и имели размеры элементарной ячейки a=154,2, b=154,2, c=142,7.
Лабораторные данные рентгеноструктурного анализа получали в токе азота при 100°K на генераторе Rigaku RU200 и детекторе R-AXIS IV++. Перед быстрой заморозкой кристалла в жидком азоте криозащиту этого кристалла обеспечивали путем его пропускания через раствор, содержащий 10% (масс./об.) полиэтиленгликоль 8000, 0,1M HEPES, pH 7,5, и 25% этиленгликоль. Полученные данные объединяли с использованием программы Mosflm (Leslie, A. (1998) J. of Appl. Crystallography 30, 1036-1040) и масштабировали с использованием программы SCALA (Collaborative Computational Project, N. (1994) Acta Crystallographica Section D 50, 760-763). Затем полученные данные синхронизировали по расположению молекул с помощью программы MrBUMP (Keegan, R.M., and Winn, M.D. (2007) Acta Crystallographica Section D 63, 447-457; Vagin, A., and Teplyakov, A. (1997) J. of Appl. Crystallography 30, 1022-1025) с использованием мономера лимоненсинтазы (банк данных белков ID 20NH) (Berman, H., et al. (2007) Nucl. Acids Res. 35, D301-303) в качестве исходной модели. Данный кристалл содержит один димер в асимметрической ячейке с содержанием растворителя 66%.
Затем получали набор данных 3,05 Å от того же самого кристалла с использованием потока лучей 11-1 в лаборатории синхротронного излучения в Стэнфорде. Эти данные также обрабатывали с использованием программы Mosflm и SCALA. Набор данных и статистическое уточнение данных приведены в таблице 16-1.
Уточнение данных с использованием программы Refmac5 (Collaborative Computational Project, N. (1994) Acta Crystallographica Section D 50, 760-763) осуществляли вручную с проведением итеративных стадий реорганизации с использованием визуализирующей программы Coot (Emsley, P., and Cowtan, K. (2004) Acta Crystallographica Section D 60, 2126-2132). В процессе уточнения, геометрическую структуру белка анализировали с использованием программы Molprobity (Davis, I.W., et al. (2007) Nucl. Acids Res., gkm216).
Укладка IspS тополя аналогична укладке борнилдифосфатсинтазы (Whittington, D.A., et al. (2002) Proc. Natl Acad. Sci. USA 99, 15375-15380), лимоненсинтазы (Hyatt, D.C, et al. (2007) Proc. Natl Acad. Sci. USA 104, 5360-5365) и 5-эпи-аристологенсинтазы табака (Starks, C.M., et al. (1997) Science 277, 1815-1820). Данная структура состоит из двух спиральных доменов, С-концевого домена, содержащего активный центр, и N-концевого домена (фиг.90 и 91). Координаты приведены в таблице 16-7.
Гибкие петли
В результате определения трехмерной структуры изопренсинтазы был сделан уникальный и неожиданный вывод, заключающийся в том, что некоторые петли, играющие решающую роль в образовании активного центра, являются гибкими. Это сразу видно при сравнении известной структуры других терпенсинтаз со структурой изопренсинтазы (фиг.94). В целом, эти структуры являются высококонсервативными в конформации вторичной структуры и на участках связывания петель. (В данном примере, в соответствии с соглашением, последовательность IspS Poplar tremuloides из конструкции P.tremTRC-pET200 пронумерована так, что полная последовательность, содержащая метку, начинается с -35, где первым остатком IspS является 1). Однако, как видно на фигурах (фиг.95-97), три сегмента, образующие значительную часть связывающегося с субстратом «кармана», а именно усеченный N-конец вместе с двумя петлями, состоящими из остатков 438-453 (петля I) и остатков 512-527 (петля II), имеют расхождения. Это обусловлено тем, что при определении структуры авторами настоящего изобретения отсутствовал субстрат, образующий комплекс с ферментом.
При сравнении этого фермента с BdpS, авторами настоящего изобретения было обнаружено, что петли, соответствующие остаткам 498-513 и 573-587, состоят из того же самого числа остатков и имеют гомологичную, но не идентичную аминокислотную последовательность в этих областях. Авторами настоящего изобретения было высказано предположение, что родственные терпенсинтазы будут обнаруживать аналогичную гибкость в этих сегментах, и поэтому эти структуры стали объектами более тщательного исследования. Номера остатков в терпенсинтазах, соответствующих этим вариабельным областям петель, указаны в таблице 16-2.
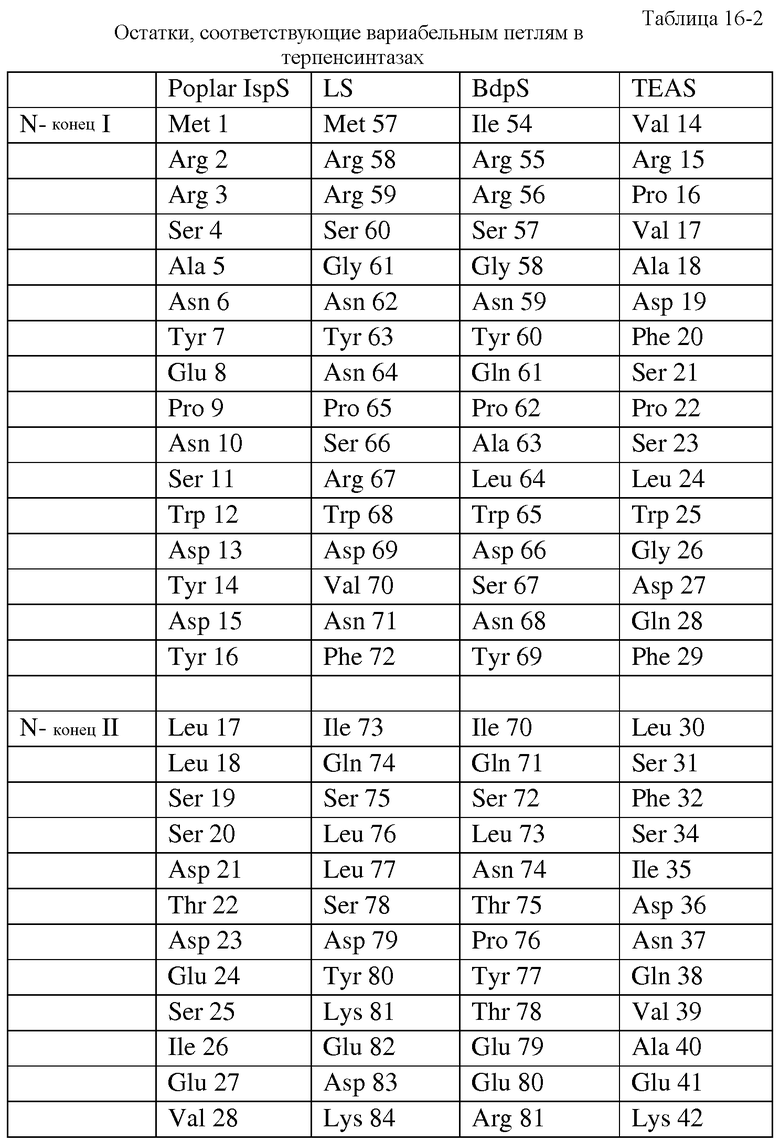
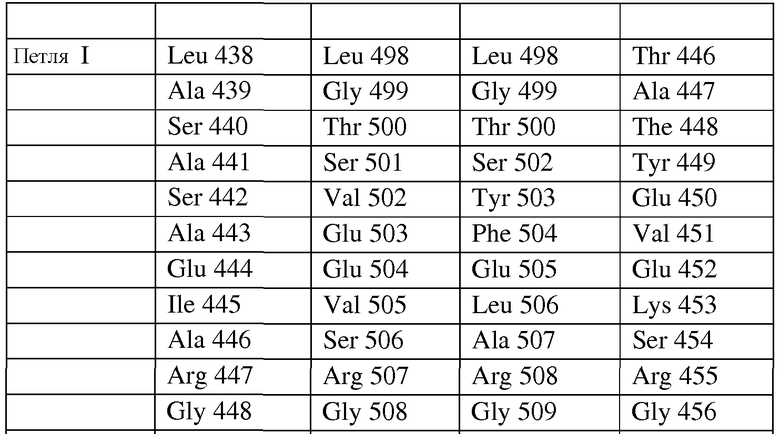
Эти важные данные могут быть использованы для конструирования изопренсинтаз с улучшенными свойствами прямым методом. При этом гибкость этих структур желательно использовать для повышения продуктивности фермента путем введения замен в аминокислоты, образующие указанные сегменты, в целях облегчения прохождения ферментом переходных состояний в стадиях связывания субстрата и в целях обеспечения реаранжировки субстрата в различных кинетических стадиях, которые, как предполагается, происходят в процессе ферментативного дефосфорилирования, а также в целях переноса электронов для превращения DMAPP в изопрен.
Данная структура дает новое представление, позволяющее предположить, что указанные петли могут присутствовать по меньшей мере в двух конформациях: в «открытой» форме в отсутствие субстрата, как было видно из структуры изопренсинтазы, не образующей комплексов, и в «закрытой» или активной форме, при связывании с субстратом. Поэтому также желательно модифицировать остатки, вступающие в контакт с петлями в их активной форме, как описано в таблице 16-3.
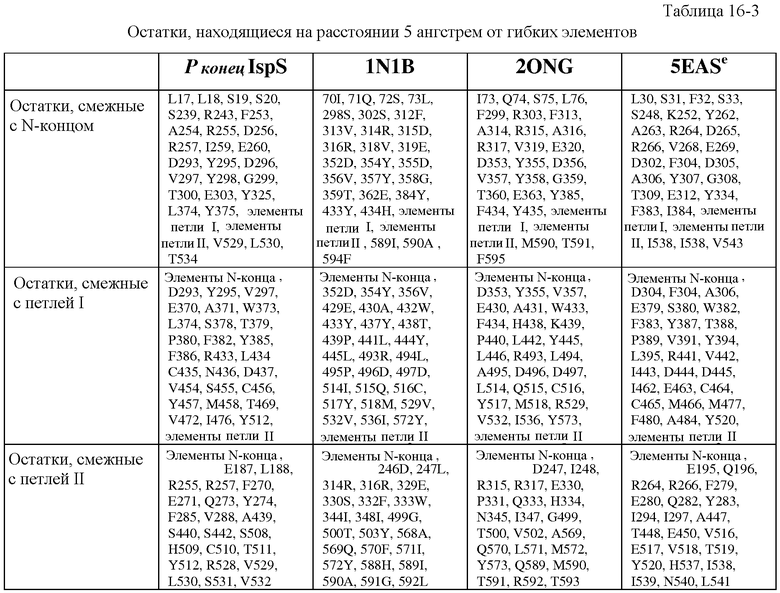
Отбор сайтов для улучшения свойств растительной изопренсинтазы
Предполагается, что изопренсинтазы растений гомологичны терпенсинтазам. Были определены трехмерные структуры трех гомологичных терпенсинтаз: борнилдифосфатсинтазы Salvia officinalis (BdpS; код ввода pdb 1N1B), лимоненсинтазы Mentha spicata (LS; код ввода pdb 2ONG) и 5-эпи-аристологенсинтазы табака (TEAS; код ввода pdb 5EAS). Эти ферменты имеют только 33%-ную гомологию, но их третичные структуры являются консервативными. Идентичность последовательностей представлена в таблице 16-4, и их структурная гомология представлена в таблице 16-5. Кроме того, было показано, что структуры промежуточных комплексов, содержащих все три родственных фермента, имеющие не только третичную укладку, но также обнаруживающие взаимодействия в своих активных центрах, являются в высокой степени консервативными.
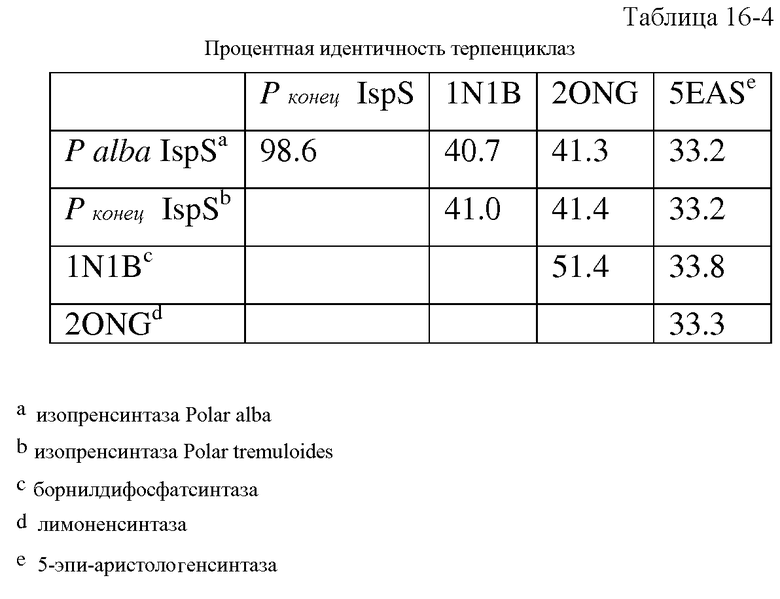
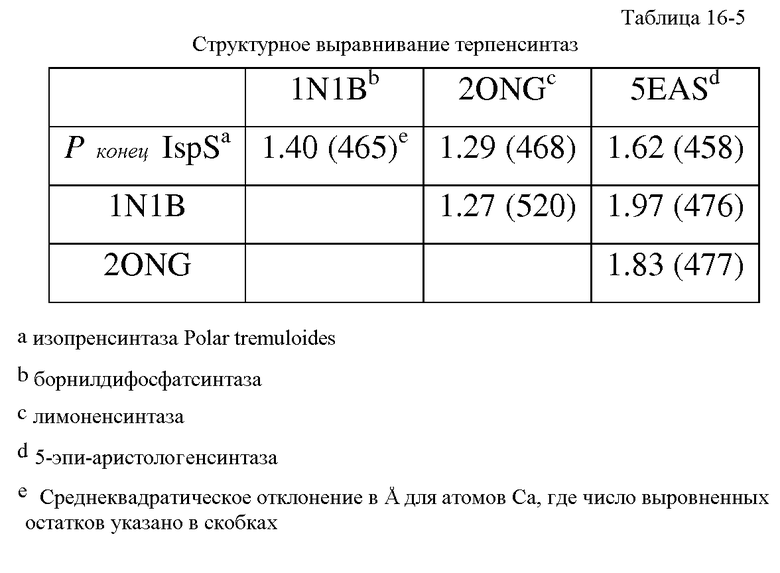
В данном примере, в соответствии с соглашением о нумерации, последовательность IspS Poplar tremuloides из конструкции P.tremTRC-pET200 пронумерована так, что полная последовательность, содержащая метку, начинается с -35, где первым остатком IspS является 1.
Сравнение активного центра структуры BdpS и структуры IspS тополя показало, что активный центр, участвующий в связывании с ионом металла и в распознавании фосфата, является консервативным. В частности, было обнаружено, что остатки Arg 255, Asp 292, Asp 296, Glu 370, Arg 433 и Asn 436 IspS тополя перекрываются с эквивалентными остатками в BdpS. Расположение промежуточного соединения BdpS было сравнимо со структурой IspS тополя. Исходя из этого, можно идентифицировать аналогичную связывающую область и понять, необходимо ли участие диметилаллилпирофосфата в связывании и взаимодействии с ферментом IspS тополя.
Исходя из структуры IspS тополя, сайты в IspS тополя были идентифицированы в качестве кандидатов на мутагенез с продуцированием вариантов фермента IspS с улучшенными свойствами. Кратко, были отобраны сайты IspS, которые могли изменять характер связывания с металлом, распознавания дифосфата, связывания цепи DMAPP и/или близости к активному центру.
I. Сайты, связывающиеся с дифосфатом/металлом
Были идентифицированы боковые цепи аминокислотных остатков в IspS тополя, находящиеся вблизи от боковых цепей, связывающихся с металлом и дифосфатом. Такими остатками являются Asp 293, Tyr 385, Ser 392 и Asp 437. Создание таких сайтов может способствовать повышению ферментативной активности.
II. Петли, доступные для субстрата
Петли IspS тополя, доступные для субстрата, находятся в областях, отличающихся от структуры BdpS. В структуре BdpS остатки образуют «покрытие» поверх активного центра. Вероятно, что после связывания с субстратом структура IspS тополя будет образовывать аналогичную структуру. Остатки в данных петлях, включая остатки 440-453 и 512-524, могут находиться в положении, изменяющем активность фермента IspS тополя. В ферменте IspS тополя остатки 440-453 имеют последовательность SASAEIARGETANS и остатки 512-526 имеют последовательность YHNGDAHTSPDEL.
III. Сайт связывания с изопренилом
Комплекс BdpS и продукта реакции, борнилдифосфата (код ввода PDB 1N24), использовали для идентификации остатков в структуре IspS тополя, которая, наряду с конструированием белка, может быть использована для модуляции специфичности к субстрату и/или скорости реакции (для изменения скорости ассоциации и диссоциации субстрата и продукта). Такими остатками являются Ser 261, Trp 264, Phe 285, Thr 289, Ser 393, Ser 394, Phe 432 и Tyr 512.










































































































































В описанные в данном описании способы и системы могут быть внесены различные модификации и изменения, очевидные для специалиста в данной области, но не выходящие за рамки существа и объема изобретения. Хотя настоящее изобретение описано на конкретных предпочтительных вариантах его осуществления, однако, следует отметить, что настоящее изобретение не должно быть необоснованно ограничено такими конкретными вариантами. Действительно, различные модификации описанных способов осуществления настоящего изобретения, являющиеся очевидными для специалиста в данной области, также входят в объем нижеследующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ ИЗОПРЕНА, НЕ СОДЕРЖАЩЕГО С5-УГЛЕВОДОРОДОВ В УСЛОВИЯХ НАРУШЕНИЯ ВЗАИМОСВЯЗИ МЕЖДУ ПРОДУЦИРОВАНИЕМ ИЗОПРЕНА И РОСТОМ КЛЕТОК И/ИЛИ В УСЛОВИЯХ ПРОДУЦИРОВАНИЯ ИЗОПРЕНА НА БЕЗОПАСНЫХ РАБОЧИХ УРОВНЯХ | 2009 |
|
RU2563513C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПОЛУЧЕНИЯ ИЗОПРЕНА | 2008 |
|
RU2545699C2 |
| ИЗОПРЕНСИНТАЗА И КОДИРУЮЩИЙ ЕЕ ГЕН, СПОСОБ ПОЛУЧЕНИЯ МОНОМЕРА ИЗОПРЕНА | 2013 |
|
RU2612916C2 |
| ТОПЛИВНЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ИЗОПРЕНА | 2010 |
|
RU2531623C2 |
| ЦИТОХРОМ P450 И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЭНЗИМАТИЧЕСКОГО ОКИСЛЕНИЯ ТЕРПЕНОВ | 2012 |
|
RU2625224C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОТЛИЧНОГО ОТ АДЕНОВИРУСА ВИРУСА-МИШЕНИ ИЛИ БЕЛКОВ-МИШЕНЕЙ, ЭКСПРЕССИРУЮЩАЯ КЛЕТКА И КЛЕТКА-ХОЗЯИН И СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ ЭКСПРЕССИРУЮЩЕЙ КЛЕТКИ | 2006 |
|
RU2449015C2 |
| СПОСОБЫ И ВЕЩЕСТВА ДЛЯ ОСНОВАННОГО НА РЕКОМБИНАЦИИ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ШАФРАНА | 2012 |
|
RU2676730C2 |
| СПОСОБ ПОЛУЧЕНИЯ АРОМАТИЧЕСКИХ СПИРТОВ | 2014 |
|
RU2654670C2 |
| ВЕКТОРЫ ДЛЯ МНОЖЕСТВЕННОЙ ГЕННОЙ ЭКСПРЕССИИ | 2008 |
|
RU2462513C2 |
| УЛУЧШЕННАЯ ПРОДУКЦИЯ БЕЛКА В BACILLUS | 2008 |
|
RU2515112C2 |




















































































































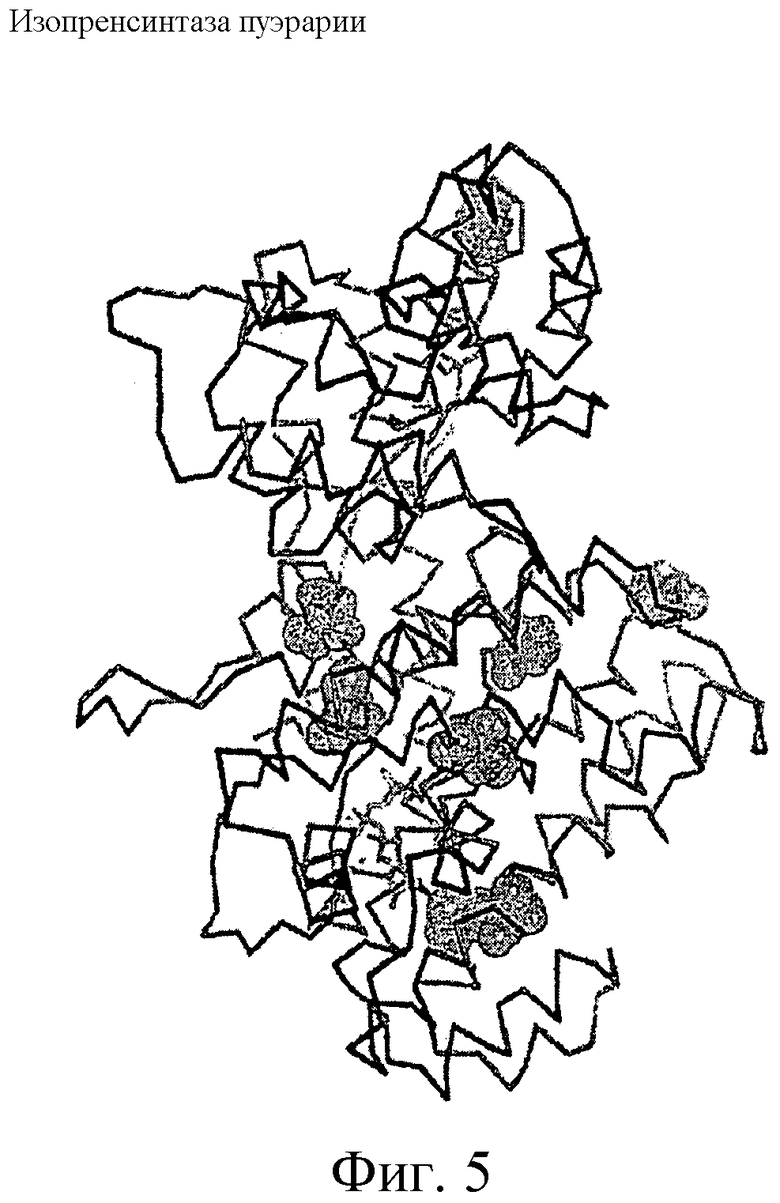

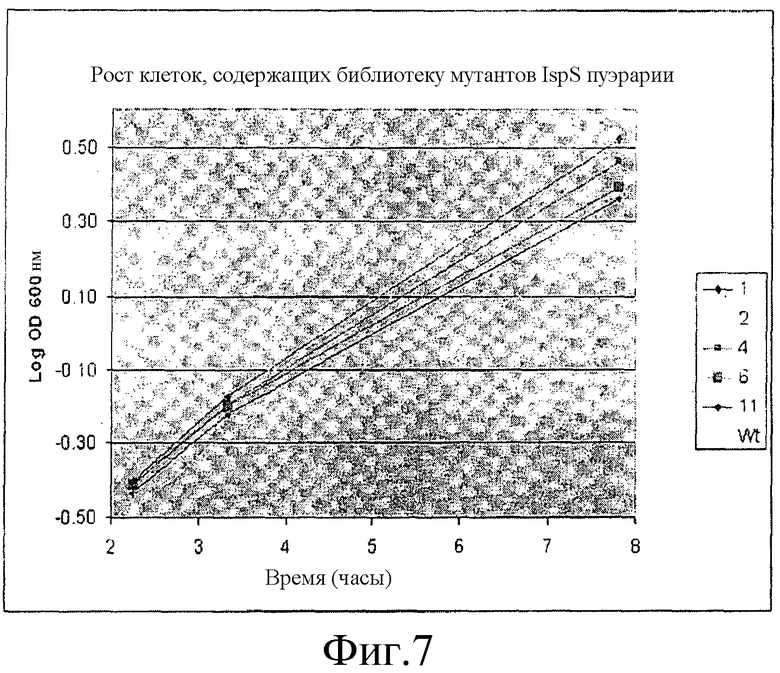
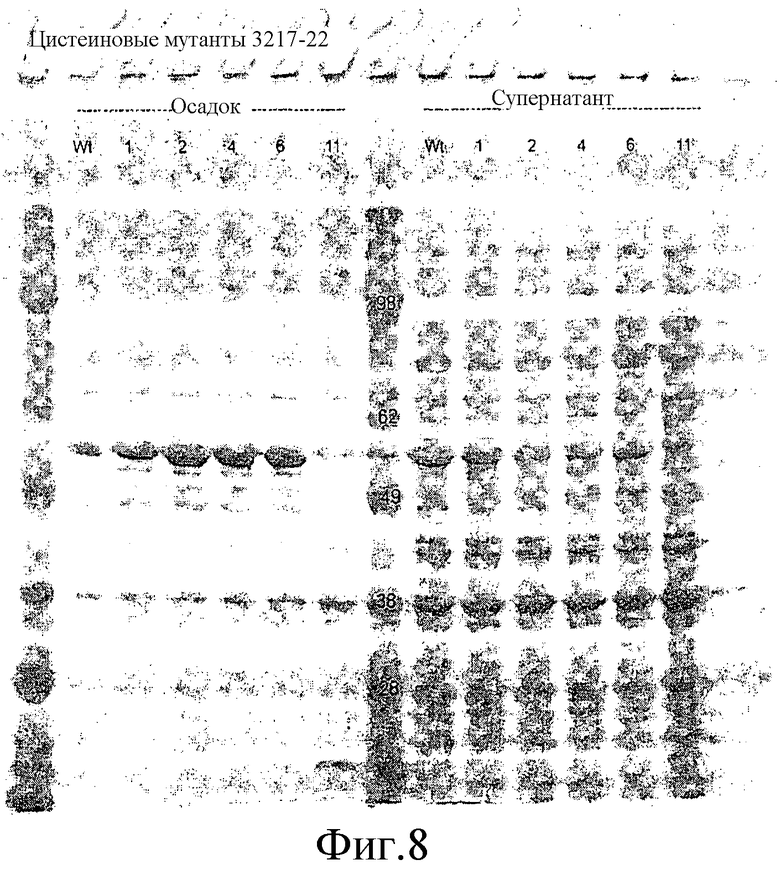




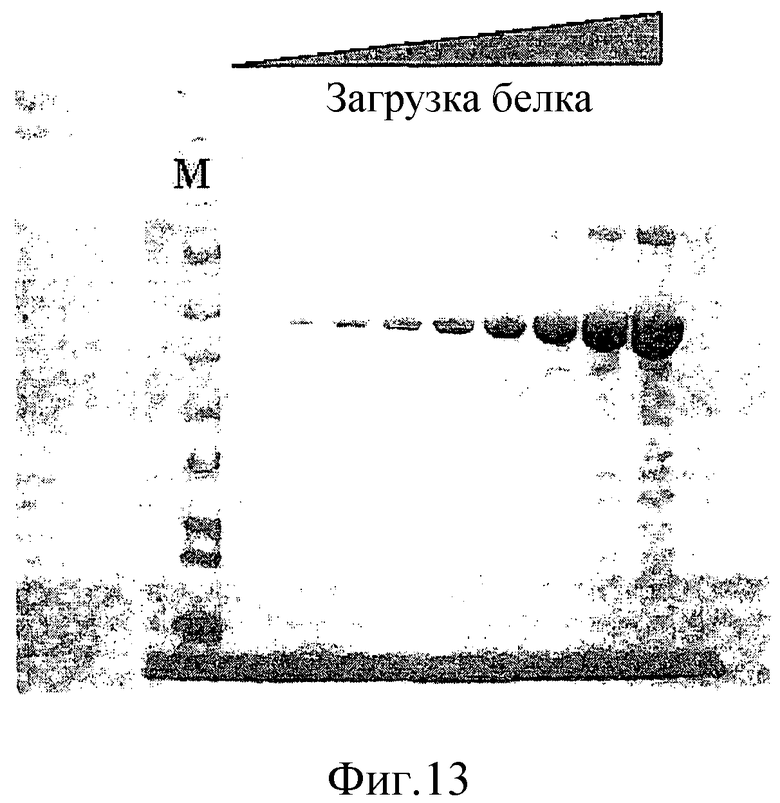
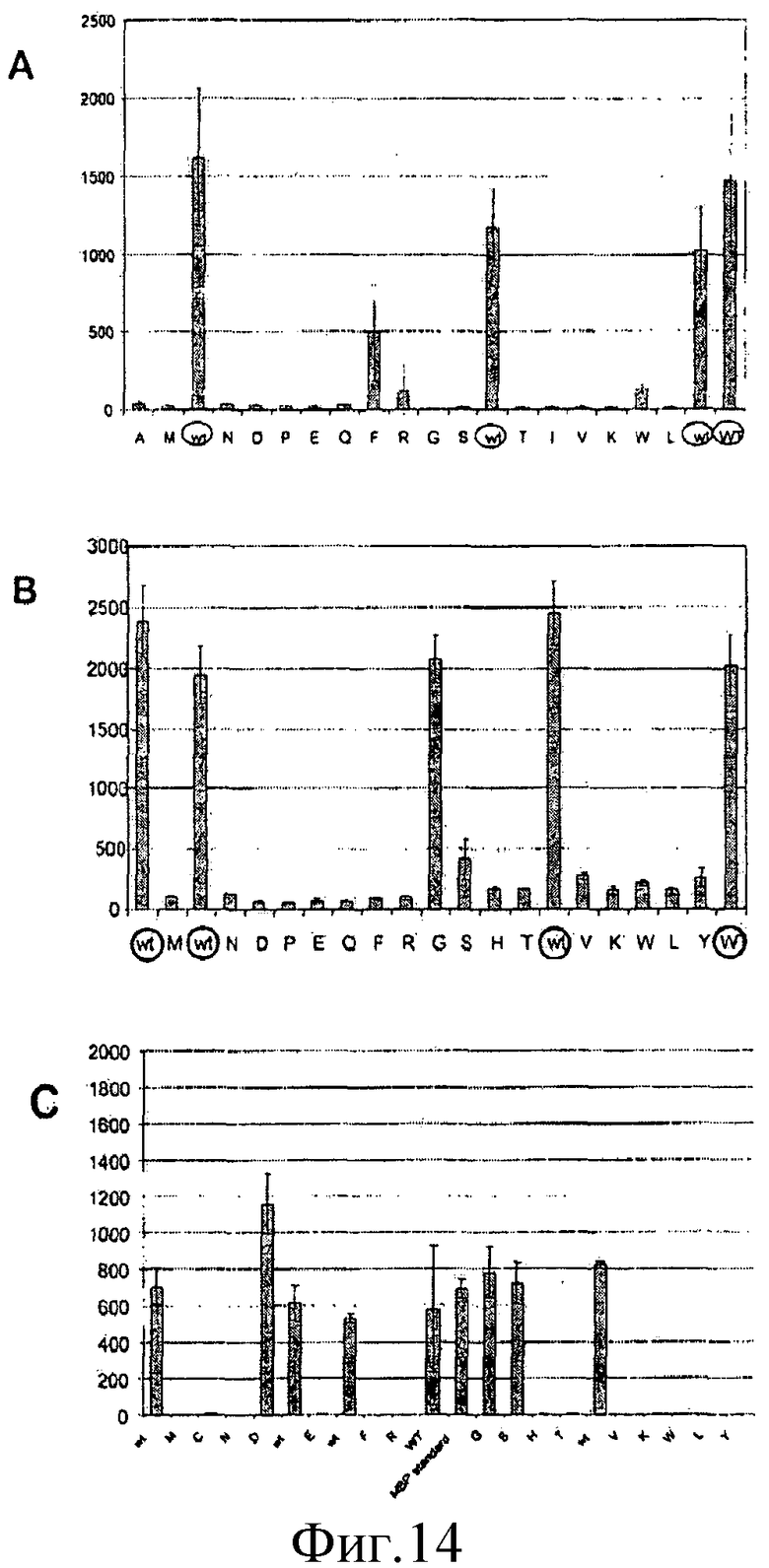
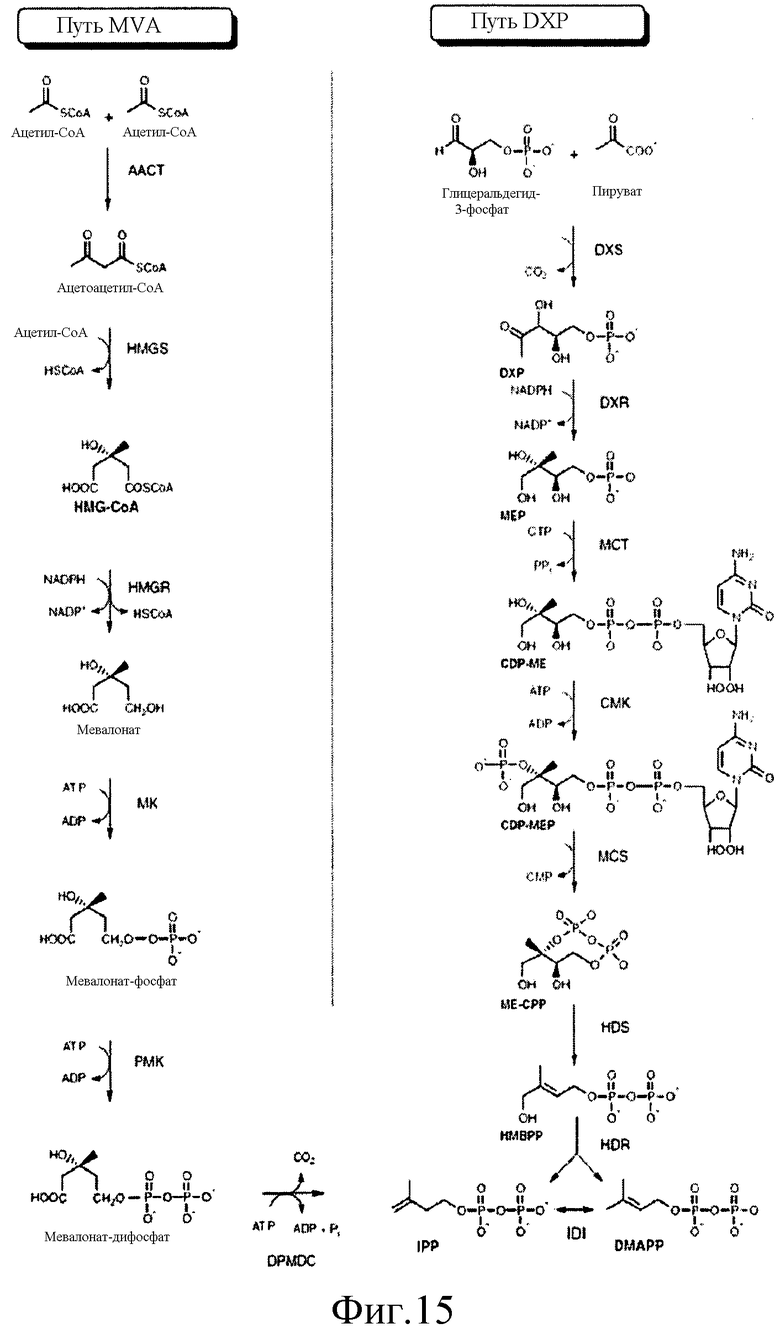
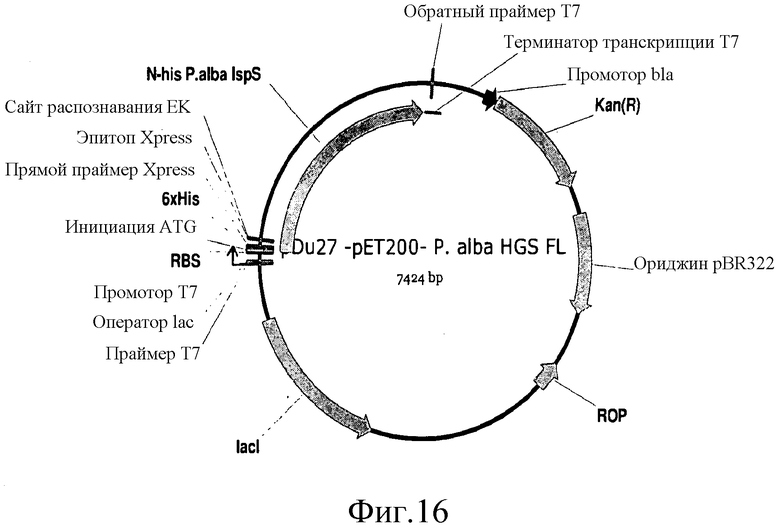









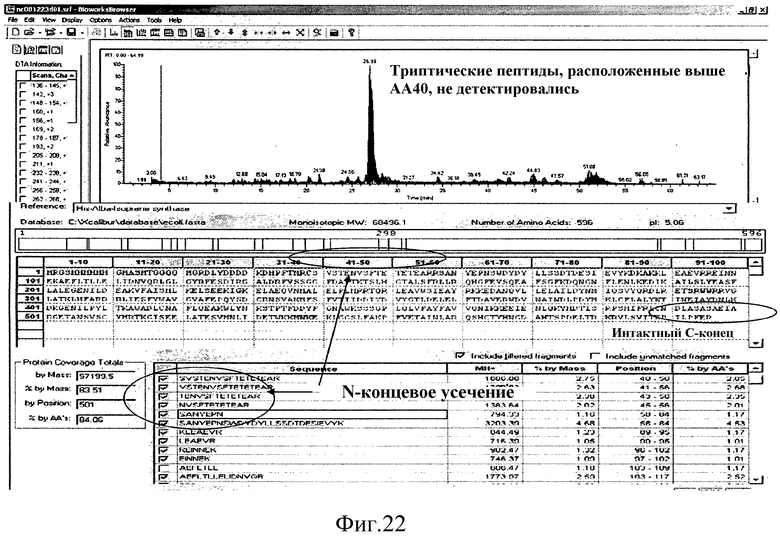




























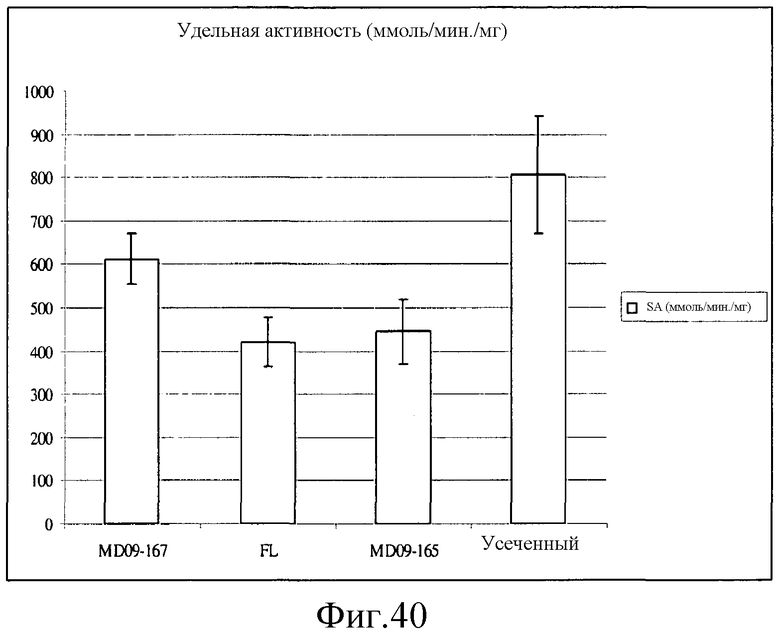
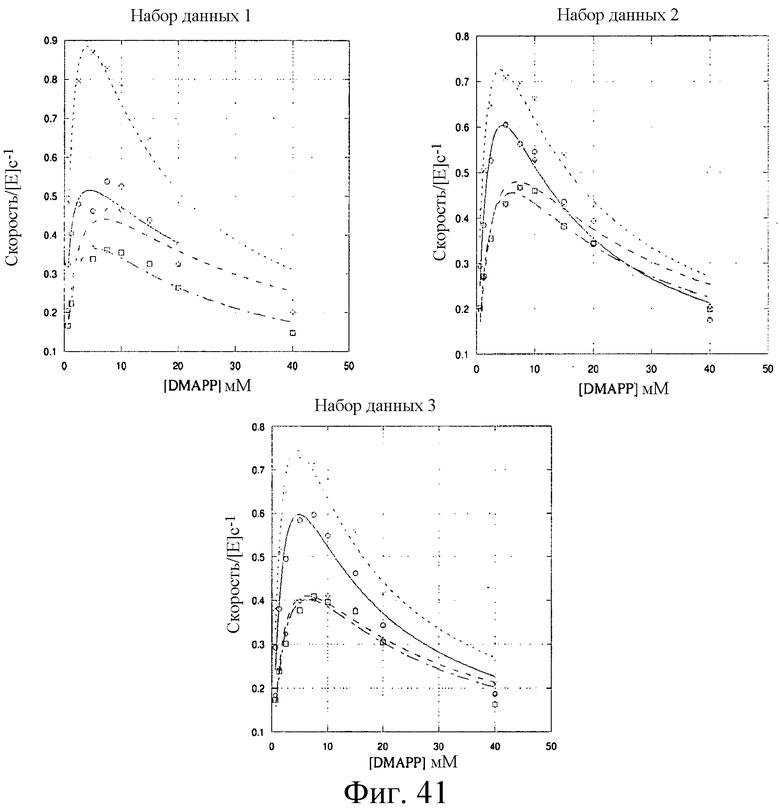
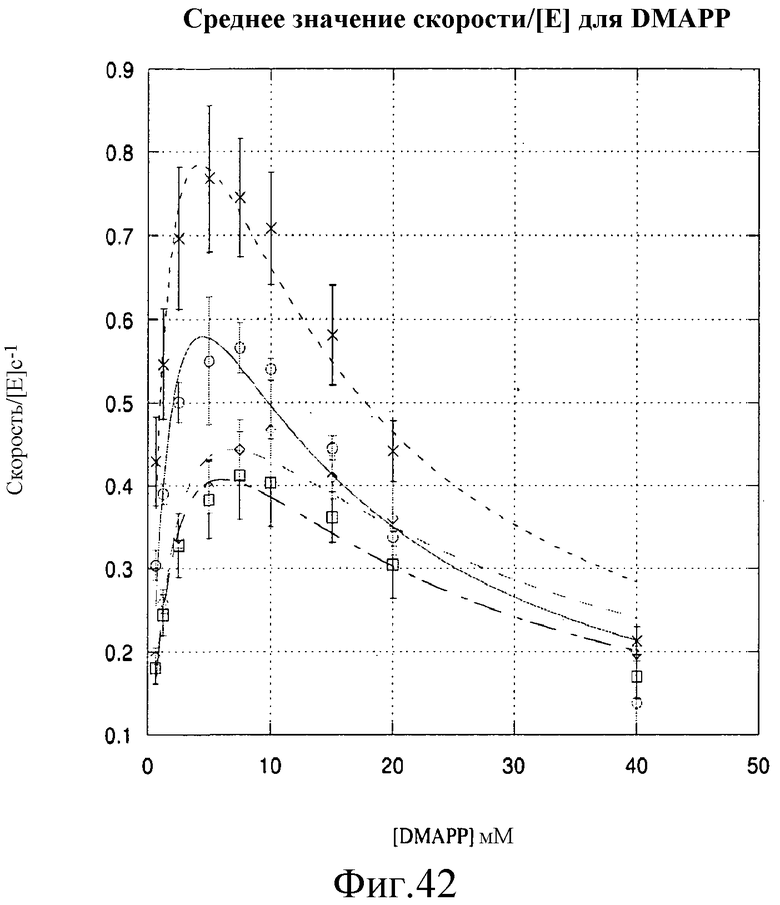

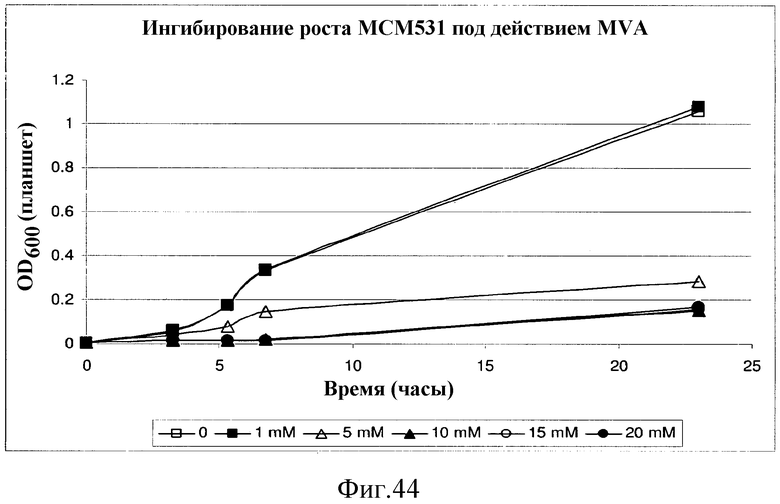
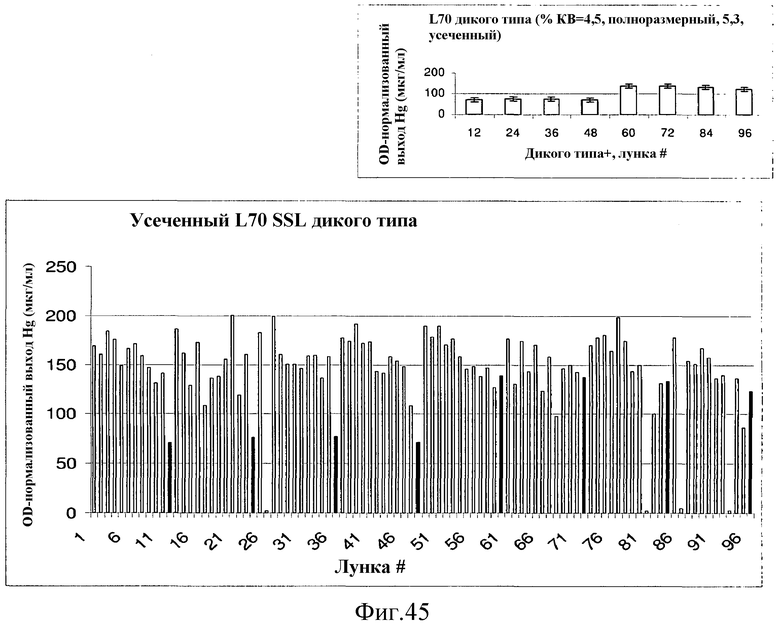
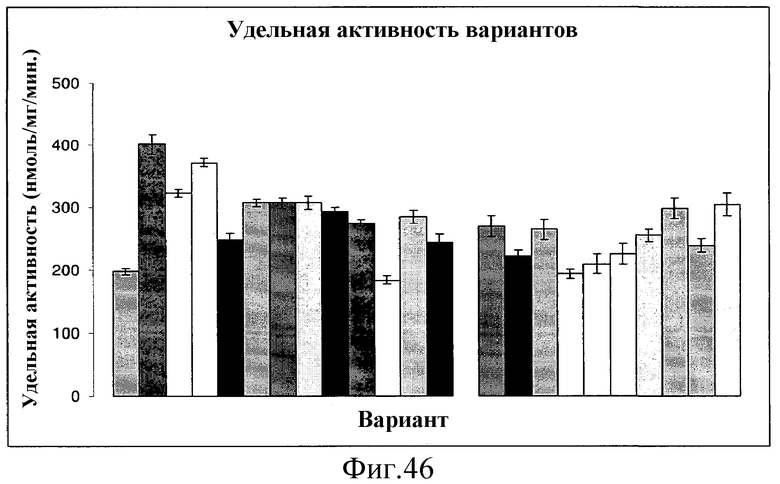
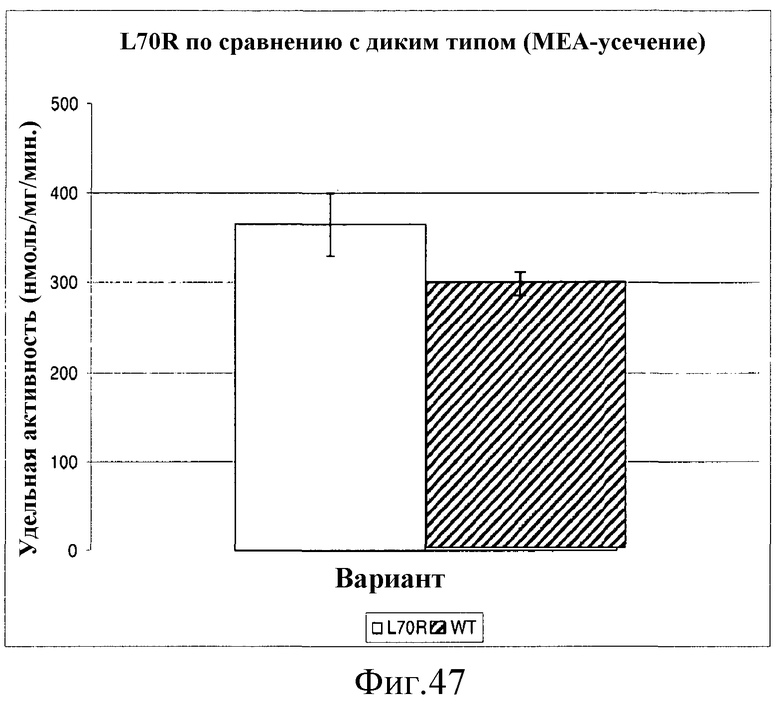
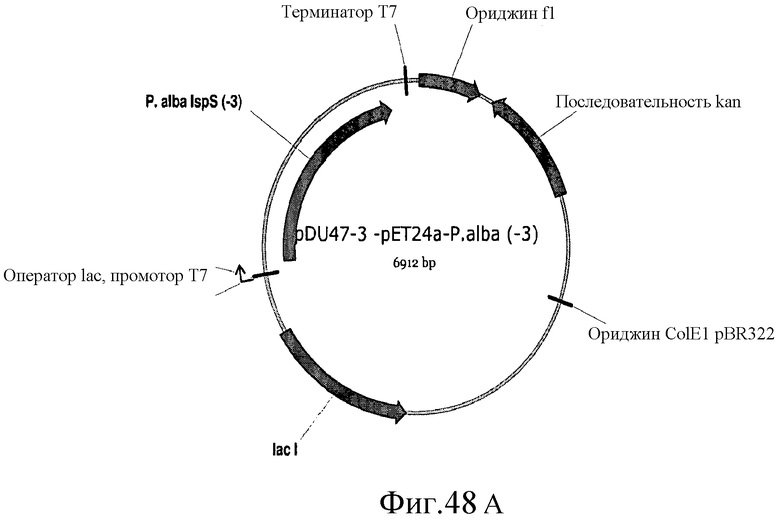

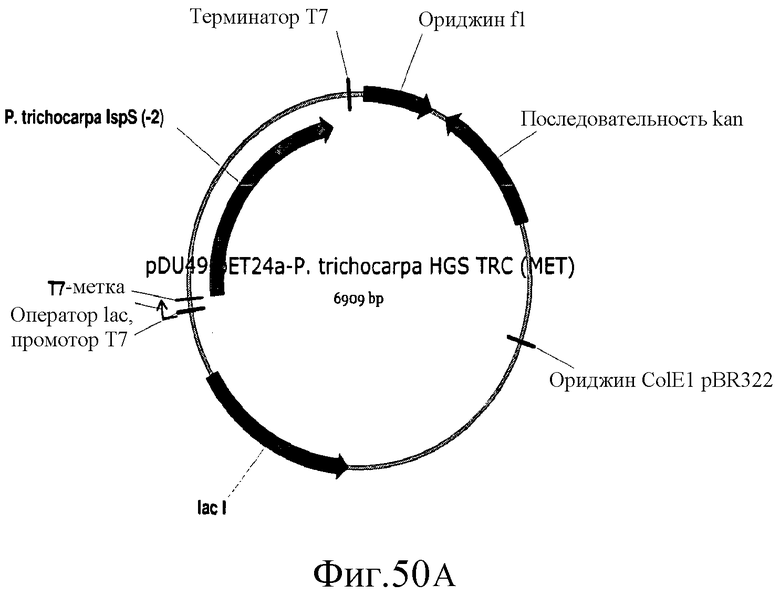

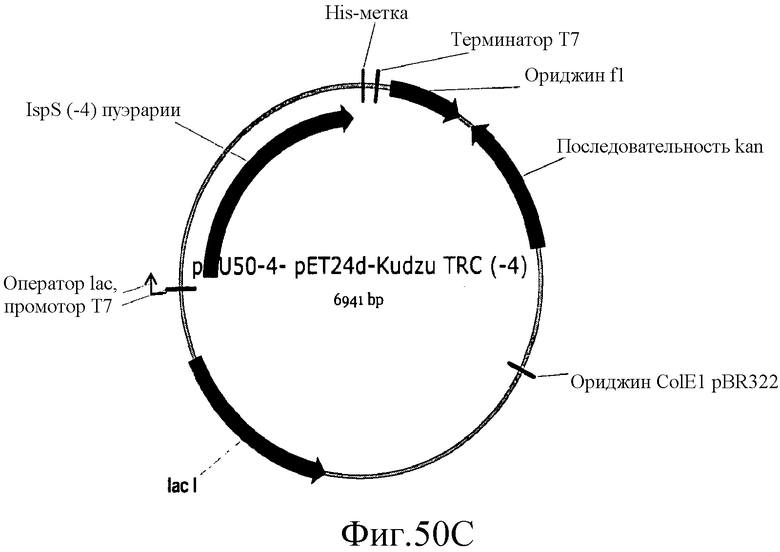























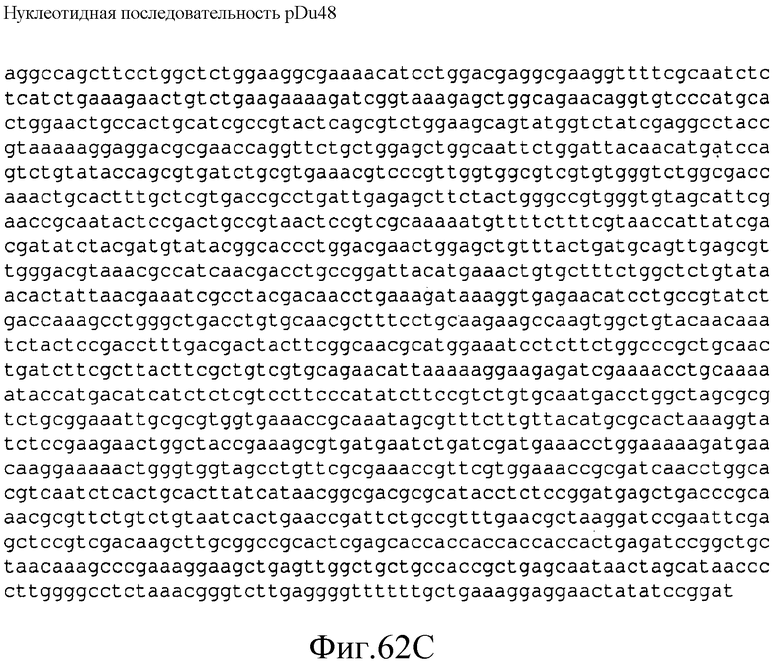



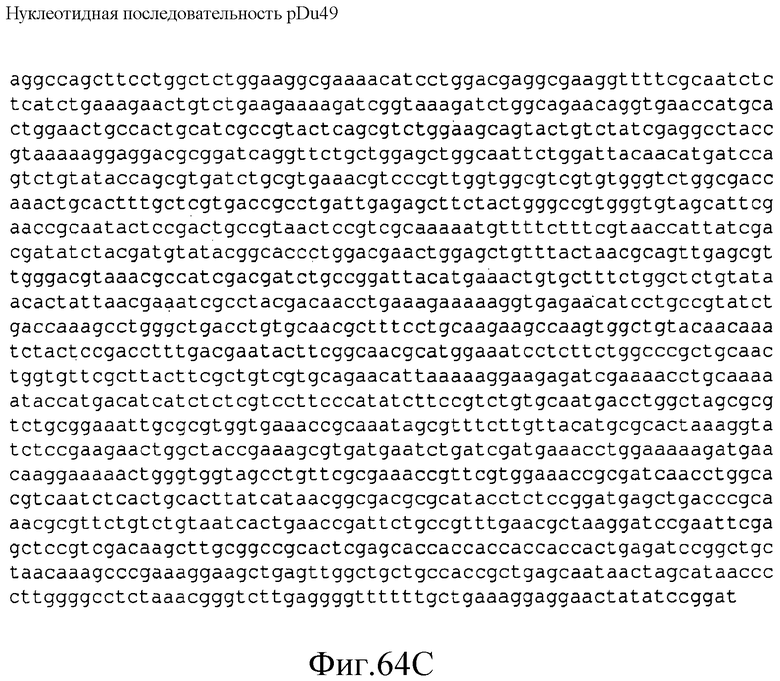







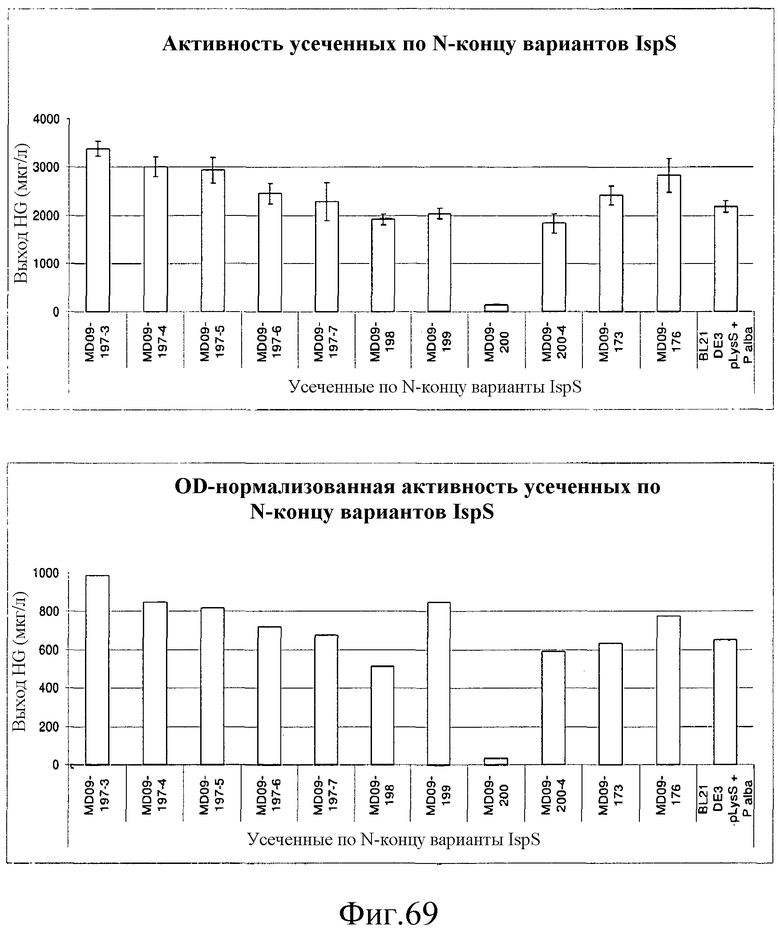
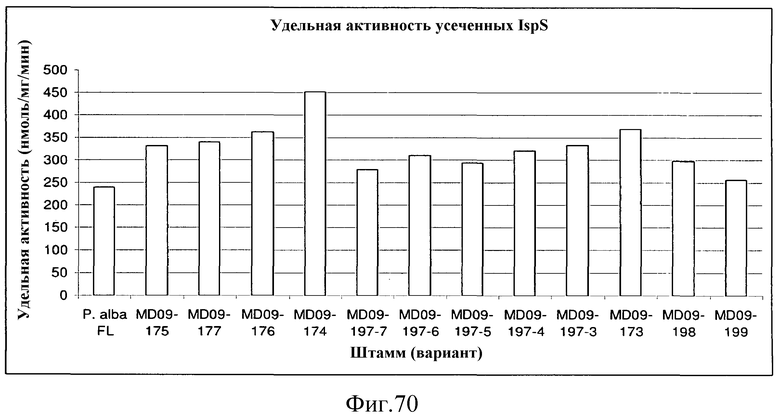


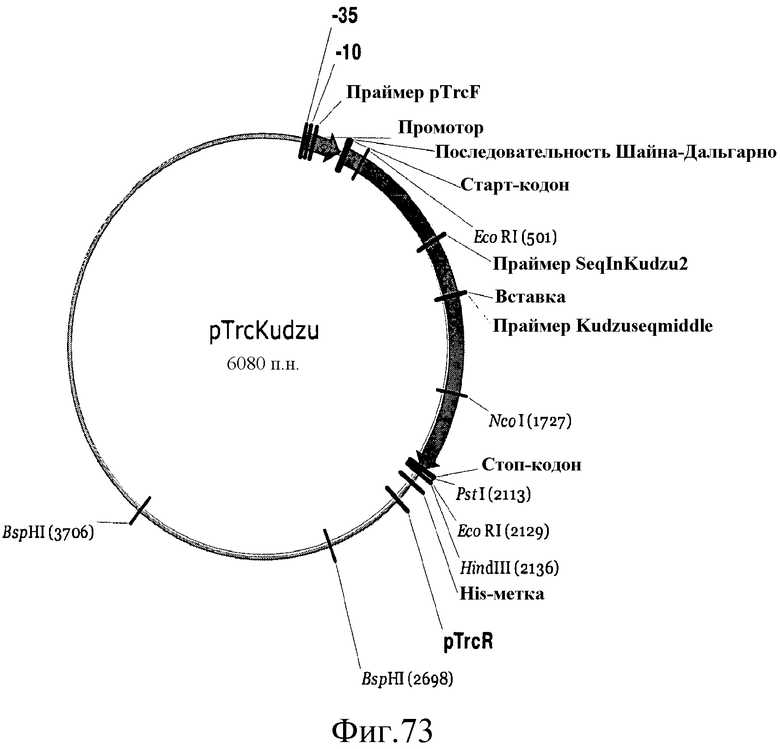



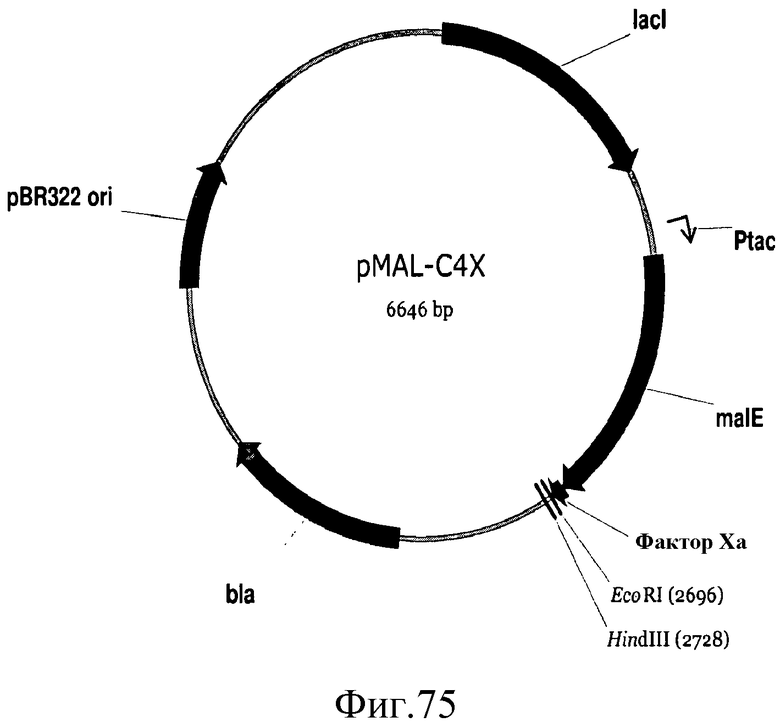



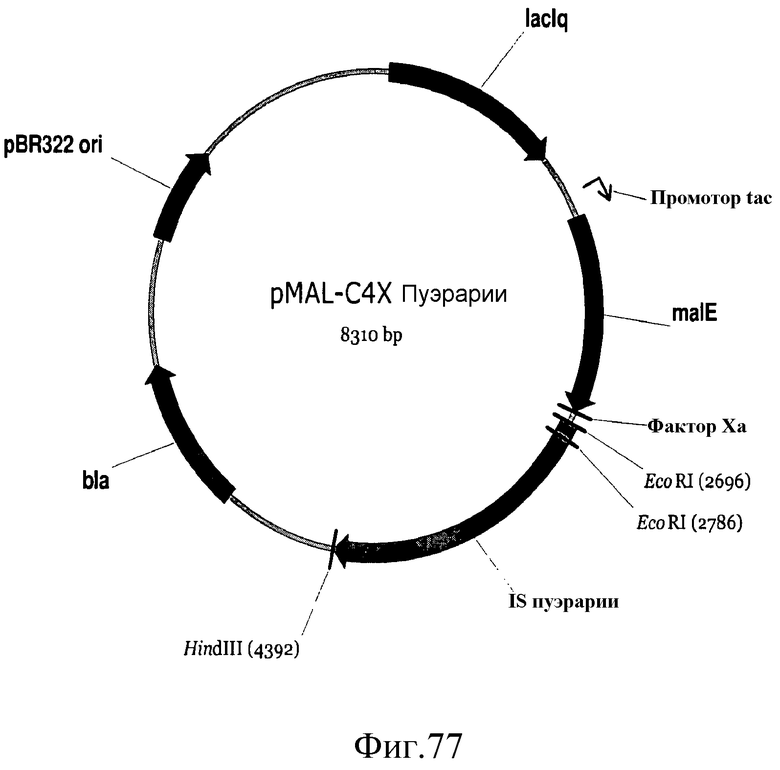



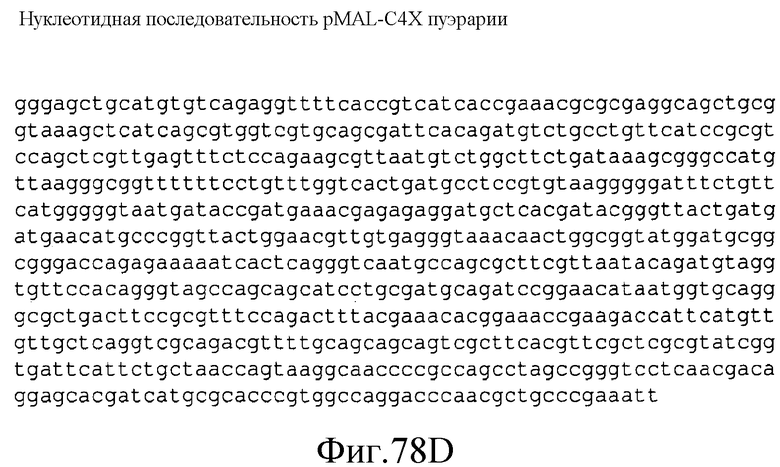




















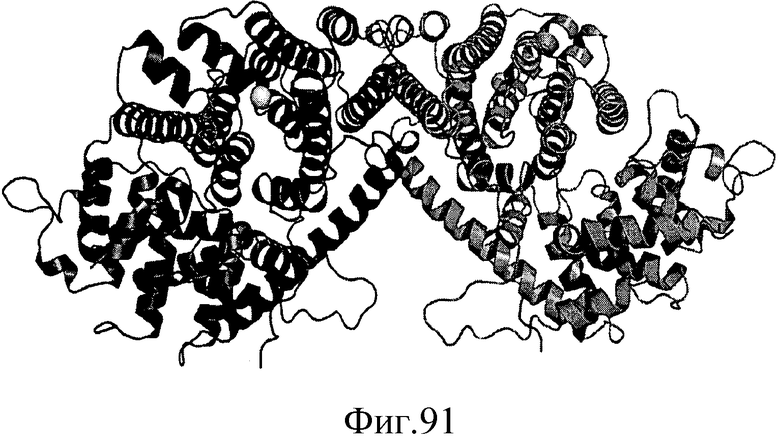

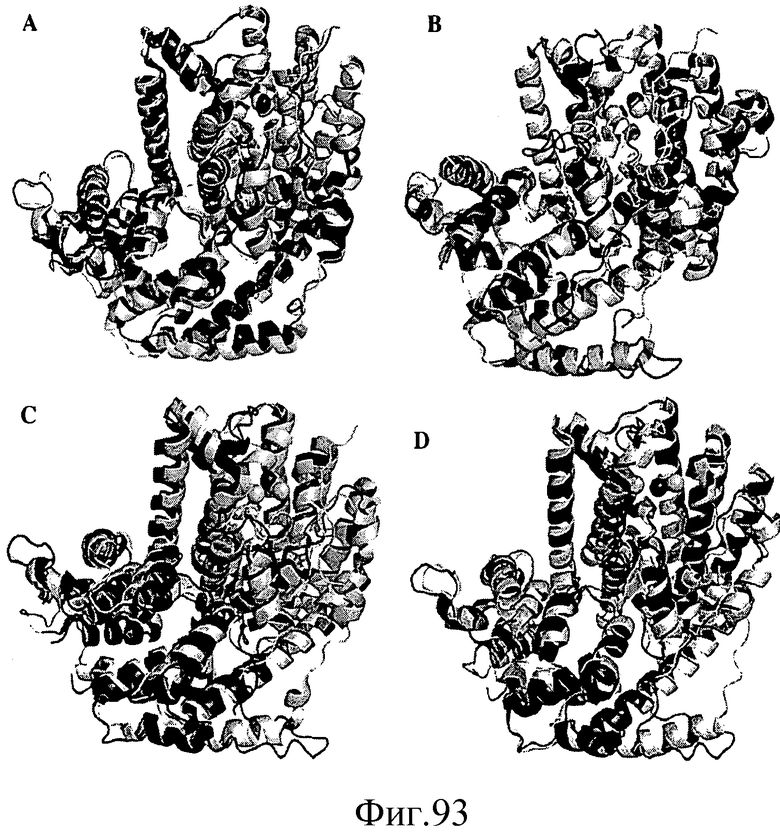
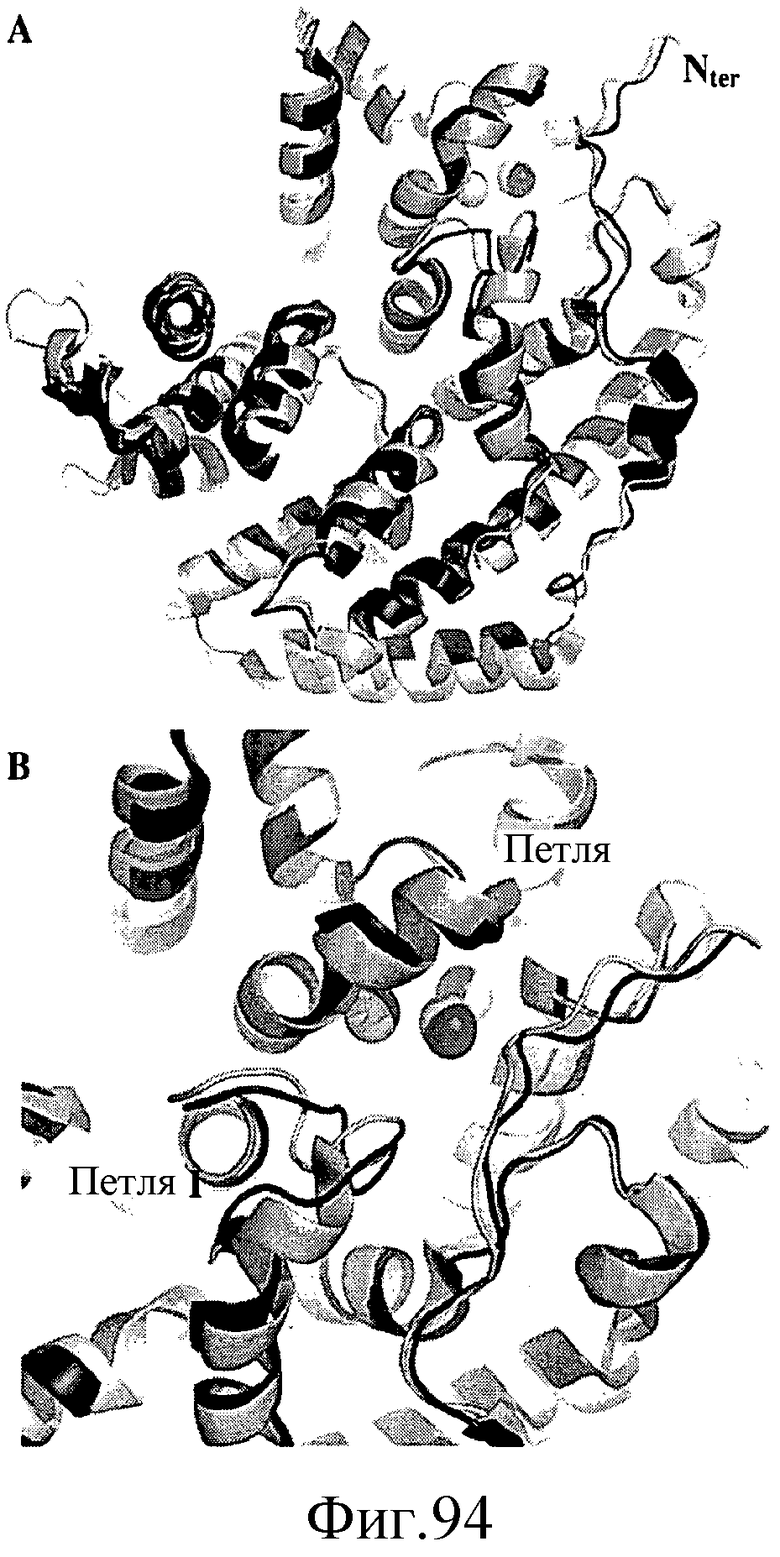
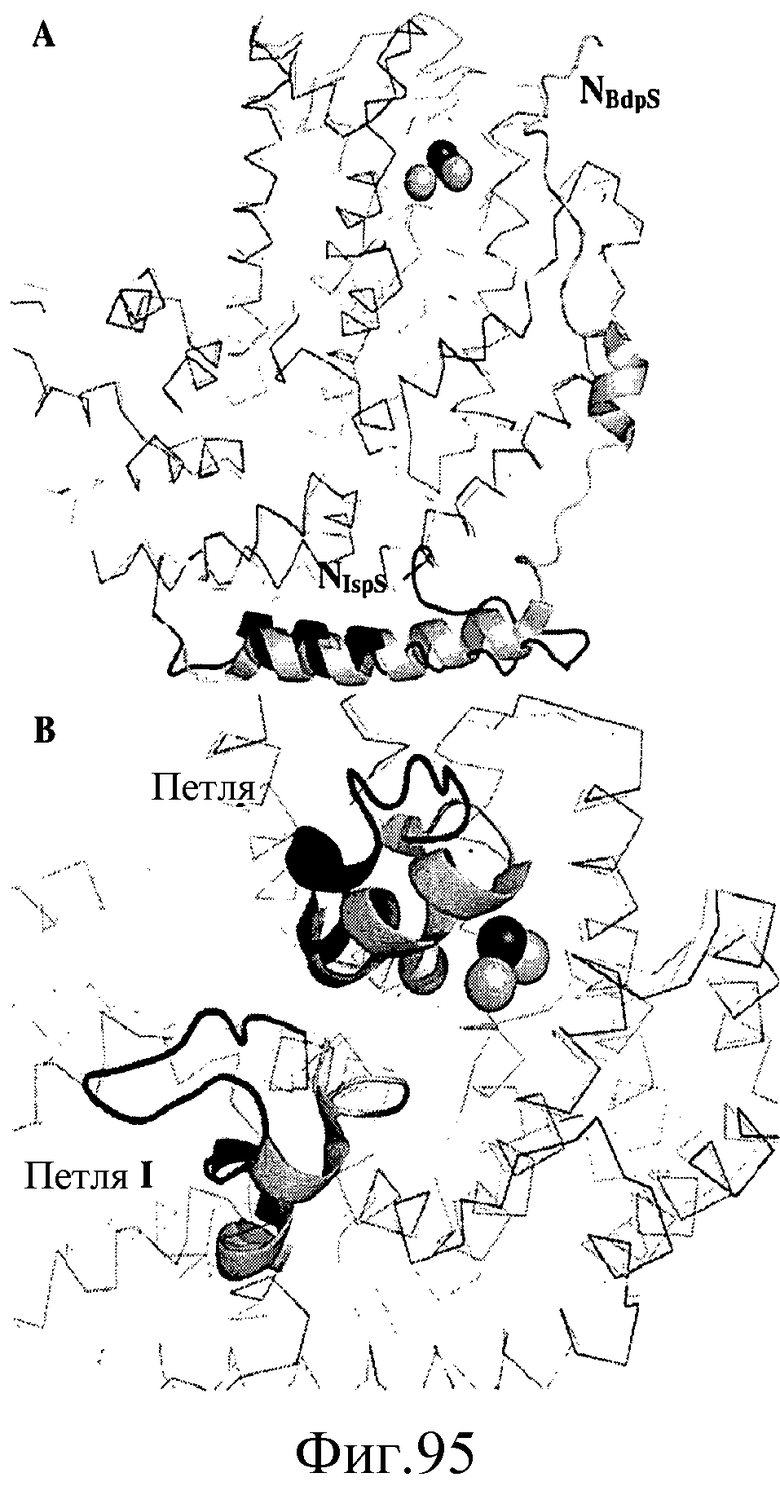
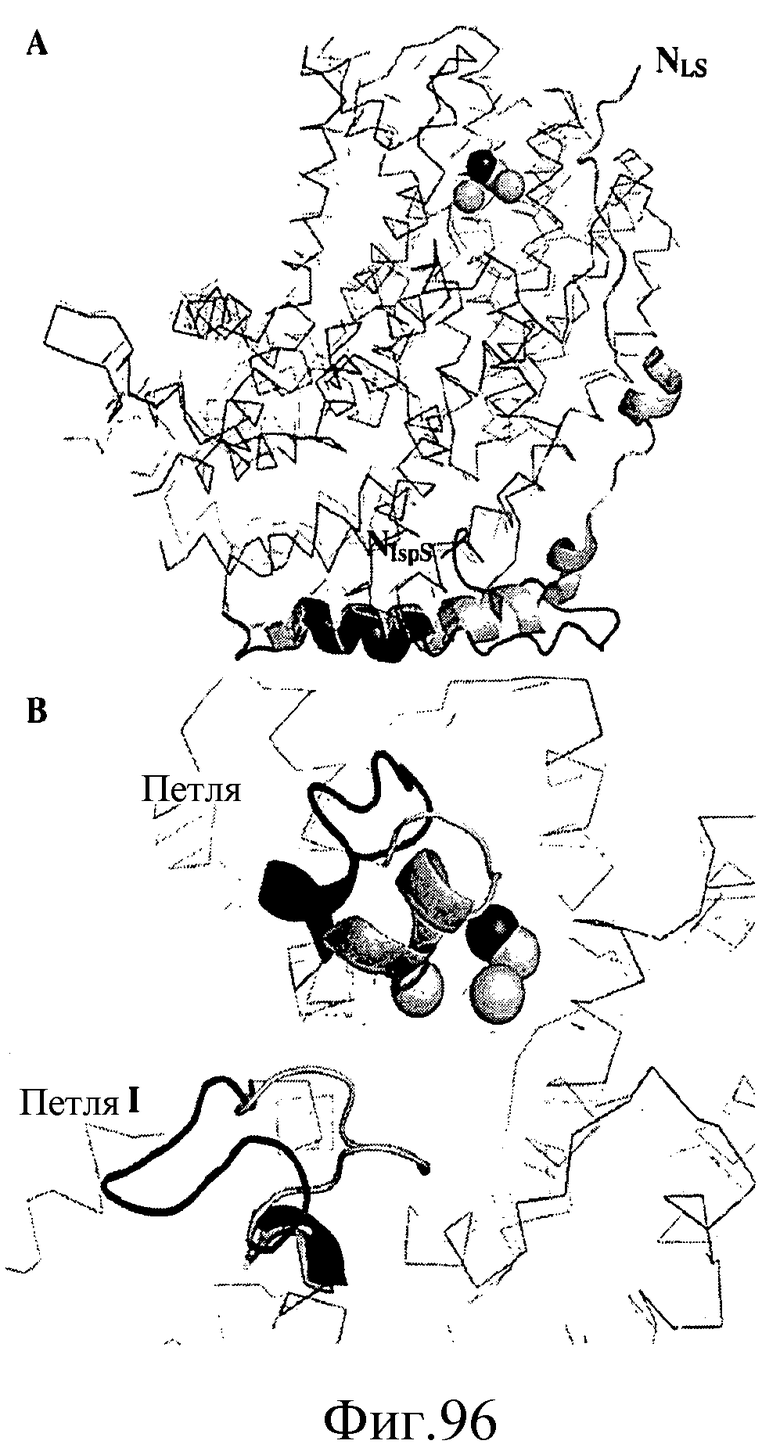
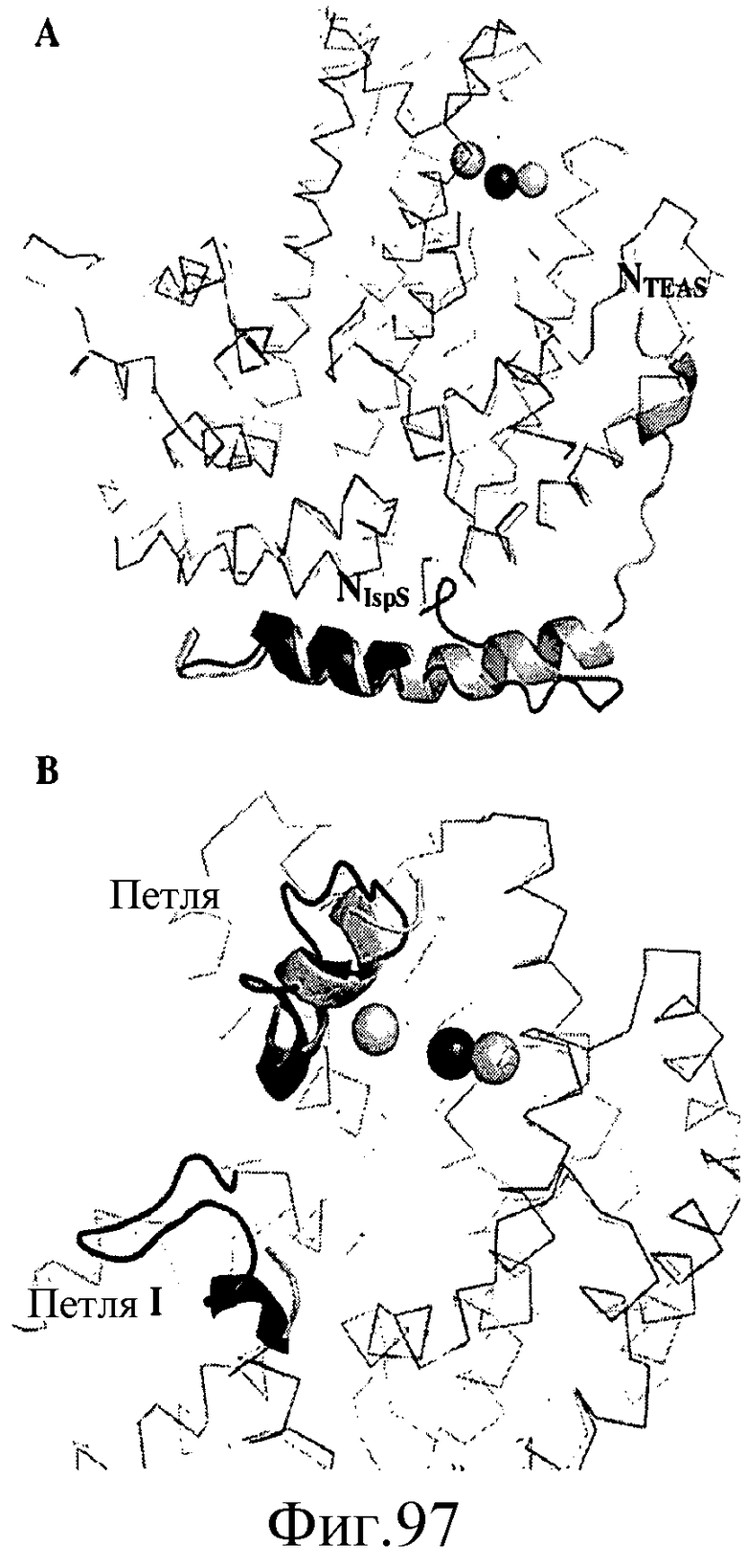
Изобретение относится к биотехнологии и генной инженерии и представляет собой клетку-хозяина, содержащую гетерологичную нуклеотидную последовательность, кодирующую усеченный вариант изопренсинтазы в функциональной комбинации с промотором, пригодную для продукции изопрена. Изобретение относится также к способу получения изопрена с использованием такой клетки. Изобретение позволяет получать изопрен с высокой степенью эффективности. 2 н. и 24 з.п.ф-лы, 97 ил., 16 табл., 16 пр.
1. Выделенная клетка-хозяин для продуцирования изопрена, содержащая гетерологическую полинуклеотидную последовательность, кодирующую усеченный вариант изопренсинтазы, в функциональной комбинации с промотором, где вариант содержит
(a) аминокислотную замену аминокислотного остатка, соответствующего изопренсинтазе тополя, имеющей последовательность SEQ ID NO:120, где указанная замена выбрана из группы, состоящей из V10M, F12S, Т15А, E18G, V58I, V58F, L70Q, L70R, L70V, L70T, Т71Р, V79L, E89D, G94A, S119F, F120L, G127R, E175V, T212I, S257A, R262G, A266G, F280L, N297K, F305L, L319M, Е323К, А328Т, D342E, А359Т, K366N, E368D, L374M, S396T, V418S, K438N, H440R, Т442А, I449V, A469S, K500R, K505Q, G507S, S509N, F511Y и N532K; или
(b) комбинацию аминокислотных замен, выбранную из группы, состоящей из G127R/F511Y, L70Q/G94A/R262G/F305L, F12S/T15A/E18G/N297K, S396T/T442I, V10M/E323K, F120L/A266G, K438N/K500R, V79L/S509N, E175V/S257A/E368D/A469S, T71P/L374M, F280L/H440R, E89D/H440R, V58F/A328T/N532K, S119F/D342E/I449V и K366N/G507S,
где указанный вариант обладает повышенной in vivo конверсией диметилаллилдифосфата (DMAPP) в изопрен по сравнению с вариантом изопренсинтазы без указанной(ых) замен(ы).
2. Клетка-хозяин по п.1, где вариант включает аминокислотную замену G507S.
3. Клетка-хозяин по п.1, где вариант включает аминокислотную замену L70R.
4. Клетка-хозяин по пп.1-3, где указанным вариантом изопренсинтазы является вариант растительной изопренсинтазы, такой как изопренсинтаза тополя, пуэрарии, осины или английского дуба.
5. Клетка-хозяин по п.1, где указанный вариант выбран из группы, состоящей из: варианта МЕА (SEQ ID NO:122), варианта MSV (SEQ ID NO:124), варианта MVS (SEQ ID NO:126), варианта MTE (SEQ ID NO:128) и варианта MNV (SEQ ID NO:130).
6. Клетка-хозяин по п.5, где указанным вариантом является вариант МЕА (SEQ ID NO:122).
7. Клетка-хозяин по п.1, где указанный вариант выбран из группы, состоящей из: варианта TRC (-3) (SEQ ID NO:136), варианта TRC (-4) (SEQ ID NO:138), варианта TRC (-5) (SEQ ID NO:140), варианта TRC (-6) (SEQ ID NO:142) и варианта TRC (-7) (SEQ ID NO:144).
8. Клетка-хозяин по п.1, где указанным вариантом является вариант MET изопренсинтазы P. tremuloides (SEQ ID NO:146).
9. Клетка-хозяин по п.1, где указанным вариантом является вариант MET изопренсинтазы P. trichocharpa (SEQ ID NO:148).
10. Клетка-хозяин по п.1, где указанная полинуклеотидная последовательность содержится в плазмиде.
11. Клетка-хозяин по п.1, где указанная полинуклеотидная последовательность интегрирована в хромосому клетки-хозяина.
12. Клетка-хозяин по п.1, где указанный хозяин выбран из группы, состоящей из грамположительных бактериальных клеток, грамотрицательных бактериальных клеток, клеток нитчатых грибов и дрожжевых клеток.
13. Клетка-хозяин по п.1, где указанный хозяин выбран из группы, состоящей из Escherichia sp. (Е. coli), Panteoa sp. (P. citrea), Bacillus sp. (B. subtilis), Yarrowia sp. (Y. lipolytica), Trichoderma (T. reesei) и Saccharomyces (S. cerevisiae).
14. Клетка-хозяин по п.1, где указанную клетку-хозяина культивируют в среде, включающей источник углерода, выбранный из группы, состоящей из глюкозы, глицерина, дигидроксиацетона, дрожжевого экстракта, биомассы, мелассы, сахарозы и масла.
15. Клетка-хозяин по п.1, где указанная клетка-хозяин дополнительно содержит гетерологичную или нативную нуклеиновую кислоту, кодирующую полипептид IDI, и/или гетерологичную или нативную нуклеиновую кислоту, кодирующую полипептид DXS, необязательно в комбинации с нативным полипептидом пути DXP.
16. Клетка-хозяин по п.1, где указанная клетка-хозяин дополнительно содержит одну или несколько нуклеиновых кислот, кодирующих полипептид IDI и полипептид DXS.
17. Клетка-хозяин по п.1, где указанная клетка-хозяин содержит один вектор, кодирующий вариант изопренсинтазы, полипептид IDI и полипептид DXS.
18. Клетка-хозяин по п.1, где указанная клетка-хозяин дополнительно содержит гетерологичную нуклеиновую кислоту, кодирующую полипептид пути мевалоната (MVA), выбранный из группы, состоящей из полипептида пути MVA, происходящего от Saccharomyces cerevisia, и полипептида пути MVA, происходящего от Enterococcus faecalis.
19. Клетка-хозяин по п.1, где указанная клетка-хозяин дополнительно содержит одну или несколько нуклеиновых кислот, кодирующих полипептид пути MVA и полипептид DXS, и где один вектор кодирует вариант изопренсинтазы, полипептид пути MVA и полипептид DXS.
20. Клетка-хозяин по п.19, где указанная клетка-хозяин дополнительно содержит одну или несколько нуклеиновых кислот, кодирующих полипептид DXS, полипептид IDI, или один или несколько остальных полипептидов пути DXP и полипептид пути MVA.
21. Клетка-хозяин по п.19, где указанная клетка-хозяин дополнительно содержит одну или несколько нуклеиновых кислот, кодирующих полипептид IDI, и один или несколько полипептидов пути MVA.
22. Клетка-хозяин по п.21, дополнительно содержащая DXS.
23. Способ продуцирования изопрена, включающий:
(a) культивирование клеток-хозяев по любому из пп.1-22 в условиях, подходящих для продуцирования изопрена, и
(b) продуцирование изопрена.
24. Способ по п.23, дополнительно включающий (c) выделение изопрена.
25. Способ по п.24, дополнительно включающий (d) полимеризацию изопрена.
26. Способ по п.25, где указанная клетка-хозяин выбрана из группы, состоящей из грамположительных бактериальных клеток, грамотрицательных бактериальных клеток, клеток нитчатых грибов и дрожжевых клеток.
| WO 2008003078, 03.01.2008 | |||
| SASAKI K et.al | |||
| Gene expression and characterization of isoprene synthase from Populus alba, FEBS Lett | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| WO 1998002550 A2, 22.01.1998 | |||
| СПОСОБ ПОЛУЧЕНИЯ ИЗОПРЕНА | 2001 |
|
RU2197461C2 |
Авторы
Даты
2014-05-20—Публикация
2009-04-23—Подача