РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка составлена согласно договору о патентной кооперации и претендует на приоритет предварительной заявки на выдачу патента США №61/502,332, поданной 28 июня 2011 г., которая полностью включена в данную посредством ссылок.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Ежегодно более чем у шести миллионов американцев выявляют заболевания опорно-двигательного аппарата, которые часто являются причиной потери работоспособности. Ежегодные расходы, связанные с лечением и уходом за больными с заболеваниями опорно-двигательного аппарата, составляют десятки миллиардов долларов. Мышечная дегенерация и нарушение функций мышц при подобных заболеваниях могут обусловливаться различными причинами, такими как ишемия тканей, тяжелые травмы, пожилой возраст, а также мышечная дистрофия, мышечная дистрофия, вызванная генетическими заболеваниями, а также такими заболеваниями, как рак, почечная недостаточность и т.п.
Принятые в настоящее время способы лечения включают, как правило, физиотерапевтическую реабилитацию, купирование болевого синдрома и применение противовоспалительных средств. В последнее время наблюдается повышенный интерес к разработке новых способов лечения, направленных непосредственно на регенерацию мышц. Например, получены перспективные результаты использования клеточных технологий при введении в организм клеток-предшественников миоцитов в организм путем инъекций в виде самостоятельного препарата или в составе полимерных композиций (Levenberg et al. 2005). Однако этот подход ограничен неполной интеграцией трансплантируемых клеток в мышечную ткань и их низкой выживаемостью.
Факторы роста также были широко изучены в рамках сосудистой регенерации при ишемии (Silva et al., 2007.), мышечной регенерации (Messina et al., 2007; Karkkainen et al., 2009). Следует отметить, что большая часть работ была осуществлена на основе применения фактора роста эндотелия сосудов (ФРЭС), хорошо известного регулятора ангиогенеза. Однако, при этом не представляется возможным отделить роль изменений ангиогенеза от непосредственного воздействия на развитие соответствующей популяции клеток-предшественников. Тем не менее, в своей статье Борселли с соавторами (Borselli et al., 2010) показали, что синергетический эффект ФРЭС и фактора роста инсулина (ИФР1), которые взаимодействуют с рецепторами типа I и активируют несколько внутриклеточных сигнальных путей: митоген-активируемую фосфоинозитол-3-киназу, кальций-кальмодулин-зависимую протеинкиназу, которые активируют сателлитные клетки мышц, вызывают их конечную миогенную дифференциацию, повышают синтез белка, и выживание миофибрилл. В связи с этим, было установлено, что эффективность применения самостоятельного препарата с замедленным высвобождением альгината или в составе полимерных композиций, значительно превышает результаты его использования в болюсной форме.
К числу альтернативных способов терапии относят применение белка теплового шока-70 (БТШ70), который является одним из белков, относящихся к общему классу белков теплового шока (БТШ), участвует в целом ряде процессов, в частности, в ренатурации денатурированных белков, активации ферментных комплексов и транспорте белков. Кроме того, БТШ способствует поддержанию целостности клеток в нормальных и патологических условиях (Vigh et al. 1997). Установлено, что повреждения тканей, возникающие в результате операций, травм или болезней, вызывают индукцию белков теплового шока. Индуцибельная форма семейства белков теплового шока с молекулярной массой 70 кДа - БТШ72, была обнаружена как в клетках различных органов, так и во внеклеточном пространстве, в том числе в скелетных мышцах в ответ на физические нагрузки.
Взаимосвязанные процессы восстановления нативной структуры белков и выживания клеток при экстремальных воздействиях являются основными механизмами действия молекулярных шаперонов (БТШ), которые играют ключевую роль в процессах ремоделирования клеток при интенсивных физических нагрузках (Morton et al. 2009; Whitman et al. 2008). Защитные свойства БТШ используют для лечения различных расстройств и состояний: при диабете, заживлении ран (Atalay et al. Curr. Pep.Prot. Sc. 2009; 10:85); раке (Ciocca et al., Stress Cell Chap. 2005; 10:86; Guzhova et al. Tsitologia 2005, 47:187); сепсисе (McConnell et al; J. Immun. 2011; 186:3718; Kustanova et al. Cell Stress Chap. 2006; 11:276); поражениях миокарда (Knowlton et al. Am. J. Physiol. Heart Cir. Physiol. 2001; 280:H455); повреждении мышц и мышечной дистрофии, восстановлении после физических нагрузок (Morton et al. Sports Med. 2009; 39(8):643); нейродегенеративных заболеваниях, в том числе болезнях Паркинсона, Альцгеймера, Хантингтона, боковом амиотрофическом склерозе (Turturici et al., Biochem. Res. Int. 2011); травмах спинного мозга (Reddy et al. Neurosurg. Focus 2008, 25(5): 1); черепно-мозговых травмах; инсульте; нейродегенеративных заболеваниях глаз, таких как глаукома и дегенерация желтого пятна (Levin, Surv. Ophthalm. 2003; 48:S21); эпилепсии (Ekimova et al. J. Neurochem. 2010; 115:1035).
Выявлено, что у пациентов с синдромом хронической усталости (СХУ) при физических нагрузках происходит активация окислительного стресса. У этих больных значительно снижены (по сравнению группой контроля) как исходные показатели БТШ70, так и его уровень после интенсивных физических нагрузок (Jammes et al. 2009). С этих позиций, индуцированный БТШ70 играет ключевую роль в механизме действия таких фитоадаптогенов, как родиола розовая и элеутеррококк колючий, которые повышают внимание, когнитивные функции, умственную и физическую работоспособность при усталости (СХУ), а также показатели выносливости. БТШ70 подавляет экспрессию NO-синтазы II и изменяет уровень циркулирующего кортизола путем прямого воздействия на рецепторы глюкокортикоидов и JNK-киназный каскад. Следовательно, профилактика NO-обусловленного стресса и связанного с ним снижения синтеза АТФ повышает работоспособность и выносливость (Panossian et al. 2009). Кроме того, установлено, что ингибиторы синтеза БТШ70 препятствуют образованию капиллярных сосудов и коллатералей в мышцах (Shiota et al. 2010).
В настоящее время известны способы применения БТШ70 для лечения многих БТШ-зависимых расстройств и состояний, в частности, в ряде патентов и опубликованных заявок приводятся данные, свидетельствующие об эффективности использования БТШ для восстановления после травм (Slepian, US Patent 5,914,345; Srivastava, US Patent Application US 2003/0012793). Кроме того, имеются патенты и заявки, касающиеся лекарственных средств, активирующих синтез БТШ70, в частности, таких, как геранилгеранилацетон, который защищает пациентов от последствий ишемических реперфузионных повреждений (Takahashi N, US Patent Application 6,846,845 B2). На экспериментальной модели мышечной дистрофии Дюшена показано, что фармакологический индуктор БТШ72 GP-15 улучшает структурно-функциональные свойства миоцитов, повышает силу и сократительную функцию пораженных мышц у мышей (Gehrig et al., 2012).
Несмотря на то, что указанные исследования показали перспективность применения БТШ70, известные способы контроля синтеза БТШ70 in vivo не удовлетворяют потребностям в данной области. Кроме того, использование экзогенного БТШ70 не получило широкого распространения по причине его низкой стабильности. Таким образом, существует острая потребность в разработке новых способов лечения, отвечающих текущим запросам.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым терапевтическим способам, которые используют БТШ70 для лечения БТШ70-зависимых расстройств или состояний путем применения экзогенного БТШ70. В связи с этим, данное изобретение представляет препараты БТШ70, применение которых повышает эффективность лечения БТШ70-зависимых расстройств или состояний. Кроме того, настоящее изобретение включает способы применения экзогенного БТШ70 для лечения БТШ70-зависимых расстройств или состояний, например для повышения работоспособности (физической и умственной), повышения выносливости или уменьшения выраженности СХУ. В качестве примеров БТШ70-зависимых расстройств или состояний могут служить дегенерация мышц и повреждения, обусловленные различными факторами, такими как ишемия тканей, тяжелые травмы, травмы тканей вследствие экстремальных физических нагрузок и утомления, пожилой возраст, мышечная дистрофия, вызванная генетическими заболеваниями, а также такими заболеваниями, как рак, почечная недостаточность и т.п.
При этом, в одном из аспектов, изобретение представляет препарат, содержащий БТШ70, например содержащий терапевтически эффективное количество БТШ70 и фармацевтически приемлемый носитель.
В другом аспекте, изобретение предлагает способ лечения БТШ70-зависимых расстройств или состояний, включающий введение субъекту препарата по настоящему изобретению, содержащего БТШ70 в терапевтически эффективном количестве, для того, чтобы обеспечить лечение БТШ70-зависимых расстройств или состояний.
В другом аспекте, изобретение предлагает способ повышения работоспособности (в частности, выносливости), уменьшения выраженности СХУ или лечения повреждений или дегенерации мышц, включающий ведение млекопитающему препарата по настоящему изобретению, содержащего человеческий БТШ70, с тем, чтобы обеспечить повышение работоспособности (в частности, выносливости), уменьшить выраженность СХУ или снизить повреждения мышц или дегенерацию мышц.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАЦИЙ
На фиг. 1 показано изменение физической работоспособности крыс (по показателю «продолжительность бега на тредбане «до отказа») в сравнении с результатами первой нагрузочной пробы.
На фиг. 2 представлена зависимость физической работоспособности крыс (по показателю «продолжительность бега на тредбане «до отказа», относительно результатов первой нагрузочной пробы) от дозы введенного БТШ70 на 12-е сутки эксперимента, нагрузочные пробы через день.
На фиг. 3 - зависимость физической работоспособности крыс (по показателю «продолжительность бега на тредбане «до отказа», относительно результатов первой нагрузочной пробы) от дозы введенного БТШ70-ПЭГ на 15-е сутки эксперимента, нагрузочные пробы через день.
На фиг. 4 - влияние БТШ70 и БТШ70-ПЭГ на физическую работоспособность крыс (по показателю «продолжительность бега на тредбане «до отказа», относительно результатов первой нагрузочной пробы) в сравнении с метапротом, нагрузочные пробы через день.
На фиг. 5 представлена электронная микроскопия (×15000) мышцы животного группы контроля. Четко видны повреждение и отек мышечных волокон, капиллярный отек, как проявления рабдомиолиза. Активированный подоцит находится в верхнем левом углу.
На фиг. 6 - электронная микроскопия (×15000) мышцы животного, получавшего препарат (БТШ70, 100 мкг). На изображении видна активированная сателлитная клетка с большим ядром, богатым эухроматином.
На фиг. 7 - электронная микроскопия (×15000) мышцы животного, получавшего препарат (БТШ70-ПЭГ, 100 мкг). На изображении видна активированная сателлитная клетка с многочисленными митохондриями.
На фиг. 8 - оптическая микроскопия (×400) мышцы животного, получавшего препарат (БТШ70, 100 мкг). Четко видны участки активации неоангиогенеза и повреждение единичных мышечных волокон.
На фиг. 9 - оптическая микроскопия (×400) мышцы животного, получавшего препарат (БТШ70-ПЭГ, 100 мкг). Четко видны зоны неоангиогенеза с большими активированными лимфоцитами и повреждением единичных мышечных волокон.
На фиг. 10 представлена зависимость физической работоспособности крыс (по показателю «продолжительность бега на тредбане «до отказа», относительно результатов первой нагрузочной пробы) от дозы введенного БТШ70 на 7-е сутки эксперимента, нагрузочные пробы ежедневно.
На фиг. 11 - зависимость физической работоспособности крыс (по показателю «продолжительность бега на тредбане «до отказа», относительно результатов первой нагрузочной пробы) от дозы введенного БТШ70-ПЭГ на 9-е сутки эксперимента, нагрузочные пробы ежедневно.
На фиг. 12 - влияние БТШ70 и БТШ70-ПЭГ на физическую работоспособность крыс (по показателю «продолжительность бега на тредбане «до отказа», относительно результатов первой нагрузочной пробы) в сравнении с метапротом, нагрузочные пробы ежедневно.
На фиг. 13 представлена электронная микроскопия (×15000) мышцы пациента до применения препарата с БТШ70. Повреждение мышцы проявляется в расслоении и деградации мышечных волокон, формировании скоплений гликогена между мышечными волокнами.
На фиг. 14 - электронная микроскопия (×15000) мышцы пациента после применения препарата с БТШ70. Регенерация мышцы проявляется в нормализации структуры мышечных волокон и увеличении активности ядер миоцитов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет новый способ лечения БТШ70-зависимых расстройств или состояний. В частности, настоящее изобретение направлено на создание препаратов БТШ70 или его производных, а также на применение подобных препаратов для лечения БТШ70-зависимых расстройств или состояний. Настоящее изобретение включает в себя лекарственные средства, способы и фармацевтические препараты, которые будут описаны с отсылкой на определения, для удобства представленные ниже. Если не указано иначе, термины, используемые в тексте, имеют следующие определения.
I. Определения
В данном контексте, термины, употребляемые в различных грамматических формах, являются равнозначными терминами, используемыми для данного изобретения (особенно в контексте формулы изобретения) и должны интерпретироваться для применения как в единственном, так и во множественном числе, если в тексте не указано обратного, или если это противоречие четко не ясно из контекста.
В данном контексте, термины «БТШ70» и «белок теплового шока 70», которые взаимно заменяют друг друга в тексте, описываются как экзогенные БТШ, которые относятся к семейству БТШ с массой 70 кДа, структура которых хорошо известна. Также используемый в тексте термин «БТШ70» включает нативный БТШ70, рекомбинантный БТШ70, а также его производные, например, БТШ70-ПЭГ.
В данном контексте, «БТШ70-зависимые расстройства или состояния» включают в себя совокупность заболеваний, расстройств и патологических состояний, регулируемых БТШ70. Например, к БТШ70-зависимым расстройствам или состояниям, относятся, но не ограничиваются ими: миопатия, наследственная и приобретенная мышечная дистрофия, рабдомиолиз, полимиозит, дерматомиозит; острая травма; травматический токсикоз, который развивается в результате природных и техногенных аварий и катастроф; ишемические повреждения, в том числе инсульт и инфаркт миокарда; сердечная недостаточность; повреждения мышц при чрезмерных физических нагрузках, в том числе без анаболических эффектов, сопровождающихся увеличением массы тела; онкологические заболевания; нейродегенеративные заболевания, такие как болезнь Альцгеймера, Хантингтона, Паркинсона, боковой амиотрофический склероз; различные воспалительные заболевания; снижение физической работоспособности (например, выносливости); снижение умственной работоспособности; СХУ; депривация сна; сепсис и геморрагический шок. В конкретном случае, БТШ70-зависимые расстройства или состояния могут быть представлены дегенерацией мышц и повреждениями, обусловленными различными факторами, такими как ишемия тканей, тяжелые травмы, травмы тканей вследствие экстремальных физических нагрузок и утомления, мышечная дистрофия, вызванная генетическими заболеваниями, а также такими заболеваниями, как рак, почечная недостаточность и т.п. или, иначе говоря, экзогенный БТШ70, описанный в тексте, получен вне организма субъекта.
В данном контексте, термин «экзогенные» описывает внешнее происхождение БТШ70, например путем рекомбинантного синтеза.
В данном контексте, термин «выносливость» описывает способность выдерживать физическую нагрузку, продолжительно обеспечивать субмаксимальную частоту сокращений мышцы сердца, или прикладывать усилия в течение длительного периода времени. В конкретном случае, выносливость может включать в себя аэробную и анаэробную, скоростную и силовую выносливость. В конкретном случае, повышение выносливости описывается, как возможность выдерживать физическую нагрузку в течение более длительного периода времени или с меньшими прилагаемыми усилиями.
В данном контексте, термин «работоспособность» описывает потенциальную возможность индивида выполнять заданную функцию физического или умственного характера на заданном уровне эффективности в течение определенного времени. Повышение умственной или физической работоспособности относится к повышению способности индивида выполнять задачу или несколько последовательных задач. Кроме того, препараты данного изобретения направлены на улучшение показателей физической и умственной работоспособности. В конкретном случае, где работоспособность является физической работоспособностью, повышение работоспособности может включать в себя повышение выносливости и мышечной силы. В другом случае, где работоспособность является умственной, повышение умственной работоспособности может включать в себя улучшение осознанного восприятия, запоминания и ясности ума.
В данном контексте, если не указано иное, термины «лечить», «леченный», «лечение» подразумевают полное излечение заболевания, расстройства или патологического состояния или уменьшение выраженности одного или нескольких симптомов, связанных с данным заболеванием, расстройством или патологическим состоянием. В конкретных случаях указанные термины используются для того, чтобы отразить минимизацию прогрессирования заболевания или расстройства или предотвращение ухудшения состояния вследствие применения препаратов по настоящему изобретению у пациентов с конкретными заболеваниями, расстройствами или патологическими состояниями. В некоторых случаях указанные термины относятся к применению описанных в рамках изобретения препаратов изолированно или в сочетании с дополнительными активными лекарственными средствами после появления у пациента симптомов, характерных для конкретных видов заболеваний, расстройств или патологических состояний. Термин «лечение» во всех его грамматических формах, используемых в тексте, подразумевает лечение заболевания, расстройства или патологического состояния у конкретного субъекта, например у млекопитающего, и включает в себя реализацию как минимум одного из пунктов: (i) предотвратить развитие заболевания, расстройства или патологического состояния, то есть задержать или остановить его прогрессирование; (ii) уменьшить тяжесть течения заболевания, расстройства или патологического состояния, то есть добиться уменьшения выраженности или исчезновения симптомов заболевания, расстройства или патологического состояния; (iii) обеспечить излечение или добиться ремиссии заболевания, расстройства или патологического состояния, предпочтительно путем устранения причины возникновения заболевания, расстройства или патологического состояния. В конкретных случаях используемый в тексте термин «лечение» во всех его грамматических формах предусматривает лечение заболевания, расстройства или патологического состояния у млекопитающего, например примата, в частности человека, в вариантах, описанных как минимум в одном из упомянутых выше пунктов (i), (ii), и (iii). Как известно, при назначении системной терапии с применением препаратов по настоящему изобретению необходимо вносить дополнительные коррективы в зависимости от возраста, массы тела, общего состояния здоровья, пола, диеты, времени приема препарата, взаимодействия с другими лекарственными средствами, тяжести состояния, которые являются предметом рутинной практики для среднего специалиста в данной области.
В данном контексте, термины «субъект», и «пациент» являются взаимозаменяемыми. Термины «субъект» и «пациент» относятся к животному (например, к птицам, таким как курица, перепел или индейка) или млекопитающему, включая, как не приматов (например, корова, свинья, лошадь, овца, кролик, морская свинка, крыса, кошка, собака и мышь), так и приматов (например, обезьяна, шимпанзе и человек). В конкретном случае субъектом является человек.
В данном контексте, если не указано иное, термины «проводить профилактику», «профилактический» и «профилактика» подразумевают предотвращение возникновения, развития или рецидива заболевания, расстройства или патологического состояния, или одного или нескольких их симптомов. В конкретных случаях термины относятся к введению препарата, устойчивого к деградации, содержащего БТШ70 и обеспечивающего поступление указанного белка субъекту, изолированно или в сочетании с другими дополнительными активными лекарственными средствами, с тем, чтобы предотвратить появление симптомов, в частности у пациентов, относящихся к группе риска для заболевания, расстройства или патологического состояния, описанного здесь. Термины охватывают подавление или снижение выраженности симптома конкретного заболевания, расстройства или патологического состояния. Пациенты с семейной предрасположенностью к данному заболеванию, расстройству или патологическому состоянию, в частности, заслуживают особого внимания как кандидаты для профилактики. Кроме того, субъекты, которые имеют в анамнезе рецидивы заболеваний, расстройств или патологических состояний, также являются потенциальными кандидатами для профилактики. В связи с этим, термин «профилактика» может быть использован взаимозаменяемо с термином «профилактическое лечение». В некоторых случаях, профилактика достигается путем введения препарата по настоящему изобретению в количестве, эффективном для профилактики.
В данном контексте, если не указано иное, «терапевтически эффективное количество» активного агента, например БТШ70, означает количество, достаточное для обеспечения терапевтического эффекта при лечении заболевания, расстройства или патологического состояния, или для того, чтобы препятствовать появлению или свести к минимуму выраженность одного или несколько симптомов, связанных с болезнью, расстройством или патологическим состоянием. Например, терапевтически эффективное количество БТШ70 означает количество БТШ70, изолированно или в сочетании с другими видами терапии, обеспечивающее терапевтический эффект при лечении заболевания, расстройства или патологического состояния. Термин «терапевтически эффективное количество» может охватывать количество препарата, которое позволяет повысить эффективность общей терапии, снизить выраженность симптомов или устранить причины заболевания, расстройства или патологического состояния, или способствует повышению терапевтической эффективности других терапевтических агентов.
В данном контексте, если не указано иное, термины «проводить терапию», «терапевтический», «терапия» относятся к предотвращению или замедлению прогрессирования, распространения или повышения тяжести течения заболевания, расстройства или патологического состояния, или одного или нескольких симптомов. Часто положительные эффекты, полученные у субъекта в результате применения профилактического и/или терапевтического средства, не приводят к излечению заболевания, расстройства или патологического состояния. В связи с этим, термин «терапия» охватывает лечение субъекта, страдающего от конкретного заболевания, расстройства или патологического состояния, которое проводится с целью предотвратить или минимизировать вероятность рецидива заболевания, расстройства или патологического состояния.
В данном контексте, если не указано иное, «эффективное для профилактики количество» активного агента, например, БТШ70 или гранулированного БТШ70, представляет собой количество, достаточное для предотвращения заболевания, расстройства или патологического состояния или для устранения вероятности его рецидива. Например, количество БТШ70, эффективное для профилактики, означает количество БТШ70, применяемого изолированно или в сочетании с другими лекарственными препаратами, достаточное для того, чтобы обеспечить предотвращение заболевания. Термин «количество, эффективное для профилактики» может охватывать количество, которое будет способствовать повышению эффективности общей профилактики или усиливать профилактическое действие другого агента.
Термин «полиэтиленгликоль» или «ПЭГ» относится к форме полиалкиленгликоль или его производным, с или без связующих веществ или производных со связующими или возбуждающими веществами. В своей обычной форме ПЭГ является линейным полимером с концевой гидроксильной группой и имеет формулу НО-СН2СН2- (CH2CH2O)n-СН2СН2-ОН. Число повторений субъединиц «n» в ПЭГ является приблизительным для молекулярной массы, единицей ее измерения является Да.
II. Лекарственные средства по настоящему изобретению
Лекарственные средства по настоящему изобретению - БТШ70 или его производные - могут быть использованы в препаратах и в способах лечения по настоящему изобретению. В конкретном случае, изобретение представляет препараты и способы использования БТШ70 в его нативной форме. В конкретном случае, изобретение предлагает препараты и способы использования производных БТШ70, например пегилированного БТШ70 (БТШ70-ПЭГ). В конкретном примере, изобретение предлагает препараты и способы использования рекомбинантного БТШ70, в частности рекомбинантного человеческого БТШ70 (рчБТШ70). В конкретном примере изобретение предлагает препараты и способы использования производных рекомбинантного БТШ70, в частности пегилированного рекомбинантного человеческого БТШ70 (рчБТШ70ПЭГ).
Еще в одном примере представляется пегилированный БТШ70, например в форме, подходящей для его использования субъектом. В конкретных примерах БТШ70 представляется в обогащенной форме, где обогащенный БТШ70 содержит преимущественно БТШ70, свободный от примесей небелковой природы. В частных случаях чистота такого обогащенного БТШ70 может составлять свыше 50% (содержится менее 50% примесей небелковой природы), например чистота свыше 60%, чистота свыше 70%, чистота свыше 80%, чистота свыше 90%, чистота свыше 92%, чистота свыше 94%, чистота свыше 96%, чистота свыше 98%, чистота свыше 99%.
III. Способы изобретения
Изобретение относится к способу применения лекарственных форм или препарата данного изобретения, которые содержат белок теплового шока 70, например, рекомбинантный человеческий белок теплового шока 70, для лечения БТШ70-ассоциированных расстройств или заболеваний. Например, в одной ситуации настоящее изобретение предлагает метод лечения БТШ70-ассоциированных расстройств или заболеваний путем введения субъекту, например, млекопитающему, лекарственной формы, полученной в результате данного изобретения, например, терапевтически эффективное количество БТШ70 (например, человеческий белок теплового шока 70, например, формулу белка теплового шока человека 70), что приводит к лечению у субъекта БТШ70-ассоциированных расстройств или заболеваний.
В конкретном случае применения данного изобретения, БТШ70-ассоциированные расстройства или заболевания, выбираются из группы, состоящей из миопатии, как наследственной, как например мускульной дистрофии, так и приобретенной, как например, рабдомиолиз, полимиозит, и дерматомиозит; острых травм; травматического токсикоза, полученного в результате аварии; ишемии, в том числе инсульта и инфаркта миокарда; сердечной недостаточности; повреждения мышц в результате чрезмерных физических упражнений, например, без анаболических эффектов, таких как увеличение массы тела; рака; нейродегенеративных заболеваний, таких как болезнь Альцгеймера, Хантингтона и Паркинсона, и латерального амиопатическиого склероза; определенного типа воспалений, снижения физической работоспособности (например, выносливости), например, по отношению к абсолютной способности личности; снижения умственной деятельности, например, по отношению к абсолютной способности человека; синдрома усталости; лишения сна; сепсиса, и геморрагического шока. В конкретном примере, БТШ70-ассоциируемые расстройства и заболевания могут включать в себя мышечную дегенерацию и повреждения, произошедшие по различным причинам, таким как ишемия тканей, тяжелые травмы, травмы тканей, вызванные физическими нагрузками и утомляемостью, пожилой возраст, мускульная дистрофия, вызванная генетическими заболеваниями, а также основные заболевания, такие как рак, почечная недостаточность и другие.
В конкретном варианте применения данного изобретения, БТШ70-ассоциируемые расстройствами и заболеваниями являются саркопения, связанные со старением и постепенным снижением мышечной массы, силы и качества. В другом конкретном варианте применения данного изобретения, БТШ70-ассоциируемые расстройства и заболевания, является снижение физической работоспособности (например, выносливость), или снижение умственной работоспособности, в случае, когда производительность (или выносливость) увеличивается путем применения лекарственных форм данного изобретения. В другом конкретном случае, БТШ70-ассоциируемым расстройством или заболеванием является синдром усталости. В другой конкретной ситуации БТШ70-ассоциируемые расстройства и заболевания представляют собой повреждение мышц или мышечная дегенерация. В другой конкретной ситуации БТШ70-ассоциируемым расстройством и заболеванием является рак.
В другом случае применения данного изобретения представляет собой метод лечения БТШ70-ассоциируемых расстройств и заболеваний, включающий в себя применение субъектом терапевтически эффективного количества БТШ70. К таким заболеваниям относятся миопатии, как наследственная, как например мускульная дистрофия, так и приобретенная, такая как рабдомиолиз, полимиозит, и дерматомиозит; острые травмы; травматический токсикоз, полученный в результате аварии; ишемия, в том числе инсульт и инфаркт миокарда; сердечная недостаточность; повреждение мышц в результате чрезмерных физических упражнений, например, без анаболических эффектов, таких как увеличение массы тела; рак; нейродегенеративные заболевания, такие как болезнь Альцгеймера, Хантингтона и Паркинсона, и латеральный амиопатический склероз; определенный тип воспаления, снижение физической работоспособности (например, выносливости), например, по отношению к абсолютной способности личности; снижение умственной деятельности, например, по отношению к абсолютной способности человека; синдром усталости; лишение сна; сепсис, и геморрагический шок. В конкретном варианте применения, БТШ70-ассоциируемым расстройством может стать саркопения, вызванная старением, прогрессивным упадком мышечной массы, силы и качества. В другом конкретном примере, БТШ70-ассоциируемыми расстройствами и заболеваниями, являются снижение физической производительности (например, выносливости), или снижение умственной производительности, когда производительность (или выносливость) повышается при помощи лечения с применением лекарственной формы данного изобретения. В другой конкретной ситуации, БТШ70-ассоциируемые расстройствами и заболеваниями является синдром усталости. В другой конкретной ситуации, БТШ70-ассоциируемыми расстройствами и заболеваниями являются разрушение мышц или мышечная дегенерация. В другой конкретной ситуации, БТШ70-ассоциируемым расстройством или заболеванием является рак.
В другом варианте применения данного изобретения, предоставляется метод увеличения производительности (например, выносливости), облегчения синдрома усталости, или лечение повреждение мышц или их дегенерации, при помощи введения субъекту, например, млекопитающему, лекарственной формы, выведенной в результате данного изобретения, например, терапевтически эффективное количество БТШ70 (например, человеческий белок теплового шока 70, например, формула белка теплового шока человека 70) таким образом, что производительность повышается, синдром усталости облегчается, а повреждение мышц или мышечная дегенерация у субъекта вылечиваются.
В другой ситуации данное изобретение предоставляет собой метод увеличения производительности (например, выносливости), облегчение синдрома усталости или предоставляет лечение повреждений мышц или мышечную дегенерацию, при помощи введения млекопитающему препарата, содержащего белок теплового шока человека 70, так, что производительность увеличивается, синдром усталости облегчается, а повреждение мышц или мышечная дегенерация у млекопитающего вылечивается.
В другой ситуации данное изобретение предоставляет собой метод лечения рака, путем введения млекопитающему лекарственного препарата, полученного при данном изобретении, например препарата, содержащего белок теплового шока человека 70, так, что рак у млекопитающего вылечивается.
В конкретном варианте данного изобретения, БТШ70 является рекомбинантным человеческим БТШ70.
В конкретном варианте данного изобретения БТШ70 является пегилированным БТШ70.
В конкретном варианте данного изобретения млекопитающее является человеком.
В конкретном варианте данного изобретения лекарственная форма применяется внутривенно, подкожно, интраназально, перорально или ингаляционно.
Кроме того, настоящее изобретение предполагает включение любого нового способа получения соединений или составов по настоящему изобретению.
В дополнительных ситуациях, данное изобретение обеспечивает способ увеличения работоспособности, облегчения синдрома усталости и лечения повреждений мышц и мышечной дегенерации, включающее введение млекопитающему, например человеку, лекарственную форму, содержащей рекомбинантный человеческий белок теплового шока 70.
В другом варианте применения данное изобретение обеспечивает способ увеличения работоспособности, облегчения синдрома усталости и лечения повреждений мышц и мышечной дегенерации, включающий введение млекопитающему, например человеку, лекарственную форму, содержащей пегелированный рекомбинантный человеческий белок теплового шока 70. В некоторых ситуациях рекомбинантный человеческий белок теплового шока 70 показывает коэффициент элиминации из сыворотки, который, по меньшей мере, на порядок медленнее, чем не пегелированного белка.
Не желая быть связанными теорией, в некоторых конкретных вариантах осуществления предполагается, что БТШ70 данного изобретения может обеспечивать свое действие путем стимулирования проангиогенеза и активации клеток-спутников - ключевой популяции мышечных стволовых клеток.
IY. Препараты по настоящему изобретению
Рецептура изобретения включает в себя БТШ70, например, терапевтически эффективное количество БТШ70, и может быть использована для любого способа введения препарата, не ухудшающего значительно способность БТШ70 выполнять свои функции, например, внутривенные инъекции, пероральное введение, интраназальное введение, внутривлагалищное введение, ректальное введение, или ингаляционный способ введения.
Таким образом, один из вариантов осуществления данного изобретения обеспечивает лекарственную форму, содержащую БТШ70, например, терапевтически эффективное количество БТШ70, и фармацевтически приемлемый носитель. В некоторых вариантах осуществления настоящего изобретения лекарственная форма, содержащая соединение, описанное в данном изобретении, разработано для внутривенного, подкожного, интраназального, перорального или ингаляционного введения.
В некоторых примерах осуществления данного изобретения количество белка теплового шока 70, присутствующего в препарате, находится в диапазоне от 0,1 до 10 мг.
В некоторых вариантах осуществления данного изобретения, БТШ70 является рекомбинантным человеческим БТШ70.
В некоторых вариантах осуществления данного изобретения, БТШ70 является пегилированным БТШ70, например, пегилированным рекомбинантным человеческим БТШ70, например, ПЭГ-рчБТШ70.
В некоторых вариантах изготовления фармацевтических препаратов, содержащих БТШ70 (например, ПЭГ-рчБТШ70) БТШ70 материал, например терапевтически эффективное количество материала, соединяется с фармацевтически приемлемым носителем или наполнителем. Предпочтительно, чтобы носитель или наполнитель был инертен. Фармацевтический носитель может быть любым совместимым, нетоксичным веществом, пригодным для доставки формулы БТШ70 согласно данному изобретению до субъекта. Примеры подходящих носителей включают физиологический раствор, раствор Рингера, раствор декстрозы и раствор Хэнка. Также могут быть использованы неводные носители, такие как нелетучие масла и этилолеат. Предпочтительным носителем является 5% раствор глюкозы/физиологического раствора. Носитель может содержать небольшие количества добавок, таких как вещества, усиливающие изотоничность и химическую стабильность, например, буферы и консерванты. Препараты данного изобретения могут быть введены перорально или в виде инъекций. Инъекции включают, но не ограничиваются внутримышечными, подкожными, внутрикожными или внутривенными. Кроме того, внутрисуставные или другие инъекции могут быть использованы при соответствующих обстоятельствах. При введении парентерально пегилированного БТШ70 предпочтительно готовят в единичной дозированной форме инъекций (раствор, суспензию, эмульсию) в сочетании с фармацевтическим носителем.
Смотреть например., Avis et al., eds., Pharmaceutical Dosage Forms: Parenteral Medications, Dekker, N.Y. (1993); Lieberman et al., eds., Pharmaceutical Dosage Forms: Tablets, Dekker, N.Y. (1990); and Lieberman et al., eds., Pharmaceutical Dosage Forms: Disperse Systems, Dekker, N.Y. (1990). Кроме того, лекарственные препараты по данному изобретению могут вводиться в тело пациента при помощи вживляемой или инъекционной системы доставки препарата, например, Urquhart et al. Ann. Rev. Pharmacol. Toxicol. 24:199-236, (1984); Lewis, ed., Controlled Release of Pesticides and Pharmaceuticals, Plenum Press, New York (1981); U.S. Pat. Nos. 3,773,919; 3,270,960; и прочее. Пегилированный БТШ70 можно вводить в водных растворителях, таких как вода, физиологический раствор или буферные транспортные средства с или без различных добавок и/или разбавителей. Получение таких фармацевтических составов известно в данной области;
Смотреть например., Remington's Pharmaceutical Sciences and U.S. Pharmacopeia: National Formulary, Mack Publishing Company, Easton, Pa. (1984).
А. Введение препаратов по настоящему изобретению
В целом, препараты данного изобретения, содержащие БТШ70, могут вводиться в различных дозировках, которые не влияют или существенно не снижают высокую стабильность БТШ70 (т.е., позволяя данным препаратам достигнуть желаемой функции), включая, но не ограничиваясь, твердой или жидкой, пероральной, парентеральной, интраназальной лекарственной формой, формой суппозиториев, пастилок, таблеток для рассасывания, буккальной, с контролируемым высвобождением лекарственной формы, с импульсным освобождением лекарственной формы, немедленным освобождением лекарственной формы, внутривенный раствор, суспензии или их комбинации. Дозировка может быть пероральной лекарственной формой. Пероральная лекарственная форма может быть таблетированной или капсуловидной таблеткой. Препарат может быть введен, например, перорально или парентерально, в том числе внутривенно, внутримышечно, внутрибрюшинно, подкожно, внутрикожно, через дыхательные пути (аэрозоль), ректально, вагинально и местно (в том числе трансбуккально и подъязычно). В одном из вариантов, препараты, содержащие БТШ70, поставляются в нужное место, например, головной мозг, путем непрерывного вливания через шунтирование.
В другом варианте препарат данного изобретения можно вводить парентерально, например внутривенно. Препараты для введения обычно содержат раствор БТШ70, растворенный в фармацевтически приемлемом носителе. К приемлемым носителям и растворителям, которые могут быть использованы, относятся вода и раствор Рингера, изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла традиционно могут быть использованы в качестве растворителя или суспендирующей среды. С этой целью любое мягкое нелетучее масло может быть использовано, в том числе синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота также могут быть использованы в приготовлении инъецируемых препаратов. Эти растворы являются стерильными и свободными от нежелательного материала. Эти составы могут быть стерилизованы с помощью обычных, хорошо известных способов стерилизации. Составы могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для физиологических условий, такие как регулятор кислотности и буферные вещества, агенты, регулирующие токсичность, например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и тому подобное. Концентрация БТШ70 в этих препаратах может широко варьироваться, и выбор в первую очередь будет основываться на объеме жидкости, вязкости, массе тела, и т.п., в соответствии с конкретным способом введения и потребностью пациента. Для внутривенного введения, смесь может представлять собой стерильный инъецируемый препарат, такой как стерильная водная или масляная суспензия для инъекций. Эту суспензию можно приготовить в соответствии с известными способами с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекций может также быть стерильным инъекционным раствором или суспензией в нетоксичном парентерально приемлемом растворителе, таким как раствор 1,3-бутандиола.
В одном случае БТШ70 можно вводить путем введения в центральную нервную систему субъекта, например, в спинномозговую жидкость субъекта. Препараты для введения обычно содержат раствор БТШ70, растворенный в фармацевтически приемлемом носителе. В некоторых аспектах, БТШ70 вводится внутриоболочечно, например, в желудочек мозга, поясничной области, или цистерна. В другом случае БТШ70 вводится интраокулярно, для контакта с ганглиозными клетками сетчатки.
Фармацевтически приемлемый состав может быть суспендирован в водном растворителе и введен с помощью обычных игл для подкожных инъекций или инфузаматов. Перед введением, состав может быть стерилизован, предпочтительно, при помощи гамма-излучения или электронным пучком.
Для перорального введения препараты обычно будут представлены в виде стандартных лекарственных форм - таблетки, пилюли, драже, пастилки или капсулы в виде порошка или гранул; или в виде водного раствора, суспензии, жидкости, геля, сиропа и т.д., пригодных для приема пациентом внутрь. Таблетки для перорального применения могут включать в свой состав активные ингредиенты вместе с фармацевтически приемлемыми эксципиентами, такими как инертные разбавители, дезинтегрирующие агенты, связующие агенты, смазывающие агенты, подслащивающие агенты, корригенты, красители и консерванты. Подходящие инертные разбавители включают, но не ограничиваются натрием и карбонатом кальция, натрием и фосфатом кальция и лактозы, в то время как кукурузный крахмал и альгиновая кислота являются подходящими веществами для улучшения распадаемости таблеток. Связующие вещества могут включать, но не ограничиваются, крахмалом и желатином, а смазочное вещество, если оно присутствует, как правило, является стеаратом магния, стеариновой кислотой или тальком. При желании, таблетки могут быть покрыты таким материалом, как глицерилмоностеаратом или глицерилдистеаратом, чтобы задержать всасывание в желудочно-кишечном тракте.
Фармацевтические препараты для перорального применения могут быть получены путем комбинации БТШ70 с твердым наполнителем, опционально измельченным для получения смеси и обработки смеси гранул после добавления подходящих дополнительных соединений, при желании, для получения таблеток или драже. Подходящими твердыми носителями в добавление к ранее упомянутым являются углеводные или белковые наполнители, которые включают, но не ограничиваются ими, сахар, в том числе лактозу, сахарозу, маннит или сорбит, кукурузный, пшеничный, рисовый, картофельный крахмал или крахмал, полученный из других растений; целлюлозу, такой как метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза натрия и камедь в том числе аравийскую и трагакант; а также белки, такие как желатин и коллаген. Дополнительно могут быть добавлены дезинтегрирующие или солюбилизирующие агенты, такие как сшитый поливинилпирролидон, агар, альгиновая кислота или ее соль, такая как альгинат натрия.
Капсулы для перорального применения включают твердые желатиновые капсулы, в которых активный ингредиент смешан с твердым разбавителем, и мягкие желатиновые капсулы, в которых активные ингредиенты смешивают с водой или маслом, таким как арахисовое масло, жидкий парафин или оливковое масло.
Драже имеют подходящее покрытие. Для этой цели, могут использоваться концентрированные растворы сахара, которые могут опционально содержать аравийскую камедь, тальк, поливинилпирролидон, карбопол, полиэтиленгликоль и/или диоксид титана, растворы лаков и подходящие органические растворители или смеси растворителей. Красители или пигменты могут быть добавлены в покрытие таблеток или драже для идентификации или характеристики различных комбинаций доз активных БТШ70.
Для введения через слизистую (например, трансбуккального, ректального, назального, глазного, и т.д.), в препарате используются соответствующие для данного барьера смачивающие средства. Такие смачивающие средства обычно известны в данной области.
В частности, препараты, полученные в результате данного изобретения могут быть введены в носовую полость в любой подходящей форме. Например, препараты, полученные в результате данного изобретения, могут быть введены в носовую полость в виде капель или спрея или порошков, полученных в результате данного изобретения, которые могут быть применены в виде аэрозоля. Одним из способов введения препаратов данного изобретения может быть использование распылительного устройства. Устройство для распыления аэрозолей может быть для единичной дозы или система для многочисленных доз, например, содержащей бутылку, насос и привод, и доступное из различных коммерческих источников, в том числе Pfeiffer (Германия), Valois (Франция), Calmar (Германия), Ursatech (Германия), Bespak (Великобритания) и Becton-Dickinson (США). Электростатические распылители, такие как описаны в патенте США №5.655.517, также пригодны для интраназального введения композиций по настоящему изобретению.
Препараты для ректального введения могут быть представлены в виде суппозиториев с подходящей основой, содержащие, например, масло какао или салицилат. Составы, пригодные для вагинального введения, могут быть представлены в виде вагинальных суппозиториев, тампонов, кремов, гелей, паст, пен или аэрозолей, содержащих в дополнение к активному ингредиенту такие носители, которые известны как применяемые в данной области. Для внутримышечного, внутрибрюшинного, подкожного и внутривенного использования, БТШ70 обычно будут представлены в виде стерильных водных растворов или суспензий, буферизованных в соответствующем pH и изотоничности. Подходящие водные носители включают раствор Рингера и изотонический раствор хлорида натрия. Водные суспензии могут включать суспендирующие агенты, такие как производные целлюлозы, альгинат натрия, поливинилпирролидон и трагакантовая камедь и смачивающие агенты, такие как лецитин. Подходящие консерванты для водных суспензий включают этил- и н-пропил-п-гидроксибензоат.
Суппозитории для ректального введения БТШ70 могут быть получены путем смешивания лекарственного средства с подходящим не раздражающим наполнителем, который является твердым при обычных температурах, но жидким при ректальной температуре и поэтому будет плавиться в прямой кишке с высвобождением лекарственного средства. К таким материалам относятся какао-масло и полиэтиленгликоли.
Препараты могут быть доставлены через кожу, приготовлены в виде палочки аппликатора, растворов, суспензии, эмульсии, геля, крема, мази, пасты, желе, красок, порошков или аэрозолей.
БТШ70 также может быть представлен в виде водных растворов или липосом. Водные суспензии могут содержать БТШ70 в смеси с эксципиентами, пригодными для изготовления водных суспензий. Такие наполнители включают, но не ограничиваются, суспендирующими агентами, такие как натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и камедь акации и диспергирующие или смачивающие агенты, такие как природные фосфатиды (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, стеарат полиоксиэтилена), продукта конденсации этиленоксида с длинноцепочечными алифатическими спиртами (например, heptadecaethylene oxycetanol), продукта конденсации этиленоксида с частичным сложным эфиром, полученным из жирной кислоты и гексита (например, полиоксиэтилен сорбит моноолеат), или продукт конденсации этиленоксида с частичным сложным эфиром, полученные из жирных кислот и гексита ангидрида (например, моноолеат полиоксиэтиленсорбитана). Водная суспензия может также содержать один или несколько консервантов, таких как этил- или н-пропил п-гидроксибензоат, один или несколько красителей, один или несколько ароматизирующих агентов и один или несколько подсластителей, таких как сахароза, аспартам или сахарин. Составы могут быть приспособлены для создания определенной осмолярности.
Масляные суспензии могут быть приготовлены суспендированием БТШ70 в растительном масле, например, в арахисовом, оливковом, кунжутном или кокосовом масле, или в минеральном масле, таком как жидкий парафин, или их смеси. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, такие как глицерол, сорбит или сахароза, могут быть добавлены, чтобы обеспечить вкус перорального препарата. Эти препараты могут быть сохранены при помощи добавления антиоксиданта, такого как аскорбиновая кислота. В качестве примера для инъекций масляным носителем (см. Minto, J. Pharmacol. Exp.Ther. 281:93-102, 1997). Фармацевтические препараты могут также быть в форме масло-в-воде эмульсий. Масляная фаза может представлять собой растительное масло или минеральное масло, описанные выше, или смесь из них. Подходящие эмульгаторы включают природные камеди, такие как аравийская камедь и трагакантовая камедь, природные фосфатиды, такие как соевый лецитин, сложные эфиры или частичные сложные эфиры, полученные из жирных кислот и ангидридов гексита, например сорбитан моноолеат, и продукты конденсации этих неполных эфиров с этиленоксидом, такие как полиоксиэтилен сорбитан моноолеат. Эмульсия может также содержать подсластители и вкусовые агенты, как для препаратов в форме сиропа и эликсира. Такие препараты могут также содержать средства, уменьшающие раздражение, консерванты, или красители.
В дополнение к препаратам, описанным выше, БТШ70 также может быть использован в виде депо-препарата. Такие длительно действующие препараты можно вводить имплантируя или перкутанно (например, подкожно или внутримышечно), при помощи внутримышечной инъекции или чрескожного пластыря. Так, например, препараты могут быть приготовлены с применением подходящих полимерных или гидрофобных материалов (например, в виде эмульсии в приемлемом масле) или ионообменных смол, или в виде труднорастворимых производных, например в виде умеренно растворимой соли.
Фармацевтические препараты также могут содержать подходящие твердые или гелеобразные носители или наполнители. Примеры таких носителей или наполнителей включают в себя, но не ограничиваются ими, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли.
Для введения путем ингаляции препараты обычно вводят в виде аэрозольного спрея из аэрозольного баллона или небулайзера с применением подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозольного баллона дозировочную единицу можно определить с помощью клапана для доставки отмеренного количества. Капсулы и картриджи, например, из желатина для использования в ингаляторе или инсуфляторе могут содержать порошкообразную смесь препарата и подходящую порошковую основу, такую как лактоза или крахмал.
В обычном состоянии подходящая доза будет находиться в диапазоне от 0,001 до 10 мг на килограмм массы тела реципиента в день, предпочтительно в интервале от 0,005 до 1 мг на килограмм массы тела в день. Необходимая доза желательно должна применяться один раз в день, но может быть дозирована в виде двух, трех, четырех, пяти, шести или более суб-доз, вводимых через соответствующие промежутки времени в течение дня.
БТШ70 можно вводить в качестве единственного активного агента или в комбинации с другими известными терапевтическими средствами для более эффективного лечения БТШ70-ассоциируемых расстройств или заболеваний. В любом случае, лечащим врачом может быть назначено профилактическое или терапевтическое лечение путем регулирования дозы и частоты введения препарата на основе наблюдений за одним или более симптомами расстройств или заболеваний, подлежащих лечению.
Подробности о методах разработки и введения хорошо описаны в научной и патентной литературе, см., например, последнее издание Remington's Pharmaceutical Sciences, Maack Publishing Co, Easton Pa. («Remington's»). После того как фармацевтический препарат получит формулировку с приемлемым носителем, он может быть помещен в соответствующий контейнер и помечен для лечения указанного патологического состояния. Для применения БТШ70, такая маркировка будет включать, например, в инструкции, количество, частоту и способ применения.
ПРИМЕРЫ
Настоящее изобретение иллюстрируется следующими примерами, которые не являются какими-либо ограничениями.
I. Получение рекомбинантных БТШ70 и БТШ70-ПЭГ
Пример 1. Ферментация рчБТШ70
Чтобы приготовить достаточное количество БТШ70, 5 л Е. coli генотипа HMS174 (DE3) рчБТШ70 могут быть выращены в среде, содержащей 12 г фитона пептона, 60 г дрожжевого экстракта, 40 г хлорида натрия, 1 г метионина, и воду до 5 л. Перед посевом бактерий выделенного штамма, среда может быть стерилизована с добавлением антибиотика канамицина в концентрации 30 мкг/мл. Носитель может быть затем засеян 1 л вчерашней культуры бактерий HMS174 (DE3).
Значение рН, уровень растворенного кислорода и температуры внутри реактора ферментера должны быть тщательно проверены. Когда культура достигнет оптической плотности примерно 1,2 (например, через 2,5 ч после введения), можно добавить ИПТГ (изопропил-В-D-тиогалактопиранозид) до конечной концентрации 1 ммоль, чтобы инициировать индукцию выработки рчБТШ70. Рост культуры может быть продолжен до достижения оптической плотности примерно 2,7 (например, через 3,5 ч после введения ИПТГ). Выделение ферментированных бактерий производят путем центрифугирования с использованием стандартных методик. Бактериальный осадок может быть повторно суспендирован в 10 ммоль фосфатно-солевого буферного раствора на 1 л (1 ммоль ЭДТК, 10% глицерола). После этого ресуспендированные бактерии могут быть заморожены на сухом льду, оставаясь в таком виде вплоть до последующего применения. Для использования замороженные бактерии можно разморозить с последующей деградацией под давлением. Полученный лизат затем может быть очищен и стерильно отфильтрован.
Пример 2. Очистка рчБТШ70
Осуществляют двухступенчатую очистку бактериального лизата, содержащего рчБТШ70. В конкретном примере используют 500 мл лизата. На первой стадии очистки 500 мл очищенного лизата разбавляют в два раза 10 ммоль натрий-фосфатного буфера (pH 7,0). 1 л разбавленного и очищенного бактериального лизата погружают в колонку ДЭАЭ Sephacel (Pharmacia) (13×15 см), предварительно уравновешенную двухкратным объемом буфера А (10 ммоль натрий-фосфатного буфера, pH 7,0, 20 ммоль хлорида натрия, 10 ммоль сульфата аммония). Элюирование проводят двухкратным объемом буфера В (20 ммоль натрий-фосфатного буфера, pH 7, 0, 85 ммоль хлорида натрия, 10 ммоль сульфата аммония). Для восстановления применяют около 2 л элюата. Затем производят диафильтрацию (буферзамещение) элюата против 10-кратного объема буфера С (20 ммоль цитрата натрия, pH 6,0, 100 ммоль хлорида натрия, 10 ммоль сульфата аммония).
На втором этапе очистки 700 мл объема колонки (13×5.5 см) АТФ агарозы (Sigma-Aldrich) уравновешивают одним объемом колонки буфера D (20 ммоль натрия цитрата, pH 6,0, 85 ммоль хлорида натрия, 10 ммоль сульфата аммония). Диафильтрированный раствор пропускают через колонку АТФ-агарозы. Колонку затем промывают 6-кратным объемом колонки буфером D и, наконец, элюируют 2-кратным объемом колонки буфером Е (20 ммоль цитрата натрия, pH 6,0, 100 ммоль хлорида натрия, 10 ммоль сульфата аммония, 1 ммоль ацетата магния, 1 ммоль АТФ). В элюированном материале - человеческом рБТШ70, имеющем чистоту выше, чем 95%, может быть произведена замена буфера на физиологический раствор, забуференный фосфатом, после чего он может быть сконцентрирован до конечной концентрации 10-20 мг/мл, а затем стерильно отфильтрован.
Пример 3. Технология пегилирования БТШ70
Эффективность терапевтического агента может быть повышена за счет улучшения его биодоступности несколькими средствами, одним из которых является пегилирование - процесс химического присоединения полиэтиленгликоля (ПЭГ) к целевому терапевтическому агенту, в результате которого будет получен конъюгат с повышенным временем полураспада. Дополнительными преимуществами пегилированных продуктов являются также более низкая иммуногенность, снижение частоты приема, повышенная растворимость, повышенная стабильность, а также снижение почечного клиренса. Поскольку наиболее распространенными реакционноспособными участками белка (в том числе, пептидов) для крепления ПЭГ являются е аминогруппа лизина и а аминогруппа N-термальной группы, известные способы пегилирования в конечном итоге приводят к модификации многочисленных участков, что не позволяет получить не только монопегилированный конъюгат, состоящий из смеси позиционных изомеров, таких как PEGINTRON™ (Grace et al, J. Biol. Chem. 2005; 280:6327) и PEGASYS® (Dhalluin et al, Bioconjugate Chem. 2005; 16:504), но также аддукты, включающие более одной ПЭГ цепи.
ПЭГ реагенты, используемые для получения пегилированных составов по настоящему изобретению, могут содержать гетерогенную смесь ПЭГ, имеющую различное количество (n) субъединиц этиленоксида в ПЭГ полимере. Одна субъединица этиленоксида в ПЭГ (-(СН2СН20)) имеет молекулярную массу приблизительно 44 кДа. Таким образом, молекулярная масса ПЭГ полимера зависит от количества (n). Количество ПЭГ, присоединенных к соединениям пегилированного рчБТШ70, в настоящем изобретении будет иметь n в диапазоне примерно от 400 до 1000 субъединиц. Предпочтительно, когда количество ПЭГ, присоединенных к соединениям пегилированного БТШ70 по настоящему изобретению, будет иметь n в интервале примерно от 400 до 750.
А. Активированный ПЭГ для амино- или иминосвязей
Для того, чтобы конъюгировать ПЭГ к БТШ70, активированный связывающий агент, ковалентно присоединенный к одной или нескольким молекулам ПЭГ, может подвергаться взаимодействию с амино- или иминогруппой аминокислотного остатка, например, с α аминогруппой на N-терминальной группе БТШ70, чтобы сформировать БТШ70-ПЭГ по настоящему изобретению.
Связывающий агент «активируется», если он химически активен и готов для ковалентной связи, например, с аминогруппой аминокислотного остатка. Любой активированный связующий агент может быть использован в данном изобретении, при условии, что он может вместить одну или несколько молекул ПЭГ и формировать ковалентную связь, например с аминогруппой аминокислотного остатка в подходящих условиях для реакции. Например, активированный связующий агент присоединяется к группе α аминогруппы с высокой избирательностью по сравнению с другими участками присоединения, например ε аминогруппе лизина или иминогруппе гистидина.
Активированный ПЭГ может быть представлен формулой: (PEG)b-L', где PEG ковалентно присоединен к атому углерода связующего агента, чтобы сформировать простую эфирную связь, b представляет собой число от 1 до 9 (т.е. от 1 до 9 молекулы ПЭГ может быть присоединено к связующему агенту) и L содержит реакционноспособную группу (активированный остаток), который может вступать в реакцию с амино- или иминогруппами на аминокислотном остатке, чтобы обеспечить ковалентное присоединение ПЭГ к БТШ70.
В одном варианте осуществления изобретения, активированный связующий агент (L') содержит альдегид формулы RCHO, где R представляет собой линейный (с неразветвленной цепью) или разветвленный алкил С1-11. После ковалентного присоединения активированного связующего агента к БТШ70, связующий агент (именуемый «-L-» в структурных формулах, указанных здесь) между БТШ70 и ПЭГ содержит от 2 до 12 атомов углерода. Пропионовый альдегид является примером активированного связующего агента, используемого в настоящем изобретении. ПЭГ-пропионовый альдегид, представленный формулой PEG-CH2CH2CHO, описан в патенте США №5.252.714 и доступен для приобретения у Shearwater Polymers (Huntsville, Ala).
В некоторых конкретных вариантах осуществления, может быть использован подходящий активированный разветвленный связующий агент. Для осуществления настоящего изобретения можно применять любой подходящий разветвленный связующий агент ПЭГ, который может ковалентно присоединить две или более молекулы ПЭГ к аминогруппе аминокислотного остатка из БТШ70, например, с α-аминогруппой на N-терминальной группе. Связующий разветвленный агент, используемый в данном изобретении, может содержать два или три молекулы ПЭГ. Например, разветвленный связующий агент ПЭГ, используемый в настоящем изобретении, может быть линейным или с разветвленными алифатическими группами, стабильными при гидролизе, и содержать активированную часть, например альдегидную группу, которая реагирует с аминогруппой аминокислотного остатка, как это описано выше. Алифатическая группа с разветвленным связующим агентом может содержать от 2 до 12 атомов углерода. Например, алифатическая группа может представлять собой трет-бутил, который содержит целых три молекулы ПЭГ на каждом из трех атомов углерода (т.е. в общей сложности 9 молекул ПЭГ), и активный альдегидный фрагмент на четвертом углероде трет-бутила. Примеры активированных разветвленных связующих агентов ПЭГ описаны также в патентах США №№5.643.575, 5.919.455 и 5.932.462. Специалист в данной области техники, в свете настоящего изобретения, может подготовить модификации разветвленных связующих агентов ПЭГ, при желании, например добавив активный альдегидный фрагмент.
Способы получения связующих агентов для использования в настоящем изобретении, хорошо известны в данной области техники, например, см. Патенты США №№. 5,643,575, 5,919,455, и 5,932,462. Активированные связующие агенты ПЭГ, такие как ПЭГ-альдегиды, могут быть доступны из коммерческих источников, например Shearwater Polymers, (Huntsville, Ala.) или Enzon, Inc. (Piscataway, N.J.).
Б. Сопряжение реакции между ПЭГ и БТШ70 амино- или иминогруппами
Уравнение реакции, схематически описывающее взаимодействие между ПЭГ-альдегидом, как активированным связующим агентом, и амино- или иминогруппой остатка аминокислоты одного из мономеров БТШ70 выглядит следующим образом:
PEG-R-CHO+NH2-HSP70 PEG-R-CH=N-HSP70,
где R - алкил С1-11;
N - азот реактивной аминогруппы аминокислотного остатка БТШ70.
В этой реакции активированный ПЭГ ковалентно присоединяется к БТШ70 с образованием иминосвязи. Превращение иминосвязи в связь с восстановителем, например, цианоборгидридом натрия (Sigma-Aldrich, St. Louis, Mo.), с образованием пегилированного БТШ70, иллюстрируется следующим уравнением:
PEG-R-CH=N-HSP70+NaCNBH3 PEG-R-СН2-NH-HSP70
Вместо цианоборгидрида натрия в указанной реакции, можно использовать другие восстановители, например, боргидрид натрия, трет-бутиламинборан, триацетил натрия борогидрид, диметиламин, триметиламинборан и пиридин. Цианоборгидрид натрия используют в конкретных примерах осуществления настоящего изобретения, в связи с тем, что он превращает иминовую связь в связь с восстановителем, которая формируется между альдегидной группой активированного ПЭГ и аминогруппой аминокислоты БТШ70.
Как показано в реакциях, в процессе получения БТШ70-ПЭГ образуется основание Шиффа. Это создает определенные проблемы в связи с тем, что данное промежуточное соединение, которое очень трудно отделить от БТШ70-ПЭГ, может значимо снизить чистоту БТШ70-ПЭГ. Одним из путей устранения этого негативного фактора является применение более высоких концентраций восстановителя, например от 75:1 до 350:1 (см., например, Kinstler et al., Pharm. Res. 13:996-1002 (1996) and Chamow et al, Bioconjugate Chem. 5: 133-140(1994)).
При осуществлении способа пегилирования по настоящему изобретению, для каталитического образования ковалентной связи ПЭГ с БТШ70 могут быть использованы различные водные буферы. Значение pH используемого буфера составляет от 5,5 до 7,8, например pH может находиться в нейтральном диапазоне, в частности от приблизительно 6,3 до 7,5. Этот нейтральный диапазон pH будет также способствовать увеличению сайт-специфического пэгилирования БТШ70 с N-терминальной α-аминогруппой по сравнению с другими имино- или аминогруппами остатков других аминокислот, например лизина или гистидина. В конкретных вариантах осуществления используются буферы, имеющие рКа, близкий к нейтральной области рН, например, фосфатный буфер.
Диапазон температур для получения БТШ70-ПЭГ по настоящему изобретению составляет приблизительно от 5 до 30°C. Например, в некоторых вариантах осуществления способа пегилирования температура составляет примерно от 18 до 25°C.
Реакция пегилирования может продолжаться от 3 до 48 ч, например от 10 до 24 ч. Реакцию можно контролировать с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), которая может различать БТШ70 с различной степенью пегилирования, например БТШ70-моно-ПЭГ и БТШ70-ди-ПЭГ (т.е. пегилирование происходит на двух аминокислотных остатках БТШ70) и т.д. В любой момент, когда требуемый БТШ70 получен, реакция может быть прекращена путем добавления раствора глицина для подавления активности оставшегося активированным ПЭГ.
Для очистки БТШ70-ПЭГ можно использовать известные способы разделения и очистки, принятые в данной области, например эксклюзивную хроматографию (в частности, гель-фильтрацию) и ионообменную хроматографию.
Предпочтительным является введение в способ получения лекарственного средства на основе БТШ70-ПЭГ, используемый в настоящем изобретении, дополнительного этапа разделения смеси БТШ70-ПЭГ. В ходе указанного дополнительного этапа в смеси изомеров БТШ70-ПЭГ производят отделение менее стабильных изомеров БТШ70-ПЭГ (например, БТШ70-гис-ПЭГ) от устойчивых БТШ70-ПЭГ (например, N-терминальных БТШ70-ПЭГ или БТШ70-лиз-ПЭГ), что позволяет обеспечить большую степень гомогенности полученной промежуточной смеси БТШ70-ПЭГ, например, составляющую 95% от аналогичного показателя готового лекарственного средства. Менее стабильные изомеры БТШ70-ПЭГ, например, БТШ70-гис-ПЭГ, могут быть гидролизованы в ходе указанного дополнительного этапа. Полученная промежуточная смесь БТШ70-ПЭГ может быть инкубирована в водном буфере, например в Трис-буфере (например, от 10 до 300 ммоль, например, приблизительно от 30 до 70 ммоль), при pH приблизительно от 5,0 до 9,0, например при pH от 7,0 до 8,0 при температуре от 15 до 35°C в течение суток. Кроме того, промежуточная смесь на основе БТШ70-ПЭГ может быть обработана 0,05-0,4 моль гидроксиламина солянокислого (pH около 6,5) при комнатной температуре в течение 0,5-10 час. Остатки гидролизованного БТШ70 и ПЭГ могут быть удалены из промежуточной смеси, содержащей стабильный БТШ70-ПЭГ, в ходе последующего этапа разделения/очистки с использованием, например, гель-фильтрации или ионообменной хроматографии.
В патенте США №5.985.265 пегилирование интерферона при использовании альдегида, как связующего агента, было достигнуто при кислом pH 4,0 при 4°C. Согласно общепринятой точке зрения в данной области, для наиболее активированного ПЭГ, в случае, если pH реакции увеличивается при базовых условиях, пегилирование происходит на более стабильных центрах белка. Для пегилированного интерлейкина 10 (патент США №7.052.686) ПЭГ-сукцинимидил карбонат формирует около 90% Лиз-ПЭГ-ИЛ-10 (более стабильного) и около 10% Гис-ПЭГ-ИЛ-10 (менее стабильного) в реакции при pH 8,8, и около 64% Лиз-ПЭГ-ИЛ-10 и 36% Гис-ПЭГ-ИЛ-10 в реакции при pH 6,3.
В. Приготовление модифицированного по цистеину БТШ70-ПЭГ
В одном из вариантов осуществления изобретения рчБТШ70-ПЭГ был получен при использовании ПЭГ-малеимид-реагента 20 кДа (Nanocs, Нью-Йорк, США). Малеимидная группа специфично реагирует с сульфгидрильными группами, когда pH реакционной смеси поддерживают между pH 6,5 и 7,5; в результате чего образуется стабильная необратимая тиоэфирная связь, которая не может быть разорвана при применении восстанавливающих агентов. БТШ70 имеет 5 цистеиновых групп в следующих АА позициях: 17,267, 306, 574 и 603.
Известно, что цистеиновые тиолы не участвуют в образовании внутримолекулярных дисульфидных связей, и поэтому все цистеиновые остатки потенциально поддаются пегилированию, но в определенных условиях Cys574 может участвовать в образовании межмолекулярных дисульфидных связей (Nemoto et al. 2006). Остатки Cys267 и Cys306 могут быть спрятаны внутри молекулы белка и/или замаскированы субстратами, что значительно снижает их доступность и способность участвовать в реакции пегилирования. Тест Эллмана подтвердил наличие свободных тиоловых групп в молекуле БТШ70. Однако изменений структуры молекулы БТШ70 при попытке проведении реакции пегилирования в физиологическом растворе при pH 7,1 не выявлено, о чем свидетельствует отсутствие изменений продолжительности удерживания по данным ВЭЖХ, а также отсутствие дополнительных продуктов реакции пегилирования кроме исходного неизмененного БТШ70 по результатам электрофореза белков в полиакриламидном геле (SDS-PAGE).
Пегилирование БТШ70 удалось осуществить только при его денатурации в присутствии 6 моль гуанидина, эффективность пегилирования БТШ70 существенно снижается при понижении концентраци гуанидина или мочевины. Степень пегилирования цистеина зависит от изменения соотношений ПЭГ-малеимид, в среднем от 1 до 5 ПЭГ фрагментов на одну молекулу белка. На основании данных ВЭЖХ, пик, связанный с образованием белка, исчезает при использовании не менее 50 экв ПЭГ-малеимид. Окончательную очистку БТШ70-ПЭГ проводят с использованием эксклюзивной хроматографии в физиологическом растворе при pH 7,4.
Пегилированные белковые продукты быстро свертываются при разбавлении в натрий-фосфатном буфере или во время проведения эксклюзивной хроматографии. Для экспериментов in vivo пегилированные продукты концентрировали с использованием мембран Amicon (удаление молекул с размерами меньше 4 кДа) до концентрации 0,5-2 мг/мл и пропускали через фильтр с размерами пор 0,22 мкм. Биологическую активность молекул БТШ70-ПЭГ выявляли путем определения активности АТФ-азы с использованием коммерческого набора (ENZO Life Sciences, Farmingdale, Нью-Йорк, США). Для повышения эффективности теста определения биологической активности АТФ-азы применяют такие соединения, как БТШ40 и модифицированный альбумин, однако максимальный эффект был получен при использовании 1 ммоль АДФ.
II. Применение БТШ70 in vivo
Пример 4. Применение рчБТШ70 для повышения работоспособности у экспериментальных животных при интенсивных физических нагрузках
Целью данного эксперимента являлось изучение влияния экзогенного рчБТШ70 и рчБТШ70-ПЭГ на выносливость (физическую работоспособность) при интенсивных физических нагрузках у здоровых взрослых нелинейных белых крыс-самцов (масса тела 180-220 г, питомник «Рапполово»). В качестве базового препарата использовали известный актопротектор метапрот, который вводили крысам внутрибрюшинно в дозе 4000 мкг на крысу (20 мг/кг массы тела животного). Каждый из исследуемых препаратов (рчБТШ70 и рчБТШ70-ПЭГ) применяли в дозах, варьировавших в интервале 0,2-250 мкг на крысу (0,0001-1,25 мг/кг массы тела животного), при этом препарат растворяли в воде для инъекций и вводили животному внутрибрюшинно из расчета 0,2 мл на 100 г массы тела животного. Нижняя граница исследуемого в эксперименте интервала доз соответствовала нижней границе заявленного диапазона доз БТШ70 и БТШ70-ПЭГ. Выбор (для данного эксперимента) в качестве верхнего граничного значения дозы 250 мкг на крысу (1,25 мг/кг массы тела животного) обусловливался тем, что при введении анализируемых препаратов (БТШ70 или БТШ 70-ПЭГ) в дозах свыше указанной отмечались случаи анорексии, причем их частота возрастала при дальнейшем повышении дозы исследуемых препаратов.
Для целей эксперимента все животные были распределены по следующим группам:
1-я группа - контрольная - введение плацебо (6 крыс);
2-я группа - введение метапрота в дозе 20 мг/кг массы тела (6 крыс);
3-я-12-я группы (опытные) - введение БТШ70 в дозах мг/кг массы тела (мкг на крысу), соответственно: 0,2 (0,001); 1,0 (0,005); 10,0 (0,05); 25 (0,125); 50,0 (0,25), 100 (0,5); 150 (0,75); 200 (1,0); 225 (1,125); 250 (1,25) (по 6 крыс в каждой группе);
13-я-22-я группы (опытные) - введение БТШ70-ПЭГ в дозах мг/кг массы тела (мкг на крысу), соответственно: 0,2 (0,001); 1,0 (0,005); 10,0 (0,05); 25 (0,125); 50,0 (0,25), 100 (0,5); 150 (0,75); 200 (1,0); 225 (1,125); 250 (1,25) (по 6 крыс в каждой группе).
В эксперимент отбирали животных, у которых были проведены предварительные тренировки, направленные на развитие выносливости, по следующей схеме: ежедневный бег на тредбане в течение 5 мин, период тренировки - трое суток (скорость беговой дорожки 20 м/мин, угол наклона 20°). Экспериментальные исследования осуществляли с использованием теста «бег на тредбане «до отказа» (отказ животного от дальнейшего продолжения бега), при этом нагрузочные пробы в рамках данного теста проводили через день в течение 19 суток, в одно и то же время суток, общее количество - девять нагрузочных проб за период наблюдения. При проведении указанного теста БТШ70 (или БТШ70-ПЭГ) вводили в ходе выполнения первых шести нагрузочных проб (в порядке отсчета), через 5-6 мин после завершения выполнения очередной нагрузочной пробы. Продолжительность бега животного на тредбане «до отказа» использовали в качестве показателя физической работоспособности (выносливости).
Результаты исследований представлены в табл. 1 (выборочно) и на фиг. 1-4 (полностью), где приведены данные (числовые и графические), отражающие влияние исследуемых препаратов (БТШ70, БТШ70-ПЭГ), вводимых в различных дозах, на физическую работоспособность крыс в сравнении с метапротом (при фиксированной дозе).
Статистически значимая разница в показателях физической работоспособности (выносливости) в группах, получавших БТШ70 (3-я-12-я), отмечалась после третьей нагрузочной пробы, причем в контрольной группе и в группах животных (3-я-7-я), получавших низкие дозы БТШ70 (0,001-0,25 мг/кг), значения анализируемых показателей значимо не отличались от результатов, полученных после первой нагрузочной пробы, а в группах животных (8-я-12-я), которым вводили более высокие дозы БТШ70 (0,5-1,25 мг/кг), выявлено достоверное повышение указанных показателей по сравнению с результатами после первой нагрузочной пробы. В последующих нагрузочных пробах, проводимых в ходе теста, результаты групп животных, получавших БТШ70, начиная с дозы 0,25 мг/кг массы (7-я-12-я группы), были значимо выше результатов контрольной группы, а начиная с дозы 0,75 мг/кг БТШ70 (9-я-12-я группы) - превышали результаты 2-й группы (метапрот). При этом положительное воздействие БТШ70 на показатели физической работоспособности носило дозозависимый характер (табл. 1; фиг. 1, 2, 4).
После пятой нагрузочной пробы было выявлено снижение показателей физической работоспособности в контрольной группе (1-я), в группе, получавшей метапрот (2-я), а также в группах животных, получавших БТШ70 в дозах 0,001-0,5 мг/кг массы (3-я-8-я). При этом, указанная тенденция была значительно менее выражена в группах животных, получавших БТШ70. После прекращения введения БТШ70, начиная с седьмой нагрузочной пробы, выявлено дальнейшее снижение выносливости (физической работоспособности) в указанных группах, однако во всех последующих нагрузочных пробах значения показателей у животных, получавших БТШ70, были более высокими по сравнению с показателями контрольной группы, например после девятой нагрузочной пробы показатели в группе, получавшей БТШ70 в дозе 0,5 мг/кг (100 мкг на крысу), превышали показатели контрольной группы на 35,5%. В группах, получавших БТШ70 в дозах 0,75-1,25 мг/кг массы (9-я-12-я), снижение работоспособности наблюдалось после седьмой нагрузочной пробы.
Результаты, полученные в группах животных (13-я-22-я), у которых применяли БТШ70-ПЭГ, свидетельствовали о том, что указанный препарат обладает более выраженным (по сравнению с БТШ70) позитивным действием в отношении физической работоспособности (выносливости) при общности выявленных тенденций в действии указанных препаратов (табл. 1, фиг. 3, 4). Так, у всех животных, которым вводили БТШ70-ПЭГ, отмечались более высокие показатели работоспособности по сравнению с соответствующими показателями в группах, получавших БТШ70, при сохранении дозозависимого характера действия препарата. Снижение работоспособности было выявлено: после пятой нагрузочной пробы - в группах животных, получавших БТШ70-ПЭГ в дозах 0,001-0,005 мг/кг массы (13-я-14-я), а в группах животных, получавших БТШ70-ПЭГ в дозах 0,05-1,25 мг/кг массы (15-я-22-я) - после восьмой нагрузочной пробы. Статистически значимая разница между показателями работоспособности у животных, получавших БТШ70-ПЭГ, и у животных, получавших метапрот, отмечалась, начиная с дозы БТШ70-ПЭГ 0,05 мг/кг (15-я группа).
Следует отметить, что положительное влияние исследуемых препаратов (БТШ70 и БТШ70-ПЭГ) на физическую работоспособность крыс, как это следует из табл. 1 и фиг. 4, начинало проявляться (хотя и весьма незначительно) при введении дозы 0,001 мг/кг массы тела (значимые отличия от контрольной группы имели место: БТШ70 - на 12-е сутки; БТШ70-ПЭГ - на 12-е и 15-е сутки). Введение БТШ70 в дозе 0,005 мг/кг массы тела (4-я группа) давало аналогичный результат (значимое повышение показателя на 12-е сутки), тогда как БТШ70-ПЭГ в указанной дозе (14-я группа) обеспечивал значимое повышение работоспособности по сравнению с контрольной группой на 12-е, 15-е, 17-е и 19-е сутки. При введении исследуемых препаратов в дозе 1,0 мг/кг (10-я и 22-я группы животных, соответственно) были отмечены максимальные значения показателей работоспособности, причем величина рассматриваемого показателя, полученного при введении БТШ70-ПЭГ, превышала величину соответствующего показателя при введении БТШ70 на 31%. При дальнейшем увеличении дозы вводимого препарата (БТШ70 или БТШ70-ПЭГ) работоспособность начинала снижаться, однако на 19-е сутки эксперимента (после завершения серии интенсивных физических нагрузок) значения анализируемого показателя у животных, которым вводили БТШ70 (в группах 8-12) и БТШ70-ПЭГ (в группах 15-22) значимо превышали значения соответствующих показателей животных контрольной группы и животных, получавших метапрот (2-я группа).
Таким образом, результаты экспериментальных исследований и клинических наблюдений авторов изобретения позволили обосновать выбор заявленного диапазона доз БТШ70 и БТШ70-ПЭГ от 0,001 до 10 мг/кг массы тела, при предпочтительном интервале 0,005-1,0 мг/кг массы тела. Нижние границы заявленного и предпочтительного интервалов являются минимальными дозами, необходимыми для проявления положительного воздействия исследуемых препаратов на физическую работоспособность. Верхняя граница предпочтительного интервала (1,0 мг/кг) обеспечивает максимальное повышение показателей работоспособности при интенсивных физических нагрузках (в эксперименте). Верхняя граница заявленного диапазона (10 мг/кг) обусловлена совокупностью таких факторов, как необходимость пересчета доз препарата для пациентов (с применением увеличивающих коэффициентов), который предусмотрен при переходе от эксперимента (на животных) на фазу клинических испытаний, необходимость применения высоких доз БТШ70 при его длительном (свыше двух месяцев) использовании (в связи с образованием антител к БТШ70), возможность появления аллергических реакций при превышении указанной величины (по аналогии с липополисахаридами), о чем свидетельствуют результаты клинических наблюдений авторов изобретения и т.п.
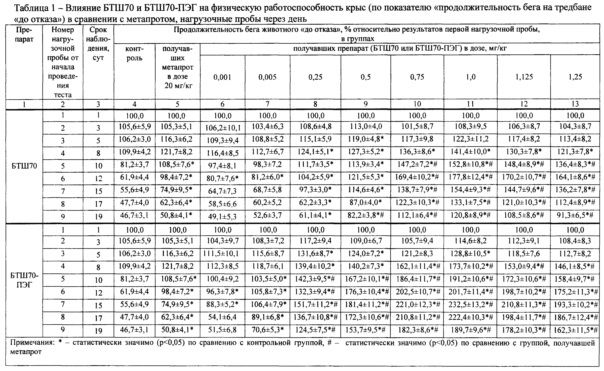
После завершения серии интенсивных физических нагрузок - на 19-е сутки от начала проведения теста - выявлено, что в контрольной группе уровни общего белка, креатинина и натрия в крови были повышены по сравнению с группами животных, получавшими БТШ70, как это видно из табл. 2, где приведены выборочные данные для 7-й и 8-й групп, получавших БТШ70 в дозах, соответственно, 50 и 100 мкг на крысу (0,25 и 0,5 мг/кг). Кроме того, у всех животных, которым вводили БТШ70 (3-я-12-я группы), отмечено существенное снижение активности креатининфосфокиназы (КФК) и лактатдегидрогеназы (ДЦГ), что свидетельствует о снижении повреждения мышц и проявлении цитопротективных свойств экзогенным БТШ70 при его применении in vivo. Аналогичные данные в рамках данного теста были получены для групп животных, которым вводили БТШ70-ПЭГ (13-я-22-я группы).
Важно отметить, что при этом не выявлено анаболического действия БТШ70 и БТШ70-ПЭГ- дополнительного увеличения массы тела животных во всех группах, получавших препараты.
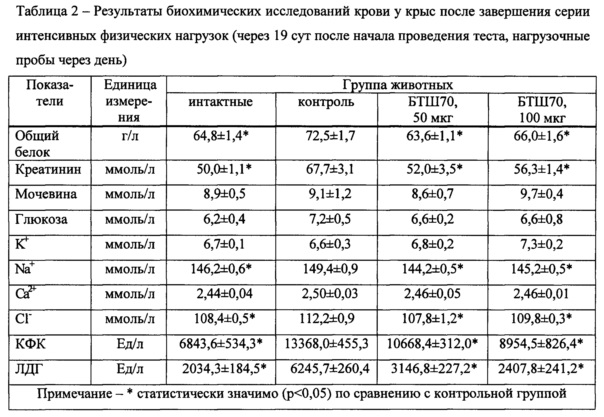
Микроскопический анализ
Для уточнения механизма влияния БТШ70 на показатели физической работоспособности, полученные при проведении нагрузочных проб, и на результаты биохимических исследований, была выполнена биопсия мышц бедра лабораторных животных после выведения их из эксперимента. Просвечивающую электронную микроскопию проводили на электронных микроскопах IEOL ПО СХ и Hitachi Н-300, биоптаты мышцы бедра фиксировали в 2,5% глутаровом альдегиде, с последующей обработкой в 2%-ном растворе четырехокиси осмия в физиологическом растворе и обезвоживанием в спирте/ацетоне (фиг. 2-4). Срезы тканей получали с использованием микротома Ultracut-Reichert. Окрашивание биоптатов для оптической микроскопии осуществляли по методу Мэллори с использованием эозина и гематоксилина (фиг. 8, 9).
Во всех группах в мышцах крыс были выявлены структурные изменения, указывающие на дистрофию мышц, рабдомиолиз и асептическое воспаление, которые были менее выражены в группах, получавших БТШ70 или БТШ70-ПЭГ. Активация ангиогенеза, как известно, в значительной степени связана с регенерацией мышц (Borselli et al., 2010). Повышение плотности капиллярной сети в мышцах является важным показателем активации восстановительных процессов в них после экстремальных физических нагрузок. Соответственно, у животных, получавших БТШ70, было обнаружено значительное дозозависимое увеличение плотности капиллярной сети, соответственно, на 170-330%, например с 275/мм2 в контрольной группе до 907/мм2 в группе, получавшей БТШ70 в дозе 0,25 мг/кг (табл. 3).
Кроме того, окрашивали биоптаты для определения в них числа сателлитных клеток мышц (миобластов), которые играют важную роль в процессах активации регенерации мышц (Wagers et al., 2005). Выявлено увеличение числа сателлитных клеток мышц в 6-8 раз у животных, получавших БТШ70 и БТШ70-ПЭГ, по сравнению с контрольной группой (табл.3). Это свидетельствует, по мнению авторов изобретения, о высокой регенеративной способности тканей в группах, получавших препараты БТШ70 и БТШ70-ПЭГ. Выявленный эффект носил дозозависимый характер. Максимальный эффект был отмечен при использовании дозы 1,0 мг/кг. Причем в группе БТШ70-ПЭГ этот эффект был более выражен, чем в группе БТШ70. В группе животных, получавших метапрот в дозе 20 мг/кг, результаты исследований достоверно не отличались от животных группы контроля.
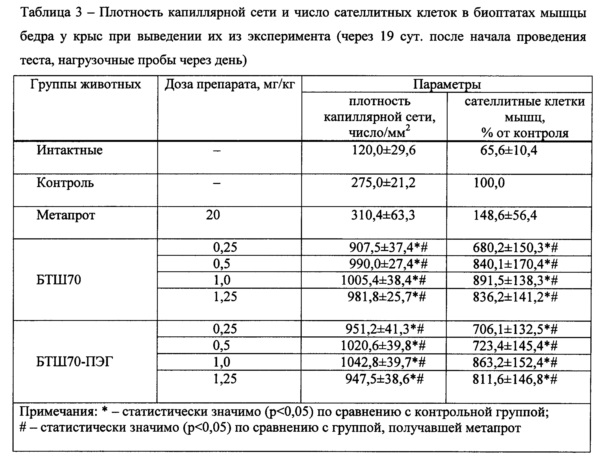
Пример 5. Применение рчБТШ70-ПЭГ для повышения работоспособности у экспериментальных животных при интенсивных физических нагрузках
Целью данного эксперимента являлось изучение влияния экзогенного рчБТШ70-ПЭГ и рчБТШ70 на выносливость (физическую работоспособность) при физических нагрузках большей интенсивности по сравнению с нагрузками, предусмотренными в примере 4, у здоровых взрослых нелинейных белых крыс-самцов (масса тела 180-220 г, питомник «Рапполово»). В качестве базового препарата, аналогично примеру 4, использовали известный актопротектор метапрот, который вводили крысам внутрибрюшинно в дозе 4000 мкг на крысу (20 мг/кг массы тела животного). Каждый из исследуемых препаратов (рчБТШ70 и рчБТШ70-ПЭГ) применяли в дозах, варьировавших в интервале 0,2-250 мкг на крысу (0,0001-1,25 мг/кг массы тела животного), при этом препарат растворяли в воде для инъекций и вводили животному внутрибрюшинно из расчета 0,2 мл на 100 г массы тела животного. Нижняя граница исследуемого в эксперименте интервала доз соответствовала (аналогично примеру 4) нижней границе заявленного диапазона доз БТШ70 и БТШ70-ПЭГ. Выбор (для данного эксперимента) в качестве верхнего граничного значения дозы 250 мкг на крысу (1,25 мг/кг массы тела животного) обусловливался тем, что при введении анализируемых препаратов (БТШ70 или БТШ70-ПЭГ) в дозах свыше указанной отмечались (аналогично примеру 4) случаи анорексии, причем их частота возрастала при дальнейшем повышении дозы исследуемых препаратов.
Для целей эксперимента все животные были распределены по следующим группам:
1-я группа - контрольная - введение плацебо (6 крыс);
2-я группа - введение метапрота в дозе 20 мг/кг массы тела (6 крыс);
3-я-12-я группы (опытные) - введение БТШ70 в дозах мг/кг массы тела (мкг на крысу), соответственно: 0,2 (0,001); 1,0 (0,005); 10,0 (0,05); 25 (0,125); 50,0 (0,25), 100 (0,5); 150 (0,75); 200 (1,0); 225 (1,125); 250 (1,25) (по 6 крыс в каждой группе);
13-я-22-я группы (опытные) - введение БТШ70-ПЭГ в дозах мг/кг массы тела (мкг на крысу), соответственно: 0,2 (0,001); 1,0 (0,005); 10,0 (0,05); 25 (0,125); 50,0 (0,25), 100 (0,5); 150 (0,75); 200 (1,0); 225 (1,125); 250 (1,25) (по 6 крыс в каждой группе).
В эксперимент отбирали животных, у которых были проведены предварительные тренировки, направленные на развитие выносливости, по следующей схеме: ежедневный бег на тредбане в течение 5 мин, период тренировки - трое суток (скорость беговой дорожки 20 м/мин, угол наклона 20°). Экспериментальные исследования осуществляли с использованием теста «бег на тредбане «до отказа» (отказ животного от дальнейшего продолжения бега), при этом нагрузочные пробы в рамках данного теста проводили ежедневно в течение 10 суток, в одно и то же время, общее количество - 10 нагрузочных проб за период наблюдения. При проведении указанного теста БТШ70 и БТШ70-ПЭГ вводили в ходе выполнения первых шести нагрузочных проб (в порядке отсчета), через 5-6 мин после завершения выполнения очередной нагрузочной пробы. Продолжительность бега животного на тредбане «до отказа» использовали в качестве показателя физической работоспособности (выносливости).
Результаты исследований представлены в табл. 4 (выборочно) и на фиг. 10-12 (полностью), где приведены данные (числовые и графические), отражающие влияние исследуемых препаратов (БТШ70, БТШ70-ПЭГ), вводимых в различных дозах, на физическую работоспособность крыс в сравнении с метапротом (при фиксированной дозе).
В период выполнения первых пяти нагрузочных проб не выявлено существенных различий между контрольной группы (1-я), группой, получавшей метапрот (2-я), а также группами, получавшими БТШ70 в дозах 0,001-0,5 мг/кг (1-я-8-я группы) и БТШ70-ПЭГ в дозах 0,001-0,75 мг/кг (13-я-19-я группы). В то же время у животных, которым вводили БТШ70 в дозах, начиная с 0,75 мг/кг (9-я-12-я группы), и БТШ70-ПЭГ, начиная с дозы 1,0 мг/кг (20-я-22-я группы) отмечалось повышение работоспособности, значимое не только по сравнению с контролем (9-я, 10-я, 12-я, 21, 22 группы), но и по сравнению с метапротом (10-я, 12-я, 20-22-я группы). В последующем работоспособность животных контрольной группы прогрессивно снижалась в динамике проведения теста - на 30-50% относительно результатов первой нагрузочной пробы. Для сравнения, у животных опытных групп выявлено повышение работоспособности в динамике, которое составляло, например в группах, получавших БТШ70 в дозах 0,25 и 0,50 мг/кг, - 115-125%, в группах с БТШ70-ПЭГ при тех же дозах - 117-126%, а в группах с высокими дозами БТШ70 и БТШ70-ПЭГ (0,75-1,0 мг/кг) - 150-165% относительно результатов первой нагрузочной пробы. При этом при применении БТШ70-ПЭГ у животных отмечались более высокие показатели работоспособности по сравнению применением БТШ70 (различия статистически значимы). Максимальные значения показателей работоспособности были получены при использовании БТШ70 и БТШ70-ПЭГ в дозе 1,0 мг/кг, соответственно, на 7-е и на 9-е сутки с последующим снижением указанного показателя, которое значимо отличалось от соответствующих показателей животных и контрольной группы и группы, получавшей метапрот. Эти данные подтверждались более высокой плотностью капиллярной сети и большим количеством сателлитных клеток мышц (табл. 5).
В данном эксперименте также не было выявлено анаболического эффекта как у БТШ70, так и у БТШ70-ПЭГ- различий в массе тела животных в опытных группах не установлено (табл. 6).
Таким образом, результаты экспериментальных исследований авторов изобретения показали, что экзогенный рчБТШ70 и экзогенный рчБТШ70-ПЭГ при введении in vivo препятствуют развитию повреждения мембран мышечных клеток (по данным индикаторных ферментов), повышают плотность капиллярной сети, обеспечивают активацию и мобилизацию сателлитных клеток мышц.
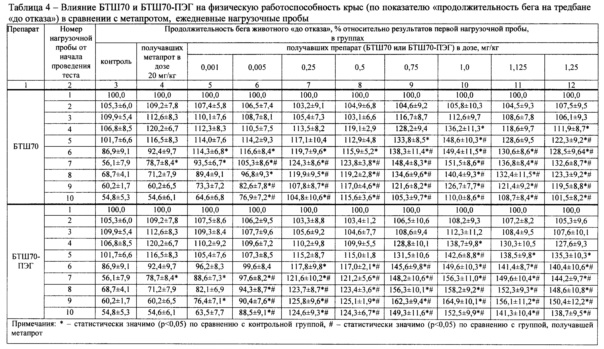
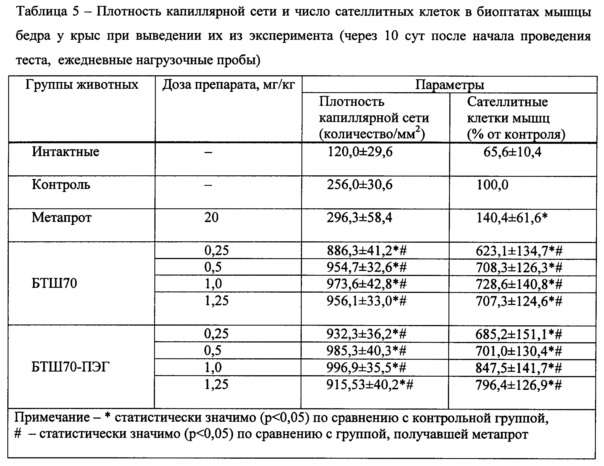
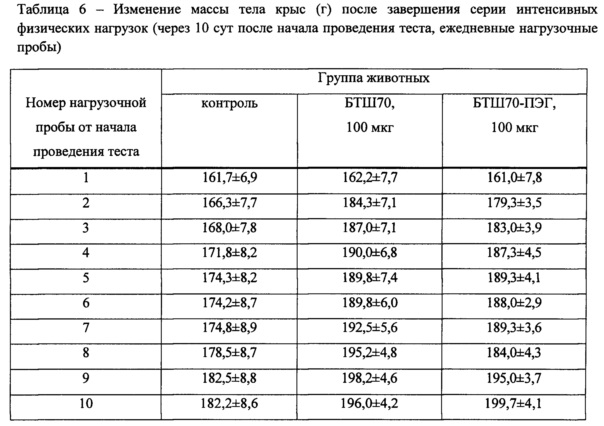
Пример 6. Применение БТШ70 для лечения приобретенной миопатии
Пациент X., 62 года. Предъявлял жалобы на значительную потерю массы тела (35 кг в течение 1 года), атрофию мышц нижних и верхних конечностей, снижение мышечной силы и выносливости, развитие мышечных контрактур. Электронная микроскопия (фиг. 13) биоптатов из плечевой и икроножной мышц: выявлены выраженные признаки рабдомиолиза, повреждение структуры митохондрий с образованием многочисленных вакуолей, уменьшение числа сателлитных клеток мышц. Клинический диагноз: Приобретенная митохондриальная миопатия, выраженная кахексия - был установлен в Военно-медицинской академии, Санкт-Петербург (Россия). Пациенту вводили внутривенно БТШ70 в дозе 0,5 мг ежедневно в течение семи суток.
Повторное обследование проведено через 6 недель после завершения курса лечения. Установлено, что масса тела пациента увеличилась на 6,5 кг, что сопровождалось увеличением массы мышц и мышечной силы более чем на 30%. Кроме того, результаты электронной микроскопии (фиг. 14) показали восстановление нарушенной структуры мышечных волокон, значительное снижение их расслоения, восстановление структуры митохондрий и активацию ядерной функции миоцитов.
Пример 7. Применение БТШ70 и БТШ70-ПЭГ при выполнении специфической нагрузки (плавание)
Проводили сравнительную оценку эффективности применения экзогенного рчБТШ70 и рчБТШ70-ПЭГ для повышения физической работоспособности у спортсменов-добровольцев при выполнении специфической нагрузки - плавания. В качестве базового препарата для сравнения использовали известный актопротектор метапрот, применяемый для повышения работоспособности, в частности при экстремальных физических нагрузках [Инструкция по применению препарата метапрот].
В исследовании принимали участие 44 спортсмена-добровольца - мужчины в возрасте 19-21 года, средняя масса тела 78,3±2,3 кг (регулярные тренировки в течение 5-7 лет до момента начала исследования). Все спортсмены были распределены на четыре группы в зависимости от применяемого препарата:
группа 1 (контрольная - плацебо) - введение лактозы перорально в капсулах (11 чел.);
группа 2 (метарпот) - введение метапрота в дозе 250 мг перорально в капсулах (13 чел.);
группа 3 (БТШ70) - введение рчБТШ70 в дозе 0,08 мг/кг внутримышечно (10 чел.);
группа 4 (БТШ70-ПЭГ) - введение рчБТШ70-ПЭГ в дозе 0,08 мг/кг внутримышечно (10 чел.).
Препарат метапрот (в группе 2) был использован в дозе 250 мг (одна капсула), принятой для повышения работоспособности при экстремальных физических нагрузках для взрослых (лиц с массой тела до 80 кг). [Инструкция по применению препарата метапрот].
Выбор дозы БТШ70 и БТШ70-ПЭГ (в группах 3 и 4) осуществляли на основе рекомендаций, приведенных в работе [Руководство по экспериментальному (доклиническому) изучению новых фармакологических средств / Под общей редакцией члена-корреспондента РАМН, проф. Р.У. Хабриева. - 2-изд., перераб. и доп. - М.: ОАО «Издательство «Медицина», 2005. - 832 с. ил.]. Использовали вариант определения дозы фармакологического средства для первой фазы клинических испытаний, базирующийся на соотношениях между массой и поверхностью тела человека и животного. В рамках этого подхода предполагается, что минимальная эффективная доза, отнесенная к поверхности тела у человека и животного, одинакова. В частности, соотношение между дозами фармакологического средства у человека (масса тела - 70000 г) и крысы (стандартная масса тела - 200 г) составляет 56,0. Исходя из данных таблиц 1 и 4 (примеры 4 и 5), авторами изобретения принято, что минимальная эффективная доза и БТШ70, и БТШ70-ПЭГ для крыс составляет 0,5 мг/кг массы тела (100 мкг или 0,1 мг на крысу). Соответственно, для человека массой 70 кг указанная доза в пересчете составила 0,1×56=0,56 мг на человека или 0,08 мг/кг массы тела.
В рамках исследования все спортсмены-добровольцы в течение восьми дней тренировались в следующем режиме: пять дней - ежедневно выполняли обычную тренирующую нагрузку, два дня - тренировки отсутствовали, на восьмой день - обычная тренирующая нагрузка. Кроме того, в первый и на восьмой дни исследования после завершения обычной тренирующей нагрузки спортсмены дополнительно выполняли тестовую нагрузку, которая включала два заплыва (первый и второй) по 50 м каждый на максимальной мощности (соответственно, этап 1 и этап 2) с перерывом между заплывами (этапами) 1,5 мин.
Препараты во всех группах вводили в конце каждого тренировочного дня через 10-20 мин после окончания тренировки в течение пяти суток. Эффективность применяемых препаратов оценивали путем анализа полученных значений показателей физической работоспособности. При этом, в первый день исследования после выполнения дополнительной тестовой нагрузки определяли фоновые значения указанных показателей (препараты во всех группах вводили до замера фоновых показателей). На восьмой день исследования после окончания дополнительной тестовой нагрузки во всех группах определяли опытные значения показателей физической работоспособности.
В качестве показателей физической работоспособности были использованы следующие:
- время заплыва;
- скорость заплыва;
- пульс;
- пульсовая стоимость преодоленного расстояния.
Время заплыва и пульс измеряли по завершении каждого из этапов. При этом пульс (П) после каждого заплыва фиксировали трижды - в периоды времени: 0-10, 30-40 и 60-70 с в течение 10 с после заплыва (соответственно, П1-1, П1-2, П1-3, П2-1, П2-2, П2-3).
Скорость заплыва определялась расчетным путем после каждого этапа как отношение времени заплыва на данном этапе к расстоянию (50 м).
Показатель «пульсовая стоимость преодоленного расстояния» (ПС) определялся расчетным путем. Известно, что ПС - количество ударов сердца на единицу расстояния - является показателем эффективности и экономичности работы в зависимости от условий проведения тренирующей нагрузки. Указанный показатель используют во всех циклических видах спорта. Уменьшение этого показателя у спортсмена считается прогрессом. Динамика ПС помогает определить, в какой стадии спортивной формы находится спортсмен. (Биомеханика физических упражнений: Учеб. пособие для студентов фак. физ. воспитания пед. ин-тов и для ин-тов физ. культуры по спец. №2114 «Физ. воспитание». - М.: Просвещение, 1989. - 210 с: ил.).
В рамках исследования показатель ПС, определяемый по формуле:
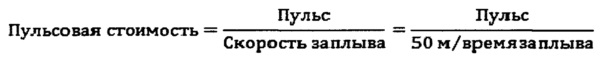
рассчитывали для каждого из этапов по каждому измеренному на данном этапе значению пульса (соответственно, ПС 1-1, ПС 1-2, ПС 1-3, ПС2-1, ПС2-2, ПС2-3).
Результаты исследований представлены в табл. 7.
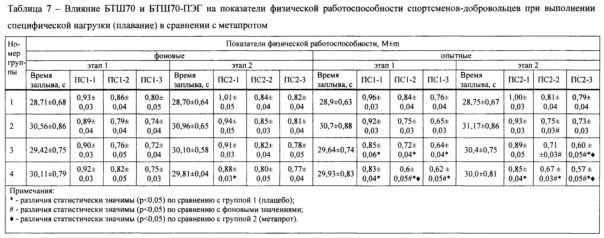
Из данных табл. 7 следует, что величины фоновых показателей физической работоспособности не имели значимых различий во всех группах спортсменов-добровольцев. В группе 2 (метапрот) опытные показатели в основном значимо не отличались ни от фоновых показателей, ни от показателей контрольной группы (значимое снижение по сравнению с величиной соответствующего фонового показателя отмечено только у одного опытного показателя - ПС2-2). При применении БТШ70 и БТШ70-ПЭГ (в группах 3 и 4, соответственно) опытные показатели ПС были значимо ниже по сравнению с контрольной группой (на 14-28%) и по сравнению с соответствующими фоновыми показателями (ПС2-3 - в группе 3; ПС2-2, ПС2-3 - в группе 4). Более того, в группах 3 и 4 отмечено значимое снижение отдельных показателей (ПС2-3 - в группе 3, ПС 1-2 и ПС2-3 - в группе 4) по сравнению с соответствующими показателями группы 2 (метапрот).
Источники информации
Borselli С, Storrie Н, Benesch-Lee F, Shvartsman D, Cezar C, Lichtman JW, Vandenburgh HH, Mooney DJ. Functional Muscle Regeneration with Combined Delivery of Angiogenesis and Myogenesis Factors. Proc, Natl, Acad, Sci, U, S. A, 2010, 107(8):3287-92.
Gehrig SM, van der Poel C, Sayer ТА, Schertzer JD, Henstridge DC, Church IE, Lamon S, Russell AP, Davies KE, Eebbraio MA, Lynch GS. Hsp72 Preserves Muscle Function and Slows Progression of Severe Muscular Dystrophy, Nature, 2012, 484(7394):394-8.
Jammes Y, Steinberg JG, Delliaux S, Bregeon F, Chronic Fatigue Syndrome Combines Increased Exercise-Induced Oxidative Stress And Reduced Cytokine and HSP Responses, J. Intern. Med. 2009, 266(2), 196-206.
Karkkainen AM, et al. Vascular Endothelial Growth Factor-D transgenic Mice Show Enhanced Blood Capillary Density, Improved Postischemic Muscle Regeneration, and Increased Susceptibility to Tumor Formation, Blood, 2009, 113:4468-4475.
Lee CE, McArdle A, Griffiths RD, The Role of Hormones, Cytokines and Heat Shock Proteins During Age-Related Muscle Loss, Clin. Nutr. 2007, 26(5):524-34.
Levenberg S, et al. Engineering Vascularized Skeletal Muscle Tissue, Nature Biotechnol. 2005, 23:879-884.
Maglara AA, Vasilaki A, Jackson MJ, McArdle A, Damage to Developing Mouse Skeletal Muscle Myotubes in Culture: Protective Effect of Heat Shock Proteins, J. Physiol. 2003, 548(3):837-846.
Messina S, et al. (2007) VEGF Overexpression via Adeno-Associated Virus Gene Transfer Promotes Skeletal Muscle Regeneration and Enhances Muscle Function in mdx Mice, FASEB J. 2007, 21:3737-3746
Morton JP, Kayani AC, McArdle A, Drust B, Exercise-Induced Stress Response of Skeletal Muscle, with Specific Emphasis on Humans, Sport Med. 2009, 39(8): 643-662.
Nemoto TK Fukuma Y, Itoh H, Takagi ТА, Опо T. Disulfide Bridge Mediated by Cysteine 574 Is Formed in the Dimer of the 70-kDa Heat Shock Protein, J. Biochem. 2006, 139: 677-687.
Panossian A, Wikman G, Evidence-Based Efficacy of Adaptogens in Fatigue, and Molecular Mechanisms Related to Their Stress-Protective Activity. Curr. Clin. Pharmacol. 2009, 4(3): 198-219.
Shiota M, Kusakabe H, Izumi Y, Hikita Y, Nakao T, Funae Y, Miura K, Iwao H, Heat Shock Cognate Protein 70 Is Essential for Akt Signaling in Endothelial Function, Arterioscler. Thromb. Vase. Biol. 2010, 30:491-497.
Silva EA, Mooney DJ, Spatiotemporal Control of Vascular Endothelial Growth Factor Delivery from Injectable Hydrogels Enhances Angiogenesis, J Thromb Haemost. 2007,5:590-598.
Slepian MJ, Massia SP, Treatment of Tissues to Reduce Subsequent Response to Injury. US Patent 5,914,345.
Srivastava PK, Chandawarkar RY, Compositions and Methods for Promoting Tissue Repair Using Heat Shock Proteins. US Patent Application US 2003/0012793.
Takahashi N., Heat Shock Protein Inducer. US Patent Application 6,846,845 B2.
Vigh L, Literati PN, Horvath I, Torek Z, Balogh G, Glatz A, Kovacs E, Boros I, Ferdirsandy P, Farkas B, Jaszlits L, Jednakovits A, Koranyi L, Maresca B. Bimoclomol: a Nontoxic, Hydroxylamine Derivative with Stress Protein-Inducing Activity and Cytoprotective Effect,Nature Medicine, 1997, 3(10): 1150-1154.
Wagers AJ, Conboy IM, Cellular and Molecular Signatures of Muscle Regeneration: Current Concepts and Controversies in Adult Myogenesis, Cell 2005, 122: 659-667.
Whitham M, Fortes MB, Heat Shock Protein 72: Release and Biological Significance, Front. Biosci. 2008, 13:1328-1339.
Включение путем ссылки
Полная комплектация всех патентов, опубликованных патентных заявок и других ссылок, приведенные здесь, специально включены таким образом в данное описание во всей своей полноте посредством ссылки.
Эквиваленты
Средние специалисты в данной области техники будут знать или будут способны установить с использованием рутинных экспериментов, многочисленные эквиваленты конкретных процедур, описанных в данном документе. Такие эквиваленты были учтены в пределах объема данного изобретения и охватываются формулой изобретения. Более того, любые численные или алфавитные диапазоны, представленные здесь, включают как верхние, так и нижние граничные значения указанных диапазонов. Кроме того, любой список или совокупность элементов подразумевают их реализацию, по меньшей мере, в одном варианте, что сделано для сокращения или удобства перечисления независимых вариантов, при этом, каждый элемент списка, как таковой, следует рассматривать как отдельный вариант.
| название | год | авторы | номер документа |
|---|---|---|---|
| Гибридные белки и белковые конъюгаты на основе белка теплового шока-70 (БТШ70) и способы их применения (варианты) | 2012 |
|
RU2685867C2 |
| СПОСОБ ПОВЫШЕНИЯ ФИЗИЧЕСКОЙ РАБОТОСПОСОБНОСТИ | 2011 |
|
RU2487717C1 |
| АДАПТОГЕН | 2004 |
|
RU2279877C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ УСИЛЕНИЯ ИЛИ ПОДДЕРЖАНИЯ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ | 2011 |
|
RU2606763C2 |
| ЛЕЧЕНИЕ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ АНТИТЕЛАМИ CD154 | 2015 |
|
RU2695443C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ НИКОТИНАМИДРИБОЗИД И УРОЛИТИН | 2016 |
|
RU2751638C2 |
| СРЕДСТВО ГУМИНОВОЙ ПРИРОДЫ ДЛЯ ПОВЫШЕНИЯ ФИЗИЧЕСКОЙ РАБОТОСПОСОБНОСТИ И ВЫНОСЛИВОСТИ | 2019 |
|
RU2727692C1 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ УЛУЧШЕНИЯ ФУНКЦИИ МИТОХОНДРИЙ И ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ И КОГНИТИВНЫХ РАССТРОЙСТВ | 2011 |
|
RU2745439C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ УРОЛИТИНЫ | 2016 |
|
RU2754761C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ СИНДРОМА ХРОНИЧЕСКОЙ УСТАЛОСТИ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2003 |
|
RU2267319C2 |
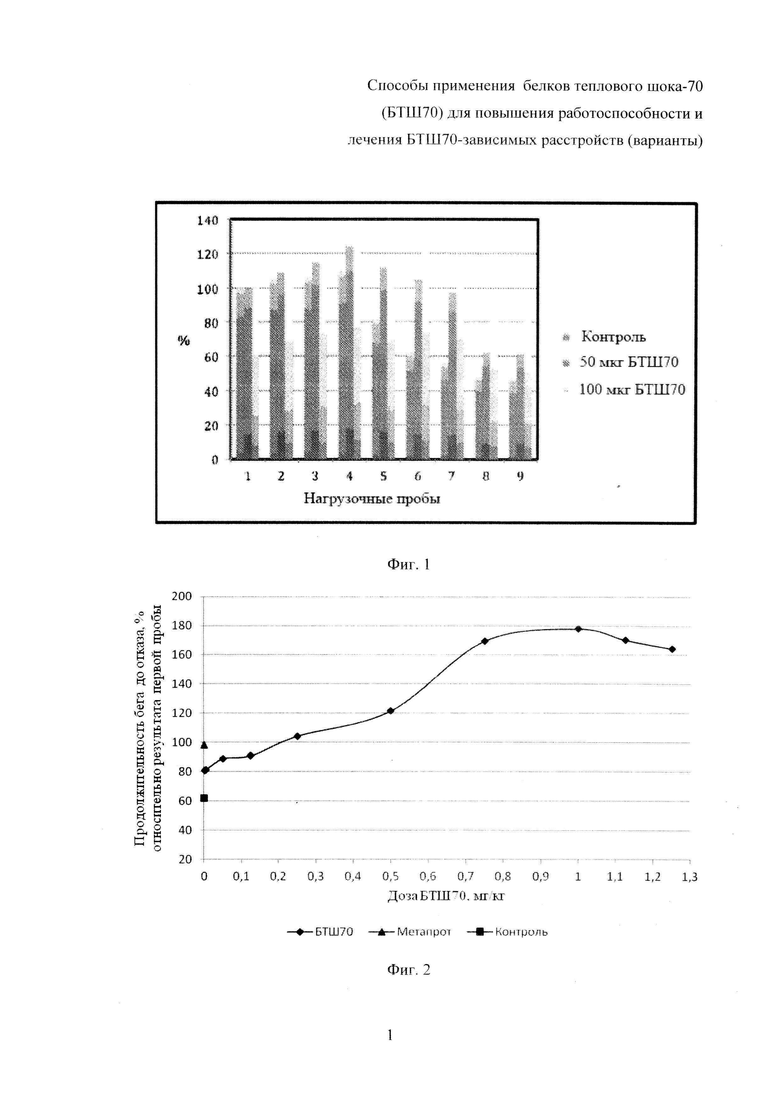
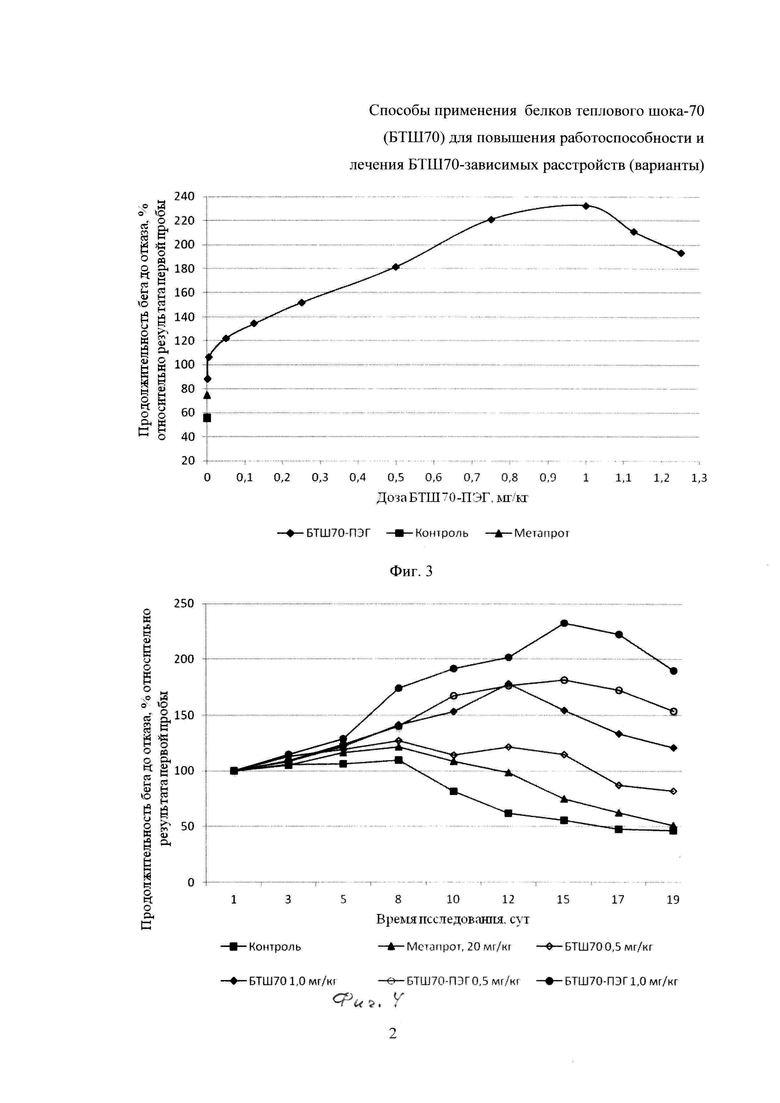
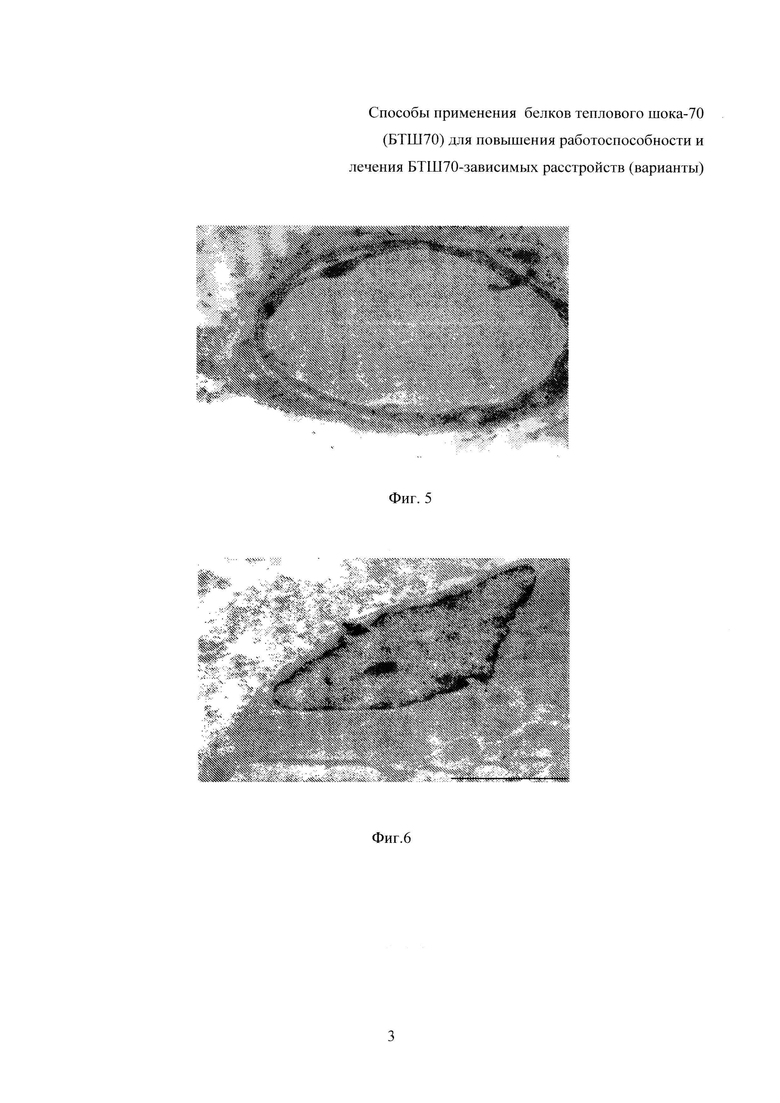
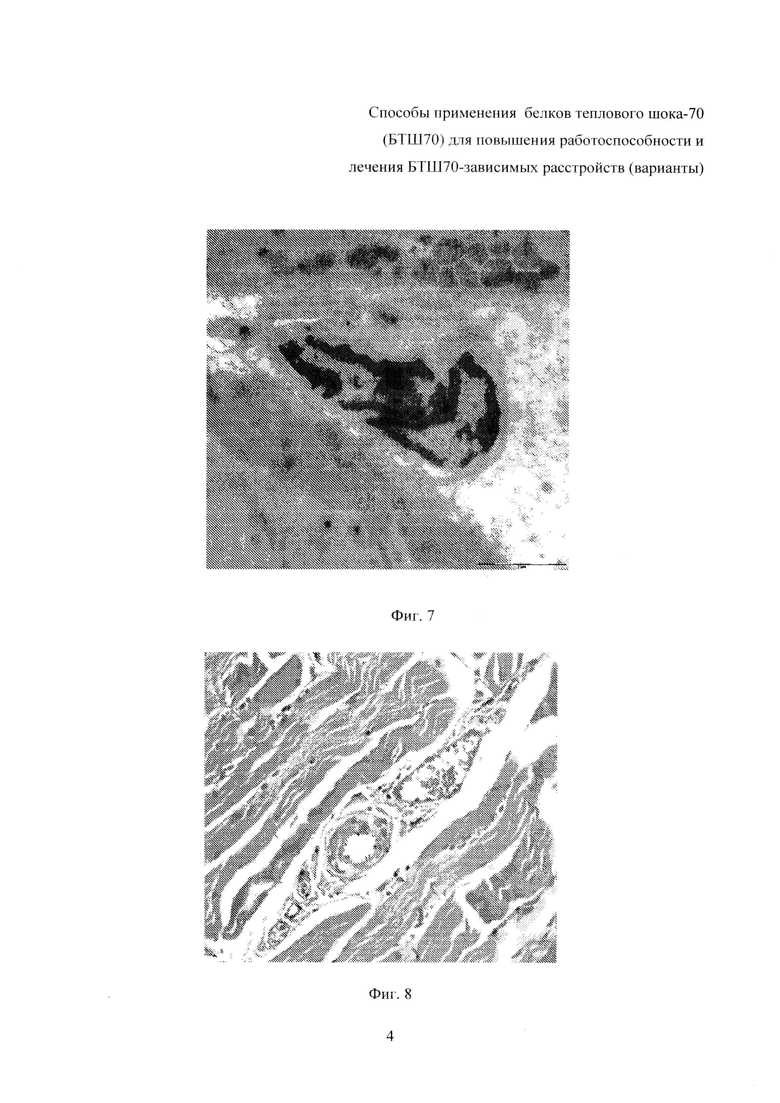
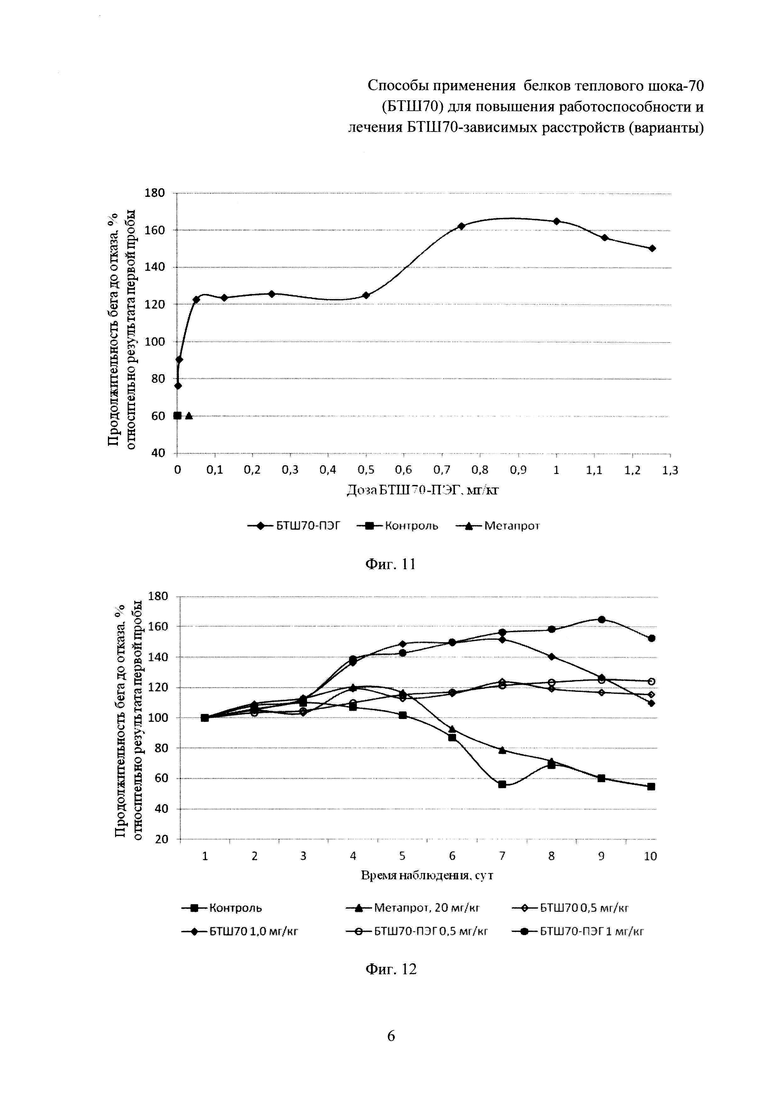

Изобретение относится к медицине, а именно к спортивной медицине, и может быть использовано для повышения работоспособности при выполнении интенсивных физических нагрузок. Способ по изобретению включает введение препарата, содержащего эффективное количество белка теплового шока-70 (БТШ70) и фармацевтически приемлемый носитель, в начале серии после каждой из по меньшей мере шести нагрузок. Использование изобретения позволяет повысить работоспособность за счет снижения или предотвращения повреждения мышц и увеличения плотности капиллярной сети, количества сателлитных клеток, стимуляции процессов восстановления мышц. 3 з.п. ф-лы, 7 табл., 14 ил., 7 пр.
1. Способ повышения работоспособности при выполнении интенсивных физических нагрузок путем введения субъекту лекарственного препарата, отличающийся тем, что субъекту при выполнении им серии физических нагрузок вводят препарат, содержащий эффективное количество белка теплового шока-70 (БТШ70) и фармацевтически приемлемый носитель, в начале серии после каждой из по меньшей мере шести нагрузок.
2. Способ по п. 1, отличающийся тем, что препарат, содержащий эффективное количество БТШ70 и фармацевтически приемлемый носитель, вводят субъекту при выполнении им серии физических нагрузок, состоящей из 9-10 нагрузок.
3. Способ по п. 1, отличающийся тем, что в качестве БТШ70 используют рекомбинантный человеческий БТШ70.
4. Способ по п. 1, отличающийся тем, что в качестве БТШ70 используют пегилированный БТШ70.
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ СИНДРОМА ХРОНИЧЕСКОЙ УСТАЛОСТИ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2003 |
|
RU2267319C2 |
| US 20030012793, 16.01.2003 | |||
| GIFONDORWA D.J | |||
| et al | |||
| Деревянный торцевой шкив | 1922 |
|
SU70A1 |
| JAMMES Y | |||
| et al | |||
| Chronic fatigue syndrome combines increased exercise-induced oxidative stress and reduced cytokine and Hsp responses// J Intern Med | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| PMID: 19457057. | |||
Авторы
Даты
2018-05-17—Публикация
2012-06-28—Подача