Техническая область
Настоящее изобретение относится к способам, наборам и системам для прогнозирования исхода рака молочной железы. Более конкретно, настоящее изобретение относится к прогнозированию рака молочной железы на основе измерения уровней экспрессии маркерных генов в образцах опухоли пациентов с раком молочной железы.
Уровень техники, к которому относится изобретение
Рак молочной железы является одной из ведущих причин смертности от рака у женщин в западных странах. Более конкретно, только в США ежегодно рак молочной железы уносит жизни приблизительно 40000 женщин, и его диагностируют приблизительно у 200000 женщин. В течение последних нескольких десятилетий адъювантная системная терапия привела к значительному увеличению выживаемости при раннем раке молочной железы. Этот клинический опыт привел к согласованным рекомендациям, предлагающим адъювантную системную терапию для подавляющего большинства пациентов с раком молочной железы (EBCAG). При раке молочной железы доступно множество вариантов лечения, которые можно применять в дополнение к обычно проводимому хирургическому удалению опухоли и последующему облучению ложа опухоли. Три основных и принципиально различных стратегии представляют собой эндокринное лечение, химиотерапию и лечение нацеленной терапией. Предпосылкой для лечения эндокринными средствами является экспрессия рецепторов гормонов в опухолевой ткани, т.е. либо рецептора эстрогена, либо рецептора прогестерона, либо обоих из них. Доступно несколько эндокринных средств с различным способом действия и различиями в исходе заболевания при тестировании в больших группах пациентов. Тамоксифен является основой эндокринного лечения на протяжении последних трех десятилетий. Крупные клинические испытания продемонстрировали, что тамоксифен значительно снижает риск рецидива опухоли. Дополнительный вариант лечения основан на ингибиторах ароматазы, которые относятся к новому классу эндокринных лекарственных средств. В противоположность тамоксифену, который является конкурентным ингибитором связывания эстрогена, ингибиторы ароматазы блокируют продуцирование самого эстрогена, тем самым снижая стимул к росту для положительных по рецептору эстрогена опухолевых клеток. Кроме того, у некоторых пациентов возникает рецидив, несмотря на эндокринное лечение, и конкретно для этих пациентов могут быть полезны дополнительные терапевтические лекарственные средства. Было показано, что химиотерапия антрациклинами, таксанами и другими средствами является эффективной для подавления рецидива заболевания как у положительных по рецептору эстрогена пациентов, так и у отрицательных по рецептору эстрогена пациентов. В исследовании NSABP-20 сравнивали тамоксифен отдельно с тамоксифеном плюс химиотерапия у отрицательных по узлам положительных по рецептору эстрогена пациентов и показали, что комбинированное лечение было более эффективным, чем лечение тамоксифеном отдельно. Однако исследование IBCSG IX, в котором сравнивали тамоксифен отдельно с тамоксифеном плюс химиотерапия, не показало какой-либо пользы добавления цитотоксических средств. Недавно было показано, что вводимое системно антитело, направленное против антигена HER2/neu на поверхности опухолевых клеток, снижает риск рецидива в несколько раз у пациентов со сверхэкспрессирующими Her2neu опухолями. Однако большинство, если не все, из различных способов медикаментозного лечения имеют многочисленные побочные действия, которые могут значительно ухудшить качество жизни пациентов (Shapiro and Recht, 2001; Ganz et al., 2002). Это делает обязательным выбор стратегии лечения на основе тщательной оценки риска у конкретного пациента, чтобы избежать избыточного, а также недостаточного лечения. Поскольку польза химиотерапии является относительно большой в случае положительных по HER2/neu опухолей и опухолей, характеризующихся отсутствием экспрессии HER2/neu и рецепторов эстрогена (базальный тип), по сравнению с отрицательными по HER2/neu и положительными по рецепторам эстрогена опухолями (люминальный тип), наиболее трудное принятие решения о лечении касается люминальных опухолей, для которых классические клинические факторы, такие как степень, размер опухоли или вовлечение лимфатических узлов, не обеспечивают четкого ответа на вопрос об использовании химиотерапии. Для удовлетворения этой медицинской потребности были разработаны более новые молекулярные инструменты, такие как анализ 21 гена, анализ геномного показателя степени и другие анализы.
Методические рекомендации по лечению обычно разрабатываются известными в данной области экспертами. В Европе методические рекомендации St Gallen 2009 года рекомендовали химиотерапию у пациентов с положительным по HER2 раком молочной железы, а также у пациентов с отрицательным по HER2 и отрицательным по ER заболеванием. Неясность о пользе химиотерапии возникает в случае пациентов с отрицательным по HER2 и положительным по ER заболеванием. Чтобы принять сбалансированное решение для субъекта в качестве наиболее полезного критерия используют вероятность рецидива рака. Клинические критерии, такие как состояние лимфатических узлов, степень опухоли, размер опухоли и прочие, являются полезными, поскольку они обеспечивают информацию о риске рецидива. Позднее было показано, что мультигенные анализы обеспечивают информацию лучше или дополнительно к стандартным клиническим факторам риска. Является общепризнанным, что маркеры пролиферации, по-видимому, обеспечивают основную прогностическую информацию. Известными примерами этих прогностических средств являются тест Mammaprint от Agendia, показатель рецидива от Veridex и геномный индекс степени, разработанный в институте Jules Bordet и лицензированный для Ipsogen. Все из этих анализов основаны на определении уровней экспрессии по меньшей мере 70 генов и все из них были разработаны для РНК, не деградированной значительно фиксацией формалином и погружением в парафин, а выделенной из свежей ткани (транспортированной в RNALaterTM). Другим важным мультигенным анализом является тест показателя рецидива от Genomic Health Inc. Этот тест определяет уровень экспрессии 16 связанных с раком генов и 5 эталонных генов после экстракции РНК из фиксированных в формалине и погруженных в парафин образцов ткани.
Однако современные инструменты имеют недостаток отсутствия клинической надежности и применимости в наиболее важной клинической группе риска, т.е. у тех пациентов с раком молочной железы, имеющих промежуточный риск рецидива на основе стандартного клинического параметра. Таким образом, требуются лучшие инструменты для оптимизации принятия решения о лечении на основе прогноза для пациента. Для клинической пользы, состоящей в избегании химиотерапии, требуется тест с высокой чувствительностью и высокой отрицательной прогностической силой, чтобы не подвергнуть пациента недостаточному лечению, у которого в конечном итоге разовьется отдаленный метастаз после хирургической операции. Что касается остающейся потребности в материалах и способах, пригодных для принятия клинических решений в отношении адъювантной терапии, настоящее изобретение удовлетворяет потребность в перспективных способах прогнозирования рака молочной железы на основе хорошо доступных клинических и экспериментальных данных.
Определения
Если не определено иначе, технические и научные термины, используемые в настоящем документе, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение.
Термин "рак" не ограничивается какой-либо стадией, степенью, гистохимической степенью, агрессивностью или злокачественностью пораженной ткани или клеточного агрегата.
Термин "предсказание исхода" заболевания, как используют в рамках изобретения, означает как предсказание исхода у пациента, подвергаемого данной терапии, так и прогноз у пациента, которого не подвергают лечению. Термин "предсказание исхода", в частности, может относиться к риску развития у пациента метастаза, локального рецидива или гибели.
Термин "предсказание", как используют в рамках изобретения, относится к индивидуальной оценке рака или к ожидаемой выживаемости (OAS, общая выживаемость или DFS, выживание без заболевания) пациента, если опухоль лечат данной терапией. В противоположность этому, термин "прогноз" относится к индивидуальной оценке рака, или к ожидаемой выживаемости (OAS, общая выживаемость или DFS, выживание без заболевания) у пациента, если опухоль остается без лечения.
"Исход" в рамках настоящего изобретения представляет собой определенное состояние, достигаемое в ходе заболевания. Этот исход заболевания может представлять собой, например, клиническое состояние, такое как "рецидив заболевания", "развитие метастаза", "развитие узлового метастаза", "развитие отдаленного метастаза", "выживание", "гибель", "показатель ремиссии опухоли", стадия или степень заболевания или сходные с ними.
Под "риском" подразумевают число, связанное с вероятностью развития у субъекта или пациента или достижения субъектом или пациентом определенного исхода заболевания. Термин "риск" в контексте настоящего изобретения не подразумевает наличия какого-либо положительного или отрицательного подразумеваемого значения в отношении благополучия пациента, а относится только к возможности или вероятности возникновения или развития данного состояния.
Термин "клинические данные" относится к полноте доступных данных и информации, касающихся состояния здоровья пациента, включая, но не ограничиваясь ими, возраст, пол, массу тела, менопаузальный/гормональный статус, этиопатологические данные, данные анамнеза, данные, полученные с помощью диагностических способов in vitro, таких как гистопатология, анализы мочи или крови, данные, полученные способами визуализации, такими как рентген, компьютерная томография, MRI, PET, spect, ультразвуковое исследование, электрофизиологические данные, генетический анализ, анализ экспрессии генов, оценка с помощью биопсии, внутриоперационные данные.
Термин "положительный по узлам", "диагностированный как положительный по узлам", "вовлечение узлов" или "вовлечение лимфатических узлов" означает пациента, у которого ранее были диагностированы метастазы в лимфатических узлах. Это охватывает метастаз как в дренирующий лимфатический узел, близкорасположенный лимфатический узел, так и в отдаленный лимфатический узел. Этот предшествующий диагноз не составляет часть способа по изобретению. Вместо этого, он является предпосылкой для выбора пациентов, образцы которых можно использовать для одного из вариантов осуществления настоящего изобретения. Этот предшествующий диагноз может быть поставлен любым пригодным способом, известным в данной области, включая, но не ограничиваясь ими, удаление лимфатических узлов и патологический анализ, анализ с помощью биопсии, анализ биомаркеров in vitro, указывающих на метастаз, способы визуализации (например, компьютерная томография, рентген, магнитно-резонансная томография, ультразвуковое исследование) и внутриоперационные данные.
В контексте настоящего изобретения "биологический образец" представляет собой образец, полученный из биологического организма или находившийся в контакте с биологическим организмом. Примерами биологических образцов являются: клетки, ткань, жидкости организма, смывная жидкость, мазки, биоптаты, кровь, моча, слюна, мокрота, плазма, сыворотка, супернатант клеточной культуры и другие.
"Образец опухоли" представляет собой биологический образец, содержащий опухолевые клетки, либо целые, либо разрушенные. Образец может представлять собой образец любой биологической ткани или жидкости. Такие образцы включают, но не ограничиваются ими, мокроту, кровь, сыворотку, плазму, клетки крови (например, лейкоциты), ткань, образцы центральной или тонкоигольной биопсии, содержащие клетки жидкости организма, мочу, жидкость брюшной полости и плевральную жидкость, спинномозговую жидкость, слезную жидкость или клетки, выделенные из них. Также они могут включать срезы тканей, такие как замороженные или фиксированные срезы, взятые для гистологических целей или подвергнутые микродиссекции клетки или их внеклеточные части. Образец опухоли, подлежащий анализу, может представлять собой тканевой материал из неопластического очага повреждения, взятого аспирированием или пункцией, вырезанием или любым другим хирургическим способом, обеспечивающим полученный биопсией или резекцией клеточный материал. Такой образец содержит опухолевые клетки или фрагменты опухолевых клеток, полученные от пациента. Клетки могут быть найдены в клеточном "мазке", взятом, например, путем аспирирования через соски, лаважа протоков, тонкоигольной биопсии или путем стимулированного или самопроизвольного выделения из сосков. В другом варианте осуществления образец представляет собой жидкость организма. Такие жидкости включают, например, жидкости крови, сыворотку, плазму, лимфу, асцитические жидкости, гинекологические жидкости или мочу, но не ограничиваясь этими жидкостями.
"Ген" представляет собой набор сегментов нуклеиновой кислоты, который содержит информацию, необходимую для получения функционального РНК-продукта. "Продукт гена" представляет собой биологическую молекулу, продуцируемую путем транскрипции или экспрессии гена, например мРНК, кДНК или транслированного белка.
"мРНК" представляет собой транскрибированный продукт гена и этот термин имеет обычное значение, подразумеваемое специалистом в данной области. "Молекула, происходящая из мРНК" представляет собой молекулу, которая химически или ферментативно получена из мРНК-матрицы, такую как кДНК.
Термин "уровень экспрессии" относится к определенному уровню экспрессии гена. Это может быть определенный уровень экспрессии гена в качестве абсолютной величины или по сравнению с эталонным геном (например, геном домашнего хозяйства), со средним значением для двух или более эталонных генов, или с вычисленной средней величиной экспрессии (например, в анализе с ДНК-чипом) или с другими информативным геном без применения эталонного образца. Уровень экспрессии гена можно измерять прямо, например, путем получения сигнала, где сила сигнала коррелирует с количеством мРНК-транскриптов этого гена, или он может быть получен непрямо на белковом уровне, например, с помощью способов иммуногистохимии, CISH, ELISA или RIA. Уровень экспрессии также можно получать с помощью конкурентной реакции с эталонным образцом. Величине экспрессии, которую определяют путем измерения некоторого физического параметра в анализе, например, испускания флуоресценции, можно присваивать числовое значение, которое можно использовать для дальнейшей обработки информации.
"Эталонный профиль уровней экспрессии" в рамках изобретения означает любой профиль уровней экспрессии, который можно использовать для сравнения с другим профилем уровней экспрессии. В предпочтительном варианте осуществления изобретения эталонный профиль уровней экспрессии представляет собой, например, средний профиль уровней экспрессии, наблюдаемый в группе здоровых субъектов, субъектов с заболеванием или субъектов с заболеванием, которым проводили конкретный тип терапии, служащих в качестве эталонной группы, или субъектов с хорошим или плохим исходом.
Термин "математическое комбинирование уровней экспрессии" в рамках настоящего изобретения означает получение числовой величины из определенного уровня экспрессии гена и применение алгоритма к одной или нескольким таким числовым величинам для получения комбинированной величины или комбинированного показателя.
"Алгоритм" представляет собой процесс, который осуществляет некоторую последовательность действий для вырабатывания информации.
"Показатель" представляет собой числовую величину, которая получена математическим комбинированием уровней экспрессии с использованием алгоритма. Также она может быть получена из уровней экспрессии и другой информации, например, клинических данных. Показатель может быть связан с исходом заболевания пациента.
"Дискриминантная функция" представляет собой функцию набора переменных, используемых для классификации объекта или события. Таким образом, дискриминантная функция позволяет классификацию пациента, образца или события в категорию или множество категорий согласно доступным данным или параметрам от указанного пациента, образца или события. Такая классификация является стандартным инструментом статистического анализа, хорошо известным квалифицированному специалисту. Например, пациента можно классифицировать как "имеющего высокий риск" или "имеющего низкий риск", "имеющего высокую вероятность метастаза" или "имеющего низкую вероятность метастаза", "нуждающегося в лечении" или "не нуждающегося в лечении" согласно данным, полученным от указанного пациента, образца или события. Классификация не ограничивается "высоким против низкого", а может осуществляться на множество категорий, степеней или сходных с ними. Классификацию также следует понимать в более широком смысле как отличающий показатель, где, например, более высокий показатель соответствует более высокой вероятности отдаленного метастаза, например, (общий) риск отдаленного метастаза. Примеры дискриминантных функций, которые позволяют классификацию, включают, но не ограничиваются ими, функции, определяемые методом опорных векторов (SVM), методом k-ближайших соседей (kNN), (наивные) байесовские модели, модели линейной регрессии или фрагментарно определяемые функции, например, такие как при выявлении подгрупп, в древовидной схеме решений, в логическом анализе данных (LAD) и т.п. В более широком значении, примерами для целей иллюстрации являются величины непрерывных показателей математических методов или алгоритмов, таких как коэффициенты корреляции, проекции, показатели метода опорных векторов, другие способы на основе сходства, их комбинации и т.п.
Термин "методика лечения", "порядок лечения", "режим", а также "режим лечения" относится к последовательному или одновременному по времени проведению введения противоопухолевых, и/или антиваскулярных, и/или стимулирующих иммунную систему средств, и/или средств, обеспечивающих пролиферацию клеток крови, и/или лучевой терапии, и/или гипертермии, и/или гипертермии для лечения рака. Их введение можно проводить в адъювантном и/или неоадъювантном порядке. Состав такого "протокола" может варьировать с точки зрения дозы одного средства, временных рамок применения и частоты введения в пределах определенного терапевтического диапазона. В настоящее время проводятся исследования различных комбинаций различных лекарственных средств и/или физических способов, и различных схем.
Термин "цитотоксическая химиотерапия" относится к различным методикам лечения, воздействующим на пролиферацию и/или выживание клеток. Лечение может включать введение алкилирующих средств, антиметаболитов, антрациклинов, алкалоидов растений, ингибиторов топоизомеразы и других противоопухолевых средств, включая моноклональные антитела и ингибиторы киназы. В частности, цитотоксическое лечение может относиться к лечению таксанами. Таксаны представляют собой алкалоиды растений, которые блокируют деление клеток путем препятствования функционированию микротрубочек. Прототипным таксаном является природный продукт паклитаксел, исходно известный как таксол и впервые полученный из коры тиса тихого.
Доцетаксел представляет собой полусинтетический аналог паклитаксела. Таксаны повышают стабильность микротрубочек, препятствуя расхождению хромосом в ходе анафазы.
Термин "эндокринное лечение" или "гормональное лечение" (также иногда называемое "антигормональным лечением") означает лечение, которое нацелено на передачу сигнала гормонами, например, ингибирование гормонов, ингибирование рецепторов гормонов, использование агонистов или антагонистов рецепторов гормонов, использование рецепторов-мусорщиков или сиротских рецепторов, использование производных гормонов и препятствование продуцированию гормонов. Конкретным примером является терапия тамоксифеном, которая модулирует передачу сигнала рецептором эстрогена, или ароматазное лечение, которое препятствует продуцированию стероидных гормонов.
Тамоксифен представляет собой перорально активный селективный модулятор рецепторов эстрогена (SERM), который применяют для лечения рака молочной железы, и в настоящее время он является наиболее продаваемым в мире лекарственным средством для этой цели. Тамоксифен продается под торговыми названиями Nolvadex, Istubal и Valodex. Однако это лекарственное средство, даже до истечения действия патента на него, было и остается широко упоминаемым по его непатентованному наименованию "тамоксифен". Тамоксифен и производные тамоксифена конкурентно связываются с рецепторами эстрогена на опухолях и других тканевых мишенях, образуя ядерный комплекс, который снижает синтез РНК и ингибирует эффекты эстрогена.
Рецепторы стероидов представляют собой внутриклеточные рецепторы (как правило, цитоплазматические), которые осуществляют передачу сигнала стероидных гормонов. Их примеры включают рецепторы типа I, в частности, рецепторы половых гормонов, например, рецептор андрогенов, рецептор эстрогена, рецептор прогестерона; рецептор глюкокортикоидов, рецептор минералокортикоидов; и рецепторы типа II, например, рецептор витамина A, рецептор витамина D, рецептор ретиноидов, рецептор гормона щитовидной железы.
Термин "способ на основе гибридизации", как используют в рамках изобретения, относится к способам, вовлекающим процесс объединения комплементарных одноцепочечных нуклеиновых кислот или нуклеотидных аналогов в одну двухцепочечную молекулу. Нуклеотиды или нуклеотидные аналоги связываются с комплементарными им молекулами в нормальных условиях, так что две абсолютно комплементарных нити легко связываются друг с другом. В биоанализах очень часто используют меченые одноцепочечные зонды для поиска комплементарных последовательностей-мишеней. Если такие последовательности существуют в образце, зонды гибридизуются с указанными последовательностями, которые затем можно выявлять благодаря метке. Другие способы на основе гибридизации включают способы на микроматрицах и/или биочипах. В этих способах зонды иммобилизуют на твердой фазе, которую затем контактируют с образцом. Если в образце существуют комплементарные нуклеиновые кислоты, они гибридизуются с зондами, и, таким образом, их можно выявить. Эти подходы также известны как "способы на основе чипов". Другим способом на основе гибридизации является ПЦР, которая описана ниже. Когда требуется определение уровней экспрессии, способы на основе гибридизации, например, можно использовать для определения количества мРНК данного гена.
Олигонуклеотид, способный специфично связываться с последовательностями гена или их фрагментами, относится к олигонуклеотиду, который специфично гибридизуется с геном или продуктом гена, таким как мРНК или кДНК гена, или с его фрагментом. Для специфической детекции гена или продукта гена необязательно выявлять всю последовательность гена. Фрагмент размером приблизительно 20-150 оснований содержит достаточную специфическую информацию о последовательности для обеспечения специфической гибридизации.
Термин "способ на основе ПЦР", как используют в рамках изобретения, относится к способам, включающим полимеразную цепную реакцию (ПЦР). Она представляет собой способ экспоненциальной амплификации нуклеиновых кислот, например ДНК, путем ферментативной репликации in vitro. Поскольку ПЦР является технологией in vitro, ее можно проводить без ограничений формы ДНК, и ее можно широко модифицировать для проведения широкого набора генетических манипуляций. Когда требуется определить уровни экспрессии, способ на основе ПЦР можно использовать, например, для детекции присутствия данной мРНК путем (1) обратной транскрипции полного набора мРНК (так называемого транскриптома) в кДНК с помощью фермента обратной транскриптазы, и (2) детекции присутствия данной кДНК с помощью соответствующих праймеров. Этот подход широко известен как ПЦР с обратной транскриптазой (ОТ-ПЦР). Более того, способы на основе ПЦР включают, например, ПЦР в реальном времени, и, в частности, пригодны для анализа уровней экспрессии, кинетической или количественной ПЦР (q-ПЦР).
Термин "количественная ПЦР" (q-ПЦР)" относится к любому типу способа ПЦР, который позволяет количественное определение матрицы в образце. Количественная ПЦР в реальном времени включает различные способы исполнения или детекции продуктов, как например, способ TaqMan или способ LightCycler. Например, в способе TaqMan используется флуорогенный зонд с двойным мечением. В ПЦР в реальном времени TaqMan измеряется накопление продукта через флуорофор на экспоненциальных стадиях ПЦР, а не на конечной стадии, как в общепринятой ПЦР. Экспоненциальное увеличение продукта используют для определения порогового цикла, CT, т.е. количества циклов ПЦР, при котором выявляется значительное экспоненциальное увеличение флуоресценции, и которое прямо коррелирует с количеством копий ДНК-матрицы, присутствующих в реакции. Условия реакции в высокой степени сходны с общепринятой ПЦР, однако ее проводят в термоблоке для анализа в реальном времени, который позволяет измерение флуоресцентных молекул в пробирках для ПЦР. В отличие от обычной ПЦР, в ПЦР в реальном времени TaqMan в реакционную смесь добавляют зонд, т.е. одноцепочечный олигонуклеотид, комплементарный сегменту из 20-60 нуклеотидов в ДНК-матрице и располагающийся между двумя праймерами. С 5'- и 3'-концами зонда связаны флуоресцентный репортер или флуорофор (например, 6-карбоксифлуоресцеин, сокращенное название: FAM, или тетрахлорфлуоресцеин, сокращенное название: TET) и тушитель (например, тетраметилродамин, сокращенное название: TAMRA, или дигидроциклопирролоиндолтрипептидный "тушитель black hole" сокращенное название: BHQ), соответственно [2]. Близкое расположение флуорофора и тушителя, связанных с зондом, ингибирует флуоресценцию флуорофора. В процессе ПЦР, по мере начала синтеза ДНК, 5'-3' экзонуклеазная активность Taq-полимеразы нарушает это соотношение в зонде, который подвергся отжигу с матрицей. Деградация зонда высвобождает флуорофор из него и нарушает близкое расположение к тушителю, таким образом, устраняя эффект тушения и обеспечивая флуоресценцию флуорофора. Таким образом, флуоресценция, выявляемая в термоблоке ПЦР в реальном времени, прямо пропорциональна высвобожденному флуорофору и количеству ДНК-матрицы, присутствующей в ПЦР.
Под "матрицей" или "упорядоченной системой" подразумевают расположение адресуемых областей или "адресов" на устройстве. Положения могут быть организованы в виде двухмерных матриц, трехмерных матриц или других форматов упорядоченных систем. Количество положений может находиться в диапазоне от нескольких до по меньшей мере сотен тысяч. Наиболее важно, каждое расположение представляет собой полностью независимый реакционный участок. Матрицы включают, но не ограничиваются ими, матрицы нуклеиновых кислот, матрицы белков и матрицы антител. "Матрица нуклеиновых кислот" относится к матрице, содержащей зонды нуклеиновых кислот, такие как олигонуклеотиды, нуклеотидные аналоги, полинуклеотиды, полимеры нуклеотидных аналогов, morpholinos или более крупные части генов. Нуклеиновая кислота и/или аналог на матрице предпочтительно являются одноцепочечными. Матрицы, где зонды представляют собой олигонуклеотиды, называют "олигонуклеотидными матрицами" или "олигонуклеотидными чипами". "Микроматрица" в настоящем описании также относится к "биочипу" или "биологическому чипу", матрице из участков, имеющей плотность отдельных участков по меньшей мере приблизительно 100/см2, и предпочтительно по меньшей мере приблизительно 1000/см2.
"Пары праймеров" и "зонды" в рамках изобретения имеют обычное значение этого термина, которое хорошо известно специалисту в области молекулярной биологии. В предпочтительном варианте осуществления изобретения "пары праймеров" и "зонды" означают полинуклеотидные молекулы, имеющие последовательность, идентичную, комплементарную, гомологичную областям полинуклеотида-мишени, или гомологичную комплементарной последовательности областей полинуклеотида-мишени, который подлежит детекции или количественному определению. Другой вариант осуществления также включает нуклеотидные аналоги для применения в качестве праймеров и/или зондов. Технологии зондов, используемые для применения в кинетической ПЦР или ПЦР в реальном времени, могут представлять собой, например, системы TaqMan®, получаемые от Applied Biosystems, зонды для удлинения, такие как Scorpion® Primers, двойные гибридизационные зонды Amplifluor®, получаемые от Chemicon International, Inc, или малобороздочные лиганды.
"Индивидуально меченные зонды" в рамках изобретения означают молекулярные зонды, содержащие полинуклеотид, олигонуклеотид или нуклеотидный аналог и метку, способствующую детекции или количественному определению зонда. Предпочтительными метками являются флуоресцентные молекулы, люминесцентные молекулы, радиоактивные молекулы, ферментные молекулы и/или молекулы тушителей.
"Размещенные зонды" в рамках изобретения означает набор иммобилизованных зондов, предпочтительно в упорядоченном расположении. В предпочтительном варианте осуществления изобретения отдельные "размещенные зонды" могут быть идентифицированы по их соответствующему положению на твердой подложке, например, на "чипе".
При использовании в отношении последовательности одноцепочечной нуклеиновой кислоты, термин "по существу гомологичный" относится к любому зонду, который может гибридизоваться (т.е. он является комплементарной последовательностью для) с последовательностью одноцепочечной нуклеиновой кислоты в условиях низкой жесткости, как описано выше.
Сущность изобретения
В общих чертах, настоящее изобретение относится к способу оценки риска рецидива у пациента с отрицательным или положительным по узлам, положительным по рецептору эстрогена и отрицательным по HER2/NEU раком молочной железы, в частности, у пациентов, которым проводят эндокринную терапию, например, при лечении тамоксифеном. Статус рецепторов эстрогена, как правило, определяют с использованием иммуногистохимии, статус HER2/NEU (ERBB2), как правило, определяют с использованием иммуногистохимии и флуоресцентной гибридизации in situ.
Однако для целей изобретения статус рецепторов эстрогена и статус HER2/NEU (ERBB2) можно определять с помощью любого пригодного способа, например, иммуногистохимии, флуоресцентной гибридизации in situ (FISH) или анализа экспрессии РНК.
Настоящее изобретение относится к способу предсказания исхода рака молочной железы у пациента с раком молочной железы, имеющему положительную по рецептору эстрогена и отрицательную по HER2 опухоль, причем указанный способ включает:
(a) определение в образце опухоли от указанного пациента уровней экспрессии РНК по меньшей мере 2 из следующих 9 генов: UBE2C, BIRC5, RACGAP1, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP;
(b) математическое комбинирование величин уровня экспрессии для генов указанного набора, причем эти величины определяют в образце опухоли с получением комбинированного показателя, где указанный комбинированный показатель указывает на прогноз у указанного пациента. В одном варианте осуществления выбирают по меньшей мере 3, 4, 5 или 6 генов.
В следующем варианте осуществления изобретения способ включает:
(a) определение в образце опухоли от указанного пациента уровней экспрессии РНК следующих 8 генов: UBE2C, RACGAP1, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP;
(b) математическое комбинирование величин уровня экспрессии для генов указанного набора, причем эти величины определяют в образце опухоли с получением комбинированного показателя, где указанный комбинированный показатель указывает на прогноз у указанного пациента.
В следующем варианте осуществления способ по изобретению включает:
(a) определение в образце опухоли от указанного пациента уровней экспрессии РНК следующих 8 генов: UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP;
(b) математическое комбинирование величин уровня экспрессии для генов указанного набора, причем эти величины определяют в образце опухоли с получением комбинированного показателя, где указанный комбинированный показатель указывает на прогноз у указанного пациента.
В другом варианте осуществления изобретения BIRC5 может быть заменен UBE2C, или TOP2A, или RACGAP1, или AURKA, или NEK2, или E2F8, или PCNA, или CYBRD1, или DCN, или ADRA2A, или SQLE, или CXCL12, или EPHX2, или ASPH, или PRSS16, или EGFR, или CCND1, или TRIM29, или DHCR7, или PIP, или TFAP2B, или WNT5A, или APOD, или PTPRT, при условии, что после замены выбирают 8 различных генов; и
UBE2C может быть заменен BIRC5, или RACGAP1, или TOP2A, или AURKA, или NEK2, или E2F8, или PCNA, или CYBRD1, или ADRA2A, или DCN, или SQLE, или CCND1, или ASPH, или CXCL12, или PIP, или PRSS16, или EGFR, или DHCR7, или EPHX2, или TRIM29 при условии, что после замены выбирают 8 различных генов; и
DHCR7 может быть заменен AURKA, BIRC5, UBE2C или любым другим геном, который может заменять BIRC5 или UBE2C, при условии, что после замены выбирают 8 различных генов; и
STC2 может быть заменен INPP4B, или IL6ST, или SEC14L2, или MAPT, или CHPT1, или ABAT, или SCUBE2, или ESR1, или RBBP8, или PGR, или PTPRT, или HSPA2, или PTGER3, при условии, что после замены выбирают 8 различных генов; и
AZGP1 может быть заменен PIP, или EPHX2, или PLAT, или SEC14L2, или SCUBE2, или PGR при условии, что после замены выбирают 8 различных генов; и
RBBP8 может быть заменен CELSR2, или PGR, или STC2, или ABAT, или IL6ST при условии, что после замены выбирают 8 различных генов; и
IL6ST может быть заменен INPP4B, или STC2, или MAPT, или SCUBE2, или ABAT, или PGR, или SEC14L2, или ESR1, или GJA1, или MGP, или EPHX2, или RBBP8, или PTPRT, или PLAT при условии, что после замены выбирают 8 различных генов; и
MGP может быть заменен APOD, или IL6ST, или EGFR при условии, что после замены выбирают 8 различных генов.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанный комбинированный показатель указывает на пользу цитотоксической химиотерапии.
Использование способа по изобретению до проведения у пациента эндокринной терапии позволяет предсказание эффективности эндокринной терапии.
В таблице 2 ниже показано, указывает ли сверхэкспрессия каждого из представленных выше маркерных генов на хороший исход или на плохой исход у пациента, которому проводят эндокринную терапию. Таким образом, квалифицированный специалист может сконструировать математическую комбинацию, т.е. алгоритм, учитывая эффект данных генов. Например, суммирование или взвешенное суммирование генов, сверхэкспрессия которых указывает на хороший исход, обеспечивает алгоритм, где высокий показатель риска указывает на хороший исход. Надежность алгоритма можно исследовать путем анализа образцов опухолей пациентов с историей болезни, где, например, показатель для пациентов с хорошим исходом и для пациентов с плохим исходом можно определять по отдельности и сравнивать. Квалифицированному специалисту, биостатистику, известно применение других математических методов, таких как дискриминантные функции, для получения оптимизированных алгоритмов. Алгоритмы можно оптимизировать, например, для чувствительности или специфичности. Алгоритмы можно адаптировать для конкретной аналитической платформы, используемой для измерения экспрессии маркерных генов, такой как количественная ПЦР.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанная эндокринная терапия включает тамоксифен или ингибитор ароматазы.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где предсказывают риск развития рецидива.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанный уровень экспрессии определяют как уровень небелковой экспрессии.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанный уровень экспрессии определяют как уровень экспрессии РНК.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанный уровень экспрессии определяют с помощью по меньшей мере одного из:
способ на основе ПЦР,
способ на основе микроматрицы, и
способ на основе гибридизации.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанное определение уровней экспрессии проводят в фиксированном в формалине погруженном в парафин образце опухоли или в свежезамороженном образце опухоли.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где уровень экспрессии указанного по меньшей мере одного маркерного гена определяют в качестве паттерна экспрессии относительно по меньшей мере одного эталонного гена, или относительно вычисленной средней величины экспрессии.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанная стадия математического комбинирования включает стадию применения алгоритма к величинам, характерным для уровня экспрессии данного гена.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанный алгоритм представляет собой линейное комбинирование указанных величин, характерных для уровня экспрессии данного гена.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где величину, характерную для уровня экспрессии данного гена, умножают на коэффициент.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где для указанного комбинированного показателя определяют одно, два или более пороговых значений и его выделяют в группы высокого и низкого риска, высокого, промежуточного и низкого риска, или большее количество групп риска путем применения порогового значения к комбинированному показателю.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где высокий комбинированный показатель указывает на пользу более агрессивной терапии, например, цитотоксической химиотерапии. Квалифицированному специалисту понятно, что "высокий показатель" в этом отношении относится к эталонной величине или пороговой величине. Кроме того, квалифицированному специалисту понятно, что, в зависимости от конкретного алгоритма, используемого для получения комбинированного показателя, также "низкий" показатель ниже предела или эталонной величины может указывать на пользу более агрессивной терапии, например, цитотоксической химиотерапии. Это происходит в том случае, когда гены, имеющие положительную корреляцию с высоким риском метастазов, учитываются в алгоритме с положительным коэффициентом, так что общий высокий показатель указывает на высокую экспрессию генов, имеющих положительную корреляцию с высоким риском.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где информация, касающаяся статуса узлов у пациента, обрабатывается на стадии математического комбинирования величин уровня экспрессии генов с получением комбинированного показателя.
Согласно одному аспекту изобретения предусмотрен способ, как описано выше, где указанная информация, касающаяся статуса узлов, представляет собой числовую величину ≤0, если указанный статус узлов является отрицательным, и указанная информация представляет собой числовую величину >0, если статус узлов является положительным или неизвестным. В иллюстративных вариантах осуществления изобретения отрицательному статусу узлов присваивают величину 0, неизвестному статусу узлов присваивают величину 0,5 и положительному статусу узлов присваивают величину 1. Можно выбирать другие величины, так чтобы они отражали различный вес статуса узлов в алгоритме.
Кроме того, изобретение относится к набору для выполнения способа, как описано выше, причем указанный набор содержит набор олигонуклеотидов, способных специфично связывать последовательности, или связываться с последовательностями, фрагментов генов в комбинации генов, где
(i) указанная комбинация содержит по меньшей мере 8 генов: UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP; или
(ii) указанная комбинация содержит по меньшей мере 10 генов: BIRC5, AURKA, PVALB, NMU, STC2, RBBP8, PTGER3, CXCL12, CDH1 и PIP; или
(iii) указанная комбинация содержит по меньшей мере 9 генов BIRC5, DHCR7, RACGAP1, PVALB, STC2, IL6ST, PTGER3, CXCL12 и ABAT; или
(iv) указанная комбинация содержит по меньшей мере 9 генов: DHCR7, RACGAP1, NMU, AZGP1, RBBP8, IL6ST и MGP;
Кроме того, изобретение относится к применению набора для осуществления способа по любому из пп.1-17 формулы изобретения, причем указанный набор содержит набор олигонуклеотидов, способных специфично связывать последовательности, или связываться с последовательностями, фрагментов генов в комбинации генов, где
(i) указанная комбинация содержит по меньшей мере 8 генов: UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP; или
(ii) указанная комбинация содержит по меньшей мере 10 генов BIRC5, AURKA, PVALB, NMU, STC2, RBBP8, PTGER3, CXCL12, CDH1 и PIP; или
(iii) указанная комбинация содержит по меньшей мере 9 генов: BIRC5, DHCR7, RACGAP1, PVALB, STC2, IL6ST, PTGER3, CXCL12 и ABAT; или
(iv) указанная комбинация содержит по меньшей мере 9 генов: DHCR7, RACGAP1, NMU, AZGP1, RBBP8, IL6ST и MGP; 19. Компьютерный программный продукт, способный обрабатывать величины, характерные для уровня экспрессии генов AKR1C3, MAP4 и SPP1, путем математического комбинирования указанных величин с получением комбинированного показателя, где указанный комбинированный показатель указывает на пользу цитотоксической химиотерапии у указанного пациента.
Кроме того, изобретение относится к компьютерному программному продукту, способному обрабатывать величины, характерные для уровней экспрессии комбинации генов, путем математического комбинирования указанных величин с получением комбинированного показателя, где указанный комбинированный показатель указывает на эффективность или пользу эндокринной терапии указанного пациента, согласно описанным выше способам.
Указанный компьютерный программный продукт может храниться на носителе данных или он может быть реализован в диагностической системе, способной выдавать величины, характерные для уровня экспрессии данного гена, такой как система ПЦР в реальном времени.
Если компьютерный программный продукт хранится на носителе данных или выполняется на компьютере, управляющий работник может вводить величины экспрессии, полученные для уровня экспрессии соответствующих генов. Затем компьютерный программный продукт может применять алгоритм для получения комбинированного показателя, указывающего на пользу цитотоксической химиотерапии для данного пациента.
Способы по настоящему изобретению имеют преимущество обеспечения надежного предсказания исхода заболевания на основе использования только небольшого количества генов. Было выявлено, что способы по настоящему изобретению особенно пригодны для анализа ответа на эндокринное лечение, например, тамоксифеном, у пациентов с опухолями, классифицированным как положительные по ESR1 и отрицательные по ERBB2.
Подробное описание изобретения
Изобретение объяснено с помощью иллюстративных вариантов осуществления и прилагаемых фигур:
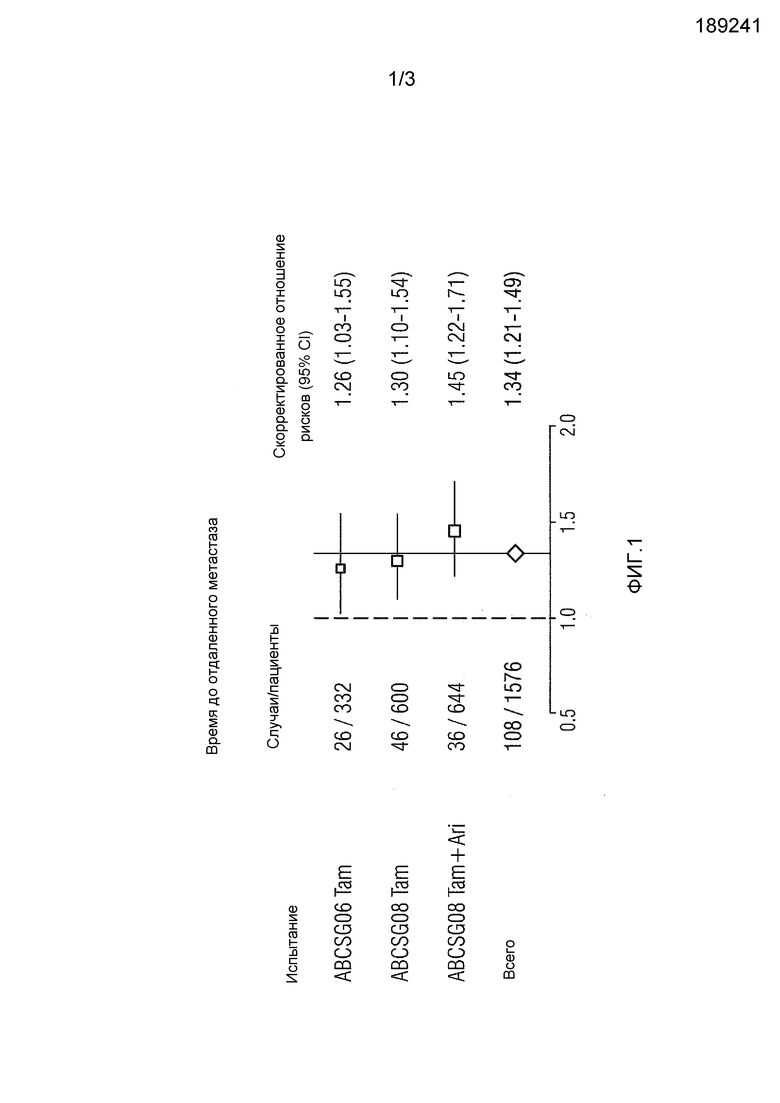
На фиг.1 представлен график типа "форрест-плот" для скорректированного отношения рисков с 95% доверительным интервалом для показателя T5 в комбинированной группе, а также в отдельных звеньях лечения исследований ABCSG06 и 08, с использованием отдаленного метастаза в качестве результата.
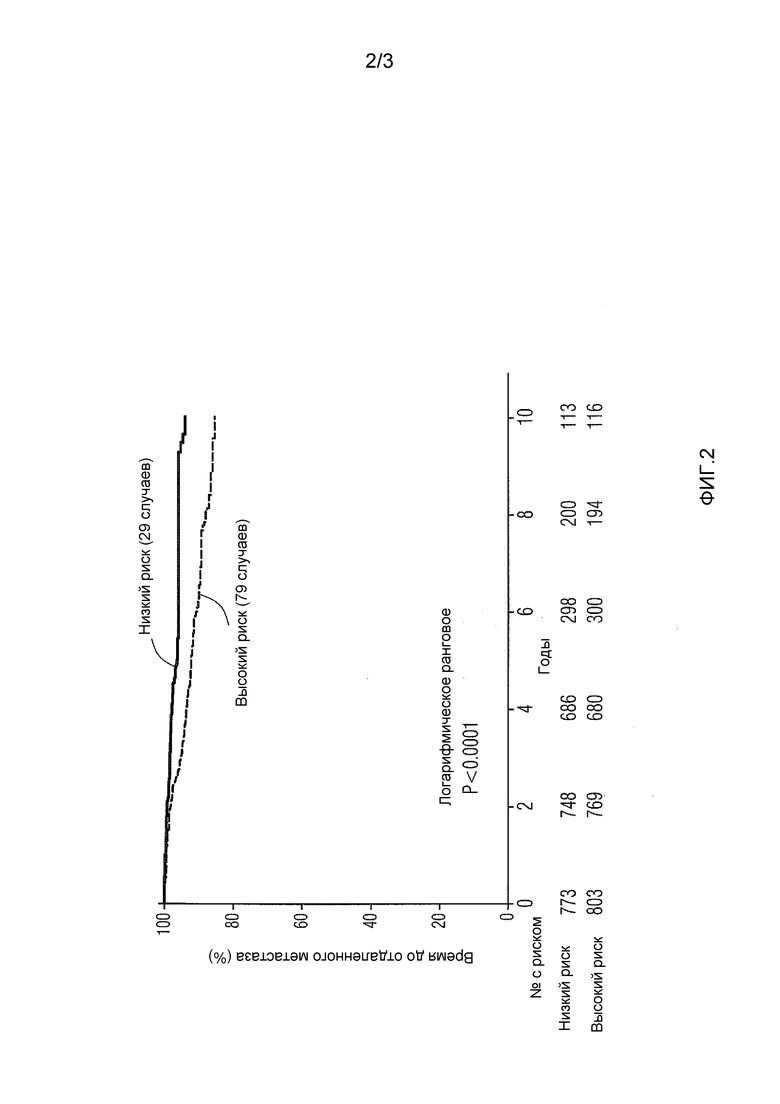
На фиг.2 представлен анализ Каплана-Мейера пациентов ER+, HER-, N0-3 из комбинированных групп ABCSG06 и 08, стратифицированных как высокий или низкий риск согласно величине показателя T5.
В настоящем описании описаны уникальные комбинации маркерных генов, которые можно комбинировать в алгоритм для представленного в настоящем описании нового предсказательного теста. Технически, способ по изобретению можно применять на практике с использованием двух технологий: 1.) Выделение общей РНК из свежей или фиксированной опухолевой ткани и 2.) Кинетическая ОТ-ПЦР выделенных нуклеиновых кислот. Альтернативно предусматривается измерение уровней экспрессии с использованием альтернативных технологий, например, с помощью микроматрицы, или путем измерения на белковом уровне.
Способы по изобретению основаны на количественном определении молекул РНК, выделенных из опухоли, для получения величин экспрессии и последующего биоинформатического анализа указанных определенных величин экспрессии. Молекулы РНК можно выделять из любого типа образца опухоли, например, биоптатов, мазков, подвергнутого резекции материала опухоли, свежезамороженной ткани опухоли или из погруженной в парафин и фиксированной в формалине опухолевой ткани. Во-первых, определяют уровни РНК генов, кодирующих конкретные комбинации генов UBE2C, BIRC5, DHCR7, RACGAP1, AURKA, PVALB, NMU, STC2, AZGP1, RBBP8, IL6ST, MGP, PTGER3, CXCL12, ABAT, CDH1 и PIP, или их конкретные комбинации, как указано. Исходя из этих величин экспрессии, вычисляют прогностический показатель путем математического комбинирования, например, согласно формулам T5, T1, T4 или T5b (см. ниже). Высокая величина показателя указывает на высокий риск развития отдаленного метастаза, низкая величина показателя указывает на низкий риск отдаленного метастаза. Следовательно, высокий показатель также указывает на то, что пациент представляет собой пациента с высоким риском, для которого будет полезна более агрессивная терапия, например, цитотоксическая химиотерапия.
Представленные примеры основаны на идентификации прогностических генов с использованием опухолей пациентов с гомогенным лечением в адъювантном режиме тамоксифеном. Более того, идентификация соответствующих генов была ограничена опухолями, классифицированными как положительные по ESR1 и отрицательные по ERBB2, исходя из уровней экспрессии РНК. Кроме того, для разработки алгоритма рассматривали гены, позволяющие выделять опухоли промежуточного риска, степени 2. Наконец, проводили перенос платформы с матриц Affymetrix HG U133a на количественную ПЦР в реальном времени, а также переключение типа образца со свежезамороженной ткани на ткань FFPE для обеспечения надежного выполнения алгоритма, независимо от платформы и типа ткани. В результате определение уровня экспрессии молекулы РНК из первичной опухоли и последующий комплексный и многофакторный анализ, как описано выше, обеспечивают лучший способ предсказания вероятности рецидива заболевания у пациентов, у которых диагностирован негативный или положительный по лимфатическим узлам ранний рак молочной железы, при лечении только тамоксифеном в адъювантном режиме. Таким образом, тест основан на меньшем количестве генов, чем конкурирующие тесты, но обеспечивает лучшую информацию с точки зрения высокой чувствительности и отрицательной предсказательной величины, в частности, для опухолей, считающихся проявляющими промежуточный риск рецидива, исходя из стандартных клинических факторов.
Тотальную РНК экстрагировали способом Siemens, основанным на гранулах из кремнизема и являющимся полностью автоматизированным способом выделения РНК, из одного цельного 10-мкм среза ткани FFPE на роботе для работы с жидкостями Hamilton MICROLAB STARlet (17). Робот, буферы и химические реагенты были частью системы Siemens VERSANT® kPCR Molecular System (Siemens Healthcare Diagnostics, Tarrytown, NY; не является коммерчески доступной в США). В кратком изложении, 150 мкл буфера FFPE (буфер FFPE, реагент для исследования, Siemens Healthcare Diagnostics) добавляли к каждому срезу и инкубировали в течение 30 минут при 80°C при встряхивании для плавления парафина. После охлаждения добавляли протеазу K и инкубировали в течение 30 минут при 65°C. После лизиса остаточный дебрис ткани удаляли из жидкости для лизиса с помощью стадии инкубации в течение 15 минут при 65°C с 40 мкл покрытых кремниземом гранул оксида железа. Гранулы со связанным с поверхностью дебрисом отделяли с помощью магнита и лизаты переносили в стандартный 2-мл планшет с глубокими лунками (96 лунок). В них тотальную РНК и ДНК связывали со 40 мкл неиспользованных гранул и инкубировали при комнатной температуре. Хаотропные условия получали путем добавления 600 мкл буфера для лизиса. Затем, гранулы подвергали магнитному разделению и супернатанты удаляли. После этого связанные с поверхностью нуклеиновые кислоты промывали три раза с последующим применением намагничивания, аспирирования и удаления супернатантов. После этого нуклеиновые кислоты элюировали путем инкубации гранул со 100 мкл буфера для элюирования в течение 10 минут при 70°C при встряхивании. Наконец, гранулы отделяли и супернатант инкубировали с 12 мкл смеси ДНКазы I (2 мкл ДНКазы I (без РНКазы); 10 мкл 10x буфера ДНКазы I; Ambion/Applied Biosystems, Darmstadt, Германия) для удаления контаминирующей ДНК. После инкубации в течение 30 минут при 37°C, не содержащий ДНК раствор тотальной РНК разделяли на аликвоты и хранили при-80°C, или непосредственно использовали для анализа экспрессии мРНК с помощью кинетической ПЦР с обратной транскрипцией (RTkPCR). Все образцы анализировали с помощью одностадийной ОТ-k-ПЦР в отношении экспрессии вплоть до трех эталонных генов (RPL37A, CALM2, OAZ1) и вплоть до 16 генов-мишеней в ABI PRISM® 7900HT (Applied Biosystems, Darmstadt, Германия). Систему для одностадийной количественной ОТ-ПЦР Superscript® III Platinum® с ROX (6-карбокси-X-родамин) (Invitrogen, Karlsruhe, Германия) использовали согласно инструкциям изготовителя. Соответствующие зонды и праймеры представлены в таблице 1. Условия ПЦР были следующими: 30 минут при 50°C, 2 минуты при 95°C, а затем 40 циклов по 15 секунд при 95°C и 30 секунд при 60°C. Все анализы ПЦР проводили в трех экземплярах. В качестве заместительного маркера для выхода РНК использовали пороговую (Ct) величину циклов для гена домашнего хозяйства RPL37A, как описано в литературе (17). Соответствующие уровни экспрессии генов-мишеней вычисляли способом дельта-Ct с использованием формулы:
20-(Ct(мишень)-среднее значение (Ct (эталонные гены))).
Перенос платформы с матриц Affymetrix HG U133a (свежезамороженная ткань) на количественную ПЦР в реальном времени (ткань FFPE) вычисляли следующим образом. Проводили измерение для материала от 158 пациентов с использованием обеих платформ с получением парных выборок. Из данных ПЦР вычисляли величины дельта-Ct. Из данных Affymetrix вычисляли Log2-выражения путем применения нижней границы (устанавливающей все величины ниже нижней границы как нижнюю границу), а затем вычисляя логарифм с основанием 2. Применение нижней границы снижает эффект увеличенного относительного шумового сигнала при измерении для генов/образцов с низкой экспрессией; использовали нижнюю границу 20, также пригодна нижняя граница от 0,1 до 200. Для каждого измеренного способом ПЦР гена был выбран набор зондов HG-U133a путем максимизации коэффициента корреляции Пирсона между величиной дельта-Ct (от ПЦР) и log2-выражением (от Affymetrix). Также пригодны другие меры корреляции, например, коэффициент корреляции Спирмана. В большинстве случаев наилучшим образом коррелирующий набор зондов принадлежал предполагаемому гену, для остальных случаев ПЦР-ген удаляли для дальнейшей обработки. Гены, демонстрирующие плохую корреляцию между платформами, также удаляли, где использовали порог коэффициента корреляции Пирсона, равный 0,7 (также пригодны величины от 0,5 до 0,8). Перенос платформы завершали вычислением не подвергавшихся контролю z-переходов для обеих платформ и комбинированием их; затем единую величину ПЦР-дельта-Ct трансформировали в шкалу Affymetrix с помощью следующих стадий: (i) применить аффинную линейную трансформацию, где коэффициенты определяют с помощью z-трансформации данных ПЦР, (ii) применить обратную аффинную линейную трансформацию, где коэффициенты определяли с помощью z-трансформации данных Affymetrix, (iii) инвертировать log2, т.е. вычислить экспоненциал по отношению к основанию 2. Альтернативами двукратным z-трансформациям являются линейная регрессия или регрессия более высокого порядка, устойчивая регрессия, или основные компонентные способы, которые также являются пригодными.
Последовательности праймеров и зондов были следующими:


В таблице 2 ниже представлены гены, использованные в способах по изобретению и в конкретных вариантах осуществления T5, T1, T4 и T5b. Также в таблице 2 показано, указывает ли сверхэкспрессия данного гена на хороший или плохой исход при терапии тамоксифеном. В таблице 2 приведена функция гена, компартментная локализация в клетке и клеточные процессы, в которые он вовлечен.
Перечень генов для алгоритмов T5, T1, T4 и T5b
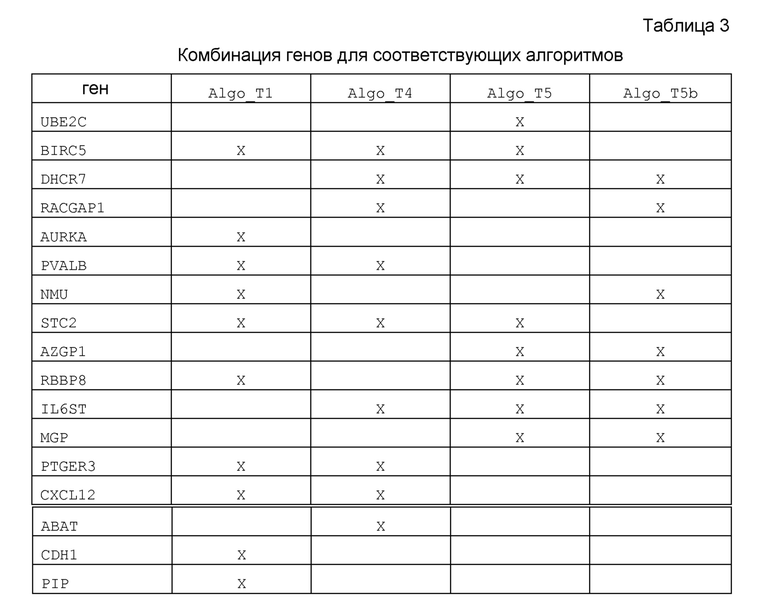
В таблице 3 ниже представлены комбинации генов, использованные для каждого алгоритма.
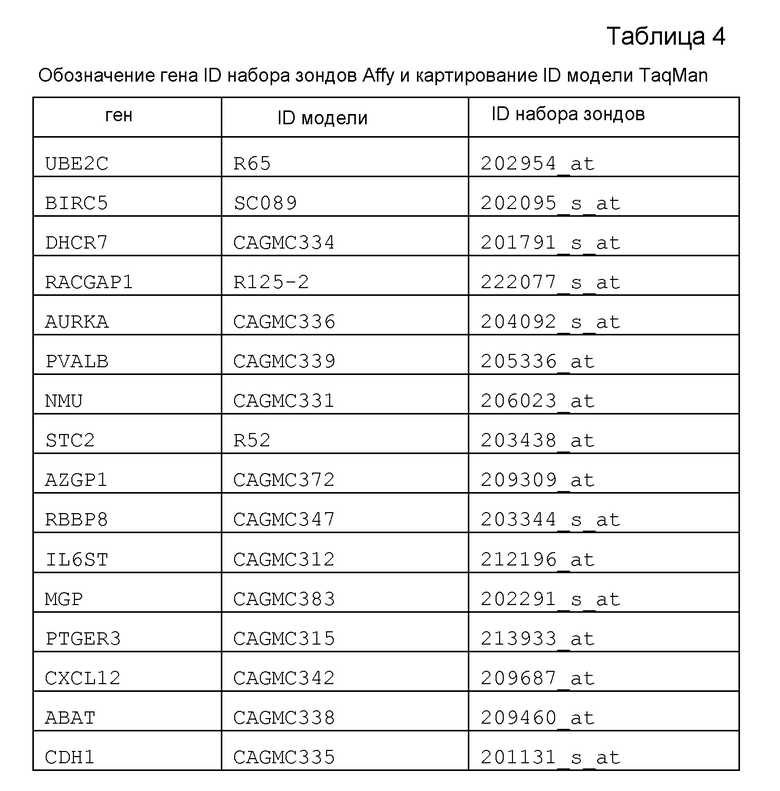
В таблице 4 ниже представлен ID набор зондов Affy и картирование ID модели TaqMan для маркерных генов по настоящему изобретению.
В таблице 5 ниже представлены полные названия, ID гена Entrez, номер доступа в gene bank и хромосомная область маркерных генов по настоящему изобретению.
Пример алгоритма T5:
Алгоритм T5 представляет собой группу из четырех членов, где каждый член представляет собой линейную комбинацию из двух генов. Математические формулы для T5 представлены ниже; обозначения являются такими же, как и для T1. T5 можно вычислять только из данных об экспрессии генов.
член 1 риска=0,434039 [0,301..0,567]*(0,939*BIRC5-3,831)
-0,491845 [-0,714..-0,270]*(0,707*RBBP8-0,934)
член 2 риска=0,488785 [0,302..0,675]*(0,794*UBE2C-1,416)
-0,374702 [-0,570..-0,179]*(0,814*IL6ST-5,034)
член 3 риска=-0,39169 [-0,541..-0,242]*(0,674*AZGP1-0,777)
+ 0,44229 [0,256..0,628]*(0,891*DHCR7-4,378)
член 4 риска=-0,377752 [-0,543..-0,212]*(0,485*MGP +4,330)
-0,177669 [-0,267..-0,088]*(0,826*STC2-3,630)
риск=член 1 риска+член 2 риска+член 3 риска+член 4 риска
Коэффициенты слева на каждой строке вычисляли в качестве коэффициентов регрессии пропорциональных рисков COX, числа в квадратных скобках обозначают 95% доверительные интервалы для этих коэффициентов. Иными словами, вместо умножения значения выражения (0,939*BIRC5-3,831) на 0,434039, оно может быть умножено на любой коэффициент между 0,301 и 0,567 и, тем не менее, будет давать предсказывающий результат с 95% доверительным интервалом. Значения выражений в круглых скобках справа в каждой строке обозначают перенос платформы с ПЦР на Affymetrix: переменные PVALB, CDH1,... обозначают основанную на ПЦР экспрессию, нормализованную к эталонным генам (величины дельта-Ct), полное значение выражения в круглых скобках соответствует логарифму (основание 2) величин экспрессии на микроматрице Affymetrix для соответствующих наборов зондов.
Эффективность алгоритма T5 тестировали у пациентов, которых лечили тамоксифеном или анастрозолом с не более чем 3 положительными лимфатическими узлами и ER+, HER2-опухолями, которые участвовали в рандомизированных клинических испытаниях ABCSG06 (n=332) или ABCSG08 (n=1244). Как представлено на фиг.1, регрессионный анализ Cox показывает, что показатель T5 имеет значимую ассоциацию с развитием отдаленного метастаза во всех протестированных группах.
Анализ Каплана-Мейера проводили после классификации пациентов объединенных групп ABCSG с использованием заданного предела для показателя T5.
Пациенты с низким риском развития отдаленного метастаза имели показатель T5≤-9,3, в то время как пациенты с высоким риском развития отдаленного метастаза имели показатель T5 выше-9,3. Как представлено на фиг.2, наблюдают высоко значимое разделение для обеих групп риска.
Важно, что показатель T5 оценивали и сравнивали против "Adjuvant! Online", интерактивного инструмента, помогающего выбрать терапию на основе введенных клинических параметров, таких как размер опухоли, степень опухоли и статус узлов. Когда показатель T5 тестировали с помощью регрессии Cox с двумя переменными против показателя риска рецидива в Adjuvant! Online, оба показателя сохраняли значимую ассоциацию с развитием отдаленных метастазов. Регрессия Cox с двумя переменными с использованием дихотомизированных данных, которые стратифицировали согласно T5 (предел-9,3), соответственно, относительно Adjuvant! Online (предел 8), вновь давала высоко значимые и независимые ассоциации со временем до метастаза в качестве клинического результата.
Регрессия Cox с двумя переменными для T5 и Adjuvant! Online
Иллюстративные кривые Каплана-Мейера представлены на фиг.1, где Высокий = группа высокого риска, Низкий = группа низкого риска, согласно заданному пределу.
Высокая величина показателя T5 указывает на увеличенный риск возникновения отдаленного метастаза в данный период времени.
Было показано, что это имеет место для пациентов, которых лечили тамоксифеном, а также для пациентов, которых лечили ингибиторами ароматазы.
Пример алгоритма T1:
Алгоритм T1 представляет собой группу из трех членов, где каждый член представляет собой линейную комбинацию из вплоть до четырех переменных. Как правило, переменные могут представлять собой экспрессию генов или клинические переменные. В T1 единственной не связанной с генами переменной является статус узлов, кодируемый 0, если пациент является отрицательным по узлам, и 1, если пациент является положительным по лимфатическим узлам. Математические формулы для T1 представлены ниже.
член 1 риска=+0,193935 [0,108..0,280]*(0,792*PVALB-2,189)
-0,240252 [-0,400..-0,080]*(0,859*CDH1-2,900)
-0,270069 [-0,385..-0,155]*(0,821*STC2-3,529)
+ 1,2053 [0,534..1,877]*статус узлов
член 2 риска=-0,25051 [-0,437..-0,064]*(0,558*CXCL12+0,324)
-0,421992 [-0,687..-0,157]*(0,715*RBBP8-1,063)
+0,148497 [0,029..0,268]*(1,823*NMU-12,563)
+0,293563 [0,108..0,479]*(0,989*BIRC5-4,536)
член 3 риска=+0,308391 [0,074..0,543]*(0,812*AURKA-2,656)
-0,225358 [-0,395..-0,055]*(0,637*PTGER3+0,492)
-0,116312 [-0,202..-0,031]*(0,724*PIP+0,985)
Риск = + член 1 риска + член 2 риска + член 3 риска
Коэффициенты слева на каждой строке вычисляли в качестве коэффициентов регрессии пропорциональных рисков COX, числа в квадратных скобках обозначают 95% доверительные интервалы для этих коэффициентов. Значения выражений в круглых скобках справа в каждой строке обозначают перенос платформы с ПЦР на Affymetrix: переменные PVALB, CDH1,... обозначают основанную на ПЦР экспрессию, нормализованную к эталонным генам (величины дельта-Ct), полное значение выражения в круглых скобках соответствует логарифму (основание 2) величин экспрессии на микроматрице Affymetrix для соответствующих наборов зондов.
Пример алгоритма T4:
Алгоритм T4 является линейной комбинацией мотивов. Верхние 10 генов нескольких анализов наборов данных Affymetrix и данных ПЦР объединяли в мотивы. Гены, не принадлежащие к кластеру, использовали в качестве мотивов одного гена. Коэффициенты регрессии пропорциональных рисков COX были найдены в многофакторном анализе.
Как правило, мотивы могут представлять собой экспрессию одного гена или среднюю экспрессию коррелирующих генов. Математические формулы для T4 представлены ниже.
prolif=((0,84 [0,697..0,977]*RACGAP1-2,174)+(0,85 [0,713..0,988]
*DHCR7-3,808)+(0,94 [0,786..1,089]*BIRC5-3,734))/3
мотив2=((0,83 [0,693..0,96]*IL6ST-5,295)+(1,11 [0,930..1,288]*
ABAT-7,019)+(0,84 [0,701..0,972]*STC2-3,857))/3
ptger3=(PTGER3*0,57 [0,475..0,659]+1,436)
cxcl12=(CXCL12*0,53 [0,446..0,618]+0,847)
pvalb=(PVALB*0,67 [0,558..0,774]-0,466)
Коэффициенты и отклонения для каждого гена обозначают перенос платформы с ПЦР на Affymetrix: Переменные RACGAP1, DHCR7,... обозначают основанную на ПЦР экспрессию, нормализованную к CALM2 и PPIA, полное значение выражения в круглых скобках соответствует логарифму (основание 2) величин экспрессии на микроматрице Affymetrix для соответствующих наборов зондов.
Числа в квадратных скобках обозначают 95% доверительные интервалы для этих коэффициентов. Поскольку алгоритм имел еще лучшие характеристики в комбинации с клинической переменной, добавляли статус узлов. В T4 статус узлов кодируется как 0, если пациент является отрицательным по лимфатическим узлам, и 1, если пациент является положительным по лимфатическим узлам. При этом алгоритм T4 представляет собой:
риск=-0,32 [-0,510..-0,137]*мотив 2
+0,65 [0,411..0,886]*prolif
-0,24 [-0,398..-0,08]*ptger3
-0,05 [-0,225..0,131]*cxcl12
+0,09 [0,019..0,154]*pvalb
+статус узлов
Коэффициенты риска вычисляли в качестве коэффициентов регрессии пропорциональных рисков COX, числа в квадратных скобках обозначают 95% доверительный интервал для этих коэффициентов.
Алгоритм T5b представляет собой группу из двух членов, где каждый член представляет собой линейную комбинацию из четырех генов. Математические формулы для T5b представлены ниже, обозначения являются такими же, как и для T1 и T5. В T5b не связанная с генами переменная представляет собой статус узлов, кодируемый 0, если пациент является отрицательным по лимфатическим узлам, и 1, если пациент является положительным по лимфатическим узлам, и 0,5, если статус лимфатических узлов неизвестен. T5b определяют как:
член 1 риска=0,359536 [0,153..0,566]*(0,891*DHCR7-4,378)
-0,288119 [-0,463..-0,113]*(0,485*MGP+4,330)
+0,257341 [0,112..0,403]*(1,118*NMU-5,128)
-0,337663 [-0,499..-0,176]*(0,674*AZGP1-0,777)
член 2 риска=-0,374940 [-0,611..-0,139]*(0,707*RBBP8-0,934)
-0,387371 [-0,597..-0,178]*(0,814*IL6ST-5,034)
+0,800745 [0,551..1,051]*(0,860*RACGAP1-2,518)
+0,770650 [0,323..1,219]*статус узлов
риск = член 1 риска + член 2 риска
Квалифицированному специалисту понятно, что эти алгоритмы отражают конкретные примеры, и что на основе информации, касающейся ассоциации экспрессии генов с исходом, как приведено в таблице 2, можно устанавливать альтернативные алгоритмы с использованием обычной квалификации.
Упрощение алгоритма с использованием подгрупп генов
"Пример алгоритма T5" представляет собой групповой предсказатель, состоящий из 4 членов по 2 представляющих интерес гена в каждом. Каждый член является независимым и самостоятельным предсказателем отдаленного рецидива, каждый дополнительный член вносит вклад в надежность и предсказательную мощность алгоритма для предсказания времени до метастаза, времени до гибели или вероятности выживания для пациента с раком молочной железы. Уравнение ниже демонстрирует "пример алгоритма T5"; для простоты прочтения количество разрядов после десятичного знака укорочено до 2; диапазон в квадратных скобках указывает на оцененный диапазон коэффициентов (среднее значение +/- 3 стандартных отклонения).
Алгоритм T5:
+0,41 [0,21..0,61]*BIRC5-0,33 [-0,57..-0,09]*RBBP8
+0,38 [0,15..0,61]*UBE2C-0,30 [-0,55..-0,06]*IL6ST
-0,28 [-0,43..-0,12]*AZGP1+0,42 [0,16..0,68]*DHCR7
-0,18 [-0,31..-0,06]*MGP-0,13 [-0,25..-0,02]*STC2
индексы c: исследуемая группа=0,724,
Названия генов в алгоритме обозначают разницу в экспрессии мРНК гена по сравнению с одним или несколькими генами домашнего хозяйства, как описано выше.
При анализе группы, отличающейся от исследуемой группы (234 образца опухоли) неожиданно было открыто, что некоторые упрощения "исходного алгоритма T5" все еще обеспечивали диагностическую эффективность, не являющуюся значительно более низкой относительно исходного алгоритма T5. Наиболее простым упрощением было уменьшение группового предсказателя только до одного члена. Примеры эффективности "групп из одного члена" представлены ниже:
только 1 член:
+0,41 [0,21..0,61]*BIRC5-0,33 [-0,57..-0,09]*RBBP8
индексы c: исследуемая группа=0,653, независимая группа=0,681
только 2 член:
+0,38 [0,15..0,61]*UBE2C-0,30 [-0,55..-0,06]*IL6ST
индексы c: исследуемая группа =0,664, независимая группа =0,696
только 3 член:
-0,28 [-0,43..-0,12]*AZGP1+0,42 [0,16..0,68]*DHCR7
индексы c: исследуемая группа=0,666, независимая группа=0,601
только 4 член:
-0,18 [-0,31..-0,06]*MGP-0,13 [-0,25..-0,02]*STC2
индексы c: исследуемая группа=0,668, независимая группа=0,593
Эффективность групп из одного гена, как представлено на независимой выборке из 234 образцов, значительно снижена по сравнению с эффективностью полного алгоритма. Тем не менее, использование группы, состоящей из меньшего числа членов, обеспечивает более простую, менее дорогостоящую оценку риска рецидива рака молочной железы, или смерти от рака молочной железы, которая может быть приемлема для определенных диагностических целей.
Последовательное комбинирование более одного, но менее четырех членов в новый групповой предсказательный алгоритм часто приводит к небольшому, но значимому увеличению диагностической эффективности по сравнению с группой из одного члена. Было неожиданно, что существовали выраженные улучшения для некоторых комбинаций групповых членов, в то время как другие комбинации не обеспечивали почти никакого улучшения. Первоначально, гипотеза состояла в том, что комбинация членов, соответствующих сходным биологическим мотивам, что отражалось используемыми генами, приводила к меньшему улучшению, чем комбинация членов, отражающих явно отличающиеся биологические мотивы. Тем не менее, дело было не в этом. Нельзя было идентифицировать правила для предсказания комбинации некоторых генов для получения алгоритма, обладающего большей прогностической мощностью, чем другая комбинация генов. Перспективные комбинации можно было выбрать только на основе экспериментальных данных.
Идентифицированные комбинации комбинированных групповых членов для получения упрощенных, но, тем не менее, мощных алгоритмов, представлены ниже.
только 1 и 2 члены:
+0,41 [0,21..0,61]*BIRC5-0,33 [-0,57..-0,09]*RBBP8
+0,38 [0,15..0,61]*UBE2C-0,30 [-0,55..-0,06]*IL6ST
индексы c: исследуемая группа =0,675, независимая группа=0,712
только 1 и 3 члены:
+0,41 [0,21..0,61]*BIRC5-0,33 [-0,57..-0,09]*RBBP8
-0,28 [-0,43..-0,12]*AZGP1+0,42 [0,16..0,68]*DHCR7
индексы c: исследуемая группа=0,697, независимая группа=0,688
только 1 и 4 члены:
+0,41 [0,21..0,61]*BIRC5-0,33 [-0,57..-0,09]*RBBP8
-0,18 [-0,31..-0,06]*MGP-0,13 [-0,25..-0,02]*STC2
индексы c: исследуемая группа =0,705, независимая группа=0,679
только 2 и 3 члены:
+0,38 [0,15..0,61]*UBE2C-0,30 [-0,55..-0,06]*IL6ST
-0,28 [-0,43..-0,12]*AZGP1+0,42 [0,16..0,68]*DHCR7
индексы c: исследуемая группа=0,698, независимая группа=0,670
только 1, 2 и 3 члены:
+0,41 [0,21..0,61]*BIRC5-0,33 [-0,57..-0,09]*RBBP8
+0,38 [0,15..0,61]*UBE2C-0,30 [-0,55..-0,06]*IL6ST
-0,28 [-0,43..-0,12]*AZGP1+0,42 [0,16..0,68]*DHCR7
индексы c: исследуемая группа=0,701, независимая группа=0,715
Исключение не полных членов группы, а отдельного гена или генов из различных членов группы также возможно, но это требует переподготовки всего алгоритма. Тем не менее, его также может быть преимущественно проводить. Эффективность упрощенных алгоритмов, полученных путем исключения целых членов или отдельных генов по большей части является идентичной.
Варианты алгоритмов с заменой генов
Описанные алгоритмы, такие как "пример алгоритма T5", выше, также можно модифицировать путем замены одного или нескольких генов одним или несколькими другими генами. Целью таких модификаций является замена генов, которые трудно измерить на конкретной платформе, геном, который проще анализировать на этой платформе. В то время как такой перенос необязательно может приводить к улучшенной эффективности по сравнению с исходным алгоритмом, он может обеспечивать ключ для внедрения прогностического алгоритма в конкретную диагностическую платформу. Как правило, замену одного гена другим геном при сохранении диагностической мощности предсказательного алгоритма можно наилучшим образом осуществлять путем замены одного гена коэкспрессируемым геном с высокой корреляцией (показанной, например, с помощью коэффициента корреляции Пирсона). Тем не менее, необходимо учитывать, что экспрессия мРНК двух генов высоко коррелирующая на одной платформе, может оказаться совершенно независимой между ними при оценке на другой платформе. Таким образом, такая казалось бы легкая замена при сведении к экспериментальной практике может приводить к неутешительно плохим результатам, а также к неожиданно значительным результатам, что всегда зависит от не поддающейся учету используемой платформы. Путем повторения этого процесса можно заменить несколько генов.
Эффективность такого подхода может быть продемонстрирована путем оценки предсказательной эффективности показателя алгоритма T5 и его варианта на группах для подтверждения. В представленной ниже таблице представлен индекс c в отношении конечного результата в виде отдаленного рецидива в двух группах для подтверждения.
Можно видеть, что исключение одного из генов T5, здесь представленное, например, для BIRC5 значительно снижает предсказательную эффективность. Замена его другим геном приводит приблизительно к такой же эффективности.
Лучшим способом замены гена является переподготовка алгоритма. Поскольку T5 состоит из четырех независимых членов группы, необходимо переподготовить только член, который содержит замененный ген. Представленные ниже уравнения демонстрируют замены генов алгоритма T5, представленные выше, подготовленные в группе из 234 пациентов с раком молочной железы. Ниже представлен только один член, для вычисления индекса c остальные члены использовали неизмененными по сравнению с исходным алгоритмом T5. В диапазоне в квадратных скобках приведен оцененный диапазон коэффициентов: среднее значение +/- 3 стандартных отклонения.
Член 1 T5:
Исходный член 1:
+0,41 [0,21..0,61]*BIRC5-0,33 [-0,57..-0,09]*RBBP8
индексы c: исследуемая группа =0,724, независимая группа=0,705
замена BIRC5 на TOP2A в члене 1:
+0,47 [0,24..0,69]*TOP2A-0,34 [-0,58..-0,10]*RBBP8
c индексы c: исследуемая группа =0,734, независимая группа=0,694
замена BIRC5 на RACGAP1 в члене 1:
+0,69 [0,37..1,00]*RACGAP1-0,33 [-0,57..-0,09]*RBBP8
индексы c: исследуемая группа =0,736, независимая группа=0,743
замена RBBP8 на CELSR2 в члене 1:
+0,38 [0,19..0,57]*BIRC5-0,18 [-0,41..0,05]*CELSR2
индексы c: исследуемая группа =0,726, независимая группа=0,680
замена RBBP8 на PGR в члене 1:
+0,35 [0,15..0,54]*BIRC5-0,09 [-0,23..0,05]*PGR
индексы c: исследуемая группа =0,727, независимая группа=0,731
Член 2 T5:
Исходный член 2:
+0,38 [0,15..0,61]*UBE2C-0,30 [-0,55..-0,06]*IL6ST
индексы c: исследуемая группа =0,724, независимая группа=0,725
замена UBE2C на RACGAP1 в члене 2:
+0,65 [0,33..0,96]*RACGAP1-0,38 [-0,62..-0,13]*IL6ST
индексы c: исследуемая группа =0,735, независимая группа=0,718
замена UBE2C на TOP2A в члене 2:
+0,42 [0,20..0,65]*TOP2A-0,38 [-0,62..-0,13]*IL6ST
индексы c: исследуемая группа =0,734, независимая группа=0,700
замена IL6ST на INPP4B в члене 2:
+0,40 [0,17..0,62]*UBE2C-0,25 [-0,55..0,05]*INPP4B
индексы c: исследуемая группа =0,725, независимая группа=0,686
замена IL6ST на MAPT в члене 2:
+0,45 [0,22..0,69]*UBE2C-0,14 [-0,28..0,01]*MAPT
индексы c: исследуемая группа =0,727, независимая группа=0,711
Член 3 T5:
Исходный член 3:
-0,28 [-0,43..-0,12]*AZGP1 +0,42 [0,16..0,68]*DHCR7
индексы c: исследуемая группа =0,724, независимая группа=0,705
замена AZGP1 на PIP в члене 3:
-0,10 [-0,18..-0,02]*PIP +0,43 [0,16..0,70]*DHCR7
индексы c: исследуемая группа =0,725, независимая группа=0,692
замена AZGP1 на EPHX2 в члене 3:
-0,23 [-0,43..-0,02]*EPHX2 +0,37 [0,10..0,64]*DHCR7
индексы c: исследуемая группа =0,719, независимая группа=0,698
замена AZGP1 на PLAT в члене 3:
-0,23 [-0,40..-0,06]*PLAT +0,43 [0,18..0,68]*DHCR7
индексы c: исследуемая группа =0,712, независимая группа=0,715
замена DHCR7 на AURKA в члене 3:
-0,23 [-0,39..-0,06]*AZGP1+0,34 [0,10..0,58]*AURKA
индексы c: исследуемая группа =0,716, независимая группа=0,733
Член 4 T5:
Исходный член 4:
-0,18 [-0,31..-0,06]*MGP-0,13 [-0,25..-0,02]*STC2
индексы c: исследуемая группа =0,724, независимая группа=0,705
замена MGP на APOD в члене 4:
-0,16 [-0,30..-0,03]*APOD-0,14 [-0,26..-0,03]*STC2
индексы c: исследуемая группа =0,717, независимая группа=0,679
замена MGP на EGFR в члене 4:
-0,21 [-0,37..-0,05]*EGFR-0,14 [-0,26..-0,03]*STC2
индексы c: исследуемая группа =0,715, независимая группа=0,708
замена STC2 на INPP4B в члене 4:
-0,18 [-0,30..-0,05]*MGP-0,22 [-0,53..0,08]*INPP4B
индексы c: исследуемая группа =0,719, независимая группа=0,693
замена STC2 на SEC14L2 в члене 4:
-0,18 [-0,31..-0,06]*MGP-0,27 [-0,49..-0,06]*SEC14L2
индексы c: исследуемая группа =0,718, независимая группа =0,681
Можно видеть, что замена отдельных генов, экспериментально идентифицированных для количественного определения с помощью кинетической ПЦР, обычно влияет на предсказательную эффективность алгоритма T5, оцененного с помощью индекса c, только незначительно.
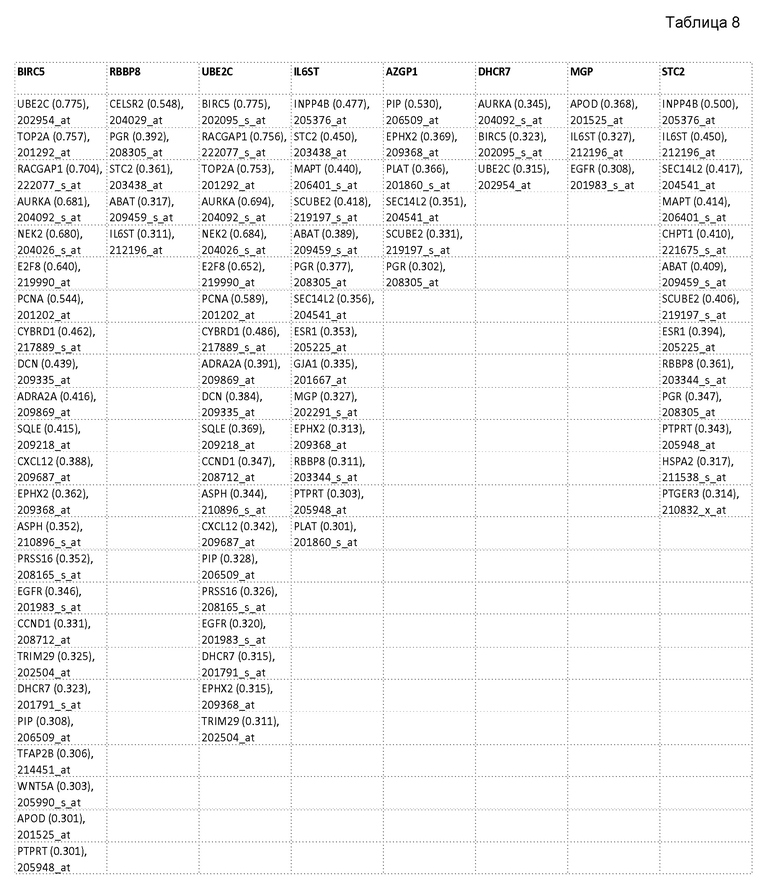
В следующей таблице (таблица 8) представлена потенциальная замена генов-кандидатов для генов в алгоритме T5. Каждый ген-кандидат представлен в одной ячейке таблицы: за названием гена следует заключенный в скобки абсолютный коэффициент корреляции Пирсона для экспрессии исходного гена в алгоритме T5 и кандидата для замены, и ID набора зондов HG-U133A.
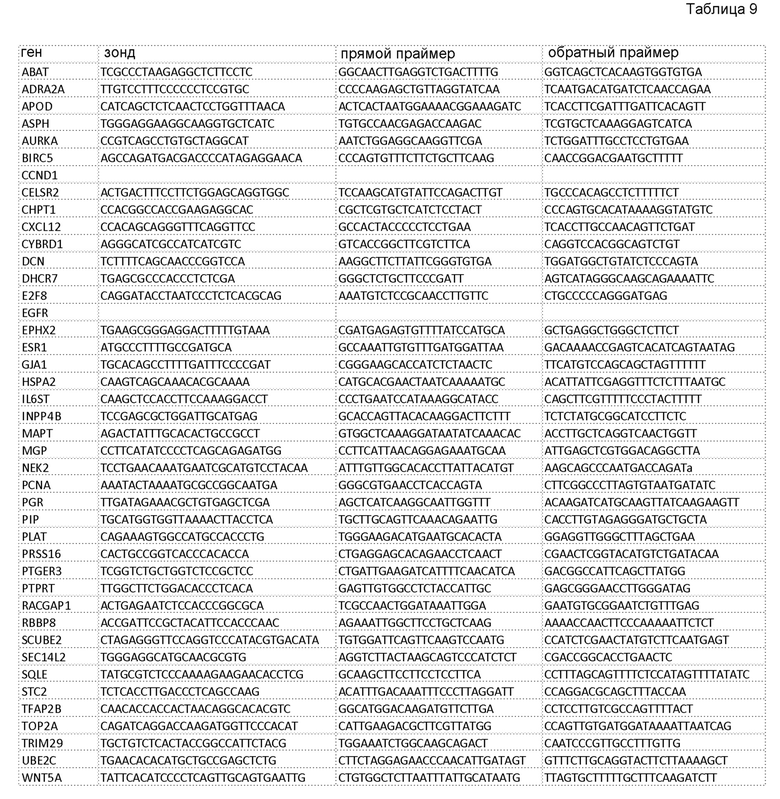
В представленной ниже таблице (таблица 9) приведены последовательности праймеров и зондов для q-ОТ-ПЦР, использованные для представленной выше таблицы.
Вторая альтернатива для неконтролируемого выбора возможных генов-кандидатов для замены основана только на данных Affymetrix. Это имеет преимущество, что его можно проводить только на основе уже опубликованных данных (например, из www.ncbi.nlm.nih.gov/geo/). В представленной ниже таблице (таблица 10) приводятся кандидаты для замены наборов зондов HG-U133a, использованных в алгоритмах T1-T5. Это основано на подготовительных данных этих алгоритмов. Заголовок столбца содержит название генов и ID набора зондов полужирным шрифтом. Затем приведены 10 наилучшим образом коррелирующих наборов зондов, где каждая ячейка таблицы содержит ID набора зондов, коэффициент корреляции в скобках и название гена.
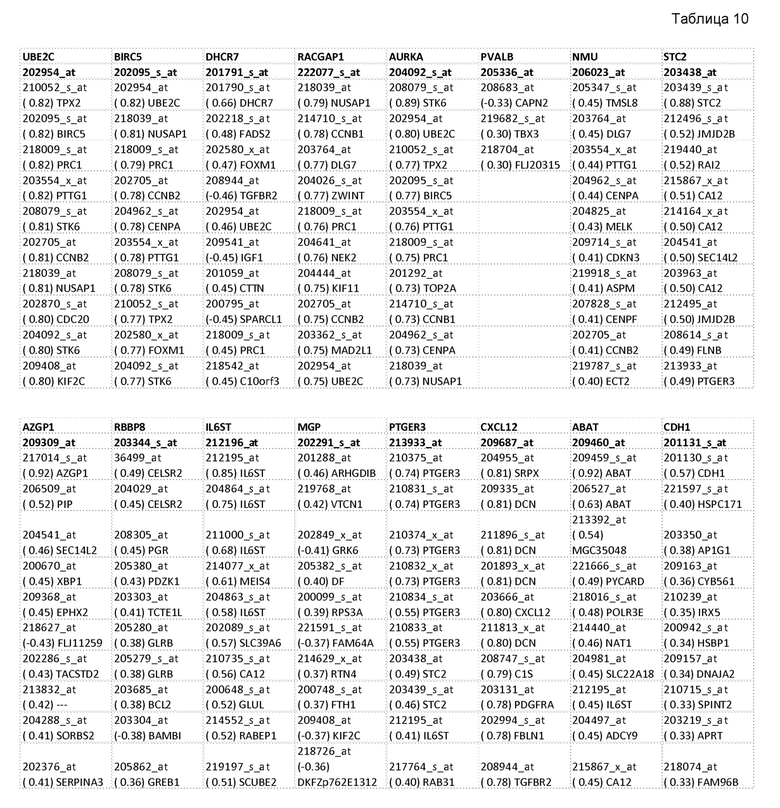
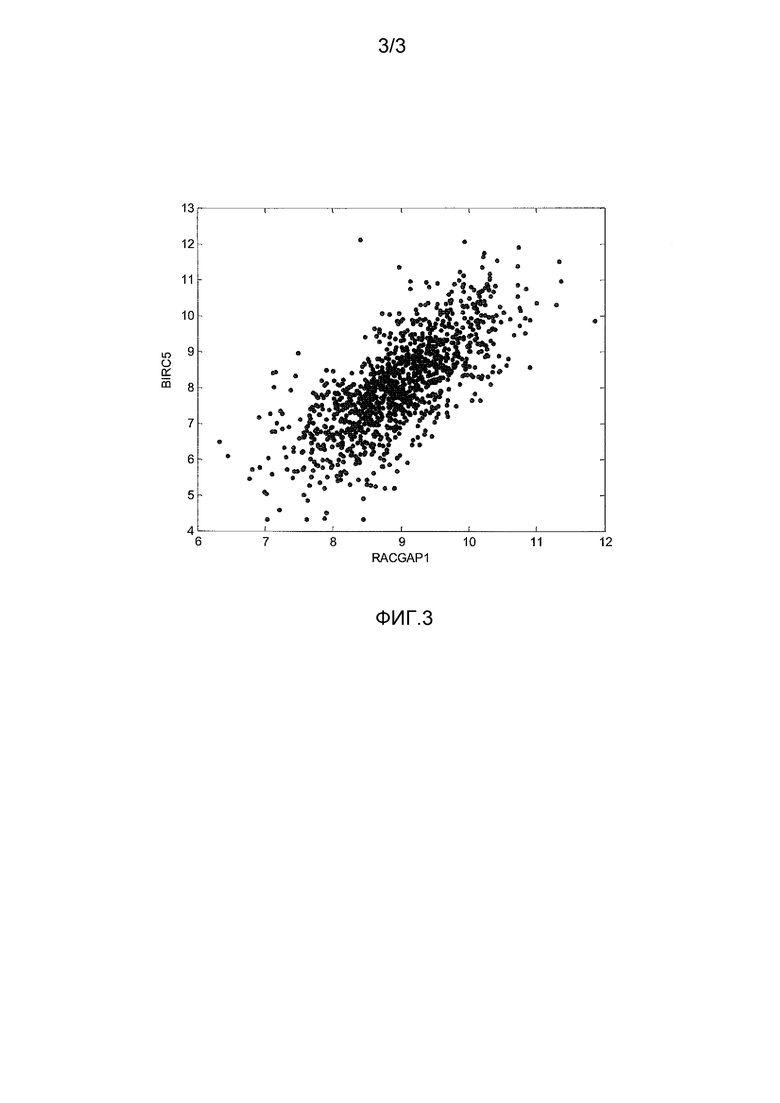
После выбора гена или набора зондов необходимо определить математическое картирование между величинами экспрессии гена для замены и величинами экспрессии нового гена. Существует несколько альтернатив, которые обсуждаются в настоящем описании на основе примера "величин дельта-Ct для замены BIRC5 на RACGAP1". В подготовительных данных совместное распределение для экспрессии сходно с фигурой 3.
Коэффициент корреляции Пирсона равен 0,73.
Одним подходом является создание функции картирования от RACGAP1 к BIRC5 с помощью регрессии. Линейная регрессия является первым выбором и результатом в этом примере
BIRC5=1,22*RACGAP1-2,85.
С использованием этого уравнения можно легко заменить переменную BIRC5, например, в алгоритме T5 правой частью. В других примерах может быть достаточно устойчивой регрессии, полиномиальной регрессии или одномерных нелинейных пре-преобразований.
Регрессионный метод предполагает измерение шумового сигнала на BIRC5, но без шумового сигнала на RACGAP1. Таким образом, картирование не является симметричным в отношении взаимозаменяемости двух переменных. Подход симметричного картирования основан на двух одномерных z-преобразованиях.
z=(BIRC5-среднее значение (BIRC5))/std(BIRC5) и
z=(RACGAP1-среднее значение (RACGAP1))/std (RACGAP1)
z=(BIRC5-8,09)/1,29=(RACGAP1-8,95)/0,77
BIRC5=1,67*RACGAP1+-6,89
Вновь, в других примерах могут быть достаточными другие преобразования: нормализация по медиане и/или среднему абсолютному отклонению, нелинейные картирования или другие.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ПРОГРЕССИРОВАНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ НА ФОНЕ ТАМОКСИФЕНА С УЧЕТОМ ЭКСПРЕССИОННЫХ ОСОБЕННОСТЕЙ ОПУХОЛИ | 2023 |
|
RU2823488C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПО УРОВНЮ мРНК TGEβ и TNFα В ПЛАЗМЕ КРОВИ | 2019 |
|
RU2742209C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ И РАКА ЯИЧНИКОВ ПО УРОВНЮ мРНК ММР-9 В ПЛАЗМЕ КРОВИ | 2020 |
|
RU2745424C1 |
| СПОСОБЫ И НАБОРЫ ДЛЯ МОЛЕКУЛЯРНОГО СУБТИПИРОВАНИЯ ОПУХОЛЕЙ | 2014 |
|
RU2690241C2 |
| Способ диагностики светлоклеточного почечно-клеточного рака | 2016 |
|
RU2643586C1 |
| Способ прогнозирования ранних рецидивов светлоклеточной карциномы тела матки | 2022 |
|
RU2784775C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ РЕЦИДИВОВ У БОЛЬНЫХ РАКОМ ТЕЛА МАТКИ НА ОСНОВАНИИ УРОВНЯ ЭКСПРЕССИИ ГЕНА ESR1 | 2017 |
|
RU2661599C1 |
| Способ персонализации медицинской помощи пациентам с раком желудка | 2019 |
|
RU2713907C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ТЕРАПИИ РАКА МОЧЕВОГО ПУЗЫРЯ ЧЕЛОВЕКА МЕТОДОМ ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 2011 |
|
RU2468088C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ВЕРОЯТНОСТИ РЕЦИДИВИРОВАНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2609199C2 |




















Изобретение относится к области биохимии, в частности к способу предсказания исхода рака молочной железы в положительной по рецептору эстрогена и отрицательной по HER2 опухоли у пациента с раком молочной железы, предусматривающему определение в образце опухоли от указанного пациента величины уровня экспрессии РНК генов UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP или генов UBE2C, RACGAP1, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP, математическое комбинирование величин уровней экспрессии, где более высокий комбинированный показатель указывает на более худший прогноз у указанного пациента по сравнению с более низким комбинированным показателем. Изобретение позволяет эффективно предсказывать исход рака молочной железы. 2 н. и 8 з.п. ф-лы, 3 ил., 10 табл.
1. Способ предсказания исхода рака молочной железы в положительной по рецептору эстрогена и отрицательной по HER2 опухоли у пациента с раком молочной железы, причем указанный способ включает:
(a) определение в образце опухоли от указанного пациента величины уровня экспрессии РНК следующих 8 генов: UBE2C, BIRC5, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP;
(b) математическое комбинирование величин уровней экспрессии с помощью формулы:
комбинированный показатель =
+0.41 [0.21..0.61] * BIRC5 -0.33 [-0.57..-0.09] * RBBP8 +0.38 [0.15..0.61] * UBE2C -0.30 [-0.55..-0.06] * IL6ST -0.28 [-0.43..-0.12] * AZGP1 +0.42 [0.16..0.68] * DHCR7 -0.18 [-0.31..-0.06] * MGP -0.13 [-0.25..-0.02] * STC2 ,
где BIRC5, RBBP8, UBE2C, IL6ST, AZGP1, DHCR7, MGP и STC2 представляют собой величины уровней экспрессии соответствующих генов, определенных на этапе (а), числа перед квадратными скобками представляют собой коэффициенты для указанных величин, а числа в квадратных скобках представляют собой доверительные интервалы для указанных коэффициентов,
и где более высокий комбинированный показатель указывает на более худший прогноз у указанного пациента по сравнению с более низким комбинированным показателем.
2. Способ предсказания исхода рака молочной железы в положительной по рецептору эстрогена и отрицательной по HER2 опухоли у пациента с раком молочной железы, причем указанный способ включает:
(a) определение в образце опухоли от указанного пациента величины уровня экспрессии РНК следующих 8 генов: UBE2C, RACGAP1, DHCR7, STC2, AZGP1, RBBP8, IL6ST и MGP;
(b) математическое комбинирование величин уровней экспрессии с помощью формулы:
комбинированный показатель =
+0.69 [0.37..1.00] * RACGAP1 -0.33 [-0.57..-0.09] * RBBP8 +0.38 [0.15..0.61] * UBE2C -0.30 [-0.55..-0.06] * IL6ST -0.28 [-0.43..-0.12] * AZGP1 +0.42 [0.16..0.68] * DHCR7 -0.18 [-0.31..-0.06] * MGP -0.13 [-0.25..-0.02] * STC2 ,
где RACGAP1, RBBP8, UBE2C, IL6ST, AZGP1, DHCR7, MGP и STC2 представляют собой величины уровней экспрессии соответствующих генов, определенных на этапе (а), числа перед квадратными скобками представляют собой коэффициенты для указанных величин, а числа в квадратных скобках представляют собой доверительные интервалы для указанных коэффициентов,
и где более высокий комбинированный показатель указывает на более худший прогноз у указанного пациента по сравнению с более низким комбинированным показателем.
3. Способ по п. 1 или 2, где комбинированный показатель > -9,3 указывает на высокий риск развития отдаленного метастаза, а комбинированный показатель ≤ -9,3 указывает на низкий риск отдаленного метастаза, посредством чего указанный комбинированный показатель используется для предсказания исхода рака молочной железы в положительной по рецептору эстрогена и отрицательной по HER2 опухоли у пациента с раком молочной железы.
4. Способ по п.1 или 2, где указанному пациенту проведена эндокринная терапия, или ему предполагают проводить эндокринную терапию.
5. Способ по п.4, где указанная эндокринная терапия включает тамоксифен или ингибитор ароматазы.
6. Способ по п.1 или 2, где предсказывают риск развития рецидива рака молочной железы или связанной с раком смерти.
7. Способ по п.1 или 2, где указанную величину уровня экспрессии определяют как величину уровня экспрессии матричной РНК.
8. Способ по п.1 или 2, где указанную величину уровня экспрессии определяют с помощью по меньшей мере одного из:
способа на основе ПЦР,
способа на основе микроматрицы и
способа на основе гибридизации.
9. Способ по п. 1 или 2, где указанное определение величины уровня экспрессии проводят в фиксированном в формалине погруженном в парафин образце опухоли или в свежезамороженном образце опухоли.
10. Способ по п. 1 или 2, где указанную величину уровня экспрессии по меньшей мере одного маркерного гена определяют в качестве профиля экспрессии относительно по меньшей мере одного эталонного гена или относительно вычисленной средней величины экспрессии.
| WO2006119593 A1, 16.11.2006 | |||
| WO2009158143 A1, 30.12.2009 | |||
| WO2010003773 A1, 01.14.2010 | |||
| ДВУХСЛОЙНЫЙ ТРИКОТАЖ | 2000 |
|
RU2163649C1 |
| CHANRION M | |||
| ET AL., A gene expression signature that can predict the recurrence of tamoxifen-treated primary breast cancer.", CLINICAL CANCER, 2008, v | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Способ обработки прорезиненных тканей с целью повышения их газонепроницаемости | 1923 |
|
SU1744A1 |
| ДВИГАТЕЛЬ ДИЗЕЛЯ ДЛЯ ТЕПЛОВОЗА | 1926 |
|
SU6512A1 |
Авторы
Даты
2018-05-21—Публикация
2011-03-29—Подача