Настоящее изобретение относится к производным 1-[(индол-3-ил)карбонил]пиперазина, к фармацевтическим композициям, содержащим данные производные, и к применению указанных производных 1-[(индол-3-ил)карбонил]пиперазина в качестве агонистов каннабиноидного рецептора для лечения боли и других нарушений.
Производные 1-[(индол-3-ил)карбонил]пиперазина известны как соединения, обладающие интересными фармакологическими свойствами. Производные 1-[(индол-3-ил)карбонил]пиперазина с незамещенным атомом азота в индольном кольце раскрыты в WO9806715 (SmithKlineBeecham Corp.) как противовоспалительные средства. Родственные производные 1-[(индол-3-ил)карбонил]пиперазина, которые могут быть замещены по атому азота индольного кольца, раскрыты в WO0143746 (Nippon Shinyaku Co.) как соединения, обладающие противовоспалительной и нефротропной активностью.
Производные 1-[(1-бензилиндол-3-ил)карбонил]пиперазина раскрыты в исследованиях по антагонистам рецептора Н1 (Battaglia, S. et al. Eur. J. Med. Chem. 34, 93-105, 1999) и противовоспалительным средствам (Duflos, M. et al. Eur. J. Med. Chem. 36, 545-553, 2001); в обоих исследованиях обнаружено, что они обладают относительно низкой активностью. Недавно в WO0158869 (Bristol-Myers Squibb) было описано, что производные 1-[(индол-3-ил)карбонил]пиперазина в целом являются активными модуляторами каннабиноидного рецептора и как таковые могут применяться для лечения респираторных заболеваний. Но в данной патентной заявке не были раскрыты конкретные производные 1-[(индол-3-ил)карбонил]пиперазина.
Лечение боли часто ограничивается побочными эффектами имеющихся в настоящее время лекарственных средств. Для ослабления тяжелой боли широко используются опиоиды. Это дешевые и эффективные средства, но они обладают серьезными побочными эффектами, представляющими угрозу для жизни, наиболее значительными из них являются угнетение дыхания и окостенение мышечной ткани. Кроме того, для пациентов, которые предпочитают, чтобы подавление боли было субоптимальным, чем страдать от мучительных побочных эффектов, вводимые дозы опиоидов ограничиваются из-за вызываемых ими таких эффектов, как тошнота, рвота, констипация, зуд и задержка мочевыделения. Указанные побочные эффекты также часто приводят к удлинению сроков госпитализации пациентов. Опиоиды вызывают сильное привыкание и во многих странах внесены в список наркотиков. Следовательно, существует потребность в новых обезболивающих средствах, которые имеют улучшенный профиль побочных эффектов по сравнению с использующимися в настоящее время продуктами, при применении в дозах, оказывающих одинаковый обезболивающий эффект.
Накапливаются данные, свидетельствующие о том, что агонисты каннабиноидных рецепторов могут служить обезболивающими и противовоспалительными средствами. Существует два типа каннабиноидных рецепторов, каннабиноидный рецептор CB1, который преимущественно локализован в центральной нервной системе, но который также экспрессируется в периферических нейронах и, в меньшей степени, в других периферических тканях, и каннабиноидный рецептор CB2, который главным образом локализован в иммунных клетках (Howlett, A. C. et al.: International Union of Pharmacology. XXVII. Classification of Cannabinoid Receptors Pharmacol, Rev. 54, 161-202, 2002). Хотя рецептор CB2 участвует в модуляции иммунного и противовоспалительного ответа на каннабиноиды, недавно было высказано предположение, что агонисты каннабиноидного рецептора, особенно рецептора CB1, могут применяться при лечении боли (Iversen, L. and Chapman, V.: Cannabinoids: a real prospect for pain relief? Current Opinion in Pharmacology, 2, 50-55, 2002 and references therein). Агонисты каннабиноидных рецепторов, такие как CP 55940 и WIN 55212-2, оказывают мощное антиноцицептическое действие с такой же эффективностью, как морфин, на животных моделях острой боли, устойчивой воспалительной боли и невропатической боли. Известные каннабиноидные агонисты в основном являются высоколипофильными и не растворяются в воде. Следовательно, существует потребность в агонистах каннабиноидных рецепторов с улучшенными свойствами в качестве терапевтических средств.
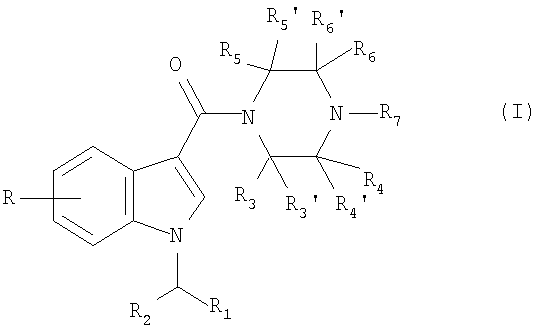
С данной точки зрения, настоящее изобретение предлагает производные 1-[(индол-3-ил)карбонил]пиперазина, имеющие общую формулу I,
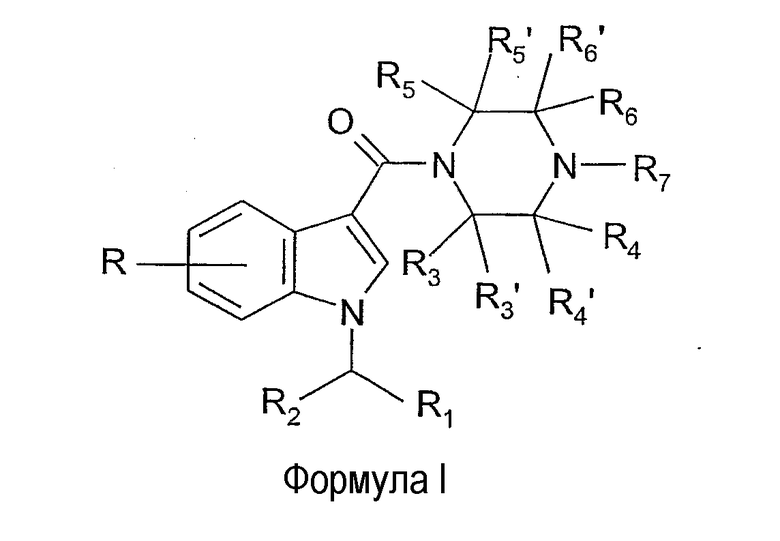
где
R обозначает 1-4 заместителя, независимо выбранных из H, (C1-4)алкила (необязательно замещенного галогеном),
(C1-4)алкилокси (необязательно замещенного галогеном), галогена, OH, NH2, CN и NO2;
R1 обозначает (C5-8)циклоалкил или (C5-8)циклоалкенил;
R2 обозначает H, метил или этил;
R3, R3', R4, R4', R5, R5' и R6' независимо обозначают водород или (C1-4)алкил, необязательно замещенный (C1-4)алкилокси, галогеном или OH;
R6 обозначает водород или (C1-4)алкил, необязательно замещенный (C1-4)алкилокси, галогеном или OH;
R6 вместе с R7 образует 4-7-членное насыщенное гетероциклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O и S;
R7 вместе с R6 образует 4-7-членное насыщенное гетероциклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O и S; или
R7 обозначает H, (C1-4)алкил или (C3-5)циклоалкил, причем алкильные группы необязательно замещены OH, галогеном или (C1-4)алкилокси; или
их фармацевтически приемлемые соли в качестве агонистов каннабиноидного рецептора 1, которые, следовательно, могут применяться для лечения боли, такой как, например, пери-операционная боль, хроническая боль, невропатическая боль, раковая боль, а также боль и спастичность, связанные с рассеянным склерозом.
Соединения данного изобретения в целом описаны в WO 0158869 (см. выше) как модуляторы каннабиноидных рецепторов, используемые для лечения респираторных заболеваний. Данные модуляторы в указанной публикации предпочтительно идентифицируются как модуляторы CB2. Большинство соединений, раскрытых в WO0158869, характеризуются наличием 2-(4-морфолинил)этильной боковой цепи в 1 положении индольного или индазольного ядра. Производные 1-[(индол-3-ил)карбонил]пиперазина данного изобретения отличаются от соединений, описанных в WO0158869, тем, что они содержат в соответствующем положении циклопентилметильную или циклогексилметильную боковую цепь, которая, в отличие от 2-(4-морфолинил)этильной или бензильной боковой цепи, придает соединениям агонистическую активность по отношению к рецепторам CB1.
Термин (C1-4)алкил, используемый в определении формулы I, обозначает разветвленную или неразветвленную алкильную группу, содержащую 1-4 атома углерода, такую, как бутил, изобутил, третичный бутил, пропил, изопропил, этил и метил.
В термине (C1-4)алкилокси (C1-4)алкил имеет определенное выше значение.
Термин (C5-8)циклоалкил обозначает насыщенную циклическую алкильную группу, содержащую 5-8 атомов углерода, и, следовательно, он может включать в себя такие соединения, как циклопентил, циклогексил, циклогептил или циклооктил.
Предпочтительными (C5-8) циклоалкильными группами являются циклопентил и циклогексил.
Термин (C5-8)циклоалкенил обозначает циклическую алкенильную группу, содержащую 5-8 атомов углерода и, по меньшей мере, одну двойную связь, например, циклопент-3-енил или циклогекс-3-енил.
Термин галоген обозначает F, Cl, Br или I.
В определении формулы I R6 вместе с R7 образуют 4-7-членное насыщенное гетероциклическое кольцо, это означает, что R6, вместе с атомом углерода, с которым он связан, и R7, вместе с атомом азота, с которым он связан, образуют 4-7-членное насыщенное кольцо, например, азетидиновое, пирролидиновое, пиперидиновое или 1H-азепиновое кольцо. Такие кольца могут дополнительно содержать гетероатомы O или S, образуя такие кольца, как морфолиновое, пиперазиновое, гомопиперазиновое, имидазолидиновое или тетрагидротриазольное.
Предпочтительными являются производные 1-[(индол-3-ил)карбонил]пиперазина формулы I, где R2 обозначает H, и R1 обозначает циклопентильную или циклогексильную группу.
Более предпочтительными являются соединения формулы I, где, в добавление к вышесказанному, R обозначает (C1-4)алкилокси или галоген, тогда как еще более предпочтительными являются производные 1-[(индол-3-ил)карбонил]пиперазина данного изобретения, где R обозначает метоксильную группу в 7 положении индольного кольца.
Особенно предпочтительными являются производные 1-[(индол-3-ил)карбонил]пиперазина формулы I, где R3, R3', R4', R5, R5' и R6' обозначают H; R4, R6 и R7 независимо обозначают H или (C1-4)алкил; или R6 вместе с R7 образуют 5- или 6-членное насыщенное гетероциклическое кольцо, а R4 обозначает H или (C1-4)алкил.
Конкретными предпочтительными агонистами рецепторами CB-1 данного изобретения являются:
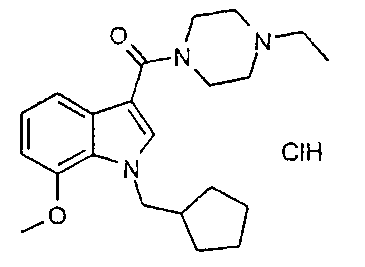
1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,5-диметил-4-этилпиперазин;
1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,4,5-триметилпиперазин;
(S)-1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,4-диметилпиперазин;
(S)-2-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}отагидро-2H-пиридо-2H-пиридо[1,2-a]пиразин;
(S)-2-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-октагидро-2H-пирроло-[1,2-a]пиразин; и
(S)-2-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-октагидро-2H-пиридо-[1,2-a]пиразин; или их фармацевтически приемлемые соли.
Производные 1-[(индол-3-ил)карбонил] пиперазина данного изобретения можно получить с помощью способов, в общем, известных в области органической химии. Более конкретно, такие соединения можно получить с помощью способов, описанных C. J. Swain et al (J. Med. Chem. 34, 140-151, 1991) и P. E. Peterson, J. P. Wolf III и C. Niemann (J. Org. Chem. 23, 303-304, 1958), или с помощью модификаций данных способов.
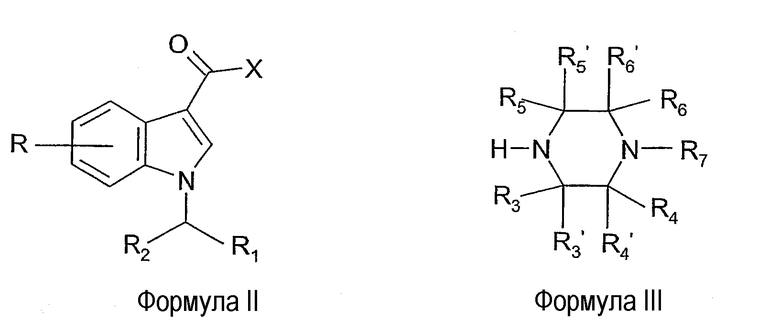
1-[(Индол-3-ил)карбонил]пиперазины формулы I, например, можно получить конденсацией соединения формулы II, где R1, R2 и R имеют указанные выше значения, а C(O)X обозначает карбоновую кислоту или ее активированное производное, например, галогенангидрид карбоновой кислоты, предпочтительно, хлорангидрид или бромангидрид, с соединением формулы III, где R3-R7 имеют указанные выше значения. Если C(O)X обозначает карбоновую кислоту (т.е. X обозначает гидроксильную группу), реакцию конденсации можно проводить с помощью конденсирующего реагента, такого как, например, карбонилдиимидазол, дициклогексилкарбодиимид и т.п., в таком растворителе, как диметилформамид или дихлорметан.
Если C(O)X обозначает галогенангидрид карбоновой кислоты (т.е., X обозначает галоген), конденсацию с содержащим аминогруппу производным формулы III можно проводить в присутствии основания, например, триэтиламина, в таком растворителе, как дихлорметан.
Соединения формулы III можно получить из коммерческих источников, кроме того, их можно получить с помощью описанных в литературе способов или модификаций этих способов, известных специалистам в данной области. Например, соединения формулы III можно получить восстановлением дикетопиперазина при помощи такого восстанавливающего реагента, как гидрид лития алюминия или комплекс боран-тетрагидрофуран, как описано M. E. Jung и J. C. Rohloff (J. Org. Chem. 50, 4909-4913, 1985). Дикетопиперазины можно получить разными способами, как описано C. J. Dinsmore и D. C. Bershore (Tetrahedron 58, 3297-3312, 2002).
Соединения формулы II можно получить взаимодействием соединения формулы IV, где R имеет указанное выше значение, с соединением формулы V, где R1 и R2 имеют указанные выше значения, а Y обозначает уходящую группу, например, галогенид или алкилсульфонат, в присутствии основания, например, гидрида натрия. При желании, карбоновую кислоту можно превратить в галогенангидрид карбоновой кислоты, например, хлорангидрид карбоновой кислоты, при помощи такого реагента, как оксалилхлорид.
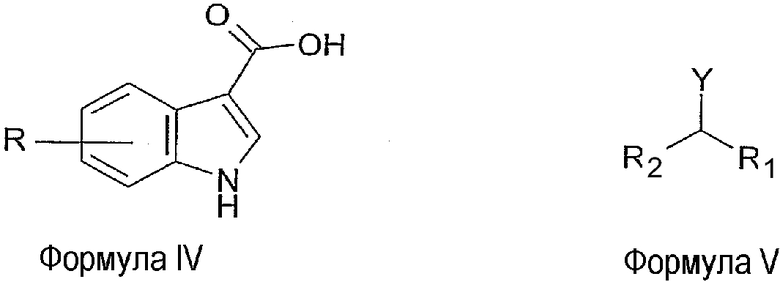
Соединения формулы V можно получить из коммерческих источников, кроме того, их можно получить с помощью описанных в литературе способов или модификаций этих способов, известных специалистам в данной области.
Например, соединения формулы V, где Y обозначает пара-толуолсульфонат, можно получить из соединений формулы V, где Y обозначает гидроксил, с помощью способа, описанного B.Torok et al (J. Chem. Soc. Perkin Trans. 1, 801-804, 1993). Соединения формулы V, где Y обозначает гидроксил, а R2 обозначает водород, можно получить восстановлением карбоновой кислоты или эфира карбоновой кислоты при помощи такого восстанавливающего реагента, как комплекс боран-тетрагидрофуран или гидрид лития алюминия.
Соединения формулы IV можно получить из соединений формулы VI ацилированием по 3 положению при помощи ацилирующего реагента. Например, соединения формулы IV можно получить из соединений формулы VI путем обработки их трифторуксусным ангидридом в таком растворителе, как диметилформамид, с последующим гидролизом в водном растворе гидроксида натрия при повышенной температуре.
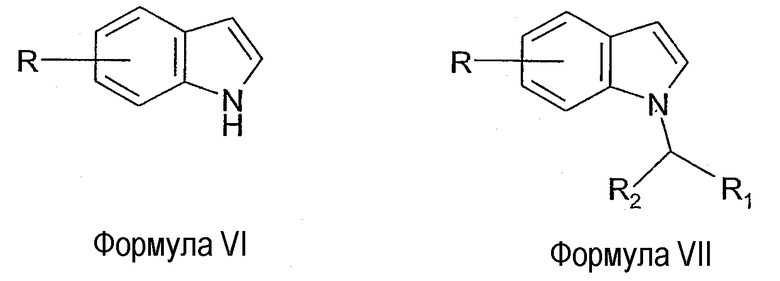
Соединения формулы VI можно получить из коммерческих источников, кроме того, их можно получить с помощью описанных в литературе способов или модификаций этих способов, известных специалистам в данной области.
Альтернативно соединения формулы II можно получить ацилированием соединения формулы VII при помощи ацилирующего реагента. Например, соединения формулы II, где X обозначает хлорид, можно получить взаимодействием соединения формулы V с оксалилхлоридом в таком растворителе, как 1,1,2,2-тетрахлорэтан, с последующей перегруппировкой при повышенной температуре.
Соединения формулы VII можно получить взаимодействием соединения формулы VI с соединением формулы V в присутствии такого основания, как гидрид натрия.
Опытному специалисту также известно, что производные 1-[(индол-3-ил)карбонил]пиперазина формулы I можно получить с помощью подходящих реакций превращения функциональных групп, соответствующих некоторым заместителям R и R1-R7. Например, соединения формулы I, где R7 обозначает (C1-4)алкил или
(C3-5)циклоалкил, алкильные группы которых могут быть замещены OH, галогеном или (C1-4)алкилокси, можно получить взаимодействием соединения формулы I, где R7 обозначает водород, с
(C1-4)алкилгалогенидом или функционализированным
(C1-4)алкилгалогенидом, содержащим функциональные группы, в присутствии основания, например, карбоната калия.
Соединения формулы I, где R обозначает (C1-4)алкилокси или функционализированный (C1-4)алкилокси, можно получить взаимодействием соединения формулы I, где R обозначает гидроксильную группу, с (C1-4)алкилгалогенидом или функционализированным (C1-4)алкилгалогенидом, в присутствии основания, например, гидрида натрия.
Соединения формулы I, где R обозначает NH2, можно получить взаимодействием соединения формулы I, где R обозначает нитрогруппу, с восстанавливающим реагентом, таким как водород/палладий на активированном угле.
Производные 1-[(индол-3-ил)карбонил]пиперазина формулы I и их соли могут содержать, по меньшей мере, один хиральный центр и, следовательно, могут существовать в виде стереоизомеров, в том числе энантиомеров и диастереомеров. В объем настоящего изобретения входят вышеупомянутые стереоизомеры и каждый из индивидуальных R и S энантиомеров соединения формулы I и их соли, по существу в чистом виде, т.е. содержащие менее 5%, предпочтительно менее 2%, в особенности, менее 1% другого энантиомера, а также смеси таких энантиомеров в любых соотношениях, в том числе рацемические смеси, содержащие по существу равные количества двух энантиомеров.
Способы асимметричного синтеза, приводящие к получению чистых стереоизомеров, хорошо известны в данной области, например, синтез, в результате которого происходит образование соединения с хиральным центром, или синтез, в котором исходные соединения имеют хиральные центры, энантиоселективные ферментативные превращения, разделение стереоизомеров или энантиомеров методом хроматографии на хиральном носителе. Такие способы описаны, например, в Chirality in Industry (edited by A. N. Collins, G. N. Sheldrake and J. Crosby, 1992; John Wiley).
Фармацевтически приемлемые соли можно получить путем обработки соединения формулы I, находящегося в виде свободного основания, минеральной кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота и серная кислота, или органической кислотой, такой как, например, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и т.п.
Соединения данного изобретения могут находиться в несольватированном виде, а также в виде сольватов, образованных фармацевтически приемлемыми растворителями, такими, как вода, этанол и т.п. В общем, с точки зрения данного изобретения, сольватированные и несольватированные формы считаются эквивалентными.
Настоящее изобретение также предлагает фармацевтические композиции, содержащие производное 1-[(индол-3-ил)карбонил]пиперазина, имеющее общую формулу I, или его фармацевтически приемлемую соль, в смеси с фармацевтически приемлемыми добавками и необязательно с другими терапевтическими средствами. Термин "приемлемый" означает, что вещество совместимо с другими ингредиентами композиции и не оказывает вредного воздействия на реципиента. Можно получить композиции, подходящие, например, для перорального, подъязычного, подкожного, внутривенного, эпидурального, интратекального, внутримышечного, чрезкожного, легочного, местного, ректального или другого введения, в виде стандартных лекарственных форм для введения.
Для перорального введения активный ингредиент может находиться в виде дискретных форм, таких как таблетки, капсулы, порошки, грануляты, растворы, суспензии и т.п.
Фармацевтическая композиция данного изобретения для парентерального введения может находиться в контейнерах, содержащих одну или несколько доз, например, жидкости для инъекций в предварительно определенных количествах могут находиться, например, в герметично закрытых флаконах или в ампулах, указанная композиция также может храниться в высушенном из замороженного состояния (лиофилизированном) виде, в данном случае перед применением нужно только добавить стерильный жидкий носитель, например, воду.
В смеси с такими фармацевтически приемлемыми добавками, которые описаны, например, в Gennaro, A. R. et al., Remington: The Science and Practice of Pharmacy (20th Edition, Lippincott Williams & Wilkins, 2000, главным образом, в части 5: Pharmaceutical Manufacturing), активный ингредиент можно прессовать в такие лекарственные формы, как пилюли, таблетки, или обрабатывать с получением капсул, свечей или пластырей. С помощью фармацевтически приемлемых жидкостей на основе активного ингредиента можно получить жидкую композицию, например, препарат для инъекций, раствор, суспензию, эмульсию или спрей, например, назальный спрей.
При получении твердых лекарственных форм используют такие традиционные добавки, как наполнители, красители, полимерные связующие и т.п. Как правило, можно использовать любую фармацевтически приемлемую добавку, которая не препятствует действию активного соединения. Подходящие носители, которые могут входить в состав твердой композиции вместе с активным ингредиентом, включают в себя лактозу, крахмал, производные целлюлозы и т.п., или их смеси, используемые в подходящих количествах. В случае композиций для парентерального введения можно использовать водные суспензии, изотонические солевые растворы и стерильные растворы для инъекций, содержащие фармацевтически приемлемые диспергирующие средства и/или увлажняющие средства, такие, как пропиленгликоль или бутиленгликоль.
Данное изобретение также включает в себя описанную выше фармацевтическую композицию в сочетании с упаковочным материалом, подходящим для упомянутой композиции, причем упаковочный материал содержит инструкции по применению (как описано выше) композиции.
Результаты исследований человеческого рецептора CB-1 с использованием клеток CHO показали, что производные 1-[(индол-3-ил)карбонил]пиперазина данного изобретения являются агонистами рецептора CB-1. Методы определения рецепторного связывания, а также биологической активности модуляторов каннабиноидного рецептора in vitro, известны в данной области. Как правило, экспрессированный рецептор приводится в контакт с анализируемым соединением, и измеряется связывание или стимуляция или ингибирование функционального ответа.
Для измерения функционального ответа осуществляют экспрессию выделенной ДНК, кодирующей ген рецептора CB1, предпочтительно человеческого рецептора, в подходящих клетках-хозяевах. Такими клетками могут служить клетки яичника китайского хомячка, но можно использовать и другие клетки. Предпочтительными являются клетки млекопитающих.
Способы создания клеточных линий, экспрессирующих рекомбинантный CB1, хорошо известны в данной области (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, последнее издание). Чтобы достичь экспрессии рецептора, нужно экспрессировать ДНК, кодирующую целевой белок. К настоящему времени все методы лигирования дополнительных последовательностей и конструирования подходящих экспрессионных систем хорошо известны в данной области. Фрагменты ДНК, кодирующей целевой белок, или всю ДНК, можно конструировать синтетически с помощью стандартных твердофазных методов, предпочтительно таким образом, чтобы ДНК включала сайты рестрикции для облегчения лигирования. К кодирующим последовательностям ДНК могут быть добавлены элементы, управляющие транскрипцией и трансляцией прилежащей кодирующей последовательности. Хорошо известно, что в настоящее время существуют экспрессионные системы, совместимые с разными хозяевами, в том числе, с прокариотическими хозяевами, такими как бактерии, и с эукариотическими хозяевами, такими как дрожжи, клетки растений, клетки насекомых, клетки млекопитающих, клетки птиц и т.п.
Затем клетки, экспрессирующие рецептор, приводят в контакт с анализируемым соединением и наблюдают связывание или стимуляцию или ингибирование функционального ответа.
Альтернативно для измерения связывания соединения можно использовать выделенные клеточные мембраны, содержащие экспрессированный рецептор CB1 (или CB2).
Для измерения связывания можно использовать радиоактивно или флюоресцентно меченные соединения. В качестве радиоактивно меченного каннабиноидного зонда чаще всего используется [3H]CP55940, который обладает примерно равным сродством к связывающим сайтам CB1 и CB2. Другой анализ включает в себя скрининг соединений, обладающих агонистической активностью по отношению к каннабиноидному рецептору CB1, по ответу вторичных мессенджеров, например, определение опосредованных рецептором изменений в метаболических путях цАМФ или MAP-киназы. Такой метод включает в себя экспрессию рецептора CB1 на поверхности клетки-хозяина и воздействие анализируемого соединения на клетку-хозяина. Затем измеряют ответ вторичного мессенджера. Уровень вторичного мессенджера уменьшается или увеличивается в зависимости от эффекта, реализующегося при связывании анализируемого соединения с рецептором.
Кроме непосредственного измерения в клетках, подвергающихся воздействию соединений, например, уровней цАМФ, можно использовать клетки, которые, в добавление к трансфекции ДНК, кодирующей рецептор, трансфицируют второй ДНК, кодирующей репортерный ген, экспрессия которого связана с активацией рецептора. Как правило, экспрессия репортерного гена может управляться элементом, отвечающим на изменение уровня вторичного мессенджера. Подходящими репортерными генами являются, например, гены LacZ, щелочной фосфатазы, желтовато-красной люциферазы и зеленого флуоресцентного белка. Принципы таких анализов трансактивации хорошо известны в данной области и описаны, например, в Stratowa, Ch, Himmler, A и Czernilofsky, A. P., Curr. Opin. Biotechnol. 6, 574 (1995). Соединения считают активными агонистами рецептора CB1, если значение EC50 <10-5 M, предпочтительно <10-7 M.
Данные соединения могут применяться для лечения боли, такой как, например, пери-операционная боль, хроническая боль, невропатическая боль, раковая боль, а также боль и спастичность, связанные с рассеянным склерозом.
Агонисты каннабиноидного рецептора данного изобретения могут применяться для лечения других заболеваний, включающих в себя рассеянный склероз, спастичность, воспаление, глаукому, тошноту и рвоту, потерю аппетита, нарушения сна, респираторные заболевания, аллергию, эпилепсию, мигрень, сердечно-сосудистые заболевания, нейродегенеративные заболевания, боязнь, травматическое повреждение мозга и инсульт.
Данные соединения также можно использовать вместе с другими обезболивающими средствами, такими как опиоиды и нестероидные противовоспалительные средства (NSAIDs), включая селективные ингибиторы COX-2.
Промежуток времени, в течение которого людям вводят соединения данного изобретения, а также количество этих соединений, должны быть достаточными для облегчения симптомов. Например, уровень ежедневной дозы может находиться в интервале 0,001-50 мг/кг массы тела, предпочтительно ежедневная доза находится в интервале 0,01-20 мг/кг массы тела.
Данное изобретение иллюстрируется нижеследующими примерами.
Пример 1
Соль малеиновой кислоты 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-4-этилпиперазина
К раствору 7-метоксииндола (3,5 г, 23,8 ммоль) в диметилформамиде (35 мл) при 0°C добавляют ангидрид трифторуксусной кислоты (4,4 мл, 31,5 ммоль) в течение 5 минут. Смесь перемешивают при комнатной температуре в течение 1 часа, затем выливают в воду (200 мл). Полученный осадок 7-метокси-3-[(трифторметил)карбонил]индола отфильтровывают, промывают водой и непосредственно используют на следующей стадии.
Влажное твердое вещество суспендируют в 4M растворе гидроксида натрия (140 мл) и нагревают до температуры кипения с обратным холодильником при перемешивании в течение 1 часа. Смесь охлаждают и дважды промывают диэтиловым эфиром. Водную фазу затем подкисляют до pH 1, используя 5M хлористоводородную кислоту, и полученный мелкий осадок отфильтровывают, промывают водой и сушат, получая 7-метоксииндол-3-карбоновую кислоту (3,6 г).
7-Метоксииндол-3-карбоновую кислоту (3,0 г, 16,6 ммоль) добавляют порциями, при перемешивании, к суспензии гидрида натрия (60% дисперсия в минеральном масле, 1,56 г, 39 ммоль) в диметилформамиде (75 мл). Через 1 час добавляют бромметилциклогексан (5,7 г, 32,3 ммоль). Смесь нагревают до 60°C при перемешивании в течение 1 часа. Смесь разбавляют водой (250 мл) и промывают этилацетатом и затем диэтиловым эфиром. Водную фазу подкисляют до pH 1, используя 5M хлористоводородную кислоту, и осадок отфильтровывают. Неочищенный продукт перекристаллизовывают из этилацетата, получая 1-(циклогексилметил)-7-метоксииндол-3-карбоновую кислоту (3,75 г) в виде кристаллического твердого вещества.
К раствору 1-(циклогексилметил)-7-метоксииндол-3-карбоновой кислоты (2,5 г, 8,8 ммоль) в ТГФ (30 мл) при перемешивании по каплям добавляют оксалилхлорид (4,5 г, 35,3 ммоль). Смесь перемешивают при комнатной температуре 18 часов. Летучие компоненты упаривают при пониженном давлении, получая 1-(циклогексилметил)-7-метоксииндол-3-карбонилхлорид (2,7 г) в виде кристаллического твердого вещества.
К 1-(циклогексилметил)-7-метоксииндол-3-карбонилхлориду (1,9 г, 6,2 ммоль) добавляют раствор N-этилпиперазина (1,35 г, 11,8 ммоль) в дихлорметане (60 мл). Смесь перемешивают до растворения хлорангидрида кислоты. Добавляют триэтиламин (3 мл, 21,5 ммоль) и раствор перемешивают при комнатной температуре 18 ч. Реакционную смесь промывают водой (2×50 мл), сушат сульфатом натрия и упаривают, получая масло. Полученное масло очищают флэш-хроматографией, элюируя 0-10% (об./об.) раствором метанола в дихлорметане, получая указанное в заголовке соединение (свободное основание) в виде смолы.
Свободное основание растворяют в диэтиловым эфире (50 мл) и фильтруют в раствор малеиновой кислоты (0,83 г, 7,15 ммоль) в эфире (24 мл) и метаноле (4 мл) при перемешивании. Полученную смесь перемешивают 30 минут и твердое вещество отфильтровывают. Твердое вещество перекристаллизовывают из смеси метанол/диэтиловый эфир, получая указанное в заголовке соединение (1:1 соль малеиновой кислоты) в виде кристаллического твердого вещества (2,7 г, 5,4 ммоль).
1H ЯМР (400 МГц, CD3OD) δH 0,99-1,08 (2H, м), 1,12-1,25 (3H, м), 1,36 (3H, т, J7,5), 1,56 (2H, д, J 12,5), 1,63-1,74 (3H, м), 1,77-1,89 (1H, м), 3,22 (2H, кв., J 7,5), 3,30-3,35 (4H, м), 3,95 (3H, с), 3,90-4,05 (4H, м), 4,25 (2H, д, J7,0), 6,25 (2H, с, малеат) 6,76 (1H, д, J 7,5), 7,10 (1H, т, J 7,5), 7,26 (1H, д, J 7,5), 7,53 (1H, с); EIMS: м/z=384,4 [М+H]+.
Пример 2
Гидрохлорид 1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-4-этилпиперазина
Циклопентанметанол п-толуолсульфонат получают по следующему способу: к раствору циклопентанметанола (2,0 г, 20,0 ммоль) и пиридина (2,9 мл, 36,3 ммоль) в дихлорметане (20 мл) добавляют п-толуолсульфонилхлорид (3,46 г, 18,1 ммоль). Смесь перемешивают при комнатной температуре 24 часа в атмосфере азота. Полученную смесь промывают 2M хлористоводородной кислотой и водный слой отделяют и экстрагируют дихлорметаном. Объединенные органические слои сушат над сульфатом натрия и концентрируют при пониженном давлении, получая п-толуолсульфонат циклопентанметанола в виде бесцветного масла (4,3 г, 17,0 ммоль).
Указанное в заголовке соединение получают по способу примера 1, используя вместо бромметилциклогексана п-толуолсульфонат циклопентанметанола.
1H ЯМР (400 МГц, CD3OD) δH 1,29-1,35 (2H, м), 1,38 (3H, т, J 7,5), 1,52-1,71 (6H, м), 2,39-2,49 (1H, м), 3,24 (2H, кв., J 7,5), 3,05-3,35 (2H, шир. м), 3,35-3,70 (4H, шир. м), 3,95 (3H, с), 4,38 (2H, д, J 7,5), 4,40-4,65 (2H, шир. м), 6,79 (1H, д, J 7,5), 7,10 (1H, т, J 7,5), 7,27 (1H, д, J 7,5), 7,60 (1H, с); EIMS: м/z=370,2 [М+H]+.
Пример 3
Способ, описанный в примерах 1 и 2, далее используют для получения следующих соединений:
3A: гидрохлорид 1-{[1-(циклогептилметил)-7-метокси-1H-индол-3-ил]карбонил}-4-этилпиперазина получают, используя п-толуолсульфонат циклогептанметанола.
EIMS: m/z=398,2 [M+H]+.
3B: гидрохлорид 1-{[1-(циклооктилметил)-7-метокси-1H-индол-3-ил]карбонил}-4-этилпиперазина получают, используя п-толуолсульфонат циклооктанметанола.
EIMS: m/z=412,4 [M+H]+.
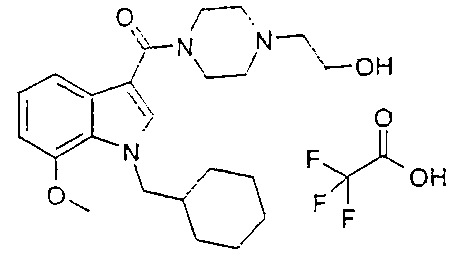
3C: соль трифторуксусной кислоты и 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-2-гидроксиэтил)пиперазина получают по способу примера 1, используя 1-(2-гидроксиэтил)пиперазин вместо N-этилпиперазина.
EIMS: m/z=400,2 [M+H]+.
3D: соль трифторуксусной кислоты и 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-4-(2-метоксиэтил)пиперазина получают, используя 1-(2-метоксиэтил)пиперазин.
EIMS: m/z=414,2 [M+H]+.
3E: 1-{[1-(циклогексилметил)-7-метил-1H-индол-3-ил]карбонил}-4-этилпиперазин получают по способу примера 1, используя 7-метилиндол вместо 7-метоксииндола. EIMS: m/z=368,0 [M+H]+.
3F: 1-{[1-(циклогексилметил)-7-этил-1H-индол-3-ил]карбонил}-4-этилпиперазин получают из 7-этилиндола.
EIMS: m/z=382,2 [M+H]+.
Пример 4
Гидрохлорид 1-{[1-(циклогексилметил)-5-фтор-1H-индол-3-ил]карбонил}-4-этилпиперазина
К раствору 5-фториндола (1,0 г, 7,4 ммоль) в диметилформамиде (20 мл) добавляют гидрид натрия (60% дисперсия в минеральном масле; 327 мг, 8,14 ммоль). Смесь перемешивают при комнатной температуре 10 минут, затем добавляют бромметилциклогексан (1,3 мл, 9,3 ммоль). Полученную смесь перемешивают при комнатной температуре 15 часов. Добавляют дополнительное количество гидрида натрия (170 мг, 4,23 ммоль) и бромметилциклогексана (0,65 мл, 4,65 ммоль) и реакционную смесь перемешивают еще 15 часов.
Реакцию гасят 2-пропанолом (10 мл) и затем концентрируют. Полученную коричневую смолу распределяют между этилацетатом (50 мл) и 5% раствором гидрокарбоната натрия (50 мл). Органический слой промывают водой (50 мл), сушат над сульфатом натрия и концентрируют. Затем неочищенное промежуточное соединение очищают флэш-хроматографией, используя в качестве элюента смесь, содержащую 95% дихлорметана и 5% метанола, и получают 1-(циклогексилметил)-5-фториндол (1,26 г, 5,45 ммоль).
К раствору 1-(циклогексилметил)-5-фториндола (208 мг, 0,9 ммоль) в 1,1,2,2-тетрахлорэтане (15 мл) при перемешивании добавляют оксалилхлорид (0,122 мл, 0,945 ммоль) при 0°C, в потоке азота. Смесь оставляют нагреваться до комнатной температуры в течение 1 часа, затем нагревают до 120°С в течение еще 1,5 часов. Смесь охлаждают до комнатной температуры и добавляют триэтиламин (0,138 мл, 0,99 ммоль). Перемешивание продолжают еще 10 минут, затем добавляют N-этилпиперазин (0,125 мл, 0,99 ммоль). Смесь перемешивают при комнатной температуре 15 часов и затем распределяют между 0,4M раствором гидроксида натрия (10 мл) и дихлорметаном (10 мл). Органический слой промывают водой (10 мл), сушат над Na2SO4 и концентрируют. Полученное коричневое масло очищают флэш-хроматографией, используя в качестве элюента смесь, содержащую 95% дихлорметана и 5% метанола, и получают указанное в заголовке соединение в виде свободного основания.
Гидрохлорид получают, добавляя к раствору свободного основания в диэтиловом эфире (5 мл) 2M раствор хлористого водорода в диэтиловом эфире (3 мл). Осадок фильтруют и сушат. Твердое вещество кристаллизуют из диэтилового эфира и метанола, получая указанное в заголовке соединение (1:1 соль хлористоводородной кислоты) в виде кристаллического твердого вещества (0,172 г, 0,42 ммоль).
1H ЯМР (400 МГц, CD3OD) δH 0,98-1,27 (2H, м), 1,17-1,27 (3H, м), 1,39 (3H, т, J7,5), 1,59 (2H, д, J 13,0), 1,64-1,77 (3H, м), 1,83-1,93 (1H, м), 3,08-3,20 (2H, м), 3,24-3,33 (2H, м), 3,51 (2H, т, J12,5), 3,63 (2H, д, J 11,0), 4,07 (2H, д, J 7,5), 4,58 (2H, д, J13,5), 7,04 (1H, тд, J 9,0, 2,5), 7,45 (1H, дд, J 9,5, 2,5), 7,47-7,51 (1H, м), 7,77 (1H, с); EIMS: м/z=372,0 [М+H]+.
Пример 5
Способ, описанный в примере 4, далее используют для получения следующих соединений:
5A: гидрохлорид 1-{[1-(циклогексилметил)-6-фтор-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 6-фториндола.
EIMS: m/z=372,0 [M+H]+.
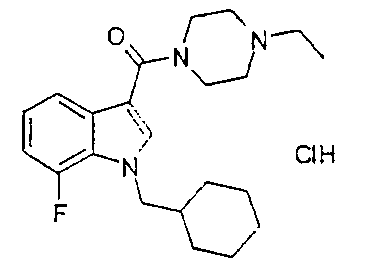
5B: гидрохлорид 1-{[1-(циклогексилметил)-7-фтор-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 7-фториндола.
EIMS: m/z=372,0 [M+H]+.
5C: гидрохлорид 1-{[6-бром-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 6-броминдола.
EIMS: m/z=432,4 [M+H]+.
5D: гидрохлорид 1-{[7-бром-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 7-броминдола.
EIMS: m/z=432,5 [M+H]+.
5E: гидрохлорид 1-{[5-хлор-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 5-хлориндола.
EIMS: m/z=388,2 [M+H]+.
5F: гидрохлорид 1-{[6-хлор-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 6-хлориндола.
EIMS: m/z=388,5 [M+H]+.
5G: гидрохлорид 1-{[7-Хлор-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 7-хлориндола.
EIMS: m/z=388,0 [M+H]+.
5H: гидрохлорид 1-{[6-циано-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 6-цианоиндола.
EIMS: m/z=379,4 [M+H]+.
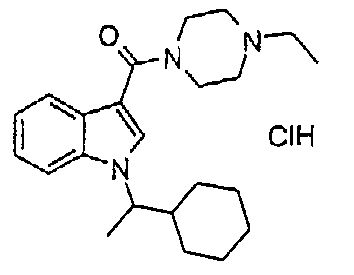
5I: гидрохлорид 1-{[1-(1-циклогексилэтил)-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из индола и рацемического 1-циклогексил-1-п-толуолсульфонилэтана.
EIMS: m/z=368,0 [M+H]+.
Продукт, полученный в примере 5I, подвергают стереоселективному разделению методом ВЭЖХ на колонке Chiracel®OD (2 см × 25 см), элюируя смесью изогексан/изопропанол 95/5 (об./об.) со скоростью потока 20 мл/мин. Продукты детектируют с помощью УФ-детектора при длине волны 240 нм.
(-)-5I: энантиомер 1; время удерживания 8,1 минут; избыток энантиомера >98%, [α]D 22-12° (c=1,25 мг/мл в CHCl3).
(+)-5I: энантиомер 2; время удерживания 11,1 минут; избыток энантиомера >98%, [α]D 22+7° (c=1,50 мг/мл в CHCl3).
5J: гидрохлорид 1-{[1-(1-циклогексилэтил)-6-метокси-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 6-метоксииндола и 1-циклогексил-1-п-толуолсульфонилэтана.
EIMS: m/z=398,2 [M+H]+.
5K: гидрохлорид 1-{[1-(1-циклогексилэтил)-7-метокси-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 7-метоксииндола и 1-циклогексил-1-п-толуолсульфонилэтана.
EIMS: m/z=398,2 [M+H]+.
5L: гидрохлорид 1-{[1-(циклогексилметил)-6-нитро-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 6-нитроиндола.
EIMS: m/z=399,2 [M+H]+.
5M: гидрохлорид 1-{[1-(циклогексилметил)-7-нитро-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 7-нитроиндола.
EIMS: m/z=399,2 [M+H]+.
5N: гидрохлорид 1-{[7-бензилокси-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 7-бензилоксииндола.
EIMS: m/z=460,4 [M+H]+.
5O: соль малеиновой кислоты 1-(циклогексилметил)-6-метокси-1H-индол-3-ил]карбонил}-4-этилпиперазина получают из 6-метоксииндола.
EIMS: m/z=384,5 [M+H]+.
5P: гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-4-изопропилпиперазина получают из 7-метоксииндола и 1-изопропилпиперазина.
EIMS: m/z=398,2 [M+H]+.
5Q: 1-{[1-(циклогекс-3-енилметил)-7-метокси-1H-индол-3-ил]карбонил}-4-этилпиперазин получают из 7-метоксииндола и п-толуолсульфоната циклогекс-3-енметанола.
EIMS: m/z=382,2 [M+H]+.
5R: гидрохлорид 1-{[6-бром-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-метилпиперазина получают, используя в качестве исходных веществ 6-броминдол и N-метилпиперазин вместо N-этилпиперазина.
EIMS: m/z=374,2 [M+H]+.
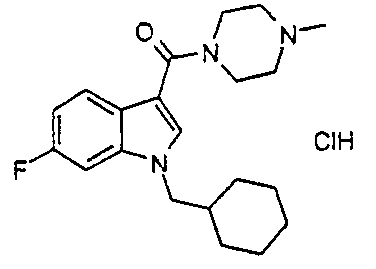
5S: гидрохлорид 1-{[1-(циклогексилметил)-5-фтор-1H-индол-3-ил]карбонил}-4-метилпиперазина получают, используя 5-фториндол и N-метилпиперазин.
EIMS: m/z=358,2 [M+H]+.
5T: гидрохлорид 1-{[1-(циклогексилметил)-6-фтор-1H-индол-3-ил]карбонил}-4-метилпиперазина получают из 6-фториндола и N-метилпиперазина.
EIMS: m/z=358,0 [M+H]+.
5U: гидрохлорид 1-{[1-(циклогексилметил)-7-фтор-1H-индол-3-ил]карбонил}-4-метилпиперазина получают из 7-фториндола и N-метилпиперазина.
EIMS: m/z=358,0 [M+H]+.
5V: гидрохлорид 1-{[6-хлор-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-метилпиперазина получают из 6-хлориндола и N-метилпиперазина.
EIMS: m/z=374,0 [M+H]+.
5W: гидрохлорид 1-{[7-хлор-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-метилпиперазина получают из 7-хлориндола и N-метилпиперазина.
EIMS: m/z=374,2 [M+H]+.
5X: гидрохлорид 1-{[6-циано-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-метилпиперазина получают из 6-цианоиндола и N-метилпиперазина.
EIMS: m/z=365,0 [M+H]+.
5Y: гидрохлорид 1-{1-(1-циклогексилэтил)-6-метокси-1H-индол-3-ил]карбонил}-4-метилпиперазина получают из 6-метоксииндола, N-метилпиперазина и 1-циклогексил-1-п-толуолсульфонилэтана.
EIMS: m/z=384,2 [M+H]+.
5Z: гидрохлорид 1-{[1-(1-циклогексилпропил)-1H-индол-3-ил]карбонил}-4-метилпиперазина получают из индола, N-метилпиперазина и 1-циклогексил-1-п-толуолсульфонилпропана.
EIMS: m/z=368,0 [M+H]+.
Пример 6
1-{[7-Амино-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-4-этилпиперазин
4-{[1-(Циклогексилметил)-7-нитро-1H-индол-3-ил]карбонил}-1-этилпиперазин (200 мг, 0,5 ммоль) растворяют в метаноле (10 мл), добавляют палладий (5 масс. % на активированном угле; 50 мг, катализатор) в виде взвеси в метаноле (3 мл). Затем систему герметично закрывают, продувают азотом и подсоединяют к источнику водорода (баллон). Смесь перемешивают при комнатной температуре в атмосфере водорода в течение 15 часов, после чего ее фильтруют через целит и концентрируют. Полученное коричневое масло очищают флэш-хроматографией, используя в качестве элюента смесь 95% дихлорметана и 5% метанола, и получают указанный в заголовке продукт в виде свободного основания.
1H ЯМР (400 МГц, CD3OD) δH 0,97-1,08 (2H, м), 1,12 (3H, т, J 7,5), 1,17-1,26 (3H, м), 1,53 (2H, д, J 12,5), 1,63-1,75 (3H, м), 1,87-1,98 (1H, м), 2,44-2,55 (6H, м), 3,37 (4H, т, J 5,0), 4,20 (2H, д, J 7,5), 6,59 (1H, дд, J 7,5, 1,0), 6,93 (1H, т, J 7,5), 7,06 (1H, дд, J 8,0, 1,0), 7,39 (1H, с); EIMS: m/z=369,0 [M+H]+.
Пример 7
Гидрохлорид 1-{[1-(циклогексилметил)-7-гидрокси-1H-индол-3-ил]карбонил}-4-этилпиперазина
К раствору 4-{[7-бензилокси-1-(циклогексилметил)-1H-индол-3-ил]карбонил}-1-этилпиперазина (1 г, 2,2 ммоль) в этаноле (50 мл) добавляют палладий (5 масс. % на активированном угле; 100 мг). Смесь гидрируют под давлением 5,5 бар, при 60°C в течение 16 часов. Полученную смесь фильтруют через дикалит, и фильтрат концентрируют при пониженном давлении, получая указанное в заголовке соединение (свободное основание) в виде смолы (865 мг, 2,3 ммоль).
Гидрохлорид получают путем добавления хлористого водорода (2M раствор в диэтиловом эфире, 3 мл) к раствору свободного основания (180 мг, 0,5 ммоль) в диэтиловом эфире (5 мл). Осадок фильтруют и сушат. Твердое вещество кристаллизуют из диэтилового эфира и этанола, получая указанное в заголовке соединение (1:1 соль хлористоводородной кислоты) в виде кристаллического твердого вещества (132 мг, 0,3 ммоль).
1H ЯМР (400 МГц, CD3OD) δH 1,05 (2H, м), 1,19 (3H, м), 1,38 (3H, т, J 7,5), 1,57 (2H, м), 1,69 (3H, м), 1,92 (1H, м), 3,13 (2H, м), 3,27 (2H, кв., J 7,5), 3,45 (2H, м), 3,61 (2H, д, J 12,0), 4,29 (2H, д, J 7,0), 4,55 (2H, д, 14,0), 6,59 (1H, д, J 7,0), 6,97 (1H, т, J 7,0), 7,14 (1H, д, J 7,0), 7,52 (1H, с); EIMS: m/z=370,2 [M+H]+
Пример 8
1-{[1-(Циклогексилметил)-7-(2-фторэтокси)-1H-индол-3-ил]карбонил}-4-этилпиперазин
Гидрид натрия (60% дисперсия в минеральном масле, 65 мг, 1,62 ммоль) добавляют порциями при перемешивании в потоке азота к раствору 4-{[1-(циклогексилметил)-7-гидрокси-1H-индол-3-ил]карбонил}-1-этилпиперазина (200 мг, 0,54 ммоль) в диметилформамиде (5 мл). Через 30 минут добавляют 1-бром-2-фторэтан (49 мкл, 0,65 ммоль). Смесь нагревают до 60°C при перемешивании в течение 48 часов. Реакцию гасят 2-пропанолом (10 мл) и затем концентрируют. Полученную коричневую смолу распределяют между дихлорметаном (50 мл) и 5% раствором гидрокарбоната натрия (50 мл). Органический слой промывают водой (50 мл), сушат над сульфатом натрия и концентрируют. Неочищенное промежуточное соединение очищают флэш-хроматографией, используя в качестве элюента смесь 95% дихлорметана и 5% метанола, и получают указанное в заголовке соединение (54 мг, 0,1 ммоль).
1H ЯМР (400 МГц, CD3OD) δH 1,05 (2H, м), 1,19 (3H, м), 1,39 (3H, т, J 7,5), 1,56 (2H, м), 1,69 (3H, м), 1,92 (1H, м), 2,48 (2H, кв., J 7,0), 2,53 (4H, м), 3,75 (4H, т, J 5,0), 4,26 (2H, д, J 7,5), 4,32 (1H, м), 4,39 (1H, м), 4,75 (1H, м), 4,87 (1H, м), 6,73 (1H, д, J 8,0), 7,06 (1H, т, J 8,0), 7,26 (1H, д, J 8,0), 7,44 (1H, с); EIMS: m/z=416,2 [M+N]+
Пример 9
1-{[1-(Циклогексилметил)-7-этокси-1H-индол-3-ил]карбонил}-4-этилпиперазин получают по способу примера 8, используя бромэтан вместо 1-бром-2-фторэтана. EIMS: m/z=398,2 [M+H]+.
Пример 10
Гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-2,3,5,6-тетраметилпиперазина
К раствору диизопропилэтиламина (0,83 мл, 4,90 ммоль) и 2,3,5,6-тетраметилпиперазина (0,35 г, 2,45 ммоль) в дихлорметане (5 мл) добавляют раствор 1-(циклогексилметил)-7-метоксииндол-3-карбонилхлорида (0,33 г, 1,08 ммоль, полученный по способу примера 1) в дихлорметане (5 мл). Смесь перемешивают 6 часов при комнатной температуре, упаривают при пониженном давлении и остаток очищают флэш-хроматографией, элюируя 5-10% (об./об.) раствором метанола в дихлорметане, и получают указанное в заголовке соединение (свободное основание) в виде бесцветного масла (0,43 г). Свободное основание (0,1 г, 0,24 ммоль) растворяют в дихлорметане (1 мл), добавляют по каплям 2М раствор хлористоводородной кислоты в диэтиловом эфире (0,3 мл) и диэтиловый эфир (3 мл). Полученный осадок собирают фильтрацией, промывают диэтиловым эфиром (15 мл) и сушат при пониженном давлении, получая указанное в заголовке соединение (1:1 соль хлористоводородной кислоты) в виде белого твердого вещества (0,09 г, 0,20 ммоль).
1H ЯМР (400 МГц, CD3OD) δH 0,98-1,39 (8H, м), 1,42 (6H, д, J 7,0), 1,64-1,89 (9H, м), 3,44-3,70 (3H, м), 3,95 (3H, с), 4,21-4,34 (3H, м), 6,77 (1H, д, J 7,7), 7,11 (1H, т, J 8,2), 7,38 (1H, д, J 8,2), 7,58 (1H, с); EIMS: m/z 412,4 [M+H]+.
Пример 11
Гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-2,6-диметилпиперазина
Трет-бутиловый эфир 4-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,5-диметилпиперазин-1-карбоновой кислоты получают по способу примера 10, используя трет-бутиловый эфир 3,5-диметилпиперазин-1-карбоновой кислоты (E. J. Jacobsen et al., J. Med. Chem. 42, 1123-1144, 1999) вместо 2,3,5,6-тетраметилпиперазина. К охлажденному на льду раствору трет-бутилового эфира 4-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,5-диметилпиперазин-1-карбоновой кислоты (0,52 г, 1,08 ммоль) в дихлорметане (5 мл) добавляют по каплям трифторуксусную кислоту (2 мл). Смесь оставляют нагреваться до комнатной температуры в течение 2 ч и затем все летучие компоненты удаляют при пониженном давлении. Остаток суспендируют в 5M растворе гидроксида натрия (10 мл) и экстрагируют в дихлорметан (2×30 мл). Объединенные органические слои сушат сульфатом магния и упаривают до получения масла. Масло очищают флэш-хроматографией, элюируя 5-10% (об./об.) раствором метанола в дихлорметане, получая указанное в заголовке соединение (свободное основание) в виде бесцветного масла. Свободное основание растворяют в диэтиловом эфире (3 мл) и добавляют по каплям 2M раствор хлористоводородной кислоты в диэтиловом эфире (1 мл). Полученный осадок собирают фильтрацией, промывают диэтиловым эфиром (15 мл) и сушат при пониженном давлении, получая указанное в заголовке соединение (1:1 соль хлористоводородной кислоты) в виде бесцветного твердого вещества (0,13 г, 0,31 ммоль).
1H ЯМР (400 МГц, CD3OD) δH 1,04 (2H, шир. кв., J 9,0), 1,11-1,25 (3H, м), 1,44 (6H, д, J 7,0), 1,54 (2H, шир. д, J 13,0), 1,62-1,90 (4H, м), 3,33-3,42 (4H, м), 3,95 (3H, с), 4,26 (2H, д, J 7,0), 4,74-4,86 (2H, м), 6,76 (1H, д, J 7,5), 7,09 (1H, т, J 8,0), 7,21 (1H, д, J 7,5), 7,46 (1H, с); EIMS: m/z=384,2 [M+H]+.
Пример 12
Гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,5-диметилпиперазина
К раствору 1-(циклогексилметил)-7-метокси-индол-3-карбоновой кислоты (0,25 г, 0,87 ммоль, полученной по способу примера 1) и 2,6-диметилпиперазина (0,12 г, 1,05 ммоль) в дихлорметане (10 мл) добавляют диизопропилкарбодиимид (0,16 мл, 1,05 ммоль) и 1-гидроксибензотриазол (0,01 г, 0,09 ммоль). Смеси перемешивают при комнатной температуре 18 часов. Смесь промывают 5M раствором гидроксида натрия (2×10 мл), сушат сульфатом магния и упаривают. Остаток очищают флэш-хроматографией, элюируя 5-10% (об./об.) раствором метанола в дихлорметане, и получают указанное в заголовке соединение (свободное основание) в виде бесцветного масла. Свободное основание (0,15 г) растворяют в диэтиловом эфире (3 мл) и обрабатывают по каплям 2M раствором хлористоводородной кислоты в диэтиловом эфире (1 мл). Полученный осадок собирают фильтрацией, промывают диэтиловым эфиром (15 мл) и сушат при пониженном давлении, получая указанное в заголовке соединение (1:1 соль хлористоводородной кислоты) в виде бесцветного твердого вещества (0,15 г, 0,36 ммоль).
1H ЯМР (400 МГц, CD3OD) δH 0,98-1,26 (5H, м), 1,32 (6H, д, J 6,5), 1,56 (2H, шир. д, J 12,0), 1,62-1,90 (4H, м), 3,06 (2H, дд, J 14,5, 11,5), 3,39-3,50 (2H, м), 3,95 (3H, с), 4,26 (2H, д, J 7,5), (4,52 (2H, шир. д, J 13,5), 6,77 (1H, д, J 7,5), 7,1 (1H, т, J 8,0), 7,24 (1H, д, J 8,0), 7,54 (1H, с); EIMS: m/z=384,2 [M+H]+.
Пример 13
Способ, описанный в примере 12 далее используют для получения следующих соединений:
13A: гидрохлорид 1-[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазина получают, используя 1-(циклогексилметил)-7-метоксииндол-3-карбоновую кислоту и рац-2-метилпиперазин.
1H ЯМР (400 МГц, CD3OD) δH 0,98-1,24 (6H, м), 1,33 (3H, д, J 6,5), 1,56 (2H, шир. д, J 12,5), 1,63-1,88 (4H, м), 3,17-3,22 (2H, м), 3,39-3,51 (3H, м), 3,94 (3H, с), 4,26 (2H, д, J 7,0), 4,43 (2H, шир. д, J 14,0), 6,76 (1H, д, J 7,5), 7,1 (1H, т, J 7,5), 7,25 (1H, д, J 8,0), 7,54 (1H, с). EIMS: m/z=370,2 [M+H]+.
13B: гидрохлорид 1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,5-диметилпиперазина получают, используя 1-(циклопентилметил)-7-метоксииндол-3-карбоновую кислоту и 2,6-диметилпиперазин.
1H ЯМР (400 МГц, CD3OD) δH 1,24-1,36 (8H, м), 1,51-1,72 (6H, м), 2,43 (1H, гептет, J 7,5), 3,07 (2H, дд, J 14,5, 11,5), 3,39-3,50 (2H, м), 3,95 (3H, с), 4,37 (2H, д, J 7,5), 4,52 (2H, д, J 14,0), 6,77 (1H, д, J 7,5), 7,10 (1H, т, J 7,5), 7,24 (1H, д, J 8,0), 7,59 (1H, с). EIMS: m/z=370,2 [M+H]+.
13C: гидрохлорид (S)-1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазина получают, используя 1-(циклопентилметил)-7-метоксииндол-3-карбоновую кислоту и (S)-2-метилпиперазин.
1H ЯМР (400 МГц, CD3OD) δH1,26-1,36 (5H, м), 1,51-1,72 (6H, м), 2,42 (1H, гептет, J 7,7), 3,20 (2H, дд, J 14,5, 10,9), 3,38-3,5 (3H, м), 3,95 (3H, с), 4,37 (2H, д, J 7,5), 4,43 (2H, шир. д, J 14,5), 6,77 (1H, д, J 7,6), 7,10 (1H, т, J 7,7), 7,25 (1H, д, J 8,1), 7,59 (1H, с). EIMS: m/z=356,2 [M+H]+.
13D: гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,3-диметилпиперазина получают, используя 1-(циклогексилметил)-7-метоксииндол-3-карбоновую кислоту и 2,2-диметилпиперазин.
1H ЯМР (400 МГц, CD3OD) δH 1,10-1,22 (5H, м), 1,38 (6H, с), 1,54-1,86 (6H, м), 3,31-3,34 (2H, м), 3,2 (2H, дд, J 14,5, 10,9), 3,81 (2H, с), 3,95 (3H, с), 3,96-3,99 (2H, м), 4,26 (2H, д, J 7,1), 6,76 (1H, д, J 7,5), 7,10 (1H, т, J 8,1), 7,24 (1H, д, J 8,0), 7,53 (1H, с). EIMS: m/z=384,5 [M+H]+.
13E: гидрохлорид (S)-1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазина получают, используя 1-(циклогексилметил)-7-метоксииндол-3-карбоновую кислоту и (S)-2-метилпиперазин.
1H ЯМР (400 МГц, CD3OD) δH 1,01-1,23 (5H, м), 1,33 (3H, д, J 6,5), 1,52-1,87 (6H, м), 3,16-3,27 (2H, м), 3,38-3,51 (3H, м), 3,95 (3H, с), 4,27 (2H, д, J 7,0), 4,43 (2H, шир. д, J 14,3), 6,76 (1H, д, J 7,8), 7,10 (1H, т, J 7,9), 7,25 (1H, д, J 8,0), 7,54 (1H, с). EIMS: m/z=370,0 [M+H]+.
13F: гидрохлорид (R)-1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазина получают, используя 1-(циклогексилметил)-7-метоксииндол-3-карбоновую кислоту и (R)-2-метилпиперазин.
1H ЯМР (400 МГц, CD3OD) δH 1,01-1,23 (5H, м), 1,33 (3H, д, J 6,5), 1,52-1,87 (6H, м), 3,16-3,27 (2H, м), 3,38-3,51 (3H, м), 3,95 (3H, с), 4,27 (2H, д, J 7,0), 4,43 (2H, шир. д, J 14,3), 6,76 (1H, д, J 7,8), 7,10 (1H, т, J 7,9), 7,25 (1H, д, J 8,0), 7,54 (1H, с). EIMS: m/z=370,0 [M+H]+.
Пример 14
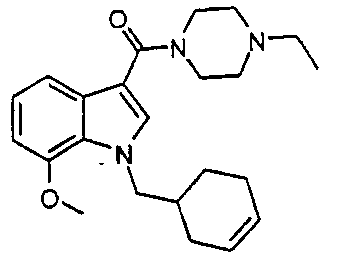
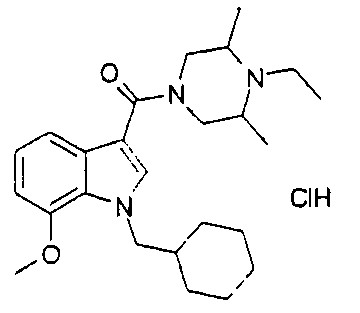
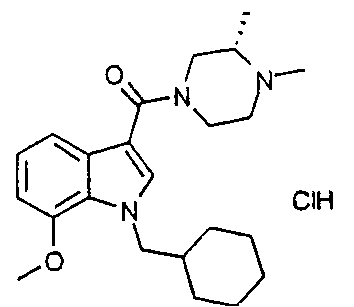
Гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,5-диметил-4-этилпиперазина
К раствору 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,5-диметилпиперазина (0,7 г, 1,83 ммоль) и карбоната калия (0,3 г, 2,19 ммоль) в диметилформамиде (5 мл) добавляют иодэтан (0,17 мл, 2,10 ммоль). Смесь нагревают до 50°C в течение 18 ч и разбавляют водой (20 мл). Затем суспензию экстрагируют трет-бутилметиловым эфиром (2×30 мл), объединенные органические слои промывают водой (3×20 мл), сушат сульфатом магния и упаривают. Остаток очищают флэш-хроматографией, элюируя 5-10% (об./об.) раствором метанола в дихлорметане, и получают указанное в заголовке соединение (свободное основание) в виде бесцветного масла. Свободное основание (0,42 г) растворяют в диэтиловом эфире (10 мл) и по каплям добавляют 2M раствор хлористоводородной кислоты в диэтиловом эфире (1 мл). Полученный осадок собирают фильтрацией, промывают диэтиловым эфиром (15 мл) и сушат при пониженном давлении, получая указанное в заголовке соединение (1:1 соль хлористоводородной кислоты) в виде белого твердого вещества (0,35 г, 0,78 ммоль).
1H ЯМР (400 МГц, CD3OD) δH0,98-1,23 (5H, м), 1,30 (3H, т, J 7,0), 1,39 (6H, д, J 7,0), 1,53-1,88 (6H, м), 3,22-3,35 (2H, м), 3,42-3,61 (4H, м), 3,95 (3H, с), 4,26 (2H, д, J 7,0), 4,53 (2H, шир. д, J 13,0), 6,77 (1H, д, J 8,0), 7,10 (1H, т, J 8,0), 7,27 (1H, д, J 8,0), 7,57 (1H, с). EIMS: m/z=412,4 [M+H]+.
Пример 15
Способ, описанный в примере 14, далее используют для получения следующих соединений:
15A: гидрохлорид 1-{(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,5-диметил-4-этилпиперазина получают, используя 1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,5-диметилпиперазин.
1H ЯМР (400 МГц, CD3OD) δH 1,27-1,40 (5H, м), 1,39 (6H, д, J 6,5), 1,73-1,43 (6H, м), 2,44 (1H гептет, J 7,0), 3,22-3,33 (2H, м), 3,42-3,61 (4H, м), 3,95 (3H, с), 4,38 (2H, д, J 7,0), 4,53 (2H, шир. д, J 14,5), 6,77 (1H, д, J 8,0), 7,10 (1H, т, J 8,0), 7,27 (1H, д, J 8,0), 7,61 (1H, с). EIMS: m/z=398,0 [M+H]+.
15B: гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-4-этил-2,3,5,6-тетраметилпиперазина получают, используя 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-2,3,5,6-тетраметилпиперазин.
1H ЯМР (400 МГц, CD3OD) δH 0,98-1,29 (8H, м), 1,32 (3H, т, J 6,5), 1,44-1,88 (15H, м), 3,32-3,83 (5H, м), 3,95 (3H, с), 4,20-4,41 (3H, м), 6,77 (1H, д, J 8,0), 7,11 (1H, т, J 8,0), 7,37 (1H, д, J 8,5), 7,55 (1H, с). EIMS: m/z=440,2 [M+H]+.
15C: гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-2,6-диметил-4-этилпиперазина получают, используя 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-2,6-диметилпиперазин.
1H ЯМР (400 МГц, CD3OD) δH 0,97-1,22 (5H, м), 1,43 (3H, т, J 7,0), 1,49 (6H, д, J 8,0), 1,51-1,88 (6H, м), 3,23-3,41 (4H, м), 3,56 (2H, шир. д, J 11,0), 3,95 (3H, с), 4,26 (2H, д, J 7,0), 4,86 (2H, шир. с), 6,76 (1H, д, J 7,5), 7,1 (1H, т, J 8,0), 7,23 (1H, д, J 8,0), 7,48 (1H, с). EIMS: m/z=412,4 [M+H]+.
15D: гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-4-этил-3-метилпиперазина получают, используя 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазин.
1H ЯМР (400 МГц, CD3OD) δH 0,97-1,43 (11H, м), 1,56 (2H, шир. д, J 12,0), 1,64-1,89 (4H, м), 3,12-3,68 (7H, шир. м), 3,95 (3H, с), 4,26 (2H, д, J 7,0), 4,50 (2H, шир. с), 6,77 (1H, д, J 8,0), 7,10 (1H, т, J 8,0), 7,26 (1H, д, J 8,0), 7,54 (1H, с). EIMS: m/z=398,2 [M+H]+.
15E: гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}транс-2,5-диметил-4-этилпиперазина
По способу примера 12 получают 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}танс-2,5-диметилпиперазин, используя 1-(циклогексилметил)-7-метоксииндол-3-карбоновую кислоту и транс-2,5-диметилпиперазин. Указанное в заголовке соединение получают по способу, описанному в примере 14.
1H ЯМР (400 МГц, CD3OD) δH 0,97-1,32 (9H, м), 1,37 (3H, т, J 7,0), 1,44-1,89 (8H, м), 3,12-3,78 (6H, шир. м), 3,95 (3H, с), 4,17-4,33 (3H, м), 5,00 (1H, шир. с), 6,76 (1H, д, J 7,5), 7,10 (1H, т, J 8,0), 7,21 (1H, д, J 8,0), 7,48 (1H, с). EIMS: m/z=412,4 [M+H]+.
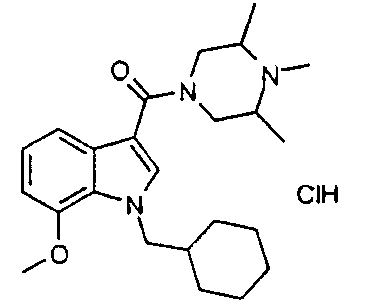
15F: гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,4,5-триметилпиперазина получают, используя 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,5-диметилпиперазин и иодметан.
1H ЯМР (400 МГц, CD3OD) δH 0,97-1,89 (17H, м), 2,96 (3H, шир. с), 3,23-3,48 (4H, шир. м), 3,95 (3H, с), 4,26 (2H, д, J 7,0), 4,49 (2H, шир. д, J 12,0), 6,77 (1H, д, J 7,5), 7,10 (1H, т, J 8,0), 7,26 (1H, д, J 7,5), 7,54 (1H, с). EIMS: m/z=398,0 [M+H]+.
15G: гидрохлорид 1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,4,5-триметилпиперазина получают, используя 1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,5-диметилпиперазин и иодметан.
1H ЯМР (400 МГц, CD3OD) δH 1,23-1,70 (14H, гептет, J 7,5), 2,96 (3H, шир. с), 3,21-3,48 (4H, шир. м), 3,95 (3H, с), 4,38 (2H, д, J 7,0), 4,50 (2H, шир. д, J 13,5), 6,77 (1H, д, J 7,5), 7,10 (1H, т, J 8,0), 7,26 (1H, д, J 8,0), 7,60 (1H, с). EIMS: m/z=384,2 [M+H]+.
15H: гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,4-диметилпиперазина получают, используя 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазин и иодметан.
1H ЯМР (400 МГц, CD3OD) δH 0,97-1,89 (14H, м), 2,92 (3H, шир. с), 3,19-3,61 (5H, шир. м), 3,95 (3H, с), 4,26 (2H, д, J 7,0), 4,49 (2H, м), 6,76 (1H, д, J 7,5), 7,10 (1H, т, J 8,0), 7,27 (1H, д, J 8,0), 7,54 (1H, с). EIMS: m/z=384,2 [M+H]+.
15I: гидрохлорид (S)-1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-4-этил-3-метилпиперазина получают, используя (S)-1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазин и иодэтан.
1H ЯМР (400 МГц, CD3OD) δH 1,24-1,42 (8H, м), 1,51-1,73 (6H, м), 2,43 (1H, гептет, J 7,6), 3,12-3,23 (2H, м), 3,47-3,71 (5H, шир. м), 3,95 (3H, с), 4,38 (2H, д, J 6,9), 4,51 (2H, шир. с), 6,77 (1H, д, J 8,2), 7,10 (1H, т, J 7,7), 7,26 (1H, д, J 8,1), 7,60 (1H, с). EIMS: m/z=384,2 [M+H]+.
15J: гидрохлорид (R)-1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-4-этил-3-метилпиперазина получают, используя (R)-1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазин (полученный по способу, подробно описанному в примере 12) и иодэтан.
1H ЯМР (400 МГц, CD3OD) δH 1,24-1,42 (8H, м), 1,51-1,73 (6H, м), 2,43 (1H, гептет, J 7,6), 3,12-3,23 (2H, м), 3,47-3,71 (5H, шир. м), 3,95 (3H, с), 4,38 (2H, д, J 6,9), 4,51 (2H, шир. с), 6,77 (1H, д, J 8,2), 7,10 (1H, т, J 7,7), 7,26 (1H, д, J 8,1), 7,60 (1H, с). EIMS: m/z=384,2 [M+H]+.
15K: гидрохлорид (S)-1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,4-диметилпиперазина получают, используя (S)-1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазин и иодметан.
1H ЯМР (400 МГц, CD3OD) δH 1,27-1,42 (5H, м), 1,52-1,74 (6H, м), 2,43 (1H, гептет, J 7,4), 2,86-2,99 (3H, м), 3,17-3,60 (5H, шир. м), 3,95 (3H, с), 4,38 (2H, д, J 7,6), 4,52 (2H, шир. д, J 14,6), 6,77 (1H, д, J 7,9), 7,10 (1H, т, J 7,7), 7,27 (1H, д, J 8,1), 7,60 (1H, с). EIMS; m/z=370,0 [M+H]+.
15L: гидрохлорид (R)-1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,4-диметилпиперазина получают, используя (R)-1-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазин и иодметан.
1H ЯМР (400 МГц, CD3OD) δH 1,27-1,42 (5H, м), 1,52-1,74 (6H, м), 2,43 (1H, гептет, J 7,4), 2,86-2,99 (3H, м), 3,17-3,60 (5H, шир. м), 3,95 (3H, с), 4,38 (2H, д, J 7,6), 4,52 (2H, шир. д, J 14,6), 6,77 (1H, д, J 7,9), 7,10 (1H, т, J 7,7), 7,27 (1H, д, J 8,1), 7,60 (1H, с). EIMS: m/z=370,5 [M+H]+.
15M: гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,3-диметил-4-этилпиперазина получают, используя 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,3-диметилпиперазин и иодэтан.
1H ЯМР (400 МГц, CD3OD) δH 0,97-1,90 (20H, м), 2,82-3,69 (6H, шир. м), 3,95 (3H, с), 4,22-4,61 (4H, м), 6,77 (1H, д, J 7,9), 7,10 (1H, т, J 8,0), 7,25 (1H, д, J 8,1), 7,53 (1H, с). EIMS: m/z=412,4 [M+H]+.
15N: гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,3,4-триметилпиперазина получают, используя 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,3-диметилпиперазин и иодметан.
1H ЯМР (400 МГц, CD3OD) δH 0,98-1,90 (17H, м), 2,85 (3H, с), 3,29-3,70 (4H, м), 3,95 (3H, с), 4,22-4,60 (4H, м), 6,77 (1H, д, J 7,7), 7,10 (1H, т, J 8,1), 7,25 (1H, д, J 8,2), 7,54 (1H, с). EIMS: m/z=398,2 [M+H]+.
15O: гидрохлорид (S)-1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,4-диметилпиперазина получают, используя (S)-1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазин и иодметан.
1H ЯМР (400 МГц, CD3OD) δH 0,97-1,89 (14H, м), 2,92 (3H, шир. с), 3,19-3,61 (5H, шир. м), 3,95 (3H, с), 4,26 (2H, д, J 7,0), 4,49 (2H, м), 6,76 (1H, д, J 7,5), 7,10 (1H, т, J 8,0), 7,27 (1H, д, J 8,0), 7,54 (1H, с). EIMS: m/z=384,2 [M+H]+.
15P: гидрохлорид (S)-1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метил-4-(2-фторэтил)пиперазина получают, используя (S)-1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилпиперазин и 1-бром-2-фторэтан.
1H ЯМР (400 МГц, CD3OD) δH 0,96-1,90 (14H, м), 3,31-3,90 (7H, шир. м), 3,95 (3H, с), 4,26 (2H, д, J 7,0), 4,40-4,59 (2H, м), 4,68-5,04 (2H, шир. м), 6,77 (1H, д, J 7,5), 7,11 (1H, т, J 8,0), 7,27 (1H, д, J 8,0), 7,56 (1H, с). EIMS: m/z=416,0 [M+H]+.
Пример 16
(R)-2-{[1-(Циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-октагидро-2H-пиридо[1,2-a]пиразин
К раствору (R)-(+)-1-(трет-бутоксикарбонил)-2-пиперидинкарбоновой кислоты (2,00 г, 8,72 ммоль) в дихлорметане (30 мл) добавляют гидрохлорид глицинметилового эфира (1,09 г, 8,72 ммоль), гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (2,01 г, 10,46 ммоль), 1-гидроксибензотриазол (1,22 г, 9,04 ммоль) и триэтиламин (2,43 мл, 17,4 ммоль). Смесь перемешивают в потоке азота в течение 18 часов. Полученную смесь промывают 0,5M хлористоводородной кислотой (20 мл), водой (2×20 мл) и насыщенным солевым раствором (20 мл), сушат над сульфатом натрия и концентрируют, получая (R)-1-(трет-бутоксикарбонил)пиперидин-2-карбоксиглицинметиловый эфир в виде бесцветного масла (2,47 г, 8,23 ммоль).
(R)-1-(Трет-бутоксикарбонил) пиперидин-2-карбоксиглицинметиловый эфир (2,46 г, 8,20 ммоль) растворяют в трифторуксусной кислоте (10 мл), и полученный раствор перемешивают в течение 1 часа. Затем трифторуксусную кислоту удаляют, получая бесцветное масло, которое растворяют в метаноле (85 мл) и добавляют триэтиламин (9,0 мл, 64,6 ммоль). Полученную смесь нагревают с обратным холодильником 4 часа. Затем раствор концентрируют, получая бледно-оранжевое масло, которое перекристаллизовывают из смеси, содержащей 48% гептана, 48% эфира и 4% 2-пропанола, получая (R)-октагидро-1,4-диоксо-2H-пиридо[1,2-a]пиразин в виде белых кристаллов (0,66 г, 3,90 ммоль).
(R)-Октагидро-1,4-диоксо-2H-пиридо[1,2-a]пиразин (0,5 г, 2,98 ммоль) добавляют порциями к перемешиваемому раствору алюмогидрида лития (1M в тетрагидрофуране; 11,9 мл, 11,9 ммоль). Полученную смесь нагревают с обратным холодильником 0,5 часа. Затем раствор охлаждают до 0°C, по каплям добавляют воду (1,35 мл), 1M раствор гидроксида натрия (0,45 мл), и снова воду (1,35 мл). Добавляют тетрагидрофуран (10 мл), и раствор перемешивают 0,5 часа, после чего фильтруют. Отфильтрованный осадок промывают тетрагидрофураном (2×5 мл), фильтрат и жидкость после промывания объединяют и концентрируют, получая (R)-октагидро-2H-пиридо[1,2-a]пиразин в виде желтого масла (0,29 г, 2,07 ммоль).
К раствору 1-(циклогексилметил)-7-метокси-1H-индола (0,49 г, 2,03 ммоль) в 1,1,2,2-тетрахлорэтане (2,5 мл) при перемешивании в потоке азота добавляют оксалилхлорид (0,19 мл, 2,13 ммоль). Смесь нагревают при 120°C 2 часа. После охлаждения до комнатной температуры добавляют триэтиламин (0,30 мл, 2,13 ммоль), затем (R)-октагидро-2H-пиридо[1,2-a]пиразин (0,28 г, 2,03 ммоль) в виде раствора в 1,1,2,2-тетрахлорэтане (2 мл). Раствор перемешивают при комнатной температуре 2 часа. Затем добавляют раствор гидроксида натрия (1M; 8 мл) и полученную смесь распределяют между дихлорметаном (10 мл) и водой (10 мл). Органический слой экстрагируют, промывают водой (10 мл), сушат над сульфатом натрия и концентрируют. Полученное фиолетовое масло очищают флэш-хроматографией, используя в качестве элюента смесь, содержащую 98% дихлорметана и 2% метанола, и получают указанный в заголовке продукт в виде бледно-коричневого масла (245 мг, 0,60 ммоль). [α]D 22+13° (c 1,87 мг/мл в CHCl3);
1H ЯМР (400 МГц, CDCl3) δH 0,92-1,05 (2H, м), 1,12-1,36 (6H, м), 1,48-1,88 (9H, м), 1,93-1,98 (1H, м), 2,07 (1H, дт, J 11,5, 4,0), 2,24 (1H, дт, J 12,0, 3,0), 2,70-2,81 (3H, м), 2,84-2,86 (1H, м), 3,19-3,25 (2H, м), 3,93 (3H, с), 4,18 (2H, д, J 7,0), 4,18-4,32 (2H, м), 6,65 (1H, д, J 7,5), 7,07 (1H, дд, J 8,0, 7,5), 7,25 (1H, с), 7,29 (1H, д, J 8,0); EIMS: m/z=410,2 [M+H]+.
Пример 17
Способ, описанный в примере 16, далее используют для получения следующих соединений:
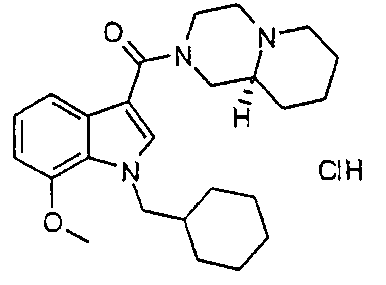
17A: гидрохлорид (S)-2-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-октагидро-2H-пиридо[1,2-a]пиразина получают, используя (S)-(-)-1-(трет-бутоксикарбонил)-2-пиперидинкарбоновую кислоту. [α]D 22-18 (свободное основание; c 4,05 мг/мл в CHCl3);
1H ЯМР (400 МГц, CDCl3) δH 0,99-1,08 (2H, м), 1,13-1,28 (3H, м), 1,50-2,03 (12H, м), 3,02-3,12 (1H, м), 3,13-3,30 (3H, м), 3,43-3,50 (3H, м), 3,95 (3H, с), 4,27 (2H, д, J 7,0), 4,49-4,59 (2H, м), 6,77 (1H, д, J 7,5), 7,11 (1H, дд, J 8,0, 7,5), 7,27 (1H, д, J 8,0), 7,54 (1H, с); EIMS: m/z=410,5 [M+H]+.
17B: (R)-2-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-октагидро-2H-пирроло[1,2-a]пиразин получают, используя (R)-(+)-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту.
1H ЯМР (400 МГц, CDCl3) δH 0,92-1,04 (2H, м), 1,13-1,21 (3H, м), 1,40-1,45 (1H, м), 1,57-1,89 (9H, м), 2,00-2,10 (1H, м), 2,15-2,29 (2H, м), 2,76-2,85 (1H, м), 3,02-3,23 (3H, м), 3,93 (3H, с), 4,18 (2H, д, J 7,0), 4,32-4,56 (2H, м), 6,67 (1H, д, J 7,0), 7,08 (1H, т, J 8,0), 7,25-7,30 (2H, м); EIMS: m/z=396,2 [M+H]+.
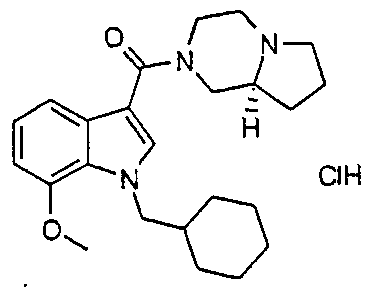
17C: гидрохлорид (S)-2-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-октагидро-2H-пирроло[1,2-a]пиразина получают, используя (S)-(-)-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту.
1H ЯМР свободного основания (400 МГц, CDCl3) δH 0,93-1,03 (2H, м), 1,11-1,21 (3H, м), 1,35-1,46 (1H, м), 1,56-1,89 (9H, м), 1,96-2,05 (1H, м), 2,21-2,27 (2H, м), 2,77 (1H, т, J 11,0), 3,07 (1H, д, J 10,5), 3,08-3,20 (2H, м), 3,93 (3H, с), 4,18 (2H, д, J 7,0), 4,26-4,41 (1H, м), 4,43-4,56 (1H, м), 6,65 (1H, д, J 8,0), 7,07 (1H, т, J 8,0), 7,25-7,30 (2H, м); EIMS: m/z=396,2 [M+H]+.
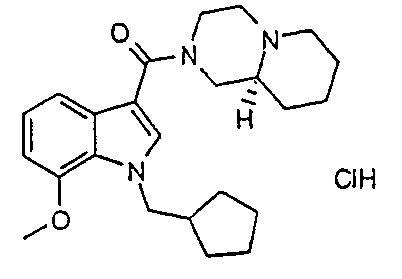
17D: гидрохлорид (S)-2-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-октагидро-2H-пиридо[1,2-a]пиразина получают, используя (S)-(-)-1-(трет-бутоксикарбонил)-2-пиперидинкарбоновую кислоту и 1-(циклопентилметил)-7-метокси-1H-индол.
1H ЯМР (400 МГц, CD3OD) δH 1,27-2,03 (14H, м), 2,41 (1H, гептет, J 7,0), 3,01-3,52 (7H, м), 3,95 (3H, с), 4,38 (2H, д, J 7,5), 4,52 (2H, дд, J 10,0, 7,0), 6,77 (1H, д, J 8,0), 7,1 (1H, т, J 8,0), 7,26 (1H, д, J 8,0), 7,6 (1H, с). EIMS: m/z=396,2 [M+H]+.
17E: гидрохлорид (S)-2-{[1-(циклопентилметил)-7-метокси-1H-индол-3-ил]карбонил}-октагидро-2H-пирроло[1,2-a]пиразина получают, используя (S)-(-)-1-(трет-бутоксикарбонил)-2-пирролидинкарбоновую кислоту и 1-(циклопентилметил)-7-метокси-1H-индол.
1H ЯМР (400 МГц, CDCl3) δH 1,21-1,23 (15H, м), 2,41 (1H, гептет, J 7,5), 2,75 (1H, т, J 11,0), 3,01-3,20 (3H, м), 3,94 (3H, с), 4,30 (2H, д, J 7,0), 4,32-4,53 (2H, м), 6,65 (1H, д, J 7,5), 7,07 (1H, т, J 7,5), 7,23-7,31 (2H, м). EIMS: m/z=382,2 [M+H]+.
17F: (3R,9R)-2-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-изобутилоктагидро-2H-пирроло[1,2-a]пиразин получают, используя (3R,9R)-октагидро-1,4-диоксо-2H-пирроло[1,2-a]пиразин (коммерчески доступный) вместо (R)-октагидро-1,4-диоксо-2H-пиридо[1,2-a]пиразина. EIMS: m/z=452,2 [M+H]+.
17G: (3S,9S)-2-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-метилоктагидро-2H-пирроло[1,2-a]пиразин получают, используя 1-(трет-бутоксикарбонил)пролин и гидрохлорид метилового эвира L-аланина. EIMS: m/z=410,0 [M+H]+.
17H: (2R,αS)-1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-2-(α-гидрокси)этил-4-метилпиперазин получают, используя 1-метил-1-(трет-бутоксикарбонил)глицин и гидрохлорид метилового эфира D-треонина. EIMS: m/z=414,2 [M+H]+.
17I: (2S,αR)-1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-2-(α-гидрокси)этил-4-метилпиперазин получают, используя 1-метил-1-(трет-бутоксикарбонил)глицин и гидрохлорид метилового эфира L-треонина. EIMS: m/z=414,2 [M+H]+.
17J: (S)-2-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3,3-диметилоктагидро-2H-пирроло[1,2-a]пиразин получают, используя 1-(трет-бутоксикарбонил)пролин и гидрохлорид метилового эфира аминоизомасляной кислоты.EIMS: m/z=424,2 [M+H]+.
Пример 18
Гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-(фторметил)пиперазина
К раствору этилового эфира 2,3-дибромпропионовой кислоты (21,91 мл, 150,7 ммоль) в толуоле (175 мл) при 40°C добавляют смесь N,N-дибензилэтилендиамина (35,87 г, 149,2 ммоль) и триэтиламина (37 мл, 269 ммоль) в толуоле (75 мл). Смесь нагревают до 80°C в течение 16 ч, фильтруют и осадок промывают толуолом (200 мл). Объединенные фильтраты промывают водой (2×200 мл), сушат сульфатом магния и упаривают, получая 1,4- этиловый эфир дибензилпиперазин-2-карбоновой кислоты (45,57 г) в виде оранжевого масла.
Алюмогидрид лития (1M раствор в тетрагидрофуране, 32 мл, 32 ммоль) при 0°C обрабатывают по каплям раствором этилового эфира 1,4-дибензилпиперазин-2-карбоновой кислоты (10 г, 32,1 ммоль) в тетрагидрофуране (30 мл) и перемешивают 16 часов. Смесь гасят, медленно добавляя раствор гидроксида натрия (4M, 150 мл) и затем дихлорметан (200 мл). Органическую фазу отделяют, сушат сульфатом натрия и упаривают, получая 1,4-дибензил-2-(гидроксиметил)пиперазин (8,36 г) в виде оранжевого масла.
К раствору трифторида диэтиламиносеры (1,5 мл, 12,16 ммоль) в дихлорметане (10 мл) при -72°C добавляют 1,4-дибензил-2-(гидроксиметил)пиперазин (3 г, 10,1 ммоль) в дихлорметане (20 мл) в течение 10 минут. Смесь перемешивают 16 часов, пока она не нагреется до комнатной температуры, и обрабатывают водой (20 мл). Водную фазу подщелачивают до pH 9, используя 4M раствор гидроксида натрия, и органическую фазу отделяют. Водную фазу экстрагируют дихлорметаном (2×30 мл) и объединенные органические слои сушат сульфатом натрия и упаривают. Остаток очищают флэш-хроматографией, элюируя 20% (об./об.) раствором этилацетата в гексане, и получают 1,4-дибензил-2-(фторметил)пиперазин (0,94 г) в виде бесцветного масла.
К взвеси палладия на угле (10% масс./масс., 1 г) в этаноле (20 мл) добавляют 1,4-дибензил-2-(фторметил)пиперазин (2,98 г, 10 ммоль) в этаноле (20 мл). Смесь нагревают до 65°C в атмосфере водорода (5 атм.) в течение 72 часов, фильтруют через дикалит, и дикалит промывают этанолом (50 мл). Фильтраты упаривают, получая 2-(фторметил)пиперазин (0,97 г) в виде бесцветного твердого вещества.
К раствору 1-(циклогексил)метил-7-метоксииндол-3-карбоновой кислоты (0,59 г, 2,04 ммоль, полученной по способу примера 1) и 2-(фторметил)пиперазина (0,37 г, 3,15 ммоль) в дихлорметане (15 мл) добавляют гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,47 г, 2,45 ммоль) и 1-гидроксибензотриазол (0,07 г, 0,51 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов и упаривают. Остаток очищают флэш-хроматографией, элюируя 0-10% (об./об.) раствором метанола в дихлорметане, и получают указанное в заголовке соединение (свободное основание) в виде бесцветного масла (0,47 г). Свободное основание (0,05 г) растворяют в диэтиловом эфире (3 мл) и по каплям добавляют 2M раствор хлористоводородной кислоты в диэтиловом эфире (1 мл). Полученный осадок собирают фильтрацией, промывают диэтиловым эфиром (10 мл) и сушат при пониженном давлении, получая указанное в заголовке соединение (1:1 соль хлористоводородной кислоты) в виде бесцветного твердого вещества (0,05 г, 0,12 ммоль).
1H ЯМР (400 МГц, CD3OD) δH 0,98-1,27 (5H, м), 1,57 (2H, шир. д, J 12,9), 1,63-1,90 (4H, м), 3,21-3,53 (4H, м), 3,68-3,79 (1H, м), 3,95 (3H, с), 4,26 (2H, д, J 7,1), 4,43-4,82 (4H, м), 6,77 (1H, д, J 7,7), 7,11 (1H, т, J 7,5), 7,27 (1H, д, J 8,0), 7,57 (1H, с); EIMS: m/z 270,2 [фрагмент+H]+.
Пример 19
Гидрохлорид 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-(фторметил)-4-циклопропилпиперазина
К раствору 1-{[1-(циклогексилметил)-7-метокси-1H-индол-3-ил]карбонил}-3-(фторметил)пиперазина (0,2 г, 0,52 ммоль, полученного по способу примера 18) в метаноле (10 мл) добавляют уксусную кислоту (0,18 мл, 3,1 ммоль), 4Å-молекулярные сита (1 г), [(1-этоксициклопропил)окси]триметилсилан (0,62 мл, 3,1 ммоль) и цианоборгидрид натрия (0,15 г, 2,33 ммоль). Смесь нагревают до 70°C в течение 18 ч, фильтруют и осадок промывают дихлорметаном (20 мл) и метанолом (20 мл). Фильтраты упаривают, растворяют в дихлорметане (30 мл) и промывают раствором гидроксида натрия (4M, 15 мл) и насыщенным раствором хлорида натрия (15 мл). Органическую фазу сушат сульфатом натрия, упаривают и остаток очищают флэш-хроматографией, элюируя 2% (об./об.) раствором метанола в дихлорметане, и получают указанное в заголовке соединение (свободное основание) в виде желтого масла (0,2 г). Свободное основание растворяют в диэтиловом эфире (3 мл) и по каплям добавляют 2M раствор хлористоводородной кислоты в диэтиловом эфире (1 мл). Полученный осадок собирают фильтрацией, промывают диэтиловым эфиром (10 мл) и сушат при пониженном давлении, получая указанное в заголовке соединение (1:1 соль хлористоводородной кислоты) в виде бесцветного твердого вещества (0,2 г, 0,43 ммоль).
1H ЯМР (400 МГц, CD3OD) δH 0,91-1,25 (9H, м), 1,57 (2H, шир. д, J 12,6), 1,62-1,91 (4H, м), 2,8-2,93 (1H, м), 3,33-3,82 (5H, м), 3,96 (3H, с), 4,27 (2H, д, J 7,0), 4,43-4,86 (3H, м), 5,10-5,31 (1H, м), 6,77 (1H, д, J 7,3), 7,11 (1H, т, J 8,1), 7,28 (1H, д, J 8,1), 7,56 (1H, с); EIMS: m/z=428,2 [M+H]+.
Пример 20
Определение работоспособности и активности человеческого рецептора CB1, экспрессированного в клетках CHO, in-vitro
Клетки яичника китайского хомячка (CHO), экспрессирующие человеческий рецептор CB1 и репортерный ген люциферазы, суспендируют в смеси феноловый красный/DMEM, не содержащая сыворотки,/F-12 Nut, которая содержит пенициллин/стрептомицин (50 ед./50 мкг/мл) и фунгизон (1 мкг/мл), и высевают в 96-луночные планшеты, получая плотность 3×104 клеток на лунку (конечный объем 100 мкл). Перед анализом клетки инкубируют в течение ночи (приблизительно 18 ч при 37°C, 5% CO2/95% воздух).
Анализируемое соединение (10 мМ раствор в ДМСО) разбавляют смесью F12 Nut, получая исходные растворы с концентрацией от 0,11 мМ до 0,11 нМ. Исходные растворы (10 мкл) добавляют непосредственно в соответствующие лунки. Планшеты инкубируют при 37°C в течение 5 часов, чтобы обеспечить индуцированную агонистом экспрессию фермента люциферазы. В приглушенном свете в каждую лунку добавляют субстрат LucLite (Packard; восстановленный в соответствии с инструкциями производителя; 100 мкл). Планшеты сверху закрывают и затем инкубируют при комнатной температуре в течение 5 минут, после чего считывают на Packard TopCount (однофотонный счет, время счета 0,01 минута, задержка счета 5 минут).
Кривая наилучшего приближения подгоняется по методу минимальной суммы квадратов к графику зависимости количества импульсов в секунду (CPS - counts per second) от концентрации соединения (M) для получения значения EC50. В таблице 1 приведены значения pEC50, полученные для некоторых типичных соединений данного изобретения.
Пример 21: Задержка отдергивания хвоста у мышей (тест Tail Flick)
Мышей приучают спокойно сидеть в аппарате для проведения теста Tail Flick (Ugo Basile, Italy) во время измерения задержки отдергивания хвоста. На хвост воздействуют сфокусированным тепловым лучом на расстоянии приблизительно 2,5 см от кончика. Задержку отдергивания хвоста определяют как интервал времени между воздействием теплового стимула и отдергиванием хвоста. Для предотвращения повреждения ткани делают 12-секундный перерыв. Четырем группам по восемь мышей вводят внутривенно среду или одну из трех доз анализируемого соединения (среда: физиологический раствор 9 г/л; объем инъекции 10 мл/кг). Задержку отдергивания хвоста измеряют перед введением анализируемого соединения и через равные промежутки времени (обычно через 20, 40 и 60 минут) после введения соединения. ED50 рассчитывают при Tмакс. Соединения примеров 14, 15F, 15О, 17A, 17C и 17D значительно увеличивают задержку отдергивания хвоста с ED50 <5 мкмоль/кг.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ (ИНДОЛ-3-ИЛ)ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ В КАЧЕСТВЕ АГОНИСТОВ КАННАБИНОИДНЫХ РЕЦЕПТОРОВ СВ1 | 2005 |
|
RU2376302C2 |
| АЗЕТИДИНИЛДИАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ МОНОАЦИЛГЛИЦЕРИН-ЛИПАЗЫ | 2010 |
|
RU2569298C2 |
| АЗЕТИДИНИЛДИАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ МОНОАЦИЛГЛИЦЕРИН-ЛИПАЗЫ | 2010 |
|
RU2549547C2 |
| ПРОЛЕКАРСТВА СОПРЯЖЕННО-БИЦИКЛИЧЕСКИХ АНТАГОНИСТОВ C5aR | 2019 |
|
RU2794327C2 |
| АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ТРОМБОТИЧЕСКИХ ЗАБОЛЕВАНИЙ | 1995 |
|
RU2156763C2 |
| СПИРОПИПЕРИДИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 1993 |
|
RU2168512C2 |
| ПРОИЗВОДНЫЕ 3-КАРБОКСИПРОПИЛ-АМИНОТЕТРАЛИНА И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АНТАГОНИСТОВ MU-ОПИОИДНОГО РЕЦЕПТОРА | 2008 |
|
RU2482107C2 |
| ЗАМЕЩЕННЫЕ ПИРРОЛИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА XIA ДЛЯ ЛЕЧЕНИЯ ТРОМБОЭМБОЛИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2636050C2 |
| ДИСПИРОПИРРОЛИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2012 |
|
RU2612534C2 |
| НОВЫЕ КОНДЕНСИРОВАННЫЕ ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ ДЛЯ ИНГИБИРОВАНИЯ ТИРОЗИНКИНАЗНОЙ АКТИВНОСТИ | 2011 |
|
RU2585177C2 |
Описывается производное 1-[(индол-3-ил)карбонил]пиперазина формулы (I), где R обозначает заместитель, выбранный из Н, (С1-4)алкила, (С1-4)алкилокси (необязательно замещенного галогеном), галогена, ОН, NH2, CN и NO2; R1 обозначает (С5-8)циклоалкил или (C5-8) циклоалкенил; R2 обозначает Н, метил или этил; R3, R3', R4, R4', R5, R5' и R6' независимо обозначают водород или (C1-4)алкил, необязательно замещенный галогеном или ОН; R6 обозначает водород или (С1-4)алкил, необязательно замещенный (С1-4)алкилокси или галогеном; или R6 вместе с R7 образует 5-6-членное насыщенное гетероциклическое кольцо; R7 обозначает Н, (С1-4)алкил, необязательно замещенный ОН, галогеном или (C1-4)алкилокси, или (С3-5) циклоалкил; или его фармацевтически приемлемая соль. Соединения формулы (I) обладают агонистической активностью в отношении СВ1 рецептора. Описываются также фармацевтическая композиция, обладающая агонистической активностью в отношении СВ1 рецептора, и применения соединения формулы (I) для получения лекарственного средства для лечения боли. 3 н. и 6 з.п. ф-лы, 1 табл.
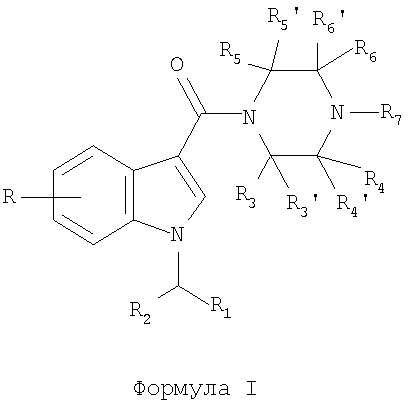
где R обозначает заместитель, выбранный из Н, (С1-4)алкила, (C1-4)алкилокси (необязательно замещенного галогеном), галогена, ОН, NH2, CN и NO2;
R1 обозначает (С5-8)циклоалкил или (С5-8)циклоалкенил;
R2 обозначает Н, метил или этил;
R3, R3', R4, R4', R5, R5' и R6' независимо обозначают водород или (C1-4)алкил, необязательно замещенный галогеном или ОН;
R6 обозначает водород или (С1-4)алкил, необязательно замещенный (C1-4)алкилокси или галогеном; или
R6 вместе с R7 образует 5-6-членное насыщенное гетероциклическое кольцо;
R7 обозначает Н, (С1-4)алкил, необязательно замещенный ОН, галогеном или (С1-4)алкилокси, или (С3-5) циклоалкил; или
его фармацевтически приемлемая соль.
1-{[1-(циклогексилметил)-7-метокси-1Н-индол-3-ил]карбонил}-3,5-диметил-4-этилпиперазина;
1-{[1-(циклогексилметил)-7-метокси-1Н-индол-3-ил]карбонил}-3,4,5-триметилпиперазина;
(S)-1-{[1-(циклогексилметил)-7-метокси-1Н-индол-3-ил]карбонил}-3,4-диметилпиперазина;
(S)-2-{[1-(циклогексилметил)-7-метокси-1Н-индол-3-ил]карбонил}октагидро-2Н-пиридо[1,2-а]пиразина;
(S)-2-{[1-(циклогексилметил)-7-метокси-1Н-индол-3-ил]карбонил}октагидро-2Н-пирроло[1,2-а]пиразина; и
(S)-2-{[1-(циклопентилметил)-7-метокси-1Н-индол-3-ил]карбонил}октагидро-2Н-пиридо[1,2-а]пиразина;
или их фармацевтически приемлемых солей.
| 0 |
|
SU158869A1 | |
| ДИАРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ | 1992 |
|
RU2099335C1 |
| MEDICINAL CHEMISTRY LETTERS, vol.4, №4, 1994, 563-566, abstracts | |||
| YORNAL OF MEDICINAL CHEMISTRY, v.38, №16, 1995, 3094-3105, abstracts. | |||
Авторы
Даты
2008-03-10—Публикация
2003-06-13—Подача