Родственные заявки
Настоящая заявка испрашивает приоритет согласно предварительной заявки США №62/268765, поданной 17 декабря 2015 года, и предварительной заявки США №62/353603, поданной 23 июня 2016 года. Содержание вышеуказанных заявок включено в настоящую заявку посредством ссылки во всей их полноте.
Область техники, к которой относится изобретение
Настоящее изобретение обеспечивает соединения формулы (I) в качестве антагонистов toll-подобного рецептора 7/8 (TLR7/8) и их применение в лечении иммунных расстройств и других заболеваний, связанные с чрезмерной экспрессией TLR7/8.
Предпосылки создания изобретения
Toll-подобные рецепторы (TLR), на данный момент включающие семейство генов 10 рецепторов с разной специфичностью, являются частью системы распознавания клеточного патогенного паттерна, которая сформировалась для защиты против различных инфекций (бактерий, вирусов, грибов). Активация TLRs приводит к ответам цитокинов, например, с высвобождением интерферонов и активацией специфических иммунных клеток. Функциональная экспрессия определенных TLR в тканях сильно различается. Часть рецепторов расположена на клеточной поверхности, такие как TLR4 (стимулируемых липополисахаридами LPS E. coli), например, на эпителиальных клетках, или TLR3, 7, 8 и 9, находящиеся на эндосомальных мембранах в определенных иммунных клетках. Последние все активируются нуклеиновыми кислотами, но распознают их различные типы. Например, TLR9 активируется одноцепочечной ДНК, содержащей CpG субпоследовательности, TLR7 и 8 активируются одноцепочечной РНК, и TLR3 активируется двухцепочечной РНК.
TLR вовлечены в различные аутоиммунные и воспалительные заболевания, при этом самым наглядным примером является роль, которую играет TLR7 в патогенезе системной красной волчанки (Barrat and Coffman, Immunol Rev, 223:271-283, 2008). Кроме того, полиморфизм TLR8 ассоциирован с ревматоидным артритом (Enevold et al., J Rheumatol, 37:905-10, 2010). Хотя были описаны различные ингибиторы TLR7, TLR8 и TLR9, желательны дополнительные ингибиторы TLR. В частности, полинуклеотиды, содержащие ингибиторные мотивы для одного или нескольких из TLR7, TLR8 и TLR9, необходимы для точного ингибирования иммунного ответа у субъекта (например, пациента, имеющего аутоиммунное заболевание или воспалительное расстройство).
В течение нескольких лет во всем мире предпринимаются активные усилия использовать сильную иммунную активацию, индуцируемую агонистами TLR7, 8 или 9, для лечения рака. Однако иммунотерапия рака имела долгую историю неудач. Однако поэтому в последние годы знания о иммуннологическом надзоре для выявления рака и функции субпопуляций иммунных клеток были значительно улучшены. Агонисты TLR7 или TLR9 находятся в стадии клинических исследований для моно- или комбинированных терапий рака или в качестве адъюванта вакцины. Подход с использованием агонистов TLR для иммунотерапии рака отличается от предыдущих попыток с использованием, например, цитокинов, интерферонов или моновалентных вакцин. TLR агонист-опосредованная иммунная активация является плейотропной через специфические иммунные клетки (в основном дендритные клетки и В-клетки, а затем другие клетки), которая генерирует врожденный и адаптивный иммунный ответ. Кроме того, индуцируется не только один интерферон, но многие различные изоформы все вместе, и не только тип I (альфа, бета), но также (опосредованно) тип II (гамма, NK-клетки).
Сущность изобретения
В одном аспекте изобретение обеспечивает соединения формулы (I):
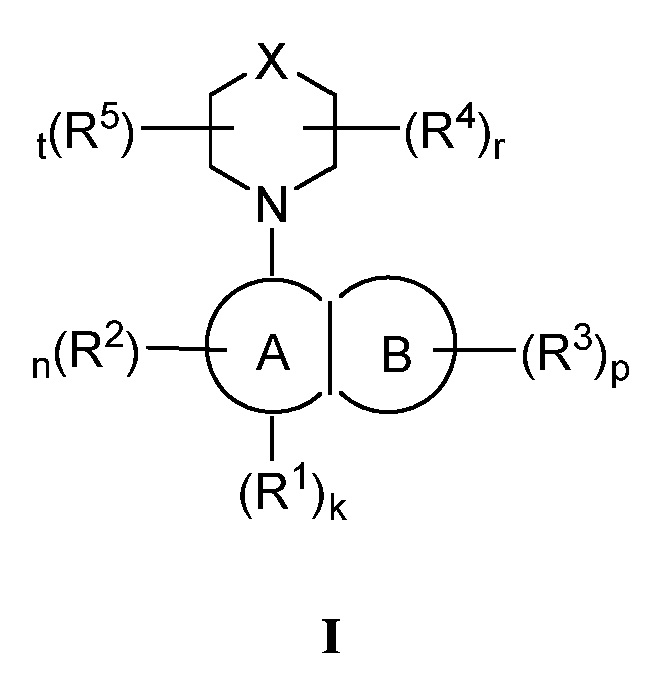
и их фармацевтически приемлемые производные, сольваты, соли, гидраты и стереоизомеры.
В другом аспекте изобретение обеспечивает соединения формулы (I), которые являются двойными антагонистами TLR7 и TLR8. В другом аспекте изобретение обеспечивает соединения формулы (I), которые являются подходящими для лечения и/или профилактики расстройств, связанных с TLR7/8. В другом аспекте изобретение обеспечивает соединения, которые способны модулировать, в частности, ингибировать активность или функцию TLR7/8 в болезненных состояниях у млекопитающих, особенно у человека.
В соответствии с другим аспектом изобретения, обеспечиваются способы для лечения и/или профилактики аутоиммунных расстройств.
В соответствии с другим аспектом, настоящее изобретение обеспечивает соединения формулы (I), которые являются селективными в отношении TLR7 или TLR8.
В соответствии с другим аспектом, настоящее изобретение обеспечивает соединения формулы (I), которые являются селективными в отношении TLR7 и TLR8.
Подробное описание некоторых вариантов осуществления
1. Общее описание соединений по изобретению
В некоторых аспектах настоящее изобретение обеспечивает антагонисты TLR7/8. В некоторых вариантах осуществления такие соединения включают соединения формул, описанных в настоящей заявке, или их фармацевтически приемлемые соли, где каждая переменная имеет значение, определенное и описанное в настоящей заявке.
2. Соединения и определения
Соединения по настоящему изобретению включают соединения, описанные в общем виде выше и далее проиллюстрированные классами, подклассами и видами, раскрытыми в настоящей заявке. В контексте настоящей заявки, применяются следующие определения, если не указано иное. Для целей настоящего изобретения химические элементы указаны в соответствии с Периодической Таблицей Элементов, CAS version, Handbook of Chemistry and Physics, 75th Ed. Кроме того, общие принципы органической химии описаны в “Organic Chemistry”, Thomas Sorrell, University Science Books, Sausalito: 1999 и “March's Advanced Organic Chemistry”, 5th Ed., Ed.: Smith, M.B. и March, J., John Wiley & Sons, New York: 2001, полное содержание которых включено в настоящую заявку посредством ссылки.
Термин “алифатический” или “алифатическая группа”, в контексте настоящей заявки, означает линейную (т.е. неразветвленную) или разветвленную, замещенную или незамещенную углеводород цепь, которая является полностью насыщенной или которая содержит одну или несколько единиц ненасыщенности, или моноциклический углеводород или бициклический углеводород, который является полностью насыщенным или который содержит одну или несколько единиц ненасыщенности, но который не является ароматическим (также указан в настоящей заявке как “карбоцикл” “циклоалифатический” или “циклоалкил”), который имеет одну точку присоединения к остальной части молекулы. Если не указано иное, алифатические группы содержат 1-6 алифатических атомов углерода. В некоторых вариантах осуществления алифатические группы содержат 1-5 алифатических атомов углерода. В других вариантах осуществления алифатические группы содержат 1-4 алифатических атомов углерода. В некоторых других вариантах осуществления алифатические группы содержат 1-3 алифатических атомов углерода, и еще в некоторых вариантах осуществления алифатические группы содержат 1-2 алифатических атомов углерода. В некоторых вариантах осуществления “циклоалифатический” (или “карбоцикл” или “циклоалкил”) относится к моноциклическому C3-C6 углеводороду, который является полностью насыщенным или который содержит одну или несколько единиц ненасыщенности, но который не является ароматическим, который имеет одну точку присоединения к остальной части молекулы. Примеры алифатических групп включают линейные или разветвленные, замещенные или незамещенные C1-C8 алкильные, C2-C8 алкенильные, C2-C8 алкинильные группы и их комбинации, такие как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил.
Термин “низший алкил” относится к C1-4 линейной или разветвленной алкильной группе. Примеры низших алкильных групп включают метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил.
Термин “низший галогеналкил” относится к C1-4 линейной или разветвленной алкильной группе, которая замещена одним или несколькими атомами галогена.
Термин “гетероатом” означает один или несколько из кислорода, серы, азота или фосфора (включая, любую окисленную форму азота, серы или фосфора; кватернизированную форму любого  азота или; замещаемый азот гетероциклического кольца, например, N (как в 3,4-дигидро-2H-пирролиле), NH (как в пирролидиниле) или NR+ (как в N-замещенном пирролидиниле)).
азота или; замещаемый азот гетероциклического кольца, например, N (как в 3,4-дигидро-2H-пирролиле), NH (как в пирролидиниле) или NR+ (как в N-замещенном пирролидиниле)).
Термин “ненасыщенный”, в контексте настоящей заявки, означает, что группа имеет одну или несколько единиц ненасыщенности.
В контексте настоящей заявки термин “двухвалентная C1-8 (или C1-6) насыщенная или ненасыщенная, линейная или разветвленная углеводородная цепь”, относится к двухвалентным алкиленовым, алкениленовым и алкиниленовым цепям, которые являются линейными или разветвленными, как определено в настоящей заявке.
Термин “алкилен” относится к двухвалентной алкильной группе. “Алкиленовая цепь” представляет собой полиметиленовую группу, т.е. -(CH2)n-, где n представляет собой целое положительное число, предпочтительно от 1 до 6, от 1 до 4, от 1 до 3, от 1 до 2 или от 2 до 3. Замещенная алкиленовая цепь представляет собой полиметиленовую группу, в которой один или несколько атомов водорода метилена замещены заместителем. Подходящие заместители включают такие, которые описаны ниже для замещенной алифатической группы.
Термин “алкенилен” относится к двухвалентной алкенильной группе. Замещенная алкениленовая цепь представляет собой полиметиленовую группу, содержащую по меньшей мере одну двойную связь, в которой один или несколько атомов водорода замещены заместителем. Подходящие заместители включают такие, которые описаны ниже для замещенной алифатической группы.
Термин “галоген” означает F, Cl, Br или I.
Термин “арил”, используемый отдельно или как часть более крупной группы, как в “аралкиле”, “аралкокси” или “арилоксиалкиле”, относится к моноциклическим и бициклическим кольцевым системам, содержащим в общей сложности от пяти до четырнадцати кольцевых членов, где по меньшей мере одно кольцо в системе является ароматическим, и где каждое кольцо в системе содержит три-семь кольцевых членов. Термин “арил” используется взаимозаменяемо с термином “арильное кольцо”. В некоторых вариантах осуществления настоящего изобретения “арил” относится к ароматической кольцевой системе. Примеры арильных групп включают фенил, бифенил, нафтил, антрацил и т.п., которые необязательно включают один или несколько заместителей. Также объемом термина “арил”, как он используется в настоящей заявке, охватывается группа, в которой ароматическое кольцо является конденсированным с одним или несколькими неароматическими кольцами, такими как инданил, фталимидил, нафтимидил, фенантридинил или тетрагидронафтил и т.п.
Термины “гетероарил” и “гетероар-“, используемый отдельно или как часть более крупной группы, например, “гетероаралкила” или “гетероаралкокси”, относятся к группам, содержащим 5-10 кольцевых атомов, предпочтительно 5, 6 или 9 кольцевых атомов; содержащим 6, 10 или 14 π электронов, распределенных в циклической структуре; и содержащим, помимо атомов углерода, от одного до пяти гетероатомов. Термин “гетероатом” относится к азоту, кислороду или сере и включает любую окисленную форму азота или серы и любую кватернизированную форму  азота. Гетероарильные группы включают, без ограничения, тиенил, фуранил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, индолизинил, пуринил, нафтиридинил и птеридинил. Термины “гетероарил” и “гетероар-“, в контексте настоящей заявки, также включают группы, в которых гетероароматическое кольцо конденсировано с одним или несколькими арильными, циклоалифатическими или гетероциклильными кольцами, где радикал или точка присоединения находится на гетероароматическом кольце. Неограничивающие примеры включают индолил, изоиндолил, бензотиенил, бензофуранил, дибензофуранил, индазолил, бензимидазолил, бензтиазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, 4H-хинолизинил, карбазолил, акридинил, феназинил, фенотиазинил, феноксазинил, тетрагидрохинолинил, тетрагидроизохинолинил и пиридо[2,3-b]-1,4-оксазин-3(4H)-он. Гетероарильная группа необязательно является моно- или бициклической. Термин “гетероарил” используется взаимозаменяемо с терминами “гетероарильное кольцо”, “гетероарильная группа” или “гетероароматический”, при этом любой из этих терминов включает кольца, которые необязательно замещены. Термин “гетероаралкил” относится к алкильной группе, замещенной гетероарилом, где алкильная и гетероарильная части независимо являются необязательно замещенными.
азота. Гетероарильные группы включают, без ограничения, тиенил, фуранил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, индолизинил, пуринил, нафтиридинил и птеридинил. Термины “гетероарил” и “гетероар-“, в контексте настоящей заявки, также включают группы, в которых гетероароматическое кольцо конденсировано с одним или несколькими арильными, циклоалифатическими или гетероциклильными кольцами, где радикал или точка присоединения находится на гетероароматическом кольце. Неограничивающие примеры включают индолил, изоиндолил, бензотиенил, бензофуранил, дибензофуранил, индазолил, бензимидазолил, бензтиазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, 4H-хинолизинил, карбазолил, акридинил, феназинил, фенотиазинил, феноксазинил, тетрагидрохинолинил, тетрагидроизохинолинил и пиридо[2,3-b]-1,4-оксазин-3(4H)-он. Гетероарильная группа необязательно является моно- или бициклической. Термин “гетероарил” используется взаимозаменяемо с терминами “гетероарильное кольцо”, “гетероарильная группа” или “гетероароматический”, при этом любой из этих терминов включает кольца, которые необязательно замещены. Термин “гетероаралкил” относится к алкильной группе, замещенной гетероарилом, где алкильная и гетероарильная части независимо являются необязательно замещенными.
В контексте настоящей заявки термины “гетероцикл”, “гетероциклил”, “гетероциклический радикал” и “гетероциклическое кольцо” используются взаимозаменяемо и относятся к стабильной 5-7-членной моноциклической или 7-10-членной бициклической гетероциклической группе, которая является либо насыщенной, либо частично ненасыщенной, и содержит, помимо атомов углерода, один или несколько, предпочтительно один-четыре гетероатома, определенных выше. При использовании в связи с кольцевым атомом гетероцикла, термин “азот” включает замещенный азот. В качестве примера, в насыщенном или частично ненасыщенном кольце, содержащем 0-3 гетероатома, выбранных из кислорода, серы или азота, азот представляет собой N (как в 3,4-дигидро-2H-пирролиле), NH (как в пирролидиниле) или +NR (как в N-замещенном пирролидиниле).
Гетероциклическое кольцо может быть связано с его боковой группой по любому гетероатому или атому углерода, который приводит к стабильной структуре, и любой из кольцевых атомов может быть необязательно замещенным. Примеры таких насыщенных или частично ненасыщенных гетероциклических радикалов включают, без ограничения, тетрагидрофуранил, тетрагидротиофенил пирролидинил, пиперидинил, пирролинил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, оксазолидинил, пиперазинил, диоксанил, диоксоланил, диазепинил, оксазепинил, тиазепинил, морфолинил и хинуклидинил. Термины “гетероцикл”, “гетероциклил”, “гетероциклильное кольцо”, “гетероциклическая группа”, “гетероциклический фрагмент” и “гетероциклический радикал”, используются взаимозаменяемо в настоящей заявке и также включают группы, в которых гетероциклильное кольцо конденсировано с одним или несколькими арильными, гетероарильными или циклоалифатическими кольцами, такие как индолинил, 3H-индолил, хроманил, фенантридинил или тетрагидрохинолинил, где радикал или точка присоединения находится на гетероциклильном кольце. Гетероциклильная группа необязательно является моно- или бициклической. Термин “гетероциклилалкил” относится к алкильной группе, замещенной гетероциклилом, где алкильная и гетероциклильная части независимо необязательно замещены.
В контексте настоящей заявки, термин “частично ненасыщенный” относится к кольцевой группе, которая включает по меньшей мере одну двойную или тройную связь. Термин “частично ненасыщенный” предназначен для охвата колец, содержащих несколько участков ненасыщенности, но не предусматривает включение арильных или гетероарильных групп, как они определены в настоящей заявке.
Как описано в настоящей заявке, некоторые соединения по изобретению содержат “необязательно замещенные” группы. Как правило, термин “замещенный”, независимо от того, предшествует ему термин “необязательно” или нет, означает, что один или несколько водородов указанной группы замещены подходящим заместителем. “Замещенный” относится к одному или нескольким водородам, которые либо определенно указаны, либо подразумеваются из структуры (например, 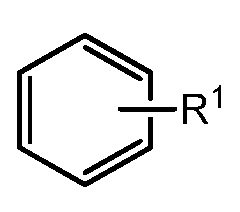 относится к по меньшей мере
относится к по меньшей мере 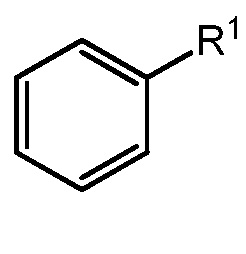 ; и
; и  относится к по меньшей мере
относится к по меньшей мере  ,
,
 или
или  . Если не указано иное, “необязательно замещенная” группа содержит подходящий заместитель в каждом замещаемом положении группы, и когда более чем одно положение в какой-либо конкретной структуре замещено более чем одним заместителем, выбранным из указанной группы, заместители в каждом положении являются либо одинаковыми, либо отличными друг от друга. Комбинации заместителей, предусматриваемые настоящим изобретением, предпочтительно являются такими, которые приводят к образованию стабильных или химически возможных соединений. Термин “стабильный”, в контексте настоящей заявки, относится к соединениям, которые по существу не изменяются, когда их подвергают условиям, делающим возможными их получение, детекцию и, в некоторых вариантах осуществления, их выделение, очистку и применение по одному или нескольким из назначений, раскрытых в настоящей заявке.
. Если не указано иное, “необязательно замещенная” группа содержит подходящий заместитель в каждом замещаемом положении группы, и когда более чем одно положение в какой-либо конкретной структуре замещено более чем одним заместителем, выбранным из указанной группы, заместители в каждом положении являются либо одинаковыми, либо отличными друг от друга. Комбинации заместителей, предусматриваемые настоящим изобретением, предпочтительно являются такими, которые приводят к образованию стабильных или химически возможных соединений. Термин “стабильный”, в контексте настоящей заявки, относится к соединениям, которые по существу не изменяются, когда их подвергают условиям, делающим возможными их получение, детекцию и, в некоторых вариантах осуществления, их выделение, очистку и применение по одному или нескольким из назначений, раскрытых в настоящей заявке.
Подходящие одновалентные заместители на замещаемом атоме углерода “необязательно замещенной” группы независимо представляют собой дейтерий; галоген; -(CH2)0-4R°; -(CH2)0-4OR°; -O(CH2)0-4Ro, -O-(CH2)0-4C(O)OR°; -(CH2)0-4CH(OR°)2; -(CH2)0-4SR°; -(CH2)0-4Ph, которые необязательно замещены группой R°; -(CH2)0-4O(CH2)0-1Ph, который необязательно замещен группой R°; -CH=CHPh, который необязательно замещен группой R°; -(CH2)0-4O(CH2)0-1-пиридил, который необязательно замещен группой R°; -NO2; -CN; -N3; -(CH2)0-4N(R°)2; -(CH2)0-4N(R°)C(O)R°; -N(R°)C(S)R°; -(CH2)0-4N(R°)C(O)NR°2; -N(R°)C(S)NR°2; -(CH2)0-4N(R°)C(O)OR°; -N(R°)N(R°)C(O)R°; -N(R°)N(R°)C(O)NR°2; -N(R°)N(R°)C(O)OR°; -(CH2)0-4C(O)R°; -C(S)R°; -(CH2)0-4C(O)OR°; -(CH2)0-4C(O)SR°; -(CH2)0-4C(O)OSiR°3; -(CH2)0-4OC(O)R°; -OC(O)(CH2)0-4SR°, SC(S)SR°; -(CH2)0-4SC(O)R°; -(CH2)0-4C(O)NR°2; -C(S)NR°2; -C(S)SR°; -SC(S)SR°, -(CH2)0-4OC(O)NR°2; -C(O)N(OR°)R°; -C(O)C(O)R°; -C(O)CH2C(O)R°; -C(NOR°)R°; -(CH2)0-4SSR°; -(CH2)0-4S(O)2R°; -(CH2)0-4S(O)2OR°; -(CH2)0-4OS(O)2R°; -S(O)2NR°2; -(CH2)0-4S(O)R°; -N(R°)S(O)2NR°2; -N(R°)S(O)2R°; -N(OR°)R°; -C(NH)NR°2; -P(O)2R°; -P(O)R°2; -OP(O)R°2; -OP(O)(OR°)2; SiR°3; -(C1-4 линейный или разветвленный алкилен)O-N(R°)2; или -(C1-4 линейный или разветвленный алкилен)C(O)O-N(R°)2, где каждый R° необязательно является является замещенным, как определено ниже, и независимо представляет собой водород, C1-6 алифатическую группу, -CH2Ph, -O(CH2)0-1Ph, -CH2-(5-6-членное гетероарильное кольцо) или 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы, или, независимо от определения выше, два независимо присутствующих R°, взятые вместе с их промежуточным атомом(атомами), образуют 3-12-членное насыщенное, частично ненасыщенное или арильное моно- или бициклическое кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы, которое необязательно является замещенным, как определено ниже.
Подходящие одновалентные заместители на R° (или кольце, образованном взятыми вместе двумя независимо присутствующими R° с их промежуточными атомами) независимо представляют собой дейтерий, галоген, -(CH2)0-2R•, -(галогенR•), -(CH2)0-2OH, -(CH2)0-2OR•, -(CH2)0-2CH(OR•)2; -O(галогенR•), -CN, -N3, -(CH2)0-2C(O)R•, -(CH2)0-2C(O)OH, -(CH2)0-2C(O)OR•, -(CH2)0-2SR•, -(CH2)0-2SH, -(CH2)0-2NH2, -(CH2)0-2NHR•, -(CH2)0-2NR•2, -NO2, -SiR•3, -OSiR•3, -C(O)SR•, -(C1-4 линейный или разветвленный алкилен)C(O)OR• или -SSR•, где каждый R• является незамещенным или, если ему предшествует термин ʺгалогенʺ, замещен только одним или несколькими галогенами, и независимо выбран из C1-4 алифатической группы, -CH2Ph, -O(CH2)0-1Ph или 5-6-членного насыщенного частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители на насыщенном атоме углерода R° включают =O и =S.
Подходящие двухвалентные заместители на насыщенном атоме углерода “необязательно замещенной” группы включают следующие: =O, =S, =NNR*2, =NNHC(O)R*, =NNHC(O)OR*, =NNHS(O)2R*, =NR*, =NOR*, -O(C(R*2))2-3O- или -S(C(R*2))2-3S-, где в каждом независимом случае R* выбран из водорода, C1-6 алифатической группы, которая замещена, как определено ниже, или незамещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители, которые связаны с вицинальными замещаемыми углеродами “необязательно замещенной” группы, включают: -O(CR*2)2-3O-, где в каждом независимом случае R* выбран из водорода, C1-6 алифатической группы, которая необязательно замещена, как определено ниже, или незамещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Подходящие заместители на алифатической группе R* включают галоген, -R•, -(галогенR•), -OH, -OR•, -O(галогенR•), -CN, -C(O)OH, -C(O)OR•, -NH2, -NHR•, -NR•2 или -NO2, где каждый R• является незамещенным или, если ему предшествует термин “галоген”, замещен только одним или несколькими галогенами, и независимо представляет собой C1-4 алифатическую группу, -CH2Ph, -O(CH2)0-1Ph или 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Подходящие заместители на замещаемом азоте “необязательно замещенной” группы включают -R†, -NR†2, -C(O)R†, -C(O)OR†, -C(O)C(O)R†, -C(O)CH2C(O)R†, -S(O)2R†, -S(O)2NR†2, -C(S)NR†2, -C(NH)NR†2 или -N(R†)S(O)2R†; где каждый R† независимо представляет собой водород, C1-6 алифатическую группу, которая необязательно замещена, как определено ниже, незамещенный -OPh или незамещенное 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы, или, независимо от определения выше, два независимо присутствующих R†, взятые вместе с их промежуточным атомом(атомами) образуют незамещенное 3-12-членное насыщенное, частично ненасыщенное или арильное моно- или бициклическое кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Подходящие заместители на алифатической группе R† независимо представляют собой галоген, -R•, -(галогенR•), -OH, -OR•, -O(галогенR•), -CN, -C(O)OH, -C(O)OR•, -NH2, -NHR•, -NR•2 или -NO2, где каждый R• является незамещенным или, если ему предшествует термин “галоген”, замещен только одним или несколькими галогенами, и независимо представляет собой C1-4 алифатическую группу, -CH2Ph, -O(CH2)0-1Ph или 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В некоторых вариантах осуществления термины “необязательно замещенный”, “необязательно замещенный алкил,” “необязательно замещенный алкенил,” “необязательно замещенный алкинил”, “необязательно замещенная карбоциклическая группа”, “необязательно замещенный арил”, “необязательно замещенный гетероарил”, “необязательно замещенная гетероциклическая группа” и любая другая необязательно замещенная группа в контексте настоящей заявки относятся к группам, которые являются незамещенными или замещены путем независимой замены одного, двух или трех или более атомов водорода на них типичными заместителями, включающими, но не ограничивающиеся этим:
-F, -Cl, -Br, -I, дейтерий,
-OH, защищенный гидрокси, алкокси, оксо, тиооксо,
-NO2, -CN, CF3, N3,
-NH2, защищенный амино, -NH алкил, -NH алкенил, -NH алкинил, -NH циклоалкил, -NH -арил, -NH -гетероарил, -NH-гетероциклическая группа, -диалкиламино, -диариламино, -
дигетероариламино,
-O-алкил, -O-алкенил, -O-алкинил, -O-циклоалкил, -O-арил, -O-гетероарил, -O-гетероциклическая группа,
-C(O)-алкил, -C(O)-алкенил, -C(O)-алкинил, -C(O)- карбоциклил, -C(O)-арил, -C(O)-гетероарил, -C(O)-гетероциклил,
-CONH2, -CONH- алкил, -CONH- алкенил, -CONH- алкинил, -CONH-карбоциклил, -CONH-арил, -CONH-гетероарил, -CONH-гетероциклил,
-OCO2-алкил, -OCO2-алкенил, -OCO2-алкинил, -OCO2-карбоциклил, -OCO2-арил, -OCO2-гетероарил, -OCO2-гетероциклил, -OCONH2, -OCONH- алкил, -OCONH- алкенил, -OCONH- алкинил, -OCONH- карбоциклил, -OCONH- арил, -OCONH-гетероарил, -OCONH- гетероциклил,
-NHC(O)-алкил, -NHC(O)-алкенил, -NHC(O)-алкинил, -NHC(O)-карбоциклил, -NHC(O)-арил, -NHC(O)-гетероарил, -NHC(O)-гетероциклил, -NHCO2-алкил, -NHCO2-алкенил, -NHCO2-алкинил, -NHCO2 -карбоциклил, -NHCO2-арил, -NHCO2-гетероарил, -NHCO2-гетероциклил, -NHC(O)NH2, -NHC(O)NH-алкил, -NHC(O)NH-алкенил, -NHC(O)NH-алкенил, -NHC(O)NH-карбоциклил, -NHC(O)NH-арил, -NHC(O)NH-гетероарил, -NHC(O)NH-гетероциклил, NHC(S)NH2, -NHC(S)NH-алкил, -NHC(S)NH-алкенил, -NHC(S)NH-алкинил, -NHC(S)NH- карбоциклил, -NHC(S)NH-арил, -NHC(S)NH-гетероарил, -NHC(S)NH-гетероциклил, -NHC(NH)NH2, -NHC(NH)NH-алкил, -NHC(NH)NH- -алкенил, -NHC(NH)NH-алкенил, -NHC(NH)NH-карбоциклил, -NHC(NH)NH-арил, -NHC(NH)NH-гетероарил, -NHC(NH)NH-гетероциклил, -NHC(NH)- алкил, -NHC(NH)-алкенил, -NHC(NH)-алкенил, -NHC(NH)- карбоциклил, -NHC(NH)-арил, -NHC(NH)-гетероарил, -NHC(NH)-гетероциклил,
-C(NH)NH-алкил, -C(NH)NH-алкенил, -C(NH)NH-алкинил, -C(NH)NH-карбоциклил, -C(NH)NH-арил, -C(NH)NH-гетероарил, -C(NH)NH-гетероциклил,
-S(O)-алкил, - S(O)-алкенил, -S(O)-алкинил, -S(O)- карбоциклил, -S(O)-арил, -S(O)-гетероарил, -S(O)-гетероциклил -SO2NH2, -SO2NH-алкил, -SO2NH-алкенил, -SO2NH-алкинил, -SO2NH- карбоциклил, -SO2NH-арил, -SO2NH-гетероарил, -SO2NH- гетероциклил,
-NHSO2-алкил, -NHSO2-алкенил, -NHSO2-алкинил, -NHSO2- карбоциклил, -NHSO2-арил, -NHSO2-гетероарил, -NHSO2-гетероциклил,
-CH2NH2, -CH2SO2CH3,
-моно-, ди- или три-алкилсилил,
-алкил, -алкенил, -алкинил, -арил, -арилалкил, -гетероарил, -гетероарилалкил, -гетероциклоалкил, -циклоалкил, -карбоциклическая группа, -гетероциклическая группа, полиалкоксиалкил, полиалкокси, -метоксиметокси, -метоксиэтокси, -SH, -S- алкил, -S-алкенил, -S-алкинил, -S-карбоциклил, -S-арил, -S-гетероарил, -S-гетероциклил или метилтиометил.
В контексте настоящей заявки, термин “фармацевтически приемлемая соль” относится к тем солям, которые, в рамках здравого медицинского суждения, подходят для использования в контакте с тканями людей и низших животных без чрезмерной токсичности, раздражения, аллергической реакции и тому подобного, и соизмеримы с разумным соотношением польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Например, S.M. Berge al. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, включенном в настоящую заявку посредством ссылки. Фармацевтически приемлемые соли соединений по настоящему изобретению включают соединения, образованные из подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых нетоксичных кислотно-аддитивных солей являются соли аминогруппы, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с использованием других способов, известных в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, фенилпропионат, фосфат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и т.п.
Соли, образованные из соответствующих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммония и N+ (С1-4 алкил)4 соли. Репрезентативные соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и т.п. Другие фармацевтически приемлемые соли включают, если они являются подходящими, нетоксичные аммониевые, четвертичные аммониевые и аминовые катионы, образованные с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
Если не указано иное, также предполагается, что структуры, представленные в настоящей заявке, включают все изомерные (например, энантиомерные, диастереомерные и геометрические (или конформационные)) формы структуры; например, R и S конфигурации для каждого асимметричного центра, Z и E изомеры двойной связи и Z и E конформационные изомеры. Поэтому в объем изобретения входят отдельные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси представленных соединений. Если не указано иное, все таутомерные формы соединений по изобретению охватываются объемом изобретения.
Кроме того, если не указано иное, предполагается, что структуры, представленные в настоящей заявке, включают соединения, которые отличаются только наличием одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие представленные структуры, включающие замещение водорода дейтерием или тритием, или замещение углерода 13С или 14С обогащенным углеродом, входят в объем настоящего изобретения. В некоторых вариантах осуществления группа включает один или несколько атомов дейтерия.
Кроме того, предполагается, что соединение формулы I включает изотопно-меченные формы. Изотопно-меченная форма соединения формулы I идентична этому соединению, за исключением того, что один или несколько атомов соединения замещены атомом или атомами, имеющими атомную массу или массовое число, которое отличается от атомной массы или массового числа этого атома, обычно присутствующих в природе. Примеры изотопов, которые легко коммерчески доступны и которые могут быть включены в соединение формулы I известными способами, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, например, 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36CI, соответственно. Соединение формулы I, его пролекарство или его фармацевтически приемлемая соль, которые содержат один или несколько из вышеуказанных изотопов и/или другие изотопы других атомов, являются частью настоящего изобретения. Изотопно-меченное соединение формулы I можно выгодно использовать для разных целей. Например, изотопно-меченное соединение формулы I, в которое включен, например, радиоизотоп, такой как 3H или 14C, является подходящим для анализов распределения лекарственного средства и/или субстрата. Эти радиоизотопы, т.е. тритий (3Н) и углерод-14 (14С), являются особенно предпочтительными из-за простоты получения и отличной обнаруживаемости. Включение более тяжелых изотопов, например дейтерия (2H), в соединение формулы I имеет терапевтические преимущества из-за более высокой метаболической стабильности этого изотопно-меченного соединения. Более высокая метаболическая стабильность непосредственно конвертируется в увеличенный период полувыведения in vivo или более низкие дозы, что в большинстве случаев будет представлять собой предпочтительный вариант осуществления настоящего изобретения. Изотопно-меченное соединение формулы I обычно можно получить путем осуществления процедур, раскрытых на схемах синтеза и в соответствующем описании в разделе, описывающем примеры, и в разделе, описывающем получение, в настоящем тексте, заменяя немеченный изотопом реагент легкодоступным изотопно-меченным реагентом.
Дейтерий (2Н) также может быть включен в соединение формулы I для целей манипуляции окислительным метаболизмом соединения посредством первичного кинетического изотопного эффекта. Первичным кинетическим изотопным эффектом является изменение скорости химической реакции, возникающей в результате обмена изотопными ядрами, что, в свою очередь, обусловлено изменением энергий основного состояния, необходимых для образования ковалентных связей после этого изотопного обмена. Обмен более тяжелого изотопа обычно приводит к снижению энергии основного состояния для химической связи и, следовательно, приводит к уменьшению скорости скорость-ограничивающего разрыва связи. Если разрыв связи происходит в или вблизи области седловой точки вдоль координаты многопродукционной реакции, то коэффициенты распределения продуктов могут быть существенно изменены. Для объяснения: если дейтерий связан с атомом углерода в необмениваемом положении, то разницы скорости kM/kD=2-7 являются типичными. Если эта разность скоростей успешно применяется к соединению формулы I, которое подвержено окислению, профиль этого соединения in vivo может быть радикально модифицирован и в результате дает улучшенные фармакокинетические свойства.
При открытии и разработке терапевтических средств специалист в данной области может оптимизировать фармакокинетические параметры, сохраняя при этом желательные свойства in vitro. Разумно предположить, что многие соединения с плохими фармакокинетическими профилями чувствительны к окислительному метаболизму. Существующие в настоящее время микросомальные анализы печени in vitro обеспечивают ценную информацию о ходе окислительного метаболизма этого типа, что, в свою очередь, позволяет рационально сконструировать дейтерированные соединения формулы I с улучшенной стабильностью благодаря устойчивости к такому окислительному метаболизму. Таким образом, достигается значительное улучшение фармакокинетических профилей соединений формулы I, и это можно выразить количественно как увеличение периода полужизни in vivo (t/2), концентрация при максимальном терапевтическом эффекте (Cmax), площадь под кривой доза-ответ (AUC) и F; и как уменьшение клиренса, дозы и стоимости материалов.
Для иллюстрации приведенного выше приводится следующее: соединение формулы I, которое имеет множество потенциальных участков атаки для окислительного метаболизма, например, атомы водорода бензила и атомы водорода, связанные с атомом азота, получают в виде ряда аналогов, в которых различные комбинации атомов водорода заменяют атомами дейтерия, так что некоторые, большинство или все из этих атомов водорода замещены атомами дейтерия. Определения периода полураспада обеспечивают выгодное и точное определение степени, до которой произошло улучшение устойчивости к окислительному метаболизму. Таким образом, определяется, что период полужизни исходного соединения может быть увеличен до 100% в результате дейтерий-водородного обмена этого типа.
Дейтерий-водородный обмен в соединении формулы I можно также использовать для достижения благоприятной модификации спектра метаболитов исходного соединения с целью уменьшения или устранения нежелательных токсичных метаболитов. Например, если токсический метаболит возникает из-за окислительного расщепления углерод-водородной (C-H) связи, разумно предположить, что дейтерированный аналог будет значительно уменьшать или исключать продукцию нежелательного метаболита, даже если конкретное окисление не является скорость-определяющей стадией. Дополнительную информацию об уровне техники, касающемся дейтерий-водородного обмена, можно найти, например, в Hanzlik et al., J. Org. Chem. 55, 3992-3997, 1990, Reider et al., J. Org. Chem. 52, 3326-3334, 1987, Foster, Adv. Drug Res. 14, 1-40, 1985, Gillette et al, Biochemistry 33(10) 2927-2937, 1994 и Jarman et al. Carcinogenesis 16(4), 683-688, 1993.
В контексте настоящей заявки, термин “модулятор” определяется как соединение, которое связывает и/или ингибирует мишень с измеримым сродством. В некоторых вариантах осуществления модулятор имеет IC50 и/или константу связывания меньше чем около 50 мкМ, меньше чем около 1 мкМ, меньше чем около 500 нМ, меньше чем около 100 нМ или меньше чем около 10 нМ.
Термины “измеряемое сродство” и “измеряемое ингибирование”, в контексте настоящей заявки, означают измеримое изменение TLR7/8 активности между образцом, включающим соединение по настоящему изобретению или его композицию и TLR7/8, и эквивалентным образцом, включающим TLR7/8 в отсутствие указанного соединения или его композиции.
Комбинации заместителей и переменных, предусматриваемые настоящим изобретением, представляют собой только такие, которые приводят к образованию стабильных соединений. Термин “стабильный”, в контексте настоящей заявки, относится к соединениям, которые обладают стабильностью, достаточной для возможности их получения, и которая поддерживает целостность соединения в течение достаточного периода времени, чтобы быть полезным для целей, подробно описанных в настоящей заявке (например, терапевтическое или профилактическое введение субъекту).
Перечень химических групп в любом определении переменной включает определения этой переменной как любой отдельной группы или комбинации перечисленных групп. Описание варианта осуществления для переменной включает этот вариант осуществления в качестве любого отдельного варианта осуществления или в сочетании с любыми другими вариантами осуществления или их частями.
3. Описание иллюстративных соединений
В соответствии с одним аспектом, настоящее изобретение обеспечивает соединение формулы I,
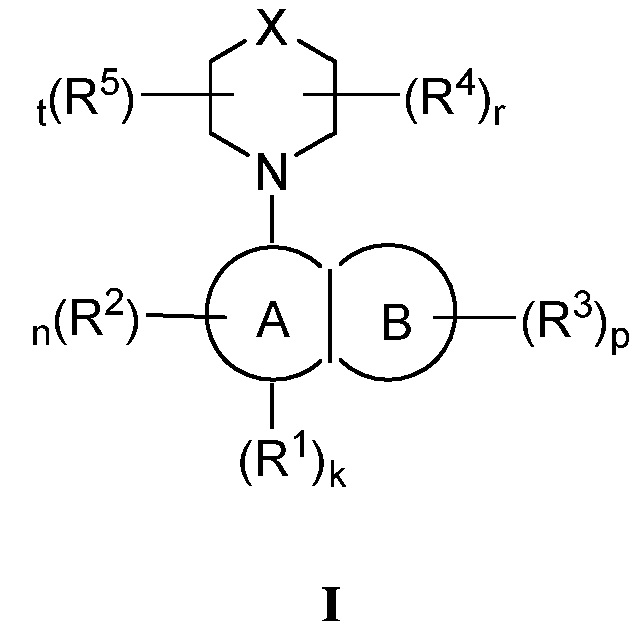
или его фармацевтически приемлемую соль, где:
Кольцо A представляет собой арил или гетероарил, содержащий 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждый из которых необязательно замещен;
Кольцо B представляет собой арил или гетероарил, содержащий 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждый из которых необязательно замещен;
R1 отсутствует или представляет собой -H, -CHF2, -CF3, -OMe или -CN;
каждый R2 независимо представляет собой -H, -R, галоген, -галогеналкил, -OR, -SR, -CN, -NO2, -SO2R, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2;
каждый R3 независимо представляет собой -H, -R, галоген, -галогеналкил, -OR, -SR, -CN, -NO2, -SO2R, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2;
X представляет собой C(R4)2, O, NR4, S, S(R4) или S(R4)2;
каждый R4 независимо представляет собой -H, -R, галоген, -галогеналкил, -OR, -SR, -CN, -NO2, -SO2R, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2;
каждый R5 независимо представляет собой -H, -R, галоген, -галогеналкил, -OR, -SR, -CN, -NO2, -SO2R, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2;
каждый R независимо представляет собой водород, C1-6 алифатическую группу, C3-10 арил, 3-8 членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 3-7 членное гетероциклическое кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или 5-6 членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждая из этих групп необязательно замещена; или
две R группы на одном и том же атоме взяты вместе с атомом, к которому они присоединены, с образованием C3-10 арила, 3-8 членного насыщенного или частично ненасыщенного карбоциклического кольца, 3-7 членного гетероциклического кольца, содержащего 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или 5-6 членного моноциклического гетероарильного кольца, содержащего 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждая из этих групп необязательно замещена;
k имеет значение 0 или 1;
n имеет значение 0, 1 или 2;
p имеет значение 0, 1 или 2;
r имеет значение 0, 1 или 2; и
t имеет значение 0, 1 или 2.
В некоторых вариантах осуществления, когда 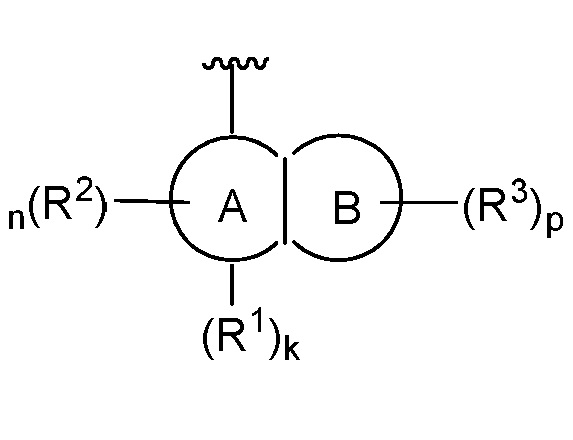 представляет собой
представляет собой 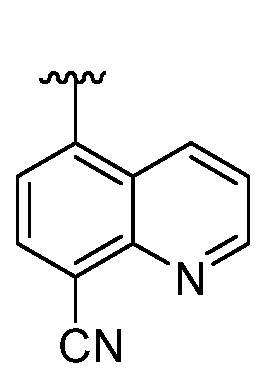 и X представляет собой CH2; тогда R4 не является H, метилом или гидроксилом.
и X представляет собой CH2; тогда R4 не является H, метилом или гидроксилом.
В некоторых вариантах осуществления, когда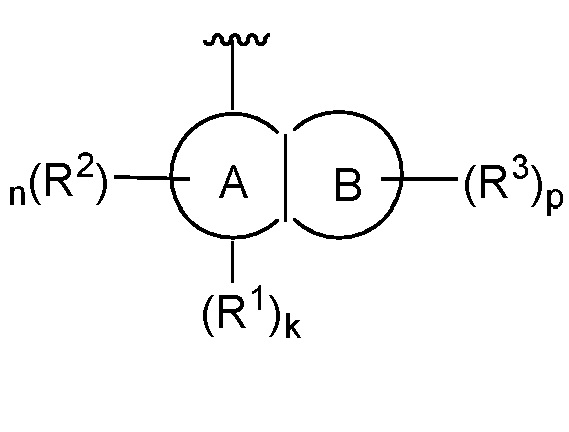 представляет собой
представляет собой 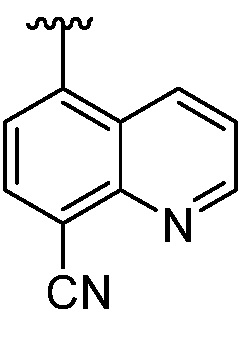 и X представляет собой O, тогда R4 не является -C(O)N(R)2.
и X представляет собой O, тогда R4 не является -C(O)N(R)2.
В некоторых вариантах осуществления R1 отсутствует.
В некоторых вариантах осуществления R1 представляет собой -H.
В некоторых вариантах осуществления, R1 представляет собой -CHF2.
В некоторых вариантах осуществления R1 представляет собой -CF3.
В некоторых вариантах осуществления R1 представляет собой -OMe.
В некоторых вариантах осуществления R1 представляет собой -CN.
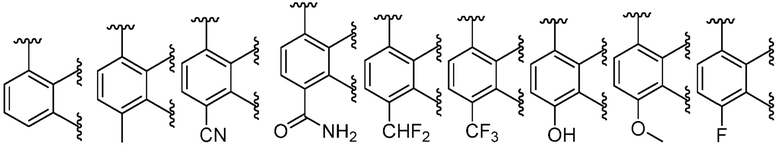
В некоторых вариантах осуществления кольцо A представляет собой C6 арил или 6-членный моноциклический гетероарил, содержащий 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждый из которых необязательно замещен.
В некоторых вариантах осуществления кольцо A представляет собой фенил, пиридил, пиримидинил, пиразинил, пиридазинил или триазинил; каждый из которых необязательно замещен.
В некоторых вариантах осуществления кольцо A представляет собой фенил, пиридил или пиримидинил; каждый из которых необязательно замещен.
В некоторых вариантах осуществления, кольцо A представляет собой
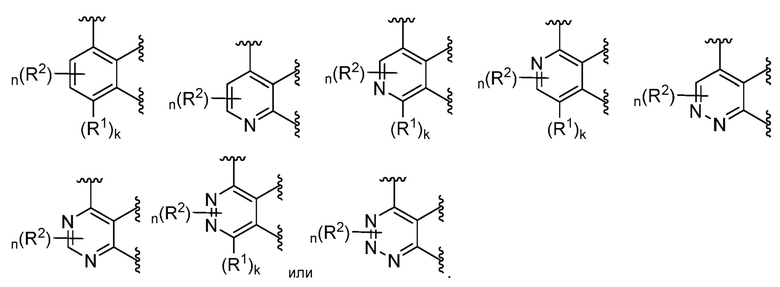
В некоторых вариантах осуществления, кольцо A представляет собой
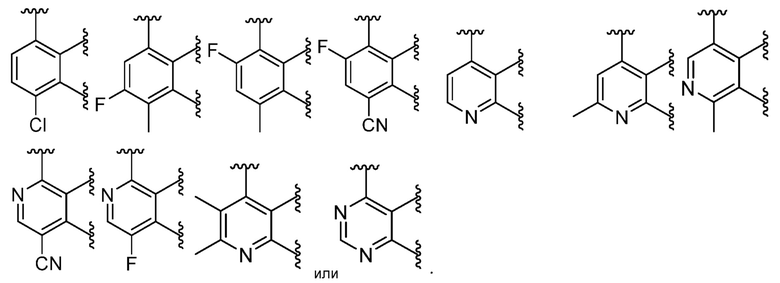
В некоторых вариантах осуществления кольцо B представляет собой C6 арил или 5-6-членный моноциклический гетероарил, содержащий 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждый из которых необязательно замещен.
В некоторых вариантах осуществления кольцо B представляет собой фенил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, пиррол, имидазол, изоксазол, оксазол или тиазол; каждый из которых необязательно замещен.
В некоторых вариантах осуществления кольцо B представляет собой
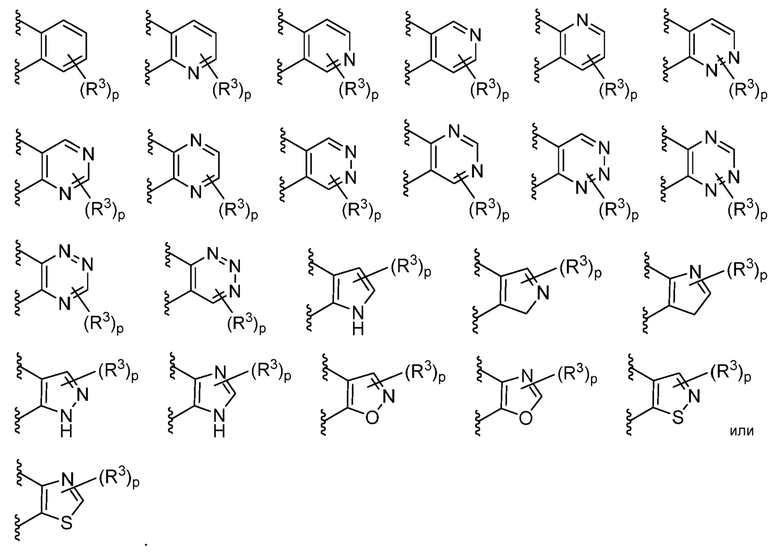
В некоторых вариантах осуществления кольцо B представляет собой
В некоторых вариантах осуществления каждый R2 независимо представляет собой -H.
В некоторых вариантах осуществления каждый R2 независимо представляет собой C1-6 алифатическую группу, C3-10 арил, 3-8 членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 3-7-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждая из этих групп необязательно замещена.
В некоторых вариантах осуществления, каждый R2 независимо представляет собой метил, этил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, линейный или разветвленный пентил или линейный или разветвленный гексил; каждый из которых необязательно замещен.
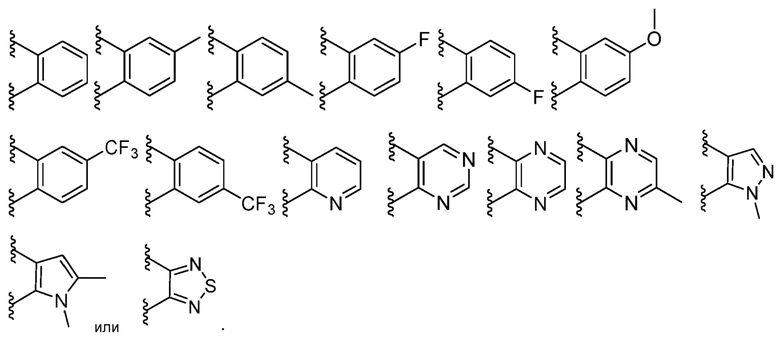
В некоторых вариантах осуществления каждый R2 независимо представляет собой фенил, нафтил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, циклооктил, [3.3.0]бициклооктанил, [4.3.0]бициклононанил, [4.4.0]бициклодеканил, [2.2.2]бициклооктанил, флуоренил, инданил, тетрагидронафтил, акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, NH-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3H-индолил, изоиндолинил, изоиндоленил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил; 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксазолидинил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, хиназолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, оксетанил, азетидинил или ксантенил; каждый из которых необязательно замещен.
В некоторых вариантах осуществления, каждый R2 независимо представляет собой галоген, -галогеналкил, -OR, -SR, -CN, -NO2, -SO2R, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2.
В некоторых вариантах осуществления, каждый R3 независимо представляет собой -H.
В некоторых вариантах осуществления каждый R3 независимо C1-6 представляет собой алифатическую группу, C3-10 арил, 3-8 членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 3-7-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или 5-6 членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждая из этих групп необязательно замещена.
В некоторых вариантах осуществления каждый R3 независимо представляет собой метил, этил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, линейный или разветвленный пентил или линейный или разветвленный гексил; каждый из которых необязательно замещен.
В некоторых вариантах осуществления каждый R3 независимо представляет собой метил.
В некоторых вариантах осуществления каждый R3 независимо представляет собой фенил, нафтил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, циклооктил, [3.3.0]бициклооктанил, [4.3.0]бициклононанил, [4.4.0]бициклодеканил, [2.2.2]бициклооктанил, флуоренил, инданил, тетрагидронафтил, акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, NH-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3H-индолил, изоиндолинил, изоиндоленил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил;- 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксазолидинил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, хиназолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, оксетанил, азетидинил или ксантенил; каждый из которых необязательно замещен.
В некоторых вариантах осуществления каждый R3 независимо представляет собой галоген, -галогеналкил, -OR, -SR, -CN, -NO2, -SO2R, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2.
В некоторых вариантах осуществления X представляет собой C(R4)2 или O.
В некоторых вариантах осуществления X представляет собой C(R4)2. В некоторых вариантах осуществления X представляет собой CH2.
В некоторых вариантах осуществления X представляет собой O.
В некоторых вариантах осуществления каждый R4 независимо представляет собой -H.
В некоторых вариантах осуществления каждый R4 независимо C1-6 представляет собой алифатическую группу, C3-10 арил, 3-8-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 3-7-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждая из этих групп необязательно замещена.
В некоторых вариантах осуществления каждый R4 независимо представляет собой метил, этил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, линейный или разветвленный пентил или линейный или разветвленный гексил; каждый из которых необязательно замещен.
В некоторых вариантах осуществления каждый R4 независимо представляет собой фенил, нафтил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, циклооктил, [3.3.0]бициклооктанил, [4.3.0]бициклононанил, [4.4.0]бициклодеканил, [2.2.2]бициклооктанил, флуоренил, инданил, тетрагидронафтил, акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, NH-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3H-индолил, изоиндолинил, изоиндоленил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил;- 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксазолидинил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, хиназолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, оксетанил, азетидинил или ксантенил; каждый из которых необязательно замещен.
В некоторых вариантах осуществления каждый R4 независимо представляет собой галоген, -галогеналкил, -OR, -SR, -CN, -NO2, -SO2R, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2.
В некоторых вариантах осуществления каждый R4 независимо представляет собой -H, C1-6 алифатическую группу, -OR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2; каждый из которых необязательно замещен.
В некоторых вариантах осуществления каждый R4 независимо представляет собой -H, C1-6 алифатическую группу, -C(O)N(R)2, -NRC(O)R или -N(R)2; каждый из этих групп необязательно замещена.
В некоторых вариантах осуществления каждый R4 независимо представляет собой
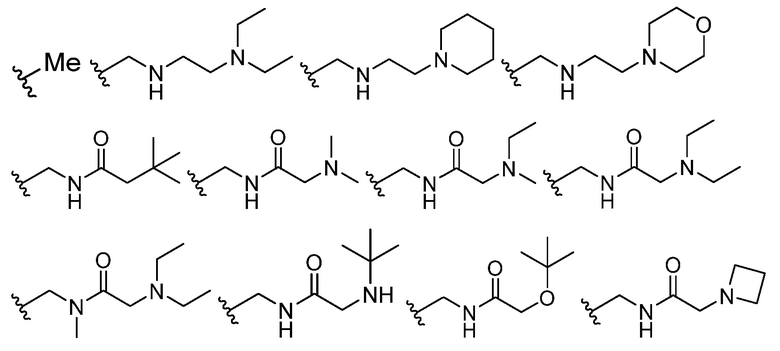
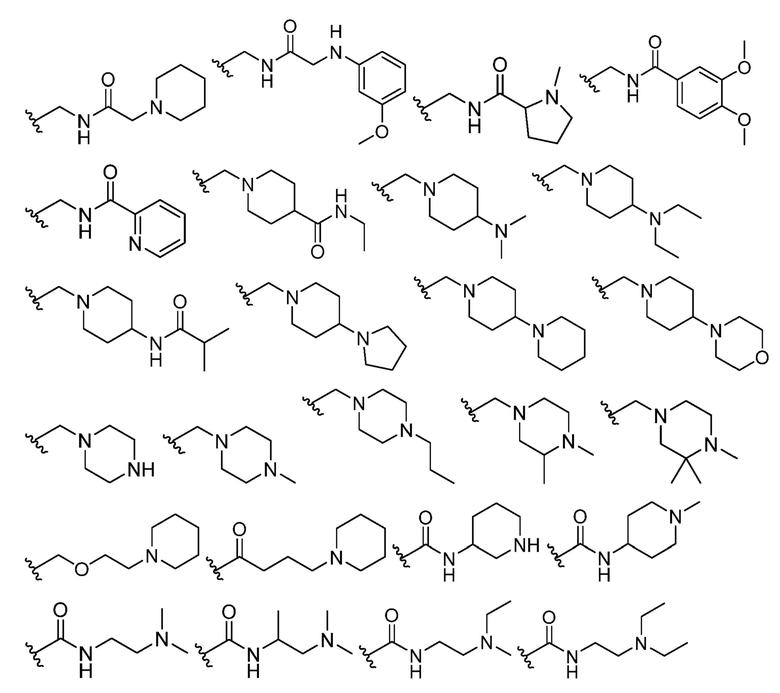
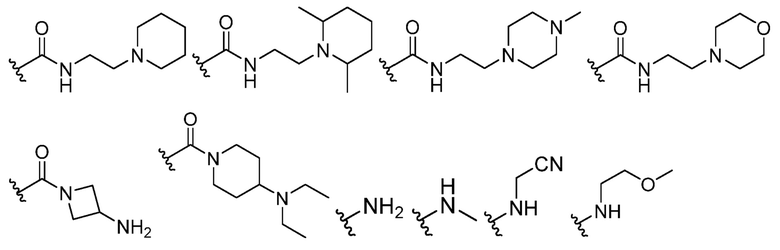
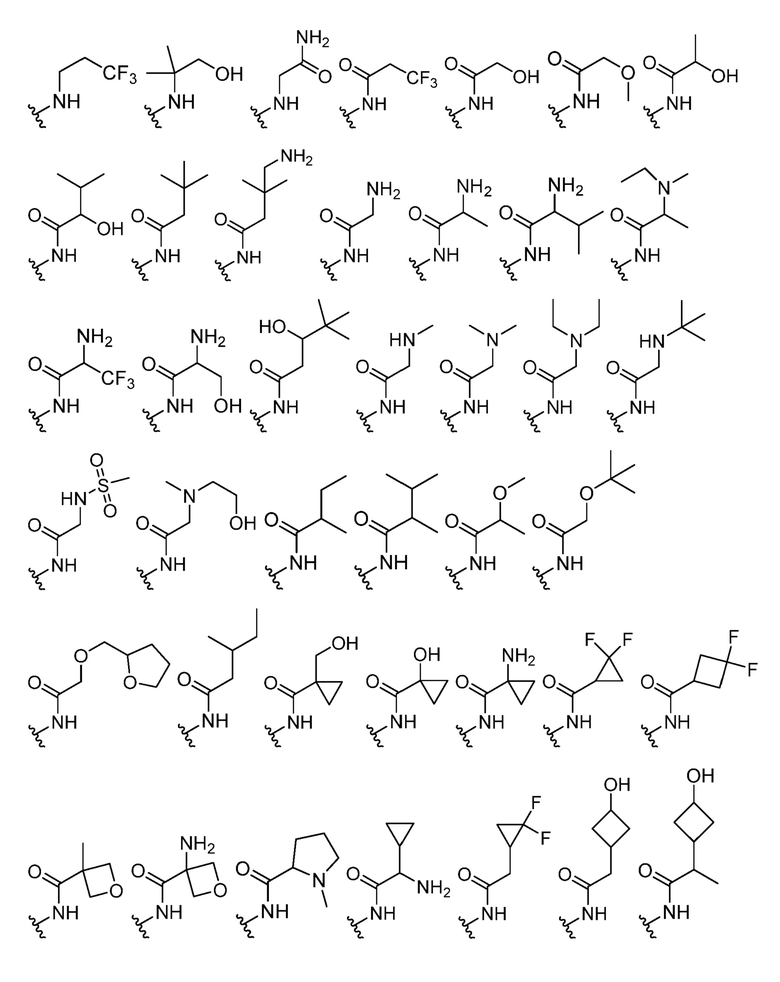
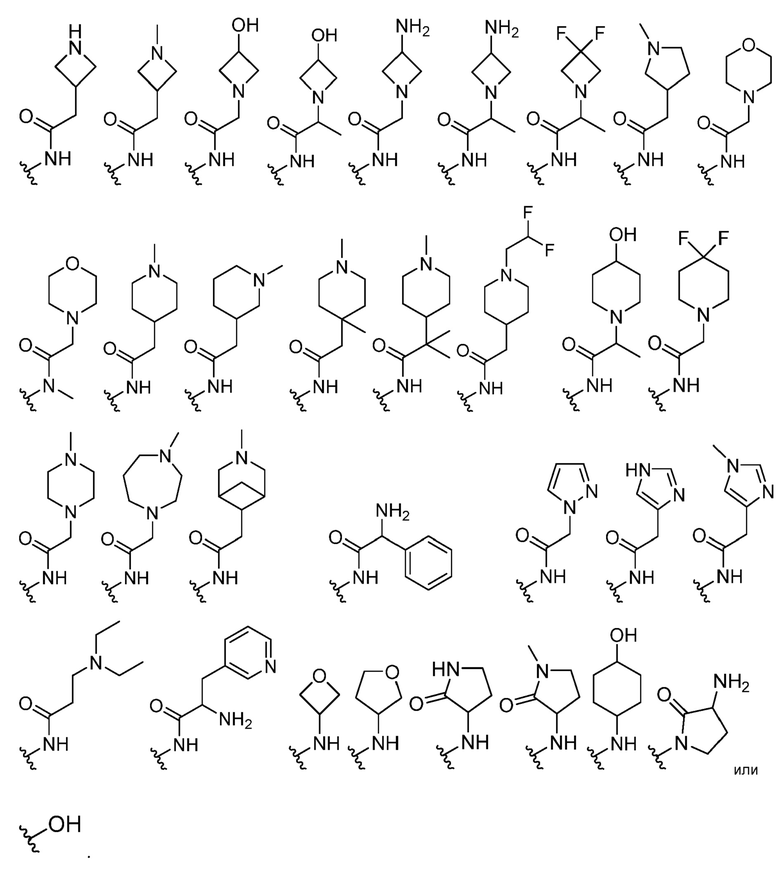
В некоторых вариантах осуществления каждый R4 независимо представляет собой
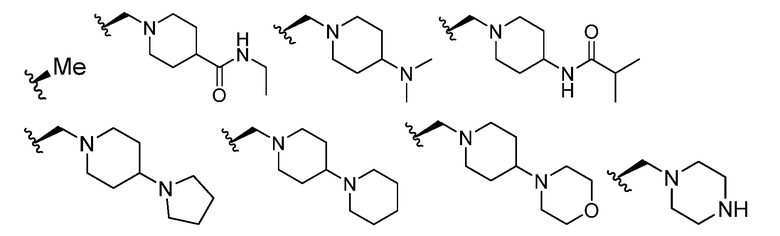
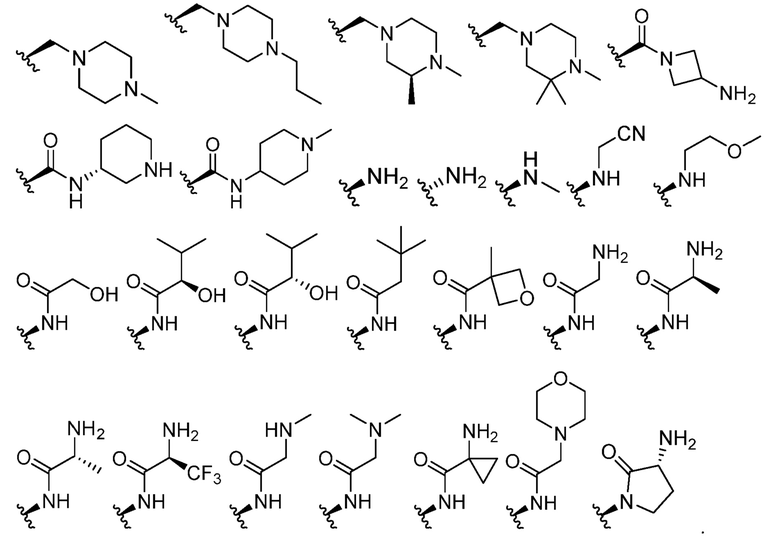
В некоторых вариантах осуществления каждый R5 независимо представляет собой -H.
В некоторых вариантах осуществления каждый R5 независимо представляет собой C1-6 алифатическую группу, C3-10 арил, 3-8 членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 3-7 членное гетероциклическое кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или 5-6 членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждая из этих групп необязательно замещена.
В некоторых вариантах осуществления каждый R5 представляет собой независимо метил, этил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, линейный или разветвленный пентил или линейный или разветвленный гексил; каждый из которых необязательно замещен.
В некоторых вариантах осуществления каждый R5 независимо представляет собой фенил, нафтил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, циклооктил, [3.3.0]бициклооктанил, [4.3.0]бициклононанил, [4.4.0]бициклодеканил, [2.2.2]бициклооктанил, флуоренил, инданил, тетрагидронафтил, акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, NH-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3H-индолил, изоиндолинил, изоиндоленил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил; -1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксазолидинил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, хиназолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, оксетанил, азетидинил или ксантенил; каждый из которых необязательно замещен.
В некоторых вариантах осуществления каждый R5 независимо представляет собой галоген, -галогеналкил, -OR, -SR, -CN, -NO2, -SO2R, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2.
В некоторых вариантах осуществления каждый R5 независимо представляет собой метил, циклопропил, -F или -CF3.
В некоторых вариантах осуществления каждый R5 независимо представляет собой
 -F или -CF3.
-F или -CF3.
В некоторых вариантах осуществления каждый из X, кольца A, кольца B, R1, R2, R3, R4, R5, k, m, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления настоящее изобретение обеспечивает соединение формулы I-a,
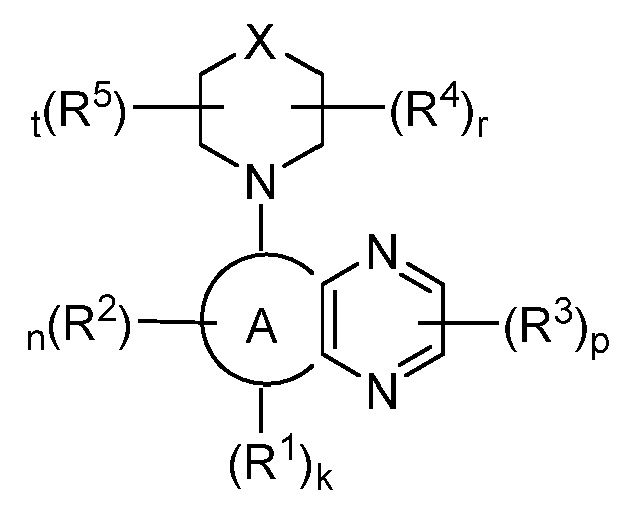
I-a;
или его фармацевтически приемлемую соль, где каждый из X, кольца A, R1, R2, R3, R4, R5, k, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления настоящее изобретение обеспечивает соединение формулы I-b
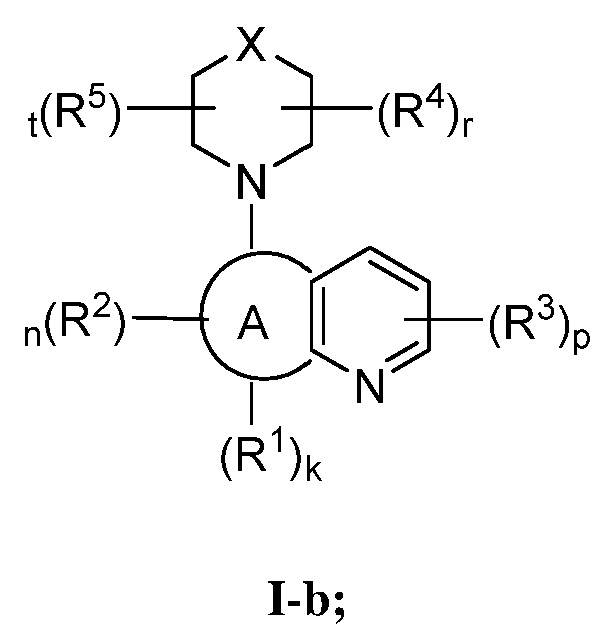
или его фармацевтически приемлемую соль, где каждый из X, кольца A, R1, R2, R3, R4, R5, k, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления настоящее изобретение обеспечивает соединение формулы I-c
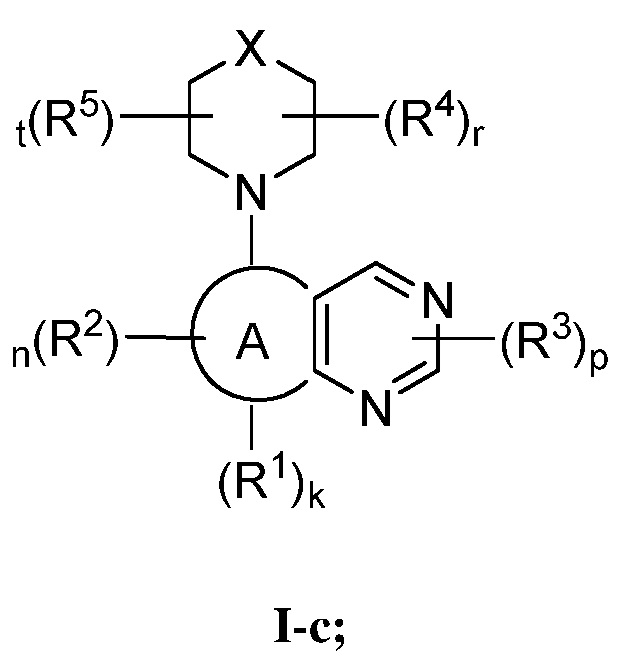
или его фармацевтически приемлемую соль, где каждый из X, кольца A, R1, R2, R3, R4, R5, k, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления настоящее изобретение обеспечивает соединение формулы I-d
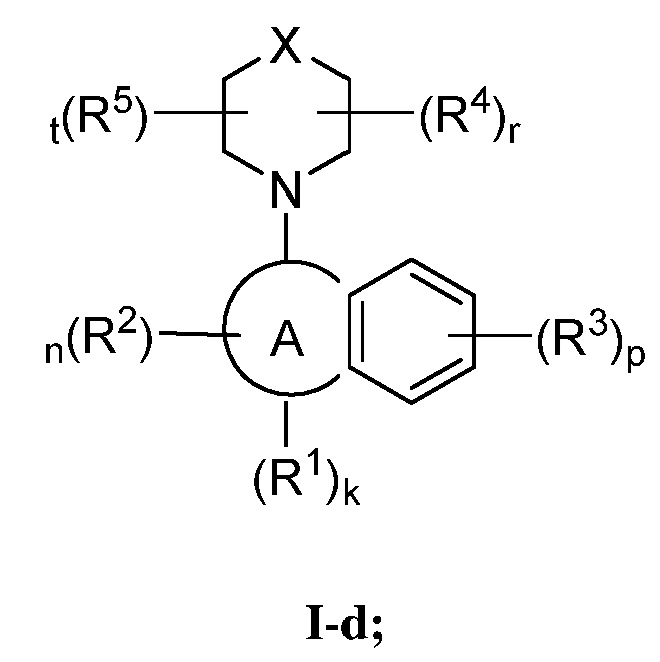
или его фармацевтически приемлемую соль, где каждый из X, кольца A, R1, R2, R3, R4, R5, k, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления настоящее изобретение обеспечивает соединение формулы I-e
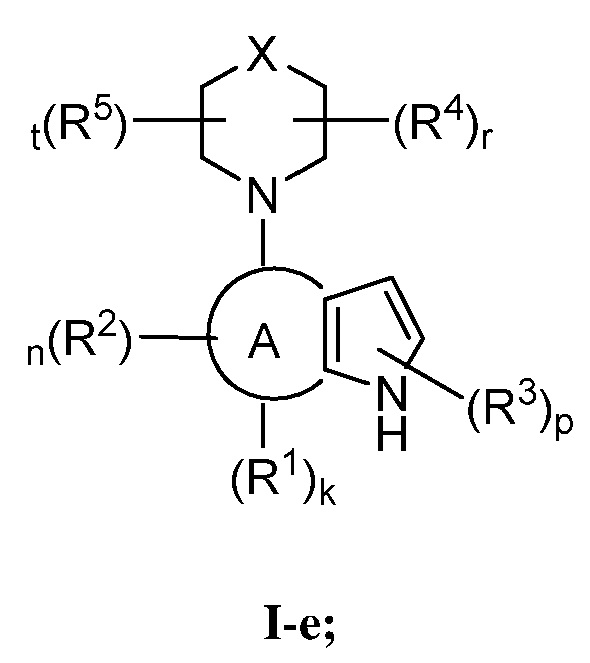
или его фармацевтически приемлемую соль, где каждый из X, кольца A, R1, R2, R3, R4, R5, k, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления, настоящее изобретение обеспечивает соединение формулы I-f
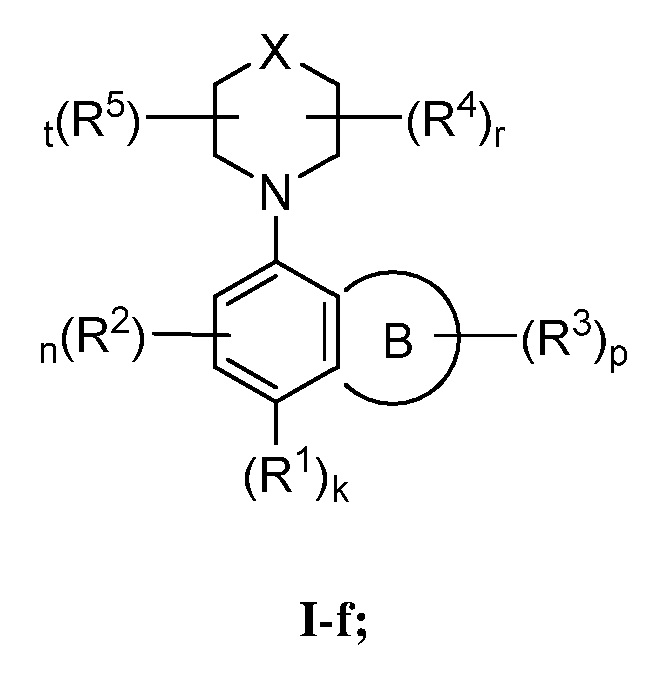
или его фармацевтически приемлемую соль, где каждый из X, кольца B, R1, R2, R3, R4, R5, k, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления настоящее изобретение обеспечивает соединение формулы I-g
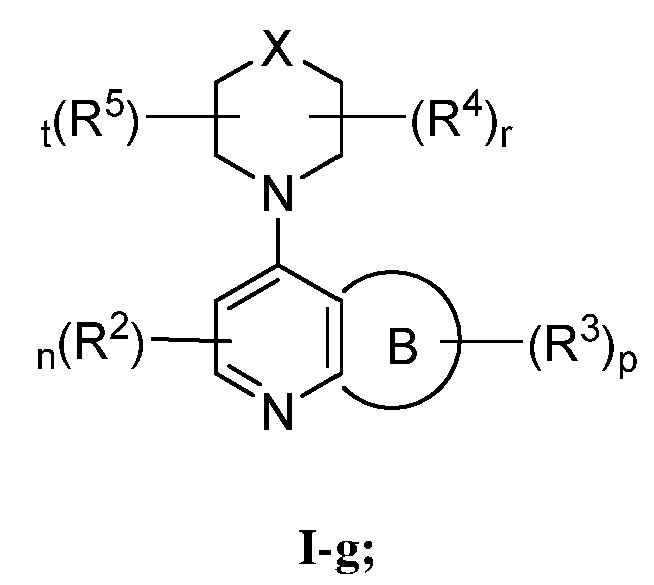
или его фармацевтически приемлемую соль, где каждый из X, кольца B, R2, R3, R4, R5, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления, настоящее изобретение обеспечивает соединение формулы I-h
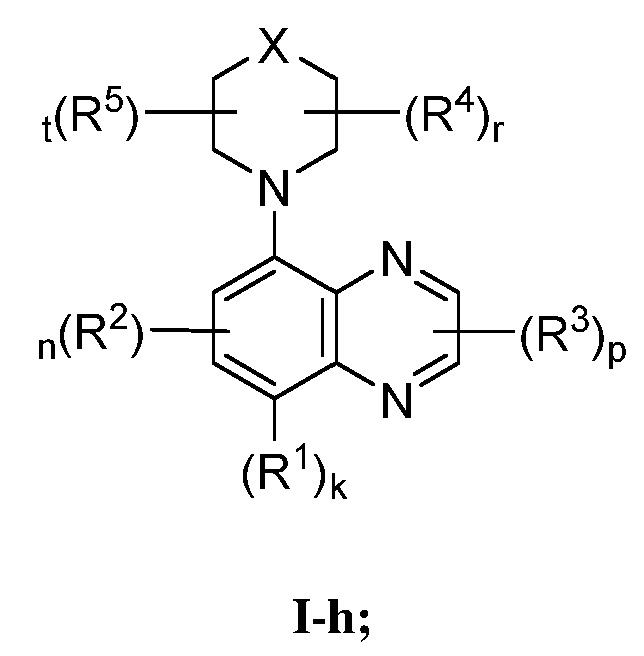
или его фармацевтически приемлемую соль, где каждый из X, R1, R2, R3, R4, R5, k, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления настоящее изобретение обеспечивает соединение формулы I-j
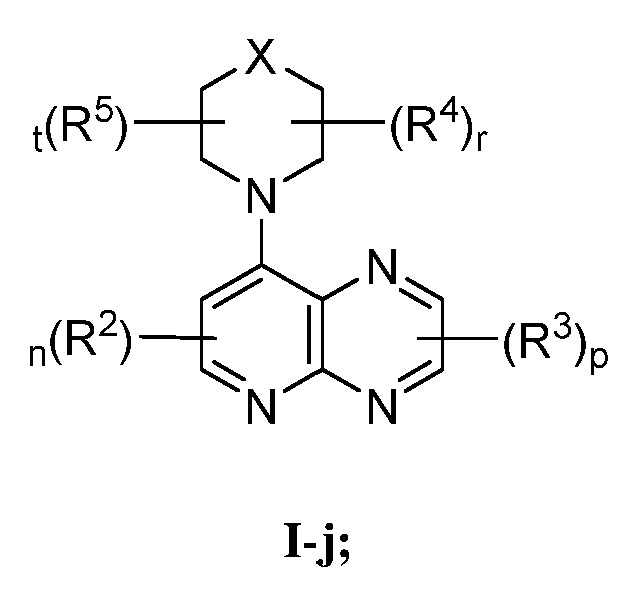
или его фармацевтически приемлемую соль, где каждый из X, R2, R3, R4, R5, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления, настоящее изобретение обеспечивает соединение формулы I-m
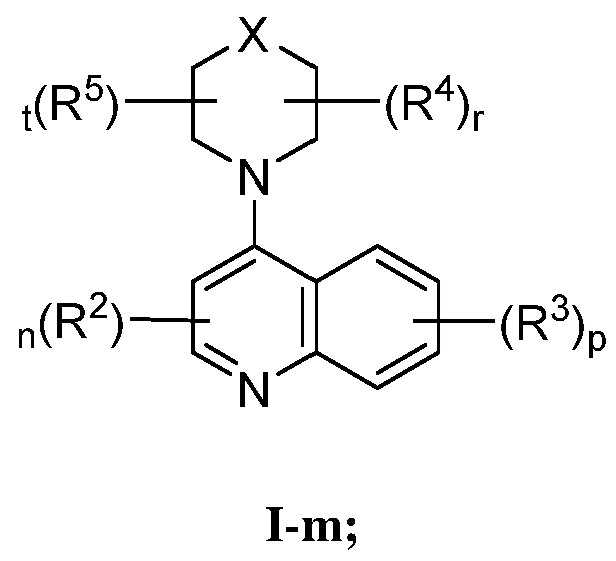
или его фармацевтически приемлемую соль, где каждый из X, R2, R3, R4, R5, n, p, r и t, имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления, настоящее изобретение обеспечивает соединение формулы I-n
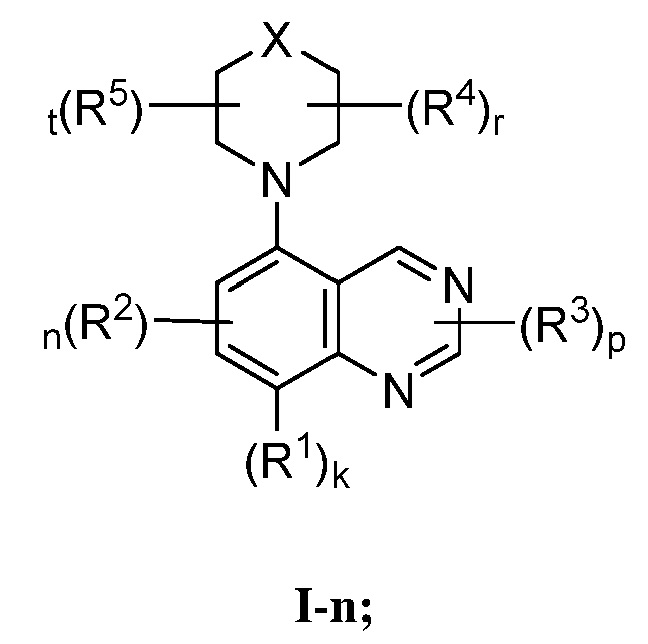
или его фармацевтически приемлемую соль, где каждый из X, R1, R2, R3, R4, R5, k, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления настоящее изобретение обеспечивает соединение формулы I-p
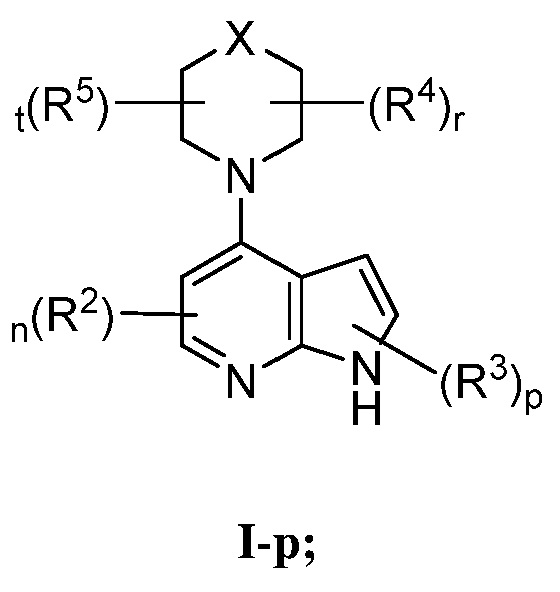
или его фармацевтически приемлемую соль, где каждый из X, R2, R3, R4, R5, n, p, r и t имеет значение, определенное выше и описанное в вариантах осуществления, классах и подклассах выше и далее, отдельно или в комбинации.
В некоторых вариантах осуществления изобретение обеспечивает соединение, выбранное из Таблицы 1:
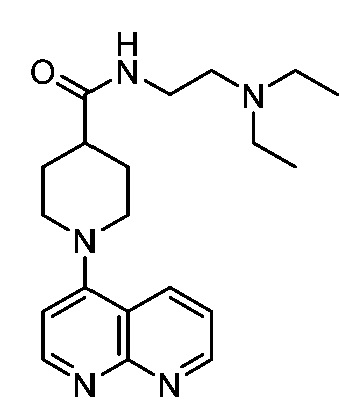
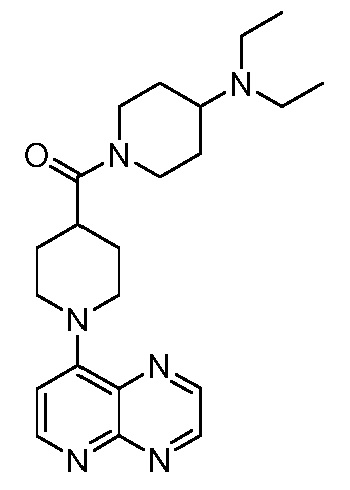
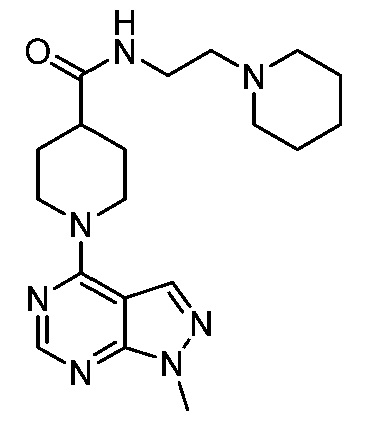
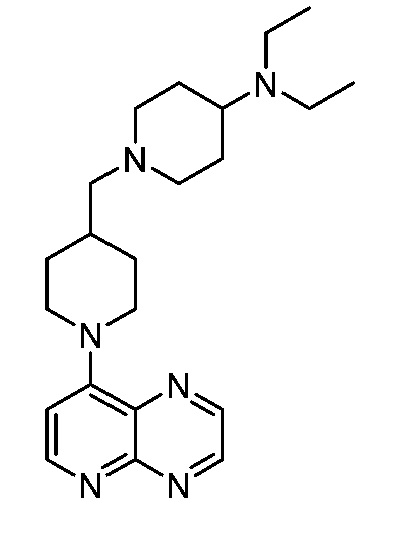
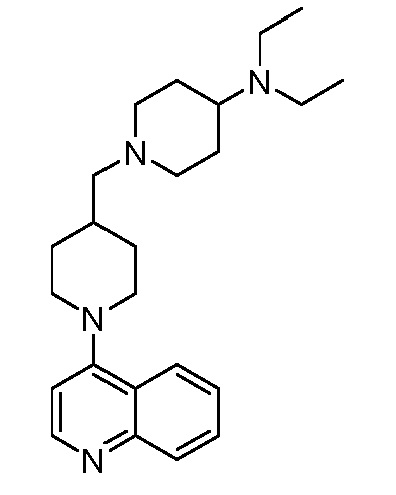
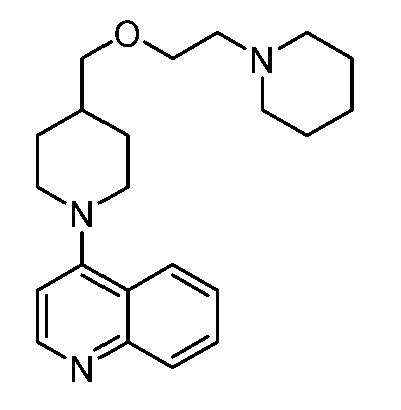
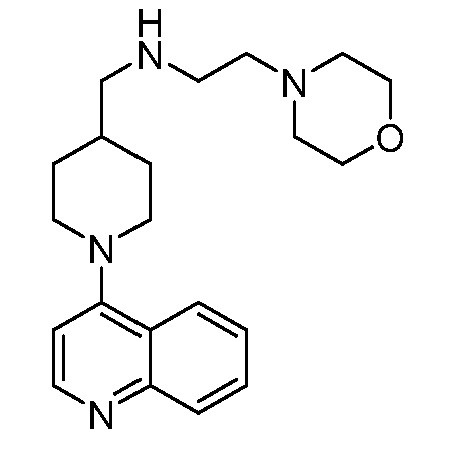
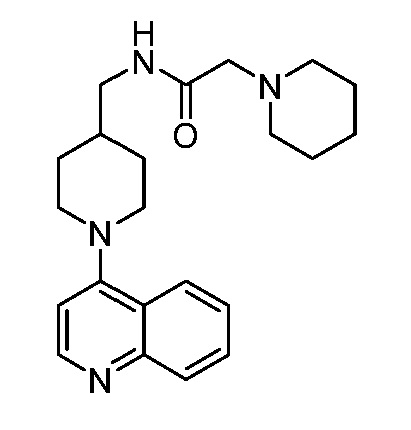
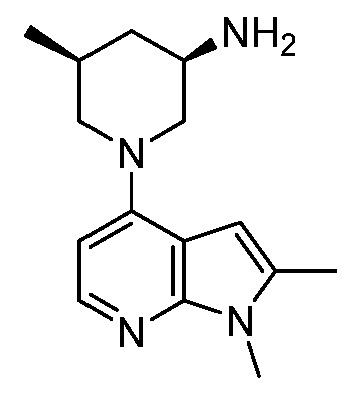
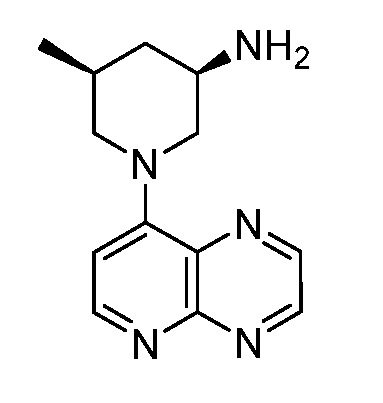
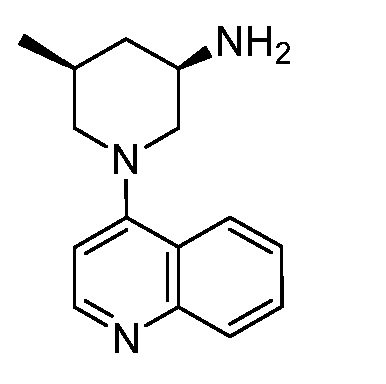
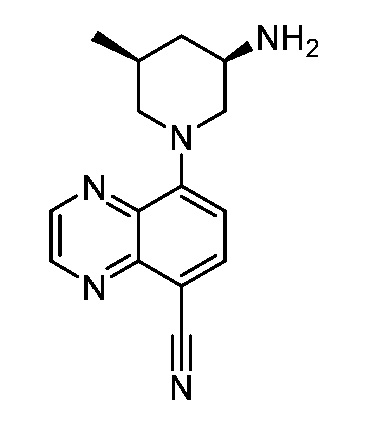
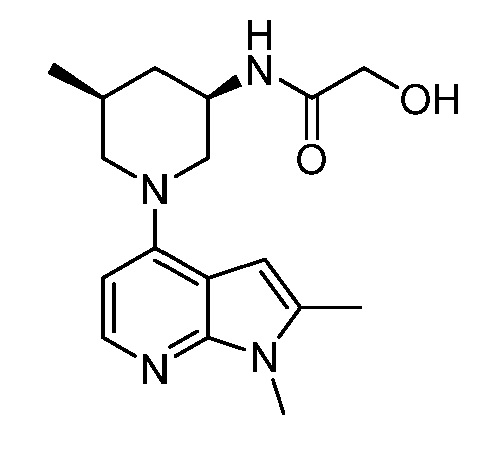
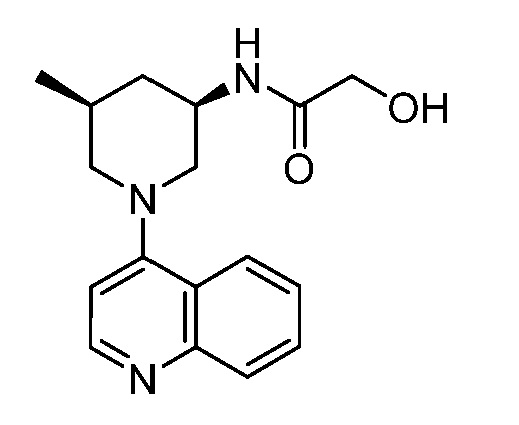
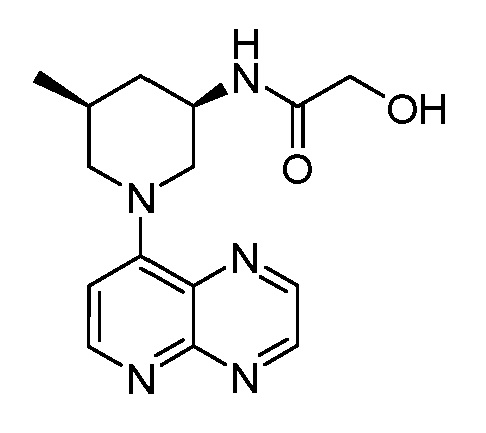
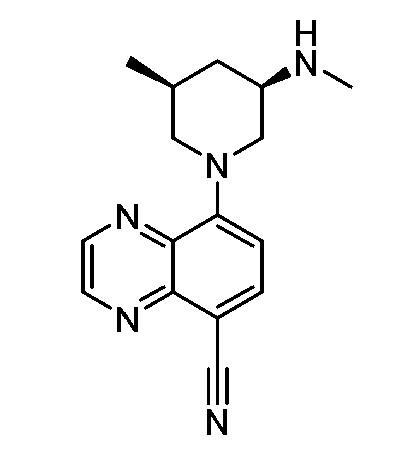
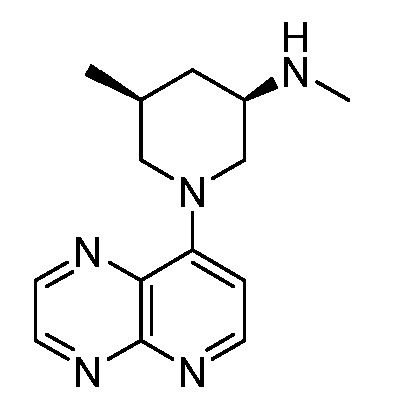
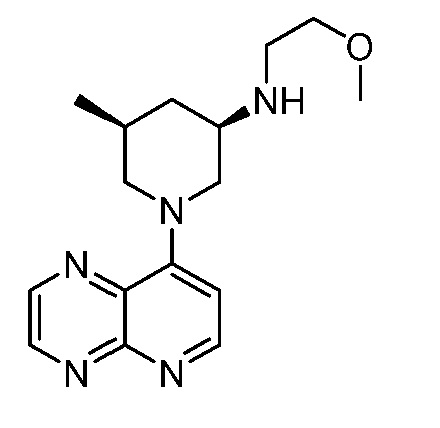
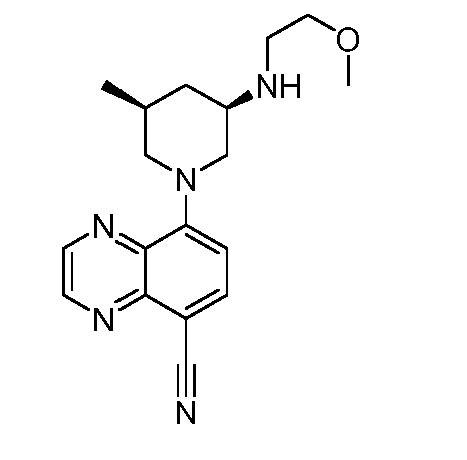
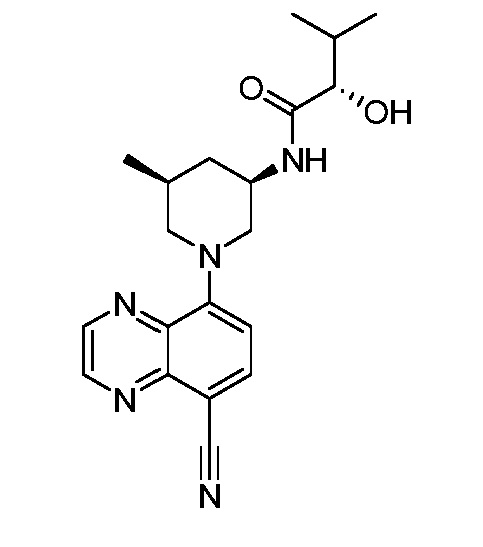
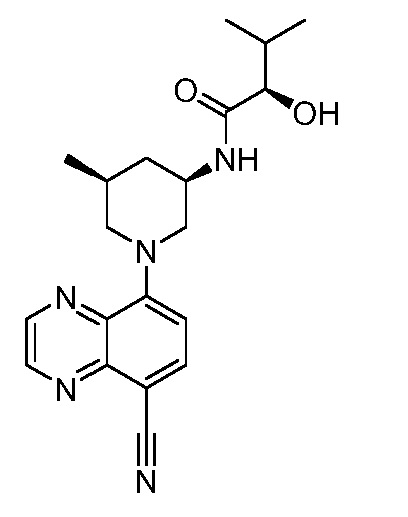
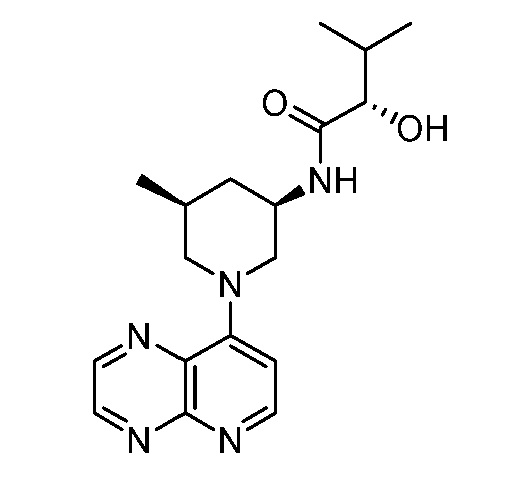
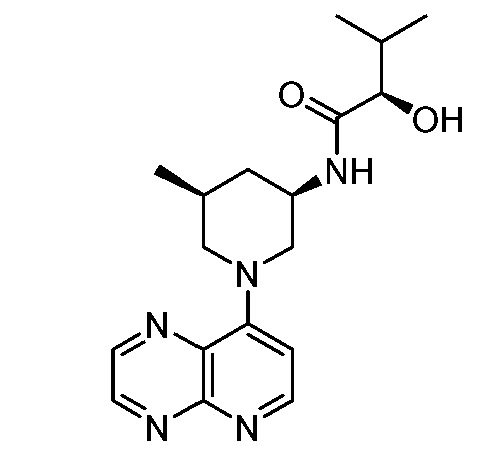
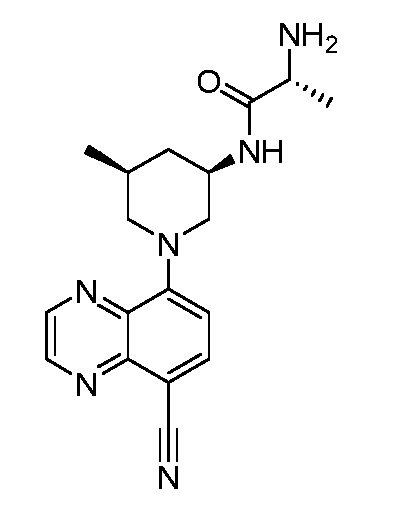
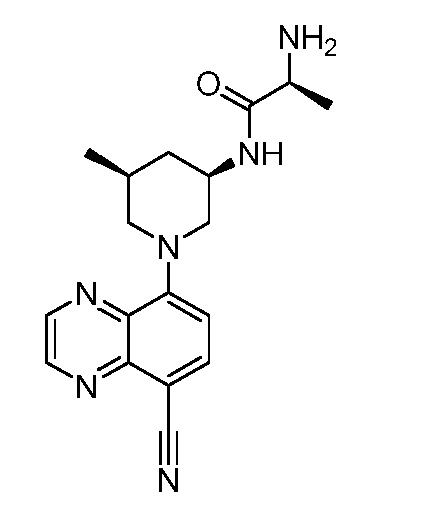
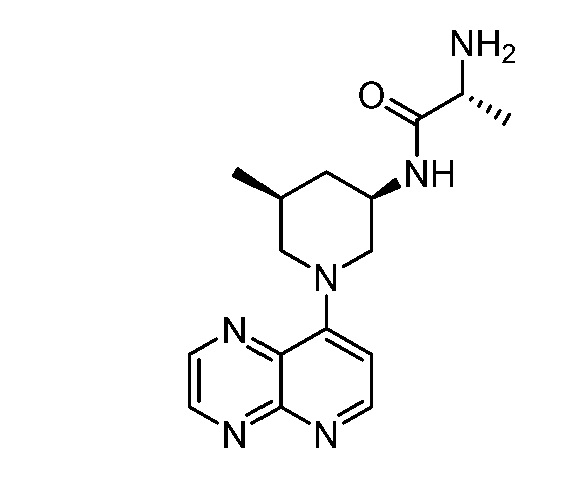
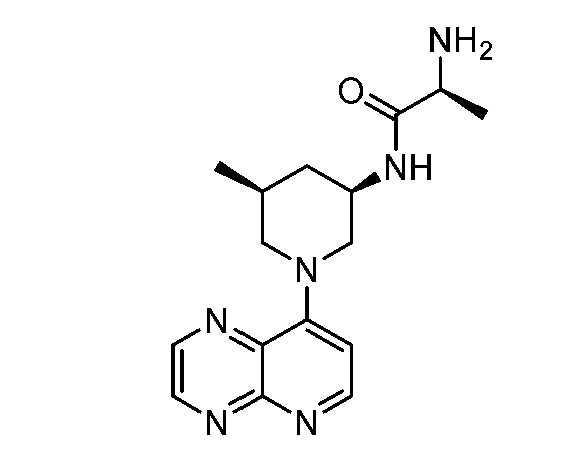
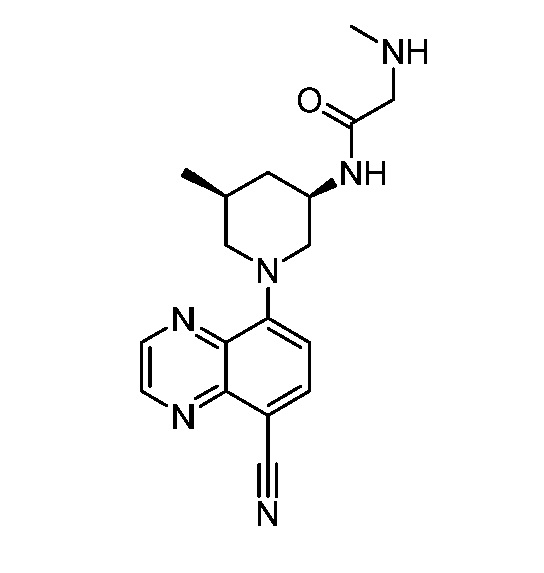
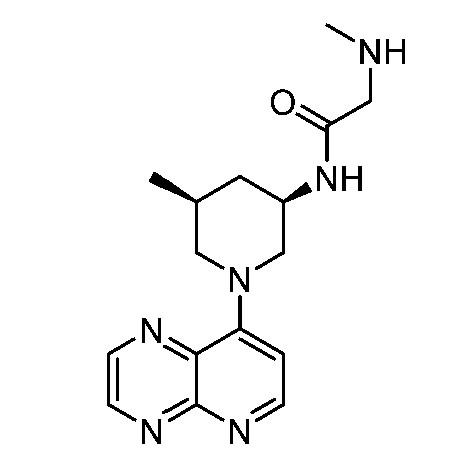
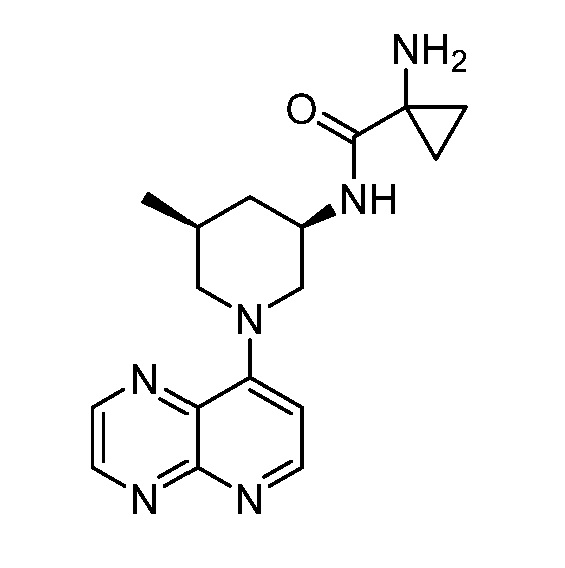
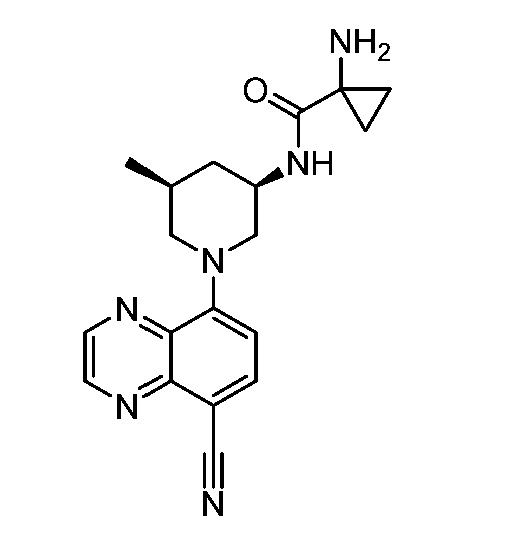
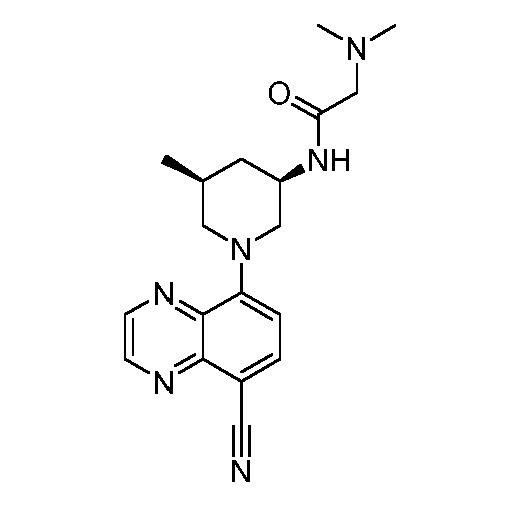
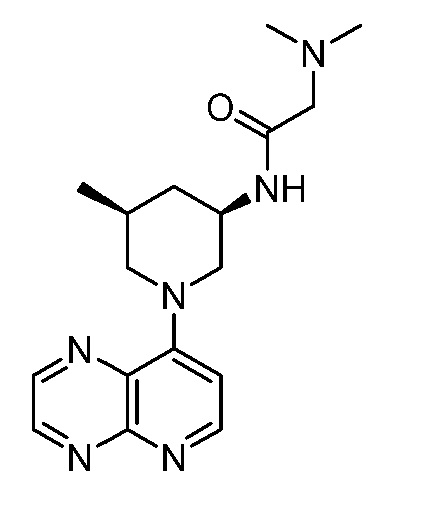
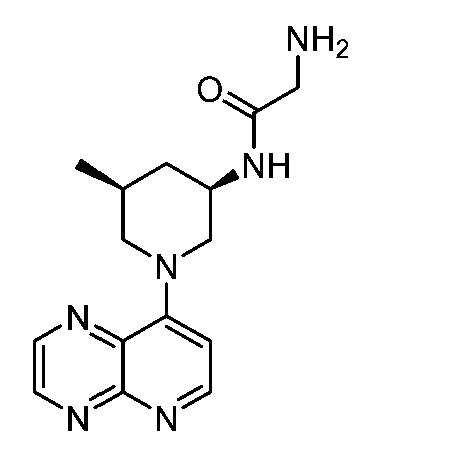
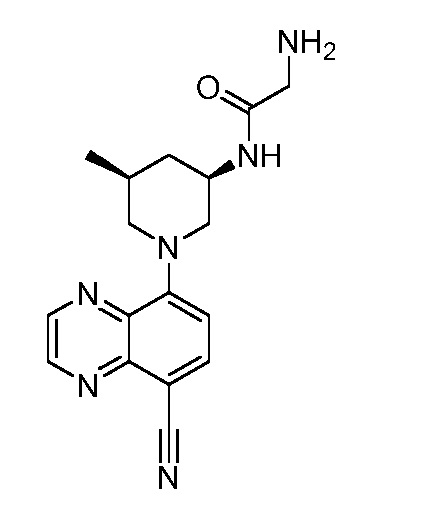
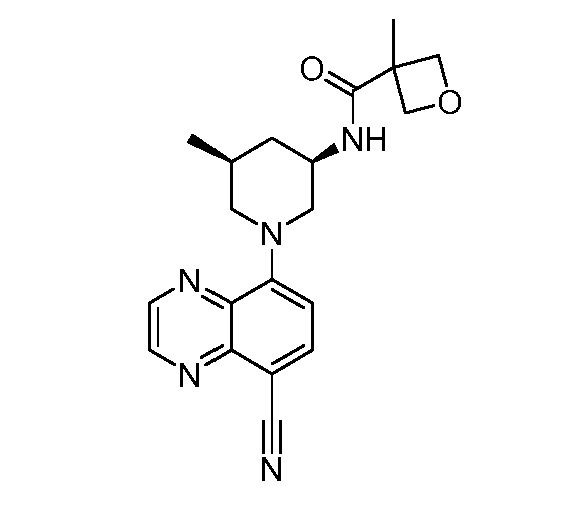
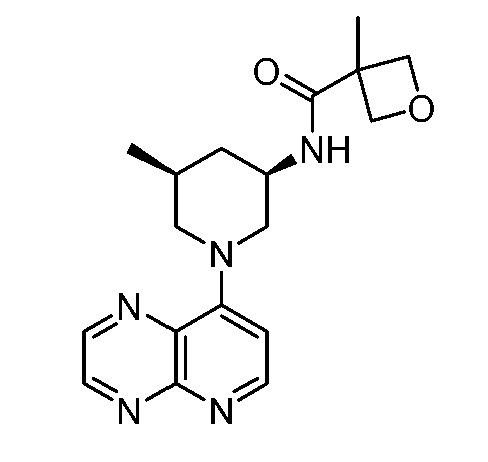
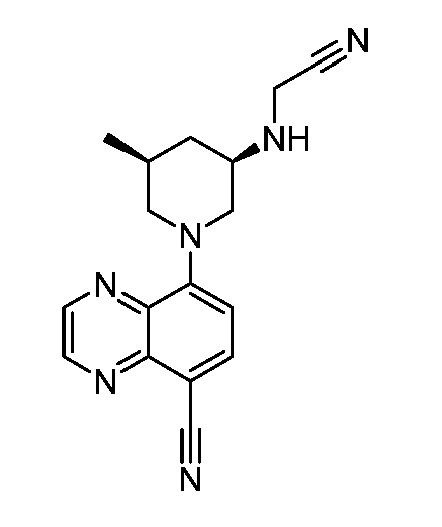
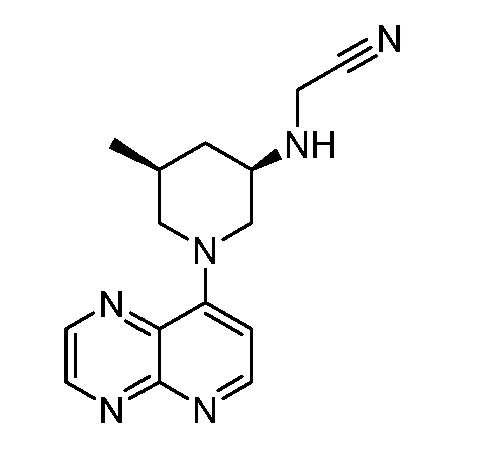
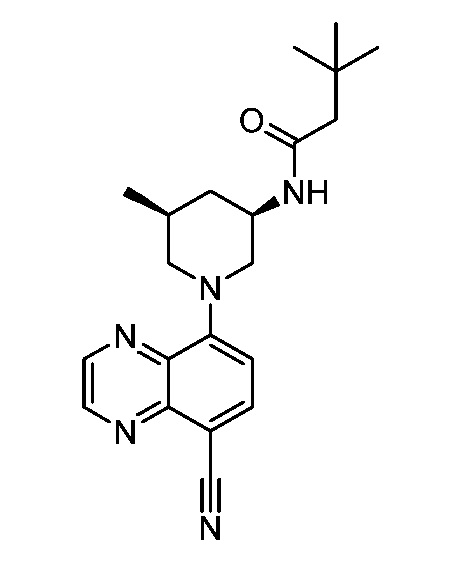
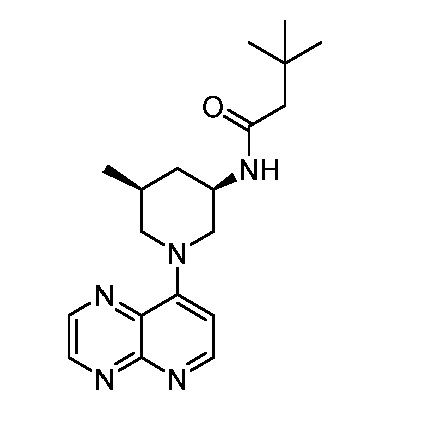
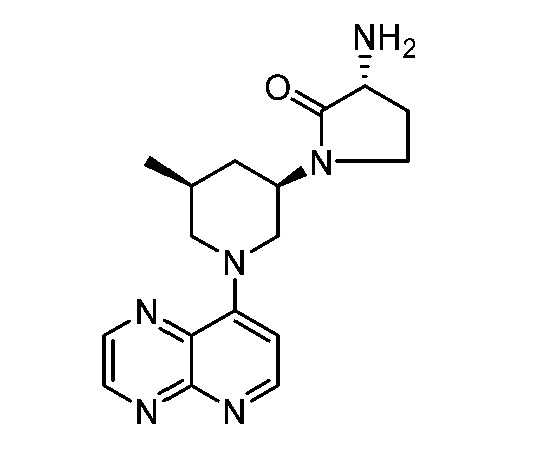
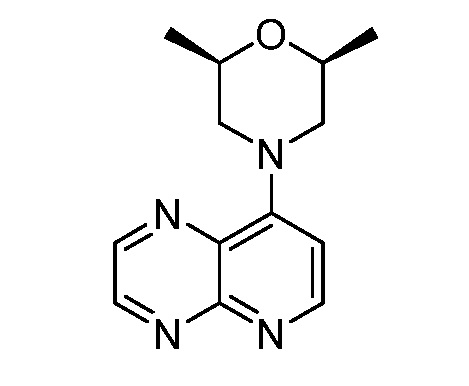
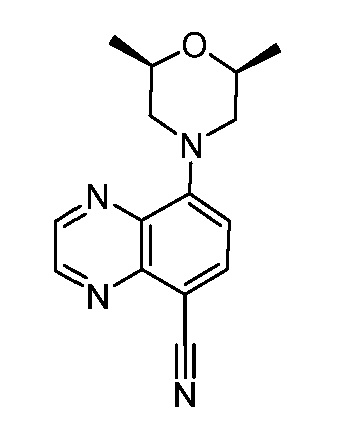
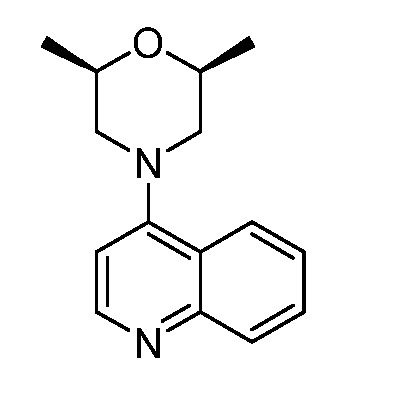
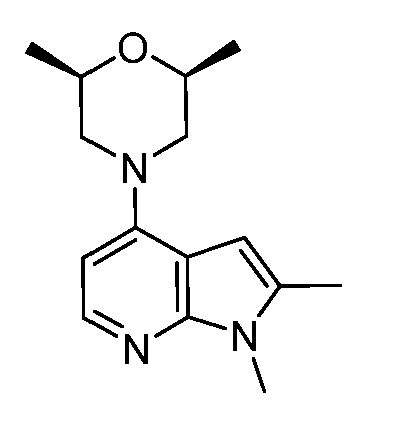
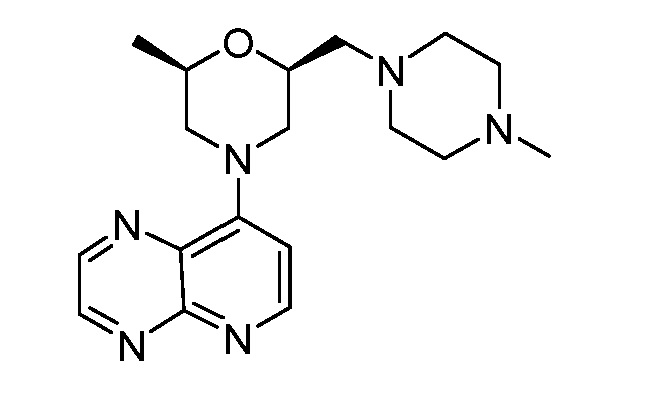
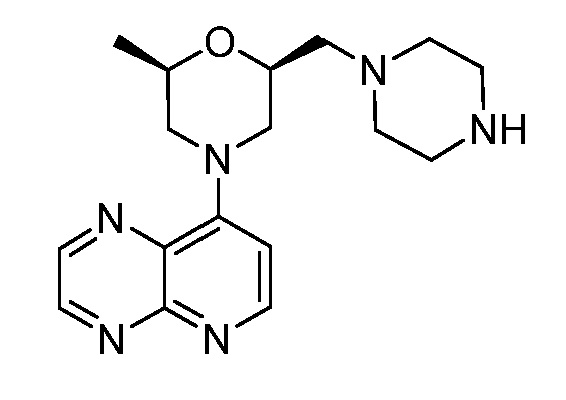
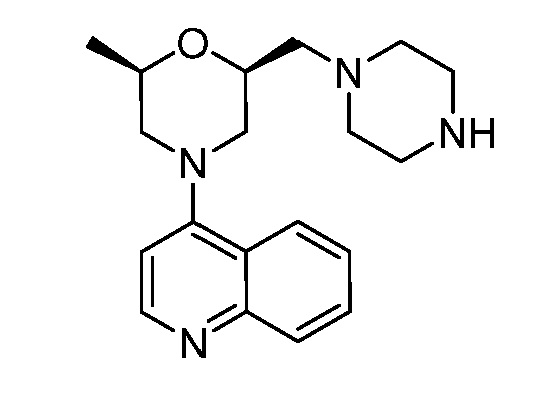
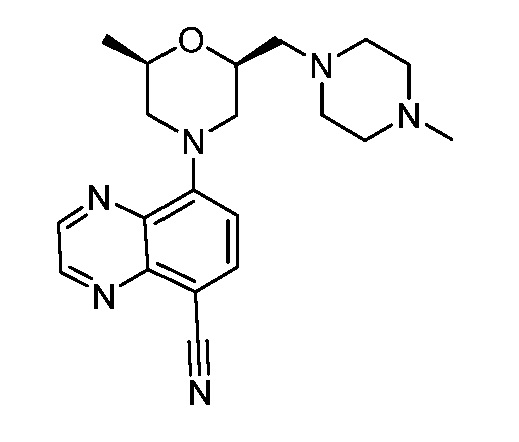
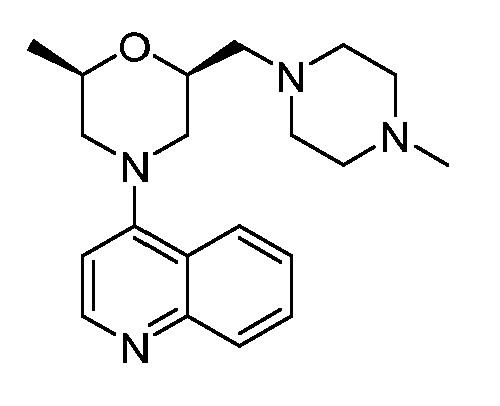
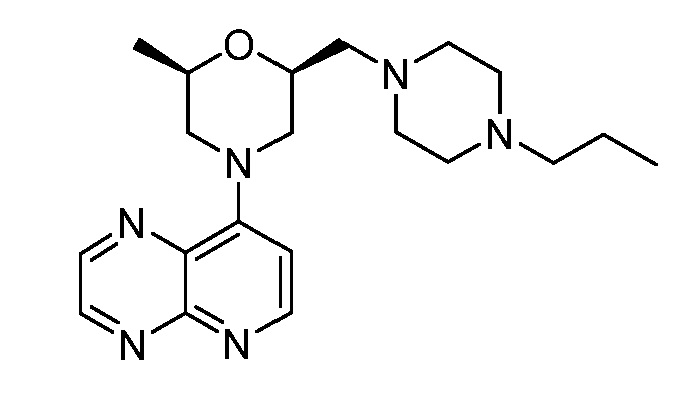
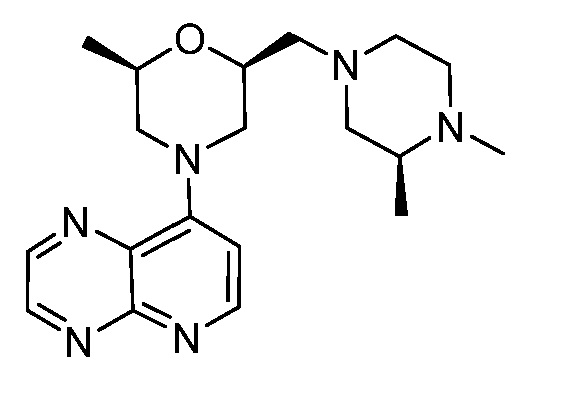
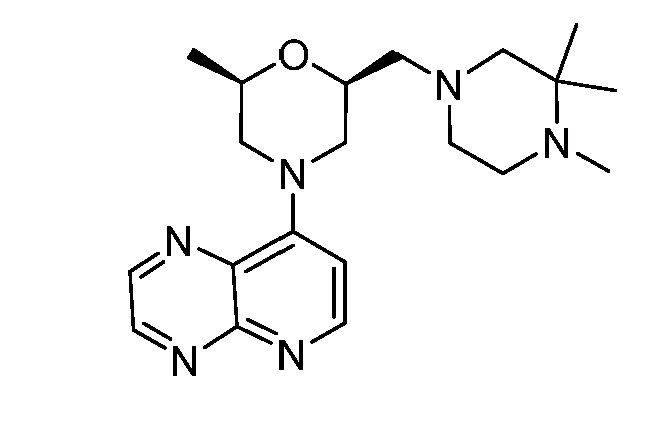
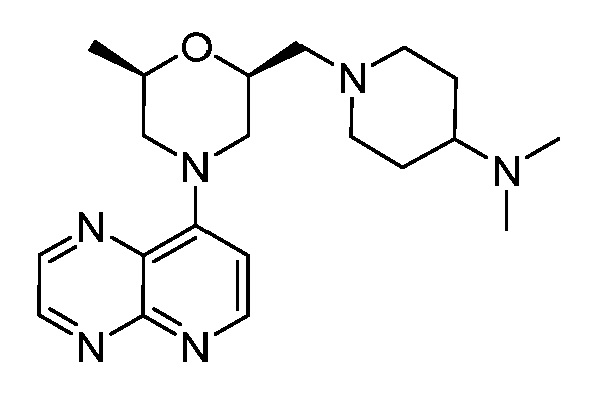
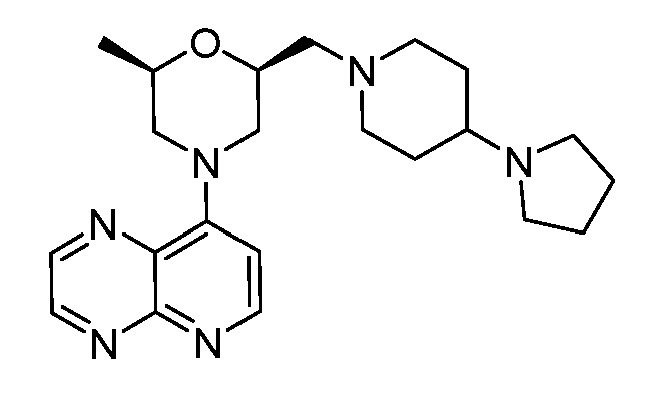
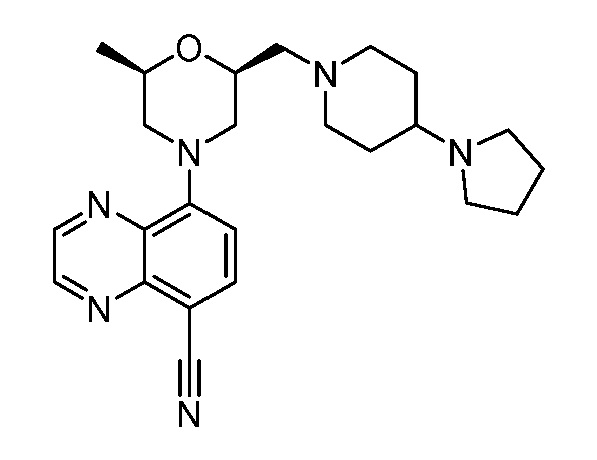
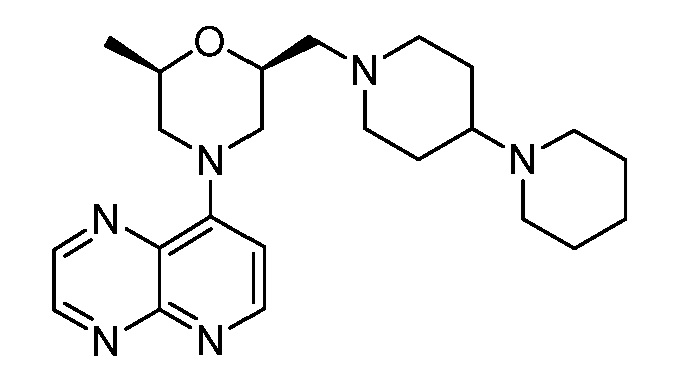
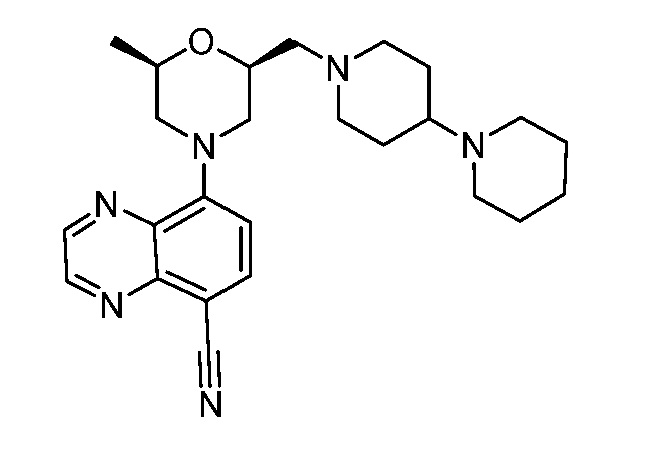
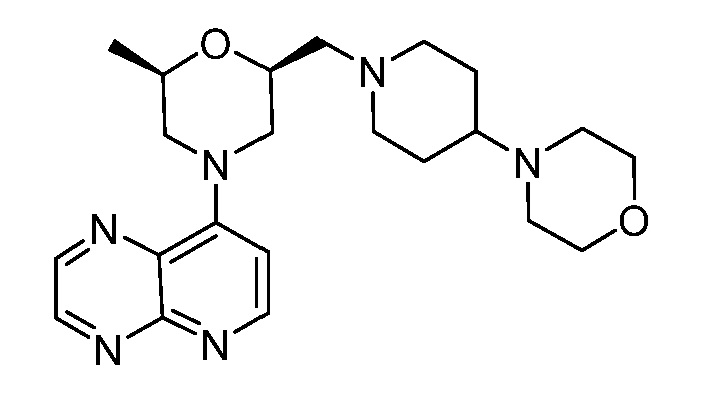
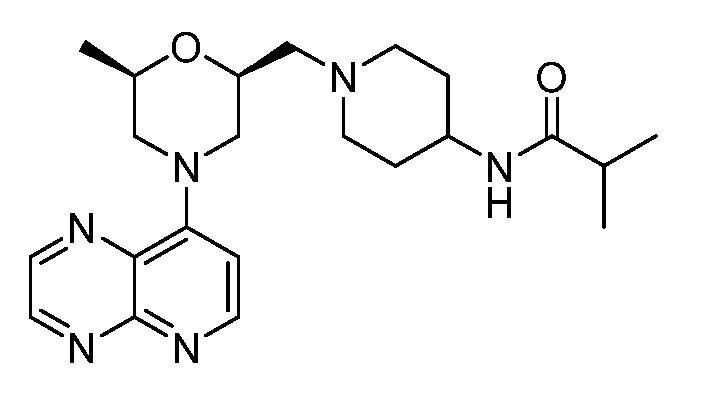
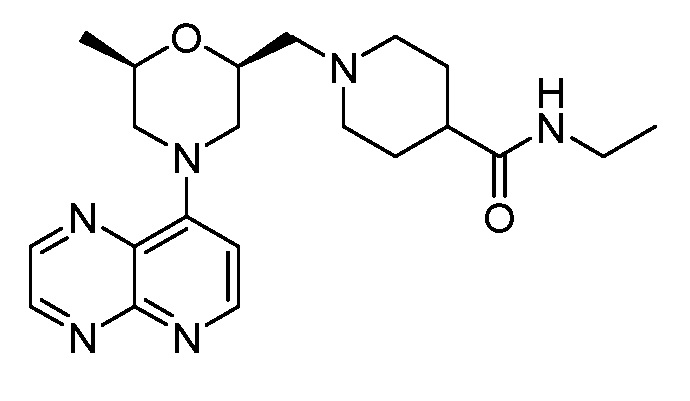
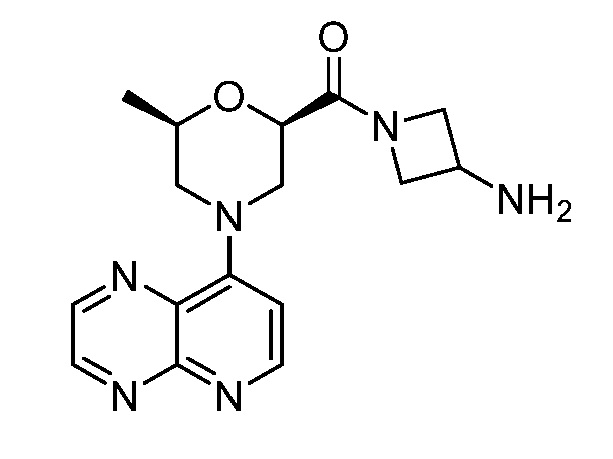
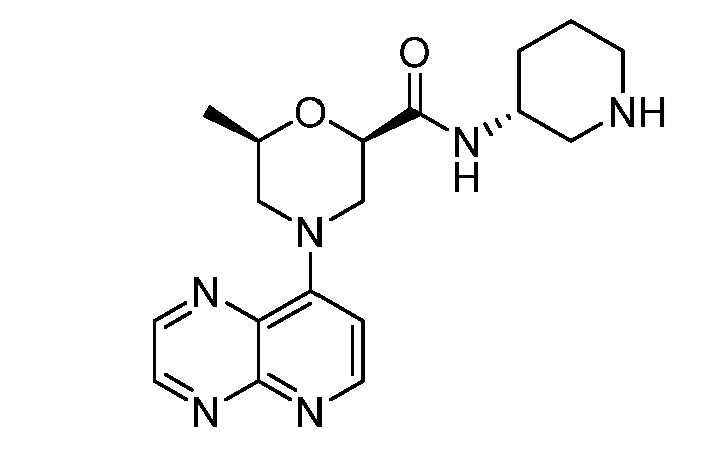
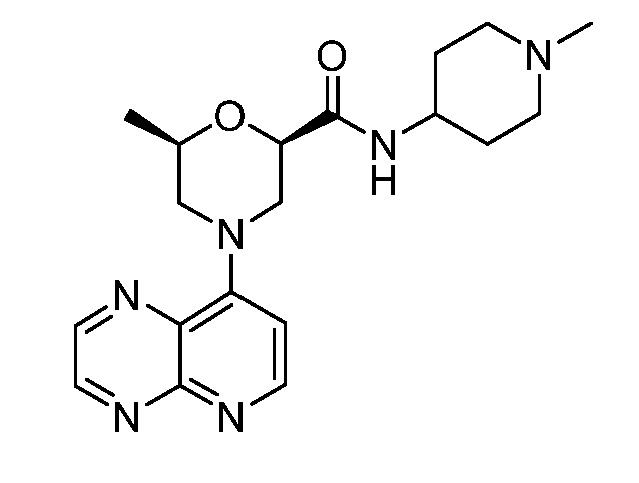
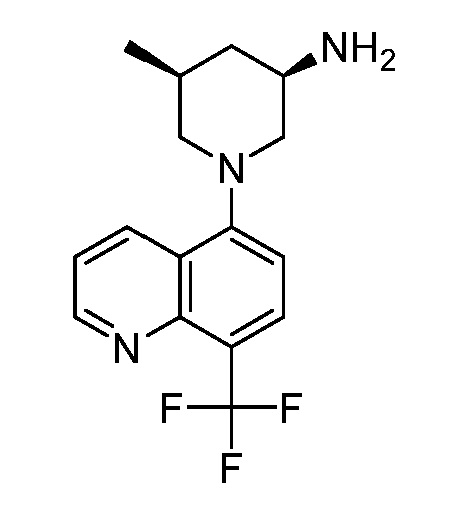
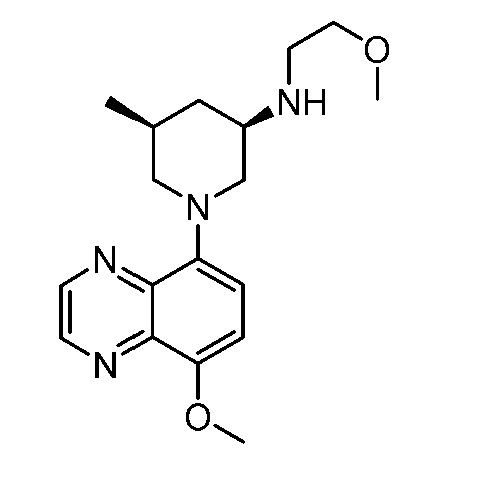
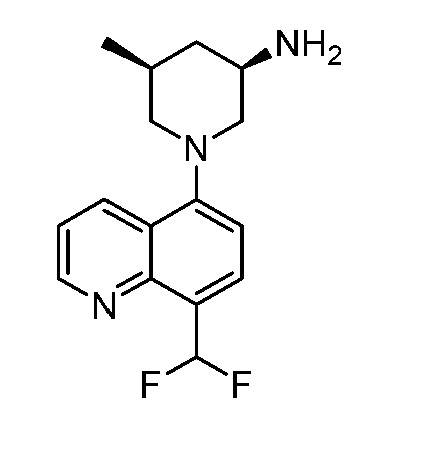
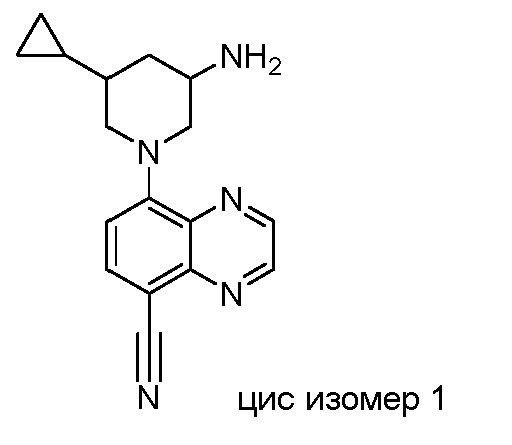
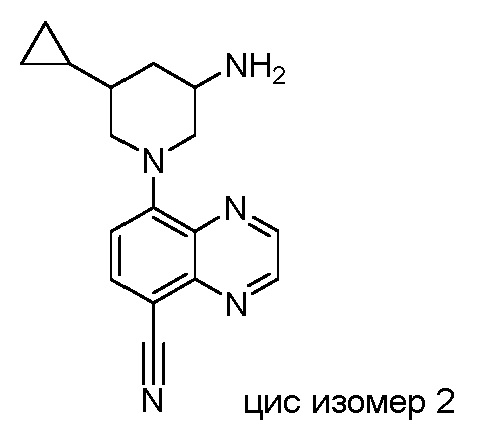
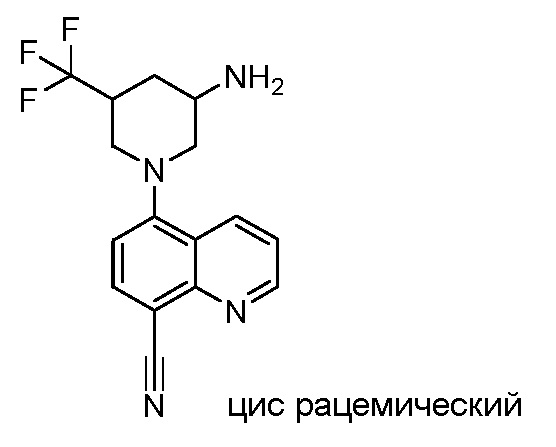
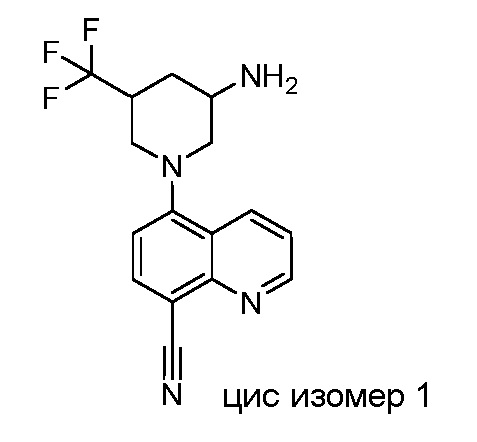
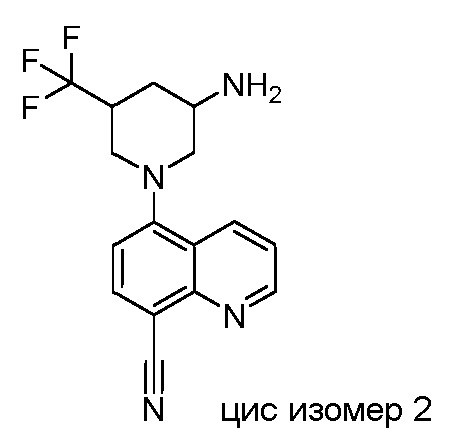
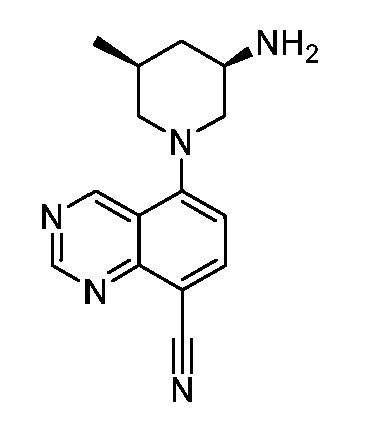
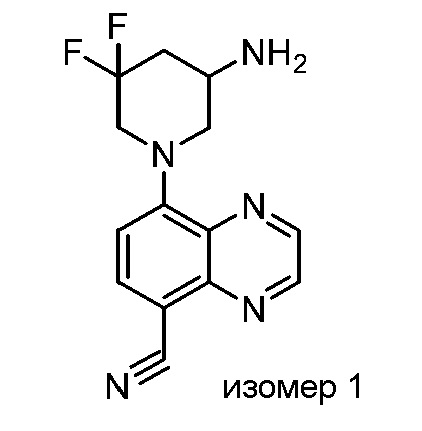
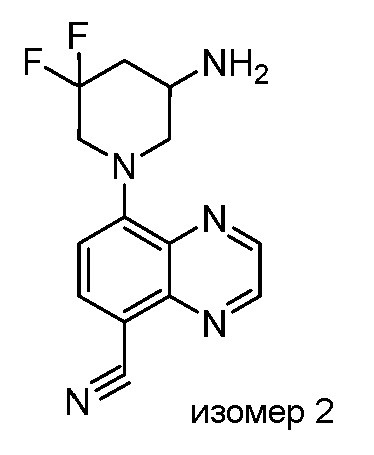
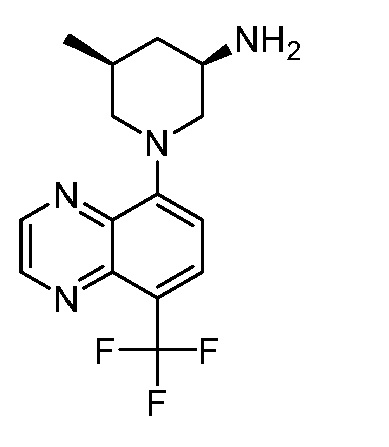
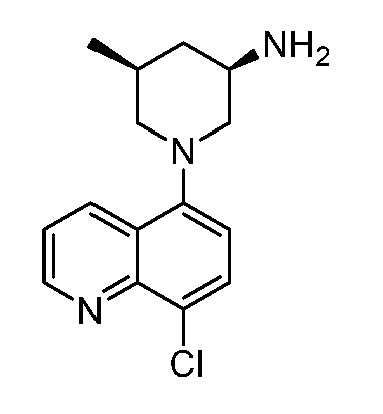
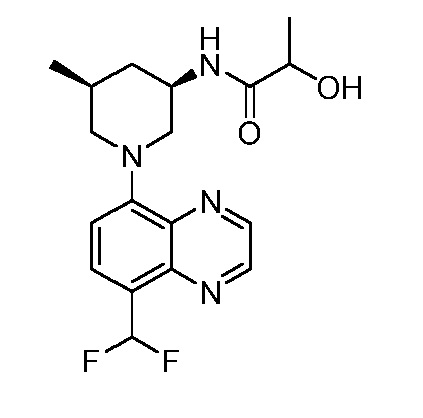
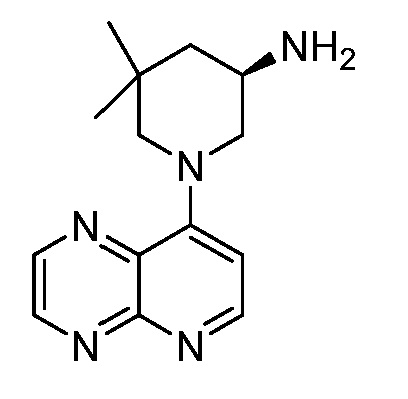
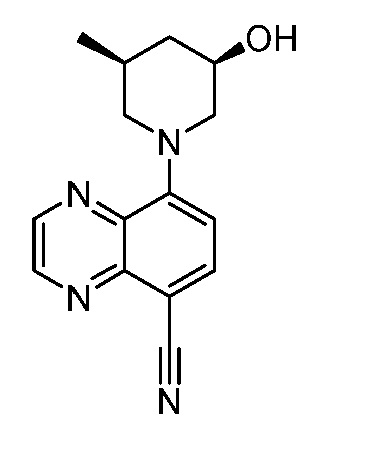
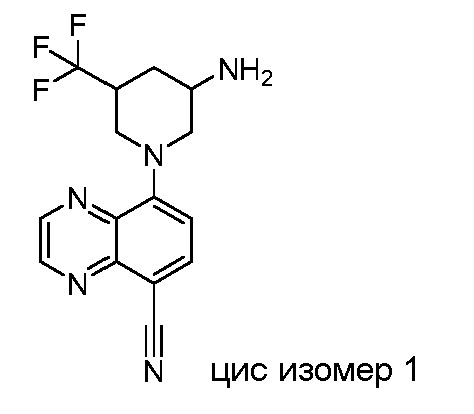
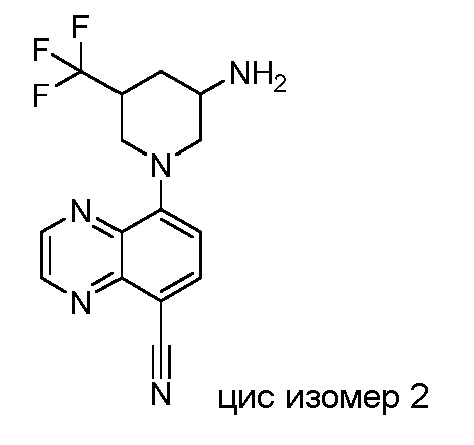
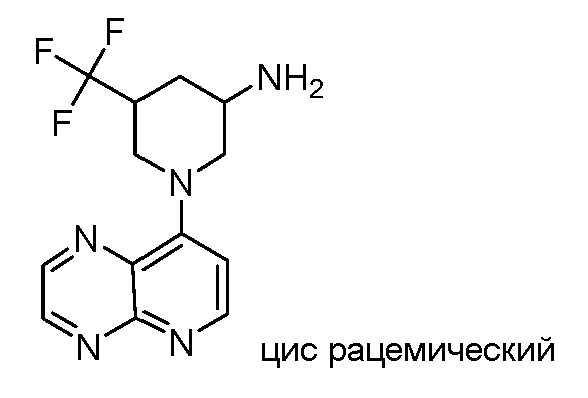
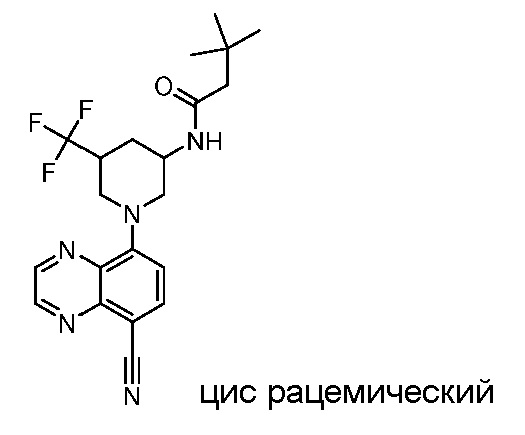
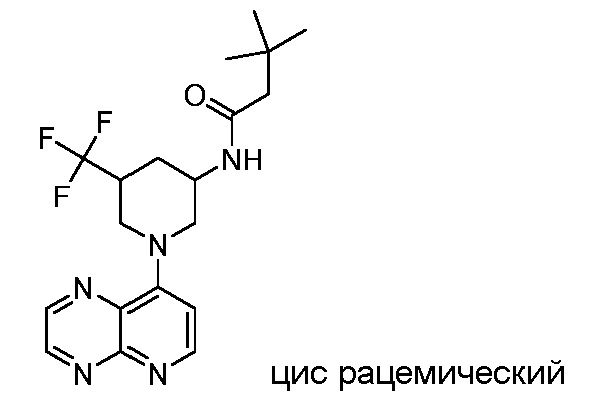
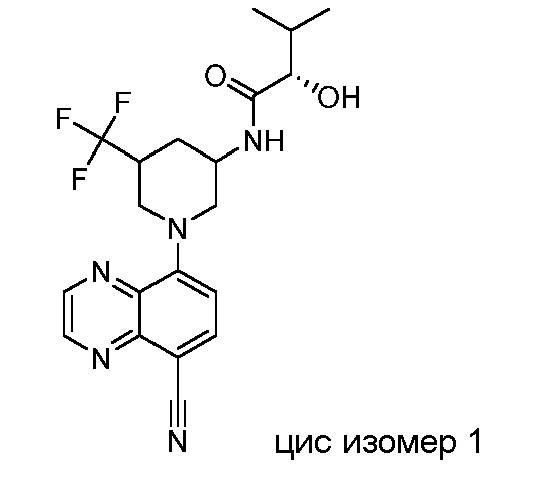
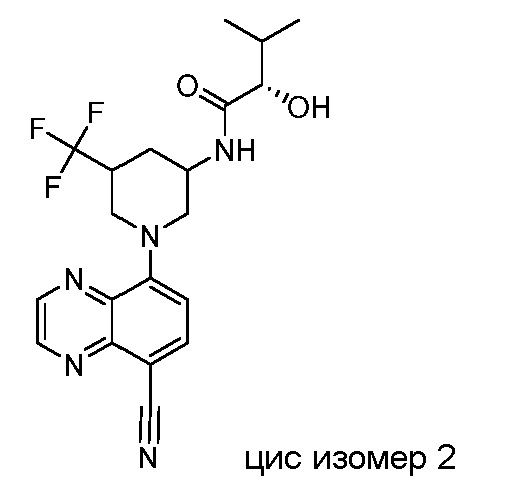
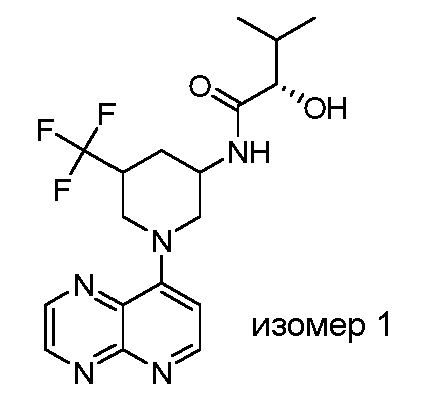
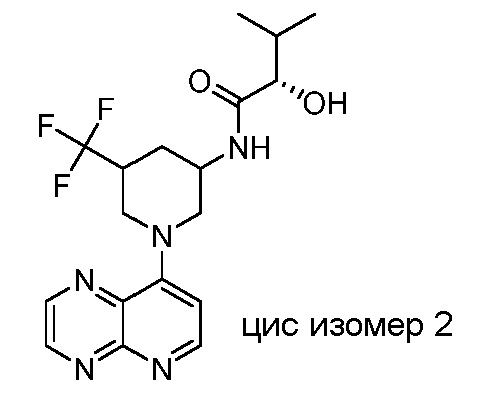
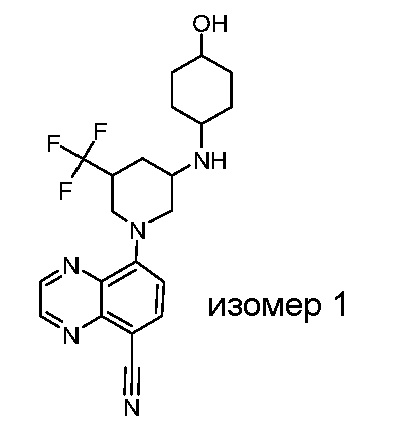
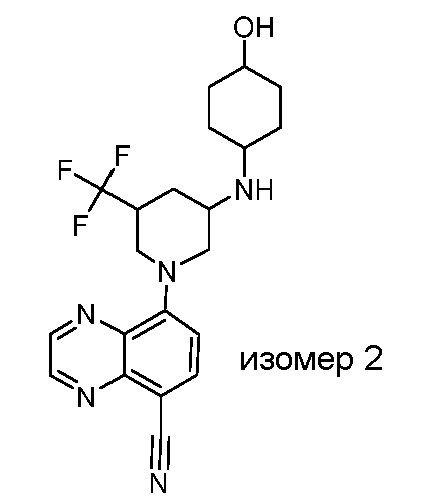
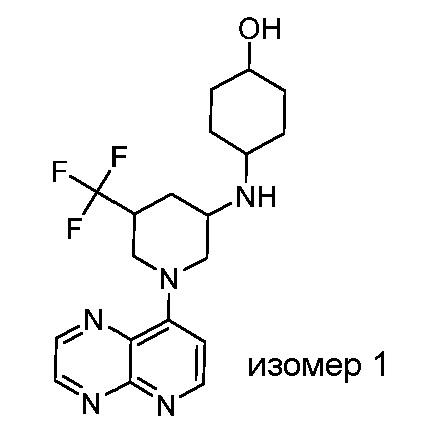
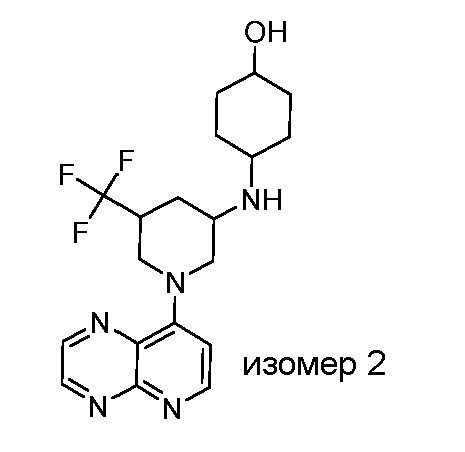
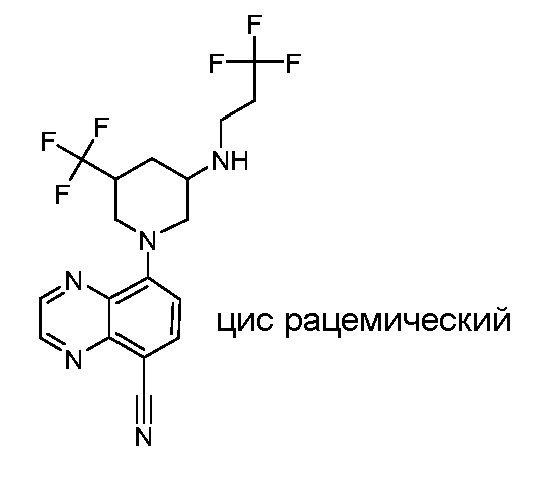
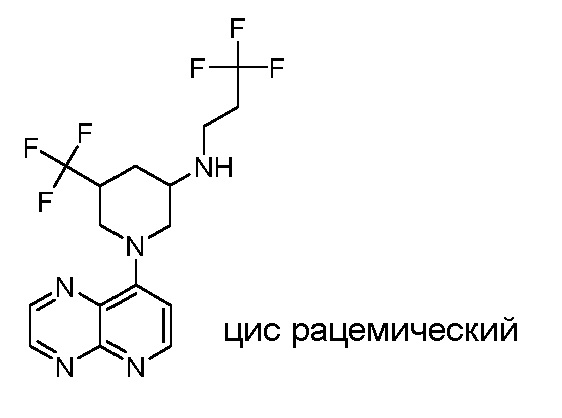
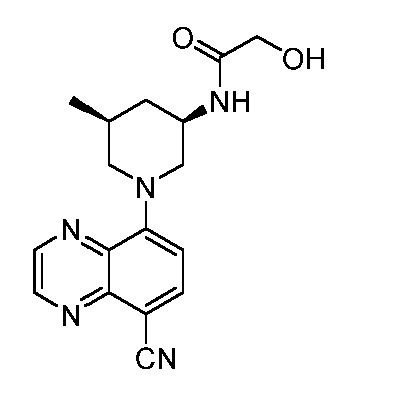
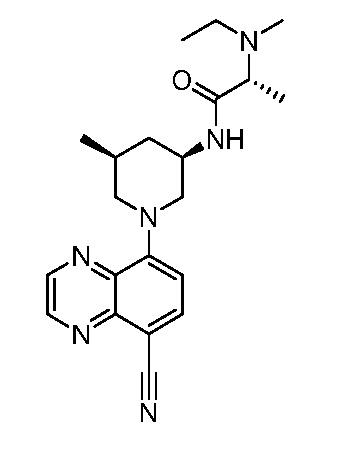
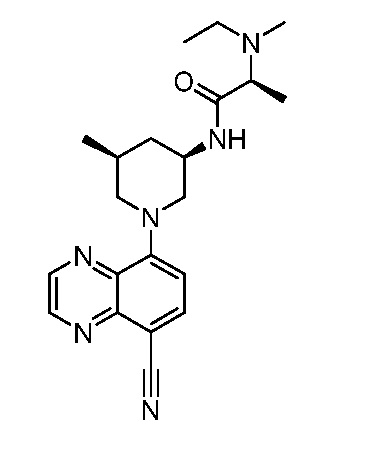
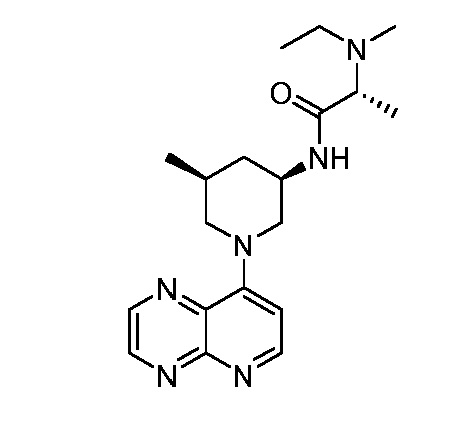
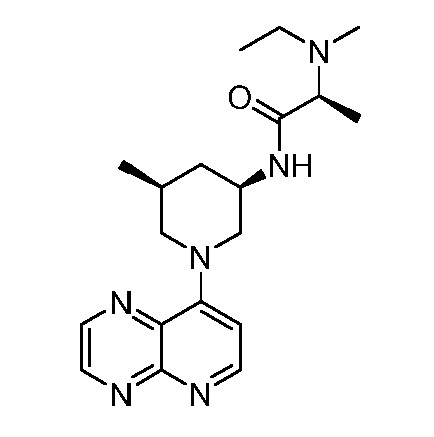
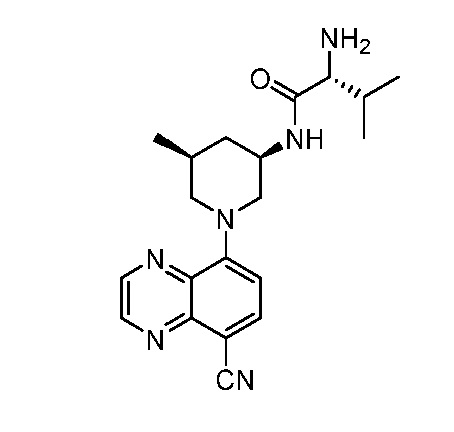
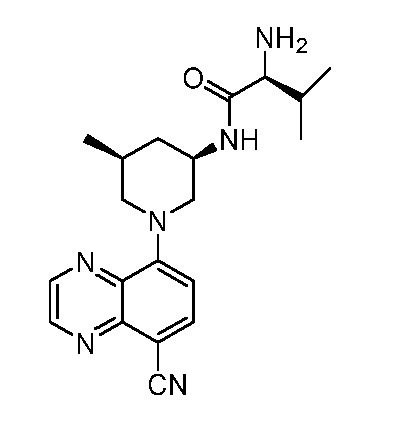
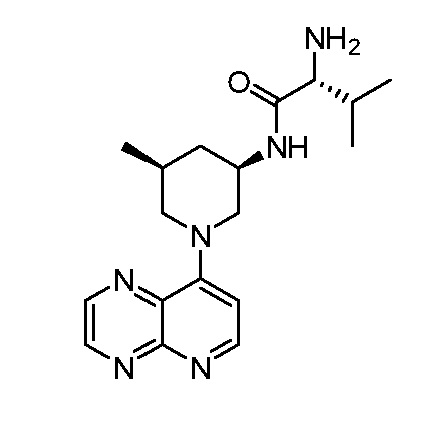
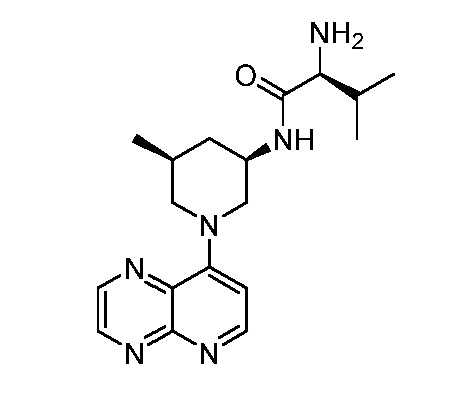
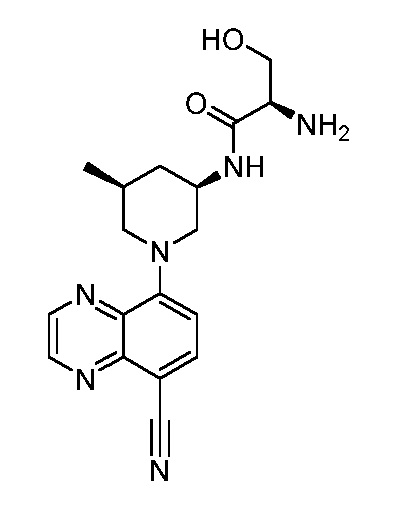
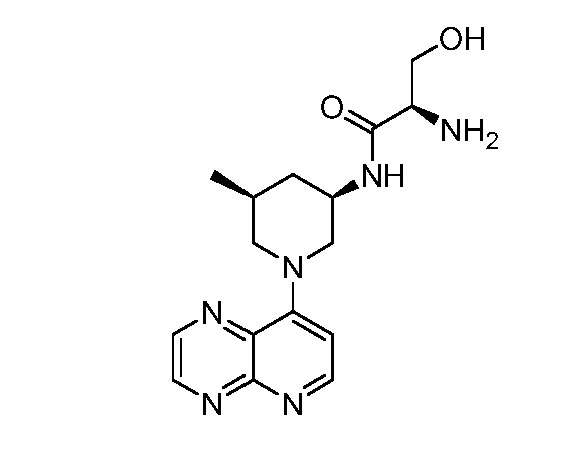
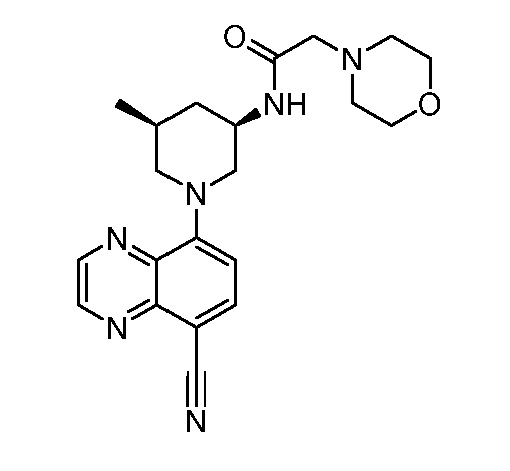
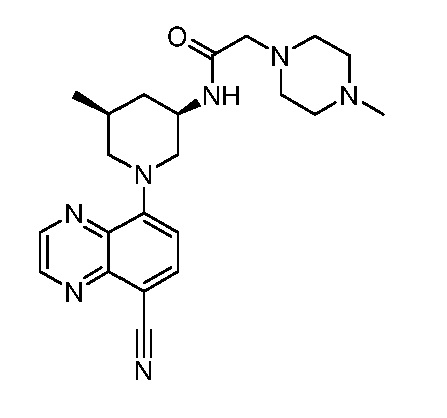
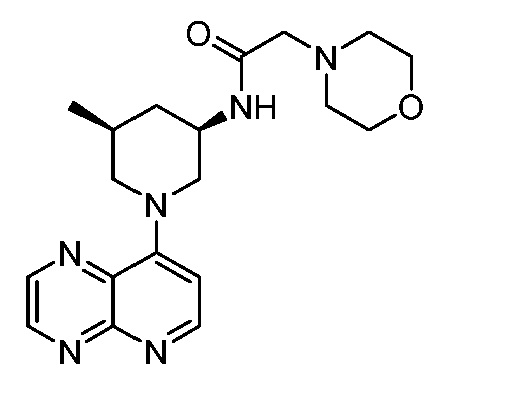
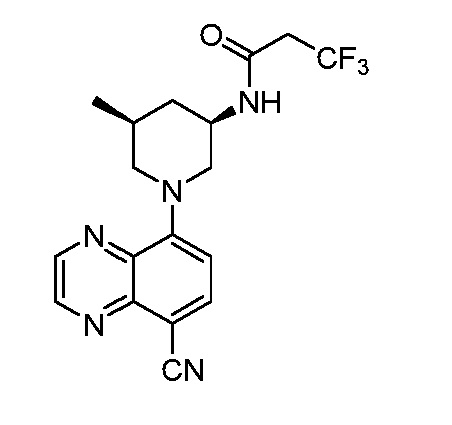
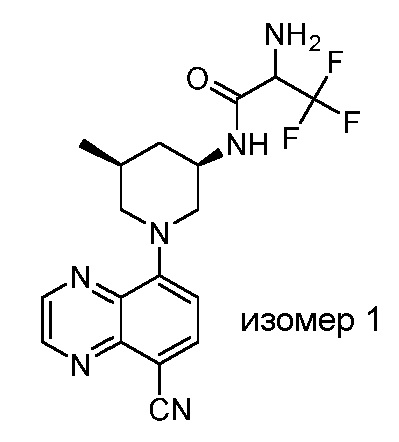
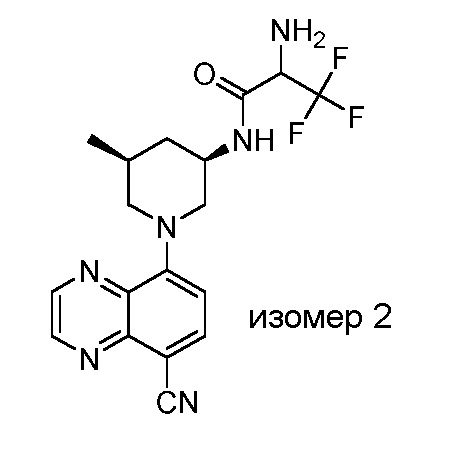
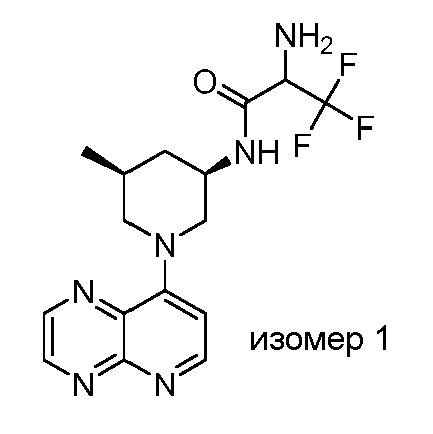
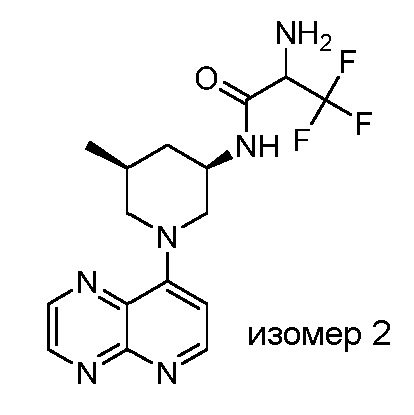
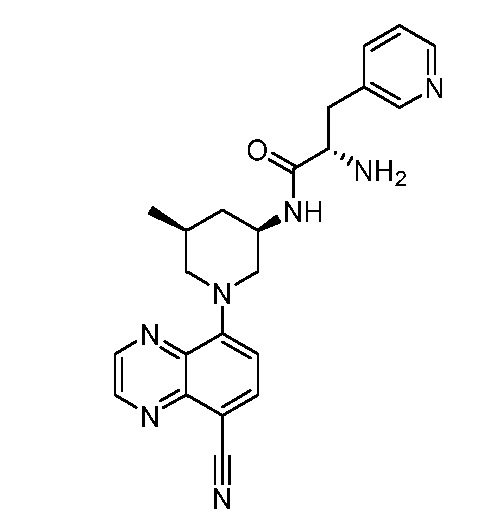
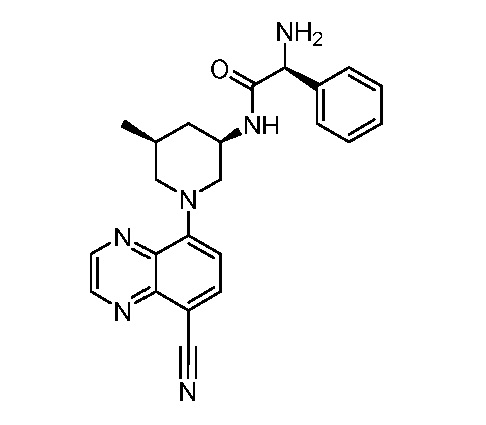
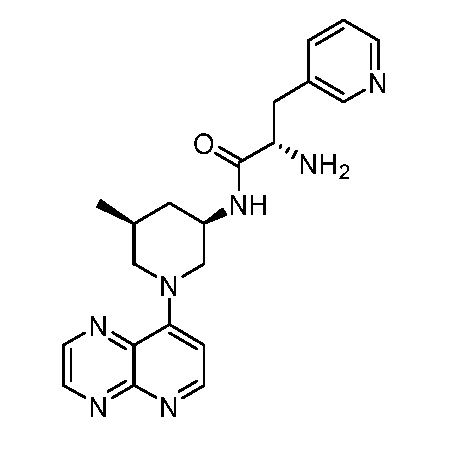
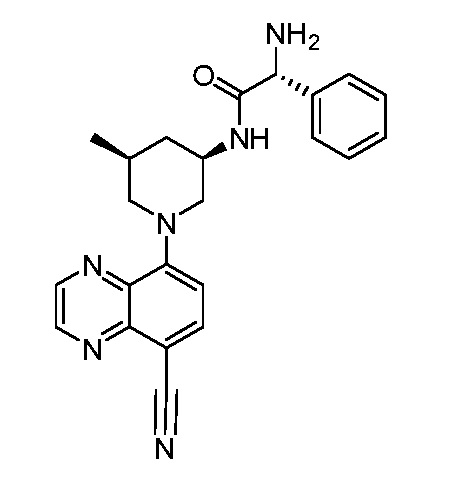
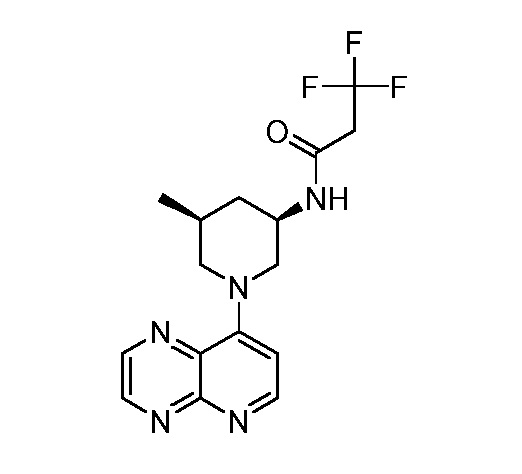
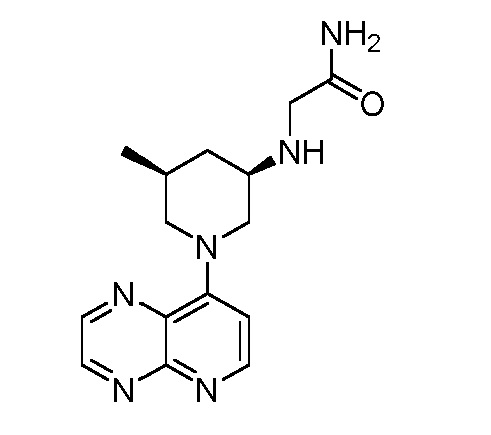
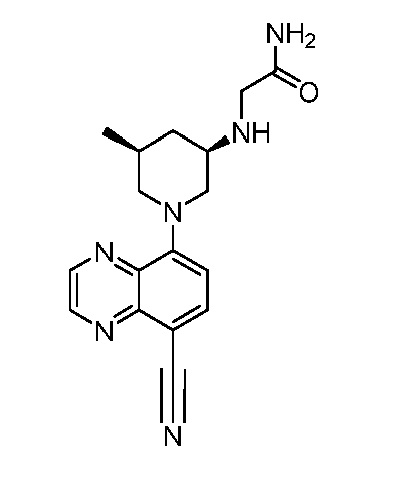
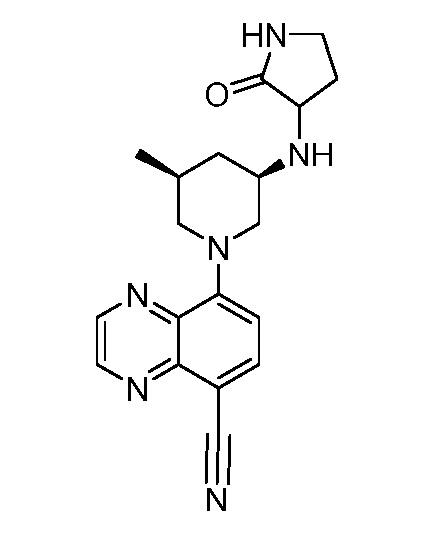
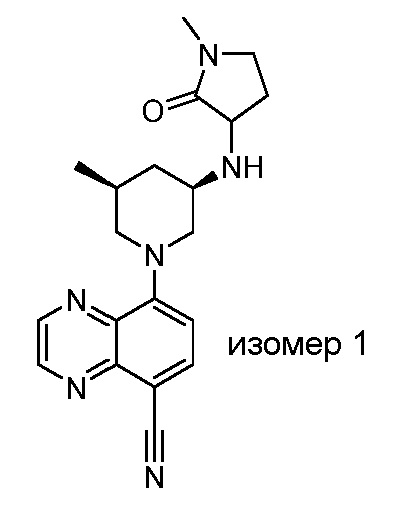
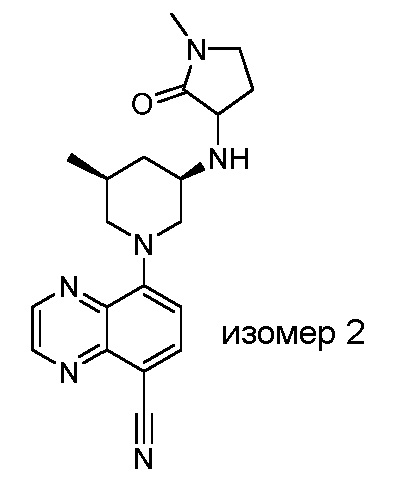
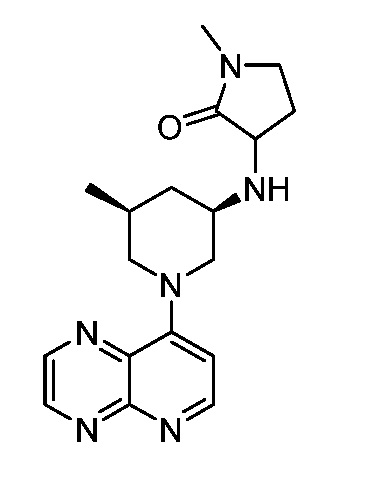
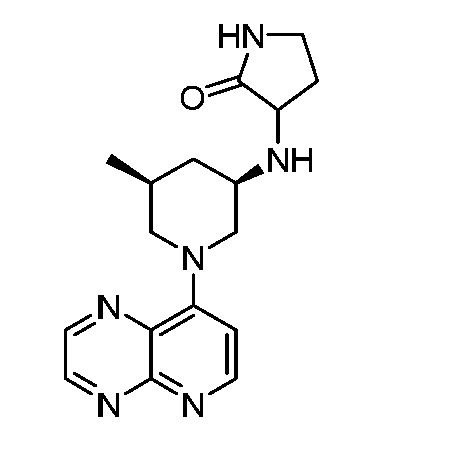
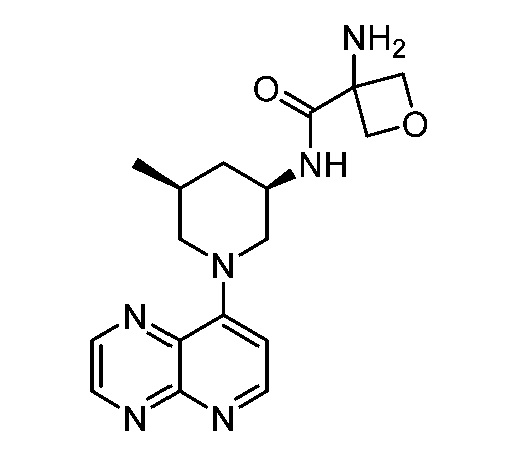
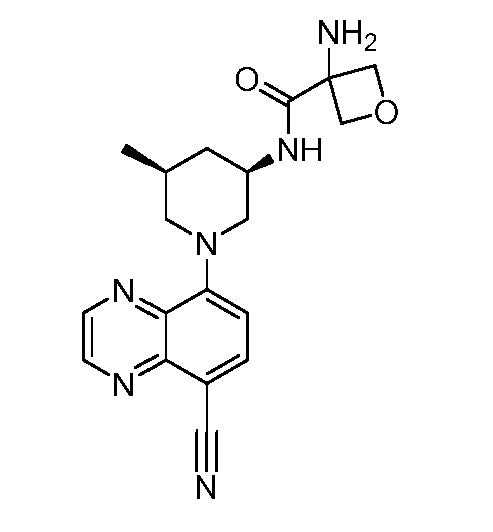
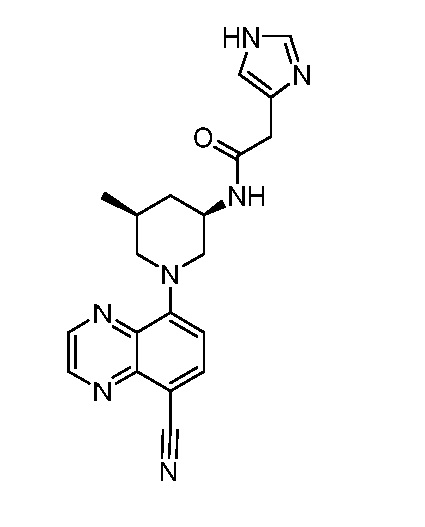
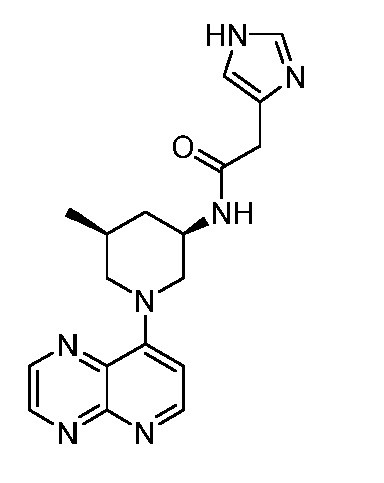
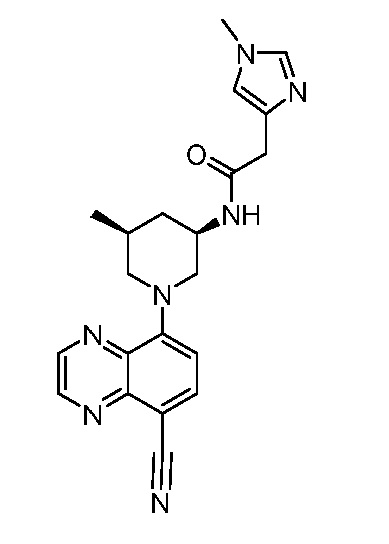
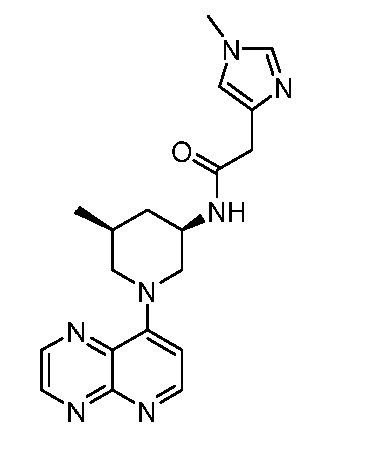
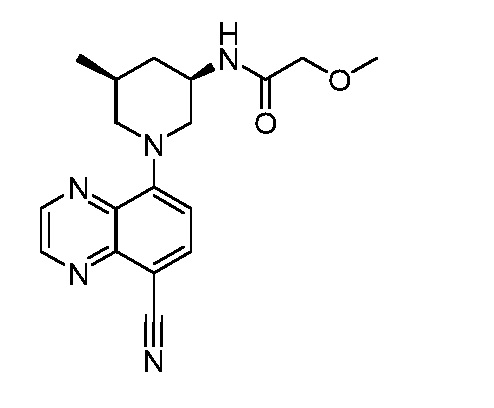
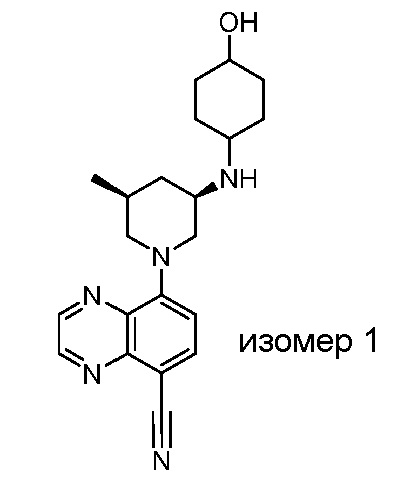
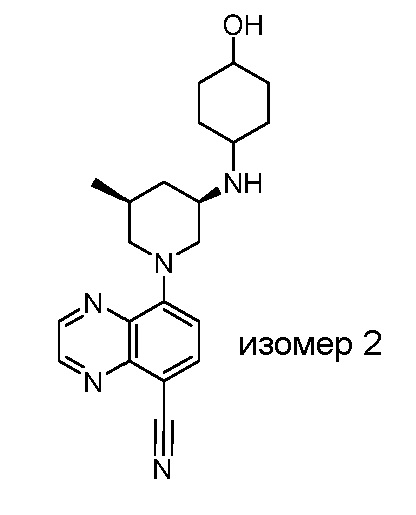
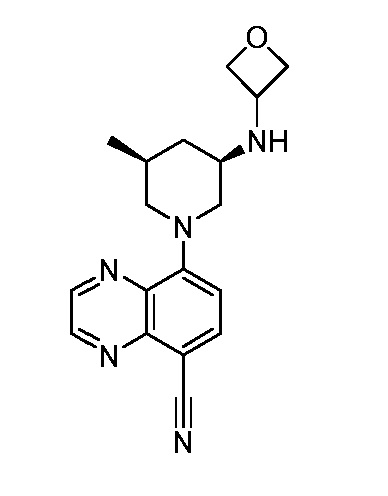
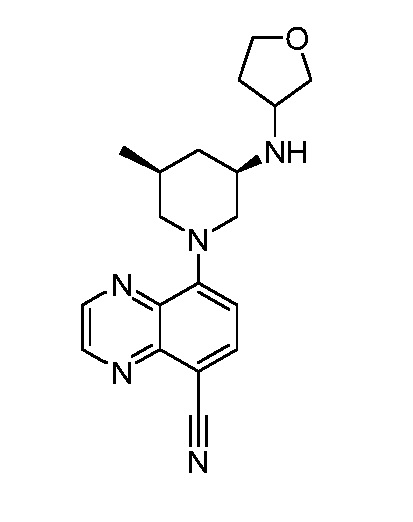
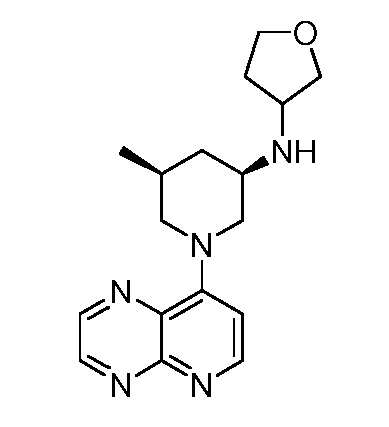
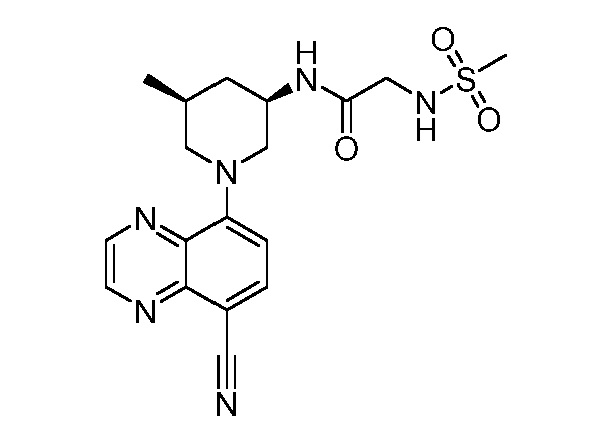
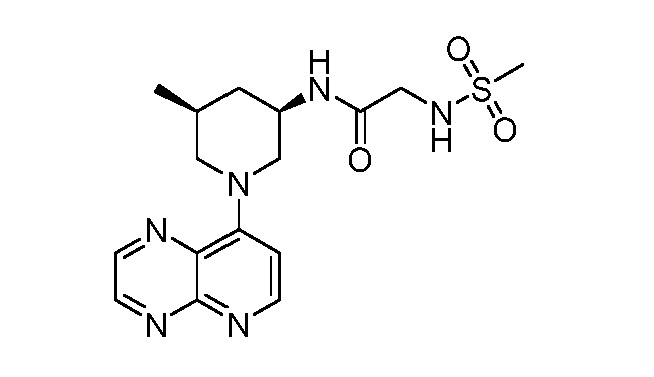
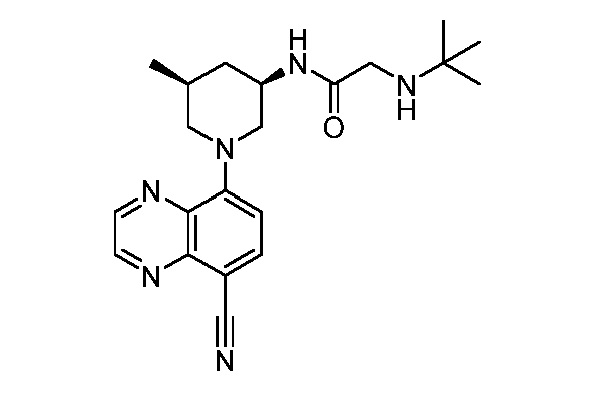
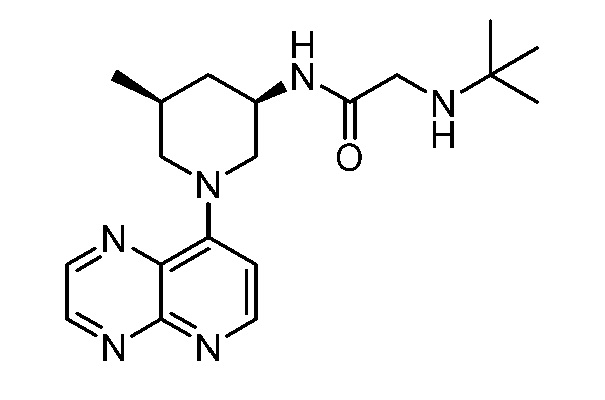
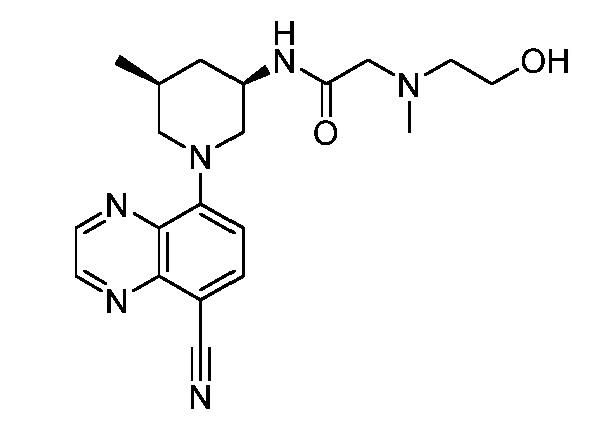
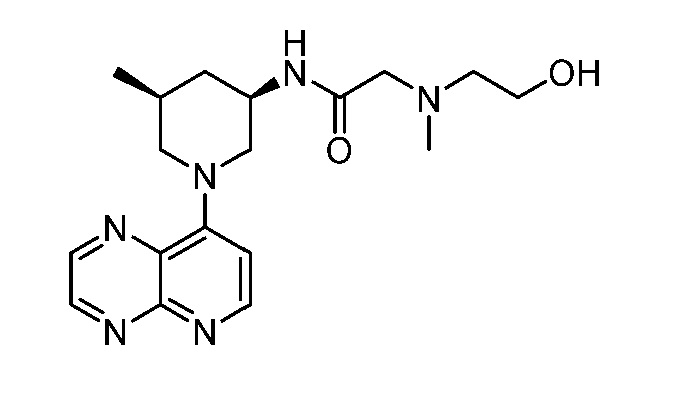
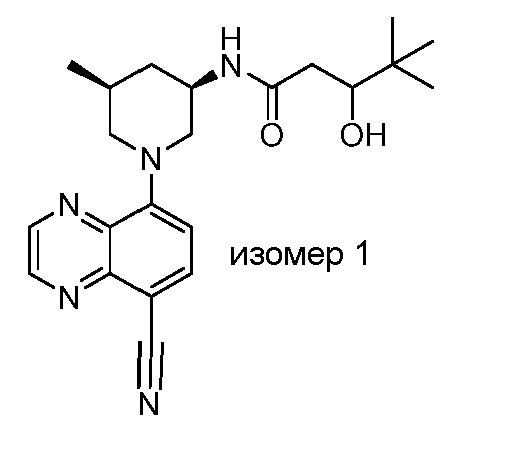
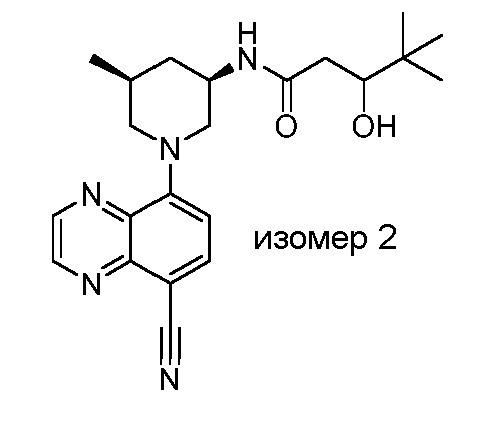
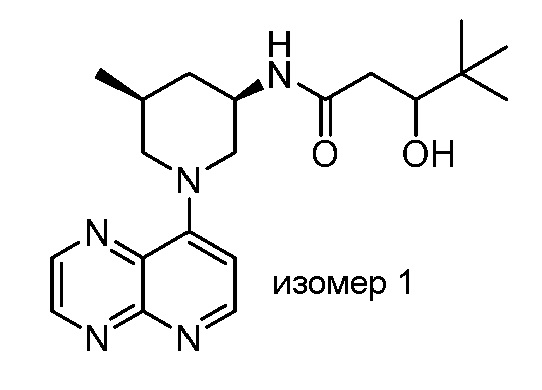
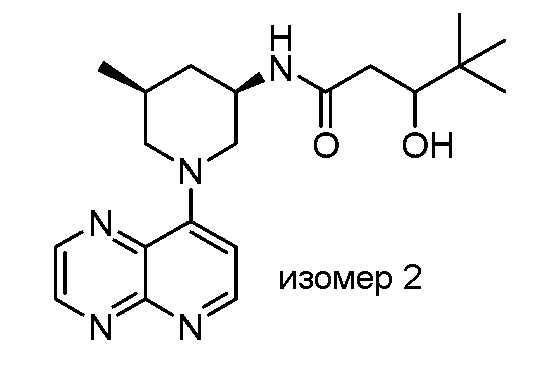
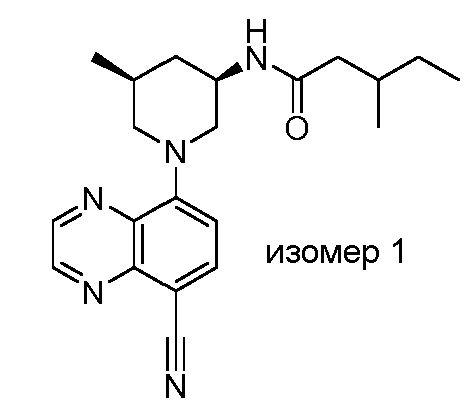
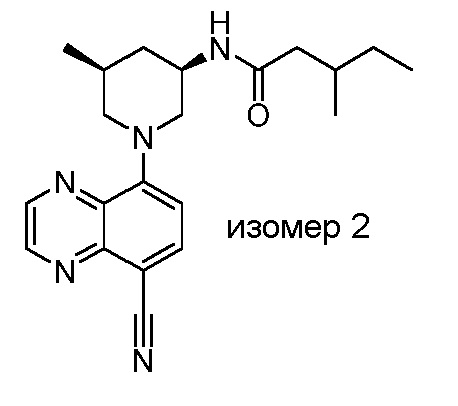
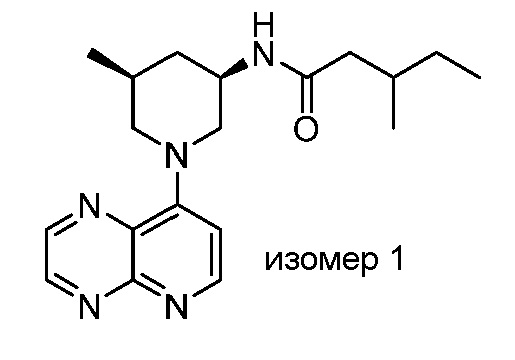
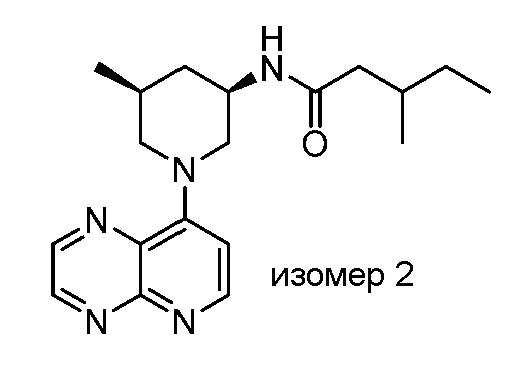
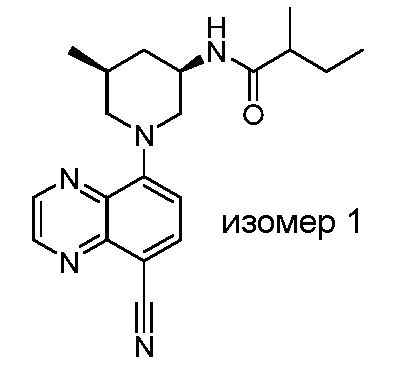
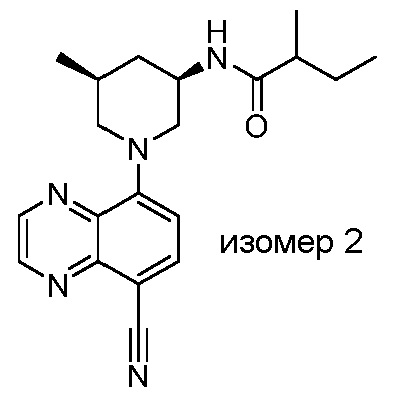
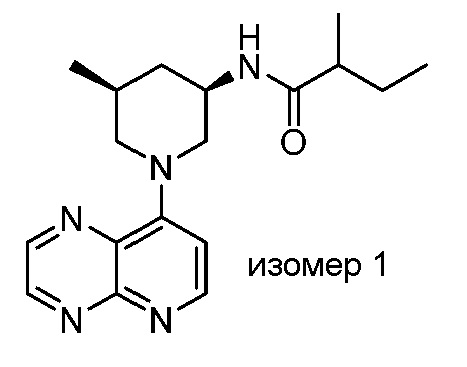
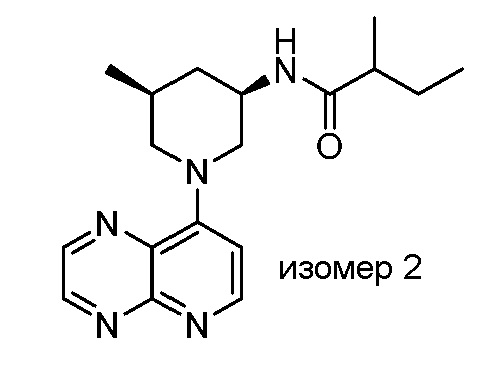
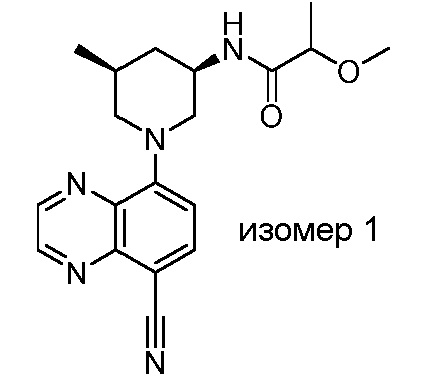
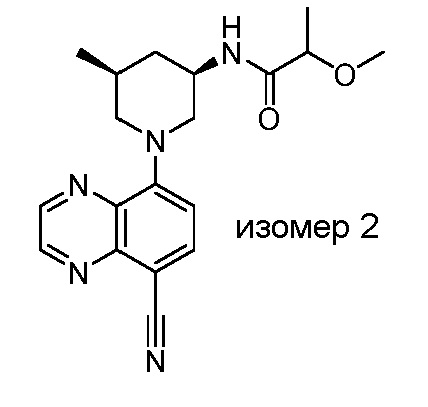
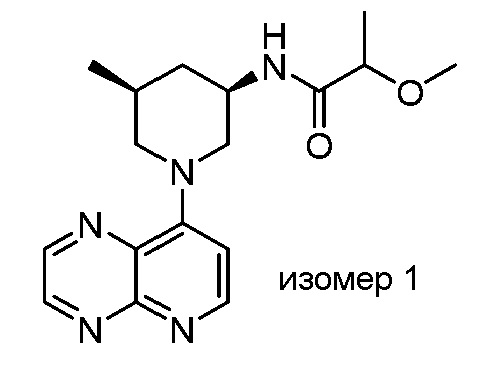
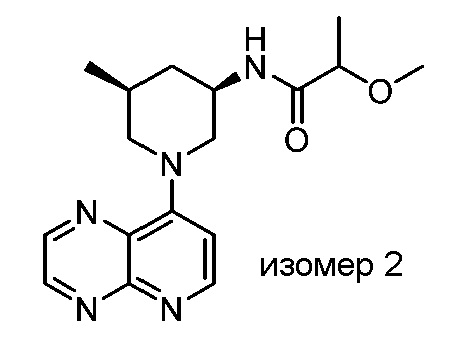
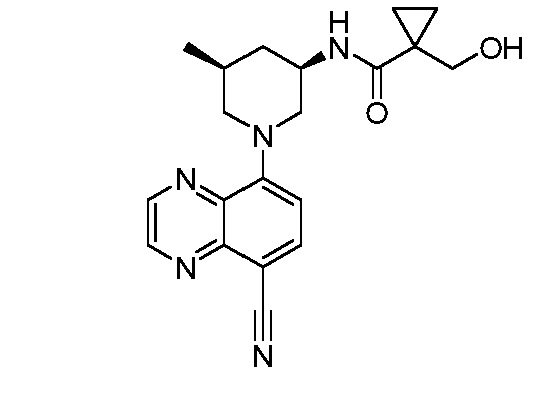
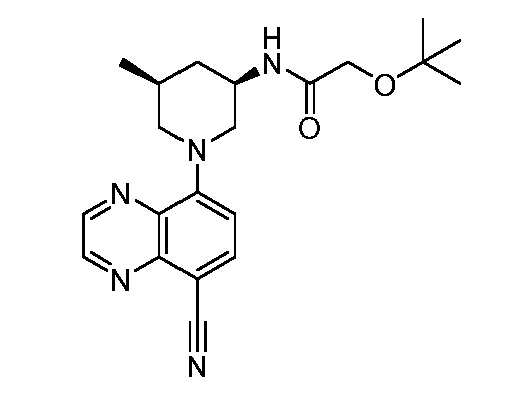
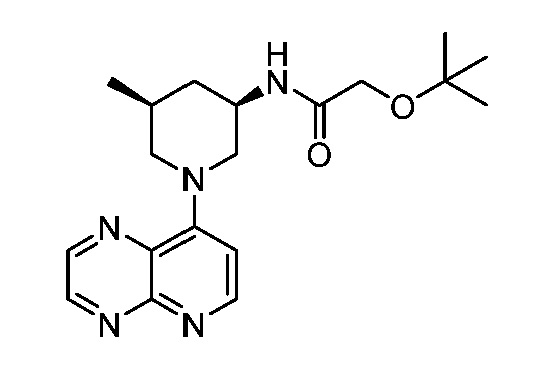
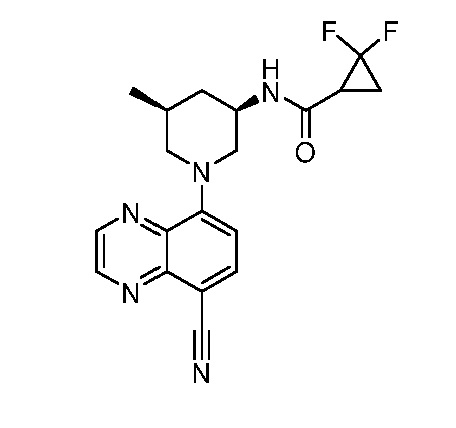
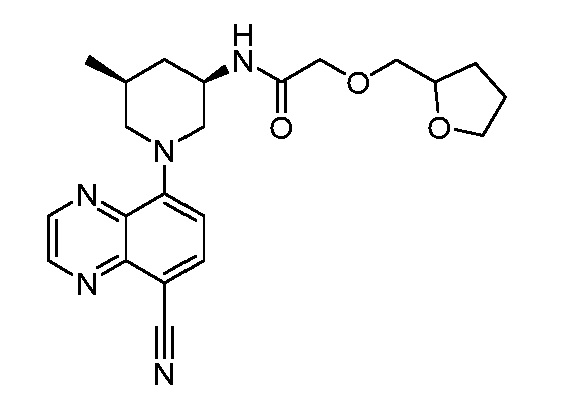
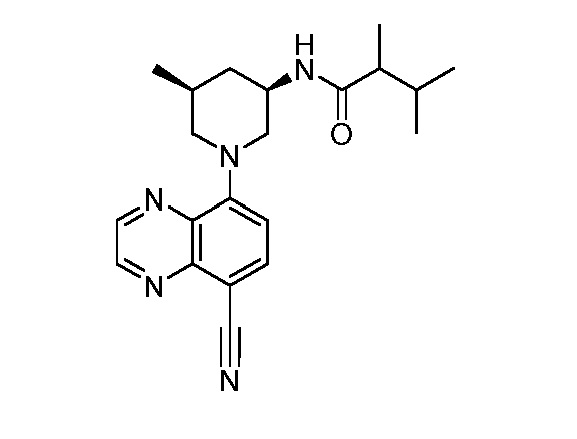
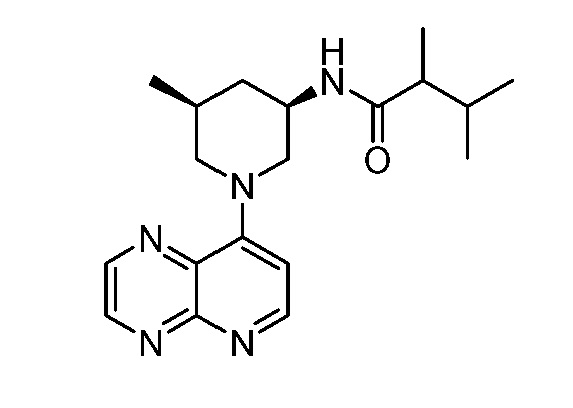
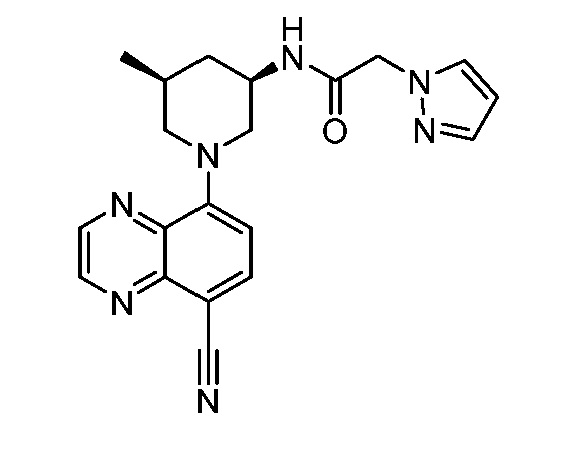
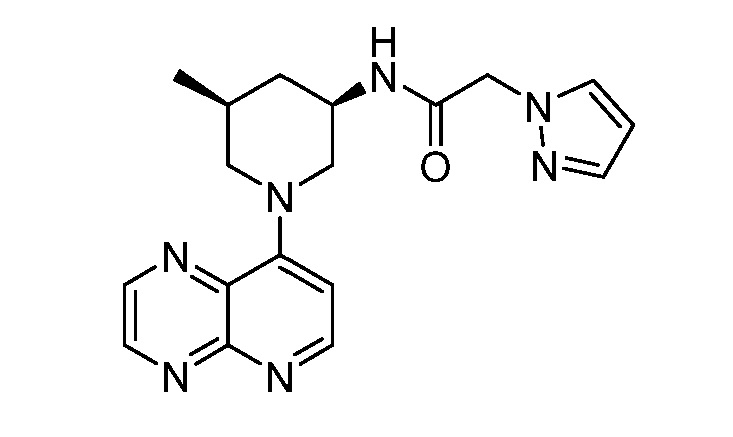
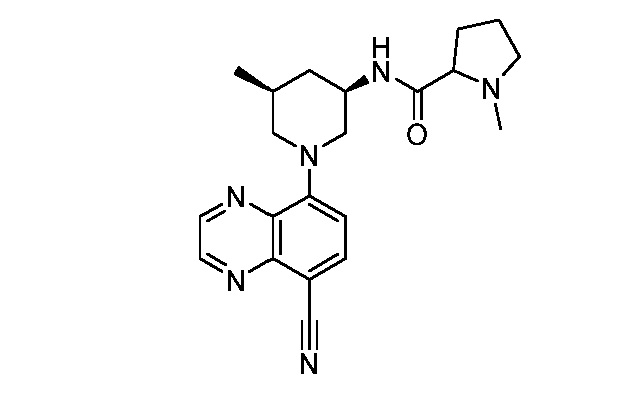
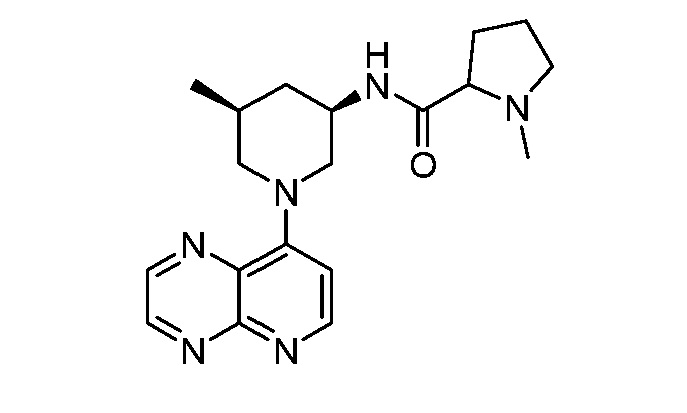
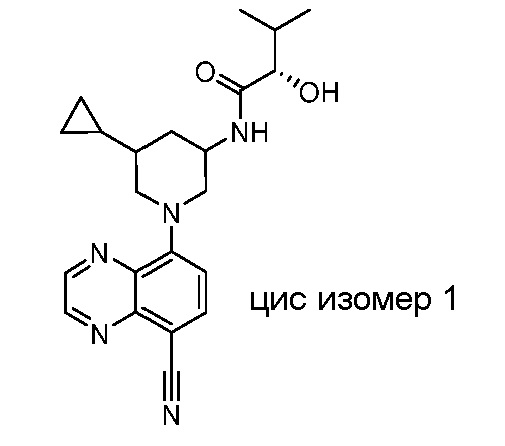
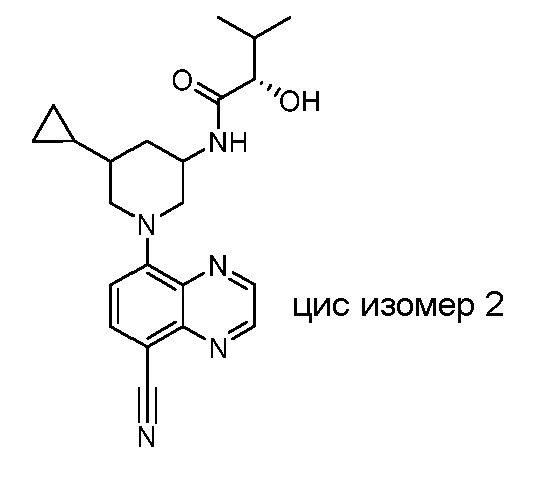
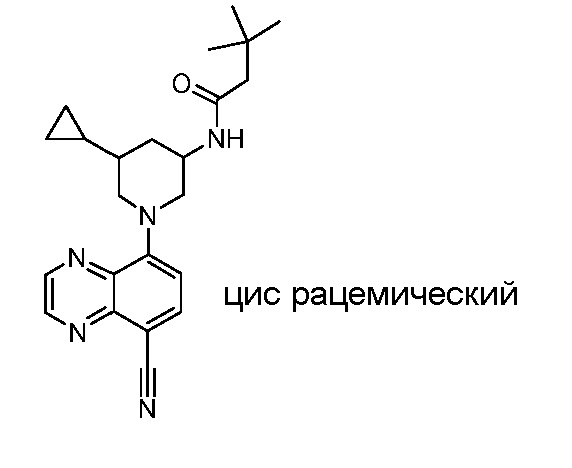
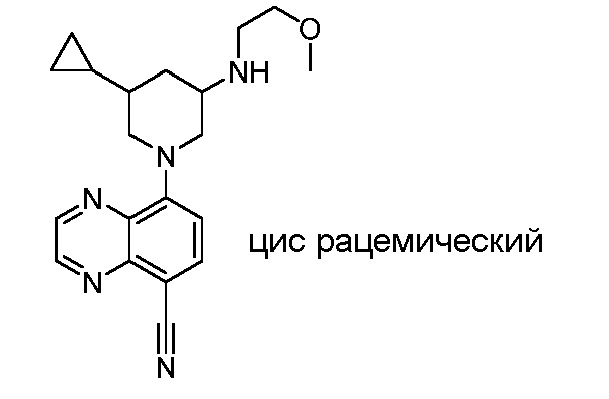
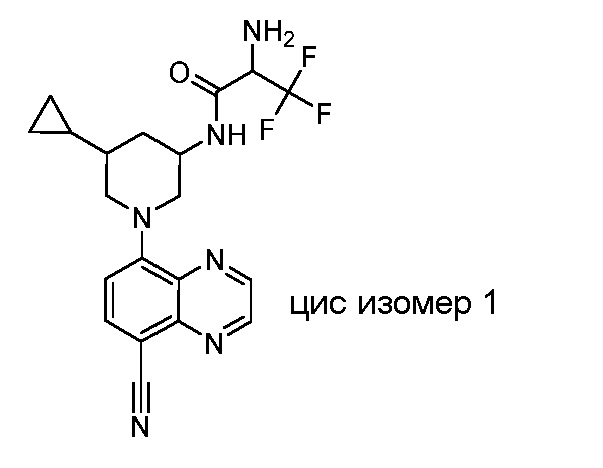
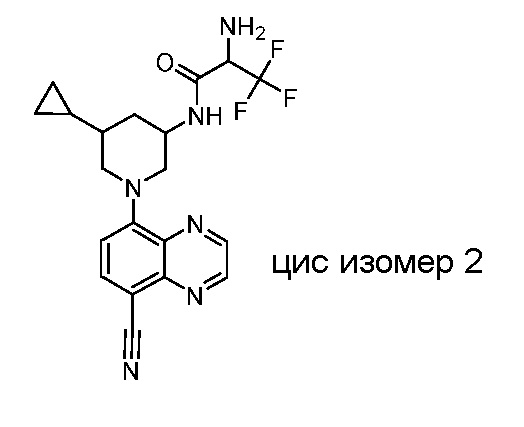
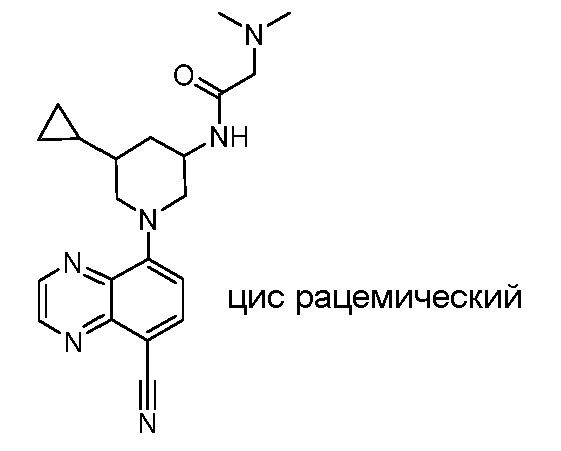
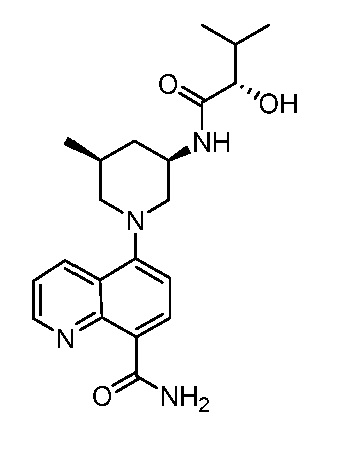
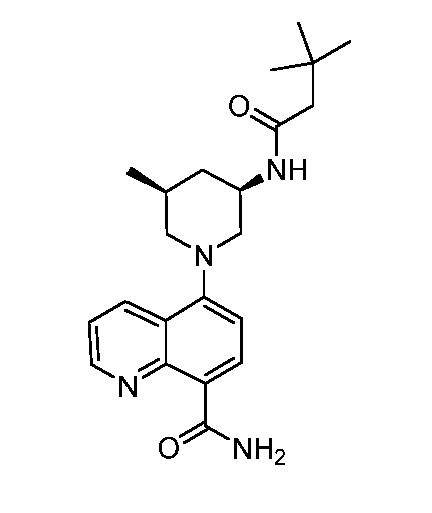
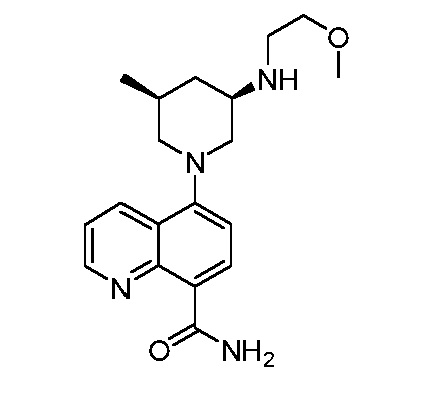
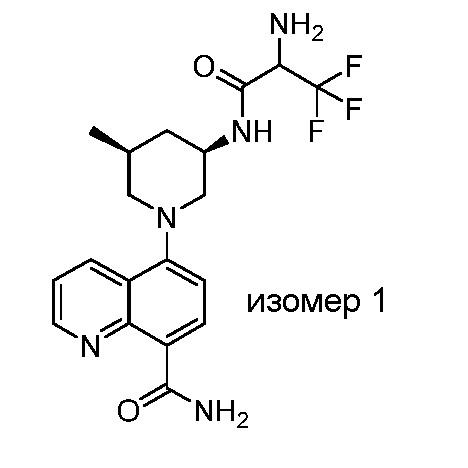
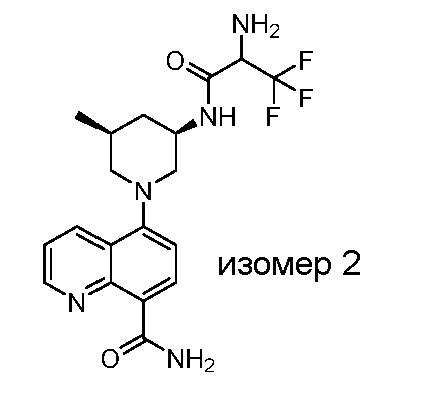
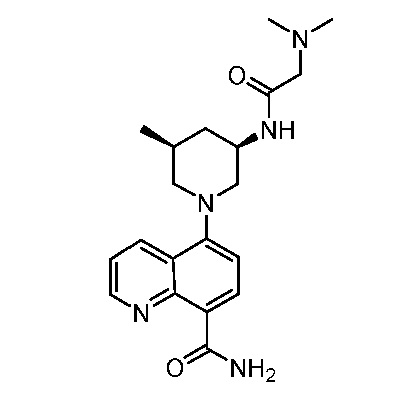
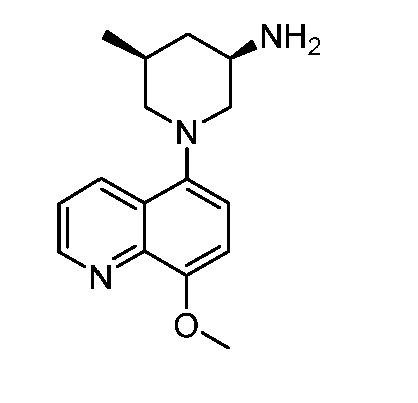
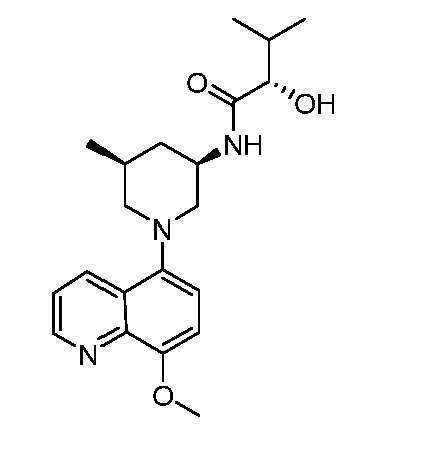
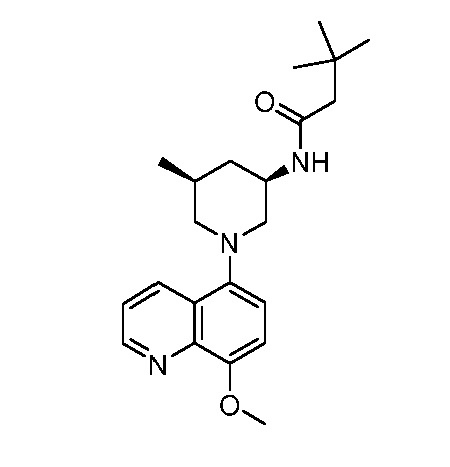
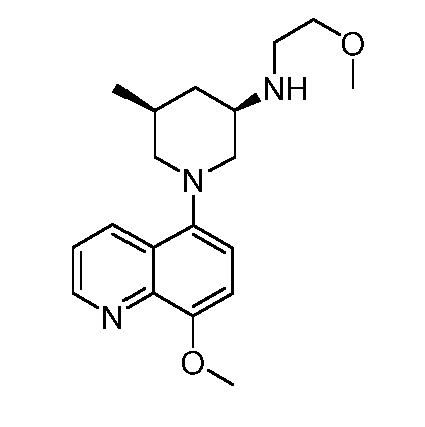
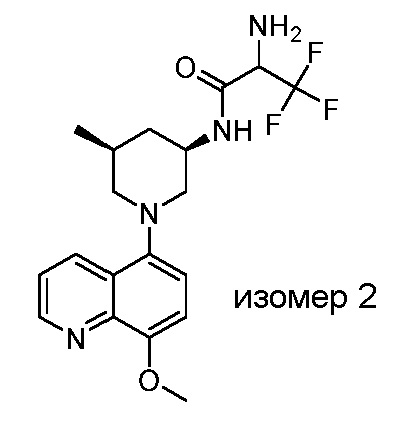
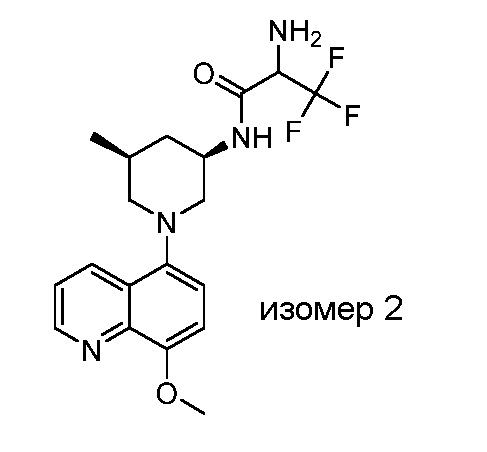
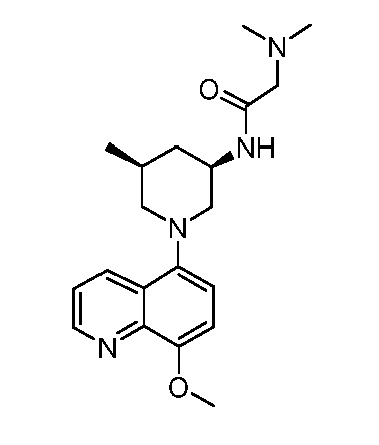
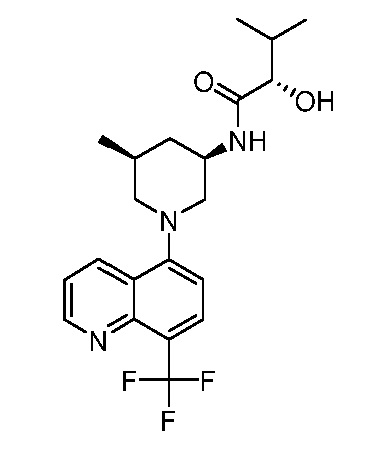
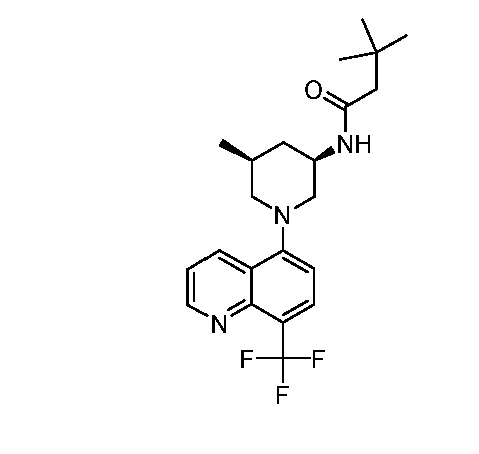
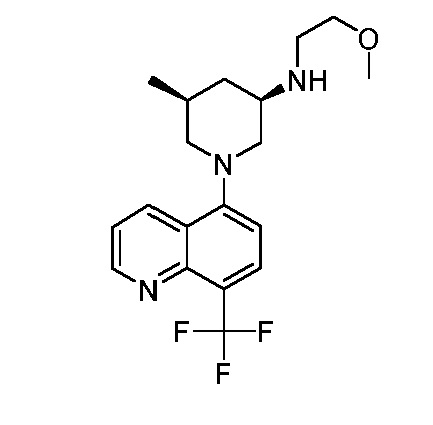
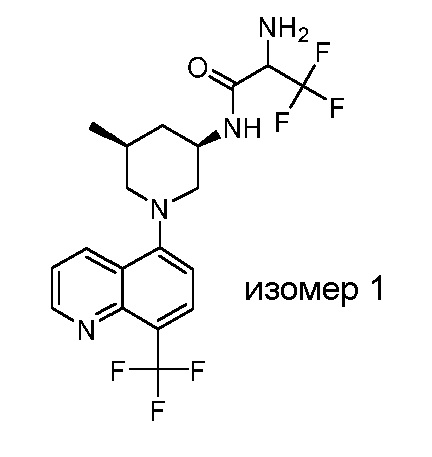
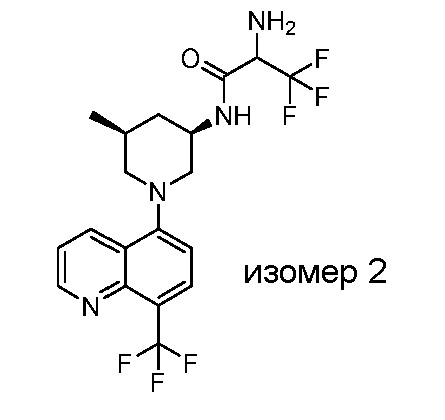
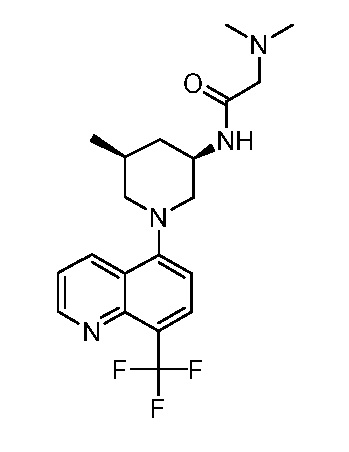
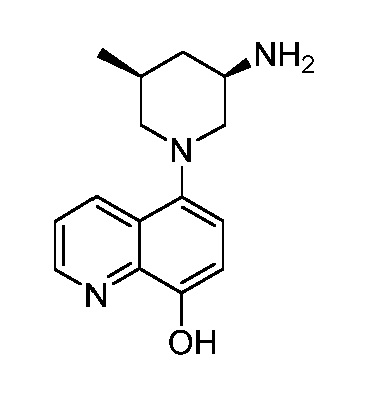
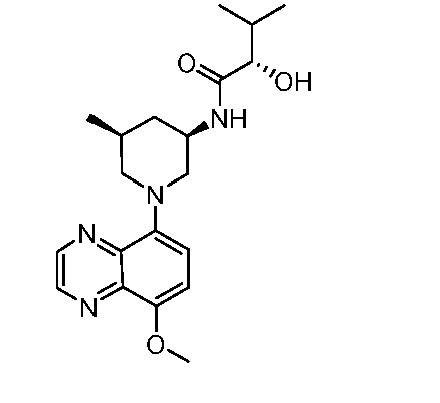
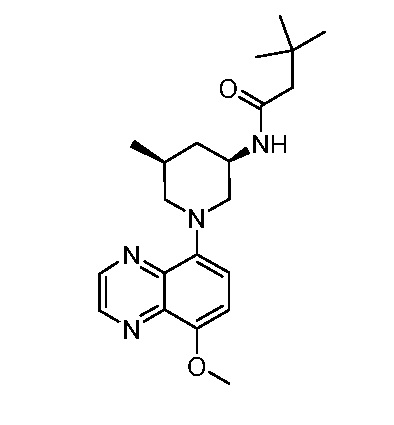
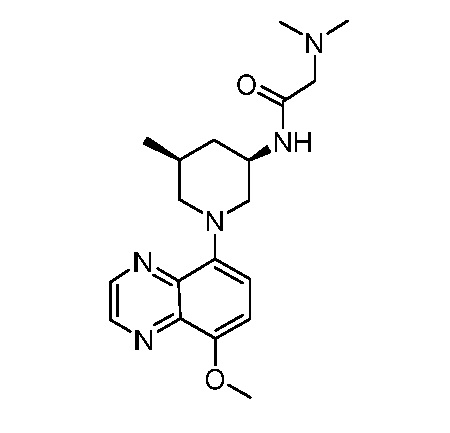
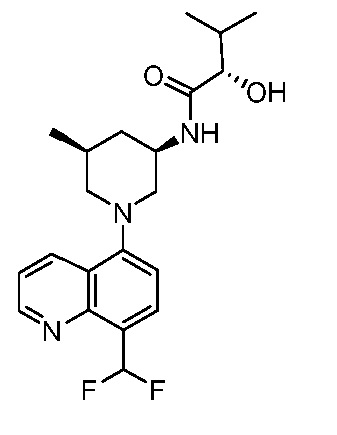
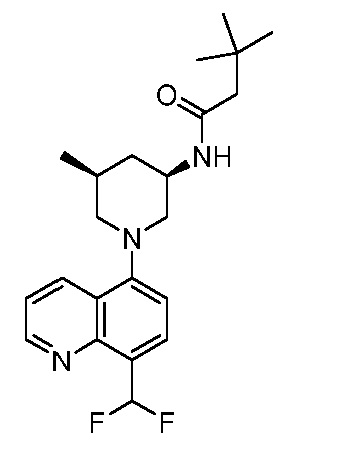
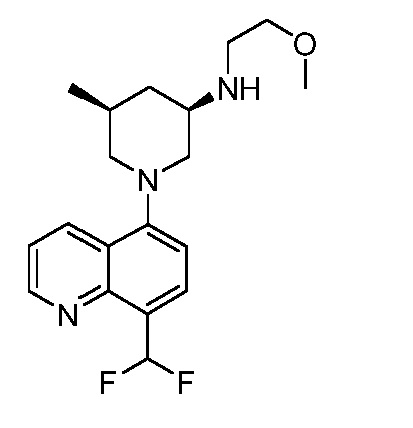
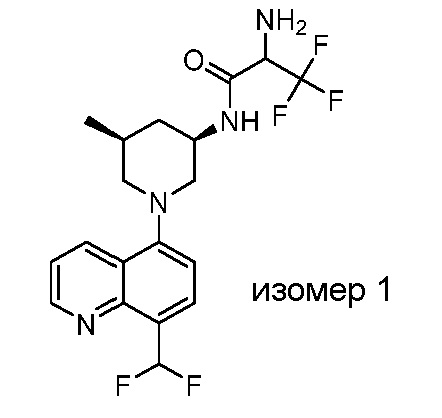
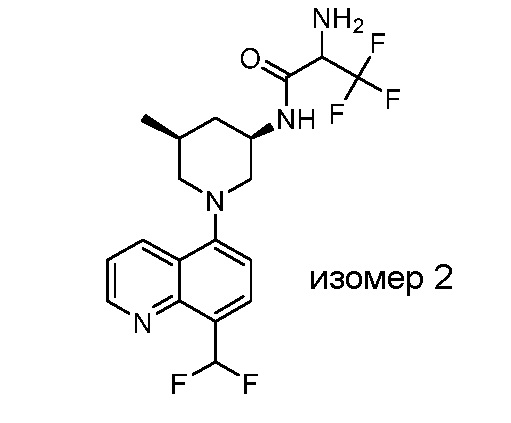
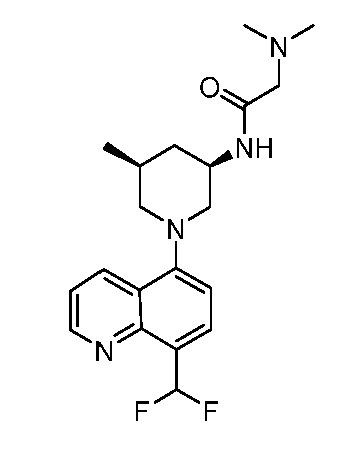
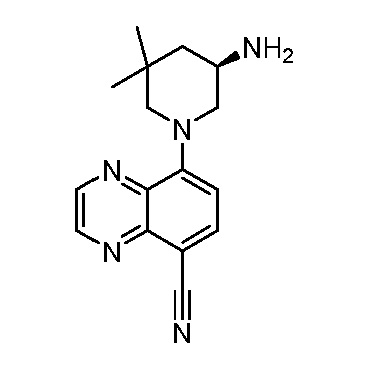
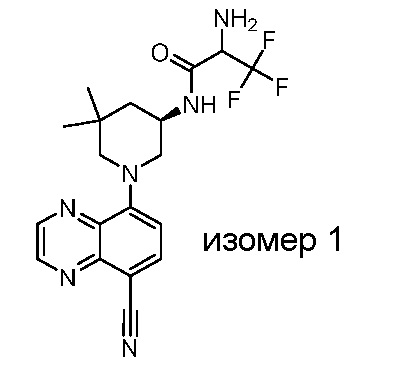
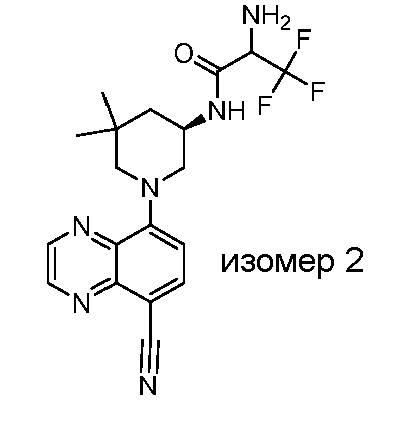
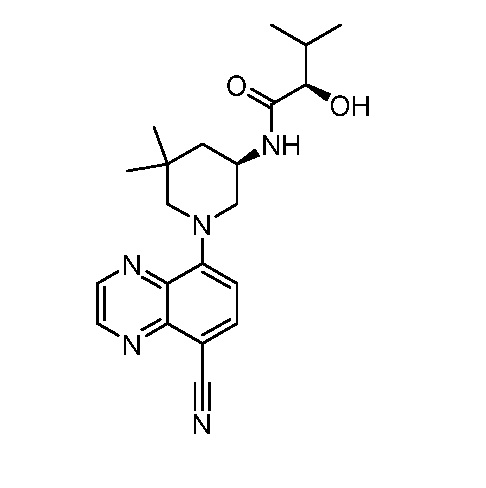
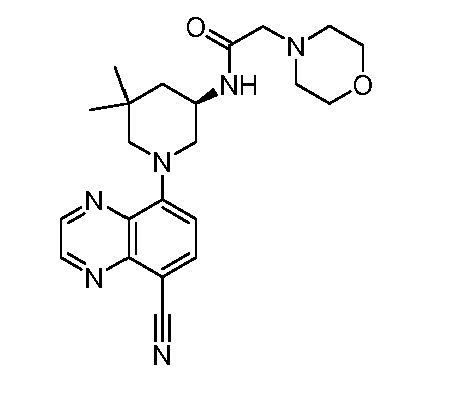
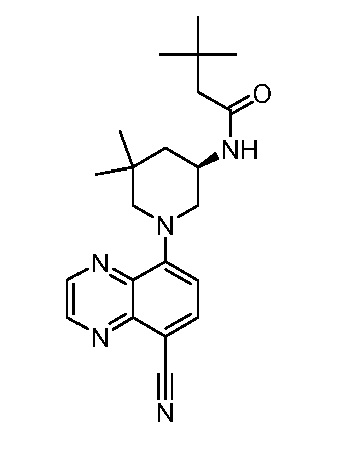
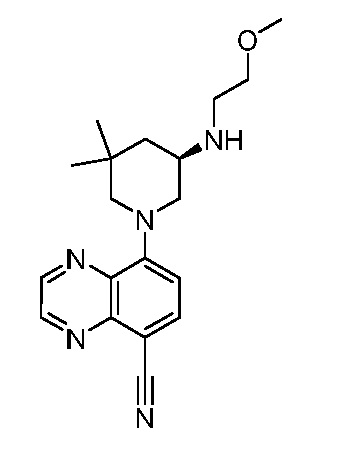
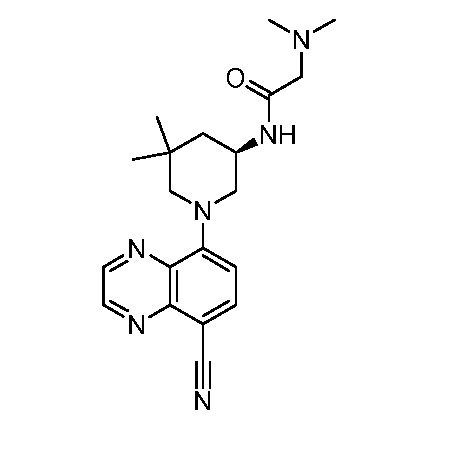
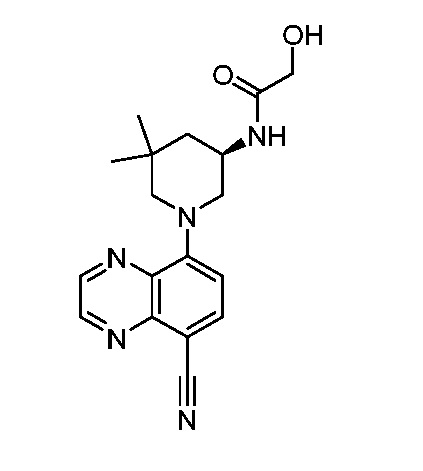
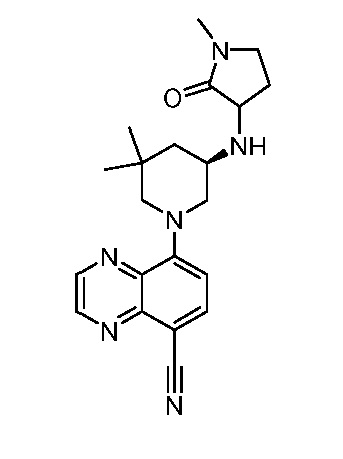
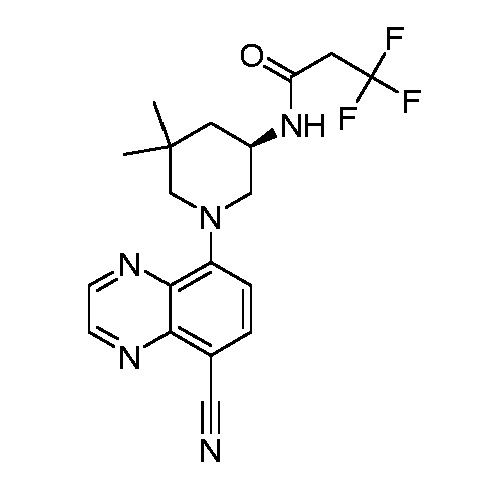
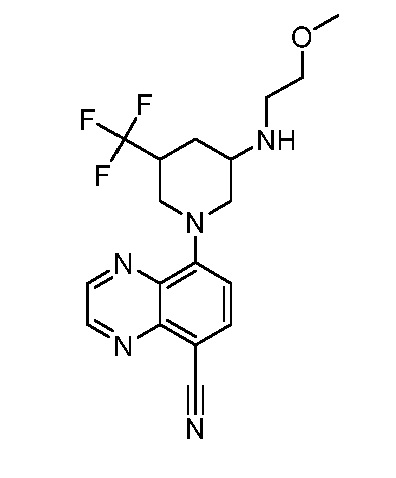
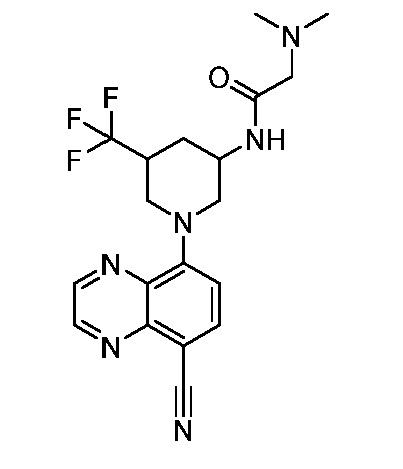
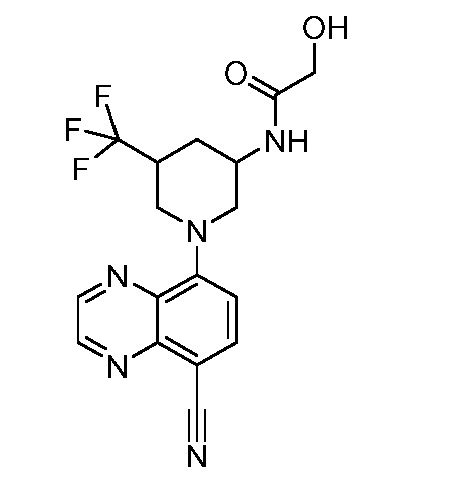
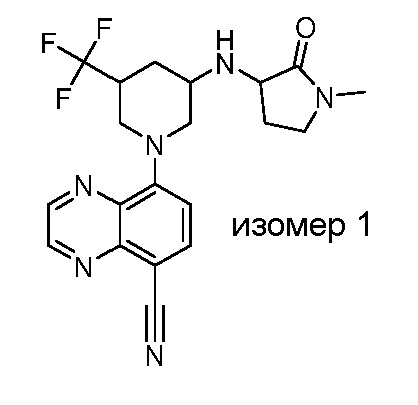
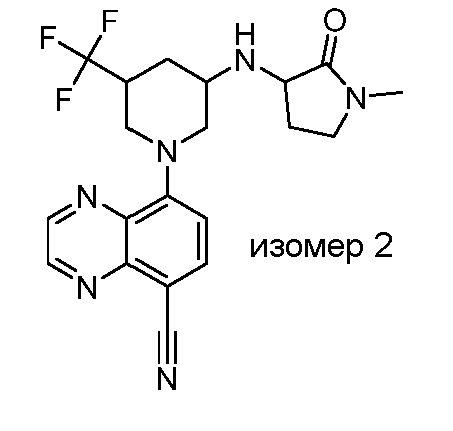
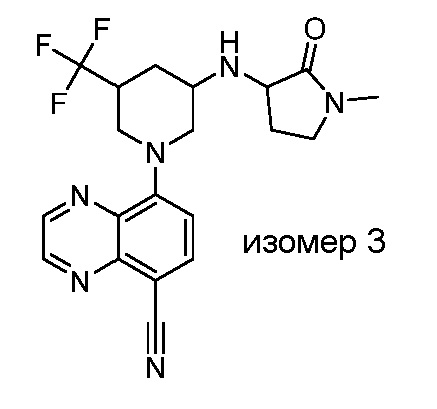
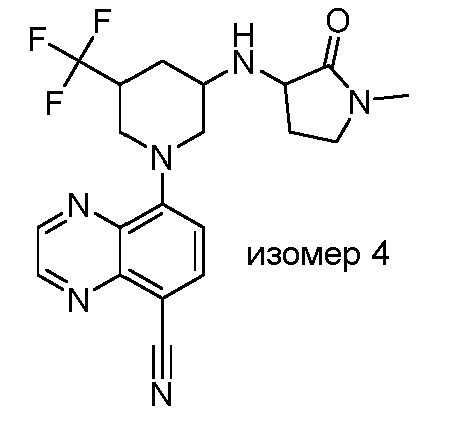
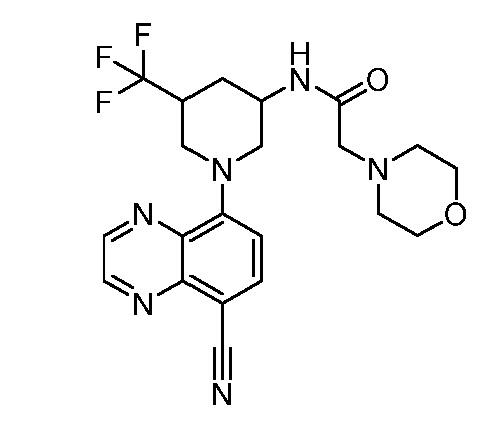
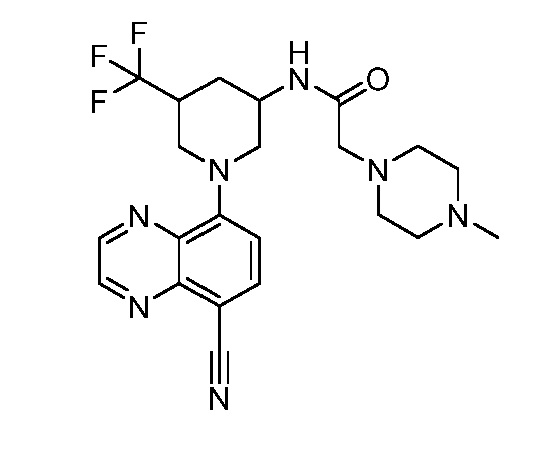
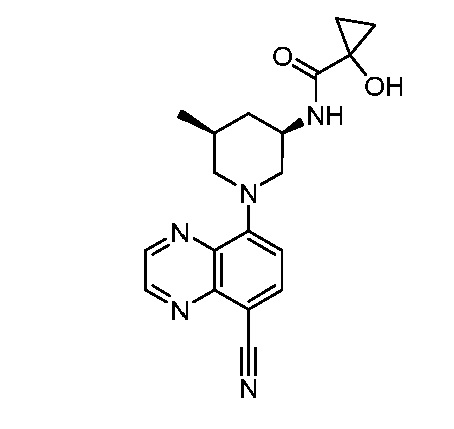
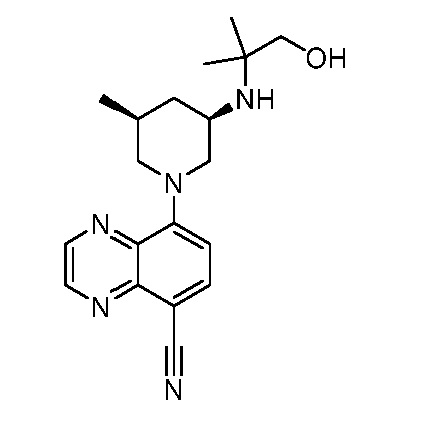
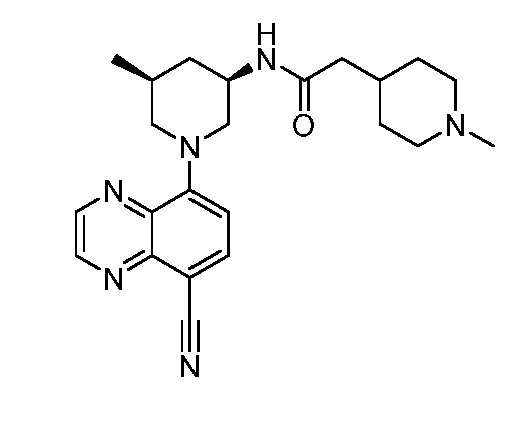
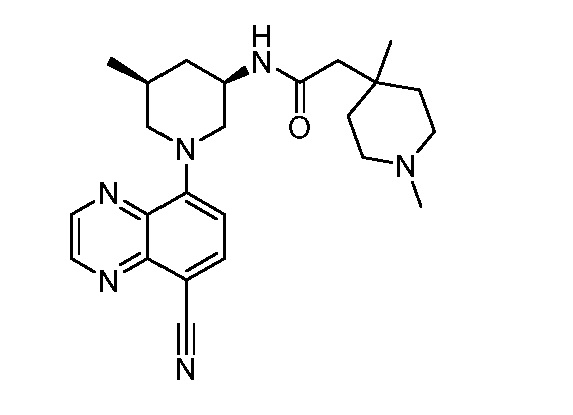
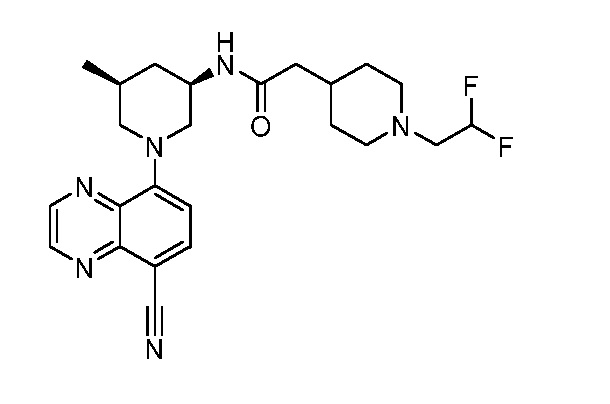
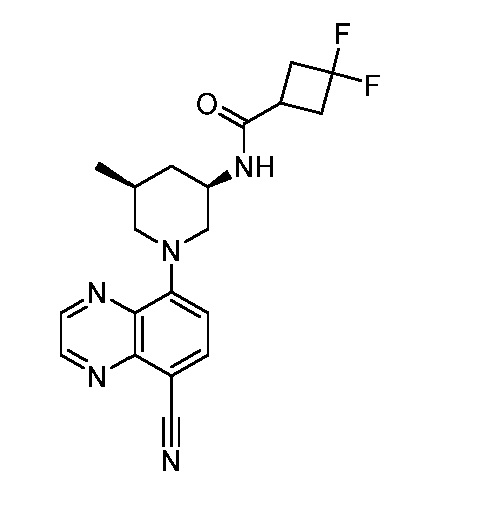
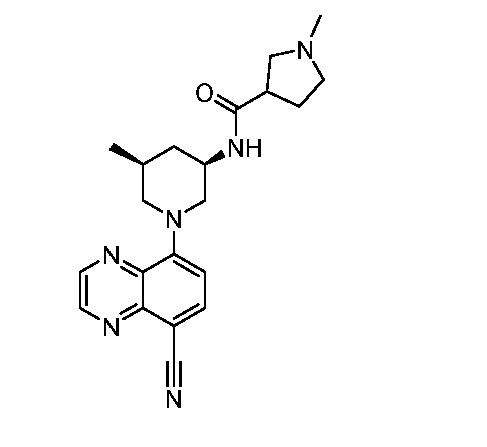
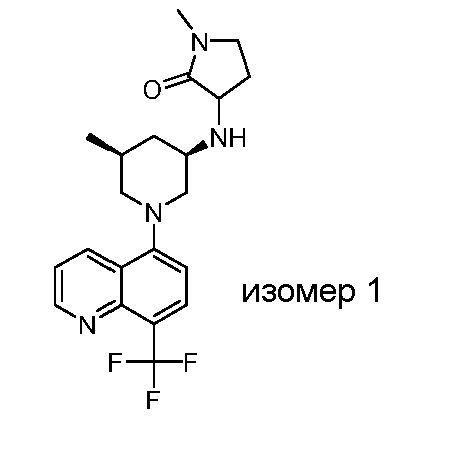
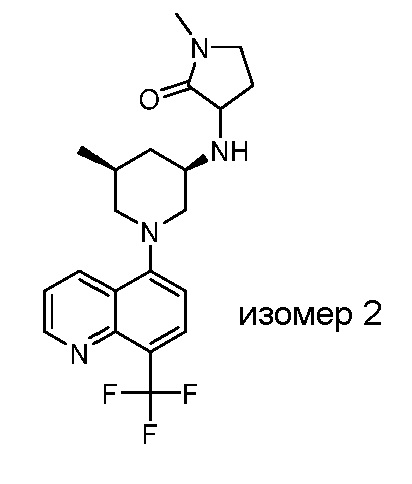
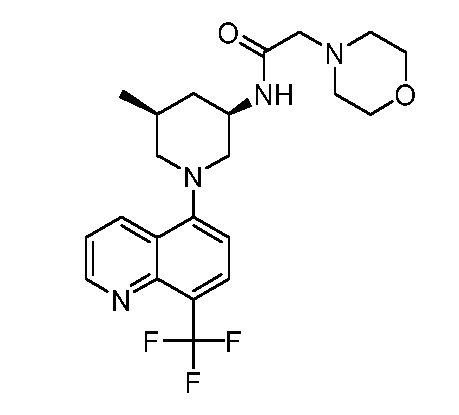
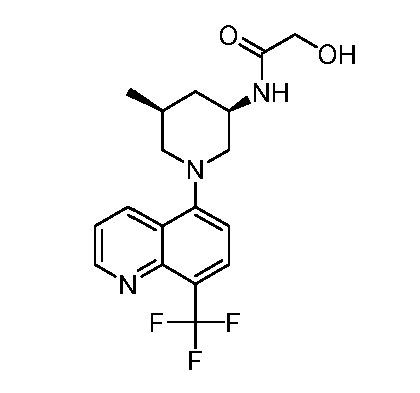
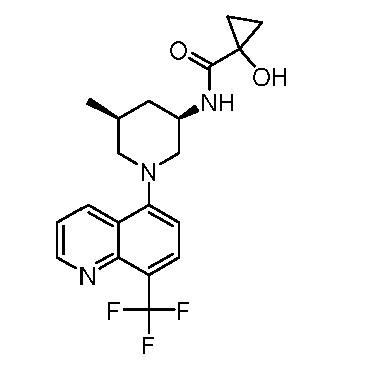
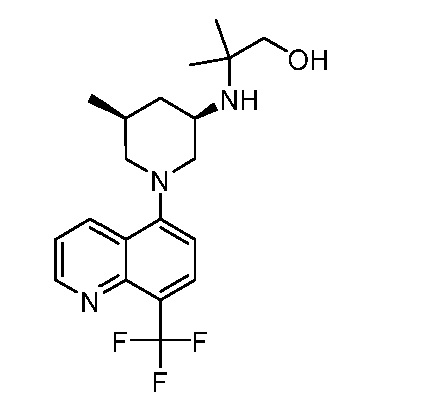
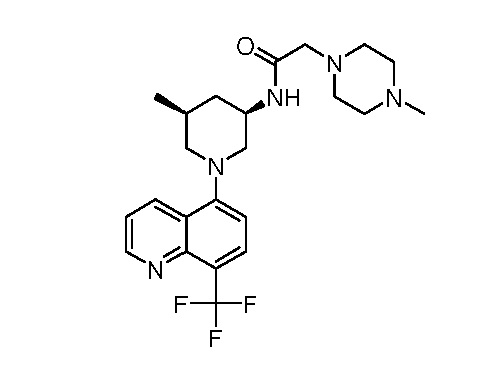
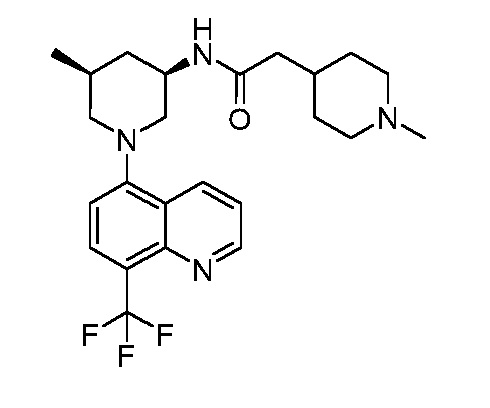
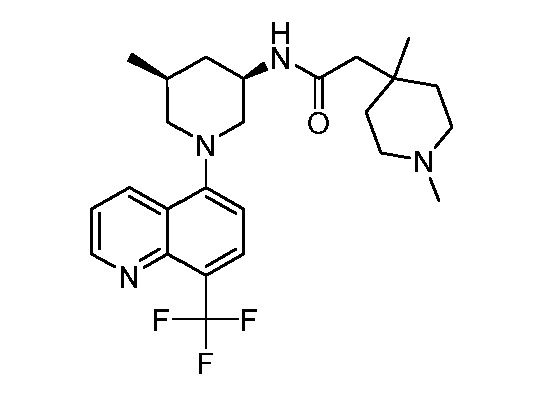
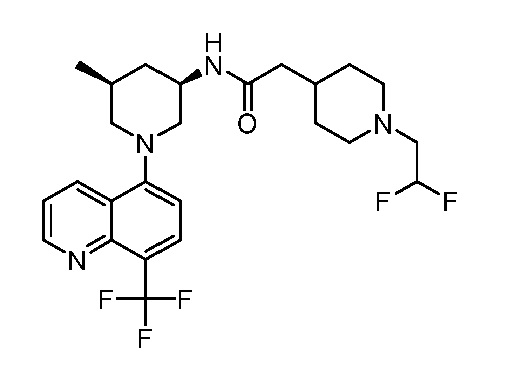
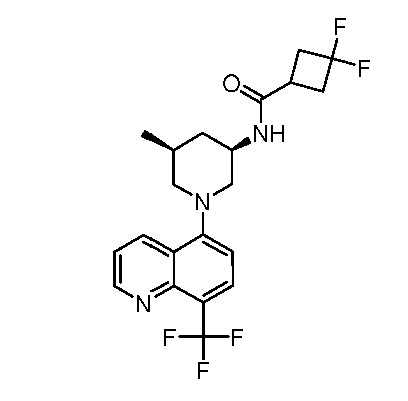
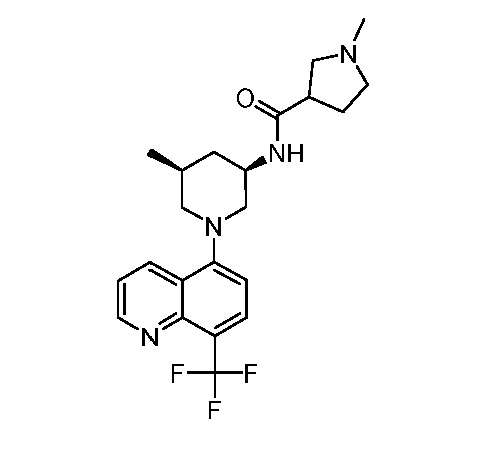
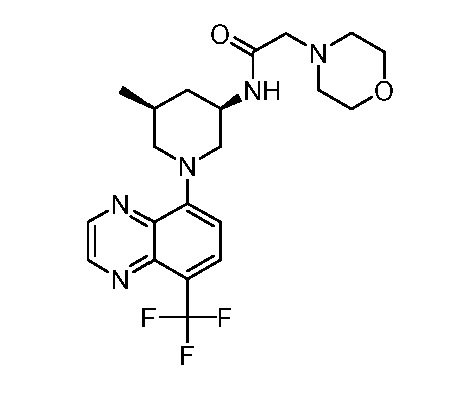
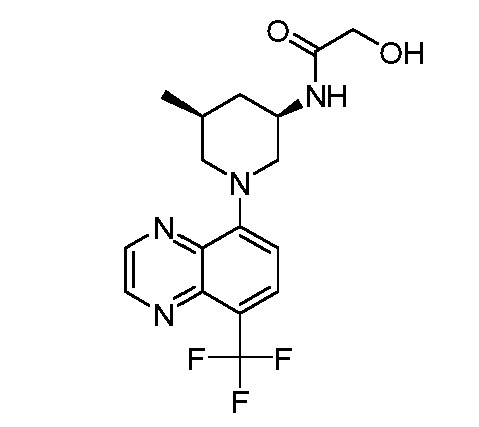
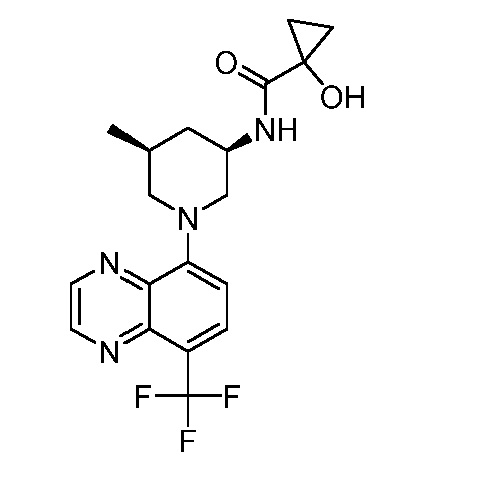
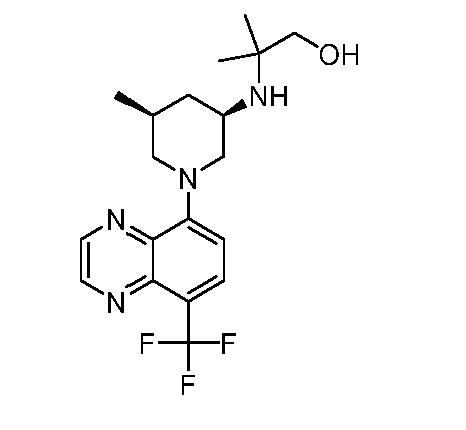
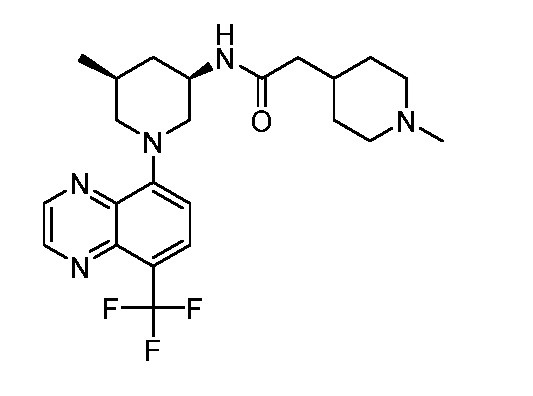
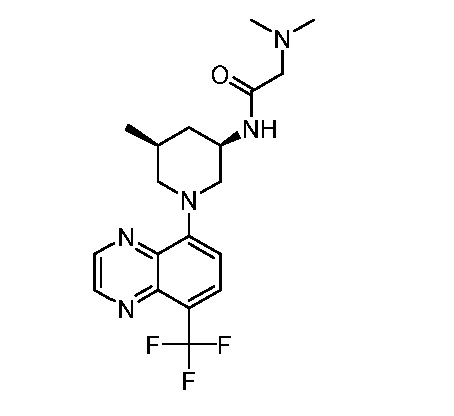
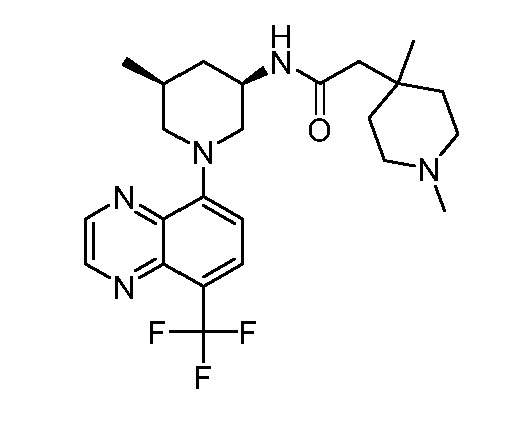
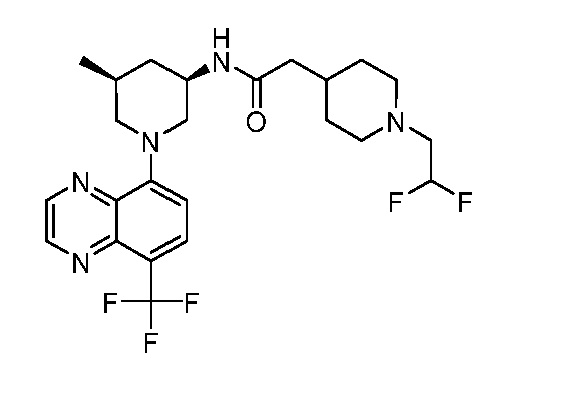
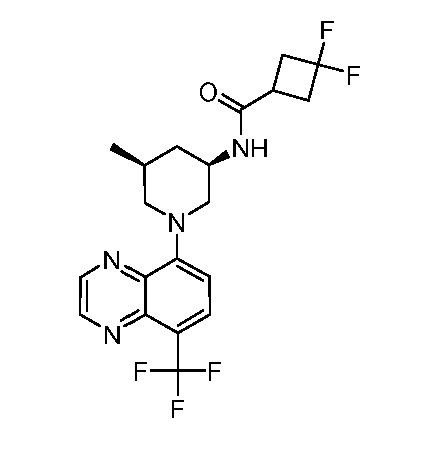
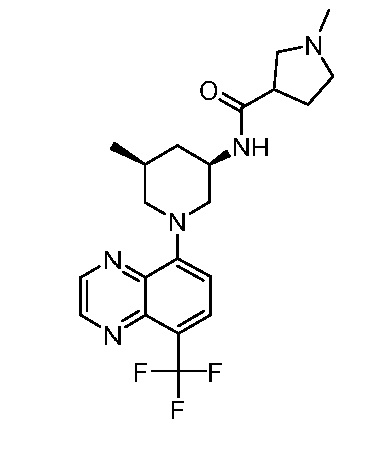
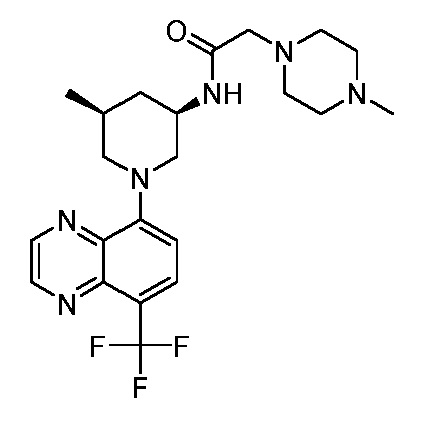
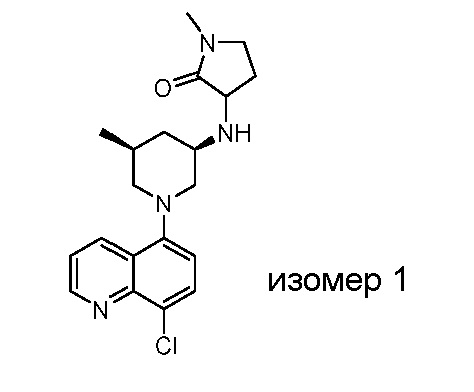
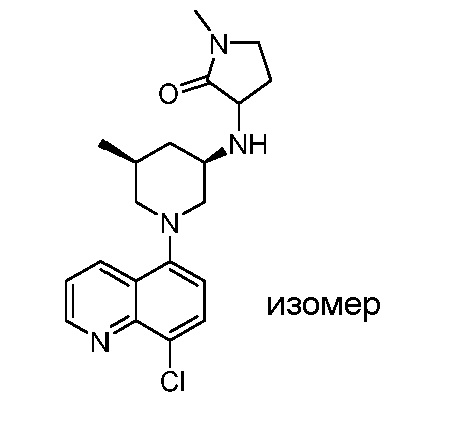
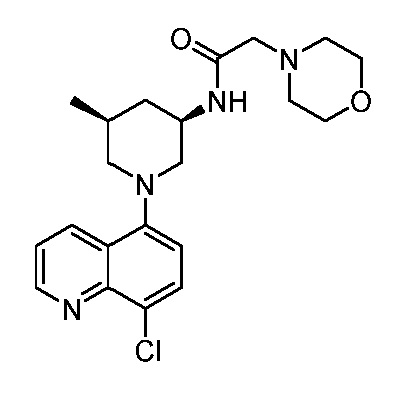
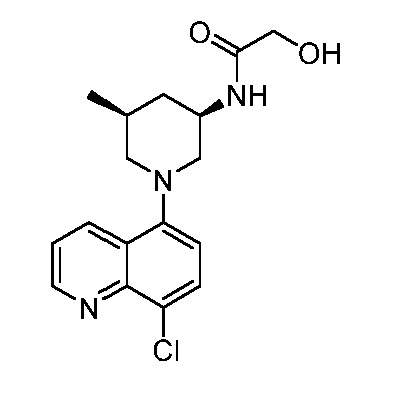
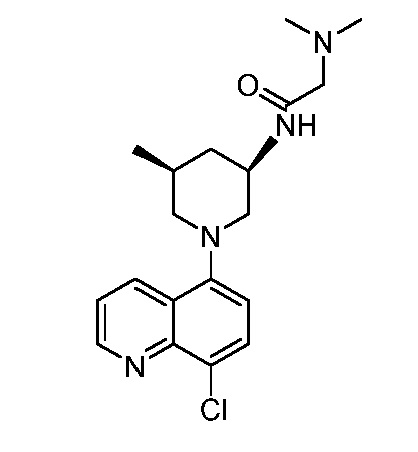
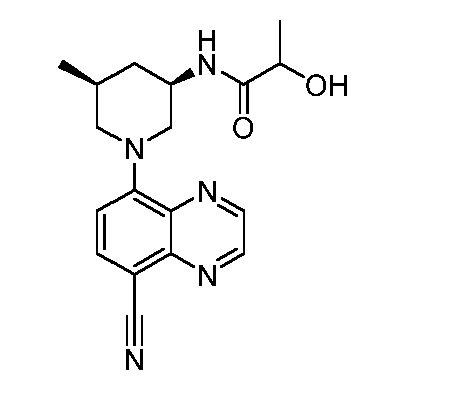
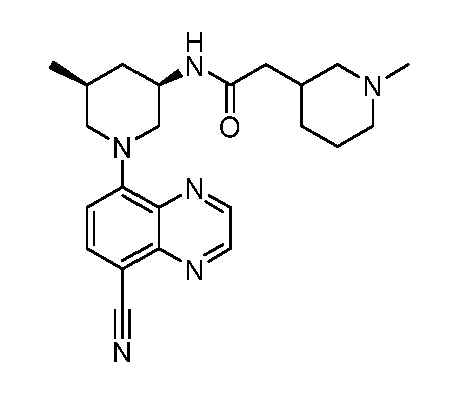
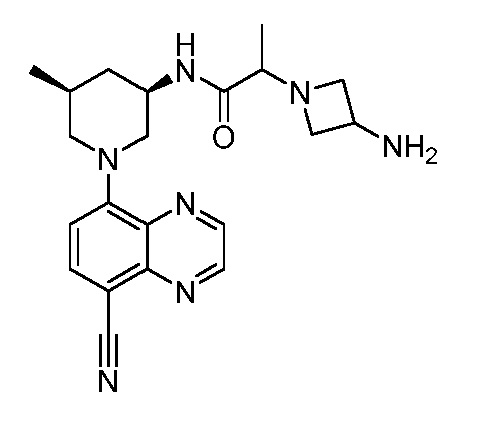
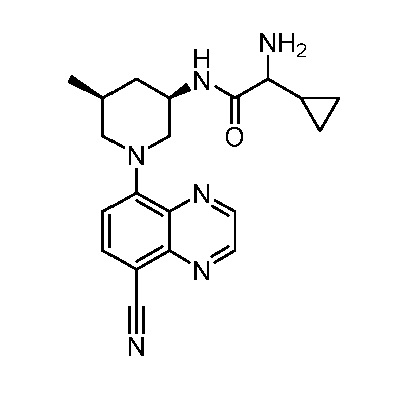
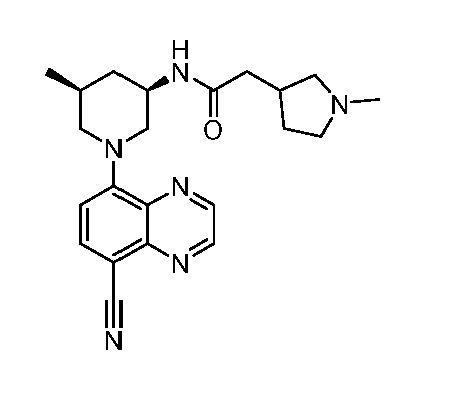
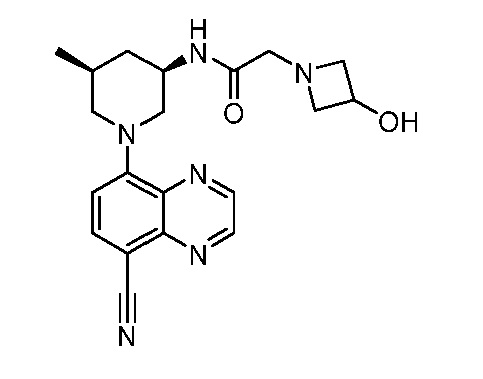
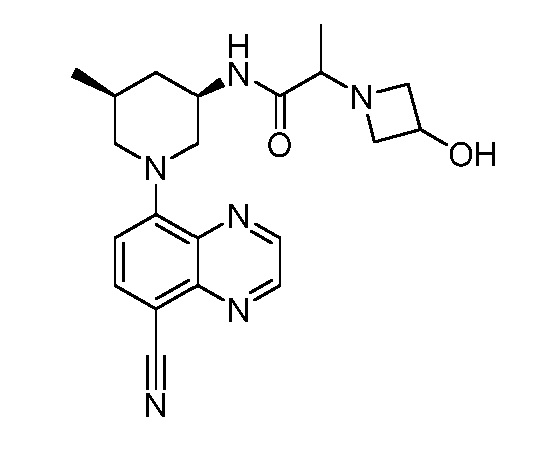
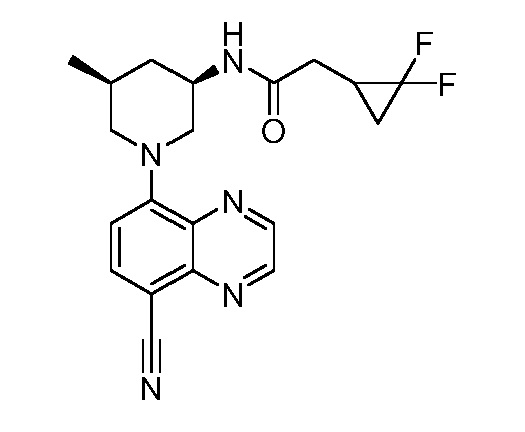
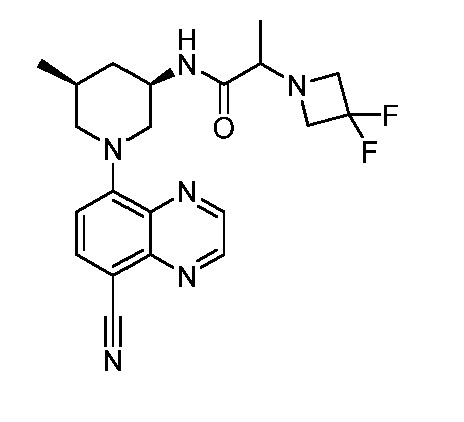
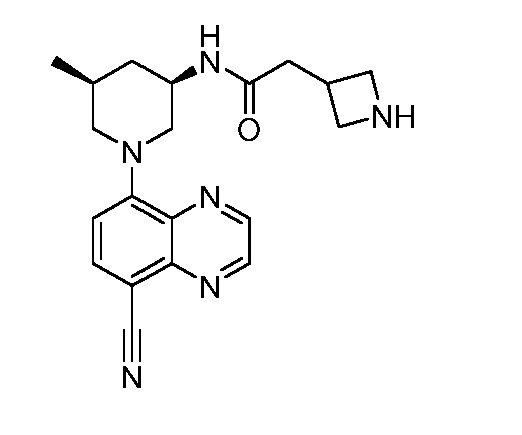
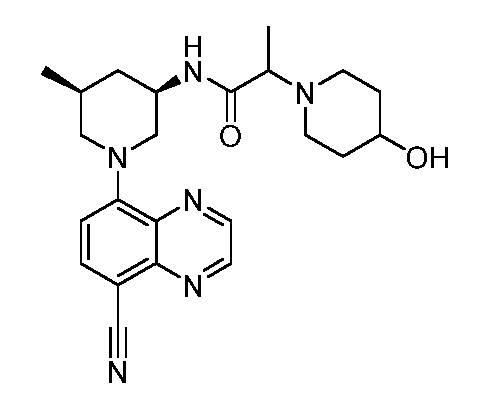
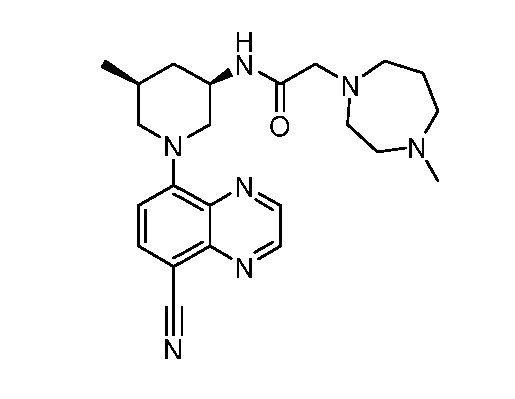
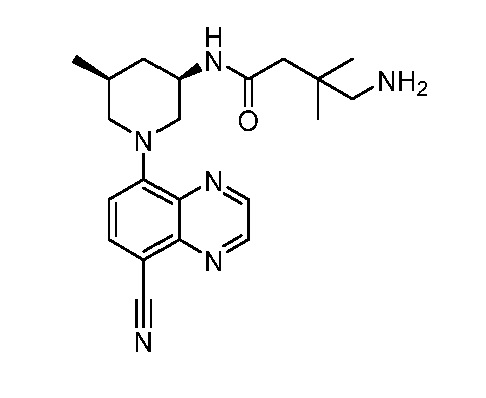
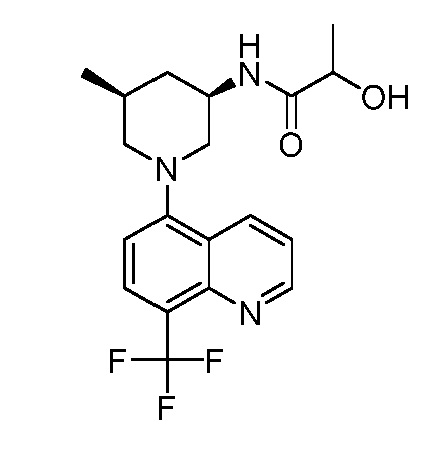
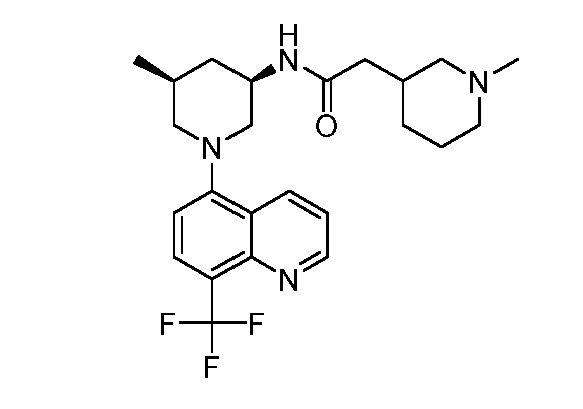
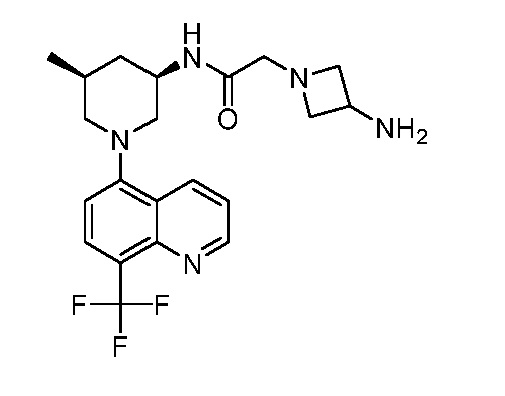
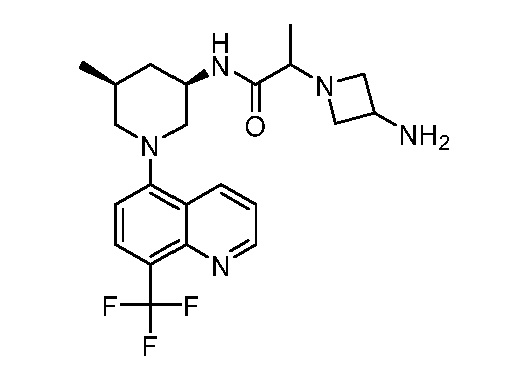
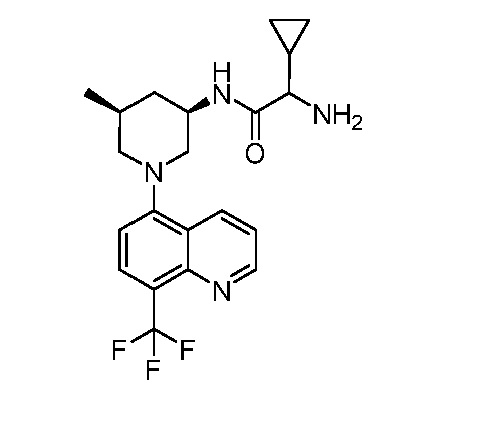
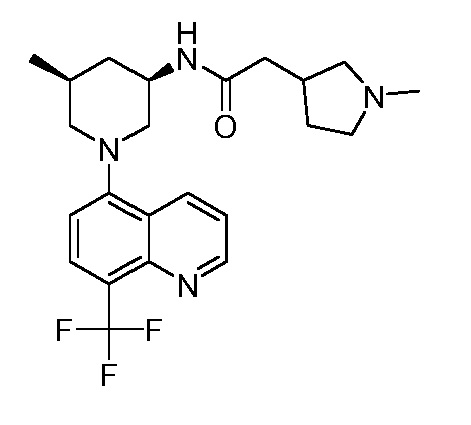
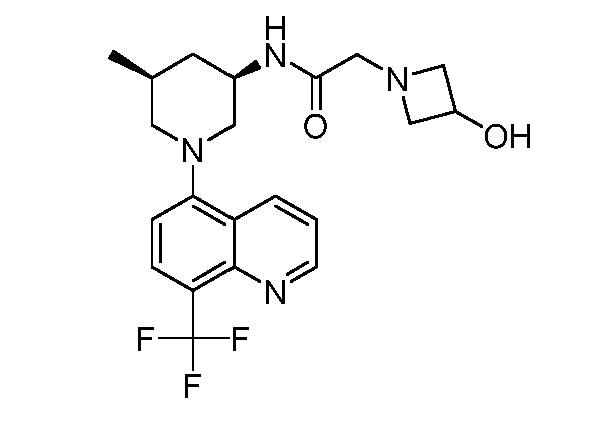
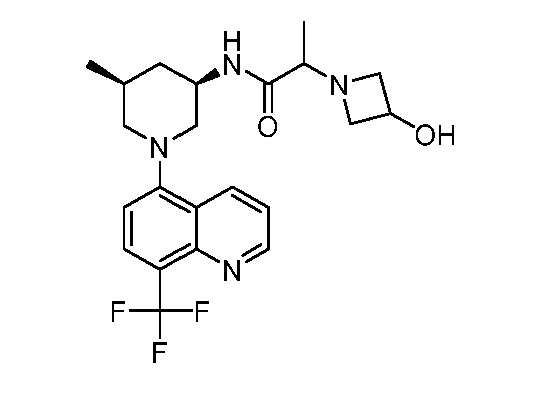
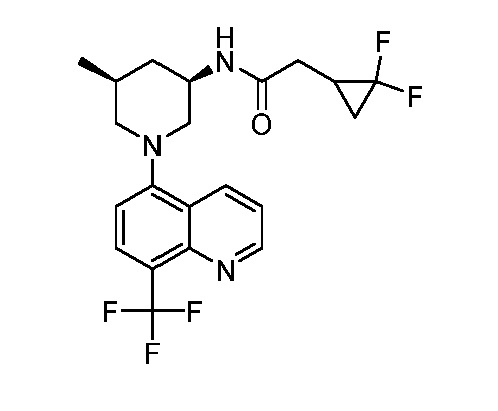
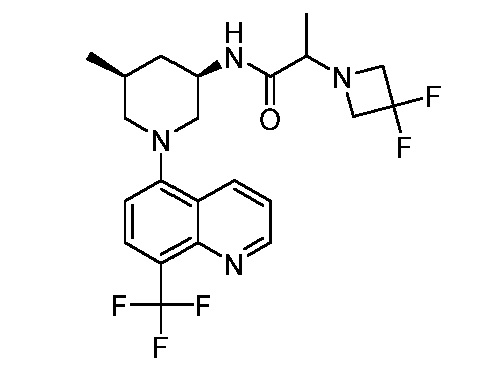
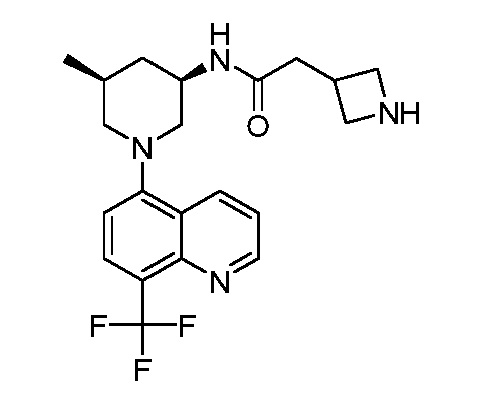
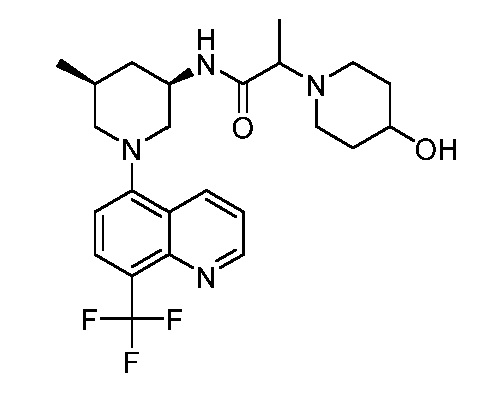
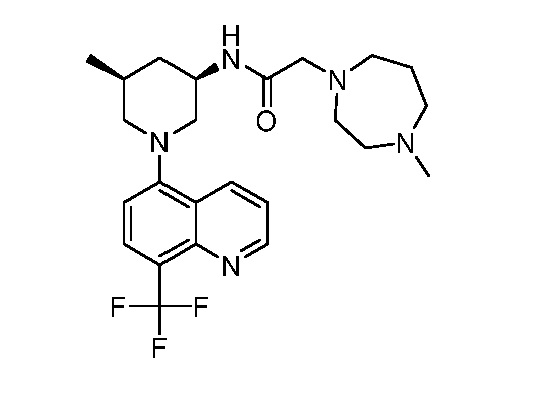
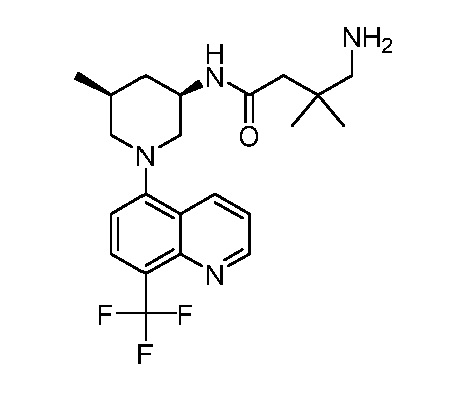
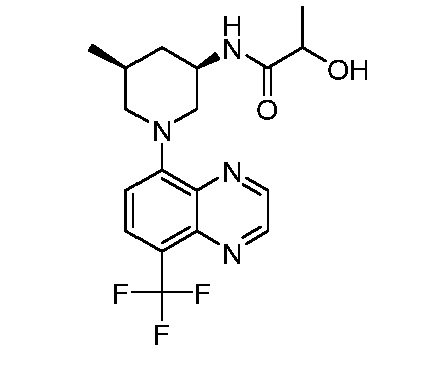
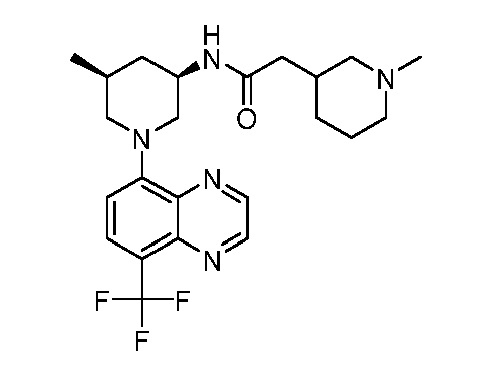
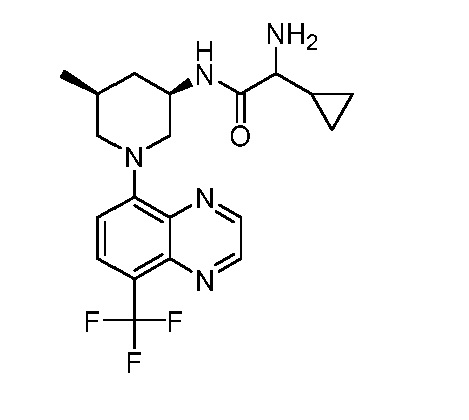
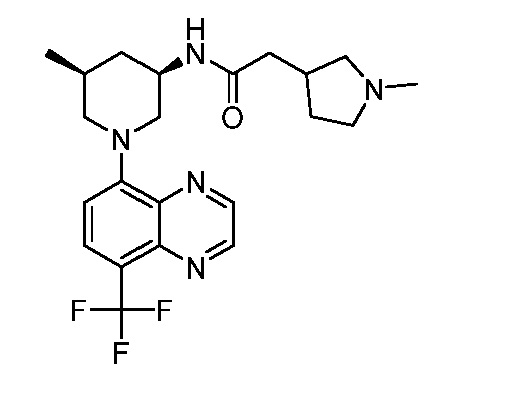
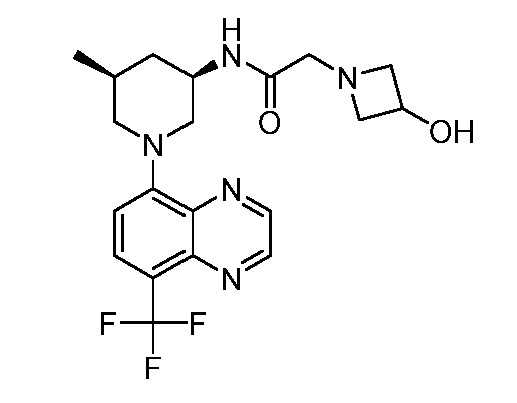
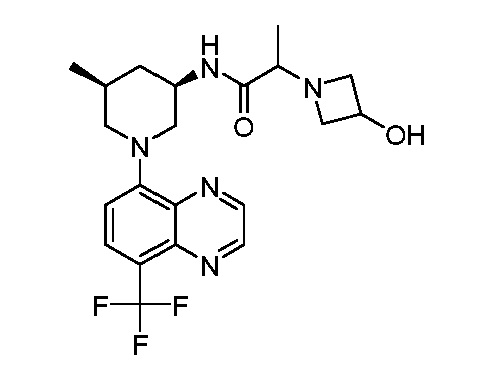
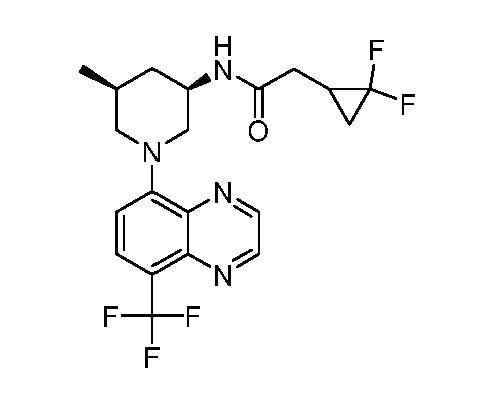
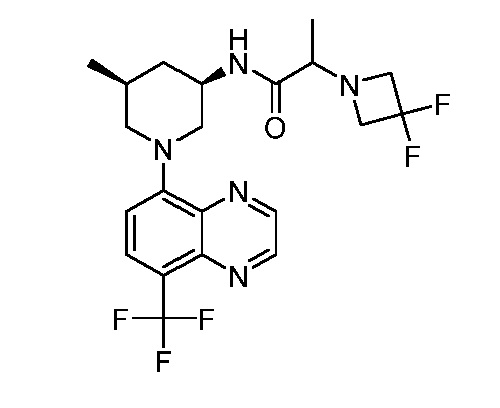
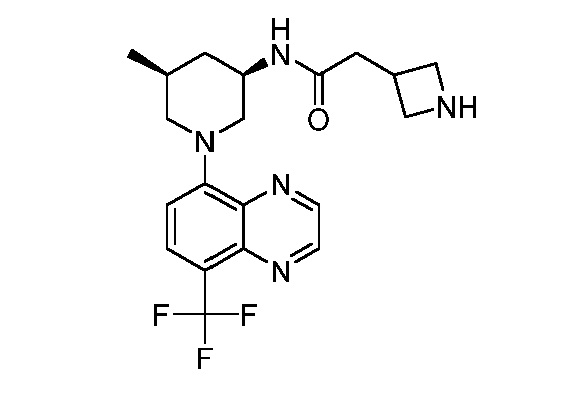
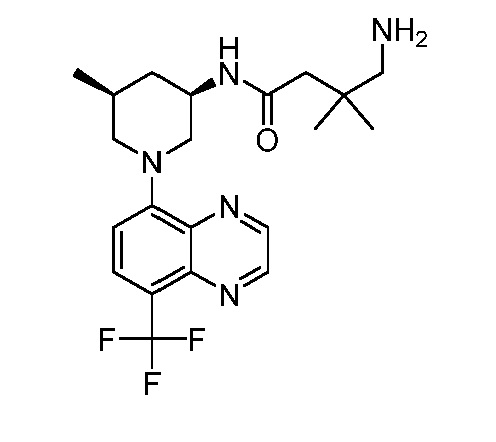
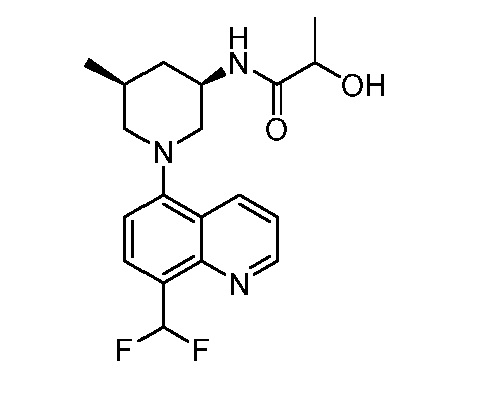
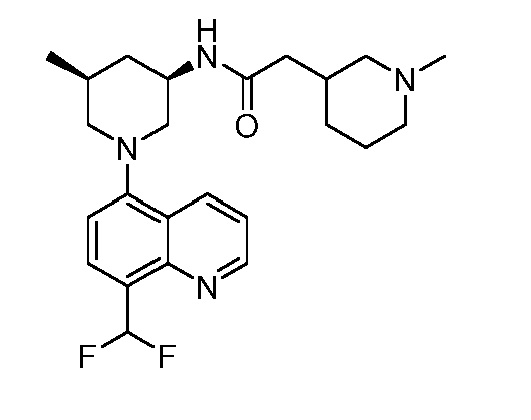
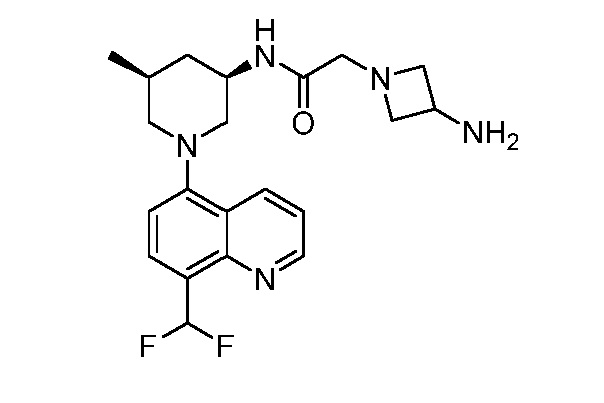
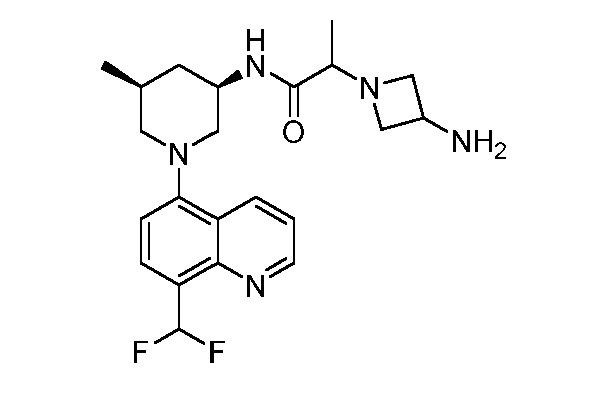
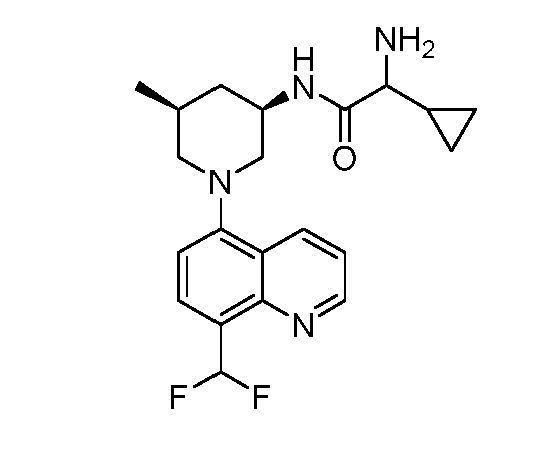
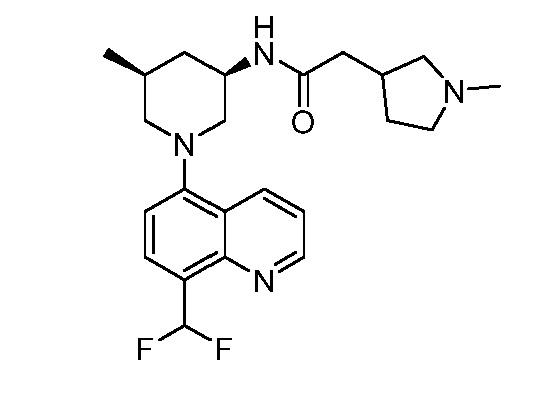
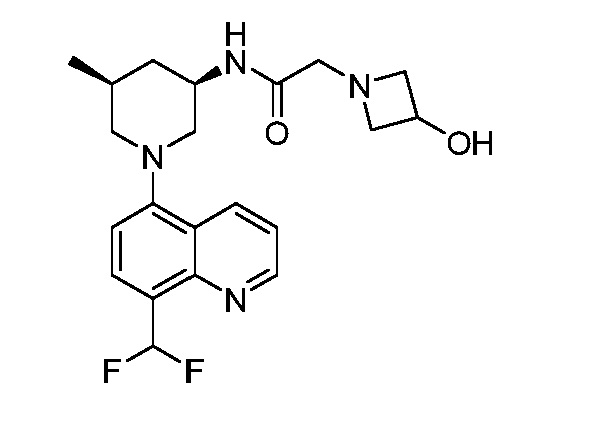
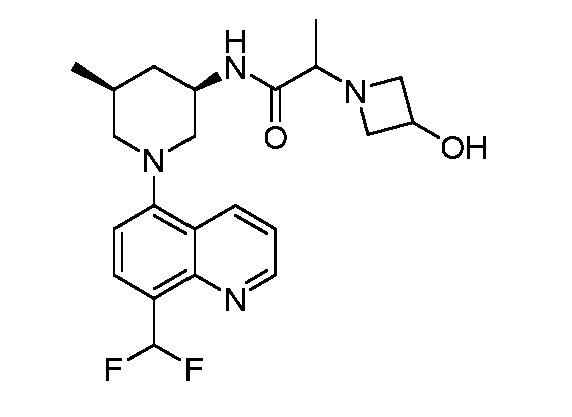
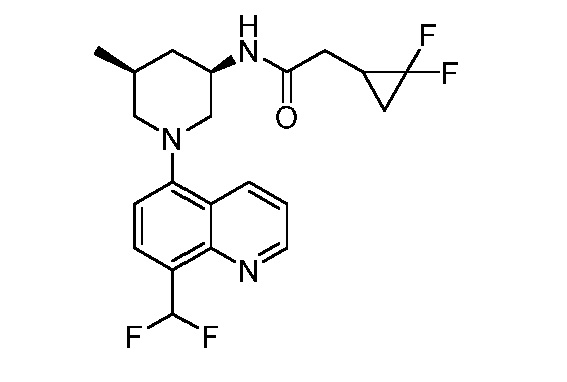
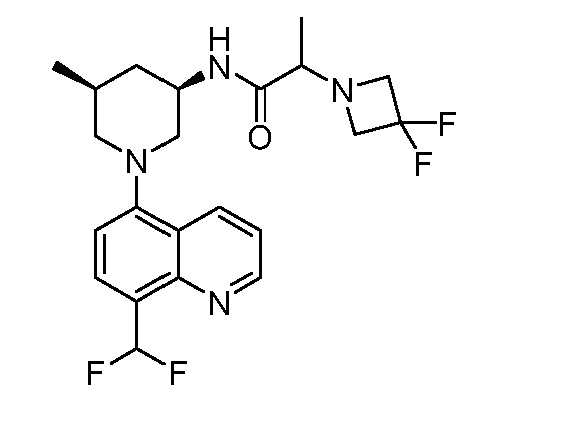
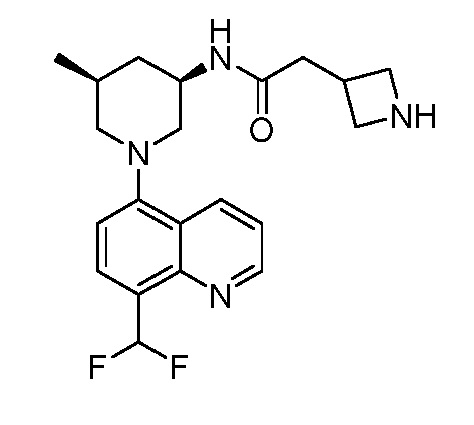
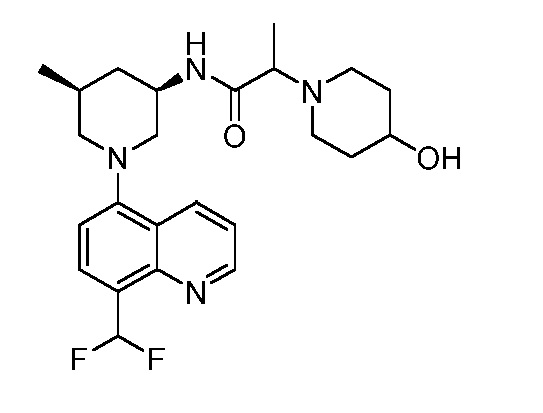
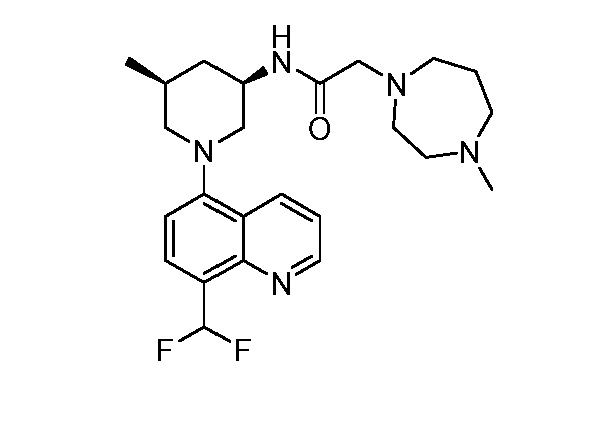
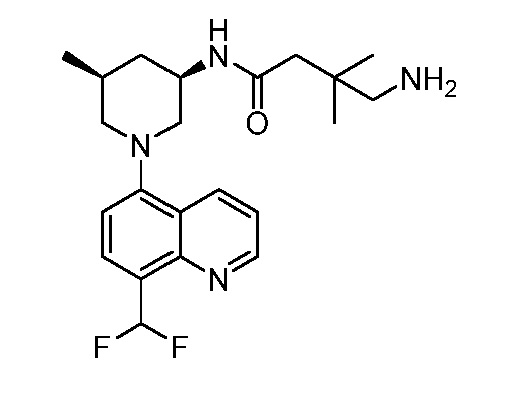
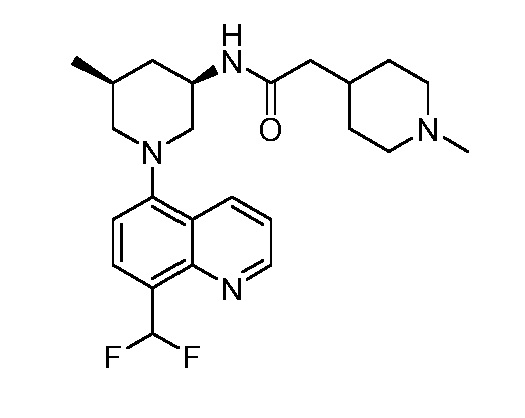
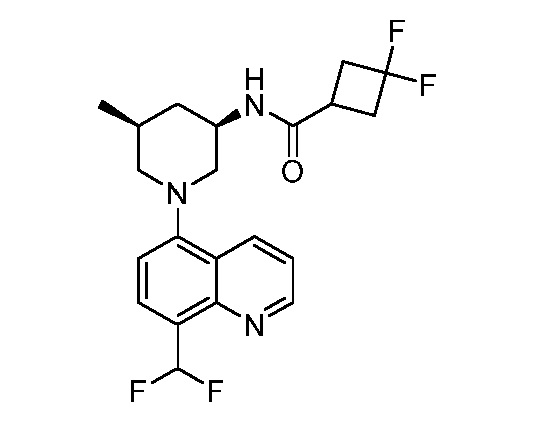
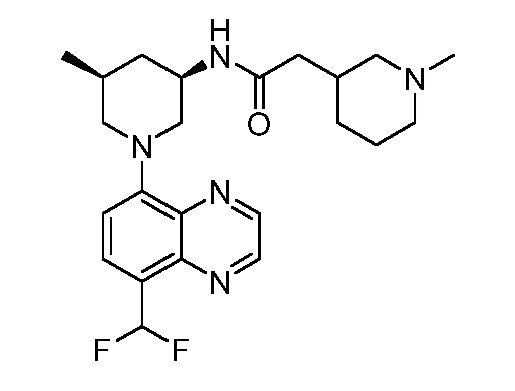
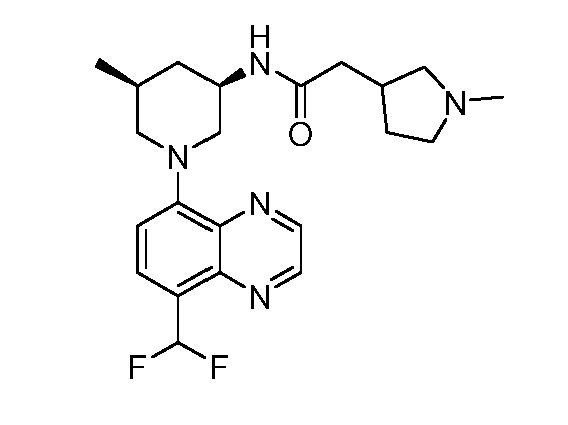
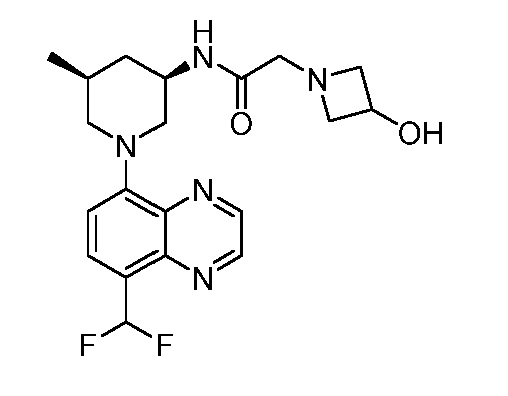
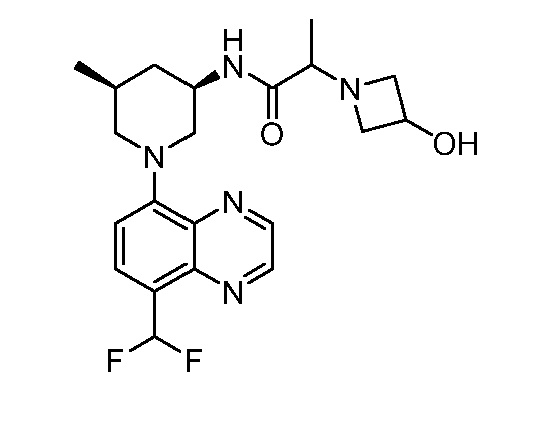
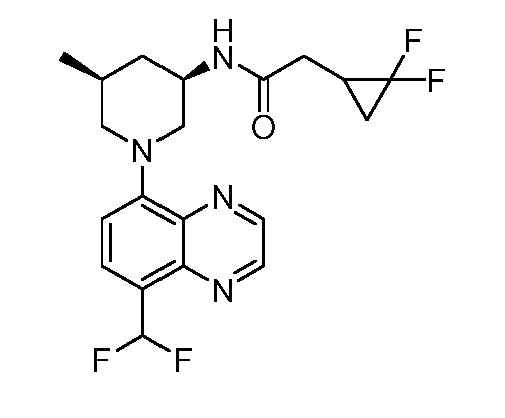
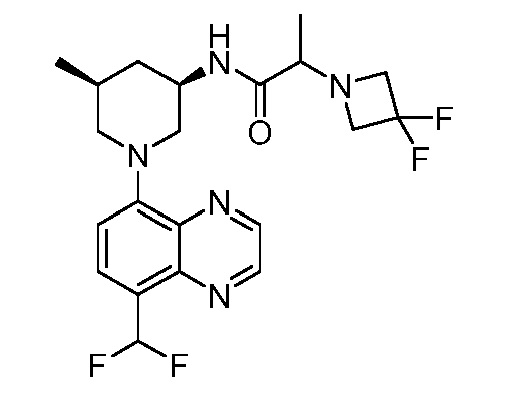
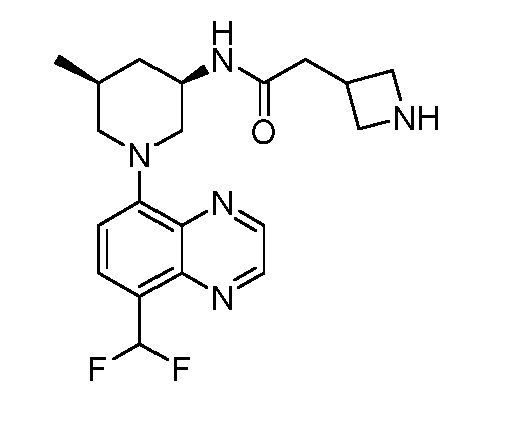
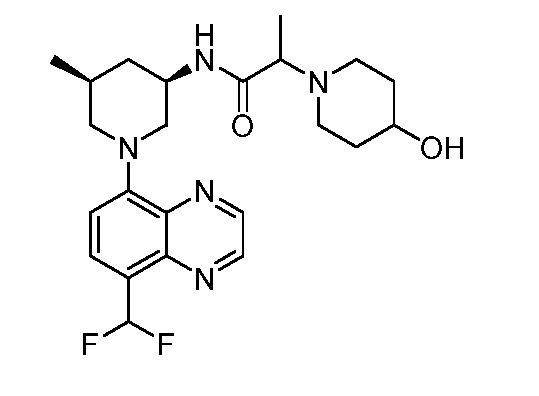
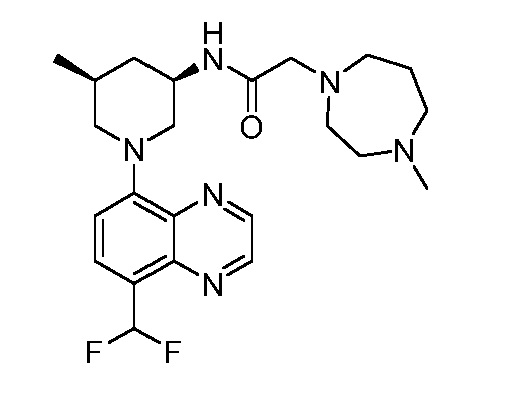
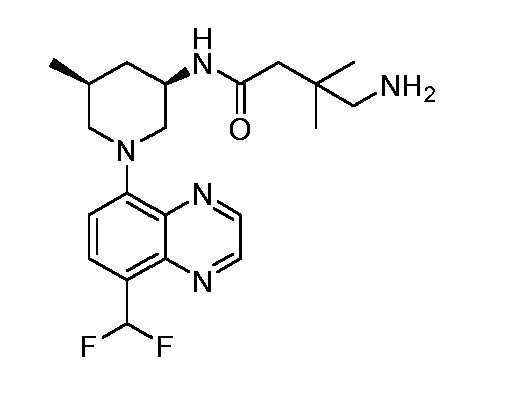
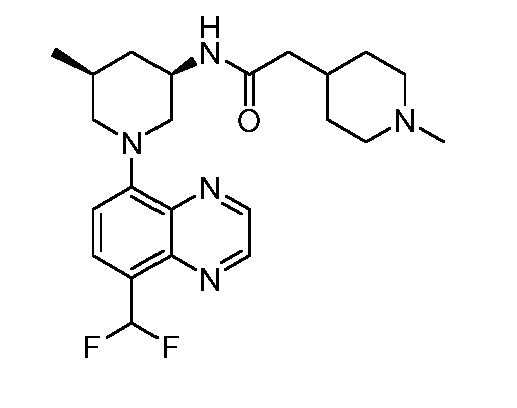
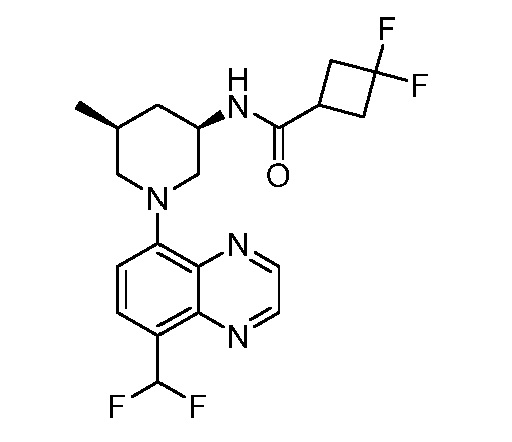
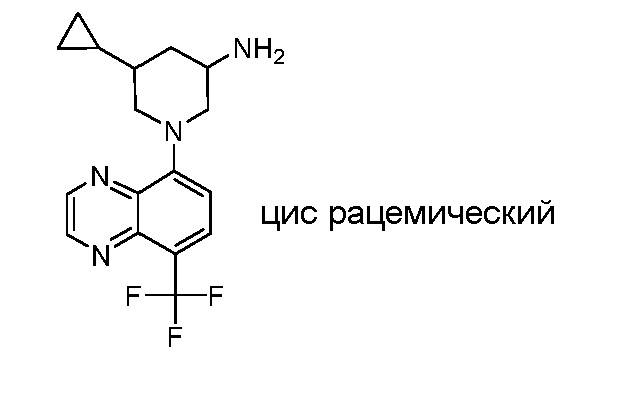
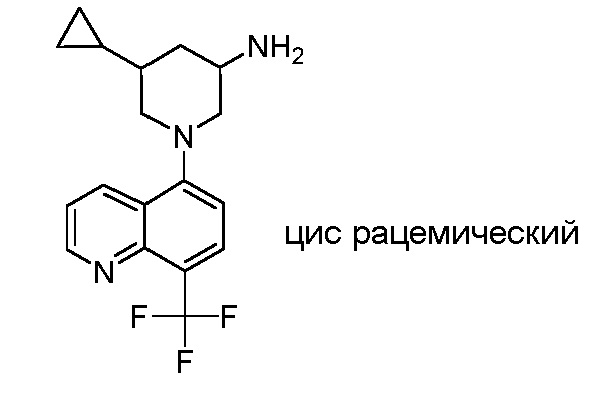
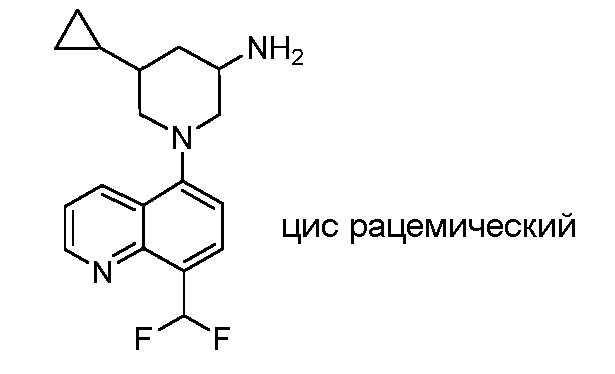
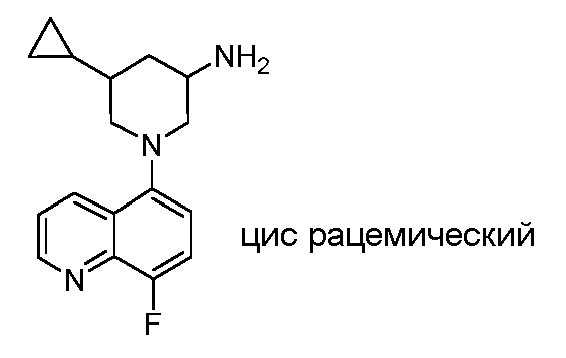
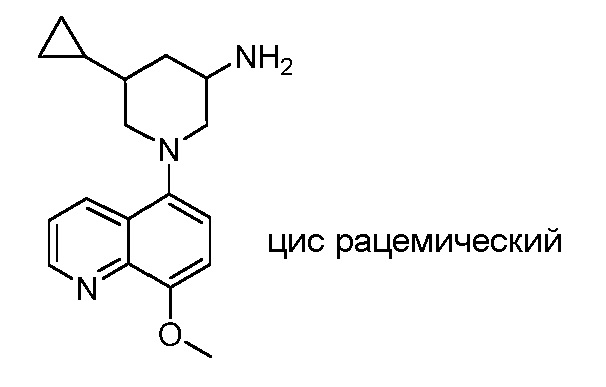
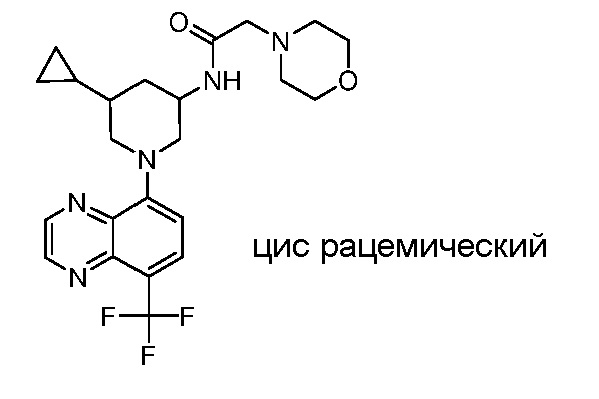
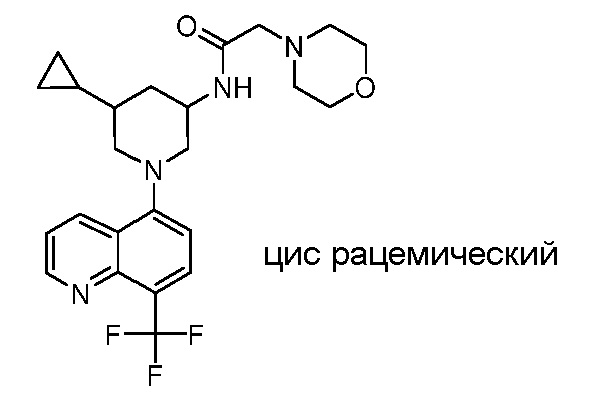
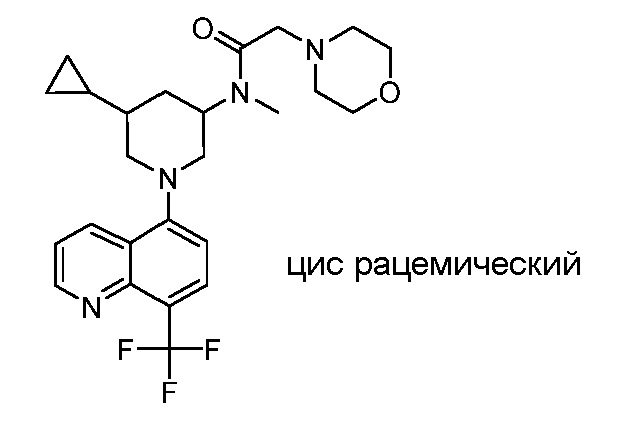
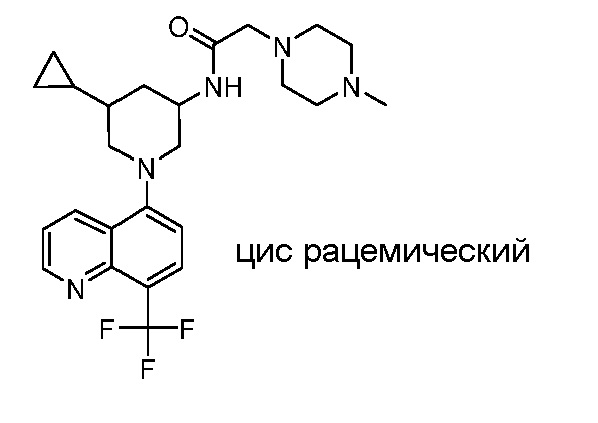
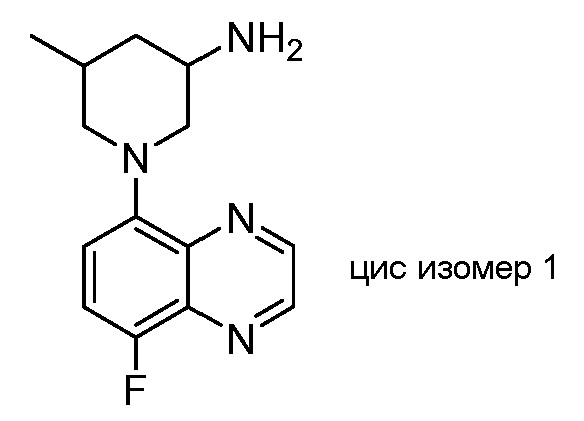
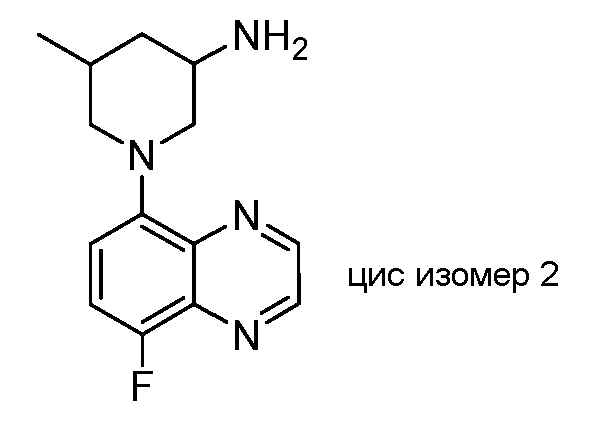
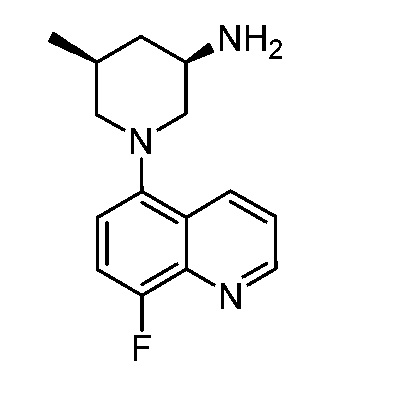
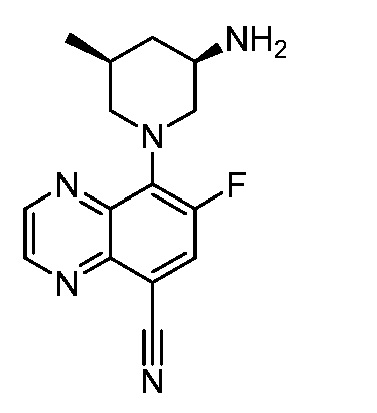
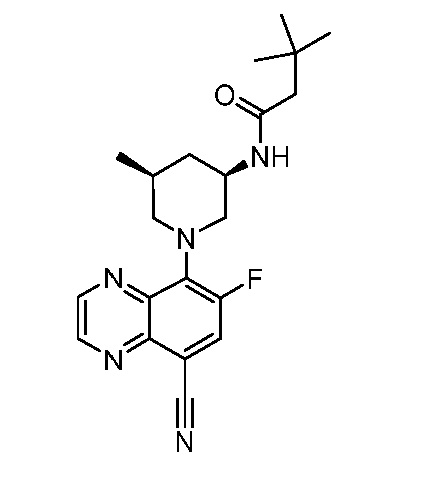
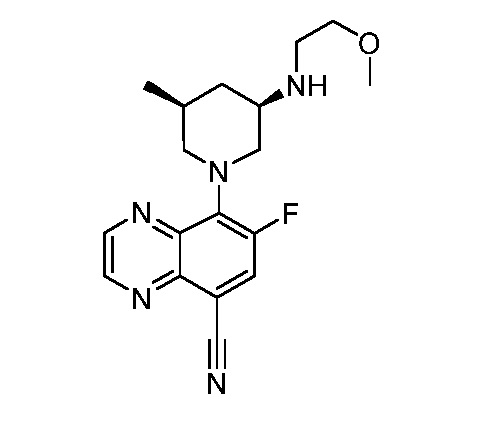
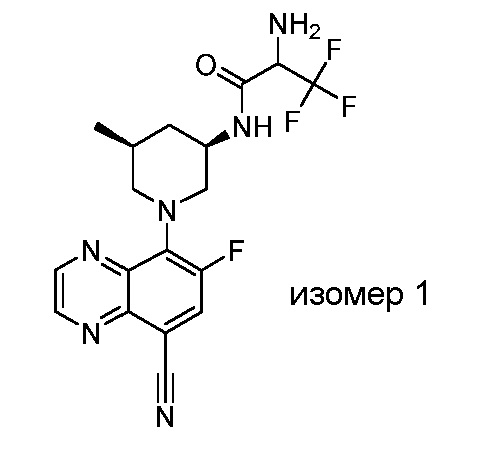
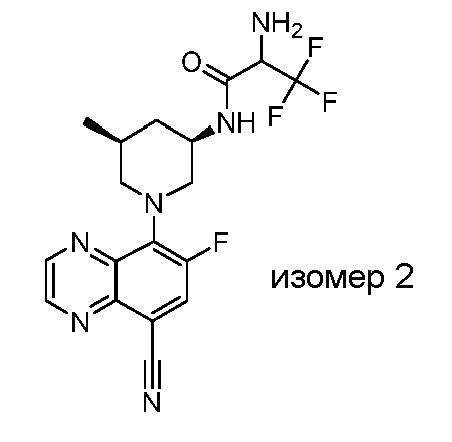
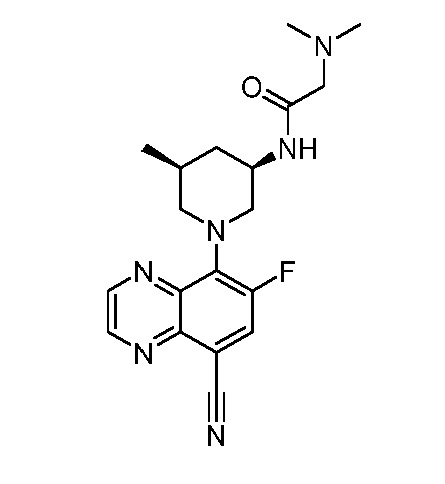
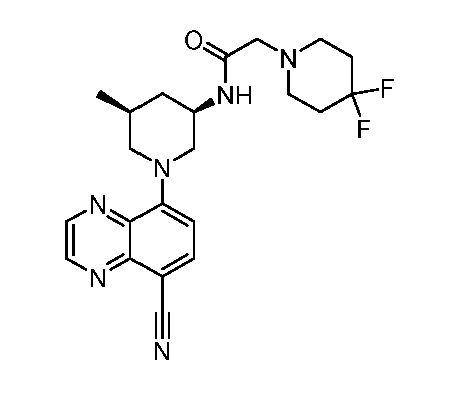
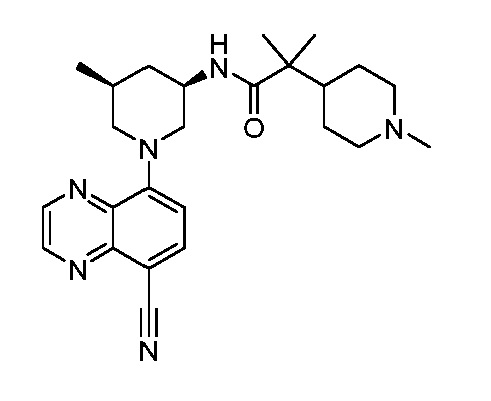
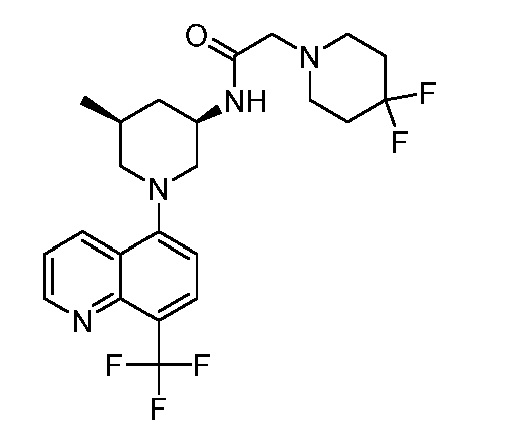
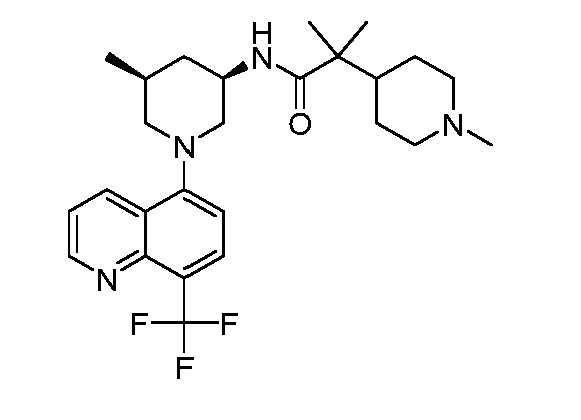
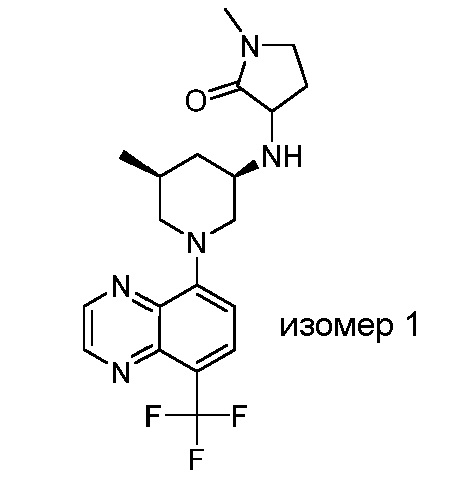
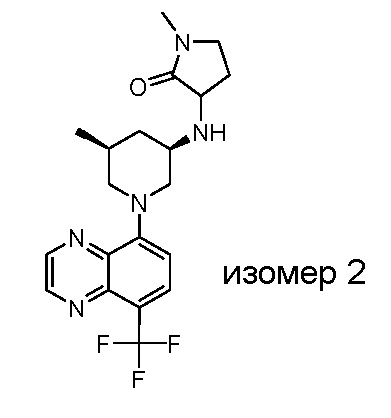
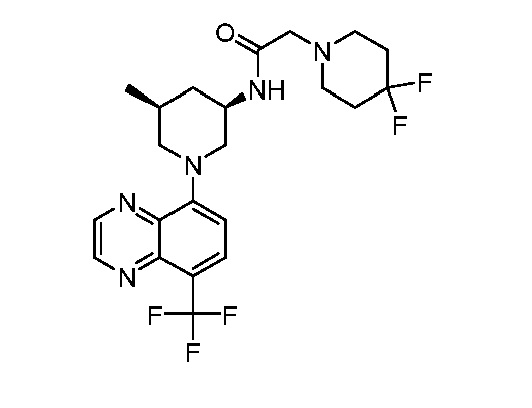
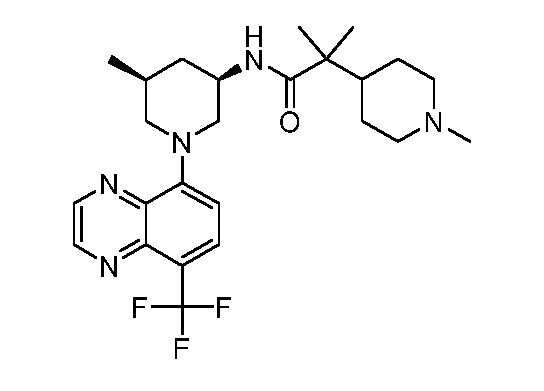
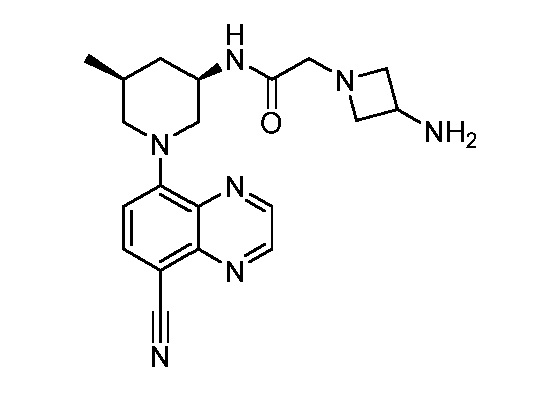
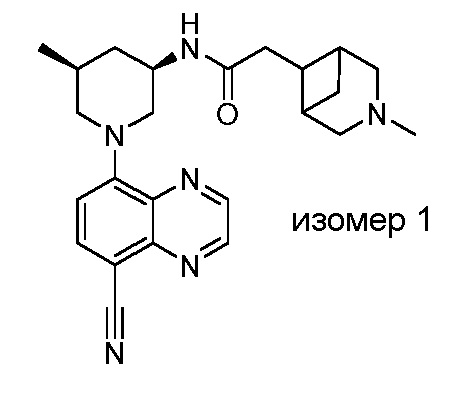
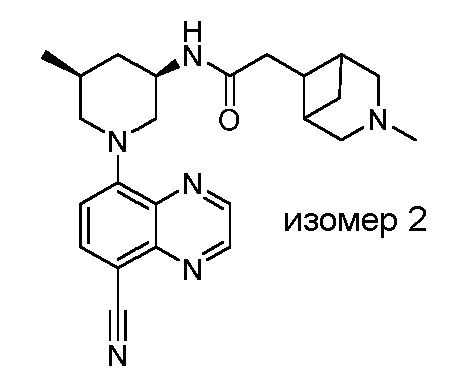
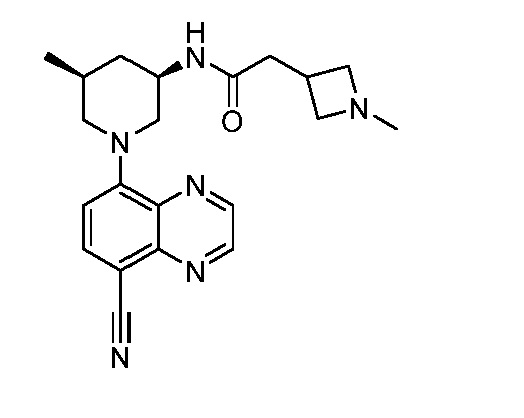
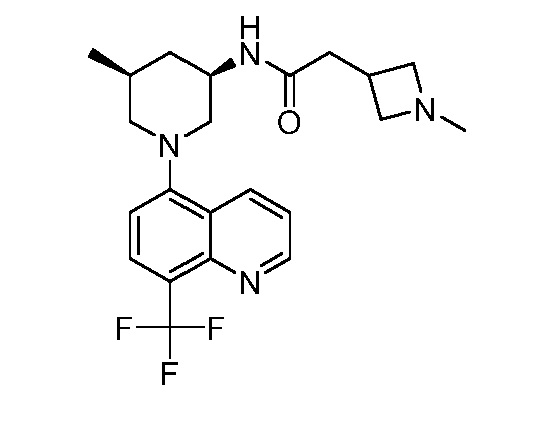
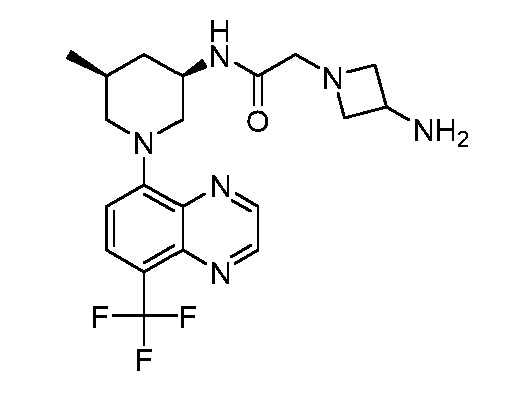
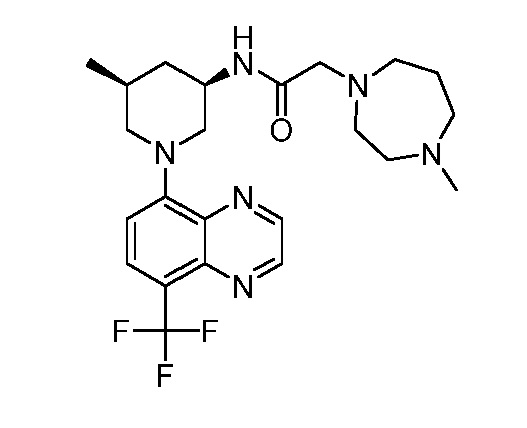
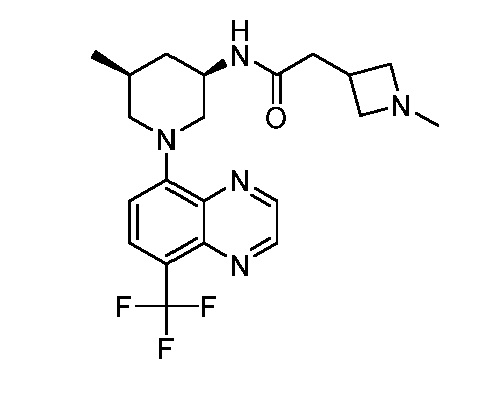
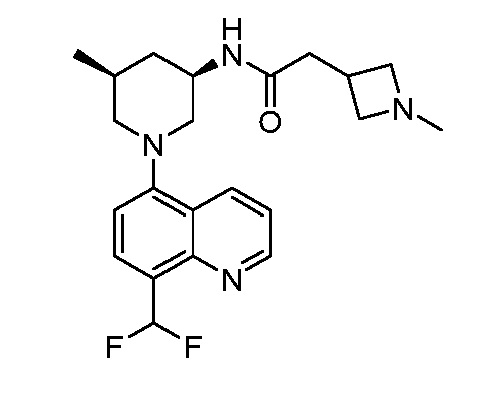
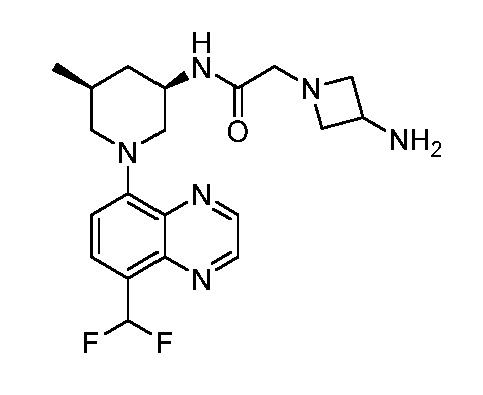
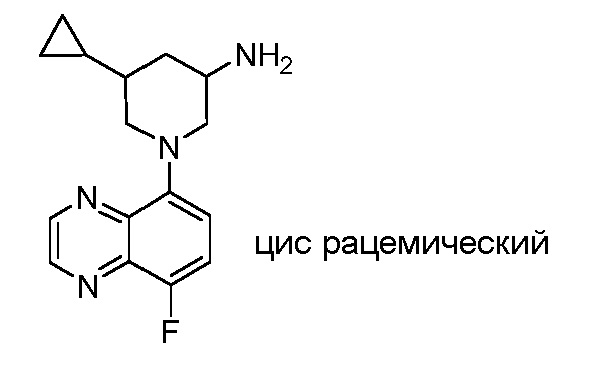
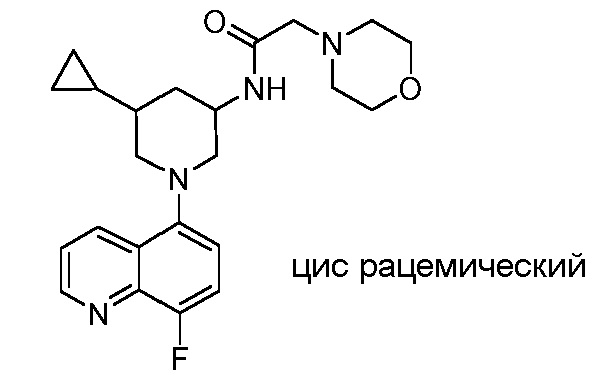
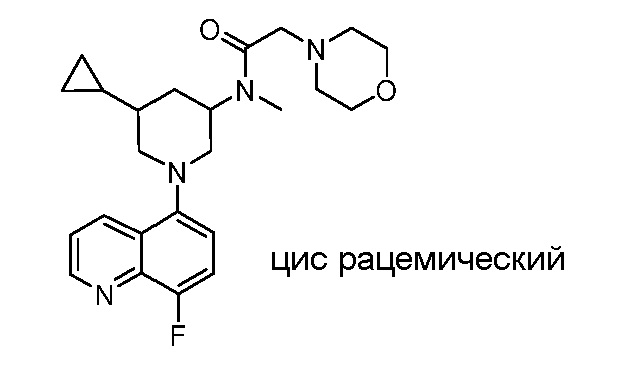
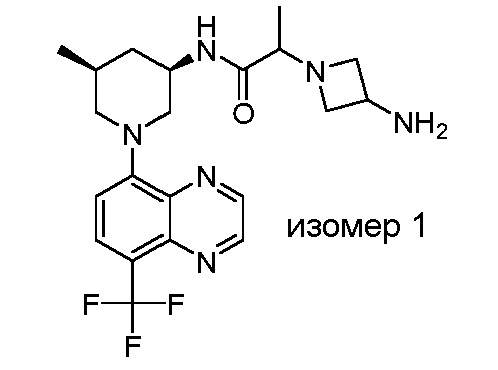
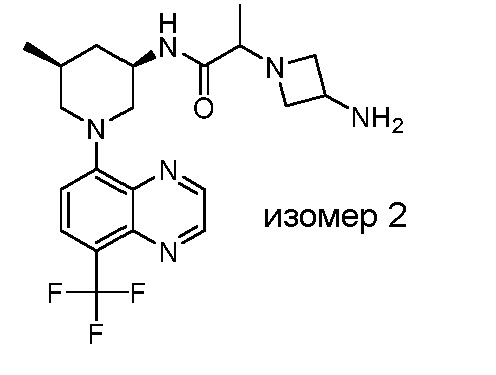
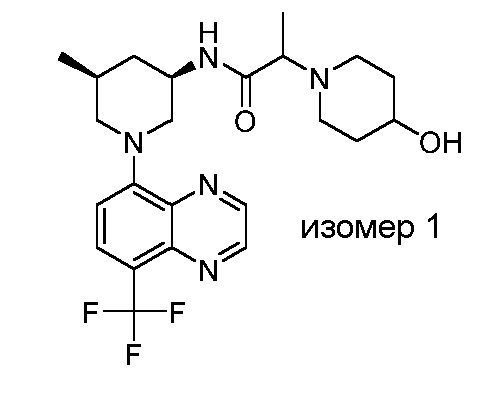
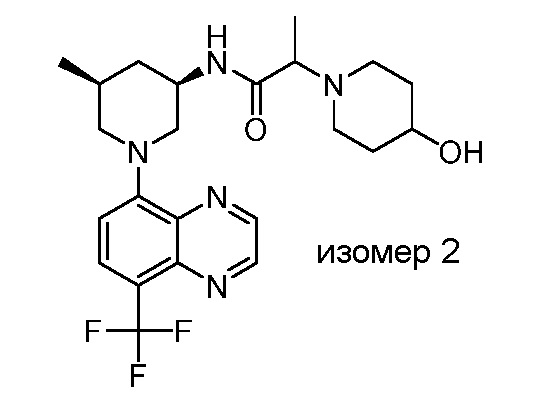
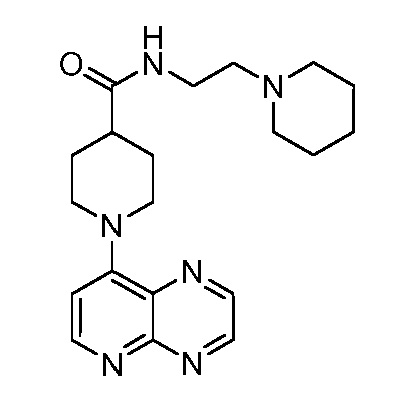
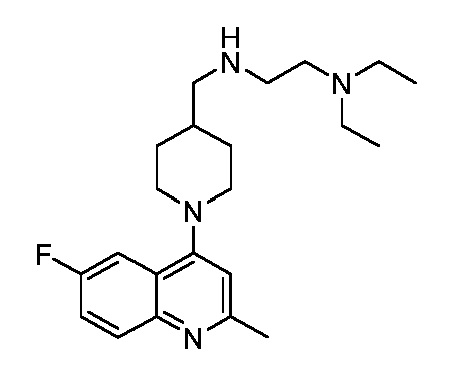
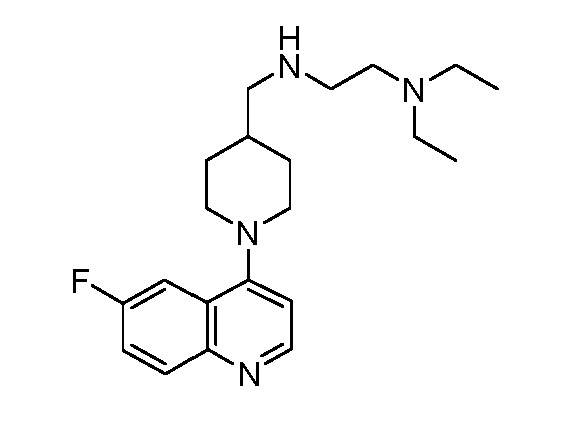
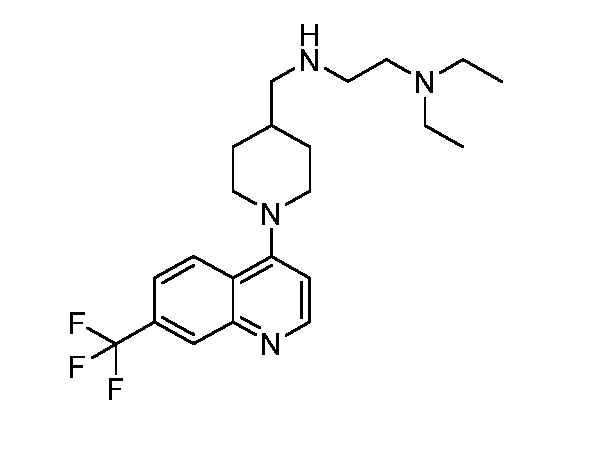
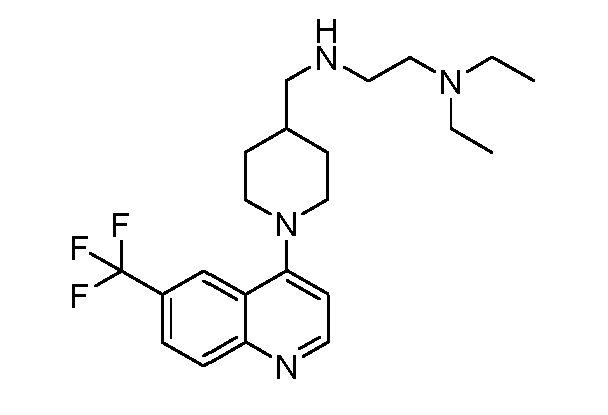
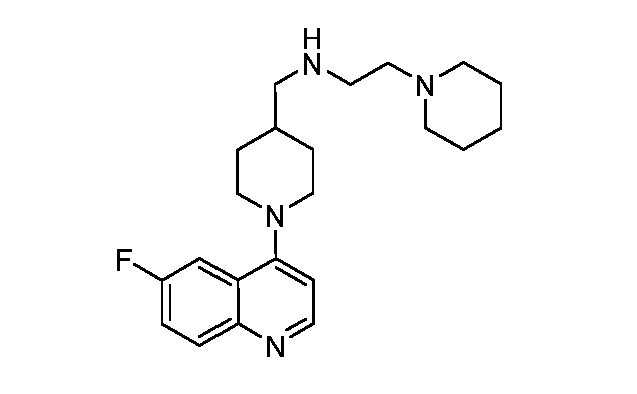
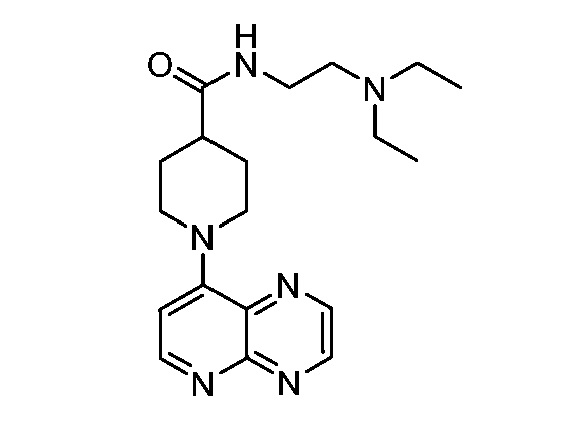
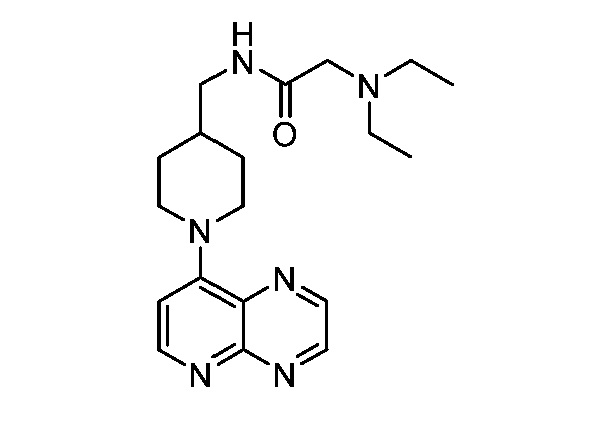
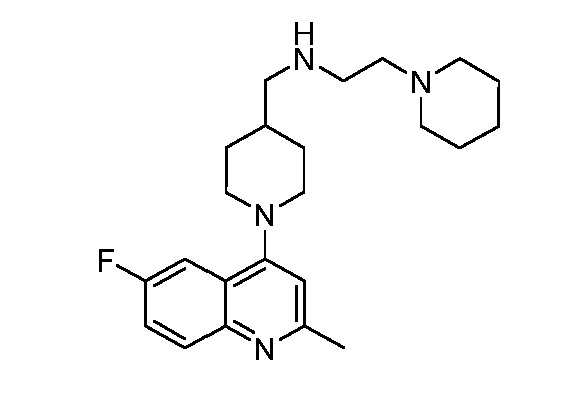
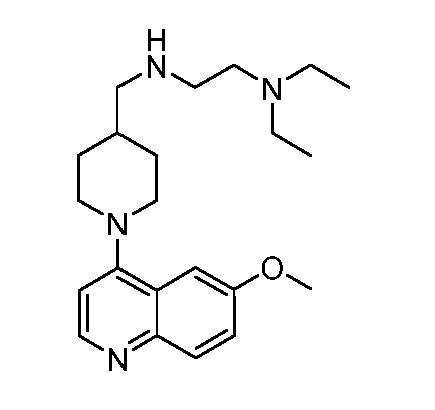
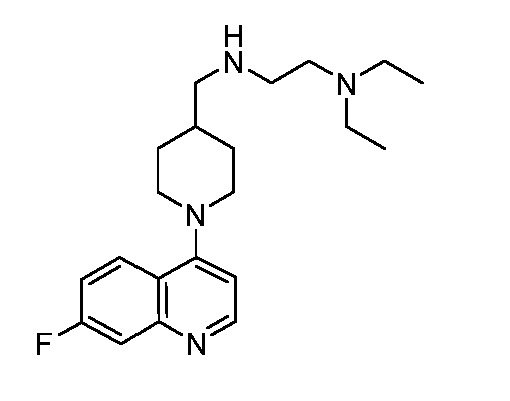
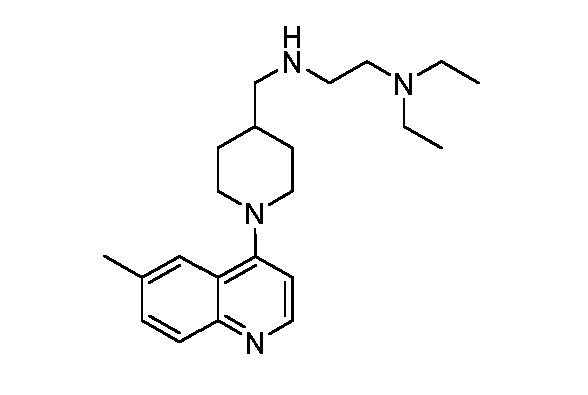
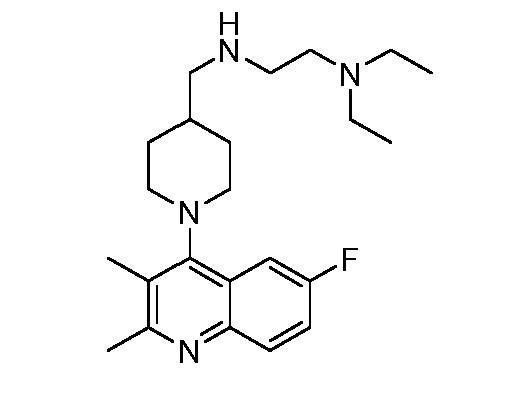
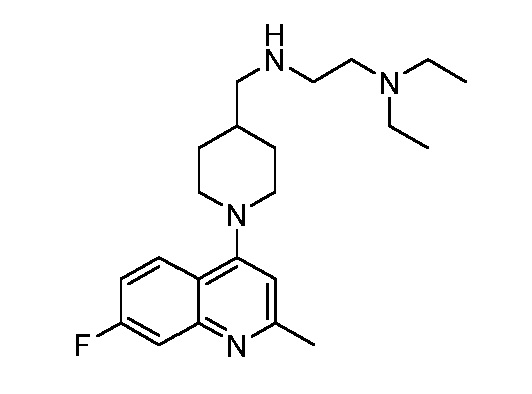
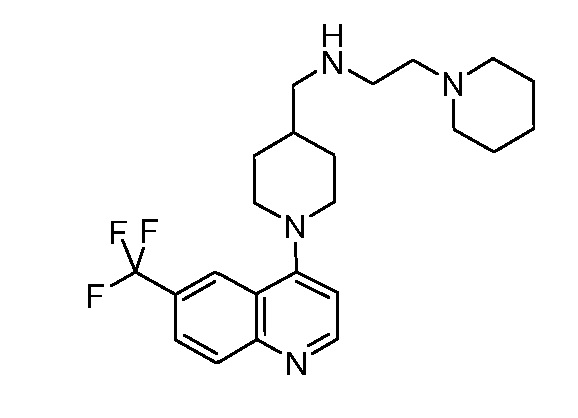
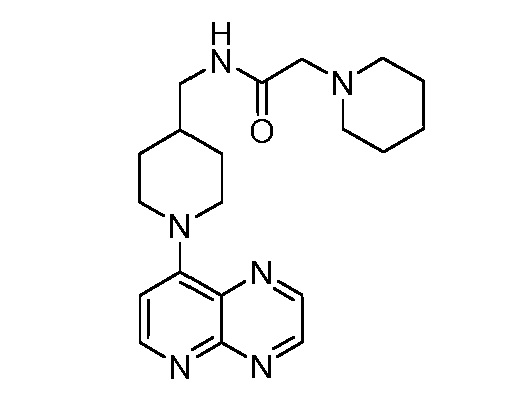
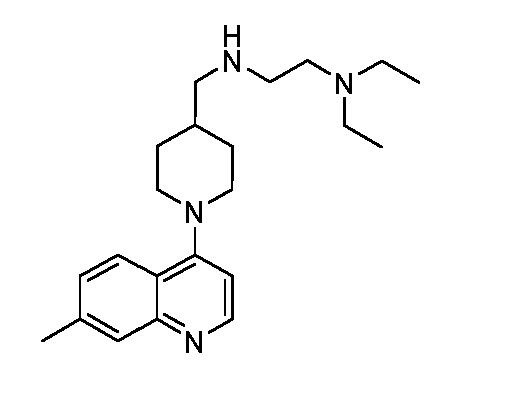
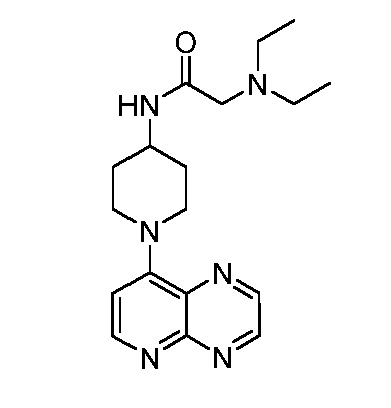
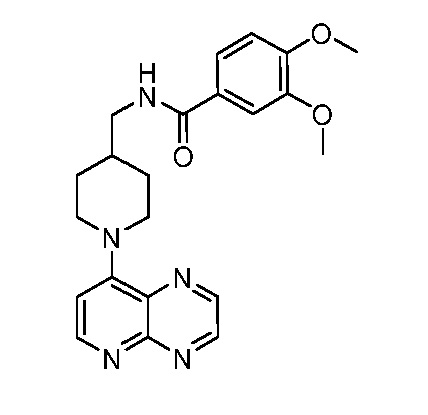
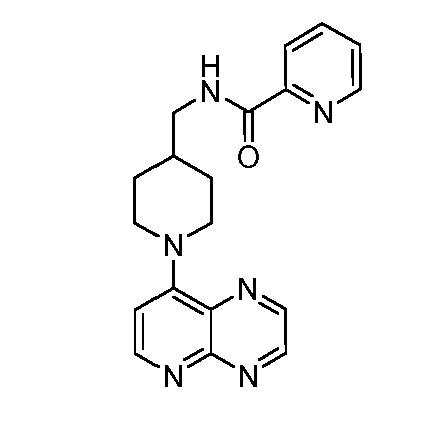
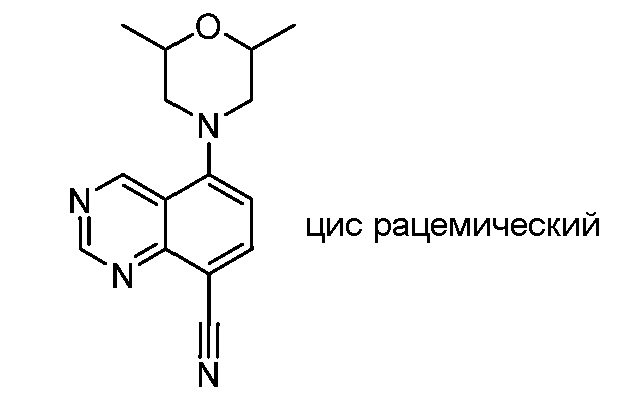
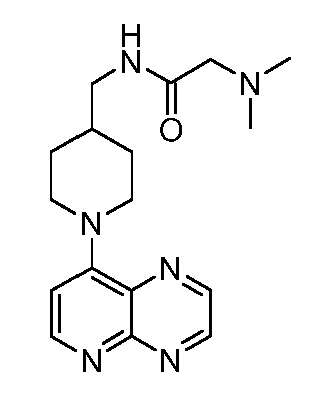
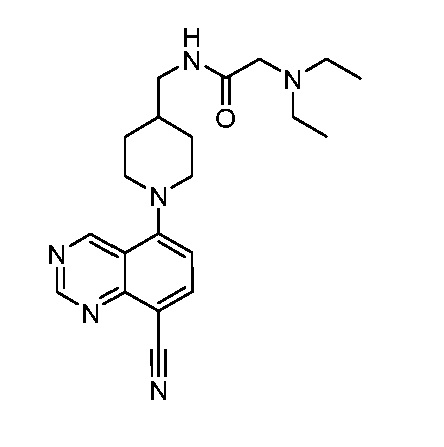
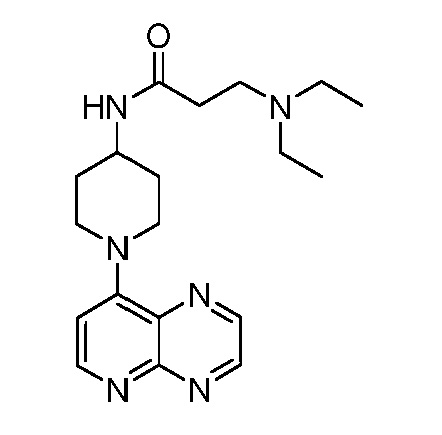
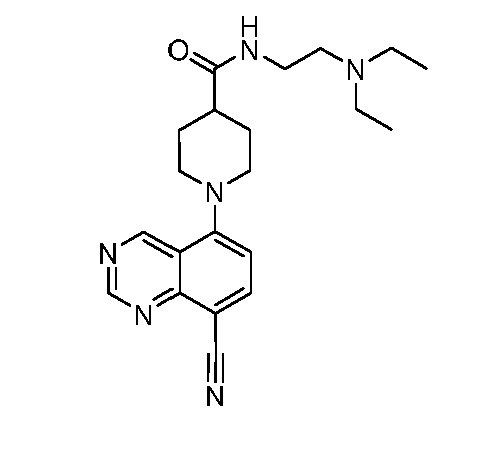
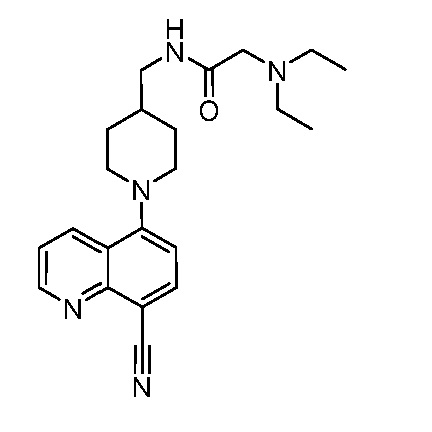
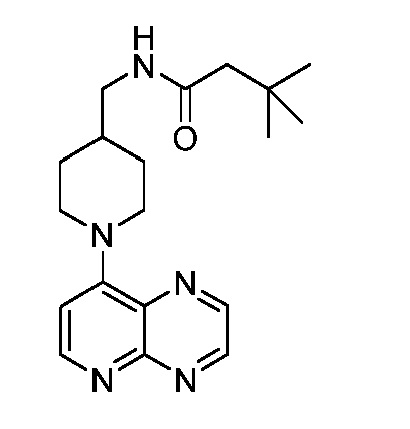
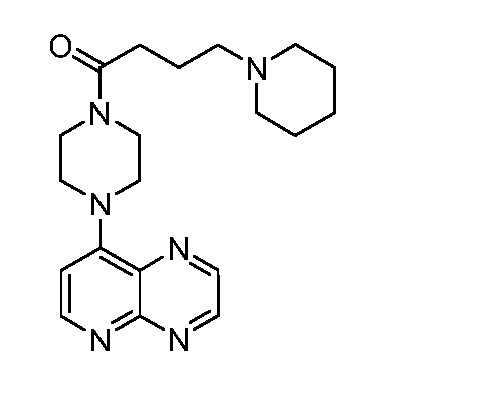
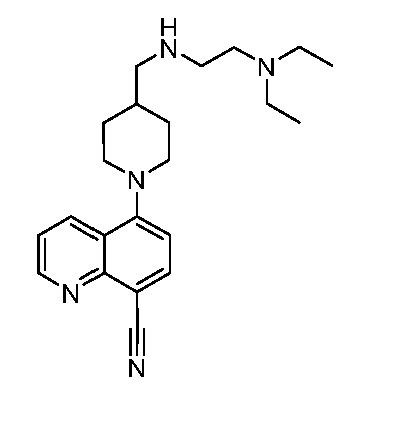
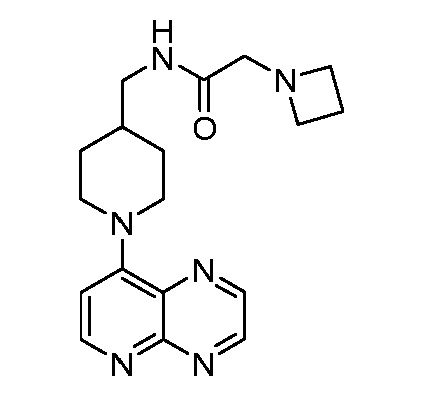
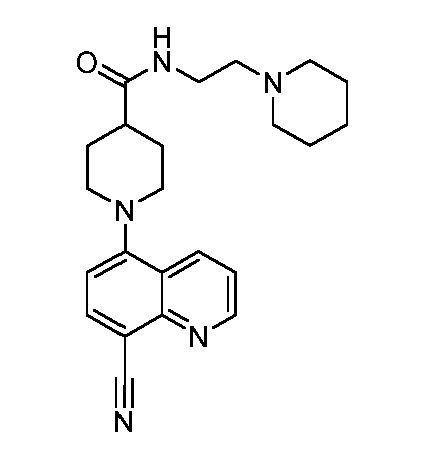
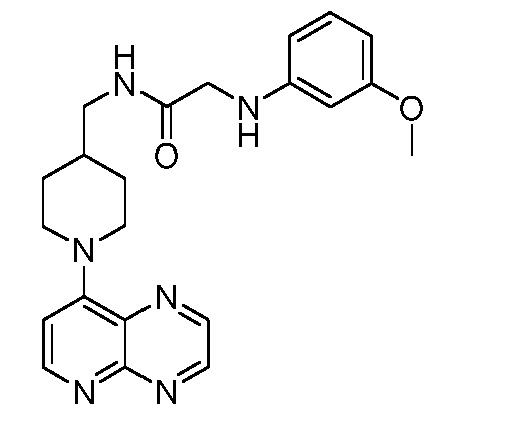
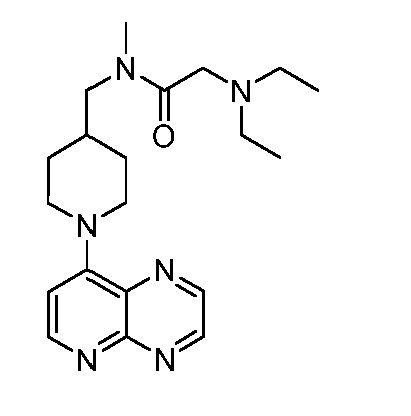
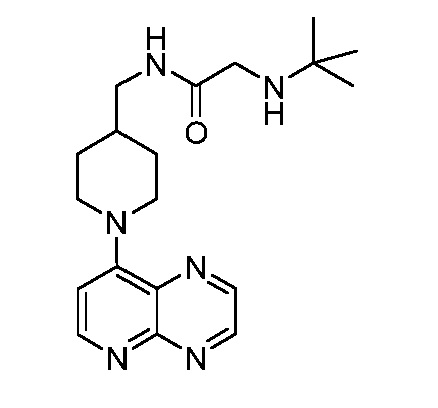
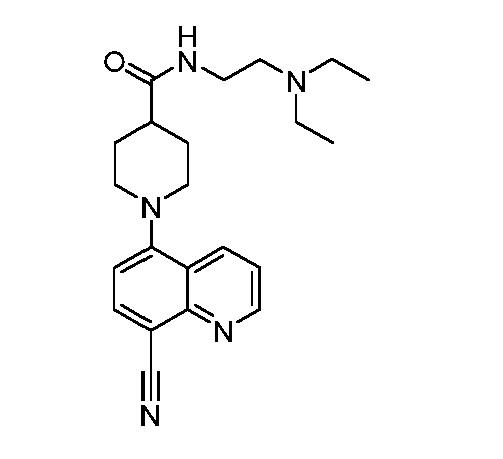
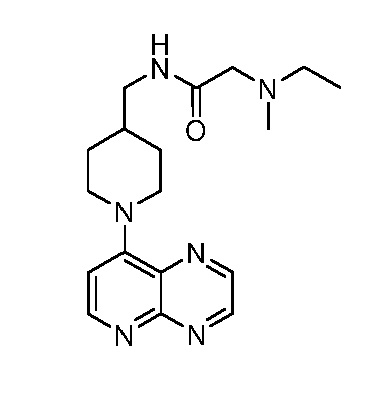
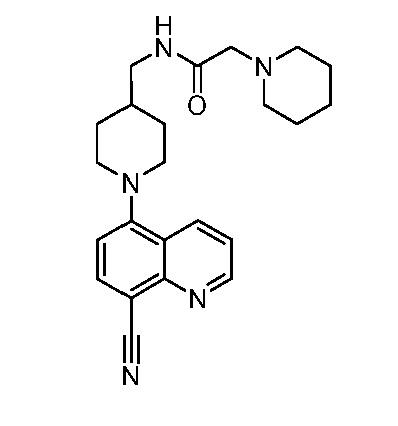
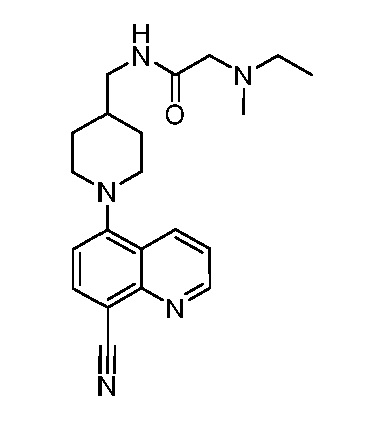
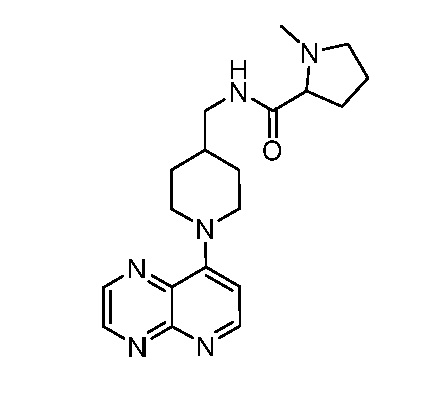
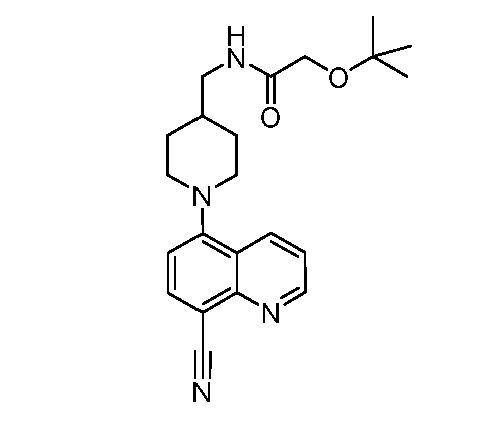
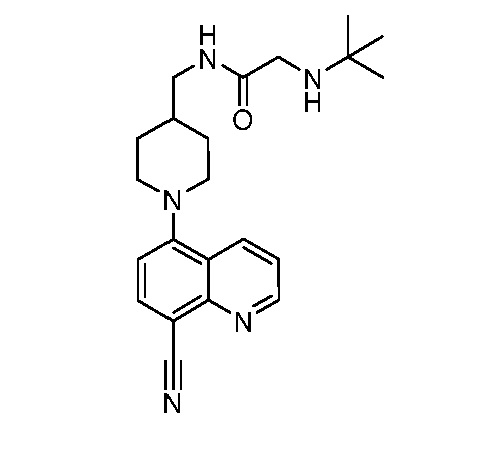
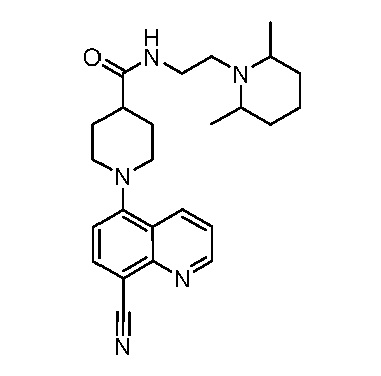
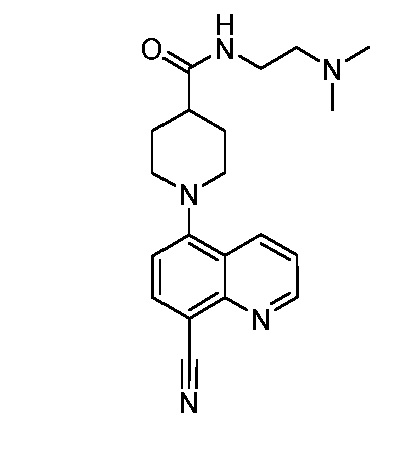
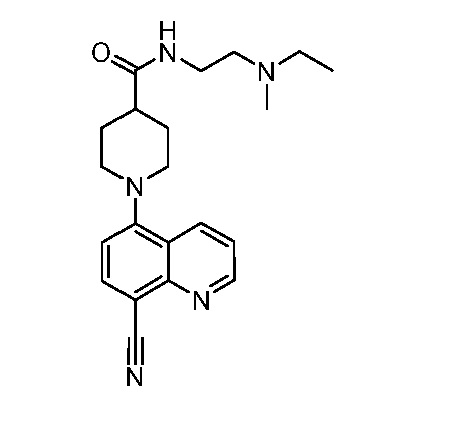
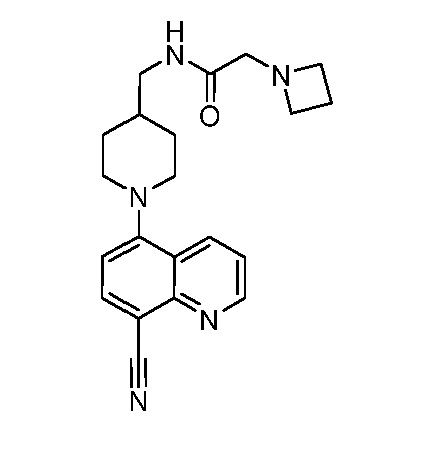
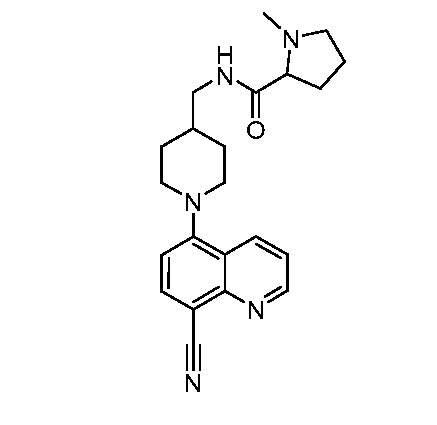
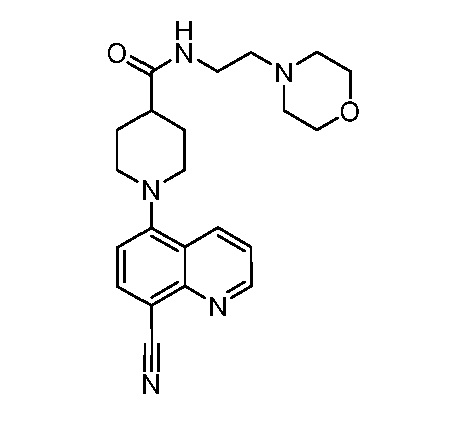
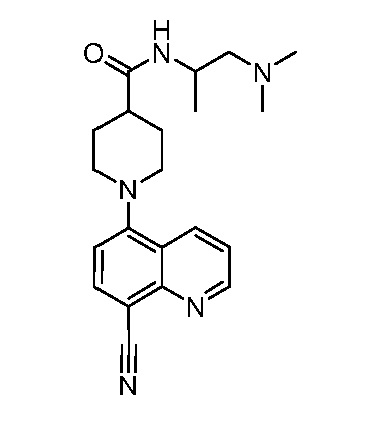
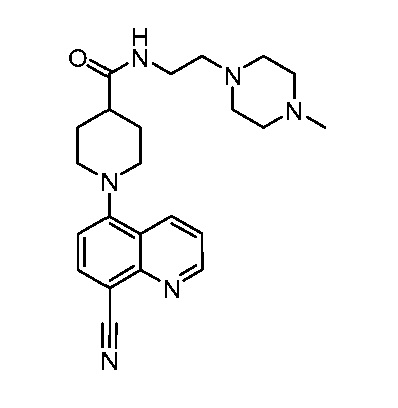
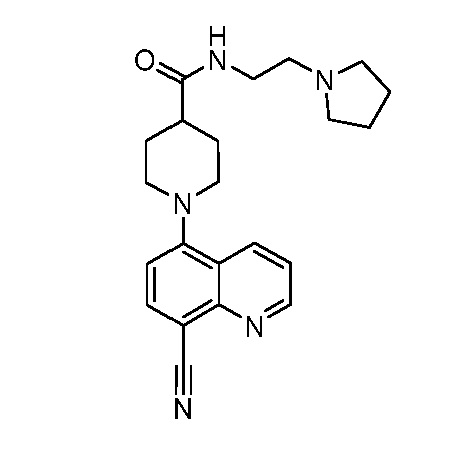
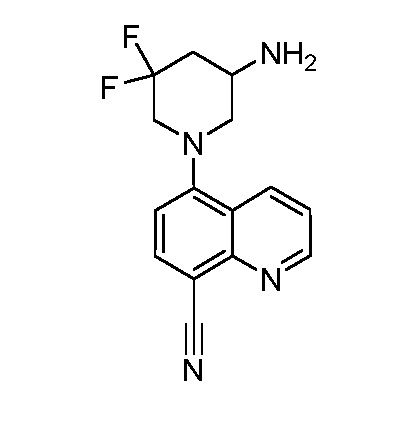
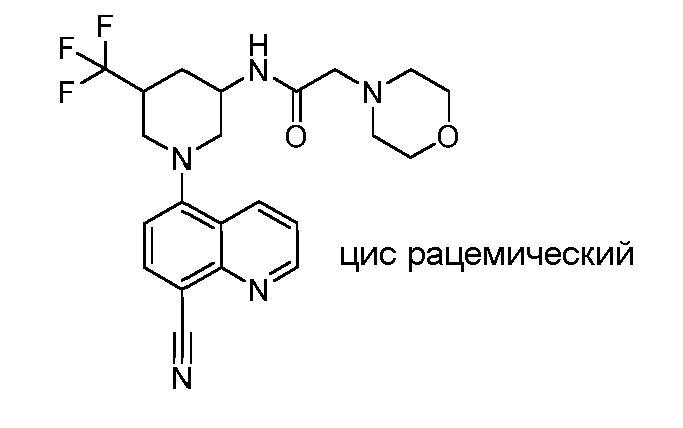
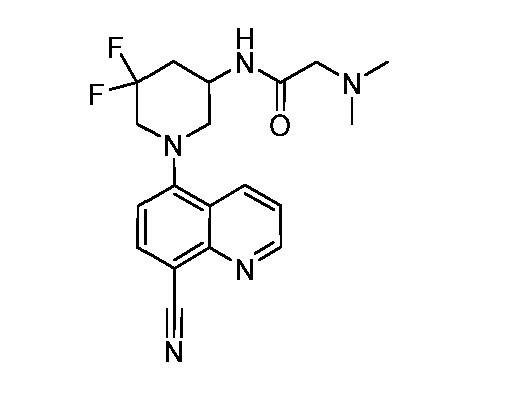
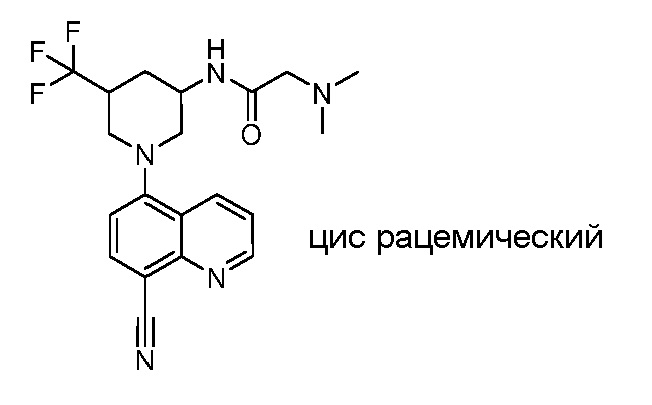
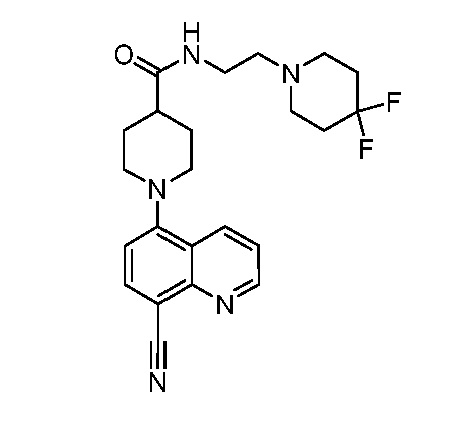
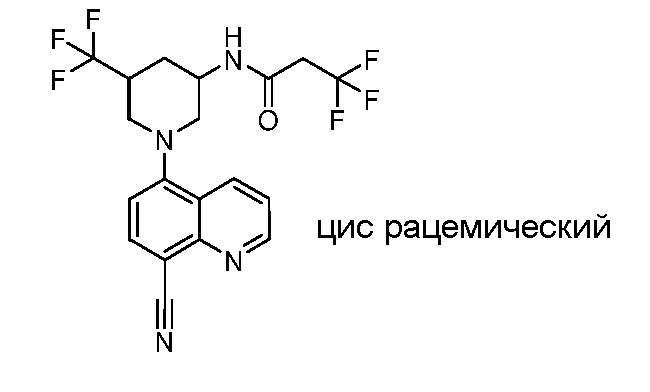
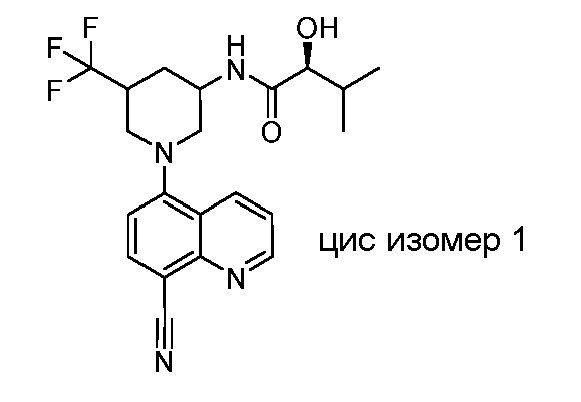
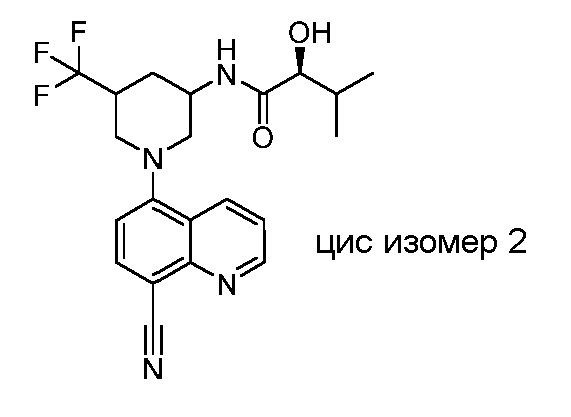
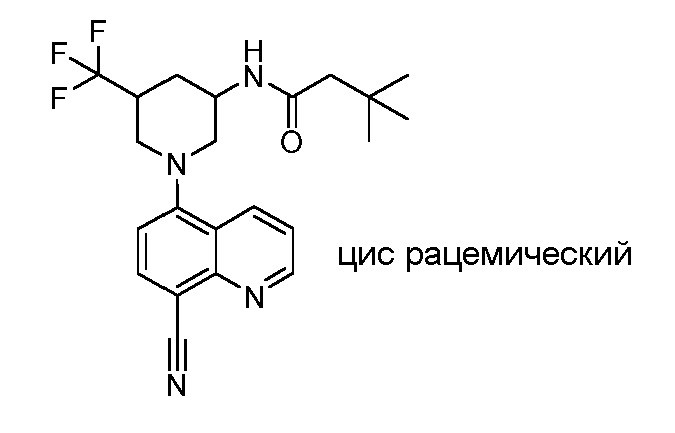
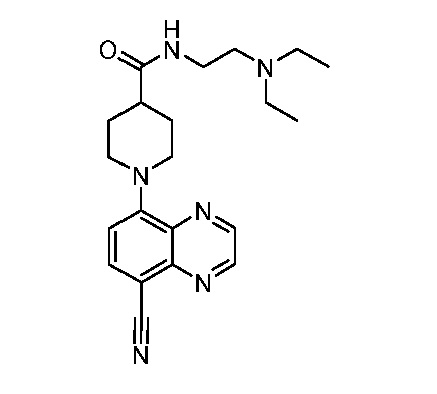
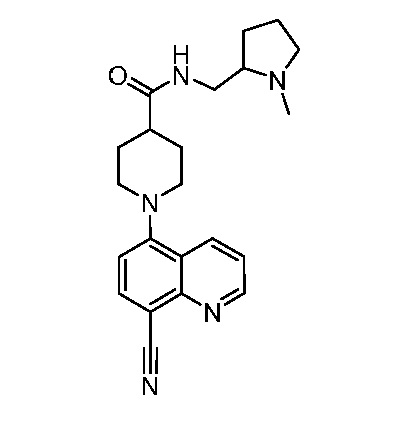
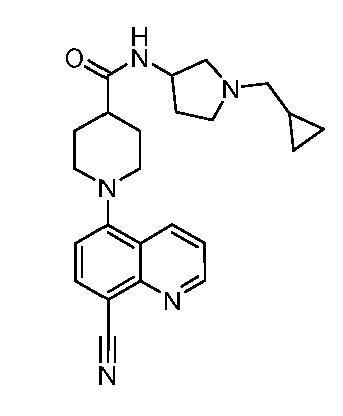
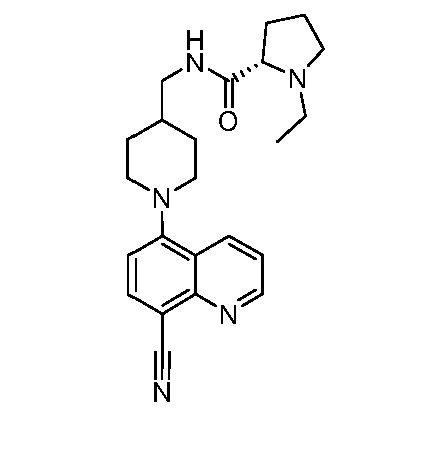
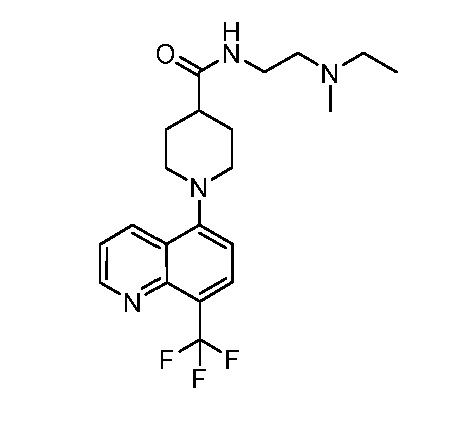
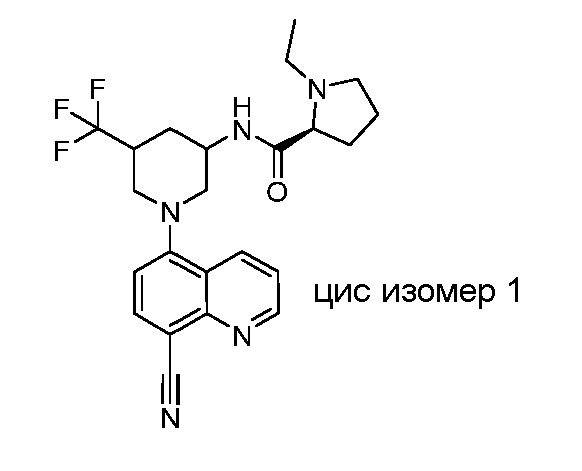
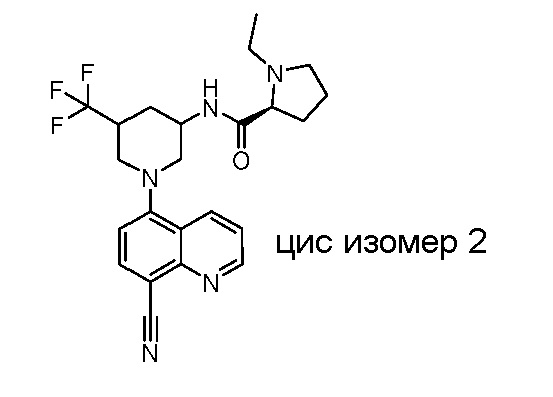
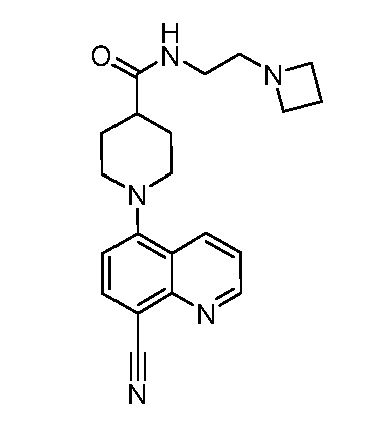
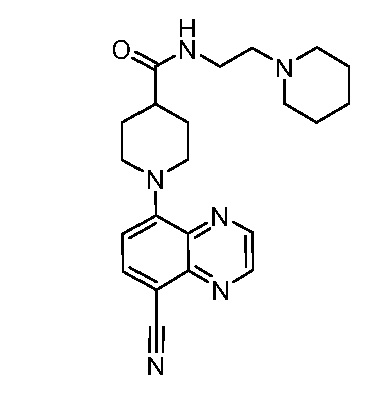
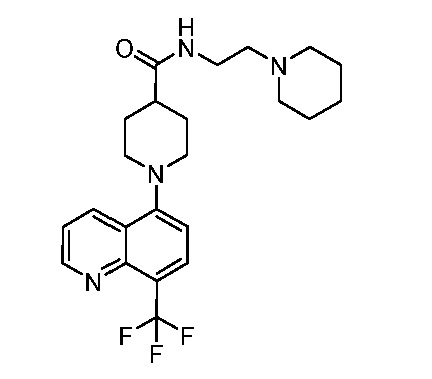
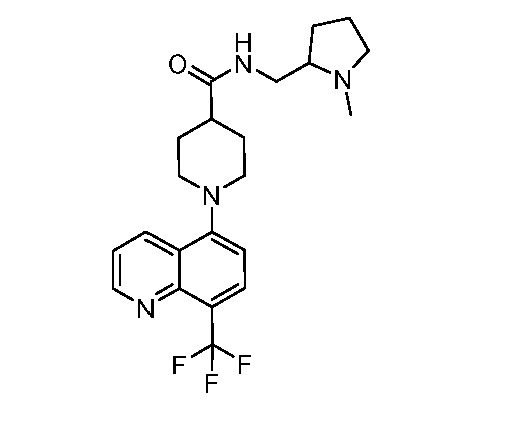
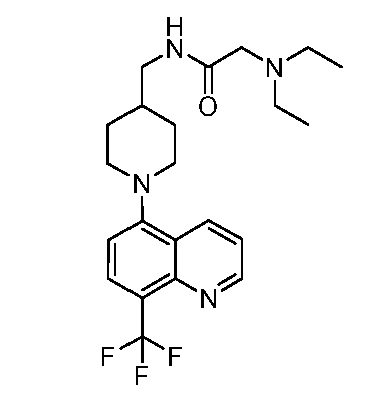
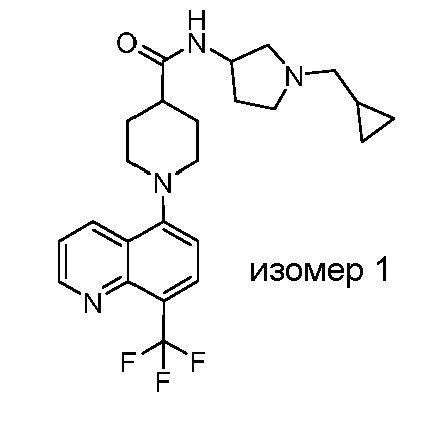
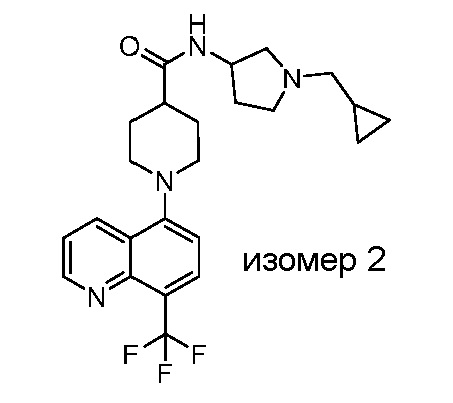
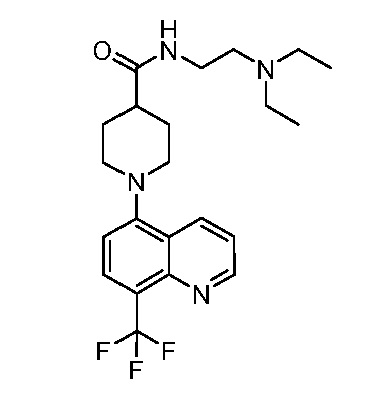
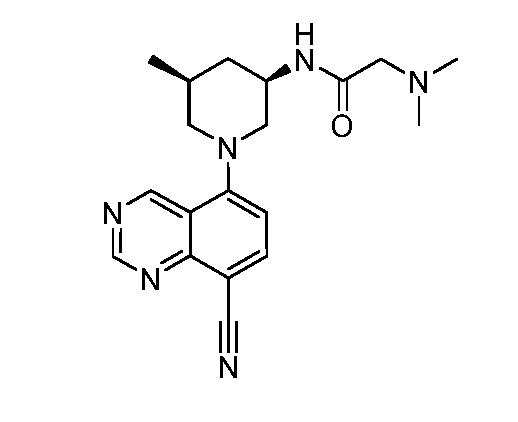
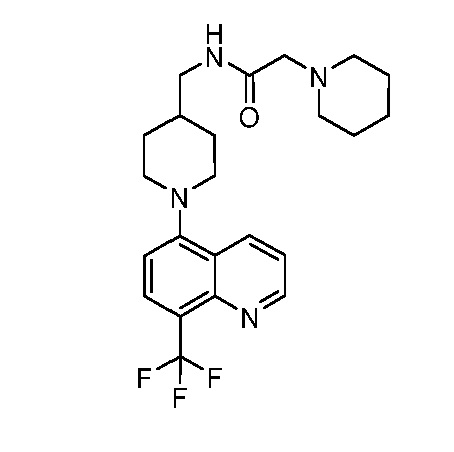
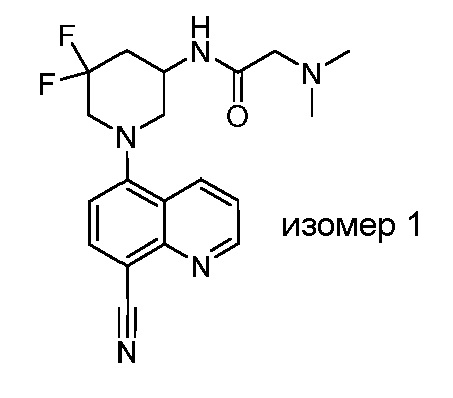
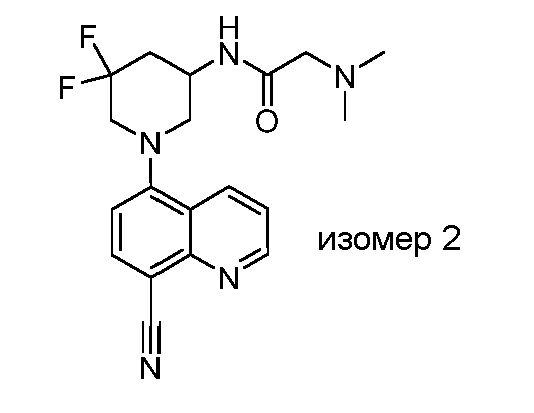
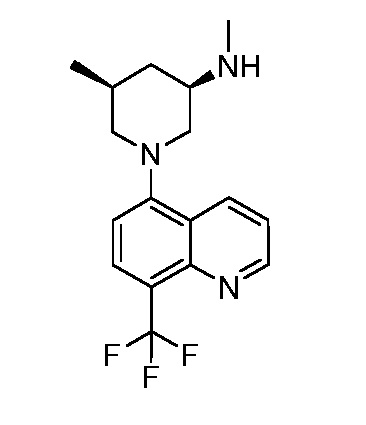
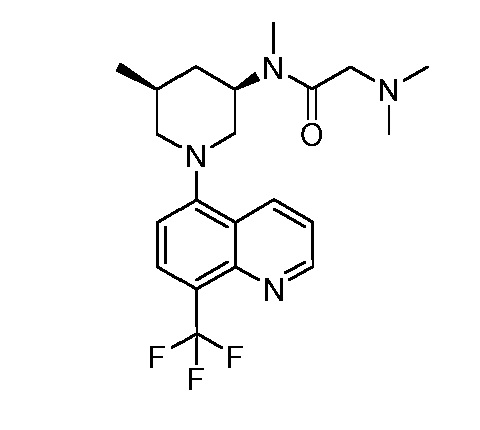
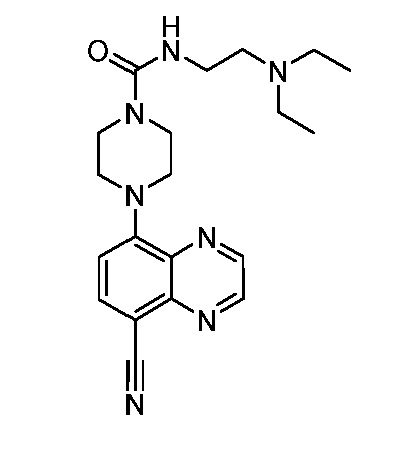
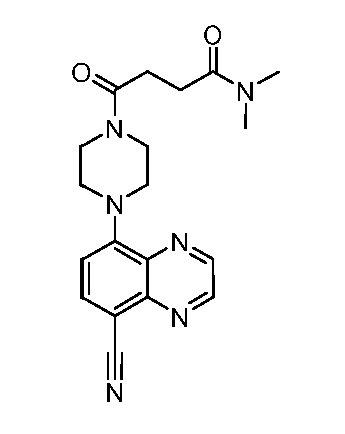
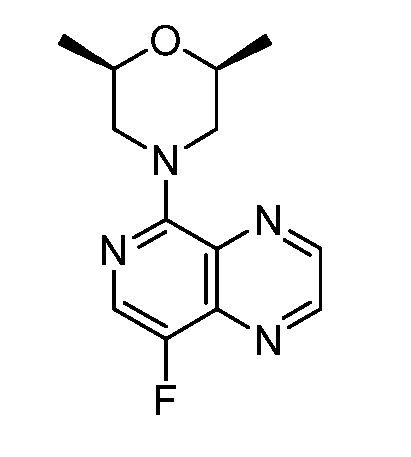
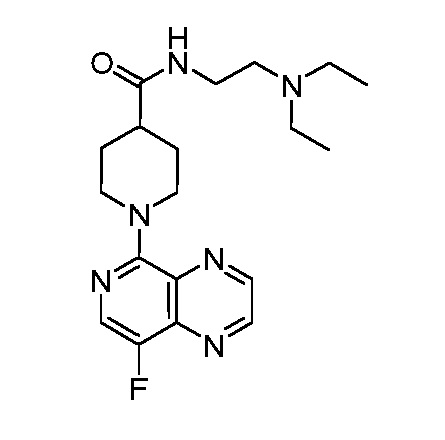
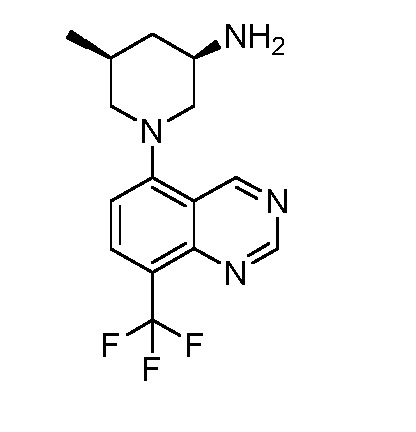
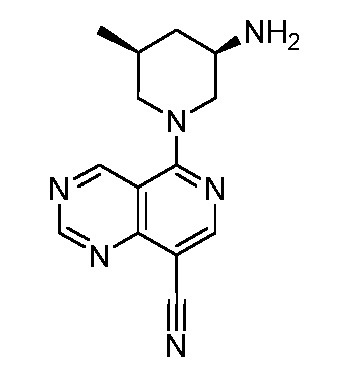
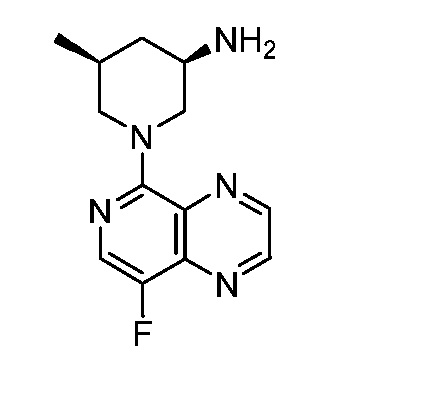
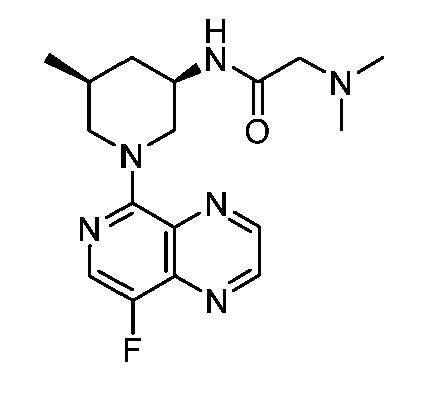
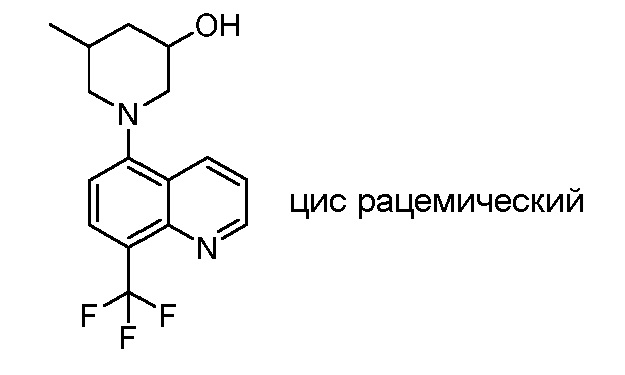
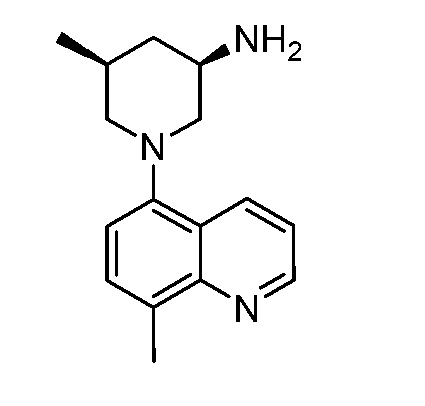
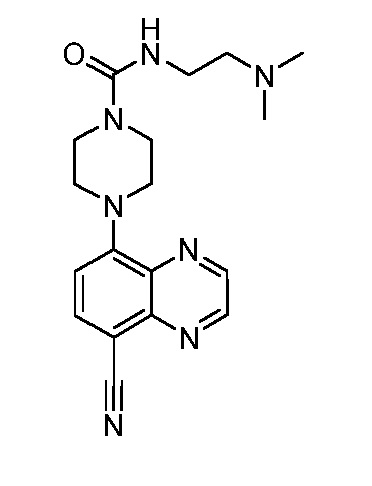
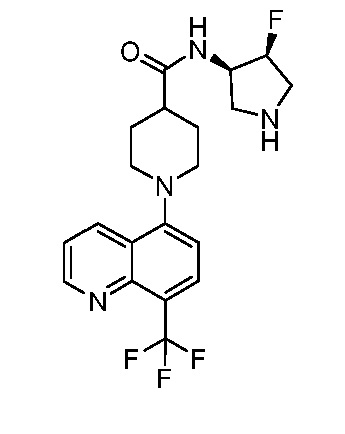
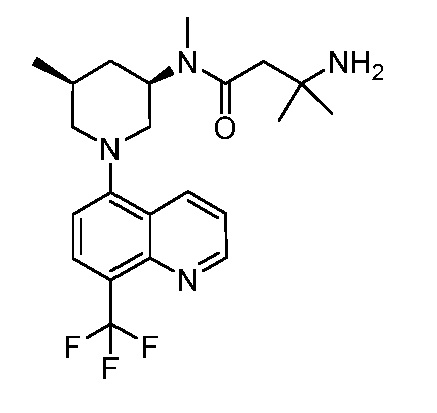
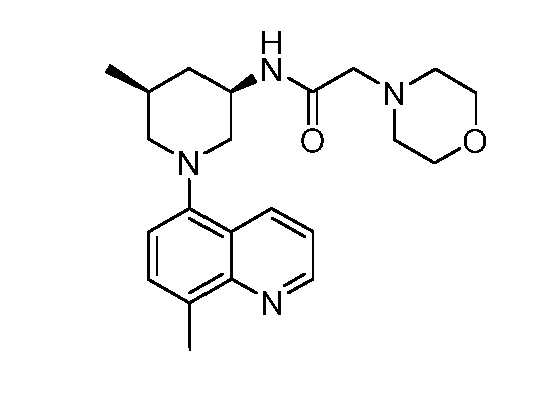
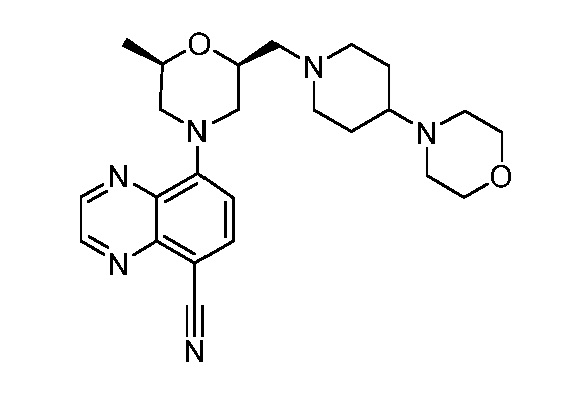
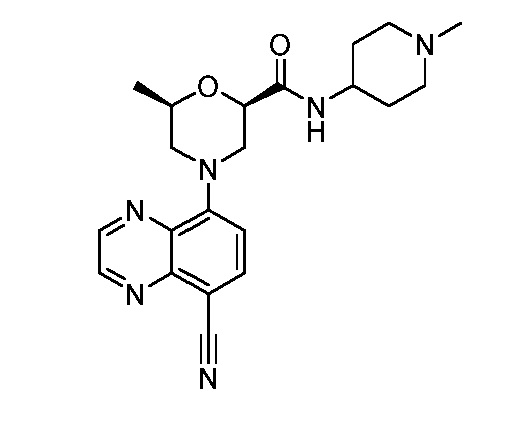
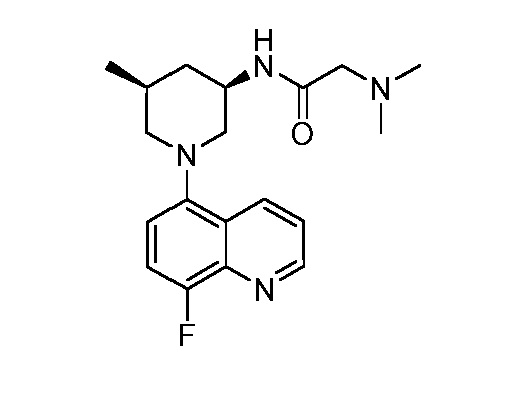
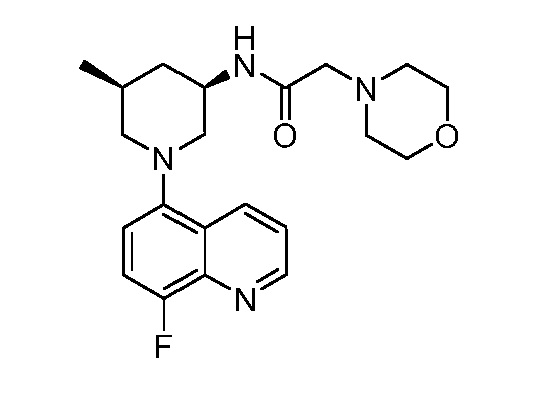
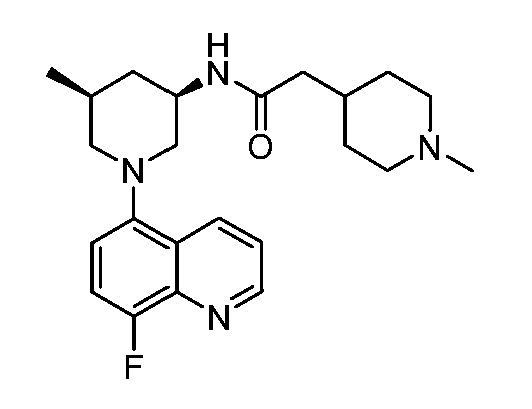
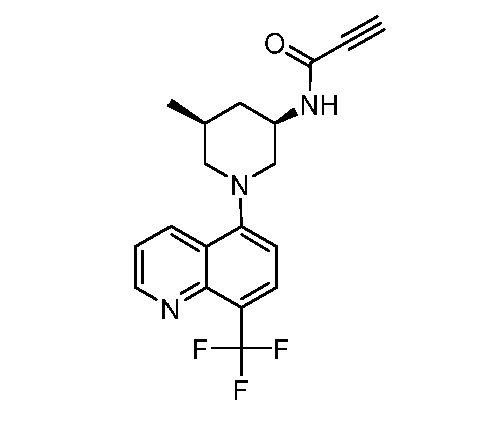
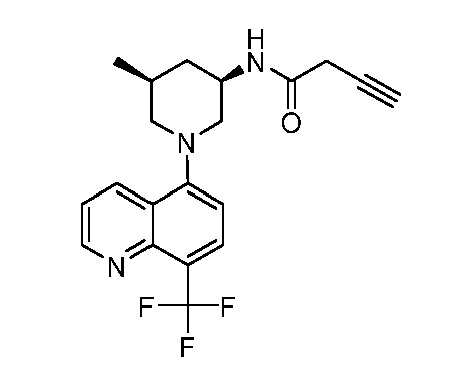
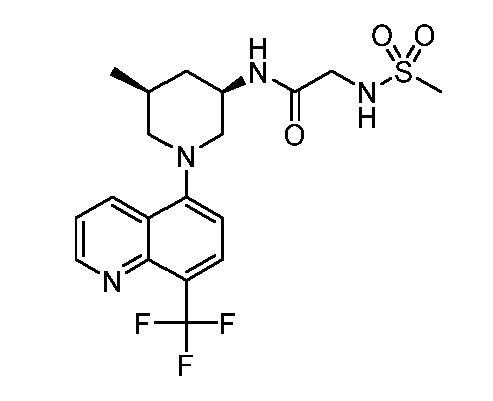
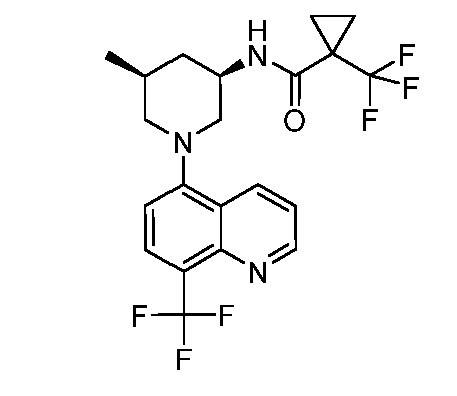
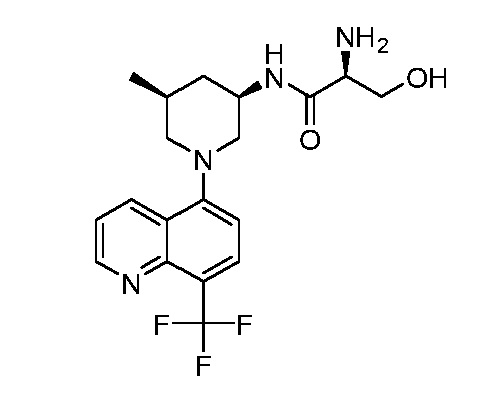
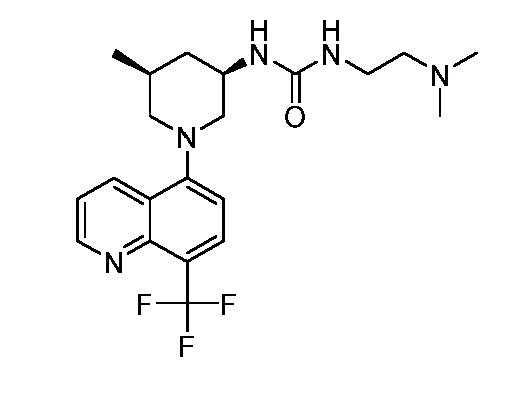
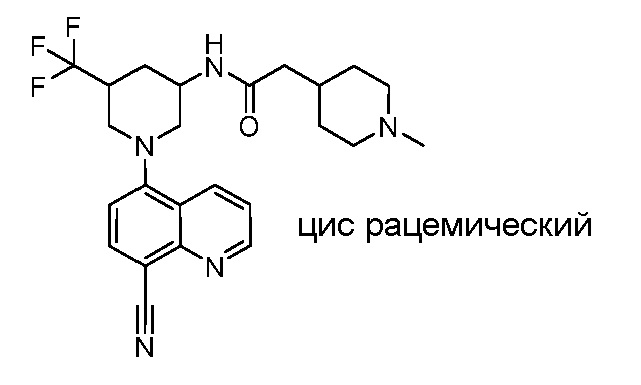
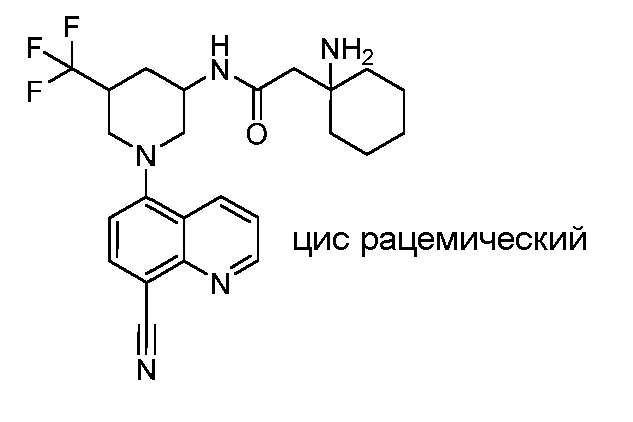
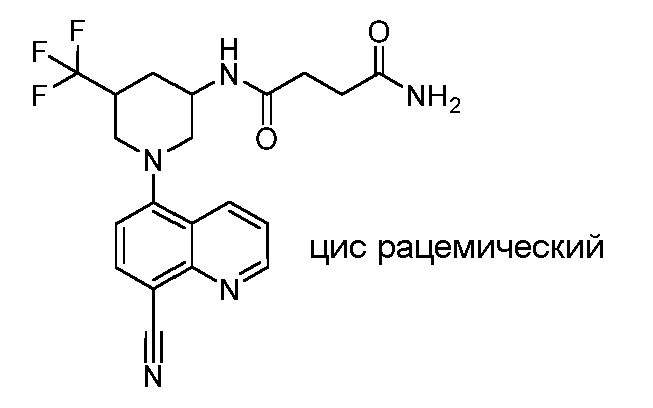
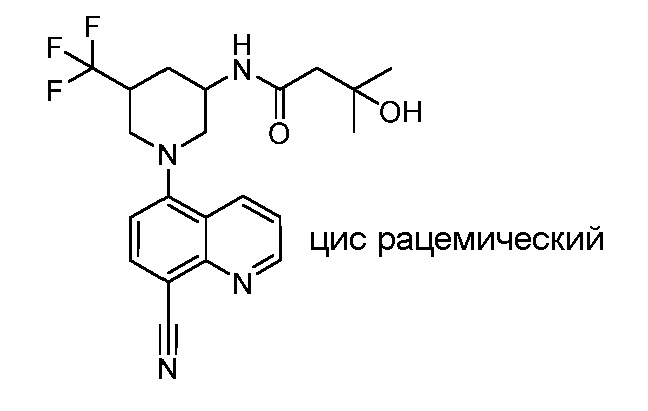
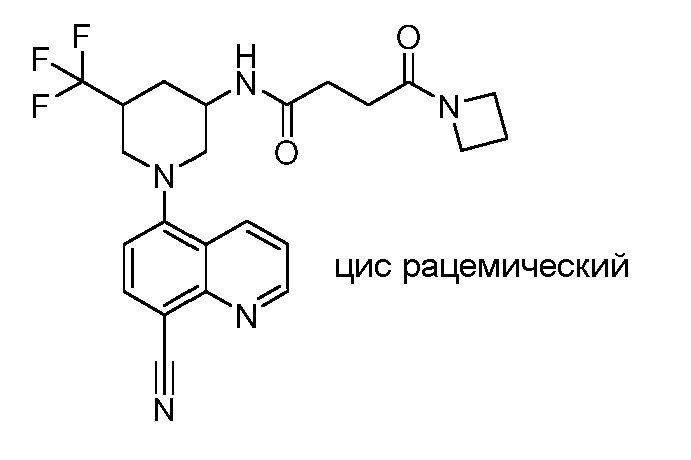
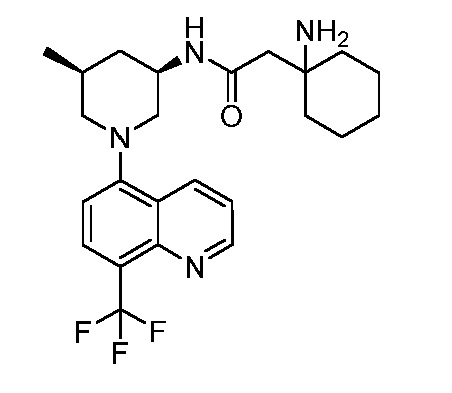
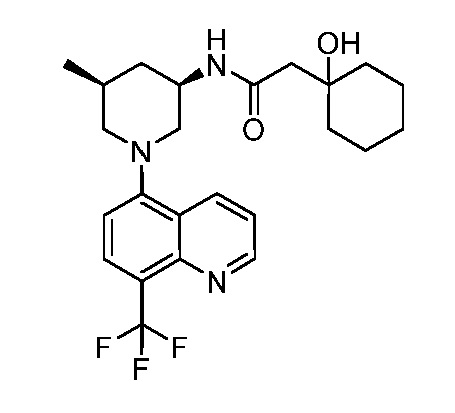
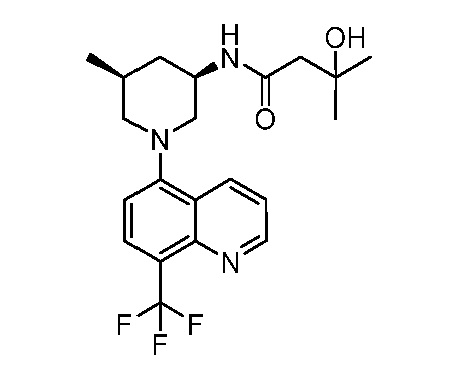
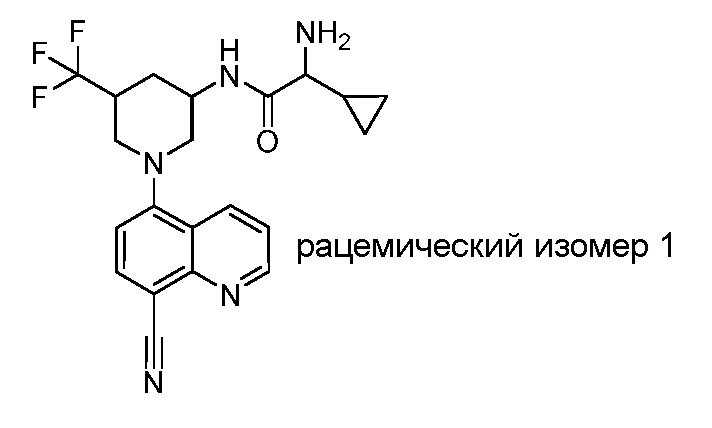
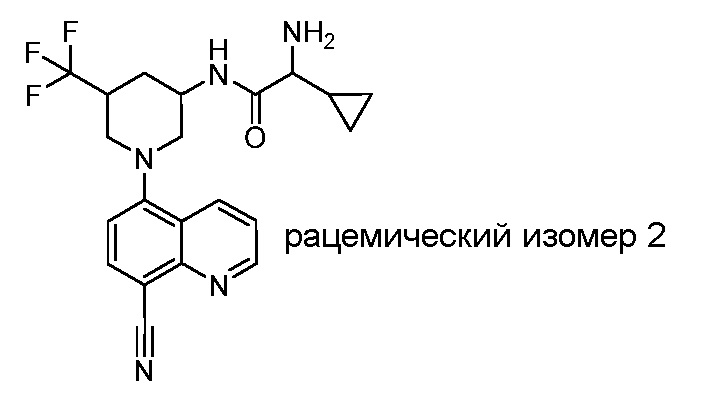
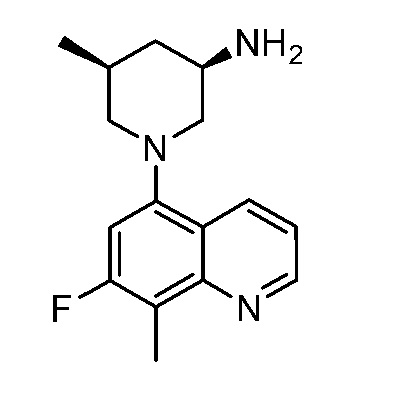
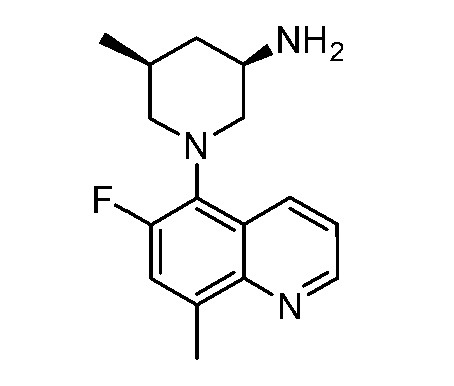
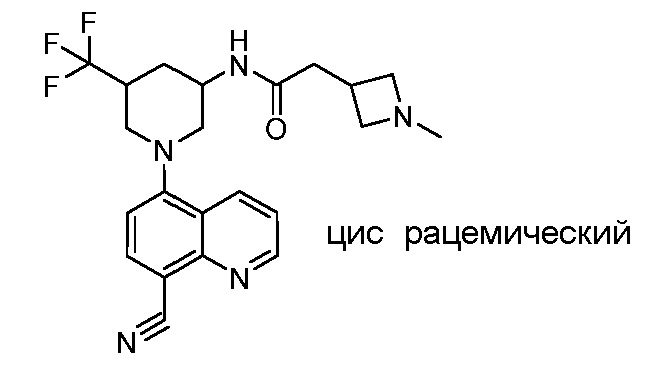
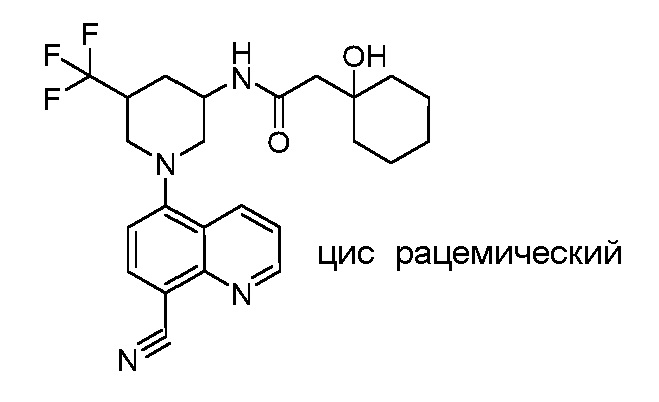
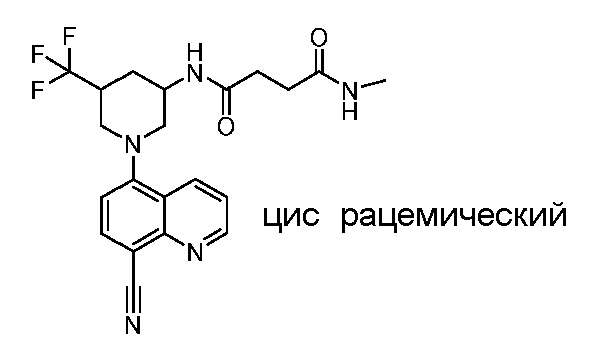
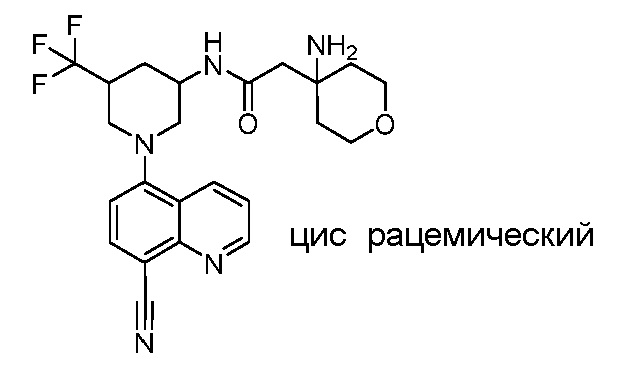
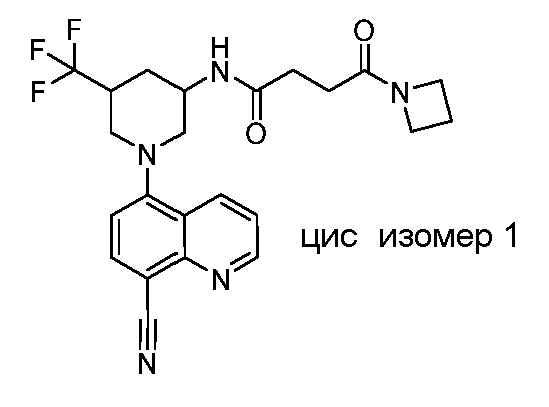
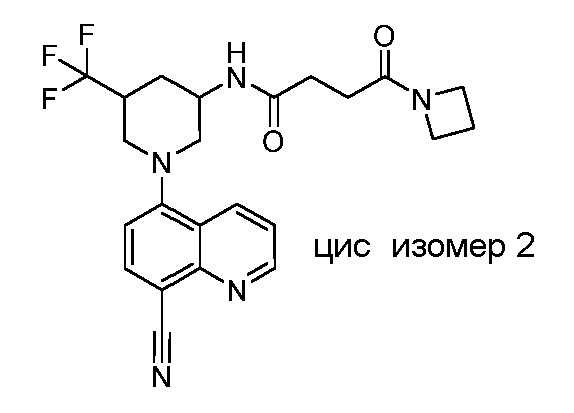
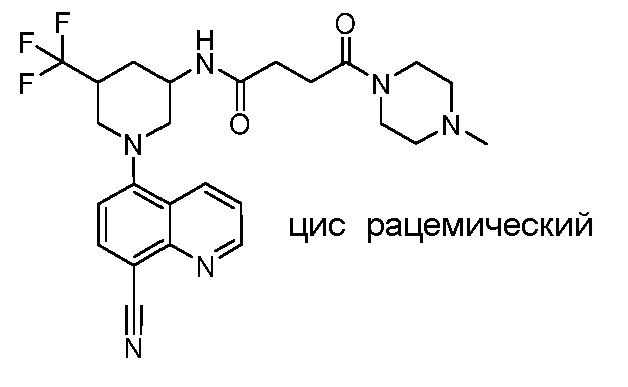
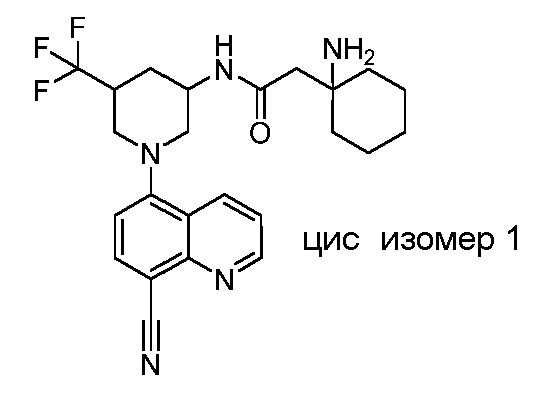
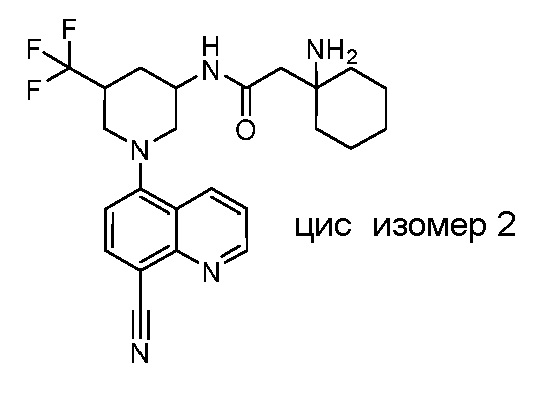
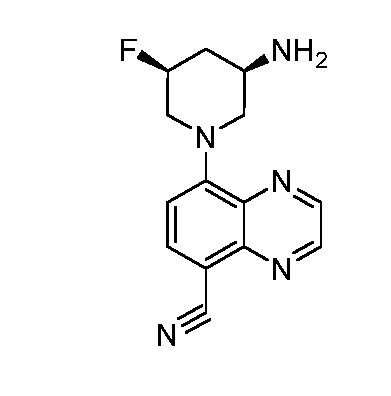
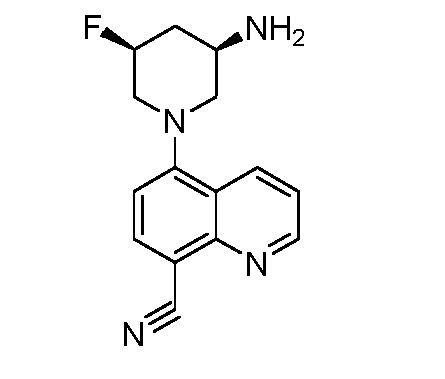
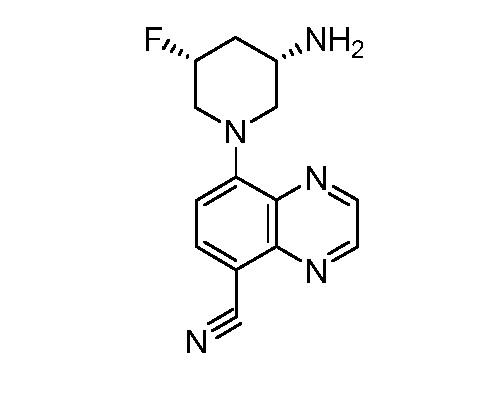
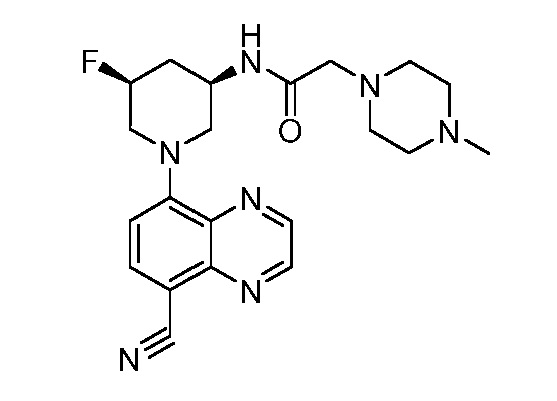
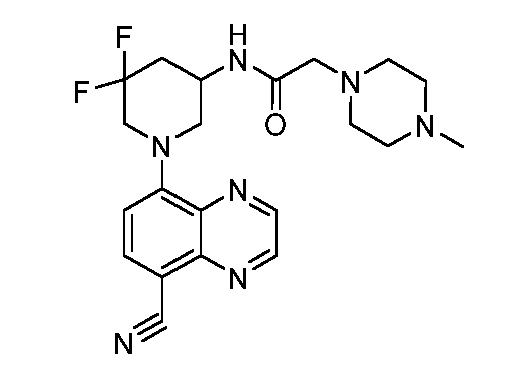
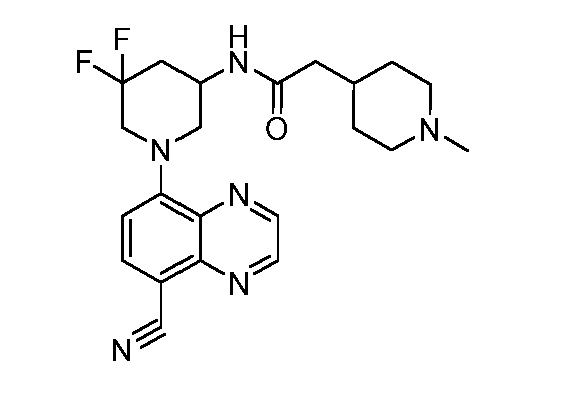
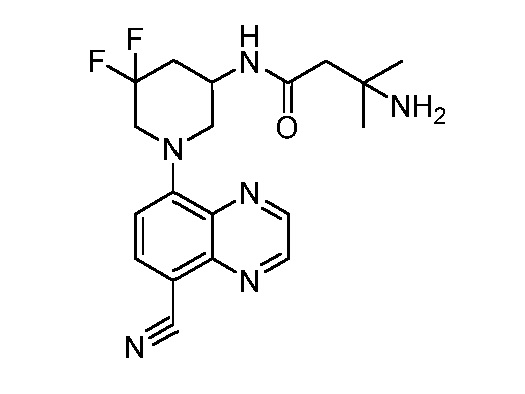
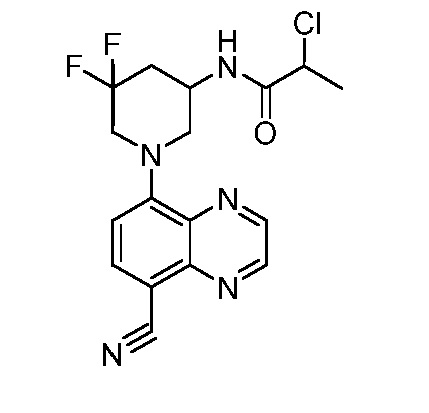
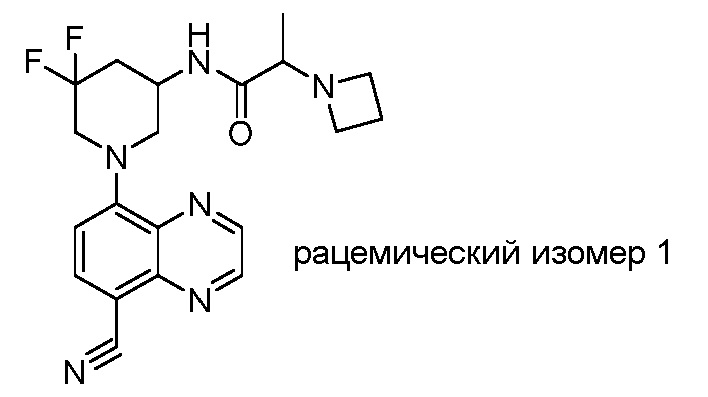
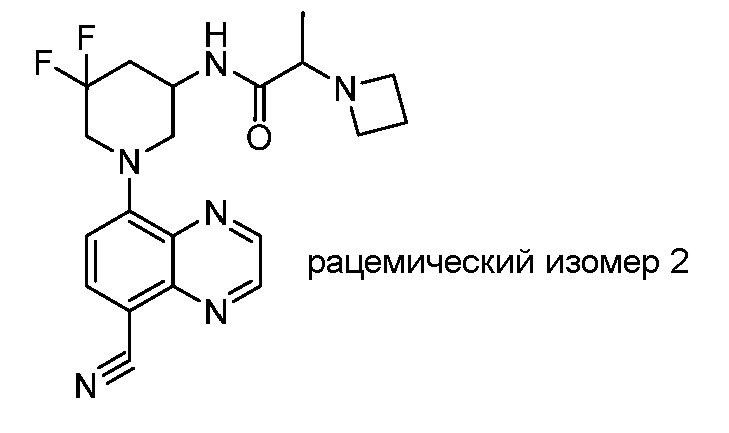
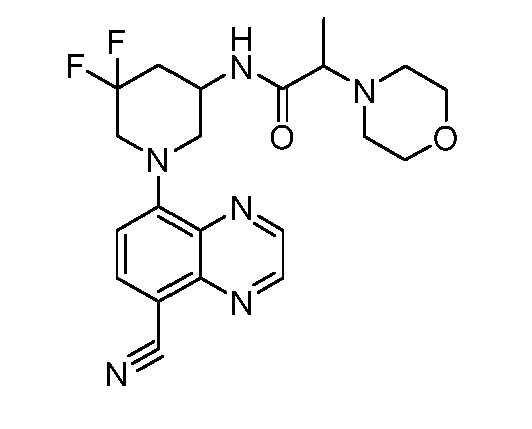
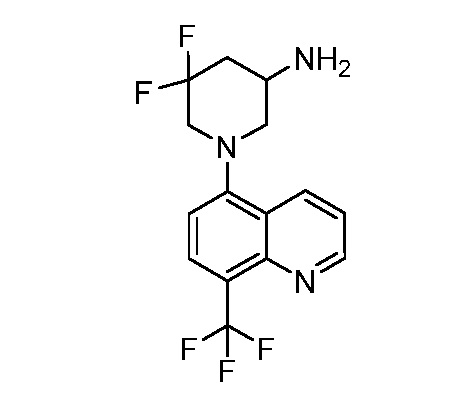
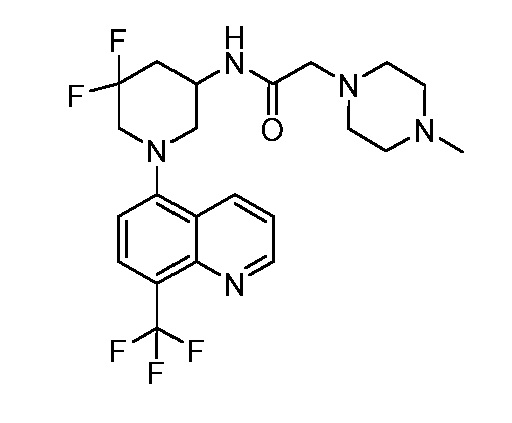
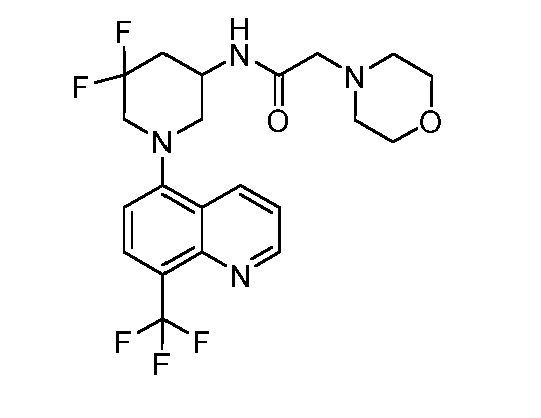
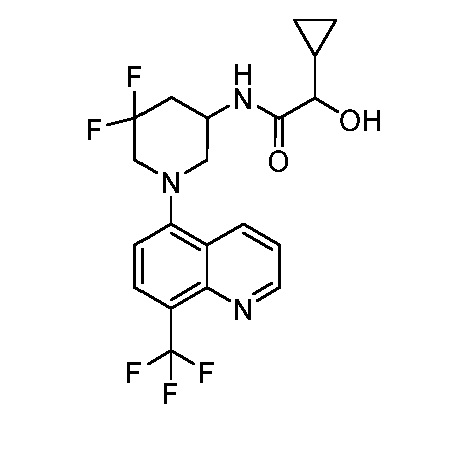
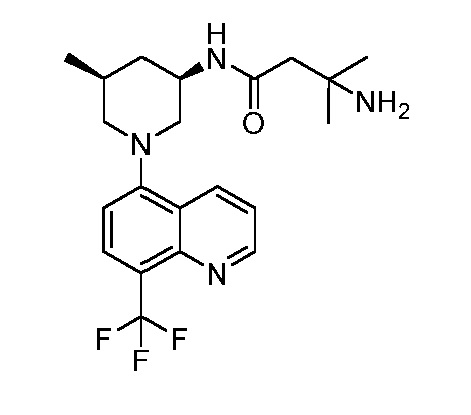
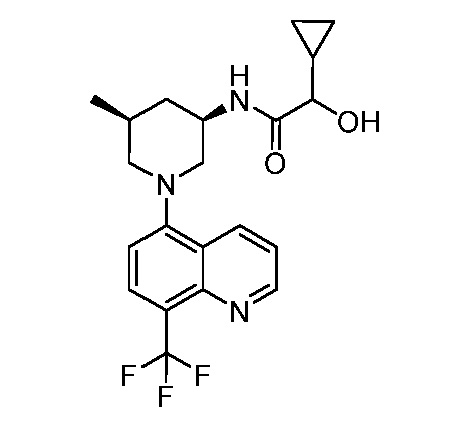
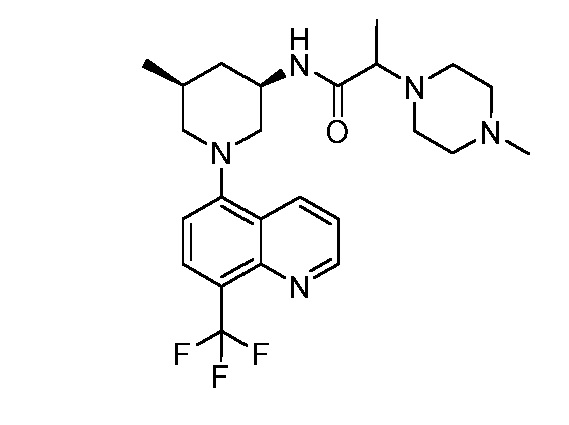
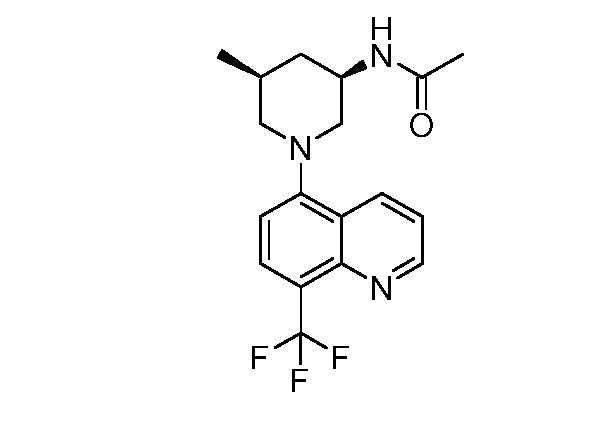
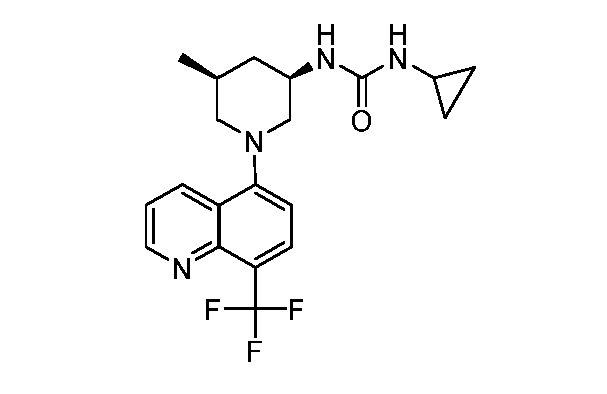
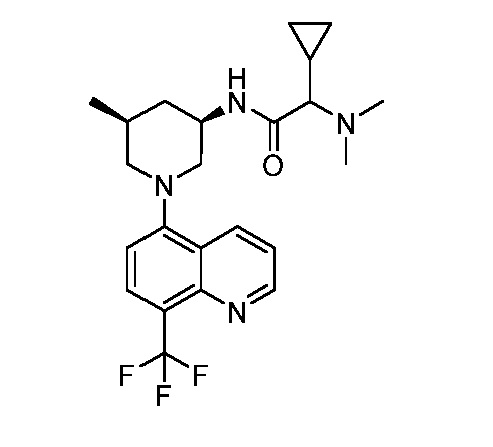
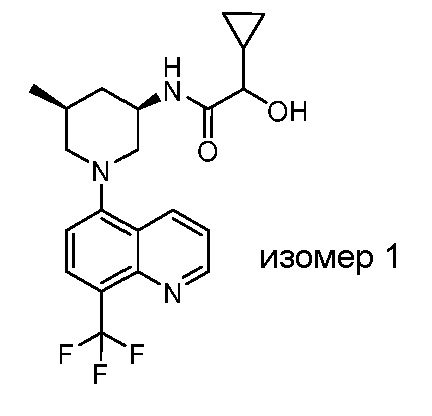
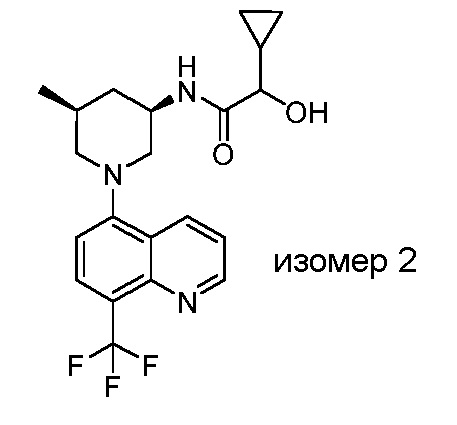
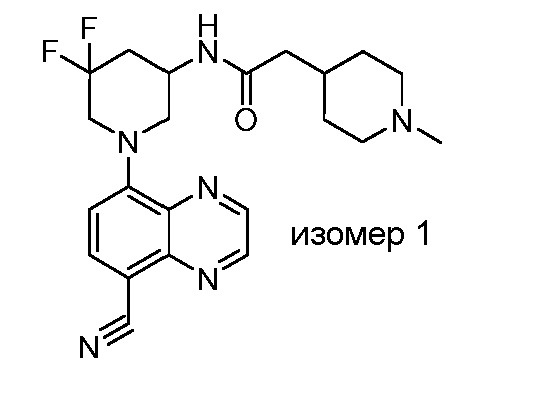

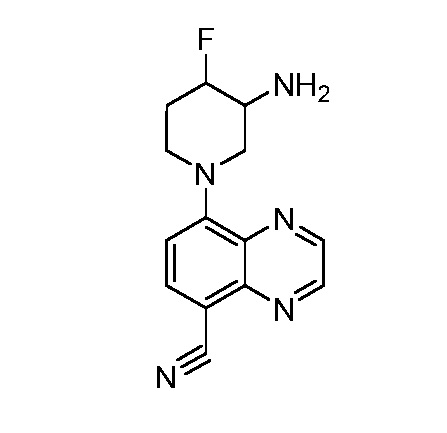
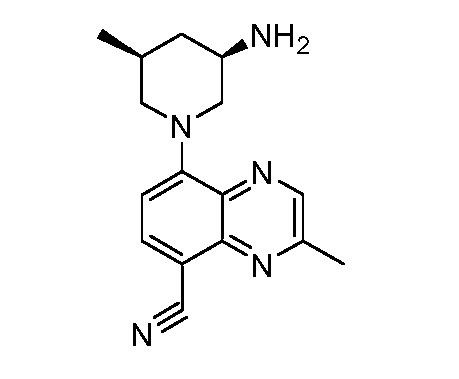
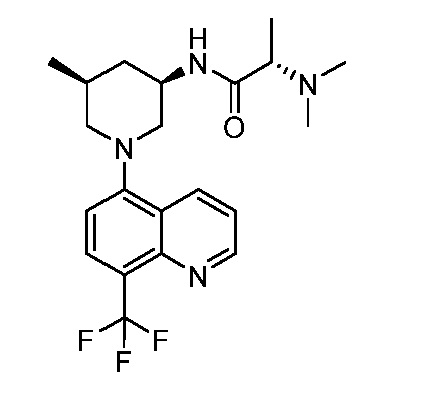
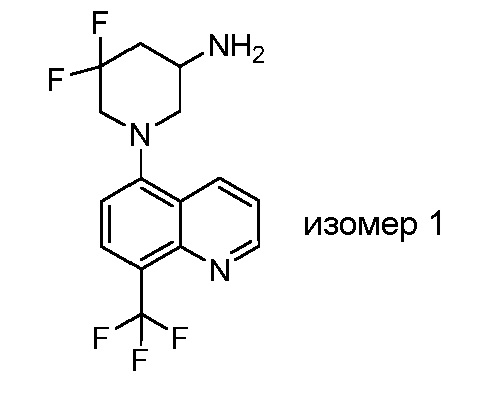
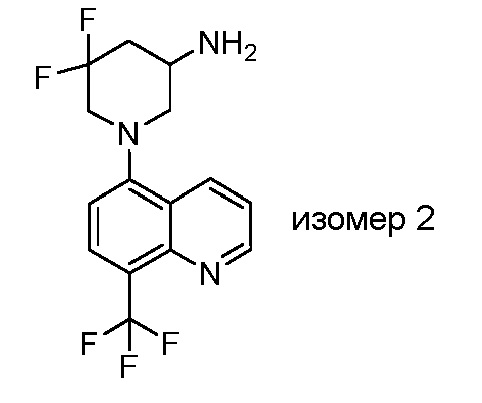
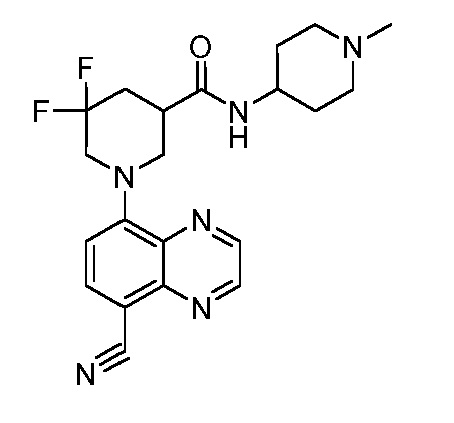
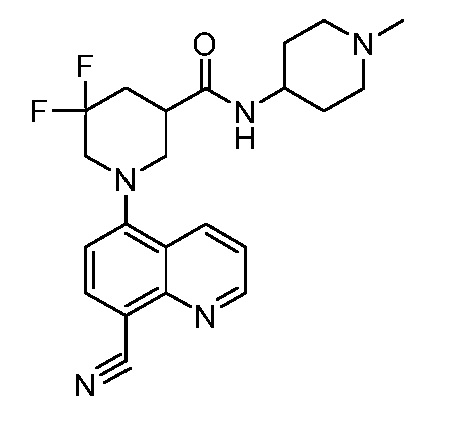
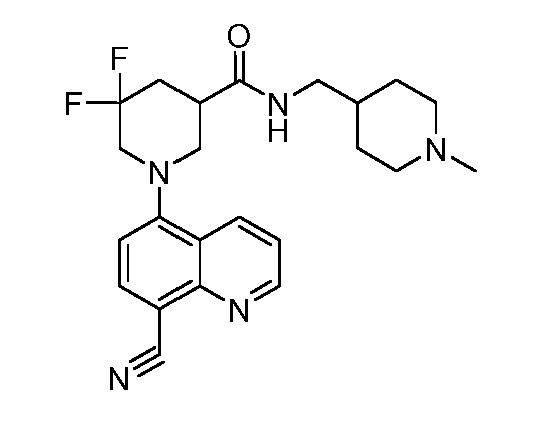
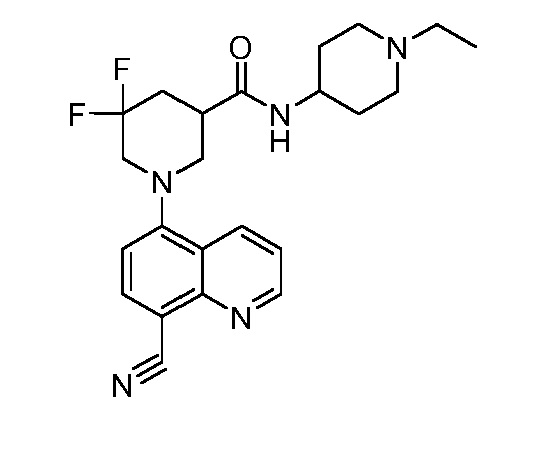
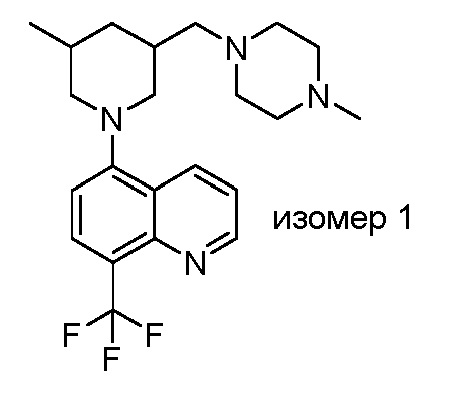
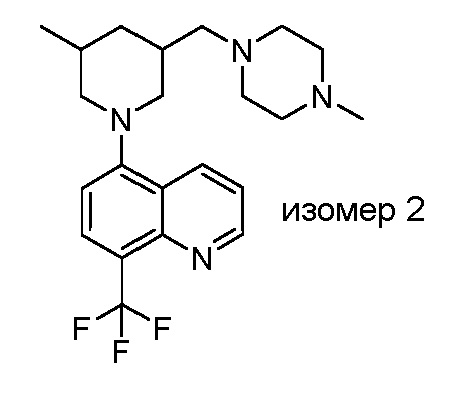
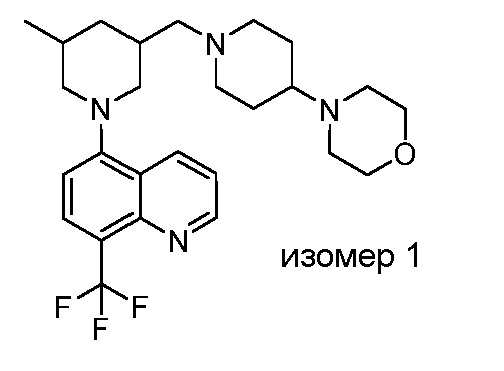
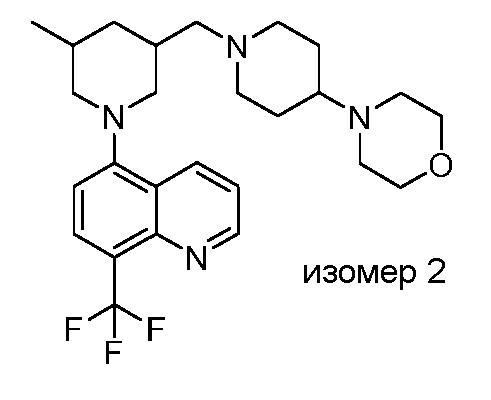
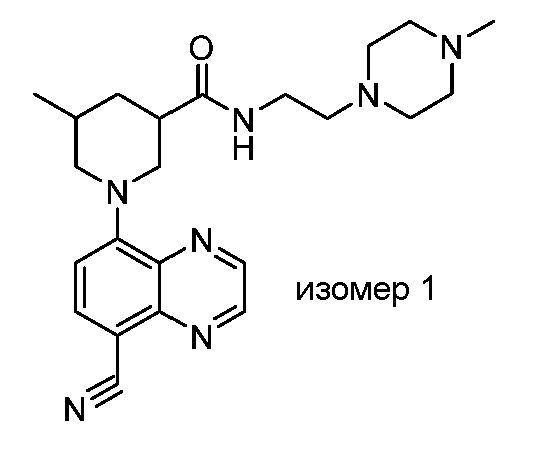
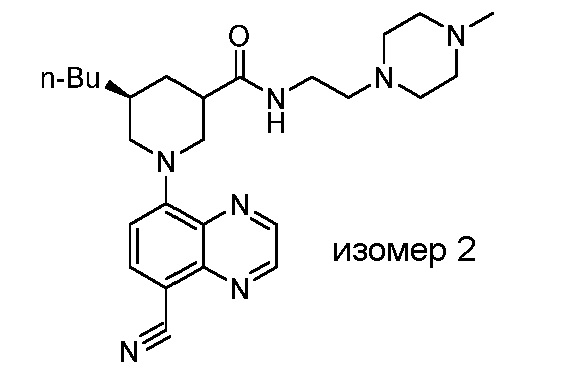
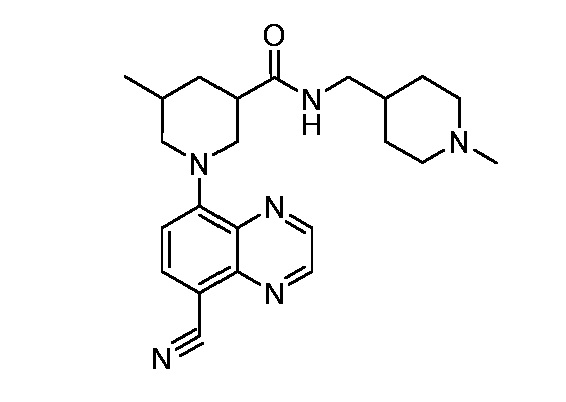
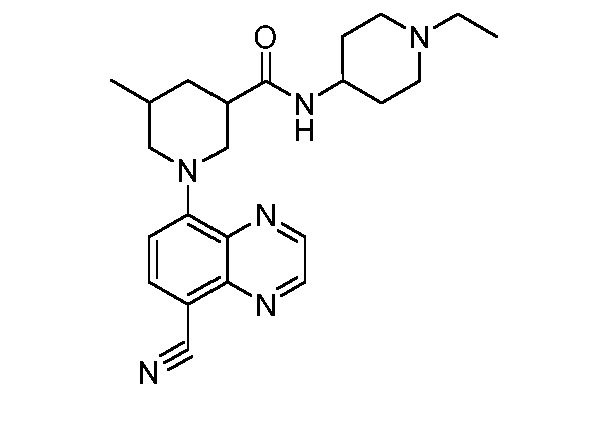
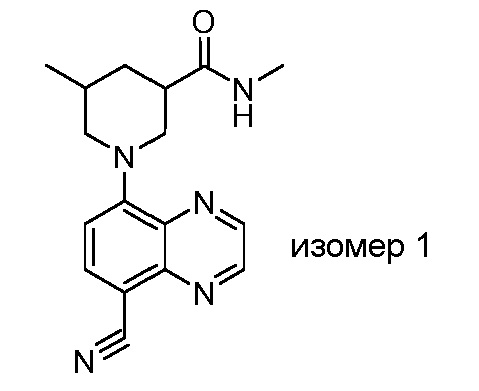
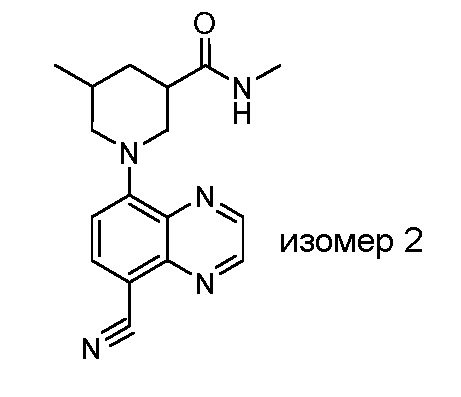
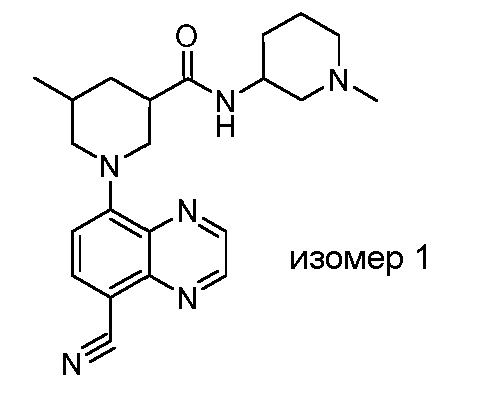
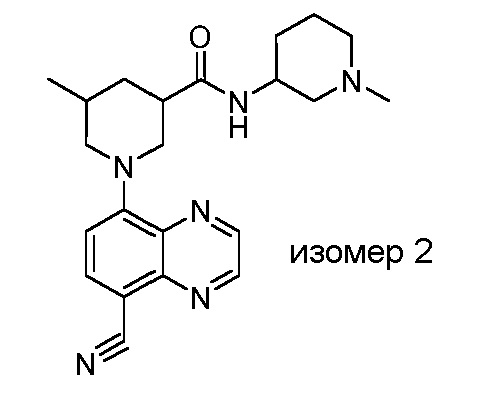
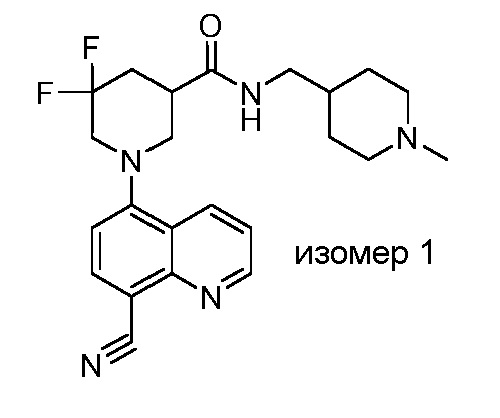
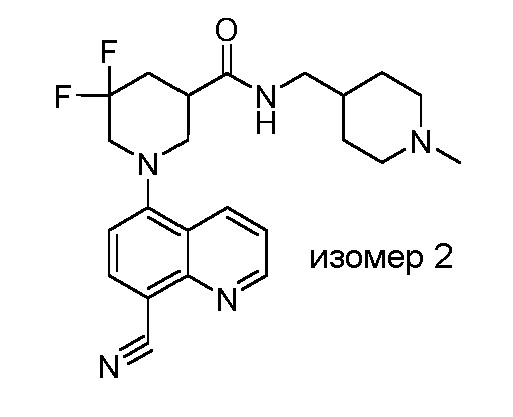
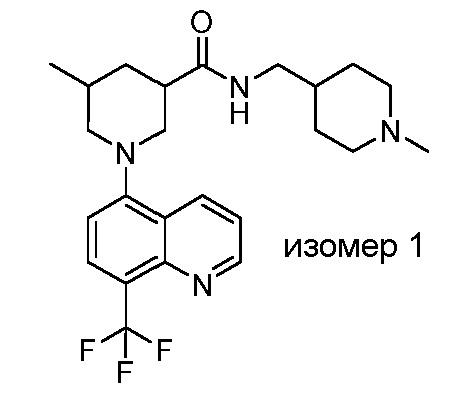
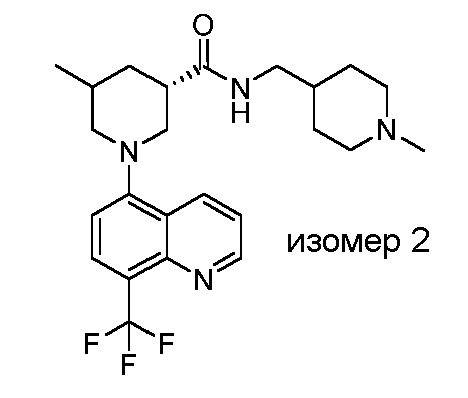
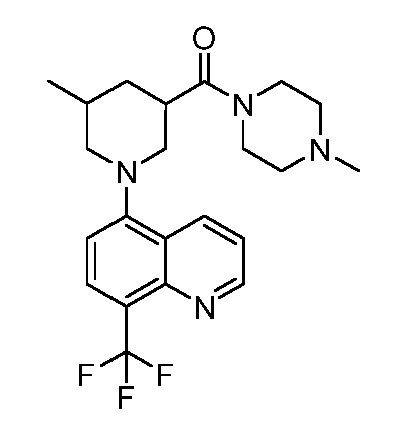
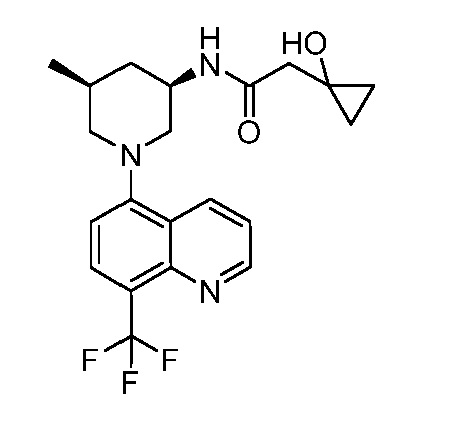
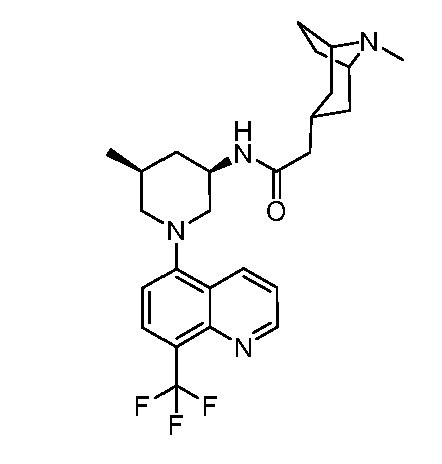
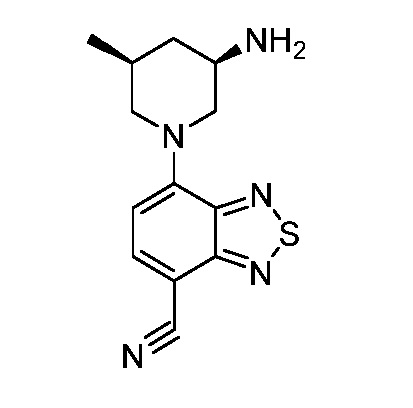
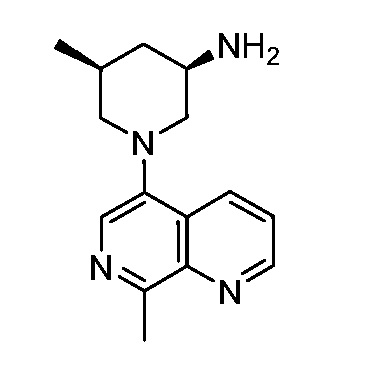
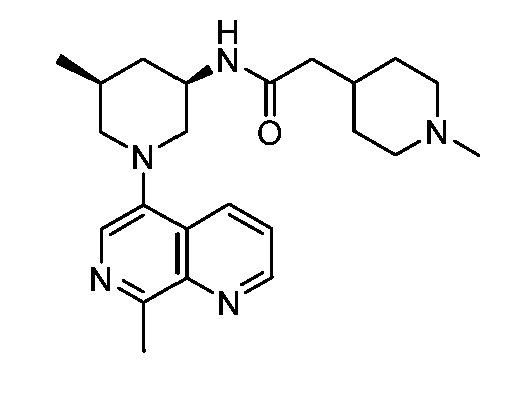
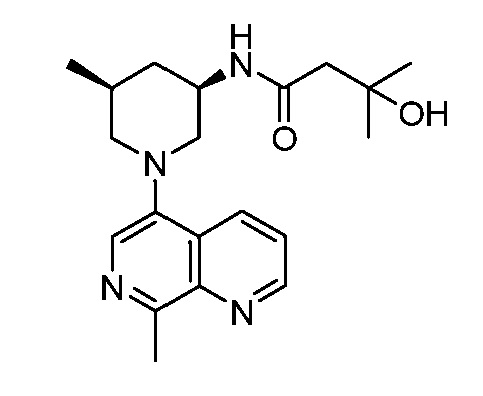
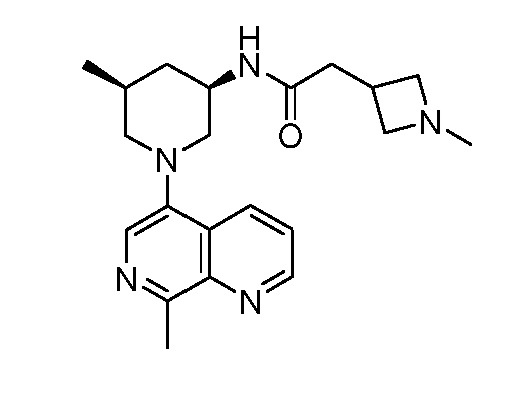
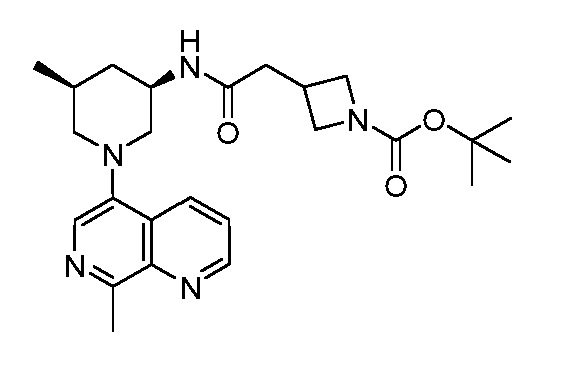
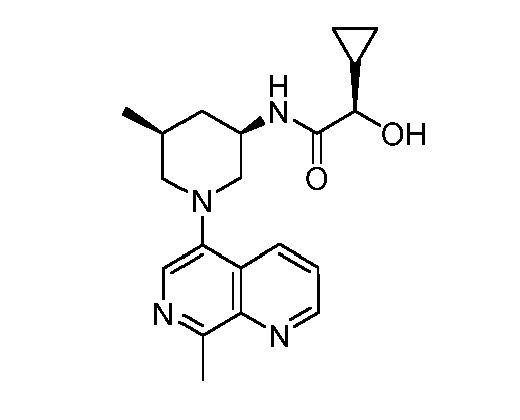
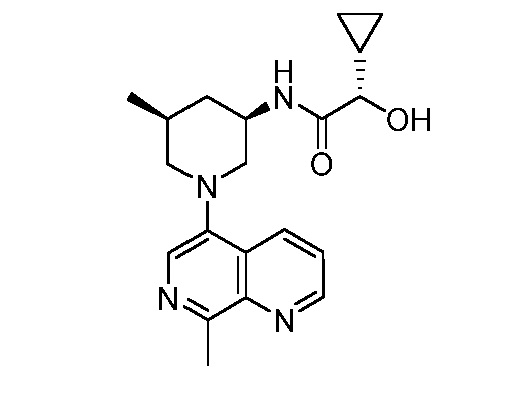
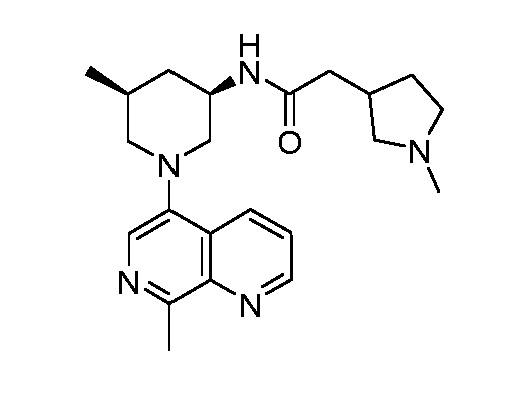
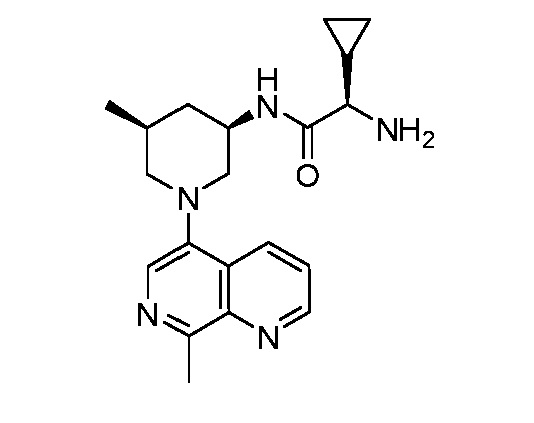
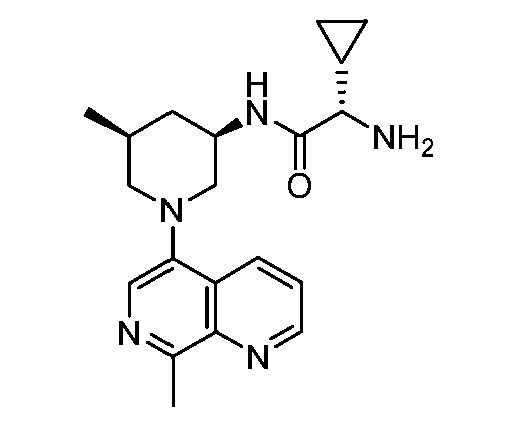
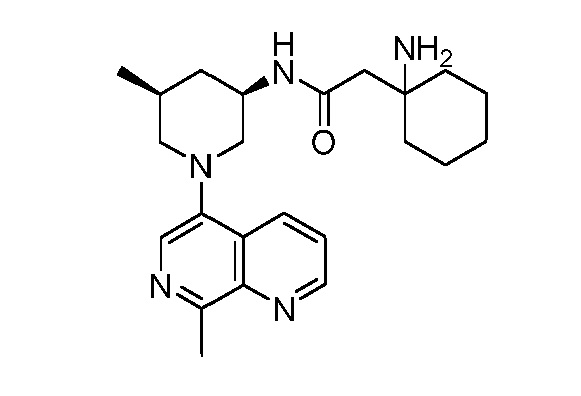
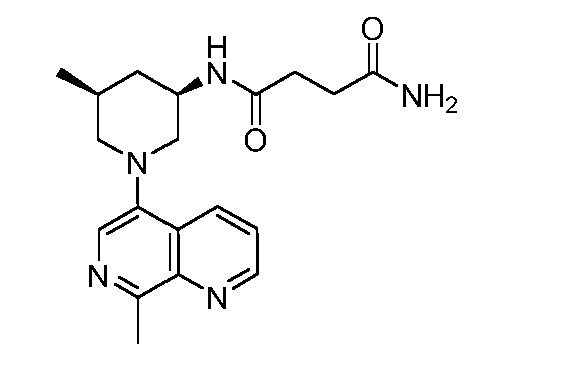
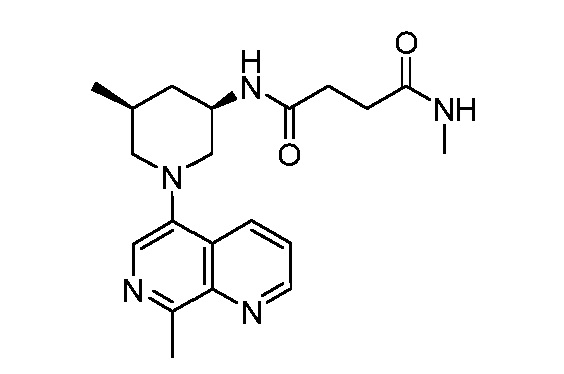
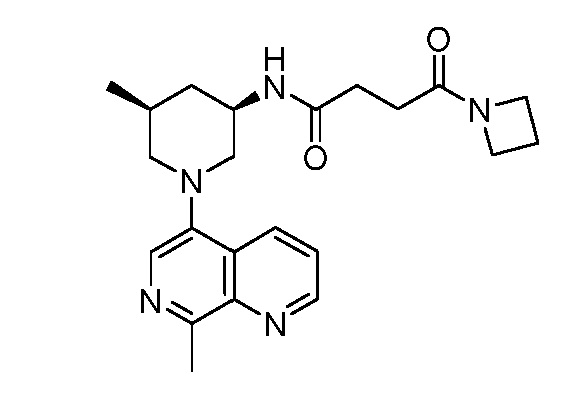
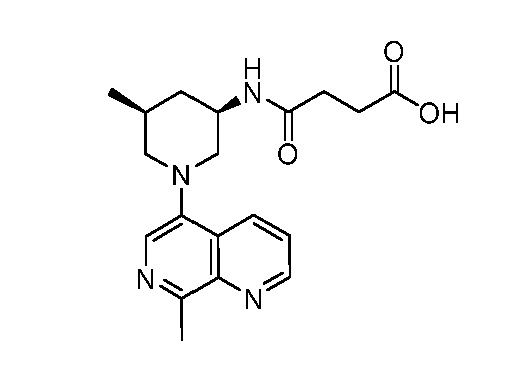
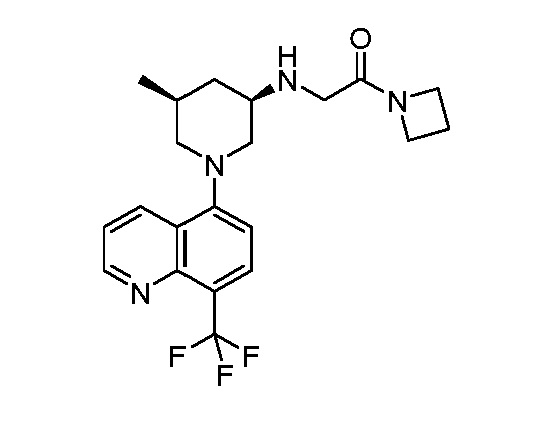
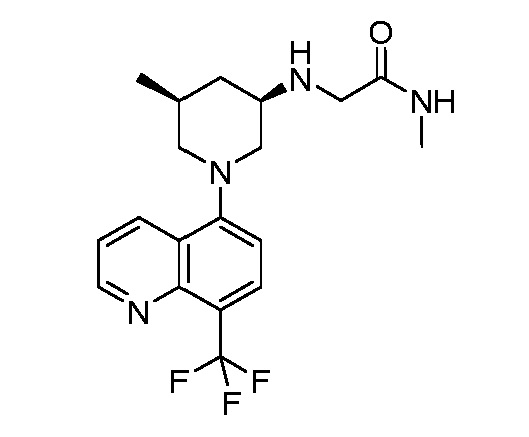
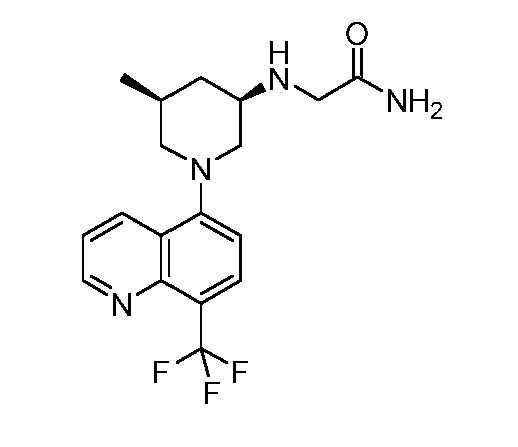
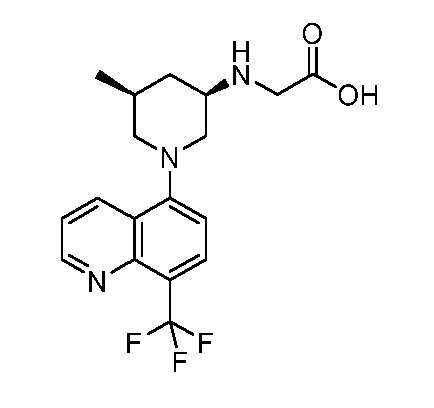
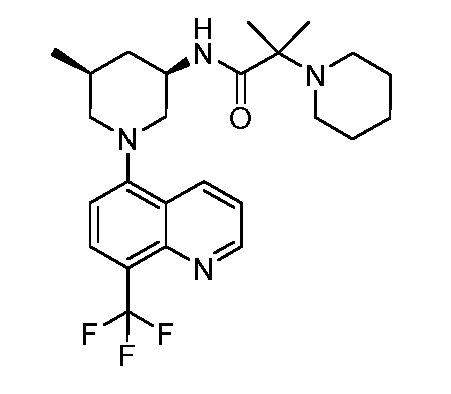
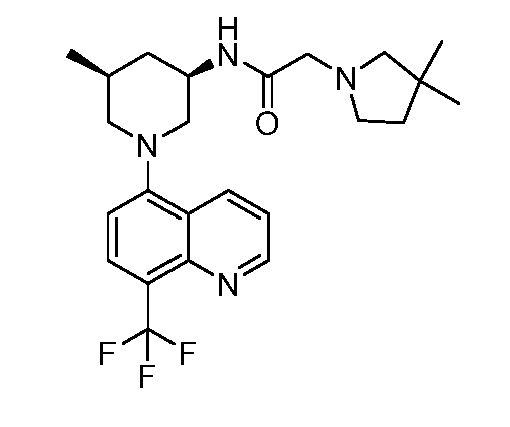
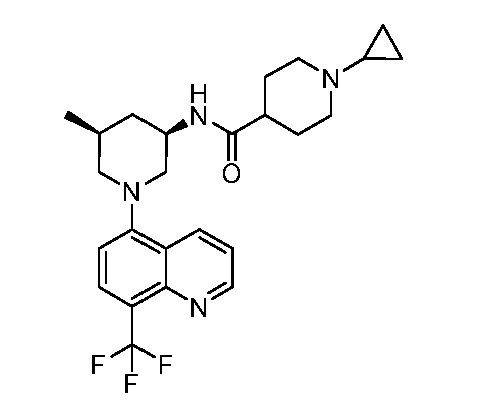
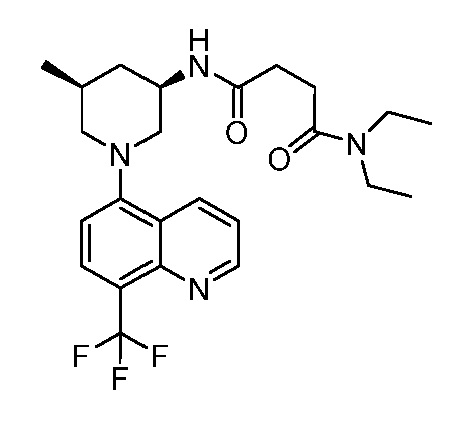
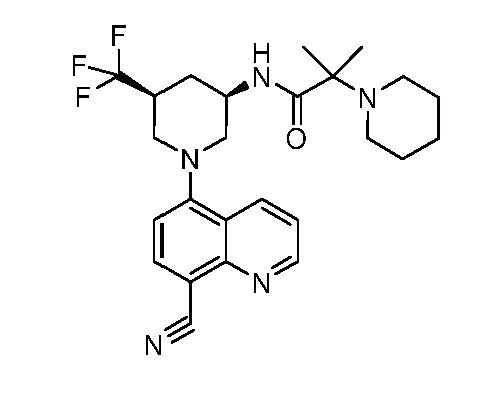
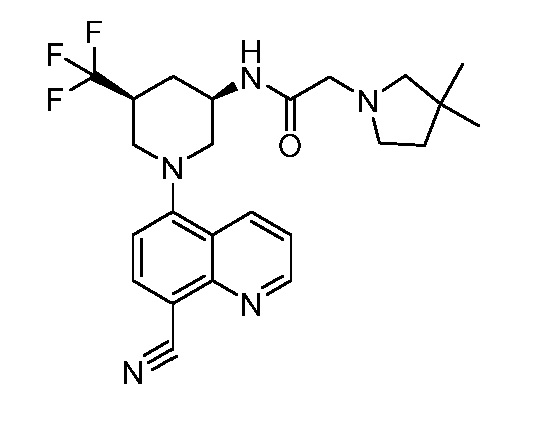
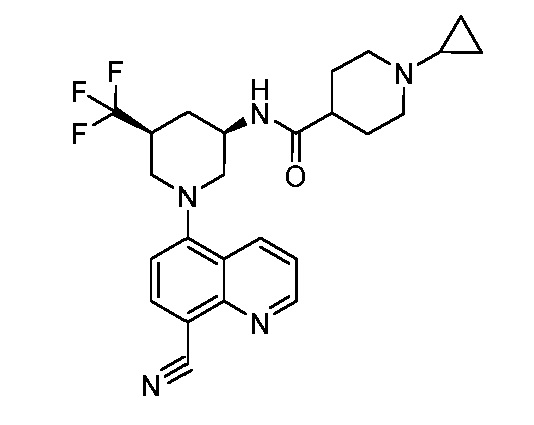
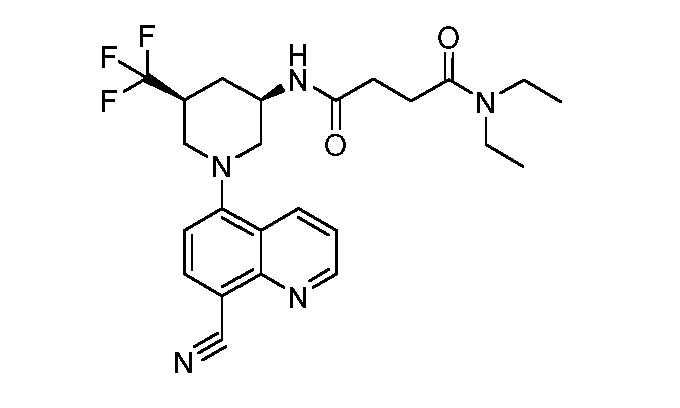
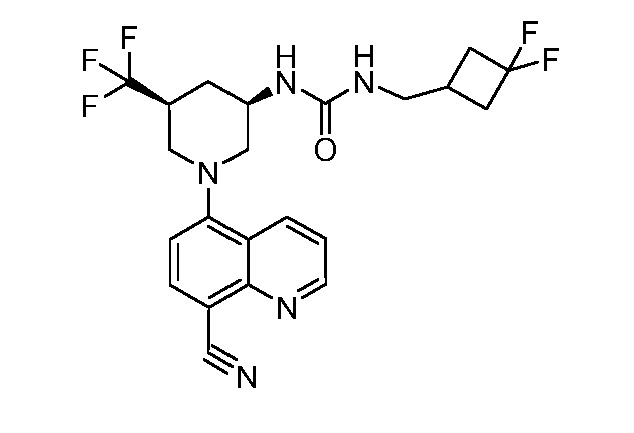
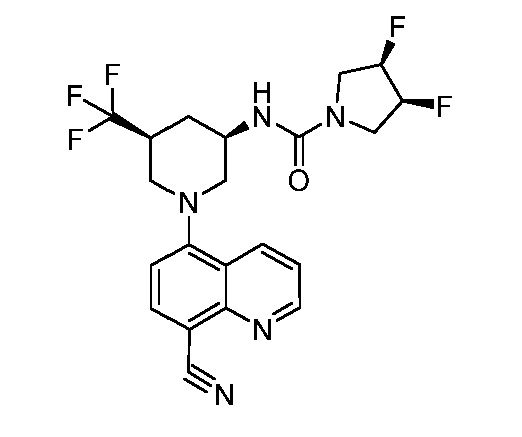
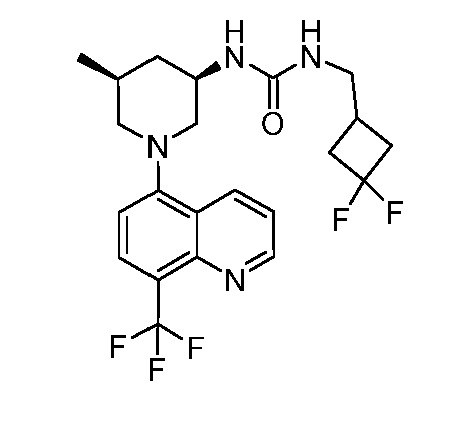
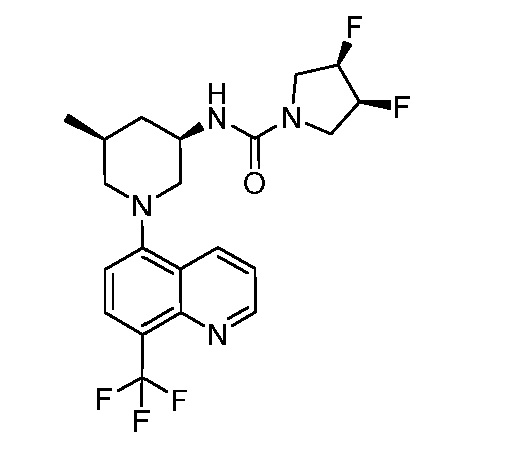
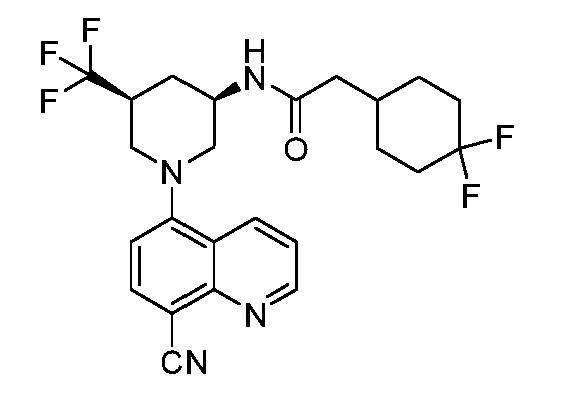
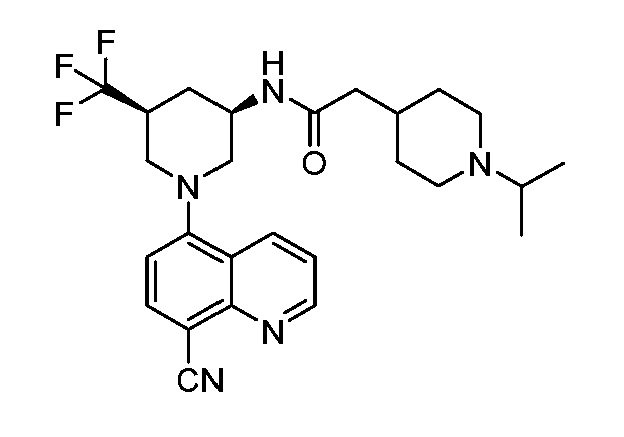
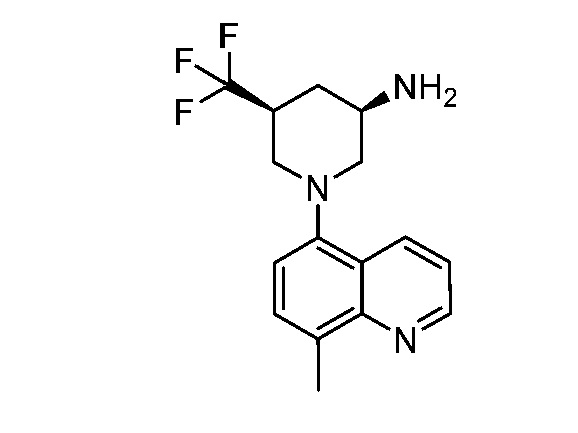
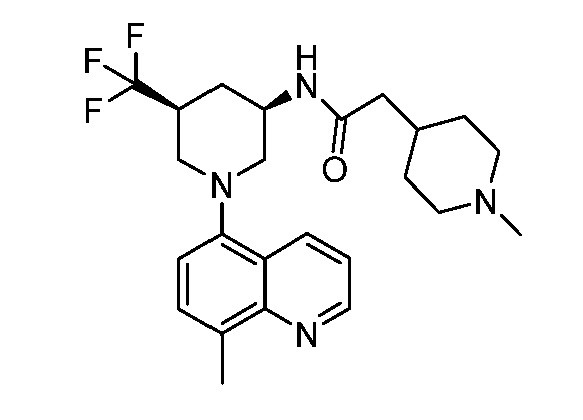
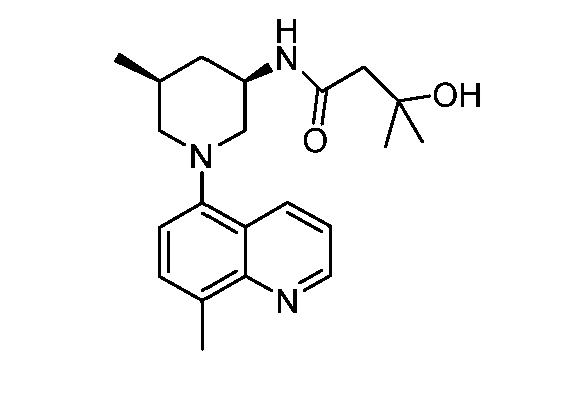
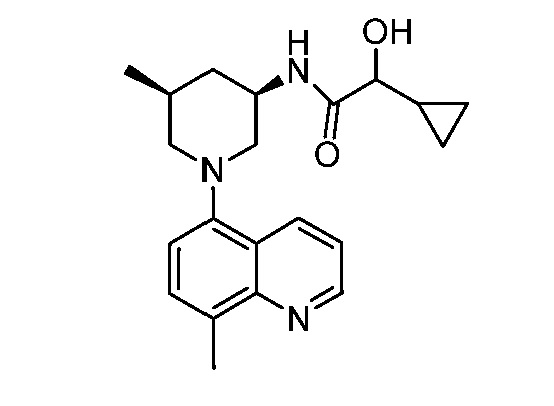
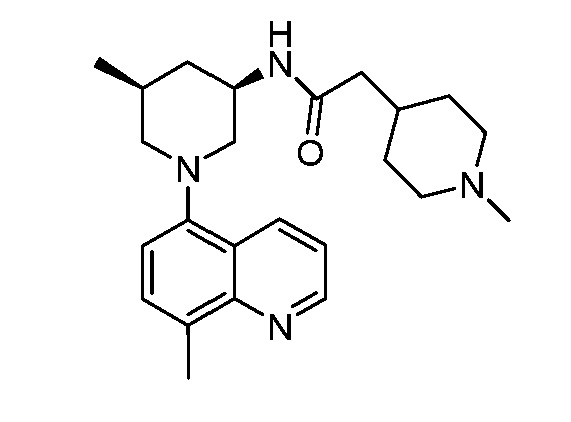
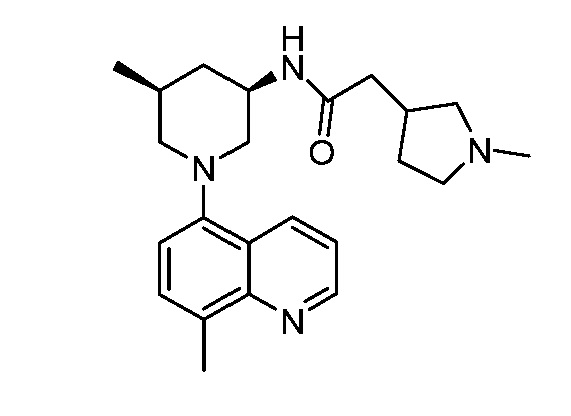
В некоторых вариантах осуществления настоящее изобретение обеспечивает соединение, выбранное из соединений, описанных выше, или его фармацевтически приемлемую соль.
Различные структурные изображения могут показывать гетероатом без присоединенной группы, радикала, заряда или противоиона. Специалистам в данной области понятно, что такие изображения предполагают, что этот гетероатом связан с водородом (например, 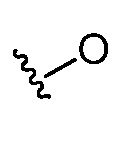 подразумевает
подразумевает 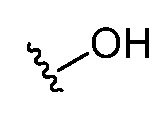 ).
).
В некоторых вариантах осуществления соединения по изобретению синтезировали в соответствии со схемами, представленными в Примерах ниже.
4. Применения, формулирование и введение
Фармацевтически приемлемые композиции
В соответствии с другим вариантом осуществления, изобретение относится к композиции, включающей соединение по настоящему изобретению или его фармацевтически приемлемое производное и фармацевтически приемлемый носитель, адъювант или наполнитель. Количество соединения в композициях по настоящему изобретению является таким, которое эффективно для измеряемого ингибирования TLR7/8 или его мутанта в биологическом образце или у пациента. В некоторых вариантах осуществления количество соединения в композициях по настоящему изобретению является таким, которое эффективно для измеряемого ингибирования TLR7/8 или его мутанта в биологическом образце или у пациента. В некоторых вариантах осуществления композиция по настоящему изобретению сформулирована для введения пациенту, нуждающемуся в такой композиции.
Термин “пациент” или “субъект”, в контексте настоящей заявки, означает животное, предпочтительно млекопитающее и наиболее предпочтительно человека.
Термин “фармацевтически приемлемый носитель, адъювант или наполнитель” относится к нетоксичному носителю, адъюванту или наполнителю, который не разрушает фармакологическую активность соединения, с которым он сформулирован. Фармацевтически приемлемые носители, адъюванты или наполнители, которые используют в композициях по настоящему изобретению, включают, но не ограничиваются этим, ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, динатрий гидрофосфат, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий карбоксиметилцеллюлозу, полиакрилаты, воски, полиэтилен-полиоксипропиленовые блок-полимеры, полиэтиленгликоль и ланолин.
“Фармацевтически приемлемое производное” означает любую нетоксичную соль, сложный эфир, соль сложного эфира или другое производное соединения по настоящему изобретению, которое при введении реципиенту может обеспечить, непосредственно или опосредованно, соединение по настоящему изобретению или его ингибиторно активный метаболит или остаток.
Композиции по настоящему изобретению вводят перорально, парентерально, путем ингаляционного спрея, местно, ректально, назально, буккально, вагинально или через имплантированный резервуар. Термин “парентеральный” в контексте настоящей заявки включает подкожную, внутривенную, внутримышечную, интраартикулярную, интрасиновиальную, интрастернальную, интратекальную, внутрипеченочную, внутриочаговую и интракраниальную инъекцию или методы инфузии. Предпочтительно композиции вводят перорально, внутрибрюшинно или внутривенно. Стерильные инъекционные формы композиций по настоящему изобретению включают водную или масляную суспензию. Эти суспензии формулируют в соответствии с методами, известными в данной области, с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих веществ. Стерильный препарат для инъекций может также представлять собой стерильный раствор или суспензию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые используются, можно указать воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используют в качестве растворителя или суспендирующей среды.
Для этой цели любое используемое мягкое нелетучее масло включает синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, пригодны для получения инъекционных материалов, а также природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных формах. Эти масляные растворы или суспензии также содержат длинноцепочечный спиртовой разбавитель или диспергатор, такой как карбоксиметилцеллюлоза или аналогичные диспергирующие вещества, которые обычно используют для формулирования фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Другие широко используемые поверхностно-активные вещества, такие как Tweens, Spans и другие эмульгаторы или усилители биодоступности, которые обычно используются при получении фармацевтически приемлемых твердых, жидких или других лекарственных форм, также используют для целей формулирования.
Фармацевтически приемлемые композиции по настоящему изобретению вводят перорально в любой приемлемой для перорального применения лекарственной форме. Примерами пероральных лекарственных форм являются капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения обычно используемые носители включают лактозу и кукурузный крахмал. Также обычно добавляют смазывающие вещества, такие как стеарат магния. Для перорального введения в форме капсулы полезные разбавители включают лактозу и сухой кукурузный крахмал. Когда требуются водные суспензии для перорального применения, активный ингредиент объединяют с эмульгаторами и суспендирующими веществами. Если желательно, необязательно также добавляют некоторые подсластители, отдушки или красители.
Альтернативно, фармацевтически приемлемые композиции по настоящему изобретению вводят в форме суппозиториев для ректального введения. Их можно получить путем смешивания средства с подходящим нераздражающим эксципиентом, который является твердым при комнатной температуре, но жидким при ректальной температуре и, следовательно, плавится в прямой кишке с высвобождением лекарственного средства. Такие вещества включают масло какао, пчелиный воск и полиэтиленгликоли.
Фармацевтически приемлемые композиции по настоящему изобретению также вводят местно, особенно когда мишень лечения включает области или органы, легко доступные посредством местного применения, включая заболевания глаз, кожи или нижнего отдела кишечного тракта. Подходящие композиции для местного введения легко получают для каждой из этих областей или органов.
Местное применение для нижнего отдела кишечного тракта можно осуществить с использованием формы ректального суппозитория (см. выше) или подходящей композиции для клизмы. Также используют применяемые местно трансдермальные пластыри.
Для местных применений представленные фармацевтически приемлемые композиции формулируют в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или нескольких носителях. Примеры носителей для местного введения соединений включают минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропиленовое соединение, эмульгирующий воск и воду. Альтернативно, представленные фармацевтически приемлемые композиции можно сформулировать в виде подходящего лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или нескольких фармацевтически приемлемых носителях. Подходящие носители включают, но не ограничиваются этим, минеральное масло, сорбитан моностеарат, полисорбат 60, воск цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
Фармацевтически приемлемые композиции по настоящему изобретению необязательно вводят посредством назального аэрозоля или ингаляции. Такие композиции получают в соответствии со способами, хорошо известными в области фармацевтического формулирования, и получают в виде растворов в физиологическом солевом растворе с использованием бензилового спирта или других подходящих консервантов, промоторов абсорбции для повышения биодоступности, фторуглеродов и/или других обычных солюбилизирующих или диспергирующих веществ.
Наиболее предпочтительно, фармацевтически приемлемые композиции по настоящему изобретению формулируют для перорального введения. Такие препараты можно вводить с пищей или без нее. В некоторых вариантах осуществления фармацевтически приемлемые композиции по настоящему изобретению вводят без пищи. В других вариантах осуществления фармацевтически приемлемые композиции по настоящему изобретению вводят с пищей.
Количество соединений по настоящему изобретению, которые необязательно объединяют с материалами-носителями для получения композиции в разовой лекарственной форме, будут варьироваться в зависимости от хозяина, которого лечат, конкретного способа введения. Предпочтительно представленные композиции должны быть сформулированы так, чтобы пациенту, получающему эти композиции, можно было вводить дозу от 0,01 до 100 мг/кг массы тела в день.
Также должно быть понятно, что конкретная дозировка и режим лечения для любого конкретного пациента будут зависеть от множества факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, время введения, скорость экскреции, комбинации лекарственных средств и суждение лечащего врача и тяжесть конкретного заболевания, подлежащего лечению. Количество соединения по настоящему изобретению в композиции также будет зависеть от конкретного соединения в композиции.
Применение соединений и фармацевтически приемлемых композиций
Настоящее изобретение также относится к способу лечения субъекта, страдающего связанным с TLR7/8 расстройством, включающему введение указанному субъекту эффективного количества соединения формулы I и родственных формул.
Соединения по настоящему изобретению являются полезными в качестве противораковых средств для лечения рака, который реагирует на активацию TLR7. В некоторых вариантах осуществления рак включает, но не ограничивается этим, рак молочной железы, мочевого пузыря, кости, головного мозга, центральной и периферической нервной системы, толстой кишки, эндокринных желез, пищевода, эндометрия, зародышевых клеток, головы и шеи, почек, печени, легких, гортани и гипофаринкса, мезотелиому, саркому, яичников, поджелудочной железы, предстательной железы, прямой кишки, почек, тонкой кишки, мягких тканей, мужских половых желез, желудка, кожи, мочеточника, влагалища и вульвы; наследственные раковые заболевания, ретинобластому и опухоль Вильмса; лейкоз, лимфому, не-ходжкинскую болезнь, хронический и острый миелоидный лейкоз, острый лимфобластный лейкоз, болезнь Ходжкина, множественную миелому и Т-клеточную лимфому; миелодиспластический синдром, плазмаклеточную неоплазию, паранеопластические синдромы, рак неизвестной первичной локализации и злокачественные новообразования, связанные со СПИДом.
В некоторых вариантах осуществления соединения по изобретению используют для лечения рака кожи или почек. Чувствительность данного рака к активации TLR7 можно оценить, но не ограничиваясь этим, путем измерения снижения первичной или метастатической опухолевой нагрузки (незначительная, частичная или полная регрессия), изменений в гемограмме, изменений концентраций гормонов или цитокинов в крови, ингибирования дальнейшего увеличения опухолевой нагрузки, стабилизации заболевания у пациента, путем оценки биомаркеров или суррогатных маркеров, имеющих отношение к заболеванию, по пролонгированию общего выживания пациента, пролонгированию периода до прогрессирования заболевания у пациента, пролонгированию периода выживания пациента без прогрессирования заболевания, пролонгированию периода выживания пациента без заболевания, улучшению качества жизни пациента или модуляции сопутствующего болезненного состояния (например, но не ограничиваясь этим, боль, кахексия, мобилизация, госпитализация, измененная гемограмма, потеря массы тела, заживление ран, лихорадка).
Соединения в соответствии с настоящим изобретением могут быть также полезны в качестве модификаторов иммунного ответа, которые могут модулировать иммунный ответ множеством различных способов, что делает их полезными для лечения различных расстройств.
В настоящей заявке представлены способы ингибирования иммунного ответа у индивидуума, включающие введение индивидууму эффективного количества ингибитора TLR7 и/или TLR8 (например, ингибитора TLR), с использованием соединений, описанных в настоящей заявке. В некоторых вариантах ингибитор TLR ингибирует TLR7-зависимый иммунный ответ. В некоторых вариантах ингибитор TLR ингибирует TLR8-зависимый иммунный ответ. В некоторых вариантах ингибитор TLR ингибирует TLR7-зависимый и TLR8-зависимый иммунный ответ. В некоторых вариантах ингибитор TLR ингибирует TLR7-зависимый, TLR8-зависимый и другой TLR-зависимый иммунный ответ. Если не указано иное, термин ингибитор TLR относится к любому из ингибиторов TLR, раскрытых в настоящей заявке. В некоторых предпочтительных вариантах осуществления индивидуум представляет собой пациента, такого как человек.
Способы иммунорегуляции представлены в настоящем раскрытии и включают такие, которые подавляют и/или ингибируют иммунный ответ, включая, но не ограничиваясь этим, иммунный ответ. Настоящее раскрытие также представляет способы улучшения симптомов, связанных с нежелательной иммунной активацией, включающих, но не ограничивающихся этим, симптомы, связанные с аутоиммунностью. Иммунное подавление и/или ингибирование в соответствии со способами, описанными в настоящей заявке, можно практиковать на субъектах, в том числе страдающих расстройством, связанным с нежелательной активацией иммунного ответа. Настоящее раскрытие также представляет способы ингибирования TLR7 и/или TLR8-индуцированного ответа (например, in vitro или in vivo). В некоторых вариантах осуществляют контактирование клетки с ингибитором TLR в количестве, эффективном для ингибирования ответа от клетки, которая способствует иммунному ответу.
Ингибирование TLR7 и/или TLR8 полезно для лечения и/или профилактики различных заболеваний или расстройств, которые реагируют на цитокины. Состояния, для лечения которых можно использовать ингибиторы TLR7 и/или TLR8, включают, но не ограничиваются этим, аутоиммунные заболевания и воспалительные расстройства. Представленные в настоящей заявке способы лечения или профилактики заболевания или расстройства у индивидуума включают введение индивидууму эффективного количества ингибитора TLR7 и/или TLR8. Кроме того, представлены способы облегчения симптомов, связанных с заболеванием или расстройством, включающие введение эффективного количества ингибитора TLR7 и/или TLR8 индивидууму, имеющему заболевание или расстройство. Также в настоящей заявке представлены способы для предотвращения или замедления развития заболевания или расстройства, включающие введение эффективного количества ингибитора одного или нескольких TLR7 и/или TLR8 индивидууму, имеющему заболевание или расстройство. В некоторых вариантах осуществления ингибитор представляет собой соединение, описанное в настоящей заявке.
В настоящей заявке представлены способы ингибирования иммунного ответа у индивидуума, включающие введение индивидууму по меньшей мере одного ингибитора TLR, раскрытого в настоящей заявке, в количестве, эффективном для ингибирования иммунного ответа у индивидуума. В некоторых вариантах иммунный ответ ассоциирован с аутоиммунным заболеванием. В других аспектах ингибирование иммунного ответа представляет собой улучшение одного или нескольких симптомов аутоиммунного заболевания. В других аспектах ингибирование иммунного ответа отличается тем, что лечит аутоиммунное заболевание. В еще некоторых аспектах ингибирование иммунного ответа отличается тем, что предотвращает или задерживает развитие аутоиммунного заболевания. В некоторых вариантах ингибитор TLR ингибирует TLR7-зависимый иммунный ответ. В некоторых вариантах ингибитор TLR ингибирует TLR8-зависимый иммунный ответ. В некоторых вариантах ингибитор TLR ингибирует TLR7-зависимый и TLR8-зависимый иммунный ответ. В некоторых аспектах по меньшей мере один ингибитор TLR вводят в количестве, эффективном для ингибирования иммунного ответа у индивидуума.
В настоящей заявке также представлены способы лечения или профилактики аутоиммунного заболевания у индивидуума, включающие введение индивидууму эффективного количества ингибитора TLR7 и/или TLR8. В некоторых аспектах аутоиммунное заболевание характеризуется болью в суставах, позитивностью к антинуклеарным антителам, малярной сыпью или дисковидной сыпью. В некоторых аспектах аутоиммунное заболевание связано с кожей, мышечной тканью и/или соединительной тканью. В некоторых вариантах осуществления у индивидуума отсутствуют симптомы аутоиммунного заболевания на коже, в мышечной ткани и/или соединительной ткани. В некоторых вариантах осуществления аутоиммунное заболевание является системным. Аутоиммунные заболевания включают, без ограничения, ревматоидный артрит (RA), аутоиммунный панкреатит (AIP), системную красную волчанку (SLE), сахарный диабет I типа, рассеянный склероз (MS), антифосфолипидный синдром (APS), склерозирующий холангит, системный артрит, воспалительное заболевание кишечника (IBD), склеродермию, болезнь Шегрена, витилиго, полимиозит, обыкновенную пузырчатку, листовидную пузырчатку, воспалительное заболевание кишечника, включая болезнь Крона и язвенный колит, аутоиммунный гепатит, гипопитуитаризм, болезнь трансплантат- против-хозяина (GvHD), аутоиммунные кожные заболевания, увеит, пернициозную анемию и гипопаратиреоз. Аутоиммунные заболевания также могут включать, без ограничения, полиангиитный перекрестный синдром, болезнь Кавасаки, саркоидоз, гломерулонефрит и криопатии.
В некоторых аспектах аутоиммунное заболевание выбрано из группы, состоящей из артрита, панкреатита, смешанного заболевания соединительной ткани (MCTD), волчанки, антифосфолипидного синдрома (APS), системного артрита и синдрома раздраженной толстой кишки.
В других аспектах аутоиммунное заболевание выбрано из группы, состоящей из системной красной волчанки (SLE), ревматоидного артрита, аутоиммунного кожного заболевания и рассеянного склероза.
В других аспектах аутоиммунное заболевание выбрано из группы, состоящей из панкреатита, гломерулонефрита, пиелита, склерозирующего холангита и диабета I типа. В некоторых аспектах аутоиммунное заболевание представляет собой ревматоидный артрит. В некоторых аспектах аутоиммунное заболевание представляет собой аутоиммунный панкреатит (AIP). В некоторых аспектах аутоиммунное заболевание представляет собой гломерулонефрит. В некоторых аспектах аутоиммунное заболевание представляет собой пиелит. В некоторых аспектах аутоиммунное заболевание представляет собой склерозирующий холангит. В некоторых аспектах аутоиммунное расстройство представляет собой псориаз. В некоторых аспектах аутоиммунное заболевание представляет собой ревматоидное заболевание или расстройство. В некоторых аспектах ревматоидное заболевание или расстройство представляет собой ревматоидный артрит. В некоторых аспектах заболевание представляет собой диабет и/или диабетическое заболевание или расстройство. В некоторых аспектах аутоиммунное заболевание отличается тем, что связано с РНК-содержащими иммунными комплексами. В некоторых аспектах аутоиммунное заболевание представляет собой болезнь Шегрена.
В настоящей заявке представлены способы ингибирования иммунного ответа у индивидуума, которые включают введение индивидууму по меньшей мере одного ингибитора TLR, раскрытого в настоящей заявке, в количестве, эффективном для ингибирования иммунного ответа у индивидуума. В некоторых вариантах иммунный ответ ассоциирован с воспалительным расстройством. Используемый в настоящей заявке термин “воспалительное расстройство” охватывает аутоиммунные заболевания, а также воспалительные состояния без известного аутоиммунного компонента (например, артеросклероз, астма и т.д.). В других аспектах ингибирование иммунного ответа улучшает один или несколько симптомов воспалительного заболевания. В еще одном аспекте ингибирование иммунного ответа лечит воспалительное расстройство. В еще некоторых аспектах ингибирование иммунного ответа предотвращает или задерживает развитие воспалительного расстройства. В некоторых аспектах воспалительное заболевание выбрано из группы, состоящей из не-ревматоидного артрита, фиброза почек и фиброза печени. В некоторых аспектах воспалительное заболевание представляет собой краевой дерматит. В некоторых других аспектах краевой дерматит выбирают из группы, состоящей из красного плоского лишая, лихеноидного дерматоза, плоский лишай-подобного кератоза, линейного лихена, хронического лихеноидного кератоза, мультиформной эритемы, сегментарной медикаментозной сыпи, лихеноидного парапсориаза, фототоксического дерматита, радиационного дерматита, вирусных экзантем, дерматомиозита, вторичного сифилиса, склероатрофического лихена, грибковых микозов, буллезного пемфигоида, золотистого лишая, порокератоза, хронического атрофического акродерматита и регрессирующей меланомы. В некоторых аспектах воспалительное заболевание представляет собой кожное заболевание, такое как атопический дерматит (экзема). В некоторых аспектах воспалительное заболевание представляет собой стерильное воспалительное заболевание, такое как лекарственно-индуцированное воспаление печени и/или поджелудочной железы. В некоторых других аспектах воспалительное заболевание представляет собой воспалительное заболевание печени. В некоторых других аспектах воспалительное заболевание представляет собой воспалительное заболевание поджелудочной железы.
В настоящей заявке представлены способы ингибирования иммунного ответа у индивидуума, которые включают введение индивидууму по меньшей мере одного ингибитора TLR, раскрытого в настоящей заявке, в количестве, эффективном для ингибирования иммунного ответа у индивидуума. В некоторых вариантах иммунный ответ ассоциирован с хронической патогенной стимуляцией. В некоторых вариантах иммунный ответ связан с инфекцией ВИЧ. В других аспектах ингибирование иммунного ответа отличается тем, что улучшает один или несколько симптомов вирусного заболевания или расстройства, вызванного заражением ВИЧ. В других аспектах ингибирование иммунного ответа отличается тем, что лечит вирусное заболевание или расстройство, вызванное ВИЧ-инфекцией. В еще нескольких аспектах ингибирование иммунного ответа отличается тем, что предотвращает или задерживает развитие вирусного заболевания или расстройства, вызванного ВИЧ инфекцией. Другие варианты, представленные в настоящей заявке, относятся к иммуноингибиторной терапии субъектов, подвергшихся воздействию или инфицированных ВИЧ. Введение ингибитора TLR индивидууму, подвергшемуся воздействию или инфицированному ВИЧ, приводит к подавлению ВИЧ-индуцированной продукции цитокинов. В некоторых аспектах по меньшей мере один ингибитор TLR вводят в количестве, эффективном для подавления ВИЧ-индуцированной продукции цитокинов у индивидуума, подвергавшегося или инфицированного ВИЧ.
В настоящей заявке представлены способы ингибирования TLR7- и/или TLR8-зависимого иммунного ответа у индивидуума, которые включают введение индивидууму ингибитора TLR в количестве, эффективном для ингибирования иммунного ответа у индивидуума. В некоторых вариантах иммунный ответ ассоциирован с аутоиммунным заболеванием. В некоторых аспектах аутоиммунное заболевание представляет собой ревматоидный артрит. В некоторых аспектах ингибитор TLR эффективен для подавления одного или нескольких симптомов ревматоидного артрита. В некоторых аспектах аутоиммунное заболевание представляет собой рассеянный склероз. В некоторых аспектах ингибитор TLR эффективен для подавления одного или нескольких симптомов рассеянного склероза. В некоторых аспектах аутоиммунное заболевание представляет собой волчанку. В некоторых аспектах ингибитор TLR эффективен для подавления одного или нескольких симптомов волчанки. В некоторых аспектах аутоиммунное заболевание представляет собой панкреатит. В некоторых аспектах ингибитор TLR эффективен для подавления одного или нескольких симптомов панкреатита. В некоторых аспектах аутоиммунное заболевание представляет собой диабет. В некоторых аспектах ингибитор TLR эффективен для подавления одного или нескольких симптомов диабета. В некоторых аспектах заболевание представляет собой болезнь Шегрена. В некоторых аспектах ингибитор TLR эффективен для подавления одного или нескольких симптомов болезни Шегрена. В некоторых вариантах иммунный ответ ассоциирован с воспалительным расстройством. В некоторых аспектах ингибитор TLR эффективен для подавления одного или нескольких симптомов воспалительного расстройства. В некоторых вариантах иммунный ответ связан с хронической патогенной стимуляцией. В некоторых аспектах ингибитор TLR эффективен для подавления одного или нескольких симптомов хронической патогенной стимуляции. В некоторых вариантах иммунный ответ ассоциирован с вирусным заболеванием, вызванным инфекцией ВИЧ. В некоторых аспектах ингибитор TLR эффективен для подавления одного или нескольких симптомов вирусного заболевания, вызванного инфекцией ВИЧ. В любом варианте ингибитор TLR представляет собой полинуклеотид, включающий ингибиторный мотив для одного или нескольких TLR7, TLR8 и TLR9.
В некоторых вариантах осуществления любого из способов, включающих введение ингибитора TLR индивидууму (например, способы ингибирования иммунного ответа, лечения или профилактики аутоиммунного заболевания или воспалительного расстройства и т.д.), ингибитор TLR имеет терапевтически приемлемый профиль безопасности. Ингибитор TLR может, например, иметь терапевтически приемлемый гистологический профиль, включающий приемлемо низкую, если таковая имеется, токсичность печени, почек, поджелудочной железы или других органов. Иногда полинуклеотиды связывают с токсичностью некоторых органов, таких как печень, почки и поджелудочная железа. В некоторых вариантах осуществления ингибитор TLR имеет профиль безопасности, который является неожиданным и выгодным. В некоторых вариантах осуществления профиль безопасности включает оценку токсичности, гистологического профиля и/или некроза (например, печени, почек и/или сердца). В некоторых вариантах осуществления ингибитор TLR имеет терапевтически приемлемый уровень токсичности. В некоторых вариантах осуществления ингибитор TLR имеет пониженный уровень токсичности по сравнению с другим ингибитором TLR. В некоторых вариантах осуществления ингибитор TLR индуцирует терапевтически приемлемое снижение массы тела по сравнению с исходной массой тела принимающего лечение индивидуума. В некоторых вариантах осуществления ингибитор TLR вызывает менее 5%, 7,5%, 10%, 12,5 или 15% снижение общей массы тела. В некоторых вариантах осуществления ингибитор TLR имеет терапевтически приемлемый гистологический профиль. В некоторых вариантах осуществления ингибитор TLR имеет, например, более лучший (например, более низкая оценка тяжести) гистологический профиль по сравнению с эталонным ингибитором TLR. В некоторых вариантах осуществления ингибитор TLR имеет лучший (например, более низкая оценка тяжести) гистологический профиль, например, при оценке печени, почек и/или сердца. В некоторых вариантах осуществления ингибитор TLR имеет терапевтически приемлемый показатель некроза. В некоторых вариантах осуществления ингибитор TLR имеет уменьшенный некроз и/или более лучшую (например, более низкую) оценку некроза, например, по сравнению с эталонным ингибитором TLR. В некоторых вариантах осуществления ингибитор TLR имеет более низкий почечный и/или гепатоцеллюлярный некроз и/или более лучшую оценку почечного и/или гепатоцеллюлярного некроза, например, по сравнению с эталонным ингибитором TLR.
Соответственно, изобретение обеспечивает способ активации TLR7 у животного, в частности, у млекопитающего, предпочтительно человека, включающий введение животному эффективного количества соединения формулы I. Как и для всех композиций для ингибирования иммунного ответа, эффективные количества и способ введения композиции конкретного ингибитора TLR могут варьироваться в зависимости от индивидуума, состояния, подлежащего лечению, и других факторов, очевидных для специалиста в данной области. Эффективное количество соединения будет варьироваться в соответствии с факторами, известными в данной области, но ожидается, что это будет доза около 0,1-10 мг/кг, 0,5-10 мг/кг, 1-10 мг/кг, 0,1-20 мг/кг, 0,1-20 мг/кг или 1-20 мг/кг.
Изобретение также обеспечивает способ лечения вирусной инфекции у животного, включающий введение животному эффективного количества соединения формулы I. Количество, эффективное для лечения или ингибирования вирусной инфекции, представляет собой количество, которое будет вызывать уменьшение одного или нескольких проявлений вирусной инфекции, таких как вирусные поражения, вирусная нагрузка, скорость продукции вируса и смертность по сравнению с необработанными контрольными животными. Точное количество будет варьироваться в зависимости от факторов, известных в данной области, но ожидается, что это будет доза, указанная выше для активации TLR7, или доза от около 100 нг/кг до около 50 мг/кг, предпочтительно от около 10 мкг/кг до 5 мг/кг.
В различных вариантах осуществления соединения формулы (I) и родственных формул демонстрируют IC50 для связывания с TLR7/8 меньше чем около 5 мкМ, предпочтительно меньше чем около 1 мкМ, и еще более предпочтительно меньше чем около 0,100 мкМ.
Способ по изобретению можно осуществить как in vitro, так и in vivo. Восприимчивость конкретной клетки к обработке соединениями согласно изобретению можно, в частности, определить испытаниями in vitro либо в ходе исследований, либо для клинического применения. Обычно культуру клеток объединяют с соединением согласно изобретению в различных концентрациях в течение периода времени, который является достаточным для того, чтобы активные средства ингибировали активность TLR7/8, обычно от около одного часа до одной недели. Обработку in vitro можно осуществить с использованием культивируемых клеток из образца биопсии или клеточной линии.
Хозяин или пациент могут относиться к любому виду млекопитающих, например, такому как приматы, в частности, человек; грызуны, включая мышей, крыс и хомяков; кролики; лошади, коровы, собаки, кошки и т.д. Животные модели представляют интерес для экспериментальных исследований, обеспечивая модель для лечения заболеваний человека.
Для идентификации пути передачи сигнала и для детекции взаимодействий между различными путями передачи сигналов разными учеными были разработали подходящие модели или модельные системы, например, модели клеточных культур и модели трансгенных животных. Для определения определенных стадий каскада сигнальной трансдукции можно использовать взаимодействующие соединения для модуляции сигнала. Соединения согласно изобретению также можно использовать в качестве реагентов для тестирования TLR7/8-зависимых путей передачи сигнала у животных и/или в моделях культивируемых клеток или в клинических заболеваниях, описанных в настоящей заявке.
Кроме того, последующее раскрытие в настоящем описании, касающееся применения соединений формулы (I) и их производных для получения лекарственного средства для профилактического или терапевтического лечения и/или мониторинга, считается действительным и применимым без ограничения к использованию соединения для ингибирования активности TLR7/8, если это целесообразно.
Изобретение также относится к применению соединений формулы (I) и/или их физиологически приемлемых солей для профилактического или терапевтического лечения и/или мониторинга заболеваний, которые вызваны, опосредованы и/или развитие которых связано с активностью TLR7/8. Кроме того, изобретение относится к применению соединений формулы (I) и/или их физиологически приемлемых солей для получения лекарственного средства для профилактического или терапевтического лечения и/или мониторинга заболеваний, которые вызваны, опосредованы и/или развитие которых связано с активностью TLR7/8. В некоторых вариантах осуществления настоящее изобретение относится к применению соединения формулы I или его физиологически приемлемых солей для получения лекарственного средства для профилактического или терапевтического лечения TLR7/8-опосредованного расстройства.
Соединения формулы (I) и/или их физиологически приемлемые соли также можно использовать в качестве промежуточного продукта для получения других активных ингредиентов лекарственных средств. Лекарственное средство предпочтительно получают нехимическим способом, например, путем объединения активного ингредиента по меньшей мере с одним твердым, жидким и/или полужидким носителем или эксципиентом и, необязательно, в сочетании с одним или несколькими другими активными средствами в соответствующей лекарственной форме.
Соединения формулы (I) в соответствии с изобретением можно вводить до или после начала заболевания один или несколько раз в качестве терапии. Вышеуказанные соединения и медицинские продукты по настоящему изобретению особенно используют для терапевтического лечения. Терапевтически значимый эффект облегчает до некоторой степени один или несколько симптомов расстройства или возвращает к нормальному, частично или полностью, один или несколько физиологических или биохимических параметров, ассоциированных с заболеванием или патологическим состоянием или являющихся их причиной. Мониторинг рассматривается как вид лечения при условии, что соединения вводят с определенными интервалами, например, чтобы вызвать ответ и полное устранение патогенов и/или симптомов заболевания. Можно применять либо идентичное соединение, либо разные соединения. Способы по изобретению также можно использовать для снижения вероятности развития расстройства или даже предотвращения начала развития расстройств, связанных с активностью TLR7/8, заранее или для лечения возникающих и сохраняющихся симптомов.
Согласно изобретению, профилактическое лечение целесообразно, если субъект имеет какую-либо предрасположенность к вышеуказанным физиологическим или патологическим состояниям, такую как наследственная предрасположенность, генетический дефект или ранее перенесенное заболевание.
Кроме того, изобретение относится к лекарственному средству, включающему по меньшей мере одно соединение в соответствии с изобретением и/или его фармацевтически приемлемые производные, соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях. В некоторых вариантах осуществления изобретение относится к лекарственному средству, включающему по меньшей мере одно соединение в соответствии с изобретением и/или его физиологически приемлемые соли.
“Лекарственное средство”, по смыслу изобретения, представляет собой любое средство в области медицины, которое включает одно или несколько соединений формулы (I) или их препаратов (например, фармацевтическая композиция или фармацевтический препарат) и может быть использовано для профилактики, лечения, наблюдения или последующего наблюдения пациентов, страдающих заболеваниями, которые связаны с активностью TLR7/8, таким образом, чтобы патогенная модификация их общего состояния или состояния конкретных областей организма могла устанавливаться как минимум, временно.
В различных вариантах осуществления активный ингредиент можно вводить отдельно или в комбинации с другими лечениями. Синергический эффект может быть достигнут при использовании в фармацевтической композиции более чем одного соединения, то есть соединение формулы (I) объединяют, по меньшей мере, с другим средством в качестве активного ингредиента, которое представляет собой либо другое соединение формулы (I), либо соединение с другим структурным каркасом. Активные ингредиенты можно использовать одновременно или последовательно.
Ингибиторы TLR по настоящему изобретению можно вводить в комбинации с одним или несколькими дополнительными терапевтическими средствами. Как описано в настоящей заявке, ингибиторы TLR можно комбинировать с физиологически приемлемым носителем. Способы, описанные в настоящей заявке, можно осуществить на практике в сочетании с другими терапиями, которые составляют стандарт лечения этого расстройства, такими как введение противовоспалительных средств
В некоторых вариантах осуществления ингибитор TLR, как описано в настоящей заявке, вводят в комбинации с кортикостероидом. В некоторых вариантах осуществления кортикостероид представляет собой глюкокортикостероид. В некоторых вариантах осуществления кортикостероид представляет собой минералокортикоид. Кортикостероиды включают, но не ограничиваются этим, кортикостерон и его производные, пролекарства, изомеры и аналоги, кортизон и его производные, пролекарства, изомеры и аналоги (то есть Кортон), альдостерон и его производные, пролекарства, изомеры и аналоги, дексаметазон и его производные, пролекарства, изомеры и аналоги (например, Декадрон), преднизон и его производные, пролекарства, изомеры и аналоги (например, Прелон), флудрокортизоны и их производные, пролекарства, изомеры и аналоги, гидрокортизон и его производные, пролекарства, изомеры и аналоги (т.е. кортизол или Кортеф), гидроксикортизон и его производные, пролекарства, изомеры и аналоги, бетаметазон и его производные, пролекарства, изомеры и аналоги (например, Целестон), будесонид и его производные, пролекарства, изомеры и аналоги (т.е. Энтокорт EC), метилпреднизолон и его производные, пролекарства, изомеры и аналоги (например, Медрол), преднизолон и его производные, пролекарства, изомеры и аналоги (например, Дельтазон, Картан, Метикортен, Оразон или Стерапред), триамцинолон и его производные, пролекарства, изомеры и аналоги (то есть Кенакорт или Кеналог) и т.п. В некоторых вариантах осуществления кортикостероид представляет собой флудрокортизон или его производное, пролекарство, изомер или аналог. В некоторых вариантах осуществления кортикостероид представляет собой флудрокортизон. В некоторых вариантах осуществления кортикостероид представляет собой гидроксикортизон или его производное, пролекарство, изомер или аналог. В некоторых вариантах осуществления кортикостероид представляет собой гидроксикортизон.
В некоторых вариантах осуществления кортикостероид вводят при дозе в пределах примерно от 0,001 мг до 1 мг, от 0,5 мг до 1 мг, от 1 мг до 2 мг, от 2 мг до 20 мг, от 20 мг до 40 мг, от 40 до 80 мг, От 80 до 120 мг, от 120 мг до 200 мг, от 200 мг до 500 мг или от 500 мг до 1000 мг в день. В некоторых вариантах осуществления кортикостероид вводят при дозе в пределах примерно от 0,1 мг/кг до 0,5 мг/кг, от 0,5 мг/кг до 1 мг/кг, от 1 мг/кг до 2 мг/кг, от 2 мг/кг до 5 мг/кг, от 5 мг/кг до 10 мг/кг, от 10 мг/кг до 15 мг/кг, от 15 мг/кг до 20 мг/кг, от 20 мг/кг до 25 мг/кг, от 25 мг/кг до 35 мг/кг или 35 мг/кг до 50 мг/кг в день.
В некоторых вариантах осуществления доставляемое количество ингибитора TLR, используемого в комбинированной терапии, может составлять, например, примерно от 0,1 до 10 мг/кг, от 0,5 до 10 мг/кг, от 1 до 10 мг/кг, от 0,1 до 20 мг/кг, от 0,1 до 20 мг/кг или от 1 до 20 мг/кг.
В некоторых вариантах осуществления ингибитор TLR вводят одновременно с одним или несколькими дополнительными терапевтическими средствами, включая, но не ограничиваясь этим, кортикостероид (одновременное введение). В некоторых вариантах осуществления ингибитор TLR вводят последовательно с дополнительным терапевтическим средством, включая, но не ограничиваясь этим, кортикостероид (последовательное введение). В некоторых вариантах осуществления последовательное введение включает введение ингибитора TLR или затем дополнительного терапевтического средства через примерно одну минуту, пять минут, 30 минут, один час, пять часов, 24 часа, 48 часов или неделю. В некоторых вариантах осуществления ингибитор TLR вводят тем же способом введения, что и дополнительное терапевтическое средство. В некоторых вариантах осуществления ингибитор TLR вводят другим путем введения, отличным от введения дополнительного терапевтического средства. В некоторых вариантах осуществления дополнительное терапевтическое средство вводят парентерально (например, путем инъекции в центральную венозную линию, интраартериально, внутривенно, внутримышечно, внутрибрюшинно, внутрикожно или подкожно), перорально, интраперитонеально, местно, назо-фарингеально и внутрилегочно (например, путем ингаляции или интраназально). В некоторых вариантах осуществления дополнительное терапевтическое средство представляет собой кортикостероид.
Раскрытые соединения формулы I можно вводить в комбинации с другими известными терапевтическими средствами, включая противораковые средства. Используемый в настоящей заявке термин “противораковое средство” относится к любому средству, которое вводят пациенту, страдающему раком, для лечения пациента.
Анти-раковое лечение, определенное выше, можно применять в качестве монотерапии, или оно может включать, помимо описанных соединений формулы I, обычную хирургию или лучевую терапию или лекарственную терапию. Такая лекарственная терапия, например, химиотерапия или таргет-терапия, могут включать одно или несколько, но предпочтительно одно, из следующих противоопухолевых средств:
Алкилирующие средства: такие как алтретамин, бендамустин, бусульфан, кармустин, хлорамбуцил, хлорметин, циклофосфамид, дакарбазин, ифосфамид, импросульфан, тозилат, ломустин, мелфалан, митобронтит, митолактол, нимустин, ранимустин, темозоломид, тиотепа, треосульфан, мехлоретамин, карбоквон; апазиквон, фотемустин, глуфосфамид, палифосфамид, пипроброман, трофосфамид, урамустин, TH-3024, VAL-0834;
Платиновые соединения: такие как карбоплатин, цисплатин, эптаплатин, мириплатин гидрат, оксалиплатин, лобаплатин, недаплатин, пикоплатин, сатраплатин;
Модифицирующие ДНК средства: такие как амрубицин, бисантрен, децитабин, митоксантрон, прокарбазин, трабектедин, клофарабин; амсакрин, бросталлицин, пиксантрон, ларомустин1,3;
Ингибиторы топоизомеразы: такие, как этопозид, иринотекан, разоксан, собузоксан, тенипозид, топотекан; амонафид, белотекан, эллиптиний ацетат, ворелоксин;
Модификаторы микротрубочек: такие как кабазитаксел, доцетаксел, эрибулин, иксабепилон, паклитаксел, винбластин, винкристин, винорелбин, виндезин, винфлунин; фосбретабулин, тезетексел;
Антиметаболиты: такие как аспарагиназа3, азацитидин, кальция левофенилат, капецитабин, кладрибин, цитарабин, эноцитабин, флоксуридин, флударабин, фторурацил, гемцитабин, меркаптопурин, метотрексат, неларабин, пеметрексед, пралатрексат, азатиоприн, тиогуанин, кармофур; доксифлуридин, элацитарабин, ралтитрексед, сапацитабин, тегафур2,3, триметрексат;
Противораковые антибиотики: такие как блеомицин, дактиномицин, доксорубицин, эпирубицин, идарубицин, левамизол, милтефозин, митомицин С, ромадепсин, стрептозоцин, валрубицин, зиностатин, зорубицин, даунорубицин, пликсамицин; акларубицин, пепломицин, пирарубицин;
Гормоны/антагонисты: такие как абареликс, абиратерон, бикалутамид, бусерелин, калустерон, хлоротрианисен, дегареликс, дексаметазон, эстрадиол, флуокортолон флуоксиместерон, флутамид, фулвестрант, госерелин, гистрелин, лейпрорелин, мегестрол, митотан, нафарелин, нандролон, нилутамид, октреотид, преднизолон, ралоксифен, тамоксифен, тиротропин альфа, торемифен, трилостан, трипторелин, диэтилстильбестрол; аколбифен, даназол, дезлорелин, эпитиостанол, ортерол, энзалутамид1,3;
Ингибиторы ароматазы: такие как аминоглутетимид, анастрозол, экземестан, фадрозол, летрозол, тестолактон; форместан;
Низкомолекулярные ингибиторы киназ: такие как кризотиниб, дазатиниб, эрлотиниб, иматиниб, лапатиниб, нилотиниб, пазопаниб, регорафениб, руксолитиниб, сорафениб, сунитиниб, вандетаниб, вемурафениб, босутиниб, гефитиниб, акситиниб; афатиниб, алисертиб, дабрафениб, дакомитиниб, динациклиб, довитиниб, энзастаурин, нинтеданиб, ленватиниб, линифаниб, линзитиниб, маситиниб, мидостаурин, мотсаниб, нератиниб, орантиниб, перифосин, понанитиб, радотиниб, ригосертиб, типифарниб, тивантиниб, тивозаниб, бриваниб аланинат, цедираниб, апатиниб4, кабозантиниб S-малат1,3, ибрутиниб1,3, икотиниб4, бупарлизиб2, ципатиниб4, кобиметиниб1,3, иделализиб1,3, федратиниб1, XL-6474;
Фотосенсибилизаторы: такие как метокссален3; натрия порфимер, таларфин, темопорфин;
Антитела: так как алемтузумаб, бесилесомаб, брентуксимаб ведотин, цетуксимаб, деносумаб, ипилимумаб, офатумумаб, панитумумаб, ритуксимаб, тозитумомаб, трастузумаб, бевацизумаб, пертузумаб2,3; катумаксомаб, элотузумаб, эпратузумаб, фаротузумаб, мамамулизумаб, нецитумумаб, нимотузумаб, обинутузумаб, окаратузумаб, ореговомаб, рамуцирумаб, рилотумумаб, силтуксимаб, тоцилизумаб, залутумумаб, занолимумаб, матузумаб, далотузумаб1,2,3, онартузумаб1,3, ракотумомаб1, табалумаб1,3, EMD-5257974, ниволумаб1,3;
Цитокины: такие как алдеслейкин, интерферон альфа2, интерферон альфа2а3, интерферон альфа2b2,3; целмолейкин, тасонермин, тецелейкин, опрелвекин1,3, рекомбинантный интерферон бета-1a4;
Конъюгаты лекарственных средств: такие как денилейкин-дифтитокс, ибритумомаб тиуксетан, иобенгуан I123, преднимустин, трастузумаб эмтансин, эстрамустин, гемтузумаб, озогамицин, афлиберцепт; цинтредикин бесудотокс, эдотреотид, инотузумаб озогамицин, наптумомаб эстафенатокс, опортузумаб монатокс, технеций (99mTc) арцитумомаб1,3, винтафолид1,3;
Вакцины: такие как сипулейсел3; витеспен3, эмепепимут-S3, онкоVAX4, риндопепимут3, троVax4, MGN-16014, MGN-17034; а также
Прочие: алитретиноин, бексаротин, бортезомиб, эверолимус, ибандроновая кислота, имиквимод, леналидомид, лентинан, метирозин, мифамуртид, памидронная кислота, пегаспаргаза, пентостатин, сипулейсел3, сизофиран, тамибаротен, темсиролимус, талидомид, третиноин, висмодегиб, золедроновая кислота, вориностат; целекоксиб, циленгитид, энтиностат, этанидазол, ганетеспиб, идроноксил, инипариб, иксазомиб, лонидамин, ниморазол, панобиностат, перетиноин, плитидепсин, помалидомид, прокодазол, ридафоролимус, тасквинимод, телотристат, тималфазин, тирапазамин, тоседостат, трабедерсен, убенимекс, валсподар, пицибанил4, реолизин4, ретаспимицин гидрохлорид1,3, требананиб2,3, вирулизин4, карфилзомиб1,3, эндостатин4, иммукотел4, белиностат3, MGN-17034.
(1Prop. INN (Предложенное Международное Непатентованное Название); 2Rec. INN (Рекомендованные Международные Непатентованные Названия); 3USAN (Принятое в США Название); 4нет INN).
В некоторых вариантах осуществления комбинация ингибитора TLR с одним или несколькими дополнительными терапевтическими средствами уменьшает эффективное количество (включая, но не ограничиваясь этим, объем дозы, концентрацию и/или общую дозу лекарственного средства) ингибитора TLR и/или одного или нескольких дополнительных терапевтических средств, вводимых для достижения такого же результата, по сравнению с эффективным количеством, вводимым, когда ингибитор TLR или дополнительное терапевтическое средство вводят отдельно. В некоторых вариантах осуществления комбинация ингибитора TLR с кортикостероидом снижает эффективное количество вводимого кортикостероида по сравнению с кортикостероидом, вводимым отдельно. В некоторых вариантах осуществления комбинация ингибитора TLR с дополнительными терапевтическими средствами снижает частоту введения терапевтического средства по сравнению с введением только одного дополнительного терапевтического средства. В некоторых вариантах осуществления комбинация ингибитора TLR с дополнительным терапевтическим средством уменьшает общую продолжительность лечения по сравнению с введением только одного дополнительного терапевтического средства. В некоторых вариантах осуществления комбинация ингибитора TLR с дополнительным терапевтическим средством уменьшает побочные эффекты, связанные с введением дополнительного терапевтического средства отдельно. В некоторых вариантах осуществления дополнительное терапевтическое средство представляет собой кортикостероид. В некоторых вариантах осуществления кортикостероид представляет собой флудрокортизон или его производное, пролекарство, изомер или аналог. В некоторых вариантах осуществления кортикостероид представляет собой флудрокортизон. В некоторых вариантах осуществления комбинация эффективного количества ингибитора TLR с дополнительным терапевтическим средством более эффективна по сравнению с эффективным количеством только ингибитора TLR или только дополнительного терапевтического средства.
Ингибиторы TLR также могут быть полезны в качестве адъюванта вакцины для использования в сочетании с любым веществом, которое модулирует гуморальный и/или клеточно-опосредованный иммунный ответ, таким как, например, живые вирусные, бактериальные или паразитарные иммуногены; инактивированные вирусные, происходящие из опухоли, протозойные, продуцируемые организмом, грибковые или бактериальные иммуногены, токсоиды, токсины; аутоантигены; полисахариды; белки; гликопротеины; пептиды; клеточные вакцины; ДНК-вакцины; рекомбинантные белки; гликопротеины; пептиды; и т.п. В некоторых аспектах, комбинированную терапию, включая, но не ограничиваясь этим, комбинацию ингибитора TLR и вакцины, используют для лечения аутоиммунного заболевания или воспалительного расстройства. В некоторых аспектах, комбинированную терапию, включая, но не ограничиваясь этим, комбинацию ингибитора TLR и вакцины, используют для лечения инфекционного заболевания.
В некоторых вариантах осуществления комбинированную терапию, включая, но не ограничиваясь этим, комбинацию ингибитора TLR и кортикостероида, используют для лечения аутоиммунного заболевания или воспалительного расстройства. В некоторых вариантах осуществления аутоиммунное заболевание выбрано, но не ограничивается этим, из ревматоидного артрита, системной красной волчанки, аутоиммунного кожного заболевания, рассеянного склероза, панкреатита, гломерулонефрита, пиелита, склерозирующего холангита и диабета I типа. В некоторых вариантах осуществления аутоиммунное заболевание представляет собой болезнь Шегрена.
Кроме того, в настоящей заявке представлены наборы, включающие ингибитор TLR, представленный в настоящей заявке, и инструкции по применению в способах ингибирования TLR7- и/или TLR8-зависимого иммунного ответа.
Наборы могут включать один или несколько контейнеров, содержащих ингибитор TLR (или композицию, содержащую ингибитор TLR), описанный в настоящей заявке, и набор инструкций, обычно письменных инструкций, хотя электронные носители информации (например, магнитная дискета или оптический диск), содержащие инструкции, также приемлемы, касающиеся применения и дозировки ингибитора TLR или препарата для предполагаемого лечения (например, подавление ответа на агонисты TLR7 и/или TLR8, подавление TLR7- и/или TLR8-зависимого иммунного ответа, улучшение одного или нескольких симптомов аутоиммунного заболевания, улучшение симптомов хронического воспалительного заболевания, уменьшение продукции цитокинов в ответ на вирус и/или лечение и/или предотвращение одного или нескольких симптомов заболевания или расстройства, опосредуемого TLR7 и/или TLR8). Инструкции, включенные в набор, обычно включают информацию о дозировке, схеме введения и пути введения для предполагаемого лечения. Контейнеры для ингибитора TLR (или композиций, включающих ингибитор TLR) могут представлять собой единичные дозы, объемные упаковки (например, многодозовые упаковки) или дробные дозы. Наборы могут дополнительно включать контейнер, содержащий адъювант.
В другом аспекте изобретение обеспечивает набор, состоящий из отдельных упаковок эффективного количества соединения в соответствии с изобретением и/или его фармацевтически приемлемых солей, производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, и необязательно, эффективное количество дополнительного активного ингредиента. Набор включает подходящие контейнеры, такие как коробки, отдельные бутыли, пакеты или ампулы. Набор может включать, например, отдельные ампулы, каждая из которых содержит эффективное количество соединения по изобретению и/или его фармацевтически приемлемых солей, производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, и эффективное количество дополнительного активного ингредиента в растворенной или лиофилизированной форме.
В контексте настоящей заявки термины “лечение”, “лечить” и “лечащий” относятся к реверсии, облегчению, задержке начала или ингибированию развития заболевания или расстройства или одного или нескольких его симптомов, описанных в настоящей заявке. В некоторых вариантах осуществления лечение вводят после проявления одного или нескольких симптомов. В других вариантах осуществления лечение вводят в отсутствие симптомов. Например, лечение вводят восприимчивому субъекту до появления симптомов (например, в свете истории симптомов и/или в свете генетических или других факторов восприимчивости). Лечение также продолжают после устранения симптомов, например, для предотвращения или отсрочки их повторения.
Соединения и композиции в соответствии со способом по настоящему изобретению вводят с использованием любого количества и любого способа введения, эффективного для лечения или уменьшения тяжести описанного выше расстройства. Точное требуемое количество будет варьироваться от субъекта к субъекту в зависимости от вида, возраста и общего состояния субъекта, тяжести инфекции, конкретного средства, способа его введения и т.п. Соединения по изобретению предпочтительно формулируют в виде стандартной лекарственной формы для удобства и равномерности введения. Выражение “стандартная лекарственная форма”, в контексте настоящей заявки, относится к физически дискретной единице средства, подходящего для лечения пациента, подлежащего лечению. Однако должно быть понятно, что общее ежедневное используемое количество соединений и композиций по настоящему изобретению будет определяться лечащим врачом в рамках здравого медицинского суждения. Конкретный эффективный уровень доз для любого конкретного пациента или организма будет зависеть от множества факторов, включая расстройство, подлежащее лечению, и тяжесть расстройства; активность конкретного используемого соединения; конкретную используемую композицию; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; время введения, способ введения и скорость экскреции конкретного используемого соединения; продолжительность лечения; препараты, используемые в комбинации или одновременно с конкретным используемым соединением, и подобные факторы, хорошо известные в медицине.
Фармацевтически приемлемые композиции по настоящему изобретению можно вводить человеку и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонеально, местно (в виде порошков, мазей или капель), букально, в виде перорального или назального спрея или т.п., в зависимости от тяжести инфекции, подлежащей лечению. В некоторых вариантах осуществления соединения по изобретению вводят перорально или парентерально при дозах от около 0,01 до около 100 мг/кг, и предпочтительно от около 1 мг/кг до около 50 мг/кг массы тела в день один или несколько раз в день для получения желаемого терапевтического эффекта.
В некоторых вариантах осуществления терапевтически эффективное количество соединения формулы (I) и родственных формул и другого активного ингредиента зависит от ряда факторов, включая, например, возраст и массу тела животного, точное состояние заболевания, которое требует лечения, и его тяжесть, природу композиции и способ введения, и в конечном итоге определяется лечащим врачом или ветеринаром. Однако эффективное количество соединения обычно находится в диапазоне от 0,1 до 100 мг/кг массы тела реципиента (млекопитающего) в день, и особенно типично в диапазоне от 1 до 10 мг/кг массы тела в день. Таким образом, фактическое количество в день для взрослого млекопитающего с массой тела 70 кг обычно составляет от 70 до 700 мг, и это количество можно вводить в виде одной дозы в день или обычно в виде ряда дробных доз (например, две, три, четыре, пять или шесть) в день, так чтобы общая суточная доза была такой же. Эффективное количество соли или сольвата или физиологически функционального производного может быть определено как доля эффективного количества соединения per se.
В некоторых вариантах осуществления фармацевтические композиции можно вводить в форме дозированных единиц, которые содержат заданное количество активного ингредиента на единицу дозирования. Такая единица может содержать, например, от 0,5 мг до 1 г, предпочтительно от 1 мг до 700 мг, особенно предпочтительно от 5 мг до 100 мг соединения согласно изобретению, в зависимости от состояния заболевания, лечения, способа введения и возраста, массы тела и состояния пациента, или фармацевтические препараты можно вводить в форме дозированных единиц, которые содержат заданное количество активного ингредиента на единицу дозирования. Предпочтительными дозированными лекарственными формами являются композиции, которые содержат суточную дозу или часть дозы, которая указана выше, или соответствующую ее долю, активного ингредиента. Кроме того, фармацевтические композиции этого типа можно получить с использованием способа, который хорошо известен в фармацевтике.
Жидкие лекарственные формы для перорального введения включают, но не ограничиваются этим, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям жидкие дозированные формы необязательно содержат инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензил спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, масло семян хлопчатника, арахисовое, кукурузное, зародышевое, оливковое, касторовое и кунжутное масло), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси. Помимо инертных разбавителей, пероральные композиции могут также включать адъюванты, такие как смачивающие вещества, эмульгаторы и суспендирующие вещества, подсластители, отдушки и ароматизаторы.
Инъекционные препараты, например, стерильные инъекционные водные или масляные суспензии, формулируют в соответствии с известным уровнем техники с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих веществ. Стерильный препарат для инъекций также представляет собой стерильный раствор, суспензию или эмульсию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Из приемлемых носителей и растворителей, которые можно использовать, можно указать воду, раствор Рингера U.S.P. и изотонический раствор хлорида натрия. Кроме того, стерильные, нелетучие масла обычно используют в качестве растворителя или суспендирующей среды. Для этой цели можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, для получения инъекционных препаратов используют жирные кислоты, такие как олеиновая кислота.
Инъекционные препараты можно стерилизовать, например, путем фильтрования через удерживающий бактерии фильтр или путем введения стерилизующих средств в форме стерильных твердых композиций, которые можно растворить или диспергировать в стерильной воде или другой стерильной инъекционной среде перед использованием.
Чтобы продлить действие соединения по настоящему изобретению, часто желательно замедлить абсорбцию соединения из подкожной или внутримышечной инъекции. Это достигается за счет использования жидкой суспензии кристаллического или аморфного вещества с плохой водорастворимостью. Скорость абсорбции соединения тогда зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленное поглощение парентерально вводимой формы соединения осуществляют путем растворения или суспендирования соединения в масляном носителе. Депо формы для инъекций получают путем формирования матриц для микроинкапсулирования соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения соединения и полимера и природы конкретного используемого полимера можно контролировать скорость высвобождения соединения. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Депо препараты для инъекций также получают путем захвата соединения в липосомы или микроэмульсии, которые совместимы с тканями организма.
Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые могут быть получены путем смешивания соединений по настоящему изобретению с подходящими нераздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела и, следовательно, плавятся в прямой кишке или влагалище и высвобождают активное соединение.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешано с по меньшей мере одним инертным фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфат, и/или а) наполнителями или создающими объем веществами, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, c) увлажнителями, такими как глицерин, d) разрыхлителями, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, e) замедляющими растворение веществами, такими как парафин, f) ускорителями абсорбции, такими как соединения четвертичного аммония, g) смачивающими веществами, такими как, например, цетиловый спирт и глицерин моностеарат, h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и их смесями. В случае капсул, таблеток и пилюль, лекарственная форма также необязательно включает буферные агенты.
Твердые композиции аналогичного типа также используют в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п. Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области формулирования фармацевтических препаратов. Они необязательно содержат вещества, придающие непрозрачность, и могут также иметь такую композицию, чтобы активный ингредиент(ингредиенты) высвобождался только или предпочтительно в определенной части кишечного тракта, необязательно, замедленным образом. Примеры композиций для погружения в них лекарственного средства, которые можно использовать, включают полимерные вещества и воски. Твердые композиции аналогичного типа также используют в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликоли и т.п.
Активные соединения также могут быть в микроинкапсулированной форме с одним или несколькими эксципиентами, как указано выше. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия, контролирующие высвобождение покрытия и другие покрытия, хорошо известные в области формулирования фармацевтических препаратов. В таких твердых лекарственных формах активное соединение может быть смешано, по меньшей мере, с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы также включают, в качестве обычной практики, дополнительные вещества, отличные от инертных разбавителей, например, смазывающие вещества для таблетирования и другие вещества для таблетирования, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, лекарственные формы необязательно также включают буферные агенты. Они необязательно содержат вещества, придающие непрозрачность, и могут также иметь такую композицию, чтобы активный ингредиент(ингредиенты) высвобождался только или предпочтительно в определенной части кишечного тракта, необязательно, замедленным образом. Примеры композиций для погружения в них лекарственного средства, которые можно использовать, включают полимерные вещества и воски.
Лекарственные формы для местного или трансдермального введения соединения по настоящему изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингалянты или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами по мере необходимости. Офтальмологическая композиция, ушные капли и глазные капли также рассматриваются как входящие в объем настоящего изобретения. Кроме того, настоящее изобретение предусматривает использование трансдермальных пластырей, которые имеют дополнительное преимущество обеспечения контролируемой доставки соединения в организм. Такие лекарственные формы можно получить путем растворения или распределения соединения в соответствующей среде. Усилители абсорбции также можно использовать для увеличения потока соединения через кожу. Скорость можно регулировать либо путем обеспечения мембраны, контролирующей скорость, либо путем диспергирования соединения в полимерной матрице или геле.
В соответствии с одним вариантом осуществления, изобретение относится к способу ингибирования активности TLR7/8 в биологическом образце, включающему стадию контактирования указанного биологического образца с соединением по настоящему изобретению или композицией, включающей указанное соединение.
В соответствии с другим вариантом осуществления, изобретение относится к способу ингибирования активности TLR7/8 или его мутанта в биологическом образце положительным образом, включающему стадию контактирования указанного биологического образца с соединением по настоящему изобретению или композицией, включающей указанное соединение.
Соединения по изобретению полезны in vitro как уникальные инструменты для понимания биологической роли TLR7/8, включая оценку многих факторов, которые, как полагают, оказывают влияние, и которые могут подвергаться влиянию, на продукцию TLR7/8 и взаимодействие TLR7/8. Соединения по настоящему изобретению также полезны при разработке других соединений, которые взаимодействуют с TLR7/8, поскольку соединения по изобретению обеспечивают важную информацию о зависимости структура-активность (SAR), которая облегчают эту разработку. Соединения по настоящему изобретению, которые связываются с TLR7/8, можно использовать в качестве реагентов для детекции TLR7/8 в живых клетках, фиксированных клетках, в биологических жидкостях, в гомогенатах тканей, в очищенных природных биологических материалах и т.д. Например, путем мечения таких соединений можно идентифицировать клетки, экспрессирующие TLR7/8. Кроме того, на основании их способности связываться с TLR7/8 соединения по настоящему изобретению можно использовать в in-situ окрашивании, FACS (сортировка клеток, активируемая флуоресценцией), электрофорезе в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), ELISA (твердофазный иммуноферментный анализ) и т.д., в очистке ферментов или в очистке клеток, экспрессирующих TLR7/8 внутри пермеабилизированных клеток. Соединения по изобретению также можно использовать в качестве коммерческих исследовательских реагентов для различных медицинских исследований и диагностических целей. Такое использование может включать, но не ограничивается этим: использование в качестве калибровочного стандарта для количественной оценки активности кандидатов-ингибиторов TLR7/8 в различных функциональных анализах; использование в качестве блокирующих реагентов в рандомизированном скрининге соединений, то есть при поиске новых семейств лигандов TLR7/8, соединения можно использовать для блокирования выделения заявленных в настоящем изобретении TLR7/8 соединений; использование в ко-кристаллизации с TLR7/8, то есть соединения по настоящему изобретению обеспечат возможность образования кристаллов соединения, связанного с TLR7/8, что позволит определить структуру фермента/соединения с помощью рентгеновской кристаллографии; другие исследования и диагностические применения, где TLR7/8 предпочтительно активируется, или такую активацию удобно откалибровать против известного количества ингибитора TLR7/8 и т.д.; использование в анализах в качестве зондов для определения экспрессии TLR7/8 в клетках; и разработка анализов для детекции соединений, которые связываются с одним и тем же сайтом, что и TLR7/8 связывающие лиганды.
Соединения по изобретению можно применять как таковые и/или в сочетании с физическими измерениями для диагностики эффективности лечения. Фармацевтические композиции, содержащие указанные соединения, и использование указанных соединений для лечения состояний, опосредуемых TLR7/8, представляют собой перспективный новый подход к широкому спектру терапий, вызывающих непосредственное и немедленное улучшение состояния здоровья как у человека, так и у животных. Перорально биодоступные и активные новые химические соединения по изобретению улучшают удобство для пациентов и соблюдение врачебных рекомендаций по приему препарата.
Соединения формулы (I), их соли, изомеры, таутомеры, энантиомерные формы, диастереомеры, рацематы, производные, пролекарства и/или метаболиты характеризуются высокой специфичностью и стабильностью, низкой стоимостью изготовления и удобством в обращении. Эти особенности служат основой для воспроизводимого действия, в которое включено отсутствие перекрестной реактивности, а также для надежного и безопасного взаимодействия с целевой структурой.
Термин “биологический образец”, в контексте настоящей заявки, включает, без ограничения, культуры клеток или их экстракты; биопсийный материал, полученный от млекопитающего, или его экстракты; и кровь, слюну, мочу, фекалии, сперму, слезы или другие биологические жидкости или их экстракты.
Модуляция активности TLR7/8 или его мутанта в биологическом образце полезна для различных целей, которые известны специалистам в данной области. Примеры таких целей включают, но не ограничиваются этим, переливание крови, трансплантацию органов, хранение биологических образцов и биологические анализы.
Иллюстративные примеры
Как показано в примерах ниже, в некоторых иллюстративных вариантах осуществления соединения получают в соответствии со следующими общими процедурами. Понятно, что, хотя общие способы иллюстрируют синтез некоторых соединений по настоящему изобретению, следующие общие способы и другие способы, известные специалистам в данной области, можно применять ко всем соединениям и подклассам и видам каждого из этих соединений, как описано в настоящей заявке.
Символы и условные обозначения, используемые в следующих описаниях способов, схем и примеров, согласуются с обозначениями, используемыми в современной научной литературе, например, Journal of the American Chemical Society или Journal of Biological Chemistry.
Если не указано иное, все температуры выражены в °C (градусы Цельсия).
Все используемые растворители были коммерчески доступны и использовались без дополнительной очистки. Реакции обычно осуществляли с использованием безводных растворителей в инертной атмосфере азота. Колоночную флэш-хроматографию обычно осуществляли с использованием силикагеля 60 (размер частиц 0,035-0,070 мм).
Все ЯМР эксперименты осуществляли на спектрометре Bruker Mercury Plus 400 NMR, снабженном зондом Bruker 400 BBFO, при 400 МГц для протонного ЯМР, или на спектрометре Bruker Mercury Plus 300 NMR, снабженном зондом Bruker 300 BBFO, при 300 МГц для протонного ЯМР, или на спектрометре Bruker Avance III 400 NMR, снабженном зондом Bruker PABBO BB-1H/DZ GRD, при 400 МГц для протонного ЯМР. Большинство дейтерированных растворителей содержали обычно от 0,03 до 0,05% об/об тетраметилсилана, который использовали в качестве эталонного сигнала (установленный при d 0,00 как для 1H, так и 13C). В случаях, когда дейтерированные растворители не содержали тетраметилсилан, в качестве эталонного сигнала использовали пики остаточного недейтерированного растворителя, в соответствии опубликованными руководящими указаниями (J. Org. Chem., Vol. 62, No. 21, 1997).
ЖХ-МС анализ осуществляли с использованием одного из двух следующих устройств:
- SHIMADZU ЖХ-МС устройство, состоящее из системы UFLC 20-AD и детектора LCMS 2020 MS. Использовали колонку XR-ODS Shim-pack, 2,2 мкм, 3,0 × 50 мм. Применяли линейный градиент, начиная с 95% A (A: 0,05% TFA в воде) и заканчивая 100% B (B: 0,05% TFA в ацетонитриле), в течение 2,2 мин, с общим временем цикла 3,6 мин. Температура колонки составляла 40°С, со скоростью потока 1,0 мл/мин. Диодно-матричный детектор работал при 200-400 нм. Масс-спектрометр был оснащен источником электрораспыления ионов (ES), работающим в положительном или отрицательном режиме. Масс-спектрометр работал в режиме сканирования между m/z 90-900 с временем сканирования 0,6 сек.
- Масс-спектрометры серии Agilent 1200 от Agilent Technologies с использованием либо химической ионизации при атмосферном давлении (APCI), либо ионизации электрораспылением (ESI). Диодно-матричный детектор работал при 200-400 нм. Масс-спектрометр работал в режиме сканирования между m/z 90-900 с временем сканирования 0,6 сек. Колонка: XBridge C8, 3,5 мкм, 4,6 × 50 мм; Растворитель A: вода + 0,1% TFA; Растворитель B: ACN+0,1% TFA; Скорость потока: 2 мл/мин; Градиент: 0 мин: 5% В, 8 мин: 100% В, 8,1 мин: 100% В, 8,5 мин: 5% В, 10 мин. 5% В или ЖХ/МС Waters ZMD (ESI).
Данные ВЭЖХ получали либо с использованием устройства SHIMAZU LC-MS, либо с использованием Agilent 1200 Series HPLC от Agilent Technologies, используя колонку (XBridge C8, 3,5 мкм, 4,6 × 50 мм) и две подвижные фазы (подвижная фаза A: вода + 0,1% TFA, подвижная фаза B: ACN+0,1% TFA). Скорость потока составляла 2 мл/мин. Метод градиента: 0 мин: 5% В; 8 мин: 100% В; 8,1 мин: 100% В; 8,5 мин: 5% В; 10 мин. 5% В, если не указано иное.
Как правило, соединения в соответствии с формулой (I) и родственными формулами по настоящему изобретению могут быть получены из легко доступных исходных веществ. Если такие исходные вещества не являются коммерчески доступными, их можно получить стандартными методами синтеза. Как правило, пути синтеза для любого отдельного соединения формулы (I) и родственных формул будут зависеть от конкретных заместителей каждой молекулы, при этом такие факторы понятны специалистами в данной области техники. Следующие общие способы и процедуры, описанные ниже в примерах, можно использовать для получения соединений формулы (I) и родственных формул. Реакционные условия, показанные в следующих схемах, такие как температуры, растворители или ко-реагенты, приведены только в качестве примеров и не являются ограничительными. Должно быть понятно, что, когда указаны типичные или предпочтительные условия эксперимента (то есть температуры реакции, время, моли реагентов, растворители и т.д.), можно использовать другие экспериментальные условия, если не указано иное. Оптимальные условия реакции могут варьироваться в зависимости от конкретных реагентов или растворителей, но такие условия смогут определить специалисты в данной области с использованием рутинных процедур оптимизации. Все способы введения защиты и снятия защиты см. в Philip J. Kocienski “Protecting Groups”, Georg Thieme Verlag Stuttgart, New York, 1994, и Theodora W. Greene and Peter G.M. Wuts “Protective Groups in Organic Synthesis”, Wiley Interscience, 3rd Edition 1999.
Промежуточное соединение 1: 8-хлорпиридо[2,3-b]пиразин
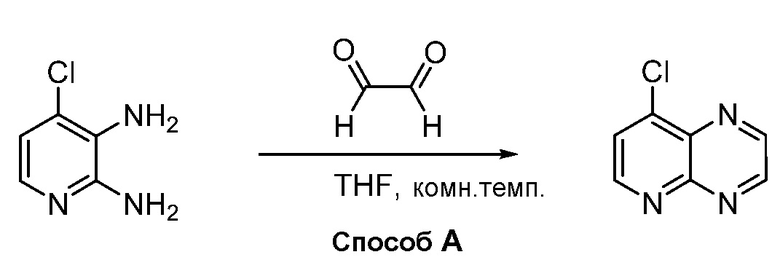
Способ A
8-Хлорпиридо[2,3-b]пиразин: К раствору 4-хлорпиридин-2,3-диамина (1,90 г, 13,20 ммоль) в THF (100 мл) добавляли оксальдегид (1,00 г, 17,20 ммоль) при комнатной температуре. Полученный раствор затем перемешивали в течение 6 часов при комнатной температуре. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 50% градиент), с получением 8-хлорпиридо[2,3-b]пиразина в виде желтого твердого вещества (2,10 г, 91%). МС: m/z=166,1 [M+H]+.
Промежуточное соединение 2: 4-хлор-1,2-диэтил-1H-пирроло[2,3-b]пиридин
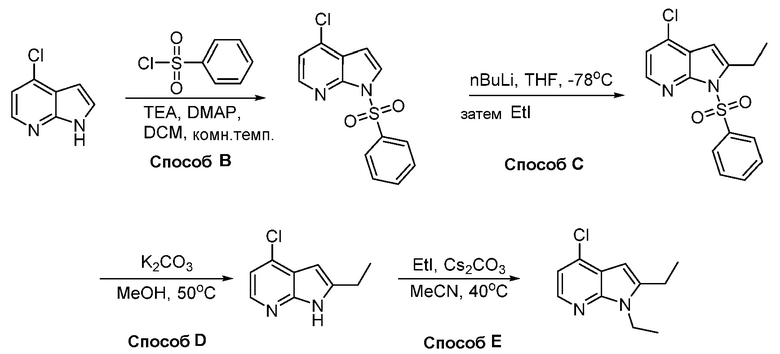
Способ B
4-Хлор-1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин: К раствору 4-хлор-1H-пирроло[2,3-b]пиридина (2,85 г, 18,68 ммоль) в DCM (100 мл) добавляли бензолсульфонилхлорид (4,95 г, 28,02 ммоль), 4-диметиламинопиридин (228 мг, 1,87 ммоль) и триэтиламин (5,67 г, 56,04 ммоль) при комнатной температуре. Полученный раствор затем перемешивали в течение 3 часов при комнатной температуре. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 50% градиент), с получением 1-(бензолсульфонил)-4-хлор-1H-пирроло[2,3-b]пиридина в виде белого твердого вещества (4,98 г, 91%). МС: m/z=292,9 [M+H]+.
Способ C
4-Хлор-2-этил-1-(фенилсульфонил)-1H-пирроло[2,3-b]: При -78°C, к раствору 1-(бензолсульфонил)-4-хлор-1H-пирроло[2,3-b]пиридина (1,86 г, 6,40 ммоль) в THF (35 мл) добавляли раствор n-BuLi (2,5 M в THF, 5 мл, 12,80 ммоль) по каплям в течение 5 минут. Полученный раствор перемешивали в течение 1 часа при -78°C и затем медленно добавляли иодэтан (2,20 г, 14,10 ммоль). Затем реакционную смесь медленно нагревали от -78°C до 0°C в течение 3 часов при перемешивании. Когда реакция была завершена, ее гасили путем добавления насыщенного раствора NH4Cl (20 мл) и полученную смесь экстрагировали этилацетатом (60 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 5% градиент), с получением 1-(бензолсульфонил)-4-хлор-2-этил-1H-пирроло[2,3-b]пиридина в виде белого твердого вещества (591 мг, 29%). МС: m/z=320,8 [M+H]+.
Способ D
4-Хлор-2-этил-1H-пирроло[2,3-b]пиридин: К раствору 1-(бензолсульфонил)-4-хлор-2-этил-1H-пирроло[2,3-b]пиридина (575 мг, 1,80 ммоль) в MeOH (20 мл) добавляли карбонат калия (592 мг, 4,30 ммоль) при комнатной температуре. Полученную смесь затем перемешивали в течение 3,5 часа при 50°C. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении и остаток разбавляли при помощи DCM (50 мл). Нерастворимые твердые вещества в смеси отфильтровывали и фильтрат концентрировали при пониженном давлении с получением 4-хлор-2-этил-1H-пирроло[2,3-b]пиридина в виде желтого твердого вещества (443 мг, неочищенный ). МС: m/z=180,9 [M+H]+.
Способ E
4-Хлор-1,2-диэтил-1H-пирроло[2,3-b]пиридин: К раствору 4-хлор-2-этил-1H-пирроло[2,3-b]пиридина (443 мг, неочищенный ) в ацетонитриле (23 мл) добавляли Cs2CO3 (1,40 г, 4,30 ммоль) и иодэтан (676 мг, 4,30 ммоль) при комнатной температуре. Полученную смесь затем перемешивали в течение 3,5 часов при 40°C. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении и остаток разбавляли при помощи DCM (30 мл). Нерастворимые твердые вещества в смеси отфильтровывали и фильтрат концентрировали при пониженном давлении с получением 4-хлор-1,2-диэтил-1H-пирроло[2,3-b]пиридина в виде желтого масла (333 мг, 89% для 2 стадий). МС: m/z=209,0 [M+H]+.
Промежуточное соединение 3: 4-хлор-1,2-диметил-1H-пирроло[2,3-b]пиридин
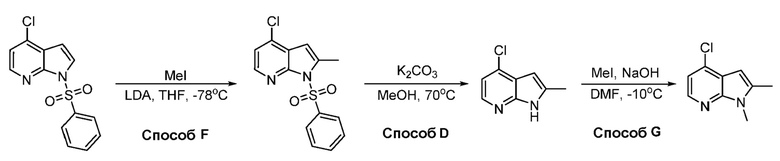
Способ F
4-Хлор-2-метил-1-(фенилсульфонил)-1H-пирроло[2,3-b]: при -78°C, к раствору 1-(бензолсульфонил)-4-хлор-1H-пирроло[2,3-b]пиридина (2,00 г, 6,85 ммоль) в тетрагидрофуране (30 мл) добавляли раствор LDA (2 M в THF, 3,4 мл, 6,85 ммоль) по каплям. Полученный раствор перемешивали в течение 1 часа при -78°C и затем медленно добавляли иодметан (0,97 г, 6,85 ммоль). Полученную смесь затем перемешивали в течение 5 часов при -78°C. Когда реакция была завершена, ее гасили при помощи H2O (30 мл) и полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 1-(бензолсульфонил)-4-хлор-2-метил-1H-пирроло[2,3-b]пиридина в виде коричневого масла (2,50 г, неочищенное).
4-Хлор-2-метил-1H-пирроло[2,3-b]пиридин: 4-хлор-2-метил-1H-пирроло[2,3-b]пиридин получали из 4-хлор-2-метил-1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридина с использованием Способа D. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи MeOH в DCM (0% - 10% градиент), с получением 4-хлор-2-метил-1H-пирроло[2,3-b]пиридина в виде желтого твердого вещества (900 мг, 79% для 2 стадий). МС: m/z=166,9 [M+H]+.
Способ G
4-Хлор-1,2-диметил-1H-пирроло[2,3-b]пиридин: при -10°C, к раствору 4-хлор-2-метил-1H-пирроло[2,3-b]пиридина (338 мг, 2,03 ммоль) в N,N-диметилформамиде (10 мл) добавляли гидроксид натрия (240 мг, 6,00 ммоль). Затем добавляли иодметан (284 мг, 2,00 ммоль) и полученную смесь перемешивали в течение 4 часов при -10°C. Когда реакция была завершена, реакционную смесь разбавляли при помощи DCM (100 мл) и полученную смесь промывали водой (30 мл × 3). Органическую фазу промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 10% градиент), с получением 4-хлор-1,2-диметил-1H-пирроло[2,3-b]пиридина в виде желтого твердого вещества (300 мг, 82%). МС: m/z=181,0 [M+H]+.
Промежуточное соединение 4: трет-бутил (3R,5S)-5-метилпиперидин-3-илкарбамат
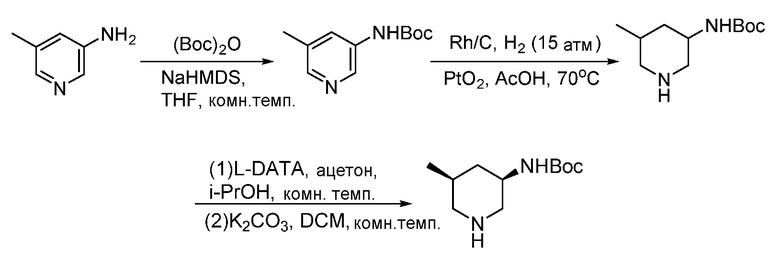
трет-Бутил 5-метилпиридин-3-илкарбамат: При комнатной температуре, к раствору 5-метилпиридин-3-амина (9,50 г, 88,0 ммоль) в тетрагидрофуране (150 мл) добавляли раствор NaHMDS (2 M в THF, 110 мл, 220,0 ммоль) по каплям в течение 10 минут. Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Затем добавляли Boc2O (21,14 г, 92,4 ммоль). Реакционную смесь перемешивали еще в течение 2 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления насыщенного раствора NH4Cl (100 мл). Полученную смесь экстрагировали этилацетатом (150 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 35% градиент), с получением трет-бутил N-(5-метилпиридин-3-ил)карбамата в виде желтого твердого вещества (15,18 г, 83%). МС: m/z=209,2 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,49 (с, 1 H), 8,38 (д, J=2,4 Гц, 1 H), 8,05-7,97 (м, 1 H), 7,73 (с, 1 H), 2,24 (с, 3 H), 1,47 (с, 9 H).
трет-Бутил 5-метилпиперидин-3-илкарбамат: в 500-мл реакторе высокого давления смешивали трет-бутил N-(5-метилпиридин-3-ил)карбамат (14,22 г, 68,43 ммоль), PtO2 (2,50 г, 11,01 ммоль) и Rh/C (5%, 2,50 г, 1,21 ммоль) в AcOH (250 мл) при комнатной температуре. Смесь гидрировали при 70°C при давлении водорода 15 атм в течение 24 часов. Когда реакция была завершена, реакционную смесь охлаждали до комнатной температуры. Нерастворимые твердые вещества в реакционной смеси отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток разбавляли при помощи DCM (100 мл) и значение pH смеси доводили до 12 при помощи раствора гидроксида натрия (20%). Полученную смесь экстрагировали при помощи DCM (100 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением трет-бутил N-(5-метилпиперидин-3-ил)карбамата в виде светло-коричневого твердого вещества (14,19, 97%). МС: m/z=215,2 [M+H]+.
трет-Бутил (3R,5S)-5-метилпиперидин-3-илкарбамат: К раствору трет-бутил N-(5-метилпиперидин-3-ил)карбамата (11,70 г, 54,60 ммоль) в ацетоне (200 мл) добавляли раствор (2R,3R)-2,3-бис[(4-метоксифенил)карбонилокси]бутандиовой кислоты (28,95 г, 69,19 ммоль) в изопропаноле (13 мл) при комнатной температуре. Полученную смесь перемешивали в течение 24 часов при комнатной температуре, происходило образование осадка. Когда реакция была завершена, осажденные вещества собирали фильтрованием с получением белого твердого вещества, которое добавляли к раствору карбоната калия (29,06 г, 210,27 ммоль) в воде (15 мл) по порциям при 0°C. Полученную смесь затем смешивали с дихлорметаном (100 мл) при 0°C и перемешивали в течение 2,5 часов при комнатной температуре. Затем смесь экстрагировали дихлорметаном (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамата в виде белого твердого вещества (2,93 г, 25%). МС: m/z=215,2 [M+H]+.
Промежуточное соединение 5: 8-хлорхиноксалин-5-карбонитрил
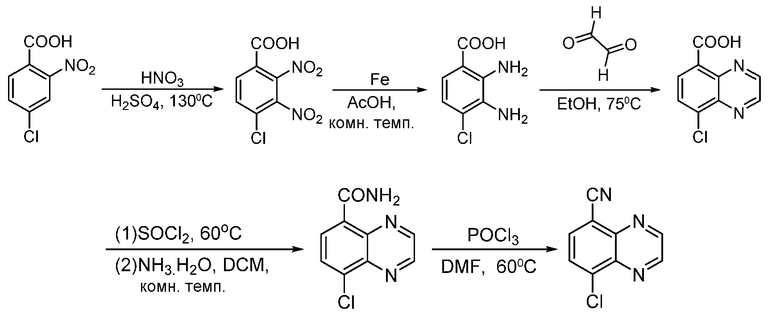
4-Хлор-2,3-динитробензойная кислота: При комнатной температуре, HNO3 (14,4 моль/л, 16 мл, 0,23 моль) добавляли к раствору 4-хлор-2-нитробензойной кислоты (19,00 г, 94,52 ммоль) в H2SO4 (80 мл) по каплям в течение 30 минут. Полученный раствор затем перемешивали в течение 1 часа при 130°C. После охлаждения до комнатной температуры реакционную смесь выливали в ледяную воду (300 мл). Значение pH полученной смеси доводили до 7 при помощи раствора гидроксида натрия (6M). Смесь затем концентрировали при пониженном давлении и нерастворимые твердые вещества отфильтровывали из оставшейся смеси. Значение pH фильтрата затем доводили до 3 при помощи раствора хлористоводородной кислоты (6 M), происходило образование осадка. Осажденные вещества собирали фильтрованием и сушили в печи в условиях вакуума с получением 4-хлор-2,3-динитробензойной кислоты в виде светло-желтого твердого вещества (4,8 г, неочищенный продукт). МС: m/z=247,0 [M+H]+.
2,3-Диамино-4-хлорбензойная кислота: К раствору 4-хлор-2,3-динитробензойной кислоты (4,80 г, неочищенная) в AcOH (80 мл) добавляли железный порошок (1000 мг, 3,58 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 2 часов при комнатной температуре. Нерастворимые твердые вещества, присутствующие в реакционной смеси, отфильтровывали и фильтрат концентрировали при пониженном давлении с получением 2,3-диамино-4-хлорбензойной кислоты в виде черного масла (3,12 г, неочищенный продукт). МС: m/z=186,9 [M+H]+.
8-Хлорхиноксалин-5-карбоновая кислота: К раствору 2,3-диамино-4-хлорбензойной кислоты (3,12 г, неочищенная) в этаноле (40 мл) добавляли раствор оксальдегида в H2O (40%, 14,4 моль/л, 20 мл, 0,29 моль) при комнатной температуре. Полученный раствор перемешивали в течение 2 часов при 75°C. После охлаждения до комнатной температуры реакционную смесь разбавляли при помощи H2O (50 мл) и полученную смесь экстрагировали этилацетатом (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 8-хлорхиноксалин-5-карбоновой кислоты в виде желтого масла (1,70 г, неочищенный продукт). МС: m/z=208,9 [M+H]+.
8-Хлорхиноксалин-5-карбоновая кислота: 8-хлорхиноксалин-5-карбоновую кислоту (1,70 г, неочищенная) добавляли к тионилхлориду (30 мл, 0,39 моль) при комнатной температуре. Полученный раствор перемешивали в течение 2 часов при 60°C. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении и остаток разбавляли при помощи DCM (30 мл). Полученный раствор охлаждали до 0°C и добавляли раствор NH4OH (28%, 14,8 моль/л, 20 мл, 0,30 моль) по каплям в течение 5 минут. Полученную смесь затем перемешивали в течение 1 часа при комнатной температуре. Когда реакция была завершена, реакционную смесь разбавляли при помощи 20 мл H2O и экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 50% градиент), с получением 8-хлорхиноксалин-5-карбоксамида в виде желтого масла (1,20 г, 6% для 4 стадий). МС: m/z=208,1 [M+H]+.
8-хлорхиноксалин-5-карбонитрил: К раствору 8-хлорхиноксалин-5-карбоксамида (0,78 г, 3,77 ммоль) в N,N-диметилформамиде (10 мл) добавляли POCl3 (4,00 г, 22,88 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 2 часов при 60°C. После охлаждения до комнатной температуры реакционную смесь гасили водой (30 мл) и экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 2% градиент), с получением 8-хлорхиноксалин-5-карбонитрила в виде не совсем белого твердого вещества (555 мг, 78%). МС: m/z=189,9 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,24 (с, 2H), 8,48 (д, J=8,1 Гц, 1H), 8,23 (д, J=8,1 Гц, 1H).
Промежуточное соединение 6: 8-бромхиноксалин-5-карбонитрил
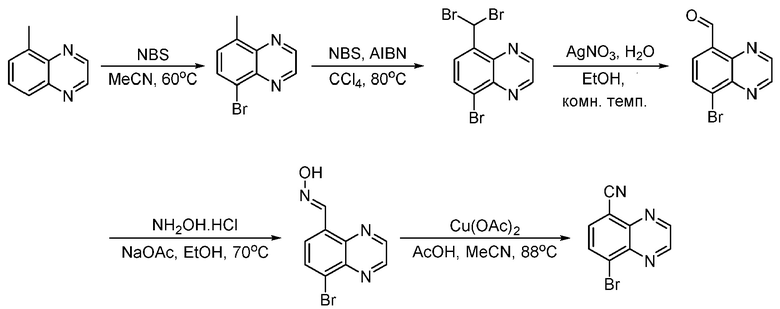
5-Бром-8-метилхиноксалин: К раствору 5-метилхиноксалина (9,50 г, 65,97 ммоль) в CH3CN (80 мл) добавляли 1-бромпирролидин-2,5-дион (27,00 г, 151,74 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 16 часов при 60°C. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении и остаток разбавляли этилацетатом (500 мл). Нерастворимые твердые вещества в смеси отфильтровывали и фильтрат промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 5-бром-8-метилхиноксалина в виде коричневого твердого вещества (6,00 г, 41%). МС: m/z=222,9 [M+H]+.
5-Бром-8-(дибромметил)хиноксалин: К раствору 5-бром-8-метилхиноксалина (6,00 г, 27,02 ммоль) в CCl4 (200 мл) добавляли NBS (19,23 г, 108,08 ммоль) и AIBN (0,71 г, 4,32 ммоль) при комнатной температуре. Полученный раствор затем перемешивали в течение 16 часов при 80°C. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении и остаток разбавляли этилацетатом (500 мл). Нерастворимые твердые вещества в смеси отфильтровывали и затем фильтрат промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 5% градиент), с получением 5-бром-8-(дибромметил)хиноксалина в виде светло-желтого твердого вещества (7,15 г, 70%). МС: m/z=378,7 [M+H]+.
8-Бромхиноксалин-5-карбальдегид: К раствору 5-бром-8-(дибромметил)хиноксалина (13,50 г, 35,71 ммоль) в этаноле (290 мл) добавляли раствор AgNO3 (24,27 г, 142,86 ммоль) в воде (90 мл) по каплям при комнатной температуре. Полученную смесь затем перемешивали в течение 1 часа при комнатной температуре. Когда реакция была завершена, реакционную смесь разбавляли при помощи CH3CN (300 мл), и происходило образование осадка. Осадок отфильтровывали и фильтрат концентрировали при пониженном давлении с получением 8-бромхиноксалин-5-карбальдегида в виде желтого твердого вещества (10,00 г, неочищенный продукт). МС: m/z=236,8 [M+H]+.
(E)-8-Бромхиноксалин-5-карбальдегид оксим: К раствору 8-бромхиноксалин-5-карбальдегида (10 г, неочищенный) в этаноле (100 мл) добавляли NaOAc (6,34 г, 73,42 ммоль) и NH2OH.HCl (3,12 г, 42,65 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов при 70°C. Когда реакция была завершена, нерастворимые твердые вещества, присутствующие в реакционной смеси, отфильтровывали при 70°C и затем фильтрат охлаждали до 0°C, происходило образование осадка. Осажденные вещества собирали фильтрованием и сушили в печи с получением (E)-N-[(8-бромхиноксалин-5-ил)метилиден]гидроксиламина в виде желтого твердого вещества (2,96 г, 33% для 2 стадий). МС: m/z=253,9 [M+H]+.
8-Бромхиноксалин-5-карбонитрил: К раствору (E)-N-[(8-бромхиноксалин-5-ил)метилиден]гидроксиламина (3,47 г, 13,82 ммоль) в ацетонитриле (20 мл) добавляли Cu(OAc)2 (577 мг, 3,18 ммоль) и уксусную кислоту (1,24 г, 20,73 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 15 часов при 88°C. После охлаждения до комнатной температуры реакционную смесь разбавляли ацетонитрилом (10 мл). Нерастворимые твердые вещества в смеси отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 15% градиент), с получением 8-бромхиноксалин-5-карбонитрила в виде желтого твердого вещества (1,22 г, 38%). МС: m/z=235,8 [M+H]+.
Промежуточное соединение 7: 5-Бромхиназолин-8-карбонитрил
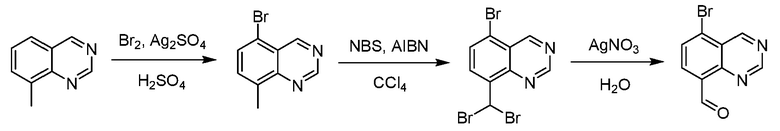
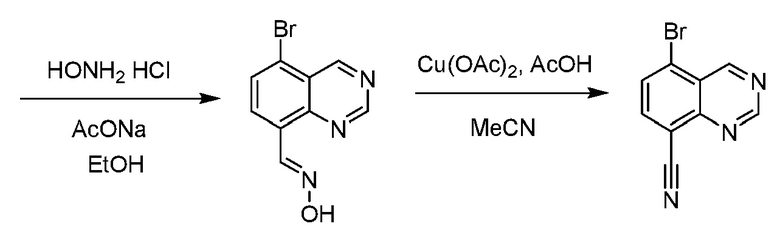
8-Метил-3H-хиназолин-4-он: 2-Амино-3-метилбензойную кислоту (125 г, 0,820 моль), формамидинацетат (257 г, 2,46 моль) и формамид (32,5 мл, 0,8200 моль) смешивали в 2-л круглодонной колбе, снабженной механической мешалкой. Реакционную смесь нагревали при 180°C в течение 3 часов. Завершение реакции отслеживали при помощи ЖХМС. Когда реакция завершалась, реакционную смесь охлаждали до комнатной температуры и разбавляли 2N раствором NaOH (300 мл). После перемешивания при этой же температуре в течение 15 минут реакционную смесь нейтрализовали 1,5N раствором HCl. Твердый осадок отфильтровывали, промывали ледяной водой и сушили в условиях вакуума с получением 8-метил-3H-хиназолин-4-она (125 г, 94%) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 12,2 (шир.с, 1H), 8,1 (с, 1H), 8,0 (д, J=7,8 Гц, 1H), 7,7 (д, J=7,2 Гц, 1H), 7,4 (т, J=7,6 Гц, 1H), 2,5 (с, 3H); ЖХ/МС(ESI) 161 (M+H).
4-Хлор-8-метилхиназолин: Оксихлорид фосфора (800 мл) загружали в 2-л круглодонную колбу в атмосфере азота. Затем добавляли 8-метилхиназолин-4(3H)-он (125 г) по порциям. Реакционную смесь кипятили с обратным холодильником при 120°C в течение 12 часов. Завершение реакции отслеживали при помощи ТСХ и ЖХМС. Когда реакция завершалась, реакционную смесь охлаждали до комнатной температуры и упаривали досуха при пониженном давлении. Полученный остаток растворяли в DCM (500 мл) и медленно гасили в охлажденном льдом насыщенном растворе K2CO3 при постоянном перемешивании. Затем органический слой отделяли и промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в условиях вакуума с получением 4-хлор-8-метилхиназолина (120 г, 86%) в виде желтого твердого вещества. Это вещество использовали на следующей стадии без дополнительной очистки. МС: m/z=179/181 [M+H]+.
8-Метилхиназолин: К перемешиваемому раствору 4-хлор-8-метилхиназолина (120 г, 0,674 моль) в DCM (700 мл) в атмосфере азота добавляли п-толуолсульфонилгидразид (175,7 г, 0,943 моль) по порциям. Реакционную смесь нагревали при 45°C в течение 12 часов. Завершение реакции отслеживали при помощи ЖХМС и ТСХ. Когда реакция завершалась, реакционную смесь охлаждали до комнатной температуры, растворитель выпаривали досуха, полученный остаток растворяли в EtOH (500 мл), добавляли 5N раствор NaOH (500 мл) и кипятили с обратным холодильником в течение 6 часов. Завершение реакции отслеживали при помощи ЖХМС. Когда реакция завершалась, реакционную смесь охлаждали до комнатной температуры и экстрагировали при помощи MTBE (3×600 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в условиях вакуума. Полученный остаток очищали хроматографией с использованием нейтрализованного силикагеля (60-120 меш) и элюировали смесью петролейный эфир/этилацетат с получением 8-метилхиназолина (60 г, 61%) в виде низкоплавкого желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,54 (с, 1H), 9,31 (с, 1H), 7,96 (дд, J=8,8, 8,1 Гц, 1H), 7,87-7,84 (м, 1H), 7,64 (д, J=15,2 Гц, 1H), 2,67 (с, 3H).
5-Бром-8-метилхиназолин: К перемешиваемому раствору сульфата серебра (151,5 г, 0,486 моль) в концентрированной серной кислоте (700 мл), добавляли 8-метилхиназолин (50 г, 0,347 моль) по порциям при 0°C. Добавляли по каплям бром (21,3 мл, 0,382 моль) и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакцию отслеживали при помощи ЖХМС с регулярными интервалами. По прошествии 16 часов ЖХМС анализ показал 40% исходного вещества, 7% изомера, 10% дибром-соединения и 40% продукта. Реакционную смесь гасили льдом, фильтровали и подщелачивали раствором гидроксида аммония. Водный слой экстрагировали при помощи MTBE (4×500 мл), промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия и концентрировали в условиях вакуума. Неочищенное вещество очищали колоночной хроматографией с использованием нейтрализованного силикагеля (60-120 меш) и элюировали смесью петролейный эфир/этилацетат с получением 5-бром-8-метилхиназолина (16 г, 20%) в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,59 (с, 1H), 9,39 (с, 1H), 7,92 (д, J=7,72 Гц, 1H), 7,76 (д, J=7,72 Гц, 1H), 2,62 (с, 3H); МС: m/z=223/225 [M+H]+.
5-Бром-8-дибромметилхиназолин: К перемешиваемому раствору 5-бром-8-метилхиназолина (53 г, 0,237 моль) в CCl4 (800 мл) в атмосфере азота добавляли N-бромсукцинимид (94,1 г, 0,522 моль) с последующим добавлением AIBN (7,8 г, 0,048 моль) при комнатной температуре. Реакционную смесь нагревали при 90°C в течение 12 часов. Когда реакция завершалась, реакционную смесь охлаждали до комнатной температуры, отфильтровывали и промывали при помощи CCl4. Фильтрат концентрировали и перекристаллизовывали с получением 5-бром-8-дибромметилхиназолина (61 г, 67%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,73 (с, 1H), 9,53 (с, 1H), 8,44 (д, J=8,04 Гц, 1H), 8,21 (д, J=8,04 Гц, 1H), 8,02 (с, 1H).
5-Бромхиназолин-8-карбальдегид: К перемешиваемому раствору 5-бром-8-дибромметилхиназолина (110 г, неочищенная смесь) в ацетоне (1 л) и воде (200 мл) добавляли нитрат серебра (110 г) по порциям при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Завершение реакции подтверждали при помощи ТСХ. Реакционную смесь отфильтровывали и фильтрат промывали 10% раствором NaHCO3 и экстрагировали этилацетатом (3×500 мл). Объединенный органический слой промывали водой и насыщенным солевым раствором. Растворитель сушили над сульфатом натрия и концентрировали в условиях вакуума с получением 5-бромхиназолин-8-карбальдегида. Это вещество использовали на следующей стадии без дополнительной очистки. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 11,14 (с, 1H), 9,80 (с, 1H), 9,58 (с, 1H), 8,29 (д, J=12,3 Гц, 2H); МС: m/z=237/239 [M+H]+.
5-Бромхиназолин-8-карбонитрил: К перемешиваемому раствору 5-бромхиназолин-8-карбальдегида (25 г, 0,105 моль) в DMF (125 мл), добавляли гидроксиламин (7,3 г 0,105 моль) и триэтиламин (89 мл, 0,633 моль) и T3P (100 мл, 0,158 моль). Реакционную смесь нагревали до 100°C в течение 3 часов. Реакцию отслеживали при помощи 1НЯМР. Когда реакция завершалась, реакционную смесь охлаждали до комнатной температуры и гасили льдом. Реакционную смесь отфильтровывали и фильтрат подщелачивали бикарбонатом натрия и экстрагировали этилацетатом (3 ×200 мл). Объединенный органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали в условиях вакуума с получением 5-бромхиназолин-8-карбонитрила (8 г, 32%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,80 (с, 1H), 9,58 (с, 1H), 8,55 (д, J=7,9 Гц, 2H), 8,27(д, J=7,8 Гц, 2H); МС: m/z=232/234 [M+H]+.
Промежуточное соединение 8: 5-Бром-хинолин-8-карбонитрил
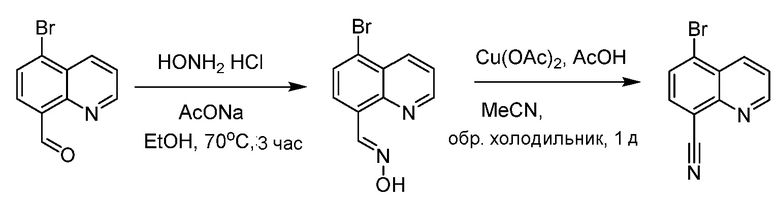
5-Бром-хинолин-8-карбальдегид оксим: Ацетат натрия (1,9 г; 23,3 ммоль), 5-бромхинолин-8-карбальдегид (5,0 г; 21,2 ммоль) и гидроксиламин гидрохлорид (1,6 г; 23,3 ммоль) добавляли в абсолютный этанол (50 мл). Бежевую суспензию нагревали при 70°C в течение 3 часов и реакционную смесь оставляли охлаждаться до комнатной температуры. После добавления воды (25 мл) бежевую суспензию концентрировали при пониженном давлении до ~30 мл. К бежевой суспензии добавляли воду (25 мл), трет-бутилметиловый эфир (12 мл) и гептан (12 мл), смесь перемешивали в течение 5 минут и концентрировали при пониженном давлении до ~30 мл. К бежевой суспензии добавляли воду (25 мл), смесь охлаждали до 0°C и добавляли 1N водный раствор гидроксида натрия (2 мл). Бежевую суспензию перемешивали при 0°C в течение 10 минут и фильтровали. Твердое вещество промывали водой и сушили в вакууме с получением 5-бром-хинолин-8-карбальдегид оксима (5,20 г; 94%) в виде бежевого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 11,61 (с, 1H), 9,16 (с, 1H), 9,03 (дд, J=4,2, 1,7 Гц, 1H), 8,54 (дд, J=8,6, 1,6 Гц, 1H), 8,08 (д, J=8,0 Гц, 1H), 8,00 (д, J=7,9 Гц, 1H), 7,75 (дд, J=8,6, 4,2 Гц, 1H); МС: m/z=251 [M+H]+.
5-Бром-хинолин-8-карбонитрил: К смеси 5-бром-хинолин-8-карбальдегид оксима (5,1 г; 20,3 ммоль) и ацетата меди(ii) моногидрата (81,1 мг; 0,41 ммоль) в безводном ацетонитриле (40 мл) добавляли уксусную кислоту (1,4 мл; 24,4 ммоль) и реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 1 дня. Коричневый раствор охлаждали и добавляли воду (40 мл). Бежевую суспензию концентрировали при пониженном давлении и к бежевой суспензии добавляли воду (30 мл). Смесь охлаждали до 0°C и добавляли 1N водный раствор гидроксида натрия (25 мл). Бежевую суспензию перемешивали при 0°C в течение 10 минут и фильтровали. Коричневое твердое вещество очищали перекристаллизацией в хлороформе и гексане с получением 5-бром-хинолин-8-карбонитрила (1,22 г; 26%) в виде кремового твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 9,13 (дд, J=4,3, 1,6 Гц, 1H), 8,61 (дд, J=8,6, 1,6 Гц, 1H), 7,98 (д, J=7,8 Гц, 1H), 7,92 (д, J=7,8 Гц, 1H), 7,66 (дд, J=8,6, 4,2 Гц, 1H); МС: m/z=234 [M+H]+.
Промежуточное соединение 9: 5-Бром-8-трифторметил-хиназолин
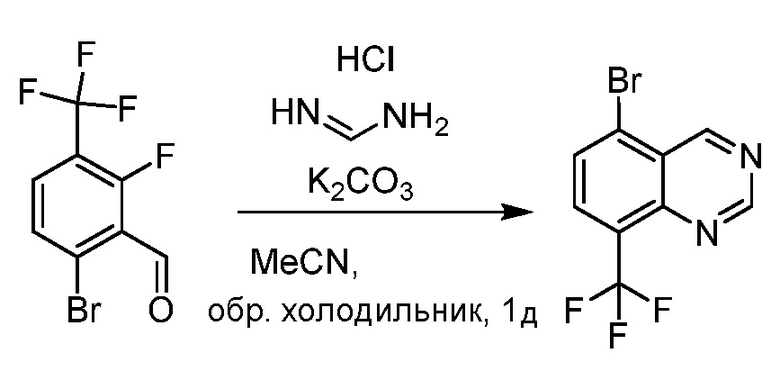
5-Бром-8-трифторметил-хиназолин: К раствору 6-бром-2-фтор-3-(трифторметил)бензальдегида (1,0 г; 3,69 ммоль) и формамидин гидрохлорида (594 мг; 7,38 ммоль) в безводном ацетонитриле (30 мл) добавляли карбонат калия (1,8 г; 12,9 ммоль) и молекулярные сита  (650 мг). Реакционную смесь нагревали при кипячении с обратным холодильником в течение ночи. Полученную суспензию охлаждали, фильтровали на целите, твердые вещества промывали ацетонитрилом и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке PuriFlash (40 г 15 мкм), элюируя гексаном и этилацетатом, с получением 5-бром-8-трифторметил-хиназолина (222 мг, 22%) в виде светло-желтого твердого вещества. МС: m/z=277 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,81 (с, 1H), 9,56 (с, 1H), 8,35 (д, J=8,0 Гц, 1H), 8,24 (д, J=8,0 Гц, 1H).
(650 мг). Реакционную смесь нагревали при кипячении с обратным холодильником в течение ночи. Полученную суспензию охлаждали, фильтровали на целите, твердые вещества промывали ацетонитрилом и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке PuriFlash (40 г 15 мкм), элюируя гексаном и этилацетатом, с получением 5-бром-8-трифторметил-хиназолина (222 мг, 22%) в виде светло-желтого твердого вещества. МС: m/z=277 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,81 (с, 1H), 9,56 (с, 1H), 8,35 (д, J=8,0 Гц, 1H), 8,24 (д, J=8,0 Гц, 1H).
Промежуточное соединение 10: 5-бром-8-метил-[1,7]нафтиридин

5-бром-8-метил-[1,7]нафтиридин: К смеси 5-бром-2-метил-пиридин-3-иламина (3,00 г; 16,0 ммоль), глицерина (4,7 мл; 64,1 ммоль), сульфата железа(II) гептагидрата (892 мг; 3,2 ммоль) добавляли серную кислоту (5,6 мл; 96,2 ммоль) по каплям. Полученную смесь нагревали при 120°C в течение ночи (o/n). Реакционную смесь обрабатывали льдом, 2N раствором гидроксида натрия, этилацетатом и дихлорметаном. После фильтрования для удаления темно-коричневого твердого вещества органический слой отделяли и промывали насыщенным солевым раствором, сушили и концентрировали. Неочищенное вещество очищали хроматографией на силикагеле, элюируя этилаацетатом и гексаном, с получением 5-бром-8-метил-[1,7]нафтиридина (470 мг, 13%). МС: m/z=224 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 9,14 (дд, J=4,2, 1,6 Гц, 1H), 8,72 (с, 1H), 8,50 (дд, J=8,6, 1,6 Гц, 1H), 7,96 (дд, J=8,5, 4,1 Гц, 1H), 2,95 (с, 3H).
Пример 1: Синтез соединения 1 (N-(2-(диэтиламино)этил)-1-(1,8-нафтиридин-4-ил)пиперидин-4-карбоксамид)
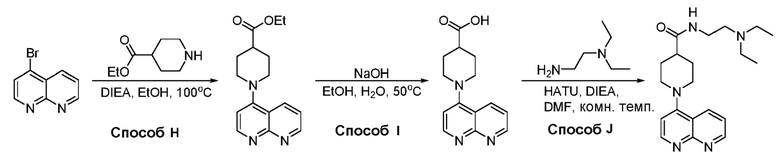
Способ H
Этил 1-(1,8-нафтиридин-4-ил)пиперидин-4-карбоксилат: в 25-мл реакционной пробирке, этилпиперидин-4-карбоксилат (157 мг, 1,00 ммоль) и DIEA (153 мг, 1,18 ммоль) добавляли к раствору 4-бром-1,8-нафтиридина (190 мг, 0,91 ммоль) в этаноле (10 мл) при комнатной температуре. Пробирку герметично закрывали и реакционную смесь нагревали до 100°C и перемешивали в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (20 мл) и полученную смесь экстрагировали при помощи DCM (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 1-(1,8-нафтиридин-4-ил)пиперидин-4-карбоксилата в виде желтого твердого вещества (211 мг, 81%).
(Примечание: в Способе H в качестве растворителя также можно использовать ацетонитрил, DMSO или NMP вместо EtOH, и температура реакции может быть в диапазоне от 95°C до 130°C)
Способ I
1-(1,8-Нафтиридин-4-ил)пиперидин-4-карбоновая кислота: К раствору этил 1-(1,8-нафтиридин-4-ил)пиперидин-4-карбоксилата (210 мг, 0,74 ммоль) в этаноле (9 мл) добавляли гидроксид натрия (147 мг, 3,67 ммоль) и воду (3 мл) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов при 50°C. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (10 мл). Значение pH полученной смеси доводили до 5 with раствором HCl (3M). Смесь экстрагировали при помощи DCM (50 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 1-(1,8-нафтиридин-4-ил)пиперидин-4-карбоновой кислоты в виде желтого твердого вещества (170 мг, 90%).
(Примечание: в Способе I гидроксид натрия также можно заменить гидроксидом лития, в качестве растворителя также можно использовать метанол или смесь метанола и THF вместо этанола, и температура реакции может быть в диапазоне от комнатной температуры до 50°C)
Способ J
N-(2-(диэтиламино)этил)-1-(1,8-нафтиридин-4-ил)пиперидин-4-карбоксамид. К раствору 1-(1,8-нафтиридин-4-ил)пиперидин-4-карбоновой кислоты (114 мг, 0,44 ммоль) в N,N-диметилформамиде (5 мл) добавляли (2-аминоэтил)диэтиламин (103 мг, 0,89 ммоль), DIEA (286 мг, 2,21 ммоль) и HATU (177 мг, 0,46 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 16 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (10 мл). Полученную смесь экстрагировали при помощи DCM (50 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: Колонка XBridge BEH130 Prep C18 OBD, 19 ×150мм 5мкм 13нм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 10% - 50% градиент за 10 мин; Детектор УФ 254 нм. N-[2-(диэтиламино)этил]-1-(1,8-нафтиридин-4-ил)пиперидин-4-карбоксамид в виде желтого сиропа (29 мг, 17%).
Соединение 1: ВЭЖХ: чистота 94,5%, RT=0,80 мин. МС: m/z=356,2 [M+H]+. 1H ЯМР (300 МГц, CDCl3, м.д.) δ 9,06 (дд, J=4,2, 2,0 Гц, 1 H), 8,92 (д, J=5,0 Гц, 1 H), 8,38 (дд, J=8,4, 2,0 Гц, 1 H), 7,43 (дд, J=8,4, 4,2 Гц, 1 H), 6,90 (д, J=5,1 Гц, 1 H), 6,64 (с, 1 H), 3,72-3,60 (м, 2 H), 3,54-3,35 (м, 2 H), 3,01-2,86 (м, 2 H), 2,66 (д, J=8,1 Гц, 6 H), 2,50-2,30 (м, 1 H), 2,21-2,00 (м, 4 H), 1,20-1,00 (м, 6 H).
Следующие соединения синтезировали аналогичным способом:
Соединение 2 ((4-(диэтиламино)пиперидин-1-ил)(1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-4-ил)метанон): из 8-хлорпиридо[2,3-b]пиразина, этилпиперидин-4-карбоксилата и N,N-диэтилпиперидин-4-амина. ВЭЖХ: чистота 96,5%, RT=1,18 мин. МС: m/z=397,1 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,97 (д, J=1,7 Гц, 1 H), 8,81 (д, J=1,7 Гц, 1 H), 8,69 (д, J=5,4 Гц, 1 H), 7,04 (д, J=5,5 Гц, 1 H), 4,42 (д, J=12,3 Гц, 3 H), 4,05 (д, J=13,6 Гц, 1H), 3,25-3,10 (м, 2 H), 3,06-2,93 (м, 2 H), 2,74-2,65 (м, 1 H), 2,55-2,45 (м, 5 H), 1,85-1,60 (м, 6 H), 1,40-1,10 (м, 2 H), 1,00-0,90 (м, 6 H).
Соединение 414 ([2-(2,6-диметил-пиперидин-1-ил)-этил]-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и 2-(3,5-диметил-пиперидин-1-ил)-этиламина. ВЭЖХ: чистота 95,7%, RT=2,60 мин. МС: m/z=420 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,45 (дд, J=8,5, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,49 (дд, J=8,5, 4,2 Гц, 1H), 7,05 (д, J=8,0 Гц, 1H), 6,23 (с, 1H), 3,53 (дт, J=12,9, 3,0 Гц, 2H), 3,39 (кв., J=5,6 Гц, 2H), 2,90 (тд, J=11,9, 2,8 Гц, 2H), 2,79 (д, J=10,2 Гц, 2H), 2,48 (т, J=6,0 Гц, 2H), 2,35 (тт, J=11,1, 4,2 Гц, 1H), 2,13 (дкв., J=12,2, 11,2, 3,8 Гц, 2H), 2,04 (дд, J=13,2, 3,7 Гц, 2H), 1,81-1,56 (м, 3H), 1,51 (т, J=10,8 Гц, 2H), 0,87 (д, J=6,5 Гц, 6H), 0,56 (кв., J=11,8 Гц, 1H).
Соединение 415 ((2-диметиламино-этил)-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и (2-аминоэтил)диметиламина. ВЭЖХ: чистота 97,8%, RT=1,84 мин. МС: m/z=352 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,45 (дд, J=8,5, 1,7 Гц, 1H), 8,01 (д, J=7,9 Гц, 1H), 7,49 (дд, J=8,5, 4,2 Гц, 1H), 7,05 (д, J=8,0 Гц, 1H), 6,17 (с, 1H), 3,53 (дт, J=12,0, 2,8 Гц, 2H), 3,37 (кв., J=6,1, 4,9 Гц, 2H), 2,89 (тд, J=12,0, 2,7 Гц, 2H), 2,49-2,40 (м, 2H), 2,36 (тт, J=11,2, 4,1 Гц, 1H), 2,25 (с, 6H), 2,14 (дкв., J=12,3, 11,4, 3,8 Гц, 2H), 2,08-1,98 (м, 2H).
Соединение 416 ([2-(этил-метил-амино)-этил]-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и (2-аминоэтил)(этил)метиламина. ВЭЖХ: чистота >99%, RT=1,94 мин. МС: m/z=366 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,45 (дд, J=8,5, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,49 (дд, J=8,5, 4,2 Гц, 1H), 7,05 (д, J=8,0 Гц, 1H), 6,20 (с, 1H), 3,53 (дт, J=12,0, 2,7 Гц, 2H), 3,37 (кв., J=5,3 Гц, 2H), 2,89 (тд, J=11,9, 2,7 Гц, 2H), 2,55-2,41 (м, 4H), 2,35 (тт, J=11,2, 4,2 Гц, 1H), 2,23 (с, 3H), 2,13 (дкв., J=12,2, 11,3, 3,8 Гц, 2H), 2,08-1,99 (м, 2H), 1,07 (т, J=7,1 Гц, 3H).
Соединение 419 ((2-морфолин-4-ил-этил)-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и 4-(2-аминоэтил)морфолина. ВЭЖХ: чистота >99%, RT=1,92 мин. МС: m/z=394 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,06 (дд, J=4,2, 1,7 Гц, 1H), 8,45 (дд, J=8,6, 1,7 Гц, 1H), 8,02 (д, J=8,0 Гц, 1H), 7,49 (дд, J=8,5, 4,2 Гц, 1H), 7,06 (д, J=8,0 Гц, 1H), 6,08 (с, 1H), 3,73 (т, J=4,7 Гц, 4H), 3,54 (д, J=12,2 Гц, 2H), 3,41 (кв., J=5,6 Гц, 2H), 2,91 (тд, J=11,9, 2,7 Гц, 2H), 2,53 (т, J=6,0 Гц, 2H), 2,48 (т, J=4,7 Гц, 4H), 2,36 (тт, J=11,2, 4,2 Гц, 1H), 2,14 (дкв., J=12,2, 11,4, 3,8 Гц, 2H), 2,08-1,98 (м, 2H).
Соединение 420 ((2-диметиламино-1-метил-этил)-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и 1-диметиламино-2-пропиламина. ВЭЖХ: чистота >99%, RT=2,06 мин. МС: m/z=366 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,06 (дд, J=4,2, 1,7 Гц, 1H), 8,46 (дд, J=8,5, 1,7 Гц, 1H), 8,02 (д, J=8,0 Гц, 1H), 7,50 (дд, J=8,5, 4,2 Гц, 1H), 7,06 (д, J=8,0 Гц, 1H), 5,96 (с, 1H), 3,96 (дкв., J=9,5, 5,9 Гц, 1H), 3,54 (д, J=12,2 Гц, 2H), 2,90 (тд, J=11,9, 2,8 Гц, 2H), 2,44-2,29 (м, 2H), 2,25 (с, 6H), 2,23-2,08 (м, 3H), 2,09-1,99 (м, 2H), 1,23 (д, J=6,4 Гц, 3H).
Соединение 421 ([2-(4-метил-пиперазин-1-ил)-этил]-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и 2-(4-метил-пиперазин-1-ил)-этиламина. ВЭЖХ: чистота 89,1%, RT=1,83 мин. МС: m/z=407 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,06 (дд, J=4,2, 1,7 Гц, 1H), 8,45 (дд, J=8,6, 1,7 Гц, 1H), 8,02 (д, J=8,0 Гц, 1H), 7,49 (дд, J=8,6, 4,2 Гц, 1H), 7,06 (д, J=7,9 Гц, 1H), 6,16 (с, 1H), 3,54 (д, J=12,3 Гц, 2H), 3,40 (кв., J=5,5 Гц, 2H), 2,91 (тд, J=11,9, 2,7 Гц, 2H), 2,54 (т, J=6,0 Гц, 4H), 2,47 (с, 4H), 2,36 (ддд, J=11,3, 7,0, 4,2 Гц, 1H), 2,31 (с, 3H), 2,13 (дкв., J=12,1, 11,3, 3,8 Гц, 2H), 2,07-2,01 (м, 2H).
Соединение 422 ((2-пирролидин-1-ил-этил)-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и n-(2-аминоэтил)пирролидина. ВЭЖХ: чистота >99%, RT=2,05 мин. МС: m/z=378 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,45 (дд, J=8,5, 1,8 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,49 (дд, J=8,5, 4,2 Гц, 1H), 7,05 (д, J=8,0 Гц, 1H), 6,19 (с, 1H), 3,53 (дт, J=12,1, 2,8 Гц, 2H), 3,40 (кв., J=5,4 Гц, 2H), 2,89 (тд, J=12,0, 2,6 Гц, 2H), 2,67-2,59 (м, 2H), 2,58-2,45 (м, 4H), 2,36 (тт, J=11,3, 4,1 Гц, 1H), 2,14 (дкв., J=12,3, 11,5, 3,9 Гц, 2H), 2,03 (дд, J=12,8, 3,1 Гц, 2H), 1,87-1,74 (м, 4H).
Соединение 427 ([2-(4,4-дифтор-пиперидин-1-ил)-этил]-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и 2-(4,4-дифторпиперидин-1-ил)этиламина. ВЭЖХ: чистота >99%, RT=2,23 мин. МС: m/z=428 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,44 (дд, J=8,6, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,49 (дд, J=8,5, 4,2 Гц, 1H), 7,05 (д, J=8,0 Гц, 1H), 6,07-5,96 (м, 1H), 3,54 (ддт, J=11,9, 4,1, 2,0 Гц, 2H), 3,41 (кв., J=5,6 Гц, 2H), 2,90 (тд, J=12,0, 2,6 Гц, 2H), 2,67-2,48 (м, 6H), 2,35 (тт, J=11,2, 4,1 Гц, 1H), 2,14 (дкв., J=12,3, 11,4, 3,8 Гц, 2H), 2,07-1,91 (м, 6H).
Соединение 433 ((1-метил-пирролидин-2-илметил)-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и (1-метилпирролидин-2-ил)метанамин. ВЭЖХ: чистота 98,9%, RT=2,01 мин. МС: m/z=378 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,06 (дд, J=4,2, 1,7 Гц, 1H), 8,45 (дд, J=8,6, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,49 (дд, J=8,5, 4,2 Гц, 1H), 7,05 (д, J=8,0 Гц, 1H), 6,10 (с, 1H), 3,65 (ддд, J=13,8, 7,8, 2,5 Гц, 1H), 3,59-3,48 (м, 2H), 3,13 (ддд, J=13,7, 4,2, 2,3 Гц, 1H), 3,07 (т, J=7,8 Гц, 1H), 2,90 (тт, J=12,1, 3,6 Гц, 2H), 2,42-2,35 (м, 1H), 2,33 (с, 3H), 2,25 (кв., J=8,9 Гц, 1H), 2,21-2,08 (м, 2H), 2,04 (дд, J=13,4, 3,8 Гц, 2H), 1,97-1,83 (м, 1H), 1,81-1,66 (м, 2H), 1,65-1,50 (м, 2H).
Соединение 434 ((1-циклопропилметил-пирролидин-3-ил)-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и 1-(циклопропилметил)пирролидин-3-амина. ВЭЖХ: чистота 96,6%, RT=2,18 мин. МС: m/z=404 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,44 (дд, J=8,6, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,49 (дд, J=8,6, 4,2 Гц, 1H), 7,05 (д, J=8,0 Гц, 1H), 6,08 (с, 1H), 4,51 (тддд, J=8,4, 6,3, 3,7, 2,3 Гц, 1H), 3,53 (дт, J=11,9, 2,6 Гц, 2H), 3,05 (тд, J=8,8, 3,4 Гц, 1H), 2,88 (тд, J=11,9, 2,7 Гц, 2H), 2,80 (дд, J=10,1, 2,6 Гц, 1H), 2,54 (дд, J=10,1, 6,4 Гц, 1H), 2,43-2,20 (м, 5H), 2,12 (дкв., J=12,0, 11,5, 3,8 Гц, 2H), 2,06-1,97 (м, 2H), 1,65 (дтт, J=11,5, 7,4, 3,2 Гц, 1H), 0,94-0,85 (м, 1H), 0,53 (ддд, J=8,0, 5,5, 4,2 Гц, 2H), 0,19-0,07 (м, 2H).
Соединение 435 ([1-(8-циано-хинолин-5-ил)-пиперидин-4-илметил]-амид (S)-1-этил-пирролидин-2-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и 1-этил-l-пролина. ВЭЖХ: чистота >99%, RT=2,21 мин. МС: m/z=392 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,41 (дд, J=8,5, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,66 (с, 1H), 7,47 (дд, J=8,6, 4,2 Гц, 1H), 7,04 (д, J=8,0 Гц, 1H), 3,50 (д, J=12,0 Гц, 2H), 3,38-3,23 (м, 2H), 3,19 (тд, J=6,9, 3,4 Гц, 1H), 3,08 (дд, J=10,3, 4,4 Гц, 1H), 2,86 (тт, J=11,9, 2,9 Гц, 2H), 2,68 (дкв., J=12,1, 7,3 Гц, 1H), 2,52 (дкв., J=12,1, 7,1 Гц, 1H), 2,34 (ддд, J=10,5, 9,1, 6,2 Гц, 1H), 2,19 (дтд, J=12,8, 10,2, 7,8 Гц, 1H), 1,98-1,67 (м, 6H), 1,62 (дкв., J=12,2, 4,2 Гц, 2H), 1,10 (т, J=7,2 Гц, 3H).
Соединение 439 ((2-азетидин-1-ил-этил)-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, этилпиперидин-4-карбоксилата и 2-(азетидин-1-ил)этан-1-амина. ВЭЖХ: чистота >99%, RT=1,89 мин. МС: m/z=364 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,45 (дд, J=8,5, 1,7 Гц, 1H), 8,01 (д, J=7,9 Гц, 1H), 7,49 (дд, J=8,6, 4,2 Гц, 1H), 7,05 (д, J=8,0 Гц, 1H), 6,09 (с, 1H), 3,53 (дт, J=12,3, 2,6 Гц, 2H), 3,31-3,15 (м, 6H), 2,88 (тд, J=11,9, 2,7 Гц, 2H), 2,55 (дд, J=6,3, 5,3 Гц, 2H), 2,34 (тт, J=11,2, 4,1 Гц, 1H), 2,22-1,98 (м, 6H).
Соединение 440 ((2-пиперидин-1-ил-этил)-амид 1-(8-циано-хиноксалин-5-ил)-пиперидин-4-карбоновой кислоты): из 8-бром-хиноксалин-5-карбонитрила, этилпиперидин-4-карбоксилата и 1-(2-аминоэтил)пиперидина. ВЭЖХ: чистота >99%, RT=1,96 мин. МС: m/z=393 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,8 Гц, 1H), 8,83 (д, J=1,8 Гц, 1H), 8,00 (д, J=8,3 Гц, 1H), 7,07 (д, J=8,3 Гц, 1H), 6,25 (с, 1H), 4,23 (дт, J=12,4, 2,8 Гц, 1H), 3,35 (тд, J=6,0, 4,8 Гц, 2H), 3,12 (ддд, J=12,4, 10,2, 3,9 Гц, 2H), 2,50-2,30 (м, 7H), 2,16-1,99 (м, 3H), 1,58 (п, J=5,5 Гц, 4H), 1,46 (кв., J=6,1 Гц, 2H).
Соединение 454 (4-[4-(8-циано-хиноксалин-5-ил)-пиперазин-1-ил]-N,N-диметил-4-оксо-бутирамид): из 8-бром-хиноксалин-5-карбонитрила, 1-boc-пиперазина и N,N-диметилсукцинамовой кислоты. ВЭЖХ: чистота >99%, RT=2,13 мин. МС: m/z=367 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,98 (д, J=1,8 Гц, 1H), 8,85 (д, J=1,8 Гц, 1H), 8,03 (д, J=8,2 Гц, 1H), 7,05 (д, J=8,3 Гц, 1H), 3,93 (т, J=5,2 Гц, 2H), 3,87 (т, J=5,1 Гц, 2H), 3,69 (т, J=5,1 Гц, 2H), 3,58 (т, J=5,2 Гц, 2H), 3,08 (с, 3H), 2,96 (с, 3H), 2,83-2,66 (м, 4H).
Соединение 456 ((2-диэтиламино-этил)-амид 1-(8-фтор-пиридо[3,4-b]пиразин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-хлор-8-фторпиридо[3,4-b]пиразина, этилпиперидин-4-карбоксилата и N,N-диэтилэтилендиамина. ВЭЖХ: чистота >99%, RT=1,38 мин. МС: m/z=376 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,8 Гц, 1H), 8,80 (д, J=1,8 Гц, 1H), 8,22 (д, J=1,3 Гц, 1H), 6,23 (с, 1H), 4,83-4,72 (м, 2H), 3,36-3,26 (м, 2H), 3,20-3,07 (м, 2H), 2,59-2,48 (м, 6H), 2,48-2,37 (м, 1H), 2,04-1,89 (м, 4H), 1,02 (т, J=7,1 Гц, 6H).
Пример 2: Синтез соединения 3 (1-(1-метил-1H-пиразоло[3,4-d]пиримидин-4-ил)-N-(2-(пиперидин-1-ил)этил)пиперидин-4-карбоксамид)
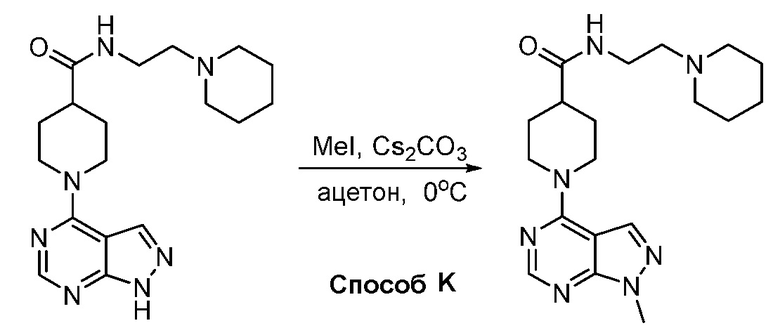
Способ K
1-(1-Метил-1H-пиразоло[3,4-d]пиримидин-4-ил)-N-(2-(пиперидин-1-ил)этил)пиперидин-4-карбоксамид. При 0°C к раствору N-[2-(пиперидин-1-ил)этил]-1-[1H-пиразоло[3,4-d]пиримидин-4-ил]пиперидин-4-карбоксамида (67 мг, 0,19 ммоль) в ацетоне (5 мл) добавляли MeI (53 мг, 0,37 ммоль) и Cs2CO3 (100 мг, 0,31 ммоль). Полученный раствор перемешивали в течение 1,5 часа при 0°C. Когда реакция была завершена, ее гасили путем добавления воды (10 мл). Полученную смесь экстрагировали при помощи DCM (30 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм ×250 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 10% - 23% градиент за 10 мин; Детектор УФ 254. 1-[1-метил-1H-пиразоло[3,4-d]пиримидин-4-ил]-N-[2-(пиперидин-1-ил)этил]пиперидин-4-карбоксамид в виде не совсем белого твердого вещества (7 мг, 10%).
Соединение 3: ВЭЖХ: чистота 99,1%, RT=0,81 мин. МС: m/z=372,2 [M+H]+. 1H ЯМР (300 МГц, CDCl3, м.д.) δ 8,38 (с, 1 H), 7,95 (с, 1 H), 6,44 (с, 1 H), 4,76 (д, J=13,2 Гц, 2 H), 4,04 (с, 3 H), 3,42-3,23 (м, 4 H), 2,60-2,30 (м, 7 H), 2,10-1,40 (м, 10H).
Пример 3: Синтез соединения 4 (N,N-диэтил-1-((1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-4-ил)метил)пиперидин-4-амин)
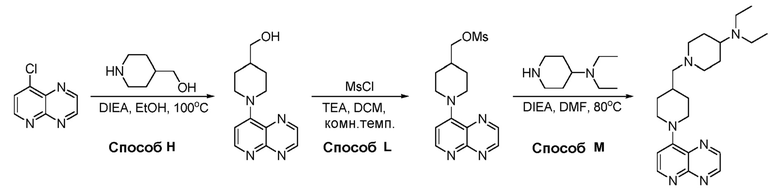
(1-(Пиридо[2,3-b]пиразин-8-ил)пиперидин-4-ил)метанол: (1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-4-ил)метанол получали из 8-хлорпиридо[2,3-b]пиразина и пиперидин-4-илметанола с использованием Способа H. (1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-4-ил)метанол получали в виде желтого твердого вещества (275 мг, 89%).
Способ L
(1-(Пиридо[2,3-b]пиразин-8-ил)пиперидин-4-ил)метил метансульфонат: К раствору (1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-4-ил)метанола (250 мг, 1,02 ммоль) и триэтиламина (155 мг, 1,53 ммоль) в дихлорметане (15 мл) добавляли метилсульфонилхлорид (152 мг, 1,33 ммоль) несколькими партиями при комнатной температуре. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (20 мл). Полученную смесь экстрагировали дихлорметаном (40 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением (1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-4-ил)метилметансульфоната в виде коричневого твердого вещества (300 мг, 91%). МС: m/z=323,1 [M+H]+.
Способ M
N,N-диэтил-1-((1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-4-ил)метил)пиперидин-4-амин: К раствору (1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-4-ил)метилметансульфоната (170 мг, 0,53 ммоль) в N,N-диметилформамиде (5 мл) добавляли N,N-диэтилпиперидин-4-амин (330 мг, 2,11 ммоль) и DIEA (136 мг, 1,05 ммоль, 2,00 экв.) при комнатной температуре. Полученный раствор перемешивали в течение 8 часов при 80°C. После охлаждения до комнатной температуры реакционную смесь гасили водой (10 мл) и экстрагировали при помощи DCM (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: Колонка XBridge BEH130 Prep C18 OBD, 19 ×150мм 5 мкм 13 нм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 10% - 23% градиент за 18 мин; Детектор УФ 254 нм. N,N-диэтил-1-[(1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-4-ил)метил]пиперидин-4-амин получали в виде коричневого твердого вещества (47 мг, 23%).
(Примечание: Температура реакции в Способе M может быть в диапазоне от 80°C до 130°C)
Соединение 4: ВЭЖХ: чистота 97,6%, RT=0,73 мин. МС: m/z=383,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,96 (д, J=1,7 Гц, 1H), 8,80 (д, J=1,7 Гц, 1H), 8,67 (д, J=5,4 Гц, 1H), 7,02 (д, J=5,5 Гц, 1H), 4,39 (д, J=12,5 Гц, 2H), 3,11-3,00 (м, 2H), 2,85 (д, J=11,1 Гц, 2H), 2,49-2,31 (м, 5H), 2,13 (д, J=6,7 Гц, 2H), 1,88-1,76 (м, 5H), 1,61 (д, J=12,0 Гц, 2H), 1,45-1,21 (м, 4H), 0,95-0,85 (м, 6H).
Пример 4: Синтез соединения 5 (N,N-диэтил-1-((1-(хинолин-4-ил)пиперидин-4-ил)метил)пиперидин-4-амин)
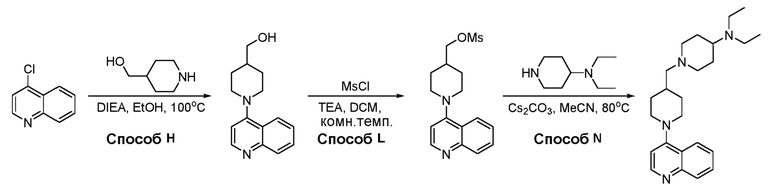
(1-(Хинолин-4-ил)пиперидин-4-ил)метилметансульфонат: (1-(хинолин-4-ил)пиперидин-4-ил)метилметансульфонат получали из 4-хлорхинолина, пиперидин-4-илметанола и метансульфонилхлорида с использованием Способа H и L. [1-(хинолин-4-ил)пиперидин-4-ил]метилметансульфонат получали в виде желтого твердого вещества (550 мг, неочищенный продукт). МС: m/z=321,0 [M+H]+.
Способ N
N,N-диэтил-1-((1-(хинолин-4-ил)пиперидин-4-ил)метил)пиперидин-4-амин. К раствору [1-(хинолин-4-ил)пиперидин-4-ил]метилметансульфоната (450 мг, неочищенный) в ацетонеитриле (8 мл) добавляли N,N-диэтилпиперидин-4-амин (209 мг, 1,34 ммоль) и Cs2CO3 (651 мг, 2,00 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение ночи при 80°C. После охлаждения до комнатной температуры реакционную смесь гасили водой (10 мл) и экстрагировали при помощи DCM (40 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм ×250 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 15% - 60% градиент за 8 мин; Детектор УФ 254 нм. N,N-диэтил-1-[[1-(хинолин-4-ил)пиперидин-4-ил]метил]пиперидин-4-амин получали в виде светло-желтого твердого вещества (40 мг, 15% для 3 стадий).
(Примечание: в Способе N в качестве растворителя также можно использовать DMF вместо ацетонитрила, и температура реакции может быть в диапазоне от 60°C до 130°C)
Соединение 5: ВЭЖХ: чистота 99,7%, RT=0,53 мин. МС: m/z=381,3 [M+H]+. 1H ЯМР (300 МГц, CDCl3, м.д.) δ 8,70 (д, J=5,0 Гц, 1H), 8,08-7,94 (м, 2H), 7,70-7,55 (м, 1H), 7,50-7,40 (м, 1H), 6,82 (д, J=5,0 Гц, 1H), 3,62 (д, J=12,0 Гц, 2H), 2,97 (д, J=11,5 Гц, 2H), 2,81 (дд, J=12,8, 10,6 Гц, 2H), 2,78-2,48 (м, 5H), 2,27 (д, J=7,0 Гц, 2H), 2,00-1,40 (м, 11H), 1,20-1,00 (м, 6H).
Пример 5: Синтез соединения 6 (4-(4-((2-(пиперидин-1-ил)этокси)метил)пиперидин-1-ил)хинолон)
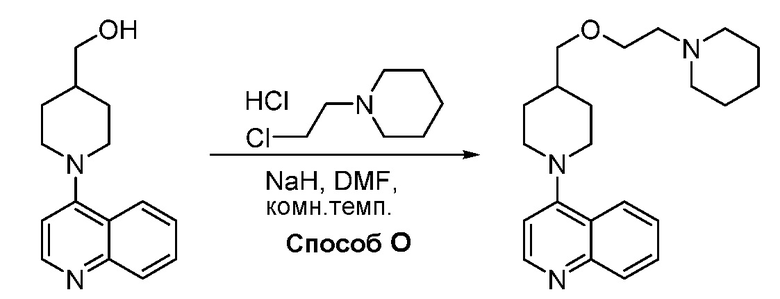
Способ O
4-(4-((2-(Пиперидин-1-ил)этокси)метил)пиперидин-1-ил): К раствору [1-(хинолин-4-ил)пиперидин-4-ил]метанола (190 мг, 0,78 ммоль) в N,N-диметилформамиде (20 мл) добавляли гидрид натрия (59 мг, 2,48 ммоль) при комнатной температуре. Полученную суспензию перемешивали в течение 30 минут при комнатной температуре и затем добавляли 1-(2-хлорэтил)пиперидин гидрохлорид (304 мг, 1,65 ммоль). Реакционную смесь перемешивали еще в течение 20 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (10 мл). Полученную смесь экстрагировали при помощи DCM (50 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: Колонка: XBridge C18 OBD Prep Column, 5 мкм, 19 мм ×250 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 41% - 50% градиент за 9 мин; Детектор УФ 254 нм. 4-(4-[[2-(пиперидин-1-ил)этокси]метил]пиперидин-1-ил)хинолин в виде не совсем белого твердого вещества (35 мг, 13%).
Соединение 6: ВЭЖХ: чистота 98,9%, RT=1,17 мин. МС: m/z=354,2 [M+H]+. 1H ЯМР (300 МГц, CDCl3, м.д.) δ 8,70 (д, J=5,0 Гц, 1 H), 8,06-7,96 (м, 2 H), 7,70-7,60 (м, 1 H), 7,50-7,40 (м, 1 H), 6,83 (д, J=5,0 Гц, 1 H), 3,69-3,56 (м, 4 H), 3,41 (д, J=6,0 Гц, 2 H), 2,90-2,75 (м, 2 H), 2,70-2,30 (м, 6 H), 2,00-1,35 (м, 11 H).
Пример 6: Синтез соединения 7 (2-морфолино-N-((1-(хинолин-4-ил)пиперидин-4-ил)метил)этанамин)
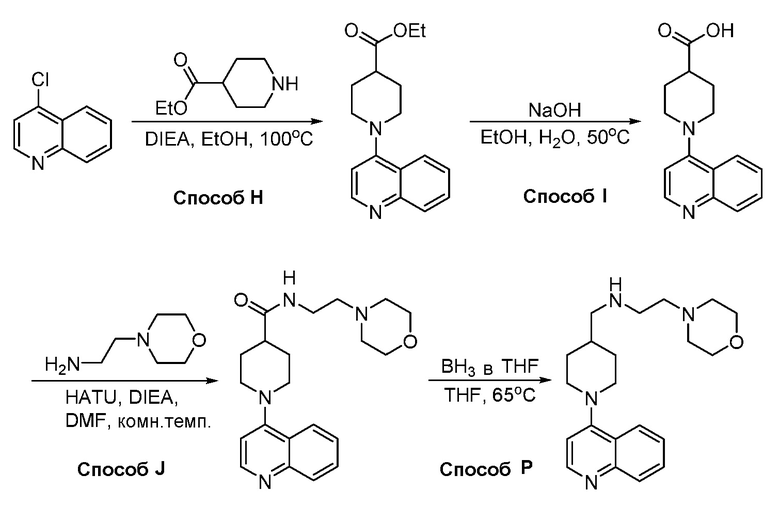
N-(2-Морфолиноэтил)-1-(хинолин-4-ил)пиперидин-4-карбоксамид: N-(2-морфолиноэтил)-1-(хинолин-4-ил)пиперидин-4-карбоксамид получали из 4-хлорхинолина, этилпиперидин-4-карбоксилата и 2-морфолиноэтанамина с использованием Способа H, I и J. N-[2-(морфолин-4-ил)этил]-1-(хинолин-4-ил)пиперидин-4-карбоксамид получали в виде желтого масла (374 мг, неочищенный продукт). МС: m/z=369,1 [M+H]+.
Способ P
2-Морфолино-N-((1-(хинолин-4-ил)пиперидин-4-ил)метил)этанамин: К раствору N-[2-(морфолин-4-ил)этил]-1-(хинолин-4-ил)пиперидин-4-карбоксамида (374 мг, неочищенный) в тетрагидрофуране (5 мл) добавляли BH3-THF (10 мл, 1M, 1,00 ммоль) при комнатной температуре. Полученный раствор затем перемешивали в течение 6 часов при 65°C. После охлаждения до комнатной температуры реакционную смесь гасили при помощи MeOH (2 мл) и экстрагировали при помощи DCM (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи MeOH в DCM (0% - 25% градиент), с получением 2-морфолино-N-((1-(хинолин-4-ил)пиперидин-4-ил)метил)этанамина в виде светло-желтого твердого вещества (50 мг, 10% для 4 стадий).
Соединение 7: ВЭЖХ: чистота 98,9%, RT=0,82 мин. МС: m/z=355,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,58 (д, J=5,2 Гц, 1H), 8,04 (дд, J=8,5, 1,5 Гц, 1H), 7,91 (дд, J=8,4, 1,3 Гц, 1H), 7,75-7,65 (м, 1H), 7,57-7,47 (м, 1H), 6,99 (д, J=5,2 Гц, 1H), 3,80-3,60 (м, 6H), 3,21-2,80 (м, 6H), 2,70-2,40 (м, 2H), 2,06-1,91 (м, 3H), 1,77-1,50 (м, 2H), 1,34-1,19 (м, 2H).
Пример 7: Синтез соединения 8 (2-морфолино-N-((1-(хинолин-4-ил)пиперидин-4-ил)метил)этанамин)
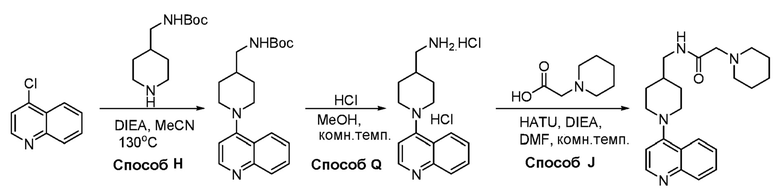
трет-Бутил (1-(хинолин-4-ил)пиперидин-4-ил)метилкарбамат: трет-бутил (1-(хинолин-4-ил)пиперидин-4-ил)метилкарбамат получали из 4-хлорхинолина и трет-бутилпиперидин-4-илметилкарбамат с использованием Способа H. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи MeOH в DCM (0% - 15% градиент), с получением трет-бутил N-[[1-(хинолин-4-ил)пиперидин-4-ил]метил]карбамата в виде светло-желтого твердого вещества (600 мг, 94%). МС: m/z=342,1 [M+H]+.
Способ Q
(1-(Хинолин-4-ил)пиперидин-4-ил)метанамин: К раствору трет-бутил N-[[1-(хинолин-4-ил)пиперидин-4-ил]метил]карбамата (557 мг, 1,63 ммоль) в MeOH (10 мл) добавляли концентрированный раствор HCl (12 M, 1,5 мл) при комнатной температуре. Полученный раствор перемешивали в течение 24 часов при комнатной температуре. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении с получением дигидрохлорида [1-(хинолин-4-ил)пиперидин-4-ил]метанамина в виде желтого твердого вещества (380 мг, 84%). МС: m/z=242,1 [M+H]+.
(Примечание: в Способе Q в качестве растворителя также можно использовать 1:1 смесь диоксан/MeOH или диоксан вместо MeOH)
2-(Пиперидин-1-ил)-N-((1-(хинолин-4-ил)пиперидин-4-ил)метил)ацетамид: 2-(пиперидин-1-ил)-N-((1-(хинолин-4-ил)пиперидин-4-ил)метил)ацетамид получали из гидрохлорида (1-(хинолин-4-ил)пиперидин-4-ил)метанамина и 2-(пиперидин-1-ил)уксусной кислоты с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 250 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 40% - 55% градиент за 10 мин; Детектор УФ 254 нм. 2-(пиперидин-1-ил)-N-[[1-(хинолин-4-ил)пиперидин-4-ил]метил]ацетамид получали в виде светло-желтого твердого вещества (152 мг, 72%).
Соединение 8: ВЭЖХ: чистота 98,1%, RT=1,46 мин. МС: m/z=367,2 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 8,66 (д, J=4,9 Гц, 1 H), 8,01-7,90 (м, 2 H), 7,83-7,62 (м, 2 H), 7,58-7,48 (м, 1 H), 6,96 (д, J=5,0 Гц, 1 H), 3,54 (д, J=12,1 Гц, 2 H), 3,19-3,09 (м, 2 H), 2,91 (с, 2 H), 2,86-2,70 (м, 2 H), 2,50-2,30 (м, 4 H), 1,85-1,62 (м, 3 H), 1,62-1,31 (м, 8 H).
Следующие соединения синтезировали аналогичным способом:
Соединение 388 (2-Пиперидин-1-ил-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-ацетамид): из 8-хлор-пиридо[2,3-b]пиразина, 4-(boc-аминометил) пиперидина и пиперидин-1-ил-уксусной кислотф. ВЭЖХ: чистота 98,6%, RT=1,16 мин. МС: m/z=369 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,7 Гц, 1H), 8,80 (д, J=5,4 Гц, 1H), 8,72 (д, J=1,7 Гц, 1H), 7,45 (с, 1H), 6,88 (д, J=5,4 Гц, 1H), 4,45 (д, J=12,7 Гц, 2H), 3,28 (т, J=6,3 Гц, 2H), 3,08 (тд, J=12,4, 2,3 Гц, 2H), 2,97 (с, 2H), 2,46 (с, 4H), 1,98-1,79 (м, 3H), 1,64-1,52 (м, 6H), 1,46 (дд, J=11,2, 5,5 Гц, 2H).
Соединение 390 (2-Диэтиламино-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-ил)-ацетамид): из 8-хлор-пиридо[2,3-b]пиразина, 4-n-boc-аминопиперидина и гидрохлорида 2-(диэтиламино)уксусной кислоты. ВЭЖХ: чистота >99%, RT=0,92 мин. МС: m/z=343 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,97 (д, J=1,7 Гц, 1H), 8,82 (д, J=5,3 Гц, 1H), 8,74 (д, J=1,7 Гц, 1H), 7,49 (д, J=8,5 Гц, 1H), 6,90 (д, J=5,4 Гц, 1H), 4,34 (дт, J=13,0, 2,9 Гц, 2H), 4,13 (дддд, J=15,0, 10,7, 8,6, 4,3 Гц, 1H), 3,26 (ддд, J=12,9, 11,4, 2,6 Гц, 2H), 3,04 (с, 2H), 2,56 (кв., J=7,1 Гц, 4H), 2,13 (дд, J=13,1, 3,8 Гц, 2H), 1,77 (дкв., J=11,5, 3,8 Гц, 2H), 1,03 (т, J=7,1 Гц, 6H).
Соединение 391 (3,4-Диметокси-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-бензамид): из 8-хлор-пиридо[2,3-b]пиразина, 4-(boc-аминометил)пиперидина и 3,4-диметоксибензойной кислоты. ВЭЖХ: чистота >99%, RT=1,90 мин. МС: m/z=408 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,7 Гц, 1H), 8,80 (д, J=5,4 Гц, 1H), 8,72 (д, J=1,8 Гц, 1H), 7,45 (д, J=2,0 Гц, 1H), 7,27 (дд, J=8,3, 2,1 Гц, 1H), 6,92-6,83 (м, 2H), 6,25 (т, J=6,2 Гц, 1H), 4,45 (д, J=12,4 Гц, 2H), 3,94 (с, 3H), 3,93 (с, 3H), 3,45 (т, J=6,3 Гц, 2H), 3,08 (тд, J=12,4, 2,4 Гц, 2H), 2,08-1,97 (м, 1H), 1,96 (д, J=13,7 Гц, 2H), 1,65 (дкв., J=12,1, 3,9 Гц, 2H).
Соединение 392 ((1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-амид пиридин-2-карбоновой кислоты): из 8-хлор-пиридо[2,3-b]пиразина, 4-(boc-аминометил)пиперидина и 2-пиколиновой кислоты. ВЭЖХ: чистота 98,7%, RT=1,19 мин. МС: m/z=349 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,99 (д, J=1,8 Гц, 1H), 8,74 (д, J=5,3 Гц, 1H), 8,62 (д, J=1,8 Гц, 1H), 8,59 (ддд, J=4,9, 1,8, 1,0 Гц, 1H), 7,80 (тд, J=7,7, 1,7 Гц, 1H), 7,62 (дт, J=7,9, 1,1 Гц, 1H), 7,34 (ддд, J=7,6, 4,9, 1,2 Гц, 1H), 6,73 (т, J=6,1 Гц, 1H), 6,58 (д, J=5,4 Гц, 1H), 4,83 (д, J=12,8 Гц, 1H), 4,04 (д, J=13,5 Гц, 1H), 3,33 (тд, J=6,5, 2,6 Гц, 2H), 3,09 (тд, J=13,5, 2,7 Гц, 1H), 2,84 (тд, J=12,9, 2,9 Гц, 1H), 2,07 (ддт, J=11,6, 8,3, 4,3 Гц, 1H), 2,00 (д, J=15,3 Гц, 1H), 1,83 (д, J=13,3 Гц, 1H), 1,47 (пд, J=12,3, 4,2 Гц, 2H).
Соединение 394 (2-Диметиламино-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-ацетамид): из 8-хлор-пиридо[2,3-b]пиразина, 4-(boc-аминометил)пиперидина и N,N-диметилглицина. ВЭЖХ: чистота >99%, RT=0,89 мин. МС: m/z=329 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,7 Гц, 1H), 8,79 (д, J=5,4 Гц, 1H), 8,72 (д, J=1,7 Гц, 1H), 7,32 (с, 1H), 6,87 (д, J=5,4 Гц, 1H), 4,43 (дт, J=12,8, 2,4 Гц, 2H), 3,28 (т, J=6,3 Гц, 2H), 3,06 (тд, J=12,4, 2,4 Гц, 2H), 2,97 (с, 2H), 2,30 (с, 6H), 1,97-1,82 (м, 3H), 1,58 (дтд, J=13,3, 11,7, 3,8 Гц, 2H).
Соединение 396 (3-Диэтиламино-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-ил)-пропионамид): из 8-хлор-пиридо[2,3-b]пиразина, 4-(n-boc-амино)пиперидина и гидрохлорида 3-(диэтиламино)пропановой кислоты. ВЭЖХ: чистота 90,1% ч, RT=1,02 мин. МС: m/z=357 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,04 (с, 1H), 8,97 (д, J=1,7 Гц, 1H), 8,83 (д, J=5,3 Гц, 1H), 8,75 (д, J=1,7 Гц, 1H), 6,90 (д, J=5,4 Гц, 1H), 4,27 (дт, J=12,7, 3,1 Гц, 2H), 4,17-4,03 (м, 1H), 3,27 (ддд, J=13,0, 11,1, 2,7 Гц, 2H), 2,67 (т, J=5,9 Гц, 2H), 2,57 (кв., J=7,1 Гц, 4H), 2,38 (т, J=5,8 Гц, 2H), 2,13 (дд, J=12,8, 3,7 Гц, 2H), 1,73 (дкв., J=11,0, 3,8 Гц, 2H), 1,06 (т, J=7,1 Гц, 6H).
Соединение 399 (3,3-Диметил-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-бутирамид): из 8-хлор-пиридо[2,3-b]пиразина, 4-(boc-аминометил)пиперидина и 3,3-диметилмасляной кислоты. ВЭЖХ: чистота 98,9%, RT=2,00 мин. МС: m/z=342 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,7 Гц, 1H), 8,80 (д, J=5,4 Гц, 1H), 8,72 (д, J=1,7 Гц, 1H), 6,87 (д, J=5,4 Гц, 1H), 5,51 (с, 1H), 4,43 (дт, J=11,0, 3,3 Гц, 2H), 3,24 (т, J=6,2 Гц, 2H), 3,07 (тд, J=12,4, 2,3 Гц, 2H), 2,07 (с, 2H), 1,93-1,79 (м, 3H), 1,56 (дкв., J=13,5, 12,9, 3,7 Гц, 3H), 1,05 (с, 9H).
Соединение 400 (4-Пиперидин-1-ил-1-(4-пиридо[2,3-b]пиразин-8-ил-пиперазин-1-ил)-бутан-1-он): из 8-хлор-пиридо[2,3-b]пиразина, 1-boc-пиперазина и гидрохлорида 4-(пиперидин-1-ил)бутановой кислоты. ВЭЖХ: чистота >99%, RT=1,02 мин. МС: m/z=369 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,00 (д, J=1,7 Гц, 1H), 8,86 (д, J=5,3 Гц, 1H), 8,76 (д, J=1,7 Гц, 1H), 6,87 (д, J=5,3 Гц, 1H), 3,96-3,79 (м, 5H), 3,83-3,66 (м, 4H), 2,51-2,27 (м, 8H), 1,87 (п, J=7,3 Гц, 2H), 1,57 (п, J=5,6 Гц, 4H), 1,50-1,37 (м, 2H).
Соединение 402 (2-Азетидин-1-ил-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-ацетамид): из 8-хлор-пиридо[2,3-b]пиразина, 4-(boc-аминометил)пиперидина и гидрохлорида 2-(азетидин-1-ил)уксусной кислоты. ВЭЖХ: чистота >99%, RT=0,94 мин. МС: m/z=341 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,7 Гц, 1H), 8,80 (д, J=5,3 Гц, 1H), 8,72 (д, J=1,7 Гц, 1H), 7,19 (с, 1H), 6,87 (д, J=5,4 Гц, 1H), 4,43 (д, J=12,5 Гц, 2H), 3,32 (т, J=7,1 Гц, 4H), 3,26 (т, J=6,3 Гц, 2H), 3,12 (с, 2H), 3,06 (тд, J=12,4, 2,3 Гц, 2H), 2,10 (п, J=7,1 Гц, 2H), 1,96-1,78 (м, 3H), 1,58 (дкв., J=13,3, 3,7 Гц, 2H).
Соединение 405 (2-Диэтиламино-N-метил-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-ацетамид): из 8-хлор-пиридо[2,3-b]пиразина, трет-бутил метил(пиперидин-4-илметил)карбамата и гидрохлорида 2-(диэтиламино)уксусной кислоты. ВЭЖХ: чистота >99%, RT=1,07 мин. МС: m/z=371 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,94 (д, J=1,7 Гц, 1H), 8,79 (д, J=5,4 Гц, 1H), 8,72 (д, J=1,7 Гц, 1H), 6,87 (д, J=5,4 Гц, 1H), 4,41 (д, J=12,7 Гц, 2H), 3,34 (д, J=7,3 Гц, 2H), 3,28 (с, 2H), 3,16 (с, 3H), 3,08 (тд, J=12,3, 2,6 Гц, 2H), 2,61 (кв., J=7,4 Гц, 4H), 2,07 (ддтд, J=14,7, 11,1, 7,6, 4,0 Гц, 1H), 1,84-1,77 (м, 2H), 1,59 (дкв., J=13,0, 12,5, 3,9 Гц, 2H), 1,05 (т, J=6,9 Гц, 6H).
Соединение 408 (2-(Этил-метил-амино)-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-ацетамид): из 8-хлор-пиридо[2,3-b]пиразина, 4-(boc-аминометил)пиперидина и [этил(метил)амино]уксусной кислоты. ВЭЖХ: чистота 98,9%, RT=1,35 мин. МС: m/z=343 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,94 (д, J=1,7 Гц, 1H), 8,79 (д, J=5,3 Гц, 1H), 8,72 (д, J=1,7 Гц, 1H), 7,43 (с, 1H), 6,87 (д, J=5,4 Гц, 1H), 4,44 (дт, J=12,4, 2,4 Гц, 2H), 3,27 (т, J=6,3 Гц, 2H), 3,07 (тд, J=12,5, 2,4 Гц, 2H), 3,01 (с, 2H), 2,49 (кв., J=7,2 Гц, 2H), 2,28 (с, 3H), 1,96-1,81 (м, 3H), 1,58 (дкв., J=13,3, 3,7 Гц, 2H), 1,06 (т, J=7,1 Гц, 3H).
Соединение 409 (N-[1-(8-циано-хинолин-5-ил)-пиперидин-4-илметил]-2-пиперидин-1-ил-ацетамид): из 5-бром-хинолин-8-карбонитрила, 4-(boc-аминометил)пиперидина и пиперидин-1-ил-уксусной кислоты. ВЭЖХ: чистота 99,0%, RT=2,25 мин. МС: m/z=392 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,41 (дд, J=8,5, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,47 (дд, J=8,5, 4,2 Гц, 2H), 7,04 (д, J=8,0 Гц, 1H), 3,50 (д, J=12,5 Гц, 2H), 3,33 (т, J=6,5 Гц, 2H), 2,99 (с, 2H), 2,86 (тд, J=12,0, 2,3 Гц, 2H), 2,49 (с, 4H), 1,90 (д, J=12,7 Гц, 2H), 1,79 (дтт, J=14,0, 6,8, 3,9 Гц, 1H), 1,71-1,52 (м, 6H), 1,47 (с, 2H).
Соединение 410 (N-[1-(8-циано-хинолин-5-ил)-пиперидин-4-илметил]-2-(этил-метил-амино)-ацетамид): из 5-бром-хинолин-8-карбонитрила, 4-(boc-аминометил)пиперидина и [этил(метил)амино]уксусной кислоты. ВЭЖХ: чистота 95,9%, RT=2,09 мин. МС: m/z=366 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,41 (дд, J=8,6, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,47 (дд, J=8,5, 4,2 Гц, 2H), 7,04 (д, J=8,0 Гц, 1H), 3,50 (д, J=12,3 Гц, 2H), 3,33 (т, J=6,5 Гц, 2H), 3,04 (с, 2H), 2,86 (тд, J=12,0, 2,3 Гц, 2H), 2,52 (кв., J=6,7 Гц, 2H), 2,32 (с, 3H), 1,91 (д, J=12,8 Гц, 2H), 1,79 (ддт, J=14,2, 6,9, 3,7 Гц, 1H), 1,62 (дкв., J=12,0, 3,8 Гц, 2H), 1,09 (т, J=7,1 Гц, 3H).
Соединение 411 ((1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-амид 1-Метил-пирролидин-2-карбоновой кислоты): из 8-хлор-пиридо[2,3-b]пиразина, 4-(boc-аминометил)пиперидина и 1-метилпирролидин-2-карбоновой кислоты. ВЭЖХ: чистота 99,7%, RT=1,02 мин. МС: m/z=355 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,7 Гц, 1H), 8,79 (д, J=5,4 Гц, 1H), 8,72 (д, J=1,7 Гц, 1H), 7,49 (с, 1H), 6,87 (д, J=5,4 Гц, 1H), 4,44 (д, J=12,6 Гц, 2H), 3,25 (тд, J=6,5, 2,3 Гц, 2H), 3,17-2,99 (м, 3H), 2,91 (дд, J=10,1, 5,3 Гц, 1H), 2,42-2,31 (м, 4H), 2,31-2,17 (м, 1H), 1,99-1,65 (м, 6H), 1,65-1,48 (м, 2H).
Соединение 412 (2-трет-Бутокси-N-[1-(8-циано-хинолин-5-ил)-пиперидин-4-илметил]-ацетамид): из 5-бром-хинолин-8-карбонитрила, 4-(boc-аминометил)пиперидина и трет-бутокси уксусной кислоты. ВЭЖХ: чистота >99%, RT=3,73 мин. МС: m/z=381 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,41 (дд, J=8,5, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,47 (дд, J=8,5, 4,2 Гц, 1H), 7,04 (д, J=8,0 Гц, 1H), 6,81 (с, 1H), 3,92 (с, 2H), 3,50 (д, J=11,9 Гц, 2H), 3,34 (т, J=6,6 Гц, 2H), 2,85 (тд, J=12,0, 2,3 Гц, 2H), 1,92 (д, J=13,4 Гц, 2H), 1,80 (дтт, J=14,3, 6,9, 3,8 Гц, 1H), 1,62 (дкв., J=12,0, 3,8 Гц, 2H), 1,25 (с, 9H).
Соединение 417 (2-Азетидин-1-ил-N-[1-(8-циано-хинолин-5-ил)-пиперидин-4-илметил]-ацетамид): из 5-бром-хинолин-8-карбонитрила, 4-(boc-аминометил)пиперидина и гидрохлорида 2-(азетидин-1-ил)уксусной кислоты. ВЭЖХ: чистота >99%, RT=2,05 мин. МС: m/z=364 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,41 (дд, J=8,5, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,47 (дд, J=8,5, 4,2 Гц, 1H), 7,21 (с, 1H), 7,04 (д, J=8,0 Гц, 1H), 3,50 (д, J=12,1 Гц, 2H), 3,43-3,20 (м, 6H), 3,14 (с, 2H), 2,85 (тд, J=12,1, 2,3 Гц, 2H), 2,11 (п, J=7,0 Гц, 2H), 1,91 (д, J=12,9 Гц, 2H), 1,78 (дтт, J=14,3, 7,0, 3,8 Гц, 1H), 1,61 (дкв., J=12,0, 3,9 Гц, 2H).
Соединение 418 ([1-(8-циано-хинолин-5-ил)-пиперидин-4-илметил]-амид 1-метил-пирролидин-2-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, 4-(boc-аминометил)пиперидина и 1-метилпирролидин-2-карбоновой кислоты. ВЭЖХ: чистота >99%, RT=2,11 мин. МС: m/z=378 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,04 (дд, J=4,2, 1,7 Гц, 1H), 8,40 (дд, J=8,5, 1,7 Гц, 1H), 8,00 (д, J=8,0 Гц, 1H), 7,58-7,49 (м, 1H), 7,47 (дд, J=8,5, 4,2 Гц, 1H), 7,04 (д, J=8,0 Гц, 1H), 3,50 (дт, J=12,2, 3,2 Гц, 2H), 3,30 (тд, J=6,6, 2,0 Гц, 2H), 3,12 (ддд, J=9,0, 6,6, 1,9 Гц, 1H), 2,93 (дд, J=10,2, 5,3 Гц, 1H), 2,85 (тдд, J=12,0, 4,0, 2,3 Гц, 2H), 2,45-2,33 (м, 4H), 2,26 (ддт, J=12,7, 9,8, 8,5 Гц, 1H), 1,96-1,87 (м, 2H), 1,86-1,69 (м, 4H), 1,67-1,53 (м, 2H).
Пример 8: Синтез соединения 9 ((3R,5S)-1-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-5-метилпиперидин-3-амин)
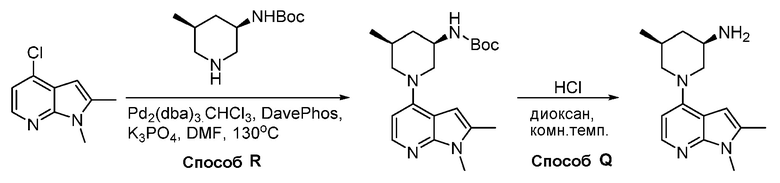
Способ R
трет-Бутил (3R,5S)-1-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-5-метилпиперидин-3-илкарбамат: К раствору 4-хлор-1,2-диметил-1H-пирроло[2,3-b]пиридина (200 мг, 1,11 ммоль) в N,N-диметилформамиде (10 мл) добавляли трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамат (237 мг, 1,11 ммоль), Pd2(dba)3.CHCl3 (115 мг, 0,11 ммоль), DavePhos (87 мг, 0,22 ммоль) и K3PO4 (588 мг, 2,77 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 2 часов при 130°C. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (10 мл). Полученную смесь экстрагировали этилацетатом (50 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 2% градиент), с получением трет-бутил N-[(3R,5S)-1-[1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил]-5-метилпиперидин-3-ил]карбамата в виде желтого твердого вещества (150 мг, 38%). МС: m/z=359,1 [M+H]+.
(Примечание: Катализатор в Способе R может представлять собой Pd2(dppf)Cl2.CHCl3) вместо Pd2(dba)3.CHCl3
(3R,5S)-1-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-5-метилпиперидин-3-амин: (3R,5S)-1-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-5-метилпиперидин-3-амин получали из трет-бутил (3R,5S)-1-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-5-метилпиперидин-3-илкарбамата с использованием Способа Q. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 250 мм; Подвижная фаза: метанол в воде (с 10 ммоль/л NH4HCO3), 3% - 65% градиент за 8 мин; Детектор УФ 254 нм. (3R,5S)-1-[1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил]-5-метилпиперидин-3-амин получали в виде не совсем белого твердого вещества (30 мг, 26%).
Соединение 9: ВЭЖХ: чистота 97,8%, RT=0,91 мин. МС: m/z=259,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 7,91 (д, J=5,7 Гц, 1H), 6,49 (д, J=5,7 Гц, 1H), 6,30 (д, J=1,2 Гц, 1H), 4,22-4,12 (м, 1H), 4,00-3,91 (м, 1H), 3,71 (с, 3H), 3,11-3,00 (м, 1H), 2,63-2,41 (м, 5H), 2,17-2,07 (м, 1H), 2,00-1,80 (м, 1H), 1,10-0,96 (м, 4H).
Пример 9: Синтез соединения 10 ((3R,5S)-1-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-5-метилпиперидин-3-амин)
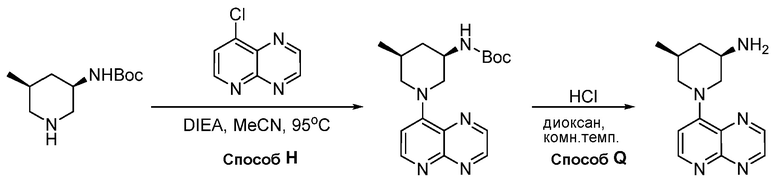
(3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амин: (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амин получали из трет-бутил (3R,5S)-5-метилпиперидин-3-илкарбамата и 8-хлорпиридо[2,3-b]пиразина с использованием Способа H и Q. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 250 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 3% - 22% градиент за 9 мин; Детектор УФ 254 нм. (3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-амин получали в виде желтого сиропа (20 мг, 10% для 2 стадий).
Соединение 10: ВЭЖХ: чистота 94,1%, RT=1,10 мин. МС: m/z=244,0 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,93 (д, J=1,8 Гц, 1H), 8,82 (д, J=1,8 Гц, 1H), 8,65 (д, J=5,6 Гц, 1H), 7,06 (д, J=5,7 Гц, 1H), 4,78-4,68 (м, 1H), 4,56-4,46 (м, 1H), 3,12-2,98 (м, 1H), 2,80-2,60 (м, 2H), 2,19-2,08 (м, 1H), 2,08-1,88 (м, 1H), 1,18-0,89 (м, 4H).
Следующие соединения синтезировали аналогичным способом:
Соединение 11 ((3R,5S)-5-метил-1-(хинолин-4-ил)пиперидин-3-амин): из трет-бутил (3R,5S)-5-метилпиперидин-3-илкарбамата и 4-хлорхинолина. ВЭЖХ: чистота 99,9%, RT=0,86 мин. МС: m/z=242,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,64 (д, J=5,2 Гц, 1H), 8,11-8,04 (м, 1H), 8,00-7,93 (м, 1H), 7,78-7,68 (м, 1H), 7,63-7,53 (м, 1H), 7,04 (д, J=5,2 Гц, 1H), 3,83-3,74 (м, 1H), 3,64-3,55 (м, 1H), 3,35-3,20 (м, 1H), 2,60-2,40 (м, 2H), 2,24-2,07 (м, 2H), 1,13-0,99 (м, 4H).
Соединение 12 (8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрил): из 8-хлорхиноксалин-5-карбонитрила и трет-бутил (3R,5S)-5-метилпиперидин-3-илкарбамата. ВЭЖХ: чистота 98,3%, RT=1,20 мин. МС: m/z=268,0 [M+H]+. 1H ЯМР (300 МГц, CDCl3, м.д.) δ 8,96 (с, 1H), 8,91 (с, 1H), 8,12 (д, J=8,5 Гц, 1H), 7,24 (д, J=8,5 Гц, 1H), 4,50-4,38 (м, 1H), 4,22-4,08 (м, 1H), 3,34-3,15 (м, 1H), 2,80-2,55 (м, 2H), 2,30-1,95 (м, 2H), 1,20-1,00 (м, 4H).
Пример 10: Синтез соединения 13 (N-((3R,5S)-1-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-5-метилпиперидин-3-ил)-2-гидроксиацетамид)
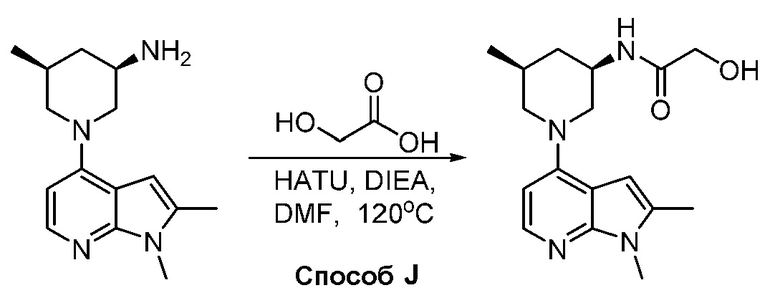
N-((3R,5S)-1-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-5-метилпиперидин-3-ил)-2-гидроксиацетамид: N-((3R,5S)-1-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-5-метилпиперидин-3-ил)-2-гидроксиацетамид получали из (3R,5S)-1-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-5-метилпиперидин-3-амина и 2-гидроксиуксусной кислоты с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 3% - 75% градиент за 8 мин; Детектор УФ 254 нм. N-[(3R,5S)-1-[1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил]-5-метилпиперидин-3-ил]-2-гидроксиацетамид получали в виде белого твердого вещества (30 мг, 17%).
Соединение 13: ВЭЖХ: чистота 96,9%, RT=0,67 мин. МС: m/z=317,1 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 7,81 (д, J=5,4 Гц, 1H), 7,61 (д, J=7,9 Гц, 1H), 6,35 (д, J=5,5 Гц, 1H), 6,20 (с, 1H), 5,42 (с, 1H), 4,00-3,91 (м, 1H), 3,88-3,74 (м, 4H), 3,57 (с, 3H), 2,51 (д, J=11,5 Гц, 1H), 2,47-2,28 (м, 3H), 1,90-1,60 (м, 2H), 1,28-1,10 (м, 1H), 0,86 (д, J=6,5 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 14 (2-гидрокси-N-((3R,5S)-5-метил-1-(хинолин-4-ил)пиперидин-3-ил)ацетамид): из (3R,5S)-5-метил-1-(хинолин-4-ил)пиперидин-3-амина и 2-гидроксиуксусной кислоты. ВЭЖХ: чистота 98,3%, RT=1,04 мин. МС: m/z=300,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,62 (д, J=5,2 Гц, 1H), 8,15 (дд, J=8,3, 1,4 Гц, 1H), 7,96 (дд, J=8,4, 1,2 Гц, 1H), 7,78-7,68 (м, 1H), 7,64-7,54 (м, 1H), 7,05 (д, J=5,3 Гц, 1H), 4,38-4,26 (м, 1H), 4,01 (с, 2H), 3,90-3,81 (м, 1H), 3,64 (д, J=12,3 Гц, 1H), 2,70-2,50 (м, 2H), 2,19-2,10 (м, 2H), 1,37-1,25 (м, 1H), 1,07 (д, J=6,4 Гц, 3H).
Соединение 15 (2-гидрокси-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)ацетамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 2-гидроксиуксусной кислоты. ВЭЖХ: чистота 95,3%, RT=0,73 мин. МС: m/z=302,0 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,8 Гц, 1H), 8,80 (д, J=1,7 Гц, 1H), 8,65 (д, J=5,7 Гц, 1H), 7,13 (д, J=5,6 Гц, 1H), 4,72-4,56 (м, 2H), 4,20-4,08 (м, 1H), 3,99 (с, 2H), 3,05-2,95 (м, 1H), 2,83-2,73 (м, 1H), 2,14-1,94 (м, 2H), 1,45-1,25 (м, 1H), 1,02 (д, J=6,6 Гц, 3H).
Соединение 20 ((S)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-гидрокси-3-метилбутанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и (S)-2-гидрокси-3-метилбутановой кислоты. ВЭЖХ: чистота 98,4%, RT=3,24 мин. МС: m/z=368,1 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,03 (д, J=1,8 Гц, 1H), 8,93 (д, J=1,8 Гц, 1H), 8,20 (д, J=8,4 Гц, 1H), 7,70 (д, J=8,0 Гц, 1H), 7,27 (д, J=8,5 Гц, 1H), 5,32 (д, J=5,7 Гц, 1H), 4,30 (д, J=13,2 Гц, 1H), 4,17 (д, J=11,8 Гц, 1H), 4,05-3,85 (м, 1H), 3,66 (дд, J=5,8, 4,0 Гц, 1H), 2,94-2,84 (м, 1H), 2,73-2,63 (м, 1H), 2,03-1,86 (м, 3H), 1,40-1,20 (м, 1H), 0,95-0,85 (м, 6H), 0,78 (д, J=6,8 Гц, 3H).
Соединение 21 (((R)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-гидрокси-3-метилбутанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и (R)-2-гидрокси-3-метилбутановой кислоты. ВЭЖХ: чистота 97,6%, RT=1,31 мин. МС: m/z=368,3 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,03 (д, J=1,7 Гц, 1H), 8,94 (д, J=1,7 Гц, 1H), 8,19 (д, J=8,4 Гц, 1H), 7,69 (д, J=8,1 Гц, 1H), 7,26 (д, J=8,5 Гц, 1H), 5,34 (д, J=5,6 Гц, 1H), 4,30-4,15 (м, 2H), 4,05-3,90 (м, 1H), 3,68 (дд, J=5,6, 3,9 Гц, 1H), 2,98-2,88 (м, 1H), 2,75-2,60 (м, 1H), 2,02-1,85 (м, 3H), 1,40-1,20 (м, 1H), 0,96-0,85 (м, 6H), 0,78 (д, J=6,8 Гц, 3H).
Соединение 22 ((S)-2-гидрокси-3-метил-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)бутанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (S)-2-гидрокси-3-метилбутановой кислоты. ВЭЖХ: чистота 96,8%, RT=1,05 мин. МС: m/z=344,0 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95 (д, J=1,8 Гц, 1H), 8,82 (д, J=1,7 Гц, 1H), 8,68 (д, J=5,6 Гц, 1H), 7,17 (д, J=5,7 Гц, 1H), 4,71-4,60 (м, 2H), 4,18-4,08 (м, 1H), 3,87 (с, 1H), 3,05-2,94 (м, 1H), 2,87-2,76 (м, 1H), 2,15-1,95 (м, 3H), 1,50-1,30 (м, 1H), 1,09-0,99 (м, 6H), 0,91 (д, J=6,8 Гц, 3H).
Соединение 23 ((R)-2-гидрокси-3-метил-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)бутанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (R)-2-гидрокси-3-метилбутановой кислоты. ВЭЖХ: чистота 96,9%, RT=1,02 мин. МС: m/z=344,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95 (д, J=1,8 Гц, 1H), 8,83 (д, J=1,8 Гц, 1H), 8,68 (д, J=5,6 Гц, 1H), 7,16 (д, J=5,7 Гц, 1H), 4,58-4,72 (м, 2H), 4,20-4,10 (м, 1H), 3,89 (м, 1H), 3,06-2,96 (м, 1H), 2,86-2,75 (м, 1H), 2,15-1,95 (м, 3H), 1,42-1,30 (м, 1H), 1,10-1,00 (м, 6H), 0,90 (д, J=6,8 Гц, 3H).
Соединение 32 (N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-(диметиламино)ацетамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-(диметиламино)уксусной кислоты. ВЭЖХ: чистота 96,9%, RT=1,25 мин. МС: m/z=353,2 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,03 (д, J=1,7 Гц, 1H), 8,94 (д, J=1,7 Гц, 1H), 8,19 (д, J=8,4 Гц, 1H), 7,75 (д, J=8,1 Гц, 1H), 7,27 (д, J=8,5 Гц, 1H), 4,33-4,13 (м, 2H), 4,05-3,88 (м, 1H), 2,97-2,79 (м, 3H), 2,72-2,60 (м, 1H), 2,21 (с, 6H), 1,98-1,82 (м, 2H), 1,34-1,20 (м, 1H), 0,92 (д, J=6,2 Гц, 3H).
Соединение 33 (2-(диметиламино)-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)ацетамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 2-(диметиламино)уксусной кислоты. ВЭЖХ: чистота 99,6%, RT=1,31 мин. МС: m/z=329,0 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,7 Гц, 1H), 8,82 (д, J=1,7 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 7,16 (д, J=5,6 Гц, 1H), 4,74-4,59 (м, 3H), 4,20-4,04 (м, 1H), 3,10-2,89 (м, 3H), 2,83-2,73 (м, 1H), 2,34 (с, 6H), 2,16-1,93 (м, 2H), 1,40-1,28 (м, 1H), 1,04 (д, J=6,6 Гц, 3H).
Соединение 36 (N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-3-метилоксетан-3-карбоксамид): из 8-хлорхиноксалин-5-карбонитрила, трет-бутил (3R,5S)-5-метилпиперидин-3-илкарбамата и 3-метилоксетан-3-карбоновой кислоты. ВЭЖХ: чистота 99,2%, RT=1,15 мин. МС: m/z=366,0 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,7 Гц, 1H), 8,86 (д, J=1,8 Гц, 1H), 8,05 (д, J=8,4 Гц, 1H), 7,25 (д, J=8,4 Гц, 1H), 4,95-4,85 (м, 2H), 4,41-4,02 (м, 5H), 2,80-2,55 (м, 2H), 2,12-1,93 (м, 2H), 1,57 (с, 3H), 1,31-1,12 (м, 1H), 0,98 (д, J=6,4 Гц, 3H).
Соединение 37 (3-метил-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)оксетан-3-карбоксамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 3-метилоксетан-3-карбоновой кислоты. ВЭЖХ: чистота 99,8%, RT=0,88 мин. МС: m/z=342,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,81 (д, J=1,7 Гц, 1H), 8,66 (д, J=5,6 Гц, 1H), 7,16 (д, J=5,6 Гц, 1H), 4,90-4,80 (м, 2H), 4,73-4,61 (м, 2H), 4,39 (д, J=6,1 Гц, 2H), 4,15-4,03 (м, 1H), 2,91-2,71 (м, 2H), 2,12-1,92 (м, 2H), 1,60 (с, 3H), 1,34-1,22 (м, 1H), 1,01 (д, J=6,6 Гц, 3H).
Соединение 40 (N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-3,3-диметилбутанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 3,3-диметилбутановой кислоты. ВЭЖХ: чистота 95,2%, RT=3,11 мин. МС: m/z=366,1 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,02 (д, J=1,7 Гц, 1H), 8,93 (д, J=1,7 Гц, 1H), 8,20 (д, J=8,4 Гц, 1H), 7,79 (д, J=7,4 Гц, 1H), 7,28 (д, J=8,5 Гц, 1H), 4,38-4,19 (м, 2H), 3,99-3,84 (м, 1H), 2,79-2,63 (м, 2H), 2,00-1,80 (с, 4H), 1,24-1,10 (м, 1H), 1,02-0,87 (м, 12Н).
Соединение 41 (3,3-диметил-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)бутанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 3,3-диметилбутановой кислоты. ВЭЖХ: чистота 94,8%, RT=0,96 мин. МС: m/z=342,2 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,00 (д, J=1,7 Гц, 1H), 8,83 (д, J=1,7 Гц, 1H), 8,71 (д, J=5,5 Гц, 1H), 7,82 (д, J=7,5 Гц, 1H), 7,16 (д, J=5,6 Гц, 1H), 4,59 (д, J=13,1 Гц, 1H), 4,46 (д, J=12,6 Гц, 1H), 3,94-3,80 (м, 1H), 2,82-2,68 (м, 2H), 2,00-1,85 (м, 4H), 1,31-1,18 (м, 1H), 1,00-0,80 (м, 12 Н).
Соединение 97 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-гидроксиацетамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-гидроксиуксусной кислоты. ВЭЖХ: чистота 97,5%, RT=1,35 мин. МС: m/z=326,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 9,05-8,83 (м, 2H), 8,10 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,34 (дд, J=12,0, 4,3 Гц, 1H), 4,29-4,17 (м, 2H), 4,02 (с, 2H), 2,99-2,87 (м, 1H), 2,72 (т, J=11,6 Гц, 1H), 2,16-2,00 (м, 2H), 1,42-1,30 (м, 1H), 1,04 (д, J=6,4 Гц, 3H).
Соединение 108 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(морфолин-4-ил)ацетамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (R)-2-(трет-бутоксикарбониламино)-3-гидроксипропановой кислоты. ВЭЖХ: чистота 98,7%, RT=1,95 мин. МС: m/z=395,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,83 (м, 2H), 8,10 (д, J=12,0 Гц, 1H), 7,28 (д, J=12,0 Гц, 1H), 4,37-4,13 (м, 3H), 3,78-3,68 (м, 4H), 3,05 (с, 2H), 2,92-2,78 (м, 1H), 2,75-2,65 (м, 1H), 2,58-2,48 (м, 4H), 2,15-1,95 (м, 2H), 1,38-1,20 (м, 1H), 1,02 (д, J=12,0 Гц, 3H).
Соединение 109 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(4-метилпиперазин-1-ил)ацетамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-(4-метилпиперазин-1-ил)уксусной кислоты. ВЭЖХ: чистота 99,8%, RT=1,47 мин. МС: m/z=408,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 m, 2H), 8,10 (д, J=8,4 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 4,41-4,12 (м, 3H), 3,14-3,01 (м, 2H), 2,86 (дд, J=11,9, 10,6 Гц, 1H), 2,72 (дд, J=12,6, 10,8 Гц, 1H), 2,60-2,40 (м, 7H), 2,32 (с, 3H), 2,09 (т, J=14,0 Гц, 2H), 1,36-1,24 (м, 1H), 1,04 (д, J=6,4 Гц, 3H).
Соединение 110 (N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 2-морфолиноуксусной кислоты. ВЭЖХ: чистота 96,5%, RT=1,31 мин. МС: m/z=371,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,7 Гц, 1H), 8,77 (д, J=1,7 Гц, 1H), 8,63 (д, J=5,6 Гц, 1H), 7,11 (д, J=5,7 Гц, 1H), 4,70-4,55 (м, 2H), 4,08 (т, J=11,4 Гц, 1H), 3,74-3,65 (м, 4H), 3,11-2,84 (м, 3H), 2,75 (дд, J=12,9, 11,1 Гц, 1H), 2,52-2,49 (м, 4H), 2,08-1,94 (м, 2H), 1,40-1,20 (м, 1H), 0,99 (д, J=6,5 Гц, 3H).
Соединение 111 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3,3-трифторпропанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 3,3,3-трифторпропановой кислоты. ВЭЖХ: чистота 91,5%, RT=1,38 мин. МС: m/z=378,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,93-8,80 (м, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,24 (д, J=8,4 Гц, 1H), 4,44-4,30 (м, 1H), 4,29-4,03 (м, 2H), 3,14 (кв., J=10,7 Гц, 2H), 2,68 (дт, J=23,6, 11,6 Гц, 2H), 2,14-1,93 (м, 2H), 1,21-1,16 (м, 1H), 0,98 (д, J=6,4 Гц, 3H).
Соединение 120 (3,3,3-трифтор-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]пропанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 3,3,3-трифторпропановой кислоты. ВЭЖХ: чистота 95,3%, RT=1,07 мин. МС: m/z=354,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,90 (д, J=1,7 Гц, 1H), 8,78 (д, J=1,7 Гц, 1H), 8,63 (д, J=5,6 Гц, 1H), 7,11 (д, J=5,7 Гц, 1H), 4,75-4,56 (м, 2H), 4,15-3,98 (м, 1H), 3,15 (кв., J=10,7 Гц, 2H), 2,85-2,65 (м, 2H), 2,15-1,85 (м, 2H), 1,22 (тд, J=12,0, 12,0 Гц, 1H), 0,99 (д, J=6,5 Гц, 3H).
Соединение 130 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(1H-имидазол-4-ил)ацетамид гидрохлорид): из 2-(1H-имидазол-4-ил)уксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,0% =, RT=1,05 мин. МС: m/z=367,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,98-8,85 (м, 3H), 8,11 (д, J=8,4 Гц, 1H), 7,45 (с, 1H), 7,32 (д, J=8,4 Гц, 1H), 4,42 (д, J=13,3 Гц, 1H), 4,30 (д, J=12,7 Гц, 1H), 4,23-4,12 (м, 1H), 3,78 (шир.с, 2H), 2,85-2,65 (м, 2H), 2,20-1,95 (м, 2H), 1,27 (тд, J=11,9, 11,9 Гц, 1H), 1,15-0,95 (м, 3H).
Соединение 131 (2-(1H-имидазол-4-ил)-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]ацетамид): из 2-(1H-имидазол-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина. ВЭЖХ: чистота 99,2%, RT=0,79 мин. МС: m/z=352,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,91 (д, J=1,7 Гц, 1H), 8,79 (д, J=1,8 Гц, 1H), 8,64 (д, J=5,6 Гц, 1H), 7,62 (д, J=1,2 Гц, 1H), 7,14 (д, J=5,6 Гц, 1H), 6,96 (с, 1H), 4,72-4,63 (м, 2H), 4,12-4,00 (м, 1H), 3,52 (шир.с, 2H), 2,90-2,70 (м, 2H), 2,15-1,85 (м, 2H), 1,26 (тд, J=12,0, 12,0 Гц, 1H), 1,00 (д, J=6,6 Гц, 3H).
Соединение 132 ( N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(1-метил-1H-имидазол-4-ил)ацетамид): из 2-(1-метил-1H-имидазол-4-ил)уксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 96,2%, RT=1,39 мин. МС: m/z=390,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,82 (м, 2H), 8,09 (д, J=8,4 Гц, 1H), 7,55 (д, J=1,3 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 7,01-6,95 (м, 1H), 4,44-4,28 (м, 2H), 4,20-4,08 (м, 1H), 3,71 (с, 3H), 3,48 (шир.с, 2H), 2,84-2,63 (м, 2H), 2,16-1,95 (м, 2H), 1,33-1,11 (м, 1H), 1,02 (д, J=6,5 Гц, 3H).
Соединение 133 (N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]-2-(1-метил-1H-имидазол-4-ил)ацетамид): из 2-(1-метил-1H-имидазол-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина. ВЭЖХ: чистота 95,9%, RT=0,84 мин. МС: m/z=366,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,91 (с, 1H), 8,78 (с, 1H), 8,63 (д, J=5,6 Гц, 1H), 7,53 (с, 1H), 7,13 (д, J=5,6 Гц, 1H), 6,96 (с, 1H), 4,77-4,57 (м, 2H), 4,13-3,99 (м, 1H), 3,69 (с, 3H), 3,47 (с, 2H), 2,90-2,70 (м, 2H), 2,15-1,85 (м, 1H), 1,26 (тд, J=12,0, 12,0 Гц, 1H), 0,99 (д, J=6,6 Гц, 3H).
Соединение 134 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-метоксиацетамид): из 2-метоксиуксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 96,7%, RT=1,20 мин. МС: m/z=340,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,82 (м, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,24 (д, J=8,4 Гц, 1H), 4,35-4,15 (м, 3H), 3,88 (д, J=0,6 Гц, 2H), 3,39 (с, 3H), 2,87 (дд, J=11,8, 10,4 Гц, 1H), 2,67 (дд, J=12,4, 10,6 Гц, 1H), 2,04 (д, J=11,8 Гц, 2H), 1,30 (тд, J=12,5, 12,5 Гц, 1H), 0,99 (д, J=6,4 Гц, 3H).
Соединение 140 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-метансульфонамидоацетамид): из 2-(метилсульфонамидо)уксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 93,6%, RT=2,22 мин. МС: m/z=403,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,81 (м, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,24 (д, J=8,4 Гц, 1H), 4,38-4,05 (м, 3H), 3,74 (с, 2H), 2,97 (с, 3H), 2,87-2,68 (м, 2H), 2,16-2,00 (м, 2H), 1,26 (тд, J=11,8, 11,8 Гц, 1H), 0,99 (д, J=6,4 Гц, 3H).
Соединение 141 (2-метансульфонамидо-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]ацетамид): из 2-(метилсульфонамидо)уксусной кислоты и (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина. ВЭЖХ: чистота 98,5%, RT=0,82 мин. МС: m/z=379,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,8 Гц, 1H), 8,77 (д, J=1,7 Гц, 1H), 8,63 (д, J=5,6 Гц, 1H), 7,11 (д, J=5,7 Гц, 1H), 4,71-4,55 (м, 2H), 4,13-3,99 (м, 1H), 3,74 (с, 2H), 2,97 (с, 3H), 2,95-2,66 (м, 2H), 2,07 (д, J=12,9 Гц, 1H), 2,00-1,90 (м, 1H), 1,27 (тд, J=12,0, 12,0 Гц, 1H), 0,99 (д, J=6,5 Гц, 3H).
Соединение 142 (2-(трет-бутиламино)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]ацетамид): из 2-(трет-бутиламино)уксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,0%, RT=1,38 мин. МС: m/z=381,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,80 (м, 2H), 8,12-8,03 (м, 1H), 7,25 (дд, J=8,3, 6,2 Гц, 1H), 4,44-4,36 (м, 1H), 4,27 (д, J=13,1 Гц, 1H), 4,18-4,14 (м, 1H), 3,25 (м, 2H), 2,80 (т, J=11,3 Гц, 1H), 2,68 (т, J=11,8 Гц, 1H), 2,16-2,02 (м, 2H), 1,32-1,21 (м, 1H), 1,13 (с, 9H), 1,03 (д, J=6,4 Гц, 3H).
Соединение 143 (2-(трет-бутиламино)-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]ацетамид): из 2-(трет-бутиламино)уксусной кислоты и (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина. ВЭЖХ: чистота 97,7%, RT=1,04 мин. МС: m/z=357,3 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,94 (д, J=1,7 Гц, 1H), 8,80 (д, J=5,4 Гц, 1H), 8,74 (д, J=1,7 Гц, 1H), 7,05 (д, J=5,5 Гц, 1H), 4,65-4,45 (м, 2H), 4,25-4,11 (м, 1H), 3,25 (с, 2H), 2,86-2,70 (м, 2H), 2,19-2,09 (м, 1H), 2,07-1,93 (м, 1H), 1,25-1,05 (м, 10H), 0,99 (д, J=6,6 Гц, 3H).
Соединение 144 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-[(2-гидроксиэтил)(метил)амино]ацетамид): из 2-((2-гидроксиэтил)(метил)амино)уксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 93,1%, RT=1,09 мин. МС: m/z=383,2 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 8,97 (д, J=1,8 Гц, 1H), 8,89 (д, J=1,8 Гц, 1H), 8,11 (д, J=8,4 Гц, 1H), 7,71 (д, J=6,6 Гц, 1H), 7,23 (д, J=8,4 Гц, 1H), 3,28 (д, J=7,2 Гц, 2H), 3,92-4,02 (м, 1H),3,50-3,54 (м, 2H), 2,83-3,07 (м, 3H), 2,55-2,72 (м, 3H), 2,025(с, 3H), 1,89-1,98 (м, 3H), 1,88-2,01 (м, 1H), 1,19-1,31 (м, 2H), 0,93-1,01 (м, 3H).
Соединение 145 (2-[(2-гидроксиэтил)(метил)амино]-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]ацетамид): из 2-((2-гидроксиэтил)(метил)амино)уксусной кислоты и (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина. ВЭЖХ: чистота 90,7%, RT=1,70 мин. МС: m/z=359,2 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 8,94 (д, J=1,5 Гц, 1H), 8,77 (д, J=1,8 Гц, 1H), 8,69 (д, J=5,4 Гц, 1H), 7,64 (д, J=7,2 Гц, 1H), 7,08 (д, J=5,7 Гц, 1H), 4,43-4,56 (м, 2H), 4,28 (с, 1H), 3,91-3,96 (м, 1H), 3,48 (с, 2H), 2,97-3,03 (м, 1H), 2,83-2,91 (м, 1H), 2,61-2,72 (м, 2H), 2,49-2,52 (м, 2H), 2,24-2,28 (м, 3H), 1,76-2,01 (м, 2H), 1,21-1,33 (м, 1H), 0,94 (д, J=6,3 Гц, 3H).
Соединение 163 (2-(трет-бутокси)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]ацетамид): из 2-трет-бутоксиуксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,3%, RT=1,54 мин. МС: m/z=382,2 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 8,97-8,85 (м, 2H), 8,10 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,38-4,16 (м, 3H), 3,93 (с, 2H), 2,95 (дд, J=11,9, 10,5 Гц, 1H), 2,73 (дд, J=12,5, 10,6 Гц, 1H), 2,18-2,00 (м, 2H), 1,44-1,33 (м, 1H), 1,27 (с, 9H), 1,04 (д, J=6,4 Гц, 3H).
Соединение 164 (2-(трет-бутокси)-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]ацетамид): из 2-трет-бутоксиуксусной кислоты и (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина. ВЭЖХ: чистота 97,9%, RT=1,23 мин. МС: m/z=358,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95 (д, J=1,8 Гц, 1H), 8,83 (д, J=1,8 Гц, 1H), 8,68 (д, J=5,6 Гц, 1H), 7,16 (д, J=5,6 Гц, 1H), 4,73-4,58 (м, 2H), 4,17 (тт, J=11,2, 4,2 Гц, 1H), 3,93 (с, 2H), 3,09-2,95 (м, 1H), 2,81 (дд, J=12,8, 11,0 Гц, 1H), 2,15-1,95 (м, 2H), 1,43 (тд, J=11,8, 11,8 Гц, 1H), 1,28 (с, 9H), 1,05 (д, J=6,5 Гц, 3H).
Соединение 165 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2,2-дифторциклопропан-1-карбоксамид): из 2,2-дифторциклопропанкарбоновой кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,3%, RT=1,39 мин. МС: m/z=372,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,8 Гц, 1H), 8,91 (д, J=1,8 Гц, 1H), 8,11 (д, J=8,4 Гц, 1H), 7,30 (дд, J=8,4, 2,4 Гц, 1H), 4,47-4,27 (м, 2H), 4,25-4,09 (м, 1H), 2,84-2,64 (м, 2H), 2,59-2,45 (м, 1H), 2,20-1,95 (м, 3H), 1,81-1,73 (м, 1H), 1,25 (тд, J=12,0, 12,0 Гц, 1H), 1,03 (дд, J=6,6, 2,4 Гц, 3H).
Соединение 166 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(оксолан-2-илметокси)ацетамид): из 2-(оксолан-2-илметокси)уксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,0%, RT=2,78 мин. МС: m/z=410,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,8 Гц, 1H), 8,91 (д, J=1,8 Гц, 1H), 8,11 (д, J=8,4 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 4,40 (д, J=11,9 Гц, 1H), 4,35-4,00 (м, 5H), 3,98-3,79 (м, 2H), 3,64 (дд, J=10,5, 2,8 Гц, 1H), 3,53-3,43 (м, 1H), 2,87 (т, J=11,3 Гц, 1H), 2,71 (т, J=11,7 Гц, 1H), 2,18-1,89 (м, 5H), 1,72-1,56 (м, 1H), 1,32 (тд, J=11,9, 11,9 Гц, 1H), 1,05 (д, J=6,5 Гц, 3H).
Соединение 167 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2,3-диметилбутанамид): из 2,3-диметилбутановой кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 98,7%, RT=1,52 мин. МС: m/z=366,3 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,96 (д, J=1,4 Гц, 1H), 8,83 (д, J=1,4 Гц, 1H), 8,02 (д, J=8,3 Гц, 1H), 7,42-7,30 (м, 1H), 5,47 (д, J=6,9 Гц, 1H), 4,39-4,19 (м, 3H), 2,94-2,79 (м, 2H), 2,18-1,79 (м, 4H), 1,30-1,16 (м, 1H), 1,14 (д, J=6,4 Гц, 3H), 1,01-0,89 (м, 9H).
Соединение 168 (2,3-диметил-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]бутанамид): из 2,3-диметилбутановой кислоты и (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина. ВЭЖХ: чистота 98,7%, RT=1,21 мин. МС: m/z=342,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,5 Гц, 1H), 8,80 (дд, J=5,8, 1,8 Гц, 1H), 8,65 (дд, J=5,6, 1,1 Гц, 1H), 7,16 (д, J=5,7 Гц, 1H), 4,75-4,60 (м, 2H), 4,11-3,99 (м, 1H), 2,90-2,70 (м, 2H), 2,12-1,88 (м, 3H), 1,83-1,69 (м, 1H), 1,34-1,19 (м, 1H), 1,14-0,82 (м, 12Н).
Соединение 169 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(1H-пиразол-1-ил)ацетамид): из 2-(1H-пиразол-1-ил)уксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,4%, RT=1,18 мин. МС: m/z=376,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,93 (д, J=1,7 Гц, 1H), 8,89 (д, J=1,7 Гц, 1H), 8,19-8,06 (м, 1H), 7,71 (д, J=1,5 Гц, 1H), 7,56 (д, J=1,5 Гц, 1H), 7,28 (д, J=8,3 Гц, 1H), 6,39-6,33 (м, 1H), 4,42 (д, J=11,7 Гц, 1H), 4,34-4,26 (м, 1H), 4,22-4,11 (м, 1H), 3,37-3,27 (м, 1H), 3,15-2,95 (м, 1H), 2,85-2,65 (м, 2H), 2,22-1,98 (м, 2H), 1,26 (тд, J=12,0, 12,0 Гц, 1H), 1,03 (д, J=6,4 Гц, 3H).
Соединение 170 (N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]-2-(1H-пиразол-1-ил)ацетамид): из 2-(1H-пиразол-1-ил)уксусной кислоты и (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина. ВЭЖХ: чистота 98,9%, RT=1,73 мин. МС: m/z=352,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,91 (д, J=1,7 Гц, 1H), 8,79 (д, J=1,7 Гц, 1H), 8,64 (д, J=5,6 Гц, 1H), 7,71-7,66 (м, 1H), 7,56-7,51 (м, 1H), 7,13 (д, J=5,6 Гц, 1H), 6,34 (т, J=2,2 Гц, 1H), 4,95-4,80 (м, 2H), 4,75-4,61 (м, 2H), 4,15-3,99 (м, 1H), 2,94-2,82 (м, 1H), 2,81-2,70 (м, 1H), 2,17-2,06 (м, 1H), 2,05-1,95 (м, 1H), 1,28 (тд, J=12,0, 12,0 Гц, 1H), 1,01 (д, J=6,6 Гц, 3H).
Соединение 171 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-1-метилпирролидин-2-карбоксамид): из 1-метилпирролидин-2-карбоновой кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 98,5%, RT=1,85 мин. МС: m/z=379,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,7 Гц, 1H), 8,85 (д, J=1,7 Гц, 1H), 8,05 (д, J=8,4 Гц, 1H), 7,24 (д, J=8,4 Гц, 1H), 4,38-4,05 (м, 3H), 3,16-3,03 (м, 1H), 2,91-2,75 (м, 2H), 2,73-2,59 (м, 1H), 2,40-2,26 (м, 4H), 2,21-1,97 (м, 3H), 1,85-1,71 (м, 3H), 1,33-1,19 (м, 1H), 0,99 (д, J=6,3 Гц, 3H).
Соединение 172 (Метил-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]пирролидин-2-карбоксамид): из 1-метилпирролидин-2-карбоновой кислоты и (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина. ВЭЖХ: чистота 97,5%, RT=2,22 мин. МС: m/z=355,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,88 (д, J=1,8 Гц, 1H), 8,76 (т, J=1,4 Гц, 1H), 8,61 (д, J=5,6 Гц, 1H), 7,08 (дд, J=5,7, 1,3 Гц, 1H), 4,66-4,50 (м, 2H), 4,11-3,97 (м, 1H), 3,16-3,00 (м, 1H), 3,01-2,64 (м, 3H), 2,40-1,66 (м, 10H), 1,29 (тд, J=11,8, 11,8 Гц, 1H), 0,97 (д, J=6,5 Гц, 3H).
Соединение 175 (цис-N-[1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил]-3,3-диметилбутанамид): из 3,3-диметилбутановой кислоты и цис-8-(3-амино-5-циклопропилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 95,1%, RT=2,95 мин. МС: m/z=392,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,8 Гц, 1H), 8,84 (д, J=1,8 Гц, 1H), 8,05 (д, J=8,4 Гц, 1H), 7,22 (д, J=8,4 Гц, 1H), 4,46-4,26 (м, 2H), 4,11-4,00 (м, 1H), 2,91-2,69 (м, 2H), 2,21-2,09 (м, 1H), 2,06 (с, 2H), 1,40-1,02 (м, 2H), 1,01 (с, 9H), 0,63-0,38 (м, 3H), 0,18 (д, J=3,5 Гц, 2H).
Соединение 179 (цис-N-[1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил]-2-(диметиламино)ацетамид): из гидрохлорида 2-(диметиламино)уксусной кислоты и цис-8-(3-амино-5-циклопропилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 97,2%, RT=2,42 мин. МС: m/z=379,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,8 Гц, 1H), 8,84 (д, J=1,8 Гц, 1H), 8,05 (д, J=8,4 Гц, 1H), 7,22 (д, J=8,4 Гц, 1H), 4,38-4,20 (м, 2H), 4,16-3,99 (м, 1H), 3,01-2,80 (м, 4H), 2,29 (с, 6H), 2,23-2,06 (м, 1H), 1,44 (кв., J=11,8 Гц, 1H), 1,21-1,07 (м, 1H), 0,69-0,38 (м, 3H), 0,27-0,11 (м, 2H).
Соединение 230 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-1-гидроксициклопропан-1-карбоксамид): из 1-гидроксициклопропан-1-карбоновой кислоты и 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрила. ВЭЖХ: чистота 98,8%, RT=3,40 мин. МС: m/z=352,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,94-8,80 (м, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,23 (д, J=8,4 Гц, 1H), 4,35-4,09 (м, 3H), 2,98-2,86 (м, 1H), 2,78-2,62 (м, 1H), 2,15-1,95 (м, 2H), 1,40-1,15 (м, 3H), 1,00-0,89 (м, 5H).
Соединение 232 ( N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(1-метилпиперидин-4-ил)ацетамид: из 2-(1-метилпиперидин-4-ил)уксусной кислоты и 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрила. ВЭЖХ: чистота 95,5%, RT=2,03 мин. МС: m/z=407,3 [M+H]+. 1H ЯМР (300 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,7 Гц, 1H), 8,83 (д, J=1,8 Гц, 1H), 8,00 (д, J=8,3 Гц, 1H), 7,23 (д, J=8,4 Гц, 1H), 5,57 (д, J=7,3 Гц, 1H), 4,38-4,14 (м, 3H), 2,95-2,69 (м, 4H), 2,30 (с, 3H), 2,19-1,93 (м, 6H), 1,89-1,68 (м, 3H), 1,47-1,09 (м, 3H), 0,98 (д, J=6,6 Гц, 3H).
Соединение 233 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(1,4-диметилпиперидин-4-ил)ацетамид): из 2-(1,4-диметилпиперидин-4-ил)уксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 95,7%, RT=2,95 мин. МС: m/z=421,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,10 (д, J=8,4 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 4,38-4,30 (м, 2H), 4,15 (т, J=11,9 Гц, 1H), 2,83-2,55 (м, 4H), 2,46 (с, 2H), 2,33 (с, 3H), 2,22-1,95 (м, 4H), 1,72-1,67 (м, 2H), 1,56-1,48 (м, 2H), 1,21 (тд, J=12,1, 12,1 Гц, 1H), 1,08 (с, 3H), 1,01 (д, J=6,3 Гц, 3H).
Соединение 234 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-[1-(2,2-дифторэтил)пиперидин-4-ил]ацетамид): из 2-(1-метилпиперидин-4-ил)уксусной кислоты и 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрила. ВЭЖХ: чистота 93,9%, RT=2,45 мин. МС: m/z=457,3 [M+H]+. 1H ЯМР (300 МГц, Хлороформ-d, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,79 (д, J=1,8 Гц, 1H), 7,97 (д, J=8,3 Гц, 1H), 7,20 (д, J=8,4 Гц, 1H), 6,10-5,70 (м, 1H), 5,51 (д, J=7,2 Гц, 1H), 4,35-4,10 (м, 3H), 2,98-2,85 (м, 2H), 2,85-2,62 (м, 4H), 2,28-1,63 (м, 8H), 1,42-1,06 (м, 4H), 0,95 (д, J=6,6 Гц, 3H).
Соединение 235 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3-дифторциклобутан-1-карбоксамид): из 3,3-дифторциклобутан-1-карбоновой кислоты и 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрила. ВЭЖХ: чистота 93,9%, RT=4,03 мин. МС: m/z=386,0 [M+H]+. 1H ЯМР (300 МГц, Хлороформ-d, м.д.) δ 8,94 (д, J=1,7 Гц, 1H), 8,81 (д, J=1,7 Гц, 1H), 7,99 (д, J=8,3 Гц, 1H), 7,23 (д, J=8,4 Гц, 1H), 5,63 (д, J=6,9 Гц, 1H), 4,30-4,22 (м, 3H), 2,96-2,63 (м, 7H), 2,17-1,99 (м, 2H), 1,21 (тд, J=11,3, 11,3 Гц, 1H), 0,97 (д, J=6,5 Гц, 3H).
Соединение 236 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-1-метилпирролидин-3-карбоксамид): из 3,3-дифторциклобутан-1-карбоновой кислоты и 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрила. ВЭЖХ: чистота 97,5%, RT=2,06 мин. МС: m/z=379,1 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,94 (д, J=1,7 Гц, 1H), 8,82 (д, J=1,7 Гц, 1H), 7,99 (д, J=8,4 Гц, 1H), 7,23 (д, J=8,4 Гц, 1H), 6,86 (д, J=7,3 Гц, 1H), 4,33 (дд, J=12,5, 4,6 Гц, 2H), 4,23-4,08 (м, 1H), 2,93-2,86 (м, 3H), 2,83-2,69 (м, 2H), 2,65-2,52 (м, 1H), 2,46-2,40 (м, 4H), 2,28-2,19 (м, 1H), 2,12 (кажущийся д, J=12,3 Гц, 1H), 2,08-1,93 (м, 2H), 1,35-1,10 (м, 1H), 0,98 (д, J=6,6 Гц, 3H).
Соединение 265 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-гидроксипропанамид): из 2-гидроксипропановой кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,3%, RT=1,16 мин. МС: m/z=340,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,81 (м, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,24 (д, J=8,4 Гц, 1H), 4,27-4,22 (м, 2H), 4,12-4,07 (м, 2H), 2,86 (дд, J=12,0, 10,4 Гц, 1H), 2,74-2,60 (м, 1H), 2,07-2,03 (м, 2H), 1,36-1,30 (м, 4H), 0,99 (д, J=6,4 Гц, 3H).
Соединение 266: (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(1-метилпиперидин-3-ил)ацетамид гидрохлорид): из 2-(1-метилпиперидин-3-ил)уксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 96,3%, RT=1,19 мин. МС: m/z=407,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 9,01-8,89 (м, 2H), 8,15 (д, J=8,2 Гц, 1H), 7,57 (дд, J=7,8, 2,9 Гц, 1H), 4,29-4,08 (м, 3H), 3,45 (д, J=12,2 Гц, 2H), 3,07-2,79 (м, 6H), 2,72 (т, J=11,3 Гц, 1H), 2,31-2,03 (м, 5H), 2,04-1,65 (м, 3H), 1,37-1,14 (м, 2H), 1,00 (д, J=6,4 Гц, 3H).
Соединение 269 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(1-метилпирролидин-3-ил)ацетамид): из 2-(трет-бутоксикарбониламино)-2-циклопропилуксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 95,1%, RT=2,41 мин. МС: m/z=393,2 [M+H]+. 1H ЯМР (300 МГц, Хлороформ-d, м.д.) δ 8,91 (д, J=1,7 Гц, 1H), 8,79 (т, J=1,5 Гц, 1H), 7,96 (д, J=8,4 Гц, 1H), 7,20 (д, J=8,4 Гц, 1H), 6,65 (д, J=7,1 Гц, 1H), 4,36-4,08 (м, 3H), 2,84-2,64 (м, 3H), 2,64-2,24 (м, 9H), 2,19-1,88 (м, 3H), 1,58-1,52 (м, 1H), 1,25-0,90 (м, 4H).
Пример 11: Синтез соединения 16 (8-((3S,5R)-3-метил-5-(метиламино)пиперидин-1-ил)хиноксалин-5-карбонитрил гидрохлорид)
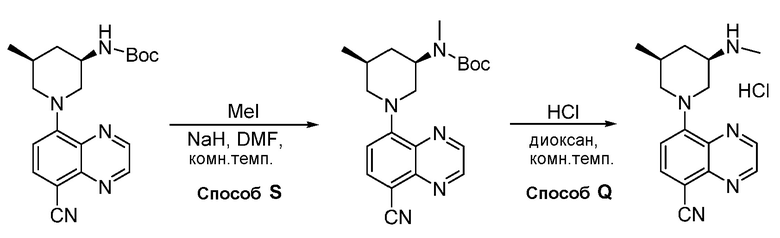
Способ S
трет-Бутил (3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил(метил)карбамат: К раствору трет-бутил N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамата (152 мг, 0,41 ммоль) в N,N-диметилформамиде (10 мл) добавляли гидрид натрия (18 мг, 0,74 ммоль, 1,78 экв.) при комнатной температуре. Смесь перемешивали в течение 10 минут при комнатной температуре и затем добавляли иодметан (70 мг, 0,49 ммоль). Реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (10 мл). Полученную смесь экстрагировали этилацетатом (50 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением трет-бутил N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-N-метилкарбамата в виде желтого твердого вещества (180 мг, неочищенный продукт).
8-((3S,5R)-3-метил-5-(метиламино)пиперидин-1-ил)хиноксалин-5-карбонитрил гидрохлорид: 8-((3S,5R)-3-метил-5-(метиламино)пиперидин-1-ил)хиноксалин-5-карбонитрил гидрохлорид получали из трет-бутил (3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил(метил)карбамата и иодметана с использованием Способа Q. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,02% об/об HCl), 30% - 40% градиент за 10 мин; Детектор УФ 254 нм. 8-[(3S,5R)-3-метил-5-(метиламино)пиперидин-1-ил]хиноксалин-5-карбонитрил гидрохлорид получали в виде желтого твердого вещества (36 мг, 26% для 2 стадий).
Соединение 16: ВЭЖХ: чистота 90,3%, RT=1,97 мин. МС: m/z=282,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=2,0 Гц, 1H), 8,88 (д, J=1,6 Гц, 1H), 8,09 (д, J=8,4 Гц, 1H), 7,22 (д, J=8,4 Гц, 1H), 4,63-4,53 (м, 1H), 4,14-4,04 (м, 1H), 3,02-2,90 (м, 1H), 2,70-2,55 (м, 2H), 2,50 (с, 3H), 2,26-2,14 (м, 1H), 2,10-1,90 (м, 1H), 1,10-0,96 (м, 4H).
Следующие соединение синтезировали аналогичным способом:
Соединение 17 ((3R,5S)-N,5-диметил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амин): из трет-бутил (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-илкарбамата и иодметана. ВЭЖХ: чистота 92,8%, RT=0,71 мин. МС: m/z=258,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95 (д, J=1,7 Гц, 1H), 8,83 (д, J=1,8 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 7,08 (д, J=5,6 Гц, 1H), 5,05-4,95 (м, 1H), 4,54-4,35 (м, 1H), 2,99-2,63 (м, 3H), 2,52 (с, 3H), 2,27-2,14 (м, 1H), 2,06 -1,88 (м, 1H), 1,14-1,00 (м, 4H).
Пример 12: Синтез соединения 18 ((3R,5S)-N-(2-метоксиэтил)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амин)
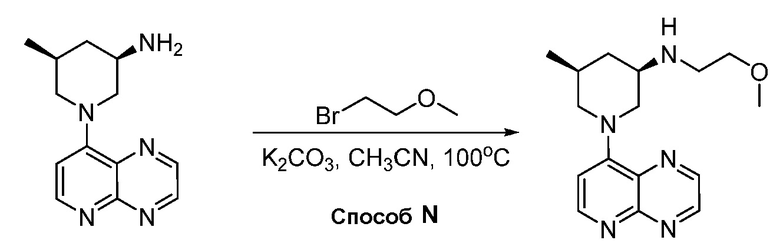
(3R,5S)-N-(2-метоксиэтил)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амин: (3R,5S)-N-(2-метоксиэтил)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амин получали из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 1-бром-2-метоксиэтана с использованием Способа N. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 3% - 80% градиент за 8 мин; Детектор УФ 254 нм. (3R,5S)-N-(2-метоксиэтил)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-амин получали в виде желтого масла (60 мг, 31%).
Соединение 18: ВЭЖХ: чистота 96,8%, RT=1,88 мин. МС: m/z=302,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,8 Гц, 1H), 8,82 (д, J=1,8 Гц, 1H), 8,66 (д, J=5,6 Гц, 1H), 7,08 (д, J=5,7 Гц, 1H), 4,61 (шир.с, 2H), 4,46 (д, J=12,6 Гц, 1H), 3,60-3,52 (м, 2H), 3,39 (с, 3H), 3,02-2,90 (м, 3H), 2,80-2,68 (м, 2H), 2,25-2,15 (м, 1H), 2,05-1,95 (с, 1H), 1,18-1,02 (м, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 19 (8-((3R,5S)-3-(2-метоксиэтиламино)-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрил): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрил и 1-бром-2-метоксиэтана. ВЭЖХ: чистота 97,8%, RT=1,22 мин. МС: m/z=326,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (с, 1H), 8,85 (с, 1H), 8,05 (д, J=8,4 Гц, 1H), 7,18 (д, J=8,5 Гц, 1H), 4,59-4,47 (м, 1H), 4,14-4,03 (м, 1H), 3,55-3,45 (м, 2H), 3,34 (с, 3H), 3,06-2,78 (м, 3H), 2,66-2,51 (м, 2H), 2,20-1,85 (м, 2H), 1,10-0,91 (м, 4H).
Соединение 38 (8-((3R,5S)-3-(цианометиламино)-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрил): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-хлорацетонитрила. ВЭЖХ: чистота 90,7%, RT=1,24 мин. МС: m/z=307,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,93-8,86 (м, 2H), 8,05 (д, J=8,4 Гц, 1H), 7,18 (д, J=8,4 Гц, 1H), 4,65-4,52 (м, 1H), 4,05 (дд, J=13,3, 3,4 Гц, 1H), 3,72 (с, 2H), 3,25-3,10 (м, 1H), 2,66-2,50 (м, 2H), 2,20-1,90 (м, 2H), 1,11-0,93 (м, 4H).
Соединение 39 (2-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-иламино)ацетонитрил гидрохлорид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 2-хлорацетонитрила. ВЭЖХ: чистота 87,2%, RT=0,97 мин. МС: m/z=283,0 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 9,12-9,02 (м, 2H), 8,55 (д, J=6,6 Гц, 1H), 7,40 (д, J=6,9 Гц, 1H), 5,92-5,72 (м, 1H), 4,60-4,30 (м, 2H), 3,95-3,60 (м, 2H), 3,20-3,10 (м, 1H), 2,48-2,38 (м, 1H), 2,16-2,06 (м, 1H), 1,65-1,52 (м, 1H), 1,16-0,96 (м, 4H).
Соединение 121 (2-[[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]амино]ацетамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 2-хлорацетамида. ВЭЖХ: чистота 99,1%, RT=0,75 мин. МС: m/z=301,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,93 (д, J=1,8 Гц, 1H), 8,83 (т, J=1,7 Гц, 1H), 8,64 (дд, J=5,8, 1,5 Гц, 1H), 7,09-7,02 (м, 1H), 5,03-4,90 (м, 1H), 4,41 (дд, J=12,8, 4,2 Гц, 1H), 3,49-3,34 (м, 2H), 3,00-2,86 (м, 1H), 2,80-2,64 (м, 2H), 2,26-2,13 (м, 1H), 2,03-1,90 (м, 1H), 1,19-1,01 (м, 4H).
Соединение 122 (2-[[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]амино]ацетамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-хлорацетамида. ВЭЖХ: чистота 99,5%, RT=1,03 мин. МС: m/z=325,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,85 (м, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,29-7,15 (м, 1H), 4,62-4,48 (м, 1H), 4,12-4,02 (м, 1H), 3,46-3,31 (м, 2H), 2,99 (тт, J=11,0, 4,0 Гц, 1H), 2,72-2,56 (м, 2H), 2,22-1,88 (м, 2H), 0,96 (м, 4H).
Соединение 126 (1-метил-3-[[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]амино]пирролидин-2-он): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 3-бром-1-метилпирролидин-2-она. ВЭЖХ: чистота 99,0%, RT=1,13 мин. МС: m/z=341,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,80 (д, J=1,8 Гц, 1H), 8,63 (д, J=5,6 Гц, 1H), 7,07 (т, J=5,4 Гц, 1H), 5,08-4,88 (м, 1H), 4,48-4,38 (м, 1H), 3,76-3,62 (м, 1H), 3,48-3,35 (м, 2H), 3,21-3,04 (м, 1H), 2,87 (с, 3H), 2,80-2,65 (м, 2H), 2,56-2,39 (м, 1H), 2,28-2,12 (м, 1H), 2,02-1,76 (м, 2H), 1,18-0,99 (м, 4H).
Соединение 176 (цис-8-[3-циклопропил-5-[(2-метоксиэтил)амино]пиперидин-1-ил]хиноксалин-5-карбонитрил): из 3,3-диметилбутановой кислоты и цис-8-(3-амино-5-циклопропилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,0%, RT=1,42 мин. МС: m/z=352,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,91 (д, J=1,8 Гц, 1H), 8,86 (д, J=1,8 Гц, 1H), 8,07 (д, J=8,4 Гц, 1H), 7,20 (д, J=8,4 Гц, 1H), 4,61-4,45 (м, 1H), 4,30-4,24 (м, 1H), 3,61-3,45 (м, 2H), 3,37 (с, 3H), 3,05-2,75 (м, 4H), 2,74-2,68 (м, 1H), 2,37-2,25 (м, 1H), 1,31-1,03 (м, 2H), 0,71-0,41 (м, 3H), 0,30-0,12 (м, 2H).
Пример 13: Синтез соединения 24 ((R)-2-амино-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)пропанамид)
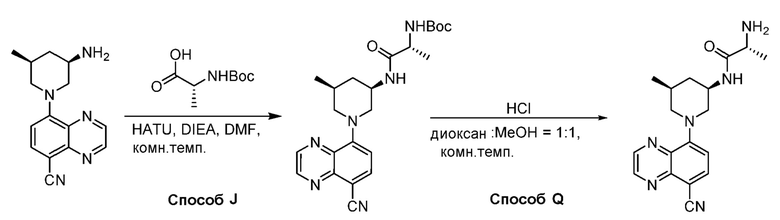
(R)-2-амино-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)пропанамид: (R)-2-амино-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)пропанамид получали из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и (R)-2-(трет-бутоксикарбониламино)пропановой кислоты с использованием Способа J и Q. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 250 mm; MeOH в воде (с 10 ммоль/л NH4HCO3), 30% - 80% градиент за 10 мин; Детектор УФ 254 нм. (2R)-2-амино-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]пропанамид получали в виде желтого твердого вещества (25 мг, 26% для 2 стадий).
Соединение 24: ВЭЖХ: чистота 94,4%, RT=1,39 мин. МС: m/z=339,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,8 Гц, 1H), 8,91 (д, J=1,8 Гц, 1H), 8,11 (д, J=8,4 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 4,44- 4,26 (м, 2H), 4,20-4,03 (м, 1H), 3,50-3,38 (м, 1H), 2,87-2,62 (м, 2H), 2,20-1,99 (м, 2H), 1,35-1,17 (м, 4H), 1,04 (д, J=6,4 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 25 ((S)-2-амино-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)пропанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и (S)-2-(трет-бутоксикарбониламино)пропановой кислоты. ВЭЖХ: чистота 91,3%, RT=1,40 мин. МС: m/z=339,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,97 (д, J=1,8 Гц, 1H), 8,92 (д, J=1,8 Гц, 1H), 8,13 (д, J=8,4 Гц, 1H), 7,32 (д, J=8,4 Гц, 1H), 4,44-4,26 (м, 2H), 4,20-4,02 (м, 1H), 3,52-3,38 (м, 1H), 2,89-2,64 (м, 2H), 2,20-2,01 (м, 3H), 1,37-1,22 (м, 4H), 1,05 (д, J=6,4 Гц, 3H).
Соединение 26 ((R)-2-амино-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)пропанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (R)-2-(трет-бутоксикарбониламино)пропановой кислоты. ВЭЖХ: чистота 94,9%, RT=0,55 мин. МС: m/z=315,1 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 8,99 (с, 1H), 8,83 (с, 1H), 8,71 (д, J=4,8 Гц, 1H), 7,81 (д, J=7,6 Гц, 1H), 7,15 (д, J=5,5 Гц, 1H), 4,55 (д, J=13,4 Гц, 1H), 4,39 (м, J=13,4 Гц, 1H), 3,92-3,76 (м, 1H), 3,45-3,35 (м, 1H), 2,90-2,60 (м, 2H), 2,03-1,75 (м, 4H), 1,33-1,08 (м, 4H), 0,92 (д, J=6,5 Гц, 3H).
Соединение 27 ((S)-2-амино-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)пропанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (S)-2-(трет-бутоксикарбониламино)пропановой кислоты. ВЭЖХ: чистота 94,0%, RT=0,93 мин. МС: m/z=315,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,90 (д, J=1,7 Гц, 1H), 8,77 (д, J=1,7 Гц, 1H), 8,63 (д, J=5,7 Гц, 1H), 7,12 (д, J=5,6 Гц, 1H), 4,72-4,58 (м, 2H), 4,07-3,93 m, 1H), 3,46-3,34 (м, 1H), 2,90-2,65 (м, 2H), 2,15-1,92 (м, 2H), 1,36-1,15 (м, 4H), 0,99 (д, J=6,5 Гц, 3H).
Соединение 28 (N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-(метиламино)ацетамид гидрохлорид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-(трет-бутоксикарбонил(метил)амино)уксусной кислоты. ВЭЖХ: чистота 98,3%, RT=1,21 мин. МС: m/z=339,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,90 (д, J=1,7 Гц, 1H), 8,84 (д, J=1,7 Гц, 1H), 8,07 (д, J=8,4 Гц, 1H), 7,24 (д, J=8,4 Гц, 1H), 4,40 (д, J=12,2 Гц, 1H), 4,28-4,06 (м, 2H), 3,75 (с, 2H), 2,82-2,57 (м, 5H), 2,16-1,97 (м, 2H), 1,251,13 (м, 1H), 0,99 (д, J=6,5 Гц, 3H).
Соединение 29 (N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)-2-(метиламино)ацетамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 2-(трет-бутоксикарбонил(метил)амино)уксусной кислоты. ВЭЖХ: чистота 99,6%, RT=0,83 мин. МС: m/z=315,1 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,00 (д, J=1,7 Гц, 1H), 8,83 (д, J=1,7 Гц, 1H), 8,72 (д, J=5,4 Гц, 1H), 8,09 (д, J=7,8 Гц, 1H), 7,14 (д, J=5,5 Гц, 1H), 4,58-4,38 (м, 2H), 4,00-3,85 (м, 1H), 3,40-3,30 (м, 2H), 2,88-2,68 (м, 2H), 2,38 (с, 3H), 2,01-1,79 (м, 2H), 1,30-1,16 (м, 1H), 0,93 (д, J=6,4 Гц, 3H).
Соединение 30 (1-амино-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)циклопропанкарбоксамид гидрохлорид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 1-(трет-бутоксикарбониламино)циклопропанкарбоновой кислоты. ВЭЖХ: чистота 99,8%, RT=0,84 мин. МС: m/z=327,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99 (д, J=1,8 Гц, 1H), 8,94 (д, J=1,8 Гц, 1H), 8,44 (д, J=7,4 Гц, 1H), 7,34 (д, J=7,5 Гц, 1H), 4,15-4,00 (м, 1H), 3,36-3,13 (м, 2H), 3,13-2,99 (м, 1H), 2,13-1,86 (м, 2H), 1,67-1,27 (м, 6H), 1,06 (д, J=6,4 Гц, 3H).
Соединение 31 (1-амино-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)циклопропанкарбоксамид гидрохлорид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 1-(трет-бутоксикарбониламино)циклопропанкарбоновой кислоты. ВЭЖХ: чистота 97,5%, RT=1,22 мин. МС: m/z=351,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,90 (д, J=1,7 Гц, 1H), 8,85 (д, J=1,7 Гц, 1H), 8,07 (д, J=8,4 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 4,35-4,08 (м, 3H), 2,85-2,60 (м, 2H), 2,08-1,93 (м, 2H), 1,59-1,15 (м, 5H), 0,98 (д, J=6,3 Гц, 3H).
Соединение 34 (2-амино-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)ацетамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 2-(трет-бутоксикарбониламино)уксусной кислоты. ВЭЖХ: чистота 99,6%, RT=0,83 мин. МС: m/z=300,9 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 8,98 (с, 1H), 8,81 (с, 1H), 8,69 (д, J=5,3 Гц, 1H), 7,82 (д, J=7,6 Гц, 1H), 7,12 (д, J=5,4 Гц, 1H), 4,55-4,46 (м, 1H), 4,46-4,37 (м, 1H), 3,94-3,82 (м, 1H), 3,07 (с, 2H), 2,86-2,76 (м, 1H), 2,74-2,64 (м, 1H), 2,30-2,78 (м, 4H), 1,29-1,15 (м, 1H), 0,91 (д, J=6,4 Гц, 3H).
Соединение 35 (2-амино-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)ацетамид гидрохлорид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-(трет-бутоксикарбониламино)уксусной кислоты. ВЭЖХ: чистота 96,6%, RT=1,19 мин. МС: m/z=325,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,91 (д, J=1,7 Гц, 1H), 8,85 (д, J=1,8 Гц, 1H), 8,07 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,45-4,33 (м, 1H), 4,27-4,07 (м, 2H), 3,66 (с, 2H), 2,85-2,60 (м, 2H), 2,18-1,95 (м, 2H), 1,27-1,13 (м, 1H), 0,99 (д, J=6,4 Гц, 3H).
Соединение 102 ((2R)-2-амино-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-3-метилбутанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (R)-2-(этил(метил)амино)пропановой кислоты. ВЭЖХ: чистота 99,7%, RT=1,54 мин. МС: m/z=367,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,10 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,5 Гц, 1H), 4,46-4,37 (м, 1H), 4,35-4,26 (м, 1H), 4,24-4,12 (м, 1H), 3,08 (д, J=5,9 Гц, 1H), 2,81 (т, J=11,3 Гц, 1H), 2,70 (т, J=11,3 Гц, 1H), 2,17-1,85 (м, 3H), 1,33-1,21 (м, 1H), 1,06-0,93 (м, 9H).
Соединение 103 ((2S)-2-амино-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-3-метилбутанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (S)-2-(этил(метил)амино)пропановой кислоты. ВЭЖХ: чистота 97,8%, RT=2,07 мин. МС: m/z=367,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94-8,90 (м, 2H), 8,11 (д, J=8,4 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 4,46-4,37 (м, 1H), 4,36-4,27 (м, 1H), 4,17 (дд, J=11,2, 7,1 Гц, 1H), 3,07 (д, J=6,0 Гц, 1H), 2,81 (т, J=11,4 Гц, 1H), 2,69 (т, J=11,8 Гц, 1H), 2,17-2,00 (м, 2H), 1,99-1,89 (м, 1H), 1,32-1,18 (м, 1H), 1,07-0,95 (м, 9H).
Соединение 104 ((2R)-2-амино-3-метил-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]бутанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (R)-2-(трет-бутоксикарбониламино)-3-метилбутановой кислоты. ВЭЖХ: чистота 94,0%, RT=0,90 мин. МС: m/z=343,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (с, 1H), 8,75 (с, 1H), 8,62 (д, J=5,6 Гц, 1H), 7,09 (д, J=5,6 Гц, 1H), 4,99-4,59 (м, 2H), 4,26-3,92 (м, 1H), 3,07-2,95 (д, J=11,5 Гц, 1H), 2,85-2,62 (м, 2H), 2,12-1,82 (м, 3H), 1,45-1,20 (м, 1H), 1,13-0,85 (м, 9H).
Соединение 105 ((2S)-2-амино-3-метил-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]бутанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (S)-2-(трет-бутоксикарбониламино)-3-метилбутановой кислоты. ВЭЖХ: чистота 97,6%, RT=1,65 мин. МС: m/z=343,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95 (с, 1H), 8,82 (с, 1H), 8,68 (д, J=5,6 Гц, 1H), 7,17 (д, J=5,7Гц, 1H), 4,87 (с, 2H), 4,18-4,02 (м, 1H), 3,08 (д, J=6,0 Гц, 1H), 2,95-2,84 (м, 1H), 2,79 (т, J=12,1 Гц, 1H), 2,17-1,85 (м, 3H), 1,30 (д, J=12,0 Гц, 1H), 1,07-0,9 (м, 9H).
Соединение 106 ((2R)-2-амино-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-3-гидроксипропанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и (R)-2-(трет-бутоксикарбониламино)-3-гидроксипропановой кислоты. ВЭЖХ: чистота 92,4%, RT=0,93 мин. МС: m/z=355,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,89-9,11 (м, 2H), 8,10 (д, J=12 Гц, 1H), 7,29 (д, J=12 Гц, 1H), 4,39-4,01 (м, 3H), 3,63-3,73 (м, 2H), 3,41-3,2 (м, 1H), 2,84-2,55 (м, 2H), 2,18-1,95 (м, 2H), 1,35-1,20 (м, 1H), 1,02 (д, J=8 Гц, 3H).
Соединение 107 ((2R)-2-амино-3-гидрокси-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]пропанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (R)-2-(трет-бутоксикарбониламино)-3-гидроксипропановой кислоты. ВЭЖХ: чистота 95,0%, RT=0,96 мин. МС: m/z=331,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (с, 1H), 8,80 (с, 1H), 8,65 (д, J=8,0 Гц, 1H), 7,15 (д, J=8,0 Гц, 1H), 4,75-4,59 (м, 2H), 4,15-4,01 (м, 1H), 3,72-3,62 (м, 2H), 3,40-3,32 (м, 1H), 2,91-2,80 (м, 1H), 2,79-2,69 (м, 1H), 2,11 (д, J=16,0 Гц, 1H), 2,05-1,85 (м, 1H), 1,35-1,23 (м, 1H), 1,01 (д, J=8,0 Гц, 3H).
Соединение 116 ((2S)-2-амино-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-3-(пиридин-3-ил)пропанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и (S)-2-(трет-бутоксикарбониламино)-3-(пиридин-3-ил)пропановой кислоты. ВЭЖХ: чистота 98,2%, RT=6,08 мин. МС: m/z=416,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,82 (м, 2H), 8,38 (дт, J=3,0, 1,5 Гц, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,70 (дд, J=7,8, 1,9 Гц, 1H), 7,35 (дд, J=7,8, 4,9 Гц, 1H), 7,20 (д, J=8,4 Гц, 1H), 4,33-4,15 (м, 2H), 4,07-3,92 (м, 1H), 3,51 (т, J=6,9 Гц, 1H), 2,93 (д, J=6,9 Гц, 2H), 2,70-2,49 (м, 2H), 1,97 (шир.с, 1H), 1,82-1,77 (м, 1H), 1,06-0,87 (м, 4H).
Соединение 117 ((2S)-2-амино-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-фенилацетамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и (S)-2-(трет-бутоксикарбониламино)-2-фенилуксусной кислоты. ВЭЖХ: чистота 99,9%, RT=1,66 мин. МС: m/z=401,1 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,02 (д, J=1,7 Гц, 1H), 8,94 (д, J=1,8 Гц, 1H), 8,25-8,09 (м, 2H), 7,45-7,17 (м, 6H), 4,40-4,20 (м, 3H), 3,91-3,80 (м, 1H), 2,88-2,56 (м, 2H), 1,96-1,82 (м, 2H), 1,28-1,04 (м, 1H), 0,90 (д, J=6,3 Гц, 3H).
Соединение 118 ((2S)-2-амино-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]-3-(пиридин-3-ил)пропанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (S)-2-(трет-бутоксикарбониламино)-3-(пиридин-3-ил)пропановой кислоты. ВЭЖХ: чистота 98,4%, RT=1,79 мин. МС: m/z=392,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,90 (д, J=1,7 Гц, 1H), 8,77 (д, J=1,7 Гц, 1H), 8,63 (д, J=5,7 Гц, 1H), 8,40-8,38 (м, 2H), 7,72-7,68 (м, 1H), 7,36 (дд, J=7,9, 4,9 Гц, 1H), 7,09 (д, J=5,7 Гц, 1H), 4,63-4,54 (м, 2H), 3,99-3,89 (м, 1H), 3,54-3,49 (м, 1H), 2,93 (д, J=6,9 Гц, 2H), 2,80-2,58 (м, 2H), 2,00-1,74 (м, 2H), 1,12-0,85 (м, 4H).
Соединение 119 ((2R)-2-амино-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-фенилацетамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и (R)-2-(трет-бутоксикарбониламино)-2-фенилуксусной кислоты. ВЭЖХ: чистота 97,3%, RT=1,87 мин. МС: m/z=401,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 9,02 (д, J=1,8 Гц, 1H), 8,92 (д, J=1,8 Гц, 1H), 8,25-8,12 (дд, J=24,8, 8,0 Гц, 2H), 7,43-7,19 (м, 6H), 4,38-4,15 (м, 3H), 3,96-3,84 (м, 1H), 2,82-2,68 (м, 2H), 1,99-1,80 (м, 2H), 1,27-1,23 (м, 1H), 0,92 (д, J=6,5 Гц, 3H).
Соединение 128 (3-амино-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]оксетан-3-карбоксамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 3-((трет-бутоксикарбонил)амино)оксетан-3-карбоновой кислоты. ВЭЖХ: чистота 97,4%, RT=0,79 мин. МС: m/z=343,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,90 (д, J=1,7 Гц, 1H), 8,79 (д, J=1,9 Гц, 1H), 8,63 (д, J=5,7 Гц, 1H), 7,13 (д, J=5,7 Гц, 1H), 4,73-4,55 (м, 2H), 4,20-3,50 (м, 3H), 3,00-2,68 (м, 2H), 2,20-1,85 (м, 3H), 1,70-1,58 (м, 1H), 1,40-1,10 (м, 1H), 1,00 (д, J=6,8 Гц, 3H).
Соединение 129 (3-амино-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]оксетан-3-карбоксамид): из 3-(трет-бутоксикарбониламино)оксетан-3-карбоновой кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,0%, RT=1,05 мин. МС: m/z=367,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,97-8,86 (м, 2H), 8,10 (дт, J=8,6, 2,3 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 4,39-4,09 (м, 4H), 3,99-3,74 (м, 2H), 2,96-2,80 (м, 1H), 2,79-2,63 (м, 1H), 2,18-1,85 (м, 3H), 1,38-1,23 (м, 1H), 1,04 (дд, J=6,6, 2,0 Гц, 3H).
Соединение 268 (2-амино-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-циклопропилацетамид): из 2-(трет-бутоксикарбониламино)-2-циклопропилуксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 47,7+47,3%, RT=2,04+2,17 мин. МС: m/z=365,2 [M+H]+. 1H ЯМР (300 МГц, Хлороформ-d, м.д.) δ 8,93 (д, J=1,7 Гц, 1H), 8,83 (д, J=1,8 Гц, 1H), 7,99 (дд, J=8,4, 2,8 Гц, 1H), 7,21 (д, J=8,2 Гц, 1H), 4,39-4,11 (м, 3H), 3,07-2,65 (м, 3H), 2,20-1,90 (м, 4H), 1,23 (д, J=14,2 Гц, 2H), 1,15-1,01 (м, 1H), 0,96 (д, J=6,6 Гц, 3H), 0,72-0,50 (м, 3H), 0,37 (с, 1H).
Соединение 277 (4-амино-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3-диметилбутанамид): из 4-(трет-бутоксикарбониламино)-3,3-диметилбутановой кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 93,8%, RT=2,08 мин. МС: m/z=381,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94-8,83 (м, 2H), 8,07 (дд, J=8,3, 1,0 Гц, 1H), 7,26 (д, J=8,4 Гц, 1H), 4,42-4,24 (м, 2H), 4,13 (тт, J=10,2, 4,2 Гц, 1H), 2,80-2,60 (м, 4H), 2,23 (с, 2H), 2,13-1,97 (м, 2H), 1,27-1,12 (м, 1H), 1,10-0,92 (м, 10H).
Пример 14: Синтез соединения 42 ((R)-3-амино-1-((3R,5S)-5-метил-1-(пиридо[3,2-b]пиразин-8-ил)пиперидин-3-ил)пирролидин-2-он)
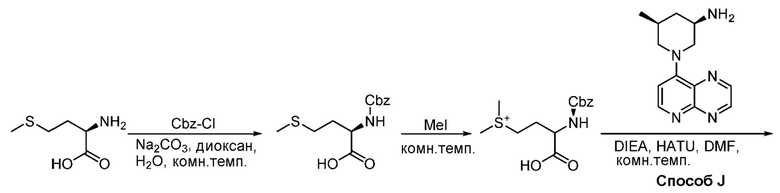
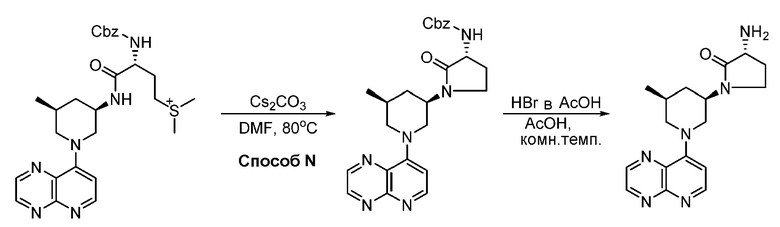
(R)-2-(бензилоксикарбониламино)-4-(метилтио)бутановая кислота: При комнатной температуре (2R)-2-амино-4-(метилсульфанил)бутановую кислоту (4,90 г, 32,84 ммоль) и карбонат натрия (16,91 г, 159,54 ммоль) растворяли в воде (100 мл), добавляли раствор бензилхлороформиата (5,59 г, 32,74 ммоль) в диоксане (50 мл) по каплям в течение 10 минут. Полученный раствор затем перемешивали в течение 5 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (100 мл). Полученную смесь экстрагировали этилацетатом (300 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали на колонке C18 с обращенной фазой, элюируя ацетонитрилом в воде (0% - 50% градиент за 30 мин), с получением (2R)-2-[[(бензилокси)карбонил]амино]-4-(метилсульфанил)бутановой кислоты в виде желтого масла (3,48 г, 36%).
(3-(Бензилоксикарбониламино)-3-карбоксипропил)диметилсульфоний: При комнатной температуре (2R)-2-[[(бензилокси)карбонил]амино]-4-(метилсульфанил)бутановой кислоты (3,31 г, 11,67 ммоль) медленно добавляли к CH3I (15 мл, 0,48 моль). Полученный раствор перемешивали в течение 15 часов при комнатной температуре. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении с получением [(3R)-3-[[(бензилокси)карбонил]амино]-3-карбоксипропил]диметилсульфания в виде коричневого масла (3,50 г, неочищенный продукт). Неочищенное вещество использовали на следующей стадии непосредственно без дополнительной очистки.
((R)-3-(бензилоксикарбониламино)-4-((3R,5S)-5-метил-1-(пиридо[3,2-b]пиразин-8-ил)пиперидин-3-иламино)-4-оксобутил)диметилсульфоний: ((R)-3-(бензилоксикарбониламино)-4-((3R,5S)-5-метил-1-(пиридо[3,2-b]пиразин-8-ил)пиперидин-3-иламино)-4-оксобутил)диметилсульфоний получали из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (3-(бензилоксикарбониламино)-3-карбоксипропил)диметилсульфония с использованием Способа J с получением N-[(1R)-3-(диметилсульфанил)-1-[[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]карбамоил]пропил]карбамата в виде коричневого твердого вещества (3,10 г, неочищенный продукт). Неочищенное вещество использовали на следующей стадии непосредственно без дополнительной очистки.
Бензил (R)-1-((3R,5S)-5-метил-1-(пиридо[3,2-b]пиразин-8-ил)пиперидин-3-ил)-2-оксопирролидин-3-илкарбамат: бензил (R)-1-((3R,5S)-5-метил-1-(пиридо[3,2-b]пиразин-8-ил)пиперидин-3-ил)-2-оксопирролидин-3-илкарбамат получали из ((R)-3-(бензилоксикарбониламино)-4-((3R,5S)-5-метил-1-(пиридо[3,2-b]пиразин-8-ил)пиперидин-3-иламино)-4-оксобутил)диметилсульфония с использованием Способа N. Неочищенный продукт очищали на колонке C18 с обращенной фазой, элюируя ацетонитрилом в воде (0% - 80% градиент за 45 мин), с получением бензил N-[(3R)-1-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]-2-оксопирролидин-3-ил]карбамата в виде желтого твердого вещества (270 мг, 5% для 3 стадий).
(R)-3-амино-1-((3R,5S)-5-метил-1-(пиридо[3,2-b]пиразин-8-ил)пиперидин-3-ил)пирролидин-2-он: К раствору бензил N-[(3R)-1-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]-2-оксопирролидин-3-ил]карбамата (125 мг, 0,27 ммоль) в уксусной кислоте (2 мл) добавляли раствор HBr в AcOH (40%, 7 моль/л, 3 мл, 21 ммоль) по каплям при комнатной температуре. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Когда реакция была завершена, реакционную смесь концентрировали в условиях вакуума. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 30% - 80% градиент за 10 мин; Детектор УФ 254 нм. (3R)-3-амино-1-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]пирролидин-2-он получали в виде коричневого твердого вещества (30 мг, 32%).
Соединение 42: ВЭЖХ: чистота 96,0%, RT=1,84 мин. МС: m/z=327,1 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,98 (д, J=1,7 Гц, 1H), 8,82 (д, J=1,7 Гц, 1H), 8,70 (д, J=5,3 Гц, 1H), 7,11 (д, J=5,4 Гц, 1H), 4,44 (дд, J=12,8, 3,9 Гц, 1H), 4,28-4,17 (м, 1H), 4,05-3,95 (м, 1H), 3,39-3,10 (м, 4H), 2,75-2,63 (м, 1H), 2,28-1,70 (м, 5H), 1,63-1,38 (м, 2H), 0,92 (д, J=6,5 Гц, 3H).
Пример 15: Синтез соединения 43 ((2S,6R)-2,6-диметил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин)
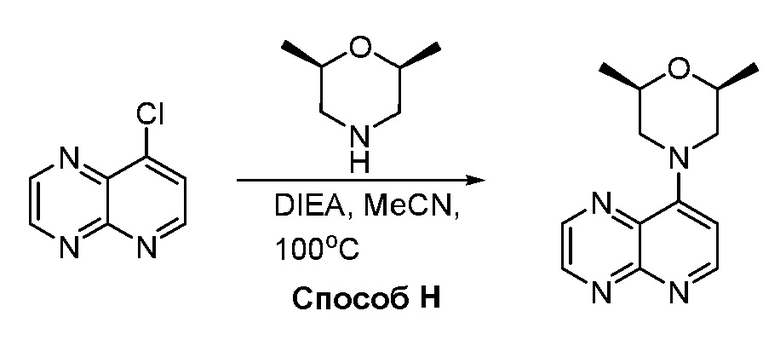
(2S,6R)-2,6-диметил-4-(пиридо[2,3-b]пиразин-8-ил): (2S,6R)-2,6-диметил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин получали из 8-хлорпиридо[2,3-b]пиразина и (2R,6S)-2,6-диметилморфолина с использованием Способа H. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 25% - 75% градиент за 10 мин; Детектор УФ 254 нм. (2R,6S)-2,6-диметил-4-[пиридо[2,3-b]пиразин-8-ил]морфолин получали в виде желтого твердого вещества (30 мг, 21%).
Соединение 43: ВЭЖХ: чистота 99,0%, RT=0,93 мин. МС: m/z=245,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,91 (д, J=1,7 Гц, 1H), 8,78 (д, J=1,7 Гц, 1H), 8,66 (д, J=5,6 Гц, 1H), 7,02 (д, J=5,6 Гц, 1H), 4,52-4,41 (м, 2H), 3,97-3,83 (м, 2H), 2,84-2,68 (м, 2H), 1,22 (д, J=6,3 Гц, 6H).
Пример 16: Синтез соединения 44 (8-((2R,6S)-2,6-диметилморфолино)хиноксалин-5-карбонитрил)
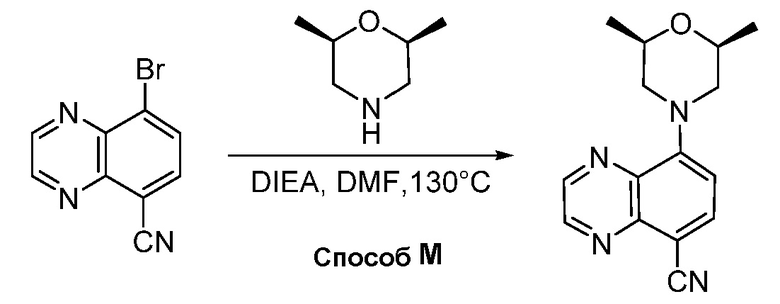
8-((2R,6S)-2,6-диметилморфолино)хиноксалин-5-карбонитрил: 8-((2R,6S)-2,6-диметилморфолино)хиноксалин-5-карбонитрил получали из 8-бромхиноксалин-5-карбонитрила и (2R,6S)-2,6-диметилморфолина с использованием Способа M. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 250 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 30% - 80% градиент за 10 мин; Детектор УФ 254 нм. 8-[(2R,6S)-2,6-диметилморфолин-4-ил]хиноксалин-5-карбонитрил получали в виде желтого твердого вещества (30 мг, 39%).
Соединение 44: ВЭЖХ: чистота 98,0%, RT=1,30 мин. МС: m/z=269,2 [M+H]+. 1H ЯМР (400 МГц, DMSO, м.д.) δ 9,04 (д, J=1,8 Гц, 1H), 8,95 (д, J=1,8 Гц, 1H), 8,21 (д, J=8,4 Гц, 1H), 7,21 (д, J=8,4 Гц, 1H), 4,19-4,10 (м, 2H), 3,91-3,79 (м, 2H), 2,75-2,61 (м, 2H), 1,14 (д, J=6,2 Гц, 6H).
Следующие соединение синтезировали аналогичным способом:
Соединение 45 ((2S,6R)-2,6-диметил-4-(хинолин-4-ил)морфолин): из 4-хлорхинолина и (2R,6S)-2,6-диметилморфолина. ВЭЖХ: чистота 99,9%, RT=1,33 мин. МС: m/z=243,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,60 (д, J=5,2 Гц, 1H), 8,06 (дд, J=8,6, 1,5 Гц, 1H), 7,93 (д, J=8,5 Гц, 1H), 7,73-7,63 (м, 1H), 7,57-7,47 (м, 1H), 6,97 (дд, J=5,3, 1,8 Гц, 1H), 4,06-3,94 (м, 2H), 3,47 (д, J=11,7 Гц, 2H), 2,64-2,50 (м, 2H), 1,21 (дд, J=6,3, 1,1 Гц, 6H).
Пример 17: Синтез соединения 46 ((2S,6R)-4-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-2,6-диметилморфолин)
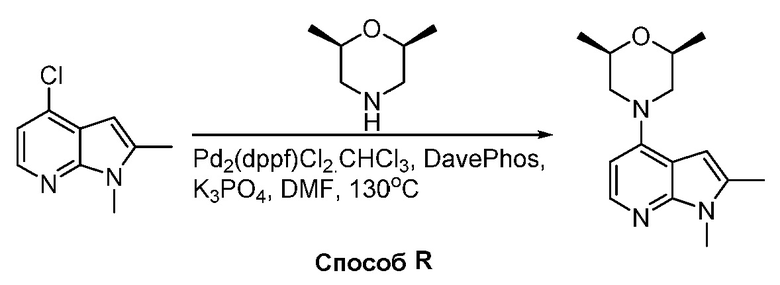
(2S,6R)-4-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-2,6-диметилморфолин: (2S,6R)-4-(1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил)-2,6-диметилморфолин получали из 4-хлор-1,2-диметил-1H-пирроло[2,3-b]пиридина и (2R,6S)-2,6-диметилморфолина с использованием Способа R. Колонка 5 мкм, 19 мм × 250 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 25% - 70% градиент за 10 мин; Детектор УФ 254 нм. (2R,6S)-4-[1,2-диметил-1H-пирроло[2,3-b]пиридин-4-ил]-2,6-диметилморфолин получали в виде белого твердого вещества (32 мг, 12%).
Соединение 46: ВЭЖХ: чистота 95,0%, RT=1,88 мин. МС: m/z=260,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 7,88 (д, J=5,7 Гц, 1H), 6,44 (д, J=5,7 Гц, 1H), 6,22 (с, 1H), 3,92-3,74 (м, 4H), 3,67 (с, 3H), 2,63-2,48 (м, 2H), 2,40 (с, 3H), 1,21 (д, J=6,2 Гц, 6H).
Пример 18: Синтез соединения 47 ((2R,6S)-2-метил-6-((4-метилпиперазин-1-ил)метил)-4-(пиридо[2,3-b]пиразин-8-ил)морфолин)
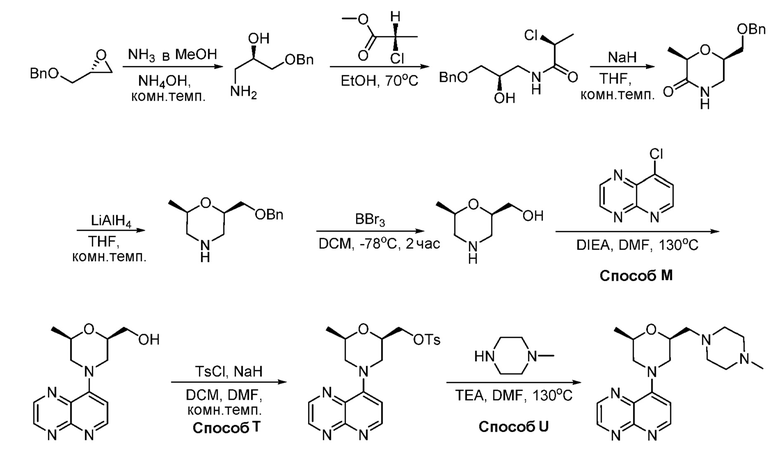
(R)-1-амино-3-(бензилокси)пропан-2-ол: При комнатной температуре к раствору (2R)-2-[(бензилокси)метил]оксирана (5,22 г, 31,82 ммоль) в этаноле (25 мл) последовательно добавляли раствор NH3 в MeOH (25 мл, 7M, 175 ммоль) и NH3.H2O (28%, 14,8 моль/л, 53 мл, 0,78 моль). Полученный раствор перемешивали в течение 16 часов при комнатной температуре. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении с получением (2R)-1-амино-3-(бензилокси)пропан-2-ола в виде бесцветного масла (6,2 г, неочищенный продукт).
(R)-1-амино-3-(бензилокси)пропан-2-ол: К раствору (2R)-1-амино-3-(бензилокси)пропан-2-ола (6,20 г, неочищенный) в этаноле (50 мл) добавляли метил (2S)-2-хлорпропаноат (3,33 г, 54,42 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 20 часов при 70°C. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 50% градиент), с получением (2S)-N-[(2R)-3-(бензилокси)-2-гидроксипропил]-2-хлорпропанамида в виде светло-желтого масла (5,65 г, 65% для 2 стадий).
(2R,6R)-6-(бензилоксиметил)-2-метилморфолин-3-он: К раствору (2S)-N-[(2R)-3-(бензилокси)-2-гидроксипропил]-2-хлорпропанамида (4,12 г, 15,18 ммоль) в тетрагидрофуране (30 мл) добавляли гидрид натрия (1,02 г, 42,50 ммоль) по порциям при комнатной температуре. Полученную смесь перемешивали в течение 2 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем медленного добавления воды (30 мл). Смесь экстрагировали этилацетатом (100 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 100% градиент), с получением (2R,6R)-6-[(бензилокси)метил]-2-метилморфолин-3-она в виде светло-желтого масла (2,68 г, 75%).
(2R,6R)-2-(бензилоксиметил)-6-метилморфолин: К раствору (2R,6R)-6-[(бензилокси)метил]-2-метилморфолин-3-она (5,40 г, 22,93 ммоль) в тетрагидрофуране (50 мл) добавляли LiAlH4 (2,00 г, 52,56 ммоль) по порциям при комнатной температуре. Полученную смесь перемешивали в течение 2 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (40 мл). Полученную смесь экстрагировали этилацетатом (100 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением (2R,6R)-2-[(бензилокси)метил]-6-метилморфолина в виде светло-желтого масла (5,40 г, неочищенный продукт).
((2R,6R)-6-метилморфолин-2-ил)метанол: при -78°C к раствору (2R,6R)-2-[(бензилокси)метил]-6-метилморфолина (1,00 г, неочищенный) в дихлорметане (20 мл) добавляли раствор BBr3 в дихлорметане (5 мл, 3 M, 15,00 ммоль) по каплям в течение 10 минут. Полученный раствор затем перемешивали в течение 3 часов при -78°C. Когда реакция была завершена, ее гасили путем медленного добавления раствора NaOH (1M, 15 мл). Полученную смесь экстрагировали дихлорметаном (60 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением [(2R,6R)-6-метилморфолин-2-ил]метанола в виде белого твердого вещества (500 мг, неочищенный продукт).
((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метанол: ((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метанол получали из ((2R,6R)-6-метилморфолин-2-ил)метанола и 8-хлорпиридо[2,3-b]пиразина с использованием Способа M. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи EtOAc в петролейном эфире (0% - 50% градиент), с получением [(2R,6R)-6-метил-4-[пиридо[2,3-b]пиразин-8-ил]морфолин-2-ил]метанола в виде желтого масла (2,00 г, 28% для 3 стадий).
Способ T
((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил 4-метилбензолсульфонат: при 5°C к раствору [(2R,6R)-6-метил-4-[пиридо[2,3-b]пиразин-8-ил]морфолин-2-ил]метанола (638 мг, 2,45 ммоль) в N,N-диметилформамиде (30 мл) добавляли гидрид натрия (203 мг, 8,45 ммоль) по порциям. Полученную смесь перемешивали в течение 10 минут при 5°C и затем добавляли раствор 4-метилбензол-1-сульфонилхлорида (926 мг, 4,86 ммоль) в дихлорметане (3 мл) по каплям в течение 5 минут. Реакционную смесь затем перемешивали в течение 8 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (50 мл). Смесь экстрагировали этилацетатом (100 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением [(2R,6R)-6-метил-4-[пиридо[2,3-b]пиразин-8-ил]морфолин-2-ил]метил 4-метилбензол-1-сульфоната в виде желтого твердого вещества (600 мг, неочищенный продукт).
Способ U
(2R,6S)-2-метил-6-((4-метилпиперазин-1-ил)метил)-4-(пиридо[2,3-b]пиразин-8-ил)морфолин: К раствору [(2R,6R)-6-метил-4-[пиридо[2,3-b]пиразин-8-ил]морфолин-2-ил]метил 4-метилбензол-1-сульфоната (60 мг, неочищенный) в N,N-диметилформамиде (5 мл) добавляли 1-метилпиперазин (21 мг, 0,21 ммоль) и TEA (42 мг, 0,41 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 10 часов при 130°C. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (10 мл) и экстрагировали при помощи DCM (30 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: Колонка SunFire Prep C18 OBD Column, 19×150мм 5мкм 10нм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 25% - 75% градиент за 10 мин; Детектор УФ 254нм. (2R,6S)-2-метил-6-[(4-метилпиперазин-1-ил)метил]-4-[пиридо[2,3-b]пиразин-8-ил]морфолин получали в виде желтого твердого вещества (30 мг, 36% для 2 стадий).
Соединение 47: ВЭЖХ: чистота 94,7%, RT=1,41 мин. МС: m/z=343,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,78 (д, J=1,7 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 7,04 (д, J=5,6 Гц, 1H), 4,65-4,53 (м, 1H), 4,47-4,37 (м, 1H), 4,10-3,85 (м, 2H), 2,85-2,39 (м, 11H), 2,35-2,25 (м, 4H), 1,23 (д, J=6,2 Гц, 3H).
Пример 19: Синтез соединения 48 ((2R,6S)-2-метил-6-(пиперазин-1-илметил)-4-(пиридо[2,3-b]пиразин-8-ил)морфолин)
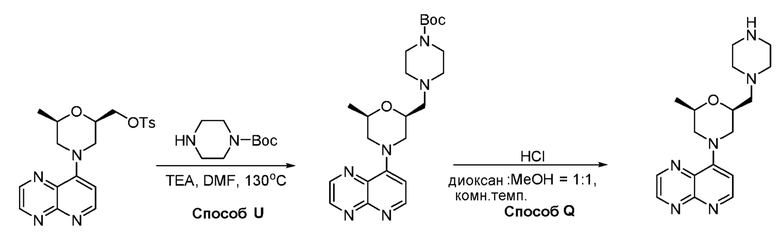
(2R,6S)-2-метил-6-(пиперазин-1-илметил)-4-(пиридо[2,3-b]пиразин-8-ил)морфолин: (2R,6S)-2-метил-6-(пиперазин-1-илметил)-4-(пиридо[2,3-b]пиразин-8-ил)морфолин получали из ((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил 4-метилбензолсульфоната и трет-бутил пиперазин-1-карбоксилата с использованием Способа U и Q. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 0,02% об/об HCl), 3% - 8% градиент за 10 мин; Детектор УФ 254 нм. (2R,6S)-2-метил-6-(пиперазин-1-илметил)-4-[пиридо[2,3-b]пиразин-8-ил]морфолин получали в виде светло-коричневого твердого вещества (15 мг, 22% для 2 стадий).
Соединение 48: ВЭЖХ: чистота 99,5%, RT=0,92 мин. МС: m/z=329,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,78 (д, J=1,8 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 7,04 (д, J=5,6 Гц, 1H), 4,64-4,52 (м, 1H), 4,47-4,37 (м, 1H), 4,12-3,83 (м, 2H), 2,95-2,40 (м, 12Н), 1,23 (д, J=6,2 Гц, 3H).
Пример 20: Синтез соединения 49 ((2R,6S)-2-метил-6-(пиперазин-1-илметил)-4-(хинолин-5-ил)морфолин)
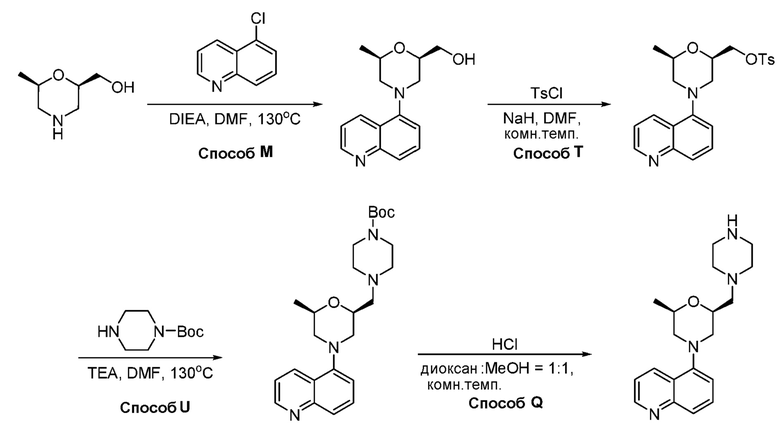
(2R,6S)-2-метил-6-(пиперазин-1-илметил)-4-(хинолин-5-ил)морфолин: (2R,6S)-2-метил-6-(пиперазин-1-илметил)-4-(хинолин-5-ил)морфолин получали из ((2R,6R)-6-метилморфолин-2-ил)метанола, 5-хлорхинолина, 4-метилбензол-1-сульфонилхлорида и трет-бутил пиперазин-1-карбоксилата с использованием Способа M, T, U и Q. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 30% - 80% градиент за 10 мин; Детектор УФ 254 нм. 4-[(2R,6S)-2-метил-6-(пиперазин-1-илметил)морфолин-4-ил]хинолин получали в виде не совсем белого твердого вещества (35 мг, 15% для 4 стадий).
Соединение 49: ВЭЖХ: чистота 95,1%, RT=0,53 мин. МС: m/z=327,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,61 (д, J=5,1 Гц, 1H), 8,13-8,03 (м, 1H), 7,98-7,88 (м, 1H), 7,74-7,64 (м, 1H), 7,58-7,48 (м, 1H), 6,99 (д, J=5,2 Гц, 1H), 4,20-3,94 (м, 2H), 3,72-3,32 (м, 2H), 2,92-2,82 (м, 4H), 2,75-2,38 (м, 8H), 1,22 (д, J=6,2 Гц, 3H).
Пример 21: Синтез соединения 50 (8-((2R,6S)-2-метил-6-((4-метилпиперазин-1-ил)метил)морфолино)хиноксалин-5-карбонитрил)
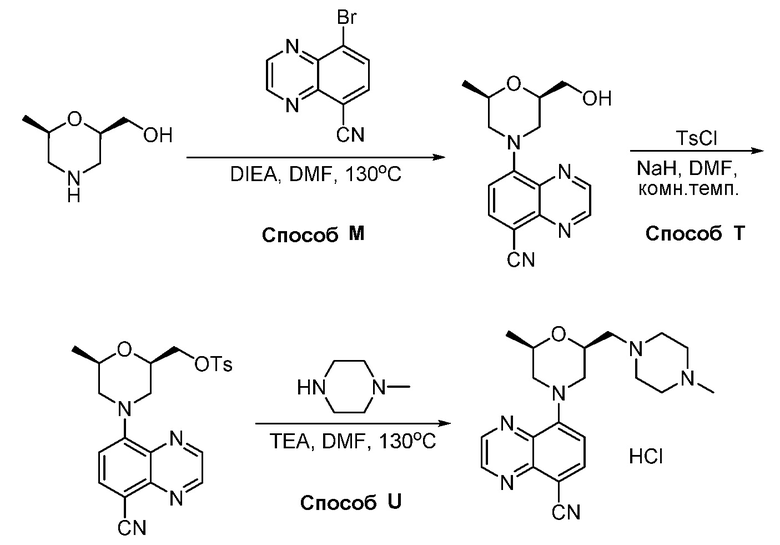
8-((2R,6S)-2-метил-6-((4-метилпиперазин-1-ил)метил)морфолино)хиноксалин-5-карбонитрил гидрохлорид: 8-((2R,6S)-2-метил-6-((4-метилпиперазин-1-ил)метил)морфолино)хиноксалин-5-карбонитрил гидрохлорид получали из ((2R,6R)-6-метилморфолин-2-ил)метанола, 8-бромхиноксалин-5-карбонитрила, 4-метилбензол-1-сульфонилхлорида и 1-метилпиперазина с использованием Способа M, T и U. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 0,02% об/об HCl), 15% - 40% градиент за 10 мин; Детектор УФ 254 нм. 8-((2R,6S)-2-метил-6-((4-метилпиперазин-1-ил)метил)морфолино)хиноксалин-5-карбонитрил гидрохлорид получали в виде черного твердого вещества (50 мг, 20% для 3 стадий).
Соединение 50: ВЭЖХ: чистота 98,5%, RT=1,48 мин. МС: m/z=367,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,8 Гц, 1H), 8,85 (д, J=1,8 Гц, 1H), 8,08 (д, J=8,3 Гц, 1H), 7,20 (д, J=8,4 Гц, 1H), 4,57-4,39 (м, 1H), 4,30-4,20 (м, 1H), 4,18-3,40 (м, 12Н), 3,02 (с, 3H), 2,90-2,74 (м, 2H), 1,30 (д, J=6,1 Гц, 3H).
Пример 22: Синтез соединения 51 ((2R,6S)-2-метил-6-((4-метилпиперазин-1-ил)метил)-4-(хинолин-5-ил)морфолин)
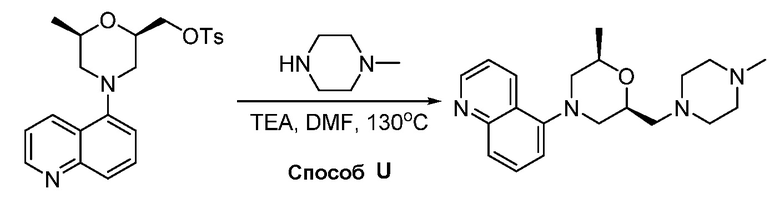
(2R,6S)-2-метил-6-((4-метилпиперазин-1-ил)метил)-4-(хинолин-5-ил)морфолин: (2R,6S)-2-метил-6-((4-метилпиперазин-1-ил)метил)-4-(хинолин-5-ил)морфолин получали из ((2R,6R)-6-метил-4-(хинолин-5-ил)морфолин-2-ил)метил 4-метилбензолсульфоната и 1-метилпиперазина с использованием Способа U. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 20% - 40% градиент за 8 мин; Детектор УФ 254 нм. 4-[(2R,6S)-2-метил-6-[(4-метилпиперазин-1-ил)метил]морфолин-4-ил]хинолин получали в виде светло-коричневого твердого вещества (45 мг, 55%).
Соединение 51: ВЭЖХ: чистота 99,9%, RT=1,10 мин. МС: m/z=341,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,61 (д, J=5,1 Гц, 1H), 8,13-8,03 (м, 1H), 8,01-7,88 (м, 1H), 7,77-7,61 (м, 1H), 7,59-7,47 (м, 1H), 6,99 (д, J=5,1 Гц, 1H), 4,19-3,94 (м, 2H), 3,62-3,42 (м, 2H), 2,84 (с, 2H), 2,70-2,36 (м, 10H), 2,26 (с, 3H), 1,22 (д, J=6,2 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 52 ((2R,6S)-2-метил-6-((4-пропилпиперазин-1-ил)метил)-4-(пиридо[2,3-b]пиразин-8-ил)морфолин): из ((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил 4-метилбензолсульфоната и 1-пропилпиперазина. ВЭЖХ: чистота 96,3%, RT=0,99 мин. МС: m/z=371,30 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,77 (д, J=1,7 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 7,03 (д, J=5,6 Гц, 1H), 4,64-4,52 (м, 1H), 4,47-4,35 (м, 1H), 4,11-3,83 (м, 2H), 2,88 -2,25 (м, 14H), 1,62-1,43 (м, 2H), 1,23 (д, J=6,2 Гц, 3H), 0,90 (т, J=7,4 Гц, 3H).
Соединение 53 ((2S,6R)-2-(((S)-3,4-диметилпиперазин-1-ил)метил)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин): из ((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил 4-метилбензолсульфоната и (S)-1,2-диметилпиперазин гидрохлорида. ВЭЖХ: чистота 97,8%, RT=0,86 мин. МС: m/z=357,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,78 (д, J=1,8 Гц, 1H), 8,67 (д, J=5,5 Гц, 1H), 7,04 (д, J=5,6 Гц, 1H), 4,68-4,52 (м, 1H), 4,49-4,37 (м, 1H), 4,11-3,85 (м, 2H), 2,98 (д, J=15,9 Гц, 1H), 2,89-2,70 (м, 4H), 2,59-2,20 (м, 8H), 2,06-1,92 (м, 1H), 1,23 (д, J=6,3 Гц, 3H), 1,06 (д, J=6,3 Гц, 3H).
Соединение 54 ((2R,6S)-2-метил-4-(пиридо[2,3-b]пиразин-8-ил)-6-((3,3,4-триметилпиперазин-1-ил)метил)морфолин): из ((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил 4-метилбензолсульфоната и 1,2,2-триметилпиперазина. ВЭЖХ: чистота 98,2%, RT=1,63 мин. МС: m/z=371,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,77 (д, J=1,8 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 7,02 (д, J=5,6 Гц, 1H), 4,81-4,67 (м, 1H), 4,41-4,29 (м, 1H), 4,05-3,82 (м, 2H), 2,89-2,15(м, 13H), 1,22 (д, J=6,3 Гц, 3H), 1,08 (с, 6H).
Соединение 55 (N,N-диметил-1-(((2S,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил)пиперидин-4-амин): из ((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил 4-метилбензолсульфоната и N,N-диметилпиперидин-4-амина. ВЭЖХ: чистота 93,3%, RT=0,83 мин. МС: m/z=371,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,78 (д, J=1,8 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 7,03 (д, J=5,6 Гц, 1H), 4,64-4,52 (м, 1H), 4,48-4,36 (м, 1H), 4,09-3,83 (м, 2H), 3,24-3,08 (м, 1H), 3,02 (д, J=11,2 Гц, 1H), 2,85-2,73 (м, 2H), 2,60-2,39 (м, 2H), 2,35-1,99 (м, 9H), 1,92-1,78 (м, 2H), 1,63-1,49 (м, 2H), 1,23 (д, J=6,2 Гц, 3H).
Соединение 56 ((2R,6S)-2-метил-4-(пиридо[2,3-b]пиразин-8-ил)-6-((4-(пирролидин-1-ил)пиперидин-1-ил)метил)морфолин): из ((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил 4-метилбензолсульфоната и 4-(пирролидин-1-ил)пиперидина. ВЭЖХ: чистота 98,8%, RT=0,90 мин. МС: m/z=397,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,78 (д, J=1,8 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 7,03 (д, J=5,6 Гц, 1H), 4,66-4,54 (м, 1H), 4,47-4,35 (м, 1H), 4,09-3,83 (м, 2H), 3,19-3,06 (м, 1H), 3,04-2,91 (м, 1H), 2,87-2,71 (м, 2H), 2,70-2,39 (м, 6H), 2,22-1,86 (м, 5H), 1,88-1,72 (м, 4H), 1,68-1,47 (м, 2H), 1,23 (д, J=6,2 Гц, 3H).
Соединение 57 (8-((2R,6S)-2-метил-6-((4-(пирролидин-1-ил)пиперидин-1-ил)метил)морфолино)хиноксалин-5-карбонитрил): из ((2R,6R)-4-(8-цианохиноксалин-5-ил)-6-метилморфолин-2-ил)метил 4-метилбензолсульфоната и 4-(пирролидин-1-ил)пиперидина. ВЭЖХ: чистота 97,4%, RT=2,24 мин. МС: m/z=421,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,98 (д, J=1,8 Гц, 1H), 8,84 (с, 1H), 8,03 (д, J=8,3 Гц, 1H), 7,06 (д, J=8,3 Гц, 1H), 4,24 (д, J=12,2 Гц, 1H), 4,13-3,97 (м, 3H), 3,08 (с, 1H), 2,91 (с, 1H), 2,80-2,40 (м, 6H), 2,20-1,40 (м, 13H), 1,27 (д, J=6,2 Гц, 3H).
Соединение 58 ((2S,6R)-2-(1,4'-бипиперидин-1'-илметил)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин): из ((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил 4-метилбензолсульфоната и 1,4'-бипиперидина. ВЭЖХ: чистота 94,8%, RT=1,11 мин. МС: m/z=411,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,8 Гц, 1H), 8,78 (д, J=1,8 Гц, 1H), 8,67 (д, J=5,5 Гц, 1H), 7,03 (д, J=5,6 Гц, 1H), 4,64-4,50 (м, 1H), 4,49-4,35 (м, 1H), 4,09-3,85 (м, 2H), 3,25-2,97 (м, 2H), 2,86-2,72 (м, 2H), 2,65-2,29 (м, 6H), 2,15-1,80 (м, 4H), 1,69-1,41 (м, 9H), 1,23 (д, J=6,2 Гц, 3H).
Соединение 59 (8-((2S,6R)-2-(1,4'-бипиперидин-1'-илметил)-6-метилморфолино)хиноксалин-5-карбонитрил): из ((2R,6R)-4-(8-цианохиноксалин-5-ил)-6-метилморфолин-2-ил)метил 4-метилбензолсульфоната и 1,4'-бипиперидина. ВЭЖХ: чистота 98,8%, RT=0,72 мин. МС: m/z=435,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,85 (д, J=1,8 Гц, 1H), 8,09 (д, J=8,4 Гц, 1H), 7,18 (д, J=8,4 Гц, 1H), 4,28-3,90 (м, 4H), 3,25-3,15 (м, 1H), 3,10-3,00 (м, 1H), 2,80-2,35 (м, 9H), 2,20-1,80 (м, 4H), 1,70-1,40 (м, 8H), 1,22 (д, J=6,2 Гц, 3H).
Соединение 60 ((2R,6S)-2-метил-6-((4-морфолинопиперидин-1-ил)метил)-4-(пиридо[2,3-b]пиразин-8-ил)морфолин): из ((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил 4-метилбензолсульфоната и 4-(пиперидин-4-ил)морфолина. ВЭЖХ: чистота 96,3%, RT=1,85 мин. МС: m/z=413,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,78 (д, J=1,7 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 7,03 (д, J=5,6 Гц, 1H), 4,65-4,43 (м, 1H), 4,47-4,35 (м, 1H), 4,10-3,83 (м, 2H), 3,72-3,63 (м, 4H), 3,24-3,10 (м, 1H), 3,09-2,98 (м, 1H), 2,88-2,70 (м, 2H), 2,61-2,41 (м, 6H), 2,27-2,01 (м, 3H), 1,96-1,82 (м, 2H), 1,62-1,44 (м, 2H), 1,23 (д, J=6,2 Гц, 3H).
Соединение 467 (8-[(2R,6S)-2-метил-6-{[4-(морфолин-4-ил)пиперидин-1-ил]метил}морфолин-4-ил]хиноксалин-5-карбонитрил: из [(2R,6R)-4-(8-цианохиноксалин-5-ил)-6-метилморфолин-2-ил]метил 4-метилбензол-1-сульфоната и 4-(пиперидин-4-ил)морфолина. ВЭЖХ: чистота 99,8%, RT=1,46 мин. МС: m/z=437,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,97 (д, J=1,8 Гц, 1H), 8,90 (д, J=1,8 Гц, 1H), 8,14 (д, J=8,3 Гц, 1H), 7,23 (д, J=8,4 Гц, 1H), 4,28 (дт, J=12,2, 2,3 Гц, 1H), 4,19-4,08 (м, 2H), 4,01 (ддд, J=10,3, 6,4, 2,5 Гц, 1H), 3,76-3,69 (м, 4H), 3,22 (д, J=12,0 Гц, 1H), 3,07 (д, J=11,6 Гц, 1H), 2,75 (ддд, J=12,5, 10,3, 2,7 Гц, 2H), 2,64-2,45 (м, 6H), 2,28-2,07 (м, 3H), 1,93 (д, J=9,9 Гц, 2H), 1,66-1,54 (м, 2H), 1,27 (д, J=6,2 Гц, 3H).
Пример 23: Синтез соединения 61 (N-(1-(((2S,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил)пиперидин-4-ил)изобутирамид)
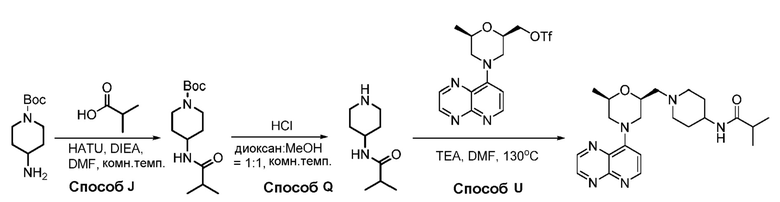
N-(1-(((2S,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил)пиперидин-4-ил)изобутирамид: N-(1-(((2S,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил)пиперидин-4-ил)изобутирамид получали из трет-бутил 4-аминопиперидин-1-карбоксилата, изомасляной кислоты и ((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил трифторметансульфоната с использованием Способа J, Q и U. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 30% - 80% градиент за 8 мин; Детектор УФ 254 нм. (2R,6S)-2-метил-6-[[4-(морфолин-4-ил)пиперидин-1-ил]метил]-4-[пиридо[2,3-b]пиразин-8-ил]морфолин получали в виде желтого твердого вещества (15 мг, 1,4%).
Соединение 61: ВЭЖХ: чистота 96,6%, RT=1,21 мин. МС: m/z=413,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,78 (д, J=1,8 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 7,04 (д, J=5,6 Гц, 1H), 4,66-4,54 (м, 1H), 4,47-4,35 (м, 1H), 4,10-3,85 (м, 2H), 3,71-3,54 (м, 1H), 3,08 (д, J=12,0 Гц, 1H), 2,96 (д, J=11,9 Гц, 1H), 2,87-2,61 (м, 2H), 2,64-2,12 (м, 5H), 1,83 (д, J=12,4 Гц, 2H), 1,65-1,45 (м, 2H), 1,24 (д, J=6,2 Гц, 3H), 1,07 (д, J=6,9 Гц, 6H).
Пример 24: Синтез соединения 62 (N-этил-1-(((2S,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил)пиперидин-4-карбоксамид)
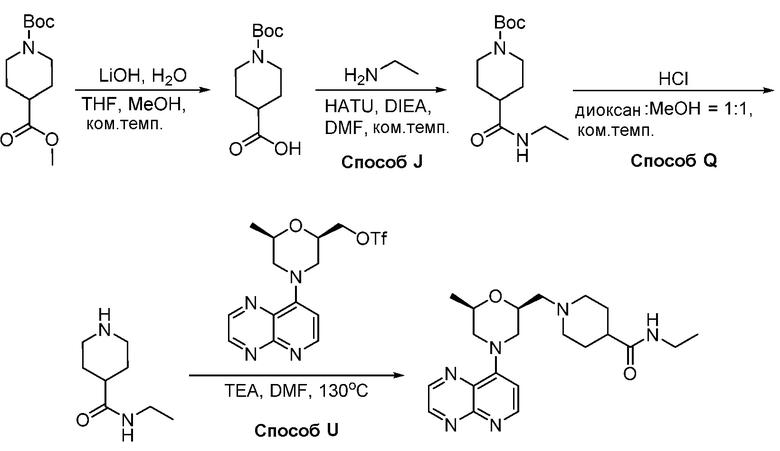
1-(трет-бутоксикарбонил)пиперидин-4-карбоновая кислота: К раствору 1-трет-бутил 4-метилпиперидин-1,4-дикарбоксилата (1,19 г, 4,87 ммоль) в метаноле (24 мл) и тетрагидрофуране (24 мл) добавляли раствор LiOH (599 мг, 24,99 ммоль) в воде (8 мл) при комнатной температуре. Полученную смесь перемешивали в течение 15 часов при комнатной температуре. Когда реакция была завершена, значение pH реакционной смеси доводили до 2 раствором хлористого водорода (1 M). Полученную смесь экстрагировали этилацетатом (200 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 1-[(трет-бутокси)карбонил]пиперидин-4-карбоновой кислоты в виде белого твердого вещества (1,10 г, 84%). МС: m/z=128,0 [M-H]+.
N-этил-1-(((2S,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил)пиперидин-4-карбоксамид: N-этил-1-(((2S,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил)пиперидин-4-карбоксамид получали из 1-(трет-бутоксикарбонил)пиперидин-4-карбоновой кислоты, этанамина и ((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метил трифторметансульфоната с использованием Способа J, Q и U. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 30% - 80% градиент за 10 мин; Детектор УФ 254 нм. N-этил-1-[[(2S,6R)-6-метил-4-[пиридо[2,3-b]пиразин-8-ил]морфолин-2-ил]метил]пиперидин-4-карбоксамид получали в виде желтого твердого вещества (20 мг, 10%).
Соединение 62: ВЭЖХ: чистота 90,4%, RT=1,11 мин. МС: m/z=399,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,78 (д, J=1,7 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 7,04 (д, J=5,6 Гц, 1H), 4,66-4,54 (м, 1H), 4,47-4,35 (м, 1H), 4,08-3,83 (м, 2H), 3,23-3,09 (м, 3H), 3,05-2,93 (м, 1H), 2,86-2,72 (м, 2H), 2,60-2,40 (м, 2H), 2,23-2,01 (м, 3H), 1,87-1,68 (м, 4H), 1,23 (д, J=6,2 Гц, 3H), 1,08 (т, J=7,2 Гц, 3H).
Пример 25: Синтез соединения 63 ((3-аминоазетидин-1-ил)((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метанон)
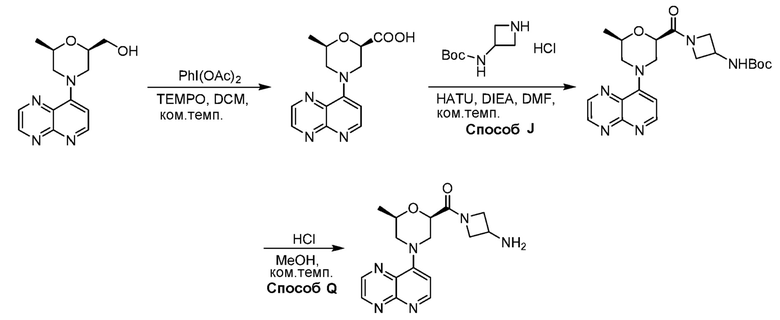
(2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-карбоновая кислота: при 10°C к раствору [(2R,6R)-6-метил-4-[пиридо[2,3-b]пиразин-8-ил]морфолин-2-ил]метанола (90 мг, 0,35 ммоль) в дихлорметане (15 мл) добавляли (ацетилокси)(фенил)-лямбда3-иоданилацетат (234 мг, 0,73 ммоль) и TEMPO (11 мг, 0,07 ммоль). Полученный раствор перемешивали в течение 30 минут при 10°C и затем нагревали до комнатной температуры и перемешивали еще в течение 17 часов при комнатной температуре. Когда реакция была завершена, ее гасили насыщенным раствором Na2S2O4 (2,5 мл). Значение pH смеси доводили до 9 раствором гидроксида натрия (1 M). Полученную смесь промывали водой (5 мл ×3) и объединенные водные фазы разбавляли при помощи BuOH (10 мл). pH водного раствора доводили до 5 при помощи H2SO4 (5 M) и полученный раствор экстрагировали при помощи BuOH (10 мл ×3). Органические фазы объединяли и концентрировали при пониженном давлении с получением (2R,6R)-6-метил-4-[пиридо[2,3-b]пиразин-8-ил]морфолин-2-карбоновой кислоты в виде желтого твердого вещества (76 мг, неочищенный продукт). МС: m/z=275,0 [M-H]+. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
(3-аминоазетидин-1-ил)((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метанон: (3-аминоазетидин-1-ил)((2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-ил)метанон получали из (2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-карбоновой кислоты и трет-бутил азетидин-3-илкарбамат гидрохлорида с использованием Способа J и Q. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: Колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 30%-70% градиент за 10 мин; Детектор УФ 254 нм. 1-[[(2R,6R)-6-метил-4-[пиридо[2,3-b]пиразин-8-ил]морфолин-2-ил]карбонил]азетидин-3-амин получали в виде светло-желтого твердого вещества (15 мг, 6%).
Соединение 63: ВЭЖХ: чистота 98,5%, RT=0,86 мин. МС: m/z=329,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,98 (д, J=1,7 Гц, 1H), 8,86 (дд, J=3,3, 1,8 Гц, 1H), 8,74 (д, J=5,5 Гц, 1H), 7,11 (д, J=5,6 Гц, 1H), 4,88-4,78 (м, 1H), 4,76-4,64 (м, 1H), 4,59-4,07 (м, 4H), 4,06-3,62 (м, 3H), 3,17-3,05 (м, 1H), 2,97-2,81 (м, 1H), 1,32 (д, J=6,0 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 64 ((2R,6R)-6-метил-N-((R)-пиперидин-3-ил)-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-карбоксамид): из (2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-карбоновой кислоты и (R)-трет-бутил 3-аминопиперидин-1-карбоксилата. ВЭЖХ: чистота 93,0%, RT=0,96 мин. МС: m/z=357,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,7 Гц, 1H), 8,83 (д, J=1,7 Гц, 1H), 8,71 (д, J=5,6 Гц, 1H), 7,09 (д, J=5,5 Гц, 1H), 4,91-4,83 (м, 1H), 4,49-4,29 (м, 2H), 4,07-3,95 (м, 2H), 3,11 (д, J=11,5 Гц, 1H), 3,06-2,79 (м, 3H), 2,70-2,52 (м, 2H), 1,9-1,72 (м, 2H), 1,65-1,53 (м, 2H), 1,33 (д, J=6,2 Гц, 3H).
Соединение 65 ((2R,6R)-6-метил-N-(1-метилпиперидин-4-ил)-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-карбоксамид): из (2R,6R)-6-метил-4-(пиридо[2,3-b]пиразин-8-ил)морфолин-2-карбоновой кислоты и 1-метилпиперидин-4-амина. ВЭЖХ: чистота 95,8%, RT=1,00 мин. МС: m/z=371,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,7 Гц, 1H), 8,82 (д, J=1,7 Гц, 1H), 8,71 (д, J=5,6 Гц, 1H), 7,09 (д, J=5,6 Гц, 1H), 4,49-4,27 (м, 2H), 4,06-3,94 (м, 1H), 3,87-3,68 (м, 2H), 3,05-2,83 (м, 4H), 2,32-2,10 (м, 5H), 1,91-1,77 (м, 2H), 1,72-1,56 (с, 2H), 1,33 (д, J=6,2 Гц, 3H).
Соединение 468 ((2R,6R)-4-(8-цианохиноксалин-5-ил)-6-метил-N-(1-метилпиперидин-4-ил)морфолин-2-карбоксамид): из (2R,6R)-4-(8-цианохиноксалин-5-ил)-6-метилморфолин-2-карбоновой кислоты и 1-метилпиперидин-4-амина. ВЭЖХ: чистота 98,0%, RT=1,19 мин. МС: m/z=395,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,96 (дд, J=17,8,1,7 Гц, 2H), 8,16 (д, J=8,3 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 4,96-4,87 (м, 1H), 4,54 (дт, J=12,4,2,4 Гц, 1H), 4,42 (дд, J=10,7, 2,8 Гц, 1H), 4,21-4,04 (м, 2H), 3,79 (тд, J=11,0, 5,6 Гц, 1H), 2,98-2,78 (м, 4H), 2,32 (с, 3H), 2,19 (т, J=12,0 Гц, 2H), 1,95-1,83 (м, 2H), 1,74-1,58 (м, 2H), 1,40-1,25 (м, 3H)
Пример 26: Синтез соединения 66 ((3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амин)
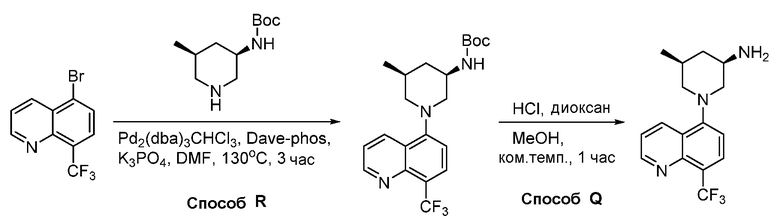
трет-Бутил N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]карбамат: При комнатной температуре к раствору 5-бром-8-(трифторметил)хинолина (950 мг, 3,44 ммоль) в DMF (10 мл) добавляли трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамат (718 мг, 3,35 моль), K3PO4 (2,19 г, 10,29 ммоль), Pd2(dba)3CHCl3 (356 мг, 0,34 ммоль) и DavePhos (270 мг, 0,69 ммоль). Полученную смесь нагревали до 130°C и перемешивали в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (10 мл). Полученную смесь экстрагировали этилацетатом (20 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 14% градиент), с получением трет-бутил N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]карбамате в виде желтого твердого вещества (1,10 г, 77%). МС: m/z=410,2 [M+H]+.
(3R,5S)-1-[8-(трифторметил)хинолин-5-ил]-5-метилпиперидин-3-амин: При комнатной температуре к раствору трет-бутил N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]карбамата (787 мг, 1,92 ммоль) в метаноле (10 мл) добавляли раствор хлористого водорода в 1,4-диоксане (5 мл, 4 M). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ при следующих условиях: колонка, XBridge BEH130 Prep C18 OBD Column, 150 мм, 5 мкм, 13 нм; подвижная фаза: ацетонитрил в воде (с 0,05% NH4OH), 30% - 60% градиент за 10 мин; детектор УФ 254 нм. (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амин получали в виде светло-желтого твердого вещества (500 мг, 83%).
Соединение 66: ВЭЖХ: чистота 99,7%, RT=3,18 мин. МС: m/z=310,0 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (дд, J=4,4, 1,6 Гц, 1H), 8,67-8,57 (м, 1H), 8,05 (д, J=8,0 Гц, 1H), 7,62 (дд, J=8,6, 4,2 Гц, 1H), 7,24 (д, J=8,1 Гц, 1H), 3,59-3,50 (м, 1H), 3,42-3,33 (м, 1H), 3,27-3,17 (м, 1H), 2,52-2,36 (м, 2H), 2,21-2,07 (м, 2H), 1,08-0,93 (м, 4H).
Пример 27: Синтез соединения 67 ((3R,5S)-N-(2-метоксиэтил)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-амин)
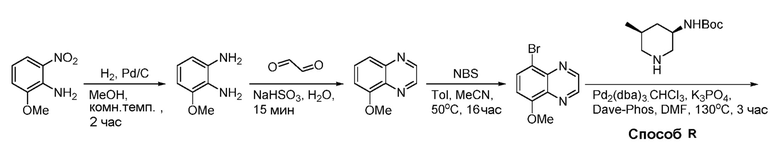
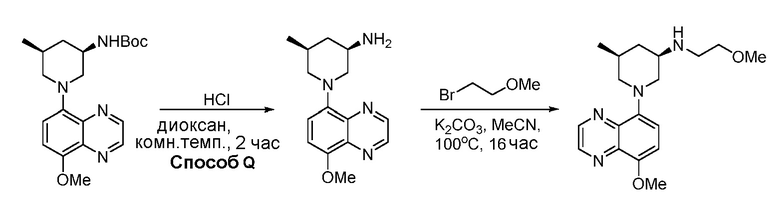
3-Метоксибензол-1,2-диамин: При комнатной температуре к раствору 2-метокси-6-нитроанилина (4,75 г, 28,25 ммоль) в метаноле (150 мл) добавляли Pd/C (10%, 500 мг) в атмосфере азота. Реакционную колбу вакуумировали и продували водородом. Реакционную смесь гидрировали в течение 2 часов при комнатной температуре в атмосфере H2 с использованием водородного баллона. Когда реакция была завершена, реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении с получением 3-метоксибензол-1,2-диамина в виде темно-красного масла (3,66 г, 94%). МС: m/z=139,1 [M+H]+.
5-Метоксихиноксалин: При комнатной температуре раствор оксальдегида в H2O (40%, 4 мл) добавляли к раствору 3-метоксибензол-1,2-диамина (3,66 г, 26,53 ммоль) в воде (100,00 мл). Затем медленно добавляли NaHSO3 (7,59 г, 72,94 ммоль). Полученный раствор перемешивали в течение 15 минут при комнатной температуре. Когда реакция была завершена, нерастворимые твердые вещества, присутствующие в реакционной смеси, отфильтровывали. Фильтрат экстрагировали при помощи DCM (300 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 100% градиент), с получением 5-метоксихиноксалина в виде темно-красного масла (3,02 г, 71%). МС: m/z=161,0 [M+H]+.
5-бром-8-метоксихиноксалин: К раствору 5-метоксихиноксалина (3,02 г, 18,86 ммоль) в толуоле (100 мл) и ацетонитриле (100 мл) добавляли NBS (5,04 г, 28,29 ммоль) при комнатной температуре. Полученный раствор затем перемешивали в течение 16 часов при 50°C. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (50 мл). Полученную смесь экстрагировали этилацетатом (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 100% градиент), с получением 5-бром-8-метоксихиноксалина в виде желтого твердого вещества (4,23 г, 94%). МС: m/z=238,8 [M+H]+.
трет-Бутил N-[(3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамат: К раствору 5-бром-8-метоксихиноксалина (1,92 г, 8,04 ммоль) в DMF (30 мл) добавляли трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамат (1,52 г, 7,09 ммоль), K3PO4 (5,13 г, 24,17 ммоль), Pd2(dba)3CHCl3 (760 мг, 0,73 ммоль) и Davephos (570 мг, 1,45 ммоль) при комнатной температуре. Полученную смесь затем перемешивали в течение 3 часов при 130°C. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (100 мл). Полученную смесь экстрагировали при помощи DCM (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 100% градиент), с получением трет-бутил N-[(3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамата в виде темно-красного масла (1,11 г, 37%). МС: m/z=373,1 [M+H]+.
(3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-амин: К раствору трет-бутил N-[(3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамата (429 мг, 1,15 ммоль) в диоксане (10 мл) добавляли раствор хлористого водорода в диоксане (4 M, 30 мл) при комнатной температуре. Полученный раствор затем перемешивали в течение 1 часа при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления H2O (50 мл). Затем значение pH полученной смеси доводили до 8 насыщенным раствором бикарбоната натрия. Смесь экстрагировали при помощи DCM (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением (3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-амина в виде темно-красного масла (180 мг, 57%). МС: m/z=273,1 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,92 (с, 1H), 8,86 (с, 1H), 7,20-7,13 (м, 2H), 3,94 (с, 3H), 3,67 (д, J=10,0 Гц, 1H), 3,59 (дд, J=11,4, 3,1 Гц, 1H), 2,96 (тд, J=10,1, 9,0, 5,2 Гц, 1H), 2,20 (дт, J=15,5, 10,8 Гц, 2H), 1,95 (д, J=12,2 Гц, 2H), 0,91 (д, J=6,3 Гц, 3H), 0,79 (кв., J=12,0 Гц, 1H).
(3R,5S)-N-(2-метоксиэтил)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-амин: К раствору (3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-амина (90 мг, 0,33 ммоль) в ацетонеитриле (5 мл) добавляли 1-бром-2-метоксиэтан (45 мг, 0,34 ммоль) и карбонат калия (238 мг, 1,72 ммоль) при комнатной температуре. Полученный раствор нагревали до 100°C и перемешивали в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь гасили путем добавления воды (50 мл). Полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge BEH130 Prep C18 OBD Column, 150 мм, 5 мкм, 13 нм; подвижная фаза: ацетонитрил в воде (с 0,05% NH4OH), 35% - 65% градиент за 10 мин; детектор УФ 254 нм. (3R,5S)-N-(2-метоксиэтил)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-амин получали в виде желтого сиропа (38 мг, 32%).
Соединение 67: ВЭЖХ: чистота 92,7%, RT=0,99 мин. МС: m/z=331,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,8 Гц, 1H), 8,81 (д, J=1,8 Гц, 1H), 7,32 (д, J=8,5 Гц, 1H), 7,21 (д, J=8,6 Гц, 1H), 4,04 (с, 3H), 3,92-3,84 (м, 1H), 3,60-3,48 (м, 3H), 3,36 (с, 3H), 3,11 (дд, J=13,9, 8,0 Гц, 1H), 2,97-2,81 (м, 2H), 2,41-2,29 (м, 2H), 2,20-2,04 (м, 2H), 1,04-0,87 (м, 4H).
Следующие соединения синтезировали аналогичным способом:
Соединение 201 ((2R)-2-гидрокси-N-[(3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-ил]-3-метилбутанамид): из (S)-2-гидрокси-3-метилбутановой кислоты и (3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 97,9%, RT=1,12 мин. МС: m/z=373,3 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,99-8,85 (м, 2H), 7,61 (д, J=8,3 Гц, 1H), 7,22-7,12 (м, 2H), 5,29 (д, J=5,8 Гц, 1H), 4,04 (с, 1H), 3,93 (с, 3H), 3,69-3,55 (м, 3H), 2,62-2,50 (м, 1H), 2,27 (т, J=11,0 Гц, 1H), 2,03-1,85 (м, 3H), 1,23-1,12 (м, 1H), 0,91 и 0,89 (д, J=8,2 Гц, 6H), 0,76 (д, J=6,7 Гц, 3H).
Соединение 202 (N-[(3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3-диметилбутанамид): из 3,3-диметилбутановой кислоты и (3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 98,8%, RT=1,33 мин. МС: m/z=371,3 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,98-8,82 (м, 2H), 7,70 (д, J=7,8 Гц, 1H), 7,22-7,12 (м, 2H), 4,08-3,90 (м, 4H), 3,70-3,61 (м, 2H), 2,48-2,32 (м, 1H), 2,30-2,28 (м, 1H), 2,02-1,86 (м, 4H), 1,05-0,85 (м, 13H).
Соединение 203 (2-(диметиламино)-N-[(3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-ил]ацетамид): из 2-(диметиламино)уксусной кислоты и (3R,5S)-1-(8-метоксихиноксалин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 98,3%, RT=1,92 мин. МС: m/z=371,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,84 (д, J=1,8 Гц, 1H), 8,71 (д, J=1,8 Гц, 1H), 7,22 (д, J=8,6 Гц, 1H), 7,10 (д, J=8,5 Гц, 1H), 4,24-4,12 (м, 1H), 3,94 (с, 3H), 3,66 (дд, J=10,9, 4,3 Гц, 1H), 3,56-3,48 (м, 1H), 2,89 (с, 2H), 2,45 (т, J=10,6 Гц, 1H), 2,33-2,15 (м, 7H), 2,09-1,91 (м, 2H), 1,04 (тд, J=11,9, 11,9 Гц, 1H), 0,90 (д, J=6,5 Гц, 3H).
Пример 28: Синтез соединения 68 ((3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-амин)
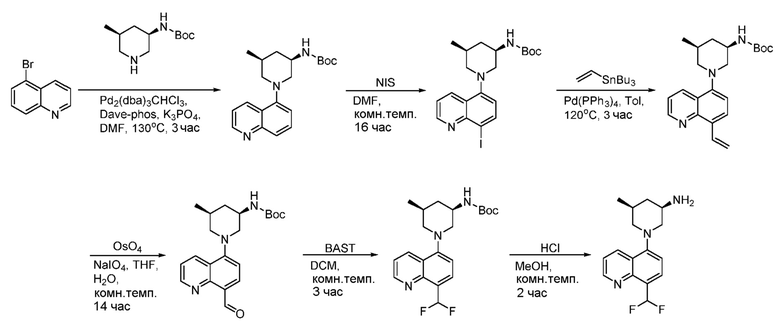
трет-Бутил (3R,5S)-5-метил-1-(хинолин-5-ил)пиперидин-3-илкарбамат: К раствору трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамата (4,75 г, 22,16 ммоль) в DMF (50 мл) добавляли 5-бромхинолин (5,07 г, 24,38 ммоль), K3PO4 (14,16 г, 66,73 ммоль), Davephos (1,75 г, 4,44 ммоль) и Pd2(dba)3.CHCl3 (2,30 г, 2,22 ммоль) при комнатной температуре. Полученную смесь затем перемешивали в течение 3 часов при 130°C. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (50 мл). Полученную смесь экстрагировали этилацетатом (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 20% градиент), с получением трет-бутил N-[(3R,5S)-5-метил-1-(хинолин-5-ил)пиперидин-3-ил]карбамата в виде желтого твердого вещества (4,00 г, 53%). МС: m/z=342,1 [M+H]+.
трет-Бутил N-[(3R,5S)-1-(8-иодхинолин-5-ил)-5-метилпиперидин-3-ил]карбамат: К раствору трет-бутил N-[(3R,5S)-5-метил-1-(хинолин-5-ил)пиперидин-3-ил]карбамата (3,80 г, 11,13 ммоль) в DMF (50 мл) добавляли NIS (2,76 г, 12,25 ммоль) при комнатной температуре. Полученный раствор затем перемешивали в течение 16 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (30 мл). Полученную смесь экстрагировали этилацетатом (60 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 35% градиент), с получением трет-бутил N-[(3R,5S)-1-(8-иодхинолин-5-ил)-5-метилпиперидин-3-ил]карбамата в виде желтого твердого вещества (4,30 г, 83%). МС: m/z=468,1 [M+H]+.
трет-Бутил N-[(3R,5S)-1-(8-этенилхинолин-5-ил)-5-метилпиперидин-3-ил]карбамат: К раствору трет-бутил N-[(3R,5S)-1-(8-иодхинолин-5-ил)-5-метилпиперидин-3-ил]карбамата (4,09 г, 8,74 ммоль) в толуоле (50 мл) добавляли Pd(PPh3)4 (1,01 г, 0,87 ммоль) и трибутил(этенил)станнан (4,16 г, 13,12 ммоль) при комнатной температуре. Реакционную смесь затем перемешивали в течение 3 часов при 120°C. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (30 мл). Полученную смесь экстрагировали этилацетатом (60 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 17% градиент), с получением трет-бутил N-[(3R,5S)-1-(8-этенилхинолин-5-ил)-5-метилпиперидин-3-ил]карбамата в виде желтого твердого вещества (2,20 г, 68%). МС: m/z=368,2 [M+H]+.
трет-Бутил N-[(3R,5S)-1-(8-формилхинолин-5-ил)-5-метилпиперидин-3-ил]карбамат: К раствору трет-бутил N-[(3R,5S)-1-(8-этенилхинолин-5-ил)-5-метилпиперидин-3-ил]карбамата (2,09 г, 5,69 ммоль) в THF (73 мл) добавляли OsO4 (145 мг, 0,57 ммоль), NaIO4 (4,86 г, 22,74 ммоль) и воду (14 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 14 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления насыщенного раствора Na2S2O3 (20 мл). Полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением трет-бутил N-[(3R,5S)-1-(8-формилхинолин-5-ил)-5-метилпиперидин-3-ил]карбамата в виде желтого твердого вещества (800 мг, 38%). МС: m/z=370,1 [M+H]+.
трет-Бутил N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]карбамат: К раствору трет-бутил N-[(3R,5S)-1-(8-формилхинолин-5-ил)-5-метилпиперидин-3-ил]карбамата (760 мг, 2,06 ммоль) в DCM (10 мл) добавляли BAST (1,37 г, 6,18 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления насыщенного раствора бикарбоната натрия (30 мл). Полученную смесь экстрагировали этилацетатом (30 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 17% градиент), с получением трет-бутил N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]карбамата в виде желтого твердого вещества (400 мг, 50%). МС: m/z=392,2 [M+H]+.
(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-амин: К раствору трет-бутил N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]карбамата (45 мг, 0,12 ммоль) в метаноле (5 мл) добавляли концентрированный раствор HCl (12 M, 0,2 мл) при комнатной температуре. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (10 мл). Полученную смесь экстрагировали при помощи DCM (20 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка, XBridge BEH130 Prep C18 OBD Column, 150 мм, 5 мкм, 13 нм; подвижная фаза: ацетонитрил в воде (с 0,05% NH4OH), 45% - 75% градиент за 10 мин; детектор УФ 254 нм. (3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-амин получали в виде желтого масла (20 мг, 57%).
Соединение 68: ВЭЖХ: чистота 97,3%, RT=1,34 мин. МС: m/z=292,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,86 (дд, J=4,2, 1,8 Гц, 1H), 8,52 (дд, J=8,6, 1,8 Гц, 1H), 7,96-7,87 (м, 1H), 7,86-7,44 (м, 2H), 7,23 (д, J=7,9 Гц, 1H), 3,52-3,42 (м, 1H), 3,34-3,11 (м, 2H), 2,49-2,29 (м, 2H), 2,19-1,97 (м, 2H), 1,07-0,86 (м, 4H).
Пример 29: Синтез соединения 69 и соединения 70 (8-(3-амино-5-циклопропилпиперидин-1-ил)хиноксалин-5-карбонитрил):
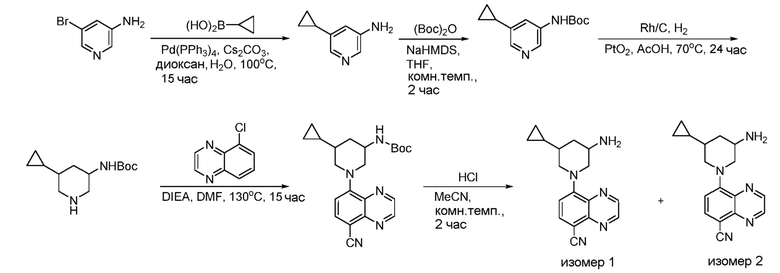
5-Циклопропилпиридин-3-амин: К раствору 5-бромпиридин-3-амина (4,75 г, 27,45 ммоль) в диоксане (45 мл) добавляли циклопропилбороновую кислоту (4,75 г, 55,30 ммоль), Cs2CO3 (28 г, 85,67 ммоль), тетракис(трифенилфосфан)палладий (1,66 г, 1,44 ммоль) и воду (5 мл) при комнатной температуре. Полученную смесь затем перемешивали в течение 15 часов при 100°C. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (200 мл). Полученную смесь экстрагировали этилацетатом (500 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 100% градиент), с получением 5-циклопропилпиридин-3-амина в виде светло-коричневого масла (2,08 г, 56%). МС: m/z=135,0 [M+H]+.
трет-Бутил N-(5-циклопропилпиридин-3-ил)карбамат: при 0°C к раствору 5-циклопропилпиридин-3-амина (2,08 г, 15,49 ммоль) в тетрагидрофуране (30 мл) добавляли раствор NaHMDS (6,84 г, 37,30 ммоль) в тетрагидрофуране (20 мл) по каплям в течение 10 минут. Полученный раствор перемешивали в течение 1 часа при 0°C и затем добавляли раствор ди-трет-бутилдикарбоната (4,85 г, 22,20 ммоль) в тетрагидрофуране (25 мл) по каплям. Полученную смесь перемешивали еще в течение 2 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления насыщенного раствора NH4Cl (100 мл). Полученную смесь экстрагировали этилацетатом (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи MeOH в EtOAc (0% - 80% градиент), с получением трет-бутил N-(5-циклопропилпиридин-3-ил)карбамата в виде белого твердого вещества (2,52 г, 69%). МС: m/z=235,0 [M+H]+.
трет-Бутил 5-циклопропилпиперидин-3-илкарбамат: В герметично закрываемую пробирку добавляли трет-бутил N-(5-циклопропилпиридин-3-ил)карбамат (2,52 г, 10,74 ммоль), PtO2 (520 мг, 2,29 ммоль), Rh/C (520 мг, 5%) и уксусную кислоту (220 мл) при комнатной температуре в атмосфере азота. Реакционную пробирку вакуумировали и продували водородом. Затем реакционную смесь гидрировали в течение 24 часов при 70°C под давлением водорода 15 атм. После охлаждения до комнатной температуры реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении. Остаток разбавляли при помощи H2O (50 мл) и значение pH смеси доводили до 9 раствором NaOH (0,5 моль/л). Полученную смесь экстрагировали при помощи DCM (150 мл 3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением трет-бутил N-(5-циклопропилпиперидин-3-ил)карбамата в виде белого твердого вещества (2,47 г, 57%). МС: m/z=241,1 [M+H]+.
трет-Бутил N-[1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил]карбамат: К раствору 8-бромхиноксалин-5-карбонитрила (2,47 г, 10,55 ммоль) в N,N-диметилформамиде (25 мл) добавляли трет-бутил N-(5-циклопропилпиперидин-3-ил)карбамат (2,10 г, 8,74 ммоль) и DIEA (3,14 г, 24,26 ммоль) при комнатной температуре. Полученный раствор затем перемешивали в течение 15 часов при 130°C. После охлаждения до комнатной температуры реакционную смесь гасили путем добавления воды (80 мл). Полученную смесь экстрагировали при помощи DCM (150 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи MeOH в DCM (0% - 20% градиент), с получением трет-бутил N-[1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил]карбамата в виде желтого твердого вещества (2,80 г, 67%). МС: m/z=394,2 [M+H]+.
8-(3-амино-5-циклопропилпиперидин-1-ил)хиноксалин-5-карбонитрил: К раствору трет-бутил N-[1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил]карбамата (850 мг, 2,16 ммоль) в метаноле (15 мл) добавляли раствор хлористого водорода в диоксане (4 M, 4 мл). Полученный раствор перемешивали в течение 1 часа при 40°C. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении и остаток сначала очищали препаративной ВЭЖХ при следующих условиях: колонка, XBridge BEH130 Prep C18 OBD Column, 150 мм, 5 мкм, 13 нм; подвижная фаза: ацетонитрил в воде (с 0,05% NH4OH), 30% - 60% градиент за 10 мин; детектор УФ 254 нм. Затем два энантиомера получали путем разделения методом хиральной препаративной ВЭЖХ при следующих условиях: колонка, CHIRALPAK AD-3, 0,46 × 10см, 5 мкм; подвижная фаза: гексан (0,1% DEA) в EtOH, 60% изократический в течение 15 мин; детектор УФ 254 нм. 8-[(3S,5S)-3-амино-5-циклопропилпиперидин-1-ил]хиноксалин-5-карбонитрил получали в виде желтого твердого вещества (78 мг, 12%).
Изомер 1: ВЭЖХ: чистота 99,3%, RT=1,44 мин. МС: m/z=294,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,87 (дд, J=15,6, 1,8 Гц, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,18 (д, J=8,4 Гц, 1H), 4,39-4,17 (м, 2H), 3,09-2,97 (м, 1H), 2,81-2,60 (м, 2H), 2,23 (д, J=11,1 Гц, 1H), 1,28-1,06 (м, 2H), 0,65-0,38 (м, 3H), 0,23-0,11 (м, 2H).
Изомер 2: ВЭЖХ: чистота 99%, МС: m/z=294,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,87 (дд, J=15,6, 1,8 Гц, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,18 (д, J=8,4 Гц, 1H), 4,39-4,17 (м, 2H), 3,09-2,97 (м, 1H), 2,81-2,60 (м, 2H), 2,23 (д, J=11,1 Гц, 1H), 1,28-1,06 (м, 2H), 0,65-0,38 (м, 3H), 0,23-0,11 (м, 2H).
Пример 30: Синтез соединения 71 (цис-5-(3-Амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил)
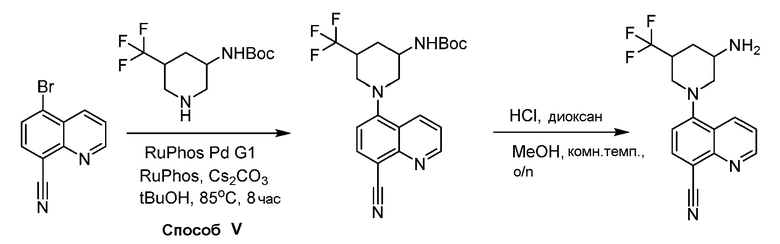
Способ V
трет-бутиловый эфир цис-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-карбаминовой кислоты: Смесь 5-бром-хинолин-8-карбонитрила (500 мг; 2,15 ммоль), цис-3-(boc-амино)-5-(трифторметил)пиперидина (691 мг; 2,57 ммоль), аддукта хлор(2-дициклогексилфосфино-2',6'-ди-изопропокси-1,1'-бифенил)[2-(2-аминоэтилфенил)]палладия(II) с метил-трет-бутиловым эфиром (88 мг; 0,11 ммоль), 2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенила (50 мг; 0,11 ммоль) и карбоната цезия (1,4 г; 4,3 ммоль) в безводном трет-бутаноле (15 мл) нагревали в условиях микроволнового облучения при 85°C в течение 8 часов. Реакционную смесь концентрировали при пониженном давлении и очищали хроматографией, элюируя гексаном и этилацетатом, с получением трет-бутилового эфира [1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-карбаминовой кислоты (731 мг; 80%) в виде светло-желтого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 9,09 (дд, J=4,2, 1,7 Гц, 1H), 8,44 (дд, J=8,6, 1,7 Гц, 1H), 8,04 (д, J=7,9 Гц, 1H), 7,57 (ддд, J=8,3, 6,2, 4,2 Гц, 1H), 7,12 (д, J=8,0 Гц, 1H), 4,50 (с, 1H), 4,06 (с, 1H), 3,75 (дд, J=11,8, 4,6 Гц, 1H), 3,65-3,55 (м, 1H), 2,89 (т, J=11,3 Гц, 1H), 2,79 (дткв.,J=15,3, 7,5, 3,8 Гц, 1H), 2,56-2,39 (м, 2H), 1,54-1,33 (м, 10H); МС: m/z=421 [M+H]+.
(Примечание: в Способе V также можно использовать палладиевый комплекс RuPhos Palladacycle 3 поколения (Метансульфонато(2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенил)(2'-амино-1,1'-бифенил-2-ил)палладий(II)) вместо RuPhos Palladacycle 1 поколения (хлор(2-дициклогексилфосфино-2',6'-ди-изопропокси-1,1'-бифенил)[2-(2-аминоэтилфенил)]палладий(II)), в качестве растворителя также можно использовать THF или диоксан вместо трет-бутанола, в качестве основания также можно использовать трет-бутоксид натрия вместо карбоната цезия, и температура реакции может быть в диапазоне от 85°C до 100°C)
Цис-5-(3-Амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил: К раствору трет-бутилового эфира [1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-карбаминовой кислоты (720 мг; 1,71 ммоль) в безводном метаноле (17 мл) добавляли раствор хлористоводородной кислоты (12,8 мл; 51,4 ммоль) 4M в диоксане и оранжевый раствор перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли простой эфир (40 мл) и оранжевый раствор перемешивали при комнатной температуре в течение 20 мин. Оранжевую суспензию фильтровали, желтое твердое вещество промывали простым эфиром и сушили в вакууме с получением 5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида (571 мг; 94%) в виде желтого твердого вещества.
Соединение 71: 1H ЯМР (400 МГц, D2O) δ 8,94 (дд, J=4,6, 1,7 Гц, 1H), 8,66 (дд, J=8,6, 1,8 Гц, 1H), 8,17 (д, J=8,1 Гц, 1H), 7,77 (дд, J=8,8, 4,5 Гц, 1H), 7,34 (д, J=8,2 Гц, 1H), 4,02-3,87 (м, 1H), 3,82 (дд, J=11,5, 3,6 Гц, 1H), 3,71 (д, J=11,8 Гц, 1H), 3,17 (тд, J=8,0, 3,9 Гц, 1H), 3,05 (тд, J=11,4, 8,8 Гц, 2H), 2,64 (д, J=12,3 Гц, 1H), 1,81 (кв., J=12,2 Гц, 1H); МС: m/z=321 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 423 (5-(5-Амино-3,3-дифтор-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорид): из 5-бром-хинолин-8-карбонитрила и трет-бутилового эфира (5,5-дифтор-пиперидин-3-ил)-карбаминовой кислоты. ВЭЖХ: чистота >99%, RT=1,88 мин. МС: m/z=289 [M+H]+. 1H ЯМР (400 МГц, Оксид дейтерия, м.д.) δ 8,96 (дд, J=4,6, 1,6 Гц, 1H), 8,89 (дд, J=8,7, 1,6 Гц, 1H), 8,22 (д, J=8,0 Гц, 1H), 7,82 (дд, J=8,7, 4,6 Гц, 1H), 7,46 (д, J=8,1 Гц, 1H), 4,17 (с, 1H), 3,81-3,68 (м, 2H), 3,64-3,40 (м, 2H), 2,74 (тдд, J=19,9, 7,8, 5,4 Гц, 1H), 2,67-2,48 (м, 1H).
Соединение 510 (5,5-Дифтор-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин): из 5-бром-8-трифторметил-хинолина и трет-бутилового эфира (5,5-дифтор-пиперидин-3-ил)-карбаминовой кислоты. 1H ЯМР (400 МГц, DMSO-d6) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,58 (дд, J=8,6, 1,8 Гц, 1H), 8,10 (д, J=8,0 Гц, 1H), 7,71 (дд, J=8,6, 4,2 Гц, 1H), 7,30 (д, J=8,0 Гц, 1H), 3,53 (т, J=9,8 Гц, 1H), 3,47-3,36 (м, 1H), 3,30-3,17 (м, 2H), 2,78-2,64 (м, 1H), 2,43 (д, J=11,3 Гц, 1H), 1,95-1,65 (м, 3H). МС: m/z=332 [M+H]+.
Соединение 524 (8-(3-Амино-4-фтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил гидрохлорид): из 8-бром-хиноксалин-5-карбонитрила и трет-бутилового 4-фтор-пиперидин-3-ил)-карбаминовой кислоты. 1H ЯМР (400 МГц, DMSO-d6) δ 9,10 (д, J=1,8 Гц, 1H), 9,02 (д, J=1,8 Гц, 1H), 8,60 (с, 3H), 8,29 (д, J=8,3 Гц, 1H), 7,34 (д, J=8,4 Гц, 1H), 5,03 (тд, J=9,0, 4,8 Гц, 1H), 4,90 (тд, J=8,9, 4,8 Гц, 1H), 4,39 (д, J=12,8 Гц, 1H), 4,10 (д, J=13,2 Гц, 1H), 3,58 (д, J=8,1 Гц, 1H), 3,54-3,37 (м, 1H), 2,32 (ддт, J=13,0, 8,6, 3,7 Гц, 1H), 2,06-1,81 (м, 1H). МС: m/z=272 [M+H]+.
Соединение 553 ((3R,5S)-5-метил-1-(8-метил-1,7-нафтиридин-5-ил)пиперидин-3-амин): из 5-бром-8-метил-[1,7]нафтиридина и трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамата. МС: m/z=257 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 9,27 (дд, J=4,1, 1,5 Гц, 1H), 8,64 (дд, J=8,7, 1,7 Гц, 1H), 8,17 (с, 1H), 8,06 (дд, J=8,6, 4,2 Гц, 1H), 3,67 (д, J=11,3 Гц, 1H), 3,61-3,56 (м, 1H), 3,34 (д, J=12,0 Гц, 1H), 3,08 (с, 3H), 2,79 (т, J=11,0 Гц, 1H), 2,58 (д, J=11,4 Гц, 1H), 2,19 (д, J=12,5 Гц, 1H), 2,13-1,98 (м, 1H), 1,22 (кв., J=12,0 Гц, 1H), 0,99 (д, J=6,6 Гц, 3H).
Пример 31: Разделение соединения 72 и соединения 73 (5-((3S,5R)-3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил и 5-((3R,5S)-3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил):
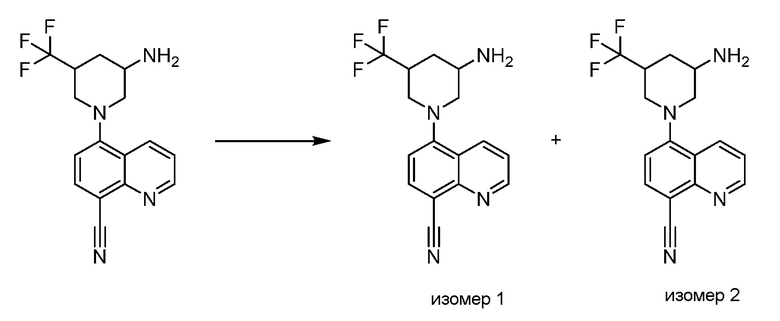
Указанные в заголовке соединения выделяли хиральной сверхкритической жидкостной хроматографией(СКЖХ) соединения 71. (Колонка: 2,1 × 25,0 см Chiralpak AD-H от Chiral Technologies (West Chester, PA); CO2 Со-растворитель (Растворитель B): Метанол с 0,2% гидроксида аммония; Изократический метод: 20% со-растворителя при 80 г/мин; Давление в системе: 100 бар; Температура колонки: 25°C).
Изомер 1: 1H ЯМР (400 МГц, Ацетон-d6) δ 8,60 (дд, J=4,2, 1,7 Гц, 1H), 8,06 (дд, J=8,6, 1,7 Гц, 1H), 7,78 (д, J=8,0 Гц, 1H), 7,24 (дд, J=8,6, 4,2 Гц, 1H), 6,84 (д, J=8,0 Гц, 1H), 3,07 (дт, J=12,0, 2,3 Гц, 1H), 3,05-2,96 (м, 1H), 2,66 (тт, J=11,2, 4,3 Гц, 1H), 2,57 (ддд, J=15,5, 7,4, 3,4 Гц, 1H), 2,40 (т, J=11,4 Гц, 1H), 2,04-1,97 (м, 1H), 1,78-1,67 (м, 1H), 1,29 (с, 2H), 0,80 (кв., J=12,1 Гц, 1H). МС: m/z=321 [M+H]+.
Изомер 2: 1H ЯМР (400 МГц, Ацетон-d6) δ 8,63 (дд, J=4,2, 1,7 Гц, 1H), 8,12 (дд, J=8,6, 1,7 Гц, 1H), 7,74 (д, J=8,0 Гц, 1H), 7,12 (дд, J=8,6, 4,2 Гц, 1H), 6,84 (д, J=8,0 Гц, 1H), 3,09 (дт, J=12,0, 2,3 Гц, 1H), 3,11-2,99 (м, 1H), 2,66 (тт, J=11,2, 4,3 Гц, 1H), 2,58 (ддд, J=15,5, 7,4, 3,4 Гц, 1H), 2,47 (т, J=11,4 Гц, 1H), 2,07-1,79 (м, 1H), 1,75-1,67 (м, 1H), 1,23 (с, 2H), 0,84 (кв., J=12,1 Гц, 1H). МС: m/z=321 [M+H]+.
Пример 32: Синтез соединения 74 (5-((3R,5S)-3-Амино-5-метил-пиперидин-1-ил)-хиназолин-8-карбонитрил)
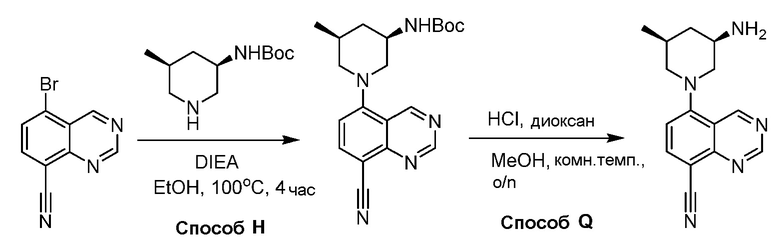
трет-бутиловый эфир [(3R,5S)-1-(8-циано-хиназолин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты: Раствор 5-бром-хиназолин-8-карбонитрила (200 мг; 0,855 ммоль), трет-бутил-N-[(3R,5S)-5-метилпиперидин-3-ил]карбамата (220 мг; 1,03 ммоль) и DIPEA (450 мкл; 2,6 ммоль) в безводном этаноле (3 мл) нагревали в условиях микроволнового облучения при 100°C в течение 4 часов. Коричневый раствор концентрировали при пониженном давлении и очищали хроматографией, элюируя гексаном и этилацетатом, с получением трет-бутилового эфира [1-(8-циано-хиназолин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты (270 мг; 86%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 9,58 (с, 1H), 9,41 (с, 1H), 8,12 (д, J=8,2 Гц, 1H), 7,11 (д, J=8,2 Гц, 1H), 4,46 (с, 1H), 3,93 (д, J=11,0 Гц, 2H), 3,58 (д, J=12,3 Гц, 1H), 2,73-2,56 (м, 2H), 2,28-2,16 (м, 1H), 2,17-2,04 (м, 1H), 1,46 (с, 9H), 1,05 (т, J=11,9 Гц, 1H), 0,99 (д, J=6,6 Гц, 3H); МС: m/z=368 [M+H]+.
5-((3R,5S)-3-Амино-5-метил-пиперидин-1-ил)-хиназолин-8-карбонитрил гидрохлорид: К раствору трет-бутилового эфира [(3R,5S)-1-(8-циано-хиназолин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты (220 мг; 0,612 ммоль) в безводном метаноле (6 мл) добавляли раствор хлористоводородной кислоты (4,6 мл; 18,4 ммоль) 4M в диоксане и оранжевый раствор перемешивали при комнатной температуре в течение ночи. К мутному раствору добавляли метанол (5 мл) и добавляли простой эфир (20 мл). Оранжевый раствор перемешивали при комнатной температуре в течение 30 минут и оранжевую суспензию фильтровали, светло-оранжевое твердое вещество промывали простым эфиром и сушили в условиях вакуума с получением 5-(3-амино-5-метил-1-пиперидил)хиназолин-8-карбонитрил гидрохлорида (204 мг; 99%) в виде оранжевого твердого вещества.
Соединение 74: 1H ЯМР (400 МГц, DMSO-d6) δ 9,63 (с, 1H), 9,41 (с, 1H), 8,43 (д, J=8,3 Гц, 1H), 8,32 (с, 3H), 7,29 (д, J=8,3 Гц, 1H), 3,92 (д, J=11,6 Гц, 1H), 3,58 (д, J=11,7 Гц, 2H), 2,94 (т, J=11,5 Гц, 1H), 2,65 (т, J=11,8 Гц, 1H), 2,19 (д, J=12,1 Гц, 1H), 2,14-1,97 (м, 1H), 1,25 (кв., J=12,0 Гц, 1H), 0,97 (д, J=6,6 Гц, 3H); МС: m/z=268 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 457 (5-((3R,5S)-3-Амино-5-метил-пиперидин-1-ил)-хиназолин-8-карбонитрил гидрохлорид): из 5-бром-хиназолин-8-карбонитрила и трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамата. ВЭЖХ: чистота >99%, RT=4,02 мин. МС: m/z=368 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,58 (с, 1H), 9,41 (с, 1H), 8,12 (д, J=8,2 Гц, 1H), 7,11 (д, J=8,2 Гц, 1H), 4,46 (с, 1H), 3,93 (д, J=11,0 Гц, 2H), 3,58 (д, J=12,3 Гц, 1H), 2,73-2,56 (м, 2H), 2,28-2,16 (м, 1H), 2,17-2,04 (м, 1H), 1,46 (с, 9H), 1,05 (т, J=11,9 Гц, 1H), 0,99 (д, J=6,6 Гц, 3H).
Соединение 459 ((3R,5S)-1-(8-Фтор-пиридо[3,4-b]пиразин-5-ил)-5-метил-пиперидин-3-иламин гидрохлорид): из 5-хлор-8-фторпиридо[3,4-b]пиразина и трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамата. ВЭЖХ: чистота >99%, RT=3,62 мин. МС: m/z=362 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,8 Гц, 1H), 8,82 (д, J=1,8 Гц, 1H), 8,22 (д, J=1,3 Гц, 1H), 4,92 (д, J=12,2 Гц, 1H), 4,64 (ддт, J=12,7, 3,8, 1,8 Гц, 1H), 4,45 (с, 1H), 3,82 (с, 1H), 2,72 (д, J=11,6 Гц, 1H), 2,58 (дд, J=12,7, 11,1 Гц, 1H), 2,18 (д, J=12,5 Гц, 1H), 2,09-1,95 (м, 1H), 1,45 (с, 9H), 1,04 (т, J=11,9 Гц, 1H), 0,99 (д, J=6,6 Гц, 3H).
Пример 33: Синтез соединения 75 и соединения 76 (8-((S)-5-амино-3,3-дифтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил и 8-((R)-5-амино-3,3-дифтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил)
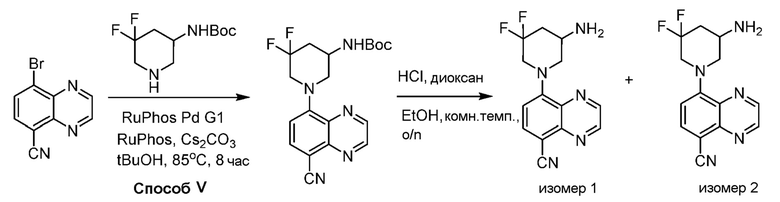
трет-бутиловый эфир [1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-карбаминовой кислоты: Указанное в заголовке получали из 8-бром-хиноксалин-5-карбонитрила и трет-бутилового эфира (5,5-дифтор-пиперидин-3-ил)-карбаминовой кислоты с получением трет-бутилового эфира [1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-карбаминовой кислоты (245 мг, 45%) в виде желтого твердого вещества. МС: m/z=390 [M+H]+.
8-(5-Амино-3,3-дифтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил: К раствору трет-бутилового эфира {1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-карбаминовой кислоты (245 мг; 0,63 ммоль) в этаноле (3 мл) добавляли раствор хлористого водорода (4,0M в диоксане) (3,1 мл; 12,58 ммоль) и полученный раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученное твердое вещество промывали ацетонитрилом с получением рацемической смеси 8-(5-амино-3,3-дифтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил гидрохлорида (200 мг, 97%) в виде желтого твердого вещества. 2 энантиомера разделяли хиральной СКЖХ (ASH колонка, метанол, диоксид углерода, 20 мин цикл) с получением желаемых чистых хиральных соединений.
Изомер 1: МС: m/z=290 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 9,07 (д, J=1,8 Гц, 1H), 8,98 (д, J=1,8 Гц, 1H), 8,23 (д, J=8,4 Гц, 1H), 7,33 (д, J=8,5 Гц, 1H), 4,71 (с, 1H), 4,15-4,06 (м, 1H), 3,60 (ддд, J=29,7, 13,6, 2,1 Гц, 1H), 3,23 (с, 1H), 2,94 (дд, J=12,7, 10,2 Гц, 1H), 2,38 (с, 1H), 1,94-1,73 (м, 1H), 1,81 (с, 2H).
Изомер 2: МС: m/z=290 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 9,07 (д, J=1,8 Гц, 1H), 8,98 (д, J=1,8 Гц, 1H), 8,23 (д, J=8,4 Гц, 1H), 7,33 (д, J=8,5 Гц, 1H), 4,71 (с, 1H), 4,15-4,06 (м, 1H), 3,60 (ддд, J=29,7, 13,6, 2,1 Гц, 1H), 3,23 (с, 1H), 2,94 (дд, J=12,7, 10,2 Гц, 1H), 2,38 (с, 1H), 1,94-1,73 (м, 1H), 1,81 (с, 2H).
Пример 34: Синтез соединения 77 ((3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амин)
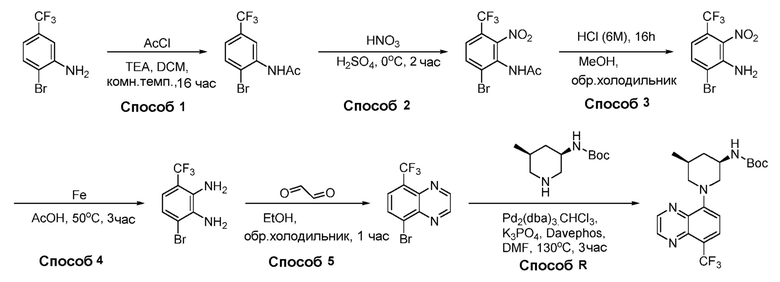
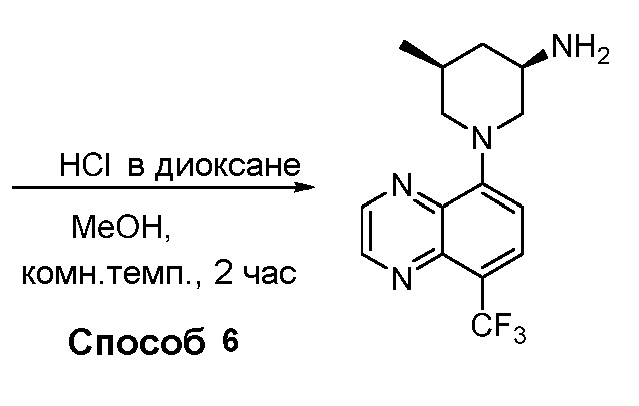
Способ 1
N-(2-бром-5-(трифторметил)фенил)ацетамид: при 0°C триэтиламин (798 мг, 7,89 ммоль) добавляли к раствору 2-бром-5-(трифторметил)анилина (950 мг, 3,96 ммоль) в DCM (30 мл), затем добавляли ацетилхлорид (18 мг, 7,87 ммоль) по каплям. Полученный раствор перемешивали в течение 16 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (100 мл). Полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением N-[2-бром-5-(трифторметил)фенил]ацетамида в виде светло-желтого твердого вещества (1,08 г, 98%). МС: m/z=281,9 [M+H]+.
Способ 2
N-(6-бром-2-нитро-3-(трифторметил)фенил)ацетамид: при 0°C к раствору HNO3 (7,5 мл, 68%) в серной кислоте (12,5 мл, 98%) добавляли N-[2-бром-5-(трифторметил)фенил]ацетамид (1,08 г, 3,84 ммоль) по порциям в течение 20 минут. Полученный раствор перемешивали в течение 2 часов при 0°C. Когда реакция была завершена, ее гасили путем добавления воды (50 мл). Полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали обращенно-фазовой флэш-хроматографией, элюируя ацетонитрилом в воде (с 0,02% HCl), 0% - 80% градиент за 45 минут, с получением N-[6-бром-2-нитро-3-(трифторметил)фенил]ацетамида в виде желтого твердого вещества (445 мг, 32%). МС: m/z=326,9 [M+H]+.
Способ 3
6-бром-2-нитро-3-(трифторметил)бензоламин: К раствору N-[6-бром-2-нитро-3-(трифторметил)фенил]ацетамида (240 мг, 0,73 ммоль) в метаноле (16 мл) добавляли раствор хлористого водорода (6 M в воде, 4 мл, 24 ммоль) при комнатной температуре. Полученный раствор нагревали до температуры кипения с обратным холодильником и перемешивали в течение 16 часов. Когда реакция была завершена, значение pH реакционной смеси доводили до 8 насыщенным раствором бикарбоната натрия. Полученную смесь экстрагировали при помощи EtOAc (50 мл ×3) и органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 6-бром-2-нитро-3-(трифторметил)анилина в виде коричневого масла (165 мг, 79%). 1H ЯМР (400 МГц, CD3OD, м.д.) δ 7,81 (д, J=8,4 Гц, 1H), 7,00 (д, J=8,3 Гц, 1H).
Способ 4
3-бром-6-(трифторметил)бензол-1,2-диамин: К раствору 6-бром-2-нитро-3-(трифторметил)анилина (189 мг, 0,66 ммоль) в AcOH (10 мл) добавляли Fe порошок (252 мг, 4,51 ммоль) при комнатной температуре. Полученную смесь затем перемешивали в течение 3 часов при 50°C. Когда реакция была завершена, реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Значение pH остатка доводили до 8 насыщенным раствором бикарбоната натрия. Полученную смесь экстрагировали этилацетатом (20 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 3-бром-6-(трифторметил)бензол-1,2-диамина в виде коричневого твердого вещества (143 мг, 84%). МС: m/z=326,9 [M+H]+.
Способ 5
5-бром-8-(трифторметил)хиноксалин: К раствору 3-бром-6-(трифторметил)бензол-1,2-диамина (143 мг, 0,56 ммоль) в этаноле (5 мл) добавляли оксальдегид (409 мг, 8,18 ммоль) при комнатной температуре. Полученный раствор нагревали до температуры кипения с обратным холодильником и перемешивали в течение 1 часа. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (1% изотропный), с получением 5-бром-8-(трифторметил)хиноксалина в виде желтого твердого вещества (150 мг, 95%). МС: m/z=278,9 [M+H]+.
(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амин: К раствору 5-бром-8-(трифторметил)хиноксалина (157 мг, 0,57 ммоль) в DMF (5 мл) добавляли трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамат (118 мг, 0,55 ммоль), Pd2(dba)3CHCl3 (57 мг, 0,06 ммоль), K3PO4 (351 мг, 1,65 ммоль), Davephos (43 мг, 0,11 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов при 130°C. После охлаждения до комнатной температуры реакционную смесь гасили путем добавления воды (10 мл). Полученную смесь экстрагировали этилацетатом (20 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 16% градиент), с получением трет-бутил N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]карбамата в виде желтого твердого вещества (107 мг, 46%). МС: m/z=411,2 [M+H]+.
Способ 6
(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-амин: К раствору трет-бутил N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]карбамата (107 мг, 0,26 ммоль) в метаноле (5 мл) добавляли раствор HCl в диоксане (5 M, 3,1 мл, 15,63 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Когда реакция была завершена, значение pH реакционной смеси доводили до 7 насыщенным раствором бикарбоната натрия. Полученную смесь экстрагировали этилацетатом (20 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка, XBridge Shield RP18 OBD Column, 150 мм, 5 мкм, 13 нм; подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 48% - 68% градиент за 8 мин; детектор УФ 254 нм. (3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амин получали в виде желтого твердого вещества (30 мг, 37%).
Соединение 77: ВЭЖХ: чистота 99,2%, RT=0,88 мин. МС: m/z=311,0 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 9,01-8,87 (м, 2H), 8,05 (д, J=8,3 Гц, 1H), 7,26 (д, J=8,3 Гц, 1H), 4,22 (м, 1H), 4,09-3,93 (м, 1H), 3,21 (м, 1H), 2,60-2,44 (м, 2H), 2,26-2,01 (м, 2H), 1,10-0,84 (м, 4H).
Пример 35: Синтез соединения 78 ((3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-амин)
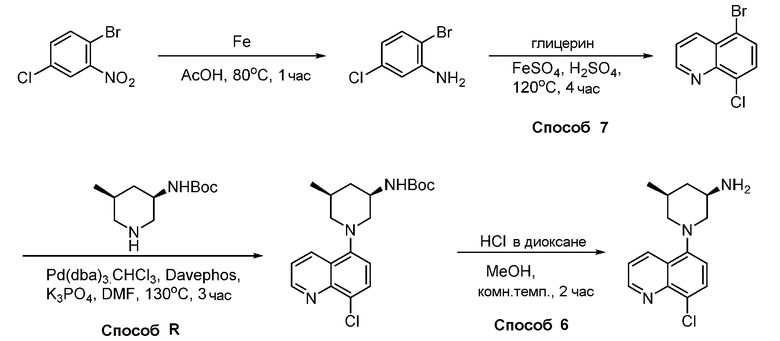
2-бром-5-хлорбензоламин: К раствору 4-бром-1-хлор-2-нитробензола (2,94 г, 12,43 ммоль) в AcOH (50 мл) добавляли Fe порошок (5,67 г, 100,52 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 1 часа при 80°C. Когда реакция была завершена, твердые вещества, присутствующие в реакционной смеси, отфильтровывали и фильтрат концентрировали при пониженном давлении. Значение pH остатка доводили до 7-8 раствором гидроксида натрия (2N). Полученную смесь экстрагировали этилацетатом (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 5-бром-2-хлоранилина в виде желтого твердого вещества (2,06 г, 80%). МС: m/z=207,9 [M+H]+.
Способ 7
5-бром-8-хлорхинолин: К раствору 5-бром-2-хлоранилина (2,06 г, 9,88 ммоль) в пропан-1,2,3-триоле (4,23 г, 45,90 ммоль) добавляли FeSO4.7H2O (520 мг, 1,87 ммоль) и серную кислоту (3 г, 29,67 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 4 часов при 120°C. После охлаждения до комнатной температуры реакционную смесь доводили до pH 13 с использованием раствора гидроксида натрия (2 M). Полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 94% градиент), с получением 5-бром-8-хлорхинолина в виде желтого твердого вещества (760 мг, 32%). МС: m/z=243,8 [M+H]+.
(3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-амин: (3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-амин получали из 5-бром-8-хлорхинолина и трет-бутил (3R,5S)-5-метилпиперидин-3-илкарбамата с использованием Способа R и 6. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 20% - 50% градиент за 10 мин; детектор УФ 254 нм. (3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-амин получали в виде светло-желтого твердого вещества (25 мг, 35%).
Соединение 78: ВЭЖХ: чистота 99,6%, RT=0,76 мин. МС: m/z=276,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,93 (дд, J=4,3, 1,6 Гц, 1H), 8,66 (дд, J=8,5, 1,7 Гц, 1H), 7,83 (д, J=8,1 Гц, 1H), 7,63 (дд, J=8,5, 4,2 Гц, 1H), 7,21 (д, J=8,1 Гц, 1H), 3,52-3,36 (м, 1H), 3,36-3,19 (м, 2H), 2,48 (т, J=10,7 Гц, 1H), 2,38 (т, J=11,1 Гц, 1H), 2,20-2,08 (м, 2H), 1,06-1,00 (м, 4H).
Пример 36: Синтез соединения 79 (N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-2-гидроксипропанамид)
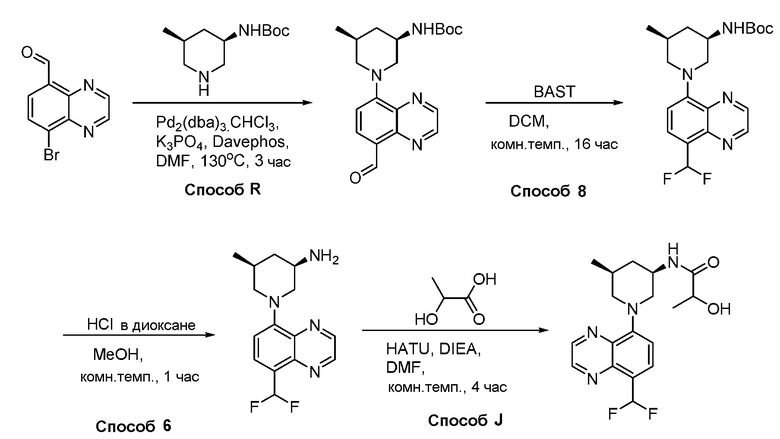
трет-бутил N-[(3R,5S)-1-(8-формилхиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамат: трет-бутил (3R,5S)-1-(8-формилхиноксалин-5-ил)-5-метилпиперидин-3-илкарбамат получали из 8-бромхиноксалин-5-карбальдегида и трет-бутил (3R,5S)-5-метилпиперидин-3-илкарбамата с использованием Способа R. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 20% градиент), с получением трет-бутил N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]карбамата в виде желтого твердого вещества (467 мг, 39%). МС: m/z=371,1 [M+H]+.
Способ 8
трет-бутил (3R,5S)-1-(8-(дифторметил)хиноксалин-5-ил)-5-метилпиперидин-3-илкарбамат: К раствору трет-бутил N-[(3R,5S)-1-(8-формилхиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамата (140 мг, 0,38 ммоль) в дихлорметане (5 мл) добавляли DAST (1,24 г, 7,66 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 16 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления раствора бикарбоната натрия (10%, 30 мл). Полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 15% градиент), с получением трет-бутил N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]карбамата в виде светло-коричневого твердого вещества (49 мг, 33%). МС: m/z=393,2 [M+H]+.
N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-2-гидроксипропанамид: N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-2-гидроксипропанамид получали из 2-гидроксипропановой кислоты и трет-бутил (3R,5S)-1-(8-(дифторметил)хиноксалин-5-ил)-5-метилпиперидин-3-илкарбамата с использованием Способа 6 и J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 30% - 60% градиент за 10 мин; детектор УФ 254 нм. N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-2-гидроксипропанамид получали в виде желтого твердого вещества (21 мг, 18%).
Соединение 79: ВЭЖХ: чистота 95,6%, RT=1,58 мин. МС: m/z=365,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,88-8,80 (м, 2H), 7,94 (д, J=8,2 Гц, 1H), 7,80-7,40 (м, 1H), 7,31 (д, J=8,2 Гц, 1H), 4,26-3,89 (м, 4H), 2,73 (т, J=10,8 Гц, 1H), 2,52 (т, J=11,1 Гц, 1H), 2,15-1,95 (м, 2H), 1,32 (д, J=6,8 Гц, 3H), 1,27-1,16 (м, 1H), 0,99 (д, J=6,4 Гц, 3H).
Пример 37: Синтез соединения 80 ((R)-5,5-диметил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амин)
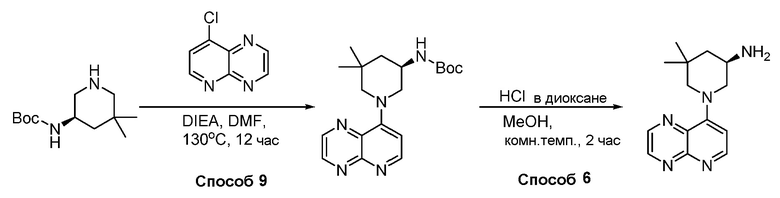
Способ 9
(R)-трет-бутил 5,5-диметил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-илкарбамат: К раствору трет-бутил N-[(3R)-5,5-диметилпиперидин-3-ил]карбамата (27 мг, 0,12 ммоль) в DMF (2 мл) добавляли 8-хлорпиридо[2,3-b]пиразин (22 мг, 0,13 ммоль) и DIEA (24 мг, 0,19 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 12 часов при 130°C. После охлаждения до комнатной температуры реакционную смесь гасили путем добавления воды (20 мл). Полученную смесь экстрагировали этилацетатом (20 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 50% градиент), с получением трет-бутил N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]карбамата в виде желтого твердого вещества (40 мг, 98%). МС: m/z=358,2 [M+H]+.
(3R)-5,5-диметил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-амин: К раствору трет-бутил N-[(3R)-5,5-диметил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]карбамата (39 мг, 0,11 ммоль) в метаноле (5 мл) добавляли раствор HCl в диоксане (4 M, 5 мл, 20 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 12 часов при комнатной температуре. Когда реакция была завершена, полученную смесь концентрировали при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка, XBridge BEH130 Prep C18 OBD Column, 150 мм, 5 мкм, 13 нм; подвижная фаза: ацетонитрил в воде (с 0,05% NH4OH), 30% - 80% градиент за 10 мин; детектор УФ 254 нм. (3R)-5,5-диметил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-амин получали в виде желтого масла (12 мг, 44%).
Соединение 80: ВЭЖХ: чистота 99,2%, RT=0,77 мин. МС: m/z=258,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95 (д, J=1,7 Гц, 1H), 8,83 (д, J=1,7 Гц, 1H), 8,66 (д, J=5,6 Гц, 1H), 7,10 (д, J=5,7 Гц, 1H), 4,72 (дд, J=12,3, 4,1 Гц, 1H), 4,34 (д, J=12,7 Гц, 1H), 3,49-3,36 (м, 1H), 2,93 (д, J=12,6 Гц, 1H), 2,78 (т, J=11,4 Гц, 1H), 1,90 (дд, J=12,7, 3,9 z, 1H), 1,40-1,27 (м, 1H), 1,08 и 1,06 (с, 6H).
Пример 38: Синтез соединения 81 (8-[(3R,5S)-3-гидрокси-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрил)
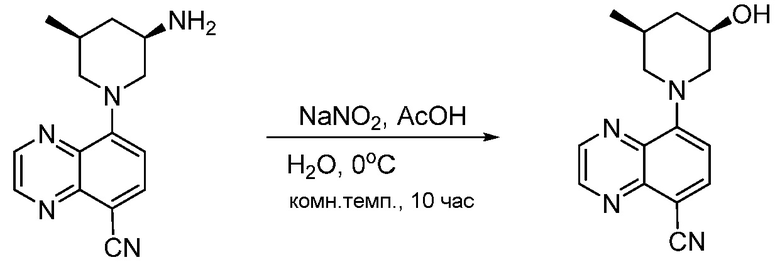
8-[(3R,5S)-3-гидрокси-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрил: при 0°C к раствору 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрила (178 мг, 0,67 ммоль) в AcOH (5 мл) добавляли по каплям раствор NaNO2 (229 мг, 3,33 ммоль) в воде (1 мл). Полученный раствор перемешивали в течение 10 часов при комнатной температуре. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge BEH130 Prep C18 OBD Column, 19 × 150 мм, 5 мкм, 13 нм; подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 30% - 80% градиент за 10 мин; детектор УФ 254 нм. 8-[(3R,5S)-3-гидрокси-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрил получали в виде желтого твердого вещества (30 мг, 17%).
Соединение 81: ВЭЖХ: чистота 99,9%, RT=1,13 мин. МС: m/z=269,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,88 (м, 2H), 8,11 (д, J=8,4 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 4,42 (дд, J=11,5, 4,2 Гц, 1H), 4,14-3,92 (м, 2H), 2,73 (дд, J=11,5, 10,3 Гц, 1H), 2,62 (т, J=11,7 Гц, 1H), 2,30-2,12 (м, 1H), 2,11-1,99 (м, 1H), 1,24-1,10 (м, 1H), 1,05 (д, J=6,6 Гц, 3H).
Пример 39: Синтез соединения 82 и соединения 83 (8-[(3R,5S)-3-амино-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрил и 8-[(3S,5R)-3-амино-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрил)
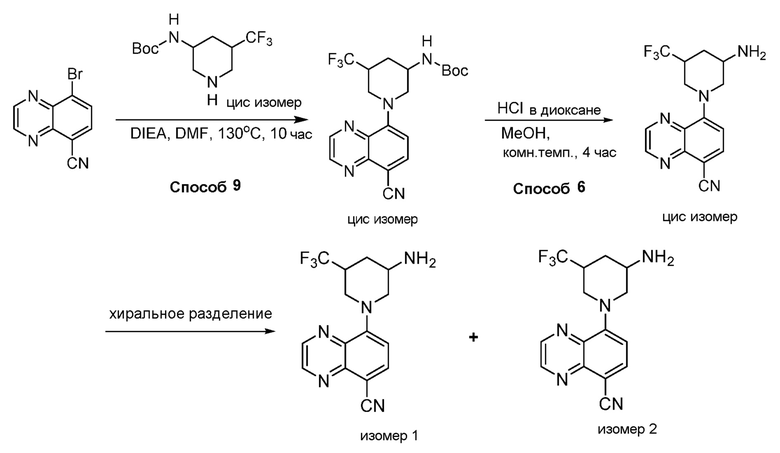
Цис-8-[3-амино-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрил: цис-8-[3-амино-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрил получали из 8-бромхиноксалин-5-карбонитрила и трет-бутил цис-5-(трифторметил)пиперидин-3-илкарбамата с использованием Способа 9 и 6. Цис-8-[3-амино-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрил получали путем очистки препаративной ВЭЖХ при следующих условиях: колонка XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 20% - 50% градиент за 10 мин; детектор УФ 254 нм. ВЭЖХ: чистота 99,0%, RT=1,21 мин. МС: m/z=322,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,15 (д, J=8,3 Гц, 1H), 7,30 (д, J=8,3 Гц, 1H), 4,54 (д, J=10,5 Гц, 1H), 4,28-4,19 (м, 1H), 3,24-3,12 (м, 1H), 3,03-2,84 (м, 2H), 2,75 (т, J=11,2 Гц, 1H), 2,36 (д, J=12,3 Гц, 1H), 1,52-1,38 (м, 1H).
8-[(3R,5S)-3-амино-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрил и 8-[(3S,5R)-3-амино-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрил: Два энантиомера цис-8-[3-амино-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрила получали путем разделения методом хиральной препаративной ВЭЖХ при следующих условиях: колонка, Repaired ADH, 0,46 × 15см, 5мкм; подвижная фаза: EtOH в гексане (0,1% DEA), 30% изократический в течение 20 мин; детектор УФ 254 нм. Разделяли и получали два продукта.
Изомер 1: (60 мг, 13%, желтое твердое вещество) ВЭЖХ: чистота 99,3%, RT=1,21 мин. МС: m/z=322,0 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,15 (д, J=8,3 Гц, 1H), 7,30 (д, J=8,3 Гц, 1H), 4,54 (д, J=10,5 Гц, 1H), 4,28-4,19 (м, 1H), 3,24-3,12 (м, 1H), 3,03-2,84 (м, 2H), 2,75 (т, J=11,2 Гц, 1H), 2,36 (д, J=12,3 Гц, 1H), 1,52-1,38 (м, 1H).
Изомер 2: (56 мг, 12%, желтое твердое вещество) ВЭЖХ: чистота 99,2%, RT=1,21 мин. МС: m/z=322,0 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,15 (д, J=8,3 Гц, 1H), 7,30 (д, J=8,3 Гц, 1H), 4,54 (д, J=10,5 Гц, 1H), 4,28-4,19 (м, 1H), 3,24-3,12 (м, 1H), 3,03-2,84 (м, 2H), 2,75 (т, J=11,2 Гц, 1H), 2,36 (д, J=12,3 Гц, 1H), 1,52-1,38 (м, 1H).
Следующие соединения синтезировали аналогичным способом:
Соединение 84 (цис-8-(3-амино-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил): из 8-хлорпиридо[2,3-b]пиразина и трет-бутил цис-5-(трифторметил)пиперидин-3-илкарбамата. ВЭЖХ: чистота 99,1%, RT=0,88 мин. МС: m/z=298,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,96 (д, J=1,7 Гц, 1H), 8,83 (д, J=1,7Гц, 1H), 8,71 (д, J=5,6 Гц, 1H), 7,12 (д, J=5,5 Гц, 1H), 4,91-4,98 (м, 1H), 4,46-4,55 (м, 1H), 3,21-3,00 (м, 2H), 2,94-2,74 (м, 2H), 2,39-2,29 (м, 1H), 1,59-1,41 (м, 1H).
Пример 40: Синтез соединения 85 (цис-N-[1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил]-3,3-диметилбутанамид)
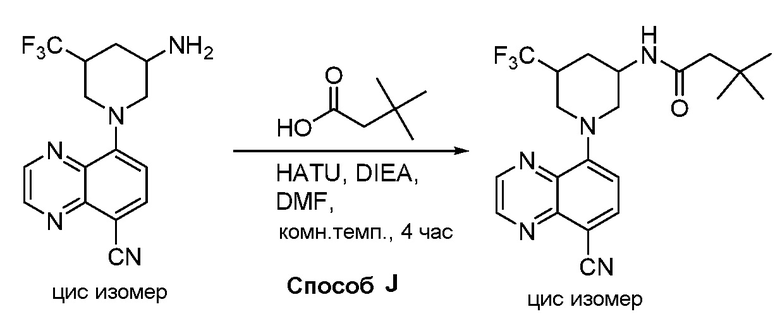
Цис-N-[1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил]-3,3-диметилбутанамид: цис-N-[1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил]-3,3-диметилбутанамид получали из цис-8-[3-амино-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрила и 3,3-диметилбутановой кислоты с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 10 ммоль/л NH4HCO3), 30% - 80% градиент за 10 мин; детектор УФ 254 нм. Цис-N-[1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил]-3,3-диметилбутанамид получали в виде желтого твердого вещества (50 мг, 45%).
Соединение 85: ВЭЖХ: чистота 99,3%, RT=2,12 мин. МС: m/z=420,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,10 (д, J=8,3 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 4,62 (д, J=11,5 Гц, 1H), 4,27-4,12 (м, 2H), 3,08-2,73 (м, 3H), 2,28 (д, J=12,5 Гц, 1H), 2,07 (с, 2H), 1,59 (д, J=12,2 Гц, 1H), 1,01 (с, 9H).
Следующие соединения синтезировали аналогичным способом:
Соединение 86 (цис-3,3-диметил-N-[1-[пиридо[2,3-b]пиразин-8-ил]-5-(трифторметил)пиперидин-3-ил]бутанамид): из цис-1-(пиридо[2,3-b]пиразин-8-ил)-5-(трифторметил)пиперидин-3-амина и 3,3-диметилбутановой кислоты. ВЭЖХ: чистота 99,4%, RT=1,33 мин. МС: m/z=396,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99 (д, J=1,7 Гц, 1H), 8,87 (д, J=1,7 Гц, 1H), 8,76 (д, J=5,5 Гц, 1H), 7,24 (д, J=5,6 Гц, 1H), 5,18-5,10 (м, 1H), 4,60-4,51 (м, 1H), 4,22-4,12 (м, 1H), 3,24-3,13 (м, 1H), 2,99-2,87 (м, 2H), 2,32 (д, J=12,5 Гц, 1H), 2,13 (с, 2H), 1,78-1,62 (м, 1H), 1,07 (с, 9H).
Соединение 222 (цис-N-[1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил]-2-(диметиламино)ацетамид): из 2-(диметиламино)уксусной кислоты и 8-(цис-3-амино-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 95,1%, RT=2,57 мин. МС: m/z=407,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,10 (д, J=8,3 Гц, 1H), 7,30 (д, J=8,3 Гц, 1H), 4,58 (д, J=11,3 Гц, 1H), 4,29-4,12 (м, 2H), 3,10-2,83 (м, 5H), 2,32-2,27 (м, 7H), 1,70 (тд, J=12,1, 12,1 Гц, 1H).
Соединение 223 (цис-N-[1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил]-2-гидроксиацетамид): из 2-гидроксиуксусной кислоты и цис-8-(3-амино-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 95,3%, RT=1,16 мин. МС: m/z=380,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,14 (д, J=8,4 Гц, 1H), 7,33 (д, J=8,3 Гц, 1H), 4,65-4,54 (м, 1H), 4,36-4,14 (м, 2H), 4,02 (с, 2H), 3,15-2,88 (м, 3H), 2,32 (д, J=12,9 Гц, 1H), 1,78 (тд, J=12,1, 12,1 Гц, 1H).
Соединение 228 (цис-N-[1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид): из 2-(морфолин-4-ил)уксусной кислоты и 8-(цис-3-амино-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 90,3%, RT=1,73 мин. МС: m/z=449,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,09 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,64-4,53 (м, 1H), 4,31-4,12 (м, 2H), 3,75-3,65 (м, 4H), 3,12-2,84 (м, 5H), 2,56-2,46 (м, 4H), 2,35-2,21 (м, 1H), 1,71 (тд, J=12,1, 12,1 Гц, 1H).
Соединение 229 (цис-N-[1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил]-2-(4-метилпиперазин-1-ил)ацетамид): из 2-(4-метилпиперазин-1-ил)уксусной кислоты и цис-8-(3-амино-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,4%, RT=1,26 мин. МС: m/z=462,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,13 (д, J=8,4 Гц, 1H), 7,33 (д, J=8,4 Гц, 1H), 4,62 (кажущийся д, J=11,7 Гц, 1H), 4,34-4,16 (м, 2H), 3,17-2,87 (м, 5H), 2,75-2,45 (м, 8H), 2,39-2,27 (м, 4H), 1,73 (тд, J=12,1, 12,1 Гц, 1H).
Соединение 424 (цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-морфолин-4-ил-ацетамид): из гидрохлорида цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрила и гидрохлорида 2-морфолиноуксусной кислоты. ВЭЖХ: чистота >99%, RT=2,66 мин. МС: m/z=448 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,09 (дд, J=4,2, 1,7 Гц, 1H), 8,47 (дд, J=8,6, 1,7 Гц, 1H), 8,04 (д, J=7,9 Гц, 1H), 7,59 (дд, J=8,6, 4,2 Гц, 1H), 7,13 (дд, J=8,1, 4,0 Гц, 2H), 4,41 (дтт, J=12,2, 8,4, 4,3 Гц, 1H), 3,84-3,71 (м, 1H), 3,71 (т, J=4,6 Гц, 4H), 3,63 (ддд, J=11,4, 3,8, 1,9 Гц, 1H), 3,09-2,95 (м, 2H), 2,94 (т, J=11,2 Гц, 1H), 2,84 (дткв.,J=15,5, 7,6, 4,1 Гц, 1H), 2,64-2,45 (м, 5H), 2,48-2,35 (м, 1H), 1,54 (кв., J=12,2 Гц, 1H).
Соединение 426 (цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-диметиламино-ацетамид): из цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и N,N-диметилглицина. ВЭЖХ: чистота 98,8%, RT=2,61 мин. МС: m/z=406 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,09 (дд, J=4,2, 1,7 Гц, 1H), 8,48 (дд, J=8,6, 1,7 Гц, 1H), 8,04 (д, J=7,9 Гц, 1H), 7,59 (дд, J=8,6, 4,2 Гц, 1H), 7,23 (с, 1H), 7,12 (д, J=7,9 Гц, 1H), 4,41 (дтд, J=15,5, 8,4, 4,2 Гц, 1H), 3,81-3,73 (м, 1H), 3,63 (д, J=11,1 Гц, 1H), 2,97-2,90 (м, 2H), 2,83 (ддп, J=11,4, 7,6, 3,7 Гц, 1H), 2,54 (т, J=11,1 Гц, 1H), 2,44 (д, J=12,2 Гц, 1H), 2,28 (с, 6H), 1,55 (кв., J=12,3 Гц, 1H), 1,28-1,24 (м, 1H).
Соединение 428 (цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-3,3,3-трифтор-пропионамид): из цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и 3,3,3-трифторпропионовой кислоты. ВЭЖХ: чистота >99%, RT=4,03 мин. МС: m/z=431 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,06 (дд, J=4,2, 1,7 Гц, 1H), 8,45 (дд, J=8,6, 1,7 Гц, 1H), 8,02 (д, J=7,9 Гц, 1H), 7,59 (дд, J=8,6, 4,2 Гц, 1H), 7,11 (д, J=8,0 Гц, 1H), 5,93 (д, J=7,6 Гц, 1H), 4,42 (дтд, J=15,0, 8,6, 8,1, 4,1 Гц, 1H), 3,79 (ддт, J=11,6, 4,1, 1,7 Гц, 1H), 3,62 (ддт, J=11,3, 3,7, 1,5 Гц, 1H), 3,11 (кв., J=10,5 Гц, 2H), 2,93 (т, J=11,2 Гц, 1H), 2,83 (дткв.,J=15,4, 7,6, 3,9 Гц, 1H), 2,56 (дд, J=11,6, 10,7 Гц, 1H), 2,47 (дт, J=12,6, 4,0 Гц, 1H), 1,55 (кв., J=12,2 Гц, 1H).
Соединение 431 (цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-3,3-диметил-бутирамид): из цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и 3,3-диметилмасляной кислоты. ВЭЖХ: чистота >99%, RT=4,37 мин. МС: m/z=419 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,08 (дд, J=4,2, 1,7 Гц, 1H), 8,48 (дд, J=8,6, 1,7 Гц, 1H), 8,03 (д, J=7,9 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,11 (д, J=8,0 Гц, 1H), 5,28 (д, J=7,8 Гц, 1H), 4,41 (дддд, J=16,2, 12,4, 8,2, 4,3 Гц, 1H), 3,79 (дкв., J=10,0, 2,2 Гц, 1H), 3,66-3,57 (м, 1H), 2,92 (т, J=11,3 Гц, 1H), 2,82 (ддкв., J=15,5, 7,9, 3,8 Гц, 1H), 2,53-2,36 (м, 2H), 2,05 (д, J=1,7 Гц, 2H), 1,48 (кв., J=12,2 Гц, 1H), 1,03 (с, 9H).
Соединение 511 (N-[5,5-Дифтор-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-2-(4-метил-пиперазин-1-ил)-ацетамид): из (4-метил-пиперазин-1-ил)-уксусной кислоты и 5,5-дифтор-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламина. 1H ЯМР (400 МГц, DMSO-d6) δ 9,07 (д, J=4,0 Гц, 1H), 8,61 (д, J=8,7 Гц, 1H), 8,13 (д, J=8,2 Гц, 1H), 8,05-7,92 (м, 1H), 7,74 (дд, J=8,3, 3,8 Гц, 1H), 7,37 (д, J=8,0 Гц, 1H), 4,41 (с, 2H), 3,47 (дт, J=33,3, 11,5 Гц, 4H), 3,11 (с, 1H), 2,95 (т, J=3,6 Гц, 2H), 2,43 (с, 4H), 2,29 (с, 4H), 2,12 (д, J=2,8 Гц, 3H). МС: m/z=472 [M+H]+.
Соединение 512 (N-[5,5-Дифтор-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-2-морфолин-4-ил-ацетамид): из морфолин-4-ил-уксусной кислоты и 5,5-дифтор-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламина. 1H ЯМР (400 МГц, DMSO-d6) δ 9,06 (д, J=3,8 Гц, 1H), 8,59 (д, J=8,6 Гц, 1H), 8,12 (д, J=7,8 Гц, 1H), 8,02 (д, J=8,3 Гц, 1H), 7,75 (дд, J=8,5, 3,9 Гц, 1H), 7,37 (д, J=8,1 Гц, 1H), 4,39 (с, 1H), 3,57 (д, J=5,5 Гц, 4H), 3,43 (д, J=13,6 Гц, 3H), 3,08 (д, J=9,7 Гц, 2H), 2,97 (с, 2H), 2,47-2,37 (м, 4H), 2,28 (д, J=15,5 Гц, 1H). МС: m/z=459 [M+H]+.
Соединение 513 (2-Циклопропил-N-[5,5-дифтор-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-2-гидроксиацетамид): из циклопропил-гидроксил-уксусной кислоты и 5,5-дифтор-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламина. 1H ЯМР (400 МГц, DMSO-d6) δ 9,05 (дд, J=4,2, 1,6 Гц, 1H), 8,57 (ддд, J=8,6, 4,7, 1,8 Гц, 1H), 8,12 (дд, J=8,1, 2,0 Гц, 1H), 7,88 (д, J=8,3 Гц, 1H), 7,73 (ддд, J=8,7, 4,2, 3,1 Гц, 1H), 7,35 (дд, J=8,0, 4,6 Гц, 1H), 5,56 (д, J=4,4 Гц, 1H), 4,35 (дд, J=8,8, 4,4 Гц, 1H), 3,65-3,49 (м, 2H), 3,49-3,36 (м, 2H), 3,01 (кв., J=9,8, 8,9 Гц, 1H), 2,48-2,16 (м, 2H), 1,12-1,00 (м, 1H), 1,00-0,85 (м, 1H), 0,54-0,19 (м, 4H). МС: m/z=430 [M+H]+.
Соединение 576 (N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-пиперидин-1-ил-изобутирамид): из 5-((3R,5S)-3-Амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и 2-Метил-2-пиперидин-1-ил-пропионовой кислоты. ВЭЖХ: чистота >99%, RT=2,92 мин. МС: m/z=474,6 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,58 (дд, J=8,6, 1,7 Гц, 1H), 8,26 (д, J=8,0 Гц, 1H), 7,75-7,68 (м, 2H), 7,33 (д, J=8,1 Гц, 1H), 4,23-4,11 (м, 1H), 3,59-3,43 (м, 2H), 3,20 (с, 1H), 2,94 (т, J=11,5 Гц, 1H), 2,75 (т, J=11,1 Гц, 1H), 2,33 (т, J=5,4 Гц, 4H), 2,14-2,06 (м, 1H), 1,76 (кв., J=12,2 Гц, 1H), 1,55 (кв., J=5,0 Гц, 4H), 1,40 (д, J=6,9 Гц, 2H), 1,06 (д, J=13,1 Гц, 6H).
Соединение 577 (N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-(3,3-диметил-пирролидин-1-ил)-ацетамид): из 5-((3R,5S)-3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и (3,3-Диметил-пирролидин-1-ил)-уксусной кислоты. ВЭЖХ: чистота >99%, RT=2,98 мин. МС: m/z=460,5 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,58 (дд, J=8,6, 1,7 Гц, 1H), 8,25 (д, J=8,0 Гц, 1H), 7,77 (д, J=8,0 Гц, 1H), 7,72 (дд, J=8,6, 4,2 Гц, 1H), 7,33 (д, J=8,1 Гц, 1H), 3,62-3,47 (м, 2H), 3,21 (с, 1H), 2,93 (т, J=11,5 Гц, 1H), 2,75 (т, J=11,1 Гц, 1H), 2,66-2,58 (м, 2H), 2,37-2,28 (м, 2H), 2,15 (д, J=12,3 Гц, 1H), 1,71 (кв., J=12,3 Гц, 1H), 1,53 (т, J=7,0 Гц, 2H), 1,05 (д, J=1,0 Гц, 6H).
Соединение 578 ([(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-амид 1-циклопропил-пиперидин-4-карбоновой кислоты): из 5-((3R,5S)-3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и 1-циклопропил-пиперидин-4-карбоновой кислоты. ВЭЖХ: чистота >99%, RT=2,77 мин. МС: m/z=472,30 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,58 (дд, J=8,6, 1,7 Гц, 1H), 8,25 (д, J=8,0 Гц, 1H), 7,91 (д, J=7,3 Гц, 1H), 7,72 (дд, J=8,6, 4,2 Гц, 1H), 7,32 (д, J=8,1 Гц, 1H), 3,62-3,50 (м, 2H), 3,19 (д, J=11,4 Гц, 1H), 2,93 (тд, J=9,6, 7,8, 4,0 Гц, 3H), 2,60 (т, J=11,2 Гц, 1H), 2,23-2,01 (м, 4H), 1,71-1,37 (м, 6H), 0,38 (дт, J=6,5, 3,2 Гц, 2H), 0,30-0,20 (м, 2H).
Соединение 579 (N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-N',N'-диэтил-сукцинамид): из 5-((3R,5S)-3-Амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и N,N-Диэтил-сукцинамовой кислоты. ВЭЖХ: чистота >99%, RT=3,82 мин. МС: m/z=476,5 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,58 (дд, J=8,6, 1,7 Гц, 1H), 8,26 (д, J=8,0 Гц, 1H), 8,02 (д, J=7,4 Гц, 1H), 7,71 (дд, J=8,6, 4,2 Гц, 1H), 7,32 (д, J=8,1 Гц, 1H), 4,13 (с, 1H), 3,61-3,51 (м, 2H), 3,30 (д, J=7,0 Гц, 2H), 3,27-3,16 (м, 3H), 2,95 (т, J=11,6 Гц, 1H), 2,60 (т, J=11,2 Гц, 1H), 2,42-2,27 (м, 3H), 2,18 (д, J=12,2 Гц, 1H), 1,51 (кв., J=12,3 Гц, 1H), 1,11 (т, J=7,1 Гц, 3H), 0,96 (т, J=7,1 Гц, 3H).
Соединение 584 (N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-(4,4-дифтор-циклогексил)-ацетамид): из 5-((3R,5S)-3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и (4,4-дифтор-циклогексил)-уксусной кислоты. ВЭЖХ: чистота >99%, RT=4,39 мин. МС: m/z=481,5 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,07 (дд, J=4,2, 1,6 Гц, 1H), 8,59 (дд, J=8,6, 1,7 Гц, 1H), 8,26 (д, J=8,0 Гц, 1H), 8,04 (д, J=7,2 Гц, 1H), 7,72 (дд, J=8,6, 4,2 Гц, 1H), 7,33 (д, J=8,1 Гц, 1H), 4,15 (с, 1H), 3,62-3,52 (м, 2H), 3,21 (д, J=11,6 Гц, 1H), 2,95 (т, J=11,6 Гц, 1H), 2,61 (т, J=11,2 Гц, 1H), 2,19 (д, J=12,4 Гц, 1H), 2,07-2,02 (м, 2H), 1,96 (с, 2H), 1,82 (с, 2H), 1,71 (т, J=11,1 Гц, 3H), 1,51 (кв., J=12,3 Гц, 1H), 1,19 (дкв., J=11,9, 6,1 Гц, 2H).
Соединение 585 (N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-(1-изопропил-пиперидин-4-ил)-ацетамид): из 5-((3R,5S)-3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрила и (1-изопропил-пиперидин-4-ил)-уксусной кислоты. ВЭЖХ: чистота >99%, RT=2,85 мин. МС: m/z=488,5 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,58 (дд, J=8,6, 1,7 Гц, 1H), 8,25 (д, J=8,0 Гц, 1H), 7,99 (д, J=7,3 Гц, 1H), 7,72 (дд, J=8,6, 4,2 Гц, 1H), 7,32 (д, J=8,1 Гц, 1H), 4,14 (с, 1H), 3,57 (д, J=8,9 Гц, 2H), 3,19 (с, 1H), 2,94 (т, J=11,6 Гц, 1H), 2,69 (с, 2H), 2,66-2,56 (м, 2H), 2,17 (д, J=12,1 Гц, 1H), 2,08-1,97 (м, 4H), 1,65-1,45 (м, 4H), 1,10 (д, J=12,6 Гц, 2H), 0,93 (д, J=6,6 Гц, 6H).
Пример 41: Синтез соединения 87 и соединения 88 ((S)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил)-2-гидрокси-3-метилбутанамид и (S)-N-((3S,5R)-1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил)-2-гидрокси-3-метилбутанамид)
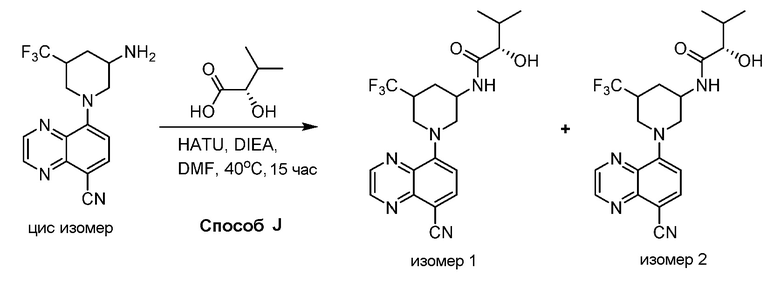
(S)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил)-2-гидрокси-3-метилбутанамид и (S)-N-((3S,5R)-1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил)-2-гидрокси-3-метилбутанамид: (S)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил)-2-гидрокси-3-метилбутанамид и (S)-N-((3S,5R)-1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил)-2-гидрокси-3-метилбутанамид получали из цис-8-(3-амино-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрила и (S)-2-гидрокси-3-метилбутановой кислоты с использованием Способа J. Продукт сначала очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 19 × 250 мм 10 мкм; подвижная фаза: ацетонитрил в воде (0,05% NH3H2O), 30% - 40% градиент за 15 мин; детектор УФ 254 нм. Затем получали два диастереомерных изомера (S)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-(трифторметил)пиперидин-3-ил)-2-гидрокси-3-метилбутанамида путем разделения методом хиральной препаративной ВЭЖХ при следующих условиях: колонка CHIRALPAK AD-3, 0,46 × 5см, 3мкм; подвижная фаза: EtOH (0,1% DEA) в гексане, 40% изократический в течение 20 мин; детектор УФ 254 нм. Два диастереомерных продукта были разделены и получены.
Изомер 1: (54 мг, 18%, желтое твердое вещество) ВЭЖХ: чистота 98,5%, RT=2,58 мин. МС: m/z=294,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,93 (д, J=1,8 Гц, 1H), 8,89 (д, J=1,8 Гц, 1H), 8,11 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,58 (д, J=12,0 Гц, 1H), 4,30-4,09 (м, 2H), 3,83 (д, J=3,7 Гц, 1H), 3,11-2,82 (м, 3H), 2,29-2,25 (м, 1H), 2,09-2,03 (м, 1H), 1,81-1,69 (м, 1H), 0,99 (д, J=6,9 Гц, 3H), 0,85 (д, J=6,8 Гц, 3H).
Изомер 2: (19 мг, 6%, желтое твердое вещество) ВЭЖХ: чистота 95,7%, RT=3,03 мин. МС: m/z=422,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,93 (д, J=1,8 Гц, 1H), 8,89 (д, J=1,8 Гц, 1H), 8,11 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,58 (д, J=12,0 Гц, 1H), 4,30-4,09 (м, 2H), 3,83 (д, J=3,7 Гц, 1H), 3,11-2,82 (м, 3H), 2,29-2,25 (м, 1H), 2,09-2,03 (м, 1H), 1,81-1,69 (м, 1H), 0,99 (д, J=6,9 Гц, 3H), 0,85 (д, J=6,8 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 89 и соединение 90 ((2S)-2-гидрокси-3-метил-N-[(3R,5S)-1-[пиридо[2,3-b]пиразин-8-ил]-5-(трифторметил)пиперидин-3-ил]бутанамид гидрохлорид и ((2S)-2-гидрокси-3-метил-N-[(3S,5R)-1-[пиридо[2,3-b]пиразин-8-ил]-5-(трифторметил)пиперидин-3-ил]бутанамид гидрохлорид): из цис-1-(пиридо[2,3-b]пиразин-8-ил)-5-(трифторметил)пиперидин-3-амина и (S)-2-гидрокси-3-метилбутановой кислоты. Изомер 1: ВЭЖХ: чистота 99,6%, RT=1,42 мин. МС: m/z=398,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 9,10-8,95 (м, 2H), 8,63 (д, J=1,5 Гц, 1H), 7,41-7,32 (д, J=5,6 Гц, 1H), 6,12-5,31 (м, 1H), 5,21-4,82 (с, 1H), 4,29-4,19 (м, 1H), 3,75 (д, J=10,5 Гц, 1H), 3,61-3,52 (м, 1H), 3,41-3,27 (м, 1H), 3,06-2,99 (м, 1H), 2,38-2,20 (м, 1H), 2,15-1,88 (м, 2H), 1,16-1,01 (м, 3H), 0,82-0,93 (м, 3H). Изомер 2: ВЭЖХ: чистота 95,8%, RT=0,89 мин. МС: m/z=398,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 910-8,95 (м, 2H), 8,63 (д, J=1,5 Гц, 1H), 7,41-7,32 (д, J=5,6 Гц, 1H), 6,12-5,31 (м, 1H), 5,21-4,82 (с, 1H), 4,29-4,19 (м, 1H), 3,75 (д, J=10,5 Гц, 1H), 3,61-3,52 (м, 1H), 3,41-3,27 (м, 1H), 3,06-2,99 (м, 1H), 2,38-2,20 (м, 1H), 2,15-1,88 (м, 2H), 1,16-1,01 (м, 3H), 0,82-0,93 (м, 3H).
Соединение 146 и соединение 147 ((R)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-3-гидрокси-4,4-диметилпентанамид и (S)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-3-гидрокси-4,4-диметилпентанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 3-гидрокси-4,4-диметилпентановой кислоты. Изомер 1: ВЭЖХ: чистота 98,0%, RT=1,39 мин. МС: m/z=396,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,82 (м, 2H), 8,09 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,5 Гц, 1H), 4,35 (дд, J=28,2, 11,8 Гц, 2H), 4,22-4,08 (м, 1H), 3,69 (дд, J=10,2, 2,6 Гц, 1H), 2,80-2,60 (м, 2H), 2,40 (дд, J=14,2, 2,6 Гц, 1H), 2,28-2,06 (м, 3H), 1,23 (тд, J=12,0, 12,0 Гц, 1H), 1,00 (д, J=6,5 Гц, 3H), 0,92 (с, 9H). Изомер 2: ВЭЖХ: чистота 99,3%, RT=1,41 мин. МС: m/z=396,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,82 (м, 2H), 8,09 (д, J=8,4 Гц, 1H), 7,31 (д, J=8,4 Гц, 1H), 4,34 (т, J=11,4 Гц, 2H), 4,13 (д, J=12,1 Гц, 1H), 3,68 (дд, J=10,3, 2,6 Гц, 1H), 2,83-2,63 (м, 2H), 2,40 (дд, J=14,1, 2,6 Гц, 1H), 2,29-2,04 (м, 3H), 1,22 (тд, J=12,0, 12,0 Гц, 1H), 1,01 (д, J=6,4 Гц, 3H), 0,92 (с, 9H).
Соединение 148 и соединение 149 ((R)-3-гидрокси-4,4-диметил-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)пентанамид и (S)-3-гидрокси-4,4-диметил-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)пентанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 3-гидрокси-4,4-диметилпентановой кислоты. Изомер 1: ВЭЖХ: чистота 99,0%, RT=1,09 мин. МС: m/z=372,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,8 Гц, 1H), 8,78 (д, J=1,8 Гц, 1H), 8,62 (д, J=5,7 Гц, 1H), 7,13 (д, J=5,7 Гц, 1H), 4,67 (т, J=11,0 Гц, 2H), 4,10-3,98 (м, 1H), 3,66 (дд, J=10,2, 2,6 Гц, 1H), 2,88-2,65 (м, 2H), 2,38 (дд, J=14,2, 2,7 Гц, 1H), 2,26-2,07 (м, 2H), 1,99-1,89 (м, 1H), 1,23 (тд, J=12,1, 12,1 Гц, 1H), 0,98 (д, J=6,6 Гц, 3H), 0,89 (с, 9H). Изомер 2: ВЭЖХ: чистота 99,3%, RT=1,12 мин. МС: m/z=372,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,8 Гц, 1H), 8,78 (д, J=1,8 Гц, 1H), 8,62 (д, J=5,7 Гц, 1H), 7,13 (д, J=5,7 Гц, 1H), 4,67 (т, J=11,0 Гц, 2H), 4,10-3,98 (м, 1H), 3,66 (дд, J=10,2, 2,6 Гц, 1H), 2,88-2,65 (м, 2H), 2,38 (дд, J=14,2, 2,7 Гц, 1H), 2,26-2,07 (м, 2H), 1,99-1,89 (м, 1H), 1,23 (тд, J=12,1, 12,1 Гц, 1H), 0,98 (д, J=6,6 Гц, 3H), 0,89 (с, 9H).
Соединение 150 и соединение 151 ((S)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-3-метилпентанамид и (R)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-3-метилпентанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 3-метилпентановой кислоты. Изомер 1: ВЭЖХ: чистота 92,2%, RT=2,86 мин. МС: m/z=366,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,11 (д, J=8,4 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 4,40 (д, J=11,9 Гц, 1H), 4,32 (д, J=12,5 Гц, 1H), 4,22-4,10 (м, 1H), 2,83-2,63 (м, 2H), 2,23 (дд, J=13,4, 6,1 Гц, 1H), 2,15-1,95 (м, 3H), 1,94-1,84 (м, 1H), 1,47-1,36 (м, 1H), 1,34-1,16 (м, 2H), 1,02 (д, J=6,4 Гц, 3H), 0,95 (д, J=6,9 Гц, 6H). Изомер 2: ВЭЖХ: чистота 90,4%, RT=1,54 мин. МС: m/z=366,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,11 (д, J=8,4 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 4,40 (д, J=11,9 Гц, 1H), 4,32 (д, J=12,5 Гц, 1H), 4,22-4,10 (м, 1H), 2,83-2,63 (м, 2H), 2,23 (дд, J=13,4, 6,1 Гц, 1H), 2,15-1,95 (м, 3H), 1,94-1,84 (м, 1H), 1,47-1,36 (м, 1H), 1,34-1,16 (м, 2H), 1,02 (д, J=6,4 Гц, 3H), 0,95 (д, J=6,9 Гц, 6H).
Соединение 152 и соединение 153 ((S)-3-метил-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)пентанамид и (R)-3-метил-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)пентанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 3-метилпентановой кислоты. Изомер 1: ВЭЖХ: чистота 97,4%, RT=1,23 мин. МС: m/z=342,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95 (д, J=1,8 Гц, 1H), 8,83 (д, J=1,8 Гц, 1H), 8,68 (д, J=5,6 Гц, 1H), 7,17 (дд, J=5,8, 1,6 Гц, 1H), 4,77-4,65 (м, 2H), 4,16-4,02 (м, 1H), 2,91-2,72 (м, 2H), 2,25 (дд, J=13,4, 6,1 Гц, 1H), 2,16-1,94 (м, 3H), 1,98-1,82 (м, 1H), 1,50-1,19 (м, 3H), 1,11-0,91 (м, 9H). Изомер 2: ВЭЖХ: чистота 96,6%, RT=1,23 мин. МС: m/z=342,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95 (д, J=1,8 Гц, 1H), 8,83 (д, J=1,8 Гц, 1H), 8,68 (д, J=5,6 Гц, 1H), 7,17 (дд, J=5,8, 1,6 Гц, 1H), 4,77-4,65 (м, 2H), 4,16-4,02 (м, 1H), 2,91-2,72 (м, 2H), 2,25 (дд, J=13,4, 6,1 Гц, 1H), 2,16-1,94 (м, 3H), 1,98-1,82 (м, 1H), 1,50-1,19 (м, 3H), 1,11-0,91 (м, 9H).
Соединение 154 и соединение 155 ((R)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-метилбутанамид и (S)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-метилбутанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-метилбутановой кислоты. Изомер 1: ВЭЖХ: чистота 92,2%, RT=2,41 мин. МС: m/z=352,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,82 (м, 2H), 8,08 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,40-4,24 (м, 2H), 4,20-4,04 (м, 1H), 2,80-2,60 (м, 2H), 2,29-2,16 (м, 1H), 2,13-1,96 (м, 3H), 1,68-1,32 (м, 2H), 1,35-1,07 (м, 5H), 1,03-0,86 (м, 6H). Изомер 2: ВЭЖХ: чистота 95,1%, RT=1,42 мин. МС: m/z=342,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,90 (дд, J=13,6, 1,8 Гц, 2H), 8,08 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,40-4,24 (м, 2H), 4,20-4,04 (м, 1H), 2,80-2,60 (м, 2H), 2,29-2,16 (м, 1H), 2,13-1,96 (м, 3H), 1,68-1,32 (м, 2H), 1,35-1,07 (м, 5H), 1,03-0,86 (м, 6H).
Соединение 156 и соединение 157 ((R)-2-метил-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)бутанамид и (S)-2-метил-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)бутанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 2-метилбутановой кислоты. Изомер 1: ВЭЖХ: чистота 96,0%, RT=1,11 мин. МС: m/z=328,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,8 Гц, 1H), 8,85 (д, J=1,8 Гц, 1H), 8,62 (д, J=6,0 Гц, 1H), 7,21 (д, J=6,0 Гц, 1H), 4,70-4,50 (м, 2H), 4,13-3,99 (м, 1H), 2,97-2,77 (м, 2H), 2,32-2,15 (м, 1H), 2,14-1,91 (м, 2H), 1,70-1,54 (м, 1H), 1,51-1,36 (м, 1H), 1,37-1,23 (м, 3H), 1,19-1,00 (м, 6H), 0,92 (т, J=7,4 Гц, 3H). Изомер 2: ВЭЖХ: чистота 91,8%, RT=1,11 мин. МС: m/z=328,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,8 Гц, 1H), 8,85 (д, J=1,8 Гц, 1H), 8,62 (д, J=6,0 Гц, 1H), 7,21 (д, J=6,0 Гц, 1H), 4,70-4,50 (м, 2H), 4,13-3,99 (м, 1H), 2,97-2,77 (м, 2H), 2,32-2,15 (м, 1H), 2,14-1,91 (м, 2H), 1,70-1,54 (м, 1H), 1,51-1,36 (м, 1H), 1,37-1,23 (м, 3H), 1,19-1,00 (м, 6H), 0,92 (т, J=7,4 Гц, 3H).
Соединение 158 и соединение 159 ((S)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-метоксипропанамид и (R)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-метоксипропанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-метоксипропановой кислоты. Изомер 1: ВЭЖХ: чистота 99,6%, RT=1,27 мин. МС: m/z=354,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,98-8,84 (м, 2H), 8,09 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,32-4,10 (м, 3H), 3,75 (кв., J=6,7 Гц, 1H), 3,37 (с, 3H), 2,89 (дд, J=12,0, 10,4 Гц, 1H), 2,70 (дд, J=12,6, 10,6 Гц, 1H), 2,15-1,99 (м, 2H), 1,41-1,27 (м, 4H), 1,02 (д, J=6,4 Гц, 3H). Изомер 2: ВЭЖХ: чистота 96,0%, RT=2,60 мин. МС: m/z=354,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,96-8,82 (м, 2H), 8,09 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,32-4,10 (м, 3H), 3,75 (кв., J=6,7 Гц, 1H), 3,37 (с, 3H), 2,89 (дд, J=12,0, 10,4 Гц, 1H), 2,70 (дд, J=12,6, 10,6 Гц, 1H), 2,15-1,99 (м, 2H), 1,41-1,27 (м, 4H), 1,02 (д, J=6,4 Гц, 3H).
Соединение 160 и соединение 161 ((S)-2-метокси-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)пропанамид и (R)-2-метокси-N-((3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-ил)пропанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 2-метоксипропановой кислоты. Изомер 1: ВЭЖХ: чистота 99,6%, RT=1,27 мин. МС: m/z=354,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,8 Гц, 1H), 8,81 (д, J=1,8 Гц, 1H), 8,65 (д, J=5,6 Гц, 1H), 7,14 (д, J=5,6 Гц, 1H), 4,70-4,54 (м, 2H), 4,10 (тт, J=11,1, 4,2 Гц, 1H), 3,75 (кв., J=6,7 Гц, 1H), 3,37 (с, 3H), 2,96 (дд, J=12,4, 10,8 Гц, 1H), 2,77 (дд, J=12,9, 11,1 Гц, 1H), 2,13-1,92 (м, 2H), 1,43-1,26 (м, 4H), 1,02 (д, J=6,5 Гц, 3H). Изомер 2: ВЭЖХ: чистота 96,0%, RT=2,60 мин. МС: m/z=354,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,8 Гц, 1H), 8,81 (д, J=1,8 Гц, 1H), 8,65 (д, J=5,6 Гц, 1H), 7,14 (д, J=5,6 Гц, 1H), 4,70-4,54 (м, 2H), 4,10 (тт, J=11,1, 4,2 Гц, 1H), 3,75 (кв., J=6,7 Гц, 1H), 3,37 (с, 3H), 2,96 (дд, J=12,4, 10,8 Гц, 1H), 2,77 (дд, J=12,9, 11,1 Гц, 1H), 2,13-1,92 (м, 2H), 1,43-1,26 (м, 4H), 1,02 (д, J=6,5 Гц, 3H).
Соединение 173 и соединение 174 ((S)-N-((3R,5R)-1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил)-2-гидрокси-3-метилбутанамид и (S)-N-((3S,5S)-1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил)-2-гидрокси-3-метилбутанамид): из цис-8-(3-амино-5-циклопропилпиперидин-1-ил)хиноксалин-5-карбонитрила и (S)-2-гидрокси-3-метилбутановой кислоты. Изомер 1: ВЭЖХ: чистота 94,0%, RT=2,52 мин. МС: m/z=394,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,8 Гц, 1H), 8,85 (д, J=1,8 Гц, 1H), 8,05 (д, J=8,4 Гц, 1H), 7,22 (д, J=8,4 Гц, 1H), 4,34-4,00 (м, 3H), 3,82 (д, J=3,7 Гц, 1H), 3,03-2,85 (м, 2H), 2,20-1,97 (м, 2H), 1,54 (кв., J=11,6 Гц, 1H), 1,22-1,04 (м, 1H), 0,99 (д, J=6,9 Гц, 3H), 0,85 (д, J=6,8 Гц, 3H), 0,72-0,56 (м, 1H), 0,52-0,38 (м, 2H), 0,18 (дд, J=4,8, 2,9 Гц, 2H). Изомер 2: ВЭЖХ: чистота 93,8%, RT=2,57 мин. МС: m/z=394,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,8 Гц, 1H), 8,85 (д, J=1,8 Гц, 1H), 8,05 (д, J=8,4 Гц, 1H), 7,22 (д, J=8,4 Гц, 1H), 4,34-4,00 (м, 3H), 3,82 (д, J=3,7 Гц, 1H), 3,03-2,85 (м, 2H), 2,20-1,97 (м, 2H), 1,54 (кв., J=11,6 Гц, 1H), 1,22-1,04 (м, 1H), 0,99 (д, J=6,9 Гц, 3H), 0,85 (д, J=6,8 Гц, 3H), 0,72-0,56 (м, 1H), 0,52-0,38 (м, 2H), 0,18 (дд, J=4,8, 2,9 Гц, 2H).
Соединение 429 и соединение 430 ((S)-N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-гидрокси-3-метил-бутирамид и (S)-N-[(3S,5R)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-гидрокси-3-метил-бутирамид): из цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и (2S)-2-гидрокси-3-метилбутановой кислоты. Изомер 1: ВЭЖХ: чистота 98,8%, RT=3,80 мин. МС: m/z=341 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,08 (дд, J=4,2, 1,7 Гц, 1H), 8,48 (дд, J=8,6, 1,7 Гц, 1H), 8,04 (д, J=8,0 Гц, 1H), 7,59 (дд, J=8,6, 4,2 Гц, 1H), 7,12 (д, J=8,0 Гц, 1H), 6,59 (д, J=8,1 Гц, 1H), 4,41 (дтд, J=16,1, 8,2, 4,2 Гц, 1H), 4,02 (д, J=3,1 Гц, 1H), 3,82-3,73 (м, 1H), 3,68-3,59 (м, 1H), 2,94 (т, J=11,3 Гц, 1H), 2,83 (дтд, J=12,0, 8,0, 4,1 Гц, 1H), 2,54 (т, J=11,2 Гц, 1H), 2,44 (д, J=12,6 Гц, 1H), 2,24 (пд, J=6,9, 3,0 Гц, 1H), 1,54 (кв., J=12,3 Гц, 1H), 1,04 (д, J=7,0 Гц, 3H), 0,88 (д, J=6,9 Гц, 3H). Изомер 2: ВЭЖХ: чистота >99%, RT=3,70 мин. МС: m/z=341 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,09 (дд, J=4,2, 1,7 Гц, 1H), 8,48 (дд, J=8,6, 1,7 Гц, 1H), 8,04 (д, J=7,9 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,13 (д, J=8,0 Гц, 1H), 6,55 (д, J=8,0 Гц, 1H), 4,40 (дтт, J=16,3, 8,3, 4,2 Гц, 1H), 4,03 (д, J=3,0 Гц, 1H), 3,81-3,72 (м, 1H), 3,68-3,60 (м, 1H), 2,93 (т, J=11,2 Гц, 1H), 2,82 (ддт, J=15,0, 7,5, 3,9 Гц, 1H), 2,54 (т, J=11,1 Гц, 1H), 2,45 (д, J=12,5 Гц, 1H), 2,19 (пд, J=6,9, 3,0 Гц, 1H), 1,56 (кв., J=12,2 Гц, 1H), 1,02 (д, J=7,0 Гц, 3H), 0,80 (д, J=6,9 Гц, 3H).
Соединение 437 и соединение 438 ((S)-1-этил-пирролидин-2-карбоновой кислоты [(3S,5R)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-амид и (S)-1-этил-пирролидин-2-карбоновой кислоты [(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-амид): из цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и 1-этил-l-пролина. Изомер 1: ВЭЖХ: чистота >99%, RT=2,77 мин. МС: m/z=446 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,09 (дд, J=4,2, 1,7 Гц, 1H), 8,49 (дд, J=8,5, 1,7 Гц, 1H), 8,04 (д, J=7,9 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,54 (д, J=8,2 Гц, 1H), 7,13 (д, J=7,9 Гц, 1H), 4,34 (дддд, J=16,3, 12,6, 8,4, 4,3 Гц, 1H), 3,77-3,69 (м, 1H), 3,67-3,57 (м, 1H), 3,14 (дд, J=8,7, 6,8 Гц, 1H), 3,05 (дд, J=10,5, 4,3 Гц, 1H), 2,93 (т, J=11,2 Гц, 1H), 2,83 (ддп, J=11,6, 7,8, 3,8 Гц, 1H), 2,71-2,46 (м, 3H), 2,41 (д, J=12,4 Гц, 1H), 2,33 (ддд, J=10,6, 9,2, 6,0 Гц, 1H), 2,14 (дтд, J=13,0, 9,8, 7,5 Гц, 1H), 1,84-1,69 (м, 2H), 1,68-1,57 (м, 1H), 1,54-1,46 (м, 1H), 1,10 (т, J=7,2 Гц, 3H). Изомер 2: ВЭЖХ: чистота >99%, RT=2,79 мин. МС: m/z=446 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,09 (дд, J=4,2, 1,7 Гц, 1H), 8,50 (дд, J=8,6, 1,7 Гц, 1H), 8,03 (д, J=7,9 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,55 (д, J=8,4 Гц, 1H), 7,12 (д, J=8,0 Гц, 1H), 4,42-4,29 (м, 1H), 3,82-3,73 (м, 1H), 3,66-3,58 (м, 1H), 3,17 (т, J=7,6 Гц, 1H), 3,03 (дд, J=10,3, 4,4 Гц, 1H), 2,95 (т, J=11,3 Гц, 1H), 2,82 (ддт, J=15,5, 7,9, 3,8 Гц, 1H), 2,60-2,38 (м, 4H), 2,38-2,29 (м, 1H), 2,18 (дтд, J=13,0, 10,3, 7,8 Гц, 1H), 1,88 (ддд, J=12,6, 8,2, 4,0 Гц, 1H), 1,84-1,76 (м, 1H), 1,71 (дд, J=12,7, 5,9 Гц, 1H), 1,54-1,47 (м, 1H), 1,01 (т, J=7,2 Гц, 3H).
Пример 42: Синтез соединения 91 и соединения 92 (цис,цис-8-(3-((4-гидроксициклогексил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил и цис,транс-8-(-3-((4-гидроксициклогексил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил)
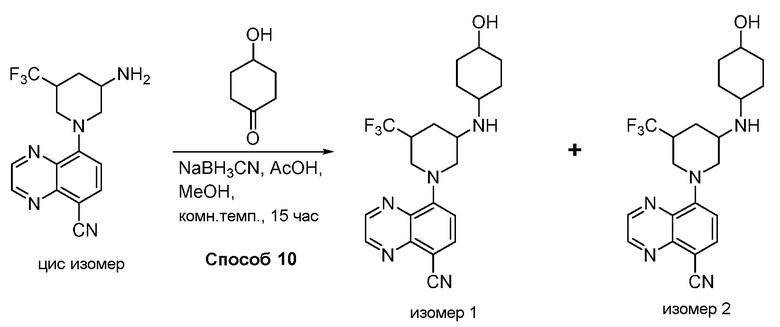
Способ 10
Цис,цис-8-(3-((4-гидроксициклогексил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил и цис,транс-8-(3-((4-гидроксициклогексил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил): К раствору цис-8-[3-амино-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрила (220 мг, 0,68 ммоль) в метаноле (5 мл) добавляли 4-гидроксициклогексан-1-он (118 мг, 1,03 ммоль), NaBH3CN (124 мг, 1,97 ммоль), уксусную кислоту (0,5 мл) при комнатной температуре. Полученный раствор перемешивали в течение 15 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления насыщенного раствора NH4Cl (10 мл). Полученную смесь экстрагировали при помощи EtOAc (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и цис и транс изомеры (каждый в виде рацемической смеси) разделяли препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 30% - 45% градиент за 11 мин; детектор УФ 254 нм.
Изомер 1: (25 мг, 23%, желтое твердое вещество) ВЭЖХ: чистота 99,4%, RT=1,25 мин. МС: m/z=420,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,84 (м, 2H), 8,10 (д, J=8,3 Гц, 1H), 7,24 (д, J=8,3 Гц, 1H), 4,46-4,28 (м, 2H), 3,59-3,44 (м, 1H), 3,24-3,13 (м, 1H), 3,01-2,93 (м, 1H), 3,01-2,80 (м, 2H), 2,70-2,57 (м, 2H), 2,33 (д, J=12,5 Гц, 1H), 2,13 (дд, J=9,3, 6,1 Гц, 1H), 2,04-1,87 (м, 3H), 1,49-1,08 (м, 5H).
Изомер 2: (19 мг, 18%, желтое твердое вещество) ВЭЖХ: чистота 97,6%, RT=1,87 мин. МС: m/z=420,0 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,84 (м, 2H), 8,10 (д, J=8,3 Гц, 1H), 7,24 (д, J=8,4 Гц, 1H), 4,43-4,33 (м, 2H), 3,87 (шир.с, 1H), 3,24-3,16 (м, 1H), 3,08-2,58 (м, 4H), 2,35 (кажущийся д, J=12,4 Гц, 1H), 1,89-1,35 (м, 9H).
Следующие соединения синтезировали аналогичным способом:
Соединение 93 и соединение 94 (цис,цис-4-((1-(пиридо[2,3-b]пиразин-8-ил)-5-(трифторметил)пиперидин-3-ил)амино)циклогексанол и транс,цис-4-((1-(пиридо[2,3-b]пиразин-8-ил)-5-(трифторметил)пиперидин-3-ил)амино)циклогексанол): из цис-1-(пиридо[2,3-b]пиразин-8-ил)-5-(трифторметил)пиперидин-3-амина и 4-гидроксициклогексанона. Изомер 1: ВЭЖХ: чистота 98,3%, RT=0,98 мин. МС: m/z=396,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,7 Гц, 1H), 8,79 (д, J=1,7 Гц, 1H), 8,69 (д, J=5,5 Гц, 1H), 7,09 (д, J=5,6 Гц, 1H), 4,83-4,63 (м, 2H), 3,59-3,44 (м, 1H), 3,23-3,00 (м, 2H), 2,84 (дд, J=8,1, 3,9 Гц, 1H), 2,75-2,65 (м, 2H), 2,40-2,28 (м, 1H), 2,18-2,05 (м, 1H), 2,03-1,88 (м, 3H), 1,50-1,42 (м, 1H), 1,35-1,15 (м, 4H). Изомер 2: ЯМР (300 МГц, CD3OD, м.д.) δ 8,93 (д, J=1,7 Гц, 1H), 8,79 (д, J=1,7 Гц, 1H), 8,69 (д, J=5,5 Гц, 1H), 7,09 (д, J=5,6 Гц, 1H), 4,78-4,69 (м, 2H), 3,88 (д, J=4,6 Гц, 1H), 3,23-2,99 (м, 2H), 2,94-2,67 (м, 3H), 2,36 (дд, J=12,2, 4,2 Гц, 1H), 1,83-1,73 (м, 3H), 1,71-1,53 (м, 5H), 1,53-1,37 (м, 1H).
Соединение 95 (цис-8-[3-(трифторметил)-5-[(3,3,3-трифторпропил)амино]пиперидин-1-ил]хиноксалин-5-карбонитрил): из цис-8-(3-амино-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрила и 3,3,3-трифторпропаналя. ВЭЖХ: чистота 98,5%, RT=2,95 мин. МС: m/z=418,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,10 (д, J=8,3 Гц, 1H), 7,25 (д, J=8,4 Гц, 1H), 4,44-4,34 (м, 2H), 3,12-2,80 (м, 5H), 2,73-2,57 (м, 1H), 2,40-2,20 (м, 3H), 1,45-1,33 (м, 1H).
Соединение 96 (цис-1-[пиридо[2,3-b]пиразин-8-ил]-5-(трифторметил)-N-(3,3,3-трифторпропил)пиперидин-3-амин гидрохлорид): из цис-1-(пиридо[2,3-b]пиразин-8-ил)-5-(трифторметил)пиперидин-3-амина и 3,3,3-трифторпропаналя. ВЭЖХ: чистота 95,0%, RT=1,33 мин. МС: m/z=394,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,8 Гц, 1H), 8,80 (д, J=1,8 Гц, 1H), 8,70 (д, J=5,6 Гц, 1H), 7,11 (д, J=5,6 Гц, 1H), 4,82-4,68 (м, 2H), 3,12-2,69 (м, 6H), 2,49-2,31 (м, 3H), 1,50-1,38 (м, 1H).
Соединение 135 и соединение 136 (цис-8-((3R,5S)-3-((4-гидроксициклогексил)амино)-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрил и транс-8-((3R,5S)-3-((4-гидроксициклогексил)амино)-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрил): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 4-гидроксициклогексанона. Изомер 1: (40 мг, 13%, желтое твердое вещество) ВЭЖХ: чистота 98,9%, RT=1,07 мин. МС: m/z=366,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,8 Гц, 1H), 8,84 (д, J=1,7 Гц, 1H), 8,07 (д, J=8,4 Гц, 1H), 7,19 (д, J=8,4 Гц, 1H), 4,63 (дд, J=13,4, 3,8 Гц, 1H), 4,04-3,95 (м, 1H), 3,54 (тт, J=10,7, 4,0 Гц, 1H), 3,24-3,11 (м, 1H), 2,74-2,49 (м, 3H), 2,22-2,08 (м, 2H), 2,06-1,89 (м, 4H), 1,41-1,11 (м, 4H), 1,09-0,95 (м, 4H). Изомер 2: ВЭЖХ: чистота 93,0%, RT=1,12 мин. МС: m/z=366,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,8 Гц, 1H), 8,84 (д, J=1,8 Гц, 1H), 8,08 (д, J=8,4 Гц, 1H), 7,20 (д, J=8,4 Гц, 1H), 4,69-4,55 (м, 1H), 4,06-3,97 (м, 1H), 3,96-3,86 (м, 1H), 3,30-3,16 (м, 1H), 2,84-2,70 (м, 1H), 2,66-2,52 (м, 2H), 2,19-1,94 (м, 2H), 1,92-1,74 (м, 3H), 1,73-1,51 (м, 5H), 1,12-0,92 (м, 4H).
Соединение 137 (8-[(3S,5R)-3-метил-5-[(оксетан-3-ил)амино]пиперидин-1-ил]хиноксалин-5-карбонитрил): из оксетан-3-она и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 95,1%, RT=1,12 мин. МС: m/z=324,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,05 (д, J=8,3 Гц, 1H), 7,16 (д, J=8,4 Гц, 1H), 4,88-4,76 (м, 2H), 4,59-4,40 (м, 3H), 4,26-4,12 (м, 1H), 4,07-3,98 (м, 1H), 3,04-2,90 (м, 1H), 2,68-2,48 (м, 2H), 2,16-1,91 (м, 2H), 1,14-0,96 (м, 4H).
Соединение 138 (8-[(3S,5R)-3-метил-5-[(оксолан-3-ил)амино]пиперидин-1-ил]хиноксалин-5-карбонитрил): из дигидрофуран-3(2H)-она и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,6%, RT=1,20 мин. МС: m/z=338,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,83 (м, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,18 (д, J=8,4 Гц, 1H), 4,68-4,54 (м, 1H), 4,09-3,72 (м, 4H), 3,68-3,48 (м, 2H), 3,14-2,98 (м, 1H), 2,65-2,52 (м, 2H), 2,31-2,11 (м, 2H), 2,08-1,93 (м, 1H), 1,89-1,69 (м, 1H), 1,11-0,95 (м, 4H).
Соединение 139 ((3R,5S)-5-метил-N-(оксолан-3-ил)-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-амин): из дигидрофуран-3(2H)-она и (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина. ВЭЖХ: чистота 97,1%, RT=0,89 мин. МС: m/z=314,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=1,7 Гц, 1H), 8,80 (т, J=1,8 Гц, 1H), 8,63 (д, J=5,6 Гц, 1H), 7,05 (д, J=5,7 Гц, 1H), 5,09-4,99 (м, 1H), 4,43-4,28 (м, 1H), 4,00-3,84 (м, 2H), 3,87-3,49 (м, 3H), 3,06-2,94 (м, 1H), 2,76-2,61 (м, 2H), 2,31-2,13 (м, 2H), 2,03-1,88 (м, 1H), 1,88-1,70 (м, 1H), 1,16-1,00 (м, 4H).
Пример 43: Синтез соединения 98 ((2R)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-[этил(метил)амино]пропанамид)
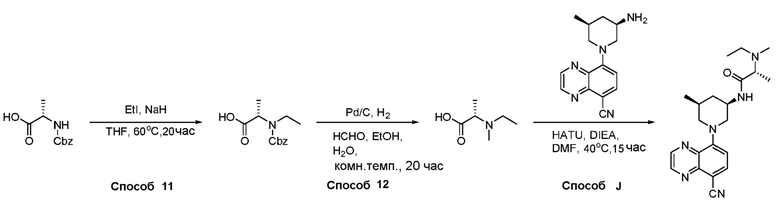
Способ 11
(S)-2-((бензилоксикарбонил)(этил)амино)пропановая кислота: при 0°C гидрид натрия (324 мг, 13,50 ммоль) добавляли к раствору (2R)-2-[[(бензилокси)карбонил]амино]пропановой кислоты (950 мг, 4,26 ммоль) в тетрагидрофуране (50 мл). Смесь перемешивали в течение 10 минут при 0°C и затем добавляли иодэтан (5,32 г, 34,11 ммоль). Реакционную смесь нагревали до 60°C и перемешивали в течение 20 часов. Когда реакция была завершена, ее гасили путем добавления воды (50 мл). Полученную смесь экстрагировали этилацетатом (60 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением (2R)-2-[[(бензилокси)карбонил](этил)амино]пропановой кислоты в виде светло-желтого масла (900 мг, 32%). МС: m/z=252,2 [M+H]+.
Способ 12
(S)-2-(этил(метил)амино)пропановая кислота: В атмосфере азота Pd/C (0,1 г, 10%) добавляли к раствору (2R)-2-[[(бензилокси)карбонил](этил)амино]пропановой кислоты (900 мг, 3,58 ммоль, 1,00 экв.) и формалина (0,8 мл, 8,74 ммоль, 40%) в этаноле (20 мл) и воде (20 мл) при комнатной температуре. Реакционную колбу вакуумировали и продували водородом. Реакционную смесь перемешивали и гидрировали в течение 20 часов при комнатной температуре под водородным баллоном. Когда реакция была завершена, реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении с получением (2R)-2-[этил(метил)амино]пропановой кислоты в виде белого твердого вещества (387 мг, 82%). МС: m/z=132,2 [M+H]+.
(R)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-(этил(метил)амино)пропанамид: (R)-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-(этил(метил)амино)пропанамид получали из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и (S)-2-(этил(метил)амино)пропановой кислоты с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 0,05% NH3.H2O), 15% - 45% градиент за 10 мин; детектор УФ 254 нм. (2R)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-[этил(метил)амино]пропанамид получали в виде желтого твердого вещества (36 мг, 32%).
Соединение 98: ВЭЖХ: чистота 90,0%, RT=1,95 мин. МС: m/z=381,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,7 Гц, 1H), 8,85 (д, J=1,8 Гц, 1H), 8,05 (д, J=8,4 Гц, 1H), 7,24 (д, J=8,4 Гц, 1H), 4,33-4,22 (м, 2H), 4,16-4,05 (м, 1H), 3,20-3,13 (м, 1H), 2,82-2,75 (м, 1H), 2,70-2,62 (м, 1H), 2,55-2,42 (м, 2H), 2,2 5 (с, 3H), 2,08-1,95 (м, 2H), 1,25-1,16 (м, 4H), 1,08 (т, J=7,0 Гц, 3H), 0,98 (д, J=6,4 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 99 ((2S)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-[этил(метил)амино]пропанамид): из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и (R)-2-(этил(метил)амино)пропановой кислоты. ВЭЖХ: чистота 97,5%, RT=2,81 мин. МС: m/z=381,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,8 Гц, 1H), 8,85 (д, J=1,8 Гц, 1H), 8,06 (д, J=8,4 Гц, 1H), 7,25 (д, J=8,4 Гц, 1H), 4,34-4,23 (м, 2H), 4,13-4,05 (м, 1H), 3,18-3,11 (м, 1H), 2,83-2,75 (м, 1H), 2,71-2,61 (м, 1H), 2,54-2,45 (м, 2H), 2,25 (с, 3H), 2,10-1,96 (м, 2H), 1,29-1,15 (м, 4H), 1,06 (т, J=7,2 Гц, 3H), 0,98 (д, J=6,4 Гц, 3H).
Соединение 100 ((2R)-2-[этил(метил)амино]-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]пропанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (S)-2-(этил(метил)амино)пропановой кислоты. ВЭЖХ: чистота 95,7%, RT=1,11 мин. МС: m/z=357,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,7 Гц, 1H), 8,77 (д, J=1,8 Гц, 1H), 8,63 (д, J=5,6 Гц, 1H), 7,12 (д, J=5,7 Гц, 1H), 4,63 (д, J=13,3 Гц, 2H), 4,12-3,95 (м, 1H), 3,18-3,12 (м, 1H), 2,92-2,84 (м, 1H), 2,79-2,71 (м, 1H), 2,55-2,46 (м, 2H), 2,26 (с, 3H), 2,10-1,92 (м, 2H), 1,34-1,24 (м, 1H), 1,20 (д, J=6,9 Гц, 3H), 1,09-1,04 (м, 3H), 0,99 (д, J=6,5 Гц, 3H).
Соединение 101 ((2S)-2-[этил(метил)амино]-N-[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]пропанамид): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и (R)-2-(этил(метил)амино)пропановой кислоты. ВЭЖХ: чистота 95,7%, RT=1,11 мин. МС: m/z=357,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (д, J=1,7 Гц, 1H), 8,77 (д, J=1,8 Гц, 1H), 8,63 (д, J=5,6 Гц, 1H), 7,12 (д, J=5,7 Гц, 1H), 4,63 (д, J=13,3 Гц, 2H), 4,12-3,95 (м, 1H), 3,18-3,12 (м, 1H), 2,92-2,84 (м, 1H), 2,79-2,71 (м, 1H), 2,55-2,46 (м, 2H), 2,26 (с, 3H), 2,10-1,92 (м, 2H), 1,34-1,24 (м, 1H), 1,20 (д, J=6,9 Гц, 3H), 1,09-1,04 (м, 3H), 0,99 (д, J=6,5 Гц, 3H).
Пример 44: Синтез соединения 112 и соединения 113 ((S)-2-амино-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-3,3,3-трифторпропанамид гидрохлорид и (R)-2-амино-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-3,3,3-трифторпропанамид гидрохлорид)
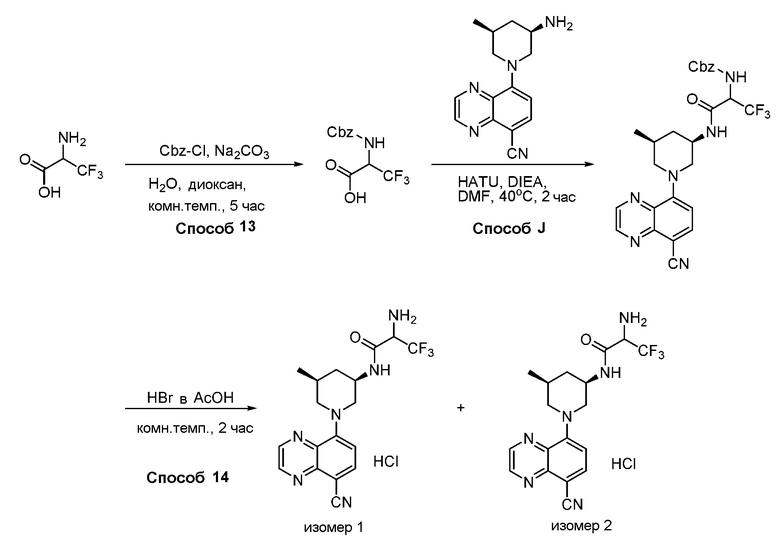
Способ 13
2-(бензилоксикарбониламино)-3,3,3-трифторпропановая кислота: при 0°C к раствору 2-амино-3,3,3-трифторпропановой кислоты (475 мг, 3,32 ммоль) в диоксане (15 мл) и воде (15 мл) добавляли карбонат натрия (1,90 г, 17,93 ммоль) и Cbz-Cl (624 мг, 3,65 ммоль). Полученную смесь перемешивали в течение 5 часов при комнатной температуре. Когда реакция была завершена, значение pH реакционной смеси доводили до 2-3 раствором хлористого водорода (4 M). Полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали обращенно-фазовой флэш-хроматографией, элюируя ацетонитрилом в воде (15% - 35% градиент за 30 мин), с получением 2-[[(бензилокси)карбонил]амино]-3,3,3-трифторпропановой кислоты в виде белого твердого вещества (500 мг, 54%). МС: m/z=276 [M-H]+.
бензил 3-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-иламино)-1,1,1-трифтор-3-оксопропан-2-илкарбамат: 3-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-иламино)-1,1,1-трифтор-3-оксопропан-2-илкарбамат получали из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-(бензилоксикарбониламино)-3,3,3-трифторпропановой кислоты с использованием Способа J. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 50% градиент), с получением бензил N-(1-[[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамоил]-2,2,2-трифторэтил)карбамата в виде желтого твердого вещества (220 мг, 50%). МС: m/z=527 [M-H]+.
Способ 14
(S)-2-амино-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-3,3,3-трифторпропанамид гидрохлорид и (R)-2-амино-N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-3,3,3-трифторпропанамид гидрохлорид: К раствору бензил N-(1-[[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамоил]-2,2,2-трифторэтил)карбамата (110 мг, 0,21 ммоль) в уксусной кислоте (5 мл) добавляли раствор HBr (40% в диоксане, 2 мл). Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: MeOH в воде (с 0,02% HCl), 10% - 27% градиент за 10 мин; детектор УФ 254 нм. Два диастереомерных продукта были разделены и получены.
Изомер 1: (30 мг, 20%, коричневое твердое вещество) ВЭЖХ: чистота 99,1%, RT=1,01 мин. МС: m/z=393,0 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,90-8,82 (м, 2H), 8,07 (д, J=8,3 Гц, 1H), 7,25 (д, J=8,4 Гц, 1H), 4,78-4,71 (м, 1H), 4,39-4,15 (м, 3H), 2,85-2,60 (м, 2H), 2,21-2,02 (м, 2H), 1,33-1,21 (м, 1H), 1,00 (д, J=6,5 Гц, 3H).
Изомер 2: (60 мг, 40%, коричневое твердое вещество) ВЭЖХ: чистота 99,1%, RT=1,05 мин. МС: m/z=393,0 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 9,00-8,80 (м, 2H), 8,08 (д, J=8,4 Гц, 1H), 7,26 (д, J=8,4 Гц, 1H), 4,76-4,69 (кв., J=7,4 Гц, 1H), 4,49-4,03 (м, 3H), 2,86-2,60 (м, 2H), 2,20-1,96 (м, 2H), 1,33-1,15 (м, 1H), 1,03-0,95 (м, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 114 и соединение 115 ((S)-2-амино-3,3,3-трифтор-N-((3R,5S)-5-метил-1-(хиноксалин-5-ил)пиперидин-3-ил)пропанамид гидрохлорид и (R)-2-амино-3,3,3-трифтор-N-((3R,5S)-5-метил-1-(хиноксалин-5-ил)пиперидин-3-ил)пропанамид гидрохлорид): из (3R,5S)-5-метил-1-(хиноксалин-5-ил)пиперидин-3-амина и 2-(бензилоксикарбониламино)-3,3,3-трифторпропановой кислоты. Изомер 1: ВЭЖХ: чистота 93,9%, RT=0,97 мин. МС: m/z=369,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 9,12 (д, J=1,8 Гц, 1H), 8,97 (д, J=1,9 Гц, 1H), 8,61 (д, J=7,3 Гц, 1H), 7,35 (д, J=7,5 Гц, 1H), 5,10-4,90 (м, 3H), 4,11-3,91 (м, 1H), 3,37 (т, J=11,8 Гц, 1H), 3,16 (т, J=12,3 Гц, 1H), 2,12-1,92 (м, 2H), 1,49-1,45 (м, 1H), 1,03 (д, J=6,4 Гц, 3H). Изомер 2: ВЭЖХ: чистота 95,8%, RT=1,04 мин. МС: m/z=369,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 9,02 (д, J=2,2 Гц, 1H), 8,68-8,58 (м, 1H), 7,33 (д, J=7,4 Гц, 1H), 5,00-4,84 (м, 3H), 4,10-3,90 (м, 1H), 3,33 (т, J=11,9 Гц, 1H), 3,17 (т, J=12,4 Гц, 1H), 2,10-1,89 (м, 2H), 1,45-1,40 (м, 1H), 1,02 (д, J=6,3 Гц, 3H).
Пример 45: Синтез соединения 123 (8-[(3S,5R)-3-метил-5-[(2-оксопирролидин-3-ил)амино]пиперидин-1-ил]хиноксалин-5-карбонитрил)
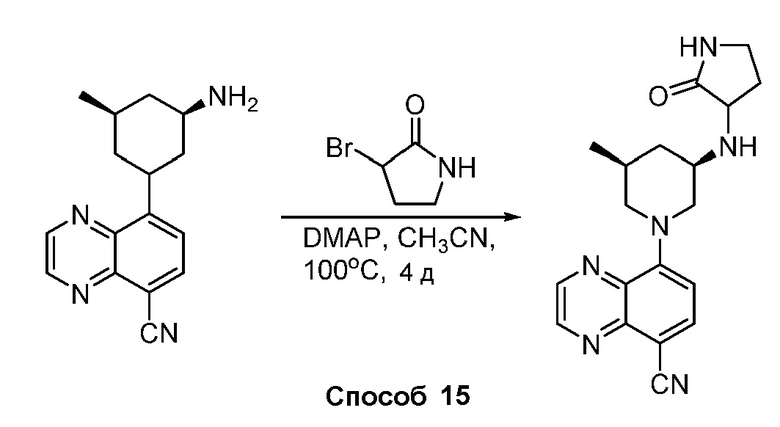
Способ 15
8-[(3S,5R)-3-метил-5-[(2-оксопирролидин-3-ил)амино]пиперидин-1-ил]хиноксалин-5-карбонитрил: К раствору 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрила (50 мг, 0,19 ммоль) в ацетонеитриле (3 мл) добавляли 3-бромпирролидин-2-он (36 мг, 0,22 ммоль), 4-диметиламинопиридин (4 мг, 0,03 ммоль) и триэтиламин (48 мг, 0,47 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 4 дней при 100°C. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 10% - 40% градиент за 10 мин; детектор УФ 254 нм. 8-[(3S,5R)-3-метил-5-[(2-оксопирролидин-3-ил)амино]пиперидин-1-ил]хиноксалин-5-карбонитрил получали в виде желтого твердого вещества (15 мг, 23%).
Соединение 123: ВЭЖХ: чистота 97,9%, RT=1,90 мин. МС: m/z=351,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,96-8,87 (м, 2H), 8,08 (дд, J=9,5, 3,7 Гц, 1H), 7,23 (дт, J=8,2, 4,0 Гц, 1H), 4,71- 4,52 (м, 1H), 4,12 (дт, J=10,7, 5,1 Гц, 1H), 3,67 (дд, J=10,1, 8,0 Гц, 1H), 3,47-3,12 (м, 3H), 2,73-2,45 (м, 3H), 2,30-2,15 (м, 1H), 2,11-1,86 (м, 2H), 1,16- 0,99 (м, 4H).
Следующие соединения синтезировали аналогичным способом:
Соединение 127 (3-[[(3R,5S)-5-метил-1-[пиридо[2,3-b]пиразин-8-ил]пиперидин-3-ил]амино]пирролидин-2-он): из (3R,5S)-5-метил-1-(пиридо[2,3-b]пиразин-8-ил)пиперидин-3-амина и 3-бромпирролидин-2-она. ВЭЖХ: чистота 90,8%, RT=1,70 мин. МС: m/z=327,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,96 (д, J=1,7 Гц, 1H), 8,83-8,70 (м, 2H), 6,90 (дд, J=5,5, 4,0 Гц, 1H), 4,84-4,65 (м, 1H), 4,30-4,19 (м, 1H), 3,62-3,51 (м, 1H), 3,46-3,28 (м, 2H), 3,12-2,98 (м, 1H), 2,74-2,44 (м, 3H), 2,20 (дд, J=28,8, 12,5 Гц, 1H), 2,07-1,91 (м, 2H), 1,14-0,98 (м, 4H).
Пример 46: Синтез соединения 124 и соединения 125 (8-[(3S,5R)-3-метил-5-{[(3R)-1-метил-2-оксопирролидин-3-ил]амино}пиперидин-1-ил]хиноксалин-5-карбонитрил и 8-[(3S,5R)-3-метил-5-{[(3S)-1-метил-2-оксопирролидин-3-ил]амино}пиперидин-1-ил]хиноксалин-5-карбонитрил)
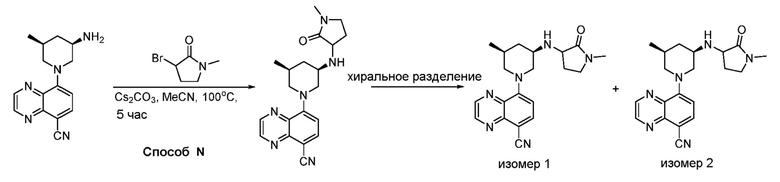
8-[(3S,5R)-3-метил-5-[(2-оксопирролидин-3-ил)амино]пиперидин-1-ил]хиноксалин-5-карбонитрил): 8-[(3S,5R)-3-метил-5-[(2-оксопирролидин-3-ил)амино]пиперидин-1-ил]хиноксалин-5-карбонитрил получали из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила и 3-бром-1-метилпирролидин-2-она с использованием Способа N. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 10% - 40% градиент за 10 мин; детектор УФ 254 нм. (19 мг, 28%, желтое твердое вещество). ВЭЖХ: чистота 94,2%, RT=0,63 мин. МС: m/z=365,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,88 (м, 2H), 8,13 (дд, J=8,4, 3,1 Гц, 1H), 7,27 (дд, J=8,4, 5,0 Гц, 1H), 4,75-4,55 (м, 1H), 4,17-4,04 (м, 1H), 3,93-3,84 (м, 1H), 3,52-3,38 (м, 3H), 2,91 (с, 3H), 2,83-2,57 (м, 3H), 2,36-2,20 (м, 1H), 2,13-1,86 (м, 2H), 1,27-1,04 (м, 4H). Затем 2 изомера 8-[(3S,5R)-3-метил-5-[(2-оксопирролидин-3-ил)амино]пиперидин-1-ил]хиноксалин-5-карбонитрила получали путем разделения методом хиральной препаративной ВЭЖХ при следующих условиях: колонка EnantioPak A1-5, 2,12 × 25см, 5 мкм; подвижная фаза: EtOH в гексане, 55% изократический в течение 32 мин; детектор УФ 254/220 нм.
Изомер 1: ВЭЖХ: чистота 98,8%, RT=1,15 мин. МС: m/z=365,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,88 (м, 2H), 8,13 (дд, J=8,4, 3,1 Гц, 1H), 7,27 (дд, J=8,4, 5,0 Гц, 1H), 4,75-4,55 (м, 1H), 4,17-4,04 (м, 1H), 3,93-3,84 (м, 1H), 3,52-3,38 (м, 3H), 2,91 (с, 3H), 2,83-2,57 (м, 3H), 2,36-2,20 (м, 1H), 2,13-1,86 (м, 2H), 1,27-1,04 (м, 4H).
Изомер 2: ВЭЖХ: чистота 99,3%, RT=1,15 мин. МС: m/z=365,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,88 (м, 2H), 8,13 (дд, J=8,4, 3,1 Гц, 1H), 7,27 (дд, J=8,4, 5,0 Гц, 1H), 4,75-4,55 (м, 1H), 4,17-4,04 (м, 1H), 3,93-3,84 (м, 1H), 3,52-3,38 (м, 3H), 2,91 (с, 3H), 2,83-2,57 (м, 3H), 2,36-2,20 (м, 1H), 2,13-1,86 (м, 2H), 1,27-1,04 (м, 4H).
Пример 47: Синтез соединения 162 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-1-(гидроксиметил)циклопропан-1-карбоксамид)
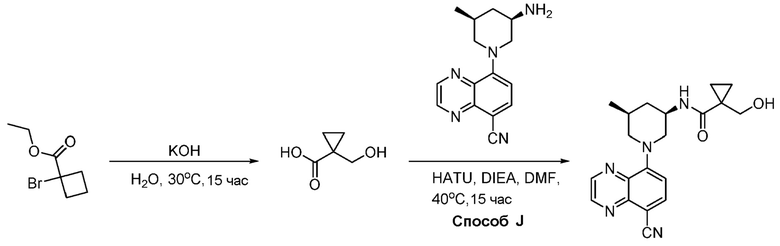
1-(гидроксиметил)циклопропанкарбоновая кислота: К раствору этил 1-бромциклобутан-1-карбоксилата (475 мг, 2,29 ммоль) в воде (10 мл) добавляли KOH (255 мг, 4,55 ммоль) при комнатной температуре. Полученную смесь перемешивали при 30°C в течение 15 часов. Когда реакция была завершена, значение pH реакционной смеси доводили до 1 раствором хлористого водорода (2 M). Полученную смесь концентрировали при пониженном давлении и разбавляли метанолом (15 мл). Нерастворимые твердые вещества отфильтровывали и фильтрат концентрировали при пониженном давлении с получением 1-(гидроксиметил)циклопропан-1-карбоновой кислоты в виде светло-желтого твердого вещества (189 мг, 71%). МС: m/z=117,2 [M+H]+.
N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-1-(гидроксиметил)циклопропан-1-карбоксамид: N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-1-(гидроксиметил)циклопропан-1-карбоксамид получали из 1-(гидроксиметил)циклопропанкарбоновой кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 25% - 45% градиент за 10 мин; детектор УФ 254 нм. N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-1-(гидроксиметил)циклопропан-1-карбоксамид получали в виде желтого твердого вещества (28 мг, 27%).
Соединение 162: ВЭЖХ: чистота 94,2%, RT=1,17 мин. МС: m/z=366,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92-8,82 (м, 2H), 8,05 (д, J=8,4 Гц, 1H), 7,25 (д, J=8,4 Гц, 1H), 4,30 (т, J=13,8 Гц, 2H), 4,11 (д, J=11,5 Гц, 1H), 3,69-3,52 (м, 2H), 2,84-2,64 (м, 2H), 2,12-1,96 (м, 2H), 1,24 (кв., J=11,7 Гц, 1H), 1,25-1,11 (м, 2H), 0,98 (д, J=6,5 Гц, 3H), 0,78-0,62 (м, 2H).
Пример 48: Синтез соединения 177 и соединения 178 ((R)-2-амино-N-((3R,5R)-1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил)-3,3,3-трифторпропанамид и (R)-2-амино-N-((3S,5S)-1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил)-3,3,3-трифторпропанамид)
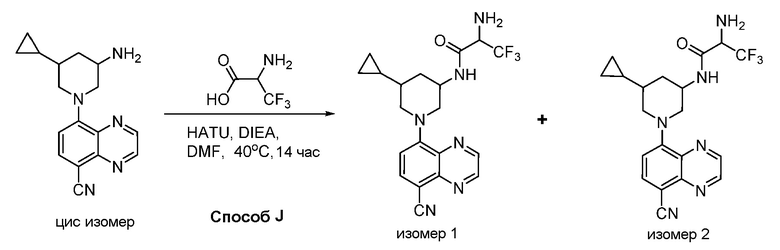
(R)-2-амино-N-((3R,5R)-1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил)-3,3,3-трифторпропанамид и (R)-2-амино-N-((3S,5S)-1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил)-3,3,3-трифторпропанамид: цис-(2R)-2-амино-N-[1-(8-цианохиноксалин-5-ил)-5-циклопропилпиперидин-3-ил]-3,3,3-трифторпропанамид получали из цис-8-(3-амино-5-циклопропилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-амино-3,3,3-трифторпропановой кислоты с использованием Способа J. Два цис диастереоизомера разделяли препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 35% - 65% градиент за 10 мин; детектор УФ 254 нм.
Изомер 1: (14 мг, 12%, желтое твердое вещество) ВЭЖХ: чистота 95,0%, RT=2,76 мин. МС: m/z=419,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,90 (д, J=1,8 Гц, 1H), 8,86 (д, J=1,8 Гц, 1H), 8,07 (д, J=8,4 Гц, 1H), 7,23 (д, J=8,4 Гц, 1H), 4,41-4,24 (м, 2H), 4,20-4,00 (м, 1H), 3,99-3,85 (м, 1H), 2,95-2,75 (м, 2H), 2,29-2,13 (м, 1H), 1,52-1,05 (м, 2H), 0,70-0,37 (м, 3H), 0,22-0,12 (м, 2H).
Изомер 2: (14 мг, 12%, желтое твердое вещество) ВЭЖХ: чистота 94,4%, RT=3,14 мин. МС: m/z=419,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,90 (д, J=1,8 Гц, 1H), 8,86 (д, J=1,8 Гц, 1H), 8,07 (д, J=8,4 Гц, 1H), 7,23 (д, J=8,4 Гц, 1H), 4,41-4,24 (м, 2H), 4,20-4,00 (м, 1H), 3,99-3,85 (м, 1H), 2,95-2,75 (м, 2H), 2,29-2,13 (м, 1H), 1,52-1,05 (м, 2H), 0,70-0,37 (м, 3H), 0,22-0,12 (м, 2H).
Пример 49: Синтез соединения 180 (5-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хинолин-8-карбоксамид)
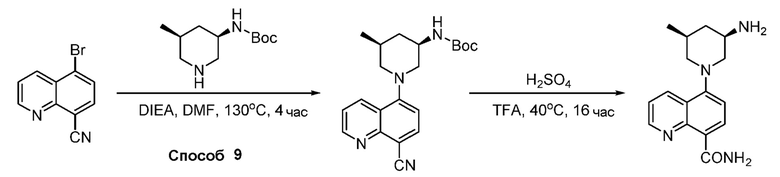
трет-бутил N-[(3R,5S)-1-(8-цианохинолин-5-ил)-5-метилпиперидин-3-ил]карбамат: трет-бутил N-[(3R,5S)-1-(8-цианохинолин-5-ил)-5-метилпиперидин-3-ил]карбамат получали из 5-бромхинолин-8-карбонитрила и трет-бутил (3R,5S)-5-метилпиперидин-3-илкарбамата с использованием Способа 9. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи DCM в петролейном эфире (0% - 100% градиент), с получением трет-бутил N-[(3R,5S)-1-(8-цианохинолин-5-ил)-5-метилпиперидин-3-ил]карбамата в виде желтого твердого вещества (128 мг, 29%). МС: m/z=367,0 [M+H]+.
5-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хинолин-8-карбоксамид: К раствору трет-бутил N-[(3R,5S)-1-(8-цианохинолин-5-ил)-5-метилпиперидин-3-ил]карбамата (128 мг, 0,35 ммоль) в трифторуксусной кислоте (4 мл) добавляли серную кислоту (1 мл) при комнатной температуре. Полученный раствор перемешивали в течение 16 часов при 40°C. Когда реакция была завершена, ее гасили путем добавления ледяной воды (30 мл) и значение pH раствора доводили до 10-12 раствором аммиака. Полученный раствор экстрагировали при помощи DCM (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 20% - 50% градиент за 10 мин; детектор УФ 254 нм. 5-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хинолин-8-карбоксамид получали в виде светло-желтого твердого вещества (79 мг, 80%).
Соединение 180: ВЭЖХ: чистота 99,0%, RT=0,96 мин. МС: m/z=285,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (дд, J=4,3, 1,8 Гц, 1H), 8,65-8,57 (м, 2H), 7,56 (дд, J=8,6, 4,2 Гц, 1H), 7,25 (д, J=8,2 Гц, 1H), 3,60-3,44 (м, 1H), 3,39-3,31 (м, 1H), 3,24-3,12 (м, 1H), 2,55-2,35 (м, 2H), 2,19-2,01 (м, 2H), 1,03-0,89 (м, 4H).
Пример 50: Синтез соединения 181 (5-[(3R,5S)-3-[(2S)-2-гидрокси-3-метилбутанамидо]-5-метилпиперидин-1-ил]хинолин-8-карбоксамид)
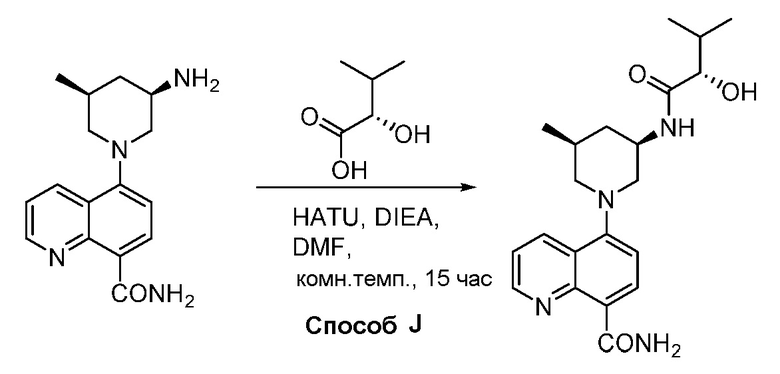
5-[(3R,5S)-3-[(2S)-2-гидрокси-3-метилбутанамидо]-5-метилпиперидин-1-ил]хинолин-8-карбоксамид: 5-[(3R,5S)-3-[(2S)-2-гидрокси-3-метилбутанамидо]-5-метилпиперидин-1-ил]хинолин-8-карбоксамид получали из (S)-2-гидрокси-3-метилбутановой кислоты и 5-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хинолин-8-карбоксамида с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 30% - 60% градиент за 10 мин; детектор УФ 254 нм. 5-[(3R,5S)-3-[(2S)-2-гидрокси-3-метилбутанамидо]-5-метилпиперидин-1-ил]хинолин-8-карбоксамид получали в виде желтого твердого вещества (35 мг, 52%).
Соединение 181: ВЭЖХ: чистота 97,4%, RT=1,21 мин. МС: m/z=385,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,98-8,92 (м, 1H), 8,73-8,65 (м, 1H), 8,61 (д, J=8,1 Гц, 1H), 7,59 (дд, J=8,6, 4,3 Гц, 1H), 7,30-7,23 (м, 1H), 4,35-4,21 (м, 1H), 3,83 (д, J=3,8 Гц, 1H), 3,61-3,52 (м, 1H), 3,38 (д, J=11,8 Гц, 1H), 2,64-2,44 (м, 2H), 2,23-1,98 (м, 3H), 1,34-1,19 (м, 1H), 1,08-0,92 (м, 6H), 0,81 (д, J=6,8 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 182 (5-[(3R,5S)-3-(3,3-диметилбутанамидо)-5-метилпиперидин-1-ил]хинолин-8-карбоксамид): из 3,3-диметилбутановой кислоты и 5-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хинолин-8-карбоксамида. ВЭЖХ: чистота 99,6%, RT=1,45 мин. МС: m/z=383,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95 (дд, J=4,2, 1,8 Гц, 1H), 8,69 (дд, J=8,6, 1,8 Гц, 1H), 8,61 (д, J=8,2 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,26 (д, J=8,2 Гц, 1H), 4,29-4,17 (м, 1H), 3,67-3,55 (м, 1H), 3,42-3,32 (м, 1H), 2,55-2,41 (м, 2H), 2,20-2,04 (м, 4H), 1,15 (тд, J=12,0, 12,0 Гц, 1H), 1,06-0,93 (м, 12Н).
Соединение 186 (5-[(3R,5S)-3-[2-(диметиламино)ацетамидо]-5-метилпиперидин-1-ил]хинолин-8-карбоксамид): из 2-(диметиламино)уксусной кислоты и 5-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хинолин-8-карбоксамида. ВЭЖХ: чистота 97,3%, RT=1,18 мин. МС: m/z=370,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95 (дд, J=4,3, 1,8 Гц, 1H), 8,69 (дд, J=8,6, 1,8 Гц, 1H), 8,61 (д, J=8,1 Гц, 1H), 7,59 (дд, J=8,6, 4,2 Гц, 1H), 7,27 (д, J=8,2 Гц, 1H), 4,33-4,20 (м, 1H), 3,61-3,57 (м, 1H), 3,39-3,36 (м, 1H), 2,99 (с, 2H), 2,62-2,42 (м, 2H), 2,29 (с, 6H), 2,16-2,09 (м, 2H), 1,20 (тд, J=12,0, 12,0 Гц, 1H), 1,03 (д, J=6,4 Гц, 3H).
Пример 51: Синтез соединения 183 (5-[(3R,5S)-3-[(2-метоксиэтил)амино]-5-метилпиперидин-1-ил]хинолин-8-карбоксамид)
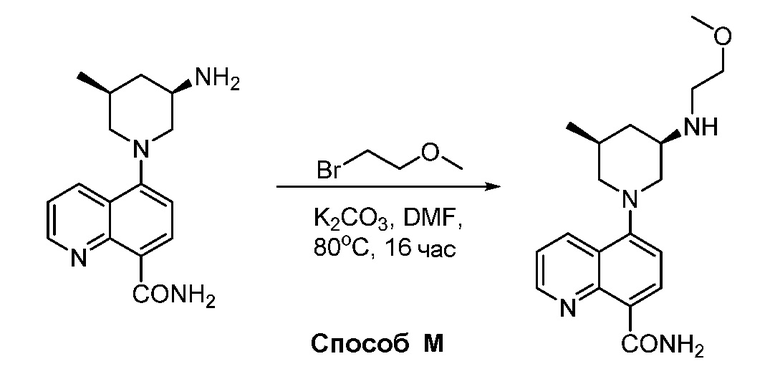
5-[(3R,5S)-3-[(2-метоксиэтил)амино]-5-метилпиперидин-1-ил]хинолин-8-карбоксамид: 5-[(3R,5S)-3-[(2-метоксиэтил)амино]-5-метилпиперидин-1-ил]хинолин-8-карбоксамид получали из 1-бром-2-метоксиэтана и 5-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хинолин-8-карбоксамида с использованием Способа M. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 35% - 65% градиент за 10 мин; детектор УФ 254 нм. 5-[(3R,5S)-3-[(2-метоксиэтил)амино]-5-метилпиперидин-1-ил]хинолин-8-карбоксамид получали в виде желтого твердого вещества (18 мг, 23%).
Соединение 183: ВЭЖХ: чистота 98,9%, RT=1,18 мин. МС: m/z=343,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95 (дд, J=4,2, 1,8 Гц, 1H), 8,69 (дд, J=8,6, 1,8 Гц, 1H), 8,61 (д, J=8,2 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,26 (д, J=8,2 Гц, 1H), 3,69-3,60 (м, 1H), 3,56-3,44 (м, 2H), 3,42-3,30 (м, 4H), 3,18-3,06 (м, 1H), 2,97-2,80 (м, 2H), 2,58-2,38 (м, 2H), 2,28-2,05 (м, 2H), 1,06-0,92 (м, 4H).
Пример 52: Синтез соединения 184 и соединения 185 ( 5-((3R,5S)-3-((R)-2-амино-3,3,3-трифторпропанамидо)-5-метилпиперидин-1-ил)хинолин-8-карбоксамид и 5-((3R,5S)-3-((S)-2-амино-3,3,3-трифторпропанамидо)-5-метилпиперидин-1-ил)хинолин-8-карбоксамид)
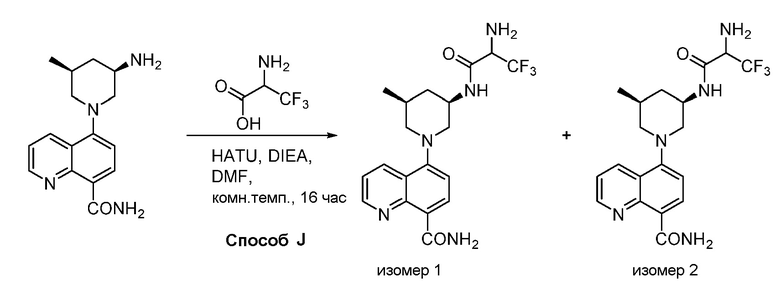
5-((3R,5S)-3-((R)-2-амино-3,3,3-трифторпропанамидо)-5-метилпиперидин-1-ил)хинолин-8-карбоксамид и 5-((3R,5S)-3-((S)-2-амино-3,3,3-трифторпропанамидо)-5-метилпиперидин-1-ил)хинолин-8-карбоксамид: 5-((3R,5S)-3-(2-амино-3,3,3-трифторпропанамидо)-5-метилпиперидин-1-ил)хинолин-8-карбоксамид получали из 5-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хинолин-8-карбоксамида и 2-амино-3,3,3-трифторпропановой кислоты с использованием Способа J. Два диастереоизомера разделяли препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 30% - 60% градиент за 10 мин; детектор УФ 254 нм.
Изомер 1: (16 мг, 12%, не совсем белое твердое вещество) ВЭЖХ: чистота 98,3%, RT=1,18 мин. МС: m/z=410,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,96 (дд, J=4,3, 1,8 Гц, 1H), 8,72-8,58 (м, 2H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,27 (д, J=8,2 Гц, 1H), 4,38-4,22 (м, 1H), 3,91 (кв., J=7,7 Гц, 1H), 3,65-3,56 (м, 1H), 3,40 (дд, J=11,9, 2,9 Гц, 1H), 2,60-2,42 (м, 2H), 2,23-2,10 (м, 2H), 1,19 (тд, J=12,6, 12,6 Гц, 1H), 1,04 (д, J=6,3 Гц, 3H).
Изомер 2: (16 мг, 12%, желтое твердое вещество) ВЭЖХ: чистота 96,9, RT=2,35 мин. МС: m/z=410,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,96 (дд, J=4,3, 1,8 Гц, 1H), 8,72-8,58 (м, 2H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,27 (д, J=8,2 Гц, 1H), 4,38-4,22 (м, 1H), 3,91 (кв., J=7,7 Гц, 1H), 3,65-3,56 (м, 1H), 3,40 (дд, J=11,9, 2,9 Гц, 1H), 2,60-2,42 (м, 2H), 2,23-2,10 (м, 2H), 1,19 (тд, J=12,6, 12,6 Гц, 1H), 1,04 (д, J=6,3 Гц, 3H).
Пример 53: Синтез соединения 187 ((3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амин)
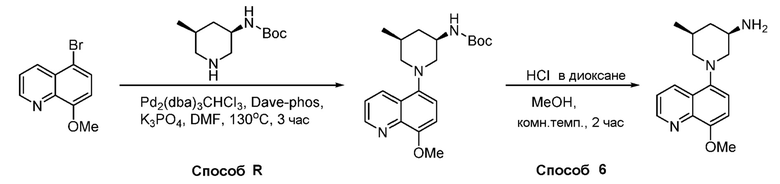
(3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амин): (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амин получали из 5-бром-8-метоксихинолина и трет-бутил (3R,5S)-5-метилпиперидин-3-илкарбамата с использованием Способа R и 6. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 20% - 50% градиент за 10 мин; детектор УФ 254 нм. (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амин получали в виде желтого твердого вещества (27 мг, 13% для 2 стадий).
Соединение 187: ВЭЖХ: чистота 98,8%, RT=1,42 мин. МС: m/z=272,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,83-8,77 (м, 1H), 8,66-8,59 (м, 1H), 7,58 (дд, J=8,5, 4,3 Гц, 1H), 7,23 (д, J=8,3 Гц, 1H), 7,14 (д, J=8,3 Гц, 1H), 4,04 (с, 3H), 3,40-3,30 (м, 1H), 3,28-3,12 (м, 2H), 2,45 (т, J=10,5 Гц, 1H), 2,33 (т, J=11,0 Гц, 1H), 2,18-2,03 (м, 2H), 1,05-0,91 (м, 4H).
Пример 54: Синтез соединения 188 ((2S)-2-гидрокси-N-[(3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-ил]-3-метилбутанамид)
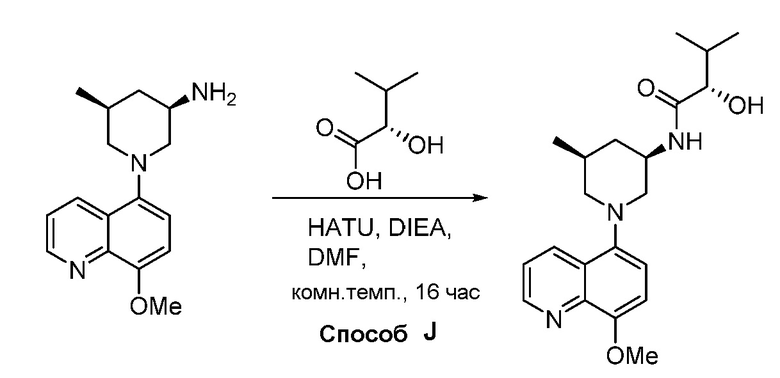
(2S)-2-гидрокси-N-[(3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-ил]-3-метилбутанамид: (2S)-2-гидрокси-N-[(3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-ил]-3-метилбутанамид получали из (S)-2-гидрокси-3-метилбутановой кислоты и (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амина с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 30% - 60% градиент за 10 мин; детектор УФ 254 нм. (2S)-2-гидрокси-N-[(3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-ил]-3-метилбутанамид получали в виде желтого твердого вещества (15 мг, 25%).
Соединение 188: ВЭЖХ: чистота 93,1%, RT=1,24 мин. МС: m/z=372,3 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,83 (д, J=4,1 Гц, 1H), 8,46 (д, J=8,6 Гц, 1H), 7,62-7,53 (м, 2H), 7,15-7,05 (м, 2H), 5,30 (д, J=5,7 Гц, 1H), 4,06 (д, J=10,8 Гц, 1H), 3,91 (с, 3H), 3,64 (т, J=4,8 Гц, 1H), 3,16 (д, J=10,0 Гц, 1H), 3,12-3,03 (м, 1H), 2,49-2,41 (м, 1H), 2,27 (т, J=11,0 Гц, 1H), 2,07-1,98 (м, 1H), 1,97-1,87 (м, 2H), 1,18 (тд, J=12,7, 12,7 Гц, 1H), 0,89 (дд, J=22,8, 6,7 Гц, 6H), 0,72 (д, J=6,7 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 189 (N-[(3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-ил]-3,3-диметилбутанамид): из 3,3-диметилбутановой кислоты и (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 99,1%, RT=1,45 мин. МС: m/z=370,2 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,94 (дд, J=4,2, 1,7 Гц, 1H), 8,57 (дд, J=8,5, 1,7 Гц, 1H), 7,50 (дд, J=8,5, 4,2 Гц, 1H), 7,06 (д, J=8,2 Гц, 1H), 6,95 (д, J=8,3 Гц, 1H), 5,22 (д, J=8,0 Гц, 1H), 4,35-4,33 (м, 1H), 4,07 (с, 3H), 3,55-3,46 (м, 1H), 3,21-3,13 (м, 1H), 2,42-2,28 (м, 2H), 2,22-2,07 (м, 2H), 2,04 (д, J=1,7 Гц, 2H), 1,08-0,92 (м, 13H).
Соединение 193 (2-(диметиламино)-N-[(3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-ил]ацетамид): из 2-(диметиламино)уксусной кислоты и (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 99,2%, RT=1,74 мин. МС: m/z=357,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,80 (дд, J=4,3, 1,7 Гц, 1H), 8,67 (дд, J=8,5, 1,7 Гц, 1H), 7,59 (дд, J=8,5, 4,2 Гц, 1H), 7,21 (д, J=8,4 Гц, 1H), 7,13 (д, J=8,3 Гц, 1H), 4,28-4,22 (м, 1H), 4,04 (с, 3H), 3,39-3,32 (м, 1H), 3,22-3,13 (м, 1H), 2,99 (с, 2H), 2,51 (т, J=10,6 Гц, 1H), 2,39 (т, J=11,0 Гц, 1H), 2,30 (с, 6H), 2,19-2,04 (м, 2H), 1,15 (тд, J=12,0, 12,0 Гц, 1H), 1,03 (д, J=6,4 Гц, 3H).
Пример 55: Синтез соединения 190 ((3R,5S)-N-(2-метоксиэтил)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амин)
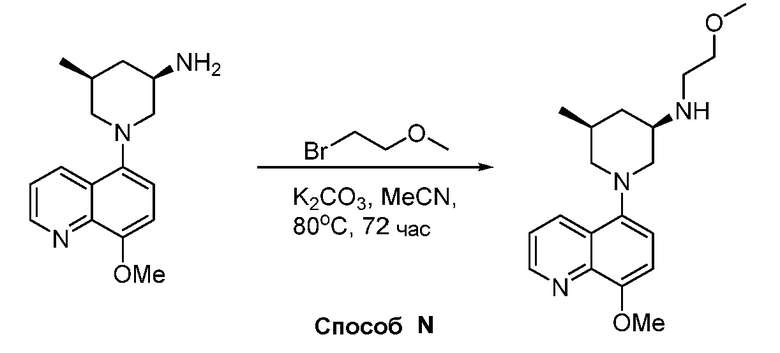
(3R,5S)-N-(2-метоксиэтил)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амин: (3R,5S)-N-(2-метоксиэтил)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амин получали из (S)-2-гидрокси-3-метилбутановой кислоты и (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амина с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 35% - 65% градиент за 10 мин; детектор УФ 254 нм. (3R,5S)-N-(2-метоксиэтил)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амин получали в виде желтого твердого вещества (24 мг, 35%).
Соединение 190: ВЭЖХ: чистота 99,2%, RT=1,89 мин. МС: m/z=330,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,80 (дд, J=4,2, 1,7 Гц, 1H), 8,61 (дд, J=8,5, 1,7 Гц, 1H), 7,58 (дд, J=8,5, 4,2 Гц, 1H), 7,22 (д, J=8,3 Гц, 1H), 7,13 (д, J=8,3 Гц, 1H), 4,04 (с, 3H), 3,52 (т, J=5,3 Гц, 2H), 3,44-3,30 (м, 4H), 3,20-2,95 (м, 2H), 2,94-2,77 (м, 2H), 2,48-2,28 (м, 2H), 2,23-2,00 (м, 2H), 1,04-0,87 (м, 4H).
Пример 56: Синтез соединения 191 и соединения 192 (5-((3R,5S)-3-((R)-2-амино-3,3,3-трифторпропанамидо)-5-метилпиперидин-1-ил)хинолин-8-карбоксамид и 5-((3R,5S)-3-((S)-2-амино-3,3,3-трифторпропанамидо)-5-метилпиперидин-1-ил)хинолин-8-карбоксамид)
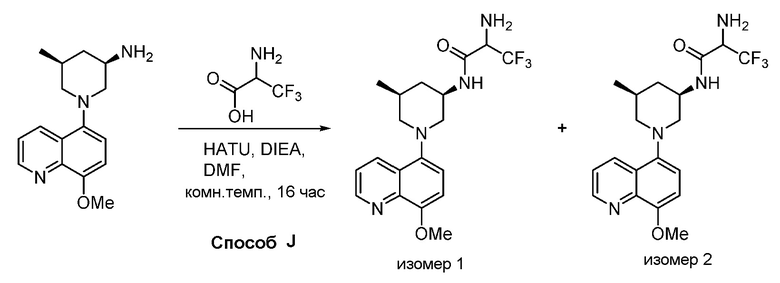
5-((3R,5S)-3-((R)-2-амино-3,3,3-трифторпропанамидо)-5-метилпиперидин-1-ил)хинолин-8-карбоксамид и 5-((3R,5S)-3-((S)-2-амино-3,3,3-трифторпропанамидо)-5-метилпиперидин-1-ил)хинолин-8-карбоксамид: 2-амино-3,3,3-трифтор-N-((3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-ил)пропанамид получали из (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амина и 2-амино-3,3,3-трифторпропановой кислоты с использованием Способа J. Два диастереоизомера разделяли препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 35% - 65% градиент за 10 мин; детектор УФ 254 нм.
Изомер 1: (7 мг, 6%, светло-желтое твердое вещество) ВЭЖХ: чистота 97,3%, RT=1,94 мин. МС: m/z=397,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,79 (дд, J=4,3, 1,7 Гц, 1H), 8,65 (дд, J=8,5, 1,7 Гц, 1H), 7,58 (дд, J=8,5, 4,2 Гц, 1H), 7,19 (д, J=8,4 Гц, 1H), 7,11 (д, J=8,3 Гц, 1H), 4,25-4,20 (м, 1H), 4,02 (с, 3H), 3,90 (кв., J=7,7 Гц, 1H), 3,17 (д, J=11,3 Гц, 1H), 2,50-2,28 (м, 2H), 2,15-2,07 (м, 2H), 1,38-1,24 (м, 1H), 1,12 (тд, J=12,7, 12,7 Гц, 1H), 1,01 (д, J=6,4 Гц, 3H).
Изомер 2: (7 мг, 6%, светло-желтое твердое вещество) ВЭЖХ: чистота 95,7%, RT=2,21 мин. МС: m/z=397,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,79 (дд, J=4,3, 1,7 Гц, 1H), 8,65 (дд, J=8,5, 1,7 Гц, 1H), 7,58 (дд, J=8,5, 4,2 Гц, 1H), 7,19 (д, J=8,4 Гц, 1H), 7,11 (д, J=8,3 Гц, 1H), 4,22 (т, J=11,3 Гц, 1H), 4,02 (с, 3H), 3,90 (кв., J=7,7 Гц, 1H), 3,17 (д, J=11,3 Гц, 1H), 2,50-2,28 (м, 2H), 2,15-2,07 (м, 2H), 1,38-1,24 (м, 1H), 1,12 (тд, J=12,7, 12,7 Гц, 1H), 1,01 (д, J=6,4 Гц, 3H).
Пример 57: Синтез соединения 194 ((2S)-2-гидрокси-3-метил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]бутанамид)
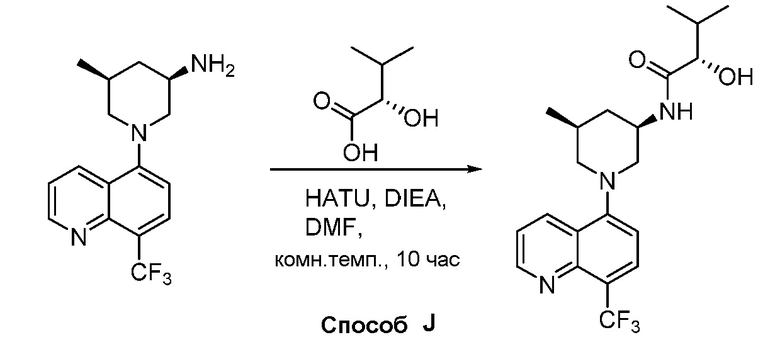
(2S)-2-гидрокси-3-метил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]бутанамид: (2S)-2-гидрокси-3-метил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]бутанамид получали из 2-(диметиламино)уксусной кислоты и (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амина с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 40% - 65% градиент за 10 мин; детектор УФ 254 нм. (2S)-2-гидрокси-3-метил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]бутанамид получали в виде белого твердого вещества (19 мг, 16%).
Соединение 194: ВЭЖХ: чистота 93,9%, RT=3,58 мин. МС: m/z=410,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95 (дд, J=4,0, 1,7 Гц, 1H), 8,67 (дд, J=8,7, 1,7 Гц, 1H), 8,05 (д, J=8,0 Гц, 1H), 7,64 (дд, J=8,6, 4,3 Гц, 1H), 7,24 (д, J=8,0 Гц, 1H), 4,32-4,27 (м, 1H), 3,85 (д, J=3,7 Гц, 1H), 3,69-3,54 (м, 1H), 3,44-3,39 (м, 1H), 2,66-2,46 (м, 2H), 2,25-2,00 (м, 3H), 1,36-1,18 (м, 1H), 1,09-0,81 (м, 9H).
Следующие соединения синтезировали аналогичным способом:
Соединение 195 (3,3-диметил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]бутанамид): из 2-(диметиламино)уксусной кислоты и (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 99,9%, RT=2,91 мин. МС: m/z=408,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (дд, J=4,3, 1,5 Гц, 1H), 8,66 (дд, J=8,6, 1,6 Гц, 1H), 8,03 (д, J=8,1 Гц, 1H), 7,63 (дд, J=8,6, 4,2 Гц, 1H), 7,21 (д, J=8,1 Гц, 1H), 4,30-4,20 (м, 1H), 3,61 (дд, J=11,0, 4,2 Гц, 1H), 3,40-3,33 (м, 1H), 2,60-2,40 (м, 2H), 2,21-2,06 (м, 4H), 1,16 (тд, J=12,2, 12,2 Гц, 1H), 1,05 (с, 3H), 1,03 (с, 9H).
Соединение 199 (2-(диметиламино)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид): из 2-(диметиламино)уксусной кислоты и (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 96,2%, RT=2,68 мин. МС: m/z=395,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,98-8,91 (м, 1H), 8,71-8,63 (м, 1H), 8,04 (д, J=8,0 Гц, 1H), 7,63 (дд, J=8,6, 4,2 Гц, 1H), 7,24 (д, J=8,1 Гц, 1H), 4,32-4,26 (м, 1H), 3,66-3,57 (м, 1H), 3,40 (д, J=12,1 Гц, 1H), 3,00 (с, 2H), 2,65-2,45 (м, 2H), 2,31 (с, 6H), 2,25-2,07 (м, 2H), 1,22 (тд, J=12,0, 12,0 Гц, 1H), 1,05 (д, J=6,4 Гц, 3H).
Соединение 239 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид): из 2-(морфолин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 99,7%, RT=1,85 мин. МС: m/z=437,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,2, 1,7 Гц, 1H), 8,61 (дд, J=8,6, 1,8 Гц, 1H), 7,99 (д, J=8,1 Гц, 1H), 7,58 (дд, J=8,6, 4,2 Гц, 1H), 7,18 (д, J=8,0 Гц, 1H), 4,29-4,19 (м, 1H), 3,73-3,63 (м, 4H), 3,62-3,50 (м, 1H), 3,38-3,30 (м, 1H), 2,99 (с, 2H), 2,60-2,38 (м, 6H), 2,17-2,04 (м, 2H), 1,19 (тд, J=12,3, 12,3 Гц, 1H), 1,00 (д, J=6,4 Гц, 3H).
Соединение 240 (2-гидрокси-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид): из 2-гидроксиуксусной кислоты и (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 94,5%, RT=3,23 мин. МС: m/z=368,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (дд, J=4,3, 1,7 Гц, 1H), 8,65 (дд, J=8,6, 1,8 Гц, 1H), 8,02 (д, J=8,0 Гц, 1H), 7,61 (дд, J=8,6, 4,2 Гц, 1H), 7,21 (д, J=8,0 Гц, 1H), 4,34-4,26 (м, 1H), 3,98 (с, 2H), 3,60-3,56 (м, 1H), 3,42-3,33 (м, 1H), 2,60 (т, J=11,0 Гц, 1H), 2,48 (т, J=11,2 Гц, 1H), 2,22-2,07 (м, 2H), 1,25 (тд, J=11,9, 11,9 Гц, 1H), 1,03 (д, J=6,4 Гц, 3H).
Соединение 241 (1-гидрокси-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]циклопропан-1-карбоксамид): из 2-(морфолин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 95,9%, RT=3,12 мин. МС: m/z=394,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (дд, J=4,3, 1,7 Гц, 1H), 8,64 (дд, J=8,6, 1,8 Гц, 1H), 8,02 (д, J=8,0 Гц, 1H), 7,61 (дд, J=8,6, 4,2 Гц, 1H), 7,22 (д, J=8,1 Гц, 1H), 4,33-4,21 (м, 1H), 3,62-3,53 (м, 1H), 3,38 (кажущийся д, J=11,5 Гц, 1H), 2,63 (т, J=10,9 Гц, 1H), 2,50 (т, J=11,3 Гц, 1H), 2,18-2,11 (м, 2H), 1,30 (тд, J=11,9, 11,9 Гц, 1H), 1,25-1,14 (м, 2H), 1,07-0,98 (м, 3H), 0,98-0,90 (м, 2H).
Соединение 243 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-2-(4-метилпиперазин-1-ил)ацетамид): из 2-(4-метилпиперазин-1-ил)уксусной кислоты и (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 98,9%, RT=2,66 мин. МС: m/z=450,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,3, 1,7 Гц, 1H), 8,61 (дд, J=8,6, 1,8 Гц, 1H), 7,99 (д, J=8,1 Гц, 1H), 7,58 (дд, J=8,6, 4,2 Гц, 1H), 7,18 (д, J=8,0 Гц, 1H), 4,29-4,19 (м, 1H), 3,62-3,51 (м, 1H), 3,38-3,30 (м, 1H), 3,04-2,97 (м, 2H), 2,59-2,38 (м, 10H), 2,26 (с, 3H), 2,20-2,02 (м, 2H), 1,17 (тд, J=12,2, 12,2 Гц, 1H), 1,00 (д, J=6,4 Гц, 3H).
Соединение 244 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-2-(1-метилпиперидин-4-ил)ацетамид): из 2-(1-метилпиперидин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 99,2%, RT=0,99 мин. МС: m/z=225,0 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,94-8,85 (м, 1H), 8,61 (дт, J=8,6, 2,0 Гц, 1H), 8,03-7,93 (м, 1H), 7,56-7,60 (м, 1H), 7,17 (дд, J=8,0, 2,6 Гц, 1H), 4,23-4,13 (м, 1H), 3,58 (кажущийся д, J=9,9 Гц, 1H), 3,34 (кажущийся д, J=11,2 Гц, 1H), 2,92-2,76 (м, 2H), 2,47-2,38 (м, 2H), 2,24 (с, 3H), 2,20-1,90 (м, 6H), 1,80-1,58 (м, 3H), 1,36-1,19 (м, 2H), 1,09 (тд, J=12,2, 12,2 Гц, 1H), 0,99 (д, J=6,5, 3H).
Соединение 245 (2-(1,4-диметилпиперидин-4-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид): из 2-(1,4-диметилпиперидин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 95,9%, RT=4,37 мин. МС: m/z=463,5 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,83 (дд, J=4,2, 1,7 Гц, 1H), 8,55 (дд, J=8,6, 1,8 Гц, 1H), 7,92 (д, J=7,9 Гц, 1H), 7,52 (дд, J=8,6, 4,2 Гц, 1H), 7,11 (д, J=8,0 Гц, 1H), 4,17-4,08 (м, 1H), 3,57-3,46 (м, 1H), 3,28 (кажущийся д, J=11,6 Гц, 1H), 2,50-2,20 (м, 6H), 2,19 (с, 3H), 2,15-1,95 (м, 4H), 1,65-1,49 (м, 2H), 1,45-1,32 (м, 2H), 1,15-0,89 (м, 7H).
Соединение 246 (2-[1-(2,2-дифторэтил)пиперидин-4-ил]-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид): из 2-(1,4-диметилпиперидин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 97,6%, RT=3,21 мин. МС: m/z=499,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,3, 1,7 Гц, 1H), 8,66-8,56 (м, 1H), 7,99 (д, J=8,1 Гц, 1H), 7,58 (дд, J=8,6, 4,2 Гц, 1H), 7,17 (д, J=8,1 Гц, 1H), 5,90 (тт, J=48,6, 4,5 Гц, 1H), 4,27-4,10 (м, 1H), 3,59 (д, J=11,3 Гц, 1H), 3,35 (д, J=11,9 Гц, 1H), 2,98-2,86 (м, 2H), 2,62-2,74 (м, 2H), 2,51-2,36 (м, 2H), 2,24-2,03 (м, 6H), 1,79-1,55 (м, 3H), 1,35-1,21 (м, 2H), 1,11 (тд, J=12,4, 12,4 Гц, 1H), 1,03-0,96 (м, 3H).
Соединение 247 (3,3-дифтор-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]циклобутан-1-карбоксамид): из 2-(1,4-диметилпиперидин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 99,9%, RT=1,55 мин. МС: m/z=428,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (дд, J=4,3, 1,7 Гц, 1H), 8,64 (дд, J=8,6, 1,8 Гц, 1H), 8,02 (д, J=8,1 Гц, 1H), 7,62 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,0 Гц, 1H), 4,17-4,25 (м, 1H), 3,66-3,57 (м, 1H), 3,42-3,34 (м, 1H), 2,91-2,84 (м, 1H), 2,83-2,59 (м, 4H), 2,50-2,43 (м, 2H), 2,19-2,09 (м, 2H), 1,13 (тд, J=12,3, 12,3 Гц, 1H), 1,02 (д, J=6,4 Гц, 3H).
Соединение 248 (1-метил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]пирролидин-3-карбоксамид): из 1-метилпирролидин-3-карбоновой кислоты и (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 92,7%, RT=1,05 мин. МС: m/z=421,3 [M+H]+. 1H ЯМР (300 МГц, Хлороформ-d, м.д.) δ 9,01 (дд, J=4,2, 1,8 Гц, 1H), 8,56-8,45 (м, 1H), 7,92 (д, J=8,1 Гц, 1H), 7,49 (дд, J=8,6, 4,2 Гц, 1H), 7,03 (д, J=8,0 Гц, 1H), 6,83 (д, J=7,9 Гц, 1H), 4,29-4,16 (м, 1H), 3,64 (кажущийся д, J=10,9 Гц, 1H), 3,35-3,24 (м, 1H), 2,89-2,82 (м, 3H), 2,52-2,31 (м, 7H), 2,27-1,88 (м, 4H), 1,11-0,92 (м, 4H).
Соединение 278 (2-гидрокси-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]пропанамид): из 2-гидроксипропановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 96,9%, RT=1,26 мин. МС: m/z=382,2 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,51 (дд, J=8,6, 1,8 Гц, 1H), 7,93 (д, J=8,0 Гц, 1H), 7,51 (дд, J=8,6, 4,2 Гц, 1H), 7,04 (д, J=8,0 Гц, 1H), 6,42 (д, J=8,1 Гц, 1H), 4,35-4,16 (м, 2H), 3,70-3,60 (м, 1H), 3,31 (д, J=11,6 Гц, 1H), 2,52-2,32 (м, 2H), 2,25-2,190(м, 3H) 1,40 (д, J=6,8 Гц, 3H), 1,14-0,95 (м, 4H).
Соединение 279 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-2-(1-метилпиперидин-3-ил)ацетамид): из 2-гидроксипропановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 97,4%, RT=3,49 мин. МС: m/z=449,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (дт, J=4,4, 1,3 Гц, 1H), 8,61 (дт, J=8,7, 2,1 Гц, 1H), 7,98 (д, J=8,2 Гц, 1H), 7,64-7,52 (м, 1H), 7,17 (дд, J=8,2, 2,4 Гц, 1H), 4,27-4,10 (м, 1H), 3,58 (д, J=11,2 Гц, 1H), 3,34 (д, J=11,5 Гц, 1H), 3,10-2,90 (м, 2H), 2,51-2,36 (м, 5H), 2,32-2,17 (м, 1H), 2,08 (д, J=9,7 Гц, 6H), 1,85-1,55 (м, 3H), 1,21-0,95 (м, 5H).
Соединение 283 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-2-(1-метилпирролидин-3-ил)ацетамид гидрохлорид): из 2-(1-метилпирролидин-3-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 99,7%, RT=2,71 мин. МС: m/z=435,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 9,27 (д, J=8,6 Гц, 1H), 9,12 (д, J=5,2 Гц, 1H), 8,31 (д, J=8,2 Гц, 1H), 8,07 (дд, J=8,6, 5,2 Гц, 1H), 7,52-7,42 (м, 1H), 4,16 (д, J=12,3 Гц, 1H), 3,78-3,38 (м, 4H), 3,29-3,04 (м, 1H), 2,94-2,72 (м, 4H), 2,68-2,59 (м, 3H), 2,45-2,08 (м, 5H), 1,86-1,66 (м, 1H), 1,21 (тд, J=12,3, 12,3 Гц, 1H), 1,02 (д, J=6,4 Гц, 3H).
Соединение 287 (2-(3,3-дифторазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]пропанамид): из 2-(3,3-дифторазетидин-1-ил)пропановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 98,4%, RT=1,81 мин. МС: m/z=457,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (дд, J=4,3, 1,7 Гц, 1H), 8,63 (дт, J=8,6, 1,6 Гц, 1H), 8,01 (д, J=8,1 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,21 (дд, J=8,0, 1,9 Гц, 1H), 4,27-4,18 (м, 1H), 3,70-3,61 (м, 4H), 3,56-3,53 (м, 1H), 3,42-3,20 (м, 2H), 3,10-2,99 (м, 1H), 2,61-2,41 (м, 2H), 2,20-2,04 (м, 2H), 1,31-1,14 (м, 4H), 1,03 (д, J=6,5 Гц, 3H).
Соединение 289 (2-(4-гидроксипиперидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]пропанамид): из 2-(4-гидроксипиперидин-1-ил)пропановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 99,8%, RT=1,75 мин. МС: m/z=465,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,90 (дд, J=4,3, 1,7 Гц, 1H), 8,62 (дт, J=8,6, 1,7 Гц, 1H), 7,99 (д, J=8,0 Гц, 1H), 7,59 (дд, J=8,6, 4,3 Гц, 1H), 7,19 (д, J=8,1 Гц, 1H), 4,24-4,16 (м, 1H), 3,58-3,55 (м, 2H), 3,37-3,32 (м, 1H), 3,07-2,96 (м, 1H), 2,80-2,71 (м, 2H), 2,55-2,42 (м, 2H), 2,34-2,06 (м, 4H), 1,89-1,77 (м, 2H), 1,55-1,50 (м, 2H), 1,23-1,07 (м, 4H), 1,01 (д, J=6,4 Гц, 3H).
Соединение 472 ([(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амид пропионовой кислоты): из (3R,5S)-1-[8-(трифторметил)хинолин-5-ил]-5-метилпиперидин-3-амина и пропионовой кислоты. ВЭЖХ: чистота >99%, RT=3,97 мин. МС: m/z=362,1 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,01 (дд, J=4,2, 1,8 Гц, 1H), 8,84 (д, J=7,4 Гц, 1H), 8,50 (дд, J=8,6, 1,8 Гц, 1H), 8,05 (д, J=8,0 Гц, 1H), 7,66 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,1 Гц, 1H), 4,15 (д, J=0,8 Гц, 1H), 4,08 (с, 1H), 3,48 (д, J=11,0 Гц, 1H), 2,40 (т, J=11,3 Гц, 1H), 2,00 (д, J=14,0 Гц, 2H), 1,13 (д, J=12,1 Гц, 1H), 0,94 (д, J=6,5 Гц, 3H).
Соединение 473 ([(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амид бут-3-иновой кислоты): из (3R,5S)-1-[8-(трифторметил)хинолин-5-ил]-5-метилпиперидин-3-амина и 3-бутиновой кислоты. ВЭЖХ: чистота >99%, RT=4,01 мин. МС: m/z=376,1 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,01 (дд, J=4,2, 1,7 Гц, 1H), 8,52 (дд, J=8,6, 1,8 Гц, 1H), 8,04 (д, J=8,1 Гц, 1H), 7,97 (д, J=7,4 Гц, 1H), 7,66 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,0 Гц, 1H), 5,74 (т, J=6,6 Гц, 1H), 5,29 (д, J=6,6 Гц, 2H), 4,08 (с, 1H), 3,54 (д, J=11,2 Гц, 1H), 3,39-3,32 (м, 1H), 2,48-2,36 (м, 2H), 2,15-1,96 (м, 3H), 1,12 (кв., J=12,0 Гц, 2H), 0,95 (д, J=6,5 Гц, 3H).
Соединение 474 (2-Метансульфониламино-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-1-[8-(трифторметил)хинолин-5-ил]-5-метилпиперидин-3-амина и N-(метилсульфонил)глицина. ВЭЖХ: чистота >99%, RT=3,52 мин. МС: m/z=445,1 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,01 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,6, 1,8 Гц, 1H), 8,02 (дд, J=24,1, 7,8 Гц, 2H), 7,66 (дд, J=8,6, 4,2 Гц, 1H), 7,30 (с, 1H), 7,20 (д, J=8,0 Гц, 1H), 4,07 (д, J=6,6 Гц, 1H), 3,61 (д, J=4,1 Гц, 2H), 3,50 (д, J=10,2 Гц, 1H), 3,34 (д, J=11,0 Гц, 1H), 2,92 (с, 3H), 2,46-2,37 (м, 1H), 2,04 (дд, J=29,3, 9,1 Гц, 2H), 1,14 (кв., J=12,0 Гц, 1H), 0,94 (т, J=7,1 Гц, 3H).
Соединение 475 ([(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амид 1-трифторметил-циклопропанкарбоновой кислоты): из (3R,5S)-1-[8-(трифторметил)хинолин-5-ил]-5-метилпиперидин-3-амина и 1-(трифторметил)циклопропан-1-карбоновой кислоты. ВЭЖХ: чистота >99%, RT=4,83 мин. МС: m/z=446,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,01 (дд, J=4,2, 1,7 Гц, 1H), 8,51 (дд, J=8,6, 1,8 Гц, 1H), 8,05 (д, J=8,1 Гц, 1H), 7,67 (дд, J=8,5, 4,0 Гц, 2H), 7,20 (д, J=8,1 Гц, 1H), 4,08 (с, 1H), 3,46-3,33 (м, 2H), 2,56 (д, J=10,9 Гц, 1H), 2,39 (т, J=11,4 Гц, 1H), 2,15-1,89 (м, 2H), 1,36-1,15 (м, 5H), 0,94 (д, J=6,6 Гц, 3H).
Соединение 515 (2-Циклопропил-2-гидрокси-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из Циклопропил-гидроксил-уксусной кислоты и (3R,5S)-5-Метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида. 1H ЯМР (400 МГц, DMSO-d6) δ 9,02 (дт, J=4,1, 1,4 Гц, 1H), 8,54 (дт, J=8,6, 2,1 Гц, 1H), 8,07 (д, J=8,1 Гц, 1H), 7,76-7,62 (м, 1H), 7,60 (д, J=7,7 Гц, 1H), 7,21 (дд, J=8,1, 4,3 Гц, 1H), 5,31 (дд, J=12,5, 5,4 Гц, 2H), 3,57-3,38 (м, 2H), 2,59 (т, J=10,9 Гц, 1H), 2,43 (т, J=11,3 Гц, 1H), 1,98 (д, J=12,6 Гц, 2H), 1,24 (дкв., J=12,1, 2,8 Гц, 1H), 1,12-1,01 (м, 1H), 0,96 (дт, J=6,5, 1,5 Гц, 3H), 0,43-0,21 (м, 4H). МС: m/z=408 [M+H]+.
Соединение 516 (2-(4-Метил-пиперазин-1-ил)-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-пропионамид: из 2-(4-Метил-пиперазин-1-ил)-пропионовой кислоты и (3R,5S)-5-Метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида. 1H ЯМР (400 МГц, DMSO-d6) δ 9,02 (дт, J=4,1, 1,5 Гц, 1H), 8,61-8,44 (м, 1H), 8,06 (дт, J=8,2, 2,7 Гц, 1H), 7,68 (дтд, J=9,2, 5,1, 4,6, 1,9 Гц, 2H), 7,20 (дд, J=12,5, 8,0 Гц, 1H), 4,20 (с, 1H), 3,55-3,39 (м, 1H), 3,34 (д, J=8,1 Гц, 3H), 3,33-3,25 (м, 2H), 3,08-2,90 (м, 1H), 2,44 (дт, J=11,1, 5,5 Гц, 7H), 2,14 (д, J=12,0 Гц, 3H), 2,12 (м, 2H), 1,99 (д, J=12,5 Гц, 2H), 1,18 (дкв., J=12,0, 2,5 Гц, 1H), 1,08 (дд, J=6,9, 1,4 Гц, 3H), 0,95 (дд, J=9,9, 6,4 Гц, 3H). МС: m/z=464 [M+H]+.
Соединение 517 (N-[(3R,5S)-5-Метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из уксусной кислоты и (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида. 1H ЯМР (400 МГц, DMSO-d6) δ 9,01 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,6, 1,8 Гц, 1H), 8,05 (д, J=8,2 Гц, 1H), 7,90 (д, J=7,4 Гц, 1H), 7,67 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,1 Гц, 1H), 3,52 (д, J=9,2 Гц, 1H), 2,43 (кв., J=11,4 Гц, 2H), 2,03 (дд, J=26,1, 12,3 Гц, 2H), 1,82 (с, 3H), 1,08 (кв., J=12,1 Гц, 1H), 0,96 (д, J=6,5 Гц, 3H). МС: m/z=352 [M+H]+.
Соединение 519 (2-Циклопропил-2-диметиламино-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из гидрохлорида циклопропил-диметиламин-уксусной кислоты и гидрохлорида (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламина. 1H ЯМР (400 МГц, Метанол-d4) δ 8,95 (дд, J=4,2, 1,7 Гц, 1H), 8,67 (дт, J=8,6, 1,8 Гц, 1H), 8,04 (д, J=8,2 Гц, 1H), 7,63 (дд, J=8,6, 4,2 Гц, 1H), 7,23 (дд, J=8,0, 1,8 Гц, 1H), 4,28 (дддд, J=14,9, 12,0, 5,8, 2,4 Гц, 1H), 3,60 (м, 1H), 3,40 (д, J=11,6 Гц, 1H), 2,53 (дтд, J=25,3, 11,2, 2,9 Гц, 2H), 2,35 (д, J=7,9 Гц, 6H), 2,23-2,04 (м, 2H), 1,86 (дд, J=9,5, 3,3 Гц, 1H), 1,20 (кв., J=12,1 Гц, 1H), 1,09-0,89 (м, 4H), 0,82-0,64 (м, 1H), 0,58-0,43 (м, 1H), 0,35 (тдд, J=12,5, 9,3, 4,8 Гц, 2H). МС: m/z=435 [M+H]+.
Соединение 526 ((S)-2-Диметиламино-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-пропионамид): из (S)-2-диметиламино-пропионовой кислоты и (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида. 1H ЯМР (400 МГц, DMSO-d6) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,54 (дд, J=8,6, 1,8 Гц, 1H), 8,06 (д, J=8,1 Гц, 1H), 7,79-7,64 (м, 2H), 7,21 (д, J=8,0 Гц, 1H), 4,20-4,15 (м, 2H), 3,47 (д, J=9,3 Гц, 1H), 2,92 (кв., J=6,8 Гц, 1H), 2,42 (т, J=11,4 Гц, 1H), 2,15 (с, 6H), 2,13-1,88 (м, 2H), 1,20 (кв., J=12,0 Гц, 1H), 1,07 (д, J=6,9 Гц, 3H), 0,95 (д, J=6,6 Гц, 3H). МС: m/z=409 [M+H]+.
Соединение 550 (2-(1-Гидрокси-циклопропил)-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорид и 2-(1-гидроксициклопропил)уксусной кислоты. 1H ЯМР (400 МГц, DMSO-d6) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,54 (дд, J=8,6, 1,8 Гц, 1H), 8,06 (д, J=8,1 Гц, 1H), 7,74 (д, J=7,4 Гц, 1H), 7,67 (дд, J=8,6, 4,1 Гц, 1H), 7,21 (д, J=8,1 Гц, 1H), 4,06 (с, 1H), 3,54 (д, J=9,1 Гц, 1H), 2,50-2,38 (м, 2H), 2,34 (с, 2H), 2,14-1,93 (м, 2H), 1,12 (кв., J=12,0 Гц, 1H), 0,96 (дд, J=6,5, 3,6 Гц, 3H), 0,63-0,53 (м, 2H), 0,53-0,38 (м, 2H). МС: m/z=408 [M+H]+.
Соединение 551 (2-(8-Метил-8-аза-бицикло[3.2.1]окт-3-ил)-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из гидрохлорида (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламина и гидрохлорида 2-(8-метил-8-азабицикло[3.2.1]октан-3-ил)уксусной кислоты. 1H ЯМР (400 МГц, DMSO-d6) δ 9,01 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,6, 1,8 Гц, 1H), 8,06 (д, J=8,1 Гц, 1H), 7,92 (д, J=7,3 Гц, 1H), 7,67 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,0 Гц, 1H), 4,15 (м, 1H) 3,51 (д, J=9,9 Гц, 2H), 3,34 (д, J=11,6 Гц, 2H), 3,14 (с, 2H), 2,43 (дт, J=11,3, 5,9 Гц, 1H), 2,23 (д, J=5,7 Гц, 3H), 2,15 (дд, J=15,8, 7,9 Гц, 2H), 2,02 (дд, J=16,8, 10,7 Гц, 4H), 1,68 (д, J=8,2 Гц, 2H), 1,22 (дд, J=13,8, 7,4 Гц, 2H), 1,10 (кв., J=12,0 Гц, 1H), 0,95 (д, J=6,5 Гц, 3H). МС: m/z=475 [M+H]+.
Соединение 572 (2-(1-изопропил-пиперидин-4-ил)-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из гидрохлорида (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламина и 2-метил-2-пиперидин-1-ил-пропионовой кислоты. ВЭЖХ: чистота >99%, RT=3,27 мин. МС: m/z=463,6 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,02 (дд, J=4,1, 1,7 Гц, 1H), 8,53 (дд, J=8,6, 1,8 Гц, 1H), 8,06 (д, J=8,1 Гц, 1H), 7,68 (дд, J=8,6, 4,2 Гц, 1H), 7,49 (д, J=8,2 Гц, 1H), 7,21 (д, J=8,0 Гц, 1H), 4,11-3,97 (м, 1H), 3,45 (дд, J=11,6, 3,9 Гц, 1H), 2,56 (т, J=10,9 Гц, 1H), 2,45 (т, J=11,4 Гц, 1H), 2,33 (с, 4H), 2,09 (с, 1H), 1,97 (д, J=12,4 Гц, 1H), 1,54 (с, 4H), 1,41 (д, J=6,9 Гц, 2H), 1,22 (кв., J=12,0 Гц, 1H), 1,06 (д, J=9,0 Гц, 6H), 0,96 (д, J=6,6 Гц, 3H).
Соединение 573 (2-(3,3-Диметил-пирролидин-1-ил)-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламина и (3,3-диметил-пирролидин-1-ил)-уксусной кислоты. ВЭЖХ: чистота >99%, RT=3,32 мин. МС: m/z=449,5 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,6, 1,8 Гц, 1H), 8,05 (д, J=8,1 Гц, 1H), 7,67 (дд, J=8,6, 4,2 Гц, 1H), 7,57 (д, J=8,0 Гц, 1H), 7,21 (д, J=8,0 Гц, 1H), 4,13-4,06 (м, 1H), 3,50-3,43 (м, 1H), 3,02 (д, J=3,0 Гц, 2H), 2,63 (м, 2H), 2,56 (т, J=10,9 Гц, 1H), 2,43 (т, J=11,4 Гц, 1H), 2,38-2,29 (м, 2H), 2,08 (тд, J=10,4, 9,1, 5,4 Гц, 1H), 1,99 (дд, J=12,4, 3,9 Гц, 1H), 1,53 (т, J=7,1 Гц, 2H), 1,21 (кв., J=12,0 Гц, 1H), 1,05 (д, J=1,3 Гц, 6H), 0,96 (д, J=6,6 Гц, 3H).
Соединение 574 (1-Циклопропил-пиперидин-4-карбоновой кислоты [(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амид): из (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и 1-Циклопропил-пиперидин-4-карбоновой кислоты. ВЭЖХ: чистота 98%, RT=3,12 мин. МС: m/z=461,5 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,01 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,7, 1,8 Гц, 1H), 8,05 (д, J=8,1 Гц, 1H), 7,76 (д, J=7,4 Гц, 1H), 7,67 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,1 Гц, 1H), 4,02 (с, 0H), 3,48 (д, J=10,9 Гц, 1H), 3,36 (д, J=5,3 Гц, 0H), 2,92 (тд, J=7,9, 3,9 Гц, 1H), 2,43 (кв., J=11,2 Гц, 1H), 2,08 (ддт, J=11,5, 8,2, 3,7 Гц, 1H), 1,98 (д, J=13,0 Гц, 0H), 1,67-1,40 (м, 2H), 1,10 (кв., J=12,1 Гц, 1H), 0,95 (д, J=6,6 Гц, 2H), 0,38 (дт, J=5,2, 2,6 Гц, 1H), 0,27 (кв., J=3,1, 2,5 Гц, 1H).
Соединение 575 (N,N-диэтил-N'-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-сукцинамид): из (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и N,N-диэтил-сукцинамовой кислоты. ВЭЖХ: чистота >99%, RT=3,98 мин. МС: m/z=465,5 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,01 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,6, 1,8 Гц, 1H), 8,06 (д, J=8,1 Гц, 1H), 7,87 (д, J=7,4 Гц, 1H), 7,67 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,0 Гц, 1H), 4,03 (с, 1H), 3,51 (д, J=10,2 Гц, 1H), 3,30 (д, J=6,8 Гц, 2H), 3,28-3,18 (м, 2H), 2,49 (д, J=6,9 Гц, 2H), 2,43 (тд, J=11,1, 4,1 Гц, 2H), 2,34 (кв., J=7,6, 7,1 Гц, 2H), 2,06 (с, 1H), 1,99 (д, J=13,1 Гц, 1H), 1,15-1,03 (м, 4H), 0,97 (т, J=6,8 Гц, 6H).
Пример 58: Синтез соединения 196 ((3R,5S)-N-(2-метоксиэтил)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амин)
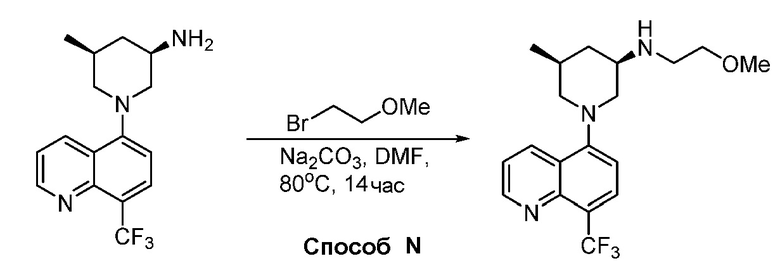
(3R,5S)-N-(2-метоксиэтил)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амин: (3R,5S)-N-(2-метоксиэтил)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амин получали из 2-(диметиламино)уксусной кислоты и (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амина с использованием Способа N. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 30% - 60% градиент за 10 мин; детектор УФ 254 нм. (3R,5S)-N-(2-метоксиэтил)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амин получали в виде желтого масла (14 мг, 15%).
Соединение 196: ВЭЖХ: чистота 94,9%, RT=2,77 мин. МС: m/z=368,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,04-8,97 (м, 1H), 8,48 (дд, J=8,7, 1,7 Гц, 1H), 8,05 (д, J=8,0 Гц, 1H), 7,66 (дд, J=8,6, 4,2 Гц, 1H), 7,19 (д, J=8,1 Гц, 1H), 3,57-3,49 (м, 1H), 3,42-3,28 (м, 2H), 3,24 (с, 3H), 2,93 (т, J=10,8 Гц, 1H), 2,82-2,66 (м, 2H), 2,41-2,33 (м, 2H), 2,12-1,94 (м, 2H), 1,59 (шир.с, 2H), 0,97-0,78 (м, 4H).
Пример 59: Синтез соединения 197 и соединения 198 ((R)-2-амино-3,3,3-трифтор-N-((3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-ил)пропанамид и (S)-2-амино-3,3,3-трифтор-N-((3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-ил)пропанамид)
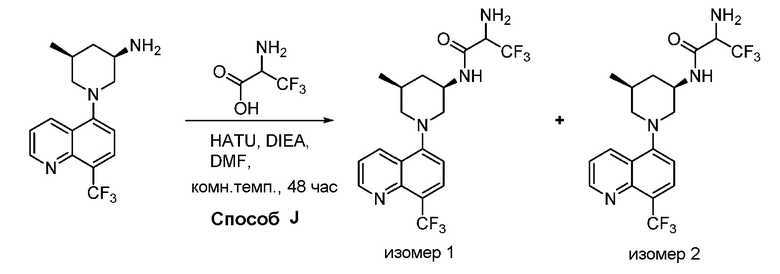
(R)-2-амино-3,3,3-трифтор-N-((3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-ил)пропанамид и (S)-2-амино-3,3,3-трифтор-N-((3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-ил)пропанамид: 2-амино-3,3,3-трифтор-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]пропанамид получали из (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина и 2-амино-3,3,3-трифторпропановой кислоты с использованием Способа J. Два диастереоизомера разделяли препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 30% - 60% градиент за 10 мин; детектор УФ 254 нм.
Изомер 1: (14 мг, 21%, белое твердое вещество) ВЭЖХ: чистота 93,2%, RT=2,62 мин. МС: m/z=434,9 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,6, 1,8 Гц, 1H), 8,37 (д, J=7,3 Гц, 1H), 8,06 (д, J=8,1 Гц, 1H), 7,68 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,0 Гц, 1H), 4,09-4,04 (м, 1H), 3,93-3,84 (м, 1H), 3,49 (кажущийся д, J=11,6 Гц, 1H), 2,51-2,39 (м, 1H), 2,31 (кажущийся д, J=8,9 Гц, 2H), 2,10-1,90 (м, 2H), 1,15 (тд, J=12,0, 12,0 Гц, 1H), 0,96 (д, J=6,5 Гц, 3H).
Изомер 2: (9 мг, 13%, белое твердое вещество) ВЭЖХ: чистота 90,5%, RT=2,71 мин. МС: m/z=434,9 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,6, 1,8 Гц, 1H), 8,37 (д, J=7,3 Гц, 1H), 8,06 (д, J=8,1 Гц, 1H), 7,68 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,0 Гц, 1H), 4,09-4,04 (м, 1H), 3,93-3,84 (м, 1H), 3,49 (кажущийся д, J=11,6 Гц, 1H), 2,51-2,39 (м, 1H), 2,31 (кажущийся д, J=8,9 Гц, 2H), 2,10-1,90 (м, 2H), 1,15 (тд, J=12,0, 12,0 Гц, 1H), 0,96 (д, J=6,5 Гц, 3H).
Пример 60: Синтез соединения 200 (5-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хинолин-8-ол гидрохлорид)
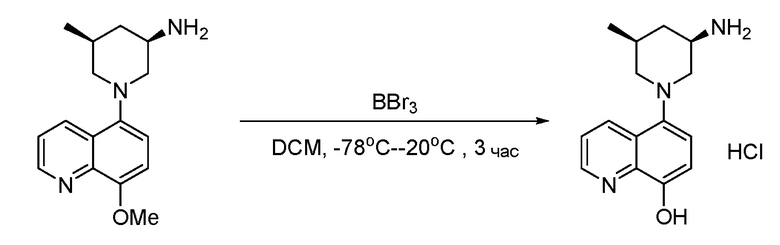
5-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хинолин-8-ол: при -78°C к раствору (3R,5S)-1-(8-метоксихинолин-5-ил)-5-метилпиперидин-3-амина (95 мг, 0,35 ммоль) в DCM (10 мл) добавляли раствор BBr3 (553 мг, 2,19 ммоль) в DCM (5 мл) по каплям. Полученный раствор перемешивали в течение 1 часа при -78°C, нагревали до -20°C и перемешивали в течение 2 часов при -20°C. Когда реакция была завершена, ее гасили путем добавления воды (10 мл). Полученную смесь экстрагировали при помощи DCM (20 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка Xbridge Shield RP18 OBD, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% HCl), 35% - 65% градиент за 10 мин; детектор УФ 254 нм. 5-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хинолин-8-ол гидрохлорид получали в виде коричневого твердого вещества (24 мг, 21%).
Соединение 200: ВЭЖХ: чистота 96,6%, RT=1,05 мин. МС: m/z=258,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 9,38 (дд, J=8,5, 1,5 Гц, 1H), 9,09 (дд, J=5,2, 1,3 Гц, 1H), 8,13 (дд, J=8,6, 5,4 Гц, 1H), 7,57 (д, J=8,4 Гц, 1H), 7,47 (д, J=8,5 Гц, 1H), 3,73-3,67 (м, 1H), 3,53 (дд, J=10,8, 3,9 Гц, 1H), 3,24 (дд, J=11,6, 3,6 Гц, 1H), 2,85 (т, J=10,7 Гц, 1H), 2,51 (т, J=11,2 Гц, 1H), 2,35-2,17 (м, 2H), 1,27 (тд, J=11,9, 11,9 Гц, 1H), 1,08 (д, J=6,5 Гц, 3H).
Пример 61: Синтез соединения 204 ((2S)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-гидрокси-3-метилбутанамид)
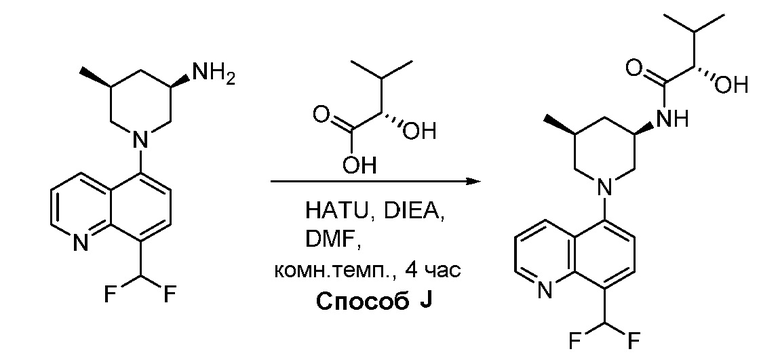
(2S)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-гидрокси-3-метилбутанамид: (2S)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-гидрокси-3-метилбутанамид получали из 2-(диметиламино)уксусной кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 25% - 50% градиент за 10 мин; детектор УФ 254 нм. (2S)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-гидрокси-3-метилбутанамид получали в виде белого твердого вещества (17 мг, 27%).
Соединение 204: ВЭЖХ: чистота 91,5%, RT=2,73 мин. МС: m/z=392,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,91 (дд, J=4,2, 1,7 Гц, 1H), 8,65 (дд, J=8,6, 1,8 Гц, 1H), 7,95 (д, J=7,8 Гц, 1H), 7,88-7,54 (м, 2H), 7,27 (д, J=7,9 Гц, 1H), 4,34-4,24 (м, 1H), 3,85 (д, J=3,8 Гц, 1H), 3,58-3,45 (м, 1H), 3,40-3,28 (м, 1H), 2,59 (т, J=10,8 Гц, 1H), 2,48 (т, J=11,2 Гц, 1H), 2,24-2,00 (м, 4H), 1,38-1,18 (м, 1H), 1,05 (д, J=6,6 Гц, 3H), 1,00 (д, J=6,6 Гц, 3H), 0,84 (д, J=6,8 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 205 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-3,3-диметилбутанамид): из 3,3-диметилбутановой кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 98,9%, RT=1,59 мин. МС: m/z=390,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,91 (дд, J=4,2, 1,7 Гц, 1H), 8,64 (дд, J=8,6, 1,8 Гц, 1H), 7,95 (дт, J=7,9, 1,5 Гц, 1H), 7,85-7,65 (м, 2H), 7,26 (д, J=7,9 Гц, 1H), 4,29-4,21 (м, 1H), 3,62-3,53 (м, 1H), 3,39- 3,36 (м, 1H), 2,57-2,37 (м, 2H), 2,23-2,06 (м, 4H), 1,15 (тд, J=12,1, 12,1 Гц, 1H), 1,05 (с, 3H), 1,03 (с, 9H).
Соединение 209 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-(диметиламино)ацетамид): из 3,3-диметилбутановой кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 95,9%, RT=2,58 мин. МС: m/z=377,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,91 (дд, J=4,2, 1,7 Гц, 1H), 8,64 (дд, J=8,6, 1,8 Гц, 1H), 7,95 (дд, J=7,9, 1,3 Гц, 1H), 7,86-7,54 (м, 2H), 7,28 (д, J=7,9 Гц, 1H), 4,33-4,24 (м, 1H), 3,61-3,54 (м, 1H), 3,40-3,28 (м, 1H), 3,10 (с, 2H), 2,60-2,40 (м, 2H), 2,37 (с, 6H), 2,24-2,09 (м, 2H), 1,20 (тд, J=12,1, 12,1 Гц, 1H), 1,05 (д, J=6,4 Гц, 3H).
Соединение 302 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-гидроксипропанамид): из 2-гидроксипропановой кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 99,0%, RT=2,13 мин. МС: m/z=364,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,2, 1,7 Гц, 1H), 8,62 (дд, J=8,6, 1,7 Гц, 1H), 7,93 (дд, J=7,9, 1,4 Гц, 1H), 7,86-7,50 (м, 2H), 7,26 (д, J=8,0 Гц, 1H), 4,28-4,20 (м, 1H), 4,11 (тд, J=6,8, 6,8 Гц, 1H), 3,54-3,49 (м, 1H), 3,38-3,30 (м, 1H), 2,56 (т, J=10,9 Гц, 1H), 2,45 (т, J=11,2 Гц, 1H), 2,21-2,05 (м, 2H), 1,32 (д, J=6,8 Гц, 3H), 1,22 (тд, J=12,1, 12,1 Гц, 1H), 1,03 (д, J=6,4 Гц, 3H).
Соединение 303 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-(1-метилпиперидин-3-ил)ацетамид): из 2-(1-метилпиперидин-3-ил)уксусной кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 98,8%, RT=1,52 мин. МС: m/z=431,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,2, 1,7 Гц, 1H), 8,62 (дд, J=8,6, 1,8 Гц, 1H), 7,98-7,84 (м, 1H), 7,73-7,46 (м, 2H), 7,25 (д, J=7,8 Гц, 1H), 4,22 (т, J=11,4 Гц, 1H), 3,57 (кажущийся д, J=11,6 Гц, 1H), 3,40-3,30 (м, 1H), 2,89-2,72 (м, 2H), 2,50-2,41 (м, 2H), 2,25-2,23 (м, 3H), 2,19-1,82 (м, 6H), 1,81-1,48 (м, 4H), 1,22-0,87 (м, 5H).
Соединение 307 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-(1-метилпирролидин-3-ил)ацетамид): из 2-(1-метилпирролидин-3-ил)уксусной кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 96,0%, RT=2,82 мин. МС: m/z=417,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,86 (дд, J=4,2, 1,7 Гц, 1H), 8,58 (дд, J=8,6, 1,8 Гц, 1H), 7,96-7,41 (м, 3H), 7,21 (д, J=7,9 Гц, 1H), 4,26-4,09 (м, 1H), 3,59-3,47 (м, 1H), 3,39-3,29 (м, 1H), 2,80-2,73 (м, 1H), 2,67-2,49 (м, 3H), 2,46-2,37 (м, 2H), 2,33-2,30 (м, 3H), 2,28-2,17 (м, 3H), 2,12-1,95 (м, 3H), 1,54-1,40 (м, 1H), 1,25 (д, J=1,4 Гц, 1H), 1,11 (тд, J=12,4, 12,4 Гц, 1H), 0,99 (д, J=6,4 Гц, 3H).
Соединение 311 (2-(3,3-дифторазетидин-1-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]пропанамид): из 2-(3,3-дифторазетидин-1-ил)пропановой кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 96,8%, RT=2,53 мин. МС: m/z=439,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,2, 1,7 Гц, 1H), 8,61 (дт, J=8,6, 1,7 Гц, 1H), 7,93 (дд, J=8,0, 1,5 Гц, 1H), 7,85-7,53 (м, 2H), 7,26 (дд, J=7,9, 2,0 Гц, 1H), 4,27-4,18 (м, 1H), 3,75-3,56 (м, 4H), 3,53-3,49 (м, 1H), 3,39-3,20 (м, 1H), 3,10-3,00 (м, 1H), 2,60-2,40 (м, 2H), 2,21-2,04 (м, 2H), 1,31-1,13 (м, 4H), 1,03 (д, J=6,5 Гц, 3H).
Соединение 313 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-(4-гидроксипиперидин-1-ил)пропанамид): из 2-(4-гидроксипиперидин-1-ил)пропановой кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 93,5%, RT=1,51 мин. МС: m/z=447,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,86 (дд, J=4,2, 1,6 Гц, 1H), 8,59 (дт, J=8,6, 1,8 Гц, 1H), 7,95-7,44 (м, 3H), 7,23 (д, J=7,9 Гц, 1H), 4,21 (д, J=11,8 Гц, 1H), 3,69-3,50 (м, 2H), 3,40-3,20 (м, 1H), 3,01 (тт, J=3,6, 3,3 Гц, 1H), 2,82-2,68 (м, 2H), 2,56-2,02 (м, 6H), 1,89-1,73 (м, 2H), 1,58-1,45 (м, 2H), 1,23-1,05 (м, 4H), 1,00 (д, J=6,4 Гц, 3H).
Соединение 316 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-(1-метилпиперидин-4-ил)ацетамид): из 2-(1-метилпиперидин-4-ил)уксусной кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 98,7%, RT=1,02 мин. МС: m/z=431,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,86 (дд, J=4,2, 1,7 Гц, 1H), 8,59 (дд, J=8,6, 1,7 Гц, 1H), 7,94-7,43 (м, 3H), 7,21 (д, J=7,9 Гц, 1H), 4,24-4,13 (м, 1H), 3,60-3,48 (м, 1H), 3,40-3,20 (м, 1H), 2,95-2,91 (м, 2H), 2,46-2,37 (м, 2H), 2,29 (с, 3H), 2,18-2,02 (м, 6H), 1,83-1,60 (м, 3H), 1,37-1,20 (м, 2H), 1,07-1,00 (м, 1H), 0,99 (д, J=6,3 Гц, 3H).
Соединение 317 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-3,3-дифторциклобутан-1-карбоксамид): из 3,3-дифторциклобутан-1-карбоновой кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 98,6%, RT=2,25 мин. МС: m/z=410,2 [M+H]+. 1H ЯМР (300 МГц, Хлороформ-d, м.д.) δ 8,93 (дд, J=4,5, 1,8 Гц, 1H), 8,54 (д, J=8,5 Гц, 1H), 7,99-7,43 (м, 3H), 7,12 (д, J=7,9 Гц, 1H), 5,38-5,28 (м, 1H), 4,39-4,23 (м, 1H), 3,68-3,64 (м, 1H), 3,31-3,27 (м, 1H), 2,94-2,62 (м, 5H), 2,49-2,29 (м, 2H), 2,22-2,07 (м, 2H), 1,03-0,95 (м, 4H).
Соединение 318 (N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-2-(1-метилпиперидин-3-ил)ацетамид): из 2-(1-метилпиперидин-3-ил)уксусной кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 92,0%, RT=2,22 мин. МС: m/z=432,3 [M+H]+. 1H ЯМР (300 МГц, Хлороформ-d, м.д.) δ 9,07-8,87 (м, 2H), 7,94-7,54 (м, 3H), 7,30 (д, J=8,3 Гц, 1H), 4,12-3,85 (м, 3H), 2,69-2,40 (м, 4H), 2,10 (с, 3H), 2,02-1,70 (м, 4H), 1,65-1,35 (м, 3H), 1,16-0,98 (м, 1H), 0,95-0,75 (м, 4H).
Соединение 319 (N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-2-(1-метилпирролидин-3-ил)ацетамид): из 2-(1-метилпирролидин-3-ил)уксусной кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 91,0%, RT=6,42 мин. МС: m/z=418,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,85 (м, 2H), 7,93 (д, J=8,1 Гц, 1H), 7,63 (т, J=55,8 Гц, 1H), 7,30 (д, J=8,2 Гц, 1H), 4,23-3,92 (м, 3H), 3,04-2,89 (м, 1H), 2,85-2,40 (м, 9H), 2,29 (д, J=7,5 Гц, 2H), 2,20-2,00 (м, 3H), 1,63-1,49 (м, 1H), 1,12-1,09 (м, 1H), 0,97 (д, J=6,4 Гц, 3H).
Соединение 323 (2-(3,3-дифторазетидин-1-ил)-N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]пропанамид): из 2-(3,3-дифторазетидин-1-ил)пропановой кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 94,2%, RT=1,25 мин. МС: m/z=440,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,85 (м, 2H), 7,97 (дд, J=8,2, 1,5 Гц, 1H), 7,63 (т, J=55,9 Гц, 1H), 7,34 (д, J=8,3 Гц, 1H), 4,27-4,13 (м, 1H), 4,09-3,95 (м, 2H), 3,77-3,58 (м, 4H), 3,11-3,01 (м, 1H), 2,75-2,68 (м, 1H), 2,57-2,05 (м, 1H), 2,14-2,03 (м, 2H), 1,31-1,13 (м, 4H), 1,01 (д, J=6,5 Гц, 3H).
Соединение 325 (N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-2-(4-гидроксипиперидин-1-ил)пропанамид): из 2-(4-гидроксипиперидин-1-ил)пропановой кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 90,5%, RT=1,50 мин. МС: m/z=448,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,97-8,81 (м, 2H), 7,97 (д, J=8,2 Гц, 1H), 7,63 (т, J=55,8 Гц, 1H), 7,34 (д, J=8,0 Гц, 1H), 4,29-3,90 (м, 3H), 3,65-3,62 (м, 1H), 3,17-3,09 (м, 1H), 2,95-2,20 (м, 6H), 2,19-1,79 (м, 4H), 1,70-1,50 (м, 2H), 1,31-1,11 (м, 4H), 1,02 (д, J=6,3 Гц, 3H).
Соединение 328 (N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-2-(1-метилпиперидин-4-ил)ацетамид): из 2-(1-метилпиперидин-4-ил)уксусной кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 90,4%, RT=1,31 мин. МС: m/z=432,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,81 (м, 2H), 7,97 (д, J=8,3 Гц, 1H), 7,64 (т, J=55,8 Гц, 1H), 7,34 (д, J=8,1 Гц, 1H), 4,29-3,95 (м, 3H), 2,97-2,94 (м, 2H), 2,66-2,46 (м, 2H), 2,35 (с, 3H), 2,24-2,03 (м, 6H), 1,90-1,70 (м, 3H), 1,40-1,36 (м, 2H), 1,14 (тд, J=12,2, 12,2 Гц, 1H), 1,01 (дд, J=6,4, 2,3 Гц, 3H).
Соединение 329 (N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-3,3-дифторциклобутан-1-карбоксамид): из 3,3-дифторциклобутан-1-карбоновой кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 91,2%, RT=2,91 мин. МС: m/z=411,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,98-8,85 (м, 2H), 7,99 (дд, J=8,2, 1,5 Гц, 1H), 7,65 (т, J=55,6 Гц, 1H), 7,36 (д, J=8,2 Гц, 1H), 4,28-4,11 (м, 2H), 4,06-3,98 (м, 1H), 2,97-2,46 (м, 7H), 2,15-2,07 (м, 2H), 1,15 (тд, J=12,2, 12,2 Гц, 1H), 1,02 (д, J=6,4 Гц, 3H).
Пример 62: Синтез соединения 206 ((3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-N-(2-метоксиэтил)-5-метилпиперидин-3-амин)
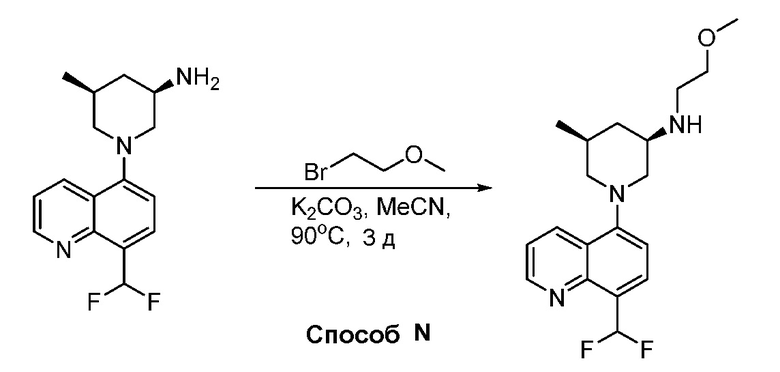
(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-N-(2-метоксиэтил)-5-метилпиперидин-3-амин): (3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-N-(2-метоксиэтил)-5-метилпиперидин-3-амин получали из 1-бром-2-метоксиэтана и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина с использованием Способа N. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 5 мкм, 19 мм × 150 мм; подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 35% - 65% градиент за 8 мин; детектор УФ 254 нм. (3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-N-(2-метоксиэтил)-5-метилпиперидин-3-амин получали в виде желтого твердого вещества (11 мг, 24%).
Соединение 206: ВЭЖХ: чистота 96,4%, RT=1,41 мин. МС: m/z=350,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,85 (дд, J=4,2, 1,8 Гц, 1H), 8,51 (дд, J=8,6, 1,8 Гц, 1H), 7,95-7,85 (м, 1H), 7,82-7,43 (м, 2H), 7,22 (д, J=7,9 Гц, 1H), 3,61-3,43 (м, 3H), 3,35-3,25 (м, 4H), 3,10-2,98 (м, 1H), 2,93-2,72 (м, 2H), 2,50-2,30 (м, 2H), 2,23-1,96 (м, 2H), 1,02-0,83 (м, 4H).
Пример 63: Синтез соединения 207 и соединения 208 ((R)-2-амино-N-((3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-ил)-3,3,3-трифторпропанамид и (S)-2-амино-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-3,3,3-трифторпропанамид)
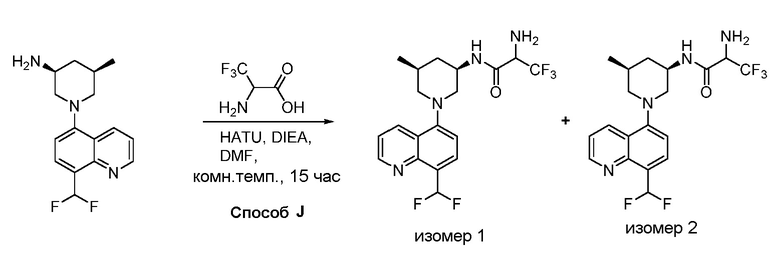
(R)-2-амино-N-((3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-ил)-3,3,3-трифторпропанамид и (S)-2-амино-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-3,3,3-трифторпропанамид: 2-амино-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-3,3,3-трифторпропанамид получали из (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина и 2-амино-3,3,3-трифторпропановой кислоты с использованием Способа J. Два диастереоизомера разделяли препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 53% - 55% градиент за 12 мин; детектор УФ 254 нм.
Изомер 1: (11 мг, 16%, белое твердое вещество) ВЭЖХ: чистота 98,5%, RT=1,88 мин. МС: m/z=417,2 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 8,87 (дд, J=4,2, 1,7 Гц, 1H), 8,58 (дд, J=8,6, 1,8 Гц, 1H), 7,91 (д, J=8,0 Гц, 1H), 7,87-7,44 (м, 2H), 7,22 (д, J=7,9 Гц, 1H), 4,30-4,18 (м, 1H), 3,89 (дт, J=7,7, 7,7 Гц, 1H), 3,58-3,47 (м, 1H), 3,39-3,28 (м, 1H), 2,55-2,35 (м, 2H), 2,3,9-2,08 (м, 2H), 1,29-1,05 (м, 1H), 1,00 (д, J=6,3 Гц, 3H).
Изомер 2: (13 мг, 19%, желтое твердое вещество) ВЭЖХ: чистота 93,8%, RT=3,84 мин. МС: m/z=417,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,87 (дд, J=4,2, 1,7 Гц, 1H), 8,58 (дд, J=8,6, 1,8 Гц, 1H), 7,91 (д, J=8,0 Гц, 1H), 7,87-7,44 (м, 2H), 7,22 (д, J=7,9 Гц, 1H), 4,30-4,18 (м, 1H), 3,89 (дт, J=7,7, 7,7 Гц, 1H), 3,58-3,47 (м, 1H), 3,39-3,28 (м, 1H), 2,55-2,35 (м, 2H), 2,3,9-2,08 (м, 2H), 1,29-1,05 (м, 1H), 1,00 (д, J=6,3 Гц, 3H).
Пример 64: Синтез соединения 210 (8-[(5R)-5-амино-3,3-диметилпиперидин-1-ил]хиноксалин-5-карбонитрил гидрохлорид)
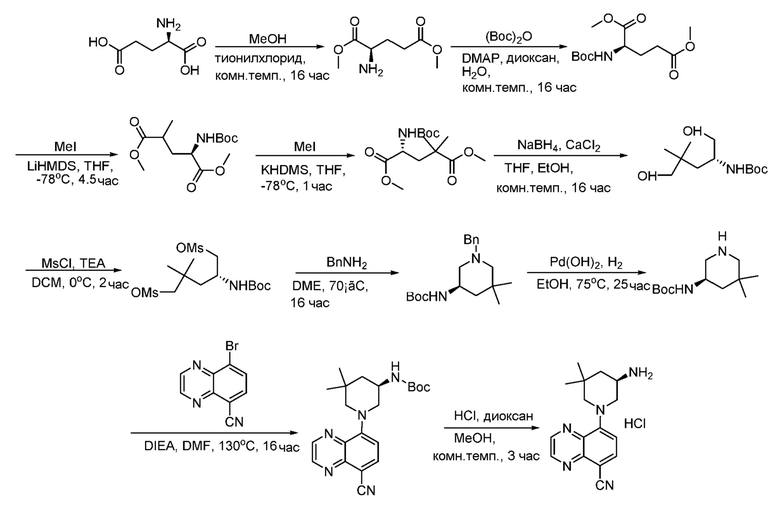
1,5-диметил (2R)-2-аминопентандиоат: при 0°C к раствору (2R)-2-аминопентандиовой кислоты (19,00 г, 129,14 ммоль) в метаноле (400 мл) добавляли тионилхлорид (60,95 г, 512,33 ммоль) по каплям в течение 20 минут. Полученный раствор затем перемешивали в течение 16 часов при комнатной температуре. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли при помощи DCM (500 мл) и значение pH смеси доводили до 8 насыщенным раствором бикарбоната натрия. Полученную смесь экстрагировали при помощи DCM (300 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 1,5-диметил (2R)-2-аминопентандиоата в виде желтого масла (19,80 г, 88%). МС: m/z=176,0 [M+H]+.
1,5-диметил (2R)-2-[[(трет-бутокси)карбонил]амино]пентандиоат: К раствору 1,5-диметил (2R)-2-аминопентандиоата (19,80 г, 119,30 ммоль) в диоксане (200 мл) добавляли 4-диметиламинопиридин (291 мг, 2,38 ммоль), (Boc)2O (29,93 г, 137,16 ммоль) и воду (200 мл) при комнатной температуре. Полученный раствор перемешивали в течение 16 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (100 мл). Полученную смесь экстрагировали при помощи DCM (200 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи DCM в гексане (0% - 30% градиент), с получением 1,5-диметил (2R)-2-[[(трет-бутокси)карбонил]амино]пентандиоата в виде бесцветного масла (23,75 г, 72%). МС: m/z=276,1 [M+H]+.
1,5-диметил (2R)-2-[[(трет-бутокси)карбонил]амино]-4-метилпентандиоат: при -78°C к раствору 1,5-диметил (2R)-2-[[(трет-бутокси)карбонил]амино]пентандиоата (3,80 г, 13,80 ммоль) в THF (40 мл) добавляли раствор LiHMDS (1 M в THF, 29 мл, 28,98 ммоль) по каплям в течение 5 минут. Полученную смесь перемешивали при -78°C в течение 1 часа и затем медленно добавляли MeI (3,13 г, 22,13 ммоль). Полученный раствор перемешивали еще в течение 4,5 часов при -78°C. Когда реакция была завершена, ее гасили путем добавления раствора хлористого водорода (1 M, 40 мл). Полученную смесь экстрагировали этилацетатом (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 10% градиент), с получением 1,5-диметил (2R)-2-[[(трет-бутокси)карбонил]амино]-4-метилпентандиоата в виде белого твердого вещества (3,33 г, 83%). МС: m/z=290,1 [M+H]+.
1,5-диметил (4R)-4-[[(трет-бутокси)карбонил]амино]-2,2-диметилпентандиоат: при -78°C раствор KHMDS в THF (1 M, 152 мл, 152 ммоль) добавляли к THF (150 мл), затем добавляли раствор 1,5-диметил (2R)-2-[[(трет-бутокси)карбонил]амино]-4-метилпентандиоата (3,52 г, 12,66 ммоль) в тетрагидрофуране (50 мл) по каплям в течение 5 минут. Полученный раствор перемешивали в течение 0,5 часа при -78°C и затем медленно добавляли MeI (1079 г, 76 ммоль). Полученный раствор затем перемешивали еще в течение 1 часа при -78°C. Когда реакция была завершена, ее гасили путем добавления насыщенного раствора NH4Cl (100 мл). Полученную смесь экстрагировали этилацетатом (200 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 5% градиент), с получением 1,5-диметил (4R)-4-[[(трет-бутокси)карбонил]амино]-2,2-диметилпентандиоата в виде светло-желтого твердого вещества (2,00 г, 52%). МС: m/z=304,1 [M+H]+.
трет-Бутил N-[(2R)-1,5-дигидрокси-4,4-диметилпентан-2-ил]карбамат: при 0°C к раствору 1,5-диметил (4R)-4-[[(трет-бутокси)карбонил]амино]-2,2-диметилпентандиоата (1,44 г, 4,75 ммоль) в EtOH (18 мл) добавляли THF (18 мл) и CaCl2 (2,19 г, 19,77 ммоль). Затем добавляли по порциям NaBH4 (1,56 г, 41,18 ммоль) в течение 20 минут при 0°C. Полученную смесь перемешивали в течение 16 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления раствора Na2CO3 (10%, 50 мл). Полученную смесь экстрагировали этилацетатом (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением трет-бутил N-[(2R)-1,5-дигидрокси-4,4-диметилпентан-2-ил]карбамата в виде бесцветного масла (1,42 г, неочищенный продукт). МС: m/z=248,1 [M+H]+.
трет-Бутил N-[(2R)-1,5-бис(метансульфонилокси)-4,4-диметилпентан-2-ил]карбамат: при 0°C к раствору трет-бутил N-[(2R)-1,5-дигидрокси-4,4-диметилпентан-2-ил]карбамата (1,42 г, неочищенный) в DCM (50 мл) добавляли TEA (2,32 г, 22,91 ммоль), затем добавляли MsCl (5,70 г, 49,76 ммоль) по каплям в течение 10 минут. Полученный раствор затем перемешивали в течение 2 часов при 0°C. Когда реакция была завершена, ее гасили путем добавления воды (20 мл). Полученную смесь экстрагировали этилацетатом (60 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением трет-бутил N-[(2R)-1,5-бис(метансульфонилокси)-4,4-диметилпентан-2-ил]карбамата в виде бесцветного масла (2,60 г, неочищенный продукт). МС: m/z=426,1 [M+H]+.
трет-Бутил N-[(3R)-1-бензил-5,5-диметилпиперидин-3-ил]карбамат: При комнатной температуре трет-бутил N-[(2R)-1,5-бис(метансульфонилокси)-4,4-диметилпентан-2-ил]карбамат (2,60 г, неочищенный) добавляли к фенилметанамину (20 мл). Полученный раствор затем перемешивали в течение 16 часов при 70°C. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 3% градиент), с получением трет-бутил N-[(3R)-1-бензил-5,5-диметилпиперидин-3-ил]карбамата в виде бесцветного масла (740 мг, 49% для 3 стадий). МС: m/z=319,2 [M+H]+.
трет-Бутил N-[(3R)-5,5-диметилпиперидин-3-ил]карбамат: в 30-мл реакторе высокого давления трет-бутил N-[(3R)-1-бензил-5,5-диметилпиперидин-3-ил]карбамат (666 мг, 2,09 ммоль) и Pd(OH)2/C (200 мг, 1,42 ммоль) смешивали в метаноле (5 мл, 123,49 ммоль, 291,31 экв.) при комнатной температуре в атмосфере азота в атмосфере. Реактор вакуумировали и продували водородом. Реакционную смесь затем гидрировали в течение 25 часов при 75°C под давлением водорода 15 атм. Когда реакция была завершена, реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении с получением трет-бутил N-[(3R)-5,5-диметилпиперидин-3-ил]карбамата в виде бесцветного масла (560 мг, неочищенный продукт). МС: m/z=229,0 [M+H]+.
трет-Бутил N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]карбамат: К раствору трет-бутил N-[(3R)-5,5-диметилпиперидин-3-ил]карбамата (560 мг, неочищенный) в DMF (5 мл) добавляли 8-бромхиноксалин-5-карбонитрил (766 мг, 3,27 ммоль) и DIEA (904 мг, 7,00 ммоль) при комнатной температуре. Полученный раствор затем перемешивали в течение 16 часов при 130°C. После охлаждения до комнатной температуры реакционную смесь гасили путем добавления воды (30 мл). Полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 14% градиент), с получением трет-бутил N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]карбамата в виде желтого твердого вещества (477 мг, 60% для 2 стадий). МС: m/z=382,0 [M+H]+.
8-[(5R)-5-амино-3,3-диметилпиперидин-1-ил]хиноксалин-5-карбонитрил гидрохлорид: К раствору трет-бутил N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]карбамата (439 мг, 1,15 ммоль) в MeOH (5 мл) добавляли раствор HCl в диоксане (4 M, 5 мл) при комнатной температуре. Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Когда реакция была завершена, полученную смесь концентрировали при пониженном давлении с получением 8-[(5R)-5-амино-3,3-диметилпиперидин-1-ил]хиноксалин-5-карбонитрил гидрохлорида в виде желтого твердого вещества (450 мг, неочищенный продукт). МС: m/z=282,2 [M+H]+.
Соединение 210: МС: m/z=282,1 [M+H]+.
Пример 65: Синтез соединения 211 и 212 (((R)-2-амино-N-((R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил)-3,3,3-трифторпропанамид и (S)-2-амино-N-((R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил)-3,3,3-трифторпропанамид)
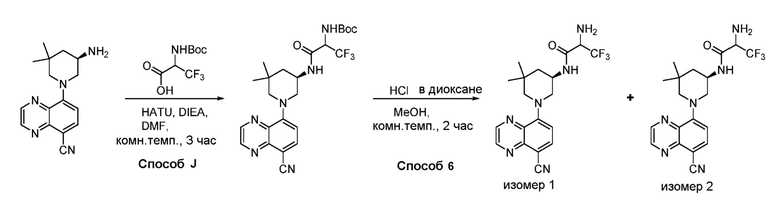
(R)-2-амино-N-((R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил)-3,3,3-трифторпропанамид и (S)-2-амино-N-((R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил)-3,3,3-трифторпропанамид: 2-амино-N-((R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил)-3,3,3-трифторпропанамид получали из (R)-8-(5-амино-3,3-диметилпиперидин-1-ил)хиноксалин-5-карбонитрила и 2-(трет-бутоксикарбониламино)-3,3,3-трифторпропановой кислоты с использованием Способа J и 6. Два диастереоизомера разделяли препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 40% - 70% градиент за 10 мин; детектор УФ 254 нм.
Изомер 1: (19 мг, 14% для 2 стадий, желтое твердое вещество) ВЭЖХ: чистота 93,0% =, RT=2,39 мин. МС: m/z=407,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 9,01-8,91 (м, 2H), 8,13 (д, J=8,4 Гц, 1H), 7,31 (д, J=8,4 Гц, 1H), 4,50-4,38 (м, 1H), 4,24 (дд, J=12,1, 4,1 Гц, 1H), 4,01-3,90 (м, 2H), 3,00-2,84 (м, 2H), 1,86-1,70 (м, 1H), 1,58-1,48 (м, 1H), 1,12 (с, 3H), 1,08 (м, 3H).
Изомер 2: (17 мг, 12% для 2 стадий, желтое твердое вещество) ВЭЖХ: чистота 93,7%, RT=2,46 мин. МС: m/z=407,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ9,01-8,91 (м, 2H), 8,13 (д, J=8,4 Гц, 1H), 7,31 (д, J=8,4 Гц, 1H), 4,50-4,38 (м, 1H), 4,24 (дд, J=12,1, 4,1 Гц, 1H), 4,01-3,90 (м, 2H), 3,00-2,84 (м, 2H), 1,86-1,70 (м, 1H), 1,58-1,48 (м, 1H), 1,12 (с, 3H), 1,08 (м, 3H).
Пример 66: Синтез соединения 213 ((2R)-N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]-2-гидрокси-3-метилбутанамид)
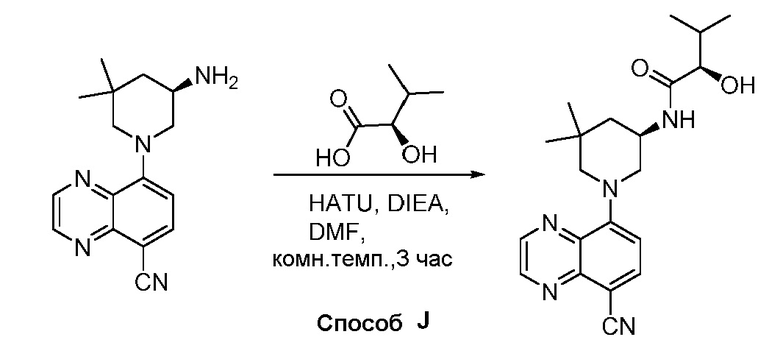
(2R)-N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]-2-гидрокси-3-метилбутанамид: (2R)-N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]-2-гидрокси-3-метилбутанамид получали из (2R)-2-гидрокси-3-метилбутановой кислоты и (R)-8-(5-амино-3,3-диметилпиперидин-1-ил)хиноксалин-5-карбонитрила с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 35% - 65% градиент за 8 мин; детектор УФ 254 нм. (2R)-N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]-2-гидрокси-3-метилбутанамид получали в виде желтого твердого вещества (18 мг, 33%).
Соединение 213: ВЭЖХ: чистота 97,2%, RT=2,51 мин. МС: m/z=382,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (дд, J=8,7, 1,8 Гц, 2H), 8,11 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 4,44-4,33 (м, 1H), 4,01 (дд, J=12,0, 4,0 Гц, 1H), 3,91 (д, J=3,7 Гц, 1H), 3,79 (д, J=12,1 Гц, 1H), 3,22-3,15 (м, 1H), 3,03 (д, J=12,1 Гц, 1H), 2,22-2,10 (м, 1H), 1,82-1,61 (м, 2H), 1,16-1,00 (м, 9H), 0,90 (д, J=6,8 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 214 (N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]-2-(морфолин-4-ил)ацетамид): из 8-[(5R)-5-амино-3,3-диметилпиперидин-1-ил]хиноксалин-5-карбонитрил гидрохлорида и 2-(морфолин-4-ил)уксусной кислоты. ВЭЖХ: чистота 97,0%, RT=1,87 мин. МС: m/z=409,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=15,0 Гц, 2H), 8,09 (д, J=8,4 Гц, 1H), 7,28 (д, J=6,3 Гц, 1H), 4,49-4,35 (м, 1H), 4,16-4,07 (м, 1H), 3,90 (д, J=12,3 Гц, 1H), 3,77-3,63 (м, 4H), 3,17-2,95 (м, 4H), 2,60-2,52 (м, 4H), 1,83-1,74 (м, 1H), 1,62-1,51 (м, 1H), 1,15-1,05 (м, 6H).
Соединение 215 (N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]-3,3-диметилбутанамид): из 3,3-диметилбутановой кислоты и (R)-8-(5-амино-3,3-диметилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,2%, RT=4,17 мин. МС: m/z=380,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,85 (м, 2H), 8,10 (д, J=8,4 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 4,48-4,36 (м, 1H), 4,36-4,26 (м, 1H), 4,11 (д, J=12,6 Гц, 1H), 2,90 (д, J=12,4 Гц, 1H), 2,80-2,68 (м, 1H), 2,12 (с, 2H), 1,85-1,75 (м, 1H), 1,44 (т, J=12,3 Гц, 1H), 1,13 (с, 3H), 1,04 (с, 9H), 1,02 (с, 3H).
Соединение 217 (N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]-2-(диметиламино)ацетамид): из 2-(диметиламино)уксусной кислоты и (R)-8-(5-амино-3,3-диметилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 97,9%, RT=2,95 мин. МС: m/z=367,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,12-8,04 (м, 1H), 7,31-7,23 (м, 1H), 4,46-4,33 (м, 1H), 4,11 (дд, J=11,6, 4,1 Гц, 1H), 3,91 (д, J=12,2 Гц, 1H), 3,11-2,92 (м, 4H), 2,34 (с, 6H), 1,78 (дд, J=12,9, 4,3 Гц, 1H), 1,58 (дд, J=12,8, 10,5 Гц, 1H), 1,12 (с, 3H), 1,07 (с, 3H).
Соединение 218 (N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]-2-гидроксиацетамид): из 2-гидроксиацетамида и (R)-8-(5-амино-3,3-диметилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 99,6%, RT=2,18 мин. МС: m/z=340,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,11 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 4,44-4,33 (м, 1H), 4,10-3,92 (м, 3H), 3,78 (д, J=12,1 Гц, 1H), 3,24 (дд, J=12,2, 8,5 Гц, 1H), 3,03 (д, J=12,1 Гц, 1H), 1,81-1,67 (м, 2H), 1,12 и 1,09 (с, 6H).
Соединение 220 (N-[(3R)-1-(8-цианохиноксалин-5-ил)-5,5-диметилпиперидин-3-ил]-3,3,3-трифторпропанамид): из 3,3,3-трифторпропановой кислоты и (R)-8-(5-амино-3,3-диметилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 96,0%, RT=2,62 мин. МС: m/z=392,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,11 (дд, J=8,4, 1,5 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 4,51-4,30 (м, 2H), 4,13-3,99 (м, 1H), 3,32-3,16 (м, 2H), 2,94 (д, J=12,3 Гц, 1H), 2,82 (т, J=11,9 Гц, 1H), 1,90-1,81 (м, 1H), 1,47 (т, J=12,2 Гц, 1H), 1,15 (с, 3H), 1,08 (с, 3H).
Пример 67: Синтез соединения 216 (8-[(5R)-5-[(2-метоксиэтил)амино]-3,3-диметилпиперидин-1-ил]хиноксалин-5-карбонитрил)
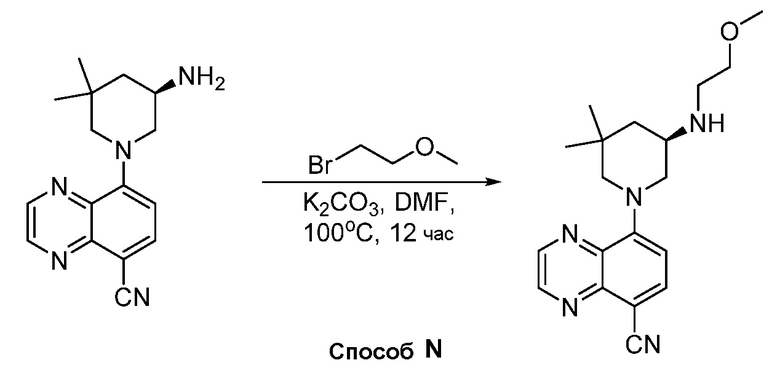
8-[(5R)-5-[(2-метоксиэтил)амино]-3,3-диметилпиперидин-1-ил]хиноксалин-5-карбонитрил: 8-[(5R)-5-[(2-метоксиэтил)амино]-3,3-диметилпиперидин-1-ил]хиноксалин-5-карбонитрил получали из 3,3-диметилбутановой кислоты и (R)-8-(5-амино-3,3-диметилпиперидин-1-ил)хиноксалин-5-карбонитрила с использованием Способа N. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 35% - 65% градиент за 8 мин; детектор УФ 254 нм. 8-[(5R)-5-[(2-метоксиэтил)амино]-3,3-диметилпиперидин-1-ил]хиноксалин-5-карбонитрил получали в виде желтого масла (13 мг, 11%).
Соединение 216: ВЭЖХ: чистота 95,0%, RT=2,30 мин. МС: m/z=340,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,96-8,86 (м, 2H), 8,09 (д, J=8,4 Гц, 1H), 7,22 (д, J=8,5 Гц, 1H), 4,61-4,52 (м, 1H), 3,93-3,85 (м, 1H), 3,63-3,51 (м, 2H), 3,40 (с, 3H), 3,37-3,30 (м, 1H), 2,98-2,91 (м, 2H), 2,86 (д, J=12,1 Гц, 1H), 2,62 (т, J=11,2 Гц, 1H), 1,96-1,87 (м, 1H), 1,33-1,20 (м, 1H), 1,12 (с, 3H), 1,06 (с, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 219 (8-[(5R)-3,3-диметил-5-[(1-метил-2-оксопирролидин-3-ил)амино]пиперидин-1-ил]хиноксалин-5-карбонитрил): из 2-гидроксиацетамида и (R)-8-(5-амино-3,3-диметилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 96,3%, RT=2,46 мин. МС: m/z=379,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,05 (дд, J=8,3, 0,9 Гц, 1H), 7,20 (дд, J=8,5, 2,1 Гц, 1H), 4,59 (шир.с, 1H), 3,95-3,81 (м, 1H), 3,70 (т, J=8,7 Гц, 1H), 3,48-3,35 (м, 3H), 2,89-2,80 (м, 4H), 2,67-2,48 (м, 2H), 1,97-1,76 (м, 2H), 1,31-1,18 (м, 1H), 1,11 и 1,06 (с, 6H).
Пример 68: Синтез соединения 221 (цис-8-[3-[(2-метоксиэтил)амино]-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрил)
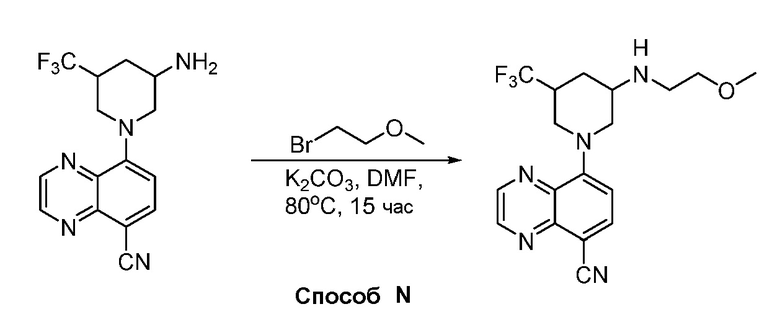
Цис-8-[3-[(2-метоксиэтил)амино]-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрил: цис-8-[3-[(2-метоксиэтил)амино]-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрил получали из 1-бром-2-метоксиэтана и цис-8-(3-амино-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрила с использованием Способа N. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 37% - 57% градиент за 8 мин; детектор УФ 254 нм. Цис-8-[3-[(2-метоксиэтил)амино]-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрил получали в виде желтого твердого вещества (30 мг, 27%).
Соединение 221: ВЭЖХ: чистота 99,2%, RT=1,37 мин. МС: m/z=380,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,13 (д, J=8,3 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,50-4,33 (м, 2H), 3,59-3,47 (м, 2H), 3,36 (с, 3H), 3,13-2,79 (м, 5H), 2,76-2,66 (м, 1H), 2,45-2,37 (м, 1H), 1,43 (тд, J=12,1, 12,1 Гц, 1H).
Пример 69: Синтез соединения 224, соединения 225, соединения 226 и соединения 227 (8-((3R,5S)-3-(((R)-1-метил-2-оксопирролидин-3-ил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил, 8-((3R,5S)-3-(((S)-1-метил-2-оксопирролидин-3-ил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил, 8-((3S,5R)-3-(((R)-1-метил-2-оксопирролидин-3-ил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил и 8-((3S,5R)-3-(((S)-1-метил-2-оксопирролидин-3-ил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил)
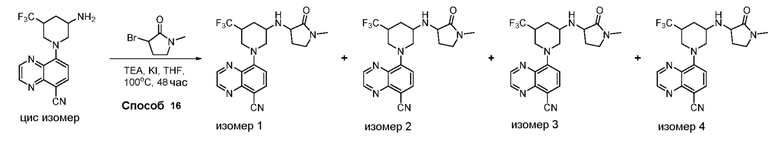
Способ 16
8-((3R,5S)-3-(((R)-1-метил-2-оксопирролидин-3-ил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил, 8-((3R,5S)-3-(((S)-1-метил-2-оксопирролидин-3-ил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил, 8-((3S,5R)-3-(((R)-1-метил-2-оксопирролидин-3-ил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил и 8-((3S,5R)-3-(((S)-1-метил-2-оксопирролидин-3-ил)амино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрил: К раствору цис-8-[3-амино-5-(трифторметил)пиперидин-1-ил]хиноксалин-5-карбонитрила (228 мг, 0,71 ммоль) в тетрагидрофуране (2 мл) добавляли TEA (359,03 мг, 3,55 ммоль), KI (353,39 мг, 2,13 ммоль), 3-бром-1-метилпирролидин-2-он (377,73 мг, 2,12 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 2 дней при 100°C. Когда реакция была завершена, ее гасили путем добавления воды (15 мл). Полученную смесь экстрагировали этилацетатом (30 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 35% - 65% градиент за 10 мин; детектор УФ 254 нм. Затем четыре энантиомера цис-8-(3-(1-метил-2-оксопирролидин-3-иламино)-5-(трифторметил)пиперидин-1-ил)хиноксалин-5-карбонитрила получали путем разделения методом хиральной препаративной ВЭЖХ при следующих условиях: колонка CHIRAL ADH, 0,46 × 15см, 5 мкм; подвижная фаза: EtOH (0,1% DEA) в гексане, 50% изократический в течение 20 мин; детектор УФ 254 нм. Четыре продукта были разделены и получены.
Изомер 1: (25 мг, 8%, желтое твердое вещество) ВЭЖХ: чистота 98,4%, RT=0,90 мин. МС: m/z=419,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,15 (д, J=8,3 Гц, 1H), 7,31 (д, J=8,4 Гц, 1H), 4,56-4,46 (м, 1H), 4,43-4,33 (м, 1H), 3,71 (т, J=8,7 Гц, 1H), 3,48-3,34 (м, 2H), 3,32-3,25 (м, 1H), 3,09-2,82 (м, 5H), 2,77 (дд, J=11,9, 10,6 Гц, 1H), 2,55-2,39 (м, 2H), 1,93-1,78 (м, 1H), 1,47 (кв., J=12,1 Гц, 1H).
Изомер 2: (25 мг, 8%, желтое твердое вещество) ВЭЖХ: чистота 97,4%, RT=1,17 мин. МС: m/z=407,2 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,99 (д, J=1,7 Гц, 1H), 8,85 (д, J=1,8 Гц, 1H), 8,03 (д, J=8,1 Гц, 1H), 7,24 (д, J=8,0 Гц, 1H), 4,56-4,42 (м, 1H), 4,38-4,30 (м, 1H), 4,22-4,06 (м, 1H), 3,82-3,68 (м, 1H), 3,60-3,20 (м, 3H), 3,10-2,40 (м, 8H), 2,15-1,82 (м, 1H), 1,30-1,20 (с, 1H).
Изомер 3: (25 мг, 8%, желтое твердое вещество) ВЭЖХ: чистота 97,1%, RT=0,90 мин. МС: m/z=419,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,82 (м, 2H), 8,13 (д, J=8,3 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 4,49-4,43(м, 2H), 3,77-3,63 (m 1H), 3,49-3,34 (м, 2H), 3,29-3,01 (м, 1H), 3,07-2,80 (м, 5H), 2,79-2,67 (м, 1H), 2,56-2,36 (м, 2H), 1,93-1,81 (м, 1H), 1,55-1,41 (м, 1H).
Изомер 4: (25 мг, 8%, желтое твердое вещество) ВЭЖХ: чистота 93,9%, RT=0,90 мин. МС: m/z=419,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,15 (д, J=8,3 Гц, 1H), 7,31 (д, J=8,4 Гц, 1H), 4,56-4,46 (м, 1H), 4,43-4,33 (м, 1H), 3,71 (т, J=8,7 Гц, 1H), 3,48-3,34 (м, 2H), 3,32-3,25 (м, 1H), 3,09-2,82 (м, 5H), 2,77 (дд, J=11,9, 10,6 Гц, 1H), 2,55-2,39 (м, 2H), 1,93-1,78 (м, 1H), 1,47 (кв., J=12,1 Гц, 1H).
Следующие соединения синтезировали аналогичным способом:
Соединение 237 и соединение 238 ((R)-1-метил-3-(((3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-ил)амино)пирролидин-2-он и (S)-1-метил-3-[[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]амино]пирролидин-2-он): из (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина и 3-бром-1-метилпирролидин-2-она. Изомер 1: 14 мг, 11%, желтое твердое вещество) ВЭЖХ: чистота 97,0%, RT=1,69 мин. МС: m/z=407,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (дд, J=4,2, 1,7 Гц, 1H), 8,59 (дд, J=8,6, 1,8 Гц, 1H), 8,02 (д, J=8,0 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,22 (д, J=8,0 Гц, 1H), 3,73-3,59 (м, 2H), 3,43-3,24 (м, 4H), 2,85 (с, 3H), 2,54-2,36 (м, 3H), 2,28-2,18 (м, 1H), 2,15-2,07 (м, 1H), 1,89-1,79 (м, 1H), 1,07-0,92 (м, 4H). Изомер 2: (11 мг, 9%, желтое твердое вещество) ВЭЖХ: чистота 98,7%, RT=1,46 мин. МС: m/z=407,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,92 (дд, J=4,2, 1,7 Гц, 1H), 8,59 (дд, J=8,6, 1,8 Гц, 1H), 8,02 (д, J=8,0 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,22 (д, J=8,0 Гц, 1H), 3,73-3,59 (м, 2H), 3,43-3,24 (м, 4H), 2,85 (с, 3H), 2,54-2,36 (м, 3H), 2,28-2,18 (м, 1H), 2,15-2,07 (м, 1H), 1,89-1,79 (м, 1H), 1,07-0,92 (м, 4H).
Пример 70: Синтез соединения 231 (8-[(3R,5S)-3-[(1-гидрокси-2-метилпропан-2-ил)амино]-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрил)
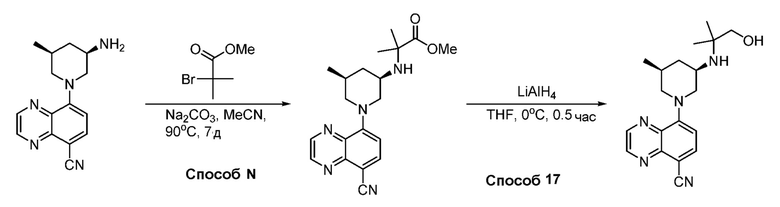
метил 2-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-иламино)-2-метилпропаноат: метил 2-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-иламино)-2-метилпропаноат получали из метил 2-бром-2-метилпропановой кислоты и 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрила с использованием Способа N. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи MeOH в DCM (0% - 5% градиент), с получением метил 2-[[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]амино]-2-метилпропаноата в виде желтого твердого вещества (190 мг, 61%). МС: m/z=368,2 [M+H]+.
Способ 17
8-[(3R,5S)-3-[(1-гидрокси-2-метилпропан-2-ил)амино]-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрил: при 0°C к раствору метил 2-[[(3R)-1-(8-цианохиноксалин-5-ил)пиперидин-3-ил]амино]-2-метилпропаноата (143 мг, 0,40 ммоль) в тетрагидрофуране (5 мл) медленно добавляли LiAlH4 (14 мг, 0,37 ммоль). Полученную смесь перемешивали в течение 0,5 часа при 0°C. Когда реакция была завершена, ее гасили путем добавления воды (10 мл). Полученную смесь экстрагировали при помощи DCM (20 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 32% - 35% градиент за 10 мин; детектор УФ 254 нм. 8-[(3R,5S)-3-[(1-гидрокси-2-метилпропан-2-ил)амино]-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрил получали в виде желтого твердого вещества (15 мг, 11%).
Соединение 231: ВЭЖХ: чистота 98,9%, RT=0,56 мин. МС: m/z=340,0 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (д, J=1,7 Гц, 1H), 8,87 (д, J=1,7 Гц, 1H), 8,10 (д, J=8,4 Гц, 1H), 7,21 (д, J=8,4 Гц, 1H), 4,60-4,50 (м, 1H), 3,99-3,90 (м, 1H), 3,48 (д, J=10,8 Гц, 1H), 3,40 (д, J=10,8 Гц, 1H), 3,23-3,11 (м, 1H), 2,64-2,52 (м, 2H), 2,14-1,97 (м, 2H), 1,21-1,01 (м, 10H).
Следующие соединения синтезировали аналогичным способом:
Соединение 242 (2-метил-2-[[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]амино]пропан-1-ол): из 2-(морфолин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 99,6%, RT=1,54 мин. МС: m/z=382,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,2, 1,7 Гц, 1H), 8,57 (дд, J=8,6, 1,7 Гц, 1H), 7,99 (д, J=8,0 Гц, 1H), 7,55 (дд, J=8,6, 4,2 Гц, 1H), 7,17 (д, J=8,0 Гц, 1H), 3,50-3,21 (м, 4H), 3,20-3,10 (м, 1H), 2,47-2,32 (м, 2H), 2,17-2,01 (м, 2H), 1,07 (д, J=9,0 Гц, 6H), 0,99-0,95 (м, 4H).
Соединение 252 (2-метил-2-[[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]амино]пропан-1-ол): из 2-(морфолин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 99,1%, RT=1,27 мин. МС: m/z=383,1 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,16-8,86 (м, 2H), 8,05 (д, J=8,5 Гц, 1H), 7,18 (д, J=8,2 Гц, 1H), 4,70-4,47 (м, 1H), 4,23 (д, J=11,8 Гц, 1H), 3,88 (дд, J=11,6, 3,8 Гц, 1H), 3,49-3,10 (м, 5H), 3,09-2,89 (м, 1H), 2,50-2,35 (м, 3H), 2,03-1,87 (м, 2H), 1,15-0,80 (м, 7H).
Пример 71: Синтез соединения 249 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид)
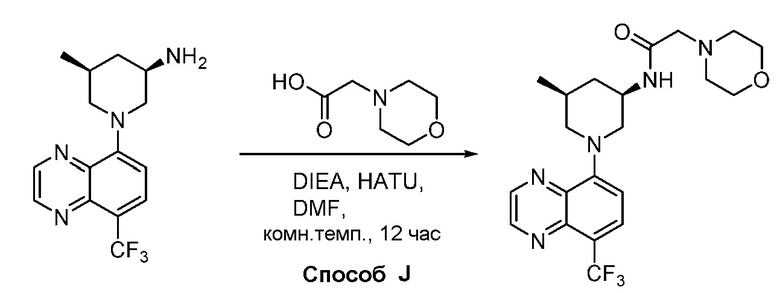
N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид: N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид получали из 1-метилпирролидин-3-карбоновой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 44% - 46% градиент за 8 мин; детектор УФ 254 нм. N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид получали в виде желтого твердого вещества (30 мг, 46%).
Соединение 249: ВЭЖХ: чистота 99,7%, RT=1,40 мин. МС: m/z=438,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,88 (м, 2H), 8,04 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,29-4,07 (м, 2H), 4,13-4,05 (м, 1H), 3,74 (кажущийся т, J=4,6 Гц, 4H), 3,12-2,99 (м, 2H), 2,77 (т, J=10,6 Гц, 1H), 2,65-2,50 (м, 5H), 2,15-2,06 (м, 2H), 1,27 (тд, J=12,3, 12,3 Гц, 1H), 1,04 (д, J=6,4 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 250 (2-гидрокси-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид): из 2-гидроксиуксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 99,0%, RT=2,60 мин. МС: m/z=369,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,88 (м, 2H), 8,05 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,31-4,23 (м, 1H), 4,18 (дд, J=11,6, 4,3 Гц, 1H), 4,10-4,03 (м, 1H), 3,30-3,20 (м, 2H), 2,84 (дд, J=11,5, 10,4 Гц, 1H), 2,63 (дд, J=12,1, 10,4 Гц, 1H), 2,16-2,10 (м, 2H), 1,33 (тд, J=12,1, 12,1 Гц, 1H), 1,05 (д, J=6,4 Гц, 3H).
Соединение 251 (1-гидрокси-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]циклопропан-1-карбоксамид): из 1-гидроксициклопропанкарбоновой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 99,8%, RT=1,46 мин. МС: m/z=395,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,96-8,85 (кв., J=1,7 Гц, 2H), 8,05 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,28-4,00 (м, 3H), 2,88 (т, J=10,9 Гц, 1H), 2,65 (т, J=12,0 Гц, 1H), 2,18-2,06 (м, 2H), 1,37 (тд, J=12,3, 12,3 Гц, 1H), 1,31-1,15 (м, 2H), 1,09-0,96 (м, 5H).
Соединение 253 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(1-метилпиперидин-4-ил)ацетамид): из 2-(1-метилпиперидин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 96,5%, RT=2,27 мин. МС: m/z=450,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,02 (д, J=1,7 Гц, 1H), 8,95 (д, J=1,7 Гц, 1H), 8,06 (д, J=8,4 Гц, 1H), 7,87 (д, J=7,5 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 4,21-4,07 (м, 2H), 3,99-3,94 (м, 1H), 2,75-2,50 (м, 4H), 2,12 (с, 3H), 2,03-1,87 (м, 4H), 1,80 (т, J=11,5 Гц, 2H), 1,67-1,50 (м, 3H), 1,23-1,04 (м, 3H), 0,92 (д, J=6,3 Гц, 3H).
Соединение 254 (2-(диметиламино)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид): из 2-(1-метилпиперидин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 97,4%, RT=0,98 мин. МС: m/z=396,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,88 (м, 2H), 8,04 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 4,30-4,16 (м, 2H), 4,11-4,07 (м, 1H), 3,01 (д, J=1,6 Гц, 2H), 2,82-2,71 (м, 1H), 2,60 (дд, J=12,2, 10,6 Гц, 1H), 2,33 (с, 6H), 2,18-2,05 (м, 2H), 1,26 (тд, J=12,4, 12,4 Гц, 1H), 1,03 (д, J=6,4 Гц, 3H).
Соединение 255 (2-(1,4-диметилпиперидин-4-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид): из 2-(1-метилпиперидин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 93,3%, RT=5,03 мин. МС: m/z=464,5 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,86 (м, 2H), 8,08-7,99 (м, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,28-4,08 (м, 3H), 2,70-2,25 (м, 9H), 2,20-2,04 (м, 4H), 1,80-1,62 (м, 2H), 1,58-1,40 (м, 2H), 1,25-0,90 (м, 7H).
Соединение 256 (2-[1-(2,2-дифторэтил)пиперидин-4-ил]-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид): из 2-(1-метилпиперидин-4-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 99,1%, RT=2,62 мин. МС: m/z=500,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,88 (м, 2H), 8,04 (д, J=8,4 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 6,15-5,85 (м, 1H), 4,27-4,08 (м, 3H), 3,02-2,94 (м, 2H), 2,82-2,51 (м, 4H), 2,27-2,21 (м, 2H), 2,19-2,05 (м, 4H), 1,85-1,67 (м, 3H), 1,43-1,27 (м, 2H), 1,18 (тд, J=12,5, 12,5 Гц, 1H), 1,02 (д, J=6,3 Гц, 3H).
Соединение 257 (3,3-дифтор-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]циклобутан-1-карбоксамид): из 3,3-дифторциклобутанкарбоновой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 98,3%, RT=1,72 мин. МС: m/z=429,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,89 (м, 2H), 8,05 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,25-4,10 (м, 3H), 2,97-2,86 (м, 1H), 2,84-2,54 (м, 6H), 2,19-2,03 (м, 2H), 1,17 (тд, J=12,3, 12,3 Гц, 1H), 1,02 (д, J=6,3 Гц, 3H).
Соединение 258 (1-метил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]пирролидин-3-карбоксамид): из 3,3-дифторциклобутанкарбоновой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 90,4%, RT=1,28 мин. МС: m/z=422,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,93-8,86 (м, 2H), 8,02 (д, J=8,3 Гц, 1H), 7,27 (д, J=8,3 Гц, 1H), 4,25-4,06 (м, 3H), 3,04-2,89 (м, 2H), 2,82-2,77 (м, 1H), 2,70-2,42 (м, 4H), 2,37 (с, 3H), 2,17-1,96 (м, 4H), 1,16 (тд, J=12,4, 12,4 Гц, 1H), 1,00 (д, J=6,4 Гц, 3H).
Соединение 259 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(4-метилпиперазин-1-ил)ацетамид): из 3,3-дифторциклобутанкарбоновой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 97,1%, RT=1,38 мин. МС: m/z=451,3 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,10-8,95 (м, 2H), 8,07 (д, J=8,3 Гц, 1H), 7,65 (д, J=8,0 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 4,17-3,93 (м, 3H), 3,40-3,30 (м, 1H), 3,00-2,85 (м, 2H), 2,78 (т, J=11,1 Гц, 1H), 2,62-2,22 (м, 8H), 2,16 (с, 3H), 1,95 (д, J=11,5 Гц, 2H), 1,26 (тд, J=12,3, 12,3 Гц, 1H), 0,94 (д, J=6,3 Гц, 3H).
Соединение 292 (2-гидрокси-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]пропанамид): из 2-гидроксипропановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 98,9%, RT=2,41 мин. МС: m/z=385,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,86 (м, 2H), 8,05 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,27-4,05 (м, 4H), 2,83 (т, J=10,8 Гц, 1H), 2,62 (т, J=11,3 Гц, 1H), 2,16-2,06 (м, 2H), 1,41-1,24 (м, 4H), 1,04 (д, J=6,4 Гц, 3H).
Соединение 293 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(1-метилпиперидин-3-ил)ацетамид): из 2-(1-метилпиперидин-3-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 99,4%, RT=1,03 мин. МС: m/z=450,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,05-8,95 (м, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,87 (д, J=7,5 Гц, 1H), 7,27 (д, J=8,3 Гц, 1H), 4,25-4,07 (м, 2H), 3,99-3,87 (м, 1H), 2,59-2,40 (м, 4H), 2,10 (с, 3H), 2,02-1,72 (м, 6H), 1,65-1,35 (м, 4H), 1,10 (тд, J=12,0, 12,0 Гц, 1H), 0,95-0,78 (м, 4H).
Соединение 295 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(1-метилпирролидин-3-ил)ацетамид): из 2-(1-метилпирролидин-3-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 92,1%, RT=4,92 мин. МС: m/z=436,1 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,03 (д, J=1,7 Гц, 1H), 8,97 (д, J=1,7 Гц, 1H), 8,07 (д, J=8,4 Гц, 1H), 7,89 (д, J=7,6 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,22-4,07 (м, 2H), 3,99-3,85 (м, 1H), 2,70-2,30 (м, 9H), 2,18-2,02 (м, 3H), 2,00-1,80 (м, 3H), 1,42-1,29 (м, 1H), 1,20-1,04 (м, 1H), 0,93 (д, J=6,3 Гц, 3H).
Соединение 299 (2-(3,3-дифторазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]пропанамид): из 2-(3,3-дифторазетидин-1-ил)пропановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 94,2%, RT=2,63 мин. МС: m/z=458,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92-8,88 (м, 2H), 8,02 (д, J=8,3 Гц, 1H), 7,27 (д, J=8,3 Гц, 1H), 4,20-4,06 (м, 3H), 3,76-3,59 (м, 4H), 3,14-3,02 (м, 1H), 2,81-2,70 (м, 1H), 2,61-2,55 (м, 1H), 2,14-1,99 (м, 2H), 1,32-1,18 (м, 4H), 1,01 (д, J=6,4 Гц, 3H).
Пример 72: Синтез соединения 260 и соединения 261 ((R)-3-(((3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил)амино)-1-метилпирролидин-2-он и (S)-3-[[(3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил]амино]-1-метилпирролидин-2-он)
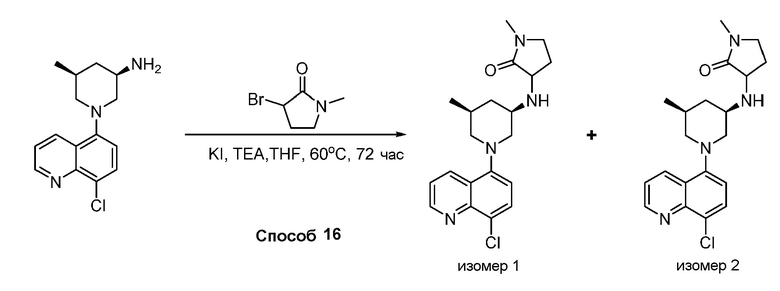
(R)-3-(((3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил)амино)-1-метилпирролидин-2-он и (S)-3-[[(3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил]амино]-1-метилпирролидин-2-он: 3-[[(3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил]амино]-1-метилпирролидин-2-он получали из (3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-амина и 3-бром-1-метилпирролидин-2-она с использованием Способа 16. Неочищенный продукт сначала очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 20% - 55% градиент за 8 мин; детектор УФ 254 нм. Затем два диастереоизомера 3-[[(3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил]амино]-1-метилпирролидин-2-она получали путем разделения методом хиральной препаративной ВЭЖХ при следующих условиях: колонка Chiral PAK ID-3, 0,46 × 10 см, 3 мкм; подвижная фаза: EtOH в гексане, 50% изократический в течение 12 мин; детектор УФ 254/220 нм.
Изомер 1: (30 мг, 15%, светло-желтое твердое вещество) ВЭЖХ: чистота 99,4%, RT=1,26 мин. МС: m/z=373,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,96 (д, J=4,3 Гц, 1H), 8,72-8,65 (м, 1H), 7,86 (д, J=8,1 Гц, 1H), 7,67 (дд, J=8,5, 4,3 Гц, 1H), 7,28 (д, J=8,1 Гц, 1H), 4,09 (т, J=9,1 Гц, 1H), 3,83-3,64 (м, 2H), 3,54-3,40 (м, 2H), 3,40-3,25 (м, 1H), 2,92 (с, 3H), 2,71 (т, J=10,5 Гц, 1H), 2,56 (дт, J=12,7, 6,9 Гц, 1H), 2,46 (т, J=11,3 Гц, 1H), 2,34 (д, J=12,4 Гц, 1H), 2,26-2,14 (м, 1H), 2,13-1,97 (м, 1H), 1,21 (тд, J=12,0, 12,0 Гц, 1H), 1,07 (д, J=6,5 Гц, 3H).
Изомер 2: (30 мг, 15%, светло-желтое твердое вещество) ВЭЖХ: чистота 99,1%, RT=0,98 мин. МС: m/z=373,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ8,96 (д, J=4,3 Гц, 1H), 8,72-8,65 (м, 1H), 7,86 (д, J=8,1 Гц, 1H), 7,67 (дд, J=8,5, 4,3 Гц, 1H), 7,28 (д, J=8,1 Гц, 1H), 4,09 (т, J=9,1 Гц, 1H), 3,83-3,64 (м, 2H), 3,54-3,40 (м, 2H), 3,40-3,25 (м, 1H), 2,92 (с, 3H), 2,71 (т, J=10,5 Гц, 1H), 2,56 (дт, J=12,7, 6,9 Гц, 1H), 2,46 (т, J=11,3 Гц, 1H), 2,34 (д, J=12,4 Гц, 1H), 2,26-2,14 (м, 1H), 2,13-1,97 (м, 1H), 1,21 (тд, J=12,0, 12,0 Гц, 1H), 1,07 (д, J=6,5 Гц, 3H).
Пример 73: Синтез соединения 262 (N-[(3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил]-2-(морфолин-4-ил)ацетамид)
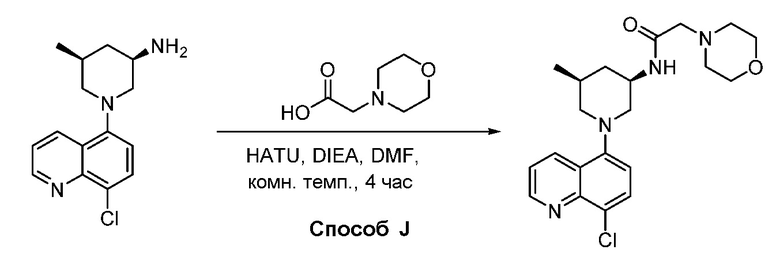
N-[(3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил]-2-(морфолин-4-ил)ацетамид: N-[(3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил]-2-(морфолин-4-ил)ацетамид получали из 3,3-дифторциклобутанкарбоновой кислоты и (3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-амина с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 20% - 39% (удерживание 39,0% в течение 7 мин) градиент за 10 мин; детектор УФ 254 нм. N-[(3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил]-2-(морфолин-4-ил)ацетамид получали в виде светло-желтого твердого вещества (30 мг, 30%).
Соединение 262: ВЭЖХ: чистота 99,8%, RT=1,43 мин. МС: m/z=403,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,93 (дд, J=4,2, 1,7 Гц, 1H), 8,71 (дд, J=8,5, 1,7 Гц, 1H), 7,81 (д, J=7,8 Гц, 1H), 7,65 (дд, J=8,5, 4,2 Гц, 1H), 7,20 (д, J=8,2 Гц, 1H), 4,31-4,24 (м, 1H), 3,73 (т, J=4,6 Гц, 4H), 3,54-3,44 (м, 1H), 3,32-3,23 (м, 1H), 3,04 (с, 2H), 2,59-2,40 (м, 6H), 2,23-2,03 (м, 2H), 1,21 (тд, J=12,0, 12,0 Гц, 1H), 1,04 (д, J=6,5 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 263 (N-[(3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил]-2-гидроксиацетамид): из 2-гидроксиуксусной кислоты и (3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 99,9%, RT=1,25 мин. МС: m/z=334,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,93 (дд, J=4,2, 1,6 Гц, 1H), 8,71 (дд, J=8,5, 1,6 Гц, 1H), 7,81 (д, J=8,1 Гц, 1H), 7,65 (дд, J=8,5, 4,2 Гц, 1H), 7,20 (д, J=8,1 Гц, 1H), 4,35-4,27 (м, 1H), 3,99 (с, 2H), 3,52-3,43 (м, 1H), 3,31-3,25 (м, 1H), 2,58 (т, J=10,8 Гц, 1H), 2,45 (т, J=11,1 Гц, 1H), 2,24-2,07 (м, 2H), 1,24 (тд, J=12,0, 12,0 Гц, 1H), 1,04 (д, J=6,5 Гц, 3H).
Соединение 264 (N-[(3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-ил]-2-(диметиламино)ацетамид): из 2-гидроксиуксусной кислоты и (3R,5S)-1-(8-хлорхинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 99,4%, RT=1,50 мин. МС: m/z=361,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,91 (дд, J=4,3, 1,7 Гц, 1H), 8,74-8,64 (м, 1H), 7,79 (дд, J=8,3, 0,8 Гц, 1H), 7,62 (дд, J=8,5, 4,2 Гц, 1H), 7,23-7,13 (м, 1H), 4,29-4,20 (м, 1H), 3,48-3,43 (м, 1H), 3,27-3,22 (м, 1H), 2,97 (с, 2H), 2,51 (т, J=10,8 Гц, 1H), 2,42 (т, J=11,2 Гц, 1H), 2,28 (с, 6H), 2,17-2,06 (м, 2H), 1,17 (тд, J=12,2, 12,2 Гц, 1H), 1,02 (д, J=6,4 Гц, 3H).
Пример 74: Синтез соединения 267 (2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]пропанамид)
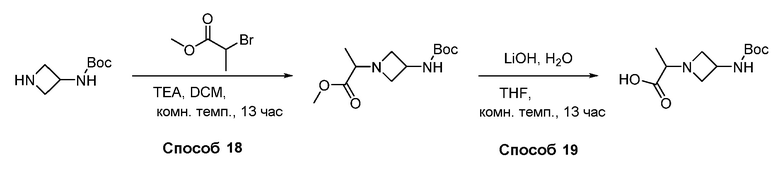
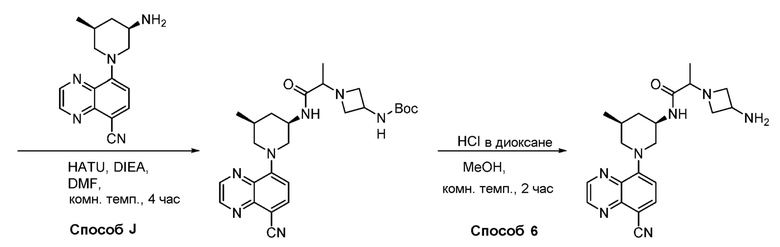
Способ 18
Этил 2-(3-[[(трет-бутокси)карбонил]амино]азетидин-1-ил)пропаноат: К раствору трет-бутил N-(азетидин-3-ил)карбамат (475 мг, 2,76 ммоль) в DCM (40 m) добавляли триэтиламин (418 мг, 4,14 ммоль) и этил 2-бромпропаноат (749 мг, 4,14 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 13 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (10 мл). Полученный раствор экстрагировали этилацетатом (30 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 50% градиент), с получением этил 2-(3-[[(трет-бутокси)карбонил]амино]азетидин-1-ил)пропаноата в виде желтого масла (330 мг, 44%). МС: m/z=259,3 [M+H]+.
Способ 19
Этил 2-(3-[[(трет-бутокси)карбонил]амино]азетидин-1-ил): К раствору этил 2-(3-[[(трет-бутокси)карбонил]амино]азетидин-1-ил)пропаноата (475 мг, 1,74 ммоль) в THF (5 мл) добавляли раствор LiOH (125 мг) в воде (15 мл) при комнатной температуре. Полученную смесь затем перемешивали в течение 13 часов при комнатной температуре. Когда реакция была завершена, значение pH реакционной смеси доводили до 5 раствором хлористого водорода (2 M). Полученную смесь экстрагировали при помощи DCM (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 2-(3-[[(трет-бутокси)карбонил]амино]азетидин-1-ил)пропановой кислоты в виде белого твердого вещества (300 мг, 70%). МС: m/z=245,1 [M+H]+
2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]пропанамид: 2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]пропанамид получали из 2-(3-(трет-бутоксикарбониламино)азетидин-1-ил)пропановой кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила с использованием Способа J и 6. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 24% - 31% градиент за 6 мин; детектор УФ 254 нм. 2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]пропанамид получали в виде желтого твердого вещества (24 мг, 17% для 2 стадий).
Соединение 267: ВЭЖХ: чистота 95,6%, RT=1,27 мин. МС: m/z=394,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,85 (м, 2H), 8,09 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,5 Гц, 1H), 4,35-4,05 (м, 3H), 3,66-3,50 (м, 3H), 2,96-2,65 (м, 5H), 2,07 (д, J=11,9 Гц, 2H), 1,33-1,22 (м, 1H), 1,16 (д, J=6,7 Гц, 3H), 1,02 (д, J=6,3 Гц, 3H).
Пример 75: Синтез соединения 270 ((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил 2-(3-гидроксиазетидин-1-ил)ацетат)
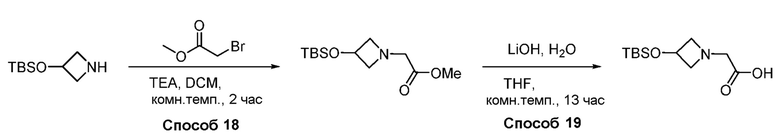
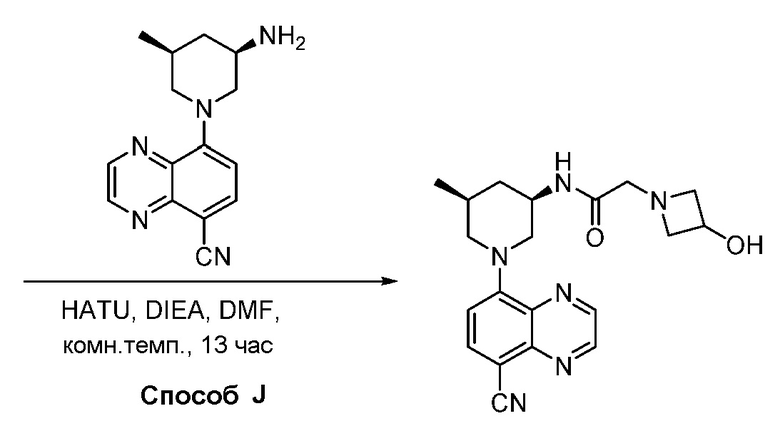
(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил 2-(3-гидроксиазетидин-1-ил)ацетат: (3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил 2-(3-гидроксиазетидин-1-ил)ацетат получали из 3-(трет-бутилдиметилсилилокси)азетидина, метил 2-бромацетата и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила с использованием Способа 18, 19 и J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 28% - 32% градиент за 7 мин; детектор УФ 254 нм. (3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил 2-(3-гидроксиазетидин-1-ил)ацетат получали в виде желтого твердого вещества (22 мг, 10% для 3 стадий).
Соединение 270: ВЭЖХ: чистота 97,7%, RT=2,43 мин. МС: m/z=381,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,85 (м, 2H), 8,08 (д, J=8,4 Гц, 1H), 7,26 (д, J=8,4 Гц, 1H), 4,42-4,21 (м, 3H), 4,19-4,07 (м, 1H), 3,77-3,68 (м, 2H), 3,18 (д, J=1,1 Гц, 2H), 3,08-2,99 (м, 2H), 2,87-2,76 (м, 1H), 2,72-2,60 (м, 1H), 2,12-1,96 (м, 2H), 1,26 (тд, J=12,1, 12,1 Гц, 1H), 1,01 (д, J=6,3 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 271 ((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил 2-(3-гидроксиазетидин-1-ил)пропаноат): из 3-(трет-бутилдиметилсилилокси)азетидина, этил 2-бромпропаноата и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 96,9%, RT=1,06 мин. МС: m/z=395,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,85 (м, 2H), 8,09 (д, J=8,4 Гц, 1H), 7,27 (дд, J=8,4, 1,1 Гц, 1H), 4,39-4,23 (м, 3H), 4,18-4,07 (м, 1H), 3,66-3,60 (м, 2H), 3,01-2,76 (м, 4H), 2,73-2,62 (м, 1H), 2,08-2,03 (м, 2H), 1,36-1,20 (м, 1H), 1,16 (д, J=6,8 Гц, 3H), 1,01 (д, J=6,4 Гц, 3H).
Соединение 273 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(3,3-дифторазетидин-1-ил)пропанамид): из 3,3-дифторазетидина, этил 2-бромпропаноата и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 97,0%, RT=1,50 мин. МС: m/z=415,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,09 (д, J=8,4 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 4,34-4,21 (м, 2H), 4,20-4,06 (м, 1H), 3,77-3,58 (м, 4H), 3,12-3,02 (м, 1H), 2,90-2,78 (м, 1H), 2,74-2,62 (м, 1H), 2,11-1,98 (м, 2H), 1,37-1,18 (м, 4H), 1,01 (д, J=6,4 Гц, 3H).
Соединение 275 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(4-гидроксипиперидин-1-ил)пропанамид): из пиперидин-4-ола, этил 2-бромпропаноата и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила. ВЭЖХ: чистота 96,7%, RT=1,82 и 1,86 мин. МС: m/z=423,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,09 (д, J=8,4 Гц, 1H), 7,28 (дд, J=8,4, 1,8 Гц, 1H), 4,39-4,10 (м, 3H), 3,62 (дд, J=9,2, 4,9 Гц, 1H), 3,15-2,98 (м, 1H), 2,90-2,63 (м, 4H), 2,42-2,19 (м, 2H), 2,15-1,80 (м, 4H), 1,56 (д, J=9,7 Гц, 2H), 1,36-1,19 (м, 4H), 1,02 (д, J=6,3 Гц, 3H).
Соединение 284 ((3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил 2-(3-гидроксиазетидин-1-ил)ацетат): из 2-(3-(трет-бутилдиметилсилилокси)азетидин-1-ил)уксусной кислоты. ВЭЖХ: чистота 99,9%, RT=1,32 мин. МС: m/z=423,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,91 (дд, J=4,2, 1,7 Гц, 1H), 8,63 (дд, J=8,6, 1,8 Гц, 1H), 8,01 (д, J=8,1 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,21 (д, J=8,1 Гц, 1H), 4,40-4,16 (м, 2H), 3,74-3,65 (м, 2H), 3,61-3,52 (м, 1H), 3,41-3,32 (м, 1H), 3,15 (с, 2H), 3,01 (дд, J=8,2, 6,0 Гц, 2H), 2,60-2,40 (м, 2H), 2,20-2,05 (м, 2H), 1,19 (тд, J=12,0, 12,0 Гц, 1H), 1,02 (д, J=6,4 Гц, 3H).
Соединение 285 (2-(3-гидроксиазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]пропанамид): из 2-(3-(трет-бутилдиметилсилилокси)азетидин-1-ил)пропановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 98,2%, RT=3,41 мин. МС: m/z=437,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94 (дд, J=4,3, 1,7 Гц, 1H), 8,69-8,62 (м, 1H), 8,04 (д, J=8,3 Гц, 1H), 7,63 (дд, J=8,6, 4,2 Гц, 1H), 7,23 (д, J=8,0 Гц, 1H), 4,38-4,31 (м, 1H), 4,25 (дд, J=11,7, 4,7 Гц, 1H), 3,62 (д, J=6,4 Гц, 3H), 3,39 (д, J=12,0 Гц, 1H), 2,95 (дт, J=23,0, 6,3 Гц, 3H), 2,62-2,42 (м, 2H), 2,11-2,16 (м, 2H), 1,28-1,12 (м, 4H), 1,08-1,01 (м, 3H).
Соединение 296 (2-(3-гидроксиазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид): из 2-(3-(трет-бутилдиметилсилилокси)азетидин-1-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 99,1%, RT=1,26 мин. МС: m/z=424,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92-8,85 (м, 2H), 8,02 (д, J=8,4 Гц, 1H), 7,29-7,22 (м, 1H), 4,34 (тт, J=6,1, 6,1 Гц, 1H), 4,21-416 (м, 2H), 4,08-4,05 (м, 1H), 3,71 (дд, J=8,4, 6,2 Гц, 2H), 3,17 (с, 2H), 3,05-3,01 (м, 2H), 2,78-2,67 (м, 1H), 2,57 (т, J=11,4 Гц, 1H), 2,09-2,05 (м, 2H), 1,22 (тд, J=12,7, 11,8 Гц, 1H), 1,01 (д, J=6,4 Гц, 3H).
Соединение 297 ((3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил 2-(3-гидроксиазетидин-1-ил)пропаноат): из 2-(3-(трет-бутилдиметилсилилокси)азетидин-1-ил)пропановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 93,0%, RT=3,18 мин. МС: m/z=438,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,88 (м, 2H), 8,04 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,38-4,34 (м, 1H), 4,20-4,06 (м, 3H), 3,69-3,60 (м, 2H), 3,00-2,82 (м, 3H), 2,76-2,74 (м, 1H), 2,59 (т, J=11,7 Гц, 1H), 2,18-2,04 (м, 2H), 1,33-1,14 (м, 4H), 1,03 (д, J=6,5 Гц, 3H).
Соединение 308 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-(3-гидроксиазетидин-1-ил)ацетамид): из 2-(3-(трет-бутилдиметилсилилокси)азетидин-1-ил)уксусной кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 97,9%, RT=2,52 мин. МС: m/z=405,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,2, 1,7 Гц, 1H), 8,61 (дд, J=8,6, 1,8 Гц, 1H), 7,93 (д, J=8,0 Гц, 1H), 7,83-7,55 (м, 2H), 7,25 (д, J=7,9 Гц, 1H), 4,40-4,30 (м, 1H), 4,27-4,18 (м, 1H), 3,74-3,65 (м, 2H), 3,58-3,49 (м, 1H), 3,35-3,20 (м, 1H), 3,15 (с, 2H), 3,05-2,96 (м, 2H), 2,58-2,38 (м, 2H), 2,18-2,02 (м, 2H), 1,17 (тд, J=12,0, 12,0 Гц, 1H), 1,03 (д, J=6,5 Гц, 3H).
Соединение 309 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-(3-гидроксиазетидин-1-ил)пропанамид): из 2-(3-(трет-бутилдиметилсилилокси)азетидин-1-ил)пропановой кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 95,7%, RT=2,47 мин. МС: m/z=419,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,2, 1,7 Гц, 1H), 8,61 (дт, J=8,6, 1,7 Гц, 1H), 7,93 (д, J=8,0 Гц, 1H), 7,85-7,55 (м, 2H), 7,26 (д, J=7,9 Гц, 1H), 4,36-4,28 (м, 1H), 4,26-4,17 (м, 1H), 3,62-3,55 (м, 2H), 3,55-3,48 (м, 1H), 3,39-3,20 (м, 1H), 2,94-2,85 (м, 3H), 2,56-2,41 (м, 2H), 2,20-2,04 (м, 2H), 1,23-1,13 (м, 4H), 1,03 (д, J=6,5 Гц, 3H).
Соединение 320 (N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-2-(3-гидроксиазетидин-1-ил)ацетамид): из 2-[3-[(трет-бутилдиметилсилил)oxy]азетидин-1-ил]уксусной кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 91,1%, RT=2,97 мин. МС: m/z=406,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,90-8,82 (м, 2H), 7,96 (д, J=8,2 Гц, 1H), 7,63 (т, J=55,6 Гц, 1H), 7,33 (д, J=8,1 Гц, 1H), 4,40-4,30 (м, 1H), 4,25-4,15 (м, 1H), 4,09 (дд, J=11,4, 4,1 Гц, 1H), 3,98 (д, J=12,0 Гц, 1H), 3,74-3,70 (м, 2H), 3,17 (с, 2H), 3,05-3,01 (м, 2H), 2,69 (т, J=11,0 Гц, 1H), 2,53 (т, J=11,4 Гц, 1H), 2,18-2,04 (м, 2H), 1,22-1,18 (м, 1H), 1,01 (д, J=6,4 Гц, 3H).
Соединение 321 (N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-2-(3-гидроксиазетидин-1-ил)пропанамид): из 2-[3-[(трет-бутилдиметилсилил)oxy]азетидин-1-ил]пропановой кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 94,2%, RT=1,24 мин. МС: m/z=420,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,91-8,80 (м, 2H), 8,00-7,92 (м, 1H), 7,63 (т, J=55,9 Гц, 1H), 7,33 (д, J=8,2 Гц, 1H), 4,36-4,30 (м, 1H), 4,22-4,16 (м, 1H), 4,11-3,95 (м, 2H), 3,66-3,60 (м, 2H), 3,00-2,85 (м, 3H), 2,72-2,65 (м, 1H), 2,52 (т, J=11,5 Гц, 1H), 2,09 (м, 2H), 1,31-1,13 (м, 4H), 1,01 (д, J=6,4 Гц, 3H).
Пример 76: Синтез соединения 272 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(2,2-дифторциклопропил)ацетамид)
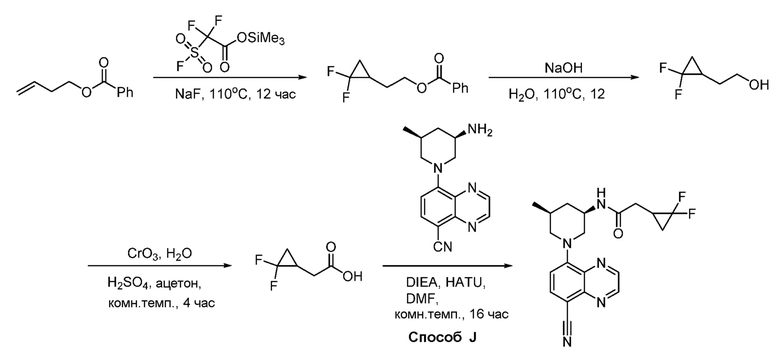
2-(2,2-дифторциклопропил)этилбензоат: Бут-3-ен-1-илбензоат (2,85 г, 16,17 ммоль) и триметилсилил 2,2-дифтор-2-(фторсульфонил)ацетат (7,98 г, 31,89 ммоль) смешивали в чистом виде, затем добавляли NaF (36 мг, 0,86 ммоль). Полученную смесь перемешивали в течение 12 часов при 110°C. После охлаждения до комнатной температуры реакцию гасили путем добавления воды (20 мл). Полученную смесь экстрагировали этилацетатом (80 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 6% градиент), с получением 2-(2,2-дифторциклопропил)этилбензоата в виде желтого масла (1,84 г, 50%). МС: m/z=227,1 [M+H]+.
2-(2,2-дифторциклопропил)этан-1-ол: К раствору 2-(2,2-дифторциклопропил)этилбензоата (900 мг, 3,98 ммоль) в воде (20 мл) добавляли гидроксид натрия (1,60 г, 40,00 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 16 часов при 100°C. После охлаждения до комнатной температуры реакционную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 2-(2,2-дифторциклопропил)этан-1-ола в виде бесцветной жидкости (210 мг, 43%). ГХМС: m/z=122 [M]+.
2-(2,2-дифторциклопропил)уксусная кислота: при 0°C к раствору CrO3 (5,70 г, 57,00 ммоль) в серной кислоте (8,3 мл) добавляли воду (92 мл). Затем добавляли по каплям раствор 2-(2,2-дифторциклопропил)этан-1-ола (180 мг, 1,47 ммоль) в ацетоне (30 мл) в течение 20 минут. Полученную смесь перемешивали в течение 4 часов при комнатной температуре. Когда реакция была завершена, реакционную смесь экстрагировали простым эфиром (50 мл × 4). Органические слои объединяли, промывали 2 M раствором гидроксида натрия (50 мл ×4) и водные слои объединяли. Значение pH полученного водного раствора доводили до 1 с использованием серной кислоты и экстрагировали простым эфиром (50 мл ×4). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 2-(2,2-дифторциклопропил)уксусной кислоты в виде бесцветного масла (117 мг, 58%). ГХМС: m/z=136 [M]+.
(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил 2-(3-гидроксиазетидин-1-ил)пропаноат: N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(2,2-дифторциклопропил)ацетамид получали из 3-(трет-бутилдиметилсилилокси)азетидина, этил 2-бромпропаноата и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,1% NH3.H2O), 30% - 60% градиент за 7 мин; детектор УФ 254 нм. N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(2,2-дифторциклопропил)ацетамид получали в виде желтого твердого вещества (30 мг, 33%).
Соединение 272: ВЭЖХ: чистота 98,5%, RT=1,45 мин. МС: m/z=386,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,10 (д, J=8,4 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 4,45-4,36 (м, 1H), 4,32 (д, J=12,7 Гц, 1H), 4,21-4,09 (м, 1H), 2,82-2,62 (м, 2H), 2,51-2,30 (м, 2H), 2,16-1,83 (м, 3H), 1,62-1,48 (м, 1H), 1,33-1,07 (м, 2H), 1,02 (д, J=6,4 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 286 (2-(2,2-дифторциклопропил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид): из 2-(2,2-дифторциклопропил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 98,0%, RT=1,77 мин. МС: m/z=428,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,97-8,91 (м, 1H), 8,74-8,62 (м, 1H), 8,03 (д, J=8,0 Гц, 1H), 7,64 (дд, J=8,6, 4,2 Гц, 1H), 7,22 (д, J=8,0 Гц, 1H), 4,24 (м, 1H), 3,69-3,60 (м, 1H), 3,44-3,35 (м, 1H), 2,56-2,39 (м, 3H), 2,33 (дд, J=15,4, 7,4 Гц, 1H), 2,24-2,09 (м, 2H), 2,00-1,80 (м, 1H), 1,61-1,45 (м, 1H), 1,23-0,97 (м, 5H).
Соединение 298 (2-(2,2-дифторциклопропил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид): из 2-(2,2-дифторциклопропил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 97,0%, RT=1,73 мин. МС: m/z=429,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-,88 (м, 2H), 8,10 (д, J=8,3 Гц, 1H), 7,35 (д, J=8,4 Гц, 1H), 4,34-4,14 (м, 3H), 2,78-2,28 (м, 4H), 2,22-2,11 (м, 2H), 2,05-1,86 (м, 1H), 1,66-1,52 (м, 1H), 1,31-1,13 (м, 2H), 1,08 (д, J=6,4 Гц, 3H).
Соединение 310 (2-(2,2-дифторциклопропил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]ацетамид): из 2-(2,2-дифторциклопропил)уксусной кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 99,3%, RT=1,46 мин. МС: m/z=410,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,91 (дд, J=4,1, 1,7 Гц, 1H), 8,67-8,60 (м, 1H), 7,95 (д, J=7,9 Гц, 1H), 7,85-7,54 (м, 2H), 7,26 (д, J=7,9 Гц, 1H), 4,28-4,20 (м, 1H), 3,65-3,56 (м, 1H), 3,40-3,34 (м, 1H), 2,52-2,41 (м, 3H), 2,32 (дд, J=15,6, 7,8 Гц, 1H), 2,24-2,08 (м, 2H), 1,96-1,84 (м, 1H), 1,58-1,49 (м, 1H), 1,22-1,01 (м, 5H).
Соединение 322 (2-(2,2-дифторциклопропил)-N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]ацетамид): из 2-(2,2-дифторциклопропил)уксусной кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 96,9%, RT=3,24 мин. МС: m/z=411,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,85 (м, 2H), 7,96 (д, J=8,2 Гц, 1H), 7,63 (т, J=55,9 Гц, 1H), 7,34 (д, J=8,2 Гц, 1H), 4,27-4,10 (м, 2H), 4,05-3,97 (м, 1H), 2,64-2,58 (м, 1H), 2,55-2,38 (м, 2H), 2,37-2,26 (м, 1H), 2,13-2,06 (м, 2H), 1,95-1,83 (м, 1H), 1,59-1,45 (м, 1H), 1,21-1,04 (м, 2H), 1,00 (д, J=6,3 Гц, 3H).
Пример 77: Синтез соединения 274 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(3,3-дифторазетидин-1-ил)пропанамид)
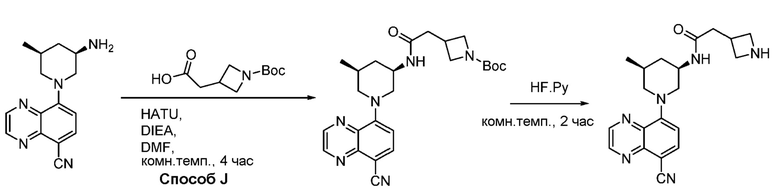
трет-бутил 3-([[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамоил]метил)азетидин-1-карбоксилат: трет-бутил 3-([[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамоил]метил)азетидин-1-карбоксилат получали из 2-(1-(трет-бутоксикарбонил)азетидин-3-ил)уксусной кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила с использованием Способа J. Неочищенное вещество очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 50% градиент), с получением трет-бутил 3-([[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамоил]метил)азетидин-1-карбоксилата в виде желтого твердого вещества (90 мг, 15%). МС: m/z=465,3 [M+H]+.
2-(азетидин-3-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]ацетамид: при 0°C к трет-бутил 3-([[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]карбамоил]метил)азетидин-1-карбоксилату (85 мг, 0,18 ммоль) добавляли раствор HF-Пиридин (7 мл) по каплям. Полученный раствор перемешивали еще в течение 2 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (15 мл). Полученную смесь экстрагировали при помощи DCM (30 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи MeOH в DCM (0% - 10% градиент), с получением 2-(азетидин-3-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]ацетамида в виде желтого твердого вещества (14 мг 21%).
Соединение 274: ВЭЖХ: чистота 91,4%, RT=2,80 мин. МС: m/z=365,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,80 (м, 2H), 8,10-7,98 (м, 1H), 7,22 (д, J=8,4 Гц, 1H), 4,28 (т, J=14,1 Гц, 2H), 4,13-3,85 (м, 3H), 3,65 (т, J=8,4 Гц, 2H), 3,13 (дт, J=15,7, 7,8 Гц, 1H), 2,77-2,42 (м, 4H), 2,12-1,92 (м, 2H), 1,25-0,92 (м, 4H).
Пример 78: Синтез соединения 276 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(4-метил-1,4-диазепан-1-ил)ацетамид)
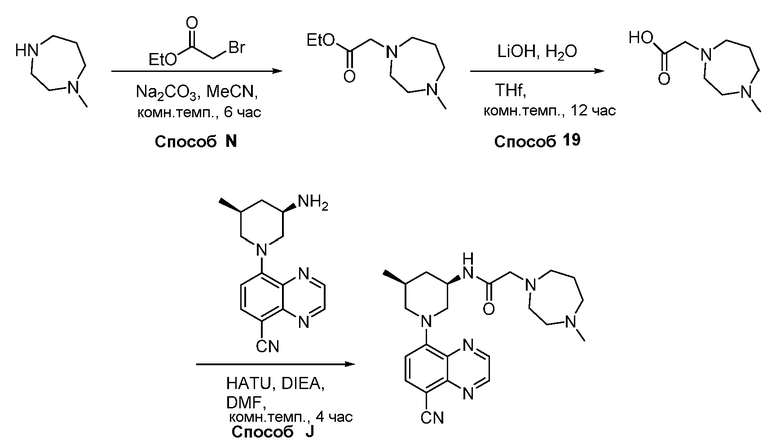
N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(4-метил-1,4-диазепан-1-ил)ацетамид: N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(4-метил-1,4-диазепан-1-ил)ацетамид получали из 1-метил-1,4-диазепана, этил 2-бромацетата и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила с использованием Способа N, 19 и J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 27% - 28% градиент за 10 мин; детектор УФ 254 нм. N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(4-метил-1,4-диазепан-1-ил)ацетамид получали в виде желтого твердого вещества (12 мг, 5% для 3 стадий).
Соединение 276: ВЭЖХ: чистота 96,6%, RT=1,08 мин. МС: m/z=422,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,24 (д, J=8,5 Гц, 1H), 4,38-4,12 (м, 3H), 3,15 (с, 2H), 2,90-2,60 (м, 10H), 2,37 (с, 3H), 2,14-1,94 (м, 2H), 1,90-1,74 (м, 2H), 1,29 (д, J=12,4 Гц, 1H), 1,00 (д, J=6,4 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 290 (2-(4-метил-1,4-диазепан-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид): из 2-(4-метил-1,4-диазепан-1-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 96,5%, RT=1,47 мин. МС: m/z=464,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (дд, J=4,2, 1,8 Гц, 1H), 8,65 (дд, J=8,6, 1,8 Гц, 1H), 8,02 (д, J=8,1 Гц, 1H), 7,61 (дд, J=8,6, 4,2 Гц, 1H), 7,22 (д, J=8,0 Гц, 1H), 4,28 (т, J=11,4 Гц, 1H), 3,58 (д, J=11,0 Гц, 1H), 3,38 (д, J=11,7 Гц, 1H), 3,18-3,14 (м, 2H), 2,81-2,30 (м, 13H), 2,23-2,03 (м, 2H), 1,83 (кв., J=5,7 Гц, 2H), 1,25 (тд, J=11,9, 11,9 Гц, 1H), 1,04 (д, J=6,4 Гц, 3H).
Соединение 314 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-(4-метил-1,4-диазепан-1-ил)ацетамид): из 2-(4-метил-1,4-диазепан-1-ил)уксусной кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 95,3%, RT=2,46 мин. МС: m/z=446,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,91 (дд, J=4,3, 1,8 Гц, 1H), 8,65 (дд, J=8,5, 1,8 Гц, 1H), 8,00-7,54 (м, 3H), 7,29 (д, J=7,9 Гц, 1H), 4,36-4,24 (м, 1H), 3,61-3,52 (м, 1H), 3,44-3,30 (м, 1H), 3,18 (с, 2H), 2,84-2,67 (м, 8H), 2,64-2,44 (м, 2H), 2,41 (с, 3H), 2,27-2,08 (м, 2H), 1,87-1,81 (м, 2H), 1,26 (тд, J=12,1, 12,0 Гц, 1H), 1,06 (д, J=6,4 Гц, 3H).
Соединение 326 (N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-2-(4-метил-1,4-диазепан-1-ил)ацетамид): из 2-(4-метил-1,4-диазепан-1-ил)уксусной кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 87,1%, RT=1,29 мин. МС: m/z=447,5 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,85 (м, 2H), 7,97 (д, J=8,2 Гц, 1H), 7,63 (т, J=56,0 Гц, 1H), 7,34 (д, J=8,3 Гц, 1H), 4,32-4,18 (м, 1H), 4,13-4,09 (м, 1H), 4,00-3,98 (м, 1H), 3,20-2,95 (м, 2H), 2,83-2,64 (м, 9H), 2,55 (т, J=11,3 Гц, 1H), 2,39 (с, 3H), 2,13-2,07 (м, 2H), 1,90-1,76 (м, 2H), 1,30-1,24 (м, 1H), 1,12-0,99 (м, 3H).
Соединение 362 (2-(4-метил-1,4-диазепан-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид): из (3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амина и 2-(4-метил-1,4-диазепан-1-ил)уксусной кислоты. ВЭЖХ: чистота 93,7%, RT=2,36 мин. МС: m/z=465,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,86 (м, 2H), 8,04 (д, J=8,3 Гц, 1H), 7,28 (д, J=8,3 Гц, 1H), 4,23-4,09 (м, 3H), 3,21 (с, 2H), 2,86-2,60 (м, 10H), 2,49 (с, 3H), 2,12-2,08 (м, 2H), 1,89-1,85 (м, 2H), 1,36-1,20 (м, 1H), 1,04 (д, J=6,3 Гц, 3H).
Пример 79: Синтез соединения 280 (2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид)
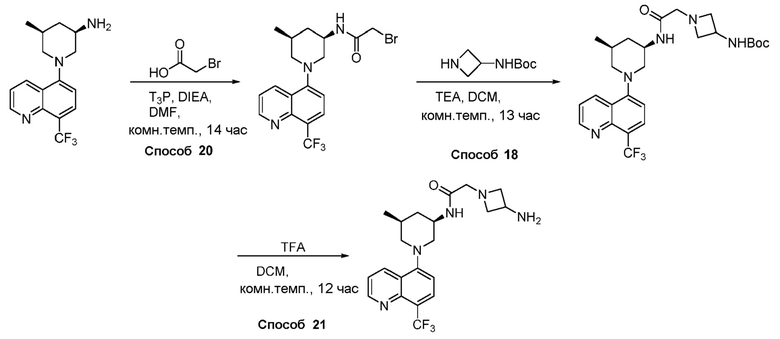
Способ 20
2-бром-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид: К раствору (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина (266 мг, 0,86 ммоль) в N,N-диметилформамиде (10 мл) добавляли 2-бромуксусную кислоту (475 мг, 3,42 ммоль), T3P (817 мг, 2,57 ммоль), DIEA (551 мг, 4,26 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 14 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (10 мл). Полученную смесь экстрагировали при помощи DCM (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением 2-бром-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамида в виде желтого твердого вещества (400 мг, неочищенный продукт).
(Примечание: в Способе 20 в качестве растворителя также можно использовать дихлорметан вместо N,N-диметилформамида)
трет-бутил N-[1-([[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]карбамоил]метил)азетидин-3-ил]карбамат: трет-бутил N-[1-([[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]карбамоил]метил)азетидин-3-ил]карбамат получали из трет-бутил азетидин-3-илкарбамата и 2-бром-N-((3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-ил)ацетамида с использованием Способа 18. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 30% - 45% градиент за 8 мин; детектор УФ 254 нм. трет-бутил N-[1-([[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]карбамоил]метил)азетидин-3-ил]карбамат получали в виде белого твердого вещества (38 мг, 26% для 2 стадий). МС: m/z=522,3 [M+H]+.
Способ 21
2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид: К раствору трет-бутил N-[1-([[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]карбамоил]метил)азетидин-3-ил]карбамата (18 мг, 0,03 ммоль) в дихлорметане (5 мл) добавляли трифторуксусную кислоту (0,5 мл) при комнатной температуре. Полученный раствор перемешивали в течение 12 часов при комнатной температуре. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3+0,1% NH3.H2O), 30% - 45% градиент за 7 мин; детектор УФ 254 нм. N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-2-(1-метилпиперидин-3-ил)ацетамид получали в виде белого твердого вещества (7 мг, 44%).
Соединение 280: ВЭЖХ: чистота 92,4%, RT=2,48 мин. МС: m/z=422,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (дд, J=4,3, 1,7 Гц, 1H), 8,64 (дд, J=8,6, 1,8 Гц, 1H), 8,02 (д, J=8,1 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,21 (д, J=8,0 Гц, 1H), 4,30-4,16 (м, 1H), 3,70-3,53 (м, 4H), 3,38 (д, J=11,5 Гц, 1H), 3,14 (с, 2H), 2,98-2,90 (м, 2H), 2,60-2,40 (м, 2H), 2,22-2,08 (м, 2H), 1,20 (тд, J=12,0, 12,0 Гц, 1H), 1,03 (д, J=6,5 Гц, 3H).
Пример 80: Синтез соединения 281 (2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]пропанамид)
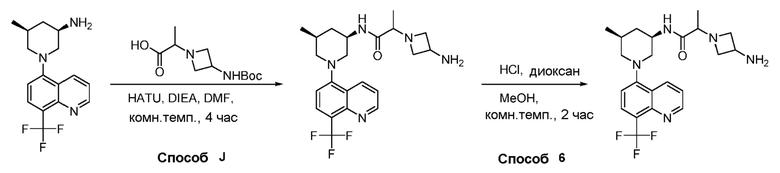
2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]пропанамид: 2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]пропанамид получали из 2-(3-(трет-бутоксикарбониламино)азетидин-1-ил)пропановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина с использованием Способа J и 6. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 30% - 37% градиент за 7 мин; детектор УФ 254 нм. 2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]пропанамид получали в виде белого твердого вещества (17 мг, 17% для 2 стадий).
Соединение 281: ВЭЖХ: чистота 99,2%, RT=2,51 мин. МС: m/z=436,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (дд, J=4,2, 1,7 Гц, 1H), 8,63 (дт, J=8,6, 1,8 Гц, 1H), 8,02 (д, J=8,1 Гц, 1H), 7,61 (дд, J=8,6, 4,2 Гц, 1H), 7,21 (д, J=8,0 Гц, 1H), 4,29-4,15 (м, 1H), 3,61-3,47 (м, 4H), 3,41-3,33 (м, 1H), 2,91-2,75 (м, 3H), 2,59-2,41 (м, 2H), 2,21-2,05 (м, 2H), 1,31-1,09 (м, 4H), 1,03 (д, J=6,4 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 282 (2-амино-2-циклопропил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид): из 2-(трет-бутоксикарбониламино)-2-циклопропилуксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 96,3%, RT=1,76 мин. МС: m/z=407,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 9,19-9,04 (м, 2H), 8,26 (д, J=6,2 Гц, 1H), 7,98-7,95 (м, 1H), 7,42 (т, J=7,8 Гц, 1H), 4,26-4,25 (м, 1H), 3,69 (д, J=11,4 Гц, 1H), 3,48 (д, J=11,3 Гц, 1H), 3,15 (дд, J=9,7, 4,8 Гц, 1H), 2,77-2,53 (м, 2H), 2,25-2,05 (м, 2H), 1,28-1,23 (м, 2H), 1,03 (д, J=6,3 Гц, 3H), 0,84-0,58 (м, 3H), 0,56-0,45 (м, 1H).
Соединение 288 (2-(азетидин-3-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид): из 2-(3,3-дифторазетидин-1-ил)пропановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 91,7%, RT=4,98 мин. МС: m/z=407,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,13-9,00 (м, 2H), 8,23 (д, J=8,2 Гц, 1H), 7,92 (дд, J=8,6, 4,8 Гц, 1H), 7,40 (д, J=8,2 Гц, 1H), 4,28-4,08 (м, 3H), 3,93 (т, J=8,9 Гц, 2H), 3,70 (д, J=11,1 Гц, 1H), 3,48 (д, J=11,7 Гц, 1H), 3,30-3,16 (м, 1H), 2,69-2,52 (м, 4H), 2,25-2,09 (м, 2H), 1,21 (тд, J=14,0, 11,9 Гц, 1H), 1,04 (д, J=6,3 Гц, 3H).
Соединение 291 (4-амино-3,3-диметил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]бутанамид): из 4-[[(трет-бутокси)карбонил]амино]-3,3-диметилбутановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 95,1%, RT=1,09 мин. МС: m/z=423,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,3, 1,7 Гц, 1H), 8,61 (дд, J=8,6, 1,8 Гц, 1H), 7,99 (д, J=8,0 Гц, 1H), 7,58 (дд, J=8,6, 4,2 Гц, 1H), 7,17 (д, J=8,0 Гц, 1H), 4,23-4,16 (м, 1H), 3,63-3,52 (м, 1H), 3,35 (кажущийся д, J=12,0 Гц, 1H), 2,64 (с, 2H), 2,52-2,38 (м, 2H), 2,18 (с, 2H), 2,13-2,04 (м, 2H), 1,29-0,96 (м, 10H).
Соединение 476 ((S)-2-Амино-3-гидрокси-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-пропионамид): из (3R,5S)-1-[8-(трифторметил)хинолин-5-ил]-5-метилпиперидин-3-амина и (S)-2-трет-бутоксикарбониламино-3-гидрокси-пропионовой кислоты. ВЭЖХ: чистота >99%, RT=2,69 мин. МС: m/z=397,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,01 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,6, 1,8 Гц, 1H), 8,05 (д, J=8,1 Гц, 1H), 7,81 (д, J=7,7 Гц, 1H), 7,67 (дд, J=8,6, 4,2 Гц, 1H), 7,19 (д, J=8,1 Гц, 1H), 4,67 (т, J=5,6 Гц, 1H), 3,48 (дт, J=10,2, 5,0 Гц, 2H), 3,42-3,33 (м, 2H), 3,17 (дд, J=6,2, 4,9 Гц, 1H), 2,42 (т, J=11,4 Гц, 1H), 2,14-1,93 (м, 2H), 1,78 (с, 2H), 1,16 (кв., J=12,1 Гц, 1H), 0,95 (д, J=6,5 Гц, 3H).
Соединение 514 (3-амино-3-метил-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-бутирамид): из (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и 3-трет-бутоксикарбониламино-3-метил-масляной кислоты. 1H ЯМР (400 МГц, DMSO-d6) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,54 (дд, J=8,6, 1,8 Гц, 1H), 8,21 (д, J=7,5 Гц, 1H), 8,06 (д, J=8,1 Гц, 1H), 7,68 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,1 Гц, 1H), 3,61-3,46 (м, 1H), 2,47-2,34 (м, 2H), 2,10 (с, 4H), 1,68 (с, 2H), 1,06 (с, 6H), 0,96 (д, J=6,5 Гц, 3H). МС: m/z=409 [M+H]+.
Пример 81: Синтез соединения 294 (2-амино-2-циклопропил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид)
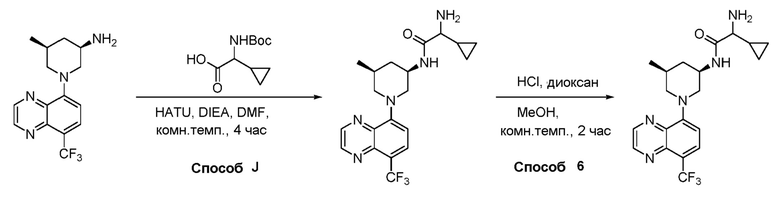
2-амино-2-циклопропил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид: 2-амино-2-циклопропил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид получали из 2-(1-метилпиперидин-3-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина с использованием Способа J и 6. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 30% - 55% градиент за 8 мин; детектор УФ 254 нм. 2-амино-2-циклопропил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид получали в виде желтого твердого вещества (30 мг, 38% для 2 стадий).
Соединение 294: ВЭЖХ: чистота 99,3%, RT=1,46 мин. МС: m/z=408,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,88 (м, 2H), 8,05 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,26-4,20 (м, 2H), 4,11 (дд, J=12,3, 3,3 Гц, 1H), 2,77-2,53 (м, 3H), 2,18-2,05 (м, 2H), 1,31-1,17 (м, 1H), 1,11-0,96 (м, 4H), 0,64-0,44 (м, 3H), 0,40-0,31 (м, 1H).
Следующие соединения синтезировали аналогичным способом:
Соединение 300 (2-(азетидин-3-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид): из 2-(1-(трет-бутоксикарбонил)азетидин-3-ил)уксусной кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 91,9%, RT=5,29 мин. МС: m/z=408,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,02 (д, J=1,8 Гц, 1H), 8,96 (д, J=1,8 Гц, 1H), 8,06 (д, J=8,4 Гц, 1H), 7,95 (с, 1H), 7,27 (д, J=8,4 Гц, 1H), 4,21-4,05 (м, 2H), 4,00-3,84 (м, 1H), 3,63-3,40 (м, 4H), 2,81-2,48 (м, 3H), 2,39 (д, J=7,7 Гц, 2H), 1,99-1,94 (м, 2H), 1,12 (тд, J=12,0, 12,0 Гц, 1H), 0,92 (д, J=6,3 Гц, 3H).
Соединение 301 (4-амино-3,3-диметил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]бутанамид): из 4-(трет-бутоксикарбониламино)-3,3-диметилбутановой кислоты и (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина. ВЭЖХ: чистота 92,8%, RT=1,06 мин. МС: m/z=424,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (д, J=7,3 Гц, 2H), 8,05 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,31-4,05 (м, 3H), 2,78-2,46 (м, 4H), 2,19 (с, 2H), 2,13-2,10 (м, 2H), 1,19 (тд, J=12,2, 12,2 Гц, 1H), 1,03 (д, J=5,1 Гц, 9H).
Пример 82: Синтез соединения 304 (2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]ацетамид)
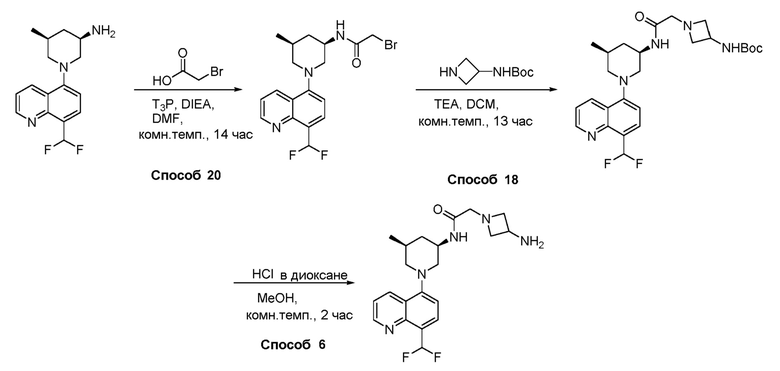
2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]ацетамид: 2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]ацетамид получали из 2-бромуксусной кислоты, трет-бутил азетидин-3-илкарбамата и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина с использованием Способа 20, 18 и 6. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 30% - 60% градиент за 8 мин; детектор УФ 254 нм. 2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]ацетамид получали в виде белого твердого вещества (20 мг, 12% для 3 стадий).
Соединение 304: ВЭЖХ: чистота 92,6%, RT=2,72 мин. МС: m/z=404,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,88 (дд, J=4,3, 1,7 Гц, 1H), 8,66-8,57 (м, 1H), 8,00-7,86 (м, 1H), 7,85-7,51 (м, 2H), 7,25 (д, J=7,9 Гц, 1H), 4,27-4,19 (м, 1H), 3,68-3,61 (м, 2H), 3,62-3,49 (м, 2H), 3,42-3,32 (м, 1H), 3,14 (с, 2H), 2,98-2,90 (м, 2H), 2,58-2,38 (м, 2H), 2,21-2,00 (м, 2H), 1,18 (тд, J=12,0, 12,0 Гц, 1H), 1,02 (д, J=6,4 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 361 (2-(3-аминоазетидин-1-ил)-N-((3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-ил)ацетамид): из (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина, 2-бромуксусной кислоты и трет-бутил азетидин-3-илкарбамата. ВЭЖХ: чистота 99,1%, RT=2,27 мин. МС: m/z=423,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,02 (д, J=1,7 Гц, 1H), 8,97 (д, J=1,6 Гц, 1H), 8,06 (д, J=8,4 Гц, 1H), 7,62 (д, J=8,0 Гц, 1H), 7,26 (д, J=8,4 Гц, 1H), 4,12-3,92 (м, 3H), 3,5-3,53 (м, 2H), 3,41-3,39 (м, 1H), 3,06-2,90 (м, 2H), 2,84-2,64 (м, 3H), 2,58-2,55 (м, 1H), 1,92-1,88 (м, 2H), 1,26-1,16 (м, 1H), 0,93 (д, J=6,3 Гц, 3H).
Соединение 365 (2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]ацетамид): из 2-(азетидин-3-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]ацетамид и полиформальдегида. ВЭЖХ: чистота 87,4%, RT=1,21 мин. МС: m/z=405,4 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92-8,82 (м, 2H), 7,96 (д, J=8,2 Гц, 1H), 7,80-7,51 (м, 1H),7,33 (д, J=8,1 Гц, 1H), 4,28-4,05 (м, 2H), 4,04-3,94 (м, 1H), 3,82-3,68 (м, 3H), 3,25-3,12 (м, 4H), 2,69-2,64 (м, 1H), 2,53-2,49 (м, 1H), 2,09-2,05 (м, 2H), 1,31-1,12 (м, 1H), 1,01 (д, J=6,4 Гц, 3H).
Пример 83: Синтез соединения 305 (2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]пропанамид)
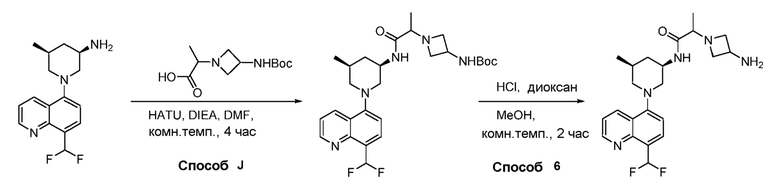
2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]пропанамид: 2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]пропанамид получали из 2-(1-(трет-бутоксикарбонил)азетидин-3-ил)уксусной кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина с использованием Способа J и 6. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3), 37% - 39% градиент за 10 мин; детектор УФ 254 нм. 2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]пропанамид получали в виде белого твердого вещества (29 мг, 23% для 2 стадий).
Соединение 305: ВЭЖХ: чистота 94,5%, RT=1,37 мин. МС: m/z=418,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,86 (дд, J=4,2, 1,7 Гц, 1H), 8,58 (д, J=8,6 Гц, 1H), 7,95-7,43 (м, 3H), 7,22 (д, J=7,9 Гц, 1H), 4,26-4,12 (м, 1H), 3,61-3,42 (м, 4H), 3,40-3,20 (м, 1H), 2,91-2,74 (м, 3H), 2,56-2,35 (м, 2H), 2,16-1,96 (м, 2H), 1,25-1,05 (м, 4H), 1,00 (д, J=6,4 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 306 (2-амино-2-циклопропил-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]ацетамид): из 2-(трет-бутоксикарбониламино)-2-циклопропилуксусной кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 84,9%, RT=2,57+2,60 мин. МС: m/z=389,2 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,92 (д, J=3,7 Гц, 1H), 8,54-8,50(м, 1H), 7,99-7,56 (м, 2H), 7,50-7,47 (м, 1H), 7,19-6,98 (м, 2H), 4,34-4,26 (м, 1H), 3,71-3,59 (м, 1H), 3,32-3,28 (м, 1H), 2,85-2,70 (м, 1H), 2,42 (кажущийся кв., J=11,3 Гц, 2H), 2,22-1,75 (м, 4H), 1,13-0,92 (м, 5H), 0,68-0,47 (м, 3H), 0,32-0,23 (м, 1H).
Соединение 312 (2-(азетидин-3-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]ацетамид): из 2-(3,3-дифторазетидин-1-ил)пропановой кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 96,7%, RT=6,65 мин. МС: m/z=389,4 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,90 (дд, J=4,3, 1,8 Гц, 1H), 8,62 (дд, J=8,7, 1,8 Гц, 1H), 7,94 (д, J=7,9 Гц, 1H), 7,85-7,50 (м, 2H), 7,26 (д, J=7,9 Гц, 1H), 4,22 (д, J=12,4 Гц, 1H), 3,96-3,75 (м, 2H), 3,65-3,45 (м, 3H), 3,24-3,05 (м, 2H), 2,63-2,36 (м, 4H), 2,20-2,08 (м, 2H), 1,22-0,94 (м, 4H).
Соединение 315 (4-амино-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-3,3-диметилбутанамид): из 4-[[(трет-бутокси)карбонил]амино]-3,3-диметилбутановой кислоты и (3R,5S)-1-(8-(дифторметил)хинолин-5-ил)-5-метилпиперидин-3-амина. ВЭЖХ: чистота 95,7%, RT=5,17 мин. МС: m/z=405,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,86 (дд, J=4,2, 1,7 Гц, 1H), 8,59 (дд, J=8,6, 1,7 Гц, 1H), 7,94-7,45 (м, 3H), 7,22 (д, J=7,9 Гц, 1H), 4,28-4,11 (м, 1H), 3,55-3,50 (м, 1H), 3,40-3,20 (м, 1H), 2,56 (с, 2H), 2,53-2,33 (м, 2H), 2,19-2,02 (м, 4H), 1,18-1,07 (м, 1H), 0,98-0,88 (м, 9H).
Соединение 324 (2-(азетидин-3-ил)-N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]ацетамид): из 2-(1-(трет-бутоксикарбонил)азетидин-3-ил)уксусной кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 95,8%, RT=1,15 мин. МС: m/z=390,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,85 (м, 2H), 7,96 (д, J=8,1 Гц, 1H), 7,63 (т, J=55,9 Гц, 1H), 7,33 (д, J=8,2 Гц, 1H), 4,22-4,01 (м, 2H), 3,94-3,90 (м, 2H), 3,66-3,62 (м, 2H), 3,23-3,09 (м, 1H), 2,65-2,44 (м, 4H), 2,10-2,03 (м, 2H), 1,13 (тд, J=12,4, 12,4 Гц, 1H), 1,00 (д, J=6,4 Гц, 3H).
Соединение 327 (4-амино-N-[(3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-ил]-3,3-диметилбутанамид): из 4-[[(трет-бутокси)карбонил]амино]-3,3-диметилбутановой кислоты и (3R,5S)-1-[8-(дифторметил)хиноксалин-5-ил]-5-метилпиперидин-3-амина. ВЭЖХ: чистота 90,8%, RT=1,29 мин. МС: m/z=406,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,93-8,82 (м, 2H), 7,96 (д, J=8,1 Гц, 1H), 7,63 (т, J=56,0 Гц, 1H), 7,33 (д, J=8,2 Гц, 1H), 4,23-3,95 (м, 3H), 2,67-2,56 (м, 3H), 2,50 (т, J=11,4 Гц, 1H), 2,19 (с, 2H), 2,11-2,08 (м, 2H), 1,21-1,07 (м, 1H), 1,04-0,94 (м, 9H).
Пример 84: Синтез соединения 330 (цис-5-циклопропил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амин)
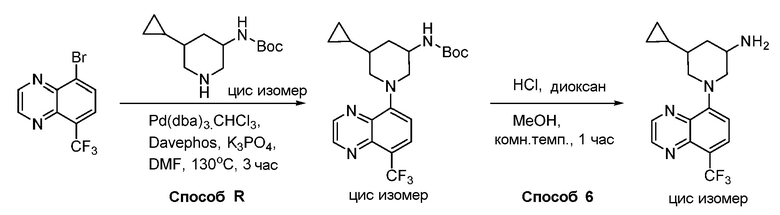
цис-5-циклопропил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амин: цис-5-циклопропил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амин получали из 5-бром-8-(трифторметил)хиноксалина и трет-бутил цис-5-циклопропилпиперидин-3-илкарбамата с использованием Способа R и 6. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), удерживание при 36%, градиент за 10 мин; детектор УФ 254 нм. цис-5-циклопропил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амин получали в виде желтого твердого вещества (20 мг, 6,5% для 2 стадий).
Соединение 330: ВЭЖХ: чистота 96,7%, RT=1,62 мин. МС: m/z=337,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,01 (д, J=1,8 Гц, 1H), 8,96 (д, J=1,7 Гц, 1H), 8,05 (д, J=8,4 Гц, 1H), 7,28-7,16 (м, 1H), 4,18-4,07 (м, 2H), 2,97-2,81 (м, 1H), 2,77-2,61 (м, 1H), 2,60-2,57 (м, 2H), 2,50-2,20 (м, 1H), 2,10-2,03 (м, 1H), 1,15-0,99 (м, 2H), 0,63-0,51 (м, 1H), 0,48-0,34 (м, 2H), 0,24-0,11 (м, 2H).
Следующие соединения синтезировали аналогичным способом:
Соединение 331 (цис-5-циклопропил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амин): из 5-бром-8-(трифторметил)хинолина и трет-бутил цис-5-циклопропилпиперидин-3-илкарбамата. ВЭЖХ: чистота 93,2%, RT=2,71 мин. МС: m/z=336,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,2, 1,8 Гц, 1H), 8,50 (дд, J=8,7, 1,8 Гц, 1H), 8,01 (д, J=8,1 Гц, 1H), 7,55 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,0 Гц, 1H), 3,55-3,38 (м, 2H), 3,20-3,03 (м, 1H), 2,63-2,44 (м, 2H), 2,25 (д, J=10,9 Гц, 1H), 1,28-1,03 (м, 2H), 0,66-0,34 (м, 3H), 0,28-0,09 (м, 2H).
Соединение 333 (цис-5-циклопропил-1-(8-фторхинолин-5-ил)пиперидин-3-амин): из 5-бром-8-фторхинолина и трет-бутил цис-5-циклопропилпиперидин-3-илкарбамата. ВЭЖХ: чистота 99,3%, RT=1,20 мин. МС: m/z=286,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,86 (дд, J=4,2, 1,6 Гц, 1H), 8,58 (дт, J=8,6, 1,6 Гц, 1H), 7,61 (дд, J=8,6, 4,3 Гц, 1H), 7,42 (дд, J=10,7, 8,4 Гц, 1H), 7,22 (дд, J=8,4, 4,2 Гц, 1H), 3,40-3,25 (м, 2H), 3,22-3,08 (м, 1H), 2,62-2,42 (м, 2H), 2,26 (д, J=10,7 Гц, 1H), 1,31-1,07 (м, 2H), 0,67-0,37 (м, 3H), 0,29-0,10 (м, 2H).
Соединение 334 (цис-5-циклопропил-1-(8-метоксихинолин-5-ил)пиперидин-3-амин): из 5-бром-8-фторхинолина и трет-бутил цис-5-циклопропилпиперидин-3-илкарбамата. ВЭЖХ: чистота 98,0%, RT=1,11 мин. МС: m/z=298,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,80 (дд, J=4,3, 1,7 Гц, 1H), 8,57 (дд, J=8,6, 1,7 Гц, 1H), 7,57 (дд, J=8,5, 4,3 Гц, 1H), 7,25 (д, J=8,3 Гц, 1H), 7,15 (д, J=8,3 Гц, 1H), 4,05 (с, 3H), 3,40-3,10 (м, 3H), 2,60-2,40 (м, 2H), 2,27 (д, J=10,8 Гц, 1H), 1,28-1,07 (м, 2H), 0,71-0,56 (м, 1H), 0,44-0,48(м, 2H), 0,18-0,23(м, 2H).
Пример 85: Синтез соединения 332 (цис-5-циклопропил-1-[8-(дифторметил)хинолин-5-ил]пиперидин-3-амин)
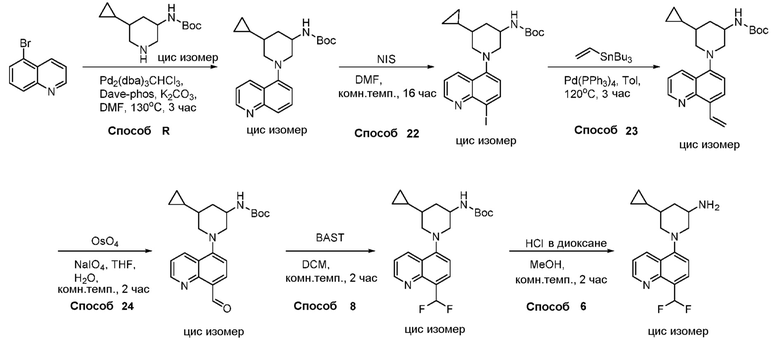
трет-бутил цис-N-[5-циклопропилпиперидин-3-ил]карбамат: трет-бутил цис-N-[5-циклопропил-1-(хинолин-5-ил)пиперидин-3-ил]карбамат получали из 5-бромхинолина и трет-бутил цис-5-циклопропилпиперидин-3-илкарбамата с использованием Способа R. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, с получением трет-бутил цис-N-[5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]карбамата в виде желтого твердого вещества (400 мг, 48%).
Способ 22
трет-Бутил цис-N-[5-циклопропил-1-(8-иодхинолин-5-ил)пиперидин-3-ил]карбамат: К раствору трет-бутил цис-N-[5-циклопропил-1-(хинолин-5-ил)пиперидин-3-ил]карбамата (400 мг, 1,03 ммоль) в DMF (10 мл) добавляли NIS (367 мг, 1,55 ммоль) при комнатной температуре. Полученный раствор затем перемешивали в течение 16 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (10 мл). Полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане с получением трет-бутил цис-N-[5-циклопропил-1-(8-иодхинолин-5-ил)пиперидин-3-ил]карбамата в виде желтого твердого вещества (350мг, 69%). МС: m/z=494,2 [M+H]+.
Способ 23
трет-бутил цис-N-[5-циклопропил-1-(8-этенилхинолин-5-ил)пиперидин-3-ил]карбамат: К раствору цис-N-[5-циклопропил-1-(8-иодхинолин-5-ил)пиперидин-3-ил]карбамата (350 мг, 0,67 ммоль) в толуоле (40 мл) добавляли Pd(PPh3)4 (82 мг, 0,07 ммоль) и трибутил(этенил)станнан (337 мг, 1,01 ммоль) при комнатной температуре. Реакционную смесь затем перемешивали в течение 3 часов при 120°C. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (30 мл). Полученную смесь экстрагировали этилацетатом (60 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, с получением цис-N-[5-циклопропил-1-(8-этенилхинолин-5-ил)пиперидин-3-ил]карбамата в виде a желтого твердого вещества (200 мг, 75%).MS: m/z=394,2 [M+H]+.
Способ 24
трет-бутил цис-N-[5-циклопропил-1-(8-формилхинолин-5-ил)пиперидин-3-ил]карбамат: К раствору цис-N-[5-циклопропил-1-(8-этенилхинолин-5-ил)пиперидин-3-ил]карбамата (200 мг, 0,48 ммоль) в THF (10 мл) добавляли OsO4 (13 мг, 0,05 ммоль), NaIO4 (435 мг, 1,93 ммоль) и воду (2,3 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 2 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления насыщенного раствора Na2S2O3 (10 мл). Полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении. Это давало трет-бутил цис-N-[5-циклопропил-1-(8-формилхинолин-5-ил)пиперидин-3-ил]карбамат в виде a желтого твердого вещества (150 мг, 79%). МС: m/z=396,2 [M+H]+.
трет-бутил цис-N-[5-циклопропил-1-[8-(дифторметил)хинолин-5-ил]пиперидин-3-ил]карбамат: К раствору трет-бутил цис-N-[5-циклопропил-1-(8-формилхинолин-5-ил)пиперидин-3-ил]карбамата (150 мг, 0,36 ммоль) в DCM (8 мл) добавляли BAST (252 мг, 1,08 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления насыщенного раствора бикарбоната натрия (30 мл). Полученную смесь экстрагировали этилацетатом (30 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, с получением трет-бутил цис-N-[5-циклопропил-1-[8-(дифторметил)хинолин-5-ил]пиперидин-3-ил]карбамата в виде желтого твердого вещества (80 мг, 53%). МС: m/z=418,2 [M+H]+.
цис-5-циклопропил-1-[8-(дифторметил)хинолин-5-ил]пиперидин-3-амин: цис-5-циклопропил-1-[8-(дифторметил)хинолин-5-ил]пиперидин-3-амин получали из трет-бутил цис-N-[5-циклопропил-1-[8-(дифторметил)хинолин-5-ил]пиперидин-3-ил]карбамата с использованием Способа 6. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи MeOH в DCM (0% - 10% градиент). цис-5-циклопропил-1-[8-(дифторметил)хинолин-5-ил]пиперидин-3-амин получали в виде светло-желтого твердого вещества (14 мг, 40%).
Соединение 332: ВЭЖХ: чистота 99,3%, RT=1,29 мин. МС: m/z=318,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,2, 1,7 Гц, 1H), 8,51 (дд, J=8,6, 1,8 Гц, 1H), 7,95 (д, J=7,8 Гц, 1H), 7,88-7,48 (м, 2H), 7,28 (д, J=7,9 Гц, 1H), 3,67-3,38 (м, 2H), 3,28-3,07 (м, 1H), 2,61 (т, J=10,9 Гц, 1H), 2,52 (т, J=10,8 Гц, 1H), 2,37-2,20 (м, 1H), 1,29-1,10 (м, 2H), 0,47-0,60 (м, 1H), 0,55-0,36 (м, 2H), 0,23-0,18 (м, 2H).
Пример 86: Синтез соединения 335 цис-(N--5-циклопропил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид)
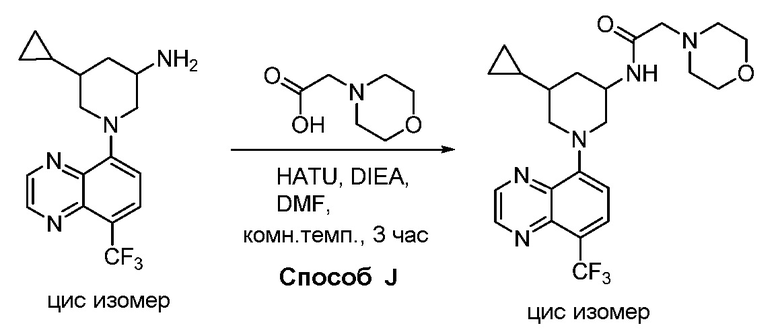
Цис-N-[5-циклопропил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид: цис-N-[5-циклопропил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид получали из 2-(морфолин-4-ил)уксусной кислоты и цис-5-циклопропил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амина с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,0,5% NH3.H2O), 46% - 52% градиент за 8 мин; детектор УФ 254 нм. Цис-N-[5-циклопропил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид получали в виде светло-желтого твердого вещества (11 мг, 13%).
Соединение 335: ВЭЖХ: чистота 97,2%, RT=0,90 мин. МС: m/z=464,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,95-8,85 (м, 2H), 8,05 (д, J=8,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,19-4,11 (м, 3H), 3,88-3,62 (м, 4H), 3,22-2,98 (м, 2H), 2,94-2,74 (м, 2H), 2,69-2,42 (м, 4H), 2,22 (д, J=12,5 Гц, 1H), 1,48 (д, J=11,7 Гц, 1H), 1,40-1,13 (м, 1H), 0,67-0,64 (м, 1H), 0,52-0,49 (м, 2H), 0,24 (дт, J=6,7, 2,6 Гц, 2H).
Следующие соединения синтезировали аналогичным способом:
Соединение 336 (цис-N-[5-циклопропил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид): из 2-(морфолин-4-ил)уксусной кислоты и цис-5-циклопропил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 99,3%, RT=1,91 мин. МС: m/z=463,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (дд, J=4,3, 1,7 Гц, 1H), 8,60 (дт, J=8,6, 1,6 Гц, 1H), 8,02 (д, J=8,0 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,26-7,19 (м, 1H), 4,25-4,17 (м, 1H), 3,71 (т, J=4,7 Гц, 4H), 3,62-3,53 (м, 1H), 3,52-3,43 (м, 1H), 3,02 (д, J=1,3 Гц, 2H), 2,70 (т, J=11,3 Гц, 1H), 2,65-2,47 (м, 5H), 2,22 (д, J=12,3 Гц, 1H), 1,41 (кв., J=12,0 Гц, 1H), 1,26 (кв., J=10,5 Гц, 1H), 0,67-0,60 (м, 1H), 0,51-0,48 (м, 2H), 0,30-0,15 (м, 2H).
Соединение 338 (цис-N-[5-циклопропил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-2-(4-метилпиперазин-1-ил)ацетамид): из 2-(4-метилпиперазин-1-ил)уксусной кислоты и цис-5-циклопропил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина. ВЭЖХ: чистота 96,7%, RT=3,28 мин. МС: m/z=476,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,92 (дд, J=4,3, 1,7 Гц, 1H), 8,61 (дд, J=8,6, 1,7 Гц, 1H), 8,03 (д, J=8,0 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,23 (д, J=8,0 Гц, 1H), 4,27-4,14 (м, 1H), 3,63-3,54 (м, 1H), 3,47 (д, J=11,2 Гц, 1H), 3,04 (д, J=1,6 Гц, 2H), 2,75-2,40 (м, 10H), 2,32-2,20 (м, 4H), 1,40 (кв., J=11,9 Гц, 1H), 1,27 (т, J=10,5 Гц, 1H), 0,71- 0,58 (м, 1H), 0,55-0,41 (м, 2H), 0,30-0,16 (м, 2H).
Пример 87: Синтез соединения 337 (цис-N-[5-циклопропил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-N-метил-2-(морфолин-4-ил)ацетамид)
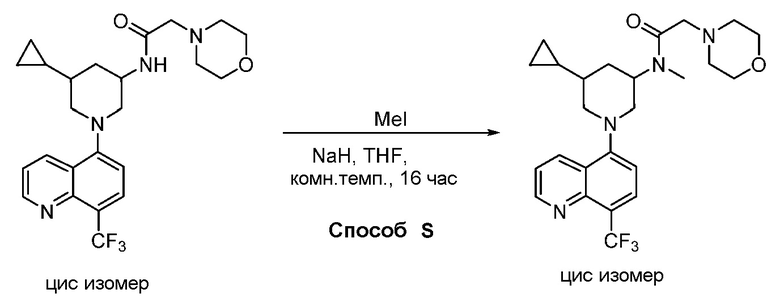
Цис-N-[5-циклопропил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-N-метил-2-(морфолин-4-ил)ацетамид: цис-N-[5-циклопропил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-N-метил-2-(морфолин-4-ил)ацетамид получали из MeI и цис-N-(5-циклопропил-1-(8-(трифторметил)хинолин-5-ил)пиперидин-3-ил)-2-морфолиноацетамида с использованием Способа S. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3 и 0,1% NH3.H2O), 52% - 59% градиент за 8 мин; детектор УФ 254 нм. Цис-N-[5-циклопропил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-N-метил-2-(морфолин-4-ил)ацетамид получали в виде светло-желтого твердого вещества (20 мг, 23%).
Соединение 337: ВЭЖХ: чистота 93,0%, RT=2,58 мин. МС: m/z=477,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,94-8,90 (м, 1H), 8,61-8,55 (м, 1H), 8,03 (дд, J=10,8, 8,0 Гц, 1H), 7,62-7,57 (м, 1H), 7,27 (дд, J=16,4, 8,1 Гц, 1H), 4,81 (д, J=12,2 Гц, 1H), 3,69 (т, J=4,7 Гц, 2H), 3,52-3,45 (м, 3H), 3,40-3,10 (м, 3H), 3,05 (с, 2H), 2,90-2,80 (м, 2H), 2,70-2,40 (м, 5H), 2,20- 2,00 (м, 1H), 1,70 (дт, J=24,3, 12,0 Гц, 1H), 1,42-1,22 (м, 1H), 0,73-0,59 (м, 1H), 0,57-0,38 (м, 2H), 0,33-0,09 (м, 2H).
Пример 88: Синтез соединения 339 и соединения 340 ((3R,5S)-1-(8-фторхиноксалин-5-ил)-5-метилпиперидин-3-амин и (3S,5R)-1-(8-фторхиноксалин-5-ил)-5-метилпиперидин-3-амин)
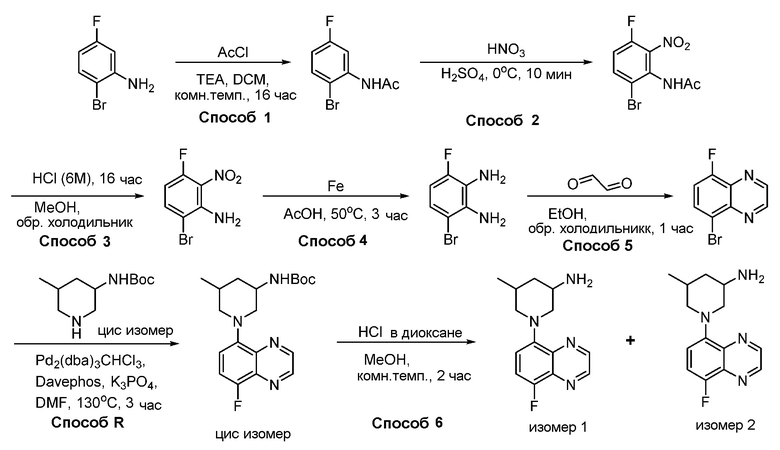
(3R,5S)-1-(8-фторхиноксалин-5-ил)-5-метилпиперидин-3-амин и (3S,5R)-1-(8-фторхиноксалин-5-ил)-5-метилпиперидин-3-амин: цис-1-(8-фторхиноксалин-5-ил)-5-метилпиперидин-3-амин получали из 2-бром-5-фторбензоламина, оксалальдегида и трет-бутил цис-5-метилпиперидин-3-илкарбамата с использованием Способа 1, 2, 3, 4, 5, R и 6. Неочищенный продукт сначала очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3+0,1% NH3.H2O), 5% - 47% градиент за 10 мин; детектор УФ 254 нм. Затем два энантиомерных изомера получали путем разделения методом хиральной препаративной ВЭЖХ при следующих условиях: колонка CHIRALPAK IE, 2 × 25см, 5 мкм; подвижная фаза: EtOH в гексане, 30% изократический в течение 25 мин; детектор УФ 254/220 нм.
Изомер 1: (35 мг, 0,13%, желтое твердое вещество, для 7 стадий) ВЭЖХ: чистота 95,2%, RT=2,57 мин. МС: m/z=261,0 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,05-8,93 (м, 2H), 7,57 (дд, J=10,2, 8,7 Гц, 1H), 7,15 (дд, J=8,7, 4,9 Гц, 1H), 3,83-3,64 (м, 2H), 3,40-3,20 (м, 2H), 3,03-2,87 (м, 1H), 2,31-2,21 (м, 2H), 1,97-1,87 (м, 2H), 0,98-0,72 (м, 4H).
Изомер 2: (33 мг, 0,12%, желтое твердое вещество, для 7 стадий) ВЭЖХ: чистота 97,3%, RT=2,58 мин. МС: m/z=261,0 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,05-8,93 (м, 2H), 7,57 (дд, J=10,2, 8,7 Гц, 1H), 7,15 (дд, J=8,7, 4,9 Гц, 1H), 3,83-3,64 (м, 2H), 3,40-3,20 (м, 2H), 3,03-2,87 (м, 1H), 2,31-2,21 (м, 2H), 1,97-1,87 (м, 2H), 0,98-0,72 (м, 4H).
Пример 89: Синтез соединения 341 ((3R,5S)-1-(8-фторхинолин-5-ил)-5-метилпиперидин-3-амин)
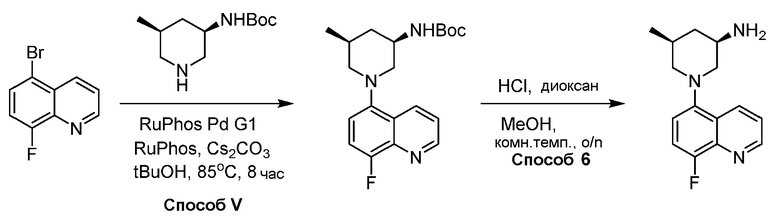
(3R,5S)-1-(8-фторхинолин-5-ил)-5-метилпиперидин-3-амин: (3R,5S)-1-(8-фторхинолин-5-ил)-5-метилпиперидин-3-амин получали с 35% выходом для 2 стадий из 5-бром-8-фторхинолина и трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамата с использованием Способа V и 6.
Соединение 341: ВЭЖХ: чистота 97,7%, RT=1,45 мин. МС: m/z=260 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,97 (дд, J=4,2, 1,6 Гц, 1H), 8,53 (д, J=8,5 Гц, 1H), 8,19 (с, 3H), 7,66 (дд, J=8,6, 4,2 Гц, 1H), 7,52 (дд, J=10,8, 8,3 Гц, 1H), 7,19 (дд, J=8,4, 4,2 Гц, 1H), 3,61-3,39 (м, 2H), 3,16 (д, J=10,0 Гц, 1H), 2,62 (т, J=10,7 Гц, 1H), 2,36 (т, J=11,2 Гц, 1H), 2,16 (д, J=12,3 Гц, 1H), 2,05 (ддд, J=16,8, 8,9, 5,2 Гц, 1H), 1,15 (кв., J=11,7 Гц, 1H), 0,96 (д, J=6,6 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 462 ((3R,5S)-5-метил-1-(8-метил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорид): из 5-Хлор-8-метил-хинолина и трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамата. ВЭЖХ: чистота >99%, RT=1,37 мин. МС: m/z=256 [M+H]+. 1H ЯМР (400 МГц, Оксид дейтерия, м.д.) δ 9,35 (д, J=8,9 Гц, 1H), 9,09 (дт, J=5,4, 1,4 Гц, 1H), 8,08 (ддд, J=8,6, 5,5, 1,1 Гц, 1H), 7,96 (д, J=8,1 Гц, 1H), 7,55 (д, J=7,9 Гц, 1H), 3,89-3,74 (м, 1H), 3,66 (д, J=11,3 Гц, 1H), 3,39 (д, J=11,0 Гц, 1H), 2,98 (т, J=10,8 Гц, 1H), 2,80 (с, 3H), 2,54 (т, J=11,5 Гц, 1H), 2,37 (д, J=12,7 Гц, 1H), 2,33-2,17 (м, 1H), 1,33 (кв., J=12,0 Гц, 1H), 1,05 (д, J=6,7 Гц, 3H).
Соединение 586 (((3R,5S)-1-(8-Метил-хинолин-5-ил)-5-трифторметил-пиперидин-3-иламин гидрохлорид): из 5-бром-8-метилхинолина и трет-бутилового эфира ((3R,5S)-5-Трифторметил-пиперидин-3-ил)-карбаминовой кислоты. ВЭЖХ: чистота >99%, RT=1,60 мин. МС: m/z=310,30 [M+H]+. 1H ЯМР (400 МГц, Оксид дейтерия, м.д.) δ 9,34-9,29 (м, 1H), 9,03 (дд, J=5,5, 1,6 Гц, 1H), 8,04 (ддт, J=8,6, 5,5, 1,4 Гц, 1H), 7,91 (дд, J=7,9, 1,1 Гц, 1H), 7,56 (д, J=7,9 Гц, 1H), 3,82 (тд, J=11,3, 5,7 Гц, 1H), 3,71 (с, 1H), 3,63-3,56 (м, 1H), 3,56-3,48 (м, 1H), 3,10 (ддп, J=11,9, 7,7, 3,9 Гц, 1H), 2,97 (дт, J=17,3, 11,2 Гц, 2H), 2,73 (д, J=1,0 Гц, 3H), 2,54 (д, J=12,2 Гц, 1H), 1,71 (кв., J=12,2 Гц, 1H).
Пример 90: Синтез соединения 342 (8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]-7-фторхиноксалин-5-карбонитрил)
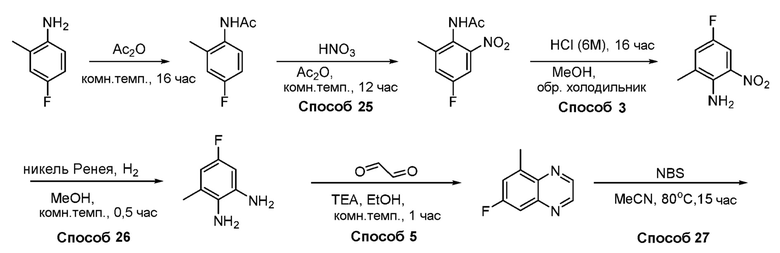
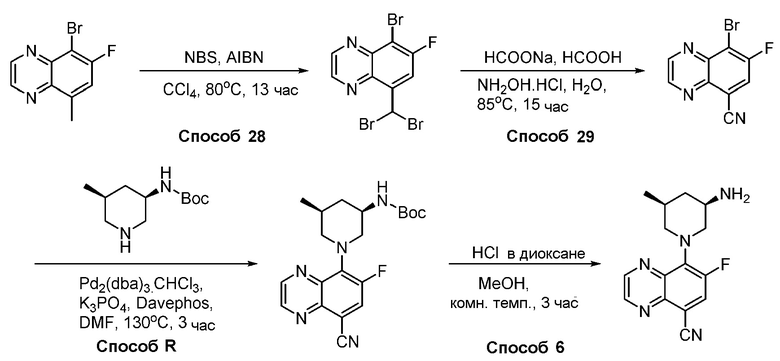
N-(4-фтор-2-метилфенил)ацетамид: 4-фтор-2-метиланилин (3,80 г, 30,37 ммоль) добавляли к 100 мл уксусного ангидрида при комнатной температуре. Полученный раствор перемешивали в течение 3 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (100 мл) и полученную смесь экстрагировали дихлорметаном (300 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением N-(4-фтор-2-метилфенил)ацетамида в виде белого твердого вещества (2,70 г, 50%). МС: m/z=168,2 [M+H]+.
Способ 25
N-(4-фтор-2-метил-6-нитрофенил)ацетамид: при 0°C к раствору N-(4-фтор-2-метилфенил)ацетамида (2,70 г, 16,15 ммоль) в уксусном ангидриде (60 мл) добавляли по каплям HNO3 (65% в воде, 3,2 мл, 46,22 ммоль) в течение 20 минут. Полученную смесь затем перемешивали в течение 15 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления ледяной воды (100 мл) и значение pH полученной смеси доводили до 7-8 насыщенным раствором бикарбоната натрия. Смесь экстрагировали дихлорметаном (300 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 15% градиент), с получением N-(4-фтор-2-метил-6-нитрофенил)ацетамида в виде коричневого твердого вещества (1,35 г, 39%). МС: m/z=213,1 [M+H]+.
4-фтор-2-метил-6-нитроанилин: 4-фтор-2-метил-6-нитроанилин получали из N-(4-фтор-2-метил-6-нитрофенил)ацетамида с использованием Способа 3. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, (0% - 17% градиент), с получением 4-фтор-2-метил-6-нитроанилина в виде желтого твердого вещества (730 мг, 64%). МС: m/z=171,1 [M+H]+.
Способ 26
5-фтор-3-метилбензол-1,2-диамин: К раствору 4-фтор-2-метил-6-нитроанилина (730 мг, 4,29 ммоль) в метаноле (10 мл) добавляли Ni Ренея (95 мг, 11,09 ммоль) при комнатной температуре в атмосфере азота. Реакционную колбу вакуумировали и продували водородом. Реакционную смесь затем перемешивали в течение 30 минут при комнатной температуре в атмосфере водорода под водородным баллоном. Когда реакция была завершена, реакционную смесь фильтровали через слой целита. Фильтрат концентрировали при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, (0% - 35% градиент), с получением 5-фтор-3-метилбензол-1,2-диамина в виде желтого твердого вещества (631 мг, 97%). МС: m/z=141,1 [M+H]+.
7-фтор-5-метилхиноксалин: 7-фтор-5-метилхиноксалин получали из 5-фтор-3-метилбензол-1,2-диамина и оксалальдегид с использованием Способа 5. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, (0% - 25% градиент), с получением 7-фтор-5-метилхиноксалина в виде желтого твердого вещества (540 мг, 62%). МС: m/z=163,1 [M+H]+.
Способ 27
5-бром-6-фтор-8-метилхиноксалин: К раствору 7-фтор-5-метилхиноксалина (540 мг, 3,33 ммоль) в ацетонеитриле (10 мл) медленно добавляли NBS (1425 мг, 8,01 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 15 часов при 80°C. Когда реакция была завершена, ее гасили путем добавления воды (20 мл). Полученную смесь экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, (0% - 10% градиент), с получением 5-бром-6-фтор-8-метилхиноксалина в виде белого твердого вещества (495 мг, 62%). МС: m/z=240,8 [M+H]+.
Способ 28
5-бром-6-фтор-8-метилхиноксалин: При комнатной температуре к раствору 5-бром-6-фтор-8-метилхиноксалина (440 мг, 1,83 ммоль) в CCl4 медленно добавляли NBS (4275 мг, 24,02 ммоль) и AIBN (67 мг, 0,40 ммоль) по порядку. Полученный раствор перемешивали в течение 15 часов при 80°C. Когда реакция была завершена, ее гасили путем добавления воды (20 мл). Полученную смесь экстрагировали этилацетатом (60 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, (0% - 15% градиент), с получением 5-бром-8-(дибромметил)-6-фторхиноксалина в виде желтого твердого вещества (450 мг, 62%). МС: m/z=400,5 [M+H]+.
Способ 29
8-бром-7-фторхиноксалин-5-карбонитрил: К раствору 5-бром-8-(дибромметил)-6-фторхиноксалина (450 мг, 1,13 ммоль) в HCOOH (10 мл) добавляли формиат натрия (404 мг, 5,94 ммоль), NH2OH.HCl (165 мг, 2,38 ммоль) и воду (3 мл) при комнатной температуре. Полученную смесь перемешивали в течение 15 часов при 85°C. Когда реакция была завершена, ее гасили путем добавления воды (50 мл). Полученную смесь экстрагировали этилацетатом (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, (0% - 17% градиент), с получением 8-бром-7-фторхиноксалин-5-карбонитрила в виде белого твердого вещества (240 мг, 84%). МС: m/z=253,8 [M+H]+.
8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]-7-фторхиноксалин-5-карбонитрил: 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]-7-фторхиноксалин-5-карбонитрил получали из 8-бром-7-фторхиноксалин-5-карбонитрила и трет-бутил (3R,5S)-5-метилпиперидин-3-илкарбамата с использованием Способа R и 6. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3 и 0,1% NH3.H2O), 5% - 65% градиент за 8 мин; детектор УФ 254 нм. 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]-7-фторхиноксалин-5-карбонитрил получали в виде желтого твердого вещества (55 мг, 48% для 2 стадий).
Соединение 342: ВЭЖХ: чистота 99,2%, RT=1,08 мин. МС: m/z=286,3 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,94 (д, J=1,7 Гц, 1H), 8,88 (д, J=1,7 Гц, 1H), 7,88 (д, J=12,2 Гц, 1H), 4,05 (д, J=12,0 Гц, 1H), 3,76 (д, J=12,6 Гц, 1H), 3,49-3,32 (м, 1H), 3,1-3,04 (м, 1H), 3,02-2,90 (м, 1H), 2,28-1,92 (м, 2H), 1,21-1,16 (м, 1H), 1,00 (д, J=6,6 Гц, 3H).
Пример 91: Синтез соединения 343 (N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3-диметилбутанамид)
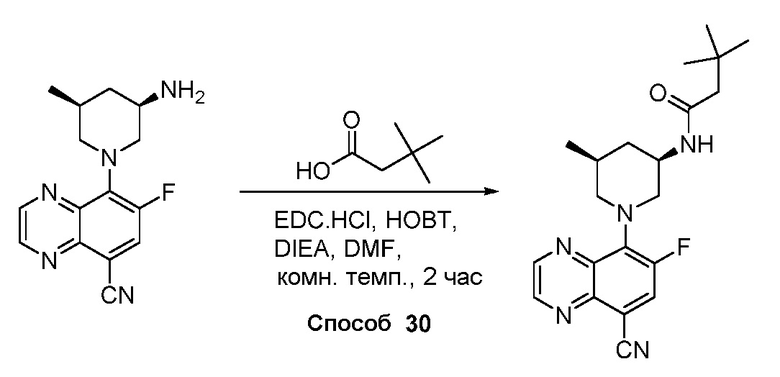
Способ 30
N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3-диметилбутанамид: К раствору 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]-7-фторхиноксалин-5-карбонитрила (50 мг, 0,17 ммоль) в DMF (3 мл) добавляли 3,3-диметилбутановую кислоту (48 мг, 0,42 ммоль), HOBT (29 мг, 0,22 ммоль), EDCI (51 мг, 0,27 ммоль) и DIEA (107 мг, 0,83 ммоль) при комнатной температуре. Полученный раствор перемешивали в течение 2 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (5 мл). Полученную смесь экстрагировали этилацетатом (20 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3 и 0,1% NH3.H2O), 45% - 67% градиент за 7 мин; детектор УФ 254 нм. N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3-диметилбутанамид получали в виде желтого твердого вещества (35 мг, 52%).
Соединение 343: ВЭЖХ: чистота 99,5%, RT=1,85 мин. МС: m/z=384,2 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,09-8,95 (м, 2H), 8,43 (д, J=12,9 Гц, 1H), 7,73 (д, J=7,7 Гц, 1H), 3,72-3,93(м, 3H), 3,03-2,96 (м, 1H), 2,87-2,78 (м 1H), 1,97-1,94 (м, 4H), 1,13-0,89 (м, 13H).
Пример 92: Синтез соединения 344 (7-фтор-8-[(3R,5S)-3-[(2-метоксиэтил)амино]-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрил)
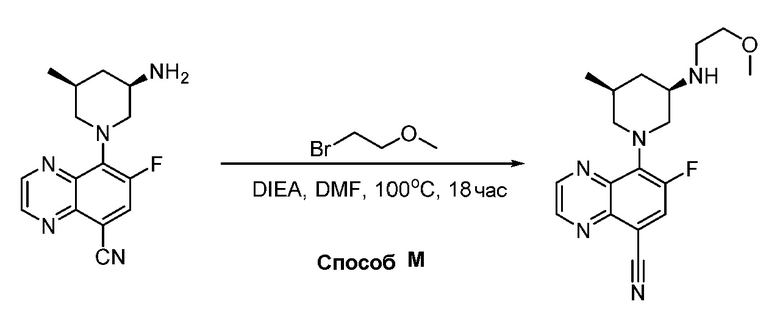
7-фтор-8-[(3R,5S)-3-[(2-метоксиэтил)амино]-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрил: 7-фтор-8-[(3R,5S)-3-[(2-метоксиэтил)амино]-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрил получали из 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]-7-фторхиноксалин-5-карбонитрила и 1-бром-2-метоксиэтана с использованием Способа M. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3 и 0,1% NH3.H2O), 42% - 43% градиент за 7 мин; детектор УФ 254 нм. 7-фтор-8-[(3R,5S)-3-[(2-метоксиэтил)амино]-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрил получали в виде желтого масла (13 мг, 22%).
Соединение 344: ВЭЖХ: чистота 98,6%, RT=1,39 мин. МС: m/z=344,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,85 (м, 2H), 8,10 (д, J=12,7 Гц, 1H), 4,16-4,11 (м, 1H), 3,86-3,76 (м, 1H), 3,61-3,49 (м, 2H), 3,38 (с, 3H), 3,14-2,83 (м, 5H), 2,18 (д, J=12,4 Гц, 1H), 2,01-1,88 (м, 1H), 1,13-0,96 (м, 4H).
Пример 93: Синтез соединения 345 и соединения 346 ((2R)-2-амино-N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3,3-трифторпропанамид и (2S)-2-амино-N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3,3-трифторпропанамид)
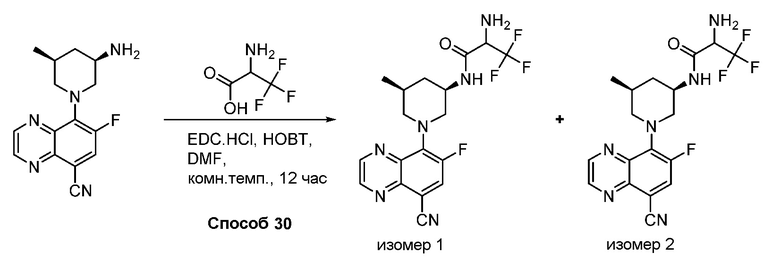
(2R)-2-амино-N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3,3-трифторпропанамид и (2S)-2-амино-N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3,3-трифторпропанамид: цис-2-амино-N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-3,3,3-трифторпропанамид получали из 2-амино-3,3,3-трифторпропановой кислоты и 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)-7-фторхиноксалин-5-карбонитрила с использованием Способа 30. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3 и 0,1% NH3.H2O), 40% - 45% градиент за 10 мин; детектор УФ 254 нм. Два диастереоизомера были разделены и получены.
Изомер 1: (34 мг, 16%, желтое твердое вещество) ВЭЖХ: чистота 97,1%, RT=1,04 мин. МС: m/z=411,1 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,05-8,95 (м, 2H), 8,42 (д, J=12,8 Гц, 1H), 8,30 (д, J=7,7 Гц, 1H), 4,10-3,70 (м, 4H), 3,11-2,95 (м, 1H), 2,94-2,78 (м, 1H), 2,38-2,22 (м, 2H), 2,07-1,91 (м, 2H), 1,26-1,10 (м, 1H), 0,92 (д, J=6,2 Гц, 3H).
Изомер 2: (34 мг, 16%, желтое твердое вещество) ВЭЖХ: чистота 96,4%, RT=2,16 мин. МС: m/z=411,1 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,07-8,97 (м, 2H), 8,43 (д, J=12,8 Гц, 1H), 8,32 (д, J=7,8 Гц, 1H), 4,05-3,80 (м, 3H), 3,74 (д, J=12,8 Гц, 1H), 3,12-2,96 (м, 1H), 2,94-2,78 (м, 1H), 2,38-2,20 (м, 2H), 2,06-1,92 (м, 2H), 1,22-1,08 (м, 1H), 0,92 (д, J=6,3 Гц, 3H).
Пример 94: Синтез соединения 347 (N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(диметиламино)ацетамид)
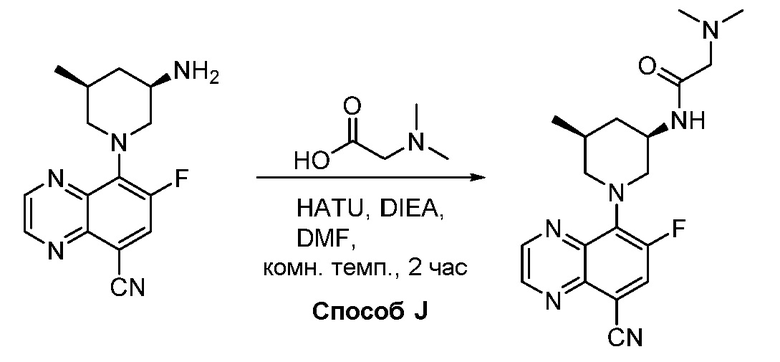
N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(диметиламино)ацетамид: N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(диметиламино)ацетамид получали из 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]-7-фторхиноксалин-5-карбонитрила и 2-(диметиламино)уксусной кислоты с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3 и 0,1% NH3.H2O), 42% - 43% градиент за 7 мин; детектор УФ 254 нм. N-[(3R,5S)-1-(8-циано-6-фторхиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(диметиламино)ацетамид получали в виде желтого твердого вещества (23 мг, 37%).
Соединение 347: ВЭЖХ: чистота 97,5%, RT=0,91 мин. МС: m/z=371,1 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,11-8,95 (м, 2H), 8,41 (д, J=12,9 Гц, 1H), 7,69 (д, J=8,4 Гц, 1H), 4,06-3,92 (м, 1H), 3,83-3,67 (м, 2H), 3,20-3,04 (м, 1H), 2,95-2,76 (м, 3H), 2,19 (с, 6H), 2,00-1,84 (м, 2H), 1,32-1,16 (м, 1H), 0,91 (д, J=6,3 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 587 (2-(1-Метил-пиперидин-4-ил)-N-[(3R,5S)-1-(8-метил-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-ацетамид): из (3R,5S)-1-(8-метил-хинолин-5-ил)-5-трифторметил-пиперидин-3-иламин гидрохлорида и (1-метил-пиперидин-4-ил)-уксусной кислоты. ВЭЖХ: чистота 99%, RT=1,90 мин. МС: m/z=449,30 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,93 (дд, J=4,1, 1,7 Гц, 1H), 8,53 (дд, J=8,5, 1,8 Гц, 1H), 7,95 (д, J=7,5 Гц, 1H), 7,57 (дд, J=8,5, 4,1 Гц, 1H), 7,54 (дд, J=7,6, 1,1 Гц, 1H), 7,19 (д, J=7,6 Гц, 1H), 4,13 (с, 1H), 3,13 (д, J=11,6 Гц, 2H), 2,76 (т, J=11,4 Гц, 2H), 2,69 (дд, J=7,4, 3,6 Гц, 2H), 2,46 (д, J=10,9 Гц, 1H), 2,16 (д, J=12,0 Гц, 1H), 2,12 (с, 3H), 1,99 (д, J=6,9 Гц, 2H), 1,85-1,77 (м, 2H), 1,63-1,49 (м, 3H), 1,44 (кв., J=12,2 Гц, 1H), 1,15 (дкв., J=9,1, 5,9, 4,7 Гц, 2H).
Соединение 588 (3-Гидрокси-3-метил-N-[(3R,5S)-5-метил-1-(8-метил-хинолин-5-ил)-пиперидин-3-ил]-бутирамид): из (3R,5S)-5-метил-1-(8-метил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и 3-гидрокси-3-метил-масляной кислоты. ВЭЖХ: чистота 98%, RT=2,06 мин. МС: m/z=356,30 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,91 (дд, J=4,1, 1,8 Гц, 1H), 8,47 (дд, J=8,5, 1,8 Гц, 1H), 7,85 (д, J=7,7 Гц, 1H), 7,55 (дд, J=8,5, 4,1 Гц, 1H), 7,51 (дд, J=7,6, 1,1 Гц, 1H), 7,08 (д, J=7,6 Гц, 1H), 4,77 (с, 1H), 3,16 (дд, J=10,9, 2,9 Гц, 1H), 2,65 (д, J=0,9 Гц, 3H), 2,38 (т, J=10,7 Гц, 1H), 2,30 (т, J=11,1 Гц, 1H), 2,20 (с, 2H), 2,04 (с, 1H), 1,99 (д, J=13,3 Гц, 1H), 1,13 (д, J=1,2 Гц, 6H), 1,04 (кв., J=11,9 Гц, 1H), 0,94 (д, J=6,4 Гц, 3H).
Соединение 589 (2-Циклопропил-2-гидрокси-N-[(3R,5S)-5-метил-1-(8-метил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-5-метил-1-(8-метил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и циклопропил-гидрокси-уксусной кислоты. ВЭЖХ: чистота >99%, RT=2,09 мин. МС: m/z=354,30 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,91 (ддд, J=4,2, 1,8, 0,8 Гц, 1H), 8,48 (ддд, J=8,5, 2,7, 1,8 Гц, 1H), 7,59-7,48 (м, 2H), 7,08 (дд, J=7,6, 4,1 Гц, 1H), 5,28 (с, 1H), 4,07 (с, 0H), 3,55-3,48 (м, 1H), 3,28 (д, J=11,0 Гц, 1H), 3,16 (д, J=10,0 Гц, 1H), 2,65 (т, J=0,9 Гц, 2H), 2,47 (дд, J=10,7, 2,1 Гц, 1H), 2,31 (т, J=11,1 Гц, 1H), 1,95 (д, J=12,6 Гц, 1H), 1,24-1,10 (м, 1H), 1,11-0,91 (м, 3H), 0,43-0,23 (м, 3H).
Соединение 590 (N-[(3R,5S)-5-метил-1-(8-метил-хинолин-5-ил)-пиперидин-3-ил]-2-(1-метил-пиперидин-4-ил)-ацетамид): из (3R,5S)-5-метил-1-(8-метил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и (1-метил-пиперидин-4-ил)-уксусной кислоты. ВЭЖХ: чистота >99%, RT=1,71 мин. МС: m/z=395,40 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,91 (дд, J=4,1, 1,8 Гц, 1H), 8,47 (дд, J=8,5, 1,8 Гц, 1H), 7,79 (д, J=7,6 Гц, 1H), 7,54 (дд, J=8,5, 4,1 Гц, 1H), 7,51 (дд, J=7,5, 1,1 Гц, 1H), 7,07 (д, J=7,6 Гц, 1H), 3,15 (д, J=10,6 Гц, 1H), 2,68 (д, J=3,3 Гц, 2H), 2,64 (д, J=1,0 Гц, 3H), 2,32 (дт, J=18,2, 10,9 Гц, 2H), 2,10 (с, 3H), 1,97 (д, J=6,8 Гц, 2H), 1,94 (с, 1H), 1,82-1,72 (м, 2H), 1,62-1,48 (м, 3H), 1,13 (дд, J=10,2, 6,1 Гц, 2H), 1,03 (кв., J=12,1 Гц, 1H), 0,93 (д, J=6,5 Гц, 3H).
Соединение 591 (N-[(3R,5S)-5-метил-1-(8-метил-хинолин-5-ил)-пиперидин-3-ил]-2-(1-метил-пирролидин-3-ил)-ацетамид): из (3R,5S)-5-метил-1-(8-метил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и (1-метил-пирролидин-3-ил)-уксусной кислоты. ВЭЖХ: чистота >99%, RT=1,65 мин. МС: m/z=381,40 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,91 (дд, J=4,1, 1,8 Гц, 1H), 8,47 (дд, J=8,5, 1,8 Гц, 1H), 7,82 (д, J=7,6 Гц, 1H), 7,55 (дд, J=8,5, 4,1 Гц, 1H), 7,51 (дд, J=7,6, 1,2 Гц, 1H), 7,07 (дд, J=7,7, 1,4 Гц, 1H), 4,02 (с, 1H), 3,16 (д, J=11,4 Гц, 2H), 2,64 (д, J=0,9 Гц, 3H), 2,40 (ддд, J=9,1, 6,3, 2,7 Гц, 4H), 2,36-2,25 (м, 3H), 2,20 (д, J=3,6 Гц, 3H), 2,12 (дт, J=7,7, 1,5 Гц, 2H), 2,10-2,04 (м, 2H), 2,03 (с, 1H), 1,96 (д, J=13,2 Гц, 2H), 1,34 (тдд, J=13,0, 7,3, 5,8 Гц, 1H), 1,03 (кв., J=12,0 Гц, 1H), 0,93 (д, J=6,5 Гц, 3H).
Пример 95: Синтез соединения 348 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(4,4-дифторпиперидин-1-ил)ацетамид)
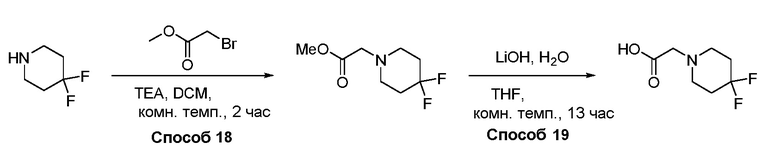
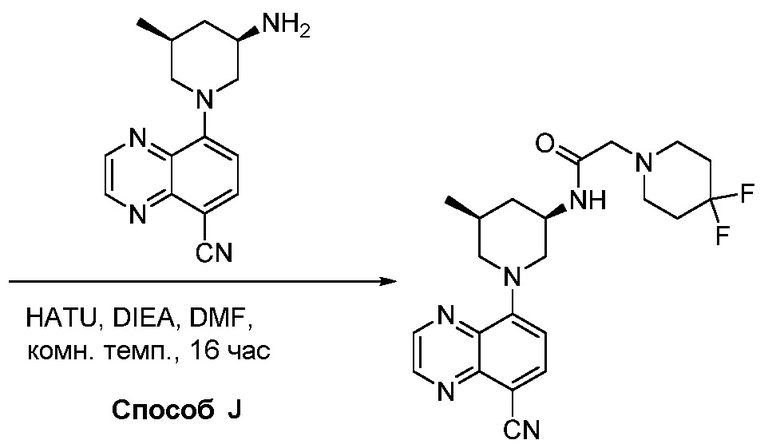
N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(4,4-дифторпиперидин-1-ил)ацетамид: N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(4,4-дифторпиперидин-1-ил)ацетамид получали из 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрила, 4,4-дифторпиперидина, метил 2-бромацетата и 2-(диметиламино)уксусной кислоты с использованием Способа 18, 19 и J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 42% - 55% градиент за 7 мин; детектор УФ 254 нм. N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(4,4-дифторпиперидин-1-ил)ацетамид получали в виде желтого твердого вещества (13 мг, 2,7% для 3 стадий).
Соединение 348: ВЭЖХ: чистота 99,4%, RT=1,51 мин. МС: m/z=429,3 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,97 (д, J=1,7 Гц, 1H), 8,86 (д, J=1,7 Гц, 1H), 8,02 (д, J=8,3 Гц, 1H), 7,21 (д, J=8,4 Гц, 1H), 7,18-6,98 (м, 1H), 4,46-4,37 (м, 1H), 4,36-4,21 (м, 2H), 3,14 (с, 2H), 2,85-2,68 (м, 6H), 2,23-2,00 (м, 6H), 1,30-1,14 (м, 1H), 1,03 (д, J=6,6 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 350 (2-(4,4-дифторпиперидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]ацетамид): из (3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-амина и 2-(4,4-дифторпиперидин-1-ил)уксусной кислоты. ВЭЖХ: чистота 99,1%, RT=2,83 мин. МС: m/z=471,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,02 (дд, J=4,1, 1,6 Гц, 1H), 8,53 (дд, J=8,6, 1,7 Гц, 1H), 8,07 (д, J=8,1 Гц, 1H), 7,79 (д, J=8,0 Гц, 1H), 7,68 (дд, J=8,6, 4,2 Гц, 1H), 7,22 (д, J=8,1 Гц, 1H), 4,15-4,05 (м, 1H), 3,51-3,30 (м, 2H), 3,02 (с, 2H), 2,57-2,35 (м, 6H), 2,12-1,93 (м, 6H), 1,25-1,21 (м, 1H), 0,96 (д, J=6,5 Гц, 3H).
Соединение 354 (2-(4,4-дифторпиперидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамид): из (3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амина и 2-(4,4-дифторпиперидин-1-ил)уксусной кислоты. ВЭЖХ: чистота 99,0%, RT=2,00 мин. МС: m/z=472,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,03 (д, J=1,7 Гц, 1H), 8,97 (д, J=1,7 Гц, 1H), 8,07 (д, J=8,4 Гц, 1H), 7,78 (д, J=8,0 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,19-3,95 (м, 3H), 3,06-2,97 (м, 2H), 2,87-2,81 (м, 1H), 2,58-2,49 (м, 5H), 2,07-1,58 (м, 6H), 1,35-1,20 (м, 1H), 0,94 (д, J=6,3 Гц, 3H).
Пример 96: Синтез соединения 349 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-метил-2-(1-метилпиперидин-4-ил)пропанамид)
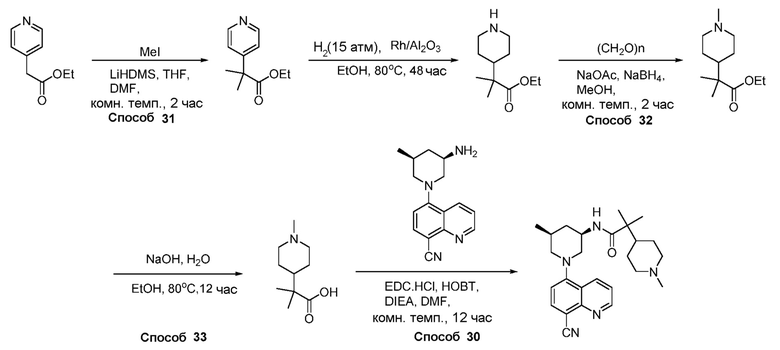
Способ 31
Этил 2-метил-2-(пиридин-4-ил)пропаноат: К раствору этил 2-(пиридин-4-ил)ацетата (1,90 г, 11,50 ммоль) в N,N-диметилформамиде (30 мл) медленно добавляли раствор LiHMDS (1 M в THF, 14,4 мл, 14,4 ммоль) при 0°C. Полученный раствор перемешивали при комнатной температуре в течение 0,5 часа и затем медленно добавляли CH3I (2,61 г, 18,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси снова добавляли раствор LiHMDS (1 M в THF, 14,4 мл, 14,4 ммоль) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 0,5 часа и затем медленно добавляли CH3I (2,61 г, 18,4 ммоль). Реакционную смесь перемешивали при комнатной температуре еще в течение 2 часов. Когда реакция была завершена, ее гасили путем добавления ледяной воды (50 мл). Полученную смесь экстрагировали при помощи DCM (150 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, (0% - 25% градиент), с получением этил 2-метил-2-(пиридин-4-ил)пропаноата в виде желтого твердого вещества (1,20 г, 54%). МС: m/z=194,1 [M+H]+.
Этил 2-метил-2-(пиперидин-4-ил)пропаноат: К раствору этил 2-метил-2-(пиридин-4-ил)пропаноата (1,14 г, 5,92 ммоль) в EtOH (20 мл) добавляли Rh/Al2O3 (285 мг, 2,77 ммоль) в сосуде высокого давления. Полученную смесь гидрировали при комнатной температуре при давлении водорода 4 бар в течение 12 часов. Когда реакция была завершена, реакционную смесь фильтровали через слой целита. Фильтрат концентрировали при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи MeOH в DCM (0% - 50% градиент), с получением этил 2-метил-2-(пиперидин-4-ил)пропаноата в виде желтого масла (300 мг, 25%). МС: m/z=200,1 [M+H]+.
Способ 32
Этил 2-метил-2-(1-метилпиперидин-4-ил)пропаноат: К раствору этил 2-метил-2-(пиперидин-4-ил)пропаноата (180 мг, 0,90 ммоль) в метаноле (10 мл) добавляли полиформальдегид (836 мг, 9,28 ммоль), NaOAc (1,56 г, 18,99 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 2 часов и затем добавляли NaBH4 (541 мг, 14,31 ммоль) при комнатной температуре. Полученную смесь перемешивали еще в течение 12 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (20 мл). Полученный раствор экстрагировали этилацетатом (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, (0% - 25% градиент), с получением этил 2-метил-2-(1-метилпиперидин-4-ил)пропаноата в виде бесцветного масла (160 мг, 83%). МС: m/z=214,1 [M+H]+.
Способ 33
Этил 2-метил-2-(1-метилпиперидин-4-ил)пропаноат: При комнатной температуре этил 2-метил-2-(1-метилпиперидин-4-ил)пропаноат (160 мг, 0,75 ммоль) растворяли в EtOH (4 мл), затем добавляли раствор гидроксида натрия (355 мг, 8,86 ммоль) в воде (2 мл). Полученную смесь перемешивали в течение 12 часов при 80°C. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge BEH130 Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% TFA), 0% - 15% градиент за 9 мин; детектор УФ 254 нм. 2-метил-2-(1-метилпиперидин-4-ил)пропановую кислоту получали в виде бесцветного масла (100 мг, 58%). МС: m/z=186,0 [M+H]+.
N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-метил-2-(1-метилпиперидин-4-ил)пропанамид: N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-метил-2-(1-метилпиперидин-4-ил)пропанамид получали из 8-[(3R,5S)-3-амино-5-метилпиперидин-1-ил]хиноксалин-5-карбонитрила и 2-метил-2-(1-метилпиперидин-4-ил)пропановой кислоты с использованием Способа 30. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge BEH130 Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 26% - 45% градиент за 8 мин; детектор УФ 254 нм. N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-метил-2-(1-метилпиперидин-4-ил)пропанамид получали в виде желтого твердого вещества (28 мг, 39%).
Соединение 349: ВЭЖХ: чистота 99,9%, RT=0,67 мин. МС: m/z=379,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,82 (м, 2H), 8,08 (д, J=8,4 Гц, 1H), 7,29 (д, J=8,4 Гц, 1H), 4,37-4,10 (м, 3H), 3,00-2,78 (м, 3H), 2,72-2,65 (м, 1H), 2,26 (с, 3H), 2,04-1,96 (м, 4H), 1,69-1,25 (м, 6H), 1,13 (с, 6H), 1,00 (д, J=6,3 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 351 (2-метил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-2-(1-метилпиперидин-4-ил)пропанамид): из 2-метил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-2-(1-метилпиперидин-4-ил)пропанамида и 2-метил-2-(1-метилпиперидин-4-ил)пропановой кислоты. ВЭЖХ: чистота 96,3%, RT=3,56 мин. МС: m/z=477,2 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,02 (дд, J=4,1, 1,7 Гц, 1H), 8,54 (дд, J=8,6, 1,7 Гц, 1H), 8,07 (д, J=8,1 Гц, 1H), 7,69 (дд, J=8,6, 4,2 Гц, 1H), 7,32-7,16 (м, 2H), 4,20-4,05 (м, 1H), 3,50-3,30 (м, 2H), 2,84-2,70 (м, 2H), 2,50-2,35 (м, 1H), 2,15-1,85 (м, 5H), 1,80-1,65 (м, 2H), 1,50-1,10 (м, 7H), 1,05-0,90 (м, 9H).
Соединение 355 (2-метил-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(1-метилпиперидин-4-ил)пропанамид): из (3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амина и 2-метил-2-(1-метилпиперидин-4-ил)пропановой кислоты. ВЭЖХ: чистота 97,7%, RT=2,35 мин. МС: m/z=478,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,95-8,86 (м, 2H), 8,04 (д, J=8,4 Гц, 1H), 7,30 (д, J=8,3 Гц, 1H), 4,30-4,05 (м, 3H), 3,09 (д, J=11,2 Гц, 2H), 2,90-2,72 (м, 1H), 2,66-2,50 (м, 1H), 2,40 (с, 3H), 2,30-1,96 (м, 4H), 1,75-1,60 (м, 3H), 1,51-1,26 (м, 4H), 1,15 (с, 6H), 1,02 (д, J=6,4 Гц, 3H).
Пример 97: Синтез соединения 352 и соединения 353 ((3S)-1-метил-3-[[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]амино]пирролидин-2-он и (3R)-1-метил-3-[[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]амино]пирролидин-2-он)
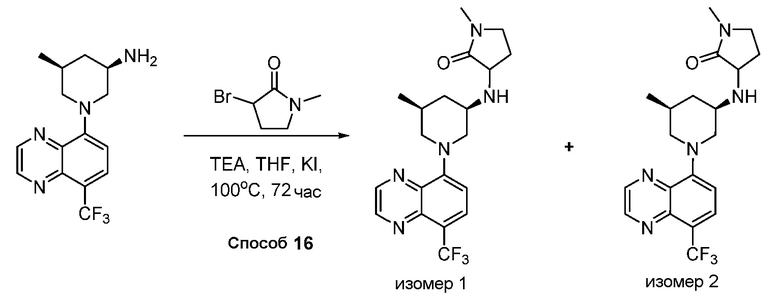
(3S)-1-метил-3-[[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]амино]пирролидин-2-он и (3R)-1-метил-3-[[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]амино]пирролидин-2-он: цис-1-метил-3-[[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]амино]пирролидин-2-он получали из (3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амина и 3-бром-1-метилпирролидин-2-она с использованием Способа 16. Неочищенный продукт сначала очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Shield RP18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (0,05% NH3.H2O), 36% - 43% градиент за 7 мин; детектор УФ 254 нм. Затем два диастереомерных изомера получали путем разделения методом хиральной препаративной ВЭЖХ при следующих условиях: колонка с насадкой Lux 5 μ Cellulose-4, AXIA, 2,12 × 25см, 5 мкм; подвижная фаза: EtOH в гексане, 50% изократический в течение 12 мин; детектор УФ 254/220 нм.
Изомер 1: (25 мг, 19%, желтое твердое вещество) ВЭЖХ: чистота 95,4%, RT=2,06 мин. МС: m/z=430,3 [M+Na]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,08-8,95 (м, 2H), 8,05 (д, J=8,4 Гц, 1H), 7,22 (д, J=8,4 Гц, 1H), 4,29 (д, J=11,5 Гц, 1H), 4,03 (д, J=11,6 Гц, 1H), 3,47-3,21 (м, 4H), 3,05-2,98 (м, 1H), 2,74 (с, 3H), 2,60-2,45 (м, 1H), 2,38-2,22 (м, 1H), 2,18-2,08 (м, 1H), 1,99-1,85 (м, 2H), 1,73-1,58 (м, 1H), 0,95-0,92 (м, 4H).
Изомер 2: (24 мг, 18%, желтое твердое вещество) ВЭЖХ: чистота 94,7%, RT=2,22 мин. МС: m/z=430,3 [M+Na]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,08-8,95 (м, 2H), 8,05 (д, J=8,4 Гц, 1H), 7,22 (д, J=8,4 Гц, 1H), 4,29 (д, J=11,5 Гц, 1H), 4,03 (д, J=11,6 Гц, 1H), 3,47-3,21 (м, 5H), 3,05-2,98 (м, 1H), 2,74 (с, 3H), 2,60-2,45 (м, 1H), 2,38-2,22 (м, 1H), 2,10-2,00 (м, 1H), 1,99-1,85 (м, 1H), 1,73-1,58 (м, 1H), 0,95-0,92 (м, 4H).
Пример 98: Синтез соединения 356 (2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]ацетамид)
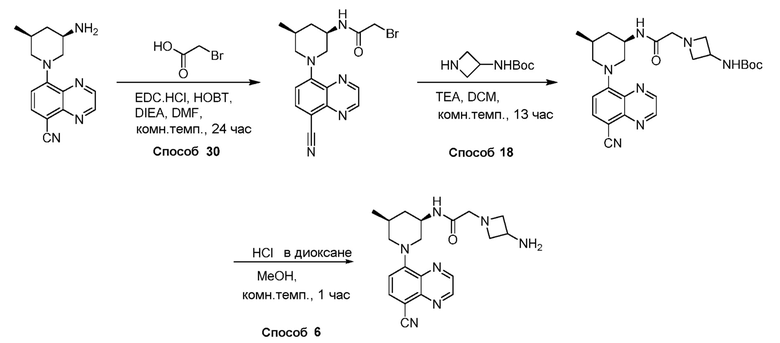
2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]ацетамид: 2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]ацетамид получали из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила, 2-бромуксусной кислоты и трет-бутил азетидин-3-илкарбамата с использованием Способа 30, 18 и 6. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 2% - 33% градиент за 10 мин; детектор УФ 254 нм. 2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]ацетамид получали в виде желтого твердого вещества (34 мг, 29%).
Соединение 356: ВЭЖХ: чистота 97,8%, RT=0,96 мин. МС: m/z=380,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 9,10-8,90 (м, 2H), 8,21 (д, J=8,4 Гц, 1H), 7,66 (д, J=8,1 Гц, 1H), 7,27 (д, J=8,5 Гц, 1H), 4,39-3,85 (м, 3H), 3,70-3,37 (м, 4H), 3,07-2,60 (м, 7H), 1,98-1,82 (м, 2H), 1,33-1,24 (м, 1H), 0,93-0,76 (м, 3H).
Пример 99: Синтез соединения 357 и 358 (N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-((1R,5S,6r)-3-метил-3-аза-бицикло[3,1,1]гептан-6-ил)ацетамид и N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-((1S,5R,6s)-3-метил-3-аза-бицикло[3,1,1]гептан-6-ил)ацетамид)
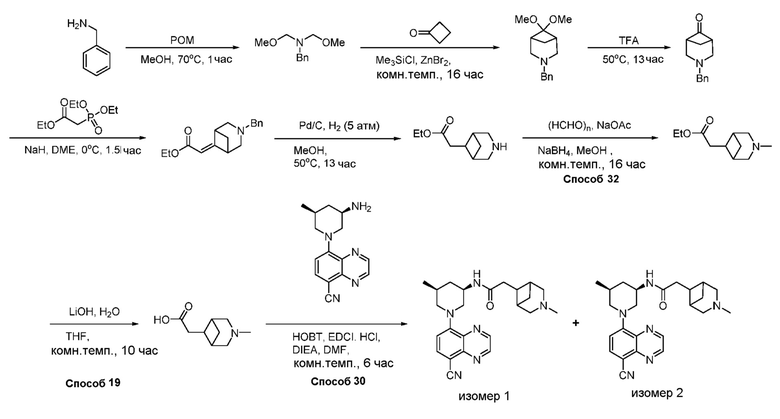
Бензилбис(метоксиметил)амин: К раствору фенилметанамина (95 г, 886,58 ммоль) в MeOH (1 л) добавляли полиформальдегид (78,4 г, 870,08 ммоль) при комнатной температуре. Полученный раствор затем перемешивали в течение ночи при 70°C. Когда реакция была завершена, ее гасили путем добавления воды ( мл). Растворитель удаляли при пониженном давлении и остаток очищали дистилляцией при пониженном давлении (10 мм рт.ст.) и фракцию собирали при 70~72°C с получением бензилбис(метоксиметил)амина в виде бесцветной жидкости (104,0 г, 75%).
Бензилбис(метоксиметил)амин: К раствору бензилбис(метоксиметил)амина (16,0 г, 81,94 ммоль) в DCM (200 мл) добавляли циклобутанон (6,8 г, 96,62 ммоль), хлортриметилсилан (22,8 г, 210,74 ммоль) и ZnBr2 (21,7 г, 96,17 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 16 часов при комнатной температуре. После охлаждения до комнатной температуры реакционную смесь гасили путем добавления воды (500 мл). Полученную смесь экстрагировали этилацетатом (200 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, (0% - 90% градиент), с получением 3-бензил-6,6-диметокси-3-азабицикло[3.1.1]гептан в виде светло-желтого масла (6,4 г, 32%). МС: m/z=248,3 [M+H]+.
Бензилбис(метоксиметил)амин: 3-бензил-6,6-диметокси-3-азабицикло[3.1.1]гептан (3,6 г, 14,56 ммоль) медленно добавляли к трифторуксусной кислоте (100 мл) при комнатной температуре. Полученный раствор затем перемешивали в течение 13 часов при 50°C. Когда реакция была завершена, реакционную смесь концентрировали при пониженном давлении и разбавляли при помощи H2O (50 мл). Значение pH полученной смеси доводили до 9 насыщенным раствором карбоната натрия. Смесь экстрагировали этилацетатом (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане (0% - 10% градиент), с получением 3-бензил-3-азабицикло[3.1.1]гептан-6-она в виде коричневого масла (2,5 г, 84%). МС: m/z=202,0 [M+H]+.
Этил 2-[3-бензил-3-азабицикло[3.1.1]гептан-6-илиден]ацетат: при 0°C к раствору 3-бензил-3-азабицикло[3.1.1]гептан-6-она (2,0 г, 9,83 ммоль) в диметиловом эфире этиленгликоля (100 мл) медленно добавляли гидрид натрия (294 мг, 12,25 ммоль). Полученную смесь перемешивали при 0°C в течение 10 минут и затем добавляли этил 2-(диэтоксифосфорил)ацетат (3,9 г, 17,29 ммоль). Реакционную смесь затем перемешивали еще в течение 1,5 часа при 0°C. Когда реакция была завершена, ее гасили путем добавления насыщенного раствора NH4Cl. Полученную смесь экстрагировали этилацетатом (100 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали флэш-хроматографией, элюируя при помощи MeOH в DCM (0% - 10% градиент), с получением этил 2-[3-бензил-3-азабицикло[3.1.1]гептан-6-илиден]ацетата в виде светло-желтого масла (1,4 г, 53%). МС: m/z=272,1 [M+H]+.
Этил 2-[3-бензил-3-азабицикло[3.1.1]гептан-6-илиден]ацетат: К раствору этил 2-[3-бензил-3-азабицикло[3.1.1]гептан-6-илиден]ацетата (1,4 г, 5,16 ммоль) в MeOH (100 мл) добавляли Pd/C (10%, 400 мг,) при комнатной температуре в атмосфере азота. Реакционную колбу вакуумировали и продували водородом. Реакционную смесь затем гидрировали при 55°C в течение 16 часов в атмосфере водорода под водородным баллоном. Когда реакция была завершена, реакционную смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении с получением этил 2-[3-азабицикло[3.1.1]гептан-6-ил]ацетата в виде светло-желтого масла (800 мг, 85%). МС: m/z=184,2 [M+H]+.
N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-((1R,5S,6R)-3-метил-3-аза-бицикло[3.1.1]гептан-6-ил)ацетамид и N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-((1S,5R,6S)-3-метил-3-аза-бицикло[3.1.1]гептан-6-ил)ацетамид: N-((3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил)-2-(3-метил-3-аза-бицикло[3.1.1]гептан-6-ил)ацетамид получали из 8-((3R,5S)-3-амино-5-метилпиперидин-1-ил)хиноксалин-5-карбонитрила, этил 2-(3-аза-бицикло[3.1.1]гептан-6-ил)ацетата и полиформальдегида с использованием Способа 32, 19 и 30. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 19 × 150 мм 10 мкм; подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3 и 0,1% NH3.H2O), 29% - 33% градиент за 7 мин; детектор УФ 254 нм. Два диастереоизомера были разделены и получены.
Изомер 1: (5 мг, 4% для 3 стадий, светло-желтое твердое вещество) ВЭЖХ: чистота 96,9%, RT=2,90 мин. МС: m/z=419,1 [M+Na]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,89 (м, 2H), 8,10 (д, J=8,3 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 4,43-4,28 (м, 2H), 4,17-4,10 (м, 1H), 3,16-3,07 (м, 2H), 2,85-2,63 (м, 4H), 2,54 (д, J=8,0 Гц, 2H), 2,41 (с, 3H), 2,33-2,31 (м, 1H), 2,18-1,99 (м, 5H), 1,69-1,66 (м, 1H), 1,30-1,14 (м, 1H), 1,02 (д, J=6,5 Гц, 3H).
Изомер 2: (6 мг, 4,4% для 3 стадий, светло-желтое твердое вещество) ВЭЖХ: чистота 97,7%, RT=1,16 мин. МС: m/z=419,5 [M+Na]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,99-8,89 (м, 2H), 8,10 (д, J=8,4 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 4,38-4,31 (м, 2H), 4,15-4,09 (м, 1H), 3,17-3,04(м, 2H), 2,92-2,80 (м, 2H), 2,79-2,51 (м, 3H), 2,41 (с, 3H), 2,37-2,30 (м, 4H), 2,11-2,03 (м, 2H), 1,92-1,75 (м, 2H), 1,23-1,15 (м, 1H), 1,02 (д, J=6,4 Гц, 3H).
Пример 100: Синтез соединения 359 (N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(1-метилазетидин-3-ил)ацетамид)
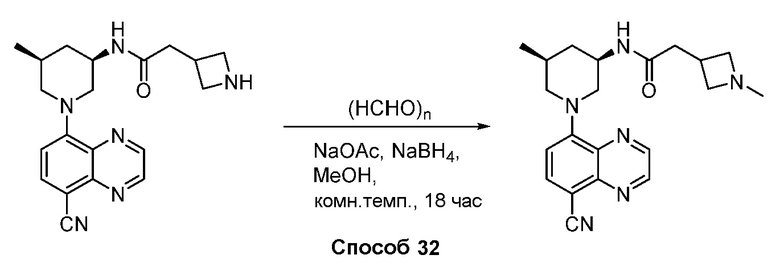
N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(1-метилазетидин-3-ил)ацетамид: N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(1-метилазетидин-3-ил)ацетамид получали из 2-(азетидин-3-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]ацетамида и полиформальдегида с использованием Способа 32. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3 и 0,1% NH3.H2O), 25% - 31% градиент за 7 мин; детектор УФ 254 нм. N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]-2-(1-метилазетидин-3-ил)ацетамид получали в виде желтого твердого вещества (5 мг, 12%).
Соединение 359: ВЭЖХ: чистота 97,2%, RT=0,84 мин. МС: m/z=379,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD, м.д.) δ 8,99-8,88 (м, 2H), 8,07 (д, J=8,4 Гц, 1H), 7,26 (д, J=8,4 Гц, 1H), 4,36-4,31 (м, 2H), 4,12-4,04(м, 1H), 3,55-3,50 (м, 2H), 3,03-2,98 (м, 2H), 2,90-2,60 (м, 3H), 2,45 (д, J=7,7 Гц, 2H), 2,33 (с, 3H), 2,15-1,94 (м, 2H), 1,26-1,10 (м, 1H), 0,99 (д, J=6,3 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 360 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хинолин-5-ил]пиперидин-3-ил]-2-(1-метилазетидин-3-ил)ацетамид): из 2-(азетидин-3-ил)-N-[(3R,5S)-1-(8-цианохиноксалин-5-ил)-5-метилпиперидин-3-ил]ацетамида и полиформальдегида. ВЭЖХ: чистота 94,0%, RT=2,27 мин. МС: m/z=421,1 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,02 (дд, J=4,2, 1,6 Гц, 1H), 8,52 (дд, J=8,6, 1,8 Гц, 1H), 8,06 (д, J=8,1 Гц, 1H), 7,92 (д, J=7,4 Гц, 1H), 7,68 (дд, J=8,6, 4,2 Гц, 1H), 7,21 (д, J=8,1 Гц, 1H), 4,01-3,99 (м, 1H), 3,48-3,21 (м, 3H), 2,81-2,70 (м, 2H), 2,51-2,28 (м, 4H), 2,16 (с, 3H), 2,09-1,95 (м, 3H), 1,18-0,91 (м, 4H).
Соединение 363 (N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]-2-(1-метилазетидин-3-ил)ацетамид): из 2-(азетидин-3-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]ацетамида и полиформальдегида. ВЭЖХ: чистота 93,5%, RT=5,81 мин. МС: m/z=422,3 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,08-8,95 (м, 2H), 8,07 (д, J=8,2 Гц, 1H), 7,91 (д, J=7,6 Гц, 1H), 7,28 (д, J=8,5 Гц, 1H), 4,23-4,04 (м, 2H), 3,92-3,81 (м, 1H), 3,43-3,26 (м, 2H), 2,80-2,65 (м, 5H), 2,34-2,31 (м, 2H), 2,16 (с, 3H), 1,95-1,83 (м, 2H), 1,21-1,02 (м, 1H), 0,93 (д, J=6,2 Гц, 3H).
Соединение 364 (N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]-2-(1-метилазетидин-3-ил)ацетамид): из 2-(азетидин-3-ил)-N-[(3R,5S)-1-[8-(дифторметил)хинолин-5-ил]-5-метилпиперидин-3-ил]ацетамида и полиформальдегида. ВЭЖХ: чистота 88,7%, RT=1,24 мин. МС: m/z=403,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,89 (дд, J=4,2, 1,7 Гц, 1H), 8,60 (дд, J=8,6, 1,8 Гц, 1H), 7,93 (дд, J=7,8, 1,6 Гц, 1H), 7,83-7,55 (м, 2H), 7,24 (д, J=7,9 Гц, 1H), 4,25-4,12 (м, 1H), 3,59-3,43 (м, 3H), 2,98-2,93 (м, 2H), 2,79-2,75 (м, 1H), 2,51-2,36 (м, 4H), 2,30 (с, 3H), 2,13-2,07 (м, 2H), 1,19-0,97 (м, 5H).
Пример 101: Синтез соединения 366 (цис-5-циклопропил-1-(8-фторхиноксалин-5-ил)пиперидин-3-амин)
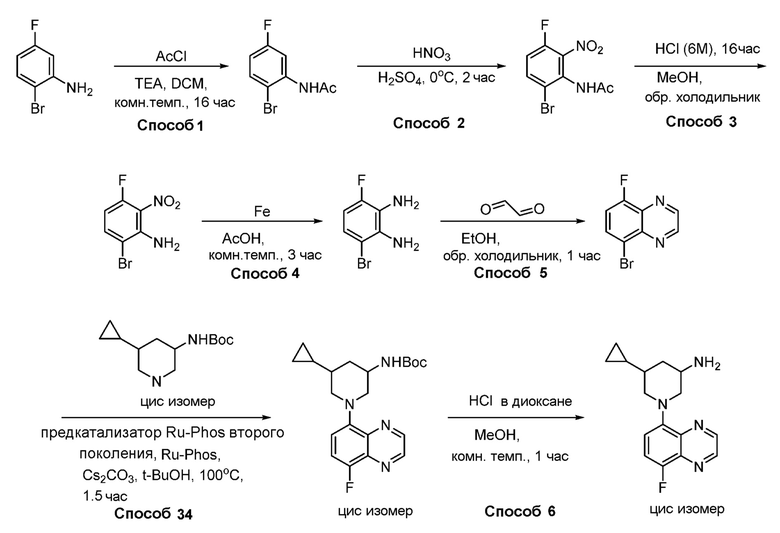
5-бром-8-фторхиноксалин: 5-бром-8-фторхиноксалин получали из 2-бром-5-фторбензоламина, ацетилхлорида и оксалальдегида с использованием Способа 1-5. Неочищенный продукт очищали флэш-хроматографией, элюируя при помощи EtOAc в гексане, (0% - 10% градиент), с получением 5-бром-8-фторхиноксалина в виде белого твердого вещества (637 мг, 71%, для 5 стадий). МС: m/z=226,8 [M+H]+.
Способ 34
трет-бутил цис-N-[5-циклопропил-1-(8-фторхиноксалин-5-ил)пиперидин-3-ил]карбамат: К раствору 5-бром-8-фторхиноксалина (66 мг, 0,29 ммоль) в трет-бутаноле (10 мл) добавляли трет-бутил N-(5-циклопропилпиперидин-3-ил)карбамат (62 мг, 0,26 ммоль), RuPhos (29 мг, 0,06 ммоль), Cs2CO3 (151,6 мг, 0,44 ммоль) и предкатализатор RuPhos 2-го поколения (23 мг, 0,03 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов при 100°C. После охлаждения до комнатной температуры реакционную смесь гасили путем добавления воды (20 мл). Полученную смесь экстрагировали этилацетатом (20 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток вносили в C18 гель колонку и очищали обращенно-фазовой флэш-хроматографией, элюируя ацетонитрилом в воде (с 10 ммоль/л NH4HCO3) (0% - 60% градиент за 30 мин), с получением трет-бутил N-[5-циклопропил-1-(8-фторхиноксалин-5-ил)пиперидин-3-ил]карбамата в виде желтого твердого вещества (32 мг, 29%). МС: m/z=387,2 [M+H]+.
цис-5-циклопропил-1-(8-фторхиноксалин-5-ил)пиперидин-3-амин: цис-5-циклопропил-1-(8-фторхиноксалин-5-ил)пиперидин-3-амин получали из трет-бутил N-[5-циклопропил-1-(8-фторхиноксалин-5-ил)пиперидин-3-ил]карбамата с использованием Способа 6. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3 и 0,1% NH3.H2O), 35% - 65% градиент за 7 мин; детектор УФ 254 нм. цис-5-циклопропил-1-(8-фторхиноксалин-5-ил)пиперидин-3-амин получали в виде желтого твердого вещества (7 мг, 29%).
Соединение 366: ВЭЖХ: чистота 99,0%, RT=1,78 мин. МС: m/z=278,1 [M+H]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,02-8,92 (м, 2H), 7,57 (дд, J=10,2, 8,6 Гц, 1H), 7,16 (дд, J=8,7, 4,9 Гц, 1H), 3,86-3,72 (м, 2H), 2,93-2,88 (м, 1H), 2,50-2,40 (м, 2H), 2,33-2,29 (м, 1H), 2,15-1,90 (м, 2H), 1,02-1,1 (м, 2H), 0,65-0,32 (м, 3H), 0,16-0,14 (м, 2H).
Пример 102: Синтез соединения 367 (цис-N-[5-циклопропил-1-(8-фторхинолин-5-ил)пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид)
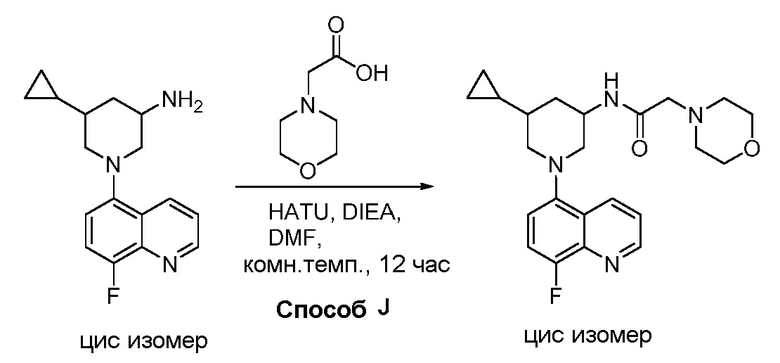
Цис-N-[5-циклопропил-1-(8-фторхинолин-5-ил)пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид: цис-N-[5-циклопропил-1-(8-фторхинолин-5-ил)пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид получали из цис-5-циклопропил-1-(8-фторхинолин-5-ил)пиперидин-3-амина и 2-(морфолин-4-ил)уксусной кислоты с использованием Способа J. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3 и 0,1% NH3.H2O), 36% - 47% градиент за 7 мин; детектор УФ 254 нм. Цис-N-[5-циклопропил-1-(8-фторхинолин-5-ил)пиперидин-3-ил]-2-(морфолин-4-ил)ацетамид получали в виде желтого твердого вещества (50 мг, 62%).
Соединение 367: ВЭЖХ: чистота 99,9%, RT=1,09 мин. МС: m/z=413,4 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,86 (дд, J=4,3, 1,6 Гц, 1H), 8,65 (дт, J=8,7, 1,6 Гц, 1H), 7,63 (дд, J=8,6, 4,3 Гц, 1H), 7,42 (дд, J=10,7, 8,4 Гц, 1H), 7,22 (дд, J=8,4, 4,2 Гц, 1H), 4,19-4,12 (м, 1H), 3,74-3,67 (м, 4H), 3,45-3,26 (м, 2H), 3,02 (с, 2H), 2,70-2,47 (м, 6H), 2,26-2,14 (м, 1H), 1,43-1,20 (м, 2H), 0,63-0,45 (м, 3H), 0,29-0,12 (м, 2H).
Пример 103: Синтез соединения 368 (цис-N-[5-циклопропил-1-(8-фторхинолин-5-ил)пиперидин-3-ил]-N-метил-2-(морфолин-4-ил)ацетамид
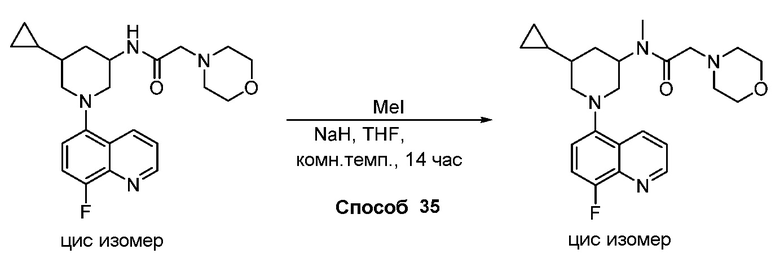
Способ 35
Цис-N-[5-циклопропил-1-(8-фторхинолин-5-ил)пиперидин-3-ил]-N-метил-2-(морфолин-4-ил)ацетамид: К раствору цис-N-[5-циклопропил-1-(8-фторхинолин-5-ил)пиперидин-3-ил]-2-(морфолин-4-ил)ацетамида (100 мг, 0,24 ммоль) в тетрагидрофуране (15 мл) добавляли гидрид натрия (17 мг, 0,73 ммоль) при комнатной температуре. Смесь перемешивали в течение 10 минут при комнатной температуре и затем добавляли MeI (294 мг, 2,07 ммоль). Полученную смесь перемешивали еще в течение 14 часов при комнатной температуре. Когда реакция была завершена, ее гасили путем добавления воды (20 мл). Полученную смесь экстрагировали при помощи DCM (50 мл ×3). Органические фазы объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 32% - 40% градиент за 8 мин; детектор УФ 254 нм. Цис-N-[5-циклопропил-1-(8-фторхинолин-5-ил)пиперидин-3-ил]-N-метил-2-(морфолин-4-ил)ацетамид получали в виде светло-коричневого твердого вещества (10 мг, 9%).
Соединение 368: ВЭЖХ: чистота 95,5%, RT=0,91 мин. МС: m/z=427,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD, м.д.) δ 8,87 (дд, J=4,2, 1,6 Гц, 1H), 8,64 (дт, J=8,7, 1,8 Гц, 1H), 7,63 (дд, J=8,7, 4,3 Гц, 1H), 7,43 (дд, J=10,6, 8,4 Гц, 1H), 7,23 (дд, J=8,4, 4,2 Гц, 1H), 4,27-4,14 (м, 3H), 4,03-3,98 (м, 4H), 3,75-3,66 (м, 4H), 3,48-3,47 (м, 1H), 3,42 (с, 3H), 2,71-2,51 (м, 2H), 2,27-2,21 (м, 1H), 1,36-1,25 (м, 3H), 0,63-0,59 (м, 1H), 0,53-0,43 (м, 2H), 0,21-0,18 (м, 2H).
Пример 104: Синтез соединения 369 и соединения 370 ((2R)-2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]пропанамид и (2S)-2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]пропанамид)
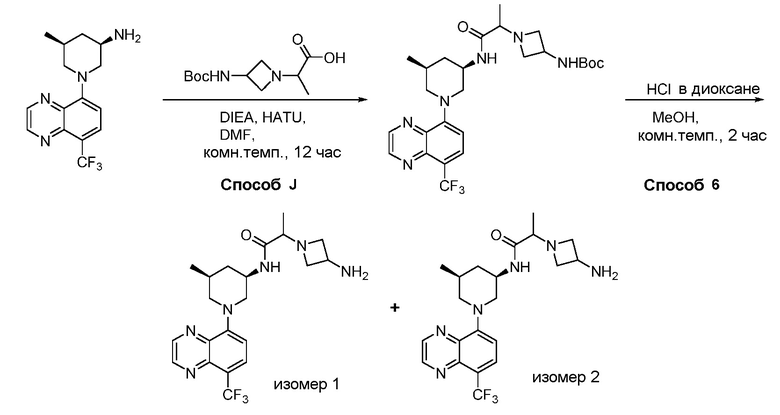
(2R)-2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]пропанамид и (2S)-2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]пропанамид: 2-(3-аминоазетидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]пропанамид получали из (3R,5S)-5-метил-1-(8-(трифторметил)хиноксалин-5-ил)пиперидин-3-амина и 2-(3-(трет-бутоксикарбониламино)азетидин-1-ил)пропановой кислоты с использованием Способа J и 6. Неочищенный продукт сначала очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4HCO3 и 0,1% NH3.H2O), 30% - 50% градиент за 7 мин; детектор УФ 254 нм. Затем два энантиомерных изомера получали путем разделения методом хиральной препаративной ВЭЖХ при следующих условиях: колонка CHIRALPAK IC, 2 × 25см, 5 мкм; подвижная фаза: EtOH в гексане (0,1% DEA), 30% изократический в течение 18 мин; детектор УФ 254/220 нм.
Изомер 1: (18 мг, 26%, желтое твердое вещество) ВЭЖХ: чистота 98,1%, RT=1,31 мин. МС: m/z=437,5 [M+Na]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,06-8,94 (м, 2H), 8,06 (д, J=8,4 Гц, 1H), 7,57 (д, J=8,0 Гц, 1H), 7,25 (д, J=8,3 Гц, 1H), 4,20-3,85 (м, 3H), 3,54-3,35 (м, 3H), 2,86-2,51 (м, 6H), 2,02-1,85 (м, 2H), 1,35-0,85 (м, 8H).
Изомер 2: (28 мг, 26%, желтое твердое вещество) ВЭЖХ: чистота 91,6%, RT=1,28 мин. МС: m/z=437,4 [M+Na]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,06-8,94 (м, 2H), 8,07 (д, J=8,4 Гц, 1H), 7,53 (д, J=8,0 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 4,14-3,97 (м, 3H), 3,49-3,32 (м, 3H), 2,87-2,52 (м, 4H), 2,20-1,85 (м, 4H), 1,31-0,89 (м, 8H).
Следующие соединения синтезировали аналогичным способом:
Соединение 371 и соединение 372 ((2R)-2-(4-гидроксипиперидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]пропанамид и (2s)-2-(4-гидроксипиперидин-1-ил)-N-[(3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-ил]пропанамид): из (3R,5S)-5-метил-1-[8-(трифторметил)хиноксалин-5-ил]пиперидин-3-амина и 2-(4-гидроксипиперидин-1-ил)пропановой кислоты. Изомер 1: ВЭЖХ: чистота 91,9%, RT=1,44 мин. МС: m/z=466,5 [M+Na]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,06-8,94 (м, 2H), 8,07 (д, J=8,4 Гц, 1H), 7,72 (д, J=7,8 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 4,62-4,46 (м, 1H), 4,20-3,90 (м, 3H), 3,50-3,34 (м, 1H), 3,14-3,00 (м, 1H), 2,85-2,50 (м, 4H), 2,30-2,05 (м, 2H), 2,03-1,87 (м, 2H), 1,79-1,63 (м, 2H), 1,46-1,17 (м, 3H), 1,07 (д, J=6,8 Гц, 3H), 0,93 (д, J=6,2 Гц, 3H). Изомер 2: ВЭЖХ: чистота 97,0%, RT=5,48 мин. МС: m/z=466,5 [M+Na]+. 1H ЯМР (300 МГц, DMSO-d6, м.д.) δ 9,09-8,95 (м, 2H), 8,08 (д, J=8,4 Гц, 1H), 7,77-7,63 (м, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,62-4,48 (м, 1H), 4,24-3,90 (м, 3H), 3,49-3,30 (м, 1H), 3,03-3,01 (м, 1H), 2,83-2,53 (м, 4H), 2,21-2,12 (м, 2H), 1,95-1,92 (м, 2H), 1,79-1,68 (м, 2H), 1,42-1,38 (м, 2H), 1,24-1,20 (м, 1H), 1,09 (д, J=6,8 Гц, 3H), 0,94 (д, J=6,2 Гц, 3H).
Пример 105: Синтез соединения 373 ((2-пиперидин-1-ил-этил)-амид 1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-карбоновой кислоты)
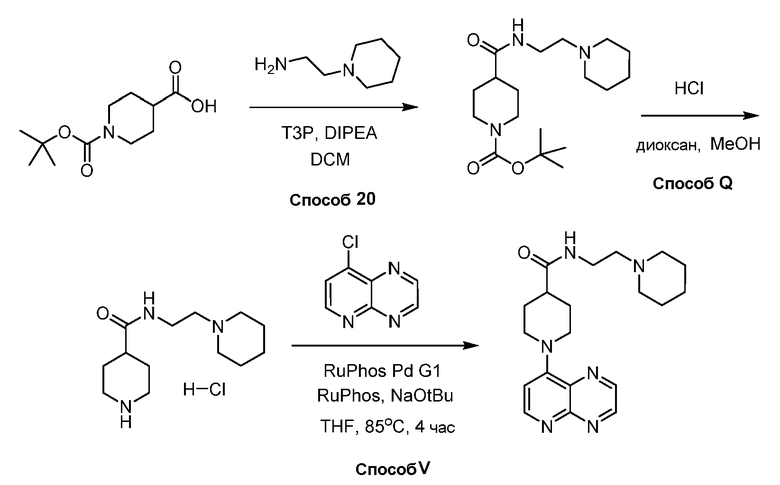
(2-Пиперидин-1-ил-этил)-амид 1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-карбоновой кислоты: (2-пиперидин-1-ил-этил)-амид 1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-карбоновой кислоты получали из 8-хлор-пиридо[2,3-b]пиразина, 1-(2-аминоэтил)пиперидина и 1-трет-бутоксикарбонилпиперидин-4-карбоновой кислоты с 11% выходом для 3 стадий, с использованием Способа 20, Q и V.
Соединение 373: ВЭЖХ: чистота 97,0%, RT=1,13 мин. МС: m/z=369 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,97 (д, J=1,7 Гц, 1H), 8,83 (д, J=5,4 Гц, 1H), 8,75 (д, J=1,7 Гц, 1H), 6,91 (д, J=5,4 Гц, 1H), 6,36 (с, 1H), 4,47 (дт, J=12,7, 2,9 Гц, 2H), 3,38 (кв., J=5,7 Гц, 2H), 3,30-3,12 (м, 2H), 2,51-2,38 (м, 6H), 2,10-2,01 (м, 4H), 2,00-1,84 (м, 1H), 1,60 (п, J=5,6 Гц, 4H), 1,53 -1,39 (м, 2H).
Следующие соединения синтезировали аналогичным способом:
Соединение 379 ((2-пиперидин-1-ил-этил)-амид 1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-карбоновой кислоты): из 8-хлор-пиридо[2,3-b]пиразина, N,N-диэтилэтилендиамина и 1-трет-бутоксикарбонилпиперидин-4-карбоновой кислоты. ВЭЖХ: чистота 93,2%, RT=1,06 мин. МС: m/z=357 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,96 (д, J=1,7 Гц, 1H), 8,81 (д, J=5,3 Гц, 1H), 8,74 (д, J=1,7 Гц, 1H), 6,89 (д, J=5,4 Гц, 1H), 6,26 (с, 1H), 4,45 (дт, J=11,4, 2,9 Гц, 2H), 3,32 (кв., J=5,5 Гц, 2H), 3,17 (ддд, J=12,7, 8,3, 6,1 Гц, 2H), 2,70-2,49 (м, 6H), 2,51-2,38 (м, 1H), 2,17-1,95 (м, 4H), 1,03 (т, J=7,1 Гц, 6H).
Соединение 380 (трет-бутиловый эфир 4-[(2-диэтиламино-ацетиламино)-метил]-пиперидин-1-карбоновой кислоты): из 8-хлор-пиридо[2,3-b]пиразина, гидрохлорида 2-(диэтиламино)уксусной кислоты и 1-boc-4-(аминометил)пиперидина. ВЭЖХ: чистота >99%, RT=1,11 мин. МС: m/z=357 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,92 (с, 1H), 8,77 (дд, J=5,8, 2,5 Гц, 1H), 8,70 (с, 1H), 7,57 (т, J=6,3 Гц, 1H), 6,85 (дд, J=5,8, 2,5 Гц, 1H), 4,43 (д, J=12,2 Гц, 3H), 3,23 (д, J=6,6 Гц, 4H), 3,14-2,96 (м, 5H), 2,54 (кв., J=6,5 Гц, 7H), 1,85 (д, J=11,3 Гц, 5H), 1,55 (кв., J=12,2 Гц, 4H), 1,01 (т, J=6,9 Гц, 10H).
Соединение 432 ((2-диэтиламино-этил)-амид 1-(8-циано-хиноксалин-5-ил)-пиперидин-4-карбоновой кислоты): из 8-бром-хиноксалин-5-карбонитрила, 1-трет-бутоксикарбонилпиперидин-4-карбоновой кислоты и N,N-диэтилэтилендиамина. ВЭЖХ: чистота 91,4%, RT=1,95 мин. МС: m/z=381 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,8 Гц, 1H), 8,83 (д, J=1,8 Гц, 1H), 8,00 (д, J=8,3 Гц, 1H), 7,06 (д, J=8,4 Гц, 1H), 4,24 (дт, J=12,3, 2,6 Гц, 2H), 3,44-3,29 (м, 2H), 3,19-3,07 (м, 2H), 2,58 (с, 5H), 2,44 (с, 2H), 2,21-1,95 (м, 4H), 1,20-0,83 (м, 6H).
Пример 106: Синтез соединения 374 (N,N-диэтил-N'-[1-(6-фтор-2-метил-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин)
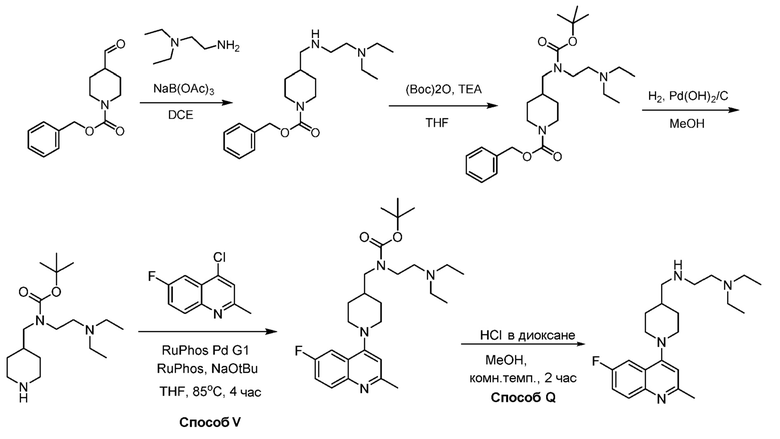
Бензиловый эфир 4-[(2-диэтиламино-этиламино)-метил]-пиперидин-1-карбоновой кислоты: Раствор 4-формил-n-cbz-пиперидина (2,0 г; 8,09 ммоль), N,N-диэтилэтилендиамина (1,4 мл; 9,71 ммоль) и триацетоксиборогидрида натрия (1,9 г; 8,90 ммоль) в безводном 1,2-дихлорэтане (80 мл) нагревали при 65°C в течение 3 часов. Бесцветный мутный раствор охлаждали, разбавляли дихлорметаном (250 мл) и промывали насыщенным водным раствором карбоната натрия (2 × 250 мл). Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в DCM и очищали хроматографией на PuriFlash 40г 30мкм, элюируя с градиентом метанола в DCM с получением бензилового эфира 4-[(2-диэтиламино-этиламино)-метил]-пиперидин-1-карбоновой кислоты (1,5 г, 43%). МС: m/z=348 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 7,52-7,17 (м, 5H), 5,06 (с, 2H), 3,99 (д, J=13,2 Гц, 2H), 2,77 (с, 2H), 2,48-2,34 (м, 10H), 1,68 (д, J=12,6 Гц, 2H), 1,62-1,47 (м, 1H), 1,01 (тд, J=12,2, 4,2 Гц, 2H), 0,93 (т, J=7,1 Гц, 6H).
Бензиловый эфир 4-{[трет-бутоксикарбонил-(2-диэтиламино-этил)-амино]-метил}-пиперидин-1-карбоновой кислоты: Раствор бензилового эфира 4-[(2-диэтиламино-этиламино)-метил]-пиперидин-1-карбоновой кислоты (1,5 г; 4,32 ммоль), триэтиламина (1,2 мл; 8,63 ммоль) и ди-трет-бутилдикарбоната (1,2 мл; 5,18 ммоль) в безводном THF (15 мл) перемешивали в течение ночи при комнатной температуре. Бесцветный раствор концентрировали при пониженном давлении, остаток растворяли в DCM и очищали хроматографией на PuriFlash 40г 15мкм колонка, элюируя с градиентом метанола в DCM, с получением бензилового эфира 4-{[трет-бутоксикарбонил-(2-диэтиламино-этил)-амино]-метил}-пиперидин-1-карбоновой кислоты (1,57 г; 68%). МС: m/z=448 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 7,46-7,21 (м, 5H), 5,06 (с, 2H), 3,99 (д, J=13,1 Гц, 2H), 3,17 (д, J=4,7 Гц, 2H), 3,05 (д, J=7,2 Гц, 2H), 2,77 (с, 2H), 2,45 (кв., J=7,0 Гц, 4H), 1,86-1,69 (м, 1H), 1,56 (д, J=13,3 Гц, 2H), 1,38 (с, 9H), 1,03 (тд, J=12,3, 4,0 Гц, 2H), 0,94 (т, J=7,2 Гц, 6H).
Бензиловый эфир 4-[(2-диэтиламино-этиламино)-метил]-пиперидин-1-карбоновой кислоты: Раствор бензилового эфира 4-{[трет-бутоксикарбонил-(2-диэтиламино-этил)-амино]-метил}-пиперидин-1-карбоновой кислоты (1,6 г; 3,46 ммоль) в метаноле (70 мл) перекачивали через H-Cube проточный гидрогенизатор, снабженный картриджем с 20 моль% Pd(OH)2/C катализатора, и нагревали до 50°C (полностью водородный режим, скорость потока 1 мл/мин). Полученный бесцветный раствор концентрировали при пониженном давлении и бесцветное масло сушили в вакууме с получением трет-бутилового эфира (2-диэтиламино-этил)-пиперидин-4-илметил-карбаминовой кислоты (1,06 г; 98%). МС: m/z=314 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 3,34 (с, 1H), 3,12 (т, J=7,4 Гц, 2H), 3,02 (д, J=7,2 Гц, 2H), 2,92 (д, J=12,1 Гц, 2H), 2,48-2,35 (м, 8H), 1,69-1,55 (м, 1H), 1,48 (д, J=12,4 Гц, 2H), 1,38 (с, 9H), 1,01 (тд, J=12,0, 3,7 Гц, 2H), 0,94 (т, J=7,1 Гц, 6H).
N,N-диэтил-N'-[1-(6-фтор-2-метил-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин: N,N-диэтил-N'-[1-(6-фтор-2-метил-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин получали с 43% выходом для 2 стадий из 4-хлор-6-фтор-2-метилхинолина и трет-бутилового эфира (2-диэтиламино-этил)-пиперидин-4-илметил-карбаминовой кислоты с использованием Способов V и Q.
Соединение 374: ВЭЖХ: чистота >99%, RT=1,33 мин. МС: m/z=373 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 7,96 (дт, J=8,3, 3,2 Гц, 1H), 7,56 (д, J=10,4 Гц, 1H), 7,38 (т, J=8,8 Гц, 1H), 6,77 (с, 1H), 3,57 (д, J=11,8 Гц, 2H), 2,80 (т, J=11,7 Гц, 2H), 2,76-2,69 (м, 2H), 2,70 -2,63 (м, 4H), 2,64-2,51 (м, 5H), 1,96 (д, J=12,8 Гц, 2H), 1,80-1,69 (м, 1H), 1,59 (кв., J=11,9 Гц, 2H), 1,05 (т, J=6,8 Гц, 5H).
Следующие соединения синтезировали аналогичным способом:
Соединение 375 (N,N-диэтил-N'-[1-(6-фтор-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин): из 4-хлор-6-фторхинолина, 4-формил-n-cbz-пиперидина и N,N-диэтилэтилендиамина. ВЭЖХ: чистота >99%, RT=1,23 мин. МС: m/z=359 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,69 (т, J=3,8 Гц, 1H), 8,12-7,98 (м, 1H), 7,61 (дд, J=10,0, 3,3 Гц, 1H), 7,42 (тд, J=8,0, 6,8, 3,9 Гц, 1H), 6,87 (т, J=3,8 Гц, 1H), 3,59 (д, J=11,7 Гц, 2H), 2,83 (т, J=12,0 Гц, 2H), 2,72 (кв., J=6,2, 5,7 Гц, 2H), 2,65 (д, J=6,1 Гц, 2H), 2,64-2,47 (м, 6H), 1,96 (д, J=12,8 Гц, 2H), 1,79-1,68 (м, 3H), 1,60 (кв., J=12,2 Гц, 2H), 1,05 (т, J=7,0 Гц, 6H).
Соединение 376 (N,N-диэтил-N'-[1-(7-трифторметил-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин): из 4-хлор-7-(трифторметил)хинолона, 4-формил-n-cbz-пиперидина и N,N-диэтилэтилендиамина. ВЭЖХ: чистота >99%, RT=1,65 мин. МС: m/z=409 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,79 (д, J=5,0 Гц, 1H), 8,35 (с, 1H), 8,12 (д, J=8,8 Гц, 1H), 7,64 (дд, J=8,8, 1,9 Гц, 1H), 6,93 (д, J=5,0 Гц, 1H), 3,64 (д, J=12,1 Гц, 2H), 2,88 (тд, J=12,1, 2,3 Гц, 2H), 2,73 (т, J=6,2 Гц, 2H), 2,66 (д, J=6,6 Гц, 2H), 2,63-2,40 (м, 6H), 2,05-1,92 (м, 2H), 1,77 (ддт, J=13,9, 6,6, 3,7 Гц, 1H), 1,61 (дкв., J=12,1, 3,8 Гц, 2H), 1,05 (т, J=7,1 Гц, 6H).
Соединение 377 (N,N-диэтил-N'-[1-(6-трифторметил-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин): из 4-хлор-6-(трифторметил)хинолона, 4-формил-n-cbz-пиперидина и N,N-диэтилэтилендиамина. ВЭЖХ: чистота >99%, RT=1,59 мин. МС: m/z=409 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,80 (д, J=5,1 Гц, 1H), 8,32 (с, 1H), 8,14 (д, J=8,8 Гц, 1H), 7,82 (дд, J=8,9, 2,1 Гц, 1H), 6,92 (д, J=5,1 Гц, 1H), 3,64 (д, J=12,3 Гц, 2H), 2,90 (тд, J=11,9, 2,0 Гц, 2H), 2,73 (т, J=6,2 Гц, 2H), 2,67 (д, J=6,6 Гц, 2H), 2,60 (т, J=6,0 Гц, 2H), 2,56 (кв., J=7,1 Гц, 4H), 1,99 (д, J=10,6 Гц, 2H), 1,77 (ддд, J=12,9, 8,9, 5,3 Гц, 1H), 1,64 (тд, J=12,7, 4,0 Гц, 2H), 1,28 (с, 2H), 1,05 (т, J=7,1 Гц, 6H).
Соединение 378 ([1-(6-Фтор-хинолин-4-ил)-пиперидин-4-илметил]-(2-пиперидин-1-ил-этил)-амин): из 4-хлор-6-фторхинолина, 4-формил-n-cbz-пиперидина и 1-(2-аминоэтил)пиперидина. ВЭЖХ: чистота >99%, RT=1,59 мин. МС: m/z=409 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,69 (д, J=5,0 Гц, 1H), 8,05 (дд, J=9,2, 5,6 Гц, 1H), 7,61 (дд, J=10,2, 2,9 Гц, 1H), 7,43 (ддд, J=9,2, 8,0, 2,9 Гц, 1H), 6,88 (д, J=4,9 Гц, 1H), 3,59 (д, J=12,4 Гц, 1H), 2,83 (тд, J=12,0, 2,3 Гц, 2H), 2,78 (т, J=6,3 Гц, 2H), 2,66 (д, J=6,6 Гц, 2H), 2,51 (т, J=6,3 Гц, 2H), 2,44 (т, J=5,3 Гц, 4H), 2,05 (с, 0H), 1,97 (дд, J=12,3, 2,8 Гц, 2H), 1,77 (ддтд, J=14,1, 10,3, 6,8, 3,6 Гц, 1H), 1,70-1,52 (м, 6H), 1,47 (п, J=5,6, 5,1 Гц, 2H).
Соединение 381 ([1-(6-Фтор-2-метил-хинолин-4-ил)-пиперидин-4-илметил]-(2-пиперидин-1-ил-этил)-амин): из 4-хлор-6-фтор-2-метилхинолина, 4-формил-n-cbz-пиперидина и 1-(2-аминоэтил)пиперидина. ВЭЖХ: чистота >99%, RT=1,34 мин. МС: m/z=385 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 7,94 (дд, J=9,2, 5,5 Гц, 1H), 7,54 (дд, J=10,2, 2,9 Гц, 1H), 7,36 (ддд, J=9,2, 8,0, 2,9 Гц, 1H), 6,75 (с, 1H), 3,55 (д, J=12,3 Гц, 2H), 2,80 (дд, J=12,0, 2,4 Гц, 2H), 2,74 (т, J=6,3 Гц, 2H), 2,65 (с, 3H), 2,63 (д, J=6,7 Гц, 2H), 2,47 (т, J=6,3 Гц, 2H), 2,40 (с, 4H), 1,94 (дд, J=13,2, 3,5 Гц, 2H), 1,79-1,67 (м, 1H), 1,64-1,49 (м, 6H), 1,49-1,34 (м, 2H).
Соединение 382 (N,N-диэтил-N'-[1-(6-метокси-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин): из 4-хлор-6-метоксихинолина, 4-формил-n-cbz-пиперидина и N,N-диэтилэтилендиамина. ВЭЖХ: чистота >99%, RT=1,31 мин. МС: m/z=371 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,60 (д, J=4,9 Гц, 1H), 7,95 (д, J=9,1 Гц, 1H), 7,31 (дд, J=9,1, 2,9 Гц, 1H), 7,27 (д, J=2,8 Гц, 1H), 6,83 (д, J=5,0 Гц, 1H), 3,94 (с, 3H), 3,58 (д, J=11,7 Гц, 2H), 3,29 (с, 2H), 3,25 (д, J=6,8 Гц, 2H), 2,77 (т, J=11,8 Гц, 2H), 2,57 (кв., J=7,1 Гц, 6H), 1,86 (д, J=10,9 Гц, 3H), 1,68-1,53 (м, 2H), 1,48 (с, 9H), 1,06 (т, J=7,1 Гц, 6H).
Соединение 383 (N,N-диэтил-N'-[1-(7-фтор-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин: из 4-хлор-7-фторхинолина, 4-формил-n-cbz-пиперидина и N,N-диэтилэтилендиамина. ВЭЖХ: чистота 98,7%, RT=1,20 мин. МС: m/z=359 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,68 (д, J=5,0 Гц, 1H), 7,99 (дд, J=9,3, 6,2 Гц, 1H), 7,64 (дд, J=10,2, 2,6 Гц, 1H), 7,23 (ддд, J=9,3, 8,0, 2,6 Гц, 1H), 6,80 (д, J=5,1 Гц, 1H), 3,59 (д, J=12,4 Гц, 2H), 2,84 (тд, J=12,1, 2,1 Гц, 2H), 2,70 (т, J=6,1 Гц, 2H), 2,63 (д, J=6,6 Гц, 2H), 2,58 (т, J=6,1 Гц, 2H), 2,54 (кв., J=7,1 Гц, 4H), 1,94 (дд, J=12,4, 3,2 Гц, 2H), 1,73 (дтт, J=14,1, 6,8, 3,9 Гц, 1H), 1,57 (дкв., J=12,2, 3,8 Гц, 2H), 1,03 (т, J=7,1 Гц, 6H).
Соединение 384 (N,N-диэтил-N'-[1-(6-метил-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин): из 4-хлор-6-метилхинолина, 4-формил-n-cbz-пиперидина и N,N-диэтилэтилендиамина. ВЭЖХ: чистота >99%, RT=1,36 мин. МС: m/z=355 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,64 (д, J=4,9 Гц, 1H), 7,92 (д, J=8,6 Гц, 1H), 7,75 (с, 1H), 7,46 (дд, J=8,6, 2,0 Гц, 1H), 6,80 (д, J=5,0 Гц, 1H), 3,61 (д, J=12,3 Гц, 2H), 2,80 (тд, J=12,0, 2,3 Гц, 2H), 2,71 (т, J=6,1 Гц, 2H), 2,64 (д, J=6,6 Гц, 2H), 2,58 (т, J=5,8 Гц, 2H), 2,57-2,49 (м, 7H), 1,94 (дд, J=12,6, 3,3 Гц, 2H), 1,73 (ддп, J=9,8, 6,4, 3,8, 3,3 Гц, 1H), 1,60 (дкв., J=12,0, 3,8 Гц, 2H), 1,03 (т, J=7,1 Гц, 6H).
Соединение 385 (N,N-диэтил-N'-[1-(6-фтор-2,3-диметил-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин): из 4-хлор-6-фтор-2,3-диметилхинолина, 4-формил-n-cbz-пиперидина и N,N-диэтилэтилендиамина. ВЭЖХ: чистота 97,2%, RT=1,33 мин. МС: m/z=387 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 7,93 (дд, J=9,1, 5,5 Гц, 1H), 7,74 (с, 1H), 7,33 (ддд, J=9,1, 8,0, 2,9 Гц, 1H), 3,33 (с, 2H), 3,17 (д, J=11,8 Гц, 2H), 2,72 (т, J=6,2 Гц, 2H), 2,68-2,61 (м, 5H), 2,60 (д, J=5,8 Гц, 2H), 2,55 (кв., J=7,1 Гц, 4H), 2,37 (с, 3H), 1,86 (д, J=12,1 Гц, 2H), 1,73 (с, 1H), 1,51 (кв., J=11,7 Гц, 2H), 1,03 (т, J=7,1 Гц, 6H).
Соединение 386 (N,N-диэтил-N'-[1-(7-фтор-2-метил-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин): из 4-хлор-7-фтор-2-метилхинолина, 4-формил-n-cbz-пиперидина и N,N-диэтилэтилендиамина. ВЭЖХ: чистота >99%, RT=1,13 мин. МС: m/z=373 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 7,92 (дд, J=9,2, 6,2 Гц, 1H), 7,56 (дд, J=10,4, 2,6 Гц, 1H), 7,17 (ддд, J=9,2, 8,0, 2,6 Гц, 1H), 6,69 (с, 1H), 3,57 (д, J=12,3 Гц, 2H), 2,81 (тд, J=12,1, 2,3 Гц, 2H), 2,70 (т, J=6,1 Гц, 2H), 2,64 (с, 3H), 2,63 (д, J=6,6 Гц, 2H), 2,58 (т, J=6,0 Гц, 2H), 2,53 (кв., J=7,1 Гц, 4H), 1,93 (дд, J=12,6, 2,4 Гц, 2H), 1,73 (дтд, J=13,9, 7,5, 6,7, 3,6 Гц, 1H), 1,56 (дкв., J=12,1, 3,8 Гц, 2H), 1,03 (т, J=7,1 Гц, 6H).
Соединение 387 ((2-Пиперидин-1-ил-этил)-[1-(6-трифторметил-хинолин-4-ил)-пиперидин-4-илметил]-амин): из 4-хлор-6-(трифторметил)хинолона, 4-формил-n-cbz-пиперидина и 1-(2-аминоэтил)пиперидина. ВЭЖХ: чистота 89,3%, RT=1,57 мин. МС: m/z =421 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,78 (д, J=5,1 Гц, 1H), 8,29 (с, 1H), 8,12 (д, J=8,8 Гц, 1H), 7,80 (дд, J=8,8, 2,1 Гц, 1H), 6,90 (д, J=5,1 Гц, 1H), 3,62 (д, J=12,6 Гц, 2H), 2,88 (тд, J=12,2, 2,4 Гц, 2H), 2,74 (т, J=6,3 Гц, 2H), 2,65 (д, J=6,7 Гц, 2H), 2,47 (т, J=6,3 Гц, 2H), 2,39 (с, 4H), 1,97 (дд, J=12,7, 3,2 Гц, 2H), 1,76 (дт, J=11,4, 3,0 Гц, 1H), 1,67-1,50 (м, 6H), 1,44 (тд, J=6,2, 3,3 Гц, 2H).
Соединение 389 (N,N-диэтил-N'-[1-(7-метил-хинолин-4-ил)-пиперидин-4-илметил]-этан-1,2-диамин): из 4-хлор-7-метилхинолина, 4-формил-n-cbz-пиперидина и N,N-диэтилэтилендиамина. ВЭЖХ: чистота 96,5%, RT=1,29 мин. МС: m/z=355 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,65 (д, J=5,0 Гц, 1H), 7,88 (д, J=8,5 Гц, 1H), 7,80 (с, 1H), 7,29 (дд, J=8,6, 1,8 Гц, 1H), 6,77 (д, J=5,0 Гц, 1H), 3,62 (д, J=12,4 Гц, 2H), 2,81 (тд, J=12,1, 2,3 Гц, 2H), 2,70 (т, J=6,1 Гц, 2H), 2,63 (д, J=6,6 Гц, 2H), 2,62-2,44 (м, 9H), 1,93 (дд, J=12,6, 2,3 Гц, 2H), 1,73 (ддкв., J=13,9, 6,7, 3,6 Гц, 1H), 1,58 (дкв., J=12,0, 3,8 Гц, 2H), 1,03 (т, J=7,1 Гц, 6H).
Соединение 401 (5-{4-[(2-диэтиламино-этиламино)-метил]-пиперидин-1-ил}-хинолин-8-карбонитрил): из 5-бром-хинолин-8-карбонитрила, 4-формил-n-cbz-пиперидина и N,N-диэтилэтилендиамина. ВЭЖХ: чистота >99%, RT=1,67 мин. МС: m/z=366 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,04 (дд, J=4,2, 1,7 Гц, 1H), 8,43 (дд, J=8,6, 1,7 Гц, 1H), 8,00 (д, J=8,0 Гц, 1H), 7,47 (дд, J=8,6, 4,2 Гц, 1H), 7,05 (д, J=8,0 Гц, 1H), 3,50 (д, J=11,9 Гц, 2H), 2,87 (тд, J=12,0, 2,3 Гц, 2H), 2,71 (т, J=6,1 Гц, 2H), 2,64 (д, J=6,6 Гц, 2H), 2,62-2,46 (м, 6H), 1,96 (тт, J=12,4, 2,1 Гц, 3H), 1,73 (дтт, J=14,0, 6,7, 3,7 Гц, 1H), 1,58 (дкв., J=12,0, 3,8 Гц, 2H), 1,03 (т, J=7,1 Гц, 5H).
Пример 107: Синтез соединения 393 (цис-5-(2,6-диметил-морфолин-4-ил)-хиназолин-8-карбонитрил)
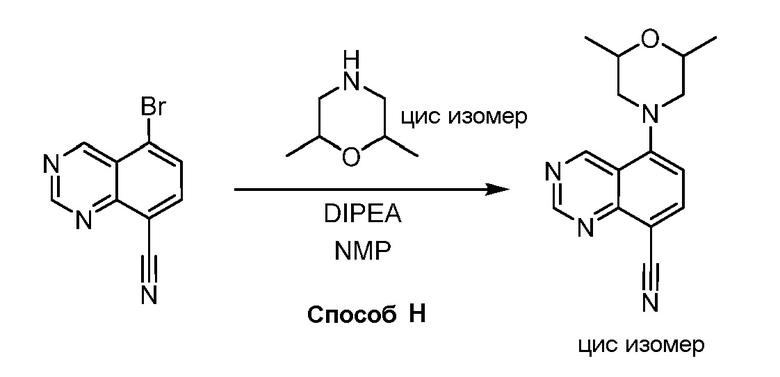
Цис-5-(2,6-диметил-морфолин-4-ил)-хиназолин-8-карбонитрил: цис-5-(2,6-диметил-морфолин-4-ил)-хиназолин-8-карбонитрил получали из 5-бром-хиназолин-8-карбонитрила и цис-2,6-диметилморфолина с 79% выходом с использованием Способа H.
Соединение 393: ВЭЖХ: чистота >99%, RT=2,70 мин. МС: m/z=269 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,61 (с, 1H), 9,43 (с, 1H), 8,16 (д, J=8,2 Гц, 1H), 7,07 (д, J=8,2 Гц, 1H), 4,03 (дкв.д, J=10,2, 6,3, 2,1 Гц, 2H), 3,41 (дт, J=11,8, 1,8 Гц, 2H), 2,77 (дд, J=12,2, 10,3 Гц, 2H), 1,28 (д, J=6,3 Гц, 6H).
Следующие соединения синтезировали аналогичным способом:
Соединение 455 (цис-5-(2,6-диметил-морфолин-4-ил)-8-фтор-пиридо[3,4-b]пиразин): из 5-хлор-8-фторпиридо[3,4-b]пиразина и цис-2,6-диметилморфолина. ВЭЖХ: чистота >99%, RT=2,38 мин. МС: m/z=263 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,96 (д, J=1,9 Гц, 1H), 8,80 (д, J=1,8 Гц, 1H), 8,23 (д, J=1,3 Гц, 1H), 4,72-4,56 (м, 2H), 3,91 (дкв.д, J=10,4, 6,2, 2,2 Гц, 2H), 2,81 (дд, J=12,9, 10,4 Гц, 2H), 1,27 (д, J=6,3 Гц, 6H).
Пример 108: Синтез соединения 395 (N-[1-(8-циано-хиназолин-5-ил)-пиперидин-4-илметил]-2-диэтиламино-ацетамид)
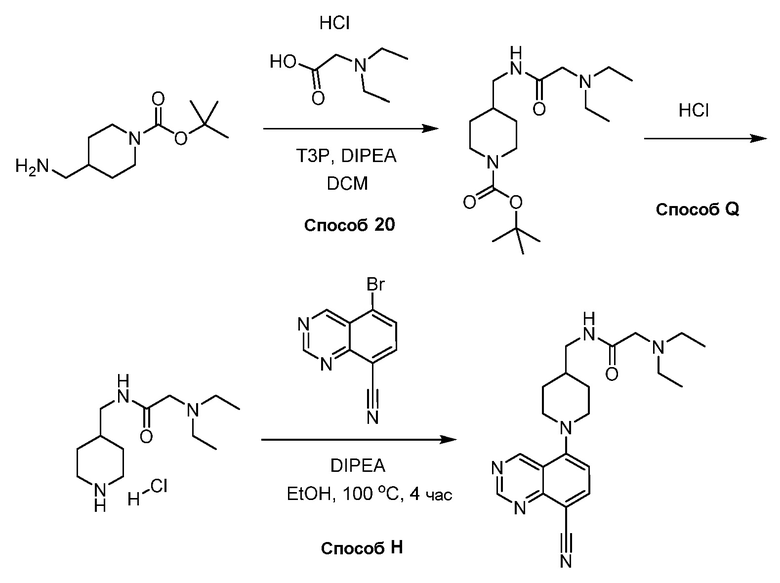
N-[1-(8-циано-хиназолин-5-ил)-пиперидин-4-илметил]-2-диэтиламино-ацетамид): N-[1-(8-циано-хиназолин-5-ил)-пиперидин-4-илметил]-2-диэтиламино-ацетамид) получали из 5-бром-хиназолин-8-карбонитрила, гидрохлорида 2-(диэтиламино)уксусной кислоты и 1-boc-4-(аминометил)пиперидина с 40% выходом для 3 стадий, с использованием Способа 20, Q и H.
Соединение 395: ВЭЖХ: чистота >99%, RT=1,88 мин. МС: m/z=381 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,54 (с, 1H), 9,39 (с, 1H), 8,12 (д, J=8,2 Гц, 1H), 7,62 (т, J=5,9 Гц, 1H), 7,05 (д, J=8,2 Гц, 1H), 3,65 (дт, J=13,0, 2,8 Гц, 2H), 3,31 (т, J=6,5 Гц, 2H), 3,06 (с, 2H), 3,01 (тд, J=12,2, 2,4 Гц, 2H), 2,58 (кв., J=7,1 Гц, 4H), 1,93 (дд, J=13,3, 3,1 Гц, 2H), 1,84 (дтт, J=14,4, 6,9, 4,0 Гц, 1H), 1,62 (дкв., J=12,4, 3,9 Гц, 2H), 1,05 (т, J=7,1 Гц, 6H).
Следующие соединения синтезировали аналогичным способом:
Соединение 397 (1-(8-циано-хиназолин-5-ил)-пиперидин-4-карбоновой кислоты (2-диэтиламино-этил)-амид): из 5-бром-хиназолин-8-карбонитрила, 1-трет-бутоксикарбонилпиперидин-4-карбоновой кислоты и N,N-диэтилэтилендиамина. ВЭЖХ: чистота >99%, RT=1,75 мин. МС: m/z=381 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,58 (с, 1H), 9,41 (с, 1H), 8,13 (д, J=8,2 Гц, 1H), 7,06 (д, J=8,2 Гц, 1H), 6,28 (с, 1H), 3,69 (дт, J=12,1, 2,4 Гц, 2H), 3,34 (кв., J=5,1 Гц, 2H), 3,06 (ддд, J=12,3, 10,3, 3,8 Гц, 2H), 2,63-2,47 (м, 6H), 2,39 (тт, J=10,2, 5,1 Гц, 1H), 2,19-2,03 (м, 4H), 1,03 (т, J=7,1 Гц, 6H).
Соединение 398 (N-[1-(8-циано-хинолин-5-ил)-пиперидин-4-илметил]-2-диэтиламино-ацетамид): из 5-бром-хинолин-8-карбонитрила, гидрохлорида 2-(диэтиламино)уксусной кислоты и гидрохлорида 2-(диэтиламино)уксусной кислоты. ВЭЖХ: чистота 98,8%, RT=2,13 мин. МС: m/z=380 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,41 (дд, J=8,5, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,60 (с, 1H), 7,47 (дд, J=8,5, 4,2 Гц, 1H), 7,04 (д, J=8,0 Гц, 1H), 3,50 (д, J=11,9 Гц, 2H), 3,32 (т, J=6,5 Гц, 2H), 3,07 (с, 2H), 2,86 (тд, J=12,0, 2,2 Гц, 2H), 2,59 (кв., J=7,1 Гц, 4H), 1,90 (д, J=12,6 Гц, 2H), 1,78 (дтт, J=14,4, 6,8, 3,6 Гц, 1H), 1,62 (дкв., J=12,1, 3,8 Гц, 2H), 1,06 (т, J=7,1 Гц, 6H).
Соединение 403 ((2-пиперидин-1-ил-этил)-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, 1-трет-бутоксикарбонилпиперидин-4-карбоновой кислоты и 1-(2-аминоэтил)пиперидина. ВЭЖХ: чистота 96,7%, RT=2,07 мин. МС: m/z=392 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,06 (дд, J=4,2, 1,7 Гц, 1H), 8,45 (дд, J=8,6, 1,7 Гц, 1H), 8,02 (д, J=8,0 Гц, 1H), 7,49 (дд, J=8,5, 4,2 Гц, 1H), 7,06 (д, J=8,0 Гц, 1H), 6,22 (с, 1H), 3,54 (д, J=12,3 Гц, 2H), 3,37 (кв., J=5,6 Гц, 2H), 2,91 (тд, J=11,9, 2,8 Гц, 2H), 2,76-2,23 (м, 7H), 2,13 (дкв., J=12,2, 11,3, 3,8 Гц, 2H), 2,08-1,94 (м, 2H), 1,73-1,52 (м, 4H), 1,53-1,36 (м, 2H).
Соединение 407 ((2-диэтиламино-этил)-амид 1-(8-циано-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, 1-трет-бутоксикарбонилпиперидин-4-карбоновой кислоты и N,N-диэтилэтилендиамина. ВЭЖХ: чистота 98,2%, RT=2,01 мин. МС: m/z=380 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,44 (дд, J=8,5, 1,7 Гц, 1H), 8,01 (д, J=8,0 Гц, 1H), 7,49 (дд, J=8,6, 4,2 Гц, 1H), 7,05 (д, J=8,0 Гц, 1H), 6,25 (с, 1H), 3,53 (д, J=12,6 Гц, 2H), 3,34 (кв., J=5,5 Гц, 2H), 2,90 (тд, J=11,8, 2,8 Гц, 2H), 2,69-2,44 (м, 6H), 2,35 (тт, J=11,1, 4,3 Гц, 1H), 2,22-1,92 (м, 4H), 1,03 (т, J=7,1 Гц, 6H).
Пример 109: Синтез соединения 404 (2-(3-метокси-фениламино)-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-ацетамид)
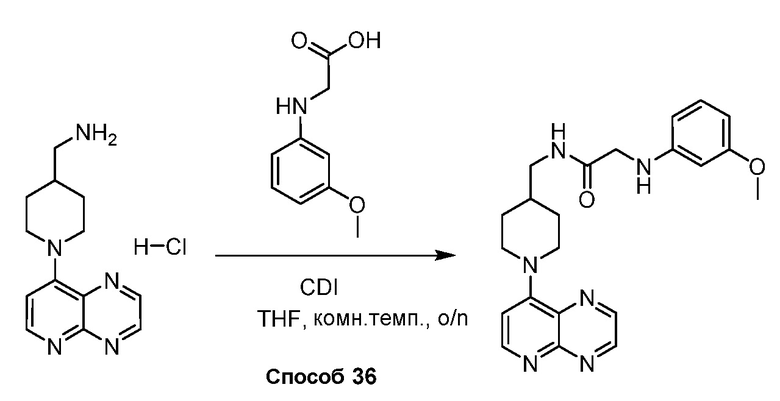
Способ 36
2-(3-метокси-фениламино)-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-ацетамид: Раствор 2-[(3-метоксифенил)амино]уксусной кислоты (77,7 мг; 0,429 ммоль) и 1,1'-карбонилдиимидазол (69,6 мг; 0,429 ммоль) в безводном THF (2,0 мл) перемешивали при комнатной температуре в течение 15 минут, затем добавляли C-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-ил)-метиламин гидрохлорид (80,0 мг; 0,286 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали при пониженном давлении. Остаток растворяли в DCM и очищали хроматографией на колонке PuriFlash NH2 35 г 30 мкм, элюируя с градиентом метанола в DCM, с получением 2-(3-метокси-фениламино)-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-ацетамида (63 мг; 54,2%).
(Примечание: в Способе 36 в качестве растворителя также можно использовать DMF вместо THF)
Соединение 404: ВЭЖХ: чистота >99%, RT=1,93 мин. МС: m/z=407 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,7 Гц, 1H), 8,79 (д, J=5,4 Гц, 1H), 8,71 (д, J=1,7 Гц, 1H), 7,11 (т, J=8,1 Гц, 1H), 6,87 (с, 1H), 6,85 (д, J=5,5 Гц, 1H), 6,37 (ддд, J=8,2, 2,3, 0,8 Гц, 1H), 6,24 (ддд, J=8,1, 2,3, 0,9 Гц, 1H), 6,18 (т, J=2,3 Гц, 1H), 4,40 (д, J=12,4 Гц, 2H), 3,82 (с, 2H), 3,76 (с, 3H), 3,27 (т, J=6,4 Гц, 2H), 3,02 (тд, J=12,4, 2,4 Гц, 2H), 1,95-1,73 (м, 3H), 1,51 (дкв., J=12,0, 3,9 Гц, 2H).
Следующие соединения синтезировали аналогичным способом:
Соединение 406 (2-трет-Бутиламино-N-(1-пиридо[2,3-b]пиразин-8-ил-пиперидин-4-илметил)-ацетамид): из гидрохлорида C-(1-Пиридо[2,3-b]пиразин-8-ил-пиперидин-4-ил)-метиламина и гидрохлорида 2-(трет-бутиламино)уксусной кислоты. ВЭЖХ: чистота 98,1%, RT=1,11 мин. МС: m/z=357 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (д, J=1,7 Гц, 1H), 8,79 (д, J=5,4 Гц, 1H), 8,72 (д, J=1,7 Гц, 1H), 7,67 (с, 1H), 6,87 (д, J=5,4 Гц, 1H), 4,44 (д, J=12,1 Гц, 2H), 3,33-3,19 (м, 4H), 3,07 (тд, J=12,5, 2,3 Гц, 2H), 1,90-1,84 (м, 2H), 1,73-1,64 (м, 1H), 1,57 (дкв., J=12,3, 11,8, 3,8 Гц, 2H), 1,09 (с, 8H).
Соединение 413 (2-трет-Бутиламино-N-[1-(8-циано-хинолин-5-ил)-пиперидин-4-илметил]-ацетамид): из 5-бром-хинолин-8-карбонитрила, 4-(boc-аминометил)пиперидина и гидрохлорида 2-(трет-бутиламино)уксусной кислоты. ВЭЖХ: чистота 97,7%, RT=2,19 мин. МС: m/z=380 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,05 (дд, J=4,2, 1,7 Гц, 1H), 8,41 (дд, J=8,6, 1,7 Гц, 1H), 8,00 (д, J=8,0 Гц, 1H), 7,73 (с, 1H), 7,47 (дд, J=8,5, 4,2 Гц, 1H), 7,04 (д, J=8,0 Гц, 1H), 3,50 (д, J=12,3 Гц, 3H), 3,32 (т, J=6,5 Гц, 2H), 3,29 (с, 2H), 2,85 (тд, J=12,0, 2,3 Гц, 2H), 1,91 (д, J=12,0 Гц, 2H), 1,78 (дддд, J=17,6, 10,3, 6,8, 3,1 Гц, 1H), 1,62 (дкв., J=12,0, 3,8 Гц, 2H), 1,12 (с, 9H).
Пример 110: Синтез соединения 425 (N-[1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-диметиламино-ацетамид)
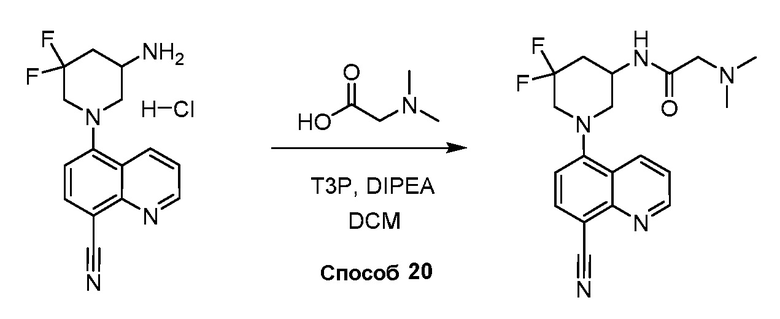
N-[1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-диметиламино-ацетамид: N-[1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-диметиламино-ацетамид получали из 5-(5-амино-3,3-дифтор-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и N,N-диметилглицина с 39% выходом, с использованием Способа 20.
Соединение 425: ВЭЖХ: чистота 96,6%, RT=2,16 мин. МС: m/z=374 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,11 (дд, J=4,2, 1,7 Гц, 1H), 8,65 (дд, J=8,6, 1,7 Гц, 1H), 8,06 (д, J=7,9 Гц, 1H), 7,87 (с, 1H), 7,57 (дд, J=8,6, 4,2 Гц, 1H), 7,14 (д, J=8,0 Гц, 1H), 4,63 (с, 1H), 3,51 (кв., J=10,7, 10,3 Гц, 1H), 3,41 (кв., J=12,4 Гц, 1H), 3,37-3,16 (м, 2H), 3,06-2,84 (м, 2H), 2,45-2,31 (м, 1H), 2,28 (с, 6H), 1,56 (с, 1H).
Пример 111: Синтез соединения 436 ([2-(этил-метил-амино)-этил]-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты)
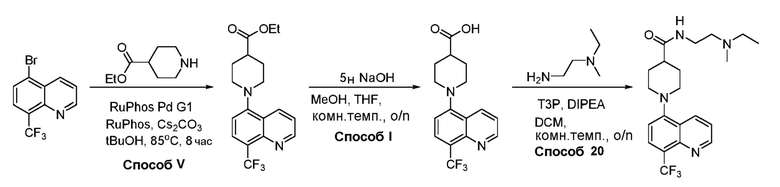
[2-(этил-метил-амино)-этил]-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты: [2-(этил-метил-амино)-этил]-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты получали из 5-бром-8-(трифторметил)хинолона, этилпиперидин-4-карбоксилата и (2-аминоэтил)(этил)метиламина с выходом 48% для 3 стадий с использованием Способа V, I и 20.
Соединение 436: ВЭЖХ: чистота 98,3%, RT=2,55 мин. МС: m/z=409 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,04 (дд, J=4,2, 1,8 Гц, 1H), 8,50 (дд, J=8,6, 1,8 Гц, 1H), 7,97 (д, J=8,0 Гц, 1H), 7,47 (дд, J=8,6, 4,2 Гц, 1H), 7,06 (д, J=8,0 Гц, 1H), 6,25 (с, 1H), 3,47 (дт, J=12,6, 3,5 Гц, 2H), 3,40 (д, J=6,2 Гц, 2H), 2,86 (тд, J=11,9, 2,7 Гц, 2H), 2,53 (с, 4H), 2,42-2,20 (м, 4H), 2,13 (дкв., J=12,1, 11,3, 3,8 Гц, 2H), 2,04 (дд, J=12,8, 3,6 Гц, 2H), 1,10 (т, J=5,9 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 441 ((2-пиперидин-1-ил-этил)-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-8-(трифторметил)хинолона, этилпиперидин-4-карбоксилата и 1-(2-аминоэтил)пиперидина. ВЭЖХ: чистота 98,0%, RT=2,63 мин. МС: m/z=435 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,03 (дд, J=4,2, 1,8 Гц, 1H), 8,50 (дд, J=8,6, 1,8 Гц, 1H), 7,96 (д, J=8,0 Гц, 1H), 7,47 (дд, J=8,6, 4,2 Гц, 1H), 7,06 (д, J=8,0 Гц, 1H), 6,24 (с, 1H), 3,47 (дт, J=11,9, 2,6 Гц, 2H), 3,37 (тд, J=6,1, 4,8 Гц, 2H), 2,86 (тд, J=11,8, 2,7 Гц, 2H), 2,47 (т, J=6,0 Гц, 2H), 2,44-2,27 (м, 5H), 2,13 (дкв., J=12,1, 11,3, 3,8 Гц, 2H), 2,08-1,96 (м, 2H), 1,59 (п, J=5,6 Гц, 4H), 1,52-1,38 (м, 2H).
Соединение 442 ((1-метил-пирролидин-2-илметил)-амид 1-(8-Трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-8-(трифторметил)хинолона, этилпиперидин-4-карбоксилата и (1-метилпирролидин-2-ил)метанамина. ВЭЖХ: чистота 98,7%, RT=2,55 мин. МС: m/z=421 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,04 (дд, J=4,2, 1,8 Гц, 1H), 8,50 (дд, J=8,6, 1,8 Гц, 1H), 7,97 (д, J=8,0 Гц, 1H), 7,47 (дд, J=8,6, 4,2 Гц, 1H), 7,06 (д, J=7,9 Гц, 1H), 6,12 (д, J=7,8 Гц, 1H), 3,66 (ддд, J=13,7, 7,9, 2,5 Гц, 1H), 3,47 (дт, J=12,1, 3,3 Гц, 2H), 3,13 (ддд, J=13,7, 4,1, 2,4 Гц, 1H), 3,07 (ддд, J=9,3, 6,8, 2,5 Гц, 1H), 2,86 (тт, J=11,8, 3,2 Гц, 2H), 2,46-2,38 (м, 1H), 2,33 (с, 3H), 2,24 (тд, J=9,4, 7,5 Гц, 1H), 2,14 (кв.т, J=11,3, 3,3 Гц, 2H), 2,03 (дд, J=13,5, 3,6 Гц, 2H), 1,96-1,83 (м, 1H), 1,80-1,65 (м, 2H), 1,60-1,47 (м, 2H).
Соединение 446 ((2-диэтиламино-этил)-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты): из 5-бром-8-(трифторметил)хинолона, этилпиперидин-4-карбоксилата и N,N-диэтилэтилендиамина. ВЭЖХ: чистота >99%, RT=2,63 мин. МС: m/z=423 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,04 (дд, J=4,2, 1,8 Гц, 1H), 8,49 (дд, J=8,6, 1,8 Гц, 1H), 7,97 (д, J=8,1 Гц, 1H), 7,47 (дд, J=8,6, 4,2 Гц, 1H), 7,06 (д, J=8,0 Гц, 1H), 6,25 (с, 1H), 3,47 (дт, J=11,8, 2,8 Гц, 2H), 3,34 (кв., J=5,3 Гц, 2H), 2,86 (тд, J=11,8, 2,8 Гц, 2H), 2,63-2,49 (м, 6H), 2,34 (тт, J=11,2, 4,3 Гц, 1H), 2,12 (дкв., J=12,2, 11,2, 3,8 Гц, 2H), 2,07-1,97 (м, 2H), 1,04 (т, J=7,1 Гц, 6H).
Пример 112: Синтез соединения 443 (2-диэтиламино-N-[1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-илметил]-ацетамид)
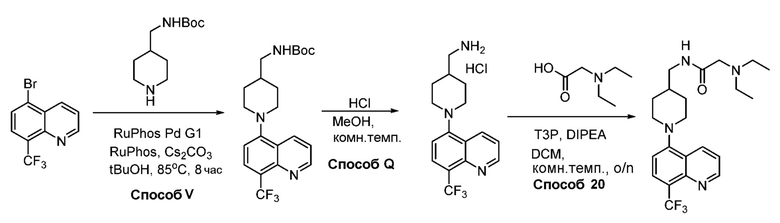
2-диэтиламино-N-[1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-илметил]-ацетамид: 2-диэтиламино-N-[1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-илметил]-ацетамид получали из 5-бром-8-трифторметил-хинолина, 4-(boc-аминометил)пиперидина и гидрохлорида 2-(диэтиламино)уксусной кислоты с выходом 55% для 3 стадий с использованием Способа V, Q и 20.
Соединение 443: ВЭЖХ: чистота >99%, RT=2,76 мин. МС: m/z=423 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,02 (дд, J=4,2, 1,8 Гц, 1H), 8,45 (дд, J=8,6, 1,8 Гц, 1H), 7,95 (д, J=8,1 Гц, 1H), 7,60 (с, 1H), 7,44 (дд, J=8,6, 4,2 Гц, 1H), 7,04 (д, J=8,0 Гц, 1H), 3,43 (дт, J=12,7, 2,9 Гц, 2H), 3,32 (т, J=6,5 Гц, 2H), 3,06 (с, 2H), 2,81 (тд, J=11,9, 2,3 Гц, 2H), 2,58 (кв., J=7,2 Гц, 4H), 1,89 (дд, J=12,8, 3,0 Гц, 2H), 1,77 (ддтд, J=13,6, 10,0, 6,6, 3,6 Гц, 1H), 1,62 (дкв., J=11,9, 3,8 Гц, 2H), 1,05 (т, J=7,2 Гц, 6H).
Следующие соединения синтезировали аналогичным способом:
Соединение 448 (2-Пиперидин-1-ил-N-[1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-илметил]-ацетамид): из 5-бром-8-трифторметил-хинолина, 4-(boc-аминометил)пиперидина и пиперидин-1-ил-уксусной кислоты. ВЭЖХ: чистота 97,6%, RT=2,79 мин. МС: m/z=435 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,03 (дд, J=4,2, 1,8 Гц, 1H), 8,46 (дд, J=8,6, 1,8 Гц, 1H), 7,96 (д, J=8,0 Гц, 1H), 7,45 (дд, J=8,6, 4,2 Гц, 2H), 7,05 (д, J=8,0 Гц, 1H), 3,44 (дт, J=11,7, 2,4 Гц, 2H), 3,33 (т, J=6,5 Гц, 2H), 2,99 (с, 2H), 2,82 (тд, J=11,9, 2,3 Гц, 2H), 2,49 (т, J=5,3 Гц, 4H), 1,89 (дд, J=12,3, 2,6 Гц, 2H), 1,77 (тдд, J=10,0, 8,6, 5,0 Гц, 1H), 1,70-1,54 (м, 6H), 1,54-1,42 (м, 2H).
Пример 113: Синтез соединения 444 и соединения 445 (((R)-1-циклопропилметил-пирролидин-3-ил)-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты и ((S)-1-циклопропилметил-пирролидин-3-ил)-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты)
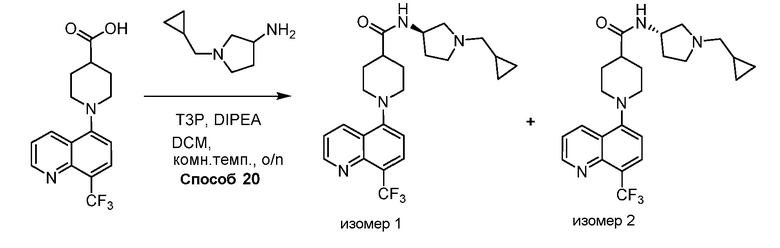
((R)-1-циклопропилметил-пирролидин-3-ил)-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты и ((S)-1-циклопропилметил-пирролидин-3-ил)-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты: ((R)-1-циклопропилметил-пирролидин-3-ил)-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты и ((S)-1-циклопропилметил-пирролидин-3-ил)-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты получали из 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты и 1-(циклопропилметил)пирролидин-3-амина с выходом 62% с использованием Способа 20. Энантиомеры выделяли хиральной СКЖХ хроматографией. (Колонка: 1,0 × 25,0 см Lux Amylose-1); CO2 со-растворитель (Растворитель B): этанол с 0,5% диметиламина; Изократический метод: 55% со-растворителя при 10 мл/мин; Давление в системе: 100 бар; Температура колонки: 40°C).
Изомер 1: ВЭЖХ: чистота 98,6%, RT=2,84 мин. МС: m/z=447 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,04 (дд, J=4,2, 1,8 Гц, 1H), 8,49 (дд, J=8,6, 1,8 Гц, 1H), 7,96 (д, J=8,0 Гц, 1H), 7,47 (дд, J=8,6, 4,2 Гц, 1H), 7,06 (д, J=7,9 Гц, 1H), 5,95 (с, 1H), 4,50 (дддд, J=10,6, 8,5, 4,5, 2,8 Гц, 1H), 3,47 (д, J=12,5 Гц, 2H), 3,02 (тд, J=8,7, 3,5 Гц, 1H), 2,84 (тд, J=11,8, 2,6 Гц, 2H), 2,77 (дд, J=10,1, 2,4 Гц, 1H), 2,53 (дд, J=10,0, 6,5 Гц, 1H), 2,41-2,19 (м, 5H), 2,12 (дкв., J=12,0, 11,5, 3,7 Гц, 2H), 2,06-1,96 (м, 2H), 1,63 (дтд, J=11,9, 7,9, 3,7 Гц, 1H), 0,89 (дддд, J=11,5, 8,1, 4,8, 2,4 Гц, 1H), 0,58-0,45 (м, 2H), 0,13 (ддд, J=6,7, 4,9, 3,7 Гц, 2H).
Изомер 2: ВЭЖХ: чистота >99%, RT=2,84 мин. МС: m/z=447 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,04 (дд, J=4,2, 1,8 Гц, 1H), 8,49 (дд, J=8,6, 1,8 Гц, 1H), 7,96 (д, J=8,0 Гц, 1H), 7,47 (дд, J=8,6, 4,2 Гц, 1H), 7,06 (д, J=8,0 Гц, 1H), 5,96 (с, 1H), 4,52 (с, 1H), 3,47 (д, J=11,9 Гц, 2H), 3,04 (с, 1H), 2,84 (тд, J=11,9, 2,7 Гц, 2H), 2,78 (д, J=8,2 Гц, 1H), 2,54 (дд, J=10,1, 6,5 Гц, 1H), 2,47-2,19 (м, 4H), 2,12 (дкв., J=11,9, 11,4, 3,7 Гц, 2H), 2,02 (д, J=12,8 Гц, 2H), 1,62 (с, 2H), 0,98-0,82 (м, 1H), 0,65-0,41 (м, 2H), 0,14 (кв., J=5,0 Гц, 2H).
Пример 114: Синтез соединения 447 (N-[(3R,5S)-1-(8-циано-хиназолин-5-ил)-5-метил-пиперидин-3-ил]-2-диметиламино-ацетамид)
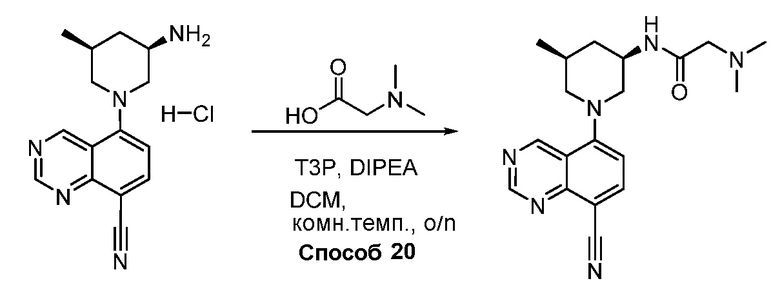
N-[(3R,5S)-1-(8-циано-хиназолин-5-ил)-5-метил-пиперидин-3-ил]-2-диметиламино-ацетамид: N-[(3R,5S)-1-(8-циано-хиназолин-5-ил)-5-метил-пиперидин-3-ил]-2-диметиламино-ацетамид получали из 5-[(3R,5S)-3-амино-5-метил-1-пиперидил]хиназолин-8-карбонитрил гидрохлорида и N,N-диметилглицина с выходом 77% с использованием Способа 20.
Соединение 447: ВЭЖХ: чистота 97,2%, RT=2,01 мин. МС: m/z=353 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, рм.д.) δ 9,61 (с, 1H), 9,41 (с, 1H), 8,11 (д, J=8,2 Гц, 1H), 7,14 (д, J=8,9 Гц, 1H), 7,11 (д, J=8,2 Гц, 1H), 4,34-4,20 (м, 1H), 3,92 (ддт, J=11,7, 4,0, 1,9 Гц, 1H), 3,61 (ддд, J=12,3, 4,0, 2,0 Гц, 1H), 2,96 (с, 2H), 2,76-2,59 (м, 2H), 2,30 (с, 6H), 2,26-2,05 (м, 2H), 1,18 (кв., J=11,9 Гц, 1H), 1,01 (д, J=6,5 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 460 (2-диметиламино-N-[(3R,5S)-1-(8-фтор-пиридо[3,4-b]пиразин-5-ил)-5-метил-пиперидин-3-ил]-ацетамид): из (3R,5S)-1-(8-Фтор-пиридо[3,4-b]пиразин-5-ил)-5-метил-пиперидин-3-иламин гидрохлорида и N,N-диметилглицина. ВЭЖХ: чистота >99%, RT=1,65 мин. МС: m/z=347 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,94 (д, J=1,8 Гц, 1H), 8,82 (д, J=1,8 Гц, 1H), 8,21 (д, J=1,4 Гц, 1H), 7,12 (д, J=8,5 Гц, 1H), 4,90 (ддт, J=12,3, 4,1, 1,8 Гц, 1H), 4,66 (ддт, J=12,7, 3,8, 1,8 Гц, 1H), 4,25-4,13 (м, 1H), 3,01-2,89 (м, 2H), 2,79 (дд, J=12,3, 10,7 Гц, 1H), 2,61 (дд, J=12,7, 11,0 Гц, 1H), 2,30 (с, 6H), 2,22-2,14 (м, 1H), 2,08 (дддт, J=14,9, 10,8, 7,8, 3,6 Гц, 1H), 1,13 (кв., J=11,8 Гц, 1H), 1,00 (д, J=6,7 Гц, 3H).
Соединение 466 (N-[(3R,5S)-5-метил-1-(8-метил-хинолин-5-ил)-пиперидин-3-ил]-2-морфолин-4-ил-ацетамид): из гидрохлорида (3R,5S)-5-метил-1-(8-метил-хинолин-5-ил)-пиперидин-3-иламина и гидрохлорид 2-морфолиноуксусной кислоты. ВЭЖХ: чистота >99%, RT=1,62 мин. МС: m/z=383 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,93 (дд, J=4,2, 1,8 Гц, 1H), 8,54 (дд, J=8,5, 1,8 Гц, 1H), 7,48-7,38 (м, 2H), 7,02 (д, J=7,6 Гц, 1H), 6,98 (с, 1H), 4,42-4,26 (м, 1H), 3,71 (т, J=4,6 Гц, 4H), 3,52 (ддт, J=10,8, 4,1, 1,7 Гц, 1H), 3,22 (ддт, J=11,4, 3,7, 1,7 Гц, 1H), 3,08-2,93 (м, 2H), 2,74 (д, J=0,9 Гц, 3H), 2,60-2,44 (м, 4H), 2,39 (тд, J=10,8, 2,1 Гц, 2H), 2,24-2,07 (м, 2H), 1,11-0,93 (м, 4H).
Соединение 469 (2-диметиламино-N-[(3R,5S)-1-(8-фтор-хинолин-5-ил)-5-метил-пиперидин-3-ил]-ацетамид): из (3R,5S)-1-(8-Фтор-хинолин-5-ил)-5-метил-пиперидин-3-иламин гидрохлорида и N,N-диметилглицина. ВЭЖХ: чистота 94,0%, RT=1,70 мин. МС: m/z=345 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (дд, J=4,2, 1,7 Гц, 1H), 8,55 (дт, J=8,6, 1,7 Гц, 1H), 7,50 (дд, J=8,6, 4,2 Гц, 1H), 7,29 (дд, J=10,4, 8,3 Гц, 1H), 7,07 (д, J=8,5 Гц, 1H), 7,02 (дд, J=8,3, 4,2 Гц, 1H), 4,32 (дддд, J=14,6, 10,5, 8,4, 4,1 Гц, 1H), 3,52 (ддт, J=10,9, 4,1, 1,8 Гц, 1H), 3,20 (ддт, J=11,3, 3,7, 1,8 Гц, 1H), 2,93 (д, J=2,2 Гц, 2H), 2,39 (кв., J=10,9 Гц, 2H), 2,28 (с, 6H), 2,21-2,04 (м, 2H), 1,11-0,92 (м, 4H).
Соединение 470 (N-[(3R,5S)-1-(8-Фтор-хинолин-5-ил)-5-метил-пиперидин-3-ил]-2-морфолин-4-ил-ацетамид): из гидрохлорида (3R,5S)-1-(8-Фтор-хинолин-5-ил)-5-метил-пиперидин-3-иламина и гидрохлорид 2-морфолиноуксусной кислоты. ВЭЖХ: чистота >99%, RT=1,73 мин. МС: m/z=387 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (дд, J=4,1, 1,7 Гц, 1H), 8,55 (дт, J=8,6, 1,7 Гц, 1H), 7,50 (дд, J=8,6, 4,2 Гц, 1H), 7,29 (дд, J=10,4, 8,3 Гц, 1H), 7,03 (дд, J=8,3, 4,2 Гц, 1H), 6,99 (с, 1H), 4,41-4,23 (м, 1H), 3,71 (с, 4H), 3,55-3,46 (м, 1H), 3,25-3,16 (м, 1H), 3,00 (с, 2H), 2,51 (с, 4H), 2,44-2,27 (м, 2H), 2,22-2,05 (м, 2H), 1,11-0,90 (м, 4H).
Соединение 471 (N-[(3R,5S)-1-(8-Фтор-хинолин-5-ил)-5-метил-пиперидин-3-ил]-2-(1-метил-пиперидин-4-ил)-ацетамид): из (3R,5S)-1-(8-Фтор-хинолин-5-ил)-5-метил-пиперидин-3-иламин гидрохлорида и 1-метил-4-пиперидинуксусной кислоты. ВЭЖХ: чистота >99%, RT=1,84 мин. МС: m/z=399 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,95 (дд, J=4,2, 1,7 Гц, 1H), 8,55 (дт, J=8,6, 1,7 Гц, 1H), 7,51 (дд, J=8,6, 4,2 Гц, 1H), 7,29 (дд, J=10,4, 8,3 Гц, 1H), 7,01 (дд, J=8,3, 4,2 Гц, 1H), 5,25 (д, J=8,0 Гц, 1H), 4,31 (ддкв., J=16,1, 8,3, 4,1 Гц, 1H), 3,63-3,48 (м, 1H), 3,26-3,08 (м, 1H), 2,81 (т, J=10,3 Гц, 2H), 2,35 (дт, J=17,8, 10,8 Гц, 2H), 2,25 (с, 3H), 2,21-2,07 (м, 2H), 1,93 (тдд, J=11,7, 5,4, 2,6 Гц, 2H), 1,80 (дп, J=11,2, 3,5 Гц, 1H), 1,74-1,64 (м, 2H), 1,34-1,21 (м, 2H), 1,04-0,91 (м, 4H).
Пример 115: Синтез соединения 449 и соединения 450 (N-[(R)-1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-диметиламино-ацетамид и N-[(S)-1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-диметиламино-ацетамид)
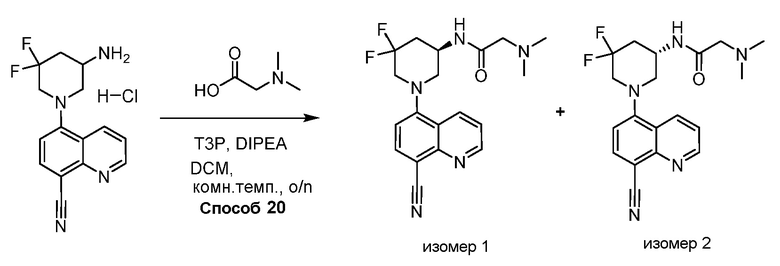
N-[(R)-1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-диметиламино-ацетамид и N-[(S)-1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-диметиламино-ацетамид: N-[(R)-1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-диметиламино-ацетамид и N-[(S)-1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-диметиламино-ацетамид получали из 5-(5-Амино-3,3-дифтор-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и N,N-диметилглицина с выходом 25% с использованием Способа 20. Энантиомеры выделяли хиральной СКЖХ хроматографией. (Колонка: 1,0 × 25,0 см Chiralpak IA; CO2 со-растворитель (Растворитель B): Метанол с 0,5% диметиламина; Изократический метод: 45% со-растворителя при 6 мл/мин; Давление в системе: 100 бар; Температура колонки: 30°C).
Изомер 1: ВЭЖХ: чистота >99%, RT=2,06 мин. МС: m/z=374 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,11 (дд, J=4,2, 1,7 Гц, 1H), 8,65 (дд, J=8,6, 1,7 Гц, 1H), 8,06 (д, J=7,9 Гц, 1H), 7,87 (с, 1H), 7,57 (дд, J=8,6, 4,2 Гц, 1H), 7,14 (д, J=7,9 Гц, 1H), 4,63 (с, 1H), 3,51 (дд, J=21,5, 10,2 Гц, 1H), 3,43 (д, J=11,9 Гц, 1H), 3,35-3,18 (м, 2H), 3,04-2,90 (м, 2H), 2,46-2,30 (м, 2H), 2,28 (с, 6H).
Изомер 2: ВЭЖХ: чистота >99%, RT=2,08 мин. МС: m/z=374 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,11 (дд, J=4,2, 1,7 Гц, 1H), 8,65 (дд, J=8,6, 1,7 Гц, 1H), 8,06 (д, J=7,9 Гц, 1H), 7,86 (с, 1H), 7,57 (дд, J=8,6, 4,2 Гц, 1H), 7,14 (д, J=7,9 Гц, 1H), 4,63 (с, 1H), 3,51 (кв., J=10,4 Гц, 1H), 3,43 (д, J=11,9 Гц, 1H), 3,37-3,17 (м, 2H), 3,04-2,90 (м, 2H), 2,46-2,29 (м, 2H), 2,28 (с, 6H).
Пример 116: Синтез соединения 451 (Метил-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амин гидрохлорид)
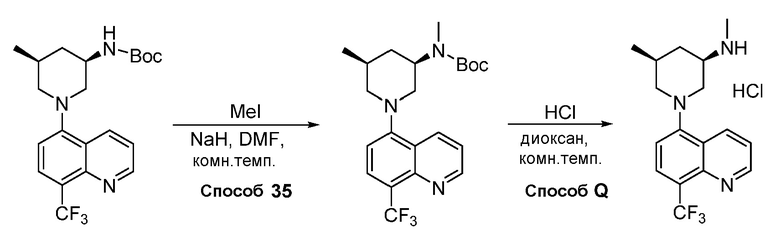
Метил-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амин гидрохлорид: Метил-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амин гидрохлорид получали из трет-бутилового эфира [(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-карбаминовой кислоты и иодметана с выходом 68% для 2 стадий с использованием Способа 35 и Q.
Соединение 451: ВЭЖХ: чистота 98,8%, RT=2,74 мин. МС: m/z=324 [M+H]+. 1H ЯМР (400 МГц, Оксид дейтерия, м.д.) δ 9,21 (дт, J=8,7, 1,3 Гц, 1H), 9,13 (дт, J=5,2, 1,4 Гц, 1H), 8,41 (д, J=8,3 Гц, 1H), 8,08 (ддд, J=8,5, 5,2, 1,1 Гц, 1H), 7,55 (д, J=8,3 Гц, 1H), 3,86 (д, J=11,2 Гц, 1H), 3,72 (тт, J=7,7, 3,8 Гц, 1H), 3,51 (д, J=12,1 Гц, 1H), 3,07 (т, J=11,0 Гц, 1H), 2,85 (с, 3H), 2,62 (т, J=11,8 Гц, 1H), 2,47 (д, J=12,5 Гц, 1H), 2,36-2,21 (м, 1H), 1,34 (кв., J=12,0 Гц, 1H), 1,07 (д, J=6,6 Гц, 3H).
Пример 117: Синтез соединения 452 (2-диметиламино-N-метил-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид)
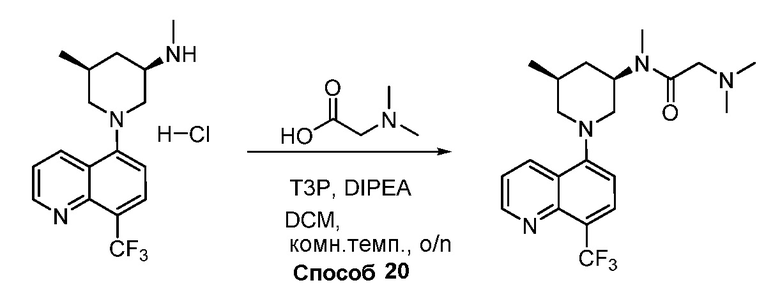
2-диметиламино-N-метил-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид: 2-диметиламино-N-метил-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид получали из Метил-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амин гидрохлорида и N,N-диметилглицина с выходом 56% с использованием Способа 20.
Соединение 452: ВЭЖХ: чистота 95,0%, RT=3,11 мин. МС: m/z=409 [M+H]+.
Пример 118: Синтез соединения 453 ((2-диэтиламино-этил)-амид 4-(8-циано-хиноксалин-5-ил)-пиперазин-1-карбоновой кислоты)
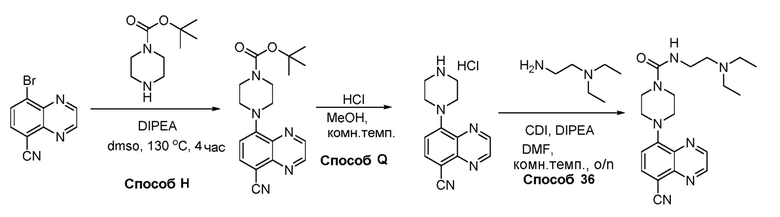
(2-диэтиламино-этил)-амид 4-(8-циано-хиноксалин-5-ил)-пиперазин-1-карбоновой кислоты: (2-диэтиламино-этил)-амид 4-(8-циано-хиноксалин-5-ил)-пиперазин-1-карбоновой кислоты получали из 8-бром-хиноксалин-5-карбонитрила, 1-boc-пиперазина и N,N-диэтилэтилендиамина с выходом 11% для 3 стадий с использованием Способа H, Q и 36.
Соединение 453: ВЭЖХ: чистота 96,4%, RT=1,85 мин. МС: m/z=382 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,98 (д, J=1,8 Гц, 1H), 8,84 (д, J=1,8 Гц, 1H), 8,03 (д, J=8,3 Гц, 1H), 7,05 (д, J=8,3 Гц, 1H), 5,36 (с, 1H), 3,77-3,59 (м, 8H), 3,37-3,25 (м, 2H), 2,56 (с, 6H), 1,03 (с, 6H).
Следующие соединение was синтезировали аналогичным способом:
Соединение 463 ((2-диметиламино-этил)-амид 4-(8-циано-хиноксалин-5-ил)-пиперазин-1-карбоновой кислоты): ВЭЖХ: чистота >99%, RT=1,62 мин. МС: m/z=354 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,98 (д, J=1,8 Гц, 1H), 8,83 (д, J=1,8 Гц, 1H), 8,03 (д, J=8,3 Гц, 1H), 7,05 (д, J=8,3 Гц, 1H), 5,28 (с, 1H), 3,79-3,67 (м, 4H), 3,67-3,57 (м, 4H), 3,35 (дт, J=5,9, 4,8 Гц, 2H), 2,47 (т, J=5,8 Гц, 2H), 2,26 (с, 6H).
Пример 119: Синтез соединения 458 (5-((3R,5S)-3-амино-5-метил-пиперидин-1-ил)-пиридо[4,3-d]пиримидин-8-карбонитрил гидрохлорид)
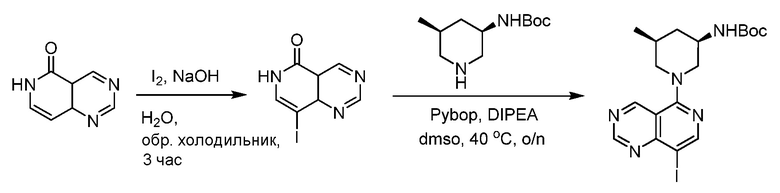
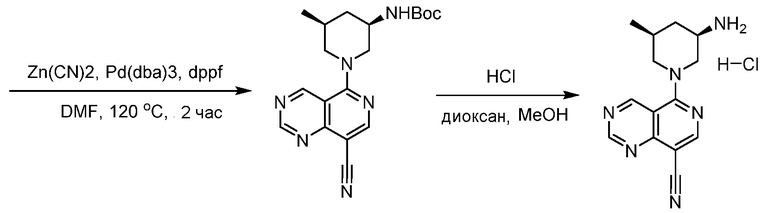
8-Иод-6H-пиридо[4,3-d]пиримидин-5-он: Смесь 5H,6H-пиридо[4,3-d]пиримидин-5-она (500 мг; 3,40 ммоль) и иода (863 мг; 3,40 ммоль) в 0,4 N растворе гидроксида натрия (15 мл) нагревали до температуры кипения с обратным холодильником в течение 3 часов. Светло-желтую суспензию охлаждали до комнатной температуры, добавляли воду (30 мл) и суспензию перемешивали при комнатной температуре в течение 15 минут. Суспензию фильтровали, твердое вещество промывали водой и сушили в вакууме с получением 8-иод-6H-пиридо[4,3-d]пиримидин-5-она (727 мг; 76%) в виде светло-желтого твердого вещества. МС: m/z=274 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 12,15 (с, 1H), 9,42 (с, 1H), 9,33 (с, 1H), 8,13 (с, 1H).
трет-бутиловый эфир [(3R,5S)-1-(8-иод-пиридо[4,3-d]пиримидин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты: Раствор 8-иод-6H-пиридо[4,3-d]пиримидин-5-она (300 мг; 1,10 ммоль), трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамата (283 мг; 1,32 ммоль), pybop (858 мг; 1,65 ммоль) и DIPEA (574 мкл; 3,30 ммоль) в безводном DMSO (9 мл) помещали в герметично закрываемую пробирку и нагревали при 40°C в течение ночи. Светло-желтый раствор охлаждали до комнатной температуры, выливали в насыщенный раствор хлорида аммония (100 мл) и экстрагировали этилацетатом (3×50 мл). Объединенные органическую фазу промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке PuriFlash (25г 30мкм), элюируя гексаном и этилацетатом, с получением трет-бутилового эфира [(3R,5S)-1-(8-иод-пиридо[4,3-d]пиримидин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты (212 мг; 41%) в виде желтого твердого вещества. МС: m/z=470 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,41 (с, 1H), 9,38 (с, 1H), 8,77 (с, 1H), 4,45 (с, 1H), 4,33 (ддт, J=12,4, 4,2, 1,9 Гц, 1H), 4,02 (ддт, J=12,9, 4,0, 1,8 Гц, 1H), 3,87 (с, 1H), 2,74 (дд, J=12,3, 10,8 Гц, 1H), 2,66 (т, J=12,1 Гц, 1H), 2,19 (д, J=12,6 Гц, 1H), 2,06 (с, 1H), 1,45 (с, 9H), 1,13-0,95 (м, 4H).
трет-бутиловый эфир [(3R,5S)-1-(8-циано-пиридо[4,3-d]пиримидин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты: Смесь трет-бутилового эфира [(3R,5S)-1-(8-иод-пиридо[4,3-d]пиримидин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты (100 мг; 0,213 ммоль), цианида цинка (62,6 мг; 0,533 ммоль), трис(дибензилиденацетон)дипалладия(0) (19,5 мг; 0,021 ммоль) и 1,1'-бис(дифенилфосфино)ферроцена (5,9 мг; 0,011 ммоль) в безводном DMF (3 мл) нагревали в условиях микроволнового облучения при 120°C в течение 2 часов. Черную суспензию фильтровали на целите, промывали этилацетатом и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке PuriFlash (12г 30мкм), элюируя гексаном и этилацетатом, с получением трет-бутилового эфира [(3R,5S)-1-(8-циано-пиридо[4,3-d]пиримидин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты (50 мг; 64%) в виде желтого твердого вещества. МС: m/z=369 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,54 (с, 1H), 9,40 (с, 1H), 8,66 (с, 1H), 4,70 (д, J=12,7 Гц, 1H), 4,48 (д, J=12,0 Гц, 2H), 3,81 (с, 1H), 2,89 (дд, J=12,6, 11,0 Гц, 1H), 2,75 (т, J=12,4 Гц, 1H), 2,21 (д, J=12,5 Гц, 1H), 1,99 (с, 1H), 1,45 (с, 9H), 1,15 (кв., J=12,0 Гц, 1H), 1,05 (д, J=6,6 Гц, 3H).
5-((3R,5S)-3-амино-5-метил-пиперидин-1-ил)-пиридо[4,3-d]пиримидин-8-карбонитрил гидрохлорид: Раствор хлористоводородной кислоты (692 мкл; 2,77 ммоль) 4M в диоксане добавляли к раствору трет-бутилового эфира [(3R,5S)-1-(8-циано-пиридо[4,3-d]пиримидин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты (34,0 мг; 0,092 ммоль) в метаноле (2 мл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Желтый раствор концентрировали при пониженном давлении, остаток растворяли в метаноле (1 мл) и добавляли этилацетат (10 мл). Желтую суспензию фильтровали, желтое твердое вещество промывали этилацетатом и сушили в вакууме с получением 5-((3R,5S)-3-амино-5-метил-пиперидин-1-ил)-пиридо[4,3-d]пиримидин-8-карбонитрил гидрохлорида (18 мг; 64%) в виде желтого твердого вещества.
Соединение 453: ВЭЖХ: чистота >99%, RT=1,42 мин. МС: m/z=269 [M+H]+. 1H ЯМР (400 МГц, Оксид дейтерия, м.д.) δ 9,58 (с, 1H), 9,32 (с, 1H), 8,79 (с, 1H), 4,85 (д, J=12,5 Гц, 1H), 4,38 (д, J=13,7 Гц, 1H), 3,73-3,62 (м, 1H), 3,42-3,33 (м, 1H), 3,22 (т, J=12,5 Гц, 1H), 2,37 (д, J=12,8 Гц, 1H), 2,08 (с, 1H), 1,51 (кв., J=12,2 Гц, 1H), 1,06 (д, J=6,7 Гц, 3H).
Пример 119: Синтез соединения 461 (цис-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ол)
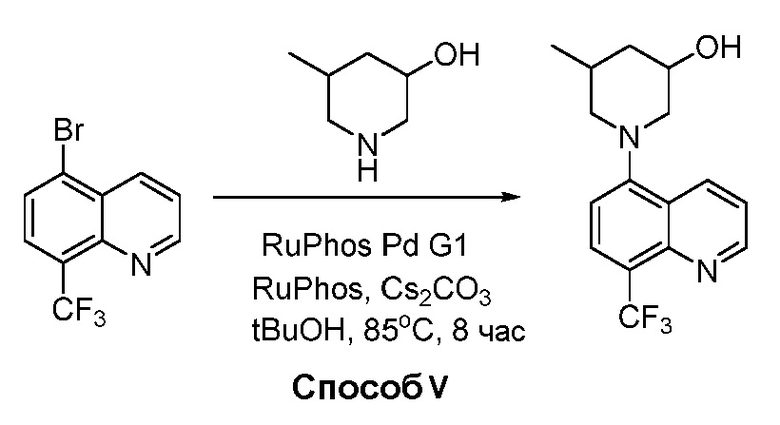
цис-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ол: цис-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ол получали из 5-бром-8-(трифторметил)хинолона и цис-5-метил-пиперидин-3-ола с выходом 7% с использованием Способа V.
Соединение 461: ВЭЖХ: чистота 95,7%, RT=3,67 мин. МС: m/z=311 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,04 (дд, J=4,2, 1,8 Гц, 1H), 8,44 (дд, J=8,6, 1,8 Гц, 1H), 7,98 (дд, J=8,0, 0,9 Гц, 1H), 7,47 (дд, J=8,5, 4,2 Гц, 1H), 7,08 (д, J=8,0 Гц, 1H), 4,18-4,03 (м, 1H), 3,57 (ддт, J=11,0, 4,4, 1,9 Гц, 1H), 3,30 (ддт, J=11,7, 3,7, 1,7 Гц, 1H), 2,59 (дд, J=11,0, 10,0 Гц, 1H), 2,38 (т, J=11,3 Гц, 1H), 2,26 (дтд, J=11,8, 3,9, 1,8 Гц, 1H), 2,10 (дддт, J=11,9, 10,6, 6,6, 4,0 Гц, 1H), 1,12 (тд, J=12,1, 10,8 Гц, 1H), 1,02 (д, J=6,7 Гц, 3H).
Пример 120: Синтез соединения 464 (((3R,4S)-4-фтор-пирролидин-3-ил)-амид 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты гидрохлорид)
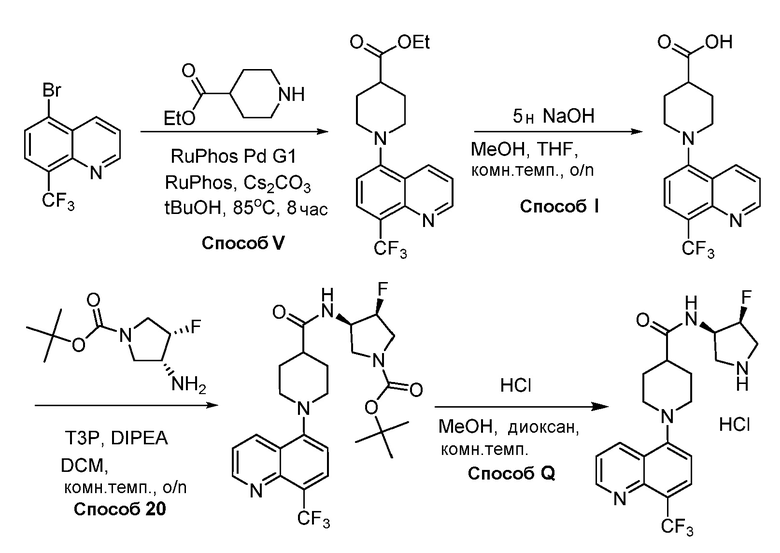
1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты ((3R,4S)-4-фтор-пирролидин-3-ил)-амид гидрохлорид: 1-(8-трифторметил-хинолин-5-ил)-пиперидин-4-карбоновой кислоты ((3R,4S)-4-фтор-пирролидин-3-ил)-амид гидрохлорид получали из 5-бром-8-(трифторметил)хинолона, этилпиперидин-4-карбоксилата и трет-бутилового эфира (3R,4S)-3-амино-4-фтор-пирролидин-1-карбоновой кислоты с выходом 45% для 4 стадий с использованием Способа V, I, 20 и Q.
Соединение 464: ВЭЖХ: чистота >99%, RT=2,45 мин. МС: m/z=411 [M+H]+. 1H ЯМР (400 МГц, Оксид дейтерия, м.д.) δ 8,97 (дд, J=4,7, 1,6 Гц, 1H), 8,79 (дд, J=8,6, 1,7 Гц, 1H), 8,19 (д, J=8,2 Гц, 1H), 7,79 (дд, J=8,6, 4,7 Гц, 1H), 7,32 (д, J=8,2 Гц, 1H), 5,42 (дт, J=52,4, 3,3 Гц, 1H), 4,92-4,81 (м, 1H), 3,95-3,76 (м, 3H), 3,52 (д, J=12,2 Гц, 2H), 3,35 (т, J=11,4 Гц, 1H), 3,02-2,87 (м, 2H), 2,73-2,59 (м, 1H), 2,17-1,92 (м, 4H).
Пример 121: Синтез соединения 465 (3-амино-3,N-диметил-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-бутирамид)
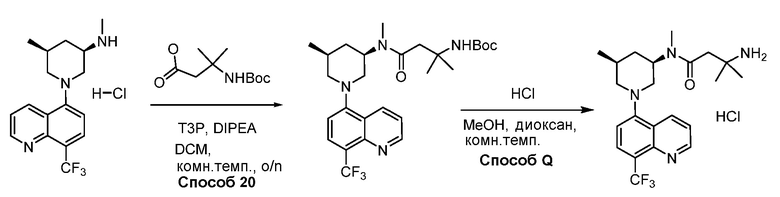
3-амино-3,N-диметил-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-бутирамид: 3-амино-3,N-диметил-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-бутирамид получали из метил-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амин гидрохлорида и 3-(трет-бутоксикарбониламино)-3-метилбутановой кислоты с выходом 13% для 2 стадий с использованием Способа 20 и Q.
Соединение 465: ВЭЖХ: чистота 93,2%, RT=3,29 мин. МС: m/z=423 [M+H]+.
Пример 121: Синтез соединения 477 (1-(2-диметиламино-этил)-3-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-мочевина)
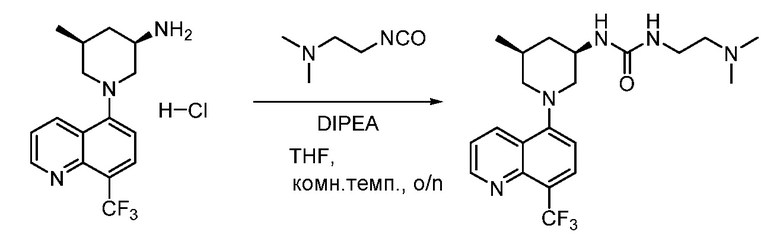
1-(2-диметиламино-этил)-3-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-мочевина: К раствору (3R,5S)-1-[8-(трифторметил)хинолин-5-ил]-5-метилпиперидин-3-амина (1,0 экв.) в THF добавляли DIEA (5,0 экв.). Раствор перемешивали при комнатной температуре в течение 10 минут, затем в колбу загружали (2-изоцианатоэтил)диметиламин. Реакционную смесь перемешивали в течение 16 часов. Реакционную смесь фильтровали и концентрировали. Неочищенный продукт очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge Prep C18 OBD Column, 5 мкм, 19 мм × 150 мм; Подвижная фаза: ацетонитрил в воде (с 0,05% NH3.H2O), 30% - 65% градиент за 7 мин; детектор УФ 254 нм.
Соединение 477: ВЭЖХ: чистота >99%, RT=2,86 мин. МС: m/z=424,2 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,00 (дд, J=4,2, 1,7 Гц, 1H), 8,52 (дд, J=8,6, 1,8 Гц, 1H), 8,03 (д, J=8,1 Гц, 1H), 7,65 (дд, J=8,6, 4,2 Гц, 1H), 7,19 (д, J=8,1 Гц, 1H), 6,09 (д, J=7,4 Гц, 1H), 5,71 (т, J=5,4 Гц, 1H), 3,56 (д, J=9,2 Гц, 1H), 3,14-2,98 (м, 2H), 2,46-2,33 (м, 2H), 2,23 (т, J=6,3 Гц, 2H), 2,12 (с, 6H), 1,98 (д, J=20,5 Гц, 2H), 1,03-0,88 (м, 4H).
Пример 122: Синтез соединения 478 (цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-(1-метил-пиперидин-4-ил)-ацетамид)
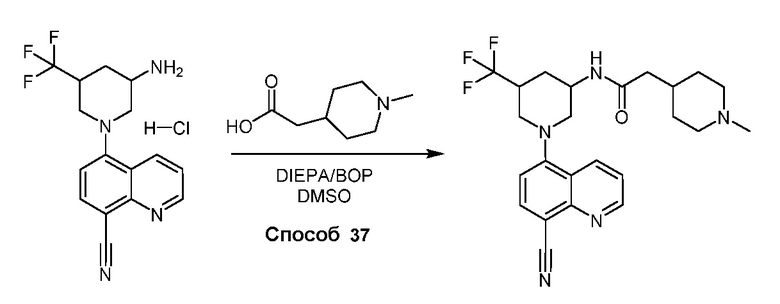
Способ 37
цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-(1-метил-пиперидин-4-ил)-ацетамид: Раствор цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида (100 мг; 0,28 ммоль), (1-метил-пиперидин-4-ил)-уксусной кислоты (53 мг; 0,34 ммоль) и DIPEA (0,2 мл; 0,84 ммоль) в DMSO (2 мл) перемешивали при комнатной температуре в течение 5 минут и затем добавляли bop (149 мг; 0,34 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа и концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой хроматографией (колонка XBridge), элюируя ацетонитрилом в воде (0,1%NH3.H2O), 30% - 70% градиент, с получением [00984] цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-(1-метил-пиперидин-4-ил)-ацетамида в виде белого твердого вещества (70 мг, 54%).
Соединение 478: 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 9,01 (дд, J=4,3, 1,6 Гц, 1H), 8,67 (дд, J=8,6, 1,7 Гц, 1H), 8,16 (д, J=8,0 Гц, 1H), 7,70 (дд, J=8,6, 4,3 Гц, 1H), 7,32 (д, J=8,0 Гц, 1H), 4,32 (тт, J=11,3, 4,3 Гц, 1H), 3,76-3,62 (м, 2H), 3,16-2,94 (м, 2H), 2,87 (т, J=10,8 Гц, 2H), 2,60 (т, J=11,2 Гц, 1H), 2,35 (д, J=12,5 Гц, 1H), 2,27 (с, 3H), 2,21-2,11 (м, 2H), 2,02 (ддт, J=14,5, 9,0, 2,9 Гц, 2H), 1,90-1,46 (м, 4H), 1,32 (дт, J=11,9, 5,4 Гц, 2H). МС: m/z=460 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 481 (цис-N-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-3-гидрокси-3-метил-бутирамид): из цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и 3-гидрокси-3-метил-масляной кислоты. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,07 (дд, J=4,2, 1,6 Гц, 1H), 8,59 (дд, J=8,6, 1,7 Гц, 1H), 8,26 (д, J=8,0 Гц, 1H), 8,02 (д, J=7,5 Гц, 1H), 7,73 (дд, J=8,6, 4,2 Гц, 1H), 7,33 (д, J=8,1 Гц, 1H), 4,70 (с, 1H), 4,19 (с, 1H), 3,57 (д, J=9,3 Гц, 2H), 3,21 (с, 1H), 2,95 (т, J=11,6 Гц, 1H), 2,65 (т, J=11,3 Гц, 1H), 2,22 (с, 2H), 1,53 (кв., J=12,2 Гц, 1H), 1,16 (с, 6H). МС: m/z=421 [M+H]+.
Соединение 484 (2-(1-гидрокси-циклогексил)-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и (1-трет-бутоксикарбониламино-циклогексил)-уксусной кислоты. 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 8,95 (д, J=4,2 Гц, 1H), 8,66 (д, J=8,6 Гц, 1H), 8,04 (д, J=8,0 Гц, 1H), 7,63 (дд, J=8,7, 4,1 Гц, 1H), 7,23 (д, J=8,0 Гц, 1H), 4,25 (с, 1H), 3,63 (д, J=11,4 Гц, 1H), 3,40 (д, J=11,6 Гц, 1H), 2,50 (кв., J=11,4 Гц, 2H), 2,31 (с, 2H), 2,14 (д, J=12,6 Гц, 2H), 1,67-1,35 (м, 11H), 1,16 (кв., J=12,4 Гц, 1H), 1,05 (д, J=6,2 Гц, 3H). МС: m/z=449 [M+H]+.
Соединение 485 (2-(1-гидрокси-циклогексил)-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и 3-гидрокси-3-метил-масляной кислоты, 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 8,94 (дд, J=4,2, 1,7 Гц, 1H), 8,67 (дд, J=8,6, 1,8 Гц, 1H), 8,04 (д, J=8,1 Гц, 1H), 7,63 (дд, J=8,6, 4,2 Гц, 1H), 7,23 (д, J=8,0 Гц, 1H), 4,26 (ддт, J=17,3, 13,6, 6,9 Гц, 1H), 3,68-3,59 (м, 1H), 3,47-3,36 (м, 2H), 2,55-2,37 (м, 2H), 2,36 (с, 2H), 2,17 (с, 2H), 1,27 (д, J=0,9 Гц, 6H), 1,17 (кв., J=12,6 Гц, 1H), 1,05 (д, J=6,4 Гц, 3H). МС: m/z=410 [M+H]+.
Соединение 490 (цис-N-[(1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-(1-метил-азетидин-3-ил)-ацетамид): из гидрохлорида цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрила и гидрохлорида (1-метил-азетидин-3-ил)-уксусной кислоты. 1H ЯМР (400 МГц, DMSO-d6) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,57 (дд, J=8,6, 1,7 Гц, 1H), 8,25 (д, J=8,0 Гц, 1H), 8,02 (д, J=7,4 Гц, 1H), 7,72 (дд, J=8,6, 4,2 Гц, 1H), 7,32 (д, J=8,1 Гц, 1H), 4,12 (с, 2H), 3,56 (т, J=8,9 Гц, 2H), 3,24 (тдд, J=7,2, 4,0, 2,1 Гц, 2H), 2,93 (т, J=11,6 Гц, 1H), 2,82-2,68 (м, 2H), 2,64-2,53 (м, 2H), 2,43-2,28 (м, 2H), 2,15 (с, 3H), 1,50 (кв., J=12,3 Гц, 1H). МС: m/z=432 [M+H]+.
Соединение 491 (цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-(1-метил-азетидин-3-ил)-ацетамид): из цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и (1-гидрокси-циклогексил)-уксусной кислоты. 1H ЯМР (400 МГц, DMSO-d6) δ 9,07 (дд, J=4,2, 1,6 Гц, 1H), 8,59 (дд, J=8,6, 1,7 Гц, 1H), 8,26 (д, J=8,0 Гц, 1H), 8,06 (д, J=7,4 Гц, 1H), 7,73 (дд, J=8,6, 4,2 Гц, 1H), 7,32 (д, J=8,1 Гц, 1H), 4,25 (м, 1H), 4,57 (с, 1H), 3,70-3,48 (м, 2H), 3,21 (д, J=11,2 Гц, 1H), 2,95 (т, J=11,6 Гц, 1H), 2,64 (т, J=11,2 Гц, 1H), 2,21 (с, 3H), 1,65-1,28 (м, 9H), 1,19 (кв., J=10,7, 10,1 Гц, 1H). МС: m/z=461 [M+H]+.
Соединение 496 (цис-N-[-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-4-(4-метил-пиперазин-1-ил)-4-оксо-бутирамид): из метилового эфира цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-сукцинамовой кислоты и 1-метил-пиперазина. 1H ЯМР (400 МГц, DMSO-d6) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,58 (дд, J=8,6, 1,7 Гц, 1H), 8,25 (д, J=8,0 Гц, 1H), 8,02 (д, J=7,3 Гц, 1H), 7,72 (дд, J=8,6, 4,2 Гц, 1H), 7,32 (д, J=8,1 Гц, 1H), 4,13 (д, J=8,2 Гц, 1H), 3,57 (д, J=11,7 Гц, 1H), 3,41 (д, J=5,0 Гц, 3H), 3,19 (с, 1H), 2,95 (т, J=11,6 Гц, 1H), 2,70-2,54 (м, 2H), 2,41-2,24 (м, 3H), 2,15 (с, 3H), 1,51 (кв., J=12,3 Гц, 1H). МС: m/z=503 [M+H]+.
Соединение 554 (N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-2-(1-метил-пиперидин-4-ил)-ацетамид): из 3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и 1-метил-4-пиперидинуксусной кислоты. МС: m/z=396 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 9,03 (дд, J=4,1, 1,7 Гц, 1H), 8,44 (дд, J=8,5, 1,7 Гц, 1H), 8,10 (с, 1H), 7,87-7,76 (м, 2H), 4,06-3,97 (м, 1H),3,45-3,36 (м, 1H), 3,26-3,19 (м, 1H), 2,88 (с, 3H), 2,74-2,63 (м, 2H), 2,42 (кв., J=11,0 Гц, 2H), 2,11 (с, 3H), 2,08-1,91 (м, 4H), 1,85-1,72 (м, 2H), 1,65-1,48 (м, 3H), 1,22-1,06 (м, 2H), 1,05 (кв., J=11,8 Гц, 1H), 0,95 (д, J=6,5 Гц, 3H).
Соединение 555 (3-гидрокси-3-метил-N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-бутирамид): из (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и бета-гидроксиизовалериановой кислоты. МС: m/z=357 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,03 (дд, J=4,1, 1,7 Гц, 1H), 8,45 (дд, J=8,5, 1,7 Гц, 1H), 8,11 (с, 1H), 7,88 (д, J=7,6 Гц, 1H), 7,80 (дд, J=8,5, 4,1 Гц, 1H), 4,77 (с, 1H), 4,13-3,95 (м, 1H), 3,47-3,37 (м, 1H), 3,28-3,18 (м, 1H), 2,88 (с, 3H), 2,43 (дд, J=23,0, 11,1 Гц, 2H), 2,21 (с, 2H), 2,12-1,91 (м, 2H), 1,14 (с, 3H), 1,13 (с, 3H), 1,12-1,00 (м, 1H), 0,95 (д, J=6,4 Гц, 3H).
Соединение 556 (2-(1-метил-азетидин-3-ил)-N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-ацетамид): из дигидрохлорида (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламина и гидрохлорида (1-метил-азетидин-3-ил)-уксусной кислоты. МС: m/z=357 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,02 (дд, J=4,1, 1,7 Гц, 1H), 8,43 (дд, J=8,5, 1,7 Гц, 1H), 8,10 (с, 1H), 7,85 (д, J=7,6 Гц, 1H), 7,79 (дд, J=8,5, 4,1 Гц, 1H), 4,03-3,95 (м, 1H), 3,44-3,35 (м, 1H), 3,23 (ддт, J=8,4, 4,6, 2,4 Гц, 3H), 2,88 (с, 3H), 2,73 (тд, J=6,3, 2,2 Гц, 2H), 2,61-2,52 (м, 1H), 2,41 (дт, J=15,1, 11,0 Гц, 2H), 2,32 (дд, J=7,7, 1,6 Гц, 2H), 2,14 (с, 3H), 2,05-1,93 (м, 2H), 1,05 (кв., J=12,0 Гц, 1H), 0,94 (д, J=6,5 Гц, 3H).
Соединение 557 (трет-бутиловый эфир 3-{[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-илкарбамоил]-метил}-азетидин-1-карбоновой кислоты): из (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и трет-бутилового эфира 3-карбоксиметил-азетидин-1-карбоновой кислоты. МС: m/z=454 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,60 (дд, J=8,6, 1,7 Гц, 1H), 8,05 (с, 1H), 7,79 (дд, J=8,6, 4,2 Гц, 1H), 4,25-4,13 (м, 1H), 4,05 (кв., J=8,0 Гц, 2H), 3,69-3,58 (м, 2H), 3,56-3,52 (м, 1H), 2,96 (с, 3H), 2,96-2,82 (м, 1H), 2,55-2,43 (м, 4H), 2,18-2,07 (м, 2H), 1,42 (с, 9H), 1,41-1,35 (м, 1H), 1,14 (кв., J=12,6 Гц, 1H), 1,04 (д, J=6,4 Гц, 3H).
Соединение 558 ((R)-2-Циклопропил-2-гидрокси-N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и циклопропил-гидрокси-уксусной кислоты. МС: m/z=355 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,03 (дд, J=4,1, 1,7 Гц, 1H), 8,46 (дд, J=8,5, 1,7 Гц, 1H), 8,11 (с, 1H), 7,80 (дд, J=8,5, 4,1 Гц, 1H), 7,58 (д, J=8,0 Гц, 1H), 5,28 (с, 1H), 4,13-4,00 (м, 1H), 3,51 (д, J=6,2 Гц, 1H), 3,37-3,33 (м, 1H), 3,26-3,22 (м, 1H), 2,88 (с, 3H), 2,57 (т, J=10,8 Гц, 1H), 2,41 (т, J=11,2 Гц, 1H), 2,09-2,01 (м, 1H), 1,99-1,90 (м, 1H), 1,19 (кв., J=12,1 Гц, 1H), 1,09-0,98 (м, 1H), 0,95 (д, J=6,6 Гц, 3H), 0,42-0,23 (м, 4H).
Соединение 559 ((S)-2-Циклопропил-2-гидрокси-N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и циклопропил-гидрокси-уксусной кислоты. МС: m/z=355 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,03 (дд, J=4,1, 1,7 Гц, 1H), 8,45 (дд, J=8,5, 1,8 Гц, 1H), 8,10 (с, 1H), 7,80 (дд, J=8,5, 4,1 Гц, 1H), 7,56 (д, J=8,0 Гц, 1H), 5,32 (с, 1H), 4,11-4,03 (м, 1H), 3,53 (д, J=6,0 Гц, 1H), 3,40-3,34 (м, 1H), 3,27-3,20 (м, 1H), 2,88 (с, 3H), 2,57 (т, J=10,8 Гц, 1H), 2,41 (т, J=11,2 Гц, 1H), 2,08-2,03 (м, 1H), 1,99-1,94 (м, 1H), 1,20 (кв., J=12,0 Гц, 1H), 1,10-0,98 (м, 1H), 0,95 (д, J=6,5 Гц, 3H), 0,42-0,25 (м, 4H).
Соединение 560 (N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-2-(1-метил-пирролидин-3-ил)-ацетамид): из дигидрохлорида (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламина и гидрохлорида (1-метил-пирролидин-3-ил)-уксусной кислоты. МС: m/z=382 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,60 (дд, J=8,6, 1,7 Гц, 1H), 8,05 (с, 1H), 7,79 (дд, J=8,5, 4,2 Гц, 1H), 4,24-4,17 (м, 1H), 3,60-3,50 (м, 1H), 2,96 (с, 3H), 2,85 (дт, J=9,8, 7,4 Гц, 1H), 2,75-2,56 (м, 3H), 2,49 (тд, J=10,9, 6,8 Гц, 2H), 2,40 (д, J=4,0 Гц, 3H), 2,35-2,25 (м, 3H), 2,22-1,99 (м, J=5,1 Гц, 4H), 1,53 (дп, J=14,3, 7,0 Гц, 1H), 1,14 (кв., J=12,5 Гц, 1H), 1,04 (д, J=6,4 Гц, 3H).
Пример 123: Синтез соединения 479 (цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорид)
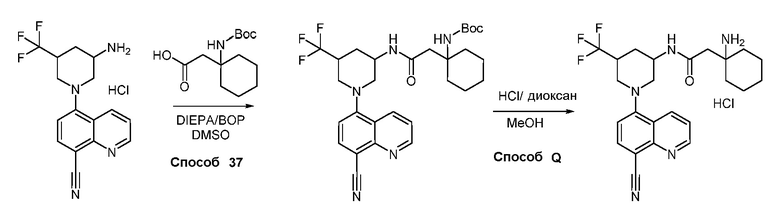
Цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорид: Цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорид получали из цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и (1-трет-бутоксикарбониламино-циклогексил)-уксусной кислоты с использованием Способа 37 и Q.
Соединение 479: 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 9,01 (дд, J=4,3, 1,6 Гц, 1H), 8,68 (дд, J=8,6, 1,7 Гц, 1H), 8,17 (д, J=8,0 Гц, 1H), 7,70 (дд, J=8,6, 4,3 Гц, 1H), 7,32 (д, J=8,0 Гц, 1H), 4,42-4,22 (м, 1H), 3,78-3,57 (м, 2H), 3,15-2,86 (м, 2H), 2,62 (т, J=11,2 Гц, 1H), 2,42-2,24 (м, 3H), 1,70-1,21 (м, 11H). МС: m/z=460 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 483 (2-(1-Амино-циклогексил)-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и 2-(1-{[(трет-бутокси)карбонил]амино}циклогексил)уксусной кислоты. 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 8,95 (д, J=4,2 Гц, 1H), 8,66 (д, J=8,6 Гц, 1H), 8,04 (д, J=8,0 Гц, 1H), 7,63 (дд, J=8,7, 4,1 Гц, 1H), 7,23 (д, J=8,0 Гц, 1H), 4,25 (с, 1H), 3,63 (д, J=11,4 Гц, 1H), 3,40 (д, J=11,6 Гц, 1H), 2,50 (кв., J=11,4 Гц, 2H), 2,31 (с, 2H), 2,14 (д, J=12,6 Гц, 2H), 1,67-1,35 (м, 11H), 1,16 (кв., J=12,4 Гц, 1H), 1,05 (д, J=6,2 Гц, 3H). МС: m/z=449 [M+H]+.
Соединение 486 и соединение 487 (рац-(R)-2-амино-N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-циклопропил-ацетамид и рац-(S)-2-амино-N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-2-циклопропил-ацетамид): из цис-5-((3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и трет-бутоксикарбониламино-циклопропил-уксусной кислоты. Изомер 1: 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 9,02 (дд, J=4,2, 1,6 Гц, 1H), 8,69 (дд, J=8,6, 1,7 Гц, 1H), 8,18 (д, J=8,0 Гц, 1H), 7,71 (дд, J=8,6, 4,3 Гц, 1H), 7,34 (д, J=8,0 Гц, 1H), 4,34 (дкв., J=11,3, 5,2, 4,3 Гц, 1H), 3,68 (д, J=10,5 Гц, 2H), 3,12-2,84 (м, 2H), 2,73-2,50 (м, 2H), 1,65 (кв., J=12,2 Гц, 1H), 0,99 (дтд, J=13,2, 8,3, 4,9 Гц, 1H), 0,68-0,23 (м, 3H). МС: m/z=418 [M+H]+. Изомер 2: 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 9,01 (дд, J=4,3, 1,6 Гц, 1H), 8,69 (дд, J=8,6, 1,7 Гц, 1H), 8,17 (д, J=8,0 Гц, 1H), 7,70 (дд, J=8,6, 4,3 Гц, 1H), 7,33 (д, J=8,0 Гц, 1H), 4,34 (ддд, J=15,4, 11,1, 4,2 Гц, 1H), 3,82-3,60 (м, 2H), 3,18-2,87 (м, 2H), 2,69-2,52 (м, 2H), 2,38 (д, J=12,5 Гц, 1H), 1,63 (кв., J=12,2 Гц, 1H), 1,03 (кв.т, J=8,3, 4,9 Гц, 1H), 0,72-0,51 (м, 2H), 0,41 (ддкв., J=45,4, 9,3, 5,0 Гц, 2H). МС: m/z=418 [M+H]+.
Соединение 493 (2-(4-Амино-тетрагидро-пиран-4-ил)-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-ацетамид гидрохлорид): из цис-5-(3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и (4-трет-бутоксикарбониламино-тетрагидро-пиран-4-ил)-уксусной кислоты. 1H ЯМР (400 МГц, DMSO-d6) δ 9,08 (дд, J=4,2, 1,6 Гц, 1H), 8,78 (д, J=7,1 Гц, 1H), 8,59 (дд, J=8,6, 1,7 Гц, 1H), 8,28 (д, J=8,0 Гц, 1H), 8,16 (с, 3H), 7,72 (дд, J=8,6, 4,2 Гц, 1H), 7,35 (д, J=8,1 Гц, 1H), 3,91-3,66 (м, 3H), 3,67-3,42 (м, 4H), 3,33-3,11 (м, 1H), 2,98 (т, J=11,5 Гц, 1H), 2,78-2,56 (м, 3H), 2,25 (д, J=12,3 Гц, 1H), 1,88-1,41 (м, 5H). МС: m/z=462 [M+H]+.
Соединение 561 ((R)-2-Амино-2-циклопропил-N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и трет-бутоксикарбониламино-циклопропил-уксусной кислоты. МС: m/z=354 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 9,02 (дд, J=4,1, 1,7 Гц, 1H), 8,51 (дд, J=8,5, 1,8 Гц, 1H), 8,30 (с, 1H), 8,14 (с, 1H), 7,67 (дд, J=8,5, 4,1 Гц, 1H), 7,14 (д, J=8,1 Гц, 1H), 4,35-4,27 (м, 1H), 3,66-3,61 (м, 2H), 3,35-3,23 (м, 1H), 3,04 (с, 3H), 2,88 (д, J=8,9 Гц, 1H), 2,50 (тд, J=10,9, 6,6 Гц, 2H), 2,20-2,09 (м, 2H), 1,16-1,06 (м, 1H), 1,03 (д, J=6,5 Гц, 3H), 0,72-0,53 (м, 3H), 0,37-0,33 (м, 1H).
Соединение 562 ((S)-2-Амино-2-циклопропил-N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и трет-бутоксикарбониламино-циклопропил-уксусной кислоты. МС: m/z=354 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,99 (дд, J=4,2, 1,7 Гц, 1H), 8,41 (дд, J=8,5, 1,8 Гц, 1H), 8,10 (с, 1H), 7,68-7,48 (м, 2H), 4,96 (шир.с, 3H), 4,25 (шир.с, 1H), 3,62-3,45 (м, 1H), 3,28-3,22 (м, 1H), 3,01 (с, 3H), 2,61-2,43 (м, 1H), 2,39 (т, J=11,1 Гц, 1H), 2,19-2,04 (м, 2H), 1,18-1,05 (м, 2H), 0,99 (д, J=6,3 Гц, 3H), 0,57 (шир.с, 3H), 0,38 (шир.с, 1H).
Соединение 563 (2-(1-Амино-циклогексил)-N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-ацетамид): из (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и (1-трет-бутоксикарбониламино-циклогексил)-уксусной кислоты, с последующим удалением защитной группы Boc с использованием Способа Q. МС: m/z=396 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 9,02 (дд, J=4,1, 1,7 Гц, 1H), 8,59 (дд, J=8,5, 1,8 Гц, 1H), 8,55 (шир.с, 1H), 8,06 (с, 1H), 7,78 (дд, J=8,6, 4,2 Гц, 1H), 4,28-4,21 (м, 1H),, 3,61-3,53 (м, 1H), 3,37-3,35 (м, 1H), 2,97 (с, 3H), 2,70-2,41 (м, 4H), 2,20-2,08 (м, 2H), 1,88-1,47 (м, 9H), 1,45-1,35 (м, 1H), 1,16 (кв., J=12,6 Гц, 1H), 1,04 (д, J=6,4 Гц, 3H).
Пример 124: Синтез соединения 480 (цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-сукцинамид)
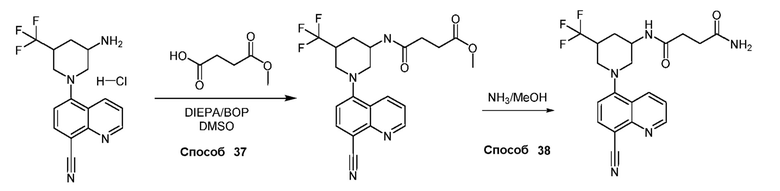
Метиловый эфир цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-сукцинамовой кислоты: метиловый эфир цис-N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-сукцинамовой кислоты получали из 5-((3R,5S)-3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и монометилового эфира янтарной кислоты с использованием Способа 37.
Способ 38
цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-сукцинамид: Раствор метилового эфира цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-сукцинамовой кислоты (55мг; 0,13 ммоль) в растворе аммиака 7,0M в метаноле (2,00 мл; 14,00 ммоль) перемешивали при 60°C в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали обращенно-фазовой хроматографией (колонка XBridge), элюируя ацетонитрилом в воде (0,1%NH3.H2O), 20% - 70% градиент, с получением цис-N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-сукцинамида (5 мг, 9%).
Соединение 480: 1H ЯМР (400 МГц, DMSO-d6) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,58 (дд, J=8,6, 1,7 Гц, 1H), 8,25 (д, J=8,0 Гц, 1H), 8,02 (д, J=7,3 Гц, 1H), 7,72 (дд, J=8,6, 4,2 Гц, 1H), 7,32 (д, J=8,1 Гц, 1H), 7,25 (с, 1H), 6,70 (с, 1H), 4,23 (д, J=10,5 Гц, 1H), 3,57 (д, J=11,5 Гц, 2H), 2,94 (т, J=11,6 Гц, 1H), 2,60 (т, J=11,2 Гц, 1H), 2,35-2,25 (м, 3H), 2,18 (д, J=12,3 Гц, 1H), 1,50 (кв., J=12,3 Гц, 1H). МС: m/z=420 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 482 (цис-4-Азетидин-1-ил-N-[(1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-4-оксо-бутирамид): из метилового эфира цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-сукцинамовой кислоты и азетидина. 1H ЯМР (400 МГц, DMSO-d6) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,58 (дд, J=8,6, 1,7 Гц, 1H), 8,25 (д, J=8,0 Гц, 1H), 8,04 (д, J=7,3 Гц, 1H), 7,72 (дд, J=8,6, 4,2 Гц, 1H), 7,32 (д, J=8,1 Гц, 1H), 4,10 (т, J=7,6 Гц, 3H), 3,79 (тд, J=7,8, 2,8 Гц, 2H), 3,56 (д, J=11,7 Гц, 2H), 3,20 (д, J=10,9 Гц, 1H), 2,95 (т, J=11,6 Гц, 1H), 2,60 (т, J=11,2 Гц, 1H), 2,38-1,99 (м, 7H), 1,50 (кв., J=12,3 Гц, 1H). МС: m/z=460 [M+H]+.
Соединение 492 цис-(N--1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-N'-метил-сукцинамид): из метилового эфира цис-N-[1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-сукцинамовой кислоты и метиламина. 1H ЯМР (400 МГц, DMSO-d6) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,58 (дд, J=8,6, 1,7 Гц, 1H), 8,25 (д, J=8,0 Гц, 1H), 8,03 (д, J=7,3 Гц, 1H), 7,72 (дд, J=8,6, 4,2 Гц, 2H), 7,32 (д, J=8,1 Гц, 1H), 4,15 (м, 1H), 3,68-3,50 (м, 2H), 3,20 (д, J=10,0 Гц, 1H), 2,94 (т, J=11,6 Гц, 1H), 2,54 (д, J=4,6 Гц, 3H), 2,30 (дкв., J=6,7, 6,0, 4,2 Гц, 4H), 2,18 (д, J=12,1 Гц, 1H), 1,50 (кв., J=12,3 Гц, 1H). МС: m/z=434 [M+H]+.
Соединение 564 (N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-сукцинамид): из (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и моно-метилсукцината, с последующим взаимодействием с аммиаком в метаноле при 50°C в течение ночи. МС: m/z=356 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,02 (дд, J=4,1, 1,7 Гц, 1H), 8,44 (дд, J=8,5, 1,7 Гц, 1H), 8,10 (с, 1H), 7,84 (д, J=7,5 Гц, 1H), 7,79 (дд, J=8,5, 4,1 Гц, 1H), 7,24 (с, 1H), 6,69 (с, 1H), 4,05-3,95 (м, 1H),3,48-3,36 (м, 1H), 3,24 (д, J=10,5 Гц, 1H), 2,88 (с, 3H), 2,41 (кв., J=11,3 Гц, 2H), 2,36-2,21 (м, 4H), 2,10-1,92 (м, 2H), 1,05 (кв., J=12,0 Гц, 1H), 0,95 (д, J=6,5 Гц, 3H).
Соединение 565 (N-метил-N'-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-сукцинамид): из (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и моно-метилсукцината, с последующим взаимодействием с метиламином в этаноле при комнатной температуре в течение ночи. МС: m/z=370 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,02 (дд, J=4,1, 1,7 Гц, 1H), 8,44 (дд, J=8,5, 1,7 Гц, 1H), 8,10 (с, 1H), 7,86 (д, J=7,5 Гц, 1H), 7,79 (дд, J=8,5, 4,1 Гц, 1H), 7,71 (д, J=5,4 Гц, 1H), 4,05-3,94 (м, 1H), 3,43-3,37 (м, 1H), 3,24 (д, J=10,1 Гц, 1H), 2,88 (с, 3H), 2,54 (д, J=4,6 Гц, 3H), 2,41 (кв., J=11,2 Гц, 2H), 2,35-2,24 (м, 4H), 2,07-1,93 (м, 2H), 1,05 (кв., J=12,0 Гц, 1H), 0,95 (д, J=6,4 Гц, 3H).
Соединение 566 (4-Азетидин-1-ил-N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-4-оксо-бутирамид): из (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и моно-метилсукцината, с последующим взаимодействием с азетидином в этаноле при комнатной температуре в течение ночи. МС: m/z=396 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,03 (дд, J=4,1, 1,7 Гц, 1H), 8,44 (дд, J=8,5, 1,7 Гц, 1H), 8,41 (с, 1H), 8,10 (с, 1H), 7,88 (д, J=7,4 Гц, 1H), 7,80 (дд, J=8,5, 4,1 Гц, 1H), 4,09 (т, J=7,7 Гц, 2H), 4,04-3,96 (м, 1H), 3,78 (тд, J=7,8, 2,2 Гц, 2H), 3,42-3,38 (м, 1H), 3,25-3,22 (м, 1H), 2,88 (с, 3H), 2,41 (тд, J=10,9, 7,6 Гц, 2H), 2,35-2,26 (м, 2H), 2,26-2,18 (м, 2H), 2,18-2,08 (м, 2H), 2,08-1,90 (м, 2H), 1,05 (кв., J=12,0 Гц, 1H), 0,95 (д, J=6,5 Гц, 3H).
Пример 125: Синтез соединения 488 ((3R,5S)-1-(7-Фтор-8-метил-хинолин-5-ил)-5-метил-пиперидин-3-иламин гидрохлорид)
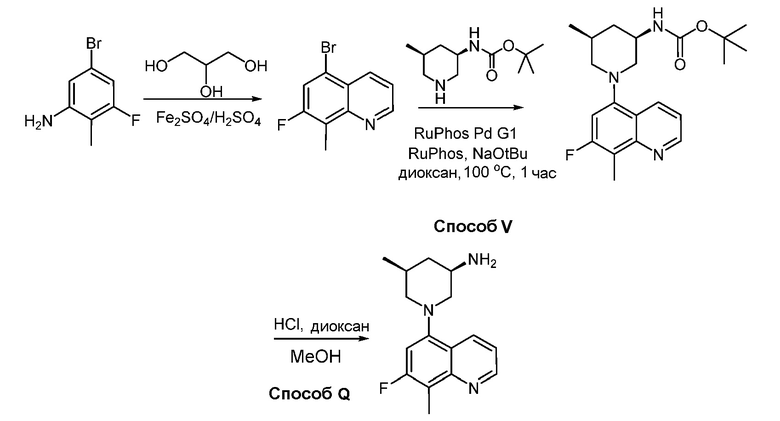
5-бром-7-фтор-8-метилхинолин: Смесь 5-бром-3-фтор-2-метил-фениламина (2,91 г; 14,3 ммоль), глицерина (4,20 мл; 57,1 ммоль), сульфата железа(II) гептагидрата (793 мг; 2,85 ммоль) и серной кислоты (4,66 мл; 85,6 ммоль) перемешивали при 120°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, затем добавляли лед (50 г) и твердый гидроксид натрия (4,5 г), смесь перемешивали в течение 30 минут и экстрагировали дихлорметаном (70 мл ×3). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюируя этилацетатом и гексаном, с получением 5-бром-7-фтор-8-метил-хинолина (1,10 г, 32%). 1H ЯМР (400 МГц, Хлороформ-d, м.д.) δ 8,99 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,5, 1,7 Гц, 1H), 7,68 (д, J=8,8 Гц, 1H), 7,50 (дд, J=8,5, 4,2 Гц, 1H), 2,70 (д, J=2,5 Гц, 3H). МС: m/z=239 [M+H]+.
трет-бутиловый эфир [(3R,5S)-1-(7-фтор-8-метил-хинолин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты: трет-бутиловый эфир [(3R,5S)-1-(7-фтор-8-метил-хинолин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты получали из 5-бром-7-фтор-8-метил-хинолина и трет-бутилового эфира ((3R,5S)-5-метил-пиперидин-3-ил)-карбаминовой кислоты с выходом 56% с использованием Способа V. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 8,94 (дд, J=4,2, 1,7 Гц, 1H), 8,43 (дд, J=8,5, 1,7 Гц, 1H), 7,53 (с, 1H), 7,04 (д, J=11,5 Гц, 1H), 6,93 (д, J=7,6 Гц, 1H), 3,73 (с, 1H), 3,36 (с, 1H), 3,18 (д, J=11,5 Гц, 1H), 2,54 (д, J=2,3 Гц, 3H), 2,34 (дт, J=27,7, 10,9 Гц, 2H), 2,08-1,80 (м, 2H), 1,39 (с, 8H), 1,03 (кв., J=12,2 Гц, 1H), 0,93 (д, J=6,4 Гц, 3H). МС: m/z=374 [M+H]+.
(3R,5S)-1-(7-Фтор-8-метил-хинолин-5-ил)-5-метил-пиперидин-3-иламин гидрохлорид: (3R,5S)-1-(7-Фтор-8-метил-хинолин-5-ил)-5-метил-пиперидин-3-иламин гидрохлорид получали из трет-бутилового эфира [(3R,5S)-1-(7-Фтор-8-метил-хинолин-5-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты с выходом 88% с использованием Способа Q.
Соединение 388: 1H ЯМР (400 МГц, DMSO-d6) δ 9,01 (дд, J=4,4, 1,7 Гц, 1H), 8,56 (д, J=8,3 Гц, 1H), 8,29 (с, 3H), 7,61 (дд, J=8,5, 4,4 Гц, 1H),,16 (д, J=11,4 Гц, 1H), 3,27-3,11 (м, 1H), 2,71-2,59 (м, 1H), 2,57 (д, J=2,3 Гц, 3H), 2,43 (т, J=11,3 Гц, 1H), 2,18 (д, J=12,4 Гц, 1H), 2,06 (с, 1H), 1,18 (кв., J=11,9 Гц, 1H), 0,98 (д, J=6,6 Гц, 3H). МС: m/z=274 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 389 ((3R,5S)-1-(6-Фтор-8-метил-хинолин-5-ил)-5-метил-пиперидин-3-иламин): из 5-бром-6-фтор-8-метил-хинолина и трет-бутилового эфира ((3R,5S)-5-метил-пиперидин-3-ил)-карбаминовой кислоты. 1H ЯМР (400 МГц, DMSO-d6) δ 8,89 (дд, J=4,1, 1,8 Гц, 1H), 8,58 (дд, J=8,5, 1,8 Гц, 1H), 7,65-7,54 (м, 1H), 7,51 (дд, J=13,1, 1,2 Гц, 1H), 3,06 (д, J=11,1 Гц, 1H), 2,95 (д, J=11,3 Гц, 2H), 2,78-2,58 (м, 5H), 2,02-1,83 (м, 2H), 1,60 (с, 2H), 0,97-0,84 (м, 3H). МС: m/z=274 [M+H]+.
Пример 126: Разделение соединения 494 и соединения 495 (4-азетидин-1-ил-N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-4-оксо-бутирамид и 4-азетидин-1-ил-N-[(3S,5R)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-4-оксо-бутирамид)
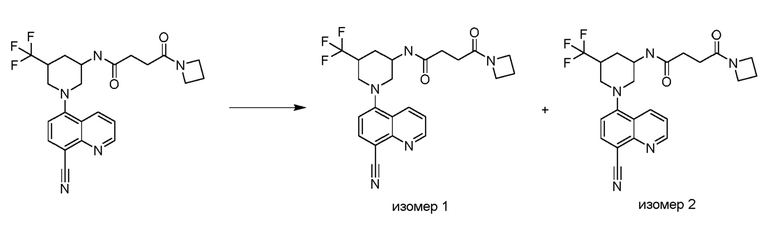
Указанные в заголовке соединения выделяли хиральной СКЖХ хроматографией соединения 482. (Колонка: Phenomenex 250×21,20 мм Lux Cellulose-2; CO2 со-растворитель (Растворитель B): Метанол; Изократический метод: 40% со-растворителя при 70 мл/мин; Давление в системе: 100 бар; Температура колонки: 40°C).
Изомер 1: МС: m/z=460 [M+H]+.
Изомер 2: МС: m/z=460 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 497 и соединение 498 (2-(1-амино-циклогексил)-N-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-ацетамид и 2-(1-амино-циклогексил)-N-[(3S,5R)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-ацетамид): из соединения 479 (Колонка: CHIRALPAK 10×250 мм IC; CO2 со-растворитель (Растворитель B): Этанол с 0,5% диметилэтиламина; Изократический метод: 55% со-растворителя при 9 мл/мин; Давление в системе: 100 бар; Температура колонки: 30°C). Изомер 1: МС: m/z=460 [M+H]+. Изомер 2: МС: m/z=460 [M+H]+.
Соединение 520 и соединение 521 ((R)-2-циклопропил-2-гидрокси-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид и (S)-2-циклопропил-2-гидрокси-N-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-ацетамид): из соединения 515 (Колонка: CHIRALPAK 10×250 мм ADH; CO2 со-растворитель (Растворитель B): Метанол с 0,5% диметилэтиламина; Изократический метод: 40% со-растворителя при 8 мл/мин; Давление в системе: 100 бар; Температура колонки: 35°C). Изомер 1: МС: m/z=408 [M+H]+. Изомер 2: МС: m/z=408 [M+H]+.
Соединение 522 и соединение 523 (N-[(S)-1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-(1-метил-пиперидин-4-ил)-ацетамид и N-[(R)-1-(8-циано-хиноксалин-5-ил)-5, 5-дифтор-пиперидин-3-ил]-2-(1-метил-пиперидин-4-ил)-ацетамид): из соединения 504 (Колонка: CHIRALPAK 10×250 мм IF; CO2 со-растворитель (Растворитель B): Этанол с 0,5% диметилэтиламина; Изократический метод: 55% со-растворителя при 8 мл/мин; Давление в системе: 100 бар; Температура колонки: 35°C). Изомер 1: МС: m/z=429 [M+H]+. Изомер 2: МС: m/z=429 [M+H]+.
Соединение 527 и соединение 528 ((S)-5,5-дифтор-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин и (R)-5,5-дифтор-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин): из соединение 510 (Колонка: CHIRALPAK 10×250 мм IF; CO2 со-растворитель (Растворитель B): этанол с 0,5% диметилэтиламина; Изократический метод: 55% со-растворителя при 4 мл/мин; Давление в системе: 100 бар; Температура колонки: 40°C). Изомер 1: МС: m/z=332 [M+H]+. Изомер 2: МС: m/z=332 [M+H]+.
Пример 127: Синтез соединения 499 (8-((3R,5S)-3-амино-5-фтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил гидрохлорид)
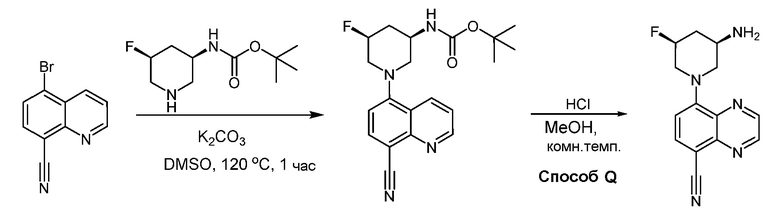
трет-Бутиловый эфир [(3R,5S)-1-(8-циано-хиноксалин-5-ил)-5-фтор-пиперидин-3-ил]-карбаминовой кислоты: Смесь 8-бром-хиноксалин-5-карбонитрила (84 мг; 0,36 ммоль), трет-бутилового эфира ((S)-5-Фтор-пиперидин-3-ил)-карбаминовой кислоты трет-бутиловый эфир (94 мг; 0,43 ммоль) дикарбоната калия (64 мг; 0,47 ммоль) и DMSO (2мл) нагревали в условиях микроволнового облучения при 120°C в течение 1 часа. Реакционную смесь очищали обращенно-фазовой хроматографией (колонка XBridge), элюируя ацетонитрилом в воде (0,1%NH3.H2O), с получением трет-бутилового эфира [(3R,5S)-1-(8-циано-хиноксалин-5-ил)-5-фтор-пиперидин-3-ил]-карбаминовой кислоты. 1H ЯМР (400 МГц, DMSO-d6) δ 9,07 (д, J=1,8 Гц, 1H), 8,99 (д, J=1,8 Гц, 1H), 8,25 (д, J=8,4 Гц, 1H), 7,33 (д, J=8,4 Гц, 1H), 7,02 (д, J=7,6 Гц, 1H), 4,85 (дт, J=9,2, 4,7 Гц, 1H), 4,49 (с, 1H), 3,93 (д, J=12,1 Гц, 1H), 3,73 (с, 1H), 3,17 (ддд, J=13,2, 9,1, 4,9 Гц, 1H), 3,04 (т, J=10,9 Гц, 1H), 1,76 (кв., J=11,1 Гц, 1H), 1,40 (с, 9H). МС: m/z=373 [M+H]+.
8-((3R,5S)-3-амино-5-фтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил гидрохлорид: 8-((3R,5S)-3-амино-5-фтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил гидрохлорид получали из трет-бутилового эфира [(3R,5S)-1-(8-циано-хиноксалин-5-ил)-5-фтор-пиперидин-3-ил]-карбаминовой кислоты с использованием Способа Q.
Соединение 499: 1H ЯМР (400 МГц, DMSO-d6) δ 9,20-9,07 (м, 1H), 9,03 (д, J=1,8 Гц, 1H), 8,42-8,12 (м, 4H), 7,38 (д, J=8,4 Гц, 1H), 5,19-4,93 (м, 1H), 3,93 (ддд, J=33,2, 13,0, 8,3 Гц, 2H), 3,78 (дд, J=12,6, 3,0 Гц, 1H), 2,46-2,29 (м, 1H), 2,22-2,07 (м, 1H). МС: m/z=273 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 500 (трет-бутиловый эфир [(3R,5S)-1-(8-циано-хинолин-5-ил)-5-фтор-пиперидин-3-ил]-карбаминовой кислоты): из 5-бром-хинолин-8-карбонитрила и трет-бутилового эфира ((3R,5S)-5-Фтор-пиперидин-3-ил)-карбаминовой кислоты. 1H ЯМР (400 МГц, DMSO-d6) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,55 (д, J=8,6 Гц, 1H), 8,25 (д, J=8,1 Гц, 1H), 7,71 (дд, J=8,7, 4,2 Гц, 1H), 7,30 (д, J=8,1 Гц, 1H), 6,97 (д, J=7,4 Гц, 1H), 4,99 (с, 1H), 3,85 (с, 1H), 3,63 (с, 1H), 3,44 (д, J=11,8 Гц, 1H), 3,00 (с, 1H), 2,71 (т, J=10,9 Гц, 1H), 2,37 (т, J=11,9 Гц, 1H), 1,70 (т, J=11,1 Гц, 1H), 1,39 (с, 5H). МС: m/z=372 [M+H]+.
Соединение 501 (8-((3S,5R)-3-амино-5-фтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил гидрохлорид): из трет-бутилового эфира [(3S,5R)-1-(8-циано-хиноксалин-5-ил)-5-фтор-пиперидин-3-ил]-карбаминовой кислоты. 1H ЯМР (400 МГц, Метанол-d4) δ 9,06 (д, J=1,8 Гц, 1H), 8,99 (д, J=1,8 Гц, 1H), 8,23 (д, J=8,2 Гц, 1H), 7,41 (д, J=8,2 Гц, 1H), 5,16 (дт, J=46,0, 2,7 Гц, 1H), 4,55-4,38 (м, 1H), 4,05-3,89 (м, 1H), 3,81 (с, 1H), 3,59 (ддд, J=36,7, 13,4, 1,8 Гц, 1H), 3,38 (дд, J=13,5, 1,9 Гц, 1H), 2,58-2,43 (м, 1H), 2,39 (ддд, J=15,8, 4,4, 3,1 Гц, 1H), 2,28 (ддд, J=15,8, 4,5, 3,1 Гц, 1H). МС: m/z=273 [M+H]+.
Пример 128: Синтез соединения 502 (N-[(3R,5S)-1-(8-циано-хиноксалин-5-ил)-5-фтор-пиперидин-3-ил]-2-(4-метил-пиперазин-1-ил)-ацетамид):
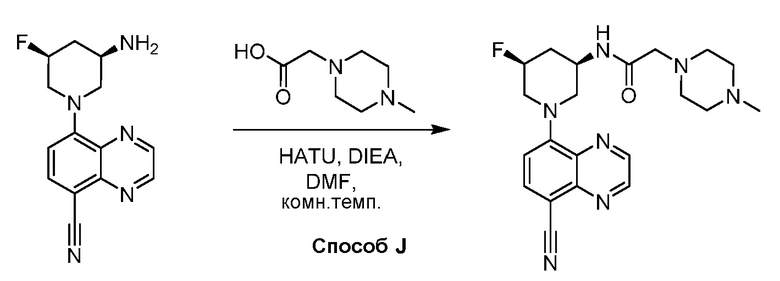
N-[(3R,5S)-1-(8-циано-хиноксалин-5-ил)-5-фтор-пиперидин-3-ил]-2-(4-метил-пиперазин-1-ил)-ацетамид: N-[(3R,5S)-1-(8-циано-хиноксалин-5-ил)-5-фтор-пиперидин-3-ил]-2-(4-метил-пиперазин-1-ил)-ацетамид получали из (4-метил-пиперазин-1-ил)-уксусной кислоты и 8-((3R,5S)-3-амино-5-фтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил гидрохлорида с использованием Способа J. 1H ЯМР (400 МГц, DMSO-d6) δ 9,07 (д, J=1,8 Гц, 1H), 8,96 (д, J=1,8 Гц, 1H), 8,24 (д, J=8,4 Гц, 1H), 8,12 (д, J=7,4 Гц, 1H), 7,31 (д, J=8,4 Гц, 1H), 5,00 (с, 1H), 4,20-4,01 (м, 2H), 3,98 (д, J=14,5 Гц, 1H), 3,82 (дд, J=29,6, 12,7 Гц, 1H), 3,52 (д, J=11,8 Гц, 1H), 2,97-2,75 (м, 2H), 2,33 (д, J=24,5 Гц, 4H), 2,11 (д, J=4,5 Гц, 3H), 2,01 (с, 3H). МС: m/z=412 [M+H]+.
Пример 129: Синтез соединения 503 (N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-(4-метил-пиперазин-1-ил)-ацетамид)
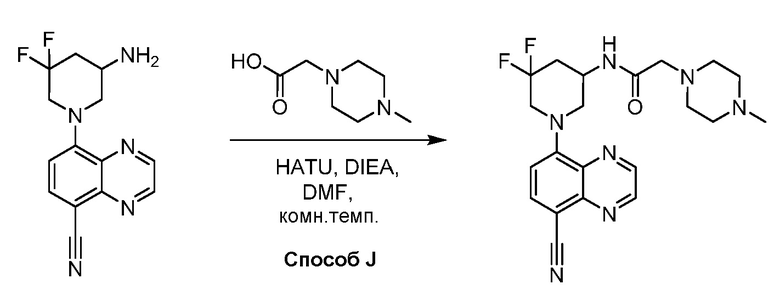
N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-(4-метил-пиперазин-1-ил)-ацетамид: N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-(4-метил-пиперазин-1-ил)-ацетамид получали из (4-метил-пиперазин-1-ил)-уксусной кислоты и 8-(5-амино-3,3-дифтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил гидрохлорида с использованием Способа J.
Соединение 503: 1H ЯМР (400 МГц, DMSO-d6) δ 9,11 (д, J=1,8 Гц, 1H), 9,01 (д, J=1,8 Гц, 1H), 8,30 (д, J=8,4 Гц, 1H), 8,21 (д, J=7,6 Гц, 1H), 7,41 (д, J=8,4 Гц, 1H), 4,32-4,11 (м, 2H), 3,98 (с, 1H), 3,87-3,62 (м, 2H), 2,39 (д, J=13,8 Гц, 5H), 2,14 (с, 3H), 2,02 (с, 3H). МС: m/z=430 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 504 (N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-(1-метил-пиперидин-4-ил)-ацетамид (рацемический)): из (1-метил-пиперидин-4-ил)-уксусной кислоты и 8-(5-амино-3,3-дифтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил гидрохлорида. 1H ЯМР (400 МГц, DMSO-d6) δ 9,09 (д, J=1,8 Гц, 1H), 8,99 (д, J=1,8 Гц, 1H), 8,30 (д, J=8,4 Гц, 1H), 8,12 (д, J=6,9 Гц, 1H), 7,45 (д, J=8,4 Гц, 1H), 4,80 (с, 1H), 4,20 (с, 1H), 4,07 (д, J=13,4 Гц, 1H), 3,79 (дд, J=29,1, 13,5 Гц, 2H), 3,16 (дд, J=13,0, 10,2 Гц, 2H), 2,71 (д, J=11,4 Гц, 2H), 2,41 (м, 2H), 2,13 (с, 3H), 2,06 (д, J=6,8 Гц, 1H), 1,82 (т, J=11,2 Гц, 2H), 1,60 (д, J=12,9 Гц, 2H), 1,18 (кв., J=11,9, 11,3 Гц, 2H). МС: m/z=429 [M+H]+.
Соединение 506 (2-хлор-N-[1-(8-циано-хиноксалин-5-ил)-5, 5-дифтор-пиперидин-3-ил]-пропионамид): из 2-хлор-пропионовой кислоты и 8-(5-амино-3,3-дифтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил гидрохлорида. 1H ЯМР (400 МГц, DMSO-d6) δ 9,10 (д, J=1,8 Гц, 1H), 9,00 (д, J=1,8 Гц, 1H), 8,56 (д, J=6,9 Гц, 1H), 8,31 (д, J=8,3 Гц, 1H), 7,44 (дд, J=8,4, 3,6 Гц, 1H), 4,75-4,45 (м, 2H), 4,21 (с, 1H), 3,97 (т, J=11,3 Гц, 1H), 3,82 (дд, J=25,6, 13,4 Гц, 1H), 3,41-3,32 (м, 1H), 2,44 (д, J=13,2 Гц, 1H), 2,26 (с, 1H), 1,59 (дд, J=6,8, 2,4 Гц, 3H). МС: m/z=380 [M+H]+.
Пример 130: Синтез соединения 505 (3-амино-N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-3-метил-бутирамид гидрохлорид)
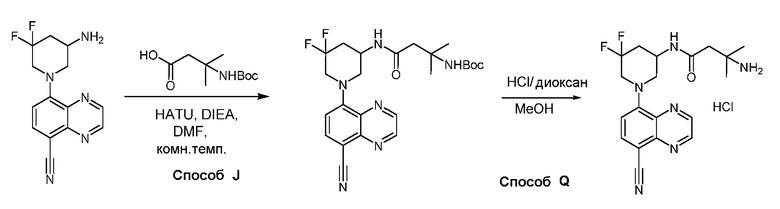
3-амино-N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-3-метил-бутирамид гидрохлорид: 3-амино-N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-3-метил-бутирамид гидрохлорид получали из 3-трет-бутоксикарбониламино-3-метил-масляной кислоты и 8-(5-амино-3,3-дифтор-пиперидин-1-ил)-хиноксалин-5-карбонитрил гидрохлорида с использованием Способа J и Q.
Соединение 505: 1H ЯМР (400 МГц, DMSO-d6) δ 9,10 (д, J=1,8 Гц, 1H), 9,01 (д, J=1,8 Гц, 1H), 8,64 (д, J=7,0 Гц, 1H), 8,29 (д, J=8,4 Гц, 1H), 8,00 (с, 2H), 7,42 (д, J=8,5 Гц, 1H), 4,72 (с, 1H), 4,26 (с, 1H), 4,11 (д, J=12,9 Гц, 1H), 3,81 (дд, J=28,3, 13,6 Гц, 2H), 3,25 (дд, J=12,9, 10,0 Гц, 2H), 2,50 (с, 2H), 2,19 (дтд, J=30,2, 12,3, 6,4 Гц, 1H), 1,31 (с, 6H). МС: m/z=389 [M+H]+.
Пример 131: Синтез соединения 507 и соединения 508 (2-азетидин-1-ил-N-[(R)-1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-пропионамид и 2-азетидин-1-ил-N-[(R)-1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-пропионамид)
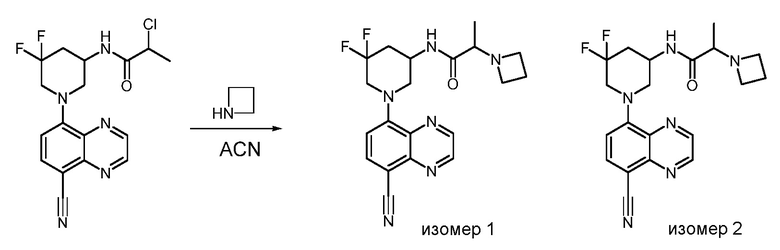
Цис-2-азетидин-1-ил-N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-пропионамид и транс-2-азетидин-1-ил-N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-пропионамид: Смесь 2-хлор-N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-пропионамида (30 мг; 0,08 ммоль) и азетидина (45 мг; 0,79 ммоль) в ацетонеитриле перемешивали при 100°C в течение 2 часов. Реакционную смесь очищали обращенно-фазовой хроматографией (колонка XBridge), элюируя ацетонитрилом в воде (0,1%NH3.H2O), с получением цис-2-азетидин-1-ил-N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-пропионамида и транс-2-азетидин-1-ил-N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-пропионамида.
Изомер 1: 1H ЯМР (400 МГц, DMSO-d6) δ 9,12 (д, J=1,8 Гц, 1H), 9,02 (д, J=1,8 Гц, 1H), 8,31 (д, J=8,3 Гц, 1H), 7,96 (д, J=7,5 Гц, 1H), 7,42 (д, J=8,4 Гц, 1H), 4,50-4,32 (м, 1H), 4,21 (с, 1H), 3,89-3,68 (м, 2H), 3,62 (дд, J=12,9, 7,7 Гц, 1H), 3,21 (кв., J=6,8 Гц, 2H), 3,09 (кв., J=6,8 Гц, 2H), 2,79 (кв., J=6,8 Гц, 1H), 2,33 (с, 2H), 1,96 (п, J=6,9 Гц, 2H), 1,02 (д, J=6,8 Гц, 3H). МС: m/z=401 [M+H]+.
Изомер 2: 1H ЯМР (400 МГц, DMSO-d6) δ 9,13 (д, J=1,8 Гц, 1H), 9,04 (д, J=1,8 Гц, 1H), 8,31 (дд, J=7,7, 4,0 Гц, 2H), 7,42 (д, J=8,3 Гц, 1H), 4,31 (тд, J=15,0, 14,5, 6,6 Гц, 1H), 4,19 (д, J=7,2 Гц, 1H), 3,81 (с, 1H), 3,65 (д, J=5,0 Гц, 1H), 3,28-3,19 (м, 1H), 3,18 (кв., J=6,9 Гц, 2H), 3,09 (кв., J=6,8 Гц, 2H), 2,77 (кв., J=6,8 Гц, 1H), 2,39-2,16 (м, 2H), 1,83 (п, J=6,9 Гц, 2H), 1,07 (д, J=6,8 Гц, 3H). МС: m/z =401 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 509 (N-[1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-ил]-2-морфолин-4-ил-пропионамид): из 2-хлор-N-[1-(8-циано-хиноксалин-5-ил)-5, 5-дифтор-пиперидин-3-ил]-пропионамида и морфина. 1H ЯМР (400 МГц, DMSO-d6) δ 9,11 (т, J=1,9 Гц, 1H), 9,01 (дд, J=8,7, 1,8 Гц, 1H), 8,37-8,16 (м, 2H), 7,43 (дд, J=8,4, 3,9 Гц, 1H), 4,44-4,14 (м, 2H), 4,01-3,85 (м, 1H), 3,82-3,71 (м, 1H), 3,65 (дт, J=13,2, 6,8 Гц, 1H), 3,46 (кв., J=4,3 Гц, 4H), 2,97 (кв., J=6,9 Гц, 1H), 2,51-2,23 (м, 6H), 1,14 (дд, J=10,9, 7,0 Гц, 3H). МС: m/z=431 [M+H]+.
Пример 132: Синтез соединения 518 (1-циклопропил-3-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-мочевина)
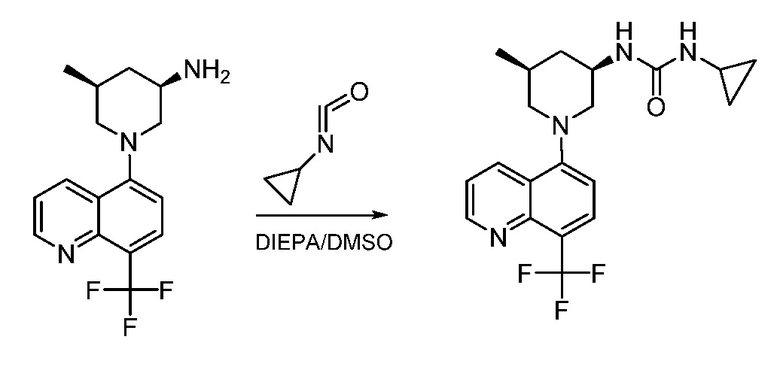
1-Циклопропил-3-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-мочевина: Смесь (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида (60 мг; 0,17 ммоль), этил-диизопропил-амина (0,04 мл; 0,21 ммоль) и изоцианатоциклопропана (28 мг; 0,35 ммоль) в DMSO (1 мл) перемешивали при комнатной температуре в течение ночи. Смесь очищали обращенно-фазовой хроматографией (колонка XBridge), элюируя ацетонитрилом в воде (0,1%NH3.H2O), с получением 1-циклопропил-3-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-мочевины в виде белого твердого вещества.
Соединение 518: 1H ЯМР (400 МГц, DMSO-d6) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,54 (дд, J=8,6, 1,8 Гц, 1H), 8,05 (д, J=8,1 Гц, 1H), 7,67 (дд, J=8,6, 4,2 Гц, 1H), 7,21 (д, J=8,1 Гц, 1H), 6,09 (д, J=2,7 Гц, 1H), 5,80 (д, J=7,5 Гц, 1H), 3,56 (д, J=8,9 Гц, 1H), 2,48-2,35 (м, 3H), 2,14-1,82 (м, 2H), 1,06 (кв., J=11,9 Гц, 1H), 0,95 (д, J=6,4 Гц, 3H), 0,56 (дд, J=7,0, 2,1 Гц, 2H), 0,32 (дд, J=3,7, 2,3 Гц, 2H). МС: m/z=293 [M+H]+.
Пример 133: Синтез соединения 525 (8-((3R,5S)-3-амино-5-метил-пиперидин-1-ил)-3-метил-хиноксалин-5-карбонитрил)
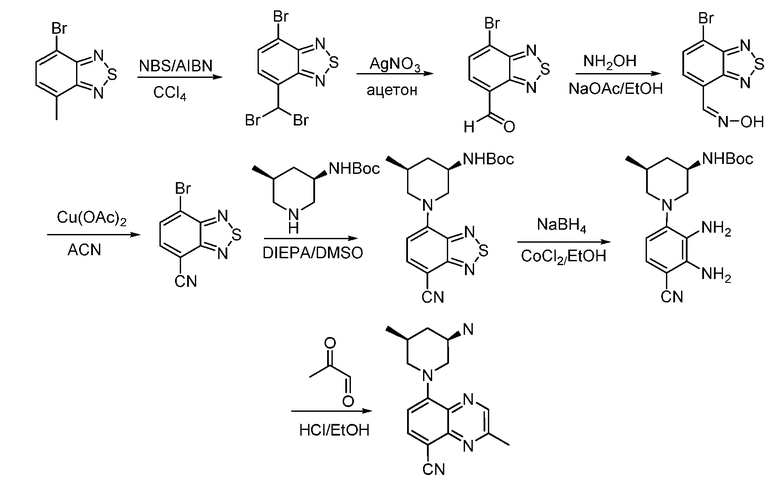
4-бром-7-дибромметил-бензо[1,2,5]тиадиазол: Смесь 4-бром-7-метил-бензо[1,2,5]тиадиазола (5,00 г; 21,8 ммоль), N-бромсукцинимида (8,24 г; 45,8 ммоль) и 2,2'-азобис(2-метилпропионитрил) (0,54 г; 3,27 ммоль) в тетрахлоруглероде (150 мл) перемешивали при 80°C в течение ночи. Суспензию фильтровали, фильтрат разбавляли этилацетатом и промывали насыщенным солевым раствором. Органическую фазу сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением 4-бром-7-дибромметил-бензо[1,2,5]тиадиазола (8,36 г количественный выход) в виде желтого твердого вещества. МС: m/z=386 [M+H]+.
7-бром-бензо[1,2,5]тиадиазол-4-карбальдегид: Раствор 4-бром-7-дибромметил-бензо[1,2,5]тиадиазола (8,36 г; 21,61 ммоль) и нитрата серебра (9,18 г; 54,02 ммоль) в ацетоне (100 мл) и воде (20 мл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, полученное твердое вещество промывали водой и сушили с получением 7-бром-бензо[1,2,5]тиадиазол-4-карбальдегида. МС: m/z=242 [M+H]+.
7-бром-бензо[1,2,5]тиадиазол-4-карбальдегид оксим: Смесь 7-бром-бензо[1,2,5]тиадиазол-4-карбальдегида (5,25 г; 21,6 ммоль) и ацетата натрия (1,95 г; 23,77 ммоль) в этаноле (200 мл) и растворе хлорида аммония (1,58. мг; 22,7 ммоль) перемешивали при 70°C в течение 1 часа. Реакционную смесь охлаждали, фильтровали и твердое вещество промывали этанолом. Фильтрат концентрировали при пониженном давлении с получением 7-бром-бензо[1,2,5]тиадиазол-4-карбальдегид оксима (4,30 г, 78%) в виде желтого твердого вещества. МС: m/z=257 [M+H]+.
7-бром-бензо[1,2,5]тиадиазол-4-карбонитрил: Смесь 7-бром-бензо[1,2,5]тиадиазол-4-карбальдегид оксима (4,30 г; 16,7 ммоль), ацетата меди(II) (302 мг; 1,67 ммоль) и уксусной кислоты (2,00 мл; 35,0 ммоль) в ацетонеитриле (20 мл) кипятили с обратным холодильником в течение уикенда. Реакционную смесь охлаждали, добавляли воду (20 мл) и медленно добавляли раствор 2M гидроксида натрия (17,5 мл). Смесь концентрировали до 1/3 при пониженном давлении, разбавляли водой (20 мл) и фильтровали. Твердое вещество промывали водой и сушили с получением 7-бром-бензо[1,2,5]тиадиазол-4-карбонитрила (3,0 г, 75%) в виде светло-зеленого твердого вещества. МС: m/z=239 [M+H]+.
трет-Бутиловый эфир [(3R,5S)-1-(7-циано-бензо[1,2,5]тиадиазол-4-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты: Смесь 7-бром-бензо[1,2,5]тиадиазол-4-карбонитрила (1,80 г; 7,50 ммоль), трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамата (1,80 г; 8,25 ммоль) и этил-диизопропил-амина (1,61 мл; 9,00 ммоль) в DMSO (2 мл) нагревали в условиях микроволнового облучения при 120°C в течение 60 минут. Реакционную смесь разбавляли метанолом (10 мл). Происходило осаждение коричневого твердого вещества, и его фильтровали с получением трет-бутилового эфира [(3R,5S)-1-(7-циано-бензо[1,2,5]тиадиазол-4-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты (2,16 мг, 77%). МС: m/z=374 [M+H]+.
трет-Бутиловый эфир [(3R,5S)-1-(2,3-диамино-4-циано-фенил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты: Смесь трет-бутилового эфира [(3R,5S)-1-(7-циано-бензо[1,2,5]тиадиазол-4-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты (2,16 г; 5,78 ммоль) и борогидрида натрия (0,24 г; 6,36 ммоль) в этаноле (130мл) кипятили с обратным холодильником в течение 2 дней. Добавляли дополнительное количество борогидрида натрия в ходе реакции вплоть до ее завершения. Реакционную смесь охлаждали и фильтровали. Фильтрат концентрировали при пониженном давлении, разбавляли простым эфиром и промывали насыщенным солевым раствором. Органическую фазу сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением трет-бутилового эфира [(3R,5S)-1-(2,3-диамино-4-циано-фенил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты (1,6 г, 80%) в виде коричневого твердого вещества. МС: m/z=346 [M+H]+.
8-((3R,5S)-3-амино-5-метил-пиперидин-1-ил)-3-метил-хиноксалин-5-карбонитрил: К раствор утрет-бутилового эфира [(3R,5S)-1-(2,3-диамино-4-циано-фенил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты (70,0 мг; 0,20 ммоль) в этаноле (2 мл) добавляли хлористый водород (0,10 мл; 0,41 ммоль) и 2-оксо-пропиональдегид (0,03 мл; 0,20 ммоль). Смесь перемешивали при 70°C в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали обращенно-фазовой хроматографией (колонка XBridge), элюируя ацетонитрилом в воде (0,1%NH3.H2O), с получением 8-((3R,5S)-3-амино-5-метил-пиперидин-1-ил)-3-метил-хиноксалин-5-карбонитрила в виде белого твердого вещества.
Соединение 525: 1H ЯМР (400 МГц, DMSO-d6) δ 8,83 (с, 1H), 8,08 (дд, J=9,7, 8,4 Гц, 1H), 7,13 (т, J=8,7 Гц, 1H), 4,21 (с, 2H), 3,01-2,79 (м, 1H), 2,73 (д, J=2,8 Гц, 3H), 2,57 (дт, J=11,3, 5,5 Гц, 1H), 2,02-1,47 (м, 4H), 0,99-0,75 (м, 3H). МС: m/z=282 [M+H]+.
Пример 134: Синтез соединения 529 ((1-метил-пиперидин-4-ил)-амид 1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты)
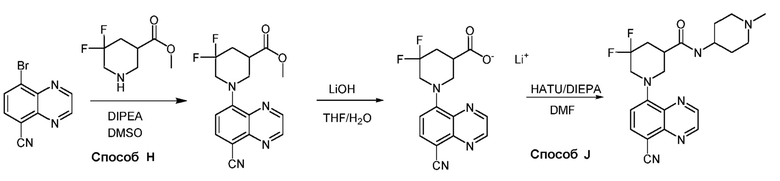
Метиловый эфир 1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты: метиловый эфир 1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты получали из 8-бром-хиноксалин-5-карбонитрила и метилового эфира 5,5-дифтор-пиперидин-3-карбоновой кислоты гидрохлорида с использованием Способа H. 1H ЯМР (400 МГц, DMSO-d6) δ 9,09 (д, J=1,8 Гц, 1H), 9,01 (д, J=1,8 Гц, 1H), 8,27 (д, J=8,4 Гц, 1H), 7,36 (д, J=8,4 Гц, 1H), 4,39 (д, J=12,5 Гц, 1H), 3,83-3,72 (м, 1H), 3,69 (с, 3H), 3,49-3,33 (м, 1H), 3,20 (с, 1H), 2,31 (дтд, J=31,9, 12,8, 6,4 Гц, 1H). МС: m/z=333 [M+H]+.
Литиевая соль 1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты: Смесь метилового эфира 1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты (25 мг; 0,08 ммоль) и гидроксида лития (7 мг; 0,30 ммоль) в THF (1,0 мл) и воде (1,0 мл) перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и полученное твердое вещество сушили с получением литиевой соли 1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты в виде желтого твердого вещества. МС: m/z=319 [M+H]+.
(1-Метил-пиперидин-4-ил)-амид 1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты: (1-метил-пиперидин-4-ил)-амид 1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты получали из литиевой соли 1-(8-циано-хиноксалин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты и 4-амино-1-метилпиперидина в виде белого твердого вещества с использованием Способа J.
Соединение 529: 1H ЯМР (400 МГц, DMSO-d6) δ 9,08 (д, J=1,8 Гц, 1H), 8,99 (д, J=1,8 Гц, 1H), 8,26 (д, J=8,4 Гц, 1H), 8,12 (д, J=7,6 Гц, 1H), 7,38 (д, J=8,5 Гц, 1H), 4,73 (с, 2H), 4,16 (д, J=13,3 Гц, 1H), 3,77-3,40 (м, 4H), 3,01 (с, 2H), 2,71 (с, 2H), 2,33 (с, 1H), 2,15 (с, 3H), 1,93 (т, J=11,1 Гц, 2H), 1,73 (д, J=12,3 Гц, 2H), 1,53-1,32 (м, 2H). МС: m/z=415 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 530 ((1-метил-пиперидин-4-ил)-амид 1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, метилового эфира 5,5-дифтор-пиперидин-3-карбоновой кислоты гидрохлорида и 4-амино-1-метилпиперидина. 1H ЯМР (400 МГц, DMSO-d6) δ 9,08 (дд, J=4,2, 1,6 Гц, 1H), 8,56 (дд, J=8,6, 1,7 Гц, 1H), 8,28 (д, J=8,0 Гц, 1H), 8,04 (д, J=7,6 Гц, 1H), 7,75 (дд, J=8,6, 4,2 Гц, 1H), 7,36 (д, J=8,1 Гц, 1H), 3,67 (с, 1H), 3,55-3,34 (м, 3H), 3,18-2,93 (м, 2H), 2,77-2,58 (м, 2H), 2,37 (д, J=12,3 Гц, 1H), 2,30 (с, 1H), 2,13 (с, 3H), 1,92 (тдд, J=10,9, 5,3, 2,2 Гц, 2H), 1,78-1,60 (м, 2H), 1,47-1,26 (м, 2H). МС: m/z=414 [M+H]+.
Соединение 531 ((1-метил-пиперидин-4-илметил)-амид 1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, метилового эфира 5,5-дифтор-пиперидин-3-карбоновой кислоты гидрохлорида и C-(1-метил-пиперидин-4-ил)-метиламина. 1H ЯМР (400 МГц, Метанол-d4) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,69 (дд, J=8,6, 1,7 Гц, 1H), 8,18 (д, J=8,0 Гц, 1H), 7,69 (дд, J=8,6, 4,3 Гц, 1H), 7,37 (д, J=8,0 Гц, 1H), 3,79-3,52 (м, 2H), 3,26-3,07 (м, 4H), 2,88 (д, J=11,8 Гц, 2H), 2,46 (с, 1H), 2,33 (дд, J=13,6, 6,1 Гц, 1H), 2,27 (с, 3H), 2,07-1,91 (м, 2H), 1,71 (дд, J=13,3, 3,2 Гц, 2H), 1,52 (дтд, J=14,3, 7,6, 6,5, 4,1 Гц, 1H), 1,29 (дкв., J=12,1, 3,9 Гц, 2H). МС: m/z=428 [M+H]+.
Соединение 532 ((1-этил-пиперидин-4-ил)-амид 1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты): из 5-бром-хинолин-8-карбонитрила, метилового эфира 5,5-дифтор-пиперидин-3-карбоновой кислоты гидрохлорида и 1-этил-пиперидин-4-иламина. 1H ЯМР (400 МГц, Метанол-d4) δ 9,02 (дд, J=4,3, 1,7 Гц, 1H), 8,69 (дд, J=8,6, 1,7 Гц, 1H), 8,18 (д, J=8,0 Гц, 1H), 7,69 (дд, J=8,6, 4,3 Гц, 1H), 7,38 (д, J=8,0 Гц, 1H), 3,77-3,64 (м, 2H), 3,60 (д, J=10,2 Гц, 1H), 3,26-3,09 (м, 3H), 2,98 (д, J=25,7 Гц, 3H), 2,45 (кв., J=7,2 Гц, 3H), 2,39-2,17 (м, 1H), 2,10 (дп, J=7,0, 3,5, 3,0 Гц, 2H), 1,90 (т, J=13,7 Гц, 2H), 1,57 (дд, J=12,4, 8,9 Гц, 2H), 1,12 (т, J=7,2 Гц, 3H). МС: m/z=428 [M+H]+.
Соединение 537 и соединение 538 ([2-(4-метил-пиперазин-1-ил)-этил]-амид цис-1-(8-циано-хиноксалин-5-ил)-5-метил-пиперидин-3-карбоновой кислоты и [2-(4-метил-пиперазин-1-ил)-этил]-амид транс-1-(8-циано-хиноксалин-5-ил)-5-метил-пиперидин-3-карбоновой кислоты): из 8-бром-хиноксалин-5-карбонитрила, метилового эфира 5-метил-пиперидин-3-карбоновой кислоты гидрохлорида и 2-(1-метил-пиперидин-4-ил)-этиламина. Изомер 1: 1H ЯМР (400 МГц, Метанол-d4) δ 8,92 (дд, J=19,8, 1,8 Гц, 2H), 8,10 (д, J=8,4 Гц, 1H), 7,24 (д, J=8,4 Гц, 1H), 4,41 (ддт, J=12,3, 3,6, 1,7 Гц, 1H), 4,17 (ддд, J=10,4, 4,5, 2,5 Гц, 1H), 3,37 (д, J=6,8 Гц, 2H), 3,09 (дд, J=12,3, 11,3 Гц, 1H), 2,90-2,75 (м, 1H), 2,67 (дд, J=12,5, 10,9 Гц, 2H), 2,54 (кв., J=10,2, 6,8 Гц, 8H), 2,29 (с, 3H), 2,13-1,98 (м, 2H), 1,45 (кв., J=13,1, 12,7 Гц, 1H), 1,03 (д, J=6,4 Гц, 3H). МС: m/z=422 [M+H]+. Изомер 2: 1H ЯМР (400 МГц, Метанол-d4) δ 9,03 (дд, J=24,4, 1,8 Гц, 2H), 8,22 (д, J=8,3 Гц, 1H), 7,40 (д, J=8,3 Гц, 1H), 4,60-4,48 (м, 1H), 3,67-3,46 (м, 2H), 3,46-3,34 (м, 3H), 3,14 (дд, J=13,2, 3,3 Гц, 1H), 2,96-2,83 (м, 1H), 2,75 (с, 1H), 2,49 (тд, J=6,5, 1,3 Гц, 3H), 2,43-2,27 (м, 4H), 2,10 (с, 5H), 1,50 (ддд, J=13,2, 11,3, 5,1 Гц, 1H), 1,06 (дд, J=10,1, 6,7 Гц, 3H).
Соединение 539 ((1-метил-пиперидин-4-илметил)-амид 1-(8-циано-хиноксалин-5-ил)-5-метил-пиперидин-3-карбоновой кислоты): из 8-бром-хиноксалин-5-карбонитрила, метилового эфира 5-метил-пиперидин-3-карбоновой кислоты гидрохлорида и C-(1-метил-пиперидин-4-ил)-метиламина. 1H ЯМР (400 МГц, Метанол-d4) δ 9,06 (д, J=1,8 Гц, 1H), 8,98 (д, J=1,9 Гц, 1H), 8,20 (д, J=8,3 Гц, 1H), 7,39 (д, J=8,3 Гц, 1H), 4,39 (дд, J=13,3, 3,5 Гц, 1H), 3,62-3,38 (м, 2H), 3,17-3,05 (м, 2H), 2,97-2,85 (м, 2H), 2,85-2,71 (м, 2H), 2,24(с, 3H). 2,14-1,84 (м, 4H), 1,71 (т, J=16,2 Гц, 2H), 1,56-1,43 (м, 2H), 1,37-1,18 (м, 2H), 1,08 (д, J=6,6 Гц, 3H). МС: m/z=407 [M+H]+.
Соединение 540 ((1-этил-пиперидин-4-ил)-амид 1-(8-циано-хиноксалин-5-ил)-5-метил-пиперидин-3-карбоновой кислоты): из 8-бром-хиноксалин-5-карбонитрила, метилового эфира 5-метил-пиперидин-3-карбоновой кислоты гидрохлорида и 1-этил-пиперидин-4-иламина. 1H ЯМР (400 МГц, Метанол-d4) δ 9,07 (с, 2H), 8,20 (д, J=8,3 Гц, 1H), 7,39 (д, J=8,4 Гц, 1H), 4,45 (д, J=12,4 Гц, 1H), 3,85 (ддд, J=15,5, 11,4, 4,3 Гц, 1H), 3,59-3,46 (м, 1H), 3,13 (дд, J=13,1, 3,2 Гц, 1H), 3,01 (д, J=10,2 Гц, 1H), 2,91 (дд, J=11,4, 9,8 Гц, 2H), 2,75 (т, J=4,3 Гц, 1H), 2,44 (кв., J=7,2 Гц, 2H), 2,18-1,91 (м, 4H), 1,82 (д, J=13,0 Гц, 1H), 1,65 (дкв., J=12,0, 3,9 Гц, 1H), 1,57-1,39 (м, 2H), 1,18-1,00 (м, 5H). МС: m/z=407 [M+H]+.
Соединение 541 и соединение 542 (метиламид цис-1-(8-циано-хиноксалин-5-ил)-5-метил-пиперидин-3-карбоновой кислоты и метиламид транс-1-(8-циано-хиноксалин-5-ил)-5-метил-пиперидин-3-карбоновой кислоты): из 8-бром-хиноксалин-5-карбонитрила, метилового эфира 5-метил-пиперидин-3-карбоновой кислоты гидрохлорида и метиламингидрохлорида. Изомер 1: 1H ЯМР (400 МГц, DMSO-d6) δ 9,03 (д, J=1,8 Гц, 1H), 8,96 (д, J=1,8 Гц, 1H), 8,18 (д, J=8,4 Гц, 1H), 7,84 (д, J=5,1 Гц, 1H), 7,24 (д, J=8,5 Гц, 1H), 4,34 (д, J=12,8 Гц, 1H), 4,18 (д, J=12,2 Гц, 1H), 3,05 (т, J=12,0 Гц, 1H), 2,76-2,63 (м, 2H), 2,58 (д, J=4,6 Гц, 3H), 1,91 (т, J=15,5 Гц, 2H), 1,35 (кв., J=12,1 Гц, 1H), 1,04-0,86 (м, 3H). МС: m/z=310 [M+H]+. Изомер 2: 1H ЯМР (400 МГц, DMSO-d6) δ 9,12-9,03 (м, 1H), 8,99 (д, J=1,8 Гц, 1H), 8,43 (д, J=5,2 Гц, 1H), 8,23 (д, J=8,4 Гц, 1H), 7,27 (д, J=8,4 Гц, 1H), 3,92 (дд, J=12,9, 6,4 Гц, 1H), 3,48 (ддд, J=20,3, 12,5, 3,6 Гц, 2H), 2,82-2,68 (м, 1H), 2,64 (д, J=4,4 Гц, 3H), 2,20-1,91 (м, 2H), 1,48 (ддд, J=12,5, 7,7, 4,7 Гц, 1H), 1,00 (д, J=6,7 Гц, 3H). МС: m/z=310 [M+H]+.
Соединение 543 и соединение 544 (цис-1-(8-цианохиноксалин-5-ил)-5-метил-N-(1-метил-3-пиперидил)пиперидин-3-карбоксамид и транс-1-(8-цианохиноксалин-5-ил)-5-метил-N-(1-метил-3-пиперидил)пиперидин-3-карбоксамид): из 8-бром-хиноксалин-5-карбонитрила, метилового эфира 5-метил-пиперидин-3-карбоновой кислоты гидрохлорида и 1-метил-пиперидин-3-иламина. Изомер 1: 1H ЯМР (400 МГц, DMSO-d6) δ 9,04 (дд, J=1,8, 0,7 Гц, 1H), 8,95 (т, J=1,8 Гц, 1H), 8,18 (дд, J=8,5, 1,3 Гц, 1H), 7,74 (д, J=8,0 Гц, 1H), 7,24 (д, J=8,5 Гц, 2H), 4,30 (с, 1H), 4,19 (д, J=12,3 Гц, 1H), 3,69 (с, 1H), 3,07 (т, J=12,0 Гц, 1H), 2,75-2,59 (м, 3H), 2,55 (с, 2H), 2,14 (д, J=1,5 Гц, 2H), 1,89 (с, 3H), 1,64 (с, 3H), 1,43 (д, J=31,3 Гц, 1H), 1,13 (д, J=11,1 Гц, 2H), 0,94 (д, J=6,0 Гц, 3H). МС: m/z=393 [M+H]+. Изомер 2: 1H ЯМР (400 МГц, DMSO-d6) δ 9,08 (д, J=1,8 Гц, 1H), 8,97 (д, J=1,8 Гц, 1H), 8,22 (д, J=8,4 Гц, 1H), 8,08 (д, J=8,0 Гц, 1H), 7,26 (д, J=8,5 Гц, 1H), 4,11-3,99 (м, 1H), 3,71 (д, J=9,5 Гц, 2H), 3,57-3,44 (м, 2H), 2,73 (с, 2H), 2,60 (с, 1H), 2,08 (с, 4H), 1,93-1,62 (м, 3H), 1,45 (д, J=47,0 Гц, 4H), 1,01 (д, J=6,6 Гц, 3H). МС: m/z=393 [M+H]+.
Соединение 547 и соединение 548 ((1-метил-пиперидин-4-илметил)-амид цис-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-карбоновой кислоты и (1-метил-пиперидин-4-илметил)-амид транс-5-метил-1(8-трифторметил-хинолин-5-ил)-пиперидин-3-карбоновой кислоты): из 5-бром-8-трифторметил-хинолина, метилового эфира 5,5-дифтор-пиперидин-3-карбоновой кислоты гидрохлорида и C-(1-метил-пиперидин-4-ил)-метиламина. Изомер 1:: 1H ЯМР (400 МГц, DMSO-d6) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,65 (дд, J=8,6, 1,8 Гц, 1H), 8,07 (д, J=8,1 Гц, 1H), 7,85 (т, J=5,9 Гц, 1H), 7,66 (дд, J=8,5, 4,2 Гц, 1H), 7,22 (д, J=8,0 Гц, 1H), 3,21-3,05 (м, 2H), 2,98 (гепт., J=6,4 Гц, 2H), 2,79 (с, 2H), 2,66-2,56 (м, 2H), 2,26 (с, 1H), 2,05-1,96 (м, 1H), 1,64 (дт, J=22,8, 11,5 Гц, 2H), 1,51 (т, J=13,0 Гц, 1H), 1,29 (дт, J=7,7, 4,1 Гц, 1H), 1,12 (д, J=6,9 Гц, 1H), 1,10-0,98 (м, 1H). Изомер 2: 1H ЯМР (400 МГц, DMSO-d6) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,52 (дд, J=8,6, 1,8 Гц, 1H), 8,06 (д, J=8,1 Гц, 1H), 7,90 (т, J=5,8 Гц, 1H), 7,66 (дд, J=8,6, 4,1 Гц, 1H), 7,24 (д, J=8,0 Гц, 1H), 3,45-3,32 (м, 2H), 3,06-2,86 (м, 2H), 2,82 (т, J=11,7 Гц, 2H), 2,71 (д, J=11,3 Гц, 2H), 2,41 (т, J=11,3 Гц, 1H), 2,12 (с, 3H), 1,99 (т, J=14,9 Гц, 2H), 1,76 (тд, J=11,6, 2,5 Гц, 2H), 1,57 (д, J=12,9 Гц, 2H), 1,30 (дд, J=16,6, 8,1 Гц, 2H), 1,12 (тт, J=13,0, 6,5 Гц, 2H), 0,95 (дд, J=6,5, 3,9 Гц, 3H). МС: m/z=449 [M+H]+.
Соединение 549 (4-метил-пиперазин-1-ил)-[5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-метанон): из 5-бром-8-трифторметил-хинолина, метилового эфира 5-метил-пиперидин-3-карбоновой кислоты гидрохлорида и 1-метил-пиперазина. 1H ЯМР (400 МГц, DMSO-d6) δ 9,02 (дд, J=4,2, 1,7 Гц, 1H), 8,62 (ддд, J=48,2, 8,6, 1,8 Гц, 1H), 8,07 (д, J=8,1 Гц, 1H), 7,67 (ддд, J=8,6, 4,1, 1,7 Гц, 1H), 7,23 (д, J=8,0 Гц, 1H), 3,68-3,40 (м, 4H), 3,12-3,01 (м, 1H), 2,85 (т, J=11,3 Гц, 1H), 2,44 (т, J=11,5 Гц, 1H), 2,32 (д, J=5,3 Гц, 4H), 2,18 (д, J=1,7 Гц, 3H), 2,10 (с, 1H), 1,93 (д, J=13,3 Гц, 1H), 1,56 (д, J=13,5 Гц, 1H), 1,23 (д, J=7,2 Гц, 2H), 0,95 (д, J=6,6 Гц, 3H). МС: m/z=421 [M+H]+.
Пример 135: Синтез соединения 533 и соединения 534 (цис-5-[3-метил-5-(4-метил-пиперазин-1-илметил)-пиперидин-1-ил]-8-трифторметил-хинолин и транс-5-[3-метил-5-(4-метил-пиперазин-1-илметил)-пиперидин-1-ил]-8-трифторметил-хинолин)
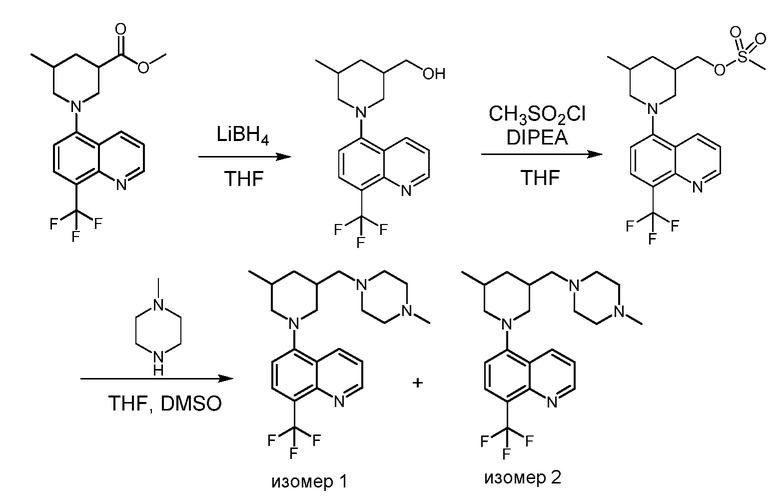
[5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-метанол: К раствору метилового эфира 5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-карбоновой кислоты (200 мг; 0,57 ммоль) в безводном THF (2 мл) добавляли 2N раствор борогидрида натрия (1,14 мл; 2,27 ммоль) в THF и реакционную смесь перемешивали при комнатной температуре в течение 48 часов. Добавляли 10% раствор лимонной кислоты (3 мл), полученную смесь доводили до pH > 8 и экстрагировали дихлорметаном. Объединенную органическую фазу промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением [5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-метанола в виде светло-желтого твердого вещества. 1H ЯМР (400 МГц, Хлороформ-d) δ 9,06 (дд, J=4,2, 1,8 Гц, 1H), 8,50 (дд, J=8,6, 1,8 Гц, 1H), 7,99 (ддд, J=8,0, 4,1, 0,9 Гц, 1H), 7,49 (ддд, J=8,5, 4,2, 1,0 Гц, 1H), 7,11 (т, J=7,4 Гц, 1H), 4,07-3,80 (м, 1H), 3,73-3,61 (м, 1H), 3,58 (ддд, J=8,4, 7,2, 3,2 Гц, 1H), 3,39 (ддт, J=11,7, 3,9, 1,8 Гц, 1H), 3,28-3,05 (м, 1H), 2,27-2,16 (м, 1H), 2,16-2,05 (м, 1H), 2,06-1,93 (м, 1H), 1,38 (с, 1H), 1,11 (д, J=6,7 Гц, 1H), 1,01 (д, J=6,6 Гц, 2H), 0,88 (кв., J=12,2 Гц, 1H). МС: m/z=325 [M+H]+.
5-Метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-илметиловый эфир метансульфоновой кислоты: Смесь [5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-метанола (175 мг; 0,54 ммоль), метансульфонилхлорида (0,05 мл; 0,70 ммоль) и этил-диизопропиламина (0,15 мл; 0,81 ммоль) в THF (2 мл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь непосредственно использовали на следующей стадии без какой-либо дополнительной очистки. МС: m/z=403 [M+H]+.
Цис-5-[3-метил-5-(4-метил-пиперазин-1-илметил)-пиперидин-1-ил]-8-трифторметил-хинолин и транс-5-[3-метил-5-(4-метил-пиперазин-1-илметил)-пиперидин-1-ил]-8-трифторметил-хинолин: Смесь 5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-илметилового эфира метансульфоновой кислоты (100 мг; 0,25 ммоль) и 1-метил-пиперазина (0,31 мл; 2,48 ммоль) в THF (1 мл) и DMSO (1 мл) нагревали при 80°C в течение ночи. Реакционную смесь очищали обращенно-фазовой хроматографией (колонка XBridge), элюируя ацетонитрилом в воде (0,1%NH3.H2O), с получением цис-5-[3-метил-5-(4-метил-пиперазин-1-илметил)-пиперидин-1-ил]-8-трифторметил-хинолина и транс-5-[3-метил-5-(4-метил-пиперазин-1-илметил)-пиперидин-1-ил]-8-трифторметил-хинолина в виде смеси 2 энантиомеров.
Изомер 1: Изомер 1 1H ЯМР (400 МГц, DMSO-d6) δ 9,02 (дд, J=4,2, 1,6 Гц, 1H), 8,48 (дд, J=8,6, 1,8 Гц, 1H), 8,06 (д, J=8,0 Гц, 1H), 7,64 (дд, J=8,6, 4,1 Гц, 1H), 7,18 (д, J=8,1 Гц, 1H), 3,60-3,45 (м, 1H), 2,49-2,33 (м, 3H), 2,28 (кв., J=16,3, 13,4 Гц, 5H), 2,21-2,15 (м, 2H), 2,12 (с, 3H), 2,01 (д, J=12,3 Гц, 1H), 1,88 (д, J=12,8 Гц, 1H), 0,94 (дд, J=6,6, 1,9 Гц, 3H), 0,74 (кв., J=11,8, 11,3 Гц, 1H). МС: m/z=407 [M+H]+.
Изомер 2: 1H ЯМР (400 МГц, DMSO-d6) δ 9,02 (дд, J=4,1, 1,7 Гц, 1H), 8,73 (дд, J=8,6, 1,8 Гц, 1H), 8,05 (д, J=8,1 Гц, 1H), 7,63 (дд, J=8,6, 4,1 Гц, 1H), 7,20 (д, J=8,1 Гц, 1H), 3,18 (д, J=9,0 Гц, 1H), 2,95 (д, J=11,5 Гц, 1H), 2,73 (с, 2H), 2,42-2,17 (м, 6H), 2,15 (с, 3H), 1,60 (д, J=13,0 Гц, 1H), 1,40 (с, 1H), 1,04 (д, J=6,6 Гц, 3H). МС: m/z=407 [M+H]+.
Следующие соединения синтезировали аналогичным способом:
Соединение 535 и соединение 536 (цис-5-[3-метил-5-(4-морфолин-4-ил-пиперидин-1-илметил)-пиперидин-1-ил]-8-трифторметил-хинолин и транс-5-[3-метил-5-(4-морфолин-4-ил-пиперидин-1-илметил)-пиперидин-1-ил]-8-трифторметил-хинолин): из 5-бром-8-трифторметил-хинолина, метилового эфира 5-метил-пиперидин-3-карбоновой кислоты гидрохлорида и 4-пиперидин-4-ил-морфолина. Изомер 1: 1H ЯМР (400 МГц, Метанол-d4) δ 8,93 (дд, J=4,2, 1,7 Гц, 1H), 8,60 (дд, J=8,6, 1,8 Гц, 1H), 8,04 (д, J=8,1 Гц, 1H), 7,60 (дд, J=8,6, 4,2 Гц, 1H), 7,21 (д, J=8,0 Гц, 1H), 3,70 (т, J=4,7 Гц, 4H), 3,62 (д, J=11,5 Гц, 1H), 3,41 (д, J=11,5 Гц, 1H), 3,14 (д, J=11,7 Гц, 1H), 2,94 (д, J=11,7 Гц, 1H), 2,57 (т, J=4,7 Гц, 4H), 2,40 (дт, J=16,9, 11,1 Гц, 2H), 2,33-2,15 (м, 4H), 2,15-1,79 (м, 6H), 1,60-1,40 (м, 2H), 1,01 (д, J=6,6 Гц, 3H), 0,82 (кв., J=11,7 Гц, 1H). МС: m/z=477 [M+H]+. Изомер 2: 1H ЯМР (400 МГц, Метанол-d4) δ 8,93 (дд, J=4,2, 1,7 Гц, 1H), 8,79 (дд, J=8,6, 1,8 Гц, 1H), 8,03 (д, J=8,1 Гц, 1H), 7,61 (дд, J=8,6, 4,2 Гц, 1H), 7,23 (д, J=8,0 Гц, 1H), 3,79-3,63 (м, 3H), 3,26 (д, J=12,9 Гц, 1H), 3,10 (с, 2H), 2,96 (д, J=11,7 Гц, 1H), 2,75 (с, 2H), 2,58 (т, J=4,7 Гц, 3H), 2,41-2,11 (м, 4H), 2,07 (т, J=11,5 Гц, 1H), 1,92 (д, J=10,7 Гц, 2H), 1,72 (д, J=12,8 Гц, 1H), 1,60-1,40 (м, 3H), 1,11 (д, J=6,6 Гц, 3H). МС: m/z=477 [M+H]+.
Пример 136: Разделение соединения 545 и соединения 546 ((1-метил-пиперидин-4-илметил)-амид (R)-1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты и (1-метил-пиперидин-4-илметил)-амид (S)-1-(8-циано-хинолин-5-ил)-5,5-дифтор-пиперидин-3-карбоновой кислоты)
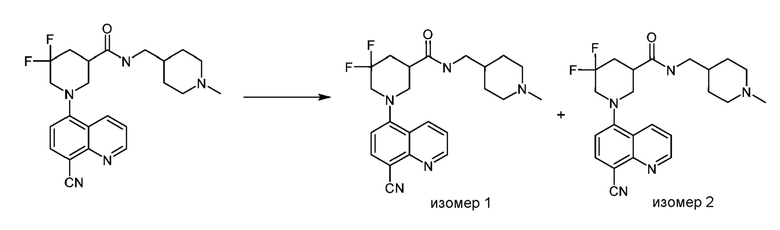
Указанные в заголовке соединения выделяли хиральной СКЖХ хроматографией соединения 531. (Колонка: CHIRALPAK 10×250 мм ADH; CO2 со-растворитель (Растворитель B): Метанол с 0,5% диметилэтиламина; Изократический метод: 45% со-растворителя при 5 мл/мин; Давление в системе: 100 бар; Температура колонки: 35°C).
Изомер 1: МС: m/z=428 [M+H]+.
Изомер 2: МС: m/z=428 [M+H]+.
Пример 137: Синтез соединения 552 (7-((3R,5S)-3-амино-5-метил-пиперидин-1-ил)-бензо[1,2,5]тиадиазол-4-карбонитрил гидрохлорид)
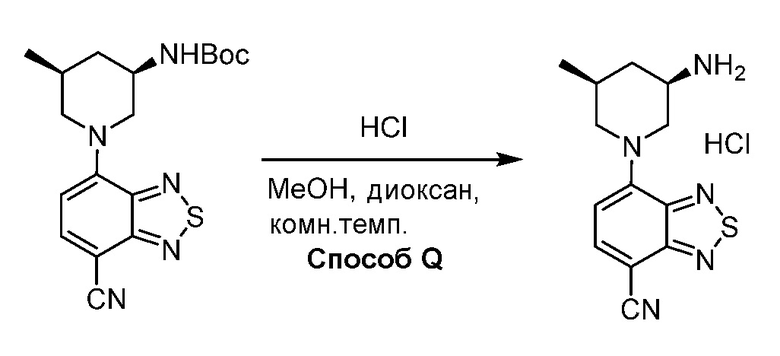
7-((3R,5S)-3-амино-5-метил-пиперидин-1-ил)-бензо[1,2,5]тиадиазол-4-карбонитрил гидрохлорид: 7-((3R,5S)-3-амино-5-метил-пиперидин-1-ил)-бензо[1,2,5]тиадиазол-4-карбонитрил гидрохлорид получали из трет-бутилового эфира [(3R,5S)-1-(7-циано-бензо[1,2,5]тиадиазол-4-ил)-5-метил-пиперидин-3-ил]-карбаминовой кислоты с использованием Способа Q.
Соединение 552: 1H ЯМР (400 МГц, DMSO-d6) δ 8,32 (с, 2H), 8,16 (дд, J=8,3, 1,2 Гц, 1H), 6,95 (д, J=8,3 Гц, 1H), 4,94 (д, J=12,1 Гц, 1H), 4,65 (д, J=11,9 Гц, 1H), 3,13 (кв., J=12,6, 11,8 Гц, 1H), 2,75 (т, J=12,3 Гц, 1H), 2,16 (д, J=12,3 Гц, 1H), 1,88 (с, 1H), 1,33 (кв., J=12,0 Гц, 1H), 0,99 (д, J=6,5 Гц, 3H). МС: m/z=354 [M+H]+.
Пример 138: Синтез соединения 567 (N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-сукцинамовая кислота)
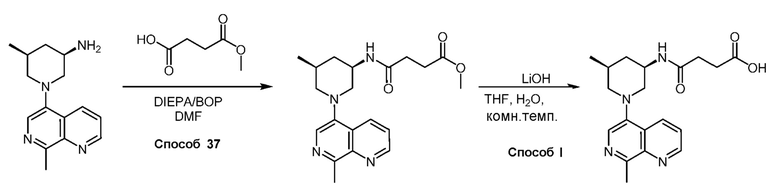
N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-сукцинамовая кислота: N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-сукцинамовую кислоту получали из (3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-иламин дигидрохлорида и моно-метилсукцината с использованием Способа 37, с последующим омылением сложного эфира до карбоновой кислоты с использованием Способа I с получением N-[(3R,5S)-5-метил-1-(8-метил-[1,7]нафтиридин-5-ил)-пиперидин-3-ил]-сукцинамовой кислоты с выходом 71% для 2 стадий.
Соединение 567: МС: m/z=357 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,02 (дд, J=4,1, 1,7 Гц, 1H), 8,44 (дд, J=8,5, 1,8 Гц, 1H), 8,10 (с, 1H), 7,90 (д, J=7,5 Гц, 1H), 7,80 (дд, J=8,5, 4,1 Гц, 1H), 4,04-3,97 (м, 1H), 3,42-3,37 (м, 1H), 3,27-3,20 (м, 1H), 2,88 (с, 3H), 2,47-2,35 (м, 4H), 2,35-2,25 (м, 2H), 2,09-1,91 (м, 2H), 1,06 (кв., J=12,1 Гц, 1H), 0,95 (д, J=6,4 Гц, 3H).
Пример 139: Синтез соединения 568 (1-азетидин-1-ил-2-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-этанон)
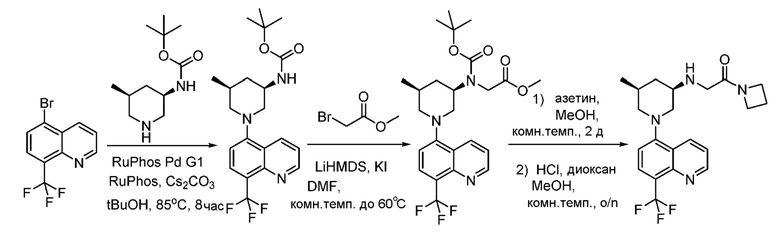
трет-Бутиловый эфир [(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-карбаминовой кислоты: Смесь 5-бром-8-трифторметил-хинолина (600 мг; 2,0 ммоль), трет-бутил N-[(3R,5S)-5-метилпиперидин-3-ил]карбамата (486 мг; 2,27 ммоль), карбоната цезия (1345 мг; 4,1 ммоль), 2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенила (48 мг; 0,1 ммоль), аддукта хлор(2-дициклогексилфосфино-2',6'-ди-изопропокси-1,1'-бифенил)[2-(2-аминоэтилфенил)]палладия(II) с метил-трет-бутиловым эфиром (84 мг; 0,1 ммоль) и tBuOH (15 мл) в 20-мл микроволновой пробирке дегазировали и помещали в микроволновую печь при 85°C на 8 часов. Реакционную смесь фильтровали. Фильтрат концентрировали. Неочищенное вещество очищали хроматографией на силикагеле, элюируя этилацетатом и гексаном, с получением трет-бутилового эфира [(3R5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-карбаминовой кислоты (764 мг; 90%). МС: m/z=410 [M+H]+.
Метиловый эфир {трет-бутоксикарбонил-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амино}-уксусной кислоты: бис(триметилсилил)амид лития (2,3 мл; 2,38 ммоль) добавляли к раствору трет-бутилового эфира [(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-карбаминовой кислоты (750 мг; 1,8 ммоль) и иодида калия (30 мг; 0,18 ммоль) в THF (2 мл) и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. К реакционной смеси добавляли метилбромацетат (0,8 мл; 9,1 ммоль). Полученную смесь перемешивали при 60°C в течение 2 дней. После охлаждения до комнатной температуры реакционную смесь гасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным солевым раствором, сушили и концентрировали. Неочищенное вещество очищали препаративной ВЭЖХ (колонка XBridge Prep C18, 10 мкМ, OBD 30×250мм, 50-95% ACN в воде с 0,1% NH4OH) с получением метилового эфира {трет-бутоксикарбонил-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амино}-уксусной кислоты (160 мг; 19%). МС: m/z=482 [M+H]+.
трет-Бутиловый эфир (2-азетидин-1-ил-2-оксо-этил)-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-карбаминовой кислоты: Смесь метилового эфира {трет-бутоксикарбонил-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амино}-уксусной кислоты (25 мг; 0,05 ммоль) и азетидина (0,14 мл; 2,0 ммоль) в метаноле (1 мл) перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь концентрировали досуха с получением неочищенного трет-бутилового эфира (2-азетидин-1-ил-2-оксо-этил)-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-карбаминовой кислоты (25 мг), который использовали непосредственно для следующей реакции. МС: m/z=507 [M+H]+.
1-Азетидин-1-ил-2-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-этанон: 1-Азетидин-1-ил-2-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-этанон получали из трет-бутилового эфира (2-азетидин-1-ил-2-оксо-этил)-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-карбаминовой кислоты с использованием Способа Q. Неочищенное вещество очищали препаративной ВЭЖХ (колонка XBridge Prep C18, 10 мкМ, OBD 30×250мм, 10-60% ACN в воде с 0,1% NH4OH) с получением 1-азетидин-1-ил-2-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-этанона (18 мг; 90%).
Соединение 568: МС: m/z=407 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 8,96 (дд, J=4,2, 1,8 Гц, 1H), 8,59 (дд, J=8,6, 1,8 Гц, 1H), 8,49 (с, 1H), 8,06 (д, J=8,0 Гц, 1H), 7,63 (дд, J=8,6, 4,2 Гц, 1H), 7,28 (д, J=8,0 Гц, 1H), 4,24 (т, J=7,7 Гц, 2H), 4,08 (т, J=7,8 Гц, 2H), 3,74-3,65 (м, 1H), 3,62 (с, 2H), 3,45-3,35 (м, 2H), 2,69 (т, J=10,9 Гц, 1H), 2,47 (т, J=11,4 Гц, 1H), 2,38 (кв., J=7,8 Гц, 2H), 2,34-2,26 (м, 1H), 2,23-2,06 (м, 1H), 1,15 (кв., J=11,9 Гц, 1H), 1,06 (д, J=6,6 Гц, 3H).
Следующие соединения синтезировали аналогичным способом:
Соединение 569 (1-Азетидин-1-ил-2-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-этанон): из метилового эфира {трет-бутоксикарбонил-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амино}-уксусной кислоты и метиламина. МС: m/z=381 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 8,95 (дд, J=4,3, 1,7 Гц, 1H), 8,58 (дд, J=8,6, 1,8 Гц, 1H), 8,46 (с, 1H), 8,06 (д, J=8,0 Гц, 1H), 7,62 (дд, J=8,6, 4,2 Гц, 1H), 7,26 (д, J=8,0 Гц, 1H), 3,72-3,63 (м, 1H), 3,59 (шир.с, 2H), 3,43-3,35 (м, 1H), 3,32-3,27 (м, 1H),2,80 (с, 3H), 2,67 (т, J=10,9 Гц, 1H), 2,46 (т, J=11,4 Гц, 1H), 2,28 (д, J=12,4 Гц, 1H), 2,22-2,07 (м, 1H), 1,13 (кв., J=11,8 Гц, 1H), 1,05 (д, J=6,6 Гц, 3H).
Соединение 570 (1-Азетидин-1-ил-2-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-этанон): из метилового эфира {трет-бутоксикарбонил-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амино}-уксусной кислоты и аммиака. МС: m/z=367 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4, м.д.) δ 8,96 (дд, J=4,2, 1,7 Гц, 1H), 8,59 (дд, J=8,6, 1,8 Гц, 1H), 8,46 (с, 2H), 8,06 (д, J=8,0 Гц, 1H), 7,63 (дд, J=8,6, 4,2 Гц, 1H), 7,27 (д, J=8,0 Гц, 1H), 3,78-3,56 (м, 3H), 3,39 (дд, J=11,9, 4,0 Гц, 2H), 2,69 (т, J=10,8 Гц, 1H), 2,47 (т, J=11,4 Гц, 1H), 2,30 (д, J=12,3 Гц, 1H), 2,22-2,10 (м, 1H), 1,15 (кв., J=11,9 Гц, 1H), 1,06 (д, J=6,6 Гц, 3H).
Пример 140: Синтез соединения 571 ([(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-уксусная кислота)
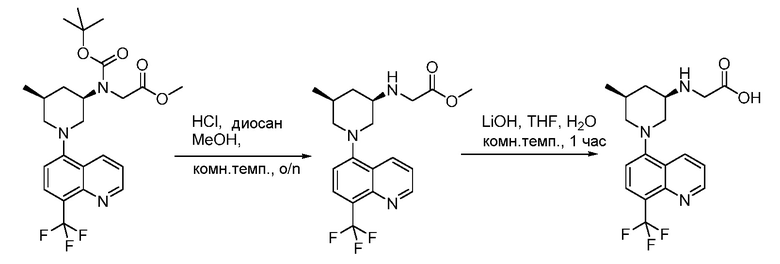
Метиловый эфир [(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-уксусной кислоты дигидрохлорид: Раствор метилового эфира {трет-бутоксикарбонил-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амино}-уксусной кислоты (18 мг; 0,04 ммоль) и 4,0M HCl в диоксане (186 мкл; 0,75 ммоль) в метаноле (1 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали досуха с получением неочищенного метилового эфира [(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-уксусной кислоты дигидрохлорида (17 мг; >99%), который использовали непосредственно для следующей реакции. МС: m/z=382 [M+H]+.
[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-уксусная кислота: Раствор метилового эфира [(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-уксусной кислоты дигидрохлорида (17 мг; 0,04 ммоль) и гидроксида лития моногидрата (9,4 мг; 0,2 ммоль) в THF (1 мл) и воде (1 мл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали и затем очищали препаративной ВЭЖХ (колонка XBridge Prep C18, 10 мкМ, OBD 30×250мм, 5-60% ACN в воде с 0,1% муравьиной кислоты) с получением [(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламино]-уксусной кислоты (11 мг; 80%).
Соединение 571: МС: m/z=368 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,03 (дд, J=4,2, 1,7 Гц, 1H), 8,49 (дд, J=8,6, 1,8 Гц, 1H), 8,07 (д, J=8,0 Гц, 1H), 7,67 (дд, J=8,6, 4,1 Гц, 1H), 7,23 (д, J=8,0 Гц, 1H), 3,73-3,64 (м, 1H), 3,48-3,41 (м, 1H), 3,34-3,30 (м, 1H), 3,28 (д, J=4,6 Гц, 2H), 2,62 (т, J=11,0 Гц, 1H), 2,41 (т, J=11,4 Гц, 1H), 2,20 (д, J=12,3 Гц, 1H), 2,07-1,95 (м, 1H), 1,09 (кв., J=12,0 Гц, 1H), 0,96 (д, J=6,6 Гц, 3H).
Пример 141: Синтез соединения 580 (1-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-3-(3,3-дифтор-циклобутилметил)-мочевина)
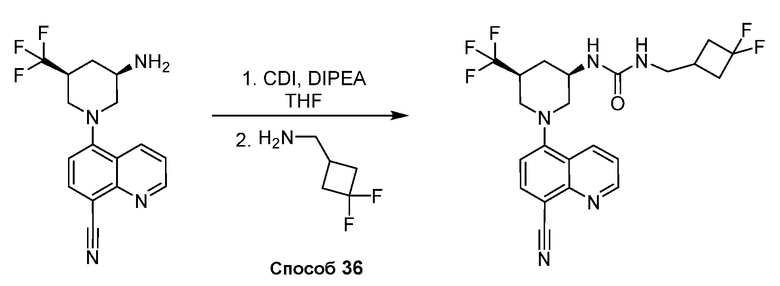
1-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-3-(3,3-дифтор-циклобутилметил)-мочевина: Раствор 5-((3R,5S)-3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида (60 мг; 0,17 ммоль) и 1,1'-карбонилдиимидазола (30 мг; 0,18 ммоль) в DMF (1 мл) перемешивали в течение 1 часа и затем добавляли C-(3,3-дифтор-циклобутил)-метиламин гидрохлорид (32 мг; 0,20 ммоль) и реакционную смесь перемешивали в течение ночи. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ВЭЖХ при следующих условиях: колонка XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 250 мм; Подвижная фаза: ацетонитрил в воде (с 10 ммоль/л NH4OH), 10% - 80% градиент в течение 25 мин; Детектор УФ 254 нм, с получением 1-[(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-3-(3,3-дифтор-циклобутилметил)-мочевины (6,8 мг, 9%) в виде белого твердого вещества.
Соединение 580: ВЭЖХ: чистота <99%, RT=4,03 мин. МС: m/z=468,3 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) θ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,58 (дд, J=8,6, 1,7 Гц, 1H), 8,25 (д, J=8,0 Гц, 1H), 7,71 (дд, J=8,6, 4,2 Гц, 1H), 7,32 (д, J=8,1 Гц, 1H), 6,13 (д, J=7,7 Гц, 2H), 3,99 (с, 1H), 3,58 (т, J=10,3 Гц, 2H), 3,12 (кв.т, J=13,2, 6,0 Гц, 3H), 2,93 (т, J=11,5 Гц, 1H), 2,64-2,54 (м, 2H), 2,35-2,16 (м, 4H), 1,46 (кв., J=12,2 Гц, 1H).
Следующие соединения синтезировали аналогичным способом:
Соединение 581 ([(3R,5S)-1-(8-циано-хинолин-5-ил)-5-трифторметил-пиперидин-3-ил]-амид (3R,4S)-3,4-дифтор-пирролидин-1-карбоновой кислоты): из 5-((3R,5S)-3-амино-5-трифторметил-пиперидин-1-ил)-хинолин-8-карбонитрил гидрохлорида и (3R,4S)-3,4-дифтор-пирролидин гидрохлорида. ВЭЖХ: чистота <99%, RT=3,73 мин. МС: m/z=454,5 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6) δ 9,06 (дд, J=4,2, 1,6 Гц, 1H), 8,59 (дд, J=8,6, 1,7 Гц, 1H), 8,25 (д, J=8,0 Гц, 1H), 7,72 (дд, J=8,6, 4,2 Гц, 1H), 7,33 (д, J=8,1 Гц, 1H), 6,39 (д, J=7,4 Гц, 1H), 5,40-5,18 (м, 3H), 4,06 (с, 2H), 3,68 (дд, J=12,6, 5,9 Гц, 2H), 3,64-3,55 (м, 3H), 3,47-3,35 (м, 3H), 2,92 (т, J=11,6 Гц, 2H), 2,64 (т, J=11,3 Гц, 1H), 2,20 (д, J=12,0 Гц, 1H), 1,63 (кв., J=12,4 Гц, 2H).
Соединение 582 (1-(3,3-дифтор-циклобутилметил)-3-[(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-мочевина): из (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и C-(3,3-дифтор-циклобутил)-метиламин гидрохлорида. ВЭЖХ: чистота <99%, RT=4,39 мин. МС: m/z=457,4 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,01 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,6, 1,8 Гц, 1H), 8,05 (д, J=8,1 Гц, 1H), 7,66 (дд, J=8,6, 4,2 Гц, 1H), 7,20 (д, J=8,1 Гц, 1H), 6,02 (т, J=5,9 Гц, 1H), 5,93 (д, J=7,5 Гц, 1H), 3,61-3,51 (м, 1H), 3,35 (с, 1H), 3,11 (кв.т, J=13,3, 6,1 Гц, 2H), 2,62-2,52 (м, 2H), 2,41 (т, J=11,0 Гц, 2H), 2,32-2,16 (м, 3H), 2,02 (с, 2H), 1,02 (кв., J=11,9 Гц, 1H), 0,95 (д, J=6,4 Гц, 3H).
Соединение 583 ([(3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-ил]-амид (3R,4S)-3,4-дифтор-пирролидин-1-карбоновой кислоты): из (3R,5S)-5-метил-1-(8-трифторметил-хинолин-5-ил)-пиперидин-3-иламин гидрохлорида и (3R,4S)-3,4-дифтор-пирролидин гидрохлорида. ВЭЖХ: чистота <99%, RT=4,08 мин. МС: m/z=44,3,4 [M+H]+. 1H ЯМР (400 МГц, DMSO-d6, м.д.) δ 9,01 (дд, J=4,2, 1,7 Гц, 1H), 8,53 (дд, J=8,6, 1,8 Гц, 1H), 8,05 (д, J=8,1 Гц, 1H), 7,67 (дд, J=8,6, 4,2 Гц, 1H), 7,21 (д, J=8,1 Гц, 1H), 6,23 (д, J=7,5 Гц, 1H), 5,21 (дд, J=9,6, 5,5 Гц, 2H), 3,94 (с, 1H), 3,73-3,49 (м, 3H), 3,49-3,32 (м, 4H), 2,48 (с, 3H), 2,40 (т, J=11,3 Гц, 1H), 2,12-1,96 (м, 2H), 1,20 (кв., J=12,1 Гц, 1H), 0,96 (д, J=6,4 Гц, 3H).
Пример 142: HEK клеточный анализ
В 384-луночные культуральные планшеты (Corning 3707) добавляли TLR7/NFKb HEK клетки по 5000 клеток/лунка в 30 мкл DMEM, не содержащей Фениловый красный (gibco#31053), и 10% инактивированной FCS и 2 мМ L-Z Глутамина. Клетки инкубировали в течение 24 часов при 37°C, 10% диоксида углерода и 90% относительной влажности. 3 мкл контролей, стандартов и соединений распределяли в лунки, инкубировали в течение 30 минут, затем добавляли 3 мкл R*48 агониста в 20 мМ Hepes. После инкубации в течение 5 часов планшетам давали выстояться при комнатной температуре в течение 15 минут. Затем добавляли 10 мкл субстрата Steady-Glo и аналитический планшет встряхивали в течение 5 минут при 1500 об/мин. Аналитический планшет оставляли выстаиваться в течение 30 минут при комнатной температуре и затем планшет считывали на EnVision.
Результаты представлены в следующей таблице.
A: IC50<1 мкМ
B: IC50: 1 мкМ -10 мкМ
C: IC50 >10 мкМ
Пример 77. Фармацевтические препараты
(A) Инъекционные флаконы: Раствор 100 г активного ингредиента в соответствии с изобретением и 5 г динатрий гидрофосфата в 3 л бидистиллированной воды доводили до pH 6,5 с использованием 2 N хлористоводородной кислоты, стерильно фильтровали, переносили в инъекционные флаконы, лиофилизировали в стерильных условиях и герметично закрывали в стерильных условиях. Каждый инъекционный флакон содержал 5 мг активного ингредиента.
(B) Суппозитории: Смесь 20 г активного ингредиента в соответствии с изобретением расплавляли с 100 г соевого лецитина и 1400 г масла какао, заливали в формы и давали охладиться. Каждый суппозиторий содержал 20 мг активного ингредиента.
(C) Раствор: Раствор получали из 1 г активного ингредиента в соответствии с изобретением, 9,38 г NaH2PO4 ⋅ 2H2O, 28,48 г Na2HPO4 ⋅ 12 H2O и 0,1 г бензалконий хлорида в 940 мл бидистиллированной воды. pH доводили до 6,8 и раствор получали в объеме 1 л и стерилизовали путем облучения. Этот раствор можно использовать в форме глазных капель.
(D) Мазь: 500 мг активного ингредиента в соответствии с изобретением смешивали с 99,5 г вазелина в асептических условиях.
(E) Таблетки: Смесь 1 кг активного ингредиента в соответствии с изобретением, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния прессовали с получением таблеток обычным способом так, чтобы каждая таблетка содержала 10 мг активного ингредиента.
(F) Таблетки с покрытием: Таблетки прессовали аналогично Примеру E и затем наносили покрытие обычным способом, используя покрытие из сахарозы, картофельного крахмала, талька, трагаканта и красителя.
(G) Капсулы: 2 кг активного ингредиента в соответствии с изобретением вводили в твердые желатиновые капсулы обычным способом так, чтобы каждая капсула содержала 20 мг активного ингредиента.
(H) Ампулы: Раствор 1 кг активного ингредиента в соответствии с изобретением в 60 л бидистиллированной воды стерильно фильтровали, переносили в ампулы, лиофилизировали в стерильных условиях и герметично закрывали в стерильных условиях. Каждая ампула содержала 10 мг активного ингредиента.
(I) Ингаляционный спрей: 14 г активного ингредиента в соответствии с изобретением растворяли в 10 л изотонического раствора NaCl и раствор переносили в коммерчески доступные контейнеры для распыления с насосным механизмом. Раствор можно распылять в полости рта или носа. Один впрыск (около 0,1 мл) соответствует дозе около 0,14 мг.
Хотя в настоящей заявке описан ряд вариантов осуществления настоящего изобретения, очевидно, что базовые примеры могут быть изменены с получением других вариантов осуществления, которые используют соединения и способы по настоящему изобретению. Поэтому должно быть понятно, что объем настоящего изобретения должен определяться прилагаемой формулой изобретения, а не конкретными вариантами осуществления, которые были представлены в качестве примера.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТАГОНИСТЫ TLR7/8 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2833035C2 |
| ПРОИЗВОДНЫЕ АМИНОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2021 |
|
RU2826628C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2340611C2 |
| АНТАГОНИСТЫ TLR7/8 И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2758686C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА И СОДЕРЖАЩИЕ ИХ ИНГИБИТОРЫ MELK | 2011 |
|
RU2582610C2 |
| ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКИХ АМИНОВ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА ЕР4 | 2011 |
|
RU2565596C2 |
| СОЕДИНЕНИЯ БЕНЗОЛСУЛЬФОНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2017 |
|
RU2769827C2 |
| ТИАЗОЛИЛФЕНИЛБЕНЗОЛСУЛЬФОНАМИДОПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2012 |
|
RU2606497C2 |
| ГЕМИНАЛЬНО-ЗАМЕЩЕННЫЕ ЦИАНОЭТИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ JANUS КИНАЗ | 2014 |
|
RU2664533C2 |
| ЗАМЕЩЕННОЕ ПИРИДИНОВОЕ СОЕДИНЕНИЕ | 2011 |
|
RU2572606C2 |
Изобретение относится к соединению формулы (1) или его фармацевтически приемлемой соли. Изобретение относится к фармацевтической композиции, ингибирующей активность TLR7/8, включающей эффективное количество соединения по изобретению, или его фармацевтически приемлемой соли, и фармацевтически приемлемый адъювант, носитель или наполнитель. Также изобретение относится к способу ингибирования активности TLR7/8 и способу лечения TLR7/8-опосредованного расстройства, выбранного из волчанки, полимиозита, дерматомиозита, болезни Шегрена и ревматоидного артрита, у пациента, нуждающегося в этом, включающему стадию введения указанному пациенту соединения по изобретению или его фармацевтически приемлемой соли. Технический результат - соединение формулы (1) в качестве антагонистов toll-подобного рецептора 7/8 (TLR7/8). 4 н. и 1 з.п. ф-лы, 2 табл., 141 пр.
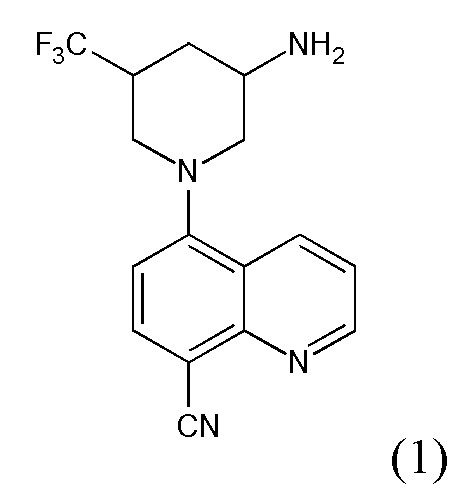
1. Соединение
или его фармацевтически приемлемая соль.
2. Соединение по п.1, представленное структурой
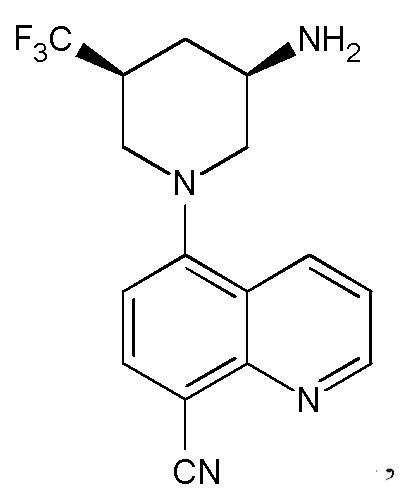
или его фармацевтически приемлемая соль.
3. Фармацевтическая композиция, ингибирующая активность TLR7/8, включающая эффективное количество соединения по п. 1 или 2 или его фармацевтически приемлемой соли и фармацевтически приемлемый адъювант, носитель или наполнитель.
4. Способ ингибирования активности TLR7/8 или его мутанта у пациента или в биологическом образце, включающий стадию введения указанному пациенту или контактирование указанного биологического образца с соединением по п. 1 или 2 или его фармацевтически приемлемой солью.
5. Способ лечения TLR7/8-опосредованного расстройства, выбранного из волчанки, полимиозита, дерматомиозита, болезни Шегрена и ревматоидного артрита, у пациента, нуждающегося в этом, включающий стадию введения указанному пациенту соединения по п. 1 или 2 или его фармацевтически приемлемой соли.
| WO 2015057655 A1, 23.04.2015 | |||
| WO 2015057659 A1, 23.04.2015 | |||
| WO 2015088045 A1, 18.06.2015 | |||
| WO 2010063352 A1, 10.06.2010 | |||
| Пружинная опора | 1989 |
|
SU1772454A1 |
| Шпунтубель | 1929 |
|
SU19768A1 |
Авторы
Даты
2022-11-16—Публикация
2016-12-16—Подача