ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное открытие относится к связанным с катионным пептидом морфолиновым (PPMO) антисмысловым олигонуклеотидам, которые направлены на участок повтора поли-CUG в 3'-нетранслируемой области гена, кодирующего протеинкиназу миотонической дистрофии (DMPK), и систематическому введению их для лечения миотонической дистрофии типа I (DM1).
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Миотоническая дистрофия типа 1 (DM1) представляет собой аутосомное доминантное наследственное нарушение, которое проявляется первоначально в виде нервно-мышечного заболевания, но может также приводить к сердечной, эндокринной, желудочно-кишечной дисфункции и дисфункции центральной нервной системы. Отличительным симптомом DM1 является миотония, нарушение миорелаксации после сокращения, и его детектируют электромиографией (EMG) в виде длинных периодов повторяющихся потенциалов действия в мышце. Генетическое повреждение DM1 состоит из неустойчивого тринуклеотидного повторного элемента CUG в 3'-нетранслируемой области гена, кодирующего протеинкиназу, называемую протеинкиназа миотонической дистрофии (DMPK). Малое количество копий повтора CUG обнаружено у непораженных индивидуумов, тогда как большие количества неустойчивых повторов CUG, варьирующиеся от 50 копий до нескольких тысяч копий, детектированы у пациентов с DM1. В генетических исследованиях было установлено, что количество повторов CUG напрямую коррелирует с возрастом в начале и тяжестью заболевания (Day & Ranum, 2005, Neuromuscul Disord 15:5-16).
РНК транскрипты, такие как DMPK, которые содержат большое количество повторов CUG, приобретают свойства получения функции и стимулируют РНК-опосредованную токсичность в клетках и тканях, экспрессирующих мутантный транскрипт DMPK (Wheeler & Thornton, 2007, Curr Opin Neurol 20:572-576). Патогенный транскрипт сохраняется в ядре (Taneja et al., 1995, J Cell Biol 128:995-1002), где он улавливает связывающие РНК белки, такие как MBNL1 (Mankodi et al., 2001, Hum Mol Genet 10:2165-2170; Mankodi et al., 2003, Ann Neurol 54:760-768). Поли-(CUG) РНК также увеличивает уровни устойчивого состояния CUG-BP1 (Timchenko NA et al., 2001, J Biol Chem, 276:7820-7826; Kuyumcu-Martinez et al., 2007, Mol Cell 28:68-78). Как секвестрация MBNL1, так и возрастание CUG-BP1 активности ассоциировано с неправильным сплайсингом большого количества РНК транскриптов. Следует отметить нарушенный сплайсинг РНК мРНК хлоридного канала ClC-1 (Mankodi et al., 2002, Mol Cell 10:35-44), который, как было продемонстрировано, непосредственно приводит к миотонии (Wheeler et al., 2007, J Clin Invest 117:3952-3957). В добавление к неправильному сплайсингу РНК последствие экспрессии мутантной DMPK включает в себя ремоделирование транскриптома скелетной мышцы (Osborne et al., 2009, Hum Mol Genet 18:1471-1481). Предполагается, что белковые продукты с измененными первичными последовательностями, полученными в результате неправильного сплайсинга РНК и дерегулированных уровней мРНК, содержащих измененный транскриптом, будут иметь ассоциации и даже причинно-следственные связи со специфическими аспектами DM1 заболевания.
В настоящее время нет терапевтических агентов в клиническом лечении для DM1, которые направлены на токсичную РНК, первичный патогенный драйвер заболевания. Стандартные лечения DM1 в основном являются поддерживающими и направлены на контроль специфических симптомов, например, миотонии (Logigian et al., 2010, Neurology 74:1441-1448). Доклиническая оценка новых терапевтических подходов была проведена на трансгенной мышиной модели HSALR, которая содержит трансген человеческого скелетного актина, несущий тринуклеотидную вставку 250 CUG в 3'-нетранслируемой области. Модель HSALR демонстрирует некоторые свойства DM1, включая MBNL1 секвестрацию посредством CUG РНК и результирующие нарушения сплайсинга РНК, изменения в мышечном транскриптоме и физиологические аберрации, такие как миотония (Osborne et al., 2009, Hum Mol Genet 18:1471-1481; Mankodi et al., (2000), Science 289:1769-1773). Новые терапевтические возможности, тестируемые на мышах HSALR, включают в себя низкомолекулярные лиганды, которые сконструированы для взаимодействия с РНК с повтором CUG и высвобождения ассоциированного с очагами белка MBNL1 (Warf et al., 2009, Proc Natl Acad Sci USA 106:18551-18556; Parkesh et al., 2012, J Am Chem Soc 134:4731-4742; Ofori et al., 2012, Nucl. Acid. Res. in press, впервые опубликована онлайн: 6 апреля, 2012). В добавление три химические структуры антисмыслового олигонуклеотида (ASO), которые направляют участок повтора CUG, оценивали в исследованиях, проведенных на трансгенных мышиных моделях DM1 (Wheeler et al., 2009, Science 325:336-339; Mulders et al., 2009, Proc Natl Acad Sci USA 106:13915-13920; Lee et al., 2012, Proc Natl Acad Sci USA 109:4221-4226). Wheeler и коллеги (2009, Science 325:336-339) продемонстрировали локальную коррекцию патологии DM1 в задней большеберцовой (tibilias anterior, TA) мышце мышей HSALR, подвергаемых внутримышечной (в/м) инъекции 25-мерного морфолинового олигонуклеотида с последовательностью CAG (CAG25). Обработанные CAG25 мышцы TA продемонстрировали снижение присутствия рибонуклеарных очагов, перераспределение белка MBNL1, коррекцию неправильного сплайсинга РНК, восстановление экспрессии и функции белка хлоридного канала (ClC-1) и уменьшение миотонии (Wheeler et al., 2009, Science 325:336-339). Хотя этот терапевтический подход продемонстрировал коррекции DM1-подобного фенотипа мышей HSALR, все еще существует потребность в стратегии систематической доставки, которая позволила бы многочисленным тканям, включая многочисленные тканевые типы, возможность подвергаться воздействию активного морфолинового олигонуклеотида, направленного на токсичные транскрипты РНК DMPK, ответственные за DM1.
На протяжении всего данного описания имеют место ссылки на различные патенты, патентные заявки и другие типы публикаций (например, журнальные статьи). Раскрытие всех патентов, патентных заявок и публикаций, приведенных в данном документе, посредством настоящего полностью включено в данный документ посредством ссылки.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Представленное в данном документе открытие раскрывает, в числе прочего, композиции и способы производства и применение связанных с катионным пептидом морфолиновых (PPMO) антисмысловых олигонуклеотидов, которые могут быть систематически доставлены в многочисленные ткани и тканевые типы, и применение того же самого для лечения DM1.
Соответственно, один объект, представленный в данном документе, является способом лечения или предотвращения миотонической дистрофии типа 1 (DM1) у индивидуума, нуждающегося в этом, содержащим: систематическое введение индивидууму терапевтически эффективного количества соединенного с катионным пептидом морфолинового антисмыслового олигонуклеотида, содержащего последовательность, комплементарную по меньшей мере 3 последовательностям повтора поли-CUG в 3'-нетранслируемой области (UTR) целевой РНК транскрипта протеинкиназы миотонической дистрофии (DMPK), в котором введение соединенного с катионным пептидом морфолинового антисмыслового олигонуклеотида облегчает по меньшей мере один симптом DM1 в по меньшей мере двух мышцах. Способ по п.1, в котором катионный пептид составляет 8-30 аминокислотных остатков в длину и содержит одну или более субпоследовательностей, выбранных из группы, состоящей из RXR, RX, RB и RBR, в которой R представляет собой аргинин, Β представляет собой β-аланин, и каждый X представляет собой независимо -NH-(CHR1)n-C(O)-, в котором n составляет от 4 до 6, и каждый R1 представляет собой независимо H или метил так, чтобы самое большее два R1 представляли собой метил. В некоторых вариантах осуществления катионный пептид содержит аминокислотную последовательность Ac(RXRRBR)2XB-. В других вариантах осуществления катионный пептид содержит аминокислотную последовательность Ac(RXR)4XB-. В некоторых вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид содержит последовательность 5'-(AGC)n-3', 5'-(GCA)n-3' или 5'-(CAG)n-3', в которой n составляет любое из приблизительно 5-25. В другом варианте осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид дополнительно содержит от 1 до 2 добавочных морфолиновых нуклеотидов на 5'- и/или 3'-конце олигонуклеотида. В некоторых вариантах осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид содержит последовательность: 5'-AGCAGCAGCAGCAGCAGCAGCAGCA-3'. В другом варианте осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид дополнительно содержит 5'-аминомодификацию. В некоторых вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид представляет собой фосфородиамидатный связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид. В других вариантах осуществления любого из способов, описанных выше, катионный пептид отделен от морфолинового антисмыслового олигонуклеотида спейсерной группой, присоединенной к 5'-концу морфолинового антисмыслового олигонуклеотида. В варианте осуществления спейсерная группа содержит
 .
.
В некоторых вариантах осуществления любого из способов, описанных выше, мышцы представляют собой скелетные мышцы, гладкие мышцы и/или сердечную мышцу. В других вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид проникает в клетки передней большеберцовой мышцы, четырехглавой мышцы и/или икроножной мышцы. В других вариантах осуществления любого из способов, описанных выше, упомянутый по меньшей мере один симптом DM1 представляет собой миотонию. В некоторых вариантах осуществления любого из способов, описанных выше, упомянутый по меньшей мере один симптом DM1 представляет собой агрегирование белка musclebind-like-1 (MBNL-1) в рибонуклеарных очагах внутри миоядер. В других вариантах осуществления любого из способов, описанных выше, упомянутый по меньшей мере один симптом DM1 представляет собой неправильный сплайсинг по меньшей мере одного РНК транскрипта в мышечных клетках. В другом варианте осуществления упомянутый по меньшей мере один транскрипт РНК (такой как транскрипт РНК человеческих генов) выбран из группы, состоящей из: Serca-1, m-Titin, Zasp и CIC. В некоторых вариантах осуществления любого из способов, описанных выше, систематическое введение связанного с катионным пептидом морфолинового антисмыслового олигонуклеотида выполняют внутривенно, внутрибрюшинно или подкожно. В других вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят индивидууму раз в неделю. В других вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят индивидууму в течение от одной до шести недель. В некоторых вариантах осуществления любого из способов, описанных выше, связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят с фармацевтически приемлемым вспомогательным веществом. В других вариантах осуществления любого из способов, описанных выше, индивидуум является человеком.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 изображает химическую структуру PPMO и оценку биоактивности PPMO-B и PPMO-K в мышах HSALR. (a) Структура PPMO, содержащая проникающий в клетку пептид (пептид Β или пептид K), ковалентно присоединенный к линкеру, расположенному на 5'-конце морфолинового олигомера. Последовательности пептида Β и пептида Κ описаны в материалах и способах. (b) Тестовую и контрольную в/м инъекцию в мышцу TA выполняли, как описано в материалах и способах. Непосредственно инъекция в TA с последующим анализом сплайсинга Serca-1 служила для определения влияния ковалентного присоединения пептида Β или пептида Κ на биоактивность CAG25. Через три недели после в/м инъекции отбирали мышцы TA, очищали общую РНК и амплифицировали Serca-1 для детектирования сплайсированных изоформ с или без экзона 22 (ex22). Каждая скобка представляет одну HSALR мышь, инъецированную с указанным ASO (GAC25, CAG25, PPMO-B и PPMO-K), инъецированную в одну TA и с контралатеральной TA (кон), инъецированной с солевым раствором-носителем. РНК из TA мыши дикого типа FVB/n также анализировали в качестве контроля, и она продемонстрировала сплайсинг Serca-1, который происходит у мышей без заболевания.
Фиг. 2 изображает, что повторные инъекции IV PPMO-B или PPMO-K корректируют сплайсинг Serca-1. Мышей HSALR инъецировали с солевым раствором, CAG25, PPMO-B или PPMO-K раз в неделю в течение шести недель. Указанные группы мышц отбирали у мышей примерно через одну неделю после последней дозы. Очищали общую РНК и амплифицировали Serca-1 для детектирования дифференцированно сплайсированных изоформ. РНК из ΤA мыши дикого типа FVB/n служила в качестве контроля как на фиг. 1. Сплайсинг Serca-1 в РНК, очищенной из TA мышей HSALR, инъецированных с GAC25 или CAG25 как на фиг. 1, служил в качестве отрицательного контроля (отр. конр.) и положительного контроля (пол. конт.), соответственно.
Фиг. 3 изображает коррекцию неправильного сплайсинга ZASP, m-Titin и ClC-1 в мышах HSАLR, дозированных с повторными IV инъекциями PPMO-K. Мышей HSALR инъецировали с солевым раствором или PPMO-K раз в неделю в течение шести недель. Указанные группы мышц отбирали у мышей, общую РНК очищали и ZASP, m-Titin и ClC-1 амплифицировали для детектирования дифференцированно сплайсированных изоформ, содержащих указанные конфигурации экзона (ex) и интрона (int). РНК из TA мыши FVB/n дикого типа служила в качестве контроля без заболевания. Положительный и отрицательный контроли генерировали с РНК как на фиг. 2 с амплификацией ПЦР на ZASP, m-Titin и ClC-1.
Фиг. 4 изображает, что систематическая доставка PPMO-K снижает частоту и интенсивность РНК очагов CUG в четырехглавой мышце мышей HSALR. Анализ FISH проводили на замороженных срезах четырехглавой мышцы, как уже описано (Mankodi et al., 2001, Hum Mol Genet 10:2165-2170), с применением 2'-O-метил-модифицированного РНК зонда (5'-GCAGCAGCAGCAGCAGCAGC-3'), меченого на 5'-конце с AlexaFluor 555, и визуализировали посредством конфокальной микроскопии. (a, b) Мыши HSALR, обработанные шесть раз в неделю IV инъекциями солевого раствора, демонстрировали обильные очаги CUG РНК в ядрах мышц, меченых с DAPI. (c, d) HSALR, обработанные шесть раз в неделю IV инъекциями PPMO-K (30 мг/кг), демонстрировали уменьшение количества и интенсивности РНК очагов CUG. (e, f) Мышца FVB/n дикого типа не содержала обнаруживаемые очаги. Масштабная линейка = 50 мкм.
Фиг. 5 изображает, что иммунофлуоресцентная микроскопия демонстрирует ядерное перераспределение белка MBNL1 в обработанных PPMO-K мышах. Иммунофлуоресцентное окрашивание белков MBNL1 в срезах четырехглавой мышцы и конфокальную микроскопию проводили, как описано в материалах и способах. (a-c) Срезы мышц HSALR мышей, обработанных солевым раствором, демонстрируют точечную локализацию MBNL1 в ядре. (d-f) Срезы мышц обработанных PPMO-K мышей HSALR демонстрируют диффузное ядерное окрашивание MBNL1. (g-i) Срезы мышц мышей FVB/n дикого типа демонстрировали диффузное ядерное окрашивание MBNL1. Масштабная линейка = 10 мкм.
Фиг. 6 изображает, что миотония была скорректирована у мышей HSALR, которым вносили дозу повторной инъекции IV PPMO-K. (a) Уровни мРНК HSALR трансгена, нормализированные по 18S РНК в TA, икроножной и четырехглавой мышце гомозиготных HSALR, гемозиготных HSALR и мышей FVB/n дикого типа. Данные представлены в виде среднее + SD, n=6 мышей на группу. (b) Отслеживания регистраций EMG в икроножной мышце HSALR (миотония) или мышей FVB/n дикого типа (без миотонии). Миотония детектирована у мышей HSALR, но не у мышей дикого типа. (c) Проводили EMG анализ на необработанных гомозиготных HSALR, гемозиготных HSALR и мышах дикого типа. EMG также проводили на гомозиготных HSALR мышах, обработанных шесть раз в неделю инъекциями солевого раствора или PPMO-K. Каждую мышцу анализировали 10 раз для генерирования степени миотонии, как описано в материалах и способах. Данные представлены в виде средняя степень + SD для каждой тестируемой группы мышц, n=3-8 мышей на группу.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное открытие, в числе прочего, относится к катионным пептидсвязанным морфолиновым (PPMO) антисмысловым олигонуклеотидам, которые могут быть систематически доставлены к многочисленным тканям и/или тканевым типам у индивидуумов с миотонической дистрофией типа 1 (DM1). Авторы открытия обнаружили, что добавление проникающего в клетку пептида к последовательности CAG морфолино позволяет достаточное внедрение PPMO в мышечную ткань для нейтрализации токсичных эффектов удлиненного CUG повтора при введении систематически в животные модели DM1. Доставка этих морфолино и их проникновение в мышечные клетки индивидуумов, обладающих высокими количествами поли-CUG мРНК, было ассоциировано с почти полным разрешением нарушений сплайсинга в ряде белков, высвобождением MBNL1 из РНК очагов и элиминацией миотонии.
I. Общие технологии
При осуществлении на практике открытия применены, если не указано иное, общепринятые технологии в химии нуклеиновых кислот, молекулярной биологии, микробиологии, клеточной биологии, биохимии и иммунологии, которые хорошо известны специалисту в данной области. Такие технологии полностью объяснены в литературе, такой как Molecular Cloning: A Laboratory Manual, второе издание (Sambrook et al., 1989), и Molecular Cloning: A Laboratory Manual, третье издание (Sambrook and Russel, 2001) (обобщенно называемой в данном документе "Sambrook"); Current Protocols in Molecular biology (F.M. Ausubel et al., eds., 1987, включая дополнения в 2001); PCR: The Polymerase Chain Reaction (Mullis et al., eds., 1994). Нуклеиновые кислоты могут быть синтезированы in vitro хорошо известными технологиями химического синтеза, как описано, например, в Carruthers (1982) Cold Spring Harbor Symp. Quant. Biol. 47:411-418; Adams (1983) J. Am. Chem. Soc. 105:661; Belousov (1997) Nucleic acids Res. 5 25:3440-3444; Frenkel (1995) Free Radic. Biol. Med. 19:373-380; Blommers (1994) Biochemistry 33:7886-7896; Narang (1979) Meth. Enzymol. 68:90; Brown (1979) Meth. Enzymol. 68:109; Beaucage (1981) Tetra. Lett. 22:1859; патенте США №4458066.
II. Определения
Термин "целевая РНК" относится к РНК транскрипту, с которым связывается морфолино специфичным к последовательности образом. В некоторых вариантах осуществления целевая РНК представляет собой одну или более молекул мРНК DMPK, имеющих переменное количество тринуклеотидных повторных элементов CUG в 3’-нетранслируемой области.
"Морфолино" или "морфолиновый антисмысловой олигонуклеотид" относятся к олигонуклеотидному аналогу, составленному из морфолиновых субъединичных структур, где (i) структуры соединены вместе содержащими фосфор соединениями от одного до трех атомов в длину, предпочтительно два атома в длину, и предпочтительно незаряженными или катионными, соединяющими азот морфолино одной субъединицы с 5’-экзоциклическим углеродом смежной субъединицы, и (ii) каждое морфолиновое кольцо несет пуриновую или пиримидиновую группу спаривания оснований, эффективную для связывания посредством специфичного к основаниям водородного связывания с основанием в полинуклеотиде. В некоторых вариантах осуществления морфолино связывает целевую РНК, что блокирует трансляцию целевой РНК в белок. В других вариантах осуществления морфолино предотвращает агрегирование целевой РНК с собой или с другими клеточными РНК, белками или рибопротеинами, такими как, но без ограничения ими, РНК, белки и рибопротеины, ассоциированные с клеточным аппаратом сплайсинга мРНК.
"Индивидуум" может являться млекопитающим, таким как любой распространенный лабораторный модельный организм или млекопитающее. Млекопитающие включают в себя, но не ограничены ими, людей и приматов, кроме человека, сельскохозяйственных животных, используемых в спортивных целях животных, домашних животных, мышей, крыс и других грызунов.
В используемом в данном документе значении "лечение" (и его грамматические варианты, такие как "лечить" или "лечащий") относится к клиническому вмешательству, разработанному для изменения естественного течения болезни у индивидуума или клетки, подвергаемых обработке во время клинической патологии. Желательные эффекты лечения включают в себя, но не ограничены ими, снижение скорости прогрессирования заболевания, облегчение или ослабление состояния заболевания и ремиссию или улучшенный прогноз.
В используемом в данном документе значении "предотвращение" включает в себя предоставление профилактики в отношении проявления или повторения заболевания или симптомов, ассоциированных с заболеванием у индивидуума. Индивидуум может являться предрасположенным, подверженным или иметь риск развития заболевания, но у него еще не было диагностировано заболевание.
"Эффективное количество" или "терапевтически эффективное количество" относится к количеству терапевтического соединения, такого как антисмысловой олигомер, вводимого млекопитающему объекту или в виде единичной дозы, или в виде части ряда доз, которая является эффективной для выработки требуемого терапевтического эффекта. Для антисмыслового олигомера этот эффект, как правило, привносится ингибированием трансляции или естественного сплайсингового процессинга выбранной целевой последовательности.
В используемом в данном документе значении формы единственного числа включают в себя ссылку на формы множественного числа, если не указано иное.
Необходимо понимать, что аспекты и варианты осуществления открытия, описанные в данном документе, включают в себя "содержащие", "состоящие из" и "по существу состоящие из" объекты и варианты осуществления.
Подразумевается, что каждое максимальное численное ограничение, приведенное по всему объему данного описания, включает в себя каждое более низкое численное ограничение, как если бы такие численные ограничения были точно описаны в данном документе. Каждое минимальное численное ограничение, приведенное по всему объему данного описания, будет включать в себя каждое более высокое численное ограничение, как если бы такие более высокие ограничения были бы точно описаны в данном документе. Каждый численный диапазон, приведенный по всему объему данного описания, будет включать в себя каждый более узкий численный диапазон, который попадает в такой более широкий численный диапазон, как если бы такие более узкие численные диапазоны были бы точно описаны в данном документе.
III. Композиции
A. Морфолино
Морфолино являются синтетическими молекулами, имеющими структуру, которая имеет большое сходство с встречающейся в природе нуклеиновой кислотой. Эти нуклеиновые кислоты связывают комплементарные последовательности РНК стандартным спариванием оснований нуклеиновых кислот. Структурно морфолино отличаются от ДНК или РНК тем, что эти молекулы имеют основания нуклеиновой кислоты, связанные с морфолиновыми кольцами вместо дезоксирибозного или рибозного колец. Дополнительно, остов морфолино состоит из неионных или катионных соединяющих групп вместо фосфатов. К примеру, замещение анионных фосфатов незаряженными фосфородиамидатными группами элиминирует ионизацию в диапазоне обычного физиологического pH, что делает морфолино незаряженными молекулами в организмах или клетках. Морфолино наиболее часто используют в виде одноцепочечных олигов, хотя гетеродуплексы морфолиновой цепи и комплементарной цепи ДНК могут быть применены в комбинации с реагентами для катионной цитозольной доставки.
В отличие от многих антисмысловых структурных типов (например, фосфотиоатов) морфолино не разрушают их целевые молекулы РНК. Вместо этого морфолино действуют посредством "стерического блокирования", т.е. связывания с целевой последовательностью внутри РНК и стерического препятствования молекулам, которые могут в противном случае взаимодействовать с РНК. Связанные с 5'-нетранслируемой областью матричной РНК (мРНК) морфолино могут препятствовать прогрессированию рибосомального инициирующего комплекса с 5'-кэп до стартового кодона. Это предотвращает трансляцию кодирующей области целевого транскрипта (так называемое "нокаутирование" генной экспрессии). Некоторые морфолино нокаутируют экспрессию настолько эффективно, что после разрушения предсуществующих белков целевые белки становятся не обнаруживаемыми посредством вестерн-блоттинга.
Морфолино могут также препятствовать этапам процессинга пре-мРНК обычно предотвращением направляющих сплайсинг комплексов мяРНП от связывания с их мишенями на границах интронов на цепи пре-РНК. Предотвращение U1 (в донорном сайте) или U2/U5 (в полипиримидиновой группе и акцепторном сайте) от связывания может в результате привести к модифицированному сплайсингу, обычно приводя к исключению экзонов из зрелого транскрипта мРНК. Сплайсированная модификация может быть удобным образом проанализирована полимеразной цепной реакцией с обратной транскриптазой (ОТ-ПЦР) и видна в виде сдвига полосы после гель-электрофореза продуктов ОТ-ПЦР.
Морфолино также были применены для блокирования интронных сплайсированных сайленсеров и сплайсированных энхансеров. Функции мяРНП U2 и U12 были ингибированы посредством морфолино. Морфолино, направленные к "скользким" последовательностям мРНК в кодирующих областях белков, могут индуцировать трансляционные сдвиги рамки. Активности морфолино против этого множества мишеней предполагают, что морфолино могут быть применены в качестве универсального инструмента для блокирования взаимодействий белков или нуклеиновых кислот с мРНК.
Композиции по данному открытию составлены из морфолиновых субъединиц, соединенных вместе незаряженными содержащими фосфор связями от одного до трех атомов в длину, соединяющими азот морфолино одной субъединицы с 5’-экзоциклическим углеродом смежной субъединицы, в котором основание, присоединенное к морфолиновой группе, является пуриновой или пиримидиновой группой спаривающегося основания, эффективной для связывания специфичным к основанию водородным связыванием с основанием в полинуклеотиде. Пуриновая или пиримидиновая группа спаривающегося основания является, как правило, аденином, цитозином, гуанином, урацилом или тимином. Приготовление таких олигомеров описано подробно в патенте США № 5185444, который настоящим полностью включен в данный документ посредством ссылки. Могут быть внесены изменения в эту связь при условии, что они не препятствуют связыванию или активности. К примеру, кислород, присоединенный к фосфору, может быть замещен серой (тиофосфородиамидат). 5'-кислород может быть замещен амино или амино с замещением низшим алкилом. Азот боковой цепи, присоединенный к фосфору, может являться незамещенным, монозамещенным или дизамещенным с (необязательно замещенным) низшим алкилом. Группа спаривания пуринового или пиримидинового основания представляет собой, как правило, аденин, цитозин, гуанин, урацил, тимин или инозин. Синтез, структуры и характеристики связывания морфолино подробно раскрыты в патентах США №№5698685, 5217866, 5142047, 5034506, 5166315, 5521063, 5506337 и опубликованной международной заявке на патент WO 2008/036127, все из которых полностью включены в данный документ посредством ссылки.
В некоторых вариантах морфолиновые антисмысловые олигонуклеотиды по данному открытию могут быть комплементарными последовательности повтора поли-CUG в 3'-нетранслируемой области (UTR) целевой РНК протеинкиназы миотонической дистрофии (DMPK). В некоторых вариантах осуществления морфолиновый антисмысловой олигонуклеотид является идентичным на по меньшей мере любую величину из приблизительно 90%, 95% или 100% включительно, включая любые проценты между этими величинами, 3’-нетранслируемой области целевой РНК протеинкиназы миотонической дистрофии (DMPK). В некоторых вариантах осуществления морфолиновые антисмысловые олигонуклеотиды являются комплементарными по меньшей мере любой из 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 или более последовательностей повтора поли-CUG в 3’-нетранслируемой области (UTR) целевой РНК DMPK. В некоторых вариантах осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид содержит последовательность 5'-(AGC)n-3', 5'-(GCA)n-3' или 5'-(CAG)n-3', в которых n составляет любое из приблизительно 5-25. В другом варианте осуществления связанные с катионным пептидом морфолиновые антисмысловые олигонуклеотиды могут дополнительно содержать от 1 до 2 добавочных морфолиновых нуклеотидов на 5'- и/или 3'-конце олигонуклеотидов. В некоторых вариантах осуществления морфолиновый антисмысловой олигонуклеотид содержит последовательность 5'-AGCAGCAGCAGCAGCAGCAGCAGCA-3. В другом варианте осуществления морфолиновый антисмысловой олигонуклеотид связывает транскрипт РНК DMPK специфичным к последовательности образом. В некоторых вариантах осуществления морфолиновый антисмысловой олигонуклеотид содержит 5'-аминомодификацию. В другом варианте осуществления морфолиновый антисмысловой олигонуклеотид может представлять собой фосфородиамидатный связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид.
B. Катионные проникающие в клетку пептиды и связанные с катионным пептидом морфолино
Морфолиновые антисмысловые олигонуклеотиды, описанные в данном документе, присоединены к катионному пептиду, который облегчает систематическую доставку морфолиновых антисмысловых олигонуклеотидов в мышечные клетки. В целом катионный пептид, как описано в данном документе, может иметь от 8 до 30 аминокислотных остатков в длину и состоять из субпоследовательностей, выбранных из группы, состоящей из RXR, RX, RB и RBR; где R представляет собой аргинин (который может включать в себя D-аргинин), Β представляет собой β-аланин, и каждый X представляет собой независимо -NH-(CHR1)n-C(O)-, где n составляет 4-6, и каждый R1 представляет собой независимо H или метил, так что самое большее два R1 являются метилом. В некоторых вариантах осуществления каждый R1 является водородом. В других вариантах осуществления катионный пептид может быть любым из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислотных остатков в длину. В другом варианте осуществления переменная составляет 5, как, например, в 6-аминогексановой кислоте. В варианте осуществления катионный пептид содержит аминокислотную последовательность Ac(RXRRBR)2XB-, где Ac представляет собой ацетильную группу. В другом варианте осуществления катионный пептид содержит аминокислотную последовательность Ac(RXR)4XB-, где Ac представляет собой ацетильную группу. Дополнительную информацию относительно синтеза и структуры катионных проникающих в клетку пептидов можно найти в публикации патентной заявки США №2009/0099066, раскрытие которой полностью включено в данный документ посредством ссылки.
В одном варианте катионный пептид присоединен непосредственно к морфолиновому антисмысловому олигонуклеотиду. В других вариантах осуществления катионный пептид присоединен к морфолиновому антисмысловому олигонуклеотиду через спейсерную группу, присоединенную к 5'-концу морфолинового антисмыслового олигонуклеотида. Спейсерная группа может быть введена в пептид во время синтеза катионного пептида. К примеру, когда спейсер содержит свободную аминогруппу и вторую функциональную группу (например, карбоксильную группу или аминогруппу), которая позволяет связывание с другой молекулярной группой, спейсер может быть конъюгирован с твердой подложкой, применяемой для синтеза пептида. Впоследствии катионный пептид может быть синтезирован непосредственно на свободной аминогруппе спейсера посредством стандартной твердофазной технологии. В другом варианте осуществления спейсерная группа может быть конъюгирована с катионным пептидом после синтеза пептида. Такое конъюгирование может быть достигнуто хорошо разработанными в данной области способами. В варианте осуществления линкер содержит по меньшей мере одну функциональную группу, пригодную для присоединения к целевой функциональной группе синтезированного катионного пептида. К примеру, спейсер со свободной аминогруппой может быть подвергнут реакции с катионными пептидами C-концевой карбоксильной группы. В некоторых вариантах осуществления спейсерная группа содержит:
 .
.
В варианте осуществления связанные с катионным пептидом морфолиновые антисмысловые олигонуклеотиды имеют следующую структуру:
 ,
,
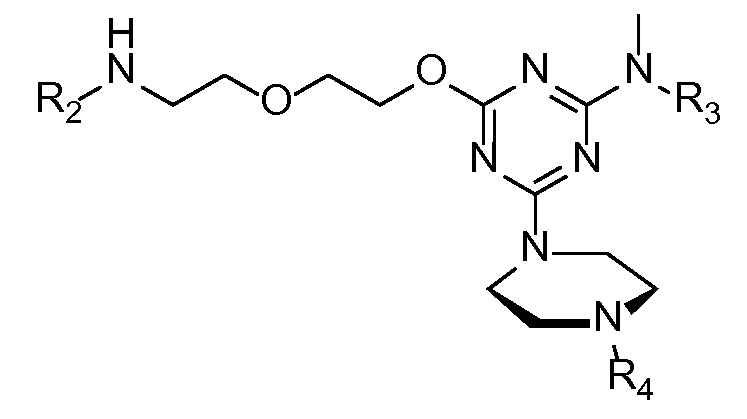
в которой R2 представляет собой катионный пептид (такой как любой из катионных пептидов, раскрытых в данном документе), R3 представляет собой H, CH3 или CH2CONH2, и R4 представляет собой морфолиновый антисмысловой олигонуклеотид, содержащий последовательность 5'-(AGC)n-3', 5'-(GCA)n-3' или 5'-(CAG)n-3', в которой n составляет любое значение из приблизительно 5-25. В другом варианте осуществления связанные с катионным пептидом морфолиновые антисмысловые олигонуклеотиды могут дополнительно содержать от 1 до 2 добавочных морфолиновых нуклеотидов на 5'- и/или 3'-конце олигонуклеотидов.
В другом варианте присоединенный к катионному пептиду морфолиновый антисмысловой олигонуклеотид содержит
 ,
,
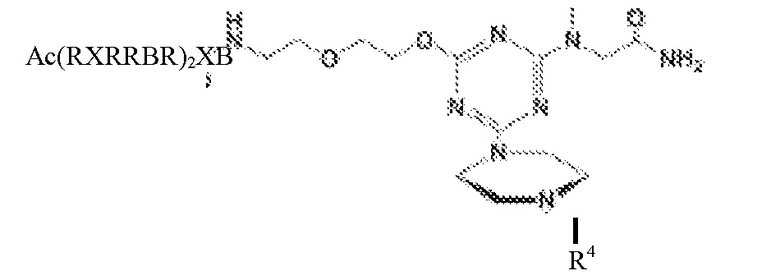
в которой Ac представляет собой ацетил, R представляет собой аргинин (который может включать в себя D-аргинин), Β представляет собой β-аланин, каждый X представляет независимо -NH-(CHR1)n-C(O)-, где n составляет 4-6, и каждый R1 представляет собой H, и R4 представляет собой морфолиновый антисмысловой олигонуклеотид, содержащий последовательность 5'-AG(CAG)7CA-3'.
В другом варианте присоединенный к катионному пептиду морфолиновый антисмысловой олигонуклеотид содержит
 ,
,
в которой Ac представляет собой ацетил, R представляет собой аргинин (который может включать в себя D-аргинин), Β представляет собой β-аланин, каждый X независимо представляет собой -NH-(CHR1)n-C(O)-, где n составляет 4-6, и каждый R1 представляет собой H, и R4 представляет собой морфолиновый антисмысловой олигонуклеотид, содержащий последовательность 5'-AG(CAG)7CA-3'.
C. Фармацевтические составы
При применении в качестве фармацевтических средств связанные с катионным пептидом морфолиновые антисмысловые олигонуклеотиды, раскрытые в данном документе, могут быть составлены с фармацевтически приемлемым вспомогательным веществом или носителями в фармацевтическую композицию.
При применении в качестве фармацевтических средств связанные с катионным пептидом морфолиновые антисмысловые олигонуклеотиды могут быть введены в форме фармацевтических композиций. Эти соединения могут быть введены разнообразными путями, включая оральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и внутриносовой. Эти соединения эффективны как в инъецируемой, так и в оральной композиции. Такие композиции приготовлены хорошо известным в фармацевтической области образом и содержат по меньшей мере одно активное соединение.
Данное открытие также включает в себя фармацевтические композиции, которые содержат в качестве активного ингредиента один или более из связанных с катионным пептидом морфолиновых антисмысловых олигонуклеотидов, ассоциированных с одним или более фармацевтически приемлемыми вспомогательными веществами или носителями. При создании композиций этого изобретения активный ингредиент обычно смешивают с вспомогательным веществом или носителем, разбавляют вспомогательным веществом или носителем или заключают в такое вспомогательное вещество или носитель, который может быть в форме капсулы, саше, бумажного или другого контейнера. Когда вспомогательное вещество или носитель служит в качестве разбавителя, он может являться твердым, мягким или жидким материалом, который действует в качестве основы, носителя или среды для активного ингредиента. Таким образом, композиции могут быть в форме таблеток, пилюль, порошков, леденцов, саше, капсул, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в виде твердой или жидкой среды), мазей, содержащих, к примеру, вплоть до 10% по массе активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных инъецируемых растворов и стерильных упакованных порошков.
При изготовлении состава может быть необходимо размолоть активное соединение для обеспечения подходящего размера частиц перед комбинированием с другими ингредиентами. Если активное соединение является по существу нерастворимым, то обычно его размалывают до размера частиц менее чем 200 меш. Если активное соединение является по существу водорастворимым, то размер частиц обычно регулируют размалыванием для обеспечения по существу однородного распределения состава, например, приблизительно 40 меш.
Некоторые примеры пригодных вспомогательных веществ или носителей включают в себя лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, аравийскую камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, стерильную воду, сироп и метилцеллюлозу. Составы могут дополнительно включать в себя: смазывающие агенты, такие как тальк, стеарат магния и минеральное масло; смачивающие агенты; эмульгирующие и суспендирующие агенты; консервирующие агенты, такие как метил- и пропилгидроксибензоаты; подслащивающие агенты и ароматизирующие агенты. Композиции открытия могут быть составлены так, чтобы обеспечивать быстрое, устойчивое или замедленное высвобождение активного ингредиента после введения пациенту посредством процедур, известных в данной области.
Композиции предпочтительно составляют в единичную форму дозирования, при этом каждое дозирование содержит от приблизительно 5 мг до приблизительно 100 мг или более, такое как любое из от приблизительно 5 мг до приблизительно 10 мг, от приблизительно 5 мг до приблизительно 20 мг, от приблизительно 5 мг до приблизительно 30 мг, от приблизительно 5 мг до приблизительно 40 мг, от приблизительно 5 мг до приблизительно 50 мг, от приблизительно 5 мг до приблизительно 60 мг, от приблизительно 5 мг до приблизительно 70 мг, от приблизительно 5 мг до приблизительно 80 мг или от приблизительно 5 мг до приблизительно 90 мг включительно активного ингредиента, включая любой диапазон между этими величинами. Термин "единичные формы дозирования" относится к физически дискретным единицам, пригодным в качестве единичных дозирований для индивидуумов, при этом каждая единица содержит заранее определенное количество активного материала, рассчитанное для выработки требуемого терапевтического эффекта, в сочетании с пригодным фармацевтическим вспомогательным веществом или носителем.
Связанные с катионным пептидом морфолиновые антисмысловые олигонуклеотиды эффективны в широком диапазоне дозирований, и их обычно вводят в терапевтически эффективном количестве. Однако будет принято во внимание то, что фактически вводимое количество связанных с катионным пептидом морфолиновых антисмысловых олигонуклеотидов будет определено врачом, исходя из соответствующих обстоятельств, включая подвергаемое лечению состояние, выбранный путь введения, вводимое действующее соединение, возраст, вес и ответ индивидуального пациента, тяжесть симптомов пациента и тому подобное.
Для изготовления твердых композиций, таких как таблетки, основной активный ингредиент/связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид смешан с фармацевтическим вспомогательным веществом или носителем для формирования твердой предварительной композиции, содержащей гомогенную смесь соединения данного открытия. При ссылке на эти предварительные композиции как гомогенные, подразумевается, что активный ингредиент диспергирован равномерно по всему объему композиции так, что композиция может быть легко подразделена на одинаково эффективные единичные формы дозирования, такие как таблетки, пилюли и капсулы.
Таблетки или пилюли по данному открытию могут быть покрыты или иным образом введены в состав для обеспечения формы дозирования, предоставляющей преимущество пролонгированного действия. К примеру, таблетка или пилюля может содержать внутренний компонент дозирования и внешний компонент дозирования, при этом последний имеет форму оболочки над первым. Два компонента могут быть разделены энтеральным слоем, который служит для противодействия разрушению в желудке и позволяет внутреннему компоненту проходить неповрежденным в двенадцатиперстную кишку или подвергаться замедленному высвобождению. Разнообразные материалы могут быть применены для таких энтеральных слоев или покрытий, при этом такие материалы включают ряд полимерных кислот и смесей полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетат целлюлозы.
Жидкие формы, в которые новые композиции по данному открытию могут быть инкорпорированы для введения орально или инъекцией, включают в себя водные растворы, соответствующим образом ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как кукурузное масло, хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, также как и эликсиры и подобные фармацевтические носители.
Композиции для ингаляции или инсуффляции включают в себя растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смеси и порошки. Жидкие или твердые композиции могут содержать пригодные фармацевтически приемлемые вспомогательные вещества, как описано выше. Композиции могут быть введены оральным или назальным респираторным путем для местного или систематического эффекта. Композиции в фармацевтически приемлемых растворителях могут быть распылены посредством применения инертных газов. Распыленные растворы могут быть ингалированы непосредственно из распыляющего устройства, или распыляющее устройство может быть присоединено к маске для лица или к дыхательному аппарату с интермиттирующим положительным давлением. Раствор, суспензия или порошковые композиции могут также быть введены орально или назально из устройств, которые доставляют состав подходящим образом.
IV. Способы по изобретению
Связанные с катионным пептидом морфолиновые (PPMO) антисмысловые олигонуклеотиды (такие как в композиции), раскрытые в данном документе, могут быть применены для лечения и/или предотвращения симптомов миотонической дистрофии типа I (DM1) у индивидуума. В некоторых вариантах индивидуум имеет риск развития DM1. В некоторых вариантах способ может содержать лечение и/или предотвращение симптомов, ассоциированных с DM1 (таких как любой из симптомов, описанных в данном документе), у индивидуума посредством систематического введения индивидууму эффективного количества присоединенных к катионному пептиду морфолиновых (PPMO) антисмысловых олигонуклеотидов или композиций, содержащих то же самое, раскрытых в данном документе. В некоторых вариантах осуществления у индивидуума диагностируют или подозревают наличие DM1.
Данное открытие направлено на способы ингибирования симптомов или состояний (нетрудоспособность, ограничение возможностей), ассоциированных с DM1, как подробно описано ниже. По сути, не требуется, чтобы все эти эффекты состояния были полностью предотвращены или инвертированы, хотя эффекты способов, раскрытых в данном изобретении, по-видимому, могут распространяться до значительных терапевтических преимуществ для пациента. По сути, терапевтическое преимущество необязательно полностью предотвращает или лечит конкретное состояние, полученное результате DM1, но, скорее, может охватывать результат, который включает в себя снижение или предотвращение симптомов, которые происходят в результате DM1, снижая или предотвращая проявление таких симптомов (или количественно, или качественно), снижая тяжесть таких симптомов или их физиологические эффекты и/или усиливая восстановление индивидуума после испытания им симптомов DM1.
В другом варианте предоставлены способы снижения агрегирования одного или более транскриптов мРНК DMPK внутри клетки. В некоторых вариантах осуществления способ предотвращает агрегирование одного или более транскриптов мРНК DMPK в ядре клетки.
В другом варианте в данном документе представлены способы снижения агрегирования одного или более транскриптов мРНК DMPK и одного или более ядерных белков или РНК внутри клетки. В некоторых вариантах осуществления один или более ядерных белков представляют собой белки, задействованные в сплайсинге пре-мРНК (иначе называемые гетероядерные РНК (гяРНК)) в зрелые сплайсированные мРНК. В варианте осуществления ядерные белки являются малыми сердцевинными белками (иначе называемыми белки Sm) и могут быть одним или более из SmB, SmB', SmD1, SmD2, SmD3, SmE, SmF, SmG или SmN. В некоторых вариантах осуществления одна или более ядерных РНК является РНК, задействованной в сплайсинге гяРНК в зрелые сплайсированные мРНК. В другом варианте осуществления ядерные РНК являются малыми ядерными РНК (мяРНК) и могут быть одной или более из U1, U2, U3, U4, U5, U6, U11, U12, U4atac или U6atac. В некоторых вариантах осуществления один или более ядерных белков или РНК содержат ядерный рибопротеиновый комплекс. В другом варианте осуществления РНК могут являться РНК, которая не является частью аппарата клеточного сплайсинга, такими как Serca-1, m-Titin, Zasp и CIC-1. В варианте осуществления клетка является мышечной клеткой, такой как скелетная мышечная клетка, клетка гладкой мышцы или сердечная мышечная клетка.
В частности, композиция данного открытия при введении индивидууму может лечить или предотвращать одно или более из симптомов или состояний, ассоциированных с DM1, и/или снижать или облегчать симптомы или состояния, ассоциированные с этим нарушением. По сути, защита индивидуума от эффектов или симптомов, полученных в результате DM1, включает в себя как предотвращение или снижение проявления и/или тяжести эффектов нарушения, так и лечение пациента, у которого эффекты нарушения уже произошли или начинают происходить. Благоприятный эффект может легко быть оценен рядовым специалистом в данной области и/или подготовленным клиницистом, который лечит пациента. Предпочтительно, существует положительное или благоприятное различие в тяжести или проявлении по меньшей мере одной клинической или биологической оценки, значения или величины, применяемой для оценки таких пациентов среди тех, кто был обработан со способами по данному открытию, по сравнению с теми, кто не был обработан.
A. Миотоническая дистрофия
Миотоническая дистрофия (иначе называемая миотоническая дистрофия или атрофическая миотония) является хроническим, медленно прогрессирующим, очень изменчивым, наследственным мультиситемным заболеванием с предоминантными симптомами, которые включают в себя мышечное истощение (мышечная дистрофия), катаракты, нарушения сердечной проводимости, эндокринные изменения и миотонию. Миотоническая дистрофия типа 1 (DM1), иным образом именуемая "заболевание Штейнерта", имеет как острую врожденную форму, так и форму с началом в средний период детства и является результатом мутации гена, расположенного в длинном плече хромосомы 19, называемого протеинкиназа миотонической дистрофии (DMPK), кодирующего белок, экспрессируемый преимущественно в скелетной мышце. Миотоническая дистрофия типа 2 (DM2), также называемая проксимальной миотонической миопатией (PROMM), является более редкой, чем DM1, и обычно проявляется с более мягкими признаками и симптомами. DM2 непосредственно вызвана нарушением гена ZNF9 на хромосоме 3. Миотоническая дистрофия может возникнуть у пациентов любого возраста, и формы заболевания отражают аутосомную доминантную модель наследования. DM1 является наиболее распространенной формой мышечной дистрофии, диагностируемой у взрослых с распространенностью, варьирующейся от 1 на 100000 в Японии до 3-15 на 100000 в Европе (Turner & Hilton-Jones, 2010, J Neurol Neurosurg Psychiatry 81:358-367).
Возраст в начале, а также тяжесть симптомов у индивидуумов, пораженных DM1, может значительно варьироваться даже между генетически родственными индивидуумами. У некоторых индивидуумов симптомы могут выражаться при рождении или не становиться различимыми до старости. DM1 является прогрессирующим нарушением с симптомами, обычно медленно становящимися хуже с течением времени. Следовательно, индивидуумы, у которых симптомы проявляются в ранний период жизни, как правило, испытывают большее количество осложнений и более тяжелые симптомы по сравнению с теми индивидуумами, у которых не присутствуют симптомы типичных нарушений до более позднего возраста. Тем не менее, индивидуальный прогноз варьируется и не может быть точно предсказан относительно того, как заболевание будет воздействовать на любого из индивидуумов.
1. Сердечно-сосудистые симптомы
Некоторые индивидуумы с DM1 могут испытывать от умеренных до тяжелых сердечно-легочных нарушений. К примеру, внезапная смерть из-за полной блокировки сердечной проводимости и желудочковая фибрилляция/тахикардия, вызванная кардиомиопатией, в некоторых случаях была обоснована DM1. Другие сердечно-сосудистые симптомы, которые были ассоциированы с DM1, включают в себя, но не ограничены ими, кардиогенный обморок и предобморочное состояние, нарушения сердечной проводимости, сердечные аритмии, гипотонию и застойную сердечную недостаточность. Часто у индивидуумов, у которых диагностировали DM1, развиваются сердечно-сосудистые симптомы после начала других нервно-мышечных симптомов. Однако некоторые данные указывают на то, что бессимптомные дети имеют заметный риск внезапной сердечной смерти.
2. Симптомы центральной нервной системы
Избыточная дневная сонливость (гиперсомния) часто наблюдается у индивидуумов с DM1 независимо от возраста начала. Хотя общее утомление также часто наблюдается при DM1, гиперсомния характеризуется потребностью в частом сне, зачастую непредсказуемо в течение дня, несмотря на нормальную или большую, чем нормальная, продолжительность ночного сна.
Хотя значительные нарушения периферического нерва не были подтверждены у индивидуумов с диагностированной DM1, некоторые небольшие нарушения функции периферического нерва были подтверждены в исследованиях нервной проводимости. Непосредственная причина индуцированной DM1 дисфункции периферического нерва в настоящее время неизвестна.
3. Симптомы желудочно-кишечного тракта
Желудочно-кишечные симптомы часто наблюдаются при DM1, и они происходят в результате дисфункции скелетных и/или гладких мышц пищеварительного тракта. Эти симптомы включают затруднение глотания из-за слабости/миотонии рта, языка или горла, гастроэзофагеальный рефлюкс из-за расслабления нижнего пищеводного сфинктера, боли в области живота, тошноту, рвоту, вздутие или кишечную псевдонепроходимость из-за неэффективного сокращения перистальтической гладкой мышцы в кишечнике и желудке, желчные камни, образовавшиеся в результате слабой/миотонической мускулатуры желчного протока/желчного пузыря, запор, диарею или малабсорбцию, вызванные нарушением кишечной моторикики, и недержание кала из-за мышечной слабости анального сфинктера и диафрагмы таза.
4. Симптомы репродуктивной и эндокринной системы
DM1 ассоциирована со значительными нарушениями репродуктивной и эндокринной системы. У мужчины эти симптомы могут быть не очевидны вплоть до взрослого состояния, когда гормональные и эндокринные изменения, ассоциированные с половой зрелостью, не могут произойти или являются замедленными. У самцов DM1 ассоциирована с тестикулярной атрофией, которая может привести в результате к сниженной или отсутствующей выработке спермы и мужской бесплодности, слабому развитию вторичных половых признаков, включая сниженное количество энергии, либидо, половых волос, мышечной массы и минеральной плотности костей. Кроме того, самцы с DM1 часто испытывают низкие уровни тестостерона в сыворотке, сопровождаемые повышенными уровнями лютеинизирующего гормона и фолликулостимулирующего гормона в сыворотке. Повышенные уровни ФСГ ассоциированы с аномально высокими соотношениями эстрадиол:тестостерон, что может привести к увеличению груди у самцов. В заключение, самцы с DM1 часто испытывают высокие показатели облысения по мужской модели и потерю волос.
5. Респираторные симптомы
Из-за мышечной слабости в диафрагме, абдоминальных и межреберных мышцах, а также миотонии респираторных мышц DM1 может быть ассоциирована с респираторной недостаточностью, и в наиболее тяжелых случаях может требоваться механическая вентиляция для содействия дыханию индивидуума. Дополнительно из-за слабости этих мышц у индивидуума с DM1 часто отсутствует сила для кашля после непреднамеренной аспирации еды или напитка, слюны, назальных выделений и жидких сред желудка в легкие, что обычно сопровождается затруднениями глотания при заболевании. Это может привести к повреждению и воспалению легких и бронхов в результате инфекции.
Другим респираторным симптомом, воздействующим на индивидуумов с DM1, является апноэ во время сна, которое является нарушением во время сна, характеризуемым неправильными приостановками дыхания или примерами аномально низкого дыхания во время сна, привнесенными при DM1 слабостью респираторной мышцы. Каждая приостановка дыхания, называемая апноэ, может продолжаться в течение от нескольких секунд до минут и может происходить от 5 до 30 раз или более в час. Недостаточный воздушный поток из-за апноэ во время сна (периоды отсутствия воздушного потока из-за узких дыхательных путей и прерывистого дыхания) может в результате привести к опасно низким уровням кислорода и высоким уровням диоксида углерода в крови. При умеренных случаях апноэ может вызывать нарушенный сон, чрезмерное утомление и утренние головные боли. В тяжелых случаях апноэ может вызывать высокое давление крови, сердечные аритмии и сердечный приступ.
6. Симптомы скелетной мышцы
Индивидуумы с DM1 обычно испытывают миотонию, что характеризуется медленной релаксацией мышц после произвольного сокращения или электрической стимуляции. Обычно, требуется повторное усилие для релаксации мышц, и состояние улучшается после того, как мышцы разогрелись. Однако длительное, тяжелое упражнение также может запустить это состояние. Индивидуумы с нарушением могут иметь проблемы с захватом объектов или могут иметь затруднение с подъемом из сидячего положения и жесткую, неуклюжую походку. Хотя любая скелетная мышца может испытывать миотонию, DM1 имеет тенденцию поражать некоторые мышцы тела более часто, чем другие. Они включают в себя мышцы предплечья и пальцев и мышцы языка и челюсти, что может привести к проблемам с речью или пережевыванием пищи. Дополнительно, быстрые движения могут иногда инициировать мышечную неподвижность, характерную для миотонии при DM1.
Мышечную слабость и атрофию также наблюдают у многих индивидуумов, страдающих от DM1. Мышечная слабость DM1 типично воздействует на некоторые мышцы, тогда как другие мышцы могут испытывать от малой до отсутствия слабости или могут поддерживать нормальную силу. Мышечная слабость является первичной причиной нетрудоспособности индивидуумов с DM1 и, как правило, воздействует на подвижность, ловкость рук и способность поднимать от умеренных до тяжелых объектов. В более тяжелых случаях индивидуумы испытывают проблемы с дыханием или глотанием, вызванные слабостью мышц горла и груди (например, мышца диафрагмы).
Кроме того, DM1 часто сопровождается мышечной болью. Боль может воздействовать на мышцу саму по себе или может иметь источник в суставах, связках или позвоночнике. Дополнительно, мышечная слабость может предрасполагать индивидуумов с DM1 к артритическому растяжению в этих областях.
У самок DM1 ассоциирована с осложнениями, от умеренных до тяжелых, ассоциированными с беременностью и родами, также как и со сниженной фертильностью. Это может включать в себя раннее начало менопаузы, более высокие степени самопроизвольных абортов и выкидышей, длительные схватки и роды, связанные с маточной дисфункцией, вызванной мышечной слабостью или миотонией, маточное растяжение, связанное с полигидрамнионом, что может вызывать преждевременные схватки, неадекватные маточные сокращения (атоническая матка) или преждевременный самопроизвольный разрыв мембраны, а также послеродовое кровотечение из-за неадекватных маточных сокращений (атоническая матка) или задержки отделения плаценты.
У новорожденных DM1 симптомы могут включать в себя симптомы, такие как полигидрамнион (чрезмерное накопление околоплодной жидкости из-за пониженного фетального глотания), что ассоциировано с повышенными рисками неблагоприятного исхода беременности, выпадение петель пуповины или отслоение плаценты, неправильное положение плода из-за большей фетальной подвижности, преждевременные роды, фетальный отек и пониженное фетальное движение.
7. Зрительные симптомы
Зрительные нарушения у пациентов с DM1 часто ассоциированы с развитием катаракты. Постериорные субкапсулярные радужные помутнения хрусталика представляют начальную фазу формирования катаракты при миотонической дистрофии и обнаруживаются только с биомикроскопией с щелевой лампой. Такие помутнения обычно обнаруживают у пациентов, у которых еще не развились никакие зрительные симптомы. Присутствие этого типа помутнений хрусталика и более зрелые катаракты могут быть единственным признаком заболевания. Блики и размытость зрения развиваются в виде прогрессирования помутнений хрусталика в звездообразные катаракты и, в конечном счете, в зрелые катаракты, которые являются неразличимыми от обычных катаракт. Катаракты при DM1 могут прогрессировать быстрее, чем обычные катаракты, и таким образом могут быть представлены пациенты с DM1 с ранним началом катаракты.
Дополнительные зрительные симптомы, ассоциированные с DM1, могут включать в себя ретинопатию, двухсторонний блефароптоз (провисание или падение верхнего или нижнего века), окулярную гипотонию и окулярную миотонию.
8. Клеточные и молекулярные симптомы
Генетическое повреждение DM1 приводит в результате к РНК транскрипту DMPK, содержащему большое количество повторов CUG в 3'-нетранслируемой области, который приобретает свойства получения функции и стимулирует РНК-опосредованную токсичность в клетках и тканях, экспрессирующих мутантный транскрипт DMPK. Настоящая модель процесса заболевания DM1 относится к взаимодействию РНК CUGexp с ядерными связывающими белками, в конечном счете приводя к неправильной регуляции альтернативного сплайсинга для выбранной группы пре-мРНК. Наиболее значительным молекулярным нарушением, идентифицированным в DM1, является мисрегуляция альтернативного сплайсинга. Хотя некоторые человеческие генетические нарушения могут быть обоснованы эффектами мутаций на сплайсинг РНК, почти все из этих эффектов являются цис-действующими эффектами, которые воздействуют на сплайсинг индивидуальной пре-мРНК, что приводит к неправильно сплайсированным транскриптам, кодирующим нефункциональный мутантный белок (Osborne & Thornton, 2006, Hum Mol Genet., 15; 15 Spec No 2:R162-9; Faustino & Cooper, 2003, Gens Dev., 17:419-437). DM1 является первым примером человеческого генетического заболевания, являющегося результатом сплайсеопатии, т.е. транс-эффекта на альтернативный сплайсинг многих РНК, что не приводит в результате к выработке мутантного белка, но приводит к экспрессии сплайсированных продуктов, которые являются эволюционно-неподходящими для конкретной ткани (Osborne & Thornton, 2006, Hum Mol Genet., 15; 15 Spec No 2:R162-9).
Белки muscleblind (MBNL) первоначально идентифицировали на связывание (CUG)90 вместо (CUG)11 in vitro (Miller et al., 2000, EMBO J., 19:4439-4448). Эти белки интенсивно привлекаются в ядерные очаги при DM1 (Mankodi et al., 2003, Ann. Neurol., 54:760-768). Из трех генов млекопитающих MBNL в скелетной мышце, сердце и мозге экспрессируются MBNL1 и MBNL2, и MBNL3 экспрессируется в основном в плаценте (Osborne & Thornton, 2006, Hum Mol Genet., 15;15 Spec No 2:R162-9). Уровня CUGexp, экспрессированного при DM1, достаточно для заметного изменения клеточного распределения MBNL1. В мозге, скелетной мышце и сердце MBNL1 привлекается в рибонуклеарные очаги до такой степени, что он бывает заметно обеднен в других местах в нуклеоплазме (Jiang et al., 2004, Hum. Mol. Genet. 13:3079-3088; Osborne & Thornton, 2006, Hum Mol Genet., 15; 15 Spec No 2:R162-9). Деструкция гена MBNL1 в мышах репродуцирует не только миотоническую миопатию, подобную DM1, но также DM1-подобные катаракты и сердечное заболевание (Osborne & Thornton, 2006, Hum Mol Genet., 15; 15 Spec No 2:R162-9). Не ограничиваясь какой-либо теорией, эти обнаружения предполагают, что секвестрация MBNL1 белка на повторное удлинение РНК играет важную роль в фенотипе и симптомах, ассоциированных с DM1.
Другим белком, который, как предполагают, играет роль в DM1, является CUG-BP1, который также способен индуцировать DM1-подобные эффекты на альтернативный сплайсинг в мышце (Philips et al., 1998, Science, 280:737-741), и он был впервые идентифицирован при связывании с олигонуклеотидами (CUG)8 in vitro (Timchenko et al., 1996, Nucleic Acids Res., 24:4407-4414). Также следует отметить аберрантный сплайсинг хлоридного канала мРНК ClC-1, который, как было продемонстрировано, в результате непосредственно приводит к миотонии (Mankodi et al., 2002, Mol. Cell, 10:35-44). Другие белки, которые, как было продемонстрировано, имеют альтернативный сплайсинг с нарушенной регуляцией в скелетных мышцах индивидуумов с DM1, включают в себя, но не ограничены ими, белки, кодируемые генами ALP, CAPN3, CLCN1, FHOS, GFAT1, IR, MTMR1, NRAP, RYR1, SERCA1, z-Titin, m-Titin, TNNT3 или ZASP. Белки, которые, как было продемонстрировано, имеют альтернативный сплайсинг с нарушенной регуляцией в сердечной мышце индивидуумов с DM1, включают в себя, но не ограничены ими, белки, кодируемые генами TNNT2, ZASP, m-Titin, KCNAB1 или ALP. Белки, которые, как было продемонстрировано, имеют альтернативный сплайсинг с нарушенной регуляцией в неврологической ткани индивидуумов с DM1, включают в себя, но не ограничены ими, белки, кодируемые генами TAU, APP или NMDAR1 (Osborne & Thornton, 2006, Hum Mol Genet., 15; 15 Spec No 2:R162-9).
B. Способы лечения миотонической дистрофии типа-I
В данном документе представлены способы лечения миотонической дистрофии типа 1 (DM1) у индивидуума, нуждающегося в этом, содержащие: систематическое введение индивидууму терапевтически эффективного количества связанного с катионным пептидом морфолинового антисмыслового олигонуклеотида (такого как любой из связанных с катионным пептидом морфолиновых антисмысловых олигонуклеотидов, раскрытых в данном документе), содержащего последовательность, комплементарную по по меньшей мере 3 последовательностям повтора поли-CUG в 3'-нетранслируемой области (UTR) РНК транскрипта протеинкиназы миотонической дистрофии (DMPK), в котором введение связанного с катионным пептидом морфолинового антисмыслового олигонуклеотида облегчает по меньшей мере один симптом DM1 в по меньшей мере двух мышцах. В варианте осуществления мышцы могут представлять собой скелетные мышцы, гладкие мышцы и/или сердечную мышцу. В другом варианте осуществления мышцы являются скелетными мышцами и могут включать в себя, без ограничения, переднюю большеберцовую мышцу, четырехглавую мышцу и/или икроножную мышцу. В некоторых вариантах осуществления введение связанного с катионным пептидом морфолинового антисмыслового олигонуклеотида может быть выполнено внутривенно, внутрибрюшинно или подкожно. В других вариантах осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид может быть введен индивидууму любым образом из следующего: раз в день, раз в два дня, раз в три дня, раз в четыре дня, раз в 5 дней, раз в 6 дней или раз в 7 дней. В некоторых вариантах осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид может быть введен индивидууму в течение периода вплоть до одной недели, двух недель, трех недель, четырех недель, пяти недель, шести недель, семи недель, восьми недель, девяти недель, десяти недель, одиннадцати недель, двенадцати недель, четырех месяцев, пяти месяцев, шести месяцев, семи месяцев, восьми месяцев, девяти месяцев, десяти месяцев, одиннадцати месяцев, одного года, двух лет, трех лет, четырех лет, пяти или более лет или времени жизни включительно, включая периоды времени между этими значениями. В других вариантах осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят индивидууму в любой концентрации из приблизительно 2 мг/кг, 4 мг/кг, 6 мг/кг, 8 мг/кг, 10 мг/кг, 12 мг/кг, 14 мг/кг, 16 мг/кг, 18 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг, 40 мг/кг, 45 мг/кг, 50 мг/кг, 55 мг/кг, 60 мг/кг, 65 мг/кг, 70 мг/кг, 75 мг/кг, 80 мг/кг, 85 мг/кг, 90 мг/кг, 95 мг/кг или 100 мг/кг или более включительно, включая концентрации между этими величинами. В варианте осуществления по меньшей мере один упомянутый симптом DM1 представляет собой миотонию. В варианте осуществления упомянутый по меньшей мере один симптом DM1 представляет собой агрегирование белка musclebind-like-1 (MBNL-1) в рибонуклеарных очагах внутри миоядер. В другом варианте осуществления упомянутый по меньшей мере один симптом DM1 представляет собой неправильный сплайсинг по меньшей мере одного РНК транскрипта в мышечных клетках. В некоторых вариантах осуществления транскрипт РНК выбран из группы, состоящей из: Serca-1, m-Titin, Zasp и CIC-1. В варианте осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят с фармацевтически приемлемым вспомогательным веществом или носителем, такими как любое из фармацевтически приемлемых вспомогательных веществ или носителей, описанных в данном документе. В другом варианте осуществления индивидуум является человеком.
В некоторых вариантах любого из способов, раскрытых в данном документе, упомянутый по меньшей мере один симптом DM1 представляет собой симптом, воздействующий на одну или более скелетных мышц. В варианте осуществления симптом выбран из группы, состоящей из: миотонии, мышечной слабости, мышечной атрофии и мышечной боли.
В другом варианте любого из способов, раскрытых в данном документе, упомянутый по меньшей мере один симптом DM1 представляет собой симптом, воздействующий на сердечно-сосудистую систему. В варианте осуществления симптом выбран из группы, состоящей из: кардиогенного обморока и предобморочного состояния, нарушений сердечной проводимости, сердечной аритмии, гипотонии и застойной сердечной недостаточности.
В некоторых вариантах любого из способов, раскрытых в данном документе, упомянутый по меньшей мере один симптом DM1 представляет собой симптом, воздействующий на респираторную систему. В варианте осуществления симптом выбран из группы, состоящей из: слабости респираторной мышцы, аспирации и апноэ во время сна.
В другом варианте любого из способов, раскрытых в данном документе, упомянутый по меньшей мере один симптом DM1 представляет собой симптом, воздействующий на желудочно-кишечную систему. В варианте осуществления симптом выбран из группы, состоящей из следующего: затруднение жевания и глотания, желудочно-пищеводный рефлюкс, абдоминальная или грудная боль (диспепсия), тошнота, рвота, вздутие, кишечная псевдонепроходимость, холестаз, запор, диарея, кишечная малабсорбция, чрезмерное уплотнение стула, мегаколон, перфорация стенки кишечника, дисхезия и недержание кала.
В некоторых вариантах любого из способов, раскрытых в данном документе, упомянутый по меньшей мере один симптом DM1 представляет собой симптом, воздействующий на нервную систему. В варианте осуществления симптом выбран из группы, состоящей из следующего: когнитивное нарушение, чрезмерная дневная сонливость (гиперсомния), поведенческие затруднения, эмоциональные затруднения, затруднения социализации и периферическая невропатия.
В другом варианте любого из способов, раскрытых в данном документе, упомянутый по меньшей мере один симптом DM1 представляет собой симптом, воздействующий на репродуктивную и/или эндокринную систему. В варианте осуществления симптом выбран из группы, состоящей из следующего: тестикулярная атрофия, женское бесплодие, слабое развитие вторичных половых признаков, сниженная энергия, сниженное либидо, сниженное количество или отсутствие лобковых волос, сниженная мышечная масса, сниженная минеральная плотность костей, низкий сывороточный тестостерон, повышенный сывороточный лютеинизирующий гормон, повышенный сывороточный фолликулостимулирующий гормон, гинекомастия у самцов, ранняя менопауза, инсулиновая резистентность, преждевременное облысение по мужской модели и повышенные уровни соотношений эстрадиола к тестостерону у самцов.
В некоторых вариантах любого из способов, раскрытых в данном документе, упомянутый по меньшей мере один симптом DM1 представляет собой симптом, воздействующий на беременность. В варианте осуществления симптом выбран из группы, состоящей из следующего: самопроизвольный аборт, мертворождение, длительные схватки и роды, маточное растяжение, преждевременные схватки, миотонические спазмы после введения деполяризующих агентов, респираторное ослабление после введения барбитуратов и послеродовое кровотечение.
В другом варианте любого из способов, раскрытых в данном документе, упомянутый по меньшей мере один симптом DM1 представляет собой неонатальные осложнения. В варианте осуществления симптом выбран из группы, состоящей из следующего: полигидрамнион, выпадение петель пуповины, разрыв плаценты, неправильное положение плода, отек плода и фетальная акинезия.
В некоторых вариантах любого из способов, раскрытых в данном документе, упомянутый по меньшей мере один симптом DM1 представляет собой симптом, воздействующий на иммунную систему. В варианте осуществления симптом выбран из группы, состоящей из: гипогаммаглобулинемии и повышенной частоты пиломатриксомы.
В другом варианте любого из способов, раскрытых в данном документе, упомянутый по меньшей мере один симптом DM1 представляет собой симптом, воздействующий на глаз или зрение. В варианте осуществления симптом выбран из группы, состоящей из следующего: расплывчатое зрение, ретинопатия, двусторонний блефароптоз (птоз), глазная гипотония и глазная миотония.
C. Введение связанных с катионным пептидом морфолиновых антисмысловых олигонуклеотидов
В некоторых вариантах осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят в форме инъекции. Инъекция может содержать соединение в комбинации с водным инъецируемым вспомогательным веществом или носителем. Неограничивающие примеры пригодных водных инъецируемых вспомогательных веществ или носителей хорошо известны специалистам в данной области, и их способы приготовления составов можно найти в таких распространенных источниках как Alfonso AR: Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton Pa., 1985. Пригодные водные инъецируемые вспомогательные вещества или носители включают в себя воду, водный солевой раствор, водный раствор декстрозы и тому подобное и необязательно содержат усилители растворения, такие как 10% маннит или другие сахара, 10% глицин или другие аминокислоты. Композиция может быть инъецирована подкожно, внутрибрюшинно или внутривенно.
В некоторых вариантах осуществления применяется внутривенное введение, и оно может являться непрерывным внутривенным вливанием в течение периода от нескольких минут до одного часа или более, такого как около пятнадцати минут. Вводимое количество может широко варьироваться в зависимости от типа присоединенного к катионному пептиду морфолинового антисмыслового олигонуклеотида, размера единицы дозирования, типа вспомогательных веществ или носителей и других факторов, хорошо известных специалисту в данной области. Связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид может содержать, к примеру, от приблизительно 0,001% до приблизительно 10% (масс/масс), от приблизительно 0,01% до приблизительно 1%, от приблизительно 0,1% до приблизительно 0,8% или любой диапазон внутри приведенного, при этом оставшаяся часть содержит вспомогательное(ые) вещество(а) или носитель(и).
Для орального введения связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид может иметь форму, к примеру, таблеток или капсул, изготовленных посредством общепринятого средства с фармацевтически приемлемыми вспомогательными веществами или носителями, такими как связывающие агенты; наполнители; скользящие вещества; разрыхлители или смачивающие агенты. Жидкие препараты для орального введения могут иметь форму, к примеру, растворов, сиропов или суспензий, или они также могут быть представлены в виде сухого продукта для смешивания с водой или другим пригодным носителем перед применением. Такие жидкие препараты могут быть изготовлены посредством общепринятого средства с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сорбитный сироп, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгирующие агенты (например, лецитин или аравийская камедь); неводные носители (например, масло ationd, масляные эфиры, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил или пропил-п-гидроксибензоаты или сорбиновая кислота). Препараты могут также содержать буферные соли, ароматизирующие и окрашивающие в соответствующих случаях.
В некоторых вариантах осуществления связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид может быть введен ингаляцией посредством спрея-аэрозоля или распылителя, который может включать в себя пригодный газ-вытеснитель, такой как, к примеру, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или их комбинация. В неограничивающем примере единица дозирования для аэрозоля под давлением может быть доставлена посредством дозирующего клапана. В другом варианте осуществления капсулы и картриджи желатина, к примеру, могут быть применены в ингаляторе и могут быть составлены так, чтобы они содержали превращенную в порошок смесь соединения с пригодным порошкообразным основанием, таким как, к примеру, крахмал или лактоза.
ПРИМЕРЫ
Пример 1: Внутримышечная инъекция двух различных конъюгатов PPMO в переднюю большеберцовую мышцу корректирует аберрантный сплайсинг РНК
Большие удлинения тринуклеотидных последовательностей CUG обеспечивают основу для получения функции токсичной РНК, что приводит к пагубным изменениям в метаболизме РНК. Такой повторный элемент CUG обычно находится в 3’-нетранслируемой области протеинкиназы DMPK, но при удлинении он является генетическим повреждением - миотонической дистрофией типа I (DM1), наследственным нервно-мышечным заболеванием. Патогенный транскрипт DMPK, содержащий удлинение CUG, сохраняется в рибонуклеарных очагах как часть комплекса с РНК связывающими белками, такими как muscleblind-like 1 (MBNL1), приводя в результате к аберрантному сплайсингу многочисленных транскриптов РНК и физиологическим нарушениям, включая миотонию.
В этом примере проводили реакции конденсационного синтеза для генерирования PPMO конъюгатов, содержащих основанные на 25-мерных последовательностях CAG морфолино (Wheeler et al., 2009, Science 325:336-339), CAG25, и проникающий в клетку пептид ковалентно присоединяли к спейсерной группе, расположенной на 5'-конце морфолино (фиг. 1a). Дополнительно, для определения влияния спейсера и пептидных модификаций на биоактивность PPMO-B и PPMO-K выполняли ряд инъекций в/м в переднюю большеберцовую (TA) мышцу трансгенных мышей HSALR и оценивали сплайсинг РНК Serca-1.
Материалы и способы
Конъюгирование проникающих в клетку пептидов с морфолиновыми олигонуклеотидами
PPMO конъюгаты синтезировали, как описано Abes et al., с модификациями, как описано ниже (2006, J Control Release 116:304-313). Пептид Β (Ac(RXRRBR)2XB-COOH) или пептид Κ (Ac(RXR)4XB-COOH) (Anaspec, Fremont, CA) активировали в диметилформамиде, содержащем O-(6-хлорбензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторофосфат (HCTU)/диизопропилэтиламин (DIEA) в молярных соотношениях 1:2 на моль пептида при комнатной температуре (КТ). Морфолино CAG25 (5'-AGCAGCAGCAGCAGCAGCAGCAGCA-3') (Gen Tools, Philomath, OR) с первичной 5'-аминомодификацией растворяли в диметилсульфоксиде и добавляли к активированному пептиду Β или пептиду Κ с молярным избытком пептида:ASO 1:2-1,5, и реакции позволяли протекать в течение 2 ч при КТ. Реакцию резко охлаждали водой; конъюгаты PPMO очищали на карбоксиметилсефарозе (GE Healthcare, Piscataway, NJ) и элюировали в 2 M гуанидин-HCl, 1 M NaCl, pH 7,5, 20% ацетонитрил. Элюат диализировали несколько раз против буфера 0,1 мМ NaHCO3 в диализной кассете с размером пор отделяющей мембраны 3000 Да. Диализованный PPMO определяли количественно спектрофотометрическим поглощением в 0,1 Н HCl при 265 нм, замораживали и лиофилизировали.
Повторное выведение и генотипирование HSALR
Получали повторно выведенных гемозиготных мышей HSALR импрегнированием самок мышей дикого типа FVB/n спермой, собранной у самцов гомозиготной линии HSALR 20b. Самца и самку гемозиготных мышей спаривали для генерирования гомозиготного потомства. Анализ количественной мультиплексной ПЦР в режиме реального времени применяли для определения состояния зиготности мышей; этот анализ детектирует человеческий скелетный актин (ACTA1) и Gapdh в качестве внутреннего контроля в той же лунке. Для детектирования геномной ДНК ACTA1 применяли следующий набор праймеров и зонда (Life Technologies, Grand Island, NY): прямой: 5'-CCACCGCAAATGCTTCTAGAC, обратный: 5'-CCCCCCCATTGAGAAGATTC, зонд: 5'-CTCCACCTCCAGCACGCGACTTCT. Проприетарную последовательность набора праймеров и зонда (Life Technologies, Grand Island, NY) применяли для детектирования геномной ДНК Gapdh. Гомозиготных мышей впоследствии перекрещивали с FVB/n дикого типа для подтверждения гомозиготного состояния. Подвержденных гомозиготных мышей спаривали для поддержания гомозиготной колонии в фоновом штамме FVB/n.
ПЦР в реальном времени трансгенной мРНК HSALR
Общую РНК очищали из TA, икроножной и четырехглавой мышц с применением набора для липидных тканей RNeasy Lipid Tissue Mini Kit (Qiagen, Valencia, CA) в соответствии с рекомендациями производителя. Количественный ПЦР в реальном времени применяли для определения уровня мРНК трансгена HSALR; уровень 18S РНК применяли в качестве фактора нормализации. Уровень 18S РНК определяли с применением набора праймеров и зонда проприетарной последовательности (Life Technologies, Grand Island, NY). Тот же набор праймеров и зонда применяли для детектирования геномной ДНК ACTA1 для детектирования мРНК ACTA1.
Внутримышечные инъекции TA
Институциональный комитет по уходу за животными и их использованию Genzyme одобрил все исследования на животных. TA анестезированных изофлураном мышей инъецировали и подвергали электропорации, как описано в Wheeler et al., 2007, J Clin Invest 117:3952-3957. TA инъецировали с 20 мкг (1 мкг/мкл) CAG25, GAC25 (5'-ACGACGACGACGACGACGACGACGA-3') (Gene Tools, Philomath, OR) или PPMO (в инъекциях PPMO-B и PPMO-K инъецировали 20 мкг эквивалентной массы ASO, принимая во внимание массу пептида), тогда как контралатеральную ΤA инъецировали с 20 мкл забуференного фосфатом солевого раствора (солевой раствор).
Результаты
Синтезировали два PPMO конъюгата, содержащих или пептид Β, или пептид Κ, и называли их PPMO-B и PPMO-K, соответственно.
В/м инъекции CAG25 в TA корректировали сплайсинг Serca-1, тогда как контралатеральная TA, которая получала инъекцию солевого раствора, сохраняла неправильную модель сплайсинга Serca-1 (фиг. 1b). Контрольная морфолиновая GAC последовательность, GAC25, как и ожидалось, не корректировала сплайсинг Serca-1.
Что важно, эти результаты указывают на то, что в/м инъекции как PPMO-B, так и PPMO-K корректировали сплайсинг Serca-1, указывая на то, что пептидные и спейсерные ковалентные модификации на 5'-конце морфолино не нарушают способность CAG25 взаимодействовать с ее мишенью и нейтрализовать токсичные эффекты CUG РНК (фиг. 1b).
Пример 2: Повторные инъекции IV PPMO-B и PPMO-K эффективно улучшают сплайсеопатию in vivo
Подтвердив то, что модификация CAG25 с пептидом Β или Κ не аннулирует его биоактивность, этот пример оценивает то, могут ли PPMO-B и PPMO-K модулировать эффекты токсичной РНК у мышей HSALR с применением режима дозирования IV.
Материалы и способы
Исследования систематической доставки в HSALR
CAG25, PPMO-B и PPMO-K растворяли в солевом растворе и вводили самцу и самке гомозиготных мышей HSALR с дозой 30 мг/кг массы тела инъекцией IV в хвостовую вену раз в неделю в течение шести недель. Кровь отбирали ретроорбитальным кровопусканием через 24 ч после последней дозы. Примерно через одну неделю после конечной дозы мышей оценивали на присутствие миотонии, как описано в процедурах электромиографии. Затем мышей умерщвляли, срезы мышц замораживали в жидком N2 для анализов РНК или заливали в среду OCT, и замораживали в охлажденном изопентане для анализов иммунофлуоресценции и FISH.
ОТ-ПЦР анализ альтернативных сплайсингов
ОТ-ПЦР проводили с применением ОТ-ПЦР системы SuperScript III One-Step с ДНК полимеразой Platinum Taq (Life Technologies, Grand Island, NY) с генспецифическими праймерами, применяемыми для синтеза кДНК и амплификации ПЦР. Последовательности праймеров для Serca-1, ZASP, m-Titin и ClC-1 были описаны ранее (Wheeler et al., 2007, J Clin Invest 117:3952-3957; Lin et al., 2006, Hum Mol Genet 15:2087-2097). Продукты ПЦР подвергали электрофорезу на агарозных гелях, окрашивали красителем нуклеиновых кислот в геле SybrGreen I (Life Technologies, Grand Island, NY) и визуализировали с применением Fujifilm LAS-3000 Intelligent Dark Box.
Результаты
Мышей HSALR подвергали инъекциям IV CAG25, PPMO-B и PPMO-K с дозой 30 мг/кг шесть раз в неделю. Мыши HSALR переносили эту дозу хорошо и не проявляли никаких явных признаков токсичности во время введения CAG25 и PPMO или на протяжении всего периода исследования. Дополнительно, эти лечения не воздействовали на трансаминазы печени (ALT, AST) или маркеры функции почек (креатинин, BUN) (данные не приведены).
Анализ сплайсинга проводили на некоторых группах мышц, включая TA, четырехглавую и икроножную мышцы. Как показано на фиг. 2, как PPMO-B, так и PPMO-K значительно корректировали сплайсинг Serca-1 и восстанавливали модель сплайсинга до наблюдаемой у мышей дикого типа. Коррекция сплайсинга Serca-1 происходила во всех исследованных мышцах, включая TA, четырехглавую и икроножную мышцы. Одна из обработанных мышей с PPMO-B демонстрировала частичную коррекцию сплайсинга в четырехглавой и икроножной мышцах. В отличие от PPMO-B и PPMO-K внутривенные инъекции немодифицированного CAG25 не приводили к каким-либо улучшениям сплайсинга Serca-1 в какой-либо из исследованных групп мышц (фиг. 2). Это соотносится с другими исследованиями, демонстрирующими более низкое биораспределение к мышце непокрытых морфолино (Sazani, et al., 2002, Nat Biotechnol 20:1228-1233).
Добавочные транскрипты, находящиеся под воздействием MBNL1 для надлежащего сплайсинга, включают в себя m-Titin, Zasp и ClC-1.8,24. Как показано на фиг. 3, систематическая доставка PPMO-K привела к сильным коррекциям сплайсинга РНК m-Titin, Zasp и ClC-1 в TA, четырехглавой и икроножной мышцах. Мыши HSALR, обработанные с инъекциями IV PPMO-B, подобным образом демонстрировали коррекции альтернативного сплайсинга для этих транскриптов (данные не приведены).
Эти результаты предполагают, что систематически доставляемые PPMO-B и PPMO-K способны проникать в скелетную мышцу, поступать в миоядра мышц, гибридизироваться с поли-(CUG) РНК и высвобождать количество секвестрированного белка MBNL1, достаточное для восстановления корректного MBNL1-регулируемого сплайсинга РНК.
Пример 3: PPMO-K разрушает комплексы ядерного включения CUG в скелетной мышце и приводит в результате к перераспределению белка MBNL1
Для того чтобы определить исход обработки рибонуклеарных очагов у мышей, обработанных с PPMO-K, этот пример демонстрирует флуоресцентную гибридизацию in situ (FISH) для детектирования рибоядерных включений CUG в мышце.
Материалы и способы
Замороженные срезы четырехглавой мышцы толщиной 6 мкм обрабатывали для детектирования локализации белка MBNL1 посредством иммунофлуоресценции, как уже описано (Lin et al., 2006, Hum Mol Genet 15:2087-2097) со следующими модификациями: поликлональное антитело A2764 применяли в концентрации 1:5000 с последующим инкубированием с меченым Alex-568 козьим антикроличьим поликлональным вторичным антителом в концентрации 1:500. Образцы визуализировали с применением лазерного сканирующего конфокального микроскопа LSM510 ΜΕΤΑ, сконфигурированного для последовательной визуализации DAPI и Alexa Fluor-568. Исследование проводили с применением масляного иммерсионного объектива 100x/NA1.45 Plan-Fluar с 4-кратным увеличением.
Результаты
У обработанных PPMO-K мышей HSALR наблюдали уменьшение количества и интенсивности очагов CUG (фиг. 4). Однако из-за того, что олигонуклеотидная последовательность PPMO-K и зонд, применяемые в процедуре FISH, состояли из той же самой последовательности (CAG)n, не было возможно определить то, были ли эффекты на РНК очаги обусловлены деструкцией очагов PPMO-K или связывающей конкуренцией между PPMO-K и пробой FISH. В качестве более прямого, однозначного средства для выяснения эффекта PPMO-K на очаги выполняли иммунофлуоресцентное мечение MBNL1, который был секвестрирован в CUG РНК очагах и демонстрировал точечное окрашивание в ядре мышей HSALR (фиг. 5a-c). Как показано на фиг. 5d-f, PPMO-K приводил к перераспределению белка MBNL1 и приводил в результате к более диффузной локализации внутри нуклеоплазмы, как наблюдали у мышей дикого типа (фиг. 5g-i).
В совокупности иммуноокрашивание и данные FISH в этом примере предполагают, что PPMO-K взаимодействует с CUG РНК конкурентным образом, посредством этого приводя к перераспределению белка MBNL1 внутри миоядер. Высвобождение MBNL1 в очагах скелетной мышцы соотносится с коррекцией сплайсинга РНК, наблюдаемой в обработанных PPMO-K мышах.
Пример 4: Миотония скорректирована у мышей HSALR, подвергаемых инъекции IV PPMO-K
Коррекция сплайсинга РНК ClC-1 посредством PPMO-B и PPMO-K предполагает, что восстановление функции хлоридного канала может привести в результате к изменениям тяжести миотонии, что, как правило, наблюдается у мышей HSALR. Для проверки этой возможности в этом примере оценивали миотонию у обработанных солевым раствором и обработанных PPMO-K HSALR мышей посредством EMG.
Материалы и способы
EMG выполняли на анестезированных изофлураном мышах отбором образцов EMG, взятых в TA, икроножной и четырехглавой мышцах с применением двух электродов с иглой калибра 29. После вставки обеих игл мышцами аккуратно манипулировали щипцами в участке входа иглы. Оценивали степень миотонии посредством следующих критериев: 0 указывает на то, что не детектировано никаких миотонических разрядов; 1 указывает на то, что менее чем 50% мышечных манипуляций привело в результате к миотоническому разряду; 2 указывает на то, что от 50% до 80% мышечных манипуляций привело в результате к миотоническому разряду; 3 указывает на то, что от 90% до 100% мышечных манипуляций привело в результате к миотоническому разряду.
Результаты
Впервые оценивали миотонию у FVB/n дикого типа, гемозиготных и гомозиготных мышей HSALR. Гемозиготные мыши содержат примерно 50% уровня мРНК HSALR в скелетной мышце по сравнению с гомозиготными мышами (фиг. 6a). Как ожидалось, наблюдали уменьшение проявления миотонии у гемозиготных мышей относительно гомозиготных мышей и мышей дикого типа без миотонии (фиг. 6c). Отслеживания типичного миотонического разряда, которые авторы детектировали в гомозиготных мышах HSALR, показаны на фиг. 6b. Как показано на фиг. 6b, не было детектировано миотонии у мышей HSALR, обработанных с PPMO-K, что соотносится с коррекциями в альтернативном сплайсинге ClC-1, который происходил у этих мышей (фиг. 3).
Выводы
Эксперименты, приведенные в данном документе, продемонстрировали, что добавление проникающего в клетку пептида к морфолино с последовательностью CAG позволяет достаточное внедрение PPMO систематически в скелетную мышцу для нейтрализации токсичных эффектов удлиненного повтора CUG. Наблюдали почти полное прекращение нарушений сплайсинга, высвобождение MBNL1 из РНК очагов и элиминацию миотонии.
Обнаружение того, что систематическая доставка морфолинового олигонуклеотида может модулировать DM1-подобную патологию in vivo, имеет несколько значений: во-первых, 5’-ковалентная модификация морфолино на основе CAG не мешает взаимодействию с целевой CUG РНК; во-вторых, биораспределение, которое является достижимым посредством обогащенного аргинином проникающего в клетку пептида, является достаточным для предоставления коррекций биохимических и физиологических аспектов патологии DM1; и, в-третьих, тестовый агент, вводимый в исследованиях, представленных здесь в HSALR модели DM1, является тем же терапевтическим соединением-кандидатом, который мог быть оценен на безопасное применение на пациентах-людях с DM1.
Примеры, которые, как подразумевается в открытии, являются полностью иллюстративными и, следовательно, не должны рассматриваться как ограничивающие открытие каким-либо образом, также описывают и детализируют аспекты и варианты осуществления открытия, описанные выше. Вышеприведенные примеры и подробное описание предоставлены в качестве иллюстрации и не в качестве ограничения. Все публикации, патентные заявки и патенты, на которые имеются ссылки в этом описании, включены в данный документ посредством ссылки, как если бы для каждой индивидуальной публикации, патентной заявки или патента было конкретно и индивидуально указано, что он включен посредством ссылки. В частности, все публикации, на которые имеются ссылки в данном документе, полностью включены в данный документ посредством ссылки в целях описания и раскрытия композиций и методологий, которые должны быть использованы в связи с изобретением. Хотя вышеприведенное открытие было описано в некоторых подробностях посредством иллюстраций и примеров в целях облегчения понимания, специалист в данной области без труда поймет, учитывая раскрытие данного изобретения, что некоторые изменения и модификации могут быть осуществлены без выхода за рамки объема и сущности прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ И СПОСОБЫ МОДУЛЯЦИИ ЭКСПРЕССИИ ДИСТРОФИЧЕСКОЙ МИОТОНИН-ПРОТЕИНКИНАЗЫ (DMPK) | 2014 |
|
RU2690333C2 |
| НАПРАВЛЯЕМОЕ АНТИСМЫСЛОВЫМ ОЛИГОНУКЛЕОТИДОМ УДАЛЕНИЕ САЙТОВ ПРОТЕОЛИТИЧЕСКОГО РАСЩЕПЛЕНИЯ, МУТАЦИИ HCHWA-D И УВЕЛИЧЕННОГО ЧИСЛА ТРИНУКЛЕОТИДНЫХ ПОВТОРОВ | 2014 |
|
RU2692634C2 |
| МНОЖЕСТВЕННЫЕ ОЛИГОНУКЛЕОТИДНЫЕ ФРАГМЕНТЫ НА ПЕПТИДНОМ НОСИТЕЛЕ | 2015 |
|
RU2739987C2 |
| НОВЫЙ СПОСОБ ЛЕЧЕНИЯ ПИГМЕНТНОГО РЕТИНИТА | 2020 |
|
RU2817702C2 |
| МОДУЛЯТОРЫ И МОДУЛЯЦИЯ РНК РЕЦЕПТОРА КОНЕЧНЫХ ПРОДУКТОВ ГЛУБОКОГО ГЛИКИРОВАНИЯ | 2020 |
|
RU2820247C2 |
| ИНГИБИТОР СИГНАЛА МИОСТАТИНА | 2019 |
|
RU2820270C2 |
| АНТИСМЫСЛОВЫЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2015 |
|
RU2702424C2 |
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛЯЦИИ SMN2 СПЛАЙСИНГА У СУБЪЕКТА | 2010 |
|
RU2683772C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С НЕЙТРОФИЧЕСКИМ ФАКТОРОМ ГОЛОВНОГО МОЗГА (BDNF), ПУТЕМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА BDNF | 2013 |
|
RU2661104C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ИНТЕРФЕРОН- СВЯЗАННЫМ РЕГУЛЯТОРОМ РАЗВИТИЯ 1 (IFRD1), ПУТЕМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА К IFRD1 | 2011 |
|
RU2611195C2 |


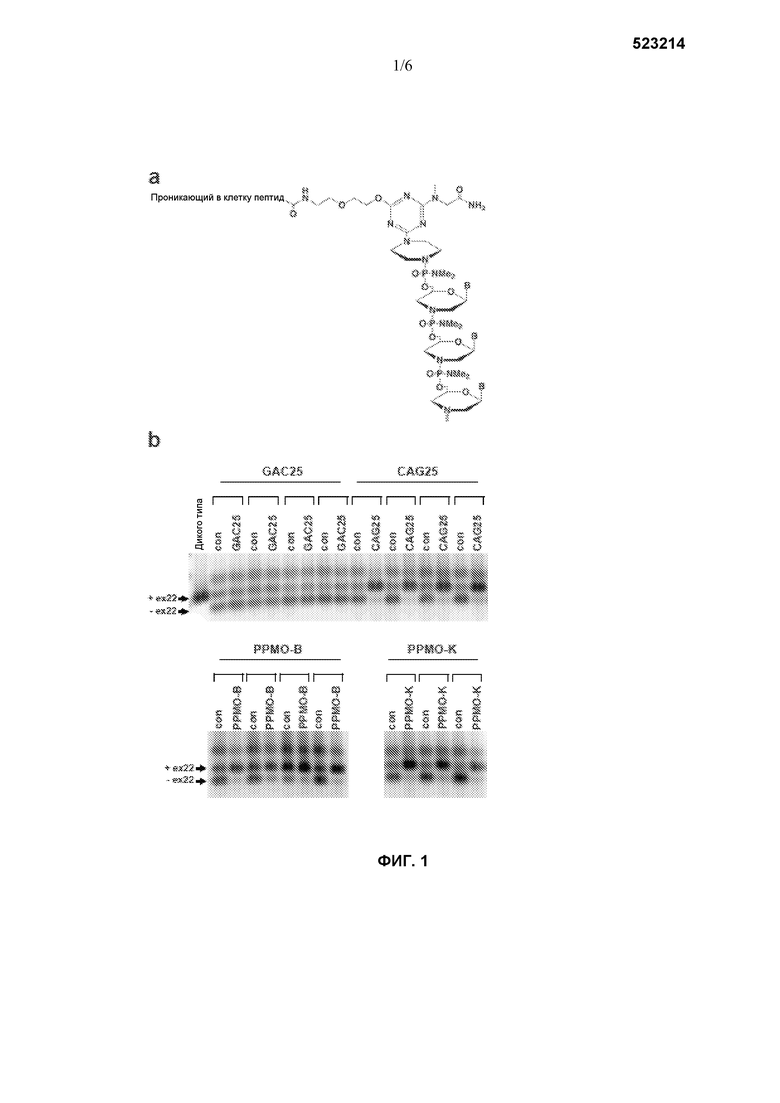
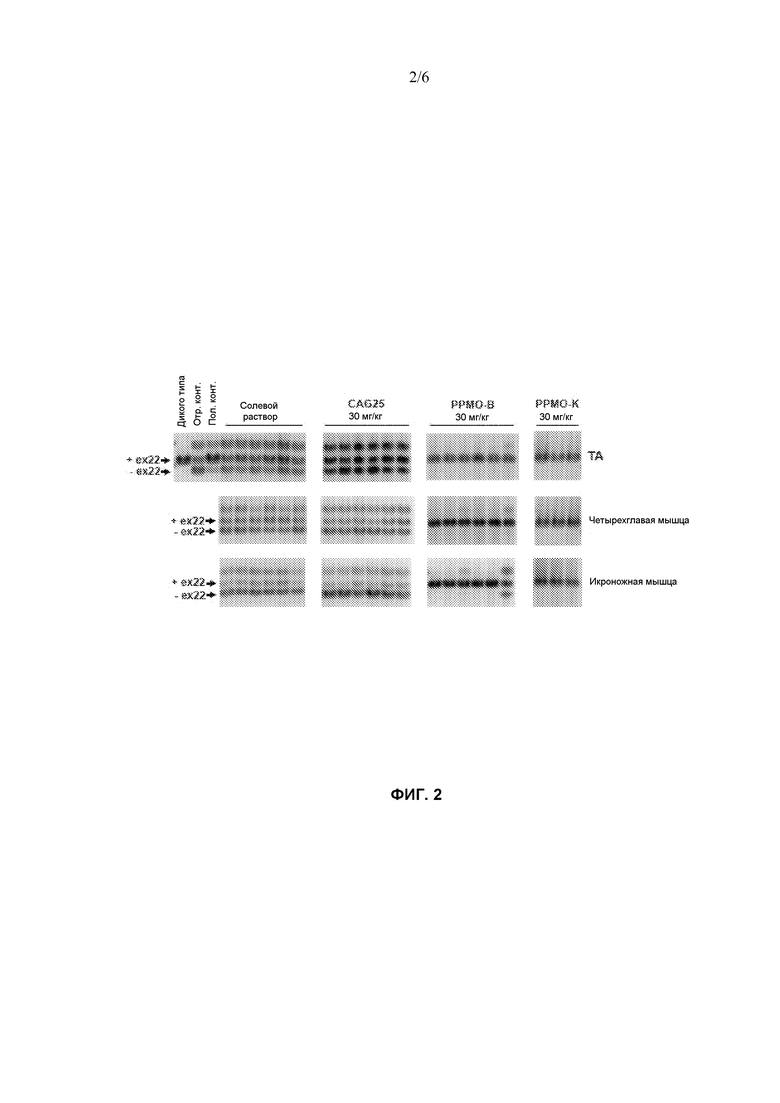


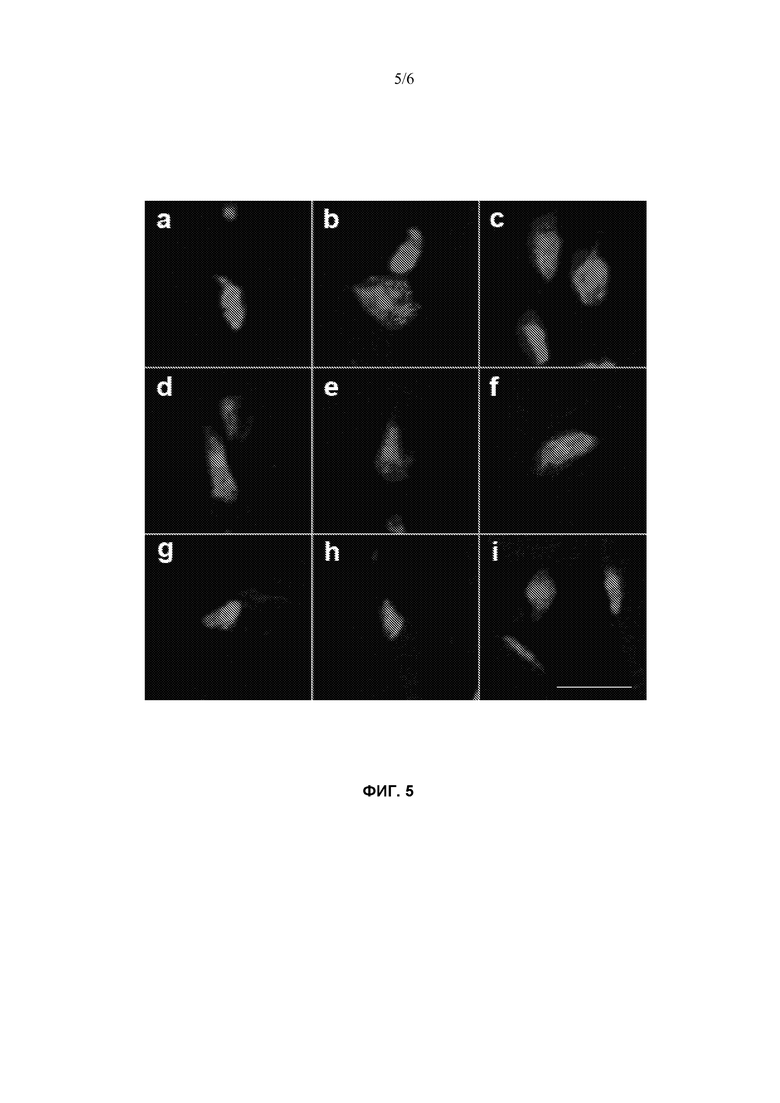

Изобретение относится к биотехнологии. Описан способ лечения или предотвращения миотонической дистрофии типа 1 (DM1) у индивидуума. Систематически вводят индивидууму терапевтически эффективное количество связанного с катионным пептидом морфолинового антисмыслового олигонуклеотида, содержащего: (a) последовательность морфолинового антисмыслового олигонуклеотида, комплементарную по меньшей мере 3 последовательностям повтора поли-CUG в 3’-нетранслируемой области (UTR) протеинкиназы миотонической дистрофии (DMPK) целевого РНК транскрипта; и (b) спейсерную группу, связывающую морфолиновый антисмысловой олигонуклеотид и катионный пептид, причем спейсерная группа содержит
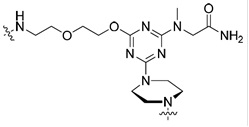 .
.
Изобретение позволяет облегчать по меньшей мере один симптом DM1 в по меньшей мере двух мышцах. 20 з.п. ф-лы, 6 ил., 4 пр.
1. Способ лечения или предотвращения миотонической дистрофии типа 1 (DM1) у индивидуума, нуждающегося в этом, содержащий: систематическое введение индивидууму терапевтически эффективного количества связанного с катионным пептидом морфолинового антисмыслового олигонуклеотида, содержащего: (a) последовательность морфолинового антисмыслового олигонуклеотида, комплементарную по меньшей мере 3 последовательностям повтора поли-CUG в 3’-нетранслируемой области (UTR) протеинкиназы миотонической дистрофии (DMPK) целевого РНК транскрипта; и (b) спейсерную группу, связывающую морфолиновый антисмысловой олигонуклеотид и катионный пептид, причем спейсерная группа содержит
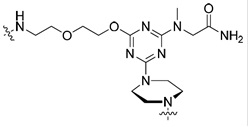 ,
,
где введение связанного с катионным пептидом морфолинового антисмыслового олигонуклеотида облегчает по меньшей мере один симптом DM1 в по меньшей мере двух мышцах.
2. Способ по п.1, в котором катионный пептид имеет 8-30 аминокислотных остатков в длину и содержит одну или более субпоследовательностей, выбранных из группы, состоящей из RXR, RX, RB и RBR, где R представляет собой аргинин, Β представляет собой β-аланин, и каждый X представляет собой независимо -NH-(CHR1)n-C(O)-, где n составляет 4-6, и каждый R1 представляет собой независимо H или метил так, что самое большее два R1 являются метилом.
3. Способ по п.2, в котором катионный пептид содержит аминокислотную последовательность Ac(RXRRBR)2XB-.
4. Способ по п.2, в котором катионный пептид содержит аминокислотную последовательность Ac(RXR)4XB-.
5. Способ по любому из пп.1-4, в котором связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид содержит последовательность 5’-(AGC)n-3’, 5’-(GCA)n-3’ или 5’-(CAG)n-3’, где n составляет любое из приблизительно 5-25.
6. Способ по п.5, в котором связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид дополнительно содержит от 1 до 2 добавочных морфолиновых нуклеотидов на 5’- и/или 3’-конце олигонуклеотида.
7. Способ по п.5, в котором связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид содержит последовательность: 5’-AGCAGCAGCAGCAGCAGCAGCAGCA-3’.
8. Способ по п.7, в котором связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид дополнительно содержит 5’-аминомодификацию.
9. Способ по любому из пп.1-4, 6-8, в котором связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид представляет собой фосфородиамидатный связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид.
10. Способ по любому из пп.1-4, 6-9, в котором катионный пептид отделен от морфолинового антисмыслового олигонуклеотида спейсерной группой, присоединенной к 5’-концу морфолинового антисмыслового олигонуклеотида.
11. Способ по любому из пп.1-4, 6-8, в котором мышцы представляют собой скелетные мышцы, гладкие мышцы и/или сердечную мышцу.
12. Способ по любому из пп.1-4, 6-8, в котором связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид проникает в клетки передней большеберцовой мышцы, четырехглавой мышцы и/или икроножной мышцы.
13. Способ по любому из пп.1-4, 6-8, в котором упомянутый по меньшей мере один симптом DM1 представляет собой миотонию.
14. Способ по любому из пп.1-4, 6-8, в котором упомянутый по меньшей мере один симптом DM1 представляет собой агрегирование белка musclebind-like-1 (MBNL-1) в рибонуклеарных очагах внутри миоядер.
15. Способ по любому из пп.1-4, 6-8, в котором упомянутый по меньшей мере один симптом DM1 представляет собой неправильный сплайсинг по меньшей мере одного РНК транскрипта в мышечных клетках.
16. Способ по п.15, в котором упомянутый по меньшей мере один транскрипт РНК выбран из группы, состоящей из: Serca-1, m-Titin, Zasp и CIC-1.
17. Способ по любому из пп.1-4, 6-8 или 16, в котором систематическое введение связанного с катионным пептидом морфолинового антисмыслового олигонуклеотида выполняют внутривенно, внутрибрюшинно или подкожно.
18. Способ по любому из пп.1-4, 6-8 или 16, в котором связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят индивидууму раз в неделю.
19. Способ по любому из пп.1-4, 6-8 или 16, в котором связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят индивидууму в течение по меньшей мере одной недели.
20. Способ по любому из пп.1-4, 6-8 или 16, в котором связанный с катионным пептидом морфолиновый антисмысловой олигонуклеотид вводят с фармацевтически приемлемым вспомогательным веществом.
21. Способ по любому из пп.1-4, 6-8 или 16, в котором индивидуум является человеком.
| US 20110269665 A1, 03.11.2011 | |||
| WO 2010037539 А1, 08.04.2010 | |||
| СПОСОБ ВВЕДЕНИЯ МОЛЕКУЛЫ ПНК, КОНЪЮГИРОВАННОЙ С ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННЫМ ПЕПТИДОМ, В ЦИТОЗОЛЬ И/ИЛИ ЯДРО ФОТОХИМИЧЕСКОЙ ИНТЕРНАЛИЗАЦИЕЙ(PCI) | 2005 |
|
RU2435859C2 |
Авторы
Даты
2018-07-31—Публикация
2013-09-24—Подача