Предпосылки создания изобретения
[0001] Миостатин, также известный как GDF8, был открыт в 1997 году как новый цитокин, принадлежащий к суперсемейству TGF-β. Экспрессия миостатина в ткани является специфичной в скелетных мышцах, которые представляют собой основную ткань, ответственную за двигательную и метаболическую активность. У животных, несущих мутации, приводящие к дефициту миостатина, наблдается значительная мышечная гипертрофия, при которой размер скелетных мышц увеличивается в два раза по сравнению с их аналогом дикого типа (McPherron et al., Nature. 387 (6628): 83-90, 1997). На основании этих наблюдений было высказано предположение, что миостатин служит важным фактором регуляции объема скелетных мышц.
[0002] Когда миостатин передает свой сигнал внутрь клетки, он подвергается такому же процессу, как и другие TGF-β, где он сначала связывается с рецептором типа II, а затем с рецептором типа I с образованием комплекса лиганд-рецептор. Благодаря такому процессу, каждый из рецепторов подвергается фосфорилированию в своем межклеточном домене, что приводит к передаче сигнала по Smad-зависимому или Smad-независимому пути (Chang et al., Endocrine Reviews. 23(6): 787-823, 2002). Оба рецептора типа I и II кодируются множеством генов, соответственно. Каждая молекула, принадлежащая к суперсемейству TGF-β, связывается с определенной комбинацией рецепторов. Миостатин связывается с комбинацией ALK4 или ALK5 рецептора типа I и с ACVR2B рецептора типа II. Однако указанная комбинация не ограничивается миостатином и, при этом, могут быть использованы и некоторые другие молекулы суперсемейства TGF-β, включая GDF11, активин A и т.п. (Wakefield and Hill. Nat Rev Cancer.13 (5): 328-41, 2013, doi: 10.1038/nrc3500). Таким образом, связывание лигандов, отличающихся от миостатина, с ACVR2B/ALK4 или ACVR2B/ALK5 может запускать передачу подавляющих сигналов в мышцы, как это происходит при связывании с миостатином. Действительно, сообщалось, что введение нейтрального антитела против ACVR2B или растворимого ACVR2B, где трансмембранный домен и его нижерасположенные области заменены Fc-доменом антитела, мышам с дефицитом гена миостатина приводит к дополнительному увеличению объема мышц помимо увеличения, вызываемого дефицитом миостатина (см. Lach-Trifilieff et al., Mol. Cell Biol. 34 (4): 606-18, 2014. doi: 10.1128/MCB.01307-13; Lee et al., Proc. Natl Acad. Sci USA. 102 (50): 18117-22, 2005). Такое дополнительное увеличение указывает на то, что помимо миостатина существуют и другие факторы, которые снижают объем мышц при связывании с ACVR2B.
[0003] Средства для снижения передачи сигналов миостатина могут быть подходящими для лечения или профилактики конкретных заболеваний мышц, а именно, мышечной дистрофии и других мышечных заболеваний. Настоящее изобретение относится к новому способу ингибирования передачи сигналов миостатина путем нацеливания на ACVR2B на уровне мРНК.
Сущность изобретения
[0004] В соответствии со своим первым аспектом, настоящее изобретение относится к соединению, которое способствует продуцированию в клетке-мишени мРНК мутантного рецептора активина типа 2B (ACVR2B), где часть последовательности мРНК, которая кодирует часть или всю внутриклеточную область ACVR2B дикого типа, отсутствует.
[0005] В соответствии с вариантом своего первого аспекта, настоящее изобретение относится к соединению, которое способно вызывать образование белка рецептора активина типа 2B (ACVR2B) в виде усеченного варианта, где отсутствует часть внутриклеточной области ACVR2B дикого типа, или к его фармацевтически приемлемой соли или гидрату.
[0006] В конкретных вариантах осуществления изобретения, соединение представляет собой олигонуклеотид, который способен вызывать пропуск одного или более экзонов 5, 6, 7, 8, 9 и 10 ACVR2B.
[0007] В соответствии со своим вторым аспектом, настоящее изобретение относится к фармацевтической композиции, содержащей соединение или его фармацевтически приемлемую соль или гидрат согласно первому аспекту изобретения.
[0008] В соответствии со своим третьим аспектом, настоящее изобретение относится к соединению или к его фармацевтически приемлемой соли или гидрату согласно первому аспекту изобретения или к фармацевтической композиции согласно второму аспекту изобретения для их применения в терапии. В конкретном варианте осуществления изобретения, терапия представляет собой профилактику или лечение мышечной дистрофии, саркопении или амиотрофического заболевания, такого как мышечная дистрофия Дюшенна.
[0009] В соответствии со своим четвертым аспектом, настоящее изобретение относится к генетически модифицированному животному, у которого экспрессируется мутантная мРНК ACVR2B, где отсутствует часть внутриклеточной области ACVR2B.
[0010] Конкретные аспекты и варианты осуществления изобретения включают:
[1] Соединение, которое способствует продуцированию в клетке-мишени мРНК мутантного рецептора активина типа 2B (ACVR2B), где часть последовательности, которая кодирует часть или всю внутриклеточную область ACVR2B дикого типа, отсутствует, или его фармацевтически приемлемую соль или гидрат.
[2] Соединение или его фармацевтически приемлемую соль или гидрат согласно [1], где указанная внутриклеточная область ACVR2B дикого типа кодируется экзонами 5-11 ACVR2B дикого типа.
[3] Соединение или его фармацевтически приемлемую соль или гидрат согласно [1] или [2], которые способствуют продуцированию в клетке-мишени усеченного белка ACVR2B, где отсутствует часть внутриклеточной области ACVR2B дикого типа.
[4] Соединение или его фармацевтически приемлемую соль или гидрат согласно [3], где в усеченном белке ACVR2B отсутствует вся или часть внутриклеточной области, кодируемой по меньшей мере одним экзоном, выбранным из группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B.
[5] Соединение согласно любому из [1]-[3], которое представляет собой антисмысловой олигомер, способный индуцировать пропуск экзона, кодирующего часть внутриклеточной области ACVR2B, или его фармацевтически приемлемую соль или гидрат.
[6] Соединение или его фармацевтически приемлемая соль или гидрат согласно [5], где указанный экзон, который должен быть пропущен, выбран из группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B.
[7] Соединение по [5] или [6], которое включает 10-50 нуклеооснований, или его фармацевтически приемлемую соль или гидрат.
[8] Соединение согласно любому из [5]-[7], содержащее последовательность, комплементарную 10-50 последовательно расположенным нуклеотидам экзона, выбранного из группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B, или его фармацевтически приемлемую соль или гидрат.
[9] Соединение или его фармацевтически приемлемую соль или гидрат согласно любому из [5]-[8], где экзон содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-6.
[10] Соединение согласно любому из [5]-[9], содержащее нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 12-36 и 43-111, или его фармацевтически приемлемую соль или гидрат.
[11] Соединение согласно любому из [5] - [10], состоящее из нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 12-36 и 43-111, или его фармацевтически приемлемую соли или гидрат.
[12] Соединение или его фармацевтически приемлемую соль или гидрат согласно любому из [5]-[11], где антисмысловой олигомер представляет собой олигонуклеотид.
[13] Соединение или его фармацевтически приемлемую соль или гидрат согласно [12], где по меньшей мере одна сахарная группа и/или по меньшей мере одна группа фосфатной связи в олигонуклеотиде является модифицированной.
[14] Соединение или его фармацевтически приемлемую соль или гидрат согласно [13], где модифицированная сахарная группа представляет собой рибозу, в которой -ОН-группа в 2'-положении замещена любой группой, выбранной из группы, состоящей из OR, R, R'OR, SH, SR, NH2, NHR, NR2, N3, CN, F, Cl, Br и I (где R представляет собой алкил или арил, а R' представляет собой алкилен).
[15] Соединение или его фармацевтически приемлемую соль или гидрат согласно [13] или [14], где модифицированная группа фосфатной связи выбрана из группы, состоящей из фосфортиоатной связи, фосфордитиоатной связи, алкилфосфонатной связи, фосфорамидатной связи и боранофосфатной связи.
[16] Соединение или его фармацевтически приемлемую соль или гидрат согласно любому из [5]-[11], где антисмысловой олигомер содержит по меньшей мере одно морфолино-кольцо.
[17] Соединение согласно [16], которое представляет собой морфолино-олигомер или фосфордиамидатный морфолино-олигомер, или его фармацевтически приемлемую соль или гидрат.
[18] Соединение согласно [16] или [17], имеющее любую из групп, представленных химическими формулами (1)-(3), показанными ниже, на своем 5'-конце, или его фармацевтически приемлемую соль или гидрат.
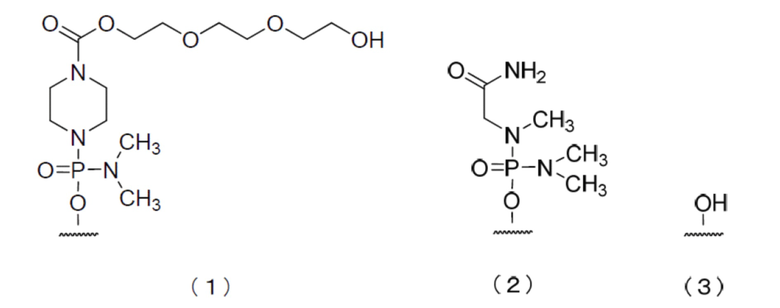
[19] Соединение, которое представляет собой конъюгат, в котором пептид, проникающий в клетку, связан с соединением согласно любому из [1]-[18], или его фармацевтически приемлемую соль или гидрат.
[20] Фармацевтическую композицию, содержащую соединение или его фармацевтически приемлемую соль или гидрат согласно любому из [1]-[19].
[21] Фармацевтическую композицию согласно [20], которая дополнительно содержит по меньшей мере один фармацевтически приемлемый носитель или добавку.
[22] Фармацевтическую композицию согласно [20] или [21], которая является лиофилизованной.
[23] Соединение или его фармацевтически приемлемую соль или гидрат согласно любому из [1]-[19] или фармацевтическую композицию согласно любому из [20]-[22] для их применения в целях лечения индивидуума.
[24] Соединение или его фармацевтически приемлемую соль или гидрат или фармацевтическую композицию для применения согласно [23], где терапия представляет собой профилактику или лечение амиотрофического заболевания, мышечной дистрофии или саркопении у индивидуума.
[25] Соединение или его фармацевтически приемлемую соль или гидрат или фармацевтическую композицию для применения согласно [24], где амиотрофическое заболевание представляет собой мышечную дистрофию Дюшенна.
[26] Соединение или его фармацевтически приемлемую соль или гидрат или фармацевтическую композицию для применения согласно любому из [23]-[25], где индивидуумом является человек.
[27] Способ лечения амиотрофического заболевания, мышечной дистрофии или саркопении у индивидуума, включающий введение указанному индивидууму терапевтически эффективного количества соединения или его фармацевтически приемлемой соли или гидрата согласно любому из [1]-[19] или фармацевтической композиции согласно любому из [20]-[22].
[28] Способ согласно [27], где амиотрофическое заболевание представляет собой мышечную дистрофию Дюшенна.
[29] Способ согласно [27] или [28], где индивидуумом является человек.
[30] Применение соединения или его фармацевтически приемлемой соли или гидрата согласно любому из [1]-[19] в целях приготовления лекарственного средства для профилактики или лечения амиотрофического заболевания, мыщечной дистрофии или саркопении у индивидуума.
[31] Применение согласно [30], где амиотрофическое заболевание представляет собой мышечную дистрофию Дюшенна.
[32] Применение согласно [30] или [31], где индивидуумом является человек.
[33] Генетически модифицированное животное, которое экспрессирует мРНК мутантного рецептора активина типа 2B (ACVR2B), где часть последовательности, кодирующая часть или всю внутриклеточную область ACVR2B дикого типа, отсутствует.
Краткое описание чертежей
[0011] На фигуре 1 показана эффективность пропуска (%) каждого экзона указанными фосфордиамидатными морфолино-олигомерами (PMO) (a и b), фосфортиоатными (PS) олигонуклеотидами (c) или конъюгатом PMO-пептид (d).
На фигуре 2 показано подавление передачи сигналов миостатина посредством экспрессии усеченного ACVR2B, где усеченный ACVR2B экспрессируется на более высоком уровне по сравнению с эндогенным ACVR2B дикого типа.
На фигуре 3 показано подавление экспрессии мРНК SMAD7, которая служит показателем интенсивности сигнала миостатина.
Подробное описание изобретения
[0012] Настоящее изобретение будет более подробно описано ниже. Нижеследующие варианты осуществления изобретения приводятся для описания изобретения только в качестве примера и не рассматриваются для ограничения объема изобретения. Настоящее изобретение может быть осуществлено различными способами, не выходящими за рамки существа изобретения. Нуклеотидные последовательности представлены так, что 5'-конец расположен слева, а 3'-конец расположен справа. Аминокислотные последовательности представлены так, что N-конец расположен слева, а С-конец расположен справа.
[0013] Соединение
Настоящее изобретение относится к соединению, которое способствует продуцированию в клетке-мишени мРНК мутантного рецептора активина типа 2B (ACVR2B), где часть последовательности мРНК, которая кодирует часть или всю внутриклеточную область ACVR2B дикого типа, отсутствует, или к его фармацевтически приемлемой соли или гидрату.
[0014] Белок ACVR2B также известен как ActRIIB и состоит из 512 аминокислот. Расположение ACVR2B на цитогенной карте соответствует 3p22-p21.3. ACVR2B состоит из трех основных доменов, внеклеточного лиганд-связывающего домена, трансмембранного домена и внутриклеточного домена серин/треонинкиназы. Ishikawa и др. (Journal of Human Genetics, том 43, страницы 132-134 (1998)) сообщали, что ген ACVR2B содержит 11 экзонов и имеет размер приблизительно 30 т.п.о. Последовательность мРНК человеческого ACVR2B дикого типа (далее называемого «ACVR2B дикого типа») раскрыта в эталонной последовательности NCBI: NM_001106.4, и в настоящем описании в SEQ ID NO: 8.
[0015] Репрезентативная кодирующая последовательность (CDS) человеческого ACVR2B представлена в SEQ ID NO:10. Нуклеотидная последовательность CDS ACVR2B не ограничивается последовательностью, представленной в SEQ ID NO:10, и включает последовательности вариантов, составляющие 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более или 100% от длины SEQ ID NO: 10, и имеет последовательность, которая на 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более или 100% идентична SEQ ID NO: 10.
[0016] Репрезентативная аминокислотная последовательность человеческого белка ACVR2B представлена в SEQ ID NO: 11. Аминокислотная последовательность белка ACVR2B не ограничивается последовательностью, представленной как SEQ ID NO: 11, и включает последовательности вариантов, составляющие 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более или 100% от длины SEQ ID NO: 11, и имеет последовательность, которая на 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более или 100% идентична SEQ ID NO: 11.
[0017] Если соединение согласно изобретению вводится в клетку, экспрессирующую ACVR2B, то оно способствует продуцированию в этой клетке мутантной мРНК ACVR2B, где часть последовательности мРНК, которая кодирует часть или всю внутриклеточную область ACVR2B дикого типа, отсутствует. «Мутантная мРНК ACVR2B, где часть последовательности мРНК, которая кодирует часть или всю внутриклеточную область ACVR2B дикого типа, отсутствует» (далее называемая «мутантной мРНК ACVR2B согласно изобретению») означает мутантную/модифицированную мРНК ACVR2B, в которой отсутствует часть последовательности, присутствующей в мРНК ACVR2B дикого типа, и где указанная последовательность, которая отсутствует, в отличие от ACVR2B дикого типа, кодирует часть или всю внутриклеточную область ACVR2B дикого типа или мутантную мРНК ACVR2B, в которой отсутствует часть последовательности, обнаруженной в мРНК ACVR2B дикого типа, которая кодирует часть или всю внутриклеточную область ACVR2B дикого типа.
[0018] Внутриклеточная область человеческого ACVR2B состоит из 159-512 аминокислот, включительно, начиная с N-концевой стороны. Последовательность мРНК, которая кодирует часть или всю внутриклеточную область репрезентативного ACVR2B дикого типа, представлена в SEQ ID NO: 9.
[0019] Мутантная мРНК ACVR2B согласно изобретению может не содержать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, 500, 501, 502, 503, 504, 505, 506, 507, 508, 509, 510, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 535, 536, 537, 538, 539, 540, 541, 542, 543, 544, 545, 546, 547, 548, 549, 550, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 566, 567, 568, 569, 570, 571, 572, 573, 574, 575, 576, 577, 578, 579, 580, 581, 582, 583, 584, 585, 586, 587, 588, 589, 590, 591, 592, 593, 594, 595, 596, 597, 598, 599, 600, 601, 602, 603, 604, 605, 606, 607, 608, 609, 610, 611, 612, 613, 614, 615, 616, 617, 618, 619, 620, 621, 622, 623, 624, 625, 626, 627, 628, 629, 630, 631, 632, 633, 634, 635, 636, 637, 638, 639, 640, 641, 642, 643, 644, 645, 646, 647, 648, 649, 650, 651, 652, 653, 654, 655, 656, 657, 658, 659, 660, 661, 662, 663, 664, 665, 666, 667, 668, 669, 670, 671, 672, 673, 674, 675, 676, 677, 678, 679, 680, 681, 682, 683, 684, 685, 686, 687, 688, 689, 690, 691, 692, 693, 694, 695, 696, 697, 698, 699, 700, 701, 702, 703, 704, 705, 706, 707, 708, 709, 710, 711, 712, 713, 714, 715, 716, 717, 718, 719, 720, 721, 722, 723, 724, 725, 726, 727, 728, 729, 730, 731, 732, 733, 734, 735, 736, 737, 738, 739, 740, 741, 742, 743, 744, 745, 746, 747, 748, 749, 750, 751, 752, 753, 754, 755, 756, 757, 758, 759, 760, 761, 762, 763, 764, 765, 766, 767, 768, 769, 770, 771, 772, 773, 774, 775, 776, 777, 778, 779, 780, 781, 782, 783, 784, 785, 786, 787, 788, 789, 790, 791, 792, 793, 794, 795, 796, 797, 798, 799, 800, 801, 802, 803, 804, 805, 806, 807, 808, 809, 810, 811, 812, 813, 814, 815, 816, 817, 818, 819, 820, 821, 822, 823, 824, 825, 826, 827, 828, 829, 830, 831, 832, 833, 834, 835, 836, 837, 838, 839, 840, 841, 842, 843, 844, 845, 846, 847, 848, 849, 850, 851, 852, 853, 854, 855, 856, 857, 858, 859, 860, 861, 862, 863, 864, 865, 866, 867, 868, 869, 870, 871, 872, 873, 874, 875, 876, 877, 878, 879, 880, 881, 882, 883, 884, 885, 886, 887, 888, 889, 890, 891, 892, 893, 894, 895, 896, 897, 898, 899, 900, 901, 902, 903, 904, 905, 906, 907, 908, 909, 910, 911, 912, 913, 914, 915, 916, 917, 918, 919, 920, 921, 922, 923, 924, 925, 926, 927, 928, 929, 930, 931, 932, 933, 934, 935, 936, 937, 938, 939, 940, 941, 942, 943, 944, 945, 946, 947, 948, 949, 950, 951, 952, 953, 954, 955, 956, 957, 958, 959, 960, 961, 962, 963, 964, 965, 966, 967, 968, 969, 970, 971, 972, 973, 974, 975, 976, 977, 978, 979, 980, 981, 982, 983, 984, 985, 986, 987, 988, 989, 990, 991, 992, 993, 994, 995, 996, 997, 998, 999, 1000, 1001, 1002, 1003, 1004, 1005, 1006, 1007, 1008, 1009, 1010, 1011, 1012, 1013, 1014, 1015, 1016, 1017, 1018, 1019, 1020, 1021, 1022, 1023, 1024, 1025, 1026, 1027, 1028, 1029, 1030, 1031, 1032, 1033, 1034, 1035, 1036, 1037, 1038, 1039, 1040, 1041, 1042, 1043, 1044, 1045, 1046, 1047, 1048, 1049, 1050, 1051, 1052, 1053, 1054, 1055, 1056, 1057, 1058, 1059, 1060, 1061, 1062, 1063, 1064 или 1065 нуклеотидов SEQ ID NO:9.
[0020] Как показано в разделе «Примеры» настоящего описания, разрушение внутриклеточной области человеческого ACVR2B на уровне мРНК эффективно снижает передачу сигналов миостатина. Таким образом, внутриклеточная область ACVR2B является хорошей мишенью для нарушения сигнала миостатина.
[0021] В одном варианте осуществления изобретения, соединение согласно изобретению способно вызывать вырабатывание клеткой-мишенью усеченного белка ACVR2B, в котором отсутствует часть внутриклеточной области белка ACVR2B дикого типа, например, такого как белок с последовательностью в SEQ ID NO: 11.
[0022] Используемый здесь термин «усеченный белок ACVR2B, в котором отсутствует часть внутриклеточной области ACVR2B дикого типа» (далее называемый «усеченным вариантом белка ACVR2B» или «усеченным белком ACVR2B») означает любой усеченный вариант белка ACVR2B, в котором отсутствует по меньшей мере одна аминокислота в указанной внутриклеточной области ACVR2B дикого типа. Часть внутриклеточной области ACVR2B, которая, в отличие от ACVR2B дикого типа, отсутствует, означает одну или более аминокислот, присутствующих в ACVR2B дикого типа, но не в усеченном ACVR2B. Так, например, в усеченном варианте белка ACVR2B может отсутствовать 1 аминокислота или 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353 или 354 аминокислоты внутриклеточной области, обнаруженные в белке ACVR2B дикого типа, например таком как вариант, представленный как SEQ ID NO: 11. Как будет очевидно, усеченная версия/вариант охватывает не только варианты, в которых одна или более аминокислот удалены у карбокси или амино-концов белка, но также и варианты, в которых отсутствует одна или более аминокислот белка ACVR2B.
[0023] Часть внутриклеточной области ACVR2B, которая отсутствует или не содержится в усеченном вариате, кодируется полностью или частично по меньшей мере одним экзоном, выбранным из группы, состоящей из экзонов 5, 6, 7, 8, 9, 10 и 11 ACVR2B дикого типа.
[0024] Используемый здесь термин «способный продуцировать белок ACVR2B в виде усеченного варианта» означает, что соединение согласно изобретению способствует синтезу или продуцированию в клетке, в которую добавляют это соединение, усеченного ACVR2B, как более подробно объясняется в настоящей заявке.
[0025] Поскольку внеклеточные и трансмембранные области ACVR2B все еще присутствуют, то усеченный вариант ACVR2B согласно изобретению может все еще обладать способностью связываться со своими нативными лигандами, но в отношении связывания с лигандом миостатина, эффективность передачи сигнала миостатина может быть снижена по сравнению с ACVR2B дикого типа. Примеры нативных лигандов, которые могут связываться с ACVR2B, включают активин-A, активин-B, GDF1, GDF3, NODAL, GDF11, миостатин (также известный как GDF8), BMP2, BMP5, GDF5 (также известный как BMP14), GDF6, GDF7, BMP5, BMP6, BMP7 и BMP8. Предпочтительным примером лиганда является миостатин, также известный как GDF8.
[0026] Используемый здесь термин «передача сигнала» означает передачу сигнала посредством активации нижерасположенных факторов, относящихся к сигналу, или посредством инактивации нижерасположенных факторов, относящихся к сигналу.
[0027] В конкретном варианте осуществления изобретения, усеченный вариант белка ACVR2B согласно изобретению способен связываться с миостатином.
[0028] Усеченный белок ACVR2B согласно изобретению передает сигналы после связывания лиганда с ACVR2B, но с меньшей интенсивностью, чем ACVR2B дикого типа. В одном из вариантах осуществления изобретения, усеченный белок ACVR2B передает сигнал миостатина с меньшей интенсивностью, чем ACVR2B дикого типа, после связывании с ним миостатина. Используемый здесь термин «интенсивность, меньшая, чем интенсивность ACVR2B дикого типа» означает снижение интенсивности сигнала (способности передавать сигнал) на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8. %, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% по сравнению с интенсивностью сигнала, передаваемого посредством связывания того же лиганда с ACVR2B дикого типа. Интенсивность сигнала может быть определена опосредованно путем количественной оценки уровня экспрессии мРНК одного или более генов, экспрессия которых запускается передачей сигнала. Так, например, интенсивность сигнала, инициируемого миостатином, может быть определена путем оценки уровня экспрессии мРНК SMAD7. В этом случае, соединение согласно изобретению способно снижать интенсивность сигнала миостатина до уровня, который коррелирует со снижением уровня экспрессии мРНК SMAD7 на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% по сравнению с сигналом миостатина, передавваемым ACVR2B дикого типа.
[0029] В другом варианте осуществления изобретения, мутантная мРНК ACVR2B согласно изобретению может не иметь части последовательности, которая кодирует часть или всю внутриклеточную область ACVR2B дикого типа из-за мутации со сдвигом рамки считывания. Такая мутация со сдвигом рамки считывания может генерировать другую рамку считывания, расположенную ниже, чем в мРНК дикого типа. Таким образом, в этом случае, мутантная мРНК ACVR2B согласно изобретению не имеет части последовательности, которая кодирует часть или всю внутриклеточную область ACVR2B дикого типа.
[0030] Такой сдвиг рамки считывания может также вызывать в мутантной мРНК ACVR2B согласно изобретению сквозное затухание мРНК, опосредуемое нонсенс-последовательностью (NMD) ACVR2B. NMD представляет собой механизм регуляции качества мРНК, который имеется у всех эукариотических организмов, и такой механизм разрушает аномальные мРНК, имеющие стоп-кодон в положении выше (ближе к 5'-концу) от исходного стоп-кодона, обычно посредством мутаций. Если некоторые экзоны, а в частности экзоны, имеющие последовательности длиной, не кратной трем нуклеотидам (то есть, не 3N, где N - заданное целое число), пропускаются, то рамка трансляции триплетов сдвигается, и это может приводить к образованию нового стоп-кодона выше исходного стоп-кодона. Так, например, если экзон 8 ACVR2B пропускается, то экзоны 7 и 9 связываются напрямую. Рамка считывания на стыке экзонов 7 и 9, «AG/GTAG» состоит из 2 нуклеотидов на самом дальнем 3'-конце экзона 7, то есть «AG», и 4 нуклеотидов на самом дальнем 5'-конце экзона 9, то есть, «GTAG». AGG TAG кодирует аргинин (Arg) и стоп-кодон с образованием несмысловой мутант-подобной мРНК. Такая мутантная мРНК может быть затем разрушена посредством NMD.
С другой стороны, в ACVR2B дикого типа, рамка считывания, расположенная на стыке экзонов 7 и 8 «AG/GGAU», состоит из 2 нуклеотидов на самом дальнем 3'-конце экзона 7, то есть, «AG», и 4 нуклеотидов на самом дальнем 5'-конце экзона 8, то есть, «GGAU». AGG GAU кодирует аргинин (Arg) и аспарагиновую кислоту (Asp).
[0031] В случае, если новый стоп-кодон генерируется из-за сдвига рамки считывания, то мутантная мРНК ACVR2B согласно изобретению сначала продуцируется, но затем она обычно разрушается/разлагается посредством NMD.
[0032] Используемый здесь термин «клетка-мишень» означает клетку, в которую вводят соединение согласно изобретению, и эта клетка может представлять собой любую клетку, экспрессирующую ACVR2B (например, ACVR2B дикого типа). Пример клетки-мишени включает миоцит, миобласт или клетку мышечной трубки. В одном из вариантов осуществления изобретения, клетка-мишень представляет собой клетку животного. В другом варианте осуществления изобретения, клетка-мишень представляет собой клетку млекопитающего. В другом варианте осуществления изобретения, клетка-мишень представляет собой клетку человека.
[0033] Соединение согласно изобретению представляет собой любое соединение, способное вызывать продуцирование мРНК и/или белка ACVR2B в виде усеченного варианта, в которой отсутствует часть внутриклеточной области ACVR2B дикого типа. Примеры подходящих соединений согласно изобретению включают: последовательность руководящей РНК CRISPR-CAS9, которая под действием соответствующей эндонуклеазы способна вырезать/удалять часть гена ACVR2B, кодирующего часть его внутриклеточной области; антисмысловой олигомер для пропуска по меньшей мере одного экзона, кодирующего часть внутриклеточной области ACVR2B, и соединения системы loxP для нокаута части гена ACVR2B, который кодирует часть его внутриклеточной области.
[0034] Как будет понятно специалисту в данной области, для получения усеченного варианта ACVR2B согласно изобретению могут быть также применены и другие хорошо известные средства редактирования генов, такие как TALEN или «цинковые пальцы» (ZFN).
[0035] Если CRISPR-CAS9 используется для ингибирования сигнала миостатина, то руководящую РНК, имеющую последовательность, комплементарную последовательности-мишени геномной ДНК, которая кодирует ACVR2B или часть ACVR2B (например, внутриклеточную область ACVR2B дикого типа), вводят в клетку-мишень для идентификации расщепляемой последовательности-мишени. Белок Cas9, введенный в клетку-мишень, расщепляет двухцепочечную часть, состоящую из геномной ДНК и руководящей РНК. В процессе репарации сайта расщепления, мутация(и) вызывается(ются) делецией и/или инсерцией нуклеотидов, что приводит к нокауту всего или части ACVR2B. Примеры последовательности-мишени геномной ДНК включают любую последовательность экзонов, например экзоны 1-11 ACVR2B. Соответственно, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере из одного экзона, выбранного из группы, состоящей из экзонов 5, 6, 7, 8, 9, 10 и 11, или группы, состоящей из 5, 6, 7, 8, 9 и 10 экзонов из ACVR2B. В одном варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере из одного экзона, выбранного из группы, состоящей из экзонов 5, 6, 7, 9 и 10 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере из одного экзона, выбранного из группы, состоящей из экзонов 5, 6, 9 и 10 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере из одного экзона, выбранного из группы, состоящей из экзонов 5, 6 и 10 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере из одного экзона, выбранного из группы, состоящей из экзонов 5 и 6 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере из одного экзона, выбранного из группы, состоящей из экзонов 7, 8 и 9 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере из одного экзона, выбранного из группы, состоящей из экзонов 7 и 8 ACVR2B. В другом вариантах осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 5 ACVR2B. В другом вариантах осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 6 ACVR2B. В другом вариантах осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 7 ACVR2B. В другом вариантах осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 8 ACVR2B. В другом вариантах осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 9 ACVR2B. В другом вариантах осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 10 ACVR2B. В другом вариантах осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 11 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере из одного экзона, выбранного из группы, состоящей из экзонов 7, 8, 9 и 10, или группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B. Альтернативно, CRISPR-CAS9 могут быть нацелены на интроны. Так, например, интроны 7 и 8, которые образуют «сэндвич»-экзон 8, могут быть расщеплены. В случае репарации сайтов расщепления, экзон 8 может отсутствовать, что будет приводить к образованию мутантной мРНК с делецией экзона 8. Аналогичным образом, интроны 4 и 5, или интроны 5 и 6, или интроны 6 и 7, или интроны 8 и 9, или интроны 9 и 10, или интроны 10 и 11 могут быть мишенью для расщепления. Таким образом, соединение согласно изобретению может представлять собой руководящую РНК для CRISPR-CAS9, как описано выше, или ДНК (такую как экспрессионная плазмида), которая обеспечивает руководящую РНК в качестве ее транскрипта, или белок CAS9 (или Cas9-подобный белок), или ДНК (такую как экспрессионная плазмида), которая кодирует и продуцирует белок CAS9 (или Cas9-подобный белок), или их комбинацию.
[0036] Если киРНК используется для ингибирования сигнала миостатина, то киРНК, сконструированную для нацеливания на последовательность мРНК ACVR2B, вводят в клетку-мишень. Если руководящая цепь введенной таким образом киРНК гибридизуется с последовательностью-мишенью, то эндогенный белок RISC в клетке-мишени идентифицирует двухцепочечную часть, состоящую из руководящей цепи и цепи мРНК-мишени, и расщепляет последовательность-мишень мРНК. Таким образом, уровень белка ACVR2B снижается. Так, например, в другом варианте осуществления изобретения, соединение согласно изобретению может представлять собой киРНК или ДНК (такую как экспрессионная плазмида), которая продуцирует киРНК в качестве своего транскрипта.
[0037] Антисмысловой олигомер
Мутантная мРНК ACVR2B может быть также продуцирована внутриклеточно посредством контактирования клетки с антисмысловым олигонуклеотидом (AON), способным индуцировать пропуск одного или более экзонов ACVR2B, которые кодируют внутриклеточную область белка в клетке.
[0038] В одном варианте осуществления изобретения, соединение согласно изобретению представляет собой антисмысловой олигомер, способный индуцировать пропуск экзона, кодирующего часть внутриклеточной области ACVR2B (в дальнейшем называемый «антисмысловым олигомером согласно изобретению» или «антисмысловым олигомером»). В соответствии с этим, экзон, который необходимо пропустить, выбран из группы, состоящей из экзонов 5, 6, 7, 8, 9, 10 и 11, или группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B. В одном варианте осуществления экзон, который необходимо пропустить, выбран из группы, состоящей из экзонов 5, 6, 7, 9 и 10. В другом варианте осуществления изобретения, экзон, который необходимо пропустить, представляет собой экзон 5. В другом варианте осуществления изобретения, экзон, который необходимо пропустить, представляет собой экзон 6. В другом варианте осуществления изобретения, экзон, который необходимо пропустить, представляет собой экзон 7. В другом варианте осуществления изобретения, экзон, который необходимо пропустить, представляет собой экзон 8. В другом варианте осуществления изобретения, экзон, который необходимо пропустить, представляет собой экзон 9. В другом варианте осуществления изобретения, экзон, который необходимо пропустить, представляет собой экзон 10. В другом варианте осуществления изобретения, экзон, который необходимо пропустить, представляет собой экзон 11. В другом варианте осуществления изобретения, экзон, который необходимо пропустить, выбран из группы, состоящей из экзонов 7, 8, 9 и 10, или из группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B.
[0039] Репрезентативные нуклеотидные последовательности экзонов 5, 6, 7, 8, 9, 10 и 11 представлены как SEQ ID NO: 1, 2, 3, 4, 5, 6 и 7, соответственно. Нуклеотидные последовательности экзонов 5, 6, 7, 8, 9, 10 и 11 не ограничиваются последовательностями, представленными как SEQ ID NO: 1, 2, 3, 4, 5, 6 и 7, и включают модифицированные последовательности, имеющие длину, которая составляет 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более или 100% от длины SEQ ID NO: 1, 2, 3, 4, 5, 6 и 7, соответственно, и последовательности, которые на 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более или 100% идентичны последовательностям SEQ ID NO: 1, 2, 3, 4, 5, 6 и 7, соответственно.
[0040] Термин «способный индуцировать пропуск экзона, кодирующего часть внутриклеточной области ACVR2B» означает, что после связывания антисмыслового олигомера согласно изобретению с его сайтом экзона-мишени, кодирующего часть внутриклеточной области транскрипта (например, пре-мРНК) гена ACVR2B (например, человеческого гена ACVR2B), указанный экзон подвергается сплайсингу. Так, например, если антисмысловой олигомер согласно изобретению связывается с частью экзона 6 пре-мРНК ACVR2B, то нуклеотидная последовательность, соответствующая 5'-концу экзона, расположенного ниже экзона 6, то есть, экзона 7, сплайсируется на 3'-стороне нуклеотидной последовательности, соответствующей 3'-концу экзона, расположенного выше экзона 6, то есть, экзона 5. Это вызвано нарушением нормального механизма сплайсинга после связывания антисмыслового олигомера согласно изобретению. Полипептид ACVR2B, кодируемый мРНК, затем будет включать аминокислоты, кодируемые экзоном 5, соединенным с экзоном 7, при этом, аминокислоты, кодируемые экзоном 6, будут проопущены (будут отсутствовать) в усеченном варианте ACVR2B.
[0041] Используемый здесь термин «связывание» означает, что, если антисмысловой олигомер согласно изобретению контактирует с (например, смешивается с) копиями транскрипта гена ACVR2B (например, гена человеческого ACVR2B), то комплементарные последовательности будут гибридизоваться в физиологических условиях с образованием двухцепочечной нуклеиновой кислоты. Термин «в физиологических условиях» относится к условиям, которые имитируют среду in vivo в отношении pH, солевого состава и температуры. Подходящие условия могут представлять собой любую комбинацию указанных ниже температур, pH и концентраций соли:
Температура: 25°°С - 40°С, 35°C - 38°С, 36°С - 38°С или 37°C;
pH: pH 5-8, pH 6-8, pH 7-8 или pH 7,4; и
Концентрация соли: 100-200 мМ, 130-170 мМ, 140-160 мМ или 150 мМ хлорида натрия.
[0042] Используемые здесь термины «идентичность последовательностей» и «гомология», если они относятся к нуклеотидной последовательности, означают процент нуклеотидных остатков в последовательности-кандидате на мишень, которые идентичны нуклеотидным остаткам в рассматриваемой нуклеотидной последовательности после выравнивания этих последовательностей и введения пробелов, если это необходимо для достижения максимального процента идентичности последовательностей, и без учета каких-либо консервативных замен при определении идентичности последовательностей. Выравнивание для определения процента идентичности нуклеотидных последовательностей может быть достигнуто различными способами, которые находятся в пределах компетенции специалиста в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как BLAST, BLAST-2, ClustalW2, ALIGN или MEGALIGNTM (DNASTAR). Специалисты в данной области могут определить подходящие параметры для оценки выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Так, например, идентичность двух или более нуклеотидных последовательностей может быть определена с использованием алгоритма Karlin и Altschul, BLAST (пакета программ для поиска основного локального выравнивания) (Proc. Natl. Acad. Sci. USA 872264-2268, 1990; Proc. Natl. Acad. Sci USA 90: 5873, 1993). На основе алгоритма BLAST были разработаны программы под названием BLASTN и BLASTX (Altschul SF, et al: J Mol Biol 215: 403, 1990). Если BLASTN используется для анализа нуклеотидной последовательности, то могут быть установлены такие параметры, как, например, весовые коэффициенты=100 и длина слова=12. Если используются программы BLAST и BLAST с пробелами, то могут быть использованы параметры по умолчанию, имеющиеся в каждой программе.
[0043] Антисмысловой олигомер согласно изобретению представляет собой олигонуклеотид или модифицированный олигонуклеотид. Используемый здесь термин «олигонуклеотид» представляет собой последовательность связанных нуклеотидов с определенной ниже длиной, которая может включать или не включать модификации. Модифицированный олигонуклеотид более подробно описан в другом разделе.
[0044] Антисмысловой олигомер согласно изобретению может иметь длину от 10 до 70 нуклеотидов, например: 11-70, 12-70, 13-70, 14-70, 15-70, 16-70, 17-70, 18-70, 19-70, 20-70, 21-70, 22-70, 23-70, 24-70, 25-70, 10-65, 11-65, 12-65, 13-65, 14-65, 15-65, 16-65, 17-65, 18-65, 19-65, 20-65, 21-65, 22-65, 23-65, 24-65, 25-65, 10-60, 11-60, 12-60, 13-60, 14-60, 15-60, 16-60, 17-60, 18-60, 19-60, 20-60, 21-60, 22-60, 23-60, 24-60, 25-60, 10-55, 11-55, 12-55, 13-55, 14-55, 15-55, 16-55, 17-55, 18-55, 19-55, 20-55, 21-55, 22-55, 23-55, 24-55, 25-55,10-50, 11-50, 12-50, 13-50, 14-50, 15-50, 16-50, 17-50, 18-50, 19-50, 20-50, 21-50, 22-50, 23-50, 24-50, 25-50, 10-45, 11-45, 12-45, 13-45, 14-45, 15-45, 16-45, 17-45, 18-45, 19-45, 20-45, 21-45, 22-45, 23-45, 24-45, 25-45, 10-40, 11-40, 12-40, 13-40, 14-40, 15-40, 16-40, 17-40, 18-40, 19-40, 20-40, 21-40, 22-40, 23-40, 24-40, 25-40, 10-38, 11-38, 12-38, 13-38, 14-38, 15-38, 16-38, 17-38, 18-38, 19-38, 20-38, 21-38, 22-38, 23-38, 24-38, 25-38, 10-36, 11-36, 12-36, 13-36, 14-36, 15-36, 16-36, 17-36, 18-36, 19-36, 20-36, 21-36, 22-36, 23-36, 24-36, 25-36, 10-35, 11-35, 12-35, 13-35, 14-35, 15-35, 16-35, 17-35, 18-35, 19-35, 20-35, 21-35, 22-35, 23-35, 24-35, 25-35, 10-34, 11-34, 12-34, 13-34, 14-34, 15-34, 16-34, 17-34, 18-34, 19-34, 20-34, 21-34, 22-34, 23-34, 24-34, 25-34, 10-33, 11-33, 12-33, 13-33, 14-33, 15-33, 16-33, 17-33, 18-33, 19-33, 20-33, 21-33, 22-33, 23-33, 24-33, 25-33, 10-32, 11-32, 12-32, 13-32, 14-32, 15-32, 16-32, 17-32, 18-32, 19-32, 20-32, 21-32, 22-32, 23-32, 24-32, 25-32, 10-30, 11-30, 12-30, 13-30, 14-30, 15-30, 16-30, 17-30, 18-30, 19-30, 20-30, 21-30, 22-30, 23-30, 24-30, 25-30, 10-29, 11-29, 12-29, 13-29, 14-29, 15-29, 16-29, 17-29, 18-29, 19-29, 20-29, 21-29, 22-29, 23-29, 24-29, 25-29, 10-28, 11-28, 12-28, 13-28, 14-28, 15-28, 16-28, 17-28, 18-28, 19-28, 20-28, 21-28, 22-28, 23-28, 24-28, 25-28, 10-27, 11-27, 12-27, 13-27, 14-27, 15-27, 16-27, 17-27, 18-27, 19-27, 20-27, 21-27, 22-27, 23-27, 24-27, 25-27, 10-26, 11-26, 12-26, 13-26, 14-26, 15-26, 16-26, 17-26, 18-26, 19-26, 20-26, 21-26, 22-26, 23-26, 24-26, 25-26, 10-25, 11-25, 12-25, 13-25, 14-25, 15-25, 16-25, 17-25, 18-25, 19-25, 20-25, 21-25, 22-25, 23-25, 24-25, 10-24, 11-24, 12-24, 13-24, 14-24, 15-24, 16-24, 17-24, 18-24, 19-24, 20-24, 21-24, 22-24, 23-24, 10-23, 11-23, 12-23, 13-23, 14-23, 15-23, 16-23, 17-23, 18-23, 19-23, 20-23, 21-23, 22-23, 10-22, 11-22, 12-22, 13-22, 14-22, 15-22, 16-22, 17-22, 18-22, 19-22, 20-22, 21-22, 10-21, 11-21, 12-21, 13-21, 14-21, 15-21, 16-21, 17-21, 18-21, 19-21, 20-21, 10-20, 11-20, 12-20, 13-20, 14-20, 15-20, 16-20, 17-20, 18-20, 19-20, 10-19, 11-19, 12-19, 13-19, 14-19, 15-19, 16-19, 17-19, 18-19, 10-18, 11-18, 12-18, 13-18, 14-18, 15-18, 16-18, 17-18, 10-17, 11-17, 12-17, 13-17, 14-17, 15-17, 16-17, 10-16, 11-16, 12-16, 13-16, 14-16, 15-16, 10-15, 11-15, 12-15, 13-15 и 14-15 нуклеотидов от 5′-конца до 3′-конца (далее называемой «репрезентативным интервалом длин антисмыслового олигомера согласно изобретению»). Антисмысловой олигомер согласно изобретению может иметь длину в 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 33, 32, 33, 34, 35, 36, 37, 38, 39, 40, 44, 42, 43, 44, 45, 46, 47, 48, 49, 50, 55, 52, 53, 54, 55, 56, 57, 58, 59, 60, 66, 62, 63, 64, 65, 66, 67, 68, 69 или 70 нуклеотидов от его 5'-конца до 3'-конца (далее называемой «репрезентативной длиной антисмыслового олигомера согласно изобретению»). Особенно подходящие интервалы длин олигомера согласно изобретению включают: 15-45, 17-35, 15-24, 15-26 и 20-40 нуклеотидов от его 5'-конца до 3'-конца.
[0045] Антисмысловой олигомер согласно изобретению содержит нуклеотидную последовательность, комплементарную части нуклеотидной последовательности экзона, выбранной из группы, состоящей из экзонов 5, 6, 7, 8, 9, 10 и 11 ACVR2B, или группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B. Часть нуклеотидной последовательности экзона, выбранная из группы, состоящей из экзонов 5, 6, 7, 8, 9, 10 и 11 ACVR2B, или группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B, также называется здесь «последовательностью-мишенью». Репрезентативные нуклеотидные последовательности экзонов 5, 6, 7, 8, 9, 10 и 11 представлены в SEQ ID NO: 1, 2, 3, 4, 5, 6 и 7, соответственно. Нуклеотидные последовательности экзонов 5, 6, 7, 8, 9, 10 и 11 не ограничиваются последовательностями, представленными как SEQ ID NO: 1, 2, 3, 4, 5, 6 и 7, и включают последовательности вариантов, которые на 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более или 100% идентичны последовательности, раскрытой в любой из SEQ ID NO: 1, 2, 3, 4, 5, 6 и 7, соответственно. Таким образом, в соответствии с конкретными вариантами осуществления изобретения, олигомер согласно изобретению содержит нуклеотидную последовательность, комплементарную последовательности, которая на 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более или 100% идентична последовательности, раскрытой в любой из SEQ ID NO: 1, 2, 3, 4, 5, 6 и 7, соответственно.
[0046] Последовательность-мишень может иметь любую длину, при условии, что будет равна длине или будет короче, чем длина антисмыслового олигомера согласно изобретению. Так, например, последовательность-мишень может иметь длину от 10 до 70 нуклеотидов, например: 11-70, 12-70, 13-70, 14-70, 15-70, 16-70, 17-70, 18-70, 19-70, 20-70, 21-70, 22-70, 23-70, 24-70, 25-70, 10-65, 11-65, 12-65, 13-65, 14-65, 15-65, 16-65, 17-65, 18-65, 19-65, 20-65, 21-65, 22-65, 23-65, 24-65, 25-65, 10-60, 11-60, 12-60, 13-60, 14-60, 15-60, 16-60, 17-60, 18-60, 19-60, 20-60, 21-60, 22-60, 23-60, 24-60, 25-60, 10-55, 11-55, 12-55, 13-55, 14-55, 15-55, 16-55, 17-55, 18-55, 19-55, 20-55, 21-55, 22-55, 23-55, 24-55, 25-55, 10-50, 11-50, 12-50, 13-50, 14-50, 15-50, 16-50, 17-50, 18-50, 19-50, 20-50, 21-50, 22-50, 23-50, 24-50, 25-50, 10-45, 11-45, 12-45, 13-45, 14-45, 15-45, 16-45, 17-45, 18-45, 19-45, 20-45, 21-45, 22-45, 23-45, 24-45, 25-45, 10-40, 11-40, 12-40, 13-40, 14-40, 15-40, 16-40, 17-40, 18-40, 19-40, 20-40, 21-40, 22-40, 23-40, 24-40, 25-40, 10-38, 11-38, 12-38, 13-38, 14-38, 15-38, 16-38, 17-38, 18-38, 19-38, 20-38, 21-38, 22-38, 23-38, 24-38, 25-38, 10-36, 11-36, 12-36, 13-36, 14-36, 15-36, 16-36, 17-36, 18-36, 19-36, 20-36, 21-36, 22-36, 23-36, 24-36, 25-36, 10-35, 11-35, 12-35, 13-35, 14-35, 15-35, 16-35, 17-35, 18-35, 19-35, 20-35, 21-35, 22-35, 23-35, 24-35, 25-35, 10-34, 11-34, 12-34, 13-34, 14-34, 15-34, 16-34, 17-34, 18-34, 19-34, 20-34, 21-34, 22-34, 23-34, 24-34, 25-34, 10-33, 11-33, 12-33, 13-33, 14-33, 15-33, 16-33, 17-33, 18-33, 19-33, 20-33, 21-33, 22-33, 23-33, 24-33, 25-33, 10-32, 11-32, 12-32, 13-32, 14-32, 15-32, 16-32, 17-32, 18-32, 19-32, 20-32, 21-32, 22-32, 23-32, 24-32, 25-32, 10-30, 11-30, 12-30, 13-30, 14-30, 15-30, 16-30, 17-30, 18-30, 19-30, 20-30, 21-30, 22-30, 23-30, 24-30, 25-30, 10-29, 11-29, 12-29, 13-29, 14-29, 15-29, 16-29, 17-29, 18-29, 19-29, 20-29, 21-29, 22-29, 23-29, 24-29, 25-29, 10-28, 11-28, 12-28, 13-28, 14-28, 15-28, 16-28, 17-28, 18-28, 19-28, 20-28, 21-28, 22-28, 23-28, 24-28, 25-28, 10-27, 11-27, 12-27, 13-27, 14-27, 15-27, 16-27, 17-27, 18-27, 19-27, 20-27, 21-27, 22-27, 23-27, 24-27, 25-27, 10-26, 11-26, 12-26, 13-26, 14-26, 15-26, 16-26, 17-26, 18-26, 19-26, 20-26, 21-26, 22-26, 23-26, 24-26, 25-26, 10-25, 11-25, 12-25, 13-25, 14-25, 15-25, 16-25, 17-25, 18-25, 19-25, 20-25, 21-25, 22-25, 23-25, 24-25, 10-24, 11-24, 12-24, 13-24, 14-24, 15-24, 16-24, 17-24, 18-24, 19-24, 20-24, 21-24, 22-24, 23-24, 10-23, 11-23, 12-23, 13-23, 14-23, 15-23, 16-23, 17-23, 18-23, 19-23, 20-23, 21-23, 22-23, 10-22, 11-22, 12-22, 13-22, 14-22, 15-22, 16-22, 17-22, 18-22, 19-22, 20-22, 21-22, 10-21, 11-21, 12-21, 13-21, 14-21, 15-21, 16-21, 17-21, 18-21, 19-21, 20-21, 10-20, 11-20, 12-20, 13-20, 14-20, 15-20, 16-20, 17-20, 18-20, 19-20, 10-19, 11-19, 12-19, 13-19, 14-19, 15-19, 16-19, 17-19, 18-19, 10-18, 11-18, 12-18, 13-18, 14-18, 15-18, 16-18, 17-18, 10-17, 11-17, 12-17, 13-17, 14-17, 15-17, 16-17, 10-16, 11-16, 12-16, 13-16, 14-16, 15-16, 10-15, 11-15, 12-15, 13-15 и 14-15 нуклеотидов от 5′-конца до 3′-конца. Последовательность-мишень может иметь длину 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 33, 32, 33, 34, 35, 36, 37, 38, 39, 40, 44, 42, 43, 44, 45, 46, 47, 48, 49, 50, 55, 52, 53, 54, 55, 56, 57, 58, 59, 60, 66, 62, 63, 64, 65, 66, 67, 68, 69 или 70 нуклеотидов от 5′-конца до 3′-конца.
[0047] Нуклеотидная последовательность, комплементарная последовательности-мишени (далее называемая «гибридизующейся последовательностью»), должна иметь такую же длину, как и последовательность-мишень. Таким образом, репрезентативная длина гибридизующейся последовательности включает: от 10 до 70 нуклеотидов, например, 11-70, 12-70, 13-70, 14-70, 15-70, 16-70, 17-70, 18-70, 19-70, 20-70, 21-70, 22-70, 23-70, 24-70, 25-70, 10-65, 11-65, 12-65, 13-65, 14-65, 15-65, 16-65, 17-65, 18-65, 19-65, 20-65, 21-65, 22-65, 23-65, 24-65, 25-65, 10-60, 11-60, 12-60, 13-60, 14-60, 15-60, 16-60, 17-60, 18-60, 19-60, 20-60, 21-60, 22-60, 23-60, 24-60, 25-60, 10-55, 11-55, 12-55, 13-55, 14-55, 15-55, 16-55, 17-55, 18-55, 19-55, 20-55, 21-55, 22-55, 23-55, 24-55, 25-55, 10-50, 11-50, 12-50, 13-50, 14-50, 15-50, 16-50, 17-50, 18-50, 19-50, 20-50, 21-50, 22-50, 23-50, 24-50, 25-50, 10-45, 11-45, 12-45, 13-45, 14-45, 15-45, 16-45, 17-45, 18-45, 19-45, 20-45, 21-45, 22-45, 23-45, 24-45, 25-45, 10-40, 11-40, 12-40, 13-40, 14-40, 15-40, 16-40, 17-40, 18-40, 19-40, 20-40, 21-40, 22-40, 23-40, 24-40, 25-40, 10-38, 11-38, 12-38, 13-38, 14-38, 15-38, 16-38, 17-38, 18-38, 19-38, 20-38, 21-38, 22-38, 23-38, 24-38, 25-38, 10-36, 11-36, 12-36, 13-36, 14-36, 15-36, 16-36, 17-36, 18-36, 19-36, 20-36, 21-36, 22-36, 23-36, 24-36, 25-36, 10-35, 11-35, 12-35, 13-35, 14-35, 15-35, 16-35, 17-35, 18-35, 19-35, 20-35, 21-35, 22-35, 23-35, 24-35, 25-35, 10-34, 11-34, 12-34, 13-34, 14-34, 15-34, 16-34, 17-34, 18-34, 19-34, 20-34, 21-34, 22-34, 23-34, 24-34, 25-34, 10-33, 11-33, 12-33, 13-33, 14-33, 15-33, 16-33, 17-33, 18-33, 19-33, 20-33, 21-33, 22-33, 23-33, 24-33, 25-33,10-32, 11-32, 12-32, 13-32, 14-32, 15-32, 16-32, 17-32, 18-32, 19-32, 20-32, 21-32, 22-32, 23-32, 24-32, 25-32, 10-30, 11-30, 12-30, 13-30, 14-30, 15-30, 16-30, 17-30, 18-30, 19-30, 20-30, 21-30, 22-30, 23-30, 24-30, 25-30, 10-29, 11-29, 12-29, 13-29, 14-29, 15-29, 16-29, 17-29, 18-29, 19-29, 20-29, 21-29, 22-29, 23-29, 24-29, 25-29, 10-28, 11-28, 12-28, 13-28, 14-28, 15-28, 16-28, 17-28, 18-28, 19-28, 20-28, 21-28, 22-28, 23-28, 24-28, 25-28, 10-27, 11-27, 12-27, 13-27, 14-27, 15-27, 16-27, 17-27, 18-27, 19-27, 20-27, 21-27, 22-27, 23-27, 24-27, 25-27, 10-26, 11-26, 12-26, 13-26, 14-26, 15-26, 16-26, 17-26, 18-26, 19-26, 20-26, 21-26, 22-26, 23-26, 24-26, 25-26, 10-25, 11-25, 12-25, 13-25, 14-25, 15-25, 16-25, 17-25, 18-25, 19-25, 20-25, 21-25, 22-25, 23-25, 24-25, 10-24, 11-24, 12-24, 13-24, 14-24, 15-24, 16-24, 17-24, 18-24, 19-24, 20-24, 21-24, 22-24, 23-24, 10-23, 11-23, 12-23, 13-23, 14-23, 15-23, 16-23, 17-23, 18-23, 19-23, 20-23, 21-23, 22-23, 10-22, 11-22, 12-22, 13-22, 14-22, 15-22, 16-22, 17-22, 18-22, 19-22, 20-22, 21-22, 10-21, 11-21, 12-21, 13-21, 14-21, 15-21, 16-21, 17-21, 18-21, 19-21, 20-21, 10-20, 11-20, 12-20, 13-20, 14-20, 15-20, 16-20, 17-20, 18-20, 19-20, 10-19, 11-19, 12-19, 13-19, 14-19, 15-19, 16-19, 17-19, 18-19, 10-18, 11-18, 12-18, 13-18, 14-18, 15-18, 16-18, 17-18, 10-17, 11-17, 12-17, 13-17, 14-17, 15-17, 16-17, 10-16, 11-16, 12-16, 13-16, 14-16, 15-16, 10-15, 11-15, 12-15, 13-15 и 14-15 нуклеотидов от 5'-конца до 3'-конца. Гибридизующаяся последовательность может иметь длину 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 33, 32, 33, 34, 35, 36, 37, 38, 39, 40, 44, 42, 43, 44, 45, 46, 47, 48, 49, 50, 55, 52, 53, 54, 55, 56, 57, 58, 59, 60, 66, 62, 63, 64, 65, 66, 67, 68, 69 или 70 нуклеотидов от 5'-конца до 3'-конца.
[0048] Примеры подходящей гибридизующейся оследовательности включают любую из SEQ ID NO: 12-36 и 43-111. Антисмысловой олигомер согласно изобретению может содержать нуклеотидную последовательность, выбранную из группы, состоящей из любой из SEQ ID NO: 12-36 и 43-111 (далее называемую «подходящей гибридизующейся последовательность» или «подходящими гибридизующимися последовательностями»).
[0049] Антисмысловой олигомер согласно изобретению может, но необязательно, содержать только гибридизующуюся последовательность. Если антисмысловой олигомер согласно изобретению сохраняет активность в отношении пропуска по меньшей мере для одного экзона, выбранного из группы, состоящей из экзонов 5, 6, 7, 8, 9, 10 и 11 ACVR2B, или группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B, то антисмысловой олигомер согласно изобретению может содержать неполную последовательность вышеуказанных подходящих гибридизирующихся последовательностей. В некоторых вариантах осуществления изобретения, антисмысловой олигомер согласно изобретению может содержать 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 последовательно расположенных нуклеотидов любой из последовательностей. раскрытых в SEQ ID NO: 12-36 и 43-111. В другом варианте осуществления изобретения, антисмысловой олигомер согласно изобретению может содержать по меньшей мере 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 последовательно расположенных нуклеотидов любой из последовательностей, раскрытых в SEQ ID NO: 12-36 и 43-111.
[0050] Антисмысловой олигомер согласно изобретению может, но необязательно, содержать только гибридизующуюся последовательность. Если антисмысловой олигомер согласно изобретению сохраняет активность в отношении пропуска по меньшей мере для одного экзона, выбранного из группы, состоящей из экзонов 5, 6, 7, 8, 9, 10 и 11 ACVR2B, или группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B, то антисмысловой олигомер согласно изобретению может содержать дополнительную последовательность (оснований), которая не комплементарна области-мишени.
[0051] Примеры последовательности, на которую нацелен антисмысловой олигомер согласно изобретению, включают любую последовательность экзонов, например экзоны 1-11 пре-мРНК ACVR2B. Соответственно, последовательность-мишень включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 5, 6, 7, 8, 9, 10 и 11, или группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 пре-мРНК ACVR2B. В одном варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 5, 6, 7, 9 и 10. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 5, 6, 9 и 10. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 5, 6 и 10. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 5 и 6. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 7, 8 и 9. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 7 и 8. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B представляет собой экзон 5. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B представляет собой экзон 6. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B представляет собой экзон 7. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B представляет собой экзон 8. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B представляет собой экзон 9. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B представляет собой экзон 10. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B представляет собой экзон 11. В другом варианте осуществления изобретения, последовательность-мишень пре-мРНК ACVR2B включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 7, 8, 9 и 10, или группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10.
[0052] В конкретном варианте осуществления изобретения, олигомер согласно изобретению имеет гибридизирующуюся последовательность, которая имеет такую же длину, как и олигомер, или длину короче олигомера на 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов. Так, например, олигомер может иметь длину 24 нуклеотида и может содержать гибридизирующуюся последовательность, которая имеет такую же длину, то есть, все 24 нуклеотида в олигомере, комплементарном области-мишени, или он может иметь гибридизирующуюся последовательность длиной в 20 нуклеотидов (на 4 нуклеотида короче олигомера), и таким образом, олигомер также содержит 4 нуклеотида, которые не комплементарны области-мишени (а поэтому не являются частью гибридизующейся последовательности). Такой олигомер может, например, иметь два нуклеотида по обе стороны от гибридизующейся последовательности, которые не комплементарны области-мишени, или 3 с одной стороны и один с другой, или 4 у одного конца.
[0053] Антисмысловой олигомер согласно изобретению, помимо гибридизующейся последовательности или неполной гибридизующейся последовательности может содержать дополнительные последовательности, которые могут участвовать, а могут и не участвовать, в гибридизации с последовательностью-мишенью. Такие дополнительные последовательности могут быть присоединены к 5'-концу, 3'-концу или к обоим концам гибридизирующейся последовательности или неполной гибридизирующейся последовательности. В этом случае, общая длина антисмыслового олигомера согласно изобретению входит в репрезентативный интервал длин антисмыслового олигомера согласно изобретению или представляет собой репрезентативную длину антисмыслового олигомера согласно изобретению.
[0054] В других вариантах осуществления изобретения, антисмысловой олигомер согласно изобретению может состоять из нуклеотидной последовательности, представленной в любой из SEQ ID NO: 12-36 и 43-111. В некоторых вариантах осуществления изобретения, антисмысловой олигомер согласно изобретению может состоять из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 последовательно расположенных нуклеотидов последовательности, представленной в любой из SEQ ID NO: 12-36 и 43-111.
В другом своем варианте, настоящее изобретение относится к конъюгату, в котором функциональный пептид, например, пептид, проникающий в клетку (CPP), связан с антисмысловым олигомером согласно изобретению. В настоящем изобретении могут быть использованы общеизвестный функциональный пептид или коммерчески доступный функциональный пептид. Функциональный пептид, который может быть использован в настоящем изобретении, включает, например, богатые аргинином пептиды, раскрытые в WO2008/036127; или пептиды, нацеленные на органы и раскрытые в WO2009/005793, такие как RXR, RBR и т.п.; или пептиды, содержащие аминокислотную субъединицу, раскрытую в WO2012/150960. Проникающие в клетки пептиды (CPP) представляют собой короткие пептидные последовательности, имеющие от 10 до приблизительно 30 аминокислот, которые могут проходить через плазматическую мембрану клеток млекопитающих и, таким образом, могут улучшать доставку лекарственного средства в клетки (см., например, Hum Mol. Genet. 2011 Aug 15; 20 (16): 3151-3160; Pharmacology & Therapeutics 154 (2015) 78-86). В настоящем изобретении могут быть использованы общеизвестные CPP или коммерчески доступные CPP. CPP, которые могут быть использованы в настоящем изобретении, включают, например; CPP, перечисленные в Таблице 1 на странице 80 Pharmacology & Therapeutics 154 (2015) 78-86, такие как TAT (48-60), пенетратин, полиаргинин, Oct4, WT1-pTj, DPV3, транспортан, MAP, VP22, Rep1, KW, KFGF, FGF12, пептид интерферин β3, C105Y, TP2; CPP, перечисленные в абзаце [0085], и в Таблице 1 JP-A-2017-500856 (WO2015/089487), такие как DPV10/6, DPV15b, YM-3, Tat, LR11, C45D18, Lyp-1, Lyp-2, BMV GAG, hLF1-22, C45D18, LR20; и т.п. CPP являются коммерчески доступными и поставляются, например, от Funakoshi, Co., Ltd. В настоящем изобретении могут быть использованы коммерчески доступные CPP, такие как TAT (Funakoshi, Co., Ltd.), пенетратин (Funakoshi, Co., Ltd.) и т.п., или общедоступные известные CPP, такие как R8 и т.п. Предпочтительные CPP, которые могут быть использованы в настоящем изобретении, включают, например, hLIMK, TAT, пенетратин, R8 и т.п. (см. WO2016/187425, WO2018/118662, WO2018/118599, WO2018/118627, EBioMedicine 45 (2019) 630-645 и др.). CPP может быть непосредственно связан с антисмысловым олигомером согласно изобретению или может быть связан посредством линкера, который может связывать CPP с антисмысловым олигомером. В настоящем изобретении могут быть использованы общеизвестные линкеры. Такие линкеры включают, например, линкеры, описанные в JP-A-2017-500856 (WO2015/089487), WO2015/089487, WO2009/073809, WO2013/075035, WO2015/105083, WO2014/179620, WO2015/006740, WO2017/010575 и т.п. Предпочтительные линкеры, которые могут быть использованы в настоящем изобретении, включают, например, 4-малеимидомасляную кислоту, линкер, который может быть присоединен к функциональному пептиду или антисмысловому олигомеру согласно изобретению посредством дисульфидной связи и т.п. Конъюгаты согласно изобретению могут быть получены методом, хорошо известным специалистам в данной области.
[0055] Эффективность пропуска:
Влияние конкретного олигомера на пропуск экзона или экзонов в гене ACVR2B может быть оценено или подтверждено путем введения антисмыслового олигомера согласно изобретению в клетку, экспрессирующую ACVR2B (например, в клетку человеческой рабдомиосаркомы), и амплификации области мРНК ACVR2B, кодирующей внутриклеточную область ACVR2B из общей РНК клетки, экспрессирующей ACVR2B, с помощью ОТ-ПЦР или анализа последовательности ПЦР-амплифицированного продукта.
[0056] Эффективность пропуска может быть определена следующим образом: реакционный раствор для ОТ-ПЦР был оценен на уровень полинуклеотидов «A» в ПЦР-амплифицированном продукте с пропуском экзонов (например, на количество мРНК усеченного ACVR2B) и уровень полинуклеотидов «B» в ПЦР-амплифицированном продукте с пропуском экзонов (например, на количество мРНК полноразмерного ACVR2B) с последующим вычислением исходя из измеренных величин «A» и «B» по следующему уравнению.
Эффективность пропуска (%) = {A/(A+B)} × 100
[0057] В предпочтительном варианте осуществления изобретения, антисмысловой олигомер согласно изобретению вызывает пропуск экзонов с эффективностью 10% или более, 15% или более, 20% или более, 25% или более, 30% или более, 35% или более, 40% или более, 45% или более, 50% или более, 55% или более, 60% или более, 62,5% или более, 65% или более, 67,5% или более, 70% или более, 72,5% или более, 75% или более, 77,5% или более, 80% или более, 82,5% или более, 85% или более, 87,5% или более, 90% или более, 92,5% или более, 95% или более, 97,5% или более, 98% или более или 99% или более. После идентификации эффективного антисмыслового олигомера, квалифицированный специалист может попытаться идентифицировать более оптимальную последовательность путем конструирования множества антисмысловых олигомеров, имеющих последовательности, которые перекрываются с последовательностью эффективного антисмыслового олигомера, и протестировать их в соответствии с описанными здесь процедурами.
[0058] Олигонуклеотид, морфолино-олигомер или пептидный олигомер нуклеиновой кислоты:
Антисмысловой олигомер согласно изобретению может представлять собой олигонуклеотид, морфолино-олигомер или пептидный олигомер нуклеиновой кислоты (PNA), каждый из которых находится в репрезентативных интервалах длин антисмыслового олигомера согласно изобретению или составляет репрезентативную длину антисмыслового олигомера согласно изобретению.
[0059] Вышеупомянутый олигонуклеотид (далее называемый «олигонуклеотидом согласно изобретению») представляет собой антисмысловой олигомер согласно изобретению, составной единицей которого является нуклеотид, и такой нуклеотид может представлять собой любой из рибонуклеотидов, дезоксирибонуклеотидов или модифицированных нуклеотидов.
Антисмысловой олигонуклеотид обычно является одноцепочечным.
[0060] Модифицированный нуклеотид означает рибонуклеотид или дезоксирибонуклеотид, в котором нуклеооснования, сахарная группа и группа фосфатной связи являются полностью или частично модифицированными.
[0061] В настоящем изобретении, примерами нуклеооснований являются аденин, гуанин, гипоксантин, цитозин, тимин, урацил или их модифицированные основания. Примерами таких модифицированных оснований могут быть, но не ограничиваются ими, псевдоурацил, 3-метилурацил, дигидроурацил, 5-алкилцитозины (например, 5-метилцитозин), 5-алкилурацилы (например, 5-этилурацил), 5-галогенурацилы (например, 5-бромурацил), 6-азапиримидин, 6-алкилпиримидины (например, 6-метилурацил), 2-тиоурацил, 4-тиоурацил, 4-ацетилцитозин, 5-(карбоксигидроксиметил)урацил, 5-карбоксиметиламинометил-2-тиоурацил, 5-карбоксиметиламинометилурацил, 1-метиладенин, 1-метилгипоксантин, 2,2-диметилгуанин, 3-метилцитозин, 2-метиладенин, 2-метилгуанин, N6-метиладенин, 7-метилгуанин, 5-метоксиаминометил-2-тиоурацил, 5-метиламинометилурацил, 5-метилкарбонилметилурацил, 5-метилоксиурацил, 5-метил-2-тиоурацил, 2-метилтио-N6-изопентениладенин, урацил-5-оксиуксусная кислота, 2-тиоцитозин, пурин, 2,6-диаминопурин, 2-аминопурин, изогуанин, индол, имидазол, ксантин и т.п.
[0062] Модификации сахарной группы могут быть представлены как модификации во 2'-положении рибозы и модификации в других положениях сахара. Примерами модификаций в 2'-положении рибозы являются модификации, вводимые для замены группы -ОН в 2'-положении рибозы на OR, R, R'OR, SH, SR, NH2, NHR, NR2, N3, CN, F, Cl, Br или I, где R представляет собой алкил или арил, а R' представляет собой алкилен.
[0063] Примеры модификаций в других положениях сахара включают, но не ограничиваются ими, замену O на S в 4'-положении рибозы или дезоксирибозы и мостиковую связь между 2'- и 4'-положениями сахара, как показано для LNA (блокированных нуклеиновых кислот) или для ENA (для нуклеиновых кислот, связанных мостиковой связью с 2'-O, 4'-C-этиленом).
[0064] Модификации в группе фосфатной связи могут быть представлены как модификации, вводимые для замены фосфодиэфирной связи на фосфортиоатную связь, фосфордитиоатную связь, алкилфосфонатную связь, фосфорамидатную связь или боранофосфатную связь (Enya et al: Bioorganic & Medicinal Chemistry, 2008, 18, 9154-9160) (см., например, JP WO2006/129594 и JP WO2006/038608).
[0065] В настоящем изобретении, алкил предпочтительно представляет собой прямой или разветвленный алкил, содержащий от 1 до 6 атомов углерода. Более конкретно, примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, трет-пентил, н-гексил и изогексил. Такой алкил может быть замещен 1-3 заместителями, включая галоген, алкокси, циано, нитро и т.п.
[0066] В настоящем изобретении, циклоалкил предпочтительно представляет собой циклоалкил, содержащий от 5 до 12 атомов углерода. Более конкретно, примеры включают циклопентил, циклогексил, циклогептил, циклооктил, циклодецил и циклододецил.
[0067] В настоящем изобретении, галогенами являются фтор, хлор, бром и йод.
[0068] Алкокси может представлять собой прямой или разветвленный алкокси, содержащий от 1 до 6 атомов углерода, например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси, изопентилокси, н-гексилокси, изогексилокси и т.п. Особенно предпочтительным является алкокси, содержащий от 1 до 3 атомов углерода.
[0069] В настоящем изобретении, арил предпочтительно, представляет собой арил, содержащий от 6 до 10 атомов углерода. Более конкретными примерами являются фенил, α-нафтил и β-нафтил. Особенно предпочтительным является фенил. Такой арил может быть замещен 1-3 заместителями, включая алкил, галоген, алкокси, циано, нитро и т.п.
[0070] В настоящем изобретении, алкилен предпочтительно представляет собой прямой или разветвленный алкилен, содержащий от 1 до 6 атомов углерода. Более конкретными примерами являются метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, 2-(этил)триметилен и 1-(метил)тетраметилен.
[0071] В настоящем изобретении, ацил может представлять собой прямой или разветвленный алканоил или ароил. Примерами такого алканоила являются формил, ацетил, 2-метилацетил, 2,2-диметилацетил, пропионил, бутирил, изобутирил, пентаноил, 2,2-диметилпропионил, гексаноил и т.п. Примерами ароила являются бензоил, толуоил и нафтоил. Такой ароил может быть замещен в любом замещаемом положении и может быть замещен алкилом(ами).
[0072] Олигонуклеотид согласно изобретению предпочтительно представляет собой антисмысловой олигомер согласно изобретению, составной единицей которого является группа, представленная нижеследующей общей формулой, где группа -ОН в 2'-положении рибозы замещена метокси, а группа фосфатной связи представляет собой фосфортиоатную связь:
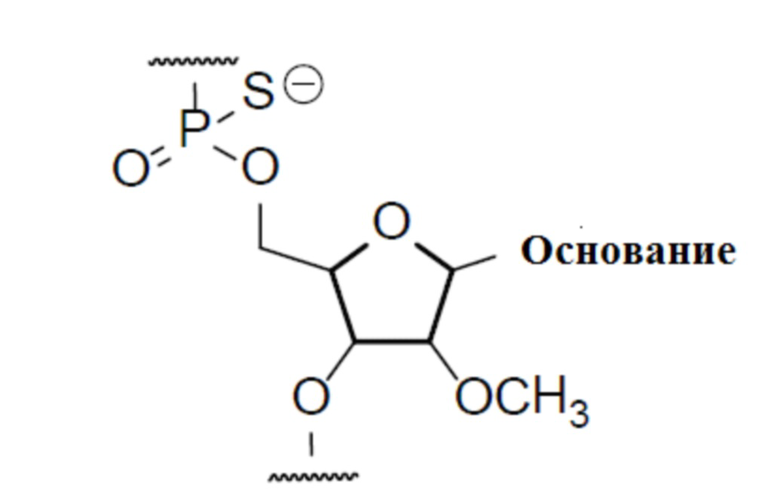
(где основание представляет собой нуклеооснование).
[0073] Олигонуклеотид согласно изобретению может быть легко синтезирован с помощью различных автоматизированных синтезаторов (например, FOCUS (Aapptec), AKTA oligopilot plus 10/100 (GE Healthcare)), или, альтернативно, его синтез может быть поручен третьей стороне (например, Promega, Takara или Japan Bio Services) и т.п.
[0074] Морфолино-олигомер согласно изобретению представляет собой антисмысловой олигомер согласно изобретению, составной единицей которого является группа, представленная нижеследующей общей формулой:
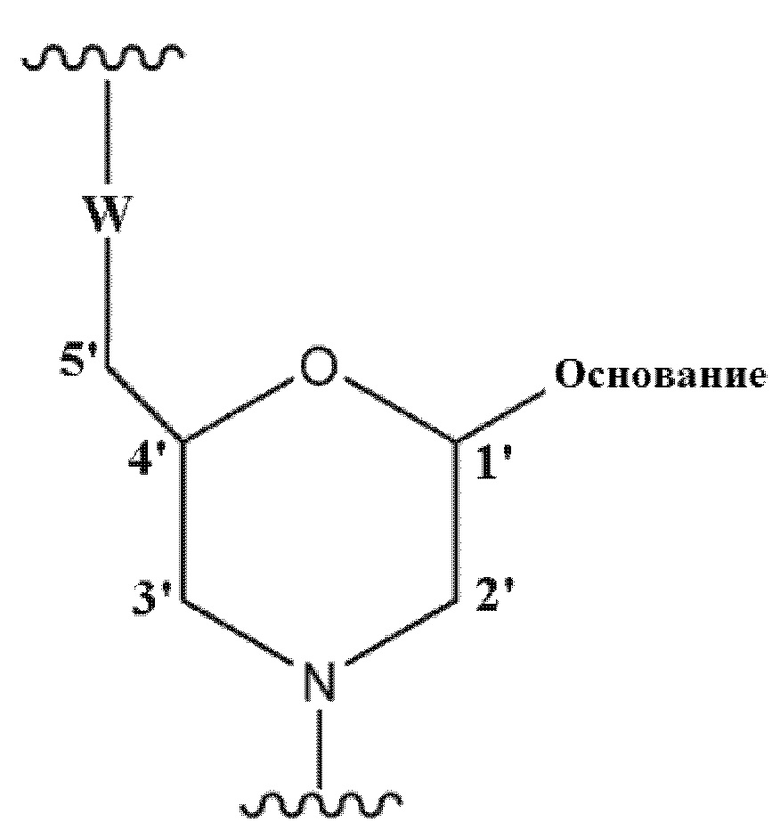
(где основание является таким же, как оно определено выше; а W представляет собой группу, представленную любой из нижеследующих формул:
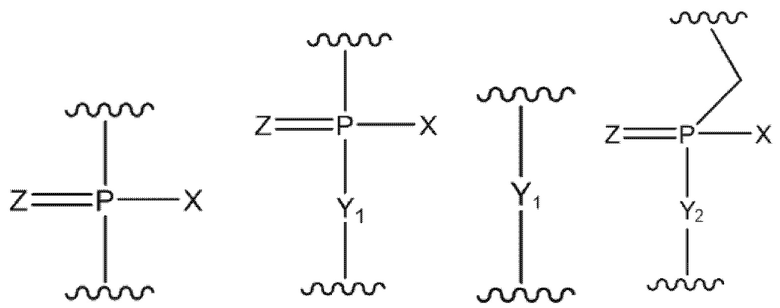
(где X представляет собой -CH2R1, -O-CH2R1, -S-CH2R1, -NR2R3 или F;
R1 представляет собой H или алкил;
каждый из R2 и R3, которые могут быть одинаковыми или различными, представляет собой H, алкил, циклоалкил или арил;
Y1 представляет собой О, S, CH2 или NR1;
Y2 представляет собой О, S или NR1; и
Z представляет собой О или S)).
Морфолино-олигомер предпочтительно представляет собой олигомер, составной единицей которого является группа, представленная нижеследующей формулой (то есть, фосфородиамидатный морфолино-олигомер (далее обозначаемый «PMO»)):
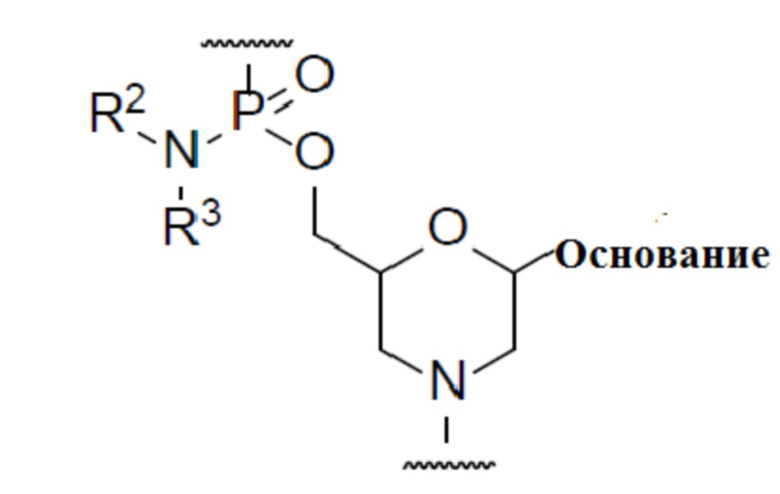
(где основание, R2 и R3 являются такими, как они были определены выше).
[0075] Так, например, морфолино-олигомер может быть получен как описано в WO1991/009033 или WO2009/064471. В частности, PMO может быть получен в соответствии с процедурами, описанными в WO2009/064471, или он может быть получен в соответствии с процедурами, описанными ниже.
[0076] [Способ получения PMO]
В качестве одного из вариантов PMO, соединение, представленное нижеследующей общей формулой (I) (далее обозначаемое PMO (I)), может быть представлено, например, как:
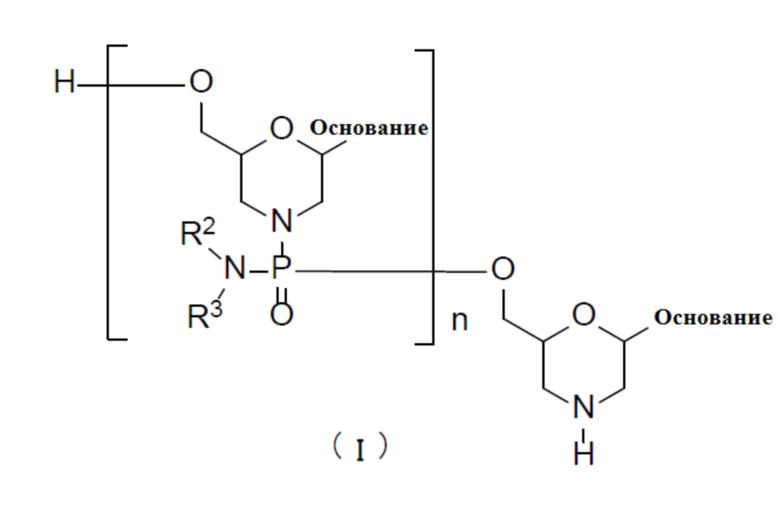
[где каждое из оснований, R2 и R3 являются такими, как они были определены выше; а n равно любому целому числу в диапазоне от 1 до 99, при этом, подходящим является любое целое число в пределах от 13 до 29, от 14 до 28 или от 15 до 27, от 16 до 26, от 17 до 25].
[0077] PMO (I) может быть получен в соответствии с известными процедурами, например, путем проведения процедур, представленных в следующих стадиях.
Соединения и реагенты, используемые в описанных ниже стадиях, не имеют конкретных ограничений, при условии, что они будут подходящими для получения PMO. Более того, все следующие стадии могут быть осуществлены жидкофазным методом или твердофазным методом (в соответствии с инструкциями по их проведению или с использованием коммерчески доступного автоматизированного синтезатора для твердофазного синтеза). Если PMO получают твердофазным методом, то с точки зрения простоты работы и точности синтеза желательно использовать автоматизированный синтезатор.
[0078] (1) Стадия А:
Далее описана стадия, в которой соединение, представленное нижеследующей общей формулой (II) (далее называемое соединением (II)), обрабатывают кислотой с получением соединения, представленного нижеследующей общей формулой (III) (далее называемого соединением (III)):
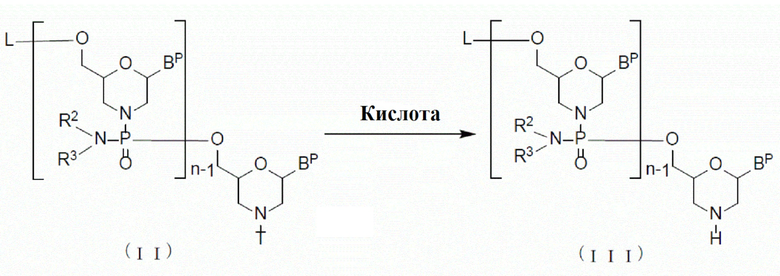
[где n, R2 и R3 являются такими, как они определены выше;
каждый BP независимо представляет собой нуклеооснование, которое может быть защищенным;
Т представляет собой тритильную группу, монометокситритильную группу или диметокситритильную группу; и
L представляет собой водород, ацил или группу, представленную нижеследующей общей формулой (IV) (далее называемую группой (IV))]:
[0079] «Нуклеооснования», представленные как BP, могут представлять собой такие же «нуклеооснования», которые указаны как «Основание», при условии, что аминогруппы или гидроксильные группы в этих нуклеооснованиях, представленных как BP, могут быть защищенными.
[0080] Защитные группы для этих аминогрупп не имеют конкретных ограничений, при условии, что они могут быть использованы в качестве защитных групп для нуклеиновых кислот. Более конкретными примерами являются бензоил, 4-метоксибензоил, ацетил, пропионил, бутирил, изобутирил, фенилацетил, феноксиацетил, 4-трет-бутилфеноксиацетил, 4-изопропилфеноксиацетил и (диметиламино)метилен. Защитными группами для гидроксильных групп являются, например, 2-цианоэтил, 4-нитрофенэтил, фенилсульфонилэтил, метилсульфонилэтил, триметилсилилэтил, фенил, который может быть замещен 1-5 электроноакцепторными группами в любом(ых) замещаемом(ых) положении(ях), дифенилкарбамоил, диметилкарбамоил, диэтилкарбамоил, метилфенилкарбамоил, 1-пирролидинилкарбамоил, морфолинокарбамоил, 4-(трет-бутилкарбокси)бензил, 4-[(диметиламино)карбокси]бензил и 4-(фенилкарбокси)бензил (см., например, WO2009/064471).
[0081] «Твердый носитель» не имеет конкретных ограничений при условии, что он будет подходящим для его использования в твердофазной реакции нуклеиновых кислот, но желательно использовать, например, носитель, который (i) плохо растворяется в реагентах, подходящих для использования в синтезе производных морфолино-нуклеиновых кислот (например, в дихлорметане, ацетонитриле, тетразоле, N-метилимидазоле, пиридине, ангидриде уксусной кислоты, лутидине, трифторуксусной кислоте), (ii) является химически стабильным по отношению к реагентам, подходящим для использования в синтезе производных морфолино-нуклеиновой кислоты, (iii) может быть химически модифицирован, (iv) может быть нагружен нужными производными морфолино-нуклеиновой кислоты, (v) обладает прочностью, достаточной для выдерживания высокого давления во время обработки, и (vi) имеет размер и распределение частиц в определенном диапазоне. Более конкретными примерами являются набухающие полистиролы (например, аминометилполистироловая смола, перекрестно связанная с 1% дивинилбензолом (от 200 до 400 меш) (от 2,4 до 3,0 ммоль/г) (Tokyo Chemical Industry Co., Ltd., Japan), аминометилированная полистироловая смола-HCl [с 1% дивинилбензолом, от 100 до 200 меш] (Peptide Institute, Inc., Japan)), ненабухающие полистиролы (например, Primer Support (GE Healthcare)), полистиролы, подобные ПЭГ-цепи (например, смола NH2-ПЭГ (Watanabe Chemical Industries, Ltd., Japan), смола TentaGel), стекло с регулируемым размером пор (CPG) (например, продукт CPG Inc.), оксалилированное стекло с регулируемым размером пор (см., например, Alul et al., Nucleic Acids Research, Vol. 19 , 1527 (1991)), носитель TentaGel - носитель, дериватизированный аминополиэтиленгликолем (см., например, Wright et al., Tetrahedron Letters, Vol. 34, 3373 (1993)), и сополимер полистирола/дивинилбензола Poros.
[0082] В качестве «линкера» может быть использован известный линкер, который обычно используется для связывания нуклеиновой кислоты или производного морфолино-нуклеиновой кислоты. Подходящие примеры включают 3-аминопропил, сукцинил, 2,2'-диэтанолсульфонил и длинноцепочечный алкиламино (LCAA).
[0083] Примерами «кислоты», подходящей для ее использования в этой стадии, являются трифторуксусная кислота, дихлоруксусная кислота или трихлоруксусная кислота. Количество используемой кислоты составляет, например, в диапазоне от 0,1 молярных эквивалентов до 1000 молярных эквивалентов, например, в диапазоне от 1 молярного эквивалента до 100 молярных эквивалентов на 1 моль соединения (II).
[0084] Кроме того, органический амин может быть использован вместе с вышеуказанной кислотой. Для этой цели может быть использован любой органический амин, примером которого является триэтиламин. Количество используемого органического амина составляет, например, в приемлемом диапазоне от 0,01 молярного эквивалента до 10 молярных эквивалентов, например, в диапазоне от 0,1 молярного эквивалента до 2 молярных эквивалентов на 1 моль кислоты.
[0085] В случае, если в этой стадии, кислота и органический амин используются в виде соли или смеси, то примерами такой соли или смеси являются соль или смесь трифторуксусной кислоты и триэтиламина, а более конкретно, смесь, содержащая 2 эквивалента трифторуксусной кислоты и 1 эквивалент триэтиламина.
[0086] Кислота, подходящая для использования в этой стадии, может быть разбавлена подходящим растворителем до концентрации в диапазоне от 0,1% до 30%. Для этой цели может быть использован любой растворитель, при условии, что он будет инертным для такой реакции, и его примерами являются дихлорметан, ацетонитрил, спирты (например, этанол, изопропанол, трифторэтанол), вода или их смеси.
[0087] Температура прохождения вышеуказанной реакции составляет, например, в пределах от 10°С до 50°С, например, в пределах от 20°C до 40°С или в пределах от 25°С до 35°C.
[0088] Время реакции может варьироваться в зависимости от типа используемой кислоты и/или температуры реакции, но обычно, оно составляет в пределах от 0,1 минуты до 24 часов, а чаще всего, от 1 минуты до 5 часов.
[0089] Кроме того, после завершения этой стадии может быть добавлено, но необязательно, основание для нейтрализации кислоты, оставшейся в системе. Для этой цели может быть использовано любое «основание», примером которого является диизопропилэтиламин. Такое основание может быть использовано путем разбавления подходящим растворителем до концентрации в пределах от 0,1% (об./об.) до 30% (об./об.).
[0090] В этой стадии может быть использован любой растворитель, при условии, что он будет инертным для такой реакции, и его примерами являются дихлорметан, ацетонитрил, спирты (например, этанол, изопропанол, трифторэтанол), вода или их смеси. Температура реакции составляет, например, в пределах от 10°С до 50°С, например в пределах от 20 до 40°С, а чаще всего в пределах от 25 до 35°C.
[0091] Время реакции может варьироваться в зависимости от типа используемой кислоты и/или температуры реакции, но обычно, оно составляет в пределах от 0,1 минуты до 24 часов, а чаще всего, от 1 минуты до 5 часов.
[0092] Следует отметить, что соединение (II), где n=1, а L представляет собой группу (IV), то есть, соединение, представленное следующей общей формулой (IIa) (далее называемое соединением (IIa)), может быть получено в соответствии со следующими процедурами:
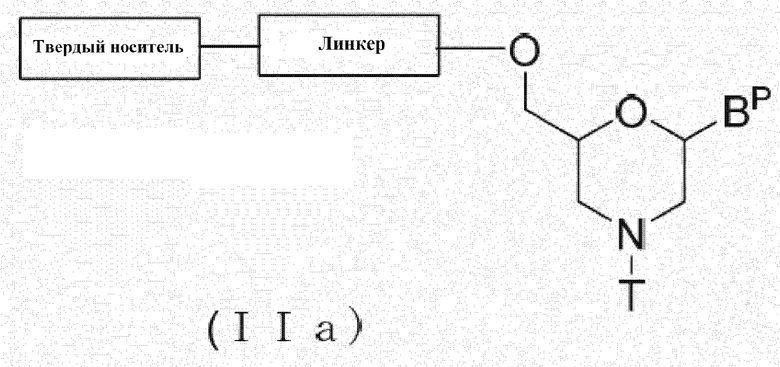
[где ВР, Т, линкер и твердый носитель являются такими, как они были определены выше].
[0093] Стадия 1: Эта стадия представляет собой стадию, в которой соединение, представленное нижеследующей общей формулой (V), обрабатывают ацилирующим агентом с получением соединения, представленного нижеследующей общей формулой (VI) (далее называемого соединением (VI)):
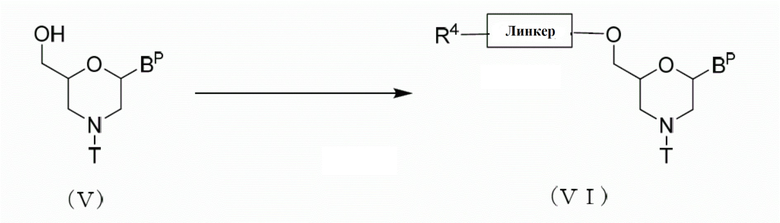
[где ВР, Т и линкер являются такими, как они были определены выше; и
R4 представляет собой гидроксильную группу, галоген, карбоксильную группу или амино].
[0094] Эта стадия может быть осуществлена исходя из соединения (V) с помощью любой известной реакции взаимодействия для введения линкера.
[0095] В частности, соединение, представленное нижеследующей общей формулой (VIa), может быть получено любым способом, известным как реакция эстерификации, с использованием соединения (V) и ангидрида янтарной кислоты:
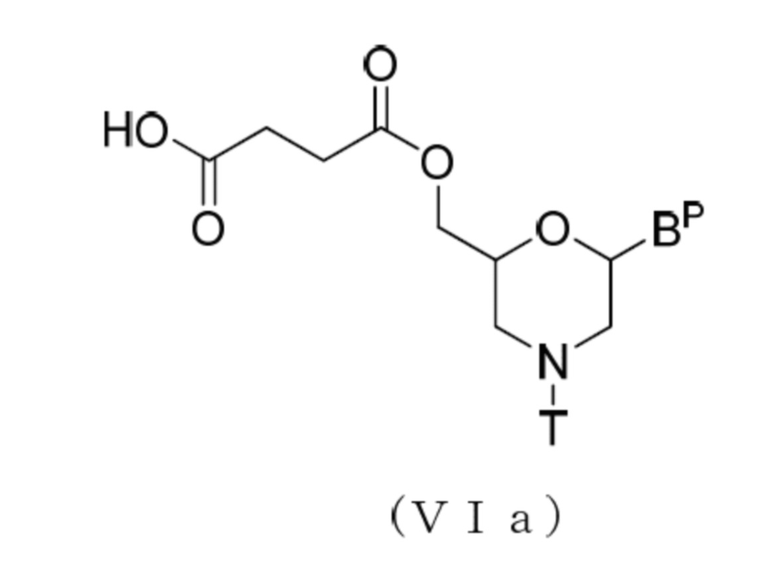
[где ВР и Т являются такими, как они были определены выше].
[0096] Стадия 2: Эта стадия представляет собой стадию, в которой соединение (VI) подвергают реакции взаимодействия с твердым носителем путем обработки конденсирующим агентом или т.п. с получением соединения (IIa):
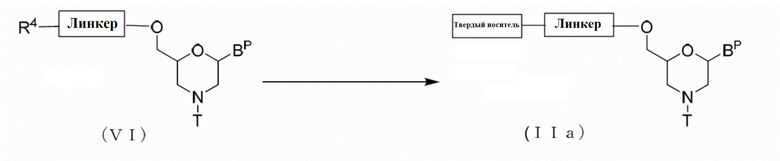
[где ВР, R4, Т, линкер и твердый носитель являются такими, как они были определены выше].
[0097] Эта стадия может быть осуществлена любым способом, известным как реакция конденсации, с использованием соединения (VI) и твердого носителя.
[0098] Соединение (II), в котором n=2-99 (а обычно, любое целое число в пределах от 13 до 29, от 14 до 28, от 15 до 27, от 16 до 26 или от 17 до 25), а L представляет собой группу (IV), то есть, соединение, представленное нижеследующей общей формулой (IIa2), может быть получено исходя из соединения (IIa) путем повторения стадий A и B нужное количество раз в описанном здесь способе получения PMO:
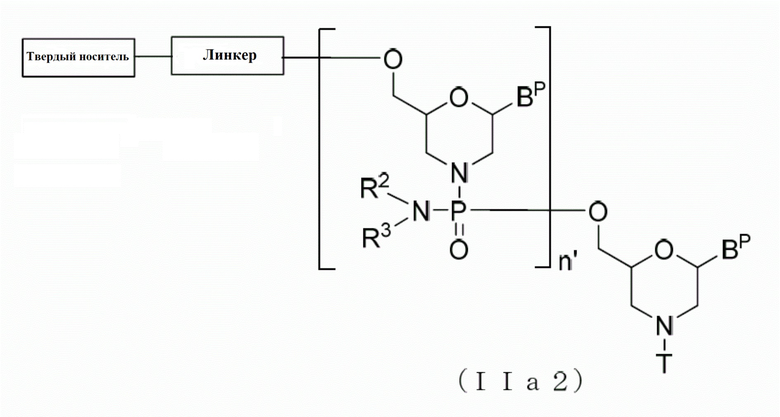
[где ВР, R2, R3, Т, линкер и твердый носитель являются такими, как они были определены выше; и
n' составляет от 1 до 98 (в конкретных вариантах осуществления изобретения, n' составляет от 1 до 28, от 1 до 27, от 1 до 26, от 1 до 25 или от 1 до 24)].
[0099] (2) Стадия B: Эта стадия представляет собой стадию, в которой соединение (III) обрабатывают морфолино-мономерным соединением в присутствии основания с получением соединения, представленного нижеследующей общей формулой (VII) (далее называемого соединением (VII)):
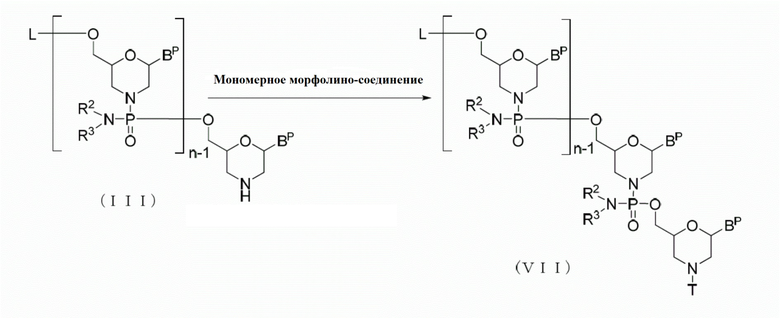
[где каждый из BP, L, n, R2, R3 и T является таким, как он был определен выше].
[00100] Эта стадия может быть осуществлена путем обработки соединения (III) морфолино-мономерным соединением в присутствии основания.
[00101] Примером такого морфолино-мономерного соединения может служить соединение, представленное нижеследующей общей формулой (VIII):
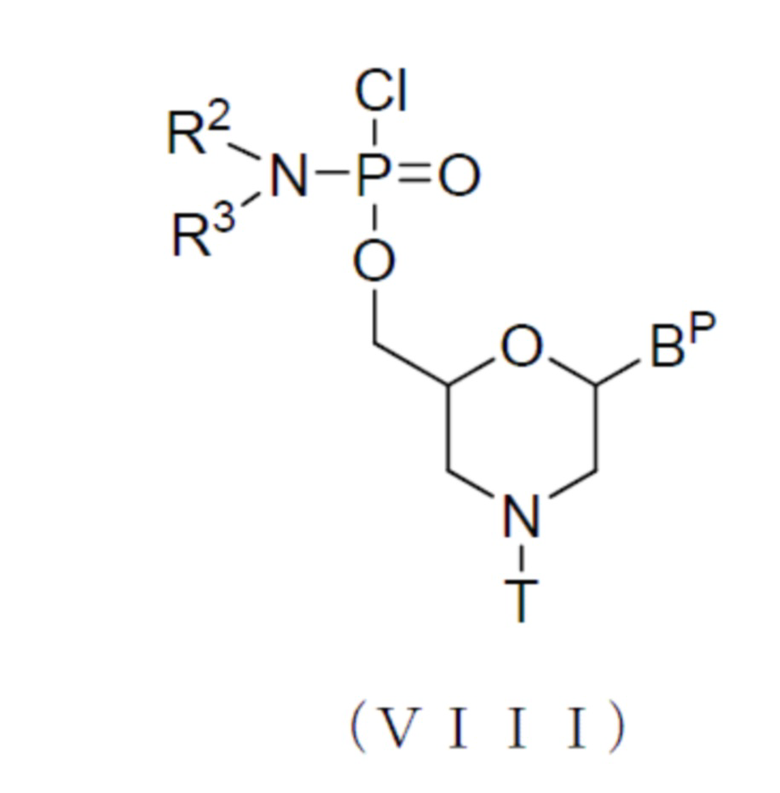
[где ВР, R2, R3 и Т являются такими, как они были определены выше].
[00102] Примерами «основания», подходящего для использования в этой стадии, являются диизопропилэтиламин, триэтиламин или N-этилморфолин. Количество используемого основания составляет, например, в пределах от 1 молярного эквивалента до 1000 молярных эквивалентов, а чаще всего, в пределах от 10 молярных эквивалентов до 100 молярных эквивалентов на 1 моль соединения (III).
[00103] Такое морфолино-мономерное соединение и основание, используемые в этой стадии, могут быть разбавлены подходящим растворителем до концентрации от 0,1% до 30%. Для этой цели может быть использован любой растворитель, при условии, что он будет инертным для такой реакции, и его примерами являются N, N-диметилимидазолидинон, N-метилпиперидон, ДМФ, дихлорметан, ацетонитрил, тетрагидрофуран или их смеси.
[00104] Температура реакции составляет, например, в пределах от 0°С до 100°С, а обычно в пределах от 10°С до 50°С.
[00105] Время реакции может варьироваться в зависимости от типа используемого основания и/или температуры реакции, но обычно, оно составляет в пределах от 1 минуты до 48 часов, а чаще всего, от 30 минут до 24 часов.
[00106] Кроме того, после завершения этой стадии может быть добавлен, но необязательно, ацилирующий агент. Примерами «ацилирующего агента» являются ангидрид уксусной кислоты, хлорангидрид уксусной кислоты и ангидрид феноксиуксусной кислоты. Такой ацилирующий агент может быть использован после его разбавления подходящим растворителем, например, до концентрации в пределах от 0,1% до 30%. Для этой цели может быть использован любой растворитель, при условии, что он будет инертным для такой реакции, и его примерами являются дихлорметан, ацетонитрил, тетрагидрофуран, спирты (например, этанол, изопропанол, трифторэтанол), вода или их смеси.
[00107] При необходимости можно использовать основание (например, пиридин, лутидин, коллидин, триэтиламин, диизопропилэтиламин, N-этилморфолин) вместе с ацилирующим агентом. Количество используемого ацилирующего агента обычно составляет в пределах от 0,1 молярных эквивалентов до 10000 молярных эквивалентов, а чаще всего в пределах от 1 молярного эквивалента до 1000 молярных эквивалентов. Количество используемого основания составляет, например, в пределах от 0,1 молярных эквивалентов до 100 молярных эквивалентов, а чаще всего в пределах от 1 молярного эквивалента до 10 молярных эквивалентов на 1 моль ацилирующего агента.
[00108] Температура этой реакции обычно составляет в пределах от 10°С до 50°С, например, в пределах от 20°C до 40°С, а чаще всего, в пределах от 25°С до 35°C. Время реакции может варьироваться, например, в зависимости от типа используемого ацилирующего агента и/или от температуры реакции, но обычно оно составляет в пределах от 0,1 минуты до 24 часов, а чаще всего, в пределах от 1 минуты до 5 часов.
[00109] (3) Стадия C: Эта стадия представляет собой стадию, в которой агент для снятия защиты используют в целях удаления защитных групп из соединения (VII), полученного на стадии B, в результате чего получают соединение, представленное общей формулой (IX):
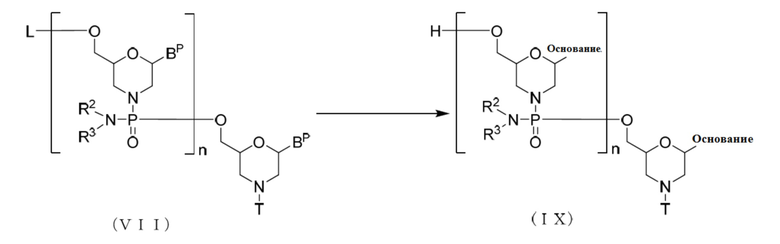
[где основание, BP, L, n, R2, R3 и T являются такими, как они были определены выше].
[00110] Эта стадия может быть осуществлена путем обработки соединения (VII) агентом для снятия защиты.
[00111] Примерами «агента для снятия защиты» являются концентрированный водный аммиак и метиламин. Такой «агент для снятия защиты», обычно используемый в этой стадии, может быть разбавлен водой, метанолом, этанолом, изопропиловым спиртом, ацетонитрилом, тетрагидрофураном, ДМФ, N, N-диметилимидазолидиноном, N-метилпиперидоном или их смесью. Среди них предпочтительным является этанол. Количество используемого агента для снятия защиты составляет, например, в пределах от 1 молярного эквивалента до 100000 молярных эквивалентов, а чаще всего в пределах от 10 молярных эквивалентов до 1000 молярных эквивалентов на 1 моль соединения (VII).
[00112] Температура реакции составляет, например, в пределах от 15°С до 75°С, а обычно, в пределах от 40°С до 60°С или от 50°С до 60°С. Время реакции снятия защиты может варьироваться в зависимости от типа соединения (VII) и/или температуры реакции и т.п., но обычно оно составляет в пределах от 10 минут до 30 часов, а чаще всего, в пределах от 30 минут до 24 часов, а более предпочтительно в пределах от 5 часов до 20 часов.
[00113] (4) Стадия D: Эта стадия представляет собой стадию, в которой соединение (IX), полученное на стадии C, обрабатывают кислотой с получением PMO (I):
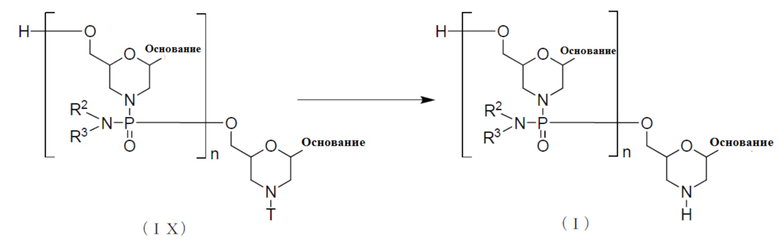
[где основание, n, R2, R3 и Т являются такими, как они были определены выше].
[00114] Эта стадия может быть осуществлена путем добавления кислоты к соединению (IX).
[00115] Примеры «кислоты», подходящей для ее использования на этой стадии, включают трихлоруксусную кислоту, дихлоруксусную кислоту, уксусную кислоту, фосфорную кислоту и соляную кислоту и т.п. Что касается количества используемой кислоты, то она может быть использована в приемлемом количестве, достаточном для доведения pH раствора, например, до 0,1-4,0, а обычно до 1,0-3,0. На этой стадии может быть использован любой растворитель, при условии, что он будет инертным для такой реакции, и его примерами являются ацетонитрил, вода или их смеси.
[00116] Температура реакции составляет, например, в пределах от 10°С до 50°С, а обычно в пределах от 20°С до 40°С или от 25°С до 35°С. Время реакции снятия защиты может варьироваться в зависимости от типа соединения (IX) и/или температуры реакции и т.п., но обычно оно составляет в пределах от от 0,1 минуты до 5 часов, например, в пределах от 1 минуты до 1 часа, а более предпочтительно в пределах от 1 минуты до 30 минут.
[00117] PMO (I) может быть получен из реакционной смеси, полученной на этой стадии, с применением обычно используемых методов разделения и очистки, включая экстракцию, концентрирование, нейтрализацию, фильтрацию, центрифугирование, перекристаллизацию, C8-C18-обращенно-фазовую колоночную хроматографию, катионообменную колоночную хроматографию, анионообменную колоночную хроматографию, колоночную гель-фильтрацию, высокоэффективную жидкостную хроматографию, диализ, ультрафильтрацию и другие способы, которые могут быть применены отдельно, либо в комбинации, в результате чего нужный PMO (I) может быть выделен и очищен (см., например, WO1991/09033).
[00118] В случае использования обращенно-фазовой хроматографии для очистки PMO (I), в качестве элюирующего растворителя может быть использован, например, смешанный раствор 20 мМ триэтиламинового/ацетатного буфера и ацетонитрила.
[00119] Аналогичным образом, в случае использования ионообменной хроматографии для очистки PMO (I), в качестве примера может быть использован смешанный раствор 1М водного хлорида натрия и 10 мМ водного гидроксида натрия.
[00120] Пептидный олигомер нуклеиновой кислоты представляет собой антисмысловой олигомер согласно изобретению, составной единицей которого является группа, представленная нижеследующей общей формулой:
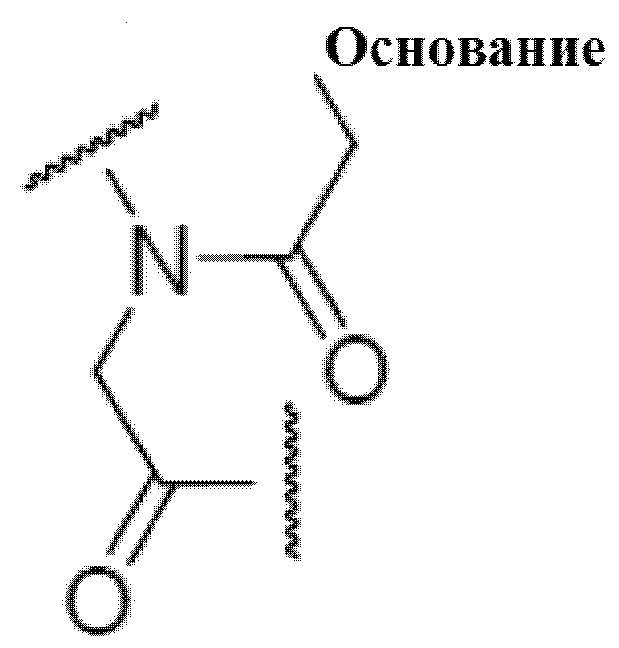
(где основание является таким же, как оно определено выше).
[00121] Пептидные нуклеиновые кислоты могут быть получены, например, как описано в документах, перечисленных ниже.
1) P. E. Nielsen, M. Egholm, R. H. Berg, O. Buchardt, Science, 254, 1497 (1991)
2) M. Egholm, O. Buchardt, P. E. Nielsen, R. H. Berg, Jacs., 114, 1895 (1992)
3) K. L. Dueholm, M. Egholm, C. Behrens, L. Christensen, H. F. Hansen, T. Vulpius, K. H. Petersen, R. H. Berg, P. E. Nielsen, O. Buchardt, J. Org. Chem., 59, 5767 (1994)
4) L. Christensen, R. Fitzpatrick, B. Gildea, K. H. Petersen, H. F. Hansen, T. Koch, M. Egholm, O. Buchardt, P. E. Nielsen, J. Coull, R. H. Berg, J. Pept. Sci., 1, 175 (1995)
5) T. Koch, H. F. Hansen, P. Andersen, T. Larsen, H. G. Batz, K. Otteson, H. Orum, J. Pept. Res., 49, 80 (1997)
[00122] Антисмысловой олигомер согласно изобретению может иметь такую конфигурацию, при которой его 5'-конец представляет собой любую из групп, представленных химическими формулами (1)-(3), при этом, предпочтительной является группа -ОН (3).
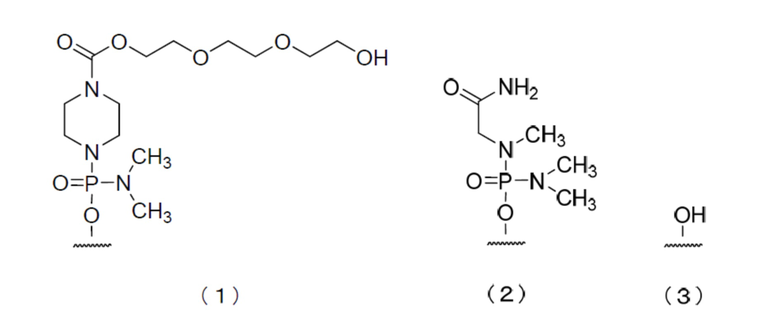
Как упоминалось выше, функциональный пептид (например, CPP (пептид, проникающий в клетку)) может быть связан с антисмысловым олигомером посредством линкера или без него. Если функциональный пептид связан с антисмысловым олигомером посредством линкера, то к функциональному пептиду может быть присоединена дополнительная аминокислота. В предпочтительном варианте осуществления изобретения, функциональный пептид может быть связан с фосфородиамидатным морфолино-олигомером («PMO») у 5'-конца или 3'-конца, причем, предпочтительной является связь с 3'-концом. Кроме того, в предпочтительном варианте осуществления изобретения, C-конец функционального пептида может быть связан с PMO.
[00123] Фармацевтически приемлемые соли и гидраты
Примерами фармацевтически приемлемой соли соединения (например, антисмыслового олигомера) согласно изобретению являются соли щелочных металлов (например, соль натрия, соль калия, соль лития); соли щелочноземельных металлов (например, соль кальция, соль магния); соли металлов (например, соль алюминия, соль железа, соль цинка, соль меди, соль никеля, соль кобальта); аммониевая соль; соли органических аминов (например, соль трет-октиламина, соль дибензиламина, соль морфолина, соль глюкозамина, соль сложного алкилового эфира фенилглицина, соль этилендиамина, соль N-метилглюкамина, соль гуанидина, соль диэтиламина, соль триэтиламина, соль дициклогексиламина, соль N, N'-дибензилэтилендиамина, соль хлорпрокаина, соль прокаина, соль диэтаноламина, соль N-бензилфенетиламина, соль пиперазина, соль тетраметиламмония, соль трис(гидроксиметил)аминометана); соли галогенированной протонной кислоты (например, соль фтористоводородной кислоты, соль соляной кислоты, соль бромистоводородной кислоты, соль иодистоводородной кислоты); соли неорганических кислот (то есть, нитратная соль, перхлоратная соль, соль серной кислоты, соль фосфорной кислоты); соли низших алкансульфоновых кислот (например, соль метансульфоновой кислоты, соль трифторметансульфоновой кислоты, соль этансульфоновой кислоты); соли арилсульфоновой кислоты (например, соль бензолсульфоновой кислоты, соль п-толуолсульфоновой кислоты); соли органических кислот (например, соль уксусной кислоты, соль яблочной кислоты, соль фумаровой кислоты, соль янтарной кислоты, соль лимонной кислоты, соль винной кислоты, соль щавелевой кислоты, соль малеиновой кислоты); соли аминокислот (например, соль глицина, соль лизина, соль аргинина, соль орнитина, соль глутаминовой кислоты, соль аспарагиновой кислоты) и т.п. Эти соли могут быть получены любым известным способом.
[00124] Гидрат соединения (например, антисмыслового олигомера) согласно изобретению может быть получен любым известным способом.
[00125] Конкретные варианты осуществления изобретения.
Антисмысловой олигомер согласно изобретению включает, например, олигонуклеотид, морфолино-олигомер или PNA, имеющие репрезентативную длину в пределах длин, характерных для антисмыслового олигомера согласно изобретению или репрезентативную длину антисмыслового олигомера согласно изобретению. В конкретном варианте осуществления изобретения, олигонуклеотид представляет собой антисмысловой олигомер, в котором по меньшей мере одна сахарная группа и/или по меньшей мере одна группа фосфатной связи в олигонуклеотиде являются модифицированными.
[00126] В конкретном варианте осуществления изобретения, антисмысловой олигонуклеотид согласно изобретению включает по меньшей мере одну модифицированную сахарную группу, то есть, рибозу, в которой группа -ОН в 2'-положении замещена любой группой, выбранной из группы, состоящей из OR, R, R'OR, SH, SR, NH2, NHR, NR2, N3, CN, F, Cl, Br и I (где R представляет собой алкил или арил, а R' представляет собой алкилен).
В конкретном варианте осуществления изобретения, олигонуклеотид включает по меньшей мере одну модифицированную группу фосфатной связи, выбранную из группы, состоящей из фосфортиоатной связи, фосфордитиоатной связи, алкилфосфонатной связи, фосфорамидатной связи и боранофосфатной связи.
[00127] В конкретном варианте осуществления изобретения, олигонуклеотид представляет собой антисмысловой олигомер, который содержит по меньшей мере одно морфолино-кольцо. В конкретном варианте осуществления изобретения, антисмысловой олигомер представляет собой морфолино-олигомер или фосфордиамидатный морфолино-олигомер.
В другом варианте осуществления изобретения, антисмысловой олигомер имеет на своем 5'-конце любую из групп, представленных химическими формулами (1) - (3), показанными ниже.

Все антисмысловые олигомеры, протестированные как описано в разделе Примеры, могут иметь любую химическую модификацию, как описано выше.
Как упоминалось выше, функциональный пептид (например, CPP (пептид, проникающий в клетку)) может быть связан с антисмысловым олигомером посредством линкера или без него. Если функциональный пептид связан с антисмысловым олигомером посредством линкера, то к функциональному пептиду может быть присоединена дополнительная аминокислота. В предпочтительном варианте осуществления изобретения, функциональный пептид может быть связан с фосфородиамидатным морфолино-олигомером («PMO») у 5'-конца или 3'-конца.
[00128] Фармацевтические композиции
Согласно своему второму аспекту, настоящее изобретение относится к фармацевтической композиции, содержащей соединение согласно изобретению (например, антисмысловой олигомер согласно изобретению) или его фармацевтически приемлемую соль или гидрат в качестве активного ингредиента (далее называемой «фармацевтической композицией согласно изобретению»).
В конкретных вариантах осуществления изобретения, фармацевтическая композиция содержит любой из вышеупомянутых олигомеров или олигонуклеотидов или их фармацевтических солей или гидратов и по меньшей мере одну фармацевтически приемлемую добавку и/или носитель.
Подходящие композиции для использования в настоящем изобретении можно найти в руководстве Remington's Pharmaceutical Sciences, Mack Publishing Company, Philadelphia, Pa., 17th ed., 1985. Краткий обзор способов доставки лекарственных средств см., например, у Langer (Science 249: 1527-1533, 1990).
[00129] Носитель может служить для доставки олигомера в мышечную ткань. Такой носитель не имеет конкретных ограничений при условии, что он является фармацевтически приемлемым. Подходящими примерами являются катионные носители (например, катионные липосомы, катионные полимеры) или носители на основе вирусной оболочки. Примерами катионных липосом являются липосомы, образованные из 2-O-(2-диэтиламиноэтил)карбамоил-1,3-O-диолеоилглицерина и фосфолипида в качестве основных составляющих компонентов (далее называемые «липосомой A»), Олигофектамин® (Invitrogen), Липофектин® (Invitrogen), Липофектамин® (Invitrogen), Липофектамин 2000® (Invitrogen), DMRIE-C® (Invitrogen), GeneSilencer® (Gene Therapy Systems), TransMessenger® (QIAGEN), TransIT TKO® (Mirus) и нуклеофектор II (Lonza). Среди них предпочтительной является липосома А. Примеры катионных полимеров включают JetSI® (Qbiogene) и Jet-PEI® (полиэтиленимин, Qbiogen). Примеры носителей на основе вирусной оболочки включают GenomeOne® (липосомы HVJ-E, Ishihara Sangyo Kaisha, Ltd., Japan). Альтернативно, может быть также использовано фармацевтическое устройство, описанное в патенте Японии № 2924179, или катионные носители, описанные в JP WO2006/129594 и JP WO2008/096690.
[00130] Более подробную информацию можно найти в патентах США №№ 4235871 и 4737323, WO96/14057, «New RRC, Liposomes: A practical approach, IRL Press, Oxford (1990) pages 33-104» и т.п.
[00131] Фармацевтическая композиция согласно изобретению может, но необязательно, содержать, помимо антисмыслового олигомера согласно изобретению или его фармацевтически приемлемой соли или гидрата и/или носителя, описанных выше, фармацевтически приемлемую добавку. Примерами такой добавки являются эмульгирующая добавка (например, жирная кислота, содержащая 6-22 атомов углерода или ее фармацевтически приемлемая соль, альбумин, декстран), стабилизирующий агент (например, холестерин, фосфатидиновая кислота), агент, придающий изотоничность (например, хлорид натрия, глюкоза, мальтоза, лактоза, сахароза, трегалоза) и регулятор pH (например, соляная кислота, серная кислота, фосфорная кислота, уксусная кислота, гидроксид натрия, гидроксид калия, триэтаноламин). Эти добавки могут быть использованы отдельно или в комбинации. Содержание добавки (добавок) в фармацевтической композиции согласно изобретению составляет обычно 90% по массе или менее, например 60% по массе или менее, а чаще всего, 50% по массе или менее.
[00132] Фармацевтическая композиция согласно изобретению может быть приготовлена путем добавления соединения (например, антисмыслового олигомера) согласно изобретению или его фармацевтически приемлемой соли или гидрата к дисперсии носителя с последующим адекватным перемешиванием. Добавка(и) может (могут) быть добавлена(ы) на любой соответствующей стадии, либо до, либо после добавления соединения согласно изобретению или его фармацевтически приемлемой соли или гидрата. Для добавления соединения согласно изобретению или его фармацевтически приемлемой соли или гидрата может быть использован любой водный растворитель при условии, что он является фармацевтически приемлемым, и примерами такого растворителя являются вода для инъекций, дистиллированная вода для инъекций, электролитические растворы (например, физиологический раствор) и растворы сахара (например, раствор глюкозы, раствор мальтозы). Кроме того, в этом случае, условия, включая pH и температуру, могут быть выбраны специалистами в зависимости от ситуации.
[00133] Фармацевтическая композиция согласно изобретению может быть приготовлена в виде раствора или лиофилизованного препарата. Такой лиофилизованный препарат может быть приготовлен стандартным способом путем сушки вымораживанием фармацевтической композиции согласно изобретению в форме раствора. Так, например, фармацевтическая композиция согласно изобретению в форме раствора может быть стерилизована, если это необходимо, а затем разлита в заданных количествах во флаконы с последующим предварительным замораживанием в условиях от -40°С до -20°C в течение приблизительно 2 часов, первой сушкой при температуре приблизительно от 0°С до 10°С при пониженном давлении, а затем второй сушкой при температуре приблизительно от 15°С до 25°С при пониженном давлении. Более того, в большинстве случаев, флаконы можно продуть газообразным азотом, а затем закрыть крышкой, в результате чего может быть получен лиофилизованный препарат фармацевтической композиции согласно изобретению.
[00134] Такой лиофилизованный препарат фармацевтической композиции согласно изобретению обычно используют после разведения путем добавления любого подходящего раствора (то есть, раствора для разведения). Примерами такого раствора для разведения являются вода для инъекций, физиологический раствор и другие обычно используемые растворы для вливания. Объем такого раствора для разведения будет варьироваться, например, в зависимости от цели использования, и не имеет конкретных ограничений, но, обычно, он в 0,5-2 раза превышает объем раствора до лиофилизации, или составляет 500 мл или менее.
[00135] Соединение (например, антисмысловой олигомер) согласно изобретению или его фармацевтически приемлемая соль или гидрат, содержащиеся в фармацевтической композиции согласно изобретению, могут быть получены в форме гидрата. Такой гидрат может быть получен любым известным способом.
[00136] Композиции и способы получения фармацевтических композиций зависят от ряда критериев, включая, но не ограничиваясь ими, способ введения, тяжесть заболевания или вводимую дозу.
[00137] Эти композиции могут быть стерилизованы обычными методами стерилизации, либо они могут быть подвергнуты стерильной фильтрации. Полученные водные растворы могут быть упакованы для использования в приготовленной форме, либо они могут быть лиофилизованы, при этом, лиофилизованный препарат перед его введением, объединяют со стерильным водным носителем. рH препаратов обычно составляет от 3 до 11, предпочтительно от 5 до 9 или от 6 до 8, а наиболее предпочтительно, от 7 до 8, например от 7 до 7,5. Полученные композиции в твердой форме могут быть упакованы в виде нескольких отдельных унифицированных доз, каждая из которых содержит фиксированное количество вышеупомянутого агента или агентов, например, они могут быть приготовлены в форме таблеток или капсул в запечатанной упаковке. Композиция в твердой форме также может быть упакована в контейнер для нефиксированного количества, такой как сжимаемый тюбик, содержащий крем или мазь, предназначенные для местного применения.
[00138] Фармацевтическая композиция согласно изобретению может быть введена любым фармацевтически приемлемым способом, который может быть выбран в зависимости от предполагаемого метода терапевтического лечения. Однако, с точки зрения легкости доставки в мышечную ткань, предпочтительными являются внутривенное введение, внутриартериальное введение, внутримышечное введение, подкожное введение, пероральное введение, интерстициальное введение, чрескожное введение и т.п. Более того, композиция согласно изобретению может быть приготовлена в любой лекарственной форме, примеры которой включают различные типы инъекций, композиции для перорального введения, капли, ингаляторы, мази, лосьоны и т.п.
[00139] Концентрация соединения (например, антисмыслового олигомера) согласно изобретению или его фармацевтически приемлемой соли или гидрата, содержащихся в фармацевтической композиции согласно изобретению, может варьироваться, например, в зависимости от типа носителя, но обычно она составляет в пределах от 0,1 нМ до 100 мкМ, а чаще всего в пределах от 100 нМ до 10 мкМ. Аналогичным образом, массовое отношение носителя к антисмысловому олигомеру согласно изобретению или его фармацевтически приемлемой соли или гидрату, содержащихся в фармацевтической композиции согласно изобретению (то есть, отношение носитель/антисмысловой олигомер или его фармацевтически приемлемая соль или гидрат) может варьироваться, например, в зависимости от свойств олигомера и типа носителя, но обычно оно составляет в пределах от 0,1 до 100, а чаще всего, от 0,1 до 10.
[00140] Соединение согласно изобретению, его фармацевтически приемлемая соль или гидрат могут быть включены в унифицированный состав, содержащий фармацевтически приемлемый носитель или разбавитель, в количестве, достаточном для доставки индивидууму терапевтически приемлемого количества без каких-либо серьезных побочных эффектов у индивидуума.
[00141] Дозу для введения фармацевтической композиции согласно изобретению желательно корректировать с учетом типа антисмыслового олигомера согласно изобретению или его фармацевтически приемлемой соли или гидрата, содержащихся в этой композиции, предполагаемой лекарственной формы, особенностей индивидуума, таких как возраст и масса тела, способа введения, и природы и тяжести заболевания. Если индивидуум является человеком, то суточная доза для взрослых обычно составляет в пределах от 0,1 мг до 10 г/кг массы тела, например, в пределах от 1 мг до 1 г/кг массы тела, от 20 мг до 120 мг/кг массы тела, от 30 мг до 100 мг/кг массы тела или от 40 мг до 80 мг/кг массы тела, в расчете на количество антисмыслового олигомера согласно изобретению или его фармацевтически приемлемой соли или гидрата. Этот числовой диапазон может варьироваться в зависимости от типа заболевания, подлежащего лечению, способа введения и/или типа молекулы-мишени. Таким образом, в некоторых случаях, может быть достаточно дозы ниже этого диапазона, или, наоборот, в некоторых случаях, может потребоваться доза выше этого диапазона. Кроме того, фармацевтическая композиция согласно изобретению может быть введена от одного до нескольких раз в день или с интервалами от одного до нескольких дней.
[00142] В другом варианте осуществления изобретения, фармацевтическая композиция согласно изобретению может представлять собой фармацевтическую композицию, содержащую вектор, способный экспрессировать соединение согласно изобретению (например, антисмысловой олигонуклеотид согласно изобретению) и носитель, как описано выше. Такой экспрессионный вектор может экспрессировать множество антисмысловых олигонуклеотидов согласно изобретению. Такая фармацевтическая композиция может, но необязательно, содержать фармацевтически приемлемую добавку, как описано выше. Концентрация экспрессионного вектора, содержащегося в этой фармацевтической композиции, будет варьироваться, например, в зависимости от типа носителя, но обычно она составляет в пределах от 0,1 нМ до 100 мкМ, а чаще всего, в пределах от 100 нМ до 10 мкМ. Массовое отношение носителя к экспрессионному вектору, содержащемуся в этой фармацевтической композиции (то есть, отношение носитель/экспрессионный вектор), может варьироваться, например, в зависимости от свойств экспрессионного вектора и типа носителя, но обычно оно составляет в пределах от 0,1 до 100, а чаще всего, в пределах от 0,1 до 10. Кроме того, содержание носителя, присутствующего в этой фармацевтической композиции, является таким же, как описано выше, и способы приготовления также являются такими, как они были описаны выше.
[00143] Терапевтическое применение
Соединение согласно изобретению или его фармацевтически приемлемая соль или гидрат, или фармацевтическая композиция согласно изобретению, содержащая эти компоненты (далее называемые «терапевтическим средством согласно изобретению»), могут быть использованы в терапии, например, при лечении человека.
[00144] Терапевтическое средство согласно изобретению может быть получено для его применения в целях профилактики или лечения нарушения обмена веществ (например, ожирения, метаболического синдрома, диабета), амиотрофического заболевания или мышечной дистрофии или саркопении. Примерами амиотрофического заболевания или мышечной дистрофии являются миогенная амиотрофия (например, мышечная дистрофия (например, мышечная дистрофия Дюшенна, мышечная дистрофия Фукуямы, миотоническая дистрофия), врожденная миопатия, миозит, вызываемый тельцами включения), нейрогенная амиотрофия (например, латеральный амиотрофический склероз, спинальная мышечная атрофия, спинальная и бульбарная мышечная атрофия), амиотрофия при малоподвижности (например, синдром малоподвижности, вызванный апоплексией), мышечная дистрофия (например, кахексия при раке, амиотрофия, вызываемая сепсисом) и саркопения различных типов, включая возрастную потерю скелетных мышц (возрастную саркопению), при этом, особенно рассматривается мышечная дистрофия.
[00145] В некоторых своих вариантах, настоящее изобретение относится к способу профилактики или лечения амиотрофического заболевания, мышечной дистрофии или саркопении, который включает введение индивидууму, нуждающемуся в профилактике или лечении амиотрофического заболевания или мышечной дистрофии, терапевтически эффективного количества терапевтического средства согласно изобретению. В конкретном варианте осуществления изобретения, соединение (например, антисмысловой олигомер) согласно изобретению или его фармацевтически приемлемая соль или гидрат могут быть введены индивидууму в форме фармацевтической композиции согласно изобретению.
[00146] В контексте настоящего изобретения, термин «индивидуум» относится к человекк или теплокровному животному, не являющемуся человеком, например к птицам и млекопитающим (включая, например, коров, обезьян, кошек, мышей, крыс, морских свинок, хомячков, свиней, собак, кроликов, овец, лошадей). Термин «индивидуум» предпочтительно относится к человеку.
[00147] В своих конкретных вариантах, настоящее изобретение относится к применению терапевтического средства согласно изобретению в целях приготовления фармацевтической композиции для профилактики или лечения амиотрофического заболевания или мышечной дистрофии.
В своих конкретных вариантах, настоящее изобретение относится к применению соединения (например, антисмыслового олигомера) согласно изобретению или его фармацевтически приемлемой соли или гидрата в целях приготовления фармацевтической композиции для профилактики или лечения амиотрофического заболевания или мышечной дистрофии.
[00148] В других своих вариантах, настоящее изобретение относится к терапевтическому средству согласно изобретению для его применения в целях лечения амиотрофического заболевания или мышечной дистрофии.
[00149] Как описано выше, соединение согласно изобретению позволяет ингибировать передачу сигнала миостатина на уровне мРНК, например, посредством индуцирования пропуска экзона или разложения мРНК. В одном варианте осуществления изобретения, соединение согласно изобретению может представлять собой антисмысловой олигомер согласно изобретению.
[00150] Ингибирование сигнала миостатина в мышечных тканях может быть применено для профилактики или лечения амиотрофического заболевания, мышечной дистрофии или саркопении. Атрофия скелетных мышц не только снижает качество жизни индивидуума, но также сопровождается серьезными системными осложнениями, включая нарушение всасывания пищи и дыхательную недостаточность, а поэтому требуются агенты и способы лечения, которые могли бы устранить эти симптомы.
[00151] Таким образом, амиотрофическое заболевание, мышечная дистрофия или саркопения могут быть предотвращены или излечены при введении терапевтического средства согласно изобретению индивидууму, нуждающемуся в профилактике или лечении амиотрофического заболевания, мышечной дистрофии или саркопении.
[00152] Настоящее изобретение также относится к терапевтическому средству согласно изобретению для его использования в терапии.
Указанная терапия может представлять собой профилактику или лечение перечисленных выше заболеваний. В одном варианте осуществления изобретения, терапия может представлять собой профилактику или лечение амиотрофического заболевания, мышечной дистрофии или саркопении у индивидуума. В одном варианте осуществления изобретения, амиотрофическое заболевание может представлять собой мышечную дистрофию Дюшенна. Индивидуумом может быть человек.
[00153] Настоящее изобретение также относится к применению соединения согласно изобретению или его фармацевтически приемлемой соли или гидрата в целях приготовления лекарственного средства (такого как фармацевтическая композиция) для профилактики или лечения амиотрофического заболевания, мышечной дистрофии или саркопении у индивидуума. В одном варианте осуществления изобретения, амиотрофическое заболевание представляет собой мышечную дистрофию Дюшенна. В одном варианте осуществления изобретения, индивидуумом является человек.
[00154] Доза и способ введения могут быть такими, как это было описано для фармацевтической композиции согласно изобретению.
[00155] Настоящее изобретение также относится к способу лечения заболевания у индивидуума, который включает введение указанному индивидууму терапевтически эффективного количества терапевтического средства согласно изобретению. Заболевание может представлять собой нарушение обмена веществ (например, ожирение, метаболический синдром, диабет), амиотрофическое заболевание, мышечную дистрофию или саркопению. Примеры амиотрофического заболевания или мышечной дистрофии включают миогенную амиотрофию (например, мышечную дистрофию (например, мышечную дистрофию Дюшенна, мышечную дистрофию Фукуямы, миотоническую дистрофию), врожденную миопатию, миозит, вызываемый тельцами включения), нейрогенную амиотрофию (например, латеральный амиотрофический склероз, спинальную мышечную атрофию, спинальную и бульбарную мышечную атрофию), амиотрофию при малоподвижности (например, синдром малоподвижности, вызванный апоплексией), мышечные дистрофии (например, кахексию при раке, амиотрофию, вызываемую сепсисом) и саркопении различных типов, включая возрастную потерю скелетных мышц (возрастную саркопеню), при этом, в частности, рассматривается мышечная дистрофия. В одном варианте осуществления изобретения, терапия может представлять собой профилактику или лечение амиотрофического заболевания, мышечной дистрофии или саркопении у индивидуума. В одном варианте осуществления изобретения, амиотрофическое заболевание может представлять собой мышечную дистрофию Дюшенна. Индивидуумом может быть человек. Доза и способ введения могут быть такими, как они былы описаны для фармацевтической композиции согласно изобретению.
[00156] Животные
Настоящее изобретение также относится к генетически модифицированному животному, у которого продуцируется усеченный вариант белка ACVR2B, где отсутствует часть внутриклеточной области ACVR2B (далее называемому «ГМ-животным согласно изобретению»). Используемый здесь термин «животные» могут относиться к любому виду, кроме человека. Особенно подходящими животными являются рыбы (например, тунец), и домашние животные, такие как крупный рогатый скот, овцы, козы или свиньи.
Специалист в данной области может создать такое генетически модифицированное животное с применением стандартных методов. Так, например, ГМ-животное согласно изобретению можно получить путем введения соединения согласно изобретению или фармацевтической композиции согласно изобретению. Так, например, ГМ-животное согласно изобретению может быть создано с использованием CRISPR-CAS9, киРНК, системы с нокаутом loxP, TALEN, «цинковых пальцев» (ZFN) или антисмыслового олигомера.
[00157] При использовании CRISPR-CAS9, руководящую РНК, имеющую последовательность, комплементарную последовательности-мишени геномной ДНК, которая кодирует ACVR2B или часть ACVR2B (например, внутриклеточную область ACVR2B дикого типа), вводят в клетку-мишень или животному-хозяину для идентификации расщепленной последовательности-мишени. Белок Cas9 (или Cas9-подобный белок), введенный в клетку-мишень, расщепляет двухцепочечную часть, состоящую из геномной ДНК и руководящей РНК. В процессе репарации сайта расщепления, мутация(и) вызывается(ются) дефицитом и/или инсерцией нуклеотидов, что приводит к нокауту ACVR2B. Примервми последовательности-мишени геномной ДНК являются любые последовательности экзонов, например, экзоны 1-11 ACVR2B. В соответствии с этим, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 5, 6, 7, 8, 9, 10 и 11, или группы, состоящей из экзонов 5, 6, 7, 8, 9. и 10 ACVR2B. В одном варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 5, 6, 7, 9 и 10 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 5, 6, 9 и 10 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 5, 6 и 10 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 5 и 6 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 7, 8 и 9 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 7 и 8 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 5 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 6 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 7 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 8 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 9 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 10 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК представляет собой экзон 11 ACVR2B. В другом варианте осуществления изобретения, последовательность-мишень геномной ДНК включает любую последовательность по меньшей мере одного экзона, выбранного из группы, состоящей из экзонов 7, 8, 9 и 10, или из группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B.
Альтернативно, мишенями для CRISPR-CAS9 могут быть интроны. Так, например, интроны 7 и 8, которые образуют «сэндвич» с экзоном 8, могут быть расщеплены. В случае репарации расщепленных сайтов, экзон 8 может отсутствовать, в результате чего образуется мутантная мРНК, дефицитная по экзону 8. Аналогичным образом, интроны 4 и 5, или интроны 5 и 6, или интроны 6 и 7, или интроны 8 и 9, или интроны 9 и 10, или интроны 10 и 11 могут быть мишенями для их расщепления.
[00158] Если киРНК используется для ингибирования сигнала миостатина, то эту киРНК, сконструированную для ее нацеливания на последовательность мРНК ACVR2B, вводят в клетку-мишень. Если введенная таким образом руководящая цепь киРНК гибридизуется с последовательностью-мишенью, то эндогенный белок RISC в клетке-мишени идентифицирует двухцепочечную часть, состоящую из руководящей цепи и цепи-мишени мРНК, и расщепляет последовательность-мишень мРНК. Таким образом, уровень белка ACVR2B у ГМ-животного согласно изобретению снижается.
[00159] Следует отметить, что все публикации, цитируемые в настоящей заявке, включая документы предшествующего уровня техники, патентные бюллетени и другие патентные документы, включены в настоящую заявку посредством ссылки. Настоящее изобретение будет более подробно описано ниже со ссылкой на нижеследующие иллюстративные примеры, которые не ограничивают объем настоящего изобретения.
ПРИМЕРЫ
[00160] [Сравнительный пример 1]
4-{[(2S,6R)-6-(5-метил-2,4-диоксопиримидин-1-ил)-4-тритилморфолин-2-ил]метокси}-4-оксобутановая кислота, нанесенная на аминополистироловую смолу
Стадия 1. Получение 4-{[(2S,6R)-6-(5-метил-2,4-диоксопиримидин-1-ил)-4-тритилморфолин-2-ил]метокси}-4-оксобутановой кислоты
В атмосфере аргона, 1-[(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]-5-метилпиримидин-2,4-дион (41,11 г) и 4-диметиламинопиридин (4-DMAP) (15,58 г) суспендировали в дихлорметане (850 мл), а затем добавляли ангидрид янтарной кислоты (12,76 г) с последующим перемешиванием при комнатной температуре в течение 3,5 часа. Реакционный раствор экстрагировали дихлорметаном и 1М водным дигидрофосфатом натрия. Полученный органический слой последовательно промывали 1М водным дигидрофосфатом натрия и насыщенным водным хлоридом натрия. Полученный органический слой сушили над сульфатом натрия и концентрировали при пониженном давлении. К полученному твердому веществу добавляли дихлорметан (600 мл) для кристаллизации, а затем фильтровали. После добавления дополнительного количества дихлорметана (300 мл), кристаллы перемешивали в течение 5 минут, а затем фильтровали и сушили в течение ночи при пониженном давлении с получением нужного продукта (50,2 г).
[00161] Стадия 2. Получение 4-{[(2S,6R)-6-(5-метил-2,4-диоксопиримидин-1-ил)-4-тритилморфолин-2-ил]метокси}-4-оксобутановой кислоты, нанесенной на аминополистироловую смолу
4-{[(2S,6R)-6-(5-метил-2,4-диоксопиримидин-1-ил)-4-тритилморфолин-2-ил]метокси}-4-оксобутановую кислоту (50,2 г) растворяли в пиридине (дегидратированном) (600 мл) с последующим добавлением 4-DMAP (12,4 г) и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (77,6 г). Затем к этой смеси добавляли аминополистироловую смолу, аминометиловую смолу (продукт Watanabe Chemical Industries, Ltd., Japan, A00673, от 200 до 400 меш, 1 ммоль/г, 1% DVB) (40,5 г) и триэтиламин (69,6 мл) с последующим встряхиванием при комнатной температуре в течение 4 дней. После реакции, смолу собирали путем фильтрации. Полученную смолу последовательно промывали пиридином, метанолом и дихлорметаном, а затем сушили при пониженном давлении. К полученной смоле добавляли тетрагидрофуран (дегидратированный) (500 мл), ангидрид уксусной кислоты (104 мл) и 2,6-лутидин (128 мл) с последующим встряхиванием при комнатной температуре в течение 4 часов. Смолу собирали путем фильтрации, последовательно промывали пиридином, метанолом и дихлорметаном, а затем сушили при пониженном давлении с получением 59,0 г нужного продукта.
[00162] Для определения загрузочного количества нужного продукта, молярное количество тритила на грамм смолы определяли известным способом по УФ-поглощению на 409 нм. Загрузочное количество на смоле составляло 467,83 мкмоль/г.
Условия для УФ-измерения:
Инструмент: U-2910 (Hitachi, Ltd., Japan)
Растворитель: метансульфоновая кислота
Длина волны: 409 нм
Величина ε: 45000
[00163] [Сравнительный пример 2]
4-{[(2S,6R)-6-(4-бензамидо-2-оксопиримидин-1-ил)-4-тритилморфолин-2-ил]метокси}-4-оксобутановая кислота, нанесенная на аминополистироловую смолу
Для получения указанного в заголовке соединения проводили процедуры, описанные в Сравнительном примере 1, за исключением того, что 1-[(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]-5-метилпиримидин-2,4-дион, используемый в стадии 1 Сравнительного примера 1, был заменен в этой стадии на N-{1-[(2R,6S)-6- (гидроксиметил)-4-тритилморфолин-2-ил]-2-оксо-1,2-дигидропиримидин-4-ил}бензамид.
[00164] Для определения загрузочного количества нужного продукта, молярное количество тритила на грамм смолы определяли известным способом по УФ-поглощению на 409 нм. Загрузочное количество на смоле составляло 460,28 мкмоль/г.
[00165] [Сравнительный пример 3]
4-{[(2S,6R)-6-(6-бензамидопурин-9-ил)-4-тритилморфолин-2-ил]метокси}-4-оксобутановая кислота, нанесенная на аминополистироловую смолу
Для получения указанного в заголовке соединения проводили процедуры, описанные в Сравнительном примере 1, за исключением того, что 1-[(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]-5-метилпиримидин-2,4-дион, используемый в стадии 1 Сравнительного примера 1, был заменен в этой стадии на N-{9-[(2R,6S)-6- (гидроксиметил)-4-тритилморфолин-2-ил]пурин-6-ил}бензамид.
[00166] Для определения загрузочного количества нужного продукта, молярное количество тритила на грамм смолы определяли известным способом по УФ-поглощению на 409 нм. Загрузочное количество на смоле составляло 425,13 мкмоль/г.
[00167] [Сравнительный пример 4]
4-{{(2S,6R)-6-{6-(2-цианоэтокси)-2-[(2-феноксиацетил)амино] пурин-9-ил}-4-тритилморфолин-2-ил}метокси}-4-оксобутановая кислота, нанесенная на аминополистироловую смолу
Для получения указанного в заголовке соединения проводили процедуры, описанные в Сравнительном примере 1, за исключением того, что 1-[(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]-5-метилпиримидин-2,4-дион, используемый в стадии 1 Сравнительного примера 1, был заменен в этой стадии на N-{6-(2-цианоэтокси)-9- [(2R,6S)-6-(гидроксиметил)-4-тритилморфолин-2-ил]пурин-2-ил}-2-феноксиацетамид.
[00168] Для определения загрузочного количества нужного продукта, молярное количество тритила на грамм смолы определяли известным способом по УФ-поглощению на 409 нм. Загрузочное количество на смоле составляло 341,09 мкмоль/г.
[00169] PMO синтезировали (5'-конец представляет собой группу (3)) в соответствии с нижеприведенным описанием в Примере 1, или в соответствии с методикой, описанной в PCT/JP2015/57180 с использованием синтезатора нуклеиновых кислот (AKTA Oligopilot 10 plus). Среди синтезированных PMO, PMO, обладающие активностью в отношении пропуска экзонов, перечислены в Таблице 1.
Таблица 1
(вычисленная)
[00171] [Пример 1]
4-{[(2S,6R)-6-(5-метил-2,4-диоксопиримидин-1-ил)-4-тритилморфолин-2-ил]метокси}-4-оксобутановую кислоту, нанесенную на аминополистироловую смолу (Сравнительный Пример 1), или 4-{[(2S,6R)-6-(4-бензамидо-2-оксопиримидин-1-ил)-4-тритилморфолин-2-ил]метокси}-4-оксобутановую кислоту, нанесенную на аминополистироловую смолу (Сравнительный Пример 2), или 4-{[(2S, 6R)-6-(6-бензамидопурин-9-ил)-4-тритилморфолин-2-ил]метокси}-4-оксобутановую кислоту, нанесенную на аминополистироловую смолу (Сравнительный Пример 3) или 4-{{(2S,6R)-6-{6-(2-цианоэтокси)-2- [(2-феноксиацетил)амино]пурин-9-ил}-4-тритилморфолин-2- ил}метокси}-4-оксобутановую кислоту, нанесенную на аминополистироловую смолу (Сравнительный Пример 4), каждая из которых соответствует 5'-концевому основанию, загружали в количестве 0,1 г в реакционный сосуд, снабженный фильтром, для инициации нижеследующих циклов синтеза с использованием синтезатора пептидов (FOCUS). Для получения нуклеотидной последовательности каждого соединения, указанного в Таблице 1, нужное морфолино-мономерное соединение добавляли в каждом цикле связывания (см. ниже Таблицу 2).
[00172] [Таблица 2]
(мл/прогон)
(мин/прогон)
[00173] Следует отметить, что используемый раствор для снятия защиты был получен путем растворения смеси трифторуксусной кислоты (2 эквивалента) и триэтиламина (1 эквивалент) при концентрации 3% (масс./об.) в растворе дихлорметана, содержащем 1% (об./об.) этанола и 10% (об./об.) 2,2,2-трифторэтанола. Используемый нейтрализующий раствор получали путем растворения N, N-диизопропилэтиламина в концентрации 5% (об./об.) в растворе дихлорметана, содержащем 25% (об./об.) 2-пропанола. Используемый активирующий раствор представлял собой раствор 1,3-диметил-2-имидазолидинона, содержащий 20% (об./об.) N, N-диизопропилэтиламина. Используемый мономерный раствор получали путем растворения соединения морфолино-мономерного соединения в концентрации 0,20 М в тетрагидрофуране. Используемый раствор для введения защиты получали путем растворения 10% (об./об.) ангидрида уксусной кислоты и 15% (об./об.) 2,6-лутидина в дихлорметане.
[00174] Аминополистироловую смолу, содержащую PMO, синтезированный, как описано выше, собирали из реакционного сосуда и сушили при 30°C в течение 2 часов или более при пониженном давлении. Осушенный PMO, нанесенный на аминополистироловую смолу, загружали в реакционный сосуд и добавляли 5 мл 28% водного раствора аммиака-этанола (1/3) с последующим выдерживанием при 55°С в течение 16 часов. Аминополистироловую смолу отделяли путем фильтрации и промывали 3 мл смеси воды-ацетонитрила (1/1). После смешивания полученного фильтрата с этанолом (3 мл) и диэтиловым эфиром (35 мл), смесь центрифугировали, а затем декантировали для удаления супернатанта, и остаток сушили при пониженном давлении. Полученный остаток растворяли в 10 мл смешанного растворителя, содержащего 20 мМ водного ацетата аммония и ацетонитрила (4/1), а затем очищали с помощью обращенно-фазовой ВЭЖХ. Используемые условия указаны ниже в Таблице 3.
[00175] [Таблица 3]
КО: колоночный объем
[00176] Каждую фракцию анализировали для сбора нужного продукта. Полученный раствор смешивали с 0,1 М водной соляной кислоты (4 мл) и оставляли на 2 часа. После реакции добавляли 1М водного гидроксида натрия (0,4 мл) для нейтрализации смеси, которую затем фильтровали через мембранный фильтр (0,22 мкм).
[00177] Полученный водный раствор, содержащий нужный продукт, подщелачивали 1М водным гидроксидом натрия (0,4 мл) и очищали на колонке с анионообменной смолой. Используемые условия указаны ниже в Таблице 4.
[00178] [Таблица 4]
1 M водного хлорида натрия
[00179] Каждую фракцию анализировали (с помощью ВЭЖХ) для получения нужного продукта в виде водного раствора. Полученный водный раствор нейтрализовали 0,1 М фосфатным буфером (pH 6,0), а затем обессоливали с помощью обращенно-фазовой ВЭЖХ в условиях, указанных ниже в Таблице 5.
[00180] [Таблица 5]
[00181] Нужный продукт собирали и концентрировали при пониженном давлении. Полученный остаток растворяли в воде и сушили вымораживанием с получением нужного соединения в виде белого хлопьевидного твердого вещества. Расчетные и измеренные величины ESI-TOF-MS указаны в Таблице 1.
[00182] [Пример 2]
Синтез конъюгата «антисмысловой олигомер-пептид» (конъюгата PMO-пептид)
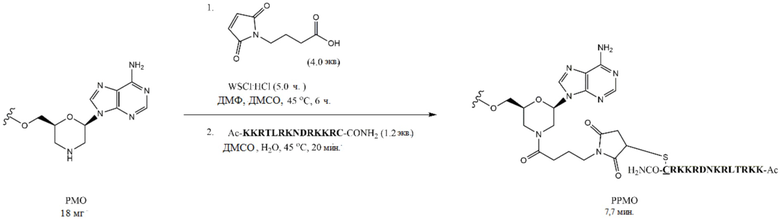
PMO (PMO No. 15, 18,1 мг, 1,0 экв.) растворяли в ДМСО (284,0 мкл) и ДМФ (17,5 мкл). К раствору добавляли смесь 4-малеимидомасляной кислоты (1,7 мг, 4,0 экв.) и WSCI ⋅ HCl (2,2 мг, 5,0 экв.) в ДМСО (23,2 мкл) и ДМФ (22,2 мкл). Реакционную смесь перемешивали при 45°С в течение 6 часов. После того, как реакция была почти полностью завершена, к смеси добавляли CH2Cl2 (13,2 мл) с получением осадка. Осадок собирали путем центрифугирования с последующей сушкой в вакууме. Осушенный осадок снова растворяли в ДМСО (175,0 мкл) и H2О (52,7 мкл). К полученному раствору добавляли hLIMK (Ac-KKRTLRKNDRKKRC-CONH2, 5,1 мг, 1,2 экв.) (SEQ ID NO: 112) и смесь перемешивали при 45°С в течение 30 минут. После подтверждения завершения реакции с помощью ВЭЖХ-анализа, реакцию прекращали добавлением раствора ацетонитрила (10% в H2O; 400 мкл). Раствор разбавляли водой (приблизительно 40 мл) и нужный продукт очищали катионообменной хроматографией. Используемые условия указаны ниже в Таблице 6.
[00183] Таблица 6
КО: колоночный объем
[00184] Фракции анализировали с помощью ВЭЖХ и собирали соответствующие фракции. Водный раствор семь раз разбавляли водой, а затем обессоливали с помощью обращенно-фазовой ВЭЖХ в условиях, указанных ниже в Таблице 7.
[00185] Таблица 7
[00186] Нужный продукт собирали и концентрировали при пониженном давлении. Полученный остаток растворяли в воде и сушили вымораживанием с получением нужного соединения (обозначенного как PPMO № 1) в виде белого хлопьевидного твердого вещества (7,7 мг, выход 34,0%).
[00187] Молекулярную массу полученного соединения (PPMO № 1) определяли с помощью ESI-TOF-MS (вычислено: 9973,92, найдено: 9973,54).
[00188] [Пример 3]
Оценка активности антисмысловых олигомеров в отношении пропуска экзонов
Перенос PMO в клетки
В 3 × 105 клеток RD (клеточной линии человеческой рабдомиосаркомы) вводили каждый из антисмысловых олигомеров, представленных в Таблице 1, в концентрации 10 или 30 мкМ с использованием Nucleofector II (Lonza) и набора Nucleofector для клеточной линии Amaxa. Используемая программа импульсного мечения представляет собой Т-030.
После трансфекции, клетки культивировали в лунках 6-луночных планшетов в 5% CO2 в модифицированной по способу Дульбекко среде Игла (DMEM) (Sigma-Aldrich), содержащей 10% фетальную бычью сыворотку (FBS) (Sigma-Aldrich). Через три дня после трансфекции, культуральную среду заменяли бессывороточной DMEM, содержащей 0,4 нг/мл рекомбинантного миостатина (R&D Systems), и клетки культивировали еще 2 часа при 37°C в 5% CO2.
[00189] Трансфекция фосфортиоатных (PS) олигонуклеотидов в клетки
За день до трансфекции, клетки RD высевали в 24-луночные планшеты при плотности 3 × 104 клеток/лунку и культивировали при 5% CO2 в среде DMEM (Sigma-Aldrich), содержащей 10% FBS (Sigma-Aldrich). На следующий день, каждый из антисмысловых олигомеров 2'-O-метилфосфортиоатных (PS) олигонуклеотидов (JbioS), показанных в Таблице 8, трансфецировали при 10 или 30 нМ с использованием реагента для трансфекции Липофектамина 3000 (Thermo Scientific). Клетки культивировали в течение трех дней после трансфекции.
[Таблица 8]
(вычисленная)
[00190] Прямая доставка конъюгата PMO-пептид в клетки
За день до трансфекции, клетки RD высевали в 24-луночные планшеты при плотности 4 × 104 клеток/лунку и культивировали при 5% CO2 в среде DMEM (Sigma-Aldrich), содержащей 10% FBS (Sigma-Aldrich). На следующий день к среде добавляли конъюгат «антисмысловой олигомер-пептид» (конъюгат «PMO-пептид»), синтезированный как описано в Примере 2. Клетки культивировали в течение трех дней после добавления конъюгата «PMO-пептид».
[00191] Экстракция РНК
Клетки промывали один раз PBS (Nissui Pharmaceutical), а затем к клеткам добавляли 350 мкл буфера RLT (Qiagen), содержащего 1% 2-меркаптоэтанол (Nacalai Tesque), и клетки подвергали лизису путем их выдерживания в течение нескольких минут при комнатной температуре. Клеточный лизат собирали в гомогенизатор QIAshredder (Qiagen) и центрифугировали при 20400× g в течение 2 минут с получением гомогената. Общую РНК экстрагировали в соответствии с инструкциями производителя, имеющимися в наборе RNeasy Mini Kit (Qiagen). Концентрацию экстрагированной общей РНК измеряли на спектрофотометре NanoDrop ND-1000 (Thermo Fisher Scientific).
[00192] Оценка эффективности пропуска экзонов
Экстрагированную общую РНК (150 нг) использовали в качестве матрицы для проведения одностадийной ОТ-ПЦР с помощью набора для одностадийной ОТ-ПЦР QIAGEN (Qiagen). Реакционный раствор получали в соответствии с протоколом, прилагаемым к набору. В качестве термоячейки использовали термоячейку для ПЦР TaKaRa PCR Thermal Cycler Dice Touch (Takara Bio). Используемая программа ОТ-ПЦР описана ниже:
50°С в течение 30 минут: реакция обратной транскрипции
95°С в течение 15 минут: активация полимеразы, инактивация обратной транскриптазы [94°С, 30 секунд; 62°С, 30 секунд; 72°С, 50 секунд;] × 32 цикла: ПЦР, 72°С, 7 минут: конечная реакция элонгации.
[00193] Нуклеотидные последовательности прямого и обратного праймеров, используемых для ОТ-ПЦР, указаны ниже.
Для детектирования пропуска экзона 5:
Прямой праймер: 5'-TGCTACGATAGGCAGGAGTG-3'(SEQ ID NO: 37)
Обратный праймер: 5'-AGCAGGTTCTCGTGCTTCAT-3'(SEQ ID NO: 38)
Для детектирования пропуска экзона 6, 7 или 8:
Прямой праймер: 5'-CATGTGGACATCCATGAGGA-3'(SEQ ID NO: 39)
Обратный праймер: 5'-GAGACACAAGCTCCCACAGC-3'(SEQ ID NO: 40)
Для детектирования пропуска экзона 9 или 10:
Прямой праймер: 5'-TCTATTGCCCACAGGGACTT-3'(SEQ ID NO: 41)
Обратный праймер: 5'-GAGCCTCTGCATCATGGTC-3'(SEQ ID NO: 42)
[00194] Вышеупомянутый реакционный раствор для ПЦР (1 мкл) анализировали с использованием биоанализатора (Agilent). Затем измеряли молярность полинуклеотида «А» ПЦР-ампликона с пропуском экзона, то есть, усеченной кДНК ACVR2B, и молярность полинуклеотида «В» ПЦР-ампликона дикого типа, то есть, кДНК ACVR2B дикого типа. На основе этих измеренных величин «А» и «В» определяли эффективность пропуска экзонов в соответствии со следующим уравнением.
Эффективность пропуска (%) = A/(A+B) × 100
Полученные результаты представлены на фигурах 1a-d.
На фигурах 1a-d показано, что антисмысловой олигомер и конъюгат «антисмысловой олигомер-пептид согласно изобретению» вызывают пропуск экзона.
[00195] [Пример 4]
Оценка доминантно-негативной активности
8 × 103 клеток HEK-293 (эмбриональных клеточных линий почек человека) высевали в 96-луночные белые планшеты (Thermo Fisher Scientific) и культивировали при 37°C в атмосфере 5% CO2 в минимальной поддерживающей среде Игла (Sigma-Aldrich), содержащей 10% FBS. На следующий день, 10 нг pBApo-CMV (Takara Bio), несущей ДНК, кодирующую каждый продукт с пропуском экзонов (экзонов 5, 6, 7, 8, 9 или 10) (Eurofins Genomics), и 14 нг репортерной ДНК люциферазы (в наборе для анализа на репортер Cignal SMAD Qiagen) котрансфицировали в клетки с использованием липофектамина LTX (Thermo Fisher Scientific). Через два дня после трансфекции, к среде добавляли рекомбинантный миостатин (R&D Systems), разведенный в бессывороточной минимальной поддерживающей среде Игла до конечной концентрации 10 нг/мл. После культивирования еще в течение 24 часов проводили анализ на люциферазу-репортер с использованием системы для анализа на люциферазу Dual-Glo (Promega) в соответствии с инструкциями производителя. Люциферазную активность измеряли на люминометре Tecan infinite F200 PRO (Tecan).
[00196] Полученные результаты показаны на фигуре 2. Как показано на фигуре 2, люциферазная активность, индуцированная добавлением миостатина, почти полностью подавлялась в клетках, трансфицированных ДНК, кодирующей продукт с пропуском каждого экзона. На фигуре 2 показано, что любой пропуск экзонов (экзонов 5, 6, 7, 8, 9 и 10) может эффективно подавлять сигнал миостатина.
[00197] [Пример 5]
Измерение сигнала миостатина
Экстрагированную общую РНК (360 нг) использовали в качестве матрицы для проведения реакции ОТ с помощью набора для обратной транскрипции кДНК High Capacity (Thermo Fisher Scientific). Приготовление реакционного раствора и температурный режим определяли в соответствии с инструкциям производителя набора. В качестве термоячейки использовали термоячейку для ПЦР TaKaRa PCR Thermal Cycler Dice Touch (Takara Bio).
Раствор для реакции ОТ (0,6 мкл) использовали в качестве матрицы для проведения кол.ПЦР с использованием смеси для экспрессии гена TaqMan Master Mix (Thermo Fisher Scientific) и с помощью анализов на экспрессию генов TaqMan, то есть, на SMAD7 и PPIB (Thermo Fisher Scientific). Для проведения количественной ПЦР использовали прибор QuantStudio 6 Flex Systems (Thermo Fisher Scientific).
[00198] Полученные результаты представлены на фигуре 3.
Как показано на фигуре 3, экспрессия гена SMAD7 увеличилась в 6 раз при стимуляции миостатином. Антисмысловые олигомеры согласно изобретению подавляли повышенную экспрессию гена SMAD7. Как показал анализ BLAST, эти антисмысловые олигомеры не имели гомологии с геном SMAD7. Следовательно, эти активности ингибирования экспрессии гена SMAD7 были специфичны для активности ингибирования сигнала миостатина.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ:
SEQ ID NO: 1
GACCCUGGGCCUCCACCACCAUCCCCUCUGGUGGGCCUGAAGCCACUGCAGCUGCUGGAGAUCAAGGCUCGGGGGCGCUUUGGCUGUGUCUGGAAGGCCCAGCUCAUGAAUGACUUUGUAGCUGUCAAGAUCUUCCCACUCCAG
SEQ ID NO: 2
GACAAGCAGUCGUGGCAGAGUGAACGGGAGAUCUUCAGCACACCUGGCAUGAAGCACGAGAACCUGCUACAGUUCAUUGCUGCCGAGAAGCGAGGCUCCAACCUCGAAGUAGAGCUGUGGCUCAUCACGGCCUUCCAUGACAAG
SEQ ID NO: 3
GGCUCCCUCACGGAUUACCUCAAGGGGAACAUCAUCACAUGGAACGAACUGUGUCAUGUAGCAGAGACGAUGUCACGAGGCCUCUCAUACCUGCAUGAGGAUGUGCCCUGGUGCCGUGGCGAGGGCCACAAGCCGUCUAUUGCCCACAG
SEQ ID NO: 4
GGACUUUAAAAGUAAGAAUGUAUUGCUGAAGAGCGACCUCACAGCCGUGCUGGCUGACUUUGGCUUGGCUGUUCGAUUUGAGCCAGGGAAACCUCCAGGGGACACCCACGGACAG
SEQ ID NO: 5
GUAGGCACGAGACGGUACAUGGCUCCUGAGGUGCUCGAGGGAGCCAUCAACUUCCAGAGAGAUGCCUUCCUGCGCAUUGACAUGUAUGCCAUGGGGUUGGUGCUGUGGGAGCUUGUGUCUCGCUGCAAGGCUGCAGACG
SEQ ID NO: 6
GACCCGUGGAUGAGUACAUGCUGCCCUUUGAGGAAGAGAUUGGCCAGCACCCUUCGUUGGAGGAGCUGCAGGAGGUGGUGGUGCACAAGAAGAUGAGGCCCACCAUUAAAGAUCACUGGUUGAAACACCCG
SEQ ID NO: 7 (экзон 11, включая концевой стоп-кодон UAA)
GGCCUGGCCCAGCUUUGUGUGACCAUCGAGGAGUGCUGGGACCAUGAUGCAGAGGCUCGCUUGUCCGCGGGCUGUGUGGAGGAGCGGGUGUCCCUGAUUCGGAGGUCGGUCAACGGCACUACCUCGGACUGUCUCGUUUCCCUGGUGACCUCUGUCACCAAUGUGGACCUGCCCCCUAAAGAGUCAAGCAUCUAA
SEQ ID NO: 8:
GGCUCGGCUCCGUGGCCGCCGCUCAGGAGCCAUUUUGGACUCGGUUCAGCUCCCCUCCCCCCCACCCCUCCCCCCGUUCAUGGCCCCUCCGGACUCGGCCCCUGCGCCCGGGGCCCGGGCCCAGCCCCGCCGCGCUAUGCCUGAGUCGGGCGCGCCCCGGCCCGUGCCCCGCCGCCGCCCCCCGGCCCCCGCGUCGCCCCGGAGCCCGGGCCGCAGCCUGCGCCGCCCGCAGCGGCCCUGAGCCCGGCCCCGCCGACCGGCCCUUGGAGCCCGAACGCUGCUCGGGGACGAAGGCGCAGGAAGCGCGCAGGGAACGAGACCGAAGGAAGGAGCGGGAAGGAGAGCGCAGCCGCCGCCUGGCCCUGCGCGCCCCGGGAGCGCCGUGCGGCCCUGCCCGCGGGCUCCGGGUGUGCGCGGGGCGGCGCCGCGGAACAUGACGGCGCCCUGGGUGGCCCUCGCCCUCCUCUGGGGAUCGCUGUGCGCCGGCUCUGGGCGUGGGGAGGCUGAGACACGGGAGUGCAUCUACUACAACGCCAACUGGGAGCUGGAGCGCACCAACCAGAGCGGCCUGGAGCGCUGCGAAGGCGAGCAGGACAAGCGGCUGCACUGCUACGCCUCCUGGCGCAACAGCUCUGGCACCAUCGAGCUCGUGAAGAAGGGCUGCUGGCUAGAUGACUUCAACUGCUACGAUAGGCAGGAGUGUGUGGCCACUGAGGAGAACCCCCAGGUGUACUUCUGCUGCUGUGAAGGCAACUUCUGCAACGAACGCUUCACUCAUUUGCCAGAGGCUGGGGGCCCGGAAGUCACGUACGAGCCACCCCCGACAGCCCCCACCCUGCUCACGGUGCUGGCCUACUCACUGCUGCCCAUCGGGGGCCUUUCCCUCAUCGUCCUGCUGGCCUUUUGGAUGUACCGGCAUCGCAAGCCCCCCUACGGUCAUGUGGACAUCCAUGAGGACCCUGGGCCUCCACCACCAUCCCCUCUGGUGGGCCUGAAGCCACUGCAGCUGCUGGAGAUCAAGGCUCGGGGGCGCUUUGGCUGUGUCUGGAAGGCCCAGCUCAUGAAUGACUUUGUAGCUGUCAAGAUCUUCCCACUCCAGGACAAGCAGUCGUGGCAGAGUGAACGGGAGAUCUUCAGCACACCUGGCAUGAAGCACGAGAACCUGCUACAGUUCAUUGCUGCCGAGAAGCGAGGCUCCAACCUCGAAGUAGAGCUGUGGCUCAUCACGGCCUUCCAUGACAAGGGCUCCCUCACGGAUUACCUCAAGGGGAACAUCAUCACAUGGAACGAACUGUGUCAUGUAGCAGAGACGAUGUCACGAGGCCUCUCAUACCUGCAUGAGGAUGUGCCCUGGUGCCGUGGCGAGGGCCACAAGCCGUCUAUUGCCCACAGGGACUUUAAAAGUAAGAAUGUAUUGCUGAAGAGCGACCUCACAGCCGUGCUGGCUGACUUUGGCUUGGCUGUUCGAUUUGAGCCAGGGAAACCUCCAGGGGACACCCACGGACAGGUAGGCACGAGACGGUACAUGGCUCCUGAGGUGCUCGAGGGAGCCAUCAACUUCCAGAGAGAUGCCUUCCUGCGCAUUGACAUGUAUGCCAUGGGGUUGGUGCUGUGGGAGCUUGUGUCUCGCUGCAAGGCUGCAGACGGACCCGUGGAUGAGUACAUGCUGCCCUUUGAGGAAGAGAUUGGCCAGCACCCUUCGUUGGAGGAGCUGCAGGAGGUGGUGGUGCACAAGAAGAUGAGGCCCACCAUUAAAGAUCACUGGUUGAAACACCCGGGCCUGGCCCAGCUUUGUGUGACCAUCGAGGAGUGCUGGGACCAUGAUGCAGAGGCUCGCUUGUCCGCGGGCUGUGUGGAGGAGCGGGUGUCCCUGAUUCGGAGGUCGGUCAACGGCACUACCUCGGACUGUCUCGUUUCCCUGGUGACCUCUGUCACCAAUGUGGACCUGCCCCCUAAAGAGUCAAGCAUCUAAGCCCAGGACAUGAGUGUCUGUCCAGACUCAGUGGAUCUGAAGAAAAAAGGAAAAAAAGUUGUGUUUUGUUUUGGAAAUCCCAUAAAACCAACAAACACAUAAAAUGCAGCUGCUAUUUUACCUUGACUUUUUAUUAUUAUUAUUAUAAUUAUUAUAAUUAUUAUUAUUAAUAUUAUUUUUUGGAUUGGAUCAGUUUUUACCAGCAUAUUGCUCUACUGUAUCACAAACAGCGGACACGUCAGCAGGCGUUGAGGUGCUGAGCUGUGGAUGCAGAACCAGCGCCAUGCUGAAGAGCCUCAGCCACCUCCUGUCCUUUGGGAUUCGUUUUUCCCGCUUUCUCUUUGUUUGUCGUCUCAGAAUCUGUGACACAAAGAAACCCAUCUCCUGUCUUAGGAAACCUAAUGCUGCAAACUCUACCUAGAGGAACCUUUGAAGACUGUUACAUAAGAACAUACCUUCCUCAGAAGAGGAGUUUCCUCUGCCCUCUGCCCUUCUCCCCUGCCUCCCUCCCUCCCCUCCUUUUAUUUUGUUUUAGUGAGCUUAAGAAACAGCAGAUGUGUCUUUCACGGAUCUAACGGGUGUUGUCCUGAUCGAGAAAAAAACUGGGAUGAGAAUGGUUUGGACUGGAGUUGGAAGGGGAGGACGGUACUGGGGGUAGGGUUUGGAACAGAGCUACACUGGACUCGGGCACAUUCGGAGCAGCAUCCUUUAGUAUGGAGGCUACUUCUCAGGUAACCAGGAAUUGAGGGGAAGGACCUUGUGGAGGCCGAGCAUUAACAGCAAGAGCGGGGUUUGGAGAAAGUCUGAGAUUGGGUGCAGCCCUGACUUACCUGCUGGCCCUGACCAGUUUCUUUUCACUAACUUGGCCUUGGGCAUAGGAUGAAACAUUUUUUCUGCCCUAAUUUUAAAACUAGGUGAGGGUAGAAUCAUCACAGGUUAGGAAUACAUUCUUCAUAAGACACGAUGCUGUAAAUACCCUUAAUGGACGAAAAGUUGAAAUACUUUUGUUUCCUCUUGGAGCAGUUCAGGGAAAUGCCCACAGGGGAUUGUCCUGCACAGAUAGGGCAAGAGGAUUUCCUGGGUGGAGUCUGCCAAGGCCUGCCUCGCUGGGGACCCCAGAGUCCUGCACCUCUGGUUCCGCCCCAGGUGGUGACAUUACUGUCCCCGUUCUGUGGCUCGUGGACAAGACUUUCUCCAGACCCCUUAAAGUGGUACAUAUUCUAAAAAACUGUUUUUCUAUUAUGCCAUAACCUUGCUCUAGUCAGUGAAUGUUCCUAAUGCUGCUGUUUCAACAUUUGAAUUCUUUUUAAUUUAUGAAACAUGCUAAAUUUUUUUUUUCAAACAAAACACACACAUCCACAUAUACACAUGCUUCGCUAUGUGGCUUCCAAGGUUUAAAUUUUGAAAAGUAAAAGAAUUAAAACUUCACGACCACAGAUCACCUCAAACCAGAAAUACCUCAGAAUUUUCUACUUAUGUAAGGUUUAUUAUAUAUUUUGUUAGUUGUGUUGUCUUGUAGUAAGUAUAUUUUAAUGUAAGUUGGCUUUUGUGACAAGGAAGUUUAAAAGAAAUAGAGAAAAAGAAAAAAGUUUGCAUCUUCUAGGGAGUGCUACCAUUUUUGUUUGAUAACGCCCCCUUGUAAAUAAUUGUCAUCAACUGUAGGUUGGCUGUCUGGGCCAAGUCUGGGCAUUUAUCAGUCUUGUUUGUGAAGGCUUUUCCUUCUGGUUUCUUUAGAUCAUUUUAUUUAAAAACAGUGCAUCUCUUCAUCGUGAGGGUAGGCAAGGCGGGGGCCGUGGGGAGAGGUUGACCUGGGUGAGAACUGAAGAGGCCGCCUCCUCUUGGGUUGUUUGGAGCUUCACAUGUAAUUCACAUGUAACAUGUAACUUGAUCGGUCAGUGUUCAGAAUGACAAGUAACCCCGCUUAAACUUGGUAGAAGGAUGGCCCUUAGACCUGAAUGGGGUGAUUUUACUUGGGAUUUAACUUCUUCAGCAAAUUAACAGCAACGUUGGAAGAGAUCUGUGGCGCCUCUGUGAAGCACACCGUGACUCAGGCCAGUCUUUUAGUGCAGCGUGUCUGGGAGUGAAGGGUUUUGCCCUUGCUGGUCUUGGAGUCCACAGUGUGAGGGGCACUGCACAUGCCUGGGCAUCUACCUAGUGUGCUAUGUUCAGUGUCUGGGGCUUACUGCCCCGGGGUCCUUUCCUCUGGGUGUUGGGGCACAGGGUGCUAUGGGAGGCCCAUUUGCUUCCCUCUCGGAGCUCAGUUUUUGCUUCAUGGGUCAAAAUGUGGGCUGGCCAAGUGGUUACAGGAACAGGGUUUCGGUAAGCUAUGUUGUCUUUUUUUUUUUUUUUUUUUUUUUUUUUAAUGGUUUGAUUUUGUGCUGUGGUAUUUUUUUUCCCUUAGAAUAAUUUUUAAUGGCAAAACAGGCCUUACAGCAGUUGCUUUUCUUUACCAUUUAUUUCUUUAAGAAGCUUUAAAAUAUUUAUUGAAAAGUGCCAUAUCUAAUUUCUUUAGCUUUCGCCUCAGGCAGUGCAGGCAUCUUUACUUUUCAUCCUCAGAAGAAACAAACGACUAACAAAUGUAGCAAAUUUACUGCAGGAAUAGUUAGGUCAUGAUACUACCUGAACACUAAACCCCAGCCUCUUUGUUUGGUUUUAGUUCCUCUGGGUGGUUUUUCUUUUGUGUGCUGGCUUGAUUCUUGUGAGAAGUUUUGACCUGGCCAAGGGAGGGUUGAGCCAUGGUUCUGGUGUGGGACUUUGCGGUCAAGACACAGUACAGACAGGUCAGGCCUGCGUGCCUUUUCUCUGGGUGGCCUCCCCGUUAGGCCCACCGUACGCUCAGCCACUAUAGUGUCCCUGUGGGGCCUUGCCAUCAGAUUGUGUGUCAGGAGAUGGUACCUUUUUGGUGUGGCUGGGGAGGAGUGUGGUCCAUGCCAGUUCUUUGGGCUUCAGGCCACUCUUCCCCUCAUGCUGUGGUGUAAAGUGCACCCAUCAGGUGGUAUAUCUGGUUCUGAUGGCAAGAAGAAGGUGGGGGAUCUCCUUAUAGGGCAUGGGUCUAGGAGCACAGAUGGGCCUUUUGCCCCGGGUAAAUGCUUGUCUGUUUGCUGUCAUGUGUUCUUUGAGGAGUGAGCCAUCUCGAGCCCUGCUUUGAAUUUACUGGGUCAUAGAGCCUCUGCCUGUGCUCUUUUCCAUAAUGACUUCAUGUGACAUGCACUUUUGGUGGGCUCAGAUAAUUGGUUUCUUUUUGUUUUUGACCUCAGGCUCUGUGGCAGACUGGGGAAAAUGGGGCCUGGCAUCAUUUUCCCUGUCAAUGGGAGGGGCUGUUCCAUGCAGGGUGGGAGGGGACCAAGUUAGCAGAGAGUAGCCAAGGAUCCUUGCUUCUUCCUUUCUAGUGUGCUGUCAUCCAAGCAGGCUCCUGGCUGUAGGGAUGGGCCUUGGGGAAGAAUCUUCUUUGAAAGCAUCUAUGAUAACUGAGAAGUCAUCCCUAGUUGGAGAAAUCCAGUAAUGAGCAGAAGGAGGAAGCAAGUGAGGACAGAGGCCAUUGUAUUACAGUGUCACGCAGAGGGCCCUCAAUGAUGGGGCAUUGGGGAAGGCUGUAGACAUAGUCAUCAGAACAUCCUGGCCUGGCAUAAGCUGGGUUUUCUCCUGGGACCAUUGGUCCUCAGCAGGAGUUCUUUGCAUGAGUUGCUCAGGGGCAAGGGCUGCAAGUGGGCUGUGCUUAGGAGAAAGUGACACCUGGCAGUGAGGGAAGAUGGUGAGCAUUAUUAGCCUUUGUUGUCCAGCAUGGCCUUCUUGUCCUGUCUGCUCUGGAGAGGAGCCUGUGGGACCAGUCCUGCCUGGGGAGGGCAUACCCACACGUGCCAGCUGAUUCUGACUCUGAAUACAUCAUGUCCGGACUUGGGGGUGUUUCUGCAGAAAAAGGAGGUUGUUUUUCAGCCUUGAACAUCUUCAGGAGGAUAGAGACUCUUGCUCACAUAUUCUUAGCAAAGGGAAGGGUCUCUCAUCUCCAGGCCACAGAGAUAGUUCUUCCAUUGCCCUAAGAGGCUAGGCUAACCCUCUUGACAUAACUUAGACAGCAAAGCACUUCAUCCUGUAGUUGGGCUCUGUCACCUUUCUCUUCAGUUGGCCACAUUCUCGUUUCCUCCAUCCUGCUAUGCUUUGUGUGCUCGGGCUGUGUGUGGGGUUUUUCCCUGGUGGAAGGAAGCCCAGCUGUGUAUUGAAUGUCCUUCAUGUGUUGUGUGUGGCUCAGAAAGCCUGUCACUUGGCCCCUGUGCUCUGAGCCGUGAGGGUGGGGAGGUGGCUGUUCCAUUAAAGUGGGAGUAUUGGAUGGCCCUCUUGAAACUAGAAUUUUGCCUUUUUUAGUAUGCAGUAUAAAGUUUCCAGCAUCUAUUGGUAACACAAAGAUUUGCUGGUUUUUAAAAUAAUACAGUAAGCAUAAGUAUGUAAGUUUUUAGAAUUGGUACUAGAAGUUGGACAGCUAGUUAUUCUCGAGAACUUUAUUUCACUAGAAAAAUAUACUAAUUGGAAAGCAGUUUCCAGGAGUUAACUCAGUUUAAUUUUCAGUCUCAGUUAUUUUAGCCUGUUGAGUUUUUGAUGGCACACCUUUGGAGAGAUGGCCACGCCUGAUUCCCAUUUCAGGGGCAUCAGACCAUACCUUUUUAAGAAGCUCCGUGAAUCUAGUCAUCUACCCUUCAUCCUGGGCGAACAGCCAAAAAGAGAAGGGGACAAGGUGUCUUUUUCUCCUUCUCACUGGGGUGACAUGAAUUCUUUUAGUUAAUGGCUGUUUGCAAAUUCUAAACUAAUGAAAUACUUAGCAGCUAACAUGUUCAAUCUAGUAAUGAUGAGUUUAAAUCUCAAUUGACAGUAAUGUUUUAGAUAAACAGGCCCAGUAAUUCAGUUGAUGAACUGUAUAUCUUCUCAGUCUAGAUUUGUAAAUGUUUAAUGAAUUCAGGGUUAUAAGCAUAGUUCUUUAAGUAAGAUUCCAGAUAGUUGAUUUGCAACCAGCAGUCUACCUAUGAAUGUAUCCCAAACCUUUAGAAGAUUGGAAAAGAUUUUUGAAAUAAUGAUUUAGUUUUGUAGGAAAAACACCCCCUUGAAAAUUAAUUCGGUUGACCCAGUAACAUUUUUUAAAACAAUUGGUGGCUCCAAAAGGCCUGCCAACAAAGAAAAGUCCAAAUUAUCUAGUGGGACAUUUUGAAUGUUUUAUGUUUAUUUUGGGUCCACUGUAAACUUUGGUUCAAAAAAGAAUUUGAAUUUAAAGAAUUUACCAUUAUUUAAAUUAUUACCAAGUUUUUACAUUUUCAUGAUGGUAUUUUCCAGGUAUGAAUGAAACAUGACUUUUUGAUUGUGGUACUUCCUGUAUCCCCUGUAGUGCCAAAACCAGUGAUACUUUAUUUGCUCCUAUGGCAGCUCAUAGAGGUAACCGAAGUGAUUUUUCCUCAGUAAUUGAAACACAUAUUCUCUAAAUGCCAAUGUGUGGUGAUGGGCCCUGCACUGCCUUCAUUUCUCUAGGGCAGUGUCUUUGGAUUGUCUAGGGCCUAGGUAAUUCUGAGAACUACUGUAAACCAACCACAGGGCACUAAAGCAAUGUACACACCACUCUUUGUGUGUAUGGAAGGGGUUAUAUAAACCUGGGCUAUGCUGGACAUCUACAGAAGAGUAUUACAUUCACUUGCAAAGUUUACAUUUUUGAGCUCACAGUUAUGAAAAAUAUGACCCACAAGUUUUUCAGGCAGGUGAGGAUGGGUCUUCUUGCAAAUGCAUGAGUUCUGUCUUGAGUCCUGGGAACUUCUCUGUUGGUUGAGUGUGGGCUCAUUCCCUGACUCUCCUAAUCAUGUUUGCGUCAGAAUGUUAGCAUUGUAAAUAAAAGAAUAGGUUGUAUAAUAGAUACACAACACUUGAAACUUUACUUUAAAAAAAUCGAUAGUUCUACAUAUAUAUUUAGUUAUAUCACUUGACAGAUUUCUUCUACACAGUGUGGAGAUUGUUUUAUACCACAGAUUAUUUUUAUAAAGUUAGUGAAUUUGAAUGAUUUUGUAAUCAGAGCUAAUGAGCUUUACCUUUCAAGAGAAACGUACACUGGAGCAUGAGUGGUGUGGAACUUUUACUUAGUGUUUAUAUGGAUUCUUGUGAUACACUGGCAGACUGGAGUCAAUUUGCGGGUCUUUUUUGGCCAAAACUCCACUUGUGGUUGUGUAGGACAGUGAUAUUCAGCUCAGCUUCUUGUGGAUUGGGAGGAGAGAGGGCCUGCAAUGUGUUUUACAUUGGUGCUUCCUCCUGAGAUUUCUGUUGAACAAAGGGUUCUGAGGUCAAAAAUUAGUUUGUAAGCCUUUGCCAUAGGACAUAGUCAUGUGAGAGUGUUUGGGGGAACAGAAAUUGUAUAGGGGUGCCUAUUGGGGUGGGAUGGGACUCGAAUAAGAUUCAGGUACAAAAACUUUGAAAUGAGAAUCUGGUGGUUUGAGUAAUCCACCAGACUGAAUUAUCUAAGAUCACAUUAUCCAGGUUGGGGGGCAGAAUUACCCAGUUAAGUAAUUGUUCAGAAAAGUGGGGAGGGUGGCAUGUGGAUGCAGUGAUCCAAUUAAAUGGAGAGCUGCCAGGCACAUUUUGUCCUCUCUGGUCAGUGAGAAUGGUUGGGUUGGCUCGCUGCUUCAAUCUGUGGAAUCAGCCAGGAGCCCAGUGAGGAAGCUCAGAACCCCAGUAACAGCAGAGCAUCUUUCAGAUAGCUCCAGAGUUUUCCUGCUUUUCUGAGGAAGCUCAGCAUCACUGCCACAAUACGGAAAGUGGUCUUCAUUUUAGCCUAUUUAUUUUUAGGCAGAGAGUGGAUGGUUAUUUGUGUGGGACUUUUGGUGGCGAUAUAUAAUGAAUAAUUAAGUUAAUUUCUGGUAUGCAUAAUGGCCAGUCCUGAGGCCCAGCUGAAGACCUGUCCCCCAGACCCUGCCCGCUGGCUUCAGGCUGCUGCUUCUAGACAGAGGUGCACUGGACGGGAUAGUUUUAUCAAGAGAAUCCCUAAUGUGUCAUUUUAAACCAGCUGUGCUUUUUAUUCAUUCUGGUUGAGCGUAUAGGUUUACACUUUACCCUUUUUAUACUUGGAAUAAAUUUAGUUCCAGCAGAUCUAGUAGCACUCCAGAAACCAACCCCAUCUGUUCCCCAUAAAAAGAACAUUUUCUCUGCUCUCCAGCCACGUGUCUUGGAAUGUAAUUCUGUUGUGCCUUUGUUUUUAUCACUCUCUUCGCCCCAAAAGCAACUGCUGUAAGCUUUUUUCUACUUGUCUUUUCUAGUCCCCAACCUCUACCUUUUUCCUUUUUCCCAGCCCUAAUUUCUGGAUGCACUUCUGUGAUCCAGGUAUUUUAAGAACCAGUUACCUCAGACCUCAUGUUGAACAGUGUCGCCAUCUGGGUCCUCUUGAUACUGCAGACUUUUAACGUACACAUGCAGGAACCCUGCUGAGCGUGGGCACUUGUUUUAAAGCAAAACUCUUCCCAAGGACUGAAGAAAGGGCUUCUGGCAAGCUCGUCAUGGCAUUGUGGUGGGAUGGGUCUAGAGUGUCAUCUGAAUGGUGCUUCCUGUGUUCCUCUUUGAAUUCUGCCAUUUUCAGUAUUCUUGUGUGUCUGAAUAGGCAAAGCGAUUUAAUUGGCUGGUCUUGCACGCAAAUUAGUUCCAAAGAUAAGCUCUUUGUAACACAUUUCCAGUCGCUAAUGCUCAAAUGUAGAACAUUCCUUUAAAUGGCAGGAUAAAAAACCCACUAUCCACCAUAGUGCAUUUUGGGAAGAUGUCUGUAGCAUAUGUUGCUGUGAAAUUAGGCCUUGUGGGAUAUGGCUGUUUGUCAUUUUGAUGUAUUUUAAAUAAAUAUAUAUAUUUUUUAAAGAGCCUUUUUUACCAGUUCAAAAAGUUUAAUUAACCAGCAGUCACCGCAUCUGAAUUUUUGUCUCUGGGGCAUAGAUGGCAGACCAAGAUUAAAAGUGGUAACUCAGCUAUACGAGCAUGGGCUACCUUCCUGGGCUCUCCUGCAGUCCUGUAGACCUGCUGUUCCGCAGACCAUGGGACACAAGGUCAGUGUGUUCCCAGUGAGGGUCCCAAGUCAGUCAUCUUAAGUGUUUGUUCUCUGCCCCAUUCAGUGGACUGUUGACUUCAGUCCCUGCAAGUGCUUUAGCCCGAGUGGGGUUUUCUCAGAGCACUGCCACGAGUUAAGUGUGUGUUUAGCCAAAUAAUUUCUCCGUAAGGGAAAAAUGCAGUCACCCAAAUUUUACCAACAAUGACAGAGAUGAGAGUAGAAAAGAUUAGGCAACAUCUGAGUUUUAACUUGAAAAGUGUCCAAGUCAUCAUGAAAGGCCGACUGGGAGCAAGUGAUUAUUAGAGAUUCUUCAGGAGACCUCAUCUGAAAAUGUUAAGACUGCCAGUGAGGGAAGGAAUUGUUAAAAUGCCAGCGGCUUUUUUUUCCUCUUUUUUUCUGUAAUUCUGUAAAAAUGCAGAGAAAGUUGAGUGGUACUUCAGAAUUGAGGGAGAGGGUUACCGCAGAGUAGAAAUAUAUUUCUAGAUUUCAGUUCCACACCACAAAUCCACAACAAUGCCAUUUUUCAACUGUACAAAAAUCUGCUUAUGAACUGGACAUGAUCUUAAUGGUAGUGUCAAAGGCCAAGUUUUUCACCUGUUAAUAUUUUUCCACAUUUGUCCUUGAAUCUGAAUAACUUUAUACAGUACUGUAAAUUUAACUUACAUCGAGUUUGUUGUCAAUUCUUAUGAAAAGAGCUUUCUGCAUGUAACACAUACGGUUAAAGAACACAGCAAAGGACAAAAUUUGCAGGAACAGUUUUGGAACCAACAGAAAAUGUCACCUUUUAUUUGCCAUCUUAUAUAUAUCUAUCAGUUUUACCAGCUACUUCUAAAUUUGUACAUUAUUUGUAAGGGAAAGAAGGAAAACCCUAAGACUUGUCUAACUUAGUGGAGAAUGUGUGUGUUGGGCUUAGGAUGGAUAGCUAAGUCUUAUUGAGCUGUGUUACCUAACUUGUAUAUAAAAAUUGUAAUUAAAAGUUUGGGUUCACCUGUUUCUCACAGUUUAAAAUGAUGAGUAAUUGCAAACUCUGGAAAUGUGACUAGUAUAUGAUUUAAGGCUGUAGAAGCAAGGAAGCUCUUUCAAGUGCUAAAACUAAAGACUUCUAGUUUUUGGCUCAAAUAAGUACUGUUUGUAUACCAGGAUAUGUGAGAUGUAAAUGUAGUAGGUCACUUUUCACCCUUGUAGCUAUAAAAUAAAAAUUUUGUAGAACAGAAAUAGCUUGUACUACUGAAUUAACAAAAGUUAUACUAAAGUAUCAUGUUUAAAAAAAAUAUAUAUAUAUAUACAGAGUUAAGCUUGUUGCUGUUACCCUGUCUGGAUUUGAAAAGUGUGCUGAUUUAUAUAUAUAUAUUACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACACAUACACCUAAAAUGGCCUAAAGCAGACAUCCAUGUAAUUACAGUUGCAAAAUGAAAACAUUUUGGAAAGAACAUUGUAUCAUAGUUCAUUCAUUUGCAGUGGAUCUUUGUUCCUUUUUACUGUGGUAAUUUUAGAAAUGAGUGUCAAGUUUGAAAUUAGAUCUGCUAAGUUGGGGUUUUGCUGCUUGAACUCUGCACUGGGUCCUCAAAUAAACCGAUGUGAAUGUAGUUUUUUCCCCCUGUGUGAAGAAGCAGUUACACCCCAACAAUAGGAGGAAAAAUCUAGAACUAUUUCAAGUUUUAUCUUUUUGUAUAUGAAAAUAAAAUAAUAAUAAAACAA
SEQ ID NO: 9:
AUGUACCGGCAUCGCAAGCCCCCCUACGGUCAUGUGGACAUCCAUGAGGACCCUGGGCCUCCACCACCAUCCCCUCUGGUGGGCCUGAAGCCACUGCAGCUGCUGGAGAUCAAGGCUCGGGGGCGCUUUGGCUGUGUCUGGAAGGCCCAGCUCAUGAAUGACUUUGUAGCUGUCAAGAUCUUCCCACUCCAGGACAAGCAGUCGUGGCAGAGUGAACGGGAGAUCUUCAGCACACCUGGCAUGAAGCACGAGAACCUGCUACAGUUCAUUGCUGCCGAGAAGCGAGGCUCCAACCUCGAAGUAGAGCUGUGGCUCAUCACGGCCUUCCAUGACAAGGGCUCCCUCACGGAUUACCUCAAGGGGAACAUCAUCACAUGGAACGAACUGUGUCAUGUAGCAGAGACGAUGUCACGAGGCCUCUCAUACCUGCAUGAGGAUGUGCCCUGGUGCCGUGGCGAGGGCCACAAGCCGUCUAUUGCCCACAGGGACUUUAAAAGUAAGAAUGUAUUGCUGAAGAGCGACCUCACAGCCGUGCUGGCUGACUUUGGCUUGGCUGUUCGAUUUGAGCCAGGGAAACCUCCAGGGGACACCCACGGACAGGUAGGCACGAGACGGUACAUGGCUCCUGAGGUGCUCGAGGGAGCCAUCAACUUCCAGAGAGAUGCCUUCCUGCGCAUUGACAUGUAUGCCAUGGGGUUGGUGCUGUGGGAGCUUGUGUCUCGCUGCAAGGCUGCAGACGGACCCGUGGAUGAGUACAUGCUGCCCUUUGAGGAAGAGAUUGGCCAGCACCCUUCGUUGGAGGAGCUGCAGGAGGUGGUGGUGCACAAGAAGAUGAGGCCCACCAUUAAAGAUCACUGGUUGAAACACCCGGGCCUGGCCCAGCUUUGUGUGACCAUCGAGGAGUGCUGGGACCAUGAUGCAGAGGCUCGCUUGUCCGCGGGCUGUGUGGAGGAGCGGGUGUCCCUGAUUCGGAGGUCGGUCAACGGCACUACCUCGGACUGUCUCGUUUCCCUGGUGACCUCUGUCACCAAUGUGGACCUGCCCCCUAAAGAGUCAAGCAUCUAA
SEQ ID NO: 10.
ATGACGGCGCCCTGGGTGGCCCTCGCCCTCCTCTGGGGATCGCTGTGCGCCGGCTCTGGGCGTGGGGAGGCTGAGACACGGGAGTGCATCTACTACAACGCCAACTGGGAGCTGGAGCGCACCAACCAGAGCGGCCTGGAGCGCTGCGAAGGCGAGCAGGACAAGCGGCTGCACTGCTACGCCTCCTGGCGCAACAGCTCTGGCACCATCGAGCTCGTGAAGAAGGGCTGCTGGCTAGATGACTTCAACTGCTACGATAGGCAGGAGTGTGTGGCCACTGAGGAGAACCCCCAGGTGTACTTCTGCTGCTGTGAAGGCAACTTCTGCAACGAACGCTTCACTCATTTGCCAGAGGCTGGGGGCCCGGAAGTCACGTACGAGCCACCCCCGACAGCCCCCACCCTGCTCACGGTGCTGGCCTACTCACTGCTGCCCATCGGGGGCCTTTCCCTCATCGTCCTGCTGGCCTTTTGGATGTACCGGCATCGCAAGCCCCCCTACGGTCATGTGGACATCCATGAGGACCCTGGGCCTCCACCACCATCCCCTCTGGTGGGCCTGAAGCCACTGCAGCTGCTGGAGATCAAGGCTCGGGGGCGCTTTGGCTGTGTCTGGAAGGCCCAGCTCATGAATGACTTTGTAGCTGTCAAGATCTTCCCACTCCAGGACAAGCAGTCGTGGCAGAGTGAACGGGAGATCTTCAGCACACCTGGCATGAAGCACGAGAACCTGCTACAGTTCATTGCTGCCGAGAAGCGAGGCTCCAACCTCGAAGTAGAGCTGTGGCTCATCACGGCCTTCCATGACAAGGGCTCCCTCACGGATTACCTCAAGGGGAACATCATCACATGGAACGAACTGTGTCATGTAGCAGAGACGATGTCACGAGGCCTCTCATACCTGCATGAGGATGTGCCCTGGTGCCGTGGCGAGGGCCACAAGCCGTCTATTGCCCACAGGGACTTTAAAAGTAAGAATGTATTGCTGAAGAGCGACCTCACAGCCGTGCTGGCTGACTTTGGCTTGGCTGTTCGATTTGAGCCAGGGAAACCTCCAGGGGACACCCACGGACAGGTAGGCACGAGACGGTACATGGCTCCTGAGGTGCTCGAGGGAGCCATCAACTTCCAGAGAGATGCCTTCCTGCGCATTGACATGTATGCCATGGGGTTGGTGCTGTGGGAGCTTGTGTCTCGCTGCAAGGCTGCAGACGGACCCGTGGATGAGTACATGCTGCCCTTTGAGGAAGAGATTGGCCAGCACCCTTCGTTGGAGGAGCTGCAGGAGGTGGTGGTGCACAAGAAGATGAGGCCCACCATTAAAGATCACTGGTTGAAACACCCGGGCCTGGCCCAGCTTTGTGTGACCATCGAGGAGTGCTGGGACCATGATGCAGAGGCTCGCTTGTCCGCGGGCTGTGTGGAGGAGCGGGTGTCCCTGATTCGGAGGTCGGTCAACGGCACTACCTCGGACTGTCTCGTTTCCCTGGTGACCTCTGTCACCAATGTGGACCTGCCCCCTAAAGAGTCAAGCATCTAA
SEQ ID NO: 11.
Met Thr Ala Pro Trp Val Ala Leu Ala Leu Leu Trp Gly Ser Leu Cys Ala Gly Ser Gly Arg Gly Glu Ala Glu Thr Arg Glu Cys Ile Tyr Tyr Asn Ala Asn Trp Glu Leu Glu Arg Thr Asn Gln Ser Gly Leu Glu Arg Cys Glu Gly Glu Gln Asp Lys Arg Leu His Cys Tyr Ala Ser Trp Arg Asn Ser Ser Gly Thr Ile Glu Leu Val Lys Lys Gly Cys Trp Leu Asp Asp Phe Asn Cys Tyr Asp Arg Gln Glu Cys Val Ala Thr Glu Glu Asn Pro Gln Val Tyr Phe Cys Cys Cys Glu Gly Asn Phe Cys Asn Glu Arg Phe Thr His Leu Pro Glu Ala Gly Gly Pro Glu Val Thr Tyr Glu Pro Pro Pro Thr Ala Pro Thr Leu Leu Thr Val Leu Ala Tyr Ser Leu Leu Pro Ile Gly Gly Leu Ser Leu Ile Val Leu Leu Ala Phe Trp Met Tyr Arg His Arg Lys Pro Pro Tyr Gly His Val Asp Ile His Glu Asp Pro Gly Pro Pro Pro Pro Ser Pro Leu Val Gly Leu Lys Pro Leu Gln Leu Leu Glu Ile Lys Ala Arg Gly Arg Phe Gly Cys Val Trp Lys Ala Gln Leu Met Asn Asp Phe Val Ala Val Lys Ile Phe Pro Leu Gln Asp Lys Gln Ser Trp Gln Ser Glu Arg Glu Ile Phe Ser Thr Pro Gly Met Lys His Glu Asn Leu Leu Gln Phe Ile Ala Ala Glu Lys Arg Gly Ser Asn Leu Glu Val Glu Leu Trp Leu Ile Thr Ala Phe His Asp Lys Gly Ser Leu Thr Asp Tyr Leu Lys Gly Asn Ile Ile Thr Trp Asn Glu Leu Cys His Val Ala Glu Thr Met Ser Arg Gly Leu Ser Tyr Leu His Glu Asp Val Pro Trp Cys Arg Gly Glu Gly His Lys Pro Ser Ile Ala His Arg Asp Phe Lys Ser Lys Asn Val Leu Leu Lys Ser Asp Leu Thr Ala Val Leu Ala Asp Phe Gly Leu Ala Val Arg Phe Glu Pro Gly Lys Pro Pro Gly Asp Thr His Gly Gln Val Gly Thr Arg Arg Tyr Met Ala Pro Glu Val Leu Glu Gly Ala Ile Asn Phe Gln Arg Asp Ala Phe Leu Arg Ile Asp Met Tyr Ala Met Gly Leu Val Leu Trp Glu Leu Val Ser Arg Cys Lys Ala Ala Asp Gly Pro Val Asp Glu Tyr Met Leu Pro Phe Glu Glu Glu Ile Gly Gln His Pro Ser Leu Glu Glu Leu Gln Glu Val Val Val His Lys Lys Met Arg Pro Thr Ile Lys Asp His Trp Leu Lys His Pro Gly Leu Ala Gln Leu Cys Val Thr Ile Glu Glu Cys Trp Asp His Asp Ala Glu Ala Arg Leu Ser Ala Gly Cys Val Glu Glu Arg Val Ser Leu Ile Arg Arg Ser Val Asn Gly Thr Thr Ser Asp Cys Leu Val Ser Leu Val Thr Ser Val Thr Asn Val Asp Leu Pro Pro Lys Glu Ser Ser Ile.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NIPPON SHINYAKU CO., LTD.
<120> ИНГИБИТОР СИГНАЛА МИОСТАТИНА
<130> G2319WO
<150> GB 1821269.6
<151> 2018-12-28
<160> 112
<170> PatentIn version 3.5
<210> 1
<211> 144
<212> РНК
<213> Homo sapiens
<400> 1
gacccugggc cuccaccacc auccccucug gugggccuga agccacugca gcugcuggag 60
aucaaggcuc gggggcgcuu uggcuguguc uggaaggccc agcucaugaa ugacuuugua 120
gcugucaaga ucuucccacu ccag 144
<210> 2
<211> 144
<212> РНК
<213> Homo sapiens
<400> 2
gacaagcagu cguggcagag ugaacgggag aucuucagca caccuggcau gaagcacgag 60
aaccugcuac aguucauugc ugccgagaag cgaggcucca accucgaagu agagcugugg 120
cucaucacgg ccuuccauga caag 144
<210> 3
<211> 149
<212> РНК
<213> Homo sapiens
<400> 3
ggcucccuca cggauuaccu caaggggaac aucaucacau ggaacgaacu gugucaugua 60
gcagagacga ugucacgagg ccucucauac cugcaugagg augugcccug gugccguggc 120
gagggccaca agccgucuau ugcccacag 149
<210> 4
<211> 115
<212> РНК
<213> Homo sapiens
<400> 4
ggacuuuaaa aguaagaaug uauugcugaa gagcgaccuc acagccgugc uggcugacuu 60
uggcuuggcu guucgauuug agccagggaa accuccaggg gacacccacg gacag 115
<210> 5
<211> 139
<212> РНК
<213> Homo sapiens
<400> 5
guaggcacga gacgguacau ggcuccugag gugcucgagg gagccaucaa cuuccagaga 60
gaugccuucc ugcgcauuga cauguaugcc augggguugg ugcuguggga gcuugugucu 120
cgcugcaagg cugcagacg 139
<210> 6
<211> 131
<212> РНК
<213> Homo sapiens
<400> 6
gacccgugga ugaguacaug cugcccuuug aggaagagau uggccagcac ccuucguugg 60
aggagcugca ggagguggug gugcacaaga agaugaggcc caccauuaaa gaucacuggu 120
ugaaacaccc g 131
<210> 7
<211> 195
<212> РНК
<213> Homo sapiens
<400> 7
ggccuggccc agcuuugugu gaccaucgag gagugcuggg accaugaugc agaggcucgc 60
uuguccgcgg gcugugugga ggagcgggug ucccugauuc ggaggucggu caacggcacu 120
accucggacu gucucguuuc ccuggugacc ucugucacca auguggaccu gcccccuaaa 180
gagucaagca ucuaa 195
<210> 8
<211> 11782
<212> РНК
<213> Homo sapiens
<400> 8
ggcucggcuc cguggccgcc gcucaggagc cauuuuggac ucgguucagc uccccucccc 60
cccaccccuc cccccguuca uggccccucc ggacucggcc ccugcgcccg gggcccgggc 120
ccagccccgc cgcgcuaugc cugagucggg cgcgccccgg cccgugcccc gccgccgccc 180
cccggccccc gcgucgcccc ggagcccggg ccgcagccug cgccgcccgc agcggcccug 240
agcccggccc cgccgaccgg cccuuggagc ccgaacgcug cucggggacg aaggcgcagg 300
aagcgcgcag ggaacgagac cgaaggaagg agcgggaagg agagcgcagc cgccgccugg 360
cccugcgcgc cccgggagcg ccgugcggcc cugcccgcgg gcuccgggug ugcgcggggc 420
ggcgccgcgg aacaugacgg cgcccugggu ggcccucgcc cuccucuggg gaucgcugug 480
cgccggcucu gggcgugggg aggcugagac acgggagugc aucuacuaca acgccaacug 540
ggagcuggag cgcaccaacc agagcggccu ggagcgcugc gaaggcgagc aggacaagcg 600
gcugcacugc uacgccuccu ggcgcaacag cucuggcacc aucgagcucg ugaagaaggg 660
cugcuggcua gaugacuuca acugcuacga uaggcaggag uguguggcca cugaggagaa 720
cccccaggug uacuucugcu gcugugaagg caacuucugc aacgaacgcu ucacucauuu 780
gccagaggcu gggggcccgg aagucacgua cgagccaccc ccgacagccc ccacccugcu 840
cacggugcug gccuacucac ugcugcccau cgggggccuu ucccucaucg uccugcuggc 900
cuuuuggaug uaccggcauc gcaagccccc cuacggucau guggacaucc augaggaccc 960
ugggccucca ccaccauccc cucugguggg ccugaagcca cugcagcugc uggagaucaa 1020
ggcucggggg cgcuuuggcu gugucuggaa ggcccagcuc augaaugacu uuguagcugu 1080
caagaucuuc ccacuccagg acaagcaguc guggcagagu gaacgggaga ucuucagcac 1140
accuggcaug aagcacgaga accugcuaca guucauugcu gccgagaagc gaggcuccaa 1200
ccucgaagua gagcuguggc ucaucacggc cuuccaugac aagggcuccc ucacggauua 1260
ccucaagggg aacaucauca cauggaacga acugugucau guagcagaga cgaugucacg 1320
aggccucuca uaccugcaug aggaugugcc cuggugccgu ggcgagggcc acaagccguc 1380
uauugcccac agggacuuua aaaguaagaa uguauugcug aagagcgacc ucacagccgu 1440
gcuggcugac uuuggcuugg cuguucgauu ugagccaggg aaaccuccag gggacaccca 1500
cggacaggua ggcacgagac gguacauggc uccugaggug cucgagggag ccaucaacuu 1560
ccagagagau gccuuccugc gcauugacau guaugccaug ggguuggugc ugugggagcu 1620
ugugucucgc ugcaaggcug cagacggacc cguggaugag uacaugcugc ccuuugagga 1680
agagauuggc cagcacccuu cguuggagga gcugcaggag gugguggugc acaagaagau 1740
gaggcccacc auuaaagauc acugguugaa acacccgggc cuggcccagc uuugugugac 1800
caucgaggag ugcugggacc augaugcaga ggcucgcuug uccgcgggcu guguggagga 1860
gcgggugucc cugauucgga ggucggucaa cggcacuacc ucggacuguc ucguuucccu 1920
ggugaccucu gucaccaaug uggaccugcc cccuaaagag ucaagcaucu aagcccagga 1980
caugaguguc uguccagacu caguggaucu gaagaaaaaa ggaaaaaaag uuguguuuug 2040
uuuuggaaau cccauaaaac caacaaacac auaaaaugca gcugcuauuu uaccuugacu 2100
uuuuauuauu auuauuauaa uuauuauaau uauuauuauu aauauuauuu uuuggauugg 2160
aucaguuuuu accagcauau ugcucuacug uaucacaaac agcggacacg ucagcaggcg 2220
uugaggugcu gagcugugga ugcagaacca gcgccaugcu gaagagccuc agccaccucc 2280
uguccuuugg gauucguuuu ucccgcuuuc ucuuuguuug ucgucucaga aucugugaca 2340
caaagaaacc caucuccugu cuuaggaaac cuaaugcugc aaacucuacc uagaggaacc 2400
uuugaagacu guuacauaag aacauaccuu ccucagaaga ggaguuuccu cugcccucug 2460
cccuucuccc cugccucccu cccuccccuc cuuuuauuuu guuuuaguga gcuuaagaaa 2520
cagcagaugu gucuuucacg gaucuaacgg guguuguccu gaucgagaaa aaaacuggga 2580
ugagaauggu uuggacugga guuggaaggg gaggacggua cuggggguag gguuuggaac 2640
agagcuacac uggacucggg cacauucgga gcagcauccu uuaguaugga ggcuacuucu 2700
cagguaacca ggaauugagg ggaaggaccu uguggaggcc gagcauuaac agcaagagcg 2760
ggguuuggag aaagucugag auugggugca gcccugacuu accugcuggc ccugaccagu 2820
uucuuuucac uaacuuggcc uugggcauag gaugaaacau uuuuucugcc cuaauuuuaa 2880
aacuagguga ggguagaauc aucacagguu aggaauacau ucuucauaag acacgaugcu 2940
guaaauaccc uuaauggacg aaaaguugaa auacuuuugu uuccucuugg agcaguucag 3000
ggaaaugccc acaggggauu guccugcaca gauagggcaa gaggauuucc uggguggagu 3060
cugccaaggc cugccucgcu ggggacccca gaguccugca ccucugguuc cgccccaggu 3120
ggugacauua cuguccccgu ucuguggcuc guggacaaga cuuucuccag accccuuaaa 3180
gugguacaua uucuaaaaaa cuguuuuucu auuaugccau aaccuugcuc uagucaguga 3240
auguuccuaa ugcugcuguu ucaacauuug aauucuuuuu aauuuaugaa acaugcuaaa 3300
uuuuuuuuuu caaacaaaac acacacaucc acauauacac augcuucgcu auguggcuuc 3360
caagguuuaa auuuugaaaa guaaaagaau uaaaacuuca cgaccacaga ucaccucaaa 3420
ccagaaauac cucagaauuu ucuacuuaug uaagguuuau uauauauuuu guuaguugug 3480
uugucuugua guaaguauau uuuaauguaa guuggcuuuu gugacaagga aguuuaaaag 3540
aaauagagaa aaagaaaaaa guuugcaucu ucuagggagu gcuaccauuu uuguuugaua 3600
acgcccccuu guaaauaauu gucaucaacu guagguuggc ugucugggcc aagucugggc 3660
auuuaucagu cuuguuugug aaggcuuuuc cuucugguuu cuuuagauca uuuuauuuaa 3720
aaacagugca ucucuucauc gugaggguag gcaaggcggg ggccgugggg agagguugac 3780
cugggugaga acugaagagg ccgccuccuc uuggguuguu uggagcuuca cauguaauuc 3840
acauguaaca uguaacuuga ucggucagug uucagaauga caaguaaccc cgcuuaaacu 3900
ugguagaagg auggcccuua gaccugaaug gggugauuuu acuugggauu uaacuucuuc 3960
agcaaauuaa cagcaacguu ggaagagauc uguggcgccu cugugaagca caccgugacu 4020
caggccaguc uuuuagugca gcgugucugg gagugaaggg uuuugcccuu gcuggucuug 4080
gaguccacag ugugaggggc acugcacaug ccugggcauc uaccuagugu gcuauguuca 4140
gugucugggg cuuacugccc cgggguccuu uccucugggu guuggggcac agggugcuau 4200
gggaggccca uuugcuuccc ucucggagcu caguuuuugc uucauggguc aaaauguggg 4260
cuggccaagu gguuacagga acaggguuuc gguaagcuau guugucuuuu uuuuuuuuuu 4320
uuuuuuuuuu uuuaaugguu ugauuuugug cugugguauu uuuuuucccu uagaauaauu 4380
uuuaauggca aaacaggccu uacagcaguu gcuuuucuuu accauuuauu ucuuuaagaa 4440
gcuuuaaaau auuuauugaa aagugccaua ucuaauuucu uuagcuuucg ccucaggcag 4500
ugcaggcauc uuuacuuuuc auccucagaa gaaacaaacg acuaacaaau guagcaaauu 4560
uacugcagga auaguuaggu caugauacua ccugaacacu aaaccccagc cucuuuguuu 4620
gguuuuaguu ccucugggug guuuuucuuu ugugugcugg cuugauucuu gugagaaguu 4680
uugaccuggc caagggaggg uugagccaug guucuggugu gggacuuugc ggucaagaca 4740
caguacagac aggucaggcc ugcgugccuu uucucugggu ggccuccccg uuaggcccac 4800
cguacgcuca gccacuauag ugucccugug gggccuugcc aucagauugu gugucaggag 4860
augguaccuu uuuggugugg cuggggagga guguggucca ugccaguucu uugggcuuca 4920
ggccacucuu ccccucaugc ugugguguaa agugcaccca ucagguggua uaucugguuc 4980
ugauggcaag aagaaggugg gggaucuccu uauagggcau gggucuagga gcacagaugg 5040
gccuuuugcc ccggguaaau gcuugucugu uugcugucau guguucuuug aggagugagc 5100
caucucgagc ccugcuuuga auuuacuggg ucauagagcc ucugccugug cucuuuucca 5160
uaaugacuuc augugacaug cacuuuuggu gggcucagau aauugguuuc uuuuuguuuu 5220
ugaccucagg cucuguggca gacuggggaa aauggggccu ggcaucauuu ucccugucaa 5280
ugggaggggc uguuccaugc agggugggag gggaccaagu uagcagagag uagccaagga 5340
uccuugcuuc uuccuuucua gugugcuguc auccaagcag gcuccuggcu guagggaugg 5400
gccuugggga agaaucuucu uugaaagcau cuaugauaac ugagaaguca ucccuaguug 5460
gagaaaucca guaaugagca gaaggaggaa gcaagugagg acagaggcca uuguauuaca 5520
gugucacgca gagggcccuc aaugaugggg cauuggggaa ggcuguagac auagucauca 5580
gaacauccug gccuggcaua agcuggguuu ucuccuggga ccauuggucc ucagcaggag 5640
uucuuugcau gaguugcuca ggggcaaggg cugcaagugg gcugugcuua ggagaaagug 5700
acaccuggca gugagggaag auggugagca uuauuagccu uuguugucca gcauggccuu 5760
cuuguccugu cugcucugga gaggagccug ugggaccagu ccugccuggg gagggcauac 5820
ccacacgugc cagcugauuc ugacucugaa uacaucaugu ccggacuugg ggguguuucu 5880
gcagaaaaag gagguuguuu uucagccuug aacaucuuca ggaggauaga gacucuugcu 5940
cacauauucu uagcaaaggg aagggucucu caucuccagg ccacagagau aguucuucca 6000
uugcccuaag aggcuaggcu aacccucuug acauaacuua gacagcaaag cacuucaucc 6060
uguaguuggg cucugucacc uuucucuuca guuggccaca uucucguuuc cuccauccug 6120
cuaugcuuug ugugcucggg cugugugugg gguuuuuccc ugguggaagg aagcccagcu 6180
guguauugaa uguccuucau guguugugug uggcucagaa agccugucac uuggccccug 6240
ugcucugagc cgugagggug gggagguggc uguuccauua aagugggagu auuggauggc 6300
ccucuugaaa cuagaauuuu gccuuuuuua guaugcagua uaaaguuucc agcaucuauu 6360
gguaacacaa agauuugcug guuuuuaaaa uaauacagua agcauaagua uguaaguuuu 6420
uagaauuggu acuagaaguu ggacagcuag uuauucucga gaacuuuauu ucacuagaaa 6480
aauauacuaa uuggaaagca guuuccagga guuaacucag uuuaauuuuc agucucaguu 6540
auuuuagccu guugaguuuu ugauggcaca ccuuuggaga gauggccacg ccugauuccc 6600
auuucagggg caucagacca uaccuuuuua agaagcuccg ugaaucuagu caucuacccu 6660
ucauccuggg cgaacagcca aaaagagaag gggacaaggu gucuuuuucu ccuucucacu 6720
ggggugacau gaauucuuuu aguuaauggc uguuugcaaa uucuaaacua augaaauacu 6780
uagcagcuaa cauguucaau cuaguaauga ugaguuuaaa ucucaauuga caguaauguu 6840
uuagauaaac aggcccagua auucaguuga ugaacuguau aucuucucag ucuagauuug 6900
uaaauguuua augaauucag gguuauaagc auaguucuuu aaguaagauu ccagauaguu 6960
gauuugcaac cagcagucua ccuaugaaug uaucccaaac cuuuagaaga uuggaaaaga 7020
uuuuugaaau aaugauuuag uuuuguagga aaaacacccc cuugaaaauu aauucgguug 7080
acccaguaac auuuuuuaaa acaauuggug gcuccaaaag gccugccaac aaagaaaagu 7140
ccaaauuauc uagugggaca uuuugaaugu uuuauguuua uuuugggucc acuguaaacu 7200
uugguucaaa aaagaauuug aauuuaaaga auuuaccauu auuuaaauua uuaccaaguu 7260
uuuacauuuu caugauggua uuuuccaggu augaaugaaa caugacuuuu ugauuguggu 7320
acuuccugua uccccuguag ugccaaaacc agugauacuu uauuugcucc uauggcagcu 7380
cauagaggua accgaaguga uuuuuccuca guaauugaaa cacauauucu cuaaaugcca 7440
auguguggug augggcccug cacugccuuc auuucucuag ggcagugucu uuggauuguc 7500
uagggccuag guaauucuga gaacuacugu aaaccaacca cagggcacua aagcaaugua 7560
cacaccacuc uuugugugua uggaaggggu uauauaaacc ugggcuaugc uggacaucua 7620
cagaagagua uuacauucac uugcaaaguu uacauuuuug agcucacagu uaugaaaaau 7680
augacccaca aguuuuucag gcaggugagg augggucuuc uugcaaaugc augaguucug 7740
ucuugagucc ugggaacuuc ucuguugguu gagugugggc ucauucccug acucuccuaa 7800
ucauguuugc gucagaaugu uagcauugua aauaaaagaa uagguuguau aauagauaca 7860
caacacuuga aacuuuacuu uaaaaaaauc gauaguucua cauauauauu uaguuauauc 7920
acuugacaga uuucuucuac acagugugga gauuguuuua uaccacagau uauuuuuaua 7980
aaguuaguga auuugaauga uuuuguaauc agagcuaaug agcuuuaccu uucaagagaa 8040
acguacacug gagcaugagu gguguggaac uuuuacuuag uguuuauaug gauucuugug 8100
auacacuggc agacuggagu caauuugcgg gucuuuuuug gccaaaacuc cacuuguggu 8160
uguguaggac agugauauuc agcucagcuu cuuguggauu gggaggagag agggccugca 8220
auguguuuua cauuggugcu uccuccugag auuucuguug aacaaagggu ucugagguca 8280
aaaauuaguu uguaagccuu ugccauagga cauagucaug ugagaguguu ugggggaaca 8340
gaaauuguau aggggugccu auuggggugg gaugggacuc gaauaagauu cagguacaaa 8400
aacuuugaaa ugagaaucug gugguuugag uaauccacca gacugaauua ucuaagauca 8460
cauuauccag guuggggggc agaauuaccc aguuaaguaa uuguucagaa aaguggggag 8520
gguggcaugu ggaugcagug auccaauuaa auggagagcu gccaggcaca uuuuguccuc 8580
ucuggucagu gagaaugguu ggguuggcuc gcugcuucaa ucuguggaau cagccaggag 8640
cccagugagg aagcucagaa ccccaguaac agcagagcau cuuucagaua gcuccagagu 8700
uuuccugcuu uucugaggaa gcucagcauc acugccacaa uacggaaagu ggucuucauu 8760
uuagccuauu uauuuuuagg cagagagugg augguuauuu gugugggacu uuugguggcg 8820
auauauaaug aauaauuaag uuaauuucug guaugcauaa uggccagucc ugaggcccag 8880
cugaagaccu gucccccaga cccugcccgc uggcuucagg cugcugcuuc uagacagagg 8940
ugcacuggac gggauaguuu uaucaagaga aucccuaaug ugucauuuua aaccagcugu 9000
gcuuuuuauu cauucugguu gagcguauag guuuacacuu uacccuuuuu auacuuggaa 9060
uaaauuuagu uccagcagau cuaguagcac uccagaaacc aaccccaucu guuccccaua 9120
aaaagaacau uuucucugcu cuccagccac gugucuugga auguaauucu guugugccuu 9180
uguuuuuauc acucucuucg ccccaaaagc aacugcugua agcuuuuuuc uacuugucuu 9240
uucuaguccc caaccucuac cuuuuuccuu uuucccagcc cuaauuucug gaugcacuuc 9300
ugugauccag guauuuuaag aaccaguuac cucagaccuc auguugaaca gugucgccau 9360
cuggguccuc uugauacugc agacuuuuaa cguacacaug caggaacccu gcugagcgug 9420
ggcacuuguu uuaaagcaaa acucuuccca aggacugaag aaagggcuuc uggcaagcuc 9480
gucauggcau ugugguggga ugggucuaga gugucaucug aauggugcuu ccuguguucc 9540
ucuuugaauu cugccauuuu caguauucuu gugugucuga auaggcaaag cgauuuaauu 9600
ggcuggucuu gcacgcaaau uaguuccaaa gauaagcucu uuguaacaca uuuccagucg 9660
cuaaugcuca aauguagaac auuccuuuaa auggcaggau aaaaaaccca cuauccacca 9720
uagugcauuu ugggaagaug ucuguagcau auguugcugu gaaauuaggc cuugugggau 9780
auggcuguuu gucauuuuga uguauuuuaa auaaauauau auauuuuuua aagagccuuu 9840
uuuaccaguu caaaaaguuu aauuaaccag cagucaccgc aucugaauuu uugucucugg 9900
ggcauagaug gcagaccaag auuaaaagug guaacucagc uauacgagca ugggcuaccu 9960
uccugggcuc uccugcaguc cuguagaccu gcuguuccgc agaccauggg acacaagguc 10020
aguguguucc cagugagggu cccaagucag ucaucuuaag uguuuguucu cugccccauu 10080
caguggacug uugacuucag ucccugcaag ugcuuuagcc cgaguggggu uuucucagag 10140
cacugccacg aguuaagugu guguuuagcc aaauaauuuc uccguaaggg aaaaaugcag 10200
ucacccaaau uuuaccaaca augacagaga ugagaguaga aaagauuagg caacaucuga 10260
guuuuaacuu gaaaaguguc caagucauca ugaaaggccg acugggagca agugauuauu 10320
agagauucuu caggagaccu caucugaaaa uguuaagacu gccagugagg gaaggaauug 10380
uuaaaaugcc agcggcuuuu uuuuccucuu uuuuucugua auucuguaaa aaugcagaga 10440
aaguugagug guacuucaga auugagggag aggguuaccg cagaguagaa auauauuucu 10500
agauuucagu uccacaccac aaauccacaa caaugccauu uuucaacugu acaaaaaucu 10560
gcuuaugaac uggacaugau cuuaauggua gugucaaagg ccaaguuuuu caccuguuaa 10620
uauuuuucca cauuuguccu ugaaucugaa uaacuuuaua caguacugua aauuuaacuu 10680
acaucgaguu uguugucaau ucuuaugaaa agagcuuucu gcauguaaca cauacgguua 10740
aagaacacag caaaggacaa aauuugcagg aacaguuuug gaaccaacag aaaaugucac 10800
cuuuuauuug ccaucuuaua uauaucuauc aguuuuacca gcuacuucua aauuuguaca 10860
uuauuuguaa gggaaagaag gaaaacccua agacuugucu aacuuagugg agaaugugug 10920
uguugggcuu aggauggaua gcuaagucuu auugagcugu guuaccuaac uuguauauaa 10980
aaauuguaau uaaaaguuug gguucaccug uuucucacag uuuaaaauga ugaguaauug 11040
caaacucugg aaaugugacu aguauaugau uuaaggcugu agaagcaagg aagcucuuuc 11100
aagugcuaaa acuaaagacu ucuaguuuuu ggcucaaaua aguacuguuu guauaccagg 11160
auaugugaga uguaaaugua guaggucacu uuucacccuu guagcuauaa aauaaaaauu 11220
uuguagaaca gaaauagcuu guacuacuga auuaacaaaa guuauacuaa aguaucaugu 11280
uuaaaaaaaa uauauauaua uauacagagu uaagcuuguu gcuguuaccc ugucuggauu 11340
ugaaaagugu gcugauuuau auauauauau uacacacaca cacacacaca cacacacaca 11400
cacacacaca cacacacaca cacacacaca cacacacaca cacauacacc uaaaauggcc 11460
uaaagcagac auccauguaa uuacaguugc aaaaugaaaa cauuuuggaa agaacauugu 11520
aucauaguuc auucauuugc aguggaucuu uguuccuuuu uacuguggua auuuuagaaa 11580
ugagugucaa guuugaaauu agaucugcua aguugggguu uugcugcuug aacucugcac 11640
uggguccuca aauaaaccga ugugaaugua guuuuuuccc ccugugugaa gaagcaguua 11700
caccccaaca auaggaggaa aaaucuagaa cuauuucaag uuuuaucuuu uuguauauga 11760
aaauaaaaua auaauaaaac aa 11782
<210> 9
<211> 1065
<212> РНК
<213> Homo sapiens
<400> 9
auguaccggc aucgcaagcc ccccuacggu cauguggaca uccaugagga cccugggccu 60
ccaccaccau ccccucuggu gggccugaag ccacugcagc ugcuggagau caaggcucgg 120
gggcgcuuug gcugugucug gaaggcccag cucaugaaug acuuuguagc ugucaagauc 180
uucccacucc aggacaagca gucguggcag agugaacggg agaucuucag cacaccuggc 240
augaagcacg agaaccugcu acaguucauu gcugccgaga agcgaggcuc caaccucgaa 300
guagagcugu ggcucaucac ggccuuccau gacaagggcu cccucacgga uuaccucaag 360
gggaacauca ucacauggaa cgaacugugu cauguagcag agacgauguc acgaggccuc 420
ucauaccugc augaggaugu gcccuggugc cguggcgagg gccacaagcc gucuauugcc 480
cacagggacu uuaaaaguaa gaauguauug cugaagagcg accucacagc cgugcuggcu 540
gacuuuggcu uggcuguucg auuugagcca gggaaaccuc caggggacac ccacggacag 600
guaggcacga gacgguacau ggcuccugag gugcucgagg gagccaucaa cuuccagaga 660
gaugccuucc ugcgcauuga cauguaugcc augggguugg ugcuguggga gcuugugucu 720
cgcugcaagg cugcagacgg acccguggau gaguacaugc ugcccuuuga ggaagagauu 780
ggccagcacc cuucguugga ggagcugcag gagguggugg ugcacaagaa gaugaggccc 840
accauuaaag aucacugguu gaaacacccg ggccuggccc agcuuugugu gaccaucgag 900
gagugcuggg accaugaugc agaggcucgc uuguccgcgg gcugugugga ggagcgggug 960
ucccugauuc ggaggucggu caacggcacu accucggacu gucucguuuc ccuggugacc 1020
ucugucacca auguggaccu gcccccuaaa gagucaagca ucuaa 1065
<210> 10
<211> 1539
<212> ДНК
<213> Homo sapiens
<400> 10
atgacggcgc cctgggtggc cctcgccctc ctctggggat cgctgtgcgc cggctctggg 60
cgtggggagg ctgagacacg ggagtgcatc tactacaacg ccaactggga gctggagcgc 120
accaaccaga gcggcctgga gcgctgcgaa ggcgagcagg acaagcggct gcactgctac 180
gcctcctggc gcaacagctc tggcaccatc gagctcgtga agaagggctg ctggctagat 240
gacttcaact gctacgatag gcaggagtgt gtggccactg aggagaaccc ccaggtgtac 300
ttctgctgct gtgaaggcaa cttctgcaac gaacgcttca ctcatttgcc agaggctggg 360
ggcccggaag tcacgtacga gccacccccg acagccccca ccctgctcac ggtgctggcc 420
tactcactgc tgcccatcgg gggcctttcc ctcatcgtcc tgctggcctt ttggatgtac 480
cggcatcgca agccccccta cggtcatgtg gacatccatg aggaccctgg gcctccacca 540
ccatcccctc tggtgggcct gaagccactg cagctgctgg agatcaaggc tcgggggcgc 600
tttggctgtg tctggaaggc ccagctcatg aatgactttg tagctgtcaa gatcttccca 660
ctccaggaca agcagtcgtg gcagagtgaa cgggagatct tcagcacacc tggcatgaag 720
cacgagaacc tgctacagtt cattgctgcc gagaagcgag gctccaacct cgaagtagag 780
ctgtggctca tcacggcctt ccatgacaag ggctccctca cggattacct caaggggaac 840
atcatcacat ggaacgaact gtgtcatgta gcagagacga tgtcacgagg cctctcatac 900
ctgcatgagg atgtgccctg gtgccgtggc gagggccaca agccgtctat tgcccacagg 960
gactttaaaa gtaagaatgt attgctgaag agcgacctca cagccgtgct ggctgacttt 1020
ggcttggctg ttcgatttga gccagggaaa cctccagggg acacccacgg acaggtaggc 1080
acgagacggt acatggctcc tgaggtgctc gagggagcca tcaacttcca gagagatgcc 1140
ttcctgcgca ttgacatgta tgccatgggg ttggtgctgt gggagcttgt gtctcgctgc 1200
aaggctgcag acggacccgt ggatgagtac atgctgccct ttgaggaaga gattggccag 1260
cacccttcgt tggaggagct gcaggaggtg gtggtgcaca agaagatgag gcccaccatt 1320
aaagatcact ggttgaaaca cccgggcctg gcccagcttt gtgtgaccat cgaggagtgc 1380
tgggaccatg atgcagaggc tcgcttgtcc gcgggctgtg tggaggagcg ggtgtccctg 1440
attcggaggt cggtcaacgg cactacctcg gactgtctcg tttccctggt gacctctgtc 1500
accaatgtgg acctgccccc taaagagtca agcatctaa 1539
<210> 11
<211> 512
<212> PRT
<213> Homo sapiens
<400> 11
Met Thr Ala Pro Trp Val Ala Leu Ala Leu Leu Trp Gly Ser Leu Cys
1 5 10 15
Ala Gly Ser Gly Arg Gly Glu Ala Glu Thr Arg Glu Cys Ile Tyr Tyr
20 25 30
Asn Ala Asn Trp Glu Leu Glu Arg Thr Asn Gln Ser Gly Leu Glu Arg
35 40 45
Cys Glu Gly Glu Gln Asp Lys Arg Leu His Cys Tyr Ala Ser Trp Arg
50 55 60
Asn Ser Ser Gly Thr Ile Glu Leu Val Lys Lys Gly Cys Trp Leu Asp
65 70 75 80
Asp Phe Asn Cys Tyr Asp Arg Gln Glu Cys Val Ala Thr Glu Glu Asn
85 90 95
Pro Gln Val Tyr Phe Cys Cys Cys Glu Gly Asn Phe Cys Asn Glu Arg
100 105 110
Phe Thr His Leu Pro Glu Ala Gly Gly Pro Glu Val Thr Tyr Glu Pro
115 120 125
Pro Pro Thr Ala Pro Thr Leu Leu Thr Val Leu Ala Tyr Ser Leu Leu
130 135 140
Pro Ile Gly Gly Leu Ser Leu Ile Val Leu Leu Ala Phe Trp Met Tyr
145 150 155 160
Arg His Arg Lys Pro Pro Tyr Gly His Val Asp Ile His Glu Asp Pro
165 170 175
Gly Pro Pro Pro Pro Ser Pro Leu Val Gly Leu Lys Pro Leu Gln Leu
180 185 190
Leu Glu Ile Lys Ala Arg Gly Arg Phe Gly Cys Val Trp Lys Ala Gln
195 200 205
Leu Met Asn Asp Phe Val Ala Val Lys Ile Phe Pro Leu Gln Asp Lys
210 215 220
Gln Ser Trp Gln Ser Glu Arg Glu Ile Phe Ser Thr Pro Gly Met Lys
225 230 235 240
His Glu Asn Leu Leu Gln Phe Ile Ala Ala Glu Lys Arg Gly Ser Asn
245 250 255
Leu Glu Val Glu Leu Trp Leu Ile Thr Ala Phe His Asp Lys Gly Ser
260 265 270
Leu Thr Asp Tyr Leu Lys Gly Asn Ile Ile Thr Trp Asn Glu Leu Cys
275 280 285
His Val Ala Glu Thr Met Ser Arg Gly Leu Ser Tyr Leu His Glu Asp
290 295 300
Val Pro Trp Cys Arg Gly Glu Gly His Lys Pro Ser Ile Ala His Arg
305 310 315 320
Asp Phe Lys Ser Lys Asn Val Leu Leu Lys Ser Asp Leu Thr Ala Val
325 330 335
Leu Ala Asp Phe Gly Leu Ala Val Arg Phe Glu Pro Gly Lys Pro Pro
340 345 350
Gly Asp Thr His Gly Gln Val Gly Thr Arg Arg Tyr Met Ala Pro Glu
355 360 365
Val Leu Glu Gly Ala Ile Asn Phe Gln Arg Asp Ala Phe Leu Arg Ile
370 375 380
Asp Met Tyr Ala Met Gly Leu Val Leu Trp Glu Leu Val Ser Arg Cys
385 390 395 400
Lys Ala Ala Asp Gly Pro Val Asp Glu Tyr Met Leu Pro Phe Glu Glu
405 410 415
Glu Ile Gly Gln His Pro Ser Leu Glu Glu Leu Gln Glu Val Val Val
420 425 430
His Lys Lys Met Arg Pro Thr Ile Lys Asp His Trp Leu Lys His Pro
435 440 445
Gly Leu Ala Gln Leu Cys Val Thr Ile Glu Glu Cys Trp Asp His Asp
450 455 460
Ala Glu Ala Arg Leu Ser Ala Gly Cys Val Glu Glu Arg Val Ser Leu
465 470 475 480
Ile Arg Arg Ser Val Asn Gly Thr Thr Ser Asp Cys Leu Val Ser Leu
485 490 495
Val Thr Ser Val Thr Asn Val Asp Leu Pro Pro Lys Glu Ser Ser Ile
500 505 510
<210> 12
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 12
cgagccttga tctccagcag ctgc 24
<210> 13
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 13
ccccgagcct tgatctccag cagc 24
<210> 14
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 14
tcatgagctg ggccttccag acac 24
<210> 15
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 15
ggagtgggaa gatcttgaca gcta 24
<210> 16
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 16
ctggagtggg aagatcttga cagc 24
<210> 17
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 17
acctggagtg ggaagatctt gaca 24
<210> 18
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 18
ctcaccttgt catggaaggc cgtg 24
<210> 19
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 19
gatgttcccc ttgaggtaat ccgt 24
<210> 20
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 20
cagttcgttc catgtgatga tgtt 24
<210> 21
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 21
ctacatgaca cagttcgttc catg 24
<210> 22
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 22
tatgagaggc ctcgtgacat cgtc 24
<210> 23
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 23
ctcatgcagg tatgagaggc ctcg 24
<210> 24
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 24
agggcacatc ctcatgcagg tatg 24
<210> 25
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 25
gtgaggtcgc tcttcagcaa taca 24
<210> 26
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 26
ctgtgaggtc gctcttcagc aata 24
<210> 27
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 27
cacggctgtg aggtcgctct tcag 24
<210> 28
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 28
ccaagccaaa gtcagccagc acgg 24
<210> 29
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 29
ggaggtttcc ctggctcaaa tcga 24
<210> 30
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 30
cccctggagg tttccctggc tcaa 24
<210> 31
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 31
cgtgggtgtc ccctggaggt ttcc 24
<210> 32
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 32
cctgtccgtg ggtgtcccct ggag 24
<210> 33
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 33
caatgcgcag gaaggcatct ctct 24
<210> 34
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 34
gcatacatgt caatgcgcag gaag 24
<210> 35
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 35
cagcatgtac tcatccacgg gtcc 24
<210> 36
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 36
cctgcagctc ctccaacgaa gggt 24
<210> 37
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 37
tgctacgata ggcaggagtg 20
<210> 38
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 38
agcaggttct cgtgcttcat 20
<210> 39
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 39
catgtggaca tccatgagga 20
<210> 40
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 40
gagacacaag ctcccacagc 20
<210> 41
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 41
tctattgccc acagggactt 20
<210> 42
<211> 19
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 42
gagcctctgc atcatggtc 19
<210> 43
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 43
gctgaagatc tcccgttcac tctg 24
<210> 44
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 44
tagcaggttc tcgtgcttca tgcc 24
<210> 45
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 45
ccacggcacc agggcacatc ctca 24
<210> 46
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 46
tcagccagca cggctgtgag gtcg 24
<210> 47
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 47
aaagtcagcc agcacggctg tgag 24
<210> 48
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 48
ccagcacggc tgtgaggtcg ctct 24
<210> 49
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 49
gtttccctgg ctcaaatcga acag 24
<210> 50
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 50
cgctcttcag caatacattc ttac 24
<210> 51
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 51
aggtcgctct tcagcaatac attc 24
<210> 52
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 52
agccaaagtc agccagcacg gctg 24
<210> 53
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 53
cggctgtgag gtcgctcttc agca 24
<210> 54
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 54
gccaagccaa agtcagccag cacg 24
<210> 55
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 55
tcgaacagcc aagccaaagt cagc 24
<210> 56
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 56
gtgtcccctg gaggtttccc tggc 24
<210> 57
<211> 23
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 57
caagccaaag tcagccagca cgg 23
<210> 58
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 58
gttacctgtc cgtgggtgtc ccct 24
<210> 59
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 59
ggctcaaatc gaacagccaa gcca 24
<210> 60
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 60
tccgtgggtg tcccctggag gttt 24
<210> 61
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 61
ggtcgctctt cagcaataca ttct 24
<210> 62
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 62
attcttactt ttaaagtccc tgtg 24
<210> 63
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 63
tacattctta cttttaaagt ccct 24
<210> 64
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 64
tgaggtcgct cttcagcaat acat 24
<210> 65
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 65
gtcgctcttc agcaatacat tctt 24
<210> 66
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 66
gctgtgaggt cgctcttcag caat 24
<210> 67
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 67
ggctgtgagg tcgctcttca gcaa 24
<210> 68
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 68
tcgctcttca gcaatacatt ctta 24
<210> 69
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 69
tgtgaggtcg ctcttcagca atac 24
<210> 70
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 70
gaggtcgctc ttcagcaata catt 24
<210> 71
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 71
cagcugcagu ggcuucaggc ccac 24
<210> 72
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 72
ugaucuccag cagcugcagu ggcu 24
<210> 73
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 73
ccccgagccu ugaucuccag cagc 24
<210> 74
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 74
gucauucaug agcugggccu ucca 24
<210> 75
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 75
cagcuacaaa gucauucaug agcu 24
<210> 76
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 76
aagaucuuga cagcuacaaa guca 24
<210> 77
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 77
cuggaguggg aagaucuuga cagc 24
<210> 78
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 78
aacuguagca gguucucgug cuuc 24
<210> 79
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 79
cuugagguaa uccgugaggg agcc 24
<210> 80
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 80
gauguucccc uugagguaau ccgu 24
<210> 81
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 81
ccaugugaug auguuccccu ugag 24
<210> 82
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 82
caguucguuc caugugauga uguu 24
<210> 83
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 83
uacaugacac aguucguucc augu 24
<210> 84
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 84
cgucucugcu acaugacaca guuc 24
<210> 85
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 85
cucgugacau cgucucugcu acau 24
<210> 86
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 86
uaugagaggc cucgugacau cguc 24
<210> 87
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 87
cucaugcagg uaugagaggc cucg 24
<210> 88
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 88
agggcacauc cucaugcagg uaug 24
<210> 89
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 89
ccacggcacc agggcacauc cuca 24
<210> 90
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 90
gugaggucgc ucuucagcaa uaca 24
<210> 91
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 91
agcacggcug ugaggucgcu cuuc 24
<210> 92
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 92
aagucagcca gcacggcugu gagg 24
<210> 93
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 93
gccaagccaa agucagccag cacg 24
<210> 94
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 94
aaucgaacag ccaagccaaa guca 24
<210> 95
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 95
ccuggcucaa aucgaacagc caag 24
<210> 96
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 96
ggagguuucc cuggcucaaa ucga 24
<210> 97
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 97
guguccccug gagguuuccc uggc 24
<210> 98
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 98
cuguccgugg guguccccug gagg 24
<210> 99
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 99
agccauguac cgucucgugc cuac 24
<210> 100
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 100
caccucagga gccauguacc gucu 24
<210> 101
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 101
ucucuggaag uugauggcuc ccuc 24
<210> 102
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 102
gaaggcaucu cucuggaagu ugau 24
<210> 103
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 103
caaugcgcag gaaggcaucu cucu 24
<210> 104
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 104
gcauacaugu caaugcgcag gaag 24
<210> 105
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 105
cccacagcac caaccccaug gcau 24
<210> 106
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 106
gacacaagcu cccacagcac caac 24
<210> 107
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 107
cuugcagcga gacacaagcu ccca 24
<210> 108
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 108
cgucugcagc cuugcagcga gaca 24
<210> 109
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 109
gcagcaugua cucauccacg gguc 24
<210> 110
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 110
uccaacgaag ggugcuggcc aauc 24
<210> 111
<211> 24
<212> РНК
<213> Искусственная
<220>
<223> Синтетическая нуклеиновая кислота
<400> 111
cugcagcucc uccaacgaag ggug 24
<210> 112
<211> 14
<212> PRT
<213> Искусственная
<220>
<223> Синтетический белок
<400> 112
Lys Lys Arg Thr Leu Arg Lys Asn Asp Arg Lys Lys Arg Cys
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИСМЫСЛОВЫЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2015 |
|
RU2825834C2 |
| СОЕДИНЕНИЕ ДЛЯ МОДУЛЯЦИИ ЭКСПРЕССИИ ГЕНА C9ORF72 И ЕГО ПРИМЕНЕНИЕ | 2013 |
|
RU2730677C2 |
| МОЛЕКУЛЫ НУКЛЕИНОВЫХ КИСЛОТ ДЛЯ УМЕНЬШЕНИЯ УРОВНЯ мРНК PAPD5 ИЛИ PAPD7 ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННОГО ГЕПАТИТА В | 2017 |
|
RU2768699C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ СНИЖЕНИЯ ЭКСПРЕССИИ TAU | 2016 |
|
RU2777570C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ СНИЖЕНИЯ ЭКСПРЕССИИ TAU | 2016 |
|
RU2747734C2 |
| Вирус-кодируемые регулируемые агенты, связывающие T-клетки (CATVERT) или NK-клетки (CATVERN), нацеленные на рак | 2020 |
|
RU2827779C2 |
| МОДУЛЯТОРЫ И МОДУЛЯЦИЯ РНК РЕЦЕПТОРА КОНЕЧНЫХ ПРОДУКТОВ ГЛУБОКОГО ГЛИКИРОВАНИЯ | 2020 |
|
RU2820247C2 |
| АНТИСМЫСЛОВАЯ НУКЛЕИНОВАЯ КИСЛОТА | 2016 |
|
RU2724554C2 |
| МОДУЛЯТОРЫ ЭКСПРЕССИИ ГЕНА ОТКРЫТОЙ РАМКИ СЧИТЫВАНИЯ 72 ХРОМОСОМЫ 9 И ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2828216C2 |
| ВАРИАНТЫ HSD17B13 И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2760851C2 |
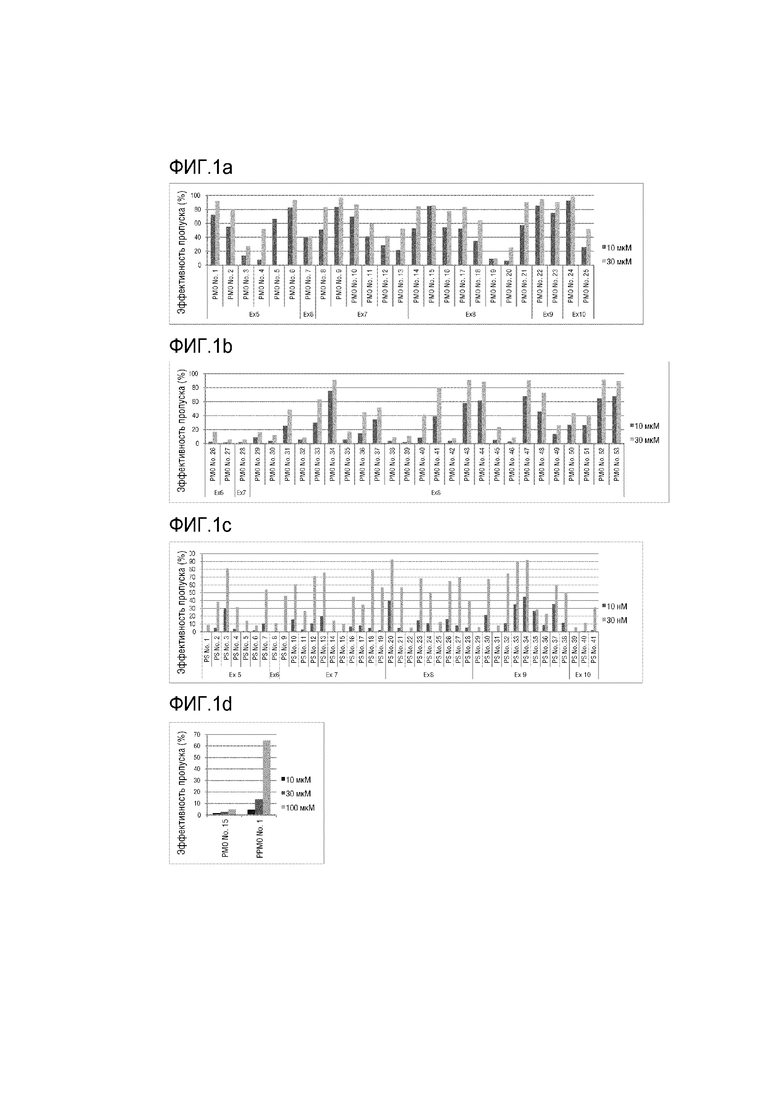

Изобретение относится к области биотехнологии. Описана группа изобретений, включающая соединение, которое способствует продуцированию в клетке-мишени мРНК мутантного рецептора активина типа 2В (ACVR2B), или его фармацевтически приемлемую соль или гидрат (варианты), фармацевтическую композицию для применения при профилактике или лечении амиотрофического заболевания, мышечной дистрофии или саркопении, способ лечения амиотрофического заболевания, мышечной дистрофии или саркопении и применение соединения или его фармацевтически приемлемой соли или гидрата в целях приготовления лекарственного средства для профилактики или лечения амиотрофического заболевания, мышечной дистрофии или саркопении. Изобретение расширяет арсенал средств, способствующих продуцированию в клетке-мишени мРНК мутантного рецептора активина типа 2В (ACVR2B). 6 н. и 23 з.п. ф-лы, 3 ил., 8 табл., 5 пр.
1. Соединение, которое способствует продуцированию в клетке-мишени мРНК мутантного рецептора активина типа 2B (ACVR2B), где часть последовательности, которая кодирует часть или всю внутриклеточную область ACVR2B дикого типа, отсутствует, или его фармацевтически приемлемая соль или гидрат, где соединение содержит или состоит из нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 12-36 и 43-111.
2. Соединение или его фармацевтически приемлемая соль или гидрат по п. 1, где указанная внутриклеточная область ACVR2B дикого типа кодируется экзонами 5-11 ACVR2B дикого типа.
3. Соединение или его фармацевтически приемлемая соль или гидрат по п. 1 или 2, которые способствуют продуцированию в клетке-мишени усеченного белка ACVR2B, где отсутствует часть внутриклеточной области ACVR2B дикого типа.
4. Соединение или его фармацевтически приемлемая соль или гидрат по п. 3, где в усеченном белке ACVR2B отсутствует вся или часть внутриклеточной области, кодируемой по меньшей мере одним экзоном, выбранным из группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B.
5. Соединение или его фармацевтически приемлемая соль или гидрат по любому из пп. 1-3, которое представляет собой антисмысловой олигомер, способный индуцировать пропуск экзона, кодирующего часть внутриклеточной области ACVR2B, или его фармацевтически приемлемая соль или гидрат.
6. Соединение или его фармацевтически приемлемая соль или гидрат по п. 5, где указанный экзон, который необходимо удалить, выбран из группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B.
7. Соединение или его фармацевтически приемлемая соль или гидрат по 5 или 6, которое включает 10-50 нуклеооснований, или его фармацевтически приемлемая соль или гидрат.
8. Соединение или его фармацевтически приемлемая соль или гидрат по любому из пп. 5-7, содержащее последовательность, комплементарную 10-50 последовательно расположенным нуклеотидам экзона, выбранного из группы, состоящей из экзонов 5, 6, 7, 8, 9 и 10 ACVR2B, или его фармацевтически приемлемая соль или гидрат.
9. Соединение или его фармацевтически приемлемая соль или гидрат по любому из пп. 5-8, где экзон содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-6.
10. Соединение или его фармацевтически приемлемая соль или гидрат по любому из пп. 5-9, где антисмысловой олигомер представляет собой олигонуклеотид.
11. Соединение или его фармацевтически приемлемая соль или гидрат по п. 10, где по меньшей мере одна сахарная группа и/или по меньшей мере одна группа фосфатной связи в олигонуклеотиде является модифицированной.
12. Соединение или его фармацевтически приемлемая соль или гидрат по п. 11, где модифицированная сахарная группа представляет собой рибозу, в которой -ОН-группа в 2'-положении замещена любой группой, выбранной из группы, состоящей из OR, R, R'OR, SH, SR, NH2, NHR, NR2, N3, CN, F, Cl, Br и I, где R представляет собой алкил или арил, а R' представляет собой алкилен.
13. Соединение или его фармацевтически приемлемая соль или гидрат по п. 11 или 12, где модифицированная группа фосфатной связи выбрана из группы, состоящей из фосфортиоатной связи, фосфордитиоатной связи, алкилфосфонатной связи, фосфорамидатной связи и боранофосфатной связи.
14. Соединение или его фармацевтически приемлемая соль или гидрат по любому из пп. 5-9, где антисмысловой олигомер содержит по меньшей мере одно морфолино-кольцо.
15. Соединение по п. 14, которое представляет собой морфолино-олигомер или фосфордиамидатный морфолино-олигомер, или его фармацевтически приемлемая соль или гидрат.
16. Соединение по п. 14 или 15, имеющее любую из групп, представленных химическими формулами (1)-(3), показанными ниже, на своем 5'-конце, или его фармацевтически приемлемая соль или гидрат
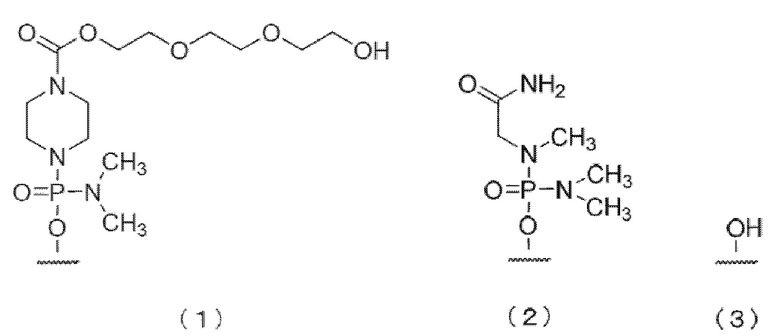 .
.
17. Соединение, которое способствует продуцированию в клетке-мишени мРНК мутантного рецептора активина типа 2B (ACVR2B), где часть последовательности, которая кодирует часть или всю внутриклеточную область ACVR2B дикого типа, отсутствует, где указанное соединение представляет собой конъюгат, в котором пептид, проникающий в клетку, связан с соединением по любому из пп. 1-16, или его фармацевтически приемлемая соль или гидрат.
18. Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемая соль или гидрат по любому из пп. 1-17, для применения при профилактике или лечении амиотрофического заболевания, мышечной дистрофии или саркопении у индивидуума.
19. Фармацевтическая композиция по п. 18, которая дополнительно содержит по меньшей мере один фармацевтически приемлемый носитель или добавку.
20. Фармацевтическая композиция по п. 18 или 19, которая является лиофилизованной.
21. Соединение или его фармацевтически приемлемая соль или гидрат по любому из пп. 1-17 для их применения при профилактике или лечении амиотрофического заболевания, мышечной дистрофии или саркопении у индивидуума.
22. Соединение или его фармацевтически приемлемая соль или гидрат или фармацевтическая композиция для применения по п. 21, где амиотрофическое заболевание представляет собой мышечную дистрофию Дюшенна.
23. Соединение или его фармацевтически приемлемая соль или гидрат или фармацевтическая композиция для применения по любому из пп. 21, 22, где индивидуумом является человек.
24. Способ лечения амиотрофического заболевания, мышечной дистрофии или саркопении у индивидуума, включающий введение указанному индивидууму терапевтически эффективного количества соединения или его фармацевтически приемлемой соли или гидрата по любому из пп. 1-17 или фармацевтической композиции по любому из пп. 18-20.
25. Способ по п. 24, где амиотрофическое заболевание представляет собой мышечную дистрофию Дюшенна.
26. Способ по п. 24 или 25, где индивидуумом является человек.
27. Применение соединения или его фармацевтически приемлемой соли или гидрата по любому из пп. 1-17 в целях приготовления лекарственного средства для профилактики или лечения амиотрофического заболевания, мыщечной дистрофии или саркопении у индивидуума.
28. Применение по п. 27, где амиотрофическое заболевание представляет собой мышечную дистрофию Дюшенна.
29. Применение по п. 27 или 28, где индивидуумом является человек.
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Formicola L | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Frontiers in physiology, 2018, 9, р | |||
| Открытка или конверт | 1925 |
|
SU515A1 |
| Lawlor M | |||
| W | |||
| et al | |||
| Inhibition of activin receptor type IIB increases strength and lifespan in | |||
Авторы
Даты
2024-06-04—Публикация
2019-12-26—Подача