Настоящее изобретение относится к области генетических и приобретенных заболеваний. В частности, настоящее изобретение относится к изменению мРНК-процессинга специфической пре-мРНК для удаления сайта протеолитического расщепления, мутации HCHWA-D или аминокислот, кодируемых увеличенным количеством тринуклеотидных повторов, из белка, кодируемого указанной пре-мРНК.
Протеолитический процессинг представляет собой основную форму посттрансляционной модификации, происходящей при расщеплении протеазой одной или большего числа связей в целевом белке для изменения его активности. Указанный процессинг может приводить к активации, ингибированию, изменению или устранению активности белка. Многие клеточные процессы контролируются посредством протеолитического процессинга. Атакующая протеаза может удалять пептидный сегмент на любом конце целевого белка, но также может расщеплять и внутренние связи в белке, что приводит к значительным изменениям функции и структуры указанного белка.
Протеолитический процессинг представляет собой высокоспецифический процесс. Механизм протеолитического процессинга варьирует в зависимости от процессируемого белка, локализации указанного белка и от протеазы.
Протеолитический процессинг может выполнять различные функции. Например, протеолиз белков-предшественников регулирует многие клеточные процессы, в том числе экспрессию генов, эмбриогенез, клеточный цикл, запрограммированную клеточную гибель, нацеливание на внутриклеточные белки и эндокринные и связанные с нервной системой функции. Во всех указанных процессах необходимо протеолитическое расщепление белков-предшественников. Протеолиз обычно осуществляют сериновые протеазы при прохождении путей секреции. Указанные протеазы представляют собой кальцийзависимые сериновые эндопротеазы, родственные дрожжевым и субтилизиновым протеазам, и, соответственно, называемые субтилизиноподобными пропротеин-конвертазами (СПК, SPC), или ПК (PC). Были идентифицированы и описаны семь представителей указанного семейства; у млекопитающих каждый из них содержит консервативные сигнальные пептиды, про-области, каталитические и P-домены, но C-концевые домены у этих белков отличаются. Автокаталитическое расщепление N-концевого пропептида активирует указанные протеазы, что необходимо для фолдинга (укладки) и обеспечения активности, а также для высвобождения продомена. Другими примерами функции, связанной с протеолитическим процессингом, являются каскады свертывания крови, металлоэндопептидазы, секретазы и каспазы. Дополнительными примерами являются вирусные протеазы, которые специфическим образом процессируют вирусные полипротеины.
Различные стратегии ингибирования различных протеаз известны в данной области техники. Например, в настоящее время разрабатывают ингибиторы гамма-секретазы для лечения T-клеточного острого лимфобластного лейкоза (Nature Medicine 2009:15, 50-58). Разрабатывают ингибиторы каспаз для ряда других применений (The Journal of Biological Chemistry 1998: 273, 32608-32613), например, для лечения сепсиса (Nature Immunology 2000: 1, 496-501).
Проблема с применением ингибиторов протеаз заключается в том, что указанные белки, как правило, имеют ряд мишеней в организме человека и таким образом связаны с рядом эффектов. Ингибирование протеазы в организме человека в результате воздействия ингибитора протеазы, соответственно, ингибирует не только нужный эффект, но, как правило, также приводит к ряду других эффектов, которые могут влиять или не влиять на возможность применения указанного ингибитора протеазы при определенном заболевании. Другая связанная с ингибиторами протеаз проблема заключается в том, что ингибитор, который в достаточной степени специфичен в отношении целевой протеазы, не всегда просто получить, и, соответственно, он может также ингибировать другие протеазы.
В настоящем изобретении
предложен альтернативный подход к изменению протеолитического процессинга целевых белков. Вместо разработки ингибиторов протеаз модифицируют собственно целевой белок. В данной области техники известны модификации сайта расщепления протеазами в целевом белке. Это, как правило, осуществляют путем введения точечных мутаций в кодирующую область белка. Указанные мутации, как правило, нарушают последовательность, которую распознает протеаза. Модификации указанных типов обычно вводят в кДНК-копию гена, и указанную измененную копию встраивают в ДНК клеток с применением технологии рекомбинантной ДНК. Хотя это может быть осуществлено в лаборатории, такие стратегии трудно реализовать в клинических условиях, хотя бы по причине того, что варианты применения генной терапии, основанные на введении полноразмерного гена в настоящее время не очень эффективны, и исходный связанный с проблемой ген не устраняется.
В настоящем изобретении предложен способ удаления сайта протеолитического расщепления из белка, включающий обеспечение клетки, которая экспрессирует пре-мРНК, кодирующую указанный белок с антисмысловым олигонуклеотидом (АОН), индуцирующим пропуск экзонной последовательности, которая кодирует указанный сайт протеолитического расщепления, или частичное удаление указанного сайта протеолитического расщепления, устранение его активности; при этом указанный способ дополнительно включает обеспечение трансляции мРНК, полученной из указанной пре-мРНК.
В настоящем изобретении также предложены способы удаления экзонов, содержащих увеличенное число тринуклеотидных повторов. Такое увеличенное число может приводить к ряду состояний, в том числе синдрому ломкой X-хромосомы, FRAXE-синдрому, атаксии Фридрейха, миотонической дистрофии, спинально-церебеллярной атаксии (SCA; СЦА) 8 типа, спинобульбарной мышечной атрофии (SBMA, также известной как болезнь Кеннеди), болезни Хантингтона (HD; БГ), дентаторубро-паллидолюисовой атрофии (DRPLA; ДРПЛА) и SCA 1, 2, 3, 6, 7, 12 и 17 типов (см. таблицы 1а и 1b). Предпочтительно, увеличение числа тринуклеотидных повторов представляет собой увеличение числа повторов CAG, т.е. увеличение количества полиглутамина.
Заболевания, связанные с полиглутамином (поли-Q), (полиглутаминовые заболевания) представляют собой группу аутосомно-доминантных нейродегенеративных расстройств, вызываемых увеличением числа триплетных повторов СAG в кодирующих областях белка в геноме. Указанный повтор СAG транслируется с образованием глутаминового удлинения в мутантном белке, что приводит к приобретению токсичности, индуцирующей потерю нейронов в различных областях головного мозга. Отличительным признаком всех поли-Q расстройств является образование больших нерастворимых белковых агрегатов, содержащих связанный с заболеванием удлиненный белок. Примеры поли-Q расстройств приведены в таблице 1а.
Наиболее распространенное поли-Q расстройство, болезнь Хантингтона (HD), вызвано увеличением числа повторов СAG в первом экзоне гена НТТ на хромосоме 4р16. Транскрипт с увеличением числа СAG транслируется в мутантный белок гентингтин (htt) с отрезком, содержащим поли-Q-тракт (поли-Q-удлинение) на N-конце. У носителей 39 или более CAG-повторов развивается HD, тогда как у людей с 35-38 повторами наблюдается пониженная пенетрантность.
Спинально-церебеллярная атаксия 3 типа (SCA-3), также известная как болезнь Мачадо-Джозефа (MJD), представляет собой другое расстройство, связанное с полиглутамином (поли-Q). При SCA-3 повтор CAG расположен в предпоследнем экзоне гена ATXN3 на хромосоме 14q32.1. У здоровых индивидуумов число CAG-повторов варьирует от 10 до 51, тогда как у пациентов с SCA-3 увеличенное число повторов составляет 55 или более. У трансгенных мышей, экспрессирующих либо кДНК-фрагмент мутантного атаксина-3, либо мутантную полноразмерную геномную последовательность, наблюдался явно выраженный атаксический фенотип, более тяжелый у животных-носителей более длинных повторов, что указывает на взаимосвязь между длиной СAG-повтора и тяжестью заболевания. Ген ATXN3 кодирует белок атаксин-3 массой 45 кДа, действующий как изопептидаза, и предположительно вовлеченый в деубиквитинирование и протеасомную деградацию белков 8-10. Белок атаксин-3 содержит N-концевой домен Josephin, проявляющий убиквитинпротеазную активность, и C-концевой хвост с 2 или 3 мотивами, взаимодействующими с убиквитином (UIM), в зависимости от изоформы.
Была продемонстрирована успешная аллельспецифическая редукция транскрипта мутантного атаксина-3 с применением лентивирусных кшРНК (shRNA), направленных против однонуклеотидного полиморфизма (SNP) в гене ATXN3 in vitro и in vivo. Однако указанный способ ограничен применением у пациентов с SCA-3, несущими гетерозиготный SNP в гене ATXN3. В настоящем изобретении предложен новый способ снижения токсичности белка атаксина-3 путем модификации белка. Применение антисмысловых олигонуклеотидов (АОН) позволяет маскировать последовательности пре-мРНК для механизмов сплайсинга, что приводит к частичному или полному исключению целевого экзона. В том случае, если рамка считывания остается интактной, последующая трансляция приводит к получению внутренне усеченного белка. Таким образом обеспечивается значительное преимущество, заключающееся в удалении содержащей поли-Q части белка при сохранении общих уровней белка атаксина-3. Указанную стратегию можно также применять для удаления тринуклеотидных повторов в других белках.
Осуществляли также попытки ингибирования патогенного эффекта тринуклеотидных повторов, направленные на стерическое блокирование антисмысловыми олигонуклеотидами. Например, при DM1 тринуклеотидный повтор в РНК секвестирует белок MBNL1 с получением фенотипа с утратой функции MBNL1. Низкомолекулярные соединения, а также антисмысловые олигонуклеотиды использовали для связывания тринуклеотидного повтора с целью ингибирования связывания MBNL1. Описанное в настоящем документе изобретение относится к олигонуклеотидам и способам обеспечения частичного или полного пропуска экзонов. Этот механизм полностью отличен от используемого при стерическом блокировании антисмысловыми олигонуклеотидами.
В настоящем изобретении предложены способы лечения связанных с увеличением числа тринуклеотидных повторов расстройств и удаления тринуклеотидных повторов из пре-мРНК, как in vivo, так и in vitro. Согласно некоторым вариантам реализации предложены способы лечения у индивидуума заболевания, связанного с мутантным геном, содержащим увеличенное число тринуклеотидных повторов относительно гена здорового индивидуума. Такие заболевания перечислены, например, в таблицах 1а и 1b. Указанные способы включают обеспечение нуждающемуся в этом индивидууму терапевтически эффективного количества по меньшей мере одного антисмыслового олигонуклеотида, который индуцирует пропуск одного или большего числа экзонных последовательностей, которые содержат аминокислоты, кодируемые увеличенным количеством тринуклеотидных повторов. Лечение может включать введение антисмысловых олигонуклеотидов или введение клеток, содержащих указанные олигонуклеотиды.
Тринуклеотидный повтор в настоящем документе составляет по меньшей мере 3, предпочтительно по меньшей мере 4 повторяющихся тринуклеотида. Экспансия тринуклеотидных повторов относится к увеличению числа тринуклеотидных повторов по сравнению со здоровым индивидуумом. Увеличение числа повторов (экспансия), которое требуется для развития патологии, отличается в зависимости от белка (см., например, таблицы 1а и 1b).
Описанные в настоящем документе способы и композиции подходят для удаления увеличенного числа тринуклеотидных повторов. Удаление увеличенного числа повторов является результатом пропуска экзонной последовательности, которая содержит указанное увеличенное число тринуклеотидных повторов. Пропуск указанной экзонной последовательности может достигаться посредством полного удаления экзона. Как вариант, экзон может быть частично пропущен. Это может происходить, например, при использовании альтернативного сайта сплайсинга или скрытого сайта сплайсинга. Так, в приведенных в настоящем описании примерах описан частичный пропуск экзона 9 в ATXN3.
Независимо от того, представляют пропущенные экзонные последовательности экзон полностью или частично, увеличенное число тринуклеотидных повторов полностью пропущено, т.е. пропущенные экзонные последовательности содержат увеличенное число тринуклеотидных повторов в полном размере.
Специалисту понятно, что в случае присутствия аллели дикого типа, где отсутствует увеличенное число тринуклеотидных повторов, пропуск экзонов приведет к удалению тринуклеотидного повтора дикого типа. В настоящем документе «удаление увеличенного числа тринуклеотидных повторов» относится к пропускам экзонной последовательности, которая содержит тринуклеотидный повтор в полном размере (в случае формы дикого типа) или увеличенное количество тринуклеотидных повторов в полном размере (в случае мутантной формы).
Предпочтительно, экзон, содержащий увеличенное число тринуклеотидных повторов, не содержит сайта протеолитического расщепления. В случае гена ATXN3 предпочтительно, чтобы при удалении тринуклеотидных повторов внутри рамки, экзоны 9 и 10 были частично или полностью пропущены. В настоящем изобретении также предложена совокупность олигонуклеотидов, содержащая первый олигонуклеотид, который индуцирует пропуск экзонных последовательностей экзона 9, и второй олигонуклеотид, который индуцирует пропуск экзонных последовательностей экзона 10.
В случае гена ATN1 СAG-повтор расположен в экзоне 5. При удалении внутри рамки считывания последовательности из экзона 6 также должны быть удалены. Предпочтительно, чтобы были пропущены экзонная последовательность из экзона 5 и экзонная последовательность из экзона 6.
В случае гена ATXN1 предпочтительно, чтобы экзонная последовательность из экзона 8 была пропущена.
В случае гена CACNA1A предпочтительно, чтобы экзонная последовательность из экзона 47 была пропущена.
В случае гена ATXN7 предпочтительно, чтобы экзонная последовательность из экзона 3 была пропущена.
В случае гена ТВР СAG-повтор расположен в экзоне 3, и при удалении внутри рамки считывания последовательности из экзона 4 также должны быть пропущены. Предпочтительно, чтобы были пропущены экзонная последовательность из экзона 3 и экзонная последовательность из экзона 4.
В настоящем изобретении также предложены способы и соединения, подходящие для лечения болезни Альцгеймера (AD). AD характеризуется отложением амилоида во внеклеточных бляшках и внутриклеточных нейрофибриллярных клубках в головном мозге. Амилоидные бляшки состоят в основном из амилоидных пептидов, получаемых из белка-предшественника амилоида (БПА, или АРР) в результате ряда этапов протеолитического расщепления. Было идентифицировано несколько форм альтернативного сплайсинга АРР, наиболее многочисленными из которых являются белки длиной 695, 751 и 770 аминокислот. Указанные белки в настоящем документе называются АРР695, АРР751 и АРР770.
Бета-пептиды синтезируются из АРР за счет последовательного действия двух протеолитических ферментов, называемых бета- и гамма-секретазами. Расщепление бета-секретазой происходит сначала во внеклеточном домене АРР непосредственно за трансмембранным доменом с образованием С-концевого фрагмента АРР, содержащего трансмембранный домен и цитоплазматический домен. Цитоплазматический домен является субстратом гамма-секретазы, расщепляющей его в нескольких соседних положениях в пределах трансмембранного домена с образованием А-бета пептидов и цитоплазматического фрагмента. Различные варианты протеолитического расщепления, опосредованные гамма-секретазой, приводят к образованию пептидов А-бета с разной длиной цепи. А-бета-42 считается более патогенным амилоидным пептидом ввиду выраженной тенденции к образованию нейротоксических агрегатов.
Согласно предпочтительным вариантам реализации предложены способы удаления сайта протеолитического расщепления из АРР, включающие получение клетки, которая экспрессирует пре-мРНК, кодирующую АРР с антисмысловым олигонуклеотидом, который индуцирует пропуск экзонной последовательности, кодирующей указанный сайт протеолитического расщепления; при этом указанный способ также предусматривает возможность трансляции мРНК, полученной из указанной пре-мРНК. Предпочтительно, пропущена экзонная последовательность, соответствующая экзону 16 АРР751. Предпочтительные олигонуклеотиды представлены в таблице 3.
В настоящем изобретении также предложен олигонуклеотид, длина которого составляет 14-40 нуклеотидов, содержащий последовательность АОН или ее производное, представленную в таблице 2 или таблице 3, для пропуска экзона в пре-мРНК, синтезируемой соответствующим геном из таблицы 2 или таблицы 3.
В настоящем изобретении также предложен олигонуклеотид, длина которого составляет 14-40 нуклеотидов, специфический в отношении целевой последовательности, представленной в таблице 3, для пропуска экзона в пре-мРНК, синтезируемой соответствующим геном, идентифицированным в таблице 3.
Предпочтительно, в настоящем изобретении предложены способы лечения болезни Альцгеймера, включающие введение нуждающемуся в этом индивидууму эффективного количества антисмыслового олигонуклеотида, который индуцирует пропуск экзонной последовательности АРР, кодирующей сайт протеолитического расщепления, согласно описанию в настоящем документе.
Мутации АРР также вовлечены в наследственную церебральную геморрагию с амилоидозом голландского типа (HCHWA-D). HCHWA-D представляет собой аутосомно-доминантное состояние, вызываемое одиночной мутацией пары нуклеотидов в гене АРР, приводящей к замене одной аминокислоты в АРР (глутамин вместо глутаминовой кислоты) (Levy et al. Science 1990 248:1124-6, соответствующей А-бета E22Q (см. фиг. 19).
При HCHWA-D происходит прогрессирующее накопление амилоидного белка в стенках церебральных кровеносных сосудов с последующими дегенеративными изменениями сосудов, которые обычно проводят к спонтанным церебральным кровоизлияниям, ишемическим повреждениям и прогрессирующей деменции. Основной клинической характеристикой являются рецидивирующие церебральные кровоизлияния, которым иногда предшествуют мигренозные головные боли или изменения психического состояния.
В настоящем изобретении предложены способы лечения индивидуумов, пораженных HCHWA-D, включающие введение нуждающемуся в этом индивидууму терапевтически эффективного количества одного или большего числа антисмысловых олигонуклеотидов, которые индуцируют пропуск экзонных последовательностей, содержащих мутацию HCHWA-D. Указанная мутация HCHWA-D расположена в экзоне 16 изоформы транскриптов АРР751 (см. фиг. 19 и 20) и экзоне 17 изоформы транскрипта АРР770 (фиг. 20). Предпочтительно, олигонуклеотиды, которые индуцируют пропуск мутации HCHWA-D, индуцируют пропуск экзонных последовательностей, соответствующих экзону 16 АРР751. Как понятно специалисту, экзонные последовательности, соответствующие экзону 16 АРР751, соответствуют экзону 17 АРР770. Специалист способен определить расположение мутации E22Q в других транскриптах АРР. Пропуск указанных экзонных последовательностей может устранять экзон полностью. Как вариант, экзон может быть удален частично, например, в том случае, если в качестве акцепторного или донорного сайта сплайсинга используется скрытый сайт сплайсинга.
Без связи с конкретной теорией предполагается, что удаление экзона, содержащего мутацию HCHWA-D, уменьшает образование или замедляет прогрессирование отложения амилоидных белков в стенках церебральных кровеносных сосудов.
В настоящем изобретении также предложены олигонуклеотиды, индуцирующие пропуск экзонных последовательностей, содержащие мутацию HCHWA-D. Такие олигонуклеотиды подходят для удаления мутации HCHWA-D из мРНК АРР, в частности, при лечении HCHWA-D. Олигонуклеотиды, соответствующие hAPPEx16_1-hAPPEx16_6 из таблицы 3, являются предпочтительными.
Способы согласно настоящему изобретению подходят, в частности, для удаления сайтов протеолитического расщепления, мутации HCHWA-D и аминокислот, кодируемых увеличенным числом тринуклеотидных повторов, из белков. При этом не требуется удаление или модификация самого гена, но предотвращается включение генетического кода для сайта протеолитического расщепления, мутации HCHWA-D или увеличенного числа тринуклеотидных повторов в кодирующую область белка в зрелой мРНК. Таким образом, указанный процесс является обратимым. Олигонуклеотид имеет конечный срок существования в клетке и, соответственно, оказывает ограниченный эффект на указанное удаление. Другое преимущество заключается в том, что удаление не является абсолютным. Как правило, не все пре-мРНК, кодирующие целевой белок, синтезируемый клеткой, являются мишенями. Возможно обеспечить высокие уровни пропусков. Эффективность пропусков зависит, например, от конкретной мишени, конкретной экзонной последовательности, которая должна быть пропущена, конкретного дизайна АОН и/или используемого количества АОН. Процент пропусков, как правило, выражают в виде отношения мРНК, не содержащей кодирующей части сайта протеолитического расщепления (мРНК с пропусками) к сумме мРНК с пропусками и немодифицированной мРНК, кодирующей немодифицированный целевой белок (немодифицированная мРНК). Возможность адаптации процента пропусков является преимуществом; например, в том случае, если немодифицированный белок связан с токсическим фенотипом, но также должен осуществлять положительную функцию, не выполняемую (в той же мере) модифицированным белком. При удалении сайта протеолитического расщепления, мутации HCHWA-D или аминокислот, кодируемых увеличенным числом тринуклеотидных повторов, только из доли образующегося белка, возможно уменьшить токсические свойства, но при этом сохранить, по меньшей мере частично, положительную или желательную функцию немодифицированного белка.
В настоящем изобретении предложена модификация сплайсинга пре-мРНК с образованием мРНК таким образом, что экзонная последовательность, которая кодирует сайт протеолитического расщепления, мутацию HCHWA-D или аминокислоты, кодируемые увеличенным числом тринуклеотидных повторов, присутствующих в экзонах, кодируемых указанной пре-мРНК, не включается в зрелую мРНК, образующуюся из пре-мРНК. Белок, впоследствии транслируемый с указанной мРНК, не содержит сайта протеолитического расщепления, мутации HCHWA-D, увеличенного числа тринуклеотидных повторов. Соответственно, согласно настоящему изобретению фактически не происходит удаления сайта протеолитического расщепления, мутации HCHWA-D или аминокислот, кодируемых увеличенным числом тринуклеотидных повторов, из белка, который уже был синтезирован, а обеспечивается способ, способствующий синтезу нового белка, который не содержит сайта протеолитического расщепления, мутации HCHWA-D или аминокислот, кодируемых увеличенным числом тринуклеотидных повторов. Однако при рассмотрении клетки как образования, где протекают равновесные процессы синтеза и деградации белков, результат указанного способа согласно настоящему изобретению может рассматриваться как удаление сайта протеолитического расщепления, мутации HCHWA-D или аминокислот, кодируемых увеличенным числом тринуклеотидных повторов, из белка. Немодифицированный целевой белок постепенно замещается целевым белком, который не содержит сайта протеолитического расщепления, мутации HCHWA-D или аминокислот, кодируемых увеличенным числом тринуклеотидных повторов. Соответственно, в настоящем изобретении также предложен способ получения клетки, содержащей модифицированный белок, в котором отсутствует сайт протеолитического расщепления, мутация HCHWA-D или аминокислоты, кодируемые увеличенным числом тринуклеотидных повторов, по сравнению с немодифицированным белком, закодированным в геноме; указанный способ включает получение клетки, которая экспрессирует пре-мРНК, кодирующую указанный белок с АОН, который индуцирует пропуск экзонной последовательности или части экзонной последовательности, кодирующей указанный сайт протеолитического расщепления, мутацию HCHWA-D или аминокислоты, кодируемые увеличенным числом тринуклеотидных повторов; при этом указанный способ также предусматривает возможность трансляции мРНК, полученной из указанной пре-мРНК, в указанной клетке. Новая мРНК, из которой удалена кодирующая последовательность сайта протеолитического расщепления, мутации HCHWA-D или увеличенного числа тринуклеотидных повторов, представляет собой укороченную кодирующую последовательность или кодирующую последовательность меньшего размера, которая кодирует более короткий вариант немодифицированного белка или вариант меньшего размера. Часто модифицированный белок представляет собой вариант с внутренней делецией немодифицированного белка, отличающийся тем, что указанная внутренняя делеция по меньшей мере разбивает и предпочтительно удаляет сайт протеолитического расщепления, мутацию HCHWA-D или аминокислоты, кодируемые увеличенным числом тринуклеотидов. В случае увеличенного числа тринуклеотидов в указанном белке с внутренней делецией отсутствуют все аминокислоты, кодируемые увеличенным числом повторов.
Опосредованная антисмысловыми последовательностями модуляции сплайсинга (также называемая пропуском экзонов) представляет собой одну из областей, применение АОН в которой смогло оправдать ожидания. В указанном способе олигонуклеотиды АОН используются для облегчения скрытого сплайсинга, изменения уровней альтернативно сплайсируемых генов, или, в случае мышечной дистрофии Дюшенна (МДД), пропуска экзона для восстановления разрушенной рамки считывания. Последнее позволяет получить содержащие внутреннюю делецию, но в основном функциональные, белки дистрофины и перевести тяжелую МДД в более умеренный фенотип мышечной дистрофии Беккера. Фактически, пропуск экзонов является в настоящее время одним из наиболее перспективных терапевтических инструментов при МДД, и недавно было успешно завершено первое испытание на людях. Опосредованная антисмысловыми последовательностями модуляции сплайсинга с момента появления разносторонне развивалась, и в настоящее время возможна реализация разнообразных манипуляций. Помимо классического пропуска экзонов, при котором, как правило, пропускается целый экзон зрелой мРНК, возможен, например, пропуск части экзона, а также включение экзонов. Последнее происходит в тех случаях, когда олигонуклеотиды АОН, направленные на соответствующие интронные последовательности, соединены с рабочим концом белков SR.
Пропуск экзонов применялся для восстановления скрытого сплайсинга, для изменения уровней альтернативно сплайсируемых генов и для восстановления разрушенных открытых рамок считывания. Указанный способ использовался для целого ряда генов, в том числе аполипопротеина В, Bcl-Х, коллагена 7 типа, дистрофина, дисферлина, простатического специфического мембранного антигена, альфа-субъединицы рецептора ИЛ-5, MyD88, Tau, рецептора ФНО альфа-2, Titin, WT1, бета-глобулина и трансмембранного регулятора муковисцидоза CFTR. Соответственно, согласно предпочтительным вариантам реализации предложены способы удаления сайта протеолитического расщепления из белка, отличающиеся тем, что указанный белок представляет собой не аполипопротеин В, Bcl-Х, коллаген 7 типа, дистрофии, дисферлин, простатический специфический мембранный антиген, альфа-субъединицу рецептора ИЛ-5, MyD88, Таи, рецептор ФНО альфа-2, Titin, WT1, бета-глобулин или CFTR, более предпочтительно представляет собой не относящийся к дистрофинам белок.
В отличие от предыдущих вариантов применения пропуска экзонов, в настоящем изобретении предложен способ удаления сайта протеолитического расщепления, мутации HCHWA-D или аминокислот, кодируемых увеличенным числом тринуклеотидных повторов, для лечения индивидуума, восстановления функции белка или уменьшения токсичности белка. Описанные в настоящем документе способы и олигонуклеотиды подходят, в частности, для удаления сайтов протеолитического расщепления, мутации HCHWA-D или аминокислот, кодируемых увеличенным числом тринуклеотидных повторов, из белка, при этом указанный белок вовлечен в нейродегенеративное расстройство.
Предотвращение включения кодирующей части сайта протеолитического расщепления, мутации HCHWA-D или аминокислот, кодируемых увеличенным числом тринуклеотидных повторов (в частности, поли-Q-повтора), в зрелую мРНК согласно настоящему изобретению достигается предпочтительно посредством пропуска экзонов. Антисмысловые олигонуклеотиды для пропуска экзонов, как правило, позволяют осуществлять пропуск экзона или его 5'- или 3'-части. Антисмысловые олигонуклеотиды могут быть направлены на 5' сайт сплайсинга, 3' сайт сплайсинга, оба сайта сплайсинга, один или большее число внутренних сайтов экзона и на интронные последовательности, например, специфические в отношении акцепторной точки сплайсинга. Последнее позволяет обеспечить пропуск расположенного выше экзона.
Пропуск нуклеотидов, которые кодируют сайт протеолитического расщепления, достигается, как правило, путем пропуска экзона, который содержит нуклеотиды, кодирующие указанный сайт протеолитического расщепления. Это приводит к удалению из белка мотива распознавания протеолитическими ферментами. Сайт протеолитического расщепления содержит последовательность распознавания специфической протеазой и две аминокислоты, пептидная связь между которыми расщепляется указанной протеазой. Сайт протеолитического расщепления может заходить за границы двух соседних экзонов или, если пропущена часть экзона, заходить на экзонную последовательность, которая содержит последовательность скрытого акцепторного/донорного сайта сплайсинга. Согласно указанному варианту реализации предпочтителен пропуск экзонной последовательности, которая кодирует пептидную связь, расщепляемую протеазой. В природе фактическое использование или неиспользование последовательности распознавания протеазой зависит не только от присутствия собственно последовательности распознавания, но и от расположения указанного сайта в укладке белка. Расположенный внутри сайт распознавания, как правило, не используется в природе. Согласно настоящему изобретению сайт протеолитического расщепления представляет собой активный сайт протеолитического расщепления, фактически используемый в природе.
Пропуск экзонных последовательностей, которые содержат нуклеотиды, кодирующие сайт протеолитического расщепления, мутацию HCHWA-D или аминокислоты, кодируемые увеличенным числом тринуклеотидных повторов, достигается предпочтительно с применением АОН, направленного на внутреннюю последовательность экзона. Олигонуклеотид считается направленным на внутреннюю последовательность экзона, если область комплементарности, содержащая последовательность, идентичную обратно комплементарной целевой пре-мРНК, расположена в пределах экзона. В настоящее время может быть индуцирован пропуск в зрелой мРНК любых экзонов, на которые проводилось нацеливание методом пропуска экзонов. Часто на экзон нацеливают один АОН и иногда два АОН. Однако не все АОН, конструирование которых возможно, индуцируют пропуски на детектируемом уровне. Наибольший опыт в области пропуска экзонов был достигнут для системы МДД. Было показано, что применение АОН, направленного на внутренние последовательности экзона, позволяет обеспечить пропуск всех экзонов (разумеется, за исключением первого и последнего экзонов). Тем не менее, не все сконструированные АОН, направленные против внутренней последовательности экзона, фактически индуцируют на индуцируемом уровне пропуск целевого экзона. Частота случайным образом выбранных АОН для внутренних последовательностей экзонов, которые индуцируют пропуск, составляет приблизительно 30% в зависимости от конкретного экзона-мишени. Однако с момента первых испытаний опыт, основанный на успешно индуцирующих пропуски АОН, привел к значительному повышению коэффициента успешности сконструированных АОН (PMID: 18813282 Aartsma-Rus et al Mol Ther 17(3):548 (2009). Повышающие коэффициент успешности факторы включают, в том числе: предсказанную структуру РНК экзона в целевом сайте, точную последовательность-мишень и предсказанное присутствие или отсутствие специфических сайтов связывания белка SR в целевом сайте (там же).
Пропуск экзонной последовательности, которая кодирует сайт протеолитического расщепления, мутацию HCHWA-D, или аминокислоты, кодируемые увеличенным числом тринуклеотидных повторов, предпочтительно представляет собой такой пропуск, при котором в новообразованном белке присутствуют впоследствии синтезируемые аминокислоты целевого белка. Таким образом сайт протеолитического расщепления, мутация HCHWA-D или аминокислоты, кодируемые увеличенным числом тринуклеотидных повторов, удаляются, при сохранении значительной доли соответствующего белка. Согласно указанному варианту реализации функциональность модифицированного белка соответствует по меньшей мере части функциональности белка, присутствующего у нормальных индивидуумов. Соответственно, модифицированный белок предпочтительно отличается «внутрирамочным» удалением сайта протеолитического расщепления, мутации HCHWA-D или аминокислот, кодируемых увеличенным числом тринуклеотидных повторов. Предпочтительно функциональность указанного отличающегося «внутрирамочным» удалением белка составляет по меньшей мере 20%, предпочтительно по меньшей мере 50% функциональности немодифицированного белка у здорового индивидуума. Соответственно, согласно предпочтительному варианту реализации число пропущенных нуклеотидов кратно трем. Пропуск экзонной последовательности, которая кодирует сайт протеолитического расщепления, мутацию HCHWA-D или аминокислоты, кодируемые увеличенным числом тринуклеотидных повторов, как правило, достигают путем пропуска экзона, который содержит указанную последовательность. Пропуск целевого экзона достаточен, если указанный экзон содержит число нуклеотидов, кратное трем. В том случае, если указанный экзон содержит другое число нуклеотидов, предпочтителен пропуск также и смежного экзона, чтобы общее число пропущенных нуклеотидов оказалось кратно трем. В большинстве случаев пропуска смежного экзона достаточно, однако если и это не проводит к кратности числа пропущенных нуклеотидов трем, может быть необходимо пропустить и следующий экзон, смежный двум указанным. Возможен пропуск четырех или большего числа экзонов, но часто не обеспечивает выхода значительной части корректного белка. Иногда возможно пропустить только часть экзона. Указанная часть представляет собой либо 5'-часть, либо 3'-часть экзона. Это реализуется в тех случаях, когда экзон содержит скрытый 3' или 5' сайт сплайсинга, который может быть активирован.
Термин пре-мРНК относится к непроцессированной или частично процессированной прекурсорной мРНК, синтезируемой с ДНК-матрицы в клеточном ядре путем транскрипции. В контексте настоящего изобретения индуцирование пропуска и/или содействие пропуску экзонной последовательности, которая кодирует сайт протеолитического расщепления согласно описанию в настоящем документе, означает, что по меньшей мере 1%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или большее количество мРНК, кодирующей целевой белок в клетке, не содержит пропуска экзонной последовательности (модифицированная / (модифицированная + немодифицированная) мРНК). Оценка предпочтительно осуществляется с применением ПЦР согласно описанию в разделе примеров.
АОН согласно настоящему изобретению, индуцирующий пропуск экзонной последовательности, которая кодирует сайт протеолитического расщепления, мутацию HCHWA-D или аминокислоты, кодируемые увеличенным числом тринуклеотидных повторов, предпочтительно содержит последовательность, комплементарную указанному экзону. Согласно некоторым вариантам реализации указанный АОН индуцирует пропуск экзона полностью. Согласно другим вариантам реализации указанный АОН индуцирует пропуск части экзона; предпочтительно, указанная часть кодирует сайт протеолитического расщепления. Указанный АОН предпочтительно содержит непрерывный отрезок длиной от 8 до 50 нуклеотидов, комплементарный указанному экзону. АОН согласно настоящему изобретению предпочтительно содержит отрезок, составляющий по меньшей мере 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 нуклеотидов, комплементарный указанному экзону. Согласно предпочтительному варианту реализации указанный АОН содержит непрерывный отрезок длиной от 12 до 45 нуклеотидов, комплементарный указанному экзону; более предпочтительно, отрезок длиной от 15 до 41 нуклеотидов. В зависимости от химической модификации, введенной в АОН, размер комплементарного отрезка может приближаться к нижней границе указанного диапазона или к верхней границе указанного диапазона. Предпочтительный антисмысловой олигонуклеотид в соответствии с настоящим изобретением включает Т-O алкилтиофосфатный антисмысловой олигонуклеотид, такой как 2'-O-метилмодифицированная рибоза (РНК), 2'-O-этилмодифицированная рибоза, 2'-O-пропилмодифицированная рибоза, и/или замещенный производные указанных модификаций, например, галогенированные производные. Наиболее предпочтительные АОН в соответствии с настоящим изобретением включают 2'-O-метилтиофосфатрибозу. Такие АОН, как правило, не обязательно должны содержать очень длинный комплементарный отрезок. Такие АОН, как правило, содержат отрезок длиной от 15 до 25 комплементарных нуклеотидов. Согласно описанию ниже в настоящем документе, другие предпочтительные АОН согласно настоящему изобретению включают морфолиновыми остов. АОН, содержащие такие остовы, как правило, содержат несколько более длинные комплементарные отрезки. Такие АОН, как правило, содержат отрезок длиной от 25 до 40 комплементарных нуклеотидов. В случае упоминания в указанном изобретении диапазона числа нуклеотидов указанный диапазон включает и приведенное(ые) число(а). Соответственно, например, в случае упоминания отрезка длиной от 8 до 50 нуклеотидов указанный диапазон включает 8 и 50 нуклеотидов.
АОН согласно настоящему изобретению, комплементарный целевой РНК, способен гибридизоваться с целевой РНК в строгих условиях. Как правило, указанное означает, что обратно комплементарная АОН последовательность по меньшей мере на 90% и предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 98% и наиболее предпочтительно по меньшей мере на 100% идентична нуклеотидной последовательности мишени в целевом сайте. Соответственно, АОН согласно настоящему изобретению предпочтительно содержит два или менее несовпадающих нуклеотидов с обратно комплементарной целевой РНК последовательностью, предпочтительно один или ни одного несовпадающего нуклеотида с обратно комплементарной целевой РНК последовательностью. Согласно другому предпочтительному варианту реализации АОН может быть специфически сконструирован таким образом, чтобы содержать один или большее количество несовпадающих нуклеотидов, предпочтительно один или два несовпадающих нуклеотида, например, в случаях, когда необходимо снизить аффинность, если пропуск 100% комплементарных АОН более эффективен, чем желательный с биологической точки зрения в отношении необходимой остаточной активности белка. Несовпадающий нуклеотид определен в настоящем документе как нуклеотид или аналог нуклеотида, не обладающий способностью к спариванию в той же мере как нуклеотид, который он заменяет, по своей природе, но необязательно по степени. Например, основание урацил, заменяющее тимин, или наоборот, не является несовпадающим нуклеотидом. Предпочтительный несовпадающий нуклеотид включает инозин. Инозиновый нуклеотид способен спариваться с любым природным основанием в РНК, т.е. способен спариваться с А, С, G или U в целевой РНК.
Согласно предпочтительному варианту реализации аналог или эквивалент содержит нуклеотида модифицированный остов. Примеры таких остовов представлены морфолиновыми остовами, карбаматными остовами, силоксановыми остовами, сульфидными, сульфоксидными и сульфоновыми остовами, формацетильные и тиоформацетильные остовы, метиленформацетильные остовы, рибоацетильные остовы, алкен-содержащие остовы, сульфаматные, сульфонатные и сульфаниламидные остовы, метилениминовые и метиленгидразиновые остовы, и амидные остовы. Фосфородиамидатные морфолиновые олигомеры представляют собой олигонуклеотиды с модифицированным остовом, которые ранее исследовали в качестве антисмысловых агентов. Морфолиновые олигонуклеотиды содержат незаряженный остов, в котором содержащийся в ДНК сахар дезоксирибоза заменен шестичленным кольцом, и фосфодиэфирная связь заменена фосфородиамидатной связью. Морфолиновые олигонуклеотиды устойчивы к ферментативному расщеплению и предположительно функционируют в качестве антисмысловых агентов за счет остановки трансляции или влияния на сплайсинг пре-мРНК, а не за счет активации РНКазы Н. Морфолиновые олигонуклеотиды успешно доставляли в клетки тканевых культур с применением способов, физически разрушающих клеточную мембрану; в ходе одного исследования, сравнивающего некоторые из указанных способ, было обнаружено, что введение при соскабливании представляло собой наиболее эффективный способ доставки; однако, поскольку морфолиновый остов не заряжен, катионные липиды не являются эффективными посредниками поглощения морфолиновых олигонуклеотидов клетками. В недавнем отчете было продемонстрировано образование морфолиновым олигонуклеотидом триплекса; указанные исследования показали, что за счет неионного остова морфолиновый олигонуклеотид был способен образовывать триплекс в отсутствие магния. Модифицированный остов предпочтительно, как правило, повышает устойчивость к нуклеазам АОН, целевой РНК или гибрида АОН/целевой РНК, или их комбинации. Модифицированный остов может также быть предпочтителен ввиду измененной аффинности в отношении целевой последовательности по сравнению с немодифицированным остовом. Немодифицированный остов может представлять собой РНК или ДНК, предпочтительно он представляет собой РНК-остов.
Также предпочтительно, чтобы связь между остатками в остове не включала атом фосфора, как, например, связь, формирующаяся в случае межнуклеозидных связей алкилов или циклоалкилов с короткой цепью, смешанных гетероатомных и алкильных или циклоалкильных межнуклеозидных связей, или одной или большего числа межнуклеозидных связей гетероатомов или гетероциклов с короткой цепью.
Предпочтительный аналог или эквивалент нуклеотида содержит пептидную нуклеиновую кислоту (ПНК) с модифицированным полиамидным остовом (Nielsen, et al. (1991) Science 254, 1497-1500). Молекулы на основе ПНК точно имитируют молекулы ДНК в отношении распознавания пар оснований. Остов ПНК состоит из 7V-(2-аминоэтил)-глициновых единиц, связанных пептидными связями, отличающимися тем, что нуклеотидные основания связаны с остовом метилен-карбонильными связями. Альтернативный вариант остова содержит удлиненный на один атом углерода мономер пирролидиновой ПНК (Govindaraju and Kumar (2005) Chem. Commun, 495-497). Поскольку остов молекулы ПНК не содержит заряженных фосфатных групп, гибриды ПНК-РНК обычно более стабильны, чем РНК-РНК, или гибриды РНК-ДНК, соответственно (Egholm et al (1993) Nature 365, 566-568).
Дополнительный предпочтительный остов содержит морфолиновый аналог или эквивалент нуклеотида, в котором сахар рибоза или дезоксирибоза заменен 6-членным морфолиновым кольцом. Наиболее предпочтительный аналог или эквивалент нуклеотида содержит фосфородиамидатный морфолиновый олигомер (ФМО), в котором сахар рибоза или дезоксирибоза заменен 6-членным морфолиновым кольцом, и анионная фосфодиэфирная связь между смежными морфолиновыми кольцами заменена неионной фосфородиамидатной связью.
Согласно дополнительному варианту реализации аналог нуклеотида или эквивалент согласно настоящему изобретению включает замену одного из не участвующих в образовании связи атомов кислорода в фосфодиэфирной связи. Указанная модификация незначительно дестабилизирует спаривание оснований, однако существенно повышает устойчивость к разложению нуклеазами. Предпочтительный аналог или эквивалент нуклеотида содержит тиофосфат, хиральный тиофосфат, фосфородитиоат, сложный фосфотриэфир, сложный аминоалкилфосфотриэфир, Н-фосфонат, метилфосфонат и другие алкильные фосфонаты, в том числе 3'-алкиленфосфонат, 5'-алкиленфосфонат и хиральный фосфонат, фосфинат, фосфорамидат, в том числе 3'-аминофосфорамидат и аминоалкилфосфорамидат, тионофосфорамидат, тионоалкилфосфонат, сложный тионоалкилфосфотриэфир, селенофосфат или борофосфат.
Дополнительный предпочтительный аналог или эквивалент нуклеотида согласно настоящему изобретению включает один или большее количество фрагментов сахара, моно- или дизамещенных в положении 2', 3' и/или 5', например, -ОН; -F; замещенный или незамещенный, линейный или разветвленный низший (С1-С10) алкил, алкенил, алкинил, алкарил, аллил, арил или аралкил, который может перемежаться одним или большим количеством гетероатомов; О-, S-, или N-алкил; О-, S-, или N-алкенил; О-, S- или N-алкинил; О-, S-, или N-аллил; О-алкил-0-алкил, -метокси, -аминопропокси; -аминокси; метоксиэтокси; -диметиламинооксиэтокси; и -диметиламиноэтоксиэтокси. Фрагмент сахара может представлять собой пиранозу или ее производное, или дезоксипиранозу или ее производное, предпочтительно рибозу или ее производное, или дезоксирибозу или ее производное. Такие предпочтительные дериватизированные фрагменты сахара содержат «закрытую» нуклеиновую кислоту (ЗНК), в которой 2'-атом углерода связан с 3' или 4' атомом углерода сахарного кольца с образованием таким образом бициклического фрагмента сахара. Предпочтительная ЗНК включает 2'-0,4'-C-этилен-связанную нуклеиновую кислоту (Morita et al. 2001. Nucleic Acid Res Supplement No. 1: 241-242). Указанные замены придают аналогу или эквиваленту нуклеотида устойчивость к РНКазе Н и нуклеазе и повышают аффинность в отношении целевой РНК. Как очевидно для специалиста в данной области техники, предложенные в настоящем изобретении замены придают двуцепочечному комплексу антисмыслового олигонуклеотида с целевой пре-мРНК устойчивость к РНКазе Н. Соответственно, предпочтительные олигонуклеотиды связываются с пре-мРНК указанного белка с образованием двуцепочечного комплекса нуклеиновых кислот и химически модифицированы для придания указанному двуцепочечному комплексу нуклеиновых кислот устойчивость к РНКазе Н.
Специалисту понятно, что нет необходимости в однородной модификации всех положений в антисмысловом олигонуклеотиде. Кроме того, более чем один из указанных выше аналогов или эквивалентов может быть включен в одиночный антисмысловой олигонуклеотид или даже в одно положение в составе антисмыслового олигонуклеотида. Согласно некоторым вариантам реализации антисмысловой олигонуклеотид согласно настоящему изобретению содержит по меньшей мере два разных типа аналогов или эквивалентов.
Как упоминалось выше в настоящем документе предпочтительный АОН в соответствии с настоящим изобретением включает Т-O алкилтиофосфатный антисмысловой олигонуклеотид, такой как 2'-O-метилмодифицированная рибоза (РНК), 2'-0-этилмодифицированная рибоза, 2'-O-пропилмодифицированная рибоза и/или замещенные производные указанных модификаций, такие как галогенированные производные. Наиболее предпочтительный АОН в соответствии с настоящим изобретением включает 2'-O-метилтиофосфатрибозу.
АОН согласно настоящему изобретению может быть связан с фрагментом, усиливающим поглощение указанного антисмыслового олигонуклеотида клетками. Примерами таких фрагментов являются холестерины, углеводы, витамины, биотин, липиды, фосфолипиды, клеточно-проникающие пептиды, включая, но не ограничиваясь перечисленными, Antennapedia, TAT, транспортан и положительно заряженные аминокислоты, такие как олигоаргинин, полиаргинин, олиголизин или полилизин, антигенсвязывающие домены, например, получаемые из антитела, Fab-фрагмент антитела или одноцепочечный антигенсвязывающий домен, такой как одиночный антигенсвязывающий домен верблюдовых.
Предпочтительно, используют дополнительные фланкирующие последовательности для модификации связывания белка с указанным АОН, или для модификации термодинамических качеств указанного АОН, более предпочтительно для модификации сродства к связыванию целевой РНК.
Введение АОН человеку, как правило, хорошо переносится. Клинические проявления введения АОН в клинических испытаниях на людях ограничивались местными побочными эффектами после подкожной (п/к) инъекции (в целом, внутривенное (в/в) введение, по-видимому, переносится лучше), а генерализованные побочные эффекты, такие как лихорадка и озноб, аналогичные ответу на введение интерферона, хорошо поддаются лечению парацетамолом. Более 4000 пациентов с различными расстройствами уже получили лечение с применением системной доставки АОН первого поколения (тиофосфатный остов), и приблизительно 500 после местного введения. Типичные используемые дозировки варьировали от 0,5 мг/кг через день в течение 1 месяца при болезни Крона до 200 мг два раза в неделю в течение 3 месяцев при ревматоидном артрите, и более высоких дозировок, составляющих 2 мг/кг в день при других протоколах для лечения злокачественных заболеваний. Меньшее число пациентов (приблизительно 300) уже получили лечение с применением АОН нового поколения (однородный тиофосфатный остов с фланкирующей 2' метоксиэтоксигруппой), вводимого системно в дозах, составляющих от 0,5 до 9 мг/кг в неделю на протяжении до 3 недель.
Доставка АОН в клетки головного мозга можно достигать различными способами. Например, их можно доставлять непосредственно в головной мозг посредством внутримозговой инокуляции (Schneider et al, Journal of Neuroimmunology 195 (2008) 21-27), интрапаренхимальной инфузии (Broaddus et al., J Neurosurg. 1998 Apr; 88(4): 734-42), интратекально или интравентрикулярно. Как вариант, АОН может быть связан с однодоменным антителом или его вариабельным доменом (VHH), обладающим способностью проходить через гематоэнцефалический барьер. Также для доставки олигонуклеотидов в головной мозг применяли нанотехнологию, например, наногель, состоящий из перекрестносвязанного ПЭГ и полиэтиленимина. Инкапсуляция АОН в липосомах также хорошо известна специалисту в данной области техники. Олигонуклеотиды АОН можно также вводить в спинномозговую жидкость.
АОН согласно настоящему изобретению предпочтительно содержит последовательность, комплементарную части указанной пре-мРНК согласно определению в настоящем документе. Согласно более предпочтительному варианту реализации длина указанной комплементарной части указанного олигонуклеотида составляет по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50 нуклеотидов. Предпочтительно для модификации связывания белка с указанной молекулой или олигонуклеотидом, или для модификации термодинамических качеств указанного олигонуклеотида, более предпочтительно для модификации сродства к связыванию целевой РНК используют дополнительные фланкирующие последовательности. АОН согласно настоящему изобретению может дополнительно содержать дополнительные нуклеотиды, не комплементарные целевому сайту на целевой пре-мРНК. Согласно предпочтительному варианту реализации АОН содержит от 8 до 50 нуклеотидов. АОН согласно настоящему изобретению предпочтительно содержит отрезок, дина которого составляет по меньшей мере 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 нуклеотидов. Согласно предпочтительному варианту реализации указанный АОН содержит непрерывный отрезок длиной от 12 до 45 нуклеотидов, более предпочтительно - отрезок длиной от 15 до 41 нуклеотидов. В зависимости от химической природы остова, как указано выше в настоящем документе, АОН согласно настоящему изобретению содержит от 15 до 25 нуклеотидов. АОН согласно настоящему изобретению с морфолиновым остовом, как правило, содержит отрезок длиной от 25 до 40 нуклеотидов. Согласно предпочтительному варианту реализации указанные количества нуклеотидов в АОН относятся к длине комплементарной целевой пре-мРНК последовательности, предпочтительно, внутренней последовательности экзона, однако указанная целевая последовательность может также представлять собой 5' или 3' сайт сплайсинга экзонной или интронной последовательности, например, предпочтительно, акцепторную точку сплайсинга. Согласно другому предпочтительному варианту реализации указанные количества относятся к общему числу нуклеотидов в АОН.
Предпочтительно комплементарная часть составляет по меньшей мере 50% от длины олигонуклеотида согласно настоящему изобретению, более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80%, даже более предпочтительно по меньшей мере 90% или даже более предпочтительно по меньшей мере 95%», или даже более предпочтительно 98% и наиболее предпочтительно до 100% от длины олигонуклеотида согласно настоящему изобретению, с предполагаемым исключением намеренно введенных специфических несовпадающих нуклеотидов, например, при необходимости, для понижающей регуляции аффинности.
В случае АОН, которые содержат также дополнительные нуклеотиды, общее числу нуклеотидов, как правило, не превышает 50, и число указанных дополнительных нуклеотидов предпочтительно варьирует в диапазоне от 5 до 25, предпочтительно от 10 до 25, более предпочтительно от 15 до 25. Дополнительные нуклеотиды, как правило, не комплементарны целевому сайту на пре-мРНК, однако могут быть комплементарны другому сайту на указанной пре-мРНК или могут служить иной цели и не быть комплементарны целевой пре-мРНК, т.е. дополнительные нуклеотиды могут быть менее чем на 95% идентичны обратного комплементарным последовательностям целевой пре-мРНК.
Сайт протеолитического расщепления, который должен быть удален из белка с применением способа или АОН согласно настоящему изобретению, представляет собой предпочтительно сайт расщепления сериновой эндопротеазой, сайт расщепления металлоэндопептидазой, сайт расщепления секретазой и/или сайт расщепления каспазой. Согласно частному предпочтительному варианту реализации указанный сайт расщепления представляет собой сайт расщепления каспазой или сайт расщепления секретазой. Каспазы представляют собой семейство внутриклеточных цистеиновых протеаз, играющих центральную роль в инициации и осуществлении запрограммированной клеточной смерти. Термин «каспазы» представляет собой короткую форму термина «цистеин-аспартат-специфические протеазы»: их каталитическая активность зависит от критического остатка цистеина в составе высококонсервативного активного пентапептидного участка QACRG, и указанные каспазы специфически расщепляют субстраты после остатков Asp (также специфичностью в отношении Asp в положении Р1 в субстратах отличается серинпротеаза гранзим В). У млекопитающих было идентифицировано более десяти различных представителей семейства каспаз. В соответствии с единой номенклатурой каспазы называют согласно порядку публикаций: таким образом, каспаза-1 представляет собой ICE (интерлейкин-1-бета-превращающий фермент), первая описанная аспартат-специфическая цистеинпротеаза. Секретазное семейство протеаз подразделяют на три группы: альфа-, бета- и гамма-секретазы. Согласно предпочтительному варианту реализации указанная секретаза представляет собой гамма-секретазу.
Белок, из которого должен быть удален сайт протеолитического расщепления или один или большее количество тринуклеотидных повторов, может представлять собой любой белок, который содержит сайт протеолитического расщепления или тринуклеотидный повтор. Согласно предпочтительному варианту реализации указанный белок представляет собой белок млекопитающих, более предпочтительно белок приматов. Согласно частному предпочтительному варианту реализации указанный белок представляет собой белок человека. Согласно предпочтительному варианту реализации указанный белок связан с заболеванием у человека. Согласно частному предпочтительному варианту реализации указанный белок связан с обусловленным триплетными повторами заболеванием у человека, предпочтительно, заболеванием, обусловленным полиглутаминовыми повторами.
Согласно предпочтительному варианту реализации указанный белок содержит сайт расщепления каспазой или сайт расщепления секретазой. Предпочтительно указанный белок содержит сайт протеолитического расщепления каспазы-3 или -6. Предпочтительно указанный белок представляет собой белок, в норме присутствующий в головном мозге млекопитающего. Согласно частному предпочтительному варианту реализации ген, кодирующий указанный белок, представляет собой мутантный ген, который по сравнению с геном здорового индивидуума кодирует увеличенное число тринуклеотидных повторов.
Согласно частному предпочтительному варианту реализации указанный белок представляет собой белок, кодируемый одним из генов, перечисленных в таблице 1а или 1b. Согласно частному предпочтительному варианту реализации указанный ген представляет собой мутантный ген, являющийся причиной заболевания, связанного с полиглутамином, предпочтительно ген из таблицы 1а. Согласно частному предпочтительному варианту реализации указанный ген представляет собой ген гентингтина (Htt). Htt экспрессируется во всех клетках млекопитающих. Максимальные концентрации обнаруживаются в головном мозге и семенниках, умеренные количеств - в печени, сердце и легких. Функция Htt у человека пока не полностью выяснена. Htt взаимодействует в том числе с белками, которые вовлечены в транскрипцию, клеточную сигнализацию и внутриклеточный транспорт. У человека указанный ген, и, в частности, его мутантные формы связаны с болезнью Хантингтона (HD). HD представляет собой прогрессирующе нейродегенеративное генетическое расстройство, нарушающее движение мышц и координацию мышц и приводящее к снижению когнитивных способностей и деменции. Как правило, оно проявляется в среднем возрасте. HD представляет собой наиболее распространенную генетическую причину аномальных непроизвольных судорожных движений, называемых хореей, и значительно чаще встречается у людей западноевропейского происхождения, чем азиатского или африканского. Указанное заболевание вызывает аутосомно-доминантная мутация гена Htt. У ребенка пораженного заболеванием родителя риск наследования заболевания составляет 50%.
В случае гена Htt предпочтительно удаление сайта протеолитического расщепления каспазой-6, кодируемого экзоном 12 Htt, из белка гентингтина. Предпочтительно, чтобы кодирующая область, которая кодирует сайт протеолитического расщепления, была удалена «внутри рамки», чтобы обеспечить включение нормальной нижерасположенной последовательности аминокислот в мутантный белок. Согласно одному варианту реализации указанное удаление «внутри рамки» достигается путем доставки в клетку АОН, обеспечивающего пропуск экзона 12, и АОН, обеспечивающего пропуск экзона 13 гена Htt. Согласно другому предпочтительному варианту реализации указанное удаление «внутри рамки» достигается путем доставки в клетку АОН, способного индуцировать пропуск экзонов, направленного на область, ограниченную нуклеотидами 269-297 экзона 12 гена Htt. Согласно предпочтительному варианту реализации указанный АОН направлен на область, ограниченную нуклеотидами 207-341 экзона 12. Предпочтительно, чтобы указанный АОН был направлен на внутреннюю область, ограниченную нуклеотидами 207-341 экзона 12. Указанная область включает нуклеотиды 207 и 341. Авторами настоящего изобретения было обнаружено, что АОН, направленные на указанные предпочтительные области, индуцируют пропуск последних 135 нуклеотидов экзона 12, с обеспечением таким образом полного «внутрирамочного» удаления двух активных сайтов расщепления каспазой-3 по аминокислотам 513 и 552, и удаление первой аминокислоты активного сайта каспазы-6, частично расположенного в экзоне 12 и частично в экзоне 13. АОН HDEx12_1 (таблица 2) активирует скрытый сайт сплайсинга в положении нуклеотида 206 в экзоне 12, что обеспечивает отсутствие остатка экзона 12 в образующейся мРНК.
В настоящем изобретении также предложена выделенная и/или рекомбинантная модифицированная мРНК Htt, где удалены по меньшей мере нуклеотиды 207-341 экзона 12. Модифицированная мРНК Htt предпочтительно содержит экзоны 1-11, первые 206 нуклеотидов экзона 12 и экзоны 13-67. Согласно другому предпочтительному варианту реализации указанная модифицированная мРНК Htt содержит экзоны 1-11, 14-67.
Согласно другому варианту реализации настоящее изобретение включает выделенный и/или рекомбинантный модифицированный белок Htt, где удалены аминокислоты 538-583. Указанный модифицированный белок Htt предпочтительно содержит последовательность аминокислот, кодируемую экзонами 1-11, первые 206 нуклеотидов экзона 12, и экзоны 13-67. Согласно другому предпочтительному варианту реализации указанный модифицированный белок Htt содержит последовательность аминокислот, кодируемую экзонами 1-11, 14-67.
Согласно еще одному варианту реализации в настоящем изобретении предложена выделенная и/или рекомбинантная клетка, содержащая модифицированную мРНК Htt и/или модифицированный белок Htt согласно описанию выше в настоящем документе. Предпочтительно, указанная клетка содержит ген Htt, содержащий кодирующую область полиглутаминового повтора, длина которого связана с HD.
В случае гена ATXN3 предпочтительно, чтобы сайты расщепления кальпаином в экзоне 7 были удалены из белка. Предпочтительно, чтобы кодирующая область, которая кодирует указанный сайт протеолитического расщепления, была удалена «внутри рамки», чтобы обеспечить включение нормальных синтезируемых впоследствии аминокислот в мутантный белок. Согласно одному варианту реализации указанное «внутрирамочное» удаление достигается путем доставки в клетку АОН, обеспечивающего пропуск экзона 7, и АОН, обеспечивающего пропуск экзона 8 гена ATXN3.
В случае гена ATXN3 предпочтительно, чтобы сайты расщепления кальпаином и каспазой в экзонах 8 и 9 были удалены из белка. Соответственно, в клетку доставляют антисмысловой(ые) олигонуклеотид(ы), индуцирующий(ие) пропуск экзонов 8 и 9, для удаления указанных сайтов протеолитического расщепления из указанного белка в клетке, продуцирующей пре-мРНК, которая кодирует указанный белок.
В случае гена ATN1 предпочтительно, чтобы сайт расщепления каспазой-3 возле N-конца белка и полиглутаминовый отрезок (106DSLD109) в экзоне 5 были удалены из белка. Предпочтительно, чтобы кодирующая область, которая кодирует указанный сайт протеолитического расщепления, была удалена «внутри рамки», чтобы обеспечить включение нормальных синтезируемых впоследствии аминокислот в мутантный белок. Согласно одному варианту реализации указанное «внутрирамочное» удаление достигается путем доставки в клетку АОН, обеспечивающего пропуск экзона 5, и АОН, обеспечивающего пропуск экзона 6 гена ATN1. Согласно предпочтительному варианту реализации указанный АОН содержит последовательность, приведенную в таблице 2 как АОН DRPLA. Дентаторубропаллидолюисова атрофия (DRPLA) представляет собой аутосомно-доминантную спиноцеребеллярную дегенерацию, вызываемую увеличением числа CAG-повтора, кодирующего полиглутаминовый отрезок в белке атрофии-1.
В настоящем изобретении также предложен АОН согласно настоящему изобретению длиной предпочтительно от 14 до 40 нуклеотидов, который индуцирует пропуск экзонной последовательности, кодирующей сайт протеолитического расщепления в белке, мутацию HCHWA-D, или аминокислоты, кодируемые увеличенным числом тринуклеотидных повторов. Согласно предпочтительному варианту реализации в настоящем изобретении предложен АОН согласно описанию выше в настоящем документе, содержащий последовательность, приведенную в таблице 2. Указанный АОН подходит для пропуска указанного экзона гена. Согласно частному предпочтительному варианту реализации указанный АОН содержит последовательность HDEx12_1 из таблицы 2. Согласно другому предпочтительному варианту реализации в настоящем изобретении предложен АОН согласно описанию выше в настоящем документе, специфический в отношении области, идентифицируемой последовательностью АОН, приведенной в таблице 2. Согласно предпочтительному варианту реализации указанный АОН содержит по меньшей мере 10 последовательных нуклеотидов области, идентифицируемой олигонуклеотидом, приведенным в таблице 2. Согласно частному предпочтительному варианту реализации в настоящем изобретении предложен АОН согласно описанию выше в настоящем документе, специфический в отношении области, идентифицируемой последовательностью HDEx12_1 из таблицы 2.
В настоящем изобретении также предложено применение пропуска экзонов в клетке для удаления сайта протеолитического расщепления из белка. Также предложено применение АОН, который индуцирует пропуск экзона, кодирующего сайт протеолитического расщепления в белке, для удаления указанного сайта протеолитического расщепления из указанного белка в клетке, которая продуцирует пре-мРНК, кодирующую указанный белок. В настоящем изобретении также предложен олигонуклеотид длиной от 14 до 40 нуклеотидов, который индуцирует пропуск экзона, кодирующего сайт протеолитического расщепления в белке, для применения при лечении заболевания, связанного с протеолитическим расщеплением указанного белкового продукта.
Согласно другому варианту реализации в настоящем изобретении предложен способ изменения протеолитического процессинга белка, который содержит сайт протеолитического расщепления, включающий доставку в клетку, продуцирующую пре-мРНК, которая кодирует указанный белок, АОН, специфического в отношении указанной пре-мРНК; это предотвращает включение кода указанного сайта протеолитического расщепления в зрелую мРНК, синтезируемую из указанной пре-мРНК; при этом указанный способ также предусматривает возможность трансляции указанной мРНК с получением белка, протеолитический процессинг которого изменен.
В настоящем изобретении также предложено применение пропуска экзонов в клетке для удаления аминокислот, кодируемых увеличенным числом тринуклеотидных повторов, из белка. Также предложено применение АОН, который индуцирует пропуск экзонной последовательности, содержащей тринуклеотидный повтор в пре-мРНК. Предпочтительно, указанный белок кодирует ген, представленный в таблице 1а или 1b. В настоящем изобретении также предложен олигонуклеотид длиной от 14 до 40 нуклеотидов, который индуцирует пропуск экзонной последовательности, содержащей увеличенное число тринуклеотидных повторов в пре-мРНК для применения при лечении заболевания, связанного с аминокислотами, кодируемыми увеличенным числом тринуклеотидных повторов указанного белка (см., например, таблицы 1а и 1b).
В настоящем изобретении также предложено применение пропуска экзонов в клетке для удаления мутации HCHWA-D из пре-мРНК АРР. Также предложено применение АОН, который индуцирует пропуск экзонной последовательности, содержащей мутацию HCHWA-D, в мутантном белке АРР, для удаления указанной мутации HCHWA-D из указанного белка в клетке, которая продуцирует пре-мРНК, кодирующую указанный белок. В настоящем изобретении также предложен олигонуклеотид длиной от 14 до 40 нуклеотидов, который индуцирует пропуск экзонной последовательности, кодирующей мутацию HCHWA-D в белке АРР, для применения при лечении HCHWA-D.
В настоящем изобретении также предложено не являющееся человеком животное, в организме которого содержится олигонуклеотид согласно настоящему изобретению. Предпочтительно указанное не являющееся человеком животное содержит мутантный ген, который кодирует увеличенное число тринуклеотидных повторов по сравнению с геном здорового индивидуума.
В настоящем изобретении также предложен модифицированный белок человека, из которого удален сайт протеолитического расщепления путем пропуска экзона. Также предложена мРНК, кодирующая модифицированный белок человека, из которого удален сайт протеолитического расщепления путем пропуска экзона.
В настоящем изобретении также предложен модифицированный белок АРР человека, из которого удалена мутация HCHWA-D путем пропуска экзона. Также предложена мРНК, кодирующая модифицированный белок АРР человека, из которого удалена мутация HCHWA-D путем пропуска экзона.
В настоящем изобретении также предложена клетка, кодирующая белок человека, содержащий сайт протеолитического расщепления, отличающаяся тем, что указанная клетка содержит АОН согласно настоящему изобретению для удаления указанного сайта протеолитического расщепления из указанного белка в указанной клетке.
В настоящем изобретении также предложена клетка, кодирующая белок человека, содержащий аминокислоты, кодируемые увеличенным числом тринуклеотидных повторов, отличающаяся тем, что указанная клетка содержит АОН согласно настоящему изобретению для удаления аминокислот, кодируемых увеличенным числом тринуклеотидных повторов, из указанного белка в указанной клетке. Предпочтительно, указанный белок кодирует ген, представленный в таблице 1а или 1b.
В настоящем изобретении также предложена клетка, кодирующая белок АРР человека, содержащий мутацию HCHWA-D, отличающаяся тем, что указанная клетка содержит АОН согласно настоящему изобретению для удаления указанной мутации HCHWA-D из указанного белка в указанной клетке.
Общие принципы номенклатуры положений сайта расщепления субстрата была сформулированы Schecter и Berger, 1967-68 [Schechter and Berger, 1967], [Schechter and Berger, 1968]. При этом сайт расщепления обозначается символами Р1-Р1', с возрастанием нумерации в N-концевом направлении расщепляемой пептидной связи (Р2, Р3, Р4 и т.п.). С карбоксильной стороны сайта расщепления нумерация возрастает аналогичным образом (Р1', Р2', Р3' и т.д.).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1: Пропуск экзонов после трансфекции АОН HDEx12_1 в различных концентрациях. А) Полученные от пациентов HD-фибробласты обрабатывали 1, 25, 150 и 1000 нМ HDEx12_1. β-актин использовали в качестве нагрузочного контроля. Увеличение концентрации АОН от 1 нМ до 25 нМ приводило к более высокому проценту пропусков, с увеличением от 16% до 92% по оценке с применением лаборатории на чипе. Максимальный процента пропуска, составляющий 95%, был получен при использовании 150 нМ HDEx12_1. Слишком высокая концентрация АОН приводила к недостаточному уровню пропусков. В I контроле с ложной трансфекцией (только агентом для трансфекции), как и ожидалось, не наблюдалось видимых пропусков. Эффективность HDEx12_1 в отношении пропуска экзона 12 наблюдалась также в другой линии HD-фибробластов и контрольной линии фибробластов и клетках нейробластомы человека SH-SY5Y. В) схематическое изображение ПЦР экзонов 9-14 при HD. Приведены схематические изображения продуктов нормального (наверху) и более короткого экзона 12 с пропуском (внизу).
Фиг. 2: Кривая логарифмированных значений зависимости доза-ответ для HDEx12_1 АОН в клетках линии HD-фибробластов. На оси X приведены логарифмированные значения концентраций (нМ), на оси Y - процент пропусков. Значение полумаксимальной ингибирующей концентрации (IC50) для HDEx12_1 АОН было определено как 40 нМ. Оптимальный процент пропуска для экзона 12 обеспечивала концентрация АОН, составляющая 150 нМ и более. Результаты представлены в виде среднего ±SEM (n=2-3).
Фиг. 3: Секвенирование по Сенгеру нормального (А) и содержащего пропуски (В) ПЦР-продукта. Трансфекция АОН HDEx12_1 в клетках линии HD-фибробластов приводило к внутрирамочному пропуску 135 нуклеотидов, что соответствует 45 аминокислотам. Наблюдаемый пропуск вызывается активацией альтернативного сайта сплайсинга (AG|GTRAG, см. обведенный пунктирной линией прямоугольник), что приводит к получению изоформы экзона с альтернативным сайтом сплайсинга. Указанный частичный пропуск экзона 12 приводит к удалению активного сайта расщепления каспазой-3 549DLND552 и частичному удалению первой аминокислоты (изолейцина) из активного сайта расщепления каспазой-6 (583IVLD586).
Фиг. 4: Частичная последовательность аминокислот белка гентингтина. Подчеркнуты аминокислоты, кодируемые экзонами 12 и 13. Красным цветом выделена часть белка, где происходит пропуск за счет применения АОН к экзону 12. Жирным шрифтом выделен сайт расщепления каспазой-3 510DSVD513, сайт расщепления каспазой-3 549DLND552 и сайт расщепления каспазой-6 583IVLD586.
Фиг. 5: Схематическая диаграмма гентингтина. А) Диаграмма полного белка htt. Поли-Q означает полиглутаминовый отрезок. Стрелками указаны сайты расщепления каспазой и положения соответствующих им аминокислот. В) Аминоконцевая часть белка htt. Представлены экзон Htt 1-17. Стрелками указаны сайты расщепления каспазой и положения соответствующих им аминокислот. С) Схематическое изображение и последовательность аминокислот экзона 12 и 13 htt с мотивами расщепления каспазой, выделенными жирным шрифтом. Границы экзонов обозначены вертикальными серыми полосами. D) Частичная аминокислотная и нуклеотидная последовательность экзонов 12 и 13 htt. Мотивы расщепления каспазой выделены жирным шрифтом, границы экзонов обозначены вертикальными серыми линиями. Выделенная светлосерым цветом последовательность соответствует пропущенной в результате обработки АОН HDEx12_1 части.
Фиг. 6: Схематическое изображение участка с каспазным мотивом в белке htt и экзонов 12 и 13 с пропусками. (А) Активный сайт расщепления каспазой-6 в положении аминокислоты 586 (IVLD) кодируют последние 3 нуклеотида экзона 12 и первые 9 нуклеотидов экзона 13. Экзон 12 также кодирует два активных сайта расщепления каспазой-3 в положениях аминокислот 513 (DSVD) и 552 (DLND). (В) Для удаления всех трех сайтов протеолитического расщепления из белка htt необходимо обеспечить пропуск обоих экзонов, 12 и 13, за счет применения 3 олигонуклеотидов АОН. (С) AON12.1 направленно воздействует на область в 3'-части экзона 12 htt. Это приводит к активации 5' скрытого сайта сплайсинга и внутрирамочному исключению 3'-части экзона 12. В полученном белке отсутствуют сайт расщепления каспазой-3 в положении аминокислоты 552 (DLND), а изолейцин (I) активного сайта расщепления каспазой-6 в положении аминокислоты 586 (IVLD) заменен глутамином (Q).
Фиг. 7: Оптимальные концентрации АОН. Фибробласты человека трансфицировали концентрациями, варьирующими от 10 до 200 нМ на АОН htt. РНК выделяли через 24 часа и выполняли анализ с применением лаборатории на чипе для вычисления уровней пропуска экзона для AON12.1 и AON12.2 в комбинации (А), и AON13 (В). (*Р<0,05, **Р<0,01, ***Р<0,001, n=4).
Фиг. 8: Трансфекция для индуцирования двойного и одиночного пропуска экзона. Контрольные клетки и HD-фибробласты пациентов трансфицировали олигонуклеотидами АОН к htt, контрольным АОН или не трансфицировали (ложная трансфекция); РНК выделяли через 24 часа. (А) Анализ агарозного геля для транскрипта htt с применением праймеров, фланкирующих экзоны 12 и 13. Трансфекция 100 нМ на АОН приводила к получению продукта, в котором отсутствовали оба экзона, 12 и 13 (AON12.1+12.2+13) или получению более короткого, чем ожидаемый, ПЦР-продукта, после трансфекции 100 нМ AON12.1, где отсутствовала 3' часть экзона 12. (В) Выполняли анализ с применением технологии лаборатории на чипе для вычисления уровней частичного пропуска экзонов 12 в контрольных клетках, трансфицированных концентрациями AON12.1, варьирующими от 10 до 200 нМ. (С) Эффективность пропусков, определенная с применением лаборатории на чипе после обработки 50 нМ АОН в клетках HD. (D) Эффективность пропусков определенная с применением лаборатории на чипе после обработки 50 нМ АОН в контрольных клетках. Показаны проценты как частичного пропуска (AON12.1), так и полного пропуска (AON12.1, AON12.2 и AON13) в С и D (**Р<0,01, ***Р<0,001, n=4). Частичный пропуск (AON12.1) (Е) и полный пропуск (AON12.1, AON12.2, и AON13) (F) подтверждали секвенированием по Сенгеру.
Фиг. 9: Образование модифицированного белка Htt после частичного пропуска экзона 12, устойчивого к расщеплению каспазой-6. Контрольные фибробласты человека трансфицировали 50 нМ AON12.1 и контрольными АОН. (А) Трансфекция AON12.1 приводила к появлению белка htt, более короткого, чем полноразмерный белок, соответствующего приблизительно 343 кДа. (В) Уровни нормального (черные столбцы) и более короткого (белый столбец) белка htt после трансфекции AON12.1, определенные путем количественного определения с применением программного обеспечения Odyssey (**Р<0,01, n=6). (С) Анализ расщепления каспазой-6 in vitro показывает наличие 586-аминокислотного N-концевого фрагмента htt размером 95 кДа, уровни которого увеличиваются с возрастанием концентрации каспазы-6. В образцах из клеток, обработанных AON12.1, количество N-концевого фрагмента htt размером 95 кДа уменьшается, тогда как количество неродственного фрагмента каспазы-6 размером 35 кДа не изменяется. (D) Количественное определение С с применением программного обеспечения Odyssey и фрагмента каспазы-6 размером 35 кДа в качестве эталона (*Р<0,05, n=4).
Фиг. 10: Пропуск экзонов 12 и 13 htt мыши in vitro. Клетки С2С12 мыши трансфицировали АОН к htt мыши, контрольными АОН, рандомизированными АОН, и не трансфицировали (ложная трансфекция). (А) Анализ агарозного геля для транскрипта htt с применением праймеров, фланкирующих экзоны 12 и 13. Пропуск экзонов 12 и 13 htt наблюдается после трансфекции мАОН12.1, mAON12.2 и мАОН13. (В) Анализ с применением лаборатории на чипе двойных пропусков экзонов после обработки АОН (***Р<0,001, n=4).
Фиг. 11: Однократная двусторонняя инъекция Аlеха488 АОН в стриатум приводила к распространенному распределению в среднем мозге мыши. АОН-Аlеха488 выделен зеленым цветом. NeuN (А) и GFAP (В) показаны красным. Ядра контрастно окрашивали DAPI, что показано синим цветом. Масштаб = 10 мкм.
Фиг. 12: Уменьшение уровня экзонов 12 и 13 htt мыши после однократной локальной инъекции в стриатум мыши. Однократную инъекцию, состоявшую из мАОН12.1, мАОН12.2 и мАОН13 (по 10 мкг) или 30 мкг рандомизированного АОН инъецировали билатерально в стриатум мыши. Через 7 дней мышей умерщвляли и исследовали присутствие экзонов 12,13 и 27 в транскрипте htt посредством кПЦР-РВ. (**Р<0,01, n=5).
Фиг. 13: Одиночный пропуск экзона в пре-мРНК атаксина-3 in vitro. Контрольные фибробласты трансфицировали олигонуклеотидами АОН к атаксину-3, контрольными АОН, или не трансфицировали (ложная трансфекция) и через 24 часа выделяли РНК. (а) Анализ агарозного геля для транскрипта атаксина-3 с праймерами, фланкирующими экзон 9 и 10 (полноразмерный, серая стрелка). Трансфекция 50 нМ АОН против экзона 9 приводила к получению продукта, в котором полностью отсутствует экзон 9 (AON9.1, белая стрелка) или отсутствует 3'-часть экзона 9 (AON9.2, две белых стрелки). Трансфекция 50 нМ AON10 приводила к получению продукта, в котором отсутствует экзон 10 (три белых стрелки). Фибробласты трансфицировали концентрациями, варьирующими от 10 до 200 нМ на АОН к атаксину-3, и выполняли анализ с применением лаборатории на чипе для вычисления уровней пропуска экзона для (b) AON9.1, (с) AON9.2 и (d) AON 10. Среднее ±SD, данные оценивали с применением парного t-критерия Стьюдента, *Р<0,05, **Р<0,01, ***Р<0,001 относительно ложной трансфекции, n=4.
Фиг. 14: Двойной пропуск экзонов пре-мРНК атаксина-3 in vitro, (а) Схематическое представление двух способов индуцирования внутрирамочного пропуска содержащего СAG-повтор экзона. (b) Пропуск экзонов 9 и 10 (AON9.1+AON10), подтвержденный секвенированием по Сенгеру. (с) Частичный пропуск экзона 9 и полный пропуск экзона 10 (AON9.2+AON10), подтвержденный секвенированием по Сенгеру. (d) Анализ агарозного геля для транскрипта атаксина-3 с праймерами, фланкирующими экзон 9 и 10. Трансфекция контрольных фибробластов приводила к получению продукта, в котором отсутствует и экзон 9, и экзон 10 (AON9.1+AON10, черная стрелка) или отсутствует 3'-часть экзона 9 и экзон 10 (AON9.2+AON10, белая стрелка), (е) Выполняли анализ с применением лаборатории на чипе для вычисления уровней пропуска экзона в контрольных клетках. Среднее +SD, данные оценивали с применением парного t-критерия Стьюдента, **Р<0,01, ***Р<0,001 относительно ложной трансфекции, n=4.
Фиг. 15: Модифицированный белок атаксин-3 после пропуска экзонов 9 и 10. Контрольные и SCA-3-фибробласты человека трансфицировали 50 нМ каждого из АОН. (а) Трансфекция AON9.1 и AON10, или AON9.2 и AON10 приводила к получению модифицированных белков атаксинов-3 размером 35 кДа (атаксин-3 Δ72АК) и 37 кДа (атаксин-3 Δ59АК), соответственно. Модифицированные белковые продукты выявляли с применением специфического антитела к атаксину-3. Уменьшение уровней содержащего поли-Q мутантного атаксина-3 выявляли с применением антитела 1С2 к поли-Q. После трансфекции олигонуклеотидами АОН проводили денситометрический анализ. Атаксин-3 Δ72АК (белые столбцы) и атаксин-3 Δ59АК (черные столбцы) в (b) контрольных и (с) SCA-3-клетках. Среднее + SD, данные оценивали с применением парного t-критерия Стьюдента, *Р<0,05, **Р<0,01, ***Р<0,001 относительно ложной трансфекции, n=5.
Фиг. 16: Полноразмерный и модифицированный белок атаксин-3 демонстрирует идентичное связывание с убиквитином. (а) Схематическое изображение известных функциональных доменов белка атаксина-3, вовлеченных в деубиквитинирование. Белок атаксин-3 состоит из N-концевого (Josephin) домена, обладающего убиквитинпротеазной активностью, и C-концевого отрезка с повтором поли-Q и тремя взаимодействующими с убиквитином мотивами (UIM). После осуществления пропуска экзонов (атаксин-3 Δ59АК) поли-Q-повтор удаляется, при сохранении интактных домена Josephin и UIM. (b) Обзор замен лейцина (L) на аланин (А) в UIM 1 (L229A), UIM 2 (L249A) или и в UIM 1, и в UIM 2 (L229A/L249A) в полноразмерных атаксине-3 и атаксине-3 Δ59АК. (с) Анализ связывания убиквитином. HIS-меченые связанные с полноразмерными атаксином-3 и атаксином-3 Δ59АК убиквитилированные белки анализировали с применением вестерн-блоттинга. HIS-меченый контроль и только гранулы использовали в качестве отрицательного контроля. Модифицированный атаксин-3 Δ59АК без поли-Q-повтора демонстрировал идентичное немодифицированному атаксину-3 связывание с убиквитилированными белками (n=3).
Фиг. 17: Двойной пропуск экзона пре-мРНК атаксина-3 мыши in vitro. Клетки С2С12 мыши трансфицировали олигонуклеотидами АОН к атаксину-3 мыши, контрольным АОН, рандомизированным АОН, и не трансфицировали (ложная трансфекция). (а) Анализ агарозного геля для транскрипта атаксина-3 с праймерами, фланкирующими экзон 9 и 10. Пропуск экзонов 9 и 10 атаксина-3 наблюдался после трансфекции мАОH9.1 и мАОН10. (b) Секвенирование по Сенгеру подтверждало точный пропуск экзонов 9 и 10. (с) Трансфекция AON9.1 и AON10 мыши приводил к появлению модифицированного белка атаксина-3 размером 34 кДа.
Фиг. 18: Уменьшение уровней экзона 9 атаксина-3 мыши in vivo. Через 7 дней после однократной инъекции, состоявшей из мАОН9 и мАОН10 (по 20 мкг каждого) в желудочек мозга мыши. Анализ мозговой ткани методом кПЦР-РВ показал уменьшение уровней транскриптов экзонов 9 и 10, тогда как уровни экзонов 4 и 11 не изменялись. Среднее + SD, данные оценивали с применением парного t-критерия Стьюдента, *Р<0,05, n=3.
Фиг. 19: Схема пре-мРНК АРР и мутации HCHWA-D. Экзонно-интронная структура АРР751 представлена на схематическом изображении указанной пре-мРНК. Форма блоков с экзонами соответствует рамке считывания. Мутация HCHWA-D расположена в экзоне 16 АРР751.
Фиг. 20: Изоформы АРР у человека и мыши
Схематическое изображение экзонно-интронной структуры двух разных изоформ АРР человека (АРР751 и АРР770) и АРР мыши. Экзон, содержащие мутацию HCHWA-D, отмечен красной стрелкой. Под схемой экзонно-интронной последовательности приведена последовательность аминокислот, кодируемая экзонами, окружающими содержащий мутацию HCHWA-D экзон, где мутация HCHWA-D заключена в синий прямоугольник, а гамма-сайт расщепления секретазой - в красный прямоугольник.
Примеры
Пример 1
Опосредованный АОН пропуск экзонов при нейродегенеративных заболеваниях для удаления сайтов протеолитического расщепления. Опосредованный АОН пропуск экзонов при болезни Хантингтона для удаления сайтов протеолитического расщепления из белка гентингтина
Методы
Олигонуклеотиды АОН и праймеры
Все олигонуклеотиды АОН состояли из 2'-O-метил РНК и полноразмерных тиофосфатных остовов.
Клеточные культуры и трансфекция АОН
Фибробласты, полученные от пациентов, и клетки нейробластомы человека трансфицировали олигонуклеотидами АОН в концентрациях, варьирующих от 1 до 1000 нМ, с применением полиэтиленимина (ПЭИ) ExGen500 в соответствии с инструкциями производителя: 3,3 мкл ПЭИ на мкг АОН для трансфекции. Вторую трансфекцию проводили через 24 часа после первой трансфекции. Через 24 часа после второй трансфекции выделяли РНК и синтезировали кДНК с применением случайных гексамерных праймеров.
Используемые клеточные линии:
Контрольные фибробласты человека FLB73
HD фибробласты человека GM04022
HD фибробласты человека GM02173
Контрольные клетки нейробластомы SH-SY5Y
Количественную ПЦР в реальном времени (кПЦР-РВ) проводили с применением системы LightCycler® 480 (Roche), позволяющей осуществлять количественное определение генной экспрессии.
Агарозный гель и секвенирование по Сенгеру
Все ПЦР-продукты проводили через 2% агарозный гель со шкалами 100 п.о. Полосы выделяли с применением набора для очищения продуктов ПЦР QIAgen® в соответствии с инструкциями производителя. Затем образцы секвенировали методом Сенгера с применением набора от Applied Biosystems BigDyeTerminator v3.1.
Лаборатории на чипе
Автоматический электрофорез с применением технологии лаборатории на чипе проводили для количественно определения продуктов ПЦР с применением анализатора 2100 Bioanalyzer. Получали образцы, состоящие из 1 части обработанного β-актинов продукта в качестве референсного транскрипта и 5 частей экспериментальных продуктов ПЦР. Образцы проводили через чип DNA 1000.
Вестерн-блоттинг
Белок выделяли из клеток через 72 часа после первой трансфекции, проводили вестерн-блоттинг, переносили на ПВДФ-мембрану и проводили иммуномечение первичными антителами, распознающими htt, 1Н6 или 4С8 (разведения 1:1000 в обоих случаях)
Материалы
Олигонуклеотиды АОН и праймеры получали от Eurogentec, Льеж, Бельгия.
Последовательности АОН:
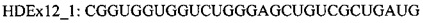
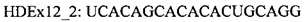
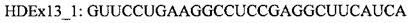
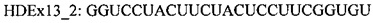
Клеточные линии GM04022 и GM02173 фибробластов пациентов получали от Coriell, Institute for Medical Research, Камден, США, а контрольную клеточную линию фибробластов FLB73 от д-ра Вресвика (Maaike Vreeswijk, LUMC).
Результаты
При трансфекции АОН HDEx12_1 как полученных от пациентов HD-фибробластов, так и клеток нейробластомы человека наблюдался эффективный пропуск (см. фиг. 1) экзона 12. Оптимальный процент пропуска экзона 12 достигался при концентрации 150 нМ, но пропуск наблюдался уже при 1 нМ (см. фиг. 2). Секвенирование по Сенгеру подтверждало, что после трансфекции клеток АОН HDEx12_1 происходил пропуск последних 135 нуклеотидов экзона 12. Это соответствовало удалению 45 аминокислот, содержащих два активных сайта расщепления каспазой-3, и первой аминокислоты активного сайта расщепления каспазой-6 (см. фиг. 3 и 4). Анализ in silico показал, что наблюдаемый пропуск, по-видимому, обусловлен активацией альтернативного сайта сплайсинга AG|GTRAG, что приводит к получению за счет альтернативного сайта сплайсинга изоформы экзона (см. фиг. 3).
Выводы
Авторы настоящего изобретения продемонстрировали частичный пропуск экзона 12 транскрипта гентингтина, приводящий к получению усеченного с сохранением рамки считывания белкового продукта при применении АОН HDEx12_1. С применением разных клеточных линий авторы подтвердили указанный частичный пропуск экзона 12 посредством секвенирования по Сенгеру; при анализе in silico обнаружен альтернативный сайт сплайсинга в экзоне 12, предположительно обуславливающий указанный частичный пропуск. В указанном содержащем пропуски белковом продукте полностью отсутствуют два сайта расщепления каспаза-3, расположенные в экзоне 12, и первая аминокислота сайта расщепления каспазой-6, расположенного на границе экзонов 12 и 13. Недавние данные, полученные в модели на мышах, показали, что предпочтительный сайт расщепления htt in vivo соответствует аминокислоте 552, используемой in vitro либо каспазой-3, либо каспазой-21, и что мутация последней аминокислоты сайта расщепления каспазой-6 в положении аминокислоты 586 уменьшает токсичность в модели HD2.
Будет проведен функциональный анализ для определения способности АОН HDEx12_1 уменьшать токсичность мутантного гентингтина и для определения уровня предотвращения образования токсических N-концевых фрагментов гентингтина. Также будут протестированы другие олигонуклеотиды АОН для полного пропуска экзонов 12 и 13 транскрипта гентингтина.
Пример 2
Опосредованный АОН пропуск экзона 12 или 13 htt в фибробластах человека Сайт расщепления каспазой-6 в положении аминокислоты 586, который, как ранее было показано, важен для патологии заболевания, закодирован частично в экзоне 12 и частично в экзоне 13. Экзон 12 также кодирует два активных сайта расщепления каспазой-3 в положениях аминокислот 513 и 552 (10, 33). При пропуске обоих экзонов 12 и 13 сохраняется открытая рамка считывания и, соответственно, предположительно образуется более короткий белок htt, в котором отсутствуют указанные 3 каспазных сайта (см. фиг. 6). Использованные для указанного исследования олигонуклеотиды АОН приведены ниже.

Олигонуклеотидами АОН трансфицировали фибробласты человека, через 24 часа выделяли тотальную РНК и амплифицировали кДНК с применением праймеров для htt, фланкирующих пропущенные экзоны, для исследования эффективности пропусков. В случае индивидуальной трансфекции ни один из олигонуклеотидов АОН не индуцировал пропуск экзона 12. Полный пропуск 341 пар оснований экзона 12 можно было обеспечить путем комбинирования двух олигонуклеотидов АОН (hHTTEx12_7 и hHTTEx12_5). Наиболее эффективный полный пропуск экзона 12, составлявший 30,9% (±0,3%), достигался при трансфекции 100 нМ каждого из hHTTEx12_7 и hHTTEx12_5 (фиг. 7А).
Эффективность пропуска экзона 13 htt при применении hHTTEx13_1 составляла (45,2%)±3,4%) при концентрации 50 нМ (фиг. 7В). Пропуск в продуктах подтверждали секвенированием по Сенгеру. При полном пропуске обоих экзонов, 12 и 13, сохраняется рамка считывания мРНК. Используя комбинацию трех олигонуклеотидов АОН, авторы настоящего изобретения добивались эффективного пропуска экзона 12 и экзона 13htt. Это приводило к пропуску 465 пар оснований (фиг. 8А), что подтверждали секвенированием по Сенгеру (фиг. 8F). Эффективность указанного двойного пропуска составляла 62,4% (±3,2%) и 58,0% (±19,1%) в HD и контрольных клетках, соответственно (фиг. 8С и D). Частичный пропуск экзона 12 приводит к получению более короткого белка htt, устойчивого к расщеплению каспазой 6. Интересно, что hНТТЕх12_7, нацеленный на 3'-часть экзона 12, приводил к частичному пропуску экзона 12, составляющему 135 пар оснований (фиг. 8А), что подтверждали секвенированием по Сенгеру (фиг. 8Е). Максимальный процент пропуска для hHTTEx12_7 в контрольных клетках составлял 59,9% (±0,7%) при концентрации 50 нМ (фиг. 8В). Эффективность указанного частичного пропуска в клетках HD составляла 62,2% (±3,6%) (фиг. 8С). Указанное частичное исключение 3'-части экзона 12 htt может объясняться активацией скрытого 5' сайта сплайсинга, присутствующего в составе экзона 12 (AG|GTCAG).
Анализ методом вестерн-блоттинга с применением антитела 4С8 действительно выявил дополнительную полосу, соответствующую приблизительно 343 кДа, после трансфекции hHTTEx12_7 (фиг. 9А). Наличие белка htt, размер которого на 5 кДа меньше, согласуется с расчетным пропуском 45 аминокислот после трансфекции AON12.1. Указанный более короткий белок htt составляет 27,9% (±15,1%) от общего количества белка htt (фиг. 9В).
Для тестирования устойчивости модифицированного белка Htt к расщеплению каспазой-6 в положении аминокислоты 586 авторы провели анализ с каспазой-6 in vitro. Белок выделяли из фибробластов человека через три дня после обработки 50 нМ hHTTEх12_7. Фрагменты белка Htt детектировали с применением вестерн-блоттинга с антителом 4С8. После инкубации образцов с рекомбинантной активной каспазой-6 детектировали N-концевые фрагменты htt размером 98 кДа (фиг. 9С). В предыдущих исследованиях было показано, что указанные фрагменты вовлечены в нейронную дисфункцию и нейродегенерацию при HD. Обработка образцов hHTTEx12_7 приводила к 31,9%о (±21,5%) снижению уровней указанных фрагментов htt размером 98 кДа, тогда как более короткий фрагмент htt размером 35 кДа, не расщепляемый по аминокислоте 586, сохранялся в неизмененном виде (фиг. 9D). Это показывает, что мутация первой аминокислоты мотива каспазы-6 длиной 586 аминокислот достаточна для предотвращения протеолитического расщепления.
Пример 3
Удаление сайта расщепления каспазой-6 586 из белка мыши htt in vitro и in vivo
Для исследования потенциала пропуска экзонов htt in vivo и для тестирования возможного вредного влияния in vivo удаления последовательности аминокислот, окружающих сайт расщепления каспазой-6 586, авторы изобретения сконструировали гомологи олигонуклеотидов АОН для последовательности мыши. Поскольку у мышей не наблюдается наличия скрытого сайта сплайсинга, отвечающего за частичный пропуск в клетках человека, авторы исследовали полный пропуск экзона 12 и 13 согласно описанию для клеток человека. При трансфекции 200 нМ каждого из специфических в отношении htt мыши АОН, нацеленных на экзоны 12 и 13 в клетках мыши С2С12, наблюдался пропуск обоих экзонов с эффективностью, составлявшей 86,8% (±5,6) (фиг. 10А и В).
Для исследования распределения АОН в головном мозге мыши 10 мкг меченого Alexa Fluor 488 контрольного АОН инъецировали билатерально в стриатум контрольной мыши. Через одну неделю мышь умерщвляли, головной мог перфузировали и проводили иммуномечение срезов с применением нейронного маркера NeuN и маркера астроцитов глиофибриллярного кислого белка (GFAP). Исследование с помощью флуоресцентного микроскопа показало повсеместное распределение АОН в среднем мозге, как в астроцитах, так и в нейронах (см. фиг. 11А и В).
Далее в стриатум мыши билатерально инъецировали однократную дозу 30 мкг рандомизированного АОН или 30 мкг смеси АОН (по 10 мкг на АОН). Через 7 дней мышей умерщвляли и оценивали уровни экспрессии экзона 12 и 13 в транскриптах htt мыши посредством кПЦР-РВ (фиг. 12). Значимо снижались уровни экзона 12, на 21,5% (±8,5%>), и уровни экзона 13, на 23,1% (±8,3%). Уровни экзона 27, расположенного ниже области-мишени для пропуска, не уменьшались, что указывает на пропуск экзонов 12 и 13 htt уже при однократном введении в стриатум олигонуклеотидов АОН.
Материалы и методы
Инъецирование мышам in vivo
Специфические к htt мыши АОН (мАОН12.1, мАОН12.2 и мАОН13) и рандомизированные контрольные олигонуклеотиды АОН инъецировали анестезированным самцам мышей C57bl/6j возрастом 12-14 недель (Janvier SAS, Франция). Животных содержали поодиночке в индивидуально вентилируемых клетках (IVC) в 12 часовом световом цикле с включением освещения в 7 утра. Пища и вода предоставлялись без ограничений. Животных анестезировали коктейлем Hypnorm/Dormicum/деминерализованная вода в объемном соотношении 1,33:1:3. Глубину анестезии подтверждали путем анализа рефлексов конечностей и хвоста. Глубоко анестезированных мышей фиксировали в стереотаксической раме от Kopf (David Kopf instruments, Тахунга, США). Всего 30 мкг смеси АОН, разведенной в 2,5 мкл стерильного солевого раствора, инъецировали билатерально в строго определенные участки: 0,50 мм фронтальнее брегмы, ±2,0 мм медиолатеральнее и -3,5 мм дорсовентральнее. Для инъекций использовали микрокапиллярные наконечники из боросиликатного стекла индивидуального изготовления диаметром приблизительно 100 мкм, соединенные с иглой Гамильтона (5 мкл, 30 размер). Шприц Гамильтона соединяли с инжекционным насосом (Harvard apparatus, Холлистон, Массачусетс, США), который контролировал скорость введения, установленную на уровне 0,5 мкл/мин. После хирургического вмешательства животных возвращали в их клетки и не тревожили до умерщвления, за исключением ежедневного взвешивания для мониторинга восстановления после хирургического вмешательства. Через 7 дней мышей умерщвляли путем внутрибрюшинной инъекции сверхдозы Эвтазола (Euthasol) (ASTfarma, Оудеватер, Нидерланды), и извлекали ткани головного мозга и мгновенно замораживали до дальнейшего анализа. Для определения распределения АОН 2 мышам инъецировали 10 мкг меченого Alexa Fluor 488 контрольного АОН. Через 7 дней мышей умерщвляли, перфузировали, извлекали головной мозг и замораживали до дальнейшего анализа.
Иммуногистохимия на срезах мозга мышей
Для оценки распределения АОН головной мозг извлекали и постфиксировали в течение ночи в 4% параформальдегиде (ПФА) (Sigma, Сент-Луис, США) в ФСБ при 4°С. Затем обеспечивали криопротекцию в 15% и 30% сахарозе в ФСБ, мгновенно замораживали на сухом льду и хранили при -80°С. Получали срезы головного мозга толщиной 30 мкм на криостате Leica, и хранили срезы в 0,1% азида натрия в ФСБ. Срезы окрашивали в свободно плавающем состоянии и после трех промывок в ФСБ, содержащем 0,2% Triton Х-100 (ФСБ-Triton), инкубировали в течение ночи при 4°С с антителами мыши против NeuN (Millipore) или антителами кролика против GFAP (Sigma), разведенных в обоих случаях 1:5000 в ФСБ-Triton с 1% нормальной козьей сыворотки и 0,4% тимеросала (Sigma). Затем срезы промывали, инкубировали в течение 3 часов с антителами кролика против Аlеха594 (Invitrogen Life Technologies). После дополнительного троекратного промывания срезы монтировали на предметных стеклах с применением раствора DAPI/DABCO и исследовали с помощью конфокального микроскопа Leica.
Расчеты и статистический анализ
Процент пропусков в РНК и белках вычисляли с применением следующей формулы: Пропуск % = (молярность продукта с пропуском / (общая молярность полноразмерного продукта + продукта с пропуском)) * 100%. Уровни N-концевого фрагмента htt размером 95 кДа вычисляли с применением фрагмента каспазы-6 размером 35 кДа в качестве эталона. Процент пропусков анализировали с применением парного двустороннего t-критерия Стьюдента. Различия считали значимыми при Р<0,05.
Пример 4
Опосредованный АОН пропуск экзонов 9 и 10 атаксина-3 in vitro
CAG-повтор в гене ATXN3 расположен в экзоне 10, длина которого составляет 119 нуклеотидов. Соответственно, его пропуск разрушает рамку считывания. Для сохранения рамки считывания необходим одновременный пропуск экзонов 9 (97 нуклеотидов) и 10 (фиг. 14а). Были сконструированы различные олигонуклеотиды АОН нацеленные на внутренние последовательности экзонов 9 и 10 атаксина-3, и ими трансфицировали фибробласты человека (таблица 1). ПЦР-анализ выявляет пропуск 97 нуклеотидов после трансфекции 100 нМ AON9.1 (эффективность = 59,2% ±1,0%) (фиг. 13а и b). Секвенирование по Сенгеру подтверждало, что это соответствует пропуску экзона 9. Трансфекция 100 нМ AON9.2 приводила к пропуску 55 нуклеотидов (эффективность = 62,3% ±3,7%) вместо ожидаемых 97 нуклеотидов (фиг. 13а и с). Секвенирование по Сенгеру показало, что указанный фрагмент соответствовал продукту частичного пропуска, по-прежнему содержавшего 5'-часть экзона 9. Анализ in silico показал присутствие скрытого 5' сайта сплайсинга AG|GTCCA в экзоне 9, что может объяснять появление указанного более короткого фрагмента 24. Успешный пропуск экзона 10 достигался при применении 50 нМ AON10 (эффективность = 96,3% ±0,3%) (фиг. 13а и d), что подтверждалось секвенированием по Сенгеру.
Совместная трансфекция AON9.1 и AON10, и AON9.2 и AON10 приводила к пропуску, соответственно, 216 и 174 нуклеотидов (фиг. 14b и с). Эффективность индуцированного AON9.1 и AON10 двойного пропуска составляла 77,0% (±0,9%) в контрольных фибробластах (фиг. 14d и е). Эффективность совместной трансфекции AON9.2 и AON10 составляла 97,8% (±0,8%) в контрольных фибробластах (фиг. 14d и е). Неожиданный внутрирамочный частичный пропуск экзона 9 при применении AON9.2 представляет собой альтернативный способ устранения содержащего СAG-повтор экзона из белок атаксина-3 (фиг. 14).
Модифицированный белок атаксин-3 сохраняет способность к связыванию убиквитина
Для исследования того, приводит ли трансфекция АОН к получению модифицированного белка атаксина-3, контрольные и SCA-3 фибробласты трансфицировали олигонуклеотидами АОН, нацеленными на экзон 9 и 10; через три дня после трансфекции выделяли белок. Авторы не наблюдали негативного действия на жизнеспособность клеток после обработки АОН ни для контрольных, ни для SCA-3 фибробластов. Анализ методом вестерн-блоттинга с применением специфического антитела к атаксину-3 выявил модифицированную полосу, соответствующую приблизительно 35 кДа, после полного пропуска экзонов 9 и 10 (атаксин-3 Δ72АК) (фиг. 15а); 11,4% (±5,1%) и 6,2%» (±1,9%) от общего количества белка атаксина-3 составлял указанный модифицированный белок атаксин-3 Δ72АК, в контрольных и SCA-3 фибробластах, соответственно (фиг. 15b и с).
Частичный пропуск экзона приводил к появлению нового белка размером 37 кДа (атаксин-3 Δ59АК) (фиг. 15а). 27,1% (±9,0%) и 15,9% (±3,2%) от общего количества белка атаксина-3 составлял указанный белок атаксин-3, размером на 59 аминокислот меньше, в контрольных и SCA-3 клетках, соответственно (фиг. 15b и с). Также образовывался и белок атаксин-3 Δ72АК, что предположительно указывает на образование некоторого количества белка атаксина-3 Δ72АК и при трансфекции AON9.2 и AON10. Стабильно более низкий процент пропуска экзонов в клетках SCA-3 был обусловлен более низкой эффективностью трансфекции АОН в пораженных заболеванием клетках по сравнению с контрольными клетками.
Значительное снижение уровня содержащего увеличенное число поли-Q атаксина-3 было показано с применением антитела 1С2, распознающего длинные глутаминовые отрезки (фиг. 15а), в образцах при применении способов получения полных и частичных пропусков экзона. Это указывает на уменьшение содержащего увеличенное число поли-Q атаксина-3 в полученных от страдающих SCA-3 пациентов фибробластах после трансфекции АОН.
Поли-Q-повтор в белке атаксине-3 расположен между вторым и третьим UIM (фиг. 16а). Применение способов как полного, так и частичного пропуска экзона приводило к удалению поли-Q-повтора, с сохранением домена Josephin, сигнала ядерного экспорта (NES) и мотивов UIM. Для исследования сохранения способности мотивов UIM к связыванию убиквитина в атаксине-3 после модификации белка полиубиквитиновые цепи инкубировали с очищенным бесклеточным полноразмерным белком атаксином-3 и белком атаксином-3 Δ59АК. В качестве отрицательного контроля авторы изобретения получили 3 разных продукта белка атаксина-3, содержащих 1 замену аминокислоты лейцина (L) на аланин (А) в UIM 1 (L229A), UIM 2 (L249A) или обоих мотивах (L229A/L249A) (фиг. 16В). При изменении одной аминокислоты в UIM 1 (L229A) уже наблюдалось уменьшение связывания атаксина-3 с полиубиквитиновыми цепями, а двойная мутация в UIM атаксина-3 (L229A/L249A) приводила к практически полному устранению связывания с полиубиквитином (фиг. 16с). HIS-меченый белок для отрицательного контроля, как и ожидалось, не связывал убиквитилированные белки. Связывание атаксином-3 Δ59АК полиубиквитиновых цепей было сопоставимо со связыванием полноразмерным атаксином-3, что указывает на сохранение способности к связыванию убиквитина после модификации белка (фиг. 16с).
Опосредованный АОН пропуск экзонов 9 и 10 атаксина-3 у мышей
Для изучения пропуска экзонов атаксина-3 в головном мозге мышей и для определения возможного вредного действия модифицированного белка авторы изобретения сконструировали олигонуклеотиды АОН, специфические для последовательности мыши. Поскольку у мышей не наблюдается присутствия скрытого сайта сплайсинга, ответственного за частичный пропуск экзона 9 в транскрипте человека, авторы изобретения исследовали только полный пропуск экзонов 9 и 10. При трансфекции 200 нМ каждого из AON9 (мАОН9) и AON10 (мАОН10) мыши клеток мыши С2С12 наблюдается пропуск обоих экзонов с эффективностью, составляющей 31,7% (±2,4%) (фиг. 17а). Секвенирование по Сенгеру подтверждало указанный внутрирамочный двойной пропуск экзонов (фиг. 17b). Трансфекция мАОН9 и мАОН10 приводила к образованию модифицированного белка размером кДа (фиг. 17с).
Далее осуществляли однократную инъекцию в желудочек головного мозга (ICV) 40 мкг смеси АОН к атаксину-3 (по 20 мкг на АОН) или 40 мкг рандомизированного АОН. Через 7 дней мышей умерщвляли и оценивали эффективность пропусков в мозжечке посредством кПЦР-РВ (фиг. 18). Было обнаружено, что уровни экзона 9 значимо уменьшались, на 44,5% (±7,6%), а уровни экзона 10 уменьшались на 35,9% (±14,1%) после однократной ICV инъекции олигонуклеотидов АОН по сравнению с инъекцией рандомизированного АОН. Уровни экзона 4, расположенного выше, и экзона 11, расположенного ниже области-мишени для пропуска, не уменьшались, что указывает на специфический пропуск экзонов 9 и 10 атаксина-3 in vivo.
В настоящем исследовании авторы изобретения представили новый способ уменьшения токсичности мутантного белка атаксина-3 за счет пропуска содержащего CAG-повтора экзона в транскрипте атаксина-3. В полученном модифицированном белке атаксине-3 отсутствует поли-Q-повтор, токсичный при увеличении его числа, однако сохраняются характеристики связывания убиквитина. ICV введение указанных АОН у мышей приводило к пропуску содержащего CAG-повтор экзона в мозжечке контрольных мышей, что подтверждает распределение и эффективность пропуска экзонов атаксина-3 после ICV инъекции in vivo.
Негативного действия на жизнеспособность клеток после лечения АОН не наблюдалось ни для контрольных, ни для SCA-3 фибробластов; также не наблюдалась избыточная токсичность in vivo.
Дополнительные материалы и методы
Клеточная культура и трансфекция
Полученные от пациентов с SCA фибробласты (GM06151, приобретались у Coriell Cell Repositories, Камден, США) и контрольные клетки (FLB73, любезно предоставленные д-ром Вресвиком (Dr. M.P.G. Vreeswijk, LUMC)) культивировали при 37°С и 5% СО2 на минимальной эссенциальной среде (MEM) (Gibco Invitrogen, Карлсбад, США) с 15% термоинактивированной фетальной бычьей сыворотки (ФБС) (Clontech, Пало-Альто, США), 1% Glutamax (Gibco) и 100 ед/мл пенициллина/стрептомицина (П/С) (Gibco). Миобласты мыши С2С12 (АТСС, Теддингтон, Великобритания) культивировали на модифицированной по Дульбекко среде Игла (DMEM) (Gibco) с 10% ФБС, 1% глюкозы, 2% Glutamax и 100 ед/мл П/С.
Трансфекцию АОН выполняли в 6-луночном планшете с 3 мкл липофектамина 2000 (Life Technologies, Пейсли, Великобритания) на лунку. АОН и липофектамин 2000 разводили в MEM до общего объема 500 мкл; готовили смеси в соответствии с инструкциями производителя. Использовали четыре разных варианта условий трансфекции: 1) трансфекция 1-200 нМ олигонуклеотидов АОН, 2) трансфекция нерелевантным h40AON2, направленным на экзон 40 гена МДД (контрольный АОН)36, 3) трансфекция рандомизированным АОН (рандомизированный) и 4) трансфекция без АОН (ложная трансфекция). Последовательности АОН приведены в таблице 1. В смеси добавляли MEM до общего объема 1 мл. Через четыре часа после трансфекции среду заменяли свежей средой, содержащей 5% ФБС. Все олигонуклеотиды АОН состояли из 2'-О-метил РНК и содержали полноразмерный тиофосфатный модифицированный остов (Eurogentec, Льеж, Бельгия).


Цитируемые источники
1. Wellington, C.L. et al. Inhibiting caspase cleavage of huntingtin reduces toxicity and aggregate formation in neuronal and nonneuronal cells. J. Biol. Chem. 275, 19831-19838 (2000).
2. Graham, R.K. et al. Cleavage at the Caspase-6 Site Is Required for Neuronal Dysfunction and Degeneration Due to Mutant Huntingtin. Cell 125, 1179-1191 (2006).


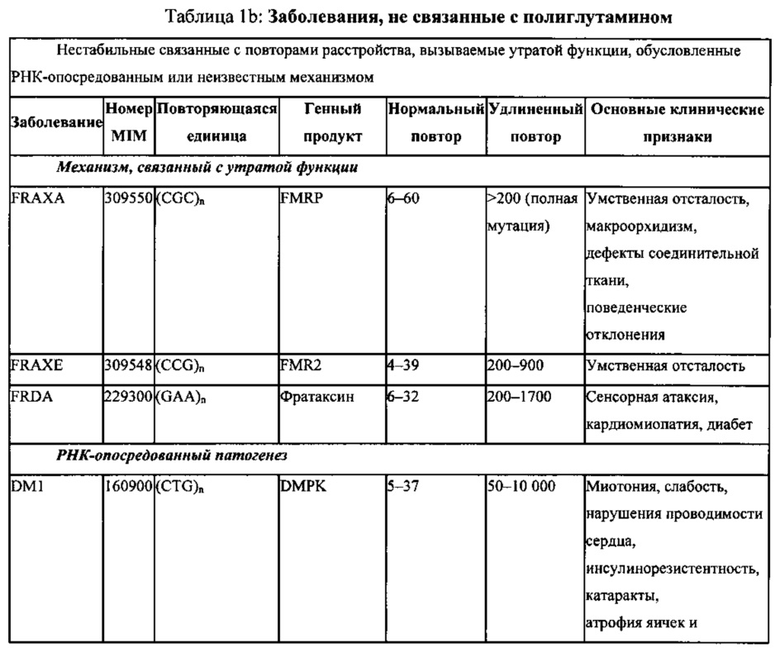
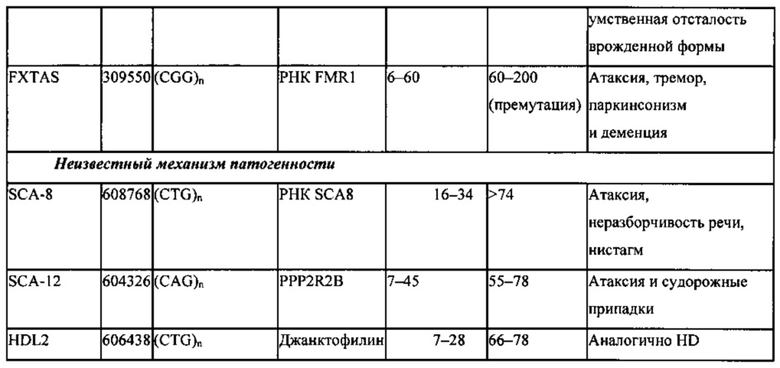
Annual Review of Neuroscience
Vol. 30: 575-621 (дата публикации тома: июль 2007)
Trinucleotide Repeat Disorders
Harry T. Orr and Huda Y. Zoghbi


АОН HDEx представляют собой олигонуклеотиды для пропуска экзонов 12 или 13 гена Htt.
DRPLA АОН представляют собой олигонуклеотиды для пропуска экзонов 5 или 6 гена DRPLA/ATN1.
В таблице 3 приведены дополнительные олигонуклеотиды для пропуска экзонов.
АРР: белок-предшественник амилоида при болезни Альцгеймера (AD); ATN1: атрофии 1 при DRPLA; ATNX3: атаксин 3 для SCA-3; ATXN7: атаксин 7 при SCA-7; ТВР: ТАТА-связывающий белок для SCA-17; и НТТ при болезни Хантингтона (HD)




































































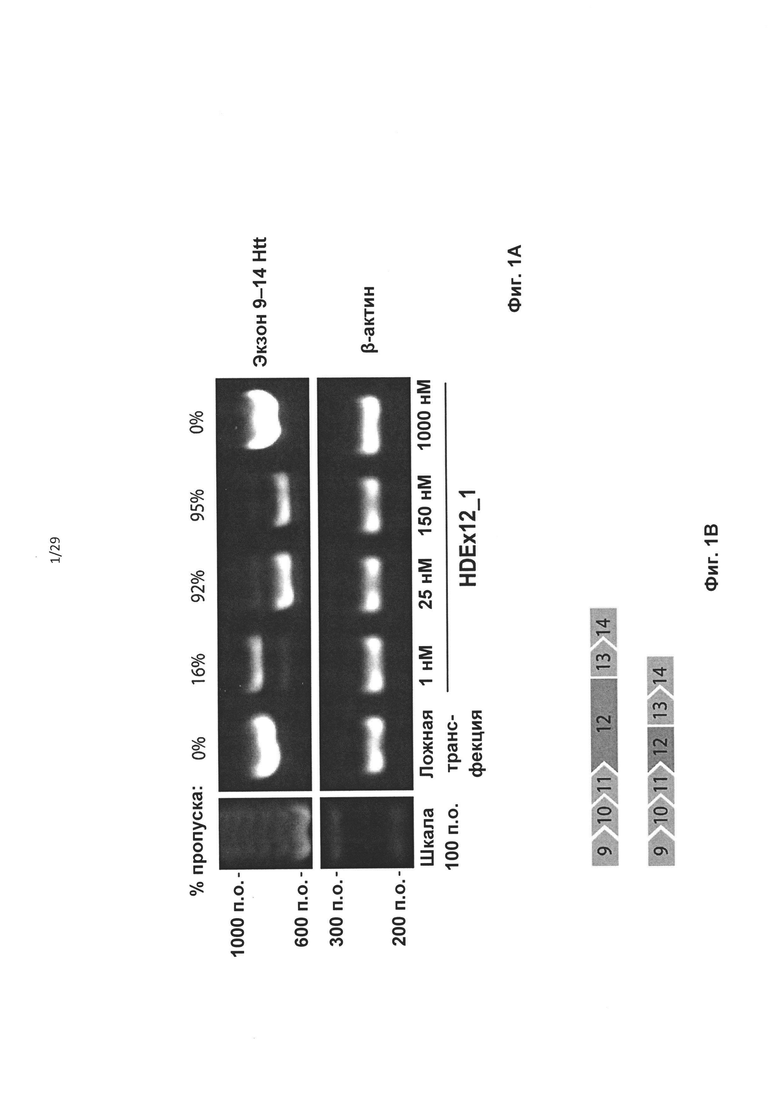
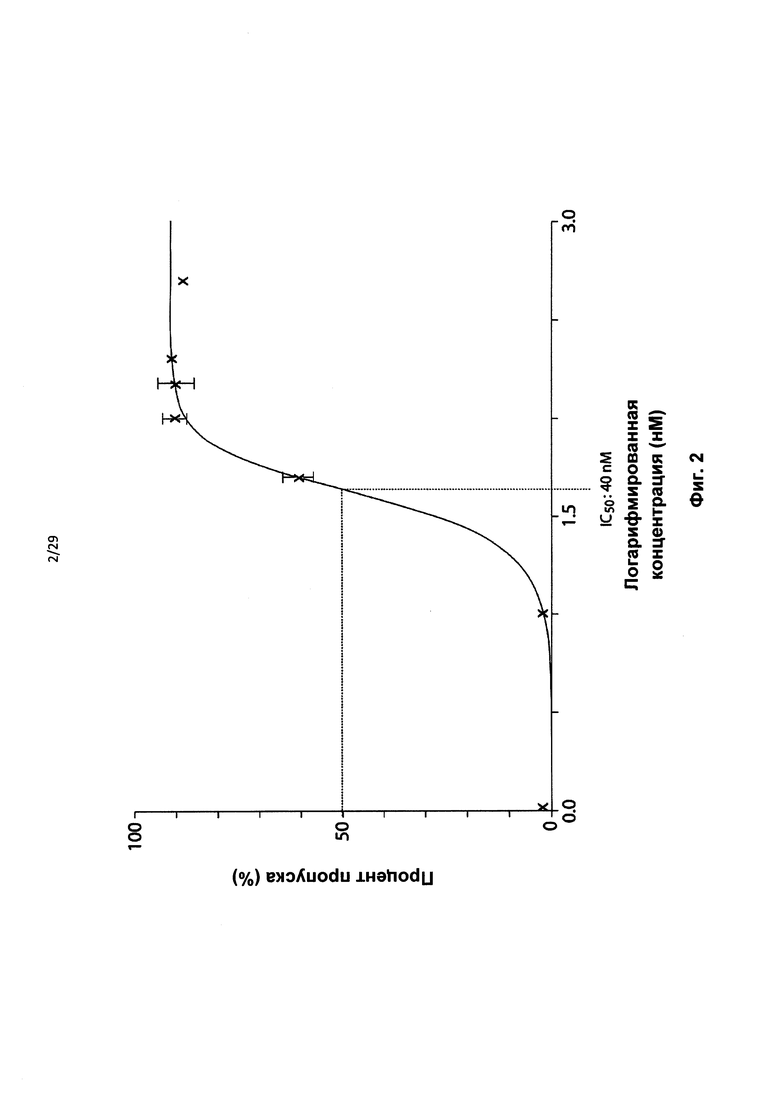
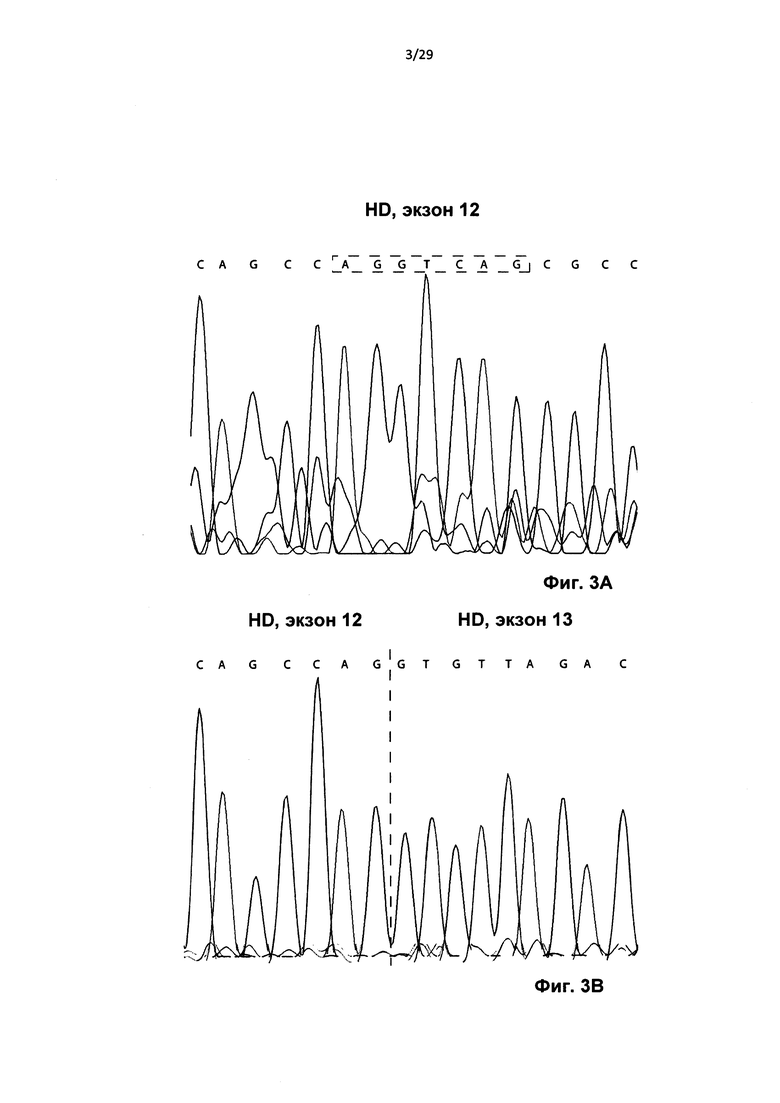

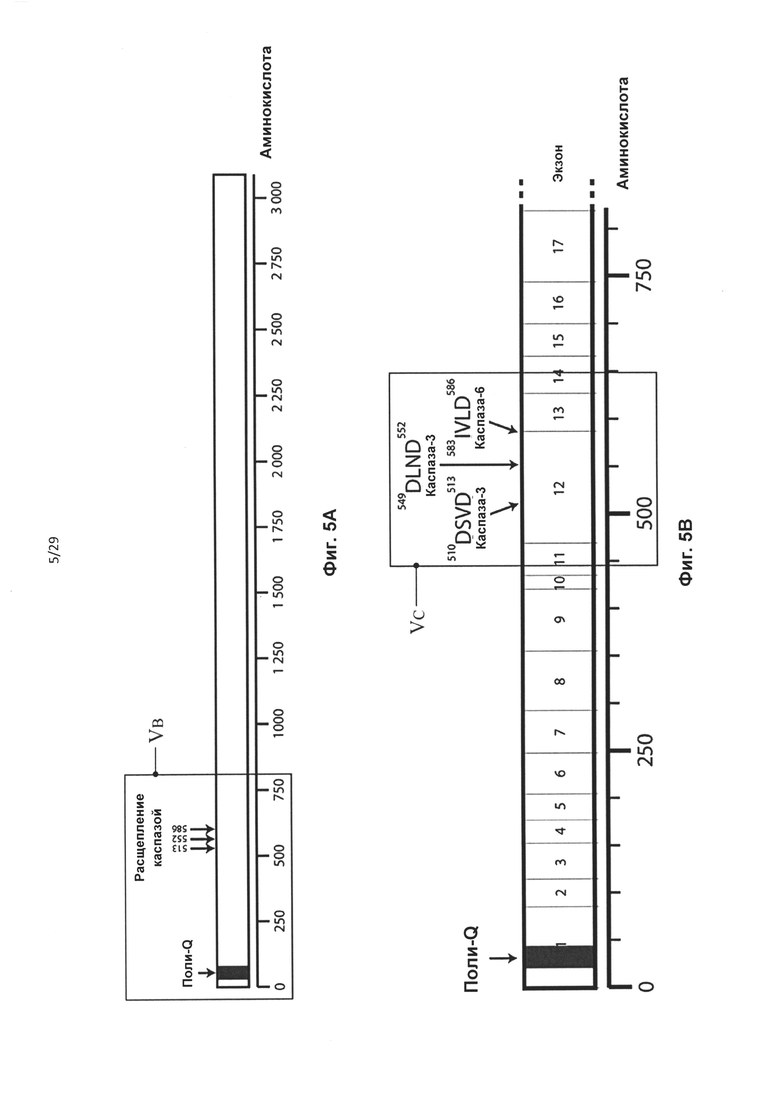
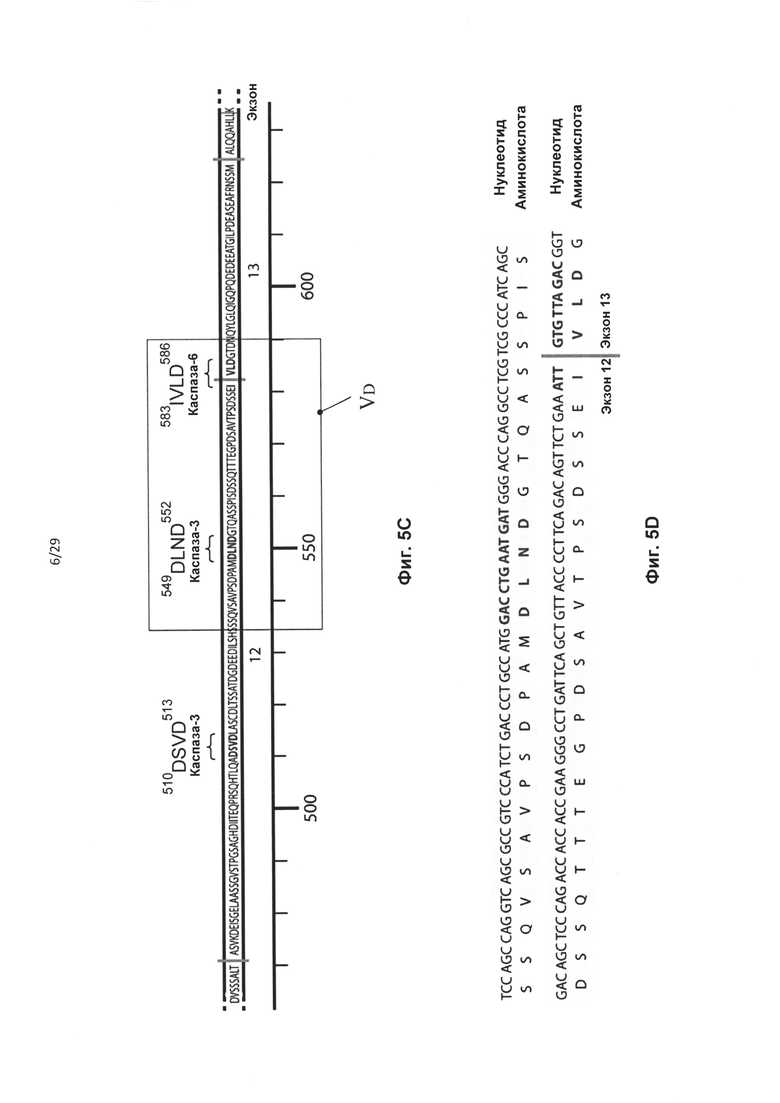
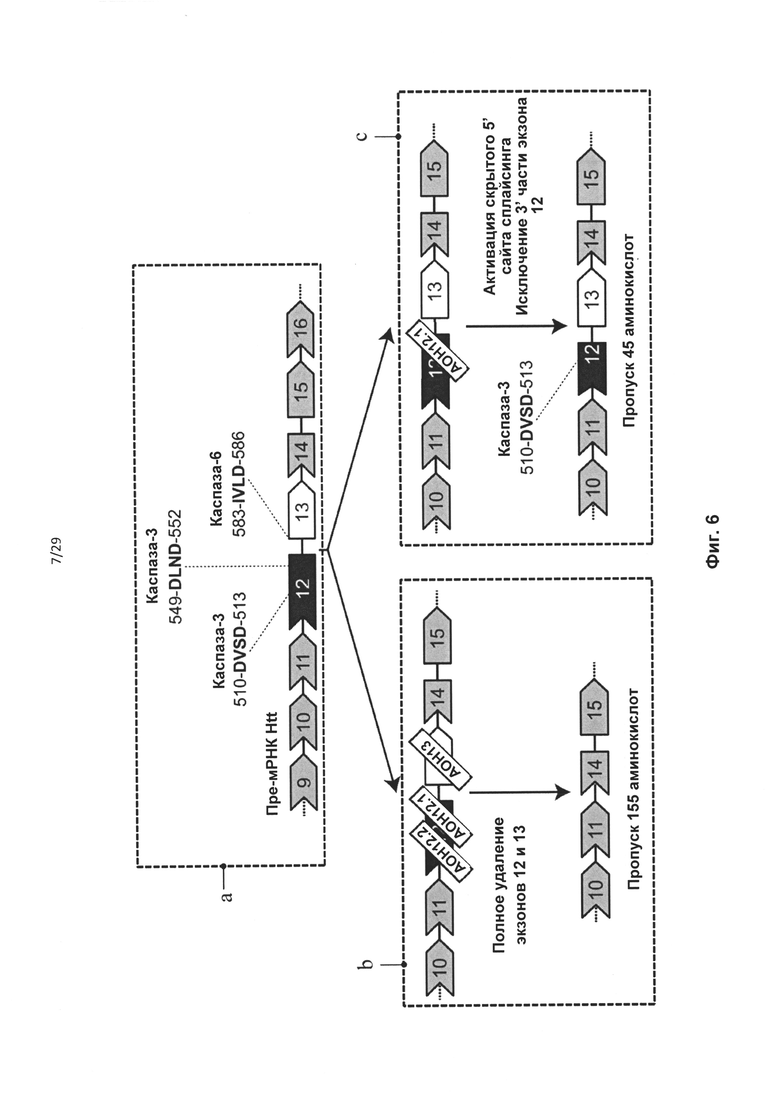
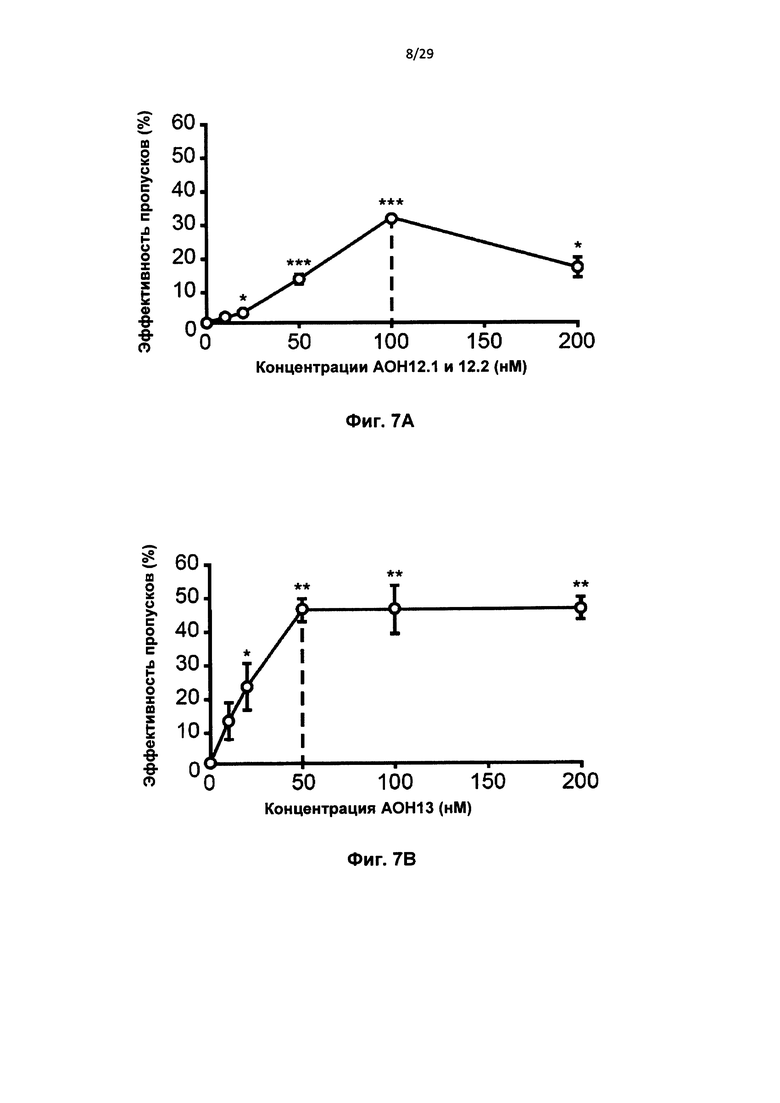
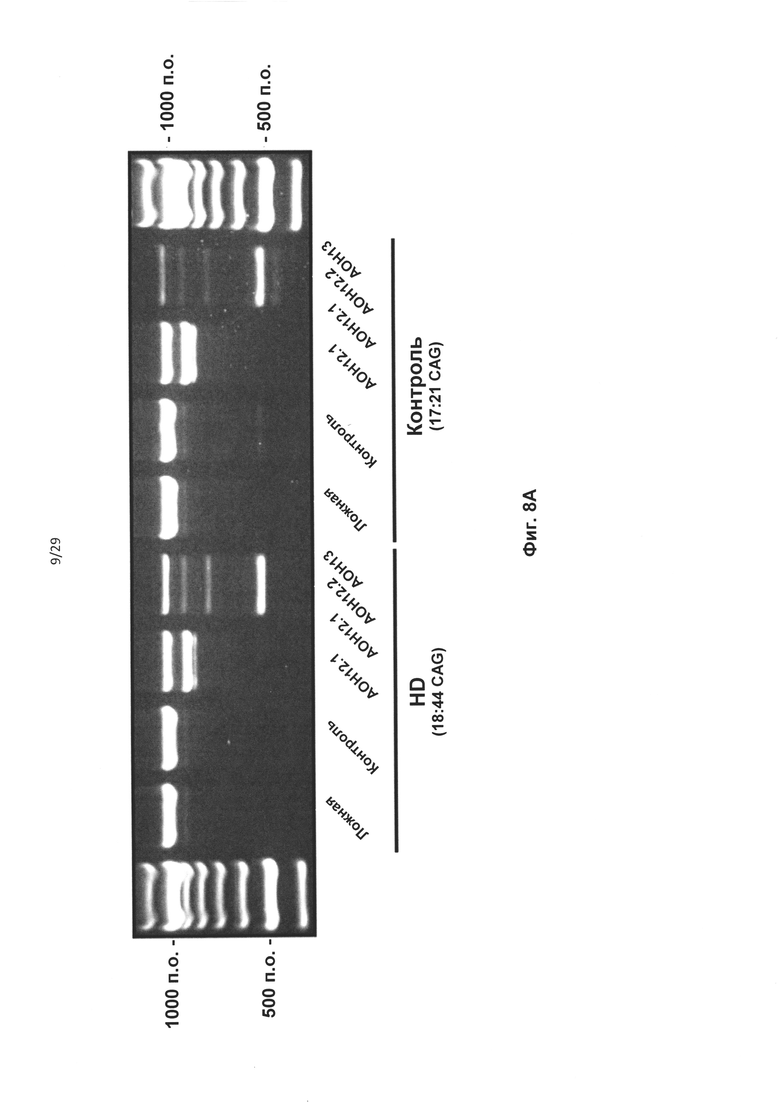
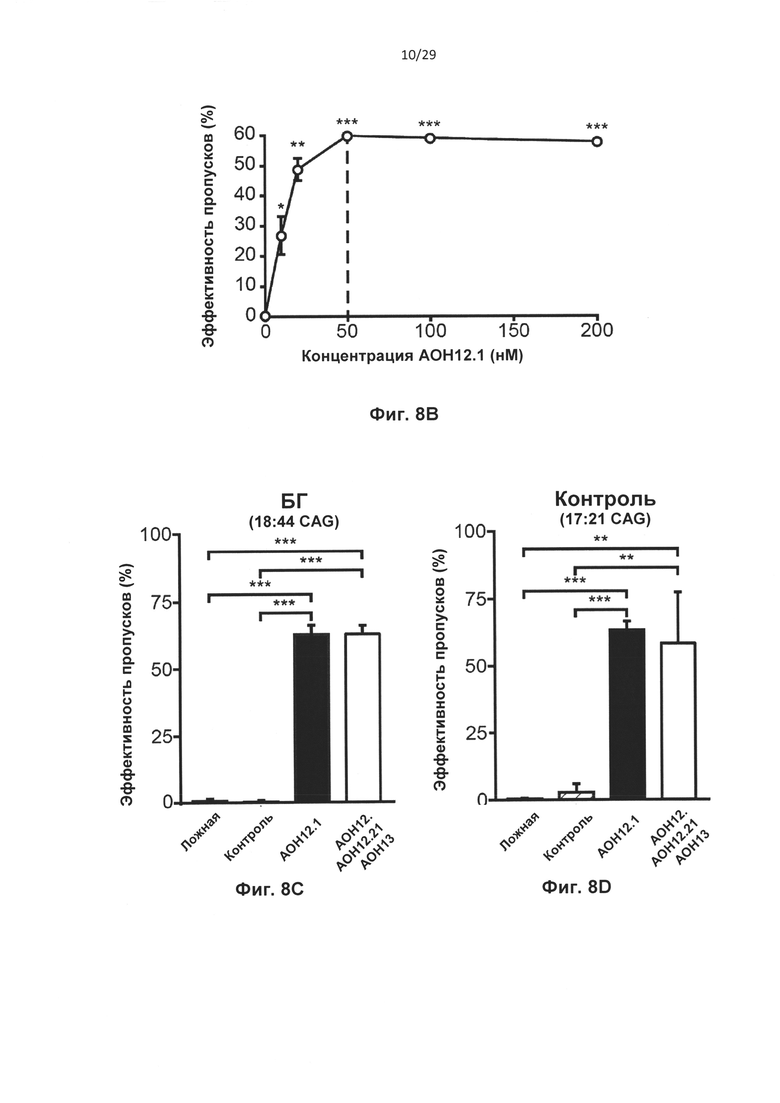
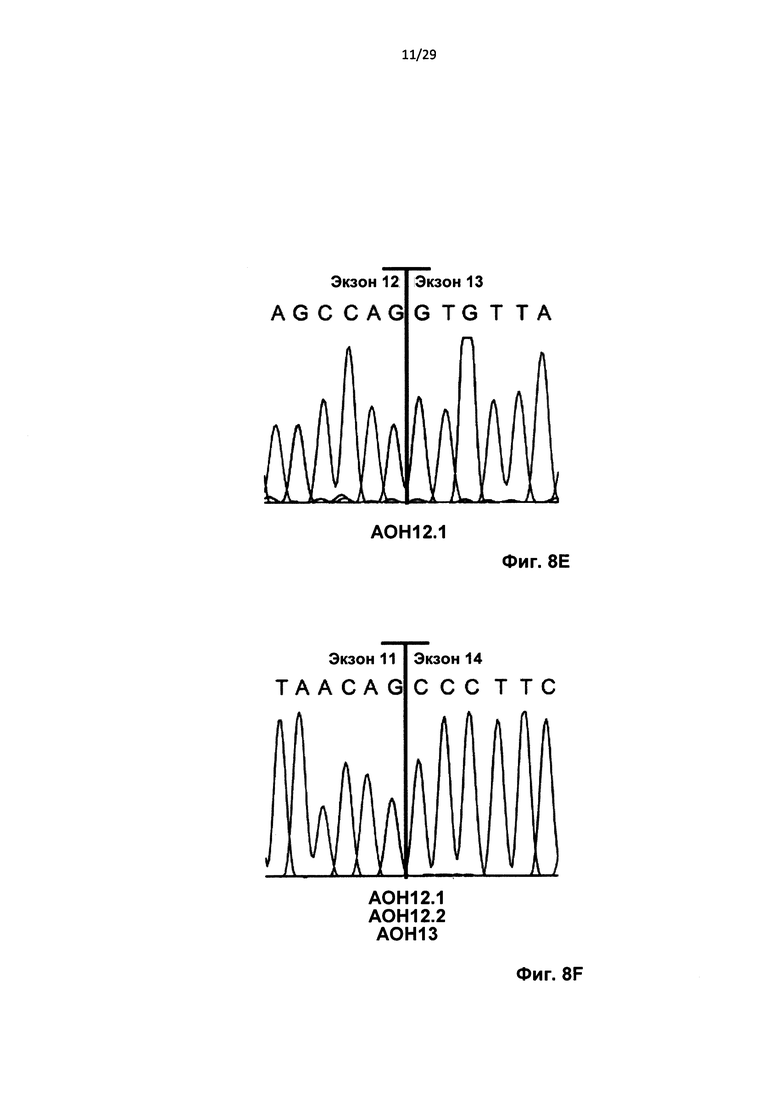
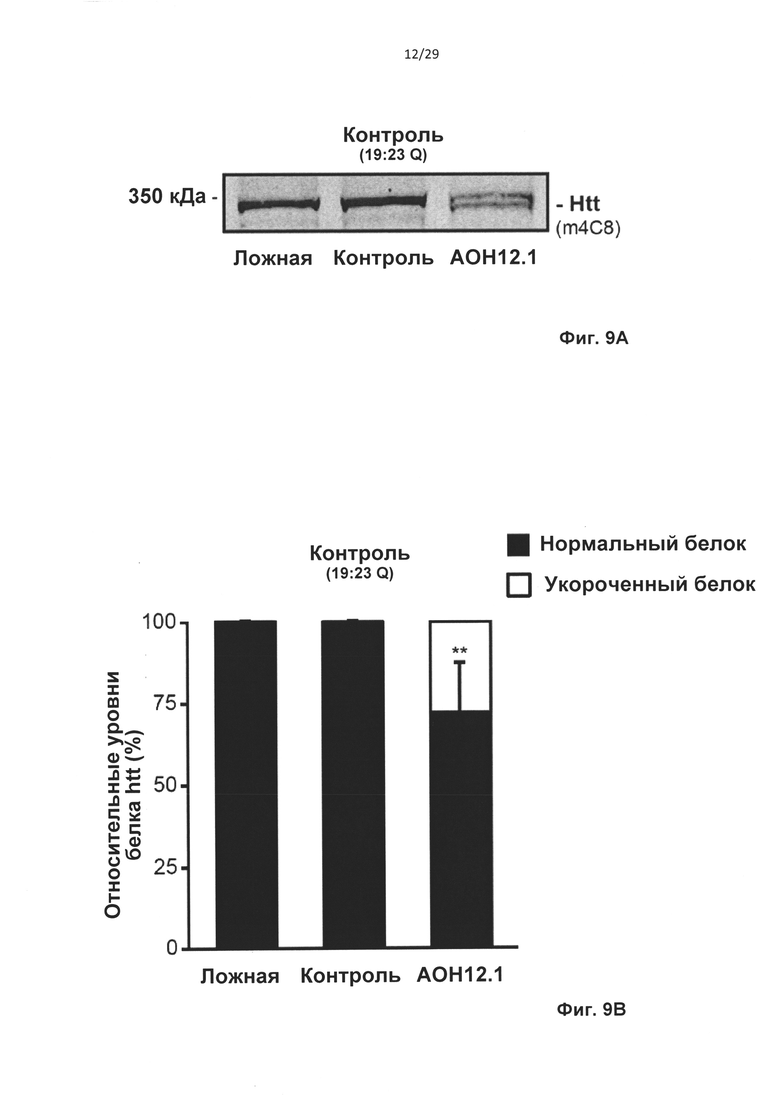
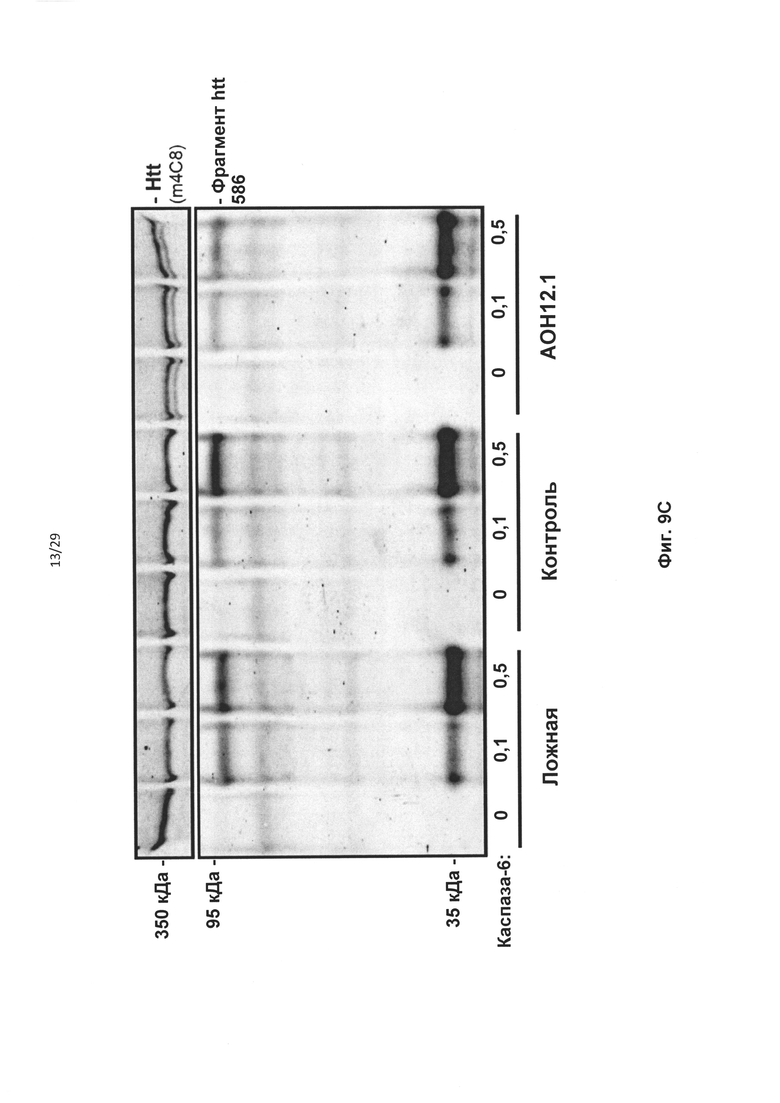
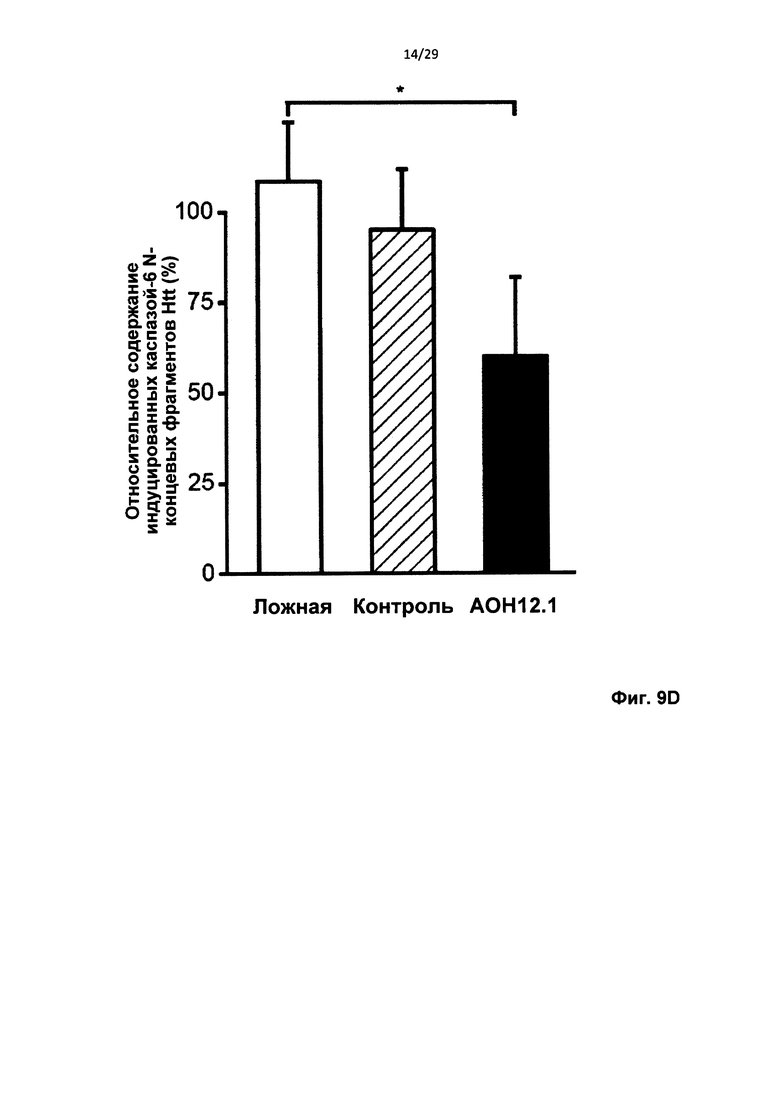
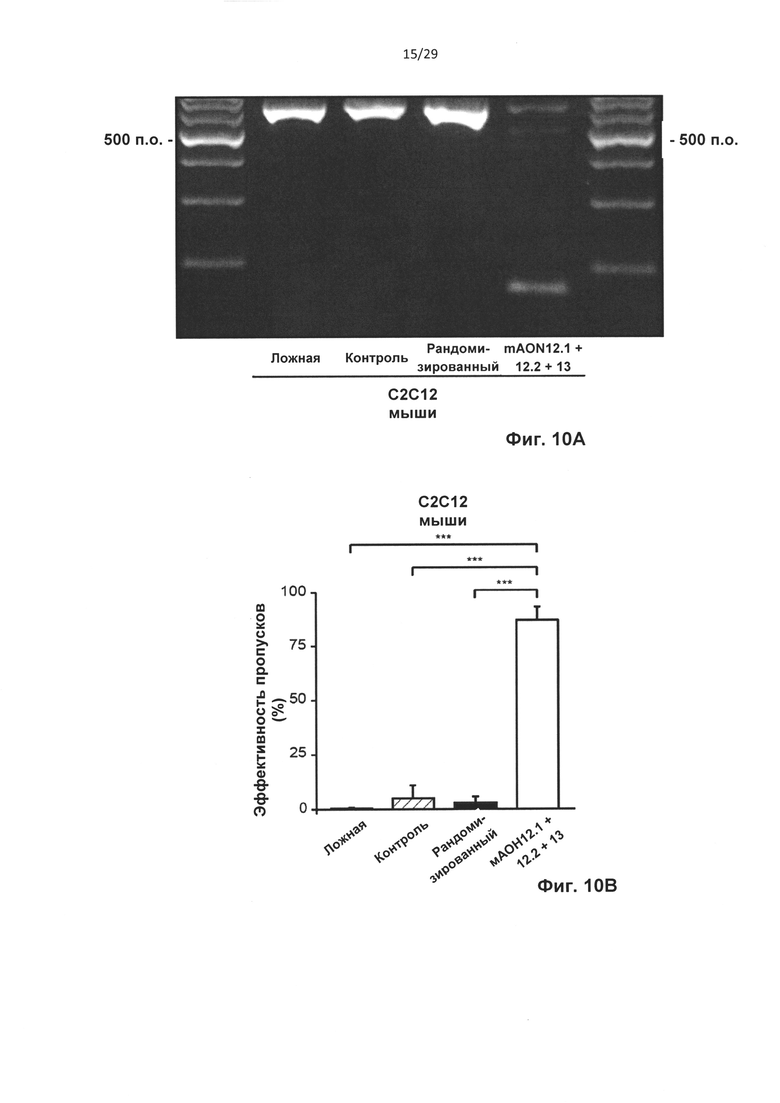
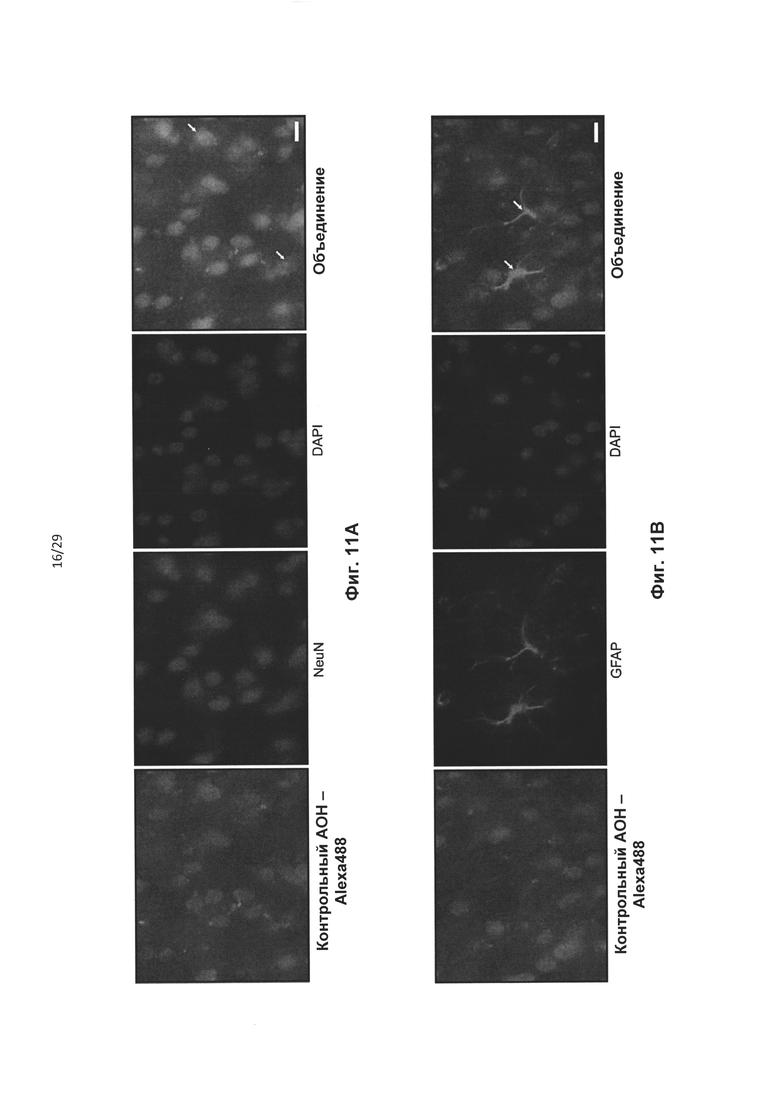
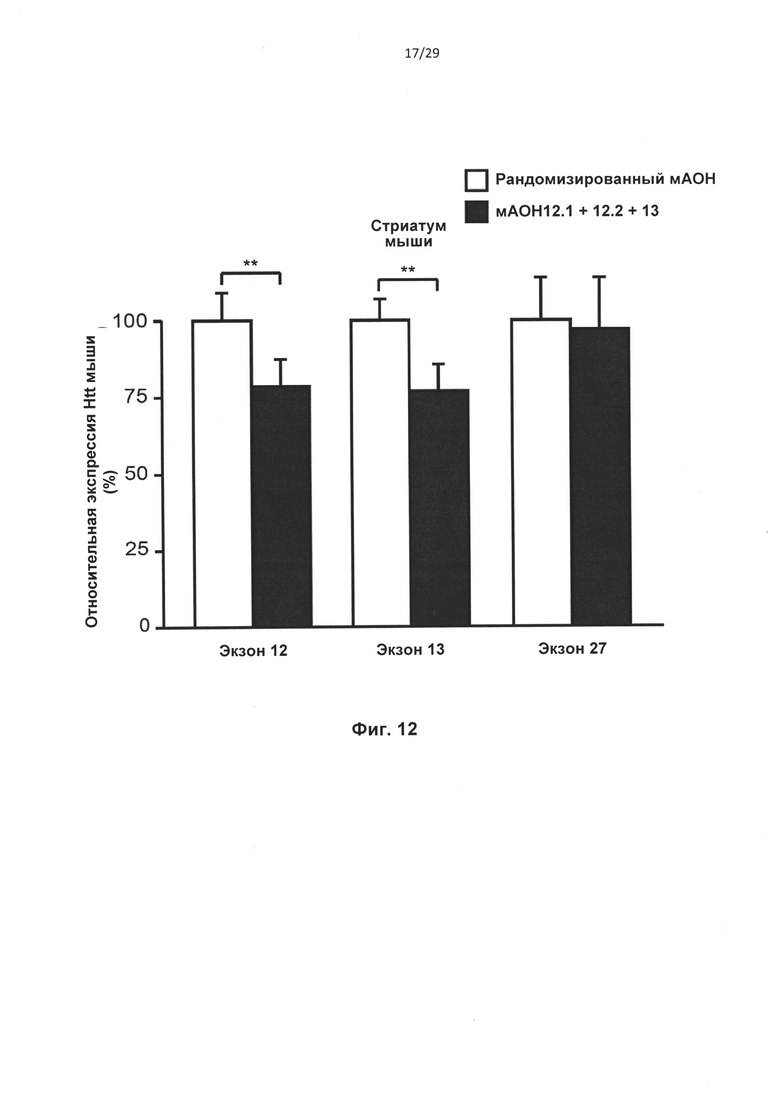
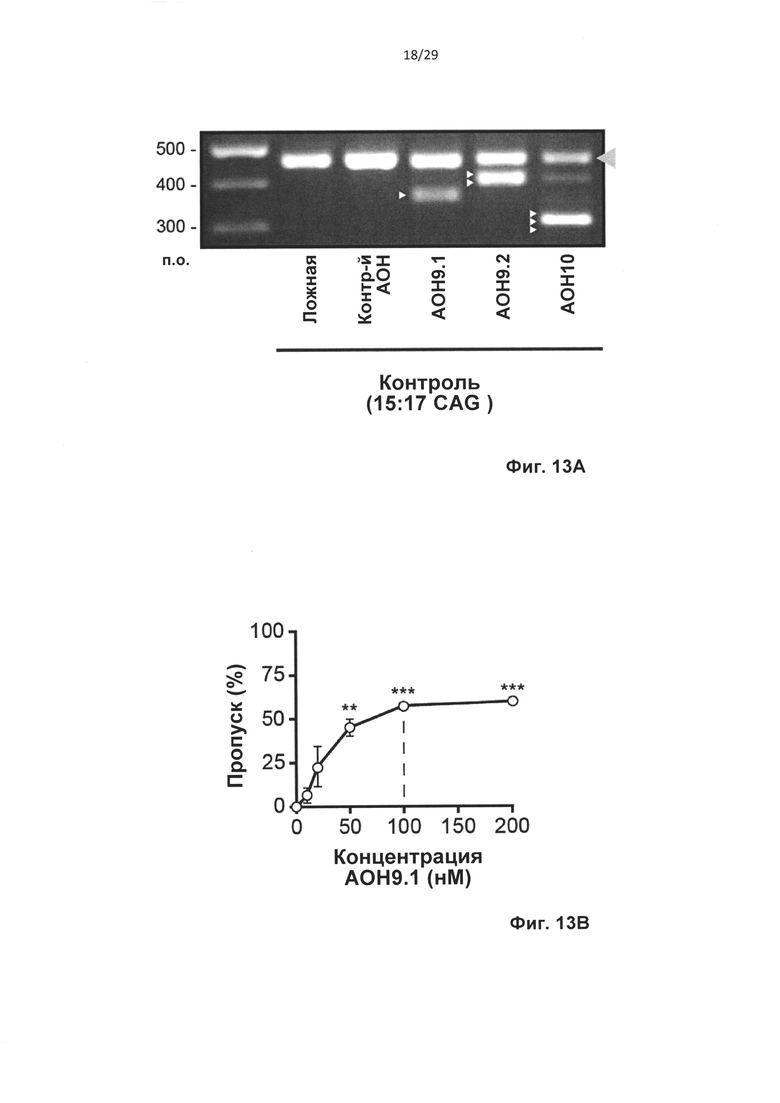
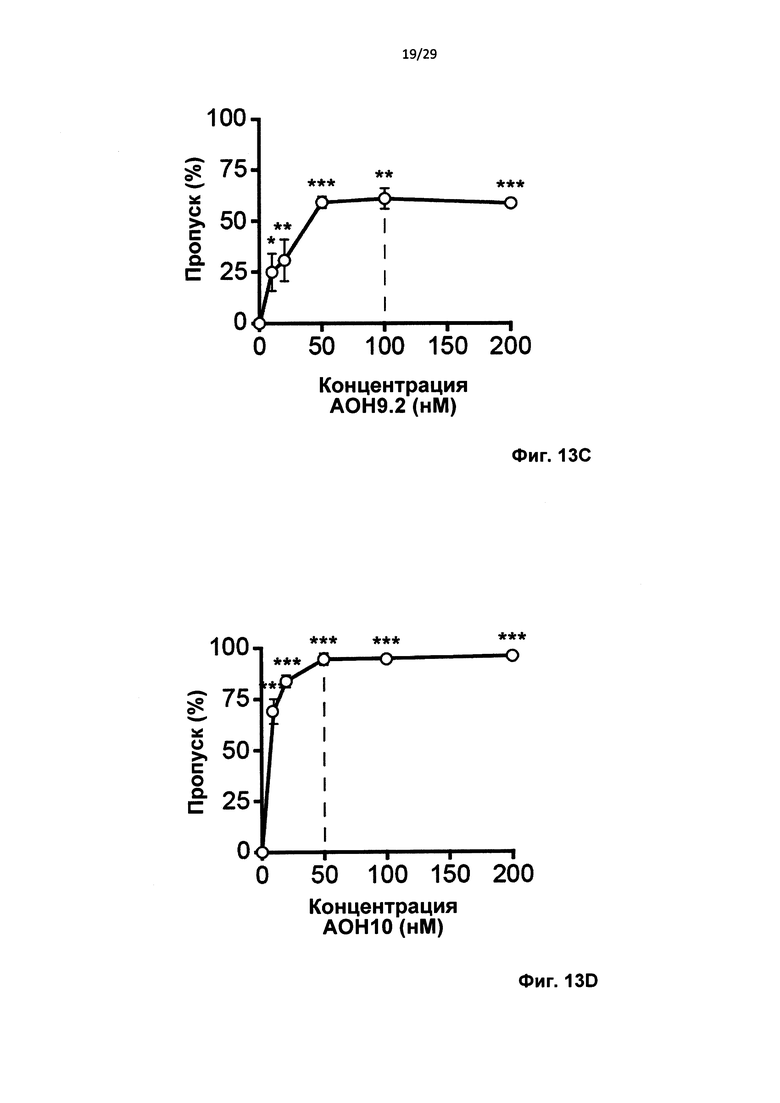
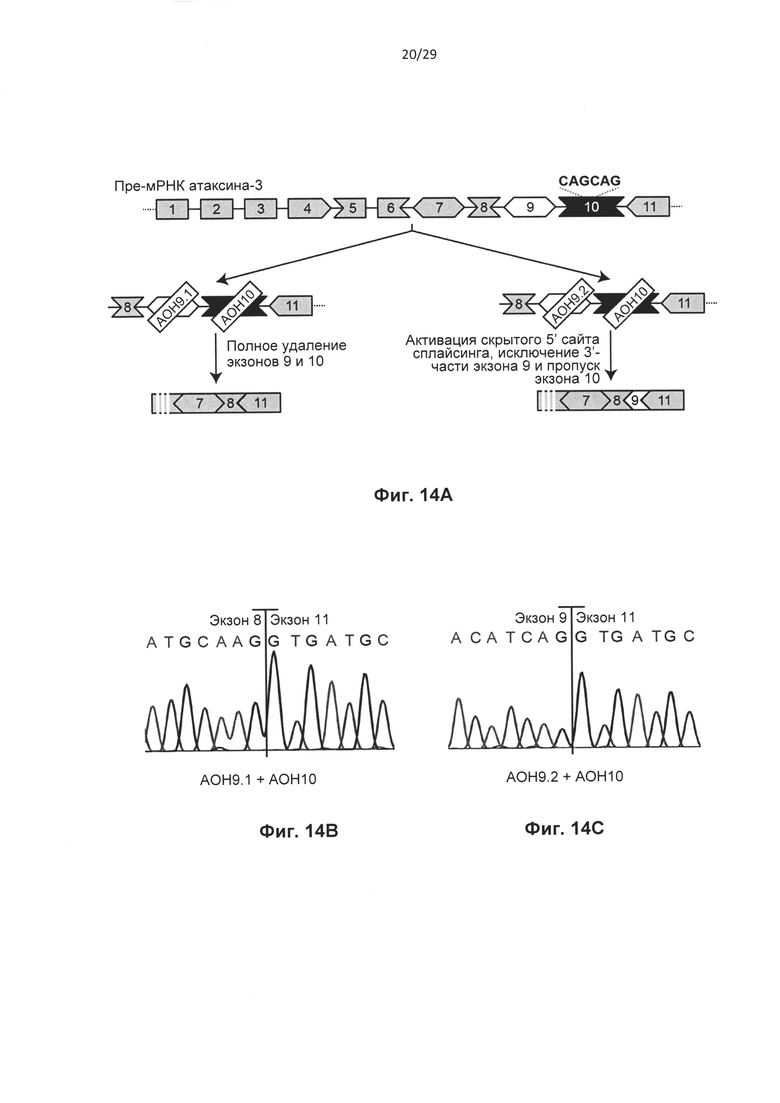
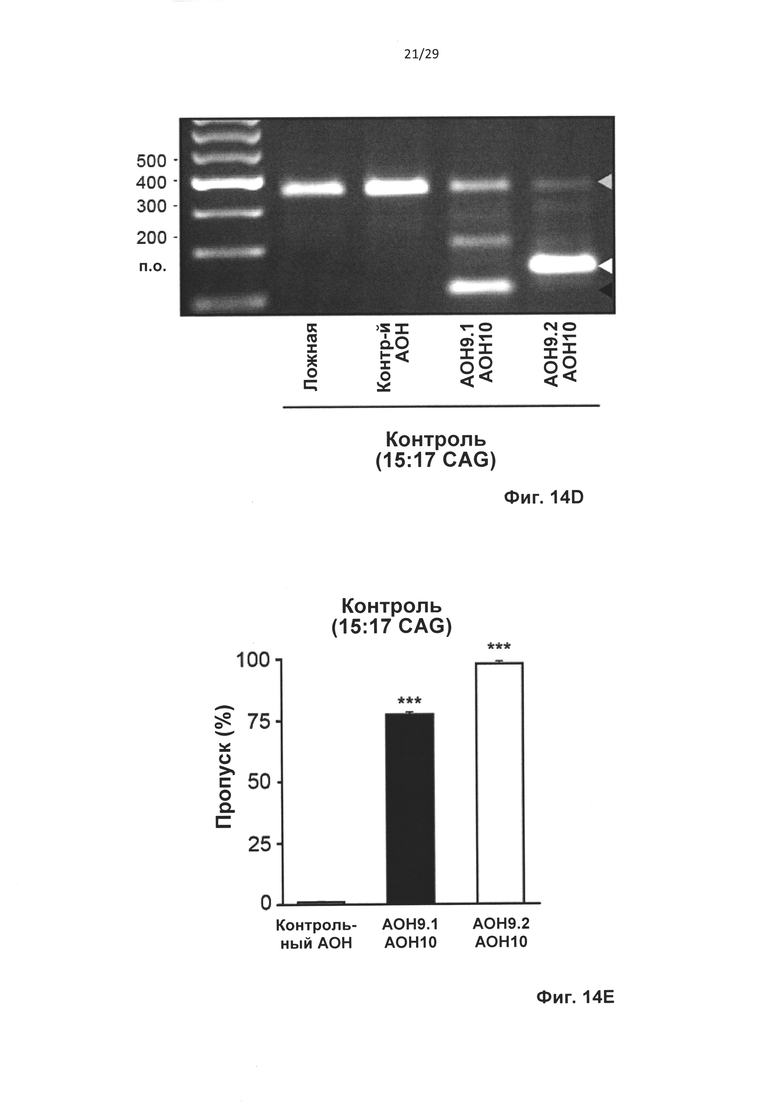

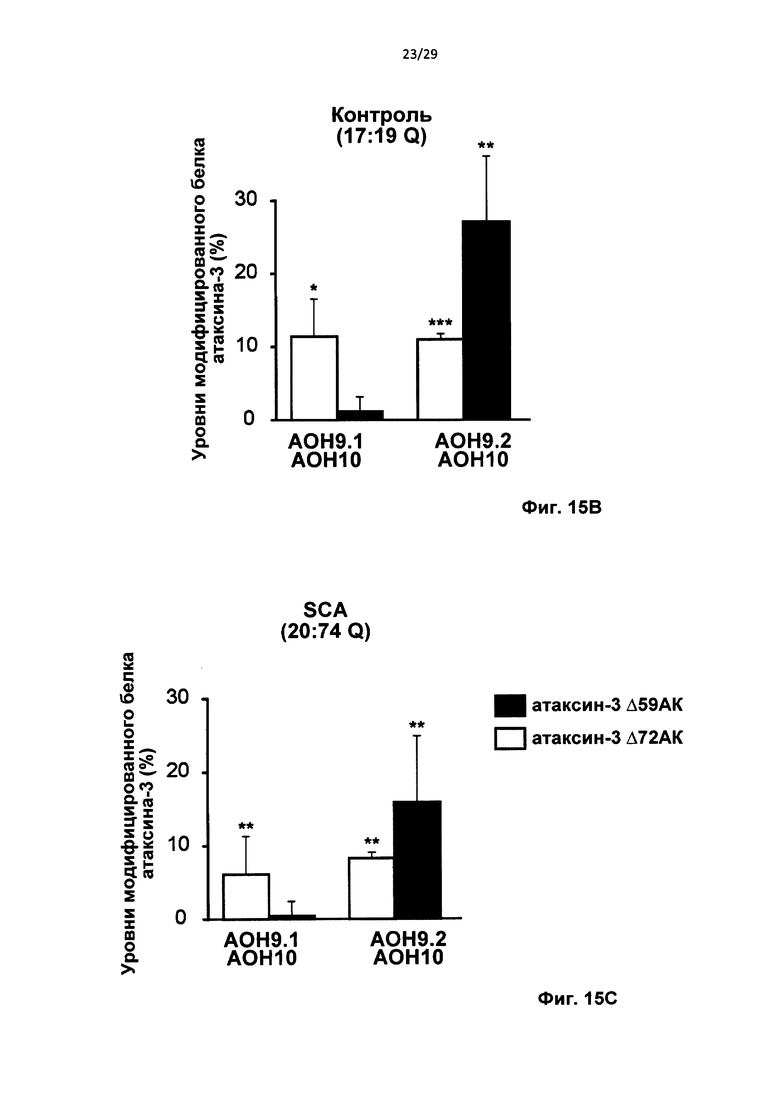
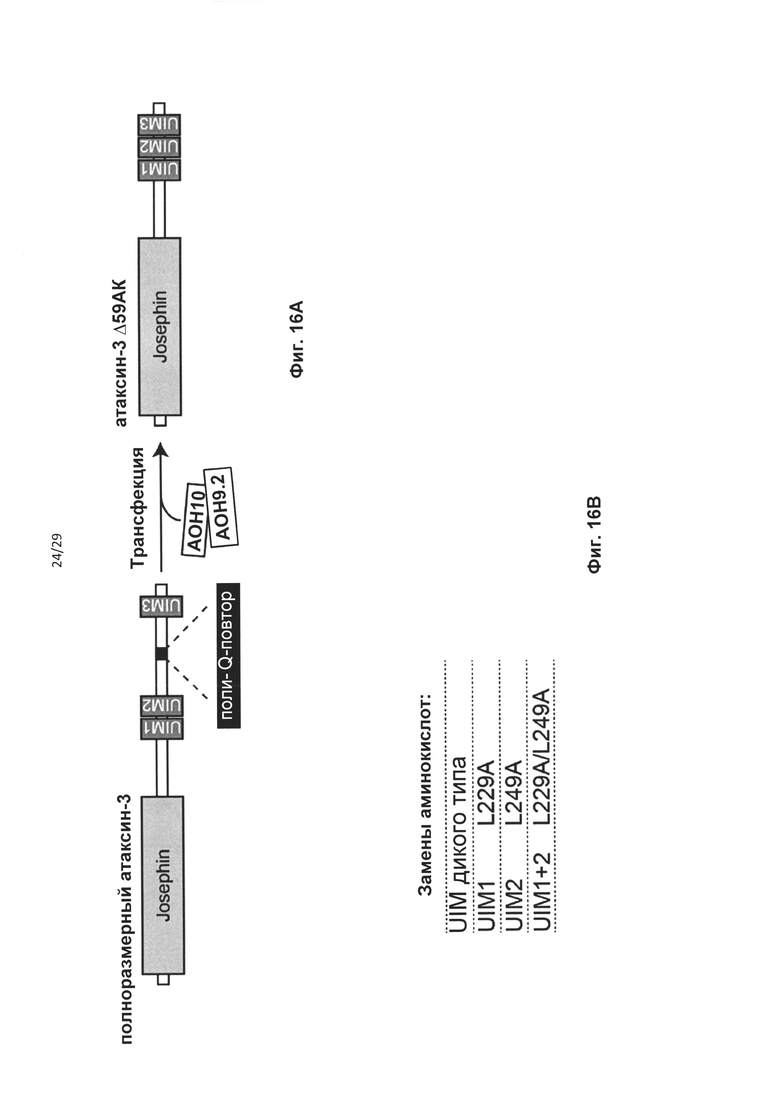
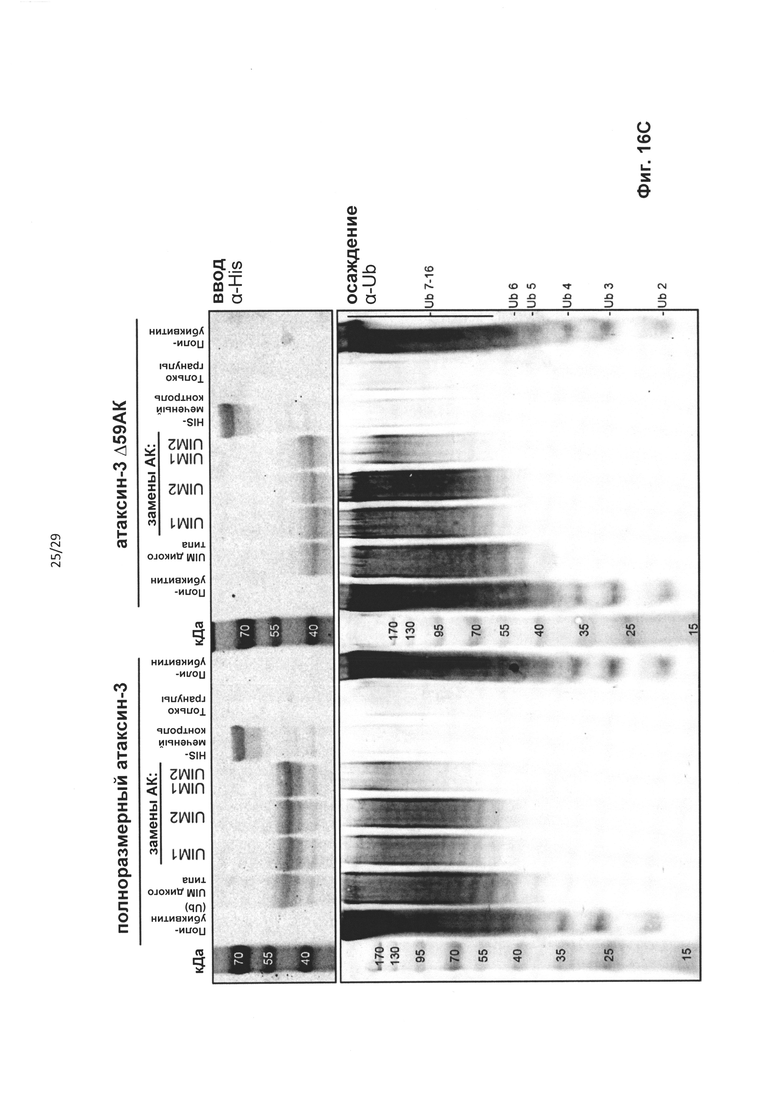
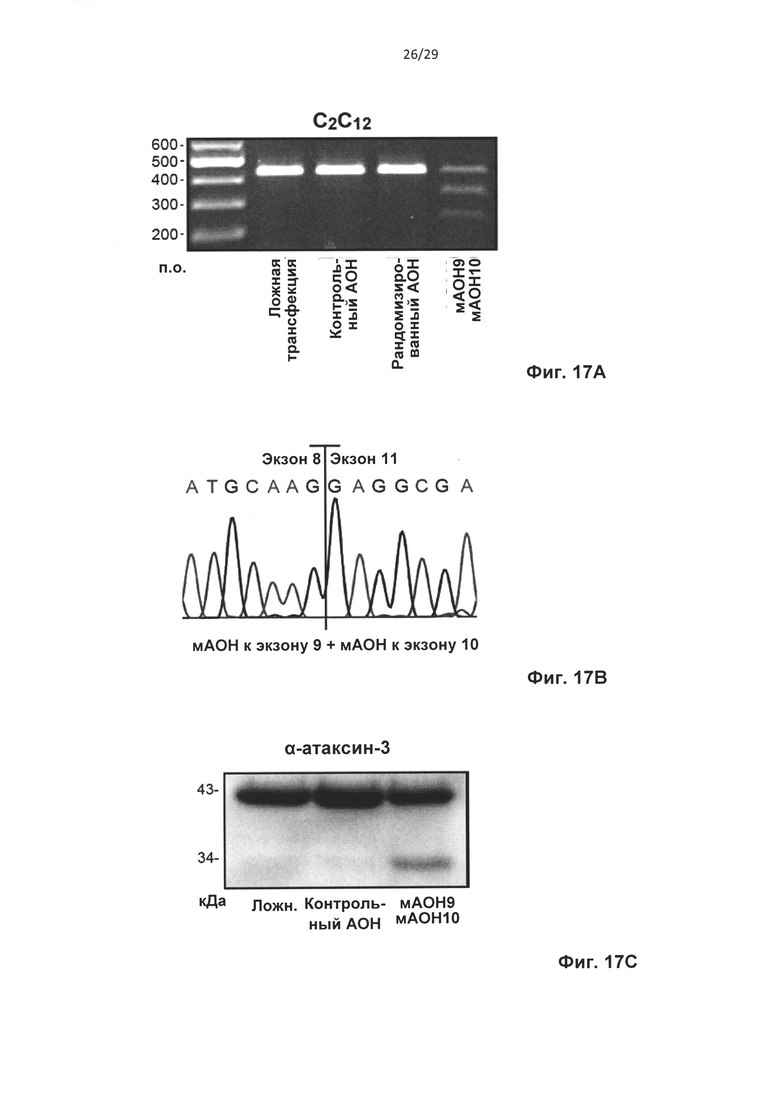
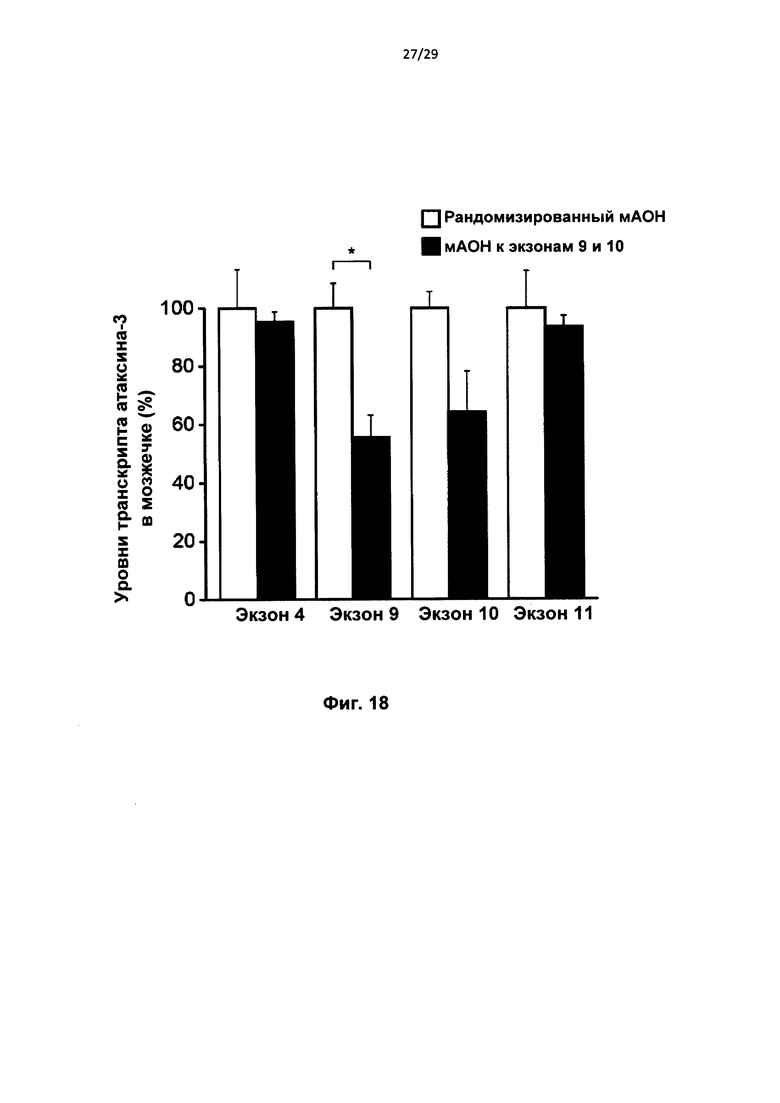
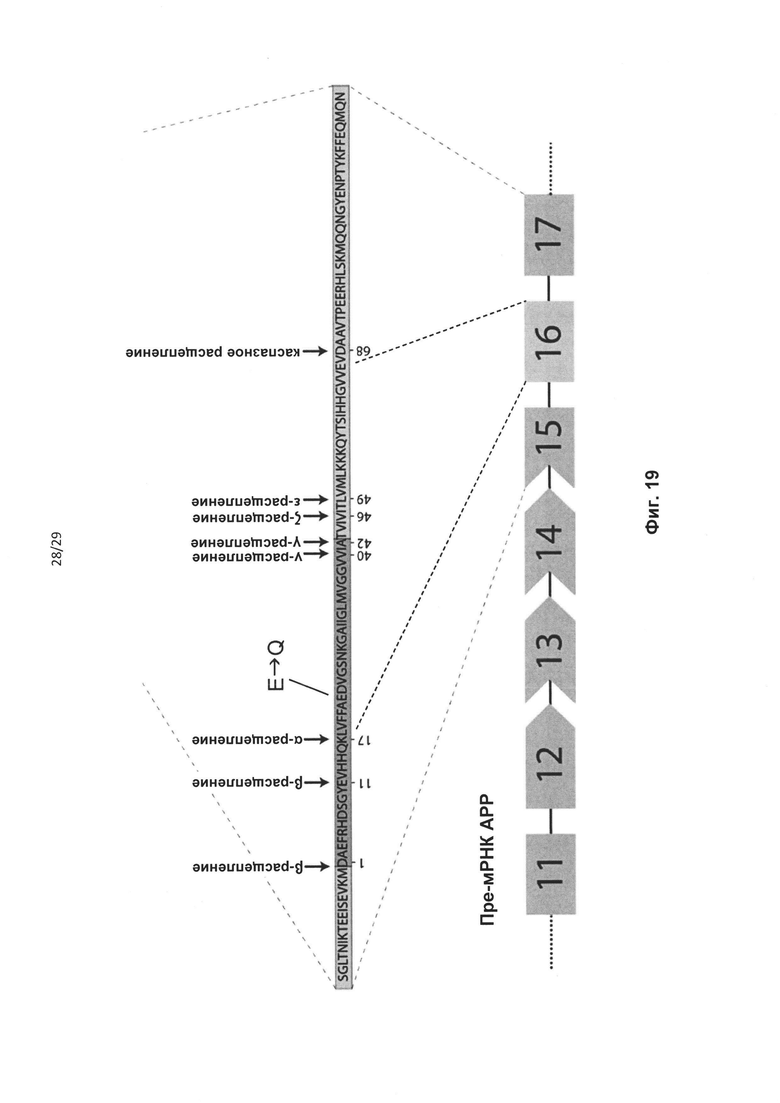
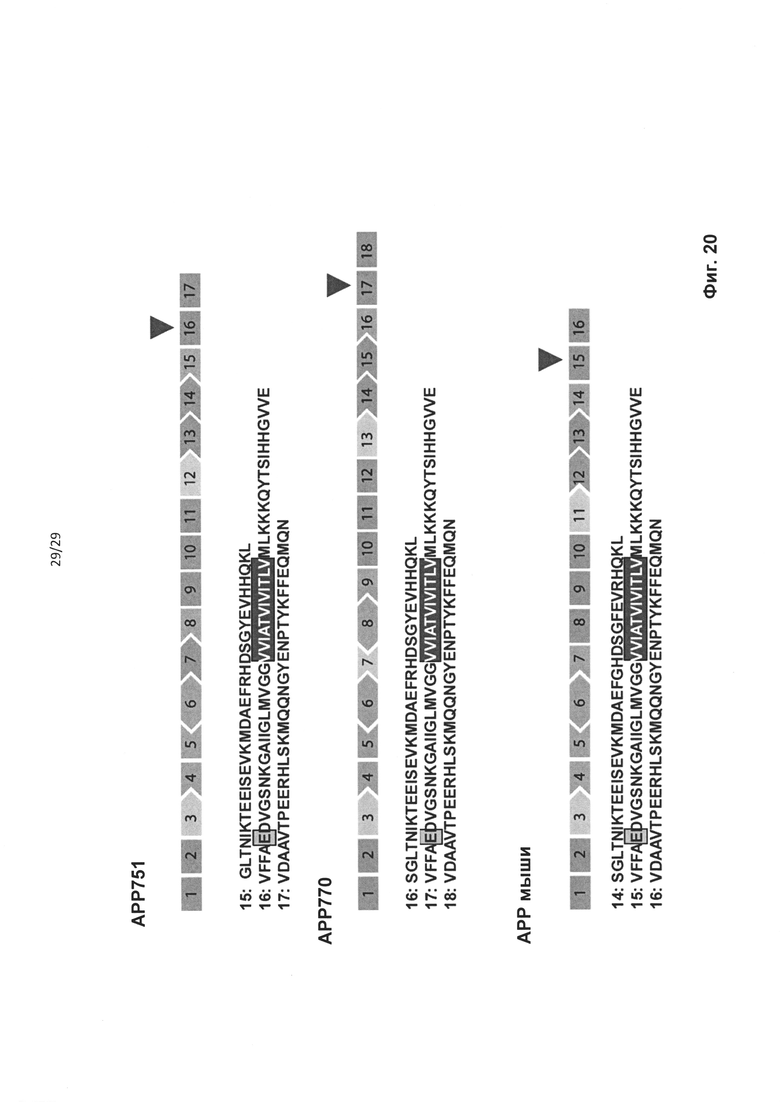
Изобретение относится к биотехнологии, в частности средствам и способам удаления сайта протеолитического расщепления, мутации HCHWA-D или аминокислот, кодируемых увеличенным числом тринуклеотидных повторов, из белка, включающим обеспечение клетки, которая экспрессирует пре-мРНК, кодирующую указанный белок, антисмысловым олигонуклеотидом, который индуцирует пропуск экзонной последовательности, которая содержит указанный сайт протеолитического расщепления, мутацию HCHWA-D или увеличенное число тринуклеотидных повторов соответственно. 3 н. и 3 з.п. ф-лы, 20 ил., 3 табл., 4 пр.
1. Способ лечения индивидуума, страдающего HCHWA-D (наследственная церебральная геморрагия с амилоидозом голландского типа), указанный способ включает введение нуждающемуся в этом индивидууму терапевтически эффективного количества антисмыслового олигонуклеотида, содержащего последовательность, которая является комплементарной внутренней последовательности экзона 16 APP751 человека, при этом указанный антисмысловой олигонуклеотид индуцирует пропуск экзона 16 APP751 человека или пропуск части экзона 16 APP751 человека, которая содержит мутацию HCHWA-D.
2. Способ удаления мутации HCHWA-D из мутантного белка APP, включающий обеспечение клетки, которая экспрессирует пре-мРНК, кодирующую указанный мутантный белок, антисмысловым олигонуклеотидом, при этом указанный способ дополнительно включает возможность трансляции мРНК, полученной из указанной пре-мРНК, причём указанный антисмысловой олигонуклеотид содержит последовательность, которая является комплементарной внутренней последовательности экзона 16 APP751 человека, при этом указанный антисмысловой олигонуклеотид индуцирует пропуск экзона 16 APP751 человека или пропуск части экзона 16 APP751 человека, которая содержит мутацию HCHWA-D.
3. Способ по любому из пп. 1, 2, отличающийся тем, что указанный антисмысловой олигонуклеотид связывается с пре-мРНК APP751 человека с образованием двухцепочечного комплекса нуклеиновых кислот, и при этом указанный антисмысловой олигонуклеотид химически модифицирован для придания указанному двухцепочечному комплексу нуклеиновых кислот устойчивости к РНКазе H.
4. Способ по любому из пп. 1-3, отличающийся тем, что указанный антисмысловой олигонуклеотид содержит нуклеотидную последовательность, выбранную из:
5’-ACCAUGAGUCCAAUGAUUGC-3’
5’-UCACCAAGGUGAUGACGAUC-3’
5’-CACCAUGAUGAAUGGAUGUGUAC-3’
5’-GUUUGAACCCACAUCUUCUGC-3’
5’-CUGUUUCUUCUUCAGCAUCACC-3’
5’-CUACCUCCACCACACCAUGAUGA-3’.
5. Антисмысловой олигонуклеотид, содержащий от 14 до 40 нуклеотидов, где указанный олигонуклеотид содержит последовательность, которая является комплементарной внутренней последовательности экзона 16 APP751 человека, причём указанный олигонуклеотид связывается с пре-мРНК APP751 человека с образованием двухцепочечного комплекса нуклеиновых кислот, и при этом указанный олигонуклеотид химически модифицирован посредством замены одного из не участвующих в образовании связи атомов кислорода в фосфодиэфирной связи для придания указанному двухцепочечному комплексу нуклеиновых кислот устойчивости к РНКазе H, и при этом указанный олигонуклеотид индуцирует пропуск экзона 16 APP751 человека или пропуск части экзона 16 APP751 человека, которая содержит мутацию HCHWA-D.
6. Антисмысловой олигонуклеотид по п. 5, отличающийся тем, что указанный олигонуклеотид содержит нуклеотидную последовательность, выбранную из:
5’-ACCAUGAGUCCAAUGAUUGC-3’
5’-UCACCAAGGUGAUGACGAUC-3’
5’-CACCAUGAUGAAUGGAUGUGUAC-3’
5’-GUUUGAACCCACAUCUUCUGC-3’
5’-CUGUUUCUUCUUCAGCAUCACC-3’
5’-CUACCUCCACCACACCAUGAUGA-3’.
| WO 1994021683 A1, 29.09.1994 | |||
| US 20110044985 A1, 24.02.2011 | |||
| Рамеев В | |||
| ЛЕЧЕНИЕ АМИЛОИДОЗА, Врач, номер 6, 2007 г., стр | |||
| Способ сужения чугунных изделий | 1922 |
|
SU38A1 |
Авторы
Даты
2019-06-25—Публикация
2014-10-07—Подача