Изобретение относится к медицине, терапии наследственных заболеваний и молекулярной биологии и может, в комплексе с направляющей РНК, быть использовано для элиминирования патогенных мутаций митохондриальной ДНК (мтДНК), ассоциированных с различными наследственными митохондриальными патологиями.
Известен «Способ лечения атрофии зрительного нерва различной этиологии» (патент РФ №2375019, A61F 9/007, A61K 35/28, А61Р 27/02, 2003 г.), обеспечивающий улучшение или стойкую стабилизацию зрительных функций на небольшом временном промежутке, поскольку не направлен на коррекцию наследственного материала митохондрий.
Известно изобретение «Митохондриальные таргетные антиоксиданты» (Mitochondrially targeted antioxidants) (патент США № US 6331532, C07F 9/54, C07F 9/572, C07F 9/655, A61K 31/665, A61K 31/66, 1998 г.), которое является технологией импорта функциональных молекул в митохондрии, с использованием липофильных агентов с иммобилизованными молекулами антиоксидантов, но не дает возможности осуществлять редактирование патогенных мутаций в митохондриальной ДНК.
Известно изобретение «Система доставки нуклеиновых кислот в митохондрии» (Mitochondrial nucleic acid delivery systems) (патент Канады № CA 2678572 2008 г. A61K48/00D2, C12N15/864A, C12N15/90B4). Недостатками данной технологии является то, что она не подразумевает доставку в митохондрии белков, поэтому не может быть использована для импорта нуклеазы AsCpf1 в митохондрии, следовательно, не подходит для работы с системой CRISPR/Cpf1.
Из данных отечественной и зарубежной литературы, патентов и патентных заявок авторам не известно использование генетических конструкций на базе системы редактирования генома CRISPR/Cpf1 для элиминирования патогенных мутаций мтДНК путем доставки нуклеазы AsCpf1 в митохондрии; генетические конструкции отличаются модификацией последовательности кодирующей AsCpf1, обеспечивающей доставку данной нуклеазы в митохондрии.
Отличительным признаком изобретения является модификация нуклеазы AsCpf1, обеспечивающая ее доставку в митохондрии для обеспечения универсального механизма для специфической элиминации дефектной мтДНК, несущей ту или иную мутацию. Новизну представляют нуклеотидные последовательности конструкции, которая кодирует модифицированный белок AsCpf1.
Задачей заявляемого изобретения является элиминирование митохондриальной ДНК, содержащей патогенные мутации, ассоциированные с наследственными митохондриальными патологиями.
Поставленная задача решается тем, что генетическая конструкция заявляемого изобретения, после попадания в цитоплазму клеток, обеспечивает экспрессию кодируемых ею молекул нуклеазы AsCpf1, которые, используя собственный аппарат клетки, транспортируются в митохондрии, где обеспечивают элиминирование мутантных молекул мтДНК путем распознавания специфического участка последовательности посредством взаимодействия со специфической направляющей РНК и последующей рестрикцией обеих цепей мтДНК. Поскольку в митохондриях отсутствуют системы репарации двухцепочечных разрывов, такие «разрезанные» мтДНК элиминируются экзонуклеазами. Общий пул мтДНК в митохондриях восстанавливается за счет мтДНК, не имеющих мутации.
Техническим результатом изобретения является обеспечение системы элиминации мутантной мтДНК и способа ее доставки в органеллы.
Принцип функционирования предлагаемых веществ базируется на особенностях работы системы CRISPR/Cpf1. Нуклеаза AsCpf1 взаимодействует с особыми направляющими молекулами РНК, образуя комплекс, который специфически взаимодействует с участком двухцепочечной ДНК комплементарным участку направляющей РНК. В результате такого взаимодействия функциональный домен AsCpf1 вносит разрывы в обе цепи ДНК.
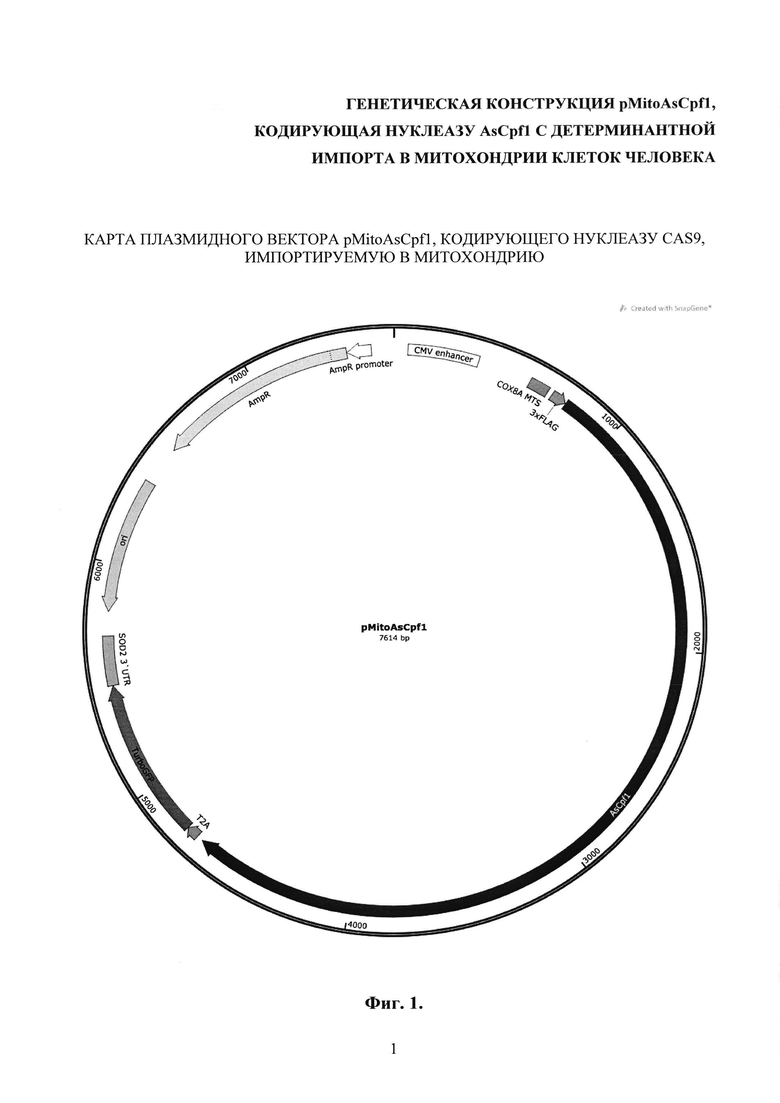
Генетическая конструкция pMitoAsCpf1, кодирующая нуклеазу AsCpf1 с детерминантной импорта в митохондрии клеток человека, представляет собой плазмидные векторы, разработанные на базе векторов pUC19 и pTurboGFP-mito. Плазмидный вектор обеспечивает возможность трансформации компетентных клеток E.coli с последующей наработкой большого количества копий. Позволяют отбирать трансформированные колонии на селективной среде, содержащей антибиотик. Обеспечивают экспрессию нуклеазы AsCpf1 в клетках млекопитающих и человека, а также доставку продуктов трансляции в митохондрии. Проникая в митохондрии, нуклеаза AsCpf1 может быть использована для специфической элиминации мтДНК, содержащей любую из описанных мутаций благодаря взаимодействию с определенной направляющей РНК.
Белок AsCpf1 обладает нуклеазной активностью и имеет два активных центра, каждый их которых участвует в расщеплении одной из цепей двухцепочечной ДНК. Нуклеаза AsCpf1 связывается с направляющей РНК, образуя комплекс. Данный комплекс сканирует молекулу ДНК и в случае обнаружения гомологичной последовательности формирует дуплекс с участком направляющей РНК. После образования дуплекса нуклеаза AsCpf1 вносит разрывы в обе цепи ДНК в определенной структуре дуплекса, названной РАМ (protospacer adjacent motif). Ближайший аналог нуклеазы семейства Cpf1 является нуклеаза Cas9. Последняя, однако, обладает большим размером, в силу чего хуже импортируется в митохондрии.
Генетическая конструкция pMitoAsCpf1 содержит ориджин репликации, ген устойчивости к ампициллину, промотор цитомегаловируса митохондриальную лидерную последовательность гена СОХ8А, 3×FLAG, последовательность, кодирующую модифицированную нуклеазу AsCpf1, Т2А, ген TurboGFP, 3' UTR гена SOD2.
Описание способа получения генетической конструкции заявляемого изобретения.
Карта генетической конструкции pMitoAsCpf1 была построена при помощи программного обеспечения SnapGene. Для сборки использовали фрагменты плазмид pTurboGFP-mito (# FP517, Evrogen), pUC19 и pY010 AsCpf1, а также синтезированные по заказу двухцепочечные фрагменты ДНК - gBloks (IDT, США). Амплификацию фрагментов ДНК проводили при помощи полимеразы PfuTurbo Сх (Agilent Technologies, США) на амплификаторе С1000 Touch (Bio-Rad, США). Олигонуклеотидные праймеры синтезировали с помощью фосфорамидитного метода на AMS-2000 («Биоссет», Россия), очищали методом обращено-фазовой хроматографии на OPS-1000 («Биоссет») с применением реагентов компании «Glen Research» (США). Сборку плазмид осуществляли с использованием ферментативной системы USER (NEB, США), а также классических методов молекулярного клонирования. «Бесшовное» соединение фрагментов ДНК проводили путем сборки по Гибсону (NEB, США) согласно инструкции фирмы производителя.
На фиг. 1 представлена карта генетической конструкции pMitoAsCpf1, кодирующего нуклеазу AsCpf1, импортируемую в митохондрию.
Оценки эффективности заявляемой генетической конструкции для реализации указанного назначения проводилась на культуре клеток.
Клетки выращивали на покровных стеклах 15×15 мм в 12-луночных планшетах. Через 48 ч после трансфекции генетической конструкцией митохондрии окрашивали 150 нМ красителем MitoTracker® Red CMXRos (Life Technologies, США) в течение 30 мин. при 37°C согласно инструкции фирмы-производителя. Далее клетки промывали фосфатно-солевым буфером (PBS), фиксировали в течение 15 мин при комнатной температуре в 4% растворе параформальдегида, приготовленном на PBS, промывали 2 раза по 5 мин раствором PBS, обрабатывали клетки 0,2% Triton Х-100 на PBS в течение 10 мин и промывали клетки 2 раза по 5 мин PBS. Для блокирования неспецифического связывания антител клетки инкубировали в течение 30 мин с 10% раствором бычьего сывороточного альбумина (Sigma, США) в фосфатно-солевом буфере при 37°C. Инкубирование с первичными антителами против эпитопа 3×FLAG (Sigma, США) в разведении 1:500 в 3% BSA проводили при 37°C в течение 2 ч. После трехкратной промывки раствором PBS в течение 5 мин добавляли вторичные антитела (Life Technologies, США), конъюгированные с Alexa Fluor® 488 в разведении 1:500 в 3% BSA на PBS, и инкубировали при 37°C в течение 45 мин. Клетки промывали 3 раза по 5 мин буфером PBS, ядра окрашивали раствором 1 мкг/мл DAPI в PBS в течение 5 мин, промывали два раза по 5 мин в PBS и под покровное стекло наносили по 10 мкл раствора антифейда (90% глицерин, 0,1 М Tris-HCl и 23,3 мг/мл DABCO (1,4диазабисцикло(2,2,2)октан). Изображения получали с помощью инвертированного флуоресцентного микроскопа Axio Observer.Z1 (Carl Zeiss, Германия).
Использование заявляемых генетических конструкций позволяет осуществлять терапию наследственных митохондриальных патологий.





Изобретение относится к биотехнологии, медицине и терапии наследственных заболеваний. Предложена генетическая конструкция pMitoAsCpfl, обеспечивающая экспрессию нуклеазы AsCpfl, специфически импортируемую в митохондрии клеток человека. Указанная конструкция содержит промотор цитомегаловируса, митохондриальную лидерную последовательность гена СОХ8А, 3xFLAG, нуклеазу AsCpfl с SEQ ID NO:1, Т2А, ген TurboGFP, 3’-UTR гена SOD2, ориджин репликации, ген устойчивости к ампицилину. Изобретение может быть использовано для элиминирования митохондриальной ДНК, содержащей патогенные мутации, ассоциированные с наследственными митохондриальными патологиями. 1 ил.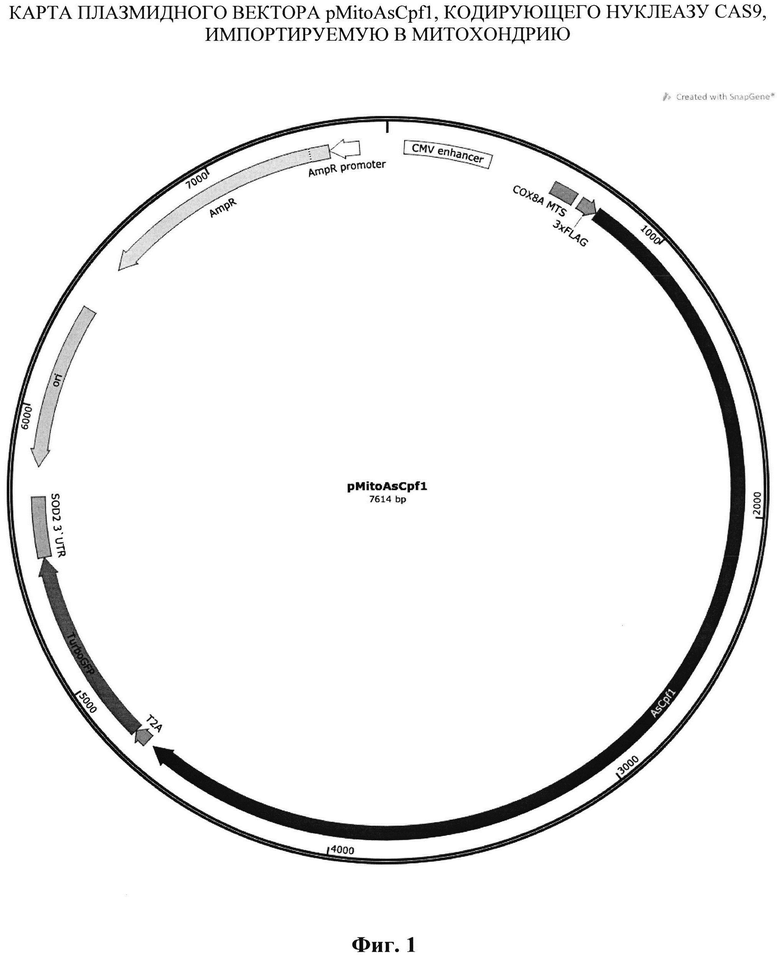
Генетическая конструкция pMitoAsCpfl, обеспечивающая экспрессию нуклеазы AsCpfl, специфически импортируемую в митохондрии клеток человека, представленная на фиг. 1 и содержащая промотор цитомегаловируса, митохондриальную лидерную последовательность гена СОХ8А, 3xFLAG, нуклеазу AsCpfl с SEQ ID NO:1, Т2А, ген TurboGFP, 3'-UTR гена SOD2, ориджин репликации, ген устойчивости к ампицилину.
| ОРИЩЕНКО К.Е | |||
| и др | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Облицовка комнатных печей | 1918 |
|
SU100A1 |
| СПОСОБ ДЛЯ УПРАВЛЕНИЯ ОРИЕНТАЦИЕЙ МОБИЛЬНОЙ ВИДЕОКАМЕРЫ, ПОДХОДЯЩЕЙ ДЛЯ СЪЕМКИ ПАРЫ СПОРТСМЕНОВ, ДВИГАЮЩИХСЯ ПО ИГРОВОМУ ПОЛЮ, И СООТВЕТСТВУЮЩАЯ СИСТЕМА ДЛЯ СЪЕМКИ ДВИГАЮЩИХСЯ СПОРТСМЕНОВ | 2014 |
|
RU2678572C2 |
| RAN F.A | |||
| ET AL | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| 2281-2308 | |||
| JO A | |||
| ET AL | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| SHMAKOV S | |||
| ET AL | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
Авторы
Даты
2018-07-31—Публикация
2016-10-14—Подача