ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу ингибирования экспрессии интерлейкина-22 активированными и дифференцированными T-клетками человека, а также к фармацевтической композиции для применения по способу.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
Фосфодиэстеразы являются ферментами, которые катализируют гидролиз циклического АМФ и/или циклического GMP в клетках в 5-АМФ и 5-GMP, соответственно, и как таковые они являются критическими для клеточной регуляции уровней цАМФ или cGMP. Из 11 фосфодиэстераз, идентифицированных к настоящему времени, фосфодиэстераза (PDE) 4, PDE7 и PDE8 являются селективными для цАМФ. PDE4 является наиболее важным модулятором цАМФ, экспрессируемого в иммунных и воспалительных клетках, таких как нейтрофилы, макрофаги и T-лимфоциты (Z. Huang и J. A. Mancini, Current Med. Chem. 13, 2006, pp. 3253-3262). Поскольку цАМФ является ключевым вторичным мессенджером при модуляции воспалительных ответов, было обнаружено, что PDE4 регулирует воспалительные ответы воспалительных клеток посредством модулирования провоспалительных цитокинов, таких как TNFα, IL-2, IFN-y, GM-CSF и LTB4. Ингибирование PDE4 таким образом становится важной мишенью для терапии воспалительных заболеваний, таких как астма, хроническое обструктивное заболевание легких (COPD), ревматоидный артрит, атопический дерматит, болезнь Крона и т.д. (M.D. Houslay et al., Drug Discovery Today 10 (22), 2005, pp. 1503-1519; N. Press & K.H. Banner, Progress in Medicinal 47 Chemistry 2009, pp. 37-74). Поскольку пациенты с атопическим дерматитом (AD) имеют увеличенную активность PDE, ингибирование PDE4 также окажется полноценным лечением AD (Journal of Investigative Dermatology (1986), 87(3), 372-6; N. Ishii et al., J. Pharmacol. Exper. Ter. 346, 2013, pp. 105-112).
Семейство генов PDE4 состоит по меньшей мере из четырех генов, A, B, C и D, которые имеют высокую степень гомологии (V. Boswell Smith и D. Spina, Curr. Opinion Investig. Drug 6(11), 2006, pp. 1136-1141). Четыре изоформы PDE4 дифференциально экспрессируются в различных тканях и типах клеток. Таким образом, PDE4B преимущественно экспрессируется в моноцитах и нейтрофилах, но не в кортексе и эпителиальных клетках, тогда как PDE4D экспрессируется в легком, кортексе, мозжечке и T-клетках (C. Kroegel и M. Foerster, Exp. Opinion Investig. Drug 16(1), 2007, pp. 109-124).
Многочисленные ингибиторы PDE4 исследовали на предмет терапевтического эффекта на воспалительные заболевания, преимущественно астму, воспалительное заболевание кишечника и COPD. Первый из них, теофиллин, является слабым, неселективным ингибитором фосфодиэстеразы, применяемым при лечении респираторных заболеваний, таких как астма и COPD. Лечение посредством теофиллина может, однако давать начало как умеренным, так и тяжелым неблагоприятным эффектам, например, аритмии и конвульсиям, ограничивая клиническое использование теофиллина (Kroegel и Foerster, выше). Поскольку фосфодиэстераза 4 осталась главной мишенью для противовоспалительной терапии, несколько других, более селективных ингибиторов PDE4 было разработано и исследовано в клинических условиях. Клиническое развитие многих ингибиторов PDE4 первого поколения, таких как ролипрам, было прервано из-за связанных с дозировкой побочных эффектов, преимущественно тошноты и рвоты. Ингибиторы PDE4 второго поколения с очевидно менее выраженными неблагоприятными эффектами находятся в настоящее время в стадии клинических испытаний (Houslay, выше).
Соединения, которые демонстрируют ингибирующую активность PDE4, были предложены в качестве терапевтических средств для системного лечения воспалительных аллергических заболеваний, таких как бронхиальная астма, COPD, аллергический ринит, и нефрит; аутоиммунных заболеваний, таких как ревматоидный артрит, рассеянный склероз, болезнь Крона и системная красная волчанка; заболеваний центральной нервной системы, таких как депрессия, амнезия и деменция; органопатологии, связанной с ишемическим рефлюксом, вызванным сердечным приступом, шоком и цереброваскулярным заболеванием и т.п.; инсулин-резистентного диабета; ран; и других заболеваний, где воспаление играет роль в этиологии или прогрессировании заболевания.
Соединения, которые демонстрируют ингибирующую активность PDE4, могут также быть предпочтительными при предотвращении, лечении или улучшении состояния ряда кожных заболеваний или состояний, таких как пролиферативные и воспалительные кожные заболевания и в частности псориаз, эпидермальное воспаление, алопеция, атрофия кожи, атрофия кожи, вызванная стероидами, старение кожи, фотостарение кожи, акне, дерматит, атопический дерматит, себорейный дерматит, контактный дерматит, крапивница, зуд и экзема.
Одним из патогенных процессов, лежащих в основе развития псориаза, является инфильтрация кожи активированными иммунными клетками, такими как Th1 и Th17 клетки, экспрессирующие цитокины, которые вызывают постоянный воспалительный цикл в псориатических бляшках. В частности, было продемонстрировано, что цитокины TNFα, IL-17 и IL-22 обладают решающей важностью для начала и прогрессирования псориаза. Анализ in vitro с применением T-клеток периферической крови человека, которые были активированы и дифференцированы в фенотип Th1/Th17, был проведен для оценки противовоспалительного эффекта тестируемых соединений посредством измерения их эффекта на экспрессию цитокина.
Во время исследования, ведущего к настоящему изобретению, к удивлению, было отмечено, что, когда ингибиторы PDE4 тестировали в Th1/Th17 анализе, они повышали регуляцию экспрессии провоспалительного цитокина IL-22 и, в меньшей степени, IL-17. Экспрессия IL-22 сильно активирована у пациентов с псориазом и атопическим дерматитом, подчеркивая его роль в хронических кожных воспалительных состояниях. Посредством его рецептора, который экспрессируется клетками негемапоэтического происхождения, такими как эпителиальные клетки, включая кератиноциты, эндотелиальные клетки и фибробласты, IL-22 играет важную роль в индукции измененной пролиферации и дифференцировке кератиноцитов и для экспрессии воспалительных молекул, таких как MHC класса I, IL-6 и IL-8, таким образом, способствуя кожному воспалению. Неожидаемая активация провоспалительных цитокинов посредством соединений, которые обладают терапевтическим потенциалом в качестве противовоспалительных лекарственных средств, представляет оптимальное решения для сопутствующего лечения с другим терапевтически активным соединением, способным снижать экспрессию IL-22.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Было обнаружено, что агонист рецептора витамина D кальципотриол способен к сильному ингибированию экспрессии IL-22 в анализе in vitro с применением активированных T-клеток человека, дифференцированных в клетки Th1/Th17. Когда кальципотриол тестировали совместно с рядом ингибиторов PDE4, в этом анализе положительная регуляция IL-22, опосредованная ингибиторами PDE4, была нейтрализована, в то время как ингибирующее действие ингибиторов PDE4 на другие провоспалительные цитокины, особенно TNFα, неожиданным образом сохранялось.
Таким образом, в одном из аспектов настоящее изобретение относится к способу ингибирования активации экспрессии провоспалительного цитокина интерлейкин-22 (IL-22) активированными и дифференцированными T-клетками человека, причем указанная активация была индуцирована введением терапевтически эффективного количества ингибитора фосфодиэстеразы 4 (PDE4), способу, содержащему введение, или последовательно или одновременно с введением ингибитора PDE4, агониста рецептора витамина D в количестве, достаточном для ингибирования активации экспрессии IL-22.
В другом аспекте изобретение относится к фармацевтической композиции для применения при лечения воспалительных заболеваний или состояний, содержащей терапевтически эффективное количество ингибитора PDE4 и агониста рецептора витамина D в количестве, достаточном для ингибирования активации экспрессии провоспалительного цитокина IL-22, индуцированного посредством введения ингибитора PDE4, а также фармацевтически приемлемый носитель или переносчик.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 является графиком, на котором представлена активация экспрессии IL-22 в Th1/Th17 клетках посредством семи ингибиторов PDE4 в клиническом испытании в концентрации 1 мкМ.
Фиг. 2 является графиком, на котором представлена зависимая от дозы положительная регуляция экспрессии IL-22 в Th1/Th17 клетках посредством соединения A.
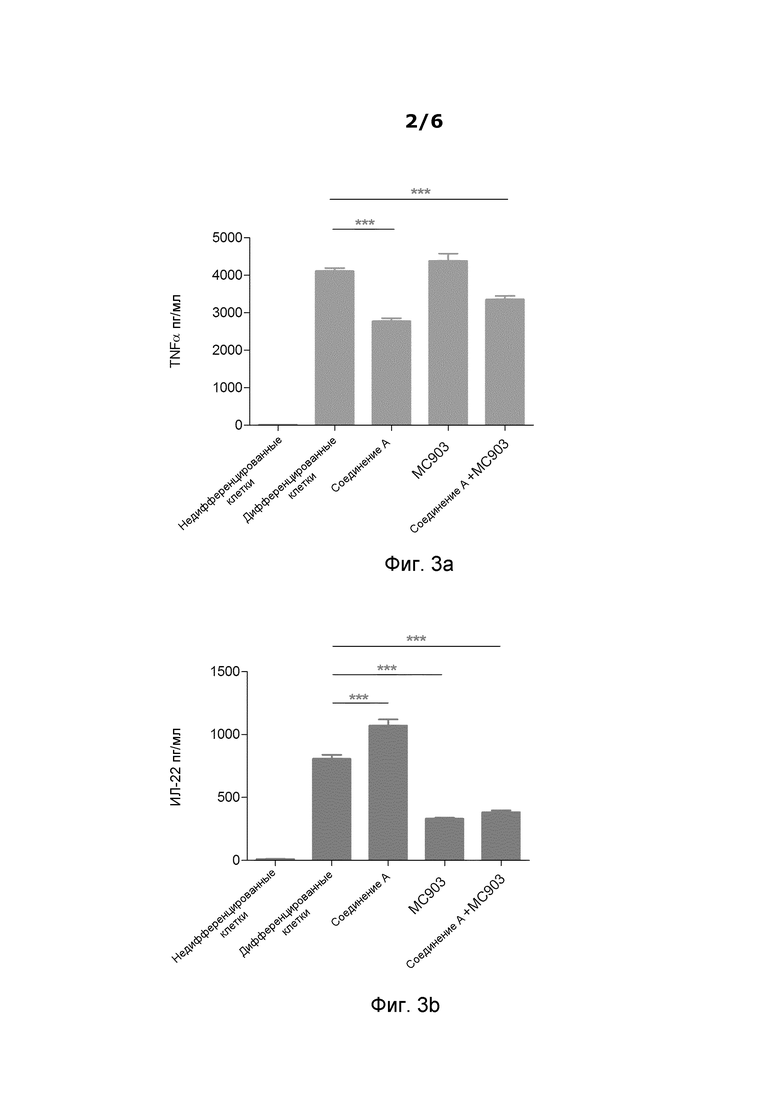
Фиг.3 является графиком, на котором представлен эффект на экспрессию Th1/Th17 клетками TNFα (Фиг. 3a) и IL-22 (Фиг. 3b) кальципотриола в концентрации 120 нМ и соединения A в концентрации 5,6 мкМ в отдельности и в комбинации. "MC 903" является кальципотриолом.
Фиг. 4 является графиком, на котором представлен эффект на экспрессию IL-22 Th1/Th17 клетками кальципотриола в концентрации 100 нМ и пяти различных ингибиторов PDE4 в концентрации 1 мкМ в отдельности или в комбинации. "MC 903" является кальципотриолом.
Фиг. 5 является графиком, на котором представлен эффект на экспрессию IL-22 Th1/Th17 клетках кальципотриола в концентрации 100 нМ и семи различных ингибиторов PDE4 в концентрации 1 мкМ в отдельности или в комбинации. "Кальцип" является кальципотриолом.
Фиг. 6 является графиком, на котором представлен эффект на экспрессию IL-22 Th1/Th17 клетками соединения A в концентрации 1 мкМ в отдельности или в комбинации с четырьмя различными аналогами витамина D в концентрации 100 нМ.
Фиг. 7 является графиком, на котором представлен эффект различных концентраций кальципотриола (MC903) на экспрессию IL-22 Th1/Th17 клетками в присутствии или отсутствии соединения A в концентрации 1 мкМ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В настоящем контексте термин "агонист рецептора витамина D" (или для краткости "агонист витамина D") предназначен обозначать биологически активное соединение, которое стимулирует активность рецептора витамина D. Агонисты рецептора витамина D можно выбирать из натуральных производных витамина D или синтетических аналогов витамин D. Кальцитриол, кальципотриол, максакальцитол и такальцитол являются примерами агонистов рецептора витамина D, которые, как было обнаружено, отрицательно регулируют экспрессию IL-22 в Th1/Th17 анализе, описываемом в настоящем документе (см. Фиг. 6).
"Кальципотриол" является аналогом витамина D по формуле

Было обнаружено, что кальципотриол существует в двух кристаллических формах, ангидрат и моногидрат. Моногидрат кальципотриола и его получение описаны в WO 94/15912. Термин "кальципотриол" предназначен включать все формы соединения.
"Рофлумиласт" является соединением 3-(циклопропилметокси)-N-(3,5-дихлорпиридин-4-ил)4-(дифторметокси)бензамид.
‘Тетомиласт" является соединением 6-[2-(3,4-диэтоксифенил)тиазол-4-ил]пиридин-2-карбоксильная кислота.
"GSK-256066 является соединением 6-[3-(N,N-диметилкарбамоил)фенилсульфонил]-4-(3-метоксифениламино)-8-метилхинолин-3-карбоксамид гидрохлорид.
"Оглемиласт" является соединением N-(3,5-дихлорпиридин-4-ил)-4-(дифлюорометокси)-8-метилсульфониламидо)дибензо(b,d)фуран-1-карбоксамид.
"Апремиласт" является соединением (+)-N-[2-[1(S)-(3-этокси-4-метилфенил)-2-(метилсульфонил)этил]-1,3-диоксо-2,3-дигидро-1H-изоиндол-4-ил]ацетамид.
"AN2728" является соединением 4-(1-гидрокси-1,3-дигидро-2,1-бензоксаборол-5-илокси)бензонитрил.
Соединение A является соединением 2-{6-[2-(2,3-дихлорпиридин-4-ил)ацетил]-2,3-диметоксифенокси}-N-пропилацетамид.
Соединение B является соединением N-бензил-2-{6-[2-(3,5-дихлорпиридин-4-ил)ацетил]-2,3-диметоксифенокси}ацетамид.
Соединение C является соединением 2-(3,5-дихлорпиридин-4-ил)1-{2-[2-(4-фторфенил)этокси]-3,4-диметоксифенил}этанона.
Соединение D является соединением 2-(3,5-дихлорпиридин-4-ил)-1-{9-метокси-спиро[2H-l,5-бензодиоксепин-3(4H),3'-оксетан]-6-ил}этанон.
Соединение E является соединением 2-{6-[2-(3,5-дихлорпиридин-4-ил)ацетил]-2,3-диметоксифенокси}-N-(2-диметиламиноэтил)ацетамид.
Термин "положительная регуляция экспрессии IL-22" предназначен для обозначения как положительной регуляции экспрессии IL-22 в дифференцированных, но не подвергавшихся воздействию Т-клеток (Th1/Th17 клетки), так и дополнительно положительной регуляции экспрессии IL-22 в дифференцированных T-клетках, подвергавшихся воздействию ингибитора PDE4.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
При псориатических кожных поражениях дендритные клетки и T-клетки взаимодействуют друг с другом и с кератиноцитами, чтобы связать врожденный и приобретенный иммунный ответ посредством сложной сети цитокинов, которая определяет псориаз на молекулярном уровне. Ключевые цитокины, образующиеся в псориатической коже посредством врожденных имунных клеток, в частности воспалительных дендритных клеток, являются TNFα, а также IL-12 и IL-23, каждый из которых играет важную роль в дифференцировке или росте T-клеток в Th1 или Th17 клетки, соответственно. Th1 клетки традиционно характеризуются образованием IFN-γ, в то время как Th17 клетки продуцируют сигнатурные цитокины IL-17, IL-22 и IL-26. Важность этих ключевых посредников патогенеза псориаза подтвердили посредством успешного таргетинга с применением биологических препаратов против TNFα, IL-17 и IL-12/IL-23 в клинике.
Принимая во внимание важную роль субпопуляции Th17 при псориазе и других хронических иммуно-обусловленных воспалительных заболеваниях, таких как псориатический артрит, ревматоидный артрит, рассеянный склероз и воспалительное заболевание кишечника, проводили клеточный анализ in vitro с применением активированных T-клеток человека, дифференцированных в клетки Th1/Th17 посредством цитокинового окружения, которое организовывает программу дифференцировки посредством активации линейных/фенотип-специфических факторов транскрипции, в то же время сопутствующие подавляющие факторы, ответственные за индукцию субпопуляций хелперных T-клеток (см. пример 1 ниже). Полученные клетки Th1/Th17 применяли для тестирования на предмет эффекта различных уровней дозирования и соотношений дозирования двух активных ингредиентов посредством сравнения уровней экспрессии провоспалительных цитокинов IL-6, IL-8, IL-17, IL-22 и TNF-α, полученных в результате применения различных тестовых концентраций индивидуально или вместе.
В одном из вариантов осуществления агонист рецептора витамина D может быть выбран из группы, состоящей из кальципотриола, кальцитриола, альфакальцидола, такальцитола, максакальцитола и парикальцитола. В предпочтительном в настоящее время варианте осуществления для местного применения агонистом рецептора витамина D является моногидрат кальципотриола или кальципотриола.
Поскольку положительная регуляция IL-22 посредством ингибиторов PDE4 представляет собой класс-специфический эффект, см. Фиг. 1 ниже, ингибитор PDE4 можно выбирать из широкого диапазона известных ингибиторов PDE4, таких как выбранные из группы рофлумиласт, GSK256066, оглемиласт, тетомиласт, апремиласт, AN2728, соединение A, соединение B, соединение C, соединение D и соединение E. В предпочтительном в настоящее время варианте осуществления, ингибитором PDE4 является соединение A (2-{6-[2-(2,3-дихлорпиридин-4-ил)ацетил]-2,3-диметоксифенокси}-N-пропилацетамид) и соединение D (2-(3,5-дихлорпиридин-4-ил)-1-{9-метокси-спиро[2H-1,5-бензодиоксепин-3(41-1),3'-оксетан]-6-ил}этанон).
Настоящий способ является подходящим для лечения воспалительного заболевания или состояния. В клеточном анализе, описанном в примере 1 ниже, было показано, что co-введение кальципотриола и соединения A приводит к широкому ингибированию цитокина в Th1/Th17 клетках. Ингибирование TNFα и IL-6 посредством соединения A и ингибирование IL-22, IL-17 и IL-8 посредством кальципотриола поддерживали посредством комбинированного лечения. Наиболее предпочтительно, co-введение кальципотриола приводило к негативной регуляции экспрессии IL-22, опосредованной соединением A и другими ингибиторами PDE4. Таким образом, существует мнение, что со-введение ингибиторов PDE4 и агонистов рецептора витамина D может приводить к значительно повышенному противовоспалительному эффекту ингибитора PDE4, при условии, что он представляет эффективную альтернативу стероидному лечению. Результаты, представленные на Фиг. 7 ниже, демонстрируют, что эффект кальципотриола на экспрессию IL-22 можно получать при гораздо более низкой концентраций, чем требуется для влияния на пролиферацию кератиноцитов. Это предполагает, что комбинацию ингибитора PDE4 и агониста рецептора витамина D можно использовать при лечении состояний, где противовоспалительный эффект необходим без сопутствующего влияния на пролиферацию кератиноцитов.
Примерами воспалительных заболеваний или состояний, которые можно было бы лечить посредством комбинации ингибитора PDE4 и агониста рецептора витамина D, являются воспалительные аллергические заболевания, такие как бронхиальная астма, COPD, аллергический ринит и нефрит; аутоиммунные заболевания, такие как ревматоидный артрит, рассеянный склероз, болезнь Крона и системная красная волчанка; органопатия, связанная с ишемическим рефлюксом, вызванным сердечным приступом, шоком, и цереброваскулярными заболеваниями и т.п.; инсулин-резистентный диабет; раны; и другие заболевания, где воспаление играет роль в этиологии или прогрессировании заболевания. Применение настоящего способа при лечении иммунообусловленных воспалительных заболеваний, таких как псориаз, псориатический артрит, ревматоидный артрит, рассеянный склероз и воспалительное заболевание кишечника, представляет особый интерес.
В предпочтительном в настоящее время варианте осуществления, настоящий способ можно использовать при лечении воспалительного кожного заболевания или состояния. Примерами воспалительных кожных заболеваний или состояний, которые предпочтительно можно лечить с применением комбинации ингибитора PDE4 и агониста рецептора витамина D, являются псориаз, эпидермальное воспаление, алопеция, атрофия кожи, атрофия кожи, вызванная стероидами, старение кожи, фотостарение кожи, акне, дерматит, атопический дерматит, себорейный дерматит, контактный дерматит, крапивница, зуд и экзема. Особый интерес представляет способ лечения воспалительных кожных заболеваний или состояний, выбранных из кожных заболеваний, при которых положительная регуляция экспрессии IL-22 играет важную роль, такую как псориаз или атопический дерматит.
На основе результатов, представленных на Фиг. 7 ниже, в настоящее время предполагают, что концентрация агониста рецептора витамина D, достаточная для ингибирования положительной регуляции экспрессии IL-22 посредством ингибитора PDE4, может быть более, чем в 10 раз ниже, чем терапевтически эффективная концентрация ингибитора PDE4. В настоящее время предполагают, что концентрация агониста рецептора витамина D может быть более чем в 25 раз, более чем в 50 раз, более чем в 100 раз, более чем в 250 раз, более чем в 500 раз, более чем в 750 раз, или более чем в 1000 раз ниже, чем концентрация ингибитора PDE4.
Таким образом, когда концентрация ингибитора PDE4 в анализе составляет 1 мкМ, концентрация агониста рецептора витамина D, достаточного для ингибирования положительной регуляции экспрессии IL-22 посредством ингибитора PDE4, может быть 100 нМ или меньше. Концентрация агониста рецептора витамина D может быть подходящим способом находиться в диапазоне 100 нМ - 100 пМ (при концентрации ингибитора PDE4 1 мкМ). Более конкретно, концентрация агониста рецептора витамина D может составлять 75 нМ, 50 нМ, 40 нМ, 30 нМ, 25 нМ, 20 нМ, 10 нМ, 5 нМ, 1 нМ, 0,5 нМ или 0,1 нМ.
Фармацевтическая композиция для применения в настоящем способе включает терапевтически эффективное количество ингибитора PDE4 и агониста рецептора витамина D в количестве, достаточном для ингибирования положительной регуляции экспрессии IL-22, индуцированной посредством введения ингибитора PDE4, а также фармацевтически приемлемого носителя или переносчика.
Подходящие композиции включают, например, композиции в форме, подходящей для перорального (включая с пролонгированным и медленным высвобождением), трансдермального, офтальмологического, местного, дермального, назального или буккального введения. Местное введение заявленной композиции является особенно подходящим при лечении воспалительного кожного заболевания или состояния.
Композиции можно получать посредством любых способов, хорошо известных специалисту в области фармацевтики, например, как описано в Remington, The Science и Practice of Pharmacy, 20th ed., 2000. Все способы включают этап приведения активных ингредиентов в связь с носителем, который содержит один или несколько эксципиентов. В основном, композиции получают посредством равномерного и тщательного приведения активных ингредиентов в связь с жидким носителем или мелко измельченным твердым носителем или обоими, а затем, при необходимости, формулируя продукт в необходимую лекарственную форму.
Композиции по настоящему изобретению, подходящие для перорального введения, могут быть в форме дискретных компонентов, таких как капсулы, саше, таблетки или леденцы, каждый содержащий предопределенное количество активных ингредиентов; в форме порошка или гранул; в форме раствора или суспензии в водной жидкости или не в водной жидкости, такой как этанол или глицерин; или в форме эмульсии «масло-в-воде» или эмульсии «вода-в-масле». Такие масла могут быть пищевыми маслами, такими как например, хлопковое масло, сезамовое масло, кокосовое масло или арахисовое масло. Подходящие диспергирующие или суспендирующие средства для водных суспензий включают синтетические или натуральные камеди, такие как трагакант, альгинат, гуммиарабик, декстран, натрий карбокси-метилцеллюлоза, желатин, метилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, карбомеры и поливинилпирролидон. Активные ингредиенты также можно вводить в форме болюсов, электуария или пасты.
Таблетка может быть сделана посредством компрессии или формования активных ингредиентов с одним или несколькими эксципиентами. Спрессованные таблетки можно получать компрессии, в подходящей машине, активные ингредиенты в легкосыпучей форме, такой как порошок или гранулы, необязательно смешанные посредством связывающего средства, такого как например, лактоза, глюкоза, крахмал, желатин, камедь гуммиарабик, камедь трагакант, альгинат натрия, карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, полиэтиленгликоль, воска или т.п.; смазочного средство, такого как например, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия или т.п.; дезинтегрирующего средство, такого как например, крахмал, метилцеллюлоза, агар, бентонит, кроскармеллоза натрия, натрий крахмал гликолят, кросповидон или т.п. или диспергирующего средства, такого как полисорбат 80. Сформованные таблетки могут быть получены посредством формования в подходящей машине смеси порошкообразных активных ингредиентов и подходящего носителя, смоченного с применением инертного жидкого разбавителя.
Для перорального введения, ингибитор PDE4 можно вводить в количестве 0,01-2 мг/кг массы тела, более конкретно 0,1-1,5 мг/кг массы тела, или 0,25-1,25 мг/кг массы тела, или 0,5-1 мг/кг массы тела. Количество агониста витамина D должно быть подобрано соответствующим образом и может быть введено в количестве 0,00001-0,001 мг/кг.
Трансдермальные композиции могут быть в форме пластыря или пленки.
Композиции, подходящие для офтальмологического введения, могут быть в форме стерильного водного препарата из активных ингредиентов, который может быть в микрокристаллической форме, например в форме водной микрокристаллической суспензии. Липосомальные составы или биодеградируемые полимерные системы, например, как описано в Encyclopedia of Pharmaceutical Technology, vol. 2, 1989, также можно использовать для предоставления активного ингредиент для офтальмологического введения.
Композиции, подходящие для местного или офтальмологического введения, включают жидкие или полутвердые препараты, такие как линименты, лосьоны, гели, мази, аэрозоли, спреи, пленки, эмульсии масло-в-воде или вода-в-масле, такие как кремы или пасты; или растворы или суспензии, такие как капли. Композиции для офтальмологического лечения могут предпочтительно дополнительно содержать циклодекстрин.
Для местного введения, ингибитор PDE4 может, как правило, присутствовать в количестве от приблизительно 0,01 до приблизительно 20% по массе композиции, такой как приблизительно от 0,1% до приблизительно 10% по массе композиции, но также может присутствовать в количестве до приблизительно 50% по массе композиции. Количество агониста рецептора витамина D должно быть подобрано соответствующим образом, и агонист рецептора витамина D может, как правило присутствовать в композиции в количестве приблизительно от 0,0001 до приблизительно 2,0% по массе композиции.
Композиции, подходящие для назального или буккального введения, включают порошковые, самоходные и спрей составы, такие как аэрозоли и распылители. Такие составы описаны в подробностях, например, в Modern Pharmaceutics, 2nd ed., G.S. Banker и C.T. Rhodes (Eds.), page 427-432, Marcel Dekker, New York; Modern Pharmaceutics, 3th ed., G.S. Banker и C.T. Rhodes (Eds.), page 618-619 и 718-721, Marcel Dekker, New York и_Encyclopedia of Pharmaceutical Technology, vol. 10, J. Swarbrick и J.C. Boylan (Eds), page 191-221, Marcel Dekker, New York.
В дополнение к указанным выше ингредиентам, настоящая композиция может включать один или несколько дополнительных ингредиентов, таких как разбавители, буферы, ароматизаторы, красители, поверхностно-активные средства, загустители, консерванты, например метил гидроксибензоат (включая антиоксиданты), эмульгаторы и т.п.
ПРИМЕРЫ
Пример 1
Анализ in vitro с применением активированных и дифференцированных T-клеток человека для оценки противовоспалительного эффекта кальципотриола и ингибиторов PDE4
В литературе была описана пластичность T-клеток периферической крови для дифференцировки в специфические субпопуляции T-клеток. Поэтому, предполагают, что различные линии дифференцировки популяций воспалительных T-клеток можно установить посредством культуры in vitro за ограниченный период времени и использовать в качестве анализов in vitro на основе клеток, где можно оценивать как фенотип воспалительных T-клеток, так и эффект противовоспалительных лекарственных средств.
Особый интерес представляло создание протокола для образования Th1/Thl7 клеток человека для тестирования потенциальных новых видов лечения псориаза и/или других, связанных с Th17, заболеваний.
МАТЕРИАЛЫ И СПОСОБЫ
В первую очередь CD4+ T-клетки были отрицательно выделены из периферической крови здоровых доноров с применением системы сепарации RosetteSep® от STEMCELL.
Затем CD4+ T-клетки были активированы посредством поперечного сшивания белков клеточной поверхности CD3 и CD28 со специфическими антителами.
Для индуцирования Th1/Th17 дифференцировки активированные CD4+ T-клетки затем культивировали во флаконах с плотностью 2-5×106 клеток на мл культуры в бессывороточной среде X-VIVO 15 в присутствии коктейля факторов роста и дифференцировки, содержащего следующее:
rhIL-2 10 нг/мл
rhTGF-β 10 нг/мл
rhIL-1β 10 нг/мл
rhIL-6 10 нг/мл
rhIL-23 20 нг/мл
Антитело анти-IL-4 1 мкг/мл
Антитело анти-IL-13 1 мкг/мл
Среды для культивирования обновляли каждые вторые сутки, и T-клетки культивировали до 5-7 суток, чтобы обеспечить полную дифференцировку в Th1/Th17 клетки.
Как только T-клетки дифференцируются в Th1/Th17 клетки, клетки отмывают от дифференцировочной среды и помещают в среду для анализа (среда X-VIVO 15, содержащая только rhIL-2 10нг/мл) в конечной концентрации 1-1,5×l06 клеток/мл в лунках с 0,250 мл клеточной суспензии на лунку (0,25-0,375×106 клетки/лунку/образец) с и без обработки тестируемым соединением в течение 24 часов. В конечной точке эффект противовоспалительных лекарственных средств оценивают посредством измерения уровня цитокинов, связанных с фенотипом, выделенных клеточной культурой в супернатанты. Для каждой обработки препаратом применяют дупликаты и клетки от различных доноров.
РЕЗУЛЬТАТЫ
Характеристика Th1/Th17 фенотипа при культивировании и дифференцировке in vitro
CD4+ T-клетки культивировали in vitro до максимум 7 суток. Клеточный фенотип Th1/Th17 оценивали посредством анализа супернатанта клеточной культуры на предмет цитокинов. В частности, через 5-7 суток в культуре в условиях дифференцировки T-клетки отмывали от дифференцировочной среды и помещали в основную среду при конечной концентрации 1-1,5×106 клеток/мл. Основная среда, представляющая среды для выращивания без каких-либо условий для дифференцировки, которая является средой X-VIVO 15, содержащей только 2 мМ глутамакса и 1 × пенициллин/стрептомицин и rhIL-2 10 нг/мл.
Вариацию в Th1/Th17 фенотипе также наблюдали между донорами; однако вариация является нормально минимальной пока отсутствие дифференцировки в Th1/Th17 происходит очень редко (менее чем в 1% случаев).
Анализ экспрессии цитокинов посредством дифференцированных клеток человека Th1/Th17 продемонстрировал, что клетки способны хорошо экспрессировать связанный с Th1 цитокин IFNy, а также связанные с Th17 цитокины IL-17 и IL-22.
Оценка комбинации кальципотриола и соединения A в Th1/Th17 клеточной модели воспаления
После дифференцировки в течение 5-6 суток все клетки аккуратно отмывали и помещали в ростовые среды, содержащие IL-2 (X-VIVO + 10 нг/мл IL-2) в конечной концентрации 1-1,5×106 клетки/мл. Разведения кальципотриола (12 нМ, 100 нМ и 120 нМ) и соединения A (0,5 мкМ, 1 мкМ и 5,6 мкМ), в отдельности или в комбинации, добавляли к полностью дифференцированным Th1/Th17 клеткам человека. Анализы проводили в двух повторениях, и включали недифференцированные T-клетки человека (отрицательный контроль) и обработанные или необработанные дифференцированные Th1/Th17 клетки человека. Все клетки культивировали при сходных условиях в средах для анализа, содержащих 0,1% ДМСО с или без тестируемых соединений.
Th1/Th17 клетки обрабатывали в течение 24 часов с или без тестируемых соединений.
Супернатанты собирали из всех образцов и оценивали на предмет экспрессии цитокинов (IL-6, IL-8, IL-17, IL-22 и TNF-α). Все цитокины измеряли (в пг/мл) с применением MSD наборов за исключением IL-22, который измеряли посредством ELISA.
Результаты
Анализ данных и графики были сделаны в Excel или GraphPad Prism. Статистический анализ был сделан с применением 1way ANOVA, скорректированного посредством критерия множественного сравнения Даннета.
Во всех проведенных анализах кальципотриол в отдельности сильно ингибировал экспрессию IL-22 (см. Фиг. 3b), IL-8 и в некоторой степени IL-17, но не оказывал никакого эффекта на экспрессию TNFα и IL-6.
Соединение A (см. Фиг. 2 и 3b) и другие тестируемые ингибиторы PDE4 (см. Фиг. 1, 4 и 5) в отдельности повышали экспрессию IL-22 и в некоторой степени IL-17, в то время как соединение A сильно снижало экспрессию TNFα (см. Фиг. 3a) и слабо IL-6, но не оказывало никакого эффекта на IL-8.
Когда кальципотриол и соединение A вводили совместно, комбинированная обработка приводила к широкому ингибированию цитокинов в Th1/Th17 клетках человека. Ингибирование TNFα и IL-6 посредством соединения A и ингибирование IL-22, IL-17 и IL-8 посредством кальципотриола поддерживали посредством комбинированной обработки (Фиг. 3a и 3b для TNFα и IL-22, соответственно). В этих экспериментах соотношение кальципотриола и ингибиторов PDE4 составляло 1:50.
Заключение
- Соединение A в отдельности значительно ингибирует экспрессию TNFα (Фиг. 3a) и IL-6 и значительно повышает экспрессию IL-22 (Фиг. 3b) в Th1/Th17 клетках человека
- Способность повышать регуляцию экспрессии IL-22 является зависимой от дозы (Фиг. 2) и ее наблюдают для нескольких ингибиторов PDE4 (Фиг. 1)
- Кальципотриол в отдельности значительно ингибирует экспрессию IL-22 (Фиг. 3b) и ингибирует IL-8 и в некоторой степени экспрессию IL-17 в Th1/Th17 клетках человека
- Комбинированная обработка кальципотриолом и соединением A приводила к широкому ингибированию цитокинов в Th1/Th17 клетках человека. Ингибирование TNFα и IL-6 посредством соединения A и ингибирование IL-22, IL-17 и IL-8 посредством кальципотриола поддерживается посредством комбинированной обработки.
Эффект нескольких ингибиторов PDE4 в отдельности или в комбинации с кальципотриолом
Несколько ингибиторов PDE4 в клинических испытаниях (рофлумиласт, тетомиласт, GSK256066, оглемиласт, апремиласт и AN2728) были протестированы на предмет эффективности активности Th1/Th17 клеток человека, когда их давали в отдельности или в комбинации с кальципотриолом.
Как продемонстрировано на Фиг. 5, по сравнению с контрольной группой, получавшей инертное вещество (представлена точечной линией), лечение 100 нМ кальципотриолом в отдельности значительно ингибирует экспрессию и секрецию IL-22 Th1/Th17 клетками человека. С другой стороны, по сравнению с контрольной группой, получавшей инертное вещество, лечение соединением A или всеми тестируемыми ингибиторами PDE4 в отдельности повышает экспрессию IL-22 Th1/Th17 клетками человека.
Более того, лечение комбинацией ингибиторов PDE4 и кальципотриола значительно ингибирует экспрессию и секрецию IL-22 Th1/Th17 клетками человека, несмотря на то, присутствуют ли в комбинации ингибиторы PDE4. Другими словами, все ингибиторы PDE4 в клиническом испытании, протестированные в данном исследовании (Рофлумиласт, тетомиласт, GSK256066, оглемиласт, апремиласт и AN2728), демонстрируют сравнимую эффективность с соединением A и положительную регуляцию экспрессии IL-22, опосредованную ингибированием активности PDE4, которая может быть нейтрализована кальципотриолом.
Эффект нескольких аналогов витамина D в отдельности или в комбинации с соединением A
Несколько аналогов витамина D в клиническом применении (кальципотриол, кальцитриол, такальцитол и максакальцитол) протестировали на предмет эффективности активности Th1/Th17 клеток человека, когда их давали в отдельности или в комбинации с соединением A.
Как продемонстрировано на Фиг. 6, по сравнению с контрольной группой, получавшей инертное вещество (представлена точечной линией), лечение 100 нМ кальципотриолом в отдельности значительно ингибирует экспрессию и секрецию IL-22 Th1/Th17 клетками человека. Подобно этому, лечение всеми тестируемыми аналогами витамина D в отдельности (всеми тестируемыми при 100 нМ) также значительно ингибирует экспрессию и секрецию IL-22 Th1/Th17 клетками человека и эффект сравним с эффектом, наблюдаемым после лечения посредством 100 нМ кальципотриола.
С другой стороны, по сравнению с контрольной группой, получавшей инертное вещество, лечение соединением A в отдельности повышает экспрессию IL-22 Th1/Th17 клетками человека.
Кроме того, лечение комбинацией соединения A и аналогов витамина D значительно ингибирует экспрессию и секрецию IL-22 Th1/Th17 клетками человека, несмотря на то, что аналог витамина D является частью комбинации. Другими словами, все аналоги витамина D в клиническом применении, протестированные в этом исследовании (кальципотриол, кальцитриол, такальцитол и максакальцитол), демонстрируют сравнимую эффективность как кальципотриол в противодействии положительной регуляции экспрессии IL-22, опосредованной ингибированием активности PDE4.
Эффект различных концентраций кальципотриола в присутствии и отсутствии соединения A
Различные концентрации кальципотриола (MC903) тестировали на предмет активности Th1/Th17 клеток человека в присутствии или отсутствии соединения A в концентрации 1 мкМ. Целью данного исследования было идентифицировать минимальную концентрацию кальципотриола, необходимую для ингибирования положительной регуляции экспрессии IL-22, опосредованной ингибитором PDE4.
Как продемонстрировано на Фиг. 7, по сравнению с контрольной группой, получавшей инертное вещество (представлена точечной линией), лечение 100 нМ кальципотриолом в отдельности ингибирует экспрессию и секрецию IL-22 Th1/Thl7 клетками человека, тогда как лечение соединением A в отдельности повышает экспрессию IL-22 Th1/Th17 клетками человека.
Лечение различными концентрациями кальципотриола (100 нМ, 1 нМ, 500 пМ и 100 пМ) совместно с соединением A ингибировало положительную регуляцию экспрессии IL-22. Этот эффект терялся при концентрация 10 пМ кальципотриола.
Результаты демонстрируют, что эффект кальципотриола на экспрессию IL-22 можно получать при гораздо более низкой концентрации, чем требовалось, чтобы повлиять на пролиферацию кератиноцитов (28 нМ). Это означает, что комбинацию ингибитора PDE4 и агониста рецептора витамина D можно использовать при лечении состояний, когда необходим противовоспалительный эффект без сопутствующего влияния на пролиферацию кератиноцитов.
| название | год | авторы | номер документа |
|---|---|---|---|
| УЛУЧШЕННЫЙ ИММУНОЛОГИЧЕСКИЙ СОСТАВ | 2012 |
|
RU2664730C2 |
| НОВЫЕ БАКТЕРИИ И ИХ ЭКСТРАКТЫ, И ИХ ПРИМЕНЕНИЕ В ДЕРМАТОЛОГИИ | 2011 |
|
RU2612790C2 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ АГОНИСТА TLR И КОМБИНИРОВАННАЯ ТЕРАПИЯ | 2011 |
|
RU2603467C2 |
| ЛИГАНД GITR И СВЯЗАННЫЕ С ЛИГАНДОМ GITR МОЛЕКУЛЫ И АНТИТЕЛА И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2369636C2 |
| НОВЫЙ ШТАММ LACTOBACILLUS PLANTARUM, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЕГО, И СВЯЗАННЫЙ С НИМ СПОСОБ И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2790442C2 |
| НОВЫЕ МОЛОЧНОКИСЛЫЕ БАКТЕРИИ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2752157C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ Actinidia, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2423139C2 |
| ПРИМЕНЕНИЕ ИНГИБИТОРОВ NKG2D ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ И МЕТАБОЛИЧЕСКИХ ЗАБОЛЕВАНИЙ, ТАКИХ КАК ДИАБЕТ 2 ТИПА | 2010 |
|
RU2566264C2 |
| СИНТЕТИЧЕСКИЕ АНАЛОГИ IL-10 | 1997 |
|
RU2194054C2 |
| МОДУЛЯЦИЯ ЭКСПРЕССИИ ТН1/ТН2 ЦИТОКИНОВ РИБАВИРИНОМ И АНАЛОГАМИ РИБАВИРИНА В АКТИВИРОВАННЫХ Т-ЛИМФОЦИТАХ | 1997 |
|
RU2186569C2 |





Изобретение относится к медицине, а именно к иммунологии, и может быть использовано для лечения воспалительных кожных заболеваний. Для этого фармацевтическая композиция содержит терапевтически эффективное количество ингибитора PDE4 и агониста рецептора витамина D в количестве более чем в 100 раз ниже, чем количество ингибитора PDE4, а также фармацевтически приемлемый носитель или переносчик. Использование данного изобретения позволяет ингибировать положительную регуляцию экспрессии провоспалительного цитокина IL-22 активированными и дифференцированными T-клетками человека без сопутствующего влияния на пролиферацию кератиноцитов, причем указанная положительная регуляция была индуцирована введением терапевтически эффективного количества ингибитора фосфодиэстеразы 4 (PDE4). 8 з.п. ф-лы, 7 ил.
1. Фармацевтическая композиция для применения при лечении воспалительных кожных заболеваний или состояний, содержащая терапевтически эффективное количество ингибитора PDE4 и агониста рецептора витамина D в количестве более чем в 100 раз ниже, чем количество ингибитора PDE4, так чтобы ингибировать положительную регуляцию экспрессии провоспалительного цитокина IL-22, вызванную введением ингибитора PDE4 без сопутствующего влияния на пролиферацию кератиноцитов, а также фармацевтически приемлемый носитель или переносчик.
2. Фармацевтическая композиция по п.1, где агонист рецептора витамина D выбран из группы, состоящей из кальципотриола, кальцитриола, такальцитола и максакальцитола.
3. Фармацевтическая композиция по п.2, где агонистом рецептора витамина D является кальципотриол или кальципотриола моногидрат.
4. Фармацевтическая композиция по любому из пп.1-3, где ингибитор PDE4 выбран из группы рофлумиласта, GSK256066, оглемиласта, тетомиласта, апремиласта, AN2728, 2-{6-[2-(2,3-дихлорпиридин-4-ил)ацетил]-2,3-диметоксифенокси}-N-пропилацетамида (соединения A), N-бензил-2-{6-[2-(3,5-дихлорпиридин-4-ил)ацетил]-2,3-диметоксифенокси}ацетамида (соединения B), 2-(3,5-дихлорпиридин-4-ил)1-{2-[2-(4-фторфенил)этокси]-3,4-диметоксифенил}этанона (соединения C), 2-(3,5-дихлорпиридин-4-ил)-1-{9-метокси-спиро[2H-l,5-бензодиоксепин-3(4H),3’-оксетан]-6-ил}этанона (соединения D) и 2-{6-[2-(3,5-дихлорпиридин-4-ил)ацетил]-2,3-диметоксифенокси}-N-(2-диметиламиноэтил)ацетамида (соединения E).
5. Фармацевтическая композиция по п.4, где ингибитором PDE4 является 2-{6-[2-(2,3-дихлорпиридин-4-ил)ацетил]-2,3-диметоксифенокси}-N-пропилацетамид (соединение A) или 2-(3,5-дихлорпиридин-4-ил)-l-{9-метокси-спиро[2H-l,5-бензодиоксепин-3(4H),3’-оксетан]-6-ил}этанон (соединение D).
6. Фармацевтическая композиция по п.1, где воспалительное заболевание или состояние кожи, выбранное из псориаза, эпидермального воспаления, алопеции, атрофии кожи, атрофии кожи, вызванной стероидами, старения кожи, фотостарения кожи, акне, дерматита, атопического дерматита, себорейного дерматита, контактного дерматита, крапивницы, зуда и экземы.
7. Фармацевтическая композиция по любому из пп.1-6, где количество агониста рецептора витамина D более чем в 250 раз ниже, чем количество ингибитора PDE4.
8. Фармацевтическая композиция по любому из пп.1-6, где количество агониста рецептора витамина D более чем в 500 раз ниже, чем количество ингибитора PDE4.
9. Фармацевтическая композиция по любому из пп.1-6, где количество агониста рецептора витамина D более чем в 1000 раз ниже, чем количество ингибитора PDE4.
| WO2008104175 A, 04.09.2008 | |||
| WO2011076207 A2, 30.06.2011 | |||
| MITRA A.et al | |||
| Topical delivery for the treatment of psoriasis // Expert Opin Drug Deliv., 2010, Aug;7(8):977-92 | |||
| KERSTIN WOLK et al | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| КОЛОГРИВОВА И.В | |||
| и др | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| LAURA A | |||
| TESMER et al | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2018-08-06—Публикация
2013-11-28—Подача