Настоящее изобретение относится к микробиологии и касается способов измерения, использующих микроорганизмы, а именно нуклеиновые кислоты. Данное изобретение может быть использовано при тестировании различных ксенобиотиков, в том числе пестицидов, на предмет генотоксичности.
Химическая защита сельскохозяйственных растений предполагает широкое применение пестицидов для борьбы с сорняками, вредителями, грибковыми заболеваниями и другими болезнями сельскохозяйственных растений. Пестициды относят к классу ксенобиотиков, чужеродных для организма соединений, которые не могут включаться в метаболизм и наносят серьезный вред организму. Актуальность проблемы токсичности ксенобиотиков резко повысилась в последние годы из-за кризиса снижения численности насекомых-опылителей. Проблема снижения численности поллинаторов является вопросом продовольственной безопасности, поскольку они опыляют 75% всех культур, употребляемых в пищу человеком (Potts, S.G., Biesmeijer, J.С., Kremen, С., Neumann, P., Schweiger, О., & Kunin, W.E. (2010). Global pollinator declines: trends, impacts and drivers. Trends in ecology & evolution, 25(6), 345-353).
Повреждение митохондрий насекомых-опылителей является одним из следствий токсичности пестицидов. Даже частичное ингибирование дыхания митохондрий пестицидами, особенно в летательных мышцах, может привести к снижению летательной активности поллинаторов, увеличению скорости продукции активных форм кислорода (АФК), что приведет к повреждению ДНК, последующим мутациям и гибели насекомых.
Митохондриальная ДНК является удобным маркером окислительного стресса, поэтому нередко используется для выявления ранних этапов различных заболеваний. Прототипом является патент № РФ 2243558 (МПК G01N 33/48, C12Q 1/68, опубл. 20.05.2000), относящийся к способу оценки атеросклеротического состояния у субъекта по повреждению митохондриальной ДНК, предусматривающий следующие стадии: (а) взятие образца крови у указанного субъекта; (b) определение количественного уровня повреждений митохондриальной ДНК в указанном образце крови по методу количественной ПЦР, где указанную ДНК обрабатывают гликозилазой FAPY до указанной ПЦР-амплификации для определения 8-оксо-G-повреждения, или определение количественного уровня повреждений ядерной ДНК по методу количественной ПЦР по амплификации продукта размером 16,2 т.п.н.; (с) сравнение количественного уровня повреждений митохондриальной ДНК в образце крови указанного субъекта с количественным уровнем повреждений митохондриальной ДНК в образце крови контрольного субъекта, не страдающего атеросклерозом, где более высокий количественный уровень повреждений митохондриальной ДНК у указанного субъекта с повышенным риском, чем у указанного контрольного субъекта, является показателем атеросклероза у указанного субъекта.
Однако этот метод не применим для анализа повреждений мтДНК насекомых, т.к. у них средний АТ-состав мтДНК составляет от 69,5% до 84,9%, в то время как у позвоночных он колеблется между 53% и 66% (Arunkumar, К.Р., & Nagaraju, J. (2006). Unusually long palindromes are abundant in mitochondrial control regions of insects and nematodes. PLoS One, 1(1), e110). Митохондриальный геном В. terrestris имеет длину 17400 п.н. и АТ-состав 85%.
Задачей настоящего изобретения является разработка способа тестирования и выявления опасных пестицидов, которые могут оказывать негативное влияние на насекомых-опылителей, вызывая повреждения митохондриальной ДНК, что может негативно сказаться на опылительных способностях насекомых или вызвать гибель значительной части популяции.
Технический результат заключается в разработке высокочувствительного, хорошо воспроизводимого и сравнительно недорогого способа определения генотоксичности ксенобиотиков.
Технический результат достигается тем, что в способе определения генотоксичности ксенобиотиков на основе анализа повреждений митохондриальной ДНК земляного шмеля (Bombus terrestris), включающем забор биологического материала, выделение ДНК, определение количественного уровня повреждений митохондриальной ДНК методом ПЦР в реальном времени, сравнение количественного уровня повреждений митохондриальной ДНК экспериментальной и контрольной группы, где более высокий уровень повреждений у экспериментальной группы является показателем генотоксичности ксенобиотиков, согласно изобретению предварительно проводят кормление земляных шмелей (Bombus terrestris) тестируемым ксенобиотиком на протяжении суток, ДНК выделяют из грудных мышц шмеля, ПЦР проводят при температуре элонгации 66,1±0,5°С в течение 5 минут с использованием Encyclo-полимеразы, соответствующего ей Encyclo-буфера и других стандартных компонентов реакции с парами праймеров, имеющими определенные последовательности.
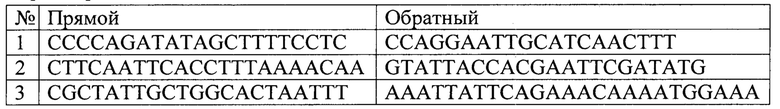
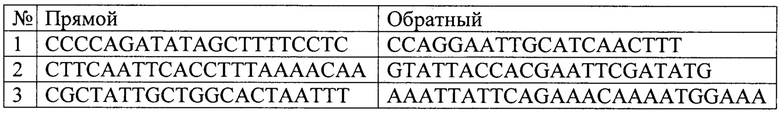
Последовательности праймеров для определения количества повреждений в митохондриальной ДНК В. Terrestris и числа ее копий приведены в Перечне последовательностей.
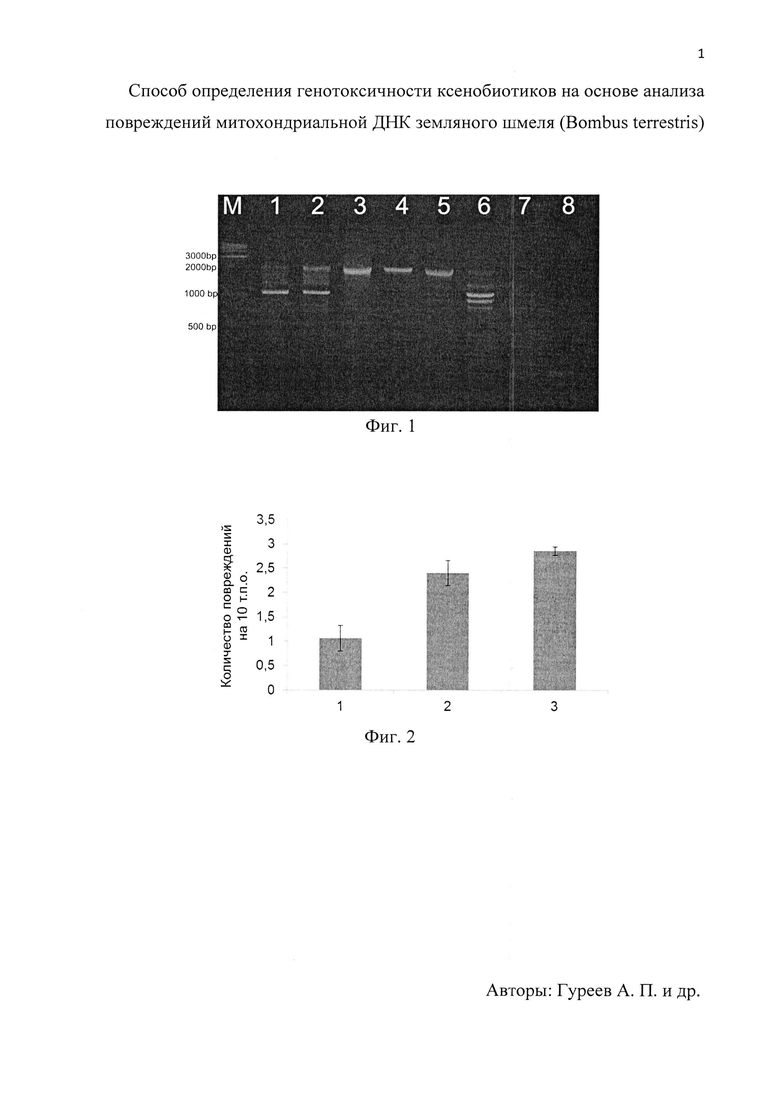
На фиг. 1 приведена электрофореграмма амплификации фрагмента при градиенте температуры элонгации, где М - маркер длин фрагментов 1 Kb; 1 - 72°С; 2 - 71,1°С; 3 - 69,3°С; 4 - 66,1°С; 5 - 62,3°С; 6 - 59,2°С; 7 - 57,1°С; 8 - 56°С. На фиг. 2 приведена диаграмма количества повреждений в 1, 2, 3 фрагментах митохондриальной ДНК В. terrestris после воздействия ротенона (n=6).
Метод ПЦР длинных фрагментов основан на предположении, что наличие повреждений в ДНК, например одноцепочечных разрывов, модифицированных оснований или их аддуктов, будут препятствовать работе ДНК-полимеразы и замедлять накопление ПЦР продукта. Таким образом, скорость накопления продукта ПЦР будет обратно пропорциональна количеству молекул ДНК с повреждениями. В основе метода лежит подбор праймеров для интересующего участка генома и последующую его амплификацию с целью детекции числа повреждений ДНК. Однако из-за высокого АТ-состава митохондриальной ДНК В. terrestris возможности для подбора большого числа праймеров были значительно ограничены. В результате разработанный набор включает в себя три пары праймеров для амплификации фрагментов митохондрильной ДНК длиной около 2000 п.н. непосредственно для выявления количества повреждений в заданных ампликонах (см. Перечень последовательностей). Также была подобрана одна пара праймеров для амплификации референсного короткого фрагмента, необходимого для определения числа копий митохондриальной ДНК.
Из-за высокого АТ-состава амплифицируемых участков мтДНК шмелей оптимальная температура элонгации составляет около 66°С. Более высокие температуры элонгации приводят к увеличению количества неспецифичных продуктов реакций, предположительно в результате разрыва цепи ДНК. При более низких температурах не происходит амплификации продуктов заданной длины (Фиг. 1).
Кроме того, не рекомендуется для выделения ДНК использовать методы, где используются агрессивные реагенты (фенол, хлороформ и т.д.), которые могут дополнительно повреждать митохондриальную ДНК.
Пример.
Способ определения количества повреждений в митохондриальной ДНК осуществляется следующим образом.
Для инициации повреждений кормили группу из 6 шмелей ротеноном, который добавляли в сахарный сироп (55-65%). Он слабо токсичен для людей и млекопитающих, но чрезвычайно токсичен для насекомых. Использовали ротенон из расчета 0,49 мкг/шмель, что соответствует половине дозы LD50, которая не вызывает летальный исход у шмелей, но при этом теоретически должна вызывать повреждения в митохондриальной ДНК. Параллельно содержалась контрольная группа шмелей того же возраста в тех же условиях с питательным сиропом без добавления ксенобиотика.
Умерщвляли шмелей спустя 24 часа после начала эксперимента.
Выделение тотальной ДНК может быть осуществлено любым коммерчески доступным способом на основе сорбционных колонок.
При постановке длинноцепочечной ПЦР в реальном времени была использована реакционная смесь следующего состава: 10Х Encyclo буфер 2 мкл; 50Х смесь полимераз Encyclo 0,4 мкл; смесь dNTP (10 мМ каждого) 0,4 мкл; 20Х SYBR-green 1 мкл; ДНК-матрица (3-10 нг/мкл) 1 мкл; праймеры (смесь прямой + обратный) 1 мкл; вода MilliQ 14,2 мкл. Протокол реакции: предварительная денатурация 95°С - 3 мин, денатурация в начале цикла - 95°С, 20 сек, отжиг праймеров - 54°С - 30 сек, элонгация - 66,1°С - 5 мин.
Расчет количества повреждений митохондриальной ДНК был произведен по следующей формуле:
Повреждения на 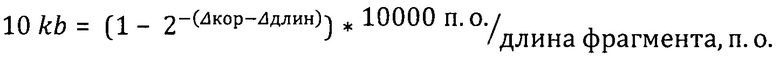
где Δкор=Cq короткого таргетного фрагмента - Cq короткого контрольного фрагмента, Δдлин = Cq длинного таргетного фрагмента - Cq длинного контрольного фрагмента.
Смертность в группе шмелей, получавших ротенон, отсутствовала. При этом было показано (фиг. 2), что ротенон за 24 часа вызывает значительные повреждения в митохондриальной ДНК В. terrestris. В 1 фрагменте наблюдалось 1,06±0,25 повреждений / 10 т.п.о. Во 2 фрагменте обнаружили 2,4±0,26 повреждений / 10 т.п.о. Наибольшее количество повреждений наблюдалось в 3 фрагменте, который соответствует D-петле (2,85±0,09 повреждений / 10 т.п.о.). Таким образом, данный метод может применяться для выявления повреждений митохондриальной ДНК в концентрациях ксенобиотика, которые не вызывают гибель насекомых, но могут снизить их двигательную активность и, как следствие, негативно сказаться на опылительных свойствах.
Предложенный способ определения количества повреждений митохондриальной ДНК В. terrestris является высокочувствительным, хорошо воспроизводимым и сравнительно недорогим. Анализ можно проводить в лабораториях, имеющих термоциклер с системой детекции флюоресценции для ПНР в реальном временем, центрифугу, камеру для электрофореза и сопутствующие реактивы и расходные материалы.
Перечень последовательностей
Праймеры
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СКРИНИНГА ПОТЕНЦИАЛЬНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА НА ОСНОВЕ АНАЛИЗА ПОВРЕЖДЕНИЙ МИТОХОНДРИАЛЬНОЙ ДНК МУХ ДРОЗОФИЛ (DROSOPHILA MELANOGASTER) | 2019 |
|
RU2743138C1 |
| Способ определения количества повреждений митохондриальной ДНК картофеля при тестировании токсичности пестицидов in vitro | 2020 |
|
RU2762904C1 |
| Способ определения количества повреждений митохондриальной ДНК берёзы для оценки устойчивости к солевому стрессу in vitro | 2022 |
|
RU2831837C2 |
| Способ определения доли мтДНК с делециями в биологических образцах | 2018 |
|
RU2676897C1 |
| Способ защиты шмелей от токсического действия митохондриально-направленных пестицидов | 2019 |
|
RU2728447C1 |
| ПОВРЕЖДЕНИЯ МИТОХОНДРИАЛЬНОЙ ДНК КАК ПРОГНОСТИЧЕСКИЙ ПРИЗНАК АТЕРОСКЛЕРОТИЧЕСКОЙ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2000 |
|
RU2243558C2 |
| Способ дифференциальной диагностики рака желудка различных гистологических типов | 2015 |
|
RU2613139C1 |
| Способ получения полноразмерной последовательности митохондриальной ДНК человека с использованием набора олигонуклеотидов методом мультиплексной амплификации для работы с образцами деградированной ДНК | 2021 |
|
RU2818323C2 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ЭКСПРЕССИЮ ГЕНА КОАКТИВАТОРА PGC-1A | 2011 |
|
RU2460524C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДНК-ДИАГНОСТИКИ НА РАЗНЫХ СТАДИЯХ ЖИЗНЕННОГО ЦИКЛА ГЕЛЬМИНТОВ-ВОЗБУДИТЕЛЕЙ ФАСЦИОЛЕЗА ЧЕЛОВЕКА И ЖИВОТНЫХ | 2007 |
|
RU2360003C1 |
Изобретение относится к биотехнологии. Описан способ определения генотоксичности ксенобиотиков на основе анализа повреждений митохондриальной ДНК земляного шмеля (Bombus terrestris). Способ включает проведение кормления земляных шмелей (Bombus terrestris) тестируемым ксенобиотиком на протяжении суток, забор биологического материала и выделение ДНК из грудных мышц шмеля, определение количественного уровня повреждений митохондриальной ДНК методом ПЦР в реальном времени при температуре элонгации 66,1±0,5°С в течение 5 минут с использованием Encyclo-полимеразы, соответствующего Encyclo-буфера и других стандартных компонентов реакции с парами праймеров, имеющих определенные последовательности, сравнение количественного уровня повреждений митохондриальной ДНК экспериментальной и контрольной группы. Более высокий уровень повреждений у экспериментальной группы является показателем генотоксичности ксенобиотиков. Последовательности праймеров для определения количества повреждений в митохондриальной ДНК В. terrestris и числа ее копий:
Данное изобретение может быть использовано при тестировании различных ксенобиотиков, в том числе пестицидов, на предмет генотоксичности. Технический результат заключается в разработке высокочувствительного, хорошо воспроизводимого и сравнительно недорогого способа определения генотоксичности ксенобиотиков. 2 ил., 1 пр.
Способ определения генотоксичности ксенобиотиков на основе анализа повреждений митохондриальной ДНК земляного шмеля (Bombus terrestris), включающий забор биологического материала, выделение ДНК, определение количественного уровня повреждений митохондриальной ДНК методом ПЦР в реальном времени, сравнение количественного уровня повреждений митохондриальной ДНК экспериментальной и контрольной группы, где более высокий уровень повреждений у экспериментальной группы является показателем генотоксичности ксенобиотиков, отличающийся тем, что предварительно проводят кормление земляных шмелей (Bombus terrestris) тестируемым ксенобиотиком на протяжении суток, ДНК выделяют из грудных мышц шмеля, ПЦР проводят при температуре элонгации 66,1±0,5°С в течение 5 минут с использованием Encyclo-полимеразы и соответствующего ей Encyclo-буфера с парами праймеров, имеющих следующие последовательности:

| Илларионов А | |||
| И., Деркач А | |||
| А | |||
| Ксенобиотики в пчелах и продуктах пчеловодства // Агрохимия, 2008, n | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| - С | |||
| Устройство для выпрямления опрокинувшихся на бок и затонувших у берега судов | 1922 |
|
SU85A1 |
| Леонова И | |||
| Н | |||
| и др | |||
| Исследование роли ферментов метаболизма ксенобиотиков в резистентности насекомых к инсектицидам // Биохимия, 1986 | |||
| Т | |||
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| - С | |||
| Приспособление для нагревания воздуха теплотой отработавшего воздуха | 1924 |
|
SU420A1 |
Авторы
Даты
2018-08-08—Публикация
2017-07-10—Подача