Настоящее изобретение относится к области биологии и экспериментальной медицины и может использоваться в медико-биологических исследованиях, в частности токсикологических, фармакологических, биофизических исследованиях и для лабораторно-экспериментальной оценки и направленного поиска веществ, обладающих лигандными свойствами по отношению к AHR человека и способствующих оценке их фармако-кинетического потенциала в лечении онкологических заболеваний.
Воздействие ксенобиотиков различного происхождения на человека в повседневной жизни достаточно частое явление. Среди них встречаются вещества, способные нарушить гомеостаз организма, регуляцию процессов детоксикации, деления клеток, их дифференцировки, поляризации и программируемой смерти, формирование органно-тканевых структур, нервной, иммунной, сердечно-сосудистой, эндокринной, генеративной и выделительных систем у высших многоклеточных организмов. В основе их влияния на перечисленные процессы лежит воздействие на сигнальные пути, регулируемые Арил Гидрокарбоновым Рецептором (Aryl hydrocarbon receptor - AHR). AHR является базовым транскрипционным фактором. Его целевые гены участвуют в регуляции процессов биодеградации токсических соединений, пролиферации клеток и их дифференцировки. Важным элементом сигнального пути активации AHR является связывание его с лигандом. У позвоночных животных, включая человека, их роль способны выполнять соединения как эндогенного, так и экзогенного происхождения - ксенобиотики, в то время как у беспозвоночных роль лигандов AHR выполняют агенты эндогенного происхождения.
Важно иметь в виду, что для организма необходимо, чтобы AHR работал в клетках на нужном уровне. Для клетки, тканей и организма в целом пагубно, как повышенный, так и пониженный уровень экспрессии AHR, как показано в работах [1]-[6]. Как пониженный, так и повышенный уровни экспрессии AHR, довольно частые явления. Понижение уровня его экспрессии часто сопутствует старению организма. К наиболее тяжелым последствиям понижения уровня экспрессии AHR можно отнести повышение опасности возникновения онкологических заболеваний и неспособность организма к полноценной защите от токсического действия ксенобиотиков. Эктопическое повышение уровня экспрессии AHR вызывает нарушения развития, органогенеза, гистогенеза, нервной, иммунной, сердечно-сосудистой, эндокринной и генеративной систем. У позвоночных и человека причиной повышения уровня экспрессии AHR чаще всего бывает воздействие ксенобиотиков. Они могут действовать опосредованно, запуская механизмы синтеза эндогенных лигандов, включающихся в ответ на действие токсичных продуктов метаболизма. Так как в большинстве своем являются высокотоксичными веществами. Но могут действовать и непосредственно, в случае обладания лигандной активностью по отношению к AHR. При этом по степени аффинности к AHR среди таких ксенобиотиков существует широкий полиморфизмом, как показано в работах [7]-[9]. По-видимому, степень аффинности лиганда сказывается на способности AHR активировать подконтрольные ему гены-мишени. Многочисленные процессы патологий у человека связаны с действием ксенобиотиков, обладающих лигандной активностью по отношению к AHR. Поиск таких веществ сопряжен с неизбежной необходимостью контактировать с высокотоксичными веществами, что накладывает определенные ограничения на выполнение экспериментальных процедур. Чаще всего их выполняют на клеточных культурах, что ограничивает понимание последствий эктопической экспрессии AHR на процессы развития системных структур в условиях in vivo.
Из уровня техники известны тест-система, позволяющая в какой-то мере эти ограничения преодолеть, а именно гуманизированная линия Drosophila, геном которой трансформирован генной конструкцией, содержащей ген AHR мыши и человека. [Cespedes М.А., Galindo M.I., Couso J.P. (2010) Dioxin toxicity in vivo results from an increase in the dioxin-independent transcriptional activity of the Aryl Hydrocarbon Receptor. PLoS ONE 5: e15382] [10]. Данная линия Drosophila наиболее близка к используемой в предлагаемом способе. В части способов определения фармакологических и токсикологических свойств веществ, известно также техническое решение "Способ оценки фармакологических и токсикологических свойств веществ - радио- и токсикопротекторов" по патенту РФ №2534822. В нем предлагается использовать мух дрозофилы, мутантных по генам spineless и CG5017 для выявления веществ, обладающих свойствами радио-, токсикопротекции и радио-, токсикосенсибилизации и способствующих адаптивному ответу организма на токсические действия различных видов радиации или экзогенных токсинов [11].
В основу настоящего изобретения положено решение технической проблемы создания эффективного, направленного, достоверного и высокочувствительного способа исследования и оценки фармакологических и токсикологических свойств веществ, способных понижать или повышать уровень транскрипции генов участвующих в регуляции процессов биодеградации токсических соединений, деления и дифференцировки клеток, их поляризации и программируемой смерти. Реализация предлагаемого изобретения позволит осуществлять быстрый направленный и достоверный отбор таких веществ.
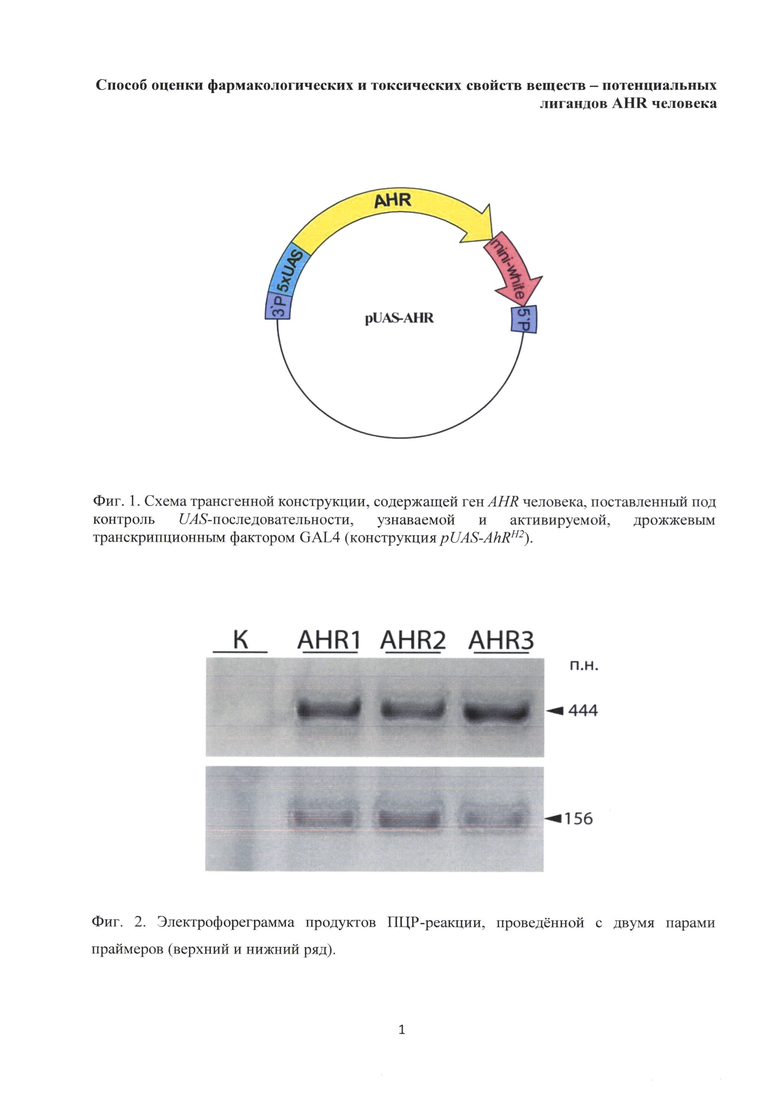
Как было сказано выше, действие ксенобиотиков вызывает активизацию AHR и повышение уровня транскрипции его целевых генов. Повышение транскрипции целевых генов AHR по отношению к базовому уровню вызывает нарушение «физиологических» и «развитийных» процессов. В первую очередь это нарушение регуляции процессов биодеградации токсических соединений и процессов деления клеток и их дифференцировки. Степень аффинности в отношении AHR у различных ксенобиотиков широко варьирует. Это, по-видимому, является причиной гетерогенности в спектре и уровне транскрипции активируемых целевых генов у разных видов организмов и в разных органно-тканевых структурах [9, 12]. Дифференцировать активацию целевых генов AHR, вызванную действием экзогенных лигандов от эндогенных, важно для оценки их фармако-кинетического потенциала. Технически это удобно выполнять с использованием созданной нами линии мух Drosophila melanogaster, трансформированных генной конструкцией, содержащей ген AHR человека, поставленный под контроль UAS-последовательности, узнаваемой и активируемой, дрожжевым транскрипционным фактором GAL4 (Фиг. 1).
Генетическую трансформацию проводили при помощи метода микроинъекций в ранние эмбрионы дрозофилы с мутацией в гене w (белые глаза). Генетически трансформированных мух выявляли благодаря наличию в конструкции w+m гена. Интегрированная в геном проинъецированных мух конструкция исправляла дефект белоглазых мух. Они приобрели красный цвет. При помощи гибридологического анализа была идентифицирована хромосома, в которую интегрировалась конструкция. Ею оказалась 2-я хромосома.
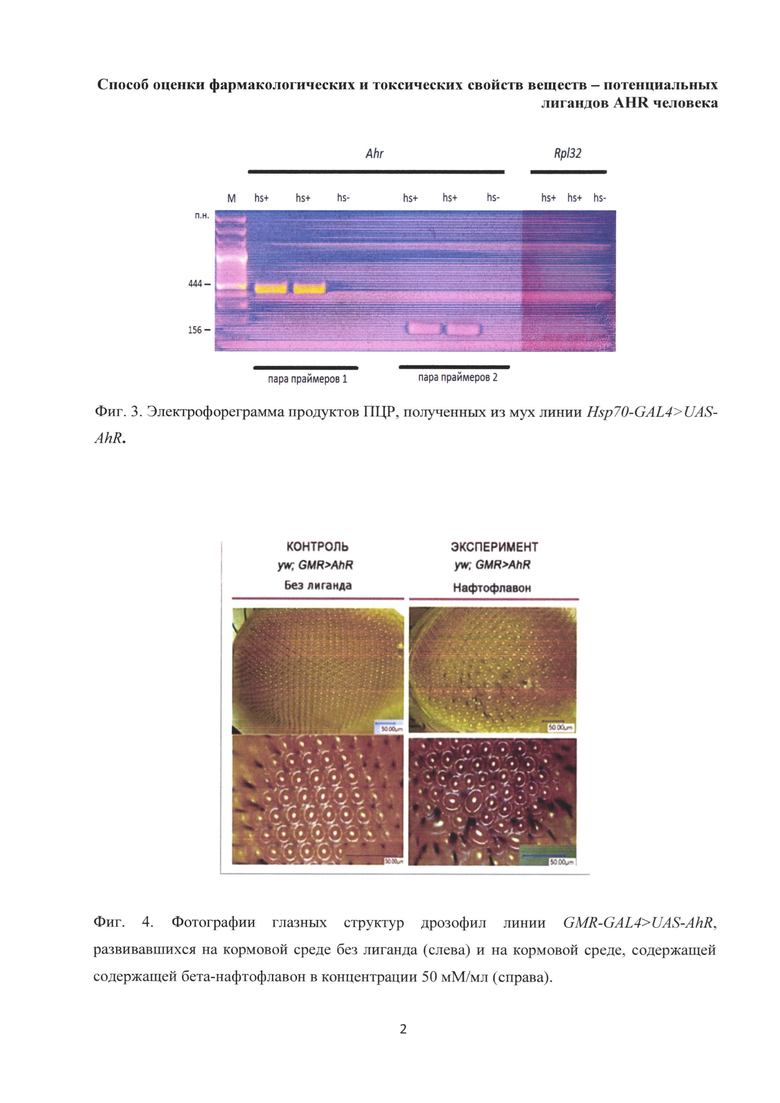
Чтобы убедиться в том, что в отселектированной линии мух UAS-AhR нет засора от случайного скрещивания с посторонними дрозофилами, а также что конструкция с геном человека AhR полностью встроилась (т.к. всегда есть риск случайного вырезания фрагментов конструкции) в геном, воспользовались методом полимеразной цепной реакции (ПЦР). С помощью этого метода было доказано наличие нуклеотидной последовательности, кодирующий ген AhR, в геноме мух полученной линии (Фиг. 2). Использовали ДНК сублиний AHR1, AHR2, AHR3 от исходной линии UAS-AhR, содержащих созданный конструкт, содержащий ген AHR человека, поставленный под контроль UAS-последовательности, узнаваемой и активируемой, дрожжевым транскрипционным фактором GAL4, и ДНК контрольной линии yw, не несущей анализируемой трансгенной конструкции в геноме (К).
Для проведения ПЦР мы использовали три отводки линии UAS-AhR: UAS-AhR1 (AHR1), UAS-AhR2 (AHR2), UAS-AhR3 (AHR3). Для контроля мы взяли линию анализатор, в которой отсутствовал ген человека AhR - yw (фиг. 2). Из мух трех сублиний AHR1, AHR2, AHR3 и контрольной линии yw нами была выделена геномная ДНК, которая затем использовалась для проведения ПЦР. Реакция ставилась с парой праймеров (прямые и обратные). Праймеры были подобраны с учетом специфичности к гену AhR человека, из соответствующей белок-кодирующей области этого гена. Для повышения достоверности результатов были использованы две пары праймеров (табл. 1).

Далее продукты ПЦР-реакции были подвергнуты электрофорезу в 1% агарозном геле. В случае эффективной вставки конструкции в геном мы ожидали получить полоски, характерные фрагментам ДНК, длиной 444 н.п. (первая пара праймеров) и 156 н.п. (вторая пара праймеров). Как видно из фиг. 2, во всех трех тестированных отводках в обоих (две пары праймеров) случаях были обнаружены одинаковые полосы, соответствующие фрагментам ДНК ожидаемой длины. В отличие от них на дорожке с ДНК мух контрольной линии, не обнаружилось никаких полос. Таким образом, результат этого эксперимента на биохимическом уровне подтверждает полноценное встраивание интересующего нас конструкта, содержащего ген AHR человека, поставленный под контроль UAS-последовательности, узнаваемой и активируемой, дрожжевым транскрипционным фактором GAL4, в геном мух линии UAS-AhR.
Работоспособность генетической конструкции, содержащей ген AHR человека, поставленный под контроль UAS-последовательности, узнаваемой и активируемой, дрожжевым транскрипционным фактором GAL4 (конструкция pUAS-AhRH2) в геноме мухи на транскрипционном уровне была подтверждена путем совмещения в одном организме двух компонентов системы UAS/GAL4 по Схеме 1.
СХЕМА 1.
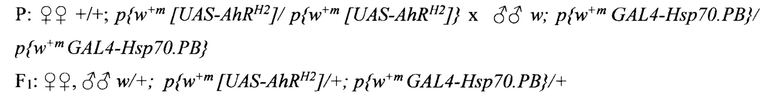
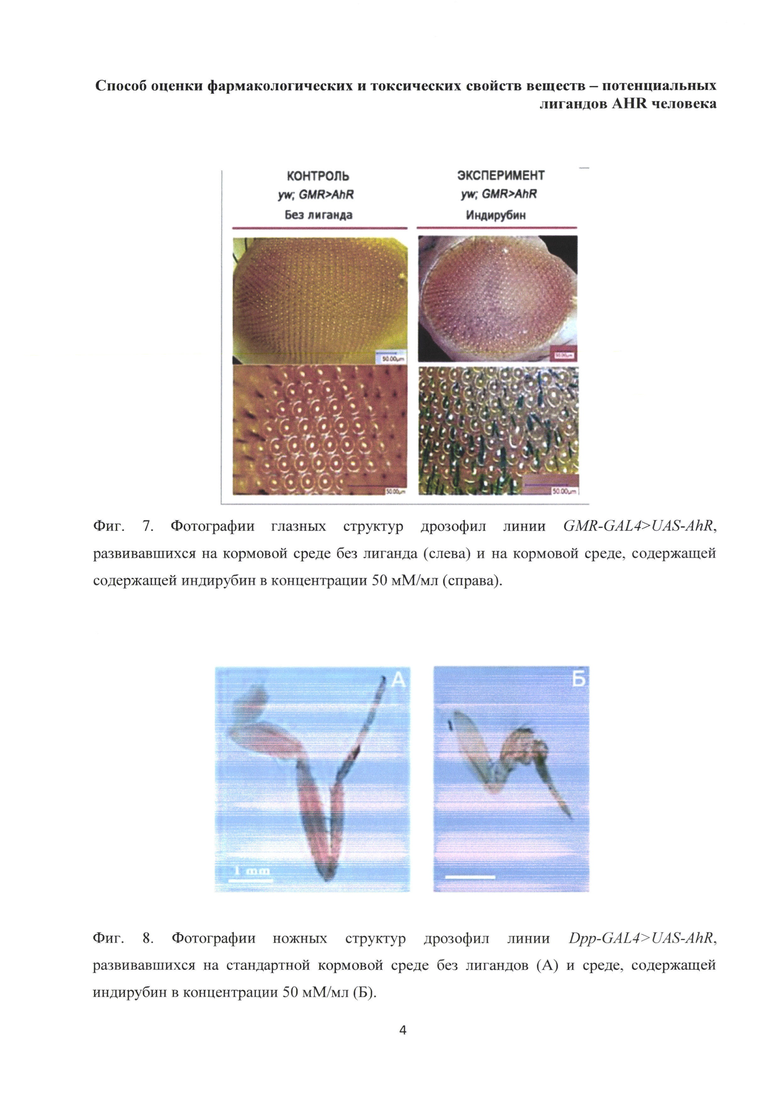
В качестве драйвера была использована линия, в которой ген GAL4 экспрессируется под промотором гена hsp70. Для активации экспрессии мухи подвергались тепловому шоку (37°С) в течение 30 минут, спустя 5 часов выделяли РНК. Также РНК была выделена из мух того же генотипа, но неподверженных тепловому шоку, это позволило исключить вероятность некорректной работы промотора hsp70. На основе выделенной РНК была синтезирована кДНК, с которой была проведена ПЦР реакция с двумя парами специфичных праймеров AhR (табл. 1). Для контроля прохождения ПЦР мы взяли ген рибосомального белка Rpl32, который транскрибируется в организме дрозофилы конститутивно. С полученными продуктами ПЦР был поставлен электрофорез в агарозном геле. В случае транскрипции гена AhR в организме дрозофилы, мы ожидали получить полоски, характерные фрагментам кДНК, длиной 444 н.п. (первая пара праймеров) и 156 н.п. (вторая пара праймеров). Тогда как при отсутствии теплового шока полосок характерных соответствующим фрагментам кДНК быть не должно, т.к. промотор hsp70 не работает без активации тепловым шоком. Результаты эксперимента представлены на фиг. 3. Для гена AhR использовали две пары праймеров и ставили в двух повторностях. Контролем служил ген рибосомального белка Rpl32, экспрессия которого не индуцируется тепловым шоком и который имеет конститутивный уровень экспрессии. «hs+» - мухи подвергались тепловому шоку, «hs-» - мухи не подвергались тепловому шоку. М - маркер.
Как можно видеть на фиг. 3, в двух повторностях (две пары праймеров) присутствуют полоски, отражающие наличие продуктов амплификации, соответствующие ожидаемым по размеру фрагментам кДНК. В отличие от них на дорожке с кДНК мух, не получивших тепловой шок, не обнаружилось никаких полос. Это доказывает, что генетическая конструкция, содержащая ген AHR человека, поставленный под контроль UAS-последовательности, узнаваемой и активируемой, дрожжевым транскрипционным фактором GAL4 встроилась в геном дрозофилы и ген AhR успешно транскрибируется под влиянием GAL4 драйвера. Вместе с тем, исследования экспрессии гена AHR человека показали, что под влиянием различных, тканеспецифичных GAL4 драйверов в данной линии мух, в большинстве органно-тканевых структур дрозофилы активация эндогенными лигандами его белкового продукта не происходит. Наиболее убедительно это проявляется при его активации в овариальных, крыловых, ножных, глазных структурах и в мозге. В перечисленных структурах AHR человека не способен активироваться эндогенными лигандами дрозофилы. Его активация происходит только под влиянием экзогенных лигандов. Оценивали активность AHR человека в органно-тканевых структурах трансгенных мух на основании анализа их морфологии и уровня транскрипции целевых генов. Для выбора целевых генов AHR человека в геноме Drosophila melanogaster, был выполнен биоинформационный поиск генов, участвующих в процессах регуляции биодеградации токсических факторов, пролиферации клеток и их дифференцировки и содержащих в своей структуре узнаваемый AHR Xenobiotic Response Elements (XREs) -5'-GCGTG-3'. В результате были отобраны гены: st6, mgat1, Sox70, Cyp6g1, JST, CDC2, RBF1, CycD, DMYC, Dorsal, Relish, p53, raf1, Rho1, Decapo, dcdc24, dcdc42, JRA.
Основываясь на полученных результатах экспрессии AHR человека в органно-тканевых структурах дрозофилы, мы предлагаем использовать созданную линию мух Drosophila melanogaster, трансформированных генной конструкцией, содержащей ген AHR человека, поставленный под контроль UAS-последовательности, узнаваемой и активируемой, дрожжевым транскрипционным фактором GAL4 для направленного поиска ксенобиотиков, обладающих свойствами лигандов AHR человека (как агонистов, так и антогонистов), для оценки фармако-кинетического потенциала найденных химических соединений, а также для оценки загрязненности токсическими соединениями образцов почвы и воздуха.
Предлагаемый способ оценки фармакологических и токсических свойств веществ - потенциальных лигандов AHR человека с использованием линии мух Drosophila melanogaster, трансформированных генной конструкцией UAS-AhR, содержащей ген AHR человека, поставленный под контроль UAS-последовательности, узнаваемой и активируемой дрожжевым транскрипционным фактором GAL4, характеризуется тем, что в геном мух Drosophila melanogaster, трансформированных генной конструкцией UAS-AhR, при помощи гибридологического синтеза, дополнительно включают тканеспецифическую генную конструкцию dpp-GAL4, либо GMR-GAL4, либо elav-GAL4, на третьей стадии личиночного развития переносят в питательную среду, содержащую исследуемое вещество, далее у достигших стадии имаго мух UAS-AhR, dpp-GAL4 - оценивают структуры конечностей, у мух UAS-AhR, GMR-GAL4 - оценивают глазные структуры, кроме того, у мух UAS-AhR, GMR-GAL4 и UAS-AhR, elav-GAL4 оценивают уровень транскрипции целевых генов AHR, сравнивают полученные характеристики мух, содержащихся на среде, включающей исследуемое вещество, и мух, содержащихся на среде, не включающей исследуемое вещество, и определяют фармакологические и токсические свойства исследуемого вещества по результатам сравнения степени морфологических изменений структур конечностей и глазных структур и уровня транскрипции целевых генов AHR человека у мух всех групп.
Далее в примерах приводится описание процедур, необходимых для проведения оценки лигандной активности к AHR человека, различных химических соединений.
Примеры реализации способа:
Пример 1. Описание процедур, направленных на оценку способности бета-нафтофлавона активировать AHR человека, корректировать уровень транскрипции целевых генов, развитие мозга, глазных и ножных структур Drosophila melanogaster. Мух всех используемых линий поддерживали в прозрачных пластиковых или стеклянных пробирках (диаметр 25 мм, высота 100 мм).
Для исследования влияния экспрессии AHR человека, активированного бета-нафтофлавоном на морфологию глазных структур дрозофилы, использовали трансгенную линию, содержащую генетическую конструкцию GMR-GAL4 экспрессирующую в тканях глаза (драйвер). Для совмещения в одном геноме GMR-GAL4 и UAS-AhR проводили скрещивания по схеме 2:
СХЕМА 2.

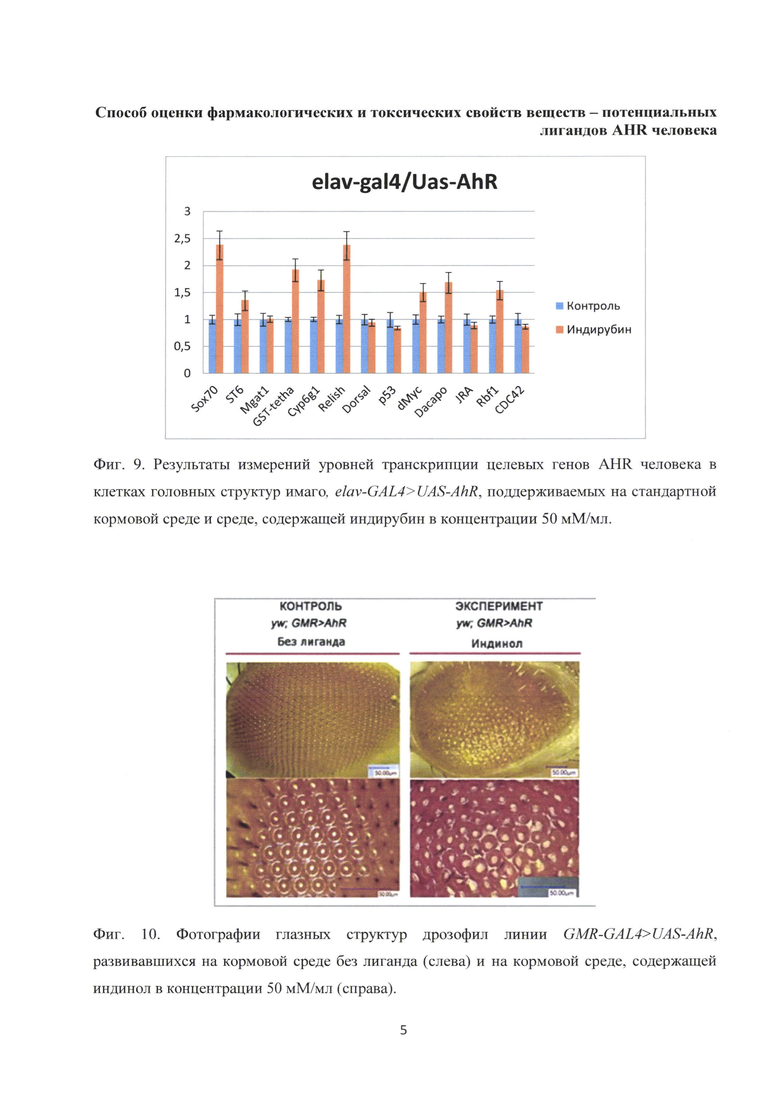
Потомство F1 развивалось в 7 мл стандартной питательной среды (Carolina Biological Sapply - Formula 4-24 (контроль) и среды содержащей бета-нафтофлавон в концентрации 50 мМ/мл (эксперимент). Анализировали структуры глаза при помощи микроскопов: МБС-10 и Keyence vhx 1000е. Фенотип глазных структур, контрольных и подопытных мух представлен на фиг. 4. Видны нарушения в построении омматидиев и механорецепторов.
На рисунке в левой колонке представлены фотографии глазных структур мух дрозофилы, GMR-GAL4>UAS-AhRH2, развивавшихся на кормовой среде без лиганда (контроль). Видна упорядоченность построения омматидиев и механорецепторов (микрощетинок). В правой колонке представлены фотографии глазных структур мух GMR-GAL4>UAS-AhRH2, развивавшихся на кормовой среде, содержащей содержащей бета-нафтофлавон в концентрации 50 мМ/мл (эксперимент). Видны нарушения в построении омматидиев и механорецепторов.
Для исследования влияния экспрессии AHR человека, активированного бета-нафтофлавоном, на морфологию ножных структур дрозофилы, использовали трансгенную линию, содержащую конструкцию dpp-GAL4, экспрессирующуюся в ножных имагинальных дисках. Для совмещения в одном геноме dpp-GAL4 и UAS-AhR проводили скрещивания по схеме 3:
СХЕМА 3.

F1 потомство развивалось в стандартной питательной среде (Carolina Biological Sapply - Formula 4-24 (контроль) и среде содержащей бета-нафтофлавон в концентрации 50 мМ/мл (эксперимент). Анализировали ножные структуры имаго без признаков мутантного гена Tb, при помощи микроскопов: МБС-10 и OLYMPUS VANOX-T АН-2. Фенотип ножных структур контрольных и опытных мух представлен на фиг. 5.
На фигуре представлены ножные структуры мух Dpp-GAL4>UAS-AhRH2, развивавшихся на стандартной кормовой среде (А) и среде содержащей бета-нафтофлавон в концентрации 50 мМ/мл (Б). Мухи, развивавшиеся на стандартной среде, имеют нормальные ножные структуры. У мух, развивавшихся на среде, содержащей бета-нафтофлавон, видны существенные нарушения всех ножных сегментов. Фенотипические проявления эктопической активности AHR человека в ножных и глазных структурах дрозофилы, вызванные действием бета-нафтофлавона, совпадают с последствиями эктопической экспрессии его целевых генов, участвующих в регуляции клеточного цикла, контролируемых тканеспецифическими регуляторными последовательностями. В совокупности эти результаты свидетельствуют о наличии у бета-нафтофлавона свойств лиганда-агониста AHR человека, способного активировать его функции транскрипционного фактора.
Для исследования влияния экспрессии AHR человека, активированного бета-нафтофлавоном на уровень транскрипции целевых генов в нервных клетках дрозофилы проводили скрещивания по схеме 4:
СХЕМА 4.
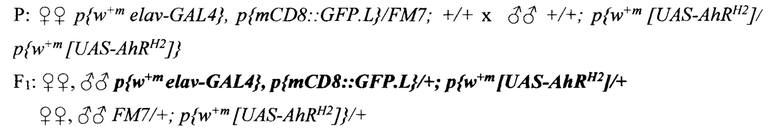
Далее, при помощи флуоресцентного микроскопа Axioskop 40 Pol отбирали имаго, имеющих гены - GFP, elav-GAL4 и UAS-AhR и помещали в пробирки со стандартной питательной средой (Carolina Biological Sapply - Formula 4-24 (контроль) и средой, содержащей бета-нафтофлавон в концентрации 50 мМ/мл (эксперимент), на одни сутки. По истечении суток, мух усыпляли эфиром и отсекали головы (не менее 15), для исследования уровня транскрипции целевых генов при помощи метода полимеразной цепной реакции в реальном времени (ПЦР-РВ).
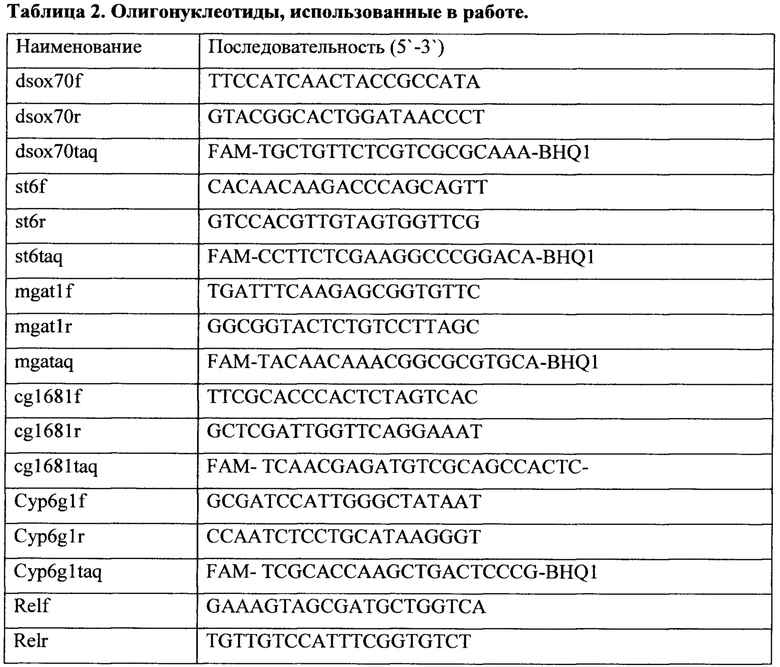
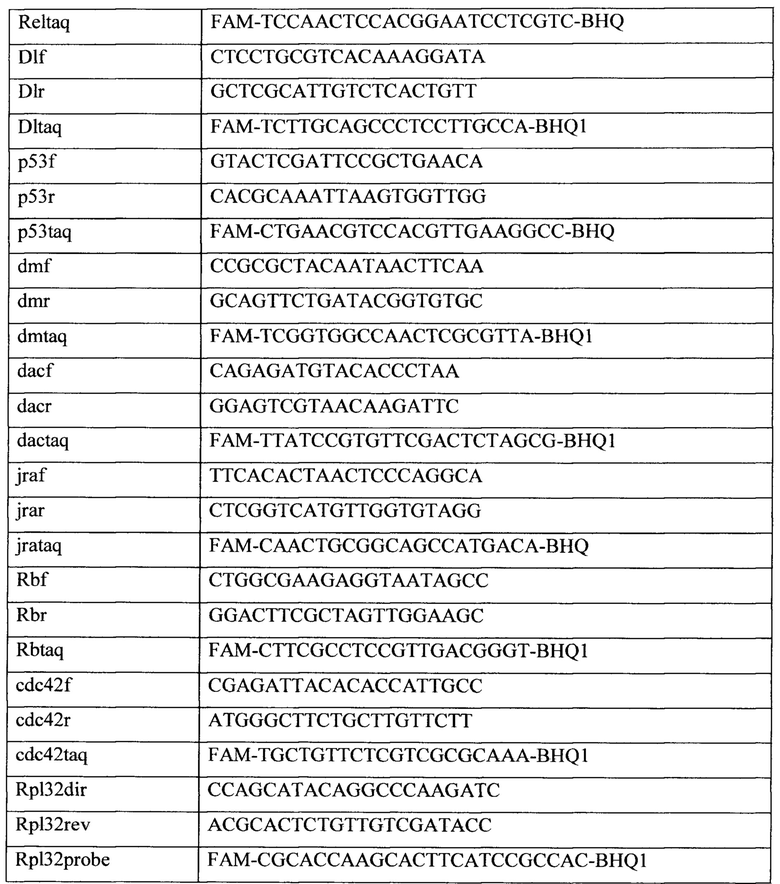
Для проведения ПЦР-РВ использовали прибор ABI Prism 7500 Sequence Detection System, Applied Biosystem, США. Каждую реакцию проводили три раза в объеме 25 μl. Для анализа результатов использовался метод ddCt, позволяющий оценить изменения уровня мРНК при двойном сравнении: исследуемого гена с контрольным между различными образцами. Реакции проводили в режиме относительных измерений. Для проведения реакции использовали готовые смеси qPCRmix-HS SYBR+LowROX («Евроген»). Условия проведения реакции: 10 минут при 95°С («горячий старт» для активации ДНК-полимеразы) и 40 циклов. Каждый цикл состоял из 15 с при 95°С (денатурации) и 1 минуты при 60°С (отжиг с праймерами и элонгация). Стандартные кривые, т.е. кривые зависимости Ст от десятичного логарифма количества внесенной кДНК и вычисление по ним эффективности амплификации для каждой последовательности проводили при помощи программного обеспечения ABI Prism 7500 SDS Software Version 2.0.6 (Applied Biosystem, США). Результаты ПЦР-РВ анализировали с помощью программного обеспечения ABI Prism 7500 SDS Software Version 2.0.6 (Applied Biosystem, США). Для одной реакции использовали 0.5 μl зонда и 0.5 μl каждого праймера (прямого и обратного). Графики различий в экспрессии генов были построены при помощи программного обеспечения Microsoft Office Excel 2007. В качестве контрольного гена использовали ген рибосомального белка Rpl32. Для амплификации использовали следующие пары праймеров и зонды: для гена sox70 праймеры dsox70f, dsox70r, зонд - dsox70taq; для гена st6 праймеры st6f, st6r, зонд-st6taq; для гена mgat1 праймеры mgat1f, mgat1r, зонд - mgataq; для гена GST-tetha праймеры cg1681f, cg1681r, зонд - cg1681 taq; для гена Cyp6g1 праймеры Cyp6g1f, Cyp6g1r, зонд-Cyp6g1taq; для гена Relish праймеры Re1f, Re1r, зонд - Re1taq; для гена Dorsal праймеры D1f, D1r, зонд - D1taq; для гена p53 праймеры p53f, p53r, зонд - p53taq; для гена dMyc праймеры dmf, dmr, зонд - dmtaq; для гена Dacapo праймеры dacf, dacr, зонд - dactaq; для гена JRA праймеры jraf, jrar, зонд - jrataq; для гена Rbf1 праймеры Rbf, Rbr, зонд - Rbtaq; для гена dcdc42 праймеры cdc42f, cdc42r, зонд - cdc42taq; для гена Rpl32 праймеры Rpl32dir, Rpl32rev, зонд - Rpl32probe (табл. 2).
FAM - флуорофор 6-carboxyfluorescein, BHQ1 - гаситель флуоресценции. Олигонуклиотиды синтезировались компанией ЗАО «Синтол» (Россия).
Результаты исследования уровня транскрипции целевых генов AHR человека представлены в виде графиков на фиг. 6.
На рисунке представлены результаты измерений уровней транскрипции целевых генов AHR человека в клетках головных структур имаго elav-GAL4>UAS-AhR, поддерживаемых на стандартной кормовой среде и содержащей бета-нафтофлавон. Результаты демонстрируют повышение уровня транскрипции ряда целевых генов AHR человека в головных структурах мух, содержащихся на кормовой среде с бета-нафтофлавоном.
Результаты измерений уровней транскрипции целевых генов AHR человека в клетках головных структур имаго elav-GAL4>UAS-AhR демонстрируют наличие свойств лиганда-агониста у бета-нафтофлавона. При этом нужно отметить, что бета-нафтофлавон активирует транскрипцию лишь части целевых генов AHR человека. По-видимому, отсутствие активации остальных целевых генов AHR человека обусловлено их эпигенетическим окружением.
В целом результаты исследования свойств бета-нафтофлавона в условиях in vivo в организмах дрозофилы, сочетающих в геноме UAS-AhR человека и различные тканеспецифические генные конструкции-драйверы, показали его способность выполнять функции лиганда-агониста AHR человека, что обуславливает его токсические свойства в отношении развивающегося организма.
Пример 2. Описание процедур, направленных на оценку способности индирубина активировать AHR человека, корректировать уровень транскрипции целевых генов, развитие мозга, глазных и ножных структур Drosophila melanogaster. Мух всех используемых линий поддерживали в прозрачных пластиковых или стеклянных пробирках (диаметр 25 мм, высота 100 мм.) Для исследования влияния экспрессии AHR человека, активированного индирубином, на морфологию глазных структур дрозофилы, использовали трансгенную линию, содержащую генетическую конструкцию - GMR-GAL4 экспрессирующуюся в тканях глаза (драйвер). Для совмещения в одном геноме GMR-GAL4 и UAS-AhR человека, проводили скрещивания по схеме 2.
Потомство F1 развивалось в 7 мл стандартной питательной среды (Carolina Biological Sapply - Formula 4-24 (контроль) и среды, содержащей индирубин в концентрации 50 мМ/мл (эксперимент). Анализировали структуры глаза при помощи микроскопов: МБС-10 и Keyence vhx 1000е. Фенотип глазных структур, контрольных и подопытных мух представлен на фиг 7, где в левой колонке представлены фотографии глазных структур дрозофил GMR-GAL4>UAS-AhR, развивавшихся на кормовой среде без лиганда. Видна упорядоченность построения омматидиев и механорецепторов (микрощетинок). В правой колонке представлены фотографии глазных структур мух GMR-GAL4>UAS-AhR, развивавшихся на кормовой среде, содержащей индирубин в концентрации 50 мМ/мл (эксперимент). Видны нарушения в построении омматидиев и механорецепторов.
Для исследования влияния экспрессии AHR человека, активированного индирубином, на морфологию ножных структур дрозофилы, использовали трансгенную линию, содержащую конструкцию dpp-GAL4, экспрессирующуюся в ножных имагинальных дисках. Для совмещения в одном геноме dpp-GAL4 и UAS-AhR человека проводили скрещивания по схеме 3.
Потомство F1 развивалось в стандартной питательной среде (Carolina Biological Sapply - Formula 4-24 (контроль) и среде, содержащей индирубин в концентрации 50 мМ/мл (эксперимент). Анализировали ножные структуры имаго, без признаков мутантного гена Tb, при помощи микроскопов: МБС-10 и OLYMPUS VANOX-T АН-2. Фенотип ножных структур контрольных и подопытных мух представлен на фиг. 8. Здесь представлены ножные структуры мух dpp-GAL4>UAS-AhR, развивавшихся на стандартной кормовой среде (А) и среде, содержащей индирубин в концентрации 50 мМ/мл (Б). Мухи, развивавшиеся на стандартной среде, имеют нормальные ножные структуры. У мух, развивавшихся на среде, содержащей индирубин, видны существенные нарушения всех ножных сегментов.
Фенотипические проявления эктопической активности AHR человека в ножных и глазных структурах дрозофилы, вызванные действием индирубина, совпадают с последствиями эктопической экспрессии его целевых генов, участвующих в регуляции клеточного цикла, контролируемых тканеспецифическими регуляторными последовательностями. В совокупности эти результаты свидетельствуют о наличии у индирубина свойств лиганда-агониста AHR человека, способного повышать его функции транскрипционного фактора.
Для исследования влияния экспрессии AHR человека, активированного индирубином, на уровень транскрипции целевых генов в нервных клетках дрозофилы проводили скрещивания по схеме 4. Далее, при помощи флуоресцентного микроскопа Axioskop 40 Pol отбирали имаго, имеющих гены GFP, elav-GAL4 и UAS-AhR, и помещали в пробирки со стандартной питательной средой (Carolina Biological Sapply - Formula 4-24 (контроль) и средой, содержащей индирубин в концентрации 50 мМ/мл (эксперимент), на одни сутки. По истечении суток, мух усыпляли эфиром и отсекали головы (не менее 15), для исследования уровня транскрипции целевых генов при помощи метода полимеразной цепной реакции в реальном времени (ПЦР-РВ). Описание процедур и праймеров применяемых при использовании ПЦР-РВ, приведено в разделе - Пример 1.
Для проведения ПЦР-РВ использовали прибор ABI Prism 7500 Sequence Detection System, Applied Biosystem, США. Каждую реакцию проводили три раза в объеме 25 μl. Для анализа результатов использовался метод ddCt, позволяющий оценить изменения уровня мРНК при двойном сравнении исследуемого гена с контрольным между различными образцами. Реакции проводили в режиме относительных измерений. Для проведения реакции использовали готовые смеси qPCRmix-HS SYBR+LowROX («Евроген»). Условия проведения реакции: 10 минут при 95°С («горячий старт» для активации ДНК-полимеразы) и 40 циклов. Каждый цикл состоял из 15 с при 95°С (денатурации) и 1 минуты при 60°С (отжиг с праймерами и элонгация). Стандартные кривые, т.е. кривые зависимости Ст от десятичного логарифма количества внесенной кДНК и вычисление по ним эффективности амплификации для каждой последовательности проводили при помощи программного обеспечения ABI Prism 7500 SDS Software Version 2.0.6 (Applied Biosystem, США). Результаты ПЦР-РВ анализировали с помощью программного обеспечения ABI Prism 7500 SDS Software Version 2.0.6 (Applied Biosystem, США). Для одной реакции использовали 0.5 μl зонда и 0.5 μl каждого праймера (прямого и обратного). Графики различий в экспрессии генов были построены при помощи программного обеспечения Microsoft Office Excel 2007. В качестве контрольного гена использовали ген рибосомального белка Rpl32. Для амплификации использовали следующие пары праймеров и зонды: для гена sox70 праймеры dsox70f, dsox70r, зонд - dsox70taq; для гена st6 праймеры st6f, st6r, зонд-st6taq; для гена mgat1 праймеры mgat1f, mgat1r, зонд-mgataq; для гена GST-tetha праймеры cg1681f, cg1681r, зонд - cg1681taq; для гена Cyp6g1 праймеры Cyp6g1f, Cyp6g1r, зонд -Cyp6g1taq; для гена Relish праймеры Re1f, Re1r, зонд - Re1taq; для гена Dorsal праймеры D1f, D1r, зонд - D1taq; для гена р53 праймеры p53f, p53r, зонд - p53taq; для гена dMyc праймеры dmf, dmr, зонд - dmtaq; для гена Dacapo праймеры dacf, dacr, зонд - dactaq; для гена JRA праймеры jraf, jrar, зонд - jrataq; для гена Rbf1 праймеры Rbf, Rbr, зонд - Rbtaq; для гена dcdc42 праймеры cdc42f, cdc42r, зонд - cdc42taq; для гена Rpl32 праймеры Rpl32dir, Rpl32rev, зонд - Rpl32probe (см. таблицу 2). FAM - флуорофор 6-carboxyfluorescein, BHQ1 - гаситель флуоресценции. Олигонуклиотиды синтезировались компанией ЗАО «Синтол» (Россия).
Результаты исследования уровня транскрипции целевых генов AHR человека представлены в виде графиков на фиг. 9. Здесь представлены результаты измерений уровней транскрипции целевых генов AHR человека в клетках головных структур имаго elav-GAL4>UAS-AhR, поддерживаемых на стандартной кормовой среде и среде, содержащей индирубин. Результаты демонстрируют повышение уровня транскрипции ряда целевых генов AHR человека в головных структурах мух, содержащихся на кормовой среде с индирубином.
Результаты измерений уровней транскрипции целевых генов AHR человека в клетках головных структур имаго elav-GAL4>UAS-AhR демонстрируют наличие свойств лиганда-агониста у индирубина. При этом нужно отметить, что индирубин активирует транскрипцию лишь части целевых генов AHR человека. По-видимому, отсутствие активации остальных целевых генов AHR человека обусловлено их эпигенетическим окружением.
В целом результаты исследования свойств индирубина в условиях in vivo в организме дрозофилы, сочетающей в геноме UAS-AhR человека и различные тканеспецифические генные конструкции-драйверы, показали его способность выполнять функции лиганда-агониста AHR человека, что обуславливает его токсические свойства в отношении развивающегося организма.
Пример 3. Описание процедур, направленных на оценку способности индинола активировать AHR человека, корректировать уровень транскрипции целевых генов, развитие мозга, глазных и ножных структур Drosophila melanogaster. Мух всех используемых линий поддерживали в прозрачных пластиковых или стеклянных пробирках (диаметр - 25 мм, высота 100 мм).
Для исследования влияния экспрессии AHR человека, активированного индинолом, на морфологию глазных структур дрозофилы, использовали трансгенную линию, содержащую генетическую конструкцию GMR-GAL4, экспрессирующуюся в тканях глаза (драйвер). Для совмещения в одном геноме GMR-GAL4 и UAS-AhR человека, проводили скрещивания по схеме 2. Потомство F1 развивалось в 7 мл стандартной питательной среды (Carolina Biological Sapply - Formula 4-24 (контроль) и среды, содержащей индинол в концентрации 100 мМ/мл (эксперимент). Анализировали структуры глаза при помощи микроскопов: МБС-10 и Keyence vhx 1000е. Фенотип глазных структур, контрольных и подопытных мух представлен на фиг. 10. На рисунке в левой колонке представлены фотографии глазных структур дрозофилы GMR-GAL4>UAS-AhR, развивавшихся на кормовой среде без лиганда. Видна упорядоченность построения омматидиев и механорецепторов (микрощетинок). В правой колонке представлены фотографии глазных структур мух GMR-GAL4>UAS-AhR, развивавшихся на кормовой среде, содержащей индинол в концентрации 50 мМ/мл (эксперимент). Видны нарушения в построении омматидиев и существенно уменьшено число механорецепторов.
Для исследования влияния экспрессии AHR человека, активированного индинолом, на морфологию ножных структур дрозофилы, использовали трансгенную линию, содержащую конструкцию dpp-GAL4, экспрессирующуюся в ножных имагинальных дисках. Для совмещения в одном геноме dpp-GAL4 и UAS-AhR человека проводили скрещивания по схеме 3. Потомство F1 развивалось в стандартной питательной среде (Carolina Biological Sapply - Formula 4-24 (контроль) и среде, содержащей индинол в концентрации 100 мМ/мл (эксперимент). Анализировали ножные структуры имаго без признаков мутантного гена Tb, при помощи микроскопов: МБС-10 и OLYMPUS VANOX-T АН-2. Фенотип ножных структур контрольных и подопытных мух представлен на фиг. 11. На рисунке представлены ножные структуры мух dpp-GAL4>UAS-AhR, развивавшихся на стандартной кормовой среде (А) и среде, содержащей индинол в концентрации 100 мМ/мл (Б). Мухи, развивавшиеся на стандартной среде, имеют нормальные ножные структуры. У мух, развивавшихся на среде, содержащей индинол, видны существенные нарушения всех ножных сегментов.
Фенотипические проявления эктопической активности AHR человека в ножных и глазных структурах дрозофилы, вызванные действием индинола, совпадают с последствиями эктопической экспрессии его целевых генов, участвующих в регуляции клеточного цикла, контролируемых тканеспецифическими регуляторными последовательностями. В совокупности эти результаты свидетельствуют о наличии у индинола свойств лиганда-агониста AHR человека, способного повышать его функции транскрипционного фактора.
Для исследования влияния экспрессии AHR человека, активированного индинолом, на уровень транскрипции целевых генов в нервных клетках дрозофилы проводили скрещивания по схеме 4. Далее, при помощи флуоресцентного микроскопа Axioskop 40 Pol отбирали имаго, имеющих гены GFP, elav-GAL4 и UAS-AhR, и помещали в пробирки со стандартной питательной средой (Carolina Biological Sapply - Formula 4-24 (контроль) и средой, содержащей индинол в концентрации 100 Мм/мл (эксперимент), на одни сутки. По истечении суток, мух усыпляли эфиром и отсекали головы (не менее 15), для исследования уровня транскрипции целевых генов при помощи метода полимеразной цепной реакции в реальном времени (ПЦР-РВ). Описание процедур и праймеров применяемых при использовании ПЦР-РВ, приведено в разделе - Пример 1. Для проведения ПЦР-РВ использовали прибор ABI Prism 7500 Sequence Detection System, Applied Biosystem, США. Каждую реакцию проводили три раза в объеме 25 μl Для анализа результатов использовался метод ddCt, позволяющий оценить изменения уровня мРНК при двойном сравнении: исследуемого гена с контрольным между различными образцами. Реакции проводили в режиме относительных измерений. Для проведения реакции использовали готовые смеси qPCRmix-HS SYBR+LowROX («Евроген»). Условия проведения реакции: 10 минут при 95°С («горячий старт» для активации ДНК-полимеразы) и 40 циклов. Каждый цикл состоял из 15 с при 95°С (денатурации) и 1 минуты при 60°С (отжиг с праймерами и элонгация). Стандартные кривые, т.е. кривые зависимости Ст от десятичного логарифма количества внесенной кДНК и вычисление по ним эффективности амплификации для каждой последовательности проводили при помощи программного обеспечения ABI Prism 7500 SDS Software Version 2.0.6 (Applied Biosystem, США). Результаты ПЦР-РВ анализировали с помощью программного обеспечения ABI Prism 7500 SDS Software Version 2.0.6 (Applied Biosystem, США). Для одной реакции использовали 0.5 μl зонда и 0.5 μl каждого праймера (прямого и обратного). Графики различий в экспрессии генов были построены при помощи программного обеспечения Microsoft Office Excel 2007. В качестве контрольного гена использовали ген рибосомального белка Rpl32. Для амплификации использовали следующие пары праймеров и зонды: для гена sox70 праймеры dsox70f, dsox70r, зонд - dsox70taq; для гена st6 праймеры st6f, st6r, зонд - st6taq; для гена mgat1 праймеры mgat1f, mgat1r, зонд - mgataq; для гена GST-tetha праймеры cg1681f, cg1681r, зонд - cg1681taq; для гена Cyp6g1 праймеры Cyp6g1f, Cyp6g1r, зонд - Cyp6g1taq; для гена Relish праймеры Re1f, Re1r, зонд - Re1taq; для гена Dorsal праймеры D1f, D1r, зонд - D1taq; для гена р53 праймеры p53f, p53r, зонд - p53taq; для гена dMyc праймеры dmf, dmr, зонд - dmtaq; для гена Dacapo праймеры dacf, dacr, зонд - dactaq; для гена JRA праймеры jraf, jrar, зонд - jrataq; для гена Rbf1 праймеры Rbf, Rbr, зонд - Rbtaq; для гена dcdc42 праймеры cdc42f, cdc42r, зонд - cdc42taq; для гена Rpl32 праймеры Rpl32dir, Rpl32rev, зонд - Rpl32probe (смотрите таблицу 2). FAM - флуорофор 6-carboxyfluorescein, BHQ1 - гаситель флуоресценции. Олигонуклиотиды синтезировались компанией ЗАО «Синтол» (Россия).
Результаты исследования уровня транскрипции целевых генов AHR человека представлены в виде графиков на фиг. 12. На рисунке представлены результаты измерений уровней транскрипции целевых генов AHR человека в клетках головных структур имаго, elav-GAL4 и UAS-AhR, поддерживаемых на стандартной кормовой среде и среде, содержащей индинол. Результаты демонстрируют как понижение, так и повышение уровня транскрипции целевых генов AHR человека в головных структурах мух, содержащихся на кормовой среде, содержащей индинол.
Результаты измерений уровней транскрипции целевых генов AHR человека в клетках головных структур имаго elav-GAL4>UAS-AhR демонстрируют способность индинола выполнять функции лиганда AHR человека, в качестве, как агониста, так и антогониста. По-видимому, реализация этих качеств зависит от эпигенетического состояния целевых генов.
В целом результаты исследования свойств индинола в условиях in vivo, в организме дрозофилы, сочетающих в геноме UAS-AhR человека и различные тканеспецифические генные конструкции-драйверы показали его способность выполнять функции лиганда AHR человека, что обуславливает его токсические свойства в отношении развивающегося организма.
Краткий перечень чертежей
Фиг. 1. Схема трансгенной конструкции, содержащей ген AHR человека, поставленный под контроль UAS-последовательности, узнаваемой и активируемой, дрожжевым транскрипционным фактором GAL4 (конструкция pUAS-AhRH2). Обозначения: UAS - дрожжевой промотор, AhR - ген, кодирующий белок арилгидрокарбонового рецептора, mini-white - ген, кодирующий трансмембранный рецептор, обеспечивающий транспорт пигмента в клетку глаза;
Фиг. 2. Электрофореграмма продуктов ПЦР-реакции, проведенной с двумя парами праймеров (верхний и нижний ряд). Использовали ДНК сублиний AHR1, AHR2, AHR3 от исходной линии w; p{w+m[UAS-AhRH2]}, содержащих конструкт pUAS-AhRH2, и ДНК контрольной линии yw, не несущей анализируемой трансгенной конструкции в геноме (К);
Фиг. 3. Электрофореграмма продуктов ПЦР, полученных из мух линии Hsp70-GAL4>UAS-AhR. Для гена AhR использовали две пары праймеров и ставили в двух повторностях. Контролем служил ген рибосомального белка Rpl32, экспрессия которого не индуцируется тепловым шоком и который имеет конститутивный уровень экспрессии. «hs+» - мухи подвергались тепловому шоку, «hs-» - мухи не подвергались тепловому шоку. М - маркер;
Фиг. 4. Фотографии глазных структур дрозофил линии GMR-GAL4>UAS-AhR, развивавшихся на кормовой среде без лиганда (слева) и на кормовой среде, содержащей содержащей бета-нафтофлавон в концентрации 50 мМ/мл (справа). Видны нарушения в построении омматидиев и механорецепторов;
Фиг. 5. Фотографии ножных структур дрозофил линии Dpp-GAL4>UAS-AhR, развивавшихся на стандартной кормовой среде без лигандов (А) и среде, содержащей бета-нафтофлавон в концентрации 50 мМ/мл (Б). Мухи, развивавшиеся на стандартной среде, имеют нормальные ножные структуры. У мух, развивавшихся на среде содержащей бета-нафтофлавоном, видны существенные нарушения всех ножных сегментов;
Фиг. 6. Результаты измерений уровней транскрипции целевых генов AHR человека в клетках головных структур имаго, elav-GAL4>UAS-AhR, поддерживаемых на стандартной кормовой среде и среде, содержащей бета-нафтофлавон в концентрации 50 мМ/мл. Результаты демонстрируют повышение уровня транскрипции ряда целевых генов AHR человека в головных структурах мух содержащихся на кормовой среде содержащей бета-нафтофлавон;
Фиг. 7. Фотографии глазных структур дрозофил линии GMR-GAL4>UAS-AhR, развивавшихся на кормовой среде без лиганда (слева) и на кормовой среде, содержащей содержащей индирубин в концентрации 50 мМ/мл (справа). Видны нарушения в построении омматидиев и механорецепторов;
Фиг. 8. Фотографии ножных структур дрозофил линии Dpp-GAL4>UAS-AhR, развивавшихся на стандартной кормовой среде без лигандов (А) и среде, содержащей индирубин в концентрации 50 мМ/мл (Б). Мухи, развивавшиеся на стандартной среде, имеют нормальные ножные структуры. У мух, развивавшихся на среде, содержащей индирубин, видны существенные нарушения всех ножных сегментов;
Фиг. 9. Результаты измерений уровней транскрипции целевых генов AHR человека в клетках головных структур имаго, elav-GAL4>UAS-AhR, поддерживаемых на стандартной кормовой среде и среде, содержащей индирубин в концентрации 50 мМ/мл. Результаты демонстрируют повышение уровня транскрипции ряда целевых генов AHR человека в головных структурах мух содержащихся на кормовой среде содержащей индирубин;
Фиг. 10. Фотографии глазных структур дрозофил линии GMR-GAL4>UAS-AhR, развивавшихся на кормовой среде без лиганда (слева) и на кормовой среде, содержащей индинол в концентрации 50 мМ/мл (справа). Видны нарушения в построении омматидиев и механорецепторов;
Фиг. 11. Фотографии ножных структур дрозофил линии Dpp-GAL4>UAS-AhR, развивавшихся на стандартной кормовой среде без лигандов (А) и среде, содержащей индинол в концентрации 50 мМ/мл (Б). Мухи, развивавшиеся на стандартной среде, имеют нормальные ножные структуры. У мух, развивавшихся на среде, содержащей индинол, видны существенные нарушения всех ножных сегментов;
Фиг. 12. Результаты измерений уровней транскрипции целевых генов AHR человека в клетках головных структур имаго elav-GAL4>UAS-AhR, поддерживаемых на стандартной кормовой среде и среде, содержащей индинол в концентрации 50 мМ/мл. Результаты демонстрируют повышение уровня транскрипции ряда целевых генов AHR человека в головных структурах мух, содержащихся на кормовой среде, содержащей индинол.
Выводы:
Совокупность признаков изобретения в виде использования мух Drosophila melanogaster, сочетающих в своем геноме генные конструкции, позволяющие управляемо экспрессировать ген арил гидрокарбонового рецептора человека (UAS-AHR) в различных тканях и органах дрозофилы в качестве тест-системы для оценки способности испытуемого вещества выполнять функции лиганда AHR человека, обеспечивает возможность реализации способа исследования и оценки фармакологических и токсикологических свойств веществ, способных понижать или повышать уровень транскрипции генов участвующих в регуляции процессов биодеградации токсических соединений, деления и дифференцировки клеток, их поляризации и программируемой смерти. Реализация предлагаемого изобретения позволит осуществлять быстрый, направленный и достоверный отбор таких веществ.
Источники
1. Ge N.L., Elferink C.J. A direct interaction between the aryl hydrocarbon receptor and retinoblastoma protein. Linking dioxin signaling to the cell cycle. J Biol Chem. 1998; 273(35):22708-22713;
2. Fukunaga B.N., Probst M.R., Reisz-Porszasz S., Hankinson O. Identification of functional domains of the aryl hydrocarbon receptor. J Biol Chem. 1995; 270(49):29270-29278;
3. Stegeman J.J., Hahn M.E., Biochemistry and molecular biology of monooxygenases: currentperspectives on forms, functions, and regulation of cytochrome P450 in aquatic species, in: D.C. Malins, G.K. Ostrander (Eds.), Aquatic Toxicology: Molecular, Biochemical and Cellular Perspectives, CRC/Lewis, Boca Raton, 1994, pp. 87-206;
4. Alan Poland and Joyce C. Knutson. 2,3,7,8-Tetrachlorodibenzo-p-Dioxin and Related Halogenated Aromatic Hydrocarbons: Examination of the Mechanism of Toxicity. Annual Review of Pharmacology and Toxicology. 1982. Vol. 22: 517-554;
5. Schmidt J.V., Su G.H., Reddy J.K., Simon M.C., Bradfield C.A. Characterization of a murine Ahr null allele: involvement of the Ah receptor in hepatic growth and development. Proc Natl Acad Sci USA. 1996; 93(13):6731-6736;
6. Benedict J.C., Lin T.M., Loeffler I.K., Peterson R.E., Flaws J.A. Physiological role of the aryl hydrocarbon receptor in mouse ovary development. Toxicol Sci. 2000; 56(2):382-388;
7. Singh K.P., Wyman A., Casado F.L., Garrett R.W., Gasiewicz T.A. Treatment of mice with the Ah receptor agonist and human carcinogen dioxin results in altered numbers and function of hematopoietic stem cells. Carcinogenesis. 2009; 30(1):11-19;
8. Jin Un-Ho, Lee Syng-ook, and Stephen. Safe Aryl Hydrocarbon Receptor (AHR)-Active Pharmaceuticals Are Selective AHR Modulators in MDA-MB-468 and BT474 Breast Cancer Cells. JPET November 2012 vol. 343 no. 2 333-341;
9. Murray I.A., Morales J.L., Flaveny C.A., Dinatale B.C.,Chiaro C.,Gowdahalli K., et al. Evidence for ligand-mediated selective modulation of aryl hydrocarbon recep toractivity. Mol Pharmacol (2010) 77:247-54.doi:10.1124/mol.109.061788;
10. Cespedes M.A., Galindo M.I., Couso J.P. (2010) Dioxin toxicity in vivo results from an increase in the dioxin-independent transcriptional activity of the Aryl Hydrocarbon Receptor. PLoS ONE 5:e15382;
11. Патент РФ №2534822 на изобретение "Способ оценки фармакологических и токсикологических свойств веществ - радио- и токсикопротекторов";
12. Un-Ho Jin, Syng-ook Lee, and Stephen. Safe Aryl Hydrocarbon Receptor (AHR)-Active Pharmaceuticals Are Selective AHR Modulators in MDA-MB-468 and BT474 Breast Cancer Cells. JPET November 2012 vol. 343 no. 2 333-341.


Изобретение относится к области биологии и экспериментальной медицины. Предложен способ оценки фармакологических и токсических свойств веществ - потенциальных лигандов AHR человека - с использованием линии мух Drosophila melanogaster. В геном мух Drosophila melanogaster, трансформированных генной конструкцией UAS-AhR, при помощи гибридологического синтеза, дополнительно включают тканеспецифическую генную конструкцию, на третьей стадии личиночного развития переносят в питательную среду, содержащую исследуемое вещество. У достигших стадии имаго мух UAS-AhR dpp-GAL4 оценивают структуры конечностей. У мух UAS-AhR GMR-GAL4 оценивают глазные структуры. У мух UAS-AhR GMR-GAL4 и UAS-AhR elav-GAL4 оценивают уровень транскрипции целевых генов AHR. Сравнивают полученные характеристики мух и определяют фармакологические и токсические свойства исследуемого вещества по результатам сравнения степени морфологических изменений структур конечностей и глазных структур и уровня транскрипции целевых генов AHR человека у мух всех групп. Изобретение обеспечивает быстрый, направленный и достоверный отбор потенциальных лигандов AHR человека. 12 ил., 2 табл., 3 пр.
Способ оценки фармакологических и токсических свойств веществ - потенциальных лигандов AHR человека - с использованием линии мух Drosophila melanogaster, трансформированных генной конструкцией UAS-AhR, содержащей ген AHR человека, поставленный под контроль UAS-последовательности, узнаваемой и активируемой дрожжевым транскрипционным фактором GAL4, характеризующийся тем, что в геном мух Drosophila melanogaster, трансформированных генной конструкцией UAS-AhR, при помощи гибридологического синтеза, дополнительно включают тканеспецифическую генную конструкцию dpp-GAL4, либо GMR-GAL4, либо elav-GAL4, на третьей стадии личиночного развития переносят в питательную среду, содержащую исследуемое вещество, далее у достигших стадии имаго мух UAS-AhR, dpp-GAL4 оценивают структуры конечностей, у мух UAS-AhR, GMR-GAL4 оценивают глазные структуры, кроме того, у мух UAS-AhR, GMR-GAL4 и UAS-AhR, elav-GAL4 оценивают уровень транскрипции целевых генов AHR, сравнивают полученные характеристики мух, содержащихся на среде, включающей исследуемое вещество, и мух, содержащихся на среде, не включающей исследуемое вещество, и определяют фармакологические и токсические свойства исследуемого вещества по результатам сравнения степени морфологических изменений структур конечностей и глазных структур и уровня транскрипции целевых генов AHR человека у мух всех групп.
| CESPEDES M.A | |||
| et al | |||
| Dioxin toxicity in vivo results from an increase in the dioxin-independent transcriptional activity of the aryl hydrocarbon receptor | |||
| PLoS One | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| US 20130096067 A1, 18.04.2013 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИМУТАГЕННЫХ ВОЗДЕЙСТВИЙ | 1986 |
|
SU1412308A3 |
Авторы
Даты
2018-08-17—Публикация
2016-10-12—Подача