Информация о грантах
Изобретение осуществлено при правительственной поддержке грант SBIR Grant No. EY016262, полученного от Department of Health and Human Services of the United States of America, National Institutes of Health. Правительство может иметь определенные права на настоящее изобретение.
Уровень техники
RdCVF представляет собой тиоредоксин-подобный белок, специфически экспрессируемый палочковидными фоторецепторными зрительными клетками в сетчатке (Léveillard et al. (2004) Nature Genetics 36:755-759 и вспомогательная информация). У людей обнаружено два различных гена RdCVF, и они обозначаются RdCVF1 и RdCVF2. Оба гена RdCVF кодируют два продукта посредством альтернативного сплайсинга: полноразмерный белок и C-концевой посттранскрипционно усеченный белок, известные как RdCVF-длинный и RdCVF-короткий, соответственно.
RdCVF-короткий описывают как секретируемый трофический фактор, способствующий выживаемости колбочек, а RdCVF-длинный - как окислительно-восстановительно-активный фермент, который взаимодействует с внутриклеточными белками (Léveillard et al. (2010) Sci Transl Med. 2(26): 26psl6). Например, тау-белок описывается как партнер по связыванию для RdCVF-L, и тау-белок является исключительно внутриклеточным (Fridlich et al. (2009) Molecular & Cellular Proteomics 8(6): 1206-18).
Индивидуумы, страдающие некоторыми видами дистрофии сетчатки, как обнаружено, имеют более низкие уровни белка RdCVF в их глазах, чем у индивидуумов, у которых нет дистрофии сетчатки (публикация PCT WO 02/081513).
Продемонстрировано, что различные формы белка RdCVF могут способствовать выживаемости колбочковидных фоторецепторных зрительных клеток in vitro и in vivo. Например, внутриглазные инъекции короткой формы белка RdCVF1 человека (RdCVF1S) не только спасают колбочковидные зрительные клетки от дегенерации, но также сохраняют их функцию на животных моделях наследственной дегенерации сетчатки (Yang et al. (2009) Mol Therapy 17: 787-795). Однако демонстрация защитного воздействия этого белка на колбочковидные зрительные клетки in vivo требует использования множества внутриглазных инъекций.
Экспрессирование значительных уровней RdCVF в масштабе и из векторов для генной терапии является проблемой; см., например, публикацию патента США № 20110034546, абзац [0004].
Цитирование или обсуждение ссылки в настоящем документе не должно рассматриваться как признание того, что она представляет собой предыдущий уровень техники для настоящего изобретения.
Сущность изобретения
Настоящее изобретение относится, частично, к нуклеиновым кислотам, кодирующим RdCVF, к конструктам экспрессирования RdCVF, к векторам RdCVF, к способам экспрессирования RdCVF, к способам замедления, предотвращения или ингибирования гибели фоторецепторных клеток (например, колбочковидных и/или палочковидных зрительных клеток), к лечению глазных заболеваний, таких как дистрофия сетчатки, и к лечению нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона или заболевания органов обоняния.
Настоящее изобретение предлагает композиции, способы экспрессирования белков RdCVF из клетки (клеток) и способы лечения.
Некоторые варианты осуществления настоящего изобретения предлагают нуклеиновые кислоты, содержащие последовательность нуклеотидов, которая кодирует кодирующую последовательность для белка RdCVF, где кодирующая последовательность RdCVF содержит перекодированную последовательность нуклеотидов.
Настоящее изобретение также включает вирусные векторы, содержащие нуклеиновую кислоту, где нуклеиновая кислота содержит последовательность нуклеотидов, которая кодирует кодирующую последовательность для белка RdCVF, где кодирующая последовательность RdCVF содержит перекодированную последовательность нуклеотидов.
Некоторые варианты осуществления настоящего изобретения относятся к изолированной клетке, содержащей нуклеиновую кислоту по настоящему изобретению.
Другие варианты осуществления настоящего изобретения относятся к белку RdCVF, продуцируемому клеткой по настоящему изобретению или из нуклеиновой кислоты по настоящему изобретению. В некоторых вариантах осуществления белок RdCVF представляет собой не встречающуюся в природе последовательность аминокислот RdCVF.
Включенными в настоящее изобретение также являются фармацевтические средства, содержащие (i) фармацевтически приемлемый носитель и (ii) нуклеиновую кислоту по настоящему изобретению, вирусный вектор по настоящему изобретению, белок RdCVF по настоящему изобретению или их сочетание.
Также предлагаются способы получения белка RdCVF, включающие культивирование клетки по настоящему изобретению при условиях, которые дают возможность для экспрессирования и секретирования белка RdCVF и выделения белка RdCVF из культуры клеток.
Некоторые варианты осуществления настоящего изобретения относятся к способам сохранения палочковидных зрительных клеток, включающим введение в глаз млекопитающего нуклеиновой кислоты по настоящему изобретению, вирусного вектора по настоящему изобретению, белка RdCVF по настоящему изобретению или их сочетания.
Настоящее изобретение также предлагает способы лечения таких заболеваний, как дистрофия сетчатки, дегенерация желтого пятна Штаргардта, пигментная дистрофия сетчатки, сухая возрастная макулярная дегенерация (сухая AMD), географическая атрофия сетчатки (поздняя стадия сухой AMD), влажная возрастная макулярная дегенерация (влажная AMD), глаукома с внутриглазной гипертонией или без нее, диабетическая ретинопатия, синдром Барде-Бидля, синдром Бессена-Корнцвейга, болезнь Беста, хороидеремия, гиратная атрофия, врожденный амавроз, синдром Рефсума, синдром Уше, глазное заболевание, связанное со щитовидной железой, Базедова болезнь, заболевание, связанное с пигментированными эпителиальными клетками сетчатки, заболевание переднего сегмента, заболевание/катаракта хрусталика, расстройство глазной чаши, увеит, болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона или заболевание органов обоняния.
Некоторые варианты осуществления настоящего изобретения относятся к способам сохранения палочковидных зрительных клеток, включающим введение в глаз млекопитающего нуклеиновой кислоты и/или вирусного вектора по настоящему изобретению, где нуклеиновая кислота и/или вирусный вектор вводятся посредством субретинальной инъекции и палочковидные зрительные клетки сохраняются в области, отличной от области субретинальной инъекции.
Некоторые варианты осуществления настоящего изобретения относятся к способам сохранения колбочковидных зрительных клеток, включающим введение в глаз млекопитающего нуклеиновой кислоты и/или вирусного вектора по настоящему изобретению, где нуклеиновая кислота и/или вирусный вектор вводятся посредством субретинальной инъекции и колбочковидные зрительные клетки сохраняют в области, отличной от области субретинальной инъекции.
Настоящее изобретение также предлагает способы секретирования белка RdCVF из клетки, включающие введение в клетку нуклеиновой кислоты или вирусного вектора по настоящему изобретению.
Белок RdCVF может представлять собой RdCVF1 или белок RdCVF2, или длинную или короткую версию.
Предполагается, что любой способ или композиция, описанные в настоящем документе, могут осуществляться по отношению к любому другому способу или композиции, описанным в настоящем документе. Использование терминов, обозначающих единственное число, когда они используются в сочетании с термином "включающий" в формуле изобретения и/или в описании, может обозначать "один", но также согласуется с обозначением "один или несколько", "по меньшей мере один" и "один или больше одного". Использование термина/фразы "и/или", когда ее используют при перечислении, означает, что можно использовать один или несколько перечисленных объектов, например, что это использование не ограничивается одним или всеми элементами.
Настоящее описание сущности изобретения необязательно описывает все признаки или необходимые признаки настоящего изобретения. Настоящее изобретение может также состоять в некотором выборочном сочетании описываемых признаков.
Краткое описание фигур
Для цели иллюстрации настоящего изобретения на чертежах изображены определенные варианты осуществления настоящего изобретения. Однако настоящее изобретение не ограничивается именно теми системами и инструментариями вариантов осуществления изобретения, которые изображены на чертежах.
Фиг. 1 показывает SDS-PAGE анализ очищенных частиц рекомбинантного вектора AAV-RdCVF1L и AAV-GFP. Белки препарата rAAV-GFP (полоса 1) и двух препаратов rAAV-RdCVF1L (полоса 2 и 3) разделяются с помощью SDS-PAGE и визуализируются с помощью анализа с окрашиванием серебром.
Фиг. 2 показывает Вестерн-блот анализ экспрессирования RdCVF1L в клетках ARPE-19, трансдуцированных вектором rAAV-RdCVF1L. Лизат клеток (Фиг. 2A) и супернатант (Фиг. 2B) клеток ARPE-19, трансдуцированных rAAV, разделяют с помощью SDS-PAGE и осуществляют Вестерн-блот по отношению к белку RdCVF1L. Полоса 1 показывает лизат нетрансдуцированных клеток ARPE-19 (Фиг. 2A) и супернатант для контроля (Фиг. 2B), полоса 2 и полоса 3 показывают лизаты клеток (Фиг. 2A) и супернатант (Фиг. 2B) клеток ARPE-19, трансдуцированных rAAV-GFP и rAAV-RdCVF1L, соответственно.
Фиг. 3 показывает подтверждение повышенного экспрессирования RdCVF в глазах после инъекции rAAV-RdCVF1L по сравнению с rAAV-GFP и нелечеными глазами нормальных мышей Balb/C с помощью Вестерн-блот через шесть недель после инъекции векторов. Экстракты белков из клеток ARPE-19, трансдуцированных rAAV-RdCVF1L, используют в качестве положительного контроля (полоса 14 и 17), в то время как экстракт нетрансдуцированных клеток используют в качестве отрицательного контроля (полоса 15). Белок RdCVF детектируют в глазах после инъекции rAAV-RdCVF1L (полоса 6, 8, 10 и 12), в то время как в нелеченых контралатеральных глазах тех же животных, а также в глазах после инъекции rAAV-GFP (полоса 2-5), наблюдают отсутствие или только слабое присутствие зон, соответствующих RdCVF (полоса 7, 9, 11 и 13). Полоса 1 представляет собой стандартный белковый маркер. Полоса 16 представляет собой экстракт белков из нормального глаза мыши дикого типа.
Фиг. 4 показывает иммуногистохимическое окрашивание RdCVF в клетках RPE RPE-хориоидно-склеральных препаратов на плоской поверхности. Устойчивое экспрессирование RdCVF наблюдают в глазу после инъекции rAAV-RdCVF1L у нормальных мышей Balb/C через шесть недель после инъекции вектора (Фиг. 4A), но не в контралатеральном глазу без инъекции (Фиг. 4B). Не наблюдается иммунной реакции в образце, обработанном без первичного антитела (Фиг. 4C). Препараты на плоской поверхности контрастно окрашивают с помощью DAPI, чтобы показать ядра клеток в голубом цвете.
Фиг. 5 показывает иммуногистохимическое окрашивание RdCVF1L нейроретинальных препаратов на плоской поверхности. Наблюдают устойчивое экспрессирование RdCVF1L фоторецепторных клеток в глазу после инъекции rAAV-RdCVF1L для нормальных мышей Balb/C через шесть недель после инъекции вектора (Фиг. 5A). Большая часть окрашивания находится на наружных сегментах фоторецепторных клеток. В противоположность этому, в фоторецепторных клетках контралатерального глаза без инъекции видно только фоновое окрашивание (Фиг. 5B). Не наблюдается иммунной реакции в образцах, обработанных без первичного антитела (Фиг. 5C).
Фиг. 6 показывает результаты исследований, которые демонстрируют экспрессирование RdCVF1L в клетках RPE и фоторецепторных клетках через 5 недель после субретинальной инъекции AAV-RdCVF1L на мышах rd10. Клетки RPE, экспрессирующие RdCVF, видны приблизительно для половины RPE-хориоидно-склеральных препаратов на плоской поверхности с вектором rAAV-RdCVF1L для глаза после инъекции (A), но не для контралатерального глаза (B) без инъекции. Фоторецепторные клетки (C) также трансдуцируются как сегменты, экспрессирующие RdCVF, они наблюдаются на препарате на плоской поверхности сетчатки для того же глаза. В противоположность этому, экспрессирования RdCVF в контралатеральном глазу (D) без инъекции не наблюдается. Темно-зеленые клетки в (D) вероятно представляют собой аутофлуоресцентные макрофаги, прилипшие к сетчатке. При большом увеличении видны трансдуцированные клетки RPE (E), сохраняющие типичную гексагональную морфологию, и фоторецепторные сегменты (F), экспрессирующие RdCVF.
Фиг. 7 показывает спасение фоторецепторов посредством субретинальной инъекции AAV-RdCVF1L на мышах rd10. Фотографии, сделанные под оптическим микроскопом, репрезентативных ретинальных срезов от 2 мышей, у которых правые глаза принимали rAAV-RdCVF1L в день 3 после рождения (A и C), а левые глаза (B и D) служили в качестве нелеченых контролей. Мышей rd10 умерщвляли в возрасте 5 недель. Нужно отметить разницу в толщине наружного ядерного слоя (ONL) между лечеными (двусторонние стрелки) и нелечеными глазами (односторонние стрелки). Имеются 2-4 ряда в глазах, леченых AAV-RdCVF (A и C), по сравнению с 1 рядом в нелеченых глазах (B и D). Фоторецепторные внутренние и наружные сегменты остаются в некоторых областях защищенной сетчатки (E). IS, внутренние сегменты; OS, наружные сегменты; ONL, наружный ядерный слой.
Фиг. 8 показывает фотографию, сделанную под оптическим микроскопом глазной чаши от репрезентативной мыши rd10 в возрасте 5 недель, которая принимала субретинальную инъекцию rAAV-RdCVF1L в одном глазу (Панель A, Фиг. 8), и никакого лечения в контралатеральном глазу (Панель B, Фиг. 8). Как показано, больше фоторецепторных клеток сохраняется в леченом глазу.
Фиг. 9 показывает аннотированную последовательность нуклеотидов rAAV-RdCVF1L.
Фиг. 10A: Доставка rAAV-RdCVF1L улучшает ретинальную функцию у мышей rd10. ERG осуществляют приблизительно через 5 недель после инъекции rAAV-RdCVF1L. Измерения реакций ERG у всех 8 мышей, которых исследовали авторы, показывает, что средние амплитуды b-волны от леченых глаз примерно в 3 раз больше амплитуд от нелеченых вторых глаз, что является статистически значимым (p=0,025).
Фиг. 10B: Доставка rAAV-RdCVF1L улучшает ретинальные функции у мышей rd10. ERG осуществляют приблизительно через 5 недель после инъекции rAAV-RdCVF1L. Правая панель: это средние значения по восьми сигналам от леченого глаза (черная линия, n=8) и от нелеченого второго глаза (красная линия, n=8), которые регистрируют при интенсивности одиночных световых вспышек на темном фоне 25 кд⋅с/м2. Очевидно, что леченые глаза имеют гораздо более высокий отклик, чем вторые глаза. Левая панель: измерение реакций ERG от всех 8 мышей, которые исследуют авторы, показывают, что средние амплитуды b-волны от леченых глаз примерно в 3 раз больше амплитуды от нелеченых вторых глаз, что является статистически значимым (p=0,025).
Фиг. 11A и 11B: Сохранение фоторецепторов с помощью субретинальной инъекции rAAV-RdCVF1L у мышей rd10. Фотографии, сделанные под оптическим микроскопом, ретинальных сечений от мышей, у которых правый глаз принимает rAAV-RdCVF1L в день 3 после рождения (A), а левый глаз (B) служит в качестве нелеченых контролей. Нужно отметить разницу в толщине ONL между леченым и нелеченым глазом. Имеется примерно 4 ряда в леченом глазу (A) по сравнению с 1 рядом в нелеченых глазах (B). Наружные сегменты фоторецепторов остаются в некоторых областях защищенной сетчатки; ONL, наружный ядерный слой.
Фиг. 12: Сравнение толщины наружного ядерного слоя (ONL) в глазах мышей rd10, леченых rAAV-RdCVF1L, и для нелеченых глаз. Средняя толщина ONL в леченых глазах (красный столбик) значимо больше (P=0,006), чем для нелеченых глаз (черный столбик). Числа представляют собой среднее значение + SD (среднеквадратичное отклонение).
Подробное описание
Как используется в настоящем документе, переходной термин "включающий" является открытым. Пункт формулы изобретения, использующий этот термин, может содержать элементы в дополнение к тем, которые упоминаются в таком пункте. Таким образом, например, пункты формулы изобретения могут читаться относительно способов, которые также включают другие стадии, не упоминаемые в них конкретно, постольку поскольку присутствуют их упоминаемые элементы или эквивалент.
Термины "идентичность" и "идентичный", когда используются в контексте сравнения двух последовательностей, таких как последовательности нуклеотидов или аминокислот, относятся к проценту последовательности, который совпадает для двух последовательностей. Процент идентичности может определяться с помощью алгоритмов, обычно используемых специалистами в данной области. Например, процент идентичности может быть определен с использованием инструментов и программ, доступных от National Center for Biotechnology Information (NCBI), как доступно на их веб-сайте. Процент идентичности двух последовательностей нуклеотидов может быть определен, например, с использованием набора NCBI/BLAST/blastn. Blastn может использоваться с параметрами, установленными при: expect threshold=10; word size=28; max matches in a query range=0; match/mismatch scores=1,-2; gap costs= existence:5 extension:2.
Публикации PCT WO 2002/081513, WO 2008/148860 и WO 2009/146183 описывают разнообразные композиции и способы, относящиеся к RdCVF. В некоторых случаях композиции и способы, относящиеся к RdCVF, описанные в публикациях PCT WO 2002/081513, WO 2008/148860 и WO 2009/146183, могут использоваться, например, для замены нуклеиновой кислоты, кодирующей RdCVF, вектора или белка, нуклеиновой кислотой, вектором или белком по настоящему изобретению, например, нуклеиновыми кислотами и векторами, содержащими кодирующую последовательность RdCVF дикого типа.
Некоторые варианты осуществления настоящего изобретения предлагают последовательности аминокислот пробелков RdCVF, такие как SEQ ID NO:2 и 4. Настоящее изобретение также предлагает последовательности нуклеотидов, кодирующие пробелки RdCVF, такие как SEQ ID NO:1, 3 и 11.
Настоящее изобретение также предлагает способы лечения заболевания у субъекта, где заболевание опосредуется изменением экспрессирования гена RdCVF1 или RdCVF2 или связано с ним (например, уменьшения присутствия полипептида RDCVF1 или RDCVF2 в глазу), посредством введения терапевтически эффективного количества нуклеиновой кислоты или вектора, кодирующего белок RDCVF1 или RdCVF2, или родственный белок, или его фрагмент или часть, субъекту.
В другом аспекте белок RdCVF, нуклеиновая кислота, вектор или композиция по настоящему изобретению могут использоваться при приготовлении лекарственного средства, например, для лечения заболеваний, перечисленных в настоящем документе.
Продукты, композиции, процессы и способы по настоящему изобретению могут использоваться, среди прочего, для исследовательских, биологических, клинических или терапевтических целей.
RdCVF
Продемонстрировано, что белок RdCVF может способствовать выживаемости колбочковидных фоторецепторных зрительных клеток in vitro и in vivo. Например, внутриглазные инъекции короткой формы белка RdCVF1 (RdCVF1S) человека не только спасают колбочковидные зрительная клетки от дегенерации, но также сохраняют их функцию на животных моделях с наследственной дегенерацией сетчатки. (Yang et al. (Mol Therapy (2009) 17: 787-795 и дополнительный материал). RdCVF экспрессируется несколькими типами клеток, включая палочковидные фоторецепторные зрительные клетки в сетчатке (Léveillard et al. (2004) Nature Genetics 36: 755-759).
Два различных гена RdCVF обнаружены у людей и других млекопитающих, и они обозначаются RdCVF1 и RdCVF2. Оба гена RdCVF кодируют два продукта посредством альтернативного сплайсинга: полноразмерный белок и C-концевой усеченный белок, известные как длинный RdCVF и короткий RdCVF соответственно.
В некоторых вариантах осуществления настоящее изобретение включает перекодированную кодирующую последовательность RdCVF. Перекодированная кодирующая последовательность RdCVF может кодировать любой белок RdCVF, включая любой белок из тех, которые описаны в настоящем документе. Последовательности для разнообразных белков RdCVF можно найти в публикациях PCT №№ WO 2002081513 и WO 2010029130; Chalmel et al. (BMC Molecular Biology (2007) 8: 74 pp 1-12 и вспомогательная информация); Léveillard et al. (Nature Genetics (2004) 36: 755-759 и вспомогательная информация); Yang et al. (Mol Therapy (2009) 17: 787-795 и дополнительный материал) и GenBank Accession No. NP_612463, AAH14127, Q96CM4, EAW84608, CAD67528, Q5VZ03, NP_001155097, NP_660326, CAM24748, CAM14247, AAH22521 и CAD67531. (Для ясности, все эти последовательности GenBank, а также все другие патентные и непатентные публикации, обсуждаемые в настоящем документе, включаются в качестве ссылок во всей их полноте.)
В некоторых вариантах осуществления белок RdCVF представляет собой фрагмент или аналог белка RdCVF, который сохраняет активность выживаемости или защитное воздействие колбочковидной зрительной клетки и/или палочковидной зрительной клетки. Способы измерения этих активностей или воздействий известны в данной области. Например, Léveillard et al. (Nature Genetics (2004) 36: 755-759 и вспомогательная информация) описывают соответствующие модели мышей и способы in vitro детектирования активности RdCVF. Белок RdCVF или RdCVF, кодируемый нуклеиновой кислотой, может иметь последовательность аминокислот иную, чем встречающаяся в природе последовательность аминокислот. Например, белок RdCVF, который не встречается в природе, может содержать аминокислоты в дополнение к тем, Которые находятся в белке RdCVF, встречающемся в природе (например, на амино- или карбокси-конце), и/или может содержать одно или множество замещений аминокислот (например, консервативные или неконсервативные замещения аминокислот) по сравнению с последовательностью аминокислот RdCVF, встречающейся в природе. Консервативное замещение аминокислоты, как правило, не изменяет заметно структурных характеристик исходной последовательности (например, аминокислота замещения не должна иметь тенденцию к разрыву спирали, которая существует в исходной последовательности, или разрушать другие типы вторичной структуры, которые характеризуют исходную последовательность). Примеры наблюдаемых в данной области вторичных и третичных структурах полипептидов описаны в Proteins, Structures and Molecular Principles (Creighton, Ed., W. H. Freeman and Company, New York (1984)); Introduction to Protein Structure (C. Branden and J. Tooze, eds., Garland Publishing, New York, N.Y. (1991)); and Thornton et al. Nature 354: 105 (1991). Консервативные замещения включают, но не ограничиваясь этим, замещения из следующих групп: кислотные остатки Asp (D) и Glu (E); основные остатки Lys (K), Arg (R) и His (H); гидрофильные незаряженные остатки Ser (S), Thr (T), Asn (N) и Gln (Q); алифатические незаряженные остатки Gly (G), Ala (A), Val (V), Leu (L) и Ile (I); неполярные незаряженные остатки Cys (C), Met (M) и Pro (P); ароматические остатки Phe (F), Tyr (Y) и Trp (W); остатки, содержащие группу спирта, S и T; алифатические остатки I, L, V и M; циклоалкенил-ассоциированные остатки F, H, W и Y; гидрофобные остатки A, C, F, G, H, I, L, M, R, T, V, W и Y; отрицательно заряженные остатки D и E; полярные остатки C, D, E, H, K, N, Q, R, S и T; положительно заряженные остатки H, K и R; малые остатки A, C, D, G, N, P, S, T и V; очень малые остатки A, G и S; остатки, вовлеченные в образование петель, A, C, D, E, G, H, K, N, Q, R, S, P и T; и гибкие остатки Q, T, K, S, G, P, D, E и R. В некоторых вариантах осуществления настоящего изобретения, не встречающийся в природе белок RdCVF имеет дополнительные аминокислоты на амино-конце, например, дополнительные аминокислоты от гетерологичного сигнального пептида. В некоторых вариантах осуществления белок RdCVF по настоящему изобретению сначала транслируется с кодирующей последовательности нуклеотидов с помощью сигнального пептида, и в некоторых случаях все аминокислоты сигнального пептида или их часть сохраняются на экспрессируемом и/или секретируемом белке RdCVF по настоящему изобретению.
Перекодированные последовательности, кодирующие RdCVF
Термин "перекодированный" или "перекодированная последовательность нуклеотидов" означает, что по меньшей мере один нативный кодон заменен на отличный кодон, который кодирует такую же аминокислоту, как и нативный кодон. В некоторых вариантах осуществления перекодированная область, кодирующая RdCVF, имеет по меньшей мере 2,5%, по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% перекодированных кодонов. В некоторых вариантах осуществления примерно 20-50%, 35-45%, 38-42% или 39-41% кодонов являются перекодированными. В некоторых вариантах осуществления перекодированный кодон заменяется кодоном, который с большим преобладанием используется у людей. В некоторых вариантах осуществления по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50% или по меньшей мере 55% кодонов заменяются кодоном, который с большим преобладанием используется у людей.
В некоторых вариантах осуществления перекодированная последовательность имеет в пределах примерно 70-90%, примерно 75-85%, примерно 80-85% или примерно 82-85% идентичность с соответствующей нативной кодирующей последовательностью. В некоторых вариантах осуществления перекодированная последовательность нуклеотидов имеет по меньшей мере 15% нуклеотидов, отличающихся от нуклеотидов, по сравнению с соответствующей нативной последовательностью нуклеотидов. В некоторых вариантах осуществления перекодированная последовательность нуклеотидов является менее чем на 90% идентичной с соответствующей нативной последовательностью нуклеотидов.
Перекодирование может также использоваться для изменения химического восполнения кодирующей последовательности ДНК и/или РНК, например, процентного содержания гуанина/цитозина (GC). В некоторых вариантах осуществления перекодирование области, кодирующей RdCVF, повышает содержание GC по меньшей мере до 60%. В некоторых вариантах осуществления перекодированная область, кодирующая RdCVF, имеет процентное отношение GC в пределах 60-64% или 60,4%-63,5%.
Перекодирование может использоваться для изменения вторичной структуры мРНК. Перекодирование может также использоваться для удаления или добавления конкретных мотивов или сайтов в кодирующую последовательность или молекулу нуклеиновой кислоты, таких как ингибиторные мотивы прокариотов, консенсусные сайты доноров сплайсированного фрагмента, сайты скрытых доноров сплайсированного фрагмента или их сочетание. В некоторых вариантах осуществления перекодированная последовательность, кодирующая RdCVF, имеет меньше ингибиторных мотивов прокариотов, консенсусных сайтов доноров сплайсированного фрагмента, сайтов скрытых доноров сплайсированного фрагмента или их сочетаний, чем нативная последовательность. В некоторых вариантах осуществления перекодированная последовательность, кодирующая RdCVF, не содержит ингибиторных мотивов прокариотов, консенсусных сайтов доноров сплайсированного фрагмента и/или сайтов скрытых доноров сплайсированного фрагмента.
Hoover et al. (Nucleic Acids Res. (2002) 30:e43, pp 1-7); Fath et al. (PLoS ONE (2011) 6:e17596 pp 1-14); Graf et al. (J Virol (2000) 74: 10822-10826; Raab et al. Syst Synth Biol (2010) 4: 215-225; и заявка на патент США 20070141557 описывают перекодированные кодирующие области.
В некоторых вариантах осуществления настоящего изобретения, перекодированная последовательность, кодирующая RdCVF, не содержит начального ATG кодона RdCVF и/или стоп-кодона RdCVF (например, TAG). Например, перекодированная последовательность, кодирующая RdCVF, может функционально связываться через 5' или 3' с другой кодирующей последовательностью, с получением в результате белка, содержащего гетерологичную последовательность аминокислот, N-концевую и/или C-концевую, с последовательностью аминокислот RdCVF, соответственно. В некоторых из этих вариантов осуществления, начальный кодон ATG RdCVF и/или стоп-кодон RdCVF может подвергаться делеции или присутствовать в области кодирования RdCVF. Например, см. SEQ ID NO:1 и SEQ ID NO:3. Если другая кодирующая последовательность сливается на рамке на 3'-конце области кодирования RdCVF, тогда нативный стоп-кодон RdCVF, как правило, не будет присутствовать на конце последовательности, кодирующей RdCVF.
В некоторых вариантах осуществления перекодированная область, кодирующая RdCVF, содержит нуклеотиды 106-741 из SEQ ID NO:1, нуклеотиды 106-429 из SEQ ID NO:1, нуклеотиды 106-432 из SEQ ID NO:3 или нуклеотиды 106-744 из SEQ ID NO:3.
В некоторых вариантах осуществления перекодированная последовательность, кодирующая RdCVF, представляет собой перекодированную последовательность, которая кодирует аминокислоты 36-246 из SEQ ID NO:2.
В некоторых вариантах осуществления кодирующая последовательность по настоящему изобретению кодирует белок, содержащий сигнальную последовательность.
Сигнальные пептиды/сигналы секретирования
Сигнальные последовательности транслируются на рамке как присоединенный пептид, как правило, на амино-концевом конце выбранного полипептида. Секреторная сигнальная последовательность вызовет секретирование полипептида из клетки посредством взаимодействия с механизмами клетки хозяина. В качестве части процесса секретирования, эта секреторная сигнальная последовательность, как правило, будет отщепляться или по меньшей мере частично отщепляться. Термин "сигнальная последовательность" также относится к последовательности нуклеиновых кислот, кодирующих сигнальный пептид. В некоторых вариантах осуществления сигнальная последовательность является гетерологичной по сравнению с конкретным RdCVF.
Структура типичного сигнального пептида может включать три различных области: (i) N-концевую область, которая содержит ряд положительно заряженных аминокислот (например, лизинов и аргининов); (ii) центральную гидрофобную сердцевинную область (h-область); (iii) область гидрофильного расщепления (c-область), которая содержит мотив последовательности, распознаваемый сигнальной пептидазой, (например, см. von Heijne, G. (1983) Eur. J. Biochem., 133: 17-21; von Heijne, G. (1985) J. Mol. Biol, 184: 99-105; von Heijne, G. (1997) Protein Engineering (10): 1-6). Примеры белков с сигнальными пептидами, которые можно использовать в настоящем изобретении, включают, но не ограничиваясь этим, гормон роста человека (HGH), костный морфогенетический белок 7 (BMP7), костный морфогенетический белок 2 (BMP2), цилиарный нейротрофический фактор (CNTF), нейротрофический фактор, полученный из головного мозга (BDNF), инсулиновый фактор роста 1 (IGF-1), β-глюкоронидазу (GUSB), нейротрофический фактор, полученный из глиальных клеток (GDNF), фактор роста гепатоцитов (HGF), фактор роста эндотелия сосудов (VEGF), ингибиторный фактор лейкемии (LIF), белки иммуноглобулины, бычий гормон роста, бычий проальбумин, проинсулин человека, интерферон-гамма человека, альфа-фибриноген человека, тяжелую цепь IgG человека, амилазу крысы, альфа-фетопротеин мыши, куриный лизозим, плацентальную щелочную фосфатазу человека и белок кукурузы реин 22.1. Эти сигнальные пептиды можно использовать в соответствии с настоящим изобретением. В некоторых вариантах осуществления сигнальный пептид, используемый в соответствии с настоящим изобретением, выбирают из группы, состоящей из HGH, BDNF, IGF-1 и GUSB. В некоторых вариантах осуществления сигнальный пептид состоит из иммуноглобулина, такого как IgK.
Сигнальная последовательность может представлять собой сигнальную последовательность млекопитающего, мыши или человека. В некоторых вариантах осуществления нуклеиновая кислота или вектор по настоящему изобретению содержит нуклеотиды 1-105 из SEQ ID NO:1 или 4-105 из SEQ ID NO:1. В некоторых вариантах осуществления сигнальная последовательность кодирует последовательность аминокислот, содержащую аминокислоты 2-34 из SEQ ID NO:2, или содержит SEQ ID NO:15. Последовательность нуклеотидов, кодирующая сигнальный пептид, может представлять собой последовательность дикого типа или она может представлять собой перекодированную последовательность.
В некоторых вариантах осуществления настоящего изобретения сигнальная последовательность пептида кодируется для N-конца или C-конца RdCVF. В некоторых вариантах осуществления сигнальный пептид направляет перенос белка в секреторные пути, например, в эндоплазматический ретикулум (ER). В некоторых вариантах осуществления сигнальный пептид облегчает перенос белка из цитоплазмы в области вне клетки. Сигнальные последовательности пептида могут выбираться из встречающихся в природе сигнальных последовательностей пептидов, их производных или из синтетически сконструированной последовательности. В некоторых вариантах осуществления неограничивающие параметры для сконструированных сигнальных последовательностей пептидов включают последовательность из 3-40 остатков, содержащую гидрофобную сердцевину из 3-20 остатков, фланкированную несколькими относительно гидрофильными остатками.
В некоторых вариантах осуществления сигнальная последовательность пептидов не имеет гидрофобной сердцевины. Неограничивающие примеры секреторных белков млекопитающих, которые не имеют типичной гидрофобной сигнальной последовательности и которые можно использовать в настоящем изобретении, включают, но не ограничиваясь этим, IL-1α, IL1β, bFGF, aFGF, PDEGF человека, антикоагулянтный белок, лектин L-14, фактор, получаемый из ATL, фактор XIIIa, Anchorin CII, липокортин I, паратимозин, α-протимозин и трансглутаминазу грызунов, паратимозин и MDGI.
Нуклеиновые кислоты
Настоящее изобретение включает нуклеиновые кислоты, содержащие последовательность нуклеотидов, кодирующую RdCVF, и включает векторы, содержащие эти нуклеиновые кислоты.
Для обеспечения локального и/или долговременного экспрессирования нуклеиновой кислоты, представляющей интерес, некоторые варианты осуществления настоящего изобретения предполагают трансдуцирование клетки нуклеиновой кислотой или вектором, кодирующим RdCVF. Настоящее изобретение не должно рассматриваться как ограниченное каким-либо одним конкретным способом доставки нуклеиновой кислоты, и любой доступный носитель для доставки нуклеиновой кислоты со стратегией доставки нуклеиновой кислоты либо in vivo, либо in vitro, или использование манипулирования клетками (такое как технология Neurotech, Lincoln, RI, например, см. патенты США №№ 6231879; 6262034; 6264941; 6303136; 6322804; 6436427; 6878544), а также нуклеиновые кислоты по настоящему изобретению, кодирующие RdCVF сам по себе (например, "голая ДНК"), могут использоваться при осуществлении настоящего изобретения. Различные носители для доставки, такие как векторы, могут использоваться в настоящем изобретении. Например, вирусные векторы, амфитропные липиды, катионные полимеры, такие как полиэтиленимин (PEI) и полилизин, дендримеры, такие как гребенчатые молекулы и звездообразные молекулы, неионные липиды, анионные липиды, везикулы, липосомы и другие синтетические средства доставки нуклеиновых кислот (например, см. патенты США №№ 6958325 и 7098030; Langer, Science 249: 1527-1533 (1990); Treat et al., in "Liposomes" in "The Тherapy of Infectious Disease and Cancer"; and Lopez-Berestein & Fidler (eds.), Liss, New York, pp. 317-327 and 353-365 (1989); "голые" нуклеиновые кислоты и тому подобное, могут использоваться при осуществлении настоящего изобретения.
В некоторых вариантах осуществления используют молекулу нуклеиновой кислоты, в которой последовательности, кодирующие RdCVF, и любые другие желаемые последовательности фланкированы областями, которые облегчают гомологичную рекомбинацию на желаемом сайте в геноме, обеспечивая, таким образом, внутрихромосомное экспрессирование нуклеиновой кислоты RdCVF (Koller et al., (1989) Proc. Natl. Acad. Sci. USA 86: 8932-8935; Zijlstra et al. (1989) Nature 342: 435-438). Доставка нуклеиновой кислоты пациенту может быть либо непосредственной, в этом случае пациент непосредственно экспонируется для нуклеиновой кислоты или вектора, несущего нуклеиновую кислоту, или опосредованным, в этом случае клетки сначала трансформируются с помощью нуклеиновой кислоты in vitro, а затем трансплантируются пациенту.
Вектор представляет собой средство, с помощью которого нуклеиновая кислота, представляющая интерес (например, терапевтическая нуклеиновая кислота, которая может кодировать терапевтический белок), вводится в целевую клетку, представляющую интерес. Способы получения или конструирования вектора, представляющего интерес, включают, но не ограничиваясь этим, стандартные методики манипулирования генами, реакции секвенирования, переваривание с помощью ферментов рестрикции, реакции полимеразы, ПЦР, ПЦР SOEing, лигации, реакции рекомбиназы (например, технология Invitrogen GATEWAY®), другие ферменты, активные на нуклеиновых кислотах, материалы и методы размножения бактерий и вирусов, химикалии и реагенты, протоколы сайт-направленного мутагенеза, и так далее, как известно в данной области, см., например, текст Maniatis et al., "Molecular Cloning".
Нуклеиновые кислоты по настоящему изобретению, как правило, будут содержать промоторную последовательность, функционально связанную с последовательностью, кодирующей RdCVF. Промотор может представлять собой, например, ткане-специфичный промотор, клетка-специфичный промотор, индуцируемый промотор, подавляемый промотор, конститутивный промотор, синтетический промотор или гибридный промотор. Примеры промоторов, пригодных для использования в конструктах по настоящему изобретению, включают, но не ограничиваясь этим, промотор фага лямбда (PL); ранний промотор SV40; промотор вируса простого герпеса (HSV); промотор цитомегаловируса (CMV), такой как непосредственный ранний промотор CMV человека; гибридный промотор с энхансером CMV и бета-актиновый промотор курицы; систему трансактиватор-чувствительного промотра (tet), контролируемого тетрациклином; промотор длинных конечных повторов (LTR), такой как MoMLV LTR, BIV LTR или HIV LTR; промотор области U3 вируса мышиной саркомы Молони; промотор Granzyme A; регуляторную последовательность (последовательности) гена металлотионеина; промотор CD34; промотор CD8; промотор тимидинкиназы (TK); промотор парвовируса B19; промотор PGK; промотор глюкокортикоидов; промотор белка теплового шока (HSP), такой как промоторы HSP65 и HSP70; промотор иммуноглобулина; промотор MMTV; промотор вируса саркомы Рауса (RSV); промотор lac; промотор CaMV 35S и промотор нопалинсинтетазы. В некоторых вариантах осуществления промотор представляет собой промотор MND (Robbins et al., 1997, J. Virol. 71: 9466-9474) или промотор MNC, который представляет собой производное промотора MND, в котором энхансеры LTR объединены с минимальным промотором CMV (Haberman et al, J. Virol. 74(18): 8732-8739, 2000). В некоторых вариантах осуществления последовательность, кодирующая RdCVF, функционально связана с промоторной последовательностью, содержащей последовательность нуклеотидов 150-812 из SEQ ID NO:11.
В некоторых вариантах осуществления вектор или нуклеиновая кислота по настоящему изобретению содержит интрон, функционально связанный с кодирующей последовательностью для белка RdCVF. Интрон может происходить из гена RdCVF или представлять собой гетерологичный интрон. Гетерологичные интроны известны, и неограничивающие примеры включают интрон гена β-глобина человека и интрон бета-актина. В некоторых вариантах осуществления последовательность интрона представляет собой последовательность интрона гена β-глобина человека. В некоторых вариантах осуществления последовательность интрона содержит нуклеотиды 820-1312 из SEQ ID NO:11 или 908-1307 из SEQ ID NO:11.
В некоторых вариантах осуществления нуклеиновая кислота по настоящему изобретению содержит последовательность нуклеотидов, которая кодирует кодирующую последовательность для белка RdCVF, где последовательность, кодирующая RdCVF, содержит перекодированную последовательность нуклеотидов. Нуклеиновая кислота может кодировать белок RdCVF1 и/или белок RdCVF2. В некоторых вариантах осуществления белок RdCVF представляет собой короткую версию белка RdCVF. В некоторых вариантах осуществления белок RdCVF представляет собой длинную версию белка RdCVF. Для ясности, белок RdCVF может представлять собой RdCVF1-короткий, RdCVF1-длинный, RdCVF2-короткий или RdCVF2-длинный белок. В некоторых вариантах осуществления белок RdCVF представляет собой белок RdCVF человека.
Как правило, область, кодирующая нуклеотиды млекопитающего, начинается с последовательности нуклеотидов ATG (начальный метиониновый кодон), например, находится в области, кодирующей RdCVF человека. Как обсуждается в настоящем документе, некоторые варианты осуществления настоящего изобретения предлагают перекодированную область, кодирующую RdCVF, а в некоторых других вариантах осуществления область кодирования является слитой, находясь на одной рамке со второй областью кодирования, например, с последовательностью, кодирующей сигнальную последовательность. В некоторых из этих случаев последовательность нуклеотидов ATG необязательно находится в начале области кодирования RdCVF, например, область кодирования RdCVF начинается с кодирования второй аминокислоты конкретного белка RdCVF. Однако последовательность нуклеотидов ATG может находиться в начале области кодирования RdCVF, даже когда область кодирования RdCVF функционально связана с помощью другой области кодирования 5' с областью кодирования RdCVF.
В некоторых вариантах осуществления нуклеиновая кислота по настоящему изобретению содержит SEQ ID NO:1, 3 или 11. В некоторых вариантах осуществления нуклеиновая кислота по настоящему изобретению содержит нуклеотиды 150-812, 820-1312 и 1340-2080 из SEQ ID NO:11. В некоторых вариантах осуществления нуклеиновая кислота по настоящему изобретению содержит нуклеотиды 150-812, 908-1307 и 1340-2080 из SEQ ID NO:11. В некоторых вариантах осуществления нуклеиновая кислота дополнительно содержит нуклеотиды 2130-2608 из SEQ ID NO:11.
В некоторых вариантах осуществления нуклеиновая кислота по настоящему изобретению содержит область кодирования для RdCVF, где последовательность, кодирующая RdCVF, является перекодированной.
В некоторых вариантах осуществления настоящего изобретения, нуклеиновая кислота по настоящему изобретению находится в векторе, таком как вирусный вектор.
Вирусные векторы
Настоящее изобретение включает вирусные векторы, содержащие область кодирования RdCVF по настоящему изобретению. Примеры вирусных векторов, пригодных для использования в настоящем изобретении, описаны в публикации PCT № WO 08/106644 и в публикации патента США № US 20100120665. В некоторых вариантах осуществления настоящее изобретение не ограничивается конкретным вирусным вектором. Вирусные векторы включают, но не ограничиваясь этим, ретровирусные векторы, лентивирусные векторы, аденовирусные векторы (см., например, патент США № 7045344), векторы AAV (например, см. патент США № 7105345), векторы вируса герпеса (например, см. патенты США №№ 5830727 и 6040172), векторы вируса гепатита (например, гепатита D) (например, см. патент США № 5225347), векторы SV40, векторы EBV (например, см. патент США № 6521449) и векторы вируса болезни Ньюкасла (например, см. патенты США №№ 6146642, 7442379, 7332169 и 6719979). В некоторых вариантах осуществления лентивирусный вектор представляет собой вектор HIV, EIAV, SIV, FIV или BIV. В некоторых вариантах осуществления вектор выбирают из вектора AAV или аденовирусного вектора. Настоящее изобретение также предлагает клетки, которые продуцируют вирусный вектор по настоящему изобретению.
Векторные вирионы по настоящему изобретению могут вводиться in vivo или in vitro в клетки (например, клетки млекопитающих). Векторы (вирусные или невирусные) могут использоваться для трансдуцирования или трансформации клеток, включая, но не ограничиваясь этим, недифференцированные клетки, дифференцированные клетки, соматические клетки, примитивные клетки и/или стволовые клетки. В некоторых вариантах осуществления стволовые клетки предназначены для введения человеку, а не для имплантации соответствующим образом псевдозабеременевшей женщине для дифференциации и развития в младенца.
В некоторых вариантах осуществления вирусный вектор по настоящему изобретению содержит фактор распада (DAF). Например, оболочечный вирусный вектор содержит DAF на вирусной мембране. В некоторых вариантах осуществления DAF представляет собой DAF дикого типа. В некоторых вариантах осуществления DAF представляет собой часть белка слияния с оболочечным белком, например, см. Guibinga et al. Mol. Ther. 2005 11(4):645-51.
Аденовирус представляет собой безоболочечный вирус ядерной ДНК с геномом, как правило, примерно 36 т.п.о. Аденовирусы человека подразделяются на многочисленные серотипы (их приблизительно 47, они нумеруются соответствующим образом и классифицируются как 6 групп: A, B, C, D, E и F).
Рекомбинантные аденовирусные векторы имеют тропизм по отношению как к делящимся, так и к неделящимся клеткам, минимальный патогенный потенциал, способность к репликации до высокого титра для приготовления исходных суспензий вектора и потенциал для осуществления относительно больших вставок в последовательность нуклеотидов (Berkner, (1992) Curr. Top. Micro. Immunol. 158: 39-66; Jolly, (1994) Cancer Gene Therapy 1: 51-64). Аденовирусные векторы с делециями разнообразных последовательностей аденовирусных генов конструируются как пригодные для использования носители для доставки нуклеиновых кислот в клетки. В некоторых вариантах осуществления аденовирусный вектор по настоящему изобретению представляет собой зависящий от хелпера или "вялый" аденовирусный вектор. Можно использовать аденовирусные векторы, которые соответствуют делециям в одном или нескольких из следующих генов: E1a, E1b, E2a, E2b и E3. Способы осуществления доставки нуклеиновых кислот на основе аденовирусов описаны, например, в патентах США №№ 5824544; 5868040; 5871722; 5880102; 5882877; 5885808; 5932210; 5981225; 5994106; 5994132; 5994134 и 6001557.
Векторы AAV получают из парвовирусов с однонитевой (ss) ДНК. Отдельная частица AAV может содержать до 5 т.п.о. кцДНК, оставляя примерно 4,5 т.п.о. для трансгенных и регуляторных элементов. Системы транс-сплайсинга, как описано, например, в патенте США № 6544785, могут примерно в два раза превышать этот предел, и эти типы векторов также могут использоваться вместе с настоящим изобретением. В связи с настоящим изобретением, можно использовать в основном AAV любого серотипа. В некоторых вариантах осуществления настоящего изобретения может использоваться серотип AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8 или AAV9 (например, см. патенты США №№ 5173414, 5252479, 5552311, 5658776, 5658785, 5763416, 5773289, 5843742, 5869040, 5942496, 5948675, 6001650 и 7790449; публикацию PCT № WO 2009134681; Kassim et al, PLoS ONE (2010) 5(10)e13424:1-10; Kotin, Hum Mol Genet (2011) 20(R1):R2-6), хотя настоящее изобретение не ограничивается этими серотипами (см., например, Gao et al. (2002) PNAS 99:11854-11859; и Viral Vectors for Gene Therapy: Methods and Protocols, ed. Machida, Humana Press, 2003).
Вектор AAV по настоящему изобретению может также быть псевдотипированным. Псевдотипированные векторы AAV содержат геном одного серотипа AAV в капсиде второго серотипа AAV (например, см. Auricchio et al, (2001) Hum. Mol. Genet., 10(26): 3075-81). Вектор AAV по настоящему изобретению может содержать мутировавшую капсиду и/или быть перенацеленным. Например, см. Grieger et al. (Adv Biochem Eng Biotechnol. (2005) 99: 119-45); Goncalves et al. (Mol Ther. (2006) 13(5): 976-86); и Warrington et al. (J Virol. (2004) 78(12): 6595-609).
В некоторых вариантах осуществления настоящего изобретения, вектор AAV покрывают полимерами, например, химически активными полимерами, чтобы уменьшить естественный тропизм или естественное связывание вектора AAV; чтобы перенацелить вектор AAV и/или обеспечить стойкость к нейтрализующим антисыворткам. Например, см. Carlisle et al. (J Gene Med. (2008) 10(4): 400-11).
Ретровирусы представляют собой вирусы РНК, где вирусный геном представляет собой РНК. Когда клетка-хозяин инфицируется ретровирусом, геномная РНК обратно транскрибируется в промежуточное соединение ДНК, которое эффективно встраивается в хромосомальную ДНК инфицированных клеток. Лентивирусы содержат другие гены с регуляторной или структурной функцией. Использование ретровирусных векторов для доставки генов описывается, например, в патенте США № 6013516; и в патенте США № 5994136. Примеры систем BIV описаны, например, в Matukonis et al, 2002 Hum. Gene Ther. 13, 1293-1303; Molina et al., 2002 Virology. 304, 10-23; Molina et al., 2004 Hum. Gene Ther., 15, 65-877; в патентах США №№ 6864085, 7125712, 7153512; в публикации PCT № WO 08/106644 и в публикации патента США № US 20100120665.
Вирусный вектор ДНК представляет собой вирусный вектор на основе вируса, который имеет геном на основе ДНК или получается из него. Вирусный вектор на основе безоболочечного вируса представляет собой вирусный вектор на основе вируса, у которого отсутствует мембрана в виде бислоя липидов, или полученный из него.
В некоторых вариантах осуществления вирусный вектор по настоящему изобретению представляет собой вектор AAV. В некоторых вариантах осуществления вирусный вектор по настоящему изобретению не представляет собой вирусный вектор бычьего иммунодефицита или не представляет собой лентивирусного вектора. В некоторых вариантах осуществления вирусный вектор выбирают из группы, состоящей из вирусного вектора с ДНК, безоболочечного вирусного вектора и аденовирусного вектора.
Клеточная доставка RdCVF, включая инкапсулированные клетки
Другой подход к генной терапии или к доставке белков включает перенос гена в клетки in vitro или ex vivo, а затем введение клеток млекопитающему или пациенту. Перенос нуклеиновых кислот в клетки может представлять собой любой способ, такой как трансфекция, микроинъекция, электропорация, слияние клеток, перенос генов, опосредуемый хромосомами, перенос гена, опосредуемый микроклетками, слияние сферопластов, липофекция, бомбордировка микрочастицами, трансфекция, опосредуемая фосфатом кальция, трансдукция вирусного вектора или бактериофага, и так далее. Необязательно, в клетки также может вводиться селектируемый маркер. Если используют селектируемый маркер, клетки могут затем подвергаться селекции, например, для усиления экспрессирования и/или для изоляции/селекции тех клеток, которые экспрессируют перенесенную область кодирования (см., например, Loeffler & Behr, Meth. Enzymol. 217: 599-618 (1993); Cohen et al., Meth. Enzymol. 217: 618-644 (1993); и Cline, Pharmac. Ther. 29: 69-92 (1985)). Эти клетки могут затем доставляться пациенту непосредственно или после инкапсулирования.
В некоторых вариантах осуществления нуклеиновая кислота вводится в клетку перед введением in vivo получаемой в результате рекомбинантной клетки. В некоторых вариантах осуществления технология может обеспечить стабильный перенос нуклеиновой кислоты в клетку таким образом, что нуклеиновая кислота может экспрессироваться клеткой и в некоторых случаях может наследоваться и экспрессироваться с помощью ее клеточного потомства. Рекомбинантные клетки могут доставляться пациенту с помощью разнообразных способов. В некоторых вариантах осуществления белок RdCVF экспрессируется из клетки посредством регулируемого, индуцируемого и/или подавляемого промотора.
В некоторых вариантах осуществления используемая клетка является аутологичной, аллогенной или ксеногенной по отношению к пациенту. В некоторых вариантах осуществления аутологичными клетками манипулируют ex vivo, чтобы заставить их содержать нуклеиновую кислоту по настоящему изобретению, которая позволяет клетке продуцировать или секретировать белок RdCVF, и клетки вводятся пациенту обратно.
В некоторых вариантах осуществления клетки вводят местным образом (например, в сустав, интравитреально, интраретинально, интракраниально, и тому подобное) или системным образом (например, внутривенно).
В некоторых вариантах осуществления рекомбинантные клетки крови (например, гематопоэтические стволовые и/или прогениторные клетки) вводятся внутривенно. В некоторых вариантах осуществления клетки глаза и/или плюрипотентные клетки могут вводиться с помощью инъекции непосредственно в глаз.
Стволовые и/или прогениторные клетки, которые могут выделяться и поддерживаться in vitro, могут потенциально использоваться в соответствии с некоторые вариантами осуществления настоящего изобретения. Такие стволовые клетки включают, но не ограничиваясь этим, гематопоэтические стволовые клетки (HSC), стволовые клетки эпителиальных тканей, таких как кожа и выстилка кишечника, эмбриональные клетки сердечной мышцы, стволовые клетки печени (см., например, WO 94/08598) и нейральные стволовые клетки (например, Stemple and Anderson (1992) Cell 71: 973-985). В некоторых вариантах осуществления вводимые клетки представляет собой стволовые клетки, содержащие нуклеиновую кислоту по настоящему изобретению и способные экспрессировать и секретировать RdCVF.
Инкапсулированные клетки могут сделать возможной контролируемую и/или непрерывную доставку белка, такого как RdCVF, in vivo. В некоторых вариантах осуществления клетки, содержащие нуклеиновую кислоту по настоящему изобретению и экспрессирующие и/или секретирующие RdCVF, инкапсулируют. В некоторых вариантах осуществления клетки инкапсулируют внутри полупроницаемой мембраны, что делает возможной диффузию RdCVF через мембрану. Дополнительную информацию, связанную с инкапсулированными клетками и имплантами инкапсулированных клеток, можно найти в Sieving et al. (Proc Natl Acad Sci USA, (2006) 103(10): 3896-901); в патентах США №№ 7115257 и 7820195 и в публикации PCT № WO 2011044216. В некоторых вариантах осуществления настоящего изобретения, инкапсулированные клетки, которые экспрессируют белок RdCVF, доставляют животному.
В некоторых вариантах осуществления инкапсулированные клетки имплантируют млекопитающему, например, имплантируют в область глаза, мозга или обонятельных органов. В некоторых вариантах осуществления инкапсулированные клетки представляют собой эпителиальные клетки пигмента сетчатки, например, ARPE-19 (доступны от ATCC, Manassas, VA). В некоторых вариантах осуществления инкапсулированные клетки используют для доставки RdCVF в глаз, например, в заднюю часть глаза.
В некоторых вариантах осуществления имплант инкапсулированных клеток по настоящему изобретению состоит из клеток, которые инкапсулированы в секции полупроницаемой полой волоконной мембраны, и клетки генетически модифицируются для получения RdCVF. В некоторых вариантах осуществления имплант инкапсулированных клеток имеет петлю лигатуры на одном краю для закрепления его на склере в витреоретинальном тельце внутри глаза. В некоторых вариантах осуществления имплант инкапсулированных клеток имеет длину 3, 4, 5, 6, 7, 8, 9 или 10 мм.
Секретирование и продуцирование белка RdCVF
Нуклеиновые кислоты и вирусные векторы по настоящему изобретению можно использовать для экспрессирования, продуцирования и/или секретирования RdCVF из клетки. Это экспрессирование, продуцирование и/или секретирование можно осуществлять in vitro, in vivo или ex vivo.
Некоторые варианты осуществления настоящего изобретения предлагают способы секретирования белка RdCVF из клетки, включающие введение в клетку нуклеиновой кислоты и/или вирусного вектора по настоящему изобретению. В некоторых вариантах осуществления клетка может представлять собой клетку млекопитающего, клетку человека, клетку глаза, эпителиальную клетку пигмента сетчатки (RPE), палочковидную зрительную клетку или колбочковидную зрительную клетку.
Некоторые варианты осуществления настоящего изобретения используют клетки позвоночных или млекопитающих. Примеры пригодных для использования линий клеток-хозяев млекопитающих представляют собой линию клеток почек обезьяны CVI, трансформированных с помощью SV40 (например, COS-7, ATCC CRL 1651); линию эмбриональных клеток почек человека (например, клетки 293 или 293T, включая любую линию клеток, субклонированную для роста в культуре суспензии, Graham et al., J. Gen Virol. 36: 59 (1977), такую как 293 Freestyle (Invitrogen, Carlsbad, CA)) или 293FT; клетки почек детенышей хомячка (например, BHK, ATCC CCL 10); клетки яичников китайского хомячка (клетки CHO); клетки яичников китайского хомячка/-DHFR (например, CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)); клетки Сертоли мышей (например, TM4, Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почек обезьяны (например, CVI ATCC CCL 70); клетки почек Африканской зеленой мартышки (например, VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (например, HELA, ATCC CCL 2); клетки почек семейства собачьих (например, MOCK, ATCC CCL 34); клетки CF2TH; клетки печени серой крысы (например, BRL 3A, ATCC CRL 1442); клетки легких человека (например, W138, ATCC CCL 75); клетки печени человека (например, Hep G2, HB 8065); клетки опухоли молочной железы мыши (например, MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383: 44-68 (1983)); клетки MRC 5; клетки ARPE-19 (ATCC) и клетки FS4.
В некоторых вариантах осуществления клетки выбирают из группы, состоящей из клеток 293, клеток CHO, клеток PerC6, клеток Vero, клеток BHK, клеток HeLa, клеток COS, клеток MDCK, клеток 3T3 или WI38.
Некоторые варианты осуществления настоящего изобретения предлагают изолированные клетки, содержащие нуклеиновую кислоту по настоящему изобретению. В некоторых вариантах осуществления нуклеиновая кислота встроена в клеточный геном/ДНК.
Настоящее изобретение также включает способы продуцирования белка RdCVF, включающие культивирование клеток при условиях, которые делают возможным экспрессирование и секретирование белка RdCVF и выделение белка RdCVF из культуры клеток, где клетки содержат нуклеиновую кислоту по настоящему изобретению, которая кодирует белок RdCVF и делает возможным его экспрессирование, например, секретирование белка RdCVF. В некоторых вариантах осуществления нуклеиновая кислота содержит последовательность нуклеотидов, которая содержит кодирующую последовательность для белка RdCVF, где последовательность, кодирующая RdCVF, содержит перекодированную последовательность. Белок RdCVF может представлять собой белок RdCVF1 или 2 или находиться в длинной или короткой форме. В некоторых вариантах осуществления эти способы дополнительно включают очистку белка RdCVF от клеток и/или супернатанта культуры.
Настоящее изобретение также включает белок RdCVF, экспрессируемый с помощью клетки из нуклеиновой кислоты по настоящему изобретению. Настоящее изобретение также предлагает секретированные формы белков RdCVF по настоящему изобретению и композиции, содержащие секретированные белки RdCVF по настоящему изобретению.
В некоторых вариантах осуществления белок RdCVF, экспрессируемый из клетки, очищают до чистоты по меньшей мере 90%, по меньшей мере 93%, по меньшей мере 95%, по меньшей мере 98%, по меньшей мере 99,5% или по меньшей мере 99,9% по отношению к белку в целом.
Композиции, составы и средства
Некоторые варианты осуществления настоящего изобретения предлагают композиции, составы или средства, например, фармацевтические композиции, содержащие нуклеиновую кислоту по настоящему изобретению, вектор по настоящему изобретению, белок RdCVF по настоящему изобретению или любое их сочетание.
Составы (например, для инъекции), как правило, но необязательно, представляют собой биологически совместимые растворы активного ингредиента, включая, например, раствор Хэнкса, раствор Рингера или фосфатный буферный солевой раствор. В некоторых вариантах осуществления состав или фармацевтическая композиция содержит один или несколько из следующих компонентов: цитрат, NaCl, хлорид калия (KCl), кальций хлорид дигидрат (CaCl2⋅2H2O), магний хлорид гексагидрат (MgCl2⋅6H2O), натрий ацетат тригидрат (CH3CO2Na⋅3H2O), натрий цитрат дигидрат (C6H5O7Na3⋅2H2O), сахарозу, гидроксид натрия и/или хлористоводородную кислоту (для регулировки pH) и воду. Приведенный выше список включает некоторые молекулы, которые перечислены как конкретные гидраты, например, дигидрат, тригидрат, гексагидрат, и тому подобное. Понятно, что в настоящем изобретении можно использовать разнообразные гидраты этих соединений и настоящее изобретение не является ограниченным этими конкретными гидратными формами перечисленных молекул. В некоторых вариантах осуществления препарат или фармацевтическая композиция содержит один или несколько ингредиентов, выбранных из группы, состоящей из гистидина, MgCl2, трегалозы, полисорбата, полисорбата 20, NaCl, сахарозы, аргинина и пролина. В некоторых вариантах осуществления препарат содержит один или несколько из следующих компонентов: гистидин; α,α-трегалоза дегидрат; MgCl2; полисорбат, такой как полисорбат 20; и NaCl. В некоторых вариантах осуществления препарат или фармацевтическая композиция содержит один или несколько из следующих компонентов: фосфатный буферный солевой раствор (PBS) и Pluronic F-68. В некоторых вариантах осуществления концентрация Pluronic F-68 может составлять 0,0001%, 0,001%, 0,005%, 0,01% или 0,1%.
Примеры пригодных для использования препаратов и способов приготовления для желаемого способа введения можно найти в Remington's Pharmaceutical Sciences, самое последнее издание, Mack Publishing Co., Easton, PA и в патенте США № 7208577.
В некоторых вариантах осуществления композиция для использования in vivo содержит "носитель" или "фармацевтически приемлемый носитель". Термин "носитель" относится к разбавителю, адъюванту, эксципиенту или наполнителю, которое вводится вместе с нуклеиновой кислотой, вектором или белком по настоящему изобретению. Термин "носитель" включает, но не ограничиваясь этим, либо твердый, либо жидкий материал, который может быть неорганическим или органическим и иметь синтетическое или природное происхождение, с которым активный компонент(ы) композиции смешивают или приготавливают для облегчения введения субъекту. Пригодными для использования являются любые другие материалы, обычно используемые при приготовлении фармацевтических средств. Фармацевтические носители могут отличаться от типичных растворов и суспензий тем, что их специально приготавливают для использования in vivo с исключением веществ, которые могут быть вредными для хозяина, которому вводят композицию (например, с удалением бактериальных токсинов).
Примеры пригодных для использования жидких носителей включают воду и водные растворы, содержащие окисленные органические соединения, такие как этанол. Буферы и другие материалы, обычно присутствующие в фармацевтических средствах, такие как ароматизирующие и суспендирующие агенты, могут также присутствовать. Как правило, пригодное для использования масло(а), солевой раствор, водный раствор декстрозы (глюкозы) и родственные растворы сахаров и гликолей, таких как пропиленгликоль или полиэтиленгликоль, как правило, являются пригодными для использования носителями для парентеральных растворов. В некоторых вариантах осуществления растворы для парентерального введения содержат водорастворимую соль активного ингредиента, пригодные для использования стабилизирующие агенты и, если это желательно или необходимо, буферные вещества. Антиоксидантные агенты, такие как бисульфит натрия, сульфит натрия или аскорбиновая кислота, могут использоваться в качестве стабилизирующих агентов либо сами по себе, либо в сочетании. Также используются лимонная кислота и ее соли и натрий EDTA. В дополнение к этому, парентеральные растворы могут содержать консерванты, такие как хлорид бензалкония, метил- или пропилпарабен и хлорбутанол.
Носители могут включать углеводы, такие как трегалоза, маннит, глютатион, ксилит, сахароза, лактоза и сорбит. Другие ингредиенты для использования в препаратах могут включать, например, DPPC (1,2-дидеканоил-sw-глицеро-3-фосфохолин), DOPE (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин), DSPC (1,2-дистеароил-sn-глицеро-3-фосфохолин 1,2-дистеароил-sn-глицеро-3-фосфохолин) и DOPC (1,2-диолеоил-sn-глицеро-3-фосфохолин). Можно использовать природные или синтетические поверхностно-активные вещества. Можно использовать полиэтиленгликоль (даже несмотря на его использование при дериватизации белка). Можно использовать декстраны, такие как циклодекстран. В некоторых вариантах осуществления можно использовать циклодекстрин, третичные амины и/или бета-циклодекстрин. Можно использовать соли желчной кислоты и другие родственные энхансеры. Можно использовать целлюлозу и производные целлюлозы. Можно использовать аминокислоты, например, использовать их при приготовлении буфера. Также, предполагается использование липосом, микрокапсул или микросфер, комплексов включения или других типов носителей.
Композиция, по желанию, может также содержать смачивающие и/или эмульгирующие агенты, и/или буферные агенты для установления pH. По необходимости, композиция может также включать солюбилизирующий агент и/или локальный анестетик, такой как лигнокаин, для облегчения боли в области инъекции.
В некоторых вариантах осуществления фармацевтическое средство или композиция по настоящему изобретению содержит (i) фармацевтически приемлемый носитель и (ii) нуклеиновую кислоту по настоящему изобретению, вирусный вектор по настоящему изобретению, белок RdCVF по настоящему изобретению или любое их сочетание.
Введение, доставка и лечение
Понятно, что когда обсуждается введение или внесение нуклеиновой кислоты или вектора, кодирующего белок RdCVF, что настоящее изобретение также предполагает введение или внесение самого белка RdCVF. Понятно, что когда обсуждается введение белка RdCVF, что настоящее изобретение также предполагает введение нуклеиновой кислоты или вектора, кодирующего белок RdCVF.
В некоторых вариантах осуществления композиции по настоящему изобретению могут вводиться локально или системно. Пригодные для использования способы введения описываются в настоящем документе и известны в данной области. Способы введения или внесения включают, но не ограничиваясь этим, интрадермальный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, внутритрахеальный способы, способ местного введения, ингаляцию, трансдермальный, ректальный, парентеральный способы, эпидуральный, интракраниальный способы, способ введения в головной мозг, интравентрикулярный, субдуральный, интраартикулярный, интратекальный, интракардиальный, внутрикоронарный, интравитреальный, субретинальный способы, способ введения в переднюю камеру глаза, способ локального введения в роговицу, подконъюктивальную, субтеноновую инъекцию, посредством применения глазных капель, с помощью пероральных способов, через балонный катетер, с помощью стента или любые их сочетания. Системное введение может представлять собой, но не ограничиваясь этим, внутривенную или внутриартериальную инъекцию или осуществляться посредством трансмукозальной, подкожной, трансдермальной и/или внутрибрюшинной доставки.
В некоторых вариантах осуществления, например, включающих введение в глаз, вектор или нуклеиновую кислоту по настоящему изобретению, кодирующую RdCVF, вводят примерно раз в неделю, месяц, 2 месяца, 3 месяца, 6 месяцев, 9 месяцев, год, 18 месяцев, 2 года, 30 месяцев, 3 года, 5 лет, 10 лет или по необходимости. В некоторых вариантах осуществления, например, включающих введение в глаз, вектор или нуклеиновую кислоту по настоящему изобретению, кодирующую RdCVF, вводят примерно каждую 1-4 недели, примерно каждую 4-8 недель, примерно каждый 1-4 месяца, примерно каждые 3-6 месяцев, примерно каждые 4-8 месяцев, примерно каждые 6-12 месяцев, примерно каждые 9-15 месяцев, примерно каждые 12-18 месяцев, примерно каждые 15-21 месяцев, примерно каждые 18-24 месяца, примерно каждый 1-2 года, примерно каждые 1,5-3 года, примерно каждые 2-4 года, примерно каждые 3-5 лет, примерно каждые 5-7 лет, примерно каждые 7-10 лет или примерно каждые 10-20 лет. Ожидается, что введение вектора, кодирующего белок RdCVF, будет менее частым, чем введение самого белка RdCVF. В некоторых вариантах осуществления настоящего изобретения фармацевтический препарат содержит вектор, кодирующий белок RdCVF, по настоящему изобретению, и фармацевтический препарат вводится пациенту только один раз.
В некоторых вариантах осуществления белок RdCVF по настоящему изобретению вводится посредством интравитреальной или субретинальной инъекции в глаз человека. В некоторых вариантах осуществления примерно от 15 мкг примерно до 5 мг; примерно от 15 мкг примерно до 500 мкг; примерно от 100 мкг примерно до 900 мкг; примерно от 300 мкг примерно до 700 мкг; примерно от 500 мкг примерно до 1 мг; примерно от 1 мг примерно до 5 мг; примерно 1 мг или примерно 500 мкг белка RdCVF вводят посредством интравитреальной или субретинальной инъекции в глаз человека.
В некоторых вариантах осуществления белок RdCVF вводят посредством субретинальной инъекции или интравитреальной инъекции вектора AAV, который кодирует RdCVF. В некоторых вариантах осуществления примерно от 5×108 примерно до 1×109; примерно от 5×108 примерно до 7,5×108; примерно от 7,5×108 примерно до 1×109; примерно от 6×108 примерно до 9×108; примерно от 7×108 примерно до 8×108; примерно 5×108; примерно 6×108; примерно 7×108; примерно 8×108; примерно 9×108 или примерно 1×109 количества копий генома вектора (GC) вектора AAV вводят посредством субретинальной инъекции. В некоторых вариантах осуществления примерно от 5×108 примерно до 1×1010; примерно от 5×108 примерно до 5×109; примерно от 5×108 примерно до 2×109; примерно от 2×109 примерно до 5×109; примерно от 5×109 примерно до 1×1010; примерно от 5×108 примерно до 1×109; примерно от 1×109 примерно до 3×109; примерно от 3×109 примерно до 6×109; примерно от 6×109 примерно до 1×1010; примерно от 1×109 примерно до 1×1010; примерно от 1×1010 примерно до 1×1011 или от 1×1011 примерно до 1×1012 GC вектора AAV вводят посредством интравитреальной инъекции. Понятно, что количество вектора AAV иногда измеряют в трансдуцирующих единицах или в количестве GC. Количество GC, как правило, в 25-300 больше, чем когда тот же образец вектора AAV измеряют относительно трансдуцирующих единиц.
В некоторых вариантах осуществления в сочетании с белком RdCVF, вектором или нуклеиновой кислотой по настоящему изобретению может доставляться противовоспалительное средство. Противовоспалительное средство может доставляться до и/или после введения молекулы или вектора по настоящему изобретению, или одновременно с ними. В некоторых вариантах осуществления противовоспалительное средство вводится в том же растворе и/или шприце, что и белок RdCVF, нуклеиновая кислота или вектор по настоящему изобретению. В некоторых вариантах осуществления белок RdCVF, нуклеиновая кислота или вектор по настоящему изобретению и противовоспалительное средство совместно вводятся в глаз.
В данной области известно множество противовоспалительных лекарственных средств, и они включают, но не ограничиваясь этим, дексаметазон, дексаметазон натрий метасульфобензоат, дексаметазон натрий фосфат, флуорометолон, бромфенак, пранопрофен, офтальмологическую эмульсию циклоспорина (например, RESTASIS™), напроксен, глюкокортикоиды, кеторолак, ибупрофен, толметин, нестероидные противовоспалительные лекарственные средства, стероидные противовоспалительные лекарственные средства, диклофенак, флурбипрофен, индометацин и супрофен.
Некоторые варианты осуществления настоящего изобретения включают введение как белка RdCVF, так и вектора, кодирующего его. Белок RdCVF может доставляться до и/или после введения вектора по настоящему изобретению или одновременно с ним. В некоторых вариантах осуществления белок RdCVF вводится в том же растворе и/или в том же шприце, что и вектор по настоящему изобретению. В некоторых вариантах осуществления вектор по настоящему изобретению и белок RdCVF совместно вводят в глаз.
В некоторых вариантах осуществления настоящего изобретения, система генной доставки может давать в результате трансдукцию и/или стабильное встраивание гена или области кодирования белка RdCVF в целевую клетку. В некоторых вариантах осуществления целевые клетки представляют собой клетки млекопитающих, такие как клетки приматов или клетки человека. В некоторых вариантах осуществления целевые клетки представляют собой клетки глаза, такие как эпителиальные клетки пигмента сетчатки, палочковидные фоторецепторные зрительные клетки, колбочковидные фоторецепторные зрительные клетки, биполярные клетки, горизонтальные клетки, клетки сетчатки, лишенные аксона, ганглиозные клетки, клетки сетчатки или плюрипотентные клетки. Целевые клетки могут находиться in vitro, ex vivo или in vivo. В некоторых вариантах осуществления целевая клетка представляет собой стволовую клетку. Стволовые клетки включают, но не ограничиваясь этим, плюрипотентные стволовые клетки, тотипотентные стволовые клетки, гематопоэтические стволовые клетки, раковые стволовые клетки и эмбриональные стволовые клетки. В некоторых вариантах осуществления плюрипотентные клетки, рассматриваемые в настоящем документе, не представляют собой те, которые размножаются в живом организме от зиготы или бластомера. Настоящее изобретение также предполагает использование частично недифференцированных клеток для имплантации в глаз пациента, нуждающегося в лечении, например, для регенерации клеток глаза.
Настоящее изобретение также предлагает способы лечения. В некоторых вариантах осуществления настоящее изобретение предлагает способы сохранения палочковидных зрительных клеток, включающие введение в глаз млекопитающего нуклеиновой кислоты по настоящему изобретению, вирусного вектора по настоящему изобретению, белка RdCVF по настоящему изобретению, фармацевтической композиции по настоящему изобретению или их сочетания. В некоторых вариантах осуществления вирусный вектор и/или нуклеиновая кислота по настоящему изобретению вводятся посредством субретинальной инъекции, интравитреальной инъекции, инъекции в переднюю камеру глаза, подконъюктивальной инъекции, субтеноновой инъекции или любого их сочетания. В некоторых вариантах осуществления лечат людей. В некоторых вариантах осуществления млекопитающее, которое должно лечиться, страдает от глазного заболевания, выбранного из группы, состоящей из дистрофии сетчатки, дегенерации желтого пятна Штаргардта, пигментной дистрофии сетчатки, сухой возрастной макулярной дегенерации (сухой AMD), географической атрофии сетчатки (поздней стадии сухой AMD), влажной возрастной макулярной дегенерации (влажной AMD), глаукомы/глазной гипертензии, диабетической ретинопатии, синдрома Барде-Бидля, синдрома Бессена-Корнцвейга, болезни Беста, хороидеремии, гиратной атрофии, врожденного амавроза, синдрома Рефсума, синдрома Уше, глазного заболевания, связанного со щитовидной железой, базедовой болезни, заболевания, связанного с пигментированными эпителиальными клетками сетчатки, заболевания переднего сегмента, заболевания/катаракты хрусталика, расстройства глазной чаши или увеита. В некоторых вариантах осуществления сохраненная палочковидная зрительная клетка не содержит нуклеиновой кислоты и/или вирусного вектора по настоящему изобретению. Например, сохраненная клетка глаза не сохраняется посредством трансдукции самой сохраненной клетки глаза.
Некоторые варианты осуществления настоящего изобретения предлагают способ сохранения палочковидных зрительных клеток, включающий введение в глаз млекопитающего нуклеиновой кислоты и/или вирусного вектора по настоящему изобретению, где нуклеиновая кислота и/или вирусный вектор вводятся посредством субретинальной инъекции и палочковидные зрительные клетки и/или колбочковидные зрительные клетки сохраняются в области на расстоянии по меньшей мере 1 мм, по меньшей мере 2 мм, по меньшей мере 3 мм, по меньшей мере 5 мм, по меньшей мере 7 мм, по меньшей мере 10 мм, по меньшей мере 15 мм, по меньшей мере 20 мм или по меньшей мере 25 мм от места субретинальной инъекции. Например, и, не желая быть связанным с теорией, клетки, трансдуцированные с помощью нуклеиновой кислоты или вирусного вектора в месте субретинальной инъекции, экспрессируют и/или секретируют белок RdCVF-длинный и/или RdCVF-короткий, который может обеспечить воздействие сохранения палочковидных и/или колбочковидных зрительных клеток в области, удаленной от трансдуцированной клетки или места инъекции.
В дополнение к экспрессированию в глазу, белок RdCVF также естественным образом экспрессируется в других тканях. С использованием подхода протеомики обнаружено, что 90 белков взаимодействуют с RdCVFL, включая связывающийся с микротрубочками тау-белок (Fridlich et al. Mol Cell Proteomics (2009) 8(6): 1206-1218). Fridlich et al. продемонстрировали, что уровень фосфорилирования TAU в сетчатке мышей Nxnll-/- (RdCVF1-/-) повышается в то время, когда он является гиперфосфорилированным в головном мозгу пациентов, страдающих от болезни Альцгеймера, предположительно, в некоторых случаях, из-за оксидативного стресса. Fridlich et al. также показали, что RdCVFL ингибирует фосфорилирование тау-белка. Cronin et al. (Cell Death and Differentiation (2010) 17: 1199-1210) обнаружили, что сетчатки глаза Nxnll-/- (RdCVFl-/-) содержат агрегированный тау-белок, как обнаружено в головном мозгу пациентов, страдающих болезнью Альцгеймера.
Мыши, у которых нет RdCVF2, имеют ослабленное зрение и обоняние. Нормальные мыши экспрессируют RdCVF2 в эпителии обонятельных органов. Jaillard et al. (ARVO meeting (2009) program#/poster# 491/D636) сообщают, что нейроны органов обоняния, как обнаружено, имеют более высокую долю выживаемости, когда культивируются в присутствии RdCVF2. Jaillard et al. также сравнивают RdCVF2-/- относительно контрольных мышей посредством осуществления исследований обучаемости обонятельной дикриминации. К возрасту 12 месяцев мыши RdCVF2-/- не могут корректно отвечать на стимул.
Белки RdCVF имеют нейропротекторную активность и не являются фактором выживаемости только лишь колбочек и/или палочек, но представляют собой общие факторы выживаемости нейронов.
По этой причине, на основании того, что сказано выше, нуклеиновую кислоту, кодирующую RdCVF, вирусный вектор или белок RdCVF по настоящему изобретению можно использовать для лечения или облегчения болезни Альцгеймера, болезни Хантингтона, болезни Паркинсона и заболевания органов обоняния.
Настоящее изобретение включает способы лечения заболевания, включающие введение млекопитающему нуклеиновой кислоты по настоящему изобретению, вирусного вектора по настоящему изобретению, белка RdCVF по настоящему изобретению, фармацевтической композиции по настоящему изобретению или их сочетания, где заболевание выбирают из группы, состоящей из болезни Альцгеймера, болезни Хантингтона, болезни Паркинсона и болезни органов обоняния. В некоторых вариантах осуществления вирусный вектор по настоящему изобретению представляет собой вектор AAV.
Примеры
Теперь настоящее изобретение описывается со ссылками на следующие далее примеры. Эти примеры приводятся только для целей иллюстрации и настоящее изобретение не должно ни в коем случае рассматриваться как ограниченное этими примерами, но скорее должно рассматриваться как охватывающее любые и все варианты, которые становятся очевидными в результате концепций, приведенных в настоящем документе.
Хотя в настоящем документе конкретные варианты осуществления настоящего изобретения описываются для целей описания, специалистам в данной области будет очевидно, что многочисленные изменения деталей могут быть проделаны без отклонения от настоящего изобретения, как описывается в прилагаемой формуле изобретения.
Все публикации, патенты и заявки на патенты, рассмотренные в настоящем описании, включаются в настоящий документ и в описание во всей их полноте в качестве ссылок до такой же степени, как если бы каждая индивидуальная публикация, патент или заявка на патент конкретно и индивидуально указывалась бы как включенная в настоящий документ в качестве ссылки. Также включаемой в качестве ссылки является любая дополнительная информация, которая публикуется вместе с любыми рассмотренными выше публикациями, патентами и заявками на патент. Например, некоторые журнальные статьи публикуются вместе с дополнительной информацией, которая, как правило, доступна on-line.
Пример 1 - Перекодированные кодирующие последовательности для длинной и короткой форм RdCVF1.
Конструируют перекодированные кодирующие области нуклеотидов RdCVF1S и RdCVF1L человека (например, нуклеотиды 106-741 из SEQ ID NO:1, нуклеотиды 106-744 из SEQ ID NO:3, SEQ ID NO:12 или 14). GENEART® (Regensburg, Germany) синтезируют последовательности нуклеиновых кислот, которые, среди прочих вещей, содержат оптимизированные по отношению к кодону последовательности кодирования нуклеотидов для RdCVF1S и RdCVF1L. Эти кодирующие последовательности также перекодированы для сведения к минимуму таких мотивов, как ингибиторные мотивы прокариотов, консенсусные сайты доноров сплайсированного фрагмента и сайты скрытых доноров сплайсированного фрагмента.
Перекодирование кодирующей последовательности RdCVF1L человека также дает перекодированную область кодирования RdCVF1S, нуклеотиды 1-327 из SEQ ID NO:12 со стоп-кодоном на 3'-конце.
Совмещение области кодирования нативного RdCVF1L с перекодированной областью кодирования
RdCVF1L (1-639): Идентичности = 529/639 (82,8%) 89/213 кодонов различаются (41,7%)
RdCVF1S (1-327): Идентичности = 274/327 (83,8%) 44/109 кодонов различаются (40,4%)
RdCVF1S (1-327 и TGA) Идентичности = 277/330 (83,9%) 44/110 кодонов различаются (40,0%)


Перекодирование нативной последовательности кодирования RdCVF1L до SEQ ID NO:12 удаляет 2 ингибиторных мотива прокариотов, 1 консенсусный сайт доноров сплайсированного фрагмента и 3 сайта скрытых доноров сплайсированного фрагмента, не оставляя ни одного из этих элементов в перекодированной последовательности (SEQ ID NO:12). Перекодирование также изменяет среднее содержание GC от 65% до 63%.
Нуклеотиды 1-327 из SEQ ID NO:12 также дают перекодированную кодирующую последовательность для RdCVF1S, но без стоп-кодона, такого как TGA.
Совмещение области кодирования нативного RdCVF1S с перекодированной областью кодирования
Идентичности = 278/330 (84,2%) 43/110 кодонов различаются (39,1%)


Перекодирование нативной кодирующей последовательности RdCVF1S до SEQ ID NO:14 удаляет 1 ингибиторный мотив прокариота, 1 консенсусный сайт доноров сплайсированного фрагмента и 2 сайта скрытых доноров сплайсированного фрагмента, не оставляя ни одного из этих элементов в перекодированной последовательности (SEQ ID NO:14). Перекодирование также изменяет среднее содержание GC от 58% до 61%.
Пример 2 - Экспрессирование in vitro длинной формы фактора выживаемости колбочек, полученных из палочек, опосредуемое адено-ассоциированным вирусным вектором
Клонирование плазмиды
c ДНК короткой формы белка RdCVF амплифицируется посредством ПЦР с нуклеиновой кислоты, синтезированной с помощью GENEART® и клонируется в плазмиду pSecTag2A (Invitrogen, Catalog No. V900-20), которая вводится в сигнальную последовательность пептидов Igk мыши таким образом, что сигнальная последовательность пептидов ДНК Igk ориентирует пять штрих (5’) на кодирующую последовательность RdCVFS. Полученная в результате плазмида обозначается pAVTrRd034. Размер и ориентацию pAVTrRd034 подтверждают с использованием гидролизатов ферментов рестрикции. Последовательность Igk-RdCVFS амплифицируется посредством ПЦР из pAVTrRd034 и вставляется в плазмиду pAAV-MCS адено-ассоциированного вирусного вектора (Cell Biolabs, San Diego, CA), с созданием плазмиды pAAV-SRd269 (SEQ ID NO:8). Оптимизированная по отношению к кодону длинная форма RdCVF амплифицируется посредством ПЦР и вставляется в приготовленную в лаборатории плазмиду клонирования pAVT001, с созданием плазмиды pAVTLrRd055 (SEQ ID NO:9). Плазмиды pAVTLrRd055 и pAAV-SRd269 подвергаются двойному перевариванию с помощью Bgl II и Stu I. 4,8-т.п.о. зона из pAAV-SRd269 и 540-т.п.о. зона из pAVTLrRd055 лигируются, с созданием pAAV-LRd268 (SEQ ID NO:10), который содержит перекодированную кодирующую последовательность для длинного RdCVF. Размер и ориентацию pAAV-LRd268 подтверждают с использованием гидролизатов ферментов рестрикции.
Поскольку N-конечные последовательности короткой и длинной формы белка RdCVF являются идентичными, конец последовательности ДНК короткого RdCVF pAVTrRd034 используют для замены вместо конца кодон-оптимизированной последовательности ДНК длинного RdCVF из плазмиды pAVTLrRdCVF055, генерируя тем самым плазмиду rAAV pAAV-LRd268, содержащую следующие особенности между AAV-ITR:
промотор CMV - интрон β-глобина - Igk-RdCVF1L - Поли A
Продуцирование и очистка рекомбинантных векторов AAV-RdCVF1L и AAV-GFP
Плазмиды pAAV-LRd268, pHELPER (Cell BioLabs, Catalog No. 340202) и pRC2 (Cell BioLabs, Catalog No. 340201) трансформируются в DH10B-компетентные клетки бактерий (Invitrogen, Catalog No. 18297-010) и масштабируются с использованием Qiagen EndoFree Plasmid Maxi Kit или EndoFree Plasmid Mega Kit в соответствии с инструкциями производителя. Концентрации плазмиды определяют с использованием спектрофотометра Beckman DU-600. Идентичность каждого вида плазмиды подтверждают посредством гидролизатов рестрикции и анализа.
Для продуцирования вектора rAAV-RdCVF1L, клетки 293AAV (Cell BioLabs, Catalog No. AAV-100) высевают как 4 миллиона клеток на 15-см чашку в cDMEM (DMEM, дополненная 10% FBS, 1% глютамина, 1% неэссенциальных аминокислот и 1% пенициллина/стрептомицина). На следующий день среду заменяют 25 мл свежей cDMEM. Через два часа осуществляют трансфицирование. Воду (57,4 мл) смешивают с 1,3 мг pHELPER, 650 мкг pRC2, 650 мкг pAAV-LRd268 и 8,1 мл 2M CaCl2 (смесь вода/плазмида/CaCl2). 12,5-мл объем 2xHBS (Lonza, Sku:RR07005) переносят в каждую из пяти 50-мл конических пробирок. Во время встряхивания медленно добавляют 12,5 мл смеси вода/плазмида/CaCl2 в каждую из конических пробирок, содержащих 2xHBS. После 5-минутного инкубирования по 2,5 мл суспензии добавляют в каждую чашку с культурой клеток, содержащую клетки 293AAV.
На следующий день среду заменяют 25 мл новой среды cDMEM на чашку. Через два дня клетки харвестируют с использованием устройства для съема клеток, и смесь клетки/среда переносят в 250-мл конические пробирки. Образцы центрифугируют при 3000 об/мин в течение 15 минут при 4°C, супернатант сливают и клеточные лепешки повторно суспендируют в 110 мл DMEM. Повторно суспендированные образцы клеток аликвотируют (30 мл) в 50-мл конические пробирки и осуществляют стадию заморозки/оттаивания/заморозки с использованием бани этанол/сухой лед и водяной бани при 37°C. Пробирки хранят при -80°C до дальнейшей обработки материала. Такой же способ используют для получения rAAV-GFP, заменяя плазмиду pAAV-LRd268 плазмидой pAAV-GFP (Cell BioLabs Catalog No. AAV-400).
Для очистки вектора rAAV-RdCVF1L, четыре 50-мл конических пробирки, содержащих вектор со стадии заморозки/оттаивания/заморозки, оттаивают при 37°C на водяной бане. Сорок микролитров BENZONASE® (Sigma, Catalog No. E8263-25kU) добавляют в каждую пробирку, которую затем инкубируют при 37°C в течение 30 минут. Пробирки центрифугируют в течение 10 минут при 3000 об/мин, и супернатанты переносят в 500-мл колбу. Добавляют шесть миллилитров 10% раствора дезоксихолата натрия (8,2 г в 82 мл воды). Образец в течение короткого времени перемешивают и инкубируют при 37°C в течение 30 минут. Суспензию фильтруют с использованием 5-мкм фильтра. Впоследствии осуществляют другую стадию фильтрования с использованием 0,8-мкм фильтров. Приготавливают колонку с гепаринизированной агарозой (8 мл) (Sigma, Catalog No. H6508-25mL), и колонку уравновешивают с помощью 48 мл фосфатного буферного солевого раствора (PBS) (Invitrogen, Catalog No. 10010-049). Отфильтрованный лизат клеток нагружают на колонку, и колонку промывают с помощью 40 мл промывочного буфера (20 мл 5M NaCl, 980 мл PBS). Вектор элюируют с использованием 15 мл буфера для элюирования (80 мл 5M NaCl, 920 мл PBS) и собирают в новую 50-мл коническую пробирку.
Вектор концентрируют с помощью центробежного фильтрования. Узел центробежного фильтрования Amicon Ultra-15 (Millipore, Catalog No. UFC910024) промывают один раз PBS, и элюированный образец добавляют в устройство. Центрифугирование осуществляют в центрифуге Beckman Allegro 6KR при 2200 об/мин, 22°C, до тех пор, пока образец не сконцентрируется до 1-2 мл объема. Добавляют 15 мл объем PBS, и центрифугирование повторяют, пока объем образца не станет ≤1 мл. Очищенный вектор собирают, и стенки фильтра промывают 100 мкл PBS. Образец перемешивают, и 30 мкл аликвоты вектора хранят при -80°C в 600-мкл конических пробирках до использования.
Этот процесс повторяют для очистки вектора rAAV-GFP.
Фиг. 9 и SEQ ID NO:11 показывают последовательность нуклеиновых кислот вектора rAAV-RdCVF1L.
Анализ геномного титрования очищенных рекомбинантных векторов AAV
Для измерения геномного титра очищенных векторов rAAV-RdCVF1L и rAAV-GFP, 5 мкл соответствующего вектора смешивают с 5 мкл буфера 10X DNase, 1 мкл фермента DNase I (Roche, Catalog No. 04716728001) и воды до общего объема 50 мкл. После инкубирования в течение 30 минут при 37°C, фермент дезактивируют посредством инкубирования при 65°C в течение 10 минут. Добавляют Proteinase K (0,5 мкл) (Roche, Catalog No, 03115887001). Образец в течение короткого времени перемешивают и инкубируют в течение 60 минут при 50°C. Proteinase K дезактивируют при 95°C в течение 20 минут. Параллельно используют импульсный контроль, где 5 мкл импульсного стандарта (2×109 однонитевой ДНК от pAAV-GFP) добавляют в реакцию. Эти реакции осуществляют в 0,2-мл 8-пробирочных полосках без крышек (Biorad, Catalog No. TBS-0201), с использованием 8-пробирочных стрип-крышек (BioRad, Catalog No. TCS-0803), в термоцикле BioRad ПЦР.
Приготавливают исходную смесь для кПЦР, содержащую 825 мкл воды, 1,875 мкл iQ SYBR Green Supermix (BioRad, Catalog No. 170-8882) и 337,5 мкл каждого из праймеров (QPCR CMV 1 (SEQ ID NO:5) и QPCR CMV 2 (SEQ ID NO:6)). Добавляют 45-мкл объем смеси в каждую лунку в 96-луночный планшет для ПЦР, и добавляют либо 5 мкл переваренного вектора, импульсно переваренного вектора, непереваренного вектора (5 мкл очищенного вектора с 40 мкл воды и 5 мкл буфера DNase), непереваренного вектора (5 мкл очищенного вектора с 35 мкл воды, 5 мкл буфера DNase и 5 мкл импульсного стандарта) и перемешивают. Осуществляют процесс ПЦР, и образцы из цикла 3 используют для анализа кривых плавления.
Концентрацию этих геномов однонитевой ДНК анализируют с помощью количественной ПЦР, как описано выше. Концентрация частиц вектора rAAV-RdCVF1L, как определено, составляет 2×1011 копий генома вектора на миллилитр (GC/мл), а концентрация частиц вектора rAAV-GFP, как определено, составляет 2×1011 GC/мл.
Окрашивание серебром очищенного рекомбинантного вектора AAV
Для исследования чистоты очищенных векторов rAAV-RdCVF1L и rAAV-GFP, лизаты векторов подвергают воздействию SDS-PAGE с анализом окрашивания серебром. Конкретно, 20 мкл буфера для лизирования (8,4 мл воды, 500 мкл 1M Tris (pH 8,0), 1 мл глицерина, 300 мкл 5M NaCl, 50 мкл NP-40, 40 мкл EDTA, 100 мкл PMSF, 1 таблетку ингибитора протеазы (Roche, Catalog No. 11836170001)) добавляют к 20 мкл соответствующего очищенного рекомбинантного вектора AAV и выдерживают на льду в течение 20 минут. Реакционную смесь центрифугируют в течение 2 минут при 13000 об/мин и 4°C на настольной центрифуге. Супернатант переносят в новую пробирку, добавляют 10 мкл 5× буфера для разбавления образца (Pierce, Catalog No. 39000), и образцы инкубируют в течение 10 минут при 95°C.
Осуществляют электрофорез в соответствии с инструкциями производителя. 4-15% гель для SDS-PAGE промывают водой и помещают в камеру для геля. Добавляют проточный буфер (1X Tris/глицин/SDS, полученный посредством разбавления проточного буфера 10X Tris/глицин/SDS (BioRad, Catalog No. 161-0732) водой) в верхнюю и нижнюю камеры для буфера. Лунки промывают два раза с помощью 200 мкл проточного буфера и нагружают образцы. В качестве контроля в другие лунки добавляют 1-мкл объем белкового маркера BENCHMARK™ (Invitrogen, Catalog No. 10747-012). Нагружают одинаковые концентрации векторов, как определено с помощью анализа геномного титрования. К гелю прикладывают напряжение 200 В, пока краситель не достигнет нижней части геля. Гель фиксируют и окрашивают серебром в соответствии с инструкциями производителя (Biorad Silver Stain Plus, Catalog No. 161-0449).
Видны только три белка вируса AAV, VP1 (90 кДа), VP2 (72 кДа) и VP3 (60 кДа) (Фиг. 1). Поскольку не видно других полос белков при анализе с окрашиванием серебром, это должно подтвердить, что приготовления вектора дают в результате получение частиц векторов высокой чистоты.
Экспрессирование RdCVF1L in vitro, опосредуемое трансдуцированием ARPE-19 вектором AAV
Клетки
Для исследования экспрессирования и секретирования RdCVF1L, опосредуемого вектором rAAV-RdCVF1L, эпителиальные клетки пигмента сетчатки человека ARPE-19 (ATCC, Manassas, VA) высевают как 200000 клеток в 3 мл cDMEM на лунку в 6-луночном планшете. Для трансгенного экспрессирования после инфицирования AAV, время-ограничивающая стадия представляет собой синтез второй нити генома однонитевой ДНК, которая может занять несколько недель, см., например, Ferrari et al. (1996). J Virol. 70: 3227-3234. Однако можно использовать излучение перед трансдуцированием для ускорения экспрессирования белков после трансдуцирования вектора AAV в культуре клеток, см., например, Alexander et al. (1994) J Virol. 68:8282-8287.
Через двадцать четыре часа клетки облучают 175 Gy 137Cs с помощью самоэкранирующегося облучателя Shepherd & Associates, Model: Mark I-68. Через два часа среду заменяют на 1,5 мл свежей cDMEM, и добавляют 3 мкл очищенного рекомбинантного вектора AAV. Один планшет, в качестве контроля, является нетрансдуцированным (без AAV), один планшет трансдуцируют вектором rAAV-GFP и один планшет трансдуцируют вектором rAAV-RdCVF1L.
Через два дня после трансдуцирования супернатанты от трансдуцированных и нетрансдуцированных клеток харвестируют и фильтруют через 0,45-мкм фильтр. Добавляют такой же объем лизатного буфера (9,4 мл воды, 200 мкл, 1M Tris (pH 8,0), 40 мкл, 0,5M EDTA, 300 мкл, 5M NaCl, 100 мкл, NP-40, 100 мкл PMSF, 1 таблетка ингибитора протеазы) и хранят при -80°C до использования. Клетки из каждого планшета промывают PBS, соскребывают с использованием устройства для съема клеток, собирают и переносят в 15-мл конические пробирки. Клетки центрифугируют в течение 4 минут при 1200 об/мин и 4°C в центрифуге Beckman Coulter Allegra 6KR, и супернатант сливают. Лепешки с клетками повторно суспендируют в 1 мл буфера для лизирования (см. выше), переносят в 1,5-мл пробирки и инкубируют на льду в течение 10 минут. Лизаты клеток центрифугируют в течение 2 минут при 13000 об/мин и 4°C в настольной центрифуге. Осветленные лизаты клеток аликвотируют в 200-мкл объемах в 1,5-мл пробирках и хранят при -80°C до использования.
Вестерн-блот анализ супернатантов трансдуцированных клеток и лизатов клеток на экспрессирование для RdCVF1L
Вестерн-блот анализ с использованием 4-20% геля для SDS-PAGE используют для детектирования экспрессирования RdCVF1L с использованием стандартных методик. В качестве контроля 5-мкл объем MAGICMARK™ XP Standart (Invitrogen, Catalog No. LC5602) добавляют в другие лунки. К гелю прикладывают напряжение 200 В, пока краситель не достигнет нижней части геля. Вестерн-блот анализ осуществляют с помощью набора для Вестерн-блот анализа Vectastain ABC-Amp от Vector Laboratories, в соответствии с модифицированной версией инструкций производителя. SDS-PAGE уравновешивают в буфере для переноса в течение 20 мин и белки, отделенные с помощью SDS-PAGE, переносят на нитроцеллюлозную мембрану с использованием Trans Blot Semi-Dry Transfer Cell при 20 В в течение 40 минут. После завершения переноса мембрану блокируют в 200 мл 1X раствора казеина при осторожном перемешивании на платформе качалки в течение по меньшей мере двух часов при комнатной температуре (КТ) для супернатанта и при 4°C в течение ночи плюс 1 час при КТ для лизата клеток. Мембрану инкубируют вместе с 50 мл протеин-специфичного моноклонального антитела кролика анти-RdCVF (первичное антитело генерируется Covance (Denver, PA) с использованием очищенного белка His-Tag RdCVF1L, продуцируемого в E. coli (Protein One, Rockville, MD)), разбавленного 1:2000 (супернатант) или 1:10000 (лизат клеток) в 1X растворе казеина, при осторожном перемешивании при 4°C в течение ночи или 2 часов при комнатной температуре, соответственно. Мембрану промывают 30 мл 1X раствора казеина 4 раза, по 5 минут каждый, при КТ, при осторожном перемешивании. Мембрану инкубируют вместе с 30 мл биотинилированного IgG козы анти-кролик (вторичное антитело), разбавленного 1:24000 в 1X растворе казеина, в течение 1 часа при КТ при осторожном перемешивании. Мембрану промывают в 30 мл 1X раствора казеина 3 раза, по 5 минут каждый, при КТ, при осторожном перемешивании. Мембрану инкубируют в течение 45 минут в Vectastain ABC-AmP в 50 мл 1X раствора казеина, содержащего 100 мкл реагента A и 100 мкл реагента B. Мембрану промывают в 30 мл 1X раствора казеина 3 раза по 5 минут каждый при КТ при осторожном перемешивании.
Мембрану инкубируют в Tris, pH 9,5. Хемилюминесцентный сигнал получают с использованием 6 мл Duolox Substrate (Vector Laboratories, Catalog No. SK 6605) и с экспонированием мембраны для рентгеновской пленки Kodak BioMax MS (Kodak Carestream Health, Catalog No. 8572786) в кассете для пленки в течение 10 секунд - 5 минут с последующим проявлением пленки с использованием проявительного раствора Kodak Developer (Kodak GBX, Catalog No. 1900984) и раствора Kodak Fixer.
Уровень экспрессируемого белка RdCVF1L в лизате клеток (Фиг. 2A) показывает, что вектор rAAV-RdCVF1L эффективно трансдуцирует клетки ARPE. Что важнее, белок RdCVF1L эффективно секретируется в среде культивирования клеток с клетками, трансдуцированными вектором (Фиг. 2B). Однако две полосы, положительные относительно белка RdCVF1L, с ожидаемой молекулярной массой наблюдаются в образцах лизата клеток, трансдуцированных вектором rAAV-RdCVF1L (Фиг. 2A, полоса 3), и три таких полосы детектируются в образцах супернатанта клеток (Фиг. 2B, полоса 3). Не желая быть связанным с теорией, две полосы с более низкой молекулярной массой в супернатанте клеток (Фиг. 2B, полоса 3), которые имеют такие же молекулярные массы, как и в лизате клеток, могут высвобождаться из некоторых мертвых клеток в культуре. Третья полоса с чуть более высокой молекулярной массой в супернатанте вероятно представляет секретированную форму RdCVF1L, которая отсутствует в лизате клеток. Данные также говорят, что три формы RdCVF1L, включая секретированную форму RdCVF1L, вероятно являются пост-трансляционно модифицированными.
Сводка результатов
Вектор AAV RdCVF1L способен эффективно трансдуцировать эпителиальные клетки пигмента сетчатки человек (ARPE-19), приводя к экспрессированию и секретированию длинного белка RdCVF, как детектируется с помощью анализа Вестерн-блот. Наблюдают две различных полосы белков RdCVFL в образцах лизата клеток, трансдуцированных вектором rAAV-RdCVF1L, в дополнение к более высокомолекулярной полосе. Три полосы белка RdCVFL детектируют в супернатанте клеток, трансдуцированных вектором. Две из них, которые имеют такие же молекулярные массы, как видны в лизате клеток, возможно, поступают от мертвых клеток в культуре клеток. Третья полоса с чуть более высокой молекулярной массой, вероятно, представляет секретируемую форму RdCVF1L. Эти данные также говорят, что RdCVF1L, включая секретируемую форму RdCVF1L, является, вероятно, пост-трансляционно модифицированным.
Пример 3 - Экспрессирование in vivo RdCVF1 и GFP с помощью вектора AAV в глазах мышей
Целью этого исследования является определение того, может ли субретинальное введение rAAV-RdCVF1L повысить уровни RdCVF в сетчатке глаза мыши. Рекомбинантный вектор AAV серотип 2, вектор rAAV-RdCVF1L и контрольный вектор rAAV-GFP приготавливают, как описано в примере 2.
Самки мышей BALB/C, возрастом 5-6 недель покупаются у The Jackson Laboratory (Bar Harbor, ME) и используются в этом исследовании. Животным дают возможность минимум для 1-недельного периода акклиматизации перед использованием для исследований. Их содержат при 12-часовом цикле свет-темнота с интенсивностью света <50 люкс, в клетках. Корм и вода доступны по потребности. Дизайн эксперимента показан в таблице 1:
Субретинальные инъекции осуществляют под анестезией. Животных анестезируют с помощью внутрибрюшинной инъекции 25-30 мкг/грамм кетамина, объединенного с 5-6 мкг/грамм ксилазина. Дозы анестетиков устанавливают для достижения глубокого уровня анестезии. Глаза обрабатывают с помощью местного нанесения 0,5% гидрохлорида пропаракаина (Bausch & Lomb Inc. Rochester, NY) для местной анестезии и 0,3% AK-Tob (Bausch & Lomb Inc.) для дезинфекции непосредственно перед процедурами. Зрачки расширяют с помощью 1% тропикамида (Akorn, Inc., Buffalo Grove, IL).
Вкратце, мышей под анестезией помещают под операционный микроскоп Zeiss, с глазом, в который должна осуществляться инъекция, находящимся в поле зрения (увеличение приблизительно 10×). К векам прикладывается небольшое давление с помощью ювелирного пинцета, чтобы сделать все глазное яблоко выступающим вперед. Верхнюю височную конъюктиву осторожно иссекают, экспонируя склеру. Иглу калибра 30 используют для осуществления близкого к касательной прокола склеры, хориоида и сетчатки приблизительно на 11 часов (правый глаз) и на 1 час (левый глаз) на расстоянии 0,5 мм за лимбом роговицы. Каплю Gonak (2,5%, Akorn, Inc.) инстилируют на роговицу, и покровное стекло осторожно помещают на поверхность роговицы, чтобы помочь увидеть глазное дно. Тупую иглу 33 калибра, присоединенную к 5-мкл шприцу Hamilton, вводят через склеротомию в тангенциальном направлении по направлению к заднему полюсу, не касаясь хрусталика, и кончик иглы помещают на внутренней поверхности сетчатки. Перфорируют сетчатку, и 1 мкл вектора впрыскивают в субретинальное пространство. После инъекции иглу осторожно извлекают и конъюктиву возвращают на место. Успех каждой инъекции подтверждают посредством оценки глазного дна относительно признаков отслоения сетчатки. Любые глаза, которые демонстрируют субретинальное или интравитреальное кровоизлияние, исключают, а также глаза, которые не демонстрируют отслоения сетчатки (или пузырька). На роговицу наносят неомицин и полимицин B сульфат, и офтальмологическую мазь Bacitracin Zinc (Bausch & Lomb Inc.) для сведения к минимуму высыхания этой ткани, в то время как животные отходят от анестезии на теплом одеяле.
Вестерн-блот анализ
Анализы Вестерн-блот генерируют с помощью экстрактов белка из глаз после инъекции вектора rAAV-RdCVF1L и контралатеральных контрольных глаз без инъекции, полученных через шесть недель после введения вектора rAAV-RdCVF1L. Кратко, глазные яблоки энуклеируют и экстраокулярные ткани и передний сегмент удаляют. Оставшиеся задние сегменты быстро замораживают с помощью жидкого азота. Эти образцы хранят при -80°C до использования с целью экстрагирования белков. Для каждой глазной чаши добавляют 200 мкл реагента для экстрагирования белков из тканей T-PER, охлажденного на льду (Pierce, Cat. No. 78510) с Protease Inhibitor Cocktail (Roche Diagnostics, Cat. No. 11836170001). Образцы обрабатывают ультразвуком 5 секунд на льду с помощью ультразвукового устройства для удаления мембран (Fisher Scientific Model 100, Pittsburgh, PA). Обработанные ультразвуком образцы выдерживают на льду в течение 15 минут и центрифугируют при 10000 g в течение 5 минут при 4°C для удаления остатков клеток. Супернатанты собирают, и концентрации белка определяют с использованием анализа белка по Bradford. Для контролей RdCVFL, лизат клеток ARPE-19, трансдуцированных rAAV-RdCVF1L, служит в качестве положительного контроля, а лизат нетрансдуцированных клеток - в качестве отрицательного контроля. Белки разделяют с помощью гель-электрофореза. Для каждой полосы 36 мкг белка в целом нагружают на 4-20% Criterion™ TGX™ Precast Gel (Bio-Rad, Cat. No. 567-1094) и подвергают воздействию электрофореза при 200 вольт в течение 70 минут. Белки подвергают воздействию электроблоттинга на 0,2-мкм нитроцеллюлозных мембранах для блоттинга с использованием Trans Blot Semi-Dry Trancfer Cell. Блоты блокируют с использованием 1× раствора казеина (Vector Laboratories, Cat. No. SP-5020) в течение 2 часов при КТ и инкубируют вместе с первичным антителом кролика анти-RdCVFL (Covance Research Products, Denver, PA), разбавленным 1:2000, или с антителом кролика анти-опсин, красным/зеленым поликлональным антителом (Millipore, Temecura, CA), разбавленным 1:500. После трех промывок 1× раствором казеина, каждый блот инкубируют вместе со щелочной фосфатазой антитела козы анти-IgG кролика (Vector Laboratories, Cat. No. AP-1000), разбавленным 1:3000. Полосы белков визуализируют с использованием наборов для детектирования хемилюминесцентного субстрата. Бета-тубулин (50 кДа) используют для контроля нагрузки белка. Блот отделяют с помощью Restore Plus Western Blot Stripping Buffer (Thermo Scientific, Cat. No. 46430) и повторно анализируют с помощью моноклонального антитела анти-B-тубулин (Sigma-Aldrich, Cat. No. T4026), разбавленного 1:500, затем с помощью конъюгированного со щелочной фосфатазой антитела лошади анти-IgG мыши (Vector Laboratories, Cat. No. AP-2000), разбавленного 1:3000 в 1X растворе казеина.
Денситометрию белков для ауторадиографических изображений, осуществляемую с помощью Kodak Imaging Station, используют для количественного определения отсканированных полос белков, которые нормируются по отношению к уровню бета-тубулина в том же блоте.
Присутствие белка RdCVF1L четко детектируется в глазах, принимавших инъекции rAAV-RdCVF1L, как яркие двойные иммунореакционные полосы с молекулярной массой приблизительно 30 кДа (Фиг. 3). Вестерн-блот анализ лизатов клеток из клеток ARPE-19, трансдуцированных rAAV-RdCVF1L, которые служат в качестве положительного контроля, также дает 2 отдельные полосы белка с идентичными массами. Ни экстракты белков из контралатеральных глаз, которые не принимают субретинальной инъекции, ни экстракты из глаз, получавших инъекцию rAAV-GFP, не дают сходных полос белков, детектируемых с помощью антитела анти-RdCVFL (Фиг. 3). Двойные иммунореакционные полосы являются сходными с двойными полосами, наблюдаемыми in vitro в клетках ARPE-19, трансдуцированных rAAV-RdCVF1L. Причина отсутствия третьей полосы (вероятно, секретируемой формы RdCVF1L) заключается в том, что эти образцы in vivo представляют собой экстракты белков из клеток сетчатки.
Иммуногистохимический анализ
Иммунное окрашивание RdCVF1L осуществляют в цельном препарате нейросетчатки и RPE-хороида-склеры. Животные терминально анестезируются, и глаза энуклеируются и непосредственно фиксируются в 4% растворе параформальдегида в фосфатном буферном солевом растворе (PBS) 7,4 (1X), в жидкости (Gibco, Cat. No. 10010-031) в течение ночи при 4°C. Каждый глаз мыши маркируется в нижнем квадранте роговицы с помощью туши перед энуклеацией. Глазные чаши приготавливают посредством удаления переднего сегмента под микроскопом Leica для иссечения. Небольшой надрез делают в нижнем квадранте для ориентировки. Нейросетчатку, закрепленную на зрительном нерве, осторожно иссекают из RPE. Цельные препараты промывают три раза 1× PBS и блокируют с помощью 5% сыворотки осла в 2% растворе Triton X-100 в PBS в течение 2 часов при КТ. После удаления блокирующего раствора цельные препараты последовательно инкубируют вместе с первичным антителом кролика анти-RdCVF, 1:1000, в блокирующем растворе при 4°C в течение ночи и с вторичным антителом ALEXA FLUOR® 488 осла анти-кролик 1:1000 в 2% Triton X-100 в PBS, 2 часа при КТ. После конечных промывок PBS каждый цельный препарат располагают на плоскости стеклянного слайда с фоторецепторами, направленными вверх для нейросетчатки, и RPE, направленными вверх для RPE-хориоида-склеры. Затем срезы исследуют с помощью микроскопа Olympus BX51, снабженного цифровой камерой (Spot RT Color 2.2.1, Diagnostic Instruments, Inc.) и эпифлуоресценцией.
Иммуногистохимия подтверждает повышенное экспрессирование белка RdCVF1L в глазах после инъекции вектора rAAV-RdCVF1L. Устойчивое иммунное окрашивание RdCVF1L наблюдают в клетках RPE в глазах после инъекции rAAV-RdCVF (Фиг. 4A), но не для контралатеральных глаз без инъекции (Фиг. 4). Повышенное экспрессирование RdCVF1L видно только в фокальной области, перекрывающей приблизительно один квадрант каждого глаза, показывая, что экспрессирование ограничено только областью пузырька от субретинальной инъекции. Образцы, окрашенные без первичного антитела, не показывают никакой иммунореакционности (Фиг. 4C). Заметное увеличение экспрессирования этого белка наблюдают также в фоторецепторных клетках (Фиг. 5A) в глазах после инъекции rAAV-RdCVF1L. Сильное окрашивание RdCVF1L видно в наружных сегментах фоторецепторов в цельном препарате нейросетчатки. Опять же, положительное окрашивание локализовано только в фокальной области сетчатки, перекрывая 10-30% сетчатки. Имеется только фоновое окрашивание в контралатеральных глазах без инъекции (Фиг. 5B). Не обнаружено иммунореакционности в образцах, обработанных без первичного антитела (Фиг. 5C).
Экспрессирование GFP в глазах мышей
Чтобы определить, могут ли исследуемые векторы AAV эффективно трансдуцировать RPE и фоторецепторные клетки в глазах мышей, группа мышей (n=7) получает субретинальные инъекции с rAAV-GFP и умерщвляется через 6 недель. RPE-хориоид-склера и нейросетчатка отделяются и помещаются в виде препаратов на плоской поверхности на стеклянные слайды. Флюоресцентная микроскопия показывает устойчивое экспрессирование GFP в RPE и фоторецепторном слое (данные не показаны). Клетки RPE, экспрессирующие GFP, распределены по 1-2 квадрантам среза, при этом максимальное количество и наиболее устойчивые клетки, экспрессирующие GFP, присутствуют в месте инъекции. Трансдуцированные клетки RPE выглядят здоровыми, поскольку они сохраняют их гексагональную морфологию. В препаратах нейросетчатки глаза, помещенных на плоской поверхности, экспрессирование GFP определяется в наружных сегментах фоторецепторов. Некоторые внутренние клетки сетчатки, такие как ганглиозные клетки, являются положительными по GFP, возможно из-за утечки вектора в стекловидное тело после субретинальной инъекции.
Сводка результатов
Настоящие исследования демонстрируют эффективное трансдуцирование RPE и фоторецепторных клеток вектором rAAV-RdCVF1L после успешной субретинальной инъекции. Конструкт для экспрессирования RdCVF1L, доставляемый с помощью этого вектора, приводит к значительному повышению уровня белка RdCVF1L в глазах мышей.
Пример 4 - Воздействие экспрессирования длинной формы RdCVF, опосредованного адено-ассоциированным вирусным вектором, на выживаемость фоторецепторов в глазах мышей rd10
Целью настоящего исследования является определение того, может ли субретинальное введение вектора для генной терапии на основе AAV, кодирующего RdCVF1L, способствовать выживаемости фоторецепторов у мышей rd10, встречающейся в природе животной модели наследственной дегенерации сетчатки у людей. Мыши rd10 представляют собой встречающуюся в природе животную модель аутосомальной рецессивной пигментной дистрофии сетчатки (RP). Мыши rd10 имеют миссенсную точечную мутацию в гене фосфодиэстеразы cGMP палочек, приводящую в результате к апоптозу фоторецепторных клеток (Chang et al. (2007) Vision Res 47: 624-633). Палочковидные фоторецепторные зрительные клетки начинают дегенерировать в возрасте 18 дней, при этом пик гибели фоторецепторов происходит на P25 (Gargini et al. (2007) J Comp Neurol 500: 222-238). Через пять недель большинство фоторецепторных клеток дегенерируют (Chang et al. (2002) Vision Res 42: 517-525; Chang et al. (2007) Vision Res 47: 624-633; Gargini et al. (2007) J Comp Neurol 500: 222-238). Что примечательно, было обнаружено, что выдерживание мышей rd10 в темноте замедляет дегенерацию фоторецепторов на целых четыре недели (Chang et al. (2007) Vision Res 47: 624-633), говоря о том, что экспонирование для света может ускорить гибель фоторецепторов. С другой стороны, замедленная дегенерация фоторецепторов посредством выдерживания этих мышей в темноте может расширить терапевтическое временное окно для векторов, которые требуют некоторого времени для терапевтического трансгенного экспрессирования, например, адекватное трансгенное экспрессирование из AAV обычно займет примерно 3 недели.
Племенные пары конгенной инбредной линии мышей rd10 в возрасте 4-5 недель покупают у The Jackson Laboratory (Bar Harbor, ME) и размножают в виварии. Их выдерживают при 12-часовом цикле свет-темнота при интенсивности света <50 люкс, в клетках. Корм и вода доступны по потребности. После операции, как описано ниже, детеныши с их матерями выдерживаются в темноте до тех пор, пока их не отлучат от матерей в возрасте 3 недель. Затем всех животных переносят обратно в предыдущую комнату с 12-часовым циклом свет-темнота. Дизайн эксперимента показан в таблице 2.
морфология/количество колбочек
Животных (в возрасте на 3 день после рождения) анестезируют посредством гипотермии. Этот способ анестезии хорошо установлен для неонатальных мышей и крыс в возрасте до 5 дней и является подходящим для коротких, небольших хирургических процедур (5-15 минут) на этих животных (Gaertner et al. Anesthesia and Analgesia 2nd ed. P. 277-278). Детенышей помещают на колотый лед в течение 3-4 минут. В течение этого времени цвет детенышей изменяется от розового до серого. Субретинальные инъекции осуществляют при этом типе анестезии.
Мышей под анестезией помещают под операционный микроскоп Zeiss с глазом, в который должна осуществляться инъекция в поле зрения (увеличение приблизительно 10×). Веко и соседнюю область дезинфицируют с помощью 5% повидона-иода. Глаз экспонируют посредством раскрытия глазной щели с использованием ножниц для иридэктомии. Прикладывают небольшое давление на веки с помощью ювелирного пинцета, чтобы сделать все глазное яблоко выступающим вперед. Вводят каплю 0,3% Tobromycin (Bausch & Lomb Inc.) для дезинфекции. Используют острую иглу калибра 30 для осуществления близкого к касательной прокола склеры, хориоида и сетчатки приблизительно в положении на 11 часов (правый глаз) примерно на 0,5 мм за лимбом роговицы. Тупую иглу 33 калибра, присоединенную к 5-мкл шприцу Hamilton, вводят через склеротомию в тангенциальном направлении к заднему полюсу. Кончик иглы помещают в субретинальное пространство, и вводят посредством инъекции 1 мкл вектора AAV в субретинальное пространство. После инъекции иглу медленно извлекают. Любые глаза, которые демонстрируют субретинальное или интравитреальное кровоизлияние, исключают из исследования. Неомицин и полимицин B сульфат и офтальмологическую мазь на основе бацитрацина цинка (Bausch & Lomb Inc.) наносят на роговицу для предотвращения инфекции и сведения к минимуму высыхания этой ткани. Животным дают возможность отойти от наркоза на теплой подогреваемой подстилке.
Гистология сетчатки
Мышей глубоко анестезируют и их глаза помечают в верхнем квадранте с помощью красного красителя для тканей, для ориентации. Затем их умерщвляют и немедленно энуклеируют и фиксируют в фиксаторе Давидсона в течение примерно 24 часов при КТ. После последовательной дегидратации в этаноле и Clear-rite, глаза погружают в парафин (Fisher Sci., Houston, TX). Срезы сетчатки толщиной 5 мкм режут вдоль вертикального меридиана, чтобы дать возможность для исследования верхней и нижней сетчатки. Срезы окрашивают гематоксилином и эозином и исследуют под оптическим микроскопом (Olympus BX51). Толщину наружного ядерного слоя (ONL) оценивают посредством счета количества рядов ядер в центральной и периферической сетчатке. Также исследуют морфологию фоторецепторов.
Леченые глаза мышей rd10 оценивают на степень спасения структуры в возрасте 5 недель. Оптическая микроскопия показывает очевидное сохранение наружного ядерного слоя (ONL) в глазах, леченых AAV-RdCVF1L, по сравнению с нелечеными контралатеральными глазами. Как правило, сетчатка, леченая вектором RdCVF1L, имеет 2-5 рядов ядер фоторецепторов в верхней и/или нижней областях в противоположность 1-2 рядам в нелеченых контралатеральных глазах в тех же положениях (Фиг. 7). Спасение не ограничивается областью инъекции, верхним квадрантом, поскольку защиту наблюдают также в нижнем квадранте. Морфометрический анализ показывает, что приблизительно 75% сетчатки защищено в глазах, леченых вектором, по сравнению с 34% в нелеченых глазах. Некоторые сохраненные фоторецепторы даже имеют внутренние и наружные сегменты (Фиг. 7E). Очевидно, что спасенные фоторецепторы содержат как палочковидные, так и колбочковидные зрительные клетки.
Окрашивание и счет колбочковидных фоторецепторов
Агглютинин арахиса (PNA), маркер, специфичный к колбочковидным зрительным клеткам, используют для окрашивания цельного препарата сетчатки. Глаза мышей метят в верхнем квадранте роговицы тушью и красным красителем на темпоральном квадранте перед энуклеацией. Их непосредственно фиксируют в 4% растворе параформальдегида по меньшей мере в течение ночи при 4°C. Глазные чаши подготавливают посредством удаления переднего сегмента под микроскопом Leica для иссечения. Небольшой надрез делают в верхнем квадранте для ориентации. После 4 радиальных надрезов по окружности всю нейросетчатку целиком осторожно иссекают из глазной чаши. Сетчатки глаза промывают три раза 1X PBS и блокируют с помощью 6% раствора бычьего сывороточного альбумина (BSA) в PBS (Gibco, Cat. No. 10010-031) с 0,2% Triton-X100 в течение 30 минут при КТ. После удаления блокирующего раствора сетчатки глаза инкубируют вместе с Lectin PNA Conjugates Alexa Fluor 594 (1:250 в PBS, Invitrogen Corp, Chicago, IL) в течение ночи при 4°C. После конечных промывок с помощью PBS каждую сетчатку помещают на плоской поверхности на стеклянном слайде с фоторецепторами, направленными вверх. Затем цельные препараты сетчатки исследуют на микроскопе Olympus BX51, снабженном цифровой камерой (Spot RT Color 2.2.1, Diagnostic Instruments, Inc.) и эпифлуоресценцией.
Для оценки плотности колбочковидных зрительных клеток в цельных препаратах сетчатки, получают по два изображения с помощью 60× объектива от каждого квадранта сетчатки в положении на расстоянии 1 и 2 мм от края диска зрительного нерва, соответственно. Количество колбочек, представленных на каждом изображении (390×293 мкм), считают с помощью программного обеспечения Image Pro Plus (Media Cybernetics, Inc. Bethesda, MD).
Для некоторых глаз срезы сетчатки из криостата (толщина 12 мкм) режут с помощью криостатируемого микротома Leica (Leica Microsystems, Model CM 1850, Leica, Bannockburn, IL) и окрашивают с помощью PNA, их исследуют с помощью указанного выше флуоресцентного микроскопа.
Колбочковидные фоторецепторные зрительные клетки идентифицируют с помощью мечения PNA, которое селективно окрашивает внутренние и наружные сегменты колбочек на нейросетчатке, помещенной на плоской поверхности. Флюоресцентная микроскопия показывает острую дегенерацию колбочковидных зрительных клеток в нелеченых глазах, в частности, в задней центральной части сетчатки, например, вокруг диска зрительного нерва. Колбочковидные зрительные клетки теряют наружные сегменты, и их внутренние сегменты являются короткими, тупыми и нерегулярными. В противоположность этому, глаза, леченые вектором, имеют более высокую плотность колбочек, гораздо меньше дезорганизованных сегментов колбочек и более однородное окрашивание колбочек (данные не показаны). При более высоком увеличении PNA-положительные колбочковидные зрительные клетки считаются во всех 4 квадрантах в положениях на расстоянии 1 и 2 мм от диска зрительного нерва. Количественное определение плотности колбочек показывает значительно более высокие количества колбочковидных фоторецепторов в глазах, леченых вектором, по отношению к нелеченым контралатеральным глазам: 181+/-46,4 по сравнению с 50+/-25,2 колбочек/0,114 мм2, p=0,001.
Иммуногистохимия RdCVF
Иммунное окрашивание RdCVF осуществляют на цельном препарате нейросетчатки и RPE-хороида-склеры. Цельные препараты промывают три раза 1X PBS и блокируют с помощью 5% сыворотки осла и 2% раствора Triton X-100 в PBS в течение 2 часов при КТ. После удаления блокирующего раствора цельные препараты последовательно инкубируют вместе с первичным антителом кролика анти-RdCVF при 1:1000 в блокирующем растворе при 4°C в течение ночи и с вторичным антителом-Alexa Fluor® 488 осла анти-кролик при 1:1000 и 2% Triton X-100 в PBS, 2 часа при КТ. После конечных промывок с помощью PBS каждый цельный препарат помещают на плоской поверхности на стеклянном слайде с фоторецепторами, направленными вверх, для нейросетчатки, и с RPE, направленными вверх, для RPE-хориоида-склеры. Затем препараты на плоской поверхности исследуют с помощью микроскопа Olympus BX51, снабженного цифровой камерой (Spot RT Color 2.2.1, Diagnostic Instruments, Inc.) и эпифлуоресценцией.
Наблюдают устойчивую иммунореакционность RdCVF в клетках RPE в 5-ти из 6-ти глаз после инъекции rAAV-RdCVF1L (репрезентативный пример для одного глаза виден на (Фиг. 6A), но не для контралатеральных глаз без инъекции (Фиг. 6B). Один глаз, который получает инъекцию rAAV-RdCVF1L, исключают из анализа из-за микрофтальмии. Эффективное экспрессирование RdCVF1L, видное в фокальной области, распределяется приблизительно на 1,5-3 квадранта каждого глаза. Клетки RPE, экспрессирующие RdCVF1L, поддерживают типичную гексагональную морфологию (Фиг. 6E), это говорит о том, что нет очевидного отрицательного влияния на RPE от введения вектора или экспрессирования RdCVF1L. Подобно экспрессированию RdCVF1L в RPE, эффективное экспрессирование при иммунореакционности этого белка также наблюдается в нейросетчатке в глазах после инъекции rAAV-RdCVF1L (Фиг. 6C). Окрашивания в контралатеральных глазах без инъекции нет (Фиг. 6D). Сильное окрашивание RdCVF1L четко видно в фоторецепторных клетках в 3-х глазах из 5-ти, в частности, во внутренних/наружных сегментах (Фиг. 6F). Отсутствие иммунореакционности RdCVF в других 2-х глазах может быть приписано дегенерации фоторецепторов. Опять же, положительное окрашивание локализовано только в фокальной области сетчатки. То наблюдение, что нет детектируемого экспрессирования RdCVF1L в контралатеральных глазах без инъекции, говорит, что уровень эндогенного RdCVF1L может быть ниже, чем предел детектирования иммуногистохимического окрашивания.
Сводка результатов
Это исследование демонстрирует, что субретинальная инъекция векторов rAAV-RdCVF1L приводит к эффективному трансдуцированию RPE и фоторецепторных клеток и к устойчивому экспрессированию белка RdCVF1L в глазах мышей rd10. Более важно, этот вектор пролонгирует выживаемость как палочковидных, так и колбочковидных фоторецепторов и улучшает морфологию колбочек для этой клинически релевантной животной модели пигментной дистрофии сетчатки (RP).
Пример 5 - Субретинальная инъекция rAAV-RdCVF1L сохраняет фоторецепторные клетки, удаленные от места инъекции у мышей rd10
Для исследования того, может ли спасение фоторецепторных клеток с помощью rAAV-RdCVF1L распространяться на области, удаленные от места инъекции, осуществляют субретинальную инъекцию rAAV-RdCVF1L (1 мкл, 2×108 GC) в верхний квадрант правых глаз мышей rd10 в 3-й день после рождения, с контралатеральными глазами без инъекции в качестве контролей. Мышей умерщвляют в возрасте 5 недель. Исследуют гистологию сетчатки из глазной чаши в целом. Фиг. 8 показывает сделанную под оптическим микроскопом фотографию глазной чаши у репрезентативной мыши rd10 в возрасте 5 недель, которая принимает субретинальную инъекцию rAAV-RdCVF1L в один глаз (панель A, Фиг. 8) и не принимает лечения в контралатеральном глазу (панель B, Фиг. 8). Нужно отметить разницу в толщине ONL между леченым и нелеченым глазом. Сохранение фоторецепторов ясно видно по всей сетчатке глаза, леченого rAAV-RdCVF1L (панель A, Фиг. 8). Место инъекции в верхней части сетчатки отмечено. В противоположность этому, в нелеченом контралатеральном глазу большинство фоторецепторных клеток потеряно, за исключением нижней периферической части сетчатки (панель B, Фиг. 8).
Пример 6 - Субретинальная инъекция rAAV-RdCVF1L сохраняет палочковидные фоторецепторные зрительные клетки
Чтобы исследовать, можно ли спасти палочковидные фоторецепторные зрительные клетки (в дополнение к колбочковидным фоторецепторным зрительным клеткам) с помощью rAAV-RdCVF1L, осуществляют субретинальную инъекцию в правых глазах мышей rd10 в день 3 после рождения с помощью rAAV-RdCVF1L (1 мкл, 2×108 GC), с контралатеральными глазами без инъекции в качестве контролей. Мышей умерщвляют в возрасте 5 недель. Ткань сетчатки подвергают иммуногистохимическому окрашиванию родопсином. Срезы контрастно окрашивают DAPI (диамидино-2-фенилиндол, голубой цвет) чтобы помочь в идентификации слоев сетчатки.
Устойчивое экспрессирование родопсина наблюдают как в сегментном слое, так и в ядерном слое фоторецепторных клеток в глазу, леченом rAAV-RdCVF1L (данные не показаны). Однако только несколько клеток показывают окрашивание родопсином в нелеченом глазу (данные не показаны).
Пример 7 - Функциональное спасение фоторецепторов с помощью RdCVFL, опосредуемое адено-ассоциированными вирусными векторами, у мышей rd10
Целью настоящего исследования является оценка защитного воздействия RdCVF, доставляемого с помощью вектора AAV, на функцию и структуру сетчатки у мышей rd10. Неонатальные мыши rd10 в возрасте 3 или 4 дня получают субретинальную инъекцию вектора rAAV-RdCVFL в один глаз, в то время как контралатеральный глаз остается нелеченым. Через пять недель после субретинальной инъекции мышей исследуют с помощью электроретинограммы (ERG) для оценки функций сетчатки. После ERG мышей умерщвляют, и их глаза обрабатывают для гистологической оценки сетчатки.
Рекомбинантный вектор rAAV-RdCVF1L, AAV серотип 2, и контрольный вектор rAAV-GFP приготавливают, как описано в примере 2.
Племенные пары конгенной имбредной линии мышей rd10 в возрасте 4-5 недель покупают у The Jackson Laboratory (Bar Harbor, ME) и размножают в виварии. Их выдерживают при 12-часовом цикле свет-темнота при интенсивности света <50 люкс в клетках. Корм и вода являются доступными по потребности. После хирургической операции детенышей с их матерями выдерживают в темнота до тех пор, пока их не отлучат от матерей в возрасте 3-х недель. Затем всех животных переносят опять в предыдущую комнату с 12-часовым циклом свет-темнота. Дизайн эксперимента показан в таблице 3.
Гистология сетчатки
Животных анестезируют и осуществляют субретинальную инъекцию, как описано выше в примере 4.
Мышей адаптируют к темноте в течение ночи (по меньшей мере 14 часов) перед экспериментами и их зрачки расширяют с помощью глазных капель 0,5% тропикамида (Alkorn). Анестезию вызывают посредством внутрибрюшинной инъекции кетамина и ксилазина. Серебряные игольчатые электроды служат в качестве электрода сравнения (лоб) и заземления (хвост), а DTL кольцевые электроды в качестве активных электродов. Наносят Gonesol для обеспечения хорошего электрического контакта и для поддержания глаза гидратированным в течение всей процедуры. Установка для регистрации содержит чашу безориентирного зрительного пространства, усилитель постоянного тока и узел контроля и регистрации на основе компьютера системы электроретинографии Espion E3 (Diagnosys LLC, Lowell, MA). Регистрируют ERG от обоих глаз одновременно, после того как мыши помещаются в чашу безориентирного зрительного пространства. Данные для единичных вспышек и для мерцающего света получают как при условиях адаптирования к темноте (скотопических), так и при условиях адаптирования к свету (фотопических). Стимулы в виде единичных вспышек представлены с увеличивающимися интенсивностями, достигающими от 10-2 до 25 кд/м2. Пять откликов усредняют при интервале между стимулами 5 или 17 секунд. Мерцающие стимулы имеют интенсивность 3 кд/м2 с частотами 2, 5, 10, 15 и 30 Гц. Адаптирование к свету осуществляют при фоновом освещении 30 кд/м2, присутствующем в течение 10 минут, для достижения стабильного уровня фотопических откликов. Для сравнения средних амплитуд используют парный t-критерий Стьюдента.
Мышей глубоко анестезируют, и их глаза помечают в верхнем квадранте с помощью красного красителя для тканей, для ориентации. Затем их умерщвляют и немедленно энуклеируют и фиксируют в фиксаторе Давидсона в течение примерно 24 часов при комнатной температуре. После последовательной дегидратации в этаноле и Clear-rite, глаза погружают в парафин (Fisher Sci., Houston, TX). Срезы сетчатки толщиной 5 мкм режут вдоль вертикального меридиана, чтобы дать возможность для исследования верхней и нижней сетчатки. Срезы окрашивают гематоксилином и эозином и исследуют под оптическим микроскопом (Olympus BX51). Толщину наружного ядерного слоя (ONL) оценивают посредством счета количества рядов ядер в центральной и периферической сетчатке. Также исследуют морфологию фоторецепторов.
Результаты
Спасение функции сетчатки в глазах, леченых rAAV-RdCVF1L
Как ожидается, в возрасте 5 недель мыши rd10 показывают значительное уменьшение скотопических и фотопических откликов при регистрации ERG по сравнению со схожими по возрасту мышами дикого типа C57BL/6 (данные не показаны). Однако у мышей rd10 (n=8) глаза, леченые rAAV-RdCVF1L, показывают приблизительно 3-кратное увеличение амплитуд b-волны (33,6±14 мкВ) по сравнению с нелечеными вторыми глазами (11,5±8,4 мкВ) при интенсивности вспышки 25 кд на скотопическом фоне (Фиг. 10A и 10B). При этих условиях регистрируют отклики как палочек, так и колбочек. Статистические анализы показывают значимые различия в амплитудах ERG между глазами, лечеными rAAV-RdCVF1L, и контрольными глазами (p=0,025). Некоторых животных (n=5) исключают из исследований с помощью ERG (исключают перед исследованием ERG) из-за помутнения роговицы, катаракты или микрофтальмии, вероятно, возникающей из-за внутриглазной операции в неонатальный период.
Структурное сохранение фоторецепторов в глазах, леченых rAAV-RdCVF1L:
Для определения того, коррелируют ли повышенные отклики на ERG в глазах, леченых rAAV-RdCVF1L, со структурным сохранением фоторецепторных клеток у мышей rd10, животных умерщвляют непосредственно после ERG. Их глаза обрабатывают для гистологической оценки. Оптическая микроскопия показывает очевидное сохранение наружного ядерного слоя (ONL) в глазах, леченых AAV-RdCVFL по сравнению с нелечеными контралатеральными глазами. Как правило, сетчатка, леченая вектором, имеет 2-4 ряда ядер фоторецепторов в верхней и/или нижней области в противоположность 1-2 рядам в нелеченых контралатеральных глазах (Фиг. 11A и 11B). Сохранение фоторецепторов не ограничивается областью инъекций, верхним квадрантом, поскольку защита наблюдается также и в нижнем квадранте. Некоторые сохраненные фоторецепторы даже имеют внутренние и наружные сегменты. Морфометрические анализы показывают значительное увеличение количество рядов ONL в леченых глазах (2,5+1,0) по сравнению с контрольными глазами (1,2+0,2) (p=0,006) (Фиг. 12).
Сводка результатов
ERG демонстрирует значимое увеличение амплитуд b-волны в глазах, леченых rAAV-RdCVF1L (33,6±14 мкВ), по отношению к нелеченым вторым глазам (11,5±8,4 мкВ). Увеличение амплитуд ERG коррелирует с улучшением структуры сетчатки. Это исследование демонстрирует, что субретинальная инъекция векторов rAAV-RdCVF1L значимо улучшает функцию сетчатки и замедляет дегенерацию фоторецепторов у мышей rd10.


















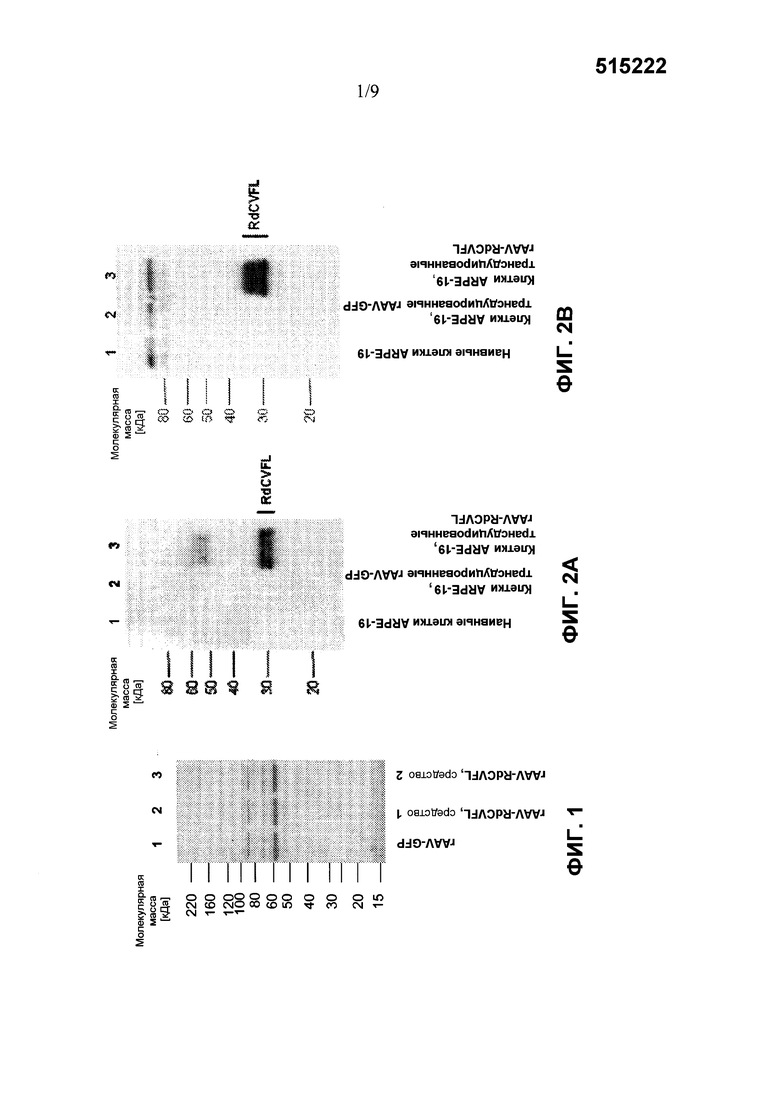
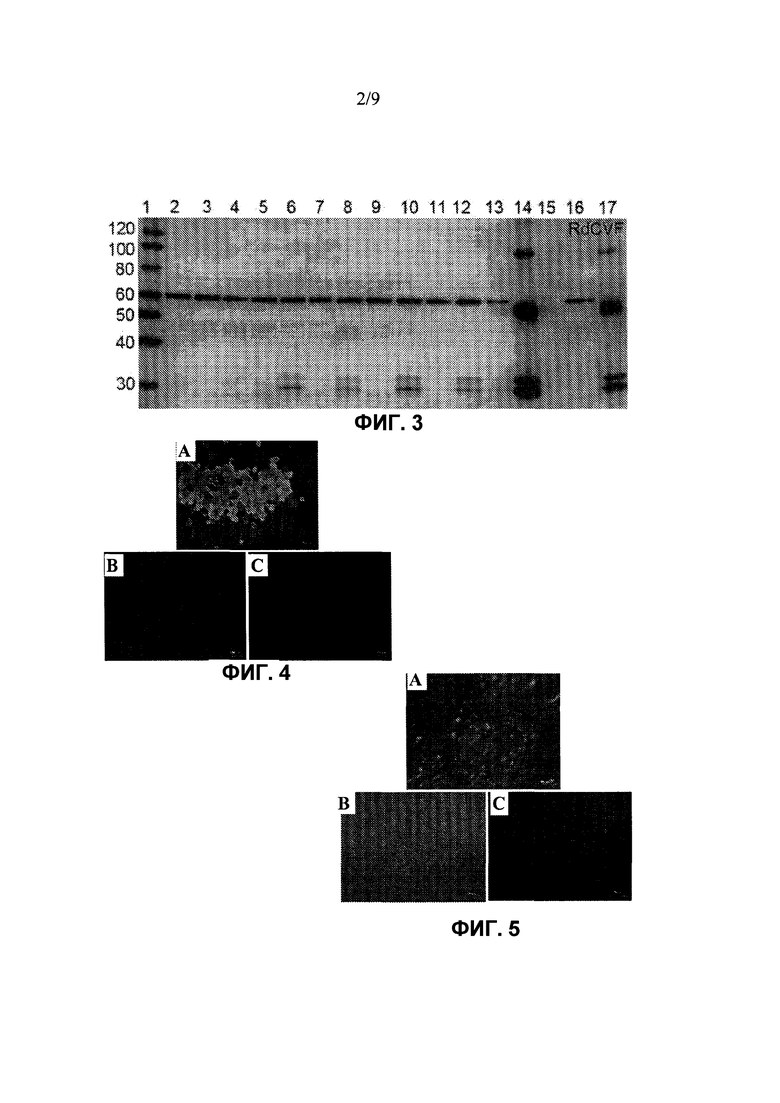
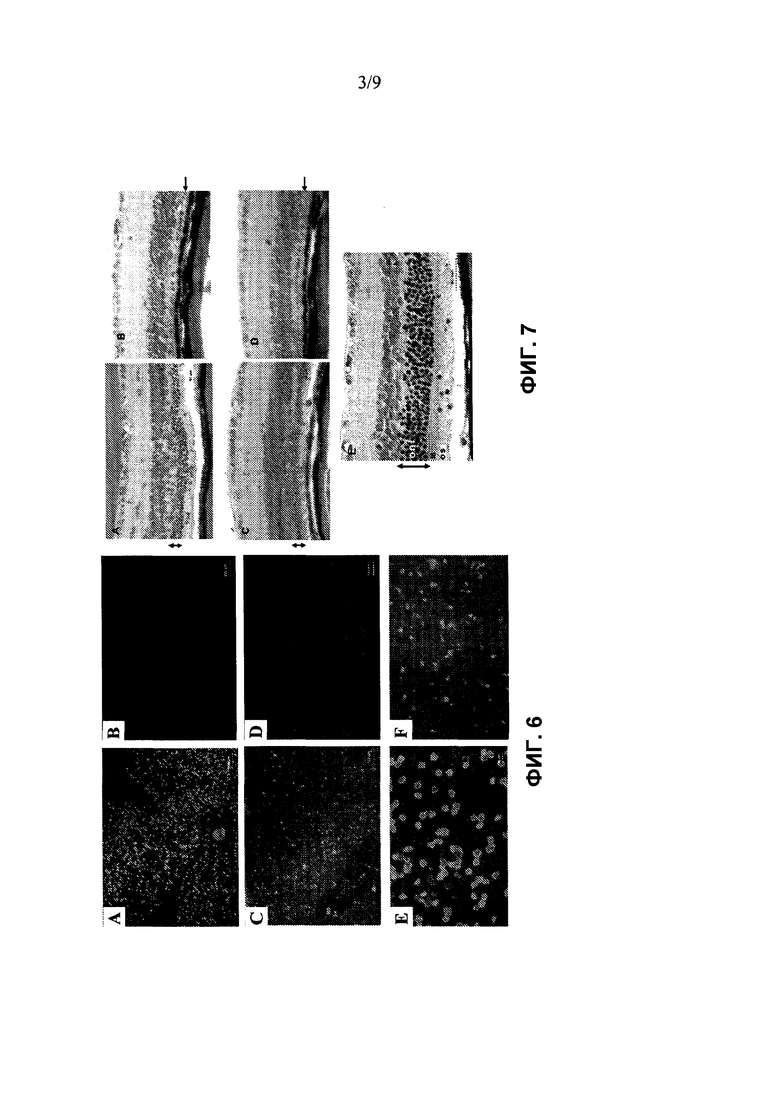
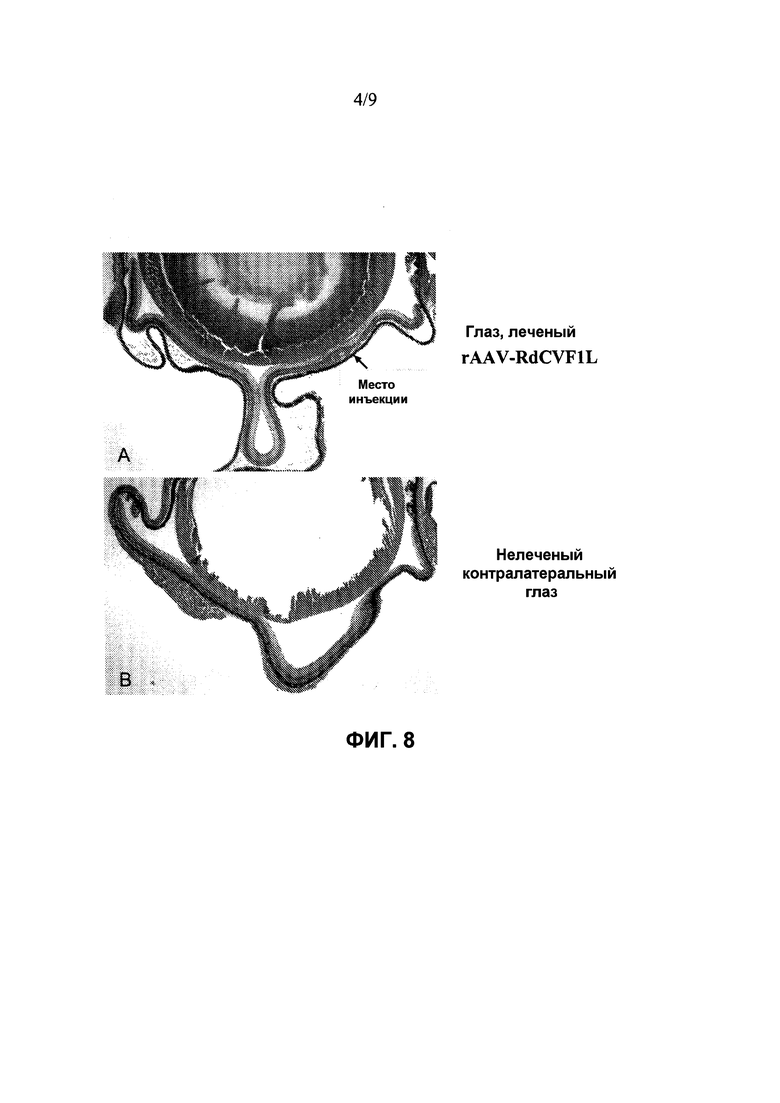


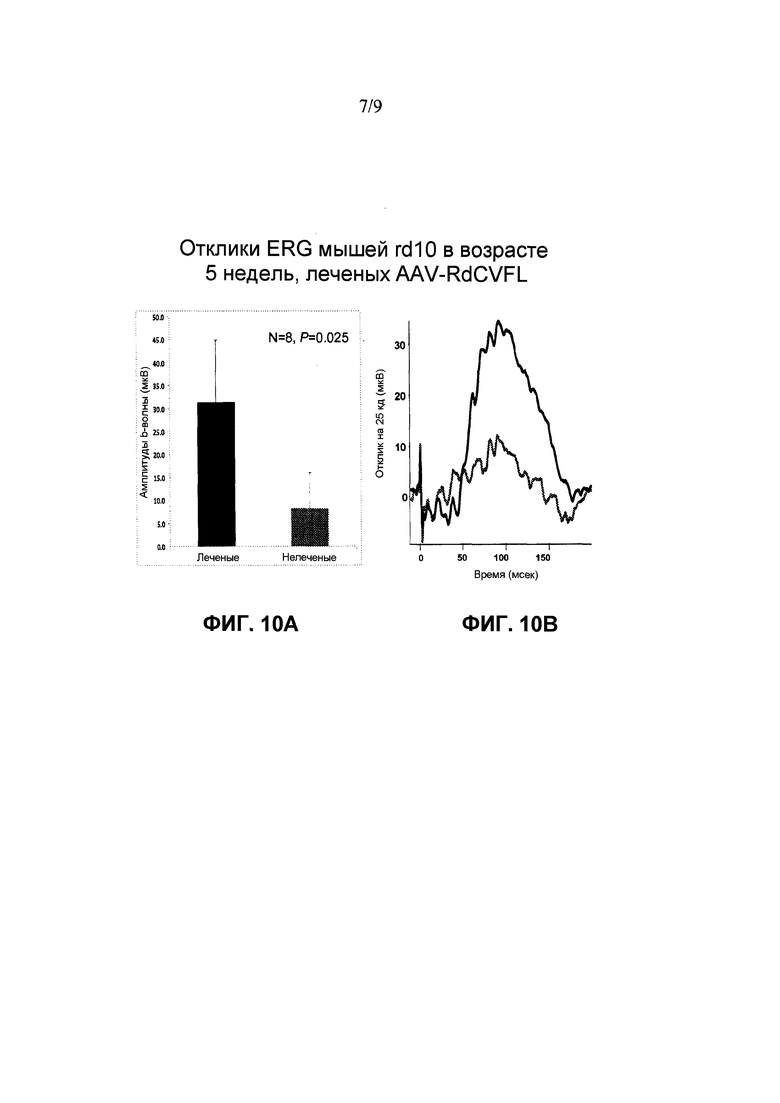

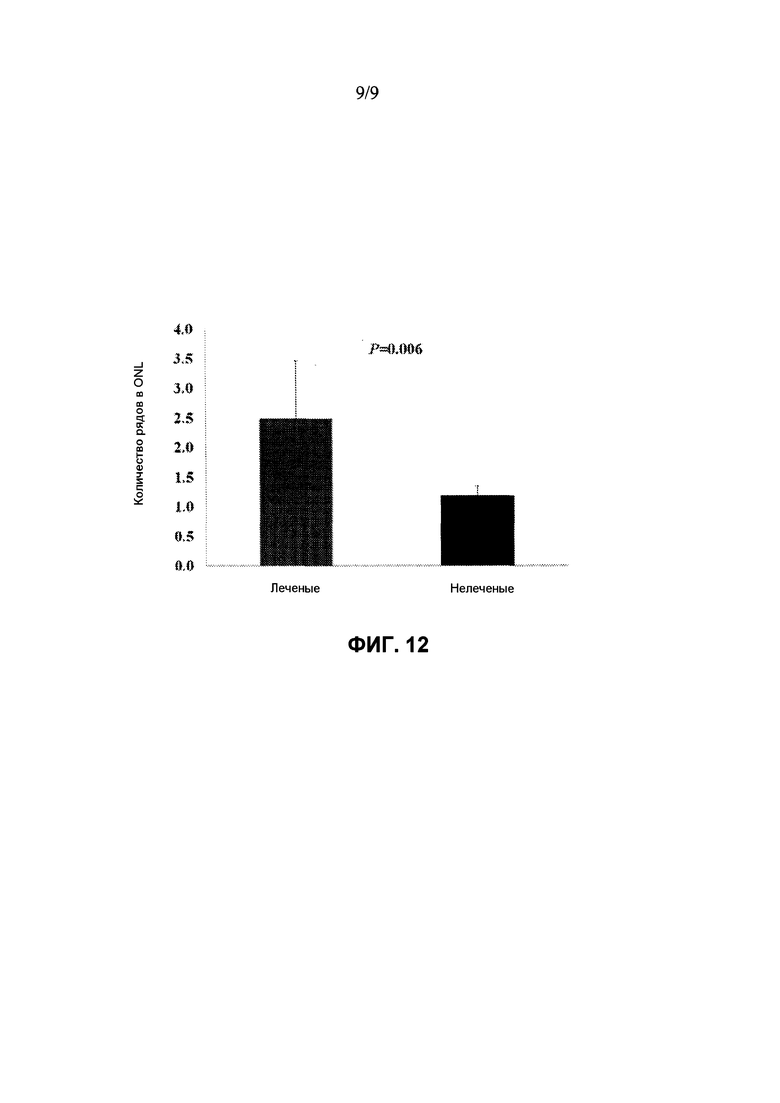
Группа изобретений относится к области медицины. Предложена нуклеиновая кислота, способствующая выживаемости фоторецепторов, содержащая последовательность нуклеотидов, которая кодирует белок RdCVF человека, и вторую последовательность нуклеотидов, которая кодирует сигнальную последовательность Igk, функционально связанную с последовательностью нуклеотидов, кодирующей белок RdCVF человека, где последовательность, кодирующая RdCVF человека, содержит перекодированную последовательность нуклеотидов. Предложены вирусный вектор, выделенная клетка, содержащая нуклеиновую кислоту, и фармацевтическое средство, способствующее выживаемости фоторецепторов. Предложен способ сохранения палочковидных зрительных клеток в глазу млекопитающего, включающий введение в глаз млекопитающего нуклеиновой кислоты. Предложенная группа изобретений обеспечивает стабильный перенос нуклеиновой кислоты в клетку для локального и/или долговременного экспрессирования. 5 н. и 23 з.п. ф-лы, 15 ил., 3 табл., 7 пр.
1. Нуклеиновая кислота, способствующая выживаемости фоторецепторов, содержащая последовательность нуклеотидов, которая кодирует белок RdCVF, и вторую последовательность нуклеотидов, которая кодирует N-концевую сигнальную последовательность, функционально связанную с последовательностью нуклеотидов, кодирующей белок RdCVF,
где последовательность, кодирующая RdCVF, содержит перекодированную последовательность нуклеотидов;
белок RdCVF представляет собой белок RdCVF человека;
и N-концевая сигнальная последовательность представляет собой сигнальную последовательность Igk.
2. Нуклеиновая кислота по п. 1, где белок RdCVF представляет собой белок RdCVF1.
3. Нуклеиновая кислота по п. 1, где белок RdCVF представляет собой белок RdCVF2.
4. Нуклеиновая кислота по п. 1, где белок RdCVF представляет собой короткую версию белка RdCVF.
5. Нуклеиновая кислота по п. 1, где белок RdCVF представляет собой длинную версию белка RdCVF.
6. Нуклеиновая кислота по п. 1, где в перекодированной последовательности нуклеотидов отсутствует начальный метиониновый кодон.
7. Нуклеиновая кислота по п. 1, где кодирующая последовательность для белка RdCVF содержит нуклеотиды 106-741 из SEQ ID NO: 1, нуклеотиды 106-429 из SEQ ID NO: 1, нуклеотиды 106-432 из SEQ ID NO: 3 или нуклеотиды 106-744 из SEQ ID NO: 3.
8. Нуклеиновая кислота по п. 1, где сигнальная последовательность содержит нуклеотиды 1-105 из SEQ ID NO: 1.
9. Нуклеиновая кислота по п. 1, где сигнальная последовательность кодирует последовательность аминокислот, содержащую SEQ ID NO: 15, аминокислоты 2-34 из SEQ ID NO: 2 или аминокислоты 7-21 из SEQ ID NO: 2.
10. Нуклеиновая кислота по п. 1, где последовательность нуклеотидов содержит SEQ ID NO: 1 или 3.
11. Нуклеиновая кислота по п. 1, где перекодированная последовательность нуклеотидов имеет по меньшей мере 40% перекодированных кодонов.
12. Нуклеиновая кислота по п. 1, где перекодированная последовательность нуклеотидов имеет по меньшей мере 15% отличающихся нуклеотидов по сравнению с соответствующей нативной последовательностью нуклеотидов.
13. Нуклеиновая кислота по п. 1, где перекодированная последовательность нуклеотидов является менее чем на 90% идентичной соответствующей нативной последовательности нуклеотидов.
14. Нуклеиновая кислота по п. 1, где перекодированная последовательность нуклеотидов имеет одну или несколько из характеристик, выбранных из группы, состоящей из отсутствия ингибиторных мотивов прокариотов, отсутствия консенсусных сайтов доноров сплайсированного фрагмента, отсутствия сайтов скрытых доноров сплайсированного фрагмента и содержания GC, находящегося в пределах между 60 и 65%.
15. Нуклеиновая кислота по п. 1, где нуклеиновая кислота содержит SEQ ID NO: 11, последовательность нуклеотидов 150-2080 из SEQ ID NO: 11 или последовательности нуклеотидов 150-812, 820-1312 и 1340-2080 из SEQ ID NO: 11.
16. Вирусный вектор, способствующий выживаемости фоторецепторов, содержащий нуклеиновую кислоту по любому из указанных выше пунктов.
17. Вирусный вектор по п. 16, где вирусный вектор представляет собой адено-ассоциированный вирусный вектор (AAV).
18. Вирусный вектор по п. 17, где вектор AAV основывается на серотипе 2 AAV.
19. Вирусный вектор по п. 17, где вектор AAV основывается на серотипе 8 AAV.
20. Вирусный вектор по п. 16, где вирусный вектор не представляет собой вирусный вектор бычьего иммунодефицита.
21. Вирусный вектор по п. 16, где вирусный вектор выбирают из группы, состоящей из вирусного вектора ДНК, безоболочечного вирусного вектора и аденовирусного вектора.
22. Выделенная клетка, содержащая нуклеиновую кислоту по любому из пп. 1-15, где клетка секретирует белок RdCVF.
23. Фармацевтическое средство, способствующее выживаемости фоторецепторов, содержащее (i) фармацевтически приемлемый носитель и (ii) нуклеиновую кислоту по любому из пп. 1-15, вирусный вектор по любому из пп. 16-21 или их сочетание.
24. Способ сохранения палочковидных зрительных клеток в глазу млекопитающего, включающий введение в глаз млекопитающего нуклеиновой кислоты по любому из пп. 1-15, вирусного вектора по любому из пп. 16-21, фармацевтического средства по п. 23 или их сочетания в количестве, эффективном для сохранения палочковидных зрительных клеток.
25. Способ по п. 24, в котором вирусный вектор или нуклеиновую кислоту вводят посредством субретинальной инъекции.
26. Способ по п. 25, в котором вирусный вектор или нуклеиновую кислоту вводят посредством интравитреальной инъекции, инъекции в переднюю камеру глаза, подконъюктивальной инъекции или субтеноновой инъекции.
27. Способ по любому из пп. 24-26, в котором млекопитающее представляет собой человека.
28. Способ по любому из пп. 24-27, в котором млекопитающее страдает от глазного заболевания, выбранного из группы, состоящей из дистрофии сетчатки, дегенерации желтого пятна Штаргардта, пигментной дистрофии сетчатки, сухой возрастной макулярной дегенерации (сухой AMD), географической атрофии (поздней стадии сухой AMD), влажной возрастной макулярной дегенерации (влажной AMD), глаукомы/глазной гипертензии, диабетической ретинопатии, синдрома Барде-Бидля, синдрома Бессена-Корнцвейга, болезни Беста, хороидеремии, гиратной атрофии, врожденного амавроза, синдрома Рефсума, синдрома Уше, глазного заболевания, связанного со щитовидной железой, базедовой болезни, заболевания, связанного с пигментированными эпителиальными клетками сетчатки, заболевания переднего сегмента, заболевания/катаракты хрусталика, расстройства глазной чаши или увеита.
| US 2005191747 A1, 01.09.2005 | |||
| US 2011034546 A1, 10.02.2011 | |||
| ГЕМАТОПОЭТИЧЕСКИЕ СТВОЛОВЫЕ КЛЕТКИ И СПОСОБЫ ЛЕЧЕНИЯ НЕОВАСКУЛЯРНЫХ ЗАБОЛЕВАНИЙ ГЛАЗ С ИХ ПОМОЩЬЮ | 2004 |
|
RU2345780C2 |
| CHOO K.H | |||
| et al | |||
| Flanking signal and mature peptide residues influence signal peptide cleavage | |||
| BMC Bioinformatics | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2018-08-21—Публикация
2012-10-26—Подача