Включение посредством ссылки материала, предоставленного в электронной форме
[0001] Заявителем включен в данный документ посредством ссылки материал из перечня последовательностей, поданный в электронной форме с данным документом. Этот файл имеет название «16-7660PCT_Seq_Listing_ST25.txt».
Предшествующий уровень техники настоящего изобретения
[0002] Хороидеремия (СНМ) представляет собой сцепленное с Х-хромосомой наследственное заболевание сетчатки, характеризующееся дегенерацией фоторецепторов, пигментного эпителия сетчатки (RPE) и хориокапилляра. Симптомы проявляются в 1-ом или 2-ом десятилетии жизни в виде жалоб на слабое ночное зрение (никталопия) и прогрессирующей потери периферического зрения. Поле зрения сужается по мере того, как заболевание прогрессирует. Она достигает кульминации с потерей центрального зрения (остроты зрения) и слепотой уже на четвертом десятке лет жизни. Было обнаружено, что более чем 140 мутаций в гене СНМ вызывают хороидеремию. Мутации могут приводить к выработке аномально малого, нефункционального и/или нестабильного Rab-эскорт белка 1 (Rab escort protein-1) (REP-1), к снижению функции белка или потере выработки белка REP-1. Отсутствие нормального REP-1 нарушает способность белков Rab способствовать перемещению внутри клетки. Неподвижность белков и органелл внутри клетки приводит к тому, что клетки плохо функционируют и гибнут преждевременно.
[0003] Ген хороидеремии, СНМ, кодирует Rab-эскорт белок 1 (REP-1), 653-аминокислотный белок, вовлеченный в регуляцию перемещения через мембрану. Поскольку локус СНМ находится на Х-хромосоме, хороидеремия, как правило, диагностируется только у мужчин. Несмотря на то что женщины-носители заболевания обычно не имеют симптомов, обследования сетчатки часто выявляют очаговую дегенерацию сетчатки и RPE, и у индивидов женского пола могут проявляться поражения в зависимости от степени инактивации нормальной Х-хромосомы (лайонизация). Coussa, RG, Traboulsi, EI (2012) Choroideremia: a review of general findings and pathogenesis, Ophthalmic Genet 33(2):57-65, которая включена в данный документ посредством ссылки. См. также, Vasireddy et al, AAV-mediated gene therapy for choroideremia: preclinical studies in personalized models. PLoS One. 2013 May 7; 8(5):e61396, которая включена в данный документ посредством ссылки.
[0004] Ахроматопсия представляет собой гетерогенную группу аутосомно-рецессивных наследственных заболеваний сетчатки, характеризующихся ранним проявлением уменьшенной остроты зрения, нарушенным восприятием цвета или полной цветовой слепотой, нистагмом, фотоаверсией и потерей функции фоторецепторов колбочек. Приблизительно у 80% пациентов с ахроматопсией проявляются мутации в альфа- или бета-субъединице (A3 и В3) управляемого циклическими нуклеотидами катионного канала (CNG), контролируемого цГМФ, в колбочковых фоторецепторах. Подобно заболеванию у людей, у мышей с недостаточностью по Cnga3 проявляется потеря специфической для колбочек функциональности, ведущая к нарушению функционирования и дегенерации пораженных колбочковых фоторецепторов.
[0005] Таким образом, необходимыми являются композиции, применимые для экспрессии CNGA3 или CNGB3 у субъектов-людей.
Краткое раскрытие настоящего изобретения
[0006] Хороидеремия (СНМ) представляет собой сцепленную с Х-хромосомой дегенерацию сетчатки, которая проявляется симптомами в 1-ом или 2-ом десятилетии жизни, вызывая никталопию и потерю периферического зрения. Заболевание прогрессирует в среднем возрасте, когда большинство пациентов слепнут. СНМ является подходящей мишенью для дополняющей генной терапии, поскольку заболевание обусловлено потерей функции белка, необходимого для здоровья клеток сетчатки, Rab-эскорт белка 1 (REP1), который кодируется геном СНМ. кДНК СНМ может быть упакована в рекомбинантный аденоассоциированный вирус (rAAV), подтвержденный опыт применения которого имеется в исследовании генной терапии у человека. Кроме того, существуют чувствительные и количественные анализы для документального подтверждения активности REP1, в том числе его способности пренилировать белки Rab, такие как Rab27, и корректировать дефект в локализации и перемещении Rab27, обусловленный отсутствием пренилирования в клетках, имеющих недостаточность по REP-1.
[0007] В соответствии с одним аспектом предполагается оптимизированная по кодону последовательность кДНК, кодирующая Rab-эскорт белок 1 (REP-1). В соответствии с одним вариантом осуществления оптимизированная по кодону последовательность кДНК представляет собой вариант SEQ ID NO: 3. В соответствии с другим вариантом осуществления оптимизированная по кодону последовательность кДНК представляет собой SEQ ID NO: 1. В соответствии с другим вариантом осуществления последовательность кДНК является оптимизированной по кодону для экспрессии у людей.
[0008] В соответствии с другим аспектом экспрессионная кассета включает в себя оптимизированную по кодону последовательность нуклеиновой кислоты, которая кодирует REP-1. В соответствии с одним вариантом осуществления экспрессионная кассета включает в себя последовательность кДНК SEQ ID NO: 1. В соответствии с дополнительными вариантами осуществления кодирующая последовательность REP-1 располагается между последовательностями 5' и 3' ITR AAV. В соответствии с одним вариантом осуществления геном вектора включает в себя все из последовательности нуклеиновой кислоты между 5' ITR и 3' ITR и в том числе 5' ITR и 3' ITR.
[0009] В соответствии с другим вариантом осуществления предполагается вектор на основе аденоассоциированного вируса (AAV). Вектор на основе AAV включает в себя капсид AAV и последовательность нуклеиновой кислоты, содержащую последовательности инвертированных концевых повторов AAV и последовательность нуклеиновой кислоты, кодирующую человеческий Rab-эскорт белок 1 (REP-1), и последовательности для контроля экспрессии, которые управляют экспрессией REP-1 в клетке-хозяине. В соответствии с одним вариантом осуществления последовательность REP-1 кодирует полноразмерный белок REP-1. В соответствии с одним вариантом осуществления последовательность REP-1 представляет собой последовательность белка SEQ ID NO: 2.
[00010] В соответствии с одним аспектом предполагается оптимизированная по кодону последовательность кДНК, кодирующая управляемый циклическими нуклеотидами канал альфа 3 (CNGA3). В соответствии с одним вариантом осуществления оптимизированная по кодону последовательность кДНК представляет собой вариант SEQ ID NO: 13 или SEQ ID NO: 15. В соответствии с другим вариантом осуществления оптимизированная по кодону последовательность кДНК представляет собой SEQ ID NO: 9 или SEQ ID NO: 11. В соответствии с другим вариантом осуществления последовательность кДНК является оптимизированной по кодону для экспрессии у людей.
[00011] В соответствии с другим аспектом экспрессионная кассета включает в себя оптимизированную по кодону последовательность нуклеиновой кислоты, которая кодирует управляемый циклическими нуклеотидами канал альфа 3 (CNGA3). В соответствии с одним вариантом осуществления экспрессионная кассета включает в себя последовательность кДНК SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13 или SEQ ID NO: 15. В соответствии с дополнительными вариантами осуществления кодирующая последовательность CNGA3 располагается между последовательностями 5' и 3' ITR AAV.
[00012] В соответствии с другим аспектом экспрессионная кассета включает в себя оптимизированную по кодону последовательность нуклеиновой кислоты, которая кодирует управляемый циклическими нуклеотидами канал альфа 3 (CNGB3). В соответствии с одним вариантом осуществления экспрессионная кассета включает в себя последовательность кДНК SEQ ID NO: 19, или SEQ ID NO: 21, или SEQ ID NO: 23. В соответствии с дополнительными вариантами осуществления кодирующая последовательность CNGB3 располагается между последовательностями 5' и 3' ITR AAV.
[00013] В соответствии с другим вариантом осуществления предполагается вектор на основе аденоассоциированного вируса (AAV). Вектор на основе AAV включает в себя капсид AAV и последовательность нуклеиновой кислоты, содержащую последовательности инвертированных концевых повторов AAV и последовательность нуклеиновой кислоты, кодирующую человеческий CNGA3, и последовательности для контроля экспрессии, которые управляют экспрессией CNGA3 в клетке-хозяине. В соответствии с одним вариантом осуществления последовательность CNGA3 кодирует полноразмерный белок CNGA3. В соответствии с одним вариантом осуществления последовательность CNGA3 представляет собой последовательность белка SEQ ID NO: 10, SEQ ID NO: 12 или SEQ ID NO: 14.
[00014] В соответствии с другим вариантом осуществления предполагается вектор на основе аденоассоциированного вируса (AAV). Вектор на основе AAV включает в себя капсид AAV и последовательность нуклеиновой кислоты, содержащую последовательности инвертированных концевых повторов AAV и последовательность нуклеиновой кислоты, кодирующую человеческий CNGB3, и последовательности для контроля экспрессии, которые управляют экспрессией CNGB3 в клетке-хозяине. В соответствии с одним вариантом осуществления последовательность CNGB3 кодирует полноразмерный белок CNGB3. В соответствии с одним вариантом осуществления последовательность CNGB3 представляет собой последовательность белка SEQ ID NO: 20.
[00015] В соответствии с еще одним аспектом предполагается вектор на основе аденоассоциированного вируса (AAV), который содержит капсид AAV8 и экспрессионную кассету, причем указанная экспрессионная кассета содержит последовательности нуклеиновой кислоты, кодирующие REP-1, последовательности инвертированных концевых повторов и последовательности для контроля экспрессии, которые управляют экспрессией REP-1 в клетке-хозяине.
[00016] В соответствии с еще одним аспектом предполагается вектор на основе аденоассоциированного вируса (AAV), который содержит капсид AAV8 и экспрессионную кассету, причем указанная экспрессионная кассета содержит последовательности нуклеиновой кислоты, кодирующие CNGA3, последовательности инвертированных концевых повторов и последовательности для контроля экспрессии, которые управляют экспрессией CNGA3 в клетке-хозяине.
[00017] В соответствии с еще одним аспектом предполагается вектор на основе аденоассоциированного вируса (AAV), который содержит капсид AAV8 и экспрессионную кассету, причем указанная экспрессионная кассета содержит последовательности нуклеиновой кислоты, кодирующие CNGB3, последовательности инвертированных концевых повторов и последовательности для контроля экспрессии, которые управляют экспрессией CNGB3 в клетке-хозяине.
[00018] В соответствии с еще одним аспектом предполагается вектор на основе аденоассоциированного вируса (AAV), который содержит капсид AAV2 и экспрессионную кассету, причем указанная экспрессионная кассета содержит последовательности нуклеиновой кислоты, кодирующие REP-1, последовательности инвертированных концевых повторов и последовательности для контроля экспрессии, которые управляют экспрессией REP-1 в клетке-хозяине.
[00019] В соответствии с еще одним аспектом предполагается вектор на основе аденоассоциированного вируса (AAV), который содержит капсид AAV2 и экспрессионную кассету, причем указанная экспрессионная кассета содержит последовательности нуклеиновой кислоты, кодирующие CNGA3, последовательности инвертированных концевых повторов и последовательности для контроля экспрессии, которые управляют экспрессией CNGA3 в клетке-хозяине.
[00020] В соответствии с еще одним аспектом предполагается вектор на основе аденоассоциированного вируса (AAV), который содержит капсид AAV2 и экспрессионную кассету, причем указанная экспрессионная кассета содержит последовательности нуклеиновой кислоты, кодирующие CNGB3, последовательности инвертированных концевых повторов и последовательности для контроля экспрессии, которые управляют экспрессией CNGB3 в клетке-хозяине.
[00021] В соответствии с еще одним аспектом предполагается фармацевтическая композиция, которая включает в себя фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество и/или адъювант и по меньшей мере вирусный вектор, который описан в данном документе.
[00022] В соответствии с еще одним дополнительным аспектом фармацевтическая композиция содержит фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество и/или адъювант и последовательность нуклеиновой кислоты, плазмиду, вектор или вирусный вектор, такой как rAAV, специально описанный в данном документе.
[00023] В соответствии с еще одним аспектом предполагается способ лечения хороидеремии. В соответствии с одним вариантом осуществления способ включает в себя введение композиции, которая включает в себя вектор на основе AAV, который кодирует REP-1, как описано в данном документе, субъекту, нуждающемуся в этом.
[00024] В соответствии с еще одним аспектом предполагается способ лечения ахроматопсии. В соответствии с одним вариантом осуществления способ включает в себя введение композиции, которая включает в себя вектор на основе AAV, который кодирует CNGA3, как описано в данном документе, субъекту, нуждающемуся в этом.
[00025] В соответствии с еще одним аспектом предполагается способ лечения ахроматопсии. В соответствии с одним вариантом осуществления способ включает в себя введение композиции, которая включает в себя вектор на основе AAV, который кодирует CNGB3, как описано в данном документе, субъекту, нуждающемуся в этом.
[00026] В соответствии с еще одним аспектом предполагается плазмида для получения вектора на основе AAV. В соответствии с одним вариантом осуществления плазмида включает в себя оптимизированную по кодону последовательность кДНК, кодирующую REP-1, как описано в данном документе. В соответствии с другим вариантом осуществления плазмида включает в себя оптимизированную по кодону последовательность кДНК, кодирующую CNGA3, как описано в данном документе. В соответствии с еще одним вариантом осуществления плазмида включает в себя оптимизированную по кодону последовательность кДНК, кодирующую CNGB3, которая представляет собой последовательность, по меньшей мере на 70% идентичную SEQ ID NO: 19 или SEQ ID NO: 21. В соответствии с одним вариантом осуществления плазмида является модульной.
[00027] В соответствии с еще одним аспектом предполагается способ получения вируса rAAV. Способ включает в себя культивирование упаковывающей клетки, несущей плазмиду, которая описана в данном документе, в присутствии достаточных вирусных последовательностей для того, чтобы позволить упаковку вирусного генома с экспрессионной кассетой гена в оболочку или капсид инфекционного AAV. В соответствии с еще одним аспектом предполагается рекомбинантный AAV, полученный в соответствии с данным способом.
[00028] Другие аспекты и преимущества настоящего изобретения будут хорошо видимы из следующего подробного описания настоящего изобретения.
Краткое описание чертежей
[00029] Фиг. 1А и фиг. 1В представляют собой изображения гелей, показывающие экспрессию белка REP-1 in vitro после трансфекции культивируемых HEK клеток 84-31. Первая дорожка каждого геля показывает экспрессию оптимизированного по кодону REP-1, который описан в данном документе, экспрессирующегося с плазмиды р944. Вторая дорожка показывает экспрессию нативного REP-1 с плазмиды р742. Третья дорожка показывает эндогенную экспрессию REP-1 клетками 84-31, которые не были подвергнуты трансфекции плазмидой. Последняя дорожка представляет собой холостую пробу. Изображения гелей демонстрируют, что оптимизированная по кодону последовательность REP-1, которая описана в данном документе, приводит в результате к более высокому уровню экспрессии белка, чем нативная последовательность REP-1, и что уровни экспрессии с эндогенно трансфицированных плазмид во много раз выше, чем эндогенная экспрессия REP-1.
[00030] Фиг. 2 представляет собой результаты выравнивания нативной кодирующей последовательности REP-1 SEQ ID NO: 1 с оптимизированной по кодону кодирующей последовательностью REP-1 SEQ ID NO: 3.
[00031] Фиг. 3 представляет собой результаты выравнивания нативной кодирующей последовательности CNGA3 SEQ ID NO: 13 с оптимизированной по кодону кодирующей последовательностью CNGA3 SEQ ID NO: 9.
[00032] Фиг. 4 представляет собой результаты выравнивания ORF нативного CNGB3 (SEQ ID NO: 19) с ORF модифицированного CNGB3 (SEQ ID NO: 21) с orf модифицированного CNGB3 с модифицированными концами (SEQ ID NO: 23). Точковые мутации выделены.
[00033] Фиг. 5 представляет собой карту плазмиды р584, описанной в данном документе. Последовательность р584 показана в виде SEQ ID NO: 7.
[00034] Фиг. 6 представляет собой карту плазмиды AAV.hCHMco.вариант 2а, описанной в данном документе. Последовательность варианта 2а показана в виде SEQ ID NO: 25.
[00035] Фиг. 7 представляет собой карту плазмиды AAV.hCHMco.вариант 2b, описанной в данном документе. Последовательность варианта 2b показана в виде SEQ ID NO: 26.
[00036] Фиг. 8 представляет собой карту плазмиды AAV.hCHMco.вариант 3а, описанной в данном документе. Последовательность варианта 3а показана в виде SEQ ID NO: 27.
[00037] Фиг. 9 представляет собой карту плазмиды AAV.hCHMco.вариант 3b, описанной в данном документе. Последовательность варианта 3b показана в виде SEQ ID NO: 28.
[00038] Фиг. 10 представляет собой карту плазмиды AAV.hCHM. вариант 1, описанной в данном документе. Последовательность варианта 1 показана в виде SEQ ID NO: 29.
[00039] Фиг. 11 представляет собой графическое отображение воздействия лямбда-вставки на загрязненность продукта на основе AAV. Все а-варианты векторов (содержащие лямбда-спейсер) характеризуются значительно сниженными сигналами Kan+ из теста qPCR.
[00040] Фиг. 12А представляет собой результат Вестерн-блоттинга, показывающий выявление с помощью антитела к человеческому REP-1 белка с молекулярной массой ~75-80 кДа в тканях глаза у CD-1 мышей, которым вводили инъекцией вектор AAV8.2b в количестве 5Е9 копий генома вектора (высокая доза). У животных, которым вводили инъекцией AAV8.2b в количестве 5Е8 (низкая доза), проявлялась очень бледная полоска, соответствующая белку с молекулярной массой ~75-80 кДа. Фиг. 12В представляет собой результаты анализа методом Вестерн-блоттинга тканей глаза у CD1 мышей (2 мыши/группа), которым вводили инъекцией AAV8.3b, при выявлении с использованием антитела к REP-1, где было выявлено присутствие белка с молекулярной массой ~75-80 кДа в одном глазу, в который вводили инъекцией низкую дозу AAV8.3b, и в обоих глазах, в которые вводили инъекцией высокую дозу AAV8.3b. В тканях глаза у мышей, которые не получали инъекции, не была выявлена экспрессия REP-1.
Подробное раскрытие настоящего изобретения
[00041] Способы и композиции, описанные в данном документе, включают композиции и способы для доставки оптимизированного СНМ, кодирующего REP-1, субъектам-млекопитающим для лечения офтальмологических нарушений, преимущественно, заболеваний, вызывающих слепоту, таких как хороидеремия. Кроме того, способы и композиции, описанные в данном документе, включают композиции и способы для доставки оптимизированных CNGA3 или CNGB3 субъектам-млекопитающим для лечения офтальмологических нарушений, преимущественно, заболеваний, вызывающих слепоту, таких как ахроматопсия. В соответствии с одним вариантом осуществления такие композиции включают оптимизацию по кодону кодирующей последовательности REP-1, CNGA3 или CNGB3. Полагают, что эти признаки повышают эффективность продукта и повышают безопасность, поскольку применяется более низкая доза реактива. Ожидается, что эта оптимизация кассеты с трансгеном теоретически может максимально повышать уровень продукции экспериментального белка по сравнению с уровнями, которые могут быть получены с применением эндогенной последовательности. Тем не менее, в данном документе также охватываются композиции, которые включают в себя нативные кодирующие последовательности REP1, CNGA3 и CNGB3, которые приведены в виде SEQ ID NO: 3, SEQ ID NO: 13 и SEQ ID NO: 19, соответственно. Следует понимать, что в случае, когда описан вариант осуществления для любого из REP-1, CNGA3 или CNGB3, предполагается, что подобный вариант осуществления описывается для других случаев.
[00042] Технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понятно квалифицированному специалисту в области техники, к которой относится настоящее изобретение, и ссылаются на опубликованные тексты, которые дают квалифицированному специалисту в данной области техники общее определение многих из терминов, используемых в данной заявке. Определения, содержащиеся в этой заявке, представлены для ясности при описании компонентов и композиций в данном документе и не предназначены для ограничения заявленного варианта осуществления.
[00043] Ген хороидеремии, СНМ, кодирует Rab-эскорт белок 1 (REP-1), 653-аминокислотный белок, который, как полагают, вовлечен в перемещение через мембрану. В контексте данного документа термины «REP-1» и «СНМ» используются взаимозаменяемо применительно к кодирующей последовательности. Поскольку локус СНМ находится на Х-хромосоме, хороидеремия, как правило, диагностируется только у мужчин. Несмотря на то что женщины-носители заболевания обычно не имеют симптомов, обследования сетчатки часто выявляют очаговую дегенерацию сетчатки и RPE, и у индивидов женского пола могут проявляться поражения в зависимости от степени инактивации нормальной Х-хромосомы (лайонизация). См., Coussa, цитируемую выше. Нативная аминокислотная последовательность, кодирующая человеческий REP-1, описана в GenBank под номером доступа Р24386 и воспроизведена в данном документе в SEQ ID NO: 2. Нативная последовательность нуклеиновой кислоты человеческого СНМ воспроизведена в данном документе в SEQ ID NO: 3 (номер доступа NM_000390.2).
[00044] Управляемые циклическими нуклеотидами (CNG) ионные каналы являются ключевыми медиаторами, лежащими в основе передачи сигнала в рецепторах сетчатки и обонятельных рецепторах. Известно, что генетические дефекты в CNGA3 и CNGB3, кодирующих две структурно родственные субъединицы CNG каналов в колбочках, приводят к ахроматопсии. CNGA3 представляет собой 694-аминокислотный белок. CNGB представляет собой 809-аминокислотный белок.
[00045] Ахроматопсия представляет собой неоднородную группу врожденных аутосомно-рецессивных нарушений сетчатки, которые проявляются в виде раннего начала дисфункции фоторецепторов колбочек, сильно сниженной остроты зрения, нарушенного восприятия цвета или полной цветовой слепоты и светобоязни. Нативная последовательность нуклеиновой кислоты, кодирующей человеческий CNGA3, описана в GenBank под номером доступа ХМ_011210554.1 и воспроизведена в SEQ ID NO: 13. Нативная последовательность нуклеиновой кислоты, кодирующей человеческий CNGA3, описана в GenBank под номером доступа ХМ_011210554.1 и воспроизведена в SEQ ID NO: 13. Нативная последовательность нуклеиновой кислоты для варианта X1 человеческого CNGA3, который включает в себя дополнительный экзон, описана в GenBank под номером доступа NM_001298.2 и воспроизведена в SEQ ID NO: 15. Нативная последовательность нуклеиновой кислоты, кодирующая человеческий CNGB3, воспроизведена в SEQ ID NO: 19.
[00046] В соответствии с определенными вариантами осуществления настоящего изобретения субъект имеет «офтальмологическое нарушение», для лечения которого предназначены компоненты, композиции и способы согласно настоящему изобретению. В контексте данного документа термин «субъект», используемый в данном документе, означает животное-млекопитающее, в том числе человека, животное-пациента ветеринара или сельскохозяйственное животное, домашнее животное или домашнего любимца и животных, которых обычно применяют в клинических исследованиях. В соответствии с одним вариантом осуществления субъект, на которого воздействуют этими способами и который получает эти композиции, представляет собой человека. Другие подходящие субъекты включают в себя, без ограничения, мышь, крысу, собаку, кошку, свинью, корову, овцу, отличного от человека примата и других. В контексте данного документа термин «субъект» используется взаимозаменяемо с «пациентом».
[00047] В контексте данного документа «офтальмологическое нарушение» включает в себя, палочко-колбочковые дистрофии и заболевания сетчатки, в том числе, без ограничения, болезнь Штаргардта (аутосомно-доминантную или аутосомно-рецессивную), пигментный ретинит и узорчатую дистрофию. В соответствии с одним вариантом осуществления субъект имеет ахроматопсию. В соответствии с другим вариантом осуществления субъект имеет хороидеремию или сцепленную с Х-хромосомой наследственную дегенерацию сетчатки. Клинические проявления таких заболеваний глаза включают в себя, без ограничения, ослабленное периферическое зрение, ослабленное центральное (используемое для чтения) зрение, ослабленное ночное зрение, потерю восприятия цвета, снижение остроты зрения, пониженную функцию фоторецепторов, изменения пигмента и, в конечном счете, слепоту.
[00048] В контексте данного документа термин «лечение» или «осуществление лечения» определен как включающий введение субъекту одного или нескольких соединений или композиций, описанных в данном документе, с целью снижения интенсивности одного или нескольких симптомов заболевания глаза. Следовательно, «лечение» может включать в себя одно или несколько из уменьшения появления или прогрессирования заболевания глаза, предупреждения заболевания, снижения тяжести симптомов заболевания или замедления их прогрессирования, в том числе прогрессирования слепоты, устранения симптомов заболевания, задержки появления заболевания или мониторинга прогрессирования заболевания или эффективности терапии у заданного субъекта.
[00049] Термин «экзогенный», используемый для описания последовательности нуклеиновой кислоты или белка, означает, что нуклеиновая кислота или белок не встречается в естественных условиях в положении, в котором он присутствует на хромосоме или в клетке-хозяине. Экзогенная последовательность нуклеиновой кислоты также относится к последовательности, полученной из той же клетки-хозяина или субъекта и вставленной в ту же клетку-хозяина или субъекта, но которая присутствует в состоянии, не являющемся естественным, например, в виде отличающегося числа копий или под контролем отличающихся регуляторных элементов.
[00050] Термин «гетерологичный», используемый для описания последовательности нуклеиновой кислоты или белка, означает, что нуклеиновая кислота или белок были получены из отличающегося организма или из вида, отличающегося от вида организма, к которому относится клетка-хозяин или субъект, в котором они экспрессируются. Термин «гетерологичный» при использовании применительно к белку или нуклеиновой кислоте в плазмиде, экспрессионной кассете или векторе указывает, что белок или нуклеиновая кислота присутствуют с другой последовательностью или подпоследовательностью, с которой обсуждаемые белок или нуклеиновая кислота не обнаруживаются в такой же взаимосвязи в естественных условиях.
[00051] Термины «процентная (%) идентичность», «идентичность последовательности», «процентная идентичность последовательности» или «идентичный в процентах» в контексте последовательностей нуклеиновой кислоты относятся к основаниям в двух последовательностях, которые являются одинаковыми при выравнивании для достижения соответствия. Процентную идентичность определяют посредством сравнения двух последовательностей, выравниваемых в оптимальных условиях по всей длине последовательностей, подлежащих сравнению. Длина сравниваемого участка для определения идентичности последовательности может представлять собой полную длину кодирующей последовательности REP-1, CNGA3 или CNGB3, или фрагмент из по меньшей мере приблизительно 100-150 нуклеотидов, или желаемую длину. Тем не менее, также может быть желательной идентичность у меньших фрагментов, например, из по меньшей мере приблизительно девяти нуклеотидов, обычно по меньшей мере приблизительно 20-24 нуклеотидов, по меньшей мере приблизительно 28-32 нуклеотидов, по меньшей мере приблизительно 36 или более нуклеотидов. Программы для множественного выравнивания последовательностей также являются доступными для последовательностей нуклеиновой кислоты. Примеры таких программ включают в себя «Clustal W», «САР Sequence Assembly», «BLAST», «МАР» и «МЕМЕ», которые являются доступными через веб-серверы в сети Интернет. Другие источники таких программ являются известными специалистам в данной области техники. В качестве альтернативы, также можно применять утилиты Vector NTI. В уровне техники также известен ряд алгоритмов, которые можно применять для измерения идентичности нуклеотидных последовательностей, в том числе алгоритмы, содержащиеся в программах, описанных выше. В качестве другого примера, полинуклеотидные последовательности можно сравнить с применением Fasta™, программы в пакете GCG версии 6.1. Также можно применять общедоступное программное обеспечение для анализа последовательности, более конкретно, BLAST, или инструменты для анализа, обеспечиваемые общедоступными базами данных.
[00052] Термин «выделенный» означает, что материал удален из своего исходного окружения (например, естественное окружение, если он встречается в естественных условиях). Например, встречающийся в естественных условиях полинуклеотид или полипептид, присутствующий в живом животном, не является выделенным, но тот же полинуклеотид или полипептид, отделенный от некоторых или всех из сопутствующих материалов в природной системе, является выделенным, даже если его затем повторно вводят в природную систему. Такие полинуклеотиды могут представлять собой часть вектора, и/или такие полинуклеотиды или полипептиды могут представлять собой часть композиции и при этом быть выделенными, поскольку такой вектор или композиция не являются частью их естественного окружения.
[00053] Под термином «подвергнутый воздействию методов генной инженерии» подразумевают, что последовательности нуклеиновой кислоты, кодирующие белок REP-1, или CNGA3, или CNGB3, описанный в данном документе, собирают и помещают в любой подходящий генетический элемент, например, депротеинизированную ДНК, фаг, транспозон, космиду, эписому и т.д.., который переносит последовательности REP-1, или CNGA3, или CNGB3, которые он несет, в клетку-хозяин, например, для создания невирусных систем доставки (например, систем на основе РНК, депротеинизированной ДНК или подобного), или для создания вирусных векторов в упаковывающую клетку-хозяин, и/или для доставки клеток-хозяев субъекту. В соответствии с одним вариантом осуществления генетический элемент представляет собой плазмиду. Способы, применяемые для создания таких полученных методами генной инженерии конструкций, являются известными специалистам в области манипуляции с нуклеиновой кислотой и включают в себя генную инженерию, инженерию с использованием технологии рекомбинантной ДНК и методики синтеза. См., например, Green and Sambrook, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, NY (2012).
[00054] Термин «трансген», который используется в данном документе, означает экзогенную или полученную методами генной инженерии кодирующую белок последовательность нуклеиновой кислоты, которая находится под контролем промотора или последовательностей для контроля экспрессии в экспрессионной кассете, геноме rAAV, рекомбинантной плазмиде или плазмиде для продуцирования, векторе или клетке-хозяине, описанных в данном описании. В соответствии с определенными вариантами осуществления трансген представляет собой последовательность человеческого СНМ (REP-1), кодирующую функциональный белок REP-1. В соответствии с некоторыми вариантами осуществления трансген представляет собой оптимизированную по кодону нуклеиновую кислоту СНМ (REP-1), кодирующую аминокислотную последовательность REP-1, изложенную в SEQ ID NO: 2. В соответствии с определенными вариантами осуществления трансген кодируется последовательностью, изложенной в SEQ ID NO: 1. В соответствии с определенными вариантами осуществления трансген REP-1 кодируется последовательностью, изложенной в SEQ ID NO: 5. SEQ ID NO: 5 включает в себя модифицированные концы, которые включают в себя сайты рестрикции для клонирования в плазмиду, такую как плазмида для продуцирования, описанная в данном документе.
[00055] В соответствии с определенными вариантами осуществления трансген представляет собой последовательность человеческого CNGA3, кодирующую функциональный белок CNGA3. В соответствии с определенными вариантами осуществления трансген представляет собой оптимизированную по кодону кодирующую последовательность CNGA3 SEQ ID NO: 10. В соответствии с определенными вариантами осуществления трансген кодируется последовательностью, изложенной в SEQ ID NO: 9. В соответствии с одним вариантом осуществления трансген включает в себя модифицированные концы, такие как показанные в SEQ ID NO: 16, SEQ ID NO 17 или SEQ ID NO: 18, которые включают в себя сайты рестрикции для клонирования в плазмиду, такую как плазмида, описанная в данном документе. В соответствии с определенными вариантами осуществления трансген представляет собой оптимизированную по кодону кодирующую последовательность CNGA3 SEQ ID NO: 12. В соответствии с определенными вариантами осуществления трансген кодируется последовательностью, изложенной в SEQ ID NO: 11. В соответствии с определенными вариантами осуществления трансген кодируется нативной кодирующей последовательностью CNGA3, которая изложена в SEQ ID NO: 13.
[00056] В соответствии с определенными вариантами осуществления трансген представляет собой последовательность человеческого CNGB3, кодирующую функциональный белок CNGB3. В соответствии с определенными вариантами осуществления трансген представляет собой оптимизированную по кодону кодирующую последовательность CNGB3, которая представляет собой последовательность, по меньшей мере на 70% идентичную SEQ ID NO: 19 или 21. В соответствии с определенными вариантами осуществления трансген кодируется последовательностью, изложенной в SEQ ID NO: 23. SEQ ID NO: 23 включает в себя модифицированные концы, которые включают в себя сайты рестрикции для клонирования в плазмиду, такую как плазмида для продуцирования, описанная в данном документе. Нуклеотиды с 13 по 2448 в SEQ ID NO: 23 обеспечивают ORF для CNGB3. В соответствии с определенными вариантами осуществления трансген представляет собой оптимизированную по кодону кодирующую последовательность CNGB3 SEQ ID NO: 20. В соответствии с определенными вариантами осуществления трансген кодируется последовательностью, изложенной в SEQ ID NO: 19. В соответствии с определенными вариантами осуществления трансген кодируется последовательностью, изложенной в SEQ ID NO: 21. В соответствии с определенными вариантами осуществления трансген включает в себя модифицированные концы для клонирования в плазмиду, такую как плазмиды, описанные в данном документе. SEQ ID NO: 21 представляет собой новую последовательность кДНК, в которой определенные «молчащие» мутации были выполнены в нативной кодирующей последовательности. Настоящим изобретением предполагаются дополнительные модификации в нативной последовательности, которые описаны в данном документе.
[00057] В соответствии с одним вариантом осуществления последовательность нуклеиновой кислоты, кодирующая REP-1, CNGA или CNGB, дополнительно содержит нуклеиновую кислоту, кодирующую полипептидную метку, ковалентно связанную с ней. Полипептидная метка может быть выбрана из известных «эпитопных меток», включающих в себя, без ограничения, полипептидную метку в виде туе, полипептидную метку в виде глутатион-S-трансферазы, полипептидную метку в виде зеленого флуоресцентного белка, полипептидную метку в виде myc-пируват-киназы, His6-полипептидную метку, полипептидную метку в виде гемагглютинина вируса гриппа, flag-полипептидную метку и полипептидную метку в виде мальтоза-связывающего белка.
[00058] В контексте данного документа «вектор» представляет собой молекулу нуклеиновой кислоты, в которую может быть введен трансген экзогенной, или гетерологичной, или полученной методами генной инженерии нуклеиновой кислоты, который может быть встроен в соответствующую клетку-хозяин. Векторы предпочтительно имеют одну или несколько точек начала репликации и один или несколько сайтов, в которые может быть введена рекомбинантная ДНК. Векторы часто имеют удобные средства, с помощью которых клетки с векторами могут быть отделены от клеток без векторов, например, они кодируют гены устойчивости к лекарственным средствам. Общепринятые векторы включают в себя плазмиды, вирусные геномы и (преимущественно у дрожжей и бактерий) «искусственные хромосомы». Определенные плазмиды описаны в данном документе.
[00059] «Вирусные векторы» определены как вирусы с дефектной репликацией, содержащие трансген(трансгены) экзогенной или гетерологичной нуклеиновой кислоты СНМ (REP-1), или CNGA3, или CNGB3. В соответствии с одним вариантом осуществления экспрессионная кассета, которая описана в данном документе, может быть встроена с помощью методов генной инженерии в плазмиду, которую применяют для доставки лекарственного средства или для продуцирования вирусного вектора. Подходящие вирусные векторы предпочтительно имеют дефектную репликацию и являются выбранными из числа векторов, которые целенаправленно воздействуют на клетки глаза Вирусные векторы могут включать в себя любой вирус, подходящий для генной терапии, в том числе, без ограничения, аденовирус; вирус герпеса; лентивирус; ретровирус; парвовирус и т.д. Тем не менее, из соображений упрощения восприятия аденоассоциированный вирус упоминается в данном документе в качестве иллюстративного вирусного вектора.
[00060] «Вирус с дефектной репликацией» или «вирусный вектор» относится к синтетической или рекомбинантной вирусной частице, в которой экспрессионная кассета, содержащая представляющий интерес ген, упакована в вирусный капсид или оболочку, при этом любые вирусные геномные последовательности, которые также являются упакованными в вирусный капсид или оболочку, имеют дефектную репликацию; т.е. они не могут образовывать вирионы-потомки, но сохраняют способность к инфицированию клеток-мишеней. В соответствии с одним вариантом осуществления геном вирусного вектора не включает в себя гены, кодирующие ферменты, требующиеся для репликации (геном может быть подвергнут воздействию методов генной инженерии с целью сделать его «неактивным» - содержащим только представляющий интерес трансген, фланкированный сигналами, требующимися для увеличения числа копий и упаковки искусственного генома), но эти гены могут обеспечиваться во время продуцирования. Таким образом, он считается безопасным для применения в генной терапии, поскольку репликация и инфицирование вирионами-потомками не могут происходить, за исключением условий наличия вирусного фермента, требующегося для репликации.
[00061] В соответствии с еще одним вариантом осуществления экспрессионная кассета, в том числе любая из описанных в данном документе, используется для создания генома рекомбинантного AAV.
[00062] В контексте данного документа термин «клетка-хозяин» может относиться к упаковывающей клеточной линии, в которой рекомбинантный AAV продуцируется с плазмиды для продуцирования. В качестве альтернативы, термин «клетка-хозяин» может относиться к любой клетке-мишени, в которой экспрессия трансгена является желательной. Таким образом, «клетка-хозяин» относится к прокариотической или эукариотической клетке, которая содержит экзогенную или гетерологичную ДНК, которая была введена в клетку с помощью любых средств, например, электропорации, осаждения с фосфатом кальция, микроинъекции, трансформации, вирусной инфекции, трансфекции, доставки в липосоме, методик слияния мембран, бомбардировки высокоскоростными частицами, покрытыми ДНК, вирусной инфекции и слияния протопластов.
[00063] В соответствии с определенными вариантами осуществления в данном документе термин «клетка-хозяин» относится к культурам клеток глаза различных видов млекопитающих для in vitro оценки композиций, описанных в данном документе. В соответствии с другими вариантами осуществления в данном документе термин «клетка-хозяин» относится к клеткам, используемым для получения и упаковки вирусного вектора или рекомбинантного вируса. Кроме того, в соответствии с другими вариантами осуществления предполагается, что термин «клетка-хозяин» относится к клеткам глаза субъекта, получающего in vivo лечение заболевания глаза.
[00064] В контексте данного документа термин «клетки глаза» относится к любой клетке в глазу или связанной с функционированием глаза. Термин может относиться к любой из фоторецепторных клеток, в том числе фоторецепторы-палочки, фоторецепторы-колбочки и светочувствительные ганглионарные клетки, клетки пигментного эпителия сетчатки (RPE), клетки Мюллера, клетки сосудистой оболочки глаза, биполярные клетки, горизонтальные клетки и амакриновые клетки. В соответствии с одним вариантом осуществления клетки глаза представляют собой фоторецепторные клетки. В соответствии с другим вариантом осуществления клетки глаза представляют собой клетки RPE.
[00065] «Плазмиды» обычно обозначаются в данном документе строчной буквой р, которая предшествует и/или за которой следуют заглавные буквы и/или числа, в соответствии со стандартными соглашениями о наименовании, с которыми знакомы специалисты в данной области техники. Многие плазмиды и другие векторы клонирования и экспрессии, которые можно применять в соответствии с настоящим изобретением, являются хорошо известными и легко доступными специалистам в данной области техники. Более того, специалисты в данной области техники легко смогут сконструировать любое количество других плазмид, подходящих для применения в настоящем изобретении. Свойства, конструирование и применение таких плазмид, а также других векторов в настоящем изобретении будут легко понятны специалистам в данной области техники из настоящего раскрытия.
[00066] В контексте данного документа термин «последовательность для контроля транскрипции» или «последовательность для контроля экспрессии» относится к последовательностям ДНК, таким как инициаторные последовательности, энхансерные последовательности и промоторные последовательности, которые индуцируют, подавляют или иным образом контролируют транскрипцию кодирующих белок последовательностей нуклеиновой кислоты, с которыми они функционально связаны.
[00067] В контексте данного документа термин «функционально связанный» или «функционально ассоциированный» относится как к последовательностям для контроля экспрессии, которые являются смежными с последовательностью нуклеиновой кислоты, кодирующей REP-1 или CNGA3, так и/или последовательностям для контроля экспрессии, которые действуют удаленно или на расстоянии, контролируя их транскрипцию и экспрессию.
[00068] Термин «AAV» или «серотип AAV» в контексте данного документа относится к множеству встречающихся в естественных условиях и доступных аденоассоциированных вирусов, а также к искусственным AAV. Среди AAV, выделенных или полученных методами генной инженерии из человека или отличных человека приматов (NHP) и хорошо охарактеризованных, человеческий AAV2 представляет собой первый AAV, который был разработан в качестве вектора для переноса генов; он широко применялся в экспериментах для эффективного переноса генов в различных тканях-мишенях и животных моделях. Если не определено иное, капсид AAV, ITR и другие выбранные компоненты AAV, описанные в данном документе, могут быть легко выбраны из любого AAV, в том числе, без ограничения, AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV8bp, AAV7M8 и AAVAnc80, вариантов любого из известных или упомянутых AAV или AAV, которые будут открыты, или их варианты или смеси. См., например, международную заявку WO 2005/033321, которая включена в данный документ посредством ссылки. В соответствии с другим вариантом осуществления капсид AAV представляет собой капсид AAV8bp, мишенью которого являются преимущественно биполярные клетки. См. международную заявку WO 2014/024282, которая включена в данный документ посредством ссылки. В соответствии с другим вариантом осуществления капсид AAV представляет собой капсид AAV7m8, который показал преимущественную доставку в наружный слой сетчатки. См. Dalkara et al, In Vivo-Directed Evolution of a New Adeno-Associated Virus for Therapeutic Outer Retinal Gene Delivery from the Vitreous, Sci Transl Med 5, 189ra76 (2013), которая включена в данный документ посредством ссылки. В соответствии с одним вариантом осуществления капсид AAV представляет собой капсид AAV8. В соответствии с другим вариантом осуществления капсид AAV представляет собой капсид AAV9. В соответствии с другим вариантом осуществления капсид AAV представляет собой капсид AAV5. В соответствии с другим вариантом осуществления капсид AAV представляет собой капсид AAV2.
[00069] В контексте данного документа применительно к AAV термин «вариант» означает любую последовательность AAV, которая получена из известной последовательности AAV, в том числе последовательности, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или более идентичные по аминокислотной последовательности или нуклеотидной последовательности. В соответствии с другим вариантом осуществления капсид AAV включает в себя варианты, которые могут включать изменение до приблизительно 10% от любой описанной или известной последовательности капсида AAV. То есть капсид AAV характеризуется идентичностью от приблизительно 90% до приблизительно 99,9%, от приблизительно 95% до приблизительно 99% или от приблизительно 97% до приблизительно 98% с капсидом AAV, представленным в данном документе и/или известным в уровне техники. В соответствии с одним вариантом осуществления капсид AAV является по меньшей мере на 95% идентичным капсиду AAV. При определении процентной идентичности капсида AAV сравнение может быть выполнено с любым из вариабельных белков (например, vp1, vp2 или vp3). В соответствии с одним вариантом осуществления капсид AAV по меньшей мере на 95% идентичен AAV8 vp3. В соответствии с другим вариантом осуществления применяют самокомплементарный AAV.
[00070] ITR или другие компоненты AAV могут быть легко выделены из AAV или получены методами генной инженерии с применением методик, доступных специалистам в данной области техники. Такие AAV могут быть выделены, получены методами генной инженерии или получены из научных, коммерческих или общедоступных источников (например, Американской коллекции типовых культур, Манассас, Виргиния, США). В качестве альтернативы, последовательности AAV могут быть сконструированы посредством синтеза или других подходящих средств, исходя из опубликованных последовательностей, как например, доступных в литературе или в базах данных, таких как, например, GenBank, PubMed, или подобные. Вирусы AAV могут быть сконструированы с помощью общепринятых методик молекулярной биологии, обеспечивающих возможность оптимизации этих частиц для специфической по отношению к клетке доставки последовательностей нуклеиновой кислоты, для сведения к минимуму иммуногенности, для настройки стабильности и времени существования частицы, для эффективного распада, для точной доставки в ядро и т.д.
[00071] В контексте данного документа «искусственный AAV» означает, без ограничения, AAV с белком капсида, который не встречается в естественных условиях. Такой искусственный капсид может быть получен с помощью любой подходящей методики с применением выбранной последовательности AAV (например, фрагмента белка капсида vp1) в комбинации с гетерологичными последовательностями, которые могут быть получены из отличающегося выбранного AAV, несмежных частей того же AAV, из источника, не относящегося к вирусу AAV, или из источника, не относящегося к вирусам. Искусственный AAV может представлять собой, без ограничения, псевдотипированный AAV, химерный капсид AAV, рекомбинантный капсид AAV или «гуманизированный» капсид AAV. Псевдотипированные векторы, в которых капсид одного AAV заменен на гетерологичный белок капсида, являются применимыми в настоящем изобретении. В соответствии с одним вариантом осуществления AAV2/5 и AAV2/8 представляют собой иллюстративные псевдотипированные векторы.
[00072] «Самокомплементарный AAV» относится к плазмиде или вектору, имеющему экспрессионную кассету, в которой кодирующий участок, переносимый последовательностью нуклеиновой кислоты рекомбинантного AAV, был сконструирован для образования внутримолекулярной двухнитевой ДНК-матрицы. При инфицировании, вместо ожидания опосредуемого клеткой синтеза второй нити, две комплементарные половины scAAV будут ассоциировать с образованием одной единицы двухнитевой ДНК (dsDNA), которая готова для немедленной репликации и транскрипции. См., например, DM McCarty et al, "Self-complementary recombinant adeno-associated virus (scAAV) vectors promote efficient transduction independently of DNA synthesis", Gene Therapy, (August 2001), Vol 8, Number 16, Pages 1248-1254. Самокомплементарные AAV описаны, например, в патентах США №№6596535; 7125717 и 7456683, каждый из которых включен в данный документ посредством ссылки во всей своей полноте.
[00073] Под термином «введение», используемым в контексте способов, подразумевается доставка композиции в выбранную клетку-мишень, которая характеризуется заболеванием глаза. В соответствии с одним вариантом осуществления способ включает доставку композиции посредством субретинальной инъекции в RPE, фоторецепторные клетки или другие клетки глаза. В соответствии с другим вариантом осуществления используют интравитреальную инъекцию в клетки глаза. В еще одном способе может использоваться инъекция в глазные клетки через вену века. Дополнительные способы введения могут быть выбраны специалистом в данной области техники с учетом настоящего раскрытия. Под «введением» или «путем введения» понимают доставку субъекту композиции, описанной в данном документе, с фармацевтическим носителем или вспомогательным веществом или без него. Пути введения можно комбинировать, если это является желательным. В соответствии с некоторыми вариантами осуществления введение периодически повторяют. Фармацевтические композиции, описанные в данном документе, предназначены для доставки субъектам, нуждающимся в этом, посредством любого подходящего пути или комбинации различных путей. Непосредственная доставка в глаз (необязательно, посредством глазной доставки, субретинальной инъекции, интраретинальной инъекции, интравитреальной, местной) или доставка через системные пути, например, внутриартериальная, внутриглазная, внутривенная, внутримышечная, подкожная, интрадермальная и другие парентеральные пути введения. Молекулы нуклеиновой кислоты и/или векторы, описанные в данном документе, могут быть доставлены в одной композиции или нескольких композициях. Необязательно, могут быть доставлены два или более различных AAV или несколько вирусов [см., например, международные заявки WO20 2011/126808 и WO 2013/049493]. В соответствии с другим вариантом осуществления несколько вирусов могут содержать различные вирусы с дефектной репликацией {например, AAV и аденовирус) отдельно или в комбинации с белками.
[00074] Определенные композиции, описанные в данном документе, представляют собой выделенные, или полученные методами синтеза, или полученные методами генной инженерии с использованием технологии рекомбинантной ДНК последовательности нуклеиновой кислоты, которые обеспечивают новые оптимизированные по кодону последовательности, кодирующие REP-1, или CNGA3, или CNGB3. В соответствии с одним вариантом осуществления предполагается выделенная или полученная методами генной инженерии оптимизированная по кодону последовательность нуклеиновой кислоты, кодирующая человеческий REP-1. В соответствии с одним вариантом осуществления оптимизированная по кодону последовательность представляет собой SEQ ID NO: 1. В соответствии с другим вариантом осуществления оптимизированная по кодону последовательность включает в себя N-концевой и С-концевой сайты рестрикции для клонирования. В соответствии с одним вариантом осуществления, таким как раскрытый в SEQ ID NO: 5, кодирующая последовательность REP-1 включает в себя N-концевой сайт рестрикции NotI и С-концевой сайт рестрикции BamHI дополнительно к консенсусной последовательностью Козак. Кроме того, оптимизированная по кодону последовательность в соответствии с некоторыми вариантами осуществления включает в себя один или несколько дополнительных сайтов рестрикции для обеспечения возможности добавления маркеров, таких как эпитопная метка. При выравнивании с нативной последовательностью нуклеиновой кислоты оптимизированный по кодону REP-1 может характеризоваться процентной идентичностью, составляющей по меньшей мере 50%, или по меньшей мере 60%, или по меньшей мере 70%, или по меньшей мере 80%, или по меньшей мере 90%, в том числе любое целое число в любом из этих диапазонов. В соответствии с одним вариантом осуществления оптимизированный по кодону REP-1 характеризуется процентной идентичностью с нативной последовательностью, составляющей по меньшей мере 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%. В соответствии с одним вариантом осуществления при выравнивании с нативной последовательностью нуклеиновой кислоты SEQ ID NO: 3 выявляется, что оптимизированный по кодону REP-1 (SEQ ID NO: 1) характеризуется процентной идентичностью последовательности, составляющей только 74% (см. фиг. 2).
[00075] В соответствии с другим вариантом осуществления предполагается выделенная или полученная методами генной инженерии оптимизированная по кодону последовательность нуклеиновой кислоты, кодирующая человеческий CNGA3. В соответствии с одним вариантом осуществления оптимизированная по кодону последовательность представляет собой SEQ ID NO: 9. В соответствии с одним вариантом осуществления оптимизированная по кодону последовательность представляет собой вариант CNGA3, показанный в SEQ ID NO: 11. В соответствии с другим вариантом осуществления оптимизированная по кодону последовательность включает в себя N-концевой и С-концевой сайты рестрикции для клонирования. В соответствии с одним вариантом осуществления кодирующая последовательность CNGA3 включает в себя N-концевой сайт рестрикции NotI и С-концевой сайт рестрикции BglII дополнительно к консенсусной последовательностью Козак. Примеры последовательностей CNGA3, которые включают в себя такие модификации, можно найти в SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18. Кроме того, оптимизированная по кодону последовательность в соответствии с некоторыми вариантами осуществления включает в себя один или несколько дополнительных сайтов рестрикции для обеспечения возможности добавления маркеров, таких как эпитопная метка. При выравнивании с нативной последовательностью нуклеиновой кислоты оптимизированный по кодону CNGA3 может характеризоваться процентной идентичностью, составляющей по меньшей мере 50%, или по меньшей мере 60%, или по меньшей мере 70%, или по меньшей мере 80%, или по меньшей мере 90%, в том числе любое целое число в любом из этих диапазонов. В соответствии с одним вариантом осуществления оптимизированный по кодону CNGA3 характеризуется процентной идентичностью с нативной последовательностью, составляющей по меньшей мере 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%. В соответствии с одним вариантом осуществления при выравнивании с нативной последовательностью нуклеиновой кислоты SEQ ID NO: 13 выявляется, что оптимизированный по кодону CNGA3 (SEQ ID NO: 9) характеризуется процентной идентичностью последовательности, составляющей только 80% (см. фиг. 3).
[00076] В соответствии с другим вариантом осуществления предполагается выделенная или полученная методами генной инженерии оптимизированная по кодону последовательность нуклеиновой кислоты, кодирующая человеческий CNGB3. В соответствии с одним вариантом осуществления оптимизированная по кодону последовательность представляет собой последовательность, по меньшей мере на 70% идентичную SEQ ID NO: 19 или SEQ ID NO 21. В соответствии с другим вариантом осуществления оптимизированная по кодону последовательность включает в себя N-концевой и С-концевой сайты рестрикции для клонирования, например, как показано в SEQ ID NO: 23. Кроме того, оптимизированная по кодону последовательность в соответствии с некоторыми вариантами осуществления включает в себя один или несколько дополнительных сайтов рестрикции для обеспечения возможности добавления маркеров, таких как эпитопная метка. При выравнивании с нативной последовательностью нуклеиновой кислоты (которая показана в виде SEQ ID NO: 19) оптимизированный по кодону CNGB3 может характеризоваться процентной идентичностью, составляющей по меньшей мере 50%, или по меньшей мере 60%, или по меньшей мере 70%, или по меньшей мере 80%, или по меньшей мере 90%, в том числе любое целое число в любом из этих диапазонов. В соответствии с одним вариантом осуществления оптимизированный по кодону CNGB3 характеризуется процентной идентичностью с нативной последовательностью, составляющей по меньшей мере 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%.
[00077] В соответствии с одним вариантом осуществления, оптимизированные последовательности нуклеиновой кислоты, которые кодируют конструкции REP-1 или CNGA3, описанные в данном документе, встроены с помощью методов генной инженерии в подходящий генетический элемент, например, депротеинизированную ДНК, фаг, транспозон, космиду, молекулу РНК (например, мРНК), эписому и т.д.., который переносит последовательности REP-1 или CNGA3, переносимые на на нем в клетку-хозяин, например, для образования наночастиц, несущих ДНК или РНК, вирусных векторов в пакующей клетке-хозяине и/или для доставки в клетки-хозяева у субъекта. В соответствии с одним вариантом осуществления генетический элемент представляет собой плазмиду.
[00078] Выбранный генетический элемент может быть доставлен с помощью любого подходящего способа, в том числе трансфекции, электропорации, доставки в липосоме, методик слияния мембран, бомбардировка высокоскоростными частицами, покрытыми ДНК, вирусной инфекции и слияния протопластов. Способы, применяемые для создания таких конструкций, являются известными специалистам в области манипуляции с нуклеиновой кислотой и включают в себя генную инженерию, инженерию с использованием технологии рекомбинантной ДНК и методики синтеза. См., например, Green and Sambrook, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, NY (2012).
[00079] Обеспечивается ряд экспрессионных кассет, в которых используются SEQ ID No. 1 или 5 для экспрессии белка REP-1. В соответствии с одним вариантом осуществления пример плазмиды, содержащей такую экспрессионную кассету, показан в виде SEQ ID NO. 25. В соответствии с одним вариантом осуществления пример плазмиды, содержащей такую экспрессионную кассету, показан в виде SEQ ID NO. 26. В соответствии с одним вариантом осуществления пример плазмиды, содержащей такую экспрессионную кассету, показан в виде SEQ ID NO. 27. В соответствии с одним вариантом осуществления пример плазмиды, содержащей такую экспрессионную кассету, показан в виде SEQ ID NO. 28. В контексте данного документа «геном вектора» представляет собой последовательность нуклеиновой кислоты, которая упакована между 5' и 3' ITR, в том числе сами ITR. В соответствии с некоторыми вариантами осуществления термин «геном вектора» используется взаимозаменяемо с «экспрессионной кассетой». Следовательно, в соответствии с одним вариантом осуществления геном вектора включает в себя 5' ITR, энхансер CMV, промотор куриного бета-актина, экзон 1 и интрон СВА, последовательность Козак, оптимизированный по кодону СНМ, поли-А bGH и 3' ITR. В соответствии с одним вариантом осуществления геном вектора содержит нуклеотиды с 1 по 4233 в SEQ ID NO: 25. В соответствии с еще одним вариантом осуществления геном вектора содержит нуклеотиды с 1 по 4233 в SEQ ID NO: 26. В соответствии с еще одним вариантом осуществления геном вектора содержит нуклеотиды с 1 по 4233 в SEQ ID NO: 27. В соответствии с еще одним вариантом осуществления геном вектора содержит нуклеотиды с 1 по 4233 в SEQ ID NO: 28.
[00080] В соответствии с другим вариантом осуществления обеспечивается ряд экспрессионных кассет, в которых используются SEQ ID No. 9, 11 или 13 для экспрессии белка CNGA3. В соответствии с другим вариантом осуществления обеспечивается ряд экспрессионных кассет, в которых используются SEQ ID No. 19, 21 или 23 для экспрессии белка CNGAB. В контексте данного документа «экспрессионная кассета» относится к молекуле нуклеиновой кислоты, которая содержит кодирующие последовательности для оптимизированных белков REP-1, или CNGA3, или CNGB3, промотор и может включать в себя другие регуляторные последовательности для них, причем данная кассета может быть встроена с помощью методов генной инженерии в генетический элемент или плазмиду и/или упакована в капсид вирусного вектора (например, вирусную частицу). В соответствии с одним вариантом осуществления экспрессионная кассета содержит оптимизированную по кодону последовательность нуклеиновой кислоты, которая кодирует REP-1. В соответствии с одним вариантом осуществления кассета обеспечивает оптимизированный по кодону REP-1, функционально связанный с последовательностями для контроля экспрессии, которые управляют экспрессией оптимизированной по кодону последовательности нуклеиновой кислоты, кодирующей REP-1, в клетке-хозяине.
[00081] В соответствии с другим вариантом осуществления экспрессионная кассета содержит оптимизированную по кодону последовательность нуклеиновой кислоты, которая кодирует CNGA3. В соответствии с одним вариантом осуществления кассета обеспечивает оптимизированный по кодону CNGA3, функционально связанный с последовательностями для контроля экспрессии, которые управляют экспрессией оптимизированной по кодону последовательности нуклеиновой кислоты, кодирующей CNGA3, в клетке-хозяине.
[00082] В соответствии с другим вариантом осуществления экспрессионная кассета содержит оптимизированную по кодону последовательность нуклеиновой кислоты, которая кодирует CNGB3. В соответствии с одним вариантом осуществления кассета обеспечивает оптимизированный по кодону CNGB3, функционально связанный с последовательностями для контроля экспрессии, которые управляют экспрессией оптимизированной по кодону последовательности нуклеиновой кислоты, кодирующей CNGB3, в клетке-хозяине.
[00083] В соответствии с другим вариантом осуществления предполагается экспрессионная кассета для применения в векторе на основе AAV. В таком варианте осуществления экспрессионная кассета на основе AAV включает в себя по меньшей мере одну последовательность инвертированного концевого повтора (ITR) AAV. В соответствии с другим вариантом осуществления экспрессионная кассета содержит последовательности 5' ITR и последовательности 3' ITR. В соответствии с одним вариантом осуществления 5' и 3' ITR фланкируют оптимизированную по кодону последовательность нуклеиновой кислоты, которая кодирует REP-1, или CNGA3, или CNGB3, необязательно, с дополнительными последовательностями, которые управляют экспрессией оптимизированной по кодону последовательности нуклеиновой кислоты, кодирующей REP-1, или CNGA3, или CNGB3, в клетке-хозяине. Таким образом, как описано в данном документе, экспрессионная кассета на основе AAV подразумевает описание экспрессионной кассеты, которая описана выше, фланкированной на своем 5' конце последовательностью 5' инвертированного концевого повтора (ITR) AAV и фланкированной на своем 3' конце 3' ITR AAV. Таким образом, этот геном rAAV содержит минимальные последовательности, требующиеся для упаковки экспрессионной кассеты в вирусную частицу AAV, т.е. 5' и 3' ITR AAV. ITR AAV могут быть получены из последовательностей ITR любого AAV, таких как описанные в данном документе. Эти ITR могут происходить из того же AAV, что и капсид, используемый в получаемом в результате рекомбинантном AAV, или из отличающегося AAV (для получения псевдотипа AAV). В соответствии с одним вариантом осуществления последовательности ITR из AAV2 или их вариант с делецией (ΔITR) применяют из соображений удобства и для ускорения одобрения регулирующими органами. Тем не менее, могут быть выбраны ITR из других источников AAV. Геном каждого rAAV затем может быть введен в плазмиду для продуцирования. В соответствии с одним вариантом осуществления плазмида для продуцирования представляет собой описанную в данном документе, или она является такой, как описанная в международной заявке WO 2012/158757, которая включена в данный документ посредством ссылки. Различные плазмиды известны в уровне техники для применения в продуцировании векторов на основе rAAV и являются применимыми в данном документе. Плазмиды для продуцирования культивируют в клетках-хозяевах, которые экспрессируют cap и/или rep белки AAV. В клетках-хозяевах каждый геном rAAV «спасали» и упаковывали в белок капсида или белок оболочки с образованием инфекционной вирусной частицы.
[00084] Одним типом плазмиды для продуцирования является показанная в виде SEQ ID NO: 7, которая имеет название р584. Эту плазмиду применяют в примерах для создания вектора rAAV-REP-1. Такая плазмида является содержащей последовательность 5' ITR AAV; выбранный промотор; последовательность поли-А и 3' ITR; кроме того, она также содержит спейсерную последовательность, такую как лямбда. В соответствии с одним вариантом осуществления, некодирующий спейсерный участок лямбда включен в остов вектора. Последовательность нуклеиновой кислоты, кодирующую REP-1, CNGA3 или CNGB2, вставляют в положение между выбранным промотором и последовательностью поли-А в плазмиде или в подобное положение. Пример р584, которая включает в себя кодирующую последовательность REP-1, можно найти в SEQ ID NO: 8. В соответствии с другим вариантом осуществления плазмиду для продуцирования подвергают модификации с целью оптимизации эффективности продуцирования плазмидного вектора. Такие модификации включают в себя добавление других нейтральных последовательностей или удаление части(частей) спейсерной последовательности лямбда или ее всей с целью модуляции уровня суперспирализации плазмидного вектора. Такие модификации предполагаются в данном документе. В соответствии с другими вариантами осуществления терминаторная и другие последовательности включены в плазмиду.
[00085] В соответствии с другим дополнительным вариантом осуществления вектор на основе рекомбинантного аденоассоциированного вируса (AAV) обеспечивается для доставки конструкций REP-1, CNGA3 и CNGB3 и оптимизированных последовательностей, описанных в данном документе. Вирусный вектор на основе аденоассоциированного вируса (AAV) представляет собой устойчивую к воздействию ДНКазы частицу AAV, имеющую капсид из белка AAV, в который упакованы последовательности нуклеиновой кислоты для доставки в клетки-мишени. Капсид AAV состоит из 60 субъединиц белка капсида (cap), VP1, VP2 и VP3, которые расположены с икосаэдрической симметрией в соотношении, составляющем примерно от 1:1:10 до 1:1:20 в зависимости от выбранного AAV. AAV могут быть выбраны в качестве источников для капсидов вирусных векторов на основе AAV, которые идентифицированы выше. См., например, опубликованную заявку на патент США №2007-0036760-А1; опубликованную заявку на патент США №2009-0197338-А1; европейский патентный документ ЕР 1310571. См. также международную заявку WO 2003/042397 (AAV7 и другой AAV обезьян), патент США №7790449 и патент США №7282199 (AAV8), международную заявку WO 2005/033321 и патент США № US 7906111 (AAV9), а также международную заявку WO 2006/110689 и международную заявку WO 2003/042397 (rh.10). В этих документах также описываются другие AAV, которые могут быть выбраны для создания AAV, и они включены посредством ссылки. В соответствии с некоторыми вариантами осуществления cap AAV для применения в вирусном векторе может быть получен посредством мутагенеза (т.е. посредством вставок, делеций или замен) одного из вышеупомянутых капсидов AAV или кодирующей его нуклеиновой кислоты. В соответствии с некоторыми вариантами осуществления капсид AAV является химерным, содержащим домены из двух, или трех, или четырех, или большего числа вышеупомянутых белков капсида AAV. В соответствии с некоторыми вариантами осуществления капсид AAV представляет собой мозаичную структуру из мономеров Vp1, Vp2 и Vp3 из двух или трех различных AAV или рекомбинантных AAV. В соответствии с некоторыми вариантами осуществления композиция rAAV содержит более чем один из вышеупомянутых Caps.
[00086] В соответствии с другим вариантом осуществления капсид AAV включает в себя варианты, которые могут включать изменение до приблизительно 10% от любой описанной или известной последовательности капсида AAV. То есть капсид AAV характеризуется идентичностью от приблизительно 90% до приблизительно 99,9%, от приблизительно 95% до приблизительно 99% или от приблизительно 97% до приблизительно 98% с капсидом AAV, представленным в данном документе и/или известным в уровне техники. В соответствии с одним вариантом осуществления капсид AAV является по меньшей мере на 95% идентичным капсиду AAV. При определении процентной идентичности капсида AAV сравнение может быть выполнено с любым из вариабельных белков (например, vp1, vp2 или vp3). В соответствии с одним вариантом осуществления капсид AAV по меньшей мере на 95% идентичен AAV8 vp3. В соответствии с другим вариантом осуществления применяют самокомплементарный AAV. В соответствии с одним вариантом осуществления желательным является использование капсида AAV, который проявляет тропизм в отношении желаемой клетки-мишени, например, фоторецепторов, RPE или других клеток глаза. В соответствии с одним вариантом осуществления капсид AAV представляет собой капсид-тирозиновый мутант, в котором определенные обращенные к поверхности тирозиновые остатки заменены на фенилаланин (F). Такие варианты AAV описаны, например, в Mowat et al, Tyrosine capsid-mutant AAV vectors for gene delivery to the canine retina from a subretinal or intravitreal approach, Gene Therapy 21, 96-105 (January 2014), которая включена в данный документ посредством ссылки.
[00087] В случае упаковки экспрессионной кассеты, или генома rAAV, или плазмиды для продуцирования в вирионы ITR являются единственными компонентами AAV, для которых требуется близкое расположение в той же конструкции, что и трансген. В соответствии с одним вариантом осуществления кодирующие последовательности для репликации (rep) и/или капсида (cap) удалены из генома AAV и обеспечиваются удаленно или пакующей клеточной линией с целью создания вектора на основе AAV. Например, как описано выше, псевдотипированный AAV может содержать ITR из источника, который отличается от источника капсида AAV. В качестве дополнения или альтернативы может быть использован химерный капсид AAV. Могут быть выбраны также другие компоненты AAV. Источники таких последовательностей AAV описаны в данном документе и могут быть выделены или получены методами генной инженерии из научных, коммерческих или общедоступных источников (например, Американской коллекции типовых культур, Манассас, Виргиния, США). В качестве альтернативы, последовательности AAV могут быть получены посредством синтеза или других подходящих средств, исходя из опубликованных последовательностей, как например, доступных в литературе или в базах данных, таких как, например, GenBank®, PubMed® или подобные.
[00088] Способы получения и выделения вирусных векторов на основе AAV, подходящих для доставки субъекту, являются известными в уровне техники. См., например, патент США №7790449; патент США №7282199; международную заявку WO 2003/042397; международную заявку WO 2005/033321, международную заявку WO 2006/110689 и патентный документ US 7588772 В2. В одной системе клеточную линию-продуцент временно трансфицируют конструкцией, которая кодирует трансген, фланкированный ITR, и конструкцией(конструкциями), которая(которые) кодирует(кодируют) rep и cap. Во второй системе пакующую клеточную линию, которая стабильно обеспечивает rep и cap, временно трансфицируют конструкцией, кодирующей трансген, фланкированный ITR. В каждой из этих систем вирионы AAV продуцируются в ответ на инфицирование аденовирусом-помощником или вирусом герпеса-помощником, что требует отделения rAAV от контаминирующего вируса. В последнее время были разработаны системы, которые не требуют инфицирования вирусом-помощником для выделения AAV - требующиеся функции помощника (т.е. аденовируса E1, Е2а, VA и Е4 или вируса герпеса UL5, UL8, UL52 и UL29 и полимеразы вируса герпеса) также обеспечиваются системой удаленно. В этих более новых системах функции помощника могут обеспечиваться за счет временной трансфекции клеток конструкциями, которые кодируют необходимые функции помощника, или клетки могут подвергнуться воздействию методов генной инженерии для того, чтобы они стабильно содержали гены, кодирующие функции помощника, экспрессия которых может контролироваться на транскрипционном или посттранскрипционном уровне.
[00089] В еще одной системе трансген, фланкированный ITR, и гены rep/сар вводят в клетки насекомых посредством инфекции векторами на основе бакуловируса. Для обзоров на эти системы для продуцирования см. в общих чертах, например, Zhang et al., 2009, "Adenovirus-adeno-associated virus hybrid for large-scale recombinant adeno-associated virus production," Human Gene Therapy 20:922-929, содержание которой включено в данный документ посредством ссылки в своей полноте. Способы создания и применения этих и других систем для получения AAV также описаны в следующих патентах США, содержание каждого из которых включено в данный документ посредством ссылки во всей своей полноте: 5139941; 5741683; 6057152; 6204059; 6268213; 6491907; 6660514; 6951753; 7094604; 7172893; 7201898; 7229823 и 7439065. См. в общих чертах, например, Grieger & Samulski, 2005, "Adeno-associated virus as a gene therapy vector: Vector development, production and clinical applications," Adv. Biochem. Engin/Biotechnol. 99. 119-145; Buning et al., 2008, "Recent developments in adeno-associated virus vector technology," J. Gene Med. 10:717-733; и источники, цитируемые ниже, каждый из которых включен в данный документ посредством ссылки во всей своей полноте.
[00090] Способы, применяемые для конструирования любого варианта осуществления настоящего изобретения, являются известными специалистам в области манипуляции с нуклеиновой кислотой и включают в себя генную инженерию, инженерию с использованием технологии рекомбинантной ДНК и методики синтеза. См., например, Green and Sambrook et al, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, NY (2012). Аналогично, способы получения вирионов rAAV являются хорошо известными, и выбор подходящего способа не является ограничением в отношении настоящего раскрытия. См., например, K. Fisher et al, (1993) J. Virol., 70:520-532; и патент США №5478745.
[00091] Векторы на основе rAAV содержат капсид AAV и экспрессионную кассету AAV, содержащую последовательности, кодирующие REP-1, или CNGA3, или CNGB3, такие как описанные выше. В соответствии с определенными вариантами осуществления экспрессионная кассета rAAV содержит последовательности инвертированных концевых повторов AAV и оптимизированную по кодону последовательность нуклеиновой кислоты, которая кодирует REP-1, или CNGA3, или CNGB3, и последовательности для контроля экспрессии, которые управляют экспрессией кодируемых белков в клетке-хозяине. Экспрессионная кассета rAAV, в соответствии с другими вариантами осуществления, дополнительно содержит один или несколько из интрона, последовательности Козак, поли-А и посттранскрипционных регуляторных элементов. В таких векторах на основе rAAV для применения в фармацевтических композициях для доставки в глаз может использоваться капсид из любого из многих известных AAV, идентифицированных выше.
[00092] Другие общепринятые компоненты экспрессионных кассет и векторов включают в себя другие компоненты, которые могут быть оптимизированы для конкретного вида с применением методик, известных в уровне техники, в том числе, например, оптимизации кодонов, которая описана в данном документе. Компоненты кассет, векторов, плазмид и вирусов или других композиций, описанных в данном документе, включают в себя промоторную последовательность в составе последовательностей для контроля экспрессии. В соответствии с другим вариантом осуществления промотор является специфическим в отношении клетки. Термин «специфический в отношении клетки» означает, что конкретный промотор, выбранный для рекомбинантного вектора, может управлять экспрессией трансгена оптимизированного REP-1, или CNGA3, или CNGB3 в конкретном типе клеток глаза. В соответствии с одним вариантом осуществления промотор является специфическим в отношении экспрессии трансгена в фоторецепторных клетках. В соответствии с другим вариантом осуществления промотор является специфическим в отношении экспрессии в палочках и колбочках. В соответствии с другим вариантом осуществления промотор является специфическим в отношении экспрессия в палочках. В соответствии с другим вариантом осуществления промотор является специфическим в отношении экспрессии в колбочках. В соответствии с одним вариантом осуществления специфический в отношении фоторецепторов промотор представляет собой промотор человеческой родопсин-киназы. Было показано, что промотор родопсин-киназы является активным как в палочках, так и в колбочках. См., например, Sun et al, Gene Therapy with a Promoter Targeting Both Rods and Cones Rescues Retinal Degeneration Caused by AIPL1 Mutations, Gene Ther. 2010 January; 17(1): 117-131, которая включена в данный документе посредством ссылки во всей своей полноте. В соответствии с одним вариантом осуществления промотор является модифицированным для добавления одного или нескольких сайтов рестрикции с целью облегчения клонирования.
[00093] В соответствии с другим вариантом осуществления промотор представляет собой промотор человеческого родопсина. В соответствии с одним вариантом осуществления промотор является модифицированным с включением сайтов рестрикции на концах для клонирования. См., например, Nathans and Hogness, Isolation and nucleotide sequence of the gene encoding human rhodopsin, PNAS, 81:4851-5 (August 1984), которая включена в данный документ посредством ссылки во всей своей полноте. В соответствии с другим вариантом осуществления промотор представляет собой часть или фрагмент промотора человеческого родопсина. В соответствии с другим вариантом осуществления промотор представляет собой вариант промотора человеческого родопсина.
[00094] Другие иллюстративные промоторы включают в себя промотор человеческой сопряженной с G-белком рецепторной протеин-киназы 1 (GRK1) (номер доступа в Genbank AY327580). В соответствии с другим вариантом осуществления промотор представляет собой 292-нуклеотидный фрагмент (положения 1793-2087) в промоторе GRK1 (см., Beltran et al, Gene Therapy 2010 17:1162-74, которая включена в данный документ посредством ссылки в своей полноте). В соответствии с другим предпочтительным вариантом осуществления промотор представляет собой проксимальный промотор человеческого межфоторецепторного ретиноид-связывающего белка (IRBP). В соответствии с одним вариантом осуществления промотор представляет собой 235-нуклеотидный фрагмент промотора hIRBP. В соответствии с одним вариантом осуществления промотор представляет собой проксимальный промотор RPGR (Shu et al, IOVS, May 2102, которая включена посредством ссылки во всей своей полноте). Другие промоторы, применимые в настоящем изобретении включают в себя, без ограничения, промотор палочкового опсина, промотор красного-зеленого опсина, промотор синего опсина, промотор цГМФ-β-фосфодиэстеразы (Qgueta et al, IOVS, Invest Ophthalmol Vis Sci. 2000 Dec; 41(13):4059-63), промотор мышиного опсина (Beltran et al 2010, приводимый выше), промотор родопсина (Mussolino et al, Gene Ther, July 2011, 18(7):637-45); промотор альфа-субъединицы колбочкового трансдуцина (Morrissey et al, BMC Dev, Biol, Jan 2011, 11:3); промотор бета-фосфодиэстеразы (PDE); промотор гена пигментного ретинита (RP1) (Nicord et al, J. Gene Med, Dec 2007, 9(12):1015-23); промотор NXNL2/NXNL1 (Lambard et al, PloS One, Oct. 2010, 5(10):el3025), промотор RPE65; промотор замедляющего дегенерацию сетчатки белка/периферина 2 (Rds/perph2) (Cai et al, Exp Eye Res. 2010 Aug; 91(2):186-94) и промотор VMD2 (Kachi et al, Human Gene Therapy, 2009 (20:31-9)). Каждый из этих документов включен в данный документ посредством ссылки во всей своей полноте. В соответствии с другим вариантом осуществления промотор является выбранным из промотора человеческого EF1α, промотора родопсина, промоторов родопсин-киназы, межфоторецепторного связывающего белка (IRBP), промоторов колбочковых опсинов (красного-зеленого, синего), вышележащих последовательностей колбочкового опсина, содержащих контролирующий участок локуса красного-зеленого колбочкового опсина, промоторов колбочковых трансдуцирующих и транскрипционных факторов (нейроретинальный белок с «лейциновой молнией» (Nrl) и фоторецептор-специфический ядерный рецептор Nr2e3, bZIP).
[00095] В соответствии с другим вариантом осуществления промотор представляет собой убиквитарный или конститутивный промотор. Примером подходящего промотора является гибридный промотор куриного β-актина (СВА) с энхансерными элементами цитомегаловируса (CMV). В соответствии с другим вариантом осуществления промотор представляет собой промотор СВ7. Другие подходящие промоторы включают в себя промотор человеческого β-актина, промотора человеческого фактора элонгации 1α, промотора цитомегаловируса (CMV), промотор вируса обезьян 40 и промотор тимидин-киназы вируса простого герпеса. См., например, Damdindorj et al, (August 2014) A Comparative Analysis of Constitutive Promoters Located in Adeno-Associated Viral Vectors. PloS ONE 9(8): el06472. Дополнительные подходящие промоторы включают в себя вирусные промоторы, конститутивные промоторы, регулируемые промоторы [см., например, международную заявку WO 2011/126808 и международную заявку WO 2013/04943]. В качестве альтернативы, промотор, отвечающий на физиологические стимулы, может использоваться в экспрессионной кассете, геномах rAAV, векторах, плазмидах и вирусах, описанных в данном документе. В соответствии с одним вариантом осуществления промотор имеет небольшой размер, до 1000 п.о., вследствие ограничений по размеру вектора на основе AAV. В соответствии с другим вариантом осуществления промотор имеет размер до 400 п.о. Другие промоторы могут быть выбраны специалистом в данной области техники. В соответствии с одним вариантом осуществления конструкция REP-1 включает убиквитарный промотор. В соответствии с другим вариантом осуществления конструкция CNGA3 включает специфический в отношении фоторецептора промотор. В соответствии с одним вариантом осуществления конструкция REP-1 включает в себя промотор СВА с энхансерными элементами CMV.
[00096] В соответствии с другим вариантом осуществления промотор представляет собой индуцируемый промотор. Индуцируемый промотор может быть выбран из известных промоторов, в том числе промотор рапамицина/рапалога, промотор экдизона, чувствительный к эстрогену промотор и чувствительный к тетрациклину промотор или гетеродимерный репрессорный переключатель. См., Sochor et al, An Autogenously Regulated Expression System for Gene Therapeutic Ocular Applications. Scientific Reports, 2015 Nov 24; 5:17105; и Daber R, Lewis M., A novel molecular switch. J Mol Biol. 2009 Aug 28; 391(4):661-70, Epub 2009 Jun 21, обе из которых включены в данный документ посредством ссылки во всей своей полноте.
[00097] В соответствии с другими вариантами осуществления конструкции кассеты, вектора, плазмиды и вируса, описанные в данном документе, содержат соответствующие последовательности инициации транскрипции, терминации транскрипции, энхансерные последовательности, сигналы для эффективного процессинга РНК, такие как сигналы сплайсинга и полиаденилирования (поли-А); TATA последовательности; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые эффективность трансляции (т.е. консенсусная последовательность Козак); интроны; последовательности, которые повышают стабильность белка; и, если желательно, последовательности, которые повышают секрецию кодируемого продукта. Экспрессионная кассета или вектор может не содержать ни одного, может содержать один или несколько из любого из элементов, описанных в данном документе. Примеры подходящих последовательностей поли-А включают в себя, например, SV40, бычьего гормона роста (bGH) и поли-А TK. Примеры подходящих энхансеров включают в себя, например, энхансер CMV, энхансер RSV, энхансер альфа-фетопротеина, минимальный промотор/энхансер TTR, LSP (промотор ТН-связывающего глобул и на/энхансер альфа-1-микроглобулина/бикунина), среди прочих. В соответствии с одним вариантом осуществления последовательность Козак включена выше кодирующей последовательности трансгена для усиления трансляции с правильного инициирующего кодона. В соответствии с другим вариантом осуществления экзон 1 и интрон СВА включены в экспрессионную кассету. В соответствии с одним вариантом осуществления трансген помещен под контроль гибридного промотора куриного β-актина (СВА). Этот промотор состоит из немедленного раннего энхансера цитомегаловируса (CMV), проксимального промотора куриного β-актина и экзон 1 СВА, фланкированный последовательностями интрона 1.
[00098] В соответствии с одним вариантом осуществления экспрессионная кассета содержит 5' ITR, промотор СВА, энхансер CMV, экзон 1 и интрон СВА, последовательность Козак, оптимизированную по кодону последовательность человеческого СНМ (SEQ ID NO: 1), поли-А bGH и 3' ITR.
[00099] В соответствии с дополнительными аспектами эти последовательности нуклеиновой кислоты, векторы, экспрессионные кассеты и вирусные векторы на основе rAAV являются применимыми в фармацевтической композиции, которые также содержат фармацевтически приемлемый носитель, буфер, разбавитель и/или вспомогательное вещество и т.д. Такие фармацевтические композиции применяют для экспрессии оптимизированного REP-1, или CNGA3, или CNGB3 в клетках газа посредством доставки с помощью таких полученных методами генной инженерии с использованием технологии рекомбинантной ДНК AAV или искусственных AAV.
[000100] Для получения этих фармацевтических композиций, содержащих последовательности нуклеиновой кислоты, векторы, экспрессионные кассеты и вирусные векторы на основе rAAV, последовательности, или векторы, или вирусный вектор предпочтительно оценивают в отношении контаминации с помощью традиционных способов, а затем составляют в фармацевтическую композицию, подходящую для введения в глаз. Такие составы включают применение фармацевтически и/или физиологически приемлемой среды или носителя, в особенности, подходящих для введения в глаз, такой как буферный солевой раствор или другие буферы, например, HEPES, для поддержания рН на соответствующих физиологических уровнях и, необязательно, других медицинских средств, фармацевтических средств, стабилизирующих средств, буферов, носителей, вспомогательных веществ, разбавителей и т.д. Для инъекции носитель, как правило, будет представлять собой жидкость. Иллюстративные физиологически приемлемые носители включают в себя стерильную апирогенную воду и стерильный апирогенный фосфатно-солевой буферный раствор. Ряд таких известных носителей представлен в публикации патента США №7629322, включенной в данный документ посредством ссылки. В соответствии с одним вариантом осуществления носитель представляет собой изотоничный раствор хлорида натрия. В соответствии с другим вариантом осуществления носитель представляет собой сбалансированный солевой раствор. В соответствии с одним вариантом осуществления носитель включает в себя tween. Если вирус должен храниться длительное время, его можно заморозить в присутствии глицерина или Tween20.
[000101] В соответствии с одним конкретным вариантом осуществления композиция носителя или вспомогательного вещества содержит 180 мМ NaCl, 10 мМ NaPi, рН 7,3 с 0,0001-0,01% Pluronic F68 (PF68). Точная композиция солевого компонента буфера находится в диапазоне от 160 мМ до 180 мМ NaCl. Необязательно, буфер с отличающимся рН (возможно, HEPES, бикарбонат натрия, TRIS) применяют вместо буфера, который специально описан. Кроме того, в качестве альтернативы, применимым является буфер, содержащий 0,9% NaCl.
[000102] Необязательно, композиции согласно настоящему изобретению может содержать, помимо rAAV и/или вариантов и носителя(носителей), другие общепринятые фармацевтические ингредиенты, такие как консерванты или химические стабилизаторы. Подходящей иллюстративные консерванты включают в себя хлорбутанол, сорбат калия, сорбиновую кислоту, диоксид серы, пропилгаллат, парабены, этилванилин, глицерин, фенол и парахлорфенол. Подходящие химические стабилизаторы включают в себя желатин и альбумин.
[000103] Фармацевтические композиции, содержащие по меньшей мере один вирус rAAV с дефектной репликацией, который описан в данном документе, могут быть составлены с физиологически приемлемым носителем, разбавителем, вспомогательным веществом и/или адъювантом для применения в переносе генов и генной терапии. В случае вирусных векторов на основе AAV количественное определение копий генома («GC»), геномов вектора («VG») или вирусных частиц можно применять для измерения дозы, содержащейся в составе или суспензии. Любой способ, известный в предшествующем уровне техники, можно применять для определения количества копий генома (GC) вируса с дефектной репликацией в композициях согласно настоящему изобретению. Один способ для осуществления определения количества GC AAV является следующим: очищенные образцы вектора на основе AAV вначале обрабатывают ДНКазой для устранения не заключенной в капсид геномной ДНК AAV или контаминирующей плазмидной ДНК из процесса продуцирования. Устойчивые к ДНКазе частицы затем подвергают термической обработке для выделения генома из капсида. Выделенные геномы затем количественно определяют с помощью ПЦР в реальном времени с использованием наборов праймеров/зондов, нацеленных на конкретный участок вирусного генома (обычно на сигнал поли-А). В еще одном способе эффективную дозу рекомбинантного аденоассоциированного вируса, несущего последовательность нуклеиновой кислоты, которая кодирует трансген оптимизированного REP-1 или CNGA3, измеряют, как описано в S.K. McLaughlin et al, 1988 J. Virol., 62:1963, которая включена посредством ссылки во всей своей полноте.
[000104] В контексте данного документа термин «доза» может относиться к общей дозе, доставленной субъекту за время курса лечения, или к количеству, доставляемому при введении одной единицы (или нескольких единиц, или разделенной дозы). Фармацевтическая композиции с вирусами могут быть составлены в дозированных единицах таким образом, чтобы они содержали количество вируса с дефектной репликацией, несущего оптимизированные по кодону последовательности нуклеиновой кислоты, которые кодируют REP-1, или CNGA3, или CNGB3, описанные в данном документе, которое находится в диапазоне от приблизительно 1,0×109 GC до приблизительно 1,0×1015 GC, в том числе все целые числа или дробные числа в пределах диапазона. В соответствии с одним вариантом осуществления композиции составлены таким образом, чтобы они содержали по меньшей мере 1×109, 2×109, 3×109, 4×109, 5×109, 6×109, 7×109, 8×109 или 9×109 GC на дозу, в том числе все целые числа или дробные числа в пределах диапазона. В соответствии с другим вариантом осуществления композиции составлены таким образом, чтобы они содержали по меньшей мере 1×1010, 2×1010, 3×1010, 4×1010, 5×1010, 6×1010, 7×1010, 8×1010 или 9×1010 GC на дозу, в том числе все целые числа или дробные числа в пределах диапазона. В соответствии с другим вариантом осуществления композиции составлены таким образом, чтобы они содержали по меньшей мере 1×1011, 2×1011, 3×1011, 4×1011, 5×1011, 6×1011, 7×1011, 8×1011 или 9×1011 GC на дозу, в том числе все целые числа или дробные числа в пределах диапазона. В соответствии с другим вариантом осуществления композиции составлены таким образом, чтобы они содержали по меньшей мере 1×1012, 2×1012, 3×1012, 4×1012, 5×1012, 6×1012, 7×1012, 8×1012 или 9×1012 GC на дозу, в том числе все целые числа или дробные числа в пределах диапазона. В соответствии с другим вариантом осуществления композиции составлены таким образом, чтобы они содержали по меньшей мере 1×1013, 2×1013, 3×1013, 4×1013, 5×1013, 6×1013, 7×1013, 8×1013 или 9×1013 GC на дозу, в том числе все целые числа или дробные числа в пределах диапазона. В соответствии с другим вариантом осуществления композиции составлены таким образом, чтобы они содержали по меньшей мере 1×1014, 2×1014, 3×1014, 4×1014, 5×1014, 6×1014, 7×1014, 8×1014 или 9×1014 GC на дозу, в том числе все целые числа или дробные числа в пределах диапазона. В соответствии с другим вариантом осуществления композиции составлены таким образом, чтобы они содержали по меньшей мере 1×1015, 2×1015, 3×1015, 4×1015, 5×1015, 6×1015, 7×1015, 8×1015 или 9×1015 GC на дозу, в том числе все целые числа или дробные числа в пределах диапазона. В соответствии с одним вариантом осуществления для применения у человека доза может находиться в диапазоне от 1×1010 до приблизительно 1×1012 GC на дозу, в том числе все целые числа или дробные числа в пределах диапазона. Все дозы могут быть измерены с помощью любого известного способа, в том числе измерены с помощью oqPCR или цифровой капельной ПЦР (ddPCR), как описано, например, в М. Lock et al, Hum Gene Ther Methods. 2014 Apr; 25(2):115-25. Doi: 10.1089/hgtb.2013.131, которая включена в данный документ посредством ссылки.
[000105] Эти вышеуказанные дозы можно вводить в ряде объемов состава носителя, вспомогательного вещества или буфера, находящихся в диапазоне от приблизительно 25 до приблизительно 1000 микролитров, в том числе все числа в пределах диапазона, в зависимости от размера области, подлежащей лечению, используемого титра вируса, пути введения и желаемого эффекта способа. В соответствии с одним вариантом осуществления объем носителя, вспомогательного вещества или буфера составляет по меньшей мере приблизительно 25 мкл. В соответствии с одним вариантом осуществления объем составляет приблизительно 50 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 75 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 100 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 125 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 150 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 175 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 200 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 225 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 250 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 275 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 300 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 325 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 350 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 375 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 400 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 450 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 500 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 550 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 600 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 650 мкл. В соответствии с еще одним вариантом осуществления объем составляет приблизительно 700 мкл. В соответствии с другим вариантом осуществления объем составляет приблизительно от 700 до 1000 мкл.
[000106] В соответствии с одним вариантом осуществления вирусные конструкции могут быть доставлены в дозах, составляющих от по меньшей мере 1×109 до приблизительно по меньшей мере 1×1011 GC, в объемах, составляющих от приблизительно 1 мкл до приблизительно 3 мкл для субъектов-мелких животных, таких как мыши. В случае более крупных субъектов-ветеринарных пациентов, имеющих глаза приблизительно того же размера, что и человеческие глаза, применимыми являются более высокие человеческие дозы и объемы, изложенные выше. См., например, Diehl et al, J. Applied Toxicology, 21:15-23 (2001); для обсуждения рекомендуемых практик для введения веществ различным животным-ветеринарным пациентам. Этот документ включен в данный документ посредством ссылки.
[000107] Желательно, чтобы использовалась самая низкая эффективная концентрация вируса или другой среды для доставки с целью снижения риска нежелательных эффектов, таких как токсичность, дисплазия и отслойка сетчатки. Другие дозы в этих диапазонах могут быть выбраны лечащим врачом с учетом физического состояния субъекта, предпочтительно человека, подлежащего лечению, возраста субъекта, конкретного офтальмологического нарушения и степени, в которой развилось нарушение, если оно прогрессирует.
[000108] Еще один аспект, описанный в данном документе, представляет собой способ лечения, замедления или остановки прогрессирования слепоты у субъекта-млекопитающего имеющего хороидеремию или имеющего риск развития хороидеремии. В соответствии с одним вариантом осуществления rAAV, несущий оптимизированные по кодону последовательности REP-1, предпочтительно, суспендированные в физиологически совместимом носителе, разбавителе, вспомогательном веществе и/или адъюванте, можно вводить желаемому субъекту, в том числе субъекту-человеку. Этот способ включает введение субъекту, нуждающемуся в этом, любой из последовательностей нуклеиновой кислоты, экспрессионных кассет, геномов rAAV, плазмид, векторов или векторов на основе rAAV или композиций, содержащих их. В соответствии с одним вариантом осуществления композицию доставляют субретинально. В соответствии с другим вариантом осуществления композицию доставляют интравитреально. В соответствии с еще одним вариантом осуществления композицию доставляют с применением комбинации путей введения, подходящих для лечения заболеваний глаза, и доставка также может включать введение через вену века или другие пути внутривенного введения или традиционные пути введения.
[000109] Еще один аспект, описанный в данном документе, представляет собой способ лечения, замедления или остановки прогрессирования слепоты у субъекта-млекопитающего имеющего ахроматопсию или имеющего риск развития ахроматопсии. В соответствии с одним вариантом осуществления rAAV, несущий нативную, модифицированную или оптимизированную по кодону последовательность CNGA3 или CNGB3, предпочтительно, суспендированные в физиологически совместимом носителе, разбавителе, вспомогательном веществе и/или адъюванте, можно вводить желаемому субъекту, в том числе субъекту-человеку. Этот способ включает введение субъекту, нуждающемуся в этом, любой из последовательностей нуклеиновой кислоты, экспрессионных кассет, геномов rAAV, плазмид, векторов или векторов на основе rAAV или композиций, содержащих их. В соответствии с одним вариантом осуществления композицию доставляют субретинально. В соответствии с другим вариантом осуществления композицию доставляют интравитреально. В соответствии с еще одним вариантом осуществления композицию доставляют с применением комбинации путей введения, подходящих для лечения заболеваний глаза, и доставка также может включать введение через вену века или другие пути внутривенного введения или традиционные пути введения.
[000110] Для применения в этих способах объем и титр вируса в каждой дозе определяют индивидуально, как дополнительно описано в данном документе, и они могут быть такими же или отличными от других методов лечения, осуществляемых на том же или противоположном глазу. Дозировки, способы и схемы введения могут быть определены лечащим врачом с учетом информации в данном описании. В соответствии с одним вариантом осуществления композицию вводят в одной дозе, выбранной из перечисленных выше, в один пораженный глаз. В соответствии с другим вариантом осуществления композицию вводят в виде одной дозы, выбранной из перечисленных выше, в оба пораженных глаза либо одновременно, либо последовательно. Последовательное введение может предполагать временной разрыв между введением в один глаз и в другой глаз с интервалами порядка минут, часов, суток, недель или месяцев. В соответствии с другим вариантом осуществления способ включает введение композиций в глаз двумя или более дозами (например, разделенными дозами). В соответствии с другим вариантом осуществления выполняют несколько инъекций в разные части одного и того же глаза. В соответствии с другим вариантом осуществления второе введение rAAV, включающего в себя выбранную экспрессионную кассету (например, СНМ-содержащую кассету) осуществляют в последующий момент времени. Такой момент времени может настать спустя недели, месяцы или годы после первого введения. Такое второе введение в соответствии с одним вариантом осуществления осуществляют с использованием rAAV, имеющего капсид, отличный от rAAV из первого введения. В соответствии с другим вариантом осуществления rAAV из первого и второго введения имеет такой же капсид.
[000111] В соответствии с другими вариантами осуществления композиции, описанные в данном документе, могут доставляться в одной композиции или нескольких композициях. Необязательно, могут быть доставлены два или более различных AAV или несколько вирусов [см., например, международные заявки WO 2011/126808 и WO 2013/049493]. В соответствии с другим вариантом осуществления несколько вирусов могут содержать различные вирусы с дефектной репликацией (например, AAV и аденовирус).
[000112] В соответствии с определенными вариантами осуществления настоящего изобретения желательно осуществлять неинвазивную визуализацию сетчатки и функциональные исследования для идентификации областей палочковых и колбочковых фоторецепторов, являющихся мишенью для терапии. В соответствии с этими вариантами осуществления клинические диагностические исследования используются для определения точного места(мест) для одной или нескольких субретинальных инъекций. Эти исследования могут включать в себя электроретинографию (ERG), периметрию, топографическое картирование слоев сетчатки и измерение толщины его слоев посредством конфокальной сканирующей лазерной офтальмоскопии (cSLO) и оптической когерентной томографии (ОСТ), топографическое картирование плотности колбочек с помощью адаптивной оптики (АО), функциональное обследование глаза и т.д. в зависимости от вида субъекта, подлежащего лечению, его физического состояния и состояния здоровья, а также дозировки. С учетом визуализации и функциональные исследований в соответствии с некоторыми вариантами осуществления настоящего изобретения одну или несколько инъекций осуществляют в один и тот же глаз с целью целенаправленного воздействия на различные области пораженного глаза. Объем и титр вируса в каждой инъекции определяют индивидуально, как дополнительно описано в данном документе, и они могут быть такими же или отличными от других инъекций, осуществляемых на том же или противоположном глазу. В соответствии с другим вариантом осуществления одну инъекцию большего объема выполняют с целью лечения всего глаза. В соответствии с одним вариантом осуществления объем и концентрацию композиции rAAV выбирают таким образом, чтобы воздействию подвергалась исключительно область с поврежденными клетками глаза. В соответствии с другим вариантом осуществления объем и/или концентрация композиции rAAV представляют собой большую величину для того, чтобы достичь больших частей глаза, включающих неповрежденные фоторецепторы.
[000113] В соответствии с одним вариантом осуществления способов, описанных в данном документе, однократная внутриглазная доставка композиции, которая описана в данном документе, например, доставка AAV кассеты с оптимизированным REP-1, является полезной в предупреждении потери зрения и слепоты у субъекта, имеющего риск развития хороидеремии. В соответствии с другим вариантом осуществления способов, описанных в данном документе, однократная внутриглазная доставка композиции, которая описана в данном документе, например, доставка AAV кассеты с оптимизированным CNGA3 или CNGB3, является полезной в предупреждении потери зрения и слепоты у субъекта, имеющего риск развития ахроматопсия.
[000114] Следовательно, в соответствии с одним вариантом осуществления композицию вводят перед возникновением заболевания. В соответствии с другим вариантом осуществления композицию вводят перед началом нарушения или потери зрения. В соответствии с другим вариантом осуществления композицию вводят после начала нарушения или потери зрения. В соответствии с еще одним вариантом осуществления композицию вводят, когда менее чем 90% палочек и/или колбочек или фоторецепторов функционируют или сохраняются по сравнению с неповрежденным глазом.
[000115] В соответствии с другим вариантом осуществления способ включает в себя осуществление дополнительных исследований, например, функциональных и визуализационных исследований, для определения эффективности лечения. В случае обследования у животных, такие исследования включают в себя оценку функции сетчатки и зрительной функции посредством электроретинограмм (ERG), изучающих функцию фоторецепторов палочек и колбочек, оптокинетический нистагм, пупиллометрию, исследования в водном лабиринте, предпочтение света-тени, оптическую когерентную томографию (для измерения толщины различных слоев сетчатки), гистологию (толщина сетчатки, ряды ядер в наружном ядерном слое, иммунофлуоресцентные исследования для подтверждения экспрессии трансгена, подсчет фоторецепторов колбочек, окрашивание срезов сетчатки агглютинином арахиса, которое идентифицирует оболочки колбочковых фоторецепторов).
[000116] Специально для субъектов-людей после введения дозы композиций, описанных в данном описании, субъект подвергается исследованию в отношении эффективности лечения с применением электроретинограмм (ERG) для оценки функции палочковых и колбочковых фоторецепторов, пупиллометрии для определения остроты зрения, исследованию контрастной чувствительности цветового зрения, исследованию поля зрения (поля зрения по Хамфри/поля зрения по Голдману), периметрическому исследованию подвижности (с препятствиями) и исследованию скорости чтения. Другим применимым выполняемым после лечения исследованием эффективности, которому субъект подвергается после лечения фармацевтической композицией, описанной в данном документе, являются визуализация с помощью функциональной магнитно-резонансной томографии (fMRI), исследование чувствительности к свету во всем поле зрения, исследования структуры сетчатки, в том числе оптическую когерентную томографию, фотографирование глазного дна, исследование аутофлуоресценции глазного дна, сканирующую лазерную офтальмоскопию с применением адаптивной оптики, исследование подвижности, исследование скорости и точности чтения, микропериметрию и/или офтальмоскопию. Эти и другие исследования эффективности являются описанными в патенте США №8147823; в публикации находящейся на совместном рассмотрении международной патентной заявки WO 2014/011210 или WO 2014/124282, включенных посредством ссылки.
[000117] В соответствии с еще одним вариантом осуществления любой из вышеописанных способов осуществляют в сочетании с другой или вторичной терапией. В соответствии с другими дополнительными вариантами осуществления способы лечения этих заболеваний глаза включают лечение субъекта композицией, подробно описанных в данном документе, в комбинации со второй терапией, как например, лечением антибиотиком, паллиативное лечение для боли и т.п. Дополнительная терапия может представлять собой любую известную в настоящее время или еще неизвестную терапию, которая помогает предотвратить, задерживать или ослаблять эти мутации или дефекты или любой из эффектов, связанных с ними. Вторичную терапию можно назначать перед, одновременно или после введения композиций, описанных выше. В соответствии с одним вариантом осуществления вторичная терапия включает неспецифические подходы для сохранения здоровья клеток сетчатки, такие как введение нейротрофических факторов, антиоксидантов, антиапоптотических средств. Неспецифические подходы достигаются посредством инъекции белков, рекомбинантной ДНК, рекомбинантных вирусных векторов, стволовых клеток, фетальной ткани или генетически модифицированных клеток. Последние могут включать в себя генетически модифицированные клетки, которые являются инкапсулированными.
[000118] В соответствии с одним вариантом осуществления способ получения рекомбинантного rAAV включает получение плазмиды, содержащей экспрессионную кассету для AAV, которая описана выше, и культивирование пакующей клетки, несущей плазмиду, в присутствии достаточных вирусных последовательностей для того, чтобы позволить упаковку вирусного генома AAV в инфекционную оболочку или капсид AAV. Конкретные способы получения вектора на основе rAAV являются описанными выше и могут использоваться в получении вектора на основе rAAV, который может доставлять оптимизированный по кодону REP-1, или CNGA3, или CNGB3 в экспрессионные кассеты и геномы, описанные выше и в примерах ниже.
[000119] В соответствии с еще одним вариантом осуществления предполагается вектор, содержащий любую из экспрессионных кассет, описанных в данном документе. Как описано выше, такие векторы могут представлять собой плазмиды из ряда источников, и в соответствии с определенными вариантами осуществления они являются применимыми для получения рекомбинантных вирусов с дефектной репликацией, которые описаны далее в данном документе.
[000120] В соответствии с еще одним вариантом осуществления вектор представляет собой плазмиду, которая содержит экспрессионную кассету, причем экспрессионная кассета содержит последовательности инвертированных концевых повторов AAV и оптимизированную по кодону последовательность нуклеиновой кислоты, которая кодирует REP-1, и последовательности для контроля экспрессии, которые управляют экспрессией кодируемого белка в клетке-хозяине.
[000121] В соответствии с другим вариантом осуществления вектор представляет собой плазмиду, которая содержит экспрессионную кассету, причем экспрессионная кассета содержит последовательности инвертированных концевых повторов AAV и оптимизированную по кодону последовательность нуклеиновой кислоты, которая кодирует CNGA3, и последовательности для контроля экспрессии, которые управляют экспрессией кодируемого белка в клетке-хозяине.
[000122] В соответствии с другим вариантом осуществления вектор представляет собой плазмиду, которая содержит экспрессионную кассету AAV, причем экспрессионная кассета содержит последовательности инвертированных концевых повторов AAV и оптимизированную по кодону последовательность нуклеиновой кислоты, которая кодирует CNGB3, и последовательности для контроля экспрессии, которые управляют экспрессией кодируемого белка в клетке-хозяине.
[000123] Следует отметить, что форма единственного числа означает один или несколько. В связи с этим термины «один» (или «некий»), «один или несколько» и «по меньшей мере один» используются в данном документе взаимозаменяемо.
[000124] Слова «содержат», «содержит» и «содержащий» следует интерпретировать включительно, а не исключительно. Слова «состоит», «состоящий» и их варианты следует интерпретировать исключительно, а не включительно. Несмотря на то что различные варианты осуществления в данном описании представлены с использованием формулировки «содержащий», при иных обстоятельствах предполагается, что связанный вариант осуществления следует интерпретировать и описывать с использованием формулировки «состоящий из» или «состоящий, по существу, из».
[000125] В контексте данного документа термин «приблизительно» означает возможность изменения на 10% от заданного эталонного значения, если не определено иное.
[000126] Термин «регуляция» или его варианты в контексте данного документа относится к способности композиции к ингибированию одного или нескольких компонентов биологического пути.
[000127] Если в данном описании не определено иное, технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понятно квалифицированному специалисту в области техники, и ссылаются на опубликованные тексты, которые дают квалифицированному специалисту в данной области техники общее определение многих из терминов, используемых в данной заявке.
[000128] Следующие примеры являются исключительно иллюстративными и не предназначены для ограничения настоящего изобретения.
[000129] Пример 1. Дифференцировка плюрипотентной стволовой клетки в RPE
[000130] Для хороидеремии отсутствует релевантная мышиная модель, и не существует модели на собаках, следовательно, трансдукцию и экспрессию исследуют в модели заболевания на клетках человеческой сетчатки. Поскольку невозможно получить клетки сетчатки от живого пациента, RPE получают из индуцированных плюрипотентных стволовых клеток. Плюрипотентные стволовые клетки направляют на дифференцировку в RPE с использованием протокола, описанного в Buchholz et al, Rapid and Efficient Directed Differentiation of Human Pluripotent Stem Cells Into Retinal Pigmented Epithelium, Stem Cells Translational Medicine, 2013; 2:384-393, которая включена посредством ссылки во всей своей полноте. См. также, Cereso et al, Proof of concept for AAV2/5-mediated gene therapy in iPSC-derived retinal pigment epithelium of a choroideremia patient, Molecular Therapy - Methods & Clinical Development (2014) 1, 14011, которая включена посредством ссылки во всей своей полноте. Другие способы получения RPE известны в предшествующем уровне техники.
[000131] Вкратце, линию индуцированных человеческих плюрипотентных стволовых клеток поддерживают в среде Игла в модификации Дульбекко: питательная смесь F-12 (DMEM/F12), содержащей 2 мМ GlutaMAX-I, 20% заменителя сыворотки от knockout, 0,1 мМ заменимых аминокислот модифицированной среды Игла (MEM NEAA), 0,1 мМ β-меркаптоэтанол и 4 нг/мл bFGF на обработанном митомицином С или облученном фидерном слое из эмбриональных фибробластов.
[000132] Плюрипотентные стволовые клетки пассируют непосредственно на Matrigel (BD Biosciences) в DMEM/F12 с 1 × В27, 1 × N2 и 1 × NEAA (Invitrogen). С Дня 0 по День 2 50 нг/мл белка Noggin, 10 нг/мл Dkk1, 10 нг/мл IGF1 и 10 мМ никотинамид добавляют в базовую среду. С Дня 2 по День 4 10 нг/мл белка Noggin, 10 нг/мл Dkk1, 10 нг/мл IGF1, 5 нг/мл bFGF и 10 мМ никотинамид добавляют в базовую среду. С Дня 4 по День 6 10 нг/мл Dkk1, 10 нг/мл IGF1 и 100 нг/мл активина A (R&D Systems) добавляют в базовую среду. С Дня 6 по День 14 100 нг/мл активина А, 10 мкМ SU5402 (EMD Millipore, Дармштадт, Германия) и 1 мМ VIP добавляют в базовую среду. Контрольные эксперименты осуществляют только в базовой среде (DMEM/F12, В27, N2 и NEAA).
[000133] Клетки подвергают механическому обогащению посредством соскабливания клеток с морфологией, отличной от RPE. Затем оставшиеся RPE подвергают воздействию расщепляющего фермента с использованием TrypLE Express (Invitrogen) в течение 5 минут при 37°С. Клетки пропускают через фильтр с размером ячеек 30 мкм для получения отдельных клеток и высевают на покрытый Matrigel пластик для тканевой культуры, мембраны Transwell или обработанные СС2 стекла с камерами. Обогащенные клетки культивируют в DMEM с высоким содержанием глюкозы с 1% фетальной бычьей сыворотки (FBS), GlutaMAX и пируватом натрия в течении 30 суток.
[000134] Пример 2. Клетки, трансдуцированные AAV-REP-1
[000135] Вкратце, вирусный вектор AAV2/8CMV.CBA-REP-1, включающий оптимизированные по кодону последовательности REP-1, получают посредством временной трансфекции HEK293 клеток, и вирусные частицы осаждают из любого супернатанта с использованием полиэтиленгликоля. См., например, Guo et al, Rapid and simplified purification of recombinant adeno-associated virus, J Virol Methods. 2012 Aug; 183(2): 139-146, которая включена в данный документ посредством ссылки. Векторы очищают посредством двойного центрифугирования с CsCl, подвергают диализу и определению титра с помощью дот-блот анализа.
[000136] Для экспериментов по изучению пренилирования RPE высевают в 24-луночные планшеты и 1,2×106 клеток оценивают при конфлюентности. Клетки подвергают трансдукции с использованием 100000 vg (геномы вируса) на клетку и анализы пренилирования осуществляют через 4 недели после трансдукции. Эксперименты осуществляют в трех параллелях.
[000137] Пример 3. Пренилирование
[000138] In vitro анализ пренилирования осуществляют, как описано в Vasireddy et al, PloS One. 2013 May 7; 8(5):e61396, цитируемой выше, с использованием [3Н]-геранилгеранил-пирофосфата (GGPP) (Perkin Elmer, Бостон, Массачусетс, США) в качестве донора пренильной группы в присутствии рекомбинантной Rab-геранилгеранил-трансферазы и RAB27. Включение пренильных групп с радиоактивной меткой в белок RAB27 измеряют с помощью измерения сцинтилляционным счетчиком. Для корректности контрольные значения нормализуют к 100 и используют как базовое значение. Все эксперименты осуществляют в трех параллелях и статистическое сравнение пренилирования между экспериментальной и контрольной группами осуществляют с использованием двухстороннего t-критерия Стьюдента для непарных выборок.
[000139] Вкратце, через 48 часов после трансдукции трансдуцированные клетки REP промывают холодным PBS. Клеточные осадки собирают и тщательно промывают холодным PBS. Клетки подвергают лизису на льду в течение 30 мин. с использованием RIPA + ингибиторы протеазы. В альтернативном протоколе клетки подвергают ультразвуковой обработке. Цитозольные фракции собирают посредством центрифугирования лизата при 75000-100000 g в течение 1-2 часов при 4°С.
[000140] Маточные растворы для реакций пренилирования готовят следующим образом.
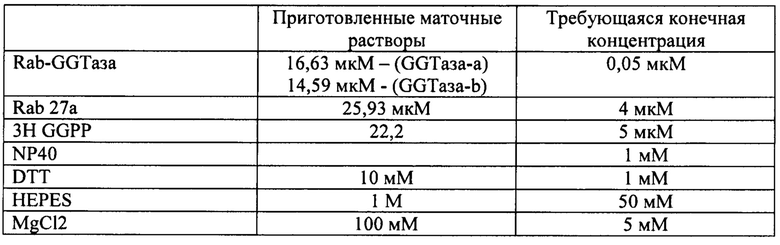
[000141] Конечный объем реакционной смеси, используемой для пренилирования, составляет 25 мкл.
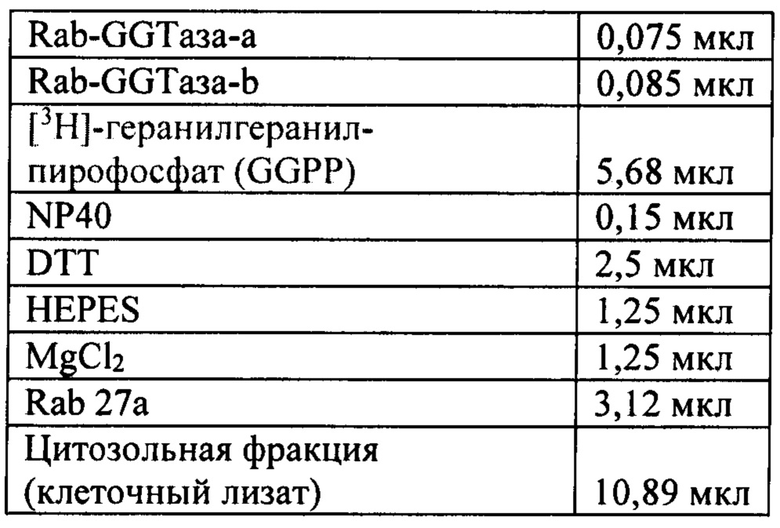
[000142] Реакционную смесь инкубируют при 37°С в течение 30 мин. Реакцию останавливают посредством добавления смеси этанол/HCL в соотношении 9:1 и реакционную смесь инкубируют в течение 30 минут. Белки собирают на стекловолоконной фильтровальной бумаге (ватманская бумага) с помощью вакуум-фильтрования (0,1 мл). Фильтры тщательно промывают холодным фосфатным буфером 3 раза для удаления несвязанного материала. Мембраны тщательно высушивают. Фильтры помещают в 5 мл смеси для определения сцинтилляций и осуществляют подсчет сцинтилляций. См. также, Tolmachova et al, CHM/REP1 cDNA delivery by lentiviral vectors provides functional expression of the transgene in the retinal pigment epithelium of choroideremia mice, The Journal of Gene Medicine, 2012; 14-158-68, которая включена в данный документ посредством ссылки во всей своей полноте.
[000143] Анализы CNGA3 или CNGB3 для экспериментальной проверки концепции могут включать в себя применение модели на животных со спонтанными мутациями (например, Cnga3-/- мыши или овцы породы Авасси). Модельных мышей можно скрестить с мышью, у которой все фоторецепторы являются колбочками, Nrl-/- мышью, с получением животных, нокаутных по двум генам. Последняя мышь (Cnga3-/-Nrl-/-) может ускорить идентификацию эффективности. Эффективность может быть измерена с помощью пупиллометрии, измерений остроты и контрастности зрения (например, с использованием оптикинетических методов), электроретинограмм и поведенческих исследований зрения. Наконец, гистологическое исследование подтвердит экспрессию трансгена с улучшенными результатами по другим измерениям. Гистологические подходы также будут использоваться для подтверждения любых эффектов вмешательства в отношении колбочковых фоторецепторов (общее количетсов колбочковых фоторецепторов, их плотность, расположение и т.д.).
[000144] Подобно тому, что обсуждалось выше для хороидеремии, анализы для экспериментальной проверки концепции в случае дополняющей генной терапии CNGA3-или CNGB3-ассоциированной ахроматопсии могут включать в себя применение моделей на индуцированных плюрипотентных стволовых клетках (iPSC). iPSC модели, созданные для пациентов с ахроматопсией, обусловленной мутациями CNGA3 или CNGB3, будут дифференцироваться в предшественники клеток сетчатки и/или фоторецепторные клетки in vitro. кДНК CNGA3 (или CNGB3) дикого типа будет доставлена в эти клетки с использованием рекомбинантного AAV, и клетки будут подвергнуты анализу в отношении биогенеза и сохранения функции соответствующего (управляемого циклическими нуклеотидами, CNG) канала, который содержит эти субъединицы. Функцию канала будут оценивать с помощью электрофизиологического исследования на фрагментах мембраны. Восстановление канала должно освобождать цГМФ-активируемые токи. В дополнительных исследованиях можно изучать чувствительность функции канала до и после доставки кДНК CNG дикого типа к физиологическим лигандам.
[000145] Пример 4. In Vitro экспрессия AAV с оптимизированным по кодону человеческим СНМ
[000146] Целью данного исследования являлась оценка возможности опосредованной AAV экспрессии СНМ после доставки гена с использованием ряда векторов нового поколения на основе AAV2 и AAV8, кодирующих оптимизированный по кодону ген СНМ (SEQ ID NO: 1), в линии клеток 84-31 и COS-7.
[000147] Для максимального повышения экспрессии СНМ получали оптимизированную по кодону последовательность СНМ (SEQ ID NO: 1). Оптимизированную по кодону плазмиду синтезировали и применяли в создании всех экспрессионных кассет нового поколения с трансгеном СНМ. Для преодоления потенциальной проблемы контаминации нефункциональных геномов AAV некодирующий лямбда-спейсерный участок был включен в остов вектора. Включение спейсера не только увеличивает длину плазмиды, но также снижает возможность контаминации остова плазмидной ДНК во время упаковки AAV. Воздействие включения спейсерного участка в остов вектора для исключения примесей плазмидной ДНК изучалось в независимом исследовании. Два остова рекомбинантных плазмид на основе провируса AAV (с высоким и низким количеством копий) использовали для создания различных конструкций. Плазмиду с высоким количеством копий конструировали на основе точки начала репликации вектора pUC. Плазмиду с низким количеством копий конструировали на основе точки начала репликации р15А. Для дополнительного повышения трансляции с корректного инициаторного кодона последовательность Козак включали выше старт-кодона.
[000148] В общей сложности четыре плазмиды были сконструированы для данного исследования, и они описаны в следующих примерах (таблица 1). Кроме того, также создавали плазмиду, несущую нативную последовательность СНМ, которая в настоящее время используется в клинических испытаниях (вариант 1). Карты плазмид для каждого из вариантов 2а, 2b, 3а и 3b и варианта 1 приведены на фиг. 6-10, соответственно.
[000149]
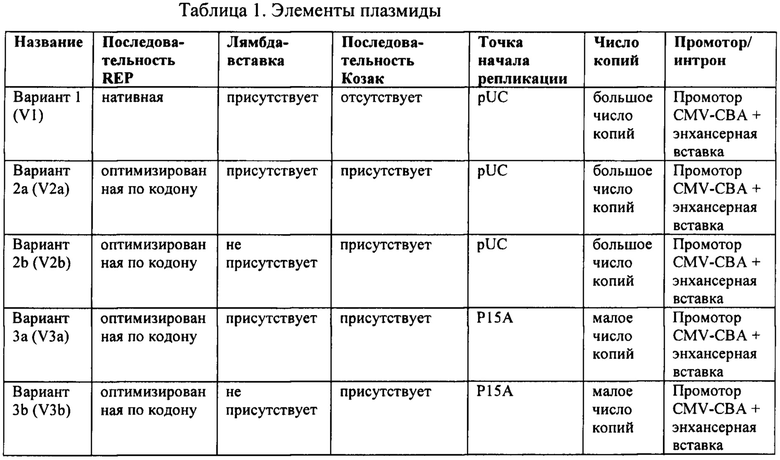
[000150] In vitro экспрессию этих конструкций исследовали в линиях клеток COS-7 и 84-31. Полученные с помощью методов генной инженерии элементы конструкций нового поколения с СНМ описаны в таблице 1.
[000151] Рекомбинантные плазмиды на основе провируса AAV с высоким и низким количеством копий получали посредством клонирования кДНК оптимизированного по кодону человеческого СНМ (hCHM) (SEQ ID NO: 1) в кассету для трансгена. Трансген помещали под контроль гибридного промотора куриного β-актина (СВА). Этот промотор состоит из немедленного раннего энхансера цитомегаловируса (CMV), проксимального промотора куриного β-актина и экзон 1 СВА, фланкированный последовательностями интрона 1. Плазмиды на основе провируса с высоким и низким количеством копий также содержат инвертированные концевые повторы AAV и последовательность поли-А. Остовы плазмиды нового поколения, используемые в данном исследовании, содержат спейсерный фрагмент из фага лямбда, за которым следует ген для отбора бактерий по чувствительности к канамицину. У дополнительных плазмид спейсер отсутствует, но они содержат ген для отбора по чувствительности к канамицину. Вектор с высоким количеством копий является подобным таковому с pUC плазмидами (~300 копий/бактериальная клетка). Плазмида с низким количеством копий (~10 копий/бактериальная клетка) имеет точку начала репликации из р15А. Для повышения трансляции с корректного инициаторного кодона все конструкции нового поколения содержат консенсусную последовательность Козак выше старт-кодона, ATG. Последовательность созданных плазмид подтверждают с использованием праймеров, которые могут специфически нацеливаться либо на последовательность вставки промотор + энхансер либо оптимизированную по кодону последовательность СНМ. Карты плазмид и последовательности всех пяти конструкций приведены на фиг. 6-10. Стандартную тройную трансфекцию с использованием фосфата кальция использовали для получения векторов на основе AAV, приведенных ниже (см. таблицу 2 для количественного определения векторов). Оба серотипа AAV2 и AAV8 векторов получали для подтверждения того, что результаты являются независимыми от серотипа.


[000152] Линия клеток 84-31 представляет собой субклон клеточной линии 293 HEK (клетки эмбриональных почек человека) и конститутивно экспрессирует белки Е4 аденовируса для усиления трансдукции вируса AAV. Клетки COS-7 представляют собой линии фибробластоподобных клеток, которые получают из тканей почки обезьяны. И клетки 84-31, и клетки COS-7 высевали отдельно, в 6-луночные планшеты для клеточной культуры и трансдуцировали одним из десяти исследуемых препаратов (либо AAV2, либо AAV8) с пятью разными значениями множества заражения (MOI). Через 36-48 часов клетки собирали, лизировали и образцы белка готовили для SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) с последующим анализом методом Вестерн-блоттинга для выявления экспрессии экзогенного СНМ.
[000153] И клетки 84-31, и клетки COS-7 культивировали в среде Игла в модификации Дульбекко (DMEM) с высоким содержанием глюкозы с 10% фетальной бычьей сыворотки и 1% пенициллина/стрептомицина при 37°С в окружающей среде, дополненной 5% CO2. За сутки до трансдукции (за 18-24 часа) клетки с плотностью 3Е5 высевали в 2 мл среды культивирования клеток в каждую лунку 6-луночной чашки для культивирования клеток. Высеянные клетки инкубировали при 37°С в окружающей среде, дополненной 5% CO2. Лунки как с клетками COS-7, так и с клетками 84-31 инфицировали векторами на основе AAV, приведенными ниже, при различных значениях множественности заражения (MOI) (таблица 3 и таблица 4). Вирус не добавляли к клеткам отрицательного контроля (нетрансдуцированные клетки). Вкратце, среду для тканевой культуры удаляли и свежую аликвоту среды объемом 2 мл добавляли в каждую лунку 6-луночной чашки для культивирования. Затем предварительно определенное количество вектора на основе AAV измеряли (непосредственно из маточного раствора) и добавляли в каждую лунку (таблица 3 и таблица 4). Для значения MOI, составляющего 1Е4, 1 мкл соответствующего маточного раствора вируса разводили до 10 мкл средой для культивирования клеток. Из этого раствора предварительно определенный объем вируса добавляли в соответствующую лунку (таблица 3 и 4). Клетки инкубировали с вирусом AAV в течение 36-48 часов при 37°C с 5% CO2 до момента сбора. Клетки наблюдали под микроскопом перед сбором для проверки в отношении аномалий.
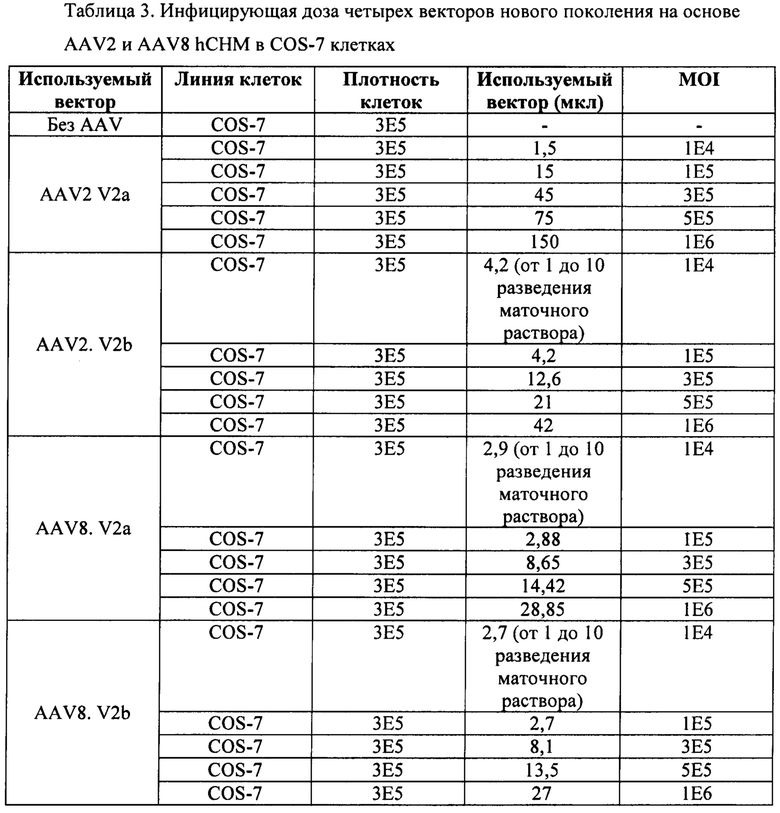

[000154] Вначале обе клеточные линии, COS7 и 84-31, использовали для определения того, является ли in vitro экспрессия СНМ независимой от клеточной линии. После того как независимость была установлена все последующие эксперименты осуществляли только на клетках 84-31, которые показали лучшую эффективность трансдукции AAV. Лунки с клетками 84-31 инфицировали векторами на основе AAV, приведенными ниже, при различных значениях MOI (см. таблицу 3 и 4).
[000155] Вестерн-блоттинг анализ: 1. Готовили клеточные лизаты. Трансдуцированные AAV клетки вместе с необработанными контрольными клетками собирали через 36-48 часов после инфицирования после тщательного промывания PBS. Клетки затем лизировали на льду с использованием RIPA буфера с ингибиторами протеазы. Клеточные лизаты расщепляли посредством центрифугирования при 13000 об./мин. в течение 10 мин. 2. Количественное определение и получение белков. Количественное определение белков в клеточных лизатах осуществляли с использованием набора для анализа белка ThermoFisher Micro ВСАТМ Protein Assay Kit, следуя инструкциям производителя. Концентрацию белка определяли посредством получения данных считывания OD (оптическая плотность) при 562 нм. Для оценки in vitro экспрессии СНМ 40-60 мкг подвергающегося измерению белка загружали на гели с 4-12% Bis-Tris. 3. Анализ методами SDS-PAGE и SDS-PAGE с блоттингом и Вестерн-блоттинга осуществляли в соответствии с известными протоколами. Вкратце, гели с белками переносили на нитроцеллюлозную мембрану, блокировали в молоке и инкубировали с первичными антителами. Антитело 2F1 к человеческому REP-1 (2F1, разведение 1:1000) и одно из следующих: антитело к GAPDH (разведение 1:1000), антитело к актину (разведение 1:1000) или антитело к тубулину (разведение 1:5000); использовали в качестве первичных антител для каждого блота. После промывания блота конъюгированное с HRP антитело к мышиному IgG и/или антитело к кроличьему IgG в концентрации 1:5000 использовали в качестве вторичных антител. Блоты проявляли с помощью хемолюминисценции при использовании ECL реактивов в соответствии с инструкциями производителя. Контроли: 1. Загрузочные контроли: Одно из следующих: антитело к актину, антитело к тубулину или антитело к GAPDH использовали в качестве загрузочного контроля для демонстрации равной загрузки белка в каждую лунку гелей. Антитело к тубулину выявляет белок с молекулярной массой ~51 кДа. Антитело к актину выявляет белок с молекулярной массой ~42 кДа, и антитело к GAPDH выявляет белок с молекулярной массой ~39 кДа. Первоначальные блоты метили или антителом к тубулину, или антителом к актину, или антителом к GAPDH в зависимости от их доступности. После первоначальных экспериментов для обеспечения согласованности антитело к GAPDH использовали в качестве загрузочного контроля. 2. Положительный контроль: После установления продуцирования белка hREP-1 в трансдуцированных AAV2. V2a клетках COS-7 лизаты клеток AAV2.V2a-Cos-7 использовали в качестве положительного контроля в последующих экспериментах с Вестерн-блоттингом. 3. Отрицательный контроль: Необработанные клетки использовали в качестве отрицательного контроля. Результаты анализов методом Вестерн-блоттинга, показывающие продуцирование белка REP-1 в различных клеточных линиях, кратко изложены в таблице. 5.
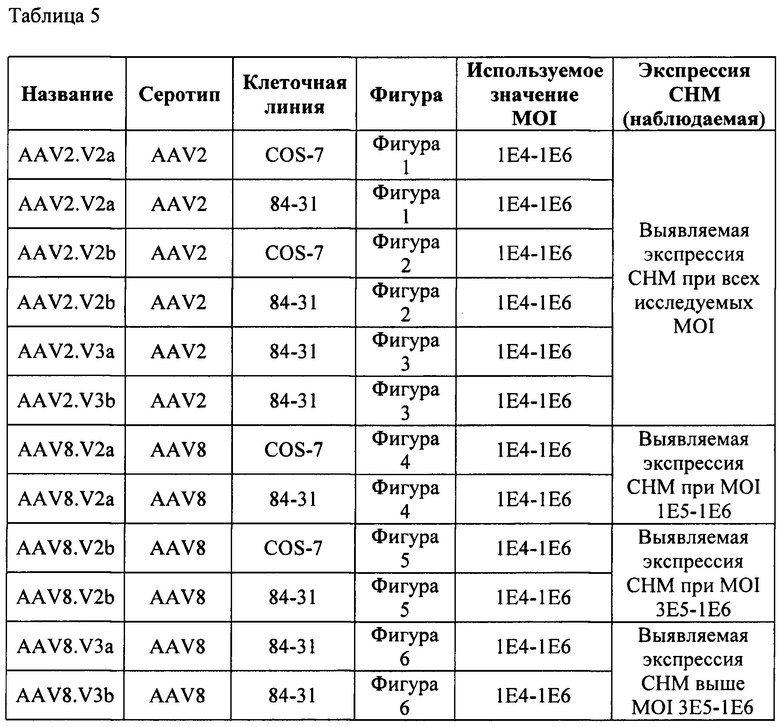
[000156] Моноклональное антитело, специфичное в отношении человеческого REP-1, выявляло один единственный белок hREP-1 с молекулярной массой ~75-80 кДа в клетках, трансдуцированных AAV2.copt.CHM/ AAV8.copt.CHM нового поколения. Полоска, соответствующая 75-80 кДа, не наблюдалась в клеточных лизатах необработанных контрольных клеток. Зондирование блотов любым из антител к актину/к тубулину/к GAPDH показывало полоску равной плотности на всех дорожках Вестерн-блота, в том числе у необработанных контролей. Антитело к актину выявляло полоску, соответствующую белку с молекулярной массой ~42 кДа, антитело к тубулину выявляло белок с молекулярной массой ~51 кДа, и антитело к GAPDH выявляло белок с молекулярной массой ~39 кДа. Все антитела выявляли только специфические полоски, соответствующие ожидаемой величине молекулярной массы. Отсутствие неспецифических полосок наблюдалось у любого из блотов. Предварительно окрашенный маркер молекулярной массы использовали для сравнения молекулярных масс белка, представляющего интерес.
[000157] Вкратце, наблюдали белок REP-1 ожидаемого размера в клетках COS-7 и 84-31, трансдуцированных AAV2.V2a, AAV2.V2b, AAV2.hCHM.V3a и AAV2.hCHM.V3b. Необработанные контроли не выявляли присутствия ожидаемого размера человеческого белка REP-1. Мечение блота антителом к актину выявляло полоску равной интенсивности во всех дорожках геля, соответствующую белку с молекулярной массой ~42 кДа. «Лесенку» молекулярных масс белков из предварительно окрашенных фрагментов белка использовали для сравнения молекулярных масс REP-1 и актина. Данные не показаны.
[000158] Результаты указывают на то, что векторы на основе серотипа AAV2 и AAV8, содержащие плазмиды нового поколения, способны к эффективной трансдукции клеток 84-31 и COS-7. Экспрессия СНМ в плазмидах нового поколения находилась в выявляемом диапазоне и демонстрировала дозозависимую тенденцию. Трансдукция клеток вирусами нового поколения с hCHM приводила в результате к продуцированию белка REP-1 прогнозированного размера.
[000159] Пример 5. Сравнение in vitro экспрессии белка с AAV с оптимизированным по кодону человеческим СНМ и AAV с нативным человеческим СНМ
[000160] Цель этого исследования заключалась в определении эффективности трансдукции векторами на основе AAV (серотип 2 и 8), содержащими различные варианты кассет с СНМ-содержащим трансгеном, посредством измерения уровней белка REP-1 в модели исследования на основе линии клеток 84-31.
[000161] Плазмиды и векторы: Всего 5 плазмид с трансгеном сравнивали либо в AAV2, либо в AAV8: Вариант 1 (ранее используемый в проводимом клиническом испытании) и четыре варианта нового поколения (V2a, V2b, V3a и V3b). Плазмиды конструировали, как описано в примере 4, и их характеристики показаны в таблице 1. В таблице 2 выше показано краткое описание созданных векторов на основе AAV2 и AAV8 и концентрации маточных растворов вирусов.
[000162] План исследования (например, группы обработки)
[000163] 1. В пробном эксперименте клетки COS-7 и 84-31 трансдуцировали вариантом 1, вариантом 2а и вариантом 2b AAV2.hCHM. Вестерн-блоттинг осуществляли для сравнения уровней эффективности трансдукции в двух линиях клеток.
[000164] 2. Клетки 84-31, высеянные в 6-луночных планшетах, трансдуцировали одним из 10 исследуемых препаратов (вариант 1, 2а, 2b, 3а и 3b в контексте либо AAV2, либо AAV8) со значением MOI, составляющим 3Е5. Спустя 36-48 часов клетки собирали и лизировали. Лизат загружали на SDS-PAGE и подвергали дополнительным анализам методом Вестерн-блоттинга. Уровни белка REP-1 сравнивают у всех вариантов конструкции. Два отдельных планшета использовали для каждого из экспериментов с AAV2.CHM или AAV8.CHM и результаты анализировали отдельно.
[000165] Введение исследуемого материала
[000166] 3.4.1 Клеточная культура
[000167] И клетки 83-41, и клетки COS-7 культивировали в среде Игла в модификации Дульбекко (DMEM) с высоким содержанием глюкозы с 10% фетальной бычьей сыворотки и 1% пенициллина/стрептомицина при 37°С в окружающей среде, дополненной 5% CO2.
[000168] 3.4.2 Получение клеток для трансдукции:
[000169] За сутки до трансдукции (за 18-24 часа) клетки 83-41 и COS-7 высевали с плотностью 3Е5 в 2 мл среды культивирования клеток на лунку в 6-луночной чашке для культивирования клеток. Высеянные клетки инкубировали при 37°С в окружающей среде, дополненной 5% CO2.
[000170] 3.4.3 Трансдукция:
[000171] Лунки с клетками 84-31 и Cos-7 инфицировали векторами на основе AAV, которые описаны ниже, со значением MOI, составляющим 3Е5 (см. таблицу 6 для пробного эксперимента и таблицу 7 для второго набора экспериментов). Вирус не добавляли к отрицательному (нетрансдуцированному) контролю. Вкратце, вначале среду для культивирования ткани удаляли и заменяли на 2 мл свежей среды/лунка в каждой из лунок в 6-луночной чашке для культивирования клеток. Затем, предварительно определенное количество вектора на основе AAV (см. таблицу 2 для объемов вектора, используемых для трансдукции) измеряли (из маточного раствора) и добавляли напрямую в каждую лунку. Клетки инкубировали с вирусом AAV в течение 36-48 часов при 37°C с 5% CO2 до момента сбора. Клетки наблюдали под микроскопом перед сбором для проверки в отношении какой-либо аномалии. Анализ методом Вестерн-блоттинга осуществляли, как описано в примере 4.
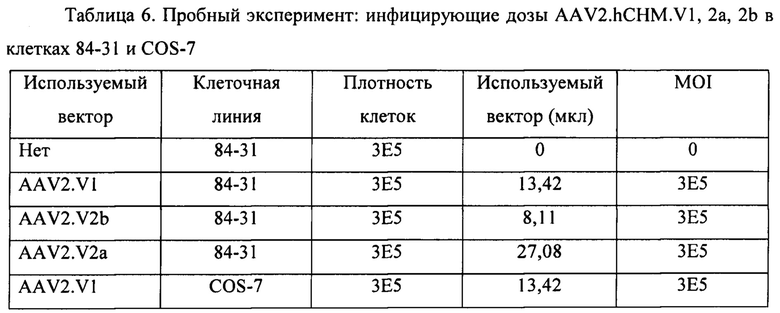

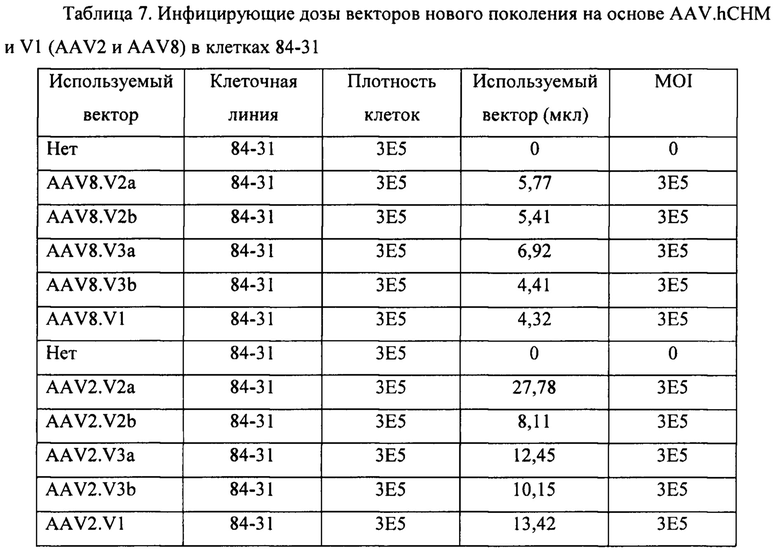
[000172] Результаты: сравнение экспрессии нативного hCHM (AAV2.hCHM.V1) и оптимизированного по кодону СНМ векторами на основе AAV2a и 2b в клетках 84-31 и COS-7
[000173] В этом эксперименте клетки 84-31 и COS-7 либо не трансдуцировали вектором (необработанный контроль), либо трансдуцировали AAV2.hCHM.вариант 1, AAV2.hCHM.вариант 2а или Aav2.hCHM.вариант 2b. Анализ методом Вестерн-блоттинга с использованием антитела к человеческому REP-1 показал, что уровни белка REP-1 выявлялись при значении молекулярной массы ~75-80 кДа во всех трансдуцированных AAV2 (V1, V2a, V2b) образцах и в обеих клеточных линиях (данные не показаны). Немного лучшая экспрессия белка наблюдалась в клеточной линии 84-31 (таблица 8). Антитело к REP1 выявляло незначительное количество белка REP-1 в необработанных клетках. Мечение блота антителом к GAPDH выявляло полоску, соответствующую молекулярной массе ~39 кДа, во всех клеточных лизатах, в том числе необработанных клетках.
[000174] Денситометрическая оценка (количественное определение уровня белка) блотов с использованием программного обеспечения ImageJ демонстрировала, что после нормализации значений к экспрессии эндогенного белка GAPDH эффективность трансдукции была подобной у клеток 84-31 и COS-7. (См. таблицу 8 для результатов.) Исходя из этого, клеточную линию 84-31, которая имеет человеческое происхождение, использовали для дальнейших экспериментов.
[000175] В заключение, AAV2.V1, AAV2.V2a и Aav2.V2b индуцировали продукцию белка REP-1 как в клетках 84-31, так и в клетках COS-7 с подобной эффективностью трансдукции.
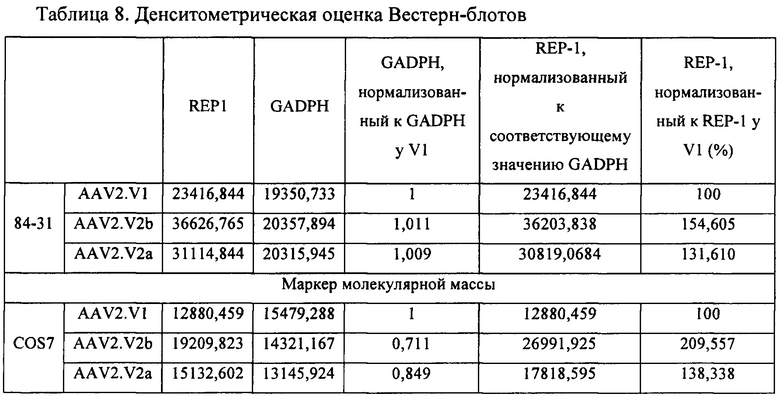
[000176] Сравнение экспрессии нативного СНМ и оптимизированного по кодону СНМ векторами на основе AAV2 в клетках 84-31: При использовании антитела к человеческому REP-1 анализ методом Вестерн-блоттинга клеток 84-31, трансдуцированных AAV2.hCHM.V2a, V3a, V2b, V3b и V1, выявил полоску, соответствующую молекулярной массе ~75-80 кДа, во всех условиях (данные не показаны). Антитело к REP1 выявляло незначительное количество белка REP-1 в необработанных клетках. Мечение блота антителом к GAPDH выявляло полоску, соответствующую молекулярной массе ~39 кДа, во всех клеточных лизатах, в том числе необработанных клетках. Денситометрическая оценка (количественное определение уровня экспрессии) блотов с использованием программного обеспечения ImageJ демонстрировала повышение экспрессии AAV2.hCHM.V2a, 3а, 2b и 3b по сравнению с AAV2.hCHM.V1 после нормализации значений к продуцированию эндогенного белка GAPDH. См. таблицу 9 и 10 для результатов.
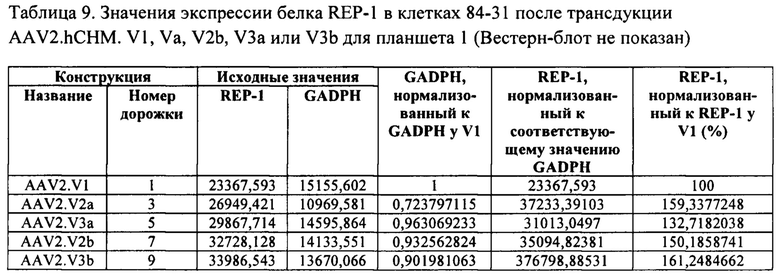
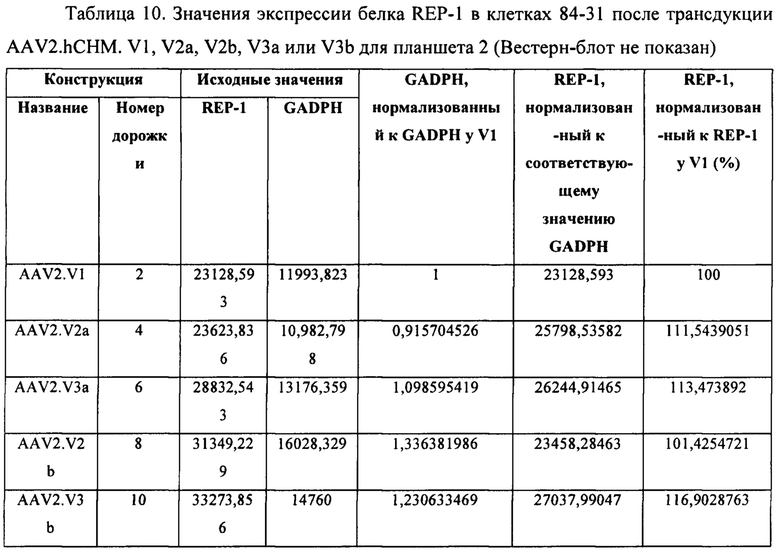
[000177] Сравнение экспрессии нативного СНМ и оптимизированного по кодону СНМ в векторах на основе AAV8.V1, V2a, V3a, V2b, V3b в клетках 84-31: Анализ методом Вестерн-блоттинга клеток, трансдуцированных AAV8.V1, AAV8.V2a, AAV8.V3a, AAV8.2b, AAV8.3b, с использованием антитела к человеческому REP-1 выявил полоску, соответствующую молекулярной массе ~75-80 кДа, во всех трансдуцированных клетках (данные не показаны). Антитело к REP1 выявляло незначительное количество белка REP-1 в необработанных клетках. Мечение блота антителом к GAPDH выявляло полоску, соответствующую молекулярной массе ~39 кДа, во всех клеточных лизатах, в том числе необработанных клетках. Денситометрическая оценка блотов с использованием программного обеспечения ImageJ демонстрировала более высокую экспрессию AAV8.hCHM.V2a; 3а; 2b; 3b по сравнению с AAV8.V1. Значения получают после нормализации значений СНМ сначала к экспрессии соответствующего эндогенного белка GAPDH, и затем их нормализуют к уровню экспрессии, среднему для варианта 1. См. таблицу 11 и таблицу 12 для результатов.
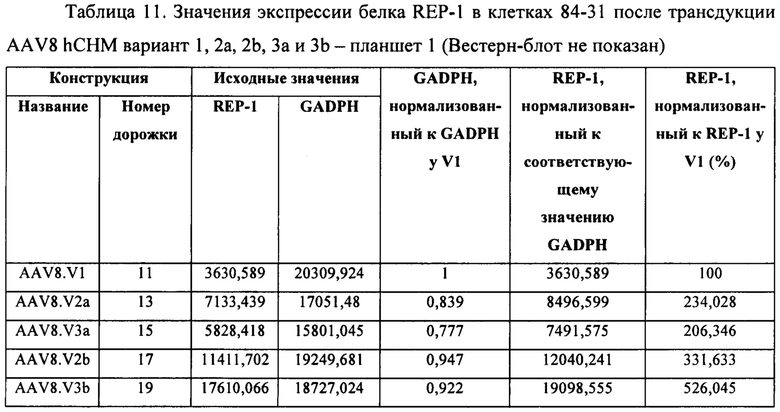
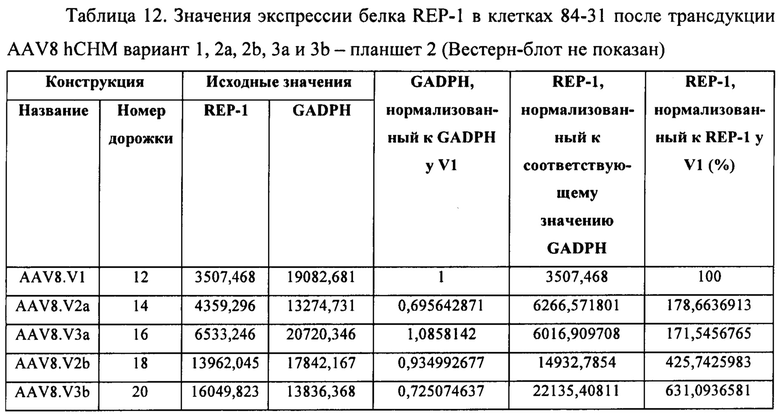
[000178] Вывод: сравнительные исследования экспрессии продемонстрировали, что применение векторов на основе AAV, несущих AAV.hCHM. вариант 2а, 2b, 3а и 3b нового поколения, индуцировало повышенную продукцию белка REP-1 по сравнению с вариантом 1 (в настоящий момент используемым в клинических испытаниях) векторов на основе обоих серотипов AAV2 и AAV8 в клетках 84-31.
[000179] Пример 6. Оценка эффекта лямбда-спейсера на продуцирование вектора на основе AAV посредством анализа титра с помощью qPCR
[000180] Один раунд qPCR (количественная полимеразная цепная реакция) осуществляли на всех 8 векторах на основе AAV, показанных в таблице 2 выше, с целью оценки эффекта лямбда-спейсерных последовательностей в отношении количества примесей ДНК. Стандарт в виде линеаризованной плазмиды на основе AAV использовали для создания стандарта для анализа. Наборы праймеров-зондов конструировали либо на основе промоторного участка CMV/CBA для количественного определения правильно упакованного генома AAV, либо на основе кодирующего участка гена, придающего устойчивость к канамицину (KanR), для обратной упаковки. Стандарты и образцы вектора изучали в двух наборах, один с набором праймер-зонд CMV/CBA, а другой с набором KanR. Значения для образцов векторов (количество копий геномов вируса на мл) определяли, исходя из каждой соответствующей стандартной кривой. Эффект спейсерной последовательности оценивали посредством сравнения относительного количества содержащих KanR примесей в каждой партии вектора с последовательностями, содержащими CMV/CBA.
Реактивы:
Титр содержащего трансген вирусного вектора:
Стандарт: Промотор CMV-CBA
Праймеры: CMV-F: ССС ACT TGG CAG ТАС АТС АА
CMV-R: GCC AAG TAG GAA AGT ССС ATA А
FAM-зонд: /56-FAM/CA ТАА TGC C/ZEN/A GGC GGG CCA ТТТ AC/3IABkFQ/
Титр содержащего примеси вирусного вектора:
Стандарт: Ген, придающий устойчивость к канамицину
Праймеры:
KAN-F: GAT GGT CGG AAG TGG CAT АА
KAN-R: TGC GCC AGA GTT GTT ТСТ
FAM-зонд: /56-FAM/CC GTC AGC C/ZEN/A GTT TAG ТСТ GAC CA/3IABkFQ/
Разбавляющий реактив: Разбавитель Q (0,001% PF-68 в не содержащей нуклеаз воде): Разбавленный 1000-кратно стерильной водой 1% раствор PF-68. Разбавитель S: Разбавитель Q+2 нг/мкл ДНК спермы лосося (Agilent technologies, кат. №201190)
Универсальный мастер-микс ABI TaqManTM Universal Master Mix (Applied Biosystems 4304437/4326708)
Набор для очистки ПЦР продукта Qiagen PCR Product Purification Kit (Qiagen 28104)
 Система ABI QuantStudio 6 Flex System
Система ABI QuantStudio 6 Flex System
[000181] ПРИГОТОВЛЕНИЕ ОБРАЗЦА
Раствор для расщепления ДНКазой готовили посредством объединения следующего: буфер для ДНКазы (10Х) 5 мкл, не содержащая нуклеазы H2O 30 мкл, ДНКаза I (Invitrogen, 18068-015) 5 мкл
[000182] Десять мкл каждого образца вектора на основе AAV смешивали и инкубировали при температуре окружающей среды в течение 10 минут. Смесь продуктов расщепления инактивировали посредством добавления 50 мкл раствора SDS/EDTA/NaCl (0,2% SDS/5 мМ EDTA/0,2 М NaCl) и инкубирования при 95°С в течение 10 минут. Каждый образец вектора на основе AAV разводили в 10-100000 раз в разбавителе S для анализа методом qPCR.
[000183] ПРИГОТОВЛЕНИЕ СТАНДАРТА ДЛЯ qPCR
[000184] Эталонный стандарт ДНК (линеаризованной) готовили посредством расщепления плазмиды р1008 (низкое количество копий плазмиды с трансгеном без спейсера) с использованием XhoI и очистки с использованием набора для очистки ПЦР продуктов Qiagen PCR purification kit. Очищенный материал анализировали на агарозном геле для подтверждения идентичности и количественно определяли с помощью метода Nanodrop. Количество копий ДНК определяли, исходя из концентрации маточного раствора, с использованием следующего равенства: 1 п.о. = 1,096Е-21 g. Стандарты для qPCR готовили согласно следующей таблице:


[000185] Условия для ПЦР реакции
[000186] Образцы экстрагированной ДНК анализировали в трех параллелях (3 лунки) в одном раунде qPCR. Раунд включал эталонные стандарты ДНК в трех параллелях в диапазоне от 103 до 108 копий на лунку. Контроль без матрицы (NTC) был включен в качестве отрицательного контроля. Каждый препарат вектора на основе AAV анализировали с использованием наборов праймеров/зондов как для CMV/CBA, так и для KanR. Аналогичным образом, для количественного определения каждого набора стандарты также анализировали с использованием наборов праймеров/зондов как для CMV/CBA, так и для KanR.
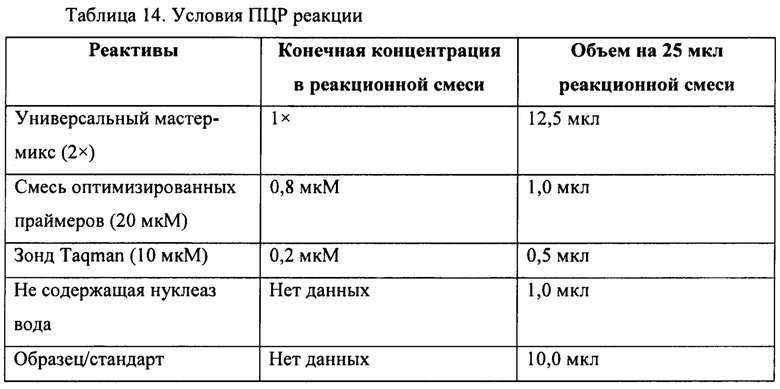
[000187] Последовательность ПЦР реакции устанавливали следующим образом: 50°С 2 минуты 1 цикл; 95°С 10 минут 1 цикл; 95°С 15 секунд 40 циклов; 60°С 1 минут 40 циклов
[000188] Характеристика раунда. Стандарты готовили и изучали при количестве 103-108 копий ДНК на лунку. Нижний предел анализа устанавливали на 1000 копий, поскольку чувствительность не являлась важным фактором для этого эксперимента. Стандартную кривую получали для раунда с использованием стандартных количеств копий и значений СТ (пороговых циклов) для стандартов. Линейную регрессию для стандартов выполняли с использованием программного обеспечения ABI (данные не показаны). Подобранная стандартная кривая имела коэффициент корреляции (значение R2), составляющий 0,998 или более, указывая надежную модель подбора. Угол наклона стандартных кривых составлял -3,5. Угол наклона использовали для расчета эффективности реакции амплификации, и значения от -3,2 до -3,6 отображали эффективность амплификации от 90% до 110%. Обе стандартные реакции проходили с эффективностью 92,6~93,8%. Погрешность в трех параллельных лунках находилась в диапазоне от 2~10%, указывая на хорошее соответствие между параллелями. Контроль без матрицы (NTC) давал в результате не определяемую количественно амплификацию ниже нижнего предела анализа.
[000189]

[000190] РЕЗУЛЬТАТЫ:
[000191] Определение значения для образца: Значения для образца (геном AAV и количество копий для обратной упаковки) интерполировали из каждой соответствующей стандартной кривой (CMV/CBA или KanR) с использованием значений СТ. Полученное интерполяцией количество копий ДНК корректировали с учетом первоначального разведения и/или разведения продуктов расщепления. Дополнительный корректирующий коэффициент 2 применяли для учета различия между стандартами двухцепочечной ДНК и одноцепочечной ДНК в образцах.
[000192] Результаты анализа для 8 векторов на основе AAV кратко изложены в таблице ниже с количественным сравнением между концентрацией содержащего трансген AAV (CMV/CBA) и концентрацией содержащих KanR примесей. Анализ результатов демонстрирует, что вставка лямбда-спейсера в плазмиду с трансгеном эффективно снижала частоту определения ДНК остова плазмиды (т.е. KanR), упакованной во время продуцирования AAV, ~7-20-кратно (фиг. 11).
[000193]
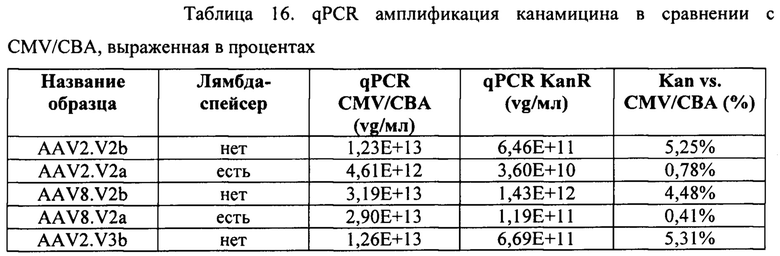

[000194] Пример 6. In vitro экспрессия векторов нового поколения на основе AAV8 в iPS клетках с помощью Вестерн-блоттинга.
[000195] Целью данного исследования являлась оценка возможности опосредованной AAV экспрессии СНМ после доставки гена с использованием ряда векторов нового поколения на основе AAV2 и AAV8, несущих оптимизированный по кодону REP-1, кодирующий ген в индуцированных плюрипотентных клеточных линиях (iPSC).
[000196] Технология индуцированных плюрипотентных стволовых клеток (iPS) успешно использовалась в качестве платформы для исследования векторов для генной терапии в нескольких исследованиях для экспериментальной проверки концепции и исследованиях генной терапии, в том числе заболеваний глаза. Эти специфические к пациенту клетки iPS обеспечивают ценную модельную систему in vitro для изучения патогенеза заболевания и создания модели для экспериментальной проверки концепции генной терапии, когда соответствующие модели на животных недоступны. В качестве подготовительной стадии для исследования данной опосредованной AAV дополняющей генной терапии для хороидеремии (СНМ) авторы настоящего изобретения получили iPS клетки от пациентов-людей, несущих мутации в гене, вызывающем заболевание, СНМ, который кодирует Rab-эскорт белок 1 (REP-1) (см. пример 1) (способ описан в NCP.003). Полученные iPS клетки использовали для оценки in vitro экспрессии данных конструкций нового поколения на основе AAV с оптимизированным по кодону СНМ.
[000197] Плазмиды и векторы были такими, как описано в примере 4. Индуцированные плюрипотентные стволовые клетки (iPS) представляют собой стволовые клетки, получаемые в лабораторных условиях из соматических клеток, мононуклеарных клеток периферической крови, которые подверглись обратному перепрограммированию в плюрипотентное состояние. Перепрограммирование клеток крови обеспечивает возможность разработки индивидуальных клеточных моделей in vitro для терапевтических применений. В этом сообщении, iPS клетки от индивидов, пораженных СНМ, использовали для исследования in vitro продуцирования белка REP-1 с помощью анализа методом Вестерн-блоттинга. В следующей таблице (таблица 17) описываются детали для изучаемых iPS клеток и их соответствующие мутации СНМ, вызывающие мутации.
[000198]
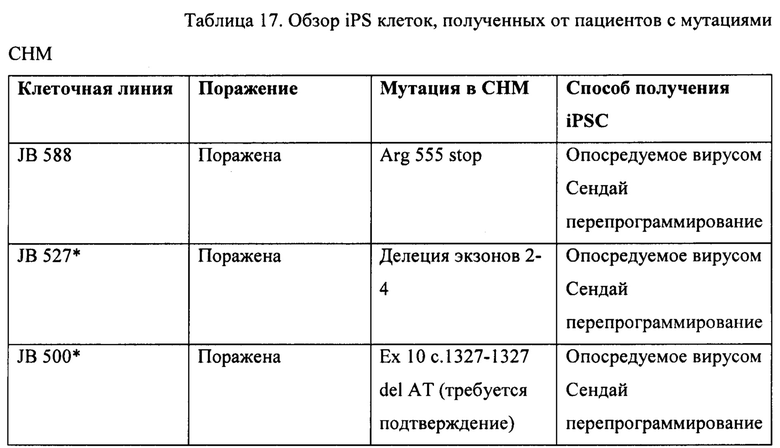
* квалификационные испытания линии iPS клеток проходят в настоящее время.
[000199] План исследования (например, группы обработки)
[000200] 1. iPS клетки, высеянные на 12-луночный планшет для культивирования клеток инфицируют AAV2. hCHM вариант 1, вариант 2а; вариант 2b; вариант 3а; вариант 3b (AAV2.V1; V2a; V2b; V3a; V3b) со значением MOI, составляющим либо 1Е5, либо 3Е5. Через 24 часа трансдукции 1 мл среды культивирования iPS клеток добавляли к клеткам. Через 36-48 часов трансдукции клетки собирали, лизировали и подвергали обработке для SDS-PAGE с последующий анализом методом Вестерн-блоттинга. Продукцию белка REP-1 оценивали в клетках, трансдуцированных всеми вариантами конструкций, и сравнивали с необработанными контролями.
[000201] 2. В качестве пробного эксперимента три разных линии iPS клеток, высеянных на 12-луночный планшет для культивирования клеток, трансдуцируют AAV8. hCHM вариант 1 и AAV8. hCHM вариант 2а (AAV8.V1; AAV8.V2a) со значением MOI, составляющим 1Е6. Линии iPS клеток получали от трех пораженных СНМ индивидов с несвязанными мутациями в гене REP1 и помещали в отдельные планшеты для для этой цели. Спустя 36-48 часов клетки собирали, лизировали и подвергали анализам методом Вестерн-блоттинга и сравнивали с лизатом необработанных клеток.
[000202] Введение исследуемого материала
[000203] 3.4.1 Клеточная культура
[000204] Культивирование iPS клеток от СНМ пациента. Вкратце, iPS клетки культивировали на мышиных эмбриональных фибробластах (MEF, фидеры) в среде культивирования iPS при 37°С в окружающей среде, дополненной 5% CO2 и 5% O2.
[000205] 3.4.2 Получение клеток для трансдукции
[000206] За сутки до высевания клеток 12-луночные чашки покрывали Matrigel, как описано в источнике NCP.003 (NCP.003: Культивирование iPS клеток от СНМ пациента и контролен). Перед трансдукцией iPS клеток соответствующими вирусными векторами на основе AAV2 или AAV8 клетки, которые культивируют на MEF, высевали на Matrigel без MEF (безфидерное культивирование). Клетки высевали с плотностью от 4,5+Е5 до 6+Е5 в 1 мл среды культивирования iPS клеток в каждой лунке 12-луночной чашки для культивирования клеток. Высеянные клетки инкубировали при 37°С в окружающей среде, дополненной 5% CO2, 5% O2.
[000207] 3.4.3 Трансдукция
[000208] Для инфицирования iPS клеток вирусными векторами клетки выращивали до примерно 50-60% конфлюентности. (Это может занять 2-4 суток в условиях отсутствия фидерных клеток). После достижения 50-60% конфлюентности содержимое одной лунки из 12 лунок подвергали диссоциации, и подсчет количества клеток осуществляли для определения общего количества клеток на лунку. Лунки с iPS клетками затем инфицировали векторами на основе AAV, приведенными ниже, с предварительно определенными значениями MOI (см. таблицу 18 и 19). Перед трансдукцией старую среду культивирования iPS клеток из планшетов удаляли и 1 мл свежей среды культивирования iPS клеток добавляли в каждую лунку. Предварительно определенные объемы вируса из маточного раствора добавляли напрямую в каждую лунку. См. таблицу 18. и таблицу 19. Для информации об общем количестве инфицированных клеток, MOI и объеме вируса, используемого для инфицирования. Клетки затем инкубировали при 37°С в окружающей среде, дополненной 5% CO2, 5% O2, в течение 18-24 часов. Через 18-24 часа трансдукции клетки наблюдали под микроскопом для определения каких-либо аномалий или гибели клеток. В этот момент еще 1 мл свежей среды культивирования iPS клеток добавляли в каждую лунку, содержащую инфицированные и неинфицированные клетки, и их подвергали дальнейшему инкубированию в течение дополнительных 18-24 часов при 37°С в окружающей среде, дополненной 5% CO2, 5% O2. Клетки наблюдали под микроскопом перед сбором для оценки каких-либо признаков гибели клеток или аномального внешнего вида.
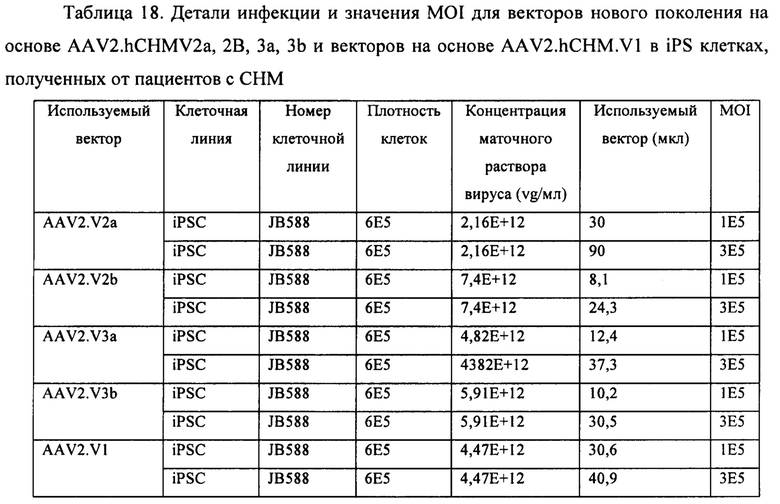
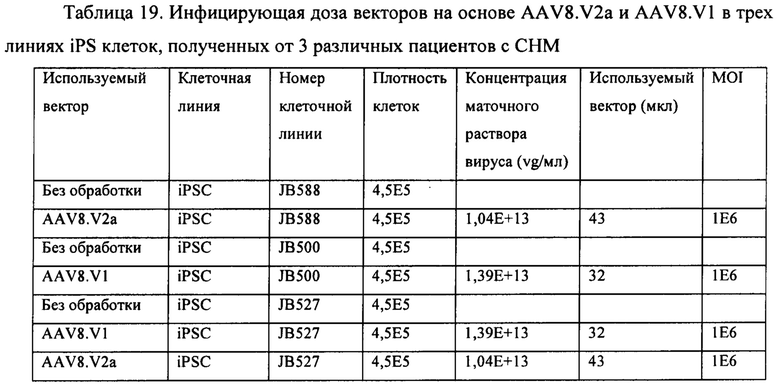
[000209] Результат способа измерения - анализ методом Вестерн-блоттинга осуществляли, как описано в данном документе.
[000210] Результаты
[000211] 5.1 Экспрессия AAV2- hCHM V1, V2a, V2b, V3a, V3b в линии iPS клеток JB588: Моноклональное антитело, специфичное в отношении человеческого REP-1, выявляло один единственный белок hREP-1 с молекулярной массой ~75-80 кДа в трансдуцированных iPS клетках JB 588 (данные не показаны). Отсутствие полоски наблюдали в случае необработанного контроля, что подтверждало наличие заболевания (данные не показаны). Наблюдали, что интенсивность полоски белка REP-1 при значении MOI, составляющем 3Е5, была большей у всех векторов по сравнению со значением MOI, составляющим 1Е5. Опосредованная рекомбинантным вирусом AAV2. hCHM доставка гена hCHM в iPS клетки приводила в результате к дозозависимому продуцированию белка REP-1. Мечение блотов антителом к GAPDH показало полоску с равной плотностью во всех лизатах. GAPDH выявило белок с молекулярной массой ~39 кДа. Антителами как к REP-1, так и к GAPDH выявлялись только специфические полоски с ожидаемой молекулярной массой. Отсутствие неспецифических полосок наблюдалось у блотов.
[000212] Экспрессия AAV8-hCHM. V1, V2a в iPS клетках: Моноклональное антитело, специфичное в отношении человеческого REP-1, выявляло один единственный белок REP-1 с молекулярной массой ~75-80 кДа в трансдуцированных полученных от пациентов iPS клетках JB527, JB500 и JB588 (данные не показаны). Отсутствие полоски наблюдали в случае необработанного контроля. (Данные не показаны). Мечение блотов антителом к GAPDH показало полоску с равной плотностью во всех клеточных лизатах, в том числе в клеточных лизатах из необработанных клеток. Антитело к GAPDH выявляло специфическую полоску, соответствующую белку с молекулярной массой ~39 кДа. Антителами как к REP-1, так и к GAPDH выявлялись только специфические полоски, соответствующие белкам с ожидаемой молекулярной массой. Никаких выявляемых неспецифических полосок, соответствующих белку, не наблюдалось у блота.
[000213] Выводы
[000214] Предварительные результаты, представленные в данном отчете, выявило следующие наблюдения: Анализ методом Вестерн-блоттинга подтверждал присутствие СНМ (отсутствие белка REP-1) в каждой из трех полученных от пациентов линий iPSC (JB588, JB500, JB527). Исследования экспрессии in vitro демонстрировали, что инфицирование iPS клеток от пациентов с СНМ AAV2.hCHM. вариант 2а, 2b, 3а, 3b и AAV2.hCHM вариант 1 (кандидат, проходящий в настоящее время клинические испытания) индуцировало продукцию белка REP-1 при всех изучаемых значениях MOI. Инфицирование iPS клеток AAV8.hCHM.вариант 2а и AAV8.hCHM вариант 1 при значении MOI, составляющем 1Е6, приводило в результате к продукции белка REP 1 во всех трех линиях iPS клеток с СНМ. Уровень продуцирования REP1 был выше у iPSC, инфицированных AAV8.hCHM.V2a, чем у инфицированных AAV8.hCHM.V1.
[000215] Пример 7. Сравнение in vivo экспрессии AAV8 с оптимизированным по кодону человеческим СНМ в сравнении с AAV с нативным человеческим СНМ
[000216] Генная терапия для ряда заболеваний сетчатки зависит от эффективной трансдукции соответствующих клеток-мишеней, которые в случае хороидеремии представляют собой клетки пигментного эпителия сетчатки (RPE) и фоторецепторные клетки. Отчет об этом исследовании фокусируется на сравнении экспрессии in vivo, индуцируемой конструкцией на основе нативной последовательности СНМ (вариант 1) и четырьмя кассетами с трансгеном нового поколения, упакованными в остов AAV8, у мышей дикого типа. В данном случае авторами настоящего изобретения оценивался серотип AAV8 с целью улучшения переноса генов в фоторецепторные клетки.
[000217] Цель данных экспериментов заключалась в поиске ответов на следующие вопросы: а. как сравнить эти векторы в отношении in vivo трансдукции фоторецепторов. В частности, как эффективно AAV8.CHM нового поколения будут трансдуцировать фоторецепторы после субретинальной инъекции соответствующего исследуемого препарата по сравнению с вариантом 1. b. Дозозависимый эффект. Будут ли векторы нового поколения на основе AAV8. СНМ и AAV8. СНМ-вариант 1 отличаться дозозависимым эффектом в отношении генной экспрессии.
[000218] Детали эксперимента:
[000219] Плазмиды и векторы были такими, как описано в примере 4. Мыши (животные): CD1 мышей дикого типа использовали для исследования in vivo экспрессии СНМ, которую оценивали по продукции белка REP-1. Линия мышей CD1 представляет собой аутбредную линию Swiss, колонию которых авторы настоящего изобретения содержат для внутрилабораторного использования. Подробности исследования описаны в протоколе исследования CAROT PCPR02.01.
[000220] 3.3 План исследования (например, группы обработки)
[000221] 3.3.1 Содержание животных: Как самцам, так и самкам мышей (возрастом ~3-4 месяца) массой ~20-30 г вводили инъекцией описанные исследуемые препараты. Животных содержали в виварии Центре ресурсов лабораторных животных университета Джона Моргана при университете Пенсильвании (University of Pennsylvania's John Morgan University Laboratory Animal Resources (ULAR)) в соответствии с правилами ULAR при университете Пенсильвании. Мышей поддерживали при цикле чередования 12 часов света/12 часов темноты. Корм и воду давали по потребности. Всех животных идентифицировали с использованием ушных бирок с номерами.
[000222] 3.4 Введение исследуемого материала: Состав исследуемого препарата, обеспеченный с помощью CAROT Vector Core, использовали для введения дозы. Исследуемый материал хранили при температуре от -60 до -80°С. Исследуемый материал оттаивали на льду перед дозированием. Для внутриглазных инъекций исследуемый препарат разводили до целевой концентрации фосфатно-солевым буфером, как описано для составов в таблице 20. Готовили всего 60 мкл мастер-микса.
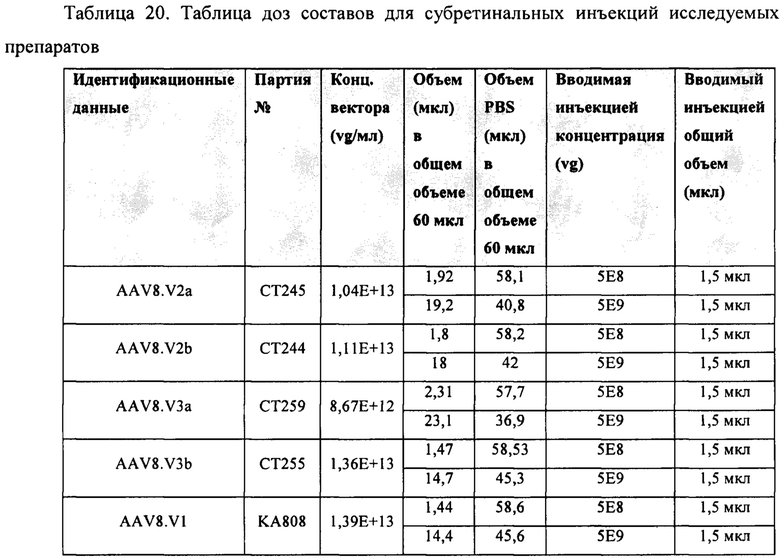
[000223] Подготовка журнала инъекций перед субретинальными инъекциями:
[000224] Журнал инъекции заполняли следующей информацией перед субретинальной инъекцией исследуемых препаратов:
 Номер клетки/номер мыши
Номер клетки/номер мыши
 Идентификационное обозначение исследования
Идентификационное обозначение исследования
 Линия
Линия
 Дата рождения
Дата рождения
 Дата инъекции
Дата инъекции
 Имя исследователя/сотрудника, выполняющего инъекцию
Имя исследователя/сотрудника, выполняющего инъекцию
 Глаз, в который производят инъекцию (левый или правый)
Глаз, в который производят инъекцию (левый или правый)
 Вводимый инъекцией материал (вектор/серотип)
Вводимый инъекцией материал (вектор/серотип)
 Доза и объем
Доза и объем
 Путь введения (ROA)
Путь введения (ROA)
[000225] Субретинальные инъекции: Инъекции осуществлялись субретинально хирургом. Вкратце, животных подвергали анестезии перед инъекцией. Субретинальную инъекцию исследуемого препарата осуществляли с использованием шприца Hamilton 33 калибра. Детали исследуемых препаратов и инъекций описаны в таблице 21. Из приготовленного мастер-микса для инъекции вводили объем 1,5 мкл на инъекцию. В один глаз животного вводили инъекцией 5Е8 vg/глаз, а в противоположный глаз вводили инъекцией 5Е9 vg/глаз.
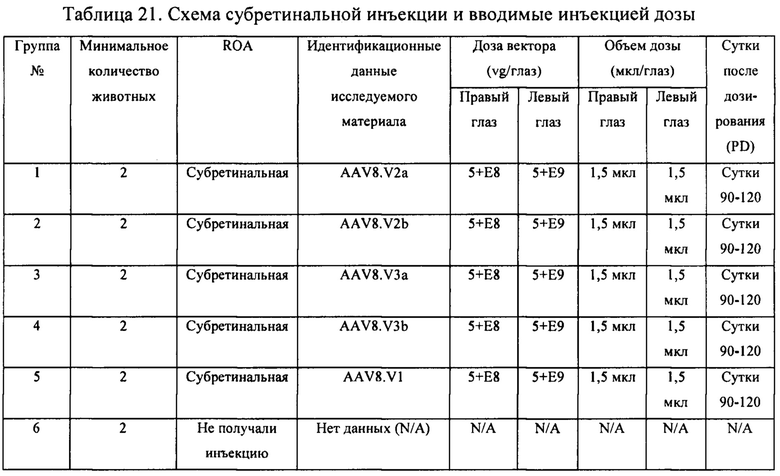
[000226] Способы измерения результатов
[000227] Умерщвление животных: а. После введения инъекцией животным тестовых препаратов за всеми животными наблюдали в течение 48 часов для выявления любых связанных с инъекцией аномалий. b. Через 21-35 суток после инъекции животных осматривали для выявления глазных аномалий с использованием офтальмоскопии, с. Через 90-12 суток после инъекции животных умерщвляли и ткани глаз собирали для оценки продуцирования экзогенного белка REP-1 с помощью SDS-PAGE с последующим анализом методом Вестерн-блоттинга.
[000228] Сбор ткани глаза: Ткань глаза для анализа методом Вестерн-блоттинга собирали после удаления хрусталика из глаза с использованием острого лезвия скальпеля. Глаз (без хрусталика) собирали в пробирки для замораживания, которые снабжают соответствующей маркировкой.
[000229] Вестерн-блоттинг анализ
[000230] Кратко: 1. Получение лизата ткани
[000231] а. Ткани глаза у животных, которым вводили инъекцией 2 разные дозы AAV8 нового поколения. СНМ и AAV8.V1 вместе с тканями контрольных животных, не получавших инъекцию, собирали через 21-35 суток после инъекции при умерщвлении животных. b. Ткани затем лизировали на льду с использованием RIPA буфера с ингибиторами протеазы.
[000232] с. Тканевые лизаты расщепляли посредством центрифугирования при 13000 об./мин. в течение 10 мин.
[000233] 2. Количественное определение и получение белков.
[000234] а. Количественное определение белков в клеточных лизатах осуществляли с использованием набора для анализа белка ThermoFisher Micro ВСАТМ Protein Assay Kit, следуя инструкциям производителя. b. Концентрацию белка определяли посредством получения данных считывания OD (оптическая плотность) при 562 нм. с. Для оценки in vivo экспрессии СНМ 20-40 мкг подвергающегося измерению белка загружали на гели с 4-12% Bis-Tris.
[000235] 3. SDS-PAGE и Вестерн-блоттинг
[000236] Гели с белками переносили на нитроцеллюлозную мембрану, блокировали в молоке и инкубировали с первичными антителами. Антитело 2F1 к человеческому REP-1 (2F1, разведение 1:1000) и/или антитело к GAPDH (разведение 1:1000) использовали в качестве первичных антител. После промывания блота конъюгированное с HRP антитело к мышиному IgG и/или антитело к кроличьему IgG в концентрации 1:5000 использовали в качестве вторичных антител. Блоты проявляли с помощью хемолюминисценции при использовании ECL реактивов в соответствии с инструкциями производителя.
[000237] 4. Контроли
[000238] а) Загрузочные контроли: антитело к GAPDH использовали в качестве загрузочных контролей для демонстрации равной загрузки белка в каждую лунку гелей. Антитело к GAPDH выявляет белок с молекулярной массой ~39 кДа. b) Положительный контроль: лизаты трансдуцированных AAV2.V2a клеток COS-7 использовали в качестве положительных контролей. с) Отрицательный контроль: ткани глаз животных, не получавших инъекций, использовали в качестве отрицательного контроля.
[000239] Определение значения для образца
[000240] Количественное определение результатов анализа методом Вестерн-блоттинга с использованием программного обеспечения Image J. Вкратце, результаты денситометрической оценки, присутствующие в данном отчете, нормализовали сначала к уровням эндогенной экспрессии белка GAPDH в соответствующем образце. Затем уровни экспрессии нормализовали снова к среднему уровню экспрессии REP-1 у контроля, не получавшего инъекций.
[000241] Детали денситометрических оценок и расчеты кратности изменения для представления экспрессии белка REP-1 представлены в виде таблицы 22 и 23.
[000242] Краткое описание:
[000243] 1. В таблице 22 и 23 в колонке 2 показаны исходные значения для белка REP-1 и в колонке 3 показаны исходные значения для белка GAPDH.
[000244] 2. Значение для GAPDH у каждого из образцов сначала нормализовали к значениям для GAPDH у животного 1 с AAV8.V1, и они показаны в таблице 22 в 4ой колонке.
[000245] 3. Значения у каждого из образцов также нормализовали к значениям для GAPDH у животного 2 с AAV8.V1, и они показаны в таблице 22 в 5ой колонке.
[000246] 4. Значения для REP-1 (колонка 2) затем нормализуют либо к GAPDH, нормализованному к животному 1 (колонка 4), либо к GAPDH, ранее нормализованному к животному 2 (колонка 5). Они представлены в колонке 6 и 7, соответственно.
[000247] 5. Нормализованные значения REP-1 затем преобразуют в кратность изменения.
[000248] 6. Соответствующие значения REP-1 нормализуют к экспрессии REP-1 либо у животного 1, либо у животного 2 в группе, получавшей инъекции AAV8.V1, и они выражены в виде кратности изменения (колонка 8 и 9)
[000249] 7. Колонка 10 представляет среднюю кратность изменения экспрессии белка REP-1.
[000250] Результаты
[000251] Сравнение экспрессии СНМ с использованием AAV8.V1 с нативным СНМ в сравнении с векторами с оптимизированным по кодону СНМ: AAV8.V2a, V2b, V3a и V3b. CD1 мышам дикого типа вводили инъекцией две различных дозы каждого вектора на основе AAV8: высокая доза 5Е9 vg/глаз и низкая доза 5Е8 vg/глаз. Следующие результаты описывают уровни белка REP 1 после инъекции высоких и низких доз AAV8.V1, AAV8.V2a и AAV8.V3a.
[000252] Сравнение экспрессии AAV8.V1 с AAV8.V2a и AAV8.V3a (векторы со спейсером) у животных, которым вводили инъекцией высокую дозу (5Е9 vg/глаз) вирусного вектора. Анализ методом Вестерн-блоттинга с использованием антитела к человеческому REP-1 выявлял полоску, соответствующую белку hREP-1 с молекулярной массой ~75-80 кДа, в тканях обоих глаз (в которые вводили инъекцией низкую и высокую дозу) каждого животного, получавшего обработку либо AAV8.V2a или V3a следующего поколения, либо исходным AAV8.вариант 1. Очень бледную (минимальную) полоску наблюдают в случае контрольных мышей, которые не получали инъекций ни в один из глаз. Полоску с повышенной интенсивностью наблюдали в тканях, которые были трансдуцированы векторами нового поколения (AAV8V.2a и AAV8.V3a), по сравнению с тканями, трансдуцированными вариантом 1. Антитела к GAPDH показывали полоску равной плотности, соответствующую молекулярной массе ~39 кДа, на всех дорожках Вестерн-блота, в том числе у контролей, не получавших инъекций. Предварительно окрашенный белковый маркер используют для сравнения молекулярных масс белка, представляющего интерес. Денситометрическая оценка (количественное определение уровня экспрессии) блотов с использованием программного обеспечения ImageJ демонстрировала, что продукция REP-1 повышалась у животных, которым вводили инъекцией один из AAV8 нового поколения. Высокие и низкие дозы конструкций (V2a или V3a). (См. таблицу 22 для значений.)
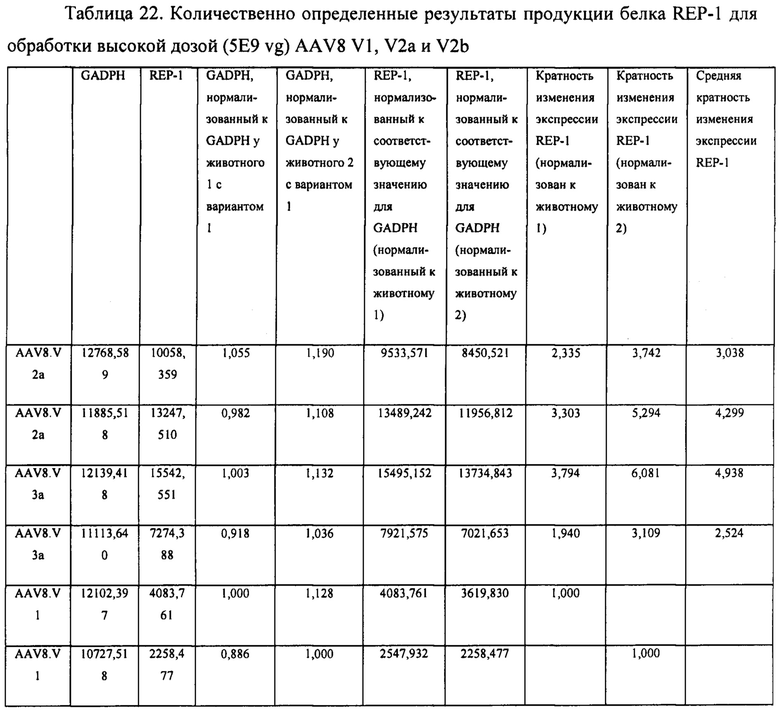
 Значения экспрессии REP-1 у необработанных животных были незначительными, исходя из значений, представленных ниже:
Значения экспрессии REP-1 у необработанных животных были незначительными, исходя из значений, представленных ниже:
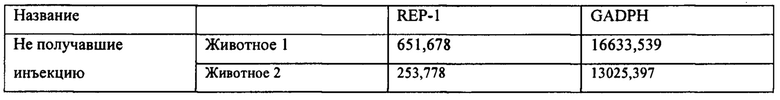
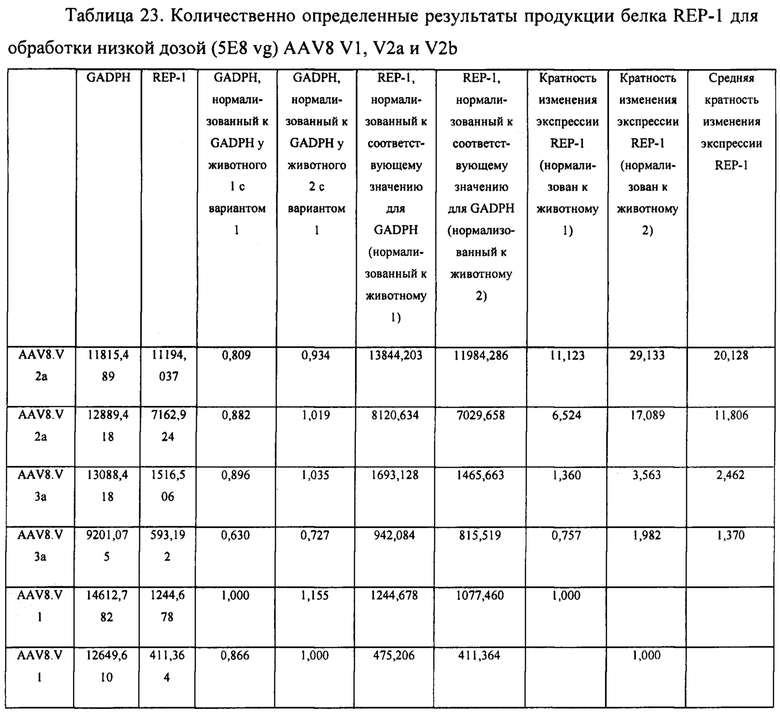
 Значения экспрессии REP-1 у необработанных животных были незначительными, исходя из значений, представленных ниже:
Значения экспрессии REP-1 у необработанных животных были незначительными, исходя из значений, представленных ниже:
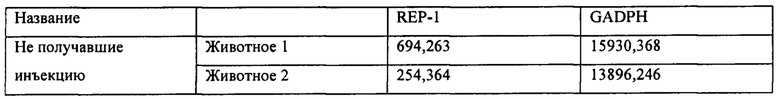
[000253] Сравнение экспрессии AAV8.V1 с AAV8.V2a и AAV8.V3a у животных, которым вводили инъекцией низкую дозу (5Е8 vg/глаз) вирусного вектора
[000254] Антитело к человеческому REP-1 при анализе методом Вестерн-блоттинга тканей глаза у животных, которым вводили инъекцией AAV8.V2a, V3a нового поколения и AAV8.вариант 1 в дозе, составляющей 5Е8, выявляло полоску, соответствующую белку hREP-1 с молекулярной массой ~75-80 кДа, в тканях инфицированных мышей. Бледную (минимальную) полоску REP-1 наблюдали в лизатах тканей глаза у контрольных мышей, которые не получали инъекций ни в один из глаз. Полоску с повышенной интенсивностью наблюдали в лизатах тканей, которые были трансдуцированы векторами нового поколения, по сравнению с лизатами, которые трансдуцированы вариантом 1. Антитело к GAPDH выявляло полоску с равной интенсивностью, соответствующую молекулярной массе ~39 кДа, во всех клеточных лизатах. Эти данные демонстрируют, что доставка V2a СНМ нового поколения с помощью AAV8 приводила в результате к повышенным уровням белка REP-1 по сравнению с уровнями, продуцируемыми после инъекции AAV8.V3a или AAV8.V1.
[000255] Денситометрическая оценка (количественное определение уровня экспрессии) блотов с использованием программного обеспечения ImageJ дополнительно демонстрирует повышенную продукцию REP-1 у животных, которым вводили инъекцией конструкции нового поколения на основе AAV8.CHM (особенно V2a) по сравнению с вариантом 1. См. таблицу 23 для значений.
[000256] Экспрессия AAV8.V2b у CD1 мышей
[000257] Это современное исследование и оценку эффекта лямбда-спейсера в отношении продуцирования вектора на основе AAV с помощью анализа титра методом qPCR осуществляли одновременно. Авторы настоящего изобретения производили все инъекции животным для исследования экспрессии in vivo, как описано в протоколе исследования PCPR.02, и все образцы собирали. После того как было завершено исследование методом qPCR на лямбда-спейсерный элемент (описанный выше), авторы данного изобретения решили провести эксперименты с Вестерн-блоттингом только для исследования экспрессии векторов на основе AAV без спейсера, таких как AAV8.2b и AAV8.3b, и исключения их из дальнейшего анализа (такого как сравнение с вариантом 1).
[000258] Антитело к человеческому REP-1 выявляло белок с молекулярной массой ~75-80 кДа в тканях глаза у CD-1 мышей, которым вводили инъекцией AAV8.2b в количестве 5Е9 (высокая доза) копий генома вектора (фиг. 12А). У животных, которым вводили инъекцией AAV8.2b в количестве 5Е8 (низкая доза), проявлялась очень бледная полоска, соответствующая белку с молекулярной массой ~75-80 кДа (фиг. 12А). Лизаты тканей глаз от контрольных животных, не получавших инъекций, не показывают наличия белка REP-1. Антитело к GAPDH выявляло белок с молекулярной массой ~39 кДа в лизатах тканей глаз, в том числе у контролей, не получавших инъекцию. Эти данные могут установить минимальную дозу для AAV8.2b.
[000259] Экспрессия AAV8.V3b у CD 1 мышей
[000260] Авторы настоящего изобретения выполняли анализ методом Вестерн-блоттинга на тканях глаза у CD1 мышей (2 мыши/группа), которым вводили инъекцией AAV8.3b, с использованием антитела к REP-1, в котором было выявлено присутствие белка с молекулярной массой ~75-80 кДа в одном глазу, в который вводили инъекцией низкую дозу AAV8.3b, и в обоих глазах, в которые вводили инъекцией высокую дозу AAV8.3b. В тканях глаза у мышей, которые не получали инъекции, не была выявлена экспрессия REP-1 (фиг. 12В). Уровень продуцируемого REP-1 был дозозависимым у животных, которым вводили инъекцией AAV8.3b. Инъекция высокой дозы AAV8.3b (5Е9 геномов вектора) индуцировала большее количество REP-1 по сравнению с глазами, в которые вводили инъекцией низкую дозу (5Е8 геномов вектора). Антитело к GAPDH выявляло белок с молекулярной массой ~39 кДа в лизатах тканей глаз у всех животных, получавших инъекцию и не получавших инъекцию.
[000261] Эти результаты выявили следующие наблюдения:
[000262] 1) Векторы нового поколения на основе AAV8.вариант 2а, 2b, 3а и 3b являются способными эффективно трансдуцировать ткани глаза. 2) Экспрессия трансгена (оптимизированного по кодону СНМ) была выявляемой для всех из векторов нового поколения. 3) Экспрессия трансгена (оптимизированная по кодону СНМ) является дозозависимой. 4) AAV8.вариант 2а и AAV8.вариант 2b индуцировали повышенную продукцию белка REP-1 по сравнению с AAV8.вариант 1 в тканях глаза CD-1 мышей. 5) Существует вариация в точном уровне продукции трансгенного белка между глазами, в которые вводили инъекцией одинаковую дозу, что отражает вариативность в хирургической процедуре доставки. Тем не менее, различия в уровнях являются большими между низкими (5Е8) и высокими (5Е9) дозами. 6) AAV8.CHM.V2a и AAV8.V3a приводят в результате к гораздо более высоким уровням продукции белка REP-1, чем AAV8.V1 после введения in vivo высокой дозы (5Е9 vg) вектора субретинально мышам.
[000263] Все публикации, цитируемые в данном описании, в том числе предварительная патентная заявка №62/266789, поданная 14 декабря 2015 года, включены в данный документ посредством ссылки в своей полноте. Аналогично, обозначения SEQ ID No, которые упоминаются в данном документе и которые появляются в прилагаемом перечне последовательностей, включены посредством ссылки. Несмотря на то что настоящее изобретение было описано со ссылкой на конкретные варианты осуществления, предполагается, что модификации могут быть выполнены без отступления от идеи настоящего изобретения. Такие модификации, как предполагается, попадают в пределы объема пунктов приложенной формулы изобретения.
[000264] ОПИСАНИЕ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ В СВОБОДНОЙ ФОРМЕ









































































































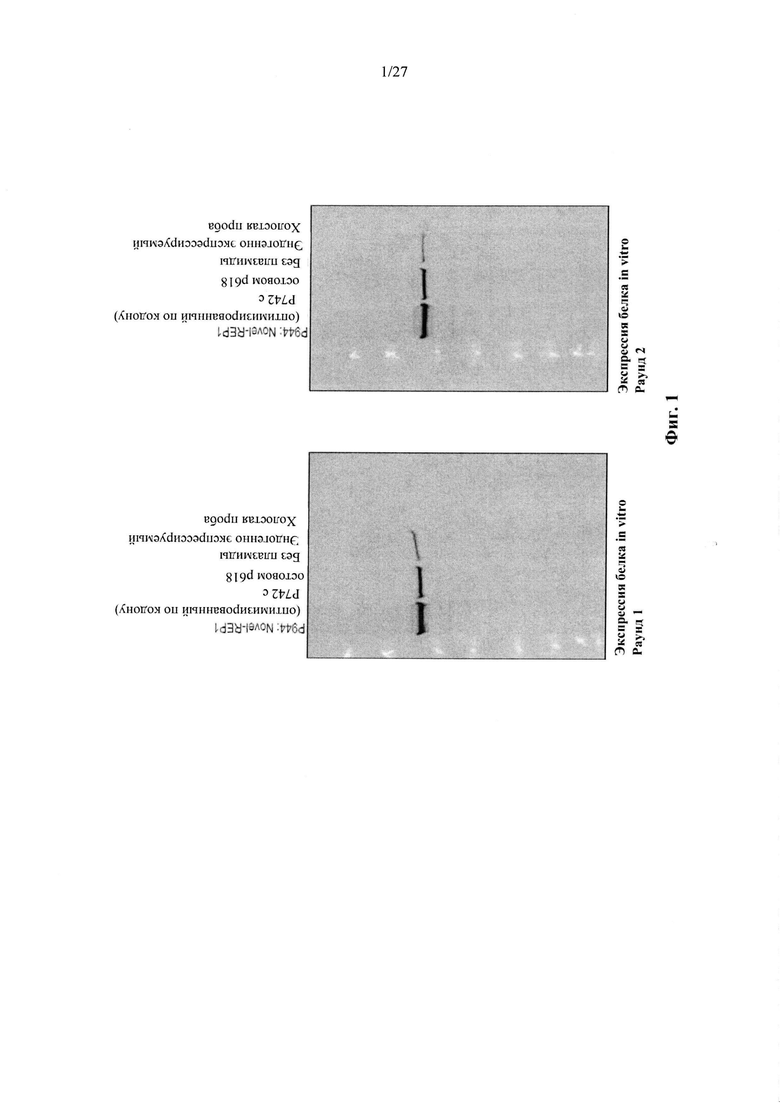













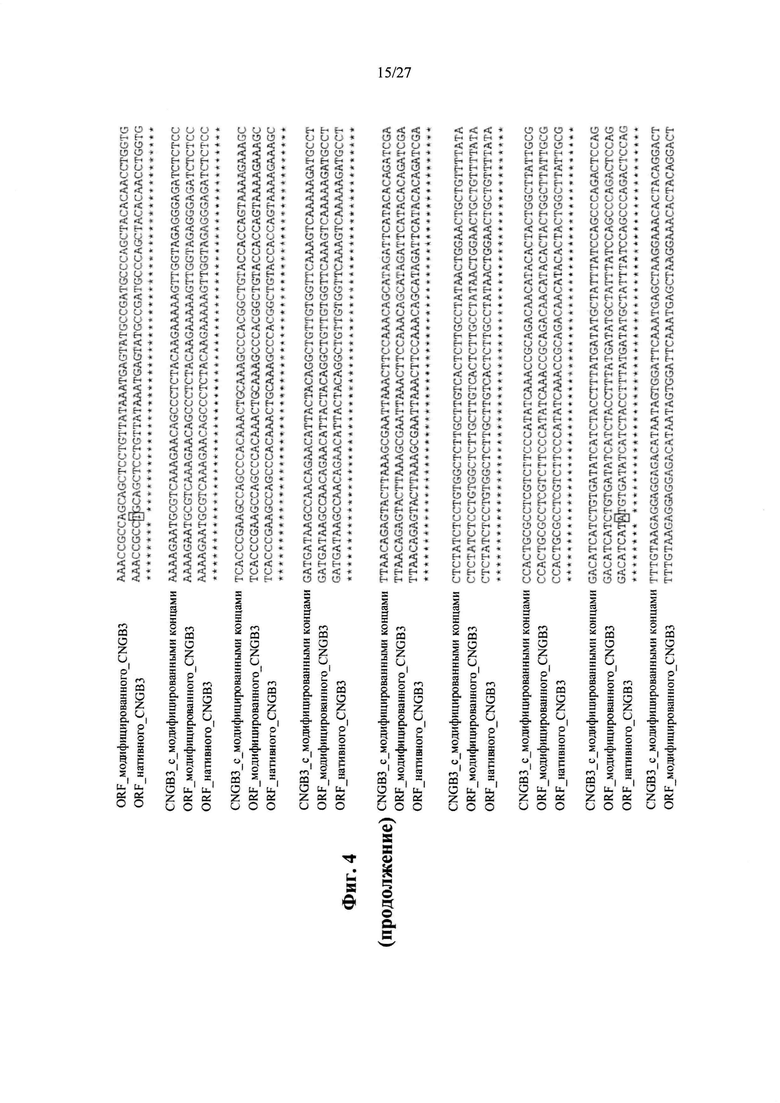




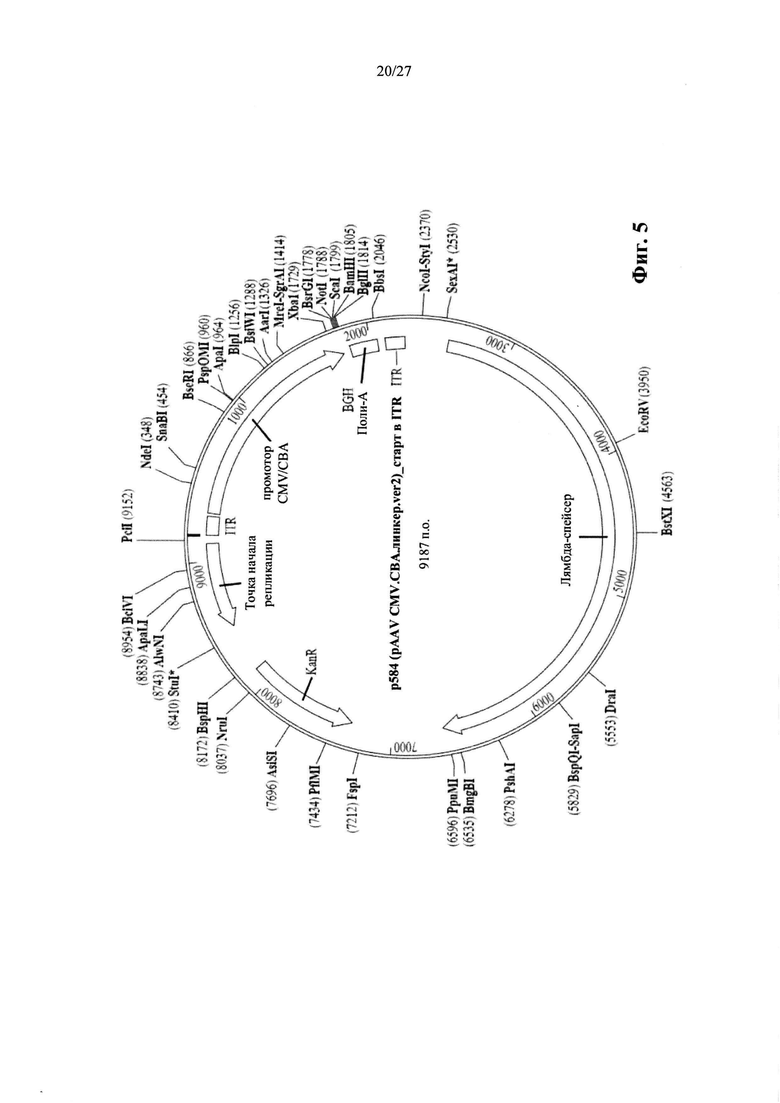
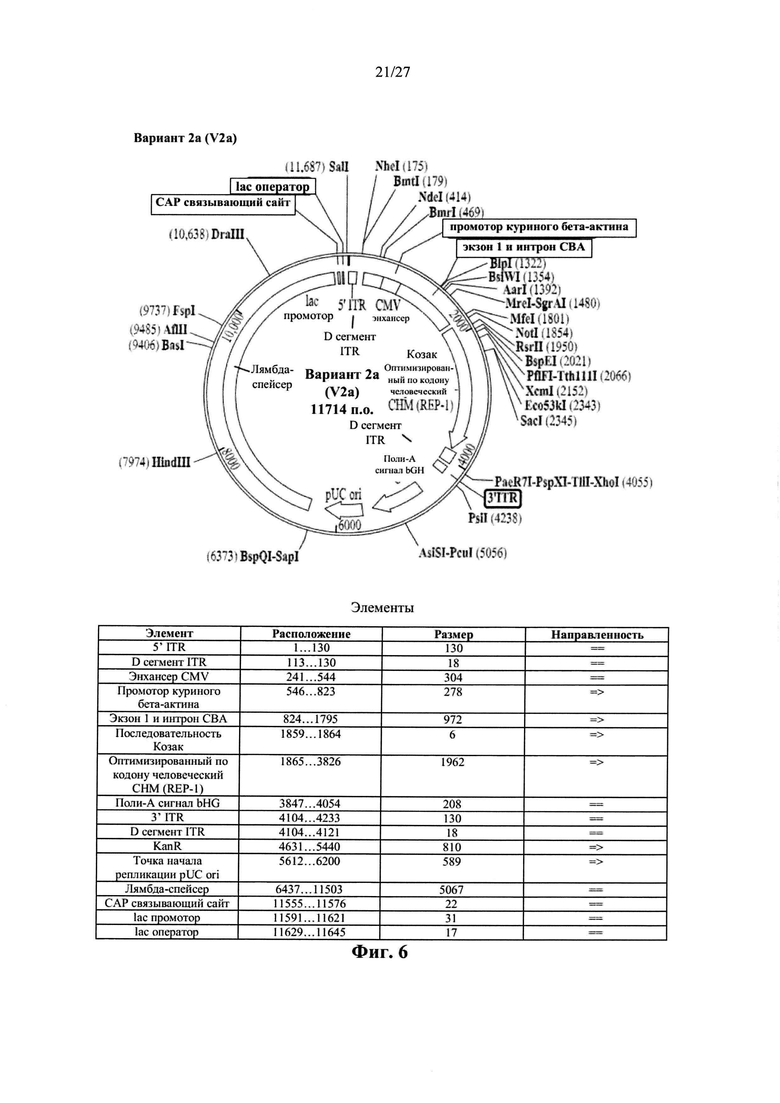
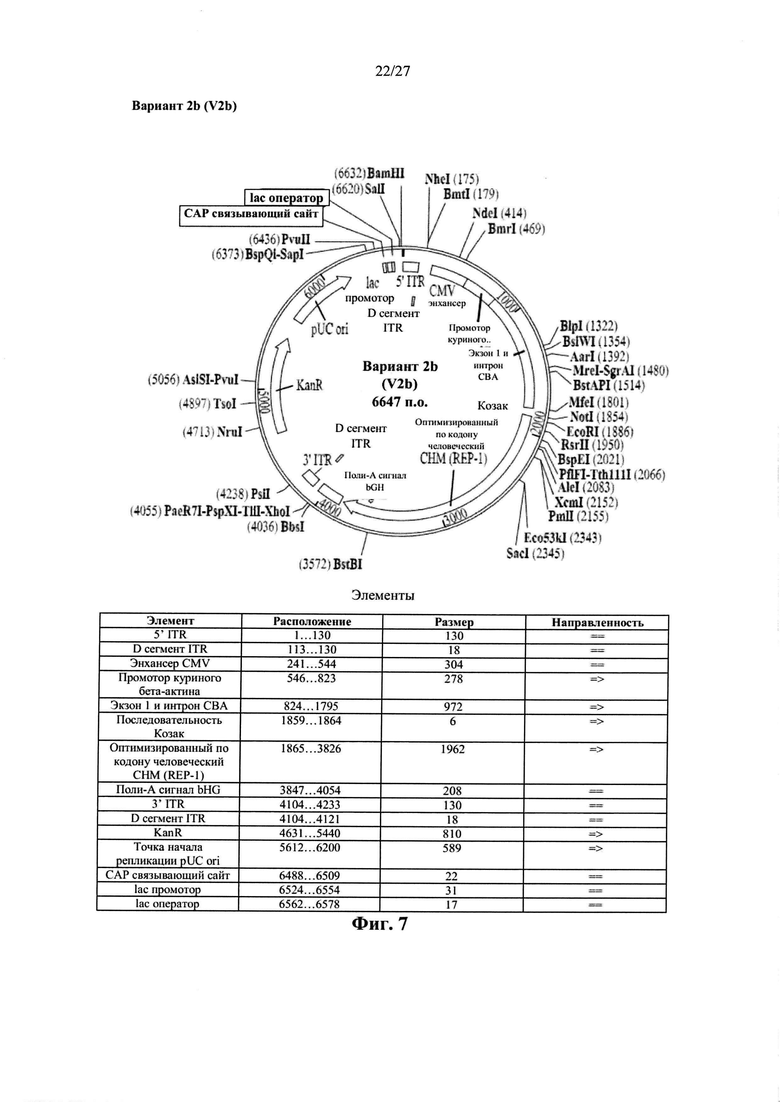

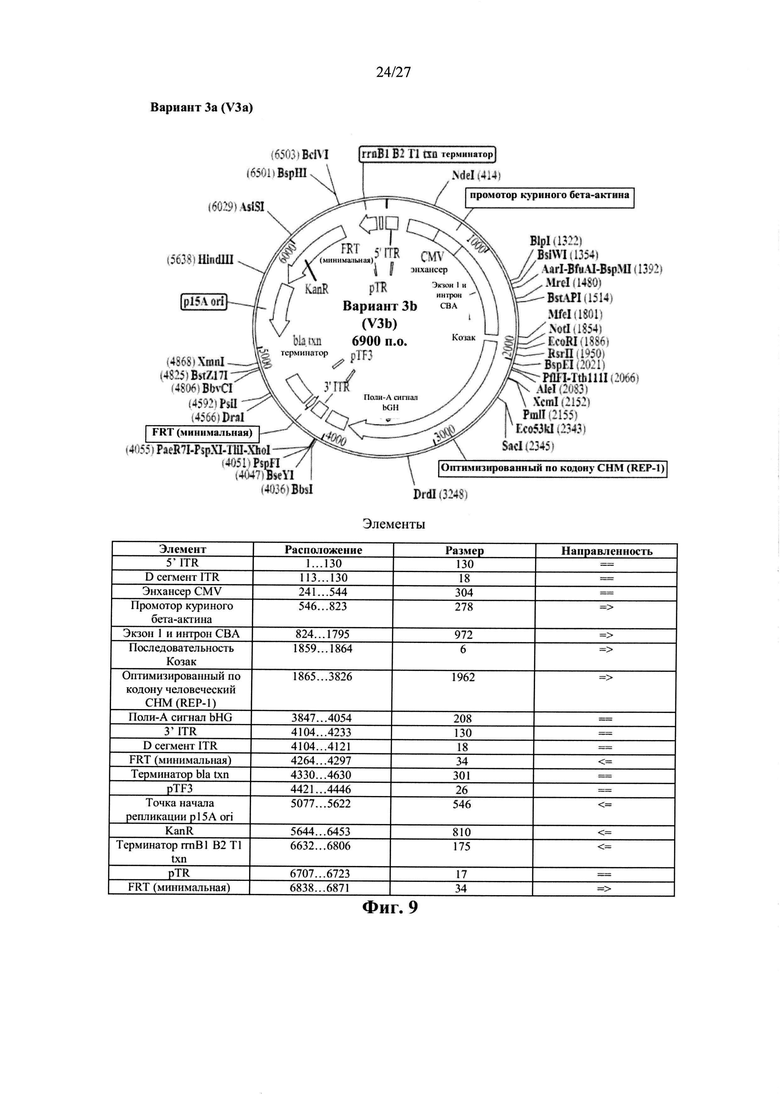
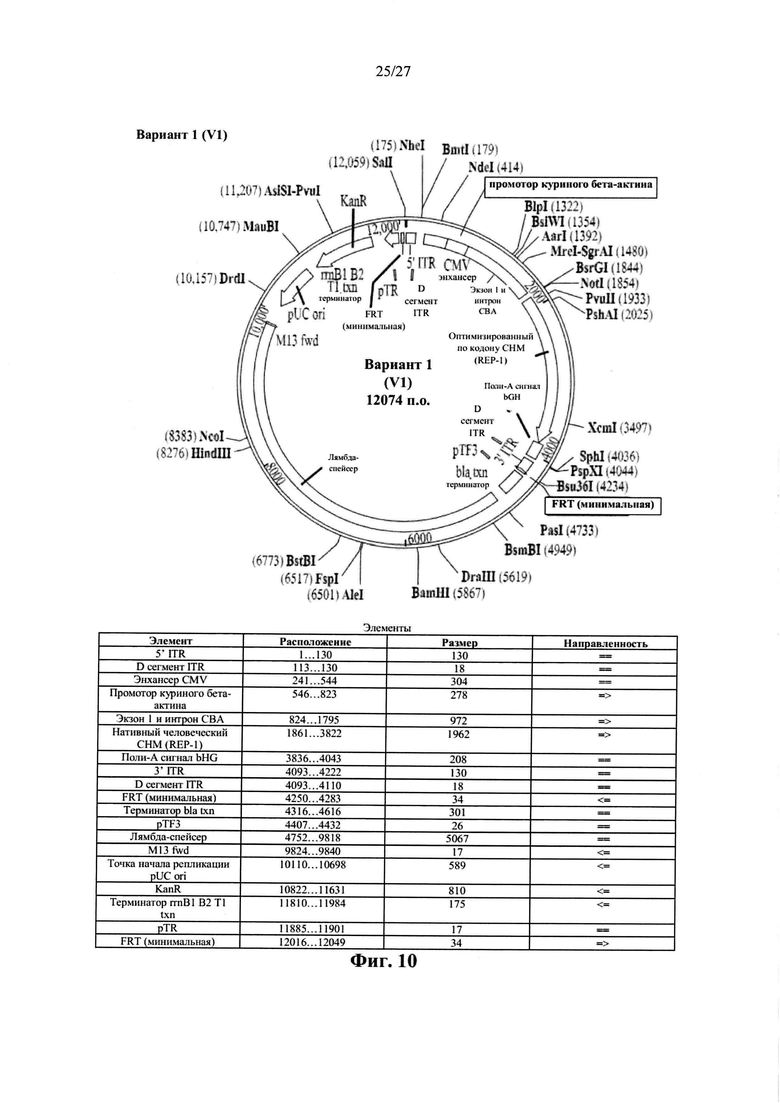
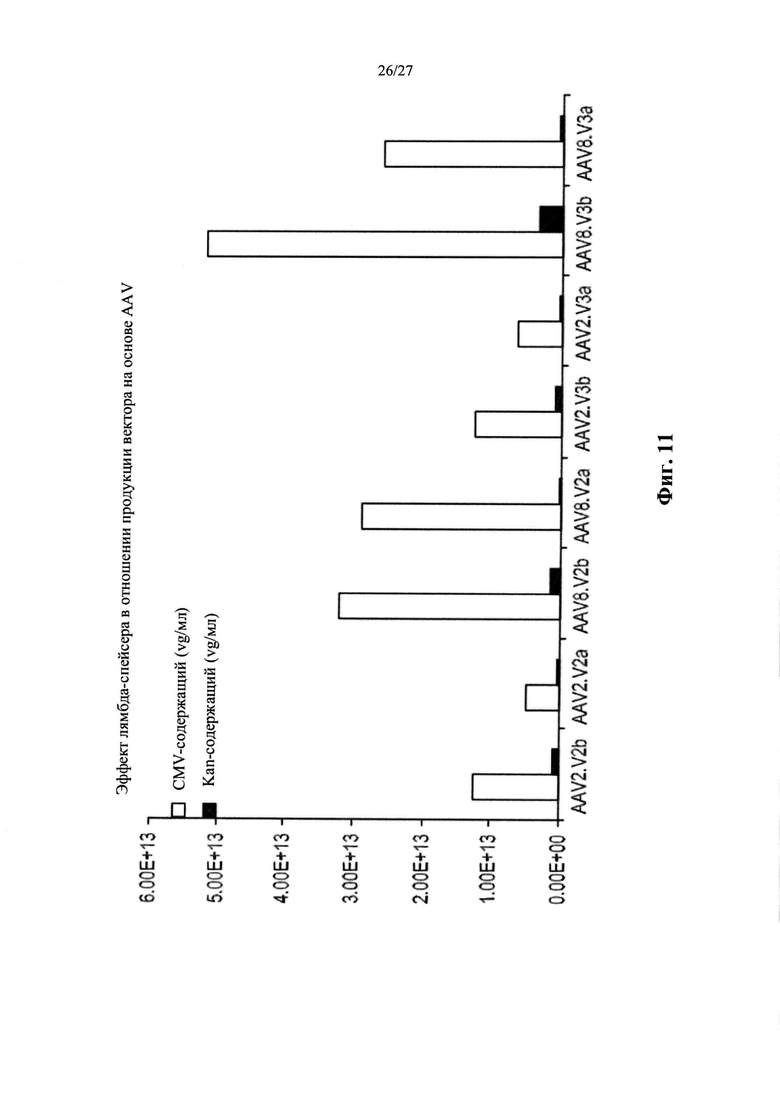
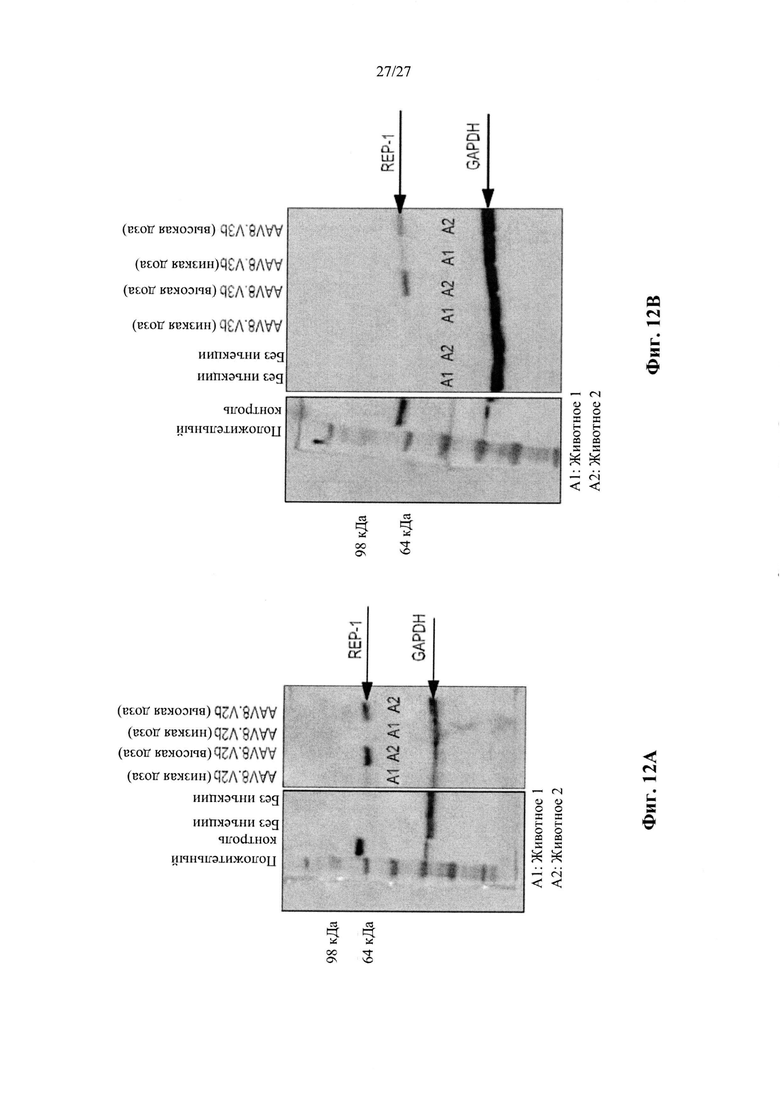
Изобретение относится к биотехнологии. Описаны композиции и способы для лечения офтальмологических нарушений у субъекта. Также описаны: вектор на основе аденоассоциированного вируса, который включает в себя молекулу нуклеиновой кислоты, содержащую последовательность, которая кодирует CNGA3, вектор на основе аденоассоциированного вируса, который включает в себя молекулу нуклеиновой кислоты, содержащую последовательность, которая кодирует CNGB3, вектор на основе аденоассоциированного вируса, который включает в себя молекулу нуклеиновой кислоты, содержащую последовательность, которая кодирует REP-1. Изобретение расширяет арсенал средств для лечения офтальмологических нарушений. 11 н. и 28 з.п. ф-лы, 12 ил., 23 табл., 7 пр.
1. Нуклеиновая кислота, характеризующаяся последовательностью, кодирующей управляемый циклическими нуклеотидами канал альфа 3 (CNGA3), содержащей SEQ ID NO: 9 или 11.
2. Экспрессионная кассета, содержащая последовательность нуклеиновой кислоты по п. 1.
3. Вектор на основе аденоассоциированного вируса (AAV) для лечения ахроматопсии, содержащий капсид AAV и последовательность нуклеиновой кислоты, содержащую:
(a) 5' инвертированный концевой повтор (ITR) AAV;
(b) последовательность нуклеиновой кислоты, которая кодирует человеческий управляемый циклическими нуклеотидами канал альфа 3 (CNGA3), содержащую SEQ ID NO: 9 или 11;
(c) 3'ITR AAV; и
(d) последовательности для контроля экспрессии, которые управляют экспрессией CNGA3 в клетке-хозяине.
4. Вектор AAV по п. 3, в котором последовательность CNGA3 кодирует последовательность белка SEQ ID NO: 10.
5. Вектор AAV по п. 3 или 4, причем последовательности для контроля экспрессии содержат промотор.
6. Вектор AAV по п. 5, причем промотор представляет собой промотор родопсина.
7. Вектор AAV по п. 5, причем промотор представляет собой промотор родопсин-киназы.
8. Вектор AAV по п. 5, причем промотор представляет собой промотор, специфический в отношении клеток глаза.
9. Вектор AAV по п. 5, причем промотор выбирают из промотора человеческого EF1α, промотора метаботропного глутаматного рецептора 6 (mGluR6), промотора родопсина, промоторов колбочкового опсина и промоторов транскрипционных факторов (нейроретинального белка с «лейциновой молнией» (Nrl) и фоторецептор-специфического ядерного рецептора Nr2e3, bZIP).
10. Вектор AAV по п. 5, причем промотор представляет собой индуцируемый промотор, конститутивный промотор или тканеспецифический промотор.
11. Вектор AAV по п. 10, причем промотор представляет собой индуцируемый промотор, выбранный из промотора рапамицина/рапалога, промотора экдизона, чувствительного к эстрогену промотора и чувствительного к тетрациклину промотора или гетеродимерного репрессорного переключателя.
12. Вектор AAV по любому из пп. 3-11, дополнительно содержащий один или несколько из интрона, последовательности Козак, поли-А и посттранскрипционных регуляторных элементов.
13. Вектор AAV по любому из пп. 3-12, причем капсид представляет собой AAV2, AAV5, AAV8, AAV9, AAV8bp или AAV7m8 капсид или его вариант.
14. Вектор AAV по любому из пп. 3-13, в котором 5' ITR AAV и 3' ITR AAV последовательности происходят из AAV, отличного от того, который обеспечивает белок капсида.
15. Вектор AAV по любому из пп. 3-14, в котором 5' ITR AAV и 3' ITR AAV последовательности происходят из AAV2.
16. Вектор на основе аденоассоциированного вируса (AAV) для лечения ахроматопсии, содержащий капсид AAV8 и экспрессионную кассету, причем указанная экспрессионная кассета содержит:
(a) 5' ITR AAV;
(b) последовательность нуклеиновой кислоты, которая кодирует CNGA3, содержащую SEQ ID NO: 9 или 11;
(c) 3' ITR AAV; и
(d) последовательности для контроля экспрессии, которые управляют экспрессией CNGA3 в клетке-хозяине.
17. Фармацевтическая композиция для лечения ахроматопсии, содержащая фармацевтически приемлемый носитель и по меньшей вектор AAV по любому из пп. 3-16.
18. Способ лечения ахроматопсии, причем указанный способ включает введение композиции по п. 17 субъекту, нуждающемуся в этом.
19. Способ по п. 18, причем указанную композицию вводят субретинально.
20. Способ по п. 18, причем указанную композицию вводят интравитреально, внутривенно или в сосудистую оболочку глаза.
21. Способ по любому из пп. 18-20, причем указанный субъект представляет собой млекопитающее.
22. Способ по п. 21, причем указанный субъект представляет собой человека.
23. Способ по любому из пп. 18-22, причем указанную композицию вводят в комбинации с другой терапией.
24. Способ по любому из пп. 18-23, причем указанную композицию вводят в дозе, составляющей от приблизительно 109 до приблизительно 1013 геномов вектора (VG).
25. Способ по любому из пп. 18-24, причем указанную композицию вводят в объеме, составляющем от приблизительно 100 мкл до приблизительно 500 мкл.
26. Способ по любому из пп. 18-25, причем указанную композицию вводят более одного раза.
27. Плазмида для получения вектора на основе AAV, причем плазмида содержит SEQ ID NO: 9 или SEQ ID NO: 11.
28. Способ получения рекомбинантного вектора на основе AAV, включающий культивирование упаковывающей клетки, несущей плазмиду по п. 27, в присутствии достаточных вирусных последовательностей для того, чтобы позволить упаковку вирусного генома с экспрессионной кассетой, содержащей SEQ ID NO: 9 или SEQ ID NO: 11, в оболочку или капсид инфекционного AAV.
29. Рекомбинантный вектор на основе AAV для лечения ахроматопсии, полученный в соответствии со способом по п. 28, причем рекомбинантный вектор на основе AAV содержит оболочку или капсид инфекционного AAV, имеющие упакованный в них вирусный геном, с экспрессионной кассетой, содержащей SEQ ID NO: 9 или SEQ ID NO: 11.
30. Композиция для применения в способе лечения ахроматопсии субъекта, причем указанная композиция содержит вектор AAV по любому из пп. 3-16.
31. Композиция по п. 30, причем указанная композиция вводится субретинально.
32. Композиция по п. 30, причем указанная композиция вводится интравитреально, внутривенно или в сосудистую оболочку глаза.
33. Композиция по любому из пп. 30-32, причем указанный субъект представляет собой млекопитающее.
34. Композиция по п. 33, причем указанный субъект представляет собой человека.
35. Композиция по любому из пп. 30-34, причем указанная композиция вводится в комбинации с другой терапией.
36. Композиция по любому из пп. 30-35, причем указанная композиция водится в дозе, составляющей от приблизительно 109 до приблизительно 1013 геномов вектора (VG).
37. Композиция по любому из пп. 30-36, причем указанная композиция вводится в объеме, составляющем от приблизительно 100 мкл до приблизительно 500 мкл.
38. Композиция по любому из пп. 30-37, причем указанная композиция вводится более одного раза.
39. Применение вектора на основе AAV по любому из пп. 3-16 в производстве лекарственного средства для лечения ахроматопсии.
| WO 2012114090 A1, 30.08.2012 | |||
| VASIREDDY VIDYULLATHA ET AL., "AAV-Mediated Gene Therapy for Choroideremia: Preclinical Studies in Personalized Models", PLOS ONE,Vol | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| СПОСОБ ДИАГНОСТИКИ АХРОМАТОПСИИ | 2009 |
|
RU2444977C2 |
Авторы
Даты
2021-12-22—Публикация
2016-12-13—Подача