Область техники настоящего изобретения
Настоящее изобретение описывает способ подвергания семенной жидкости, а именно популяций клеток спермы, анализу с целью обнаружения внутриклеточных вирусов, хламидий, паразитов и других микроорганизмов внутри сперматозоидов в стремлении изучить и определить этиологию недостаточности репродуктивной функции и бесплодия, а также для предупреждения врожденных инфекций. Вся процедура осуществляется с применением специального способа облегчения структуры ДНК, нацеливания антител на микроорганизмы и оценки результатов с помощью проточной цитометрии.
Уровень техники
Недостаточность репродуктивной функции в настоящее время является все более часто встречающейся проблемой, которая затрагивает многие семьи. Для решения этой проблемы было разработано множество подходов, в том числе экстракорпоральное оплодотворение (IVF).
Непроходимость фаллопиевых труб, азооспермия и менопауза являются бесспорными причинами недостаточности репродуктивной функции. Олигоспермия и пре-менопауза, которые являются ранними стадиями азооспермии и менопаузы, также представляют интерес, поскольку являются все более актуальными факторами, ведущими к недостаточности репродуктивной функции. Олигоспермия, в частности, должна быть проблемой, легко решаемой с помощью IVF, поскольку одного сперматозоида должно быть достаточно для зачатия. На практике, однако, это не так.
Для сперматозоидов существует множество качественных дефектов, которые интенсивно изучались и которые специфически действуют на два параметра оценки качества спермы: морфологию и подвижность. Подвижность предоставляет эмбриологам при попытках IVF только приблизительную информацию о пригодности сперматозоидов для микрооплодотворения. Морфология спермы, с другой стороны, является гораздо более точным критерием для оценки спермы как подходящей или нет для оплодотворения. Однако морфология спермы не может быть использована непосредственно в качестве меры для выбора хороших сперматозоидов, которые будут использоваться при IVF, поскольку сперматозоиды, используемые для морфологической характеристики образца спермы, в данном процессе разрушаются. В соответствии с вышеуказанным, несомненно, есть множество путей для оценки образцов спермы (World Health Organization reference values for human semen characteristics, Human Reproduction Update 2009), которые принимаются во внимание при наблюдении пар с недостаточностью репродуктивной функции, многие из которых перейдут к использованию способов IVF.
Окончательная характеристика образцов спермы будет результатом комбинированной оценки всех конкретных морфологических аномалий, обнаруженных у каждого исследованного сперматозоида. Сперматозоиды, характеризующиеся отсутствием этих аномалий, классифицируют как "подходящие" или "нормальные". Кроме того, физиологические показатели также даны с помощью индекса тератозооспермии (TZI), который измеряет среднюю величину морфологических аномалий на аномальный сперматозоид. Также можно оценить качество спермы путем измерения процента апоптотических сперматозоидов в образце, то есть сперматозоидов, которые вошли в процесс запрограммированной гибели клеток.
Однако каждая аномалия спермы может быть связана с конкретной причиной. Такими причинами могут быть микроорганизмы, например, в случаях хронического простатита, или другие факторы, такие как курение, ожирение, чрезмерные физические упражнения, высокие температуры и т.д.
Напротив, вирусные факторы, как причина мужской недостаточности репродуктивной функции, не вызывали значительной обеспокоенности медицинского сообщества до настоящего времени. В 2004 и 2005 годах в двух публикациях American Journal of Reproductive Immunology исследователи из Locus Medicus S.A. (в том числе V. Tsilivakos, автор настоящего изобретения) описали корреляцию между большим числом натуральных киллеров-лимфоцитов (далее в настоящем документе названные NK) в крови женщин с историей недостаточности репродуктивной функции и/или выкидышей и наличием субклинической герпесной виремии (HSV1-2, EBV, CMV, HHV6 и HHV7).
После этого авторы настоящего изобретения наблюдали в абортивном материале, что NK-лимфоциты в основном собраны в месте имплантации, тогда как уровни NK в крови этих женщин были нормальными. Согласно теории авторов настоящего изобретения это можно объяснить, если эмбрионы в данных случаях были сами по себе антигенными из-за присутствия вирусных (по меньшей мере герпетических) антигенов, берущих начало от мужчины через клетки спермы, в том числе сперматозоиды. Эти антигены были бы экспрессированы и представлены иммунной системе женщины фетальными клетками, вызывая ответ NK.
Однако, когда мы попытались установить присутствие вирусных элементов с помощью классических способов диагностики, таких как морфология спермы или другие параметры анализа семенной жидкости, мы обнаружили, что это было невозможно.
Проблема, подлежащая решению
Когда пара попадает в клинику бесплодия, правильный подход заключается в исследовании причины данной проблемы. Многие симптомы и признаки подразумеваются как факторы, связанные с бесплодием, но многие из них не являются основными причинами, они сами по себе являются результатом других факторов, как правило, инфекционной природы, искоренение или сдерживание которых может способствовать лечению. Например, мы знаем, что присутствие хламидий или других микроорганизмов в фаллопиевых трубах может приводить к непроходимости труб, поначалу временной, но которая может стать постоянной, если не будет иметь место терапевтическое вмешательство. Точно так же, фрагментация ДНК клеток спермы, в том числе сперматозоидов, из-за апоптоза клеток часто является результатом бактериальной или, возможно, вирусной инфекции различных частей мужских половых путей, а также других факторов, таких как оксидативный стресс.
Успех в решении проблемы бесплодия пары зависит от абсолютной точности объяснения первоначальных причин проблемы, достигает ли пара естественного зачатия или применяет своего рода вспомогательную репродукцию. К сожалению, только недавно клиническая значимость присутствия вирусов в семенной жидкости признана отдельными исследователями (но не медицинским сообществом в целом), фактом, который становится даже более клинически значимым, если вирусы действительно содержатся в сперматозоидах, которые в конечном итоге оплодотворят яйцеклетку. В этом случае вирусная инфекция может перейти от сперматозоида к зиготе путем вертикальной передачи, приводя к одновременной пролиферации фетальных и вирусных клеток, которые могут затем населить органы и ткани, где они, как известно, вызывают врожденные дефекты, такие как в случае вируса герпеса в нервной системе или других вирусов в сердечно-сосудистой системе. По нашему мнению, для того, чтобы имели место негативные последствия присутствия инфекционного (вирусного) фактора, необходим отказ иммунной системы от борьбы с инфекцией. Напротив, если защитный механизм женщины способен противостоять инфекционному (вирусному) фактору через распознавание вирусных антигенов, это приведет к разрушению инфицированных вирусом фетальных клеток.
Механизмы отторжения эмбриональных клеток могут включать те, которые проходят с помощью NK-клеток, которым было оказано так много внимания за последние 25 лет, подтверждая их роль в процессе выкидышей первого триместра иммунологической этиологии. Это может быть верно по меньшей мере в случае вирусов герпеса, активация NK-клеток против которых является сопутствующей реакцией. Кроме того, в недавней публикации авторы настоящего изобретения описали высокую частоту бесплодия среди греческих учителей. Это может быть связано с их высокой подверженностью детским вирусным инфекциям, т.е. более высоким концентрациям вирусов. Кроме того, мы наблюдали более частое возникновение выкидышей у пар, которые находятся в долгосрочных отношениях, что может свидетельствовать о более сильной иммунной памяти со стороны женщины. Это может привести к более сильному иммунному ответу женской иммунной системы на "известные" вирусы партнера-мужчины, приводя в результате к быстрому разрушению инфицированных эмбриональных клеток. К сожалению, еще нет международных исследований, касающиеся эмбриональной антигенности. Тем не менее, авторы настоящего изобретения полагают, что развивающийся эмбрион экспрессирует в малом количестве или совсем не экспрессирует только мужские антигены, которые являются антигенами, выработанными мужчиной, и антигенами, которые женский организм не будет создавать, так чтобы распознать их как собственные - по меньшей мере до конца первого триместра.
Что касается молекул HLA, которые отличаются между супругами, мы знаем, что их экспрессия подавляется в фетальных клетках, которые вступают в непосредственный контакт с иммунной системой женщины. Таким образом, вопрос состоит в том, какие чужеродные антигены заставляют женский организм атаковать во время выкидыша первого триместра или во время выкидыша, который происходит гораздо раньше и, таким образом, не может быть осознан с помощью задержки менструации. В будущем необходимо, чтобы международное научное сообщество обратило внимание на степень клинической важности, а также соответствующее лечение в каждом случае субклинической вирусной инфекции у мужчин (будь то спорадическая или хроническая), которая может привести к вертикальной передаче вирусных антигенов плоду.
Включение этого фактора авторами настоящего изобретения создало мнение у авторов настоящего изобретения, что отказ от рассмотрения загрязнителей не вирусной природы и других загрязнителей в клетках спермы, в том числе сперматозоидах, соответствует ошибочному и неполноценному изучению бесплодия.
Таким образом, существует большая потребность в способе обнаружения возбудителей инфекции в клетках спермы, в том числе сперматозоидах, с высокой чувствительностью и специфичностью, но, к сожалению, до сих пор это было технически невозможным.
ДРУГИЕ ПОДХОДЫ
До настоящего времени в способах обнаружения в семенной жидкости микроорганизмов, таких как хламидий, используют иммунофлуоресценцию (микропрепарат суспензии клеток), но это представляет собой способ с очень низкой чувствительностью. Серологический способ ELISA с обнаружением циркулирующих антител в крови также является часто используемым, но не дает никакой информации относительно локализации инфекции.
Микроорганизмы, в том числе микоплазмы, в настоящее время обнаруживают с помощью посева клеток семенной жидкости. Однако чтобы культивировать внутриклеточных возбудителей инфекции, требуется применение специализированных клеточных линий и оборудование для культивирования клеток, а также строгие правила безопасности в лаборатории. Эти повышенные требования делают практически невозможным применение данного метода на ежедневной основе.
В последние годы применение молекулярных методов (в основном, полимеразной цепной реакции или ПЦР) может быть использовано для обнаружения хламидий и возбудителей инфекции после экстракции ДНК из спермы или отмытых клеточных компонентов семенной жидкости. Но обнаружение внутриклеточных возбудителей внутри клеток спермы, в том числе сперматозоидов, с помощью сканирующей электронной микроскопии не было описано.
Наконец, электронная микроскопия может обнаружить присутствие микроорганизмов или вирусов, прикрепленных только к наружной поверхности клеточной мембраны, но не к внутриклеточным поверхностям.
Для обнаружения вирусов в семенной жидкости наиболее эффективным подходом, доступным сегодня, который характеризуется высокой чувствительностью и специфичностью, является ПЦР отмытых клеточных компонентов семенной жидкости. Основным недостатком этого метода, однако, является то, что он не может различить внеклеточных или внутриклеточных паразитов, то есть, расположены ли обнаруженные микроорганизмы на внешней или внутренней стороне сперматозоидов, а также он не может указать конкретный тип инфицированных клеток, будь то сперматозоиды или другие типы клеток, содержащиеся в семенной жидкости, такие как, например, лейкоциты или предшественники клеток спермы.
Кроме того, серологическое обнаружение антител против вирусов и/или токсоплазмы не предоставляет никакой информации о локализации возбудителя инфекции на внутренней или на внешней стороне клеток спермы или на любом другом клеточном компоненте семенной жидкости.
Наконец, обнаружение микроорганизмов в клетках возможно с помощью флуоресцентной или хромогенной гибридизации in situ. Однако этот способ имеет более низкую чувствительность, отнимает больше времени и является более дорогостоящим, чем тот, который описан в настоящем изобретении.
Способ, раскрытый и описанный в настоящем изобретении, впервые позволяет внутриклеточное обнаружение возбудителей инфекции, то есть, тех, которые расположены в пределах (на внутренней стороне) клеток спермы, в том числе сперматозоидов.
Патентная заявка от Stuart и соавт., публикация заявки на патент США №2006/0099661 А1 под названием "Detection and quantification of intracellular pathogens", фокусируется на обнаружении хламидий как на поверхности клетки, а также внутриклеточно, в основном, в клетках периферической крови, но также на клетках других биологических жидкостей, в том числе спермы. В этом патенте авторы изобретения описывают следующие три основных этапа:
a) получение биологической жидкости,
b) применение первичного антитела для специфического распознавания хламидийного антигена на поверхности клетки или внутриклеточно и
c) анализ образца с помощью проточной цитометрии,
и, таким образом, они описывают, что при применении предлагаемых способов, описанных в патенте, они успешно обнаруживают хламидии в клетках периферической крови.
Кроме того, в соответствии с описанным способом обнаружения хламидий в лимфоцитах с помощью применения химического реактива TRITON-X авторы публикации заявки на патент США №2006/0099661 А1 под названием "Detection and quantification of intracellular pathogens" заявляют, что способ может быть расширен до обнаружения хламидий также в других клетках, в том числе клетках спермы.
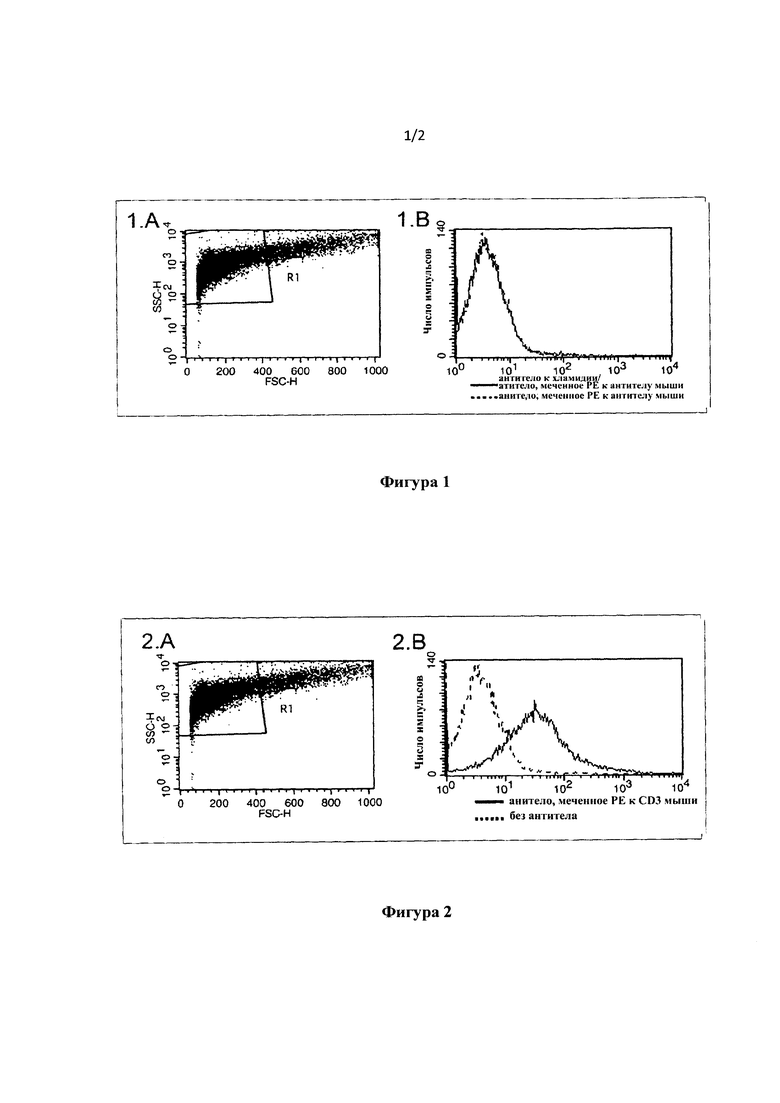
Для того чтобы проверить это предположение, сделанное в указанном документе уровня техники, авторы настоящего изобретения выполнили эксперименты, описанные в 2006/0099661 А1, в соответствии с экспериментальным способом, предложенным авторами изобретения, Elizabeth S. Stuart и Lloyd Н. Semprevivo. Однако, несмотря на утверждение, выраженное в 2006/0099661 А1 относительно расширения способа до обнаружения хламидий в клетках спермы, как мы показываем в гистограммах, которые сопровождают данную заявку в качестве фигуры 1, авторы настоящего изобретения убедились, что внутриклеточное обнаружение хламидий в клетках спермы, следуя экспериментальному методу, описанному Stuart и Semprevivo, невозможно, и это на известном образце, который охарактеризован как "очень положительный" на присутствие хламидий по способу, раскрытому авторами настоящего изобретения в настоящем изобретении.
В соответствии с результатами авторов настоящего изобретения кривая, представляющая образец спермы, использованный для обнаружения хламидий в соответствии с процедурой, описанной Stuart и Semprevivo, не показывает сдвиг вправо по сравнению с контролем (фигура 1. В) - эти две кривые неразличимы. Это означает, что данный способ не обнаруживает присутствие хламидий в образце. Авторы настоящего изобретения объясняют неспособность способа Stuart и Semprevivo обнаружить хламидии внутри клеток спермы отсутствием ферментативной обработки клеток (с ДНКазой), той обработки, которую авторы настоящего изобретения предложили и доказали как обязательный этап процедуры обнаружения любого инфекционного фактора (бактериального или вирусного) внутри клеток спермы, и эта процедура занимает центральное место и является обязательным элементом способа по настоящему изобретению.
Кроме того, результаты авторов настоящего изобретения показали, что способ Stuart & Semprevivo характеризуется низкой чувствительностью и низкой специфичностью, когда это относится к исследованию спермы, особенно когда используют способ прямой флуоресценции. Это проиллюстрировано в фигуре 2, на которой показано, что с помощью протокола, предложенного в патентной заявке Stuart & Semprevivo, антитела к CD3 со специфичностью в отношении антигена мыши обнаружены внутри отрицательного контрольного образца спермы, хотя теоретически это антитело не должно связываться ни с каким антигеном в клетках спермы (низкая специфичность). Другими словами, предложенный способ Stuart & Semprevivo производит ошибочные и вводящие в заблуждение результаты.
Приведенные выше результаты доказывают, что способ, предложенный в заявке на патент США №2006/0099661 А1 от Stuart и соавт. для обнаружения хламидий внутриклеточно в клетках спермы, не обеспечивает решение проблемы, указанной в настоящем изобретении.
РАСКРЫТИЕ СПОСОБА ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
По мнению авторов настоящего изобретения подробное исследование предполагаемых инфекционных факторов в сперме является необходимым всякий раз, когда присутствует клиническая история одного или нескольких из следующего: срыв беременности на ранних сроках, биохимическая беременность, олигоспермия, астеноспермия или тератоспермия, неудачная попытка IVF, недостаточность репродуктивной функции, или для профилактики недостаточности репродуктивной функции в целом.
В частности, для профилактики недостаточности репродуктивной функции основное внимание направлено на обнаружение хламидий в сперматозоидах, и мы решили сделать это в комбинации со спермограммой и посевом семенной жидкости с целью обнаружения присутствия также и других микроорганизмов.
Настоящее изобретение описывает способ обнаружения и изучения присутствия вирусов, хламидий, паразитов и других микроорганизмов внутри сперматозоидов с использованием способов прямой или непрямой иммунофлуоресценции с последующей визуализацией и оценкой с помощью проточной цитометрии.
Настоящее изобретение описывает, что это обнаружение выполняют в клетках для обнаружения микроорганизмов, которые находятся внутри сперматозоидов. Способ, предложенный в настоящем изобретении, является иммунофлуоресценцией в комбинации с оценкой результата с помощью проточной цитометрии с применением специальной обработки для облегчения ДНК, например, расщепления ДНК.
Характерной чертой настоящего изобретения является то, что описанный способ для исследования на присутствие вирусов, хламидий, паразитов и других инфекционных возбудителей внутриклеточно в сперматозоидах включает следующие этапы:
- облегчение плотной структуры ДНК клеток спермы (в том числе сперматозоидов),
- прямую и непрямую иммунофлуоресценцию внутри клеток спермы,
- визуализацию и оценку результата с помощью проточной цитометрии.
Мы хотели бы подчеркнуть, что очень важно, что облегчение плотной структуры ДНК происходит до иммунофлуоресценции для того, чтобы сделать антигены-мишени обнаруживаемыми специфическими антителами.
Выгодно, что этап визуализации и оценки результатов с помощью проточной цитометрии включает инкубацию клеточных осадков с 7-аминоактиномицином D (7AAD) в WB, чтобы дать возможность различить клетки 1N и 2N.
Предпочтительно, способ, описанный в настоящем изобретении, выполняют для определения причин недостаточности репродуктивной функции, срыва беременности на ранних сроках, или выкидыша, или гибели плода. Кроме того, он может быть использован для предупреждения и изучения врожденной инфекции или для предупреждения вертикальной передачи и для обнаружения воспаления и инфекций мужской половой системы, например, эпидидимита.
Способом по настоящему изобретению можно также обнаружить специфическое присутствие одного из следующих патогенов: цитомегаловируса (CMV), вируса простого герпеса I (HSV I), вируса простого герпеса II (HSV II), вируса Эпштейна-Барра (EBV), HHV6, HHV7, HHV8, парвовируса 19, вируса гепатита В (HBV), вируса гепатита С (HCV), коксаки-вируса, вирусов иммунодефицита человека (HIV-1, HIV-2), аденоассоциированного вируса (AAV), вируса краснухи, HPV, хламидий, токсоплазмы и норовируса.
В частности, в отношении обнаружения хламидий в сперматозоидах настоящий способ можно комбинировать со спермограммой и посевом семенной жидкости для обнаружения других патогенов со значительным преимуществом, что они могут быть выполнены на том же образце, или на различных образцах.
Предпочтительно, облегчение структуры ДНК сперматозоидов, которая является очень плотной, выполняют с расщеплением ДНК и получают фрагментацию ДНК.
Выгодно, что расщепление ДНК осуществляют с помощью фермента, который разрушает ДНК.
Например, этот фермент может быть ДНКазой I.
Для иммунофлуоресценции может быть использовано любое подходящее флуоресцентное антитело или антитела к антителу. Для этой цели может быть использован любой флуорохромом, в том числе любой из следующих, которые известны на сегодня: флуоресцеин-5-изотиоцианат (FITC), аминометилкумарина ацетат (АМСА 350), производное 6,8-дифтор-7-гидроксикумарина (Marina Blue), Cascade Blue, Alexa fluor 405, производное 6,8-дифтор-7-гидроксикумарина (Pacific Blue), Alexa Fluor 430, Cascade Yellow, Alexa Fluor 488, фикоэритрин (РЕ), фикоэритрин-техасский красный (PE-Texas Red), фикоэритрин-цианин 5 (PE-Су5), перидинин-хлорофилл протеин (PerCP), перидинин-хлорофилл протеин-цианин 5.5 (PerCP-Су5.5), фикоэритрин-цианин 7 (РЕ-Су7), родамин TR, аллофикоцианин (АРС), ALexa Fluor 647, аллофикоцианин-цианин 7 (АРС-Су7), BD АРС-Н7 или Alexa Fluor 700.
Способ по настоящему изобретению может включать дополнительный этап обнаружения поверхностных антигенов.
Настоящее изобретение описывает также разработку и применение набора для внутрисперматозоидного обнаружения хламидий, вирусов, паразитов и других возбудителей внутри сперматозоидов с использованием способа по настоящему изобретению. Этот набор обязательно должен содержать вещество, которое может облегчать ДНК клеток сперматозоидов. Это вещество, например, может представлять собой фермент, который расщепляет ДНК; например, фермент может быть ДНКазой I. Кроме того набор, раскрытый в настоящем изобретении, должен содержать одно или несколько антител против конкретных возбудителей, присутствие которых необходимо выявить. Приведенные выше антитела могут быть непосредственно помечены флуорохромом, таким как описанные выше. Если специфические антитела для возбудителей не помечены, должно быть включено второе меченое флуорохромом или биотинилированное антитело, которое распознает первое.
ОПИСАНИЕ ФИГУР
Настоящее изобретение может быть проиллюстрировано с помощью следующих фигур.
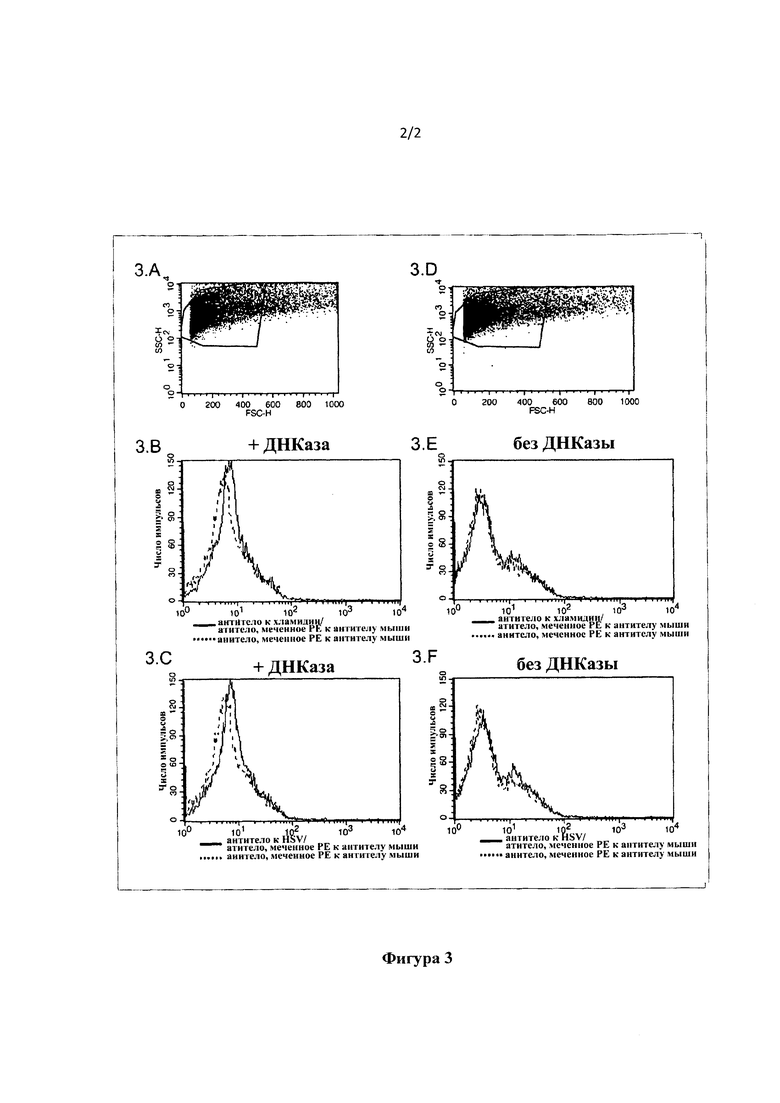
На фигуре 3 проиллюстрировано внутрисперматозоидное обнаружение с помощью проточной цитометрии антигенов С. trachomatis и HSV. На фигурах 3А, 3В, 3С наблюдается обнаружение специфических антигенов после расщепления ДНКазой I. В противоположность этому, на фигурах 3D, 3F, 3G, где не было расщепления ДНКазой, подобного обнаружения нет.
На фигуре 1 показано отсутствие обнаружения хламидий внутри сперматозоидов в соответствии с протоколом, описанным в заявке на патент США №2006/0099661 А1 от Stuart и соавт. (для других клеточных типов). Этот же образец охарактеризован как очень положительный после расщепления ДНК в соответствии с настоящим изобретением (данные не показаны).
На фигуре 2 проиллюстрирована потеря специфичности антитела в соответствии с протоколом, описанным в заявке на патент США №2006/0099661 А1 от Stuart и соавт. (для других клеточных типов). Антитело, которое связывает мышиные CD3, неспецифически связывается со сперматозоидом, вызывая сдвиг флуоресценции вправо.
ПРИМЕР
Примером одного из вариантов осуществления настоящего изобретения является следующее:
1. Фиксация клеток спермы, в том числе сперматозоидов
После сбора и сжижения семенной жидкости сперматозоиды осаждали и фиксировали в 4% параформальдегиде (PFA) при 4°С в течение 30 мин. PFA действует путем поперечной сшивки белков, тем самым инактивируя возбудители и иммобилизируя предполагаемые аутоантитела, которые уже связаны со сперматозоидом, тем самым делая их обнаруживаемыми, если это требуется. В некоторых редких случаях некоторые антигенные детерминанты могут быть изменены или разрушены, что делает их необнаруживаемыми определенными антителами. В таких случаях поверхностное окрашивание может быть выполнено до фиксации. Кроме того, фиксация с PFA сохраняет физические характеристики клеток: т.е. после фиксации клетки обладают теми же характеристиками разброса, показанными во время анализа, проведенного с помощью проточной цитометрии. Кроме того, фиксация с PFA позволяет последующее применение внеклеточной или внутриклеточной процедуры окрашивания.
2. ВАЖНОЕ ПРИМЕЧАНИЕ: Перед инкубированием конкретного антитела с возбудителем, который оно будет распознавать и связывать, жизненно важно для процедуры и необходимо выполнить сначала этап облегчения или ослабления плотной структуры ДНК сперматозоидов. Этот процесс может быть достигнут любым способом, который может ослабить структуру ДНК, среди прочего, с помощью расщепления ДНК, которое имеет возможность ослабить плотную структуру ДНК сперматозоидов. Этот процесс ослабления ДНК может быть выполнен с любыми другими средствами, которые могут достичь того же результата, либо механическим, термическим, электролитическим способом, либо с применением восстановителей, таких как β-меркаптоэтанол, дитиотреитол, трис(2-карбоксиэтил)фосфин. Таким может быть применение расщепляющего ДНК фермента. В конкретном примере, представленном в настоящем описании, примером такого вещества является расщепляющий ДНК фермент. В конкретном примере, использованном в настоящем описании, в качестве такого вещества для расщепления ДНК мы использовали фермент ДНКазу I. На фигуре 3 проиллюстрирована неспособность обнаружения возбудителя без этапа расщепления ДНКазой I.
3. ВНУТРИКЛЕТОЧНОЕ ОКРАШИВАНИЕ КЛЕТОК СПЕРМЫ (НЕПРЯМОЕ)
Непрямое окрашивание использовано в нашем примере потому, что оно менее дорогостоящее, чем прямое окрашивание. Однако настоящее изобретение также может работать, если альтернативно используют прямо конъюгированные антитела, как описано ниже.
1. Фракцию клеток осаждали, ресуспендировали и инкубировали в течение 30 мин с 100-500 мкл фосфатно-солевого буфера (PBS), содержащего 4% PFA и 0,1% сапонина (среда А). Затем клетки промывали 2 мл PBS, содержащего 0,1% сапонина и 2% фетальной телячьей сыворотки (FCS) (промывочный буфер - WB). Надосадочную жидкость отбрасывали и осадок инкубировали с 100-500 мкл PBS, содержащего 10% диметилсульфоксида (DMSO) и 0,1% сапонина в течение 10 мин. После промывки WB осадок фиксировали 100-500 мкл среды А при 4°С. Через 10 мин инкубации клетки промывали WB, надосадочную жидкость отбрасывали и осадок ресуспендировали и инкубировали в течение 30 мин с ДНКазой I (500 мкг/мл) при 37°С. Наконец, клетки промывали WB, надосадочную жидкость отбрасывали и осадок инкубировали с титрованными количествами конкретного антитела, специфического по отношению к одному из следующих патогенов:
a. Цитомегаловирус (CMV)
b. Вирус простого герпеса I (HSV I) и/или вирус простого герпеса II (HSV II)
c. Вирус Эпштейна-Барра (EBV)
d. HHV6
e. HHV7
f. HHV8
g. Парвовирус 19
h. Вирус гепатита В
i. Вирус гепатита С
j. Коксаки-вирус
k. HIV (HIV I, HIV II)
l. Аденоассоциированный вирус (AAV)
m. Вирус краснухи
n. HPV
о. Норовирус
р. Хламидии
q. Токсоплазма.
Инкубация клеток с антителами происходит либо в отдельных пробирках для каждого из возбудителей, либо в одной и той же пробирке, что позволяет одновременное обнаружение возбудителей при условии, что используют прямо конъюгированные антитела с отдельными флуорофорами, которые излучают цвета, контрастные друг относительно друга.
Через 30 мин инкубации при 4°С клетки промывают с WB и надосадочную жидкость отбрасывают.
2. Клеточный осадок ресуспендировали и следовала новая инкубация с 50 мкл поликлонального конъюгированного с флуорофором антитела против иммуноглобулинов животного, от которого создано первое антитело. Можно применять любой флуорофор. Ниже приведены наиболее известные в настоящее время флуорофоры, которые упомянуты предположительно и которые не следует рассматривать для ограничения нашего выбора флуорофора:
флуоресцеин-5-изотиоцианат (FITC), аминометилкумарина ацетат (АМСА 350), производное 6,8-дифтор-7-гидроксикумарина (Marina Blue), Cascade Blue, Alexa Fluor 405, производное 6,8-дифтор-7-гидроксикумарина (Pacific Blue), Alexa Fluor 430, Cascade Yellow, Alexa Fluor 488, фикоэритрин (РЕ), фикоэритрин-техасский красный (PE-Texas Red), фикоэритрин-цианин 5 (PE-Су5), перидинин-хлорофилл протеин (PerCP), перидинин-хлорофилл протеин-цианин 5.5 (PerCP-Су5.5), фикоэритрин-цианин 7 (РЕ-Су7), родамин TR, аллофикоцианин (АРС), ALexa Fluor 647, аллофикоцианин-цианин 7 (АРС-Су7), BD АРС-Н7, Alexa Fluor 700.
Следовала инкубация клеток в течение 30 мин при 4°С, а затем клетки промывали 2 мл WB. Если необходимо провести исследование лейкоцитов, то процедура переходит к следующему этапу. Альтернативно, процедура переходит к этапу, где клетки собирают.
Факультативный этап окрашивания лейкоцитов
Если возникал вопрос, присутствуют ли микроорганизмы в лейкоцитах семенной жидкости, образцы будут инкубировать с прямо-конъюгированным антителом против лейкоцитарного антигена для оценки возможного присутствия возбудителей в лейкоцитах. Флуорофор, присоединенный к этому антителу, должен отличаться от других флуорофоров, использованных для обнаружения возбудителя. Следовали 30 мин инкубации при 4°С, а затем следовала другая промывка 2 мл WB. Надосадочную жидкость отбрасывали и клетки ресуспендировали. Кроме того, различение между клетками 1N и 2N является осуществимым после инкубации клеточных осадков с 7-аминоактиномицином D (7AAD) в WB. Через 5 мин инкубации клетки готовы для обнаружения в проточном цитометре.
ПРЯМОЕ ИММУНОФЕНОТИПИРОВАНИЕ ВОЗБУДИТЕЛЕЙ
Альтернативно, если специфические антитела против предполагаемых возбудителей прямо конъюгированы с флуорофорами, этап В, описанный выше, может быть опущен. Кроме того, каждое специфическое антитело может быть конъюгировано с биотином и их обнаружение достигается за счет последующей инкубации с комплексом стрептавидин-флуорофор. В качестве альтернативы биотину может быть использован любой другой способ конъюгирования флуорофора. Можно использовать любой флуорофор, в том числе без ограничения следующие известные флуорофоры: Флуоресцеин-5-изотиоцианат (FITC), аминометилкумарина ацетат (АМСА 350), производное 6,8-дифтор-7-гидроксикумарина (Marina Blue), Cascade Blue, Alexa Fluor 405, производное 6,8-дифтор-7-гидроксикумарина (Pacific Blue), Alexa Fluor 430, Cascade Yellow, Alexa Fluor 488, фикоэритрин (РЕ), фикоэритрин-техасский красный (PE-Texas Red), фикоэритрин-цианин 5 (PE-Су5), перидинин-хлорофилл протеин (PerCP), перидинин-хлорофилл протеин-цианин 5.5 (PerCP-Су5.5), фикоэритрин-цианин 7 (РЕ-Су7), родамин TR, аллофикоцианин (АРС), Alexa Fluor 647, аллофикоцианин-цианин 7 (АРС-Су7), BD АРС-Н7, Alexa Fluor 700.
4. ПОЛУЧЕНИЕ И ОЦЕНКА РЕЗУЛЬТАТОВ
Образцы сканировали в приборе проточной цитометрии и выполняли анализ данных с использованием соответствующего программного обеспечения. Клетки гейтируют с помощью комбинаций областей на основе их размера и сложности и/или экспрессии антигенов (таких как лейкоцитарные антигены). Анализ фокусируется на предполагаемом присутствии возбудителей внутри сперматозоидов или внутри других клеточных компонентов спермы. Кроме того, обнаружение таких возбудителей в лейкоцитах является возможным с использованием соответствующих областей на основе экспрессии лейкоцитарных антигенов.
В. ПОВЕРХНОСТНОЕ ИММУНООКРАШИВАНИЕ
В дополнение к внутрисперматозоидному окрашиванию также возможно обнаружение предполагаемых внеклеточных возбудителей. Вторую фракцию клеток подвергали центрифугированию, надосадочную жидкость отбрасывали и клетки равномерно распределяли в пробирки, которые содержали титрованное количество конкретного антитела, специфичного по отношению к каждому возбудителю. После 30 мин инкубации при 4°С пробирки промывали PBS, содержащим 2% FCS (PBS - 2% FCS), и надосадочную жидкость отбрасывали. Далее, клетки ресуспендировали и инкубировали еще раз в 50 мкл поликлонального флуорофор-конъюгированного антитела против иммуноглобулинов животного, от которого было создано первое антитело. После 30 мин инкубации при 4°С пробирки промывали PBS, содержащим 2% FCS (PBS - 2% FCS), и надосадочную жидкость отбрасывали. Клетки ресуспендировали и помещали в прибор проточной цитометрии для сканирования и анализа.
ПОДРОБНОЕ ОПИСАНИЕ ФИГУР
В частности:
На 2D диаграмме рассеяния фигуры 3 размер сперматозоидов (FSC-H) представлен с точки зрения их комплексности (SSC-H), где определена огороженная область R, так что может быть изучена обогащенная сперматозоидами популяция клеток.
Специфическая флуоресценция для антител, которые обнаруживали один антиген хламидий и один антиген герпеса, соответственно, в соответствии с описанной выше процедурой без применения ДНКазы, представлена на гистограммах 3Е и 3F на фигуре 1. Кроме того, на тех же гистограммах также показана флуоресценция контроля с помощью меченого антитела к антителу. Сравнение этих двух кривых показывает, что нет обнаружения антигена, т.е. нет обнаружения возбудителя инфекции.
Те же параметры из исследования сперматозоидов в той же огороженной области R проиллюстрированы на гистограммах 3А, 3В и 3С на фигуре 3, но в данном случае была включена инкубация с ДНКазой, подробно описанная выше. Анализ данных показывает, что в присутствии ДНКазы обнаружение возбудителей инфекции в сперматозоидах является возможным, как доказано сдвигом флуоресценции вправо по сравнению с контролем (который обработан по той же процедуре, минуя применение специфического к возбудителю инфекции антитела).
Фигуры 1 и 2 более подробно описаны выше в главе уровня техники настоящего описания.
ПРЕИМУЩЕСТВА СПОСОБА ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
- Основным преимуществом способа обнаружения возбудителей инфекции внутри клеток спермы, в том числе сперматозоидов, описанного в настоящем изобретении, является его высокая чувствительность при условии, что соответствуют метод и условия для фиксации клеток, проницаемость мембраны и, что наиболее важно, ферментативное ослабление плотной структуры ДНК с помощью расщепляющего ДНК фермента. В параллельном исследовании, выполненном авторами настоящего изобретения, установлено, что данный способ обнаруживает присутствие возбудителя инфекции даже в случаях, когда молекулярный (ПЦР) тест обнаружения в этом же образце является отрицательным. Кроме того, с применением метода, который использует специальные гранулы и может сопоставить уровни флуоресценции с количеством антигенов, можно построить кривую, которая приводит в соотношение интенсивность флуоресценции и количество микроорганизмов или вирусов на инфицированные клетки спермы, в том числе сперматозоиды. Способ, предложенный настоящим изобретением, позволяет исследовать большое число клеток (например, 20000) на образец и ретроспективно повторно проверять образцы. Это количественное превосходство, обеспеченное предложенным способом, сводит к минимуму вероятность ложно отрицательного результата (отсутствие обнаружения возбудителя инфекции).
- Высокая специфичность настоящего способа была установлена и обеспечивается благодаря применению отрицательных контролей и, конечно, благодаря применению моноклональных антител (реагентов, которые специфически обнаруживают и взаимодействуют с единичным специфическим сайтом конкретной молекулы для каждого микроорганизма или вируса). Кроме того, путем оценки характеристик разброса и/или с помощью дополнительных антител (т.е., к CD45), может быть подтверждено присутствие микроорганизмов в клетках спермы, в том числе сперматозоидах. Также четко показано, что возбудители инфекции прикреплены к внешней поверхности клеточной мембраны, а не к внутренней поверхности клеток спермы, в том числе сперматозоидов; такая информация может иметь большое клиническое значение.
- Описанный способ позволяет оценить эффективность антибиотика или противовирусного лечения. Это полезно для контроля патогенного состояния посредством определения регрессии инфекции, отмеченной уменьшением количества обнаруженных микроорганизмов в образце (например, хламидий после лечения тетрациклином).
- Фиксированные образцы могут безопасно храниться в течение длительного периода времени до испытания. Пересылка фиксированных образцов также возможна. Поскольку способ, описанный в настоящем изобретении для изучения семенной жидкости, требует применения проточной цитометрии, его невозможно использовать для лабораторий, не имеющих данной технологии. Чтобы справиться с этой проблемой, способ, описанный в настоящем изобретении, позволяет безопасную передачу или пересылку фиксированных образцов (между различными местоположениями и лабораториями) без потери чувствительности или специфичности. Кроме того, возможность безопасной транспортировки образцов позволяет повторно испытывать образец в различных лабораториях в случае технического сбоя проточного цитометра. И наконец, полученные данные хранятся в электронном виде в устройстве, и поэтому доступны для повторной оценки в любое время.
- Описанный способ характеризуется очень низкой стоимостью, которая, конечно, меньше, чем у эквивалентных тестов ПЦР.
- Описанный способ также характеризуется очень быстрым сроком выполнения работ в лаборатории, поскольку результаты испытаний доступны в тот же день.
Кроме того, настоящее изобретение впервые описывает способ обнаружения внутриклеточных возбудителей инфекции в клетках спермы, в том числе сперматозоидах, с использованием метода специфической иммунофлуоресценции и оценки результатов испытаний с помощью проточной цитометрии.
- Внутриклеточный анализ сперматозоидов становится возможным благодаря применению расщепляющего ДНК фермента, который "ослабляет" структуру ДНК внутри клеток. Авторы настоящего изобретения объясняют невозможность реагентов (антител) обнаружить микроорганизмы (антигены-мишени) в головке сперматозоидов до настоящего момента специфической и очень высокой концентрацией ДНК, которая присутствует в этой области клетки. В результате авторы настоящего изобретения считают необходимым "ослабить" ДНК путем расщепления, чтобы очистить путь для антител, которые должны вступить в контакт и связаться с антигенами-мишенями (микроорганизмами).
- Поскольку описано обнаружение микроорганизмов внутриклеточно или на внешней стороне клеточной мембраны, авторы настоящего изобретения полагают, что это два разных вида подхода с различной клинической интерпретацией. Например, авторы настоящего изобретения относят субклинические виремии и хламидиемии к инфекции предшественников клеток спермы путем проникновения через гематотестикулярный барьер. С другой стороны, мембранная локализация микроорганизмов в основном связана с инфекцией спермовыводящих путей (эпидидимиса, простаты, уретры).
Что касается естественного зачатия, зиготические клетки не производят впечатления защищенных от вертикальной передачи внутриклеточных возбудителей инфекции, то есть от прямой передачи возбудителей инфекции сперматозоидом плоду, тогда как передача мембраносвязанных возбудителей инфекции может быть остановлена легче. Например, в соответствии с Aynaud и соавт. (Frequency of herpes simplex virus, cytomegalovirus and human papillomavirus DNA in semen. Aynaud O. et al. Int J STD AIDS. 2002 Aug; 13 (8):547-50), сменная плазма предотвращает присоединение вируса к клеточной мембране.
Авторы настоящего изобретения рассматривают возбудителей инфекции на клеточной поверхности как относительно низкий фактор риска вертикальной передачи из-за воздействия таких факторов, как семенная плазма, антитела, протеазы и т.д. В отличие от этого, они рассматривают вертикальную передачу интактных внутриклеточных возбудителей инфекции плоду как имеющую большой риск развития таких проблем, как врожденные заболевания, бесплодие или выкидыш на ранних сроках.
Особенно во время естественного зачатия (не внутрицитоплазматическая инъекция сперматозоида) только головка сперматозоида проникает в яйцеклетку, тогда как остальная часть клетки (которая составляет большую часть клеточной поверхности сперматозоида) исключена. В результате внутриклеточные возбудители инфекции неизбежно проникают в яйцеклетку, тогда как, с другой стороны, то же самое не верно для мембраносвязанных микроорганизмов, поскольку клеточная мембрана сперматозоида остается снаружи зиготы при оплодотворении.
В результате, авторы настоящего изобретения рассматривают исследование внутриклеточных возбудителей инфекции при изучении вертикальной передачи от сперматозоида к плоду как первостепенно важное.
В Таблице 1 ниже мы представили данные от образцов, испытанных в лабораториях LOCUS MEDICUS S.A., а также предварительные результаты из лаборатории клеточной биологии и иммунологии LOCUS MEDICUS S.A. за пятимесячный период.
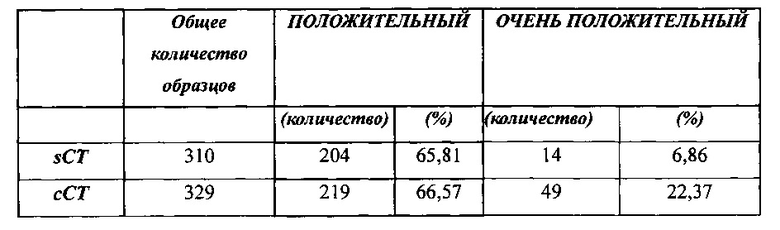

В таблице 1 показано обнаружение возбудителей инфекции в образцах спермы с помощью проточной цитометрии. sCT: мембраносвязанная C. trachomatis, сСТ: внутриклеточная C. trachomatis, CMV: цитомегаловирус, EBV: вирус Эпштейна-Барра, HSV I/II: вирус простого герпеса.
Мы рассматриваем образцы, в которых положительный сперматозоид обнаружен в более чем 5% образца, как "очень положительные".
Приведенные выше результаты показывают, что значительный процент испытанных образцов был установлен как инфицированный внутриклеточными хламидиями и/или вирусами. Обнаруженная внутриклеточная инфекция не могла быть найдена другим образом. Положительный результат (т.е. обнаружение инфекции) позволяет немедленное лечение инфекции соответствующими антибиотиками, как показано в таблице 2 ниже.

Таблица 2. Количество случаев, показывающих значительное снижение хламидийной нагрузки до и после лечения антибиотиками для инфекции С. trachomatis в "очень положительных" образцах с помощью проточной цитометрии. sCT: мембраносвязанная С. trachomatis, сСТ: внутриклеточная С. trachomatis
Более конкретно, в таблице 2 показано, что в 20 из в общей сложности 37 (54,05%) "очень положительных" образцов, где была обнаружена мембраносвязанная С. trachomatis, хламидийная нагрузка снизилась после лечения антибиотиками. Кроме того, в таблице 2 показано, что в случаях внутриклеточного обнаружения С. trachomatis процент образцов, которые показали снижение хламидийной нагрузки, был даже выше, так как в 27 из 37 (72,97%) случаях показано улучшение после лечения антибиотиками.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИСКРИМИНАЦИИ ПО МЕНЬШЕЙ МЕРЕ ДВУХ КЛЕТОЧНЫХ ПОПУЛЯЦИЙ И ЕГО ПРИМЕНЕНИЕ | 2006 |
|
RU2397494C2 |
| СПОСОБЫ И СРЕДСТВА ДЛЯ МОНИТОРИНГА НАРУШЕНИЯ ТКАНЕВОГО ГОМЕОСТАЗА В ОРГАНИЗМЕ | 2012 |
|
RU2635767C2 |
| СПОСОБЫ ДЕТЕКЦИИ АНТИЦИТОМЕГАЛОВИРУСНЫХ НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛ | 2013 |
|
RU2660712C2 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ВИРУСНОГО ИНФИЦИРОВАНИЯ СПЕРМАТОЗОИДОВ | 2020 |
|
RU2738798C1 |
| СПОСОБ ЛЕЧЕНИЯ УРОГЕНИТАЛЬНОЙ ХЛАМИДИЙНОЙ, УРЕАПЛАЗМЕННОЙ И МИКОПЛАЗМЕННОЙ ИНФЕКЦИИ | 1995 |
|
RU2137483C1 |
| СПОСОБ ИЗМЕРЕНИЯ КЛЕТОЧНО-ОПОСРЕДОВАННОЙ ИММУНОЛОГИЧЕСКОЙ РЕАКТИВНОСТИ | 2010 |
|
RU2605381C2 |
| КОМПОЗИЦИИ ВАКЦИН И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2600798C2 |
| НАНОАНТИТЕЛА, СВЯЗЫВАЮЩИЕ АНТИГЕН Chlamydia trachomatis, СПОСОБ ПОДАВЛЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ Chlamydia trachomatis | 2012 |
|
RU2487724C1 |
| СПОСОБ ДИАГНОСТИКИ ХРОНИЧЕСКОЙ СКРЫТОЙ БАКТЕРИАЛЬНОЙ ИНФЕКЦИИ С ПОРАЖЕНИЕМ СОСУДИСТОЙ СТЕНКИ | 2009 |
|
RU2414714C1 |
| СПОСОБ ДЕТЕКЦИИ ВНЕКЛЕТОЧНОЙ ДНК В ЦЕЛЬНОЙ ПЕРИФЕРИЧЕСКОЙ КРОВИ С ИСПОЛЬЗОВАНИЕМ ПРОТОЧНОЙ ЦИТОМЕТРИИ | 2022 |
|
RU2815709C1 |
Группа изобретений относится к области медицины. Предложены способ и набор для исследования на присутствие цитомегаловируса (CMV), вируса простого герпеса I (HSV I), вируса простого герпеса II (HSV II), вируса Эпштейна-Барра (EBV), HHV6, HHV7, HHV8, парвовируса 19, вируса гепатита В (HBV), вируса гепатита С (HCV), коксаки-вируса, вирусов иммунодефицита человека (HIV-1, HIV-2), аденоассоциированного вируса (AAV), вируса краснухи, HPV, хламидий, токсоплазмы и норовируса внутри сперматозоидов. Предложенная группа изобретений обеспечивает эффективное обнаружение микроорганизмов внутри сперматозоидов путем применения процедуры облегчения плотной структуры ДНК клеток спермы. 2 н. и 11 з.п. ф-лы, 3 ил., 2 табл., 1 пр.
1. Способ исследования на присутствие вирусов, хламидий, паразитов и других возбудителей инфекции, выбранных из цитомегаловируса (CMV), вируса простого герпеса I (HSV I), вируса простого герпеса II (HSV II), вируса Эпштейна-Барра (EBV), HHV6, HHV7, HHV8, парвовируса 19, вируса гепатита В (HBV), вируса гепатита С (HCV), коксаки-вируса, вирусов иммунодефицита человека (HIV-1, HIV-2), аденоассоциированного вируса (AAV), вируса краснухи, HPV, хламидий, токсоплазмы и норовируса, внутриклеточно в сперматозоидах, при этом способ включает следующие этапы:
- процедуру для облегчения плотной структуры ДНК клеток спермы, в том числе сперматозоидов,
- прямую и непрямую иммунофлуоресценцию внутри клеток спермы,
- визуализацию и оценку результатов с помощью проточной цитометрии,
и данный способ отличается тем, что этап облегчения плотной структуры ДНК обязательно должен происходить до иммунофлуоресценции.
2. Способ по п. 1, где этап визуализации и оценки результатов с помощью проточной цитометрии включает инкубацию клеточных осадков с 7-аминоактиномицином D (7AAD) в WB для того, чтобы дать возможность различить клетки 1N и 2N.
3. Способ по любому из пп. 1 или 2, который применяют для определения причин бесплодия, срыва беременности на ранних сроках, выкидыша или гибели плода и для профилактики врожденных инфекций или для профилактики вертикальной передачи, а также для исследования воспаления и инфекций мужской половой системы.
4. Способ по п. 1, который применяют специально для исследования одного из указанных возбудителей инфекции.
5. Способ по п. 1, который применяют для исследования на присутствие хламидий в сперматозоидах в комбинации со спермограммой и посевами с использованием одного и того же образца, или на разных образцах.
6. Способ по п. 1, где облегчение очень плотной структуры ДНК сперматозоидов выполняют с расщеплением ДНК.
7. Способ по п. 6, где расщепление ДНК осуществляют с помощью фермента, который разрывает ДНК.
8. Способ по любому из пп. 6 или 7, где ферментом, который разрывает ДНК, является ДНКаза I.
9. Способ по п. 1, где для флуоресценции можно применять любое соответствующим образом меченое антитело к антителу.
10. Способ по п. 9, где для флуоресценции можно применять любой флуорохром, среди которых любой из следующего: флуоресцеин-5-изотиоцианат (FITC), аминометилкумарина ацетат (АМСА 350), производное 6,8-дифтор-7-гидроксикумарина (Marina Blue), Cascade Blue, Alexa fluor 405, производное 6,8-дифтор-7-гидроксикумарина (Pacific Blue), Alexa Fluor 430, Cascade Yellow, Alexa Fluor 488, фикоэритрин (РЕ), фикоэритрин-техасский красный (PE-Texas Red), фикоэритрин-цианин 5 (PE-Cy5), перидинин-хлорофилл протеин (PerCP), перидинин-хлорофилл протеин-цианин 5.5 (PerCP-Cy5.5), фикоэритрин-цианин 7 (PE-Cy7), родамин TR, аллофикоцианин (АРС), ALexa Fluor 647, аллофикоцианин-цианин 7 (АРС-Су7), BD АРС-Н7 или Alexa Fluor 700.
11. Способ по п. 1, где включен дополнительный этап поверхностной иммунофлуоресценции.
12. Набор для исследования на присутствие вирусов, хламидий, паразитов и других возбудителей инфекции, выбранных из цитомегаловируса (CMV), вируса простого герпеса I (HSV I), вируса простого герпеса II (HSV II), вируса Эпштейна-Барра (EBV), HHV6, HHV7, HHV8, парвовируса 19, вируса гепатита В (HBV), вируса гепатита С (HCV), коксаки-вируса, вирусов иммунодефицита человека (HIV-1, HIV-2), аденоассоциированного вируса (AAV), вируса краснухи, HPV, хламидий, токсоплазмы и норовируса, внутри сперматозоидов, который включает по меньшей мере следующее:
вещество, которое может облегчить ДНК сперматозоидных клеток,
одно или несколько антител, подходящих для применения против представляющих интерес возбудителей инфекции.
13. Набор по п. 12, где вещество, которое может облегчить ДНК сперматозоидных клеток, является любым расщепляющим ДНК ферментом.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| WO 03060520 A2, 24.07.2003 | |||
| Уреаплазма (Уреаплазмоз) | |||
| Информация с сайта "ИМЕДИС +", г.Екатеринбург; 2010 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2018-08-22—Публикация
2013-03-29—Подача