ПРЕДПОСЫЛКИ ДЛЯ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники
[0001] Настоящее изобретение относится к роли фитохромных генов в регуляции цветения, зарождения и роста волокон и других характеристик, поддающихся влиянию фотоморфогенеза у растений Gossypium, сайленсинг-конструктам гена PHYA1, включающим полинуклеотиды, кодирующие фитохромные белки А1, трансгенным хлопчатникам, включающим полинуклеотиды PHYA1 RNAi, и к способу использования РНК-интерференции фитохромного гена PHYA1 для создания новых трансгенных растений, имеющих улучшенное качество хлопковых волокон, ранее цветение и ранее созревание семенной коробочки, усиленное удлинение корня и увеличенное производство семян хлопчатника как из-за супрессии PHYA1, так и из-за увеличения в несколько раз экспрессии других фитохромных генов.
Описание уровня техники
[0002] Свет является одним из наиболее важных факторов окружающей среды, управляющих развитием и физиологией растений. Он влияет практически на все аспекты роста растений, от прорастания семян до вегетативной морфологии, начала цветения, управления циркадными ритмами, регуляции и экспрессии генов, гравитропизма и фототропизма (Fankhauser and Chory. 1997. Ann. Rev. Cell Dev. Biol. 13:203-229; Furuya and Kim. 2000. Trends in Plant Sci. 3:87-88; Tepperman et al. 2001. Proc. Natl. Acad. Sci. USA 98(16):9437-9442). Растения реагируют на свет посредством нескольких фоторецепторных систем. Семейство фитохромных фоторецепторных генов лучше всего охарактеризовано в модели растения арабидопсис (резуховидка), которое имеет пять фитохромных генов: PHYA, PHYB, PHYC, PHYD и PHYE (Sharrock and Quail. 1989. Genes and Dev. 3:1745-1757; Clack et al. 1994. Plant Mol. Biol. 25:413-427; Cowl et al. 1994. Plant Physiol. 106:813-814). Фитохромы взаимодействуют с криптохромами, циркадными часами, фитогормонами и другими сигналами для регуляции начала цветения (Devlin et al. 1998. Plant Cell 10:1479-1487; Devlin eral. 1999. Plant Physiol. 119:909-915; Koornneef et al. 1997. Plant Cell & Environ. 20:779-784; Koornneef et al. 1998. Ann. Rev. Plant Physiol. Plant Mol. Biol. 49:345-370). У арабидопсиса PHYA способствует цветению растения. Мутация этого гена вызывает у арабидопсиса фенотип позднего цветения (Neff and Chory. 1998. Plant Physiol. 118:27-35). Наоборот, PHYB является ингибитором начала цветения (Koornneef et al. 1998, см. выше; Reed et al. 2000. Plant Physiol. 122:1149-1160). Мутации в PHYB вызывают раннее цветение в условиях короткого дня и длинного дня (Bagnall et al. 1995. Plant Physiol. 108: 1495-1503) арабидопсиса, гороха (Mockler et al. 1999. Dev. 106:2073-2082) и сорго (Childs et al. 1997. Plant Physiol. 97:714-719). Растения с повышенной экспрессией PHYA, являясь гипочувствительными к световому периоду, проявляют зависящую от света карликовость, имеют более темные зеленые листья, пониженную апикальную доминантность и фенотип раннего цветения в условиях короткого и длинного дня (Bagnall et al., см. выше). Сверхэкспрессия PHYB/D/E коррелируется с уменьшением длины гипокотиля (Clough et al. 1995. Plant Physiol. 109:1039-1045; Devlin et al. 1999, см. выше; Devlin et al. 1998, см. выше; Lin, C. 2000. Plant Physiol. 1239:39-50) и фенотипом раннего цветения, который наблюдался, например, у мутантов phyb, предполагая более сложные механизмы действия для PHYB (Bagnall et al., см. выше; Lin, см. выше). PHYC также способствует фотопериодическому цветению и естественному фенотипному изменению во время цветения арабидопсиса (Franklin et al. 2003. Plant Cell 15:1981-1989; Monte et al. 2003. Plant Cell 15:1962-1980; Balasubramanian et al. 2006. Nat. Genet. 38:711-715). Помимо этого, фитохромные гены регулируют вегетативные параметры роста растений, такие как высоту, рост листьев и розеток (Bagnall et al., см. выше).
[0003] В культивируемых видах хлопчатника семейство фитохромных генов имеет дополнительную важность, поскольку существуют доказательства того, что отношение фотонов дальней красной/красной областях влияет на длину и диаметр развивающегося волокна. Например, волокна хлопчатника, которые подвергали действию высокого фотонного отношения в дальней красной/красной областях, были длиннее чем подвергавшиеся повышенному фотосинтетическому свету (Kasperbauer, М.J. 1994. Physiol. Plantarum 91:317-321; Kasperbauer, М.J. 2000. Crop Sci. 40:1673-1678). Генетическое улучшение урожайности волокон и качества волокон, т.е., длины волокна и прочности волокна, является главной задачей программ по выращиванию хлопчатника во всем мире (Perkins et al. 1984. In: Cotton Agron. Monogr. Kohel and Lewis, Eds., ASA, CSSA, and SSSA, Madison, Wl, pp.437-509). Качество волокон стало крупной проблемой в последние годы из-за технологических изменений в текстильной промышленности (Perkins et al., см. выше; El-Mogahzy and Chewning. 2001. In: Cotton Fiber to Yarn Manufacturing Technology. Cotton Incorporated, Cary, NC). Волокна хлопчатника пима (Gossypium barbadense) мелкие, генетически более сильные и более однообразные чем широко распространенные, рано созревающие и имеющие хорошую урожайность виды американского хлопчатника (Gossypium hirsutum) (El-Mogahzy and Chewning, см. выше). Поиск легкого пути улучшения свойств волокон культиваров американского хлопчатника, наряду с поддержанием урожайности и раннего созревания, является фундаментальной проблемой, которую решают в традиционном выращивании хлопчатника во всем мире.
[0004] Таким образом, существует необходимость в разработке усовершенствованных культивируемых растений хлопчатника, которые дают высокие урожаи качественных волокон хлопчатника с повышенной длиной волокон и прочностью волокон.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
[0005] Мы открыли, что РНК-интерференция гена PHYA1 хлопчатника приводит к супрессии гена-мишени PHYA1, а также к увеличению в несколько раз экспрессии других фитохромных генов; что это изменение в профиле экспрессии семейства фитохромных генов хлопчатника приводит к измененной архитектуре растения с удлиненными черешками листьев, плодовыми ветвями, плодоножками семенных коробочек и корневой системой, интенсивному вегетативному росту, раннему цветению и раннему созреванию семенных коробочек, усиленной старением пигментации антоциана в стволах листьях, повышенному качеству волокон (длина, прочность, средний диаметр и т.д.) и фенотипам урожая волокон; и что эти изменения стабильно экспрессированы в последующих поколениях и могут быть перенесены из трансформированного генотипа Coker 312 на американский культивар посредством генетической гибридизации и селекции.
[0006] В соответствии с этим открытием одна цель изобретения заключается в том, чтобы предложить стратегию для эффективного сайленсинга эндогенного гена PHYA1 в хлопчатнике, чтобы изменить фотоморфогенез в растениях Gossypium.
[0007] Еще одна цель изобретения заключается в том, чтобы предложить новую молекулу выделенного или рекомбинантного полинуклеотида, включающую последовательность ДНК, кодирующую часть шарнирной области полипептида PHYA1 Gossypium hirsutum.
[0008] Еще одна цель изобретения заключается в том, чтобы предложить молекулу выделенного или рекомбинантного полинуклеотида, включающую последовательность ДНК, содержащую вторичную молекулу нуклеотида из 213 пар оснований, кодирующую часть шарнирной области пол и пептида PHYA1.
[0009] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить шпилечный конструкт нуклеиновой кислоты, кодирующий последовательность генов полинуклеотида PHYA1, включающую последовательную смысловую нуклеотидную часть из 213 пар оснований (SEQ ID NO:1) шарнирной области гена PHYA1 Gossypium и его антисмысловой комплемент, так что первая и вторая полинуклеотидные последовательности гибридизируются при их транскрипции в рибонуклеиновую кислоту, чтобы сформировать шпилеподобную двухцепочечную рибонуклеотидную молекулу.
[0010] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить способ снижения уровня фитохрома А1 в хлопчатнике, причем способ включает экспрессию в растении гетерологичного конструкта нуклеиновой кислоты, кодирующего последовательность генов PHYA1, включающую последовательную смысловую нуклеотидную часть из 213 пар оснований гена PHYA1 Gossypium и ее антисмысловой комплемент, и причем экспрессия индуцирует РНК-интерференцию (RNAi) в растении, что приводит к растениям, которые продуцируют удлиненные черешки листьев, плодовые ветви, плодоножки семенных коробочек и корневую систему, интенсивный вегетативный рост, раннее цветение и раннее созревание семенных коробочек, усиленную старением пигментацию антоциана в стеблях и листьях, повышенное качество волокон (длина, прочность, средний диаметр, однородность и т.д.) и фенотипы урожая волокон по отношению к хлопчатнику дикого типа при нормальном солнечном освещении.
[0011] Еще одна цель изобретения заключается в том, чтобы предложить способ модификации или супрессии экспрессии гена PHYA1 в клетках Gossypium sp., причем способ включает: трансформацию растения с помощью вектора, включающего нуклеинокислотную последовательность, кодирующую двухцепочечную ДНК и оперативно связанную с промотором и последовательностью терминации транскрипции, отбор трансформированных растений, которые интегрировали нуклеинокислотную последовательность в их геномы, скрининг трансформированных растений на экспрессию двухцепочечной ДНК, кодированной нуклеинокислотной последовательностью, и отбор растений, которые экспрессируют двухцепочечную ДНК и/или малую интерферирующую РНК.
[0012] Еще одна цель изобретения заключается в том, чтобы предложить рекомбинантные нуклеотидные последовательности, включающие бинарный вектор, конструкт PHYA1 RNAi, причем конструкт PHYA1 RNAi включает нуклеотидную последовательность из 213 пар оснований из шарнирной области гена PHYA1, и причем промотор 35S вируса мозаики цветной капусты (CaMV) присутствует в этой нуклеотидной последовательности сразу же перед шпилем PHYA1, каждый конструкт доставлен инокуляцией, опосредованной Agrobacterium, что приводит к рекомбинации in vitro, супрессии генов PHYA1 и измененным уровням экспрессии других фитохромов.
[0013] Еще одна цель изобретения заключается в том, чтобы предложить клетку-хозяина, включающую конструкт бинарного вектора PHYA1 RNAi.
[0014] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить способ получения трансгенного хлопчатника, в котором ген хлопчатника PHYA1 супрессирован, причем способ включает: (а) стабильную трансформацию клетки-хозяина хлопчатника с помощью конструкта PHYA1 RNAi изобретения, (b) соматическую регенерацию трансгенного растения из стабильно трансформированной клетки-хозяина хлопчатника и (с) выращивание трансгенного растения в условиях, при которых упомянутые растения проявляют измененные фотоморфогенные характеристики, включая измененную архитектуру растения с более длинными черешками листьев, плодовыми ветвями и плодоножками семенных коробочек, усиленное удлинение корневой системы, интенсивный вегетативный рост, раннее цветение и раннее созревание семенных коробочек, усиленную старением пигментацию антоциана в стеблях и листьях по сравнению с нетрансформированным хлопчатником дикого типа.
[0015] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить трансгенный хлопчатник, полученный способами изобретения, или его потомство, включающее: конструкт изобретения PHYA1 RNAi, причем упомянутые растения проявляют измененную экспрессию фотоморфогенных характеристик, включая измененную архитектуру растения с более длинными черешками листьев и плодовыми ветвями, усиленное удлинение корневой системы, интенсивный вегетативный рост, раннее цветение и раннее созревание семенных коробочек, усиленную старением пигментацию антоциана в стеблях и листьях по сравнению с нетрансформированным хлопчатником дикого типа.
[0016] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить трансгенную клетку хлопчатника, включающую конструкт изобретения PHYA1 RNAi.
[0017] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить трансгенный хлопчатник, включающий конструкт изобретения PHYA1 RNAi, причем трансгенное растение имеет волокна хлопчатника увеличенной длины и прочности, а также улучшенный средний диаметр, удлинение и однородность волокон по отношению к хлопчатнику дикого типа.
[0018] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить трансгенные семена вышеуказанного трансгенного растения, включающие конструкт изобретения PHYA1 RNAi.
[0019] Еще одна цель изобретения заключается в том, чтобы предложить растения, клетки растений, части растений и семена растений, которые трансформированы конструктом изобретения PHYA1 RNAi.
[0020] Еще одна цель изобретения заключается в том, чтобы предложить способ индуцирования превосходного качества волокон увеличенной длины и прочности и улучшенным средним диаметром, удлинением и однородностью волокон, повышенной урожайностью семян у хлопчатника по отношению к хлопчатнику дикого типа, включающий супрессию гена PHYA1.
[0021] Еще одна цель изобретения заключается в том, чтобы предложить способ инициации раннего цветения и раннего созревания семенных коробочек хлопчатника по отношению к хлопчатнику дикого типа, включающий супрессию гена PHYA1.
[0022] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить способ усиления развития корней хлопчатника по отношению к хлопчатнику дикого типа, включающий супрессию гена PHYA1.
[0023] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить способ усиления интенсивного вегетативного роста, усиленную старением пигментацию антоциана в стеблях и листьях и удлинение корешков листьев, плодовых ветвей и плодоножек семенных коробочек хлопчатника по отношению к хлопчатнику дикого типа, включающий супрессию гена PHYA1.
[0024] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить способ изменения характеристик растения путем изменения числа копий конструктов изобретения PHYA1 RNAi, чтобы усилить супрессию.
[0025] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить способ изменения характеристик растения путем изменения числа копий конструктов изобретения PHYA1 RNAi, чтобы усилить супрессию гена PHYB/C/E.
[0026] Еще одна дополнительная цель изобретения заключается в том, чтобы предложить трансгенную клетку хлопчатника, включающую конструкт изобретения PHYA1 RNAi, причем трансгенное растение, регенерированное из упомянутой клетки, проявляет супрессию гена PHYA1 и сверхэкспрессию генов PHYB/C/E, давая растение, демонстрирующее измененную архитектуру растения с более длинными черешками листьев и плодовыми ветвями, усиленное удлинение корневой системы, интенсивный вегетативный рост, раннее цветение и раннее созревание семенных коробочек, усиленную старением пигментацию антоциана в стеблях и пластинках листьев, превосходное качество волокон увеличенной длины и прочности и улучшенным средним диаметром, удлинением и однородностью волокон и повышенной урожайностью семян хлопчатника по отношению к хлопчатнику дикого типа.
[0027] Другие цели и преимущества настоящего изобретения станут очевидными из нижеприведенного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0028] Досье патента или заявки содержит по меньшей мере один чертеж, выполненный в цвете. Копии публикации настоящего патента или патентной заявки с цветными чертежами будут предоставлены Ведомством США по патентам и товарным знакам по запросу и после уплаты необходимой пошлины.
[0029] На Фиг. 1А-1С показаны эффекты PHYA1 RNAi в хлопчатнике: Фиг. 1А - схематическое изображение гена PHYA, положения фрагмента RNAi и плазмиды pHellsgate-8::PHYA1 RNAi; Фиг. 1В - развитие побега и корня; и Фиг. 1С - характеристики длины волокон поколения Т0 PHYA1 RNAi и контрольных хлопчатников, соматически регенерированных в тканевой культуре.
[0030] На Фиг. 2A-2D показаны связанные с фитохромом изменения в развитии растений PHYA1 RNAi по сравнению с контрольными: Фиг. 2А - усиленный вегетативный рост и раннее цветение растения Т0 RNAi по сравнению с контрольным растением, высаженным в тот же день, регенерированного посредством соматического эмбриогенеза. Фиг. 2С - раннее цветение растения RNAi из поколения T1 по сравнению с контрольным растением (Фиг. 2В), высаженным в тот же день в ту же среду. Фиг. 2D - разница в длине черешка (Т0), и Фиг. 2Е - разница в развитии корня (Т3) по сравнению с контрольным растением Coker-312.
[0031] На Фиг. 3 показана штапельная длина волокон из хлопчатников RNAi из поколений Т1. Зеленые столбцы показывают показатели штапельной длины для 3 отдельных растений Coker-312 (помечены как К-312); оранжевые столбцы показывают показатели штапельной длины для отдельных растений RNAi поколения Т1; и желтый столбец показывает показатель штапельной длины для хлопчатника пима. Контрольные растения и растения RNAi Coker-312 были выращены в той же самой тепличной среде.
[0032] На Фиг. 4A-4D показаны связанные с фитохромом эффекты RNAi в линии RNAi, полученной путем скрещивания RNAi Coker 312 и культивара AN-Boyovut-2 (узбекская разновидность): Фиг. 4А - связанную со старением пигментацию антоциана у растений, выращенных в поле; Фиг. 4 В и 4D - накопление антоциана в листьях и семенных коробочках хлопчатника и удлинение черешков листьев и плодоножки семенных коробочек; и Фиг. 4С - тип куста и продуктивность линии RNAi, разработанной с использованием настоящего изобретения.
[0033] На Фиг. 5 показана общая тенденция изменения основных качественных признаков волокон во втором поколении растений RNAi Coker-312 по сравнению с контрольными, выращенными в тех же условиях.
[0034] На Фиг. 6А-6Н показаны гистограммы средних фенотипических характеристик отобранных семейств растений PHYA1 RNAi поколения Т2 (Т2-1_7 и Т2-31_10) по сравнению с контрольными хлопчатниками, выращенными в той же среде и при тех же условиях: Фиг. 6А верхнее полусреднее (UHM); Фиг. 6В, средний диаметр (MIC); Фиг. 6С, прочность волокна (STR); Фиг. 6D, однородность волокон; Фиг. 6Е, удлинение волокон (ELO); Фиг. 6F, средняя длина гипокотиля; Фиг. 6G, среднее число цветов к 15 июля 2009 г.; и Фиг. 6Н, среднее число открытых семенных коробочек к 15 сентября 2009 г. Статистическая значимость измеренных характеристик генотипов RNAi и контрольных по критерию знаковых рангов Вилкоксона при р≤0.05 определен буквами "а", "b" и "с".
[0035] На Фиг. 7А показаны характеристики длины волокон, и на Фиг. 7С и 7D показаны характеристики развития корней отобранных семейств растений PHYA1 RNAi поколения Т3 (Т3-1_7 и Т3-31_10) по сравнению с контрольными хлопчатниками, выращенными в той же среде и условиях. ПЦР-проверка этих отобранных растений показана на Фиг. 7В: лестница пар оснований М-100, 1 - Т3-1_7; 2- Т3-31_10; 3 - Coker 312; 4 - плазмида pHellsgate-8::PHYA1; 5 - контроля матрицы ДНК нет. Эти растения использовали для идентификации номера копии и анализов относительной экспрессии с использованием количественной ПЦР.
[0036] На Фиг. 8А and 8В показана разница в вегетативном росте выращенных в поле Т3 RNAi т контрольных растений в экспериментально контролируемом полевом испытании 2009 года (Фиг. 8А). Возможность переноса связанных с фитохромом эффектов RNAi из RNAi Coker-312 в американский культивируемый хлопчатник (AN-Boyovut-2) показана на Фиг. 8А и 8В. На Фиг. 8С показано сравнение улучшения образцов волокон между оригинальным культиваром (слева) и гибридами RNAi F2 (справа), выращенными в той же среде.
[0037] На Фиг. 9 показана общая тенденция изменения основных качественных признаков волокон для гибридов AN-Boyovut-2 × RNAi Coker-312 второго поколения по сравнению с контрольными растениями, выращенными в тех же условиях.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0038] Настоящее изобретение касается роли фитохромных генов в регуляции конкретных фенотипических признаков хлопчатника. Мы выдвинули гипотезу роли фитохромных генов в регуляции удлинения хлопковых волокон (Abdurakhmonov, I. Y. 2001. Thesis. Texas А& М University, USA) на основании тех фактов, что наши начальные усилия по картированию фитохромных генов в длине волокна, разделяющем популяцию от двух родителей, предполагали значительную связь полиморфизмов гена PHYA1 с локусом количественных признаков длины волокна (Abdurakhmonov 2001, см. выше). Используя консервативные последовательности шарнирной области фитохромных генов у покрытосемянных растений, в частности, филогенетически тесно связанных эвдикотов (относящихся к покрытосеменным и розидам), таким как арабидопсис, томат, картофель, цитрус, хрен, морковь и другие овощи, плодовые, масличные и кормовые культуры, нам удалось клонировать и секвенсировать ортологи хлопчатника семейства фитохромных генов (Abdurakhmonov 2001, см. выше; Abdurakhmonov 2010, см. выше). Мы недавно сообщили о наших исследованиях молекулярно-эволюционной характеризации семейства фитохромных генов у хлопчатника (Abdurakhmonov et al. 2010. ВМС Plant Biol. 10:119). Другие исследователи доказали, что технология сайленсинга РНК-индуцированных генов является успешным инструментом для исследования генной функции у нескольких организмов, включая растения (Waterhouse and Helliwell. 2003. Nature Reviews Genetics 4:29-38; Wesley et al. 2001. The Plant Journal 27:581-590; Helliwell et al. 2002. Fund. Plant Biol. 29:1217-1225).
[0039] Мы исследовали эффекты сайленсинга генов посредством РНК-интерференции фитохромных генов в хлопчатниках. В частности, мы исследовали влияние РНК-интерференции на генерацию более длинного хлопкового волокна и на усовершенствование других важных качественных признаков волокон в свете ранее изученных генетических корреляций среди признаков волокон. Изменение в экспрессии фитохромных генов влияет на период цветения. Также было оценено влияние РНК-интерференции фитохромных генов на развитие корней и побегов, поскольку предыдущие исследования предполагали участие фитохромных генов растения в регуляции нитратредуктазы (Jonassen et al. 2008. Planta 227(3):559-564; Lillo, С. 2008. Biochem J. 415(1):11-19) и гомолога 2 и гомолога 3 переносимости соли (Datta et al. 2007. Plant Cell 19(10):3242-3255; Datta et al. 2008. Plant Cell 20(9):2324-2338). Помимо этого, есть несколько отчетов об участии фитохромов их сигнальных трансдукционных факторов к переносимости холода/мороза и засухи арабидопсисом (Kim ef al. 2002. Plant J. 29(6):693-704; Franklin and Whitelam. 2007. Nat. Genet. 39(11)1410-1413; Beck et al. 2007. J. Biosci. 32(3):501-510).
[0040] Мы ранее охарактеризовали все фитохромы хлопчатника и изучили их молекулярную эволюцию в геноме хлопчатника (Abdurakhmonov 2001, см. выше; Abdurakhmonov et al. 2010, см. выше). Два паралогичных гена PHYA1 и PHYA2 были идентифицированы в диплоидных хлопчатниках, являющихся результатом Malvaceae-специфической дупликации генов приблизительно 14 млн лет назад до дивергенции предков геномов А и D. В диплоидных хлопчатниках была обнаружена одна генная копия PHYB, PHYC и PHYE. Эти хлопчатники с аллотетраплоидными геномами (AD) в большой степени сохранили полные комплементы генов по меньшей мере с четырьмя генами PHYA и двумя генами, кодирующими PHYB, PHYC и PHYE. Ген PHYD не был найден в каком-либо из исследованных геномов (Abdurakhmonov et al. 2010, см. выше).
[0041] Здесь мы сообщаем результаты наших исследований по биологической роли фитохромных генов посредством РНК-интерференции (RNAi) с использованием генной последовательности PHYA1, связанной с локусом количественных признаков качества волокон. Мы здесь представляем первое молекулярное доказательство важности факторов, относящихся к фотоморфогенезу в сложном процессе развития хлопковых волокон, и пригодность специфической для фитохромов RNAi для улучшения важных агрономических признаков хлопчатника. Кроме того, мы показываем, что эти эффекты могут быть перенесены посредством сексуального кроссинга на культивары хлопчатника американского.
[0042] В этой работе мы смогли индуцировать связанные с фитохромами фенотипы RNAi хлопчатника, которые создали несколько улучшенных комплексных агрономических признаков, которые признаны важными для выращивания хлопчатника, но которые изменяются для традиционного выращивания. Характеризация шарнирной области фитохромов А, В, С и Е хлопчатника (Abdurakhmonov 2001, см. выше; Abdurakhmonov et al. 2010, см. выше) и существенная связь генов PHYA1 с качеством волокон подсказали нам, что необходимо выбрать и использовать РHYA1-специфическую последовательность для развития конструкта RNAi. Выбранный фрагмент PHYA1 длиной 213 пар оснований имел нуклеотидное сходство 87% с генами PHYA2 хлопчатника, 75% с арабидопсисом PHYA, 59% с генами РНУБ хлопчатника, 53% с генами PHYE хлопчатника и ~50% с генами PHYC хлопчатника. Эффективный сайленсинг генов обычно требует 80-100% нуклеотидной идентичности, чтобы индуцировать сильную и специфическую RNAi (Holzberg et al. 2002. Plant J. 30:315-327); поэтому наш конструкт RNAi был разработан так, чтобы быть нацеленным предпочтительно на гены PHYA хлопчатника.
[0043] Наши результаты по трансформации хлопчатника вскрыли интересные, связанные с фитохромами фенотипы у зародышевых проростков на ранней стадии. Например, мы наблюдали интенсивное развитие побегов и боковых корней, а также фенотип раннего цветения. Такое интенсивное развитие боковых корней наблюдалось с мутациями для гена HY5 у арабидопсиса; HY5 является положительным регулятором фотоморфогенеза (Oyama et al. 1997. Genes Dev. 11:2983-2995). С учетом того, что волокна хлопчатника развиваются из эпидермиса семян и, таким образом, анатомически напоминают эпидермальные концы корней, наблюдение процесса удлинения корней в растениях Т0 PHYA1 RNAi важно для оценки наличия более длинных волокон в тех же растениях. Действительно, наши результаты продемонстрировали значительное, но ценное улучшение в длине волокон, а также другие характеристики качества волокон в других семействах хлопчатника RNAi, которые были стабильно экспрессированы в растениях последующих поколений Т1, Т2 and Т3, выращенных в экспериментально контролируемых полевых условиях под нормальным солнечным освещением. Наши результаты согласуются с более ранними наблюдениями за влиянием отношений дальнего красного/красного света на длину и диаметр волокон (Kasperbauer 2000, см. выше) и нашими предварительными результатами по связи PHYA1 с ЛКП длины волокон у хлопчатника (Abdurakhmonov 2001, см. выше).
[0044] Связанное с фитохромом удлинение волокон может происходить из-за опосредованного фитохромом сигналинга гормона растения (Neff et al. 2000. Genes Dev. 3:257-271; Coton-Carmona et al. 2000. Plant Physiol. 124(4): 1728-1738; Stamm and Kumar. 2010. J. Exp.Bot. 61(11):2889-2903), такого как ауксин (IAA), абсцизовая кислота (ABA), гибберелловая кислота (GA), брассиностероиды (BR), этилен и цитокинин, которые признаны ключевыми факторами, связанными с развитием волокна (Lee et al. 2007. Ann. Bot. 100:1391-1401). Например, недавние попытки пространственно-временного манипулирования биосинтезом ауксина в развивающихся семяпочках хлопчатника продемонстрировали увеличение выхода волокон и качественных параметров хлопчатника (Zhang et al. 2011. Nature Biotechnol. 29(5):453-458). Это серьезное доказательство молекулярного перекрестного взаимодействия между сигналингом ауксина и света посредством внутреннего взаимодействия ауксин-фитохром, в частности PHYA (Neff et аl. 2000, см. выше; Colon-Carmona et аl., см. выше). Это может объяснить улучшение качества волокон в наших растениях RNAi и предполагает роль гена PHYA в этом процессе. Кроме того, посредством характеризации небольших видов РНК из развивающихся семяпочек (Abdurakhmonov et al. 2008. ВМС Plant Biol. 8:93; Devor et al. 2009. Int. J. Plant Genomics. PubMedID: 19551152) мы наблюдали, что факторы, относящиеся к фотоморфогенезу (PHYC, SPA1, FAR1, СОР1/9, CIP7/8 и RTP2), которые ответственны за восприятие дальнего красного/красного света и трансдукцию сигнала света, фототропизм, гравитропизм и циркадные ритмы, были мишенями для полученных из семяпочек малых интерферирующих РНК на фазе инициации волокна и более четко на фазе удлинения волокон при развитии волокон.
[0045] Однако следует сказать, что мы наблюдали переменную тенденцию улучшения признаков волокон в растениях Т2 RNAi от разных событий трансформации, таким образом предполагая, что переменные типы и уровни RNAi были индуцированы фрагментом PHYA1 последовательности генов, который мы использовали. Этот результат мог быть связан с RNAi из-за сочетания разных уровней супрессии фитохромных генов и разного числа копий конструкта RNAi в геноме. Наши результаты предполагают, что два четко различающихся, односеменных, семейства хлопчатников RNAi со специфическими фенотипами RNAi отличаются по числу копий плазмиды RNAi, введенной в их геномы, а также уровень выключения гена и супрессии комбинаций генов. Мы наблюдали, что образец с тремя копиями был связан с более глубокой супрессией гена PHYA1. Как мы предположили, наш конструкт RNAi на основе последовательности PHYA1, нацеленный главным образом только на последовательности PHYA1 хлопчатника, не влиял на другие фитохромные гены хлопчатника, даже на гены PHYA2, которые имели 87% нуклеотидной идентичности в обоих отобранных семействах RNAi. Однако в Т3-31_10 мы наблюдали 10% супрессию генов PHY6 хлопчатника, которые имели нуклеотидную идентичность ~60% с фрагментом PHYA1 RNAi. Эти результаты поддерживают нашу гипотезу о том, что разные комбинации фитохромных генов супрессируются с помощью последовательности генов PHYA1, которую мы использовали для трансформации. В дополнение к выключению PHYA1 небольшая супрессия PHYB в Т3-31_10 привела к фенотипу раннего цветения по сравнению с Т3 -1_7.
[0046] В то же время, увеличение в ~2 - 20 раз уровней экспрессии других фитохромных генов, т.е., PHYA2, PHYB, PHYC и PHYE, в РНYA1-супрессированных растениях RNAi были неожиданными результатами. Что интересно, более глубокая супрессия PHYA1 в Т3-1_7 привела к повышенной экспрессии других фитохромов чем в случае Т3 -31_10. Этот факт в общем согласуется с отчетом о возможных перекрывающихся функциях фитохромных генов (Reed et al. 1994. Plant Physiol. 1104:1139-1149). Другими словами, фитохромы могут замещать друг друга при регуляции некоторых связанных с фитохромами фенотипов, таких как цветение. Повышенные уровни PHYA2 и PHYC в семействах PHYA1 RNAi могут быть результатом такого замещения, поскольку в рисовых растениях PHYC реагирует на постоянный дальний красный свет, как и PHYA (Takano et al. 2005. Plant Cell 17:3311-3325; Kneissl et al. 2008. Mol. Plant. 1(1):84-102), хотя фотосенсорная специфичность PHYC подобна таковой у PHYB/D/E (Monte et al., см. выше), который является сенсором слабого красного света (Schepens et al. 2004. Curr. Opin. Plant Biol. 7(5):564-569). Помимо этого, наблюдавшееся увеличение от ~5 до 20 раз в экспрессии генов PHYE/B в наших растениях PHYA1 RNAi предполагает возможное перекрывание функций между PHYA и PHYE/B хлопчатника, которые могут быть специфическими для фитохромных видов хлопчатника.
[0047] Мы выдвинули гипотезу, что супрессия генов PHYA в хлопчатнике будет генерировать фенотипы позднего цветения, поскольку PHYA обычно способствует цветению растений (Neff and Chory 1998, см. выше). Альтернативно, повышенная экспрессия PHYA2 поддерживала раннее цветение у наших отобранных семейств RNAi хлопчатника. Также, повышенная экспрессия PHYC может способствовать фенотипу раннего цветения на фоне супрессии PHYA1, поскольку PHYC может способствовать цветению в отсутствие PHYA в условиях длинного дня (Franklin et al. 2003, см. выше; Monte et al., см. выше; Balasubramanian et al., см. выше). Этот изменяемый уровень экспрессии фитохромных генов у растений RNAi может быть индуцировал процесс "избегания затенения", приводя к ускоренному росту растений. Растения пытаются завершить их жизненный цикл, когда затенение становится проблемой, и ускоряют цветение как реакция на листовой полог (Devlin et al. 1999, см. выше; Salter et al. 2003. Nature 426(6967):680-683). Мы наблюдали удлиненные черешки листьев и плодовых ветвей как фенотип маркера у хлопчатников PHYA1 и PHYA1/B RNAi, что предполагает индукцию процесса избегания затенения как попытку перерасти соседние растения (Salter et al., см. выше). Раннее созревание семенных коробочек хлопчатника, наблюдавшееся у хлопчатников PHYA1 RNAi, также могло быть связано с реакцией на тень, также как реакция избегания затенения у арабидопсиса включает и раннее цветение, и ранее созревание семян (Devlin et al. 1999, см. выше; Salter et al., см. выше).
[0048] Стоит упомянуть, что в семействах RNAi наблюдались пониженный процент линта, признаки показателей семян и линта, с учетом того, что известна отрицательная корреляция между длиной волокон и этими признаками у хлопчатника (Miller and Rawlings. 1967. Crop Sci. 7:637-640; Meredith and Bridge. 1973. Crop Sci. 13:698-701), приводящая к влиянию на совокупную урожайность хлопчатника. Однако повышенный потенциал урожайности, который мы наблюдали у растений RNAi, может быть объяснен связанным с фитохромом интенсивным развитием стеблей и корней, что дало больше плодовых ветвей, цветов и семенных коробочек и повысило эффективность усвоения питательных веществ из фунта, таким образом потенциально способствуя наблюдавшемуся повышению урожайности. Предыдущие исследования показали, что сверхэкспрессия гена PHYB арабидопсиса в картофеле привела к повышению фотосинтеза и что трансгенные растения картофеля с повышенной пигментацией антоциана дали повышенный объем биомассы и повышенный урожай клубней по сравнению с контрольными (Thiele et al. 1999. Plant Physiol. 120(1):73-82). Еще одна возможность заключается в том, что измененное восприятие фотосинтетического света из-за измененной экспрессии фитохромных генов, особенно увеличение экспрессии PHYB/E и PHYC, может быть повлияло на скорость фотосинтеза, таким образом приводя к повышению потенциала урожайности растений RNAi. Будучи фотосенсором красного света, как PHYB, увеличенная в несколько раз сверхэкспрессия PHYE/C хлопчатника на фоне PHYA1/B RNAi возможно может также создавать вышеупомянутый фенотип растения картофеля со сверхэкспрессированным PHYB, при этом повышаются потенциал урожайности и пигментация антоциана при биологическом старении растения PHYA1 RNAi.
[0049] Мы также оцениваем улучшение характеристик стойкости разработанных растений PHYA1/B RNAi к засухе, засоленности, похолоданию, морозу из-за наблюдавшегося интенсивного развития корней, поскольку в предыдущих исследованиях сообщалось о связи фитохромных генов с этими эффектами (Jonassen et al., см. выше; Lillo, см. выше; Datta et al. 2007, см. выше; Datta et al. 2008, см. выше; Kim et al., см. выше; Franklin and Whitelam, см. выше; Beck et al., см. выше). В направлении этой цели ведутся исследования и активные попытки оценить более высокое поколение этих трансгенных растений в естественных полевых условиях, а также в благоприятной окружающей среде.
[0050] Мы использовали Coker 312, линию с плохим потенциалом урожайности из-за ее хорошо документированного высокого соматического эмбриогенеза и эффективности регенерации in vitro. Кроссы трансгенных линий Coker 312 с улучшенными культиварами продемонстрировали передачу тех же фенотипических и генетических эффектов от RNAi Coker 312. Одновременное улучшение нескольких комплексных признаков без влияния на другие параметры, которое мы достигли здесь посредством PHYA1 RNAi, ограничено в традиционном выращивании. Например, интрогрессия качественных генов мелких волокон от культиваров хлопчатника пима в культивары американского хлопчатника с использованием межвидовой генетической гибридизации представляет собой проблему из-за широкой генетической сегрегации, сопротивления сцеплению и генетическим нарушениям у последующих поколений гибридов, которые поздно созревают и имеют низкое агрономическое качество (Endrizzi et al. 1985. Adv. Genetics 23:271-375). Результаты наших исследований RNAi направлены на решение этих фундаментальных поблеем и позволяют быстро разрабатывать рано созревающие культивары, имеющие повышенное качество волокон, например, рано созревающие разновидности хлопчатника американского, имеющие повышенное качество волокон. Таким образом, мы разработали превосходные культивары хлопчатника узбекского, которые адаптированы к местному производству хлопка при сохранении всех других характеристик, специфических для исходного культивара. Новые рынки сбыта для более длинного и прочного хлопкового волокна, а также раннее созревание и повышенный потенциал урожайности повысят оцененную экономическую ценность этой технологии. Улучшение стойкости к абиотическим стрессам посредством фитохрома RNAi еще больше повышает его коммерческий потенциал.
[0051] Наши результаты поддерживают и освещают важность фотоморфогенеза растений для развития хлопкового волокна и его воздействие на качество волокна. Мы делаем вывод, что РНК-интерференция генов PHYA1 хлопчатника приводит к супрессии генов-мишеней, а также изменяет уровень экспрессии остальных фитохромов. Наблюдавшиеся эффекты РНК-интерференции в хлопчатника поэтому являются результатом как супрессии PHYA1, так и увеличения в несколько раз экспрессии других фитохромов. Это изменение в профиле экспрессии семейства фитохромных генов хлопчатника приводит к измененной архитектуре растения с удлиненными черешками листьев и плодовыми ветвями, раннему цветению, раннему созреванию семенных коробочек, повышенному качеству волокна и повышенной урожайности. Эти изменения стабильно выражены в последующих поколениях и могут быть перенесены из трансформированного генотипа Coker 312 в культивар хлопчатника американского посредством генетической гибридизации и селекции.
Поэтому разработка превосходных растений хлопчатника RNAi с длинными волокнами, основанная на РНК-интерференции фитохромных генов, полученных из видов Gossypium, позволит селекционерам быстро улучшить созревание, основные качественные признаки и выход волокна. Переносимый конструкт PHYA1 RNAi может повысить стойкость культивара хлопчатника американского к абиотическим стрессам. Эта стратегия РНК-интерференции не только предлагает решение фундаментальных проблем традиционного выращивания хлопка, но и дает существенный экономический доход от производства хлопка во всем мире и откроет новую парадигму для выращивания хлопчатника американского.
[0052] В одном предпочтительном варианте осуществления настоящего изобретения, клетка-хозяин, содержащая нуклеотидные последовательности изобретения, является бактериальной клеткой, в частности, клеткой Agrobacterium tumefaciens.
[0053] Как для прямого переноса генов, так и для переноса, опосредованного Agrobacterium, трансформацию обычно (но не обязательно) выполняют с селектируемым маркером, который может придавать стойкость к антибиотику (канамицину, гигромицину или метатрексату) или гербициду (сульфонилмочевине, имидазолинону или Basta). Выбор селектируемого маркера однако не критичен для изобретения.
[0054] Используемые здесь термины "молекула нуклеиновой кислоты", "нуклеинокислотная последовательность", "полинуклеотид", "полинуклеотидная последовательность", "фрагмент нуклеиновой кислоты", "выделенный фрагмент нуклеиновой кислоты" используются в настоящем документе взаимозаменяемо. Эти термины охватывают нуклеотидные последовательности и т.п. Полинуклеотид может быть полимером РНК или ДНК, которая является одноцепочечной или двухцепочечной и которая, по выбору, содержит синтетические, неприродные или измененные нуклеотидные основания. Полинуклеотид в форме полимера ДНК может состоять из одного или нескольких сегментов кДНК, геномной ДНК, синтетической ДНК или их смесей.
[0055] Термин "выделенный" полинуклеотид относится к полинуклеотиду, который по существу свободен от других нуклеинокислотных последовательностей, таких как другие хромосомные и сверххромосомные ДНК и РНК, которые обычно сопровождают или взаимодействуют с ним в его природной среде. Однако выделенные полинуклеотиды могут содержать полинуклеотидные последовательности, которые могут изначально существовать как сверххромосомные ДНК, но существуют как нуклеотидная вставка в выделенном полинуклеотиде. Выделенные полинуклеотиды могут быть очищены от клетки-хозяина, в которой они натурально встречаются.
Традиционные способы очистки нуклеиновых кислот, известные специалистам в данной области, могут быть использованы для получения выделенных полинуклеотидов. Этот термин также охватывает рекомбинантные полинуклеотиды и химически синтезированные полинуклеотиды.
[0056] Используемый здесь термин "рекомбинантная" относится к молекуле нуклеиновой кислоты, которая получена путем манипуляции генетическим материалом с использованием рестрикционных ферментов, лигаз и подобных приемов генетического инжиниринга, которые описаны, например, Сэмбруком и др. (Sambrook et al.) 1989. Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY or DNA Cloning: A Practical Approach, Vol. I and II (Ed. D.N. Glover), IRL Press, Oxford, 1985. Термин "рекомбинантная", используемый в настоящем документе, не относится к встречающимся в природе генетическим рекомбинациям.
[0057] Используемый здесь термин "химерный" относится к двум или больше молекулам ДНК, которые получены из разных источников, штаммов или видов, которые не рекомбинируются в природных условиях, или к двум или больше молекулам ДНК из одного вида, которые связаны таким образом, который не встречается в нативном геноме. "Конструкт" или "химерный генный конструкт" относится к нуклеинокислотной последовательности, кодирующей белок, оперативно связанной с промотором и/или другими регуляторными последовательностями.
[0058] Используемый здесь термин "экспрессировать" или "экспрессия" определяется как означающий только транскрипцию. "Измененные уровни" или "измененная экспрессия" относится к производству генного продукта (или продуктов) в трансгенных организмах в количествах или долях, которые отличаются от таковых у нормальных или нетрансформированных организмов.
[0059] Используемые здесь термины "кодирование" или "кодированный" при использовании в контексте определенной нуклеиновой кислоты означают, что эта нуклеиновая кислота содержит требуемую информацию для направления трансляции нуклеотидной последовательности в определенный белок. Информация, которой кодируется белок, определена путем использования кодонов. Нуклеиновая кислота, кодирующая белок, может содержать нетранслированные последовательности (например, интроны) в транслированных областях нуклеиновой кислоты или может не содержать такие вставочные нетранслированные последовательности (например, как в кДНК).
[0060] Термин "оперативно связанный" относится к связи двух или больше фрагментов нуклеиновой кислоты на одном фрагменте нуклеиновой кислоты, так что функция одного влияет на другой. Например, промотор оперативно связан с кодирующей последовательностью, когда он способен влиять на экспрессию этой кодирующей последовательности (т.е., когда кодирующая последовательность находится под транскрипционным управлением промотора). Кодирующие последовательности могут быть оперативно связаны с регуляторными последовательностями в смысловой или антисмысловой ориентации.
[0061] Термин "регуляторные последовательности" относится к нуклеотидным последовательностям, расположенным перед (5ʹ некодирующие последовательности), в или после (3ʹ некодирующие последовательности) кодирующей последовательности, которые влияют на транскрипцию, процессинг или стабильность РНК или трансляцию связанной кодирующей последовательности. Регуляторные последовательности здесь могут включать промоторы: промотор Т7, промотор CaMV 35S и субгеномные промоторы (два, на каждой стороне сайта множественного клонирования), трансляционные лидерные последовательности, интроны и последовательности распознавания полиаденилирования.
[0062] Термин "промотор" относится к нуклеотидной последовательности, способной управлять экспрессией кодирующей последовательности или функциональной РНК. Обычно кодирующая последовательность расположена 3ʹ к промоторной последовательности. Промоторная последовательность состоит из проксимальных и более дистальных, расположенных выше, элементов, причем эти элементы часто называют энхансерами. Соответственно, "энхансер" - это нуклеотидная последовательность, которая может стимулировать активность промотора и может быть естественным элементом промотора или гетерологичным элементом, вставленным для усиления уровня или тканевой специфичности промотора. Промоторы могут быть получены в их целостности из нативного гена или могут быть составлены из разных элементов, полученных от разных промоторов, найденных в природе, или даже могут включать синтетические нуклеотидные сегменты. Специалисты в данной области понимают, что разные промоторы могут направлять экспрессию гена в разных типах клеток или тканей, или на разных стадиях развития, или в ответ на разные условия окружающей среды. Промоторы, которые вызывают экспрессию фрагмента нуклеиновой кислоты в большинстве типов клеток в большинстве случаев обычно называются "конститутивными промоторами". Постоянно открываются новые промоторы разных типов, подходящие для клеток растений, многочисленные примеры можно найти в компиляции Окамуро и Гольдберга (Okamuro and Goldberg). 1989. Biochemistry of Plants 15:1-82. Кроме того признано, что, поскольку в большинстве случаев точные границы регуляторных последовательностей полностью не определены, фрагменты нуклеиновых кислот разной длины могут иметь идентичную промоторную активность.
[0063] Термин "транскрипт РНК" относится к продукту, являющемуся результатом транскрипции, катализированной РНК-полимеразой, последовательности ДНК. Когда транскрипт РНК является совершенной комплементарной копией последовательности ДНК, его называют первичным транскриптом, или он может быть РНК-последовательностью, полученной путем посттранскрипционного процессинга первичного транскрипта и называется зрелой РНК. Термин "матричная РНК (мРНК)" относится к РНК, которая не имеет интронов и которая может быть транслирована клеткой в полипептиды. Термин "кДНК" относится к ДНК, которая является комплементарной к матрице мРНК и получена из нее. кДНК может быть одноцепочечной или может быть преобразована в двухцепочечную форму с использованием, например, фрагмента Кленова ДНК-полимеразы I. "Смысловая" РНК относится к транскрипту РНК, который включает мРНК и поэтому может быть транслирован клеткой в полипептид. "Антисмысловая", используемая в контексте конкретной нуклеотидной последовательности, относится к комплементарной цепи эталонного продукта транкрипции. "Антисмысловая РНК" относится к транскрипту РНК, который является комплементарным к части или всему целевому первичному транскрипту или мРНК и который блокирует экспрессию гена-мишени. Комплементарность антисмысловой РНК может быть с любой частью специфической нуклеотидной последовательности, т.е., в 5ʹ некодирующей последовательности, 3ʹ некодирующей последовательность, интронах или кодирующей последовательности. "Функциональная РНК" относится к смысловой РНК, антисмысловой РНК, рибозимной РНК или другой РНК, которая не может быть транслирована, но все же оказывает воздействие на клеточные процессы.
[0064] "Супрессия гена" означает любой из хорошо известных способов супрессии экспрессии белка из гена, включая антисмысловую супрессию или супрессию RNAi. При супрессии генов для получения растений с желательным фенотипом предпочтительными являются способы антисмысловой супрессии и супрессии RNAi. Описание антисмысловой регуляции экспрессии генов в клетках растений смотрите в патенте США №5,107,065. Описание супрессии RNAi в растениях путем транскрипции двухцепочечной ДНК смотрите в патенте США №6,506,559, опубликованной патентной заявке США №2002/0168707 А1 и патентной заявке США с серийным номером 09/423,143 (WO 98/53083), 09/127,735 (WO 99/53050) 09/084,942 (WO 99/61631), которые все включены в настоящий документ путем ссылки. Супрессия гена РНК-идентификацией может быть достигнута путем использования конструкта рекомбинантной ДНК, имеющего промотор, оперативно связанный с элементом ДНК, включающим смысловой и антисмысловой элемент сегмента геномной ДНК гена, например, сегмент из по меньшей мере 23 нуклеотидов, более предпочтительно от 50 до 200 нуклеотидов, где смысловой и антисмысловой компоненты ДНК могут быть прямо связаны или соединены интроном или искусственным сегментом ДНК, который может образовывать петлю, когда транскрибированная РНК гибридизируется, чтобы сформировать шпилечную структуру.
[0065] "Трансформация" относится к переносу фрагмента нуклеиновой кислоты в геном организма-хозяина, приводя к генетически стабильному наследованию. Организмы-хозяева, содержащие трансформированные фрагменты нуклеиновой кислоты называются "трансгенными" организмами. Примеры способов трансформации растений включают трансформацию, опосредованную Agrobacterium (De Blaere et al. 1987. Meth. Enzymol. 143:277) и технологию трансформации ускоренными частицами или "генной пушкой" (Klein et al. 1987. Nature (London) 327:70-73; патент США №4,945,050, включенный в настоящий документ путем ссылки). Другие способы трансформации раскрыты ниже. Таким образом, выделенные полинуклеотиды настоящего изобретения могут быть введены в рекомбинантные конструкты, обычно конструкты ДНК, способные к введению в клетку-хозяин и к репликации в ней. Таким конструктом может быть вектор, который включает систему репликации и последовательности, которые способны к транскрипции и трансляции кодирующей полипептид последовательности в данной клетке-хозяине. Число векторов, подходящих для стабильной трансфекции клеток растений или для создания трансгенных растений, описано, например, в публикациях: Pouwels et al. 1985. Supp.1987. Cloning Vectors: A Laboratory Manual; Weissbach and Weissbach. 1989. Methods for Plant Molecular Biology, Academic Press, New York; и Flevin et al. 1990. Plant Molecular Biology Manual, Kluwer Academic Publishers, Boston. Обычно экспрессирующие векторы для растений включают, например, один или несколько клонированных генов растений при транскрипционном управлении 5ʹ и 3ʹ регуляторными последовательностями и доминирующем селектируемом маркере. Такие экспрессирующие векторы для растений также могут содержать промоторную регуляторную область (например, регуляторную область, управляющую индуцируемой или конститутивной, регулируемой окружающей средой или развитием, или специфической к клетке или ткани экспрессией), сайт начала инициации транскрипции, сайт связывания рибосомы, сигнал процессинга РНК, сайт терминации транскрипции и/или сигнал полиаденилирования.
[0066] "Белок" или "полипептид" является цепью аминокислот, расположенных в специфическом порядке, определенном кодирующей последовательностью в полинуклеотиде, кодирующем такой полипептид. Каждый белок или полипептид имеет уникальную функцию.
[0067] Изобретение включает функциональные полипептиды и их функциональные фрагменты, а также мутанты и варианты, имеющие ту же биологическую функцию или активность. Используемые здесь термины "функциональный фрагмент", "мутант" и "вариант" относятся к полипептиду, который обладает биологической функцией или активностью, идентифицированной посредством определенного функционального анализа и связанной с конкретным биологическим, морфологическим или фенотипическим изменением в клетке. Функциональные фрагменты, могут меняться по размеру, например, от фрагмента полипептида, такого как эпитоп, способный связывать молекулу антитела, до крупного полипептида, способного участвовать в характеристической индукции или программировании фенотипических изменений в клетке.
[0068] Гетерологичная кодирующая последовательность относится к кодирующим последовательностям, которые кодируют пептиды или белки, которые не относятся к полипептидам, представленным выше, и которые не находятся в положении, предусмотренном в химерном генном конструкте.
[0069] Фитохромные гены PHYA, PHYB, PHYC, PHYD и PHYE, кодирующие фитохромные белки PHYA, PHYB, PHYC, PHYD и PHYE, могут быть клонированы с использованием разных способов согласно изобретению. Простейшая процедура клонирования таких генов требует клонирования комплементарной ДНК из вирусной геномной РНК или геномной ДНК из организма, идентифицированного как продуцирующий упомянутый белок (или белки), и переноса клонированной ДНК на подходящую плазмиду или вектор в организм-хозяин, который не продуцирует этот белок, после чего следует идентификация трансформированных хозяев, которым придана способность продуцировать этот белок. ДНК, придающая функцию трансформации белка может быть расщеплена на более мелкие фрагменты, и самый малый, который поддерживает способность придания функции белка, можно характеризовать дальше. Способы, подходящие для клонирования путем гомологии, включают стандартный скрининг библиотек путем гибридизации ДНК или амплификацию путем полимеразной цепной реакции (ПЦР) с использованием праймеров, полученных из консервативных последовательностей. Как определено в настоящем документе, две последовательности ДНК являются по существу гомологичными, когда по меньшей мере 80% (предпочтительно по меньшей мере 85% и наиболее предпочтительно 90%) нуклеотидов совпадают с определенной длиной последовательности при использовании таких алгоритмов как CLUSTAL или PILEUP. Последовательности, которые являются по существу гомологичными, могут быть идентифицированы в эксперименте по Саузерн-гибридизации в строгих условиях, который известен в данной области. Смотрите, например, Сэмбрук и др. (Sambrook et al.), см. выше. Сэмбрук и др. описывают очень строгие условия, такие как температура гибридизации на 5-10°С ниже температуры плавления Тm совершенно согласованных цели и пробы; таким образом, последовательности, которые "по существу гомологичны", будут гибридизироваться в таких условиях.
[0070] Используемое здесь выражение "по существу сходный " относится к фрагментам нуклеиновой кислоты, в которых изменения в одном или нескольких нуклеотидных основаниях приводят к замене одной или нескольких аминокислот, но не влияют на функциональные свойства полипептида, кодированного нуклеотидной последовательностью. "По существу сходные" также относится к модификациям фрагментов нуклеиновой кислоты настоящего изобретения, таким как делеция или вставка нуклеотидов, которые существенно не влияют на функциональные свойства получаемого транскрипта. Поэтому понимается, что изобретение охватывает более чем специфический пример нуклеотидной или аминокислотной последовательности и включает ее функциональные эквиваленты. Изменения в фрагменте нуклеиновой кислоты, которые приводят к продуцированию химически эквивалентной аминокислоты в определенном сайте, но не влияют на функциональные свойства кодируемого полипептида, хорошо известны в данной области. Таким образом, кодон для аланина, гидрофобной аминокислоты, может быть замещен кодоном, кодирующим другой, менее гидрофобный остаток, такой как глицин, или более гидрофобный остаток, такой как валин, лейкин или изолейкин. Подобным же образом, изменения, которые приводят к замене одного отрицательно заряженного остатка на другой, например, глутаминовой кислоты на аспарагиновую кислоту, или одного положительно заряженного остатка на другой, например, аргинин на лизин, также, как можно ожидать, дадут функционально эквивалентный продукт. Нуклеотидные изменения, которые приводят к изменению N-концевой и С-концевой частей молекулы полипептида, также, как можно ожидать, не будут изменять активность полипептида. Каждая из предложенных модификаций вполне входит в обычный объем знаний в данной области, как и определение сохранения биологической активности кодированных продуктов. Способ выбора выделенного полинуклеотида, который влияет на уровень экспрессии полипептида в вирусе или в клетке-хозяине (эукариот, такой как растение, дрожжи, грибы или водоросли; прокариот, такой как бактерии) может включать следующие этапы: конструирование выделенного полинуклеотида настоящего изобретения или выделенного химерного гена настоящего изобретения; введение выделенного полинуклеотида или выделенного химерного гена в клетку-хозяин; измерение уровня полипептида в клетке-хозяине, содержащей выделенный полинуклеотид; и сравнение уровня полипептида в клетке-хозяине, содержащей выделенный полинуклеотид с уровнем полипептида в другой клетке-хозяине, которая не содержит выделенный полинуклеотид.
[0071] Более того, по существу сходные фрагменты нуклеиновой кислоты также могут характеризоваться их способностью к гибридизации. Оценки такой гомологии представлены гибридизацией ДНК-ДНК или ДНК-РНК в строгих условиях, как хорошо понятно специалистам в данной области (1985. Nucleic Acid Hybridization, Hames and Higgins, Eds., IRL Press, Oxford, U.K.). Строгие условия могут быть отрегулированы для скрининга от умеренно сходных фрагментов, такие как гомологичные последовательности от организмов с низкой степенью родства, до фрагментов сходных в высокой степени, таких как гены, которые дублируют функциональные ферменты от организмов с высокой степень родства.
[0072] Таким образом, выделенные последовательности, которые кодируют полипептиды PHYA1 и которые гибридизируются в строгих условиях с раскрытыми здесь последовательностями или с их фрагментами, охвачены настоящим изобретением.
[0073] По существу сходные фрагменты нуклеиновой кислоты настоящего изобретения также могут характеризоваться процентом идентичности аминокислотных последовательностей, которые они кодируют, с раскрытыми здесь аминокислотными последовательностями, что определяется алгоритмами, обычно применяемыми специалистами в данной области.
[0074] Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Так, определение процента идентичности любых двух последовательностей может быть выполнено с использованием математического алгоритма. Не ограничивающие примеры таких математических алгоритмов - это алгоритм Майерса и Миллера (1988. CABIOS 4:11-17), алгоритм локальной гомологии Смита и др. (1981. Adv. Appl. Math. 2:482); алгоритм выравнивания Нидлмана и Вунша (1970. J. Mol. Biol. 48:443-453); метод поиска сходства Пирсона и Липмана (1988. Рrос. Natl. Acad. Sci. 85:2444-2448; алгоритм Карлина и Альтшуля (1990. Рrос. Natl. Acad. Sci. USA 87:2264), модифицированный ими (1993. Рrос. Natl. Acad. Sci. USA 90:5873-5877).
[0075] Компьютерные реализации этих математических алгоритмов можно использовать для сравнения последовательностей, чтобы определить идентичность последовательностей. Такие реализации включают, но без ограничения: CLUSTAL в программе PC/Gene (предлагается компанией Intelligenetics, Маунтин-Вью, Калифорния); программу ALIGN (версия 2.0) и GAP, BESTFIT, BLAST, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics, версия 8 (предлагается компанией Genetics Computer Group (GCG), 575 Science Drive, Мэдисон, Висконсин, США). Выравнивание с использованием этих программ может быть выполнено с использованием параметров по умолчанию.
[0076] Если не указано иное, выравнивание последовательностей и вычисление процента идентичности были выполнены с использованием программы Megalign из набора программ по биоинформатике LASERGENE (компания DNASTAR Inc., Мэдисон, Висконсин) или любой эквивалентной программой. Множественное выравнивание последовательностей было выполнено с использованием способа выравнивания Clustal W (Higgins and Sharp (1989. CABIOS 5:151-153) с параметрами по умолчанию (GAP PENALTY=10, GAP LENGTH PENALTY=1.0), тогда как параметры по умолчанию для парных выравниваний при использовании способа Clustal W были следующими: GAP PENALTY=10, GAP LENGTH PENALTY=1.0, Slow-Accurate, если не указано иное.
[0077] Используемые здесь термины "идентичность последовательности" или "идентичность" в контексте двух нуклеинокислотных или полипептидных последовательностей относятся к остаткам в двух последовательностях, которые являются такими же при выравнивании на максимальное соответствие в определенном окне сравнения. Если процент идентичности последовательности используется в отношении белков, признается, что положения остатков, которые не идентичны, часто отличаются заменами консервативных аминокислот, где аминокислотные остатки заменены другими аминокислотными остатками со сходными химическими свойствами (например, заряд или гидрофобность) и, поэтому, не изменяют функциональные свойства молекулы.
[0078] Используемое здесь выражение "процент идентичности последовательности" означает значение, определенное путем сравнения двух оптимально выровненных последовательностей в окне сравнения, причем часть полинуклеотидной последовательности в окне сравнения может включать добавления или делеции (т.е., разрывы - "гэпы") по сравнению с контрольной последовательностью (которая не включает добавления или делеции) для оптимального выравнивания двух последовательностей. Такой процент вычисляется путем определения числа положений, в которых идентичное нуклеинокислотное основание или аминокислотный остаток встречается в обеих последовательностях, для получения числа совпадающих положений, деления числа совпавших положений на совокупное число положений в окне сравнения и умножения результата на 100 для получения процента идентичности последовательности.
[0079] Используемый здесь термин "контрольная последовательность" относится к определенной последовательности, используемой в качестве основы для сравнения последовательностей. Контрольная последовательность может быть поднабором или всей определенной последовательностью; например, как сегмент кДНК или генной последовательности полной длины, или полная кДНК или генная последовательность.
[0080] Термин "существенная идентичность" полинуклеотидных последовательностей означает, что полинуклеотид включает последовательность, которая имеет по меньшей мере 80% идентичности последовательности, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, наиболее предпочтительно по меньшей мере 95% идентичности последовательности по сравнению с контрольной последовательностью при использовании одной из указанных программ выравнивания с использованием стандартных параметров. Специалист в данной области поймет, что эти значения могут быть соответственно отрегулированы, чтобы определить соответствующую идентичность белков, кодированных двумя нуклеотидными последовательностями с учетом вырождения кодонов, сходства аминокислот, позиционирования рамки считывания и т.д. Существенная идентичность аминокислотных последовательностей для этих целей обычно означает идентичность последовательностей по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95%. Предпочтительно, оптимальное выравнивание осуществляют, используя алгоритм выравнивания гомологии Нидлмана и др. (1970. J. Mol. Biol. 48:443).
[0081] Еще одним указанием того, что нуклеотидные последовательности по сущности идентичные, является тот факт, когда две молекулы гибридизируются друг с другом в строгих условиях. Обычно строгие условия выбирают так, чтобы температура была приблизительно на 5°С ниже чем температура плавления (Тm) конкретной последовательности при определенной ионной силе и рН. Строгие условия однако охватывают температуры приблизительно от 1°С до 20°С, в зависимости от желательной степени строгости, как определено в настоящем документе.
[0082] "Существенная часть" аминокислотной или нуклеотидной последовательности включает аминокислотную или нуклеотидную последовательность, которой достаточно, чтобы позволить предполагаемо идентифицировать белок или ген, который включает аминокислотная или нуклеотидная последовательность. Аминокислотные и нуклеотидные последовательности могут быть оценены вручную специалистом в данной области или используя компьютерное сравнение последовательностей и инструменты идентификации с применением такого алгоритма как BLAST. Обычно необходима последовательность из десяти или больше смежных аминокислот или из тридцати или больше смежных нуклеотидов, чтобы предполагаемо идентифицировать полипептидную или нуклеинокислотную последовательность как гомологичную известному белку или гену. Более того, в отношении нуклеотидных последовательностей, ген-специфические олигонуклеотидные пробы, включающие 30 или больше смежных нуклеотидов, можно использовать в зависящих от последовательности способах идентификации и выделения генов. Кроме того, короткие олигонуклеотиды из 12 или больше нуклеотидов можно использовать в качестве амплификационных праймеров в ПЦР, чтобы получить конкретный фрагмент нуклеиновой кислоты, включающий эти праймеры. Соответственно, "существенная часть" нуклеотидной последовательности включает нуклеотидную последовательность, которая позволит специфически идентифицировать и/или выделить фрагмент нуклеиновой кислоты, включающий эту последовательность. В настоящем описании говорится об аминокислотных и нуклеотидных последовательностях, кодирующих полипептиды, которые включают конкретный растительный белок. Специалист в данной области, воспользовавшись описанными здесь последовательностями, теперь может использовать все или существенную часть раскрытых последовательностей для целей, известных специалистам в данной области. Таким образом, такая часть представляет "существенную часть" и может быть использована для установления "существенной идентичности", т.е., идентичность последовательности по меньшей мере 80%, по сравнению с контрольной последовательностью, PHYA1. Соответственно, настоящее изобретение включает полные последовательности, которые указаны в прилагаемом Листинге последовательностей, а также существенные части тех последовательностей, которые определены выше.
[0083] Фрагменты и варианты раскрытых нуклеотидных последовательностей и белков, кодируемых ими, также охватываются настоящим изобретением. Под "фрагментом" понимается часть нуклеотидной последовательности или часть аминокислотной последовательности и, следовательно, кодируемый ими белок. Фрагменты нуклеотидной последовательности могут кодировать фрагменты белка, которые сохраняют биологическую активность нативного белка и, следовательно, имеют активность, подобную белку PHYA1. Альтернативно, фрагменты нуклеотидной последовательности, которые пригодны в качестве проб гибридизации, не могут кодировать белки, сохраняющие биологическую активность.
[0084] Под "вариантами" понимаются по существу сходные последовательности. Для нуклеотидных последовательностей, консервативные варианты включают те последовательности, которые из-за вырождения генетического кода кодируют аминокислотную последовательность одного полипептида PHYA1 изобретения. Встречающиеся в природе аллельные варианты, такие как те, которые могут быть идентифицированы с использованием способов, хорошо известных в молекулярной биологии, как, например, полимеразная цепная реакция (ПЦР), способ, используемый для амплификации специфических сегментов ДНК. Обычно варианты конкретной нуклеотидной последовательности изобретения будут иметь по меньшей мере приблизительно 90%, предпочтительно по меньшей мере приблизительно 95% и более предпочтительно по меньшей мере приблизительно 98% идентичности последовательности с той конкретной нуклеотидной последовательностью, которая определена программами выравнивания последовательностей, упомянутыми в настоящем документе.
[0085] Под "вариантным белком" понимается белок, полученный из нативного белка путем делеции (так называемое усечение) или добавления одной или нескольких аминокислот к N-концу и/или С-концу нативного белка, делеции или добавления одной или нескольких аминокислот в одном или нескольких сайтах в нативном белке или замены одной или нескольких аминокислот в одном или нескольких сайтах в нативном белке. Вариантные белки, охватываемые настоящим изобретением, биологически активные, то есть, они продолжают обладать желательной биологической активностью нативного белка. Такие варианты могут являться результатом, например, генетического полиморфизма или человеческой манипуляции. Биологически активные варианты нативного белка PHYA1 изобретения будут иметь по меньшей мере приблизительно 90%, предпочтительно по меньшей мере приблизительно 95% и более предпочтительно по меньшей мере приблизительно 98% идентичности последовательности с аминокислотной последовательностью нативного белка, что определяется программами выравнивания последовательностей, упомянутыми в настоящем документе. Биологически активный вариант белка изобретения может отличаться от такого белка всего 1-15 аминокислотными остатками или даже одним аминокислотным остатком.
[0086] Полипептиды изобретения могут быть изменены разными путями, включая замены, делеции, усечения и вставки. Новые белки, имеющие свойства, представляющие интерес, могут быть созданы путем объединения элементов и фрагментов белков настоящего изобретения, а также с другими белками. Способы таких манипуляций общеизвестны в данной области. Таким образом, гены и нуклеотидные последовательности изобретения включают встречающиеся в природе последовательности, а также мутантные формы. Также, белки изобретения охватывают встречающиеся в природе белки, а также их вариации и модифицированные формы. Такие варианты будут по-прежнему обладать желательной активностью PHYA1. Очевидно, что мутации, которые будут выполнены в ДНК, кодирующей вариант, не должны вытеснять последовательность из рамки считывания и, предпочтительно, не создавать комплементарные области, которые могли бы продуцировать вторичную структуру мРНК.
[0087] Делеции, вставки и замены белковых последовательностей, охватываемых настоящим изобретением, не будут, как ожидается, продуцировать радикальные изменения в характеристиках белка. Однако, если будет трудно предсказать точный эффект замены, делеции или вставки перед тем, как ее выполнить, специалист в данной области будет понимать, что эффект будет оцениваться путем обычных скрининговых анализов, в которых можно наблюдать эффекты белка PHYA1.
[0088] При этом следует понимать, что используемый здесь термин "трансген" включает любую клетку, клеточную линию, каллюс, ткань, часть растения или растение, генотип которого был изменен присутствием гетерологичной нуклеиновой кислоты, включая те трансгены, измененные так изначально, а также созданные путем половых кроссов или бесполым распространением из изначального трансгена. Термин "трансген", который здесь использован, не охватывает изменение генома (хромосомное или экстра-хромосомное) традиционными способами выращивания растений или встречающимися в природе событиями, такими как случайное перекрестное оплодотворение, не рекомбинантная вирусная инфекция, не рекомбинантная бактериальная трансформация, не рекомбинантная транспозиция или спонтанная мутация.
[0089] Используемый здесь термин "хлопчатник" включает любые виды рода Gossypium, который используется для получения коммерческого волокна, предпочтительно G. hirsutum или G. barbadense.
[0090] Используемый здесь термин "растение" включает ссылку на цельные растения, органы растений (например, листья, стебли, корни и т.д.), семена, клетки растений их потомство. Части трансгенных растений должны пониматься в объеме изобретения как включающие, например, клетки, протопласты, ткани, каллюс, зародыши растений, а также цветы, стебли, плоды, листья, корни, трансгенных растений или их потомства, ранее трансформированных молекулой ДНК изобретения и поэтому состоящих, по меньшей мере частично, из трансгенных клеток, и также являющихся целью настоящего изобретения.
[0091] Используемый здесь термин "клетки растений " включает, но без ограничения, суспензионные культуры семян, зародыши, меристематические области, ткань каллюса, листья, корни, побеги, гаметофиты, спорофиты, пыльцу и микроспоры. Класс растений, который может быть использован в способах изобретения, обычно также широк, как и класс высших растений, поддающихся трансформации, включая однодольные и двудольные растения.
ПРИМЕРЫ
[0092] Теперь, после общего описания настоящего изобретения, оно будет лучше понято на определенных конкретных примерах, которые включены в настоящее описание только для дальнейшей иллюстрации изобретения и не должны пониматься как ограничивающие объем изобретения, который определен формулой изобретения.
ПРИМЕР 1 Растительный материал
[0093] Растительные материалы, использованные для данного исследования, были соматически регенерируемой линией Coker 312 генотипа хлопчатника Gossypium hirsutum и ее трансгенными производными линиями, трансформированными с помощью вектора pHellsgate-8::PHYA1 Регенерируемые семена Coker-312 были предоставлены д-ром Кеерти Ратором (Keerti Rathore) (Texas А&М University, College Station, Texas, USA). Для проверки возможности переноса наблюдавшихся эффектов RNAi мы использовали несколько коммерчески важных культиваров узбекского хлопчатника, например, G. hirsutum cv. AN-Boyovut-2 для обычных экспериментов по генетической гибридизации с растениями RNAi Coker-312.
ПРИМЕР 2
Конструирование вектора RNAi
[0094] Мы сконструировали специфический для гена PHYA1 конструкт бинарного вектора RNAi, использовав высоко эффективные плазмидные векторы pHellsgate-8 GateWay (предоставлены д-ром П. Уотерхаусом и д-ром К. Хеллиуэллом, CSIRO, Австралия)(Wеsley er al., см. выше; Helliwell et al., см. выше). Векторы RNAi были трансформированы в штамм A. tumefaciens LBA4404 и использованы для экспериментов по трансформации растений.
[0095] Для сайта attB (attB1 и attB2) гена PHY At хлопчатника были разработаны и куплены у компании Integrated DNA Technologies Inc. (Айова, США) прикрепленные ген-специфические праймеры Gos_PHYA1attB1-F and Gos_PHYA1 attB2-R (Таблица 1). Пары этих праймеров специфически амплифицировали фрагмент из 213 пар оснований гена PHYA1 (SEQ ID N0:1) хлопчатника, который соответствовал части шарнирной области генов фитохрома А хлопчатника. Следует сказать, что тетраплоидные хлопчатника имеют два разных гена PHYA1, один приобретенный от диплоидного D-геномного предка и другой от диплоидного А-геномного предка (Abdurakhmonov et al. 2010, см. выше). Эти два гена PHYA1 имеют 99% нуклеотидной идентичности в части из 213 пар оснований в RNAi; они отличаются двумя одиночными нуклеотидными полиморфизмами в положениях Y (С или Т) и R (G или А) в последовательности, представленной и идентифицированной SEQ ID N0:1. Сначала специфический фрагмент гена фитохрома хлопчатника для PHYA1 был амплифицирован из геномной ДНК хлопчатника с помощью KODHiFi, полимеразы ДНК высокой надежности для исправления ошибок (компания Novagen, США), с использованием не ген-специфических праймеров attB согласно инструкции изготовителя и протоколу. Ожидаемые ген-специфические продукты ПЦР были проверены электрофорезом на агарозном геле. Сайты attB1 и attB2 затем были прикреплены к полученным продуктам ПЦР во втором цикле реакции ПЦР с attB-фланкированными ген-специфическими праймерами (Таблица 1) и с очищенным первым ПЦР-ампликоном, служащим в качестве матрицы. Размер и правильность полученных attB-фланкированных продуктов ПЦР были проверены путем гель-электрофореза. Продукты ПЦР были очищены раствором полиэтиленгликоля (ПЭГ) (содержащим 26% ПЭГ 8000, 6,5 мМ MgCl2 и 0,6 мМ ацетата натрия рН 5,2), чтобы удалить остающиеся праймеры attB. Сайт-специфическая реакция рекомбинации с продуктом сайт-фланкированного продукта attB и вектором была проведена как описано Хеллиуэллом и др. (Helliwell ef al.) (см. выше).
[0096] Реакции рекомбинации с pDONOR221 (компания Invitrogen, США) были выполнены в совокупном объеме 10 мкл смеси реакции, с 2 мкл буфера BP Clonase (компания Invitrogen, США), 2 мкл attB сайт-фланкированного продукта ПЦР, 150 нг плазмидного вектора и 2 мкл BP Clonase (компания Invitrogen, США). Смесь реакции инкубировали при 25°С в течение ночи. Рекомбинационная смесь (2 мкл) была трансформирована в химически компетентные клетки DH5-alpha Е. coli (компания Invitrogen, США). Трансформированные клетки выращивали на планшетах с лизогенным бульоном, содержащих 50 мг/л спектиномицина. Колонии подвергали дальнейшему выделению плазмид и анализировали на вставки путем ПЦР, используя праймеры М13. Плазмиды выделяли способом лизиса в растворе NaOH/SDS (Sambrook et al., см. выше). Реакция рекомбинации из плазмиды pDONOR221, содержащей вставку attB-PHYA1 в pHellsgate-8, была выполнена в совокупном объеме 10 мкл с 2 мкл буфера LR Clonase (компания Invitrogen, США), 2 мкл рекомбинантного pDONOR221-attB-PHYA1 (150 нг), 300 нг pHellsgate-8 и 2 мкл LR Clonase (компания Invitrogen, США) согласно инструкции изготовителя. Смесь реакции инкубировали в течение ночи при комнатной температуре, обработали протеиназой К, и 2 мкл аликвоты трансформировали в клетки DH5 (компания Invitrogen, США). Клетки выращивали на LB-планшетах, содержащих селективный антибиотический спектиномицин. Колонии взяли для дальнейшей проверки правильности рекомбинации с attB-сайтами. Были выполнены рестрикционные анализы с Xhol (для смысловой ориентации) и Хbа (для антисмысловой ориентации); проверенные клоны были отобраны для дальнейшей подготовке вектора RNAi, как описано у Хеллиуэйла и др. (см. выше).



ПРИМЕР 3
Трансформация и соматический эмбриогенез хлопчатника
[0097] Для трансформации и соматического эмбриогенеза хлопчатника мы использовали методологию Сунилкумара и Ратора (Sunilkumar and Rathore) (2001. Mol. Breeding 8:37-52) модифицированную по отношению к среде для регенерации растений на основании других исследований по культивированию тканей (Stewart and Hsu. 1977. Planta 137:113-117; Firoozabady et al. 1987. Plant Mol. Biol. 10:105-116). Все реагенты для культуры тканей хлопчатника были куплены у компании Phytotechnology Laboratories®, США. Ростки поколения Т0 были перенесены в почву в горшках и выращены в теплице в 2008 г.
[0098] Семена хлопчатника Coker-312, линтерованные серной кислотой, были поверхностно стерилизованы путем промывки 70%-м этанолом в течение 10 минут и в течение короткого времени обожжены под вытяжкой, чтобы удалить следы этанола. Семена были посеяны в 0,7%-ю агаровую среду и выдержаны в условиях темноты в течение 3 суток при 28°С для проращивания. Пророщенные семена были помещены в условия периодического освещения, заключающиеся в 16 часах света и 8 часах темноты для развития рассады. Срезы гипокотиля 5-7 мм были взяты из недельных саженцев. Из этих срезов гипокотиля 75% были использованы для экспериментов по трансформации; остальные 25% срезов держали отдельно в качестве отрицательного контроля. Срезы гипокотиля были посечены лабораторной бритвой в нескольких местах и помещены на среду Р1 [4,31 г/л соли MS, 0,4 мг/л тиамин-HCL, 100 мг/л миоинозитола, 0,75 мг/л MgCl2, 3% глюкозы, 0,2% фитагеля, 5 мг/л 2 ip, 0,1 мг/л NAA, рН 5,8]. Суспензия LBA4404 (5 мкл), несущая вектор pHellsgate-8::PHYi4f RNAi, была нанесена на посеченные срезы гипокотиля и затем инкубирована в темноте при 22°С в течение 72 часов. Вектор pHellsgate-8::PHYA1 RNAi был выращен в среде YEP [10 г/л пептона Bacto, 5 г/л NaCl, 10 г/л экстракта дрожжей Bacto, рН 7,0] содержащей антибиотики рифампицин (10 мг/л) и спектиномицин (50 мг/л). Бактериальные культуры были выращены в пробирках в течение 36 часов при 26°С со встряхиванием 200 об/мин. Клетки из 5 пробирок были сведены вместе, собраны путем центрифугирования и повторно суспендированы в 10 мл преиндукционной среды (10 г/л глюкозы, 14,62 г/л MES, 20 мл/л буферного раствора фосфата натрия с рН 5,6, 50 мл/л 20×АВ соляного штока (Chilton et al. 1974. Рrос. Nat. Acad. Sci. USA 71(9):3672-3676), содержащего 100 мкМ ацетосирингона. Для контроля 5 мкл стерильной воды нанесли вместо бактериальной суспензии.
[0099] Спустя 72 часа инфицированные и контрольные срезы гипокотиля были перенесены на свежую среду Р1, содержащую канамицин (50 мг/л) и цефабол (500 мг/л; аналог клавамокса), и культуры выращивали согласно световому периоду 16 часов (10 мкМ-2 с-1). Спустя три недели ткани каллюса размером 3 мм, выращенные в селективной среде Р1, были перенесены в новую среду Р7 [4,31 г/л солей MS, 0,4 мг/л тиамина-HCL, 100 мг/л мио-инозитола, 0,75 мг/л MgCl, 3% глюкозы, 0,2% фитагеля, 0,1 мг/л 2 ip, 5 мг/л NAA, рН 5,8] и выращивались в постоянной культуре при субкультивировании тканей ежемесячно. Ткани каллюса размером меньше 3 мм держали в среде Р1 еще три недели и затем перенесли в среду Р7. После 16 недель индукции соматического эмбриогенеза ткани каллюса, выращенные на селективной среде Р7, были перенесены на новую модифицированную среду R5, содержащую 4,31 г/л соли MS, 1 мл/л витаминного раствора Гамборга, 1,9 г/л KNO3, 0,75 мг/л MgCl, 3% мальтозы, 0,2% фитагеля). Соматические зародыши сформировались через 12-16 недель в среде R5. Соматические зародыши размером 6 - 7 мм затем были перенесены в модифицированную среду SH1 [10 мл/л 100 × микропитательных веществ, 50 мл/л 50 × макропитательных веществ, 1 мл/л витамина В5, 5 г/л сахарозы, 15 г/л бактоагара, 2 г/л фитогеля] и инкубированы в условиях темноты в течение 10 суток. Процесс обезвоживания и образования корней произошел в течение этого времени. Затем зародыши были перенесены в новую среду SH-2 [10 мл/л 100 × микропитательных веществ, 50 мл/л 50 × макропитательных веществ, 1 мл/л витамина В5, 20 г/л сахарозы, 1 г/л фитагеля и 5 г/л агара] и выращивались в течение 10 суток согласно световому периоду 16 часов (10 мкМ-2 с-1) для развития корней и листьев. После развития начальных корней и листьев зародышевые саженцы были перенесены на среду SH-3 [10 мл/л 100 × микропитательных веществ, 50 мл/л 50 × макропитательных веществ, 1 мл/л витамина В5, 20 г/л сахарозы, 1 г/л фитагеля и 2,25 г/л агара] и выращивались при повышенной освещенности (70 мкМ м-2 с-1) для полного развития корней и листьев. Спустя 10 суток полностью развившиеся зародышевые саженцы были перенесены в пластиковые контейнеры со средой SH-3, что привело к развитию 4-5 листьев и дополнительных корней.
ПРИМЕР 4
Идентификация трансформированных растений с использованием ПЦР
[0100] Из каждого проверенного генотипа хлопчатника геномные ДНК были выделены из замороженных тканей листьев по способу Деллапорта и др. (Dellaporta et al.) (1983. Plant Mol. Biol. Rep.1:19-21) с небольшой модификацией и оптимизацией на замороженные ткани. Препарированные геномные ДНК были проанализированы электрофорезом с 0,9% агарозы, и концентрации ДНК оценивали по количеству фермента, необходимому для гидролиза 1 мкг ДНК фага лямбда (HindIII-digest) за 1 час при 50°С в 50 мкл реакционной смеси. Специфические к вектору RNAi пары праймеров 35S-F/PDK-R или PDK-F/OST-R (Таблица 1) использовали для проверки положительных трансгенных растений.
[0101] Реакции амплификации были выполнены в объемах 50 мкл, содержащих 4,5 мкл 10 × ПЦР-буфер с MgCl2, 1 мкл бычьего сывороточного альбумина, 0,5 мкл 25 мМ смеси dATP, dGTP, dTTP и dCTP, 2,5 мкл 50 нг/мл каждого обратного и прямого праймера и 1 мкл 50 нг/мл матричной ДНК. Полимераза Taq ДНК (0,5 U) (компания Sigma, USA) была добавлена к реакции при температуре отжига в первом цикле. Амплификации были выполнены с первым денатурированием при 94°С в течение 3 минут, затем были выполнены 45 циклов 94°С на 1 минуту, 55°С на 1 минуту (отжиг) и 72°С на 2 минуты (растяжение). Затем было выполнено конечное 5-минутное растяжение при 72°С. Для определения продуктов ПЦР электрофорез на 2%-м агарозном геле (компания Sigma) был выполнен в растворе 0,5 × буфер ТВЕ. гели были окрашены бромидом этидия.
ПРИМЕР 5
Оценки растений RNAi
[0102] Поколения T0 и Т1: ПЦР-положительные, трансгенные растения Т0 RNAi Coker 312 вместе с не трансгенными контрольными зародышами растений, и те, и другие получены путем соматического эмбриогенеза, были перенесены в горшки с землей и выращены в тепличной среде, чтобы получить самоопыленные семена T1. Самоопыление было достигнуто путем оборачивания лепестков хлопковыми нитями перед раскрытием цветов. Далее, 15-20 семян от каждого Неположительного растения Т0 прорастили в небольших бумажных стаканчиках с землей в тепличной среде; затем геномные ДНК были выделены из небольшой части тканей листьев семядолей, и ПЦР-амплификация была выполнена с использованием праймеров, специфических для вектора RNAi. ПЦР-положительные растения Т, были выбраны для дальнейшего выращивания, и, когда появились первые настоящие листья, они были перенесены в более крупные горшки, чтобы выполнить фенотипические наблюдения и получить самоопыленные семена Т2. В поколении ТА растения RNAi оценивали на время цветения и созревание семенных коробочек, а также на характеристики штапельной длины волокон в сравнении с выращенными в той же тепличной среде не трансгенными растениями Coker 312. Время цветения было определено по дате раскрытия первого цветка и числу раскрывшихся цветов. Созревание семенных коробочек было определено на основании числа открытых коробочек на одно растение Т, на время оценки. Длину волокна измерили вручную и сравнили с обычными волокнами Coker 312.
[0103] Поколение T2: на основании предварительных характеристик цветения и волокон отдельные растения Т, из разных событий трансформации были выбраны для оценки растений следующего поколения Т2. Для этого 40-45 семян Т2 от каждого выбранного ПЦР-положительного растения посеяли и выращивали с небольших бумажных стаканчиках с землей в условиях солнечного освещения. Когда появились настоящие листья, растения пересадили на полевую станцию Института генетики и экспериментальной биологии растений (Ташкент, Узбекистан) в 2009 г. 40-45 растений Т2, полученных от каждого растения (односемянного подходящего) от разного события трансформации посадили как семейство с 25 не трансгенными контрольными растениями Coker 312 на стандартную делянку длиной 10 м в два ряда (60 см между рядами). Регистрировали средние показатели длины гипокотиля, числа раскрывшихся цветков и открывшихся коробочек выращенного в поле семейства Т2 RNAi и контрольных растений. Первые раскрывшиеся цветки пометили с указанием даты, чтобы определить разницу во времени цветения. Качественные признаки волокон этих выращенных в поле отдельных растений Т2 RNAi и контрольных растений, включая верхнюю среднюю длину (ВСД), прочность волокон (ПВ), средний диаметр (СД) и однородность волокон, были измерены с использованием оборудования HVI в Центре сертификации хлопкового волокна "СИФАГ1, Ташкент, Узбекистан. Все растения были самоопылены, чтобы получить чистые семена поколения Т3, для чего перед раскрытия цветков лепестки оборачивали хлопковыми нитями.
[0104] Поколение Т3: на основании полевых оценок в 2009 году мы выбрали растения из двух разных семейств Т2 RNAi (Т2-1_7 и Т2-31_10) с улучшенным качеством хлопкового волокна, интенсивным развитием побегов и корней и фенотипами раннего цветения по сравнению с контрольными растениями. В 2010 году самоопыленные семена поколения Т3 от этих двух семейств RNAi были выращены в тех же полевых условиях: в 10 рядах на делянке длиной 10 м (90 см между рядами, 0,010 га) вместе с выращенными рядом контрольными растениями на 0,010 га. Мы измерили урожай путем взвешивания семян хлопка от 600 растений/0,010 га семейств хлопчатника Т3 RNAi и контрольных семейств. Процент линта, масса 100 семян (показатель семян) и показатель линта были измерены вручную и усреднены для 24 отдельных растений из выбранных семейств Т3 RNAi и контрольных растений, причем семена брали из шести полностью созревших коробочек одного растения. Мы отдельно проанализировали качественные признаки волокна этих семейств поколения Т3 в Центре сертификации хлопкового волокна "СИФАТ", Ташкент, Узбекистан. Мы также измерили длину корней у этих выбранных семейств RNAi, вырастив ПЦР-положительные саженцы в специальных лабораторных пластиковых горшках в теплице. Длину корней измеряли спустя 25 суток после прорастания, сравнивая ее с контрольными растениями Coker 312 такого же возраста из той же среды выращивания. Для этого пластиковые горшки разрезали и почву вокруг корней тщательно смыли. Помимо этого растения Т3 с поля выкапывали на стадиях цветения и созревания коробочек, корни промывали и длину корней сравнивали с контрольными растениями, росшими на том же поле. Статистическая значимость различий в признаках между семействами RNAi и контрольными растениями была проверена с помощью непараметрического теста парных выборок (тест Уилкоксона) с использованием программы Plainstat версии 0.2.1 (найдена в Интернете: <URL.plainstat.com).
[0105] Трансформация хлопчатника и фенотипические наблюдения за поколениями Т0-Т3
Мы успешно получили популяции тканей каллюса трансгенного хлопчатника, несущие конструкт PHYA1 RNAi (Фиг. 1), которые были стойкими к селектируемому маркеру канамицину. Эти трансгенные ткани каллюса были выращены до стадии соматических зародышей и были получены зародыши трансгенных растений. По сравнению с соматически регенерированными, не трансформированными контрольными растениями, мы наблюдали очень быстрое и интенсивное развитие боковых корней и основного корня, измененную архитектуру растения с удлиненными черешками и плодовыми ветвями и фенотип раннего цветения у всех кандидатов на зародыши трансгенных растений хлопчатника, трансформированных вектором pHellsgate-8::PHYA1 RNAi (Фиг. 1 и 2).
[0106] Когда мы измеряли волокна от зародышей растений Т0, то волокна трансгенных растений RNAi были, по меньшей мере, на 5 мм длиннее чем волокна контрольных растений (Фиг. 1). ПЦР-анализ для проверки вставки конструкта RNAi в геномную ДНК поколений Т0 и T1, а также Т2 (данные не приведены) подтвердил трансформацию конструкта RNAi и его стабильное наследие в последующих поколениях. Подробная фенотипическая оценка выращенных в поле растений поколений T1 и Т2 также выявила интенсивный вегетативный рост при заметно измененной архитектуре растений (Фиг. 2), цветение на 5-10 суток раньше и более раннее созревание коробочек (Фиг. 2) при увеличении длины волокна ВСД на 2-8 мм (Фиг. 3). Как маркерный фенотип, растения с более длинными гипокотилями и удлиненными черешками листьев также имели повышенную пигментацию антоциана в стволах и листьях растений RNAi по сравнению с контрольными. Эта пигментация была заметно выражена в период созревания коробочек (Фиг. 4).
[0107] Анализ основных характеристик волокна для поколений Т2:3
Чтобы проанализировать характеристики волокна выращенных в поле растений Т2, мы собрали коробочки с каждого отдельного растения. Мы выбрали 89 растений, которые цвели и созревали на 5-10 суток раньше чем нетрансформированные растения, из разных семейств RNAi и измерили основные признаки волокна, сравнив их с волокнами от 8 отдельных нетрансформированных растений Coker 312, выращенных на том же поле рядом с растениями RNAi в тех же условиях. Анализ образцов волокон на оборудовании HVI выявил, что растения, содержащие конструкт pHellsgate-8::PHYA1 RNAi, имели увеличенную длину волокна (верхняя средняя длина - ВСД) от 1,25 до 1,36 дюйма (Фиг. 5). В общем, другие характеристики волокна, такие как средний диаметр (СД) и однородность волокон (ОВ) также были значительно улучшены (р<0,0001; Фиг. 5). Например, мы наблюдали отдельные генотипы RNAi высокого качества с длиной волокна 1,32 дюйма, средний диаметр 4,6, прочность волокна 35,5 г/текс и однородность волокон 88%. Нетрансформированные контрольные растения Coker-312, выращенные на том же поле, имели среднюю ВСД 1,23 дюйма, СД 5,2, ПВ 31 г/текс и ОВ 87%.
[0108] На основании фенотипической оценки Т2 мы выбрали два семейства растений, а именно Т2-1_7 и Т2-31_10, со значительно улучшенными характеристиками качества волокна: ВСД (р<0,001), СД (р<0,001), ОВ (р<0,02), удлинение (р<0,0001), цветение (р<0.01), длина гипокотиля (р<0.0001) и созревание коробочек (р<0.0001) по сравнению с контрольными растениями (Фиг. 6). У обоих семейств RNAi средняя длина волокна была значительно увеличена (р<0.0001); однако растения из семейства Т2-1_7 RNAi имели значительно повышенные СД (р=0,00006) и ОВ (р=0,001) по сравнению с растениями семейства Т2-31_10. Наоборот, растения Т2-31_10 имели более длинные гипокотили (р=0,0001), больше раскрывшихся цветков (к 15 июля 2009 г.; р=0,005) и коробочек (к 15 сентября 2009 г.; р<0,0001) по сравнению с семейством Т2-1_7 RNAi. Дополнительно мы наблюдали более длинные основной и боковые корни у семейства Т2-1_7 RNAi по сравнению с семейством Т2-31_10 и контрольными растениями Coker 312 (Фиг. 7). Полевые оценки этих двух выбранных семейств RNAi в 2010 году показали, что основные эффекты RNAi, наблюдавшиеся у поколений Ti:2 стабильно экспрессированы в Т3, и мы наблюдали постоянное улучшение в признаках волокна, таких как прочность, ВСД, ОВ и удлинение (р<0,05) (Таблица 2, Фиг. 7А), развитие корней (Фиг. 7С, D) и созревание коробочек (дополнительная Фиг. S6 в реальном времени), а также интенсивный вегетативный рост (Фиг. 8). Однако в среде 2010 года наблюдавшаяся разница в улучшении по СД волокна Т3-31_10 не была статистически значащей по сравнению с контрольным волокном, но волокно семейства Т3-1_7 RNAi значительно отличалось от контрольного волокна. В то же время, в среде 2010 года мы наблюдали статистически значащее (р<0,02) улучшение по среднему показателю ПВ растений Т3 RNAi по сравнению с контрольными.
[0109] Измерение других характеристик волокна в выбранных семействах Т3 показало небольшое, но статистически значащее (р<0,05-0,001) уменьшение до 1,6% линта, 3,8% в показателе семян (масса 100 семян) и снижение до 9,8% в показателе линта (Таблица 2). Однако, до 6 кг (18%) больше массы семян хлопчатника в семействах Т3 RNAi по сравнению с контрольными, нетрансгенными растениями Coker 312. Сводные результаты показаны в Таблице 2.
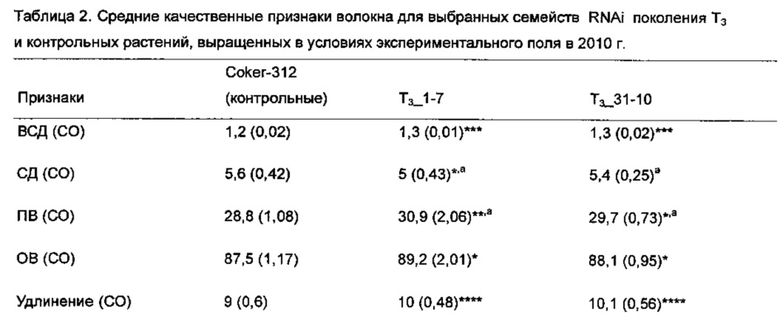

ПРИМЕР 6
Идентификация числа копий для интегрированной последовательности RNAi-вектора
[0110] Количественную ПЦР в реальном времени использовали для идентификации числа копий интегрированной трансгенной векторной последовательности в поколении Т3. Для этого мы следовали методологии вычисления числа копий, описанной Уэнгом и др. (Weng et al.) (2004. Plant Mol. Biol. Rep.22:289-300) и использовали ген-специфические пары праймеров неомицин-фосфотрансферазу II (nptII) и убиквитин, специфический к геному G. hirsutum At (GhUBCI) и пробы Taq Man real-time для ПЦР (Таблица 1), разработанные для идентификации числа копий в линиях трансгенного хлопчатника (Yi et al. 2008. Anal. Biochem. 375(1): 150-152).
[0111] Для создания стандартной кривой мы клонировали фрагмент GhUBC1 в плазмидный вектор pCR4® ТОРО-ТА, следуя протоколу и инструкции изготовителя (компания Invitrogen, США); плазмидный вектор содержал ген nptII в качестве селектируемого маркера. Таким образом был получен контрольный плазмидный вектор, содержащий ген nptII и GhUBC1 для построения стандартной кривой, основанной на абсолютных копиях этого плазмидного вектора. Вектор pCR4-TOPO-nptII-GhUCB1 имел длину ~4,1 кб; поэтому 20 нг исходной концентрации, использованной для амплификации, имели 4526321921 копий. Мы сделали шесть 10-кратных последовательных разбавлений и амплифицировали гены-мишени, используя пары праймеров qPCR и пробы (Таблица 1).
[0112] Количественная ПЦР в реальном времени была выполнена на оборудовании Applied Biosystems 7500 real-time PCR systems (компания Applied Biosystems, Фостер-Сити, США). Реакции ПЦР выполняли в объеме 12,5 мкл по следующей стандартной программе, рекомендованной изготовителем: 95°С в течение 10 мин, затем 40 циклов 95°С в течение 15 с и 60°С в течение 1 мин. Каждые 12,5 мкл смеси реакции содержали 6,25 мкл Основной смеси (2х), 0,25 мкл (200 нМ) каждого праймера (10 мкМ), 1 мкл (40 нМ) пробы (0,5 мкМ), 4 мкл матрицы ДНК (0,2 пг - 20 нг) и 0,75 мкл стерильной деионизированной воды. Основная смесь 2 × ПЦР содержала No AmpErase UNG, полимеразу ДНК AmpliTaq Gold, деоксинуклеозидные трифосфаты с dUTP и буфер реакции Taq Man с хлоридом магния (компания Applied Biosystems, Фостер-Сити, США).
[0113] Средние значения С, были нанесены на график против логарифма абсолютных чисел копий, чтобы получить стандартные кривые. Для получения стандартных кривых для каждого гена-мишени были выполнены шесть дублирующих реакций. Эффективность амплификации вычисляли на основании наклонов стандартных кривых по формуле: E=10(-1/slpoe)-1 (Ginzinger, 2008; Yi et al., см. выше). Число копий вычисляли так, как описано Уэнгом и др. (см. выше) с выведением X0/R0=10[(<Ct,X-IX)/SX)]-[(Ct, R-IR)/SR], где X - nptII, R - UBC1, I - точка пересечения стандартной кривой, S - наклон стандартной кривой для мишени (X) и контрольных (R) генов (Weng et al., см. выше). Значения X0/R0 использовали непосредственно (т.е. без дублирования) для оценки числа копий, поскольку нашими пробами были растения поколения Т3, а не Т0 как у Уэнга и др. (см. выше). Коэффициент изменения при оценках числа копий был вычислен из коэффициента изменения оценок для GhUBC1 (эндогенный контроль) и nptII (ген-мишень).
[0114] Вектор-специфическая ПЦР-амплификация выбранных растений RNAi поколения Т3 показала, что выбранные растения RNAi имели геномные вставки для плазмиды pHellsgate-8::PHYA1 RNAi (Фиг. 7В). Кроме того, в эксперименте с ПЦР в реальном времени коэффициенты корреляции, наклоны и эффективность ПЦР были в высокой степени приемлемыми (Ginzinger, 2008) для идентификации числа копий. Коэффициент изменения для пороговых значений цикла (Ct) был в диапазоне всего 1,1-4,6% для шести повторных амплификации в каждой серии разбавлений (Таблица 3). Результаты показали, что ПЦР-положительное растение RNAi из семейства Т3-1_7 имело три копии, а растение RNAi из семейства Т3-31_10 содержало 2 копии векторы pHellsgate-8:: PHYA1 RNAi в их геномах. В качестве дополнительного контроля мы включили пробу ДНК Bt-хлопчатника, который имел одну копию трансгена cry I, вставленную в его геном (Таблица 4).
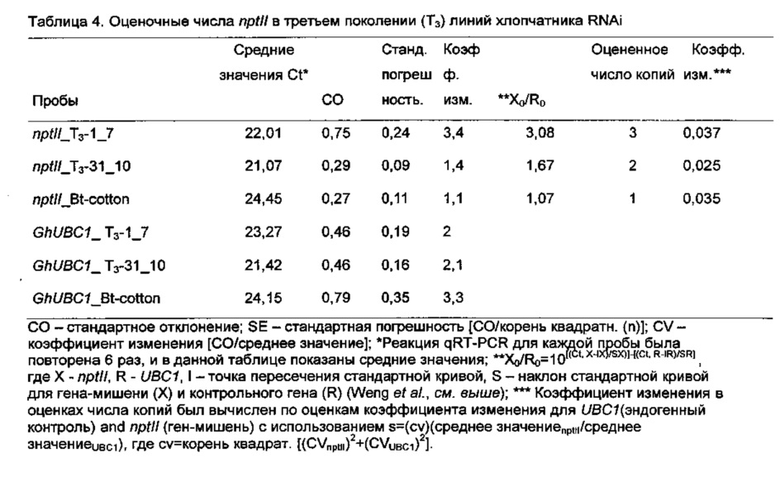
ПРИМЕР 7
Выделение РНК и количественная ПЦР в реальном времени
[0115] Полные РНК были выделены из тканей листьев растений хлопчатника RNAi поколения Т3 и контрольных растений без RNAi с использованием сочетания протоколов, описанных Сузуки и др. (Suzuki et al.) (2001. J. Exp. Bot. 52:1575-1579) и By и др. (Wu et al.) (2002. Plant Mol. Biol. Rep.20:213-218) с небольшими модификациями. Подетальному протоколу выделения РНК, синтеза кДНК и амплификации посредством количественной ПЦР в реальном времени смотрите "Дополнительные способы 5" на сайте. Для идентификации влияния RNAi на экспрессию генов PHYA1, а также других фитохромных генов (PHYA2, PHYB, PHYC и PHYE) хлопчатника мы использовали способ количественной ПЦР в реальном времени (qRT-PCR), используя детектирование ампликона на основе SYBR-зеленого. Мы синтезировали кДНК из Coker 312 без RNAi и тех же растений RNAi, которые были использованы для идентификации числа копий и фенотипических оценок. Контрольные растения и растения RNAi были выращены в одной и той же тепличной среде и в тех же условиях освещения. Для создания стандартных кривых для каждого гена, использовавшегося в анализе путем количественной ПЦР в реальном времени была создана последовательность двукратного разбавления (1, 2 и до 128х) разбавленной 1:15 кДНК из контрольного растения Coker 312. Средние значения Ct, по меньшей мере из 2, были нанесены на график против логарифма исходного количества, чтобы получить стандартные кривые. Эффективность амплификации вычисляли на основании наклонов стандартных кривых по формуле: Е=10(-1/наклон)-1 (Ginzinger, 2008). Показатели наклона и точки пересечения из стандартных кривых, полученных для каждого анализируемого гена, были использованы для вычисления логарифма вводимого количества [Log вводимого количества=(Среднее Сtгена-мишени-Точка пересечения гена-мишени)/Наклонгена-мишени]; затем введенное количество вычисляли, используя 10log введенного количества. Введенные количества, полученные для фитохромных генов, разделили на введенное количество эндогенного контрольного гена GhPP2A1 (Artico et al. 2010. BMC Plant Bio. 21:10-49). Относительное количество генов-мишеней затем вычислили путем деления нормализованной величины экспрессии гена-мишени в растениях RNAi на нормализованную величину экспрессии того же гена в контрольном растении, использованном как калибратор. Коэффициент изменения был вычислен по оценкам коэффициента изменения для GhPP2A1 и каждого из фитохромов.
[0116] Вкратце, 100 мг тканей листьев были мгновенно заморожены в жидком азоте и превращены в порошок с использованием ступки и пестика, после чего добавили 2 мл горячего экстракционного буфера согласно By и др. (см. выше), нагретого до 80°С и добавили 10 мМ свежего ДТТ. Затем к гомогенату добавили 60 мкл 25 мг/мл протеиназы К и измельчали далее, чтобы смешать. Гомогенат был очень хорошо перемешан, перенесен в пластиковые пробирки 2 мл, выдержан при комнатной температуре в течение 15 мин и центрифугирован (Eppendorf 5415R, Germany) на максимальной частоте вращения в течение 20 мин, +4°С. Супернатант был перенесен в свежие пробирки 2 мл, после чего была выполнена известная процедура осаждения РНК - вода-насыщенный фенол:хлороформ-изоамиловый спирт (Chomczynski and Sacchi. 1987. Analyt. Bioch. 162:156-159; Suzuki et al., см. выше). С этого момента все этапы были точно такими же, как описано и оптимизировано Сузуки и др. (см. выше). Полученный осадок РНК промыли 75%-м этанолом, высушили на воздухе и растворили в стерильной воде, обработанной диэтилпирокарбонатом (DEPC).
[0117] Для проверки целостности РНК 5 мкл раствора полной РНК загрузили на 1% агарозный гель, содержащий 2,2 М формальдегида в присутствии бромида этидия (Maniatis et al., 1982). О целостности РНК судили по присутствию и интенсивности полос рРНК. Далее пробы совокупной РНК обработали РНКазой, свободной от рДНКазы I (компания Ambion, США) согласно протоколу изготовителя и повторно очистили на дополнительных этапах очистки, используя кислый фенол:хлороформ (5:1; компания Ambion, США) и осаждение этанолом. Концентрацию проб совокупной РНК квантифицировали, используя спектрофотометр (GENESYS 10UV, компания Thermo Scientific, США). кДНК первой нити синтезировали из ~2 мкг совокупной РНК, используя набор "Avian RT cDNA" (компания Sigma, США) с произвольными праймерами без названия согласно протоколу изготовителя. Синтезированные кДНК первой нити разбавили в соотношении 1:15 стерильной водой и использовали в анализах в реальном времени и количественной ПЦР в реальном времени. Сначала реакции ПЦР в реальном времени выполняли с парами праймеров, специфических к интрону (A1341F/R; Table 1; Cronn et al. 2002. Am. J. Bot. 89:707-725) для проверки загрязнения ДНК и с праймерами для каталитической субединицы протеинфосфатазы 2А гена хлопчатника (GhPP2A1; Artico et al., 2010) для проверки качества синтезированных кДНК. Реакции ПЦР в реальном времени выполнили с использованием набора "RT-PCR" (компания Sigma, США) согласно протоколу изготовителя. Пробы подвергали количественной ПЦР только в случаях, если они не амплифицировали пары интронных праймеров, но не эндогенный контрольный ген (данные не приведены). Это делали для того, чтобы убедиться в полном удалении геномных ДНК после обработки рДНКазой.
[0118] Количественную ПЦР в реальном времени выполняли на оборудовании "Applied Biosystems 7500 real-time PCR systems" (компания Applied Biosystems, Фостер-Сити, США). Реакции ПЦР выполняли в объеме 25 мкл при следующих условиях циклов: 95°С в течение 10 мин, затем 40 циклов при 95°С в течение 15 с и при 65°С в течение 45 с. Каждые 25 мкл смеси реакции содержали 12,5 мкл основной смеси "SYBR GREEN Master Mix" (2х), 0,35 мкл (140 нМ) каждого праймера (10 мкМ), 6 мкл матрицы кДНК, разбавленной 1:15, и 5,8 мкл стерильной деионизированной воды. Основная смесь "2х SYBR GREEN PCR" содержала No AmpErase UNG, ДНК-полимеразу AmpliTaq Gold, деоксинуклеозидные трифосфаты с dUTP и буфер реакции "SYBR Green" с хлоридом магния (компания Applied Biosystems, Фостер-Сити, США). После ПЦР в реальном времени кривые диссоциации конструировали для каждой из пар праймеров, используемых для оценки праймеров-димеров, загрязнений геномной ДНК и проблем неправильного отжига. В анализ не были включены проблемные лунки реакции. Анализ амплификации при количественной ПЦР в реальном времени был выполнен с использованием программного обеспечения 7500 System SDS версии 1.4 (компания Applied Biosystems, Фостер-Сити, США).
[0119] Для количественного определения относительной экспрессии генов в двух семействах растений RNAi (как показано на Фиг. 7) мы сначала создали стандартные кривые для каждого гена из двукратных последовательных разбавлений 1:15 разбавленной кДНК пробы калибратора (Coker 312). Результаты показали, что коэффициенты корреляции и наклоны для каждого из генов-мишеней, а также эффективность ПЦР (выше 95%) для пар праймеров каждого проверенного гена были в приемлемых диапазонах (Ginzenger, 2008), чтобы выполнить относительное количественное определение (Таблица 5). Коэффициент изменения для пороговых значений циклов (Ct) составил только 0,2-2,6%, и значения стандартного отклонения составили только 0,2-0,7 для повторных амплификаций среди шести проверенных пар праймеров генов, указывая, что система количественной ПЦР в реальном времени функционировала стабильно и надежно (Таблица 6).
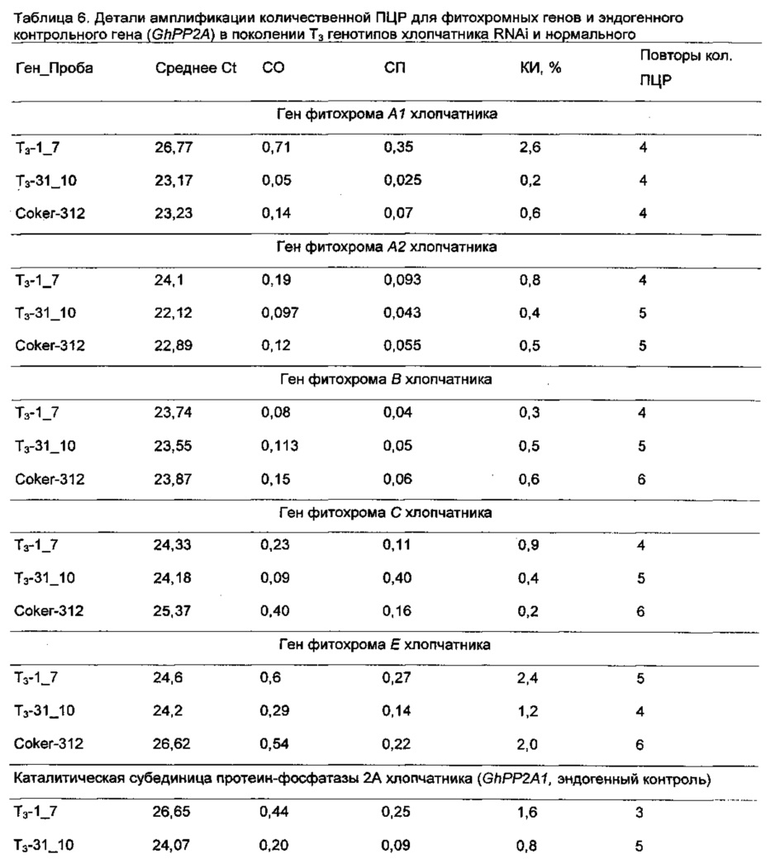

[0120] Трансформация и интеграция вектора pHellsgate-8::PHYA1 RNAi повлияли на экспрессию нескольких фитохромных генов хлопчатника (Таблица 1; Таблица 7). Экспрессия гена PHYA1 была супрессирована на 70% в Т3-1_7 и на 24% в семействе Т3-31_10. Конструкт PHYA1 RNAi не супрессировал экспрессию других проверенных фитохромных генов, за исключением небольшой регуляции вниз (10%) гена PHYB в семействе Т3-31_10. Мы скорее детектировали сверхэкспрессию от 2 до 20 раз генов PHYA2, PHYB (только в пробе Т3-1_7), PHYC и PHYE в обеих пробах растений RNAi. Что интересно, высокий уровень сверхэкспрессии других проверенных фитохромных генов был более очевиден в пробе Т3-1_7, где была детектирована более глубокая супрессия экспрессии гена PHYA1 по сравнению с другой пробой RNAi Т3-31_10 (Таблица 7).
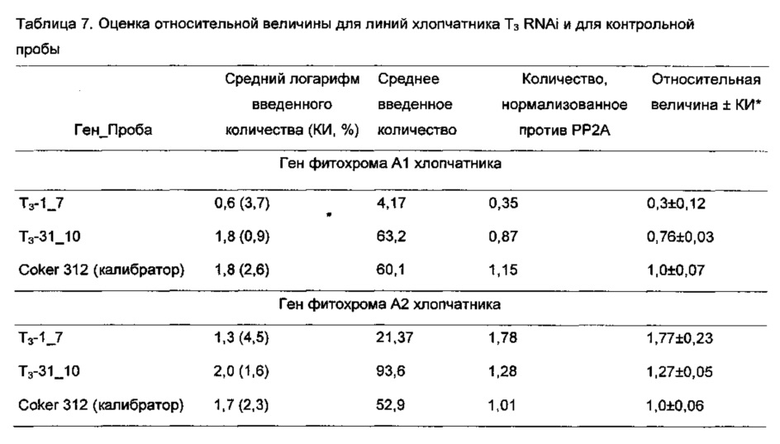
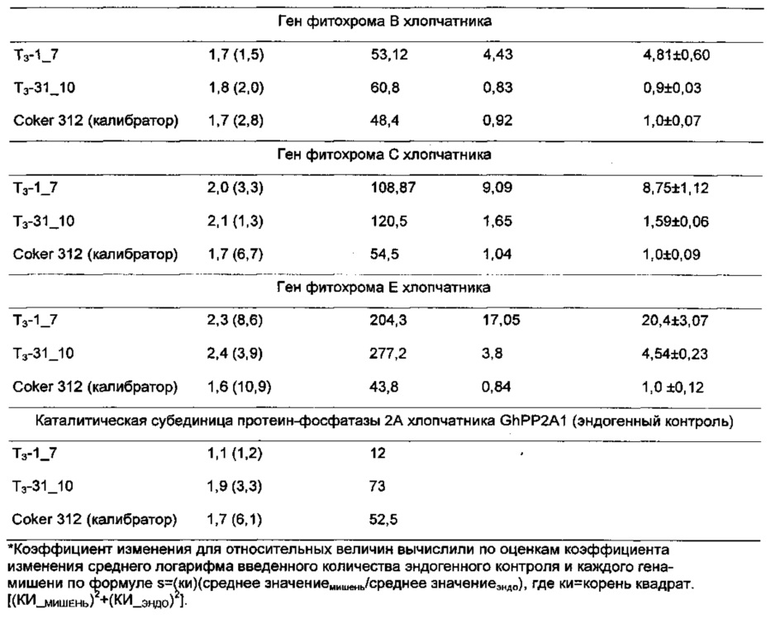
ПРИМЕР 8
Генетический перенос эффектов RNAi, специфических к фитохрому посредством традиционных генетических кроссов
[0121] Когда мы скрестили поколение Т0 растений RNAi Coker 312 с четырьмя коммерческими разновидностями узбекского хлопчатника (Наманган-77, AN-Boyovut-2, С-6524 и Ташкент-6) и оценили гибриды поколений F1 и F2 от этих кроссов, мы обнаружили заметно измененную архитектуру растения с удлиненными черешками и плодовыми ветвями, повышенное среднее число цветов и семенных коробочек, и растения цвели и созревали в среднем на 5-10 суток раньше по сравнению с контрольными растениями (оригинальная разновидность), выросшими рядом в одинаковых полевых условиях. Мы также наблюдали больше пигментации антоциана в гибридах RNAi (Фиг. 8). Измерение характеристик волокон с помощью системы HVI подтвердило, что гибриды поколения F2 всех вышеупомянутых разновидностей имели заметно улучшенное качество волокна. Например, у гибридов поколения F2 одной из широко распространенной в Узбекистане разновидности, AN-Boyovut-2, признаки качества волокна (Фиг. 9) были улучшены подобно тому, что наблюдалось для поколений Т2 и Т3 растений RNAi Coker -312. У гибридов поколения F2 разновидности AN-Boyovut-2 × RNAi Coker 312 мы наблюдали высококачественные генотипы RNAi с ВСД 1,37 дюйма, СД 3,8, ПВ 31,5 г/текс и ОВ 90%. Выращенные на том же поле контрольные растения AN-Boyovut-2 имели среднюю ВСД 1,17 дюйма, СД 4,9, ПВ 30 г/текс и ОВ 86%. Сходную тенденцию улучшения признаков волокон, а также цветения и развития корней наблюдали у поколений F2 и F3 кроссов других разновидностей (данные не приведены). Хотя процент линта, показатели линта и семян у гибридов были меньше, мы наблюдали урожайность семян хлопчатника на 6-13 кг на 0,010 га больше у семейств гибридов F3 RNAi разных кроссов разновидностей чем у выращенных на том же поле оригинальных родительских версий, что предполагает потенциальное увеличение урожайности семян хлопчатника на 18-40%. Таким образом, конструкты были интегрированы в геном и переданы посредством полового цикла, и можно было выбрать растения, которые проявляли очень сходные результаты измерения признаков с оригинальными трансформированными растениями Т3 RNAi.
[0122] Все публикации и патенты, упомянутые в настоящем описании изобретения включены в него по ссылке в таком же объеме, как если бы каждая отдельная публикация или патент была конкретно и индивидуально указана как включенная путем ссылки.
[0123] Вышеприведенное описание и определенные представительные варианты осуществления и подробности изобретения представлены для целей проиллюстрировать и описать изобретение. Они не должны восприниматься как исчерпывающие или ограничивающие изобретение точными раскрытыми формами. Специалистам в данной области будет понятно, что в изобретение могут быть внесены модификации и изменения, не нарушающие объем изобретения.






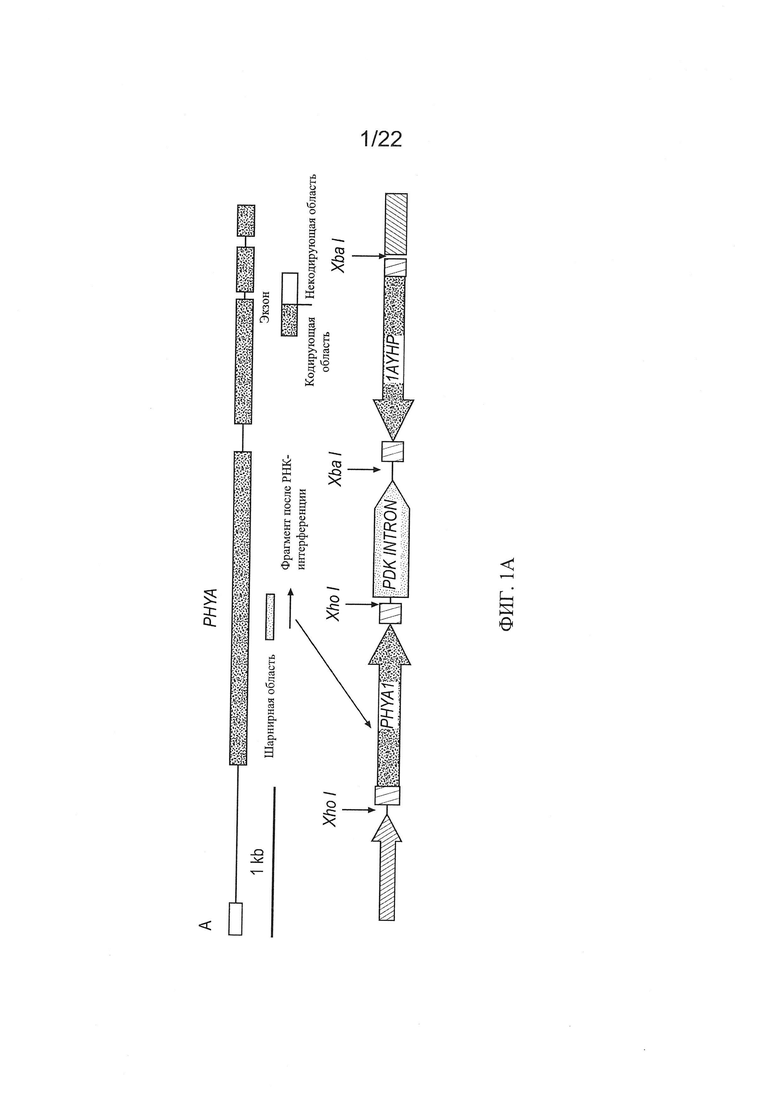


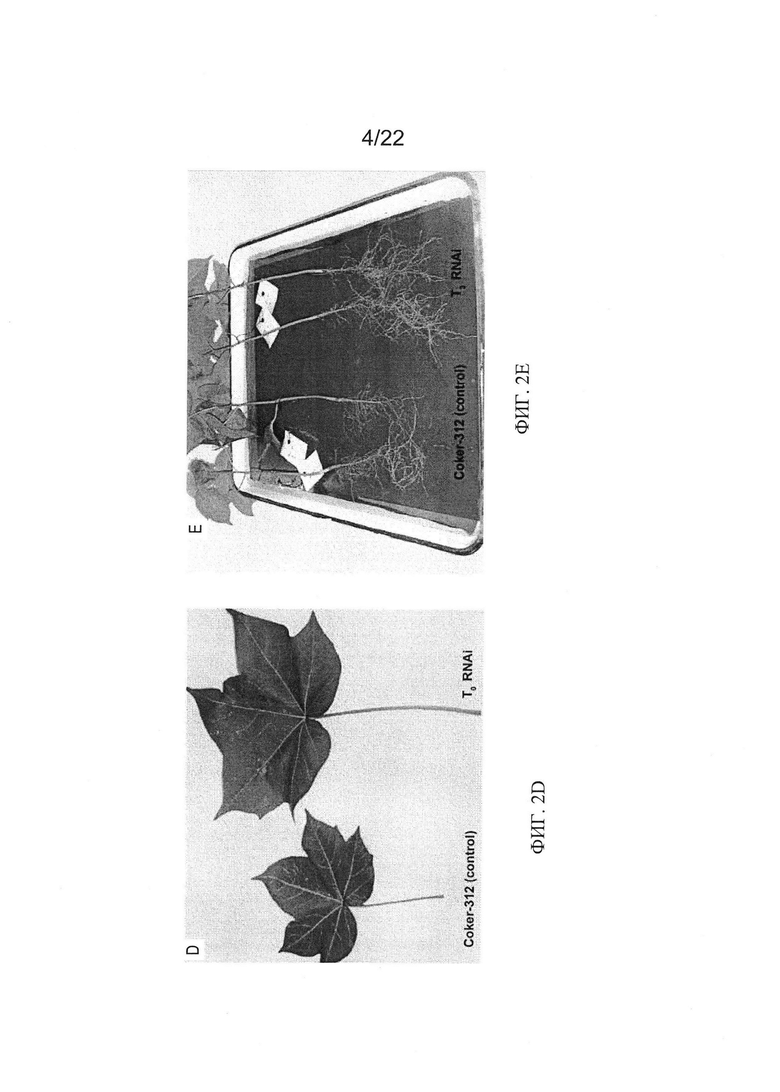
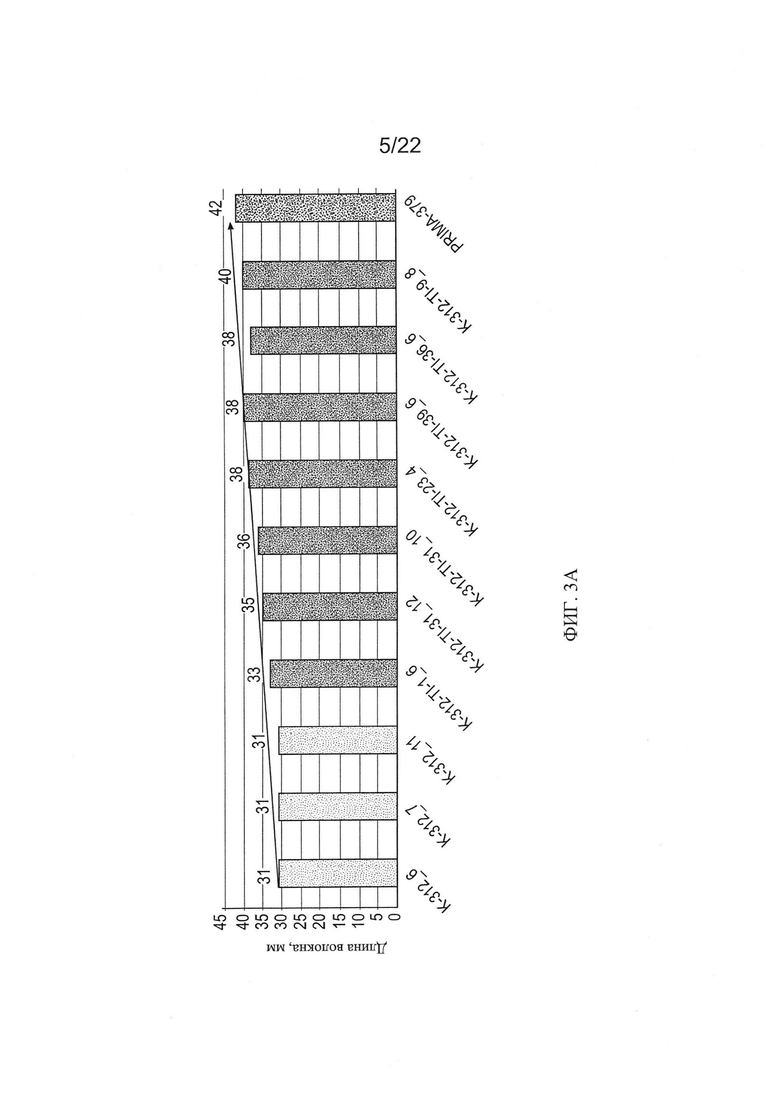
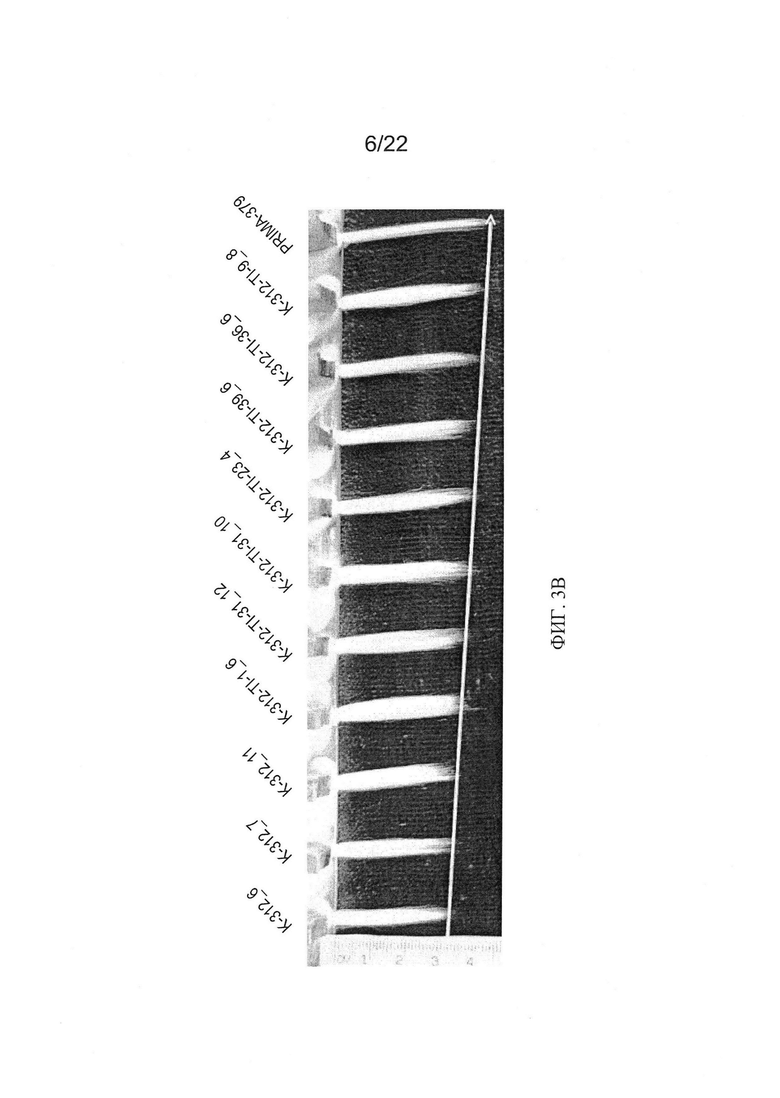


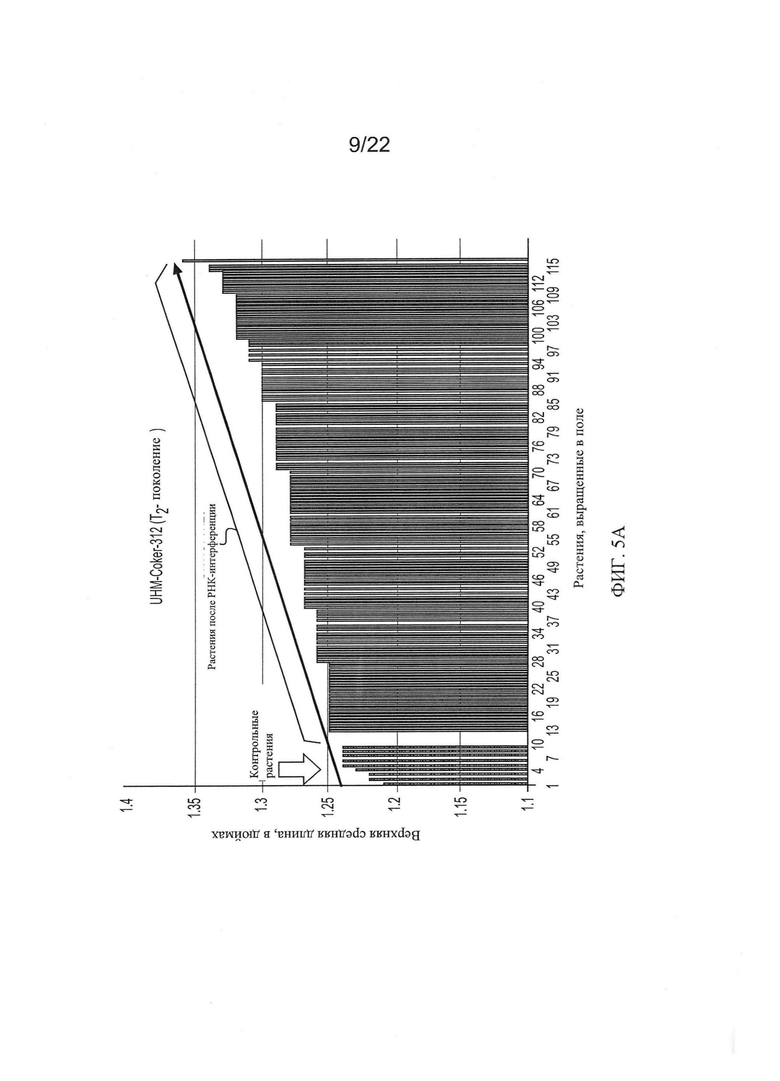
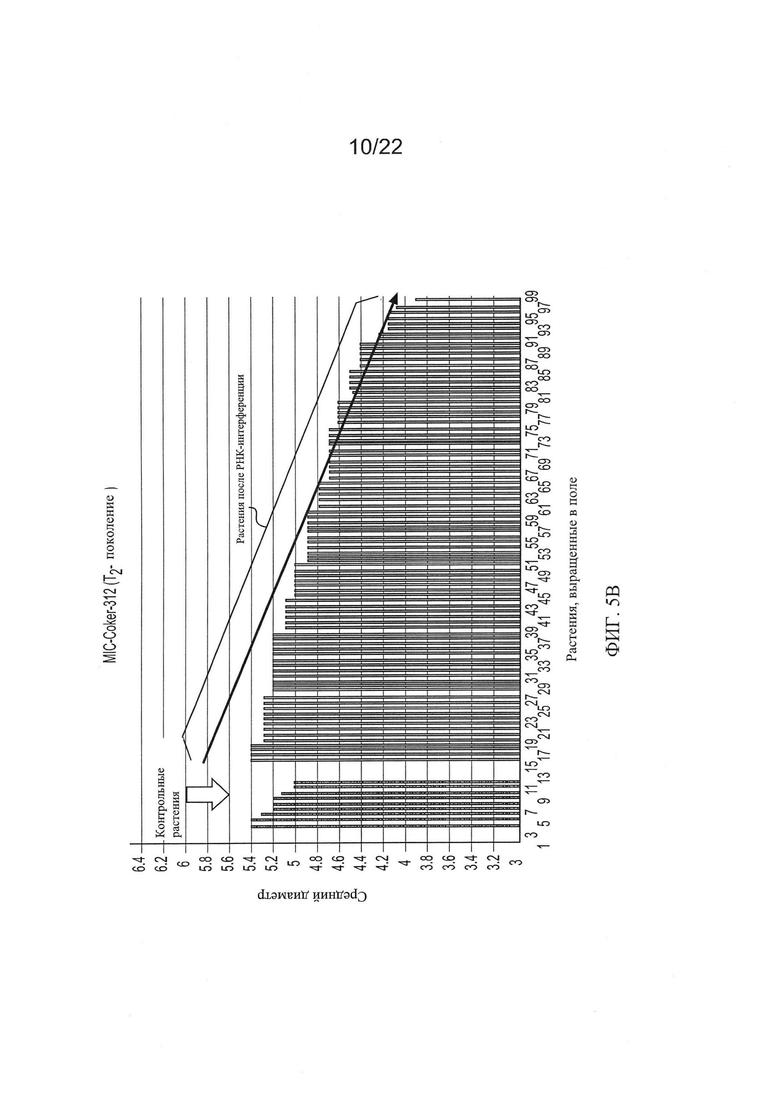
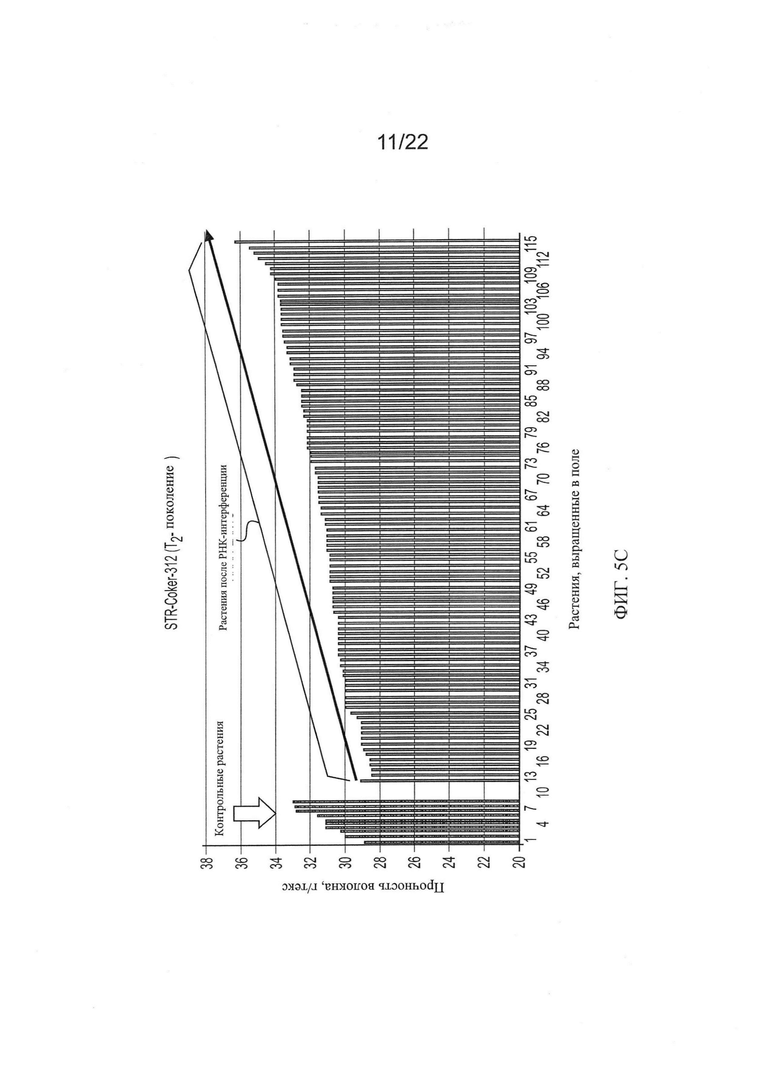
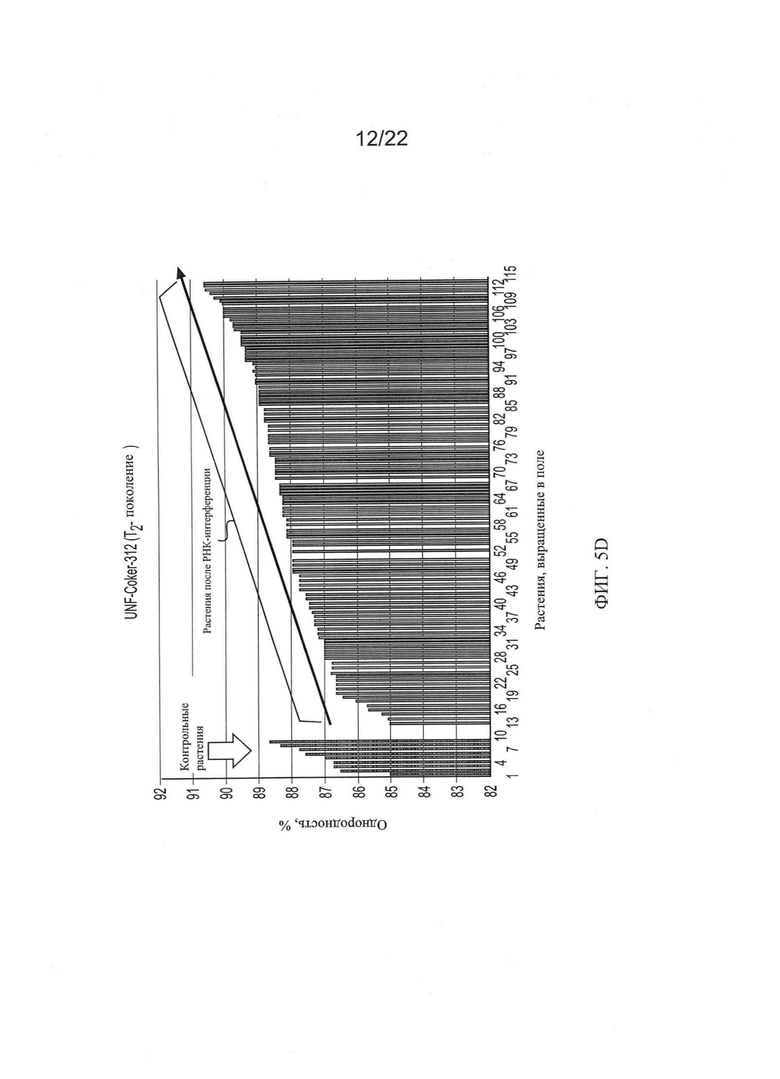
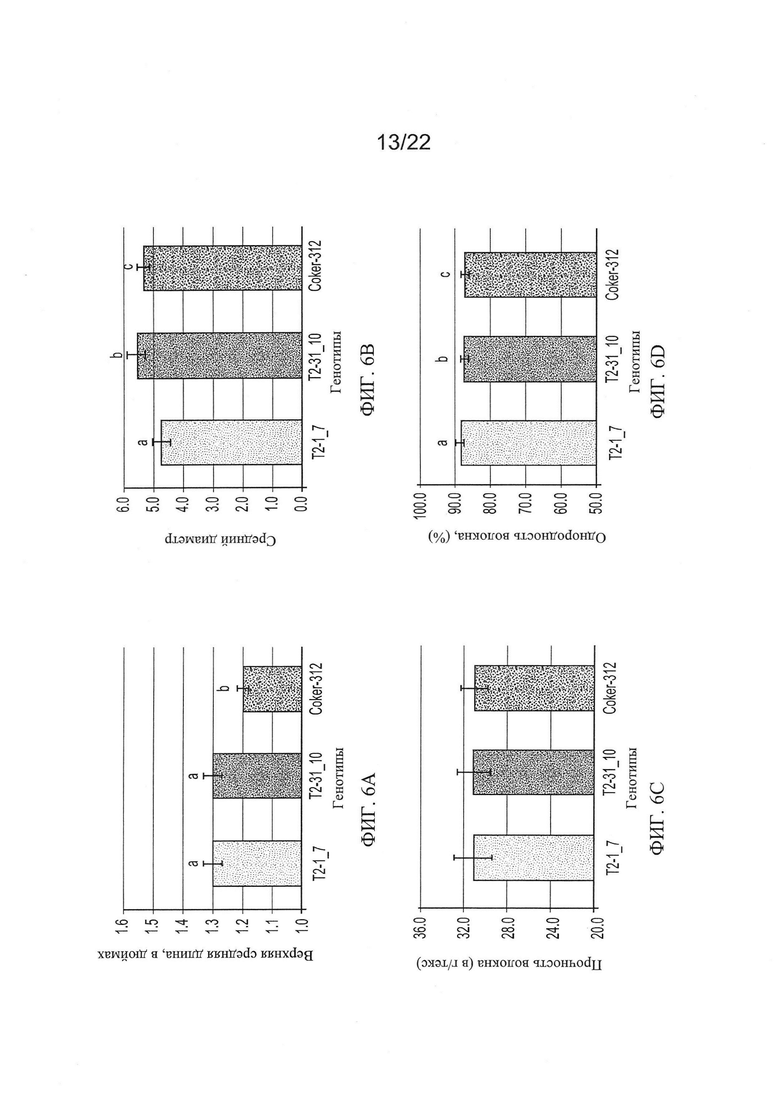

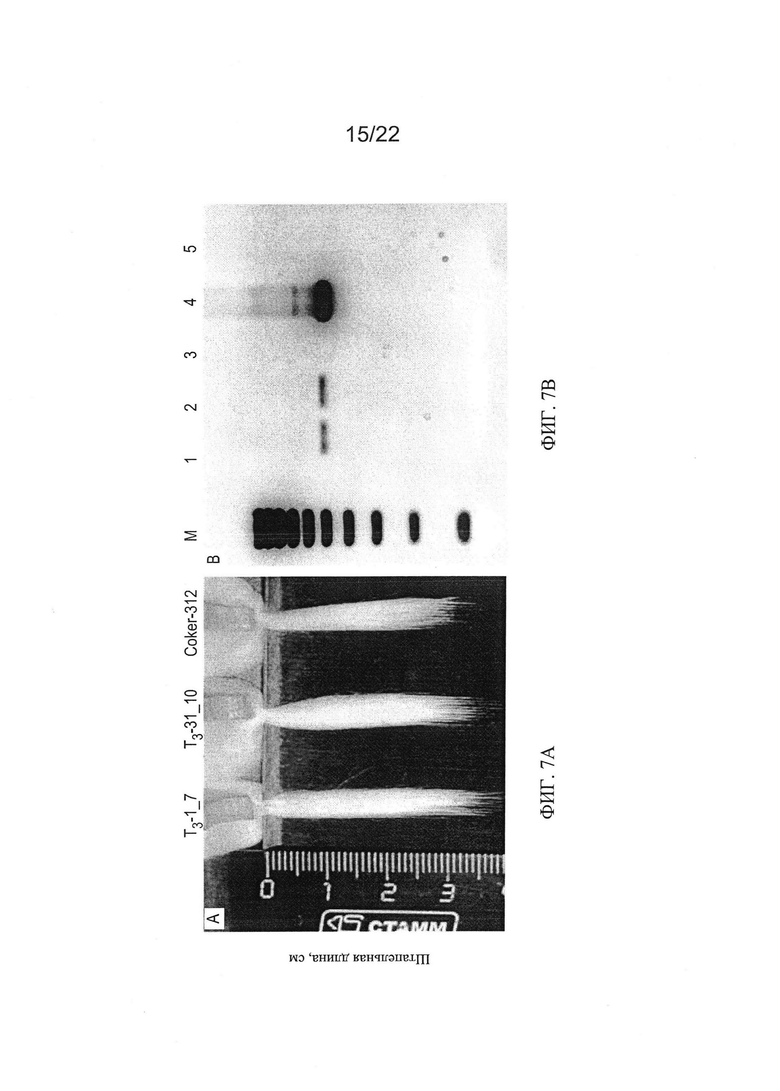
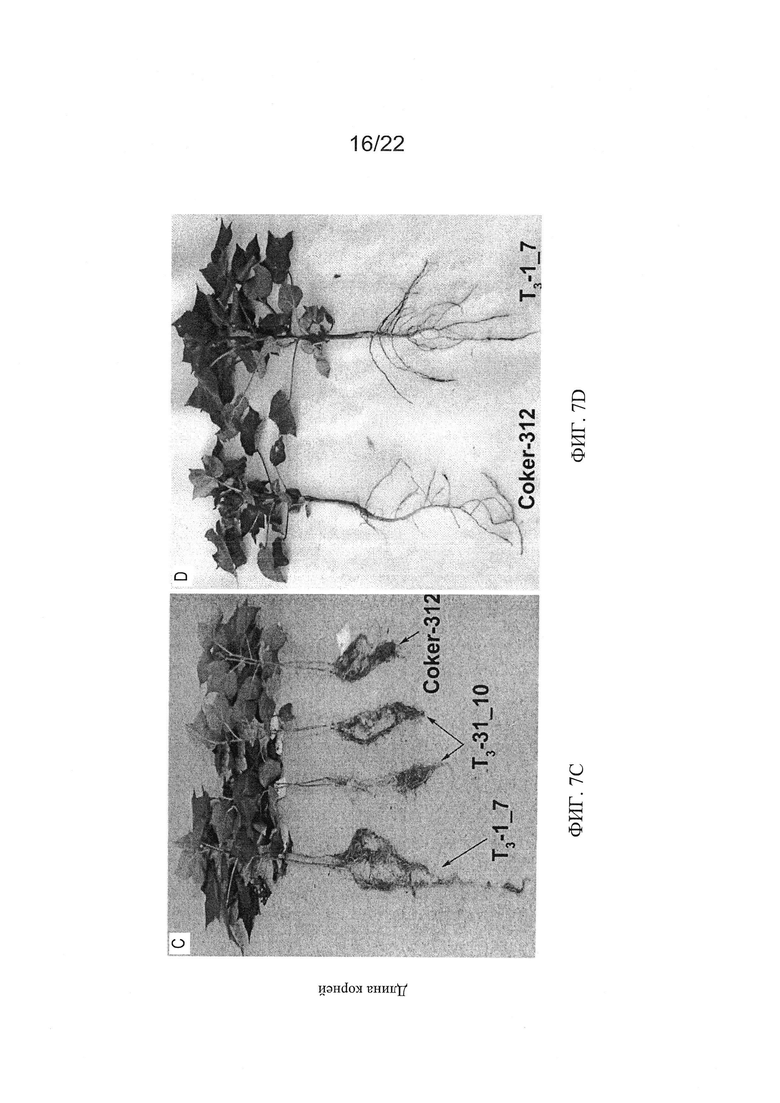

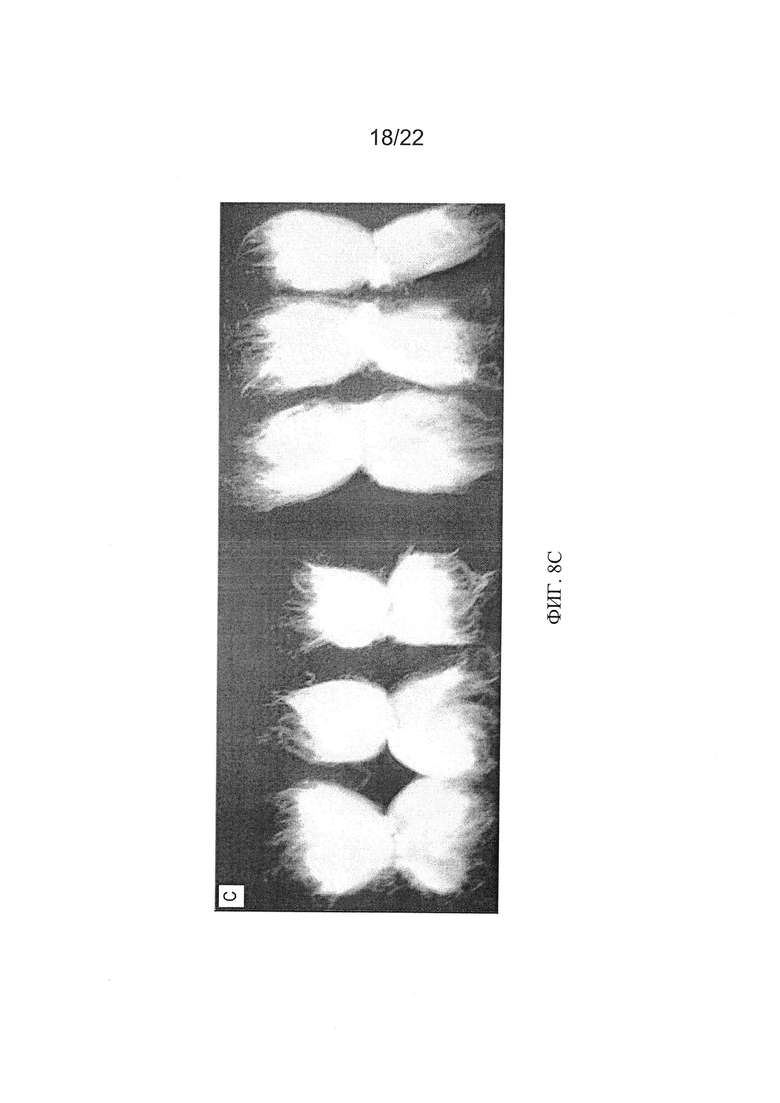
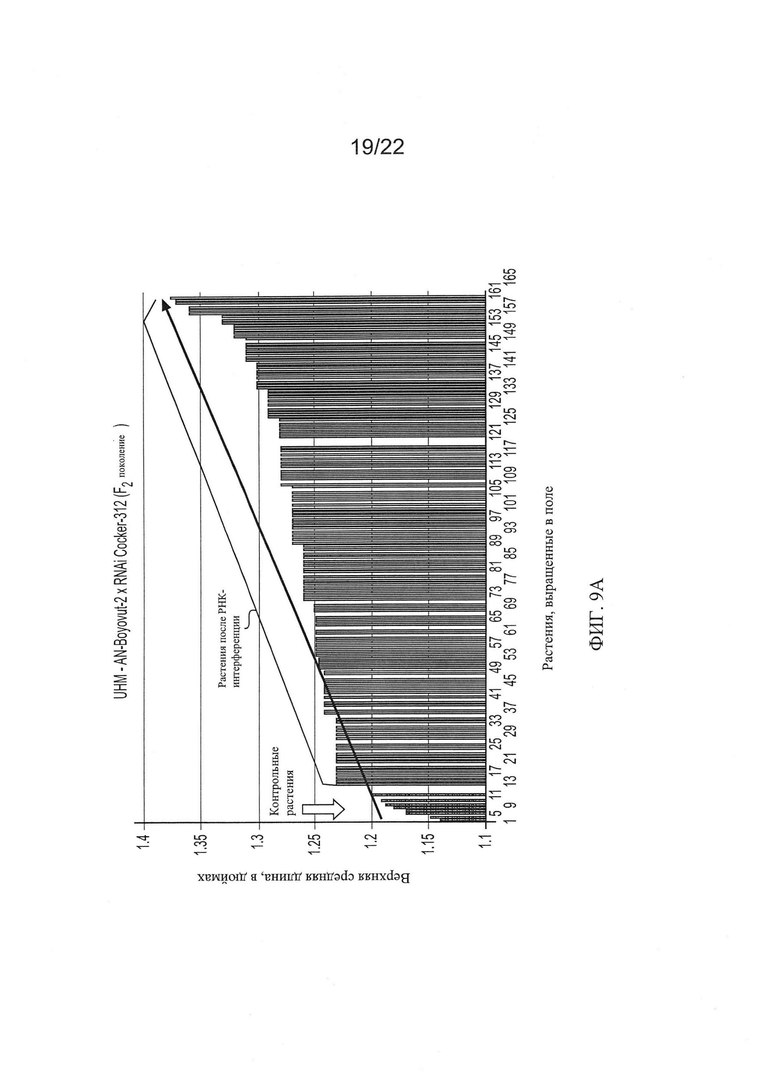
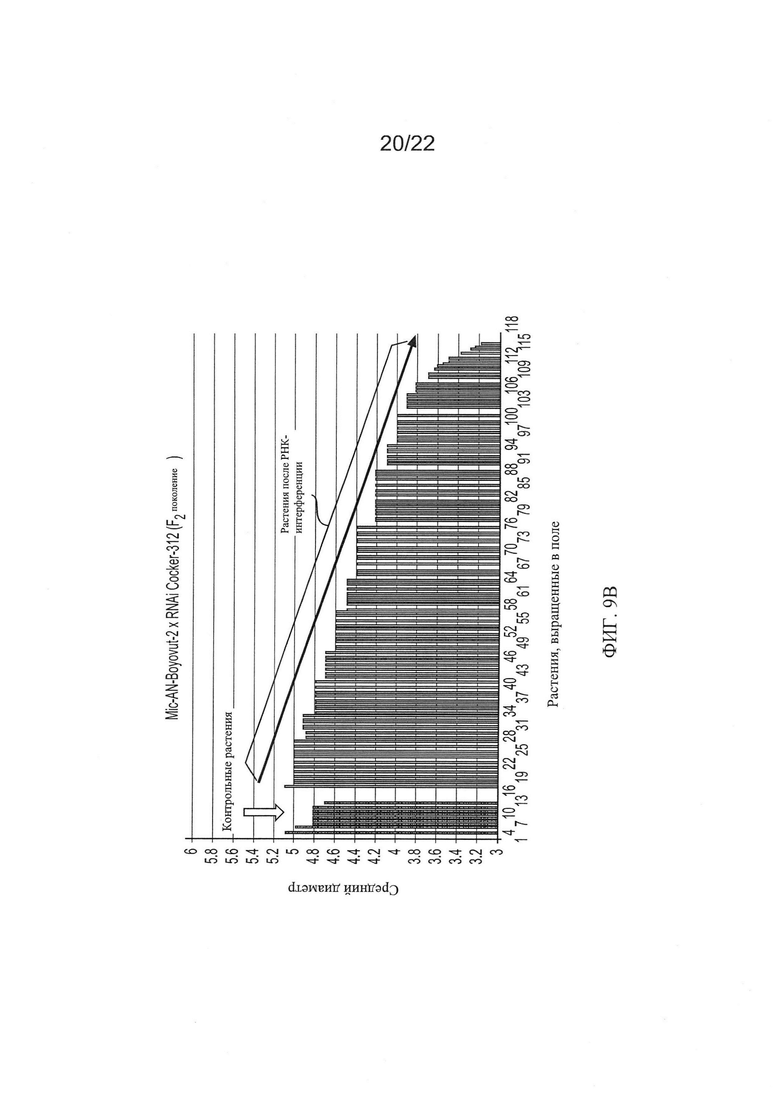
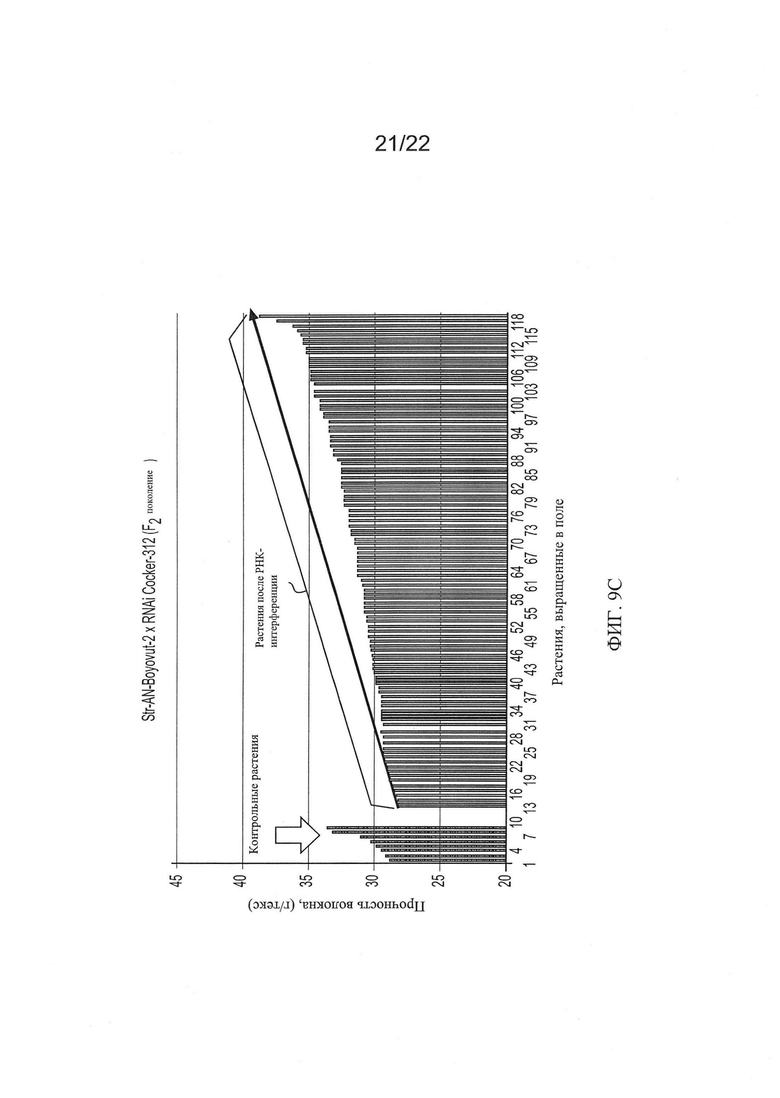
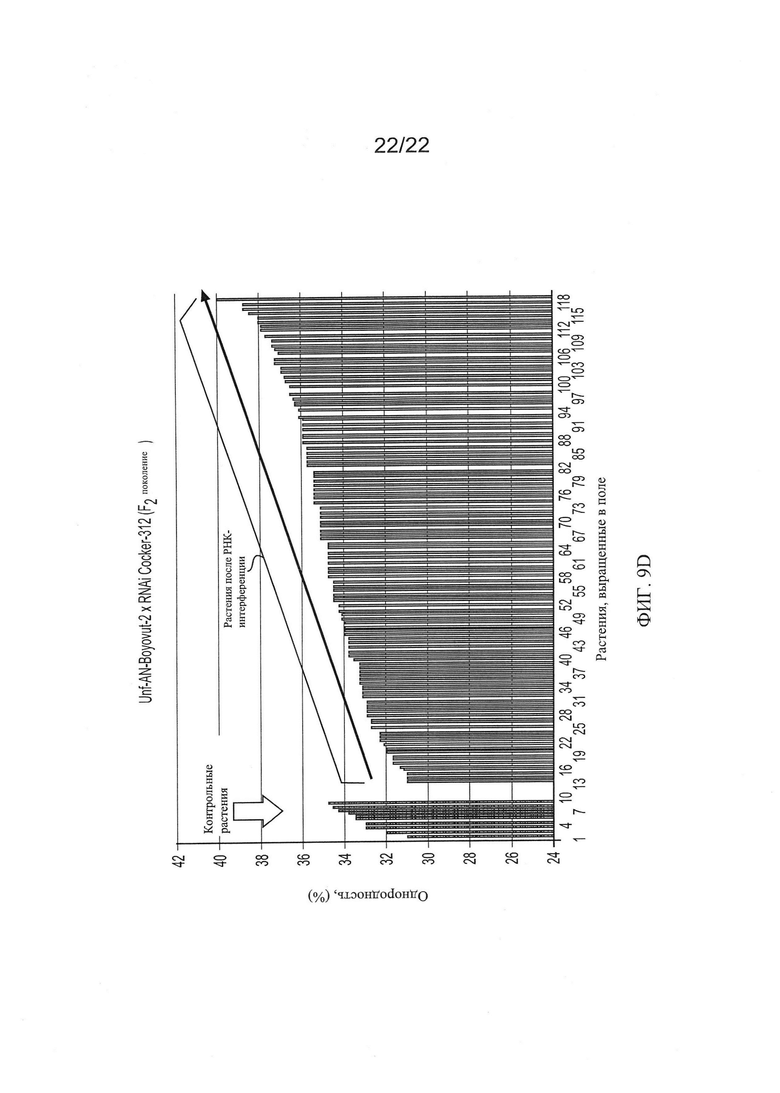
Изобретение относится к области биохимии, в частности к рекомбинантной молекуле полинуклеотида, предназначенной для снижения уровня гена фитохрома PHYA1. Также раскрыты шпилечный конструкт нуклеиновой кислоты, рекомбинантный бинарный вектор, клетка-хозяин, включающая указанный конструкт, трансгенный хлопчатник, трансгенная клетка хлопчатника, трансгенное семя трансгенного растения, часть растения. Раскрыты способ снижения уровня фитохрома А1, способ супрессии экспрессии гена PHYA1, способ получения указанного трансгенного хлопчатника, способ изменения характеристик растения путем изменения числа копий указанного конструкта, способ использования указанного трансгенного растения для получения трансформированного растения. Изобретение позволяет получать высокие урожаи волокон хлопчатника с повышенной длинной и прочностью. 18 н. и 8 з.п. ф-лы, 18 ил., 7 табл., 8 пр.
1. Рекомбинантная молекула полинуклеотида, предназначенная для снижения уровня гена фитохрома PHYA1 и изменения архитектуры растения хлопчатника, характеризующаяся последовательностью ДНК, кодирующей часть шарнирной области полипептида PHYA1 растения Gossypium hirsutum,
причем упомянутая последовательность ДНК включает последовательность, имеющую 100% идентичности с SEQ ID NO: 1 или с последовательностью, полностью ей комплементарной.
2. Выделенная молекула полинуклеотида по п. 1, отличающаяся тем, что упомянутая последовательность ДНК включает молекулу из 213 последовательных нуклеотидных пар оснований, кодирующую часть шарнирной области упомянутого полипептида PHYA1,
причем упомянутая последовательность ДНК включает последовательность, имеющую 100% идентичности с SEQ ID NO: 1 или с последовательностью, полностью ей комплементарной.
3. Выделенная молекула полинуклеотида по п. 1, отличающаяся тем, что упомянутая последовательность ДНК является последовательностью SEQ ID NO: 1 или последовательностью, полностью комплементарной ей.
4. Шпилечный конструкт нуклеиновой кислоты, предназначенный для снижения уровня гена фитохрома PHYA1 и изменения архитектуры растения хлопчатника, кодирующий последовательность генов полинуклеотида PHYA1, включающую часть из приблизительно 213 последовательных смысловых нуклеотидных пар оснований шарнирной области гена PHYA1 Gossypium и его антисмысловой комплемент, так что первая и вторая полинуклеотидные последовательности гибридизируются при их транскрипции в рибонуклеиновую кислоту, чтобы образовать шпилечноподобную двухцепочечную молекулу рибонуклеотида,
причем упомянутый конструкт включает последовательность, имеющую 100% идентичности с SEQ ID NO: 1 или с последовательностью, полностью ей комплементарной.
5. Шпилечный конструкт нуклеиновой кислоты по п. 4, отличающийся тем, что часть шарнирной области из 213 последовательных нуклеотидных пар оснований является последовательностью SEQ ID NO: 1.
6. Рекомбинантный бинарный вектор, предназначенный для снижения уровня гена фитохрома PHYA1 и изменения архитектуры растения хлопчатника, включающий конструкт PHYA1 RNAi, отличающийся тем, что упомянутый конструкт включает нуклеотидную последовательность из приблизительно 213 последовательных пар оснований из шарнирной области гена PHYA1, причем в этой нуклеотидной последовательности присутствует промотор 35S вируса мозаики цветной капусты (CaMV) сразу же перед шпилькой PHYA1, каждый конструкт доставлен инокуляцией, опосредованной Agrobacterium, что приводит к рекомбинации in vitro и супрессии генов PHYA1 и измененным уровням экспрессии других фитохромов,
причем упомянутый конструкт включает последовательность, имеющую 100% идентичности с SEQ ID NO:1 или с последовательностью, полностью ей комплементарной.
7. Клетка-хозяин, включающая конструкт PHYA1 RNAi бинарного вектора по п. 6, предназначенный для снижения уровня гена фитохрома PHYA1 и изменения архитектуры растения хлопчатника.
8. Клетка-хозяин по п. 7, отличающаяся тем, что упомянутая клетка-хозяин является клеткой растения.
9. Клетка-хозяин по п. 8, отличающаяся тем, что клетка растения относится к эудикотному растению.
10. Клетка-хозяин по п. 9, отличающаяся тем, что клетка растения относится к хлопчатнику.
11. Клетка-хозяин по п. 9, отличающаяся тем, что клетка растения происходит из растения, выбираемого из группы, состоящей из покрытосеменных и розидов.
12. Клетка-хозяин по п. 11, отличающаяся тем, что клетка растения происходит из группы, состоящей из арабидопсиса, томата, картофеля, цитруса, хрена, моркови, цветной капусты, ячменя, хлопчатника, винограда, маиса, люцерны, риса, сои и пшеницы.
13. Способ снижения уровня фитохрома А1 в растении хлопчатника, причем способ включает экспрессию в растении хлопчатника гетерологичного конструкта нуклеиновой кислоты, кодирующего генную последовательность PHYA1, включающую часть из приблизительно 213 последовательных смысловых нуклеотидных пар оснований шарнирной области гена PHYA1 эудикотного растения и ее антисмысловой комплемент, отличающийся тем, что экспрессия индуцирует РНК-интерференцию (RNAi) в растении, тем самым снижая уровень экспрессии гена фитохрома А1 в растении хлопчатника, что приводит к проявлению растением хлопчатника одной или нескольких из следующих характеристик: удлиненные черешки листьев, удлиненные плодовые ветви, удлиненные плодоножки семенных коробочек и удлиненная корневая система, интенсивный вегетативный рост, раннее цветение, раннее созревание семенных коробочек, усиленную старением пигментацию антоциана в стеблях и листьях, увеличенную длину волокна, увеличенную прочность волокна, увеличенный средний диаметр волокна, увеличенную однородность волокон и увеличенную урожайность волокна относительно эудикотного растения дикого типа, культивируемого при нормальном солнечном освещении.
14. Способ снижения уровня фитохрома А1 в хлопчатнике, причем способ включает экспрессию в растении гетерологичного конструкта нуклеиновой кислоты, кодирующего генную последовательность PHYA1, включающую часть из приблизительно 213 последовательных смысловых нуклеотидных пар оснований шарнирной области гена PHYA1 Gossypium и ее антисмысловой комплемент, отличающийся тем, что экспрессия индуцирует РНК-интерференцию (RNAi) в растении, тем самым снижая уровень экспрессии гена фитохрома А1 в растении, с получением растения, которое производит длинные волокна, проявляющие одну или несколько из характеристик волокна повышенного качества, при этом упомянутыми характеристиками являются прочность, средний диаметр волокна, удлинение и однородность.
15. Способ снижения уровня фитохрома А1 в хлопчатнике, причем способ включает экспрессию в растении гетерологичного конструкта нуклеиновой кислоты, кодирующего генную последовательность PHYA1, включающую часть из приблизительно 213 последовательных смысловых нуклеотидных пар оснований шарнирной области гена PHYA1 Gossypium и ее антисмысловой комплемент, отличающийся тем, что экспрессия индуцирует РНК-интерференцию (RNAi) в растении, тем самым снижая уровень экспрессии гена фитохрома А1 в растении, с получением растения или потомства упомянутого растения, имеющего одну или несколько из следующих характеристик: удлиненные черешки листьев, удлиненные плодовые ветви, удлиненные плодоножки семенных коробочек и удлиненная корневая система, интенсивный вегетативный рост, раннее цветение и раннее созревание семенных коробочек, усиленную старением пигментацию антоциана в стеблях и листьях, повышенную урожайность семян хлопчатника, и одну или несколько из характеристик волокна повышенного качества, при этом упомянутыми характеристиками являются прочность, средний диаметр волокна, удлинение и однородность относительно хлопчатника дикого типа, культивируемого при нормальном солнечном освещении.
16. Способ супрессии экспрессии гена PHYA1 в клетках Gossypium sp., причем способ включает: трансформацию растения с помощью вектора, включающего нуклеинокислотную последовательность, кодирующую двухцепочечную ДНК и оперативно связанную с промотором, и терминацию транскрипции последовательности, выбор трансформированных растений, которые интегрировали эту нуклеинокислотную последовательность в их геномы, скрининг трансформированных растений на экспрессию двухцепочечной ДНК, кодированной этой нуклеинокислотной последовательностью, и выбор растений, которые экспрессируют эту двухцепочечную ДНК и/или малую интерферирующую РНК,
причем упомянутая нуклеинокислотная последовательность включает последовательность, имеющую по меньшей мере 100% идентичности с SEQ ID NO: 1 или с последовательностью, полностью ей комплементарной.
17. Способ получения трансгенного хлопчатника, отличающийся тем, что ген PHYA1 хлопчатника супрессирован, причем способ включает: (а) стабильную трансформацию клетки-хозяина хлопчатника с помощью конструкта PHYA1 RNAi изобретения, (b) соматическую регенерацию трансгенного растения из стабильно трансформированной клетки-хозяина хлопчатника и (с) выращивание трансгенного растения в условиях, посредством которых упомянутые растения проявляют измененные фотоморфогенные характеристики, включая измененную архитектуру растения, и причем упомянутые растения имеют одну или несколько из следующих характеристик: удлиненные черешки листьев, удлиненные плодовые ветви, удлиненные плодоножки семенных коробочек и удлиненную корневую систему, интенсивный вегетативный рост, раннее цветение и раннее созревание семенных коробочек, усиленную старением пигментацию антоциана в стеблях и листьях, повышенную урожайность семян хлопчатника, и одну или несколько характеристик волокна повышенного качества, при этом упомянутыми характеристиками являются прочность, средний диаметр волокна, удлинение и однородность по сравнению с нетрансформированным хлопчатником дикого типа,
причем упомянутый конструкт включает последовательность, имеющую по меньшей мере 100% идентичности с SEQ ID NO: 1 или с последовательностью, полностью ей комплементарной.
18. Трансгенный хлопчатник со сниженным уровнем гена фитохрома PHYA1 и измененной архитектурой, полученный способом по п. 14, включающий: конструкт PHYA1 RNAi по п. 6, причем упомянутое растение имеет измененную экспрессию фотоморфогенных характеристик, включая измененную архитектуру растения, и причем упомянутое растение имеет одну или несколько из следующих характеристик: удлиненные черешки листьев, удлиненные плодовые ветви, удлиненные плодоножки семенных коробочек и удлиненную корневую систему, интенсивный вегетативный рост, раннее цветение и раннее созревание семенных коробочек, усиленную старением пигментацию антоциана в стеблях и листьях, повышенную урожайность семян хлопчатника и одну или несколько характеристик волокна повышенного качества, при этом упомянутыми характеристиками являются прочность, средний диаметр волокна, удлинение и однородность, по сравнению с нетрансформированным хлопчатником дикого типа.
19. Трансгенная клетка хлопчатника, включающая конструкт PHYA1 RNAi по п. 6, предназначенный для уменьшения уровня гена фитохрома PHYA1 и для изменения архитектуры растения, происходящего из нее.
20. Трансгенный хлопчатник со сниженным уровнем гена фитохрома PHYA1 и измененной архитектурой, включающий конструкт PHYA1 RNAi по п. 6, отличающийся тем, что трансгенное растение имеет волокна хлопчатника увеличенной длины и прочности, а также улучшенный средний диаметр волокна, удлинение и однородность волокон по отношению к хлопчатнику дикого типа.
21. Трансгенное семя трансгенного растения по п. 18 со сниженным уровнем гена фитохрома PHYA1 и измененной архитектурой, включающее конструкт PHYA1 RNAi изобретения, для выращивания растения со сниженным уровнем гена фитохрома PHYA1.
22. Часть растения со сниженным уровнем гена фитохрома PHYA1 и измененной архитектурой, которая трансформирована конструктом PHYA1 RNAi по п. 6.
23. Способ изменения характеристик растения путем изменения числа копий конструктов PHYA1 RNAi по п. 6, чтобы усилить супрессию экспрессии гена PHYA1.
24. Способ изменения характеристик растения путем изменения числа копий конструктов PHYA1 RNAi по п. 6, чтобы усилить экспрессию гена PHYB/C/E.
25. Трансгенная клетка хлопчатника со сниженным уровнем гена фитохрома PHYA1 и измененной архитектурой, включающая конструкт PHYA1 RNAi по п. 6, отличающаяся тем, что трансгенное растение, регенерированное из упомянутой клетки, проявляет супрессию гена PHYA1 и сверхэкспрессию генов PHYB/C/E, результатом чего является растение, демонстрирующее измененную архитектуру растения, причем упомянутое растение имеет одну или несколько из следующих характеристик: удлиненные черешки листьев, удлиненные плодовые ветви, удлиненные плодоножки семенных коробочек и удлиненную корневую систему, интенсивный вегетативный рост, раннее цветение и раннее созревание семенных коробочек, усиленную старением пигментацию антоциана в стеблях и листьях, повышенную урожайность семян хлопчатника и одну или несколько характеристик волокна повышенного качества, при этом упомянутыми характеристиками являются прочность, средний диаметр волокна, удлинение и однородность по сравнению с нетрансформированным хлопчатником дикого типа.
26. Способ использования трансгенного растения по любому одному из пп. 18-20, 22 и 25 в традиционной селекции, чтобы получить больше трансформированных растений с одинаковыми характеристиками или ввести генный конструкт для снижения фенотипической экспрессии PHYA1 в другие разновидности тех же или родственных видов растений или в гибридные растения.
| ABDURAKHMONOV I.Y | |||
| AND ET.AL., Research article Duplication, divergence and persistence in the Phytochrome photoreceptor gene family of cottons (Gossypium spp.) | |||
| BMC Plant Biology, 2010, v.10, n.119, pp.1-18 | |||
| WO 2005082931 A1, 09.09.2005 | |||
| WO 2002046425 A1, 13.06.2002 | |||
| US 0007271004 B2, 18.09.2007 | |||
| СПОСОБ СВЕТОИМПУЛЬСНОЙ ОБРАБОТКИ РАСТЕНИЙ | 2004 |
|
RU2262834C1 |
Авторы
Даты
2018-09-04—Публикация
2013-02-26—Подача