Область техники, к которой относится изобретение
Изобретение относится к способу стабилизации суспензий эритроцитов, заключающих в себе активный ингредиент. Данное изобретение относится также к способу получения таких суспензий, способам лечения с использованием таких суспензий и новым стабильным суспензиям эритроцитов, заключающих в себе активный ингредиент.
Уровень техники
На сегодняшний день описаны различные методы, позволяющие включать в эритроциты активные ингредиенты. В их числе наиболее часто применяемый метод лизиса с последующим закрытием мембранных пор. Существуют три варианта этого метода: с гипотоническим диализом, с гипотоническим набуханием и с гипотоническим разбавлением; все они основываются на разнице осмотического давления между внутриклеточным содержимым и внеклеточной средой. В этих вариантах имеются пять общих этапов: осадок эритроцитов промывают забуференным физиологическим раствором и центрифугируют один или более раз; эритроциты контактируют с гипотонической жидкой средой, что ведет к раскрытию пор в клеточной мембране; активный ингредиент поступает внутрь эритроцитов; поры закрываются в результате воздействия на клетки гипертонического буферного раствора, так что активный ингредиент оказывается заключенным внутри эритроцитов; эритроциты суспендируют в консервирующем растворе. Наиболее предпочтителен метод, включающий гипотонический диализ; его моно применять в промышленных условиях. Метод, описанный в ЕР 1773452, дает наилучшие результаты и обладает теми преимуществами, что он является воспроизводимым и обеспечивает больший захват активного ингредиента клетками.
Для использования получаемого таким образом продукта при лечении людей необходимо, чтобы он был стабильным. В частности количество внеклеточного гемоглобина в таком продукте на момент его введения пациенту должно быть ниже некоторого заранее определенного порогового значения. Например, согласно требованиям Управления по контролю качества пищевых продуктов, медикаментов и косметических средств США (FDA), в предназначенном для введения человеку конечном продукте пороговое значение содержания внеклеточного гемоглобина составляет не более 0,2 г/дл.
Продукты, получаемые методами, известными в данной области техники, в процессе хранения и транспортировки до введения пациенту претерпевают гемолиз. В результате гемолиза, при котором нарушается целостность наиболее хрупких эритроцитов, во внеклеточную среду высвобождается гемоглобин, из-за чего эти продукты на момент введения пациенту не удовлетворяют требованиям FDA.
Раскрытие изобретения
Одна из целей данного изобретения - предложить, помимо прочего, способ, позволяющий производить такие суспензии эритроцитов, содержащих активный ингредиент, в которых уровень внеклеточного гемоглобина не изменяется после хранения или которые остаются соответствующими рекомендациям FDA или любой другой официальной организации здравоохранения.
Другая цель изобретения - предложить способ, применимый к любым суспензиям эритроцитов с инкапсулированным активным ингредиентом, независимо от метода их получения, в частности при использовании лизиса с восстановлением закрытого состояния пор в клеточной мембране.
Еще одна цель изобретения - предложить способ, позволяющий производить стабилизированные суспензии эритроцитов, заключающих в себе активный ингредиент, с высоким выходом клеток.
Эти и другие цели могут быть достигнуты путем исключения наиболее хрупких эритроцитов из суспензии, получаемой после инкапсулирования активного ингредиента в эритроциты (то есть после восстановления закрытого состояния мембранных пор), чтобы получить суспензию, содержащую устойчивые к гемолизу эритроциты в максимально возможном количестве. Такую суспензию эритроцитов можно хранить без существенного гемолиза до момента введения пациенту, так что в этот момент в ней будет низкий уровень внеклеточного гемоглобина. Таким образом, способ по изобретению обеспечивает отсутствие в суспензии эритроцитов наиболее хрупких клеток, низкие уровни внеклеточного гемоглобина и внеклеточного активного ингредиента. Заявителям удалось осуществить это, причем с хорошим выходом клеток и разумным компромиссом между исключением наиболее хрупких эритроцитов и достижением максимального количества клеток в суспензии. Заявителю удалось определить, какие условия позволяют добиться стабилизации суспензии эритроцитов, заключающих в себе активный ингредиент, с сохранением высокого выхода клеток.
Выражение «эритроцит, заключающий в себе активный ингредиент» или «эритроцит с инкапсулированным активным ингредиентом» означает, что активный ингредиент полностью или в основном содержится внутри клеток. «В основном» означает, что, тем не менее, малая доля активного ингредиента может быть захвачена клеточной мембраной.
Выражение «заключающий в себе активный ингредиент/ с инкапсулированным активным ингредиентом» означает, что эритроциты несут внутри себе молекулы, выполняющие функцию активного ингредиента, или что в эритроцитах образуется комплекс, включающий молекулярный компонент, обладающий функцией активного ингредиента.
Термин «раствор для инкубации» означает раствор, в котором содержатся эритроциты, заключающие в себе активный ингредиент, на этапе инкубации. Инкубация эритроцитов может осуществляться в широком диапазоне значений гематокрита, в частности от 10% до 85%.
Термин «консервирующий раствор»/«раствор для хранения» означает раствор, в котором суспендируют стабилизированные эритроциты с инкапсулированным активным ингредиентом в форме, пригодной для хранения до использования. Консервирующий раствор предпочтительно содержит по меньшей мере один агент, способствующий сохранности эритроцитов и выбираемый, в частности, из глюкозы, декстрозы, аденина и маннита.
Термин «хрупкие эритроциты» означает эритроциты после процедуры включения в них активного ингредиента, склонные к лизису в суспензии в консервирующем растворе при хранении при температуре от 2°C до 8°C, в частности спустя 1-72 часа.
Термин «исходный гематокрит» означает гематокрит, имевший место до потери клеток из-за лизиса хрупких эритроцитов в ходе инкубации.
Факт «стабилизации» устанавливается в основном по стабильности во времени эритроцитов, несущих активный ингредиент, в частности по потере внутриклеточного гемоглобина и по уровню внеклеточного гемоглобина.
Термин «стабилизированная суспензия эритроцитов» означает конкретно суспензию с уровнем внеклеточного гемоглобина вплоть до момента использования (введения пациенту) остающимся 0,5 г/дл или менее, в частности 0,3 г/дл или менее, предпочтительно 0,2 г/дл или менее, причем введение пациенту может осуществляться спустя от 1 до 72 часов после получения данной партии эритроцитов, несущих активный ингредиент. Стабильность суспензии эритроцитов можно также характеризовать степенью гемолиза, которая при хранении в течение 72 часов при температуре от 2°C до 8°C остается 2% или менее, в частности 1,5% или менее, предпочтительно 1% или менее.
Термин «готовая к использованию стабилизированная суспензия эритроцитов» означает стабилизированную суспензию в растворе, подходящем для введения путем инъекции пациенту, в частности в консервирующем растворе; ее гематокрит составляет, как правило, 40% или более.
Термин «осадок эритроцитов» означает концентрат эритроцитов, собранный после отделения этих клеток от жидкой среды, в которой они были суспендированы до этого. Отделение эритроцитов может осуществляться путем фильтрования или центрифугирования. Как правило, для отделения эритроцитов применяется центрифугирование. Получаемый в результате центрифугирования осадок содержит некоторое количество жидкой среды. Как правило, гематокрит осадка составляет от 70% до 85%.
Способ по изобретению можно применять независимо от того, какой метод применялся для инкапсулирования в эритроциты активного ингредиента. Предпочтительно применять этот способ в случае метода с лизисом и восстановлением закрытого состояния мембранных пор, в частности с использованием гипотонического диализа, предпочтительно так, как описано в ЕР 1773452, к которому может обратиться заинтересованный специалист в данной области техники. Содержание ЕР 1773452 включается в настоящий документ путем отсылки. Как станет ясно из приведенного ниже описания, способ стабилизации по данному изобретению можно применять к суспензии или к осадку эритроцитов с восстановленным закрытым состоянием мембранных пор, заключающих в себе активный ингредиент; или же этот способ может включать этапы лизиса и восстановления закрытого состояния мембранных пор, которые осуществляются до получения суспензии или осадка эритроцитов с восстановленным закрытым состоянием мембранных пор.
Таким образом, целью изобретения является способ получения стабилизированных суспензий эритроцитов, заключающих в себе активный ингредиент, из эритроцитов с восстановленным закрытым состоянием мембранных пор после проникновения в них этого активного ингредиента. Способ по изобретению включает инкубацию эритроцитов с восстановленным закрытым состоянием пор в растворе для инкубации, имеющем осмоляльность не менее 280 мосмоль/кг, в частности от около 280 мосмоль/кг до 380 мосмоль/кг, предпочтительно от около 290 мосмоль/кг до 330 мосмоль/кг. Инкубацию проводят, в частности, в течение 30 минут или более, в частности, в течение 1 часа или более. Этот этап инкубации называется «инкубация после восстановления закрытого состояния мембранных пор», то есть осуществляется применительно к эритроцитам с восстановленным закрытым состоянием пор в клеточной мембране. Затем из инкубированной суспензии клеток удаляют жидкую среду и полученные эритроциты суспендируют в растворе, подходящем для введения путем инъекции пациенту, предпочтительно в консервирующем растворе, подходящем для введения путем инъекции пациенту.
Раствором для инкубации, как правило, служит солевой раствор, содержащий по меньшей мере ионы, обеспечивающие нужную осмоляльность (например, раствор на основе NaCl, KCl и/или фосфата). Он может содержать и другие ингредиенты, в частности углеводы, в особенности сахара, и/или кислые и/или щелочные добавки, обеспечивающие нужное значение рН (в частности, от около 6 до около 8,5, предпочтительно от около 7 до около 7,5). Раствор для инкубации не содержит никаких агентов, способных вызвать денатурацию клеточной мембраны эритроцитов, например химических веществ, образующих мостики или поперечные сшивки - такие, как бис-сульфосукцинимидилсуберат (BS3), глутаровый альдегид и нейраминидаза. Таким образом, раствор для инкубации является инертным или не вызывающим нарушения целостности клеточной мембраны эритроцитов с восстановленным закрытым состоянием мембранных пор.
В одном из воплощений изобретения предлагаемый способ включает перед инкубацией инкапсулирование - введение активного ингредиента внутрь эритроцитов - путем лизиса с последующим восстановлением закрытого состояния мембранных пор и получение эритроцитов, содержащих активный ингредиент и имеющих восстановленное закрытое состояние мембранных пор.
Предпочтительно перед инкубацией эритроциты с восстановленным закрытым состоянием мембранных пор промывают (по меньшей мере один цикл промывания).
Эритроциты с восстановленным закрытым состоянием мембранных пор, к которым применяется указанный способ, могут быть в виде суспензии в консервирующем растворе. В этом случае можно разбавлять консервирующий раствор раствором для инкубации, чтобы достичь значения осмоляльности по данному изобретению. Или же эритроциты отделяют от консервирующего раствора, например путем центрифугирования или фильтрации, после чего к ним прибавляют раствор для инкубации Можно также промывать эритроциты с восстановленным закрытым состоянием мембранных пор (по меньшей мере один цикл промывания, как описано ниже); цикл промывания предпочтительно включает разбавление суспензии, затем отделение клеток, которые после этого суспендируют в растворе для инкубации. Эритроциты с восстановленным закрытым состоянием мембранных пор, к которым применяется указанный способ, могут быть в виде суспензии в том растворе, в котором проходило восстановление. Тогда можно отделить эритроциты от восстанавливающего раствора, например путем центрифугирования или фильтрации, и/или промыть полученные эритроциты с восстановленным закрытым состоянием мембранных пор (по меньшей мере один цикл промывания, как описано ниже); цикл промывания предпочтительно включает разбавление суспензии, затем отделение клеток, которые после этого суспендируют в растворе для инкубации.
Способ по изобретению, таким образом, включает разведение и инкубацию эритроцитов с восстановленным закрытым состоянием мембранных пор в растворе для инкубации с осмоляльностью не менее 280 осмоль/кг, в частности от около 280 мосмоль/кг до 380 мосмоль/кг, предпочтительно от около 290 мосмоль/кг до 330 мосмоль/кг.
Объектом изобретения является, в частности, способ получения стабилизированной суспензии эритроцитов с инкапсулированным активным ингредиентом, который включает введение активного ингредиента внутрь эритроцитов путем лизиса с последующим восстановлением закрытого состояния мембранных пор, получение суспензии или осадка эритроцитов с восстановленным закрытым состоянием мембранных пор, содержащих активный ингредиент, промывание (по меньшей мере один цикл промывания) эритроцитов с восстановленным закрытым состоянием мембранных пор, затем их разведение и инкубацию в растворе для инкубации с осмоляльностью не менее 280 осмоль/кг, в частности от около 280 мосмоль/кг до 380 мосмоль/кг, предпочтительно от около 290 мосмоль/кг до 330 мосмоль/кг. Инкубацию проводят в течение, в частности, 30 минут или более, в частности в течение 1 часа или более. Из инкубированной суспензии эритроцитов затем удаляют жидкую среду и полученные эритроциты суспендируют в растворе, подходящем для введения путем инъекции этой суспензии пациенту, предпочтительно в консервирующем растворе, подходящем для введения путем инъекции полученной суспензии пациенту. Указанные значения осмоляльности имеет раствор, в котором находятся эритроциты (в виде суспензии или осадка) в рассматриваемый момент времени.
Способ по изобретению, в частности, включает следующие этапы:
(а) введение активного ингредиента внутрь эритроцитов, включающее их контактирование с гипотонической средой (обеспечивающей открывание пор в клеточной мембране), контактирование с активным ингредиентом (так что он поступает внутрь эритроцитов), восстановление закрытого состояния пор в клеточной мембране эритроцитов, в частности, с использованием изотонической или гипертонической среды, предпочтительно гипертонической;
(b) получение или приготовление суспензии или осадка, содержащих эритроциты, несущие в себе активный ингредиент, и раствор с осмоляльностью не менее 280 осмоль/кг, в частности, от около 280 мосмоль/кг до 380 мосмоль/кг, предпочтительно от около 290 мосмоль/кг до 330 мосмоль/кг;
(c) инкубация осадка или суспензии, полученных на этапе (b), в том виде, в каком они получены, или же после добавления раствора для инкубации при осмоляльности не менее 280 осмоль/кг, в частности от около 280 мосмоль/кг до 380 мосмоль/кг, предпочтительно от около 290 мосмоль/кг до 330 мосмоль/кг, в течение 30 минут или дольше, в частности в течение 1 часа или дольше;
(d) удаление жидкой среды из суспензии, инкубированной на этапе (с);
(e) суспендирование эритроцитов, полученных на этапе (d), в растворе, подходящем для введения путем инъекции этой суспензии пациенту, предпочтительно в консервирующем растворе, подходящем для введения путем инъекции полученной суспензии пациенту.
По первому варианту этого способа этап, следующий после инкапсулирования активного ингредиента в эритроциты путем лизиса с последующим восстановлением закрытого состояния мембранных пор, в частности этап (b), включает по меньшей мере один цикл промывания, предпочтительно два или три цикла промывания путем разбавления суспензии или осадка, содержащих эритроциты с восстановленным закрытым состоянием мембранных пор, например полученных после этапа лизиса и восстановления или этапа (а), раствором с осмоляльностью не менее 280 осмоль/кг, в частности, от около 280 мосмоль/кг до 380 мосмоль/кг, предпочтительно от около 290 мосмоль/кг до 330 мосмоль/кг, и затем получения осадка эритроцитов или суспензии. Эти осадок или суспензия содержат эритроциты, несущие введенный активный ингредиент, и раствор с осмоляльностью не менее 280 осмоль/кг, в частности от около 280 мосмоль/кг до 380 мосмоль/кг, предпочтительно от около 290 мосмоль/кг до 330 мосмоль/кг. После этого осуществляют следующие этапы, например (с), (d) и (е).
Этапы, следующие после лизиса и восстановления закрытого состояния мембранных пор, например этапы (b)-(е), проводят в условиях, ведущих к лизису хрупких эритроцитов или большинства из них, в частности более 50, 60, 70, 80 или 90%, или более. Под условиями подразумеваются продолжительность и температура инкубации, а также осмоляльность раствора, в котором суспендированы эритроциты. Чем выше осмоляльность, тем больше продолжительность инкубации. Чем ниже осмоляльность, тем меньше продолжительность инкубации для достижения такого же эффекта. Аналогично, чем выше температура, тем короче инкубация, и наоборот. Затем в результате одного или более циклов промывания удаляются обломки клеток и внеклеточный гемоглобин, а также внеклеточный активный ингредиент.
Согласно изобретению цикл промывания включает разбавление суспензии или осадка эритроцитов и затем отделение эритроцитов от промывающего раствора. Предпочтительно этап промывания включает два или три цикла разбавления-разделения. Отделение клеток от промывающего раствора осуществляется любыми подходящими методами, например путем центрифугирования или фильтрации. Предпочтительно центрифугирование. Предпочтительно промывать клетки раствором для инкубации. Инкубация не ограничивается гематокритом суспензии. Поэтому можно инкубировать суспензии, у которых исходный гематокрит, как правило, от 10% до 85%, в частности, от 40% до 80%. Материал, характеризующийся гематокритом 70% или более, считается осадком; при гематокрите меньше 70% употребляется термин «суспензия».
На этапе удаления или этапе (d) должна быть удалена жидкая часть инкубированной суспензии или осадка эритроцитов, чтобы, в частности, удалить обломки клеток и внеклеточный гемоглобин, а также внеклеточный активный ингредиент.
По первому варианту этапа удаления или этапа (d) осуществляется разделение путем центрифугирования, что, в частности, применимо к суспензии. После этого разделения можно сделать один или более, например два-три, цикла промывания путем разбавления изотоническим раствором, после чего проводят разделение, в частности, путем центрифугирования.
По второму варианту этапа удаления или этапа (d) разбавление делают до разделения, в частности, путем центрифугирования, что применимо к суспензии или к осадку. Разбавление осуществляют, в частности, изотоническим раствором для промывания или консервирующим раствором.
На конечном этапе или этапе (е) получают окончательную суспензию, которую без какой-либо другой обработки можно вводить пациенту.
По первому варианту этого этапа осадок эритроцитов, полученный в результате этапа удаления или этапа (d), разводят раствором для введения путем инъекции, в частности, консервирующим раствором.
По второму варианту этого этапа с осадком эритроцитов, полученным в результате этапа удаления или этапа (d), проводят один или более циклов промывания раствором для введения путем инъекции, в частности консервирующим раствором, путем разбавления с последующим разделением. После промывания эритроциты суспендируют в растворе для введения путем инъекции, в частности, в консервирующем растворе.
Способ по изобретению может также включать один, несколько или все из следующих признаков:
- этап инкубации или этап (с) проводится при температуре от около 2°C до около 39°C в течение промежутка времени, достаточного для того, чтобы произошел лизис хрупких эритроцитов;
- этап инкубации или этап (с) проводится при низкой температуре, в частности, от около 2°С до около 10°C, в частности от около 2°C до около 8°C, и продолжается от около 1 часа до около 72 часов, в частности от около 6 часов до около 48 часов, предпочтительно от около 19 часов до около 30 часов;
- этап инкубации или этап (с) проводится при более высокой температуре от около 20°C до около 39°C, в частности, при температуре окружающей среды (25°C+/-5°C), и продолжается от около 30 минут до около 10 часов, в частности, от около 1 часов до около 6 часов, предпочтительно от около 2 часов до около 4 часов; возможно проведение этого этапа при температуре выше температуры окружающей среды, но это может отрицательно повлиять на выход клеток, Р50 и/или содержание 2,3-DPG;
- на этапе инкубации или этапе (с) суспензия эритроцитов характеризуется исходным гематокритом от 10% до 85%, в частности от 40% до 80%; можно инкубировать осадок, полученный при отделении клеток и характеризующийся гематокритом, например, от 70% до около 85%, или разбавленный осадок, характеризующийся гематокритом от около 40% до около 70%;
- этап инкубации включает перемешивание суспензии эритроцитов;
- этап инкубации не включает перемешивание;
- в качестве раствора для промывания и/или инкубации используется водный раствор NaCl с такой концентрацией этой соли, чтобы он имел нужную осмоляльность; например, раствор может содержать 0, 9% NaCl; в частности, помимо NaCl или другой соли (например, KCl, фосфата), этот раствор может содержать также глюкозу, в частности глюкозы моногидрат, дигидрат однозамещенного фосфата натрия, додекагидрат двузамещенного фосфата натрия; например, композиция содержит 0,9% NaCl, 0,2% глюкозы моногидрата, 0,034% дигидрата однозамещенного фосфата натрия, 0,2% додекагидрата двузамещенного фосфата натрия;
- промывание на конечном этапе или этапе (е) осуществляется консервирующим раствором;
- осмоляльность жидкой части готовой к использованию суспензии или суспензии, предназначенной для введения пациенту путем инъекции, составляет от около 280 мосмоль/кг до около 380 мосмоль/кг, предпочтительно от около 290 мосмоль/кг до около 330 мосмоль/кг;
- гематокрит готовой к использованию суспензии эритроцитов или суспензии, которую можно вводить пациенту путем инъекции, составляет 40% или более;
- все процедуры промывания и этап инкубации проводятся с использованием консервирующего раствора;
- раствор для промывания на этапе (b) и/или раствор для промывания на этапе (е), и консервирующий раствор имеют одинаковый состав и содержат одно или более соединений, способствующих сохранению эритроцитов;
- консервирующий раствор (и растворы для промывания или инкубации, когда их применяют) является водным раствором, содержащим хлорид натрия, аденин и по меньшей мере одно соединение из следующих: глюкоза, декстроза и маннит;
- консервирующий раствор (и растворы для промывания или инкубации, когда их применяют) содержит хлорид натрия, аденин и декстрозу, предпочтительна среда AS3;
- консервирующий раствор (и растворы для промывания или инкубации, когда их применяют) содержит хлорид натрия, аденин, глюкозу и маннит, предпочтительна среда SAG-M или ADsol.
Данное изобретение состоит, можно также сказать, в способе получения стабилизированной суспензии эритроцитов с инкапсулированным активным ингредиентом, включающем, в частности, следующие этапы:
(а) инкапсулирование активного ингредиента внутрь эритроцитов, включающее контактирование эритроцитов с гипотонической средой (что обеспечивает открывание пор в клеточной мембране), контактирование с активным ингредиентом (в результате чего он проникает в эритроциты), восстановление закрытого состояния пор в клеточной мембране эритроцитов с помощью изотонической или гипертонической среды; сбор суспензии или осадка эритроцитов, включающих какое-то количество так называемых хрупких эритроцитов, а именно таких, которые, будучи суспендированы в консервирующем растворе, склонны претерпевать лизис, когда суспензия находится при температуре от 2°C до 8°C, в частности спустя 1-72 часа,
(b-с) промывание и инкубация эритроцитов, полученных на этапе (а), в таком растворе и при таких условиях, что это ведет к лизису хрупких эритроцитов или большинства из них, в частности более 50, 60, 70, 80 или 90%,
(d) удаление жидкой среды из суспензии, инкубированной на предыдущем этапе,
(e) суспендирование эритроцитов, полученных на этапе (d), в растворе, позволяющем ввести эту суспензию пациенту путем инъекции, предпочтительно в консервирующем растворе, позволяющем ввести указанную суспензию пациенту.
Этап (b) отличается тем, что он включает получение или приготовление суспензии или осадка, содержащих эритроциты, заключающие в себе активный ингредиент, и раствор с осмоляльностью не менее 280 мосмоль/кг, в частности от около 280 мосмоль/кг до около 380 мосмоль/кг, предпочтительно от около 290 мосмоль/кг до около 330 мосмоль/кг.
Этап (с) отличается тем, что он включает инкубацию осадка или суспензии, полученных на этапе (b), в том виде, в каком они получены, или после добавления раствора для инкубации с осмоляльностью не менее 280 мосмоль/кг, в частности от около 280 мосмоль/кг до около 380 мосмоль/кг, предпочтительно от около 290 мосмоль/кг до около 330 мосмоль/кг, в течение промежутка времени продолжительностью 30 минут или более, в частности 1 часа или более.
Этап (d) отличается тем, что он включает промывание, в частности два-три цикла промывания, эритроцитов, полученных на этапе (с), для удаления обломков клеток и внеклеточного гемоглобина.
Этот способ порождает два его воплощения и их различные варианты и признаки, описанные в настоящем документе.
Способ по изобретению, в частности, включает следующие этапы:
(а) инкапсулирование активного ингредиента внутрь эритроцитов, включающее контактирование эритроцитов с гипотонической средой для открывания пор в клеточной мембране эритроцитов, контактирование эритроцитов с активным ингредиентом для его проникновения в эритроциты, восстановление закрытого состояния пор в клеточной мембране эритроцитов с помощью изотонической или гипертонической среды. Следует отметить, что активный ингредиент может присутствовать в суспензии эритроцитов до их лизиса или же его можно добавлять в ходе лизиса либо после него, но непременно до восстановления закрытого состояния пор в клеточной мембране эритроцитов.
В одном из воплощений этапа (а) он включает следующие подэтапы:
(a1) получение суспензии эритроцитов с гематокритом не менее чем 60 или 65%,
(а2) определение осмотической хрупкости эритроцитов в этой суспензии,
(а3) манипуляции для осуществления лизиса и для включения активного ингредиента внутрь эритроцитов, в том числе пропускание суспензии эритроцитов через устройство для диализа, в частности диализную трубку, в противотоке с раствором для лизиса, подбирая скорость потока суспензии эритроцитов или раствора для лизиса, или осмолярность раствора для лизиса в зависимости от осмотической хрупкости эритроцитов, определенной на этапе (а2),
(а4) манипуляции для восстановления закрытого состояния пор в клеточной мембране эритроцитов.
В этом воплощении этапа (а) этап (a1) включает промывание/центрифугирование осадка клеток и суспендирование промытых эритроцитов в забуференном физиологическом растворе при гематокрите не менее чем 60% или 65%.
На этапах (a1) и (а3) поддерживается температура предпочтительно от 2°C до 8°C, и используемые продукты имеют температуру предпочтительно от 2°C до 8°C.
Процедура восстановления закрытого состояния пор в клеточной мембране эритроцитов осуществляется предпочтительно с использованием гипертонического раствора при температуре предпочтительно от 30°C до 40°C, в частности около 37°C.
После восстановления закрытого состояния мембранных пор эритроциты отделяют от среды, в которой эта процедура осуществлялась, путем предпочтительно центрифугирования. После центрифугирования собирают осадок эритроцитов в центрифужную пробирку или иную емкость. Согласно предпочтительному признаку данного изобретения собранный материал - это вся или практически вся фракция, которая должна содержать эритроциты, что увеличивает конечный выход клеток после процедуры удаления хрупких эритроцитов.
В одном из воплощений изобретения активным ингредиентом является L-аспарагиназа. Другие воплощения изобретения предполагают включение в эритроциты, предпочтительно инкапсулирование, активного ингредиента, выбираемого из следующих: инозитолгексафосфат, аргининдеиминаза, фактор VIII, фактор IX, алглюкозидаза, бета-глюкозидаза, бисфосфонаты (особенно 2-го и 3-го поколений), уриказа, тимидинфосфорилаза, аденозиндеиминаза и др.
Между этапами (а) и (b) или после этапа (с) или (d) эритроциты можно подвергать дополнительной обработке для модификации их поверхности или для придания ей нужных функциональных свойств путем включения в клеточную мембрану или присоединения к ней агентов, соответствующим образом изменяющих свойства поверхности клеток. В одном из вариантов эта обработка проводится после инкубации, в частности после этапа инкубации или после промывания, следующего за инкубацией. Эта обработка может состоять в одной из следующих процедур:
- химическое воздействие с использованием агентов, изменяющих поверхность эритроцитов, в частности агентов, образующих мостики или поперечные сшивки, например бис(сульфосукцинимидил)суберата (BS3), глутарового альдегида и нейраминидазы (денатурирующих агентов);
- тепловое воздействие, проводимое, например, в следующих условиях: нагревание эритроцитов в течение от около 15 минут до около 90 минут, предпочтительно от около 25 минут до около 50 минут при температуре от около 42°C до около 55°C, предпочтительно от около 47°C до около 51°C;
- образование иммунных комплексов с антителами, предпочтительно подтипа IgG, например с антителами к резус-фактору, антителами к гликофорину А и антителами к рецептору комплемента типа 1 (CR1).
Другим объектом изобретения является применение этапа инкубации суспензии эритроцитов, заключающих в себе активный ингредиент, с последующим удалением инкубационной среды предпочтительно путем промывания для стабилизации эритроцитов или суспензии эритроцитов. Предпочтительно это применение включает также дополнительный этап суспендирования эритроцитов в консервирующем растворе. К этому объекту данного изобретения применимы упомянутые выше различные более конкретные отличительные признаки.
В частности, по одному из отличительных признаков этот этап инкубации включает инкубацию суспензии или осадка, содержащих эритроциты с восстановленным закрытым состоянием мембранных пор, заключающие в себе активный ингредиент, и раствор с осмоляльностью не менее 280 мосмоль/кг, в частности от около 280 мосмоль/кг до около 380 мосмоль/кг, предпочтительно от около 290 мосмоль/кг до около 330 мосмоль/кг, в течение промежутка времени продолжительностью 30 минут или более, в частности 1 часа или более.
Более конкретно, этот этап инкубации по изобретению может включать один или более из следующих признаков:
- этап инкубации проводится при температуре от около 2°C до около 39°С в течение промежутка времени, достаточного для лизиса хрупких эритроцитов;
- этап инкубации проводится при низкой температуре, в частности от около 2°С до около 10°С, конкретнее от около 2°С до около 8°С, и продолжается от около 1 ч до около 72 ч, в частности от около 6 ч до около 48 ч, предпочтительно от 19 ч до около 30 ч;
- этап инкубации проводится при более высокой температуре от около 20°С до около 39°С, в частности при температуре окружающей среды (25°С+/-5°С), и продолжается от около 30 мин до около 10 ч, в частности от около 1 ч до около 6 ч, предпочтительно от около 2 ч до около 4 ч; возможно его проведение при температуре выше температуры окружающей среды, но это может отрицательно повлиять на выход клеток, Р50 и/или содержание 2,3-DPG;
- на этапе инкубации суспензия эритроцитов характеризуется гематокритом от 10% до 85%, в частности от 40% до 80%; можно инкубировать осадок, полученный при отделении клеток и характеризующийся гематокритом, например, от 70% до около 85%, или разбавленный осадок, характеризующийся гематокритом от около 40% до около 70%;
- этап инкубации включает перемешивание суспензии эритроцитов;
- этап инкубации не включает перемешивание;
Другим объектом изобретения является стабилизированная суспензия эритроцитов с инкапсулированным активным ингредиентом, которую можно получить путем практического осуществления способа по данному изобретению.
В частности, суспензия в консервирующем растворе характеризуется концентрацией внеклеточного гемоглобина, остающейся на уровне 0,5 г/дл или меньше, в частности 0,3 г/дл или меньше, конкретнее 0,2 г/дл или меньше, предпочтительно 0,15 г/дл или меньше, более предпочтительно 0,1 г/дл или меньше после хранения в течение 72 ч при температуре от 2°С до 8°С.
В частности, суспензия в консервирующем растворе характеризуется концентрацией внеклеточного гемоглобина, остающейся на уровне 0,5 г/дл или меньше, в частности 0,3 г/дл или меньше, конкретнее 0,2 г/дл или меньше, предпочтительно 0,15 г/дл или меньше, более предпочтительно 0,1 г/дл или меньше в течение промежутка времени от 24 ч до 20 сут, в частности, от 24 ч до 72 ч при хранении при температуре от 2°С до 8°C.
Уровень внеклеточного гемоглобина измеряют предпочтительно стандартным ручным методом, описанным в работе G.B. Blakne, A.J. Dinwoodie, Clin. Biochem. 8, 96-102, 1975. Для таких измерений существует и автоматическое оборудование, различные варианты которого обладают разной чувствительностью. Тем не менее, в примерах осуществления данного изобретения с использованием трех различных методов измерения показано, что, применяя способ по изобретению, можно получить согласующиеся данные или что три упомянутых метода можно использовать для контроля.
В частности, суспензия в консервирующем растворе характеризуется скоростью гемолиза, остающейся на уровне 2% или меньше, в частности 1,5% или меньше, предпочтительно 1% или меньше после хранения в течение 72 ч при температуре от 2°C до 8°C.
В частности, суспензия в консервирующем растворе характеризуется степенью гемолиза, остающейся на уровне 2% или меньше, в частности 1,5% или меньше, предпочтительно 1% или меньше в течение промежутка времени от 24 ч до 20 сут, в частности от 24 ч до 72 ч при хранении при температуре от 2°С до 8°C.
В частности, гематокрит суспензии составляет 40% или выше.
В одном из воплощений данного изобретения активным ингредиентом является L-аспарагиназа. Другие воплощения данного изобретения включают введение в эритроциты, предпочтительно инкапсулирование, активного ингредиента, выбираемого из следующих: инозитолгексафосфат, аргининдеиминаза, фактор VIII, фактор IX, алглюкозидаза, бета-глюкозидаза, бисфосфонаты (особенно 2-го и 3-го поколений), уриказа, тимидинфосфорилаза, аденозиндеиминаза и др.
Предпочтительно суспензия эритроцитов в консервирующем растворе по данному изобретению является готовой к использованию, причем характеризуется низким уровнем внеклеточного гемоглобина, согласующимся, в частности, с рекомендациями FDA.
Другим объектом изобретения является способ терапевтического воздействия, состоящий во введении пациенту путем инъекции суспензии эритроцитов с инкапсулированным активным ингредиентом.
В первом воплощении этого способа пациенту вводят путем инъекции суспензию эритроцитов, заключающих в себе активный ингредиент, полученную за 1-72 часа, в частности за 10-72 часа до указанного введения. У этой суспензии гематокрит составляет 40% или более. Клетки суспендированы в консервирующем растворе. Уровень внеклеточного гемоглобина составляет 0,5 г/дл или меньше, в частности 0,3 г/дл или меньше, конкретнее 0,2 г/дл или меньше, предпочтительно 0,15 г/дл или меньше, более предпочтительно 0,1 г/дл или меньше и/или степень гемолиза составляет 2% или меньше, в частности 1,5% или меньше, предпочтительно 1% или меньше. Перед введением пациенту указанную суспензию не подвергают промыванию или аналогичным процедурам.
В другом воплощении изобретения способ включает этап получения осадка клеток, суспендирования его в забуференном физиологическом растворе с гематокритом 60% или 65%) или более, инкапсулирования в эти эритроциты активного ингредиента путем лизиса с последующим восстановлением закрытого состояния мембранных пор, инкубации полученных эритроцитов, их промывания и сбора конечной суспензии эритроцитов. Гематокрит получаемой суспензии составляет 40% или более. Клетки в ней находятся в консервирующем растворе. Полученную суспензию хранят при температуре от 2°C до 8°C. Эту конечную суспензию вводят путем инъекции пациенту через 1-72 часа, предпочтительно через 24-72 часа после ее получения. В указанной суспензии уровень внеклеточного гемоглобина составляет 0,5 г/дл или меньше, в частности 0,3 г/дл или меньше, конкретнее 0,2 г/дл или меньше, предпочтительно 0,15 г/дл или меньше, более предпочтительно 0,1 г/дл или меньше и/или степень гемолиза составляет 2% или меньше, в частности 1,5% или меньше, предпочтительно 1% или меньше. Перед введением пациенту суспензию не подвергают промыванию или аналогичным процедурам.
Этот способ включает следующие этапы:
(a1) получение суспензии эритроцитов с гематокритом 60% или 65%, или более;
(а2) определение осмотической хрупкости эритроцитов в суспензии,
(а3) лизис и заключение активного ингредиента внутрь эритроцитов, включающие пропускание суспензии эритроцитов через диализную трубку в противотоке с раствором для лизиса, подбирая скорость потока суспензии эритроцитов или раствора для лизиса, или осмолярность раствора для лизиса в зависимости от осмотической хрупкости эритроцитов, определенной на этапе (а2),
(а4) восстановление закрытого состояния пор в клеточной мембране эритроцитов.
(b) при необходимости по меньшей мере один цикл промывания путем разведения полученной суспензии или осадка эритроцитов, полученных на этапе (а4), соответствующим раствором, сбор осадка или суспензии эритроцитов в растворе для промывания;
(b) инкубация осадка или суспензии, полученных на этапе (а4) или (b) в том виде, в котором они были получены, или после добавления раствора для инкубации;
(d) удаление жидкой среды из суспензии, инкубированной на этапе (с);
(e) суспендирование эритроцитов, полученных на этапе (d), в растворе, позволяющем ввести эту суспензию пациенту путем инъекции, в частности в консервирующем растворе.
В одном из воплощений этого способа в эритроциты заключают L-аспарагиназу. Активным ингредиентом, заключаемым в эритроциты, может служить также один из других активных ингредиентов, упомянутых выше (не ограничиваясь перечисленным там).
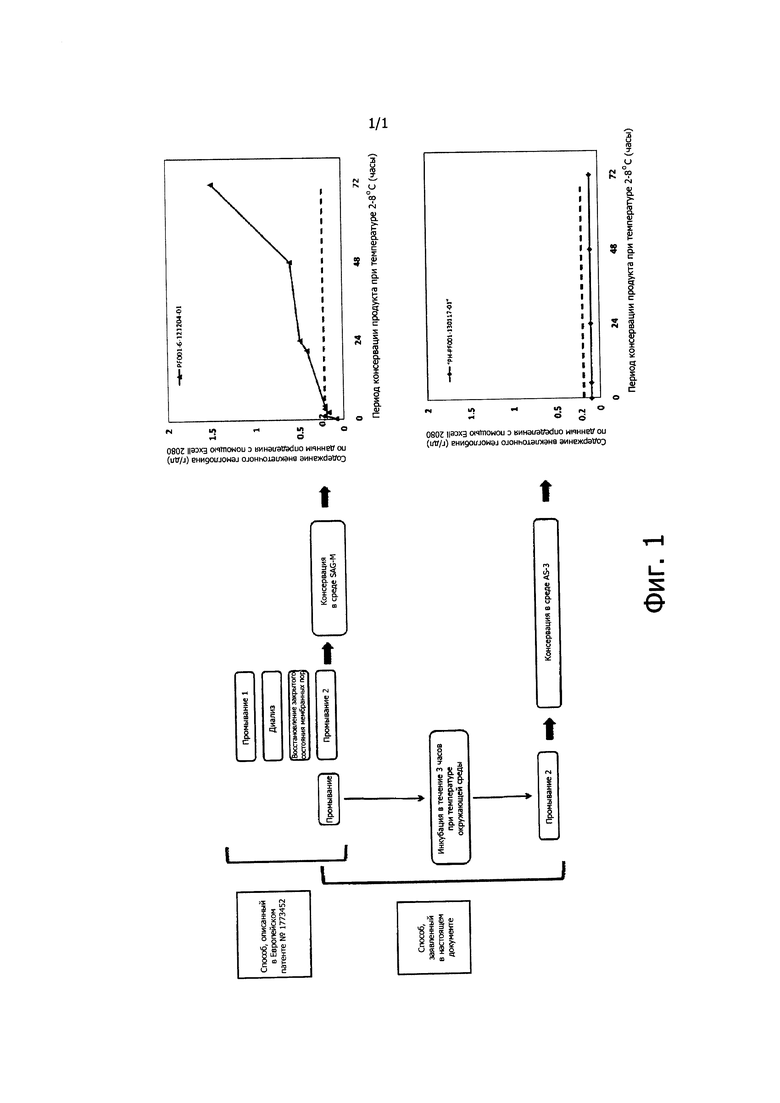
Ниже данное изобретение описывается подробнее с помощью его воплощений, взятых в качестве примеров, не имеющих ограничительного характера, и фигуры, иллюстрирующей способ, описанный в ЕР 1773452, и способ по данному изобретению и представляющей полученные при применении этих способов результаты определения внеклеточного гемоглобина через 72 часа.
Пример 1. Инкубация эритроцитов в растворе хлорида натрия с глюкозой при температуре окружающей среды в течение различных промежутков времени
Осадок человеческих эритроцитов обрабатывали в присутствие либо в отсутствие активного ингредиента (L-аспарагиназы) так, как описано в ЕР 1773452, до завершения восстановления закрытого состояния мембранных пор, и суспензию эритроцитов помещали в мешочек для сбора крови. Для промывания мешочек с кровью помещали в клеточный сепаратор центрифужного типа Cobe 2991. Предварительно суспензию разводили 0,9%-ным раствором хлорида натрия, содержавшим 0,2% глюкозы, затем переносили в мешок для центрифугирования. Суспензию эритроцитов центрифугировали при 3000 об/мин в течение 2 минут. Супернатант сливали в мешок для отходов со скоростью вытекания 350 мл/мин. Процедуру разбавления/центрифугирования повторяли еще два раза; этим заканчивался цикл промывания. Мешок для центрифугирования, содержащий эритроциты с гематокритом 80% оставляли при температуре окружающей среды (24±5°C) в аппарате Cobe 2991 на 30 мин, 1 час или 3 часа. После инкубации вновь проделывали цикл промывания. Затем эритроциты суспендировали в 100 мл консервирующего раствора AS-3 (Caridian ВСТ) и хранили при температуре 5±3°C. Определяли стабильность продукта путем измерения внеклеточного гемоглобина в день получения продукта (D0), через 24 часа (D1), через 48 часов (D2) и т.д. Для измерения внеклеточного гемоглобина применяли два метода: с помощью автоматического анализатора (использовали аппаратуру Cell Dyn Ruby при длине волны 555 нм, линейная область определения концентрации гемоглобина в диапазоне 0,0-25,0 г/дл ± 0.3, отклонение от линейности <2,0%, для определения следовых количеств гемоглобина использовали функцию снижения уровня фонового шума, чувствительность определения ±0,2 г/дл; либо Excell 2280 при длине волны 540 нм, линейная область определения концентрации гемоглобина в диапазоне 1,5-30,0 г/дл ± 0,1, отклонение от линейности 1%) или же применяли спектрофотометрию в видимой области (при длине волны 577 нм), как описано в работе G.B. Blakney, A.J. Dinwoodie, Clin. Biochem. 8, 96-102, 1975, включенной в настоящий документ путем отсылки. В описанных здесь примерах автоматические анализаторы использовали согласно рекомендациям производителя. Полученные результаты представлены ниже (табл.1-3).
1.1. Определение внеклеточного гемоглобина (в г/дл) с помощью автоматического анализатора Cell Dyn Ruby в четырех суспензиях эритроцитов с инкапсулированной L-аспарагиназой.
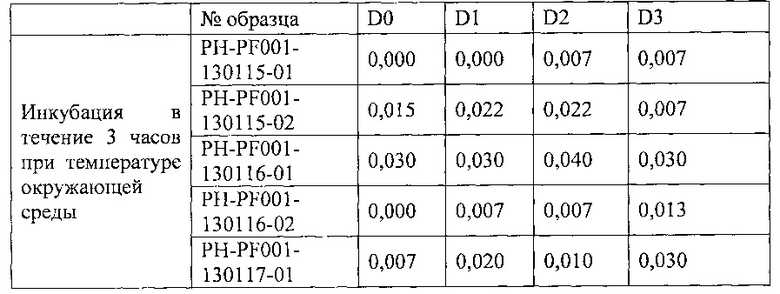
1.2. Определение внеклеточного гемоглобина (в г/дл) путем спектрофотометрии в трех суспензиях эритроцитов с инкапсулированной L-аспарагиназой (ERY-ASP-121217-CG) или не содержащих ее (ERY-121210-MA и ERY-121217-Q)
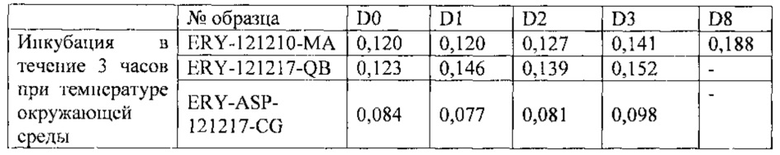
1.3. Определение внеклеточного гемоглобина (в г/дл) с помощью автоматического анализатора Excel 2280 в двух суспензиях эритроцитов, из которых в одной клетки несли инкапсулированную L-аспарагиназу, а во второй клетки не содержали активного ингредиента.

Описанный в этом примере способ, включающий этап инкубации эритроцитов в растворе хлорида натрия с глюкозой (время инкубации варьирует от 30 мин до 3 ч), обеспечивает получение стабильного продукта, характеризующегося уровнем внеклеточного гемоглобина менее 0,2 г/дл через 72 часа после его получения (D3) и даже дольше - до восьми суток после получения (D8). Эти результаты подтверждаются определением внеклеточного гемоглобина тремя разными методами.
Пример 2. Изменения уровня внеклеточного гемоглобина в ходе инкубации при температуре окружающей среды
Осадок эритроцитов обрабатывали, как описано в примере; он не содержал активного ингредиента. В ходе его инкубации при температуре окружающей среды брали аликвоты, центрифугировали их при 1000 g в течение 10 мин при температуре 4°C. Собирали супернатант и определяли уровень внеклеточного гемоглобина путем спектрофотометрии в видимой области спектра (при 577 нм). Полученные результаты представлены ниже (см. таблицу).
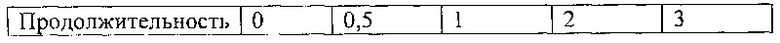
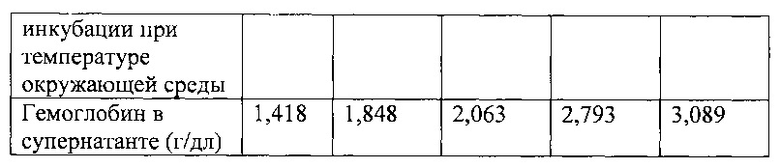
Полученные результаты показывают, что гемолиз эритроцитов оставался неизменным в течение 3 часов инкубации в растворе хлорида натрия с глюкозой при температуре окружающей среды. Таким образом, этап инкубации существенно способствует удалению наиболее хрупких эритроцитов и, следовательно, совершенно необходим в способе по данному изобретению для получения стабильного конечного продукта. Продолжительность инкубации можно, тем не менее, уменьшить до 30 мин, как показано в примере 1. Хрупкие не гемолизированные эритроциты в ходе этапа инкубации теряют прочность и во время окончательного промывания лопаются.
Пример 3. Инкубация эритроцитов в консервирующем растворе (AS-3 или SAG-M) при температуре 5±3°C в течение 24 часов
Осадок человеческих эритроцитов обрабатывали, как описано в ЕР 1773452, до завершения восстановления закрытого состояния мембранных пор, и включали в них L-аспарагиназу. Мешочек с эритроцитами помещали в клеточный сепаратор центрифужного типа Cobe 2991. Предварительно суспензию разводили 0,9%-ным раствором хлорида натрия, содержавшим 0,2% глюкозы, затем переносили в мешок для центрифугирования. Суспензию эритроцитов центрифугировали при 3000 об/мин в течение 2 минут. Супернатант сливали в мешок для отходов со скоростью вытекания 350 мл/мин. Процедуру разбавления/центрифугирования повторяли еще два раза; этим заканчивался цикл промывания. Суспензию эритроцитов с гематокритом 80% суспендировали в 100 мл консервирующего раствора AS-3 или 80 мл раствора SAG-M. Затем мешки с эритроцитами (гематокрит ~50%) держали 24 часа при температуре 5±3°C, после чего промывали и вновь суспендировали в 100 мл консервирующего раствора AS-3 (Caridian ВСТ). Конечный продукт хранили при температуре 2-8°C. Определяли стабильность продукта путем измерения уровня внеклеточного гемоглобина в день получения продукта (D0), через 24 часа (D1), через 48 часов (D2) и т.д. Для определения внеклеточного гемоглобина применяли спектрофотометрию в видимой области (при длине волны 577 нм). Полученные результаты представлены ниже (см. таблицу).
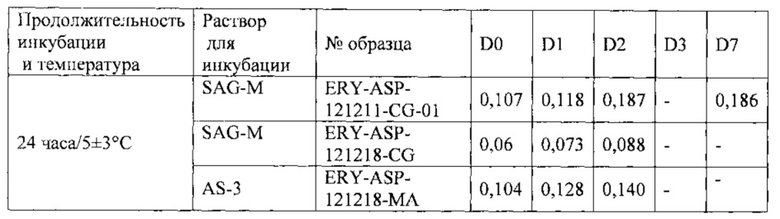
Инкубация эритроцитов в растворах AS-3 и SAG-M дала сходные результаты. Испытанные продукты демонстрировали очень хорошую стабильность в течение по меньшей мере 48 часов, причем уровень внеклеточного гемоглобина был ниже 0,2 г/дл. То же можно ожидать на седьмые сутки (D7), как для образца ERY-ASP-121211-CG-01.
Пример 4. Улучшение выхода клеток
Заявленный в настоящем документе способ позволяет улучшит стабильность продукта, как показывает Пример 1. Однако выход клеток при этом меняется отрицательно (~55% по сравнению с ~65% для способа, описанного в ЕР 1773452). Чтобы выход клеток стал лучше при сохранении хорошей стабильности продукта, в двух циклах промывания согласно заявленному способу был изменен один из параметров. Вкратце, образцы получали в условиях по Примеру 1 за тем исключением, что в ходе центрифугирования суспензии эритроцитов скорость вытекания супернатанта установили 100 мл/мин вместо 350 мл/мин. Благодаря этому детектор клеток успевал определить границу между супернатантом и собственно клетками. В мешок для отходов уходило меньше эритроцитов, и выход клеток увеличился. Средний выход клеток по способу, описанному в примере 4, составлял 73% по сравнению с 54% для способа по примеру 1. Стабильность продукта по существу не изменялась (см. таблицу).
Определение внеклеточного гемоглобина (в г/дл) путем спектрофотометрии (Excell 2280) и выход клеток (в %)

Пример 5. Снижение уровня внеклеточного гемоглобина после оптимизации способа получения эритроцитов
На фиг. 1 сравниваются уровни внеклеточного гемоглобина в продуктах, полученных способом, описанным в ЕР 1773452, и способом по Примеру 1 настоящего документа. Содержание внеклеточного гемоглобина, определенное после хранения в течение 72 часов, значительно меньше: в первом случае оно составляет 1,5 г/дл, а во втором менее 0,2 г/дл (после оптимизации), то есть предлагаемый способ позволяет снизить уровень внеклеточного гемоглобина в конечном продукте более чем в 7 раз.
Изобретение относится к способу стабилизации суспензий эритроцитов, заключающих в себе активный ингредиент. Способ для получения стабилизированной суспензии эритроцитов, несущих инкапсулированный активный ингредиент, из содержащих активный ингредиент эритроцитов с восстановленным закрытым состоянием мембранных пор включает инкубацию эритроцитов с восстановленным закрытым состоянием мембранных пор в растворе для инкубации с осмоляльностью не менее 280 мосмоль/кг в течение 30 мин или дольше, причем раствор для инкубации не содержит агентов, вызывающих денатурацию клеточной мембраны эритроцитов, а жидкую среду затем удаляют из инкубированной суспензии и полученные эритроциты суспендируют в растворе, подходящем для введения этой суспензии пациенту путем инъекции, и причем указанный раствор для инкубации не содержит агентов, образующих мостики или поперечные сшивки. 2 н. и 18 з.п. ф-лы, 1 ил., 6 табл., 4 пр.
1. Способ получения стабилизированной суспензии эритроцитов, заключающих в себе активный ингредиент, из содержащих активный ингредиент эритроцитов с восстановленным закрытым состоянием мембранных пор; этот способ включает инкубацию эритроцитов с восстановленным закрытым состоянием мембранных пор в растворе для инкубации с осмоляльностью не менее 280 мосмоль/кг в течение 30 минут или дольше, причем раствор для инкубации не содержит агентов, вызывающих денатурацию клеточной мембраны эритроцитов, а жидкая среда затем удаляется из инкубированной суспензии и полученные эритроциты суспендируют в растворе, подходящем для введения этой суспензии пациенту путем инъекции, и причем указанный раствор для инкубации не содержит агентов, образующих мостики или поперечные сшивки.
2. Способ по п. 1, включающий перед инкубацией введение активного ингредиента в эритроциты путем их лизиса с последующим восстановлением закрытого состояния мембранных пор и получение содержащих активный ингредиент эритроцитов с восстановленным закрытым состоянием мембранных пор.
3. Способ по п. 1, в котором инкубацию проводят при осмоляльности от 280 мосмоль/кг до 380 мосмоль/кг.
4. Способ по п. 1, в котором инкубацию проводят при осмоляльности предпочтительно от около 290 мосмоль/кг до около 330 мосмоль/кг.
5. Способ по любому из пп. 1-4, в котором инкубация длится 1 час или больше.
6. Способ по любому из пп. 1-4, дополнительно включающий промывание эритроцитов с восстановленным закрытым состоянием мембранных пор перед инкубацией.
7. Способ по п. 6, в котором промывание включает по меньшей мере один цикл промывания, включающий разбавление суспензии эритроцитов с восстановленным закрытым состоянием мембранных пор раствором с осмоляльностью не менее 280 мосмоль/кг или суспендирование в нем и затем разделение.
8. Способ по п. 7, в котором промывание включает два или три цикла промывания.
9. Способ по п. 1, включающий следующие этапы:
(a) введение активного ингредиента внутрь эритроцитов;
(b) получение суспензии или осадка, содержащих эритроциты, несущие в себе активный ингредиент, и раствор с осмоляльностью 280 мосмоль/кг или больше;
(c) инкубация осадка или суспензии, полученных на этапе (b), в том виде, в каком они получены, или же после добавления раствора для инкубации с осмоляльностью 280 осмоль/кг или больше в течение 30 минут или дольше;
(d) удаление жидкой среды из суспензии, инкубированной на этапе (c);
(e) суспендирование эритроцитов, полученных на этапе (d), в растворе, подходящем для введения путем инъекции этой суспензии пациенту, предпочтительно в консервирующем растворе, подходящем для введения путем инъекции полученной суспензии пациенту.
10. Способ по п. 9, в котором этап (b) включает по меньшей мере один цикл промывания путем разбавления суспензии или осадка эритроцитов, полученных на этапе (а), раствором с осмоляльностью 280 мосмоль/кг или больше и затем получение осадка или суспензии эритроцитов.
11. Способ по любому из пп. 9-10, в котором на этапе (d) осуществляется разделение либо разбавление перед разделением.
12. Способ по любому из пп. 1-4, 9 и 10, в котором этап инкубации проводится при температуре от около 2°C до около 39°C.
13. Способ по любому из пунктов 1-4, 9 и 10, в котором:
- этап инкубации проводится при низкой температуре от около 2°C до около 10°C и продолжается от около 1 ч до около 72 ч; или
- этап инкубации проводится при температуре от около 20°C до около 39°C и продолжается от около 30 мин до около 1 ч.
14. Способ по любому из пп 1-4, 9 и 10, включающий получение стабилизированной суспензии эритроцитов, в которой содержание внеклеточного гемоглобина сохраняется на уровне 0,5 г/дл или меньше, в частности 0,3 г/дл или меньше, конкретнее 0,2 г/дл или меньше, предпочтительно 0,15 г/дл или меньше, более предпочтительно 0,1 г/дл или меньше и/или степень гемолиза остается на уровне 2% или меньше, в частности 1,5% или меньше, предпочтительно 1% или меньше в течение 72 часов после суспендирования эритроцитов в консервирующем растворе и при температуре от около 2°C до около 8°C.
15. Способ по любому из пп. 1-4, 9 и 10, включающий получение стабилизированной суспензии эритроцитов, в которой содержание внеклеточного гемоглобина сохраняется на уровне 0,5 г/дл или меньше, в частности 0,3 г/дл или меньше, конкретнее 0,2 г/дл или меньше, предпочтительно 0,15 г/дл или меньше, более предпочтительно 0,1 г/дл или меньше и/или степень гемолиза остается на уровне 2% или меньше, в частности 1,5% или меньше, предпочтительно 1% или меньше в течение промежутка времени от 24 часов до 20 суток, в частности от 24 ч до 72 ч, после суспендирования эритроцитов в консервирующем растворе и при температуре от около 2°C до около 8°C.
16. Способ по любому из пп. 1-4, 9 и 10, в котором активный ингредиент выбирают из следующих: L-аспарагиназа, инозитолгексафосфат, аргининдеиминаза, фактор VIII, фактор IX, алглюкозидаза, бета-глюкозидаза, бисфосфонаты (в частности, 2-го и 3-го поколений), уриказа, тимидинфосфорилаза, аденозиндеиминаза.
17. Стабилизированная суспензия эритроцитов, заключающих в себе активный ингредиент, которую можно получить путем применения способа по любому из пп. 1-16.
18. Суспензия по п. 17, отличающаяся тем, что содержание внеклеточного гемоглобина сохраняется на уровне 0,5 г/дл или меньше, в частности 0,3 г/дл или меньше, конкретнее 0,2 г/дл или меньше, предпочтительно 0,15 г/дл или меньше, более предпочтительно 0,1 г/дл или меньше, и/или степень гемолиза остается на уровне 2% или меньше, в частности 1,5% или меньше, предпочтительно 1% или меньше в течение 72 часов после суспендирования эритроцитов в консервирующем растворе и при температуре от около 2°C до около 8°C.
19. Суспензия по п. 17, отличающаяся тем, что содержание внеклеточного гемоглобина сохраняется на уровне 0,5 г/дл или меньше, в частности 0,3 г/дл или меньше, конкретнее 0,2 г/дл или меньше, предпочтительно 0,15 г/дл или меньше, более предпочтительно 0,1 г/дл или меньше и/или степень гемолиза остается на уровне 2% или меньше, в частности 1,5% или меньше, предпочтительно 1% или меньше в течение промежутка времени от 24 часов до 20 суток, в частности от 24 ч до 72 ч, после суспендирования эритроцитов в консервирующем растворе и при температуре от около 2°C до около 8°C.
20. Суспензия по п. 17, в которой активный ингредиент выбирают из следующих: L-аспарагиназа, инозитолгексафосфат, аргининдеиминаза, фактор VIII, фактор IX, алглюкозидаза, бета-глюкозидаза, бисфосфонаты (в частности, 2-го и 3-го поколений), уриказа, тимидинфосфорилаза, аденозиндеиминаза.
| US 2011014171 A1, 20.01.2011 | |||
| US 4224313 A, 23.09.1980 | |||
| СПОСОБ ПОЛУЧЕНИЯ БИОМАГНОИММУНОСОРБЕНТА ДЛЯ ОБНАРУЖЕНИЯ БАКТЕРИАЛЬНЫХ АНТИГЕНОВ (ВАРИАНТЫ) | 2003 |
|
RU2271540C2 |
Авторы
Даты
2018-10-02—Публикация
2014-05-07—Подача