Настоящее изобретение относится к новому способу, в частности, ферментативному способу лечения рака у млекопитающего, включая человека, и к новому применению аспарагиназы и метиониназы в лечении рака. Ферментативные терапии предназначены для истощения опухолей и содействия, в частности, регуляции онкологических заболеваний.
Предшествующий уровень техники
Аспарагиназа гидролизует и истощает аспарагин - аминокислоту, незаменимую для продукции белков, необходимых для жизни клеток. При этом, в отличие от нормальных клеток, определенные раковые лимфобластные клетки не обладают способностью к продукции аспарагина, и зависят от внеклеточных источников для синтеза своих белков. Таким образом, фермент можно применять для лечения лейкозов (раков жидких тканей или иначе злокачественных заболеваний крови или иначе гемобластозов). Таким образом, L-аспарагиназу применяли в комбинированной химиотерапии для лечения острого лимфобластного лейкоза (ОЛЛ) в течение последних тридцати лет. ERY-ASP состоит из аспарагиназы, инкапсулированной в эритроцитах. Инкапсулирование позволяет L-аспарагиназе разрушать аспарагин внутри эритроцитов, предотвращая аллергические реакции и снижая другие нежелательные явления (WO 2006/016247, включенный в настоящей заявке посредством ссылки).
Метионин-γ-лиаза (МГЛ; EC № 4.4.1.11; CAS № 42616-25-1), также обозначенная как метиониназа, является пиридоксин-зависимым ферментом, участвующим в метаболизме L-метионина (Met), незаменимой серосодержащей протеиногенной аминокислоты. Потребность в метионине для раковых клеток была предположена в 1970-х: исследования установили, что замена метионина на его предшественник гомоцистеин в культуральной среде не оказывает влияния на нормальные клетки, например фибробласты, но приводит к существенному замедлению роста некоторых трансформированных или злокачественных клеток. В клетках рака простаты РС-3 противоопухолевый эффект истощения метионина был также усилен с применением аналога метионина, который резко замедлял пролиферацию раковых клеток in vitro и in vivo, и стимулировал апоптоз клеток. Дополнительные исследования показали, что ограничение экзогенного метионина в метионин-зависимых раковых клетках блокирует деление клеток в поздней S или G2 фазе клеточного цикла. Поскольку было установлено, что ограничение метионина является эффективным в лечении рака, был исследован терапевтический подход с применением фермента МГЛ из некоторых источников для деплеции метионина в микроокружении опухоли. Целью была разработка нового терапевтического решения на основе МГЛ, инкапсулированной в эритроциты, для системной деплеции метионина у пациентов с метионин-зависимыми видами рака (WO 2015/121348, включенный в настоящей заявке посредством ссылки).
Изложение сущности изобретения
Однако все еще имеется потребность в новых или дополнительных терапевтических решениях в лечении рака.
Эффект лекарственной комбинации по своей природе является непредсказуемым. Часто у одного лекарства имеется склонность к частичному или полному ингибированию эффектов другого лекарства. Были проведены исследования in vitro для оценки цитотоксических эффектов ферментов, составляющих ERY-ASP и ERY-MET, L-аспарагиназы и МГЛ, по отдельности или в комбинации, на избранной клеточной линии лейкоза человека (HL-60). Для каждого лекарства по отдельности определяли концентрацию, обеспечивающую 50% ингибирование жизнеспособности клеток (IC50). Затем проводили анализы для оценки полезных эффектов лечебной комбинации, где лекарства добавляли с некоторым интервалом, например, 72 часа, между применением L-аспарагиназы и МГЛ (в дозе IC50 для каждого фермента), в зависимости от порядка в комбинации.
Настоящее изобретение основано на неожиданном наблюдении, что клеточная гибель может быть повышена при добавлении МГЛ в дозе IC50 с последующим добавлением L-аспарагиназы в дозе IC50 спустя 3 суток. Обратный дизайн добавления ферментов не позволял добиться такого повышения клеточной гибели на модели гемобластоза in vitro, например, модели лейкоза. Этот значительный эффект был подтвержден на солидных опухолях, таких как опухоль желудка, где наблюдалось повышение клеточной гибели in vitro и снижение объема опухоли in vivo. Не углубляясь в теорию, можно предположить, что истощение метионина, индуцированное активностью МГЛ, может делать клетки более чувствительными к L-аспарагиназе, и что, вероятно, имеется связь с ролью каждого фермента, участвующего в регуляции клеточного цикла. Это наблюдение открывает путь к режимам лечения, включающим последовательное истощение метионина или лечение метиониназой, и истощение аспарагина или лечение аспарагиназой. Как будет понятно из следующего описания, изобретение может охватывать применение рациона и/или лекарства, оказывающее благоприятное влияние при раке. Таким образом, изобретение может комбинировать применение диеты и лекарства, в любой комбинации, где истощение метионина или лечение метиониназой предшествует истощению аспарагина или лечению аспарагиназой. Поскольку известно, что метиониназа также обладает цистеиназной активностью, а аспарагиназа обладает глутаминазной активностью, нельзя исключить, что цистеиназная активность, и соответственно, глутаминазная активность может быть включена в режим действия метиониназы, и соответственно, аспарагиназы.
Объектом изобретения является способ лечения рака у млекопитающего, нуждающегося в лечении, включающий истощение у млекопитающего метионина, с последующим истощением у млекопитающего аспарагина. Задачей является снижение количества метионина и аспарагина, доступного для раковых клеток. Как должно быть понятно из вышеизложенного, истощение метионина может быть осуществлено посредством истощения метионина в рационе и/или посредством введения метиониназы, в то время как истощение аспарагина может предпочтительно быть выполнено с введением аспарагиназы.
Истощение означает существенное снижение метионина или аспарагина для достижения благоприятных эффектов в лечении рака, где раковые клетки лишены значительных количеств аминокислоты.
Лечение ферментами означает, что фермент будет разрушать упомянутую аминокислоту, и по возможности индуцировать другие благоприятные эффекты, такие как ингибирование синтеза белка или аминокислоты, или любой механизм, который ведет к отсутствию достаточного количества аминокислоты в раковой клетке.
Объектом настоящего изобретения является фармацевтическая композиция для применения в лечении рака у млекопитающего, включающая аспарагиназу и метиониназу по меньшей мере для одного последовательного введения, где метиониназу вводят перед аспарагиназой. Поскольку аспарагиназа и метиониназа предназначены для введения по отдельности и последовательно, композиция может быть квалифицирована как набор или комплект, включающий отдельные составы или композиции для применения в соответствии с порядком и частотой из настоящего изобретения.
В контексте изобретения в его разных аспектах или объектах по меньшей мере одно последовательное введение означает, что одно и тоже млекопитающее может получать лечение последовательно более одного раза во время курса или фазы лечения. Однако одно или несколько введений метиониназы могут быть осуществлены до одного или нескольких введений аспарагиназы.
Другим объектом настоящего изобретения является применение аспарагиназы и метиониназы для приготовления фармацевтической композиции или фармацевтических композиций или набора или комплекта из фармацевтических композиций (где одна содержит метиониназу, а другая содержит аспарагиназу), где композиция(и) или набор предназначены для применения в лечении рака у млекопитающего по меньшей мере с одним последовательным введением метиониназы, а затем аспарагиназы.
Другими объектами изобретения являются:
- фармацевтическая композиция, включающая аспарагиназу для применения в лечении рака у млекопитающего, где композиция предназначена для введения млекопитающему, которому ввели метиониназу;
- фармацевтическая композиция, включающая аспарагиназу для применения в лечении рака у млекопитающего, где композиция предназначена для введения млекопитающему, которого подвергли диете с истощением метионина, т.е. оп получает питание, лишенное метионина, терапевтическое или нет; где терапевтическое питание в настоящем изобретении означает пищу, применяемую в медицинской среде и/или проходящую государственную регистрацию регуляторными органами, особенно жидкую пищу, которая может вводиться путем инфузии или другим путем;
- фармацевтическая композиция, включающая метиониназу для применения в лечении рака у млекопитающего, где композиция предназначена для введения млекопитающему, которому затем будут вводить аспарагиназу;
- пищевая композиция или рацион, терапевтический или не терапевтический, не содержащие метионина или по существу не содержащие метионина, для применения в деплеции у млекопитающего метионина, перед лечение млекопитающего аспарагиназой.
Другими объектами изобретения являются:
- применение аспарагиназы для приготовления фармацевтической композиции для применения в лечении рака у млекопитающего, где композиция предназначена для введения млекопитающему, которому ввели метиониназу;
- применение аспарагиназы для приготовления фармацевтической композиции для применения в лечении рака у млекопитающего, где композиция предназначена для введения млекопитающему, которого подвергли диете с истощением метионина, т.е. применяли рацион, лишенный метионина, терапевтически или не терапевтический;
- применение метиониназы для приготовления фармацевтической композиции для применения в лечении рака у млекопитающего, где композиция предназначена для введения млекопитающему, которому затем будет вводиться аспарагиназа.
Еще одним объектом изобретения является набор, содержащий фармацевтическую композицию, включающую метиониназу или терапевтическое питание или рацион для деплеции метионина, и фармацевтическую композицию, содержащую аспарагиназу, где композиции упакованы по отдельности. Композиции предназначены для последовательного введения, где метиониназа или питание/рацион вводятся до аспарагиназы. Набор может дополнительно содержать инструкцию, указывающую, что композиции предназначены для последовательного введения, при котором метиониназу или питание/рацион вводят перед аспарагиназой.
Еще одним объектом изобретения является способ лечения рака у млекопитающего, включающий введение млекопитающему вначале эффективного количества метиониназы, а затем эффективного количества аспарагиназы.
Еще одним объектом изобретения является способ лечения рака у млекопитающего, включающий введение млекопитающему вначале пищи или рациона, терапевтических или не терапевтических, для истощения метионина, а затем эффективного количества аспарагиназы.
Еще одним объектом изобретения является способ лечения рака у млекопитающего, имеющего низкий уровень биодоступного метионина, или принимавшего пищу или рацион, терапевтические или не терапевтические, истощенные по метионину, где способ включает введение млекопитающему эффективного количества аспарагиназы.
В этих различных объектах введение метиониназы и рациона с истощением метионина может быть комбинированным.
Изобретение может быть полезным при любом виде рака, включая гемобластозы, т.е. онкологические гематологические заболевания, и солидные виды рака.
Специфическим объектом изобретения является применение настоящего изобретения в лечении видов рака, ауксотрофных по аспарагину и/или метионину.
Специфическим объектом изобретения является применение настоящего изобретения в лечении видов рака, не ауксотрофных по аспарагину и/или метионину.
Изобретение можно применять для любого млекопитающего, и особенно человека, домашних животных, таких как собаки и кошки, и спортивных животных, таких как лошади.
Подробное описание изобретения
Специалист в данной области техники может понять из настоящего описания, что продолжительность лечения рационом или одним из лекарств, и интервал между истощением метионина и лечением аспарагиназой может варьировать, в зависимости от лечения, от ответа пациента и, что важно, от времени полужизни лекарства или эффекта диеты. Возможна разница в зависимости от лекарственной формы, используемой в изобретении, например, свободного фермента, пэгилированного фермента и эритроцитов, инкапсулирующих фермент, или также фермента, связанного с микрокапсулами (например, изготовленными из ПМК или ПЛГК) или липосомами, или инкапсулированного в этих структурах.
В предпочтительном варианте осуществления этих различных объектов интервал между окончанием введения метиониназы и началом введения аспарагиназы составляет примерно от 1 часа до 7 суток, в частности, примерно от 3 часов до 6 суток, предпочтительно примерно от 1 суток до 5 суток. Предпочтительно, в данном варианте осуществления метиониназа находится в свободной форме или в пэгилированной форме, а аспарагиназа может быть в любой из форм, описанных в настоящей заявке.
В другом варианте осуществления интервал между окончанием введения метиониназы и началом введения аспарагиназы составляет примерно от 1 часа до 30 суток, в частности, примерно от 1 суток до 20 суток, предпочтительно примерно от 1 суток до 10 суток. Предпочтительно, в данном варианте осуществления метиониназа является инкапсулированной, предпочтительно в эритроцитах, а аспарагиназа может быть в любой из форм, описанных в настоящей заявке.
В еще одном варианте осуществления интервал между окончанием ограничения метионина и началом введения аспарагиназы составляет примерно от 1 часа до 7 суток, в частности, примерно от 1 часа до 3 суток, предпочтительно примерно от 1 часа до 1 суток. Аспарагиназа может быть в любой из форм, описанных в настоящей заявке.
Композиции, включающие ферменты в свободной форме или пэгилированной форме, и тому подобные:
Эти композиции можно вводить млекопитающему с применением стандартных методик. Методики и композиции, как правило, можно найти в Remington's Pharmaceutical Sciences, 18.sup.th ed., Mack Publishing Co., Easton, Pa., 1990 (включенном посредством ссылки в настоящей заявке).
Фармацевтически пригодные носители и/или наполнители могут также быть включены в фармацевтическую композицию в соответствии с изобретением для облегчения введения конкретной метиониназы или аспарагиназы. Примеры носителей, пригодных для применения для осуществления изобретения, включают кальция карбонат, кальция фосфат, различные сахара, такие как лактоза, глюкоза, или сахароза, или типы крахмала, производные целлюлозы, желатин, растительные масла, полиэтиленгликоли, и физиологически совместимые растворители. Примеры физиологически совместимых растворителей включают стерильные растворы из воды для инъекций (ВДИ), солевой раствор и декстрозу.
Фармацевтические композиции в соответствии с изобретением могут быть введены различными путями, включая внутривенное, интраперитонеальное, подкожное, внутримышечное, пероральное, местное (трансдермальное) или трансмукозальное введение. Для системного введения предпочтительным является пероральное введение. Для перорального введения, например, соединения могут быть составлены в обычные пероральные лекарственные формы, такие как капсулы, таблетки и жидкие препараты, такие как сиропы, эликсиры и концентрированные капли.
Альтернативно, можно использовать инъекцию (парентеральное введение), например, внутримышечную, внутривенную, интраперитонеальную и подкожную инъекцию. Для инъекций фармацевтические композиции готовят в жидких растворах, предпочтительно в физиологически совместимых буферах или растворах, таких как солевой раствор, раствор Хэнкса или раствор Рингера. Кроме того, соединения могут быть приготовлены в твердой форме и повторно растворены или суспендированы непосредственно перед использованием. Например, можно использовать лиофилизированные формы метиониназы или аспарагиназы.
Системное введение также может быть осуществлено с помощью трансмукозальных или трансдермальных средств. Для трансмукозального или трансдермального введения в композиции используют пенетранты, соответствующие проницаемому барьеру. Такие пенетранты хорошо известны в данной области техники, и включают, например, для трансмукозального введения соли желчных кислот и производные фузидовой кислоты. Кроме того, для облегчения проникновения могут использоваться детергенты. Трансмукозальное введение, например, может быть осуществлено через спреи для носа, ингаляторы (для легочной доставки), ректальные суппозитории или вагинальные суппозитории. Для местного применения соединения могут быть приготовлены в виде мазей, бальзамов, гелей или кремов, как хорошо известно в данной области техники.
Изобретение охватывает также использование имплантируемых устройств или применение у млекопитающего для доставки фермента, например, путем инфузии или другим путем. В специальном варианте осуществления устройство содержит две камеры или ёмкости, где одна содержит метиониназу, а другая - аспарагиназу. Устройство для каждой камеры или ёмкости имеет трубку и тому подобное для доставки фермента в кровоток, электронный или электрический клапан или насос или управляемый поршень, который контролируется электронной схемой и подходящим программным обеспечением. Электронная схема и ее программное обеспечение контролируют доставку метиониназы сначала в течение заранее определенного периода времени, предпочтительно с определенной скоростью доставки, период задержки, а затем доставку аспарагиназы в течение заранее определенного периода времени, предпочтительно при определенной скорости доставки.
Композиции, включающие эритроциты (красные кровяные клетки или тельца), инкапсулирующие фермент:
В одном варианте осуществления аспарагиназа инкапсулирована внутри эритроцитов, и композиция содержит суспензию этих эритроцитов в фармацевтически приемлемом носителе или растворителе.
В одном варианте осуществления метиониназа инкапсулирована внутри эритроцитов, и композиция содержит суспензию этих эритроцитов в фармацевтически приемлемом носителе или растворителе.
В одном варианте осуществления аспарагиназа находится в свободной форме или в пэгилированной форме (ПЭГ-аспарагиназа) в фармацевтически приемлемом носителе или растворителе.
В одном варианте осуществления метиониназа находится в свободной форме или в пэгилированной форме (ПЭГ-метиониназа) в фармацевтически приемлемом носителе или растворителе.
В одном варианте осуществления метиониназу применяют в количестве примерно от 100 до 100 000 МЕ, в частности примерно от 500 до 50 000 МЕ, предпочтительно примерно от 500 до 5000 МЕ.
В одном варианте осуществления аспарагиназу применяют один раз в количестве примерно от 500 до 100 000 МЕ, в частности примерно от 1000 до 50 000 МЕ, предпочтительно примерно от 5000 до 30 000 МЕ.
В одном варианте осуществления композиция предназначена для использования для двух или более последовательных введений, особенно 2 или 3 введений.
В одном варианте осуществления аспарагиназу и метиониназу применяют последовательно в соответствии с изобретением, и оба этих фермента инкапсулируют в эритроциты.
В одном варианте осуществления аспарагиназу и метиониназу применяют последовательно в соответствии с изобретением, причем аспарагиназу инкапсулируют в эритроциты, а метиониназу используют в свободной форме или в пэгилированной форме.
В одном варианте осуществления аспарагиназу и метиониназу применяют последовательно в соответствии с изобретением, причем метиониназу инкапсулируют в эритроциты, а аспарагиназу используют в свободной форме или в пэгилированной форме.
«Инкапсулированный» означает, что фермент содержится внутри эритроцитов. Возможно, однако, что некоторое небольшое количество фермента сохраняется внутри стенки эритроцита.
Диетическое ограничение метионина:
Диетическое ограничение метионина было предложено либо в сочетании с терапией цистемустином при меланоме и глиоме (E. Thivat et al., Anticancer Research 2009, 29: 5235-5240), либо с FOLFOX в качестве терапии первой линии метастатического колоректального рака (X. Durando et al., Oncology 2010, 78: 205-209). Диета с ограничением метионина или лишенная метионина является режимом питания или кормлением млекопитающего пищевой композицией в течение времени, достаточного, чтобы вызвать полное или значительное уменьшение или элиминацию свободного метионина у млекопитающего.
Пища может предпочтительно представлять собой жидкую пищу, которую вводят парентеральным путем, особенно путем инфузии.
Кроме того, ограничение метионина с использованием метиониназы направлено на то, чтобы вызвать полное или значительное уменьшение или элиминацию свободного метионина у млекопитающего. Как правило, эту диету применяют для снижения уровня метионина от 30 до 100%, обычно от 30 до 60% по отношению к среднему уровню у млекопитающего. Ссылка может быть сделана на работы Thivat, 2009 и Durando, 2010.
Применение пищи может быть осуществлено в течение одного дня или более, например, от одного дня до семи дней.
В одном варианте осуществления питание объединяют с обработкой метиониназой, например, пищу применяют в течение всей или частичной продолжительности лечения метиониназой.
Метиониназа
Метиониназу также называют, среди прочего, L-метиониназой, метионин-гамма-лиазой МГЛ; это соединение имеет номер EC 4.4.1.11 и номер CAS 42616-25-1. Для указания источников метиониназы, которые могут быть использованы в соответствии с изобретением, можно отметить, в частности, публикацию El Sayed A, Applied Microbiol. Biotechnol. (2010) 86: 445-467.
Рекомбинантная метиониназа может быть произведена в бактерии Escherichia coli из гена, кодирующего фермент, например, из бактерии Pseudomonas putida. Полученный таким образом фермент, называемый рMETазой, можно использовать в свободной форме или в модифицированной форме, например, в пэгилированной форме (ПЭГ-рMETаза). См. X. Sun et al. Cancer Research 2003, 63: 8377-8383. Она также может быть инкапсулирована в эритроциты; композиция или суспензия преимущественно содержат количество эритроцитов и количество инкапсулированной метиониназы, которое является достаточным для доставки пациенту определенной дозы аспарагиназы.
Специалист в данной области техники может ознакомиться с WO 2015/121348 для композиций и способов их применения.
Композиция метиониназы может дополнительно содержать кофактор фермента, то есть пиридоксальфосфат, и/или его предшественник, который может быть нефосфатным предшественником, таким как нефосфатная форма витамина B6, и/или фосфатным предшественником, такими как пиридоксинфосфат (PNP).
Витамин B6 существует в разных формах, фосфатной или нефосфатной. Пиридоксинфосфат (PNP), пиридоксальфосфат (PLP) и пиридоксаминфосфат (PMP) представляют собой их фосфатные формы. Соответствующими нефосфатными формами являются пиридоксин (PN), пиридоксаль (PL) и пиридоксамин (PM). Нефосфатные формы витамина B6 могут пересекать мембрану эритроцитов, в то время как для фосфатных форм это пересечение затруднено. В соответствии с преобладающим путем, пиридоксин (PN) трансформируется внутри эритроцитов в PNP под действием PN-киназы, PNP затем трансформируется в PLP под действием PNP-оксидазы. Затем PLP может быть трансформирован в пиридоксаль (PL) под действием PLP-фосфатазы, и PL может покидать эритроциты. Легко понять, что обеспеченный предшественник способен претерпевать трансформации в эритроцитах во время способа получения или во время хранения композиции.
Под нефосфатной формой витамина B6 здесь подразумевается один из трех «витамеров» витамина B6 или смесь двух или трех витамеров: PL, PN и PM. PN форма является предпочтительной. Они также могут быть в форме соли.
Композиция может содержать PLP, инкапсулированный в эритроцитах. PLP может быть обеспечен во время процедуры инкапсуляции, или полностью или частично получен в эритроцитах из его предшественника. PLP, который присутствует или образуется, может быть связан с ферментом. Следовательно, композиция может содержать соответствующий холофермент, например метиониназу-PLP. В этих условиях период полужизни активного фермента, наблюдаемый, например, по продолжительности истощения в плазме его субстрата, значительно увеличивается. Композиция в соответствии с изобретением, в частности, дает возможность сохранять ферментативную активность в течение 24 часов после введения, особенно в течение 1, 5, 10 или 15 дней или больше.
Таким образом, в одном варианте осуществления композиция из метиониназы содержит пиридоксальфосфат (PLP) и/или нефосфатную форму витамина B6 и/или фосфатный предшественник, пиридоксинфосфат (PNP) и/или пиридоксаминфосфат (PMP).
В соответствии с признаком, PNP и/или PMP инкапсулируют внутри эритроцитов в композиции. Этот предшественник может быть совместно инкапсулирован с ферментом, или полностью или частично получен в эритроцитах из его собственного предшественника.
Композиция, в частности, содержит примерно от 0,05 до 600, в частности примерно от 0,5 до 100, предпочтительно примерно от 5 до 50 мкмоль PLP и/или PNP и/или PMP, инкапсулированных на литр (л) красных кровяных клеток (эритроцитов).
Согласно признаку, композиция содержит эритроциты, инкапсулирующие PLP фермент и PLP, а также нефосфатный предшественник PLP, инкапсулированный в эритроциты, присутствующие внутри эритроцитов или присутствующие внутри и снаружи эритроцитов. Этот нефосфатный предшественник может представлять собой PN, PL или PM, предпочтительно PN, или смесь двух или трех из этих соединений. Нефосфатный предшественник может присутствовать внутри и/или снаружи эритроцитов. Наличие этого нефосфатного предшественника дает возможность достичь значительно более высокого уровня внутри-эритроцитарного PLP, чем при отсутствии этого нефосфатного предшественника.
В одном варианте осуществления композиция содержит эритроциты, инкапсулирующие метиониназу и дополнительно PLP и один из его фосфатных предшественников, PNP, PLP и/или PMP. Эта же композиция может дополнительно содержать преимущественно нефосфатный предшественник, особенно PN, как это уже было описано.
Композиция или суспензия преимущественно содержит количество эритроцитов и количество инкапсулированной метиониназы, которое является достаточным для доставки пациенту определенной дозы метиониназы.
Таким образом, композиция может дополнительно содержать PLP или предшественник PLP для одновременного, раздельного или последовательного введения метиониназы. В одном варианте осуществления композиция включает метиониназу, инкапсулированную внутри эритроцитов, и нефосфатный предшественник PLP для раздельного или последовательного введения.
Согласно одному из вариантов осуществления, композиция включает (i) состав из эритроцитов и фармацевтически приемлемого растворителя, где эритроциты инкапсулируют метиониназу, и (ii) состав из витамина B6 в нефосфатной форме, предпочтительно PN, и фармацевтически приемлемого растворителя. Эти составы обеспечены для одновременного, раздельного или последовательного введения, и предназначены для истощения метионина в соответствии с изобретением. В представленном ниже способе использования будут подробно описаны наилучшие способы введения. Композиция может быть, в частности, в виде комплекса или набора, включающего отдельно эти составы. Согласно одному варианту осуществления, фармацевтически приемлемый растворитель в составе из эритроцитов представляет собой «консервирующий раствор» для эритроцитов, то есть раствор, в котором эритроциты, инкапсулирующие активный ингредиент, суспендированы в их подходящей форме для хранения в ожидании их инъекции. Консервирующий раствор предпочтительно содержит по меньшей мере один агент, способствующий сохранению эритроцитов, особенно выбранных из глюкозы, декстрозы, аденина и маннитола. По возможности, консервирующий раствор содержит неорганический фосфат, что позволяет ингибировать интра-эритроцитарный фермент PLP-фосфатазу.
В одном варианте осуществления метиониназа, инкапсулированная внутри эритроцитов, должна вводиться по меньшей мере один раз, предпочтительно по меньшей мере дважды, до введения аспарагиназы, инкапсулированной внутри эритроцитов, и после каждого введения метиониназы следует вводить раствор нефосфатного предшественника PLP перед применением аспарагиназы.
Активность МГЛ выражают в МЕ, что соответствует количеству МГЛ, необходимому для высвобождения одного микромоля аммония в минуту при следующих условиях.
В присутствии своего кофактора PLP МГЛ гидролизует L-метионин в альфа-кетомасляную кислоту, образуя одну молекулу аммония на молекулу L-метионина:
L-метионин + H2O  метантиол + NH4+ + альфа-кетомасляная кислота
метантиол + NH4+ + альфа-кетомасляная кислота
Величину активности МГЛ определяют при 37°С, рН = 8,6, в присутствии 0,26 мкг/мл МГЛ, 20 нМ PLP и 25 мМ L-метионина; при этом может использоваться коммерческий тест (например, набор NH3, Roche diagnostics).
Метод состоит в измерении кинетики продукции аммония между 5 мин и 10 мин реакции, когда достигается максимальная активность (Vmax) МГЛ. Измерение продукции аммония осуществляют путем определения изменения оптической плотности при 340 нм за счет окисления NADPH до NADP+ глутаматдегидрогеназой (GLDH) в присутствии аммония и альфа-кетоглутаровой кислоты следующим образом:
Альфа-кетоглутаровая кислота + NH4+ + NADPH  L-глутаминовая кислота + NADP+ + H2O.
L-глутаминовая кислота + NADP+ + H2O.
Аспарагиназа
Сама аспарагиназа обозначается номером CAS: 9015-68-3. Её обычное название - аспарагиназа; другие общие названия для неё: коласпаза, L-аспарагиназа и L-аспарагин-аминогидролаза.
Термин «аспарагиназа» в контексте настоящего изобретения охватывает аспарагиназу любого происхождения, она может, в частности, иметь природное или рекомбинантное происхождение, и любое производное, включающее аспарагиназу, такое как, например, пэгилированная или ПЭГ-форма (ПЭГ-аспарагиназа), или фрагмент, сохраняющий активность L-аспарагиназы. Он также охватывает аспарагиназу независимо от её бактериального происхождения. Таким образом, аспарагиназа может быть типа E. coli, в частности E. coli HAP-A-1-3, типа Erwinia chrysanthemi или типа Wolinella succinogenes. «Тип» означает, что она может быть получена из культуры рассматриваемой бактерии или что она может быть рекомбинантной, другими словами, формой аспарагиназы этой бактерии, полученной генной инженерией. В предпочтительном варианте осуществления она относится к типу E. coli HAP-A-1-3.
Коммерческими продуктами, доступными и пригодными для использования в настоящей заявке, являются: 5000 U Medac, 10000 U Medac®, Oncaspar®. Продукт находится в виде порошка, который должен быть солюбилизирован перед использованием в жидкости для инъекций или воде. Могут присутствовать вспомогательные вещества, такие как дигидрофосфат натрия 1H2O, моногидрофосфат натрия 7H2O и/или хлорид натрия.
Термин «аспарагиназа» также охватывает вещества, подобные аспарагиназе, которые в контексте изобретения представляют собой бактериальные ферменты, обладающие активностью L-аспарагин-аминогидролазы. В качестве примера можно привести глутаминазу-аспарагиназу акинетобактерий (AGA).
Согласно варианту осуществления изобретения, аспарагиназу инкапсулируют в эритроциты, и композиция или суспензия преимущественно содержит количество эритроцитов и количество инкапсулированной аспарагиназы, которое является достаточным для доставки пациенту определенной дозы аспарагиназы.
Одна МЕ аспарагиназы определяется как обычно, как количество фермента, необходимое для высвобождения 1 мкмоль аммиака в минуту при рН 7,3 и 37°С из L-аспарагина, причем количество L-аспарагиназы находится в избытке.
Инкапсулирование в эритроциты
Согласно одному варианту осуществления, композиция метиониназы и/или композиция аспарагиназы включает эритроциты, инкапсулирующие фермент, и фармацевтически приемлемый растворитель. Предпочтительно, эритроциты получены у млекопитающего того же вида, что и субъект, подвергаемый лечению. Когда млекопитающее является человеком, эритроциты предпочтительно имеют человеческое происхождение. В одном варианте осуществления эритроциты поступают от самого пациента.
Согласно одному из вариантов осуществления, фармацевтически приемлемый растворитель представляет собой «консервирующий раствор» для эритроцитов, то есть раствор, в котором эритроциты, инкапсулирующие фермент, суспендированы в их подходящей форме для хранения в ожидании их инъекции. Консервирующий раствор предпочтительно содержит по меньшей мере один агент, способствующий сохранению эритроцитов, особенно выбранный из глюкозы, декстрозы, аденина и маннитола.
Консервирующим раствором может быть водный раствор, содержащий NaCl, аденин и по меньшей мере одно соединение из глюкозы, декстрозы и маннитола.
Консервирующий раствор может включать NaCl, аденин и декстрозу, предпочтительно среду AS3.
Консервирующий раствор может включать NaCl, аденин, глюкозу и маннитол, предпочтительно среду SAG-Маннитол или ADsol.
В частности, композиция или суспензия в консервирующем растворе характеризуется уровнем внеклеточного гемоглобина, поддерживаемым на уровне 0,5 или меньше, в частности 0,3, особенно 0,2, предпочтительно 0,15, более предпочтительно 0,1 г/дл в течение 72 часов и в условиях хранения при температуре от 2 до 8°С.
В частности, композиция или суспензия в консервирующем растворе характеризуется уровнем внеклеточного гемоглобина, поддерживаемым на уровне 0,5 или меньше, в частности 0,3, особенно 0,2, предпочтительно 0,15, более предпочтительно 0,1 г/дл в течение периода времени от 24 до 20 дней, в частности, от 24 до 72 часов, и в условиях хранения при температуре от 2 до 8°С.
Уровень внеклеточного гемоглобина преимущественно измеряют методом, описанным в руководстве, изложенном в G. B. Blakney and A. J. Dinwoodie, Clin. Biochem. 8, 96-102, 1975. Также существуют автоматические устройства, которые позволяют производить измерения с чувствительностью, специфической для них.
В частности, композиция или суспензия в консервирующем растворе характеризуется скоростью гемолиза, составляющей 2% или меньше, в частности 1,5%, предпочтительно 1% в течение 72 часов и в условиях хранения при температуре от 2 до 8°С.
В частности, композиция или суспензия в консервирующем растворе характеризуется скоростью гемолиза, составляющей 2% или меньше, в частности 1,5, предпочтительно 1% в течение периода от 24 до 20 дней, в частности от 24 до 72 часов и в условиях хранения при температуре от 2 до 8°С.
Способы инкапсулирования
Инкапсулирование ферментов в эритроциты можно проводить с использованием суспензии эритроцитов, которую вводят в контакт с гипотонической жидкой средой, что приводит к открытию пор в мембране эритроцитов. Существуют три альтернативы в методике лизиса - повторной герметизации, которые представляют собой гипотонический диализ, гипотоническое предварительное набухание и гипотоническое разведение, все из которых основаны на разнице осмотического давления внутри и снаружи эритроцитов. Предпочтительным является гипотонический диализ.
Суспензию эритроцитов, инкапсулирующих фермент, в частности, можно получить следующим способом:
1 - суспендирование осадка эритроцитов в изотоническом растворе на уровне гематокрита 65% или больше, охлаждение от +1 до + 8°С;
2 - процедура лизиса при температуре, поддерживаемой между +1 и +8°C, включающая пропускание суспензии эритроцитов на уровне гематокрита 65% или больше, и охлажденного раствора для гипотонического лизиса между +1 и +8°C, через диализное устройство, такое как спираль или диализный картридж (предпочтительным является картридж);
3 - процедура инкапсулирования путем добавления, предпочтительно постепенно, фермента, который должен быть инкапсулирован (особенно в предварительно приготовленном растворе), в суспензию до или во время лизиса, при температуре, поддерживаемой между +1 и + 8°С; а также
4 - процедура повторной герметизации, проведенная в присутствии изотонического или гипертонического, предпочтительно гипертонического раствора, при более высокой температуре, в частности, между +30 и + 42°С.
В предпочтительной альтернативе можно применять способ, описанный в WO-A-2006/016247 (EP 1773452; включенном посредством ссылки):
1 - суспендирование осадка эритроцитов в изотоническом растворе при уровне гематокрита 65% или больше, охлаждение до температуры от +1 до +8°С;
2 - измерение осмотической хрупкости образца эритроцитов из того же самого осадка;
3 - процедура лизиса при температуре от +1 до + 8°С, включающая пропускание суспензии эритроцитов на уровне гематокрита 65% или больше, и раствора для гипотонического лизиса, охлажденного до температуры от +1 до + 8°C, через диализное устройство, такое как спираль или диализный картридж (предпочтительным является картридж); параметры лизиса корректируют в соответствии с ранее измеренной осмотической хрупкостью; в частности, в зависимости от измеренной осмотической хрупкости, регулируют поток суспензии эритроцитов, проходящей через диализное устройство, или регулируют осмолярность раствора для лизиса; и
4 - процедура инкапсулирования путем добавления, предпочтительно постепенно, фермента, который должен быть инкапсулирован (особенно в заранее приготовленном растворе) в суспензию до и во время лизиса, при температуре, поддерживаемой между +1 и + 8°С; и
5 - процедура повторной герметизации, проводимая в присутствии изотонического или гипертонического, предпочтительно гипертонического раствора, при более высокой температуре, в частности, между +30 и + 42°С.
В частности, для диализа осадок эритроцитов суспендируют в изотоническом растворе с высоким уровнем гематокрита, 65% или больше, и предпочтительно 70% или больше, и эту суспензию охлаждают до температуры между +1 и +8°C, предпочтительно от +2 до +6°C, обычно около +4°C. В соответствии с определенным способом, уровень гематокрита составляет от 65 до 80%, предпочтительно от 70 до 80%.
При измерении осмотическую хрупкость преимущественно определяют на эритроцитах непосредственно перед стадией лизиса в присутствии или в отсутствие, предпочтительно в присутствии фермента, который должен быть инкапсулирован. Эритроциты или суспензия, содержащая их, преимущественно находятся при температуре, близкой или идентичной температуре, выбранной для лизиса. В соответствии с другим предпочтительным признаком изобретения, проводимое измерение осмотической хрупкости осуществляют быстро, то есть процедуру лизиса проводят через короткое время после взятия образца. Предпочтительно, чтобы этот промежуток времени между отбором проб и началом лизиса составлял 30 минут или меньше, более предпочтительно 25 минут или меньше, и даже 20 минут.
Что касается того, как проводить процедуру лизиса - повторной герметизации с измерением и с учетом осмотической хрупкости, специалист в данной области может посмотреть дополнительные подробности в WO-A-2006/016247. Этот документ включен в настоящее описание посредством ссылки.
Улучшение этой методики инкапсулирования было описано в WO 2014/180897, к которому может обратиться специалист в данной области техники, и который включен в настоящую заявку посредством ссылки. Таким образом, в соответствии с вариантом осуществления, эритроциты, инкапсулирующие фермент, получают способом, включающим инкапсулирование активного ингредиента внутри эритроцитов путем лизиса - повторной герметизации; получение суспензии или осадка, содержащего эритроциты, включающие фермент и раствор с осмоляльность 280 мОсмоль/кг или выше, в частности, примерно от 280 до 380 мОсмоль/кг, предпочтительно примерно от 290 до 330 мОсмоль/кг; инкубацию осадка или суспензии как таковой или после добавления инкубационного раствора, при осмоляльности 280 мОсмоль/кг или выше, в частности, примерно от 280 до 380 мОсмоль/кг, предпочтительно примерно от 290 до 330 мОсмоль/кг. Инкубацию осуществляют преимущественно в течение периода 30 минут или больше, в частности, 1 часа или больше. Затем проводят удаление жидкой среды инкубированного раствора, и полученные эритроциты суспендируют в растворе, позволяющем вводить суспензию пациенту, предпочтительно в консервирующем растворе, позволяющий вводить суспензию пациенту. Указанная осмоляльность является осмолярностью раствора, в котором суспендированы эритроциты, или осадка в соответствующий момент.
Под «стабилизированной суспензией эритроцитов», в частности, подразумевается суспензия с содержанием внеклеточного гемоглобина, которая остается равным 0,2 г/дл или меньше до ее использования у людей, которое может быть осуществлено, в частности, от 1 до 72 часов после производства серии эритроцитов, включающих активный ингредиент.
Под «готовой к употреблению стабилизированной суспензией эритроцитов» подразумевается стабилизированная суспензия в растворе, позволяющая вводить их пациенту, особенно в консервирующем растворе. Её гематокрит обычно составляет 35%, 40% или 45%, или больше.
Под «осадком эритроцитов» подразумевается концентрат или концентрация эритроцитов, собранных после отделения эритроцитов от жидкой среды, в которой они были суспендированы ранее. Отделение может быть обеспечено фильтрацией или центрифугированием. Центрифугирование является средством, обычно используемым для такого разделения. Осадок содержит определенную долю жидкой среды. Как правило, осадок имеет гематокрит от 70 до 85%.
Под «раствором для инкубации» подразумевается раствор, в котором эритроциты, инкапсулирующие активный ингредиент, присутствуют на стадии инкубации. Инкубация может быть выполнена в большом диапазоне гематокрита, в частности, при гематокрите от 10 до 85%.
Под «хрупкими эритроцитами» подразумеваются эритроциты, полученные от процедуры включения, которые при суспендировании в консервирующем растворе могут подвергаться лизису, когда суспензию хранят при температуре от 2 до 8°C, особенно спустя 1-72 часа.
Под «исходным гематокритом» подразумевается гематокрит перед потерей клеток из-за лизиса хрупких эритроцитов во время инкубации.
Способ может, в частности, включать следующие этапы:
(а) инкапсулирование фермента внутри эритроцитов, включающее введение эритроцитов в контакт с гипотонической средой (позволяющее открывать поры в мембране эритроцитов), контактирование с активным ингредиентом (позволяющее ему поступать в эритроциты), повторную герметизацию эритроцитов, в частности, с помощью изотонической или гипертонической среды, преимущественно гипертонической;
(b) получение или приготовление суспензии или осадка, содержащего эритроциты, включающие фермент, и раствор с осмоляльностью 280 мОсмоль/кг или больше, в частности, примерно от 280 до 380 мОсмоль/кг, предпочтительно примерно от 290 до 330 мОсмоль/кг;
(c) инкубация осадка или суспензии стадии (b) как таковых или после добавления инкубационного раствора при осмоляльности 280 мОсмоль/кг или больше, в частности, примерно от 280 до 380 мОсмоль/кг, предпочтительно примерно от 290 до 330 мОсмоль/кг, в течение периода 30 минут или больше, предпочтительно 1 час или больше;
(d) удаление жидкой среды инкубированной суспензии с этапа (с);
(е) суспендирование эритроцитов, полученных на этапе (d), в растворе, позволяющем вводить суспензию пациенту, предпочтительно консервирующем растворе, позволяющем вводить суспензию пациенту.
Согласно первому способу, этап, следующий за инкапсулированием путем лизиса и повторной герметизации, особенно этап (b), включает по меньшей мере 1 цикл промывания, предпочтительно 2 или 3 цикла промывания, путем разбавления полученной суспензии или осадка на этапе лизиса - повторной герметизации или этапе (а) в растворе при осмоляльности 280 мОсмоль/кг или больше, в частности, примерно от 280 до 380 мОсмоль/кг, предпочтительно примерно от 290 до 330 мОсмоль/кг, с последующим получением осадка эритроцитов или суспензии. Этот осадок или эта суспензия включает эритроциты, содержащие фермент, и раствор с осмоляльностью 280 мОсмоль/кг или больше, в частности, примерно от 280 до 380 мОсмоль/кг, предпочтительно примерно от 290 до 330 мОсмоль/кг. Затем проводят следующие этапы, например, (c), (d) и (e).
В соответствии со вторым способом, на этапе лизиса - повторной герметизации или этапе (а) повторная герметизация эритроцитов с помощью изотонической или гипертонической среды обеспечивает суспензию эритроцитов, которая затем может быть подвергнута инкубации, например, суспензию с этапа (b), в растворе с осмоляльностью 280 мОсмоль/кг или больше, в частности, примерно от 280 до 380 мОсмоль/кг, предпочтительно примерно от 290 до 330 мОсмоль/кг. Другими словами, этап лизиса - повторной герметизации или этап (а) включает этап повторной герметизации эритроцитов, в котором суспендированные эритроциты, инкапсулирующие фермент, смешивают с изотоническим или гипертоническим раствором для повторной герметизации, преимущественно с гипертоническим раствором, с получением суспензии эритроцитов с осмоляльностью 280 мОсмоль/кг или больше, в частности, примерно от 280 до 380 мОсмоль/кг, предпочтительно примерно от 290 до 330 мОсмоль/кг. В этом способе этап инкубации или этап (с) включает инкубацию суспензии, полученной от повторной герметизации. Инкубацию проводят в течение периода 30 минут или больше, особенно 1 час или больше. Затем проводят следующие этапы, например, (d) и (e).
Этапы, следующие после лизиса - повторной герметизации, например, (b) - (e), проводят в условиях, приводящих к лизису хрупких эритроцитов или большинства из них, в частности более 50, 60, 70, 80 или 90% или больше. Для этого можно воздействовать на инкубационный период, температуру инкубации и осмоляльность раствора, в котором суспендированы эритроциты. Чем выше осмоляльность, тем дольше может быть время инкубации. Таким образом, чем ниже осмоляльность, тем короче может быть инкубация для достижения такого же эффекта. Кроме того, чем выше температура, тем короче время инкубации, и наоборот. Один или несколько циклов промывания позволят удалить клеточный дебрис и внеклеточный гемоглобин, а также внеклеточный фермент.
В соответствии с изобретением, цикл промывания включает разбавление суспензии или осадка эритроцитов, а затем разделение эритроцитов и промывающего раствора. Предпочтительно, этап промывания включает предпочтительно 2 или 3 цикла разбавления/разделения. Разделение может быть достигнуто с помощью любых подходящих средств, таких как фильтрация и центрифугирование. Предпочтительным является центрифугирование.
Инкубация не ограничивается гематокритом суспензии. Таким образом, можно инкубировать суспензию, имеющую исходный гематокрит, обычно составляющий от 10 до 85%, в частности от 40 до 80%. Суспензию скорее называют осадком при 70%, и суспензией при более низком значении.
Этап удаления или этап (d) направлен на удаление жидкой части суспензии или инкубированного осадка для того, чтобы по существу удалить клеточный дебрис и внеклеточный гемоглобин, а также, следовательно, внеклеточный фермент.
В соответствии с первым способом, для этапа удаления или этапа (d) проводят разделение, в частности центрифугирование, что особенно применимо к суспензии. За этим разделением может следовать один или несколько, например 2 или 3, циклов промывания путем разбавления в изотоническом растворе с последующим разделением, особенно путем центрифугирования.
Согласно второму способу, для этапа удаления или этапа (d) проводят разбавление перед разделением, преимущественно посредством центрифугирования, что применимо к суспензии или к осадку. Разбавление может быть осуществлено, в частности, с помощью изотонического промывающего раствора или консервирующего раствора.
Последний этап или этап (е) состоит в приготовлении итоговой суспензии, так что ее можно вводить пациенту без какой-либо другой обработки.
В соответствии с первым способом, для этого этапа разбавление осадка эритроцитов с этапа удаления или этапа (d) проводят с инъекционным раствором, в частности, консервирующим раствором.
В соответствии со вторым способом, для этого этапа один или несколько циклов для промывания осадка эритроцитов, полученных на этапе удаления или этапе (d), проводят с инъекционным раствором, в частности, с консервирующим раствором, путем разбавления с последующим разделением. После промывания эритроциты повторно суспендируют в инъекционном растворе, особенно в консервирующем растворе.
Способ по изобретению может дополнительно включать один, несколько или все из следующих признаков:
- этап инкубации или этап (с) проводят при температуре, составляющей примерно от 2 до 39°С, в течение достаточного времени для обеспечения лизиса хрупких эритроцитов;
- этап инкубации или этап (с) проводят при низкой температуре, в частности, примерно от 2 до 10°С, в частности, примерно от 2 до 8°С, и продолжают в течение примерно от 1 часа до 72 часов, в частности, примерно от 6 часов до 48 часов, предпочтительно примерно от 19 часов до 30 часов;
- этап инкубации или этап (с) проводят при более высокой температуре, составляющей примерно от 20 до 39°С, особенно при комнатной температуре (25°С ± 5°С), и продолжают в течение примерно от 30 мин до 10 часов, в частности примерно от 1 часа до 6 часов, предпочтительно примерно от 2 часов до 4 часов; можно работать при еще более высокой температуре, чем комнатная температура, но это может оказать негативное влияние на выход клеток, содержание P50 и/или содержание 2,3-DPG;
- на этапе инкубации или этапе (с) суспензия находится в исходном гематокрите, составляющем от 10 до 85%, в частности от 40 до 80%; можно инкубировать осадок от разделения, имеющий, например, гематокрит от 70 до примерно 85%, или разведенный осадок, имеющий гематокрит, составляющий примерно от 40 до 70%;
- этап инкубации включает перемешивание суспензии;
- этап инкубации не включает никакого перемешивания;
- в качестве раствора для промывания и/или инкубации для получения необходимой осмоляльности используют дозированный водный раствор NaCl; в качестве примера раствор может, таким образом, содержать 0,9% NaCl; этот раствор может также содержать, в частности, помимо NaCl, глюкозу, особенно глюкозы моногидрат, мононатрий фосфат дигидрат, динатрий фосфат додекагидрат; в качестве примера композиция содержит 0,9% NaCl, 0,2% глюкозы моногидрат, 0,034% мононатрий фосфат дигидрат, 0,2% динатрий фосфат додекагидрат;
- промывание на заключительном этапе или этапе (е) проводят с помощью консервирующего раствора;
- осмоляльность раствора (жидкой части) в готовой к употреблению суспензии или суспензии, которая может быть введена пациенту, составляет примерно от 280 до 380 мОсмоль/кг, предпочтительно примерно от 290 до 330 мОсмоль/кг;
- гематокрит готовой к употреблению суспензии или суспензии, которая может быть введена пациенту, составляет 35%, 40% или 45% или более;
- все этапы промывания, инкубации проводят с использованием консервирующего раствора;
- промывающий раствор с этапа (b) и/или промывающий раствор с этапа (е) и консервирующий раствор имеют одинаковый состав и содержат соединение(я), способствующее сохранению эритроцитов;
- консервирующий раствор (и промывающий раствор(ы) или растворы для инкубации, при необходимости) представляет собой водный раствор, содержащий NaCl, аденин и по меньшей мере одно соединение из глюкозы, декстрозы и маннитола;
- консервирующий раствор (и промывающий раствор(ы) или раствор(ы) для инкубации, при необходимости) содержит NaCl, аденин и декстрозу, предпочтительно среду AS3;
- консервирующий раствор (и промывающий раствор(ы) или раствор(ы) для инкубации, при необходимости) содержит NaCl, аденин, глюкозу и маннитол, предпочтительно SAG-Маннитол или среду ADsol.
Способы в соответствии с изобретением, в частности, включают следующий этап:
(а) инкапсулирование фермента внутри эритроцитов, включающее контактирование с гипотонической средой, позволяющее открывать поры в мембране эритроцитов, контактировать с ферментом, чтобы обеспечить его проникновение в эритроциты, повторную герметизацию эритроцитов с помощью изотонической или гипертонической среды. Следует отметить, что фермент может присутствовать в суспензии эритроцитов до лизиса последних или, кроме того, добавляться во время лизиса или после лизиса, но всегда перед повторной герметизацией. В одном варианте осуществления этого этапа (а) способ содержит следующие подэтапы:
a1) получения суспензии эритроцитов с гематокритом 60 или 65% или больше;
(a2) измерения осмотической хрупкости эритроцитов в этой суспензии;
(а3) процедуры лизиса и интернализации активного ингредиента (ингредиентов), включающей пропускание суспензии эритроцитов через диализное устройство, в частности диализный картридж, против лизирующего раствора, регуляцию потока суспензии эритроцитов или регуляцию скорости потока лизирующего раствора или регуляцию осмолярности лизирующего раствора, в зависимости от осмотической хрупкости, измеренной в соответствии с (а2);
(а4) - процедуры повторной герметизации эритроцитов.
Способы применения
В первом аспекте изобретение представляет собой способ лечения рака у млекопитающего, нуждающегося в лечении, включающий истощение у млекопитающего метионина, а затем истощение у млекопитающего аспарагина, особенно путем введения аспарагиназы в достаточном количестве. Целью изобретения является уменьшение количества метионина и аспарагина, доступных для раковых клеток. Истощение метионина может быть выполнено, как указано выше, посредством диетического истощения метионина и/или применения метиониназы.
Во втором аспекте изобретение представляет собой способ лечения рака у млекопитающего, нуждающегося в лечении, включающий введение, в частности инъекцию, млекопитающему, нуждающемуся в этом, композиции, содержащей метиониназу, а затем композиции, содержащей аспарагиназу.
Последовательное введение, интервал между депривацией метионина и/или введением метиониназы, и введением аспарагиназы, дозы, повторные введения и формы фармацевтических композиций (свободная форма, пэгилированная форма и/или суспензия эритроцитов, инкапсулирующих фермент) были подробно описаны выше и применяются к способам использования.
В одном варианте осуществления метиониназу (например, в свободной форме, пэгилированной форме или инкапсулированную) вводят один или несколько раз.
В другом варианте осуществления свободную или пэгилированную метиониназу вводят более одного раза перед введением аспарагиназы, например, две или более (например, 3, 4, 5) дозы метиониназы вводят млекопитающему, как правило, в разные дни, например, ежедневно.
В одном варианте осуществления пациенту вводят эффективное количество кофактора метиониназы. Его можно вводить до, в то же время или после введения метиониназы. В одном варианте осуществления он присутствует в той же композиции, что и метиониназа. В другом варианте осуществления его вводят в отдельной композиции.
В одном варианте осуществления вводят метиониназу, инкапсулированную в эритроциты, и кофактор также может быть инкапсулирован, или кофактор может находиться в свободной форме в растворе. В предпочтительном варианте осуществления кофактор находится в растворе в фармацевтически приемлемом растворителе, и представляет собой нефосфатную форму витамина B6, предпочтительно PN. Этот раствор нефосфатной формы витамина B6 можно применять путем инъекции или пероральным путем, или любым другим путем. В одном варианте осуществления раствор вводят один или несколько раз после каждой инъекции инкапсулированной метиониназы, например, спустя от 1 до 10 часов после этого. Предпочтительно, раствор вводят преимущественно один раз в день, а также дважды или более в день, во время лечения метиониназой или при наличии активности метиониназы в кровотоке (в зависимости от периода полужизни). При применении метиониназы, инкапсулированной внутри эритроцитов, кофактор в растворе можно вводить по меньшей мере один раз в день в течение 10-30 дней.
В одном варианте осуществления аспарагиназу в свободной форме, пэгилированной форме или инкапсулированной форме вводят один или несколько раз.
В другом варианте осуществления свободную или пэгилированную аспарагиназу вводят более одного раза, например, две или более (например, 3, 4, 5) дозы аспарагиназы вводят млекопитающему, обычно в разные дни, например, ежедневно.
В одном варианте осуществления метиониназа и/или аспарагиназа находятся в порошковой форме, и способ их применения включает их солюбилизацию в фармацевтически приемлемом растворе или жидкости перед введением млекопитающему.
В одном варианте осуществления используют устройство, как описано выше. Таким образом, способ лечения рака включает имплантацию или размещение у млекопитающего, особенно человека, устройства, как описано в настоящей заявке. Имплантация или размещение может включать соединение трубок с кровеносным сосудом или с катетером и т.п., которые уже установлены. Затем способ может включать запуск устройства для его последовательной доставки в соответствии с планом его программного обеспечения, согласно способу из изобретения.
Предпочтительно суспензия эритроцитов, инкапсулирующих метиониназу или аспарагиназу в консервирующем растворе, готова к использованию и предпочтительно может иметь низкий уровень внеклеточного гемоглобина, соответствующий, в частности, рекомендациям FDA (Управления по контролю продуктов питания и лекарственных средств).
В первом варианте осуществления инъекцию проводят у млекопитающего, особенно пациента - человека, с суспензией эритроцитов, инкапсулирующих активный ингредиент, приготовленной за 1-72 часа, в частности за 10-72 часа перед инъекцией. Гематокрит этой суспензии составляет 40% или выше. Она содержится в консервирующем растворе. Уровень внеклеточного гемоглобина составляет 0,5 или ниже, в частности 0,3 или ниже, более предпочтительно 0,2 или ниже, предпочтительно 0,15 или ниже, более предпочтительно 0,1 г/дл или ниже, и/или скорость гемолиза составляет 2% или ниже, в частности, 1,5% или ниже, предпочтительно 1% или ниже. Перед инъекцией суспензию не подвергают промыванию или аналогичной процедуре.
В другом варианте осуществления этот способ включает этапы обеспечения упакованных эритроцитов, помещения их в суспензию в физиологическом буфере при гематокрите 60 или 65% или выше, инкапсулирования активного ингредиента в эти эритроциты с использованием процедуры лизиса и повторной герметизации, инкубации полученных эритроцитов, промывания последних и сбора окончательной суспензии эритроцитов. Гематокрит суспензии составляет 40% или выше. Её хранят в консервирующем растворе. Эту суспензию хранят при температуре от 2 до 8°С. Эту итоговую суспензию вводят млекопитающему, особенно человеку, спустя 1-72 часа, предпочтительно спустя 24-72 часа после приготовления суспензии. Уровень внеклеточного гемоглобина этой суспензии составляет 0,5 или ниже, в частности 0,3 или ниже, более предпочтительно 0,2 или ниже, предпочтительно 0,15 или ниже, более предпочтительно 0,1 г/дл или ниже, и/или скорость её гемолиза составляет 2% или ниже, в частности, 1,5% или ниже, предпочтительно 1% или ниже. Перед инъекцией суспензию не подвергают промыванию или аналогичной процедуре.
Композиции, наборы и способы направлены на лечение гемобластозов (опухолей системы крови) и солидных опухолей, ауксотрофных по аспарагину и/или метиониназе. В качестве примера можно привести лейкоз (острый миелоидный лейкоз, острый промиелоцитарный лейкоз) и рак желудка (карциному IV стадии, аденокарциному).
Далее изобретение будет описано более подробно с использованием следующих не ограничивающих вариантов осуществления.
Фигура 1 является графиком, демонстрирующим жизнеспособность клеток в процентах в различных условиях лечения.
Фигуры 2 и 3 являются графиками, демонстрирующими жизнеспособность клеток в процентах в различных условиях лечения.
Фигура 4 является графиком, демонстрирующим объем отдельных опухолей с медианой в зависимости от времени.
Пример 1
I. Сокращения
CCK-8: Набор для подсчета клеток-8
DPBS: Фосфатно-солевой буфер Дульбекко
IMDM: Среда Дульбекко, модифицированная по способу Исков
МГЛ: Метионин-γ-лиаза
о/о: объемный %
II. Условия эксперимента
II.1. Объект анализа
II.1.1. L-аспарагиназа
Описание: Medac® (Германия), E. Coli L-аспарагиназа, 10 000 МЕ.
Одну концентрацию L-аспарагиназы (2,53 МЕ/мл) готовили путем серийных разведений в фосфатно-солевом буфере Дульбекко (DPBS) 1X. L-аспарагиназу разбавляли в 11 раз до получения итоговой концентрации 0,23 МЕ/мл (IC50).
II.1.2. Метионин-γ-лиаза (МГЛ)
Описание: метионин-γ-лиаза (МГЛ) P. рutida, продуцируемая в E. сoli.
Одну концентрацию МГЛ (2,09 МЕ/мл) готовили путем серийных разведений в фосфатно-солевом буфере Дульбекко (DPBS) 1X. МГЛ разбавляли в 11 раз для получения итоговой концентрации 0,19 МЕ/мл (IC50).
II.2. Клеточные линии
II.2.1. Описание
Наименование: клеточная линия HL-60
Описание: Клеточная линия промиелоцитарного лейкоза человека (суспензия)
Поставщик и справочный номер: ATCC, CCL-240
II.2.2. Условия культивирования
Клетки культивировали в среде IMDM с L-глутамином с добавлением 20 об.% эмбриональной телячьей сыворотки, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина. Субкультивирование проводили в соответствии с PO-CELL-002 и PO-CELL-005.
II.2.3. Набор для колориметрии
Наименование: Набор для подсчета клеток-8 (CCK-8)
Поставщик и справочный номер: Fluka 96992
Принцип анализа: CCK-8 реагент содержит высоко растворимую в воде соль тетразолия WST-8. WST-8 восстанавливается дегидрогеназами в клетках с образованием продукта с желтой окраской (формазана), который растворим в среде для культивирования тканей. Количество красителя формазана, образуемого под действием дегидрогеназ, прямо пропорционально числу живых клеток.
Колориметрический анализ проводили в соответствии с PO-CELL-004.
III. Анализ цитотоксической активности
III.1. Метод
Пятнадцать тысяч клеток в 100 мкл/лунку распределяли в пяти 96-луночных планшетах с плоским дном. Кроме того, 2 лунки заполняли культуральной средой для холостого контроля на каждом планшете. Все пустые лунки заполняли культуральной средой, чтобы минимизировать испарение и конденсацию. В день 0 (D0) в соответствующие лунки добавляли 10 мкл IC50 концентраций L-аспарагиназы или МГЛ. В контроли (лунки с холостой пробой и контрольный планшет) вносили 10 мкл DPBS 1X. На 3-й день (D3) среду удаляли из лунок и заменяли свежей средой, и добавляли 10 мкл DPBS 1X или 10 мкл IC50 концентраций L-аспарагиназы (для клеток, ранее инкубированных с МГЛ) или МГЛ (для клеток, ранее инкубированных с L-аспарагиназой) в соответствующие лунки. В контроли (холостой и положительный контроль) вносили 10 мкл DPBS 1X. Затем планшеты инкубировали еще 3 дня в инкубаторе. В конце инкубационного периода (D6) в каждую лунку добавляли 10 мкл раствора CCK-8 в соответствии с PO-CELL-004, и планшеты инкубировали в течение 2 часов в инкубаторе. Оптическую плотность (OП) затем определяли при 450 нм с использованием ридера микропланшетов.
III.2. Внутренние контроли
Контроли осуществляли в двух экземплярах.
III.2.1. Лунки с холостым контролем
Небольшое спонтанное поглощение около 460 нм наблюдается в культуральной среде с CCK-8. Это фоновое поглощение зависит от культуральной среды, рН, времени инкубации и длины воздействующего света. Поэтому были использованы лунки с холостой пробой, содержащие 100 мкл культуральной среды и 10 мкл L-аспарагиназы или разбавителя МГЛ, DPBS 1X. Среднюю абсорбцию этих контрольных лунок вычитали из показаний других лунок, содержащих клетки.
III.2.2. Контроль жизнеспособности (положительный контроль)
В качестве положительного контроля клеточной линии HL-60 (100% жизнеспособность клеток) клетки культивировали в культуральной среде (100 мкл) без L-аспарагиназы или МГЛ, но с 10 мкл разбавителя (DPBS 1X).
III.3. Определение жизнеспособности клеток
Культуральная среда без клеток представляла холостые контроли (ОП Холостой пробы). Клетки без L-аспарагиназы и без МГЛ представляли положительные контроли (контроль жизнеспособности).
Процент живых клеток рассчитывали, как показано ниже:
ОП L-аспарагиназы+МГЛ* - ОП холостой пробы Х 100
ОП контроля жизнеспособности** - ОП холостой пробы
*: клетки с обработкой L-аспарагиназой и МГЛ
**: клетки без обработки L-аспарагиназой и МГЛ
Расчеты автоматически производили с помощью программного обеспечения Gen 5, управляющего ридером микропланшетов. Средняя оптическая плотность (ОП) 2 лунок с холостой пробой автоматически вычиталась из всех оптических плотностей. Расчеты жизнеспособности клеток применяли для последующей обработки.
IV. Результаты
IV.1. Внутренний контроль
Внутренние контроли были приемлемыми, когда это не указывалось в необработанных данных.
IV.2. Расчеты IC50 с L-аспарагиназой или МГЛ по отдельности
Процентное значение жизнеспособности клеток с лекарством по отдельности (МГЛ или L-аспарагиназой) контролировали в каждом эксперименте с комбинацией лекарств.
IV.2.1. Последовательное добавление L-аспарагиназы и МГЛ
Эксперимент с последовательной обработкой L-аспарагиназой и МГЛ проводили один раз с данными в двух экземплярах. Все качественные контроли (холостой и положительный контроль) были приемлемыми во всех экспериментах.
Подробности расчетов % жизнеспособности клеток и графическое представление представлены ниже в Таблице 1 и на Фигуре 1.
Таблица 1: Жизнеспособность клеток в % для контролей и связь с ферментами
Результаты показывают, что ассоциация фермента с МГЛ, добавленной в дозе IC50 перед добавлением L-аспарагиназы в дозе IC50 (красным цветом на Фигуре 1) позволила снизить жизнеспособность клеток:
- на 76% по сравнению с IC50 L-аспарагиназы (IC50 контроль для L-аспарагиназы),
- на 70% по сравнению с МГЛ (IC50 контроль для МГЛ),
- на 75% по сравнению с ассоциацией с ферментом с L-аспарагиназой, добавленной вначале в дозе IC50.
Тем не менее, обратная последовательность ассоциаций ферментов не давала таких результатов, без каких-либо преимуществ ассоциации в отношении жизнеспособности клеток по сравнению с ферментами по отдельности (контроли).
V. Заключение
Последовательная ассоциация ферментов показала, что смертность клеток может быть увеличена с добавлением МГЛ при дозе IC50, а затем через 3 дня с добавлением L-аспарагиназы при дозе IC50. Тем не менее, обратная конструкция добавления фермента не позволила получить такие результаты.
Можно предположить, что истощение метионина, вызванное ферментативной активностью МГЛ, делает лейкозные клетки HL-60 более чувствительными к активности L-аспарагиназы. Более того, роли L-аспарагиназы и МГЛ должны обсуждаться с учетом их известного соответствующего эффекта. Действительно, L-аспарагиназа, как известно, вызывает апоптоз в клетках лейкоза (Ueno et al., 1997), поэтому она, вероятно, может играть роль цитотоксического агента. МГЛ, известная тем, что блокирует деление клеток в фазе S или G2 клеточного цикла, скорее всего, действует как цитостатический агент.
Пример 2. Способ инкапсулирования L-аспарагиназы в мышиных эритроцитах.
L-аспарагиназу (Medac®, E. coli L-аспарагиназу) инкапсулируют в мышиные эритроциты (мыши OF1) методом гипотонического диализа в диализном мешке. Кровь предварительно центрифугируют для удаления плазмы, а затем три раза промывают 0,9% NaCl. Гематокрит доводят до 70% в присутствии аспарагиназы, до конечной концентрации 400 МЕ/мл эритроцитов или красных кровяных клеток перед началом диализа. Диализ длится 50 минут при 4°C против лизисного буфера с низкой осмолярностью. Затем эритроциты мыши повторно герметизируют путем добавления раствора с высокой осмолярностью, и инкубируют 30 минут при 37°С. После двух промываний с 0,9% NaCl и одного промывания Sag-маннитолом с добавлением бычьего сывороточного альбумина БСА (6%), эритроциты доводят до гематокрита 50%. Эритроциты, инкапсулирующие L-аспарагиназу, называются L-Асп RBC. Инкапсулирование генерирует L-Асп RBC в концентрации 40 МЕ аспарагиназы/мл эритроцитов при 50% гематокрите.
Во время процедуры инкапсулирования цельную кровь, промытые эритроциты, эритроциты, смешанные с L-аспарагиназой (до диализа) и эритроциты, нагруженные L-аспарагиназой (после диализа), испытывают на:
- гематокрит (Гт)
- средний корпускулярный объем (ACV)
- среднюю концентрацию корпускулярного гемоглобина (ACHC)
- общую концентрацию гемоглобина, и
- количество клеток.
Аликвоты клеточных суспензий отбирают до и после гипотонического диализа для измерения ферментативной активности L-аспарагиназы. Оценку L-аспарагиназы проводили в соответствии с протоколом, опубликованным в: Orsonneau et al., Ann Biol Clin, 62: 568-572.
Пример 3. Инкапсулирование L-аспарагиназы в человеческих эритроцитах
Способ, описанный в WO-A-2006/016247, используют для получения серии эритроцитов, инкапсулирующих L-аспарагиназу. В соответствии с учением WO-A-2006/016247, учитывают осмотическую хрупкость и корректируют параметры лизиса (регулируют скорость потока суспензии эритроцитов в картридже для диализа). Способ дополнительно проводят в соответствии с рецептом врача, который учитывает вес пациента и дозу L-аспарагиназы для введения. Спецификации конечного продукта являются следующими:
- средний корпускулярный объем (MCV): 70-95 фл
- средняя концентрация корпускулярного гемоглобина (MCHC): 23-35 г/дл
- внеклеточный гемоглобин ≤ 0,2 г/дл суспензии
- осмотическая хрупкость ≤ 6 г/л NaCl
- средняя корпускулярная концентрация L-аспарагиназы: 78-146 МЕ/мл
- внеклеточная L-аспарагиназа ≤2% от общей ферментативной активности.
Суспензия полученных таким образом эритроцитов называется GRASPA® и упоминается в литературе.
Пример 4. Способ получения и характеристики метионин-гамма-лиазы (МГЛ)
Получение штамма и выделение гипер-продуцирующего клона: натуральная последовательность МГЛ Pseudomonas putida (GenBank: D88554,1) была оптимизирована путем модификации редких кодонов (чтобы адаптировать последовательность, происходящую от P. putida, к производственному штамму Escherichia coli). Другие изменения были внесены для улучшения контекста начала трансляции. Наконец, были выполнены молчащие мутации для удаления трех элементов, которые являются частью предполагаемого бактериального промотора в кодирующей последовательности (бокс -35, бокс -10 и сайт связывания фактора транскрипции в положении 56). Продуцирующий штамм E. coli HMS174 (DE3) трансформировали экспрессирующим вектором pGTPc502_MGL (промотор T7), содержащим оптимизированную последовательность, и выбирали производящий клон. Производящий клон предварительно культивировали в среде GY + 0,5% глюкозы + канамицин в течение 6-8 часов (предварительная культура 1) и 16 часов (предварительная культура 2) при 37°С.
Ферментация: продукцию затем обеспечивают в ферментере с средой GY с перемешиванием, контролируемым давлением и рН из предварительной культуры 2 при оптической плотности 0,02. Фаза роста (при 37°С) происходит до достижения оптической плотности 10, а индукция экспрессии достигается при 28°С путем добавления 1 мМ IPTG в культуральную среду. Клеточный осадок собирают через 20 часов после индукции в две фазы: клеточный бульон концентрируют 5-10 раз после прохождения по пустому волокну 500 кДа, а затем осадок клеток извлекают центрифугированием при 15900 g, и затем хранят при -20°C.
Очистка: клеточный осадок размораживают и суспендируют в буфере для лизиса (7 м/о). Лизис проводят при 10°С в три этапа путем гомогенизации под высоким давлением (один этап при 1000 бар, а затем два этапа при 600 бар). Затем клеточный лизат подвергают осветлению при 10°С путем добавления 0,2% ПЭИ и центрифугирования при 15900 g. Растворимую фракцию затем стерилизуют фильтрацией через 0,2 мкм фильтр перед осаждением сульфатом аммония (60% насыщения) при 6°С, более 20 часов. Две стадии кристаллизации проводят на повторно солюбилизированном осадке с использованием солюбилизирующего буфера, где первую стадию кристаллизации осуществляют путем добавления ПЭГ-6000 при 10% (конечная концентрация) и сульфата аммония при насыщении 10%, и затем выполняют вторую кристаллизацию путем добавления ПЭГ-6000 при конечной концентрации 12% и 0,2 М NaCl (конечная концентрация) при 30°С. Осадки, содержащие белок МГЛ, собирают на каждой стадии после центрифугирования при 15900 g. Осадок, содержащий белок МГЛ, повторно суспендируют в буфере для солюбилизации и пропускают через фильтр 0,45 мкм перед тем, как подвергнуть двум стадиям анионообменной хроматографии (DEAE сефароза FF). Затем очищенный белок подвергают стадии дополнительной очистки и пропускают через капсулу для хроматографии с мембраной Q для удаления различных загрязняющих веществ (эндотоксины, белок клетки-хозяина HCP, остаточная ДНК). Наконец, очищенный белок МГЛ концентрируют до 40 мг/мл и подвергают диафильтрации в буфере для приготовления, используя кассету для тангенциальной фильтрации потока с отсечением 10 кДа. Вещество затем аликвотируют примерно по 50 мг белка на флакон, в конечном итоге лиофилизируют при контролируемом давлении и температуре, и хранят при -80°C.
Характеристика: удельную активность фермента определяют путем измерения полученного NH3, как описано в WO 2015/121348. Чистоту определяют посредством SDS-PAGE. Уровень пиридоксальфосфата после приема с водой оценивали по методу, описанному в WO 2015/121348. Осмолярность измеряют осмометром (Micro-Osmometer Loser Type 15).
В следующей Таблице 2 обобщены основные характеристики одной полученной серии МГЛ
Характеристики после разведения в 625 мкл воды: 78,7 мг/мл, ~622 мкМ пиридоксальфосфата, 50 мМ Na фосфата, pH 7,2;
Осмолярность - 300 мОсмоль/кг.
Обсуждение способа получения. Способ очистки МГЛ, описанный в WO 2015/121348, основан на способе, подробно описанном в патенте ЕР 0978560 B1 и соответствующей публикации (Takakura et al., Appl Microbiol Biotechnol 2006). Этот выбор объясняется простотой и надежностью стадии кристаллизации, которая описана как особенно практичная и легко адаптируемая к крупномасштабным производствам, по мнению авторов. Эта стадия основана на использовании ПЭГ6000 и сульфата аммония после нагревания раствора МГЛ, полученного после лизиса/осветления и удаления примесей, путем этапов добавления ПЭГ6000/ сульфата аммония. Другой важной точкой этой стадии является возможность быстрого достижения высокого уровня чистоты на стадии удаления примесей путем проведения центрифугирования после обработки раствора МГЛ с помощью ПЭГ6000. Примеси снова обнаруживаются в осадке после центрифугирования, причем МГЛ находится в большинстве случаев в растворе в надосадочной жидкости. Из-за этой чистоты пропускание раствора МГЛ на одной хроматографической стадии через анионообменную колонку (DEAE), связанное со стадией очистки гель-фильтрацией на колонке с сефакрилом S200 HR, дает возможность получения очищенного белка.
После установки запатентованного метода для испытаний в небольшом масштабе оказалось, что полученные результаты нельзя было воспроизвести. В соответствии с патентом EP 0978560 B1, в конце стадии удаления примесей (обработка ПЭГ6000/ сульфатом аммония и центрифугирование) фермент МГЛ находится в большинстве случаев в растворимой фракции, центрифугирование вызывает удаление примесей в осадок. Во время испытаний в небольшом масштабе, проведенных в соответствии со способом, описанным в EP 0978560 B1, белок МГЛ снова в большинстве случаев (~ 80%) выявлялся в осадке после центрифугирования. В таблице 3 ниже приведено процентное отношение МГЛ, оцененное по денситометрии на геле SDS-PAGE в растворимых фракциях.
Таким образом, этот неожиданный результат привел к оптимизации запатентованного способа путем: (1) обработки осадка после центрифугирования, содержащего МГЛ; (2) проведения двух последовательных стадий кристаллизации для улучшения удаления примесей после загрузки на колонку DEAE; (3) оптимизация хроматографии на колонке DEAE.
Для этой последней стадии установлено, что смола DEAE сефароза FF, наконец, не является достаточно сильным ионообменником в испытанных условиях буфера и рН. После различных дополнительных экспериментов по оптимизации выбор был окончательно направлен на (1) замещение фосфатного буфера, используемого в исходном способе, на Трис-буфер, pH 7,6 для повышения надежности способа, и (2) проведение второго пропускания через DEAE для того, чтобы существенно улучшить уровень эндотоксина и чистоту белка без потери МГЛ (0,8 ЭЕ/мг в соответствии с Takakura et al., 2006, против 0,57 ЭЕ/мг для модифицированного способа).
Наконец, чтобы получить способ, совместимый с требованиями для крупномасштабного производства GMP, была добавлена стадия дополнительной очистки на мембране Q, чтобы уменьшить остаточные уровни эндотоксинов и белков клетки-хозяина. Этот последний этап дополнительной очистки предотвращает использование гель-фильтрационной хроматографии S200, которая является трудной стадией для использования в производственных процессах в промышленном масштабе (из-за затрат и продолжительности хроматографии).
Полученный продукт кратко описан в следующей таблице 4, с применением двух способов.
$ после сефакрила S-200 HR (EP 978560) или после мембраны Q (способ из изобретения).
Пример 5. Совместное инкапсулирование МГЛ и пиридоксальфосфата в мышиных эритроцитах.
Цельную кровь мышей CD1 (Charles River) центрифугируют при 1000 × g в течение 10 мин при 4°C для удаления плазмы и лейкотромбоцитарного слоя. Эритроциты промывают три раза 0,9% NaCl (о/о). Лиофилизированную МГЛ повторно суспендируют в воде при концентрации 78,7 мг/мл и добавляют к суспензии эритроцитов, чтобы получить конечную суспензию с гематокритом 70%, содержащую различные концентрации МГЛ и пиридоксальфосфата. Затем суспензию загружали на гемодиализатор со скоростью 120 мл/ч и диализовали против гипотонического раствора со скоростью потока 15 мл/мин в качестве противотока. Затем суспензию повторно герметизировали гипертоническим раствором, и затем инкубировали в течение 30 мин при 37°С. После трех промываний в 0,9% NaCl, 0,2% глюкозы, суспензию разбавляли консервирующим раствором SAG-Маннитол с добавлением 6% БСА. Полученные продукты характеризовали в D0 (в течение 2 часов после их получения) и в D1 (т.е. спустя примерно 18-24 часа хранения при 2-8°C). Гематологические характеристики получены с помощью ветеринарного автомата (Sysmex, PocH-100iV).
Результаты
В различных исследованиях, упомянутых ниже, активность МГЛ в готовых продуктах анализировали способом, описанным в примере 5, против внешнего диапазона калибровки МГЛ в водном растворе. Эти результаты в сочетании с пояснительными исследованиями показывают, что активность МГЛ в готовых продуктах возрастает с увеличением количества фермента, введенного в этот способ, и что можно легко инкапсулировать до 32 МЕ МГЛ на мл готового продукта, сохраняя при этом хорошую стабильность.
В другом исследовании три мышиных готовых продукта RC-MGL-PLP1, RC-MGL-PLP2 и RC-MGL-PLP3 были получены по следующим методикам:
- RC-MGL-PLP1: совместное инкапсулирование МГЛ и пиридоксальфосфата из суспензии, содержащей 3 мг/мл МГЛ и примерно 30 мкМ пиридоксальфосфата. Готовый продукт был получен в SAG-Маннитоле, 6% БСА, с добавлением в итоге 10 мкМ пиридоксальфосфата.
- RC-MGL-PLP2: совместное инкапсулирование МГЛ и пиридоксальфосфата из суспензии, содержащей 3 мг/мл МГЛ и примерно 30 мкМ пиридоксальфосфата. Готовый продукт был получен в SAG-Маннитоле, 6% БСА.
- RC-MGL-PLP3: этот продукт был получен совместным инкапсулированием МГЛ и пиридоксальфосфата из суспензии, содержащей 3 мг/мл МГЛ и примерно 124 мкМ пиридоксальфосфата. Готовый продукт был получен в SAG-Маннитоле, 6% БСА.
В третьем исследовании полученный готовый продукт RC-MGL-PLP4 мыши был приготовлен из новой партии МГЛ в соответствии со следующими способами:
- RC-MGL-PLP4: совместное инкапсулирование МГЛ и пиридоксальфосфата из суспензии, содержащей 5 мг/мл МГЛ и примерно 35 мкМ пиридоксальфосфата. Готовый продукт был получен в SAG-Маннитоле, 6% БСА.
Наконец, в четвертом исследовании мышиный продукт RC-MGL-PLP5 получали из третьей серии МГЛ в соответствии со следующими способами:
RC-MGL-PLP5: совместное инкапсулирование МГЛ и пиридоксальфосфата из суспензии, содержащей 6 мг/мл МГЛ и примерно 100 мкМ пиридоксальфосфата. Готовый продукт был получен в SAG-Маннитоле, 6% БСА.
Гематологические и биохимические характеристики трех готовых продуктов при D0 (после их приготовления) подробно описаны в таблице 5 ниже. Выходы инкапсулирования являются удовлетворительными, и варьируют от 18,6% до 30,5%.
Пример 6. Получение человеческих эритроцитов, инкапсулирующих метионин-гамма-лиазу и пиридоксальфосфат, в соответствии с промышленным способом.
Мешок с человеческими эритроцитами, из которых были удалены лейкоциты (предоставленный «Etablissement 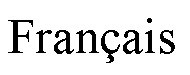 du Sang») подвергают циклу из трех промываний с 0,9% NaCl (промывающее устройство Cobe 2991). Лиофилизированную МГЛ повторно суспендируют с 0,7% NaCl и добавляют к суспензии эритроцитов для получения конечной суспензии с гематокритом 70%, содержащей 3 мг/мл МГЛ и 30 мкМ пиридоксальфосфата (полученного из композиции МГЛ). Суспензию гомогенизируют и продолжают инкапсулировать в соответствии со способом, описанным в ЕР 1773452. Затем суспензию от повторной герметизации инкубируют в течение 3 часов при комнатной температуре, чтобы удалить наиболее хрупкие эритроциты. Суспензию трижды промывают 0,9% NaCl, 0,2% раствором глюкозы (промывающее устройство Cobe 2991), и затем снова суспендируют с 80 мл консервирующего раствора (AS-3). Уровень инкапсулированной МГЛ анализируют, как в примере 6, см. Таблицу 6 ниже.
du Sang») подвергают циклу из трех промываний с 0,9% NaCl (промывающее устройство Cobe 2991). Лиофилизированную МГЛ повторно суспендируют с 0,7% NaCl и добавляют к суспензии эритроцитов для получения конечной суспензии с гематокритом 70%, содержащей 3 мг/мл МГЛ и 30 мкМ пиридоксальфосфата (полученного из композиции МГЛ). Суспензию гомогенизируют и продолжают инкапсулировать в соответствии со способом, описанным в ЕР 1773452. Затем суспензию от повторной герметизации инкубируют в течение 3 часов при комнатной температуре, чтобы удалить наиболее хрупкие эритроциты. Суспензию трижды промывают 0,9% NaCl, 0,2% раствором глюкозы (промывающее устройство Cobe 2991), и затем снова суспендируют с 80 мл консервирующего раствора (AS-3). Уровень инкапсулированной МГЛ анализируют, как в примере 6, см. Таблицу 6 ниже.
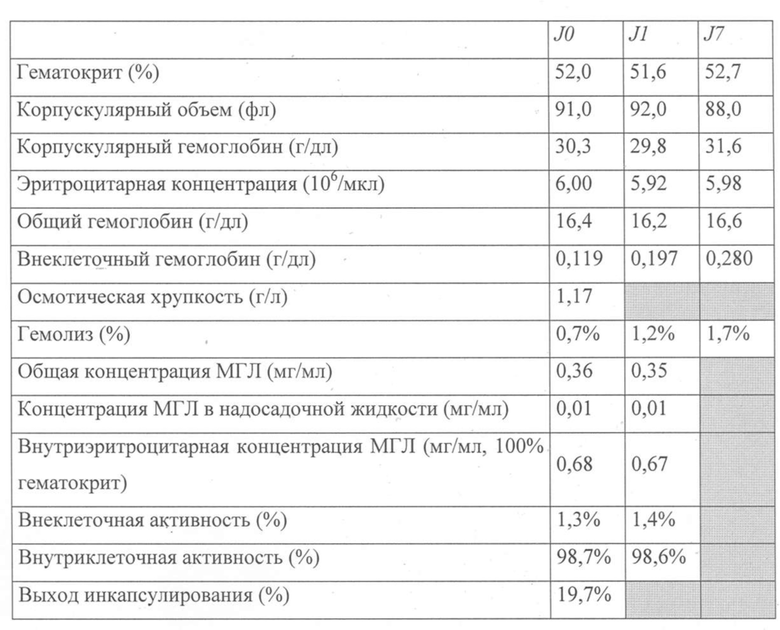
Пример 7
Дополнительные сокращения
RPMI: среда Мемориального института Розуэлла Парка
I. Условия эксперимента
I.1. Объект анализа
I.1.1. L-аспарагиназа
Описание: Medac® (Германия), E. Coli L-аспарагиназа, 10 000 МЕ.
Одну концентрацию L-аспарагиназы (2,2 МЕ/мл) готовили путем серийных разведений в фосфатно-солевом буфере Дульбекко (DPBS) 1X. L-аспарагиназу разбавляли в 11 раз до получения итоговой концентрации 0,20 МЕ/мл (IC50).
I.1.2. Метионин-γ-лиаза (МГЛ)
Описание: метионин-γ-лиаза (МГЛ) P. рutida, продуцируемая в E. сoli.
Одну концентрацию МГЛ (3,85 МЕ/мл) готовили путем серийных разведений в фосфатно-солевом буфере Дульбекко (DPBS) 1X. МГЛ разбавляли в 11 раз для получения итоговой концентрации 0,35 МЕ/мл (IC50).
I.2. Клеточные линии
I.2.1. Описание
Наименование: клеточная линия NCI-N87
Описание: Клеточная линия карциномы желудка человека (адгезивная)
Поставщик и справочный номер: ATCC, CRL-5822
I.2.2. Условия культивирования
Клетки культивировали в среде RPMI с добавлением 10 об.% эмбриональной телячьей сыворотки, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина. Субкультивирование проводили в соответствии с PO-CELL-002 и PO-CELL-005.
I.2.3. Набор для колориметрии
Наименование: Набор для подсчета клеток-8 (CCK-8)
Поставщик и справочный номер: Fluka 96992
Принцип анализа: CCK-8 реагент содержит высоко растворимую в воде соль тетразолия WST-8. WST-8 восстанавливается дегидрогеназами в клетках с образованием продукта с желтой окраской (формазана), который растворим в среде для культивирования тканей. Количество красителя формазана, образуемого под действием дегидрогеназ, прямо пропорционально числу живых клеток.
Колориметрический анализ проводили в соответствии с PO-CELL-004.
II. Анализ цитотоксической активности
II.1. Метод
Две тысячи пятьсот клеток в 100 мкл/лунку распределяли в 96-луночных планшетах с плоским дном (см. число планшетов в необработанных данных). Кроме того, 2 лунки заполняли культуральной средой для холостого контроля на каждом планшете. Все пустые лунки заполняли культуральной средой, чтобы минимизировать испарение и конденсацию. В день 0 (D0) в соответствующие лунки добавляли 10 мкл IC50 концентраций L-аспарагиназы или МГЛ. В контроли (лунки с холостой пробой и контрольный планшет) вносили 10 мкл DPBS 1X. На 4-й день (D4) среду удаляли из лунок и заменяли свежей средой, и добавляли 10 мкл DPBS 1X или 10 мкл IC50 концентраций L-аспарагиназы (для клеток, ранее инкубированных с МГЛ) или МГЛ (для клеток, ранее инкубированных с L-аспарагиназой) в соответствующие лунки. В контроли (холостой и положительный контроль) вносили 10 мкл DPBS 1X. Затем планшеты инкубировали еще 4 дня в инкубаторе. В конце инкубационного периода (D8) в каждую лунку добавляли 10 мкл раствора CCK-8 в соответствии с PO-CELL-004, и планшеты инкубировали в течение 4 часов. Оптическую плотность (OП) затем определяли при 450 нм с использованием ридера микропланшетов.
II.2. Внутренние контроли
Контроли осуществляли в двух экземплярах.
II.2.1. Лунки с холостым контролем
Как указано выше в Примере 1.
II.2.1. Контроль жизнеспособности (положительный контроль)
В качестве положительного контроля клеточной линии NCI-N87 (100% жизнеспособность клеток) клетки культивировали в культуральной среде (100 мкл) без L-аспарагиназы или МГЛ, но с 10 мкл разбавителя (DPBS 1X).
II.3. Определение жизнеспособности клеток
Как указано выше в Примере 1.
III. Результаты
III.1. Внутренний контроль
Внутренние контроли были приемлемыми, когда это не указывалось в необработанных данных.
III.2. Расчеты IC50 с L-аспарагиназой или МГЛ по отдельности
Процентное значение жизнеспособности клеток с лекарством по отдельности (МГЛ или L-аспарагиназой) контролировали в каждом эксперименте с комбинацией лекарств. Пятьдесят процентов жизнеспособности клеток ожидалось на половине анализа (D4), поскольку значение IC50, используемое здесь для ферментов, было предварительно оценено при одиночной обработке в D4.
III.2.1. Последовательное добавление L-аспарагиназы и МГЛ
Эксперимент с последовательной обработкой L-аспарагиназой и МГЛ выполняли дважды в двух экземплярах. В экспериментах были приняты все качественные контроли (холостой и положительный контроль).
Подробная информация о расчетах процентов жизнеспособности клеток и графическом представлении приведена ниже в таблице 7 и на фигуре 2.
Таблица 7: Жизнеспособность клеток (%) для контролей, и ассоциация ферментов
Результаты показывают, что ассоциация фермента с МГЛ, добавленной в дозе IC50 перед добавлением L-аспарагиназы в дозе IC50 (см. Фигуру 2) позволила снизить жизнеспособность клеток:
- на 55% по сравнению с IC50 L-аспарагиназы (IC50 контроль для L-аспарагиназы),
- на 44% по сравнению с МГЛ (IC50 контроль для МГЛ),
- на 43% по сравнению с ассоциацией с ферментом с L-аспарагиназой, добавленной вначале в дозе IC50.
IV. Заключение
Последовательная ассоциация ферментов показала, что смертность клеток может быть увеличена с добавлением МГЛ при дозе IC50, а затем через 4 дня с добавлением L-аспарагиназы при дозе IC50.
Можно предположить, что истощение метионина, вызванное ферментативной активностью МГЛ, делает клетки рака желудка NCI-N87 более чувствительными к активности L-аспарагиназы. Более того, роли L-аспарагиназы и МГЛ должны обсуждаться с учетом их известного соответствующего эффекта. Действительно, L-аспарагиназа, как известно, вызывает апоптоз в клетках лейкоза (Ueno et al., 1997), поэтому она, вероятно, может играть роль цитотоксического агента. МГЛ, известная тем, что блокирует деление клеток в фазе S или G2 клеточного цикла, скорее всего, действует как цитостатический агент.
Пример 8
I. Дополнительные сокращения
F12K: Среда F-12 Нam в модификации Kaighn
II. Условия эксперимента
II.1. Объект анализа
II.1.1. L-аспарагиназа
Описание: Medac® (Германия), E. Coli L-аспарагиназа, 10 000 МЕ.
Одну концентрацию L-аспарагиназы (2,97 МЕ/мл) готовили путем серийных разведений в фосфатно-солевом буфере Дульбекко (DPBS) 1X. L-аспарагиназу разбавляли в 11 раз до получения итоговой концентрации 0,27 МЕ/мл (IC50).
II.1.2. Метионин-γ-лиаза (МГЛ)
Описание: метионин-γ-лиаза (МГЛ) P. рutida, продуцируемая в E. сoli.
Одну концентрацию МГЛ (1,43 МЕ/мл) готовили путем серийных разведений в фосфатно-солевом буфере Дульбекко (DPBS) 1X. МГЛ разбавляли в 11 раз для получения итоговой концентрации 0,13 МЕ/мл (IC50).
II.2. Клеточные линии
II.2.1. Описание
Наименование: клеточная линия AGS
Описание: Клеточная линия аденокарциномы желудка человека (адгезивная)
Поставщик и справочный номер: ATCC, CRL-1739
II.2.2. Условия культивирования
Клетки культивировали в среде F12K с L-глутамином с добавлением 10 об.% эмбрирональной телячьей сыворотки, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина. Субкультивирование проводили в соответствии с PO-CELL-002 и PO-CELL-005.
II.2.3. Набор для колориметрии
Наименование: Набор для подсчета клеток-8 (CCK-8)
Поставщик и справочный номер: Fluka 96992
Принцип анализа: CCK-8 реагент содержит высоко растворимую в воде соль тетразолия WST-8. WST-8 восстанавливается дегидрогеназами в клетках с образованием продукта с желтой окраской (формазана), который растворим в среде для культивирования тканей. Количество красителя формазана, образуемого под действием дегидрогеназ, прямо пропорционально числу живых клеток.
Колориметрический анализ проводили в соответствии с PO-CELL-004.
III. Анализ цитотоксической активности
III.1. Метод
Одну тысячу клеток в 100 мкл/лунку распределяли в 96-луночных планшетах с плоским дном (см. число планшетов в необработанных данных). Кроме того, 2 лунки заполняли культуральной средой для холостого контроля на каждом планшете. Все пустые лунки заполняли культуральной средой, чтобы минимизировать испарение и конденсацию. В день 0 (D0) в соответствующие лунки добавляли 10 мкл IC50 концентраций L-аспарагиназы или МГЛ. В контроли (лунки с холостой пробой и контрольный планшет) вносили 10 мкл DPBS 1X. На 4-й день (D4) среду удаляли из лунок и заменяли свежей средой, и добавляли 10 мкл DPBS 1X или 10 мкл IC50 концентраций L-аспарагиназы (для клеток, ранее инкубированных с МГЛ) или МГЛ (для клеток, ранее инкубированных с L-аспарагиназой) в соответствующие лунки. В контроли (холостой и положительный контроль) вносили 10 мкл DPBS 1X. Затем планшеты инкубировали еще 4 дня в инкубаторе. В конце инкубационного периода (D8) в каждую лунку добавляли 10 мкл раствора CCK-8 в соответствии с PO-CELL-004, и планшеты инкубировали в течение 4 часов. Оптическую плотность (OП) затем определяли при 450 нм с использованием ридера микропланшетов.
III.2. Внутренние контроли
Контроли осуществляли в двух экземплярах.
III.2.1. Лунки с холостым контролем
Как указано выше в Примере 1.
III.2.2. Контроль жизнеспособности (положительный контроль)
В качестве положительного контроля клеточной линии AGS (100% жизнеспособность клеток) клетки культивировали в культуральной среде (100 мкл) без L-аспарагиназы или МГЛ, но с 10 мкл разбавителя (DPBS 1X).
III.3. Определение жизнеспособности клеток
Как указано выше в Примере 1.
IV. Результаты
IV.1. Внутренний контроль
Внутренние контроли были приемлемыми, когда это не указывалось в необработанных данных.
IV.2. Расчеты IC50 с L-аспарагиназой или МГЛ по отдельности
Процентное значение жизнеспособности клеток с лекарством по отдельности (МГЛ или L-аспарагиназой) контролировали в каждом эксперименте с комбинацией лекарств. Пятьдесят процентов жизнеспособности клеток ожидалось на половине анализа (D4), поскольку значение IC50, используемое здесь для ферментов, было предварительно оценено при одиночной обработке в D4.
IV.2.1. Последовательное добавление L-аспарагиназы и МГЛ
Эксперимент с последовательной обработкой L-аспарагиназой и МГЛ выполняли дважды в двух экземплярах. В экспериментах были приняты все качественные контроли (холостой и положительный контроль).
Подробная информация о расчетах процентов жизнеспособности клеток и графическом представлении приведена ниже в таблице 8 и на фигуре 3.
Таблица 8: Жизнеспособность клеток (%) для контролей, и ассоциация ферментов
Результаты показывают, что ассоциация фермента с МГЛ, добавленной в дозе IC50 перед добавлением L-аспарагиназы в дозе IC50 (см. Фигуру 3), позволила снизить жизнеспособность клеток:
- на 22% по сравнению с IC50 L-аспарагиназы (IC50 контроль для L-аспарагиназы),
- на 26% по сравнению с МГЛ (IC50 контроль для МГЛ),
- на 10% по сравнению с ассоциацией с ферментом с L-аспарагиназой, добавленной вначале в дозе IC50.
Более того, для точности, контроль IC50 для L-аспарагиназы или МГЛ (используемый и подтвержденный первоначально на D4) возвращался к 100% жизнеспособности клеток после 8 дней культивирования с возобновлением среды при D4/ половине теста. Действительно, оставшиеся жизнеспособные клетки в D4 могут вновь расти с добавлением «свежих» питательных веществ. Результаты были соответствующими для контролей IC50 (только фермент), где достигалась 50% жизнеспособность клеток при D4.
V. Заключение
Последовательная ассоциация ферментов показала, что смертность клеток может быть увеличена с добавлением МГЛ при дозе IC50, а затем через 4 дня с добавлением L-аспарагиназы при дозе IC50.
Можно предположить, что истощение метионина, вызванное ферментативной активностью МГЛ, делает клетки рака желудка AGS более чувствительными к активности L-аспарагиназы. Более того, роли L-аспарагиназы и МГЛ должны обсуждаться с учетом их известного соответствующего эффекта. Действительно, L-аспарагиназа, как известно, вызывает апоптоз в клетках лейкоза (Ueno et al., 1997), поэтому она, вероятно, может играть роль цитотоксического агента. МГЛ, известная тем, что блокирует деление клеток в фазе S или G2 клеточного цикла, скорее всего, действует как цитостатический агент.
Пример 9
I. Дополнительные сокращения
A.M.: до полудня
ERY-ASP: L-аспарагиназа, инкапсулированная в эритроцитах
ERY-MET: Метионин-гамма-лиаза, инкапсулированная в эритроцитах
ВЖ: внутрижелудочное введение (введение через зонд)
МЕ: Международная единица, соответствующая мкмоль/мин
ВВ: Внутривенное введение
НО: Не определено
PN: пиридоксин
ИРТ: ингибирование роста опухоли
II. Задача исследования in vivo
Цель этого исследования состоит в том, чтобы определить, может ли комбинация эритроцитов, нагруженных метиониназой (ERY-MET) с эритроцитами, нагруженными L-аспарагиназой (ERY-ASP), улучшить противоопухолевую активность, наблюдаемую только с помощью ERY-MET на мышиной модели подкожного ксенотрансплантата опухоли желудка NCI-N87.
III. Условия эксперимента
Клетки NCI-N87 культивировали в ERYTECH Pharma и готовили 5,107 клеток/мл в DPBS 1X для инъекций. Четырем группам из 10 или 12 самок мышей NMRI (группы 1, 2, 3 и 4) подкожно вводили клеточную линию при фиксированной концентрации 5,106/100 мкл. Применяли инъекции ERY-MET и ERY-ASP (внутривенно) по 108 МЕ/кг (8 мл/кг) и 200 МЕ/кг (4-5,4 мл/кг), соответственно. Группа 2 получила 3 инъекции ERY-MET на 7, 14 и 21 день. Группа 3 (ERY-ASP/ERY-MET) получила 1 инъекцию ERY-ASP на 7-й день, а затем 2 инъекции ERY-MET в дни 21 и 28. Группа 4 (ERY-MET/ERY-ASP) получила 2 инъекции ERY-MET на 7-й и 14-й дни, а затем 1 инъекцию ERY-ASP на 21-й день. Группе 1 вводили с консервирующим раствором ERY-MET (SAG-Маннитол/ плазма) по 8 мл/кг в дни 7, 14 и 21.
Пероральное введение (посредством зонда) кофактора PN выполняли через 6 часов после каждой инъекции ERY-MET (день 7 + 6 часов, день 15 + 6 часов, день 21 + 6 часов для группы 2; день 21 + 6 часов, день 28 + 6 часов для группы 3; день 7 + 6 часов, день 15 + 6 часов для группы 4) и один раз в день (A.M.) на другие дни (без введения ERY-MET) до 20-го дня (для группы 4), 27-го дня 27 (для группы 2) или 34-го дня (для группы 3).
IV. Результаты
Уменьшение объема опухоли, связанное с комбинацией ERY-MET/ERY-ASP, оказалось иным, чем при наблюдении у группы ERY-MET; действительно, на 37 день у мышей ERY-MET отмечался средний объем опухоли 298,3±36,2 мм3, а у мышей ERY-MET/ERY-ASP отмечался средний объем опухоли 189,7±29,8 мм3, что составляло, соответственно, 37% и 57% уменьшению среднего объема опухоли, в то время как у мышей, получающих растворитель (контроль) отмечался средний объем опухоли 441,5±56,6 мм3. Процент ингибирования роста опухоли (ИРТ*) рассчитывали для ассоциации ферментов ERY-MET/ERY-ASP по сравнению с контролем (группа с применением растворителя) или против группы ERY-MET, в соответствии со следующей формулой:

Результаты представлены ниже в таблице 9.
Таблица 9. Расчеты ИРТ для ассоциации ERY-MET/ERY-ASP
**Не определяется (несущественно) из-за низкой разницы в начале исследования (D7 является первым моментом времени, когда измеряли опухоль).
Чтобы оценить разницу между группами и эффективность лечения ERY-MET/ ERY-ASP по сравнению с ERY-MET по отдельности при опухолях желудка NCI-N87, проводили двухсторонний тест ANOVA с использованием программного обеспечения GraphPad Prism (версия 5.04) для оценки роста опухоли. Сравнительный анализ растворителя (контроль), ERY-MET и ERY-MET/ERY-ASP, показывающий значимость между группами в D37 с величиной P ниже 0,0001 (см. фигуру 4), продемонстрировал эффективность комбинации ERY-MET/ERY-ASP спустя 16 дней после последних инъекций для лечения опухолей желудка. При обратной схеме введения ERY-ASP/ ERY-MET лечения по сравнению с ERY-MET по отдельности при опухолях желудка NCI-N87 двухсторонний тест ANOVA (см. фигуру 4) не выявил достоверной разницы между группами в трех временных точках наблюдения, (D7/ D20/ D37) со значением P>0,05.
V. Заключение
ERY-MET объединяли с ERY-ASP с двумя схемами введения: 1-ERY-ASP (D7) -ERY-MET (D21/ D28) и 2-ERY-MET (D7/ D15) - ERY-ASP (D21). Положительный ответ по сравнению с ERY-MET, по-видимому, появляется, когда ERY-MET вводят (дважды) перед ERY-ASP. Эта достоверность результата подтверждается получением значения Р ниже 0,0001 на 37 день при измерении объема отдельных опухолей.
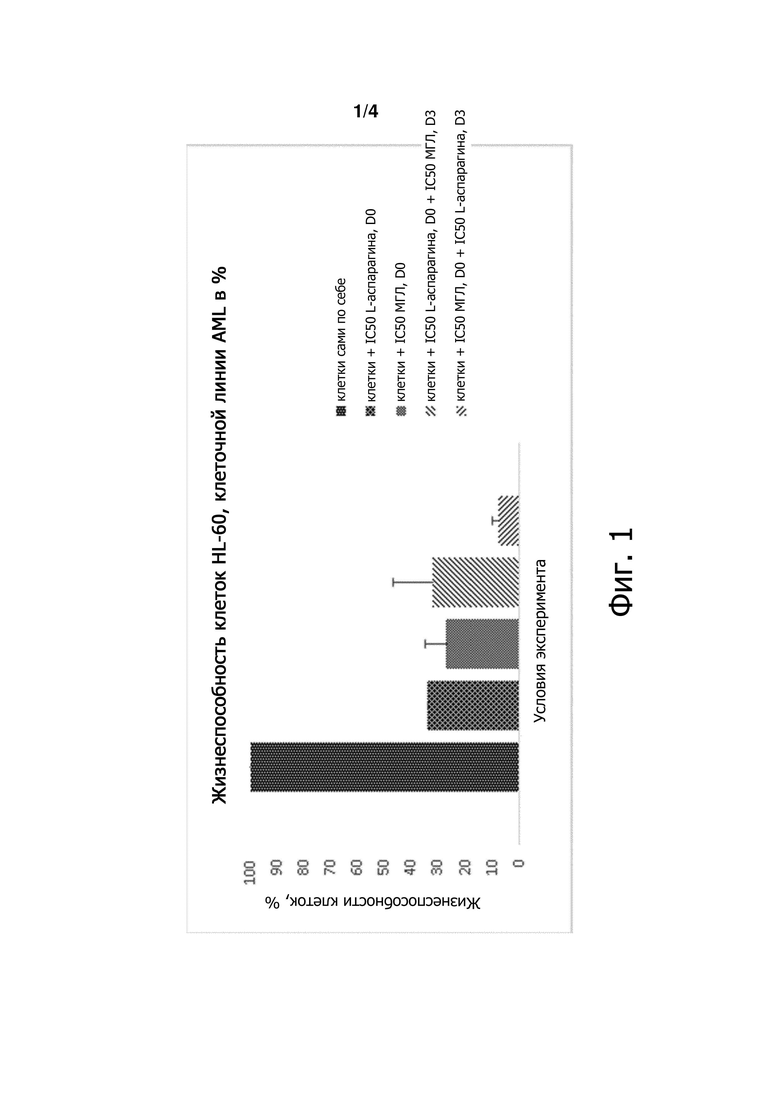
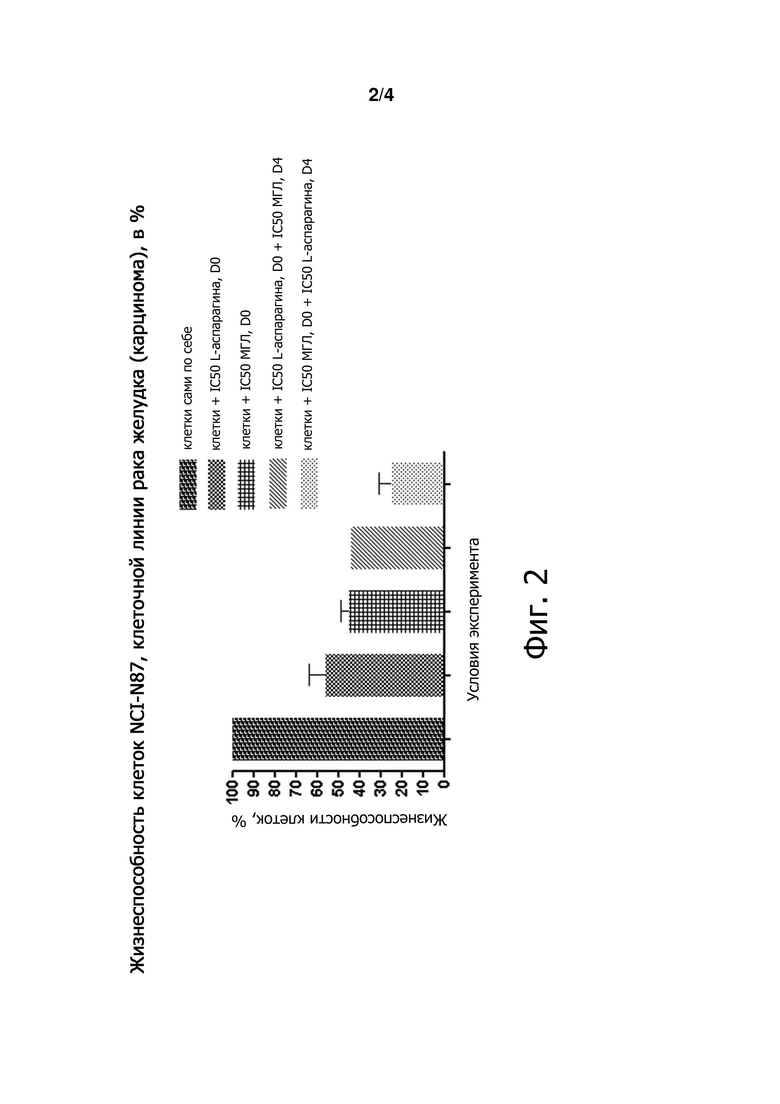
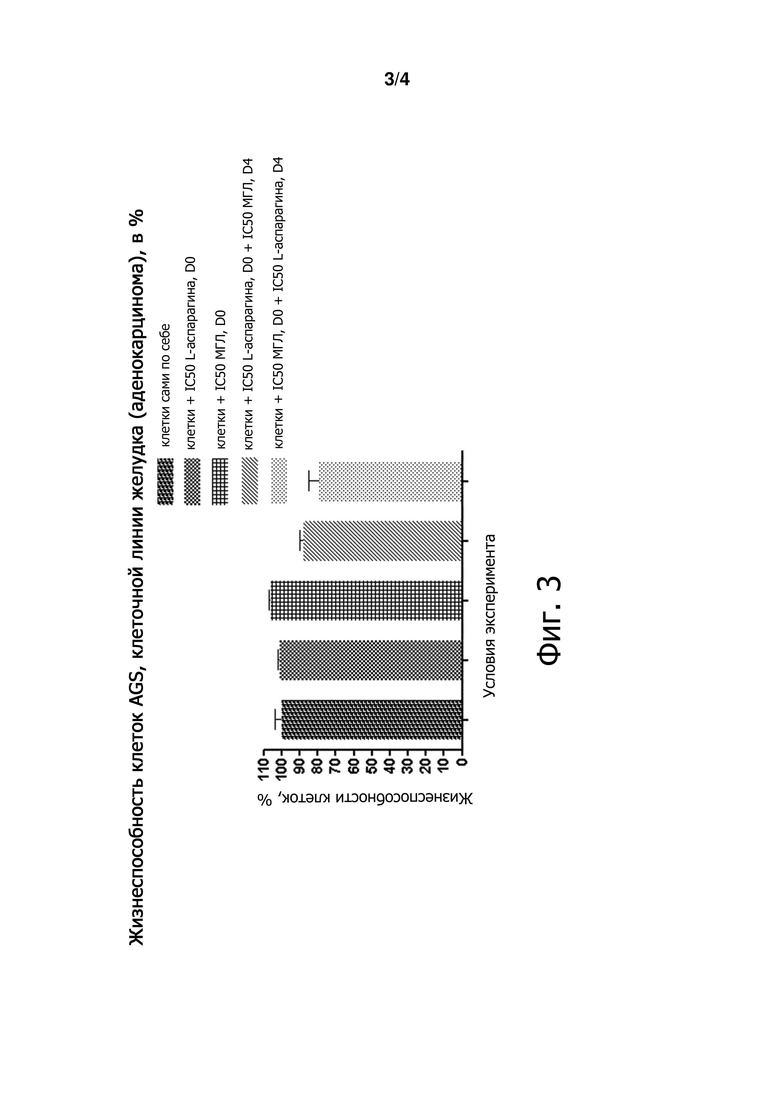
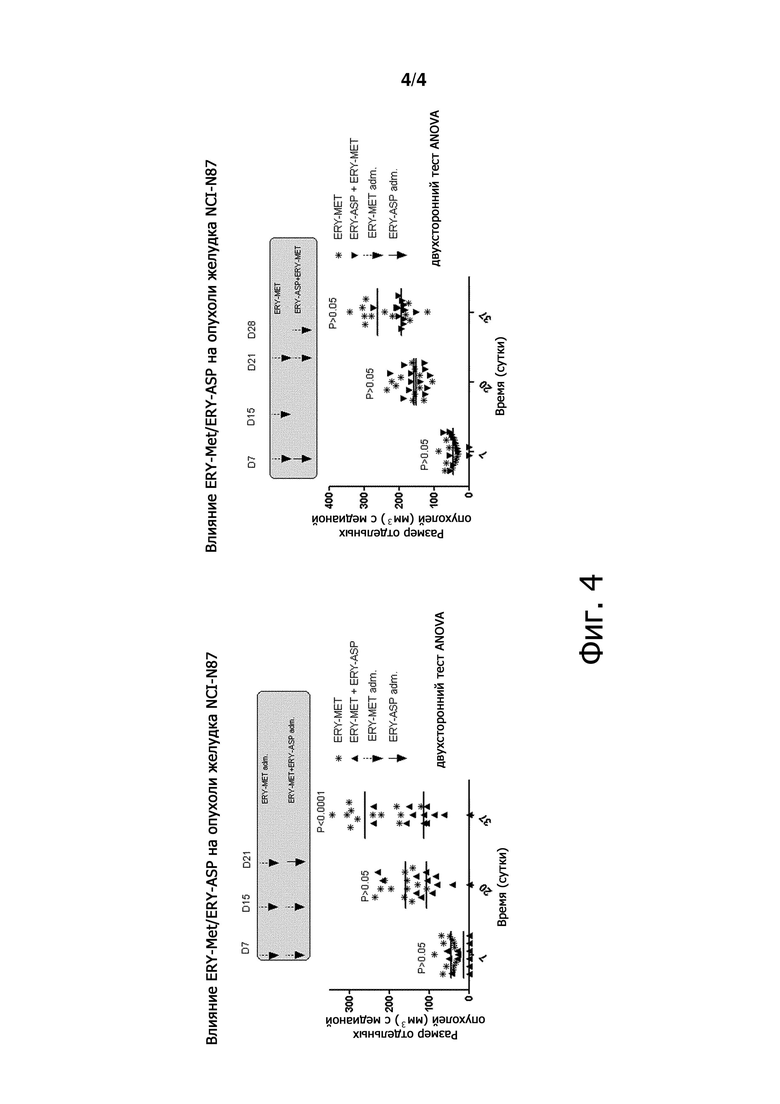
Группа изобретений относится к области медицины, а именно к применению набора для лечения рака у млекопитающего. Для этого используют аспарагиназу и метиониназу по меньшей мере для одного последовательного введения, где метиониназу вводят перед аспарагиназой. Группа изобретений также относится к применению фармацевтической композиции, включающей аспарагиназу, для лечения рака у млекопитающего, которому вводили метиониназу, а также к способу лечения рака у млекопитающего, нуждающегося в этом. Группа изобретений обеспечивает повышенную эффективность предлагаемого лечения комбинацией двух средств, вводимых по определенной схеме, по сравнению с введением каждого из этих средств по отдельности, или с введением этих же средств по другой схеме. 4 н. и 21 з.п. ф-лы, 4 ил., 9 табл., 9 пр.
1. Применение набора для лечения рака у млекопитающего, включающего аспарагиназу и метиониназу по меньшей мере для одного последовательного введения, где метиониназу вводят перед аспарагиназой.
2. Применение по п.1, где метиониназа и аспарагиназа находятся в свободной форме, пэгилированной форме или инкапсулированы внутри эритроцитов.
3. Применение по п.1, где метиониназа находится в свободной форме или в пэгилированной форме, а интервал между окончанием введения метиониназы и началом введения аспарагиназы составляет от 1 часа до 7 суток, в частности, от 3 часов до 6 суток, предпочтительно от 1 суток до 5 суток.
4. Применение по п.1, где метиониназа инкапсулирована в эритроцитах, а интервал между окончанием введения метиониназы и началом введения аспарагиназы составляет от 1 часа до 30 суток, в частности, от 1 суток до 20 суток, предпочтительно от 1 суток до 10 суток.
5. Применение по любому из предыдущих пунктов, где метиониназу вводят один или несколько раз в количестве от 100 до 100 000 МЕ, в частности, от 500 до 50 000 МЕ, предпочтительно от 500 до 5000 МЕ.
6. Применение по любому из предыдущих пунктов, где аспарагиназу вводят один или несколько раз в количестве от 500 до 100 000 МЕ, в частности, от 1000 до 50 000 МЕ, предпочтительно от 5000 до 30 000 МЕ.
7. Применение фармацевтической композиции, включающей аспарагиназу, для лечения рака у млекопитающего, которому вводили метиониназу, где интервал между окончанием введения метиониназы и началом введения аспарагиназы составляет от 1 часа до 30 суток.
8. Применение по п.7, где интервал между введением метиониназы и введением аспарагиназы составляет от 1 часа до 7 суток, в частности, от 3 часов до 6 суток, предпочтительно от 1 суток до 5 суток.
9. Применение по п.7, где интервал между введением метиониназы и введением аспарагиназы составляет от 1 часа до 30 суток, в частности, от 1 суток до 20 суток, предпочтительно от 1 суток до 10 суток.
10. Применение по любому из пп.7-9, где метиониназу вводят один или несколько раз в количестве от 100 до 100 000 МЕ, в частности, от 500 до 50 000 МЕ, предпочтительно от 500 до 5000 МЕ.
11. Применение по любому из пп.7-10, где аспарагиназу вводят один или несколько раз в количестве от 500 до 100 000 МЕ, в частности, от 1000 до 50 000 МЕ, предпочтительно от 5000 до 30 000 МЕ.
12. Применение по любому из пп.1-11, дополнительно предусматривающее введение пиридоксальфосфата или предшественника пиридоксальфосфата одновременно, отдельно или последовательно с метиониназой.
13. Применение по п.12, где отдельно или последовательно вводится метиониназа, инкапсулированная внутри эритроцитов, и нефосфатный предшественник пиридоксальфосфата.
14. Применение по любому из пп.1-11, где метиониназа, инкапсулированная внутри эритроцитов, вводится по меньшей мере один раз или два раза перед введением аспарагиназы, инкапсулированной в эритроцитах, и каждое введение метиониназы сопровождается последующим введением раствора нефосфатного предшественника пиридоксальфосфата перед введением аспарагиназы.
15. Применение по любому из предыдущих пунктов для лечения гемобластозов или солидных опухолей.
16. Применение по п.15 для лечения лейкоза или рака желудка.
17. Способ лечения рака у млекопитающего, нуждающегося в этом, включающий введение млекопитающему, нуждающемуся в этом, композиции, включающей метиониназу, а затем композиции, содержащей аспарагиназу.
18. Способ лечения рака у млекопитающего, нуждающегося в этом, включающий введение млекопитающему, нуждающемуся в этом, композиции, включающей метиониназу, инкапсулированную внутри эритроцитов, а затем композиции, содержащей аспарагиназу, инкапсулированную внутри эритроцитов.
19. Способ по п.18, где интервал между окончанием введения метиониназы и началом введения аспарагиназы составляет от 1 часа до 30 суток.
20. Способ по п.18, где метиониназу вводят один или несколько раз в количестве от 100 до 100 000 МЕ.
21. Способ по п.18, где аспарагиназу вводят один или несколько раз в количестве от 500 до 100 000 МЕ.
22. Способ по п.18, где метиониназу, инкапсулированную внутри эритроцитов, вводят по меньшей мере один или два раза перед введением аспарагиназы, инкапсулированной внутри эритроцитов, и каждое введение метиониназы сопровождается введением пиридоксальфосфата или предшественника пиридоксальфосфата перед введением аспарагиназы.
23. Способ по п.22, где раствор нефосфатного предшественника пиридоксальфосфата вводят один или несколько раз после каждого введения инкапсулированной метиониназы.
24. Способ по п.23, где раствор нефосфатного предшественника пиридоксальфосфата вводят один раз в сутки, или два или больше раз в сутки, во время лечения метиониназой.
25. Способ по п.18, где рак является лейкозом или раком желудка.
| US 20100284982 A1, 11.11.2010 | |||
| WO 1996040284 A1, 19.12.1996 | |||
| US 20150086521 A1, 26.03.2015 | |||
| WO 2015042204 A1, 26.03.2015. |
Авторы
Даты
2020-10-01—Публикация
2017-01-02—Подача