Область техники
Настоящее изобретение относится к новым изоформам трипсина ZT. В частности, изобретение относится к применению изоформ трипсина ZT в медицинских устройствах, фармацевтических препаратах и косметике.
Уровень техники
Протеиназы представляют собой ферменты, которые определяются их способностью расщеплять белки. Протеиназы могут расщеплять субстраты в разных аминокислотных остатках в последовательности белка, демонстрируя разницу в субстратной специфичности. Трипсины представляют собой протеиназы и отчасти определяются по их предпочтениям в расщеплении C-конца на остатки аргинина или лизина (Olsen, Ong et al., 2004, Mol Cell Proteomics 3: 608-614). Метод множественного профилирования субстратов выявляет сайты расщепления протеиназ и раскрывает критическую важность остатков, окружающих сайт, их расщепления по их специфичности (O'Donoghue, Eroy-Reveles et al., 2012, Nat Methods 9: 1095-1100).
В патентах США №4801451 и 4963991 описана смесь экзо- и эндопептидаз, выделенных из антарктического криля (Euphasia superba), и применение этой смеси в качестве очищающего раствора. В 4801451 описано применение таких ферментов для удаления посторонних веществ и мертвой ткани из ран. В WO 85/04809 описано применение ферментов криля в качестве агента, способствующего пищеварению. В ЕР-A1-0170115 описано применение ферментов криля для растворения сгустков крови. Однако все эти ссылки раскрывают неочищенные или плохо охарактеризованные материалы. Для получения фармацевтически полезного продукта желательна очищенная пептидаза или смесь очищенных пептидаз.
В WO 96/24371 описано применение многофункционального протеолитического фермента, полученного из криля, и семейства протеолитических ферментов, полученных из ракообразных и рыбы, имеющих структурное сходство с многофункциональным ферментом, полученным из антарктического криля. Документ также относится к способам очистки многофункционального фермента и к фармацевтическим, косметическим и другим применениям многофункционального фермента. Структурное сходство с многофункциональным ферментом, полученным из антарктического криля, определено в этом документе как по меньшей мере 70% гомологии с многофункциональной гидролазой, полученной из криля.
В WO 2000078332 описано применение трипсинов, полученных из трески и химотрипсинов в фармацевтических композициях или медикаментах для локального и местного применения для лечения внутренних заболеваний и расстройств и косметического применения таких ферментов. Было установлено, что местное применение для лечения локальных, внутренних расстройств без фермента, проникающего через открытые раны или слизистую, является эффективным. Сериновые протеиназы, описанные в WO 2000078332, представляют собой протеиназы, которые имеют гомологию по меньшей мере 90% аминокислот с трипсином I, трипсином II, трипсином III, трипсином IV, полученными из атлантической трески, и протеиназы, которые представляют собой химотрипсин, имеющий гомологию по меньшей мере 90% аминокислотной последовательности с любым из химотрипсина А и химотрипсина В, выделенных из атлантической трески.
Комплементарную ДНК (кДНК), кодирующую трипсин Y, выделяли из библиотеки кДНК атлантической трески (Spilliaert and Gudmundsdottir, 1999, Mar Biotechnol (NY) 1: 598-607). Трипсин Y трески имеет примерно 45 % идентичности с двумя трипсинами I и X атлантической трески (WO 2000078332). Ранее были описаны нативный трипсин Y и рекомбинантные формы трипсина Y (Palsdottir and Gudmundsdottir, 2007, Protein Expr Purif 51: 243-252, Palsdottir и Gudmundsdottir, 2008, Chemistry Food 111: 408-414).
Краткое описание сущности изобретения
Настоящее изобретение относится к новым изоформам трипсина, которые называются изоформами трипсина ZT. Такие изоформы, полученные из рыб, таких как атлантическая треска, или могут быть получены в рекомбинантной форме с применением белковых экспрессирующих систем. Кроме того, настоящее изобретение относится к композициям, содержащим по меньшей мере одну изолированную изоформу трипсина ZT трески согласно изобретению вместе с подходящими эксципиентами и носителями.
Изобретатели идентифицировали неожиданные, полезные и уникальные характеристики новых изоформ трипсина ZT по сравнению с трипсинами, известными ранее. Эти характеристики дают преимущество в применении изоформ трипсина ZT для различных применений в медицинских устройствах, фармацевтических препаратах и косметике. В настоящем изобретении предложены изоформы трипсина ZT per se и для применения при лечении или профилактике заболеваний, вызываемых патогенными организмами. Это особенно важно для применения при лечении или профилактике заболевания верхних дыхательных путей, вызванных патогенными микроорганизмами. С этой целью, изоформы трипсина ZT можно, например, использовать в медицинских устройствах или в качестве активного ингредиента(ов) в лекарственном препарате. Кроме того, в настоящем изобретении предложены указанные изоформы трипсина ZT для применения при лечении раневых инфекций и ран от ожогов, для применения при удалении мертвой или шелушившейся кожи с оставшейся здоровой кожи, например, в медицинском устройстве, в качестве лекарственного препарата или в виде косметики. Кроме того, настоящее изобретение относится к способам получения изоформ трипсина ZT трески по настоящему изобретению.
- Основываясь на множественном профилировании субстратов, изоформы трипсина ZT предпочитают расщепление на остатках Arg по сравнению с трипсином I. Трипсин I предпочитает расщепление на остатках Lys по сравнению с изоформами трипсина ZT.
- Множественное профилирование субстратов показывает, что различные аминокислотные остатки в субстрате, окружающем сайт расщепления, оказывают большое влияние на расщепление (около четырех аминокислотных остатков на N-концевой стороне и около четырех аминокислотных остатков на C-концевой стороне). Изоформы трипсина ZT предпочитают определенные аминокислотные остатки, окружающие сайт расщепления по сравнению с трипсином I.
- Богатые аргинином и лизином аминокислотные последовательности часто встречаются в вирусных, бактериальных и паразитных последовательностях, которые связаны с инфекцией.
- Числовые значения, основанные на стандартном значении баллов (Z-оценка) (данные множественного профилирования субстратов), показывают, что изоформы трипсина ZT гораздо лучше адаптированы для расщепления пептидов, содержащих несколько последовательных основных аминокислотных остатков (Arg и Lys) по сравнению с трипсином I. Основываясь на данных, изоформы трипсина ZT могут действовать как антимикробные агенты против вирусов и бактерий, поскольку они могут расщепляться в кластеризованных основных аминокислотных остатках, таких как лизин и аргинин.
Подробное описание сущности изобретения
Настоящее изобретение относится к новым изоформам трипсина, которые называются изоформами трипсина ZT. Такие изоформы, полученные из рыб, таких как атлантическая треска, или могут быть получены в рекомбинантной форме с применением белковых экспрессирующих систем. Настоящее изобретение относится к применению таких изоформ трипсина ZT для лечения и профилактики заболеваний и для косметической области. В частности, изобретение относится к новым изоформам трипсина ZT атлантической трески, пригодным в качестве лекарственных средств, в медицинских устройствах и косметике.
Краткое описание графических материалов
На фиг. 1 показана изоляция изоформ трипсина ZT анионообменной хроматографией. Хроматограмма из разделения MonoQ бензамидин-очищенных изоформ трипсина трески, показавших поглощение при 280 нм по сравнению с объемом элюирования. Изоформы трипсинов трески были загружены в колонку MonoQ и белки, элюированные градиентом соли (пунктирная линия). Стрелка показывает пик, содержащий изоформы трипсина ZT. Колонку уравновешивали буфером (20 мМ Трис, 10 мМ CaCl2, pH 8,0) и ферменты элюировали линейным 0-150 мМ градиентом NaCl в 40 объемах колонки, линейным 150-620 мМ NaCl в 6 объемах колонки, 620-850 мМ NaCl в 10 объемах колонки при скорости потока 1 мл/мин.
На фиг. 2 показан SDS-PAGE изоформ трипсина ZT трески. SDS-PAGE анализ пика анионообменной хроматографии, помеченного трипсином ZT, из фиг. 1. Трипсин 1, трипсин 5 и трипсин 7 очищают и выделяют изоформы трипсина X трески. Трипсин Х трески тесно связан с трипсином I трески, отличается на около восемь аминокислотных остатков. Белки разделяли SDS-PAGE и окрашивали гелем серебра. Полосы и цифры слева показывают миграцию и молекулярную массу в кДа стандартных белков (Dalton Mark VII-L), разделенных на геле.
На фиг. 3 показан анализ вестерн-блоттинга трипсина X трески (трипсин 1, трипсин 5 и трипсин 7) и изоформы трипсина ZT. Трипсин X трески и изоформы трипсина ZT подвергали SDS-PAGE. После переноса, образцы иммуноблотировали трипсином I/X (верхние изображения) и изоформой трипсина ZT (нижние изображения), реагирующие с антителами. Это демонстрирует, что изоформы трипсина ZT отделяли от трипсина I/X, используя анионный обмен. Как можно видеть на фиг. 3, поликлональное антитело, которое реагирует с изоформами трипсина ZT, не реагирует перекрестно с трипсином I/X, а пептидное антитело, индуцированное против трипсина I/X, не реагирует перекрестно с изоформами трипсина ZT.
На фиг. 4 показана диаграмма Венна, иллюстрирующая общие и уникальные расщепления, генерируемые трипсином ZT и трипсином I в трех разных временных точках в анализе множественного профилирования субстрата. Количество общих (черный) и уникальных сайтов расщепления трипсина ZT (белый слева) и трипсина I (белый справа) после инкубации в течение 5 мин. (А), 15 мин. (В) и 60 мин (С). На фигуре показано, что во всех временных точках в библиотеке имеются общие сайты расщепления и уникальные сайты расщепления для трипсина ZT и трипсина I в 124 определенных пептидах (каждый из которых содержит 14 аминокислотных остатков). Данные демонстрируют, что субстратная специфичность трипсина ZT отличается от субстратной специфичности трипсина I.
На фиг. 5 показана антивирусная активность трипсина ZT против энтеровируса (Coxsackievirus B2). Ось Y показывает процент инфицированных лунок по сравнению с контролем, а ось X показывает контроль (левая полоса) и обработку изоформами трипсина ZT (правая полоса).
Авторы идентифицировали новые изоформы трипсина, называемые изоформами трипсина ZT. Трипсин ZT включает по меньшей мере следующие изоформы: Изоформы трипсина ZT-1 атлантической трески, изоформы трипсина ZT-2 атлантической трески, изоформы трипсина ZT-3 атлантической трески и изоформы трипсина ZT-4 атлантической трески. Все четыре изоформы трипсина ZT атлантической трески имеют сходную молекулярную массу около 25 кДа. Изоформы трипсина ZT атлантической трески по настоящему изобретению представлены следующими аминокислотными последовательностями:
SEQ ID NO: 1
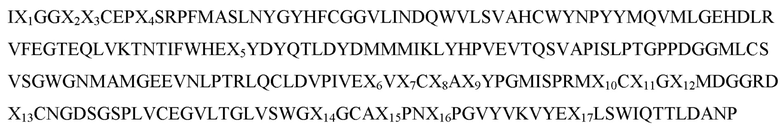
где
X1 выбран из I и V;
X2 выбран из Q и H;
X3 выбран из D и E;
X4 выбран из R и N;
X5 представляет собой L;
X6 выбран из T и P;
X7 выбран из D и A;
X8 выбран из E и Q;
X9 выбран из A и S;
X10 выбран из V и M;
X11 выбран из A и V;
X12 выбран из Y и F;
X13 выбран из A и V;
X14 выбран из Q и R;
X15 выбран из L и E;
X16 выбран из Y и S; и
X17 выбран из Y и F.
SEQ ID NO: 2 Изоформа трипсина ZT-1 атлантической трески
IVGGHECEPNSRPFMASLNYGYHFCGGVLINDQWVLSVAHCWYNPYYMQVMLGEHDLRVFEGTEQLVKTNTIFWHELYDYQTLDYDMMMIKLYHPVEVTQSVAPISLPTGPPDGGMLCSVSGWGNMAMGEEVNLPTRLQCLDVPIVEPVACQASYPGMISPRMMCVGFMDGGRDVCNGDS GSPLVCEGVLTGLVSWGRGC AEPNSPGVYVKVYEFLSWIQTTLDANP
SEQ ID NO:3 Изоформа трипсина ZT-2 атлантической трески
IVGGHECEPNSRPFMASLNYGYHFCGGVLINDQWVLSVAHCWYNPYYMQVMLGEHDLRVFEGTEQLVKTNTIFWHELYDYQTLDYDMMMIKLYHPVEVTQSVAPISLPTGPPDGGMLCSVSGWGNMAMGEEVNLPTRLQCLDVPIVETVDCEAAYPGMISPRMVCAGYMDGGRDACNGDS GSPLVCEGVLTGLVSWGQGC ALPNYPGVYVKVYEYLSWIQTTLDANP
SEQ ID NO:4 Изоформа трипсина ZT-3 атлантической трески
IIGGQDCEPRSRPFMASLNYGYHFCGGVLINDQWVLSVAHCWYNPYYMQVMLGEHDLRVFEGTEQLVKTNTIFWHELYDYQTLDYDMMMIKLYHPVEVTQSVAPISLPTGPPDGGMLCSVSGWGNMAMGEEVNLPTRLQCLDVPIVEPVACQASYPGMISPRMMCVGFMDGGRDVCNGDS GSPLVCEGVLTGLVSWGRGCAEPNSPGVYV KVYEFLSWIQTTLDANP
SEQ ID NO:5 Изоформа трипсина ZT-4 атлантической трески
IIGGQDCEPRSRPFMASLNYGYHFCGGVLINDQWVLSVAHCWYNPYYMQVMLGEHDLRVFEGTEQLVKTNTIFWHELYDYQTLDYDMMMIKLYHPVEVTQSVAPISLPTGPPDGGMLCSVSGWGNMAMGEEVNLPTRLQCLDVPIVETVDCEAAYPGMISPRMVCAGYMDGGRDACNGDSGSPLVCEGVLTGLVSWGQGC ALPNYPGVYVKVYEYLSWIQTTLDANP
Изоформы ZT трипсина по настоящему изобретению имеют идентичность менее чем 50 % аминокислот с трипсинами, описанными в WO 2000078332, и менее чем 45 % гомологии с химотрипсинами, описанными в WO 2000078332.
Вышеуказанные изоформы трипсина ZT представляют собой активные варианты этих трипсинов, то есть варианты, которые были активированы, когда N-конец трипсинов был отщеплен. Эти трипсины представляют собой белки, экспрессированные в пилорическом слепом отростке (ткань поджелудочной железы у рыб) с рядом аминокислот на конце N-конца, которые важны для секреции из клеток и для поддержания фермента в неактивном состоянии. Полноразмерные изоформы трипсина ZT также описаны в данном документе как
SEQ ID NO: 19 Нерасщепившаяся изоформа трипсина ZT-1 атлантической трески
MIGLALLMLLGAAAAAVPRDVGKIVGGHECEPNSRPFMASLNYGYHFCGGVLINDQWVLSVAHCWYNPYYMQVMLGEHDLRVFEGTEQLVKTNTIFWHELYDYQTLDYDMMMIKLYHPVEVTQSVAPISLPTGPPDGGMLCSVSGWGNMAMGEEVNLPTRLQCLDVPIVEPVACQASYPGMISPRMMCVGFMDGGRDVCNGDSGSPLVCEGVLTGLVSWGRGCAEPNSPGVYVKVYEFLSWIQTTLDANP
SEQ ID NO: 20 Нерасщепившаяся изоформа трипсина ZT-2 атлантической трески
MIGLALLMLLGAAAAAVPRDVGKIVGGHECEPNSRPFMASLNYGYHFCGGVLINDQWVLSVAHCWYNPYYMQVMLGEHDLRVFEGTEQLVKTNTIFWHELYDYQTLDYDMMMIKLYHPVEVTQSVAPISLPTGPPDGGMLCSVSGWGNMAMGEEVNLPTRLQCLDVPIVETVDCEAAYPGMISPRMVCAGYMDGGRDACNGDSGSPLVCEGVLTGLVSWGQGCALPNYPGVYVKVYEYLSWIQTTLDANP
SEQ ID NO: 21 Нерасщепившаяся изоформа трипсина ZT-3 атлантической трески
MIGLALLMLLGAAAAVPREDGRIIGGQDCEPRSRPFMASLNYGYHFCGGVLINDQWVLSVAHCWYNPYYMQVMLGEHDLRVFEGTEQLVKTNTIFWHELYDYQTLDYDMMMIKLYHPVEVTQSVAPISLPTGPPDGGMLCSVSGWGNMAMGEEVNLPTRLQCLDVPIVEPVACQASYPGMISPRMMCVGFMDGGRDVCNGDSGSPLVCEGVLTGLVSWGRGCAEPNSPGVYVKVYEFLSWIQTTLDANP
SEQ ID NO: 22 Нерасщепившаяся изоформа трипсина ZT-4 атлантической трески
MIGLALLMLLGAAAAVPREDGRIIGGQDCEPRSRPFMASLNYGYHFCGGVLINDQWVLSVAHCWYNPYYMQVMLGEHDLRVFEGTEQLVKTNTIFWHELYDYQTLDYDMMMIKLYHPVEVTQSVAPISLPTGPPDGGMLCSVSGWGNMAMGEEVNLPTRLQCLDVPIVETVDCEAAYPGMISPRMVCAGYMDGGRDACNGDSGSPLVCEGVLTGLVSWGQGCALPNYPGVYVKVYEYLSWIQTTLDANP
Множественное профилирование субстратов используется для анализа субстратной специфичности ферментов (протеиназ) (O'Donoghue, Eroy-Reveles et al., 2012, Nat Methods 9: 1095-1100). Протеиназы могут расщеплять субстраты на разных аминокислотных остатках в пептидной последовательности, демонстрируя разницу в субстратной специфичности. Трипсины определяются по их предпочтениям в расщеплении C-конца на остатки аргинина или лизина. Неожиданно множественное профилирование субстрата на изоформы трипсина ZT показало, что аминокислоты, окружающие аргинин или лизин в субстрате, оказывают различное влияние на его расщепление по сравнению с трипсином I. Короче говоря, изоформы трипсина ZT или трипсин I инкубировали (5, 15 и 60 мин.) с библиотекой пептидов (124 определенных пептида, 14-мерных последовательностей, всего 1612 пептидных связей) с обширным физико-химическим разнообразием (O'Donoghue, Eroy-Reveles et al., 2012, Nat Methods 9: 1095-1100). После инкубации сайты расщепления идентифицировали с помощью масс-спектрометрического анализа. Результаты представлены в следующих примерах и показывают, что существует множество сайтов расщепления, уникальных для трипсина ZT, в сравнении с трипсином I. Кроме того, были идентифицированы сайты расщепления, которые показали предпочтительное расщепление изоформами трипсина ZT по сравнению с трипсином I. Кроме того, новые изоформы трипсина ZT имеют различную субстратную специфичность по сравнению с трипсином I, описанным в WO 2000078332. Эти результаты были неожиданными. На основании результатов анализа множественного профилирования субстрата была создана таблица, содержащая числовые значения, основанные на стандартном значении баллов (Z-оценка) в положениях P4-P4' в субстрате, где субстрат специфичный трипсину ZT сравнивался с трипсином I. Положительные значения (Z-оценка) отражают предпочтение аминокислотного остатка в определенной позиции P в пользу изоформ трипсина ZT по сравнению с трипсином I.
Изоформы трипсина ZT обладают специфическими антимикробными свойствами. На основе значений, полученных и представленных в примерах, можно видеть, что изоформы трипсина ZT гораздо лучше адаптированы в расщепляемых пептидах, содержащих несколько последовательных положительно заряженных остатков (аргинин или лизин) по сравнению с трипсином I. Эти типы последовательностей (лизин- и аргининобогащенные аминокислотные последовательности) зачастую обнаруживаются в вирусных белках (Suzuki, Orba et al., 2010, PLoS Pathog 6: e1000801, Jiang, Cun et al., 2012, J Virol 86: 7256-7267, Gallaher and Garry, 2015, Viruses 7: 285-305).
Виропорины представляют собой группу белков, которые взаимодействуют с плазматическими мембранами, изменяя проницаемость, и могут способствовать высвобождению вирусных частиц. Кластеризованные остатки лизина и/или аргинина важны для активности виропоринов. Основываясь на анализе множественного профилирования субстратов, изоформы трипсина ZT могут выступать в качестве противовирусных агентов против РНК вирусов, поскольку они могут расщеплять эти кластеризованные основные аминокислотные остатки. Виропорины описаны как присутствующие в ряде семейств вирусов, включая Flaviviridae, Picornaviridae, Retroviridae, Coronaviridae, Reoviridae и Paramyxoviridae (Royle, Dobson et al., 2015, Viruses 7: 5375-5387). Исследования показали, что основные остатки лизин или аргинин в виропоринах являются критическим требованием для их функции. Большинство виропоринов были идентифицированы в РНК-вирусах. Вирусы, содержащие виропорины, богатые лизином и аргинином, которые были бы мишенью для изоформ трипсина ZT, включают вирус иммунодефицита человека (ВИЧ), ротавирус, Эбола, вирус Рестон (RESTV), вирус Лловиу (LLOV), вирус Судан (SUDV), Бундибугио (BDBV), вирус леса Тай (TAFV) (Suzuki, Orba et al., 2010, PLoS Pathog 6: e1000801, Gallaher and Garry, 2015, Viruses 7: 285-305).
Виропорины встречаются в широком спектре ДНК- и РНК-вирусов, таких как Paramecium bursaria chlorella вирус 1, simian virus 40 (SV40), человеческая полиома JC (JCV), коронарный вирус тяжелого острого респираторного синдрома (SARS-CoV) (Kang, Moroni et al., 2004, Proc Natl Acad Sci USA 101: 5318-5324, Liao, Tam et al., 2006, Adv Exp Med Biol 581: 199-202, Daniels, Sadowicz et al., 2007, PLoS Pathog 3: e98).
Недавно были идентифицированы высокоосновные вирусные белки, называемые агнопротеинами, из ДНК-вирусов, таких как семейства Polyomaviridae и Papillomaviridae (Royle, Dobson et al., 2015, Viruses 7: 5375-5387). Эти белки показывают ряд характеристик виропорина. Сохраненные последовательности были идентифицированы в агнопротеинах, которые содержат ряд кластеризованных основных аминокислотных остатков (Royle, Dobson et al., 2015, Viruses 7: 5375-5387). Основываясь на анализе множественного профилирования субстратов, изоформы трипсина ZT могут выступать в качестве противовирусных агентов против ДНК-вирусов, поскольку они могут расщеплять эти кластерные основные аминокислотные остатки (Royle, Dobson et al., 2015, Viruses 7: 5375-5387).
Многие вирусы и бактерии разработали механизмы для проникновения в клетки с применением пептидов проникновения в клетки или белков (Milletti, 2012, Drug Discov Today 17: 850-860). Вирусы включают пестивирусы семейства Flaviviridae, вирус герпеса (HSV-1), вирус иммунодефицита человека (ВИЧ-1, гепатит B и респираторно-синцитиальный вирус человека (RSV) (Elliott and O'Hare, 1997, Cell 88: 223-233, Oess and Hildt, 2000, Gene Ther 7: 750-758, Langedijk, 2002, J Biol Chem 277: 5308-5314, Langedijk, Olijhoek et al., 2005, International Congress Series 1277: 95-107, Lu, Tager et al., 2006, Anal Biochem 353: 7-14, Godet, Guergnon et al., 2010, PLoS One 5: e13760). Кроме того, эти типы белков были обнаружены у бактерий, таких как Mycobacterium tuberculosis (Lu, Tager et al., 2006, Anal Biochem 353: 7-14). Пептиды проникновения в клетку (СРР) имеют общее то, что они богаты основными аминокислотными остатками, особенно аргининами (Milletti, 2012, Drug Discov Today 17: 850-860). Порины представляют собой белки наружной мембраны, которые играют решающую роль в бактериальной патогенности и для защиты, и являются по этой причине полезными целями для терапии (Galdiero, Falanga et al., 2012, Curr Protein Pept Sci 13: 843-854). Эти белки часто содержат последовательные аминокислотные остатки аргинина. Основываясь на анализе множественного профилирования субстратов, изоформы трипсина ZT могут выступать в качестве противомикробных агентов против вирусов и бактерий, поскольку он способен расщеплять кластеризованные основные аминокислотные остатки.
Паразиты зависят от детерминантов вирулентности, таких как белки, содержащие богатые аргинином домены, например Toxoplasma gondii (Fentress, Steinfeldt et al., 2012, Cell Microbiol 14: 1921-1933). Анализ множественного профилирования субстрата показал, что изоформы трипсина ZT будут полезны против паразитов, действуя против таких белков.
Средство поиска основного локального выравнивания (BLAST) использовалось для поиска некоторых из уникальных и предпочтительных аминокислотных последовательностей, расщепленных изоформами трипсина ZT. Результаты поиска показали, что эти типы последовательностей обнаруживаются во многих патогенах, включая вирусы (например, из семейства вирусов Paramyxoviridae и Coronaviridae), бактерии (например, род Haemophilus) и паразиты (например, род Plasmodium). Семейство Paramyxoviridae включает вирусы, такие как респираторно-синцитиальный вирус (RSV) и вирусы паравирусов человека и вирусы, которые вызывают эпидемический паротит и корь. Семейство Coronaviridae включает вирусы, которые вызывают тяжелый острый респираторный синдром (SARS).https://en.wikipedia.org/wiki/Severe_Acute_Respiratory_Syndrome Род бактерий Haemophilus включает Haemophilus parainfluenzae, который связан с эндокардитом, менингитом и бактериемией. Род Plasmodium включает Plasmodium falciparum, который вызывает малярию.
Под фразой «медицинское устройство» понимается, но не ограничивается ими, любой инструмент, аппарат, устройство, программное обеспечение, материал или другая статья с целью диагностики, профилактики, мониторинга, лечения или облегчения болезни, такая как диагностика, мониторинг, лечение, облегчение или компенсацию; для травмы или дефекта, такая как исследование, замена или модификация анатомии или физиологического процесса; контроль за концепцией; включая устройства, которые не достигают своего основного предполагаемого действия в организме человека или на нем, с помощью фармакологических, иммунологических или метаболических средств, но могут быть использованы с их функцией с помощью таких средств.
Настоящее изобретение относится к новым изоформам трипсина ZT. Изобретение описывает непредсказуемые и уникальные свойства расщепления белка изоформ трипсина ZT, которые делают его ценным в медицинских применениях. В частности, изобретение относится к новым изоформам трипсина ZT атлантической трески, пригодным в качестве лекарственных средств, в медицинских устройствах и косметике.
В одном аспекте изобретения предложена изолированная изоформа трипсина ZT трески, содержащая аминокислотную последовательность в соответствии с SEQ ID NO: 1 или аминокислотную последовательность с гомологией последовательности 80 % или более. Как правило, такая гомология последовательности составляет 85, 90, 95 или 99 % гомологии аминокислотной последовательности SEQ ID NO: 1.
В одном варианте осуществления этого аспекта предложена изолированная изоформа трипсина ZT трески, выбранная из трипсина ZT-1, содержащего аминокислотную последовательность согласно SEQ ID NO: 2; трипсина ZT-2, содержащего аминокислотную последовательность в соответствии с SEQ ID NO: 3; трипсина ZT-3, содержащего аминокислотную последовательность согласно SEQ ID NO: 4; и трипсина ZT-4, содержащего аминокислотную последовательность в соответствии с SEQ ID NO: 5 или аминокислотную последовательность с гомологией последовательности 80 % или более. Включаются также аминокислотные последовательности с 80 % гомологией последовательности или более, к аминокислотным последовательностям, указанным в SEQ ID NO: 2-5. Как правило, такая гомология последовательности составляет 85, 90, 95 или 99 % гомологии аминокислотной последовательности SEQ ID NO: 2-5.
В одном аспекте изобретения предложена композиция, содержащая по меньшей мере одну изоформу трипсина ZT трески согласно изобретению вместе с подходящими эксципиентами и носителями. Указанная изоформа трипсина ZT трески может быть выбрана из трипсина ZT-1 трески, содержащего аминокислотную последовательность согласно SEQ ID NO: 2; трипсин ZT-2 трески, содержащий аминокислотную последовательность в соответствии с SEQ ID NO: 3; трипсин ZT-3 трески, содержащий аминокислотную последовательность в соответствии с SEQ ID NO: 4; и трипсин ZT-4 трески, содержащий аминокислотную последовательность согласно SEQ ID NO: 5. Включаются также аминокислотные последовательности с 80 % гомологией последовательности или более к аминокислотным последовательностям, указанным в SEQ ID NO: 2-5. Как правило, такая гомология последовательности составляет 85, 90, 95 или 99 % гомологии аминокислотной последовательности SEQ ID NO: 2-5.
Как правило, указанная композиция содержит изоформы трипсина ZT трески, присутствующие в смеси с другими трипсинами трески. Предпочтительно, изоформы трипсина ZT трески содержат по меньшей мере 5 % (мас./мас.) от общего содержания трипсинов трески в указанной композиции, таких как по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45 или 50% или более (мас./мас.) от общего содержания трипсинов трески в указанной композиции.
Указанную композицию обычно применяют местно, в виде лосьона, гидрогеля, аэрозоля для полости рта или назального спрея. Указанная композиция может дополнительно содержать поливалентный спирт, такой как глицерин.
В одном варианте осуществления этого аспекта предлагается указанная композиция для применения в терапии.
В одном варианте осуществления этого аспекта предложена указанная композиция для лечения или профилактики заболевания, вызванного патогенным организмом, выбранным из группы, состоящей из вируса, бактерии, гриба, паразита и простейшего.
В одном варианте осуществления этого аспекта предлагается указанная композиция для применения при лечении или профилактике заболевания верхних дыхательных путей, вызванных патогенными организмами, такими как вирусы, бактерии и грибы.
В одном варианте осуществления этого аспекта предложена указанная композиция для лечения или предупреждения боли, острого воспаления, хронического воспаления, артрита, воспаления суставов, бурсита, остеоартрита, ревматоидного артрита, ювенильного ревматоидного артрита, септического артрита, фибромиалгии, системной красной волчанки, флебита, тендинита, сыпи, псориаза, акне, экземы, себорейной экземы лица, экземы рук, лица или шеи, инфекции крайней плоти, «ноги спортсмена», инфекции фистулы, инфицированных злокачественных язв, пупочных инфекций у новорожденных, морщин, шрамов, келлоидов, фурункулов, бородавок и аллергического зуда, геморроя, грибковой инфекции и иммунологического расстройства, включая аутоиммунное заболевание.
В одном варианте осуществления этого аспекта предложена указанная композиция для применения при лечении раневых инфекций и ран от ожогов.
В одном варианте осуществления этого аспекта предложена указанная композиция для применения при удалении мертвой или шелушащейся кожи от остальной здоровой кожи.
В одном варианте осуществления этого аспекта предлагается указанная композиция для косметического применения. Указанная композиция может дополнительно содержать дополнительное косметически активное соединение.
В одном аспекте изобретения предлагается способ лечения заболевания, включающий введение терапевтически эффективного количества композиции в соответствии с настоящим изобретением пациенту, нуждающемуся в этом.
В одном варианте осуществления этого аспекта указанное заболевание вызвано патогенным организмом, выбранным из группы, состоящей из вируса, бактерии, гриба, паразита и простейшего
В одном варианте осуществления этого аспекта указанное заболевание является заболеванием верхних дыхательных путей, вызванным патогенными организмами, такими как вирусы и бактерии.
В одном варианте осуществления этого аспекта указанное заболевание выбрано из болей, острого воспаления, хронического воспаления, артрита, воспаления суставов, бурсита, остеоартрита, ревматоидного артрита, ювенильного ревматоидного артрита, септического артрита, фибромиалгии, системной красной волчанки, флебита, тендинита, сыпи, псориаза, акне, экземы, себорейной экземы лица, экземы рук, лица или шеи, инфекции крайней плоти, «ноги спортсмена», инфекции фистулы, инфицированных злокачественных язв, пупочной инфекции у новорожденных, морщин, шрамов, келлоидов, фурункулов, бородавок и аллергического зуда, геморроя, грибковой инфекции и иммунологического расстройства, включая аутоиммунное заболевание.
В одном варианте осуществления этого аспекта, указанное заболевание представляет собой раневые инфекции или раны от ожогов.
В одном аспекте изобретения предложена изолированная изоформа трипсина ZT трески, выбранная из полноразмерного трипсина ZT-1, содержащего аминокислотную последовательность согласно SEQ ID NO: 19; полноразмерного трипсина ZT-2, содержащего аминокислотную последовательность согласно SEQ ID NO: 20; полноразмерного трипсина ZT-3, содержащего аминокислотную последовательность в соответствии с SEQ ID NO: 21; и полноразмерного трипсина ZT-4, содержащего аминокислотную последовательность согласно SEQ ID NO: 22.
В одном аспекте изобретения предлагается способ получения изоформ трипсина ZT трески, содержащего аминокислотную последовательность в соответствии с любой из SEQ ID NO: 2-5, включающий
- извлечение трипсина ZT из внутренностей трески,
- применение экстракта по меньшей мере в одной или более стадиях хроматографии, включая стадию аффинной хроматографии с применением аффинного лиганда p-аминобензамидина и
- десорбирование и элюирование изоформ трипсина ZT, связанных с аффинным лигандом p-аминобензамидина.
В одном варианте осуществления этого аспекта указанный способ дополнительно включает, по меньшей мере, одну стадию, используя анионную обменную смолу после указанной стадии (ii) аффинной хроматографии.
В одном варианте осуществления этого аспекта, указанные изоформы трипсина ZT трески, выбраны из трипсина ZT-1, содержащего аминокислотную последовательность согласно SEQ ID NO: 2; трипсина ZT-2, содержащего аминокислотную последовательность в соответствии с SEQ ID NO: 3; трипсина ZT-3, содержащего аминокислотную последовательность согласно SEQ ID NO: 4; и трипсина ZT-4, содержащего аминокислотную последовательность в соответствии с SEQ ID NO: 5 или их смесь.
Внутренности трески обычно используются для очистки и изолировании изоформ трипсина ZT. Авторы идентифицировали новые способы, описанные ниже, пригодные для коммерческого производства изоформ трипсина ZT. Экстракцию проводят при рН 6-8 при температуре ниже 10°C. Внутренности трески смешиваются с водой в соотношении (мас./мас.) от 1:6 до 1:20. Экстракт отделяют от остаточных субпродуктов и дополнительно осветляют осаждением и фильтрацией. Затем следует микрофильтрация и ультрафильтрация, в результате чего получают раствор, содержащий изоформы трипсина ZT, который используется для хроматографического разделения, которое может включать в себя несколько этапов.
Для очистки изоформ трипсина ZT проводят аффинную хроматографию, предпочтительно аффинную хроматографию на аминобензамидине. Затем изоформы трипсина ZT могут быть дополнительно очищены анионообменной хроматографией.
Один из способов применения изоформ трипсина ZT или смесей очищенных трипсинов трески, содержащих изоформы трипсина ZT, заключается в получении гидрогеля или лосьона и воды, содержащей от 0 до 90% (об./об.) поливалентного спирта (полиола), такого как глицерин. Подходящая концентрация изоформ трипсина ZT составляет по меньшей мере 1 к 100 отношения концентрации белка к другим формам трипсина, предпочтительно 5% или выше (мас./мас.) от общего содержания трипсинов трески. Активность трипсина составляет от 0,1 до 10000 единиц активности для CBZ-Gly-Pro-Arg-pNA (карбобензокси Gly-Pro-Arg-пара нитроанилид) на 100 миллилитров конечного препарата гидрогеля/лосьона.
Изобретение далее предусматривает (а) способы, относящиеся к определенным условиям, с применением эффективных количеств очищенных изоформ трипсина ZT, описанных выше, (b) композиции или вещества для применения в таких способах, (с) фармацевтические или медицинские композиции, содержащие эффективные количества изоформы трипсина ZT для применения в таких способах, и (d) применение фермента или ферментной композиции для изготовления лекарственного средства (фармацевтического и медицинского оборудования) для применения в таких способах.
Эти методы, среди прочего, включают:
лечение или профилактику патогенного заболевания, вызванного вирусами, бактериями и грибами, которые, например, встречаются в верхних дыхательных путях, нижних дыхательных путях и в легких;
лечение или профилактическое предотвращение дерматологических состояний, таких как акне, сыпь, псориаз или экзема, включая себорейную экзему лица или экзему рук, лица, кожи головы или шеи, геморрой и тому подобное, где предпочтительное количество изоформ трипсина ZT и других вводимых трипсинов лечат дерматологическое состояние или предотвращают эффективное количество;
лечение легочных заболеваний, где изоформы трипсина ZT с или без других трипсинов используются, например, в высокоэффективном ингаляторе с отмеряемой дозой в эффективной для лечения дозе;
лечение или профилактическое предотвращение раневой инфекции и растрескивание ран (путем внесения в рану антибактериальной инфекции, предотвращающего эффективного количества изоформ трипсина ZT с или без других трипсинов или путем улучшения заживления ран путем введения ингибирующего микроб эффективного количества изоформ трипсина ZT с или без других трипсинов, при лечении рана может быть по существу освобождена от некротической ткани;
лечение ожогов, где предпочтительное количество трипсина ZT изоформ с или без других трипсинов, вводится в достаточном количестве для улучшения заживления;
лечение солнечных ожогов, где предпочтительное количество трипсина ZT изоформ с или без других трипсинов, вводится в достаточном количестве для улучшения заживления;
лечение радиационных ожогов, где предпочтительное количество трипсина ZT изоформ с или без других трипсинов, вводится в достаточном количестве для улучшения заживления;
удаление мертвой или шелушащейся кожи от остальной здоровой кожи для улучшения внешнего вида кожи, где предпочтительное количество изоформ трипсина ZT с или без других трипсинов вводят в количестве эффективном для удаления омертвевшей кожи;
обработка трещин на пятках, где предпочтительное количество изоформ трипсина ZT с или без других трипсинов вводят в количестве достаточном для эффективного лечения;
для лечения раздраженной кожи, такой как сухие пятна, зуд, покраснение и пятна, где предпочтительное количество изоформ трипсина ZT с или без других трипсинов вводят в количестве достаточном для эффективного лечения;
лечение или профилактическое предупреждение кистозного фиброза, рака, например, путем введения эффективного количества для лечения опухоли или метастазирования опухоли, препятствующего или ингибирующего количества изоформ трипсина ZT, атеросклероза, астмы, септического шока, синдрома токсического шока, спаек тканей, таких как сухожилия-оболочка, послеоперационных спаек брюшной полости или суставных спаек, реперфузионного повреждения, малярии, иммунного расстройства, такого как аутоиммунное заболевание, апоптоз, колит и энтерит, такие как болезнь Крона, где предпочтительное количество изоформ трипсина ZT и связанных с ним пептидаз эффективны;
лечение или профилактическое предотвращение микробной инфекции, например, вирусной инфекции, такой как риновирус (RV), респираторно-синцитиальный вирус (RSV), грипп, инфекция герпеса (например, HSV-1, HSV-2, опоясывающий герпес или генитальный герпес), ВИЧ, гепатит, коронавирус, цитомегаловирус или вирус папилломы; инфекции, вызывающей желудочно-кишечные заболевания, такие как язва или диарея; грибковой инфекции, такой как системная, кожная, оральная, вагинальная или пищеводная грибковая инфекция, включая, например, дрожжевую инфекцию, включая грибковую инфекцию ногтей и инфекции Candida; микробной инфекции глаза, предпочтительно обработанные глазными введениями; бактериальной инфекции, включая инфекцию Helicobacter pylori, Staphylococcus spp., устойчивый к метициллину Staphylococcus aureus (MRSA), Streptococcus pneumonia, Haemophilus influenza, Streptococcus mitis, Streptococcus spp., Klebsiella spp., Pseudomonas spp., Neisseria gonorrheae, Haemophilus spp., Chlamydia spp., сифилис и инфекции E. coli и бактериальные инфекции, вызывающие шанкроид; оппортунистических микробных инфекций у пациентов с ослабленным иммунитетом, где предпочтительное вводимое количество трипсинов трески представляет собой лекарственное средство, способствующее лечению микробной инфекции или предотвращающее эффективное количество, или имеющее ингибирующее действие против адгезии клетка-клетка или клетка-вирус;
лечение или профилактическое предотвращение симптомов, выбранных из группы, состоящей из боли, воспаления, острого или хронического воспаления, артрита, воспаления суставов, бурсита, остеоартрита, ревматоидного артрита, ювенильного ревматоидного артрита, септического артрита, фибромиалгии, системной красной волчанки и флебита, где предпочтительное количество лечит или предотвращает эффективное количество;
удаление зубного налета, где предпочтительное количество изоформ трипсина ZT с или без других трипсинов вводят в количестве эффективном для эффективного удаления зубного налета; и
лизис сгустков крови, где предпочтительное количество изоформ трипсина ZT представляет собой количество эффективное для лизиса сгустка.
Способ включает введение композиции, содержащей изоформы трипсина ZT, как описано выше.
Изобретение относится к местным косметическим и медицинским композициям, содержащим изоформы трипсина ZT, описанные выше; и гель, крем или композиции суппозиториев.
Изобретение также относится к способу ингибирования или профилактического предотвращения передачи патогенного микроорганизма путем введения изоформ трипсина ZT с другими трипсинами или без них. Предпочтительно, трипсин ZT с или без других трипсинов применяется к части тела, которая содержит первичный вход для микроорганизма, о котором идет речь. В одном варианте осуществления спрей, мазь или лосьон наносят на отверстие тела, вовлеченное в половую деятельность, например, для предотвращения передачи ВИЧ или гепатита. В другом варианте осуществления изобретения, изоформы трипсина ZT или родственные пептидазы наносят на верхние дыхательные пути, например, через аэрозоль, для ингибирования или предотвращения передачи обычного вируса гриппа, такого как риновирус или коронавирус.
Способ экстракорпоральной обработки ткани, жидкости организма или состава клеток для удаления компонентов клеточной адгезии снижает иммунное отторжение ткани, жидкости тела или состава клеток, которые трансплантируются от одного человека к другому. В другом аспекте такие обработки удаляют или инактивируют компоненты адгезии клеток, обнаруженные в обработанной ткани, жидкости тела или композиции клеток, участвующих в микробной инфекции.
При лечении или профилактическом предотвращении септического шока или синдрома токсического шока путем введения изоформ трипсина ZT или связанных пептидаз соответствующие пути введения включают системное введение. Для вагинальных инфекций, связанных с шоком, в качестве метода введения могут использоваться влагалищные промывания, кремы, гели или суппозитории. При лечении или профилактическом предупреждении боли, воспаления, острого или хронического воспаления, артрита, воспаления суставов, бурсита, остеоартрита, ревматоидного артрита, ювенильного ревматоидного артрита, септического артрита, фибромиалгии, системной красной волчанки, флебита при введении изоформ трипсина ZT или связанных пептидаз, соответствующие пути введения будут включать без ограничений кремы, гели или суппозитории, в частности, но не ограничиваясь ими, гидрогели, содержащие глицерин или другие полиолы.
При лечении или профилактике сыпи, псориаза, угревой сыпи, экземы, в том числе себорейной экземы лица или экземы рук, лица, кожи головы или шеи, инфекций крайней плоти, «ногах спортсмена», инфекций фистул, заражения топических язв, инфекций пуповины у новорожденных, морщин, рубцов и келлоидов, фурункулов, бородавок и аллергического зуда, геморроя и т.п., ран, раневых инфекций, ран от ожогов, удаления мертвой или шелушащейся кожи от остальной кожи для улучшения кожи, грибковой инфекции, такой как системная, кожная, оральная, вагинальная или пищеводная грибковая инфекция, включая, например, дрожжевую инфекцию, включая грибковую инфекцию ногтей и инфекции Candida, и иммунные расстройства, включая аутоиммунные заболевания, путем введения изоформ трипсина ZT с или без других трипсинов, подходящими путями введения включая кремы, гели или суппозитории, в частности, но не ограничиваясь ими, гидрогели, содержащие глицерин или другие полиолы.
Вышеуказанные цели достигаются с применением композиции, содержащей эффективное количество изоформ трипсина ZT с или без других трипсинов, которая способна облегчить боль, воспаление, артрит, отек, водянку, псориазную экзему, дерматит, сыпь и/или другие симптомы болезни, упомянутые во вводной части. Изоформы трипсина ZT могут быть получены с высоким выходом и относительно обычным способом из внутренностей трески. Было обнаружено, что изоформы трипсина ZT можно очищать в коммерческом масштабе относительно простым способом с разумными выходами. Для целей изобретения могут быть использованы изоформы трипсина ZT без или вместе с другими атлантическими сериновыми протеазами.
Изоформы трипсина ZT, представленные в настоящем описании, могут десорбироваться из матрицы сродства, применяя условия, которые дестабилизируют взаимодействие между ферментом и аффинным лигандом. Такие условия включают высокое содержание соли с низким рН, предпочтительно в 30 % или более глицерина. Элюент колонки пропускают через нейтрализующий буфер для стабилизации трипсина трески после стадии элюирования кислотой. Затем изоформы трипсина ZT могут быть дополнительно очищены с применением анионного обмена и элюированы с увеличением концентрации соли. Этими методами могут быть выделены изоформы трипсина ZT с чистотой свыше около 90 %. Полученная таким образом фракция трипсина трески содержит 2-3 основные изоформы, которые проявляются при электрофорезе SDS, который дает две полосы, и масс-спектрометрическом анализе MALDI-TOF. Молекулярная масса изоформ трипсина ZT составляет около 25 кДа, тогда как рассчитанная изоэлектрическая точка составляет 4,35-4,49 в зависимости от изоформы.
Изоформы трипсина ZT с или без других трипсинов в конкретных препаратах могут быть использованы в качестве фармацевтических препаратов, в медицинских устройствах (таких как химические составы) или в косметических средствах в зависимости от предполагаемого применения. Изоформы трипсина ZT (с или без других трипсинов) по изобретению вводят местно, перорально, ректально, вагинально, путем инстилляции (например, в мочевой путь или в свищи), с помощью легочного пути, например, с применением аэрозоля (например, с применением дозирующего ингалятора под давлением (pMDI)), путем нанесения капель в глаз, или системного пути, такого как парентеральный, включая, например, внутримышечный, подкожный, внутрибрюшинный, внутриартериальный или внутривенный пути. Изоформы трипсина ZT вводят в раствор или комбинируют с фармацевтически приемлемым носителем или эксципиентом в соответствии со стандартной фармацевтической практикой. Для перорального способа введения изоформы трипсина ZT используют в форме таблеток, капсул, таблеток для рассасывания, жевательной резинки, пастилок, порошков, сиропов, эликсиров, водных растворов и суспензий и тому подобное. Для парентерального введения обычно готовят стерильные растворы изоформ трипсина ZT, и значения рН растворов соответствующим образом регулируют и забуферивают. Для внутривенного применения необходимо контролировать общую концентрацию растворенных веществ, чтобы сделать изотонический препарат. Для окулярного введения мази или жидкости с каплями могут быть доставлены системами доставки в глаз, известными в данной области, такими как аппликаторы или капельницы для глаз.
Для легочного введения будут выбраны разбавители и/или носители для обеспечения формирования аэрозоля. Для местных применений изоформы трипсина ZT обычно вводят в гидрогеле, содержащем от 0 до 85% глицерина, например от около 20 до 30% глицерина и, возможно, до 85% глицерина.
Для местного лечения, подходящая доза изоформ трипсина ZT с или без других трипсинов на применение составляет от около 0,01 мкг/см2 до около 1 мг/см2, предпочтительно от около 0,1 мкг/см2 до около 0,01 мг/см2 (с применением, например, около 0,01 мг/мл ферментного геля). Для систематического лечения, дозировки обычно выбирают для поддержания сывороточного уровня изоформы трипсина ZT с или без других трипсинов от около 0,1 мг/100 мл до около 100 мг/100 мл, предпочтительно от около 0,5 мг/100 мл до около 2,0 мг/100 мл. В альтернативном измерении предпочтительных системных количеств введения, будут использоваться предпочтительно от около 0,1 мг/кг до около 10 мг/кг, более предпочтительно около 1 мг/кг. Для лечения вагинального и мочевого тракта, подходящие растворы для промывания/инстилляции изоформ трипсина ZT обычно будут иметь концентрацию от около 1 мкг/мл до около 15 мг/мл, предпочтительно от около 100 мкг/мл до около 3 мг/мл. Для всех обработок ферментная композиция обычно применяется от около 1 до около 10 раз в день, предпочтительно от около 2 до около 5 раз в день. Разумеется, эти значения будут варьироваться в зависимости от ряда факторов, включая тип и тяжесть заболевания, а также возраст, вес и состояние здоровья пациента, что будет признано специалистами в области медицины. Считается, что значительно более высокие дозы могут быть использованы без существенного побочного эффекта.
Для заживления ран, изоформы трипсина ZT с или без других трипсинов предпочтительно наносят чаще, чем просто в то время, когда рана сначала покрыта. Предпочтительно, изоформы трипсина ZT применяются, по меньшей мере, каждый раз, когда меняется перевязка ран. Изоформы трипсина ZT также можно применять, по крайней мере, каждый день, более предпочтительно, каждый день или несколько раз в день. Для дерматологических ситуаций, таких как экзема, псориаз и т.п., гидрогель изоформ трипсина ZT (с или без других трипсинов) предпочтительно наносят каждый день, более предпочтительно два раза в день. При остром или хроническом воспалении, артритах, воспалениях суставов, бурсите, остеоартрите и т. п., изоформы трипсина ZT предпочтительно наносят каждый день, более предпочтительно дважды в день.
В данной области известны многочисленные методы определения процентной гомологии белков. Процент идентичности был рассчитан с применением ClustalW2 (версия Clustal2.1) при проведении сопоставлений последовательностей (веб-сайт EMBL-EBI http://www.ebi.ac.uk/Tools/msa/clustalw2/ date 4th May 2015).http://www.ebi.ac.uk/Tools/msa/clustalw2/
Далее изобретение будет описано несколькими неограничивающими примерами.
Пример 1
Получение смеси протеаз из трески
Около 100 кг замороженной атлантической трески оттаивали и добавляли в четырехкратный объем холодной питьевой воды в экстракционном резервуаре, а рН доводили до около рН 6 раствором гидроксида натрия. Смесь перемешивали в течение около 10 часов при температуре от 0 до 5°C. После непродолжительного периода сырой седиментации (около 30 минут) водный экстракт отводили от оставшихся нерастворимых внутренних органов с помощью насоса и собирали в осадочном резервуаре. Водный экстракт оставляли стоять в охлажденном осадочном резервуаре для осаждения в течение около 40-80 часов. Супернатант декантировали из супернатантного резервуара в резервуар для хранения с применением насоса. Супернатант концентрировали в 10-20 раз путем ультрафильтрации и подвергали диафильтрации до приемлемого уровня ионной силы с проводимостью ниже около 2,5 мСм/см. Было получено около 10-15 литров ультрафильтрованного и диафильтрованного белкового концентрата.
Пример 2
Очистка изоформ трипсина ZT трески из концентрированного экстракта внутренностей трески
Около 12 литров ультрафильтрованного и диафильтрованного концентрата, полученного в примере 1, наносили на непрерывную соединенную серию около 1 литровых хроматографических колонок, первая из которых содержала карбоксиметил (CM) быстрорастворимую катионообменную смолу (GE healthcare), а вторая аффинный лиганд p-аминобензамидина, связанный с сефарозной смолой (GE healthcare). CM колонки и p-аминобензамидиновые колонки предварительно уравновешивали с около 10 объемами колонки 25 мМ Трис-буфера с рН 7,8, содержащим 2,5 мМ хлорида кальция (буфер А). Концентрат закачивали в СМ колонки и p-аминобензамидиновые колонки со скоростью потока около 100 мл/мин. Когда нанесение концентрированного раствора на колонки было закончено, остаточный материал смывался с непрерывной колонной системы с около 8 литрами буфера A. После завершения промывки аффинную p-аминобензамидиновую колонку отключали от колонки CM и промывали с около 5 объемами колонки с высоким содержанием солевого раствора 25 мМ Трис-буфера с рН 7,5, содержащего 0,5 М NaCl и 2,5 мМ хлорида кальция. Трипсины трески затем десорбировали из аффинного лиганда и элюировали колонку кислотным раствором 25 мМ уксусной кислоты с рН 3,2, содержащим 10 мМ хлорида кальция и 30 % глицерина.
Препарат, содержащий очищенные изоформы трипсина ZT, был гомогенным при SDS-PAGE электрофорезе. Очищенный препарат стерилизуют фильтрованием через 0,22-микронный фильтр и хранят в замороженном состоянии при температуре около -20°С. Препарат, содержащий изоформу трипсина ZT трески, стерилизуют фильтрованием через фильтр 0,22 мкм и хранят в замороженном состоянии при температуре около -20°C. Препарат, содержащий изоформу трипсина ZT трески, использовали в колонке с анионообменной хроматографией (MonoQ) и белках, элюированных градиентом соли (фиг. 1). Колонку уравновешивали буфером (20 мМ Трис, 10 мМ CaCl2, pH 8,0) и ферменты элюировали линейным 0-150 мМ градиентом NaCl в 40 объемах колонки, линейным 150-620 мМ NaCl в 6 объемах колонки, 620-850 мМ NaCl в 10 объемах колонки при скорости потока 1 мл/мин. Белки в пике, помеченном трипсином ZT на фиг.1, подвергали анализу SDS-PAGE (фиг. 2). Полосу белка на геле из пика трипсина ZT вырезали из геля и анализировали с применением времяпролетной масс-спектрометрии с лазерной ионизацией и десорбцией из жидкой матрицы (MALDI-TOF MS). Анализ масс-спектрометрии (MC) показал идентичность трипсину ZT-1, трипсину ZT-2, трипсину ZT-3 и трипсину ZT-4 (таблица 1 и таблица 2). Антитела против трипсина I и трипсина Х были получены у кроликов против пептида ((NH2-) CVLSGWVRDTMA (-COOH)) (SEQ ID NO: 23), соответствующего остаткам 228-239 на конце C-конца трипсина I трески и трипсина Х трески. Антитела были аффинно очищены от сыворотки кролика, с применением пептида, связанного с опорой гелевого шарика. Поликлональные антитела против изоформ трипсина ZT были получены в асцитной жидкости мыши, как описано в Overkamp et al. (Overkamp, Mohammed-Ali et al., 1988, J Immunoassay 9: 51-68). Очищенную форму рекомбинантного трипсина ZT-4 инъецировали внутрибрюшинно (ip) мышам Balb/C2. Мышей умерщвляли на 34-й день и собирали асцитную жидкость. Соответствующие антитела использовали в вестерн-блот анализе. Вестерн-блот анализ проводили на белках в пике, помеченном трипсином ZT на фиг. 1 (фиг. 3). Антитело изоформы трипсина ZT реагировало с белками с пиковым меченым трипсином ZT, тогда как антитело против трипсина I и трипсина X нет (фиг. 3).
В таблице 1 представлены массы пептидов, полученные из МС анализа на белковой полосе из геля SDS-PAGE на фиг. 2 (не гуанидированный образец), см. колонку 1 Mr (expt). Mr обозначает относительную молекулярную массу в Да. В столбцах 2, 3 и 4 показаны расчетные значения (для масс, соответствующих массам в столбце 1) при переваривании трипсина in silico аминокислотных последовательностей трипсина ZT-1, трипсина ZT-2, трипсина ZT-3 и трипсина ZT-4. В колонке 5 показана последовательность пептида, которая дает значение массы при переваривании in silico. В колонке 6 показаны модификации различных пептидов на основе переваривания in silico.
Таблица 1
Пропионамид (C)
Окисление (М)
Последовательности в таблице 1 представлены ниже:
В таблице 2 представлены массы пептидов, полученные из МС анализа на белковой полосе из геля SDS-PAGE на фиг. 2 (гуанидированный образец), см. колонку 1 Mr (expt). Mr обозначает относительную молекулярную массу в Да. В столбцах 2, 3 и 4 показаны расчетные значения (для масс, соответствующих массам в столбце 1), при переваривании трипсина in silico аминокислотных последовательностей трипсина ZT-1, трипсина ZT-2, трипсина ZT-3 и трипсина ZT-4. В колонке 5 показана последовательность пептида, которая дает значение массы при переваривании in silico. В колонке 6 показаны модификации различных пептидов на основе переваривания in silico.
Таблица 2
Окисление (М)
EGVLTGLVSWGR(G)
Карбоксиметил (С)
EGVLTGLVSWGR(G)
Пропионамид (C)
CEAAYPGMISPR (М)
CQASYPGMISPR (М)
CQASYPGMISPR (М)
Пропионамид (C)
ACQASYPGMISPR(М)
Окислительный пропионамид
DCEAAYPGMISPR(М)
DCEAAYPGMISPR(М)
Пропионамид
Последовательности в таблице 2 представлены ниже:
Пример 3
Множественное профилирование субстратов на изоформы трипсина ZT
Множественное профилирование субстратов использовалось для анализа субстратной специфичности ферментов (протеиназ) (O'Donoghue, Eroy-Reveles et al., 2012, Nat Methods 9: 1095-1100). Протеиназы могут расщеплять субстраты в разных аминокислотных остатках в пептидной последовательности, демонстрируя разницу в субстратной специфичности. Трипсины определяются по их предпочтениям в расщеплении C-конца на остатки аргинина или лизина.
Изоформы ферментов
Изоферменты трипсина трески были разделены путем применения бензамидин очищенного трипсина трески в ионообменной колонке MonoQ HR 5/5. Для выделения трипсина I колонку уравновешивали 20 мМ Трис, 5 мМ этаноламина, 10 мМ CaCl2, pH 9,1, и ферменты элюировали линейным градиентом 0-200 мМ NaCl в 80 объемах колонки, линейным градиентом 200-1000 мМ NaCl в 10 объемах колонки при скорости потока 1 мл/мин. рН образца доводили до рН 9,1 1 М NaOH перед применением.
Для выделения изоформ трипсина ZT колонку уравновешивали 25 мМ Трис, 25 мМ CaCl2, 15 % (об./об.) глицерина, pH 7,5, и ферменты элюировали линейным градиентом 0-150 мМ NaCl в 5 объемах колонки, линейным градиентом 150-550 мМ NaCl в 20 объемах колонки, линейным градиентом 500-1000 мМ NaCl в 1 объеме колонки при скорости потока 1 мл/мин.
Состав обоих образцов ферментов (трипсин ZT и трипсин I) был отрегулирован таким образом, чтобы конечная концентрация Трис составляла 60 мМ, CaCl2 30 мМ и 15 % глицерина (об./об.) с рН 8,5.
Анализ множественного профилирования субстратов
Очищенные изоформы трипсина ZT или трипсина I инкубировали (5, 15 и 60 мин) с библиотекой пептидов (124 определенных пептидов, 14-мерных последовательностей, всего 1612 пептидных связей) с обширным физико-химическим разнообразием, как описано в O ' Donoghue, Eroy-Reveles et al. (O'Donoghue, Eroy-Reveles et al., 2012, Nat Methods 9: 1095-1100). После инкубации сайты расщепления идентифицировали с помощью масс-спектрометрического анализа (O'Donoghue, Eroy-Reveles et al., 2012, Nat Methods 9: 1095-1100).
Результаты
Анализ множественного профилирования субстратов неожиданно показал, что существует множество сайтов расщепления, уникальных для изоформ трипсина ZT, по сравнению с трипсином I, описанным в WO 2000078332 (фиг. 4 и таблица 4). Кроме того, были идентифицированы сайты расщепления, которые показали предпочтительное расщепление изомерами трипсина ZT по сравнению с трипсином I (таблица 4). На основании результатов анализа множественного профилирования субстрата была создана таблица, содержащая числовые значения, основанные на стандартном значении баллов (Z-оценка) в положениях P4-P4' в субстрате, где субстрат специфичный трипсину ZT сравнивался с трипсином I (таблица 3). Положительные значения (Z-оценка) отражают предпочтение аминокислотного остатка в определенной позиции P в пользу изоформ трипсина ZT по сравнению с трипсином I. Неожиданно множественное профилирование субстрата на изоформы трипсина ZT показало, что аминокислоты, окружающие аргинин или лизин в субстрате имеют различное влияние на его расщепление по сравнению с трипсином I.
В таблице 3 приведены числовые значения на основе стандартных показателей (Z-оценка) в позициях P4-P4 'в субстрате, по сравнению с субстратной специфичностью трипсина ZT и трипсина I после инкубации в течение 5, 15 и 60 мин. Аминокислотные остатки в субстрате, подвергающемся расщеплению, обозначали P1, P2, P3, P4 в N-концевом направлении от расщепленной связи (Schechter and Berger, 1967, Biochem Biophys Res Commun 27: 157-162, Schechter and Berger, 1968, Biochem Biophys Res Commun 32: 898-902). Остатки в С-концевом направлении обозначены P1 ', P2', P3 ', P4'. Позиции P представлены в столбцах, а в рядах показаны аминокислоты в разных положениях P. Положительные значения (Z-оценка) в таблице отражают предпочтение аминокислотного остатка в определенной позиции P в пользу изоформ трипсина ZT по сравнению с трипсином I. Отрицательные значения (Z-оценка) отражают предпочтение в пользу трипсина I по сравнению трипсином ZT. Например, на основании значений из таблицы 3 видно, что трипсин ZT гораздо лучше адаптирован для расщепления пептидов, содержащих несколько последовательных положительно заряженных остатков (аргинин или лизин) по сравнению с трипсином I. Опять же, эти типы последовательностей, то есть богатые лизином и аргинином аминокислотные последовательности, часто встречаются в белковых токсинах, белках и пептидах, участвующих в патогенезе (Suzuki, Orba et al., 2010, PLoS Pathog 6: e1000801, Fentress, Steinfeldt et al., 2012, Cell Microbiol 14 : 1921-1933, Jiang, Cun et al., 2012, J Virol 86: 7256-7267, Milletti, 2012, Drug Discov Today 17: 850-860, Gallaher and Garry, 2015, Viruses 7: 285-305). Как упоминалось ранее, изоформы трипсина ZT обладают свойствами, выгодными для белков, ответственных за патогенность многих микроорганизмов.
Таблица 3.
Таблица 3 продолжение.
Таблица 3 продолжение.
В таблице 4 показаны интенсивности ионов-предшественников выбранных пептидов из множественного профилирования после инкубации с трипсином ZT или с трипсином I. Интенсивности ионов-предшественников представляют собой интенсивности пептидных пиков в МС до фрагментации, которые представляют собой показатель относительной численности для данного вида. X в пептидной последовательности обозначает заполнитель для отсутствия аминокислоты в пептидной последовательности. Данные показывают, что изоформы трипсина ZT способны исключительно расщеплять три пептидные последовательности (QGKKAPXX, WGNRSPLE и QAVRPNGM) по сравнению с трипсином I. Кроме того, данные показывают, что изоформы трипсина ZT предпочтительно расщепляют два пептида по сравнению с трипсином I. Изоформы трипсина ZT для расщепления XIARQPWN в течение 5 минут и FDNRVGKW в течение 15 минут, тогда как расщепление в пределах этих двух пептидов было обнаружено только с трипсином I после 60-минутной инкубации.
Таблица 4
Пример 4
Очистка изоформ трипсина ZT трески из концентрированного экстракта внутренностей трески
Около 12 литров ультрафильтрованного и диафильтрованного концентрата, полученного в примере 1, наносили на непрерывную соединенную серию колонок около 1 литровых хроматографических колонок, первая из которых содержала быстрорастворимую катионообменную смолу CM (GE healthcare), вторая - аффинный лиганд p-аминобензамидин, связанный с сефарозной смолой (GE healthcare), и третий DEAE быстрорастворимую анионообменную смолу (GE healthcare). CM колонки и p-аминобензамидиновые колонки предварительно уравновешивали с около 10 объемами колонки 25 мМ Трис-буфера с рН 7,8, содержащим 2,5 мМ хлорида кальция. Концентрат закачивали в СМ колонки и p-аминобензамидиновые колонки со скоростью потока около 100 мл/мин. Когда нанесение концентрированного раствора на колонки было закончено, остаточный материал смывался с непрерывной колонной системы с около 8 литрами буфера A. После завершения промывки аффинную p-аминобензамидиновую колонку отключали от колонки CM и промывали с около 5 объемами колонки с высоким содержанием солевого раствора 25 мМ Трис-буфера с рН 7,5, содержащего 0,5 М NaCl и 2,5 мМ хлорида кальция. Трипсины трески затем десорбировали из аффинного лиганда и элюировали колонку кислотным раствором 25 мМ уксусной кислоты с рН 3,2, содержащим 10 мМ хлорида кальция и 30% глицерина. Фракцию трипсина трески собирали в нейтрализующем буфере 200 мМ Трис, pH 8,5, содержащей 30 % глицерина. Анионобменную колонку DEAE предварительно уравновешивали около 10 объемами колонки 25 мМ Трис-буфера с рН 7,8, содержащим 2,5 мМ хлорида кальция. Фракцию трипсина трески использовали на анионообменной смоле DEAE и промывали около 5 объемами колонки уравновешивающего буфера. Изоформы трипсина ZT затем десорбировались из колонки с применением раствора градиентной соли 0,95 М NaCl. Очищенный препарат изоформы трипсина ZT трески был гомогенизирован методом электрофореза SDS PAGE и FPLC Mono Q хроматографии. Очищенный препарат стерилизуют фильтрованием через 0,22-микронный фильтр и хранят в замороженном состоянии при температуре около -20°С.
Пример 5
Приготовление гидрогелевого препарата трипсинов трески, включая изоформы трипсина ZT трески
Очищенную изоформу трипсина ZT трески, содержащую препарат примера 2, смешивали с гидроколлоидным гелем, содержащим водный гель, содержащий 0,8% мас./об. Карбомера 940 и 40% глицерина. Препарат трипсина трески смешивали в соотношении 1:1 с гидрогелем с получением конечной концентрации 4 единицы фермента на мг (Ед/мг) конечной смеси гель-ферментов (ферментная гидрогелевая мазь), определяли ферментную единицу используя Cbz-GPR-pNA в качестве субстрата, как описано выше. Таким образом, полученная в результате ферментная гидрогелевая мазь содержала около 0,01 мг/мл или 1 Ед/мл ферментов трипсина трески, 0,4% карбомера 940, 20% глицерина и 0,04% параоксибензоата.
Пример 6
Противовирусная активность изоформ трипсина ZT против энтеровируса в качестве модели риновируса
Пикорнавирусы представляют собой небольшие одноцепочечные положительные смысловые РНК-вирусы, у которых отсутствует липидная оболочка. Энтеровирус и риновирус представляют собой два рода Picornaviridae. Энтеровирус реплицируется первоначально в ротоглотке и выживает в кислой среде желудка. Тонкий кишечник является основным местом инвазии энтеровируса. Риновирус реплицируется в носовом проходе, но разрушается в кислой среде желудка. Риновирус и энтеровирус имеют идентичную морфологию, но их можно отличить на основе клинических, биофизических и эпидемиологических исследований. Риновирус является проблематичным для обращения в клеточных культурах (Racaniello, 2007, Fields virology, 5th ed: 795-838). Поэтому энтеровирус использовался в качестве модели риновируса для анализа антивирусных свойств изоформ трипсина ZT.
Материалы и способы
Исходный раствор энтеровируса
Энтеровирус (Coxsackievirus B2) выделяли у пациента в университетской больнице Исландии, отделение вирусологии и выращивали в клетках MA-104 (клетки почек африканской зеленой обезьяны) или клетках Vero (клетки почек африканской зеленой обезьяны). Coxsackievirus B2 титровали (TCID50 = 8,23) согласно Reed-Muench (REED и MUENCH, 1938, American Journal of Epidemiology 27: 493-497).
Изоформы ферментов
Изоферменты трипсина трески были разделены путем применения бензамидин очищенного трипсина трески в ионообменной колонке MonoQ HR 5/5. Для выделения изоформ трипсина ZT колонку уравновешивали 25 мМ Трис, 25 мМ CaCl2, pH 7,5, и ферменты элюировали линейным 0-400 мМ градиентом NaCl в 5 объемах колонки, линейным 400-1000 мМ NaCl в 20 при объеме потока 1 мл/мин.
Лечение
Клетки MA-104 выращивали в 96-луночном планшете для микротитрования до 95% слияния. Энтеровирус разбавляли из исходного раствора до 10-6 с применением минимальной основной среды (MEM) и 1,5 мл разбавленного раствора помещали в две разные пробирки. В пробирках обрабатывали 1,5 мл изоформы трипсина ZT и 1,5 мл MEM в качестве положительного контроля. Отрицательным контролем был MEM (3 мл) без вируса. Все флаконы инкубировали при 34°С и 5% СО2 в течение 90 мин перед добавлением 100 мкл раствора бензамидиновой агарозы для удаления остаточного трипсина и инкубации в течение еще 30 мин. Раствор центрифугировали при 5500 об/мин в течение 3 мин перед помещением 2 мл надосадочной жидкости в пробирку Эппендорфа. 200 мкл раствора помещали в каждую лунку, всего 10 лунок в планшет для микротитрования. Планшет инкубировали в течение 30 мин. После инкубации среду отбрасывали и добавляли MEM с 1 % сывороткой новорожденных телят (NCS) во все лунки. Микроскоп использовался для мониторинга наличия инфекции.
Результаты
Изоформы трипсина ZT были очень эффективны в качестве противовирусных агентов против энтеровируса (Coxsackievirus B2), который использовался в качестве модели для риновируса. Результаты представлены на фиг. 5.
--->
Перечень последовательностей
<110> Zymetech EHF
<120> NOVEL TRYPSIN ISOFORMS AND THEIR USE
<130> 21083149
<150> EP15178208.3
<151> 2015-07-24
<160> 23
<170> PatentIn version 3.5
<210> 1
<211> 227
<212> PRT
<213> Artificial Sequence
<220>
<223> Generic sequence
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Xaa can be I or V
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa can be Q or H
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Xaa can be D or E
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> Xaa can be R or N
<220>
<221> MISC_FEATURE
<222> (77)..(77)
<223> Xaa is L
<220>
<221> MISC_FEATURE
<222> (148)..(148)
<223> Xaa can be T or P
<220>
<221> MISC_FEATURE
<222> (150)..(150)
<223> Xaa can be D or A
<220>
<221> MISC_FEATURE
<222> (152)..(152)
<223> Xaa can be E or Q
<220>
<221> MISC_FEATURE
<222> (154)..(154)
<223> Xaa can be A or S
<220>
<221> MISC_FEATURE
<222> (164)..(164)
<223> Xaa can be V or M
<220>
<221> MISC_FEATURE
<222> (166)..(166)
<223> Xaa can be A or V
<220>
<221> MISC_FEATURE
<222> (168)..(168)
<223> Xaa can be Y or F
<220>
<221> MISC_FEATURE
<222> (175)..(175)
<223> Xaa can be A or V
<220>
<221> MISC_FEATURE
<222> (198)..(198)
<223> Xaa can be Q or R
<220>
<221> MISC_FEATURE
<222> (202)..(202)
<223> Xaa can be L or E
<220>
<221> MISC_FEATURE
<222> (205)..(205)
<223> Xaa can be Y or S
<220>
<221> MISC_FEATURE
<222> (215)..(215)
<223> Xaa can be Y or F
<400> 1
Ile Xaa Gly Gly Xaa Xaa Cys Glu Pro Xaa Ser Arg Pro Phe Met Ala
1 5 10 15
Ser Leu Asn Tyr Gly Tyr His Phe Cys Gly Gly Val Leu Ile Asn Asp
20 25 30
Gln Trp Val Leu Ser Val Ala His Cys Trp Tyr Asn Pro Tyr Tyr Met
35 40 45
Gln Val Met Leu Gly Glu His Asp Leu Arg Val Phe Glu Gly Thr Glu
50 55 60
Gln Leu Val Lys Thr Asn Thr Ile Phe Trp His Glu Xaa Tyr Asp Tyr
65 70 75 80
Gln Thr Leu Asp Tyr Asp Met Met Met Ile Lys Leu Tyr His Pro Val
85 90 95
Glu Val Thr Gln Ser Val Ala Pro Ile Ser Leu Pro Thr Gly Pro Pro
100 105 110
Asp Gly Gly Met Leu Cys Ser Val Ser Gly Trp Gly Asn Met Ala Met
115 120 125
Gly Glu Glu Val Asn Leu Pro Thr Arg Leu Gln Cys Leu Asp Val Pro
130 135 140
Ile Val Glu Xaa Val Xaa Cys Xaa Ala Xaa Tyr Pro Gly Met Ile Ser
145 150 155 160
Pro Arg Met Xaa Cys Xaa Gly Xaa Met Asp Gly Gly Arg Asp Xaa Cys
165 170 175
Asn Gly Asp Ser Gly Ser Pro Leu Val Cys Glu Gly Val Leu Thr Gly
180 185 190
Leu Val Ser Trp Gly Xaa Gly Cys Ala Xaa Pro Asn Xaa Pro Gly Val
195 200 205
Tyr Val Lys Val Tyr Glu Xaa Leu Ser Trp Ile Gln Thr Thr Leu Asp
210 215 220
Ala Asn Pro
225
<210> 2
<211> 227
<212> PRT
<213> Gadus morhua
<400> 2
Ile Val Gly Gly His Glu Cys Glu Pro Asn Ser Arg Pro Phe Met Ala
1 5 10 15
Ser Leu Asn Tyr Gly Tyr His Phe Cys Gly Gly Val Leu Ile Asn Asp
20 25 30
Gln Trp Val Leu Ser Val Ala His Cys Trp Tyr Asn Pro Tyr Tyr Met
35 40 45
Gln Val Met Leu Gly Glu His Asp Leu Arg Val Phe Glu Gly Thr Glu
50 55 60
Gln Leu Val Lys Thr Asn Thr Ile Phe Trp His Glu Leu Tyr Asp Tyr
65 70 75 80
Gln Thr Leu Asp Tyr Asp Met Met Met Ile Lys Leu Tyr His Pro Val
85 90 95
Glu Val Thr Gln Ser Val Ala Pro Ile Ser Leu Pro Thr Gly Pro Pro
100 105 110
Asp Gly Gly Met Leu Cys Ser Val Ser Gly Trp Gly Asn Met Ala Met
115 120 125
Gly Glu Glu Val Asn Leu Pro Thr Arg Leu Gln Cys Leu Asp Val Pro
130 135 140
Ile Val Glu Pro Val Ala Cys Gln Ala Ser Tyr Pro Gly Met Ile Ser
145 150 155 160
Pro Arg Met Met Cys Val Gly Phe Met Asp Gly Gly Arg Asp Val Cys
165 170 175
Asn Gly Asp Ser Gly Ser Pro Leu Val Cys Glu Gly Val Leu Thr Gly
180 185 190
Leu Val Ser Trp Gly Arg Gly Cys Ala Glu Pro Asn Ser Pro Gly Val
195 200 205
Tyr Val Lys Val Tyr Glu Phe Leu Ser Trp Ile Gln Thr Thr Leu Asp
210 215 220
Ala Asn Pro
225
<210> 3
<211> 227
<212> PRT
<213> Gadus morhua
<400> 3
Ile Val Gly Gly His Glu Cys Glu Pro Asn Ser Arg Pro Phe Met Ala
1 5 10 15
Ser Leu Asn Tyr Gly Tyr His Phe Cys Gly Gly Val Leu Ile Asn Asp
20 25 30
Gln Trp Val Leu Ser Val Ala His Cys Trp Tyr Asn Pro Tyr Tyr Met
35 40 45
Gln Val Met Leu Gly Glu His Asp Leu Arg Val Phe Glu Gly Thr Glu
50 55 60
Gln Leu Val Lys Thr Asn Thr Ile Phe Trp His Glu Leu Tyr Asp Tyr
65 70 75 80
Gln Thr Leu Asp Tyr Asp Met Met Met Ile Lys Leu Tyr His Pro Val
85 90 95
Glu Val Thr Gln Ser Val Ala Pro Ile Ser Leu Pro Thr Gly Pro Pro
100 105 110
Asp Gly Gly Met Leu Cys Ser Val Ser Gly Trp Gly Asn Met Ala Met
115 120 125
Gly Glu Glu Val Asn Leu Pro Thr Arg Leu Gln Cys Leu Asp Val Pro
130 135 140
Ile Val Glu Thr Val Asp Cys Glu Ala Ala Tyr Pro Gly Met Ile Ser
145 150 155 160
Pro Arg Met Val Cys Ala Gly Tyr Met Asp Gly Gly Arg Asp Ala Cys
165 170 175
Asn Gly Asp Ser Gly Ser Pro Leu Val Cys Glu Gly Val Leu Thr Gly
180 185 190
Leu Val Ser Trp Gly Gln Gly Cys Ala Leu Pro Asn Tyr Pro Gly Val
195 200 205
Tyr Val Lys Val Tyr Glu Tyr Leu Ser Trp Ile Gln Thr Thr Leu Asp
210 215 220
Ala Asn Pro
225
<210> 4
<211> 227
<212> PRT
<213> Gadus morhua
<400> 4
Ile Ile Gly Gly Gln Asp Cys Glu Pro Arg Ser Arg Pro Phe Met Ala
1 5 10 15
Ser Leu Asn Tyr Gly Tyr His Phe Cys Gly Gly Val Leu Ile Asn Asp
20 25 30
Gln Trp Val Leu Ser Val Ala His Cys Trp Tyr Asn Pro Tyr Tyr Met
35 40 45
Gln Val Met Leu Gly Glu His Asp Leu Arg Val Phe Glu Gly Thr Glu
50 55 60
Gln Leu Val Lys Thr Asn Thr Ile Phe Trp His Glu Leu Tyr Asp Tyr
65 70 75 80
Gln Thr Leu Asp Tyr Asp Met Met Met Ile Lys Leu Tyr His Pro Val
85 90 95
Glu Val Thr Gln Ser Val Ala Pro Ile Ser Leu Pro Thr Gly Pro Pro
100 105 110
Asp Gly Gly Met Leu Cys Ser Val Ser Gly Trp Gly Asn Met Ala Met
115 120 125
Gly Glu Glu Val Asn Leu Pro Thr Arg Leu Gln Cys Leu Asp Val Pro
130 135 140
Ile Val Glu Pro Val Ala Cys Gln Ala Ser Tyr Pro Gly Met Ile Ser
145 150 155 160
Pro Arg Met Met Cys Val Gly Phe Met Asp Gly Gly Arg Asp Val Cys
165 170 175
Asn Gly Asp Ser Gly Ser Pro Leu Val Cys Glu Gly Val Leu Thr Gly
180 185 190
Leu Val Ser Trp Gly Arg Gly Cys Ala Glu Pro Asn Ser Pro Gly Val
195 200 205
Tyr Val Lys Val Tyr Glu Phe Leu Ser Trp Ile Gln Thr Thr Leu Asp
210 215 220
Ala Asn Pro
225
<210> 5
<211> 227
<212> PRT
<213> Gadus morhua
<400> 5
Ile Ile Gly Gly Gln Asp Cys Glu Pro Arg Ser Arg Pro Phe Met Ala
1 5 10 15
Ser Leu Asn Tyr Gly Tyr His Phe Cys Gly Gly Val Leu Ile Asn Asp
20 25 30
Gln Trp Val Leu Ser Val Ala His Cys Trp Tyr Asn Pro Tyr Tyr Met
35 40 45
Gln Val Met Leu Gly Glu His Asp Leu Arg Val Phe Glu Gly Thr Glu
50 55 60
Gln Leu Val Lys Thr Asn Thr Ile Phe Trp His Glu Leu Tyr Asp Tyr
65 70 75 80
Gln Thr Leu Asp Tyr Asp Met Met Met Ile Lys Leu Tyr His Pro Val
85 90 95
Glu Val Thr Gln Ser Val Ala Pro Ile Ser Leu Pro Thr Gly Pro Pro
100 105 110
Asp Gly Gly Met Leu Cys Ser Val Ser Gly Trp Gly Asn Met Ala Met
115 120 125
Gly Glu Glu Val Asn Leu Pro Thr Arg Leu Gln Cys Leu Asp Val Pro
130 135 140
Ile Val Glu Thr Val Asp Cys Glu Ala Ala Tyr Pro Gly Met Ile Ser
145 150 155 160
Pro Arg Met Val Cys Ala Gly Tyr Met Asp Gly Gly Arg Asp Ala Cys
165 170 175
Asn Gly Asp Ser Gly Ser Pro Leu Val Cys Glu Gly Val Leu Thr Gly
180 185 190
Leu Val Ser Trp Gly Gln Gly Cys Ala Leu Pro Asn Tyr Pro Gly Val
195 200 205
Tyr Val Lys Val Tyr Glu Tyr Leu Ser Trp Ile Gln Thr Thr Leu Asp
210 215 220
Ala Asn Pro
225
<210> 6
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 1
<400> 6
Ile Ile Gly Gly Gln Asp Cys Glu Pro Arg
1 5 10
<210> 7
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 2
<400> 7
Val Phe Glu Gly Thr Glu Gln Leu Val Lys
1 5 10
<210> 8
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 3
<400> 8
Leu Gln Cys Leu Asp Val Pro Ile Val Glu Pro Val Ala Cys Gln Ala
1 5 10 15
Ser Tyr Pro Gly Met Ile Ser Pro Arg
20 25
<210> 9
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 4
<400> 9
Leu Gln Cys Leu Asp Val Pro Ile Val Glu Thr Val Asp Cys Glu Ala
1 5 10 15
Ala Tyr Pro Gly Met Ile Ser Pro Arg
20 25
<210> 10
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 5
<400> 10
Met Val Cys Ala Gly Tyr Met Asp Gly Gly Arg
1 5 10
<210> 11
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 6
<400> 11
Met Met Cys Val Gly Phe Met Asp Gly Gly Arg
1 5 10
<210> 12
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 7
<400> 12
Gly Cys Ala Glu Pro Asn Ser Pro Gly Val Tyr Val Lys
1 5 10
<210> 13
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 8
<400> 13
Asp Val Cys Asn Gly Asp Ser Gly Ser Pro Leu Val Cys Glu Gly Val
1 5 10 15
Leu Thr Gly Leu Val Ser Trp Gly Arg
20 25
<210> 14
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 9
<400> 14
Gln Gly Lys Lys Ala Pro
1 5
<210> 15
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 10
<400> 15
Trp Gly Asn Arg Ser Pro Leu Glu
1 5
<210> 16
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 11
<400> 16
Gln Ala Val Arg Pro Asn Gly Met
1 5
<210> 17
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 12
<400> 17
Phe Asp Asn Arg Val Gly Lys Trp
1 5
<210> 18
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Fragment 13
<400> 18
Ile Ala Arg Gln Pro Trp Asn
1 5
<210> 19
<211> 250
<212> PRT
<213> Gadus morhua
<400> 19
Met Ile Gly Leu Ala Leu Leu Met Leu Leu Gly Ala Ala Ala Ala Ala
1 5 10 15
Val Pro Arg Asp Val Gly Lys Ile Val Gly Gly His Glu Cys Glu Pro
20 25 30
Asn Ser Arg Pro Phe Met Ala Ser Leu Asn Tyr Gly Tyr His Phe Cys
35 40 45
Gly Gly Val Leu Ile Asn Asp Gln Trp Val Leu Ser Val Ala His Cys
50 55 60
Trp Tyr Asn Pro Tyr Tyr Met Gln Val Met Leu Gly Glu His Asp Leu
65 70 75 80
Arg Val Phe Glu Gly Thr Glu Gln Leu Val Lys Thr Asn Thr Ile Phe
85 90 95
Trp His Glu Leu Tyr Asp Tyr Gln Thr Leu Asp Tyr Asp Met Met Met
100 105 110
Ile Lys Leu Tyr His Pro Val Glu Val Thr Gln Ser Val Ala Pro Ile
115 120 125
Ser Leu Pro Thr Gly Pro Pro Asp Gly Gly Met Leu Cys Ser Val Ser
130 135 140
Gly Trp Gly Asn Met Ala Met Gly Glu Glu Val Asn Leu Pro Thr Arg
145 150 155 160
Leu Gln Cys Leu Asp Val Pro Ile Val Glu Pro Val Ala Cys Gln Ala
165 170 175
Ser Tyr Pro Gly Met Ile Ser Pro Arg Met Met Cys Val Gly Phe Met
180 185 190
Asp Gly Gly Arg Asp Val Cys Asn Gly Asp Ser Gly Ser Pro Leu Val
195 200 205
Cys Glu Gly Val Leu Thr Gly Leu Val Ser Trp Gly Arg Gly Cys Ala
210 215 220
Glu Pro Asn Ser Pro Gly Val Tyr Val Lys Val Tyr Glu Phe Leu Ser
225 230 235 240
Trp Ile Gln Thr Thr Leu Asp Ala Asn Pro
245 250
<210> 20
<211> 250
<212> PRT
<213> Gadus morhua
<400> 20
Met Ile Gly Leu Ala Leu Leu Met Leu Leu Gly Ala Ala Ala Ala Ala
1 5 10 15
Val Pro Arg Asp Val Gly Lys Ile Val Gly Gly His Glu Cys Glu Pro
20 25 30
Asn Ser Arg Pro Phe Met Ala Ser Leu Asn Tyr Gly Tyr His Phe Cys
35 40 45
Gly Gly Val Leu Ile Asn Asp Gln Trp Val Leu Ser Val Ala His Cys
50 55 60
Trp Tyr Asn Pro Tyr Tyr Met Gln Val Met Leu Gly Glu His Asp Leu
65 70 75 80
Arg Val Phe Glu Gly Thr Glu Gln Leu Val Lys Thr Asn Thr Ile Phe
85 90 95
Trp His Glu Leu Tyr Asp Tyr Gln Thr Leu Asp Tyr Asp Met Met Met
100 105 110
Ile Lys Leu Tyr His Pro Val Glu Val Thr Gln Ser Val Ala Pro Ile
115 120 125
Ser Leu Pro Thr Gly Pro Pro Asp Gly Gly Met Leu Cys Ser Val Ser
130 135 140
Gly Trp Gly Asn Met Ala Met Gly Glu Glu Val Asn Leu Pro Thr Arg
145 150 155 160
Leu Gln Cys Leu Asp Val Pro Ile Val Glu Thr Val Asp Cys Glu Ala
165 170 175
Ala Tyr Pro Gly Met Ile Ser Pro Arg Met Val Cys Ala Gly Tyr Met
180 185 190
Asp Gly Gly Arg Asp Ala Cys Asn Gly Asp Ser Gly Ser Pro Leu Val
195 200 205
Cys Glu Gly Val Leu Thr Gly Leu Val Ser Trp Gly Gln Gly Cys Ala
210 215 220
Leu Pro Asn Tyr Pro Gly Val Tyr Val Lys Val Tyr Glu Tyr Leu Ser
225 230 235 240
Trp Ile Gln Thr Thr Leu Asp Ala Asn Pro
245 250
<210> 21
<211> 249
<212> PRT
<213> Gadus morhua
<400> 21
Met Ile Gly Leu Ala Leu Leu Met Leu Leu Gly Ala Ala Ala Ala Val
1 5 10 15
Pro Arg Glu Asp Gly Arg Ile Ile Gly Gly Gln Asp Cys Glu Pro Arg
20 25 30
Ser Arg Pro Phe Met Ala Ser Leu Asn Tyr Gly Tyr His Phe Cys Gly
35 40 45
Gly Val Leu Ile Asn Asp Gln Trp Val Leu Ser Val Ala His Cys Trp
50 55 60
Tyr Asn Pro Tyr Tyr Met Gln Val Met Leu Gly Glu His Asp Leu Arg
65 70 75 80
Val Phe Glu Gly Thr Glu Gln Leu Val Lys Thr Asn Thr Ile Phe Trp
85 90 95
His Glu Leu Tyr Asp Tyr Gln Thr Leu Asp Tyr Asp Met Met Met Ile
100 105 110
Lys Leu Tyr His Pro Val Glu Val Thr Gln Ser Val Ala Pro Ile Ser
115 120 125
Leu Pro Thr Gly Pro Pro Asp Gly Gly Met Leu Cys Ser Val Ser Gly
130 135 140
Trp Gly Asn Met Ala Met Gly Glu Glu Val Asn Leu Pro Thr Arg Leu
145 150 155 160
Gln Cys Leu Asp Val Pro Ile Val Glu Pro Val Ala Cys Gln Ala Ser
165 170 175
Tyr Pro Gly Met Ile Ser Pro Arg Met Met Cys Val Gly Phe Met Asp
180 185 190
Gly Gly Arg Asp Val Cys Asn Gly Asp Ser Gly Ser Pro Leu Val Cys
195 200 205
Glu Gly Val Leu Thr Gly Leu Val Ser Trp Gly Arg Gly Cys Ala Glu
210 215 220
Pro Asn Ser Pro Gly Val Tyr Val Lys Val Tyr Glu Phe Leu Ser Trp
225 230 235 240
Ile Gln Thr Thr Leu Asp Ala Asn Pro
245
<210> 22
<211> 249
<212> PRT
<213> Gadus morhua
<400> 22
Met Ile Gly Leu Ala Leu Leu Met Leu Leu Gly Ala Ala Ala Ala Val
1 5 10 15
Pro Arg Glu Asp Gly Arg Ile Ile Gly Gly Gln Asp Cys Glu Pro Arg
20 25 30
Ser Arg Pro Phe Met Ala Ser Leu Asn Tyr Gly Tyr His Phe Cys Gly
35 40 45
Gly Val Leu Ile Asn Asp Gln Trp Val Leu Ser Val Ala His Cys Trp
50 55 60
Tyr Asn Pro Tyr Tyr Met Gln Val Met Leu Gly Glu His Asp Leu Arg
65 70 75 80
Val Phe Glu Gly Thr Glu Gln Leu Val Lys Thr Asn Thr Ile Phe Trp
85 90 95
His Glu Leu Tyr Asp Tyr Gln Thr Leu Asp Tyr Asp Met Met Met Ile
100 105 110
Lys Leu Tyr His Pro Val Glu Val Thr Gln Ser Val Ala Pro Ile Ser
115 120 125
Leu Pro Thr Gly Pro Pro Asp Gly Gly Met Leu Cys Ser Val Ser Gly
130 135 140
Trp Gly Asn Met Ala Met Gly Glu Glu Val Asn Leu Pro Thr Arg Leu
145 150 155 160
Gln Cys Leu Asp Val Pro Ile Val Glu Thr Val Asp Cys Glu Ala Ala
165 170 175
Tyr Pro Gly Met Ile Ser Pro Arg Met Val Cys Ala Gly Tyr Met Asp
180 185 190
Gly Gly Arg Asp Ala Cys Asn Gly Asp Ser Gly Ser Pro Leu Val Cys
195 200 205
Glu Gly Val Leu Thr Gly Leu Val Ser Trp Gly Gln Gly Cys Ala Leu
210 215 220
Pro Asn Tyr Pro Gly Val Tyr Val Lys Val Tyr Glu Tyr Leu Ser Trp
225 230 235 240
Ile Gln Thr Thr Leu Asp Ala Asn Pro
245
<210> 23
<211> 12
<212> PRT
<213> Gadus morhua
<400> 23
Cys Val Leu Ser Gly Trp Val Arg Asp Thr Met Ala
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ИЗОФОРМЫ ТРИПСИНА И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2739945C2 |
| ВАРИАНТЫ СВИНОГО ТРИПСИНА | 2019 |
|
RU2783315C2 |
| АНТИТЕЛА К CD40L И СПОСОБЫ ЛЕЧЕНИЯ СВЯЗАННЫХ С CD40L ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ | 2016 |
|
RU2727646C2 |
| ИММУНОДОМИНАНТНЫЕ БЕЛКИ И ФРАГМЕНТЫ ПРИ РАССЕЯННОМ СКЛЕРОЗЕ | 2019 |
|
RU2828590C2 |
| ИММУНОКОНЪЮГАТЫ IL2 И МУТАНТНОГО TNF | 2017 |
|
RU2758139C2 |
| СЕЛЕКТИВНЫЕ В ОТНОШЕНИИ ИЗОФОРМЫ АНТИТЕЛА К TGF-БЕТА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2021 |
|
RU2839151C1 |
| АНТИТЕЛА К CD38 И СОСТАВЫ | 2020 |
|
RU2826957C2 |
| АМАТОКСИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2826004C2 |
| КОНСТРУКЦИИ СЛИТОГО БЕЛКА ДЛЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С КОМПЛЕМЕНТОМ | 2019 |
|
RU2824402C2 |
| T-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ, РАСПОЗНАЮЩИЕ МУТАЦИЮ R175H ИЛИ Y220C В P53 | 2020 |
|
RU2830061C2 |
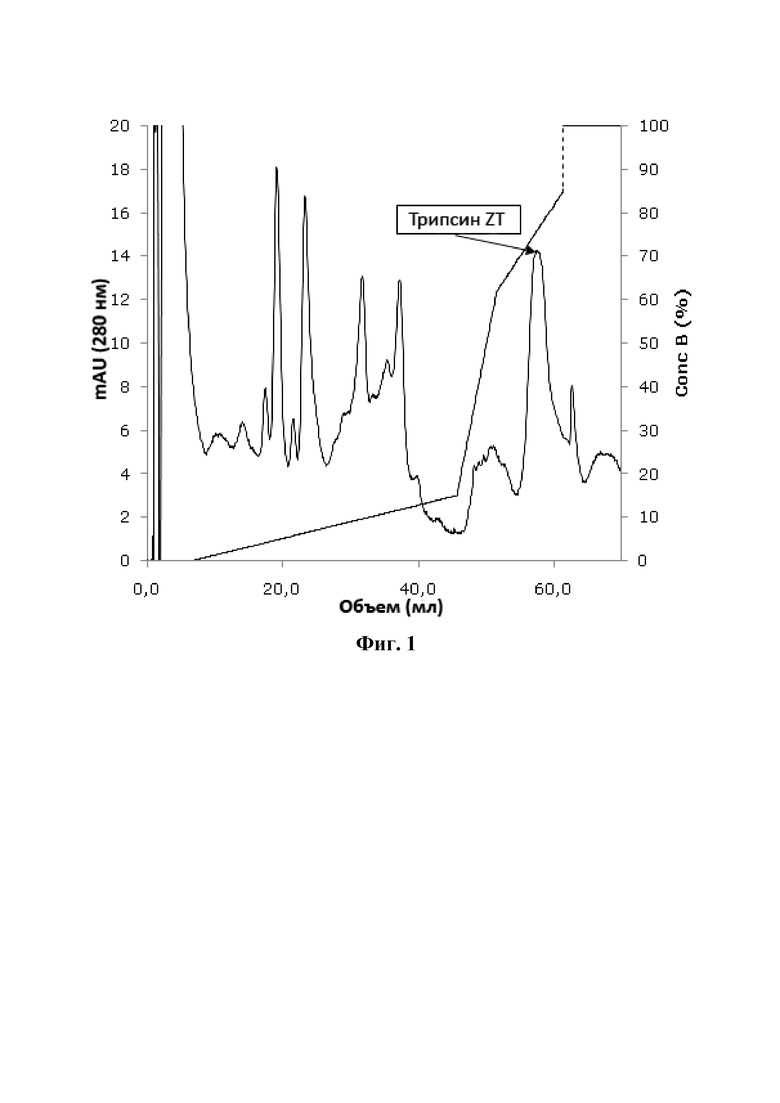
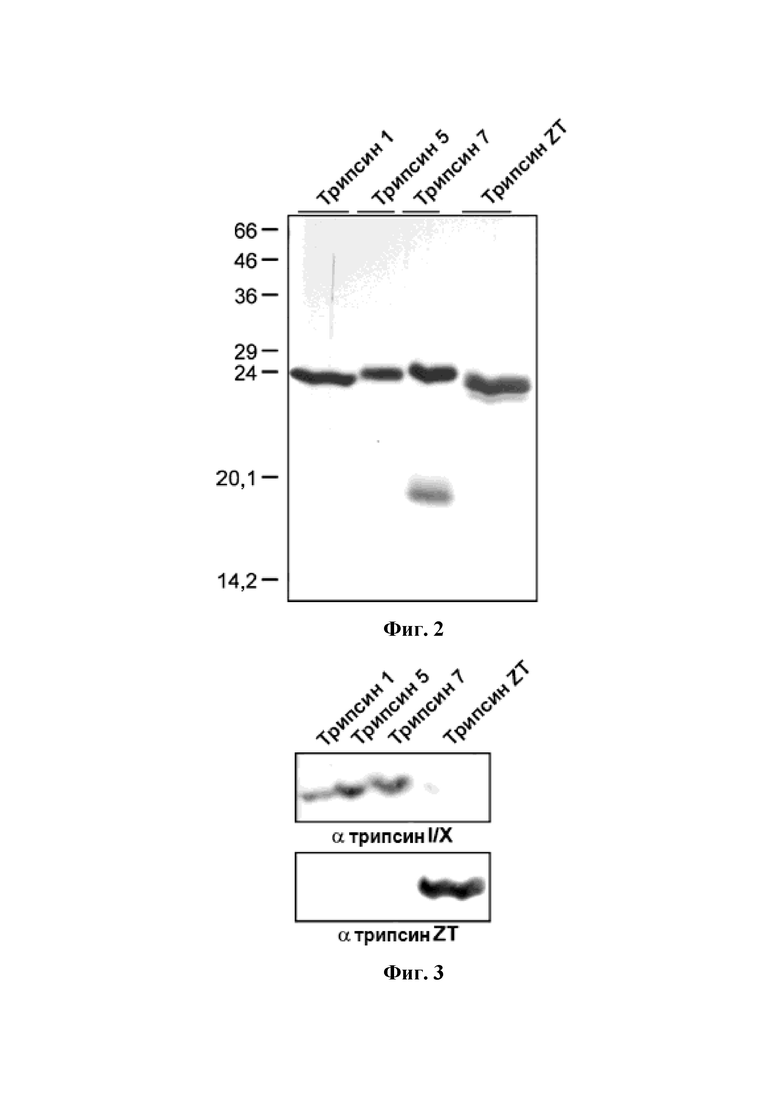
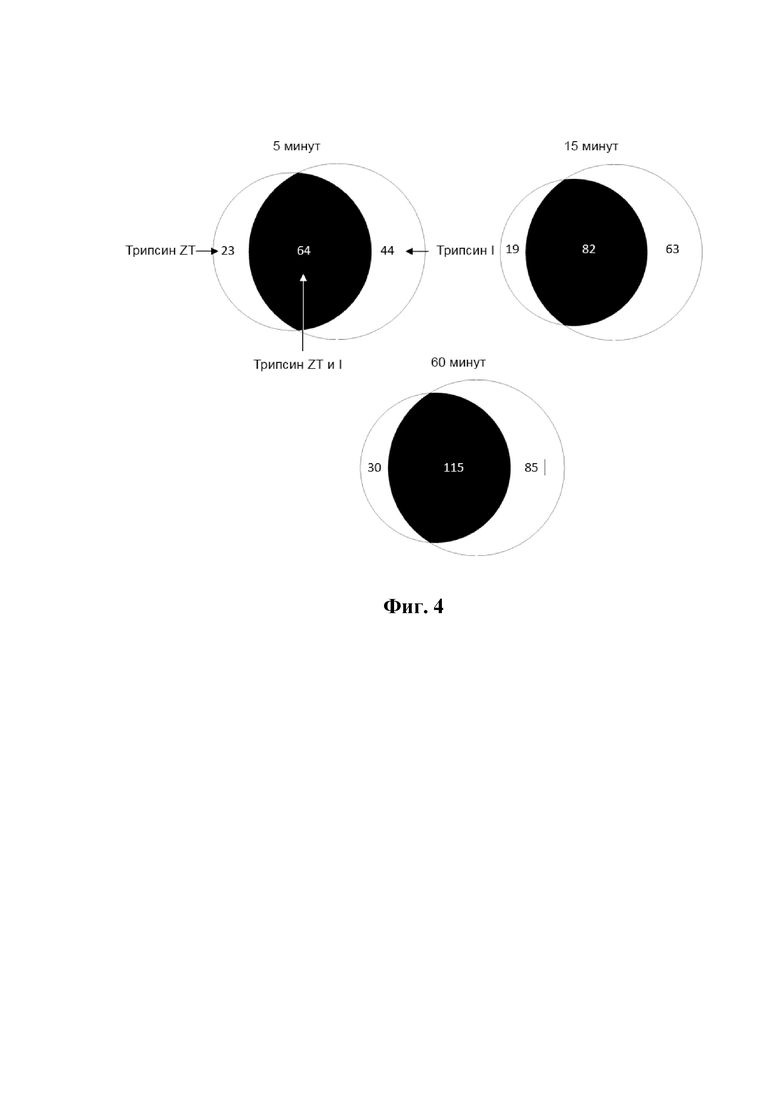
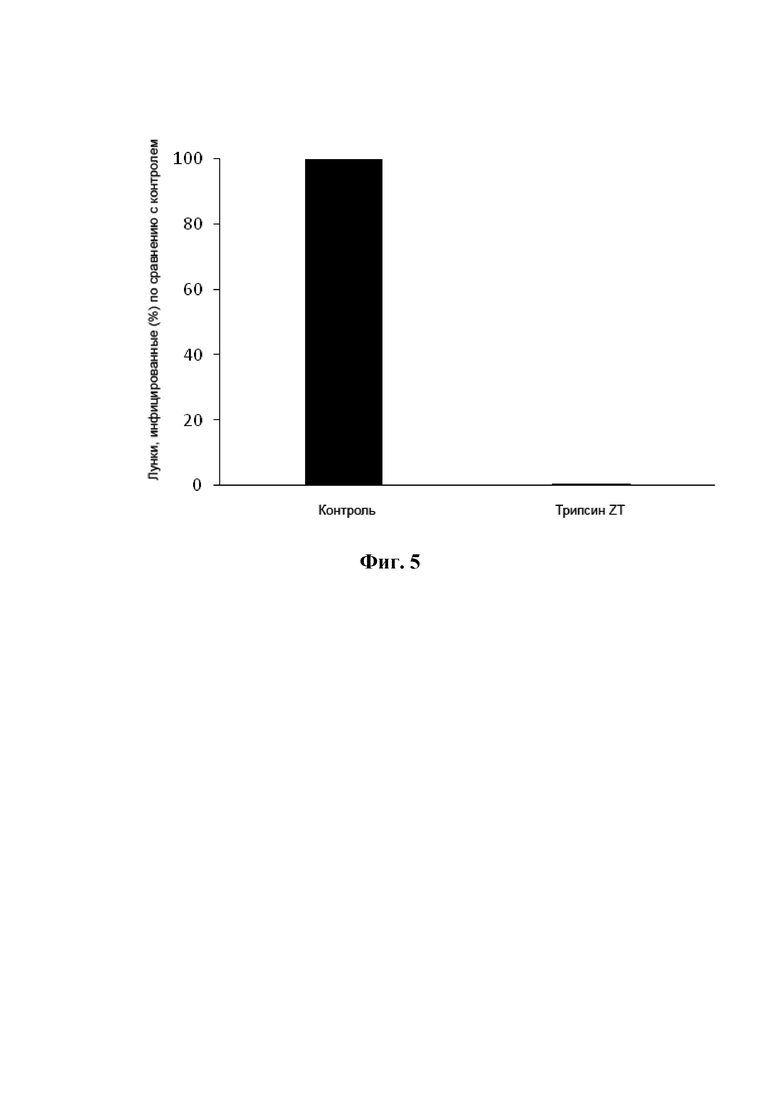
Группа изобретений относится к биотехнологии и медицине. Предложены изолированная изоформа трипсина ZT атлантической трески, содержащая аминокислотную последовательность SEQ ID NO: 2 или аминокислотную последовательность с гомологией последовательности 99% или более, медицинская композиция на ее основе и способ лечения заболеваний, вызванных пикорнавирусами, который включает введение терапевтически эффективного количества композиции. Новая изоформа трипсина ZT лучше адаптирована для расщепления пептидов, содержащих несколько последовательных основных аминокислотных остатков Arg и Lys, обладает специфической противовирусной активностью. 4 н. и 7 з.п. ф-лы, 5 ил., 4 табл., 6 пр.
1. Изолированная изоформа трипсина ZT атлантической трески, содержащая аминокислотную последовательность в соответствии с SEQ ID NO: 2 или аминокислотную последовательность с гомологией последовательности 99% или более.
2. Медицинская композиция, обладающая противовирусной активностью в отношении пикорнавирусов, содержащая по меньшей мере одну изоформу трипсина ZT атлантической трески по п. 1 вместе с подходящими фармацевтическими наполнителями и носителями.
3. Композиция по п. 2, в которой указанная изоформа(ы) трипсина ZT атлантической трески находится в смеси с другими трипсинами атлантической трески.
4. Композиция по п. 2 или 3, в которой указанная изоформа(ы) трипсина ZT атлантической трески составляет по меньшей мере 5% (мас./мас.) от общего содержания трипсинов атлантической трески в указанной композиции.
5. Композиция по любому из пп. 2-4, которая дополнительно содержит поливалентный спирт, такой как глицерин.
6. Композиция по любому из пп. 2-5, которая вводится местно в виде лосьона, гидрогеля, спрея для полости рта или назального спрея.
7. Композиция по любому из пп. 2-6, где пикорнавирус представляет собой риновирус.
8. Применение композиции по любому из пп. 2-6 для лечения или профилактики заболеваний верхних дыхательных путей, вызванных пикорнавирусами.
9. Применение по п. 8, где пикорнавирус представляет собой риновирус.
10. Способ лечения заболеваний, вызванных пикорнавирусами, который включает введение терапевтически эффективного количества композиции по любому из пп. 2-6 пациенту, нуждающемуся в этом.
11. Способ по п. 10, где пикорнавирус представляет собой риновирус.
| SPILLIAERT R | |||
| and GUDMUNDSDOTTIR A | |||
| Atlantic Cod Trypsin Y-Member of a Novel Trypsin Group | |||
| Mar | |||
| Biotechnol | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| ФОРМА КОРМОВОЙ ЧАСТИ ОДНОВИНТОВОГО СУДНА | 1931 |
|
SU30563A1 |
| СЕРИНОВЫЕ ПРОТЕИНАЗЫ РЫБ И ИХ ФАРМАЦЕВТИЧЕСКОЕ И КОСМЕТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2000 |
|
RU2264824C2 |
| ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ И ЖЕЛУДОЧНО-КИШЕЧНЫХ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ БАКТЕРИАЛЬНОЙ И ВИРУСНОЙ ЭТИОЛОГИИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ И ЖЕЛУДОЧНО-КИШЕЧНЫХ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ БАКТЕРИАЛЬНОЙ И ВИРУСНОЙ ЭТИОЛОГИИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ | 2005 |
|
RU2286171C1 |
Авторы
Даты
2024-03-04—Публикация
2016-07-22—Подача