ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к производным пиперидина в качестве антагонистов рецептора орексина и к их композициям, а также к их применению для получения лекарственного средства для лечения бессонницы, хронической обструктивной болезни легких, обструктивного апноэ во сне, гиперсомнии, тревоги, обсессивно-компульсивного расстройства, панической атаки, никотиновой зависимости или психогенного переедания.
УРОВЕНЬ ТЕХНИКИ
Орексин (Orexin или Orexine), вырабатываемый гипоталамусом, включает два нейропептида: орексин А (ОХ-А) (пептид с 33 аминокислотами) и орексин В (ОХ-В) (пептид с 28 аминокислотами) (Sakurai Т., et al., Cell, 1998, 92, 573-585). Установлено, что орексин может стимулировать потребление пищи у крыс, то есть в центральном механизме обратной связи регуляции пищевого поведения указанный пептид играет физиологическую роль посредника (Sakurai Т. et al., Cell, 1998, 92, 573-585). Орексин может регулировать состояние сна и бессонницы, тем самым потенциально обеспечивая новый способ лечения сна у пациентов с бессонницей или судорожными припадками (Chemelli R.M. et al., Cell, 1999, 98, 437-451). Орексин также играет определенную роль в пробуждении, мотивации, обучении и памяти (Harris, et al., Trends Neuroscl., 2006, 29 (10), 571-577). Два рецептора орексина, принадлежащих суперсемейству рецепторов, связанных с G-белком, были клонированы и охарактеризованы у млекопитающих (Sakurai Т. et al., Cell, 1998, 92, 573-585): Рецептор орексина-1 (ОХ или OX1R) является селективным в отношении ОХ-А, и рецептор орексина-2 (OX2 или OX2R) способен связывать ОХ-А и ОХ-В. Полагают, что физиологическая роль орексина предварительно определяется с одним или обоими рецепторами OX1 и OX2 (два подтипа рецептора орексина).
Рецепторы орексина могут быть найдены в мозгу теплокровных животных, а также участвуют во многих заболеваниях, таких как депрессия; тревога; зависимость; обсессивно-компульсивное расстройство; аффективный невроз; депрессивный невроз; невроз тревоги; дистимическое расстройство; поведенческое расстройство; расстройство настроения; сексуальная дисфункция; психосексуальная дисфункция; тендерное расстройство; шизофрения; маниакальная депрессия; делирий; слабоумие; умственная отсталость и двигательное расстройство тяжелой степени, такое как болезнь Гентингтона и синдром Туретта; расстройства пищевого поведения, такие как анорексия, булимия, кахексия и ожирение; расстройства пищевого поведения с зависимостью; расстройства пищевого поведения с компульсивным перееданием; сердечно-сосудистые заболевания; диабет; расстройства аппетита или вкусовые расстройства; рвота, тошнота, сильная тошнота; астма; рак; болезнь Паркинсона; синдром Кушинга; базофильная аденома; пролактинома; гиперпролактинемия; опухоль или аденома гипофиза; гипоталамическая болезнь; воспалительное заболевание кишечника; дисфункция желудка; язва желудка; генитальная деградация, вызванная ожирением; расстройства гипофиза; расстройства желез гипофиза; гипогонадизм гипофиза; гиперактивность гипофиза; гипогонадизм гипоталамуса; комплексная болезнь Каллманна (аносмия, гипосмия); функциональная или психогенная аменорея; гипопитуитаризм; гипотиреоз гипоталамуса; гипоталамо-надпочечниковая дисфункция; внезапная гиперпролактинемия; дефицит гормона роста при болезни гипоталамуса; внезапное отсутствие роста; карликовость; гигантизм; акромегалия; нарушенные биологические и циркадные ритмы; нарушения сна, связанные с заболеваниями, такими как неврологические нарушения, невропатическая боль и синдром усталых ног; заболевания сердца и легких, острая и застойная сердечная недостаточность; гипотензия; гипертензия; задержка мочи; остеопороз; стенокардия; острый инфаркт миокарда; ишемический или геморрагический инсульт; субарахноидальное кровоизлияние; язвы; аллергическая реакция; доброкачественная гипертрофия предстательной железы; хроническая почечная недостаточность; болезнь почек; нарушенная толерантность к глюкозе; мигрень; гипералгезия; боль; повышенная или увеличенная чувствительность к боли, такая как гипералгезия, каузалгия и аллодиния; острая боль; жгучая боль; атипичная лицевая боль; невропатическая боль; боль в спине; комплексный региональный болевой синдром I и II; боль при артрите; спортивные болевые травмы; и боль, связанная с инфекцией (например, ВИЧ), боль после химиотерапии; боль после инсульта; послеоперационная боль; невралгия; рвота, тошнота, рвота; расстройства, связанные с висцеральной болью, такие как синдром раздраженной толстой кишки и стенокардия; мигрень; недержание мочевого пузыря, например, неотложное недержание мочи; толерантность к наркотикам или анестетикам; нарушения сна; апноэ во сне; бессонница; парасомния; синдром смены часовых поясов; и нейродегенеративные расстройства, в том числе заболеваний, таких как синдром расторможенности-слабоумия-Паркинсона-мышечной атрофии; эпилепсия; эпилептические и другие заболевания, сопутствующие общей системной дисфункции орексина.
Некоторые антагонисты рецептора орексина раскрыты в следующих патентах: WO 99/09024, WO 99/58533, WO 00/47576, WO 00/47577, WO 00/47580, WO 01/68609, WO 01/85693, WO 01/96302, WO 2002/044172, WO 2002/051232, WO 2002/051838, WO 2002/089800, WO 2002/090355, WO 2003/002559, WO 2003/002561, WO 2003/032991, WO 2003/037847, WO 2003/041711, WO 2003/051368, WO 2003/051872, WO 2003/051873, WO 2004/004733, WO 2004/026866, WO 2004/033418, WO 2004/041807, WO 2004/041816, WO 2004/052876, WO 2004/083218, WO 2004/085403, WO 2004/096780, WO 2005/060959, WO 2005/075458, WO 2005/118548, WO 2006/067224, WO 2006/110626, WO 2006/127550, WO 2007/019234, WO 2007/025069, WO 2007/061763, WO 2007/116374, WO 2007/122591, WO 2007/126934, WO 2007/126935, WO 2008/008517, WO 2008/008518, WO 2008/008551, WO 2008/020405, WO 2008//026149 и WO 2008/038251.
Кроме того, в вышеуказанных патентах WO 2008147518 (или CN 101679366 В) были раскрыты структуры формулы B-I и MK6096:
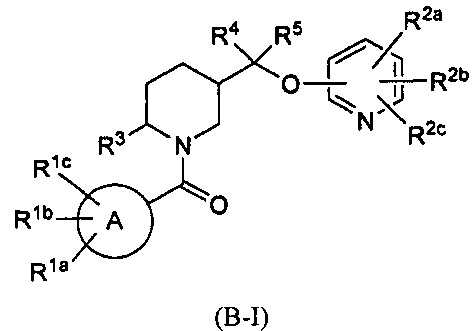
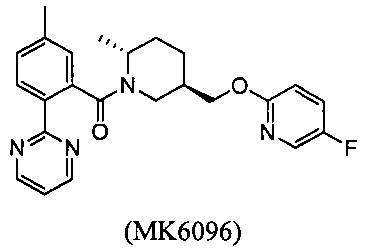
Тем не менее, их эффекты, такие как активность, растворимость, фармакокинетика, период полувыведения и так далее, нуждаются в улучшении.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является обеспечение соединения формулы (I) или его фармацевтически приемлемой соли,
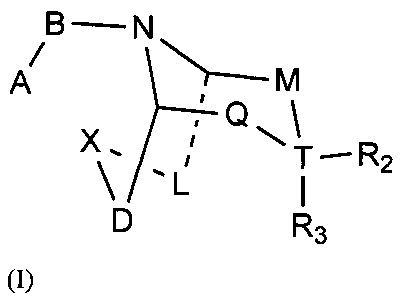
где:
А выбран из необязательно замещенного 3-12 членного циклогидрокарбила или гетероциклогидрокарбила или циклического гетерогидрокарбила; где указанный циклогидрокарбил или гетероциклогидрокарбил или циклический гетерогидрокарбил представлены в форме одного кольца, бициклического кольца, спирокольца, конденсированного кольца или конденсированного кольца, и указанный заместитель выбран из группы, состоящей из F, Cl, Br, I, CN, =O, =S, ОН, SH, NH2, галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного С1-6 алкила или гетероалкила или алкилгетерогруппы или гетероалкилгетерогруппы, и галоген-замещенной, гидрокси-замещенной, амино-замещенной или незамещенной С3-8 циклической группы или гетероциклической группы или циклической гетерогруппы или гетероциклической гетерогруппы; где указанный гетероатом или гетероатомная группа независимо выбрана из C1-6 алкил-замещенного, С3-8 циклоалкил-замещенного или незамещенного C(=O)NH, С(=O)O, C1-6 алкил-замещенного или С3-8 циклоалкил-замещенного или незамещенного NH, О, S, C1-6 алкил-замещенной или С3-8 циклоалкил-замещенной или незамещенной C=NH, С=O, C=S, S(=O) и/или S(=O)2, где количество заместителей, гетероатомов или гетероатомных групп является произвольно выбранным до тех пор, пока возможно достижение химической стабильности;
В выбран из С(=O), S(=O) или S(=O)2;
X выбран из необязательно замещенной (CH2)r1(U)r2(CH2)r3, где указанный заместитель выбран из группы, состоящей из F, Cl, Br, I, CN, =O, =S, ОН, SH, NH2, галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного C1-6 алкила или гетероалкила или алкилгетерогруппы или гетероалкилгетерогруппы, галоген-замещенной, гидрокси-замещенной, амино-замещенной или незамещенной С3-8 циклической группы или гетероциклической группы или циклической гетерогруппы или гетероциклической гетерогруппы, где указанный гетероатом или гетероатомная группа независимо выбрана из C1-6 алкил-замещенного, С3-8 циклоалкил-замещенного или незамещенного C(=O)NH, С(=O)O, С1-6 алкил-замещенного или С3-8 циклоалкил-замещенного или незамещенного NH, О, S, C1-6 алкил-замещенного или С3-8 циклоалкил-замещенного или незамещенного C=NH, С=O, C=S, S(=O) и/или S(=O)2, где количество заместителей, гетероатомов или гетероатомных групп является произвольно выбранным до тех пор, пока возможно достижение химической стабильности;
r1 и r3 независимо выбраны из 0, 1 или 2, r2 выбран из 0 или 1, и когда все r1, r2 и r3 представляют собой 0, это означает, что X представляет собой одинарную связь;
U выбран из галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного СН2, С1-6 алкил-замещенного или С3-8 циклоалкил-замещенного или незамещенного C(=O)NH, С(=O)O, С1-6 алкил-замещенного или С3-8 циклоалкил-замещенного или незамещенного NH, О, S, C1-6 алкил-замещенного или С3-8 циклоалкил-замещенного или незамещенного C=NH, С=O, C=S, S(=O) и/или S(=O)2, где количество заместителей является произвольно выбранным до тех пор, пока возможно достижение химической стабильности;
D и L независимо выбраны из необязательно замещенного CH2, где указанный заместитель выбран из F, Cl, Br, I, CN, =O, =S, ОН, SH, NH2, галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного C1-6 алкила или гетероалкила или алкилгетерогруппы или гетероалкилгетерогруппы, галоген-замещенной, гидрокси-замещенной, амино-замещенной или незамещенной С3-8 циклической группы или гетероциклической группы или циклической гетерогруппы или гетероциклической гетерогруппы, где указанный гетероатом или гетероатомная группа независимо выбрана из С1-6 алкил-замещенного, С3-8 циклоалкил-замещенного или незамещенного C(=O)NH, С(=O)O, C1-6 алкил-замещенного или С3-8 циклоалкил-замещенного или незамещенного NH, О, S, С1-6 алкил-замещенного или С3-8 циклоалкил-замещенного или незамещенного C=NH, С=O, C=S, S(=O) и/или S(=O)2, где количество заместителей, гетероатомов или гетероатомных групп является произвольно выбранным до тех пор, пока возможно достижение химической стабильности;
Т выбран из С или одинарной связи, и R2 и R3 отсутствуют, когда Т представляет собой одинарную связь;
М выбран из C(Y)(R1a), когда Q выбран из C(R1b)(R1c), или М выбран из C(R1b)(R1c), когда Q выбран из C(Y)(R1a);
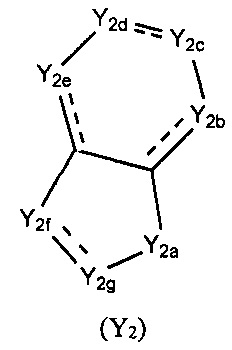
Y выбран из -(CH2)r4(G)r5(CH2)r6-Y1, где Y1 выбран из -O-Е или структуры формулы (Y2),
G выбран из галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного СН2, C1-6 алкил-замещенного, С3-8 циклоалкил-замещенного или незамещенного NH, О, S, S(=O), S(=O)2, С(=O) или C(=S), где количество заместителей является произвольно выбранным до тех пор, пока возможно достижение химической стабильности;
r4 и r6 независимо выбраны из 0, 1 или 2, r5 выбран из 0 или 1, и когда все r4, r5 и r6 представляют собой 0, это означает, что соответствующая структура представляет собой одинарную связь;
Е выбран из необязательно замещенного 5-6-членного циклогидрокарбила или гетероциклической группы, где указанный заместитель выбран из F, Cl, Br, I, CN, =O, =S, ОН, SH, NH2, галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного C1-6 алкила или гетероалкила или алкилгетерогруппы или гетероалкилгетерогруппы, галоген-замещенной, гидрокси-замещенной, амино-замещенной или незамещенной C3-8 циклической группы или гетероциклической группы или циклической гетерогруппы или гетероциклической гетерогруппы, где указанный гетероатом или гетероатомная группа независимо выбрана из C1-6 алкил-замещенного, C3-8 циклоалкил-замещенного или незамещенного C(=O)NH, С(=O)O, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного NH, О, S, С1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного C=NH, С=O, C=S, S(=O) и/или S(=O)2, где количество заместителей, гетероатомов или гетероатомных групп является произвольно выбранным до тех пор, пока возможно достижение химической стабильности;
каждый из Y2a, Y2b, Y2c, Y2d, Y2e, Y2f, и Y2g выбран из необязательно замещенного СН2, СН, NH, или выбран из N, О, S, S(=O), S(=O)2, С(=O) или C(=S), и по меньшей мере один из Y2a, Y2b, Y2c, Y2d, Y2e, Y2f, и Y2g представляет собой необязательно замещенный СН, СН2 или NH, где указанный заместитель выбран из F, Cl, Br, I, CN, =O, =S, ОН, SH, NH2, галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного C1-6 алкила или гетероалкила или алкилгетерогруппы или гетероалкилгетерогруппы, галоген-замещенной, гидрокси-замещенной, амино-замещенной или незамещенной C3-8 циклической группы или гетероциклической группы или циклической гетерогруппы или гетероциклической гетерогруппы, где указанный гетероатом или гетероатомная группа независимо выбрана из C1-6 алкил-замещенного, C3-8 циклоалкил-замещенного или незамещенного C(=O)NH, С(=O)O, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного NH, О, S, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного C=NH, С=O, C=S, S(=O) и/или S(=O)2, где количество заместителей, гетероатомов или гетероатомных групп является произвольно выбранным до тех пор, пока возможно достижение химической стабильности;
 представляет собой одинарную связь или двойную связь;
представляет собой одинарную связь или двойную связь;
каждый из R1a, R1b, R1c, R2, и R3 независимо выбран из Н, F, Cl, Br, I, CN, =O, =S, ОН, SH, NH2, галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного C1-6 алкила или гетероалкила или алкилгетерогруппы или гетероалкилгетерогруппы, галоген-замещенной, гидрокси-замещенной, амино-замещенной или незамещенной C3-8 циклической группы или гетероциклической группы или циклической гетерогруппы или гетероциклической гетерогруппы, где указанный гетероатом или гетероатомная группа независимо выбрана из C1-6 алкил-замещенного, C3-8 циклоалкил-замещенного или незамещенного C(=O)NH, С(=O)O, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного NH, О, S, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного C=NH, С=O, C=S, S(=O) и/или S(=O)2, где количество заместителей, гетероатомов или гетероатомных групп является произвольно выбранным до тех пор, пока возможно достижение химической стабильности; или R2 и R3 необязательно соединены с образованием кольца; и
соединение или его фармацевтически приемлемая соль содержит один или более хиральных центров.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли А выбран из структурного звена, показанного в формуле (A1) или (А2):
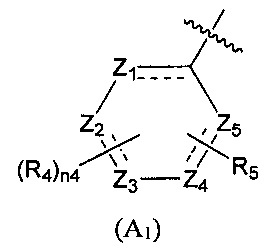
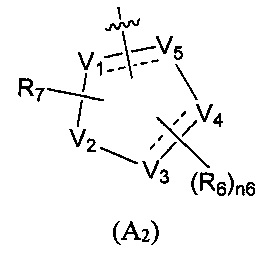
где:
Z1, Z2, Z3, Z4, и Z5 независимо выбраны из галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного СН или СН2, или C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного C(=O)NH или NH, C=N, N, О, S, S(=O), S(=O)2, С(=O)O, С(=O) или C(=S), где количество заместителей является произвольно выбранным до тех пор, пока возможно достижение химической стабильности;
V1, V2, V3, V4, и V5 независимо выбраны из галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного СН или СН2, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного C(=O)NH или NH, C=N, С, N, О, S, S(=O), S(=O)2, С(=O)O, С(=O) или C(=S), и по меньшей мере один из V1-V5 представляет собой С или N, где количество заместителей является произвольно выбранным до тех пор, пока возможно достижение химической стабильности;
 представляет собой одинарную связь или двойную связь;
представляет собой одинарную связь или двойную связь;
R4 и R6 независимо выбраны из Н, F, Cl, Br, I, CN, =O, =S, ОН, SH, NH2, галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного C1-6 алкила или гетероалкила или алкилгетерогруппы или гетероалкилгетерогруппы, галоген-замещенной, гидрокси-замещенной, амино-замещенной или незамещенной C3-8 циклической группы или гетероциклической группы или циклической гетерогруппы или гетероциклической гетерогруппы, где указанный гетероатом или гетероатомная группа независимо выбрана из C1-6 алкил-замещенного, C3-8 циклоалкил-замещенного или незамещенного C(=O)NH, С(=O)O, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного NH, О, S, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного C=NH, С=O, C=S, S(=O) и/или S(=O)2, где количество заместителей, гетероатомов или гетероатомных групп является произвольно выбранным до тех пор, пока возможно достижение химической стабильности;
R5 и R7 независимо выбраны из необязательно замещенного 5-6-членного циклогидрокарбила или гетероциклической группы, в то время как указанный заместитель выбран из F, Cl, Br, I, CN, =O, =S, ОН, SH, NH2, галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного C1-6 алкила или гетероалкила или алкилгетерогруппы или гетероалкилгетерогруппы, галоген-замещенной, гидрокси-замещенной, амино-замещенной или незамещенной C3-8 циклической группы или гетероциклической группы или циклической гетерогруппы или гетероциклической гетерогруппы, где указанный гетероатом или гетероатомная группа независимо выбрана из C1-6 алкил-замещенного, C3-8 циклоалкил-замещенного или незамещенного C(=O)NH, С(=O)O, С1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного NH, О, S, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного C=NH, С=O, C=S, S(=O) и/или S(=O)2, где количество заместителей, гетероатомов или гетероатомных групп является произвольно выбранным до тех пор, пока возможно достижение химической стабильности;
n4 выбран из 0, 1, 2, 3, 4; и
n6 выбран из 0, 1, 2, 3.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли указанное структурное звено 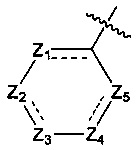 выбрано из фенила или пиридила;
выбрано из фенила или пиридила; 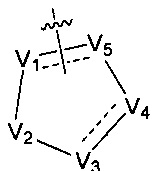 - выбрано из фурила, тиенила или тиазолила.
- выбрано из фурила, тиенила или тиазолила.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли, формула (А2) выбрана из структуры формулы (А21):
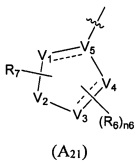
где V1, V2, V3, V4, V5, R6, R7 и n6 определены в формуле (А2).
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли, А выбран из структурного звена формулы (А22):
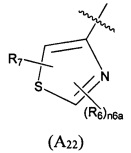
где R6 и R7 определены в формуле (А2); и n6a выбран из 0, 1 или 2.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли указанный 5-6-членный циклогидрокарбил или гетероциклическая группа независимо выбраны из фенила, пиридила, фурила, тиенила, тиазолила, пиримидинила, пиразолила, 1,2,3-триазолила или 1,2,5-триазолила.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли А выбран из:
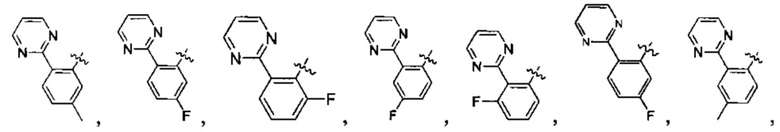
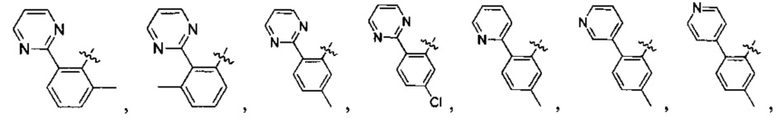
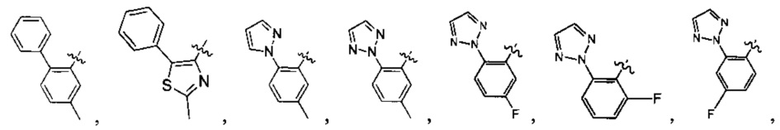
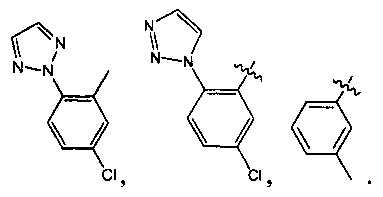
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли формула (Y2) выбрана из структуры формулы (Y21):
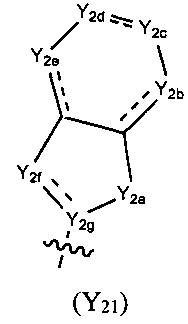
где Y2a, Y2b, Y2c, Y2d, Y2e, Y2f и Y2g определены в формуле (I).
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли формула (Y21) выбрана из структуры формулы (Y22), которая представляет собой необязательно замещенный:
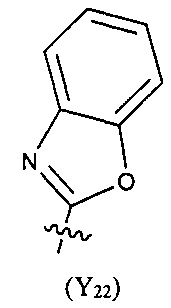
где указанный заместитель выбран из F, Cl, Br, I, CN, =O, =S, ОН, SH, NH2, галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного C1-6 алкила или гетероалкила или алкилгетерогруппы или гетероалкилгетерогруппы, галоген-замещенной, гидрокси-замещенной, амино-замещенной или незамещенной C3-8 циклической группы или гетероциклической группы или циклической гетерогруппы или гетероциклической гетерогруппы, где указанный гетероатом или гетероатомная группа независимо выбрана из C1-6 алкил-замещенного, C3-8 циклоалкил-замещенного или незамещенного C(=O)NH, С(=O)O, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного NH, О, S, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного C=NH, С=O, C=S, S(=O) и/или S(=O)2, где количество заместителей, гетероатомов или гетероатомных групп является произвольно выбранным до тех пор, пока возможно достижение химической стабильности.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли Y выбран из необязательно замещенного 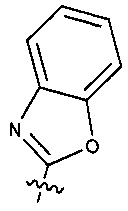 или
или 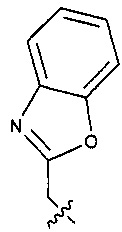 .
.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли Y выбран из -СН2-О-Е или -О-Е, где Е определен в формуле (I).
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли Е выбран из структурного звена формулы (Еа):
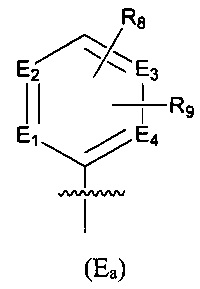
где:
E1, Е2, Е3 и Е4 независимо выбраны из галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного СН, N; и
R8 и R9 независимо выбраны из Н, F, Cl, Br, I, CN, =O, =S, ОН, SH, NH2, галоген-замещенного, гидрокси-замещенного, амино-замещенного или незамещенного C1-6 алкила или гетероалкила или алкилгетерогруппы или гетероалкилгетерогруппы, галоген-замещенной, гидрокси-замещенной, амино-замещенной или незамещенной C3-8 циклической группы или гетероциклической группы или циклической гетерогруппы или гетероциклической гетерогруппы, где указанный гетероатом или гетероатомная группа независимо выбрана из C1-6 алкил-замещенного, C3-8 циклоалкил-замещенного или незамещенного C(=O)NH, С(=O)O, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного NH, О, S, C1-6 алкил-замещенного или C3-8 циклоалкил-замещенного или незамещенного C=NH, С=O, C=S, S(=O) и/или S(=O)2, где количество заместителей, гетероатомов или гетероатомных групп является произвольно выбранным до тех пор, пока возможно достижение химической стабильности.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли, указанное структурное звено 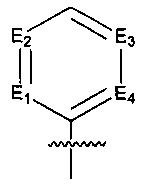 определено как фенил или пиридил, или заменено на тиенил или фурил.
определено как фенил или пиридил, или заменено на тиенил или фурил.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли Y выбран из:
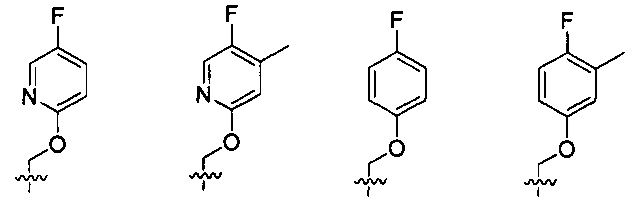
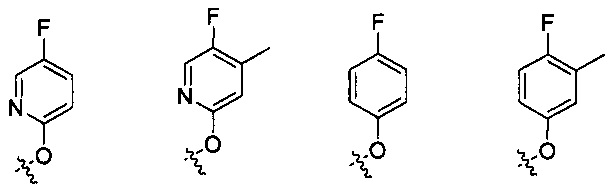
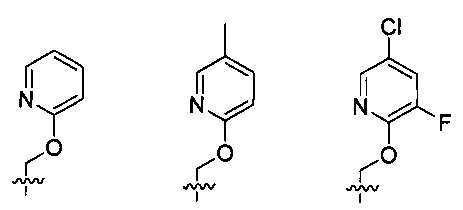 .
.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли U, X и G независимо выбраны из NH или N(C1-6 алкил).
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли R1a, R1b и R1c независимо выбраны из Н, метила или фтора.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли R2 и R3 независимо выбраны из Н, метила, фтора или циклопропила.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли R2 и R3 совместно образуют 3-8 членный циклоалкил.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли R2 и R3 совместно образуют циклопропил.
Предпочтительно, в указанном выше соединении или его фармацевтически приемлемой соли C1-6 алкил выбран из метила, этила, пропила, бутила, пентила и гексила, где пропил, бутил, пентил, и гексил необязательно циклизованы или частично циклизованы.
Предпочтительно, указанное выше соединение или его фармацевтически приемлемая соль имеют любую из следующих структур:
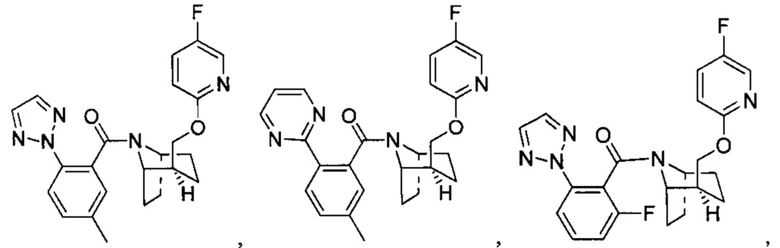
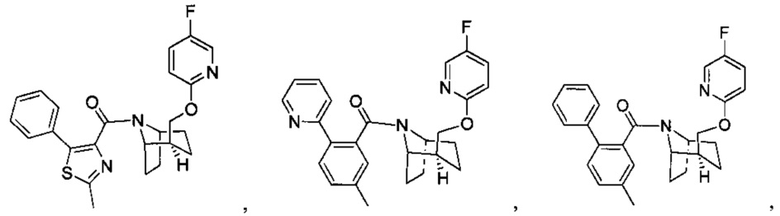
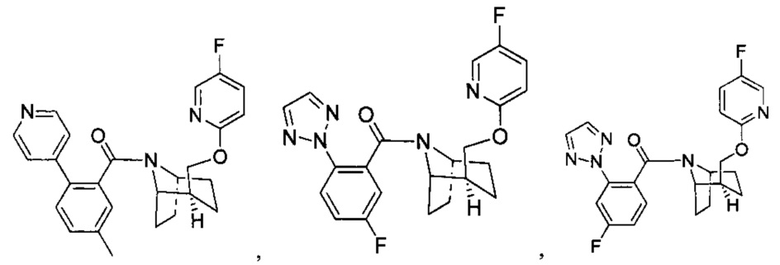
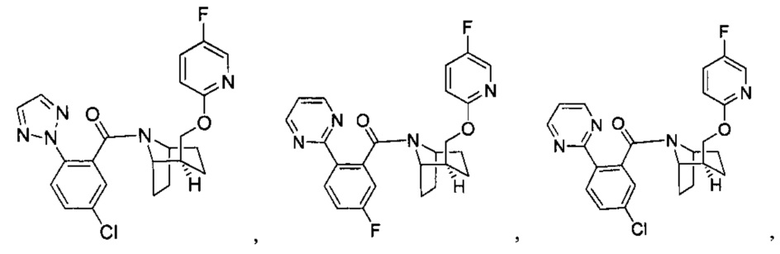
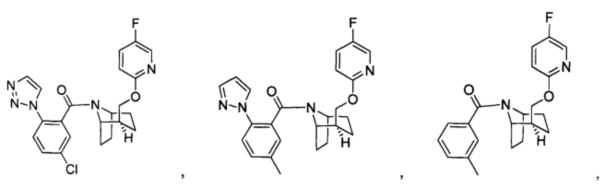
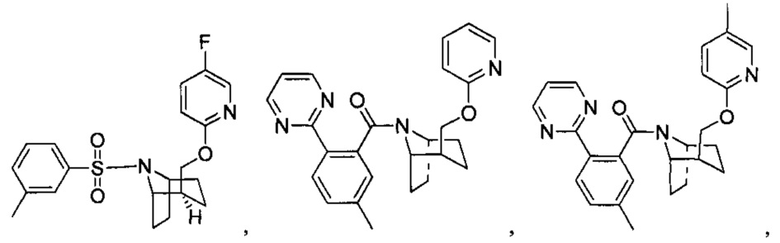 и
и
 .
.
Другой задачей настоящего изобретения является обеспечение фармацевтической композиции, содержащей терапевтически эффективное количество указанного выше соединения или его фармацевтически приемлемой соли, и фармацевтически приемлемый носитель.
Другой задачей настоящего изобретения является обеспечение применения указанного выше соединения или его фармацевтически приемлемой соли для получения лекарственного средства для лечения бессонницы, хронической обструктивной болезни легких, обструктивного апноэ во сне, гиперсомнии, тревоги, обсессивно-компульсивного расстройства, панической атаки, никотиновой зависимости или психогенного переедания.
Термин «фармацевтически приемлемая соль» относится к соли соединения согласно настоящему изобретению, которую получают путем взаимодействия соединения, имеющего специфические заместители, предложенные в настоящем изобретении, с относительно нетоксичной кислотой или основанием. Когда соединение согласно настоящему изобретению содержит относительно кислотные функциональные группы, соли присоединения основания могут быть получены путем использования достаточного количества основания, приведенного в контакт с нейтральной формой такого соединения в чистом растворе или подходящих инертных растворителях. Фармацевтически приемлемые соли присоединения основания включает соли натрия, калия, кальция, аммония, органического амина, магния и тому подобное. Когда соединение согласно настоящему изобретению содержит относительно основные функциональные группы, соли присоединения кислоты могут быть получены с использованием достаточного количества кислоты, приведенного в контакт с нейтральной формой такого соединения в чистом растворе или подходящих инертных растворителях. Примеры фармацевтически приемлемых солей присоединения кислоты включают соли неорганических кислот, где неорганическая кислота включает, например, соляную кислоту, бромистоводородную кислоту, азотную кислоту, карбонат, бикарбонат, фосфат, гидрофосфат, дигидрофосфат, сульфат, бисульфат, иодистоводородную, фосфорную и т.п.; и соли органических кислот, где органическая кислота включает, например, уксусную кислоту, пропионовую кислоту, изомасляную кислоту, малеиновую кислоту, малоновую кислоту, бензойную кислоту, янтарную кислота, субериновую кислоту, фумаровую кислоту, молочную кислоту, миндальную кислоту, фталевую кислоту, бензолсульфоновую кислоту, п-толуолсульфоновую кислоту, лимонную кислоту, винную кислоту и метансульфоновую кислоту, и тому подобное. Кроме того, они включают соли аминокислот (например, аргинина и т.д.), а также соли органических кислот, таких как глюкуроновая кислота и т.д. (см. Berge et al., «Pharmaceutical Salts», Journal of Pharmaceutical Science 66: 1-19 (1977)). Некоторые соединения согласно настоящему изобретению содержат как основные и кислотные функциональные группы, таким образом, они могут быть преобразованы как в соли присоединения основания, так и соли присоединения кислоты.
Предпочтительно соединение приводят в контакт с основанием или кислотой традиционным способом, и исходное соединение выделяют, тем самым регенерируя нейтральную форму соединения. Отличие формы исходного соединения от его различных солевых форм заключается в физических свойствах, например, разной растворимости в полярных растворителях.
В настоящем документе «фармацевтически приемлемая соль» представляет собой производное соединения согласно настоящему изобретению, в котором исходное соединение модифицируют путем образования соли с кислотой или основанием. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими: соли неорганических или органических кислот и основных групп, такие как амины, соли щелочных металлов или органические соли кислотных радикалов, таких как карбоновые кислоты. Фармацевтически приемлемые соли включают традиционные нетоксичные соли или соли четвертичного аммония исходного соединения, такие как соли, образованные с помощью нетоксичных неорганических или органических кислот. Традиционные нетоксичные соли включают, но не ограничиваются ими, соли, полученные из неорганических и органических кислот, где указанные неорганические или органические кислоты выбраны из 2-ацетоксибензойной кислоты, 2-оксиэтилсульфоновой кислоты, уксусной кислоты, аскорбиновой кислоты, бензолсульфоновой кислоты, бензойной кислоты, бикарбоната, карбоната, лимонной кислоты, этилендиаминтетрауксусной кислоты, этандисульфоновой кислоты, этансульфоновой кислоты, фумаровой кислоты, глюкогептоната, глюконовой кислоты, глутаминовой кислоты, гликолевой кислоты, бромисто-водородной кислоты, соляной кислоты, йодоводорода, гидроксила, гидроксилнафталина, изэтионовой кислоты, молочной кислоты, лактозы, лауриловой кислоты, малеиновой кислоты, яблочной кислоты, миндальной кислоты, лопразолама, азотной кислоты, щавелевой кислоты, памовой кислоты, пантотеновой кислоты, фенилуксусной кислоты, фосфорной кислоты, полигалактуроновой кислоты, пропионовой кислоты, салициловой кислоты, стеариновой кислоты, этиленуксусной кислоты, янтарной кислоты, сульфаминовой кислоты, сульфаниловой кислоты, серной кислоты, танина, винной кислоты и п-толуолсульфоновой кислоты.
Фармацевтически приемлемые соли согласно настоящему изобретению могут быть синтезированы с использованием исходного соединения, содержащего кислотный радикал или основную группу, традиционным химическим способом. В целом, способ получения таких солей включает: в воде или органическом растворителе или в их смеси, соединение в форме свободной кислоты или основания реагирует со стехиометрическим количеством соответствующего основания или кислоты. Как правило, неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил, являются предпочтительными.
В дополнение к форме соли, соединение согласно настоящему изобретению может быть представлено в виде пролекарства. Пролекарство соединения, описанного в настоящем документе, может легко претерпевать химические изменения в физиологических условиях с превращением в соединения согласно настоящему изобретению. Кроме того, пролекарства могут быть преобразованы в соединение изобретения с помощью химических или биохимических способов в среде in vivo.
Некоторые соединения согласно настоящему изобретению могут быть в несольватированной форме или в сольватированной форме, включая гидратированные формы. Как правило, сольватированная форма и несольватированная форма являются сопоставимыми и включены в объем настоящего изобретения. Некоторые соединения согласно настоящему изобретению могут существовать в поликристаллической или аморфной форме.
Некоторые соединения согласно настоящему изобретению могут иметь асимметричные атомы углерода (оптические центры) или двойные связи. Рацематы, диастереомеры, геометрические изомеры и отдельные изомеры входят в объем настоящего изобретения.
Если не указано иное, термин «замещенный» относится к любому одному или более атомам водорода на отдельных атомах, которые замещены заместителем, включая дейтерий и варианты водорода, до тех пор, пока конкретный атом имеет нормальную валентность, и соединение является стабильным после замещения. Когда заместитель представляет собой кетоновую группу (т.е. =О), это означает, что два атома водорода замещены. Замещение кетоновой группой не происходит на ароматической группе. Термин «необязательно замещенный» означает, что группа может быть замещена или может быть не замещена. Если не указано иное, то тип и число заместителей может быть произвольно выбранным до тех пор, пока возможно достижение химической стабильности.
Если не указано иное, когда любая переменная (например, R) встречается более одного раза в составе или структуре соединения, ее определение в каждом случае является независимым. Так, например, если группа замещена 0-2 R, то указанная группа может содержать до двух групп R, и в каждом случае R могут быть независимыми. Кроме того, комбинация заместителей и/или их варианты допускается только, если такая комбинация приводит к образованию стабильного соединения.
Когда одна из переменных выбрана из одинарной связи, то это означает, что две связанные группы связаны непосредственно. Например, когда L представляет собой простую связь, A-L-Z означает, что структура на самом деле представляет собой A-Z.
Если не указано иное, когда связь группы или заместителя могут быть перекрестно соединены с двумя атомами на кольце, указанная группа или заместитель могут быть связаны с любым атомом кольца. Если атом в примере группы или заместителя, соединенного с общей химической структурой, не указан, когда конкретное соединение не упоминается, указанная группа или заместитель могут быть связаны через любой атом. Комбинация групп или заместителей и/или их варианты допускаются только, если такая комбинация приводит к образованию стабильного соединения. Например, структурное звено  или
или  демонстрирует, что замещение может происходить в любом положении циклогексила или циклогексадиена. Если не указано иное, термин «гидрокарбил» или конкретные группы (например, алкил, алкенил, алкинил, фенил и т.п.) сам по себе или как часть другого заместителя, представляет собой линейный, разветвленный или циклический углеводородный радикал, или их комбинации, может быть полностью насыщенными, моно- или полиненасыщенными, может быть моно-, ди- или поли-замещенным, и может включать двухвалентные или поливалентные радикалы, и имеет определенное число атомов углерода (например, С1-С10 обозначает от 1 до 10 атомов углерода). Углеводородные группы включают алифатические углеводородные группы и ароматические углеводородные группы. Алифатические углеводородные группы включают линейные и циклические группы, и включают, но не ограничиваются ими, алкильную группу, алкенильную группу и алкинильную группу; ароматические углеводородные группы, включают, но не ограничиваются ими, 6-12-членные ароматические углеводородные группы, такие как бензол, нафталин и тому подобное. Согласно некоторым вариантам реализации термин «алкил» обозначает линейные, разветвленные или циклические радикалы, или их комбинации, которые могут быть полностью насыщенными, моно- или полиненасыщенными и могут включать ди- или поливалентные радикалы. Примеры насыщенных углеводородных радикалов включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, изобутил, циклогексил, (циклогексил)метил, циклопропилметил, и гомологи или изомеры радикалов н-пентила, н-гексила н-гептила, н-октила. Ненасыщенные алкильные группы имеют одну или несколько двойных или тройных связей, примеры которых включают, но не ограничиваясь ими, этенил, 2-пропенил, бутенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и изомеры.
демонстрирует, что замещение может происходить в любом положении циклогексила или циклогексадиена. Если не указано иное, термин «гидрокарбил» или конкретные группы (например, алкил, алкенил, алкинил, фенил и т.п.) сам по себе или как часть другого заместителя, представляет собой линейный, разветвленный или циклический углеводородный радикал, или их комбинации, может быть полностью насыщенными, моно- или полиненасыщенными, может быть моно-, ди- или поли-замещенным, и может включать двухвалентные или поливалентные радикалы, и имеет определенное число атомов углерода (например, С1-С10 обозначает от 1 до 10 атомов углерода). Углеводородные группы включают алифатические углеводородные группы и ароматические углеводородные группы. Алифатические углеводородные группы включают линейные и циклические группы, и включают, но не ограничиваются ими, алкильную группу, алкенильную группу и алкинильную группу; ароматические углеводородные группы, включают, но не ограничиваются ими, 6-12-членные ароматические углеводородные группы, такие как бензол, нафталин и тому подобное. Согласно некоторым вариантам реализации термин «алкил» обозначает линейные, разветвленные или циклические радикалы, или их комбинации, которые могут быть полностью насыщенными, моно- или полиненасыщенными и могут включать ди- или поливалентные радикалы. Примеры насыщенных углеводородных радикалов включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, изобутил, циклогексил, (циклогексил)метил, циклопропилметил, и гомологи или изомеры радикалов н-пентила, н-гексила н-гептила, н-октила. Ненасыщенные алкильные группы имеют одну или несколько двойных или тройных связей, примеры которых включают, но не ограничиваясь ими, этенил, 2-пропенил, бутенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и изомеры.
Если не указано иное, гетероуглеводородная группа, гетероциклическая группа, углеводородная гетерогруппа, циклическая гетерогруппа, гетероуглеводородная гетерогруппа, гетероциклическая гетерогруппа означает, что гетероатом или гетероатомная группа присутствует на конкретной группе, где гетероатом или гетероатомная группа включает, но не ограничивается ими, N, NH, замещенный или защищенный NH, О, S, S (=O), S (=O)2. Гетероуглеводородная группа или гетероциклическая группа соединяется с остальной частью молекулы через атом углерода, то есть, гетероатом может быть расположен в любом внутреннем положении группы, но не в положении, присоединенном к остальной части молекулы; углеводородная гетерогруппа или циклическая гетерогруппа соединяется с остальной частью молекулы через гетероатом, то есть, указанный гетероатом находится в положении, присоединенном к остальной части молекулы; и гетероуглеводородная гетерогруппа или гетероциклическая гетерогруппа соединяется с остальной частью молекулы через гетероатом, и указанный гетероатом может находиться в любом внутреннем положении группы, включая положение, присоединенное к остальной части молекулы,.
Если не указано иное, термин «гетерогидрокарбил» или его конкретные группы (например, гетероалкил, гетероалкенил, гетероалкинил, гетероарил, и т.д.) сам по себе или в сочетании с другими терминами, обозначает стабильную прямую цепь, разветвленную цепь или циклический углеводородный радикал, или их комбинацию, и включает определенное число атомов углерода и по меньшей мере один гетероатом. Согласно некоторым вариантам реализации термин «гетерогидрокарбил» или конкретные группы (например, гетероалкил, гетероалкенил, гетероалкинил, гетероарил и т.д.) сам по себе или в сочетании с другими терминами, обозначает стабильную прямую цепь, разветвленную цепь или их комбинацию, и включает определенное число атомов углерода и по меньшей мере один гетероатом. Согласно некоторым вариантам реализации гетероатом выбран из В, О, N и S, где атомы азота и серы необязательно окислены и атом азота необязательно кватернизован. Гетероатомы В, О, N и S могут быть расположены в любом внутреннем положении гетерогидрокарбила (за исключением положений, по которым углеводородная группа присоединена к остальной части молекулы). Варианты реализации включают, но не ограничиваются ими, -СН2-СН2-О-СН3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -СН2-СН2, -S(O)-CH3, -CH2-CH2-S(O)2-CH3, -СН=СН-O-СН3, -CH2-CH-N-OCH3 и -CH=CH-N(CH3)-CH3. До двух гетероатомов могут следовать друг за другом, например -CH2-NH-OCH3.
Если не указано иное, термины «алкокси», «алкиламино» и «алкилтио» (или тиоалкокси) представляют собой традиционно используемые термины, которые относятся к алкилу, связанному с остальной частью молекулы через атом кислорода, аминогруппу или атом серы.
Если не указано иное, термины «циклоалкил», «гетероциклоалкил», «циклическая углеводородная гетерогруппа» или их конкретные группы (например, арил, гетероарил, арилгетеро, циклоалкил, гетероциклоалкил, циклоалкилгетеро, циклоалкенил, гетероциклоалкенил, циклоалкенилгетерогруппа, циклоалкинил, гетероциклоалкинил, циклоалкинилгетерогруппа и т.д.) сами по себе или в сочетании с другими терминами представляют собой, соответственно, циклизованную «углеводородную группу», «гетерогидрокарбил» или «углеводородную гетерогруппу». Примеры циклоалкила включают, но не ограничиваются ими, циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и тому подобное. Не ограничивающие примеры гетероциклической группы включают 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофураниндол-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил и 2-пиперазинил.
Если не указано иное, термин «элемент галогена» или «гало» сам по себе или как часть другого заместителя, обозначает атом фтора, хлора, брома или йода. Кроме того, термин «галогеналкил» включает моногалогеналкил и полигалогеналкил. Например, термин «галоген (С1-С4) алкил» включает, но не ограничивается ими, трифторметил, 2,2,2-трифторэтил, 4-хлорбутил и 3-бромпропил и т.п.
Если не указано иное, термин «арил» означает полиненасыщенные ароматические углеводородные заместители, которые могут быть моно-, ди- или полизамещенными, могут быть представлены в виде одного кольца или нескольких колец (предпочтительно 1-3 колец), конденсированных или связанных ковалентно. Термин «гетероарил» относится к арильной группе (или кольцу), содержащему от одного до четырех гетероатомов. Согласно одному примеру варианта реализации гетероатом выбран из В, N, О и S, где атомы азота и серы необязательно окислены и атом азота необязательно кватернизован. Гетероарил может быть присоединен к другим частям молекулы через гетероатом. Не ограничивающие примеры арильных или гетероарильных групп включают фенил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил и 6-хинолил. Заместители для любого из указанных выше арильных и гетероарильных колец выбраны из любого из приемлемых заместителей, описанных в настоящем документе.
Если не указано иное, для простоты, при использовании в сочетании с другими терминами (например, арилокси группа, арилтиогруппа, арилалкильная группа), арильная группа включает арильное или гетероарильное кольцо, как определено выше. Таким образом, термин «аралкил» включает атомарные группы, в которых арильная группа присоединена к алкилу (например, бензил, фенэтил, пиридилметил и т.п.), а также включают группы, в которых атом углерода (например, группа метилена) был заменен, например, кислородом, например, феноксиметил, 2-пиридилоксиметил-3-(1-нафтилокси)пропил и т.п.
Если не указано иное, «кольцо» представляет собой замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклический алкил, замещенную или незамещенную арильную группу или замещенный или незамещенный гетероарил. Кольцо включает конденсированное кольцо. Число атомов в кольце, как правило, определяется по количеству членов в кольце, например, «5-7-членное кольцо» означает, что от 5 до 7 атомов расположены в указанном кольце. Если не указано иное, то кольцо необязательно содержит от 1 до 3 гетероатомов. Таким образом, «5-7-членное кольцо» включает, например, фенил пиридин и пиперидинил; с другой стороны, термин «5-7-членное гетероциклоалкильное кольцо» включают пиридил и пиперидил, но не включает фенил. Термин «кольцо» также включает кольцевые системы, содержащие по меньшей мере одно кольцо, где каждое «кольцо» независимо соответствует приведенному выше определению.
Если не указано иное, в данном описании, термин «гетероатом» включает другие атомы, отличные от углерода (С) и водорода (Н), например, включает кислород (О), азот (N), серу (S), кремний (Si), германий (Ge), алюминий (Al) и бор (В) и т.п.
Если не указано иное, термин «уходящая группа» относится к функциональной группе или атому, который может быть замещен другой функциональной группой или атомом посредством реакции замещения (такой как реакция нуклеофильного замещения). Например, типичные уходящие группы включают трифлат; хлор, бром и йод; сульфонатные группы, такие как мезилат, тозилат, брозилат, сложные эфиры п-толуолсульфоновой кислоты и тому подобное; ацилоксигруппы, такие как ацетокси, трифторацетокси и т.п.
Если не указано иное, термин «защитная группа» включает, но не ограничивается «аминозащитной группой», «гидроксизащитной группой» или «меркаптозащитной группой». Термин «аминозащитная группа» означает защитную группу, подходящую для блокирования побочных реакций азота в аминогруппе. Представители аминозащитных групп включают, но не ограничиваются ими: формил; ацильные группы, такие как алканоил (т.е. ацетильная, трихлорацетильная или трифторацетильная группа); алкоксикарбонил, такой как трет-бутоксикарбонил (Boc); арилметоксикарбонил, такой как бензилоксикарбонил (Cbz) и 9-флуоренил метоксикарбонил (Fmoc); группы арилметила, такие как бензил (Bn), тритил (Tr), 1,1-ди(4'-метоксифенил)метил; силильные группы, такие как группы триметилсилила (TMS) и трет-бутилдиметилсилила (TBS) и тому подобное. Термин «гидроксизащитная группа» означает защитную группу, подходящую для блокировки побочных реакций гидроксильных групп. Представители гидроксизащитных групп включают, но не ограничиваются ими: алкил, такой как метил, этил и трет-бутил; ацил, например алканоильную группу (например, ацетил); группы арилметила, такие как бензил (Bn), метоксибензил п-толуолсульфоновой кислоты (РМВ), 9-флуоренилметил (Fm) и дифенилметил (бензгидрил, DPM); силильные группы, такие как триметилсилильные группы (TMS) и трет-бутилдиметилсилил (TBS) и тому подобное.
Если не указано иное, галогеналкильные группы включают, но не ограничиваются ими: трифторметил, трихлорметил, пентафторэтил и пентахлорэтил. «Алкокси» означает алкильную группу, присоединенную через кислородный мостик и имеющую указанное выше число атомов углерода. C1-6 алкокси включает C1, С2, С3, С4, С5 и С6 алкокси. Примеры алкокси включают, но не ограничиваются ими: метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентилокси и S-пентокси. «Циклоалкил» включает насыщенные кольцевые группы, например циклопропил, циклобутил или циклопентил. 3-7 циклоалкил включает С3, С4, С3, С6, С7 и С6-циклоалкил. «Алкенил» включает углеводородную цепь в прямой или разветвленной конфигурации цепи, в которой присутствует один или несколько углерод-углеродных двойных связей на стабильных участках цепи, такую как винил и пропенил.
Если не указано иное, термин «галоген» или «гало» обозначает фтор, хлор, бром и йод.
Если не указано иное, термин «гетероцикл» или «гетероциклическая группа» означает стабильное моноциклическое кольцо или бициклическое кольцо или бициклическое гетероциклическое кольцо, которое может быть насыщенным, частично ненасыщенным или ненасыщенным (или ароматическим), и содержит атомы углерода и 1, 2, 3 или 4 гетероатомов в кольце, независимо выбранных из N, О и S, где указанное гетероциклическое кольцо может быть конденсировано с бензольным кольцом с образованием бициклического кольца.
Если не указано иное, примеры гетероциклических соединений включают, но не ограничиваются ими: акридинил, азоциноил, бензимидазолил, бензофуранил, бензомеркаптофурил, бензомеркаптобензил, бензоксазолил, бензооксазолинил, бензотиазолил, бензотриазолил, бензотетразолил, бензоизоксазолил, бензоизотиазол, бензоимидазолил, карбазолил, 4aH-карбазолил, карболинил, хроманил, хромен, циннолинил тетрагидрохинолинил, 2Н,6Н-1,5,2-дитиазинил, дигидрофуранил[2,3-b]тетрагидрофуранил, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1Н-индазолил, индоленил, индолил, индолизинил, индолил, 3Н-индолил, изатино (isatino) группа, изобензофуран, пиранил, изоиндолил, изоиндолинил, изоиндолил, индолил, изохинолинил, изотиазолил, изоксазолил, метилендиоксифенил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, изоксазолил, оксиндол, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, бензоксантинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, пиперидонил, 4-пиперидонил, пиперонил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридиноксазолил, пиридиноимидазолил, пиридинотиазол, пиридин, пиримидинил, пирролидинил, пирролинил, 2Н-пирролил, пирролил, пиразолил, хиназолинил, хинолинил, 4Н-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, тетразолил, 6Н-1,2,5-тиадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, изотиазолилтиенил, тиенил, тиеноксазолил, тиенотиазолил, тиеноимидазолил, тиенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил и ксантенил. Кроме того, она включает конденсированные и спирокольцевые соединения. Если не указано иное, соединения согласно настоящему изобретению могут быть получены различными способами синтеза, хорошо известными специалистам в этой области техники, включая конкретные варианты реализации, перечисленные ниже, варианты реализации в сочетании с другими методами химического синтеза, а также их эквиваленты знакомые специалистам в данной области техники. Предпочтительные варианты реализации включают, но не ограничиваются примерами настоящего изобретения.
Если не указано иное, то структура соединения определяют с помощью ядерного магнитного резонанса (ЯМР) и/или жидкостной масс-спектрометрии (ЖХМС). Химический сдвиг ЯМР (δ) приведен в единицах 10-6 (частей на миллион). ЯМР измеряли на ЯМР-оборудовании Bruker AVANCE-400, измерительный растворитель содержал дейтерированный диметилсульфоксид (ДМСО-d6), дейтерированный хлороформ (CDCl3) или дейтерированный метанол (CD3OD) и внутренний стандарт представлял собой тетраметилсилан (ТМС).
Если не указано иное, то определение абсолютной конфигурации осуществляли с помощью традиционного измерения дифракции методом рентгенодифракционного монокристального анализа. Например, при определении абсолютной конфигурации соединений 1-16, используемое оборудование представляло собой Bruker АРЕХ-II CCD, температура составляла 296K, длина волны излучения составляла 1,54178, тип излучения был Cu-Ka, и результаты испытаний показаны на фигуре 1.
Если не указано иное, жидкостную хроматограмму в результате жидкостной масс-спектрометрии ЖХМС получали с использованием Agilent 1200 (Xtimate С18 2,1*30 мм колонка), и масс-спектрометрию проводили с использованием Agilent 6110 (источник ионов: ESI).
Если не указано иное, то определение ВЭЖХ проводили с использованием жидкостной хроматографии высокого давления Shimadzu LC10AD (Xtimate С18 2,1*30 мм колонка).
Если не указано иное, пластины, используемые для тонкослойной хроматографии, представляли собой пластины с силикагелем Yantai Huanghai HSGF254 или пластины с силикагелем Qingdao GF254Э и пластины с силикагелем, используемые в тонкослойной хроматографии (ТСХ) были 0,15 мм - 0,2 мм. Пластины, используемые для тонкослойного разделения и очистки, были 0,4 мм - 0,5 мм.
Если не указано иное, в колоночной хроматографии на силикагеле, как правило, в качестве носителя использовали силикагель Yantai Huanghai 200-300 меш.
Если не указано иное, известные исходные вещества согласно настоящему изобретению могут быть синтезированы способами, известными в данной области, или могут быть приобретены у ABCR GmbH & Co. KG, Acros Organics, Aldrich Chemical Company, TCI, Alfa, Accela ChemBio Inc, Ouhechem Inc. и других компании.
Если не указано иное, если нет особых указаний в вариантах реализации, реакции можно проводить как в атмосфере аргона, так и азота. Атмосфера аргона или азота означает, что реакционная колба соединена с баллоном аргона или азота объемом 1 л.
Если не указано иное, атмосфера водорода означает, что реакционная колба соединена с баллоном водорода объемом 1 литр.
Если не указано иное, то при гидрировании под давлением использовали аппарат гидрирования типа Parr 3916EKX и генератор водорода типа Qinglan QL-500 или устройство гидрирования типа HC2-SS. Реакционную смесь для гидрирования обычно вакуумировали, заполняли водородом и повторяли три раза.
Если не указано иное, то для микроволновой реакции использовали микроволновую печь СЕМ Discover-S 908860 или микроволновый реактор Biotage Initiator 60.
Если не указано иное, если нет особых указаний в вариантах реализации, раствор относится к водному раствору.
Если не указано иное, если нет особых указаний в вариантах реализации, температура реакции представляет собой комнатную температуру, которая составляет от 20°С до 30°С.
Если не указано иное, контроль процесса реакции проводят с помощью тонкослойной хроматографии (ТСХ), системы проявляющего агента, используемые в реакциях, представляют собой: А: систему метиленхлорида и метанола, В: н-гексан и этилацетат, С: систему петролейного эфира и этилацетата, D: ацетон, где объемное соотношение растворителя регулируется в соответствии с различной полярностью соединения.
Если не указано иное, системы элюента, используемые в колоночной хроматографии, и системы проявляющего агента, используемые в тонкослойной хроматографии и колоночной хроматографии, используемые при очистке соединений, включают: А: систему метиленхлорида и метанола, В: систему петролейного эфира и этилацетата, С: систему метиленхлорида и ацетона, где объемное соотношение растворителя регулируется в соответствии с различной полярностью соединения, и небольшое количество основного или кислотного агента, такого как триэтиламин или уксусная кислота, могут быть использованы для кондиционирования.
Если не указано иное, оборудование, используемое для разделительной ВЭЖХ представляет собой Shimadzu LC-8A Prep.; колонка разделения представляет собой Phenomenex Luna C18 250*50 мм, 10 мкм; подвижная фаза составляет соответственно А: Вода (0,2% ФА), В: CH3CN; где градиент подвижной фазы (0-100% В) определяется в соответствии с различной полярностью соединения; время выделения составляет 25 мин; скорость потока составляет 90 мл/мин; и длина волны обнаружения составляет: 220/254 нм.
Настоящее изобретение далее будет проиллюстрировано со ссылкой на конкретные примеры, которые не ограничивают объем настоящего изобретения.
Если не указано иное, растворители, используемые в настоящем изобретении, являются коммерчески доступными и могут быть использованы без дополнительной очистки.
Если не указано иное, в настоящем изобретении применяются следующие сокращения: водн. представляет собой воду; HATU представляет собой O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилмочевины гексафторфосфат; EDC представляет собой N-(3-диметиламинопропил)-N'-этилкарбодиимид; m-СРВА представляет собой 3-хлорпероксибензойную кислоту; экв. представляет собой эквиваленты или равное количество; CDI представляет собой карбонилдиимидазол; ДХМ представляет дихлорметан; РЕ представляет собой петролейный эфир; DIAD представляет диизопропилазодикарбоксилат; ДМФА представляет собой N,N-диметилформамид; ДМСО представляет собой диметилсульфоксид; EtOAc представляет собой этилацетат; EtOH представляет собой этанол; МеОН представляет собой метанол; CBz обозначает бензилоксикарбонил, который представляет собой аминозащитную группу; ВОС представляет собой трет-бутил карбонильную группу, которая представляет собой аминозащитную группу; НОАс представляет уксусную кислоту; NaCNBH3 представляет собой цианоборгидрид натрия; КТ представляет собой комнатную температуру; O/N представляет в течение ночи; ТГФ представляет собой тетрагидрофуран; Вос2О представляет собой трет-бутилдикарбонат; ТФУ представляет собой трифторуксусную кислоту; DIPEA представляет собой диизопропилэтиламин; SOCl2 представляет собой сульфонхлорид; CS2 представляет сероуглерод; TsOH представляет собой п-толуолсульфоновую кислоту; NFSI представляет собой N-фтор-N-(фенилсульфонил)бензолсульфонамид; NCS представляет собой 1-хлорпирролидин-2,5-дион; n-BiuNF представляет тетрабутиламмония фторид; iPrOH представляет собой 2-пропанол; mp представляет собой температуру плавления.
Если не указано иное, соединения названы человеком или программным обеспечением ChemDraw®, и для коммерчески доступных соединений используются названия каталогов поставщиков.
По сравнению с существующей технологией, соединения согласно настоящему изобретению обладают высокой эффективностью и низкой токсичностью, и демонстрируют значительное, даже неожиданное улучшение активности, периода полувыведения, растворимости, фармакокинетики и других аспектов, так что они очень подходят для фармацевтических использования.
ВАРИАНТЫ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Настоящее изобретение далее будет проиллюстрировано со ссылкой на конкретные примеры, но указанные примеры никоим образом не ограничивают настоящее изобретение. Настоящее изобретение было подробно описано в настоящем документе, а также раскрыты варианты реализации изобретения. Следует понимать, что специалист в данной области техники может внести различные изменения и модифицировать варианты реализации для осуществления настоящего изобретения, не выходя за пределы сущности и объема настоящего изобретения.
Примеры 1 и 2
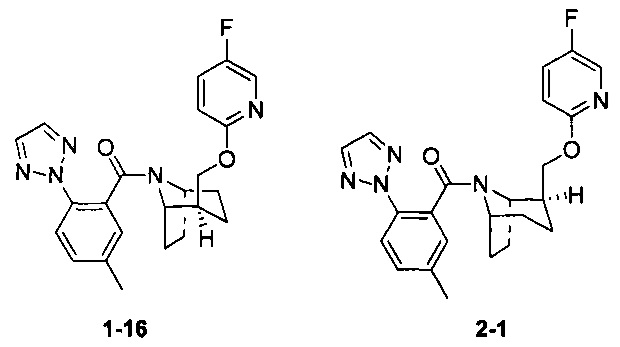
Волнистая связь указывает на то, что связь может быть направлена вверх или вниз и не зависит от других групп (здесь и далее она имеет то же значение).
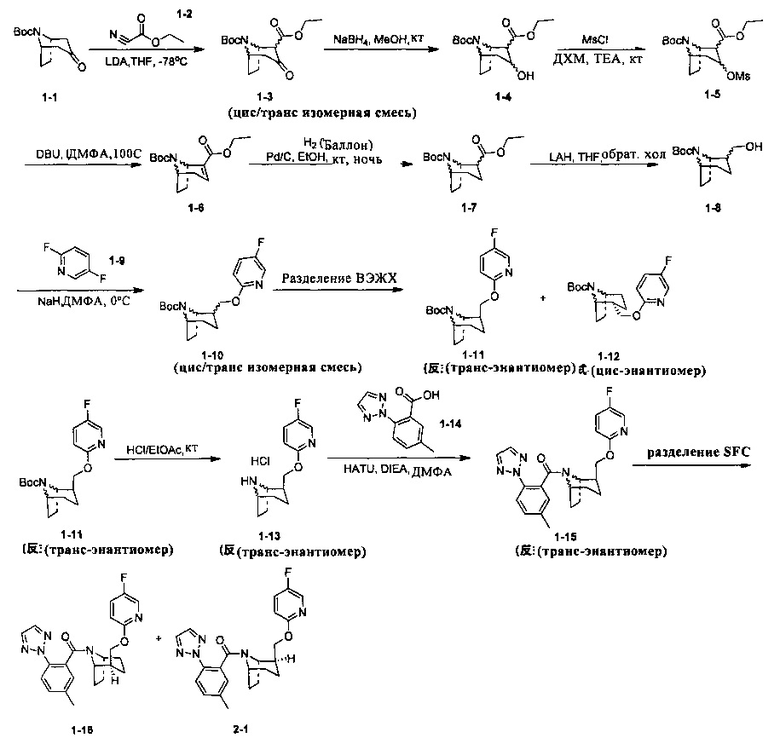
Стадия 1 (синтез 1-3)
Соединение 1-1 (10,0 г, 44,4 ммоль) растворяли в 55 мл тетрагидрофурана, LDA (24,4 мл, 0,0488 моль) медленно добавляли по каплям при -78°С, и смесь перемешивали в течение 1 ч при -78°С. Поддерживая температуру при -78°С, соединение 1-2 по каплям добавляли в реакционную смесь, и после добавления, температуру медленно поднимали до комнатной температуры, и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь выливали в водный раствор хлорида аммония (50 мл), и концентрировали при пониженном давлении с получением неочищенного продукта. Добавляли 50 мл насыщенного водного раствора хлорида натрия, и экстрагировали этилацетатом (100 мл × 3). Объединенную органическую фазу последовательно промывали водой (100 мл × 2), насыщенным раствором NaCl (100 мл × 2) и сушили над безводным Na2SO4, фильтровали и очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 50:1) с получением продукта 1-3 в виде желтой жидкости, выход: 80%. (Твердое вещество осаждали после охлаждения и размещения)
ЖХ/МС: 198,0 (М-Вос+Н+)
Стадия 2 (синтез 1-4)
Соединение 1-3 (1,5 г, 5,05 ммоль) растворяли в 15 мл метанола и добавляли NaBH4 (192 мг, 5,05 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов. 20 мл воды добавляли в реакционную смесь с гашением, и смесь концентрировали и экстрагировали этилацетатом (20 мл × 3). Объединенную органическую фазу последовательно промывали водой (100 мл × 2), насыщенным раствором NaCl (100 мл × 2) и сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали в вакууме с получением продукта 1-4, который был использован на следующей стадии без очистки.
Стадия 3 (синтез 1-5)
Неочищенное соединение 1-4 (1,4 г) растворяли в 40 мл дихлорметане. триэтиламине (1,01 г, 10 ммоль) и метансульфонилхлориде (1,12 г, 9,86 ммоль) добавляли при 0°С. После перемешивания в течение 30 минут, смесь нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 10 часов. Реакционную смесь выливали в воду и экстрагировали дихлорметаном (100 мл × 3). Объединенную органическую фазу последовательно промывали водой (100 мл × 2), насыщенным раствором NaCl (100 мл × 2) и сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали в вакууме с получением продукта 1-5, который использовали на следующей стадии без очистки.
Стадия 4 (синтез 1-6)
Неочищенное соединение 1-5 (примерно 600 мг) растворяли в 10 мл ДМФА и добавляли DBU (4 г, 16 ммоль). Смесь нагревали до 100°С и перемешивали в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры. После добавления 50 мл воды смесь экстрагировали этилацетатом (20 мл × 2). Объединенную органическую фазу последовательно промывали водой (20 мл × 2) и насыщенным раствором NaCl (20 мл × 2) и сушили над безводным Na2SO4, фильтровали и очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 50:1) с получением 280 мг продукта 1-6 (желтая жидкость. Твердое вещество осаждали после охлаждения и размещения. Общий выход с трех стадий: 30%.
ЖХ/МС: 182,0 (М-Boc+Н+), 226,0 (М-56+Н+), 304,0 (M+Na+)
1Н ЯМР (400 МГц, CDCl3) δ 6,75 (s, 1Н), 4,34-4,32 (m, 1H), 4,10-4,02 (m, 2H), 2,96-2,90 (m, 1H), 2,08-2,02 (m, 2H), 1,97-1,91 (m, 2H), 1,63-1,55 (m, 2H), 1,45 (s, 9H), 1,42-1,28 (m, 3H).
Стадия 5 (синтез 1-7)
Соединение 1-6 (300 мг, 1,06 ммоль) растворяли в 20 мл метанола, и добавляли влажный Pd(OH)2 (50 мг, 5%) и перемешивали в атмосфере водорода в течение 16 часов. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением продукта 1-7, который использовали на следующей стадии без очистки.
Стадия 6 (синтез 1-8)
Соединение 1-7 (300 мг, 1,06 ммоль) растворяли в 30 мл тетрагидрофурана. При 0°С, LAH (80 мг, 2 ммоль) добавляли несколькими партиями с небольшим количеством в каждой партии. После добавления ледяную баню удаляли и смесь нагревали до комнатной температуры, и реакцию проводили при комнатной температуре в течение 4 часов. В реакционную смесь последовательно добавляли 0,08 мл воды, 0,08 мл 15% водного гидроксида натрия и 0,24 мл воды. Добавляли небольшое количество сульфата магния. Смесь фильтровали после перемешивания в течение 10 минут, и фильтрат сушили при вращении с получением продукта 1-8, который использовали на следующей стадии без очистки.
ЖХ/МС: 237,0 (М-Вос+Н+), 337,1 (М+Н+)
Стадия 7 (синтез 1-10)
Соединение 1-8 (280 мг, 1,16 ммоль) растворяли в 14 мл ДМФА. При 0°С NaH (139 мг, 3,48 ммоль) добавляли несколькими партиями с небольшим количеством в каждой партии. Смесь перемешивали при той же температуре в течение 30 минут, и медленно добавляли соединение 1-9. После добавления реакцию проводили при комнатной температуре в течение 10 часов. Реакционную смесь выливали в 30 мл воды и добавляли 10 мл насыщенного раствора NaCl. Смесь экстрагировали этилацетатом (10 мл × 3). Объединенную органическую фазу последовательно промывали водой (10 мл × 2), насыщенным раствором NaCl (10 мл × 2) и сушили над безводным Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 50:1) с получением продукта 1-10 (150 мг, и общий выход с трех стадий: 42%.
Стадия 8 (синтез 1-11)
Соединение 1-10 (300 мг) разделяли с помощью препаративной ВЭЖХ с получением рацемического продукта 1-11 (120 мг, 80%), с получением в то же время рацемата продукта 1-12 (100 мг, 67%).
Стадия 9 (синтез 1-13)
Соединение 1-11 (120 мг) растворяли в 4 мл этилацетата, и хлористый водород в растворе этилацетата (4 мл, 4М) добавляли по каплям при охлаждении на ледяной бане. Смесь перемешивали в течение 2 часов, концентрировали при пониженном давлении с получением продукта 1-13 (форма гидрохлорида), и продукт использовали на следующей стадии без очистки.
Стадия 10 (синтез 1-15)
Соединение 1-13 (120 мг, 0,32 ммоль), соединение 1-14 (77 мг, 0,38 ммоль), HATU (182 мг, 0,48 ммоль) и DIEA (124 мг, 0,96 ммоль) растворяли в 5 мл ДМФА и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в водный солевой раствор и экстрагировали этилацетатом (10 мл × 3). Органическую фазу объединяли и промывали водой (10 мл × 2) и насыщенным раствором NaCl (10 мл × 2), и сушили при вращении с получением продукта 1-15 (28 мг, твердое вещество белого цвета, выход: 16%).
1Н ЯМР (400 МГц, MeOD) δ 8,01 (s, 1Н), 7,93-7,88 (m, 2H), 7,75-7,73 (m, 1H), 7,52-7,45 (m, 2H), 7,41-7,36 (m, 1H), 6,86 (s, br, 0,5H), 6,41-6,38 (m, 0,5H), 4,75-4,66 (m, 1Н), 4,48-4,33 (m, 1H), 4,14-4,04 (m, 1H), 3,77-3,72 (m, 1H), 2,45-2,42 (m, 1H), 2,30-225 (m, 1H), 1,94 (s, 3H), 1,87-1,83 (m, 4H), 1,67-1,46 (m, 3H).
Стадия 11 (синтез 1-16 и 2-1)
Рацемическое соединение 1-15 (28 мг) разделяли посредством разделения SFC (способ разделения: Модель прибора: MG II препаративная SFC; разделительная колонка: phenomenex Lux С2, 250×30 мм I.D.; подвижная фаза: А: СО2, В: этанол (0,1% водный раствор аммиака); плотность: В 40%; скорость потока: 50 мл/мин; давление обратного потока: 100 бар; температура колонки: 38°С; длина волны УФ-детекции: 220 ни) с получением оптически чистого соединения 1-16 (10 мг, твердое вещество белого цвета, выход: 71%) и оптически чистого соединения 2-1 (10 мг, твердое вещество белого цвета, выход: 71%). Абсолютная конфигурация соединения 1-16 была подтверждена спектром рентгеновского монокристального анализа.
Примеры 3 и 4
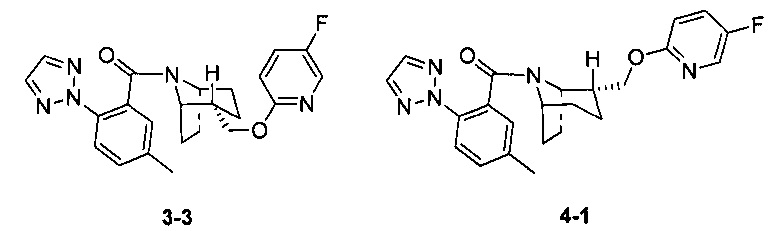
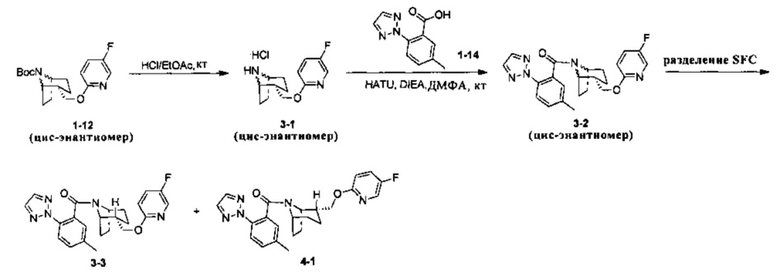
Стадия 1 (синтез 3-1)
Соединение 1-12 (100 мг) растворяли в 4 мл этилацетата и хлороводород в этилацетате (4 мл, 4М) добавляли по каплям при охлаждении на ледяной бане. Смесь перемешивали в течение 2 часов, концентрировали при пониженном давлении с получением продукта 3-1 (форма гидрохлорида), который использовали на следующей стадии без очистки.
Стадия 2 (синтез 3-2)
Соединение 3-1 (100 мг, 0,26 ммоль), соединение 1-14 (58 мг, 0,28 ммоль), HATU (150 мг, 0,39 ммоль) и DIEA (124 мг, 0,96 ммоль) растворяли в 5 мл ДМФА и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в водный солевой раствор и экстрагировали этилацетатом (10 мл × 3). Органическую фазу объединяли и промывали водой (10 мл × 2) и насыщенным раствором NaCl (10 мл × 2), сушили, фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт разделяли с помощью препаративной ВЭЖХ с получением соединения 3-2 (30 мг, твердое вещество белого цвета, выход: 20%).
1Н ЯМР (400 МГц, MeOD) δ = 8,14 (br. s., 1Н), 8,00-7,61 (m, 4H), 7,49 (br. s., 0,5H), 7,33 (dd, J=8,0, 17,8 Hz, 1H), 7,12 (br. s., 1H), 6,56 (br. s., 0,5H), 5,00-4,83 (m, 1H), 4,48 (br. s., 3H), 3,88-3,62 (m, 1H), 2,45-2,34 (m, 3H), 2,05-1,56 (m, 5H), 1,42-1,35 (m, 3H)
Стадия 3 (синтез 3-3 и 4-1)
Рацемическое соединение 3-2 (30 мг) разделяли посредством разделения SFC (способ разделения: Модель прибора: MG II препаративная SFC; разделительная колонка: ChiralPak IC, 250×30 мм I.D.; подвижная фаза: А: СО2, В: этанол (0,1% водный раствор аммиака); плотность: В 50%; скорость потока: 45 мл/мин; давление обратного потока: 100 бар; температура колонки: 38°С; длина волны детектирования: 220 нм) с получением оптически чистого соединения 3-3 (12 мг, твердое вещество белого цвета, выход: 80%) и оптически чистого соединения 4-1 (12 мг, твердое вещество белого цвета, выход: 80%).
(3-3 и 4-1 представляли собой пару энантиомеров, и относительные структуры представляли собой гипотетические структуры, и абсолютная структура была еще не подтверждена).
Примеры 5 и 6
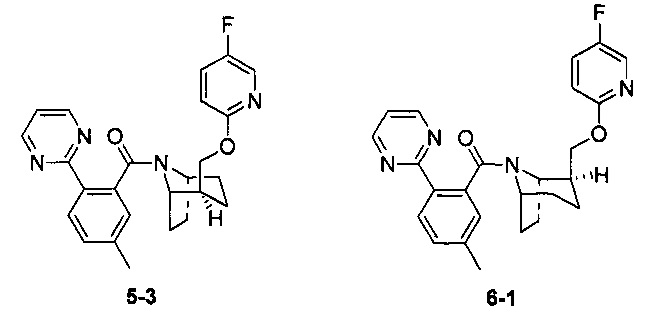
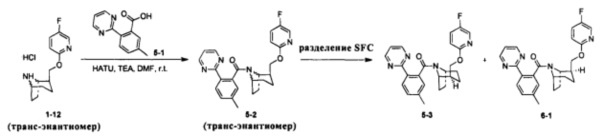
Стадия 1 (синтез 5-2)
Соединение 1-12 (120 мг, 0,32 ммоль), соединение 5-1 (77 мг, 0,38 ммоль), HATU (182 мг, 0,48 ммоль) и DIEA (124 мг, 0,96 ммоль) растворяли в 5 мл ДМФА и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в водный солевой раствор и экстрагировали этилацетатом (10 мл × 3). Органическую фазу объединяли и промывали водой (10 мл × 2) и насыщенным раствором NaCl (10 мл × 2), сушили с безводным Na2SO4, фильтровали, неочищенный продукт очищали с помощью препаративной ВЭЖХ с получением продукта 5-2 (24 мг, твердое вещество белого цвета, выход: 14%).
1H ЯМР (400 МГц, МЕТАНОЛА-d4) δ = 8,83 (br. s., 2Н), 8,17-8,01 (m, 2Н), 7,49-7,33 (m, 3Н), 6,86 (dd, J=3,5, 9,0 Hz, 1H), 6,41 (br. s., 1H), 4,63 (br. s., 1H), 4,43 (br. s., 1H), 4,11 (br. s, 1H), 3,79 (br. s., 1H), 2,52-2,48 (m, 2H), 2,35-2,11 (m, 1H), 2,01-1,95 (m, 3H), 1,90-1,67 (m, 3H), 1,63-1,43 (m, 1H), 1,29-1,20 (m, 2H)
Стадия 2 (синтез 3-3 и 6-1)
Рацемическое соединение 5-2 (24 мг) разделяли посредством разделения SFC (способ разделения: Модель прибора: MG II препаративная SFC; разделительная колонка: ChiralPak IC, 250×30 мм I.D.; подвижная фаза: А: СО2, В: этанол (0,1% водный раствор аммиака); плотность: В 45%; скорость потока: 40 мл/мин; давление обратного потока: 100 бар; температура колонки: 38°С; длина волны детектирования: 220 нм) с получением оптически чистого соединения 5-3 (8 мг, твердое вещество белого цвета) и соединение 6-1 (8 мг, твердое вещество белого цвета). Общий выход двух соединений составил 67%.
Примеры 7 и 8
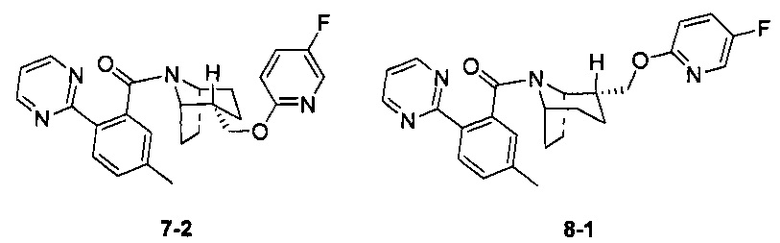
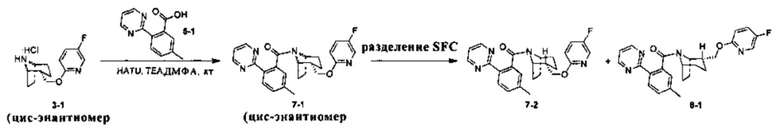
Стадия 1 (синтез 7-1)
Соединение 3-1 (100 мг, 0,26 ммоль), соединение 5-1 (58 мг, 0,28 ммоль), HATU (150 мг, 0,39 ммоль) и DIEA (124 мг, 0,96 ммоль) растворяли в 5 мл ДМФА и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в водный солевой раствор и экстрагировали этилацетатом (10 мл × 3). Органическую фазу объединяли и промывали водой (10 мл × 2) и насыщенным раствором NaCl (10 мл × 2), сушили, фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт разделяли с помощью препаративной ВЭЖХ с получением соединения 7-1 (30 мг, твердое вещество белого цвета, выход: 20%).
1Н ЯМР (400 МГц, MeOD) δ = 8,78 (dd, J=4,9, 9,7 Hz, 2H), 8,17 (d, J=8,2 Hz, 0,5H), 8,11 (d, J=7,9 Hz, 0,5H), 8,01 (d, J=3,1 Hz, 0,5H), 7,75 (br. s., 0,5H), 7,57-7,50 (m, 0,5H), 7,43 (d, J=8,2 Hz, 0,5H), 7,38-7,31 (m, 2H), 7,26 (s, 0,4H), 7,13 (s, 0,6H), 6,86 (dd, J=3,5, 9,0 Hz, 0,5H), 6,36 (dd, J=3,5, 9,0 Hz, 0,5H), 4,77-4,72 (m, 0,5H), 4,21-4,11 (m, 1,5H), 3,78 (br. s., 1H), 2,52 (br. s., 1H), 2,46 (s, 1,5H), 2,35 (s, 1,5H), 2,09-1,95 (m, 2H), 1,91-1,37 (m, 7H)
Стадия 7 (синтез 3-2 и 8-1)
Рацемическое соединение 7-1 (30 мг) разделяли посредством разделения SFC (способ разделения: Модель прибора: MG II препаративная SFC; разделительная колонка: ChiralPak AS, 250×30 мм I.D.; подвижная фаза: А: СО2, В: этанол (0,1% водный раствор аммиака); плотность: В 15%; скорость потока: 60 мл/мин; давление обратного потока: 100 бар; температура колонки: 38°С; длина волны детектирования: 220 нм) с получением оптически чистого соединения 7-2 (12 мг, твердое вещество белого цвета, выход: 80%) и оптически чистого соединения 8-1 (12 мг, твердое вещество белого цвета, выход: 80%).
(7-2 и 8-1 представляли собой пару энантиомеров, и относительные структуры представляли собой гипотетические структуры, и абсолютная структура была еще не подтверждена).
Пример 9
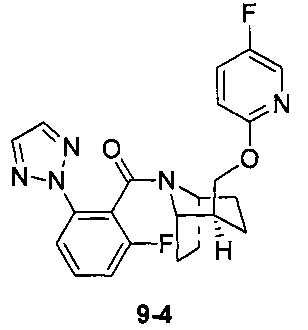
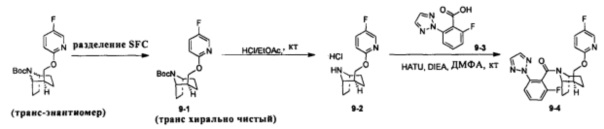
Стадия 1 (синтез 9-1)
Рацемическое соединение 1-11 (280 мг) разделяли посредством разделения SFC (способ разделения: Модель прибора: MG II препаративная SFC (SFC-1); разделительная колонка: ChiralPak AS, 250×30 мм I.D.; подвижная фаза: А: СО2, В: этанол (0,1% водный раствор аммиака); плотность: В 25%; скорость потока: 60 мл/мин; давление обратного потока: 100 бар; температура колонки: 38°С; длина волны детектирования: 220 нм) с получением оптически чистого продукта 9-1 (100 мг, твердое вещество белого цвета, выход: 71%).
Стадия 2 (синтез 9-2)
Соединение 9-1 (120 мг) растворяли в 4 мл этилацетата, и хлороводород в этилацетате (4 мл, 4М) добавляли по каплям при охлаждении на ледяной бане. Смесь перемешивали в течение 2 часов, концентрировали при пониженном давлении с получением продукта 9-2 (форма гидрохлорида), который использовали на следующей стадии без очистки.
Стадия 3 (синтез 9-4)
Соединение 9-2 (120 мг, 0,32 ммоль), соединение 9-3 (77 мг, 0,38 ммоль), HATU (182 мг, 0,48 ммоль) и DIEA (124 мг, 0,96 ммоль) растворяли в 5 мл ДМФА и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в водный солевой раствор и экстрагировали этилацетатом (10 мл × 3). Органическую фазу объединяли и промывали водой (10 мл × 2) и насыщенным раствором NaCl (10 мл × 2), сушили с безводным Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с получением продукта 9-4 (22 мг, твердое вещество белого цвета, выход: 21%).
1Н ЯМР (400 МГц, MeOD) δ = 8,20-7,98 (m, 3Н), 7,85-7,72 (m, 1H), 7,71-7,50 (m, 2H), 7,48-7,17 (m, 1H), 7,03-6,75 (m, 1H), 4,87-4,66 (m, 1H), 4,54-4,36 (m, 1H), 4,31-4,05 (m, 1H), 3,86-3,55 (m, 1H), 2,14 (br. s., 1H), 2,08-1,95 (m, 1H), 1,88 (td, J=7,2, 19,8 Hz, 2H), 1,77 (dd, J=11,3, 18,1 Hz, 2H), 1,68-1,54 (m, 1H), 1,53-1,32 (m, 2H)
Пример 10
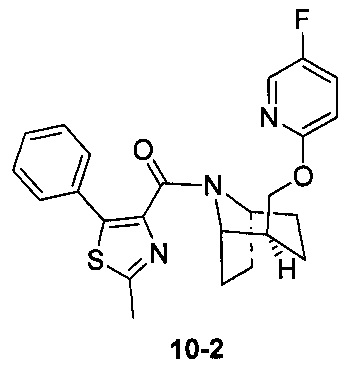
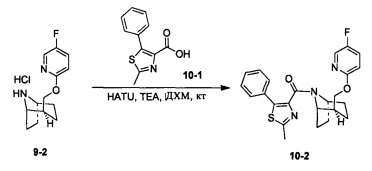
Стадия 1 (синтез 10-2)
Соединение 9-2 (120 мг, 0,32 ммоль), соединение 10-1 (77 мг, 0,38 ммоль), HATU (182 мг, 0,48 ммоль) и DIEA (124 мг, 0,96 ммоль) растворяли в 5 мл ДМФА и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в водный солевой раствор и экстрагировали этилацетатом (10 мл × 3). Органическую фазу объединяли и промывали водой (10 мл × 2) и насыщенным раствором NaCl (10 мл × 2), сушили с безводным Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с получением продукта 10-2 (41 мг, твердое вещество белого цвета, выход: 42%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,11-7,90 (m, 1Н), 7,81-7,56 (m, 2H), 7,49-7,38 (m, 2H), 7,35 (d, J=8,8 Hz, 1H), 6,77 (br. s., 1H), 6,42 (d, J=6,0 Hz, 1H), 4,97 (br. s., 0,3H), 4,82 (br. s., 0,7H), 4,40 (br. s., 0,5H), 4,14 (br. s., 1H), 4,06 (br. s., 0,6H), 4,00 (d, J=10,3 Hz, 0,5H), 3,74 (br. s., 0,4H), 2,76 (br. s., 1H), 2,12 (br. s., 0,5H), 2,06-1,86 (m, 2,5H), 1,85-1,67 (m, 2H), 1,62 (br. s., 1H), 1,65-1,56 (m, 2H), 1,45 (br. s., 1H), 1,12 (br. s., 1H), 0,67 (d, J=6,3 Hz, 1H)
Пример 11
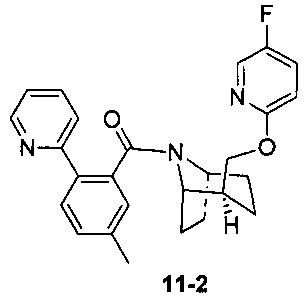
Пример 11 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 11-1: 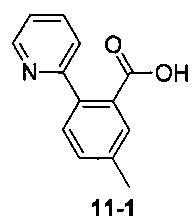 , и продукт 11-2 получали с помощью очистки препаративной ВЭЖХ (24 мг, твердое вещество белого цвета, выход: 25%).
, и продукт 11-2 получали с помощью очистки препаративной ВЭЖХ (24 мг, твердое вещество белого цвета, выход: 25%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,55 (br. s., 1Н), 8,42 (br. s., 0,5H), 8,03-7,85 (m, 1H), 7,80-7,63 (m, 2H), 7,57 (d, J=7,5 Hz, 1H), 7,41 (d, J=8,0 Hz, 1H), 7,34-7,28 (m, 1,5H), 7,23 (d, J=5,0 Hz, 1H), 6,84-6,63 (m, 1H), 4,50 (t, J=9,5 Hz, 1H), 4,32 (dd, J=5,8, 10,8 Hz, 1H), 3,89 (br. s., 2H), 2,40 (s, 3H), 2,20-1,93 (m, 4H), 1,84 (dt, J=7,3, 13,4 Hz, 1H), 1,72 (d, J=8,5 Hz, 2H), 1,52 (d, J=11,5 Hz, 1H), 1,48-1,35 (m, 1H)
Пример 12
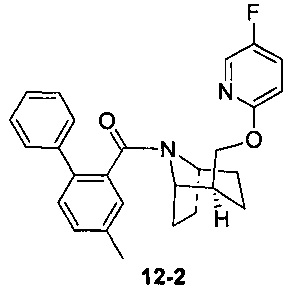
Пример 12 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 12-1: 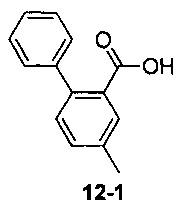 , и продукт 12-2 получали с помощью очистки препаративной ВЭЖХ (8 мг, твердое вещество белого цвета, выход: 9%).
, и продукт 12-2 получали с помощью очистки препаративной ВЭЖХ (8 мг, твердое вещество белого цвета, выход: 9%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 7,96 (d, J=2,5 Hz, 1H), 7,57-7,43 (m, 2H), 7,42-7,30 (m, 3H), 7,30-7,23 (m, 2,5H), 7,20 (s, 1H), 7,09 (d, J=8,0 Hz, 1H), 6,26 (dd, J=3,5, 9,0 Hz, 0,5H), 4,94-4,71 (m, 1H), 4,09-3,97 (m, 1H), 3,96-3,79 (m, 1H), 3,61 (d, J=7,0 Hz, 1H), 2,40 (s, 1H), 1,99-1,89 (m, 2,5H), 1,86-1,59 (m, 2,5H), 1,57-1,24 (m, 4H), 1,23-1,09 (m, 1H), 0,99-0,87 (m, 1H)
Пример 13

Пример 13 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 13-1: 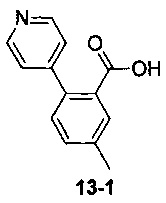 , и продукт 13-2 получали с помощью очистки препаративной ВЭЖХ (37 мг, твердое вещество белого цвета, выход: 32%).
, и продукт 13-2 получали с помощью очистки препаративной ВЭЖХ (37 мг, твердое вещество белого цвета, выход: 32%).
1H ЯМР (400 МГц, CHCl3-d) δ = 8,64 (br. s., 2Н), 8,13-7,85 (m, 1Н), 7,85-7,53 (m, 2H), 7,40-7,33 (m, l,5H),7,40-7,29 (m, 0,5H), 7,24 (br. s., 1H), 7,17 (d, J=7,5 Hz, 1H), 6,76 (dd, J=3,5, 9,0 Hz, 0,5H), 6,27 (dd, J=3,5, 9,0 Hz, 0,5H), 4,95-4,74 (m, 1H), 4,12-3,87 (m, 2H), 3,64-3,44 (m, 1H), 2,44 (s, 1H), 2,11 (d, J=6,5 Hz, 1H), 2,07-1,88 (m, 2H), 1,88-1,72 (m, 2H), 1,72-1,63 (m, 1H), 1,62-1,42 (m, 3H), 1,41-1,29 (m, 1H), 1,29-0,98 (m, 1H)
Пример 14
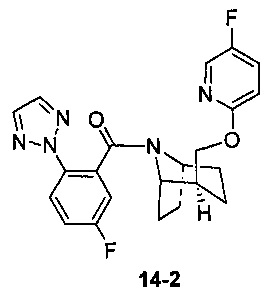
Пример 14 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 14-1: 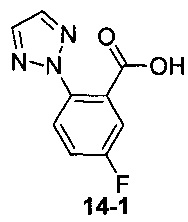 , и продукт 14-2 получали с помощью очистки препаративной ВЭЖХ (19 мг, бледно-желтое твердое вещество, выход: 20%).
, и продукт 14-2 получали с помощью очистки препаративной ВЭЖХ (19 мг, бледно-желтое твердое вещество, выход: 20%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,04-7,90 (m, 1Н), 7,89-7,63 (m, 2H), 7,34-7,26 (m, 1H), 7,23 (d, J=8,0 Hz, 1,5H), 7,15-6,93 (m, 1,5H), 6,80-6,76 (m, 0,5H), 6,32-6,30 (m, 0,5 H), 4,99-4,90 (m, 1H), 4,49-4,35 (m, 1H), 4,19-4,03 (m, 1H) 3,87-3,68 (m, 1H), 2,01-1,86 (m, 6H), 1,70-1,38 (m, 2,5H), 1,36-1,05 (m, 0,5H)
Пример 15
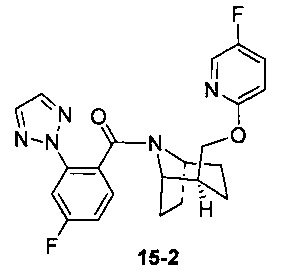
Пример 15 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 15-1: 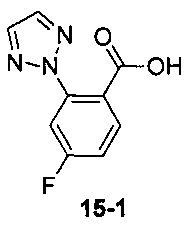 , и продукт 15-2 получали с помощью очистки препаративной ВЭЖХ (17 мг, бледно-желтое твердое вещество, выход: 18%).
, и продукт 15-2 получали с помощью очистки препаративной ВЭЖХ (17 мг, бледно-желтое твердое вещество, выход: 18%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,01 (br. s., 1H), 7,94-7,70 (m, 2H), 7,64 (d, J=8,0 Hz, 1H), 7,42-7,23 (m, 2H), 6,77 (d, J=6,3 Hz, 1H), 6,59-6,24 (m, 1H), 4,99 (d, J=17,l Hz, 1H), 4,52 -4,32 (m, 1H), 4,25-4,04 (m, 1H), 3,92-3,44 (m, 1H), 2,53-2,10 (m, 1H), 2,09-1,76 (m, 4H), 1,68 (br. s., 1H), 1,61-1,38 (m, 2H), 1,37-0,62 (m, 1H)
Пример 16
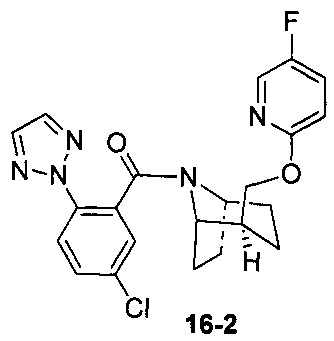
Пример 16 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 16-1: 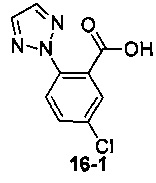 , и продукт 16-2 получали с помощью очистки препаративной ВЭЖХ (6,5 мг, твердое вещество белого цвета, выход: 1,5%).
, и продукт 16-2 получали с помощью очистки препаративной ВЭЖХ (6,5 мг, твердое вещество белого цвета, выход: 1,5%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,30-7,72 (m, 2Н), 7,71-7,52 (m, 1Н), 7,52-7,37 (m, 1H), 7,35-7,14 (m, 3H), 6,78-6,38 (m, 1H), 4,94-4,66 (m, 1H), 4,53-4,21 (m, 1H), 4,08 (br. s., 1H), 3,83-3,58 (m, 1H), 2,53-2,40 (m, 0,5H), 1,90-1,82 (m, 1,5H), 1,81-1,45 (m, 5,5H), 1,27 (br. s., 0,5H), 1,0-0,91 (m, 1H)
Пример 17
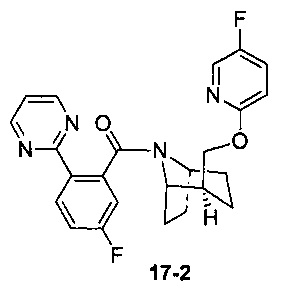
Пример 17 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 17-1: 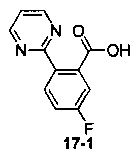 , и продукт 17-2 получали с помощью очистки препаративной ВЭЖХ (4,3 мг, твердое вещество белого цвета, выход: 3,5%).
, и продукт 17-2 получали с помощью очистки препаративной ВЭЖХ (4,3 мг, твердое вещество белого цвета, выход: 3,5%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,76 (d, J=4,5 Hz, 1,5H), 8,39-8,12 (m, 1H), 7,96 (br. s., 1H), 7,34 (t, J=6,7 Hz, 0,5H), 7,30-7,26 (m, 1H), 7,19 (br. s., 1H), 7,16-6,84 (m, 2H), 6,74 (d, J=5,8 Hz, 0,5H), 6,29 (br. s., 0,5H), 5,08-4,83 (m, 1H), 4,48-4,15 (m, 1,5H), 4,14-4,04 (m, 0,5H), 3,89 (br. s., 0,5H), 3,78-3,63 (m, 0,5H), 2,27-2,06 (m, 2H), 2,03-1,93 (m, 1H), 1,92-1,81 (m, 1,5H), 1,79-1,59 (m, 2H), 1,57-1,41 (m, 1,5H), 1,25 (br. s., 1H)
Пример 18
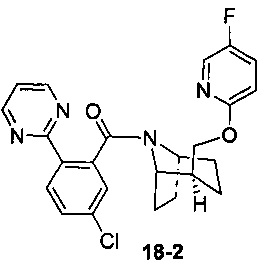
Пример 18 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 18-1: 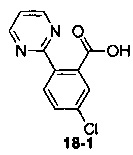 , и продукт 18-2 получали с помощью очистки препаративной ВЭЖХ (4,3 мг, твердое вещество белого цвета, выход: 9,5%).
, и продукт 18-2 получали с помощью очистки препаративной ВЭЖХ (4,3 мг, твердое вещество белого цвета, выход: 9,5%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,94-8,74 (m, 1Н), 8,65 (br. s., 1H), 8,39-8,26 (m, 1,5H), 7,70-7,42 (m, 0,5H), 7,36- 7,25 (m, 1H), 7,14 (br. s., 1H), 6,92-6,8 (m, 0,5H), 6,79 (d, J=19,3 Hz, 1H), 5,98 (br. s., 0,5H), 5,15-4,97 (m, 1H), 4,70-4,38 (m, 1H), 4,26-4,07 (m, 1,6H), 3,80 (br. s., 0,4H), 2,52-2,32 (m, 1H), 2,29-2,18 (m, 2H), 2,11-1,92 (m, 1H), 1,91-1,81 (m, 2H), 1,62-1,35 (m, 3H)
Пример 19
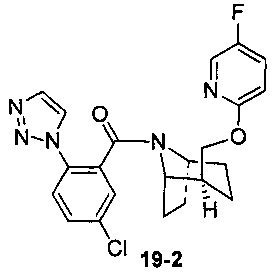
Пример 19 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 19-1: 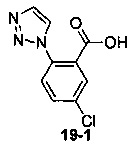 , и продукт 19-2 получали с помощью очистки препаративной ВЭЖХ (29 мг, твердое вещество белого цвета, выход: 7%).
, и продукт 19-2 получали с помощью очистки препаративной ВЭЖХ (29 мг, твердое вещество белого цвета, выход: 7%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,28-7,90 (m, 1H), 7,85-7,69 (m, 1H), 7,64-7,47 (m, 1,5H), 7,46-7,38 (m, 1H), 7,36-7,28 (m, 1H), 7,25-7,21 (m, 1,5H), 6,76 (dd, J=3,3, 9,0 Hz, 0,5H), 6,36 (dd, J=3,4, 8,9 Hz, 0,5H), 4,85-4,69 (m, 1H), 4,57-4,20 (m, 1H), 4,06 (d, J=4,5 Hz, 1H), 3,77-3,57 (m, 1H), 2,24-1,99 (m, 1H), 1,97-1,78 (m, 2,5H), 1,76-1,52 (m, 4H), 1,46 (d, J=8,0 Hz, 1,5H)
Пример 20
Пример 20 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 20-1:  , и продукт 20-2 получали с помощью очистки препаративной ВЭЖХ (51 мг, твердое вещество белого цвета, выход: 55%).
, и продукт 20-2 получали с помощью очистки препаративной ВЭЖХ (51 мг, твердое вещество белого цвета, выход: 55%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,08-7,93 (m, 1H), 7,87-7,60 (m, 2H), 7,56-7,42 (m, 1H), 7,34-7,24 (m, 2H), 7,22-7,16 (m, 1H), 6,79 (d, J=5,3 Hz,0,4H), 6,42-6,27 (m, 1,6H), 4,97-4,73 (m, 1H), 4,50-3,91 (m, 2H), 3,77 (d, J=6,0 Hz, 0,6H), 3,58 (br. s.,0,4H), 2,43 (br. s., 1H), 2,26-2,03 (m, 1H), 2,00-1,88 (m, 3H), 1,85-1,65 (m, 3H), 1,59 (d, J=6,0 Hz, 2H), 1,51-1,37 (m, 2H)
Пример 21
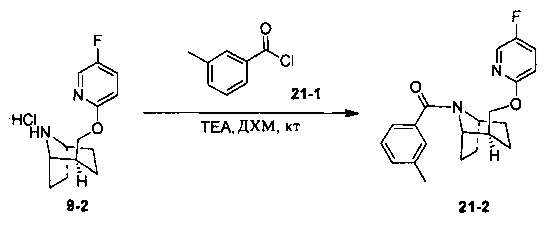
Стадия 1 (синтез 21-2)
Соединение 9-2 (50 мг, 0,18 ммоль) растворяли в 2 мл дихлорметана. Затем добавляли триэтиламин (56 мг, 0,55 ммоль) и соединение 21-1 (48 мг, 0,28 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь повергали центробежной сушке с удалением растворителя с получением неочищенного продукта. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с получением продукта 21-2 (31 мг, твердое вещество желтого цвета, выход: 9%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 7,96 (br. s., 1H), 7,50-7,18 (m, 3H), 7,16-6,94 (m, 2H), 6,78-6,19 (m, 1H), 5,14-4,80 (m, 1H), 4,69-4,23 (m, 1,5H), 4,20-3,86 (m, 1,5H), 2,39 (br. s., 1H), 2,28-2,09 (m, 3H), 2,09-1,92 (m, 3H), 1,85 (br. s., 1H), 1,75 (br. s., 1H), 1,64 (s, 1H), 1,52 (br. s., 1H), 1,44-1,08 (m, 1H)
Пример 22
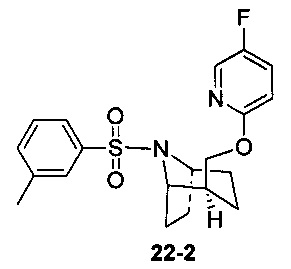
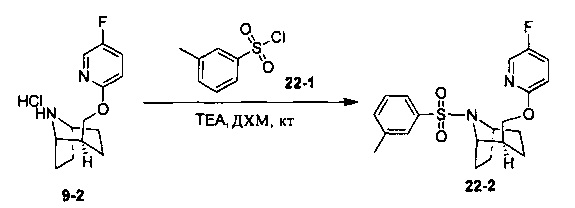
Соединение 9-2 (50 мг, 0,18 ммоль) растворяли в 2 мл дихлорметана. Добавляли триэтиламин (56 мг, 0,55 ммоль) и соединение 22-1 (53 мг, 0,28 ммоль). После перемешивания при комнатной температуре в течение 2 часов, реакционную смесь повергали центробежной сушке с удалением растворителя с получением неочищенного продукта. Неочищенный продукт очищали с помощью препаративной ВЭЖХ с получением соединения 22-2 (60 мг, твердое вещество белого цвета, выход: 87%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 7,96 (d, J=2,8 Hz, 1H), 7,78-7,54 (m, 2H), 7,34-7,19 (m, 3H), 6,63 (dd, J=3,4, 8,9 Hz, 1H), 4,48-4,24 (m, 3H), 4,21-4,07 (m, 1H), 2,35 (s, 3H), 2,03 (d, J=6,0 Hz, 1H), 1,97-1,69 (m, 4H), 1,68-1,60 (m, 2,6H), 1,54-1,45 (m, 1.5H)
Пример 23
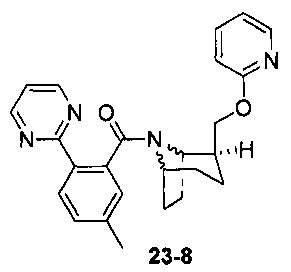
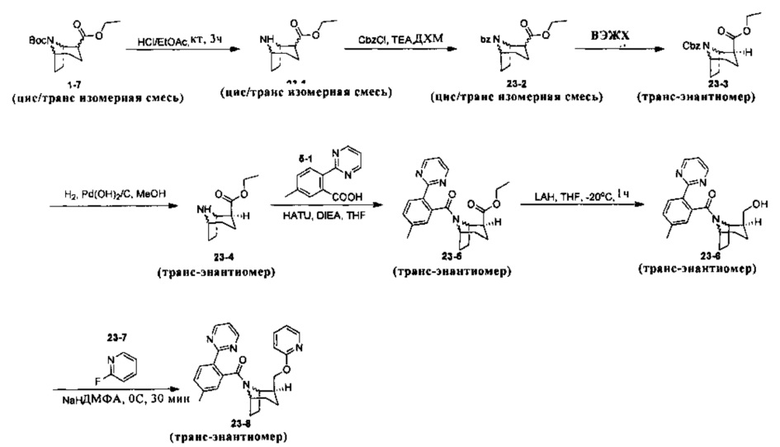
Стадия 23 (синтез 1-1)
Соединение 1-7 (48 г) растворяли в 50 мл этилацетата и хлороводород в этилацетате (150 мл, 4М) добавляли по каплям при охлаждении на ледяной бане. Смесь перемешивали в течение 2 часов, концентрировали при пониженном давлении с получением продукта 23-1 (форма гидрохлорида), который использовали на следующей стадии без очистки.
Стадия 2 (синтез 23-2)
Соединение 23-1 (33 г, 150 ммоль) растворяли в 300 мл дихлорметана. TEA (62,7 мл, 450 ммоль) и CbzCl (21,3 мл, 150 ммоль) добавляли последовательно в условиях ледяной бани. Через полчаса реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь охлаждали до комнатной температуры и экстрагировали этилацетатом (300 мл × 3). Объединенную органическую фазу последовательно промывали водой (100 мл × 2), насыщенным раствором NaCl (100 мл × 2) и сушили над безводным Na2SO4, фильтровали, и очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 50: 1) с получением продукта 23-2 (35 г, желтая жидкость. Твердое вещество осаждали после охлаждения и размещения. Выход: 74%).
Стадия 3 (синтез 23-3)
Соединение 23-2 (35 г) разделяли с помощью препаративной ВЭЖХ с получением продукта 23-3 (22 г, 62,8%).
Стадия 4 (синтез 23-4)
Соединение 23-3 (5 г, 15,75 ммоль) растворяли в 100 мл метанола и добавляли влажный Pd(OH)2 (500 мг, 5%). Смесь перемешивали в атмосфере водорода в течение 16 часов. Реакционную смесь фильтровали и фильтрат концентрировали с получением продукта 23-4 (2,7 г, 94%) (бесцветное масло), который использовали на следующей стадии без очистки.
Стадия 5 (синтез 23-5)
Соединение 23-4 (8 г, 43,7 ммоль), соединение 5-1 (11,2 г, 52,4 ммоль), HATU (24,9 г, 65,6 ммоль) и DIEA (16,9 г, 131,1 ммоль) растворяли в 200 мл THF, и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь выливали в водный солевой раствор и экстрагировали этилацетатом (100 мл × 3). Органическую фазу объединяли и промывали водой (50 мл × 2) и насыщенным раствором NaCl (50 мл × 2), сушили с безводным Na2SO4, фильтровали, и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищали с помощью колонки (петролейный эфир : этилацетат = 1:2) с получением продукта 23-5 (13 г, твердое вещество белого цвета, выход: 78%).
Стадия 6 (синтез 23-6)
Соединение 23-5 (950 мг, 2,5 ммоль) растворяли в 25 мл THF, и LAH (100 мг, 2,5 ммоль) добавляли в ледяную этаноловую баню. Реакционную смесь перемешивали при температуре среды в течение 1 часа. 20 мл безводного THF добавляли для разбавления. 0,1 мл воды, 0,1 мл 15% раствора гидроксида натрия и 0,3 мл воды последовательно добавляли по каплям с гашением реакционной смеси. Затем смесь сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении с получением продукта 23-6 (800 мг, твердое вещество желтого цвета, выход: 96%), который непосредственно использовали на следующей стадии без очистки.
Стадия 7 (синтез 23-8)
Соединение 23-6 (80 мг, 0,237 ммоль) растворяли в 5 мл ДМФА и NaH (38 мг, 60%, 0,984 ммоль) добавляли в условиях ледяной бани. Соединение 23-7 (46 мг, 0,474 ммоль) добавляли в реакционную смесь после перемешивания при температуре среды в течение 0,5 часа. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, выливали в солевой раствор и экстрагировали дихлорметаном (20 мл × 3). Объединенную органическую фазу последовательно промывали водой (10 мл × 2), насыщенным раствором NaCl (10 мл × 2) и сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали при пониженном давлении, и очищали с помощью пластинки препаративной ТСХ с получением продукта 23-8 (23,24 мг, твердое вещество белого цвета, выход: 23,7%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,75 (br. s., 2Н), 8,22-8,06 (m, 2Н), 7,58-7,46 (m, 1H), 7,28 (d, J=8,0 Hz, 1H), 7,23-7,05 (m, 2H), 6,88-6,76 (m, 1H), 6,34 (br. s., 1H), 5,01 (d, J=6,5 Hz, 1H), 4,65-4,37 (m, 1H), 4,16 (d, J=6,3 Hz, 1H), 3,94-3,75 (m, 1H), 2,41 (s, 1H), 2,21 (d, J=7,0 Hz, 1H), 1,96-1,77 (m, 5H), 1,54-1,45 (m, 2H), 1,33-0,77 (m, 3H)
Пример 24
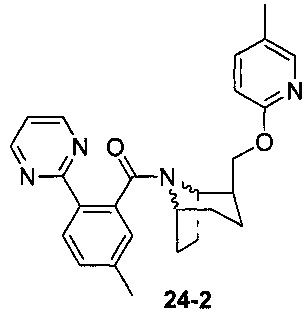
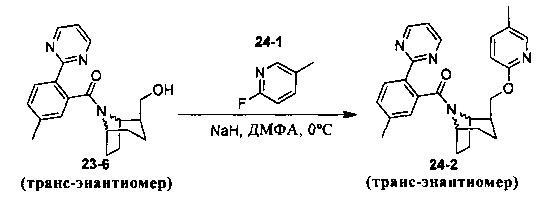
Стадия 1 (синтез 24-2)
Соединение 23-6 (80 мг, 0,237 ммоль) растворяли в 5 мл ДМФА и NaH (38 мг, 60%, 0,984 ммоль) добавляли в условиях ледяной бани. Соединение 24-1 (53 мг, 0,474 ммоль) добавляли в реакционную смесь после ее перемешивания при температуре среды в течение 0,5 часа. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, выливали в солевой раствор и экстрагировали этилацетатом (20 мл × 3). Объединенную органическую фазу последовательно промывали водой (10 мл × 2), насыщенным раствором NaCl (10 мл × 2) и сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта, который дополнительно очищали с помощью пластинки препаративной ТСХ с получением продукта 24-2 (17,6 мг, твердое вещество белого цвета, выход: 19%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,75 (br. s., 2Н), 8,20-8,07 (m, 1Н), 7,98-7,88 (m, 1H), 7,41-7,28 (m, 1H), 7,23-7,08 (m, 3H), 6,71-6,25 (m, 1H), 5,01 (d, J=6,3 Hz, 1H), 4,64-4,30 (m, 1H), 4,12 (d, J=6,8 Hz, 1H), 3,92-3,75 (m, 1H), 2,41 (s, 1,5H), 2,29-2,16 (m, 4H), 2,01-1,75 (m, 6H), 1,56-1,44 (m, 1,5H), 1,30-1,21 (m, 1,5H), 0,98 (d, J=6,8 Hz, 0,5H)
Пример 25
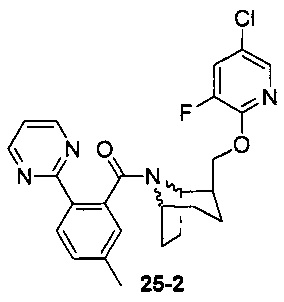
Стадия 1 (синтез 25-2)
Пример 25 получен в соответствии со способом примера 24, где указанный реагент 24-1 заменяли на 25-1:  , и продукт 25-2 получали с помощью очистки на пластинке ТСХ (33,72 мг, твердое вещество белого цвета, выход: 22%).
, и продукт 25-2 получали с помощью очистки на пластинке ТСХ (33,72 мг, твердое вещество белого цвета, выход: 22%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,74 (br. s., 2Н), 8,16 (dd, J=7,7, 18,2 Hz, 1H), 7,89 (br. s., 1H), 7,37-7,25 (m, 2H), 7,24-7,12 (m, 2H), 5,01 (br. s., 1H), 4,84-4,36 (m, 1H), 4,21 (br. s., 1H), 3,80 (d, J=19,8 Hz, 1H), 2,42 (br. s., 2H), 2,09 (br. s., 2H), 1,86-1,8 (m, 3H), 1,68-1,60 (m, 1H), 1,60-1,43 (m, 2H), 1,35-1,13 (m, 2H),
Пример 26
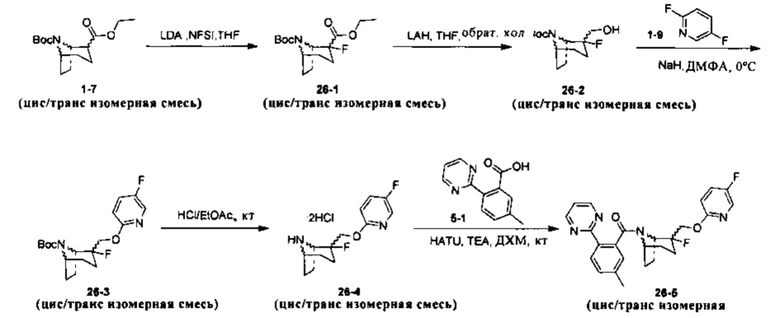
Стадия 26 (синтез 26-1)
Соединение 1-7 (4,0 г, 14,13 ммоль) растворяли в 30 мл тетрагидрофурана и LDA (14,4 мл, 28,26 ммоль) медленно добавляли по каплям при 0°С. Смесь перемешивали при 0°С в течение 1 ч. При поддержании температуры при 0°С в реакционную смесь добавляли соединение NFSI (5,3 г, 16,96 ммоль). После завершения добавления температуру медленно поднимали до комнатной температуры, и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь выливали в водный раствор хлорида аммония (30 мл) и концентрировали при пониженном давлении. Неочищенный продукт добавляли в 20 мл насыщенного водного раствора NaCl, и экстрагировали этилацетатом (40 мл × 3). Объединенную органическую фазу последовательно промывали водой (40 мл × 2), насыщенным раствором NaCl (40 мл × 2) и сушили над безводным Na2SO4, фильтровали, и очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 60:1-20:1) с получением продукта 26-1 (1,5 г, желтая маслянистая жидкость, выход: 40%).
ЖХ/МС: 245,9 (М-56+Н+), 323,9 (M+Na+)
Стадия 2 (синтез 26-2)
Соединение 26-1 (1,8 г, 6,0 ммоль) растворяли в 30 мл тетрагидрофурана. При 0°С LAH (500 мг, 13,15 ммоль) добавляли несколькими партиями с небольшим количеством в каждой партии. После завершения добавления смесь нагревали до комнатной температуры и реакцию проводили при комнатной температуре в течение ночи. 0,5 мл воды, 0,5 мл 15% водного гидроксида натрия и 1,5 мл воды последовательно добавляли в реакционную смесь. Добавляли небольшое количество сульфата магния. Смесь фильтровали после перемешивания в течение 10 минут и фильтрат сушили при вращении с получением продукта 26-2, который использовали на следующей стадии без очистки.
Стадия 3 (синтез 26-3)
Соединение 26-2 (1,5 г, 5,88 ммоль) растворяли в 20 мл ДМФА. При 0°С NaH (800 мг, 20,0 ммоль) добавляли несколькими партиями с небольшим количеством в каждой партии. Смесь перемешивали при той же температуре в течение 30 минут и добавляли соединение 1-9 (676 мг, 5,88 ммоль). После добавления реакцию проводили при комнатной температуре в течение 10 часов. Реакционную смесь выливали в 30 мл воды. Добавляли 10 мл насыщенного раствора NaCl. Смесь экстрагировали этилацетатом (30 мл × 3). Объединенную органическую фазу последовательно промывали водой (30 мл × 2), насыщенным раствором NaCl (30 мл × 2) и сушили над безводным Na2SO4, фильтровали, и очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 50:1) с получением продукта 26-3 (500 мг. Выход за три стадии: 25%).
ЖХ/МС: 254,9 (М-56+Н+), 254,9 (М-Вос+Н+), 354,9 (М+Н+)
Стадия 4 (синтез 26-4)
Соединение 26-3 (150 мг) растворяли в 4 мл этилацетата и хлороводород в этилацетате (4 мл, 4М) добавляли по каплям при охлаждении на ледяной бане. Смесь перемешивали в течение 2 часов, концентрировали при пониженном давлении с получением продукта 26-4 (форма гидрохлорида), который использовали на следующей стадии без очистки.
Стадия 5 (синтез 26-5)
Соединение 26-4 (120 мг, 0,37 ммоль), соединение 5-1 (94 мг, 0,38 ммоль), HATU (209 мг, 0,55 ммоль) и DIEA (143 мг, 0,96 ммоль) растворяли в 5 мл ДМФА и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в водный солевой раствор и экстрагировали этилацетатом (10 мл × 3). Органическую фазу объединяли и промывали водой (10 мл × 2) и насыщенным раствором NaCl (10 мл × 2), сушили с безводным Na2SO4, фильтровали и концентрировали с получением неочищенного продукта, который очищали с помощью препаративной ВЭЖХ с получением продукта 26-5 (14 мг, выход: 7,8%).
1Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 8,91-8,78 (m, 2Н), 8,21-8,00 (m, 2Н), 7,59-7,40 (m, 2Н), 7,38-7,17 (m, 2Н), 6,92 (dd, J=3,8, 9,3 Hz, 1Н), 5,17-5,01 (m, 1H), 4,81-4,58 (m, 2H), 4,34 (br. s., 1H), 2,64-2,36 (m, 3H), 2,29-2,09 (m, 2H), 2,01-1,67 (m, 6H)
Пример 27
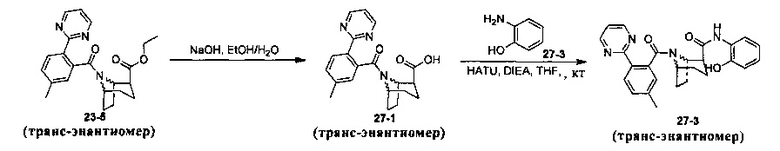
Стадия 1 (синтез 27-1)
Соединение 23-5 (190 мг) растворяли в 10 мл THF и добавляли 10 мл 0,48% водного раствора LiOH. Смесь нагревали с обратным холодильником в течение 3 часов. Разбавленную соляную кислоту добавляли по каплям до достижения слабой кислотности. Смесь экстрагировали этилацетатом и органическую фазу концентрировали при пониженном давлении с получением продукта 27-1 (160 мг, 94%), который использовали на следующей стадии без очистки.
Стадия 2 (синтез 27-3)
Соединение 27-1 (105,4 мг, 0,3 ммоль), соединение 23-2 (65,5 мг, 0,6 ммоль), HATU (171 мг, 0,45 ммоль) и DIEA (0,157 мл, 0,9 ммоль) растворяли в 5 мл THF, и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь выливали в водный солевой раствор и экстрагировали этилацетатом (10 мл × 3). Органическую фазу объединяли и промывали водой (5 мл × 2) и насыщенным раствором NaCl (5 мл × 2), сушили с безводным Na2SO4, фильтровали, и фильтрат концентрировали при пониженном давлении и очищали с помощью пластинки препаративной ТСХ с получением 100 мг продукта 27-3 (100 мг, твердое вещество бледно-желтого цвета).
1Н ЯМР (400 МГц, CHCl3-d) δ = 10,63 (br. s., 0,5Н), 9,23 (br. s., 1Н), 8,76 (br. s., 0,5H), 8,38 (br. s., 1H), 8,20 (br. s., 1H), 7,35 (d, J=8,0 Hz, 1,5H), 7,14-6,92 (m, 5H), 6,76-6,54 (m, 1,5H), 5,36-5,22 (m, 1H), 3,99 (br. s., 0,5H), 3,83 (br. s., 0,5H), 2,80 (s, 5H), 2,46-2,42 (m, 3H), 2,23 (d, J=7,5 Hz, 1H), 2,11-1,96 (m, 3H)
Пример 28
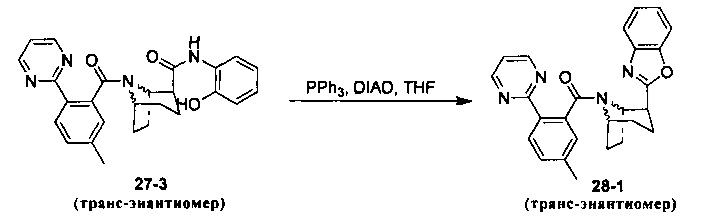
Стадия 28 (синтез 28-1)
Соединение 27-3 (88 мг, 0,2 ммоль) и трифенилфосфин (52,4 мг, 0,2 ммоль) растворяли в 25 мл THF. В условиях защиты азота 2 мл DIAD (40,4 мг, 0,2 ммоль) в THF добавляли через шприц. Реакционную смесь нагревали с обратным холодильником в течение 3 часов, выливали в солевой раствор и экстрагировали этилацетатом (10 мл × 3). Объединенную органическую фазу последовательно промывали водой (10 мл × 2), насыщенным раствором NaCl (10 мл × 2) и сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали с получением неочищенного продукта, который очищали с помощью пластинки препаративной ТСХ с получением продукта 28-1 (11,7 мг, твердое вещество белого цвета, выход: 13,37%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 10,51 (br. s., 0,4Н), 10,03 (br. s., 0,1H), 9,15 (s, 1H), 8,74 (br. s., 1H), 8,39 (br. s., 1H), 8,26-8,10 (m, 1H), 7,41-7,30 (m, 1,5H), 7,05 (br. s., 1,5H), 6,92 (d, J=8,5 Hz, 1,5H), 6,74 (br. s., 1H), 5,24 (br. s., 1H), 4,99-4,81 (m, 2H), 4,01 (br. s., 0,6H), 3,78 (br. s., 0,4H), 2,78 (br. s., 1H), 2,43 (br. s., 4H), 2,25 (br. s., 1H), 2,11-1,93 (m, 3H), 1,81 (br. s., 1H)
Пример 29
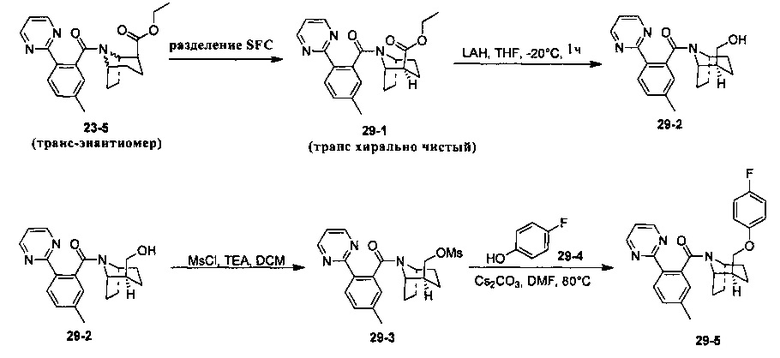
Стадия 29 (синтез 29-1)
Соединение 23-5 (5 г) разделяли посредством разделения SFC (способ разделения: Модель прибора: MG II препаративная SFC (SFC-1); разделительная колонка: ChiralPak OD, 250×30 мм I.D.; подвижная фаза: А: CO2, В: этанол (0,1% водный раствор аммиака); плотность: В 30%; скорость потока: 55 мл/мин; давление обратного потока: 100 бар; температура колонки: 38°С; длина волны детектирования: 220 нм) с получением хирально чистого продукта 29-1 (2 г, твердое вещество белого цвета, выход: 80%).
Стадия 2 (синтез 29-2)
Соединение 29-1 (1,3 г, 3,426 ммоль) растворяли в 25 мл THF, и LAH (100 мг, 2,5 ммоль) добавляли медленно в условиях ледяной этанольной бани. Реакционную смесь перемешивали при температуре среды в течение 1 часа. 20 мл безводного THF добавляли для разбавления. 0,1 мл воды, 0,1 мл 15% раствора гидроксида натрия и 0,3 мл воды последовательно добавляли по каплям с гашением реакционной смеси. Затем смесь сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении с получением продукта 29-2 (1,1 г, твердое вещество желтого цвета, выход: 96%), который непосредственно использовали на следующей стадии без очистки.
Стадия 3 (синтез 29-3)
Соединение 29-2 (200 мг, 0,6 ммоль) растворяли в 10 мл ДХМ, и последовательно добавляли триэтиламин (152 мг, 1,5 ммоль) и MsCl (103 мг, 0,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, выливали в солевой раствор и экстрагировали дихлорметаном (10 мл × 3). Объединенную органическую фазу последовательно промывали водой (10 мл × 2), насыщенным раствором NaCl (10 мл × 2) и сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали в вакууме с получением продукта 29-3 (244 мг, выход: 98%), который использовали на следующей стадии без очистки.
Стадия 4 (синтез 29-5)
Соединение 29-3 (98 мг, 0,237 ммоль) и соединение 29-4 (53 мг, 0,474 ммоль) растворяли в 5 мл ДМФА, и карбонат цезия (196 мг, 0,6 ммоль) добавляли при комнатной температуре. Реакционную смесь перемешивали при 80°С в течение 16 часов, выливали в солевой раствор и экстрагировали этилацетатом (20 мл × 3). Объединенную органическую фазу последовательно промывали водой (10 мл × 2), насыщенным раствором NaCl (10 мл × 2) и сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали при пониженном давлении, и очищали с помощью препаративной ВЭЖХ с получением продукта 29-5 (5,45 мг, твердое вещество белого цвета, выход: 5,3%).
1H ЯМР (400 МГц, CHCl3-d) δ = 8,76 (d, J=4,3 Hz, 1H), 8,70 (br. s., 1H), 8,16 (d, J=8,0 Hz, 0,5H), 8,10 (d, J=8,0 Hz, 0,5H), 7,31 (d, J=8,0 Hz, 0,5H), 7,17 (d, J=7,3 Hz, 1,5H), 7,10 (br. s., 1H), 6,98-6,88 (m, 3H), 6,57 (br. s., 1H), 5,00 (d, J=7,3 Hz, 0,6H), 4,92 (br. s., 0,4H), 4,26 (br. s., 0,6H), 4,04 (br. s., 0,4H), 3,84 (br. s., 1,5H), 3,66 (dd, J=6,0, 8,5 Hz, 0,5H), 2,41 (s, 2H), 2,17 (br. s., 0,5H), 1,98-1,73 (m, 7H), 1,52 (d, J=8,5 Hz, 1,5H), 1,25 (br. s., 1H)
Пример 30
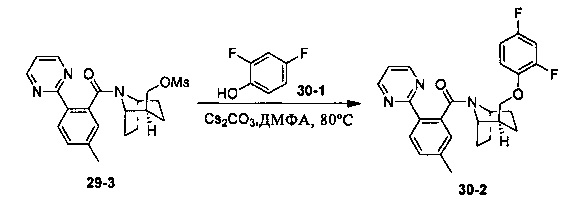
Стадия 30 (синтез 30-2)
Соединение 29-3 (98 мг, 0,237 ммоль) и соединение 30-1 (63 мг, 0,474 ммоль) растворяли в 5 мл ДМФА, и карбонат цезия (196 мг, 0,6 ммоль) добавляли при комнатной температуре. Реакционную смесь перемешивали при 80°С в течение 16 часов, выливали в солевой раствор и экстрагировали этилацетатом (20 мл × 3). Объединенную органическую фазу последовательно промывали водой (10 мл × 2), насыщенным раствором NaCl (10 мл × 2) и сушили над безводным Na2SO4, фильтровали, и фильтрат концентрировали при пониженном давлении, и очищали с помощью препаративной ВЭЖХ с получением продукта 30-2 (19,63 мг, твердое вещество белого цвета, выход: 18,4%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,75 (d, J=3,8 Hz, 1H), 8,70 (br. s., 1H), 8,17 (d, J=8,0 Hz, 0,6H), 8,12 (d, J=7,8 Hz, 0,4H), 7,31 (d, J=7,8 Hz, 0,5H), 7,21 (d, J=8,0 Hz, 0,5H), 7,18-7,05 (m, 2,5H), 6,91-6,82 (m, 1H), 6,79 (br. s., 1,5H), 5,01 (d, J=6,5 Hz, 0,5H), 4,92 (br. s., 0,5H), 4,32 (br. s., 0,6H), 4,12 (br. s., 0,4H), 4,03-3,68 (m, 2H), 2,41 (s, 2H), 2,21 (br. s., 1H), 2,02 (d, J=11,5 Hz, 2H), 1,94-1,78 (m, 4H), 1,61-1,48 (m, 2H), 1,25 (br. s., 1H)
Пример 31
Пример 31 получен в соответствии со способом примера 30, где указанный реагент 30-1 заменяли на 31-1: 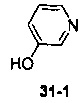 , и продукт 31-2 получали с помощью очистки препаративной ВЭЖХ (5,79 мг, твердое вещество белого цвета, выход: 5,9%).
, и продукт 31-2 получали с помощью очистки препаративной ВЭЖХ (5,79 мг, твердое вещество белого цвета, выход: 5,9%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,84-8,61 (m, 2Н), 8,47-8,26 (m, 1H), 8,18 (d, J=8,0 Hz, 1H), 8,12-8,06 (m, 0,5H), 8,02 (br. s., 0,5H), 7,37 (dd, J=l,5, 8,5 Hz, 0,5H), 7,33-7,27 (m, 1,5H), 7,22-7,04 (m, 3H), 5,02 (d, J=6,5 Hz, 1H), 4,40 (br. s., 0,5H), 4,17-4,06 (m, 0,5H), 3,92 (br. s., 1H), 3,80 (br. s., 0,5H), 3,74 (dd, J=5,5, 8,5 Hz, 0,5H), 2,41 (s, 1,5H), 2,26-2,21 (m, 0,5H), 1,99-1,73 (m, 6H), 1,67 (br. s., 1,5H), 1,51 (d, J=9,5 Hz, 1,5H), 0,98-0,79 (m, 1H)
Пример 32
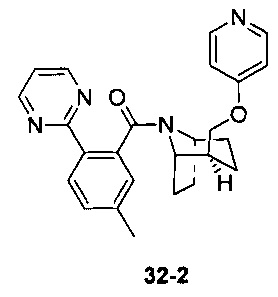
Пример 31 получен в соответствии со способом примера 30, где указанный реагент 30-1 заменяли на 32-1: 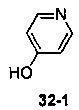 , и продукт 32-2 получали с помощью очистки препаративной ВЭЖХ (7,32 мг, твердое вещество белого цвета, выход: 7,46%).
, и продукт 32-2 получали с помощью очистки препаративной ВЭЖХ (7,32 мг, твердое вещество белого цвета, выход: 7,46%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,75 (d, J=4,5 Hz, 2H), 8,26 (d, J=6,8 Hz, 1H), 7,87 (br. s., 2H), 7,36 (d, J=8,0 Hz, 1H), 7,20 (br. s., 2H), 6,60 (br. s., 2H), 4,75 (d, J=5,5 Hz, 1Н), 4,29 (br. s., 1H), 3,90 (br. s., 2H), 2,45 (s, 3,5H), 2,07 (br. s., 3,5H), 1,77 (br. s., 1H), 1,63 (br. s., 2H), 1,52 (d, J=12,8 Hz, 1H), 1,34 (br. s., 1H)
Пример 33
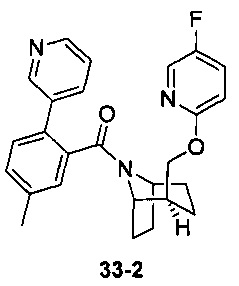
Пример 33 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 33-1:  , и продукт 33-2 получали с помощью очистки препаративной ВЭЖХ (25 мг, бледно-желтое твердое вещество, выход: 29%).
, и продукт 33-2 получали с помощью очистки препаративной ВЭЖХ (25 мг, бледно-желтое твердое вещество, выход: 29%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,87-8,68 (m, 1Н), 8,68-8,48 (m, 1H), 8,30-7,89 (m, 2H), 7,58-7,40 (m, 1H), 7,34 (s, 1H), 7,33-7,22 (m, 2H), 7,18 (d, J=7,8 Hz, 1H), 6,77 (dd, J=3,0, 8,8 Hz, 0,4H), 6,30 (dd, J=3,1, 8,9 Hz, 0,6H), 4,95-4,71 (m, 1H), 4,07-3,92 (m, 1H), 3,71-3,49 (m, 1H), 3,38 (br. s., 1H), 2,44 (s, 1H), 2,29-2,04 (m, 1H), 2,04-1,93 (m, 2H), 1,93-1,70 (m, 2H), 1,66-1,52 (m, 1H), 1,59-1,20 (m, 5H)
Пример 34
Пример 34 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 34-1:  , и продукт 34-2 получали с помощью очистки препаративной ВЭЖХ (30 мг, бледно-желтое твердое вещество, выход: 34,5%).
, и продукт 34-2 получали с помощью очистки препаративной ВЭЖХ (30 мг, бледно-желтое твердое вещество, выход: 34,5%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 9,31-9,12 (m, 1Н), 9,06-8,74 (m, 2H), 8,07-7,88 (m, 1H), 7,43-7,10 (m, 4H), 6,78 (dd, J=3,4, 8,9 Hz, 0,4H), 6,28 (dd, J=3,4, 8,9 Hz, 0,6H), 4,98-4,73 (m, 1H), 4,41 (br. s., 1H), 4,13-3,85 (m, 1H), 3,69-3,44 (m, 1H), 2,45 (s, 1H), 2,33-2,06 (m, 1H), 2,04-1,93 (m, 3H), 1,93-1,73 (m, 2H), 1,68 (br. s., 1H), 1,60-1,51 (m, 1H), 1,50-1,23 (m, 3H)
Пример 35
Пример 35 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 35-1: 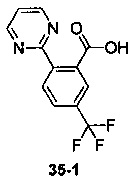 , и продукт 35-2 получали с помощью очистки препаративной ВЭЖХ (4,47 мг, твердое вещество белого цвета, выход: 4,6%).
, и продукт 35-2 получали с помощью очистки препаративной ВЭЖХ (4,47 мг, твердое вещество белого цвета, выход: 4,6%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,80 (br. s., 2Н), 8,52-8,25 (m, 1Н), 7,86-7,63 (m, 2H), 7,31 (t, J=8,2 Hz, 1H), 7,26-7,18 (m, 2H), 6,75 (dd, J=3,5, 9,0 Hz,0,5H), 6,26 (br. s., 0,5H), 5,02 (br. s., 1H), 4,65-4,38 (m, 1H), 4,28-3,98 (m, 1H), 3,78 (br. s., 1H), 2,27-2,10 (m, 1H), 2,06-1,79 (m, 3H), 1,59-1,56 (m, 4H), 1,25 (br. s., 1H)
Пример 36
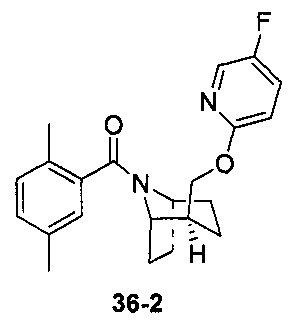
Пример 36 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 36-1: 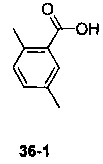 , и продукт 36-2 получали с помощью очистки препаративной ВЭЖХ (25,32 мг, твердое вещество белого цвета, выход: 34,4%).
, и продукт 36-2 получали с помощью очистки препаративной ВЭЖХ (25,32 мг, твердое вещество белого цвета, выход: 34,4%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,06-7,79 (m, 1Н), 7,38-7,27 (m, 1H), 7,12-7,02 (m, 1H), 6,95-6,77 (m, 2H), 6,29 (br. s., 1H), 5,09-4,93 (m, 1H), 4,54 (dd, J=7,8, 10,5 Hz, 0,5H), 4,34 (dd, J=7,7, 10,4 Hz, 0,5H), 4,22-4,14 (m, 0,5H), 4,06 (br. s., 1H), 3,73 (br. s.,0,5H), 2,44-2,19 (m, 3H), 2,19-2,05 (m, 3H), 2,04-1,87 (m, 3H), 1,87-1,60 (m, 3H), 1,60-0,90 (m, 3H)
Пример 37
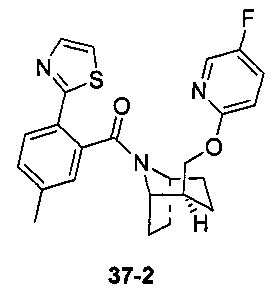
Пример 37 получен в соответствии со способом примера 10, где указанный реагент 10-1 заменяли на 37-1:  , и продукт 37-2 получали с помощью очистки препаративной ВЭЖХ (29,63 мг, твердое вещество бежевого цвета, выход: 33,9%).
, и продукт 37-2 получали с помощью очистки препаративной ВЭЖХ (29,63 мг, твердое вещество бежевого цвета, выход: 33,9%).
1Н ЯМР (400 МГц, CHCl3-d) δ = 8,30-7,93 (m, 1Н), 7,92-7,78 (m, 1H), 7,77-7,54 (m, 1H), 7,46-6,95 (m, 4H), 6,79 (dd, J=3,5, 9,0 Hz, 0,5H), 6,33 (d, J=6,3 Hz, 0,5H), 5,11-4,76 (m, 1H), 4,69-4,24 (m, 1H), 4,16-3,97 (m, 1H), 3,89-3,55 (m, 1H), 2,42 (s, 1H), 2,27-1,94 (m, 3H), 1,92-1,70 (m, 3H), 1,63 (br. s., 1H), 1,56-1,39 (m, 2H), 1,27-0,80 (m, 2H)
Экспериментальный пример 1: in vitro тест OX1/2R
Задача эксперимента:
Ингибирующее действие соединения на GPCR рецептор ОХ1 и ОХ2 оценивали путем обнаружения изменений сигнала кальция в клетках с FLIPR и значение IC50 соединения использовали в качестве показателя.
Материалы для эксперимента:
Клеточная линия: стабильный штамм клеток HEK293-ОХ1 и ОХ2
клеточная культуральная среда HEK293-ОХ1 (DMEM, Invitrogen#11960-044, 10% сыворотка Gibco#10099141, L-Глутамин 1 x, Gibco#25030, пируват натрия 1 x, Gibco #11360, Генетицин 300 мкг/мл, Gibco #10131).
клеточная культуральная среда HEK293-ОХ2 (DMEM, Invitrogen#11960-044, 10% сыворотка Gibco# 10099141, L-Глутамин 1 x, Gibco#25030, пируват натрия 1 х, Gibco #11360, Генетицин 300 мкг/мл, Gibco #10131, бластицидин 2 мкг/мл, Invitrogen# R21001).
Панкреатический фермент (Invitrogen, #25200-072)
DPBS (Hyclone, #SH30028,01B)
Fluo-4 AM, Invitrogen# F14202
F-127, Invitrogen # P3000MP
Пробенецид, Sigma # P8761
384-луночный планшет для клеток, Greiner # 781946
384-луночный планшет для соединений, Greiner # 781280
СО2 инкубатор, Thermo#371
Центрифуга, Eppendorf #5810R
Цитометрия Vi-cell, Beckman Coulter
Микропланшетная система для предварительной обработки POD 810 Plate Assembler Automatic
Молекулярное устройство Labcyte FLIPR.
Экспериментальные процедуры и методы:
a) инокуляция клеток (клетки HEK293-ОХ1 и HEK293-ОХ2)
1) Среду трипсина и DPBS предварительно нагревали при 37°С в условиях водяной бани. Культуральную среду для клеток отсасывали и клетки промывали 10 мл DPBS.
2) Предварительно нагретый трипсин добавляли в культуральную бутыль, которую вращали для равномерного покрытия бутыли трипсином. Ее поместили в инкубатор (37°С, 5% СО2) настаиваться в течение 1-2 минут;
3) Каждый Т150 суспендировали с 10-15 мл культуральной среды и центрифугировали при 800 об/мин в течение 5 минут. Клетки повторно суспендировали с 10 мл среды, и 1 мл повторной суспензии клеток отсасывали и подсчитывали с помощью цитометрия Vi-cell.
4) Клетки ОХ1 разводили в культуральной среде до 5×105 клеток/мл, и клетки ОХ2 разводили до 4×105 клеток/мл. Разведенные клетки добавляли в 384 планшет (Greiner. 781946) с помощью многоканальных пипеток (50 мкл/лунка, клетки ОХ1: 25000 клеток/лунка; и клетки ОХ2: 20000 клеток/лунка). Клеточный планшет помещали в инкубатор (37°С, 5% СО2) в течение ночи.
b) загрузка соединения:
1) ДМСО использовали для разбавления соединения до 20 мМ с использованием 3-кратного разведения. Были использованы 8 градиентов лунках в двух повторностях. Станция дозирования жидкости Echo была использован для добавления соединения в планшет для соединений. Затем добавляли 20 мкл буфера, чтобы конечная концентрация ДМСО составляла 0,1%.
c) эксперимент FLIPR:
1) Клеточную культуральную среду в 384-луночном планшете смывали с помощью вакуумного насоса. Добавляли 30 мкл флуоресцентного красителя Fluo4AM. Клетку инкубировали при 37°С, 5% СО2 в инкубаторе в течение 1 ч, а затем снова уравновешивали при комнатной температуре в течение 10 минут.
2) Тест ЕС50: Орексин А разбавляли вручную на льду с использованием 3-кратно разбавления. Были использованы 8 градиентов лунках в двух повторностях. Затем готовили планшеты ДМСО и концентрация ДМСО составляла 0,5%. Планшет для клеток, планшет орексина и планшет ДМСО помещали в FLIPR, соответственно, и считывали значения флуоресценции.
3) Значение ЕС70 рассчитывали на основании значения ЕС50 для орексина А. Получали 5х раствор ЕС70 и добавляли в 384-луночный планшет для соединений с помощью многоканальных пипеток. Планшет помещали на лед для сохранения.
4) В указанном FLIPR, планшет для соединений, планшет 5 х ЕС70, планшет для клеток и контроли FLIPR помещали, соответственно. Запускали программу и считывали значения флуоресценции.
d) Анализ данных: Prism5,0 использовали для анализа данных и рассчитывали значение IC 50 соединения.
Экспериментальные результаты приведены в таблице 1:
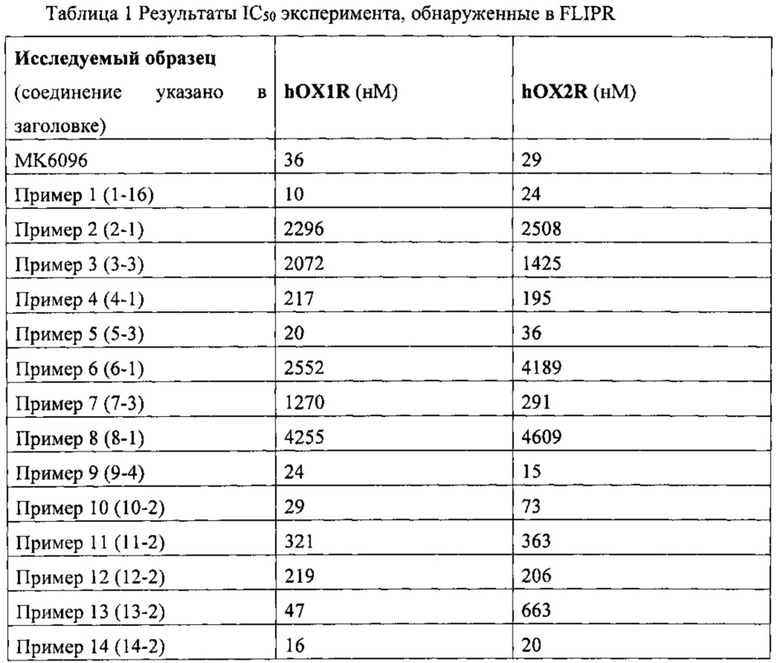
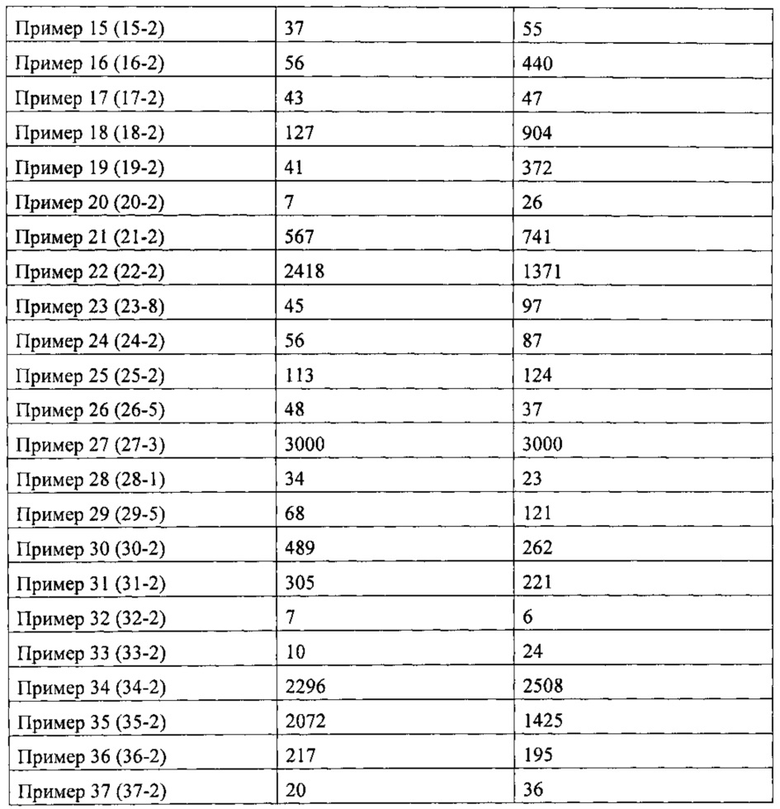
Вывод: Как видно из таблицы 1, типичные соединения настоящего изобретения значительно ингибируют GPCR рецепторы OX1 и OX2, а некоторые соединения имеют более высокую активность по сравнению с положительным контролем. Также было установлено, что для некоторых типичных соединений различная пространственная конфигурация может сильно повлиять на ингибирующее действие в отношении GPCR рецепторов OX1 и OX2.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕГУЛЯТОРЫ ПРОИЗВОДНЫХ СТЕРОИДОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2803499C1 |
| КОНДЕНСИРОВАННЫЕ ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПИРИДИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПРОИЗВОДСТВА И ПРИМЕНЕНИЕ | 2014 |
|
RU2668074C2 |
| ТИЕНОДИАЗЕПИНОВЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2795005C2 |
| ПРОИЗВОДНОЕ НА ОСНОВЕ ДИГИДРОПИРИМИДО-КОЛЬЦА В КАЧЕСТВЕ ИНГИБИТОРА HBV | 2015 |
|
RU2693897C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА ПРОТИВ ВИРУСА ГРИППА | 2017 |
|
RU2727772C1 |
| ЗАМЕЩЁННЫЕ ИНДОЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ПОНИЖАЮЩИХ РЕГУЛЯТОРОВ РЕЦЕПТОРОВ ЭСТРОГЕНА | 2017 |
|
RU2722441C2 |
| АНАЛОГ ПИРИДИНО[1,2-А]ПИРИМИДОНА, ИСПОЛЬЗУЕМЫЙ В КАЧЕСТВЕ ИНГИБИТОРА mTOR/PI3K | 2015 |
|
RU2658912C1 |
| ПРОИЗВОДНЫЕ ПИРИДИНА И ИХ ПРИМЕНЕНИЕ ПРОТИВ МИКОБАКТЕРИЙ | 2015 |
|
RU2664587C1 |
| ХИНОЛИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА, ИНГИБИРУЮЩЕГО ТРАНСПОРТЕР УРАТОВ | 2016 |
|
RU2715229C2 |
| БЕНЗАМИДНЫЕ ПРОИЗВОДНЫЕ, ОБЛАДАЮЩИЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2565079C2 |
Изобретение относится к соединению формулы (I), в которой А выбран из замещенного 3-12-членного циклогидрокарбила или гетероциклогидрокарбила или циклического гетерогидрокарбила, где указанный гетероциклогидрокарбил или циклический гетерогидрокарбил содержит 1 или 2 гетероатома в кольце, независимо выбранных из N и S; В выбран из С(=O); X представляет собой одинарную связь; D и L независимо выбраны из СН2; Т представляет собой С; М выбран из C(Y)(R1a), когда Q выбран из C(R1b)(R1c), или М выбран из C(R1b)(R1c), когда Q выбран из C(Y)(R1a); где А выбран из структурного звена, показанного в формуле (A1) или (А2), значения остальных радикалов указаны в формуле изобретения. Технический результат: получены новые соединения формулы (I), которые обладают свойствами антагонистов рецептора орексина. 7 з.п. ф-лы, 1 табл., 37 пр.
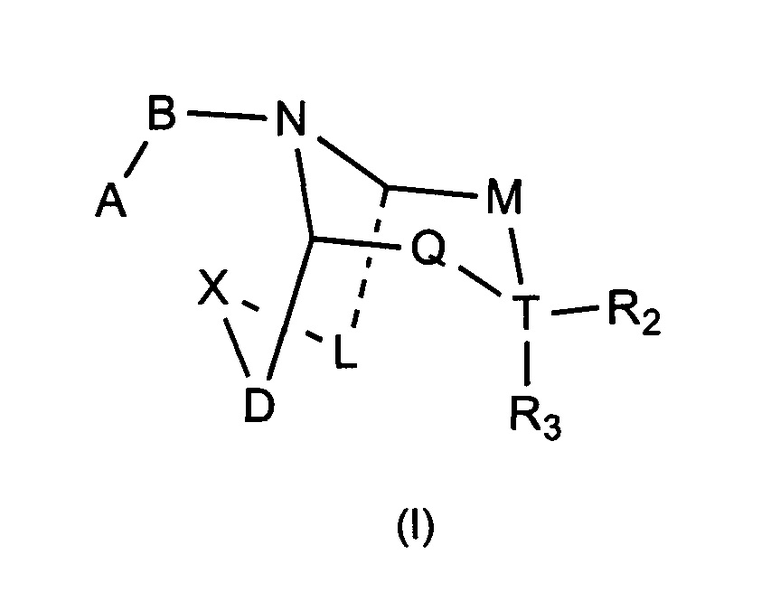
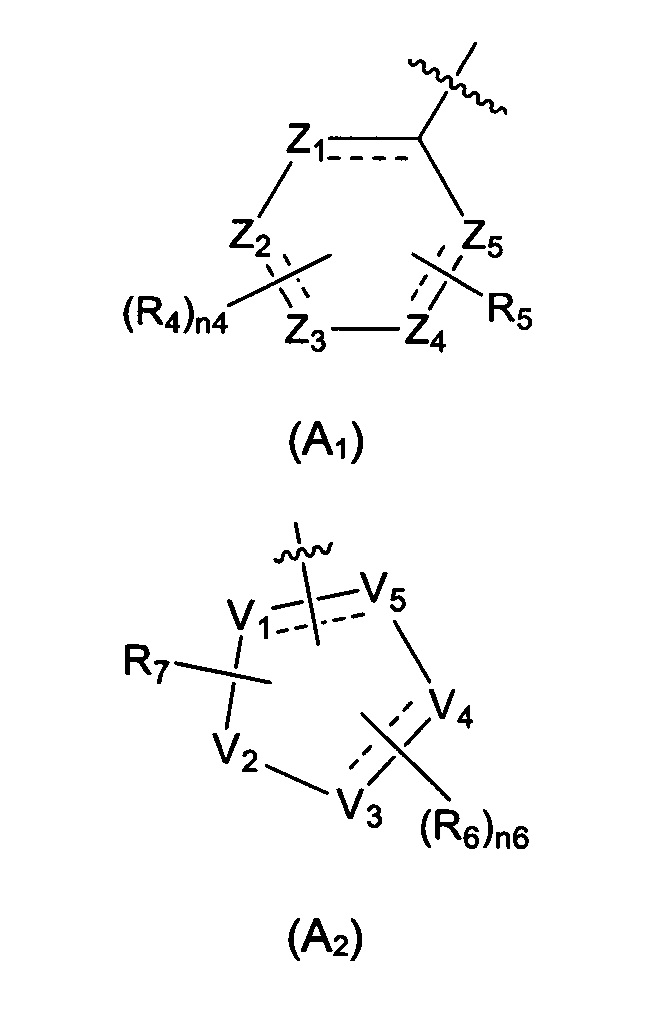
1. Соединение формулы (I),
где:
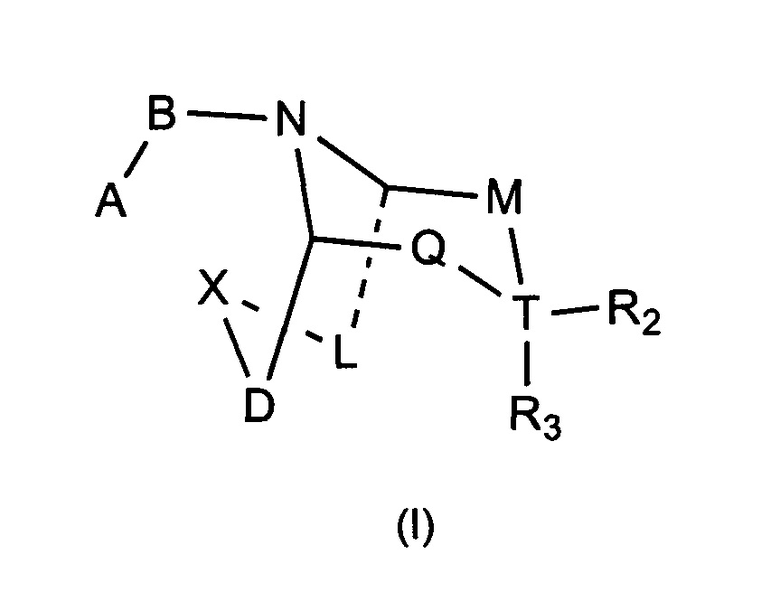
А выбран из замещенного 3-12-членного циклогидрокарбила или гетероциклогидрокарбила или циклического гетерогидрокарбила, где указанный гетероциклогидрокарбил или циклический гетерогидрокарбил содержит 1 или 2 гетероатома в кольце, независимо выбранных из N и S;
В выбран из С(=O);
X представляет собой одинарную связь;
D и L независимо выбраны из СН2;
Т представляет собой С;
М выбран из C(Y)(R1a), когда Q выбран из C(R1b)(R1c), или М выбран из C(R1b)(R1c), когда Q выбран из C(Y)(R1a);
Y выбран из -(CH2)r4(G)r5(CH2)r6-Y1, где Y1 выбран из -О-Е или структуры формулы (Y22)
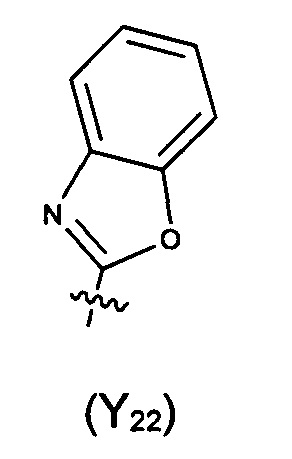
G представляет собой незамещенный СН2;
r4 и r6 независимо выбраны из 0, r5 выбран из 0 или 1, и когда r4, r5, и r6 все представляют собой 0, это означает, что соответствующая структура представляет собой одинарную связь;
Е выбран из структурного звена формулы (Еа):
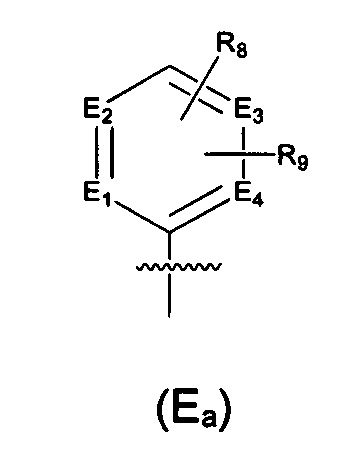
где:
структурное звено 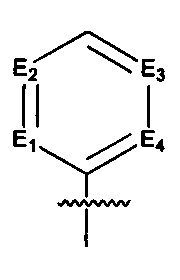 определено как фенил или пиридил;
определено как фенил или пиридил;
R8 и R9 независимо выбраны из Н, F, Cl, Br, галоген-замещенного или незамещенного С1-6 алкила;
каждый из R1a, R1b, R1c, R2 и R3 независимо выбран из Н, F и Cl; и
указанное соединение содержит один хиральный центр;
где А выбран из структурного звена, показанного в формуле (A1) или (А2):
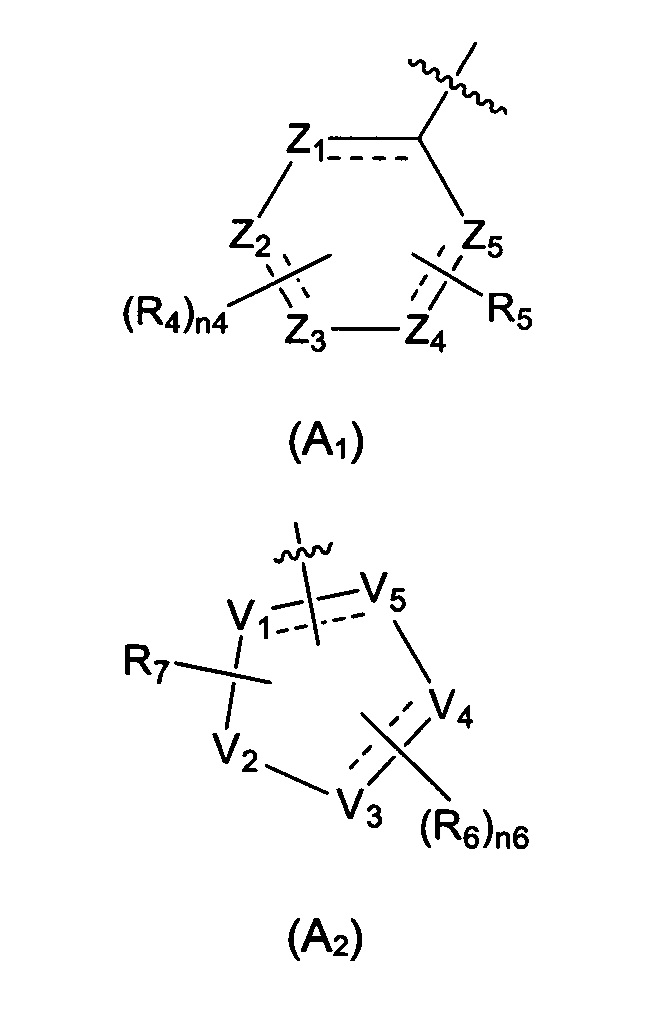
где:
структурное звено 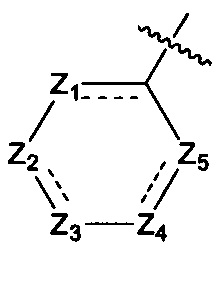 выбрано из фенила;
выбрано из фенила;
формула (А2) выбрана из структуры формулы (А22):
n6a выбран из 0 или 1;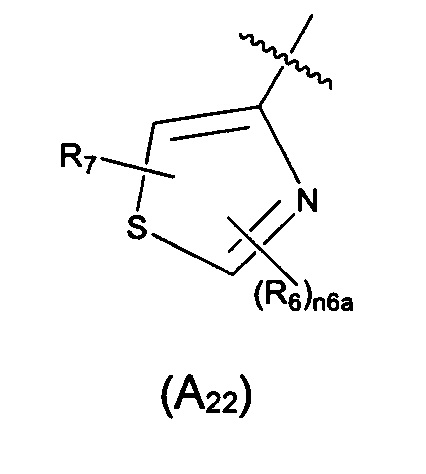
R4 и R6 независимо выбраны из Н, F, Cl, Br, галоген-замещенного или незамещенного С1-6 алкила;
R5 и R7 независимо выбраны из 5-6-членного циклогидрокарбила или гетероциклической группы; где каждый 5-6-членный циклогидрокарбил или гетероциклическая группа независимо выбраны из фенила, пиридила, тиазолила, пиримидинила, пиразолила, 1,2,3-триазолила или 1,2,5-триазолила;
n4 выбран из 0, 1, 2, 3, 4; и
С1-6 алкил выбран из метила, этила, пропила, бутила, пентила или гексила.
2. Соединение по п. 1, отличающееся тем, что А выбран из:
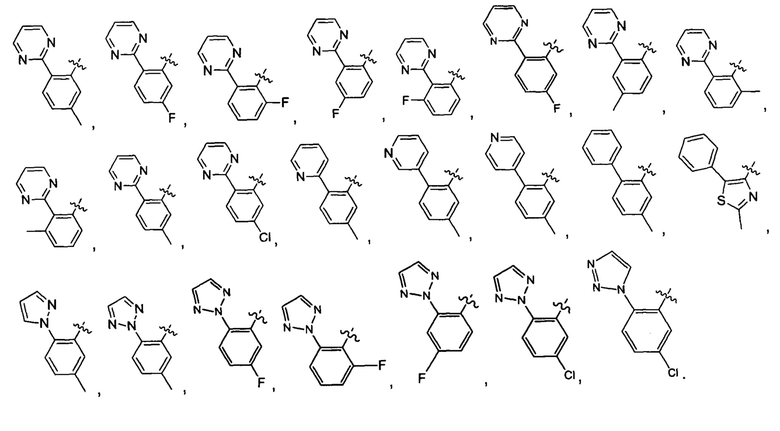
3. Соединение по п. 1, отличающееся тем, что Y выбран из -СН2-O-Е или -О-Е, где Е определен в п. 1.
4. Соединение по п. 1, отличающееся тем, что указанное структурное звено 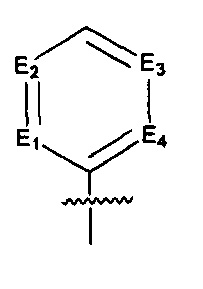 определено как пиридил.
определено как пиридил.
5. Соединение по п. 3, отличающееся тем, что Y выбран из:
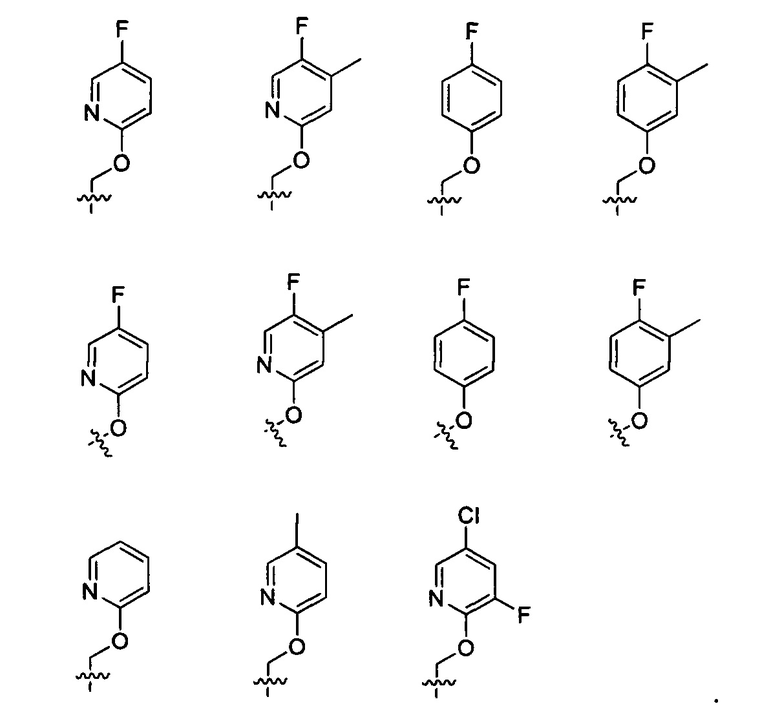
6. Соединение по п. 1, отличающееся тем, что R1a, R1b и R1c независимо выбраны из Н или фтора.
7. Соединение по п. 1, отличающееся тем, что R2 и R3 независимо выбраны из Н или фтора.
8. Соединение по п. 1, которое имеет любую из следующих структур:
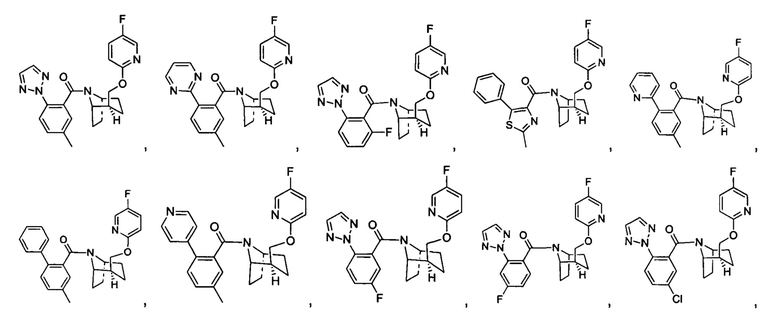
| L | |||
| Ogier et al | |||
| "Rearrangement of a Mesylate Tropane Intermediate in Nucleophilic Substitution Reactions | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
| S | |||
| P | |||
| Runyon et al | |||
| "Synthesis, structural identification, and ligand binding of tropane ring analogs of paroxetine and an unexpected aza-bicyclo[3.2.2]nonane rearrangement product" Bioorganic & Medicinal Chemistry, vol.13, N7, 2005, 2439-2449, соед | |||
| Насос | 1917 |
|
SU13A1 |
| WO 2004101562 A2, 25.11.2004 | |||
| КОРРЕКС | 2003 |
|
RU2261210C2 |
| ПИРИДИЛПИПЕРИДИНОВЫЕ АНТАГОНИСТЫ РЕЦЕПТОРА ОРЕКСИНОВ | 2008 |
|
RU2470021C2 |
Авторы
Даты
2018-10-15—Публикация
2015-02-27—Подача