ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет заявки США № 61/778540, поданной 13 марта 2013 г., и заявки США № 61/808381, поданной 4 апреля 2013 г., описание которых включено в настоящий документ в качестве ссылок в полном объеме.
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДСТАВЛЕННЫХ ЧЕРЕЗ EFS-WEB
Содержание текстового файла ASCII списка последовательностей, озаглавленного «20140313_034543_002WO1_seq», размером 56,7 кб, созданного 13 марта 2014 г. и доступный в электронном виде через EFC-Web, целиком включен в настоящую заявку в качестве ссылки.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
1. ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Область настоящего изобретения относится к антителам к CD38, карфилзомибу и лечению злокачественных новообразований.
2. ОПИСАНИЕ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Множественная миелома (ММ) представляет собой В-клеточное злокачественно новообразование. При ММ патологические плазматические клетки накапливаются в костном мозге, где они препятствуют выработке нормальных клеток. Современное лечение ММ включает введение ингибиторов протеасом, таких как бортезомиб и карфилзомиб, иммуномодулируюих лекарственных средств, таких как леналидомид и талидомид, и химиотерапевтических агентов, таких как мелфалан и преднизон. В то время как указанные агенты обеспечивают улучшение выживаемости при множественной миеломе, проблематичной становится постоянная резистентность, и пациенты погибают от указанного заболевания. Множественная миелома, таким образом, в конечном итоге остается фатальной, при средней выживаемости лишь приблизительно от 3 до 5 лет.
CD38 экспрессируется в злокачественных плазматических клетках. CD38 представляет собой трансмембранный гликопротеин типа II размером 45 кДа, с длинным С-концевым внеклеточным доменом и коротким N-концевым цитоплазматическим доменом. Белок CD38 представляет собой бифункциональный эктоэнзим, который может катализировать превращение NAD+ в циклическую АДФ-рибозу (цАДФР), а также гидролизовать цАДФР в АДФ-рибозу. CD38 подвержена повышающей регуляции и участвует во многих гематопоэтических злокачественных процессах.
Таким образом, некоторые предлагаемые виды лечения ММ включают введение антител к CD38. См., например, WO 2012/041800; de Weers et al. (2011) J. Immunol. 186: 1840-1848 и Van der Deer et al. (2011) Haematologica 96(2): 284-290.
К сожалению, подобно различным лекарственным средствам и химиотерапевтическим агентам, не все антитела одинаковы и не все антитела против одного и того же антигена демонстрируют одинаковую активность.
Таким образом, существует потребность в новых и эффективных лекарственных средствах для продления выживания и улучшения исхода лечения при множественной миеломе, и, в более общем смысле, при раках крови.
ОПИСАНИЕ ФИГУР
Как последующее общее описание, так и последующее подробное описание представляют собой лишь примеры и объяснения и предназначены для дальнейшего объяснения завяленного изобретения. Прилагаемые изображения включены в описание для обеспечения дополнительного понимания изобретения и составляют часть указанного описания, иллюстрируют несколько вариантов осуществления настоящего изобретения и совместно с описанием служат для объяснения принципов изобретения.
Настоящее изобретение дополнительно объясняется ссылками на изображения, где:
На фиг. 1А показана скорость роста опухолей в ксенотрансплантатных моделях с имплантированными клетками NCI-H929 (модели H929).
На фиг. 1В показана скорость роста опухолей в ксенотрансплантатных моделях с имплантированными клетками RPMI 8226 (модели RPMI).
На фиг. 2А показан объем опухолей в моделях RPMI после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (стрелки).
На фиг. 2В показана масса тела в моделях RPMI после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (стрелки).
На фиг. 3А показан объем опухолей в моделях Н929 после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (стрелки).
На фиг. 3В показана масса тела в моделях Н929 после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (стрелки).
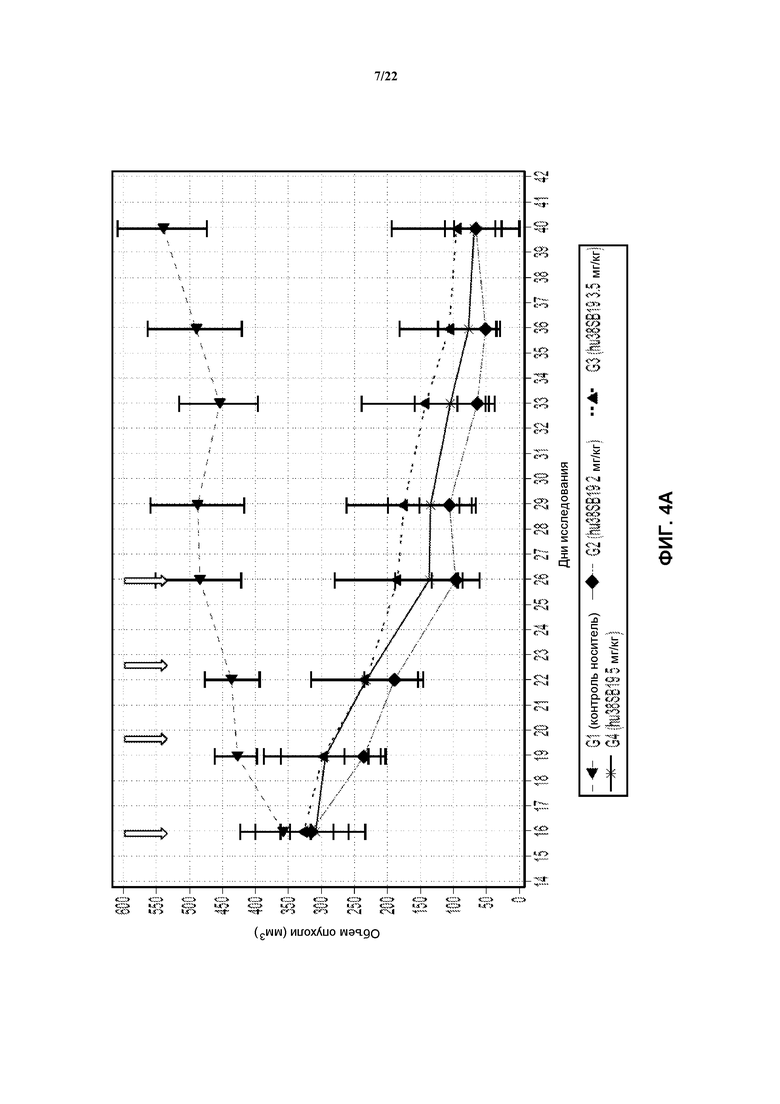
На фиг. 4А показан объем опухолей в моделях Н929 после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (стрелки).
На фиг. 4В показана масса тела в моделях Н929 после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (стрелки).
На фиг. 5А показан объем опухолей в моделях Н929 после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (стрелки).
На фиг. 5В показана масса тела в моделях Н929 после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (стрелки).
На фиг. 6А показан объем опухолей в моделях Н929 после лечения с использованием указанной дозы карфилзомиба в указанные моменты времени (стрелки).
На фиг. 6В показана масса тела в моделях Н929 после лечения с использованием указанной дозы карфилзомиба в указанные моменты времени (стрелки).
На фиг. 7А показан объем опухолей в моделях RPMI после лечения с использованием указанной дозы карфилзомиба в указанные моменты времени (стрелки).
На фиг. 7В показана масса тела в моделях RPMI после лечения с использованием указанной дозы карфилзомиба в указанные моменты времени (стрелки).
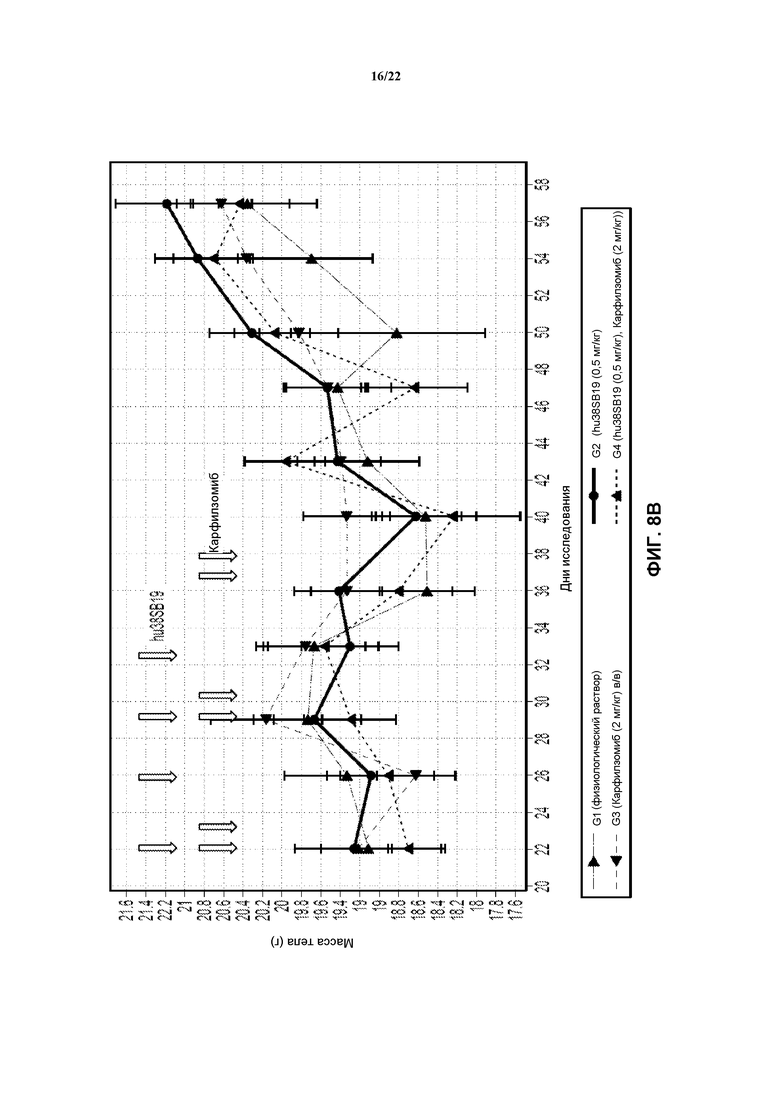
На фиг. 8А показан объем опухолей в моделях Н929 после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (верхние стрелки) и указанной дозы карфилзомиба в указанные моменты времени (нижние стрелки).
На фиг. 8В показана масса тела в моделях Н929 после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (верхние стрелки) и указанной дозы карфилзомиба в указанные моменты времени (нижние стрелки).
На фиг. 9А представлен график, показывающий средние сырые веса опухолей в моделях Н929 после указанного лечения карфилзомибом и/или hu38SB19 (mAb).
На фиг. 9В представлен график, показывающий медианные сырые веса опухолей в моделях Н929 после указанного лечения карфилзомибом и/или hu38SB19 (mAb).
На фиг. 10А показан объем опухолей в моделях RPMI-8226 после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (верхние стрелки) и указанной дозы карфилзомиба в указанные моменты времени (нижние стрелки).
На фиг. 10В показана масса тела в моделях RPMI-8226 после лечения с использованием указанной дозы hu38SB19 в указанные моменты времени (верхние стрелки) и указанной дозы карфилзомиба в указанные моменты времени (нижние стрелки).
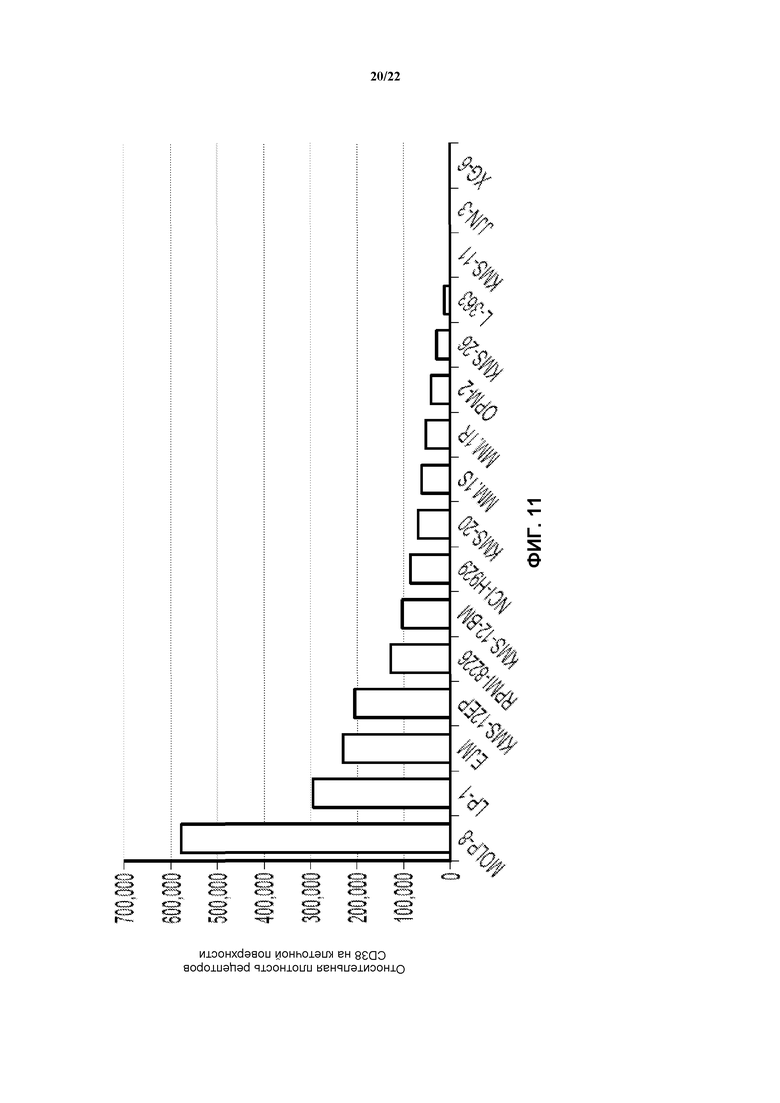
На фиг. 11 представлен график, показывающий плотность CD38 на клеточной поверхности в клеточных линиях множественной миеломы.
На фиг. 12 представлен график, показывающий, что hu38SB19, в качестве единственного активного ингредиентов, обеспечивает дозозависимые противоопухолевые эффекты и устранение роста имплантированной в задне-боковую область опухоли NCI-H929. Четыре суммарные дозы, введенные два раза в неделю в количестве 5 мг/кг, были достаточны для ликвидации пальпируемых опухолей у всех мышей в группе.
На фиг. 13 представлен график, показывающий, что низкие дозы комбинаций карфилзомиба и hu38SB19 приводят к почти полному ингибированию опухолевого роста ксенотрансплантатов NCI-H929.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения злокачественного новообразования у субъекта, который включает введение субъекту одного или более антител к CD38 и одного или более соединений карфилзомиба. В некоторых вариантах осуществления настоящего изобретения злокачественное новообразование представляет собой гематологическое злокачественное новообразование. В некоторых вариантах осуществления настоящего изобретения злокачественное новообразование представляет собой множественную миелому. В некоторых вариантах осуществления настоящего изобретения злокачественное новообразование представляет собой рецидивирующую множественную миелому или рефрактерную множественную миелому. В некоторых вариантах осуществления настоящего изобретения одно или более соединений карфилзомиба представляют собой карфилзомиб. В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 вводят в эффективном количестве, предпочтительно, в синергическом количестве. В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 и/или одно или более соединений карфилзомиба вводят в терапевтически эффективном количестве. В некоторых вариантах осуществления настоящего изобретения по меньшей мере одно или более антител к CD38 способны убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) или комплемент-зависимую цитотоксичность (CDC). В некоторых вариантах осуществления настоящего изобретения антитело представляет собой hu38SB19. В некоторых вариантах осуществления настоящего изобретения по меньшей мере одно или более антител к CD38 включают одну или более определяющих комплементарность областей с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 13, 14, 81, 15, 16, 17, 18, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 и 36. В некоторых вариантах осуществления настоящего изобретения по меньшей мере одно или более антител к CD38 выбраны из группы, состоящей из: а) антитела, содержащего тяжелую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 13, 15 и одной из SEQ ID NO: 14 или SEQ ID NO: 81, и легкую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 16, 17 и 18; b) антитела, содержащего тяжелую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 25, 26 и 27, и легкую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 28, 29 и 30; с) антитела, содержащего тяжелую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 1, 2 и 3, и легкую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 4, 5 и 6; d) антитела, содержащего тяжелую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 7, 8 и 9, и легкую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 10, 11 и 12; е) антитела, содержащего тяжелую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 19, 20 и 21, и легкую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 22, 23 и 24; и f) антитела, содержащего тяжелую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 31, 32 и 33, и легкую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, состоящими из SEQ ID NO: 34, 35 и 36. В некоторых вариантах осуществления настоящего изобретения антитело содержит тяжелую цепь с вариабельной областью VH, представленной SEQ ID NO: 66, и легкую цепь с вариабельной областью VL, представленной SEQ ID NO: 62 или SEQ ID NO: 64. В некоторых вариантах осуществления настоящего изобретения антитело содержит тяжелую цепь с вариабельной областью VH, представленной SEQ ID NO: 72, и легкую цепь с вариабельной областью VL, представленной SEQ ID NO: 68 или SEQ ID NO: 70. В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения одно или более соединений карфилзомиба вводят перорально. В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 и одно или более соединений карфилзомиба вводят последовательно. В некоторых вариантах осуществления настоящего изобретения способ дополнительно включает введение субъекту соединения дексаметазона, предпочтительно, дексаметазона. В некоторых вариантах осуществления настоящего изобретения соединение дексаметазона вводят перорально. В некоторых вариантах осуществления настоящего изобретения соединение дексаметазона вводят в низкой дозе. В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38, одно или более соединений карфилзомиба и соединение дексаметазона вводят последовательно. В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 и одно или более соединений карфилзомиба вводят последовательно.
В некоторых вариантах осуществления настоящее изобретение относится к композиции, содержащей: а) по меньшей мере одно антитело к CD38, предпочтительно, антитело, способное убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC); и b) по меньшей мере одно соединение карфилзомиба, предпочтительно, карфилзомиб; и, необязательно, соединение дексаметазона, предпочтительно, дексаметазон. В некоторых вариантах осуществления настоящее изобретение относится к композиции, содержащей: а) по меньшей мере одно антитело к CD38; и b) по меньшей мере одно соединение карфилзомиба; и, необязательно, соединение дексаметазона. В некоторых вариантах осуществления настоящего изобретения антитело способно убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC). В некоторых вариантах осуществления настоящего изобретения антитело представляет собой hu38SB19. В некоторых вариантах осуществления настоящего изобретения соединение карфилзомиба представляет собой карфилзомиб. В некоторых вариантах осуществления настоящего изобретения соединение дексаметазона представляет собой дексаметазон.
В некоторых вариантах осуществления настоящее изобретение относится к набору, содержащему: а) первую композицию, которая содержит по меньшей мере одно антитело к CD38, предпочтительно, антитело, способное убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC); и b) вторую композицию, которая содержит по меньшей мере одно соединение карфилзомиба, предпочтительно, карфилзомиб. В некоторых вариантах осуществления настоящего изобретения композиции в наборе упакованы для последовательного введения субъекту. В некоторых вариантах осуществления настоящего изобретения антитело представляет собой hu38SB19. В некоторых вариантах осуществления настоящего изобретения набор дополнительно содержит соединение дексаметазона, предпочтительно, дексаметазон. В некоторых вариантах осуществления настоящего изобретения соединение карфилзомиба и соединение дексаметазона упакованы для последовательного введения субъекту.
В некоторых вариантах осуществления настоящее изобретение относится к набору, содержащему по меньшей мере одно антитело к CD38, способное убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC), упакованные вместе с этикеткой, содержащей одно или более сообщений о том, что по меньшей мере одно антитело к CD38 должно вводиться в комбинации с карфилзомибом и, необязательно, с дексаметазоном. В некоторых вариантах осуществления настоящего изобретения антитело представляет собой hu38SB19. В некоторых вариантах осуществления настоящего изобретения набор дополнительно содержит соединение дексаметазона, предпочтительно, дексаметазон. В некоторых вариантах осуществления настоящего изобретения соединение карфилзомиба и соединение дексаметазона упакованы для последовательного введения субъекту.
В некоторых вариантах осуществления настоящее изобретение относится к комбинации: (i) по меньшей мере одного антитела к CD38, предпочтительно, антитела, способного убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC); и (ii) по меньшей мере одного соединения карфилзомиба, предпочтительно, карфилзомиба; и, необязательно, (iii) соединения дексаметазона, предпочтительно, дексаметазона. В некоторых вариантах осуществления настоящее изобретение относится к комбинации, включающей: а) по меньшей мере одно антитело к CD38; и b) по меньшей мере одно соединение карфилзомиба; и, необязательно, i) соединение дексаметазона. В некоторых вариантах осуществления настоящего изобретения антитело способно убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC). В некоторых вариантах осуществления настоящего изобретения антитело представляет собой hu38SB19. В некоторых вариантах осуществления настоящего изобретения соединение карфилзомиба представляет собой карфилзомиб. В некоторых вариантах осуществления настоящего изобретения соединение дексаметазона представляет собой дексаметазон. В некоторых вариантах осуществления настоящего изобретения комбинация предназначается для последовательного применения для лечения гематологического злокачественного заболевания, предпочтительно, множественной миеломы.
В некоторых вариантах осуществления настоящее изобретение относится к применению: (i) по меньшей мере одного антитела к CD38, предпочтительно, антитела, способного убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC); и (ii) по меньшей мере одного соединения карфилзомиба, предпочтительно, карфилзомиба; и, необязательно, (iii) соединения дексаметазона, предпочтительно, дексаметазона, для лечения гематологического злокачественного заболевания, предпочтительно, множественной миеломы. В некоторых вариантах осуществления настоящее изобретение относится к применению: а) по меньшей мере одного антитела к CD38; и b) по меньшей мере одного соединения карфилзомиба; и, необязательно, i) соединения дексаметазона для лечения гематологического злокачественного заболевания, предпочтительно, множественной миеломы. В некоторых вариантах осуществления настоящего изобретения антитело способно убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC). В некоторых вариантах осуществления настоящего изобретения антитело представляет собой hu38SB19. В некоторых вариантах осуществления настоящего изобретения соединение карфилзомиба представляет собой карфилзомиб. В некоторых вариантах осуществления настоящего изобретения соединение дексаметазона представляет собой дексаметазон.
В некоторых из различных вариантов осуществления настоящего изобретения субъект, подвергаемый лечению, представляет собой млекопитающее. В некоторых из различных вариантов осуществления настоящего изобретения субъект, подвергаемый лечению, представляет собой экспериментальное животное, такое как мышь. В некоторых из различных вариантов осуществления настоящего изобретения субъект, подвергаемый лечению, представляет собой человека.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам лечения злокачественного новообразования у субъекта, которые включают введение субъекту одного или более антител к CD38 и одного или более соединений карфилзомиба. Используемый в настоящем документе термин «лечить» или «лечение» означает облегчения симптомов, устранение этиологии симптомов на временной или на постоянной основе или предотвращение или замедление появления симптомов указанного расстройства или состояния. Как описано в настоящем документе, эффективность карфилзомиба значительно улучшается при введении совместно с одним или более антител к CD38 по настоящему изобретению. Фактически, введение одного или более антител к CD38, которые демонстрируют способность (а) убивать клетку CD38+ через апоптоз, (b) антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и (c) комплемент-зависимую цитотоксичность (CDC), как полагают, значительно улучшает эффективность соединений карфилзомиба для лечения гематологических злокачественных новообразований, включая ММ, до степени, которая неожиданно превышает таковую для других антител к CD38, которые не демонстрируют все три (а)-(с) активности. Таким образом, в некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 способны (а) убивать клетку CD38+ через апоптоз, (b) антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и (c) комплемент-зависимую цитотоксичность (CDC). В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 и/или одно или более соединений карфилзомиба вводят в терапевтически эффективном количестве. Используемый в настоящем документе термин «терапевтически эффективное количество» относится к количеству того вещества, которое приводит к облегчению симптомов, устранению этиологии симптомов на временной или на постоянной основе и/или предотвращению или уменьшению проявления симптомов указанного расстройства или состояния у большинства субъектов, страдающих или проходящих сходное лечение в связи с указанным расстройством или состоянием.
В некоторых вариантах осуществления настоящего изобретения злокачественное новообразование представляет собой злокачественное новообразование, при котором злокачественными клетками экспрессируется CD38. В некоторых вариантах осуществления настоящего изобретения рак представляет собой гематологическое злокачественное новообразование крови, костного мозга и/или лимфатических узлов. В некоторых вариантах осуществления настоящего изобретения злокачественное новообразование представляет собой рак крови. Раки крови включают миелому, лимфому и лейкоз. Рак крови может быть, например, выбран из группы, состоящей из множественной миеломы, неходжкинской лимфомы, лимфомы Ходжкина, лейкоза ворсистых клеток, хронического лимфолейкоза, острого миелолейкоза и острого лимфолейкоза. В некоторых вариантах осуществления настоящего изобретения злокачественное новообразование представляет собой множественную миелому (ММ). В некоторых вариантах осуществления настоящего изобретения злокачественное новообразование представляет собой рецидивирующую ММ или рефрактерную ММ. Используемый в настоящем документе термин «рецидивирующая ММ» относится к клинически активной ММ после периода ремиссии, а «рефрактерная ММ» относится к прогрессирующему или стабильному заболеванию при наличии лечения или к прогрессирующему заболеванию через 3 месяца после предыдущего лечения. См. Dimopoulos et al. (2010) Eur. J. Haemotology 88: 1-15.
В некоторых вариантах осуществления настоящего изобретения субъектом является млекопитающее, предпочтительно, человек. В некоторых вариантах осуществления настоящего изобретения субъектом является взрослый человек, например, в возрасте по меньшей мере 18 лет. В некоторых вариантах осуществления настоящего изобретения субъект нуждается в лечении злокачественного новообразования. В некоторых вариантах осуществления настоящего изобретения у субъекта было диагностировано злокачественное новообразование. В некоторых вариантах осуществления настоящего изобретения злокачественное новообразование находится в состоянии частичной или полной ремиссии, однако, одно или более соединений карфилзомиба и одно или более антител к CD38 вводят субъекту, чтобы уменьшить вероятность рецидива. В некоторых вариантах осуществления настоящего изобретения субъект имеет общее состояние по шкале Карновского, равное или превышающее 60%. Шкала Карновского варьируется от 100 до 0, где 100 обозначает «идеальное» здоровье, а 0 - смерть (Karnofsky and Burchenal, 1949, “The Clinical Evaluation of Chemotherapeutic Agents in Cancer». В публикации: MacLeod CM (Ed.), Evaluation of Chemotherapeutic Agents. Columbia Univ. Press). В некоторых вариантах осуществления настоящего изобретения субъект ранее подвергался по меньшей мере одной или двум предшествующим терапиям множественной миеломы; при этом индукционная терапия считается одной предшествующей терапией. В некоторых вариантах осуществления настоящего изобретения у субъекта проявляются признаки того, что злокачественное новообразование у него прогрессировало во время прохождения субъектом предшествующей терапии, или что субъект был рефрактерным к предшествующей терапии.
В некоторых вариантах осуществления настоящего изобретения антитела к CD38 специфически связываются с CD38. В некоторых вариантах осуществления настоящего изобретения антитела к CD38 вырабатываются против CD38 или его эпитопа. В некоторых вариантах осуществления настоящего изобретения антитела к CD38 представляют собой моноклональные антитела. В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 по настоящему изобретению представляют собой моноклональные антитела, как описано в WO 2008/047242, которая целиком включена в настоящий документ в качестве ссылки. В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 представляют собой моноклональные антитела 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 и 38SB39, как описано в WO 2008/047242, которая целиком включена в настоящий документ в качестве ссылки. В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 способны убивать клетки CD38+ посредством трех различных цитотоксических механизмов, индукции апоптоза, антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC) и комплемент-зависимой цитотоксичности (CDC).
Термин «антитело» используется здесь в широчайшем смысле и включает моноклональные антитела (включая полноразмерные моноклональные антитела) любого изотипа, такие как IgG, IgM, IgA, IgD и IgE, поликлональные антитела, мульспецифические антитела, химерные антитела и фрагменты антител. Используемый здесь предлог «к» в сочетании с антигеном указывает на то, что данное антитело является реакционноспособным в отношении указанного антигена. Антитело, реакционноспособное в отношении специфического антигена, может вырабатываться синтетическими и/или рекомбинантными способами, такими как селекция библиотек рекомбинантных антител с использованием фага или сходных векторов или иммунизация животного антигеном или кодирующей антиген нуклеиновой кислотой.
Типичное IgG антитело состоит из двух идентичных тяжелых цепей и двух идентичных легких цепей, которые соединены дисульфидными связями. Каждая тяжелая и легкая цепь содержит константную область и вариабельную область. Каждая вариабельная область содержит три сегмента, называемые «областями, определяющими комплементарность» («CDR»), или «гипервариабельными областями», которые, главным образом, ответственны за связывание эпитопа антигена. Их обычно обозначают как CDR1, CDR2 и CDR3, пронумерованные последовательно, начиная от N-конца. Наиболее консервативные части вариабельных областей вне CDR называются «каркасными участками». Используемый здесь «VH» или «VH» относится к вариабельной области тяжелой цепи иммуноглобулина, включая тяжелую цепь фрагмента Fv, scFv, dsFv, Fab, Fab' или F(ab')2. Ссылка на «VL» или «VL» относится к вариабельной области легкой цепи иммуноглобулина, включая тяжелую цепь фрагмента Fv, scFv, dsFv, Fab, Fab' или F(ab')2.
Антитела по настоящему изобретению могут быть, например, мышиными, химерными и/или гуманизированными антителами. Используемый здесь термин «химерное антитело» означает антитело, в котором константная область или ее часть изменена, замещена или заменена таким образом, что вариабельная область связана с константной областью другого вида животного или принадлежит к другому классу или подклассу антител. «Химерное антитело» также относится к антителу, в котором константная область или ее часть изменена, замещена или заменена таким образом, что вариабельная область связана с константной областью другого вида животного или принадлежит к другому классу или подклассу антител. Способы получения химерных антител известны специалистам. См., например, Morrison, 1985, Science, 229: 1202; Qi et al., 1986, BioTechniques, 4: 214; Gillies et al., 1989, J. Immunol. Methods, 125: 191-202; патенты США №№ 5807715, 4816567 и 4816397, которые целиком включены в настоящий документ в качестве ссылок. Термин «гуманизированное антитело», используемый здесь, относится к химерному антителу, которое содержит минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Целью гуманизации является уменьшение иммуногенности ксеногенного антитела, такого как мышиное антитело, при введении человеку, с полным сохранением антигенсвязывающей аффинности и специфичности антитела. Гуманизированные антитела или антитела, адаптированные таким образом, чтобы они не отторгались другими млекопитающими, можно получить с использованием нескольких методик, таких как изменение поверхности антител и трансплантация CDR. В используемой здесь технологии изменения поверхности антител используется комбинация молекулярного моделирования, статистического анализа и мутагенеза для изменения поверхностей вариабельных областей антитела, отличных от CDR, чтобы они напоминали поверхности известных антител хозяина-мишени. Технология трансплантации CDR включает замену областей, определяющих комплементарность, например, мышиного антитела, на человеческий каркасный домен, например, см. WO 92/22653. Гуманизированные химерные антитела, предпочтительно, имеют константные области и вариабельные области, отличающиеся от областей, определяющих комплементарность (CDR), полученных, в основном или исключительно, из соответствующих областей человеческого антитела, и CDR, полученные, в основном или исключительно, от млекопитающего, не являющегося человеком.
Стратегии и способы изменения поверхности антител и другие способы уменьшения иммуногенности антител для другого хозяина описаны в патенте США № 5639641, который целиком включен в настоящий документ в качестве ссылки. Антитела можно гуманизировать с использованием ряда методик, включая трансплантацию CDR (EP 0239400; WO 91/09967; патенты США №№ 5530101 и 5585089), венирование или изменение поверхности (EP 0592106; EP 0519596; Padlan E.A., 1991, Molecular Immunology 28(4/5): 489-498; Studnicka G.M. et al., 1994, Protein Engineering, 7(6): 805-814; Roguska M.A. et al., 1994, PNAS, 91: 969-973), перестановку цепей (патент США № 5565332) и идентификацию гибких остатков (PCT/US2008/074381). Человеческие антитела можно получать рядом способов, известных специалистам, включая методы фагового дисплея. См. также патенты США №№ 4444887, 4716111, 5545806 и 5814318 и публикации международных патентных заявок №№ WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741 (указанные источники целиком включены в качестве ссылок).
В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 способны убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC). В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 по настоящему изобретению способны убивать указанные клетки CD38+ через апоптоз даже в отсутствии клеток стромы или цитокинов, полученных из стромы. Указанную активность можно оценивать, как описано в WO 2008/047242, которая целиком включена в настоящий документ в качестве ссылки.
В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 выбраны из группы, состоящей из 38SB13, 38SB18, 38SB19, 38SB30, 38SB31, 38SB39 и антител, перекрестно конкурирующих с 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 или 38SB39. Гибридомные клеточные линии 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 и 38SB39, продуцирующие мышиные антитела к CD38, депонированы в Американской коллекции типовых культур (10801 University Bld, Manassas, VA, 20110-2209, USA) c 21 июня 2006 г. под номерами доступа РТА-7667, РТА-7669, РТА-7670, РТА-7666, РТА-7668 и РТА-7671, соответственно (как описано в WO 2008/047242, которая целиком включена в настоящий документ в качестве ссылки).
Как здесь описано, ссылки на SEQ ID NO относятся к последовательностям, описанным в списке последовательностей, представленном в настоящем документе, а также упомянутых в WO 2008/04722, целиком включенной в настоящий документ в качестве ссылки. В некоторых вариантах осуществления настоящего изобретения антитела к CD38 по настоящему изобретению могут, например, содержать тяжелую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, представленными SEQ ID NO: 1, 2 и 3, и легкую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, представленные SEQ ID NO: 4, 5 и 6. Примером указанного антитела является антитело 38SB13, которое содержит тяжелую цепь с вариабельной областью VH, представленной SEQ ID NO: 50, и легкую цепь с вариабельной областью VL, представленной SEQ ID NO: 38.
В некоторых вариантах осуществления настоящего изобретения антитела к CD38 по настоящему изобретению могут, например, содержать тяжелую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, представленными SEQ ID NO: 7, 8 и 9, и легкую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, представленными SEQ ID NO: 10, 11 и 12. Примером указанного антитела является антитело 38SB18, которое содержит тяжелую цепь с вариабельной областью VH, представленной SEQ ID NO: 52, и легкую цепь с вариабельной областью VL, представленной SEQ ID NO: 40.
В некоторых вариантах осуществления настоящего изобретения антитела к CD38 по настоящему изобретению могут, например, содержать тяжелую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, представленными SEQ ID NO: 13, SEQ ID NO: 15 и одной из SEQ ID NO: 14 или SEQ ID NO: 81, и легкую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, представленными SEQ ID NO: 16, 17 и 18. Примером указанного антитела является антитело 38SB19, которое содержит тяжелую цепь с вариабельной областью VH, представленной SEQ ID NO: 54, и легкую цепь с вариабельной областью VL, представленной SEQ ID NO: 42. Конкретные примеры гуманизированных версий 38SB19 (hu38SB19) включают антитела, содержащие тяжелую цепь с вариабельной областью VH, представленной SEQ ID NO: 66, и легкую цепь с вариабельной областью VL, представленной SEQ ID NO: 62 или SEQ ID NO: 64. hu38SB19 представляет собой гуманизированное антитело к CD38, которое в настоящее время проходит клинические испытания в отношении CD38-положительных гематологических злокачественных новообразований, включая множественную миелому. Ранее проводившиеся и текущие исследования показывают, что в антимиеломной активности, связанной с указанным агентом, участвуют механизмы ADCC и CDC, а также новая, прямая апоптотическая и анти-АДФ-рибозилциклазная активность. См. Marie-Cécile Wetzel, Céline Nicolazzi, François Valée et al. hu38SB19: characterization of potent phase I humanized anti-CD38 antibody for the treatment of multiple myeloma and other hematologic malignancies. AACR Annual Meeting 2013, Abstract # 4735.
В некоторых вариантах осуществления настоящего изобретения антитела к CD38 по настоящему изобретению могут, например, содержать тяжелую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, представленными SEQ ID NO: 19, 20 и 21, и легкую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, представленными SEQ ID NO: 22, 23 и 24. Примером указанного антитела является антитело 38SB30, которое содержит тяжелую цепь с вариабельной областью VH, представленной SEQ ID NO: 56, и легкую цепь с вариабельной областью VL, представленной SEQ ID NO: 44.
В некоторых вариантах осуществления настоящего изобретения антитела к CD38 по настоящему изобретению могут, например, содержать тяжелую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, представленными SEQ ID NO: 25, 26 и 27, и легкую цепь, которая включает три последовательные CDR с аминокислотными последовательностями, представленными SEQ ID NO: 28, 29 и 30. Примером указанного антитела является антитело 38SB31, которое содержит тяжелую цепь с вариабельной областью VH, представленной SEQ ID NO: 58, и легкую цепь с вариабельной областью VL, представленной SEQ ID NO: 46. Конкретные примеры гуманизированных версий 38SB31 (hu38SB31) включают антитела, содержащие тяжелую цепь с вариабельной областью VH, представленной SEQ ID NO: 72, и легкую цепь с вариабельной областью VL, представленной SEQ ID NO: 68 или SEQ ID NO: 70.
В некоторых вариантах осуществления настоящего изобретения антитела к CD38 по настоящему изобретению могут, например, содержать тяжелую цепь, которая включает три последовательные CDR, имеющие аминокислотные последовательности, представленные SEQ ID NO: 31, 32 и 33, и легкую цепь, включающую три последовательные CDR, имеющие аминокислотные последовательности, представленные SEQ ID NO: 34, 35 и 35. Примером указанного антитела является антитело 38SB39, которое включает тяжелую цепь, имеющую вариабельную область VH, представленную SEQ ID NO: 60, и легкую цепь, имеющую вариабельную область VL, представленные SEQ ID NO: 48.
В некоторых вариантах осуществления настоящего изобретения антитела к CD38 по настоящему изобретению представляет собой гуманизированные антитела, состоящие из двух идентичных тяжелых цепей и двух идентичных легких цепей, в которых каждая цепь состоит из одной константной области и одной вариабельной области.
Используемый здесь термин «соединение карфилзомиба» относится к карфилзомибу (S)-4-метил-N-((S)-1-(((S)-4-метил-1-((R)-2-метилоксиран-2-ил)-1-оксопентан-2-ил)амино)-1-оксо-3-фенилпропан-2-ил)-2-((S)-2-(2-морфолиноацетамидо)-4-фенилбутанамидо)пентанамиду и производным карфилзомиба. Используемый здесь термин «производные карфилзомиба» относится к соединениям, которые имеют 2-ацетамидо-N-(1-((1-(1-метилциклопропил)-1-оксопропан-2-ил)-1-оксопропан-2-ил)пропанмамид, т.е.,

который может быть замещенным или незамещенным, как часть его структурной формулы. В некоторых вариантах осуществления настоящего изобретения производные карфилзомиба включают соединения, которые имеют следующую структуру, которая может быть замещенной или незамещенной, как часть ее структурного скелета:

где Х выбран из О, NH и N-C1-6алкила, предпочтительно, О. Примеры «производных карфилзомиба» по настоящему изобретению включают производные, перечисленные в патентах США №№ 7232818, 7417042, 7491704, 7737112, 8129346, 8207125, 8207126, 8207127 и 8207297.
В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 вводят в эффективном количестве. В настоящем документе эффективное количество одного или более антител к CD38 представляет собой количество, которое обеспечивает аддитивный или синергический эффект с одним или более соединений карфилзомиба. Используемый здесь термин «синергическое количество» означает количество, обеспечивающее синергический эффект. Используемый здесь термин «синергический эффект» относится к эффекту комбинации одного или более антител к CD38 и одного или более соединений карфилзомиба, который превышает их ожидаемый аддитивный эффект. В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 вводят до, во время и/или после введения одного или более соединений карфилзомиба. В некоторых вариантах осуществления настоящего изобретения одно или более антител к CD38 и одно или более соединений карфилзомиба вводят совместно в форме единой композиции, например, в виде смеси.
Таким образом, в некоторых вариантах осуществления настоящее изобретение относится к композициям, включающим смесь по меньшей мере одного антитела к CD38 и по меньшей мере одного соединения карфилзомиба. В некоторых вариантах осуществления настоящего изобретения смесь включает по меньшей мере одно антитело к CD38 в количестве, которое обеспечивает аддитивный или синергический эффект с по меньшей мере одним соединением карфилзомиба у субъекта после введения обоих агентов. В некоторых вариантах осуществления настоящего изобретения по меньшей мере одно антитело к CD38 в смеси представляет собой антитело, которое способно убивать клетку CD38+ посредством апоптоза, антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC) и комплемент-зависимой цитотоксичности (CDC), и по меньшей мере одно соединение карфилзомиба.
Для целей настоящего изобретения способы и композиции по настоящему изобретению не ограничиваются исключительно теми, которые были получены путем физической ассоциации антител к CD38 и соединения карфилзомиба, но также теми, которые позволяют производить раздельное введение, которое может быть одновременным или разделяться некоторым периодом времени. Таким образом, настоящее изобретение относится к первой композиции, включающей одно или более антител к CD38, и второй композиции, включающей одно или более соединений карфилзомиба. В некоторых вариантах осуществления настоящего изобретения по меньшей мере одно антитело к CD38 представляет собой антитело, которое способно убивать клетку CD38+ посредством апоптоза, антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC) и комплемент-зависимой цитотоксичности (CDC), и по меньшей мере одно соединение карфилзомиба. В некоторых вариантах осуществления настоящего изобретения количество одного или более антител к CD38, содержащееся в первой композиции, представляет собой количество, которое обеспечивает аддитивный или синергический эффект с по меньшей мере одним соединением карфилзомиба во второй композиции у субъекта после введения обоих агентов.
В некоторых вариантах осуществления настоящего изобретения первая и вторая композиции могут быть упакованы в набор. Таким образом, настоящее изобретение относится к наборам, которые содержат первую композицию, включающую одно или более антител к CD38, и вторую композицию, включающую одно или более соединений карфилзомиба. В некоторых вариантах осуществления настоящего изобретения первую и вторую композиции можно смешивать перед введением субъекту. В некоторых вариантах осуществления настоящего изобретения первую и вторую композиции можно вводить одновременно или последовательно (т.е., разделенными некоторым периодом времени) таким образом, чтобы получить максимальную эффективность, аддитивность, синергию или их комбинацию. В некоторых вариантах осуществления настоящее изобретение относится к наборам, включающим по меньшей мере одно антитело к CD38, упакованное с этикеткой, содержащей одно или более сообщений о том, что антитело к CD38 должно или может быть введено в комбинации с карфилзомибом и, необязательно, с дексаметазоном. Наборы по настоящему изобретению могут дополнительно включать одно или более сообщений о том, что антитело должно или может вводиться субъекту, страдающему раком крови, таким как множественная миелома (например, рецидивирующая или рефрактерная множественная миелома). В одном варианте осуществления настоящего изобретения одно или более антител к CD38 в наборах по настоящему изобретению представляют собой антитела, которые способны убивать клетку CD38+ посредством апоптоза, антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC) и комплемент-зависимой цитотоксичности (CDC).
В некоторых вариантах осуществления композиции по настоящему изобретению представляют собой фармацевтические композиции. Используемый в настоящем документе термин «фармацевтическая композиция» относится к композиции, включающей по меньшей мере один активный агент (например, антитело к CD38 или соединение карфилзомиба) и по меньшей мере один фармацевтически приемлемый носитель. Фармацевтически приемлемые носители хорошо известны специалистам и обычно зависят от выбранного пути введения. Фармацевтические композиции по настоящему изобретению могут производиться в любой форме или составе, которые являются удобными для выбранного пути введения, такие как, например, раствор в случае внутривенного пути введения, например, капсулы, пилюли или таблетки в случае перорального пути введения и т.п.
Схему введения активных агентов и фармацевтической композиции, описанных в настоящем документе, могут выбирать лечащие врачи, основываясь на своих знаниях, включая информацию, опубликованную руководящими органами. Например, карфилзомиб обычно вводят внутривенно. Согласно управлению по контролю за продуктами питания и лекарственными средствами США (FDA), карфилзомиб можно вводить внутривенно, например, в течение 2-10 минут, в течение двух дней подряд еженедельно, в течение трех недель (дни 1, 2, 8, 9, 15 и 16), с последующим 12-дневным периодом отдыха (дни с 17 по 28). В некоторых вариантах осуществления настоящего изобретения рекомендованная доза для цикла 1 составляет 20 мг/м2 в день, и, если переносятся, дозы для цикла 2 и последующих циклов увеличиваются до 27 мг/м2 в день. В некоторых вариантах осуществления настоящего изобретения пациентов гидратируют до и/или после введения. Поскольку, однако, совместное введение одного или более антител к CD38 и одного или более соединений карфилзомиба обеспечивает аддитивный или синергический эффект, дозирование соединения карфилзомиба можно корригировать соответственно, например, изменять дозу и/или модифицировать схему введения. Разумеется, лечащие врачи должны продумывать, какую дозу и схему использовать, в зависимости от состояния и статуса заболевания пациента и на основании клинических и лабораторных данных.
Поскольку FDA рекомендует премедикацию дексаметазоном перед введением всех доз цикла 1, во время первого цикла увеличения доз и если симптомы реакции на инфузию возникают или вновь появляются, способы и композиции по настоящему изобретению могут дополнительно включать дексаметазон, который представляет собой член глюкокортикоидного класса стероидных лекарственных средств и действует как противовоспалительный агент и иммунодепрессант. Таким образом, в некоторых вариантах осуществления, способы лечения по настоящему изобретению дополнительно включают введение соединения дексаметазона субъекту, который подвергается лечению одним или более антителами к CD38 и одним или более соединениями карфилзомиба. Подобным образом, композиции и наборы по настоящему изобретению, которые включают одно или более антител к CD38 и/или одно или более соединений карфилзомиба, могут дополнительно включать соединение дексаметазона. Используемый в настоящем документе термин «соединение дексаметазона» относится к дексаметазону ((8S,9R,10S,11S,13S,14S,16R,17R)-9-фтор-11,17-дигидрокси-17-(2-гидроксиацетил)-10,13,16-триметил-6,7,8,9,10,11,12,13,14,15,16,17-додекагидро-3Н-циклопента[a]фенантрен-3-ону) и производным дексаметазона. Используемый в настоящем документе термин «производное дексаметазона» относится к соединению, имеющему следующую структурную формулу:
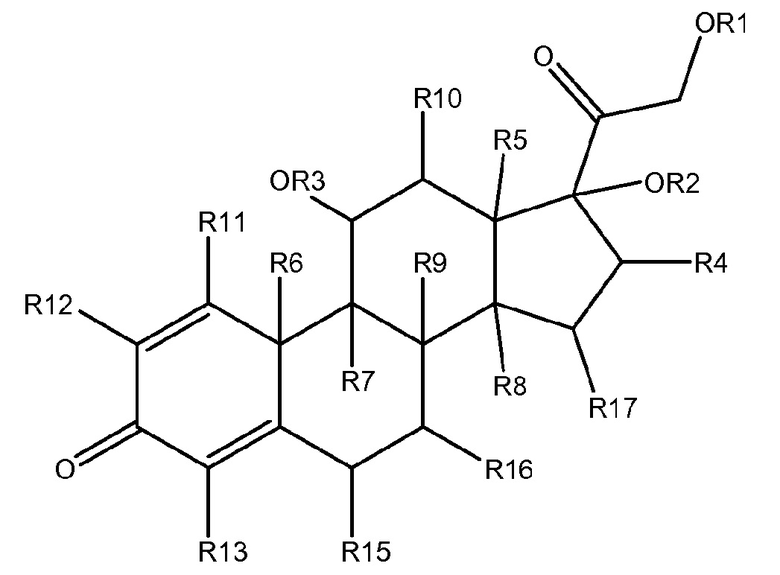
где R1-R17 каждый независимо представляет собой Н, галоген, алкил, алкокси, амино или алкиламин. В некоторых предпочтительных вариантах осуществления настоящего изобретения R1-R3 представляют собой Н. В некоторых предпочтительных вариантах осуществления настоящего изобретения R4-R6 представляют собой метил. В некоторых предпочтительных вариантах осуществления настоящего изобретения R7 представляет собой галоген, предпочтительно, фтор. В некоторых предпочтительных вариантах осуществления настоящего изобретения R8 представляет собой Н. В некоторых предпочтительных вариантах осуществления настоящего изобретения R1-R3 представляют собой Н, R4-R6 представляют собой метил, R7 представляет собой галоген, предпочтительно, фтор, а R8 представляет собой Н.
В некоторых вариантах осуществления настоящего изобретения соединение дексаметазона можно вводить перорально. В некоторых вариантах осуществления настоящего изобретения соединение дексаметазона можно вводить в той же или более низкой дозе, чем доза, рекомендованная ЕМА для дексаметазона.
Композиции по настоящему изобретению можно использовать в качестве лекарственного средства и/или для применения в производстве лекарственного средства. В некоторых вариантах осуществления композиции по настоящему изобретению можно использовать в качестве лекарственного средства и/или для применения в производстве лекарственного средства для использования для лечения рака, такого как гематологическое злокачественное заболевание крови, костного мозга и/или лимфатических узлов, предпочтительно, рака крови.
В тексте настоящего описания процитировано несколько документов. Все указанные документы (включая любую журнальную статью или резюме, опубликованную или неопубликованную патентную заявку, выданный патент, описания производителя, инструкции и т.п.) включены в настоящий документ в качестве ссылок. Однако, не имеет место допущение, что любой процитированный документ является прототипом в том, что касается настоящего изобретения.
Следующие примеры предназначены для иллюстрации, но не для ограничения изобретения.
ПРИМЕРЫ
hu38SB19 поставляли в виде раствора 5 мг/мл и хранили при 4°С. Его разбавляли стерильным физиологическим раствором, с получением препарата для введения, хранили при 4°С и использовали в течение 10 дней после разбавления.
Карфилзомиб (PR-171) получали от Chemie Tek (CT-CARF 98). Карфилзомиб изготавливали в водном растворе 10% (масс./об.) сульфобутилэфир-h-циклодекстрина (Cydex) и 10 ммоль/л цитрата натрия (рН 3,5); 2 мг/мл маточный раствор изготавливали и замораживали при -80°С, разбавляли ежедневно носителем перед инъекцией. Карфилзомиб вводили еженедельно qdx2 × 3 нед. (в/в).
Пример 1: Эффект введения антитела к CD38 и карфилзомиба на мышиной модели ММ
Указанные исследования, описанные в данном примере, осуществлялись с одобрения UCSF IACUC.
Мышиные модели с подкожными ксенотрансплантатами множественной миеломы (ММ) устанавливали с использованием клеточных линий NCI-H929 или RPMI-8226. Конкретно, 5-6-недельных самок мышей Balb/c Scid получали из Jackson Lab. Передержка мышей до имплантации составляла 7-10 дней. Мышей содержали в специальной комнате в здании UCSF Mt Zion Animal Barrier Facility. Клетки NCI-H929 и RPMI-8226 получали из коллекции микроорганизмов и клеточных культур Германии, DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkulturen) и выращивали в стерильной суспензионной культуре во флаконах Т225 следующим образом: RPMI1640 + 20% ФБС + 4 мМ L-глутамин + 1 мМ пируват натрия + 50 мкМ меркаптоэтанол. RPMI-8226: RPMI1640 + 10% ФБС + 4 мМ L-глутамин.
Ко времени имплантации мышам выбривали область правого бока и плеча и обезболивали и/п авертином. Клетки ММ, суспендированные в не содержащей сыворотки среде RPMI1640, разбавленной 1:1 с использованием Matrigel (BD), до концентрации 1×108 клеток/мл, инъецировали п/к в правый бок в объеме 100 мкл (1×107 клеток) с использованием 1 мл шприца и иглы 25 g. Мышей осматривали два раза в неделю на предмет появления опухолей, и, после того, как опухоли становились видимыми, два раза в неделю производили измерения массы тела и объема опухоли. Использовали электронные весы и толщиномеры, и данные собирали непосредственно в программу лечения (Study Director). Когда средний объем опухолей достигал приблизительно 150-200 мм3, мышей распределяли на группы лечения, по 8-10 мышей на группу, и начинали введение.
Схема введения была следующей: для hu38SB19 2х/нед. × 2 нед. (в/в, боковая хвостовая вена), а для карфилзомиба еженедельно qdx2 × 3 нед. (в/в, боковая хвостовая вена) (один раз в день, два дня в неделю в течение трех недель). Уровни доз для использования в исследованиях комбинаций были следующими:
Данные собирали с помощью электронных весов и толщиномеров, с использованием приложения по программе лечения, названное StudyLog (Study Director). Графики брали непосредственно из приложения. Результаты экспериментов представлены на фиг. 1А-10В.
По результатам изучения hu38SB19 и карфилзомиба в качестве единственных агентов на моделях ксенотрансплантатов множественной миеломы RPMI-8226 и NCI-H929, модель H929 оказалась более чувствительной к обоим агентам, в то время как модель RPMI, как представляется, является более резистентной к лечению даже при самых высоких изучавшихся дозах (фиг. 1А-7В). Таким образом, в исследований комбинаций субоптимальную дозу для каждого агента выбирали для оценки активности комбинированного лечения (карфилзомиб + hu38SB19) на модели H929, в то время как более высокую дозу карфилзомиба и hu38SB19 тестировали на модели RPMI.
Противоопухолевую активность определяли в соответствии со стандартами NCI на основе соотношения медианы изменения объема опухоли у леченных (Т) животных/ медианы изменения объема опухоли у контрольных (С) животных × 100 (%ΔТ/ΔС). Низкие численные величины для ΔТ/ΔС описывают более сильную противоопухолевую активность. Противоопухолевую активностью определяют как Т/С≤40% минимум. Т/С<10% считается высокой противоопухолевой активностью.
На модели Н929 hu38SB19 в отдельности в дозе 0,5 мг/кг на инъекцию (дважды в неделю в течение 2 недель) был неактивным, с %ΔТ/ΔС 74%. Лечение карфилзомибом в отдельности в дозе 2 мг/кг (дважды в неделю в течение трех недель) было неактивным (68% ΔТ/ΔС). Комбинация hu38SB19 (0,5 мг/кг на инъекцию) и карфилзомиба (2 мг/кг на инъекцию) обладала гораздо более высокой активностью (регрессия опухоли), с %ΔТ/ΔС -11% (фиг. 8). Результаты суммированы в таблице 1.
(общая доза)
в/в путь
(D69)
Как показано на фиг. 10А-10В, сходные результаты были получены на моделях ксенотрансплантатов RPMI-8226. В частности, на день 41, карфилзомиб (3 мг/кг qdx2 каждую неделю - 3 нед.) давал 0/10 случаев полной регрессии; hu38SB19 (3 мг/кг BIW × 2 нед.) давал 2/10 случаев полной регрессии. Таким образом, ожидаемая аддитивность на основе экстраполяции для комбинации карфилзомиба и hu38SB19, как ожидается, будет составлять 2/10 случаев полной регрессии. Однако, комбинация карфилзомиба и hu38SB19 неожиданно дала 5/8 случаев полной регрессии, что более чем в 3 раза превышает ожидавшийся результат.
Как в случае модели ксенотрансплантата NCI-H929, так и RPMI-8226, комбинированное лечение ингибировало опухолевый рост в гораздо более высокой степени, чем один агент в отдельности, что указывает на то, что комбинация hu38SB19 и карфилзомиба блокирует рост опухолевых клеток через потенциальные синергические механизмы. Карфилзомиб представляет собой ингибитор протеасом второго поколения, который недавно был разрешен для лечения пациентов с рецидивирующей и рефрактерной множественной миеломой. Ингибирование активности протеасом карфилзомибом приводит к накоплению полиубиквитинированных белков, которые могут вызывать остановку клеточного цикла, апоптоз и ингибирование опухолевого роста. hu38SB19 продемонстрировал множественные механизмы действия, включая ADCC, CDC и индукцию прямого апоптоза.
Имеются сообщения о том, что некоторые CD38 антитела, такие как Daratumumab, способны индуцировать апоптоз только после поперечной сшивки с вторичным антителом, при отсутствии собственного большого прямого эффекта. Однако, в ходе доклинических исследований hu38SB19 продемонстрировал мощную прямую проапоптотическую активность в отношении опухолевых клеток без поперечной сшивки. Таким образом, указанное уникальное свойство hu38SB19 также может вызывать более выраженную гибель опухолевых клеток при комбинировании с карфилзомибом по сравнению с другими CD38 антителами в комбинации с карфилзомибом.
Пример 2: Эффект совместного введения антитела к CD38 и карфилзомиба у людей
Клинические испытания для оценки эффектов лечения с использованием hu38SB19 в комбинации с карфилзомибом у пациентов с рецидивирующей или рефрактерной множественной миеломой можно осуществлять следующим образом.
Цели исследований могут включать:
- Определение эффективности и максимальной переносимой дозы;
- Оценку безопасности, включая иммуногенность, hu38SB19 в комбинации с карфилзомибом при рецидивирующей или рефрактерной множественной миеломе. Оценивается тяжесть, частота и заболеваемость для всех видов токсичности;
- Оценку фармакокинетики (ФК) hu38SB19 при введении hu38SB19 в комбинации с карфилзомибом и ФК карфилзомиба в комбинации с hu38SB19, и, необязательно, с дексаметазоном.
- Оценку взаимоотношений между клиническими (неблагоприятные события и/или опухолевый ответ) эффектами и фармакологическими параметрами (ФК/фармакодинамика) и/или биологическими (соответствующие лабораторные данные) результатами;
- Определение активности (частоты ответов) с использованием определенных международной рабочей группой по миеломе критериев hu38SB19 + карфилзомиб, и, необязательно, дексаметазон; и
- Описание общего выживания, выживания без прогрессирования заболевания (ВБП) и времени до прогрессирования заболевания у пациентов, которых лечили указанной комбинацией.
Участвовали пациенты с рецидивирующей множественной миеломой, которые ранее получали по меньшей мере два курса лечения (включая бортезомиб и талидомид и/или леналидомид) и у которых заболевание имело меньший или равный 25% ответ на предыдущее лечение или прогрессировало во время последнего лечения или через 60 дней после него. Пациентов исключали из исследования, если они имели уровни билирубина, ≥ в 2 раза превышающие верхнюю границу нормы (ВГН); скорости клиренса креатинина <30 мл/мин; застойную сердечную недостаточность класса III-IV по шкале Нью-Йоркской кардиологической ассоциации; симптоматическую сердечную ишемию; инфаркт миокарда в течение последних 6 месяцев; периферическую нейропатию от 3 до 4 степени или периферическую нейропатию 2 степени с болями; активные инфекции, требующие лечения и плевральный выпот.
Карфилзомиб вводят внутривенно в течение 2-10 минут два дня подряд каждую неделю в течение трех недель, с последующим 12-дневным периодом отдыха (28-дневный цикл лечения), до прогрессирования заболевания, появления неприемлемой токсичности или в течение максимум 12 циклов. Пациенты получают 20 мг/м2 с каждой дозой во время 1 цикла и 27 мг/м2 во время последующих циклов. Для уменьшения частоты и тяжести лихорадки, озноба, дрожи, одышки, миалгии и артралгии можно вводить 4 мг дексаметазона перорально или путем внутривенной инфузии перед всеми дозами карфилзомиба во время первого цикла и перед всеми дозами карфилзомиба во время первого цикла повышения доз (27 мг/м2). Премедикацию дексаметазоном (4 мг перорально или внутривенно) можно возобновлять, если указанные симптомы повторно появляются во время последующих циклов. Дозы hu38SB19 можно вводить в те же дни, что и дозы карфилзомиба, и/или в другие дни. При введении в одни и те же дни hu38SB19 и карфилзомиб можно вводить в одно и то же время как одну композицию или как две отдельные композиции.
Продолжительность исследования для отдельного пациента включает период скрининга для включения в исследования до 21 дня и по меньшей мере 4 недели лечения при отсутствии тяжелой неблагоприятной реакции, ограничивающей дозу токсичности или прогрессирования заболевания, плюс до 60 дней наблюдения после лечения. Общая продолжительность исследования может составлять один год.
Следующие параметры могут быть измерены во время и/или в конце исследования:
- Количество пациентов с неблагоприятными событиями при лечения hu38SB19 в комбинации с карфилзомибом;
- Оценка частичного ответа, полного ответа, выживания без прогрессирования и выживания;
- Оценка следующих параметров ФК: площади под кривой (AUC), максимальной концентрации (Cmax) и полупериода существования в плазме (Т1/2);
- Количество рецепторов CD38, занятых hu38SB19; и
- Количество антител к SAR антител в ответ на hu38SB19.
Пример 3: Эффективность антитела к CD38 в in vivo опухолевых моделях множественной миеломы как единственного агента или в комбинации с карфилзомибом
А. Материалы и методы
Плотность CD38: Плотность CD38 определяли с использованием антител к CD38-PE Quantibrite (BD Biosciences; Cat. 342371) по протоколам, рекомендованным производителем.
Реагенты и соединения: hu38SB19 получали от Sanofi Oncology в виде раствора 5 мг/мл и хранили при 4°С. hu38SB19 разбавляли стерильным физиологическим раствором с получением препарата для введения и использовали в течение 10 дней после разбавления. hu38SB19 вводили дважды в неделю × 2 нед. в/в. Карфилзомиб (PR-171) получали от Chemie Tek (CT-CARF 98). Карфилзомиб изготовливали в водном растворе 10% (масс./об.) сульфобутилэфир-h-циклодекстрине (Cydex) и 10 ммоль/л цитрате натрия (рН 3,5), изготавливали маточный раствор 2 мг/мл и замораживали при -80°С, разбавляли ежедневно носителем перед инъекцией. Карфилзомиб вводили еженедельно qdx2 × 3 нед. (в/в).
Экспериментальные животные: 5-6-недельных самок мышей Balb/c Scid получали из Jackson Lab. Передержка мышей до имплантации клеточных линий множественной миеломы (ММ) составляла 7-10 дней. Мышей содержали в специальной комнате в здании UCSF Mt. Zion Animal Barrier Facility.
Модель ксенотрнасплантата: Ко времени имплантации мышам выбривали область правого бока и плеча. Клетки ММ суспендировали в не содержащей сыворотки среде RPMI 1640, разбавленной 1:1 с использованием Matrigel (BD), до концентрации 1×108 клеток/мл, инъецировали п/к в правый бок в объеме 100 мкл (1×107 клеток) с использованием 1 мл шприца и иглы 25 g. Мышей осматривали два раза в неделю на предмет появления опухолей, и, после того, как опухоли становились видимыми, два раза в неделю производили измерения массы тела и объема опухоли. Использовали электронные весы и толщиномеры, и данные собирали непосредственно в программу лечения (Study Director). Когда средний объем опухолей достигал приблизительно 150-200 мм3, мышей распределяли на группы лечения, по 8-10 мышей на группу, и начинали введение.
В. Резюме и выводы
hu38SB19 представляет собой гуманизированное антитело к CD38, в антимиеломных эффектах которого участвуют механизмы ADCC, CDC и прямого апоптоза. Фиг. 11 показывает плотность CD38 на поверхности клеток клеточных линий множественной миеломы. См. Kim D., Park C.Y., Medeiros B.C., Weissman I.L. CD19-CD45 low/-CD38 high/CD138+ plasma cells enrich for human tumorigenic myeloma cells. Leukemia. 2012 Dec., 26(12): 2530-7. CD38-положительные плазматические клетки множественной миеломы демонстрируют вариабельные плотности CD38 на поверхности клеток. Все клеточные линии, за исключением XG-6, как сообщается, являются CD38-положительными. См. Bataille R., Jego G., Robillard N., et al. The phenotype of normal, reactive and malignant plasma cells. Identification of “many and multiple myelomas” and new targets for myeloma therapy. Haemotologica. 2006 Sept., 91(9): 1234-40. Связывание hu38SB19 с CD38 также оказывает негативное действие на ADPRC ферментативную активность CD38. In vivo hu38SB19 демонстрирует мощные противоопухолевые эффекты в отношении ксенотрансплантатов множественной миеломы, заболевания, в большой степени характеризующееся неопластическими плазматическими клетками, экспрессирующими CD38. Фигура 12 показывает, что введение hu38SB19 в качестве единственного агента приводит к дозозависимому ингибированию опухолевого роста на модели задне-боковой опухоли NCI-H929. Размеры и значимость ингибирования опухолевого роста к концу исследования возрастали с возрастанием доз hu38SB19. Фиг. 13 показывает, что комбинированная схема введения hu38SB19 и карфилзомиба приводит к значимому ингибированию опухолевого роста на модели ксенотрансплантата NCI-H929, которая не является устойчиво чувствительной к терапии карфилзомибом в качестве единственного агента. Указанные данные демонстрируют, что hu38SB19 в качестве единственного агента ингибирует рост опухолей NCI-H929 и комбинируется с субэффективными дозами карфилзомиба, с получением значимого ингибирования опухолевого роста. Все вместе указанные данные подтверждают дополнительную оценку hu38SB19, как в качестве единственного агента, так и в комбинации со стандартными схемами лечения, как потенциального лекарственного средства для лечения множественной миеломы.
В пределах, необходимых для понимания или полного описания настоящего изобретения, все публикации, патенты и патентные заявки, упомянутые в настоящем документе, специально включены в него в качестве ссылок в той же степени, в которой они были бы включены индивидуально.
Имея описанные таким образом типичные варианты осуществления настоящего изобретения, специалистам следует заметить, что указанные описания являются только примерами и что другие альтернативы, адаптации и модификации можно производить в пределах объема настоящего изобретения. Соответственно, настоящее изобретение не ограничивается конкретными проиллюстрированными в настоящем документе вариантами осуществления, а ограничивается лишь следующей формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ АНТИТЕЛА К CD38 И КАРФИЛЗОМИБ | 2014 |
|
RU2723937C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИТЕЛА К CD38 И ЛЕНАЛИДОМИД | 2013 |
|
RU2698911C2 |
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ РАКА, НАЦЕЛИВАЮЩИЕСЯ НА CD38 И TGF-БЕТА | 2019 |
|
RU2808632C2 |
| СОСТАВЫ НА ОСНОВЕ АНТИТЕЛ К CD38 ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ | 2020 |
|
RU2838165C1 |
| ЧЕЛОВЕЧЕСКИЕ АНТИ-CD38-АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2402568C2 |
| СПОСОБЫ ЛЕЧЕНИЯ МНОЖЕСТВЕННОЙ МИЕЛОМЫ | 2020 |
|
RU2838203C2 |
| Средство для лечения множественной миеломы (ММ) | 2016 |
|
RU2723047C2 |
| ДИАГНОСТИКА И ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛА ПРОТИВ EREG | 2007 |
|
RU2537245C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ГУМАНИЗИРОВАННОГО АНТИ-CD19 ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА | 2014 |
|
RU2711975C2 |
| АНТИТЕЛО К CD38 И ЛЕНАЛИДОМИД ИЛИ БОРТЕЗОМИБ ДЛЯ ЛЕЧЕНИЯ МНОЖЕСТВЕННОЙ МИЕЛОМЫ И NHL | 2011 |
|
RU2595839C2 |



















































Изобретение относится к области биохимии, в частности к способу лечения множественной миеломы у субъекта с помощью антитела к CD38. Также раскрыты композиция для лечения множественной миеломы, набор для лечения множественной миеломы у субъекта с помощью антитела к CD38, комбинация для лечения множественной миеломы у субъекта с помощью антитела к CD38. Изобретение обладает способностью эффективно лечить множественную миелому у субъекта с помощью антитела к CD38. 4 н. и 42 з.п. ф-лы, 3 пр., 1 табл., 22 ил.
1. Способ лечения множественной миеломы у субъекта, который включает введение субъекту терапевтически эффективного количества антитела к CD38 и терапевтически эффективного количества карфилзомиба, где антитело к CD38 содержит тяжелую цепь, которая включает три последовательные CDR SEQ ID NO: 13, 81 и 15, и легкую цепь, которая включает три последовательные CDR SEQ ID NO: 16, 17 и 18,
и где субъект подвергался по меньшей мере двум предшествующим терапиям множественной миеломы.
2. Способ по п.1, в котором по меньшей мере одной из по меньшей мере двух предшествующих терапий являлось иммуномодулирующее лекарственное средство.
3. Способ по п.2, в котором иммуномодулирующим лекарственным средством являлся леналидомид или талидомид.
4. Способ по п.1, в котором по меньшей мере одной из по меньшей мере двух предшествующих терапий являлся ингибитор протеасом.
5. Способ по п.4, в котором ингибитором протеасом являлся бортезомиб.
6. Способ по п.1, в котором антитело к CD38 и карфилзомиб вводят в синергическом количестве.
7. Способ по п.1, в котором антитело к CD38 способно убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC).
8. Способ по п.1, в котором указанное антитело содержит тяжелую цепь, которая включает вариабельную область, содержащую аминокислотную последовательность, представленную SEQ ID NO: 66, и легкую цепь, которая включает вариабельную область, содержащую аминокислотную последовательность, представленную SEQ ID NO: 62 или SEQ ID NO: 64.
9. Способ по любому из пп.1-8, в котором антитело к CD38 вводят внутривенно.
10. Способ по любому из пп.1-8, в котором карфилзомиб вводят внутривенно.
11. Способ по любому из пп.1-8, в котором антитело к CD38 и карфилзомиб вводят последовательно.
12. Способ по любому из пп.1-8, который дополнительно включает введение субъекту соединения дексаметазона.
13. Способ по п.12, в котором соединением дексаметазона является дексаметазон.
14. Способ по п.12, в котором соединение дексаметазона вводят перорально.
15. Способ по п.12, в котором антитело к CD38, карфилзомиб и соединение дексаметазона вводят последовательно.
16. Композиция для лечения множественной миеломы у субъекта, который подвергался по меньшей мере двум предшествующим терапиям множественной миеломы, содержащая:
а) антитело к CD38, содержащее тяжелую цепь, которая включает три последовательные CDR SEQ ID NO: 13, 81 и 15, и легкую цепь, которая включает три последовательные CDR SEQ ID NO: 16, 17 и 18;
и
b) карфилзомиб.
17. Композиция по п.16, в которой антитело к CD38 способно убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC).
18. Композиция по п.16, в которой указанное антитело содержит тяжелую цепь, которая включает вариабельную область, содержащую аминокислотную последовательность, представленную SEQ ID NO: 66, и легкую цепь, которая включает вариабельную область, содержащую аминокислотную последовательность, представленную SEQ ID NO: 62 или SEQ ID NO: 64.
19. Композиция по п.16, дополнительно включающая соединение дексаметазона.
20. Композиция по п.19, в которой соединением дексаметазона является дексаметазон.
21. Композиция по п.16, в которой по меньшей мере одной из по меньшей мере двух предшествующих терапий являлось иммуномодулирующее лекарственное средство.
22. Композиция по п.21, в которой иммуномодулирующим лекарственным средством являлся леналидомид или талидомид.
23. Композиция по п.16, в которой по меньшей мере одной из по меньшей мере двух предшествующих терапий являлся ингибитор протеасом.
24. Композиция по п.23, в которой ингибитором протеасом являлся бортезомиб.
25. Набор для лечения множественной миеломы у субъекта, который подвергался по меньшей мере двум предшествующим терапиям множественной миеломы, содержащий:
а) антитело к CD38, содержащее тяжелую цепь, которая включает три последовательные CDR SEQ ID NO: 13, 81 и 15, и легкую цепь, которая включает три последовательные CDR SEQ ID NO: 16, 17 и 18;
и
b) этикетку с одним или несколькими сообщениями о том, что антитело к CD38 предназначено для введения в комбинации с карфилзомибом и, при необходимости, с дексаметазоном.
26. Набор по п.25, в котором антитело к CD38 способно убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC).
27. Набор по п.25, в котором указанное антитело содержит тяжелую цепь, которая включает вариабельную область, содержащую аминокислотную последовательность, представленную SEQ ID NO: 66, и легкую цепь, которая включает вариабельную область, содержащую аминокислотную последовательность, представленную SEQ ID NO: 62 или SEQ ID NO: 64.
28. Набор по п.25, дополнительно включающий карфилзомиб.
29. Набор по п.25 или 28, дополнительно включающий соединение дексаметазона.
30. Набор по п.29, в котором соединением дексаметазона является дексаметазон.
31. Набор по п.28, в котором антитело к CD38 и карфилзомиб упакованы для последовательного введения субъекту.
32. Набор по п.29, в котором антитело к CD38, карфилзомиб и соединение дексаметазона упакованы для последовательного введения субъекту.
33. Набор по п.25, в котором по меньшей мере одной из по меньшей мере двух предшествующих терапий являлось иммуномодулирующее лекарственное средство.
34. Набор по п.33, в котором иммуномодулирующим лекарственным средством являлся леналидомид или талидомид.
35. Набор по п.25, в котором по меньшей мере одной из по меньшей мере двух предшествующих терапий являлся ингибитор протеасом.
36. Набор по п.35, в котором ингибитором протеасом являлся бортезомиб.
37. Комбинация для лечения множественной миеломы у субъекта, который подвергался по меньшей мере двум предшествующим терапиям множественной миеломы, содержащая:
(i) антитело к CD38, содержащее тяжелую цепь, которая включает три последовательные CDR SEQ ID NO: 13, 81 и 15, и легкую цепь, которая включает три последовательные CDR SEQ ID NO: 16, 17 и 18;
и
(ii) карфилзомиб.
38. Комбинация по п. 37, в которой указанное антитело содержит тяжелую цепь, которая включает вариабельную область, содержащую аминокислотную последовательность, представленную SEQ ID NO: 66, и легкую цепь, которая включает вариабельную область, содержащую аминокислотную последовательность, представленную SEQ ID NO: 62 или SEQ ID NO: 64.
39. Комбинация по п.37, дополнительно включающая соединение дексаметазона.
40. Комбинация по п.39, в которой соединением дексаметазона является дексаметазон.
41. Комбинация по п.37, в которой антитело к CD38 способно убивать клетку CD38+ через апоптоз, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC).
42. Комбинация по п. 37 или 39, которая предназначена для последовательного применения.
43. Комбинация по п. 37, в которой по меньшей мере одной из по меньшей мере двух предшествующих терапий являлось иммуномодулирующее лекарственное средство.
44. Комбинация по п.43, в которой иммуномодулирующим лекарственным средством являлся леналидомид или талидомид.
45. Комбинация по п.37, в которой по меньшей мере одной из по меньшей мере двух предшествующих терапий являлся ингибитор протеасом.
46. Комбинация по п.45, в которой ингибитором протеасом являлся бортезомиб.
| WO 2012041800 A1, 05.04.2012 | |||
| EP 1914242 A1, 23.04.2008 | |||
| WO 2012135528 A2, 04.10.2012 | |||
| WO 2010057048 A1, 20.05.2010 | |||
| КОМБИНАЦИИ СПЕЦИФИЧНЫХ ИНГИБИТОРОВ ГИСТОНОВЫХ ДЕАЦЕТИЛАЗ КЛАССА I С ИНГИБИТОРАМИ ПРОТЕАСОМ | 2007 |
|
RU2456990C2 |
Авторы
Даты
2018-10-18—Публикация
2014-03-13—Подача