ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАВАЕМЫЙ В ЭЛЕКТРОННОМ ВИДЕ
[0001] Содержание подаваемого в электронном виде перечня последовательностей в текстовом файле в формате ASCII (название: sequencelisting_ascii.txt; размер: 12,3 килобайт; дата создания документа: 10 декабря 2013 г.), подающегося вместе с заявкой, включено в настоящий документ в полном объеме посредством ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0002] Ожирение является главной и растущей проблемой здравоохранения во всем мире и ассоциировано со многими опасными для жизни заболеваниями, такими как сердечно-сосудистые заболевания, заболевания почек, гипертензия, инсульт, бесплодие, респираторная дисфункция и сахарный диабет 2 типа.
[0003] Глюкагон и глюкагоноподобный пептид-1 (GLP-1) образуются из препроглюкагона, полипептида-предшественника из 158 аминокислот, который преобразуется в различных тканях с образованием ряда различных пептидов, получаемых из проглюкагона, включая глюкагон, глюкагоноподобный пептид-1 (GLP-1), глюкагоноподобный пептид-2 (GLP-2) и оксинтомодулин (ОХМ), которые принимают участие в осуществлении широкого спектра физиологических функций, в том числе поддержания гомеостаза глюкозы, секреции инсулина, опорожнения желудка и развития кишечника, а также регулирования потребления пищи. Глюкагон представляет собой пептид из 29 аминокислот, которые соответствуют аминокислотам 33-61 проглюкагона (53-81 препроглюкагона), тогда как GLP-1 получают в виде пептида из 37 аминокислот, которые соответствуют аминокислотам 72-108 проглюкагона (92-128 препроглюкагона). GLP-1 (7-36) в форме амида или GLP-1 (7-37) в форме кислоты представляют собой биологически активные формы GLP-1, которые демонстрируют фактически эквивалентную активность в отношении рецепторов GLP-1.
[0004] Глюкагон вырабатывается поджелудочной железой и взаимодействует с рецептором глюкагона ("glucR"). Глюкагон осуществляет свою деятельность в печени, поднимая уровень глюкозы в крови посредством глюконеогенеза и гликогенолиза. Когда уровень глюкозы в крови начинает падать, глюкагон сигнализирует печени о необходимости разрушения гликогена и высвобождения глюкозы, в результате чего уровни глюкозы в крови поднимаются до нормального уровня.
[0005] Биологическая активность GLP-1 отличается от таковой у глюкагона. Он секретируется L-клетками кишечника и связывается с рецептором GLP-1. Его активность включает стимуляцию синтеза и секреции инсулина, ингибирование секреции глюкагона и снижение потребления пищи.
[0006] Было показано, что как глюкагон, так и GLP-1, выступающие в качестве агонистов соответствующих рецепторов, эффективны в отношении снижения массы тела. Определенные аналоги GLP-1 имеются в продаже или находятся в стадии разработки в качестве средств для лечения ожирения, в том числе, например, лираглутид (VICTOZA® от Novo Nordisk) и эксенатид (Byetta® от Eli Lilly/Amylin).
[0007] По-прежнему существует потребность в дополнительных средствах для эффективного лечения ожирения, например, пептидах, являющихся агонистами рецепторов GLP-1/глюкагона, с улучшенными растворимостью, пригодностью для составления, стабильностью и эффективностью.
КРАТКОЕ ОПИСАНИЕ
[0008] В настоящем раскрытии представлен выделенный пептид, содержащий следующую аминокислотную последовательность или состоящий из нее:
HX2QGTFTSDX10SX12X13LX15X16X17X18AX20X21FX23X24WLX27X28GX30;
где X2 представляет собой G или S, X10 представляет собой Y или K, X12 представляет собой K, E, R или S, X13 представляет собой K или Y, X15 представляет собой D или E, X16 представляет собой S или G, X17 представляет собой E, R, Q или K, X18 представляет собой R, S или A, X20 представляет собой R, K или Q, X21 представляет собой D или E, X23 представляет собой V или I, X24 представляет собой A или Q, X27 представляет собой E или V, X28 представляет собой A или K, а X30 представляет собой G или R (SEQ ID NO:4). В определенных аспектах X2 представляет собой S, X15 представляет собой D, X16 представляет собой S, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X28 представляет собой A, а X30 представляет собой G (SEQ ID NO:5). В определенных аспектах если X17 представляет собой E, то X18 представляет собой R, а если X17 представляет собой R, то X18 представляет собой S (SEQ ID NO:6 и 7). В определенных аспектах X10 представляет собой Y, X12 представляет собой K, X13 представляет собой K, а X27 представляет собой V (SEQ ID NO:8 и 9). В определенных аспектах X10 представляет собой K, X13 представляет собой Y, а X27 представляет собой E (SEQ ID NO:10 и 11). В определенных аспектах X12 представляет собой E (SEQ ID NO:12 и 13), в качестве альтернативы, X12 представляет собой R (SEQ ID NO:14 и 15). В определенных аспектах выделенный пептид содержит SEQ ID NO:16 или состоит из нее. В определенных аспектах выделенный пептид содержит аминокислотную последовательность SEQ ID NO:17 или аминокислотную последовательность SEQ ID NO:19 или состоит из них. В определенных аспектах выделенный пептид содержит SEQ ID NO:18 или состоит из них.
[0009] В определенных вариантах осуществления описанных выше пептидов карбоксильная группа аминокислоты X30 является амидированной. В других вариантах осуществления карбоксильная группа является немодифицированной кислотной группой.
[0010] Любые из пептидов, представленных в настоящем документе, могут дополнительно содержать одну или несколько модифицированных аминокислот, например, с добавлением ацильного компонента, например, модификация может представлять собой добавление пальмитоильного компонента к N(эпсилон)-группе лизинового остатка. В определенных вариантах осуществления пальмитоильная группа связана с лизиновым остатком посредством гамма-глутаматного линкера. Применялись альтернативные линкеры, в том числе бета-аланин и аминогексановая кислота. Могут применяться дополнительные альтернативные линкеры, в том числе линкеры, содержащие короткие PEG-компоненты, содержащие, например, 2 или 4 звена PEG.
[0011] В различных вариантах осуществления выделенные пептиды, представленные в настоящем документе, могут связываться с рецептором глюкагона, рецептором GLP-1 или как с рецептором глюкагона, так и с рецептором GLP-1. В определенных аспектах рецептор глюкагона является рецептором глюкагона человека и/или рецептор GLP-1 является рецептором GLP-1 человека. В определенных аспектах выделенный пептид, представленный в настоящем документе, связывается с рецептором глюкагона человека при EC50, определенной в анализе 1 cAMP (описываемом в настоящем документе), составляющей менее 10000 пМ, менее 5000 пМ, менее 2500 пМ, менее 1000 пМ, менее 900 пМ, менее 800 пМ, менее 700 пМ, менее 600 пМ, менее 500 пМ, менее 400 пМ, менее 300 пМ, менее 200 пМ, менее 100 пМ, менее 50 пМ, менее 25 пМ, менее 20 пМ, менее 15 пМ, менее 10 пМ, менее 5 пМ, менее 4 пМ, менее 3 пМ или менее 2 пМ. В определенных аспектах выделенный пептид, представленный в настоящем документе, связывается с рецептором GLP-1 человека при EC50, определенной в анализе 1 cAMP, составляющей менее 10000 пМ, менее 5000 пМ, менее 2500 пМ, менее 1000 пМ, менее 900 пМ, менее 800 пМ, менее 700 пМ, менее 600 пМ, менее 500 пМ, менее 400 пМ, менее 300 пМ, менее 200 пМ, менее 100 пМ, менее 50 пМ, менее 25 пМ, менее 20 пМ, менее 15 пМ, менее 10 пМ, менее 5 пМ, менее 4 пМ, менее 3 пМ или менее 2 пМ.
[0012] В определенных аспектах выделенный пептид, представленный в настоящем документе, является агонистом активности GLP-1, агонистом активности глюкагона или агонистом активности как GLP-1, так и глюкагона. В определенных вариантах осуществления выделенный пептид, представленный в настоящем документе, связывается как с рецептором глюкагона, так и с рецептором GLP-1, и проявляет по меньшей мере приблизительно в 2 раза большую активность относительно естественного лиганда при связывании с рецептором GLP-1, чем при связывании с рецептором глюкагона. В одном варианте осуществления пептид имеет в 5-10 раз более высокую относительную эффективность по сравнению с GLP1 при связывании с GLP1R, чем относительно глюкагона при связывании с рецептором глюкагона.
[0013] В определенных аспектах выделенный пептид, представленный в настоящем документе, может дополнительно содержать гетерологичный компонент, связанный с пептидом. В определенных аспектах гетерологичный компонент представляет собой белок, пептид, белковый домен, линкер, органический полимер, неорганический полимер, полиэтиленгликоль (PEG), биотин, альбумин, человеческий сывороточный альбумин (HSA), участок HSA, связывающийся с FcRn, антитело, домен антитела, фрагмент антитела, одноцепочечное антитело, доменное антитело, альбумин-связывающий домен, фермент, лиганд, рецептор, связывающий пептид, каркасный белок, отличный от FnIII, эпитопную метку, рекомбинантный полипептидный полимер, цитокин или любую комбинацию двух или более таких компонентов.
[0014] Также настоящее изобретение представляет фармацевтическую композицию, содержащую выделенный пептид, описываемый в настоящем документе, и носитель. Дополнительно представлен набор, содержащий такую фармацевтическую композицию.
[0015] Также представлен способ лечения или предупреждения заболевания или состояния, вызываемого или характеризующегося избыточной массой тела, где способ включает введение субъекту, нуждающемуся в лечении, эффективного количества выделенного пептида, представленного в настоящем документе, или композиции, которая содержит такой пептид. В определенных аспектах заболеванием или состоянием может быть ожирение, инсулинорезистентность, нарушение толерантности к глюкозе, предиабет, повышенный уровень глюкозы натощак, сахарный диабет 2 типа, гипертензия, дислипидемия (или комбинацию этих метаболических факторов риска), глюкагономы, сердечно-сосудистые заболевания, например, застойная сердечная недостаточность, атеросклероз, артериосклероз, ишемическая болезнь сердца или заболевание периферических артерий; инсульт, респираторная дисфункция, заболевание почек и любая их комбинация. В соответствии с данным способом выделенный пептид, описываемый в настоящем документе, может вводиться путем инъекции, например, путем подкожной инъекции. В соответствии с данным способом
пептид может вводиться один раз в день. В определенных вариантах осуществления субъектом является человек.
[0016] Также настоящее изобретение представляет способ лечения или предупреждения заболевания или состояния, вызываемого или характеризующегося избыточной массой тела, где способ включает введение субъекту, нуждающемуся в лечении, эффективного количества выделенного пептида, представленного в настоящем документе, или композиции, которая содержит такой пептид. В соответствии с данным способом выделенный пептид, описываемый в настоящем документе, может вводиться путем инъекции, например, путем подкожной инъекции. В соответствии с данным способом пептид может вводиться один раз в день. В определенных вариантах осуществления субъектом является человек.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ/ФИГУР
[0017] На фигуре 1 показано среднее процентное изменение массы тела по сравнению с нулевым днем у мышей в модели DIO после введения пептида G730, являющегося коагонистом рецепторов глюкагона/GLP-1, в трех различных дозах по сравнению с обработкой инертным веществом и обработкой лираглутидом. Исходная масса тела в различных группах была следующей: инертное вещество: 47,4±3,7 г, 10 нмоль/кг G730: 44,5±2,2 г, 20 нмоль/кг G730: 45,9±3,6 г и 50 нмоль/кг G730: 46,1±2,4 г, соответственно.
[0018] На фигуре 2 показано среднее процентное изменение массы тела по сравнению с нулевым днем у мышей в модели DIO после введения пептида G797, являющегося коагонистом рецепторов глюкагона/GLP-1, в трех различных дозах по сравнению с обработкой инертным веществом и обработкой лираглутидом. Исходная масса тела в различных группах была следующей: инертное вещество: 47,4±3,7 г, 5 нмоль/кг G797: 47,5±1,2 г, 20 нмоль/кг G797: 47,4±2,2 г и 50 нмоль/кг G797: 47,2±1,8 г, соответственно.
[0019] На фигуре 3 показано среднее процентное изменение массы тела по сравнению с нулевым днем у мышей в модели DIO после введения пептида G812, являющегося коагонистом рецепторов глюкагона/GLP-1, в дозе 20 нмоль/кг по сравнению с обработкой инертным веществом и обработкой лираглутидом. Исходная масса тела в различных группах была следующей: инертное вещество: 47,4±3,7 г и 20 нмоль/кг G812: 49,2±3,4 г, соответственно.
[0020] Фигура 4 представляет собой график, на котором сравниваются результаты изменения массы тела для трех пептидов, являющихся коагонистами рецепторов глюкагона/GLP-1, представленные на фигурах 1, 2 и 3.
[0021] На фигуре 5 показано среднее процентное изменение массы тела по сравнению с нулевым днем у мышей в модели DIO после введения пептида G796, являющегося коагонистом рецепторов глюкагона/GLP-1, в двух различных дозах по сравнению с обработкой инертным веществом и обработкой лираглутидом.
[0022] На фигуре 6 показано среднее процентное изменение массы тела по сравнению с нулевым днем у мышей в модели DIO после введения пептида G865, являющегося коагонистом глюкагона/GLP-1, в двух различных дозах по сравнению с обработкой инертным веществом и обработкой лираглутидом.
[0023] На фигуре 7 показано среднее процентное изменение массы тела по сравнению с нулевым днем у мышей в модели DIO после введения пептида G933, являющегося коагонистом рецепторов глюкагона/GLP-1, в двух различных дозах по сравнению с обработкой инертным веществом и обработкой лираглутидом.
[0024] Фигура 8 представляет собой график, на котором сравниваются результаты изменения массы тела для трех пептидов, являющихся коагонистами рецепторов глюкагона/GLP-1, представленные на фигурах 5, 6 и 7.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
[0025] Во всем настоящем раскрытии объект в форме единственного числа относится к одному или нескольким таким объектам; например, следует понимать, что "полинуклеотид" означает один или несколько полинуклеотидов. Таким образом, формы единственного числа, термины "один или несколько" и "по меньшей мере один" могут применяться в документе взаимозаменяемо.
[0026] Кроме того, термин "и/или", применяемый в настоящем документе, необходимо понимать как конкретное раскрытие каждого из двух указанных признаков или компонентов вместе с другим или без него. Таким образом, термин "и/или", применяемый в настоящем документе в такой фразе, как "A и/или B", предусматривает включение "A и B", "A или B", "A" (отдельно) и "B" (отдельно). Подобным образом, термин "и/или", используемый в такой фразе, как "A, B и/или C", предусматривает включение каждого из следующих аспектов: A, B и C; A, В или C; A или C; A или B; B или C; A и C; A и B; B и C; A (отдельно); B (отдельно) и C (отдельно).
[0027] Следует понимать, что во всех применимых случаях аспекты описываются в настоящем документе с использованием формулировки "содержащий", также представлены другие аналогичные аспекты, описываемые с использованием терминов "состоящий из" и/или "фактически состоящий из".
[0028] Если не указано иное, все используемые в настоящем документе технические и научные термины имеют тот же смысл, какой обычно понимается средним специалистом в данной области, к которой относится настоящее изобретение. Например, в Concise Dictionary of Biomedicine and Molecular Biology, Juo, Pei-Show, 2nd ed., 2002, CRC Press; The Dictionary of Cell and Molecular Biology, 3rd ed., 1999, Academic Press; и Oxford Dictionary Of Biochemistry and Molecular Biology, Revised, 2000, Oxford University Press, для специалиста приведен общий словарь многих из терминов, используемых в настоящем раскрытии.
[0029] Единицы измерения, приставки и обозначения приводятся в форме, принятой в Международной системе единиц (СИ). Числовые диапазоны включают числа, определяющие данный диапазон. Если не указано иное, аминокислотные последовательности написаны слева направо в направлении от амино- до карбоксиконца. Заголовки, приведенные в настоящем документе, не ограничивают различные аспекты настоящего раскрытия, информацию о которых можно получить путем ссылки на описание изобретения в целом. Соответственно, термины, определенные непосредственно ниже, более подробно определяются путем ссылки на описание изобретения в полном объеме.
[0030] Предполагается, что используемый в настоящем документе термин "полипептид" охватывает единственное число "полипептид", а также множественное число "полипептиды", и включает любую цепь или цепи из двух или более аминокислот. Таким образом, используемый в настоящем документе термин "пептид", "пептидная субъединица", "белок", "аминокислотная цепь", "аминокислотная последовательность" или любой другой термин, используемый для обозначения цепи или цепей из двух или более аминокислот, включены в определение "полипептида", хотя каждый из этих терминов может иметь более конкретное значение. Термин "полипептид" может использоваться вместо любого из этих терминов или взаимозаменяемо с ними. Этот термин дополнительно включает полипептиды, которые подверглись посттрансляционной или постсинтетической модификации, например, гликозилированию, ацетилированию, фосфорилированию, амидированию, дериватизации известными защитными/блокирующими группами, протеолитическому расщеплению или модификации под действием не встречающихся в природе аминокислот.
[0031] Более конкретно, используемый в настоящем документе термин "пептид" охватывает пептиды полной длины и их фрагменты, варианты или производные, например, пептид, являющийся агонистом рецепторов GLP-1/глюкагона (длиной, например, 29, 30 или 31 аминокислота). "Пептид", описываемый в настоящем документе, например, пептид, являющийся агонистом рецепторов GLP-1/глюкагона, может быть частью полипептида слияния, содержащего дополнительные компоненты, такие как, например, Fc-домен или домен альбумина, позволяющие увеличить период полувыведения. Пептид, описываемый в настоящем документе, также может быть подвергнут дериватизации с применением ряда различных способов.
[0032] Термины "фрагмент", "аналог", "производное" или "вариант", когда речь идет о пептиде, являющемся агонистом рецепторов GLP-1/глюкагона, включают любой пептид, который сохраняет по меньшей мере некоторую желательную активность, например, связывание с рецепторами глюкагона и/или GLP-1. Фрагменты пептидов, являющихся агонистами GLP-1/глюкагона, представленные в настоящем документе, включают протеолитические фрагменты, делеционные фрагменты, которые проявляют желаемые свойства при экспрессии, очистке и/или введении субъекту.
[0033] Используемый в настоящем документе термин "вариант" относится к пептиду, который отличается от описанного выше пептида в связи с присутствием аминокислотных замен, делеций, вставок и/или модификаций. Варианты могут быть получены с применением известных в данной области техники методик мутагенеза. Варианты могут также, или в качестве альтернативы, содержать другие модификации, например, пептид может быть конъюгирован или связан, например, слит с гетерологичной аминокислотной последовательностью или другим компонентом, например, для увеличения периода полувыведения, растворимости или стабильности. Примеры компонентов, подлежащих конъюгации или связыванию с пептидом, представленным в настоящем документе, включают, без ограничений, альбумин, Fc-участок иммуноглобулина, полиэтиленгликоль (PEG) и подобные. Пептид также может быть конъюгирован или получен связанным с линкером или другой последовательностью для облегчения синтеза, очистки или идентификации пептида (например, 6-His) или для усиления связывания полипептида с твердой подложкой.
[0034] Используемый в настоящем документе термин "идентичность последовательностей" относится к сходству двух или более последовательностей полинуклеотидов или двух или более последовательностей полипептидов. Если положение в одной последовательности занято теми же основанием нуклеиновой кислоты или аминокислотой, которые находятся в соответствующем положении в сравниваемой последовательности, то говорят, что эти последовательности "идентичны" по этому положению. Процентное значение "идентичности последовательностей" рассчитывают путем определения количества положений, в которых идентичные основания нуклеиновых кислот или аминокислоты присутствуют в обеих последовательностях, с получением количества "идентичных" положений. Количество "идентичных" положений затем делят на общее количество положений в окне сравнения и умножают на 100 с получением процентного значения "идентичности последовательности". Процентное значение "идентичности последовательностей" определяют путем сравнения двух оптимально выровненных последовательностей в окне сравнения. Для обеспечения оптимального выравнивания последовательностей для сравнения часть последовательности полинуклеотида или полипептида в окне сравнения может содержать добавления или делеции, называемые гэпами, тогда как эталонная последовательность остается неизменной. Оптимальным выравниванием является такое выравнивание, которое даже при наличии гэпов дает наибольшее возможное количество "идентичных" положений между эталонной и сравниваемой последовательностями. Процентное значение "идентичности последовательностей" между двумя последовательностями можно определить с помощью версии программы "BLAST 2 Sequences", которая была доступна от Национального центра биотехнологической информации по состоянию на 1 сентября 2004 года, каковая программа включает в себя программы BLASTN (для сравнения нуклеотидных последовательностей) и BLASTP (для сравнения последовательностей полипептидов), каковые программы основаны на алгоритме Карлина-Альтшуля (Proc. Natl. Acad. Sci. USA 90(12):5873-5877, 1993). При использовании программы "BLAST 2 Sequences" параметры, которые были параметрами по умолчанию по состоянию на 1 сентября 2004 года, могут применяться для размера слова (3), штрафа за открытие гэпа (11), штрафа за продление гэпа (1), величины снижения балла для выравнивания с гэпами (50), ожидаемого значения (10) и любого другого необходимого параметра, в том числе, без ограничений, для выбора матрицы.
[0035] Термины "композиция" или "фармацевтическая композиция" относятся к композициям, содержащим пептид, являющийся агонистом рецепторов GLP-1/глюкагона, представленный в настоящем документе, вместе, например, с фармацевтически приемлемыми носителями, наполнителями или растворителями для введения субъекту, нуждающемуся в лечении, например, человеку, которого лечат от ожирения.
[0036] Термин "фармацевтически приемлемый" относится к композициям, которые в пределах объема тщательной медицинской оценки подходят для контакта с тканями человека и животных, не вызывая избыточной токсичности или других осложнений, соответствуя целесообразному соотношению польза/риск.
[0037] "Эффективным количеством" называется такое количество пептида, являющегося агонистом рецепторов GLP-1/глюкагона, представленного в настоящем документе, введение которого субъекту в виде однократной дозы или части серии доз является эффективным для лечения, например, лечения ожирения. Количество является эффективным, например, в том случае, если его введение приводит к одному или нескольким из следующих результатов: снижение массы тела или поддержание массы тела (например, предупреждение набора массы тела), снижение массы жировой ткани, предупреждение или модуляция гипогликемии, предупреждение или модуляция гипергликемии, стимуляция синтеза инсулина или снижение потребления пищи. Это количество может быть представлено в виде фиксированной дозы для всех субъектов, получающих лечение, или может меняться в зависимости от массы тела, состояния здоровья и физического состояния субъекта, подлежащего лечению, желаемой степени снижения массы тела или поддержания массы тела, состава пептида, профессиональной оценки клинической ситуации, а также других соответствующих факторов.
[0038] Термин "субъект" подразумевает любого субъекта, в частности, субъекта-млекопитающего, нуждающегося в лечении с помощью пептида, являющегося агонистом рецепторов GLP-1/глюкагона, представленного в настоящем документе. Субъекты-млекопитающие включают, без ограничений, людей, собак, кошек, морских свинок, кроликов, крыс, мышей, лошадей, крупный рогатый скот, медведей, коров, обезьян, человекообразных обезьян, орангутанов, шимпанзе и т.д. В одном варианте осуществления субъектом является человек.
[0039] Используемый в настоящем документе термин "субъект, нуждающийся в лечении" относится к индивидууму, для которого желательно получение лечения, например, к субъекту с ожирением или субъекту, склонному к ожирению, для которого желательны содействие снижению массы тела или жировой ткани, поддержание массы тела или жировой ткани или предотвращение или минимизация набора массы тела в течение определенного периода времени.
[0040] Используемый в настоящем документе термин "пептид, являющийся агонистом рецепторов GLP-1/глюкагона" является химерным пептидом, который проявляет активность при связывании с рецептором глюкагона, составляющую по меньшей мере приблизительно 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более относительно активности нативного глюкагона, и также проявляет активность при связывании с рецептором GLP-1, составляющую по меньшей мере приблизительно 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более относительно активности нативного GLP-1, в условиях анализа 1.
[0041] Используемый в настоящем документе термин "нативный глюкагон" относится к встречающемуся в природе глюкагону, например, к глюкагону человека, содержащему последовательность SEQ ID NO:1. Термин "нативный GLP-1" относится к встречающемуся в природе GLP-1, например, к GLP-1 человека, и является обобщающим термином, который включает, например, GLP-1(7-36) в форме амида (SEQ ID NO:2), GLP-1(7-37) в форме кислоты (SEQ ID NO:3) или смесь этих двух соединений. Предполагается, что используемая в настоящем документе общая ссылка на "глюкагон" или " GLP-1" в отсутствие каких-либо дополнительных указаний означает нативный глюкагон человека или нативный GLP-1 человека, соответственно. Если не указано иное, "глюкагон" относится к глюкагону человека, а "GLP-1" относится к GLP-1 человека.
Пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона
[0042] В настоящем документе представлены пептиды, которые связываются как с рецептором глюкагона, так и с рецептором GLP-1. В определенных вариантах осуществления пептиды, представленные в настоящем документе, являются коагонистами активности глюкагона и GLP-1. Такие пептиды называются в настоящем документе пептидами, являющимися агонистами GLP-1/глюкагона. Пептиды, являющиеся агонистами GLP-1/глюкагона, представленные в настоящем документе, обладают видами активности GLP-1 и глюкагона в соотношениях, благоприятных для содействия снижению массы тела, предупреждения набора массы тела или поддержания желаемой массы тела, и обладают оптимизированной растворимостью, пригодностью для составления и стабильностью. В определенных вариантах осуществления пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, являются активными при связывании с рецепторами GLP1 человека и глюкагона человека; в определенном варианте осуществления относительная активность по сравнению с естественным лигандом при связывании с рецептором GLP-1 является по меньшей мере приблизительно в 1 раз, 2 раза, 5 раз, 8 раз, 10 раз, 15 раз, 20 раз или 25 раз более высокой, чем при связывании с рецептором глюкагона.
[0043] В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, имеют желаемые значения активности при связывании с рецепторами глюкагона и GLP-1 и имеют желаемые значения относительной эффективности для содействия снижению массы тела. В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, проявляют значения in vitro эффективности при связывании с рецептором GLP-1, определяемые в анализе 1 cAMP по EC50 (см. пример 2), составляющей менее 10000 пМ, менее 5000 пМ, менее 2500 пМ, менее 1000 пМ, менее 900 пМ, менее 800 пМ, менее 700 пМ, менее 600 пМ, менее 500 пМ, менее 400 пМ, менее 300 пМ, менее 200 пМ, менее 100 пМ, менее 50 пМ, менее 25 пМ, менее 20 пМ, менее 15 пМ, менее 10 пМ, менее 5 пМ, менее 4 пМ, менее 3 пМ или менее 2 пМ. В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, проявляют значения in vitro эффективности при связывании с рецептором GLP-1, определяемые в анализе cAMP в 4,4% человеческом сывороточном альбумине по EC50 (анализ 2, см. пример 2), составляющей менее 10000 пМ, менее 5000 пМ, менее 2500 пМ, менее 1000 пМ, менее 900 пМ, менее 800 пМ, менее 700 пМ, менее 600 пМ, менее 500 пМ, менее 400 пМ, менее 300 пМ, менее 200 пМ, менее 100 пМ, менее 50 пМ, менее 25 пМ, менее 20 пМ, менее 15 пМ, менее 10 пМ, менее 5 пМ, менее 4 пМ, менее 3 пМ или менее 2 пМ. В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, проявляют значения in vitro эффективности при связывании с рецептором глюкагона, определяемые в анализе 1 cAMP по EC50 (см. пример 2), составляющей менее 10000 пМ, менее 5000 пМ, менее 2500 пМ, менее 1000 пМ, менее 900 пМ, менее 800 пМ, менее 700 пМ, менее 600 пМ, менее 500 пМ, менее 400 пМ, менее 300 пМ, менее 200 пМ, менее 100 пМ, менее 50 пМ, менее 25 пМ, менее 20 пМ, менее 15 пМ, менее 10 пМ, менее 5 пМ, менее 4 пМ, менее 3 пМ или менее 2 пМ. В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, проявляют значения in vitro эффективности при связывании с рецептором глюкагона, определяемые в анализе cAMP в 4,4% человеческом сывороточном альбумине по EC50 (анализ 2, см. пример 2), составляющей менее 10000 пМ, менее 5000 пМ, менее 2500 пМ, менее 1000 пМ, менее 900 пМ, менее 800 пМ, менее 700 пМ, менее 600 пМ, менее 500 пМ, менее 400 пМ, менее 300 пМ, менее 200 пМ, менее 100 пМ, менее 50 пМ, менее 25 пМ, менее 20 пМ, менее 15 пМ, менее 10 пМ, менее 5 пМ, менее 4 пМ, менее 3 пМ или менее 2 пМ. В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, имеют относительные показатели эффективности по сравнению с нативными лигандами при связывании с GLP1-R/glucR в диапазоне от приблизительно 0,01 до 0,50, например, от приблизительно 0,02 до 0,30, например, приблизительно 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,10, 0,11. 0,12, 0,13, 0,14, 0,15, 0,16, 0,17, 0,18, 0,19, 0,20, 0,21, 0,22, 0,23, 0,24, 0,25, 0,26, 0,27, 0,28 или 0,30, при применении анализа 2.
[0044] В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, проявляют значения in vitro эффективности при связывании с рецептором глюкозозависимого инсулинотропного пептида (желудочного ингибиторного пептида) (GIPR), определяемые в анализе 1 cAMP по EC50 (см. пример 2), составляющей менее 10000 пМ, менее 5000 пМ, менее 2500 пМ, менее 1000 пМ, менее 900 пМ, менее 800 пМ, менее 700 пМ, менее 600 пМ, менее 500 пМ, менее 400 пМ, менее 300 пМ, менее 200 пМ, менее 100 пМ, менее 50 пМ, менее 25 пМ, менее 20 пМ, менее 15 пМ, менее 10 пМ, менее 5 пМ, менее 4 пМ, менее 3 пМ или менее 2 пМ. В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, проявляют значения in vitro эффективности при связывании с GIPR, определяемые в анализе cAMP в 4,4% человеческом сывороточном альбумине по EC50 (анализ 2, см. пример 2), составляющей менее 10000 пМ, менее 5000 пМ, менее 2500 пМ, менее 1000 пМ, менее 900 пМ, менее 800 пМ, менее 700 пМ, менее 600 пМ, менее 500 пМ, менее 400 пМ, менее 300 пМ, менее 200 пМ, менее 100 пМ, менее 50 пМ, менее 25 пМ, менее 20 пМ, менее 15 пМ, менее 10 пМ, менее 5 пМ, менее 4 пМ, менее 3 пМ или менее 2 пМ.
[0045] В определенных вариантах осуществления пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, обладают одним или несколькими критериями приемлемой растворимости, простоты в составлении, стабильности в плазме крови и улучшенных фармакокинетических свойств. В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, растворимы в стандартных буферах в широком диапазоне рН.
[0046] В определенных вариантах осуществления пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, растворимы в обычных буферных растворах в концентрации до 0,5 мг/мл, 0,6 мг/мл, 0,7 мг/мл, 0,8 мг/мл, 0,9 мг/мл, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл или более высокой, в буферных системах и в диапазоне значений ионной силы, например, от 0,25 до 150 мМ, в том числе, без ограничений, в фосфатном буфере, Трис-буфере, глутаматном буфере, ацетатном буфере, сукцинатном буфере или гистидиновом буфере. Примеры буферов включают 100 мМ глутаматный буфер с pH 4,5, 100 мМ ацетатный буфер с pH 5, 100 мМ сукцинатный буфер с pH 5, 100 мМ фосфатный буфер с pH 6, 100 мМ гистидиновый буфер с pH 6, 100 мМ фосфатный буфер с pH 6,5, 100 мМ фосфатный буфер с pH 7,0, 100 мМ гистидиновый буфер с pH 7,0, 100 мМ фосфатный буфер с pH 7,5, 100 мМ Трис-буфер с pH 7,5 и 100 мМ Трис-буфер с pH 8,0. В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, растворимы в стандартных буферах при 0,8 мг/мл в определенном диапазоне рН, например, от рН 4,0 до рН 8,0, например, при рН 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0 или 8,5. В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, растворимы в стандартных буферах при рН от 4,5 до 8,0, от 5,0 до 8,0, от 5,5 до 8,0, от 6,0 до 8,0, от 6,5 до 8,0, от 7,0 до 8,0, от 4,5 до 8,5, от 5,5 до 8,5, от 5,5 до 8,5, от 6,0 до 8,5, от 6,5 до 8,5 или от 7,0 до 8,5.
[0047] В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, пригодны для составления в стандартные фармацевтические составы. Примеры составов включают, без ограничений: 0,1 M Трис с pH 7,5, 150 мМ маннит, рН конечного состава = 7,2; 0,05 M Трис, 50 мМ аргинин/пролин, рН конечного состава = 8,0; или натрий-фосфатный буфер (рН=8)/1,85% вес/объем пропиленгликоль, рН конечного состава = 7,0. В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, растворимы в этих или других составах в концентрации до 0,5 мг/мл, 0,6 мг/мл, 0,7 мг/мл, 0,8 мг/мл, 0,9 мг/мл, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл или более высокой.
[0048] В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, являются достаточно устойчивыми к действию протеаз в сыворотке или плазме крови. Обычные продукты разложения глюкагона или GLP-1 включают продукты с массой +1 (кислоту) и продукты расщепления с помощью DPP-IV. Продукты с массой +1 могут образовываться в результате дезамидирования по амидным группам глутамина или на С-конце. Продукты расщепления образуются под действием протеазы DPP-IV в плазме крови. В определенных вариантах осуществления раскрываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, остаются стабильными в плазме крови на уровнях до 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% через 24 часа нахождения в плазме крови при 37°С.
[0049] В настоящем документе представлен пептид, являющийся агонистом рецепторов GLP-1/глюкагона, содержащий следующую аминокислотную последовательность:
HX2QGTFTSDX10SX12X13LX15X16X17X18AX20X21FX23X24WLX27X28GX30;
где X2 представляет собой G или S, X10 представляет собой Y или K, X12 представляет собой K, E, R или S, X13 представляет собой K или Y, X15 представляет собой D или E, X16 представляет собой S или G, X17 представляет собой E, R, Q или K, X18 представляет собой R, S или A, X20 представляет собой R, K или Q, X21 представляет собой D или E, X23 представляет собой V или I, X24 представляет собой A или Q, X27 представляет собой E или V, X28 представляет собой A или K, а X30 представляет собой G или R (SEQ ID NO:4). В определенных вариантах осуществления представлен указанный выше выделенный пептид, где X2 представляет собой S, X10 представляет собой Y или K, X12 представляет собой K, E, R или S, X13 представляет собой K или Y, X15 представляет собой D, X16 представляет собой S, X17 представляет собой E, R, Q или K, X18 представляет собой R, S или A, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X27 представляет собой E или V, X28 представляет собой A, а X30 представляет собой G (SEQ ID NO:5). В определенных вариантах осуществления представлен указанный выше выделенный пептид, где X2 представляет собой S, X10 представляет собой Y или K, X12 представляет собой K, E, R или S, X13 представляет собой K или Y, X15 представляет собой D, X16 представляет собой S, если X17 представляет собой E, то X18 представляет собой R, или если X17 представляет собой R, то X18 представляет собой S, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X27 представляет собой E или V, X28 представляет собой A, а X30 представляет собой G (SEQ ID NO:6 и SEQ ID NO:7, соответственно). В определенных вариантах осуществления представлен указанный выше выделенный пептид, где X2 представляет собой S, X10 представляет собой Y, X12 представляет собой K, X13 представляет собой K, X15 представляет собой D, X16 представляет собой S, если X17 представляет собой E, то X18 представляет собой R, или если X17 представляет собой R, то X18 представляет собой S, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X27 представляет собой V, X28 представляет собой A, а X30 представляет собой G (SEQ ID NO:8 и SEQ ID NO:9, соответственно). В определенных вариантах осуществления представлен указанный выше выделенный пептид, где X2 представляет собой S, X10 представляет собой K, X12 представляет собой K, E, R или S, X13 представляет собой Y, X15 представляет собой D, X16 представляет собой S, если X17 представляет собой E, то X18 представляет собой R, а если X17 представляет собой R, то X18 представляет собой S, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X27 представляет собой E, X28 представляет собой A, а X30 представляет собой G (SEQ ID NO:10 и SEQ ID NO:11, соответственно). В определенных вариантах осуществления представлен указанный выше выделенный пептид, где X2 представляет собой S, X10 представляет собой K, X12 представляет собой E, X13 представляет собой Y, X15 представляет собой D, X16 представляет собой S, если X17 представляет собой E, то X18 представляет собой R, или если X17 представляет собой R, то X18 представляет собой S, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X27 представляет собой E, X28 представляет собой A, а X30 представляет собой G (SEQ ID NO:12 и SEQ ID NO:13, соответственно). В определенных вариантах осуществления представлен указанный выше выделенный пептид, где X2 представляет собой S, X10 представляет собой K, X12 представляет собой R, X13 представляет собой Y, X15 представляет собой D, X16 представляет собой S, если X17 представляет собой E, то X18 представляет собой R, или если X17 представляет собой R, то X18 представляет собой S, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X27 представляет собой E, X28 представляет собой A, а X30 представляет собой G (SEQ ID NO:14 и SEQ ID NO:15, соответственно).
[0050] Пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, включают, без ограничений, G730 (SEQ ID NO:16), G797 (SEQ ID NO:17), G849 (SEQ ID NO:18), G933 (SEQ ID NO:19), G865 (SEQ ID NO:20), G796 (SEQ ID NO:21), G812 (SEQ ID NO:22) и G380 (SEQ ID NO:23). Эти пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, перечислены в таблице 1.
Последовательности пептидов для рецепторов GLP-1/глюкагона
K(gE-пальмитоил) = лизин с пальмитоильной группой, конъюгированной с эпсилон-атомом азота посредством линкера, представляющего собой гамма-глутаминовую кислоту.
[0051] Оба из пептидов G797 и G933 имеют глутаматный остаток в положении 12 и сохраняют устойчивую активность при связывании с рецепторами как глюкагона, так и GLP-1, как показано в примере 2. Соответствующим остатком является лизин у эксендина-4 и глюкагона и серин у GLP-1. Хотя считается, что этот остаток не контактирует с рецептором, изменения заряда с положительного на отрицательный могут изменить ближайшее окружение. Более того, G797, G849 и G933 имеют глутаматный остаток в положении 27. Остаток в 27 положении представляет собой лизин у экзендина-4 и незаряженный гидрофобный остаток у GLP-1 (валин) и глюкагона (метионин). Лизин эксенатида осуществляет электростатические взаимодействия с остатками Glu127 и Glu24 рецептора GLP-1 (C.R.Underwood et al J Biol Chem 285 723-730 (2010); S.Runge et al J Biol Chem 283 11340-11347 (2008)). Хотя в том случае, когда заряд в положении 27 меняется на отрицательный, можно ожидать потерю эффективности для GLP1R, это изменение соответствует активности G797, G849 и G933 в отношении GLP1R.
[0052] Способы получения. Настоящее раскрытие представляет способ получения пептида, являющегося агонистом рецепторов GLP-1/глюкагона. Пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, могут быть получены с применением любого подходящего способа. Например, в определенных вариантах осуществления пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, получают путем химического синтеза с применением способов, хорошо известных средним специалистам в данной области, например, путем твердофазного синтеза, как описано Merrifield (1963, J Am Chem Soc. 85:2149-2154). Твердофазный синтез пептидов может быть выполнен, например, с помощью автоматических синтезаторов с использованием стандартных реагентов, например, как поясняется в примере 1.
[0053] В качестве альтернативы, пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, могут быть получены рекомбинантным путем с использованием подходящей комбинации вектора/клетки-хозяина, которая может быть хорошо известна среднему специалисту в данной области. Существуют разнообразные способы получения пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, рекомбинантным путем. Как правило, последовательность полинуклеотида, кодирующая пептид, являющийся агонистом рецепторов GLP-1/глюкагона, вставляют в соответствующее средство экспрессии, например, в вектор, который содержит необходимые элементы для транскрипции и трансляции вставленной кодирующей последовательности. Нуклеиновую кислоту, кодирующую пептид, являющийся агонистом рецепторов GLP-1/глюкагона, вставляют в вектор в соответствующую рамку считывания. Вектор экспрессии затем вводят путем трансфекции в подходящую клетку-хозяина, которая будет экспрессировать пептид, являющийся агонистом рецепторов GLP-1/глюкагона. Подходящие клетки-хозяева включают, без ограничения, клетки бактерий, дрожжей или млекопитающих. Разнообразные коммерчески доступные системы хозяин/вектор экспрессии могут использоваться для экспрессии пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, описываемых в настоящем документе.
[0054] Модификации, конъюгаты, продукты слияния и производные. В определенных вариантах осуществления пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, стабилизированы посредством модификаций аминокислот. В определенных вариантах осуществления карбоксильная группа C-концевой аминокислоты является амидированной. В определенных вариантах осуществления C-концевой аминокислотой является амидированный глицин, например, G730, G797, G849, G865, G796, G812 и G380. В определенных вариантах осуществления, например, в случае G933, C-концевой глицин является немодифицированной кислотой. В определенных вариантах осуществления представлены пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, в которых один или несколько аминокислотных остатков являются ацилированными. Например, в определенных вариантах осуществления пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, содержат один или несколько лизиновых остатков, в которых пальмитоильный компонент присоединен к N(эпсилон)-группе. В определенных вариантах осуществления между лизином и пальмитоильной группой включен линкер. Этот линкер может представлять собой группу гамма-глутаминовой кислоты или альтернативный линкер, такой как, без ограничений, бета-аланин и аминогексановая кислота. Могут применяться различные способы ацилирования, например, добавление холестерина или миристоильных групп. В определенных вариантах осуществления пальмитоильный компонент добавляется в положение 13 (например, G730). В определенных вариантах осуществления пальмитоильный компонент добавляется в положение 10 (например, G797, G849, G933, G865, G796 и G812). В определенных вариантах осуществления пальмитоильный компонент добавляется в положение 17 (например, G380).
[0055] Пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, например, G730, G797, G849 и G933, могут быть пальмитированы для увеличения их периода полувыведения путем ассоциации с сывороточным альбумином с уменьшением, таким образом, их склонности к выведению через почки, как описано в примере 1.
[0056] В качестве альтернативы или в дополнение, пептид, являющийся агонистом рецепторов GLP-1/глюкагона, раскрываемый в настоящем документе, можно подвергать ассоциации с гетерологичным компонентом, например, для увеличения периода полувыведения. Гетерологичный компонент может представлять собой белок, пептид, белковый домен, линкер, органический полимер, неорганический полимер, полиэтиленгликоль (PEG), биотин, альбумин, человеческий сывороточный альбумин (HSA), участок HSA, связывающийся с FcRn, антитело, домен антитела, фрагмент антитела, одноцепочечное антитело, доменное антитело, альбумин-связывающий домен, фермент, лиганд, рецептор, связывающий пептид, каркасный белок, отличный от FnIII, эпитопную метку, рекомбинантный полипептидный полимер, цитокин и комбинацию двух или более таких компонентов.
[0057] Например, пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, можно подвергать слиянию с гетерологичным полипептидом. Пептиды можно подвергать слиянию с белками путем слияния и экспрессии рекомбинантных генов или путем химической конъюгации. Белки, которые пригодны в качестве партнеров для слияния, включают, без ограничения, человеческий сывороточный альбумин, антитела и фрагменты антител, предусматривающие слияние с Fc-участком антител. GLP-1 подвергали слиянию с этими белками с сохранением эффективности (L. Baggio et al, Diabetes 53 2492-2500 (2004); P. Barrington et al Diabetes, Obesity and Metabolism 13 426-433 (2011); P. Paulik et al American Diabetes Association 2012, стендовый доклад 1946). Также было описано, что удлинение последовательностей рекомбинантных пептидов придает пептиду высокую молекулярную массу (V.Schellenberger et al Nature Biotechnol 27 1186-1190 (2009); ПАСилирование (EP2173890)). В определенных вариантах осуществления пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, включены в качестве N-концевой части гибридного белка, при этом партнер слияния, например, альбумин или Fc-участок, находится в C-концевой части. Пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, описываемые в настоящем документе, можно подвергать слиянию с пептидами или белковыми доменами, такими как "AlbudAb", которые имеют сродство к человеческому сывороточному альбумину (M.S. Dennis et al J Biol Chem 277 35035-35043 (2002); A. Walker et al Protein Eng Design Selection 23 271-278 (2010)). Способы слияния пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, которые раскрываются в настоящем документе, c гетерологичным полипептидом, например, с альбумином или с Fc-участком, хорошо известны средним специалистам в данной области.
[0058] Другие гетерологичные компоненты можно конъюгировать с пептидами, являющимися агонистами рецепторов GLP-1/глюкагона, для дополнительной стабилизации или для увеличения периода полувыведения. Для химического слияния в некоторых вариантах осуществления предусмотрено сохранение свободного N-конца, но могут быть созданы альтернативные точки для дериватизации. Дополнительным альтернативным способом является дериватизация пептида с помощью крупного химического компонента, такого как высокомолекулярный полиэтиленгликоль (PEG). У "пегилированного пептида, являющегося агонистом рецепторов GLP-1/глюкагона" имеется ковалентно связанная с ним цепь PEG. Дериватизацию пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, например, пегилирование, можно производить по лизину, который пальмитирован, или, в качестве альтернативы, по такому остатку, как цистеин, который для обеспечения дериватизации замещается или встраивается c удлинением молекулы. Вышеописанные формы пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, могут быть охарактеризованы in vitro и/или in vivo в отношении относительной эффективности и баланса между активацией рецепторов GLP-1 и глюкагона.
[0059] Общий термин "цепь полиэтиленгликоля" или "цепь PEG" относится к смесям конденсационных полимеров этиленоксида и воды c разветвленной или прямой цепью, которые представлены общей формулой Н(OCH2CH2)nOH, где n является целым числом 3, 4, 5, 6, 7, 8, 9 или более. Цепи PEG включают в себя полимеры этиленгликоля с общей средней молекулярной массой, выбранной из диапазона от приблизительно 500 до приблизительно 40000 дальтон. Средняя молекулярная масса цепи PEG обозначается числом, например, PEG-5000 обозначает цепь полиэтиленгликоля, имеющую общую среднюю молекулярную массу приблизительно 5000.
[0060] Пегилирование может быть осуществлено с применением любой из реакций пегилирования, известных в данной области. См., например, Focus on Growth Factors, 3: 4-10, 1992 и заявки на Европейские патенты EP 0154316 и EP 0401384. Пегилирование может быть выполнено с применением реакции ацилирования или реакции алкилирования с реакционноспособной молекулой полиэтиленгликоля (или аналогичного реакционноспособного водорастворимого полимера).
[0061] Способы получения пегилированных пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, как правило, включают этапы (a) введения пептида, являющегося агонистом рецепторов GLP-1/глюкагона, в реакцию с полиэтиленгликолем (как, например, с реакционноспособным сложным эфиром или альдегидным производным PEG) в условиях, при которых молекула присоединяется к одной или нескольким группам PEG, и (b) получения продукта(продуктов) реакции.
Фармацевтические композиции
[0062] Дополнительно представлены композиции, например, фармацевтические композиции, которые содержат эффективное количество пептида, являющегося агонистом рецепторов GLP-1/глюкагона, представленного в настоящем документе, составленные для лечения метаболических заболеваний, например, ожирения.
[0063] Композиции по настоящему раскрытию могут быть составлены в соответствии с известными способами. Подходящие способы получения описаны, например, в Remington's Pharmaceutical Sciences, 19th Edition, A.R. Gennaro, ed., Mack Publishing Co., Easton, PA (1995), включенном в настоящий документ в полном объеме посредством ссылки. Композиция может быть представлена в различных формах, в том числе, без ограничений, в форме водного раствора, эмульсии, геля, суспензии, в лиофилизированной форме или любой другой форме, известной в данной области. В дополнение, композиция может содержать фармацевтически приемлемые добавки, в том числе, например, растворители, связующие вещества, стабилизаторы и консерванты. После составления композиции по настоящему изобретению можно непосредственно вводить субъекту.
[0064] Носители, которые можно применять с композициями по настоящему изобретению, хорошо известны в данной области техники и включают, без ограничений, например, тиреоглобулин, альбумины, такие как человеческий сывороточный альбумин, столбнячный анатоксин и полиаминокислоты, такие как поли-L-лизин, поли-L-глутаминовая кислота, капсидный белок вируса гриппа, гепатита B и т.п. Могут применяться разнообразные водные носители, например, вода, буферная вода, 0,8% солевой раствор, 0,3% глицин, гиалуроновая кислота и подобные. Композиции можно стерилизовать с применением обычных, хорошо известных методик стерилизации или можно подвергать стерилизующей фильтрации. Полученную в результате композицию можно упаковать для применения в существующем состоянии или лиофилизировать, в этом случае лиофилизированный препарат объединяют со стерильным раствором перед введением. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, которые необходимы для приблизительного соответствия физиологическим условиям, такие как средства регуляции рН и буферные средства, средства регуляции тоничности, увлажняющие средства и т.п., например, ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, сорбитанмонолаурат, триэтаноламинолеат и т.д.
Способ лечения ожирения, модельные системы
[0065] Пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, могут сочетать в себе эффект глюкагона, например, снижение потребления пищи или регуляцию уровня глюкозы, и эффект GLP-1, например, ингибирование перистальтики желудка или стимуляцию высвобождения инсулина. Их действие, следовательно, может быть направлено на ускорение устранения избыточной жировой ткани, индукцию устойчивого снижения массы тела и улучшение гликемического контроля. Действие пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, также может быть направлено на ослабление факторов риска сердечно-сосудистых заболеваний, таких как высокий уровень холестерина и высокий уровень холестерина LDL или аномальное соотношение уровней HDL/LDL.
[0066] В настоящем раскрытии представлен способ лечения ожирения или связанного с ожирением заболевания или нарушения, включающий введение субъекту, нуждающемуся в лечении, пептида, являющегося агонистом рецепторов GLP-1/глюкагона, раскрываемого в настоящем документе. Дополнительно представлен пептид, являющийся агонистом рецепторов GLP-1/глюкагона, для лечения ожирения или связанного с ожирением заболевания или нарушения. Дополнительно представлено применение пептида, являющегося агонистом рецепторов GLP-1/глюкагона, представленного в настоящем документе, в производстве лекарственного препарата для лечения ожирения или связанного с ожирением заболевания или нарушения.
[0067] Пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, можно вводить для предупреждения набора массы тела, стимуляции снижения массы тела, снижения избыточной массы тела или лечения ожирения (например, путем контроля аппетита, питания, потребления пищи, потребления калорий и/или расходования энергии), в том числе патологического ожирения. В дополнение, пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, можно применять для лечения других связанных с ожирением нарушений метаболизма. Примеры других связанных с ожирением нарушений включают, без ограничений: инсулинорезистентность, нарушение толерантности к глюкозе, предиабет, повышенный уровень глюкозы натощак, сахарный диабет 2 типа, гипертензию, дислипидемию (или комбинацию этих метаболических факторов риска), глюкагономы, сердечно-сосудистые заболевания, такие как застойная сердечная недостаточность, атеросклероз, артериосклероз, ишемическая болезнь сердца или заболевание периферических артерий, инсульт, респираторная дисфункция или заболевание почек.
[0068] "Лечением" называется подход, применяемый для получения благоприятных или желаемых клинических результатов. Описываемые в настоящем документе благоприятные или желаемые клинические результаты применения раскрываемых пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, включают, без ограничений, снижение массы тела, снижение темпов набора массы тела, снижение аппетита, снижение или стабилизацию уровней глюкозы в сыворотке крови и инсулина в сыворотке крови, снижение интенсивности, облегчение, стабилизацию, уменьшение степени тяжести связанных с ожирением заболеваний или задержку или замедление прогрессирование связанных с ожирением заболеваний. "Лечение" относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам в определенных вариантах осуществления. Субъекты, нуждающиеся в лечении, включают тех субъектов, у которых уже имеется нарушение, а также тех, у которых необходимо предупредить нарушение. Под лечением подразумевается подавление или снижение темпов увеличения интенсивности связанных с ожирением симптомов (например, набора массы тела) по сравнению с отсутствием лечения и не обязательно подразумевается полное прекращение соответствующего состояния.
[0069] Путем введения пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, представленных в настоящем документе, может быть, например, пероральный, парентеральный, ингаляционный или местный. Используемый в настоящем документе термин "парентеральный" включает, например, внутривенное, внутриартериальное, внутрибрюшинное, внутримышечное, подкожное, ректальное или вагинальное введение. Другой пример формы для введения представляет собой раствор для инъекций, в частности, для внутривенных или внутриартериальных инъекций или для капельного внутривенного вливания. Пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, могут вводиться в виде однократной дозы или в виде многократных доз. В определенных вариантах осуществления пептид, являющийся агонистом рецепторов GLP-1/глюкагона, вводят путем подкожной инъекции.
[0070] Составы для парентерального введения можно вводить в виде однократной болюсной дозы, путем инфузии или в виде нагрузочной болюсной дозы с последующим введением поддерживающей дозы. Эти композиции можно вводить с определенными фиксированными или переменными интервалами, например, один раз в день или по мере необходимости. Режимы дозирования также можно корректировать для обеспечения оптимального желаемого ответа (например, терапевтического или профилактического ответа).
[0071] Количество пептида, являющегося агонистом рецепторов GLP-1/глюкагона, для введения может быть легко определено средним специалистом в данной области без проведения ненужной экспериментальной работы с учетом раскрытия, приведенного в настоящем документе. Факторы, влияющие на способ введения и соответствующее количество пептида, являющегося агонистом рецепторов GLP-1/глюкагона, включают, без ограничений, тяжесть заболевания (например, степень ожирения), анамнез субъекта, а также возраст, рост, массу тела, состояние здоровья и физическое состояние субъекта, подвергающегося терапии. Аналогичным образом, количество пептида, являющегося агонистом рецепторов GLP-1/глюкагона, для введения будет зависеть от способа введения и от того, будут ли введены субъекту однократная доза или многократные дозы этого средства. В определенных вариантах осуществления пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, представленные в настоящем документе, могут вводиться один раз в день путем инъекции.
НАБОРЫ
[0072] В еще нескольких вариантах осуществления в настоящем раскрытии представлены наборы, содержащие пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, которые можно применять для осуществления способов, описываемых в настоящем документе. В определенных вариантах осуществления набор содержит пептид, являющийся агонистом рецепторов GLP-1/глюкагона, раскрываемый в настоящем документе, в одном или нескольких контейнерах. Специалист в данной области легко поймет, что описываемые пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, можно легко включить в один из установленных форматов наборов, которые хорошо известны в данной области техники.
ПРИМЕРЫ
Пример 1. Синтез, модификации и характеристика пептидов, являющихся агонистами рецепторов GLP-1/глюкагона
[0073] Список сокращений:
Вос: трет-бутилоксикарбонил
трет-Bu: трет-бутил
DCM: дихлорметан
DIC: диизопропилкарбодиимид
Fmoc: 9-флуоренилметоксикарбонил
HOBt: 1-гидроксибензотриазол
HPLC: высокоэффективная жидкостная хроматография
Mtt: 4-метилтритил
NMP: N-метилпирролидон
Pbf: 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил
TFA: трифторуксусная кислота
TIS: триизопропилсилан
Trt: трифенилметил, тритил
[0074] Пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, синтезировали следующим образом. Удлинение пептидных цепей на смоле NovaSyn TGR или предварительно загруженной смоле Ванга, модифицированной с помощью Fmoc (Novabiochem), проводили при помощи твердофазного пептидного синтезатора PRELUDE™ (ProteinTechnologies, Тусон, Аризона, США). Предоставленные производителями протоколы применяли для реакции сочетания гидроксибензотриазоловых сложных эфиров аминокислот в N-метилпирролидоне (NMP). Флуоренилметоксикарбонильную (Fmoc) группу применяли для полупостоянной защиты альфа-аминогрупп аминокислот, тогда как боковые цепи защищали трет-бутилом (трет-Bu) для серина, треонина, аспарагиновой кислоты, глутаминовой кислоты и тирозина, и 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонилом (Pbf) для аргинина, и тритилом (Trt) для гистидина. N-концевую аминогруппу гистидина в положении 1 защищали трет-бутилоксикарбонильной группой (Boc). Lys (Mtt) встраивали в пептидную цепь, когда требовалась последующая химическая модификация боковой цепи.
[0075] После окончания удлинения пептидной цепи Mtt-группу удаляли путем промывания комплекса пептид-смола с помощью DCM, содержащего 2% TFA и 5% TIS (10×7 мл, по 0,5 мин). Реакцию сочетания липидного компонента и боковой цепи Lys проводили в синтезаторе пептидов PRELUDE™ с использованием DIC в качестве реагента сочетания в присутствии HOBt.
[0076] Пептиды отщепляли от смолы с применением смеси TFA:TIS:вода (95:2,5:2,5). Через 2 часа при комнатной температуре пептидил-смолу отфильтровывали, промывали с помощью TFA, а объединенные фильтраты выпаривали досуха in vacuo. Остаток растирали с эфиром, а образовавшийся осадок отфильтровывали, промывали эфиром и высушивали. Неочищенные пептиды растворяли в 5% уксусной кислоте в воде и анализировали с помощью обращенно-фазовой жидкостной хроматографии высокого давления на колонке Polaris 3-С8A, подсоединенной к системе Varian 920-LC. Для анализа применяли систему стандартного градиента буфера B от 10 до 90% в течение 15 мин. Буфер A представлял собой 0,1% TFA в воде, а буфер B представлял собой 0,1% TFA в ацетонитриле. Профили HPLC регистрировали при 210 нм. Препаративные разделения проводились на системе Varian ProStar с колонкой С18 RP XBridge Waters для полупрепаративной хроматографии. Для разделения применялась вышеописанная система растворителей из воды и ацетонитрила в градиенте буфера B от 30 до 70% в течение 30 минут. Хроматографически однородные продукты (чистота >97%) анализировали с помощью масс-спектрометрии с ионизацией электрораспылением (MassLynx, Waters).
Пример 2. In vitro исследования опосредованной рецепторами глюкагона и GLP-1 выработки cAMP
[0077] Биологическая активность пептидов в клеточном количественном анализе активности по уровню cAMP (количественный анализ 1)
Биологическую активность пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, синтезированных с применением способа, описанного в примере 1, оценивали в тестировании биологической активности, например, путем стимуляции одного или нескольких реакций клеточных рецепторов с применением следующих способов. Стабильные клеточные линии, экспрессирующие рецептор GLP-1 (GLP-1R), рецептор глюкагона (GCGR) или рецептор глюкозозависимого инсулинотропного пептида (желудочного ингибиторного полипептида) (GIPR) человека, мыши, крысы или собаки, получали из клеток HEK293S или клеток СНО с применением стандартных способов. Активация пептидами этих различных рецепторов приводит к последующей выработке вторичного мессенджера cAMP, что может быть измерено в анализе функциональной активности.
[0078] Анализы cAMP проводили с применением "среды для анализа":
Среда для анализа: 10% FBS в DMEM (Gibco № 41966), содержащая 0,5 мМ IBMX (Sigma № 17018).
384-луночные планшеты с низким связыванием белков (Greiner № 781280) применяли для проведения одиннадцати серийных разведений тестируемых образцов 1 к 5, которые выполняли в среде для анализа. Все разведения образцов выполнялись в двух повторностях.
[0079] Замороженную криопробирку с клетками, экспрессирующими рецептор, представляющий интерес, быстро размораживали на водяной бане, переносили в предварительно подогретую среду для анализа и центрифугировали при 240 × g в течение 5 минут. Клетки повторно суспендировали в среде для анализа в оптимизированной концентрации (например, клетки с hGCGR при 1×105 клеток/мл, клетки с hGLP-1R и hGIPR при 0,5×105 клеток/мл).
[0080] Из планшета для разведения реплику на 5 мкл наносили отпечатком на черный 384-луночный планшет с мелкими лунками с U-образным дном (Corning № 3676). К ней добавляли суспензию клеток на 5 мкл, и планшеты инкубировали при комнатной температуре в течение 30 минут.
[0081] Уровни cAMP измеряли с применением коммерчески доступного набора Dynamic 2 для анализа cAMP по методу HTRF (Cisbio, № по кат. 62AM4PEJ), следуя двухэтапному протоколу согласно рекомендациям производителя. Вкратце; криптат, конъюгированный с антителом к cAMP (донорный флуорофор), и cAMP-d2 (акцепторный флуорофор) приготавливали отдельно путем разведения 1/20 в буфере для конъюгации и лизиса, представленном в наборе. 5 мкл криптата, конъюгированного с антителом к cAMP, добавляли во все лунки аналитического планшета, и 5 мкл cAMP-d2 добавляли во все лунки за исключением лунок для неспецифического связывания (NSB), в которые добавляли буфер для конъюгации и лизиса. Планшеты инкубировали при комнатной температуре в течение одного часа, а затем прочитывали на Envision (Perkin Elmer), используя длину волны возбуждения 320 нм и длины волн излучения 620 нм и 665 нм.
[0082] Последовательности синтезированных пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, и их значения EC50, определенные в анализах cAMP, выполненных в "среде для анализа", показаны в таблице 2. Все пептиды в таблице 2 были синтезированы с C-концевым амидом. Дополнительные пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, были синтезированы с C-концевой кислотой, и значения EC50, определенные в анализах cAMP, выполненных в "среде для анализа", показаны в таблице 3. Значения EC50 для дополнительных пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, определенные в "среде для анализа", показаны в таблице 4. Все пептиды в таблице 4 имеют C-концевой амид, если они не обозначены как "кислота", в каковом случае они имеют C-концевую кислоту.
Активность пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, с C-концевым амидом, определенная по уровню cAMP (анализ 1)
Активность пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, с C-концевой кислотой, определенная по уровню cAMP (анализ 1)
Активность дополнительных пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, определенная по уровню cAMP
(анализ 1)
K(gE-пальмитоил) = лизин с пальмитоильной группой, конъюгированной с эпсилон-атомом азота посредством линкера, представляющего собой гамма-глутаминовую кислоту;
K(Ahx-пальмитоил) = лизин с пальмитоильной группой, конъюгированной с эпсилон-атомом азота посредством линкера, представляющего собой аминогексановую кислоту;
K(bA-пальмитоил) = лизин с пальмитоильной группой, конъюгированной с эпсилон-атомом азота посредством линкера, представляющего собой бета-аланиновую кислоту;
Aib, аминоизомасляная кислота;
K(пальмитоил) = лизин с пальмитоильной группой, непосредственно конъюгированной с эпсилон-атомом азота.
[0083] Анализы опосредованной рецепторами глюкагона и GLP-1 выработки cAMP в присутствии различных концентраций сывороточного альбумина в плазме крови (анализ 2). Определение эффективности агонистов для пептидов, индуцирующих выработку cAMP, осуществляли в клетках CHO, экспрессирующих рецепторы глюкагона человека, крысы или мыши (сокращенно GlucR или GCGR) или рецепторы GLP-1 в присутствии человеческого, крысиного или мышиного сывороточного альбумина при 4,4, 3,2 и 3,2%, соответственно, как описано ниже.
[0084] Клетки CHO со стабильной экспрессией рекомбинантного рецептора GlucR или GLP-1 человека, мыши или крысы культивировали в DMEM с добавлением 10% FBS и генетицина (100 мкг/мл). Запасы криоконсервированных клеток готовили в 1x бессывороточной среде для заморозки клеток с DMSO (Sigma Aldrich)) при 2×107/пробирка и хранили при -80°C. Клетки быстро размораживали при 37°C, а затем разбавляли в аналитическом буфере (DMEM), содержащем сывороточный альбумин при 4,4, 3,2 и 3,2% для человеческого, крысиного и мышиного сывороточного альбумина, соответственно. Пептиды подвергали серийному разведению в DMSO, а затем разбавляли в 100 раз в DMEM, содержащей сывороточный альбумин в указанной конечной концентрации. Разбавленные пептиды затем переносили в черные 384-луночные аналитические микропланшеты для титрования с мелкими лунками. Клетки добавляли в аналитические планшеты и инкубировали в течение 30 мин при комнатной температуре. После инкубирования анализ останавливали, и измеряли уровни cAMP с помощью набора Dynamic d2 для анализа cAMP по методу HTRF®, доступного от Cisbio Bioassays, в соответствии с руководством от производителя. Планшеты прочитывали на флуоресцентном планшет-ридере ENVISION® от Perkin Elmer. Человеческий и крысиный сывороточные альбумины были приобретены у Sigma Aldrich, а мышиный сывороточный альбумин - у Equitech Bio Ltd.
[0085] Данные переводили в % дельта-F, как это описано в руководстве от производителя, и анализировали с помощью подбора кривой с применением 4-параметрического логарифмического логистического метода, чтобы определить значения EC50. Значения ЕС50, полученные в анализе 2 для выбранных пептидов, показаны в таблице 5. Определенные в ходе анализа 2 значения ЕС50 зависят как от собственной эффективности пептидов, тестируемых при связывании с рецепторами GLP1 и глюкагона в рекомбинантных линиях клеток, так и от сродства пептида к сывороточному альбумину, которое определяет количество свободного пептида. Ассоциация с сывороточным альбумином повышает получаемое значение ЕС50. Доля свободного пептида при различных концентрациях альбумина в плазме крови и ЕС50 при 0% HSA могут быть рассчитаны на основе изменения образования cAMP с изменением концентрации HSA. К примеру, G730 и G933 давали значения 0,85% и 0,29% для свободного пептида при 4,4% HSA и 7 пМ и 6 пМ для ЕС50 при связывании с GLP1R при 0% HSA, соответственно. G797 и G849 дают значения 0,82% и 0,48% для свободного пептида при 4,4% HSA и 7 пМ и 2 пМ для ЕС50 при связывании с GLP1R при 0% HSA, соответственно. Для сравнения баланса активностей при связывании с GLP1R и GlucR для различных пептидов и в различных условиях их можно сопоставить с применением расчета, описанного ниже, где устанавливается связь между значениями ЕС50 и соответствующими значениями для естественных лигандов.
Выраженные в EC50 значения эффективности пептидов, являющихся агонистами рецепторов GLP-1/глюкагона,
в присутствии различных концентраций сывороточного альбумина в плазме (анализ 2)
[0086] Тестирование стабильности пептидов в плазме крови. Стабильность пептидов G730, G797, G849 и G933 в плазме крови определяли, как описано ниже.
[0087] Исходные растворы пептидов при приблизительно 200 мкмоль/л готовили путем отвешивания твердого пептида в пробирке Eppendorf с низким связыванием белка и растворяли в DMSO. По 10 мкл исходных растворов добавляли к 990 мкл плазмы крови в пробирке Eppendorf с низким связыванием белка с получением начальной концентрации пептидов в плазме крови, составляющей приблизительно 2 мкмоль/л. Замороженную контрольную плазму крови человека, крысы и мыши размораживали и нагревали до температуры 37°C перед добавлением исходного раствора. Образцы плазмы крови с введенным точным количеством исходного раствора осторожно перемешивали, и обеспечивали их уравновешивание в течение приблизительно 5 минут перед началом эксперимента. Образцы плазмы крови инкубировали в течение 48 часов в инкубаторе GalaxyR с атмосферой CO2 при 37°C. Отбор образцов (30 мкл) производили в моменты времени 0, 1, 2, 6,5, 17, 24 и 48 часов. Образцы хранили при -70°C до проведения анализа.
[0088] Образцы плазмы крови анализировали, как описано ниже. В образцах плазмы крови на 30 мкл осаждали белок с применением 180 мл холодного этанола в 96-луночном планшете с низким связыванием белка (Eppendorf Protein LoBind). После перемешивания и центрифугирования 100 мкл надосадочной жидкости переносили в новый планшет, и 1 мкл вводили в аналитическую колонку.
[0089] Анализ выполняли с применением системы микрокапиллярной LC (LC Exigent μLC), соединенной с масс-спектрометром среднего и высокого разрешения (Perkin Elmer PenTOF) с положительной ионизацией электрораспылением. Аналитическая колонка представляла собой колонку Agilent Poroshell С18 (изготовленную по заказу) 5 см × 1 мм с размером частиц 2,7 мкм. Скорость потока: 0,1 мл/мин. с использованием медленного градиента для обращенно-фазовой хроматографии. Используемые подвижные фазы представляли собой ацетонитрил и воду, содержащие 0,1% муравьиную кислоту.
[0090] Полученные данные оценивали вручную для следующих продуктов разложения: продукт с массой +1 (кислота) и продукт расщепления с помощью DPP-IV. Продукты с массой +1 могут образовываться в результате дезамидирования по амидным группам глутамина или на С-конце. Продукты расщепления образуются под действием протеазы DPP-IV в плазме крови. Как разложение пептидов, так и образование пептидных продуктов регистрировали в виде процентной доли от начальной концентрации пептидов. Пики интегрировали, и рассчитывали % оставшегося пептида: (площадь пика/площадь пика в 0 ч)*100. Данные для момента времени 24 ч показаны в таблице 6. Уровни дезамидирования и расщепления с помощью DPP-IV для G797 и G933 были низкими.
Стабильность пептидов в плазме крови
[0091] Растворимость. Растворимость пептидов оценивали в различных видах буферов в диапазоне рН от 4,5 до 8,0, как описано ниже. Пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, в виде сухого порошка растворяли в различных буферах при комнатной температуре. Поглощение измеряли при 280 нм с использованием спектрофотометра NanoDrop 2000, и концентрацию пептидов рассчитывали с помощью следующего уравнения:
c=(A280*Mw)/ε;
где: c - концентрация, ε - коэффициент экстинкции,
Mw- молекулярная масса, A280 - поглощение при 280 нм
ε=(1×Trp=5560)+(1×Tyr=1200)
[0092] Результаты показаны в таблице 7. Каждый из пептидов был растворим при 0,8 мг/мл в диапазоне различных значений рН (от 6,5 до 8,5). G730 был растворим в диапазоне рН от 4,5 до 8,0, G797 был растворим в диапазоне рН от 6 до 8,0, и G933 был растворим в диапазоне рН от 6 до 8,0. Растворимость G933 тестировали в ряде различных буферных систем, также показанных в таблице 7. G933 был растворим при 1 мг/мл по меньшей мере в следующих буферных системах: гистидин (рН 6 и 7; ионная сила: от 0,25 до 100 мМ), фосфат натрия (рН 6-7,5; ионная сила: от 0,25 до 100 мМ) и трис(гидроксиметил)аминометан (рН 7-9; ионная сила: от 0,25 до 100 мМ).
Профиль растворимости пептидов
(ионная сила всех буферов: 100 мМ)
A280
Целевое значение 1 мг/мл
[0093] Составы. Растворимость пептидов оценивали в трех различных изотонических составах:
Основной состав (DF)= 0,1M Трис, pH 7,5, 150 мМ маннит. рН конечного состава = 7,2.
Вспомогательный состав 1 (BF1)=0,05M Трис, 50 мМ аргинин/пролин. рН конечного состава = 8,0.
Вспомогательный состав 2 (BF2)= натрий-фосфатный буфер (pH 8)/1,85% вес/объем пропиленгликоль. рН конечного состава = 7,0.
[0094] Растворимость измеряли, как описано выше, и результаты показаны в таблице 8. G730, G797 и G933 были растворимы по меньшей мере до 5 мг/мл в DF, максимальная растворимость G849 в DF составляла 3,7 мг/мл, G797 был растворимым по меньшей мере до 10 мг/мл в BF1, и G933 был растворим по меньшей мере до 10 мг/мл в BF2.
Растворимость пептидов в составе
Концентрацию определяли при A280 нм
[0095] Стабильность DF оценивали путем измерения чистоты методом обращенно-фазовой сверхэффективной жидкостной хроматографии (RP UPLC) в течение одного месяца. Условия хранения были следующими: 5°C, 25°C, 40°C и -80°C. Результаты показаны в таблицах 9 и 10.
Чистота пептидного состава спустя 1 месяц в условиях стабильности
Потеря чистоты пептидного состава (% по сравнению с T0)
спустя 1 месяц в условиях стабильности
Все пептиды показали приемлемые характеристики в отношении растворимости, пригодности для составления и стабильности.
Пример 3. Исследования in vivo
[0096] G730, G797 и G812 (исследование A). Выбранные пептиды, являющиеся агонистами рецепторов GLP-1/глюкагона, раскрываемые в настоящем документе, тестировали в мышиной модели алиментарного ожирения (DIO), как описано ниже. Самкам C57/B16JHsdO1a (полученным от Harlan Laboratories, Великобритания) начинали давать корм с высоким содержанием жиров D12492 (Research Diets, Нью-Джерси, США) и шоколадное кондитерское изделие "Delicatoball" (Delicata Bakverk, Швеция) в возрасте 9-11 недель, и их выдерживали на таком рационе в течение 16 недель до прибытия в виварий, в течение трех недель периода акклиматизации и в ходе обработки лекарственными средствами; калорийность двух компонентов рациона показана в таблице 11. Мышей разделяли на 9 групп (n=5-6), и обработку начинали в возрасте 29 недель. Группы обработки и дозы показаны в таблице 12.
Содержимое рациона в модели DIO
Группы обработки для исследования A
[0097] Пептиды G730, G797 и G812, являющиеся агонистами рецепторов GLP-1/глюкагона, а также лираглутид составляли в инертном веществе, 100 мМ Трис/150 мМ маннит, pH 7,4. Обработку осуществляли путем подкожного введения составов два раза в день в течение 14 дней, при этом животных выдерживали на рационе с высоким содержанием жиров. Массу тела животных отслеживали ежедневно в течение периода дозирования. В день 14 от мышей, находящихся в сознании после 4-часового периода голодания, получали образцы крови для измерения уровня глюкозы и инсулина в плазме крови. Затем мышей подвергали анестезии изофлураном, и производили терминальный отбор крови из капиллярного русла позади глаза. Измеряли следующие параметры: показатели биохимического анализа крови, представляющие собой уровни триглицеридов, общего холестерина, неэстерифицированных жирных кислот (NEFA), бета-гидроксибутирата и фактора роста фибробластов 21 (FGF21) (таблицы 14 и 15 ниже).
[0098] Эффект обработки лираглутидом и пептидами G730, G797 и G812, являющимися агонистами рецепторов GLP-1/глюкагона, в отношении массы тела по сравнению с обработкой лираглутидом и инертным веществом показан на фигурах 1-4. У животных, которых обрабатывали с помощью G730 или G797, демонстрировалось дозозависимое и непрерывное снижение массы тела в течение 14 дней периода дозирования. При 50 нмоль/кг у животных, которых обрабатывали с помощью G730 и G797, проявлялось приблизительно 24% изменение массы тела в день 14 по сравнению с животными, которых обрабатывали инертным веществом.
[0099] У мышей, которых обрабатывали с помощью G730 или G797, демонстрировалось дозозависимое снижение уровней глюкозы в день 14 (таблица 13). Также при применении этих двух видов обработки наблюдалось снижение уровней инсулина, особенно при более высоких дозах (таблица 13). Индекс чувствительности к инсулину, определенный в гомеостатической модели оценки (HOMA), значительно улучшался при 20 нмоль/кг G730 и 20 и 50 нмоль/кг G797. HOMA представляет собой способ моделирования, в котором используется сумма уровней инсулина и глюкозы в плазме крови для оценки функции β-клеток и инсулинорезистентности (таблица 14). Уровень общего холестерина в плазме крови снижался под действием как лираглутида, так и G730 и G797 во всех дозах, при этом изменения уровней неэстерифицированных жирных кислот (NEFA) в плазме крови и уровней триглицеридов (TG) в плазме крови и печени были менее выраженными. Наблюдалась тенденция к повышению уровней бета-гидроксибутирата (BeHy) наряду со снижением массы тела. Уровень фактора роста фибробластов 21 (FGF21), как правило, повышался при обработке пептидами, являющимися двойными агонистами рецепторов GLP-1/глюкагона.
Эффект обработки пептидами, являющимися агонистами рецепторов GLP-1/глюкагона,
в отношении уровней глюкозы, инсулина и HOMA-индекса
Эффект обработки пептидами, являющимися агонистами рецепторов GLP-1/глюкагона, в отношении дополнительных показателей биохимического анализа крови
* означает p<0,05 по сравнению с инертным веществом.
[0100] G865, G933 и G796 (исследование B). Дополнительный набор пептидов, являющихся агонистами рецепторов GLP-1/глюкагона, тестировали в модели алиментарного ожирения с применением того же протокола, который описан выше, но с группами обработки и дозами, показанными в таблице 15.
Группы обработки для исследования B
[0101] Пептиды G865, G933 и G796, являющиеся агонистами рецепторов GLP-1/глюкагона, а также лираглутид составляли в инертном веществе, 100 мМ Трис/150мМ маннит, pH 7,4. Обработку осуществляли путем подкожного введения составов два раза в день в течение 14 дней, при этом животных выдерживали на рационе с высоким содержанием жиров. Массу тела животных отслеживали ежедневно в течение периода дозирования. В день 14 от мышей, находящихся в сознании после 4-часового периода голодания, получали образцы крови для измерения уровня глюкозы и инсулина в плазме крови. Затем мышей подвергали анестезии изофлураном, и производили терминальный отбор крови из капиллярного русла позади глаза. Измеряли следующие параметры: показатели биохимического анализа крови, представляющие собой уровни триглицеридов, общего холестерина, неэстерифицированных жирных кислот (NEFA), бета-гидроксибутирата и фактора роста фибробластов 21 (FGF21) (таблица 16 и таблица 17 ниже).
[0102] Эффект обработки лираглутидом и пептидами G933, G865, G796, являющимися агонистами рецепторов GLP-1/глюкагона, в отношении массы тела по сравнению с обработкой лираглутидом и инертным веществом показан на фигурах 5-8. У животных, которых обрабатывали с помощью G933, G865 или G796, демонстрировалось дозозависимое и непрерывное снижение массы тела в течение 14 дней периода дозирования.
[0103] Уровни глюкозы, уровни инсулина и HOMA-индекс в день 14 после окончания обработки показаны в таблице 16. Уровни общего холестерина в плазме крови, уровни неэстерифицированных жирных кислот (NEFA) в плазме крови, уровни триглицеридов (TG) в плазме крови и печени, уровни бета-гидроксибутирата (BeHy) и уровни фактора роста фибробластов 21 (FGF21) в день 14 после окончания обработки показаны в таблице 17.
Эффект обработки пептидами, являющимися агонистами рецепторов GLP-1/глюкагона, в отношении уровней глюкозы, инсулина и HOMA-индекса
* означает p<0,05 по сравнению с инертным веществом.
Эффект обработки пептидами, являющимися агонистами рецепторов GLP-1/глюкагона, в отношении дополнительных показателей биохимического анализа крови
* означает p<0,05 по сравнению с инертным веществом.
[0104] Объем настоящего раскрытия не должен ограничиваться конкретными описанными вариантами осуществления, которые подразумеваются в качестве единичных иллюстраций отдельных аспектов настоящего раскрытия, и любыми композициями или способами, которые являются функционально эквивалентными в пределах объема настоящего раскрытия. В действительности, различные модификации настоящего раскрытия, в дополнение к тем, которые показаны и описаны в настоящем документе, будут очевидны специалистам в данной области из предшествующего описания и сопроводительных графических материалов. Предусматривается, что такие модификации включены в объем прилагаемой формулы изобретения.
[0105] Все публикации и заявки на патенты, упоминаемые в данном описании, включены в настоящий документ посредством ссылки в той же степени, как если бы каждая отдельная публикация или заявка на патент была конкретно и отдельно указана как включенная посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДЫ ГЛЮКАГОНОВОГО СУПЕРСЕМЕЙСТВА, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ОТНОСИТЕЛЬНО ЯДЕРНЫХ ГОРМОНАЛЬНЫХ РЕЦЕПТОРОВ | 2011 |
|
RU2604067C2 |
| АНАЛОГИ ГЛЮКАГОНА, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ РАСТВОРИМОСТЬЮ И СТАБИЛЬНОСТЬЮ В БУФЕРАХ С ФИЗИОЛОГИЧЕСКИМИ ЗНАЧЕНИЯМИ Ph | 2009 |
|
RU2560254C2 |
| АНАЛОГИ ГЛЮКАГОНА, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ РАСТВОРИМОСТЬЮ В БУФЕРАХ С ФИЗИОЛОГИЧЕСКИМ ЗНАЧЕНИЕМ pH | 2008 |
|
RU2477286C2 |
| ПРОЛЕКАРСТВА, СОДЕРЖАЩИЕ КОНЬЮГАТ ГИАЛУРОНОВОЙ КИСЛОТЫ, ЛИНКЕРА И ДВОЙНОГО АГОНИСТА GLP-1/ГЛЮКАГОНА | 2016 |
|
RU2719482C2 |
| СОЕДИНЕНИЯ АГОНИСТЫ РЕЦЕПТОРА ГЛЮКАГОНОПОДОБНОГО БЕЛКА-1 (GLP-1R) | 2008 |
|
RU2432361C2 |
| КОНЪЮГАТЫ ИНСУЛИН-ИНКРЕТИН | 2014 |
|
RU2678134C2 |
| ПОЛИПЕПТИДЫ, СЕЛЕКТИВНЫЕ К РЕЦЕПТОРАМ ГЛЮКАГОНА, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2760007C2 |
| ДВОЙНЫЕ АГОНИСТЫ GLP1/GIP ИЛИ ТРОЙНЫЕ АГОНИСТЫ GLP1/GIP/ГЛЮКАГОНА | 2013 |
|
RU2652783C2 |
| ОСНОВАННЫЕ НА АМИДАХ ПРОЛЕКАРСТВА ПЕПТИДОВ ГЛЮКАГОНОВОГО НАДСЕМЕЙСТВА | 2009 |
|
RU2550696C2 |
| АНАЛОГИ ОКСИНТОМОДУЛИНА | 2009 |
|
RU2542362C2 |











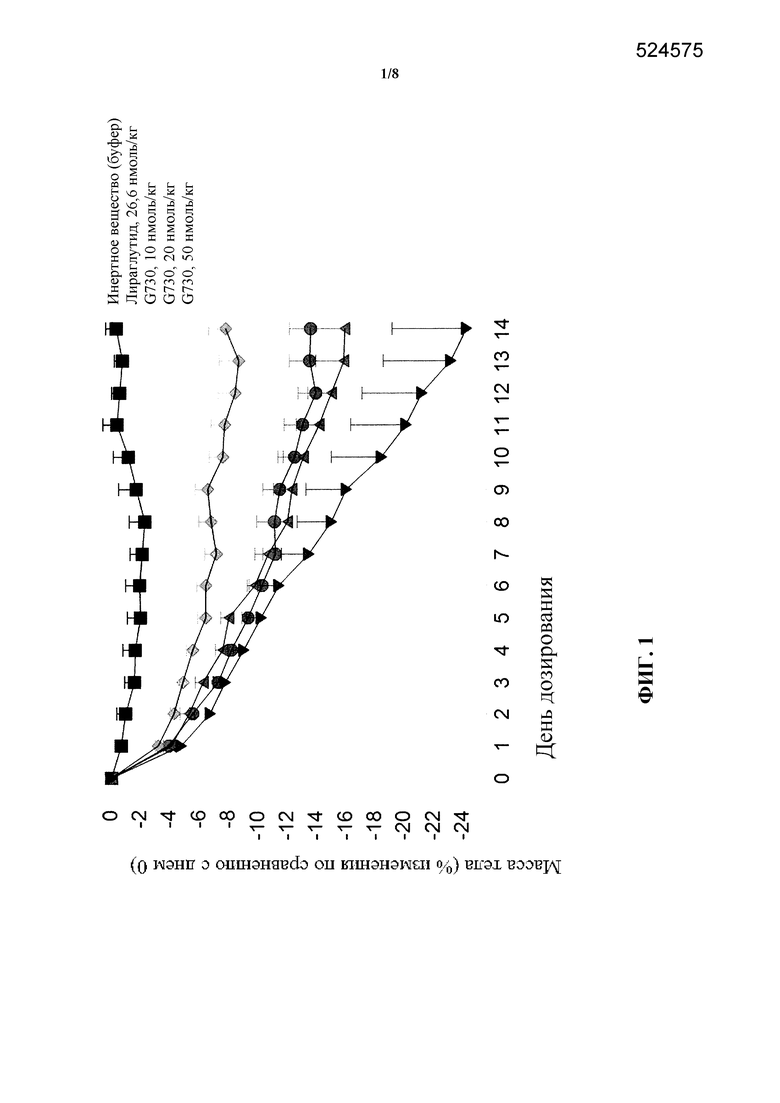
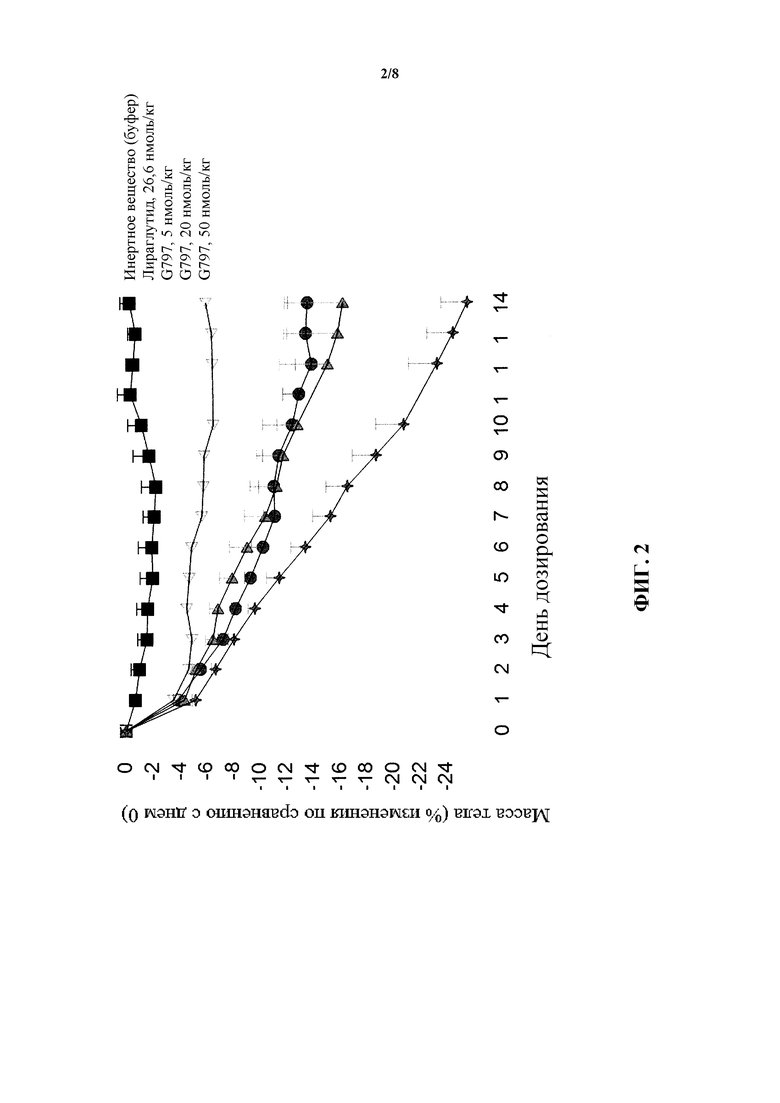
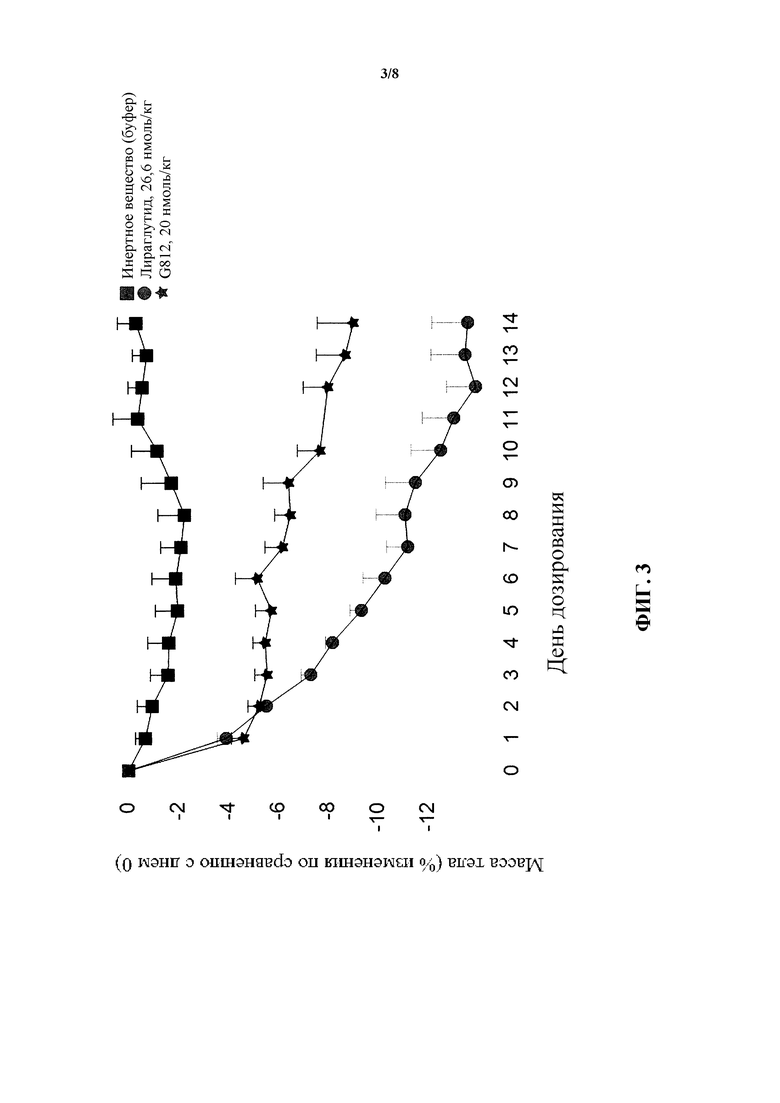
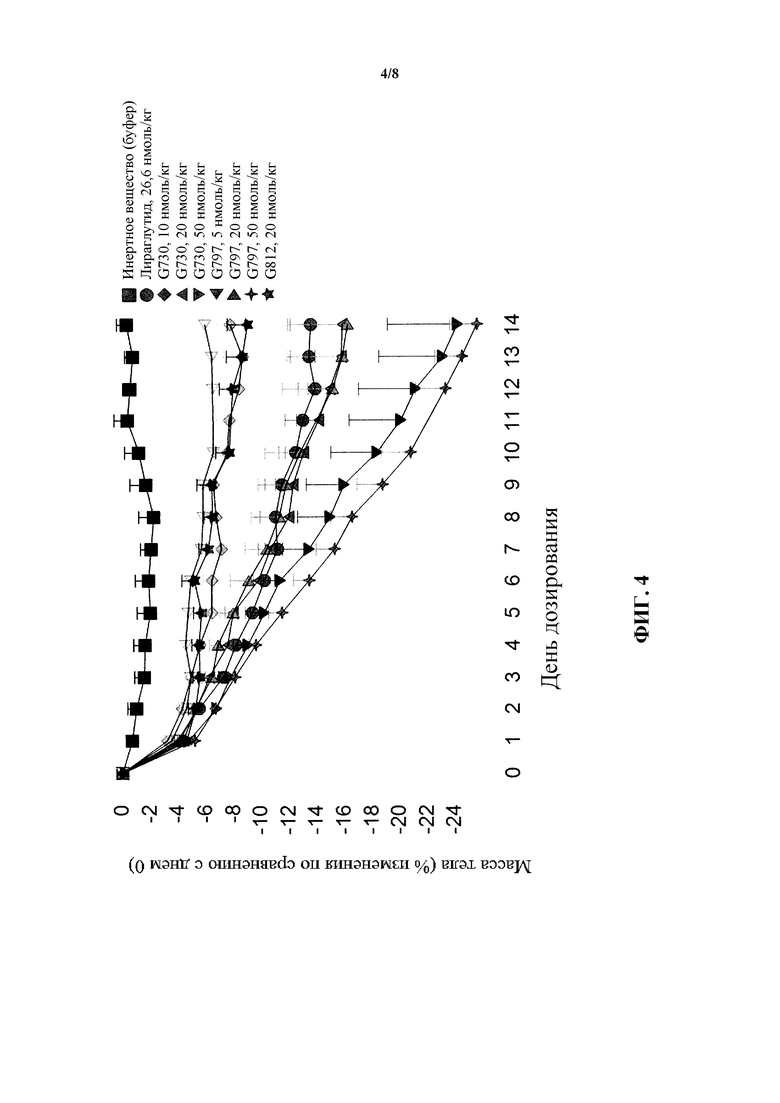
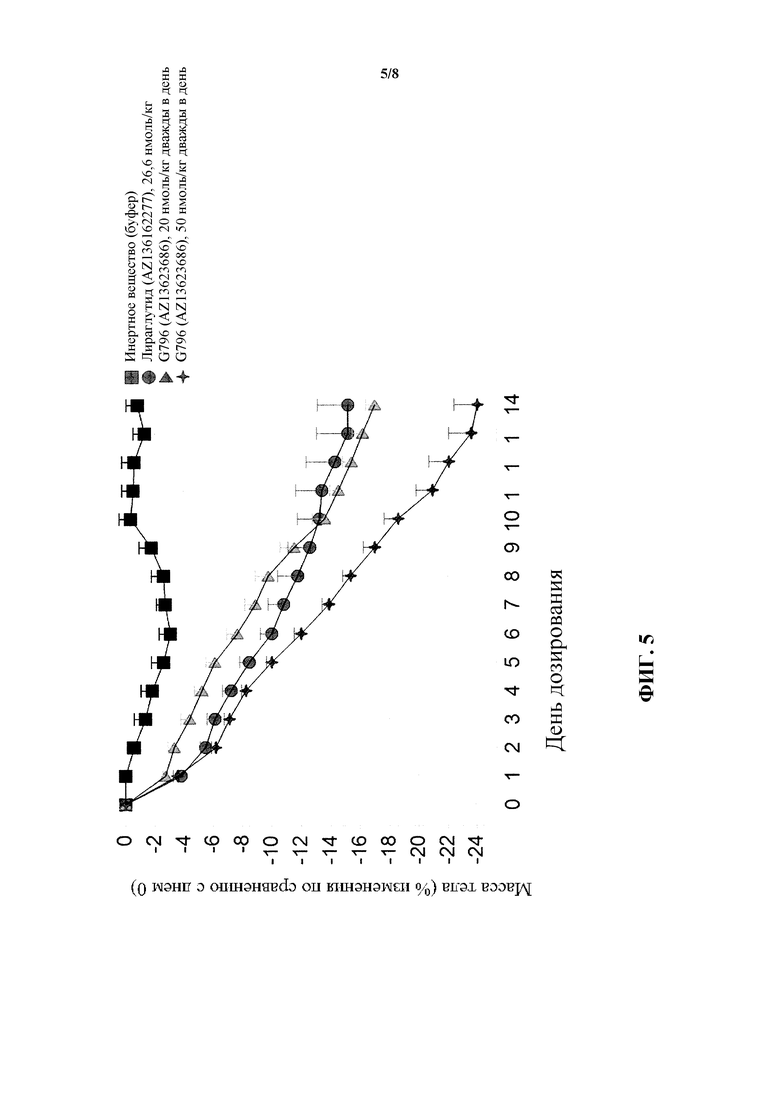
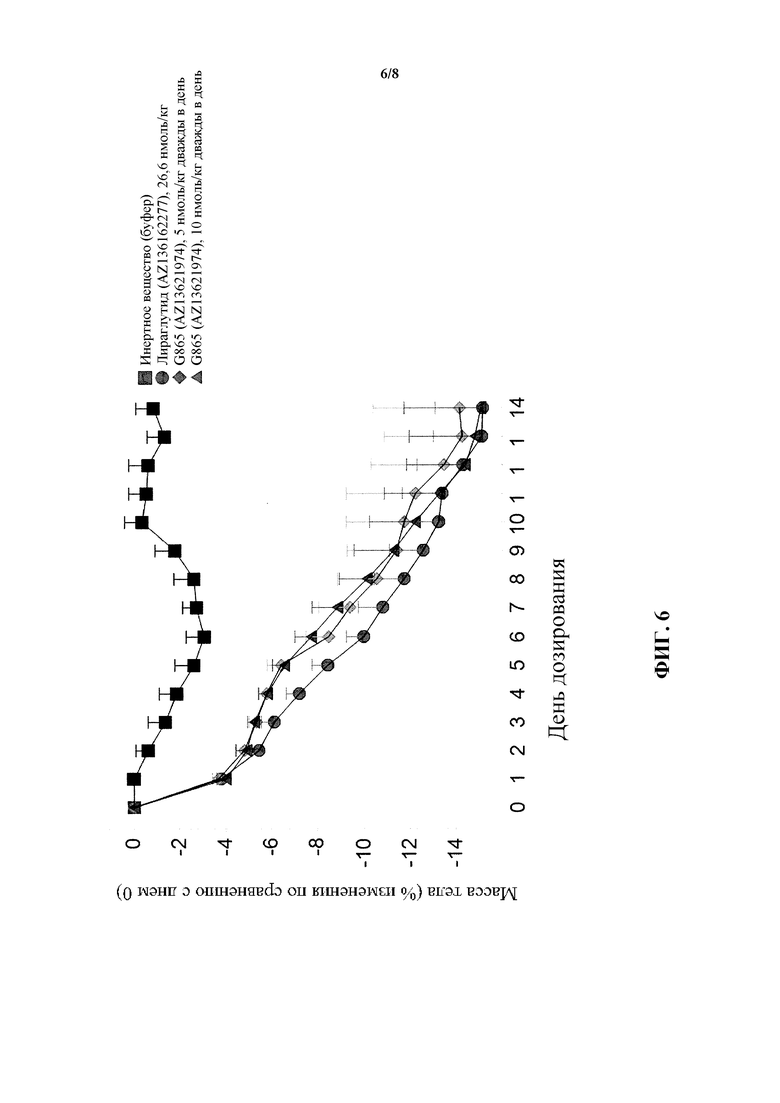
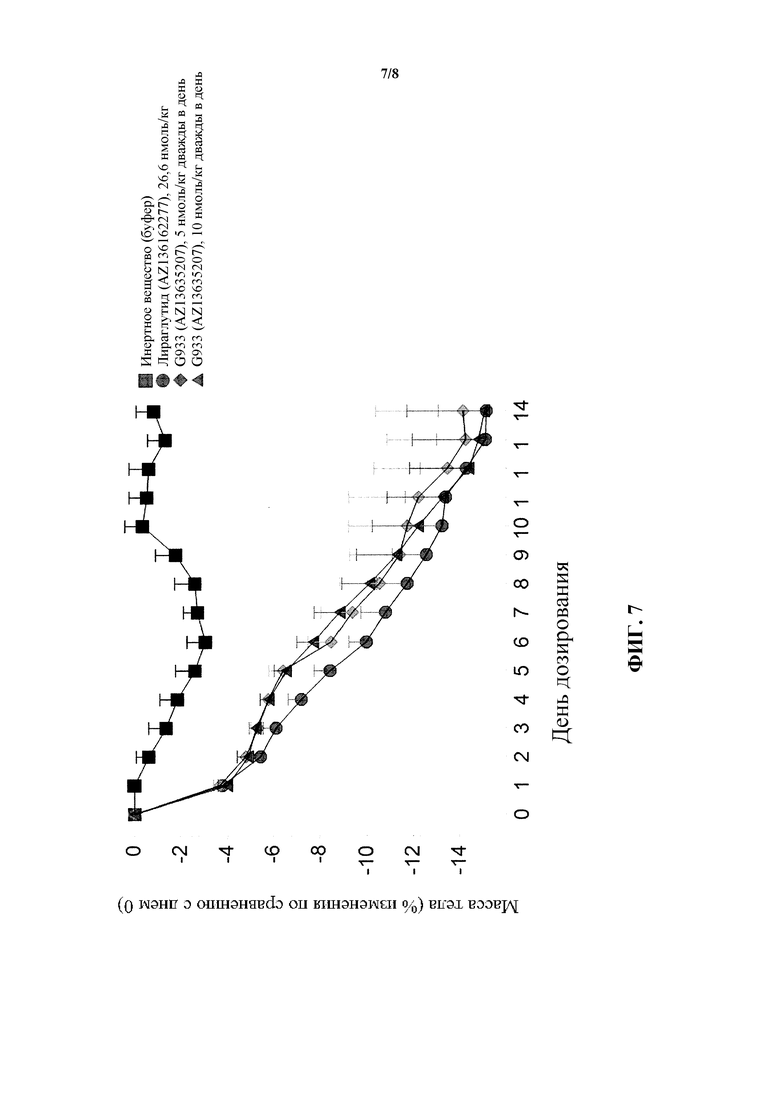
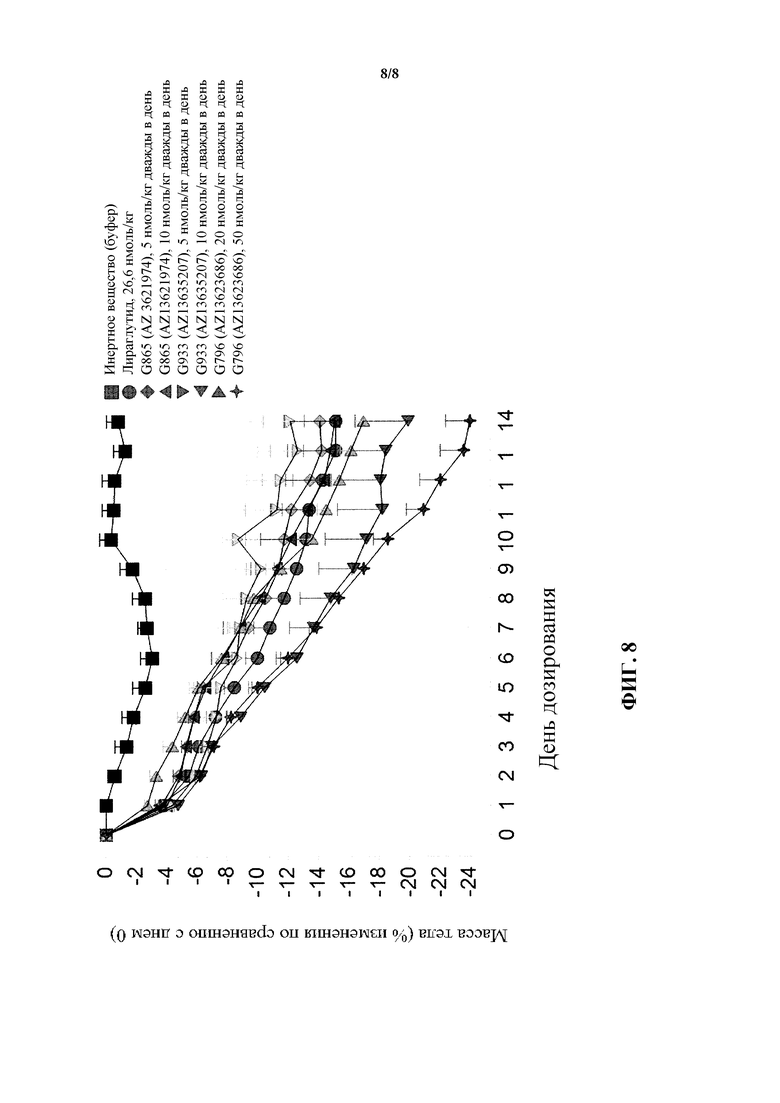
Настоящее изобретение относится к области биотехнологии, конкретно к пептидным агонистам рецепторов GLP-1/глюкагона, и может быть использовано в медицине для лечения ожирения. Получены пептиды с общей структурой HX2QGTFTSDX10SX12X13LX15X16X17X18AX20X21FX23X24WLX27X28GX30 (SEQ ID NO:4), а также их модифицированные формы, например HSQGTFTSDK(gE-пальмитоил)SEYLDSERARDFVAWLEAGG. Изобретение позволяет эффективно понижать массу тела, что может быть использовано при лечении ожирения. 4 н.п. ф-лы, 8 ил., 17 табл., 3 пр.
1. Выделенный пептид-агонист рецепторов GLP-1/глюкагона, состоящий по существу из аминокислотной последовательности
HX2QGTFTSDX10SX12X13LX15X16X17X18AX20X21FX23X24WLX27X28GX30 (SEQ ID NO:4);
где
(1) X2 представляет собой S, X10 представляет собой Y, X12 представляет собой K, X13 представляет собой K, X15 представляет собой D, X16 представляет собой S, X17 представляет собой E, X18 представляет собой R, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X27 представляет собой V, X28 представляет собой A, и X30 представляет собой G (SEQ ID NO: 16);
(2) X2 представляет собой S, X10 представляет собой K, X12 представляет собой E, X13 представляет собой Y, X15 представляет собой D, X16 представляет собой S, X17 представляет собой E, X18 представляет собой R, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X27 представляет собой E, X28 представляет собой A, и X30 представляет собой G (SEQ ID NO: 17);
(3) X2 представляет собой S, X10 представляет собой K, X12 представляет собой S, X13 представляет собой Y, X15 представляет собой D, X16 представляет собой S, X17 представляет собой R, X18 представляет собой S, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X27 представляет собой E, X28 представляет собой A, и X30 представляет собой G (SEQ ID NO: 20);
(4) X2 представляет собой S, X10 представляет собой K, X12 представляет собой E, X13 представляет собой Y, X15 представляет собой D, X16 представляет собой S, X17 представляет собой E, X18 представляет собой R, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X27 представляет собой E, X28 представляет собой A, и X30 представляет собой G (SEQ ID NO: 19); или
(5) X2 представляет собой S, X10 представляет собой K, X12 представляет собой S, X13 представляет собой Y, X15 представляет собой D, X16 представляет собой S, X17 представляет собой R, X18 представляет собой R, X20 представляет собой R, X21 представляет собой D, X23 представляет собой V, X24 представляет собой A, X27 представляет собой E, X28 представляет собой A, и X30 представляет собой G (SEQ ID NO:21).
2. Фармацевтическая композиция для понижения массы тела или для понижения массы тела при лечении ожирения, содержащая эффективное количество пептида по п. 1 и фармацевтически приемлемый носитель.
3. Выделенный пептид-агонист рецепторов GLP-1/глюкагона, содержащий последовательность
HSQGTFTSDK(gE-пальмитоил)SEYLDSERARDFVAWLEAGG-кислоту.
4. Фармацевтическая композиция для понижения массы тела или для понижения массы тела при лечении ожирения, содержащая эффективное количество пептида по п. 3 и фармацевтически приемлемый носитель.
| HJORTH S | |||
| A | |||
| ET AL., GLUCAGON AND GLUCAGON-LIKE PEPTIDE 1: SELECTIVE RECEPTOR RECOGNITION VIA DISTINCT PEPTIDE EPITOPES, JOURNAL OF BIOLOGICAL CHEMISTRY, 1994, v | |||
| Нож для надрезывания подошвы рантовой обуви | 1917 |
|
SU269A1 |
| Приспособление для автоматической односторонней разгрузки железнодорожных платформ | 1921 |
|
SU48A1 |
| WO 2004022004, 18.03.2004 | |||
| WO 2011143209, 17.11.2011 | |||
| Льнопрядильная машина | 1928 |
|
SU14647A1 |
Авторы
Даты
2018-10-29—Публикация
2013-12-10—Подача