Изобретения относятся к фармацевтической промышленности, конкретно к средствам для стимуляции роста клеток гранулоцитарного и лимфоидного ряда в костном мозге и регенерации костной ткани и способам их получения.
Остеомиелит - инфекционный воспалительный процесс, поражающий все элементы кости, костный мозг и нередко характеризующееся генерализацией. К увеличению числа больных с хроническим остеомиелитом в последнее время приводят рост травматизма и широкое использование металлоостеосинтеза в лечении переломов. Несмотря на достигнутые успехи в лечении данного заболевания, частота рецидивов достигает от 10 до 40% и это сопряжено с повторными операциями. При этом наблюдается тенденция к смещению от ограниченных форм заболевания в сторону более тяжелых проявлений [9, 18, 19]. Известно, что развитие остеомиелита сопровождается как метаболическими нарушениями в органической основе костной ткани и костном мозге, так и сосудистыми и иммунными нарушениями [1, 8].
Современное лечение остеомиелита направлено по трем звеньям: воздействие на макроорганизм (консервативная терапия), на микроорганизм (антибиотикотерапия) и на местный очаг (хирургическое удаление инфицированной ткани). По последним двум направлениям исследования ведутся активно. Так, авторами описан ряд оптимальных способов антибиотикотерапии [3, 6, 15] и хирургической санации [10, 11]. Данные способы лечение направлены на устранение инфицирующего агента, либо дефектов костной ткани. В то же время, в патогенезе остеомиелита значение имеют следующие изменения: ослабление иммунной защиты (в том числе, вследствие нарушения функции костного мозга), нарастание воспалительного процесса, нарушение кровоснабжения и регенерации костной ткани в зоне поражения. Применение комплексных средств консервативной терапии остеомиелита мало исследовано, в то же время, их применение при остеомиелите является актуальным и необходимым [4, 5, 7, 17].
Предложены несколько лекарственных средств для лечения остеомиелита антиоксидантами. Так, авторами выявлено изменение показателей перекисного окисления липидов (ПОЛ) и антиоксидантной системы в острой стадии заболевания и их нормализация в динамике комплексной патогенетической терапии синтетическими антиоксидантами [12, 13]. Экспериментально показана эффективность применения при остеомиелите иммуномодулирующих средств: трансфер фактора молозива [16] и средства на основе прополиса [2]. Исследовано влияние β-аланиламида бетулоновой кислоты при остеомиелите, действие которого ускоряет регенерацию костной ткани [14].
Согласно стандартам оказания медицинской помощи при хирургических инфекциях, терапия остеомиелита сопровождается длительным применением антибиотиков, негормональных противовоспалительных средств (НПВС), иммуномодуляторов, обладающих рядом побочных эффектов и обусловливающих высокую ксенобиотическую нагрузку на организм.
Поэтому, поиск лекарственных средств для лечения остеомиелита, является актуальной проблемой современной медицины. В этом плане перспективны лекарственные средства на основе природных биологически активных веществ, обладающие полимодальным фармакологическим действием, сочетанным с низкой токсичностью и редким индуцированием аллергических реакций.
Ранее для лечения остеомиелита на основе растительных экстрактов не были описаны.
Новый технический результат состоит в расширении арсенала средств консервативной терапии остеомиелита, обладающих высокой активностью и низкой токсичностью, а так же способов их получения.
Поставленную задачу решают применением экстракта из листьев соссюреи спорной (Saussurea controversa DC сем. Asteraceae) для стимуляции роста клеток гранулоцитарного и лимфоидного ряда в костном мозге и регенерации костной ткани.
Способ получения экстракта соссюреи спорной заключается в экстракции листьев, измельченных до 3-6 мм 40% этанолом при температуре 80°C трехкратно в течение 60 мин при соотношении сырье-экстрагент 1:15 с последующим удалением экстрагента под вакуумом до получения сухого остатка.
Фармакологические испытания
В качестве объекта исследования использовали листья S.controversa, собранные в июле 2013 г в местах естественного произрастания в Иркутской области. Воздушно-сухой растительный материал с влажностью 6,3±0,1% измельчали и просеивали через сита с диаметром отверстий 2-6 мм. Экстракт получали путем обработки сырья 40% этанолом методом мацерации при нагревании. Извлечения концентрировали под вакуумом досуха при температуре не выше 50°C.
Эксперименты выполняли на белых крысах самцах линии Вистар массой 280-300 г, количество животных в каждой группе - 6. Животных содержали в стандартных условиях вивария при свободном доступе к воде и пище. При проведении экспериментов руководствовались принципами, изложенными в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинской декларации. Экспериментальный остеомиелит развивали с применением ранее разработанной модели (Способ моделирования травматического остеомиелита, патент №2584402 от 21.04.2016). Статистическую обработку результатов проводили с использованием пакета программ статистического анализа Statistica 6,0. Для оценки значимости отличий между выборками использовали непараметрический критерий Манна-Уитни с вычислением среднего арифметического значения М и его стандартной ошибки т.
Первичную оценку эффективности экстракта при экспериментальном остеомиелите проводили с помощью метода трехфазной сцинтиграфии. Животных распределяли на три группы: интактные (1); с экспериментальным остеомиелитом, не леченные (2); с экспериментальным остеомиелитом, леченные экстрактом соссюреи спорной (3). У крыс 2 и 3 групп моделировали травматический остеомиелит правой бедренной кости. С 7-го дня эксперимента животным 3 группы внутрижелудочно вводили экстракт один раз в сутки в течение трех недель в виде водной суспензии в дозе 100 мг/кг. Трехфазную сцинтиграфию с 99mТс-технефор (ООО «Диамед», Россия, 18,5 МБк) выполняли на 7 и 28 сутки эксперимента на однофотонном эмиссионном компьютерном томографе Philips BrightView (США). Исследование включало в себя радионуклидную ангиографию, мягкотканную фазу (blood-pool) и костную фазу исследования (остеосцинтиграфию).
В результате исследования на 7 сутки в группе здоровых крыс определялось одновременное поступление индикатора в магистральные сосуды задних конечностей, отсутствие участков гиперфиксации препарата в мягкотканную и костные фазы исследования. В 2 и 3 группах регистрировалось ускоренное и повышенное поступление препарата в артерии на стороне поражения, а также определялись участки гиперфиксации индикатора в мягкотканую и костную фазы исследования, что расценивалось нами как проявление остеомиелита.
На 28-е сутки у крыс второй группы повышенное поступление препарата на стороне пораженной конечности сохранялось во все фазы сцинтиграфического исследования. В то же время у крыс 3 группы происходило уменьшение фиксации препарата в мягкотканую фазу на 44%, что свидетельствовало о положительной динамике воспалительного процесса в окружающих тканях пораженной конечности (фиг. 1). В костную фазу исследования у крыс 3 группы происходило снижение концентрации препарата, поступающего в правую конечность, на 64% в сравнении с группой 2 (фиг. 2). Полученный результат в виде уменьшения степени аккумуляции радиофармацевтического препарата в 3 группе животных указывает на снижение костного метаболизма и гиперемии мягких тканей, что отражает положительную динамику течения остеомиелита при применении экстракта S. controversa.
Влияние экстракта на состояние костного мозга и костной ткани исследовали на фоне антибиотикотерапии (Цефазолин), рекомендуемой стандартом лечения.
Для этого крыс распределяли на четыре группы: интактные (1); с экспериментальным остеомиелитом, не леченные (2); с экспериментальным остеомиелитом, леченные антибиотиком широкого спектра цефазолином (3); с экспериментальным остеомиелитом, леченные экстрактом S.controversa и антибиотиком (4). Экстракт вводили в желудок в виде водной суспензии в дозе 100 мг/кг в течение 14 дней. Животным 3-5 групп внутримышечно вводили антибиотик цефалоспориновой группы Цефазолин («Рузфарма», Россия) в дозе 50 мг/кг в течение пяти дней. На 21 сутки животных выводили из эксперимента при использовании CO2-асфиксии.
Состояние костномозгового кроветворения у крыс оценивали путем подсчета общего количества миелокариоцитов (ОКК) на бедренную кость (106/бедро) и миелограмм на мазках. Для чего, костный мозг из канала левой бедренной кости вымывали 1 мл 5% раствора уксусной кислоты и ресуспендировали. Дополнительное разведение проводили с помощью лейкоцитарного меланжера (конечное разведение в 20000 раз). Вычисление ОКК проводили с помощью камеры Горяева. Миелограммы подсчитывали на мазках, приготовленных из гомогената фрагмента миелоидной ткани, взятой из сегмента грудины, и аутологичной сыворотки (1:1), комбинированно окрашенных фиксатором-красителем Май-Грюнвальда и азур II-эозином по Нохту. Процентное содержание отдельных клеточных форм при подсчете миелограмм переводили в абсолютные цифры - ×106 клеток на бедро.
Для гистологического исследования правую бедренную кость декальцинировали, обезвоживали в спиртах восходящей концентрации и заливали в парафин. Депарафинированные срезы толщиной 7 мкм окрашивали гематоксилином и эозином.
При наблюдении клинической картины к 10 дню у всех крыс группы 2 появилась боль при пальпации, увеличение объема коленного сустава в 2-3 раза по сравнению со здоровой конечностью, а также наблюдали симптомы разлитого воспаления окружающих тканей. В группе 3 у 5-ти животных происходило расхождение краев раны и наблюдалось серозное, а затем гнойное отделяемое. В то же время, у 2-х животных в группе 4 воспаление локализовалось в виде инкапсулированных абсцессов в области правой бедренной кости, а у 4-х рана затягивалась. Таким образом, применение экстракта S.controversa способствовало локализации воспалительного процесса и положительной динамике при остеомиелите.
ОКК крыс с экспериментальным остеомиелитом (группа 2), в том числе леченных только антибиотиком (группа 3), снижалось на 46 и 58% соответственно в сравнении с ОКК интактных животных (табл.1). Введение экстракта S.controversa заболевшим крысам на фоне антибиотикотерапии (группа 4) способствовало достоверной нормализации общего количества ядросодержащих клеток костного мозга, что свидетельствует о большей эффективности сочетанной терапии в группе 4 по сравнению с монотерапией (группа 3).
В результате развития экспериментального остеомиелита в костном мозге экспериментальных животных (группа 2) наблюдали угнетение гранулоцитарного ростка, о чем свидетельствовало достоверное уменьшение количества молодых форм клеток в среднем на 70% и угнетение эритроидного ростка, вследствие чего общее число эритрокариоцитов уменьшалось на 40%. Кроме того, у крыс в группе 2 в четыре раза возрастало количество мегакариоцитов, а число лимфоцитов снижалось в три раза в сравнении с интактной группой животных. При этом в костном мозге крыс группы 2 наблюдали большое количество разрушенных лимфоцитов.
После монотерапии антибиотиком (группа 3), в костном мозге крыс с экспериментальным остеомиелитом сохранялись изменения со стороны гранулоцитарного ростка. Отмечено достоверное уменьшение количества молодых форм клеток: количество миелобластов уменьшалось на 88%, промиелоцитов - на 73%, миелоцитов - на 60%, сокращалось количество митозов на 83%. Лейкоэритробластическое отношение (ЛЭО) клеток костного мозга смещалось в сторону уменьшения клеток миелоидного ряда. Количество лимфоцитов в костном мозге экспериментальных животных после антибиотикотерапии еще более снижалось.
После курсового применения экстракта 5. controversa на фоне антибиотикотерапии значительно возрастало количество молодых и зрелых форм гранулоцитов и лимфоцитов до показателей в интактной группе. Кроме того, после терапии экстрактом S.controversa наблюдали достоверное увеличение количества зрелых форм эритрокариоцитов по сравнению с животными, получавшими только антибиотикотерапию.
Полученные данные позволяют говорить о стимуляции гранулопоэза и коррекции клеточных показателей костного мозга, измененных в результате антибиотикотерапии экспериментального остеомиелита, при курсовом применении экстракта S. controversa.
При морфологическом исследовании в диафизе бедренной кости крыс, на 21 сутки после моделирования остеомиелита без лечения (группа 2), отмечались признаки выраженного воспаления. В костномозговых пространствах - лейкоцитарная инфильтрация и гиперемия сосудов. Выявлялся некроз и аутолиз костных пластинок кортикального и трабекулярного слоев с образованием секвестров. Нормальное строение остеонов было нарушено, гаверсовы каналы частично запустевали. Наряду с признаками воспаления в кости отмечались не резко выраженные признаки регенерации: разрастание грануляционной ткани и активация остеобластов в области костных дефектов (Фиг. 3).
В группе крыс, получавших антибиотикотерапию цефазолином (группа 3), воспаление имело разлитой характер, однако, его интенсивность была ниже, чем у крыс группы 2. Сохранялась дискомплексация костных пластинок. Процесс резорбции некротизированной костной ткани преобладал над процессом остеогенеза (Фиг. 4).
В группах крыс, получавших терапию антибиотиком в комплексе с экстрактом S. controversa (группа 4) отмечали снижение интенсивности воспалительных процессов. Признаки регенераторных процессов: активация эндооста, периоста, появление остеобластических "почек", формирование грануляционной ткани, были повсеместно видны на протяжении бедренной кости, но более выражены в эпифизарном отделе. Большинство костных пластин имели нормальное строение и равномерную минерализацию (Фиг. 5).
Таким образом, при курсовом применении экстракта S. controversa снижается интенсивность воспалительных процессов в костной ткани и костном мозге, усиливаются гранулопоэз и регенерация костной ткани.
Обоснование способа получения экстракта соссюреи спорной.
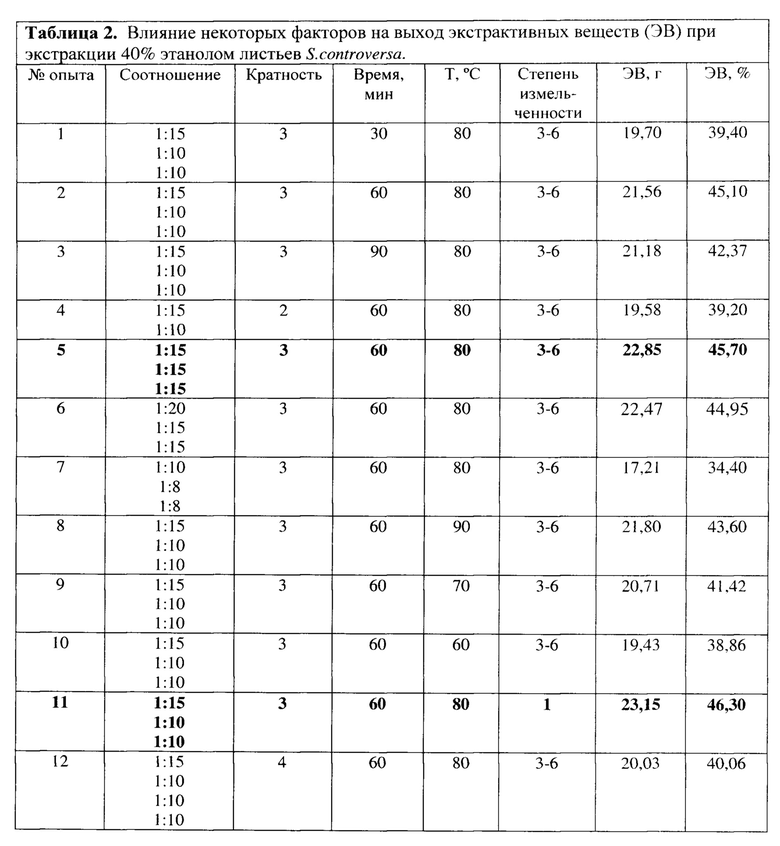
Экстракцию сырья осуществляли методом многократной мацерации при нагревании, моделируя технологический процесс в лабораторном реакторе (Radley's, Великобритания), снабженном обогревающейся водяной рубашкой и мешалкой RZR 2020 (Heidolph, Германия) при скорости 300 об/мин. Экстракты, полученные после каждого приема мацерации, объединяли, экстрагент удаляли в роторном испарителе при температуре не выше 50°C, сконцентрированный густой экстракт высушивали методом конвективной сушки до содержания влаги не более 5%. Выбор оптимальных параметров экстракции (соотношение сырья и экстрагента, степень измельченности сырья, время, температура, кратность экстракции) осуществляли после определения выхода экстрактивных веществ (ЭВ).
Опыт 1. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 3-6 мм, заливали 40% этанолом в соотношении 1:15. Второй и третий раз экстракцию проводили в соотношении сырье-экстрагент 1:10. Температура экстракции 80°C, время 30 мин. Общий выход ЭВ составил 19,70 г (39,40%, табл. 2).
Опыт 2. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 3-6 мм, заливали 40% этанолом в соотношении 1:15. Второй и третий раз экстракцию проводили в соотношении сырье-экстрагент 1:10. Температура экстракции 80°C, время 60 мин. Общий выход ЭВ составил 21,56 г (45,10%).
Опыт 3. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 3-6 мм, заливали 40% этанолом в соотношении 1:15. Второй и третий раз экстракцию проводили в соотношении сырье-экстрагент 1:10. Температура экстракции 80°C, время 90 мин. Общий выход ЭВ составил 21,18 г (42,37%).
Опыт 4. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 3-6 мм, заливали 40% этанолом в соотношении 1:15. Экстракцию проводили дважды, второй раз в соотношении сырье-экстрагент 1:10. Температура экстракции 80°C, время 60 мин. Общий выход ЭВ составил 19,58 г (39,20%).
Опыт 5. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 3-6 мм, заливали 40% этанолом в соотношении 1:15. Экстракцию проводили 3 раза при температуре 80°C, 60 мин. Общий выход ЭВ составил 22,85 г (45,70%).
Опыт 6. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 3-6 мм, заливали 40% этанолом в соотношении 1:20. Второй и третий раз экстракцию проводили в соотношении сырье-экстрагент 1:15. Температура экстракции 80°C, время 60 мин. Общий выход ЭВ составил 22,47 г (44,95%).
Опыт 7. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 3-6 мм, заливали 40% этанолом в соотношении 1:10. Второй и третий раз экстракцию проводили в соотношении сырье-экстрагент 1:8. Температура экстракции 80°C, время 60 мин. Общий выход ЭВ составил 17,21 г (34,40%).
Опыт 8. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 3-6 мм, заливали 40% этанолом в соотношении 1:15. Второй и третий раз экстракцию проводили в соотношении сырье-экстрагент 1:10. Температура экстракции 90°C, время 60 мин. Общий выход ЭВ составил 21,80 г (43,60%).
Опыт 9. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 3-6 мм, заливали 40% этанолом в соотношении 1:15. Второй и третий раз экстракцию проводили в соотношении сырье-экстрагент 1:10. Температура экстракции 70°C, время 60 мин. Общий выход ЭВ составил 20,71 г (41,42%).
Опыт 10. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 3-6 мм, заливали 40% этанолом в соотношении 1:15. Второй и третий раз экстракцию проводили в соотношении сырье-экстрагент 1:10. Температура экстракции 60°C, время 60 мин. Общий выход ЭВ составил 19,43 г (38,86%).
Опыт 11. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 1 мм, заливали 40% этанолом в соотношении 1:15. Второй и третий раз экстракцию проводили в соотношении сырье-экстрагент 1:10. Температура экстракции 80°C, время 60 мин. Общий выход ЭВ составил 23,15 г (46,30%).
Опыт 12. В экстрактор помещали 50,0 г сырья, измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 3-6 мм, заливали 40% этанолом в соотношении 1:15. Экстракцию проводили еще три раза в соотношении сырье-экстрагент 1:10. Температура экстракции 80°C, время 60 мин. Общий выход ЭВ составил 20,03 г (40,06%).
Исходя из полученных результатов оптимальное для выхода ЭВ соотношение сырья и экстрагента 1:15 при трехкратной экстракции в течение 60 мин (опыт 5). Дальнейшее уменьшение кратности экстракции, соотношения сырья и экстрагента при одновременном повышении или понижении времени экстракции приводит к снижению выхода ЭВ. Так же влияет снижение температуры экстракции до 60-70°C или ее повышение до 90°C. Максимальный выход ЭВ наблюдали при экстракции фракции сырья, проходящего через отверстия с диаметром 1 мм, отсеянное от пыли (опыт 11). Это явление можно объяснить особенностью строения листа соссюреи спорной: нижний эпидермис листа обильно покрыт нитевидными трихомами, образующими как бы войлочное покрытие. Поэтому даже при измельчении сырья, его частицы посредством волосков слипаются, образуя более крупные. Основная масса сырья (около 98%) просеивается лишь через сита с отверстиями диаметром 3-6 мм. Через отверстия с диаметром 1 мм проходят частицы сырья, свободные от волосков, вследствие чего, содержащие большее количество биологически активных веществ.
Таким образом оптимальным способом получения комплексного средства консервативной терапии остеомиелита является трехкратная экстракция 40% этанолом листьев соссюреи спорной, измельченных до 3-6 мм в соотношении 1:15 при 80°C в течение 60 мин. Этанол из жидкого экстракта удаляют под вакуумом, экстракт высушивают до содержания влаги не более 5%.
Источники информации
1. Акжигитов Г.Н. Гематогенный остеомиелит / Г.Н. Акжигитов, Я.Б. Юдин. - М.: Медицина, 1998. 288 с.
2. Амиров Н.Х., Мубаракова Л.Н., Захаров Ю.А. Способ лечения одонтогенного остеомиелита, осложненного флегмоной. Патент №2232029 от 27.08.2001.
3. Афиногенов Г.Е. Антимикробная биодеградируемая композиция на основе высокомолекулярного поливинилпирролидона для профилактики экспериментального остеомиелита/ Г.Е. Афиногенов, P.M. Тихилов, А.Г. Афиногенова и др. // Травматология и ортопедия России. 2010. №3. С. 47-54.
4. Батаков Е.А. Современные аспекты диагностики и лечения хронического остеомиелита / Е.А. Батаков, Д.Г. Алексеев, В.Е. Батаков. - Самара: Медицина. 2008. 117 с.
5. Белохвостикова Т.С. Коррекция вторичных нарушений иммунной системы при хроническом посттравматическом остеомиелите / Т.С. Белохвостикова, Л.Е. Кирдей, Е.Ю. Гаврилова и др. // Медицинская иммунология. 2002. №4 (2). С. 228-229.
6. Дзюба Г.Г. Опыт использования локальных антибактериальных носителей при лечении хронического гнойного остеомиелита длинных трубчатых костей / Г.Г. Дзюба, С.А. Ерофеев, Д.И. Одарченко // Современные проблемы науки и образования. 2013. №4. С. 111.
7. Кирдей Е.Г. Иммунный статус больных с различными формами остеомиелитов / Е.Г. Кирдей, А.П. Барабаш, Д.Г. Данилов и др. // Сибирский медицинский журнал. 1977. №9 (1-2). С. 19-21.
8. Корженевский А.А. Обоснование выбора препарата для иммунотерапии хронического остеомиелита // Аллергология и иммунология. 2008. №9 (2). С. 227-230.
9. Кутин А.А. Гематогенный остеомиелит у взрослых / А.А. Кутин, Н.И. Мосиенко. - М.: Медицина и жизнь. 2000. 224 с.
10. Ладонин С.В. Экспериментальное обоснование использования аллогенного деминерализованного костного имплантата в комплексном лечении хронического остеомиелита / С.В. Ладонин, Е.А. Белозерцева // Морфологические ведомости. 2011. №1. С. 101-107.
11. Линник С.А. Способ пластики костных дефектов у больных с остеомиелитом предплечья мышечным лоскутом, сфомированным из musculus pronator qvadratus / С.А. Линник, Н.Ф. Фомин, Ш.Л. Динаев и др. // Травматология и ортопедия России.2011. №3. С. 97-100.
12. Матузов С.А. Лечение хронического травматического остеомиелита с применением антиоксидантов: автореф. дисс.… к.м.н. Иркутск, 1997. 27 с.
13. Султонов Ш.Р. Динамика процессов перекисного окисления липидов и антиоксидантной системы защиты при хроническом гематогенном остеомиелите у детей / Ш.Р. Султонов, А.А. Азизов, A.M. Сабурова // Докл. Акад. наук Респ.Таджикистан. 2009. Т. 52. №9. С. 723-727.
14. Толстикова Т.Г., Сорокина И.В., Жукова Н.А. Средство для лечения остеомиелита. Патент №2604124 от 28.10.2015.
15. Федянин С.Д. Рациональная антибиотикотерапия у пациентов с гематогенным и посттравматическим остеомиелитом // Вестник Витебского государственного медицинского университета. 2004. №2. С. 61-68.
16. Хеннен У.Дж. Трансфер фактор Плюс: идеальная комбинация биологически активных веществ для оптимального иммунитета / У.Дж. Хеннен, Ю.П. Гичева, Э.А. Оганова. - Новосибирск, 2001.
17. Шалыгин А.В. Коррекция реологических свойств крови в лечении острого гематогенного остеомиелиае у детей / А.В. Шалыгин, А.А. Солнышко, А.П. Скударнова // Науки о человеке. Томск, 2003. С. 112.
18. Bohndorf К. Osteomyelitis / К. Bohndorf,  // Handbuch diagnostische Radiologic 2005. S. 80.
// Handbuch diagnostische Radiologic 2005. S. 80.
19. Davis J.S. Menagement of bone and joint infections due to Staphilococcus aureus // Intern. Medicine J. 2005. №35. P. 79-96.
Приложение
Фиг. 1. Содержание 99mТс-технефор (%) в мягкотканую фазу сцинтиграфического исследования пораженной конечности крыс с экспериментальным остеомиелитом.
Фиг. 2. Содержание 99mТс-технефор в костную фазу сцинтиграфического исследования пораженной конечности крыс с экспериментальным остеомиелитом.
*p≤0.05 в сравнении с группой-2.
Фиг. 3. Участок диафиза бедренной кости крысы на 21 сутки после моделирования остеомиелита без лечения. Признаки воспаления без видимой активации остеогенеза. Окрашивание гематоксилином и эозином, ×200.
Фиг. 4. Участок диафиза бедренной кости крысы на 21 сутки после моделирования остеомиелита при лечении антибиотиком. Сохранение признаков воспаления, незначительная активация остеогенеза. Окрашивание гематоксилином и эозином, ×200.
Фиг. 5. Участок диафиза бедренной кости крысы вблизи костно-мозгового канала, на 21 сутки после моделирования остеомиелита при терапии антибиотиком в комплексе с экстрактом S. controversa. Активация остеобластических процессов на месте погибших остеонов. Окрашивание гематоксилином и эозином, ×200.
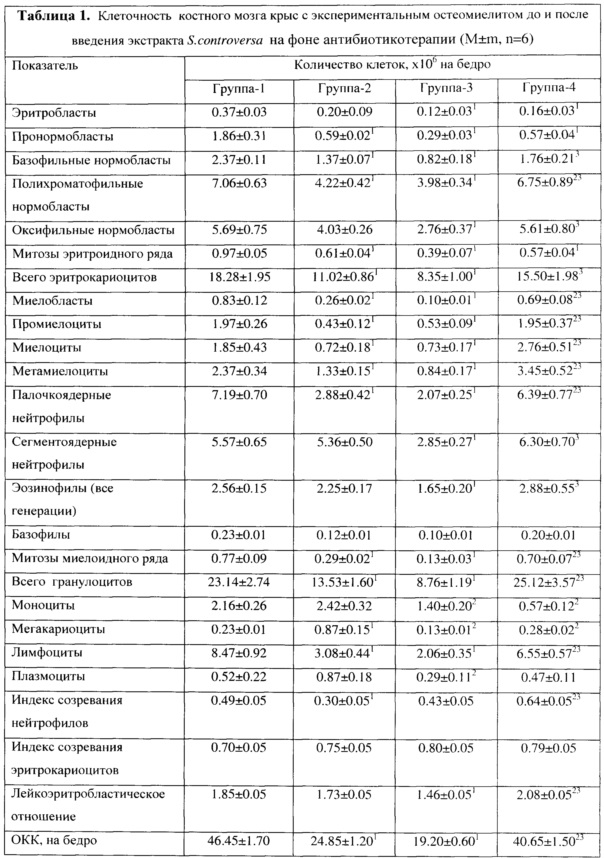
Примечание. 1,2,3 - p≤0,05 в сравнении с группами 1,2 и 3 соответственно.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство на основе водорастворимых растительных полисахаридов, усиливающее секрецию оксида азота макрофагами in vitro | 2018 |
|
RU2735080C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТРАВМАТИЧЕСКОГО ОСТЕОМИЕЛИТА | 2015 |
|
RU2584402C1 |
| Способ получения средства, обладающего нейропротективным, метаболическим действием | 2023 |
|
RU2826494C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВОИШЕМИЧЕСКОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2603465C1 |
| Способ получения средства, обладающего тиреотропной активностью | 2016 |
|
RU2619863C1 |
| Способ получения средства, обладающего ноотропной и антиоксидантной активностью | 2024 |
|
RU2839867C1 |
| Способ получения средства, обладающего нейропротективной, иммуномодулирующей активностью | 2022 |
|
RU2784435C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ ГАСТРОПРОТЕКТИВНОЙ (ПРОТИВОЯЗВЕННОЙ) АКТИВНОСТЬЮ | 2016 |
|
RU2637644C1 |
| Способ получения средства, обладающего стресспротективной и антиоксидантной активностью | 2016 |
|
RU2619856C1 |
| СМЕСЬ ЭКСТРАКТОВ ПЛОДОВ ZIZIPHUS JUJUBE MILL., ОБЛАДАЮЩАЯ ПРОТИВОЯЗВЕННЫМ, ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЯМИ | 2022 |
|
RU2802434C1 |



Изобретение относится к фармацевтической промышленности, а именно к применению средства для стимуляции роста клеток гранулоцитарного и лимфоидного ряда в костном мозге. Применение экстракта листьев соссюреи спорной (Saussurea Controversa DC), полученного путем трехкратной экстракции измельченных до 3-6 мм листьев соссюреи спорной 40% водным этанолом в соотношении 1:15 при 80°С в течение 60 мин, удаление экстрагента, высушивания, для стимуляции роста клеток гранулоцитарного и лимфоидного ряда в костном мозге. Средство, полученное вышеописанным способом, эффективно для стимуляции роста клеток гранулоцитарного и лимфоидного ряда в костном мозге. 5 ил., 2 табл.
Применение экстракта листьев соссюреи спорной (Saussurea Controversa DC), полученного путем трехкратной экстракции измельченных до 3-6 мм листьев соссюреи спорной 40% водным этанолом в соотношении 1:15 при 80°С в течение 60 мин, удаление экстрагента, высушивания, для стимуляции роста клеток гранулоцитарного и лимфоидного ряда в костном мозге.
| АВДЕЕВА Е.Ю | |||
| и др | |||
| Биохимическое исследование активности экстрактов Saussurea Controversa DC | |||
| И Filipendula Ulmaria (L.) maxim при экспериментном остеомиелите //Бюллетень сибирской медицины, 2016, подписано в печать 15.03.2016, т.15, N2, стр.5-15 | |||
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ АДАПТОГЕННОЙ АКТИВНОСТЬЮ | 2003 |
|
RU2259840C2 |
| АВДЕЕВА Е.Ю | |||
| и др | |||
| Исследование биологически активных веществ экстракта Saussurea Controversa, обладающего иммуностимулирующей активностью //Фенольные соединения: фундаментальные и прикладные аспекты, Сборник материалов IX международного симпозиума, Москва, 20-25 апреля 2015, стр.12-14 | |||
| АВДЕЕВА Е.Ю | |||
| и др | |||
| Проблема создания фитопрепаратов для профилактики и лечения остеомелита //Биологические особенности лекарственных и ароматических растений и их роль в медицине, Сборник трудов конференции, Москва, 23-25 июня 2016, стр.559-561 | |||
| KR 20070071029 A, 04.07.2007 | |||
| US 20130028968 A1, 31.01.2013. | |||
Авторы
Даты
2018-11-28—Публикация
2017-05-22—Подача