Изобретение относится к области биотехнологии и производству противоящурных вакцин, а именно к способу определения титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины с применением метода обратной транскрипции-полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР-РВ) и разработанной отрицательной регрессионной модели зависимости величины порогового цикла амплификации от титра инфекционной активности вируса ящура.
Ящур - высококонтагиозное вирусное заболевание парнокопытных животных, которое относится к категории трансграничных инфекций [1]. Возбудитель принадлежит к порядку Picornavirales, семейству Picornaviridae, роду Aphthovirus [2]. Характерной особенностью вируса ящура является наличие 7 типов: А, О, С, Asia-1, SAT-1, SAT-2, SAT-3. В пределах каждого типа существует множество генетических и антигенных вариантов вируса [3].
Вирион вируса ящура имеет диаметр около 23-25 нм, геном представлен одноцепочечной позитивной РНК, состоящей приблизительно из 8500 н.о. с одной большой открытой рамкой считывания длиной около 7000 н.о., которая состоит из 1А-, 1В-, 1С-, 1D-, 2А-, 2В-, 2С-, 3А-, 3В-, 3С-, 3D-генов. Весь геном возбудителя ящура характеризуется высокой степенью вариабельности нуклеотидов, за исключением 3D-гена, который стабилен для всех изолятов вируса ящура. Обнаружение 3D-гена позволяет детектировать вирус в исследуемом материале [1, 4].
Ящур наносит огромный экономический ущерб в связи с затратами на ликвидацию болезни и введением строгих ограничений, налагаемых на внутреннюю и международную торговлю продукцией животноводства. Система мер для борьбы с ящуром и его профилактики предусматривает массовую иммунизацию крупного и мелкого рогатого скота, а также контроль уровня напряженности поствакцинального иммунитета [3, 5].
В процессе производства противоящурных вакцин перед заражением чувствительной культуры клеток неинактивированный вируссодержащий материал исследуют на определение титра инфекционной активности вируса ящура для оценки его цитопатического действия. В 1 см3 суспензии вируса устанавливают количество инфекционных доз, вызывающих 50%-ное цитопатическое действие, что фактически отражает концентрацию вирусных частиц, содержащих РНК в активном состоянии. Традиционно для определения титра инфекционной активности возбудителя ящура используют монослойную клеточную линию почки свиньи IB-RS-2, с помощью которой вычисляют минимальную дозу вируса, способную вызвать лизис 50% клеток [1, 6, 7].
Существенными недостатками данного метода являются: 1) длительная процедура титрования, связанная с развитием цитопатического действия (не менее 3 суток), 2) определенная степень субъективности при оценке результатов анализа, 3) высокая стоимость клеточной линии как тест-системы и затраты на ее поддержание. В связи с этим целесообразно провести поиск способа определения титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины на основе ОТ-ПЦР-РВ.
Проблемой является отсутствие чувствительного и специфичного экспресс-метода определения титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины с целью устранения вышеуказанных недостатков.
Данная проблема была решена благодаря разработке нового способа определения титра инфекционной активности вируса ящура (ТВЯ) в неинактивированом сырье для вакцины с применением метода ОТ-ПЦР-РВ, с помощью которого между значениями титра вируса и порогового цикла амплификации (Ct) выявлена зависимость, отраженная в виде отрицательной линейной корреляции с высоким коэффициентом - 0,9994. Построенная отрицательная регрессионная модель вида Твя = -0,2956Ct+11,465 позволяет оценивать инфекционный титр вируса ящура в неинактивированном сырье для вакцины.
Сущность изобретения заключается в новом подходе по определению титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины с помощью метода ОТ-ПЦР-РВ и отрицательной регрессионной модели. Заявляемый способ основан на проведении ОТ-ПЦР-РВ с учетом сигнала с помощью флуоресцентного ПЦР-детектора. По итогам анализа оценивают интенсивность флуоресцентного сигнала, определяют значения порогового цикла амплификации. На основании выборки известных значений титра вируса ящура разных типов и установленных значений пороговых циклов амплификации разработали отрицательную регрессионную модель, позволяющую определять титр инфекционной активности вируса ящура по результатам ОТ-ПЦР-РВ.
В настоящее время метод ОТ-ПЦР-РВ применяют для обнаружения вируса ящура в образцах патологического материала диких и домашних парнокопытных животных, а также для определения концентрации 146S компонента вируса [8]. Для оценки титра вируса ящура в неинактивированном сырье для вакцины используют клеточную линию почки свиньи IB-RS-2. По сравнению с титрованием в культуре клеток метод ОТ-ПЦР-РВ отличается высокой чувствительностью и специфичностью, является более экономичным, позволяет одновременно исследовать несколько десятков проб неинактивированного вируссодержащего материала для вакцины, а время проведения анализа сократить до 4-5 часов [5, 9, 10]. Исходя их этого, актуально применять ОТ-ПЦР-РВ и разработанную отрицательную регрессионную модель для определения титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины. Ключевым элементом заявляемого способа является установление отрицательной линейной корреляционной зависимости между титром инфекционной активности разных типов вируса ящура в неинактивированном сырье для вакцины и пороговым циклом амплификации в виде регрессионной модели.
Сведений об аналогах предлагаемого способа определения титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины авторами не обнаружено.
Сущность предлагаемого изобретения пояснена на графическом материале - графике зависимости порогового цикла амплификации от титра инфекционной активности вируса ящура.
Для определения титра инфекционной активности подготавливают калибровочную панель положительных контролей, в качестве которых используют неинактивированные суспензии вируса ящура с титрами инфекционной активности: 1,0, 2,0, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0 lg ТЦД50/см3. В качестве отрицательного контроля применяют суспензию клеток из почки свиньи IB-RS-2, не зараженную вирусом ящура. Из всех контролей выделяют РНК вируса ящура. Полученные элюаты РНК вируса ящура добавляют к смеси компонентов для проведения ОТ-ПЦР-РВ в соотношении 1:4. Проводят амплификацию с последующей детекцией продуктов реакции с помощью флуоресцентного ПЦР-детектора, анализируют полученные значения порогового цикла амплификации. Смесь для проведения ОТ-ПЦР-РВ включает в свой состав следующие компоненты: специфичные праймеры и TagMan флуоресцентномеченый зонд (каждый) - 10 пМ, смесь дезоксирибонуклеозидтрифосфатов (dNTP) - 10 мМ, MgCl2 - 5 мМ, Taq ДНК-полимераза - 1 ед., AMV-ревертаза - 2,5 ед.
ОТ-ПЦР-РВ проводят при следующих температурных и временных параметрах:
- обратная транскрипция: 42°С в течение 15 мин;
- предварительная денатурация: 95°С в течение 5 мин;
- полимеразная цепная реакция:
 денатурация: 95°С в течение 15 с,
денатурация: 95°С в течение 15 с,
 отжиг праймеров: 55°С в течение 15 с,
отжиг праймеров: 55°С в течение 15 с,
 элонгация: 60°С в течение 20 с.
элонгация: 60°С в течение 20 с.
Амплификация составляет 40 циклов.
Проводят постановку ОТ-ПЦР-РВ с определением величины порогового цикла амплификации, которая обратно пропорциональна концентрации РНК и полных частиц вируса ящура и, соответственно, титру инфекционной активности вируса.
Устанавливают зависимость между пороговым циклом амплификации и титром инфекционной активности вируса ящура в неинактивированном сырье для вакцины в процессе построения отрицательной регрессионной модели. Оценивают величину эффективности реакции амплификации (Е) по формуле: Е=1-10-1/k, где k - угловой коэффициент в зависимости Ct = k⋅ТВЯ+b, а также коэффициент детерминации (R2). На основе разработанной модели рассчитывают значение титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины.
Пример 1. Определение титра инфекционной активности вируса ящура штамма А №2187/Кути/2013 в неинактивированном сырье для сорбированной вакцины методом ОТ-ПЦР-РВ.
Подготавливают калибровочную панель положительных контролей, в качестве которых используют неинактивированные суспензии вируса ящура с титрами инфекционной активности: 1,0, 2,0, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0 lg ТЦД50/см3. Отрицательным контролем служит суспензия клеток линии IB-RS-2, не инфицированная вирусом ящура. Стандартным методом выделяют РНК вируса ящура штамма А №2187/Кути/2013 из неинактивированного сырья для сорбированной вакцины, а также образцов отрицательного и положительных контролей. Подготавливают реакционную смесь для проведения ОТ-ПЦР-РВ, которая включает в свой состав следующие компоненты: специфичные праймеры и TagMan флуоресцентномеченый зонд (каждый) - 10 пМ, смесь дезоксирибонуклеозидтрифосфатов (dNTP) - 10 мМ, MgCl2 - 5 мМ, Taq ДНК-полимераза - 1 ед., AMV-ревертаза - 2,5 ед. Полученные элюаты РНК вируса ящура добавляют к смеси компонентов для проведения ОТ-ПЦР-РВ в соотношении 1:4. Общий объем реакционной смеси составляет 25 мкл.
Постановку ОТ-ПЦР-РВ осуществляют на ДНК амплификаторе для ПЦР в режиме реального времени «Rotor-Gene 6000» при следующих температурных и временных режимах: обратная транскрипция: 42°С в течение 20 мин, предварительная денатурация - 95°С в течение 5 мин, полимеразная цепная реакция: денатурация - 95°С в течение 15 с, отжиг праймеров - 55°С в течение 15 с, элонгация - 60°С в течение 20 с. Количество циклов амплификации - 40.
С помощью приложения «Анализ» программы «Rotor-Gene 1.8.17.5» отображают полученные результаты реакции, применяют функции «линейная шкала» и «динамический фон» для интерпретации количественных данных. Устанавливают пороговую линию в системе экспоненциальной зависимости уровня детектируемого сигнала от количества проведенных циклов амплификации.
По результатам анализа получают значения пороговых циклов амплификации для исследуемой пробы и контролей, которые обратно пропорциональны титру инфекционной активности вируса ящура штамма А №2187/Кути/2013. Результаты эксперимента по представлению системы параллельной оценки величины порогового цикла амплификации (Ct) и титра вируса ящура (ТВЯ) в положительных контролях отражены в таблице 1. Значения Ct для всех разведений неинактивированных суспензий вируса ящура с титрами от 1,05±0,05 до 8,03±0,03 lg ТЦД50/см3 находятся в диапазоне от 35,23±0,05 до 11,62±0,05, соответственно. На основании полученных данных построена линейная регрессионная модель связи между значением Ct и титром инфекционной активности вируса ящура: ТВЯ = -0,2956Ct + 11,465 (график). Обратная связь данной зависимости отражена в виде функции: Ct = -3,3783ТВЯ + 38,746, следовательно, эффективность реакции амплификации (Е) составляет 97,70%. В отрицательном контроле вирус ящура не обнаружен.
На графике видно, что между титром инфекционной активности вируса ящура и пороговым циклом амплификации существует зависимость, которая отражена в виде отрицательной линейной корреляции. Фактический коэффициент детерминации (R2) стремится к 1 и составляет 0,9994, что подтверждает высокую достоверность полученных результатов. Параллельно пробу и контроли исследовали в культуре клеток из почки свиньи IB-RS-2 для определения титра инфекционной активности вируса ящура.
Из таблицы 1 видно, что значение порогового цикла амплификации неинактивированного сырья из штамма А №2187/Кути/2013 для производства сорбированной вакцины против ящура составило 11,99±0,06. Пользуясь разработанной регрессионной моделью, отраженной функцией ТВЯ = -0,2956Ct + 11,465 (график), определили значение титра инфекционной активности вируса ящура штамма А №2187/Кути/2013, которое составило 7,92 lg ТЦД50/см3, что коррелирует с результатами титрования в культуре клеток IB-RS-2 (7,92±0,06 lg ТЦД50/см3). Отсюда следует, что разработанная с помощью результатов ОТ-ПЦР-РВ регрессионная модель позволяет оценивать титр вируса ящура в неинактивированном сырье для вакцины.
На следующем этапе работы по стандартной методике определяли и сравнивали иммуногенную активность сорбированной вакцины против ящура из штамма А №2187/Кути/2013 при разных способах оценки титра инфекционной активности вируса до инактивации антигена. Результаты исследования представлены в таблице 2, из которой следует, что после иммунизации крупного рогатого скота сорбированной вакциной против ящура из штамма А №2187/Кути/2013 с титром вируса в сырье для вакцины до инактивации 7,92±0,06 lg ТЦД50/см3 (по данным титрования вируса в культуре клеток IB-RS-2) и 7,92 lg ТЦД50/см3 (по результатам ОТ-ПЦР-РВ) титр накопления специфических антител на 28 сутки составил 6,40±0,38 log2 и 6,45±0,33 log2, соответственно. Полученные средние значения титра антител коррелируют между собой, а также сочетаются со значениями титра инфекционной активности до инактивации антигена, определенными в культуре клеток IB-RS-2 и с помощью ОТ-ПЦР-РВ. Таким образом, разработанная линейная регрессионная модель позволяет достоверно оценивать титр инфекционной активности вируса ящура в неинактивированном сырье для сорбированной противоящурной вакцины.
Пример 2. Определение титра инфекционной активности вируса ящура штамма А №2187/Кути/2013 в неинактивированном сырье для эмульсионной вакцины методом ОТ-ПЦР-РВ.
Подготовку и проведение анализа неинактивированного сырья для эмульсионной вакцины против ящура в ОТ-ПЦР-РВ осуществляли так же, как указано в примере 1. Результаты исследования отражены в таблице 1, из которой видно, что значение порогового цикла амплификации исследуемого неинактивированного сырья для производства эмульсионной вакцины против ящура штамма А №2187/Кути/2013 составило 11,79±0,04. Пользуясь разработанной регрессионной моделью, отраженной графиком ТВЯ = -0,2956Ct + 11,465, вычислили значение титра инфекционной активности вируса ящура штамма А №2187/Кути/2013, которое составило 7,98 lg ТЦД50/см3, что коррелирует с результатами титрования в культуре клеток IB-RS-2 (7,98±0,08 lg ТЦД50/см3). Таким образом, разработанная с помощью результатов ОТ-ПЦР-РВ модель позволяет оценивать титр инфекционной активности вируса ящура в неинактивированном сырье для вакцины.
Произведенную из полученного инактивированного сырья вакцину стандартным методом оценивали на иммуногенность, проводя заражение животных. Далее сравнивали иммуногенную активность эмульсионной вакцины против ящура из штамма А №2187/Кути/2013 при разных способах определения титра вируса до инактивации антигена. Результаты исследования представлены в таблице 3, из которой видно, что после иммунизации животных вакциной, изготовленной из сырья с титром инфекционной активности до инактивации антигена 7,98±0,08 lg ТЦД50/см3 (по данным титрования в культуре клеток IB-RS-2) и 7,98 lg ТЦД50/см3 (по результатам ОТ-ПЦР-РВ) титр накопления противоящурных антител на 28 день составил 7,10±0,22 log2 и 7,10±0,14 log2, соответственно. Полученные средние значения титра антител коррелируют между собой, а также сочетаются со значениями титра вируса ящура, определенными в культуре клеток и методом ОТ-ПЦР-РВ. Таким образом, разработанная регрессионная модель позволяет достоверно оценивать титр инфекционной активности вируса ящура в неинактивированном сырье для эмульсионной вакцины.
Пример 3. Определение титра инфекционной активности вируса ящура штамма О №2212/Приморский/2014 в неинактивированном сырье для сорбированной вакцины методом ОТ-ПЦР-РВ
Сырье для сорбированной вакцины против ящура из штамма О №2212/Приморский/2014 исследовали методом ОТ-ПЦР-РВ так же, как описано в примере 1. Результаты анализа представлены в таблице 1, в которой указано, что значение порогового цикла амплификации исследуемого неинактивированного сырья составило 14,87±0,05. Пользуясь разработанной регрессионной моделью, отраженной графиком функции ТВЯ = -0,2956Ct + 11,465, определили значение титра инфекционной активности вируса ящура штамма О №2212/Приморский/2014, которое составило 7,07 lg ТЦД50/см3, что коррелирует с результатами титрования вируса в культуре клеток IB-RS-2 (7,07±0,06 lg ТЦД50/см3). Следовательно, разработанная с помощью результатов ОТ-ПЦР-РВ модель дает возможность определять значение титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины.
Сорбированную вакцину против ящура из штамма О №2212/Приморский/2014 стандартным способом тестировали на иммуногенность в процессе заражения крупного рогатого скота. Определяли титр накопления специфичных антител и тем самым сравнивали иммуногенную активность вакцины при разных способах оценки титра вируса ящура до инактивации антигена. Результаты исследования продемонстрированы в таблице 4, из которой следует, что после иммунизации животных вакциной, изготовленной из сырья с титром вируса ящура до инактивации 7,07±0,06 lg ТЦД50/см3 (по данным титрования в клеточной линии IB-RS-2) и 7,07 lg ТЦД50/см3 (по результатам ОТ-ПЦР-РВ) титр накопления противоящурных антител на 28 сутки составил 6,45±0,21 log2 и 6,50±0,18 log2, соответственно. Полученные средние значения титра близки друг к другу, а также сочетаются со значениями титра вируса, определенными по результатам титрования в культуре клеток IB-RS-2 и методом ОТ-ПЦР-РВ. Следовательно, разработанная регрессионная модель позволяет достоверно оценивать титр инфекционной активности вируса ящура в неинактивированном сырье для сорбированной противоящурной вакцины.
Пример 4. Определение титра инфекционной активности вируса ящура штамма О №2212/Приморский/2014 в неинактивированном сырье для эмульсионной вакцины методом ОТ-ПЦР-РВ.
Постановку ОТ-ПЦР-РВ с последующим анализом неинактивированного сырья для эмульсионной вакцины против ящура из штамма О №2212/Приморский/2014 проводили, как указано в примере 1. Результаты исследования представлены в таблице 1, которая показывает, что значение порогового цикла амплификации исследуемого неинактивированного сырья для производства эмульсионной вакцины против ящура из штамма О №2212/Приморский/2014 составило 13,28±0,05. Применяя разработанную регрессионную моделью, отраженную графиком ТВЯ = -0,2956Ct + 11,465, вычислили значение титра вируса ящура штамма О №2212/Приморский/2014, которое составило 7,54 lg ТЦД50/см3, что коррелирует с результатами титрования вируса в культуре клеток IB-RS-2 (7,55±0,05 lg ТЦД50/см3). Таким образом, что разработанная с использованием результатов ОТ-ПЦР-РВ модель позволяет определять титр инфекционной активности вируса ящура в неинактивированном сырье для вакцины.
На следующем этапе работы по стандартной методике определяли и сравнивали иммуногенную активность эмульсионной вакцины против ящура из штамма О №2212/Приморский/2014 при разных способах определения титра инфекционной активности. Результаты анализа отражены в таблице 5, из которой следует, что после иммунизации животных данной вакциной, изготовленной из сырья с титром инфекционной активности вируса до инактивации антигена 7,55±0,05 lg ТЦД50/см3 (по данным титрования в культуре клеток IB-RS-2) и 7,54 lg ТЦД50/см3 (по результатам ОТ-ПЦР-РВ) титр накопления специфических антител на 28 день составил 6,60±0,14 log2 и 6,65±0,22 log2, соответственно. Средние значения титра антител коррелируют между собой и сочетаются со значениями титра вируса, определенными по итогам исследования в культуре клеток и методом ОТ-ПЦР-РВ. Иными словами, разработанная регрессионная модель позволяет достоверно оценивать значение титра инфекционной активности вируса ящура в неинактивированном сырье для эмульсионной вакцины.
Пример 5. Определение титра инфекционной активности вируса ящура штамма Азия-1 №2145/Таджикистан/2011 в неинактивированном сырье для сорбированной вакцины методом ОТ-ПЦР-РВ.
Неинактивированное сырье для сорбированной вакцины против ящура из штамма Азия-1 №2145/Таджикистан/2011 анализировали методом ОТ-ПЦР-РВ, как описано в примере 1. Результаты исследования представлены в таблице 1, в которой указано, что значение порогового цикла амплификации исследуемого неинактивированного сырья составило 12,80±0,05. Применяя разработанную регрессионную модель, отраженную графиком функции ТВЯ = -0,2956Ct + 11,465, рассчитывали значение титра инфекционной активности вируса ящура штамма Азия-1 №2145/Таджикистан/2011, которое составило 7,68 lg ТЦД50/см3, что коррелирует с результатами титрования вируса в клеточной линии IB-RS-2 (7,68±0,05 lg ТЦД50/см3). Таким образом, разработанная регрессионная модель с помощью результатов ОТ-ПЦР-РВ позволяет оценивать значение титра инфекционной активности вируса ящура штамма Азия-1 №2145/Таджикистан/2011 в неинактивированном сырье для вакцины.
Произведенную из полученного инактивированного сырья вакцину исследовали на иммуногенность стандартным методом, проводя заражение крупного рогатого скота. Сравнивали иммуногенную активность сорбированной вакцины против ящура из штамма Азия-1 №2145/Таджикистан/2011 при разных способах оценки титра инфекционной активности вируса ящура. Результаты сравнительного анализа представлены в таблице 6, из которой видно, что после иммунизации животных вакциной, полученной из сырья с титром вируса до инактивации антигена 7,68±0,05 lg ТЦД50/см3 (по данным титрования вируса в культуре клеток IB-RS-2) и 7,68 lg ТЦД50/см3 (по результатам ОТ-ПЦР-РВ) титр накопления противоящурных антител в организме иммунизированных животных на 28 сутки составил 6,90±0,22 log2 и 6,85±0,14 log2, соответственно. Полученные средние значения титра антител коррелируют между собой, а также сочетаются со значениями титра вируса, определенными методом титрования в культуре клеток IB-RS-2 и с помощью ОТ-ПЦР-РВ. Следовательно, разработанная регрессионная модель позволяет достоверно определять значение титра инфекционной активности вируса ящура в неинактивированном сырье для сорбированной вакцины.
Пример 6. Определение титра инфекционной активности вируса ящура штамма Азия-1 №2145/Таджикистан/2011 в неинактивированном сырье для эмульсионной вакцины методом ОТ-ПЦР-РВ.
Постановку ОТ-ПЦР-РВ и последующий анализ результатов исследования неинактивированного сырья для эмульсионной вакцины против ящура из штамма Азия-1 №2145/Таджикистан/2011 проводили, как указано в примере 1. Результаты тестирования представлены в таблице 1, которая показывает, что значение порогового цикла амплификации вируссодержащего неинактивированного сырья для получения эмульсионной вакцины против ящура из штамма Азия-1 №2145/Таджикистан/2011 составило 11,69±0,03. Пользуясь разработанной регрессионной моделью, представленной графиком функции ТВЯ = -0,2956Ct + 11,465, определили значение титра вируса ящура штамма Азия-1 №2145/Таджикистан/2011, которое составило 8,00 lg ТЦД50/см3, что коррелирует с результатами титрования вируса в культуре клеток IB-RS-2 (8,02±0,10 lg ТЦД50/см3). Иными словами, модель, разработанная на основании данных ОТ-ПЦР-РВ, позволяет определять титр инфекционной активности вируса ящура в неинактивированном сырье для противоящурной вакцины.
На заключительном этапе работы по стандартной методике сравнивали иммуногенную активность эмульсионной вакцины против ящура из штамма Азия-1 №2145/Таджикистан/2011 при разных способах оценки титра инфекционной активности вируса. Результаты исследования показаны в таблице 7, из которой видно, что при иммунизации животных данной вакциной, изготовленной из сырья с титром инфекционной активности вируса до инактивации антигена 8,02±0,10 lg ТЦД50/см3 (по результатам титрования в культуре клеток IB-RS-2) и 8,00 lg ТЦД50/см3 (по данным ОТ-ПЦР-РВ) титр накопления специфических антител на 28 сутки составил 6,90±0,14 log2 и 6,95±0,21 log2, соответственно. Средние значения титра антител близки друг к другу и сочетаются со значениями титра вируса ящура, по данным исследования в культуре клеток и методом ОТ-ПЦР-РВ. Таким образом, разработанная регрессионная модель позволяет достоверно оценивать значение титра инфекционной активности вируса ящура в неинактивированном сырье для эмульсионной противоящурной вакцины.
Основным преимуществом предлагаемого изобретения является возможность одновременного исследования большого количества проб для определения титра инфекционной активности вируса ящура в сырье для вакцины в течение 4-5 часов. В предлагаемом изобретении между титром вируса ящура и пороговым циклом амплификации установлена зависимость, отраженная в виде отрицательной линейной корреляции с высоким коэффициентом - 0,9994. Разработанная линейная регрессионная модель вида ТВЯ = -0,2956Ct + 11,465 дает возможность оценивать значение титра инфекционной активности вируса ящура разных типов в неинактивированном сырье для производства вакцины.
Предлагаемое изобретение позволяет быстро и с высокой степенью достоверности определять значение титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины на основе ОТ-ПЦР-РВ с последующим применением разработанной регрессионной модели.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Способ определения титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины с применением метода обратной транскрипции-полимеразной цепной реакции в режиме реального времени»:
1. Пономарев А.П., Узюмов В.Л. Вирус ящура: структура, биологические и физико-химические свойства. Владимир: Фолиант, 2006. - 250 с.
2. Lubroth, J., Rodriguez, L. and Dekker, A. (2006) Vesicular diseases. In: Straw, B.E., Zimmerman, J.J., 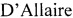 , S. and Taylor, D.J., editors. Diseases of Swine. 9th ed. Blackwell Publishing Professional, Ames, Iowa, USA. p. 517-536.
, S. and Taylor, D.J., editors. Diseases of Swine. 9th ed. Blackwell Publishing Professional, Ames, Iowa, USA. p. 517-536.
3. Alexandersen, S., Zhang, Z., Donaldson, A.L. and Garland, A.J.M. (2003) The pathogenesis and diagnosis of foot and mouth disease. J. Compr. Pathol., V. 129. - p. 268-282.
4. OIE. Manual of diagnostic tests and vaccines for terrestrial animals. - 7th ed. - Paris, 2012. - Vol. 1, Chap. 2.1.5. - p. 166-169.
5. Implementation of a one-step real-time RT-PCR protocol for diagnosis of foot-and-mouth disease / A. Shaw, S. M. Reid, K. Ebert [et al.] // J. Virol. Methods. - 2007. - Vol. 143, N 1. - C. 81-85.
6. Жильцова M.B. Биологические свойства эпизоотических изолятов вируса ящура типов А, О и Азия-1: Дис … канд. ветер, наук: 16.00.03. - Владимир, 2008. - 146 с.
7. OIE. (2008) Foot and mouth disease. In: Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. 6th ed., Ch. 2.1.5. World Organisation for Animal Health (OIE), Paris, France.
8. Патент РФ №2619878, G01N 33/58, 18.05.2017 г.
9. Enhanced laboratory diagnosis of foot-and-mouth disease by real-time polymerase chain reaction / A.E. Shaw, S.M. Reid, D.P. King [et al.] // Rev. Sci. Techn. OIE. - 2004. - Vol. 23, №3. - P. 1003-1009.
10. Rapid detection of foot-and-mouth disease virus, influenza A virus and classical swine fever virus by high-speed real-time RT-PCR / K. Wernike, M. Beer, B. Hoffmann // Journal of Virological Methods. - 2013. - Vol. 193, №1. -P. 50-54.
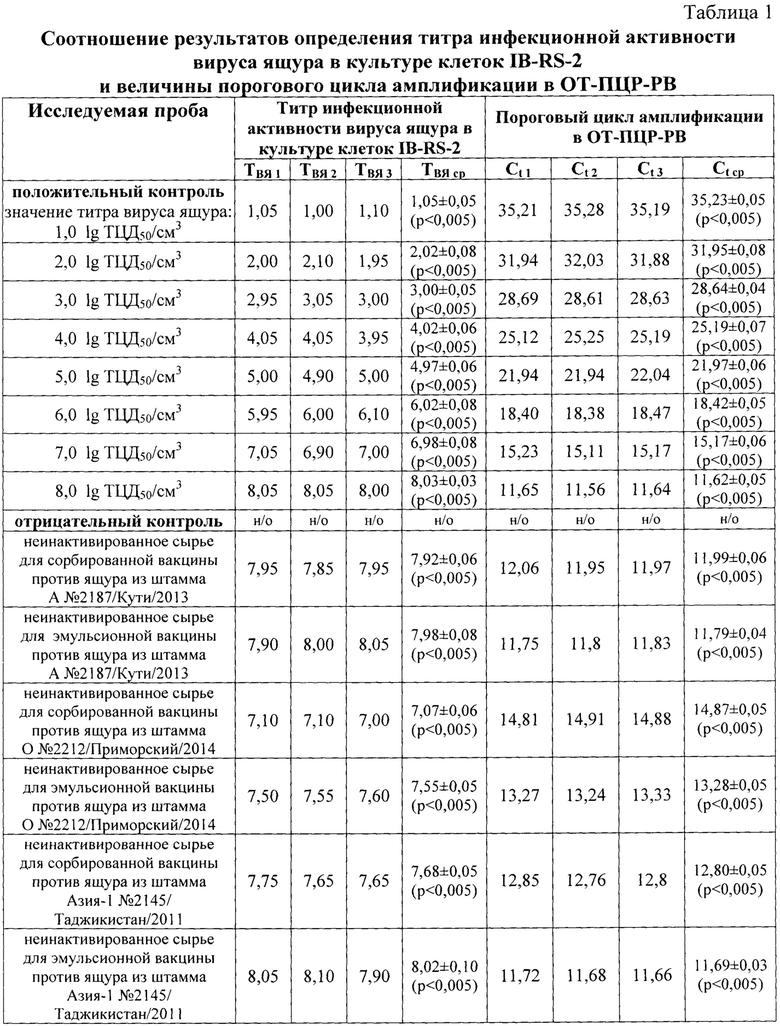
Примечание: «н/о» - вирус ящура не обнаружен

Изобретение относится к области биотехнологии и производству противоящурных вакцин, а именно к способу определения титра инфекционной активности вируса ящура в неинактивированном сырье для производства вакцины с применением метода ОТ-ПЦР-РВ и разработанной регрессионной моделью зависимости титра инфекционной активности вируса ящура от величины порогового цикла амплификации. На основании установленной с помощью флуоресцентного ПЦР-детектора величины порогового цикла амплификации (Ct) с применением разработанной отрицательной регрессионной модели рассчитывают значение титра вируса ящура (ТВЯ) разных типов. Предлагаемое изобретение позволяет быстро и с высокой степенью достоверности определять значение титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины. 3 з.п. ф-лы, 7 табл., 1 ил., 6 пр.
1. Способ определения титра инфекционной активности вируса ящура в неинактивированном сырье для производства вакцины с помощью обратной транксрипции-полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР-РВ), включающий следующие стадии:
- подготавливают калибровочную панель положительных контролей, в качестве которых используют неинактивированные суспензии вируса ящура с титрами инфекционной активности: 1,0, 2,0, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0 lg ТЦД50/см3, а также суспензию клеток из почки свиньи IB-RS-2, не зараженную вирусом ящура (отрицательный контроль);
- выделяют РНК вируса ящура из неинактивированного сырья для вакцины, образцов отрицательного и положительных контролей;
- элюаты РНК вируса ящура добавляют к смеси компонентов для проведения ОТ-ПЦР-РВ в соотношении 1:4;
- проводят ОТ-ПЦР-РВ с последующей детекцией продуктов амплификации с помощью флуоресцентного ПЦР-детектора, анализируют полученные данные для определения величины порогового цикла амплификации;
- определяют величину порогового цикла амплификации, обратно пропорциональную титру инфекционной активности вируса ящура;
- устанавливают зависимость между пороговым циклом амплификации и титром инфекционной активности вируса ящура в неинактивированном сырье для вакцины в процессе построения отрицательной регрессионной модели;
- оценивают величину эффективности реакции амплификации (Е) и коэффициент детерминации (R2);
- рассчитывают значение титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины на основе разработанной регрессионной модели.
2. Способ по п. 1, отличающийся тем, что на основании установленной в ОТ-ПЦР-РВ величины порогового цикла амплификации (Ct) рассчитывают значение титра инфекционной активности вируса ящура (ТВЯ) разных типов с применением разработанной регрессионной модели:
ТВЯ = -0,2956Ct+11,465.
3. Способ по п. 1, отличающийся тем, что смесь компонентов для проведения ОТ-ПЦР-РВ включает в свой состав следующие компоненты: специфичные праймеры и TagMan флуоресцентномеченые зонды (каждый) - 10 пМ, смесь дезоксирибонуклеозидтрифосфатов (dNTP) - 10 мМ, MgCl2 - 5 MM, Taq ДНК-полимераза - 1 ед., AMV-ревертаза - 2,5 ед.
4. Способ по п. 1, отличающийся тем, что ОТ-ПЦР-РВ проводят с соблюдением следующих режимов:
- обратная транскрипция: 42°С в течение 15 мин;
- предварительная денатурация: 95°С в течение 5 мин;
- полимеразная цепная реакция:
 денатурация: 95°С в течение 15 с,
денатурация: 95°С в течение 15 с,
 отжиг праймеров: 55°С в течение 15 с,
отжиг праймеров: 55°С в течение 15 с,
 элонгация: 60°С в течение 20 с.
элонгация: 60°С в течение 20 с.
| Пономарев А.П., Узюмов В.Л | |||
| Вирус ящура: структура, биологические и физико-химические свойства | |||
| Владимир: Фолиант, 2006 | |||
| Катодное реле | 1921 |
|
SU250A1 |
| Способ определения концентрации 146S-компонента вируса ящура в вируссодержащем сырье для вакцины с применением метода обратной транскрипции-полимеразной цепной реакции в режиме реального времени | 2016 |
|
RU2619878C1 |
Авторы
Даты
2018-12-04—Публикация
2017-12-25—Подача