Изобретение относится к области биотехнологии и производству антирабических вакцин, а именно к способу опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
Бешенство является одним из опасных зоонозов, который приводит к поражению центральной нервной системы, энцефаломиелитам, параличам с неизбежным летальным исходом для человека и животных [1]. В соответствии с классификацией Международного комитета по таксономии возбудителем бешенства является вирус порядка Mononegavirales семейства Rhabdoviridae рода Lyssavirus вида Rabies lyssavirus [2].
Геном возбудителя бешенства представлен несегментированной одноцепочечной негативной молекулой РНК длиной около 11800-12000 н.о. Нуклеиновая кислота данного инфекционного агента кодирует 5 основных белков, расположенных в консервативном линейном порядке: нуклеопротеин (N-белок), фосфопротеин (Р-белок), матриксный белок (М-белок), гликопротеин (G-белок), РНК-зависимую РНК-полимеразу (L-белок). Вирионы имеют пулевидную форму диаметром около 75 нм и длиной 100-300 нм в зависимости от изолята/штамма вируса бешенства [3].
В процессе репродукции в биологических системах вирус бешенства формирует полную вирусную частицу, которая является иммуногенным компонентом антирабических вакцинных препаратов [3, 4].
Бешенство приводит к непоправимым экономическим потерям, которые связаны с гибелью людей, животных, ликвидацией последствий вспышек болезни, введением строгих ограничений, налагаемых на внутреннюю и международную торговлю продукцией животноводства, проведением профилактических и карантинных мероприятий и др. [4, 5].
В соответствии с Кодексом наземных животных и Руководством МЭБ (OIE) по диагностическим тестам и вакцинам для борьбы с бешенством рекомендуется вакцинопрофилактика [3].
В процессе промышленного производства антирабических вакцин особое внимание уделяют титру инфекционной активности вируса [2]. Исходя из этого, сырье для вакцин исследуют для определения данного параметра с применением монослойной перевиваемой клеточной линии почки новорожденного сирийского хомячка (ВНК-21/2-17) (прототип) [6]. В 1,0 см3 суспензии вируса определяют количество клеточных культуральных инфекционных доз, вызывающих 50%-ное поражение клеток, что фактически отражает концентрацию вирионов, содержащих РНК в активном состоянии.
Существенными недостатками данного метода являются: 1) длительная процедура анализа (не менее 72 часов), связанная с поражением клеток вирусом бешенства; 2) высокая степень субъективности при оценке результатов исследования; 3) большие материальные затраты на получение и поддержание клеточной линии как тест-системы; 4) наличие риска контаминации культуры клеток [6].
В настоящее время молекулярно-генетические методы, в том числе ПЦР, применяют для проведения качественного и количественного исследования суспензий вируса бешенства [7-9]. В литературе описаны «Способ опосредованного определения титра инфекционной активности вируса бешенства штамма ВНИИЗЖ в сырье для инактивированной антирабической вакцины методом ПЦР в режиме реального времени» и «Способ опосредованного определения инфекционного титра вируса бешенства в неинактивированном сырье для антирабических вакцин при транскрипционной амплификации и детекции продуктов реакции с применением beacon-технологии» (последний является наиболее близким прототипом) [10, 11]. Данный способ применяется в настоящее время для исследований, но при этом он имеет некоторые особенности, что ограничивает их использование для рутинного анализа, а именно: 1) предполагает применение технологии NASBA, которой владеет ограниченное количество лабораторий в мире; 2) требует проведения дополнительного количества этапов анализа, в частности, спектрометрического анализа; 3) предполагает использование реактивов с высокими концентрациями, в частности, дезоксирибонуклеозидтрифосфатов по 2 мМ, а также дорогостоящих ферментов AMV-ревертаза - 10 ед., РНКаза Н Е. coli - 10 ед., Т7 ДНК-зависимой РНК-полимеразы - 10 ед., что увеличивает стоимость проведения одного исследования; 4) степень достоверности анализа с помощью прототипного способа составляет 93% при титре инфекционной активности 1,0 lg ККИД50/см3, что ограничивает применение указанного способа при низких значениях данного параметра.
В связи с этим целесообразно провести поиск более достоверного, экономичного способа опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением молекулярно-биологического метода с последующим достоверным алгебраическим анализом.
Данный метод позволяет в течение 2,5 часов достоверно определять титр инфекционной активности вируса бешенства в сырье для изготовления антирабических вакцин. Исходя из этого, целесообразно предложить новый способ опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины на основе альтернативного метода.
Задачей настоящего изобретения является разработка способа опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением современных технологий с целью устранения вышеуказанных недостатков.
Техническое решение заключается в разработке высокочувствительного, высокоспецифичного, объективного и быстрого в исполнении способа опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
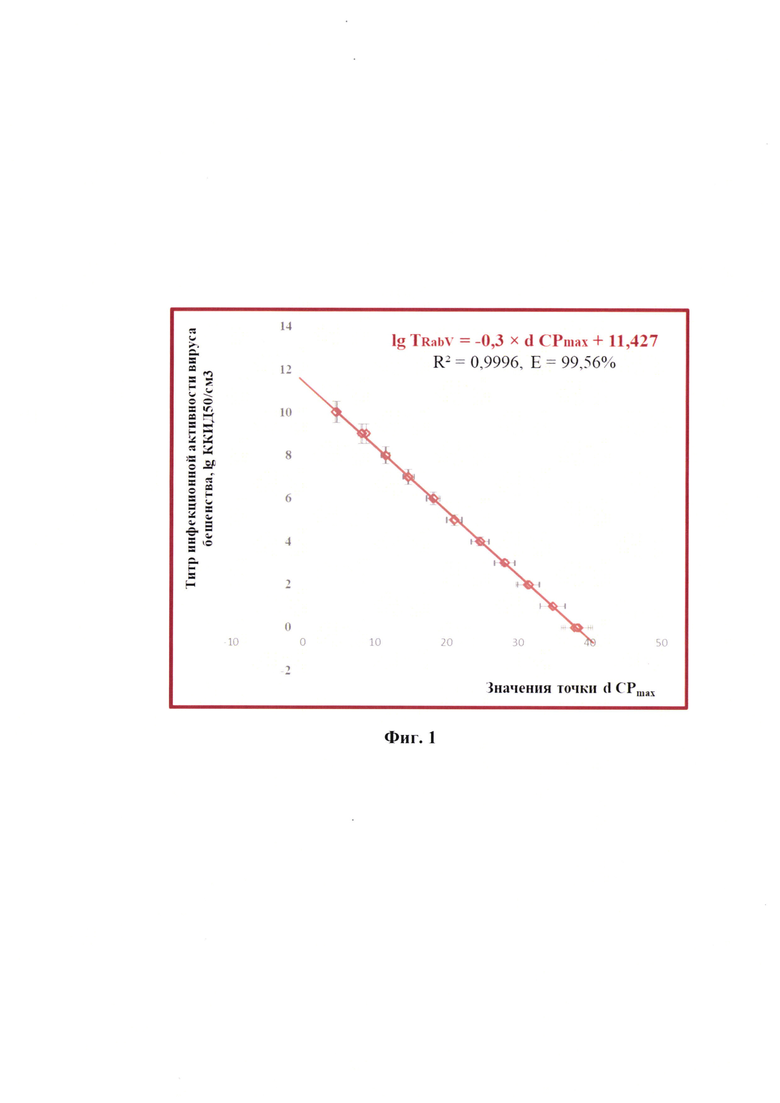
Разработанный способ позволяет: 1) достичь максимальной специфичности анализа проб биоматериала за счет разработки высокоспецифичных оригинальных олигонуклеотидных праймеров и ДНК-зонда; 2) повысить достоверность проводимого анализа благодаря установлению зависимости между титром инфекционной активности вируса бешенства (TRabV) и значением дифференциала второго порядка максимальной точки логистической кривой ПЦР (d CPmax), представленной в виде следующей логарифмической функции: lg TRabV=-0,3×d CPmax+11,427 с достоверностью аппроксимации (R2), равной 0,9996, и эффективностью амплификации 99,56%. Точка d CPmax определяется на графике, полученном после проведения дифференцирования второго порядка логистических кривых ПЦР для исследуемых проб. Предложенная модель позволит опосредованно определять титр инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки логистической кривой ПЦР.
Сущность изобретения отражена на графических изображениях:
Фиг. 1 - график зависимости между титром инфекционной активности вируса бешенства (TRabV) и значением дифференциала второго порядка максимальной точки логистической кривой ПЦР (d CPmax) (с указанием стандартной погрешности) (n=5, р<0,001).
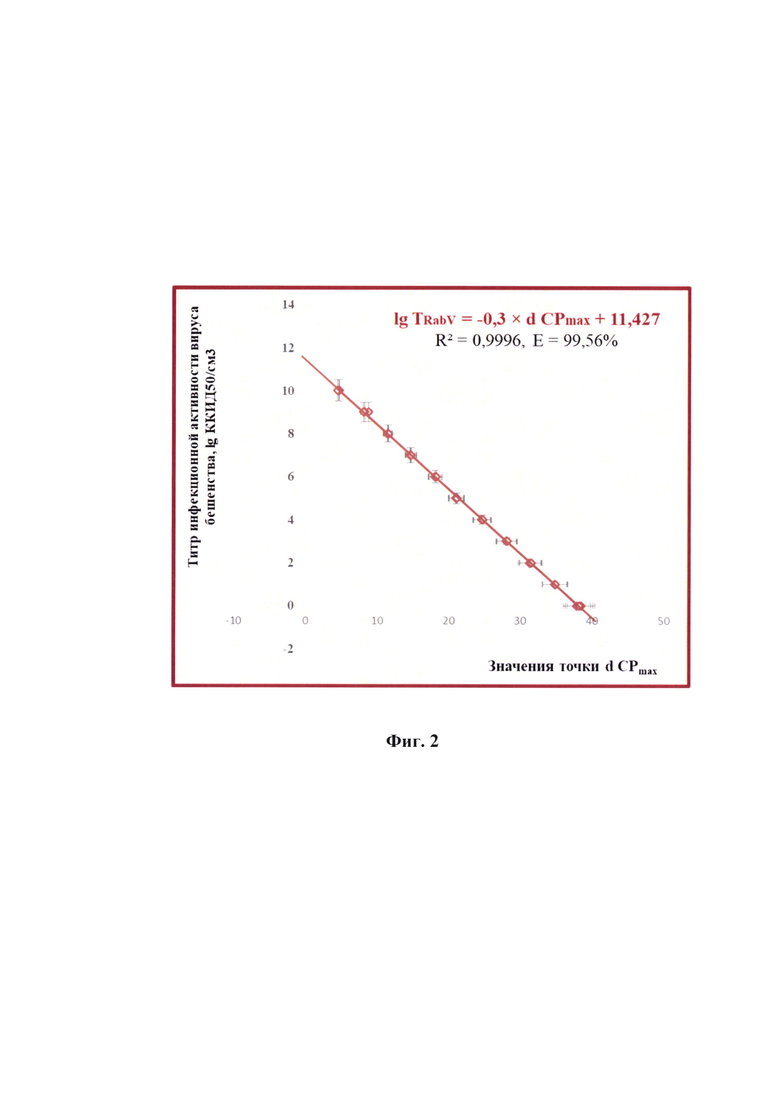
Фиг. 2 - график обратной зависимости между титром инфекционной активности вируса бешенства (TRabV) и значением дифференциала второго порядка максимальной точки логистической кривой ПЦР (d CPmax) (с указанием стандартной погрешности) (n=5, р<0,001).
Фиг. 3 - дизайн оригинальных олигонуклеотидных праймеров и ДНК-зонда для опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР. Примечание: А - прямой праймер, Б - ДНК-зонд и обратный праймер, который дан в двух вариантах: в комплементарном прямом и в формате revers-complement, который используется в анализе.
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO: 1 представляет последовательность нуклеотидов G-гена кДНК вируса бешенства вакцинного штамма «РВ-97».
SEQ ID NO: 2 представляет последовательность аминокислот, которые кодируются G-гена кДНК вируса бешенства штамма «РВ-97».
Сущность изобретения заключается в возможности определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
Заявляемый способ основан на экстрагировании элюата РНК вируса бешенства, проведении обратной транскрипции и ПЦР в режиме реального времени с использованием высокоспецифичных оригинальных олигонуклеотидных праймеров и ДНК-зонда, применении технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР для расчета титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной вакцины против бешенства.
В отличие от наиболее близкого прототипа разработанный способ включает этап экстрагирования РНК вируса бешенства; стадию проведения обратной транскрипции и ПЦР с применением высокоспецифичных оригинальных олигонуклеотидных праймеров и ДНК-зонда; новый подход к методике расчета титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с использованием технологии алгебраического анализа дифференциала второго порядка максимальной точки логистической кривой ПЦР. Применение разработанного способа повышает достоверность анализа по определению титра инфекционной активности вируса бешенства в пробах сырья для вакцины. Предлагаемое изобретение не предполагают применение технологии NASBA; не требует проведения дополнительного количества этапов анализа, в частности, спектрометрического анализа; не предполагает использование реактивов с высокими концентрациями, тем самым уменьшая стоимость проведения одного исследования на 37%; позволяет повысить степень достоверности анализа с помощью разработанного способа до 98,21% при титре инфекционной активности 0,2 lg ККИД50/см3, что подразумевает значительное увеличение аналитической чувствительности анализа. Исходя из этого, актуально применять разработанный способ для опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
Ключевым элементом заявляемого способа является детекция максимальной точки логистической кривой ПЦР после расчета алгебраического дифференциала второго порядка, на основе которого проводится опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением разработанной логарифмической функции.
Сопоставительный анализ с наиболее близким прототипом позволяет сделать вывод, что новизна и изобретательский уровень заявляемого изобретения заключается в применении способа опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР, который ранее не использовали для расчета данного параметра.
Сведений о разработке предлагаемого способа опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР авторами не обнаружено.
Также технический результат изобретения заключается в том, что разработанный способ дает возможность: 1) повысить чувствительность и специфичность за счет применения высокоспецифичных оригинальных праймеров и ДНК-зонда, рассчитанных для целевого участка G-гена вируса бешенства; 2) увеличить достоверность проводимого анализа благодаря подбору оптимальных температурного и временного режимов термоциклирования; 3) быстро и с небольшими экономическими затратами проводить определение титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
Сущность предлагаемого изобретения пояснена на графическом материале - график зависимости между титром инфекционной активности вируса бешенства (TRabV) и значением дифференциала второго порядка максимальной точки логистической кривой ПЦР (d CPmax) (с указанием стандартной погрешности) (n=5, р<0,001) (фиг.1).
На первом этапе исследования подготавливают исследуемые образцы, разведения стандарта, положительные и отрицательные пробы. В качестве стандарта используют неинактивированную лиофильно высушенную стабильную суспензию вируса бешенства, репродуцированного в суспензионной культуре клеток почки новорожденного сирийского хомячка (BHK-21/SUSP/ARRIAH) с титром инфекционной активности вируса 10,0 lg ККИД50/см3. Методом разведений получают суспензии стандарта с содержанием вирусной РНК, эквивалентным следующим титрам инфекционной активности вируса бешенства: 0,0, 1,0, 2,0, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0, 9,0, 10,0 lg ККИД50/см3. Применяют также положительный контроль на этапе выделения РНК, который представляет собой лиофильно высушенную суспензию вируса бешенства вакцинного штамма «РВ-97», репродуцированного в суспензионной перевиваемой культуре клеток BHK-21/SUSP/ARRIAH, с титром инфекционной активности не ниже 7,0 lg ККИД50/см3. На данном этапе используют также отрицательный контроль, в качестве которого применяют суспензию клеток линии ВНК-21/SUSP/ARRIAH, не контаминированную микроорганизмами. На этапе проведения ПЦР используют положительный (кДНК вируса бешенства, полученная из вируссодержащей культуральной суспензии с титром инфекционной активности 7,25±0,10 lg ККИД50/см3) и отрицательный контроли (деионизированная вода, свободная от нуклеаз).
На следующем этапе анализа осуществляют выделение РНК из контролей и исследуемых образцов твердофазным сорбционным методом на стекловолокнистых фильтрах. К 100 мкл суспензии иммунного комплекса добавляют 400 мкл 5,5 М гуанидинизотиоцианата, инкубируют содержимое в процессе перемешивания в течение 5 мин., затем продлевают инкубирование в твердотельном термостате при температуре 65±2°С в течение 2 мин. Полученный лизат пропускают через колонку со стекловолокнистыми фильтрами на установке Promega Vac-Man Vacuum Manifold с поддержанием отрицательного давления, создаваемого вакуумным насосом. Проводят отмывание стекловолокнистого фильтра от балластных составляющих. Для этого в каждую колонку при работающем вакуумном насосе добавляют по 500 мкл 80% раствор пропанола-2, ждут полного прохождения жидкости через фильтр. Для очистки от гидрофобных примесей в каждую пробирку добавляют по 500 мл 90%-ного раствора пропанола-2, затем ту же процедуру со 100%-ным пропанолом-2 дважды. После удаления спирта в колонки добавляют по 50 мкл раствора для элюирования (деионизированная вода, свободная от нуклеаз) и прогревают содержимое при температуре 65±2°С в течение 5 мин. После процесса десорбции колонки помещают в пробирки объемом 1,5 см3 и центрифугируют в течение 1 мин при 14000 об/мин на настольной микроцентрифуге, отбирают элюаты РНК. Полученный экстракт РНК хранят при температуре минус 20±2°С в течение 4 недель или сразу используют для анализа.
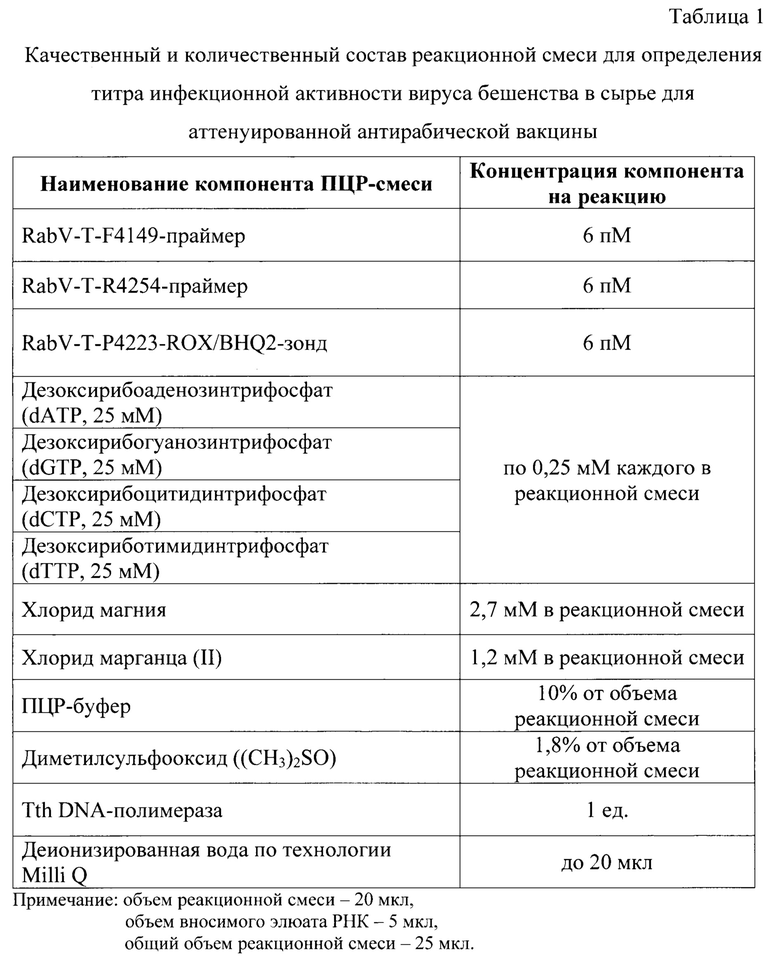
После экстрагирования РНК вируса бешенства проводят обратную транскрипцию и ПЦР с использованием высокоспецифичных оригинальных олигонуклеотидных праймеров и ДНК-зонда для исследования контрольных образцов и проб. Для постановки реакции готовят реакционную смесь, рецептура приготовления которой представлена в таблице 1. В качестве гомологичных высоковариабельному G-гену вируса бешенства вакцинного штамма «РВ-97» [12] олигонуклеотидов используют следующие праймеры и ДНК-зонд:

в концентрации 6 пМ на реакцию. Для формирования нуклеотидных цепей продуктов реакции применяют дезоксирибонуклеозидтрифосфаты с концентрацией каждого в реакционной смеси по 0,25 мМ. В качестве основы используют ПЦР-буфер следующего состава: 150 мМ (NH4)2SO4, 650 мМ Tris-HCl (рН 8,75), 0,1% Tween-20. В реакционную смесь добавляют 2,7 мМ хлорида магния, 1,2 мМ сульфата марганца и диметилсульфооксид в количестве 1,8% от общего объема без элюата РНК. В качестве растворителя используют деионизированную воду системы очистки Milli Q. В качестве катализатора обратной транскрипции и реакции амплификации применяют Tth (Thermus thermofilus) ДНК-полимеразу (1 ед.). Данное количество единиц позволяло увеличить эффективность реакции амплификации без снижения специфичности отжига олигонуклеотидов. Данную полимеразу выбрали, поскольку она проводит катализ реакции обратной транскрипции и амплификации в одной пробирке без внесения ревертазы, что позволяет сократить время проведения анализа.
Объем реакционной смеси компонентов для проведения одной реакции составляет 20 мкл. Элюаты РНК каждого образца добавляют к смеси по 5 мкл. Общий объем реакционной смеси составляет 25 мкл.
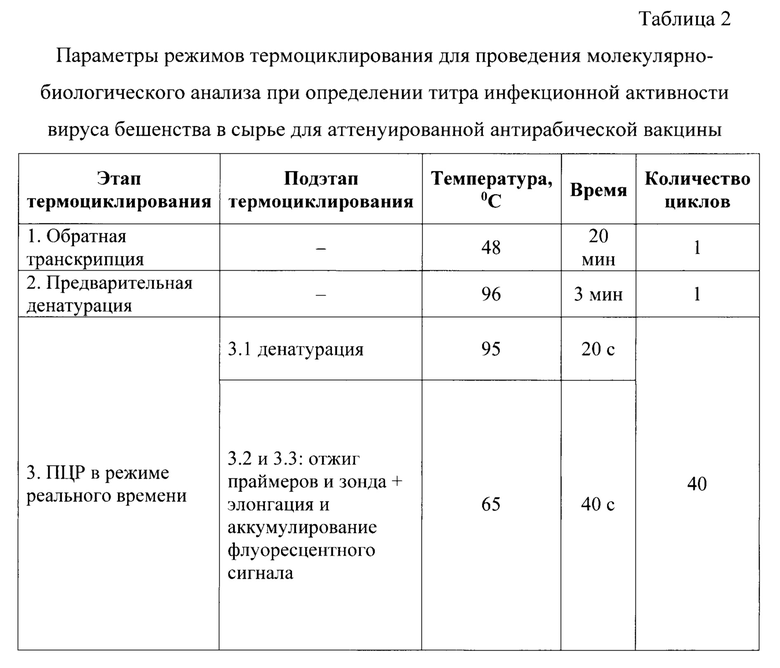
Постановку реакции осуществляют при температурных и временных параметрах, сведения о которых представлены в таблице 2. Обратную транскрипцию проводят при температуре 48°С в течение 20 мин. за 1 цикл, предварительную денатурацию комплементарной ДНК - при температуре 96°С за 3 мин. в течение 1 цикла. Реакцию амплификации в режиме реального времени осуществляют в течение 40 циклов, каждый из которых складывается из 3 подэтапов: «денатурации», проводимой при температуре 96°С в течение 10 с, а также подэтапов «отжига праймеров и зонда» и «элонгации и аккумулирования флуоресцентного сигнала», осуществляемых при температуре 65°С за 40 с одновременно.
Результаты реакции анализируют, оценивая и сравнивая логистические графики ПЦР вида F1=f (CP) после проведения анализа с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки данной функции. Дифференциал точки CP (d CPmax) является важной характеристикой реакции, поскольку позволяет достоверно судить о начальной концентрации РНК и, соответственно, титре инфекционной активности вируса бешенства в сырье для изготовления вакцины. При этом учитываются все фоновые явления, значения которых вычитаются и проводится алгебраический расчет после вычета фона и всех шумовых явлений. Данный метод имеет преимущество в связи с тем, что при умножении кривой на любые множители положение наибольших значений функции не изменяется. Точка d CPmax при его исследовании на максимумы располагается внутри экспоненциального участка логистической кривой, где эффективность реакции амплификации является постоянной величиной. Наибольшие значения дифференциала первого порядка находятся преимущественно в зоне искажения значений эффективности амплификации, поэтому их не следует использовать для исследования. Графики дифференциала высших порядков дают менее точные результаты, поскольку их координаты во многом сопряжены с шумовыми значениями [13].
Получив значения d CPmax графиков логистических графиков ПЦР, отражающих накопление флуоресцентного сигнала образцов с разным титром инфекционной активности вируса бешенства, устанавливают зависимость между титром вируса и значением точки d CPmax. На основе разработанной модели опосредованно рассчитывают титр инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины.
Сущность предлагаемого изобретения пояснена примерами его исследования, которые не ограничивают объем изобретения.
Пример 1. Выявление существования зависимости между титром инфекционной активности вируса бешенства и точки d CPmax для разработки способа опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
На первом этапе исследования подготавливали исследуемые образцы, разведения стандарта, положительные и отрицательные пробы. В качестве стандарта использовали неинактивированную лиофильно высушенную стабильную суспензию вируса бешенства вакцинного штамма «РВ-97», репродуцированного в суспензионной культуре клеток ВНК-21/SUSP/ARPIAH с титром инфекционной активности вируса 10,0 lg ККИД50/см3. Методом разведений получают суспензии стандарта с содержанием вирусной РНК, эквивалентным следующим титрам инфекционной активности вируса бешенства: 0,0, 1,0, 2,0, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0, 9,0, 10,0 lg ККИД50/см3. В качестве положительного контроля на этапе выделения РНК применяли лиофильно высушенную суспензию вируса бешенства вакцинного штамма «РВ-97», репродуцированного в суспензионной перевиваемой культуре клеток BHK-21/SUSP/ARRIAH, с титром инфекционной активности не ниже 7,0 lg ККИД50/см3. Использовали также отрицательный контроль, в качестве которого применяют суспензию клеток линии BHK-21/SUSP/ARRIAH, не контаминированную микроорганизмами. На этапе проведения ПЦР использовали положительный (кДНК вируса бешенства, полученная из вируссодержащей культуральной суспензии с титром инфекционной активности 7,25±0,10 lg ККИД50/см3) и отрицательный контроли (деионизированная вода, свободная от нуклеаз).
На следующем этапе анализа осуществляли выделение РНК из контролей и исследуемых образцов твердофазным сорбционным методом, как описано выше. Полученные экстракты РНК хранили при температуре минус 20±2°С в течение 4 недель и далее использовали в работе.
После экстрагирования РНК вируса бешенства проводили обратную транскрипцию и реакцию амплификации кДНК с использованием высокоспецифичных оригинальных олигонуклеотидных праймеров и ДНК-зонда для исследования контрольных образцов и проб. Для постановки реакции готовили реакционную смесь, рецептура приготовления которой представлена в таблице 1. В качестве гомологичных высоковариабельному G-гену вируса бешенства вакцинного штамма «РВ-97» олигонуклеотидов использовали праймеры и ДНК-зонд, дизайн которых отражен выше. Состав реакционной смеси представлен в таблице 1. Постановку реакции осуществляли при температурных и временных параметрах, сведения о которых указаны в таблице 2.
Результаты реакции анализировали, оценивая и сравнивая логистические графики ПЦР вида Fl=f (CP) после проведения анализа с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки данной функции. Получив значения d CPmax графиков логистических графиков ПЦР, отражающих накопление флуоресцентного сигнала образцов с разным титром инфекционной активности вируса бешенства, устанавливали зависимость между титром вируса и значением точки d CPmax.
Полученные данные анализировали с помощью программного обеспечения «Rotor-Gene FRT-Manager», которое позволяет строить графики накопления флуоресцентного сигнала в режиме реального времени на протяжении заданного количества циклов амплификации (С). Применяя технологии компьютерной программы «Maxima», или аналога, проводили построение логистических графиков после вычисления дифференциала второго порядка и определения точки d CPmax для полученных элюатов РНК вируса бешенства каждого разведения стандарта с определенными значениями титра вируса (Фиг. 1).
Значения точки d CPmax для всех разведений стандарта вируса бешенства с титрами инфекционной активности от 0,0 до 10,0 lg ККИД50/см3 находились в диапазоне от 38,09±0,09 до 4,76±0,01, соответственно. Стандартное отклонение при низком титре инфекционной активности (0,00 lg ККИД50/см3) выше (0,09), чем при высоком (10,0 lg ККИД50/см3) по причине снижения чувствительности анализа. При исследовании отрицательных контролей формирования логистических графиков не наблюдалось, что подтверждает отсутствие вируса бешенства в данном образце. В представленных исследованиях р-уровень значимости меньше 0,001, что подтверждает достоверность проводимых количественных исследований.
Прямая зависимость титра инфекционной активности вируса бешенства и значений точки d CPmax представлена на фиг.1 и в виде следующей регрессионной логарифмической функции:
lg TRabV=-0,3 × d CPmax+11,427
с достоверностью аппроксимации (R2), равной 0,9996, и эффективностью амплификации (Е) 99,56%.
Эффективность реакции амплификации вычислили при анализе углового коэффициента из графика следующей функции:
d CPmax=-3,3324 × lg TRabV+38,088
с высокой достоверностью аппроксимации R2=0,9996, представленного на фиг.2. Точка d CPmax определяется на графике, полученном после проведения дифференцирования второго порядка логистических кривых ПЦР для исследуемых проб. Таким образом, выявлено существование зависимости титра инфекционной активности вируса бешенства в сырье для вакцины и точки d CPmax. Предложенная модель позволяет опосредованно определять титр инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
Пример 2. Опосредованное определение титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
Для анализа использовали референтные суспензии культурального вируса бешенства вакцинного штамма «РВ-97», который применяется для изготовления аттенуированной антирабической вакцины с разными значениями титров инфекционной активности (7,00; 7,25; 7,50; 7,75; 8,00; 8,25; 8,50; 8,75; 9,00; 9,25; 9,50; 9,75; 10,00 lg ККИД50/см3) по данным исследования с помощью классического метода в культуре клеток и наиболее близкого прототипа. Все этапы анализа и контроли представлены выше.
Значение d CPmax среднее для положительных контролей составляло 13,93±0,01, что соответствовало титру инфекционной активности вируса бешенства 7,25±0,01 lg ККИД50/см3 (совпадает с референс-значением, которое составляет 7,25 lg ККИД50/см3). Значение d CPmax среднее для проб с титрами вируса 7,00; 7,25; 7,50; 7,75; 8,00; 8,25; 8,50; 8,75; 9,00; 9,25; 9,50; 9,75; 10,00 lg ККИД50/см3 составляли 14,76±0,04, 13,93±0,03, 13,10±0,04, 12,26±0,03, 11,42±0,02, 10,60±0,01, 9,76±0,03, 8,93±0,01, 8,09±0,03, 7,26±0,01, 6,43±0,03, 5,60±0,01, 4,46±0,03, соответственно.
Пользуясь следующей разработанной моделью:
lg TRabV=-0,3 × d CPmax+11,427
определили, что значения титра инфекционной активности вируса бешенства, составляли 7,00±0,01, 7,25±0,03, 7,49±0,01, 7,75±0,02, 8,01±0,02, 8,25±0,01, 8,49±0,03, 8,76±0,01, 9,02±0,03, 9,25±0,02, 9,50±0,01, 9,76±0,03, 10,01±0,01 lg ККИД50/см3, что сочеталось с данными анализов, проведенных с помощью прототипа и наиболее близкого прототипа. В отрицательном контроле вирус бешенства не обнаружен ни одним из указанных методов. Анализ занял не более 2,5 ч.
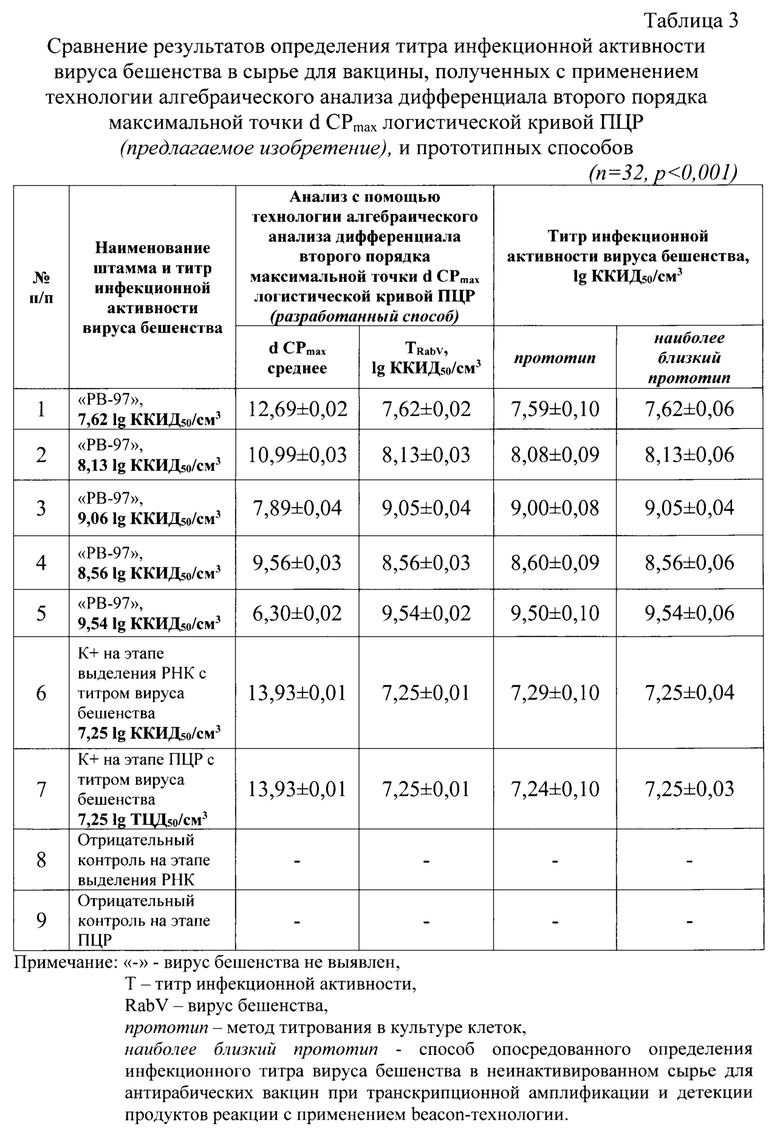
Отдельно исследовали 5 проб культурального вируса бешенства вакцинного штамма «РВ-97» с разными значениями титра инфекционной активности в 32 повторностях. Результаты анализа пяти модельных суспензий представлены в таблице 3. Выявили, что данные, полученные с помощью разработанного способа, коррелировали с данными прототипа на 99,38-99,61% и результатами наиболее близкого прототипа на 100%.
Таким образом, разработанный способ позволяет быстро и достоверно опосредованно определять титр инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
Пример 3. Определение степени достоверности, аналитической чувствительности и специфичности способа опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
Для анализа использовали 423 пробы суспензии культурального вируса бешенства с титрами инфекционной активности 0,00-10,00 lg ККИД50/СМ3. Положительные и отрицательные контроли использовали те же, что и выше. Количественный анализ проводили, как отражено выше.
С полученными экстрактами РНК вируса бешенства проводили обратную транскрипцию и ПЦР с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР и разработанных оригинальных специфических олигонуклеотидных праймеров и ДНК-зонда. Расчеты осуществляли с помощью следующей логарифмической регрессионной функции:
lg TRabV=-0,3 × d CPmax+11,427.
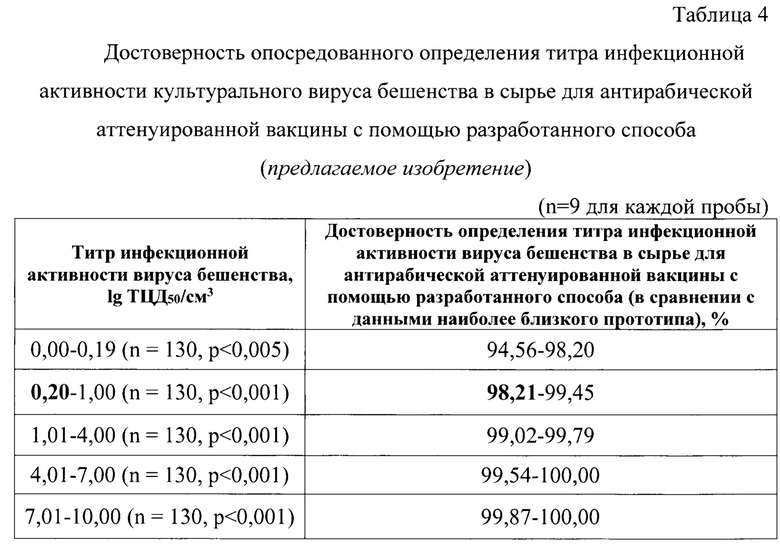
Представленные пробы и контроли также тестировали с помощью прототипа и наиболее близкого прототипа. Результаты анализа пяти модельных суспензий для примера представлены в таблице 4. Выявили, что данные, полученные с помощью разработанного способа, коррелировали с данными наиболее близкого прототипа на 99,87-100,00% для значений титра инфекционной активности культурального вируса бешенства в диапазоне 7,01-10,00 lg ККИД50/см3, на 99,54-10,00 - для диапазона 4,01-7,00 lg ККИД50/см3, на 99,02-99,79 - для диапазона 1,01-4,00 lg ККИД50/см3, на 98,21-99,45% - для диапазона 0,20-1,00 lg ККИД50/см3 и на 94,56-98,20% - для диапазона 0,00-0,19 lg ККИД50/см3. Таким образом, разработанный способ позволяет достоверно определять титр инфекционной активности культурального вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины. Аналитическая чувствительность разработанного способа составила 0,20 lg ККИД50/см3 с достоверностью определения данного показателя, равной 98,21%.
Специфичность разработанного способа оценивали путем тестирования следующих образцов: культуральных суспензий вируса бешенства вакцинного штамма «РВ-97», вируса инфекционного некроза гемопоэтической ткани лососевых, вируса инфекционного некроза поджелудочной железы, вируса ящура серотипа O, вируса чумы мелких жвачных животных изолята «PPRV/Israel-2536/Hebron/1997», бактериальной суспензии Mycoplasma capricolum ssp.
В качестве положительных контролей использовали культуральную лиофильно высушенную суспензию вакцинного штамма «РВ-97» вируса бешенства с титром инфекционной активности 7,25 lg ККИД50/см3. В качестве отрицательного контроля использовали деионизированную воду. В результате исследования амплификация с неспецифичными нуклеиновыми кислотами других инфекционных агентов не была обнаружена.
В результате исследования обнаружили, что для проб, не содержащих нуклеиновую кислоту вируса бешенства, и для отрицательного контроля не были сформированы графики плавления и не были определены значения точки d CPmax. При исследовании культуральной лиофильно высушенной суспензии вируса бешенства вакцинного штамма «РВ-97» определили, что значение точки d CPmax составило 13,93±0,01 (n=5, р<0,001), а титр инфекционной активности - 7,25±0,01 lg ККИД50/см3 (n=5, р<0,001).
Таким образом, полученные результаты свидетельствовали о 100%-ной специфичности разработанного способа опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
Пример 4. Определение диагностических показателей разработанного способа опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР.
Для разработанного способа (предлагаемое изобретение) для опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР исследовали стандартные диагностические показатели [14, 15].
Для определения диагностической чувствительности разработанного способа анализировали 650 проб вируссодержащего неинактивированного сырья, которые являлись заведомо положительными по данным наиболее близкого прототипа. Титр инфекционной активности вируса бешенства для исследуемых проб находился в диапазоне 5,0-10,0 lg ККИД50/см3. Постановку реакции и проведение анализа осуществляли, как отражено выше. Разработанным способом опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР (предлагаемое изобретение) определили, что из 650 образцов проб 650 определены в качестве положительных, 0-в качестве отрицательных.
Для исследования специфичности метода тестировали 175 отрицательных проб, не содержащих вирус бешенства. В результате исследования с помощью разработанного способа (предлагаемое изобретение) определили, что из 175 отрицательных проб все определены в качестве отрицательных.
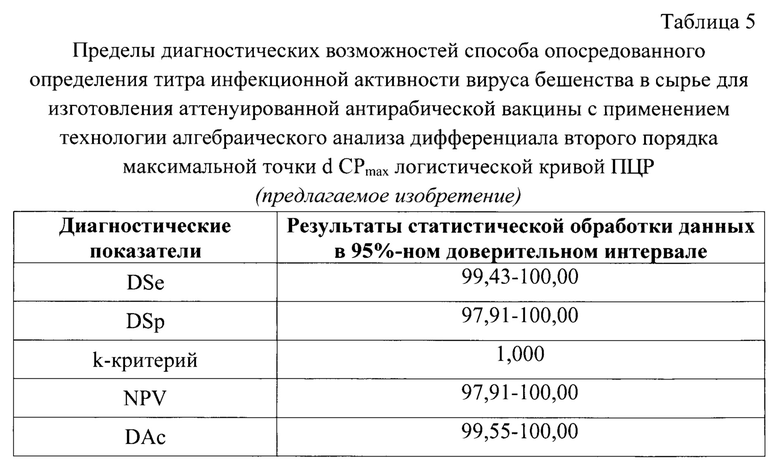
На основе представленных данных определили, что в 95%-ном доверительном интервале диагностическая чувствительность (DSe) составила 99,43-100,0%, диагностическая специфичность (DSp) - 97,91-100,0%, k-критерий - 1,000; прогностичность отрицательного результата (NPV) -97,91-100,00%, общая точность (DAc) - 99,55-100,0% (табл. 5).
Основным преимуществом предлагаемого изобретения является возможность опосредованно определять титр инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР. Данный способ для возбудителя бешенства применяется впервые. Предлагаемое изобретение позволяет за 2,5 ч опосредованно проводить анализ вируссодержащего сырья для изготовления аттенуированной антирабической вакцины. В представленном изобретении предлагается применять Tth ДНК-полимеразу, позволяющая совмещать этапы обратной транскрипции и ПЦР в режиме реального времени, а также оригинальные высокоспецифические олигонуклеотидные праймеры и ДНК-зонд, рассчитанные для целевого участка G-гена вируса бешенства. В предлагаемом изобретении зависимость титра инфекционной активности вируса бешенства и значений точки d CPmax представлена в виде следующей регрессионной логарифмической функции:
lg TRabV=-0,3 × d CPmax+11,427
с достоверностью аппроксимации (R2), равной 0,9996, и эффективностью амплификации 99,56%. Точка d CPmax определяется на графике, полученном после проведения дифференцирования второго порядка логистических кривых ПЦР для исследуемых проб. Предложенная модель позволит опосредованно определять титр инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки логистической кривой ПЦР.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Способ опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР»:
1. European Pharmacopoeia 7.0. (2012а). Monograph 0451: Rabies vaccine (live, oral) for foxes. European Directorate for the Quality of Medicines and HealthCare (EDQM), Council of Europe, Strasbourg, France.
2. ICTV (International Committee on Taxonomy of Viruses). URL: http://www.ictvonline.org/virusTaxonomy.asp?bhcp=1 (Дата обращения: 14.06.2023).
3. OIE. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. 7th ed. Paris. - 2022. - Ch. 2.1.17.
4. World Health Organization (2007). Oral Vaccination of Dogs against Rabies. WHO, Geneva, Switzerland. WU X., SMITH T.G. & RUPPRECHT C.E. (2011). From brain passage to cell adaptation: the road of human rabies vaccine development. Exp.Rev. Vaccines, 10, 1597-1608.
5. Warner C.K., Whitfield S.G., Fekadu M. & Ho H. (1997). Procedures for reproducible detection of rabies virus antigen mRNA and genome in situ in formalin-fixed tissues. J. Virol. Methods, 67, 5-12.
6. Сухарьков Андрей Юрьевич. Разработка методов оценки оральной антирабической вакцинации животных: диссертация... кандидата биологических наук: 03.02.02 / Сухарьков Андрей Юрьевич. [Место защиты: Федеральное государственное бюджетное учреждение «Федеральный центр охраны здоровья животных»]. - Владимир, 2014. - 141 с.
7. Heminested PCR assay for detection of six genotypes of rabies and rabies-related viruses / P.R. Heaton, P. Johnstone, L.M. McElhinney [et al.] // J. Clin. Microbiol. - 1997. - Vol.35. - P. 2762-2766.
8. Faye, M. Development and validation of sensitive real-time RT-PCR assay for broad detection of rabies vims / M. Faye, L. Dacheux, M. Weidmann // J. Virol. Methods. - 2017. - Vol.243. - P. 120-130.
9. Lourenc Correia Moreira B., Aparecida Pereira L., Lappas Gimenez A.P., Minor Fernandes Inagaki J., Raboni S.M. Development and validation of a real-time RT-PCR assay for the quantification of rabies virus as quality control of inactivated rabies vaccines. J Virol Methods. 2019 Aug;270:46-51. doi: 10.1016/j.jviromet.2019.04.025. Epub 2019 May 3. PMID: 31047970.
10. Патент РФ №2 755 925, 03.08.2020. Способ опосредованного определения титра инфекционной активности вируса бешенства штамма ВНИИЗЖ в сырье для инактивированной антирабической вакцины методом ПЦР в режиме реального времени // Заявка 2020126182, Бюл. №27 от 23.09.2021 / Доронин М.И., Михалишин Д.В., Борисов А.В., Луговская Н.Н., Оковытая Т.В.
11. Способ опосредованного определения инфекционного титра вируса бешенства в неинактивированном сырье для антирабических вакцин при транскрипционной амплификации и детекции продуктов реакции с применением beacon-технологии // Заявка 2020129954, Бюл. №28 от 30.09.2021 / Доронин М.И., Михалишин Д.В., Борисов А.В., Мудрак Н.С.
12. Rabies virus strain RV-97 glycoprotein (G) gene, complete cds. URL: https://www.ncbi.nlm.nih.gov/nuccore/AY683208.l (дата обращения 25.05.2023).
13. Rutledge R.G. Mathematics of quantitative kinetic PCR and the application of standard curves / R.G. Rutledge, C. Cote // Nucleic Acide Res. - 2004. - V. 31, N. 16.-e.93.P. 1-6.
14. Liu W., Saint D.A. Validation of a quantitative method for real-time PCR kinetics // Biochem. Biophys. Res. Commun. - 2002. - V. 294. - P. 347-353.
15. Peirson S.N., Butler J.M., Foster R.G. Experimantal validation of novel and conventional approaches to quantitative real-time PCR data analysis // Nucleic Acids Res. - 2003. - V. 31:e.73.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="RabV Titre.xml"
softwareName="WIPO Sequence" softwareVersion="2.1.2"
productionDate="2023-07-07">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-07-07</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>521</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-07-07</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">ФГБУ "Федеральный центр охраны
здоровья животных" (ФГБУ "ВНИИЗЖ")</ApplicantName>
<ApplicantNameLatin>FGBI "ARRIAH"</ApplicantNameLatin>
<InventorName languageCode="ru">Доронин Максим
Игоревич</InventorName>
<InventorNameLatin>Doronin Maksim Igorevich </InventorNameLatin>
<InventionTitle languageCode="ru">Способ опосредованного определения
титра инфекционной активности вируса бешенства в сырье для
изготовления аттенуированной антирабической вакцины с применением
технологии алгебраического анализа дифференциала второго порядка
максимальной точки d CPmax логистической кривой ПЦР</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>1572</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1572</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>RabV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggttcctcaggctcttttgtttgtaccctttctgggtttttcattgt
gtttcgggaaattccctatttacacgataccggacaaacttggtccctggagcccgattgatatacatca
tctcagttgcccaaacaatttggtcgtggaggatgaaggatgcaccaacctgtcagggttctcctacctg
gaacttaaagttggacacatctctgctataaaggtgaacggattcacttgcacaggcgttgtgacagagg
cagagacctacactaactttgttggttatgtcaccaccacgttcaaaagaaagcatttccgcccgacacc
agatgcatgtagagccgcatacaactggaagacggctggtgatcccagatatgaagagtctttacaaaat
ccgtaccctgactaccagtggctccgaactgtaagaaccaccaaggagtctctcgttatcatatccccaa
gtgcggcagatttggacccatatgacaaatcccttcactcgagggtcttccctagcggaaagtgctcagg
aataacggtgtcctctgtttactgctcaacaaaccacgattacaccatttggatgcctgagaatccgaga
caagggatgtcttgtgacattttcaccaatagtagagggaagagagcatccaaggagagaaagacctgcg
gctttgtggatgaaagaggcctgtataagtctctaagaggctcatgcaaactcaagttatgtggagttct
tggacttagacttatggatggaacatgggtcgcgatgcagacatcaaatgagaccaaatggtgttcccct
gatcagttggttaatctgcacgactttcactcagatgaaattgagcatcttgttgtagaggagttggtca
agaaaagagaggagtgtctggatgcactagagtccatcatgaccaccaagtcagtaagtttcagacgtct
cagtcatttaagaaaacttgtccctgggttcggaaaagcatataccataatcaacaagactttgatggag
gctgaggctcactacaagtcagtccggacttggaatgagatcgtcccctcaaaagggtgtttaagagtcg
aagggaggtgtcatcctcatgtaaacggggtatttttcaatggtataatattagggcctgacggccatgt
tctaatcccagagatgcaatcatccctcctccagcaacatatggagttattggaatcctcagttattccc
ctgatgcacccccttgcagacccgtccacggttttcaaggaaggcgatgaggcggaggactttgtagaag
ttcactttccagatgtgcataaaaaggtctcagaggttgacctgggtctcccgaactggggagagtatgt
attactgagtgcagggaccctgattgccttgatgttgataattttcctaatgatatgtcgtagaagagtc
aatagaccagaatctacgcaacgcagtctcagagggacagagatgaaggtgtcggtcaccccccaaagcg
ggaaattcaaatcttcatgggaatcatataaaagtggggatgaagctagactg</INSDSeq_sequenc
e>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>524</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..524</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>RabV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MVPQALLFVPFLGFSLCFGKFPIYTIPDKLGPWSPIDIHHLSCPNNLVV
EDEGCTNLSGFSYLELKVGHISAIKVNGFTCTGVVTEAETYTNFVGYVTTTFKRKHFRPTPDACRAAYNW
KTAGDPRYEESLQNPYPDYQWLRTVRTTKESLVIISPSAADLDPYDKSLHSRVFPSGKCSGITVSSVYCS
TNHDYTIWMPENPRQGMSCDIFTNSRGKRASKERKTCGFVDERGLYKSLRGSCKLKLCGVLGLRLMDGTW
VAMQTSNETKWCSPDQLVNLHDFHSDEIEHLVVEELVKKREECLDALESIMTTKSVSFRRLSHLRKLVPG
FGKAYTIINKTLMEAEAHYKSVRTWNEIVPSKGCLRVEGRCHPHVNGVFFNGIILGPDGHVLIPEMQSSL
LQQHMELLESSVIPLMHPLADPSTVFKEGDEAEDFVEVHFPDVHKKVSEVDLGLPNWGEYVLLSAGTLIA
LMLIIFLMICRRRVNRPESTQRSLRGTEMKVSVTPQSGKFKSSWESYKSGDEARL</INSDSeq_seque
nce>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---

Изобретение относится к области биотехнологии. Описан способ опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР, с применением разработанных оригинальных высокоспецифичных олигонуклеотидов. Технический результат заключается в разработке высокочувствительного, высокоспецифичного, объективного и быстрого в исполнении способа опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины, с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР. 2 з.п. ф-лы, 3 ил., 5 табл., 4 пр.
1. Способ опосредованного определения титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистической кривой ПЦР, с применением следующих разработанных оригинальных высокоспецифичных олигонуклеотидов:
RabV-T-F4149-праймер с дизайном 5'-ATCTGCACGACTTTCACTCAGATG-3',
RabV-T-R4254-праймер с дизайном 5'-CTGAGACGTCTGAAACTTACTGAC-3',
RabV-T-P4223-ROX/BHQ2-зонд с дизайном 5'-ROX-TGG ATGCACTAGAGTCCATCATG-BHQ2-3' и включающий следующие стадии:
- экстрагирование РНК вируса бешенства из сырья для изготовления аттенуированной антирабической вакцины с использованием твердофазного сорбционного метода на стекловолокнистых фильтрах;
- проведение обратной транскрипции и ПЦР с применением разработанных оригинальных олигонуклеотидов, которые рассчитаны на целевой участок G-гена вируса бешенства в диапазоне 4149…4277 п.н.;
- применение технологии алгебраического анализа дифференциала второго порядка максимальной точки d CPmax логистических кривых ПЦР для каждой исследуемой пробы и контролей;
- определение титра инфекционной активности вируса бешенства в сырье для изготовления аттенуированной антирабической вакцины с применением следующей разработанной логарифмической регрессионной функции: lg TRabV=-0,3×d CPmax+11,427, с достоверностью аппроксимации 0,9996 и эффективностью амплификации 99,56%.
2. Способ по п. 1, отличающийся тем, что используется фермент Tth ДНК-полимераза в количестве 1 единицы активности в комплексе с хлоридом марганца (II) в концентрации 1,2 мМ на 1 реакцию, для совмещения обратной транскрипции и реакции амплификации во времени и пространстве.
3. Способ по п. 1, отличающийся тем, что в 95% доверительном интервале диагностическая чувствительность составляет 99,43-100,0%, диагностическая специфичность - 97,91-100,0%, k-критерий - 1,000; прогностичность отрицательного результата - 97,91-100,00%, общая точность - 99,55-100,0%.
| Способ опосредованного определения инфекционного титра вируса бешенства в неинактивированном сырье для антирабических вакцин при транскрипционной амплификации и детекции продуктов реакции с применением beacon-технологии | 2020 |
|
RU2756472C1 |
| Способ опосредованного определения концентрации иммуногенного RNP-комплекса вируса бешенства в сырье для антирабических вакцин методом амплификации и гибридизационно-флуоресцентной детекции ДНК-ампликонов | 2020 |
|
RU2760436C1 |
| CN 101565758 B, 24.08.2011 | |||
| Доронин Максим Игоревич, Михалишин Дмитрий Валерьевич, Мудрак Наталья Станиславовна ОПОСРЕДОВАННОЕ ОПРЕДЕЛЕНИЕ ИНФЕКЦИОННОГО ТИТРА ВИРУСА БЕШЕНСТВА В СЫРЬЕ ДЛЯ ВАКЦИН С ПРИМЕНЕНИЕМ ТРАНСКРИПЦИОННОЙ АМПЛИФИКАЦИИ И BEACON-ТЕХНОЛОГИИ // Актуальные вопросы ветеринарной | |||
Авторы
Даты
2024-01-22—Публикация
2023-08-18—Подача