Изобретение относится к медицине, а именно к экспериментальной кардиологии, и может быть использовано для моделирования хронической тромбоэмболической легочной гипертензии (ХТЛГ) с целью изучения патогенеза, разработки новых подходов к лечению.
Тромбоэмболия легочной артерии (ТЭЛА), по данным ВОЗ, является третьей по частоте причиной смерти во всем мире. ХТЛГ - одно из наиболее тяжелых осложнений ТЭЛА, характеризующееся нарушением фибринолиза тромбоэмболов и типичной гистологической картиной сосудистого ремоделирования. Эффективность современных терапевтических подходов в лечении этой патологии остается недостаточной.
Известен способ моделирования ХТЛГ, согласно которому суспензию полистироловых микросфер диаметром 45 мкм, покрытых фибриновой-коллагеновой оболочкой, вводят животному внутривенно 3 раза с интервалом в 7 дней в количестве 1000 микросфер/г, 1000 микросфер/г, 750 микросфер/г, соответственно (Arias-Loza P.A. et al. Development and Characterization of an Inducible Rat Model of Chronic Thromboembolic Pulmonary Hypertension. Hypertension. 2016; 5., опубл. 04.04.16).
Из-за абсолютной нерастворимости полистиролового ядра микросфер, полученная по указанному способу модель не соответствует патогенезу ХТЛГ, характеризующейся частичной биодеградацией тромбов с высвобождением биологически активных веществ.
Известен способ моделирования ХТЛГ путем введения полистироловых микросфер в сочетании с ингибитором неоангиогенеза (Neto-Neves Е.М. et al. Chronic Embolic Pulmonary Hypertension Caused by Pulmonary Embolism and Vascular Endothelial Growth Factor Inhibition. Am J Pathol. 2017; 4., опубл. 04.02.2017). Суспензию полистироловых микросфер диаметром 85 мкм в количестве 970 микросфер/г в сочетании с ингибитором сосудистого эндотелиального фактора роста (VEGF) - SU5416 (20 мг/кг) вводят однократно в хвостовую вену.
К указанным выше недостаткам в описанной модели присоединяется воздействие системных эффектов ингибитора VEGF.
В доступных источниках информации не обнаружено способов моделирования, в достаточной степени воспроизводящих патофизиологические и структурные изменения сосудистого русла легких при ХТЛГ, что затрудняет изучение перспективных лекарственных субстанций для лечения ХТЛГ и трансляцию полученных результатов для клинических исследований.
Технический результат заявленного изобретения заключается в наиболее полном воспроизведении патогенетических процессов при формировании ХТЛГ, обеспечивающих у лабораторных животных патофизиологические и структурные изменения сосудистого русла легких, соответствующих ХТЛГ.
Заявленный технический результат достигается в способе моделирования хронической тромбоэмболической легочной гипертензии, включающем внутривенное введение животному эмболизирующих частиц, в котором в качестве эмболизирующих частиц используют аутологичные тромбы, инкапсулированные в альгинатные микрокапсулы диаметром 130-400 мкм с соотношением по объему тромбов и альгината натрия от 1:7 до 1:3, 200-250 мкл микрокапсул вводят не менее 4 раз с интервалом не менее 2 дней.
После введения в венозное русло микроинкапсулированные тромбы эмболизируют сосудистое русло малого круга кровообращения, при этом микроинкапсулированные аутологичные тромбы характеризуются устойчивостью к биодеградации в течение первых двух недель, проявляют признаки биодеградации в сосудистом русле в период с третьей по четвертую недели и полностью растворяются к шестой неделе после введения. Это вызывает ремоделирование сосудистого русла и стойкое повышение давления в легочной артерии, характерные для ХТЛГ.
Диаметр микрокапсул 130-400 мкм является достаточным для эмболизации дистальных, субсегментарных, сегментарных и долевых ветвей легочной артерии крыс, что является оптимальным для формирования ХТЛГ при многократном введении эмболизирующих частиц.
Соотношение по объему тромбов и альгината натрия от 1:7 до 1:3 обеспечивает оптимальное соотношение прочности. микрокапсулы,, обеспечивающей выполнение заданных сроков биодеградации, и достаточного уровня тромботических масс внутри микрокапсулы, ответственных за паракринное действие продуктов деградации тромба.
Объем в 200-250 мкл микрокапсул в качестве однократной дозы для внутривенного введения является достаточным для редукции необходимого объема сосудистого русла малого круга кровообращения и, таким образом, повышения давления в легочной артерии.
С учетом медленной биодеградации микрокапсул и в соответствии с патогенезом дистальных форм ХТЛГ, целесообразно введение микрокапсул не менее 4 раз с интервалом не менее 2 дней, что позволяет достичь ремоделирования сосудистого русла, стойкого повышения давления в легочной артерии и, таким образом, формирования ХТЛГ.
На чертежах представлены:
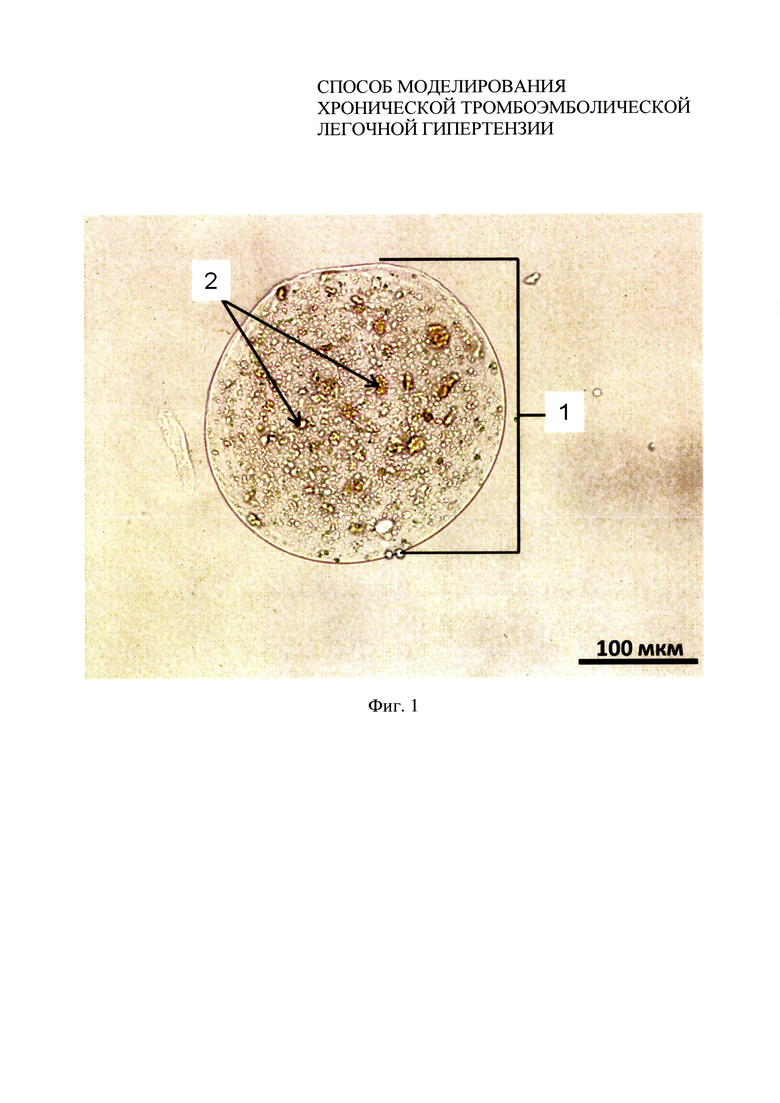
Фиг. 1 - микрофотография в проходящем свете микрокапсулы, полученной по протоколу примера 1;
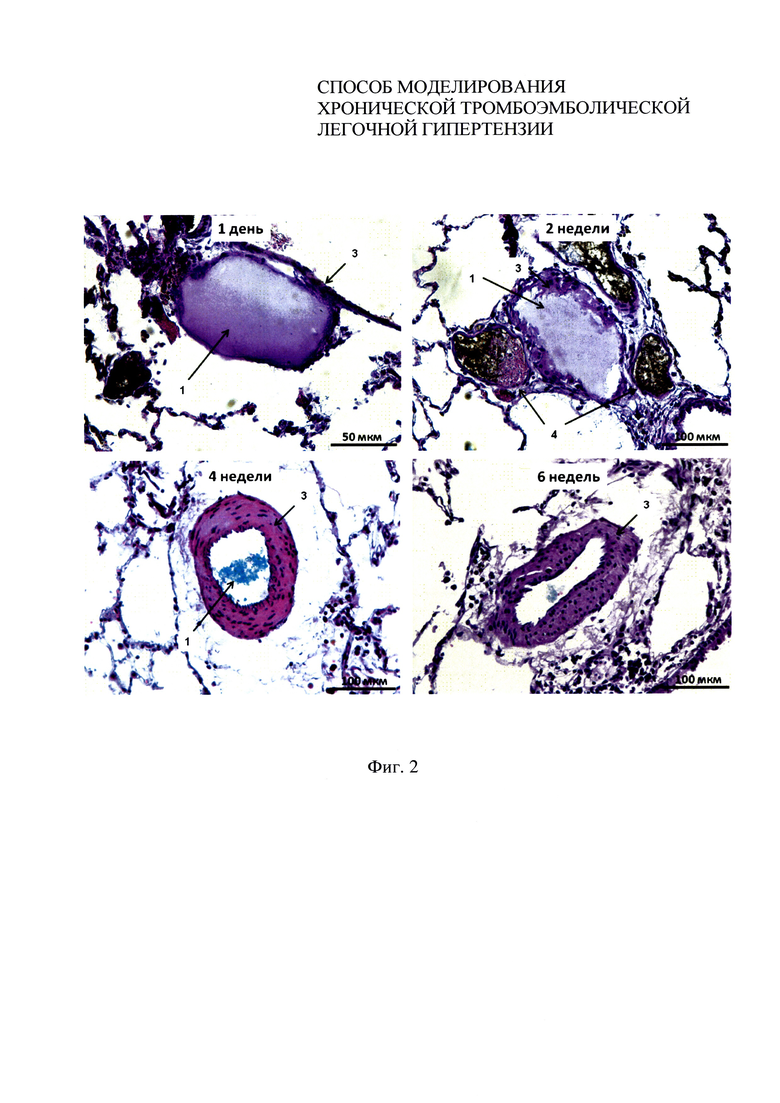
Фиг. 2 - динамика биодеградации микрокапсул в примере 1.
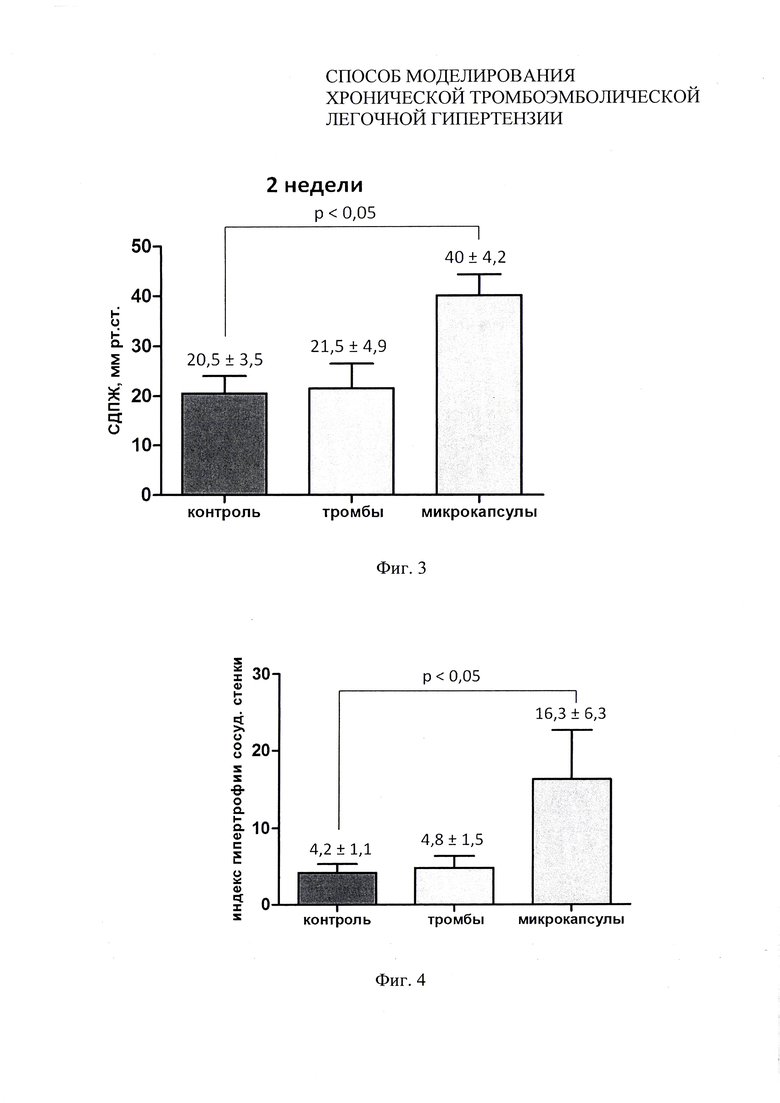
Фиг. 3 - уровень систолического давления в правом желудочке через 2 недели после последнего введения микрокапсул в примере 1.
Фиг. 4 - индекс гипертрофии сосудистой стенки ветвей легочной артерии через 6 недель после последнего введения микрокапсул в примере 1.
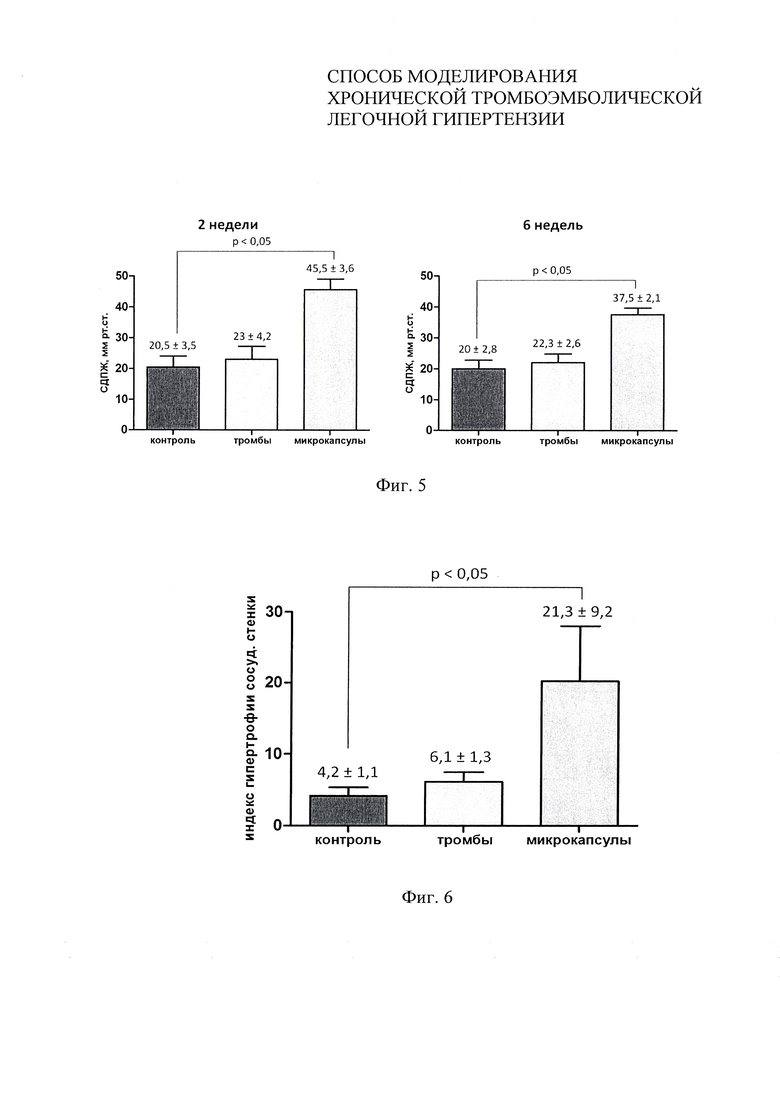
Фиг 5 - уровень систолического давления в правом желудочке через 2 и 6 недель после последнего введения микрокапсул в примере 2.
Фиг 6 - индекс гипертрофии сосудистой стенки ветвей легочной артерии через 6 недель после последнего введения микрокапсул в примере 2.
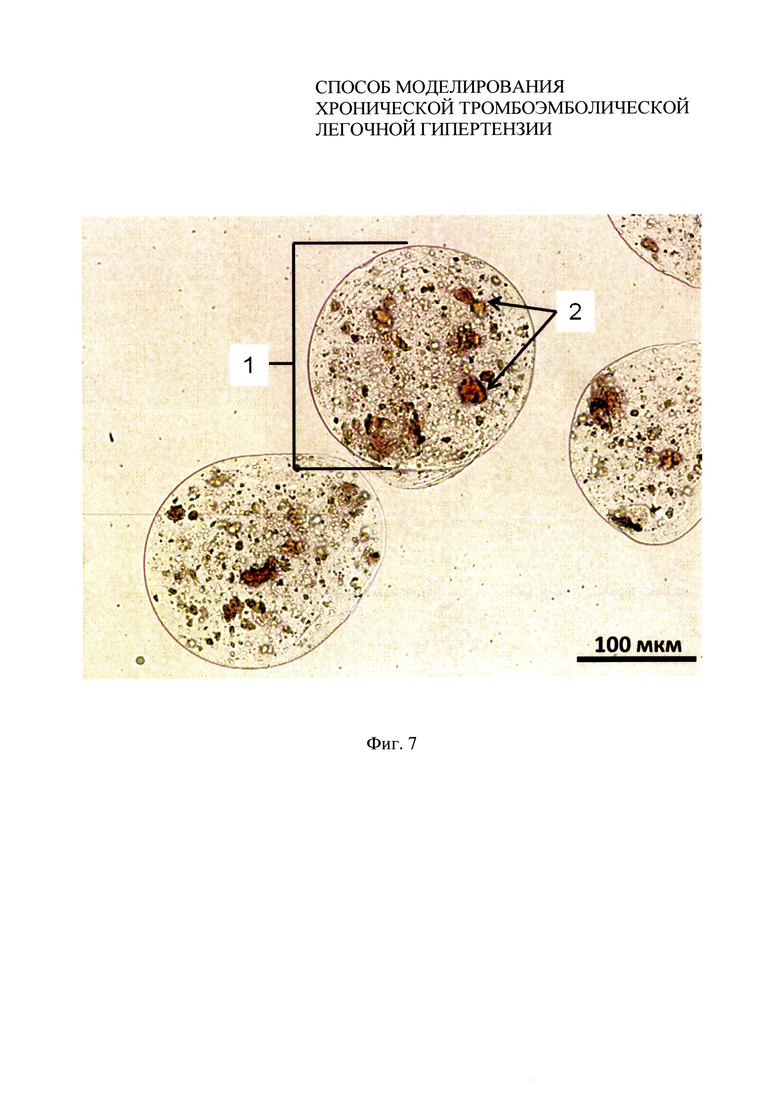
Фиг. 7 - микрофотография в проходящем свете микрокапсул, полученных по протоколу примера 3.
Способ осуществляют, например, следующим образом.
Для получения аутологичных тромбов у предварительно наркотизированной крысы массой 200-400 г из бедренной вены забирают 1-1,5 мл крови. Кровь высушивают в стерильных условиях, измельчают и посредством сита с ячейками заданного диаметра отбирают фракцию тромбов размером менее либо равную 71 мкм.
Для микроинкапсулирования тромбов изготавливают суспензию измельченной тромботической массы в растворе альгината натрия 0,5-3% в соотношении по объему от 1:7 до 1:3 соответственно. Полученную суспензию подают на вход установки Encapsulator В-390 (BUCHI, Швейцария) с параметрами работы: диаметр форсунки 70-150 мкм, напряжение электродов 1300-2800 В, частота вибрации 2400-3600 Гц, давление 400-600 мбар. Такие параметры позволяют получить микрокапсулы со средними размерами от 130 до 400 мкм. В качестве раствора для стабилизации поверхностного слоя микрокапсул используют раствор хлорида бария 1-3%. Перед введением микрокапсулы отмывают физиологическим раствором до полного удаления стабилизирующего раствора. 200-250 мкл отмытых микрокапсул в 1-1,5 мл физиологического раствора вводят внутривенно крысе, предпочтительно, в хвостовую вену. Процедуру внутривенного введения повторяют не менее 4 раз с интервалом не менее 2 дней.
Изобретение иллюстрируется следующими примерами.
1. Для получения аутологичных тромбов у 14 крыс-самцов стока Wistar массой 225±28 г, наркотизированных внутрибрюшинным введением тиопентала натрия (50 мг/кг), из бедренной вены забирали по 1,5 мл крови. Высушенную и измельченную кровь в стерильных условиях просеивали через сито с размером ячейки 71 мкм. Тромботические массы смешивали с 2% раствором альгината натрия в соотношении 1:4 соответственно. Полученную смесь подавали на вход установки Encapsulator В-390 с параметрами работы: диаметр используемой форсунки 120 мкм, частота вибрации 2800 Гц, напряжение электродов 2300 В, давление 550 мбар. В качестве стабилизирующего раствора использовали 2% хлорид бария. Размер полученных микрокапсул составил 190±48 мкм. На фиг. 1 представлена микрофотография в проходящем свете микрокапсулы 1 с заключенными в нее частицами 2 тромботической массы. Микрокапсулы в объеме 250 мкл, суспензированные в 1,5 мл физиологического раствора, вводили в хвостовую вену крысы 4 раза с интервалом в 7 дней. В качестве группы сравнения использовали 7 крыс-самцов стока Wistar, которым вводили нативные аутологичные тромбы диаметром 175±64 мкм в объеме 250 мкл, суспензированные в 1,5 мл физиологического раствора, по идентичному протоколу введения. В качестве контроля взяты здоровые животные (n=7).
Была проведена оценка стабильности полученных микрокапсул в сосудистом русле по данным гистологического исследования на разных сроках после последнего введения: 1 день, 2 недели, 4 недели, 6 недель. На панели микрофотографий (фиг. 2) сосудов легких отображена динамика биодеградации микрокапсул 1 в просвете артерий малого круга кровообращения. 1 день после эмболизации - микрокапсула стабильна; 2 неделя - разрыхление, неоднородность структуры микрокапсулы; 4 неделя - почти полная биодеградация микрокапсулы, в просвете сосуда остаточные альгинатные структуры; 6 неделя - полная биодеградация микрокапсулы. Отмечается последовательное утолщение стенки легочной артерии 3 с 1 дня по 6 неделю после эмболизации, что является характерным проявлением ремоделирования сосудистой стенки при ХТЛГ. Просвет бронхиальных артерий 4 заполнен черным красителем. Отмечается расширение бронхиальных артерий 4 с максимумом через 2 недели после эмболизации сосудистого русла. Это изменение является также характерным гистологическим проявлением ХТЛГ.
Измерение систолического давления в правом желудочке (СДПЖ) производили через 2 недели после последнего введения микрокапсул (фиг. 3). На диаграмме видно значимое повышение СДПЖ в опытной группе (введение микрокапсул) по сравнению со здоровыми животными, что указывает на формирование легочной гипертензии у животных опытной группы. При введении нативных тромбов значимого изменения СДПЖ не отмечалось.
Гистологическое исследование легких производили через 6 недель. В качестве критерия оценки ремоделирования сосудистого русла использовали индекс гипертрофии сосудистой стенки - отношение толщины стенки к внешнему диаметру сосуда в процентах (фиг. 4). Отмечалось значимое увеличение индекса гипертрофии в опытной группе по сравнению со здоровыми животными, что указывает на ремоделирование сосудов малого круга кровообращения, характерное для ХТЛГ. Изменений в уровне индекса гипертрофии сосудистой стенки при применении нативных тромбов выявлено не было.
2. Характеристики использованных животных и протокол приготовления микрокапсул совпадал с примером 1.
Микрокапсулы в объеме 250 мкл, суспензированные в 1,5 мл физиологического раствора, вводили в хвостовую вену крысы 8 раз с интервалом в 4 дня. В качестве группы сравнения использовали животных, которым вводили нативные аутологичные тромбы диаметром 175±64 мкм в объеме 250 мкл суспензированные в 1,5 физиологического раствора по идентичному протоколу введения.
Измерение СДПЖ производили через 2 и 6 недель после последнего введения микрокапсул (фиг. 5). В опытной группе отмечалось значимое повышение СДПЖ после введения микрокапсул по сравнению с контрольной группой в обеих временных точках наблюдения, что указывает на стабильность смоделированных изменений гемодинамики. В группе сравнения значимого изменения СДПЖ не отмечалось.
Гистологическое исследование легких производили через 6 недель (фиг. 6). Отмечалось значимое увеличение индекса гипертрофия в опытной группе по сравнению со здоровыми животными (контроль), что указывает на ремоделирование сосудов малого круга кровообращения, характерное для легочной гипертензии. Изменений индекса гипертрофии сосудистой стенки при применении нативных тромбов выявлено не было.
3. Для получения аутологичных тромбов у 14 крыс-самцов стока Wistar массой 230±42 г, наркотизированных внутрибрюшинным введением тиопентала натрия (50 мг/кг), из бедренной вены забирали 0,5 мл крови. Высушенную и измельченную кровь в стерильных условиях просеивали через сито с размером ячейки 20 мкм. Тромботические массы смешивали с 1,5% раствором альгината натрия в соотношении 1:7, соответственно. Полученную смесь подавали на вход установки Encapsulator В-390 с параметрами работы: диаметр форсунки - 100 мкм, напряжение электродов - 2000 В, частота вибрации 3000 Гц, давление 500 мбар. В качестве стабилизирующего раствора использовали 1,5% хлорид бария. Размер полученных микрокапсул составил 160±33 мкм (фиг. 7).
Протокол внутривенного введения микрокапсул совпадал с примером 2, что приводило через 6 недель к формированию ХТЛГ с показателями ремоделирования сосудистой стенки и давления в легочной артерии значимо не отличающимися от примера 2.
Использование заявленного способа обеспечивает у лабораторных животных патофизиологические и структурные изменения сосудистого русла легких, соответствующие ХТЛГ, за счет наиболее полного воспроизведения патогенетических процессов при формировании ХТЛГ.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ моделирования хронической тромбоэмболической легочной гипертензии с помощью микроинкапсулированного фибрина | 2024 |
|
RU2830534C1 |
| Способ моделирования хронической тромбоэмболической легочной гипертензии у крупных животных | 2023 |
|
RU2811651C1 |
| Способ моделирования тромбоза легочной артерии в условиях венозного тромбоза | 2021 |
|
RU2770355C1 |
| СПОСОБ ИНГИБИРОВАНИЯ ТРОМБООБРАЗОВАНИЯ И УСКОРЕНИЯ ФИБРИНОЛИЗА С ПОМОЩЬЮ ДНК АПТАМЕРОВ, ИНГИБИРУЮЩИХ АКТИВНОСТЬ ТРОМБИНА, В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2559545C1 |
| Применение динитрозильного комплекса железа с глутатионом-GS { (GS) Fe(NO)} для лечения больных с легочной артериальной гипертензией | 2022 |
|
RU2804734C1 |
| СПОСОБ ДОСТУПА К КРУПНЫМ ВЕНАМ ВЕРХНИХ КОНЕЧНОСТЕЙ (V.BASILICA и V.CEPHALILCA) ДЛЯ ПРОВЕДЕНИЯ ДИАГНОСТИЧЕСКИХ И ЛЕЧЕБНЫХ ИНТЕРВЕНЦИОННЫХ ВМЕШАТЕЛЬСТВ | 2016 |
|
RU2613562C1 |
| СПОСОБ ДИСТАНТНОЙ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ГЕПАТОЦИТОВ | 2015 |
|
RU2590859C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ РЕНОПАРЕНХИМАТОЗНОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ У КРЫС | 2012 |
|
RU2507593C1 |
| Способ количественной оценки объема нарушений перфузии легких | 2017 |
|
RU2653994C1 |
| Способ лечения сердечно-сосудистых больных после перенесенного острого коронарного синдрома и кардиохирургических вмешательств | 2019 |
|
RU2715209C1 |
Изобретение относится к медицине, а именно к экспериментальной кардиологии. Для моделирования хронической тромбоэмболической легочной гипертензии (ХТЛГ) крысе внутривенно вводят эмболизирующие частицы в виде аутологичных тромбов, инкапсулированные в альгинатные микрокапсулы диаметром 130-400 мкм с соотношением по объему тромбов и альгината натрия от 1:7 до 1:3 в количестве 200-250 мкл микрокапсул не менее 4 раз с интервалом не менее 2 дней. Способ позволяет наиболее полно воспроизвести патогенетические процессы при формировании ХТЛГ, обеспечивая у лабораторных животных патофизиологические и структурные изменения сосудистого русла легких, соответствующие ХТЛГ. 7 ил., 3 пр.
Способ моделирования хронической тромбоэмболической легочной гипертензии, включающий внутривенное введение животному эмболизирующих частиц, отличающийся тем, что в качестве эмболизирующих частиц используют аутологичные тромбы, инкапсулированные в альгинатные микрокапсулы диаметром 130-400 мкм с соотношением по объему тромбов и альгината натрия от 1:7 до 1:3, 200-250 мкл микрокапсул вводят не менее 4 раз с интервалом не менее 2 дней.
| АМОСОВ В.И | |||
| и др., Экпериментальное моделирование тромбоэмболии легочной артерии, Региональное кровообращение и микроциркуляция, 2003, 3, том 2, с | |||
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
| RU 2075110 C1, 10.03.1997 | |||
| Способ приготовления зубопротезной оттисковой массы | 1938 |
|
SU53542A1 |
| Neto-Neves Е.М | |||
| et al | |||
| Chronic Embolic Pulmonary Hypertension Caused by Pulmonary Embolism and Vascular Endothelial Growth Factor Inhibition | |||
| Am J Pathol | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
Авторы
Даты
2018-12-18—Публикация
2018-05-28—Подача